Abstract
为了探讨兔眼前节内前后房压强差随时间变化的规律,设计了一套前后房压强差在体测量装置。利用连通器原理,搭建在体测量眼内前后房压强差的平台。通过注射复方卡波姆升高眼压的方法构建高眼压兔眼模型,实现正常和高眼压兔眼的前后房压强差的在体 24 小时连续测量。设计的本装置对于眼内微小的压强差会产生比较敏感的反应。正常兔眼前后房压强差随时间变化,一天的变化范围为 5.84~96.84 Pa,反映出生理性规律的存在。高眼压性兔眼多呈现前房压强高于后房压强的状况,符合自适应性调整学说。本文所设计的方法和装置可以较好地实现眼内前后房压强差的测量,且前后房压强差在一天当中随时间呈规律性变化。
Keywords: 前后房压强差, 眼生物力学, 房水, 实验研究
Abstract
A set of device for the in vivo measurement of the pressure difference between the anterior and the posterior chambers (PDAP) was designed to investigate the temporal varying rules of PDAP in the anterior segment of rabbit eyes. A platform was established for the in vivo measurement of PDPA according to the mechanism of joint implement. Rabbit models with high intraocular pressure (IOP) were constructed by means of injecting Carbomer into anterior chamber to increase IOP. The in vivo 24 hours continuous measurements of PDAP were performed for normal rabbit eye and eye with high IOP. The developed device could sensitively response to the small pressure difference in eye. The pressure difference in the normal rabbit eye varied with time, and the variation range during a whole day was 5.84–96.84 Pa which reflected the existence of physiological rule. For the rabbit eye with high IOP, pressure in anterior chamber was higher than that in posterior chamber which was in consistence with the theory of self-adaptation adjustment. The present study indicates that the approaches and device designed in this paper can well implement the measurement of PDAP as well as the temporal varying rules of PDAP in the anterior segment during a whole day.
Keywords: pressure difference between the anterior and the posterior chambers, ocular biomechanics, aqueous humor, experiment study
引言
青光眼是一系列令视神经受到永久性破坏的眼疾统称,而病理性的眼内压升高是重要的危险因素之一,是临床上对青光眼进行诊治的第一个必查指标,也是实施眼内灌注的决定因素[1]。
房水产生速度、房角处的流出阻力和巩膜路径上的流动是决定眼内压的因素,房水流动不畅和房角吸收减少是高眼内压出现的主要原因。正常情况下房水是无色透明的液体,由睫状突产生,经由后房穿过瞳孔到达前房,再由前房角进入巩膜静脉窦,借此汇入眼静脉。因某种原因,房水流动受阻或者房水循流状态改变,一直被公认为是闭角型青光眼发生的主要力学原因之一[2-3]。房水流出阻力增加产生瞳孔阻滞,瞳孔阻滞力的存在使得后房压力上升,前后房压强差(pressure difference between the anterior and the posterior chambers,PDAP)增大,虹膜受压向前隆起,形成前凸曲线剖面,虹膜膨隆到关闭房角时,就形成闭角型青光眼。
前后房压强差是克服瞳孔阻滞力、维持房水流动的唯一动力,瞳孔阻滞加重时前后房压强梯度会增大,因此认识前后房压强差的变化规律对青光眼的早期诊断和治疗有重要意义。但由于眼内结构的复杂性,前后房空间有限,前后房压强差很小,理论估计不超过 300 Pa[4]。目前对于在体眼前后房压强差的文献报道很少,且大多集中于前房和后房压强的分别测量。
临床上对于前房内压强的测量,多采用各式的无创眼压计,但因为个体角膜厚度、曲率半径以及眼球壁硬度系数的不同,会给测量结果造成很大干扰[5],且结果不稳定。更准确的测量应该是眼内直接测量。贾莉君等[6]采用二道生理记录仪,通过张力丝传感器,用前房穿刺法检测兔眼前房的压力值。张虹等[7]用 Tono-Pen 眼压计对兔眼前房中央区的压强值进行了测量。McLaren 等[8]采用遥测的方法连续 24 小时测量了眼前房内压强。Campos 等[9]也采用前房穿刺的方法,使用压力传感器测量了眼内压强由人为加大到 60 mm Hg 再逐渐恢复到正常值的眼压变化情况。全海英等[10]用前房穿刺的方法,在体连续测量了 24 小时正常兔眼前房压强。这些研究工作为本文的眼内前后房压强差测量奠定了技术基础和对比验证数据。
由于眼睛后房很小,加上测量条件、手段和方法学等方面的限制,国内外对于眼后房压强的在体测量很少报道。Schnell 等[11]在兔眼玻璃体中植入遥测传感器连续 24 小时测量患有青光眼兔子的眼内压。Schnakenberg 等[12]采用硅胶囊式的传感器进行后房在体测量。Lu 等[13]提出通过手术用植入传感器的人工晶状体替代正常晶状体,再利用遥感技术测量后房眼压。
本课题组前期通过离体实验测算出正常情况下,前后房压强差的范围不超过 300 Pa[14];用 Millar 微型压力传感器穿刺前后房,即将传感器穿刺兔眼前房和由前房通过瞳孔穿刺后房的方法,在体测量了兔眼前后房压强差[15]。在此原理基础上,本文改变后房穿刺方法,用静脉留置针直接穿刺后房,分别对正常兔眼和高眼压兔眼进行了连续 24 小时的前后房压强差监测。
1. 方法
1.1. 前后房压强差测量装置的设计与制作
本研究中前后房压强差测量装置原理如图 1 所示。A、C 分别代表眼球的后房、前房,B 为空气压力传感器,其两端的 V1、V2 为传感器内互不连通的密闭导管,且不与大气相通,内充有等体积空气。在 A 与 B 腔体间、B 与 C 腔体间为半径、长度都相等的双向开口刚性材料导管,并充满等量生理盐水 L1、L2,生理盐水的液面高度应当相同,这样压力传感器两侧压强差为 0 Pa。注满生理盐水的穿刺留置针分别插入兔眼前房和后房,这样前房和后房的压力就会传递到压力传感器两侧,从而可以计算它们的压力差。
图 1.
Principle diagram of measurement device
测量装置原理图
即,在测量中的任意时刻,
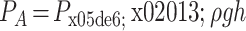 ,
,
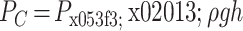 。其中,
。其中,
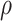 为生理盐水密度,g为重力加速度,
为生理盐水密度,g为重力加速度,
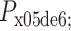 为传感器左边压力,
为传感器左边压力,
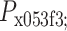 为传感器右边压力,从而得到 A、C 腔体的压强差为:
为传感器右边压力,从而得到 A、C 腔体的压强差为:
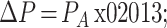
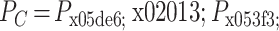 。
。
由于现有的液体差压传感器最高精度是满量程的 5‰,量程最小的仪器也有 4~5 kPa,而眼内前后房压强差理论值小于 300 Pa,无法实现准确测量,因此,我们采用精度达到帕斯卡级的 CP300 型空气压力传感器,按照上述原理进行改装来测量前后房压强差。具体做法是:与传感器相连的空气通过三通管先与大气连接,实验时在压力传感器两侧的空气腔内分别加压至 1.5 个标准大气压(1 标准大气压 = 101.325 kPa),然后打开三通管泄压至 1 个标准大气压。如此反复三次,使得空气腔内的气压稳定。关闭三通管,封闭压力传感器两侧空气。空气与生理盐水之间由薄膜隔离,注入等量的生理盐水后产生高度相同的液面,这样使得压力传感器两侧压强差为 0 Pa,薄膜变形也趋于稳定。
对于搭建的测量装置平台,利用 CP300 空气压差传感器进行校正。借助 100 mL 量筒蒸馏水进行校正,校正结果表明这套装置对于眼内微小的压差会产生比较敏感的反应。
1.2. 高眼压性兔眼模型的制备
本文采用前房注射复方卡波姆溶液的方法制备高眼压性动物模型。这种方法可使眼压平稳持续升高,随着时间的增加,出现青光眼特征性表现,其视网膜电图、组织病理学检查等发现与长期慢性高眼压病理变化类似,并且与临床青光眼对视神经的损害类似[16]。
选用健康成年新西兰白兔 10 只,2.0~2.5 kg/只,无可见外眼疾病,结膜无充血,角膜房水清亮,虹膜淡粉色且放射状纹理清晰可见,瞳孔圆且大小适度,晶状体正位,普通级,由首都医科大学动物部提供。主要药品和试剂为:卡波姆 940GE 粉末和地塞米松磷酸钠注射液,按照一定比例配置成 0.3% 的复方卡波姆溶液;3% 的戊巴比妥钠溶液;规格为“5 mL∶0.1 g”的盐酸利多卡因注射液;规格为“1 mL∶5 mg”的地塞米松磷酸钠注射液。高眼压兔眼模型制备的实验操作过程如下:
(1)取兔称重,固定于兔台上,3% 的戊巴比妥钠按照 1.5 mL/kg 的剂量经耳缘静脉注射全身麻醉,双眼滴适量盐酸利多卡因局部麻醉。
(2)右眼(R)作为实验眼:用 1 mL 注射器从兔眼颞侧角巩膜缘处进针,缓慢抽取房水 0.1 mL,拔针后用棉签摁压针眼;换用盛有复方卡波姆的 1 mL 注射器由原针眼处进针,直至针头到达瞳孔正上方,缓慢注入 0.1 mL 复方卡波姆,拔针后用棉签按压针眼,复方卡波姆可迅速成为黏胶状而不返流,阻塞房角和小梁网等处房水的正常排出而升高眼内压。
(3)左眼(L)作为对照眼:用 1 mL 注射器从颞侧角巩膜缘处进针,缓慢抽取房水 0.1 mL,拔针后用棉签摁压针眼;换用盛有生理盐水的 1 mL 注射器由原针眼处进针,直至针头到达瞳孔正上方,缓慢注入 0.1 mL 生理盐水,拔针后用棉签按压针眼 10 s 左右防止水分沿针眼外流。
(4)术后每天同一时间段利用回弹式眼压计测量双眼眼压,实验眼眼压稳定升高(> 22 mm Hg)7 d 以上且眼压稳定为造模成功。
10 只兔随机编号 1~10,术后监测眼压发现 1~5、7~10 号高眼压模型稳定,造模成功率为 90%。6 号兔实验眼眼压进行性降低,对照眼眼压术后前 3 天稳定在 1 250 Pa 左右,第 4 天开始眼压骤降并死亡。造模成功的 9 只兔眼,术后 3 天实验眼眼压开始升高,直至第 8 天左右稳定,之后在 3 100 Pa 左右波动,而对照眼眼压值则稳定在 1 414.0 Pa 上下,实验眼眼压值比对照眼平均升高 1 199.9 Pa(如图 2 所示)。
图 2.
Intraocular pressure of high intraocular pressure eyes after surgery
高眼压兔眼的术后眼压值
1.3. 兔眼前后房压强差的 24 小时测量
本文采用前房穿刺和后房直接穿刺联合的方法,在新搭建的前后房压强差测量装置平台上对正常兔眼和高眼压性兔眼前后房压强差进行 24 小时的连续监测。
20% 的乌拉坦用于全麻;规格为“2 mL∶10 mg”的地西泮注射液静注用于辅助全麻;规格为“5 mL∶0.1 g”的盐酸利多卡因注射液用于局麻点眼;5% 的葡萄糖注射液用于营养补充;同时,HARVARD PHD 2000 微量注射泵用于间断性的兔眼局麻给药。
前后房压强差测量实验过程如下:
(1)取兔称重,固定于兔台上,按照 7.5 mL/kg 的剂量经耳缘静脉注射 20% 的乌拉坦进行全身麻醉,5~8 min 后观察到兔子全身肌肉松弛、呼吸平稳、角膜反应迟钝后,依据兔的平均体重 2.5 kg,追加注射地西泮 1 mL;如角膜还有反射,在眼球表面滴两滴盐酸利多卡因注射液进行局部麻醉。
(2)用眼科镊夹住眼球结膜,将静脉留置针自角巩膜缘处进针,约 5° 角倾斜向上滑行,针头到达瞳孔正上方时停止。停留几分钟后等待房水补充一部分,以同样的方法穿刺后房,从角巩膜缘外周 1~1.5 mm 处斜行进针,穿透巩膜,使针水平滑行于虹膜下进入后房(如图 3 所示)。
图 3.
Diagram of puncture path
穿刺路径示意图
(3)压力平衡后 Chart 软件开始记录测量数据。观察兔子麻醉状态,每隔 6 小时追加 2.5 mg 地西泮注射液,实验中发现给药过量可导致兔共济失调、震颤等;同时微量注射泵定时注射盐酸利多卡局麻角膜,实验发现局部给药过于频繁时可导致眼部肌肉震颤、呼吸抑制等现象。
(4)长时间麻醉兔子,需要给其及时补充能量、体液,静脉点滴葡萄糖注射液。每只兔子 24 小时内静脉滴注的药液成分及用量为生理盐水 350 mL 和 5% 的葡萄糖溶液 100 mL。
2. 结果
2.1. 正常眼压实验测量结果
由于后房体积太小,静脉留置针的可动范围极其有限等原因,得到有效兔眼实验数据 5 只,测得的眼前后房压强差数据经过滤波、去噪处理,得到图 4 正常兔眼前后房压强差 24 小时的平均值。
图 4.
Variation of average PDAP during 24 hours in normal rabbit eye
正常兔眼前后房压强差在 24 小时内的平均值变化
可以看出一天当中随着时间变化前后房压强差也在变化,大致规律是白天压强差较大,晚上压强差较小,但在中午时分也出现了较低的压强差。最大值出现在上午 8 时,为 96.84 Pa,10 时和 17 时也出现了较大的数值,分别为 93.54 Pa 和 89.52 Pa,平均压强差为 33.6 Pa。
2.2. 高眼压实验测量结果
本实验获得有效的高眼压兔眼实验数据 5 只,测得的高眼压眼前后房压强差数据经过滤波、去噪处理,得到图 5 高眼压兔眼前后房压强差 24 小时的平均值。
图 5.
Variation of average PDAP during 24 hours in high intraocular pressure rabbit eye
高眼压性兔眼前后房压强差在 24 小时内的平均值变化
可以看出随着时间变化一天当中前后房压强差也在变化,大致规律是白天绝对压强差较大,晚上绝对压强差较小,并且前后房压强差大多出现负值,即前房压强高于后房压强。绝对值最大值出现在上午 7 时,为 70.44 Pa,9 时和 19 时也出现了较大的数值,分别为–65.01 Pa 和 70.37 Pa,绝对值平均为 27.785 Pa。
3. 讨论
由于正常眼压的兔眼眼内压强差很小,理论上小于 300 Pa,前后房空间有限,加大了测量难度,没有装置可以在体测量。本文研制的实验装置将传感器分别植入前房和后房,实时监测压强差的变化,精度在可控范围内。为了验证装置的可靠性,我们将传感器单独植入前房,测得的前房压强最大值为 2 740 Pa,而贾莉君等[6]采用二道生理仪通过张力丝传感器前房穿刺测得压强值为 2 600 Pa 左右,张虹等[7]用 Tono-Pen 眼压计测得兔眼前房中央区的压强值为 2 580 Pa 左右,文献数据在一定程序上验证了我们装置的可靠性。
正常兔眼前后房压强差在一天当中随时间变化,变化范围为 5.84~96.84 Pa,白天压强差较大,晚上压强差较小,上午 8 时出现最大值。李婷[15]用 Millar 微型压力传感器穿刺兔眼前房和经前房过瞳孔穿刺后房,在体测量了兔眼前后房压强差值,测得中午 13 时至晚上 21 时的前后房压强差在 60~80 Pa 范围内,与本实验结果在同一数量级。
同时,兔眼后房空间太小,穿刺的静脉留置针可动范围极其有限,穿刺过程中极易损坏虹膜;长时间麻醉兔子,呼吸、心跳、麻醉减轻等都可能使静脉留置针脱出,实验过程中兔子耐受性等也影响了实验数据的有效数量,只获得了 5 只兔子的有效数据。后续工作可以增大样本量,验证本文结果。
目前,关于导致眼内压增高和出现青光眼症状的原因有多种说法,机制仍不够明确。当房水正常的排出受到阻碍时,会产生病理性高眼压,如瞳孔阻滞、房水流动不畅、房角闭锁、小梁网流出阻力增加、炎症等。本研究采用阻碍房水流出通道的眼内注射药物方法造模,也就是通过阻塞房角处的房水正常排出而升高眼压。所取 10 只样本 9 只成功,成功率达 90%。且术后前房反应轻,无眼内炎、晶状体脱位等并发症,术后 3 天眼压开始升高,第 8 天稳定。任燕如等[16]有研究报道,该方法建立的高眼压模型对视神经的损伤类似于临床青光眼病理变化。我们团队[17]为了观察造模效果,也对正常眼球和高眼压眼球分别进行了固定、脱水、石蜡切片、苏木精—伊红染色等操作,发现两组间角膜、视网膜、眼球壁和房角都有明显差别。
高眼压兔眼前后房压强差的 24 小时连续测量发现,一天当中不同时段出现不同数值,且大多时段出现负值,即前房压强高于后房压强。这与 Pavlin 等[18]最先提出的自适应性调整学说一致,即由于自适应性调整出现了压强反转,虹膜向更凹的方向变形。因为我们是在造模成功 12 天后做的压强差测量实验,所以原因可能是连续多天的高眼压使得组织发生了自适应性调整,出现了反向瞳孔阻滞所致。虹膜表面出现凹陷引起色素释放,因而在临床上色素性青光眼角膜内面出现色素带[19]。引起虹膜凹陷的原因虽不十分清楚,但 Karickhoff[20]提出的反向瞳孔阻滞,即前房压强高于后房压强导致虹膜紧贴于晶状体上,房水不能从后房流入前房而产生瞳孔阻滞,足以解释这个问题。
关于前房内压强为何升高有许多理论,如行走、头的某种方位、眼球的运动都可以导致虹膜与晶状体间的开与关。Heys 等[21]通过建立虹膜与房水间的数学模型,也分析了这种自适应性调整对虹膜位置和房水压力分布的影响。
4. 结论
本研究旨在探讨正常和高眼压性眼前节内房水的压力测量。为此我们利用连通器原理,搭建了在体测量眼内前后房压强差的平台。利用此装置,实现了在体 24 小时兔眼前后房压强差的连续测量。利用连通器原理搭建在体前后房压强差测量装置的目的是要获取随时间变化的前后房压强差实验数据。本文将空气差压传感器进行改装,并在前房和后房分别置入传感器,满足了小力学量小空间内压强差的测量,经过体外实验校正,证明了该装置的可靠性。
利用搭建的平台,对正常兔眼前后房压强差进行了 24 小时测量,结果显示一天中此压强差随时间在不断变化,白天压强差较大,晚上压强差较小,变化范围为 5.84~96.84 Pa,反映出生理性规律的存在。
通过前房注射复方卡波姆升高眼压的方法,成功率高,眼压值高,维持时间长,说明这是一种很好的高眼压造模方法。在此基础上,利用搭建的平台,对高眼压眼进行了 24 小时压强差测量,变化范围为-65.01~70.44 Pa,结果多呈现前房压强高于后房压强的状况,与前人发表的自适应性调整学说一致。
Funding Statement
国家自然科学基金(10802053);北京市自然科学基金(7152022)
References
- 1.Flammer J, Orgül S, Costa V P, et al The impact of ocular blood flow in glaucoma. Prog Retin Eye Res. 2002;21(4):359–393. doi: 10.1016/s1350-9462(02)00008-3. [DOI] [PubMed] [Google Scholar]
- 2.Kondo T, Miura M A method measuring papillary blocking force in the human eye. Graefe Arch Clin Exp Ophthalmol. 1987;225(5):361–364. doi: 10.1007/BF02153406. [DOI] [PubMed] [Google Scholar]
- 3.Stamper R L, Lieberman M F, Drake M V. Becker-Shaffer’s diagnosis and therapy of the glaucomas. 8th ed. United Kingdom: Elsevier, 2009: 200-220
- 4.Liu X, Zhang K, Song H, et al. Experimental research on the biomechanical properties of the rabbit Iris//Proceeding of The 27th Annual International Conference of the IEEE Engineering in Medicine and Biology Society. Shanghai: IEEE Engineering in Medicine and Biology Society, 2005, 6: 6196-9198
- 5.Quigley H A, Friedman D S, Congdon N G Possible mechanisms of primary angle-closure and malignant glaucoma. J Glaucoma. 2003;12(2):167–180. doi: 10.1097/00061198-200304000-00013. [DOI] [PubMed] [Google Scholar]
- 6.贾莉君, 蒋幼芹, 吴振中 兔眼压正常值与前房穿刺直接测量法. 眼科研究. 1994;12(4):267–268. [Google Scholar]
- 7.张虹, 李贵刚, 胡军, 等 Tono-Pen 眼压计对兔眼不同部位眼压测量值的相关性研究. 眼科新进展. 2006;26(10):744–746. [Google Scholar]
- 8.McLaren J W, Brubaker R F, Fitzsimon J S Continuous measurement of intraocular pressure in rabbits by telemetry. Invest Ophthalmol Vis Sci. 1996;37(6):966–975. [PubMed] [Google Scholar]
- 9.Campos T V, Jacobovitz S, Almeida H G, et al Computerized invasive measurement of time-dependent intraocular pressure. Braz J Med Biol Res. 2006;39(9):1249–1253. doi: 10.1590/s0100-879x2006000900013. [DOI] [PubMed] [Google Scholar]
- 10.全海英, 薄雪峰, 刘敬华, 等 兔眼前房压强在体连续测量方法的研究. 生物医学工程研究. 2008;27(4):251–253. [Google Scholar]
- 11.Schnell C R, Debon C, Percicot C L Measurement of intraocular pressure by telemetry in conscious, unrestrained rabbits. Invest Ophthalmol Vis Sci. 1996;37(6):958–965. [PubMed] [Google Scholar]
- 12.Schnakenberg U, Walter P, Bögel G V, et al Initial investigations on systems for measuring intraocular pressure. Sensors & Actuators A Physical. 2000;85(1):287–291. [Google Scholar]
- 13.Lu Anhui, Smått J-H, Backlund S, et al Easy and flexible preparation of nanocasted carbon monoliths exhibiting a multimodal hierarchical porosity. Microporous and Mesoporous Materials. 2004;72(1-3):59–65. [Google Scholar]
- 14.刘晓华, 陈琛, 张昆亚, 等 虹膜组织力学特性及瞳孔阻滞力定量研究的方法学探索. 中国医学物理学杂志. 2005;22(1):382–383. [Google Scholar]
- 15.李婷. 动物眼前后房压强差变化规律的在体实验研究. 北京: 首都医科大学, 2008
- 16.任燕如, 于静 复方卡波姆溶液诱导慢性实验性兔高眼压模型研究现状. 眼科新进展. 2010;30(7):686–689. [Google Scholar]
- 17.宋红芳. 基于在体实测前后房压强差的房水循流仿真研究. 北京: 首都医科大学, 2012
- 18.Pavlin C J, Macken P, Trope G E, et al Accommodation and iridotomy in the pigment dispersion syndrome. Ophthalmic Surg Lasers. 1996;27(2):113–120. [PubMed] [Google Scholar]
- 19.Campbell D G Pigmentary dispersion and glaucoma. Arch Ophthalmol. 1979;97:1667–1672. doi: 10.1001/archopht.1979.01020020235011. [DOI] [PubMed] [Google Scholar]
- 20.Karickhoff J R Pigmentary dispersion syndrome and pigmentary glaucoma: a new mechanism concept, a new treatment, and a new technique. Ophthalmic Surg. 1992;23(4):269–277. [PubMed] [Google Scholar]
- 21.Heys J J, Barocas V H Computational evaluation of the role of accommodation in pigmentary glaucoma. Invest Ophthalmol Vis Sci. 2002;43(3):700–708. [PubMed] [Google Scholar]







