Abstract
睡眠中如果癫痫发作会增加患者并发症发作和猝死的概率,有效预测患者睡眠中的癫痫发作可让医患及时采取措施,降低上述概率。现有癫痫发作预测方法多是基于脑电信号设计的,但并未在睡眠时期进行针对性研究,而该时期脑电信号相比其他时期有其特殊性,因此为提高灵敏度、降低错误报警率,本文将挖掘睡眠脑电信号的特点,研究睡眠中癫痫发作的预测方法。本文提出的方法中首先构建特征向量,包括不同波段的绝对功率谱、相对功率谱和功率谱比值;其次应用分离性判据和分支定界法进行特征选择;最后训练支持向量机分类器并实现预测。相比于不针对睡眠脑电信号特点的癫痫预测方法(灵敏度 91.67%,错误报警率 9.19%),本文方法的灵敏度(100%)有所提高,而错误报警率(2.11%)则有所降低。本文方法是对现有癫痫预测方法的补充,具有一定的临床价值。
Keywords: 癫痫预测, 脑电信号, 功率谱, 支持向量机
Abstract
Seizures during sleep increase the probability of complication and sudden death. Effective prediction of seizures in sleep allows doctors and patients to take timely treatments to reduce the aforementioned probability. Most of the existing methods make use of electroencephalogram (EEG) to predict seizures, which are not specific developed for the sleep. However, EEG during sleep has its characteristics compared with EEG during other states. Therefore, in order to improve the sensitivity and reduce the false alarm rate, this paper utilized the characteristics of EEG to predict seizures during sleep. We firstly constructed the feature vector including the absolute power spectrum, the relative power spectrum and the power spectrum ratio in different frequencies. Secondly, the separation criterion and branch-and-bound method were applied to select features. Finally, support vector machine classifier were trained, which is then employed for online prediction. Compared with the existing method that do not consider the characteristics of sleeping EEG (sensitivity 91.67%, false alarm rate 9.19%), the proposed method was superior in terms of sensitivity (100%) and false alarm rate (2.11%). This method can improve the existing epilepsy prediction methods and has important clinical value.
Keywords: seizure prediction, electroencephalogram signals, power spectrum, support vector machine
引言
癫痫(epilepsy)是脑部神经元突发性异常放电从而导致短暂大脑功能障碍的一种慢性疾病。患者在癫痫发作时如果得不到及时的救治,并发症发病率和猝死率都将相对增大。如果能对癫痫发作进行准确预测,可使医生或者家庭成员提前做好准备,及时救治,有效降低并发症发病率和猝死率[1]。目前临床上通常采取两类措施应对癫痫发作:一方面通过视频或者传感器监测患者的运动状况,从而判断癫痫是否发作[2-4],原理上该类方法目前只能进行检测而非预测;另一方面通过脑电信号可预测癫痫发作,其原理为癫痫发作症状滞后于脑电信号的改变[5],但现有基于脑电信号的癫痫预测方法并未在睡眠时期进行针对性研究,而睡眠状态下的脑电信号与清醒状态下的脑电信号有很大区别[6]。因此,应用现有不针对睡眠脑电信号特点的方法对睡眠中癫痫发作进行预测,会导致特征冗余、计算量增加,并会影响预测精度。综上所述,有必要根据睡眠中脑电信号的特点研究癫痫发作的预测方法,提升睡眠中癫痫发作的预测精度。
现有基于脑电信号预测癫痫发作的方法大部分是基于“特征提取与分类”的模式进行的[7]。目前,特征提取的方法包括如:小波变换(wavelet transform)相关特征[8]、功率谱密度(power spectrum density,PSD)相关特征[9-11]、样本熵(sample entropy)[12]、幅度频率调制信号(amplitude-frequency modulation signal,AM-FM)[13]等。而癫痫脑电信号具有频率变化大、非平稳的特点,因此选择时频特征相关的特征提取方法能够比较好地反映癫痫脑电信号的特点。功率谱是脑电信号分析最常用的特征,表示信号功率随频率的变化情况,因此本文选择功率谱相关的特征用于癫痫发作的预测。支持向量机(support vector machine,SVM)能够较好地解决小样本、非线性、高维数等问题,在分类问题中具有广泛的应用基础,因此本文采用支持向量机作为分类器。
脑电信号中 δ 波段因频率过低,且在清醒状态下不出现,因此现有不针对睡眠脑电信号特点的方法中一般不加入 δ 波段的相关特征[6]。但睡眠状态下脑电信号呈现 δ 波加强,α 波减少甚至消失的趋势,因此本文中加入 δ 波段的相关特征作为研究指标。本文方法具体的步骤为:首先分离头皮脑电信号中包括 δ 波段在内的不同频段信号;其次提取不同频段下脑电信号的绝对功率谱(absolute power spectrum,APS)、相对功率谱(relative power spectrum,RPS)和功率谱比值(power spectrum ratio,PSR)3 种特征,组成混合特征;利用分离性判据和分支定界法(branch and bound,BAB)进行特征选择,构建出表征个体癫痫的特征向量,最后将分类标签(标签由有经验的医生进行分类打标)放入支持向量机训练分类器,利用分类器判断实时脑电信号的状态,如果可以判断为癫痫发作前期,即完成对睡眠中的癫痫发作的预测。最终期望通过本文的研究结果,实现对现有癫痫预测方法的补充,以提升睡眠中癫痫发作的预测精度。
1. 实验数据
本文选取的数据集为波士顿儿童医院与麻省理工大学的头皮脑电信号开源数据库(网址为: http://www.physionet.org/pn6/chbmit)[14]。该头皮脑电数据以国际标准的 10-20 导联系统收集于波士顿儿童医院,所有患者均确诊为难治性癫痫,所有数据的采样频率均为 256 Hz (fs = 256 Hz)。对于该数据集脑电信号状态本文分类如下:发作前 60 min 作为发作前期(preictal)(以符号 C1 表示),发作时作为发作期(ictal,)(以符号 C2 表示),发作后 30 min 作为发作后期(postictal)(以符号 C3 表示),其余的时间作为发作间期(interictal)(以符号 C0 表示)。本文采用该数据集中有睡眠中癫痫发作的 3、10、12、15、16、20 号患者数据,对他们在睡眠状态下发作前期和发作间期的脑电信号数据进行实验分析。为尽量保持平衡,发作间期和发作前期的数据量要相适应,因此对于发作间期数据,本文通过随机采样挑选发作间期的样本,使发作间期数据和发作前期数据在数据量上保持平衡。
2. 方法
为实现预测睡眠中癫痫的发作,本文提出一种基于功率谱相关特征的分类方法,其方法流程如图 1 所示。① 分类器训练阶段:首先对个体脑电信号数据进行预处理,将数据根据时间和频率进行分段;其次提取绝对功率谱、相对功率谱和功率谱比值 3 种特征,组成混合特征;再次针对混合特征进行优化选择,降低特征向量的维数,去掉冗余特征,构建出能有效表征个性癫痫的低维特征向量;最后结合数据标签放入支持向量机训练分类器。② 实时分类阶段:将实时脑电信号通过分类器分类,观察其状态是否为发作前期,从而完成癫痫发作的预测。
图 1.
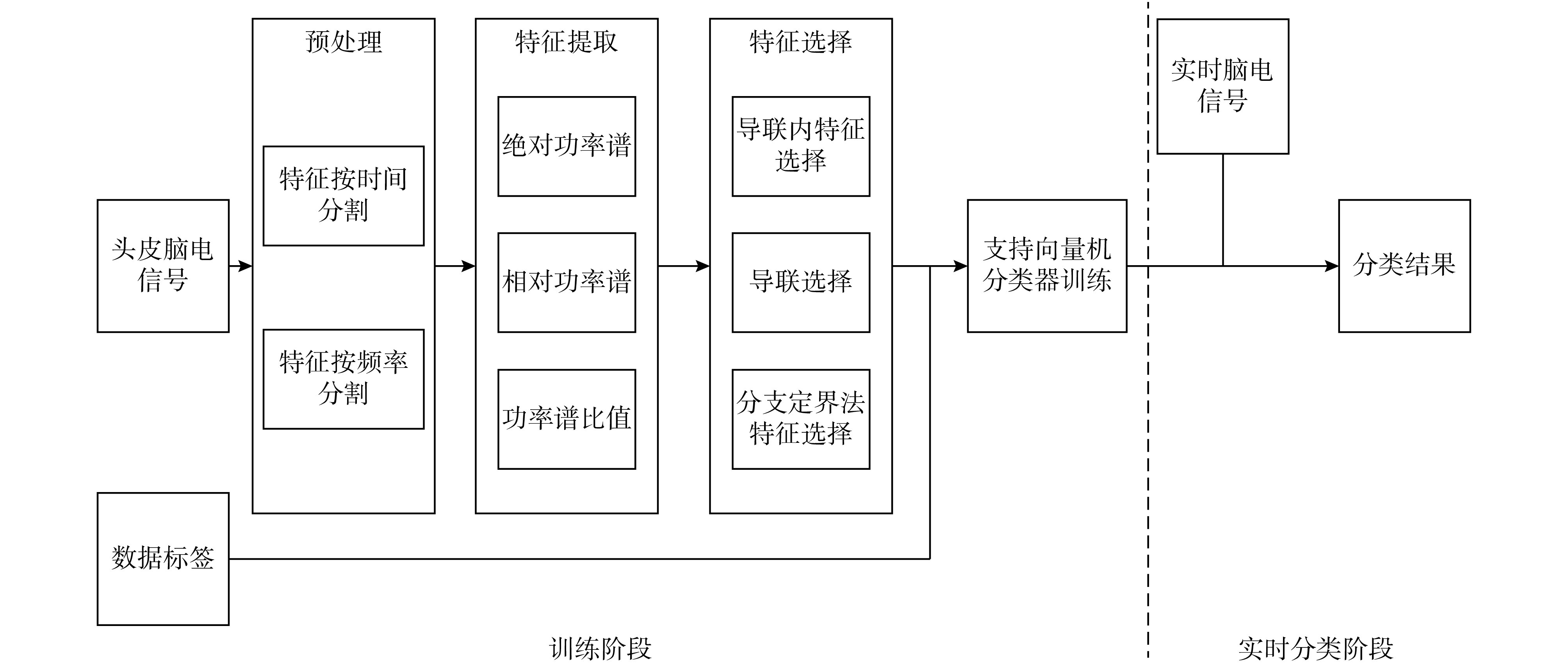
Flowchart of the proposed method
方法流程图
2.1. 预处理
2.1.1. 信号按时间分割
在信号预处理阶段,为了减少计算复杂度和加快计算速度,需要对脑电信号进行分割,形成数据处理的基本单位。每个时间窗口数据的构成如式(1)所示:
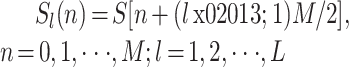 |
1 |
其中,S 为信号序列,M 为每个时间窗的样本长度,L 为时间窗的总数。相邻的 2 个窗口数据有 50% 的重叠部分,则本文中时间窗的长度为 4 s(即 M = 4 × fS)。
2.1.2. 信号按频域分解
本文所要提取的特征为时频特征,因此需要将信号进行频率分解。基于 2.1.1 节的窗口信号,本文首先将信号分解成 9 个波段(分界点频率分到上波段),分别为 δ(1~4 Hz)、θ(4~8 Hz)、α(8~13 Hz)、β(13~30 Hz)、γ1(30~50 Hz)、γ2(50~70 Hz)、γ3(70~90 Hz)、γ4(90~110 Hz)、γ5(110~128 Hz)波段,其中 δ 波段为只在睡眠期间出现的波段,θ、α、β 波段为清醒状态下脑电信号出现的波段,γ 波段则为高频脑电波,主要出现在癫痫发作状态下[15]。
2.2. 特征提取
基于 2.1.2 节的信号数据,提取如下 3 种特征:绝对功率谱、相对功率谱、功率谱比值。这些特征在文献[9, 11, 16]中已经验证可以用于癫痫预测。其中相对功率谱和功率谱比值在错误报警率(false alarm rate,FAR)(以符号 FAR 表示)方面表现较好,但是在灵敏度(sensitivity,SS)(以符号 SS 表示)方面略差,绝对功率谱则相反,在灵敏度方面表现较好,错误报警率方面表现较差。为了得到更好的效果,本文同时对 3 种特征进行提取,并组成混合特征。
2.2.1. 绝对功率谱
绝对功率谱为第 i 个频段中所有功率谱总和的对数。其计算公式如式(2)所示:
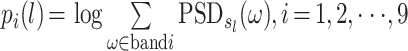 |
2 |
其中,Pi(l)为窗口数据 l 在频段 i 的绝对功率谱。
2.2.2. 相对功率谱
相对功率谱衡量的是第 i 个频段的功率谱之和与全部频段的功率谱之和的比值的对数,如式(3)所示:
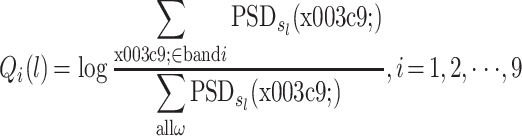 |
3 |
其中,Qi(l)为窗口数据 l 在频段 i 的相对功率谱。
2.2.3. 功率谱比值
功率谱比值定义如式(4)所示:
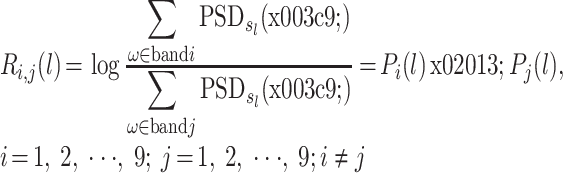 |
4 |
其中,Ri,j(l)表示窗口数据 l 的频段 i 相对于频段 j 的功率谱比值。功率谱比值表示不同频段之间的能量分布变化。对于每个导联,都有
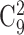 = 36 个功率谱比值特征。
= 36 个功率谱比值特征。
2.2.4. 混合特征
基于 2.2.1~2.2.3 小节所计算的特征向量,构建混合特征。其中每个导联有 54 个特征,包括 9 个绝对功率谱、9 个相对功率谱和 36 个功率谱比值,最终特征向量为F = [P1(l),P2(l),
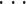 ,P9(l),Q1(l),Q2(l),
,P9(l),Q1(l),Q2(l),
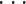 ,Q9(l),R1(l),R2(l),
,Q9(l),R1(l),R2(l),
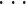 ,R36(l)]T。
,R36(l)]T。
2.3. 特征选择
为了减少冗余特征,并防止分类器过拟合,需要从混合特征中挑选最具有统计意义的特征子集。本文特征选择的方法主要分为 3 步:① 导联内特征选择:利用特征值分析找出每个导联中线性独立的特征子集。② 导联选择:根据可分离性判据 J,选择能够表征癫痫的导联。③ 根据分支定界法进一步对特征进行优化选择。特征选择的标准采用可分离性判据。
可分离性判据是特征选择中重要的选择依据。可分离性判据的计算包含以下步骤:
(1)定义类内距离 Sw 和类间距离 Sb,如式(5)、(6)所示:
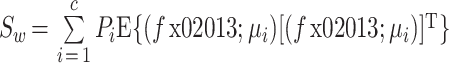 |
5 |
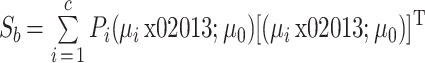 |
6 |
其中 c 代表类的数量,本文中 c 分为发作前期和发作间期两种类别。E{ (f - μi) [ (f - μi)]T}为类别 i 的协方差矩阵,Pi 代表类别 i 的发生概率,μ0 为全部特征向量的平均向量,μi 为类别 i 的特征向量的平均向量。
(2)通过 Sw 和 Sb,得到可分离性判据 J,如式(7)所示:
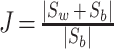 |
7 |
|A|代表矩阵 A 的迹。类内的数据聚类得越集中或者不同类的数据分开得越分散,则 J 值越大;相反,如果类内距离不能很好地集中聚类,或者不同类的数据不能很好地分开,则 J 值变小。对于特征向量来说,特征 J 越大,则表示该特征表征能力越强,越容易被选择。
2.3.1. 导联内特征选择
导联内特征选择可以快速地减少每个导联内的无关特征,是导联选择和利用分支定界法优化特征选择之前必不可少的一步。本文利用分离性判据及特征值分析法,从每个导联的 54 个特征中选择出 R 个特征。
特征值分析法被用来确定 R 的数量,本文对每个导联的特征的协方差矩阵进行特征值分析,并找出其贡献率大于 99% 的特征数量,即为 R 的值。如 3 号患者,贡献率超过 99% 的特征数量为 10,则 R = 10。
确定 R 数量后,本文采取贪婪算法和分离性判据选择出具体的特征。具体步骤为从空集开始,依次添加未被选择的特征中可分离性判据 J 最大的特征,直到选择出 R 个特征。值得注意的是,当特征向量线性相关时,J 可能会出现无限大的情况,这是由于 Sw 亏秩造成的。因此当选择特征线性相关时,即 J 为无限大的时候,将该特征的 J 值设为 0。这种顺序选择方案将产生线性独立的特征向量子集。
2.3.2. 导联选择
导联选择可以根据实际情况,进一步限制特征的数量,避免了过多的计算。在实际情况中,癫痫发作往往只在 1 个或几个脑区中进行,其余脑区对应的导联对于癫痫发作预测来说,只能提供很少的信息量。本文中使用的导联选择标准和特征标准选择一样,具体描述为:从所有导联中选择 k 个导联,如果选出的 k 个导联的混合特征向量的可分离性判据 J 为所有混合特征向量中最大的,即选择这 k 个导联。例如,k = 2,计算导联中所有两个导联组合成的特征向量的可分离性判据 J,选择其中 J 值最大的组合,即为选择的导联。
2.3.3. 基于分支定界法的优化特征选择
为了使特征向量达到最好的分类效果或者说达到最大的可分离性判据 J,本文在特征基础选择和导联选择之后,运用分支定界法从原有的 R × k 个特征中选出最优的 r 个特征。分支定界法是一种常见的优化特征选择方法,其基本思想为将所有可能的特征组合构建成一个树状结构,按照某种特定的规律对树进行搜索,使搜索过程尽可能早地达到最优解而不必遍历整棵树的所有节点。
在文献[17]中,开发了一种有效针对全局最优变量选择的分支定界算法。该法能够有效地选择全局最优的特征向量子集,从而使回归误差最小。f(l) = [f1(l),f2(l),
 ,fR(l)]T 表示为根据窗口数据 l 经过导联内特征选择和导联选择计算得出的特征向量。yl 代表窗口数据 l 的标签。y = [y1,y2,
,fR(l)]T 表示为根据窗口数据 l 经过导联内特征选择和导联选择计算得出的特征向量。yl 代表窗口数据 l 的标签。y = [y1,y2,
 ,yL]T 为类标签向量,F 为特征矩阵,如式(8)所示:
,yL]T 为类标签向量,F 为特征矩阵,如式(8)所示:
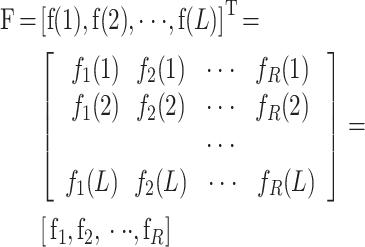 |
8 |
其中,fi(j)为窗口 j 的第 i 个特征。F 中的每一列都为对应窗口 l 的特征向量,F 中的每一行都为对应特征的时间序列。定义 Gr = [fi1,fi2,
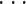 ,fir]为含有 r 变量的 F 矩阵子集,其中 i1,i2,
,fir]为含有 r 变量的 F 矩阵子集,其中 i1,i2,
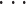 ,ir 为特征的序号。本文选择子集的标准是,当子集 Gr 用最小二乘法计算时,可以达到最小的误差,则该子集即为选择的子集。实际上就是选择一组 i1,i2,
,ir 为特征的序号。本文选择子集的标准是,当子集 Gr 用最小二乘法计算时,可以达到最小的误差,则该子集即为选择的子集。实际上就是选择一组 i1,i2,
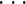 ,ir,使式(9)达到最小。
,ir,使式(9)达到最小。
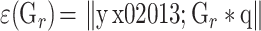 |
9 |
其中,q = (GTG)–1GTy 为最佳投影向量。
在实际应用中,r 是非先验的、未知的。所以需要对 r 进行选择,选择步骤如下:
(1)对每个可能的 r 值(r ∈ {1,2,
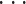 ,R × k}),分别通过分支定界算法选出最优的特征向量子集。
,R × k}),分别通过分支定界算法选出最优的特征向量子集。
(2)对步骤(1)算出的每个特征向量子集,计算它们的 J 值。
(3)对于其中可分离性判据 J 大于阈值的特征向量子集,选出其中最小的 r 值,该 r 值即为最终选择出的 r。
其中,阈值取 0.9 × Jmax,Jmax 为步骤(2)中计算的可分离性判据 J 中的最大值。
通过特征基本选择、导联选择和基于分支定界法的特征优化算法,得出含有 r 个特征的特征向量。
2.4. 基于支持向量机的分类器训练
将上述处理结果通过机器学习的方法进行分类训练,从而判断某个时刻属于癫痫发作前期还是属于癫痫发作间期,如果为前期即进行报警。本文将发作间期数据 C0 编码为–1,发作前期数据 C1 编码为 1。针对每个人的数据集,利用留一法对数据进行训练和测试。本文采用支持向量机中的支持向量分类机(support vector clustering,SVC),核心函数为径向基函数(radial basis function,RBF)。SVC 要解决的优化问题如式(10)所示:
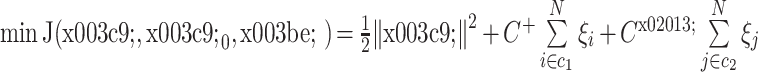 |
10 |
约束于
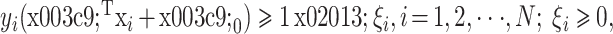
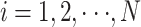 。其中 xi 代表 r 维的特征向量,N 代表用来训练的样本数量,ω 为超平面的方向,ω0 为初始的平面偏移,yi 为训练的标签,ξi 为松弛变量,C+、C– 为惩罚系数。惩罚系数 C+、C– 在如下数组中进行选择(2–3,2–2,
。其中 xi 代表 r 维的特征向量,N 代表用来训练的样本数量,ω 为超平面的方向,ω0 为初始的平面偏移,yi 为训练的标签,ξi 为松弛变量,C+、C– 为惩罚系数。惩罚系数 C+、C– 在如下数组中进行选择(2–3,2–2,
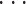 ,22,23)。
,22,23)。
为了解决训练样本非线性问题,引入核函数 Kn,将数据映射到高维空间,以解决原本空间下的线性不可分问题。本文采用的核函数 Kn 为径向基函数,其函数如式(11)所示:
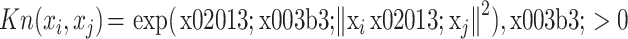 |
11 |
2.5. 脑电信号实时分类
脑电信号经过预处理、特征提取、特征选择,最后利用支持向量机训练得到分类器。此时将实时脑电信号放入分类器中,判断其状态是否为发作前期。如果为发作前期,则进行报警。
3. 实验结果与分析
本文两个重要的评价指标分别为灵敏度、错误报警率。灵敏度和错误报警率定义如式(12)、(13)所示:
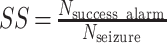 |
12 |
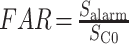 |
13 |
其中,Nsuccess alarm 为成功报警次数,Nseizure 为癫痫发作总次数;Salarm 为在间期进行报警的时间窗数量,SC0 为间期所有时间窗的数量;其中灵敏度越高越好,而错误报警率则越低越好。
3.1. 本文方法的结果
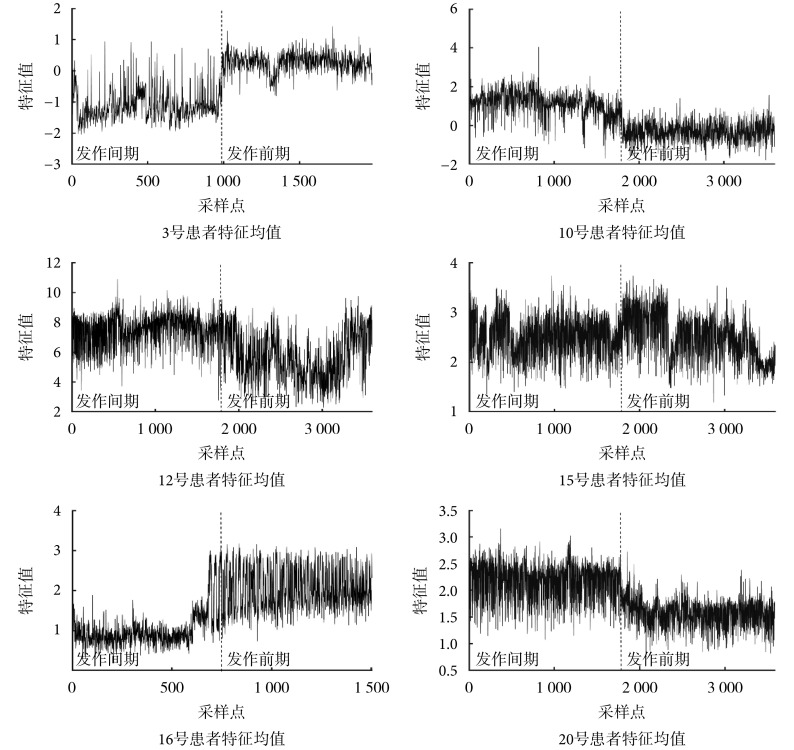
不同患者因致痫区不同等原因,癫痫脑电信号差异过大,故本文采取个性化处理,即每位患者的分类器都单独进行训练,最终得到的分类器采用留一法进行验证得到分类结果,并利用灵敏度与错误报警率对该分类结果进行评价。各组患者发作间期和发作前期特征值变化如图 2 所示,通过特征选择得出的特征及分类结果评价如表 1 所示
图 2.
The mean feature value change between interictal and ictal
癫痫发作间期与发作前期的特征均值变化
表 1. The selected feature after feature selection and the evaluation of seizures prediction.
各组患者经过特征选择所得特征及预测结果评价
| 患者编号 | 选择导联 | 绝对功率谱 | 相对功率谱 | 功率谱比值 | 癫痫发作次数 | 灵敏度 | 错误报警率 |
| 3 | 18 | - | γ2,γ13 | θ/γ2,θ/γ3,α/γ2,β/γ2 | 3 | 100% | 0 |
| 10 | 11 | - | - | β/γ1 | 3 | 100% | 0 |
| 12 | 15 | - | - | α/γ5,β/γ5 | 5 | 100% | 0.57% |
| 15 | 16 | γ2 | - | θ/γ2,γ2/γ5 | 3 | 100% | 4.09% |
| 16 | 2 | γ2 | α | δ/γ2,θ/γ2,α/γ1 | 3 | 100% | 6.56% |
| 20 | 13 | γ2 | γ2 | δ/γ2,θ/γ2,α/γ2,β/γ2,γ1/γ2,γ2/γ3,γ2/γ4,γ3/γ5 | 4 | 100% | 2.27% |
| 平均 | - | - | - | - | 3.5 | 100% | 2.11% |
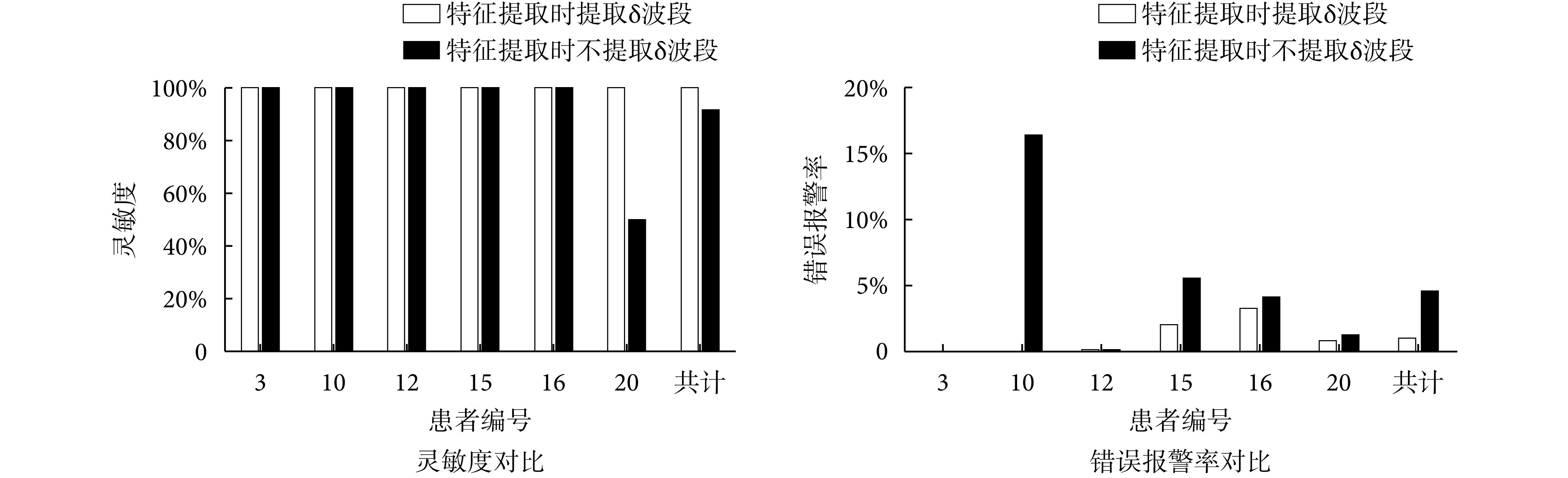
3.2. 本文方法与预测时不加入 δ 波段的方法结果对比
人在清醒状态下脑电信号中不出现 δ 波段,现有癫痫预测或检测算法中在进行频域分割时,不考虑 δ 波段。但 δ 波段是睡眠期间的主要波段,因此本文方法在特征提取阶段加入了 δ 波段。为了体现 δ 波段的效果,对比方法在频域分解阶段,脑电信号不在 δ 波段上进行分解。将对比方法的结果评价与在本文方法的结果评价进行对比。其结果评价对比如图 3 所示。
图 3.
Comparison of results with or without δ band in feature extraction
特征提取阶段提取 δ 波段与不提取 δ 波段的结果评价对比
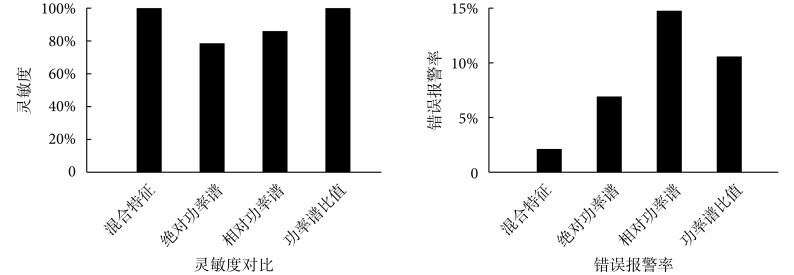
3.3. 本文方法与使用单独功率谱相关特征的方法对比
虽然文献[9, 11, 16]证明绝对功率谱、相对功率谱和功率谱比值可以用来预测癫痫发作,但是每个特征单独用来进行分类器训练都有自己的劣势。为了证明混合特征在预测睡眠中癫痫发作的应用方面的优势,在特征提取阶段,分别提取单独的绝对功率谱、相对功率谱和功率谱比值特征。用这 3 种特征向量分别进行特征选择和分类器训练,得到分类结果,并对结果进行评价。其结果与本文方法即特征提取阶段使用混合特征的结果评价进行对比,对比结果如图 4 所示。
图 4.
Comparison of results obtained by extraction of mixed features, absolute power spectrum, relative power spectrum or power spectrum ratio in feature extraction
特征提取阶段提取混合特征、绝对功率谱、相对功率谱与功率谱比值进行预测的结果评价对比
3.4. 实验结果分析
在灵敏度上,本文方法的灵敏度为 100%,特征提取阶段不加入 δ 波段的方法灵敏度为 91.67%,特征提取阶段使用绝对功率谱的灵敏度为 78.6%,使用相对功率谱的灵敏度为 86.1%,使用功率谱比值的灵敏度为 100%。本文方法和使用功率谱比值的方法都达到了 100% 的灵敏度,特征提取阶段不提取 δ 波段、单独使用绝对功率谱和相对功率谱的方法的灵敏度均低于 100%。因此在灵敏度方面本文方法与单独使用功率谱比值的方法均有较好的效果。
在错误报警率上,本文方法的平均错误报警率为 2.11%,特征提取阶段不加入 δ 波段的方法错误报警率为 9.19%,特征提取阶段使用绝对功率谱的错误报警率为 6.92%,使用相对功率谱的错误报警率为 14.75%,使用功率谱比值的错误报警率为 10.58%。本文方法的错误报警率最低。而在灵敏度方面表现较好的功率谱比值方法,其错误报警率则高达 14.75%。通过灵敏度和错误报警率的对比,体现出本文方法具有良好的预测能力。
4. 结论
现有基于脑电信号的癫痫预测方法中,很少专门研究如何对睡眠中发作的癫痫进行预测。睡眠中发作的癫痫相对于在人体清醒状态时发作的癫痫更难进行及时的救助,且有很大几率会导致多种并发症甚至导致癫痫猝死[1]。对于睡眠脑电信号来说,其特征与清醒时有明显不同。睡眠脑电信号呈现低频率、δ 波段增强、α 波段减弱等特点。如果不针对睡眠脑电信号的特点进行特殊处理就进行预测,很可能造成灵敏度下降或者错误报警率增加。
本文提出了一种基于脑电信号的个性化预测睡眠中癫痫发作的方法,该方法基于脑电信号,提取不同波段的绝对功率谱,相对功率谱和功率谱比值组成混合特征,并根据睡眠脑电信号的特殊性加入了 δ 波段的功率谱相关特征,应用分离性判据和分支定界法方法进行特征选择,最后运用支持向量机对脑电信号进行分类,判断实时输入的脑电信号数据是否为癫痫前期,从而达到预测的结果。对比实验得出,不加入 δ 波段特征方法的灵敏度为 91.67%,错误报警率为 9.19%。本文方法相对于上述方法在敏感度和错误报警率方面都得到提升,得到了 100% 的敏感度和 2.11% 的错误报警率。本方法得到了较好的预测效果,也证明了功率谱特征对于睡眠中的癫痫发作有一定的预测能力。
本文方法对于脑电信号只去除了机器噪声,未进行进一步的去噪处理,这导致一些无关信息也被加入进来,从而降低了运算速度和预测效果。同时本文方法得到的错误报警率,虽然相较不针对睡眠脑电信号特点的方法得到提升,但 2.11% 的错误报警率还不能达到临床级别。因此在以后的工作中,将在降低错误报警率方面和研究快速去噪方法方面继续深入研究,以期使预测更加准确。
Funding Statement
国家高技术研究发展计划(863计划)(2015AA020514);江苏省自然科学基金(BK2012189);江苏省重点研发计划-社会发展(BE2016613);脑功能疾病调控治疗北京市重点实验室开放课题
References
- 1.Langan Y, Nashef L, Sander J W Case-control study of SUDEP. Neurology. 2005;64(7):1131–1133. doi: 10.1212/01.WNL.0000156352.61328.CB. [DOI] [PubMed] [Google Scholar]
- 2.Cuppens K, Lagae L, Ceulemans B, et al Automatic video detection of body movement during sleep based on optical flow in pediatric patients with epilepsy. Med Biol Eng Comput. 2010;48(9):923–931. doi: 10.1007/s11517-010-0648-4. [DOI] [PubMed] [Google Scholar]
- 3.Salem O, Rebhi Y, Boumaza A, et al. Detection of nocturnal epileptic seizures using wireless 3-D accelerometer sensors//IEEE 16th International Conference on E-Health Networking, Applications and Services. Natal, 2014: 237-242
- 4.Fulton S, Poppel K V, Mcgregor A, et al Prospective study of 2 bed alarms for detection of nocturnal seizures. J Child Neurol. 2013;28(11):1430–1433. doi: 10.1177/0883073812462064. [DOI] [PubMed] [Google Scholar]
- 5.刘晓燕. 临床脑电图学. 北京: 人民卫生出版社, 2006: 126-127
- 6.Giannakakis G, Sakkalis V, Pediaditis M, et al. Methods for seizure detection and prediction: an overview. Sakkalis V. Modern Electroencephalographic Assessment Techniques, New York, Hymana Press, 2014: 131-157
- 7.Shoeb A, Edwards H, Connolly J, et al Patient-specific seizure onset detection. Epilepsy Behav. 2004;5(4):483–498. doi: 10.1016/j.yebeh.2004.05.005. [DOI] [PubMed] [Google Scholar]
- 8.Fathima T, Bedeeuzzaman M, Farooq O, et al Wavelet based features for epileptic seizure detection. MES Journal of Technology and Management. 2011;2(1):108–112. [Google Scholar]
- 9.Park Y, Luo Lan, Parhi K K, et al Seizure prediction with spectral power of EEG using cost-sensitive support vector machines. Epilepsia. 2011;52(10):1761–1770. doi: 10.1111/j.1528-1167.2011.03138.x. [DOI] [PubMed] [Google Scholar]
- 10.Alarcon G, Binnie C D, Elwes R D, et al Power spectrum and intracranial EEG patterns at seizure onset in partial epilepsy. Electroencephalogr Clin Neurophysiol. 1995;94(5):326–337. doi: 10.1016/0013-4694(94)00286-t. [DOI] [PubMed] [Google Scholar]
- 11.Bandarabadi M, Teixeira C A, Rasekhi J, et al Epileptic seizure prediction using relative spectral power features. Clin Neurophysiol. 2015;126(2):237–248. doi: 10.1016/j.clinph.2014.05.022. [DOI] [PubMed] [Google Scholar]
- 12.Fergus P, Hussain A, Hignett D, et al A machine learning system for automated whole-brain seizure detection. Applied Computing & Informatics. 2016;12(1):70–89. [Google Scholar]
- 13.Lyu M R, Wang N. Exploration of instantaneous amplitude and frequency features for epileptic seizure prediction// IEEE 12th International Conference on Bioinformatics & Bioengineering, Larnaca, 2012: 292-297
- 14.Goldberger A L, Amaral L A, Glass L, et al PhysioBank, PhysioToolkit, and PhysioNet: components of a new research resource for complex physiologic signals. Circulation. 2000;101(23):E215–E220. doi: 10.1161/01.cir.101.23.e215. [DOI] [PubMed] [Google Scholar]
- 15.Worrell G A, Parish L, Cranstoun S D, et al High-frequency oscillations and seizure generation in neocortical epilepsy. Brain. 2004;127(Pt 7):1496–1506. doi: 10.1093/brain/awh149. [DOI] [PubMed] [Google Scholar]
- 16.Bandarabadi M, Teixeira C A, Netoff T I, et al. Robust and low complexity algorithms for seizure detection//36th Annual International Conference of the IEEE Engineering in Medicine and Biology Society, Chicago,2014: 4447-4450
- 17.Kariwala V, Ye Lingjian, Cao Yi Branch and bound method for regression-based controlled variable selection. Comput Chem Eng. 2013;54:1–7. [Google Scholar]