Abstract
孤独症谱系障碍(ASD)是一种涉及多种神经系统的复杂发育障碍性疾病,主要表现为社交沟通障碍以及刻板行为。脑电图(EEG)测量与皮层突触活动相关的神经电生理变化,对检查者无损伤,已被证明是检测神经疾病的有力工具。为深入研究低频重复经颅磁刺激(rTMS)应用于 ASD 患者康复的作用,本文招募 32 名 ASD 被试,其中 16 名 ASD 患者作为实验组,16 名 ASD 患者作为对照组,用频率为 1 Hz 的 rTMS 调控实验组,基于快速傅里叶变换提取额叶、顶叶、左颞叶、右颞叶、枕叶五个脑区的节律,用非参数估计中的 Welch 法计算四个频段的相对功率及额叶内通道之间的相干性,并分析所有 ASD 被试干预前后静息态脑电特征值的变化。统计实验组干预前后的孤独症行为量表(ABC),计算并比较干预前后各项指标得分。结果显示经过 rTMS 干预之后,ASD 患者右颞叶和顶叶 δ 频段的相对功率普遍降低,额叶通道之间的相干性降低。此研究表明 rTMS 能够改善 ASD 患者的注意力、执行能力、语言能力,减少刻板行为和过激行为。
Keywords: 孤独症, 相对功率, 相干性, 脑电
Abstract
Autism spectrum disorders (ASD) is a complex developmental disorder characterized by impairments in social communication and stereotyped behaviors. Electroencephalograph (EEG), which can measure neurological changes associated with cortical synaptic activity, has been proven to be a powerful tool for detecting neurological disorders. The main goal of this study is to explore the effects of repetitive transcranial magnetic stimulation (rTMS) on behavioral response and EEG. We enrolled 32 autistic children, rTMS group (n = 16) and control group (n = 16) and calculated the relative power of the δ, θ, α, β rhythms in each brain area by fast Fourier transform and Welch’s method. We also compared Autism Behavior Checklist (ABC) scores of the patients before and after rTMS. The results showed a significant decrease in the relative power of the δ band on right temporal region and parietal region and also a decreased coherence on frontal region after rTMS intervention. The study proves that rTMS could have positive effects on behavior of attention, execution ability, and language ability of children and could reduce their stereotyped behavior and radical behavior.
Keywords: autism spectrum disorder, relative power, coherence, electroencephalogram
引言
孤独症谱系障碍(autism spectrum disorder,ASD)是一种涉及多种神经系统的发育障碍性疾病,主要表现为社交沟通障碍以及刻板行为。相关文献表明,孤独症患者对周围环境的感觉与视觉感知存在异常[1-2]。根据美国疾病控制与预防中心的最新数据显示,孤独症的发病率已经达到 1/68[3]。随着孤独症发病率的急剧增加,治疗 ASD 已经成为全球热点话题。到目前为止,ASD 的发病机制没有得到一致的确认,能够针对孤独症核心症状进行治疗的药物极少。同时,ASD 的诊断和定义仅依靠行为和量表进行评估,缺乏客观评估依据。
脑电图是测量皮层神经元间电活动的神经电生理变化的有力工具,对测量者无损伤,常应用于多种神经精神障碍的研究。静息态脑电一般分为五种频段:δ_(1~4 Hz)、θ_(4~8 Hz)、α_(8~13 Hz)、β_(13~30 Hz)和 γ_(30~100 Hz)。不同的频段与不同的认知记忆综合功能相关[4]。其中,δ 频段覆盖全脑区,与注意力相关,δ 频段过多,导致注意力不集中[5]。有研究发现 ASD 儿童患者在功率谱能量上与正常人有很大区别,正常人脑电特征呈倒“U”型,低频和高频能量分布较少,中间频段能量分布较多;而 ASD 儿童的功率谱能量分布呈“U”型,低频和高频能量分布过多,而中间频段能量分布过少,与正常儿童正好相反[6]。另外,在 ASD 儿童的额叶、顶叶、右颞叶区都发现 δ 频段的相对功率和绝对功率过大,且分布广泛。因为 δ 频段的振荡可以引起神经元抑制/兴奋失衡,从而可造成 ASD 患者额叶和颞叶皮层中的神经元和连通性被破坏。有文献证实,δ 频段能量分布过高在低功能[即智力商数(intelligence quotient,IQ)< 80]ASD 患者中影响最为严重,其中超过 20% 的 ASD 患者处于大脑发育迟缓状态[7]。
ASD 患者大脑异常连接与其核心症状有着非常紧密的关系。有研究表明,ASD 患者大脑连接性存在长距离连接缺乏而短距离连接过剩的特点,在额叶尤为突出[8]。额叶同其他脑区的连接不足,而额叶脑区内部却连接过剩。这种异常连接直接导致孤独症患者对外来信息无法进行辨识加工,进而不能作出准确回应。
ASD 的康复问题已经引起全世界范围内越来越多的关注,其中,低频重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)以其安全有效和非侵入性的特点成为近年来治疗神经性疾病的有力工具[9]。TMS 是一种无创神经调控技术,能够通过对特定脑区的刺激改变皮层内神经回路的电活动,调节神经元抑制/兴奋,从而改变 ASD 患者的个体感知与社会交往能力。rTMS 作为一种非侵入式手段,可以改变皮层内神经元的兴奋性,并且能够通过改变刺激的部位和参数达到对不同神经疾病进行治疗的效果。文献表明 rTMS 技术已经应用到治疗抑郁症、多动症、阿尔兹海默症、精神分裂症、戒除烟瘾,以及提高学习能力等方面[10-15]。本研究将低频 rTMS 技术应用于 ASD 儿童康复中,并对干预前后脑电信号的变化作出阐述分析。
1. 材料与方法
1.1. 被试
入组患者均由儿童神经科医生根据《精神病诊断与统计手册》(第五版)和《孤独症诊断访谈量表》(修订版)进行诊断确定,并由儿科医生通过第五版儿童韦氏智力测试量表测得 IQ < 80。入组被试共 32 名,其中实验组 16 名,14 男 2 女,均为右利手,年龄为(6.68 ± 0.6)岁,IQ 为(66.56 ± 7.8)分,详细情况如 表 1 所示。对照组 16 名,基本情况与实验组一一对应。详细情况如表 2 所示。将两组被试的年龄和 IQ 进行独立样本 t 检验,年龄:t = 0,P = 1;IQ:t = –0.479,P = 0.635。因此,两组被试基本情况相似,有可比性。
表 1. Subjects’ information record in trial group.
实验组被试信息记录表
| 受试者 | 性别 | 年龄/岁 | 利手 | 诊断情况 | IQ/分 |
| S1 | 女 | 6 | 右 | 孤独症 | 56 |
| S2 | 男 | 7 | 右 | 发育迟缓 | 72 |
| S3 | 男 | 7 | 右 | 孤独症 | 65 |
| S4 | 男 | 6 | 右 | 可疑孤独症 | 70 |
| S5 | 男 | 7 | 右 | 孤独症 | 63 |
| S6 | 男 | 8 | 右 | 阿斯伯格综合征 | 74 |
| S7 | 男 | 6 | 右 | 发育迟缓 | 60 |
| S8 | 男 | 7 | 右 | 阿斯伯格综合征 | 78 |
| S9 | 男 | 7 | 右 | 阿斯伯格综合征 | 76 |
| S10 | 男 | 6 | 右 | 可疑孤独症 | 70 |
| S11 | 男 | 7 | 右 | 孤独症 | 61 |
| S12 | 男 | 7 | 右 | 可疑孤独症 | 67 |
| S13 | 男 | 6 | 右 | 阿斯伯格综合征 | 78 |
| S14 | 女 | 6 | 右 | 孤独症 | 52 |
| S15 | 男 | 7 | 右 | 发育迟缓 | 59 |
| S16 | 男 | 7 | 右 | 发育迟缓 | 64 |
表 2. Subjects’ information record in control group.
对照组被试信息记录表
| 受试者 | 性别 | 年龄/岁 | 利手 | 诊断情况 | IQ/分 |
| N1 | 女 | 7 | 右 | 孤独症 | 60 |
| N2 | 女 | 6 | 右 | 可疑孤独症 | 70 |
| N3 | 男 | 5 | 右 | 孤独症 | 67 |
| N4 | 男 | 7 | 右 | 孤独症 | 68 |
| N5 | 男 | 7 | 右 | 孤独症 | 63 |
| N6 | 男 | 8 | 右 | 阿斯伯格综合征 | 70 |
| N7 | 男 | 6 | 右 | 孤独症 | 65 |
| N8 | 男 | 6 | 右 | 阿斯伯格综合征 | 75 |
| N9 | 男 | 6 | 右 | 可疑孤独症 | 72 |
| N10 | 男 | 7 | 右 | 孤独症 | 68 |
| N11 | 男 | 7 | 右 | 孤独症 | 63 |
| N12 | 男 | 7 | 右 | 可疑孤独症 | 65 |
| N13 | 男 | 7 | 右 | 孤独症 | 58 |
| N14 | 男 | 6 | 右 | 孤独症 | 52 |
| N15 | 男 | 8 | 右 | 发育迟缓 | 50 |
| N16 | 男 | 7 | 右 | 阿斯伯格综合征 | 78 |
所有参与该研究的被试者及其父母均会获得有关此项研究的相关信息,包括研究的目的、要求、程序、风险、权益,并签署知情同意书。
1.2. 数据与实验设计
1.2.1. 量表评估
孤独症行为量表(Autism Behavior Checklist,ABC)评估是一种用来评估和筛选 ASD 患者严重程度的问卷调查。要求患者看护人员或父母(与患者共同生活一个月以上的人)根据患者行为表现,用“是”或“否”的回答来完成问卷。问卷共有 57 个子项,包含五个功能区:感觉能力、语言能力、交往能力、运动能力、自我照顾能力。每个子项分数各异,将每个功能区回答“是”的每个子项对应分数相加,得到各功能区分数,最后将每个功能区分数相加得到总分数。研究表明,各功能区分数与孤独症严重程度呈正相关,得分越高症状越严重,大于等于 67 分则诊断为孤独症[16]。
在实验开始之前对被试监护者详细解释 ABC 量表内容,要求监护者花 15~20 min 完成量表填写,并由研究人员计算量表得分。
1.2.2. 脑电数据的采集
本研究采用由美国 EGI(Electrical Geodesic IC)公司按照 10–20 国际标准导联设计的高密度 128 通道网状电极帽和放大器设备进行脑电数据采集。采样频率是 1 000 Hz,参考电极为 Cz,电极帽与头皮之间的阻抗要求低于 50 kΩ。共记录 128 通道的脑电数据,选择其中 62 个通道进行分析。采集过程中,要求被试在屏蔽室中处于安静放松状态。
基于 MATLAB 与 EEGLAB 工具包对数据进行预处理。主要包括:① 坏通道数据替换,本文将阻抗大于 50 kΩ 或信号幅值大于 200 μV 的通道认定为坏通道,基于相邻通道数据对坏通道进行插值;② 通过 0.5~45 Hz 的带通滤波;③ 基于独立成分分析(independent component analysis,ICA)算法去除眼动、眨眼、肌电等伪迹信号;④ 对所有通道进行平均参考,进一步基于视觉剔除不好的数据段,最后将数据截成时长为 4 s 的非重叠数据段。
1.2.3. TMS 干预方案
本研究中使用的经颅磁刺激仪设备是英国 Magstim 公司生产的 Magstim Rapid 220 系统,“8”字形线圈。首次治疗时需确定运动阈值(motion threshold,MT),受试者取端坐位,以“8”字线圈中心置于受试者颞部皮层,通过磁刺激仪的肌电放大器在对侧手部鱼际肌记录运动诱发电位(motor evoked potentials,MEP),调整刺激部位和刺激量至 10 次刺激中至少有 5 次诱发的 MEP 波幅大于 50 μV,此时的刺激输出量即为 MT,在引出 MEP 部位水平前移 4~5 cm,该部位为背外侧前额叶皮层(dorsolateral prefrontal cortex,DLPFC)。
对实验组 ASD 进行每周 2 次、为期 9 周的 rTMS 干预:在整个干预中,rTMS 的频率参数为 1 Hz,每次干预施加 18 组脉冲,每组 10 个,组间间隔 20 s,即孤独症被试每次被施加 180 个频率为 1 Hz 的磁场脉冲,强度 90% MT。rTMS 干预的位置是左右侧 DLPFC,其中前 6 次干预施加于左侧 DLPFC,中间 6 次施加于右侧 DLPFC,最后 6 次干预施加两侧 DLPFC(左侧 90 组脉冲,右侧 90 组脉冲)。在刺激之前,将线圈放于被试者 DLPFC,线圈与头部接触,使线圈平面与头部保持切线。
对照组 ASD 儿童每周接受 2 次 TMS 伪刺激,即将 TMS 设备放置在对照组被试的 DLPFC 位置,方案设计和操作与实验组一致,设备处于关机状态,并在患者耳边播放提前录好的 TMS 刺激时的声音。
低频 1 Hz 刺激能够增强神经元的抑制作用,同时使癫痫发作的风险降低[17]。根据之前采用 rTMS 来干预精神和神经疾病患者前额叶的报道,刺激强度设置为 90% MT[18]。相关文献表明,若 TMS 刺激脉冲数少于 100,每周刺激一次,则刺激对患者没有功效[19]。因此,本研究中将 TMS 刺激频率设置成 1 Hz,每次干预脉冲数为 180 个。根据 Casanova 教授提出的孤独症“微柱”病变理论,“微柱”结构病变使大脑皮层内抑制神经元减少,引起神经元抑制兴奋比失调,进而导致孤独症患者在信息加工和情绪控制方面的异常,在前额叶“微柱”结构异变尤为突出,因此,将刺激部位选择在背外侧前额叶。本实验已经通过认知神经科学与学习国家重点实验室伦理审查委员会审查。
2. 数据分析
2.1. 功率谱分析
功率谱密度用来描述随机信号的能量随频率变化的关系。计算功率谱通常有两种方法,非参数估计法和参数估计法。此次研究中采用非参数估计中的 Welch 法,此方法是平均周期图法的改进,分段数据可以重叠,每个分段数据使用加窗运算。在频域分析上,加窗的作用是平滑原功率谱,为了减少能量泄露,使用汉宁窗作为窗函数。先分别计算 δ、θ、α、β 四个频段的绝对功率及总功率,各个频段的绝对功率与总功率的比值即为相对功率。然后用配对 t 检验比较每个脑区内在干预前后 δ 频段相对功率的变化趋势,检验水准 α = 0.05,当 P < 0.05 时,差异具有统计意义,并进行 Bonferroni 校正 [20]。
2.2. 相干性的计算
在静息状态下,在同一频段上通道之间存在着某种同步活动,我们用相干度来衡量通道之间的相关性。前文提到,ASD 患者的大脑功能连接异常,脑功能网络的长距离连接不足和短距离连接过高,前额叶连接缺陷尤为突出,导致患者在情绪控制和社会认知上受到损害。本文研究 ASD 患者 δ 频段的额叶脑区内 17 个通道之间的相干性。先选取一个通道作为研究对象,然后求出其他各个通道和这个通道的相关系数,其他通道与此通道类似。用 Welch 方法,得到输入信号
 、
、
 幅值平方的相干性估计
幅值平方的相干性估计
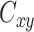 ,公式如下[21],
,公式如下[21],
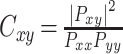 |
1 |
其中
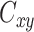 是频率谱密度的函数,其值介于 0 和 1 之间,表示在每个频段
是频率谱密度的函数,其值介于 0 和 1 之间,表示在每个频段
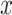 与
与
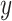 的相关程度。
的相关程度。
 代表
代表
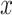 通道的功率谱密度,
通道的功率谱密度,
 代表
代表
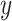 通道的功率谱密度,
通道的功率谱密度,
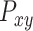 代表
代表
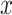 通道和
通道和
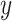 通道的交叉功率谱密度。
通道的交叉功率谱密度。
3. 结果
3.1. δ 频段相对功率谱比较
实验组和对照组 ASD 背外侧前额叶区域施加 18 组 TMS 干预之后,分析干预前后各脑区 δ 频段的相对功率,进行配对 t 检验,并对检验结果进行 Bonferroni 校正,结果如图 1 所示。
图 1.
Comparison of re-power of delta band in each brain area between the two groups (*P < 0.05)
两组被试各脑区 δ 频段相对功率比较(*P < 0.05)
实验组主要结果如下:
(1)经过干预之后,16 名被试顶叶脑区 δ 相对功率均有明显的降低(t 检验,P = 0.03),校正之后,差异具有统计学意义(P = 0.012)。
(2)经过干预之后,16 名被试右颞叶脑区 δ 相对功率均有明显下降的趋势(t 检验,P = 0.06),校正之后,差异具有统计学意义(P = 0.024)。
(3)经过干预之后,16 名被试左颞叶脑区 δ 相对功率均有下降的趋势((t 检验,P = 0.014),但校正之后,差异无统计学意义(P = 0.056)。
(4)经过干预之后,16 名被试额叶脑区 δ 相对功率均有下降的趋势,但 t 检验显示差异无统计学意义(P = 0.276)。
(5)经过干预之后,16 名被试枕叶脑区 δ 相对功率有下降的趋势,但 t 检验显示差异无统计学意义(P = 0.136)。
对照组在 TMS 干预前后的各脑区相对功率均无明显差异。
3.2. 短距离相干性比较
在 TMS 干预之后,实验组 ASD 患者额叶脑区内 δ 频段相干性显著降低(t = 3.409,P = 0.028),而对照组 ASD 患者在干预前后则无显著差异。额叶脑区内相干性结果如图 2 所示。
图 2.
Comparison of coherence in frontal lobe (*P < 0.05)
额叶脑区内相干性比较(*P < 0.05)
3.3. ABC 量表各项指标比较
实验组 ASD 在 rTMS 干预之后,ABC 量表分项评分及总评分均有明显下降,结果如表 3 所示,表中含干预前得分/干预后得分,以及干预后的变化趋势。
表 3. The ABC scale score of each subject before and after rTMS.
每位被试干预前后 ABC 量表得分
| 被试 | S | R | B | L | S | 总分 | |||||||||||
| 前/后 | 变化 | 前/后 | 变化 | 前/后 | 变化 | 前/后 | 变化 | 前/后 | 变化 | 前/后 | 变化 | ||||||
| 注:S:感觉能力;R:交往能力;B:运动能力;L:语言能力;S:自我照顾能力。↓:干预前 > 干预后;↑:干预前 < 干预后;“—”干预前 = 干预后 | |||||||||||||||||
| S1 | 24/20 | ↓ | 25/23 | ↓ | 27/31 | ↑ | 19/8 | ↓ | 10/16 | ↑ | 105/98 | ↓ | |||||
| S2 | 4/6 | ↑ | 13/5 | ↓ | 0/3 | ↑ | 6/11 | ↑ | 18/15 | ↓ | 41/40 | ↓ | |||||
| S3 | 14/15 | ↑ | 13/11 | ↓ | 18/5 | ↓ | 26/22 | ↓ | 18/13 | ↓ | 89/66 | ↓ | |||||
| S4 | 7/6 | ↓ | 18/11 | ↓ | 9/3 | ↓ | 10/6 | ↓ | 9/7 | ↓ | 53/33 | ↓ | |||||
| S5 | 22/20 | ↓ | 22/17 | ↓ | 2/5 | ↑ | 13/18 | ↑ | 9/6 | ↓ | 68/66 | ↓ | |||||
| S6 | 15/8 | ↓ | 15/7 | ↓ | 6/4 | ↓ | 5/10 | ↑ | 11/13 | ↑ | 52/42 | ↓ | |||||
| S7 | 12/14 | ↑ | 11/10 | ↓ | 3/4 | ↑ | 12/9 | ↓ | 8/10 | ↑ | 47/47 | — | |||||
| S8 | 0/0 | — | 0/0 | — | 14/11 | ↓ | 6/8 | ↑ | 12/5 | ↓ | 32/24 | ↓ | |||||
| S9 | 14/10 | ↓ | 16/9 | ↓ | 0/0 | — | 5/4 | ↓ | 5/7 | ↑ | 40/30 | ↓ | |||||
| S10 | 17/16 | ↓ | 15/12 | ↓ | 0/2 | ↑ | 10/9 | ↓ | 16/15 | ↓ | 58/54 | ↓ | |||||
| S11 | 12/10 | ↓ | 11/11 | — | 26/22 | ↓ | 9/10 | ↑ | 12/10 | ↓ | 70/63 | ↓ | |||||
| S12 | 18/20 | ↑ | 24/13 | ↓ | 4/4 | — | 14/10 | ↓ | 12/16 | ↑ | 72/63 | ↓ | |||||
| S13 | 8/10 | ↑ | 13/9 | ↓ | 0/2 | ↑ | 12/4 | ↓ | 8/8 | — | 41/33 | ↓ | |||||
| S14 | 18/11 | ↓ | 19/20 | ↑ | 28/26 | ↓ | 16/6 | ↓ | 19/15 | ↓ | 100/78 | ↓ | |||||
| S15 | 21/21 | ↑ | 14/12 | ↓ | 22/16 | ↓ | 12/8 | ↓ | 11/12 | ↑ | 80/69 | ↓ | |||||
| S16 | 7/4 | ↓ | 13/7 | ↓ | 0/2 | ↑ | 13/6 | ↓ | 12/10 | ↓ | 45/29 | ↓ | |||||
| 均值 | 13 ± 6.76/12 ± 6.38 | 15 ± 5.94/11 ± 5.57 | 10 ± 10.83/9 ± 9.66 | 12 ± 5.50/9 ± 4.73 | 12 ± 4.01/11 ± 3.76 | 62 ± 22.39/52 ± 20.83 | |||||||||||
| t 值 | – 1.828 | – 4.653 | – 1.065 | – 1.903 | – 0.873 | – 5.558 | |||||||||||
| P 值 | 0.088 | < 0.001 | 0.304 | 0.076 | 0.396 | < 0.001 | |||||||||||
经过统计得出:在感觉能力方面,有 9 名被试得分降低;在交往能力方面,有 13 名被试得分降低;在运动能力方面,有 7 名被试得分降低;在语言能力方面,有 11 名被试得分降低;在自我照顾方面,有 9 名被试得分降低。结果说明 rTMS 调控 ASD 可以增强被试的注意力、控制力、理解力、逻辑能力和语言能力,减少刻板行为和过激行为。
4. 讨论与总结
额叶脑区负责信息的理解与加工以及情绪和行为的控制,是精神与思维主要的活动场所。本文采用低频 rTMS 刺激背外侧前额叶,研究 rTMS 对孤独症患者大脑 δ 频段在各个脑区相对功率及额叶脑区内相干性的影响。之前研究大多针对高功能(IQ > 80)孤独症患者进行报道,高功能孤独症患者在经过 rTMS 干预之后,在错觉事物辨识、错误检测、对新奇事物的处理方面有显著提高 [22-23]。有研究发现,高频 TMS 干预之后低功能患者的眼手协调性增强,但高频干预有诱发癫痫的风险[24]。本文研究低频 rTMS 对低功能患者的影响,而低功能孤独症患者主要存在情绪和行为控制、语言表达、交往能力方面的障碍;经过低频 rTMS 干预之后,患者的注意力、理解能力和言语表达能力有所改善,刻板行为减少,情绪稳定。
δ 频段的振荡主要与认知领域的注意力和潜意识有关[5]。根据相关文献,δ 频段的能量与患者大脑发育呈负相关,与孤独症核心症状呈正相关[6]。本研究中,经过 rTMS 干预之后,被试五个脑区 δ 频段相对功率明显降低,在顶叶、右颞叶尤为突出。
在额叶脑区内,δ 频段短连接过多,孤独症患者脑部受损严重,造成孤独症患者无法准确对外来的信息进行加工,做出相应的反应。被试接受低频 rTMS 干预后,额叶区内相干性明显下降,脑区内的连接减少。
低频 rTMS 对孤独症进行调控干预还处于研究阶段,因此,实验参数和设计的普遍性有待商榷。本文的研究工作为改善低功能孤独症患者的情绪控制和注意力缺陷提供了一定的科学依据。
Funding Statement
国家重点研发计划重点专项(2016YFC1306203)
References
- 1.Toru T Autism spectrum disorders. Nihon Rinsho Japanese Journal of Clinical Medicine. 2012;80(2):2–11. [Google Scholar]
- 2.Happé F Autism: cognitive deficit or cognitive style? Trends in Cognitive Sciences. 1999;3(6):216–222. doi: 10.1016/s1364-6613(99)01318-2. [DOI] [PubMed] [Google Scholar]
- 3.Blumberg S J, Bramlett M D, Kogan M D, et al Changes in prevalence of parent-reported autism spectrum disorder in school-aged U.S.children:2007 to 2011-2012. Natl Health Stat Report. 2013;(65):1–11. [PubMed] [Google Scholar]
- 4.Başar E Gamma, alpha, delta, and theta oscillations govern cognitive processes. Int J Psychophysiol. 2001;39(2/3):241–248. doi: 10.1016/s0167-8760(00)00145-8. [DOI] [PubMed] [Google Scholar]
- 5.Knyazev G G EEG delta oscillations as a correlate of basic homeostatic and motivational processes. Neurosci Biobehav Rev. 2012;36(1):677–695. doi: 10.1016/j.neubiorev.2011.10.002. [DOI] [PubMed] [Google Scholar]
- 6.Wang Jun, Barstein J, Ethridge L E, et al Resting state EEG abnormalities in autism spectrum disorders. J Neurodev Disord. 2013;5(1):24. doi: 10.1186/1866-1955-5-24. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Stroganova, T A, Nygren G, Tsetlin M M, et al Abnormal EEG lateralization in boys with autism. Clin Neurophysiol. 2007;118(8):1842–1854. doi: 10.1016/j.clinph.2007.05.005. [DOI] [PubMed] [Google Scholar]
- 8.Shou Guofa, Mosconi M W, Wang Jun, et al Electrophysiological signatures of atypical intrinsic brain connectivity networks in autism. J Neural Eng. 2017;14(4):046010. doi: 10.1088/1741-2552/aa6b6b. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Klooster D C W, de Louw A J A, Aldenkamp A P, et al Technical aspects of neurostimulation: Focus on equipment, electric field modeling, and stimulation protocols. Neuroscience & Biobehavioral Reviews. 2016;65:113–141. doi: 10.1016/j.neubiorev.2016.02.016. [DOI] [PubMed] [Google Scholar]
- 10.Baeken C, De Raedt R Neurobiological mechanisms of repetitive transcranial magnetic stimulation on the underlying neurocircuitry in unipolar depression. Dialogues in Clinical Neuroscience. 2011;13(1):139–145. doi: 10.31887/DCNS.2011.13.1/cbaeken. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Zaman R Transcranial magnetic stimulation (TMS) in Attention Deficit Hyperactivity Disorder (ADHD) Psychiatr Danub. 2016;28(Suppl 1):S99. [PubMed] [Google Scholar]
- 12.Devi G, Voss H U, Levine D, et al Open-label, short-term, repetitive transcranial magnetic stimulation in patients with Alzheimer's disease with functional imaging correlates and literature review. Am J Alzheimers Dis Other Demen. 2014;29(3):248–255. doi: 10.1177/1533317513517047. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Schulz T, Berger C, Krecklow B, et al Repetitive transcranial magnetic stimulation (rTMS) in schizophrenia with treatment-refractory auditory hallucinations and major self-mutilation. J Neural Transm. 2015;122(1):19–23. doi: 10.1007/s00702-013-1151-5. [DOI] [PubMed] [Google Scholar]
- 14.Pripfl J, Tomova L, Riecansky I, et al Transcranial magnetic stimulation of the left dorsolateral prefrontal cortex decreases cue-induced nicotine craving and EEG delta power. Brain Stimul. 2014;7(2):226–233. doi: 10.1016/j.brs.2013.11.003. [DOI] [PubMed] [Google Scholar]
- 15.Cho S S, Yoon E J, Lee J M, et al Repetitive transcranial magnetic stimulation of the left dorsolateral prefrontal cortex improves probabilistic category learning. Brain Topogr. 2012;25(4):443–449. doi: 10.1007/s10548-012-0242-1. [DOI] [PubMed] [Google Scholar]
- 16.Fernandes F D, Miilher L P Relations between the Autistic Behavior Checklist (ABC) and the functional communicative profile. Pró-Fono Revista de Atualização Científica. 2008;20(2):111–116. doi: 10.1590/s0104-56872008000200007. [DOI] [PubMed] [Google Scholar]
- 17.Sokhadze E, Baruth J, Tasman A Low-frequency repetitive transcranial magnetic stimulation (rTMS)affects Event-Related potential measures of novelty processing in autism. Appl Psychophysiol Biofeedback. 2010;35(2):147–161. doi: 10.1007/s10484-009-9121-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Casanova M F, Hensley M K, Sokhadze E M, et al Effects of weekly low-frequency rTMS on autonomic measures in children with autism spectrum disorder. Frontiers in Human Neuroscience. 2014;8:851. doi: 10.3389/fnhum.2014.00851. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Maeda F, Keenan J P, Tormos J M, et al Modulation of corticospinal excitability by repetitive transcranial magnetic stimulation. Clin Neurophysiol. 2000;111(5):800–805. doi: 10.1016/s1388-2457(99)00323-5. [DOI] [PubMed] [Google Scholar]
- 20.Ranstam J Multiple p-values and Bonferroni correction. Osteoarthritis Cartilage. 2016;24(5):763. doi: 10.1016/j.joca.2016.01.008. [DOI] [PubMed] [Google Scholar]
- 21.Wang Y, Li J, Stoica P Spectral analysis of signals: The missing data case. San Rafael: Morgan & Claypool Publishers. 2006:102. [Google Scholar]
- 22.Daskalakis Z J, Christensen B K, Fitzgerald P B, et al Transcranial magnetic stimulation: a new investigational and treatment tool in psychiatry. J Neuropsychiatry Clin Neurosci. 2002;14(4):406–415. doi: 10.1176/jnp.14.4.406. [DOI] [PubMed] [Google Scholar]
- 23.Helmich R C, Siebner H R, Bakker M A, et al Repetitive transcranial magnetic stimulation to improve mood and motor function in Parkinson's disease. J Neurol Sci. 2006;248(1/2):84–96. doi: 10.1016/j.jns.2006.05.009. [DOI] [PubMed] [Google Scholar]
- 24.Panerai S, Tasca D, Lanuzza B, et al Effects of repetitive transcranial magnetic stimulation in performing eye-hand integration tasks: Four preliminary studies with children showing low-functioning autism. Autism. 2014;18(6):638–650. doi: 10.1177/1362361313495717. [DOI] [PubMed] [Google Scholar]




