Abstract
为了提高基于脊髓功能性电激励重建后肢运动功能时电极植入位置的准确性和可靠性,实验测定了大鼠后肢运动相关的脊髓功能核心区域的分布情况。此次研究利用三维扫描式椎管内微刺激技术对脊髓进行刺激,以产生髋关节、膝关节和踝关节等后肢运动,并记录诱发这些运动的脊髓内坐标。为了克服个体间差异,本文对 12 只 SD 大鼠的脊髓功能区域归一化后进行叠加,得到踝关节背屈、屈髋关节、伸髋关节和内收髋关节等运动的脊髓功能核心区域。本研究为微电子神经桥接系统用于后肢运动功能的重建提供了参考。
Keywords: 椎管内微刺激, 运动功能, 功能性电激励, 核心区域
Abstract
In order to improve the accuracy and reliability of the electrodes implant location when using spinal functional electrical stimulation to rebuild hindlimb motor function, we measured the distributions of function core regions in rat spinal cord associated with hindlimb movements. In this study, we utilized three-dimensional scanning intraspinal microstimulation technology to stimulate the rat spinal cord to generate hip, knee and ankle joint movements, and acquired the coordinates of the sites in spinal cord which evoked these movements. In this article, 12 SD rats were used to overcome the individual differences in the functional region of the spinal cord. After normalized and overlaid the messages, we obtained the function core regions in spinal cord associated with ankle dorsiflexion movement, hip flexion movement, hip extension movement and hip adduction movement. It provides a reference for rebuilding the hindlimb movement function with micro-electronic neural bridge.
Keywords: intraspinal microstimulation, motor function, functional electrical stimulation, core region
引言
脊髓损伤是最具破坏性的神经创伤之一。我国的脊髓损伤患者人数已突破百万,并以每年 12 万的速度激增,全球脊髓损伤人数已突破 300 万[1]。由于受损神经元的再生和其轴突的传导功能恢复较难,使得脊髓损伤治疗成为世界性难题[2]。经实验表明若低于损伤平面的脊髓运动神经网络仍保持完好,在电刺激时能够激活其运动功能[3]。对此,有研究人员提出微电子神经桥接方案来重建受损脊髓的运动功能[4]。其目的是借助植入式微电子神经再生模块代替中断的中枢神经传导束,实现瘫痪肢体的神经信号再生、信道桥接和功能重建[5-7]。要在受损脊髓两端开展微电子神经桥接实验,首先需要解决的一个关键问题就是功能性电激励电极的精准植入。
尽管目前已有研究人员使用神经示踪剂,如生物素葡聚糖胺、荧光金、伪狂犬病毒等对脊髓神经的走向和分布作了研究,但通过这些方法获得功能图谱则需要对实验对象进行灌注取材、脱水、冷冻切片等操作[8-10]。这些过程极有可能对脊髓神经“在体”时的三维坐标造成改变,从而使所获结果不能直接应用于实验。同时,它也不能提供电激励下多组神经纤维共同兴奋的效果。因此,本文利用椎管内微刺激技术对大鼠脊髓腰骶段进行三维式扫描电刺激,以“在体”测试方式确定控制大鼠后肢运动的脊髓功能核心区域的分布情况,以提高微电子桥接实验中刺激电极植入位置的准确性和可靠性。
1. 椎管内微刺激的脊髓功能核心区域测定方案
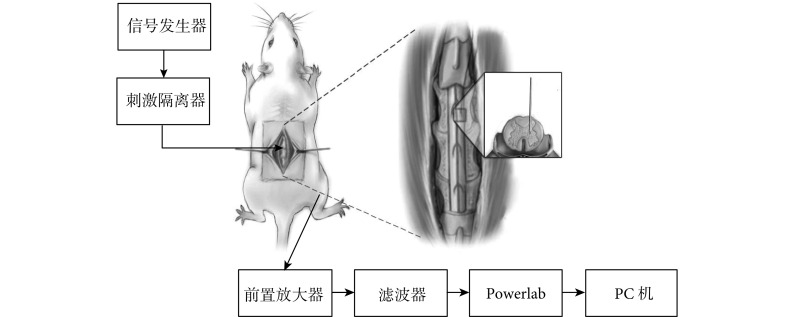
椎管内微刺激是一种功能性电激励技术,通过直接刺激脊髓腹侧的运动回路以实现更为自然的运动神经元激活,并选择性地激活相应的肌肉或肌肉群[11-13]。同时,刺激电极植入位置是在离运动肌肉相对较远的脊髓中,降低了因运动而造成的电极移位。实验方案如图 1 所示。由信号发生器(Master-9)产生刺激波形,通过刺激隔离器(ISO-Flex)输出到固定在全自动立体定位仪上的刺激电极,然后对脊髓进行三维扫描式电刺激。在诱发后肢动作时,同时记录动作类型、脊髓刺激位点和关键肌肉的肌电信号。
图 1.
Experimental scheme of measuring the function core regions for hindlimb movements in rat spinal cord
大鼠后肢运动脊髓功能核心区域测定实验方案
2. 材料与方法
2.1. 动物手术及电极植入
成年雄性 SD 大鼠 12 只,体重 250 g 左右,由南通大学医学院实验动物中心提供。实验前,利用外科手术器械快速干燥消毒器(Germinator 500,美国 Harvardappraatus)对手术器械进行消毒。腹腔注射水合氯醛(4 mL/kg)麻醉后,对其后肢及背部剃毛,并用酒精消毒。然后暴露脊椎 T12~L5 节段对应的脊髓,用游标卡尺测量脊髓各个节段的横径及暴露脊髓的长度以便归一化处理。利用全自动立体定位仪将刺激电极植入脊髓腰骶部用于三维扫描式电刺激。右后肢六块肌肉(胫骨前肌、股直肌、股二头肌、长收肌、腓肠肌、股外侧肌)中植入双极电极以用于记录肌电信号。参考电极植入于同侧脊旁肌。大鼠置于恒温毯上维持体温。
2.2. 刺激电极与记录电极
刺激电极采用美国 MicroProbes 公司生产的钨丝单电极(WE30030.5A3),其尖端直径为 1 μm,阻抗为 1.5 MΩ,电极表面绝缘性能良好且电极尖端暴露面积小。记录电极采用直径为 0.16 mm 的自制针灸针电极。
2.3. 刺激波形及参数
为了降低电刺激对神经组织造成的电化学损伤,本文采用双极串脉冲序列作为刺激波形[14]。利用 Master-9 脉冲刺激器输出至刺激隔离器产生电流大小可调的串脉冲序列,正脉冲宽度 20 ms,负脉冲宽度 2 ms,脉冲周期 30 ms,并由 40 个双向脉冲组成序列,序列间隔 5 s。
2.4. 刺激位点定位方法
将大鼠卧放于立体定位仪上,用大鼠脊柱适配器对脊椎进行固定。利用钨丝电极对大鼠脊髓腰骶段进行三维扫描式电刺激。刺激位点以脊髓后正中沟为坐标原点,横径方向为 X 轴,背腹方向为 Y 轴,脊髓头尾方向为 Z 轴。在 X 轴上以 200 μm 为间隔(为了避开血管,第一列点的 X 值为 300 μm),Y 轴方向上以 300 μm 为间隔,Z 轴以 500 μm 为间隔进行椎管内微刺激。在确定诱发后肢运动的同时记录脊髓刺激位点、诱发动作类型以及关键肌肉的肌电信号。
2.5. 刺激位点归一化坐标描述
由于不同的大鼠体长和脊髓横径存在差异,所以在描述脊髓刺激位点时须将其进行归一化以减小个体间的差异性。归一化处理的方法为:横径方向 X 以脊髓横径的二分之一进行归一化处理,背腹方向 Y 以脊髓横径进行归一化处理,头尾方向 Z 以对应的脊椎节段长度进行归一化处理。头尾方向归一化处理采用脊椎节段长度是因为在体实验中脊椎节段的确认和测量比脊髓节段更为便捷可靠。
2.6. 脊髓功能核心区域划定方法
为了减少大鼠个体间差异,提升刺激电极植入的准确性,我们将 12 只大鼠的刺激位点进行归一化并将其叠加。我们定义同种运动的脊髓功能区域的重叠范围为该运动的脊髓功能核心区域。选择脊髓功能核心区域可以减少脊髓组织因电极多次植入而造成的不必要损伤,提高微电子神经桥接系统的实用性。
3. 实验及结果分析
3.1. 踝关节背屈运动的脊髓功能核心区域测定
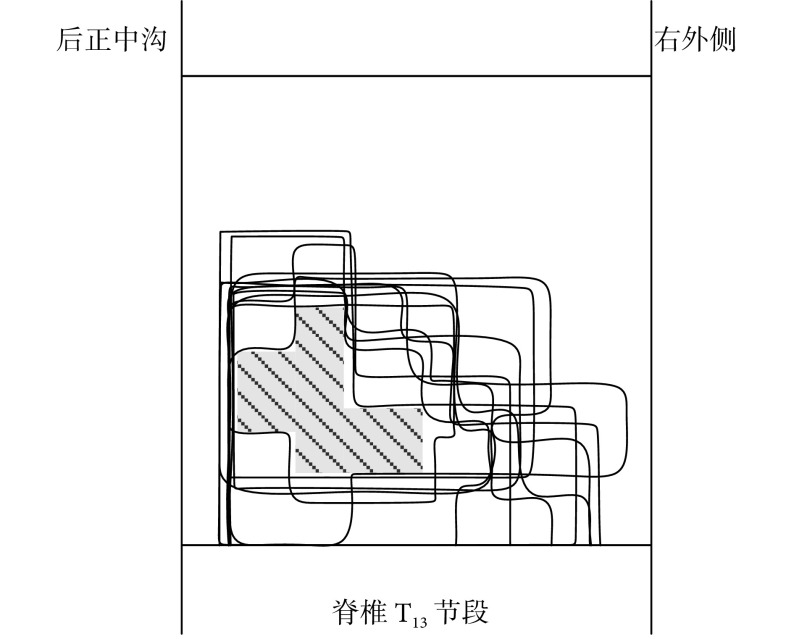
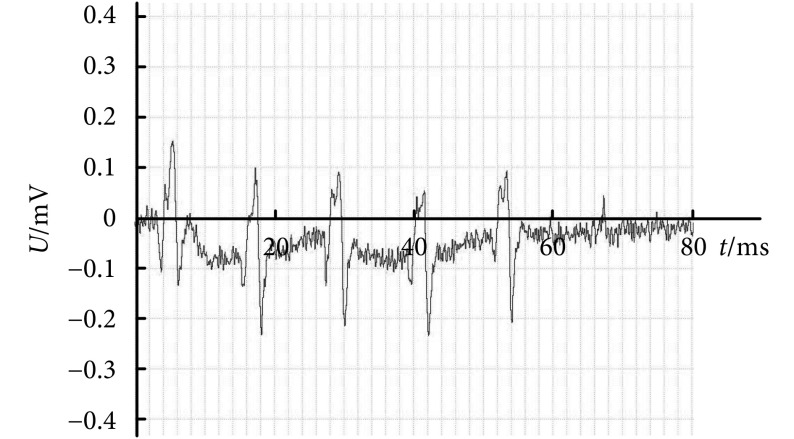
根据上述实验方案对大鼠踝关节背屈运动的脊髓功能核心区域进行测定。在脊椎 T13 节段进行三维扫描式电刺激,对能成功诱发踝关节背屈运动的位点位置进行记录。图 2 所示为踝关节背屈运动的脊髓功能核心区域图,其中阴影部分为该运动的核心区域,电极植入深度为 0.588~0.735。踝关节背屈运动的关键肌肉胫骨前肌的肌电信号如图 3 所示。
图 2.
Functional core regions map for ankle dorsiflexion movement in spinal cord
踝关节背屈运动脊髓功能核心区域图
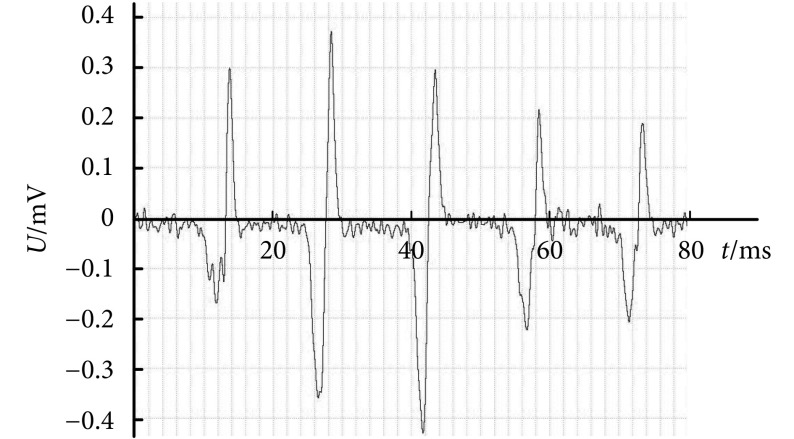
图 3.
Electromyogram of the anterior tibial muscle
胫骨前肌肌电信号
3.2. 屈髋关节运动的脊髓功能核心区域测定
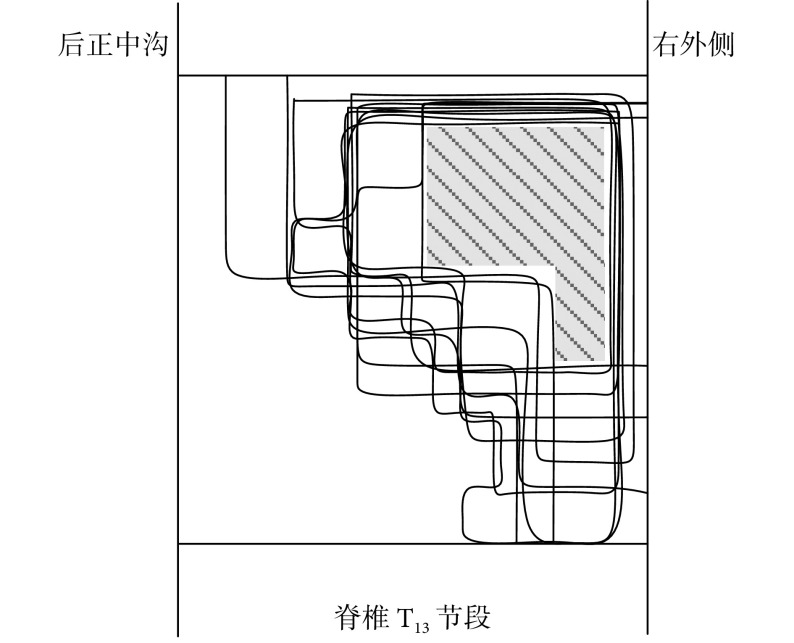
在脊椎 T13 节段进行三维扫描式电刺激,对能成功诱发屈髋关节运动的位点位置进行记录。图 4 所示为屈髋关节运动的脊髓功能核心区域图,其中阴影部分为该运动的核心区域,电极植入深度为 0.500~0.735。屈髋关节运动的关键肌肉股直肌的肌电信号如图 5 所示。
图 4.
Functional core regions map for hip flexion movement in spinal cord
屈髋关节运动脊髓功能核心区域图
图 5.
Electromyogram of the rectus femoris muscle
股直肌肌电信号
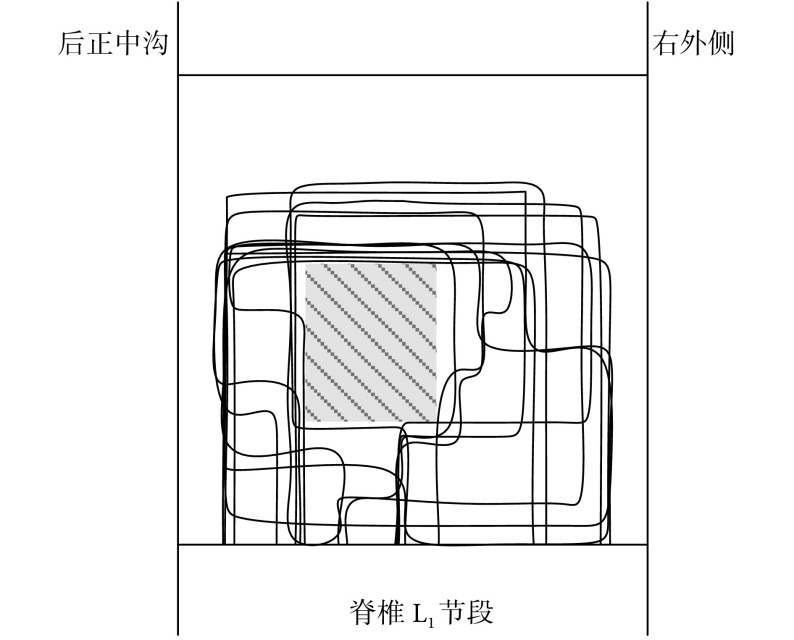
3.3. 伸髋关节运动脊髓功能核心区域图
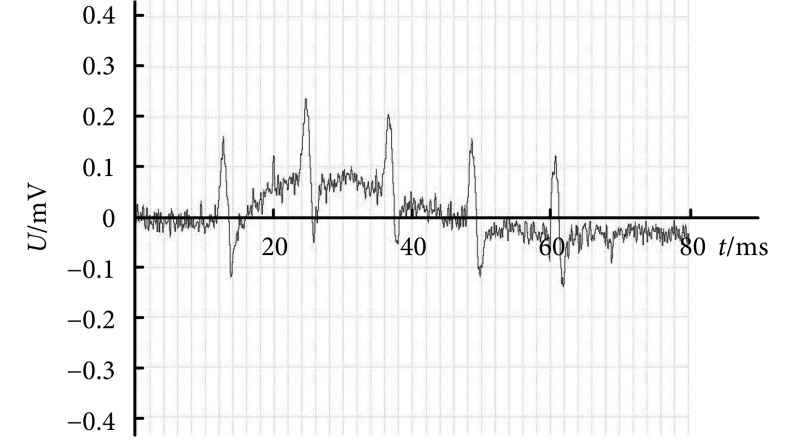
在脊椎 L1 节段进行三维扫描式电刺激,对能成功诱发伸髋关节运动的位点位置进行记录。图 6 所示为伸髋关节运动的脊髓功能核心区域图,其中阴影部分为该运动的核心区域,电极植入深度为 0.588~0.735。伸髋关节运动的关键肌肉股二头肌的肌电信号如图 7 所示。
图 6.
Functional core regions map for hip extension movement in spinal cord
伸髋关节运动脊髓功能核心区域图
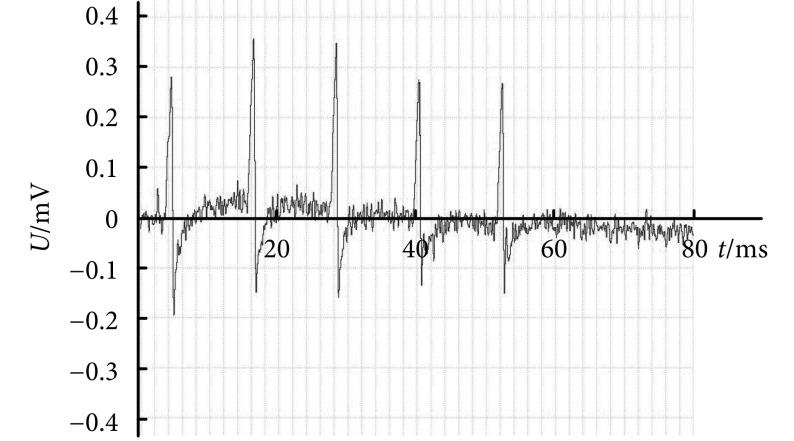
图 7.
Electromyogram of the biceps femoris muscle
股二头肌肌电信号
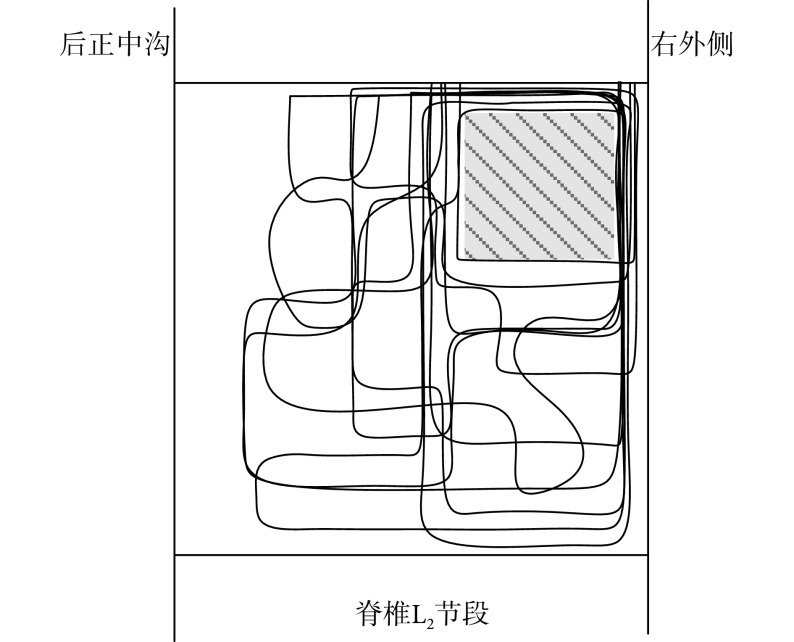
3.4. 内收髋关节运动脊髓功能核心区域图
在脊椎 L2 节段进行三维扫描式电刺激,对能成功诱发内收髋关节运动的位点位置进行记录。图 8 所示为内收髋关节运动的脊髓功能核心区域图,其中阴影部分为该运动的核心区域,电极植入深度为 0.647~0.706。内收髋关节运动的关键肌肉长收肌的肌电信号如图 9 所示。
图 8.
Functional core regions map for hip adduction movement in spinal cord
内收髋关节运动脊髓功能核心区域图
图 9.
Electromyogram of the long adductor muscle
长收肌肌电信号
4. 结论
本文利用椎管内微刺激技术对大鼠腰骶段的脊髓功能核心区域进行了测定,其中包括踝关节背屈、屈髋关节、伸髋关节和内收髋关节四个动作的脊髓功能核心区域。绘制出了归一化后的大鼠脊髓功能核心区域图。结果在很大程度上提高了电极植入后诱发期望运动的概率,有效地避免因电极反复植入而对脊髓造成不必要的二次损伤,并验证了椎管内微刺激技术能够用于后肢运动功能重建的可行性。实验解决了微电子神经桥接过程中功能性电激励电极植入到何处的问题,为利用微电子技术实现脊髓神经信道桥接及其它神经假体的脊髓功能电激励研究提供实用图谱。
Funding Statement
国家自然科学基金面上项目(81371663);国家自然科学基金重大项目(61534003)
References
- 1.封亚平, 朱辉, 刘艳生, 等 脊髓损伤治疗现状. 中华神经外科疾病研究杂志. 2008;7(3):279–280. [Google Scholar]
- 2.韩倩倩, 许琰, 王宏, 等 干细胞与脊髓损伤的治疗. 组织工程与重建外科杂志. 2015;(4):269–273. [Google Scholar]
- 3.Jackson A, Zimmermann J B Neural interfaces for the brain and spinal cord-restoring motor function. Nat Rev Neurol. 2012;8(12):690–699. doi: 10.1038/nrneurol.2012.219. [DOI] [PubMed] [Google Scholar]
- 4.王志功, 顾晓松, 吕晓迎. 微电子系统辅助神经信道功能恢复方法及其装置: CN, CN1810203. 2006-08-02.
- 5.王志功, 吕晓迎, 顾晓松. 中枢神经信号微电子技术检测、处理与重建研究//第十四届中国神经网络学术会议论文集. 合肥, 2004: 77-81.
- 6.沈晓燕, 王志功, 吕晓迎, 等 用微电子神经桥实现受控脊蟾蜍运动功能重建的研究. 高技术通讯. 2011;21(5):530–534. [Google Scholar]
- 7.Huang Zonghao, Wang Zhigong, Lu Xiaoying, et al The principle of the Micro-Electronic neural bridge and a prototype system design. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 2016;24(1):180–191. doi: 10.1109/TNSRE.2015.2466659. [DOI] [PubMed] [Google Scholar]
- 8.季达峰, 吕广明, 刘苏, 等 生物素化葡聚糖胺顺行追踪标记大鼠皮质脊髓束. 南通大学学报: 医学版. 2008;28(5):336–338. [Google Scholar]
- 9.谭龙旺, 秦兆邦, 朱峰,等 电针联合嗅鞘细胞移植对大鼠脊髓损伤神经轴突再生及走向的影响. 中国骨伤. 2015;28(5):441–445. [PubMed] [Google Scholar]
- 10.叶达伟. 调控小鼠肾脏功能的相关中枢核团神经解剖学研究. 武汉: 华中科技大学, 2012.
- 11.Grahn P J, Lee K H, Kasasbeh A, et al Wireless control of intraspinal microstimulation in a rodent model of paralysis. J Neurosurg. 2015;123(1):232–242. doi: 10.3171/2014.10.JNS132370. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Bamford J A, Mushahwar V K Chapter 17–Intraspinal microstimulation for the recovery of function following spinal cord injury. Progress in Brain Research. 2011;194(1):227–239. doi: 10.1016/B978-0-444-53815-4.00004-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Bamford J A, Putman C T, Mushahwar V K Intraspinal microstimulation preferentially recruits fatigue-resistant muscle fibres and generates gradual force in rat. Journal of Physiology. 2005;569(3):873–884. doi: 10.1113/jphysiol.2005.094516. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.van den Honert C, Mortimer J T The response of the myelinated nerve fiber to short duration biphasic stimulating currents. Ann Biomed Eng. 1979;7(2):117–125. doi: 10.1007/BF02363130. [DOI] [PubMed] [Google Scholar]