Abstract
本研究目的为获得不同浓度唑来膦酸对破骨细胞抑制作用的特征及最低有效浓度。取 C57 小鼠骨髓单核细胞并诱导分化破骨细胞。实验组分别加入唑来膦酸的浓度为 1×10–8、1×10–7、1×10–6、1×10–5、1×10–4 mol/L;同时设置不含任何双膦酸盐的对照组。计数多核细胞、通过滤网细胞、附壁细胞、骨吸收陷窝,观察不同浓度唑来膦酸对破骨细胞抑制作用的特征。发现唑来膦酸抑制体外破骨细胞形成的最低有效浓度为 1×10–6 mol/L;在 1×10–5 mol/L 浓度下抑制破骨细胞迁移和骨吸收的作用更为显著;在 1×10–4 mol/L 浓度下效果进一步增强,但高浓度唑来膦酸抑制破骨细胞能力的增强已趋于平缓。提示临床应用中要注意选择合适浓度和剂量的唑来膦酸进行治疗。
Keywords: 破骨细胞, 骨吸收, 唑来膦酸, 双膦酸盐, 有效浓度
Abstract
This study is to investigate the inhibitory effect of different concentrations of zoledronic acid on the activity of osteoclasts, to obtain characteristics on inhibitory effect and to find the lowest effective concentration of zoledronic acid. Marrow cells of C57 mice (6 weeks) were cultured in vitro. Osteoclasts were induced by single nuclear cells. According to the concentration of zoledronic acid, we set up the experimental group with five different concentrations, i.e. 1×10–8 mol/L, 1×10–7 mol/L, 1×10–6 mol/L, 1×10–5 mol/L, and 1×10–4 mol/L. The control group did not contain any bisphosphonate. By tartrate resistant acid phosphatase staining, the number of multinuclear cells, cells through the filter and bone resorption lacune were counted. Five days after the cultivation, the number of multinuclear cells in the experimental group decreased with the increase of concentration of zoledronic acid. Inhibition on the formation of osteoclasts in vitro was effective at 1×10–6 mol/L. At the concentration of 1×10–5 mol/L, the effect of inhibition on migration of osteoclast and bone resorption was more obvious. The effect was further enhanced at concentration of 1×10–4 mol/L. However, the concentration and inhibition curves were gradually mild. The inhibitory effect on different concentrations of zoledronic acid on the activity of osteoclasts was different. The inhibition effect was obvious at 1×10–6 mol/L. We should pay attention to administrate appropriate concentration of zoledronic acid in the clinical applications.
Keywords: osteoclast, bone resorption, zoledronic acid, bisphosphonate, effective concentration
引言
唑来膦酸属于第三代双膦酸盐,可静脉应用[1]。目前普遍应用于抗骨质疏松、抗骨质破坏的临床治疗中[2],在治疗骨巨细胞瘤、骨转移癌等方面取得满意疗效。唑来膦酸是目前已知的最强双膦酸盐药物,药效作用强大[3]。文献报道唑来膦酸预防及治疗骨相关事件很有效,在其他双膦酸盐类药物治疗失效时,换用唑来膦酸仍能缓解骨痛[4]。双膦酸盐类药物作用特点与剂量相关,即剂量越大药效越强[5]。但本课题组早期应用唑来膦酸治疗癌性骨痛研究中,应用 4 mg剂量时改善率为85.5%,8 mg时为80.1%;并且发现大剂量应用唑来膦酸并没有达到预期临床疗效,但大剂量应用唑来膦酸时不良反应较突出。同时,文献报道唑来膦酸在肾脏代谢的半衰期明显长于同代双膦酸盐类药物(如伊班膦酸),对肾脏的毒性相对较大[6]。本课题组认为唑来膦酸对破骨细胞的抑制作用特征尚未明确,临床应用缺乏科学的理论依据。所以本研究通过分析比较不同浓度唑来膦酸对破骨细胞活性的影响程度,获得其抑制作用特征及最低有效浓度,为临床治疗工作提供科学的理论依据。
1. 实验材料与方法
1.1. 实验材料与仪器
课题组 C57 小鼠来自河北医科大学,一级实验动物;实验通过河北医科大学动物实验中心批准。唑来膦酸(国药集团国瑞药业);集落刺激因子-1(colony stimulating factor 1,CSF-1,Peprotech,Rocky Hills,NC,US)、NF-κB 受体活化因子(recep-tor activator for nuclearfactor-κB ligand,RANKL,Sigma Ltd.,US)、α-MEM 培养基(α-modified mini-mal essential medium,α-MEM,Gibco BRL Ltd.,US)、胎牛血清(fetal bovine serum,FBS,Sigma,Ltd.,US)、TRAP 试剂盒(Sigma,Ltd.,US),8×10–6 m 孔径滤网(Costar,Boston,MA,US)、光学显微镜(Nikon TE2000-S,Nikon Inc.,NY,US)、Imaging-Pro 图像处理软件(Media Cybernetics Inc.,US)、SPSS 19.0 统计软件(version 19.0,SPSS Inc.,Chicago,IL,US)。
1.2. 破骨细胞分离和培养
实验中处置 6 周龄 C57 小鼠符合动物伦理学,致死后无菌条件下取其前肢肱骨和后肢长骨骨髓,并离心沉淀骨髓单核细胞(bone marrow mononu-clear cells,BMMNCs)。在配制的 α-MEM 培养液中将 BMMNCs 培养 3 d,其中 α-MEM 培养液含有 10% FBS、3×10–5 g/L CSF-1、2×10–5 g/L RANKL。在破骨细胞培养的第 4 天,实验组分别加入 1×10–8、1×10–7、1×10–6、1×10–5、1×10–4 mol/L 浓度的唑来磷酸溶液;对照组中应用同等量磷酸盐缓冲液。同时调整 α-MEM 培养液并继续培养 5 d,此时 α-MEM 培养液含有 4×10–5 g/L CSF-1 和 6×10–5 g/L RANKL。
1.3. 破骨细胞 TRAP 染色处理
破骨细胞培养结束后(5 d),培养板细胞通过 4%多聚甲醛溶液固定,应用乙醇丙酮混合液处理。进行 TRAP 染色之后光学显微镜下观察制图;应用 Imaging-Pro 软件计算 TRAP 阳性细胞数量。
1.4. 破骨细胞黏附性观察
离心沉淀 BMMNCs 接种于 96 孔培养板,并放置骨片。实验组含有浓度分别为 1×10–8、1×10–7、1×10–6、1×10–5、1×10–4 mol/L 唑来膦酸溶液,对照组中应用同等量磷酸盐缓冲液。孵育 40 min,应用 pH 7.4 的磷酸盐缓冲液反复冲洗去掉游离细胞,观察附壁 TRAP 阳性细胞并计算数量。在光学显微镜下分别观察 1×10–8、1×10–7、1×10–6、1×10–5、1×10–4 mol/L 唑来膦酸组及对照组破骨细胞结构的变化。
1.5. 破骨细胞迁移性观察
应用 8×10–6 m 孔径 Transwell 系统(8×10–6 m 孔径滤网,Costar,Boston,MA)分析并测量破骨细胞活动性。实验组含有浓度分别为 1×10–8、1×10–7、1×10–6、1×10–5、1×10–4 mol/L 唑来膦酸溶液,对照组为同等量磷酸盐缓冲液;六组均加入 3×10–5 g/L CSF-1。分出相同量破骨细胞,加于 Transwell 系统滤网上,光学显微镜下观察通过 Transwell 系统滤网的破骨细胞并计算数量。
1.6. 破骨细胞骨吸收性观察
BMMNCs 接种于 96 孔培养板,并放置骨片;添加 4×10–5 g/L CSF-1 和 6×10–5 g/L RANKL。实验组含有浓度分别为 1×10–8、1×10–7、1×10–6、1×10–5、1×10–4 mol/L 唑来膦酸溶液,对照组为同等量磷酸盐缓冲液;放置于 37 ℃、体积分数为 0.05 的湿化CO2培养箱内饱和温度下孵育 5 d,应用 pH 7.4 的磷酸盐缓冲液反复冲洗去掉骨板上的破骨细胞,应用四硼 酸钠(浓度0.005 g/L)、甲苯胺蓝(浓度0.01 g/L)染色,光学显微镜下观察骨吸收陷窝(How-ship陷窝)的数量,并计算 Howship 陷窝所占面积的百分比。
1.7. 统计学分析
应用 SPSS19.0 进行实验数据的统计学分析,计量数据用均数±标准差表示,6 组间整体情况比较采用单因素方差分析,组间两两比较采用 Student-Newman-Keuls(SNK)多重比较检验。P<0.05 为差异有统计学意义。
2. 结果
2.1. 破骨细胞形态学观察
破骨细胞体积较大,形态不规则,有短突起,细胞内有多核,在显微镜下呈现较清晰的轮廓。可见破骨细胞侵蚀骨板,在骨板上形成 Howship 陷窝。Howship 陷窝大小形态各异,观察有圆形、椭圆形及不规则形。对照组破骨细胞体积、形态观察情况良好;而 1×10–6 mol/L 实验组多核细胞在唑来膦酸作用下体积明显减小,突起变短甚至消失(见图 1)。
图 1.

Inhibition of zoledronic acid with concentration of 1×10–6 mol/L on osteoclasts in vitro
1×10–6 mol/L 浓度唑来膦酸对体外培养破骨细胞的抑制作用
2.2. 破骨细胞 TRAP 染色观察
显微镜下观察 1×10–8、1×10–7、1×10–6、1×10–5、1×10–4 mol/L 唑来磷酸组及对照组均可见 TRAP 阳性细胞。同对照组相比,实验组唑来膦酸在 1×10–8 mol/L、1×10–7 mol/L 浓度下对破骨细胞形成抑制作用尚不明显。1×10–6 mol/L 浓度时抑制作用开始明显增强,为最低有效浓度。1×10–5 mol/L 浓度下,破骨细胞生成被显著抑制,在1×10–4 mol/L 浓度下效果进一步增强,但其抑制破骨细胞能力的增强已趋于平缓。见表 1。
表 1. Comparison of inhibition effects of different concentrations of zoledronic acid on osteoclasts in vitro (n=3,
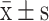 )
.
)
.
不同浓度唑来膦酸对体外培养破骨细胞抑制作用比较(n=3,
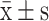 )
)
| 组别 | TRAP 阳性细胞数 | 附壁细胞数量 | 迁移细胞数量 | Howship 陷窝数量 | 陷窝面积(%) |
| 表中 F 值与 P 值指 6 组间整体比较结果;进一步两两比较,△与 1×10–6 mol/L 组比较 P<0.05,*与对照组比较 P<0.05,# 与 1×10–8 mol/L 组比较 P<0.05 | |||||
| 对照组 | 26.9±6.1△ | 66.4±5.9△ | 26.3±4.0△ | 26.2±4.3△ | 10.00±1.65△ |
| 1×10–8 mol/L | 24.7±5.6△ | 63.8±7.4△ | 25.7±5.3△ | 22.3±5.1△ | 8.95±1.85△ |
| 1×10–7 mol/L | 21.8±5.3△ | 56.6±9.2△ | 24.3±4.8△ | 20.7±6.3△ | 7.03±2.05△ |
| 1×10–6 mol/L | 6.4±3.3* | 20.4±4.2* | 16.6±3.2* | 5.7±3.0* | 1.02±0.33* |
| 1×10–5 mol/L | 5.0±2.5*# | 15.2±3.8*# | 15.3±2.5*# | 4.6±2.5*# | 0.81±0.28*# |
| 1×10–4 mol/L | 4.1±2.2*# | 13.9±3.3*# | 14.1±1.9*# | 4.1±2.0*# | 0.76±0.30*# |
| F 值 | 10.880 | 21.556 | 53.392 | 21.458 | 80.751 |
| P 值 | 0.003 | 0.001 | 0.000 | 0.000 | 0.000 |
对照组与最低有效浓度 1×10–6 mol/L 组的 TRAP 染色结果见图 1。对照组破骨细胞体积较大,细胞质丰富,胞浆内有红色阳性颗粒及棕红色沉淀,形态不规则,有短突起,细胞内有多核,呈现较清晰轮廓。1×10–6 mol/L 实验组多核细胞轮廓较清晰,但体积明显减小且无明显突起。
2.3. 唑来膦酸对破骨细胞黏附性的影响
破骨细胞黏附性是发挥骨吸收功能的基本条件,也是细胞迁移及发挥功能的调节因素。实验组唑来膦酸 1×10–8 mol/L、1×10–7 mol/L 浓度下对破骨细胞黏附性未见明显抑制作用。1×10–6 mol/L 浓度时抑制作用开始明显增强,为最低有效浓度。然而 1×10–4 mol/L 浓度唑来膦酸抑制破骨细胞黏附性的效果与 1×10–5 mol/L 浓度进行组间比较,差异无统计学意义。见表 1。
对照组与最低有效浓度 1×10–6 mol/L 组的 TRAP 染色结果见图 1。对照组附壁 TRAP 阳性细胞数量较多,且密度大。实验组多核细胞在 1×10–6 mol/L 浓度时细胞的黏附性被明显抑制,可见附壁破骨细胞数量明显减少,分布稀疏。
2.4. 唑来膦酸对破骨细胞迁移性的影响
破骨细胞迁移性对其发挥骨趋化作用起重要影响。通过观察 Transwell 系统滤网的破骨细胞数量,对迁移细胞数量进行计数。对实验组进行组内比较发现:实验组唑来膦酸在 1×10–8 mol/L、1×10–7 mol/L 浓度下对破骨细胞迁移性的影响尚不明显;唑来膦酸浓度为 1×10–6 mol/L 时可明显降低细胞迁移性,为最低有效浓度;1×10–5 mol/L、1×10–4 mol/L 浓度下抑制破骨细胞迁移作用逐渐增强,但其抑制能力的增强已趋于平缓。见表 1。
对照组与最低有效浓度 1×10–6 mol/L 组的 TRAP 染色结果见图 1。对照组通过 Transwell 系统滤网的破骨细胞数量多,观察破骨细胞可见明显伪足变化,胞体收缩。1×10–6 mol/L 实验组唑来膦酸对破骨细胞迁移性的抑制作用明显增强,可见主动穿过小孔发生迁移活动的破骨细胞数量明显减少,胞体及伪足变化相对不明显,迁移活动性下降。
2.5. 唑来膦酸对破骨细胞溶骨性的影响
实验组唑来膦酸在 1×10–8 mol/L 浓度下对破骨细胞侵蚀骨板的能力起到抑制作用,但仍可见较深的 Howship 陷窝。1×10–6 mol/L 的唑来膦酸可明显抑制破骨细胞的溶骨作用,为最低有效浓度。1×10–4 mol/L 浓度唑来膦酸抑制破骨细胞溶骨性的能力比 1×10–5 mol/L 浓度稍增强,但其增强已趋于平缓。见表 1。
对照组与最低有效浓度 1×10–6 mol/L 组的四硼酸钠-甲苯胺蓝染色结果见图 1。对照组存在明显的 Howship 陷窝,其长度和深度均明显超过实验组。对照组 Howship 陷窝数量多,呈现椭圆形、梅花形或串珠状,陷窝较深,范围较大并且重叠。唑来膦酸浓度为 1×10–6 mol/L 时,破骨细胞溶骨性被显著抑制,可见 Howship 陷窝的表面积小、明显变浅,且数量明显减少。
3 讨论
双膦酸盐类药物与焦磷酸一样,能紧密地吸附在羟磷灰石的表面并结合,使羟磷灰石与磷酸钙互相转变的双向过程被抑制[7]。双膦酸盐抗骨吸收的机制为:① 改变破骨细胞的形态学,从而抑制其功能;② 与骨基质理化结合,直接干扰骨吸收;③ 抑制成骨细胞介导的细胞因子如白细胞介素-6、肿瘤坏死因子的产生[8]。双膦酸盐在骨内半衰期长,能吸附在矿物质的结合位点上,从而干扰破骨细胞附着,导致破骨细胞超微结构变化而丧失功能。同时,双膦酸盐可抑制成骨细胞产生的细胞因子而阻止破骨细胞修复,诱导破骨细胞的凋亡。并且在抑制肿瘤细胞的浓度下不呈现任何细胞毒作用[9]。本研究中所应用的唑来膦酸为第三代双膦酸盐类药物,含有氮原子的同时含有杂环结构,药效作用明显。
唑来膦酸抑制破骨细胞作用的特点与药物浓度有关[10],即药效随浓度的增加作用逐渐增强。但课题组早期临床应用唑来膦酸治疗癌性骨痛研究中,4 mg 剂量下改善率为 85.5%,8 mg 剂量下为 80.1%,可见大剂量应用唑来膦酸并没有达到预期效果。在本次试验中,唑来膦酸在 1×10–6 mol/L 浓度下对破骨细胞生成、黏附、迁移、溶骨的抑制性作用明显增强,为最低有效浓度。 1×10–6 mol/L 浓度唑来膦酸抑制破骨细胞的黏附性和溶骨性与更高浓度的 1×10–5 mol/L 组、1×10–4 mol/L 组比较,差异没有统计学意义;1×10–6 mol/L 浓度下唑来膦酸对破骨细胞的抑制作用已经非常明显, Howship 陷窝的数量明显减少,而 1×10–5 mol/L 和 1×10–4 mol/L 高浓度下虽然抑制作用亦有增强,但差异亦无统计学意义。
唑来膦酸在 1×10–5 mol/L 和 1×10–4 mol/L 高浓度下对破骨细胞的抑制性进一步增强,这与药物随浓度的增加作用逐渐增强的理论一致;但本课题组发现在最低有效浓度 1×10–6 mol/L 下,唑来膦酸抑制破骨细胞的能力已经明显增强,而更高浓度唑来膦酸对破骨细胞抑制作用的增强已趋于平缓,这可以解释在临床应用大剂量唑来膦酸并没有取得预期疗效的现象。提示临床静脉应用唑来膦酸应选取合适的剂量,达到其有效治疗浓度即可;首次静脉应用唑来膦酸可适当加大剂量,之后维持有效治疗浓度,不必大剂量长疗程应用。而且唑来膦酸的不良反应与使用剂量和疗程相关,因此选择合适用量的唑来膦酸对降低不良反应事件发生率具有临床意义。
综上所述,此次实验证明不同浓度唑来膦酸对破骨细胞活性的影响程度不同,高浓度抑制作用更强,但 1×10–6 mol/L 浓度的唑来膦酸即有明显的抗破骨细胞作用,更高浓度时抑制破骨细胞能力的增强则趋于平缓,提示临床应用中应注意选择合适剂量浓度和疗程的唑来膦酸用于治疗。但是,针对不同疾病仍需进一步的临床药学、影像学及病理学研究总结治疗方法。
References
- 1.InsalacoL, Di GaudioF, TerrasiM Analysis of molecular mechanisms and anti-tumoural effects of zoledronic acid in breast cancer cells. J Cell Mol Med. 2012;16(9):2186–2195. doi: 10.1111/j.1582-4934.2012.01527.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.郑小飞, 尹庆水, 杨传红 双膦酸盐诱导骨巨细胞瘤细胞凋亡的实验研究. 临床肿瘤学杂志. 2011;16(3):219–222. [Google Scholar]
- 3.李鹏飞, 靳宪辉, 李华 双膦酸盐类药物治疗脊柱骨巨细胞瘤二例报告. 中华肿瘤防治杂志. 2012;19(8):627–628. [Google Scholar]
- 4.SokiF N, LIXin, BerryJ The effects of zoledronic acid in the bone and vasculature support of hematopoietic stem cell niches. J Cell Biochem. 2013;114(1):67–78. doi: 10.1002/jcb.24301. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.MurphyC M, SchindelerA, GleesonJ P A collagen-hydroxyapatite scaffold allows for binding and co-delivery of recombinant bone morphogenetic proteins and bisphosphonates. Acta Biomater. 2014;10(5):2250–2258. doi: 10.1016/j.actbio.2014.01.016. [DOI] [PubMed] [Google Scholar]
- 6.BrennanM A, GleesonJ P, O'brienF J Effects of ageing, prolonged estrogen deficiency and zoledronate on bone tissue mineral distribution. J Mech Behav Biomed Mater. 2014;29:161–170. doi: 10.1016/j.jmbbm.2013.08.029. [DOI] [PubMed] [Google Scholar]
- 7.郑小飞, 尹庆水, 杨传红 唑来膦酸诱导骨巨细胞瘤基质细胞向成骨细胞分化的实验研究. 临床肿瘤学杂志. 2011;16(2):128–133. [Google Scholar]
- 8.VoskaridouE, ChristoulasD, PlataE High circulating sclerostin is present in patients with thalassemia-associated osteoporosis and correlates with bone mineral density. Hormone and Metabolic Research. 2012;44(12):909–913. doi: 10.1055/s-0032-1312618. [DOI] [PubMed] [Google Scholar]
- 9.DasS, EdwardsP A, CrockettJ C Upregulation of endogenous farnesyl diphosphate synthase overcomes the inhibitory effect of bisphosphonate on protein prenylation in Hela cells. Biochim Biophys Acta. 2014;1841(4):569–573. doi: 10.1016/j.bbalip.2013.12.010. [DOI] [PubMed] [Google Scholar]
- 10.DedesP G, KanakisI, GialeliC Preclinical evaluation of zoledronate using an in vitro mimetic cellular model for breast cancer metastatic bone disease. Biochim Biophys Acta. 2013;1830(6):3625–3634. doi: 10.1016/j.bbagen.2013.01.020. [DOI] [PubMed] [Google Scholar]


