Abstract
慢性精神分裂症患者大脑的结构和功能异常已经被广泛报道,但是首发未用药精神分裂症患者和正常人的相关研究较少。本研究采集了 44 名首发未用药精神分裂症患者和 56 名正常人的结构和静息态功能磁共振图像,基于自动解剖标签模板提取了 90 个感兴趣区域的灰质体积、局部一致性、低频振荡振幅和度中心度作为特征,并将这些特征作为输入,用基于递归特征消除的支持向量机对首发未用药精神分裂症患者和正常人进行分类。结果表明,局部一致性和低频振荡振幅的组合为最佳分类特征,分类准确率达到 96.97%,并且分类权重最大的脑区主要位于额叶。研究结果有利于加深对精神分裂症神经病理机制的了解,有助于开发出用于临床辅助诊断的生物学标记物。
Keywords: 首发精神分裂症, 多模态磁共振影像, 支持向量机, 递归特征消除
Abstract
A great number of studies have demonstrated the structural and functional abnormalities in chronic schizophrenia (SZ) patients. However, few studies analyzed the differences between first-episode, drug-naive SZ (FESZ) patients and normal controls (NCs). In this study, we recruited 44 FESZ patients and 56 NCs, and acquired their multi-modal magnetic resonance imaging (MRI) data, including structural and resting-state functional MRI data. We calculated gray matter volume (GMV), regional homogeneity (ReHo), amplitude of low frequency fluctuation (ALFF), and degree centrality (DC) of 90 brain regions, basing on an automated anatomical labeling (AAL) atlas. We then applied these features into support vector machine (SVM) combined with recursive feature elimination (RFE) to discriminate FESZ patients from NCs. Our results showed that the classifier using the combination of ReHo and ALFF as input features achieved the best performance (an accuracy of 96.97%). Moreover, the most discriminative features for classification were predominantly located in the frontal lobe. Our findings may provide potential information for understanding the neuropathological mechanism of SZ and facilitate the development of biomarkers for computer-aided diagnosis of SZ patients.
Keywords: first-episode schizophrenia, multi-modal magnetic resonance imaging, support vector machine, recursive feature elimination
引言
精神分裂症(schizophrenia,SZ)是一种常见的重性精神疾病,常有感知觉、思维、情感和行为等多方面的障碍,临床症状主要包括幻觉、妄想、社会功能退缩、注意力及工作记忆损害等[1]。SZ 的发病原因非常复杂,包括遗传、发育、免疫、心理、环境和社会等因素,病理机制至今仍未完全明确。磁共振影像(magnetic resonance imaging,MRI)的诞生使得定量化检测大脑结构和功能特征成为可能,为阐明 SZ 的病理机制开辟了一条新的道路。结构 MRI 包含了大脑形态特征的信息,可用于对灰质体积(gray matter volume,GMV)等的测量;功能 MRI(functional MRI,fMRI)则可以基于血氧水平依赖实时地检测大脑的功能活动情况。大量的研究表明了慢性 SZ 患者大脑额、颞叶的结构和功能异常[2-6]。同时也有研究表明了慢性 SZ 患者顶叶、枕叶、基底节、脑岛等的结构和功能异常[4, 7-9]。但是,慢性 SZ 患者受到药物和长期疾病的影响,大脑结构异常可能更为广泛[2, 10-11]。为避免这些影响,我们选择首发 SZ(first-episode SZ,FESZ)患者作为研究对象。
上述研究主要是分析组水平上的大脑差异,并不能对单个受试者进行分类。而机器学习可以对单个受试者进行自动分类,因而近年来被广泛用于神经和精神类疾病的研究,如阿尔茨海默病、SZ 和抑郁症等[12-14]。但之前对 SZ 的研究大部分只采用单一模态的特征进行分类[13, 15],可能会忽略其他模态 MRI 中的有效信息。
本文结合结构 MRI 和静息态 fMRI(resting-state fMRI,rs-fMRI),以 GMV、局部一致性(regional homogeneity,ReHo)、低频振荡振幅(amplitude of low frequency fluctuation,ALFF)和度中心度(degree centrality,DC)为特征参数,利用基于递归特征消除(recursive feature elimination,RFE)的支持向量机(support vector machine,SVM)(即 SVM-RFE 算法)[16]对 FESZ 患者和正常人(normal controls,NCs)进行分类,比较不同特征结合对分类效果的影响,并找到权重最大的十个脑区,为 SZ 患者的临床诊断提供神经影像学参考。
1. 方法
1.1. 实验材料与设计
FESZ 患者在广州医科大学附属脑科医院(广州市惠爱医院)招募,入组标准如下:① 采用基于《精神障碍诊断与统计手册》第 4 版(Diagnostic and Statistical Manual of Mental Disorders-Fourth Edition-Text Revision,DSM-Ⅳ-TR)的结构式临床访谈(Structured Clinical Interview for DSM,SCID),符合 DSM-Ⅳ-TR 关于精神分裂症的临床诊断标准;② 住院患者,生物学父母均为汉族,年龄 18~45 岁;③ 阳性与阴性症状量表(Positive And Negative Syndrome Scale,PANSS)的总分≥60 分(1-7 分制),其中 7 个阳性症状条目中,评分≥4 分的条目必须≥3 项,其中幻觉行为评分≥4 分;④ 病程小于 2 年且首次发作,未使用过任何精神科药物治疗。NCs 组通过海报或论坛等形式向社会公开募集,要求生物学父母均为汉族,年龄 18~45 岁。
所有受试者符合以下标准将被剔除:① 采用 DSM-Ⅳ-TR 的 SCID,有其他符合 DSM-Ⅳ 轴Ⅰ诊断的精神疾病或符合 DSM-Ⅳ-TR 酒药依赖(尼古丁依赖除外)诊断标准;② 两系三代内有亲属符合 DSM-Ⅳ 轴Ⅰ诊断标准的精神障碍;③ 患有严重的不稳定的躯体疾病者;已确诊的糖尿病、甲状腺疾病、高血压病、心脏病等。所有受试者在量表测试及 MRI 等检测前均充分了解了实验细节并签署了知情书,实验严格根据赫尔辛基宣言的要求,并在广州市惠爱医院伦理委员会的许可下开展。
实验纳入 44 名 FESZ 患者和 56 名 NCs,其中一名 FESZ 患者因为头动过大被去除(详见 1.3.2 节)。受试者特征如表 1 所示。对两组的性别进行 χ2 检验,对两组的年龄、大脑体积、PANSS 各项评分以及教育年限进行双样本 t 检验,两组之间年龄、性别和大脑体积无明显差异,PANSS 各项评分有明显差异,但教育年限也有明显差异。为了去除这一协变量的影响,我们对后面计算得到的参数进行了多元线性回归,去除了年龄、性别、教育年限和大脑体积的影响。
表 1. Demographic and clinical characteristics.
人口和临床统计学特征分析表
| 项目 | FESZ 患者(n=43) | NCs(n=56) | t 值(χ2 值) | P 值 |
| 年龄 | 26.42±8.02 | 25.07±5.85 | 0.97 | 0.336 |
| 性别(女∶男) | 43(15∶28) | 56(23∶33) | 0.39 | 0.530 |
| 教育年限 | 10.37±3.29 | 12.14±2.42 | –3.09 | 0.003 |
| 大脑体积 | 1 193.27±111.65 | 1 203.59±108.70 | –0.46 | 0.644 |
| PANSS 阳性量表分 | 25.21±3.93 | 7.05±0.30 | 34.45 | <0.000 1 |
| PANSS 阴性量表分 | 21.42±7.84 | 8.79±2.70 | 11.24 | <0.000 1 |
| PANSS 一般精神病理量表评分 | 40.49±9.21 | 17.18±2.34 | 18.22 | <0.000 1 |
| PANSS 总评分 | 87.12±18.09 | 33.02±4.74 | 21.47 | <0.000 1 |
1.2. 数据获取
所有受试者通过飞利浦 3.0T 场强的 MRI 扫描仪,在标准的头部线圈内完成扫描。有研究表明大脑执行认知任务的时候能量消耗增加值只占静息态时人脑所需能量的 5%,这表明人脑在静息状态时也在不断活动[17]。在任务态 fMRI 的实验中,一部分受试者无法顺利完成任务,而扫描静息态 fMRI 则可以避免这一问题,因此本研究选择扫描静息态 fMRI。在扫描的过程中要求受试者平静地躺在仪器内,呼吸保持平稳,闭眼放松,保持意识清晰,不要有任何思维活动,不要睡着。三维结构 MRI 是应用 T1 加权三维磁化强度预备梯度回波序列进行扫描,扫描层面平行于前后联合。扫描参数设置如下:TR = 8.2 ms,TE = 3.7 ms,TI = 795 ms,翻转角 = 7°,层数 188,层厚 = 1 mm,层间距 = 0 mm,矩阵 = 256×256,体素为 1 mm × 1 mm × 1 mm。fMRI 应用轴向回波平面成像序列进行扫描,扫描层面平行于前后联合。扫描参数设置如下:TR = 2 000 ms,TE = 30 ms,FOV 为 220 mm × 220 mm,翻转角 = 90°,层数 36,层厚 = 4 mm,矩阵 = 64×64,体素为 3.4 mm × 3.4 mm × 4 mm,共扫描 240 次,总扫描时间为 486 s。
1.3. 数据预处理
1.3.1 结构 MRI 数据分析 结构 MRI 通过 Statistical Parametric Mapping(SPM8, http://www. fil.ion.ucl.ac.uk/spm)和 DPARSF V4.0( http://www. restfmri.net)软件进行预处理。对每张 T1 加权 MRI 进行分割、配准、空间标准化和平滑。用自动解剖标签(automated anatomical labeling,AAL)模板将每位受试者的灰质图像分割成 90 个感兴趣区域(region of interest,ROI),得到每位受试者 90 个 ROI 的 GMV。
1.3.2 fMRI 数据分析 fMRI 也通过 SPM8 和 DPARSF 软件进行预处理。由于扫描初始信号不稳定以及受试者需要适应环境,前 10 个时间点的数据被去除,剩下 230 个时间点的数据进行了时间层的校正,同时将图像配准到第一个时间点的图像。其中有一名 FESZ 患者因为头动过大(最大头动 >2 mm 或者头动角度 > 2°)而被剔除。我们去除了头动和全局信号的影响。校正后的图像通过 SPM 自带的标准 EPI 模板进行空间标准化之后重采样,采用带通滤波器提取 0.01~0.08 Hz 的信号。
ReHo 的定义是一个体素的时间序列和它相邻体素的时间序列的肯德尔协和系数,被用于衡量 fMRI 时间序列局部同步程度,其值越大代表序列的同步性越高[18]。我们选择的体素的相邻体素个数为 26,利用上述预处理之后的图像进行 ReHo 的计算,之后再对 ReHo 进行标准化。然后将每个人的 ReHo 图像用 AAL 模板分割成 90 个 ROI,得到 90 个 ROI 的 ReHo 值。
一个体素的 ALFF 为该体素的时间序列经过快速傅里叶变换后,频率在 0.01~0.08 Hz 之间的功率谱的平方根,它对于测量大脑局部自发神经活动是有生理学意义的。用滤波之后的图像计算 ALFF,之后进行标准化,并用 AAL 模板进行分割,得到大脑 90 个 ROI 的 ALFF 值。
DC 描述了一个给定 ROI 和其他脑区的平均相关程度。一个 ROI 的 DC 定义为它与其它 89 个 ROI 的功能连接之和,而两个 ROI 之间的功能连接即为它们时间序列的皮尔森相关系数。用 AAL 模板将单个受试者滤波后的图像分割成 90 个 ROI,每个 ROI 的时间序列为该 ROI 内所有体素时间序列的平均值。DC 的表达式如下:
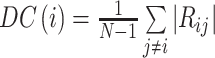 |
其中 Rij 为区域 i 和区域 j 的时间序列的皮尔森相关系数,N 为 ROI 的总数。
1.4. SVM-RFE 分类
SVM 是一种基于结构风险最小化原则的有效的分类算法。它的基本思想如下:将特征通过核函数映射到高维空间,在这个高维空间内寻找一个超平面,使得两类数据集中到超平面最近的数据点到超平面的距离最大[19]。本研究以 90 个 ROI 的 GMV、ReHo、ALFF 和 DC 间的 15 种排列组合作为输入特征,由于样本的特征数量大于样本数,所以选用线性核函数来减少过拟合的风险。
在分类的过程中,有一些特征对分类来说是冗余的,可能会造成过拟合的风险,降低特征维度不仅简化了分类模型,又提高了分类精度。RFE 就是一种有效的降维方法。它是一种循环算法,将特征应用于 SVM 分类器,得到每个特征的权重,移除权重最小的特征,再作为 SVM 分类器的输入,周而复始。本文中分别以 GMV、ReHo、ALFF 和 DC 的 15 种排列组合作为输入特征,将输入特征数从最大值降到 1,得到每一次分类的效果,选取精确度最高时所选用的特征作为 RFE 降维的结果,这一过程总耗时 2 022 s。对于每次的分类,每个脑区对应的特征有其相应的权重,将该脑区对应的所有特征权重标准化后乘以此次分类的准确度作为该次分类过程中该脑区的权重,将 15 次分类中该脑区的权重求和作为该脑区最终的权重。
我们用留一交叉验证法来判别分类器的分类效果,即将一个样本作为测试集,其他样本作为训练集,将训练集用于 SVM-RFE 分类器,训练出一个模型,用测试集验证模型的准确程度。分类器的效果用敏感度 S、特异性 T 和准确率 A 来评价,其计算公式如下:
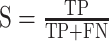 |
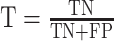 |
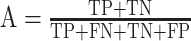 |
其中 TP 是 FESZ 患者被正确分类的个数;FN 是 FESZ 患者被错误分类的个数;TN 是 NCs 被正确分类的个数;FP 是 NCs 被错误分类的个数。
我们进一步用受试者工作特征(receiver operating characteristic,ROC)曲线下面积(area under the curve,AUC)来评价分类效果,ROC 曲线的纵轴是真阳性率,即为 TP/(TP + FN),横轴是假阳性率,即为 FP/(TN + FP)。AUC 的取值范围是 0~1,值越接近 1 表明分类效果越好。
分类结果的统计学意义用置换检验来评估,如果结果无统计学意义则表明用 SVM 分类和随机分类没有差别[20]。我们将训练集的类别随机置换 1 000 次,每次置换后进行分类分析,得到相应的分类效果。随后将类别置换后的分类效果与类别未置换的分类效果进行比较,P < 0.01 为结果有统计学意义。
2. 结果
2.1. 分类效果
在输入特征为 ReHo 和 ALFF 的组合时,取得了最好的分类效果,其中 S 达到了 100.00%,T 为 94.64%,A 达到 96.97%,AUC 达到 0.998(P < 0.01)。以 GMV、ReHo、ALFF 和 DC 为输入取得了较好的分类效果,S 达到了 86.05%,T 为 94.64%,A 达到 90.91%,AUC 为 0.968( P < 0.01)。详细的分类效果如 表 2 所示,同时给出了分别以 ReHo 和 ALFF 组合,以及 GMV、ReHo、ALFF 和 DC 组合为输入时的 ROC 曲线(见图 1),以及分类准确率随特征数改变而变化的曲线(见图 2)。
表 2. Classification performance.
分类效果
| 输入特征 | S | T | A | AUC | 置换检验 |
| GMV | 55.81% | 57.14% | 56.57% | 0.576 | P<0.01 |
| ReHo | 81.40% | 85.71% | 83.84% | 0.897 | P<0.01 |
| ALFF | 69.77% | 80.36% | 75.76% | 0.839 | P<0.01 |
| DC | 93.02% | 94.64% | 93.94% | 0.970 | P<0.01 |
| GMV+ReHo | 81.40% | 87.50% | 84.85% | 0.920 | P<0.01 |
| GMV+ALFF | 69.77% | 85.71% | 78.79% | 0.851 | P<0.01 |
| GMV+DC | 93.02% | 94.64% | 93.94% | 0.970 | P<0.01 |
| ReHo+ALFF | 100.00% | 94.64% | 96.97% | 0.998 | P<0.01 |
| ReHo+DC | 93.02% | 96.43% | 94.95% | 0.979 | P<0.01 |
| ALFF+DC | 95.35% | 94.64% | 94.95% | 0.987 | P<0.01 |
| GMV+ReHo+ALFF | 97.67% | 94.64% | 95.96% | 0.992 | P<0.01 |
| GMV+ReHo+DC | 93.02% | 96.43% | 94.95% | 0.979 | P<0.01 |
| GMV+ALFF+DC | 95.35% | 94.64% | 94.95% | 0.987 | P<0.01 |
| ReHo+ALFF+DC | 86.05% | 94.64% | 90.91% | 0.968 | P<0.01 |
| GMV+ReHo+ALFF+DC | 86.05% | 94.64% | 90.91% | 0.968 | P<0.01 |
图 1.
ROC curves with putting ReHo + ALFF and GMV + ReHo + ALFF + DC as input features, respectively
分别以 ReHo + ALFF 和 GMV + ReHo + ALFF + DC 为输入时的 ROC 曲线
图 2.
Accuracy of classification using different number of features in the classification process
使用不同特征数得到的分类准确度
the reduction of features is based on RFE
其中降维是依据 RFE 算法
2.2. 特征权重
图 3 和表 3 列举了在分类过程中权重最大的 10 个脑区,包括:左侧扣带回中部、右侧额叶中眶部、左侧额中回、右侧额下回三角部、右侧舌叶、左侧嗅球、左侧额下回眶部、苍白球、左侧额中回眶部和右侧脑岛。
图 3.

The top 10 brain regions with the most discrimination power
权重最大的 10 个脑区示意图
表 3. The top 10 regions of interest that have shown the most discriminative features for classification.
分类中权重最大的 10 个脑区
| 脑区 | 半球 | 英文名称 | 英文缩写 | 权重 |
| 扣带回中部 | 左 | Middle cingulate gyrus. L | MCG. L | 0.506 |
| 额眶部内侧 | 右 | Orbitofrontal cortex (medial). R | ORBmed. R | 0.357 |
| 额中回 | 左 | Middle frontal gyrus. L | MFG. L | 0.349 |
| 额下回三角部 | 右 | Inferior frontal gyrus (triangular). R | IFGtriang. R | 0.344 |
| 舌叶 | 右 | Lingual gyrus. R | LING. R | 0.324 |
| 嗅球 | 左 | Olfactory. L | OLF. L | 0.321 |
| 额下回眶部 | 左 | Orbitofrontal cortex (inferior). L | ORBinf. L | 0.312 |
| 苍白球 | 左 | Pallidum. L | PAL. L | 0.311 |
| 额中回眶部 | 左 | Orbitofrontal cortex (middle). L | ORBmid. L | 0.296 |
| 脑岛 | 右 | Insula. R | INS. R | 0.291 |
3. 讨论
本研究基于多模态 MRI 图像,使用多水平的特征,利用 SVM-RFE 算法区分 FESZ 患者和 NCs,用 ReHo + ALFF 作为输入,获得了 96.97% 的最高准确度,并且 AUC 值达到了 0.998。由图 2 可知,分类器的分类精度不是简单地随特征量增加而增加的,特征数量过多可能会导致过拟合现象,选择合适的特征数量对分类效果有至关重要的影响。另外选择不同的特征形态,如结构特征和功能特征,也可能影响分类的结果。之前的一项研究使用多模态 MRI,用多特征对阿尔茨海默病患者和正常人进行区分,使用 GMV + ReHo + ALFF + DC 作为输入取得了最好的分类效果[12]。但本组结果中,选取 ReHo + ALFF 作为输入取得了最好的分类效果,而不是 GMV + ReHo + ALFF + DC。很多研究表明 FESZ 患者大脑结构损伤范围没有慢性 SZ 患者的损伤范围广泛[11, 21];经过药物治疗后,SZ 患者的部分大脑功能活动得到恢复[22-23]。因此,在对 FESZ 进行自动识别的时候,ReHo + ALFF 可能是更为敏感的特征。但是,也不排除另一种可能是由于样本存在局限性。
我们发现在分类中权重最大的脑区主要在额叶,之前很多研究包括采用组分析方法和独立成分分析方法的研究也表明了 SZ 患者额叶的异常[2, 4]。在对 SZ 的研究中,不同研究方法都显示了额叶的结构、功能受损,这些方法相互验证,使额叶成为最受关注的脑区之一[24]。额眶部在情绪的处理中起到了重要作用,它的异常可能使感知觉的异常更为显著,导致幻觉和错觉[25]。最近一项研究表明 FESZ 患者的额眶部内侧皮层和前扣带回的白质连接异常,并且这种异常与量表中关于情感、幻觉和错觉相关的评分有统计学意义的相关性[26]。额叶和其它脑区连接程度的改变与患者认知功能的损伤程度以及主要症状的严重程度相关,表明了连接模式的异常可能引发了 SZ 的主要症状[27]。但不同方法得到的结果仍有差异,统计水平不同、所选取脑区数量不同、样本不同以及不同方法本身的特点可能导致了这种差异。因此,增加样本数量以及多方法融合将使研究的结果更加稳定。
本研究还存在一定局限性:① 本研究的样本数量不大,分类训练出来的模型鲁棒性不强,我们会在接下来的研究中扩充样本的数量;② 本研究只对 FESZ 患者进行了研究,我们会在接下来的研究中对这些 FESZ 患者进行随访,进一步阐述疾病的病理机制。
4. 结语
本文基于脑多模态 MRI 数据,使用包括 GMV、ReHo、ALFF 和 DC 的多水平特征作为 SVM-RFE 分类器的输入,达到了 96.97% 的高分类准确率,能从个体水平上有效区分 FESZ 患者和 NCs,并发现在分类中权重最高的脑区主要集中在额叶,说明额叶的特征用于 SZ 的早期诊断可能敏感性更高。本研究对 FESZ 的临床诊断有重要的参考价值。
Funding Statement
国家自然科学基金青年科学基金项目(31400845);国家自然科学基金面上项目(81471654,81571333,31771074);广东省自然科学基金资助项目(2015A030313800);广东省前沿与关键技术创新专项资金(重大科技专项)(2016B010108003);广东省公益研究与能力建设专项资金(2016A020216004);广东省协同创新与平台环境建设专项资金(2017A040405059);广州市产学研协同创新重大专项(201604020170,201704020168,201704020113);华南理工大学中央高校基本科研业务费(2015ZZ042);广州市医学重点学科建设广州市惠爱医院课题(GBH2014-QN06)
References
- 1.Friston K J Schizophrenia and the disconnection hypothesis. Acta Psychiatr Scand Suppl. 1999;99(395):68–79. doi: 10.1111/j.1600-0447.1999.tb05985.x. [DOI] [PubMed] [Google Scholar]
- 2.Glahn D C, Laird A R, Ellison-Wright I, et al Meta-analysis of gray matter anomalies in schizophrenia: application of anatomic likelihood estimation and network analysis. Biol Psychiatry. 2008;64(9):774–781. doi: 10.1016/j.biopsych.2008.03.031. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Gupta C N, Calhoun V D, Rachakonda S A, et al Patterns of gray matter abnormalities in schizophrenia based on an international mega-analysis. Schizophr Bull. 2015;41(5):1133–1142. doi: 10.1093/schbul/sbu177. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Xu Lai, Groth K M, Pearlson G, et al Source-based morphometry: the use of independent component analysis to identify gray matter differences with application to schizophrenia. Hum Brain Mapp. 2009;30(3):711–724. doi: 10.1002/hbm.20540. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Antonova E, Kumari V, Morris R, et al The relationship of structural alterations to cognitive deficits in schizophrenia: a voxel-based morphometry study. Biol Psychiatry. 2005;58(6):457–467. doi: 10.1016/j.biopsych.2005.04.036. [DOI] [PubMed] [Google Scholar]
- 6.Kreczmanski P, Heinsen H, Mantua V, et al Volume, neuron density and total neuron number in five subcortical regions in schizophrenia. Brain. 2007;130(Pt 3):678–692. doi: 10.1093/brain/awl386. [DOI] [PubMed] [Google Scholar]
- 7.Xu Yongjie, Zhuo Chuanjun, Qin Wen, et al. Altered spontaneous brain activity in schizophrenia: a meta-analysis and a large-sample study. Biomed Res Int, 2015(2015): Article ID 204628.
- 8.Yu Rongjun, Hsieh M H, Wang H L, et al Frequency dependent alterations in regional homogeneity of baseline brain activity in schizophrenia. PLoS One. 2013;8(3):e57516. doi: 10.1371/journal.pone.0057516. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Shenton M E, Dickey C C, Frumin M, et al A review of MRI findings in schizophrenia. Schizophr Res. 2001;49(1/2):1–52. doi: 10.1016/s0920-9964(01)00163-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Zhang Wenjing, Deng Wei, Yao Li, et al Brain structural abnormalities in a group of never-medicated patients with long-term schizophrenia. Am J Psychiatry. 2015;172(10):995–1003. doi: 10.1176/appi.ajp.2015.14091108. [DOI] [PubMed] [Google Scholar]
- 11.Nakamura M, Salisbury D F, Hirayasu Y, et al Neocortical gray matter volume in first-episode schizophrenia and first-episode affective psychosis: a cross-sectional and longitudinal MRI study. Biol Psychiatry. 2007;62(7):773–783. doi: 10.1016/j.biopsych.2007.03.030. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Dai Zhengjia, Yan Chaogan, Wang Zhiqun, et al Discriminative analysis of early Alzheimer's disease using multi-modal imaging and multi-level characterization with multi-classifier (M3) Neuroimage. 2012;59(3):2187–2195. doi: 10.1016/j.neuroimage.2011.10.003. [DOI] [PubMed] [Google Scholar]
- 13.Nieuwenhuis M, van Haren N E, Hulshoff Pol H E, et al Classification of schizophrenia patients and healthy controls from structural MRI scans in two large Independent samples. Neuroimage. 2012;61(3):606–612. doi: 10.1016/j.neuroimage.2012.03.079. [DOI] [PubMed] [Google Scholar]
- 14.Chi Minyue, Guo Shengwen, Ning Yuping, et al Discriminative analysis of major depressive disorder and anxious depression using support vector machine. J Comput Theor Nanosci. 2015;12(7, SI):1395–1401. [Google Scholar]
- 15.Shen Hui, Wang Lubin, Liu Yadong, et al Discriminative analysis of resting-state functional connectivity patterns of schizophrenia using low dimensional embedding of fMRI. Neuroimage. 2010;49(4):3110–3121. doi: 10.1016/j.neuroimage.2009.11.011. [DOI] [PubMed] [Google Scholar]
- 16.Ding Xiaoyu, Yang Yihong, Stein E A, et al Multivariate classification of smokers and nonsmokers using SVM-RFE on structural MRI images. Hum Brain Mapp. 2015;36(12):4869–4879. doi: 10.1002/hbm.22956. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Raichle M E, Mintun M A Brain work and brain imaging. Annu Rev Neurosci. 2006;29:449–476. doi: 10.1146/annurev.neuro.29.051605.112819. [DOI] [PubMed] [Google Scholar]
- 18.Zang Yufeng, Jiang Tianzi, Lu Yingli, et al Regional homogeneity approach to fMRI data analysis. Neuroimage. 2004;22(1):394–400. doi: 10.1016/j.neuroimage.2003.12.030. [DOI] [PubMed] [Google Scholar]
- 19.Cherkassky V The nature of statistical learning theory~. IEEE Trans Neural Netw. 1997;8(6):1564. doi: 10.1109/TNN.1997.641482. [DOI] [PubMed] [Google Scholar]
- 20.Golland P, Fischl B Permutation tests for classification: towards statistical significance in image-based studies. Inf Process Med Imaging. 2003;18:330–341. doi: 10.1007/978-3-540-45087-0_28. [DOI] [PubMed] [Google Scholar]
- 21.Meisenzahl E M, Koutsouleris N, Bottlender R, et al Structural brain alterations at different stages of schizophrenia: A voxel-based morphometric study. Schizophr Res. 2008;104(1/3):44–60. doi: 10.1016/j.schres.2008.06.023. [DOI] [PubMed] [Google Scholar]
- 22.Nielsen M O, Rostrup E, Wulff S, et al Improvement of brain reward abnormalities by antipsychotic monotherapy in schizophrenia. Arch Gen Psychiatry. 2012;69(12):1195–1204. doi: 10.1001/archgenpsychiatry.2012.847. [DOI] [PubMed] [Google Scholar]
- 23.Keedy S K, Rosen C, Khine T, et al An fMRI study of visual attention and sensorimotor function before and after antipsychotic treatment in first-episode schizophrenia. Psychiatry Res. 2009;172(1):16–23. doi: 10.1016/j.pscychresns.2008.06.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Zhou Yuan, Liang Meng, Jiang Tianzi, et al Functional dysconnectivity of the dorsolateral prefrontal cortex in first-episode schizophrenia using resting-state fMRI. Neurosci Lett. 2007;417(3):297–302. doi: 10.1016/j.neulet.2007.02.081. [DOI] [PubMed] [Google Scholar]
- 25.Shad M U, Muddasani S, Keshavan M S Prefrontal subregions and dimensions of insight in first-episode schizophrenia--A pilot study. Psychiatry Res. 2006;146(1):35–42. doi: 10.1016/j.pscychresns.2005.11.001. [DOI] [PubMed] [Google Scholar]
- 26.Ohtani T, Bouix S, Lyall A E, et al Abnormal white matter connections between medial frontal regions predict symptoms in patients with first episode schizophrenia. Cortex. 2015;71:264–276. doi: 10.1016/j.cortex.2015.05.028. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Zhou Yuan, Fan Lingzhong, Qiu Chenxiang, et al Prefrontal cortex and the dysconnectivity hypothesis of schizophrenia. Neurosci Bull. 2015;31(2):207–219. doi: 10.1007/s12264-014-1502-8. [DOI] [PMC free article] [PubMed] [Google Scholar]




