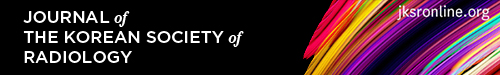Abstract
다발성 골수종은 골수에서 클론 형질 세포의 증식으로 인한 악성 혈액 질환으로 최근 우리나라에서도 발병률이 증가하고 있다. 다발성 골수종의 치료법이 발전하면서 질환의 조기 진단과 조기 치료의 필요성이 대두되었고 International Myeloma Working Group (이하 IMWG) 중심으로 질병의 진단의학적, 영상의학적 진단 기준이 여러 차례 개정되고 있다. 또한 다발성 골수종 환자의 진단과 치료 반응 평가에 전신 자기공명영상(whole body MR; 이하 WBMR)의 사용량이 증가하면서 WBMR의 영상 획득 기법이나 영상 결과 해석, 반응평가법을 표준화하기 위해 Myeloma Response Assessment and Diagnosis System (이하 MY-RADS)가 만들어졌다. 이 종설에서는 다발성 골수종의 정확한 진단을 위해 영상의학과 의사로서 알아야 할 최신 지견으로 IMWG의 최신 가이드라인에 따른 다발성 골수종의 영상검사법 및 MY-RADS에 따른 WBMR에서의 영상 획득 기법 및 반응 평가 기법에 대해 설명하였다.
Keywords: Multiple Myeloma; Whole Body Imaging; Computed Tomography, X-Ray; Magnetic Resonance Imaging; International Myeloma Working Group; Myeloma Response Assessment and Diagnosis System
Abstract
Multiple myeloma (MM) is a malignant hematologic disease caused by the proliferation of clonal plasma cells in the bone marrow, and its incidence is increasing in Korea. With the development of treatments for MM, the need for early diagnosis and treatment has emerged. In recent years, the International Myeloma Working Group (IMWG) has been constantly revising the laboratory and radiological diagnostic criteria for MM. In addition, as whole-body MRI (WBMR) has been increasing used in the diagnosis and treatment response evaluation of patients with MM, the Myeloma Response Assessment and Diagnosis System (MY-RADS) was created to standardize WBMR image acquisition techniques, image interpretation, and response evaluation methods. Radiologists need to have a detailed knowledge of the features of MM for accurate diagnosis. Thus, in this review article, we describe the imaging method for MM according to the latest IMWG guidelines as well as the image acquisition and response evaluation technique for WBMR according to MY-RADS.
서론
다발성 골수종(multiple myeloma; 이하 MM)은 골수에서의 클론 형질세포(clonal plasma cell)의 증식과 침윤으로 인해 발생하는 악성 혈액 질환이다. 우리나라에서는 서양에 비해 비교적 낮은 발병률을 보였으나, 최근 그 발병률이 증가하고 있다. 2020년에 발표된 국가암등록통계에 따르면, 한국에서의 다발성 골수종의 조발생률은 2000년도에는 10만 명당 1명 정도였으나, 2018년도에는 10만 명당 3.4명으로 증가하였다. 2018년 우리나라의 암 발생 총 243837건 중, 다발성 골수종은 총 1719건으로 전체 암 발생의 0.7%를 차지하고 있다(1).
과거에 다발성 골수종은 고칼슘혈증, 신부전, 빈혈, 뼈 병변(hypercalcemia, renal failure, anemia, destructive bone lesion; 이하 CRAB)의 임상 소견이 진행되었을 때 진단을 내렸었다. 이전에는 다발성 골수종의 치료가 어려웠기 때문에 이러한 질병의 정의가 크게 문제가 되지는 않았지만 다발성 골수종의 치료법이 개발되면서 질병의 조기 진단과 조기 치료의 필요성이 대두되었다. 이에 2000년도에 설립된 International Myeloma Working Group (이하 IMWG)에서는 2014년에 다발성 골수종에 대한 진단의학적, 영상의학적인 세부적인 진단기준을 제시하였으며 2019년에는 영상의학적 진단법을 알고리즘으로 제시하였다. 다발성 골수종의 정확한 진단을 위해 저선량 전신 컴퓨터단층촬영(low-dose whole body CT; 이하 LDWBCT), 전신 자기공명영상(whole body MRI; 이하 WBMR), 양전자방출단층촬영(이하 PET/CT)과 같은 민감도가 높은 영상 의학 장비들의 역할이 점점 더 커지고 있으며 이에 따라 영상의학과 의사로서 알아야 할 지식들도 늘어나고 있다. 이 논문에서는 최근 변화한 다발성 골수종의 최신 지견에 대해 설명하고자 한다. 다발성골수종의 이해를 돕고자 다발성 골수종을 포함한 형질세포질환(plasma cell dyscrasia)에 대해 먼저 기술하였으며, IMWG의 2014년 가이드라인과 가장 최근에 발표된 2019년 가이드라인에 대해 정리하였고 다발성골수종 진단에 주로 사용되는 영상검사의 장단점을 기술하였다. 또한 WBMR의 영상 획득 기법 및 프로토콜, 영상 결과의 해석, 반응평가, 판독문 작성법 등을 표준화하기 위해 만들진 Myeloma Response Assessment and Diagnosis System (이하 MY-RADS)에 대해서도 소개하였다.
형질세포질환(Plasma Cell Dyscrasia)
다발성 골수종은 악성 형질세포가 증식하면서 발생하는 질환으로 악성 형질세포는 단일 클론 면역글로불린(immunoglobulin; 이하 Ig)을 분비하는데 이 면역글로불린은 소변과 혈청에서 검출할 수 있다(2). 다발성 골수종의 이해에 앞서 형질세포질환에 대한 이해가 필요하다. 형질세포(plasma cell) 혹은 형질 B세포(plasma B cell)란 항체를 형성할 수 있도록 분화된 B세포를 말하며 골수에서 형성된다. 형질세포질환은 형질세포의 비정상적인 증식으로 인한 질환의 스펙트럼을 일컫는다. 여기에는 monoclonal gammopathy of undetermined significance (이하 MGUS), smoldering MM (이하 SMM), MM, solitary plasmacytoma (이하 SP), 그리고 plasma cell leukemia 등이 포함된다. 다발성 골수종은 항상 전암 단계인 MGUS와 SMM의 선행 단계를 거치면서 발생하게 된다(3,4).
MGUS는 단클론감마병증이 있으나 골수 형질세포가 10% 미만이거나 혈청 M-단백질이 30 g/L 미만인 경우를 말하며 CRAB와 같은 임상 소견이나 증상이 없어야 한다. 치료가 필요한 것은 아니지만 다발성 골수종으로 진행할 확률이 매년 1% 정도이므로 꾸준한 추적검사가 필요하다(5). 참고로 MGUS는 non-IgM MGUS, IgM MGUS, light-chain MGUS 세 가지로 나눌 수 있다(3).
SMM은 MGUS와 다발성 골수종의 중간 단계로, 다발성 골수종으로 진행할 확률이 연간 5%–10%로 MGUS보다 높다(6). 골수 형질 세포가 10%–60% 이거나 혈청 M-단백질이 30 g/L 이상이면서 MGUS와 마찬가지로 CRAB와 같은 임상 증상은 없는 경우 SMM이라고 진단한다. SMM에는 MGUS처럼 전암 단계인 경우와 CRAB 증상이 없는 악성 단계인 경우를 모두 포함하고 있는데, 이 둘을 명확히 구분하기는 어렵다(2,3).
다발성 골수종은 악성 형질세포의 증식과 침윤이 일어나는 질환으로 혈청 M-단백질과 골수 형질 세포 수치가 높으면서 앞서 언급했던 CRAB와 같은 임상 소견이 동반된 경우이고, 이는 말초 기관의 손상이 동반되었음을 의미한다(2,7).
SP는 뼈나 연부조직에 생기는 조직검사로 확인된 단일 병변이면서 골수 형질 세포는 10% 미만이고 혈청 M 단백질도 높지 않아야 한다. CRAB와 같은 다발성 골수종에서 보일 수 있는 임상증상도 없어야 한다(2).
이 논문에서는 형질세포질환 중에서도 다발성 골수종에 초점을 두고 설명하고자 한다.
다발성 골수종의 진단을 위한 가이드라인
2014 IWMG 가이드라인
다발성 골수종의 진단에는 2000년도에 설립된 IMWG의 가이드라인이 일반적으로 사용되고 있다. 과거에 다발성 골수종은 CRAB라고 불리는 심각한 말초기관의 손상이 이미 진행되었을 때 진단을 내렸다. 따라서 말초기관의 손상이 진행하기 전에 조기 진단과 조기 치료를 할 수 없다는 문제가 있었지만, 과거에는 다발성 골수종의 치료법은 부작용이 많으면서도 임상적으로 명백하게 치료 효과가 있는 것이 아니었기 때문에 이러한 진단기준이 크게 문제가 되지는 않았다. 하지만 다발성 골수종에 대한 치료법이 발전하게 되었고 증상이 없는 고위험군 환자에게 조기 치료를 하였을 때 환자의 생존율이 올라간다는 데이터들이 축적되면서, 조기 진단과 치료를 가능하게 하는 명확한 진단기준의 필요성이 대두되었다(8,9). 이에 IMWG에서는 2014년 다발성 골수종에 대한 진단의학 및 영상의학적인 새로운 진단기준을 제시하였는데, 여기에는 CRAB의 진단기준뿐 아니라 CRAB에 상응하는 criteria로 myeloma-defining events (이하 MDEs)가 포함되었다(Table 1) (3).
Table 1. Diagnostic Criteria for Multiple Myeloma according to the IMWG 2014 Guidelines.
| Clonal BM plasma cells > 10% or biopsy-proven bony/extramedullary plasmacytoma | |||
| And any one or more of the following CRAB features and MDE | |||
| CRAB | Evidence of end organ damage attributed to underlying plasma cell proliferative disorder | • Hyper-calcemia: serum Ca > 11 mg/dL or serum Ca > 1 mg/dL higher than upper limit of normal • Renal insufficiency: Cr clearance < 40 mL/min or serum Cr > 2 mg/dL • Anemia: Hb value < 100g/L or Hb > 20g/L below the lowest limit of normal • Bone lesions: ≥ 1 osteolytic lesion on skeletal radiography, CT, or PET/CT. If < 10% clonal plasma cells in BM, ≥ 1 bone lesion is required (distinguish from solitary plasmacytoma with minimal BM involvement) |
|
| MDEs | Any 1 of the following biomarkers of malignancy | • Clonal plasma cells ≥ 60% on BM examination • Serum involved/uninvolved free light chain ratio ≥ 100, provided the absolute level of the involved light chain ≥ 100 mg/L • More than one focal lesion on MRI ≥ 5 mm |
|
BM = bone marrow, Ca = calcium, Cr = creatinine, CRAB = hypercalcemia, renal failure, anemia, destructive bone lesion, Hb = hemoglobin, IMWG = International Myeloma Working Group, MDE = myeloma-defining event
영상의학 분야에서는 다발성 골수종에서 뼈와 골수 외 질병(extramedullary disease)을 진단하기 위한 영상검사법으로 기존의 고식적 전신 골격 검사(conventional skeletal survey; 이하 CSS) 뿐만 아니라 LDWBCT, WBMR, PET/CT가 소개되었다(10). 다발성골수종의 CRAB의 “B”에 해당하는 골파괴병변은 과거에는 형질세포질환 환자에서 확인된 압박 골절을 동반한 골다공증이나 골용해성병변을 의미하였고(11) 주로 CSS로 진단하였으나 민감도가 낮다는 단점이 있었다(3). 그러나 영상 기술이 발전하면서 다발성 골수종의 골 질환 평가에 CT, WBMR, PET/CT 등과 같은 영상검사들이 효과적이라는 것이 여러 연구를 통해 확인되었고(10) 이에 2014 IMWG 가이드라인에서는 CSS, CT, 혹은 PET/CT 상에서 5 mm 이상의 골 용해성 병변이 한 개 이상 있는 경우 골병변의 기준을 충족하는 것이라고 구체화하여 설명하였다(3).
또한 다발성 골수종 진단에서 WBMR의 역할에 대해서도 기술하였는데, WBMR에서 5 mm 이상의 국소 병변이 발견되면 MDEs로, 다시 말해 악성을 시사하는 소견으로 다발성 골수종으로 간주하여야 한다고 하였다. Hillengass 등(12)의 연구에 따르면 SMM 환자에서 하나 이상의 국소 병변이 발견된 경우 다발성 골수종으로 진행할 위험성이 높았고, 이에 2014 IMWG 가이드라인에서는 WBMR에서 국소 병변이 발견된 경우 MDEs로 다발성 골수종의 진단기준에 포함시켰다. 이는 말초 기관의 손상이 진행하기 전에 질병의 조기 진단과 조기 치료를 위한 노력이다.
2019 IWMG 가이드라인
가장 최근 발표된 IWMG의 2019년 가이드라인에서는 민감도가 높은 영상장비인 LDWBCT, WBMR, PET/CT를 이용하여 각각의 형질세포질환에서 사용될 수 있는 영상진단법과 치료 후 추적기간 동안 사용할 수 있는 영상진단지침을 알고리즘으로 제시하였으며 영상진단법을 표준화하고자 하였다. 영상의학 분야에서 관심을 가져야 할 또 하나의 중요한 변화 중 한 가지는 다발성골수종의 진단에 CSS 대신 LDWBCT를 사용할 것을 권장했다는 점이다.
다발성 골수종의 골 질환 평가에는 비용이 저렴하고 접근 가능성이 높은 CSS가 널리 사용되어 왔다(13). 하지만 Edelstyn 등(14)의 연구에 의하면 골 용해성 병변을 X-ray로 발견하려면 뼈가 50%–75% 소실이 되어야 발견할 수 있다고 한다. 이에 비해 LDWBCT는 다발성 골수종 환자에서 골용해성 병변 발견에 민감도가 더 높다는 것이 여러 연구를 통해 확인되었다. 이에 2019 IMWG 가이드라인에서는 다발성 골수종 의심 환자에서 1st line study로 CSS 대신 LDWBCT를 사용할 것을 권장하고 있다. LDWBCT 대신 PET/CT를 사용할 수도 있는데, PET/CT 역시 뼈의 국소 병변을 발견하는 데에 민감도가 높기 때문이다. LDWBCT에서 골용해성 병변이 발견되어 다발성골수종으로 확인된 경우 추후 다발성골수종에 대한 치료 및 반응평가를 위한 base line study로 PET/CT 사용을 권장하고 있다. 반대로 1st line study인 LDWBCT나 PET/CT에서 골용해성 병변이 발견되지 않으면, 2nd line study로 WBMR를 시행한다. WBMR을 시행할 수 없을 경우 척추 및 골반 MRI 검사로 대체할 수도 있다. 여기에서도 음성 결과가 나오면, 최소 5년간 매년 영상 추적검사를 시행해야 한다. 또한 단 한 개의 국소 병변이 WBMR에서만 확인된 경우, 6개월 간격으로 WBMR과 LDWBCT를 교대로 사용하며 추적검사를 시행해야 한다. 두 개 이상의 국소 병변이 WBMR에서 확인되면 다발성 골수종에 준하여 치료를 시작한다. 앞서 설명한 다발성 골수종 의심 환자에서의 진단 알고리즘을 그림으로 첨부하였다(Fig. 1).
Fig. 1. Imaging algorithm for multiple myeloma at 1st diagnosis based on the IMWG 2019 guidelines.
IMWG = International Myeloma Working Group, LDWBCT = low-dose whole body CT, MDE = myeloma-defining event, SMM = smoldering multiple myeloma, WBMR = whole body MRI
다발성 골수종의 진단에 사용되는 영상 기법의 역할과 특징
다발성골수종의 진단에 사용되는 각 영상 기법들의 역할과 특징은 다음과 같다(Table 2) (7).
Table 2. Comparison of Imaging Modalities for Multiple Myeloma.
| Strong Point | Weak Point | |
|---|---|---|
| CSS | • Low cost • Easy accessibility |
• Low sensitivity to detection of bone lesions • A significant amount of bone must be lost to be seen on X-rays • Long acquisition time • Limited bone marrow evaluation • Difficulty in distinguishing between benign and malignant compression fractures • Difficulty evaluating treatment responses |
| LDWBCT | • Higher sensitivity than CSS to osteolytic lesions • A biopsy, surgery or radiation treatment plan may be available • Possible to detect extramedullary lesions • Cheaper than PET/CT or WBMR |
• Radiation exposure • Difficulty evaluating treatment responses • Higher cost than CSS • Unable to identify lesions prior to bone destruction or diffuse lesions in the bone marrow |
| Whole body MRI | • No radiation exposure • Both diffuse or focal bone marrow lesions can be detected • High sensitivity to detect bone marrow lesions • Good for detecting extramedullary lesions or compression fractures • Can be used for prognostic evaluation • A biopsy, surgery or radiation treatment plan may be available |
• Higher cost compared to CSS and LDWBCT • Long acquisition time |
| PET/CT | • Possible to evaluate the activity of the disease before and after treatment • Ability to evaluate extramedullary lesions • CT component can define lytic diseases |
• Higher cost compared to CSS and LDWBCT • Long acquisition time • Radiation exposure • High false positive rate • Poor resolution |
Adapted from Lee et al. Korean J Radiol 2021;22:1497-1513 (7).
CSS = conventional skeletal survey, LDWBCT = low dose whole body CT
고식적 전신 골격 검사 및 저선량 전신 컴퓨터단층촬영
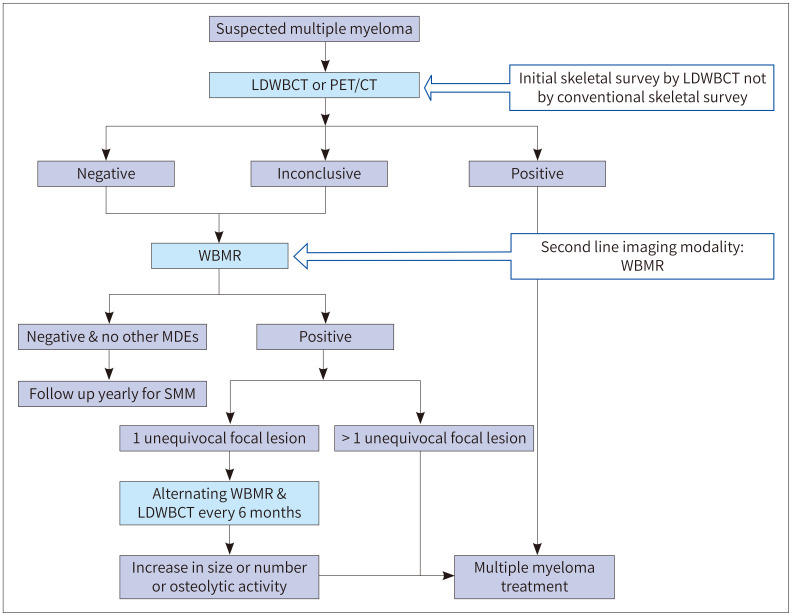
CSS는 비용이 적게 들면서 이용 가능성이 높은 검사로, 다발성 골수종에서 골병변의 진단에 전통적으로 사용되어온 영상검사이다. 그러나 앞서 설명한 바와 마찬가지로 골병변의 발견율과 민감도가 낮고 뼈가 상당히 소실되어야 X-ray에서 확인 가능하다는 단점이 있다. 그에 비해 LDWBCT는 골병변 발견에 민감도가 높다(Fig. 2).
Fig. 2. A 66-year-old male patient with multiple myeloma.
A-C. A conventional skeletal survey shows no definite osteolytic lesion.
D, E. Low-dose whole-body CT images show multiple osteolytic lesions in the spine and pelvis (arrows).
여러 연구를 통해 LDWBCT가 CSS에 비해 민감도가 높다는 것이 확인되었다(4,15,16). CSS보다 WBCT에서 골 질환 발견의 민감도가 높은 부위는 척추와 골반뼈였으며 장골에서는 큰 차이는 없었다(15). 2019년 IMWG 가이드라인에서는 다발성 골수종 의심 환자의 1st line study로 CSS 대신 LDWBCT 사용을 권장하였다. 또 다른 연구에 의하면 확산강조영상(diffusion weighted imaging; 이하 DWI)과 비교 시 CT는 민감도와 특이도가 모두 높은 검사로 IMWG 가이드라인에서 제시하는 바와 마찬가지로 1st line study로 LDWBCT가 적합하다고 하였다(17). LDWBCT는 골외 질환(extraskeletal disease)을 확인할 수도 있고 환자의 측면에서는 짧은 시간 동안 누워서 시행할 수 있는 검사이기 때문에 CSS에 비해 촬영이 용이하다(4).
뼈는 대조도가 높기 때문에 뼈를 평가하기 위한 WBCT는 연조직을 평가하는 일반적인 CT보다 방사선 노출량이 낮다(7). LDWBCT의 방사선 노출량은 3.2–4.8 mSv이고 CSS는 1.2–2.4 mSv 정도이다(4). 이에 비해 일반적인 CT의 평균 유효 선량은 head의 경우 2 mSv, chest는 7 mSv, abdomen은 8 mSV 정도라고 알려져 있다(18). 따라서 LDWBCT는 CSS에 비해서는 방사선 노출량이 약간 많지만 chest/abdomen CT에 비해서는 전신을 평가함에도 불구하고 월등하게 방사선 노출량이 적은 것을 알 수 있다.
LDWBCT의 프로토콜은 tube voltage는 120 kVP, tube current는 40–50 mAs, collimation은 16.0 × 1.5 mm, pitch는 1, section thickness는 2 mm로 설정할 것을 권장하고 있다(19). 스캔 범위는 두정(skull vertex)부터 무릎까지 포함되어야 하고 상완골을 조사야(field of view)에 포함시켜야 하므로 팔을 굽혀서 머리맡에 두거나 몸 옆에 붙여야 하는데, 흉부와 허리 부분에 beam hardening artifact가 생기지 않도록 하기 위해 쿠션 위에 팔을 두도록 한다(4).
전신 자기공명영상
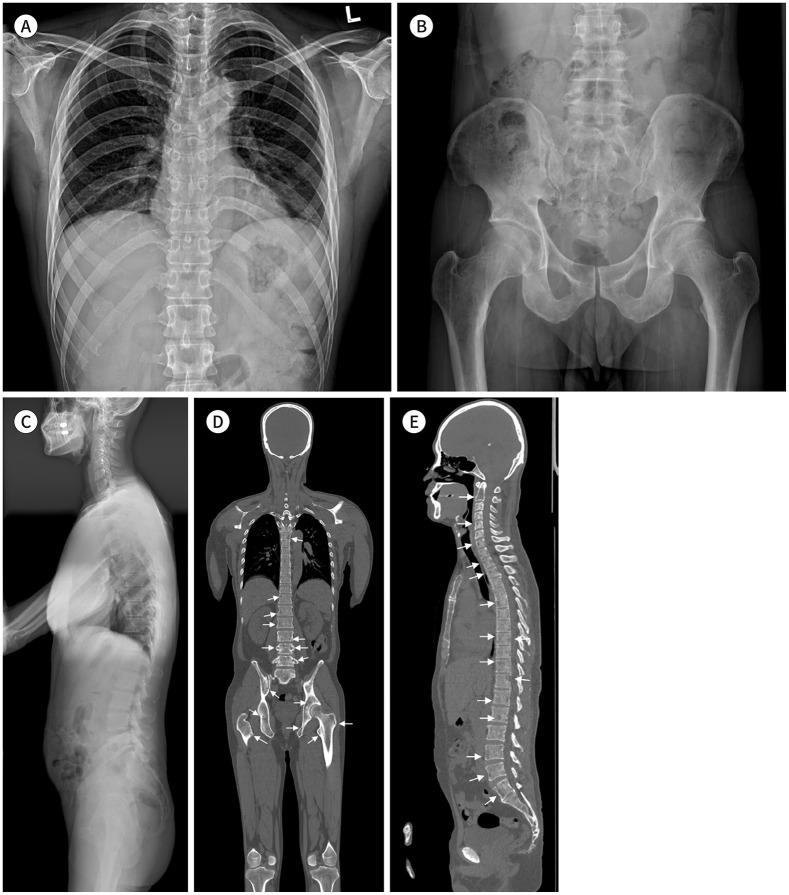
최근 기술의 발전으로 30–60분 만에 DWI를 포함한 WBMR 촬영이 가능해졌고, 이에 WBMR의 사용량이 증가하고 있다(7). CT와 CSS 영상에서는 비교적 발견이 쉬운 골파괴 병변에 비해 골수만 침범된 병변은 그 유무를 확인하기가 어렵다. MRI는 연조직을 잘 구분할 수 있는 특징이 있어 골파괴가 일어나기 전이라도 골수 병변을 확인할 수 있다. 골수종 환자에서 골수 침윤의 중증도와 패턴을 평가할 수 있는 가장 민감한 영상검사로 국소 병변의 조기 발견이 가능하다는 장점이 있다(Fig. 3) (20,21). MRI에서 국소 병변이 발견된 경우 환자의 예후가 더 나쁘다는 것은 이미 잘 알려져 있는 사실이며, 질병의 조기 발견과 질병 진행 정도에 따른 적절한 치료는 환자의 생존에도 큰 도움이 될 수 있다(12,20). 이에 2014 IMWG 가이드라인에서는 WBMR에서 5 mm 이상의 국소 병변이 있는 경우 다발성 골수종의 진단기준으로 포함시켰다. 골병변은 국소 병변뿐 아니라 미만성 골수 이상으로도 보일 수 있는데, SMM 환자에서 미만성 골수 이상이 있으면 다발성 골수종으로의 진행할 위험이 높기 때문에 주의를 기울여야 한다(3).
Fig. 3. A 52-year-old female patient with a diffuse pattern of multiple myeloma.
A. CT shows no definite bone lesions in the pelvis and sacrum.
B. Whole-body MR inverted diffusion-weighted image (b-value = 900 sec/mm2) shows diffuse but increased bone marrow signal change compared with that of the soft tissue.
C. The corresponding apparent diffusion coefficient map shows an increased apparent diffusion coefficient value (approximately 700–800 µm2/sec) compared to the normal bone marrow (less than 600–700 µm2/sec).
D, E. T1-weighted Dixon fat-only (D) and in-phase (E) images show decreased signal intensity at the sacrum and pelvic bone, suggesting a diffuse pattern of multiple myeloma involvement.
MRI는 방사선 노출이 없는 검사로 고위험군 MGUS나 SMM 환자처럼 골병변을 수시로 확인해야 하는 환자에서 그 중요성이 더욱 증가할 것이다(20). 또 척추관(spinal cord)이나 신경근(nerve root) 압박과 같은 합병증 평가에 유용하며 척추압박골절이 있는 환자에서 양성 혹은 악성 압박골절을 감별할 수 있다(Fig. 4) (20,22). 골수 병변뿐 아니라 골수 외 병변을 발견할 수 있다는 것도 WBMR의 장점이다.
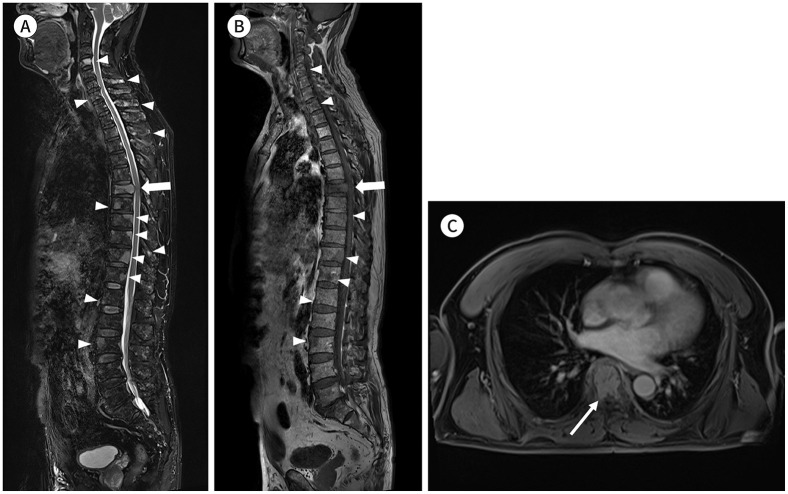
Fig. 4. A 61-year-old male patient with multiple myeloma.
A-C. Sagittal fat-suppressed T2-weighted (A) and T1-weighted (B) images and axial contrast-enhanced fat-suppressed T1-weighted image (C) show the decreased height of the T7 vertebral body with diffuse bone marrow signal change and anterior epidural mass formation abutting the spinal cord (arrows), suggesting a pathologic compression fracture. Other multifocal bone lesions are visible in the whole spine (arrowheads).
그러나 WBMR은 다발성 골수종 환자의 치료반응 평가에는 한계가 있다. WBMR은 질환의 진행(progression) 평가에는 민감도와 특이도 모두 높은 우수한 검사방법이지만(Fig. 5) 부분 또는 완전 관해(partial or complete response)는 저평가(underestimate) 할 수 있는 단점이 있다. 그러나 DWI를 검사방법에 추가하면 치료 반응 평가의 정확도가 올라가므로 이러한 문제를 보완할 수 있다(Fig. 6) (23).
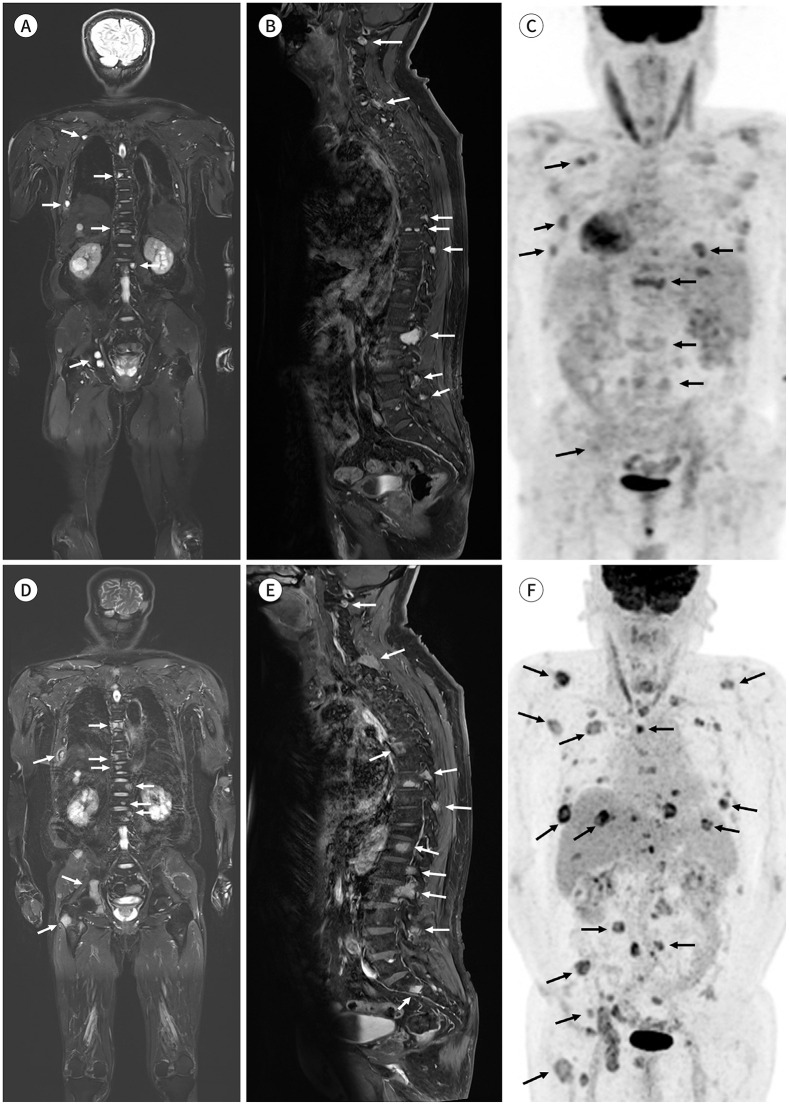
Fig. 5. A 63-year-old male patient with multiple myeloma.
A-C. Initial coronal fat-suppressed T2-weighted (A) and sagittal contrast-enhanced fat-suppressed T1-weighted images (B) show multifocal bone marrow lesions (white arrows). A PET/CT performed at around the same time (C) shows multifocal hypermetabolic bone lesions (black arrows).
D-F. Coronal fat-suppressed T2-weighted (D) and sagittal contrast-enhanced fat-suppressed T1-weighted images (E) and PET/CT image (F) acquired at 1 year and 4 months of follow-up after chemotherapy initiation show an increased size and a high number of multifocal bone marrow lesions in the whole skeleton (arrows). According to the response assessment category of MY-RADS, the lesion appears category 5 and is highly likely to be progressing. Progression of the disease is visible on whole-body MRI, similar to that on PET/CT.
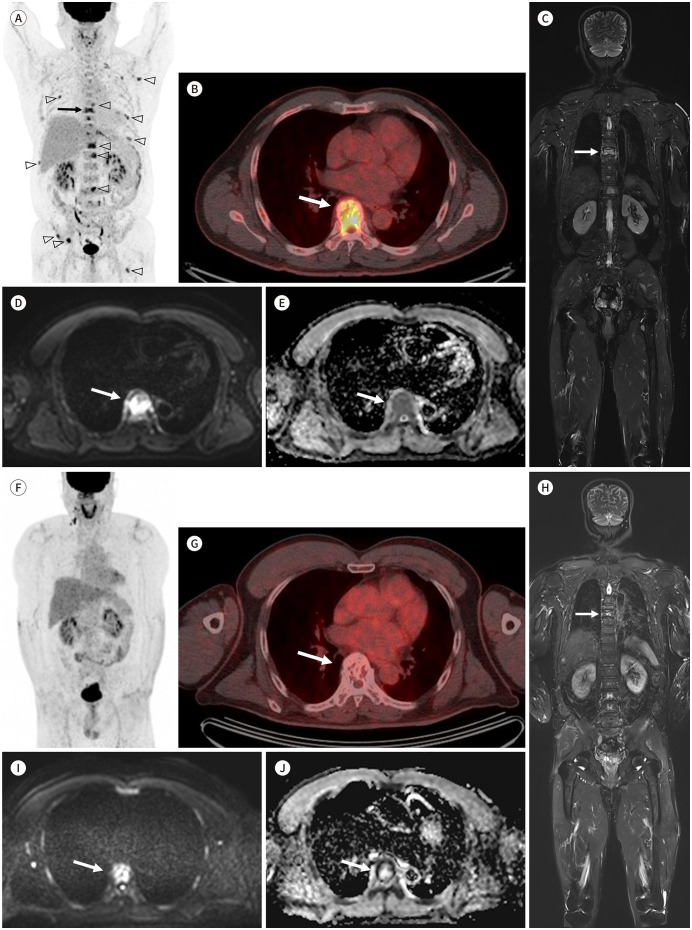
Fig. 6. A 64-year-old male patient with multiple myeloma.
A-E. Initial PET/CT images (A, B) show multiple hypermetabolic bone lesions (arrowheads) in the skeleton, including at the T7, with pathologic compression fracture (arrows). Coronal fat-suppressed T2-weighted image (C) shows a lesion with high signal intensity at T7 (arrow). A high b-value image (D, b = 900 sec/mm2) shows a high signal intensity lesion at T7 (arrow), and the apparent diffusion coefficient map (E) shows a higher apparent diffusion coefficient value (arrow) than that of the normal bone marrow.
F-J. PET/CT images (F, G) acquired at 1-year follow-up after chemotherapy show no residual hypermetabolic lesions, suggesting complete response (category 1; highly likely to be responding according to the response assessment category from MY-RADS). In the coronal fat-suppressed T2-weighted image (H), a lesion with high signal intensity is still visible in T7 (arrows). However, the diffusion-weighted image (I, b = 900 sec/mm2) and apparent diffusion coefficient map (J) show no diffusion restriction, indicating a treated lesion (arrows).
WBMR을 포함한 모든 전신영상(whole body imaging)은 두정(skull vertex)부터 무릎까지 포함되어야 하고 가능하다면 사지도 포함시키는 것이 좋다. 또한 일반적으로 WBMR의 절편두께(slice thickness)는 5 mm이므로 IMWG에서는 국소 병변의 최소 직경의 기준을 5 mm로 설정하였다.
양전자방출단층촬영
PET/CT는 방사성 물질을 이용하여 세포의 대사활동에 대한 정보를 얻는 것으로, 18F가 포함된 fluorodeoxyglucose (이하 FDG)를 가장 많이 사용하고 있고, MM의 진단에도 18F-FDG PET/CT를 주로 사용한다(4). PET/CT 영상에서 FDG uptake는 골수종 세포의 대사를 반영하는 활동성 골수종을 의미한다(7). PET/CT는 골수 병변뿐 아니라 골수 외 병변까지 확인 가능하며 다발성 골수종 환자의 치료 반응 평가 및 모니터링에 유용하다. IMWG 가이드라인에 의하면 다발성 골수종 치료반응 평가 및 모니터링의 최적표준진단법으로 PET/CT가 받아들여지고 있다(7,24). 다발성 골수종으로 치료받는 환자에게 남아있는 종양의 유무는 환자의 예후평가뿐만 아니라 치료 방향 설립에도 중요한 정보인데, PET/CT는 세포 조직과 괴사 조직을 구분할 수 있어 남아있는 종양 평가가 가능하다(7,25).
PET/CT의 한계점은 감염이나 수술로 인한 변화, 골절이나 양성 골질환과 같은 질환 등에서 위양성 결과를 보일 수 있다는 것이다. 또한 고용량 스테로이드 치료 중이거나 고혈당증이 있는 경우에는 위음성 결과를 보일 수도 있다(7). PET/CT는 국소 병변의 생존(viability) 평가에는 MRI보다 우수하지만 미만성 골수 침윤 평가에 있어서는 민감도가 떨어지며 WBMR이 더 민감하다고 알려져 있다(4).
PET/CT에서 병변이 있다고 판단하는 기준이 다소 불명확하여 판독자 간에 차이가 있을 수 있는데 IMWG에서는 PET/CT에서 추적자(tracer)의 흡수가 조혈 골수나 간 보다 높은 경우를 병변의 기준으로 제시하고 있다(4).
Myeloma Response Assessment and Diagnosis System
다발성 골수종 환자에서 민감도가 높은 검사법인 WBMR의 중요성이 더욱 강조되면서 영상의학과 의사를 비롯한 각 분야의 전문가들이 국제적, 다학제적 논의를 통해 2019년 MY-RADS를 발표하였다(20). MY-RADS는 WBMR의 영상 획득 기법 및 프로토콜, 영상 결과의 해석, 반응평가, 판독문 작성법 등을 표준화하기 위해 만들어졌으며 IMWG의 가이드라인과 영국의 National Institute for Clinical Excellence의 지침을 토대로 하였다(20).
전신 자기공명영상 프로토콜
WBMR 프로토콜은 핵심 프로토콜(core clinical protocol)과 종합 프로토콜(comprehensive assessment for research)로 나눌 수 있는데 핵심 프로토콜은 다발성 골수종에서 골수 질환 및 골수 외 질환을 발견하기 위한 필수 프로토콜로 30분 만에 검사를 시행할 수 있으며 질병 진단 목적으로 시행될 수 있다. 종합 프로토콜은 45–50분 정도 소요되는 검사로 연조직이나 골수 외 병변, 치료 반응 평가 등에서 사용될 수 있다. 각 프로토콜에 포함되어야 하는 sequence는 Table 3에 정리하였다(20).
Table 3. Whole Body MRI Protocol from MY-RADS.
| No. | Sequence | Core Clinical Protocol (30 min) | Comprehensive Assessment (50 min) | |
|---|---|---|---|---|
| 1 | Whole spine: sagittal, T1-WI, FSE, section thickness 4–5 mm | O | O | |
| 2 | Whole spine: sagittal, T2, STIR or FS T2-WI, section thickness 4–5 mm | O | O | |
| 3 | Whole body (vertex to knee): T1-WI, GE Dixon. Fat and water image reconstruction with fat fraction maps (FF = F/(F + W)/100%) | Axial or coronal (5 mm) | Axial and coronal | |
| 4 | Whole body: axial, diffusion-weighted, STIR FS, 5 mm contiguous sectioning, multiple stations | Two b-values (50–100 sec/mm2, 800–900 sec/mm2) | Three b-values (+500–600 sec/mm2) | |
| • ADC calculations with monoexponetial data fitting | ||||
| • 3D MIP reconstructions of highest b-value images | ||||
| 5 | Whole body: axial, T2WI, FSE w/o FS, 5 mm contiguous sectioning, preferably matching the DWI | Optional | O | |
| 6 | Regional assessments such as symptomatic or known sites, suspected cord compression/nerve root involvement/extramedullary disease | Usually not | Optional | |
Adapted from Messiou et al. Radiology 2019;291:5-13 (20).
ADC = apparent diffusion coefficient, DWI = diffusion weighted imaging, FS = fat suppression, FSE = fast spin-echo, GE = gradient-echo, MIP = maximum intensity projection, MY-RADS = myeloma response assessment and diagnosis system, STIR = short inversion time inversion-recovery, WI = weighted imaging
MY-RADS에는 포함되어 있지 않지만, 다발성골수종이나 다른 종양의 평가를 위한 WBMR에서 관상 T2 강조 영상(coronal T2 weighted image)을 찍기도 하며(26,27,28) 각 병원의 상황에 맞게 프로토콜을 만들 수 있겠다. WBMR에 관상 T2 강조 영상을 추가한 프로토콜의 예는 Table 4에 정리하였다. 촬영 시간이 8분 정도 소요되는데, 관상 영상(coronal image)은 축상 영상(axial image)보다 몸통과 상하지 장골 전체를 한눈에 쉽게 파악할 수 있으며 지방 억제 영상(fat suppression image)으로 gradient echo image보다 영상의 해상도가 더 좋다. 또 축상 뇌 T1 강조 스핀에코 지방 억제 영상(axial brain T1-weighted spin-echo fat suppression image)을 추가하였고 뇌 실질과 두개골의 병변이 더 잘 보일 것으로 기대한다.
Table 4. Whole Body MRI Protocol Including Coronal T2 Image in Asan Medical Center.
| No. | Sequence (Total Scan Time, 33 min) | |
|---|---|---|
| 1 | Whole body (vertex to knee): coronal, T2-WI, TSE DFS, 5 mm contiguous sectioning | |
| 2. | Whole spine: sagittal, T1-WI, TSE, section thickness 3.9 mm | |
| 3 | Whole spine: sagittal, FS T2-WI, section thickness 3.9 mm | |
| 4 | Whole body (vertex to knee): axial T1-WI, VIBE, FS Dixon. Section thickness 5 mm | |
| Water only, fat only, in-phase, and opposed-phase sequences | ||
| 5 | Whole body: axial, DWEPI, 5 mm contiguous sectioning, two b-values (50 sec/mm2, 900 sec/mm2) | |
| • ADC calculations with monoexponetial data fitting | ||
| • 3D MIP reconstructions of highest b-value images | ||
| 6 | Brain: axial, T1-WI SE , FS, section thickness 5 mm | |
ADC = apparent diffusion coefficient, DFS = Dixon-based fat saturated, DWEPI = diffusion-weighted echo planar image, FS = fat suppression, MIP = maximum intensity projection, SE = spin echo, TSE = turbo-spin echo, VIBE = volumetric interpolated breath-hold sequence, WI = weighted imaging
전신 자기공명영상의 해석
Table 3에 설명한 대로 두정부터 무릎까지 축상으로 DWI를 얻는데 high b-value의 maximum intensity projections (이하 MIP) 이미지를 inverted gray scale로 바꾸게 되면 전반적인 병변의 범위나 병변의 위치를 쉽게 파악할 수 있다. 그러나 MIP 이미지는 민감도는 높지만 특이도는 떨어지며 위양성과 위음성률이 높기 때문에 MIP만 단독으로 보지는 말아야 하고 다른 고식적 자기공명영상(conventional MRI)을 함께 평가해야 한다(20,29). High b-value의 값은 800–900 sec/mm2이며 여기에서 고신호/저신호강도의 구분은 인접한 근육의 신호강도를 기준으로 구분하는 것이 권장된다. High b-value에서 고신호강도로 보일 수 있는 위양성 병변으로는 골절이나 골 관절염, 감염, 경색, 척추 혈관종이나 물혹 등이 있다(20,30). 또한 치료된 병변은 액체화(liquid transformation) 되면서 T2 shine through phenomenon을 보일 수 있다. 머리덮개뼈(skull vault) 병변은 axial high b-value image와 Dixon fat fraction image를 함께 평가하는 것이 좋다. High b-value에서 뇌의 고신호강도로 병변 평가가 어려울 수 있기 때문이다. DWI에서 위양성 병변과 감별하기 위해서는 T1 강조 스핀에코 Dixon 영상과(T1 weighted spin echo and Dixon images) 현성확산계수(apparent diffusion coefficient; 이하 ADC) 값을 함께 확인해야 한다(20,31). 참고적으로 정상 골수의 ADC 값은 600–700 µm2/sec 이하이지만 종양의 경우 보통 700–1400 µm2/sec로 확인된다. 치료받은 후의 병변이나 괴사성 병변의 경우 ADC value는 1400 µm2/sec 이상일 수 있다. 그러나 다발성 골수종에서의 병변은 골수종 세포와 지방 및 골수 세포가 혼합되어 있기 때문에 ADC 값은 다양하게 보일 수 있음을 염두에 두어야 한다(20,32).
병변의 크기 측정
IMWG에서는 WBMR의 국소 병변의 최소 직경을 5 mm로 정의하였는데, 일반적으로 WBMR의 절편 두께(slice thickness)가 5 mm 이기 때문이다. 5 mm 미만의 병변은 판독지에 기록은 하지만 정확한 크기 측정은 필요하지 않다. 5 mm 이상 1 cm 미만의 병변의 경우에도 국소 병변으로 판독지에 정확한 크기 측정은 필요 없다.
골수의 미만성 병변
다발성 골수종이 의심되는 환자에서 골수의 미만성 병변은 T1 고속스핀에코(fast spin-echo)나 Dixon in-phase fat only 영상에서 신호강도가 전반적으로 감소되어 있으면서 high b-value image에서 신호강도가 근육보다 높은 경우 의심할 수 있다(20,33). ADC 값에 대해서는 아직 확립된 기준은 없지만 치료받지 않은 다발성 골수종 의심 환자에서 ADC 값이 600–700 µm2/sec 이상의 값인 경우 미만성 침윤을 생각할 수 있다(20,21).
판독문(Structural Report)
다발성 골수종 환자의 WBMR의 판독양식은 Table 5와 같다(20). 판독문에는 병변의 패턴에 대해서 기술하도록 되어있으며 normal, focal, focal on diffuse, diffuse, micronodular pattern으로 나눌 수 있다(Fig. 7). 앞서 설명한 바와 마찬가지로 여러 sequence를 보며 판단하여 병변으로 확인되면 high b-value와 ADC map에서 병변의 형태(pattern)를 확인하고 기술한다.
Table 5. Clinical Reporting Template for Multiple Myeloma on Whole Body MRI.
| Clinical Reporting Template | Notes | |
|---|---|---|
| Technique | Core vs. comprehensive protocol | |
| Additional sequences and deviations | ||
| Dates of previous examinations | ||
| Findings | ||
| • Bone | Spine first, and then head to thighs | |
| • Measurement of up to 5 focal lesions/pattern of marrow infiltration | Normal, focal, focal on diffuse, diffuse, micronodular | |
| • Paramedullary or extramedullary sites | ||
| • Vertebral fractures | ||
| • Response assessment category for each anatomic sites | 1: Highly likely to be responding | |
| 2: Likely to be responding | ||
| 3: Stable | ||
| 4: Likely to be progressing | ||
| 5: Highly likely to be progressing | ||
| • Incidental findings | ||
| Conclusion | ||
Adapted from Messiou et al. Radiology 2019;291:5-13 (20).
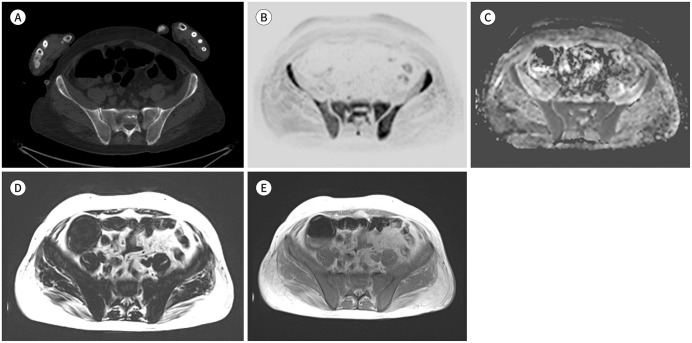
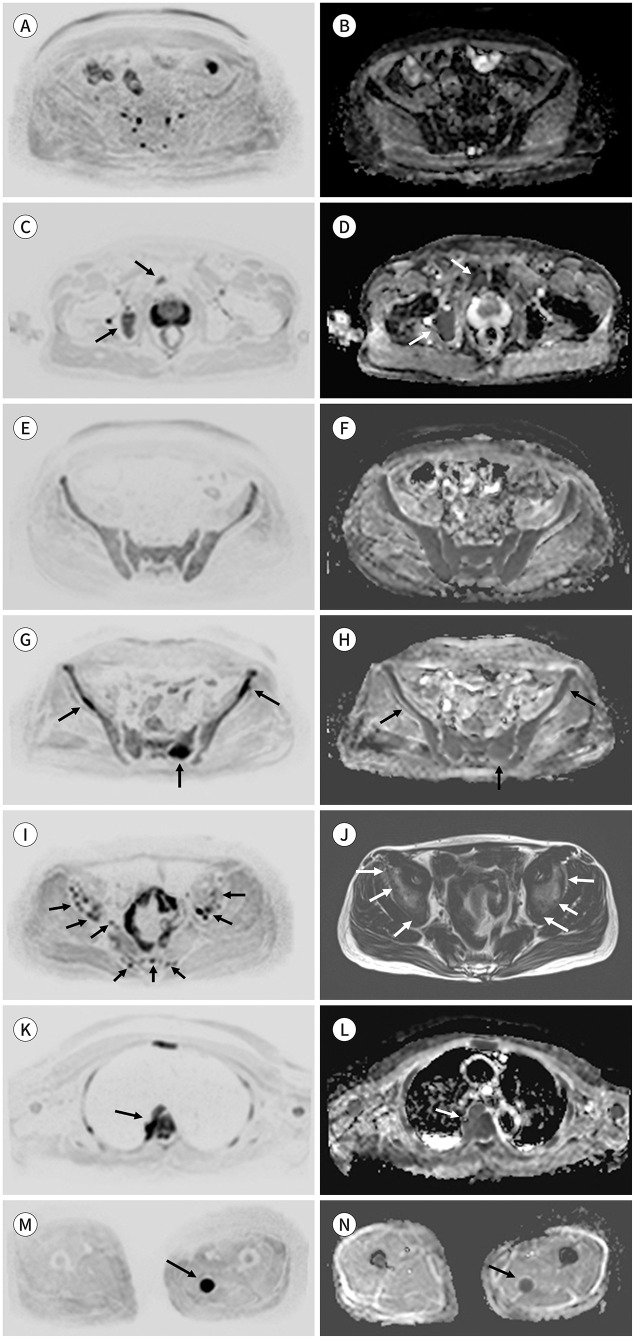
Fig. 7. Patterns of multiple myeloma.
A-H. Axial inverted DWI (b-value = 900 s mm2) (A, C, E, G, I). Corresponding to the ADC maps (B, D, F, H).
A, B. Normal adult bone marrow.
C, D. Focal pattern. Images demonstrate focal bone lesions greater than 5 mm (arrows), which have a higher signal intensity, with high b-value, than the muscle and background marrow, as well as a higher ADC value than the background bone marrow.
E, F. Diffuse pattern. A high b-value image (E) shows a more diffuse, higher signal intensity than muscle, and the corresponding ADC map (F) shows a higher signal intensity than that of the normal bone marrow.
G, H. Focal diffuse pattern. DWI (G) shows focal bone lesions (arrows) with a higher signal intensity than the muscle. However, the background marrow has a higher signal intensity than that of the muscle, and the corresponding ADC (H) shows a higher signal intensity than that of the normal bone marrow.
I, J. Micronodular patterns. DWI (I) and T1-weighted Dixon fat-only images (J) show multiple small nodular signal changes (≤ 5 mm).
K, L. The images show a paramedullary soft-tissue disease with direct continuity with the bone marrow lesion (arrows).
M, N. The images show an extramedullary disease that is not in continuity with bone marrow disease (arrows).
ADC = apparent diffusion coefficient, DWI = diffusion-weighted image
그 외에도 다발성 골수종의 치료 반응 평가(response assessment category; 이하 RAC)에 대한 보고 양식도 포함되어 있는데, RAC는 다섯 가지 카테고리가 있고 1, highly likely to be responding; 2, likely to be responding; 3, stable; 4, likely to be progressing; 5, highly likely to be progressing으로 나눈다(Table 6) (20).
Table 6. Response Assessment Categories for MM.
| 1: Highly likely to be responding | • Return of normal fat containing marrow in areas previously infiltrated by focal or diffuse myelomatous infiltration |
| • Unequivocal decrease in number or size of focal lesions | |
| • Conversion of a packed bone marrow infiltrate into discrete nodules, with unequivocal decrease in tumor load in the respective bone marrow space | |
| • Decreasing soft tissue associated with bone disease | |
| • Emergence of intra- or peritumoral fat within/around focal lesions (fat dot or halo signs) | |
| • Previously evident lesion shows increase in ADC from ≤ 1400 µm2/sec to > 1400 µm2/sec | |
| • ≥ 40% increase in ADC from baseline with corresponding decrease in normalized high b-value signal intensity; morphologic findings consistent with stable or responding disease | |
| • For soft-tissue disease, RECIST version 1.1 criteria for PR/CR | |
| 2: Likely to be responding | • Evidence of improvement but not enough to fulfill criteria for RAC 1 |
| • Slight decrease in number/size of focal lesions | |
| • Previously evident lesions showing increases in ADC from ≤ 1000 µm2/sec to < 1400 µm2/sec | |
| • > 25% but < 40% increase in ADC from baseline with corresponding decrease in high b-value signal intensity; morphologic findings consistent with stable or responding disease | |
| • For soft-tissue disease, RECIST version 1.1 not meeting requirements for PR | |
| 3: No change | • No observable change |
| 4: Likely to be progressing | • Evidence of worsening disease, but not enough to fulfill criteria for RAC 5 |
| • Equivocal appearance of new lesion(s) | |
| • No change in size but increasing signal intensity on high b-value images (with ADC values < 1400 µm2/sec) consistent with possible disease progression | |
| • Relapsed disease: reemergence of lesion(s) that previously disappeared or enlargement of lesion(s) that had partially regressed/stabilized with prior treatments | |
| • Soft tissue in spinal canal causing narrowing not associated with neurologic findings and not requiring radiation therapy | |
| • For soft-tissue disease, RECIST version 1.1 criteria not meeting requirements for PD | |
| 5: Highly likely to be progressing | • New critical fracture(s)/cord compression requiring radiation therapy/surgical intervention; only if confirmed as malignant with MRI signal characteristics |
| • Unequivocal new focal (> 5 to 10 mm)/diffuse area(s) of infiltration in regions of previously normal marrow | |
| • Unequivocal increase in number/size of focal lesions | |
| • Evolution of focal lesions to diffuse neoplastic pattern appearance/increasing soft tissue associated with bone disease | |
| • New lesions/regions of high signal intensity on high b-value images with ADC value between 600–1000 µm2/sec |
Adapted from Messiou et al. Radiology 2019;291:5-13 (20).
ADC = apparent diffusion coefficient, CR = complete response, PD = progressive disease, PR = partial response, RAC = response assessment category, RECIST = response evaluation criteria in solid tumors, MM = multiple myeloma
MY-RADS의 활용
2019년 MY-RADS가 발표된 이후 여러 연구에서 질환의 평가에 MY-RADS를 활용하고 있다. 한 연구에 의하면 MY-RADS로 다발성 골수종 환자의 치료 반응 효과를 예측할 수도 있다고 하였는데, MY-RADS에서 총 tumor burden이 적거나 ADC value가 낮거나 fat fraction이 높은 경우 치료 반응이 좋을 가능성이 높다. 그러나 빈혈이 있는 환자의 경우 적색 골수의 증식으로 인해 이러한 예측이 어렵다고 한다(34). 또한 자가 줄기세포 이식을 시행 받은 다발성 골수종 환자에서 MY-RADS의 RAC criteria는 환자의 예후 평가에도 사용될 수 있다(35).
결론
다발성 골수종에 대한 치료법이 개발되면서 질환의 정확한 진단 기준이 필요해졌고 이에 IMWG를 중심으로 질병에 대한 진단의학적 그리고 영상의학적인 진단기준이 여러 차례 개정되었다. 골수 병변이나 골수 외 병변을 잘 확인할 수 있는 LDWBCT, WBMR, PET/CT와 같은 영상검사의 중요성이 점점 더 강조되고 있다. 여러 장비 중에서 다발성 골수종의 진단에 1st line study 로 LDWBCT를 사용할 수 있으며 WBMR은 골수 병변을 발견하는 데에 민감도가 높은 장비로 DWI를 추가하면 치료반응 평가에도 적합하다. 이 논문에서는 IMWG의 2014 가이드라인과 2019 가이드라인을 토대로 영상의학과 의사로서 알아야 할 최신 지식들을 정리하였다. 또한 MY-RADS를 영상 기법 및 프로토콜, 영상 결과의 해석, 반응평가, 판독문 작성에 사용할 수 있다. 최근 업데이트되고 있는 위와 같은 정보들을 잘 알고 이해하여 적절한 영상검사로 적절한 진단을 내릴 수 있어야 하겠다.
Footnotes
Invited for the Pictorial Essay at 2021 KCR Annual Meeting.
- Conceptualization, H.W.C.
- data curation, all authors.
- investigation, A.Y.S.
- methodology, H.W.C.
- project administration, H.W.C.
- resources, all authors.
- supervision, H.W.C.
- visualization, all authors.
- writing—original draft, A.Y.S.
- writing—review & editing, all authors.
Conflicts of Interest: The authors have no potential conflicts of interest to disclose.
Funding: None
References
- 1.Hong S, Won YJ, Lee JJ, Jung KW, Kong HJ, Im JS, et al. Cancer statistics in Korea: incidence, mortality, survival, and prevalence in 2018. Cancer Res Treat. 2021;53:301–315. doi: 10.4143/crt.2021.291. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Röllig C, Knop S, Bornhäuser M. Multiple myeloma. Lancet. 2015;385:2197–2208. doi: 10.1016/S0140-6736(14)60493-1. [DOI] [PubMed] [Google Scholar]
- 3.Rajkumar SV, Dimopoulos MA, Palumbo A, Blade J, Merlini G, Mateos MV, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014;15:e538–e548. doi: 10.1016/S1470-2045(14)70442-5. [DOI] [PubMed] [Google Scholar]
- 4.Hillengass J, Usmani S, Rajkumar SV, Durie BGM, Mateos MV, Lonial S, et al. International Myeloma Working Group consensus recommendations on imaging in monoclonal plasma cell disorders. Lancet Oncol. 2019;20:e302–e312. doi: 10.1016/S1470-2045(19)30309-2. [DOI] [PubMed] [Google Scholar]
- 5.Kyle RA, Rajkumar SV. Criteria for diagnosis, staging, risk stratification and response assessment of multiple myeloma. Leukemia. 2009;23:3–9. doi: 10.1038/leu.2008.291. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Kyle RA, Remstein ED, Therneau TM, Dispenzieri A, Kurtin PJ, Hodnefield JM, et al. Clinical course and prognosis of smoldering (asymptomatic) multiple myeloma. N Engl J Med. 2007;356:2582–2590. doi: 10.1056/NEJMoa070389. [DOI] [PubMed] [Google Scholar]
- 7.Lee K, Kim KW, Ko Y, Park HY, Chae EJ, Lee JH, et al. Comprehensive updates in the role of imaging for multiple myeloma management based on recent international guidelines. Korean J Radiol. 2021;22:1497–1513. doi: 10.3348/kjr.2020.0886. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Mateos MV, Hernández MT, Giraldo P, de la Rubia J, de Arriba F, López Corral L, et al. Lenalidomide plus dexamethasone for high-risk smoldering multiple myeloma. N Engl J Med. 2013;369:438–447. doi: 10.1056/NEJMoa1300439. [DOI] [PubMed] [Google Scholar]
- 9.Dispenzieri A, Stewart AK, Chanan-Khan A, Rajkumar SV, Kyle RA, Fonseca R, et al. Smoldering multiple myeloma requiring treatment: time for a new definition? Blood. 2013;122:4172–4181. doi: 10.1182/blood-2013-08-520890. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Regelink JC, Minnema MC, Terpos E, Kamphuis MH, Raijmakers PG, Pieters-van den Bos IC, et al. Comparison of modern and conventional imaging techniques in establishing multiple myeloma-related bone disease: a systematic review. Br J Haematol. 2013;162:50–61. doi: 10.1111/bjh.12346. [DOI] [PubMed] [Google Scholar]
- 11.International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Br J Haematol. 2003;121:749–757. [PubMed] [Google Scholar]
- 12.Hillengass J, Fechtner K, Weber MA, Bäuerle T, Ayyaz S, Heiss C, et al. Prognostic significance of focal lesions in whole-body magnetic resonance imaging in patients with asymptomatic multiple myeloma. J Clin Oncol. 2010;28:1606–1610. doi: 10.1200/JCO.2009.25.5356. [DOI] [PubMed] [Google Scholar]
- 13.Dimopoulos M, Terpos E, Comenzo RL, Tosi P, Beksac M, Sezer O, et al. International Myeloma Working Group consensus statement and guidelines regarding the current role of imaging techniques in the diagnosis and monitoring of multiple myeloma. Leukemia. 2009;23:1545–1556. doi: 10.1038/leu.2009.89. [DOI] [PubMed] [Google Scholar]
- 14.Edelstyn GA, Gillespie PJ, Grebbell FS. The radiological demonstration of osseous metastases. Experimental observations. Clin Radiol. 1967;18:158–162. doi: 10.1016/s0009-9260(67)80010-2. [DOI] [PubMed] [Google Scholar]
- 15.Hillengass J, Moulopoulos LA, Delorme S, Koutoulidis V, Mosebach J, Hielscher T, et al. Whole-body computed tomography versus conventional skeletal survey in patients with multiple myeloma: a study of the International Myeloma Working Group. Blood Cancer J. 2017;7:e599. doi: 10.1038/bcj.2017.78. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Wolf MB, Murray F, Kilk K, Hillengass J, Delorme S, Heiss C, et al. Sensitivity of whole-body CT and MRI versus projection radiography in the detection of osteolyses in patients with monoclonal plasma cell disease. Eur J Radiol. 2014;83:1222–1230. doi: 10.1016/j.ejrad.2014.02.008. [DOI] [PubMed] [Google Scholar]
- 17.Yoon MA, Chee CG, Chung HW, Lee DH, Kim KW. Diagnostic performance of computed tomography and diffusion-weighted imaging as first-line imaging modality according to the International Myeloma Working Group (IMWG) imaging algorithm for monoclonal plasma cell disorders. Acta Radiol. 2022;63:672–683. doi: 10.1177/02841851211008383. [DOI] [PubMed] [Google Scholar]
- 18.Costello JE, Cecava ND, Tucker JE, Bau JL. CT radiation dose: current controversies and dose reduction strategies. AJR Am J Roentgenol. 2013;201:1283–1290. doi: 10.2214/AJR.12.9720. [DOI] [PubMed] [Google Scholar]
- 19.Ormond Filho AG, Carneiro BC, Pastore D, Silva IP, Yamashita SR, Consolo FD, et al. Whole-body imaging of multiple myeloma: diagnostic criteria. Radiographics. 2019;39:1077–1097. doi: 10.1148/rg.2019180096. [DOI] [PubMed] [Google Scholar]
- 20.Messiou C, Hillengass J, Delorme S, Lecouvet FE, Moulopoulos LA, Collins DJ, et al. Guidelines for acquisition, interpretation, and reporting of whole-body MRI in myeloma: myeloma response assessment and diagnosis system (MY-RADS) Radiology. 2019;291:5–13. doi: 10.1148/radiol.2019181949. [DOI] [PubMed] [Google Scholar]
- 21.Messiou C, Kaiser M. Whole body diffusion weighted MRI--a new view of myeloma. Br J Haematol. 2015;171:29–37. doi: 10.1111/bjh.13509. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Lecouvet FE, Vande Berg BC, Maldague BE, Michaux L, Laterre E, Michaux JL, et al. Vertebral compression fractures in multiple myeloma. Part I. Distribution and appearance at MR imaging. Radiology. 1997;204:195–199. doi: 10.1148/radiology.204.1.9205246. [DOI] [PubMed] [Google Scholar]
- 23.Park HY, Kim KW, Yoon MA, Lee MH, Chae EJ, Lee JH, et al. Role of whole-body MRI for treatment response assessment in multiple myeloma: comparison between clinical response and imaging response. Cancer Imaging. 2020;20:14. doi: 10.1186/s40644-020-0293-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Cavo M, Terpos E, Nanni C, Moreau P, Lentzsch S, Zweegman S, et al. Role of 18F-FDG PET/CT in the diagnosis and management of multiple myeloma and other plasma cell disorders: a consensus statement by the International Myeloma Working Group. Lancet Oncol. 2017;18:e206–e217. doi: 10.1016/S1470-2045(17)30189-4. [DOI] [PubMed] [Google Scholar]
- 25.Weng WW, Dong MJ, Zhang J, Yang J, Xu Q, Zhu YJ, et al. A systematic review of MRI, scintigraphy, FDG-PET and PET/CT for diagnosis of multiple myeloma related bone disease--which is best? Asian Pac J Cancer Prev. 2014;15:9879–9884. doi: 10.7314/apjcp.2014.15.22.9879. [DOI] [PubMed] [Google Scholar]
- 26.Morone M, Bali MA, Tunariu N, Messiou C, Blackledge M, Grazioli L, et al. Whole-body MRI: current applications in oncology. AJR Am J Roentgenol. 2017;209:W336–W349. doi: 10.2214/AJR.17.17984. [DOI] [PubMed] [Google Scholar]
- 27.Albano D, La Grutta L, Grassedonio E, Patti C, Lagalla R, Midiri M, et al. Pitfalls in whole body MRI with diffusion weighted imaging performed on patients with lymphoma: what radiologists should know. Magn Reson Imaging. 2016;34:922–931. doi: 10.1016/j.mri.2016.04.023. [DOI] [PubMed] [Google Scholar]
- 28.Horger M, Weisel K, Horger W, Mroue A, Fenchel M, Lichy M. Whole-body diffusion-weighted MRI with apparent diffusion coefficient mapping for early response monitoring in multiple myeloma: preliminary results. AJR Am J Roentgenol. 2011;196:W790–W795. doi: 10.2214/AJR.10.5979. [DOI] [PubMed] [Google Scholar]
- 29.Padhani AR, Lecouvet FE, Tunariu N, Koh DM, De Keyzer F, Collins DJ, et al. METastasis reporting and data system for prostate cancer: practical guidelines for acquisition, interpretation, and reporting of whole-body magnetic resonance imaging-based evaluations of multiorgan involvement in advanced prostate cancer. Eur Urol. 2017;71:81–92. doi: 10.1016/j.eururo.2016.05.033. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Perez-Lopez R, Nava Rodrigues D, Figueiredo I, Mateo J, Collins DJ, Koh DM, et al. Multiparametric magnetic resonance imaging of prostate cancer bone disease: correlation with bone biopsy histological and molecular features. Invest Radiol. 2018;53:96–102. doi: 10.1097/RLI.0000000000000415. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Koh DM, Blackledge M, Padhani AR, Takahara T, Kwee TC, Leach MO, et al. Whole-body diffusion-weighted MRI: tips, tricks, and pitfalls. AJR Am J Roentgenol. 2012;199:252–262. doi: 10.2214/AJR.11.7866. [DOI] [PubMed] [Google Scholar]
- 32.Hillengass J, Bäuerle T, Bartl R, Andrulis M, McClanahan F, Laun FB, et al. Diffusion-weighted imaging for non-invasive and quantitative monitoring of bone marrow infiltration in patients with monoclonal plasma cell disease: a comparative study with histology. Br J Haematol. 2011;153:721–728. doi: 10.1111/j.1365-2141.2011.08658.x. [DOI] [PubMed] [Google Scholar]
- 33.Messiou C, Collins DJ, Morgan VA, Desouza NM. Optimising diffusion weighted MRI for imaging metastatic and myeloma bone disease and assessing reproducibility. Eur Radiol. 2011;21:1713–1718. doi: 10.1007/s00330-011-2116-4. [DOI] [PubMed] [Google Scholar]
- 34.Dong H, Huang W, Ji X, Huang L, Zou D, Hao M, et al. Prediction of early treatment response in multiple myeloma using MY-RADS total burden score, ADC, and fat fraction from whole-body MRI: impact of anemia on predictive performance. AJR Am J Roentgenol. 2022;218:310–319. doi: 10.2214/AJR.21.26534. [DOI] [PubMed] [Google Scholar]
- 35.Belotti A, Ribolla R, Cancelli V, Villanacci A, Angelini V, Chiarini M, et al. Predictive role of diffusion-weighted whole-body MRI (DW-MRI) imaging response according to MY-RADS criteria after autologous stem cell transplantation in patients with multiple myeloma and combined evaluation with MRD assessment by flow cytometry. Cancer Med. 2021;10:5859–5865. doi: 10.1002/cam4.4136. [DOI] [PMC free article] [PubMed] [Google Scholar]