Die Diagnostik und Therapie pulmonaler Mukormykosen fordern den Kliniker heraus. Die Diagnosestellung erfolgt durch ein Zusammenspiel von Risikofaktoren und klinischer Präsentation des Patienten mit bildgebenden Verfahren sowie mykologischen und histopathologischen Befunden. Die Erstlinientherapie besteht aus hochdosiertem liposomalem Amphotericin B. Sollte diese Therapie nicht möglich sein, besitzt auch Isavuconazol in Deutschland eine Zulassung bei Mukormykose. Die Abgrenzung zur Aspergillose und ein rascher Therapiestart sind essenziell.
* Erstpubliziert in PNEUMONEWS. 2021;13(5):36-44. Es handelt sich um eine auf Wunsch der Redaktion vom Autor geringfügig angepasste Übernahme.
Taxonomie der pathogenen Pilze der Ordnung Mucorales
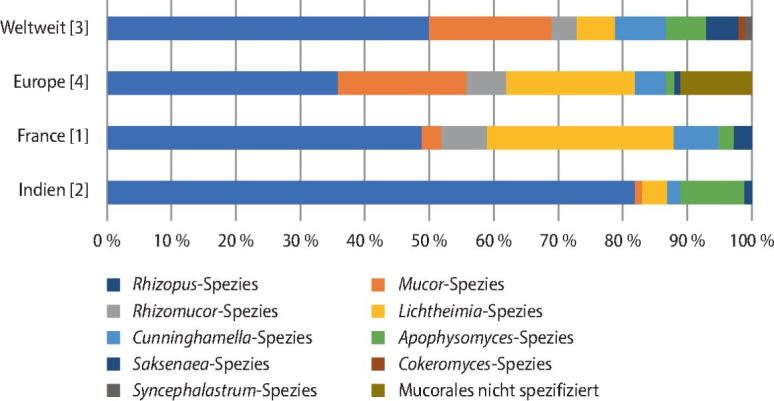
Bis in das Jahr 2007 formten die Zygomyzeten ein einziges Phylum (zu deutsch: Reich) innerhalb des Königreichs der Pilze. Ihre Klassifizierung erfolgte aufgrund der Fähigkeit, sich neben der asexuellen Reproduktion über Konidien (Sporen/Sporangiosporen), auch sexuell über die Produktion von Zygosporen (in denen eine Meiose stattfindet) fortzupflanzen (▶Abb. 1). Phylogenetische Studien konnten jedoch belegen, dass die Zygomyzeten polyphyletisch sind und nicht nur ein einziges Taxon bilden. Die Ordnung der Mucorales, welche die meisten der früheren Zygomyzeten gruppiert, fasst die pathogenen Mitglieder der Mucorales innerhalb der Familien der Cunninghamellaceae, Lichtheimiaceae, Mucoraceae, Saksenaceae, und Syncephalastraceae zusammen. Die Mehrzahl der Mucorales, welche für Krankheiten bei Menschen, den Mukormykosen, verantwortlich sind, sind Mitglieder der Familien der Mucoraceae und Lichtheimiaceae, welche die Gattungen Rhizopus, Mucor, Lichtheimia und Rhizomucor beinhalten (▶Abb. 2). Die virulentesten Spezies sind Rhizopus arrhizus und Rhizopus microsporus [1, 2, 3, 4], gefolgt von Mitgliedern der Gattung Mucor [3, 4]. Einzelne Länder wie Frankreich oder Indien zeichnen ein etwas anders Bild. Dort dominieren Lichtheimia-Spezies [1], bzw. Apophysomyces-Spezies [2] als häufigste Erreger nach den Rhizopus-Spezies. Neben R. arrhizus und R. microsporus bei Infektionen häufig auftretende Vertreter der anderen Gattungen sind Mucor circinelloides, Lichtheimia corymbifera und Rhizomucor pusillus [5]. Seltener werden Spezies wie Cunninghamella bertholletiae, Saksenaea vasiformis, Syncephalastrum racemosum, oder Cokeromyces recurvatus als Verursacher der Mukormykose gefunden [3]. In einer Metaanalyse konnte gezeigt werden, dass mindestens acht Gattungen mit 24 verschiedenen Spezies für die Mukormykose verantwortlich sind [5].
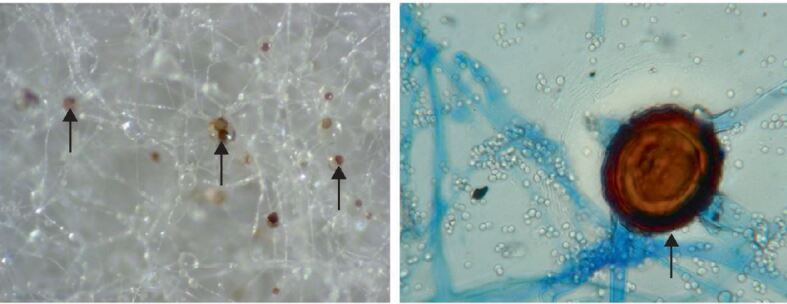
Ökologie
Die Mehrheit der pathogenen Mucorales-Spezies kommen ubiquitär vor und finden sich in zersetzten organischen Materialen wie verrottendem Obst und Gemüse, Ernterückständen, Komposthaufen, Tierkot oder in Böden. Glukose ist die wichtigste Kohlenstoffquelle der Mucorales, sie können jedoch auch eine große Zahl anderer Kohlenstoffquellen für das Wachstum nutzen [6]. Die meisten pathogenen Mucorales sind thermotolerant und können bei Temperaturen über 37 °C wachsen, was mit ihrer Virulenz koinzidiert. Die optimalen Wachstumsbedingungen der Pilze liegen bei 27 °C und einer hohen Luftfeuchtigkeit [7]. Licht kann einen Einfluss auf das Wachstum und die Sporulation haben. Die ubiquitäre Verbreitung, das schnelle Wachstum und die Thermotoleranz sind für die Mucorales von besonderer Bedeutung, um die Mukormykose beim Menschen zu verursachen.
Epidemiologie
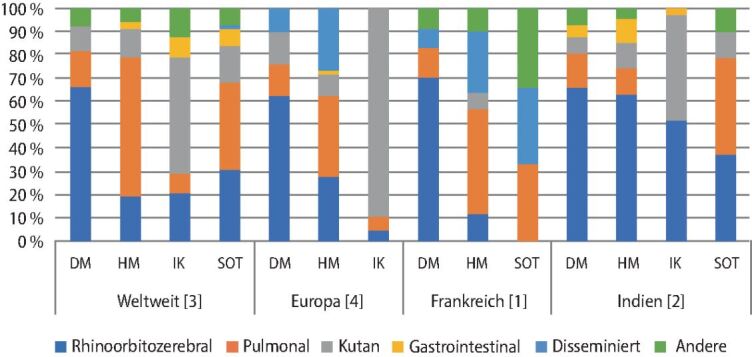
Obwohl seltener auftretend als die invasive Candidiasis oder die invasive Aspergillose, ist die Mukormykose immerhin die zweithäufigste Schimmelpilzinfektion in Europa. Die Infektion ist mit einer hohen Morbidität und einer sehr hohen Gesamtmortalität von ca. 50 % assoziiert [3]. Risikopatienten sind in europäischen Ländern insbesondere immunsupprimierte Patienten, hauptsächlich solche mit hämatologischen Grunderkrankungen (▶Abb. 3). Bei Patienten mit HIV oder AIDS treten Mukormykosen eher selten auf. Neben hämatologischen Erkrankungen ist Diabetes mellitus die zweithäufigste Grunderkrankung bei Patienten mit Mukormykosen in Europa [1, 4]. Weltweit und in Indien zeichnet sich ein anderes Bild ab. Dort dominieren Mukormykosen bei Patienten mit unkontrolliertem Diabetes mellitus, wohingegen Mukormykosen bei Patienten mit Hämoblastosen eine geringere Inzidenz als in Europa haben [2, 3].
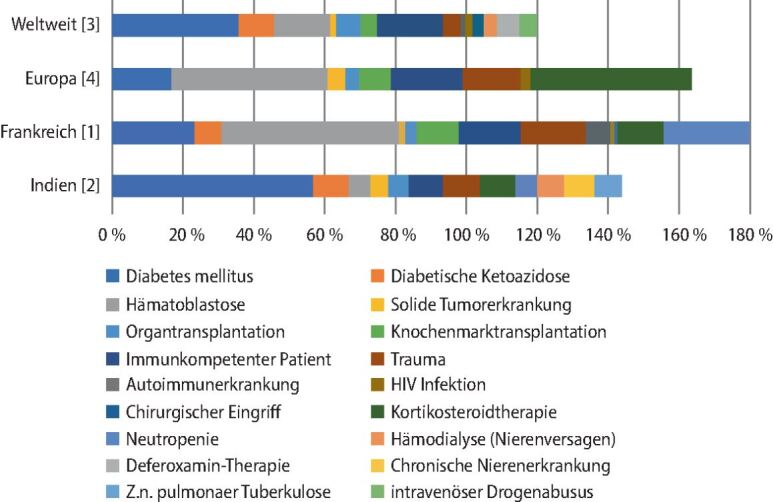
Mukormykosen bei Patienten ohne offensichtliche Immunschwäche sind typischerweise primär kutan in Verbindung mit Traumata oder Verbrennungen. Weitere Risikofaktoren für die Entwicklung einer Mukormykose sind eine hochdosierte Kortikosteroidtherapie, welche Defekte in Makrophagen und Neutrophilen verursacht und zu Hyperglykämien führt, sowie systemische rheumatoide Erkrankungen. Auch Eisenchelatoren wie Deferoxamin, die zur Behandlung von Eisenüberladung bei Dialysepatienten eingesetzt werden, stellen einen Risikofaktor für die Entwicklung einer Mukormykose dar [3].
Insgesamt hat die Inzidenz von Mukormykosen weltweit in den letzten Jahren stark zugenommen [3, 8]. Im Rahmen dieser Entwicklung ist es in westlichen Ländern zu einer Verschiebung der Fälle von Diabetikern [3] hin zu Patienten mit hämatologischen Grunderkrankungen [1] sowie zu Empfängern von soliden Organtransplantaten gekommen. Ursächlich hierfür ist die Zunahme an hämatologischen Patienten sowie die Einführung neuer, potenter Immunsuppressiva und immunsuppressiver Therapien. In anderen Teilen der Welt sieht die Epidemiologie anders aus. Für Aufsehen sorgte zuletzt der drastische Anstieg von rhinoorbitocerebralen Mukormykosen in Indien im Rahmen der COVID-19-Pandemie [9]. Ursächlich hierfür könnten, neben den traditionellen Risikofaktoren wie unkontrolliertem Diabetes, die Freiverkäuflichkeit und der hohe Einsatz von Glukokortikoiden im Rahmen der COVID-19-Pandemie sein. Erschwerend kommt hinzu, dass Mucorales sich resistent gegenüber Antimykotika wie den Echinocandinen und Voriconazol zeigen [10], Antimykotika, die zur Erstlinientherapie von Candida- bzw. Aspergillus-Infektionen eingesetzt werden. Als Folge der intrinsischen Voriconazol- und Echinocandinresistenz von Mucorales kann es zum Auftreten von Durchbruchsmukormykosen unter antimykotischer Prophylaxe, aber auch beim kurativen Einsatz von Voriconazol oder Caspofungin kommen.
Pathophysiologie und Krankheitsmanifestationen
Infektionen durch Mucorales beginnen normalerweise in der Lunge oder in den Nasennebenhöhlen durch Einatmen der Sporen aus der Umgebung, aber auch ein kutaner Weg mittels direkter Inokulation, oder ein oraler Weg über kontaminierte Nahrung sind möglich.
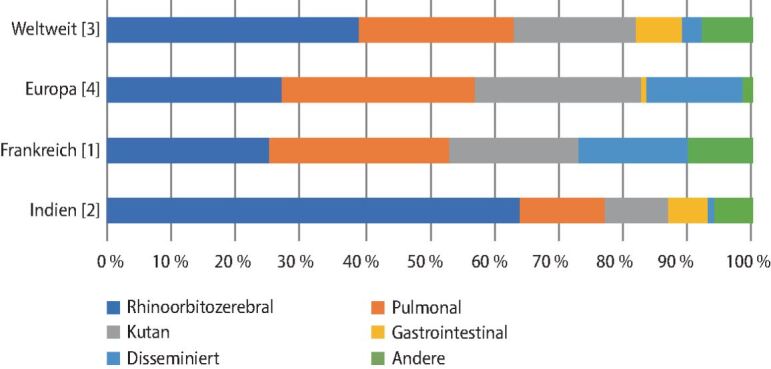
Die Krankheitsmanifestationen sind variabel und in sechs Kategorien unterteilt (▶Abb. 4): rhinoorbitozerebrale, pulmonale, kutane, gastrointestinale, disseminierte und sonstige Formen [1, 2, 3, 4]. Die Krankheitsmanifestationen sind mit den oben genannten Risikofaktoren der Patienten verbunden. Während die meisten neutropenen Patienten, Empfänger von hämatopoetischen Stammzellen oder Organtransplantaten pulmonale Infektionen entwickeln, zeigen sich bei Patienten mit Diabetes mellitus meist rhinoorbitozerebrale Infektionen [1, 3, 4]. Kutane Infektionen finden sich insbesondere bei Patienten ohne Grunderkrankung (z. B. Trauma, Verbrennungen; ▶Abb. 5). Allein in Indien zeichnet sich ein leicht anderes Bild ab. Dort dominieren rhinoorbitozerebrale Infektionen sowohl bei hämatologischen Patienten, als auch bei kutanen Infektionen [2].
Diagnostik
Für die Behandlung von invasiven Mykosen ist eine frühzeitige Diagnosestellung wichtig, insbesondere für das Management der rapide wachsenden Mukormykosen, da eine frühzeitige Therapieeinleitung zu einer deutlich verbesserten Prognose des Patienten führt [11]. Der Ablauf der Diagnostik sollte jedoch bei hochgradigem Verdacht in keinem Fall den Beginn einer empirischen Therapie verzögern, sondern parallel dazu erfolgen. Diesbezüglich ist eine frühzeitige Differenzierung zwischen einer Schimmelpilzinfektion durch Aspergillus-Spezies und Mucorales-Spezies von besonderer Bedeutung, da eine präemptive Therapie mit Voriconazol, in der Annahme es könnte sich um die am häufigsten auftretende Schimmelpilzerkrankung handeln (eine Aspergillus-Infektion), keine Wirkung zeigen würde [10]. Darüber hinaus ist neben dem epidemiologischen Interesse eine genaue Identifizierung auf Speziesebene wichtig. Denn diese könnte als zukünftiger Therapieleitfaden dienen, da die Mucorales artabhängige Empfindlichkeitsprofile gegenüber Antimykotika aufweisen. Zu erwähnen ist hier insbesondere C. bertholletiae, welche hohe In-vitro-MHK (minimale Hemmkonzentration) gegenüber Amphotericin B besitzt, was sich in einer erhöhten Mortalität von über 70 % wiederspiegelt [5].
Die EORTC (European Organization for Research and Treatment of Cancer) und die MSGERC (Mycoses Study Group Education and Research Consortium) haben Leitlinien zur Diagnosesicherung von invasiven Mykosen veröffentlicht [12]. Diese zur Vergleichbarkeit von Studien veröffentlichen Leitlinien, nicht zur Evaluation eines Behandlungskonzeptes, teilen die Wahrscheinlichkeit für das Bestehen einer invasiven Mykose in drei Stufen ein: "bewiesen", "wahrscheinlich" oder "möglich"
Die Diagnosesicherung einer Mukormykose erfolgt durch das Zusammenspiel mehrerer Faktoren: die Risikofaktoren und die klinische Präsentation des Patienten, bildgebende Verfahren (insbesondere Computertomografie und Magnetresonanztomografie) sowie mykologische und histopathologische Befunde:
Mukormykose "bewiesen": Für Schimmelpilze wie die Mucorales gilt der Nachweis von invasivem Wachstum in Histopathologie, Zytopathologie oder direkter Untersuchung bzw. der Kultur eines normalerweise sterilen Gewebes als beweisend. Die Gewebeentnahme erfolgt mittels Biopsie, Feinnadelaspiration oder operativ.
Mukormykose "wahrscheinlich": Ein wahrscheinlicher Nachweis setzt sich zusammen aus den patientenspezifischen Risikofaktoren (z. B. prolongierte Neutropenie oder hämatopoetische Stammzelltransplantation), klinischen Befunden (z. B. typische bildmorphologische Veränderungen) und einem mykologischen Nachweis (Kultur oder positive Mikroskopie eines nicht sterilen Gewebes). Verlässliche Biomarker für Mukormykosen existieren aktuell nicht, jedoch kann ein Test auf Galactomannan aus der bronchoalveolären Lavage helfen, zwischen einer Mukormykose und einer Aspergillose zu unterscheiden (Test positiv bei Aspergillose).
Mukormykose "möglich": Bei dem nur "möglichen" Nachweis gelten die Ausführungen zur Stufe "wahrscheinlich", es fehlt aber der mykologische Befund.
Sollte sich der Verdacht auf eine Mukormykose bestätigen, sollte zum Ausschluss einer disseminierten Infektion immer ein Staging mittels Computertomografie der Nasennebenhöhlen, der Lungen, des Abdomens und des Beckens erfolgen [13].
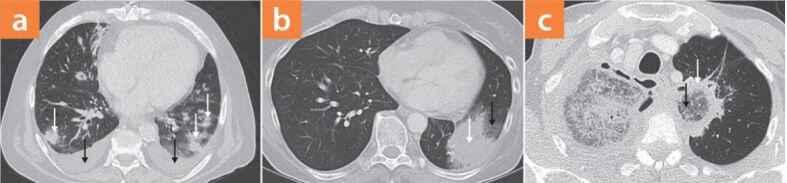
Patienten mit pulmonalen Mykosen zeigen oft unspezifische Symptome wie Fieber, Husten, vermehrten Auswurf, pleuritische Schmerzen, Hämoptysen oder Dyspnoe. Patienten mit hohem Risiko (z. B. prolongierte Neutropenie), persistierendem Fieber und pulmonalen Symptomen sollten unverzüglich eine Dünnschichtcomputertomografie der Lunge erhalten. Diese ist dem konventionellen Röntgenbild in Aussagekraft bezüglich pulmonaler Mykosen deutlich überlegen. Eine Kontrastmittelgabe kann zusätzlich zur Erhöhung der Spezifität beitragen.
▶Abb. 6 zeigt typische pulmonale Veränderungen in der Computertomografie bei hämatologischen Patienten mit Schimmelpilzinfektionen. Bei Hochrisikopatienten mit pulmonalen Mykosen können singuläre, aber auch disseminierte, bilaterale Rundherde und Pleuraergüsse auftreten (▶Abb. 6a). Manchmal lässt sich eine von Milchglasinfiltraten umgebene Konsolidierung nachweisen, dieses Phänomen wird auch Halo-Zeichen (englisch: "halo sign") genannt (▶Abb. 6b). Pilze wie Aspergillus und Mucorales-Spezies wachsen angioinvasiv, die Milchglasinfiltrate des Halos entsprechen Hämorrhagien, die durch die in Blutgefäße einwachsenden Schimmelpilze entstehen. Im Rahmen dieser Angioinvasion kann es zu einem in der computertomografischen Angiografie sichtbaren Gefäßverschlusszeichen kommen (englisch: "vascular occlusion sign"), definiert als ein unterbrochenes Gefäß am Rand einer fokalen Läsion, ohne dass sich das Gefäß innerhalb oder peripher zur Läsion darstellen lässt. Zuweilen lässt sich noch ein weiteres Phänomen, das "umgedrehte" Halo-Zeichen (englisch: "reversed halo sign") beobachten (▶Abb. 6c). In diesem sind Milchglasinfiltrate von einer zirkulären Konsolidierung umgeben. Wobei mehr als zehn disseminierte Rundherde und Pleuraergüsse verdächtig auf das Vorliegen einer Mukormykose sind. Der Nachweis des "umgedrehten" Halo-Zeichens ist hochverdächtig auf das Vorliegen einer Mukormykose bei neutropenen, hämatopoetisch stammzell- oder solidorgantransplantierten Patienten. Das in diesem Patientenkollektiv auftrete Halo-Zeichen tritt zwar auch bei Mukormykosen auf, kommt jedoch öfter bei invasiven Aspergillosen vor [13].
Für die Identifizierung von Mucorales auf Speziesebene ist die Kultur verschiedener klinischer Proben nach wie vor der Goldstandard. Bis in die 1990er-Jahre erfolgte die Speziesidentifizierung durch klassische Lichtmikroskopie anhand morphologischer Merkmale. Mucorales-Spezies weisen jedoch enge morphologische Gemeinsamkeiten auf, was Spezialisten und Referenzlabore unentbehrlich machte. In den späten 1990er-Jahren begann die kulturbasierte Identifizierung von Mucorales einem Wandel zu unterliegen. Neue Ansätze mit molekularen Werkzeugen wurden untersucht. Es wurden molekulare Datenbanken für alle klinisch wichtigen Mucorales erstellt.
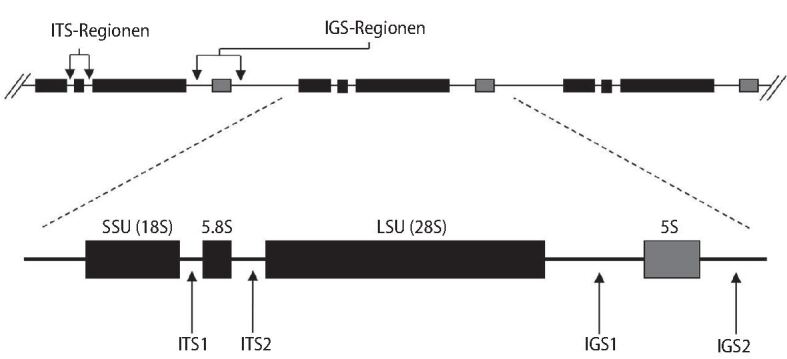
Zuerst wurden Nukleotidsequenzen aus der nuklearen ribosomalen DNA der kleinen Untereinheit (18S-Gene) und die Domänen D1 und D2 der nuklearen ribosomalen DNA der großen Untereinheit (28S-Gene) verwendet. Später wurden die Regionen ITS("internal transcribed spacer")1 und ITS2, die zwischen den 18S- und 28S-Genen liegen, evaluiert (▶Abb. 7). Diese zeichnen sich durch eine hohe Intraspezieshomogenität und Interspeziesheterogenität aus [14]. Die Identifizierung erfolgt nach Amplifikation mittels Polymerasekettenreaktion (PCR) und anschließender Sequenzierung der oben erwähnten Regionen mittels Abgleich mit den erstellten molekularen Datenbanken.
Weitere Möglichkeiten des Einsatzes von Kulturen ist die biochemische Identifizierung aufgrund verschiedener Kohlenstoffassimilationsprofile [6] oder auch Matrix-Assisted-Laser-Desorption/Ionisation-Time-of-Flight-Massenspektrometrie (MALDI-TOF MS), welche insbesondere zur Identifizierung von Bakterien und Hefen eingesetzt wird. Es konnte jedoch auch gezeigt werden, dass das Verfahren zur Identifizierung von Schimmelpilzen wie den Mucorales einsetzbar ist [15]. Wichtige Vorteile gegenüber anderen kulturbasierten Identifizierungsmethoden sind: einfache Handhabung, geringe Kosten, sowie hohe Geschwindigkeit und hoher Durchsatz. Neben der Identifizierung auf Speziesebene ermöglichen Kulturen weiterhin auch eine In-vitro-Sensibilitätstestung, welche bei Mukormykosen in jedem Fall durchgeführt werden sollte [13]. Dennoch sind Kulturen insbesondere bei Mucorales leider oft negativ [16], was alternative, nicht kulturbasierte Methoden notwendig macht.
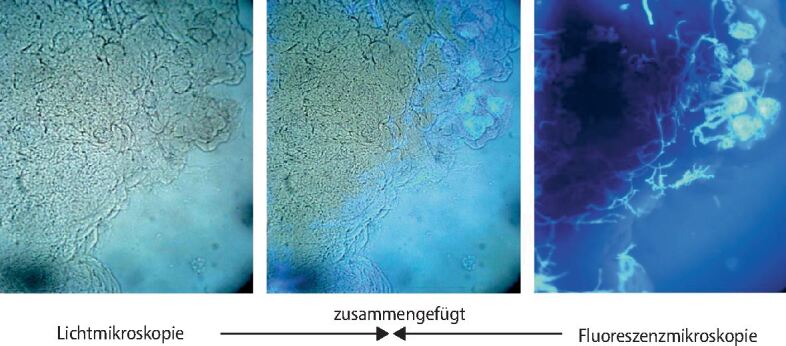
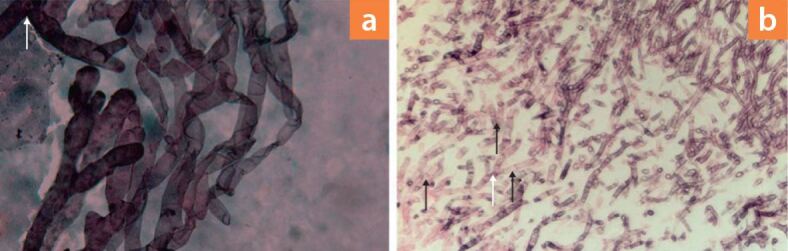
Die bisher wichtigste nicht kulturbasierte Methode zur Identifizierung von Mucorales ist die direkte und histopathologische Mikroskopie von klinischen Präparaten [13]. In der direkten Untersuchung kann homogenisiertes Gewebe, zum Beispiel aus Biopsien, aber auch anderen klinischen Proben wie einer bronchoalveolären Lavage, eingesetzt werden. Hierzu werden die Proben mittels optischer Aufheller wie Calcofluor White behandelt und dann unter dem Fluoreszenzmikroskop angeschaut (▶Abb. 8). Weiterhin möglich sind auch direkte Färbetechniken wie die Grocott-Methenamin-Silber-Färbung (▶Abb. 9a). Die Hyphen von Mucorales-Spezies sind oft rechtwinkelig (90°) verzweigt, unseptiert, und haben einen Durchmesser von etwa 6-16 µm, während die Breite von Aspergillus- oder Candida-Hyphen deutlich kleiner ist (2-3 µm), diese sind septiert und verzweigen sich oft spitzwinkelig (45°). Hämatoxylin-Eosin-Färbungen können verwendet werden, um Pilzhyphen in formalinfixierten, paraffinierten Geweben nachzuweisen. Zur besseren Hervorhebung und Bewertung morphologischer Details können eine Perjodsäure-Schiffsches-Reagenz(PAS)-Färbung oder die Grocott-Methenamin-Silber-Färbungen (▶Abb. 9b) verwendet werden, jedoch ist eine Identifizierung von Mucorales auf Gattungs- oder Speziesebene durch histopathologische Untersuchung von Geweben nicht möglich. Manchmal kann sogar die Unterscheidung zwischen Aspergillus oder anderen morphologisch verwandten Schimmelpilzen und Mucorales-Hyphen schwierig sein, dennoch unterscheidet der Nachweis einer Gewebeinvasion eine luftgetragene Kontamination oder eine Organkolonisation von einer echten invasiven Infektion und ist daher ein wichtiges diagnostisches Instrument.
Zur Identifizierung auf Speziesebene kann zusätzlich eine Identifizierung mittels PCR aus frischen oder formalinfixierten Organen versucht werden [14, 17].
Therapieoptionen
Amphotericin B
Erstlinientherapie der Mukormykose ist liposomales Amphotericin B, welches auch von den klinischen Leitlinien der ESCMID (European Society of Clinical Microbiology and Infectious Diseases) und ECMM (European Confederation of Medical Mycology) für das Management der Mukormykose angeraten wird [13]. In Abhängigkeit von der Krankheitsmanifestation beträgt die empfohlene Tagesdosierung 5-10 mg/kg Körpergewicht. Abgesehen von Amphotericin B und seinen Lipidformulierungen besitzen auch einige Azole Effektivität bei Mucorales-Infektionen.
Isavuconazol
Isavuconazol ist ein neues Breitspektrum-Azol, das auch gegenüber Mucorales Aktivität zeigt. Isavuconazol ist in den USA zur Erstlinientherapie der Mukormykose zugelassen, in Europa jedoch nur bei Versagen oder Nichtdurchführbarkeit einer Therapie mit Amphotericin B. Im Rahmen einer Nichtdurchführbarkeit spielt insbesondere die hohe Nephrotoxizität von Amphotericin B eine Rolle.
Isavuconazol als Primärtherapie wurde in einer multizentrischen, offenen, einarmigen Studie untersucht [18]. Patienten mit Mukormykose (n = 21) erhielten 200 mg Isavuconazol einmal täglich (nach initialem Loading mittels 6 Dosen à 200 mg alle 8 Stunden). In einer gematchten Fall-Kontroll-Studie (VITAL-Studie) wurden Patienten, die mit Isavuconazol therapiert wurden, mit Kontrollen (n = 33) verglichen, die konventionelles Amphotericin B oder Lipidformulierungen (hauptsächlich liposomales Amphotericin B) als Primärbehandlung erhielten. Die Gesamtmortalität an Tag 42 war in beiden Gruppen ähnlich (33 vs. 39 % für Isavuconazol bzw. Amphotericin B).
Obwohl diese Daten darauf hindeuten, dass Isavuconazol bei der Therapie der Mukormykose wirksam ist, weist die Studie jedoch einige Limitierungen auf. Aufgrund der geringen Studiengröße und des nicht randomisierten Studiendesigns reicht die Power der Studie möglicherweise nicht aus, um Unterschiede zwischen Fällen und Kontrollen zu erkennen.
Posaconazol
Weiterhin besitzt Posaconazol Effektivität bei der Therapie der Mukormykose, hat jedoch hierfür keine Zulassung. Als Zweitlinientherapie in Dosierungen von 800 mg pro Tag (orale Suspension: 400 mg zweimal oder 200 mg viermal täglich) betrug die Erfolgsrate (d. h. entweder vollständiges oder partielles Ansprechen) nach Woche 12 60 %. Bei 21 % der Patienten wurde eine stabile Erkrankung festgestellt [19]. Die Einführung der intravenösen und Tablettenformulierung könnte die Effektivität des Medikaments noch verstärkt haben, da die neuen Formulierungen zu einer verbesserten Bioverfügbarkeit und einer erhöhten Exposition gegenüber dem Arzneimittel führen. Die Dosierung für beide Formulierungen beträgt zweimal 300 mg am ersten Tag, gefolgt von 300 mg einmal täglich.
Debridement
Zusätzlich zur antimykotischen Therapie sollte immer, sofern möglich, ein chirurgisches Debridement des nekrotischen Gewebes erfolgen. Dies dient sowohl als unterstützende therapeutische Maßnahme als auch der Möglichkeit zur Gewinnung histopathologischer und mikrobieller Proben.
PD Dr. Dr. Patrick Schwarz.
Medizinische Klinik IV für Hämatologie und Onkologie
Universitätsklinikum Gießen
Klinikstraße 33, 35392 Gießen
patrick.schwarz@innere.med.uni-giessen.de
und
Zentrum für Invasive Mykosen und Antimykotika
Fachbereich 20 - Humanmedizin
Philipps-Universität Marburg
Baldingerstraße, 35043 Marburg
CME-Fragebogen.
Mukormykosen - frühe Abgrenzung zur Aspergillose besonders wichtig
Teilnehmen und Punkte sammeln können Sie
als e.Med-Abonnent*in von SpringerMedizin.de
als registrierte*r Abonnent*in dieser Fachzeitschrift
zeitlich begrenzt unter Verwendung der abgedruckten FIN.
Dieser CME-Kurs ist auf SpringerMedizin.de/CME zwölf Monate verfügbar. Sie finden ihn, wenn Sie die FIN oder den Titel in das Suchfeld eingeben. Alternativ können Sie auch mit der Option "Kurse nach Zeitschriften" zum Ziel navigieren oder den QR-Code links scannen.

Dieser CME-Kurs wurde von der Bayerischen Landesärztekammer mit zwei Punkten in der Kategorie I (tutoriell unterstützte Online- Maßnahme) zur zertifizierten Fortbildung freigegeben und ist damit auch für andere Ärztekammern anerkennungsfähig.
Für eine erfolgreiche Teilnahme müssen 70 % der Fragen richtig beantwortet werden. Pro Frage ist jeweils nur eine Antwortmöglichkeit zutreffend. Bitte beachten Sie, dass Fragen wie auch Antwort-optionen online abweichend vom Heft in zufälliger Reihenfolge ausgespielt werden.
Bei inhaltlichen Fragen erhalten Sie beim Kurs auf SpringerMedizin.de/CME tutorielle Unterstützung. Bei technischen Problemen erreichen Sie unseren Kundenservice kostenfrei unter der Nummer 0800 7780777 oder per Mail unter kundenservice@springermedizin.de.
Welche Aussage über die verschiedenen Mucorales-Spezies ist richtig?
In der Gattung Mucor werden die Infektionen hauptsächlich durch die Spezies Mucor indicus verursacht.
In Frankreich werden die meisten Infektionen durch Lichtheimia corymbifera verursacht.
Die weltweit virulentesten Spezies sind Rhizopus arrhizus und Rhizopus microsporus.
In Indien dominiert Cunninghamella bertholletiae.
Saksenaea vasiformis gehört zu den am häufigsten auftretenden Mucorales-Spezies.
Welche Aussage zur Ökologie von Mucorales trifft zu?
Die Thermotoleranz ist ein wichtiger Virulenzfaktor von Mucorales.
Das Vorkommen von Mucorales ist auf semiaride Klimaregionen beschränkt.
Mucorales können ausschließlich Glukose als Kohlenstoffquelle verwerten.
Licht kann keinen Einfluss auf das Wachstum von Mucorales nehmen.
Mucorales-Spezies weisen ein ubiquitäres Vorkommen auf und finden sich auf zersetzten anorganischen Materialen.
Welche Aussage zur Epidemiologie der Mukormykose trifft zu?
T-Zell-Defekte wie zum Beispiel bei HIV stellen den Risikofaktor Nummer 1 für das Auftreten von Mukormykosen dar.
Risikopatienten sind in europäischen Ländern insbesondere immunsupprimierte Patienten mit hämatologischen Grunderkrankungen.
Die Mukormykose ist nach der invasiven Aspergillose und der Fusariose die dritthäufigste Schimmelpilzinfektion in Europa.
Die Mortalität der Erkrankung ist mit 20 % als moderat einzustufen.
Rhinoorbitozerebrale Mukormykosen treten überwiegend bei Patienten mit schwerer Immunsuppression auf.
Welche Aussage zu den Krankheitsmanifestationen der Mukormykose trifft zu?
Krankheitsmanifestationen sind variabel und werden in vier Kategorien unterteilt: rhinoorbitozerebrale, pulmonale, kutane und disseminierte Formen.
Ingestion von kontaminierter Nahrung kann nicht zu einer Krankheitsmanifestation der Mukormykose führen.
Rhinoorbitozerebrale Infektionen wurden bei der COVID-19-Pandemie in Indien, im Gegensatz zu pulmonalen Manifestationen, nicht beobachtet.
Bestimmte Krankheitsmanifestationen treten gehäuft bei bestimmten Patientenkollektiven auf, so treten in Europa pulmonale Mukormykosen insbesondere bei hämatologischen Patienten auf.
Kutane Infektionen setzen eine irgendwie geartete Immunsuppression des Patienten voraus.
Welche Aussage hinsichtlich der Diagnostik von Mukormykosen ist richtig?
Mukormykosen sind sich nur langsam progredient entwickelnde Erkrankungen, weswegen zur Erhöhung der diagnostischen Aussagekraft die Therapieeinleitung hinausgezögert werden kann.
Eine frühzeitige Differenzierung zwischen einer Aspergillus- und Mucorales-Spezies-Infektion ist nur von epidemiologischen Interesse, da beide Erkrankungen gut auf Voriconazol ansprechen.
Schone heute bestimmt die Identifizierung der Mucorales auf Speziesebene regelhaft die Wahl des Antimykotikums bei Mukormykose.
Bei positiver Kultur wird eine Bestimmung der MHK (minimalen Hemmkonzentration) mittels In-vitro-Sensibilitätstestung empfohlen.
Ein Staging mittels Computertomografie der Nasennebenhöhlen, der Lungen, des Abdomens und des Beckens sollte aus ökonomischen Gründen nur bei dringendem klinischen Verdacht auf eine Dissemination erfolgen.
Welche Aussage bezüglich pulmonaler Veränderungen in der Computertomografie bei hämatologischen Patienten mit Schimmelpilzinfektionen trifft zu?
Das umgedrehte Halo-Zeichen ("reversed halo sign") ist hochverdächtig auf eine Mukormykose.
Das Halo-Zeichen ("halo sign") ist bestimmend für eine invasive Aspergillose.
Pleuraergüsse kommen bei Mukormykosen nicht vor.
Das umgedrehte Halo-Zeichen ("reversed halo sign") entsteht durch Hämorrhagien angioinvasiv wachsender Aspergillus- und Mucorales-Spezies beim Einwachsen in Blutgefäße.
Das umgedrehte Halo-Zeichen ("reversed halo sign") ist definiert als Milchglasinfiltrate, die eine Konsolidierung umgeben.
Welche Aussage bezüglich der Identifizierung von Mucorales ist zutreffend?
Die histopathologische Identifizierung auf Speziesebene hat die Kultur als Goldstandard zur Identifizierung von Mucorales-Spezies abgelöst.
Die ITS("internal transcribed spacer")-Regionen der ribosomalen DNA zeichnen sich durch eine hohe Intraspezieshomogenität und Interspeziesheterogenität bei Mucorales-Spezies aus.
Außer lichtmikroskopischer Identifizierung durch Spezialisten und der Amplifikation ribosomaler DNA-Abschnitte mit anschließender Sequenzierung und Abgleich mit molekularen Datenbanken stehen aktuell keine anderen Techniken zur Nutzung der Kultur zur Identifizierung von Mucorales auf Speziesebene zur Verfügung.
Die histopathologische Aufarbeitung von Biopsien erlaubt zwar eine Identifizierung auf Ebene der Gattung, jedoch nicht auf Ebene der Spezies.
Kulturen zeigen sich bei korrekter Aufarbeitung von klinischen Proben oft positiv, weswegen alternative, nicht kulturbasierte Methoden kaum eine Rolle spielen.
Welche Aussage zur direkten Mikroskopie und histopathologischen Aufarbeitung klinischer Proben bei Schimmelpilzinfektion trifft zu?
Eine bronchoalveoläre Lavage stellt keine geeignete klinische Probe zur direkten Untersuchung mittels optischer Aufheller wie Calcofluor White dar.
Die Grocott-Methenamin-Silber-Färbung färbt spezifisch die Zellwand von Aspergillus-Spezies an, von MucoralesSpezies jedoch nicht.
Der Hyphendurchmesser bei Aspergillus-Spezies ist deutlich größer, als der von Mucorales-Spezies.
Die Hyphen von Mucorales-Spezies ist oft septiert und verzweigen sich spitzwinkelig (45°), wohingegen die Hyphen von Aspergillus-Spezies oft unseptiert sind und sich rechtwinkelig (90°) verzweigen.
Die Unterscheidung zwischen Aspergillus oder anderen morphologisch verwandten Schimmelpilzen und Mucorales-Hyphen kann zuweilen schwierig sein, dennoch unterscheidet der Nachweis einer Gewebeinvasion eine luftgetragene Kontamination oder eine Organkolonisation von einer invasiven Infektion.
Welche Aussage zu den Therapiemöglichkeiten der Mukormykose trifft zu?
Aufgrund des hohen Patientenrisikos sollte ein chirurgisches Debridement von nekrotischem Gewebe nur im Ausnahmefall erfolgen.
Zulassung zur Erstlinientherapie in Deutschland haben liposomales Amphotericin B und Posaconazol.
Studien konnten zeigen, dass Voriconazol effektiv bei Mukormykose eingesetzt werden kann, in Deutschland würde die Anwendung jedoch off-label erfolgen.
Echinocandine und Posaconazol besitzen keine In-vitro-Aktivität gegenüber Mucorales.
Die hohe Nephrotoxizität von Amphotericin B kann dessen Einsatz limitieren.
Welche Aussage zur medikamentösen Therapie der Mukormykose ist zutreffend?
Bei der Therapie der Mukormykose ist auf das Einhalten der Voriconazol-Spiegel zu achten.
Die Dosierung von Voriconazol erfolgt initial mit 400 mg zweimal an Tag 1 und dann 200 mg zweimal täglich ab Tag 2.
Liposomales Amphotericin wird abhängig von der Krankheitsmanifestation in Dosierungen von 5-10 mg/kg eingesetzt.
Die Suspension, Tabletten und intravenöse Formulierungen von Posaconazol weisen das gleiche Dosierungsschema auf.
Echinocandine und Posaconazol besitzen zwar keine In-vitro-Aktivität gegenüber Mucorales, zeigen bei ausreichend hoher Dosierung jedoch eine Effektivität in vivo.
Interessenkonflikt
Der Autor erklärt, dass er sich bei der Erstellung des Beitrages von keinen wirtschaftlichen Interessen leiten ließ. Er legt folgende potenzielle Interessenkonflikte offen: Patrick Schwarz hat Forschungsstipendien von Basilea Pharmaceutica, Gilead und Pfizer, Reisestipendien von Gilead und Pfizer sowie Vortragshonorare von Pfizer erhalten. Patrick Schwarz war Mitglied in Advisory Boards von Gilead und Pfizer.
Der Verlag erklärt, dass die inhaltliche Qualität des Beitrags durch zwei unabhängige Gutachten bestätigt wurde. Werbung in dieser Zeitschriftenausgabe hat keinen Bezug zur CME-Fortbildung. Der Verlag garantiert, dass die CME-Fortbildung sowie die CME-Fragen frei sind von werblichen Aussagen und keinerlei Produktempfehlungen enthalten. Dies gilt insbesondere für Präparate, die zur Therapie des dargestellten Krankheitsbildes geeignet sind.
Literatur
- 1.Lanternier F et al. A global analysis of mucormycosis in France: the RetroZygo Study (2005-2007). Clin Infect Dis. 2012;(54 Suppl 1):S35-43 [DOI] [PubMed]
- 2.Prakash H et al. A prospective multicenter study on mucormycosis in India: Epidemiology, diagnosis, and treatment. Med Mycol. 2019;57(4):395-402 [DOI] [PubMed]
- 3.Roden MM et al. Epidemiology and outcome of zygomycosis: a review of 929 reported cases. Clin Infect Dis. 2005;41(5):634-53 [DOI] [PubMed]
- 4.Skiada A et al. Zygomycosis in Europe: analysis of 230 cases accrued by the registry of the European Confederation of Medical Mycology (ECMM) working group on zygomycosis between 2005 and 2007. Clin Microbiol Infect. 2011;17(12):1859-67 [DOI] [PubMed]
- 5.Jeong W et al. The epidemiology and clinical manifestations of mucormycosis: a systematic review and meta-analysis of case reports. Clin Microbiol Infect. 2019;25(1):26-34 [DOI] [PubMed]
- 6.Schwarz P et al. Carbon assimilation profiles as a tool for identification of zygomycetes. J Clin Microbiol. 2007;45(5):1433-9 [DOI] [PMC free article] [PubMed]
- 7.Richardson M. The ecology of the Zygomycetes and its impact on environmental exposure. Clin Microbiol Infect. 2009;(15 Suppl 5):2-9 [DOI] [PubMed]
- 8.Bitar D et al. Increasing incidence of zygomycosis (mucormycosis), France, 1997-2006. Emerg Infect Dis. 2009;15(9):1395-401 [DOI] [PMC free article] [PubMed]
- 9.Patel A et al. Multicenter epidemiologic study of coronavirus disease-associated mucormycosis, India. Emerg Infect Dis. 2021(9);27 [DOI] [PMC free article] [PubMed]
- 10.Schwarz P et al. Antifungal combinations in Mucorales: a microbiological perspective. Mycoses. 2019;62(9):746-60 [DOI] [PubMed]
- 11.Chamilos G et al. Delaying amphotericin B-based frontline therapy significantly increases mortality among patients with hematologic malignancy who have zygomycosis. Clin Infect Dis. 2008;47(4):503-9 [DOI] [PubMed]
- 12.Donnelly JP et al. Revision and update of the consensus definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer and the Mycoses Study Group Education and Research Consortium. Clin Infect Dis. 2020;71(6):1367-76 [DOI] [PMC free article] [PubMed]
- 13.Cornely OA et al. Global guideline for the diagnosis and management of mucormycosis: an initiative of the European Confederation of Medical Mycology in cooperation with the Mycoses Study Group Education and Research Consortium. Lancet Infect Dis. 2019;19(12):e405-e21 [DOI] [PMC free article] [PubMed]
- 14.Schwarz P et al. Molecular identification of zygomycetes from culture and experimentally infected tissues. J Clin Microbiol. 2006;44(2):340-9 [DOI] [PMC free article] [PubMed]
- 15.Schwarz P et al. Identification of Mucorales by matrix-assisted laser desorption ionization time-of-flight mass spectrometry. J Fungi (Basel). 2019;5(3):56 [DOI] [PMC free article] [PubMed]
- 16.Skiada A et al. Challenges in the diagnosis and treatment of mucormycosis. Med Mycol. 2018;56(suppl_1):93-101 [DOI] [PMC free article] [PubMed]
- 17.Dannaoui E et al. Molecular detection and identification of zygomycetes species from paraffin-embedded tissues in a murine model of disseminated zygomycosis: a collaborative European Society of Clinical Microbiology and Infectious Diseases (ESCMID) Fungal Infection Study Group (EFISG) evaluation. J Clin Microbiol. 2010;48(6): 2043-6 [DOI] [PMC free article] [PubMed]
- 18.Marty FM et al. Isavuconazole treatment for mucormycosis: a single-arm open-label trial and case-control analysis. Lancet Infect Dis. 2016;16(7):828-37 [DOI] [PubMed]
- 19.van Burik JA et al. Posaconazole is effective as salvage therapy in zygomycosis: a retrospective summary of 91 cases. Clin Infect Dis. 2006;42(7):e61-5 [DOI] [PubMed]



