Abstract
Neben Nierenersatzverfahren werden auf der Intensivstation mehrere andere extrakorporale Verfahren eingesetzt. In den 1970er- bis 2000er-Jahren stand die Hämoperfusion mit Aktivkohlekapseln zur Entfernung von Toxinen im Vordergrund. Dies ist mittlerweile aufgrund der effektiven Dialyseverfahren, die im Vergiftungsfall auch stark proteingebundene Toxine entfernen, fast bedeutungslos geworden. Vor 10 Jahren erlebte ein Zytokinadsorber die Markteinführung, der darauf gerichtet ist, den „Zytokinsturm“ zu überstehen. Dieser erfreut sich trotz ernüchternder Daten aus prospektiven, randomisierten, kontrollierten Studien wachsender Beliebtheit. Ein gänzlich anderes Therapiekonzept ist der biomimetische Pathogenadsorber, der Bakterien, Viren und Pilze durch Bindung an immobilisiertes Heparin aus dem Blutstrom entfernt. Ob sich diese schnelle Reduktion der Pathogenlast in eine Verbesserung klinisch relevanter Endpunkte übersetzt, ist unklar, da hier prospektive, randomisierte und kontrollierte Studien gänzlich fehlen. Für ein sehr altes Verfahren, nämlich die Plasmapherese, werden wir für die Frühphase der Sepsis bis zum Jahr 2025/2026 Ergebnisse aus 2 großen randomisierten, kontrollierten Studien aus Europa und Kanada erhalten. Neben der Entfernung von Zytokinen erhofft man sich durch die Verwendung von Frischplasma als Austauschflüssigkeit auch das Wiederauffüllen reduzierter protektiver Faktoren wie Angiopoietin 1, ADAMTS13 („a disintegrin and metalloproteinase with a thrombospondin type 1 motif, member 13“) und Protein C. Alle genannten Verfahren funktionieren nicht nur unterschiedlich, sondern werden auch zu unterschiedlichen Zeitpunkten der Blutstrominfektion/Sepsis eingesetzt.
Schlüsselwörter: Blutreinigung, Toxine, Zytokine, Plasmapherese, Sepsis
Abstract
In addition to kidney replacement procedures, several other extracorporeal procedures are employed in the intensive care unit. Hemoperfusion with activated charcoal was the predominant treatment used for removal of toxins from the 1970s until the millennium. Nowadays, this treatment does no longer play a clinically meaningful role as even strongly protein-bound toxins can be removed by effective dialysis procedures in case poisoning. The concept of a cytokine adsorber was introduced 10 years ago, which is directed towards withstanding the cytokine storm. Despite negative data from prospective randomized controlled studies, its use is steadily increasing in Germany. A totally different treatment concept is the biomimetic pathogen adsorber, which removes bacteria, viruses and fungi from the bloodstream by binding to immobilized heparin. Whether this rapid reduction of the pathogen load translates into an improvement of clinically relevant endpoints is unclear, as prospective randomized controlled studies are lacking. For the early hours of septic shock a very old procedure, plasmapheresis, has recently regained interest. The results of two large randomized controlled studies in this setting from Europe and Canada will become available in 2025/2026. The rationale to use plasma exchange in early sepsis is that this procedure not only removes cytokines but also replenishes reduced levels of protective factors, such as angiopoietin‑1, a disintegrin and metalloproteinase with a thrombospondin type 1 motif, member 13 (ADAMTS-13) and protein C, if fresh plasma is used as exchange fluid. All afore mentioned procedures do not only have a different mode of action but are also used at seperate time points of bloodstream infections and/or sepsis.
Keywords: Blood purification, Toxins, Cytokines, Plasmapheresis, Sepsis
Meist stören sie doch, die kleinen weißen Schnipsel mit den Waschsymbolen im Inneren von Kleidungsstücken. Wer die Piktogramme zum Waschen, Bügeln, Trocknen und Reinigen des jeweiligen Textils jedoch entschlüsseln kann, wird kaum noch einen Fehler machen. Das Waschen von Blut ist leider komplizierter. Jahrzehnte haben wir benötigt, um zu verstehen, wann mit der Nierenersatztherapie auf der Intensivstation begonnen werden soll [8]. Nach 10 randomisierten Studien mit 4932 Patient:innen glauben wir, zumindest hierauf eine Antwort gefunden zu haben [8]. Andere Fragen wie die nach dem idealen Verfahren der Nierenersatztherapie bleiben jedoch unbeantwortet. Noch unklarer wird es, wenn es um Verfahren wie die Hämoperfusion oder die Plamapherese geht. Wegen neuer Entwicklungen in diesem Bereich soll jedoch ein Versuch unternommen werden, wesentliche Aspekte dreier Verfahren im Bereich der Intensivmedizin zu adressieren. Einen Anspruch auf Vollständigkeit kann diese Übersicht aufgrund der Beschränkungen im Umfang nicht erheben.
Hämoperfusion
Die Hämoperfusion ist ein extrakorporales Blutreinigungsverfahren, das zur Entfernung von Stoffen mit hoher Plasmaproteinbindung oder kleinem Verteilungsvolumen dient. Je nach eingesetztem Adsorbens kann es sich dabei um eher lipophile Giftstoffe, um andere Toxine oder auch um Zytokine oder Pathogene handeln, die in einem extrakorporalen Kreislauf direkt aus dem Vollblut an ein Adsorbens gebunden und so aus dem Blutstrom entfernt werden. Die genutzten Sorbentien sind üblicherweise 50 μm bis 1,2 cm groß und zeichnen sich durch, bezogen auf das Volumen, extrem große Oberfläche aus (300–1200 m2/g; [39]).
Die verfügbaren Adsorber zur Hämoperfusion werden (zu) häufig oder besser fast ausschließlich in Kombination mit (bevorzugt kontinuierlichen) Nierenersatzverfahren eingesetzt. Eine isolierte Hämoperfusion findet man auf deutschen Intensivstationen selten. Dieser Umstand macht es zum einen schwierig, den Effekt des Adsorbers vom Effekt der Nierenersatztherapie zu trennen, führt aber auch dazu, dass die Hämoperfusion häufig erst dann zum Einsatz kommt, wenn eine Nierenersatztherapie notwendig ist. Hier ist ein Umdenken erforderlich, da die Indikation für die Hämoperfusion selten zur gleichen Zeit wie die für eine Nierenersatztherapie besteht und es somit durchaus zu einer Verzögerung der Therapie kommen kann.
Der Kohle droht das Aus
Die klassische Hämoperfusion ist für viele immer noch der Aktivkohleadsorber („Kohlekapsel“), der, beginnend in den 1960er-Jahren, gern für die Therapie von Vergiftungen eingesetzt wurde [25]. Nach rezenten Daten des Annual Report of the American Association of Poison Control Centers droht der Kohle jedoch in diesem Bereich das Aus [23]. Lediglich 31 dieser Aktivkohleadsorber wurden im gesamten Jahr 2020 in den USA zur Therapie von Vergiftungen eingesetzt [23]. Dies liegt nicht nur an den Nebenwirkungen der Kohleperfusion wie Thrombopenie, Hypokalzämie und Hypotherapie, sondern auch daran, dass High-flux-Hämodialyse eine wirksame, ubiquitär verfügbare und komplikationsarme Alternative ist und daher zu Recht 2543 Mal in der Therapie von Vergiftungen zum Einsatz kam [23]. Möglich ist dies, weil sich die Pharmakokinetik eines Medikaments erheblich von der Toxikokinetik unterscheiden kann. Daher gelingt es im Falle einer Vergiftung nämlich, auch Substanzen zu entfernen, die im therapeutischen Bereich eine ausgeprägte Proteinbindung haben. In den rezenten Empfehlungen der Extracorporeal Treatments in Poisoning Workgroup (EXTRIP; www.extrip-workgroup.org), einer internationalen Vereinigung von Toxikolog:innen, Intensivmediziner:innen, Pharmakolog:innen und Nephrolog:innen, findet sich daher folgerichtig nicht ein einziges Mal die Empfehlung zur Kohleperfusion. Dies gilt für Baclofen [16], Betabocker [5], Kalziumantagonisten [54], Carbamazepin [21], Gabapentin/Pregabalin [6], Isoniazid [34], Methanol [37], Methotrexat (MTX; [19]), Paracetamol [22], Chinin/Chloroquin [2], Salizylate [28], Thallium [18], Theophyllin [20] und Valproat [17]. Unter Umständen wird das Thema Kohle nochmal interessant, wenn neue Strukturen und größere Oberflächen, z. B. durch Nanotechnologie, verfügbar sind.
Unwetterwarnung vor dem Zytokinsturm
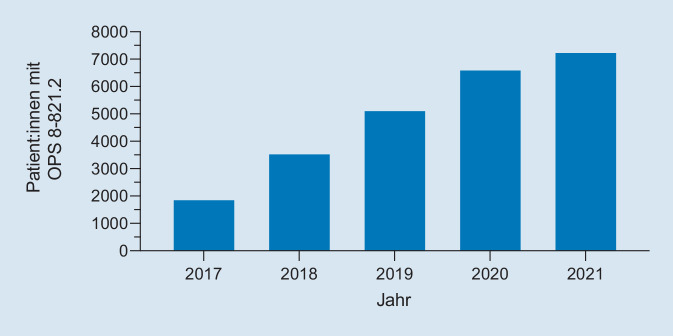
Die laut Statistischem Bundesamt (Abb. 1) am häufigsten durchgeführte Form der Hämoperfusion in Deutschland ist die Zytokinadsorbtion mittels CytoSorb®-Adsorber (CytoSorbents Europe, Berlin, Deutschland). Dieser besteht aus kleinen geladenen, porösen Polymer-Sorbent-Kügelchen mit einer Oberfläche von 45.000 m2. Diese binden unspezifisch hydrophobe Substanzen von 8–50 kDa. Dazu zählen zahlreiche (inflammatorische, aber auch protektive) Zytokine, Chemokine, aber auch DAMP („damage-associated molecular patterns“). Diese sollten v. a. den „Zytokinsturm“ dämpfen [50, 52]. Die Food and Drug Administration (FDA) erteilte dem CytoSorb®-Adsorber deshalb in der SARS-CoV-2(„severe acute respiratory syndrome coronavirus 2“)-Pandemie eine Sonderzulassung. Seit 10 Jahren ist der Adsorber in Deutschland verfügbar, seit 2017 besteht ein eigener Prozedurencode. Die Zahl der behandelten Patient:innen in Deutschland steigt seit Jahren (Abb. 1) ebenso wie die Zahl der Kasuistiken und kleinen Fallserien. In einer Open-label-Studie mit 20 Patient:innen mit therapierefraktärem septischen Schock konnte durch die CytoSorb®-Therapie (in Kombination mit einer kontinuierlichen venovenösen Hämofiltration [CVVH]) die Noradrenalindosis um 0,4–0,6 µg/kg/min gesenkt und die Laktat-Clearance erhöht werden [15], wobei unklar ist, welchen Anteil die Nierenersatztherapie an diesem Ergebnis hatte. Weniger positiv sieht es bei den kontrollierten, randomisierten, prospektiven Studien aus. Deren Zahl ist gering, und ihre Ergebnisse sind alles andere als ermutigend. Bei 100 Patient:innen im septischen Schock hatte die CytoSorb®-Therapie keinen signifikanten Effekt auf den primären Endpunkt, den Verlauf des Interleukin(IL)-6-Spiegels zwischen Tag 1 und Tag 7 [41]. Auch die Mortalität wurde nicht beeinflusst. Die größte randomisierte, kontrollierte Studie mit dem CytoSorb® fand in der Herzchirurgie bei Endokarditis statt [11]. Intraoperativ erhielten 142 Patient:innen eine CytoSorb®- und 146 Patient:innen die Standardtherapie. Weder der primäre Endpunkt (Veränderung des SOFA[„sepsis-related organ failure assessment“]-Scores) noch die Mortalität (21 % vs. 22 %) wurde durch den CytoSorb® beeinflusst [11].
Zwei kleinere prospektive, randomisierte, kontrollierte Studien haben den CytoSorb® im Rahmen der SARS-CoV-2-Pandemie untersucht. Supady et al. konnten an 34 COVID-19(„coronavirus disease 2019“)-Patient:innen, die mit extrakorporaler Membranoxygenierung (ECMO) behandelt wurden, zeigen, dass der Abfall von IL‑6 über 72 h unabhängig davon war, ob der CytoSorb® verwendet wurde oder nicht [52]. Für Aufmerksamkeit sorgte die Analyse der Mortalität, die in der CytoSorb®-Gruppe deutlich höher war [52], wobei die Fallzahl der Studie für eine solche Analyse nicht ausreichte. In einer monozentrischen, prospektiven, randomisierten, kontrollierten Pilotstudie untersuchten Stockmann et al. 50 schwerkranke COVID-19-Patient:innen (Norarenalin > 0,2 µg/kg/min für MAD [„mean arterial pressure“] ≥ 65 mm Hg, C‑reaktives protein [CRP] > 100 mg/l, AKI[„acute kidney injury“]-Stadium 3 mit Notwendigkeit einer Nierenersatztherapie; [49]). Weder der primäre Endpunkt (Umkehr des vasoplegischen Schocks) noch sekundäre Endpunkte (Mortalität, Verlauf der Inflammationsparameter) wurde durch die CytoSorb®-Therapie positiv beeinflusst. Signifikante Nebenwirkungen hatte die Therapie jedoch auch nicht [49]. Das sah in einer anderen, nichtprospektiven Studie anders aus: Im Vergleich von 48 prospektiv untersuchten Patient:innen mit 160 Kontrollen sank weder IL‑6 noch die Katecholamindosis durch die CytoSorb®-Therape, doch das Risiko für die Mortalität stieg. Dass der CytoSorb® nicht mit dem HA330 und dem HA380 von Jafron gleichzusetzen ist, wurde unlängst an anderer Stelle thematisiert [51].
Der CytoSorb® kann auch Pharmaka entfernen. Dies kann bei der Therapie von Sepsispatient:innen eine zusätzliche Herausforderung sein, da z. B. Antibiotika oder Virustatika nachdosiert werden müssen. Im Falle von Ticagrelor und Rivaroxaban resultierte aus der exzellenten Entfernung beider Substanzen [26] eine nachträgliche Zulassung für die intraoperative Entfernung von Ticagrelor/Rivaroxaban bei kardiopulmonalen Bypassoperationen. Ein interessanter rezenter Anwendungsbereich des CytoSorb® ist die Rhabdomyolyse, eine dramatische Erkrankung, für deren Therapie bereits mehrere extrakorporale Verfahren eingesetzt wurden, von denen aber z. B. die High-Cut-off(HCO)-Dialyse-Membran nicht mehr verfügbar ist [27].
Die Grundsätze der Pharmakologie setzt der CytoSorb® jedoch nicht außer Kraft. Dies suggerieren jedoch Kasuistiken, die den Abfall des Blutspiegels einer Substanz unter einer extrakorporalen Therapie als klinisch relevante Entfernung fehlinterpretieren. Eine euphorische Erstbeschreibung und die ernüchternde pharmakokinetische Analyse finden sich für 3,4-Methylendioxy-N-methylamphetamin (MDMA), Amitriptylin und Quetiapin. Die Erklärung hierfür ist, dass das Verteilungsvolumen von Substanzen die wesentliche Variable ist, die bestimmt, ob Substanzen substanziell extrakorporal entfernt werden. Zu hoffen, dass eine Senkung des Blutspiegels von Amitryptilin durch den CytoSorb® einen substanziellen Beitrag zur Entgiftung leistet, ist genauso verwegen, wie zu befürchten, Jeff Bezos wäre nach dem Diebstahl von 10 Dollar aus seiner Hosentasche pleite. In beiden Fällen ist das Verteilungsvolumen (Amitryptilin oder Geld) so groß, dass die Entfernung von Amitryptilin aus dem Blut oder 10 Dollar aus der Hosentasche keine Relevanz hat.
Der Bakterienmagnet – Entfernung von Pathogenen aus dem Blut
Eine neue Variante der Hämoperfusion, die sich in Aufbau und Funktionsweise von den beiden vorgenannten Verfahren unterscheidet, ist die Pathogenadsorption. Die Rationale dahinter ist es, die Pathogenlast im Blut, die mit der Mortalität korreliert, schneller zu senken. Im Idealfall sollte dies für viele Pathogene funktionieren und auch nicht durch die Resistenzlage beeinflusst werden. Nachdem solche Versuche in den 1980er-Jahren unter Verwendung von Aktivkohle scheiterten [31], konkurrieren nun mehrere Technologien miteinander. Humanes Opsonin („mannose-binding lectin“ [MBL]; [12]) oder biegbare Nanowires [30] sind noch in Erprobung. Zugelassen sind Polyethylenkügelchen mit kovalent endpunktgebundenem Heparin [33], welche als Filter mit dem Namen Seraph® 100 Microbind® Affinity in der Europäischen Union (EU) zugelassen sind. Der Mechanismus beruht hierbei darauf, dass Bakterien und Viren an das im Adsorber befindliche immobilisierte Heparin binden, wie sie es normalerweise innerhalb des Körpers mit Heparansulfat an der Zelloberfläche tun würden [45]. Die meisten Daten zu dieser Therapie stammen aus der SARS-CoV-2-Pandemie. Da bis zu drei Viertel aller kritisch kranken SARS-CoV-2-Patient:innen RNA oder SARS-CoV‑2 im Blut haben [3] und dies auch mit der Schwere der Erkrankung korreliert [53], wurde dieses Verfahren bei kritisch kranken COVID-19-Patient:innen eingesetzt. Daten eines Registers [43], eine multizentrische retrospektive Studie aus den USA [9] und mehrere Fallberichte [35, 36, 40] zeigten ermutigende Ergebnisse in Bezug auf Sicherheit und Effektivität dieser Therapie, jedoch fehlen Daten aus randomisierten, kontrollierten, prospektiven Studien.
Zur Therapie von Bakterieämien gibt es neben Fallberichten [10, 46] nur die Daten aus der Zulassungsstudie. Die dort behandelten 15 Hämodialysepatient:innen mit Blutstrominfektionen vertrugen die Therapie gut. Der primäre Endpunkt – die Sicherheit – erbrachte keine negativen Signale [14]. In Bezug auf die Effektivität, den sekundären Endpunkt der Studie, konnte die TTP („time to positivity“) der Blutkultur durch die Therapie um mehr als 22 min erhöht werden, was einer Senkung der Bakterienzahl entspricht. Ein Designproblem der Studie war jedoch, dass vor der Therapie eine positive Blutkultur vorhanden sein musste, sodass der Seraph® 100 im Maximum erst 138 h nach Abnahme der Blutkultur begonnen wurde. Dennoch hatten 4 von 15 Patient:innen zu diesem Zeitpunkt immer noch eine positive Blutkultur. Eine kontrollierte, prospektive Studie, die klinisch relevante Endpunkte untersucht, fehlt auch im dritten Jahr der Verfügbarkeit des Seraph® 100. Bekannt ist allerdings bereits für 19 Antinifektiva, aber auch für Mykophenolat-Mofetil und für Tacrolimus, dass diese Substanzen durch den Seraph® 100 nicht entfernt werden [10, 42, 44].
Geben ist seliger als nehmen
Der Satz „Geben ist seliger denn nehmen“ entstammt der Apostelgeschichte 20,35. Eine Historie fast biblischen Alters hat auch die Plasmapherese, für die dieses Zitat eine besondere Bedeutung hat. Bereits 1913 wurde in St. Petersburg die erste erfolgreiche experimentelle Plasmapherese durchgeführt [47]. Eigentlich wirkt dieses Verfahren wie aus der Zeit gefallen. In der Krasenlehre hätte es Sinn ergeben, „Säfte“ auszutauschen, aber warum sollten wir dies in den 2020er-Jahren tun? Zum einen entfernt die Plasmapherese unspezifisch diverse Mediatoren, darunter natürlich auch Zytokine [4], zum anderen, soweit Frischplasma als Austauschflüssigkeit verwendet wird, erfolgt der Ersatz von wichtigen Plasmakomponenten wie ADAMTS-13 („a disintegrin and metalloproteinase with a thrombospondin type 1 motif, member 13“), Angiopoietin 1 und Protein C. ADAMTS-13 zerschneidet ähnlich einer Heckenschere den vom aktivierten Endothel ausgeschütteten Von-Willebrand-Faktor (vWF), der wie eine wild wuchernden Hecke den Weg des Blutes in den Kapillaren verstopft und Thrombozyten bindet. Auf der Substitution von ADAMTS-13 beruht die Plasmaphereseindikation bei thrombotisch-thrombozytopenischer Purpura [38]. Das gestörte vWF/ADMATS-13-Verhältnis wurde auch bei COVID-19 mit Hyperkoagulabilität durch die Plasmapherese korrigiert [13]. Ein niedriger ADAMTS-13-Spiegel ist bei Sepsis prädiktiv für die Mortalität [32].
In den aktuellen ASFA(American Society for Apheresis)-Guidelines wird die Plasmapherese zur Therapie der Sepsis nur als Rescue-Verfahren empfohlen, da die letzte prospektive, randomisierte, kontrollierte Studie zum Einsatz der Plasmapherese bei Sepsis negativ ausfiel [7]. Dennoch wurde und wird die Plasmapherese bei Sepsis eingesetzt [24]. Um eine neue, ausreichend gepowerte Studie vorzubereiten, hat ein Team um Prof. Sascha David zunächst eine monozentrische Studie durchgeführt, in der eine frühe Plasmapherese neben dem Katecholaminbedarf auch proinflammatorische Zytokine und Permeabilitätsfaktoren (IL‑6, IL-1b, Angiopoietin 2) reduzierte. Die In-vitro-Permeabilität von Endothelzellen wurde verbessert [29]. Eine prospektive, randomisierte, kontrollierte Studie konnte nachfolgend nicht nur erneut den positiven Effekt der Plasmapherese auf die Katecholamine bestätigen, sondern auch das Wiederauffüllen der depletierten Plasmakomponenten wie ADAMTS-13 [48].
Die multizentrische EXCHANGE-Studie wird mit einer ausreichenden Zahl an Patient:innen eine definitive Antwort darauf geben können, ob die Plasmapherese bei Sepsis positive Effekte auf klinische relevante Endpunkte hat. Kolleg:innen in Kanada verfolgen ein ähnliches Studienkonzept (NCT03844542). Eine Zusammenfassung der Indikationen für die Plasmapherese auf der Intensivstation findet sich unter [1].
Simon & Garfunkel enden ihren Titel „Bridge over troubled water“ mit der Zeile „Like a bridge over troubled water I will ease your mind“. Das Gewissen beruhigen – das tun auch alle heute verfügbaren extrakorporalen Therapien, die wir außerhalb der Nierenersatztherapie auf der Intensivstation zum Einsatz bringen. So gut es auch ist, das Gewissen zu beruhigen – insbesondere bei Patient:innen die „nicht sterben dürfen“ – so wenig ausreichend ist dieses Argument auf Dauer, um die oben genannten invasiven und teuren Therapieverfahren zu rechtfertigen.
Fazit für die Praxis
Extrakorporale Blutreinigungsverfahren auf der Intensivstation haben unterschiedliche pathophyiologische Ansatzpunkte und werden zu verschiedenen Zeitpunkten eingesetzt.
Während die Pathogenadsorption in Kombination mit Antibiotika in der fulminanten Bakteriämie zur schnellen Reduktion der Keimlast beitragen soll, ist das Ziel der Plasmapherese, in der Frühphase der Sepsis (< 24 h) schädliche Mediatoren zu entfernen und protektive Substanzen zu ersetzen.
Die Zytokinadsorption soll vor den Folgen des Zytokinsturms schützen, der nach (herzchirurgischen) Operationen oder bei der fulminanten Sepsis auftritt.
Evidenz in Sinne positiver prospektiver, kontrollierter, prospektiver Studien fehlt derzeit für sämtliche der oben genannten Verfahren.
Einhaltung ethischer Richtlinien
Interessenkonflikt
J.T. Kielstein erhielt Forschungsförderung von ExThera Medical sowie Vortragshonorare von Fresenius Medical Care und Baxter.
Für diesen Beitrag wurden von den Autor/-innen keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Literatur
- 1.Bauer PR, Ostermann M, Russell L, et al. Plasma exchange in the intensive care unit: a narrative review. Intensive Care Med. 2022;48:1382–1396. doi: 10.1007/s00134-022-06793-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Berling I, King JD, Shepherd G, et al. Extracorporeal treatment for chloroquine, hydroxychloroquine, and quinine poisoning: systematic review and recommendations from the EXTRIP Workgroup. J Am Soc Nephrol. 2020;31:2475–2489. doi: 10.1681/ASN.2020050564. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Bermejo-Martin JF, Gonzalez-Rivera M, Almansa R, et al. Viral RNA load in plasma is associated with critical illness and a dysregulated host response in COVID-19. Crit Care. 2020;24:691. doi: 10.1186/s13054-020-03398-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Boser M, Kielstein JT. Role of plasmapheresis and immunoadsorption in salvage therapy of rheumatological diseases. Z Rheumatol. 2016;75:964–972. doi: 10.1007/s00393-016-0219-7. [DOI] [PubMed] [Google Scholar]
- 5.Bouchard J, Shepherd G, Hoffman RS, et al. Extracorporeal treatment for poisoning to beta-adrenergic antagonists: systematic review and recommendations from the EXTRIP workgroup. Crit Care. 2021;25:201. doi: 10.1186/s13054-021-03585-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Bouchard J, Yates C, Calello DP, et al. Extracorporeal treatment for Gabapentin and pregabalin poisoning: systematic review and recommendations from the EXTRIP workgroup. Am J Kidney Dis. 2022;79:88–104. doi: 10.1053/j.ajkd.2021.06.027. [DOI] [PubMed] [Google Scholar]
- 7.Busund R, Koukline V, Utrobin U, et al. Plasmapheresis in severe sepsis and septic shock: a prospective, randomised, controlled trial. Intensive Care Med. 2002;28:1434–1439. doi: 10.1007/s00134-002-1410-7. [DOI] [PubMed] [Google Scholar]
- 8.Chen JY, Chen YY, Pan HC, et al. Accelerated versus watchful waiting strategy of kidney replacement therapy for acute kidney injury: a systematic review and meta-analysis of randomized clinical trials. Clin Kidney J. 2022;15:974–984. doi: 10.1093/ckj/sfac011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Chitty SA, Mobbs S, Rifkin BS, et al. A multicenter evaluation of the seraph 100 Microbind affinity blood filter for the treatment of severe COVID-19. Crit Care Explor. 2022;4:e0662. doi: 10.1097/CCE.0000000000000662. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.De Geus HRH, Smeets T, Hoek RS, et al. The seraph(R)-100 Microbind affinity blood filter does not affect vancomycin, tacrolimus, and mycophenolic acid plasma concentrations. Blood Purif. 2021;50:971–975. doi: 10.1159/000514523. [DOI] [PubMed] [Google Scholar]
- 11.Diab M, Lehmann T, Bothe W, et al. Cytokine hemoadsorption during cardiac surgery versus standard surgical care for infective endocarditis (REMOVE): results from a multicenter randomized controlled trial. Circulation. 2022;145:959–968. doi: 10.1161/CIRCULATIONAHA.121.056940. [DOI] [PubMed] [Google Scholar]
- 12.Didar TF, Cartwright MJ, Rottman M, et al. Improved treatment of systemic blood infections using antibiotics with extracorporeal opsonin hemoadsorption. Biomaterials. 2015;67:382–392. doi: 10.1016/j.biomaterials.2015.07.046. [DOI] [PubMed] [Google Scholar]
- 13.Doevelaar AN, Bachmann M, Holzer B, et al. von Willebrand factor multimer formation contributes to Immunothrombosis in Coronavirus disease 2019. Crit Care Med. 2021 doi: 10.1097/CCM.0000000000004918. [DOI] [PubMed] [Google Scholar]
- 14.Eden G, Schmidt JJ, Buttner S, et al. Safety and efficacy of the Seraph(R) 100 Microbind(R) Affinity Blood Filter to remove bacteria from the blood stream: results of the first in human study. Crit Care. 2022;26:181. doi: 10.1186/s13054-022-04044-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Friesecke S, Stecher SS, Gross S, et al. Extracorporeal cytokine elimination as rescue therapy in refractory septic shock: a prospective single-center study. J Artif Organs. 2017;20:252–259. doi: 10.1007/s10047-017-0967-4. [DOI] [PubMed] [Google Scholar]
- 16.Ghannoum M, Berling I, Lavergne V, et al. Recommendations from the EXTRIP workgroup on extracorporeal treatment for baclofen poisoning. Kidney Int. 2021;100:720–736. doi: 10.1016/j.kint.2021.07.014. [DOI] [PubMed] [Google Scholar]
- 17.Ghannoum M, Laliberte M, Nolin TD, et al. Extracorporeal treatment for valproic acid poisoning: systematic review and recommendations from the EXTRIP workgroup. Clin Toxicol. 2015;53:454–465. doi: 10.3109/15563650.2015.1035441. [DOI] [PubMed] [Google Scholar]
- 18.Ghannoum M, Nolin TD, Goldfarb DS, et al. Extracorporeal treatment for thallium poisoning: recommendations from the EXTRIP Workgroup. Clin J Am Soc Nephrol. 2012;7:1682–1690. doi: 10.2215/CJN.01940212. [DOI] [PubMed] [Google Scholar]
- 19.Ghannoum M, Roberts DM, Goldfarb DS, et al. Extracorporeal treatment for methotrexate poisoning: systematic review and recommendations from the EXTRIP Workgroup. Clin J Am Soc Nephrol. 2022;17:602–622. doi: 10.2215/CJN.08030621. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Ghannoum M, Wiegand TJ, Liu KD, et al. Extracorporeal treatment for theophylline poisoning: systematic review and recommendations from the EXTRIP workgroup. Clin Toxicol. 2015;53:215–229. doi: 10.3109/15563650.2015.1014907. [DOI] [PubMed] [Google Scholar]
- 21.Ghannoum M, Yates C, Galvao TF, et al. Extracorporeal treatment for carbamazepine poisoning: systematic review and recommendations from the EXTRIP workgroup. Clin Toxicol. 2014;52:993–1004. doi: 10.3109/15563650.2014.973572. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Gosselin S, Juurlink DN, Kielstein JT, et al. Extracorporeal treatment for acetaminophen poisoning: recommendations from the EXTRIP workgroup. Clin Toxicol. 2014;52:856–867. doi: 10.3109/15563650.2014.946994. [DOI] [PubMed] [Google Scholar]
- 23.Gummin DD, Mowry JB, Beuhler MC, et al. 2020 annual report of the American association of poison control centers’ national poison data system (NPDS): 38th annual report. Clin Toxicol. 2021;59:1282–1501. doi: 10.1080/15563650.2021.1989785. [DOI] [PubMed] [Google Scholar]
- 24.Hadem J, Hafer C, Schneider AS, et al. Therapeutic plasma exchange as rescue therapy in severe sepsis and septic shock: retrospective observational single-centre study of 23 patients. BMC Anesthesiol. 2014;14:24. doi: 10.1186/1471-2253-14-24. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Hagstam KE, Larsson LE, Thysell H. Experimental studies on charcoal haemoperfusion in phenobarbital intoxication and uraemia, including histopathologic findings. Acta Med Scand. 1966;180:593–603. doi: 10.1111/j.0954-6820.1966.tb02875.x. [DOI] [PubMed] [Google Scholar]
- 26.Hassan K, Kannmacher J, Wohlmuth P, et al. Cytosorb adsorption during emergency cardiac operations in patients at high risk of bleeding. Ann Thorac Surg. 2019;108:45–51. doi: 10.1016/j.athoracsur.2018.12.032. [DOI] [PubMed] [Google Scholar]
- 27.Jerman A, Andonova M, Persic V, et al. Extracorporeal removal of myoglobin in patients with rhabdomyolysis and acute kidney injury: comparison of high and medium cut-off membrane and an Adsorber cartridge. Blood Purif. 2022;51:907–911. doi: 10.1159/000521923. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Juurlink DN, Gosselin S, Kielstein JT, et al. Extracorporeal treatment for salicylate poisoning: systematic review and recommendations from the EXTRIP workgroup. Ann Emerg Med. 2015;66:165–181. doi: 10.1016/j.annemergmed.2015.03.031. [DOI] [PubMed] [Google Scholar]
- 29.Knaup H, Stahl K, Schmidt BMW, et al. Early therapeutic plasma exchange in septic shock: a prospective open-label nonrandomized pilot study focusing on safety, hemodynamics, vascular barrier function, and biologic markers. Crit Care. 2018;22:285. doi: 10.1186/s13054-018-2220-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Liu L, Chen S, Xue Z, et al. Bacterial capture efficiency in fluid bloodstream improved by bendable nanowires. Nat Commun. 2018;9:444. doi: 10.1038/s41467-018-02879-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Marks DH, Medina F, Lee S, et al. Removal of bacteria from blood by charcoal hemoperfusion. Biomater Artif Cells Artif Organs. 1988;16:135–140. doi: 10.3109/10731198809132564. [DOI] [PubMed] [Google Scholar]
- 32.Martin K, Borgel D, Lerolle N, et al. Decreased ADAMTS-13 (A disintegrin-like and metalloprotease with thrombospondin type 1 repeats) is associated with a poor prognosis in sepsis-induced organ failure. Crit Care Med. 2007;35:2375–2382. doi: 10.1097/01.CCM.0000284508.05247.B3. [DOI] [PubMed] [Google Scholar]
- 33.Mccrea K, Ward R, Larosa SP. Removal of Carbapenem-Resistant Enterobacteriaceae (CRE) from blood by heparin-functional hemoperfusion media. Plos One. 2014;9:e114242. doi: 10.1371/journal.pone.0114242. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Mowry JB, Shepherd G, Hoffman RS, et al. Extracorporeal treatments for isoniazid poisoning: Systematic review and recommendations from the EXTRIP workgroup. Pharmacotherapy. 2021;41:463–478. doi: 10.1002/phar.2519. [DOI] [PubMed] [Google Scholar]
- 35.Olson SW, Oliver JD, Collen J, et al. Treatment for severe Coronavirus disease 2019 with the seraph-100 microbind affinity blood filter. Crit Care Explor. 2020;2:e0180. doi: 10.1097/CCE.0000000000000180. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Pape A, Kielstein JT, Kruger T, et al. Treatment of a critically ill COVID-19 patient with the seraph 100 microbind affinity filter. Th Open. 2021;5:e134–e138. doi: 10.1055/s-0041-1727121. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Roberts DM, Yates C, Megarbane B, et al. Recommendations for the role of extracorporeal treatments in the management of acute methanol poisoning: a systematic review and consensus statement. Crit Care Med. 2015;43:461–472. doi: 10.1097/CCM.0000000000000708. [DOI] [PubMed] [Google Scholar]
- 38.Rock GA, Shumak KH, Buskard NA, et al. Comparison of plasma exchange with plasma infusion in the treatment of thrombotic thrombocytopenic purpura. Canadian Apheresis Study Group. N Engl J Med. 1991;325:393–397. doi: 10.1056/NEJM199108083250604. [DOI] [PubMed] [Google Scholar]
- 39.Ronco C, Bellomo R. Hemoperfusion: technical aspects and state of the art. Crit Care. 2022;26:135. doi: 10.1186/s13054-022-04009-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Sandoval D, Rama I, Quero M, et al. Treatment for severe COVID-19 with a biomimetic sorbent haemoperfusion device in patients on haemodialysis. Clin Kidney J. 2021;14:1475–1477. doi: 10.1093/ckj/sfab010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Schadler D, Pausch C, Heise D, et al. The effect of a novel extracorporeal cytokine hemoadsorption device on IL-6 elimination in septic patients: a randomized controlled trial. PLoS ONE. 2017;12:e0187015. doi: 10.1371/journal.pone.0187015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Schmidt JJ, Bode-Boger SM, Martens-Lobenhoffer J, et al. Pharmacokinetics of Remdesivir and GS-441524 during PIRRT and Seraph 100 Therapy. Clin J Am Soc Nephrol. 2021;16:1256–1257. doi: 10.2215/CJN.17601120. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Schmidt JJ, Borchina DN, Van TKM, et al. Interim-analysis of the COSA (COVID-19 patients treated with the Seraph(R) 100 Microbind(R) Affinity filter) registry. Nephrol Dial Transplant. 2021 doi: 10.1093/ndt/gfab347. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Schmidt JJ, Eden G, Seffer MT, et al. In vitro elimination of anti-infective drugs by the Seraph((R)) 100 Microbind((R)) affinity blood filter. Clin Kidney J. 2020;13:421–424. doi: 10.1093/ckj/sfaa063. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Seffer MT, Cottam D, Forni LG, et al. Heparin 2.0: a new approach to the infection crisis. Blood Purif. 2020;50(1):28–34. doi: 10.1159/000508647. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Seffer MT, Eden G, Engelmann S, et al. Elimination of Staphylococcus aureus from the bloodstream using a novel biomimetic sorbent haemoperfusion device. BMJ Case Rep. 2020;13:e235262. doi: 10.1136/bcr-2020-235262. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Sokolov AA, Solovyev AG. Russian pioneers of therapeutic hemapheresis and extracorporeal hemocorrection: 100-year anniversary of the world’s first successful plasmapheresis. Ther Apher Dial. 2014;18:117–121. doi: 10.1111/1744-9987.12067. [DOI] [PubMed] [Google Scholar]
- 48.Stahl K, Wand P, Seeliger B, et al. Clinical and biochemical endpoints and predictors of response to plasma exchange in septic shock: results from a randomized controlled trial. Crit Care. 2022;26:134. doi: 10.1186/s13054-022-04003-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Stockmann H, Keller T, Buttner S, et al. CytoResc—„CytoSorb“ Rescue for critically ill patients undergoing the COVID-19 Cytokine Storm: a structured summary of a study protocol for a randomized controlled trial. Trials. 2020;21:577. doi: 10.1186/s13063-020-04501-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Stockmann H, Thelen P, Stroben F, et al. CytoSorb rescue for COVID-19 patients with vasoplegic shock and multiple organ failure: a prospective, open-label, randomized controlled pilot study. Crit Care Med. 2022 doi: 10.1097/CCM.0000000000005493. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Supady A, Brodie D, Wengenmayer T. Extracorporeal haemoadsorption: does the evidence support its routine use in critical care? Lancet Respir Med. 2022;10:307–312. doi: 10.1016/S2213-2600(21)00451-3. [DOI] [PubMed] [Google Scholar]
- 52.Supady A, Weber E, Rieder M, et al. Lancet Respir Med. 2021;9(7):00177–00176. doi: 10.1016/S2213-2600. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Tang K, Wu L, Luo Y, et al. Quantitative assessment of SARS-CoV-2 RNAemia and outcome in patients with Coronavirus Disease 2019. J Med Virol. 2021 doi: 10.1002/jmv.26876. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Wong A, Hoffman RS, Walsh SJ, et al. Extracorporeal treatment for calcium channel blocker poisoning: systematic review and recommendations from the EXTRIP workgroup. Clin Toxicol. 2021;59:361–375. doi: 10.1080/15563650.2020.1870123. [DOI] [PubMed] [Google Scholar]