Résumé
Les virus animaux sont présents dans la plupart des environnements humains. Leur viabilité dans ces milieux est très variable et l’élément le plus important qui conditionne cette viabilité est l’existence ou non d’une enveloppe de nature phospholipidique autour de la nucléocapside. Après quelques considérations générales sur la structure des virus, leur cycle de multiplication et leur résistance à différents agents physico-chimiques, seront proposés quelques exemples de l’impact des virus animaux présents dans l’environnement sur la santé humaine. Les situations présentées sont en relation avec l’actualité épidémiologique récente : circulation de poliovirus de type 2 dérivés de la souche vaccinale Sabin dans les eaux usées de New York, de Londres et de Jérusalem, risque de transmission du Sars-CoV-2 lors de l’épandage sur les terres agricoles de boues provenant de stations d’épuration à l’ère de la pandémie de Covid-19, « nouvelles » formes de toxi-infections alimentaires d’origine virale (hépatite E, encéphalite à tique, infection à virus Nipah), contaminations par des virus épidémiques des téléphones portables utilisés par les pédiatres, rôle des fomites dans la propagation des orthopoxviroses (variole, cowpox, monkeypox). Le risque attaché aux virus animaux présents dans l’environnement doit être évalué de façon mesurée sans surestimation ni sous-estimation de leurs conséquences potentielles en santé humaine.
Mots clés: eau usée, environnement, fomite, toxi-infection alimentaire virale, virus Sars-CoV-2
Abstract
Animal viruses are present in most human environments. Their viability in these media is very variable and the most important element that conditions this viability is the existence or not of a phospholipid envelope surrounding the nucleocapsid. After some general considerations on the structure of viruses, their multiplication cycle and their resistance to different physico-chemical agents, some examples of the impact of animal viruses present in the environment on human health will be presented. The situations that are related concern recent epidemiological events: circulation of type 2 polioviruses derived from the Sabin vaccine strain in the wastewater of New York, London and Jerusalem; risk of transmission of Sars-CoV-2 during the spreading of sludge from wastewater treatment plants on agricultural land in the era of the Covid-19 pandemic; « new » forms of food-borne poisoning of viral origin (hepatitis E, tick-borne encephalitis, Nipah virus infection); contamination by epidemic viruses of mobile phones used by pediatricians; role of fomites in the spread of orthopoxvirus infections (smallpox, cowpox, monkeypox). The risk attached to animal viruses present in the environment must be assessed in a measured way without overestimating or underestimating their potential consequences for human health.
Keywords: environment, fomite, Sars-CoV-2 virus, viral food-borne poisoning, wastewater
Introduction
Les virus sont omniprésents dans les environnements aquatiques naturels où ils représentent l’entité biologique la plus importante. Leur abondance, dominée par les bactériophages, varie généralement entre 107 et 108 particules par mL [1]. Ils représentent le deuxième réservoir de biomasse carbonée dans les écosystèmes marins après les procaryotes. Dans les environ- nements aquatiques anthropiques, se surajoutent des virus humains à tropisme intestinal qui peuvent être à l’origine de pathologies variées dans l’espèce humaine. Les virus peuvent également contaminer l’air, l’alimentation, les surfaces, les instruments, les jouets, les mains des soignants, etc. ; ces médias deviennent alors des réservoirs à l’origine d’infections virales humaines qui, lorsqu’elles surviennent à l’hôpital, constituent des infections nosocomiales.
Sera illustrée ici la place des virus environnementaux dans les pathologies virales humaines. Après quelques rappels fondamentaux sur la présence et la survie des virus dans l’environnement, différents exemples d’intérêt pédagogique et tirés de l’actualité récente seront choisis pour illustrer le concept de transmission virale « indirecte » qui constitue un volet essentiel de l’épidémiologie des pathologies virales humaines.
Présence et pouvoir infectieux des virus dans l’environnement
Rappels sur la structure des virus
Les virus sont des entités biologiques nanométriques dont la forme la plus élémentaire se résume à « un paquet de mauvaises nouvelles dans une boîte de protéines », selon la formule célèbre de Sir Peter Medawar qui, lors de son discours de réception du prix Nobel en 1960, a déclaré : « No virus is known to do good. It has been well said that a virus is a piece of bad news wrapped up in protein. » Le paquet de mauvaises nouvelles est constitué d’une molécule d’ADN ou d’ARN enfermée à l’intérieur d’une structure protéique appelée capside. L’ensemble constitue la nucléo-capside (figure 1).
Figure 1.
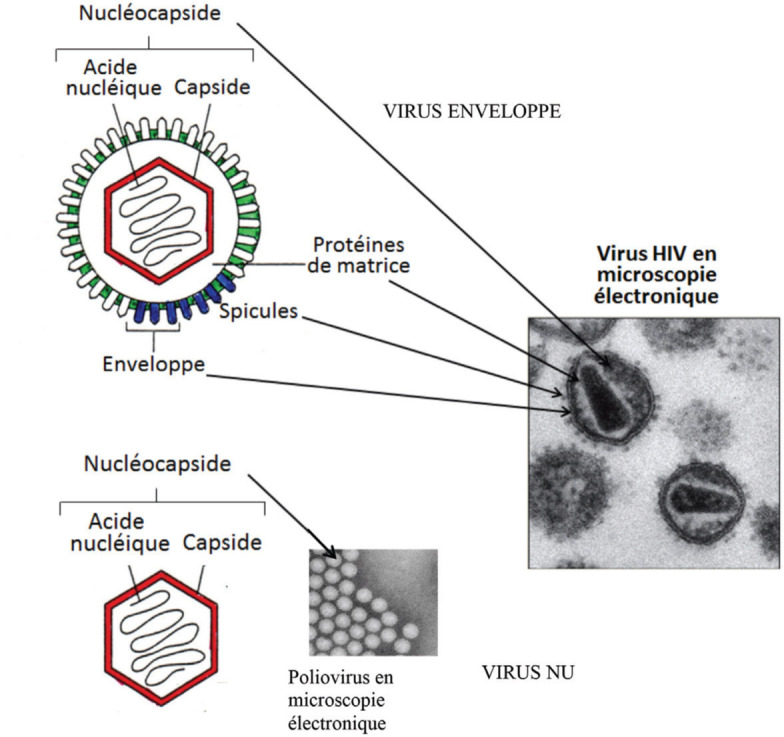
Structure schématique des virus, en différenciant les virus nus et les virus enveloppés.
L’enveloppe virale coloriée en vert, de nature phospholipidique, est héritée des membranes cellulaires. Elle est colonisée par des protéines virales qui, lorsqu’elles sont visibles en microscopie électronique, prennent le nom de spicules, coloriées en bleu sur le schéma. La matrice, constituée de protéines virales, est la zone intermédiaire entre la capside coloriée en rouge et l’enveloppe.
© B. Pozzetto
Les virus existent sous deux formes, selon qu’ils possèdent ou non, en plus de la nucléocapside, une structure phospholipidique appelée enveloppe (figure 1) :
-
◗
les virus dits nus (ou non enveloppés) se limitent à une nucléocapside ;
-
◗
les virus dits enveloppés comportent en sus un péplos (πεπλος qui signifie manteau en grec) ou enveloppe, structure phospholipidique d’origine cellulaire héritée par bourgeonnement de la particule virale à travers les membranes cellulaires (membrane cytoplasmique, endoplasmique ou nucléaire selon le cycle de répli-cation virale dans la cellule que le virus parasite).
Données sur le cycle viral dans la cellule permissive
Les virus sont des parasites intracellulaires obligatoires, ce qui signifie que leur multiplication n’est possible qu’à l’intérieur d’une cellule vivante. Lors de son entrée dans la cellule, le virus se débarrasse de son enveloppe quand il en possède une et de sa capside puis il débute la réplication de son génome en puisant dans la cellule tous les ingrédients nécessaires à cette réplication ; à partir de la machinerie cellulaire, une polymérase (d’origine virale ou cellulaire) pilote la réplication du génome qui permet à son tour la synthèse des protéines virales structurales et non structurales (enzymes) à l’origine de la reconstruction d’une particule virale infectieuse (encore appelée virion). Dans les cellules eucaryotes, le rendement de cette opération est très faible puisqu’il est produit une particule virale infectieuse pour 100 à 10 000 particules défectives (c’est-à-dire non infectieuse). La prise de contrôle du métabolisme cellulaire par le virus est facilitée par la production de facteurs viraux qui bloquent plus ou moins fortement les synthèses nucléiques et protéiques de la cellule (phénomène connu sous le terme de « shut-off » cellulaire). Pour plus de détails, se reporter à l’excellent diaporama de C. Bressollette-Bodin disponible sur Internet [2].
Pour bien comprendre la survie différentielle des virus, selon qu’ils sont enveloppés ou non, dans l’environnement (dépourvu de cellules eucaryotes capables de permettre la réplication des virus animaux), il convient d’intégrer que l’entrée du virus dans la cellule permissive est médiée par des protéines virales de surface (qui sont le plus souvent des glycoprotéines) capables de reconnaître spécifiquement certaines structures externes de la cellule, appelées récepteurs, ce qui constitue la première étape indispensable du cycle viral. Chaque virus – ou groupe de virus – reconnaît des récepteurs propres (molécule CD4 pour le virus HIV-1, molécule ACE-2 pour les virus Sars-CoV et Sars-CoV-2 par exemple) à l’aide de ses glyco- protéines de surface (gp160 pour HIV-1, spicule ou Spike pour Sars-CoV et Sars-CoV-2). Cette interaction entre une protéine virale et une structure cellulaire conditionne en partie la spécificité d’hôte des virus que l’on peut résumer par la formule « n’importe quel virus n’entre pas dans n’importe quelle cellule ». Pour les virus nus, la glycoprotéine virale qui reconnaît le récepteur cellulaire est située sur la capside ; pour les virus enveloppés, elle est située à la surface de l’enveloppe. Compte tenu de la nature chimique différente de ces deux structures (protéique pour la capside, phospholipidique pour l’enveloppe), il apparaît que les virus animaux nus sont plus stables dans l’environnement que les virus enveloppés, dans la mesure où les protéines sont beaucoup plus résistantes aux agents physico-chimiques présents dans l’environnement que les phospholipides.
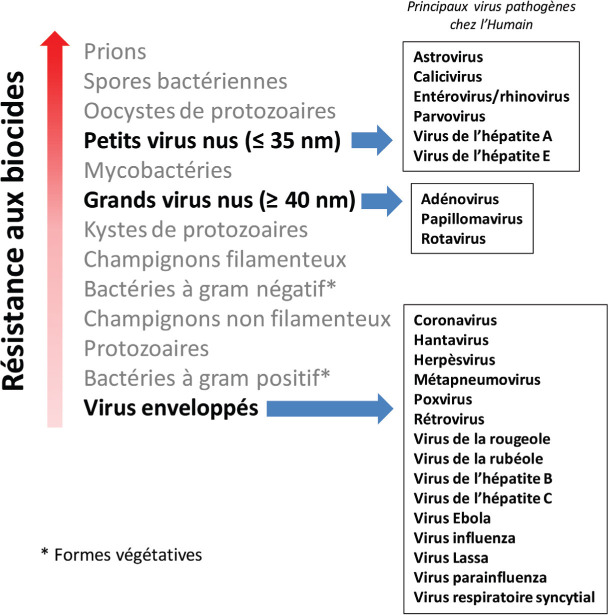
Résistance des virus aux agents physico-chimiques dans l’environnement
La figure 2 illustre le niveau de résistance aux biocides des différents agents pathogènes. Tandis que les virus enveloppés sont très sensibles à l’action des agents physiques (température, pH, etc.) et chimiques (composés hydro-alcooliques, ammoniums quaternaires, éther, acétone, sels biliaires) et donc rapidement inactivés dans des environnements hostiles, en particulier des eaux polluées, les virus nus font partie, avec les mycobactéries, les oocytes de protozoaires, les spores bactériennes et les prions, des formes de vie les plus stables dans des environnements complexes. Concernant les virus nus, il faut des températures élevées (plus de 60 °C) ou des biocides puissants (dérivés chlorés ou halogénés, phénols, aldéhydes, etc.) à des concentrations élevées et appliquées de façon prolongée pour obtenir un effet virucide. Cela explique que des virus animaux nus puissent conserver leur pouvoir infectieux pendant des périodes prolongées (jusqu’à plusieurs mois) lorsqu’ils sont exposés à un environnement aqueux modérément pollué, même s’ils sont incapables de s’y multiplier en l’absence de cellules permissives.
Figure 2.
Place des virus en matière de résistance aux biocides au sein des agents pathogènes.
© B. Pozzetto
Méthodes d’étude de la viabilité virale
Enfin, pour bien appréhender la notion de survie des virus dans l’environnement, il convient de s’arrêter sur quelques considérations méthodologiques.
La méthode recommandée pour étudier la viabilité virale est la culture cellulaire in vitro à partir de cellules permissives ; cela suppose que le virus recherché soit cultivable in vitro, que le traitement des échantillons soit suffisamment soigneux pour retirer les facteurs cytotoxiques sans nuire à la viabilité virale (ce qui peut être complexe pour des échantillons très pollués comme les eaux usées et les boues de stations d’épuration) et qu’il soit relativement simple de mettre en évidence le caractère infectieux du virus en culture ; pour ce faire, on peut mettre en évidence un effet cytopathique (désorganisation de l’architecture des cellules) ou des plages de lyse au niveau de la nappe cellulaire, ou encore mesurer la quantité de génome viral produit en culture par PCR ou visualiser les parti-cules virales produites en microscopie électronique. Toutes ces techniques relèvent de laboratoires de virologie spécialisés ; elles sont longues, coûteuses en personnel technique, nécessitent souvent des niveaux de confinement élevés du fait du niveau de classement de la culture de nombreux virus et se prêtent mal à l’analyse de milieux complexes pouvant contenir plusieurs virus différents.
Du fait des difficultés évoquées précédemment, beaucoup de laboratoires se tournent vers les techniques moléculaires (méthodes d’amplification géniques de type PCR ou séquençage haut débit [3]) pour détecter des virus dans l’environnement. Ces méthodes ont l’avantage d’être plus faciles, plus rapides à mettre en œuvre, moins coûteuses, et elles sont capables de détecter simultanément plusieurs pathogènes. Cependant, elles ont le grand inconvénient de ne donner aucune information sur la viabilité virale. Le rapport acide nucléique/virus infectieux étant compris entre 1 000 et plus de 100 000, il est impossible de prédire la viabilité et encore moins l’infectiosité d’un virus dont il a été détecté des quantités plus ou moins importantes de matériel génétique [4]. Contrairement aux tests de charge virale utilisés en médecine humaine pour établir une corrélation entre la quantité de génome dans le sang ou dans des organes et la présence in vivo de virus infectieux, les virus animaux présents dans l’environnement ne se multiplient pas ; il est donc erroné de vouloir prédire la transmissibilité d’un virus à partir d’un échantillon environnemental dans lequel a été détecté du matériel génétique viral. Ce concept sera illustré par un exemple concret au cours de cette revue.
Les autorités sanitaires européennes ont réactivé la surveillance de la circulation des entérovirus dans les circuits d’eau
Virus et environnement hydrique : l’exemple des entéroviroses en pathologie humaine
Les entérovirus (EV) sont de petits virus nus à ARN (20-25 nm) qui sont impliqués dans de très nombreuses pathologies humaines. Ils appartiennent au genre Enterovirus qui, pour les virus d’intérêt médical, a intégré l’ensemble des anciens « Human enterovirus », et sont classés en quatre espèces intitulées Enterovirus A, B, C et D (le chef de file du genre est le poliovirus type 1 [PV-1] qui appartient à l’espèce C) et les rhinovirus (RV) qui étaient autrefois classés dans un genre à part et qui constituent désormais trois espèces de ce genre : Rhinovirus A, B et C [5].
Les pathologies induites par ces virus sont extrêmement variées et d’une très grande fréquence [6]. La contamination se fait principalement par voie digestive ou aérienne. Outre une majorité de formes asymptomatiques, les EV sont à l’origine de pathologies neurologiques à type de myélites responsables de paralysies (avec au premier chef les PV), de méningites à liquide clair (première cause de méningites pour lesquelles un agent infectieux est identifié), d’encéphalites et de radiculites (syndrome de Guillain-Barré notamment). Les autres patho-logies induites par les EV concernent des fièvres, des infections respiratoires hautes et basses, des angines vésiculeuses, des éruptions cutanées (dont le syndrome pieds-mains-bouche très caractéristique), des conjonctivites hémorragiques, des myocardites et des cardiomyopathies dilatées. Ils ont même été suspectés d’être associés à la survenue de diabètes de type 1 chez l’enfant. À l’inverse, si ces virus ont un tropisme intestinal très marqué, ils sont exceptionnellement à l’origine de gastro-entérites.
Le réservoir environnemental des EV est essentiellement hydrique. Ils peuvent survivre plusieurs mois dans des eaux de rivières, de lacs ou de piscines peu traitées. Il existe un très grand nombre de génotypes au sein des espèces citées plus haut, ce qui explique la fréquence de ces infections. L’évolution se fait sur un mode endémique avec des pics épidémiques (notamment de méningites) plus ou moins marqués du printemps à l’automne. Des corrélations ont été établies entre les EV trouvés dans des eaux récréatives et ceux qui circulent en pathologie humaine dans un même espace-temps [7]. L’humain contamine l’environ- nement par les matières fécales qu’il y déverse et se contamine soit à partir de réservoirs hydriques contaminés soit directement à partir d’autres individus infectés.
En juin 2022, l’actualité des entéroviroses a été marquée par le retour de la poliomyélite dans le comté de Rockland dans l’État de New York chez un homme jeune non vacciné ayant présenté une forme paralytique [8]. Le virus en cause est un PV-2 dérivé d’une souche vaccinale. Il convient de rappeler les efforts déployés par l’Organisation mondiale de la santé (OMS) depuis une quarantaine d’années pour éradiquer les PV de la planète. Le PV-3 a été effectivement éradiqué, officiellement depuis octobre 2019. Le PV-1 sauvage est quasiment éradiqué en dehors de certaines régions d’Afghanistan et du Pakistan où le virus continue à circuler. Cependant, le PV-2 continue à donner de petites épidémies, essentiellement par le biais de variants de la souche vaccinale Sabin par suite d’une réversion spontanée vers le phénotype sauvage (il suffit de quelques mutations ponctuelles pour passer d’une souche sauvage paralytogène à une souche vaccinale et vice-versa). En effet, dans les parties du monde où circulent encore des PV, la vaccination orale par virus vivant atténué continue à être recommandée car elle induit une immunité plus puissante que les vaccins inactivés injectables de type Salk utilisés dans la plupart des régions du monde et qui sont incapables de redonner un virus paralytogène. Suite au cas décrit précédemment en 2022 aux États-Unis, les autorités new-yorkaises ont relancé la vaccination et fait des enquêtes épidémiologiques qui ont abouti à la détection du même virus dans les eaux usées du comté voisin d’Orange [8]. Le dernier cas de poliomyélite aux États-Unis remontait à 2005 avec une souche dérivée d’un PV-1 vaccinal alors que ce pays avait été déclaré indemne de polio en 1994.
Parallèlement à cette observation, les autorités anglaises ont décrit des isolements répétés de PV-2 vaccinal dans les réseaux d’eau de la ville de Londres ; 118 souches ont été isolées à partir de deux prélèvements (sur 52 effectués) entre février et juillet 2022. Certaines de ces souches présentent des marqueurs de réversion vers la virulence. L’absence de cas cliniques est à mettre sur le compte de la bonne immunité vaccinale de la population britannique [9]. Il est intéressant de noter que les virus isolés dans les réseaux d’eau londoniens présentent des similarités phylogéniques avec les souches new-yorkaises mentionnées plus haut et avec des souches environnementales isolées entre avril et juillet 2022 à Jérusalem [10]. À la suite de ces observations, les autorités sanitaires européennes ont réactivé la surveillance de la circulation des EV dans les circuits d’eau. Ces constatations confirment par ailleurs la nécessité de maintenir une grande vigilance dans les prophylaxies vaccinales anti-PV.
Virus et boues d‘épandage : quel risque de transmission du virus Sars-CoV-2 à l’humain ?
L’émergence du virus Sars-CoV-2 fin 2019 en Chine a suscité toutes sortes d’inquiétudes, notamment par rapport à ses modes de transmission. Même si les Coronaviridae infectant l’humain sont nombreux avec l’émergence récente du Sars-CoV en 2002-2003 et du Mers-CoV en 2012, et que leur structure de virus à ARN positif de symétrie hélicoïdale avec une enveloppe hérissée de glycoprotéines S (d’où leur aspect en couronne en microscopie électronique) servant d’amarre au récepteur cellulaire est parfaitement connue, de nombreuses interrogations se sont posées sur leurs modes de transmission au-delà de la simple propagation par gouttelettes ; on se souvient par exemple des polémiques autour du rôle des aérosols et des fomites, ou encore des mesures d’hygiène très strictes imposées pour la gestion des corps des personnes mortes de Covid-19.
La transmission par voie entérique du Sars-CoV-2 rentre dans le même type de discussion. Suite à la détection en quantités assez importantes d’ARN viral dans les eaux usées des zones épidémiques, au point de faire de cette mesure un outil épidémiologique pour la surveillance de la diffusion du SARS-CoV-2 au sein des populations (concept de « wastewater-based epidemiology » ou WBE [11]), la question s’est rapidement posée du risque d’épandre les boues semi-solides, confectionnées à partir des eaux usées dans les stations d’épuration, sur les terres agricoles vis-à-vis des professionnels qui les manipulent, mais aussi de la population rurale qui vit dans cet environnement. Au nom de la nouveauté de la Covid-19 et du principe de précaution inscrit dans notre constitution, des mesures supplémentaires d’ « hygiénisation » des boues d’épandage ont été promulguées par arrêté du 30 avril 2020, « précisant les modalités d’épandage des boues issues du traitement des eaux usées urbaines pendant la période de Covid-19 » [12]. Les arguments qui ont conduit à prendre cette décision reposent sur les quantités d’ARN de Sars-CoV-2 détectables et quantifiables par RT-qPCR dans les selles de patients infectés, dans les eaux usées et même dans certaines boues après traitement, mais aussi sur la capacité du Sars-CoV-2 à survivre un peu plus longtemps que d’autres virus enveloppés, voire que d’autres coronavirus, même si cette survie se chiffre en jours (sept jours dans l’étude [13]).
Le Haut Conseil de la santé publique a récemment réactualisé les données scientifiques disponibles sur l’infectiosité du Sars-CoV-2 dans les selles, les eaux usées et les boues issues des stations d’épuration. Il ressort de cette analyse que :
-
◗
le virus Sars-CoV-2 est un virus très fragile qui perd rapidement sa viabilité dans le milieu extérieur ;
-
◗
le virus infectieux est très rarement présent dans les matières fécales : à partir de dix études ayant rapporté des tentatives d’isolement de virus dans les selles, seulement six patients sur 139 testés ont été trouvés positifs [[14], [15], [16], [17]-18], sans compter toutes les études négatives jamais publiées ;
-
◗
la mise en évidence de virus infectieux dans les eaux usées reste une observation exceptionnelle, avec une absence de corrélation entre la détection d’ARN du Sars-CoV-2 dans l’environnement et le risque de contamination à partir de ces milieux : du fait de l’absence de cellules permettant la réplication virale et la présence de nombreux facteurs physico-chimiques susceptibles de dégrader les enveloppes virales (support de l’infectiosité), la quantité de virus infectieux potentiellement présent dans les eaux usées décroit rapidement au fil du temps, même en l’absence de traitement inactivateur [19,20] ;
-
◗
il n’y a pas d’arguments épidémiologiques en faveur d’une infection à Sars-CoV-2 à partir d’une exposition à des eaux usées [21] ;
-
◗
les procédés techniques et les temps de traitement dans les stations d’épuration conduisent à l’inacti-vation des virus ;
-
◗
l’épandage des boues liquides n’entraîne pas d’aérosolisation ;
-
◗
il n’existe aucune restriction liée à la Covid-19 sur l'utilisation des boues en agriculture dans les autres pays européens.
Quels que soient les risques pour la santé humaine de l’épandage des boues (comme par exemple le rejet de produits toxiques et de résidus médicamenteux), il ressort de cette analyse qu’il n’existe pas de risque additionnel induit par la présence de traces d’ARN de Sars-CoV-2 dans ces milieux.
Virus dans l’alimentation à l’origine de toxi-infections alimentaires collectives
Une toxi-infection alimentaire collective (TIAC) est définie comme l’apparition d’au moins deux cas similaires d’une symptomatologie dont on peut rapporter la cause à une même origine alimentaire. En ce qui concerne les TIAC d’origine virale, les manifestations cliniques les plus fréquentes sont représentées par les gastro-entérites associant de façon variable des nausées, des vomissements et des diarrhées, par des hépatites et par des syndromes neurologiques [22,23]. Les principaux virus associés à des TIAC sont listés dans le tableau 1 . Les gastro-entérites à calicivirus, rotavirus, adénovirus et astrovirus ainsi que l’hépatite A étant des TIAC bien connues dont on sait le rôle joué par l’eau souillée (« péril fécal »), les crudités et les mollusques bivalves, seules trois pathologies émergentes responsables de TIAC seront brièvement décrites dans cette revue : l’hépatite E, l’encéphalite à tique et l’infection à virus Nipah.
Tableau 1.
Principaux virus responsables de toxi-infections alimentaires collectives (TIAC) dans l’espèce humaine.
| Génome | Enveloppe | Famille | Virus en cause | Principaux symptômes |
|---|---|---|---|---|
| ADNdb | Non | Adenoviridae | Adénovirus 40 et 41 | Gastro-entérites |
| ARNdb | Non | Reoviridae | Rotavirus | Gastro-entérites |
| ARNsb positif | Non | Astroviridae | Astrovirus | Gastro-entérites |
| Non | Caliciviridae | Norovirus - Sapovirus | Gastro-entérites | |
| Oui | Flaviviridae | Virus de l’encéphalite à tique | Encéphalites | |
| Non | Hepeviridae | Virus de l’hépatite E | Hépatites | |
| Non | Picornaviridae | Virus de l’hépatite A | Hépatites | |
| ARNsb négatif | Oui | Paramyxoviridae | Virus Nipah | Pneumonies et encéphalites |
ADNdb : ADN double brin ; ARNdb : ARN double brin (segmenté) ; ARNsb positif : ARN simple brin de polarité positive ; ARNsb négatif : ARN simple brin de polarité négative.
Hépatite E
L’hépatite E est une pathologie connue de longue date, du moins sous la forme d’épidémies à transmission fécale-orale touchant parfois un nombre considérable de sujets, principalement dans des parties du monde considérées comme à faible niveau d’hygiène ; avec la progression des conditions d’hygiène, ces grandes épidémies sont d’ailleurs en forte régression. Cette forme d’hépatite E est due aux génotypes 1 et 2 du virus de l’hépatite E (HEV). Il y a une vingtaine d’années, il a été mis en évidence de nouvelles modalités épidémiologiques de l’hépatite E qui la font considérer comme une zoonose. Principalement transmises par voie alimentaire, ces infections, isolées ou touchant de petits groupes de sujets (TIAC), sont dues aux génotypes 3 et 4 dont le principal réservoir est constitué d’animaux, au premier rang desquels se situent les suidés (cochons et sangliers) mais qui englobent de nombreuses autres variétés [24]. Cette nouvelle forme d’hépatite E est devenue la première cause d’hépatite virale aiguë en Europe. La fréquence des formes asymptomatiques explique sa relative méconnaissance. À l’autre extrême du spectre patho- logique, on peut observer des hépatites fulminantes mortelles et des formes chroniques, notamment chez les transplantés [25].
Virus de l’encéphalite à tique
Si tous les virus précédemment cités sont des virus nus très résistants dans le milieu extérieur, il est plus surprenant de trouver dans la liste des agents de TIAC le virus de l’encéphalite à tique (tick-borne encephalitis virus ou TBEV), à la fois de par son caractère enveloppé et son appartenance aux arbovirus. Ce virus, principalement transmis par la tique Ixodes ricinus, également vectrice de la maladie de Lyme, sévit dans toute l’Europe centrale depuis l’Est de la France (Alsace et région Rhône-Alpes-Auvergne) [26] jusqu’en République tchèque et en Pologne, et l’Europe du Nord (pays baltes et scandinaves). Il est responsable de formes asymptomatiques mais aussi de fièvres et de méningo-encéphalites de pronostic plutôt favorable. L’infection peut être prévenue par une vaccination à base de virus inactivé. Outre la transmission habituelle du TBEV par morsure de tique à partir d’un réservoir animal sauvage (rongeurs et cervidés), l’humain peut se contaminer par ingestion de laitages provenant d’animaux domestiques mordus par des tiques. L’épidémie qui a sévi en France entre mars et mai 2020 a concerné une cinquantaine de patients dont 39 ont été confirmés par des tests virologiques ; tous les malades se sont contaminés par des produits artisanaux à base de lait cru non pasteurisé de chèvre provenant d’un même élevage dans le département de l’Ain [27]. Il s’agit du premier épisode de ce type en France. Une revue récente, mais n’intégrant pas cet épisode, a recensé 410 cas publiés d’infection à TBEV transmise par voie alimentaire en Europe entre 1980 et 2021 [28].
Infection à virus Nipah
La transmission alimentaire du virus Nipah est également mal connue. Ce virus enveloppé de la famille de Paramyxoviridae trouve son réservoir dans les chauves-souris frugivores du genre Pteropus. Découvert en 1998 en Malaisie, le virus peut contaminer les porcs et de nombreux autres animaux ; il infecte accidentellement l’humain chez qui il peut entraîner des patho-logies respiratoires et surtout des encéphalites potentiellement mortelles (mortalité de 50 à 70 % dans certaines épidémies). Les épidémies ont principalement été observées en Asie du Sud-Est (Malaisie, Singapour), en Inde et au Bangladesh. La transmission peut se faire par des contacts avec des animaux infectés ou par voie alimentaire, par la consommation de sève fraîche de palmier dattier contaminée par des déjections de chauves-souris [29]. L’infection à virus Nipah constitue une zoonose émergente particulièrement surveillée en Asie.
Virus et environnement hospitalier : le rôle des téléphones portables
Les téléphones portables sont devenus des instruments indispensables à la pratique médicale ; comme la main-outil, ils constituent un véritable prolongement du soignant. Une revue générale publiée en 2019 a fait le point sur le rôle de ces appareils comme vecteurs d’agents pathogènes dans le cadre des infections associées aux soins [30]. Sur les 56 études répertoriées dans cette méta-analyse, une seule s’est intéressée à la présence de virus et elle émane de notre laboratoire [31]. Dans ce dernier travail, les téléphones portables utilisés par les soignants de pédiatrie ont été testés par PCR pour la détection de l’ARN de cinq virus impliqués dans des épidémies hospitalières en pédiatrie : métapneumovirus (MPV), virus respiratoire syncytial (VRS), virus influenza, rotavirus (RV) et norovirus. À partir de 109 appareils testés, l’ARN viral a été détecté sur 42 (38,5 %) d’entre eux : 39 RV, 3 VRS et 1 MPV. Comme attendu, ce sont les virus nus qui ont été retrouvés de façon prédominante, ce qui n’exclut pas le rôle des téléphones portables dans la transmission des virus enveloppés. La principale limite de l’étude réside dans l’absence de tests de viabilité.
En 2020, nos équipes ont publié une nouvelle étude [32] sur le suivi de la contamination des téléphones mobiles : dix appareils détenus par des pédiatres seniors ou partagés lors des gardes dans trois unités cliniques pédiatriques de notre hôpital (tableau 2) ont été testés une fois par semaine pendant 23 semaines ; des cultures bactériennes et des tests de PCR multiplex détectant les principaux virus respiratoires et entériques ont été effectués sur chaque échantillon. Le tableau 2) illustre les principaux résultats de l’étude. En matière de virologie, ce sont les virus nus (adénovirus, bocavirus et rotavirus) qui sont le plus souvent détectés, ce qui ne signifie pas que ce soit les plus associés à des infections croisées. De façon attendue, les téléphones sont plus contaminés en hiver, à la période où les virus circulent le plus activement en pédiatrie ; de même, les trois appareils utilisés dans le service d’urgence sont les plus fortement contaminés (tableau 2) [32].
Tableau 2.
Suivi hebdomadaire sur 23 semaines consécutives de la contamination virale et bactérienne de dix téléphones portables.
| USIP_1 | USIP_2 | USIP_3 | USIP_C | SUP_4 | SUP_5 | SUP_C | SHP_6 | SHP_7 | SHP_8 | Total | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Virus respiratoires | |||||||||||
| Adénovirus | 9 | 5 | 4 | 4 | 15 | 8 | 16 | 5 | 7 | 2 | 75 |
| Bocavirus | 7 | - | - | 6 | 6 | 13 | 14 | 8 | 6 | 3 | 63 |
| Virus respiratoire syncytial | 3 | - | - | 1 | - | - | - | 1 | - | - | 5 |
| Rhinovirus | - | - | 2 | - | 1 | - | 1 | - | - | 1 | 5 |
| Entérovirus | - | - | - | - | - | 1 | - | 1 | - | 1 | 3 |
| Coronavirus | - | - | 1 | - | - | 2 | - | - | - | - | 3 |
| Sous-total | 19 | 5 | 7 | 11 | 22 | 24 | 31 | 15 | 13 | 7 | 154 |
| Virus entériques | |||||||||||
| Rotavirus | - | - | - | - | 3 | 9 | 4 | 8 | 3 | 1 | 28 |
| Adénovirus | - | - | - | - | 1 | 1 | 4 | - | - | - | 6 |
| Sous-total | - | - | - | - | 4 | 10 | 8 | 8 | 3 | 1 | 34 |
| Bactéries | |||||||||||
| Staphylococcus aureus | 2 | - | - | 2 | - | - | 2 | 1 | - | 6 | 13 |
| Staphylococcus capitis | 1 | 7 | 2 | 4 | 2 | 3 | 3 | - | 5 | 1 | 28 |
| Pseudomonas aeruginosa | - | 1 | - | - | - | 5 | - | 1 | - | - | 7 |
| Paracoccus yeei | - | - | - | - | - | 7 | 1 | 1 | 2 | - | 11 |
| Sous-total | 3 | 8 | 2 | 6 | 2 | 15 | 6 | 3 | 7 | 7 | 59 |
| TOTAL | 22 | 13 | 9 | 17 | 28 | 49 | 45 | 26 | 23 | 15 | 247 |
Suivi une fois par semaine sur 23 semaines consécutives de la contamination virale et bactérienne de dix téléphones portables (une colonne par téléphone) utilisés individuellement par huit médecins séniors (numérotés de 1 à 8) ou partagés lors des gardes (notés P) dans trois services de pédiatrie du CHU de Saint-Étienne, France (USIP : unité de soins intensifs pédiatriques ; SUP : service des urgences pédiatriques ; SHP : service d’hospitalisation pédiatrique). Le génome des virus a été détecté à l’aide de trousses de PCR multiplex. Les bactéries ont été testées par culture sur milieux adaptés. Paracoccus yeei est une bactérie environnementale sans pouvoir pathogène, utilisée comme marqueur de contamination [32].
À l’ère de la Covid-19, même s’il n’existe pour le moment aucune étude publiée ciblant la potentielle transmission du Sars-CoV-2 en relation avec les défauts d’hygiène attachés aux téléphones portables, les résultats ci-dessus plaident pour renforcer l’attention de l’ensemble des utilisateurs (soignants ou non) sur l’importance de la désinfection régulière de ces instruments familiers, notamment en période épidémique, un point sans doute négligé par rapport à l’hygiène des mains.
Il y a une vingtaine d’années, il a été mis en évidence de nouvelles modalités épidémiologiques de l’hépatite E qui la font considérer comme une zoonose
Virus et fomites, l’exemple des infections à orthopoxvirus
Le mot « fomite » est un anglicisme qui désigne toute substance ou objet inanimé qui est capable de transmettre un agent infectieux (virus, bactérie, parasite) à un hôte réceptif. Il peut s’agir d’une surface dans une chambre ou une salle de soins, d’un interrupteur, d’une poignée de porte, de linge, etc., bref de tout support susceptible d’être porteur d’agents pathogènes. Le caractère infectieux de ces derniers dépend de leur nature physico-chimique (figure 1), de la présence de matières organiques capables de protéger leur viabilité et du temps qui s’est écoulé entre leur dépôt sur l’objet et le contact avec l’hôte réceptif.
Les infections à orthopoxvirus qui ont envahi la scène épidémiologique au printemps dernier constituent une bonne opportunité pour discuter les modalités de transmission de virus présents au moins transitoirement dans l’environnement humain. Les orthopoxvirus sont de gros virus enveloppés à ADN, à la limite de la visibilité en microscopie optique. Ils appartiennent tous au genre Orthopoxvirus et contaminent toutes sortes de mammifères ; l’humain se contamine habituellement suite à un contact avec un réservoir animal. À cela il existe deux exceptions : la variole dont le virus – appelé en anglais variola virus – dérive d’un réservoir zoonotique mais qui s’est progressivement différencié pour n’entraîner que des infections interhumaines, et l’épidémie actuelle de Monkeypox qui est en train de suivre la même évolution (affranchissement du réservoir animal pour ne donner que des infections interhumaines, ce qui était exceptionnel avec le Monkeypox avant l’épidémie actuelle). L’unité de ce genre viral est constituée par une très forte immunité croisée entre ces différents agents, ce qui est d’ailleurs à l’origine du succès de la vaccination jennérienne qui a consisté à utiliser à partir de la fin du xviiie siècle une souche peu pathogène responsable d’une infection bénigne chez les vaches appelée vaccine, due au cowpox virus. Ces souches vaccinale, propagées in vivo puis en culture cellulaire, sont à l’origine du vaccinia virus dérivé du cowpox virus qui a permis à l’OMS, à la suite d’une vaccination à l’échelle mondiale, de déclarer la variole éradiquée de la surface de la planète en 1980. Les orthopoxvirus se transmettent principalement par contacts directs rapprochés (moins de deux mètres) entre individus (y compris au cours de relations sexuelles) ou entre un animal infecté et l’humain (cas du Monkeypox en Afrique ou du Cowpox). Dans la suite de la revue, le focus sera mis sur les situations moins fréquentes où les fomites participent à la propagation du virus.
Variole
Concernant la variole, on s’interroge sur la possibilité d’une résurgence, notamment suite à des manipulations génétiques malveillantes, d’autant que l’immunité vaccinale décline avec l’arrêt de la vaccination. Des données historiques ont bien documenté le rôle des fomites comme moyen accessoire de propagation de la maladie à partir de linges ou de vêtements contaminés. Outre le rôle des épidémies naturelles de variole et autres pathologies infectieuses qui ont réduit la population autochtone des Amériques de 50 à 80 % selon les régions, l’utilisation de matériel contaminé a même été mise en place en Amérique du Nord avec des arrière-pensées « génocidaires », en distribuant des couvertures contaminées aux Amérindiens, entraînant le déclenchement d’épidémies meurtrières [33]. Un travail récent [34] a fait une étude rétrospective très documentée pour étayer la possibilité, certes accessoire mais très vraisemblable, de transmission du virus sur de longues distances (jusqu’à quinze kilomètres) par le biais de poussières contaminées véhiculées par les flux d’air naturels ou artificiels (par exemple entre différents étages, voire entre un bateau sur un fleuve accueillant des varioleux et la population résidant sur la berge).
Virus cowpox
Concernant l’infection par le virus cowpox, qui survient généralement lors d’un contact rapproché avec un animal infecté (souvent des animaux de compagnie eux-mêmes contaminés par des rongeurs), il a été rapporté le cas d’un homme adulte, pourtant vacciné dans l’enfance, qui a présenté des lésions vésiculeuses typiques au niveau du thorax suite à une blessure avec une clôture en fil de fer barbelé probablement contaminée par du bétail ; le virus cowpox a été isolé au niveau des lésions cutanées [35].
Monkeypox
Concernant l’épidémie d’infection Monkeypox qui sévit depuis le printemps 2022 dans la communauté homosexuelle masculine mondiale, la transmission est principalement médiée par les contacts rapprochés entre individus. Cependant, des études mettent en évidence la présence de génome viral dans une proportion importante de prélèvements environnementaux [[36], [37]-38]. Dans deux des trois études, certaines cultures virales ont été positives, confirmant la viabilité du virus, même si les titres infectieux étaient faibles ; une des études [37] montre que le virus est encore détectable dans leur résidence quinze jours après le départ des patients et que le virus infectieux est trouvé plus volontiers sur les tissus que sur les surfaces rigides. Ce risque infectieux environnemental est corroboré par la publication récente de transmission croisée chez deux infirmières s’étant déplacées en voiture pour faire des prélèvements au domicile d’un sujet infecté ; les deux soignantes ont passé environ une heure au domicile du patient ; elles étaient masquées et avaient revêtu des gants lors des prélèvements. Aucun contact direct avec le patient n’a été noté. Cinq jours plus tard, les deux soignantes ont développé une lésion vésiculeuse au niveau d’un doigt pour l’une et d’un avant-bras pour l’autre, associée à un tableau fébrile avec altération de l’état général. Les virus isolés chez les trois malades ont été séquencés par technique haut débit avec 100 % d’homologie entre les trois souches. Le mode précis de contamination des deux infirmières reste indéterminé : exposition aux fomites présents dans le domicile du cas index, contact avec la boîte ayant servi à transporter les échantillons (qui n’a pas été désinfectée), manipulation impropre des masques ? [39] Ces observations récentes incitent à bien respecter les règles d’isolement et de désinfection de l’environ- nement préconisées par les autorités de santé comme celles édictées par le Haut Conseil de la santé publique français à l’occasion de cette épidémie à monkeypox virus [40].
Conclusion
Les virus sont omniprésents dans l’environnement, qu’il soit hydrique, aérien, alimentaire ou mobilier, à l’hôpital comme dans la communauté. La survie des virus dans ces environnements est très dépendante de leur structure physico-chimique mais aussi des conditions extérieures et du temps passé dans des contextes souvent hostiles. Les différents exemples en relation avec l’actualité qui sont présentés ici illustrent que le risque environnemental est souvent difficile à cerner avec objectivité et qu’il faut se garder à la fois de l’ignorer ou de le surestimer. Le respect des mesures standard d’hygiène reste le meilleur garant de la prévention. Il faut encourager les recherches multidisciplinaires visant à mieux comprendre le comportement des virus dans l’environnement et à évaluer plus objectivement leur viabilité par des techniques standardisées faciles à comparer d’une étude à l’autre. La virologie environ-nementale a encore de beaux défis à relever.
Déclaration de liens d’intérêts : les auteurs déclarent ne pas avoir de liens d'intérêts.
Points à retenir
-
◗
Les virus sont abondants dans l’environnement. La durée de leur survie est principalement conditionnée par l’existence ou non d’une enveloppe autour de la nucléocapside. Les virus nus sont beaucoup plus résistants aux agents physico-chimiques que les virus enveloppés.
-
◗
En 2022, il a été mis en évidence dans les eaux usées de New York, Londres et Jérusalem la présence de poliovirus de type 2 dérivés de la souche vaccinale Sabin. Cette observation s’est accompagnée de la découverte d’un cas de poliomyélite paralytique chez un homme non vacciné dans un comté de l’État de New York.
-
◗
Une analyse de risque conduit à conclure que les traces d’ARN de Sars-CoV-2, détectées dans les boues issues de stations d’épuration destinées à l’épandage sur les terres agricoles, ne présentent pas de risque de dissémination du virus à l’humain.
-
◗
À côté des toxi-infections alimentaires (TIAC) virales bien répertoriées, il existe des TIAC « émergentes », notamment en relation avec le virus de l’hépatite E, le virus de l’encéphalite à tique et le virus Nipah.
-
◗
Les téléphones portables utilisés en pédiatrie sont fortement contaminés par des virus et des bactéries. Un effort pour désinfecter régulièrement ces instruments doit être recommandé afin de prévenir les infections virales associées aux soins en périodes d’épidémies virales.
-
◗
Les fomites, et notamment le linge des patients, constituent un mode de transmission accessoire mais avéré des orthopoxvirus (virus de la variole, virus cowpox, virus monkeypox). Ce risque doit être prévenu par le respect des gestes barrières et la désinfection de l’environnement des patients.
Références
- 1.Bergh O., Børsheim K.Y., Bratbak G., Heldal M. High abundance of viruses found in aquatic environments. Nature. 1989;340(6233):467–468. doi: 10.1038/340467a0. [DOI] [PubMed] [Google Scholar]
- 2.Bressollette-Bodin C. Virus et machinerie cellulaire. Séminaire SFLS 2015. www.sfls.aei.fr/ckfinder/userfiles/files/Formations/diaporamas/2015/topo-bressollette_sfls-mars-2015.pdf.
- 3.Desdouits M., de Graaf M., Strubbia S., et al. Novel opportunities for NGS-based one health surveillance of foodborne viruses. One Health Outlook. 2020;2:14. doi: 10.1186/s42522-020-00015-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Sobsey M.D. Absence of virological and epidemiological evidence that Sars-CoV-2 poses COVID-19 risks from environmental fecal waste, wastewater and water exposures. J Water Health. 2021;20:126–138. doi: 10.2166/wh.2021.182. [DOI] [PubMed] [Google Scholar]
- 5.Bessaud M., Blondel B., Joffret M-L., et al. Nomenclature et classification des entérovirus : quelle histoire ! Virologie. 2018;22:289–303. doi: 10.1684/vir.2018.0756. [DOI] [PubMed] [Google Scholar]
- 6.Pillet S, Berri F. Gretteau PA et al. Entérovirus et autres picornavirus pathogènes pour l’homme (à l’exception du virus de l’hépatite A) Encyclopédie Médico-Chirurgicale. Biologie Médicale. 2020;90-55-0045-A.
- 7.Bisseux M., Colombet J., Mirand A., et al. Monitoring human enteric viruses in wastewater and relevance to infections encountered in the clinical setting: a one-year experiment in central France, 2014 to 2015. Euro Surveill. 2018;23:17–00237. doi: 10.2807/1560-7917.ES.2018.23.7.17-00237. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Link-Gelles R., Lutterloh E., Schnabel Ruppert P., et al. Public health response to a case of paralytic poliomyelitis in an unvaccinated person and detection of poliovirus in wastewater - New York, June-August 2022. MMWR Morb Mortal Wkly Rep. 2022;71(33):1065–1068. doi: 10.15585/mmwr.mm7133e2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Klapsa D., Wilton T., Zealand A., et al. Sustained detection of type 2 poliovirus in London sewage between February and July, 2022, by enhanced environmental surveillance. Lancet. 2022;S0140-6736(22):01804–01809. doi: 10.1016/S0140-6736(22)01804-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Zuckerman N.S., Bar-Or I., Sofer D., et al. Emergence of genetically linked vaccine-originated poliovirus type 2 in the absence of oral polio vaccine, Jerusalem, April to July 2022. Euro Surveill. 2022;27(37):2200694. doi: 10.2807/1560-7917.ES.2022.27.37.2200694. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Mackul'ak T., Gál M., Špalková V., et al. Wastewater-Based Epidemiology as an early warning system for the spreading of SARS-CoV-2 and its mutations in the population. Intern J Environ Res Public Health. 2021;18(11):56289. doi: 10.3390/ijerph18115629. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Arrêté du 30 avril 2020 précisant les modalités d’épandage des boues issues du traitement des eaux usées urbaines pendant la période de covid-19. Consulté sur Internet le 20 octobre 2022. www.legifrance.gouv.fr/jorf/id/JORFTEXT000041845678
- 13.Bivins A., Greaves J., Fischer R., et al. Persistence of SARS-CoV-2 in water and wastewater. Environ Sci Technol Lett. 2020;7(12):937–942. doi: 10.1021/acs.estlett.0c00730. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Heneghan C.J., Spencer E.A., Brassey J., et al. SARS-CoV-2 and the role of orofecal transmission: a systematic review. F1000Research. 2021;10:231. doi: 10.12688/f1000research.51592.1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Young B.E., Ong S.WX., Kalimuddin S., et al. Epidemiologic features and clinical course of patients infected with SARS-CoV-2 in Singapore [published correction appears in JAMA. JAMA. 2020;323(15):1488–1494. doi: 10.1001/jama.2020.3204. 1510. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Albert S., Ruíz A., Pemán J., et al. Lack of evidence for infectious SARS-CoV-2 in feces and sewage. Eur J Clin Microbiol Infect Dis. 2021;40(12):2665–2667. doi: 10.1007/s10096-021-04304-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Dergham J., Delerce J., Bedotto M., et al. Isolation of viable SARS-CoV-2 virus from feces of an immunocompromised patient suggesting a possible fecal mode of transmission. J Clin Med. 2021;10(12):2696. doi: 10.3390/jcm10122696. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Cerrada-Romero C., Berastegui-Cabrera J., Camacho-Martínez P., et al. Excretion and viability of SARS-CoV-2 in feces and its association with the clinical outcome of COVID-19. Sci Rep. 2022;12(1) doi: 10.1038/s41598-022-11439-7. Art. 1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Varbanov M., Bertrand I., Philippot S., et al. Somatic coliphages are conservative indicators of SARS-CoV-2 inactivation during heat and alkaline pH treatments. Sci Total Environ. 2021;797:149112. doi: 10.1016/j.scitotenv.2021.149112. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Wurtzer S., Lacote S., Murri S., et al. Reduction in SARS-CoV-2 virus infectivity in human and hamster feces. Viruses. 2022;14(8):1777. doi: 10.3390/v14081777. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Zaneti R.N., Girardi V., Spilki F.R., et al. Quantitative microbial risk assessment of SARS-CoV-2 for workers in wastewater treatment plants. Sci Total Environ. 2021;754:142163. doi: 10.1016/j.scitotenv.2020.142163. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Newell D.G., Koopmans M., Verhoef L., et al. Food-borne diseases. The challenges of 20 years ago still persist while new ones continue to emerge. Intern J Food Microbiol. 2010;139:S3–s15. doi: 10.1016/j.ijfoodmicro.2010.01.021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Ezzatpanah H., Gómez-López V.M., Koutchma T., et al. Risks and new challenges in the food chain: viral contamination and decontamination from a global perspective, guidelines, and cleaning. Compr Rev Food Sci Food Saf. 2022;21(2):868–903. doi: 10.1111/1541-4337.12899. [DOI] [PubMed] [Google Scholar]
- 24.Ferri G., Vergara A. Hepatitis E Virus in the food of animal origin: a review. Foodborne Pathog Dis. 2021;18(6):368–377. doi: 10.1089/fpd.2020.2896. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Kamar N., Selves J., Mansuy J.M., et al. Hepatitis E virus and chronic hepatitis in organ-transplant recipients. N Engl J Med. 2008;358(8):811–817. doi: 10.1056/NEJMoa0706992. [DOI] [PubMed] [Google Scholar]
- 26.Botelho-Nevers E., Gagneux-Brunon A., Velay A., et al. Tick-Borne Encephalitis in Auvergne-Rhône-Alpes Region, France, 2017-2018. Emerg Infect Dis. 2019;25(10):1944–1948. doi: 10.3201/eid2510.181923. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Gonzalez G., Bournez L., Moraes R.A., et al. A one-health approach to investigating an outbreak of alimentary tick-borne encephalitis in a non-endemic area in France (Ain, Eastern France): a longitudinal serological study in livestock, detection in ticks, and the first tick-borne encephalitis virus isolation and molecular characterisation. Front Microbiol. 2022;13:863725. doi: 10.3389/fmicb.2022.863725. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Elbaz M., Gadoth A., Shepshelovich D., et al. Systematic review and meta-analysis of foodborne tick-borne encephalitis, Europe, 1980-2021. Emerg Infect Dis. 2022;28(10):1945–1954. doi: 10.3201/eid2810.220498. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Quarleri J., Galvan V., Delpino M.V. Henipaviruses: an expanding global public health concern? [published online ahead of print, 2022 Oct 11] Geroscience; 2022. pp. 1–13. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Olsen M., Campos M., Lohning A., et al. Mobile phones represent a pathway for microbial transmission: a scoping review. Travel Med Infect Dis. 2020;35:101704. doi: 10.1016/j.tmaid.2020.101704. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Pillet S., Berthelot P., Gagneux-Brunon A., et al. Contamination of healthcare workers’ mobile phones by epidemic viruses [published correction appears in Clin Microbiol Infect. Clin Microbiol Infect. 2016;22(5):456. doi: 10.1016/j.cmi.2015.12.008. Sep;22(9):e21]. 2016;22(5):.e1-456.e4566. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Cantais A., Grattard F., Gagnaire J., et al. Longitudinal study of viral and bacterial contamination of hospital pediatricians’ mobile phones. Microorganisms. 2020;8(12):2011. doi: 10.3390/microorganisms8122011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Berche P. Vie et mort de la variole. Rev Biol Méd. 2022;365:49–62. [Google Scholar]
- 34.MacIntyre C.R., Das A., Chen X., et al. Evidence of long-distance aerial convection of variola virus and implications for disease control. Viruses. 2019;12(1):33. doi: 10.3390/v12010033. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Andreani J., Arnault J.P., Bou Khalil J.Y., et al. Atypical cowpox virus infection in smallpox-vaccinated patient, France. Emerg Infect Dis. 2019;25(2):212–219. doi: 10.3201/eid2502.171433. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Pfeiffer J.A., Collingwood A., Rider L.E., et al. High-contact object and surface contamination in a household of persons with monkeypox virus infection - Utah, June 2022. MMWR Morb Mortal Wkly Rep. 2022;71(34):1092–1094. doi: 10.15585/mmwr.mm7134e1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Morgan C.N., Whitehill F., Doty J.B., et al. Environmental persistence of monkeypox virus on surfaces in household of person with travel- associated infection, Dallas, Texas, USA. 2021. Emerg Infect Dis. 2022;28(10):1982–1989. doi: 10.3201/eid2810.221047. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Gould S., Atkinson B., Onianwa O., et al. Air and surface sampling for monkeypox virus in a UK hospital: an observational study [published online ahead of print, 2022 Oct 7] Lancet Microbe. 2022;S2666-5247(22):00257–00259. doi: 10.1016/S2666-5247(22)00257-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Salvato R.S., Rodrigues Ikeda M.L., Barcellos R.B., et al. Possible occupational infection of healthcare workers with monkeypox virus, Brazil [published online ahead of print, 2022 Sep 30] Emerg Infect Dis. 2022;28(12) doi: 10.3201/eid2812.221343. 10.3201/eid2812.221343. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Lepelletier D., Pozzetto B., Chauvin F., et al. Management of patients with monkeypox virus infection and contacts in the community and in healthcare settings: a French position paper [published online ahead of print, 2022 Sep 2] Clin Microbiol Infect. 2022;S1198-743X(22):00455–00465. doi: 10.1016/j.cmi.2022.08.018. [DOI] [PMC free article] [PubMed] [Google Scholar]