Abstract
本研究旨在探索脉冲电磁场(PEMF)调控间充质干细胞外泌体(MSCs-Exo)对软骨细胞凋亡的作用。采用强度1 mT,频率15、45、75 Hz的PEMF在体外干预MSCs 30 min后提取外泌体并鉴定。荧光标记PEMF干预前后的MSCs-Exo,并分别与星形孢菌素(STS)诱导的软骨细胞共培养24 h,观察软骨细胞对MSCs-Exo的摄取、细胞的凋亡及细胞内aggrecan、caspase-3和collagenⅡA的基因和蛋白表达变化。与15 Hz组和45 Hz组相比,75 Hz的PEMF显著增强了MSCs-Exo抑制软骨细胞凋亡、促进细胞外基质合成的作用。本研究为应用PEMF调控MSCs-Exo的生物学功能提供了研究基础,为优化利用MSCs-Exo抑制软骨细胞凋亡提供了新的研究方向。
Keywords: 脉冲电磁场, 间充质干细胞, 外泌体, 凋亡, 软骨细胞
Abstract
The study aims to explore the effect of mesenchymal stem cells-derived exosomes (MSCs-Exo) on staurosporine (STS)-induced chondrocyte apoptosis before and after exposure to pulsed electromagnetic field (PEMF) at different frequencies. The AMSCs were extracted from the epididymal fat of healthy rats before and after exposure to the PEMF at 1 mT amplitude and a frequency of 15, 45, and 75 Hz, respectively, in an incubator. MSCs-Exo was extracted and identified. Exosomes were labeled with DiO fluorescent dye, and then co-cultured with STS-induced chondrocytes for 24 h. Cellular uptake of MSC-Exo, apoptosis, and the protein and mRNA expression of aggrecan, caspase-3 and collagenⅡA in chondrocytes were observed. The study demonstrated that the exposure of 75 Hz PEMF was superior to 15 and 45 Hz PEMF in enhancing the effect of exosomes in alleviating chondrocyte apoptosis and promoting cell matrix synthesis. This study lays a foundation for the regulatory mechanism of PEMF stimulation on MSCs-Exo in inhibiting chondrocyte apoptosis, and opens up a new direction for the prevention and treatment of osteoarthritis.
Keywords: Pulsed electromagnetic fields, Mesenchymal stem cells, Exosomes, Apoptosis, Chondrocyte
0. 引言
骨关节炎(osteoarthritis,OA)是一种常见的慢性疾病,也是老年人残疾的主要原因[1]。在骨关节炎疾病进程中,关节软骨的再生是治疗骨关节炎的主要挑战之一[2-3]。骨关节炎的发病机制与软骨细胞凋亡和组织减少有关,由于关节软骨完全依赖软骨细胞来维持细胞外基质,因此软骨细胞的功能受损和细胞死亡将导致关节软骨的退变[2,4]。文献显示软骨损伤程度与软骨细胞凋亡有一定的相关性,软骨细胞死亡和基质丢失可能形成恶性循环[5]。因此探索安全有效的抑制关节软骨细胞凋亡[6]、促进关节软骨再生修复的方法是促进骨关节炎患者全面康复的迫切需求。
关节软骨作为一种终末分化的结缔纤维组织,缺乏血液供应、淋巴循环及神经支配,其损伤与退变难以自身修复[2]。目前正在探索的关节软骨再生修复技术包括骨髓刺激技术、骨软骨移植、软骨细胞植入、干细胞技术及组织工程等[7]。其中,间充质干细胞(mesenchymal stem cells,MSCs)因其广泛的来源、较强的增殖特性和多样的分化潜能而被广泛应用于骨与软骨组织的再生修复[8]。而间充质干细胞外泌体(mesenchymal stem cells-derived exosomes,MSCs-Exo)通过旁分泌作用传递MSCs的生物学功能[9],避免了对于同种异体MSCs治疗导致肿瘤、疾病传播和宿主免疫排斥反应的担忧,作为一种具有较好生物相容性、低免疫原性和低致瘤性的治疗手段[10],被广泛用于骨关节炎的再生治疗研究。
多项研究发现,MSCs及其外泌体可通过抑制软骨细胞的凋亡减轻骨关节炎的症状,促进关节软骨修复[11]。然而,MSCs-Exo的异质性导致的治疗效果不佳已成为制约其临床转化的主要瓶颈[10]。因此,如何调控MSCs-Exo的生物学功能,并促进它对骨关节炎软骨损伤的再生修复是MSCs-Exo转化与应用的研究热点。在康复医学领域,脉冲电磁场(pulsed electromagnetic field,PEMF)作为一种物理因子治疗方法,在临床上应用于骨折延迟愈合、骨质疏松及骨关节炎的治疗[12-14]。研究发现,8 Hz、3.8 mT和75 Hz、1.6 mT的PEMF均能促进骨关节炎软骨损伤修复,改善软骨下骨重建;抑制肿瘤坏死因子α(tumour necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)等炎症因子,实现抑制Caspase 3/8轴诱导的软骨细胞凋亡[15-17]。最新的研究发现,经过10 min的PEMF干预,MSCs的上清液也具有类似MSCs的生物学功能,如促进成软骨分化、抑制骨关节炎软骨细胞炎症和凋亡、增加软骨细胞迁移,提示PEMF可能通过调控MSCs的外泌体促进其抗凋亡作用[18]。但不同频率的PEMF对于MSCs-Exo的作用尚未得到探索,通过PEMF调控MSCs-Exo治疗骨关节炎的最佳频率尚未得到统一。因此,本研究旨在探索不同频率PEMF干预后的MSCs-Exo对软骨细胞凋亡的作用。
1. 材料和方法
1.1. 材料
1.1.1. 主要材料和试剂
Sprague-Dawley(SD)大鼠软骨细胞与原代细胞DMEM/F-12基础培养基、SD大鼠脂肪间充质干细胞(adipose mesenchymal stem cells,AMSCs)与原代细胞DMEM低糖基础培养基、胎牛血清(Gibco,美国);细胞膜荧光探针(3,3′-dioctadecyloxacarbocyanine perchlorate,DiO)染色剂(优逸兰迪,苏州);Annexin V binding buffer、Annexin V-FITC、CFSE染色剂(索莱宝,北京);反转录试剂盒(翌圣,上海);anti-CD9/TSG101/SOX9/CASPASE-3(Abcam,英国)。
1.1.2. 主要仪器设备
Cyto flex S流式细胞仪(Beckman,美国);western blot电泳系统(Bio-rad,美国);脉冲电磁场体外细胞干预系统[定制设计的PEMF系统包括一个波形信号发生器(DG1022U,RIGOL,苏州)、一个可调开关电源(MS-605D,东莞麦生)、一个功率放大器和带有3线圈阵列的亥姆霍兹线圈];细胞培养箱(Thermo,美国);酶标仪(Bio-rad,美国);超净工作台(Thermo,美国);倒置荧光显微镜(Leica,德国);MILi-Qso型超纯水仪(Millipore,美国);高速冷冻离心机(Eppendorf,德国);Optima™ XE超速离心机(Beckman Coulter,美国)。
1.2. 实验方法
1.2.1. SD大鼠软骨细胞和AMSCs的体外培养
取两周龄SD大鼠膝关节,用含100 U/mL青-链霉素的磷酸盐缓冲液(phosphate buffer saline,PBS)将大鼠关节软骨冲洗干净,以0.25%胰酶在37 ℃、5% CO2培养箱中消化1 h后用无菌PBS冲洗两次,将软骨剪碎至匀浆状,加入等体积完全培养基[10%胎牛血清(fetal bovine serum,FBS)+100 U/mL青-链霉素+DMEM/F-12基础培养基],1 000 r/min离心5 min,再次加入含有0.5 μg/mL Ⅱ型胶原酶的完全培养基重悬细胞,过滤除菌后接种于培养皿中消化24 h,收集细胞悬液,加入等体积的完全培养基,300 g离心5 min,再次加入完全培养基重悬细胞,接种于新的细胞培养皿中。
取四周龄SD大鼠腹股沟处脂肪组织,去除表面的结缔组织后放入含100 U/mL青-链霉素PBS的离心管中。将清洗后的脂肪组织转移到干燥的培养基中,剪至浆糊状后,加入2倍脂肪体积量的0.1%浓度Ⅰ型胶原酶,转移至离心管中,置于37 ℃摇床上消化60 min。后加入含10% FBS的低糖基础培养基(Dulbecco’s Modified Eagle Medium,DMEM)中和,300 g离心10 min,丢弃上层组织和液体后加入完全培养基重悬细胞,接种于培养皿中,24 h后首次换液。
两种细胞分别置于细胞培养箱中进行培养,每3天更换一次培养基,细胞密度达80%~90%时传代。
1.2.2. AMSCs的鉴定和三系分化
在干细胞培养至第三代时,用流式细胞术检测AMSCs表型:将细胞用胰酶消化,用含Ca2+、游离Mg2+的PBS,1%牛血清白蛋白和13.6 mmol/L柠檬酸钠的荧光激活细胞分选缓冲液冲洗2次,离心计数(1×107 cells/mL)。在200 μL细胞悬液中分别加入CD90、CD34、CD44和CD45抗体。随后,同免疫球蛋白和异硫氰酸酯(fluorescein isothiocyanate,FITC)(10 μL)完全混合,室温下反应30 min。离心后用流式细胞分析仪来检测细胞表面抗原,之后用Flowjo软件分析结果。
使用大鼠AMSCs成软骨、成骨和成脂诱导试剂盒(赛业生物科技有限公司,美国),按照试剂盒操作方法对三代AMSCs进行成软骨、成骨和成脂分化诱导操作。成软骨诱导培养结束后行石蜡包埋切片,用阿利辛蓝染色判定诱导结果:低倍镜下可见蓝色着色的酸性粘多糖说明该AMSCs具有成软骨能力。成骨诱导培养结束后用4%中性甲醛固定,用茜素红染色后于显微镜下观察判定诱导结果:低倍镜下可见红色着色的钙结节说明该AMSCs具有成骨能力。成脂诱导培养结束后用4%中性甲醛固定,用油红O染液染色后于显微镜下观察判定诱导结果:低倍镜下可见大面积红色着色点或20/40倍镜下可见细胞内有红色球形的脂滴说明该AMSCs具有成脂能力。
1.2.3. 脉冲电磁场干预AMSCs
PEMF干预采用报道过的干预体系[19]置于37 ℃细胞恒温培养箱中,该体系主要由PEMF信号发射器与圆柱电磁线圈组成(见附图1)。信号发射器可发出脉冲持续时间300 μs,输出强度1 mT、可调频率的电磁场。第3~4代AMSCs 细胞接种于培养皿上,以无血清培养基培养,并置于PEMF 发生器内,给予强度1 mT,频率分别为0、15、45、75 Hz 的PEMF干预30 min,24 h后取上清。
图 1.
Isolation and characterization of rat AMSCs and exosomes
AMSCs及其外泌体的培养与鉴定
a. 间充质干细胞明场及三系分化诱导图片;b. AMSC的流式鉴定结果,检测到细胞表面抗原CD34、CD44、CD45和CD90;c. 外泌体WB结果图片(三组exosome为平行实验组);d. 外泌体电镜结果
a. the osteogenic induction, adipogenic induction and chondrogenic induction of mesenchymal stem cells; b. cell surface antigens CD34, CD44, CD45 and CD90 were detected by flow cytometry; c. WB results of antibodies CD9 and TSG101 in exosomes; d. TEM result of exosomes
1.2.4. AMSCs外泌体的提取和鉴定
将AMSCs传代培养至第3~4代,待细胞融合度达90%左右时,使用无血清的DMEM换液。放入细胞培养箱24 h后将培养皿取出,收集上清至离心管内,重复离心两次取上清后,用0.22 μm过滤器过滤上清,取滤液以2 200 g离心35 min。取离心后上清于浓缩管中,1 360 g离心10 min,将浓缩管中上层液体转移至离心管内。将离心管放入适配器中配平(差距小于0.1 g)后,于超高速离心机中以4 ℃、140 000 g离心90 min。离心结束后弃上清,所得沉淀重悬后即为外泌体悬液。
外泌体形态学观察:吸取50 µL外泌体悬液滴在铜网上,室温静置1 min,用滤纸从侧面吸干液体,使用2%磷钨酸溶液在室温下负染1 min,滤纸吸干染液,室温晾干,于透射电镜(transmission electron microscope,TEM)下观察并拍照。用纳米颗粒跟踪分析(nanoparticle tracking analysis,NTA)测定外泌体浓度。外泌体标志蛋白检测:通过免疫印迹分析(western blot,WB)进行外泌体表面标志物CD9、TSG101检测。
1.2.5. DiO标记外泌体后与软骨细胞共培养
按照DiO荧光染料试剂盒操作说明标记MSCs-Exo,该染料可染双层分子膜使其呈红色荧光。外泌体提取后用1 mL无菌PBS稀释,加入1 μL DiO染料混匀后置于37 ℃避光孵育30 min,配平后120 000 g离心90 min,弃上清,用软骨细胞的完全培养基重悬后与软骨细胞共培养。20 h后使用4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)标记软骨细胞,该染料可使细胞核呈蓝色荧光。
1.2.6. 外泌体对软骨细胞凋亡的作用探索
将软骨细胞以0.3×106个/孔的密度接种于6孔板内,分6组培养:A、对照组(control);B、凋亡组[星形孢菌素(staurosporine,STS)];C、外泌体治疗组(STS+Exo);D、15 Hz外泌体治疗组(STS+Exo,15 Hz);E、45 Hz外泌体治疗组(STS+Exo,45 Hz);F、75 Hz外泌体治疗组(STS+Exo,75 Hz)。该分组在图片中均以A、B、C、D、E、F指代。对照组换液后将正常软骨细胞培养24 h,凋亡组将4 μmol/L STS与软骨细胞共培养24 h,治疗组将不同频率(0、15、45、75 Hz)、1 mT的PEMF干预后的外泌体(1×108个/mL)与4 μmol/L STS共同加入培养基中,与软骨细胞共培养24 h。
软骨细胞摄取外泌体情况:培养结束后,收集各组软骨细胞,经胰酶消化并用基础细胞培养基吹打成单细胞悬浮液。将细胞悬浮液直接涂片后在倒置荧光显微镜下拍照。
软骨细胞凋亡检测:根据凋亡检测试剂盒说明,采用流式细胞术检测软骨细胞的凋亡情况。培养结束后,0.25%胰酶消化,离心后弃上清,用PBS洗涤一次,离心后弃上清;用1×Annexin V binding buffer重悬细胞,加入Annexin V-FITC,避光孵育10 min;加入PI和1×Annexin V binding buffer继续避光孵育5 min,1 h内上机检测。
软骨细胞蛋白表达测定:用WB法,将提取的蛋白原液用WB试剂盒按照标准操作流程进行蛋白浓度测定,并将获得的蛋白原液与上样缓冲液配置混匀后于100 ℃加热5 min进行变性,然后于120 V电泳。于冰浴中250 mA转膜后,放入5%脱脂牛奶封闭1 h,结束后加入一抗,4 ℃孵育过夜。孵育结束后用1×TBST洗涤10 min,重复三次,加入二抗室温孵育1 h。孵育结束后用1×TBST洗涤10 min,重复三次。使用显影液在仪器上对条带进行曝光并拍摄照片。
软骨细胞核糖核酸(ribonucleic acid,RNA)表达测定:用反转录定量聚合酶链反应(real time-PCR,RT-PCR)法,采用Eastep®Super总RNA提取试剂盒提取RNA,去除基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)反应后进行反转录,将反转录得到的液体稀释后向96孔板上样。完成上样后放入荧光定量PCR仪进行PCR分析。得到的数据经过Excel处理后用Prism5.0软件进行数据分析及图像制作。引物序列见附表1。
表 A1. RT-PCR primer sequence.
RT-PCR引物序列
| Genes | Primer sequence (5′-3′) |
| COL2A1 | F: 5′-GCCCAACTGGCAAACAAGGAGAC-3′ R: 5′-GCAGGGCCAGAAGTACCCTGATC-3′ |
| ACAN | F: 5′-GGCTTCCCACCGTCCCAGCAG-3′ R: 5′-GAAGTGTCTGTGCTGCCTGTGAA-3′ |
| Caspase3 | F: 5′- GGCATGGAGAACACTGAAAAC -3′ R: 5′- GCGAATCTGTTTCTTTGCATG-3′ |
| SOX9 | F: 5'-GCGTATGAATCTCCTGGACC-3' R: 5'-GCGGCTGGTACTTGTAATCC-3' |
| GAPDH | F: 5′-CCTGGAGAAACCTGCCAAGTAT-3′ R: 5′-TAGCCCAGGATGCCCTTTAGT-3′ |
1.3. 统计学分析
采用SPSS 22.0统计软件进行统计,实验定量数据以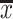 ±s表示,使用单因素方差分析比较多样本均数差异,检验水准为0.05,在总体差异有统计学意义时,进一步用Bonferroni校正进行显著性检验。
±s表示,使用单因素方差分析比较多样本均数差异,检验水准为0.05,在总体差异有统计学意义时,进一步用Bonferroni校正进行显著性检验。
2. 结果
2.1. AMSCs培养及鉴定
观察培养的AMSCs,可见细胞呈梭形,为典型的AMSCs形态(见图1a)。流式细胞学鉴定检测到细胞表面抗原CD34、CD44、CD45和CD90(见图1b)。对细胞进行三系分化诱导,证明该细胞具有分化为软骨细胞、骨细胞和脂肪细胞的能力(见图1a)。以上结果均证明提取大鼠腹股沟脂肪进行原代细胞培养所得为AMSCs。
2.2. MSCs-Exo的鉴定
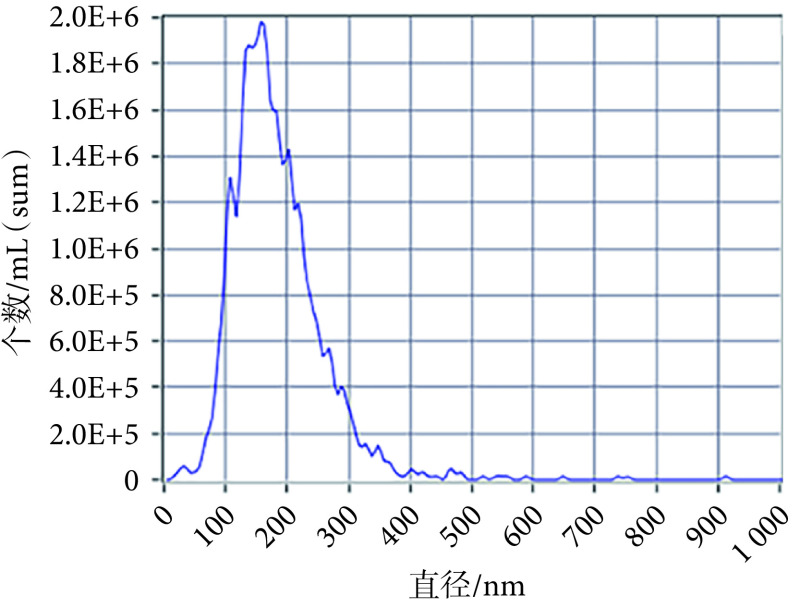
从外泌体中提取蛋白进行免疫印迹分析,检测到外泌体内抗体CD9、TSG101表达相较于AMSCs内均增加(见图1c,P < 0.01)。在TEM下观察见外泌体形态呈茶托状双层膜结构(见图1d)。NTA测得外泌体平均直径为164.5 nm(见附图2)。以上结果证明,通过超高速离心细胞上清所获得的为AMSCs的外泌体。
图 2.
The chondrocytes were cocultured with exosomes
外泌体与软骨细胞共培养
a. 软骨细胞对外泌体的摄取;b. 流式细胞术检测细胞凋亡率。*:P < 0.01
a. exosomes were endocytosed by chondrocytes thorough co-culture; b. the apoptosis rate was detected by flow cytometry. *: P < 0.01
2.3. 软骨细胞摄取外泌体
DiO标记的MSCs-Exo(红色荧光)与DAPI标记的软骨细胞(细胞核呈蓝色荧光)共培养后,通过倒置荧光显微镜观察,在软骨细胞中可观察到红色点状荧光(见图2a)。结果证明,外泌体可通过与软骨细胞共培养而被软骨细胞摄取。
2.4. STS诱导软骨细胞凋亡
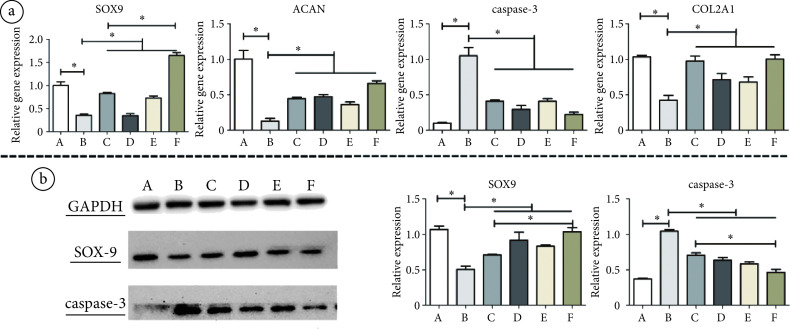
流式细胞术检测软骨细胞凋亡的实验结果如图2b所示,在细胞培养基中加入4 μmol/L STS可使软骨细胞凋亡率显著增高(P < 0.01)。RT-PCR检测结果(见图3a)显示,与对照组相比,STS诱导的凋亡组软骨细胞内可聚蛋白多糖(aggrecan,ACAN)、Y染色体性别决定区(sex-determing region of Y chromosome,SRY)-盒转录因子9(SRY-box transcription factor 9,SOX9)、Ⅱ型胶原(Type Ⅱ collagen,COL2A)的mRNA表达显著降低(P < 0.01,P < 0.01,P < 0.01),半胱氨酸-天冬氨酸蛋白酶-3(caspase-3)的mRNA表达明显升高(P < 0.01);且WB结果(见图3b)显示,STS诱导显著下调了软骨细胞内SOX9的蛋白表达(P < 0.01),上调了caspase-3的蛋白表达(P < 0.01)。结果表明,STS诱导可抑制软骨细胞活性,使软骨细胞凋亡的生物标志物caspase-3合成增加,从而增加软骨细胞凋亡;可造成细胞基质合成ACAN和COL2A能力下降,减少软骨细胞细胞外基质的合成;还可造成SOX9合成降低,减少软骨细胞分化。
图 3.
The effect of different frequencies PEMF-exposed MSCs-Exo in chondrocyte apoptosis and extracellular matrix synthesis
不同频率PEMF干预后MSCs-Exo对STS诱导后的软骨细胞凋亡及细胞外基质合成影响
a. RT-qPCR检测各组软骨细胞内SOX9、ACAN、caspase-3和COL2A1的RNA相对表达量;b. WB检测各组软骨细胞内SOX9和caspase-3的相对蛋白表达量。*:P < 0.01
a. RT-qPCR results showed the relative gene expression levels of SOX9, ACAN, caspase-3 and COL2A1 in chondrocytes of each group; b. WB results showed the relative protein expression levels of SOX9 and caspase-3 in chondrocytes of each group. *:P < 0.01
2.5. MSCs-Exo抑制STS诱导的软骨细胞凋亡
软骨细胞的流式细胞学检测结果显示,MSCs-Exo与软骨细胞共培养可显著降低STS诱导的软骨细胞凋亡(P < 0.01),抑制STS的促凋亡作用(见图2a)。RT-PCR检测结果显示,与凋亡组相比,未经磁场干预的外泌体治疗组的软骨细胞内SOX9、ACAN、COL2A的mRNA表达明显升高(P < 0.01,P < 0.01,P < 0.01),caspase-3的mRNA表达明显降低(P < 0.01)(见图3a);WB结果显示,与外泌体共培养后软骨细胞内SOX9的蛋白表达升高(P < 0.01),caspase-3的蛋白表达降低(P < 0.01)(见图3b)。因此,AMSCs来源的外泌体能抑制STS诱导的软骨细胞凋亡,增加软骨细胞的细胞外基质合成。
2.6. 不同频率PEMF对MSCs-Exo抑制软骨细胞凋亡的影响
RT-PCR和WB结果显示(见图3a~b),与STS诱导的凋亡组相比,15、45、75 Hz PEMF干预后的MSCs-Exo均可不同程度上调STS诱导后的软骨细胞内ACAN、COL2A和SOX9的mRNA表达(P < 0.01,P < 0.01,P < 0.01)以及SOX9的蛋白表达(P < 0.01);且三种频率PEMF干预后的MSCs-Exo均可下调STS诱导所致的软骨细胞内caspase-3的mRNA和蛋白表达升高(P < 0.01,P < 0.01)。这些结果表明,不同频率的PEMF干预后的MSCs-Exo对于STS诱导的软骨细胞凋亡均具有一定的治疗作用。然而,与未经磁场干预的MSCs-Exo治疗组的软骨细胞相比,仅75 Hz PEMF干预后的MSCs-Exo治疗组软骨细胞内COL2A的mRNA(P < 0.01)和SOX9的蛋白表达量(P < 0.01)明显升高,caspase-3的蛋白表达量明显降低(P < 0.01)。上述结果提示,频率15 Hz和45 Hz的PEMF对MSCs-Exo抑制细胞凋亡的作用没有显著影响,而75 Hz PEMF可明显增强MSCs-Exo对软骨细胞的抗凋亡和促进基质合成的作用。
3. 讨论与结论
骨性关节炎是一种缓慢进展的惰性疾病[20],人们一直在寻求能够有效防止关节软骨破坏的治疗手段。鉴于软骨细胞活力的丧失是骨关节炎的一个重要标志,软骨细胞的凋亡将是防止软骨破坏、减缓软骨退变的潜在治疗靶点[21-22]。MSCs作为一种多能干细胞,存在于骨髓、脂肪、脐带等多种组织内,具有抗凋亡、抗炎和免疫抑制等功能[23]。其中AMSCs具有来源广、易获取等特性,可被广泛应用于再生修复治疗领域,如骨关节炎等退行性疾病[24-25]。研究发现,MSCs的外泌体是其生物学功能的传递者[26]。MSCs来源的外泌体通过靶向递送miRNAs,抑制软骨细胞凋亡,抑制炎症因子分泌,促进软骨组织再生和修复[27-28]。这与本研究的结果相符。
相关研究发现,组织工程技术、细胞预处理、基因调控等技术能调控MSCs-Exo的生物学功能[29-30]。PEMF是由脉冲发生器的电流在线圈中所产生的一种交变电磁场,具有调控细胞功能的物理-生物学效应,如激活细胞内信号通路、影响基因表达、改善线粒体能量代谢等[31-34]。已有研究证实,PEMF可通过调节MSCs的旁分泌功能抑制软骨细胞的凋亡[18]。Ongaro等[35]报道,1.5 mT、75 Hz PEMF通过抑制前列腺素E2(prostaglandin E2,PGE2)、白细胞介素-1β(interleukin-1β,IL-1β)和IL-6的释放来增加软骨细胞的抗炎性能。Fitzsimmons等[36]的研究证明,1 mT、15 Hz的PEMF显著降低了软骨细胞中IL-1α和IL-6的产生,并参与调控软骨细胞的凋亡。然而,现有研究中PEMF参数异质性较大,无法比较不同频率的PEMF对MSCs-Exo抗凋亡作用的影响。本实验通过体外用固定强度(1 mT)、不同频率(15、45、75 Hz)的PEMF分别干预AMSCs 30 min,并提取干预后的MSCs-Exo与STS诱导后的软骨细胞共培养,初步观察不同频率PEMF干预后的MSCs-Exo对STS诱导的软骨细胞凋亡的影响。实验结果证实了在三个干预组中,75 Hz的PEMF可显著提高MSCs-Exo抑制STS诱导的软骨细胞凋亡和细胞外基质合成减少的作用。
STS可通过caspase依赖性和caspase非依赖性机制诱导细胞凋亡,并已被广泛用于软骨细胞的凋亡模型诱导[37]。它通过影响关节软骨细胞的活性,干扰必要结构蛋白的产生,包括SOX9、Ⅱ型胶原蛋白和聚集蛋白[38]。COL2A1是软骨基质的主要成分,在介导软骨细胞-软骨细胞和软骨细胞-基质相互作用中发挥着重要作用,可与其他蛋白和蛋白聚糖共同形成复杂的细胞外支架,承担机械力,维持生理稳态,为软骨细胞、细胞外基质分子和生长因子提供锚定位点,而且COL2A1的降解和减少是骨性关节炎软骨典型的病理改变[39-41]。因此,COL2A1、SOX9和ACAN在本研究中被作为软骨细胞基质合成的标志物。在本研究中,75 Hz PEMF干预的MSCs-Exo在改善STS诱导的大鼠软骨细胞凋亡、caspase-3上调和SOX9下调方面效果最好。这些观察结果表明,75 Hz PEMF干预后的MSCs-Exo优于15 Hz和45 Hz PEMF干预的外泌体,可以抑制软骨细胞凋亡,促进细胞的基质合成,从而增强软骨修复。
PEMF通过调控MSCs-Exo促进骨关节炎再生修复的具体机制尚未见深入研究。研究已证明,软骨细胞过度凋亡和增殖减少常伴随软骨降解。磷脂酰肌醇三激酶/蛋白激酶B(PI3K/AKT)信号通路是软骨细胞存活和凋亡的重要调节因子[42]。越来越多的证据表明,多种生长因子,如成纤维细胞生长因子18(fibroblast growth factor 18,FGF18)、类胰岛素一号生长因子(insulin-like growth factor-1,IGF-1)和血小板源性生长因子,可以通过激活PI3K/AKT来拯救线粒体相关凋亡的增加。不仅如此,许多生物活性化合物也通过激活PI3K/AKT发挥类似的抗凋亡作用[43-44]。与这些结果一致的是,其他证据表明激活PI3K/AKT可以阻断TNF-α和脂多糖(lipopolysaccharide,LPS)诱导的骨关节炎软骨细胞凋亡[45-46]。综上所述,PI3K/AKT信号通路可在多种病理条件下负向调节软骨细胞凋亡,激活的信号通路可以通过减少软骨细胞凋亡来治疗骨关节炎。因此,下一步实验中我们将重点探索PI3K/AKT信号通路在PEMF干预MSCs-Exo调控骨关节炎软骨细胞凋亡过程中的作用机制。
综上所述,本研究证实AMSC-Exo存在与其来源亲本干细胞类似的作用效果,可抑制软骨细胞的凋亡,且75 Hz的PEMF可显著增强MSCs-Exo的作用效果。本研究为探索PEMF调控MSCs-Exo修复关节软骨损伤的分子机制奠定了基础,为新型“无细胞”治疗方法的转化与临床应用提供基础数据,为骨关节炎的防治提供了更为广阔的思路。
重要声明
利益冲突声明:本文全体作者均声明不存在利益冲突。
作者贡献声明:王谦、汪香秀、徐扬负责实验设计,徐扬、汪香秀、张奖银负责实验实施,何红晨负责实验评估,向小娜、彭佳蕾负责资料收集,徐扬、王谦撰写论文,徐扬、王谦、何红晨负责文章审校。
本文附表、附图见本刊网站的电子版本(www.biomedeng.cn)。
图 A1.
MSCs were exposed to the PEMF with this machine
PEMF干预脂肪间充质干细胞
图 A2.
Results of NTA detection of exosomes
外泌体NTA检测结果
References
- 1.Glyn-Jones S, Palmer A J, Agricola R, et al Osteoarthritis. Lancet (London) 2015;386(9991):376–387. doi: 10.1016/S0140-6736(14)60802-3. [DOI] [PubMed] [Google Scholar]
- 2.Roseti L, Desando G, Cavallo C, et al Articular cartilage regeneration in osteoarthritis. Cells. 2019;8(11):1305. doi: 10.3390/cells8111305. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Buckwalter J A, Mankin H J Articular cartilage: degeneration and osteoarthritis, repair, regeneration, and transplantation. Instr Course Lect. 1998;47:487–504. [PubMed] [Google Scholar]
- 4.Varela-Eirin M, Louriro J, Fonseca E, et al Cartilage regeneration and ageing: targeting cellular plasticity in osteoarthritis. Ageing Res Rev. 2018;42:56–71. doi: 10.1016/j.arr.2017.12.006. [DOI] [PubMed] [Google Scholar]
- 5.Hwang H S, Kim H A Chondrocyte apoptosis in the pathogenesis of osteoarthritis. Int J Mol Sci. 2015;16(11):26035–26054. doi: 10.3390/ijms161125943. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Abramoff B, Caldrea F E Osteoarthritis: pathology, diagnosis, and treatment options. Med Clin North Am. 2020;104(2):293–311. doi: 10.1016/j.mcna.2019.10.007. [DOI] [PubMed] [Google Scholar]
- 7.Makris E A, Gomoll A H, Malizos K N, et al Repair and tissue engineering techniques for articular cartilage. Nat Rev Rheumatol. 2015;11(1):21–34. doi: 10.1038/nrrheum.2014.157. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Ding N, Li E, Ouyang X, et al The therapeutic potential of bone marrow mesenchymal stem cells for articular cartilage regeneration in osteoarthritis. Curr Stem Cell Res Ther. 2021;16(7):840–857. doi: 10.2174/1574888X16666210127130044. [DOI] [PubMed] [Google Scholar]
- 9.Taghiyar L, Jahangir S, Khozaei R M, et al Cartilage repair by mesenchymal stem cell-derived exosomes: preclinical and clinical trial update and perspectives. Adv Exp Med Biol. 2021;1326:73–93. doi: 10.1007/5584_2021_625. [DOI] [PubMed] [Google Scholar]
- 10.Fuloria S, Subramaniyan V, Dahiya R, et al Mesenchymal stem cell-derived extracellular vesicles: regenerative potential and challenges. Biology. 2021;10(3):172. doi: 10.3390/biology10030172. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Chang Y H, Wu K C, Liu H W, et al Human umbilical cord-derived mesenchymal stem cells reduce monosodium iodoacetate-induced apoptosis in cartilage. Ci Ji Yi Xue Za Zhi. 2018;30(2):71–80. doi: 10.4103/tcmj.tcmj_23_18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Daish C, Blanchard R, Fox K, et al The application of pulsed electromagnetic fields (PEMFs) for bone fracture repair: past and perspective findings. Ann Biomed Eng. 2018;46(4):525–542. doi: 10.1007/s10439-018-1982-1. [DOI] [PubMed] [Google Scholar]
- 13.Zhu S, He H, Zhang C, et al Effects of pulsed electromagnetic fields on postmenopausal osteoporosis. Bioelectromagnetics. 2017;38(6):406–424. doi: 10.1002/bem.22065. [DOI] [PubMed] [Google Scholar]
- 14.Yang X, He H, Ye W, et al Effects of pulsed electromagnetic field therapy on pain, stiffness, physical function, and quality of life in patients with osteoarthritis: a systematic review and meta-analysis of randomized placebo-controlled trials. Phys Ther. 2020;100(7):1118–1131. doi: 10.1093/ptj/pzaa054. [DOI] [PubMed] [Google Scholar]
- 15.Ye W, Guo H, Yang X, et al Pulsed electromagnetic field versus whole body vibration on cartilage and subchondral trabecular bone in mice with knee osteoarthritis. Bioelectromagnetics. 2020;41(4):298–307. doi: 10.1002/bem.22263. [DOI] [PubMed] [Google Scholar]
- 16.Yang X, He H, Gao Q, et al Pulsed electromagnetic field improves subchondral bone microstructure in knee osteoarthritis rats through a Wnt/β-catenin signaling-associated mechanism. Bioelectromagnetics. 2018;39(2):89–97. doi: 10.1002/bem.22106. [DOI] [PubMed] [Google Scholar]
- 17.Yang X, He H, Zhou Y, et al Pulsed electromagnetic field at different stages of knee osteoarthritis in rats induced by low-dose monosodium iodoacetate: effect on subchondral trabecular bone microarchitecture and cartilage degradation. Bioelectromagnetics. 2017;38(3):227–238. doi: 10.1002/bem.22028. [DOI] [PubMed] [Google Scholar]
- 18.Parate D, Kadir N D, Celik C, et al Pulsed electromagnetic fields potentiate the paracrine function of mesenchymal stem cells for cartilage regeneration. Stem Cell Res Ther. 2020;11(1):46. doi: 10.1186/s13287-020-1566-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Yang X, Guo H, Ye W, et al Pulsed electromagnetic field attenuates osteoarthritis progression in a murine destabilization-induced model through inhibition of TNF-α and IL-6 signaling. Cartilage. 2021;13(2_suppl):1665S–1675S. doi: 10.1177/19476035211049561. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Barnett R Osteoarthritis. Lancet. 2018;391(10134):1985. doi: 10.1016/S0140-6736(18)31064-X. [DOI] [PubMed] [Google Scholar]
- 21.Xia B, Di C, Zhang J, et al Osteoarthritis pathogenesis: a review of molecular mechanisms. Calcif Tissue Int. 2014;95(6):495–505. doi: 10.1007/s00223-014-9917-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Castrogiovanni P, Ravalli S, Musumeci G Apoptosis and autophagy in the pathogenesis of osteoarthritis. J Invest Surg. 2020;33(9):874–885. doi: 10.1080/08941939.2019.1576811. [DOI] [PubMed] [Google Scholar]
- 23.Uder C, Brückner S, Winkler S, et al Mammalian MSC from selected species: features and applications. Cytometry A. 2018;93(1):32–49. doi: 10.1002/cyto.a.23239. [DOI] [PubMed] [Google Scholar]
- 24.Song Y, Du H, Dai C, et al Human adipose-derived mesenchymal stem cells for osteoarthritis: a pilot study with long-term follow-up and repeated injections. Regen Med. 2018;13(3):295–307. doi: 10.2217/rme-2017-0152. [DOI] [PubMed] [Google Scholar]
- 25.Han S B, Seo I W, Shin Y S Intra-articular injections of hyaluronic acid or steroids associated with better outcomes than platelet-rich plasma, adipose mesenchymal stromal cells, or placebo in knee osteoarthritis: a network meta-analysis. Arthroscopy. 2021;37(1):292–306. doi: 10.1016/j.arthro.2020.03.041. [DOI] [PubMed] [Google Scholar]
- 26.Mancuso P, Raman S, Glynn A, et al Mesenchymal stem cell therapy for osteoarthritis: the critical role of the cell secretome. Front Bioeng Biotechnol. 2019;7:9. doi: 10.3389/fbioe.2019.00009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Phinney D G, Pittenger M F Concise review: MSC-derived exosomes for cell-free therapy. Stem cells. 2017;35(4):851–868. doi: 10.1002/stem.2575. [DOI] [PubMed] [Google Scholar]
- 28.Toh W S, Lai R C, Zhang B, et al MSC exosome works through a protein-based mechanism of action. Biochem Soc Trans. 2018;46(4):843–853. doi: 10.1042/BST20180079. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Wechsler M E, Rao V V, Borelli A N, et al Engineering the MSC secretome: a hydrogel focused approach. Adv Healthc Mater. 2021;10(7):e2001948. doi: 10.1002/adhm.202001948. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Feng K, Xie X, Yuan J, et al Reversing the surface charge of MSC-derived small extracellular vesicles by εPL-PEG-DSPE for enhanced osteoarthritis treatment. J Extracell Vesicles. 2021;10(13):e12160. doi: 10.1002/jev2.12160. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Ross C L, Ang D C, Almeida-Porada G Targeting mesenchymal stromal cells/pericytes (MSCs) with pulsed electromagnetic field (PEMF) has the potential to treat rheumatoid arthritis. Front Immunol. 2019;10:266. doi: 10.3389/fimmu.2019.00266. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Gaynor J S, Hagberg S, Gurfein B T Veterinary applications of pulsed electromagnetic field therapy. Res Vet Sci. 2018;119:1–8. doi: 10.1016/j.rvsc.2018.05.005. [DOI] [PubMed] [Google Scholar]
- 33.Androjna C, Yee C S, White C R, et al A comparison of alendronate to varying magnitude PEMF in mitigating bone loss and altering bone remodeling in skeletally mature osteoporotic rats. Bone. 2021;143:115761. doi: 10.1016/j.bone.2020.115761. [DOI] [PubMed] [Google Scholar]
- 34.Vadalà M, Morales-Medina J C, Vallelunga A, et al Mechanisms and therapeutic effectiveness of pulsed electromagnetic field therapy in oncology. Cancer Med. 2016;5(11):3128–3139. doi: 10.1002/cam4.861. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Ongaro A, Varani K, Masieri F F, et al Electromagnetic fields (EMFs) and adenosine receptors modulate prostaglandin E(2) and cytokine release in human osteoarthritic synovial fibroblasts. J Cell Physiol. 2012;227(6):2461–2479. doi: 10.1002/jcp.22981. [DOI] [PubMed] [Google Scholar]
- 36.Fitzsimmons R J, Gordon S L, Kronberg J, et al A pulsing electric field (PEF) increases human chondrocyte proliferation through a transduction pathway involving nitric oxide signaling. J Orthop Res. 2008;26(6):854–869. doi: 10.1002/jor.20590. [DOI] [PubMed] [Google Scholar]
- 37.Stolberg-Stolberg J, Boettcher A, Sambale M, et al Toll-like receptor 3 activation promotes joint degeneration in osteoarthritis. Cell Death Dis. 2022;13(3):224. doi: 10.1038/s41419-022-04680-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Belmokhtar C A, Hillion J, Ségal-Bendirdjian E Staurosporine induces apoptosis through both caspase-dependent and caspase-independent mechanisms. Oncogene. 2001;20(26):3354–3362. doi: 10.1038/sj.onc.1204436. [DOI] [PubMed] [Google Scholar]
- 39.Bridgewater L C, Lefebvre V, de Crombrugghe B Chondrocyte-specific enhancer elements in the Col11a2 gene resemble the Col2a1 tissue-specific enhancer. J Biol Chem. 1998;273(24):14998–15006. doi: 10.1074/jbc.273.24.14998. [DOI] [PubMed] [Google Scholar]
- 40.Kiani C, Chen L, Wu Y J, et al Structure and function of aggrecan. Cell Res. 2002;12(1):19–32. doi: 10.1038/sj.cr.7290106. [DOI] [PubMed] [Google Scholar]
- 41.Lian C, Wang X, Qiu X, et al Collagen type II suppresses articular chondrocyte hypertrophy and osteoarthritis progression by promoting integrin β1-SMAD1 interaction. Bone Res. 2019;7:8. doi: 10.1038/s41413-019-0046-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Sun K, Luo J, Guo J, et al The PI3K/AKT/mTOR signaling pathway in osteoarthritis: a narrative review. Osteoarthritis Cartilage. 2020;28(4):400–419. doi: 10.1016/j.joca.2020.02.027. [DOI] [PubMed] [Google Scholar]
- 43.Bao J, Chen Z, Xu L, et al Rapamycin protects chondrocytes against IL-18-induced apoptosis and ameliorates rat osteoarthritis. Aging. 2020;12(6):5152–5167. doi: 10.18632/aging.102937. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Zhang Y, Cai W, Han G, et al Panax notoginseng saponins prevent senescence and inhibit apoptosis by regulating the PI3K-AKT-mTOR pathway in osteoarthritic chondrocytes. Int J Mol Med. 2020;45(4):1225–1236. doi: 10.3892/ijmm.2020.4491. [DOI] [PubMed] [Google Scholar]
- 45.Han G, Zhang Y, Li H The combination treatment of curcumin and probucol protects chondrocytes from TNF-α induced inflammation by enhancing autophagy and reducing apoptosis via the PI3K-Akt-mTOR pathway. Oxid Med Cell Longev. 2021;2021:5558066. doi: 10.1155/2021/5558066. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Sun L, Zheng W, Liu Q D, et al Valproic acid protects chondrocytes from LPS-stimulated damage via regulating miR-302d-3p/ITGB4 axis and mediating the PI3K-AKT signaling pathway. Front Mol Biosci. 2021;8:633315. doi: 10.3389/fmolb.2021.633315. [DOI] [PMC free article] [PubMed] [Google Scholar]