Abstract
多导睡眠图(PSG)监测是临床上用于诊断诸如失眠、呼吸暂停等疾病的重要手段。为了解决以手工逐帧视觉判断PSG进行睡眠障碍患者睡眠阶段分期耗时长、耗费精力大等问题,本文提出一种结合卷积神经网络(CNN)与双向门控循环神经网络 (Bi GRU)的深度学习算法模型,并设计了一种动态稀疏性自注意力机制以解决门控循环单元(GRU)网络对长距离信息难以获得准确向量表示的问题。本文采集来自上海精神卫生中心143例睡眠障碍患者整晚PSG数据并结合开源数据集153例睡眠障碍患者整晚PSG数据,选取其中的6个脑电(EEG)信号通道、2个眼电(EOG)信号通道与单个下颌肌电(EMG)信号通道等共9个通道的电生理通道信号进行模型训练与测试评估。经交叉验证后得到的分期准确率为(84.0±2.0)%,一致性检验值为0.77±0.50,优于医师间评分的一致性检验值0.75±0.11。实验结果表明,本文算法模型在不同人群中具有较高的分期效果并具有普适性,对于协助临床医师进行快速、大规模PSG睡眠自动分期具有重要研究意义。
Keywords: 多导睡眠图, 睡眠分期, 自注意力机制, 双向门控循环单元
Abstract
Polysomnography (PSG) monitoring is an important method for clinical diagnosis of diseases such as insomnia, apnea and so on. In order to solve the problem of time-consuming and energy-consuming sleep stage staging of sleep disorder patients using manual frame-by-frame visual judgment PSG, this study proposed a deep learning algorithm model combining convolutional neural networks (CNN) and bidirectional gate recurrent neural networks (Bi GRU). A dynamic sparse self-attention mechanism was designed to solve the problem that gated recurrent neural networks (GRU) is difficult to obtain accurate vector representation of long-distance information. This study collected 143 overnight PSG data of patients from Shanghai Mental Health Center with sleep disorders, which were combined with 153 overnight PSG data of patients from the open-source dataset, and selected 9 electrophysiological channel signals including 6 electroencephalogram (EEG) signal channels, 2 electrooculogram (EOG) signal channels and a single mandibular electromyogram (EMG) signal channel. These data were used for model training, testing and evaluation. After cross validation, the accuracy was (84.0±2.0)%, and Cohen's kappa value was 0.77±0.50. It showed better performance than the Cohen's kappa value of physician score of 0.75±0.11. The experimental results show that the algorithm model in this paper has a high staging effect in different populations and is widely applicable. It is of great significance to assist clinicians in rapid and large-scale PSG sleep automatic staging.
Keywords: Polysomnography, Sleep stage, Self-attention mechanism, Bidirectional gate recurrent unit
0. 引言
多导睡眠图(polysomnography,PSG)是临床上通过采集人体不同部位如大脑、眼部、下颌等生物电信号与鼻息、鼾声等生理信号并经过滤波放大等处理后呈现给医师的多通道信号图。在20世纪70年代,PSG信号通道逐步加入脑电图(electroencephalogram,EEG)、呼吸、心电等信号形成了完整的PSG并广泛投入临床使用,在失眠、睡眠呼吸暂停等睡眠相关疾病的诊断中占据主要的地位。在睡眠障碍等疾病的诊断中,通常需要根据PSG中的电生理信号部分将睡眠障碍患者的整晚睡眠阶段进行分类。最早由Rechtschaffen等[1]在1968年制定了相对统一的标准,即Rechtschaffen & Kales(R&K)标准,其将睡眠阶段分为6期:清醒期(wake,W)、快速眼动期(rapid eye movement,REM)和非快速眼动期(non-rapid eye movement,NREM),其中NREM又分为NREM一期(N1)、NREM二期(N2)、NREM三期(N3)、NREM四期(N4)。美国睡眠医学会(American academy of sleep medicine,AASM)在此标准的基础上发展和完善[2],将N3、N4合并为N3期,形成了如今通用的分期标准。临床上医师依据AASM标准,手动逐帧判读患者整晚的PSG数据得到睡眠分期结果。
在Stepnowsky等[3]于2013年进行的多人睡眠分期准确性评分试验中,不同医师之间评分一致值为0.46~0.89。这种手工方式的睡眠分期判读效果取决于医师的经验与疲劳程度,且PSG信号中的EEG信号具有随机性与混沌性,在视觉上难以分辨,由此学术界对自动睡眠分期算法进行了广泛的研究。在统计学和机器学习领域中,研究者们基于单通道EEG信号或者包含眼电图(electrooculogram,EOG)与肌电图(electromyogram,EMG)的PSG数据提取记录时域、频域等非线性特征与信息,然后通过特征选择方法,如最大相关最小冗余(max-relevance and min-redundancy,mRMR)、快速相关特征选择(fast correlation-based filter, FCBF)[4] 等,来消除不相关的冗余特征,以提高分类器的预测精度且减少计算量,并可将选择后的特征作为分类算法的输入来进行分类。有关的分类算法有支持向量机[5](support vector machine,SVM)、随机森林(random forest,RF)、决策树[6]等。以上机器学习算法在单通道或多通道的EEG数据上取得了较好的分期效果。近年来,由于卷积神经网络(convolutional neural networks,CNN)在医学影像和信号特征提取方面效果良好,取得了不错的成绩[7];此外,长短期记忆(long short-term memory,LSTM)网络对长期时序信号前后记忆功能也有显著提升[8],因此于此相关的一系列深度学习算法被学者广泛用于睡眠阶段分期的模型研究中。在Längkvist等[9]开展的研究中,率先提出了基于全连接层的多通道(EEG、EOG、EMG)PSG信号睡眠阶段分期系统。Supratak等[10]构建了名为深度睡眠网络(DeepSleepNet)的网络结构,利用CNN和双向LSTM(bidirectional LSTM,Bi LSTM)从单通道EEG信号中提取时不变性特征并学习不同睡眠阶段的转换规则,但单通道信号之间的准确率差距较大且忽略了医师通过AASM准则对整体PSG信号特征的判读。在Zhang等[11]研究中,使用了来自一项多中心队列研究——美国睡眠心脏健康研究(sleep heart health study,SHHS)的5 213例患者大规模PSG数据中多通道信号,来进行CNN-LSTM神经网络模型训练。然而上述实验并未将多通道PSG数据与自注意力(self attention)机制等重赋权值算法结合,其分期效果具有一定的局限性。
基于上述研究,本文以CNN与双向门控循环单元(bidirectional gate recurrent unit,Bi GRU)[12]为基础构建了对多通道PSG信号进行睡眠分期的神经网络模型,为解决Bi GRU对长时序信号的信息记忆不足的问题,设计了一种动态稀疏性自注意力机制;对一维卷积层(one-dimensional convolution,Conv1d)与Bi GRU等网络结构提取的时域频域等特征进行各部分相关度计算,以此调整权值并通过激活函数映射到新的函数空间,从而构建了一种新型自注意力机制卷积Bi GRU(Self-attention-CNN-Bi GRU)分期算法。实验数据由143例采集于上海市精神卫生中心与153例国外开源数据集的患者整晚PSG数据组成,通过提取其EEG、EOG、下颌EMG等通道信号来制作训练集、验证集和测试集,并对模型进行训练调优和分期结果的可靠性评价。通过本文提出的新型算法模型,期待可以更有效地在长时多通道PSG数据上进行睡眠阶段分期,今后对于协助临床医师进行快速PSG睡眠分期或具有重要研究意义。
1. 实验数据
本文研究数据集包括由睡眠监测仪器Neurofax JE-912A(Nihon Kohden Inc.,日本)2020年于上海市精神卫生中心采集的143例睡眠障碍患者整晚PSG数据及其专业医生睡眠分期报告和临床诊断报告组成的上海市精神卫生中心睡眠数据集(shanghai mental health center sleep staging database,SHDB)。为了判断模型的普适性,本研究还选取荷兰海牙医疗中心睡眠分期数据集 (Haaglanden medisch centrum sleep staging database,HMCSDB)(网址为:https://physionet.org/content/hmc-sleep-staging/1.1/)[13]中153例睡眠障碍患者的整晚PSG数据做了相同实验与结果评价。所有PSG数据格式为欧洲通用数据格式(European data format,EDF),并包含以AASM 2.4为标准的医师手动睡眠阶段分期结果标签文件。两组数据集中都包含具有睡眠障碍有关疾病的异质人群整晚PSG数据,其中SHDB由包含EEG、EOG、EMG等电生理信号和其它如鼻息等信号的21个通道数据所组成,而HMCSDB仅有电生理信号部分。两组数据手工分期标签的类别分布表如表1所示。由于电生理信号部分特别是EEG信号频率特征是AASM2.4标准的主要判读依据,所以本研究选择其中的9个由EEG、EMG、EOG等电生理信号来制作样本集,后者数据集同样选择上述通道制作样本集。
表 1. Category distribution of manual classification label.
手工分类标签类别数量分布
| 数据集 | 不同睡眠分期类别数量 | ||||
| W/例 | REM/例 | N1/例 | N2/例 | N3/例 | |
| SHDB | 34 321 | 14 581 | 13 646 | 67 943 | 9 454 |
| HMCSDB | 24 470 | 21 462 | 15 972 | 50 768 | 26 934 |
2. 数据预处理
首先对各个数据集进行预处理,其整体步骤流程如图1所示。
图 1.
Pretreatment flow chart
预处理流程图
首先,读取原始EDF格式数据中相关电生理通道信号值与文本文件(textfile,txt)中医师手动分期睡眠阶段标签,并去除开灯与信号值中>200 μV等无关伪影样本及对应标签。对于SHDB数据集提供的PSG数据,本文提取9个通道的信号,包括:左眼EOG(EOG-L)信号、右眼EOG(EOG-R)信号;下颌EMG信号:Chin a-b;EEG信号:F4-M1、F3-M2、C4-M1、C3-M2、O2-M1、O1-M2;采样频率200 Hz,根据每样本30 s的尺度,将输入模型的单个样本尺寸设为(6 000,9)。对于HMCSDB数据集的PSG数据来说,其采样频率为256 Hz,将其样本采样点矩阵设为(7 268,9),提取信号通道相同。然后,对样本进行小波降噪,并将样本集划分为训练集、验证集与测试集。实验使用多贝西(Daubechies,Db)小波函数族的Db8小波基将信号进行8个频率尺度的分解[14],设定0.1的极小化极大准则(minimax)阀值,低于阀值的分解后各段频率信息被认为是由于噪声产生的[15],通过软阀值(soft thresholding)函数来将其修正,这样经过小波系数滤波后重组的信号可以进行后续自动分期算法处理。本文整体小波降噪过程如图2所示。
图 2.

Wavelet de-noising process
小波滤噪过程
3. 基于自注意力机制与Bi GRU的算法模型结构
3.1. Bi GRU
循环神经网络(recurrent neural networks,RNN)的提出让神经网络具有了记忆时序信息前后特征的能力,但对长时序信号特征信息记忆力不足。为此,Hochreiter 等[16]提出中长短期记忆人工神经网络,其拥有三个精细设置的门结构可去除或增加信息到细胞,并保护和控制细胞单元的状态,解决了RNN对长时序信息依赖不足等问题,因而广泛用于时序信号如天气、EEG等信号处理。而门控循环单元(gate recurrent unit,GRU)则通过将LSTM的遗忘门与输入门参数合并为更新门,来控制单元对上一时刻信息传递与当前时刻隐藏信息计算传递[17],并且可以选择性考虑上一单元对当前状态影响,在防止欠拟合的同时与LSTM性能相当。本文在GRU的基础上对其网络层进行双层互逆链接形成Bi GRU,在该结构中底层GRU接受上层网络提取的原始顺序PSG样本特征输入,而顶部网络则按照相反的顺序接受样本特征输入,并将两层结构获得的信息和参数综合输出,即可同时获得PSG时序信号之前和之后时间段特征对当前信息状态的影响。
CNN包含多个隐藏层并以具有特殊拓扑结构的多层感知器(multi-layer perceptron,MLP)为核心,可以代替人工特征提取和先验知识等操作。通过卷积核不断提取,将局部特征压缩为整体特征,并通过池化功能随机删除部分特征来减少冗余,所以具有共享权值和稀疏性链接的特点。CNN网络层卷积核通常用于二维图像数据,但Conv1d具有一维卷积核可以适用于一维数据,例如生物生理与电信号、声音信号等,所以将其用于PSG信号的初步特征提取,再将其卷积后的压缩特征传递给下一步的Bi GRU单元进行时序性特征提取。
3.2. 动态稀疏性自注意力机制
注意力机制是一种模仿人类注意力来解决问题的方法。由谷歌大脑实验室Vaswani等[18]在2017年提出,主要用于解决当LSTM/RNN模型的输入序列较长时,难以获得最终合理向量表示的问题。该方法保留LSTM的中间结果,用新权值学习,并将其与输出重新关联[19],从大量信息中过滤出少量重要信息[20]。然而这也导致了在序列长度为n时其时间和空间复杂性为n2,难以扩展到长序列任务的计算中。由于本研究中PSG序列样本的内部数据特质具有时序长、关键信号值分布稀疏等特点,所以需要提升自注意力机制算法灵活性来提升基于整体局部之间的特征结合收益。本研究通过第一阶段将提取的样本整体信息(query)(以符号q表示)与部分关键信息(key)(以符号k表示)分别进行聚类,然后在同一个簇中使用聚类注意力评分(cluster attention scoring function)系数(以符号ca表示)将q与k映射为标量,从而减少信息冗余度,簇内k的个数总和以符号cn表示,计算公式如式(1)所示:
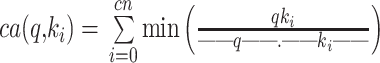 |
1 |
然后,第二阶段通过柔性最大值(softmax)激活函数将注意力评分函数值进行归一化转换,调整原始分布为所有元素权值和为1的概率分布[21]。获得q与ki的权重值(attention wight)(以符号w表示),m为全部k的个数,如式(2)所示:
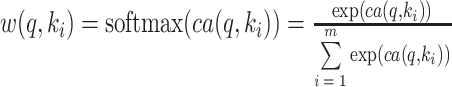 |
2 |
第三阶段将上述计算并激活后的权值与全连接(dense)层对应PSG样本分期类别(class)(以符号c表示)相结合,得到最终睡眠分期结果,其整体计算流程图如图3所示。
图 3.
Calculation flow chart of self-attention mechanism
自注意力机制计算流程图
3.3. 实验模型结构
本实验模型主要由三个部分组成,如图4所示。首先是CNN部分,数据首先以每帧采样点数、通道数的尺寸输入第一层Conv1d结构(Conv1d 1),卷积核为15,步长为2。输出的第一个维度,即卷积后的采样点数量维度为:(n − f + 2p)/s + 1,n为原数量维度,f表示卷积核大小,p表示使用边界填充,s表示步长,输出的最后一个维度值由原来的信号通道数扩展为64,并输入后续的第二个Conv1d网络层(Conv1d 2)。在Conv1d层中使用线性整流函数(rectified linear unit,ReLU)作为激活层,其后伴随一层随机失活(dropout)层,其中ReLU会使一部分神经元输出为0,通过增加网络稀疏性减少了参数相互依存关系,缓解了过拟合问题发生。模型结构第二个主体部分为Bi GRU结构部分,其中底层是接受逆向输入的GRU层。最后将提取特征与信号整体通过自注意力机制提取相关性获得新的权重值,输入到全连接层,激活函数为softmax函数,输出一个长度为5、和为1的向量,向量中每个值代表对应分期结果概率。此外,模型加入批量归一化(batch normalization,BN)层,通过其来实现正则化,并将神经网络每层输入都调整到均值为0、方差为1的标准正态分布,缓解了神经网络中的梯度消失问题。
图 4.
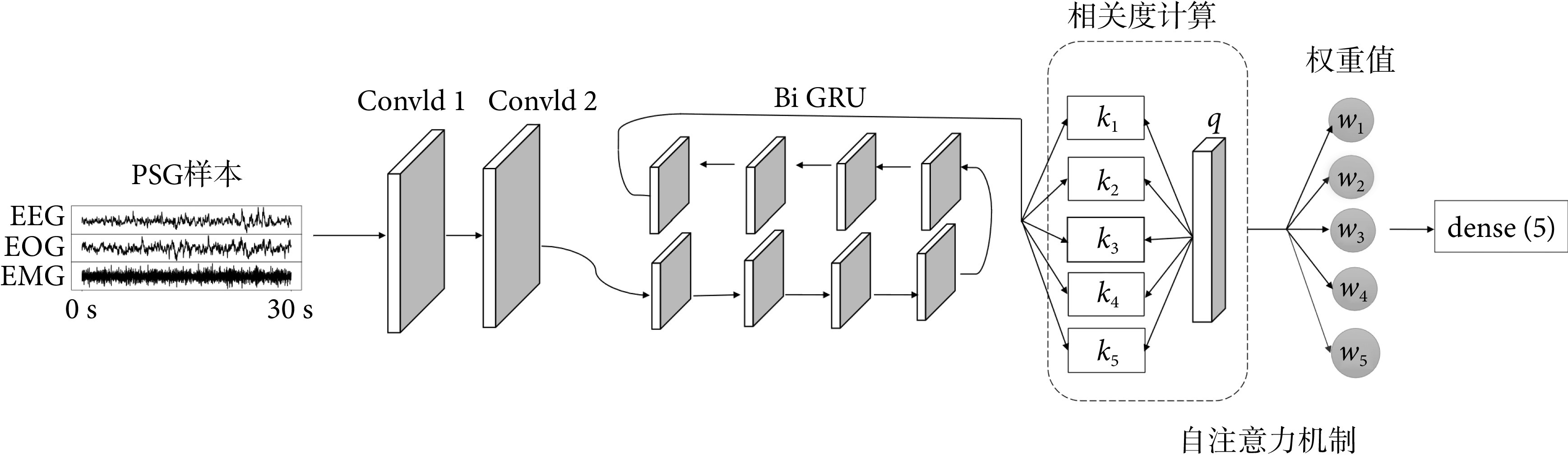
Structure of Self-attention-CNN-Bi GRU model
Self-attention-CNN-Bi GRU算法模型结构
4. 模型训练
本研究采用深度学习代码框架Tensorflow-GPU 2.6(Google Inc.,美国)与通用并行计算架构CUDA 11.3(NIVIDIA Inc.,美国)进行模型训练。使用了11重交叉验证,其中训练集、验证集以及测试集的比例为10:1:1,网络训练的单迭代内次数的值为总样本数/批量尺寸,以保证在一次迭代(epoch)内能完整训练所有样本。
在超参数优化上,首先通过参数优化器预先设定最优参数,由于此参数具有偶然性容易陷入局部最优,需要再次进行手动参数值调整。经过预训练后,使用比例系数为0.5的随机失活层来随机丢弃网络中的一半神经网络单元,以减弱神经元节点间的联合适应性,增强泛化能力[22],最终使得模型在面对不同数据集时具有广泛应用性。优化器使用自适应矩估计(adaptive moment estimationadam,Adam)[23],学习率(learning rate)设置为0.01,设置150次迭代,并通过张量板(tensorboard)来监测和控制训练,当损失值(loss)连续5次迭代不再下降时,则将学习率乘以0.1;当正确率连续10次迭代不再提升时候,则停止训练;每次迭代结束后会保存最优模型参数文件,然后使用预留未参与训练测试集的整晚PSG数据(约10 000例样本)做算法分期结果预测,再将其结果与医师分期结果做混淆矩阵分析。
5. 实验结果分析
实验分别在两组PSG数据集的9通道电生理信号上进行了11重交叉训练,保存了其平均模型参数并进行了相关指标评价,其分期准确率随着迭代次数的变化结果如图5所示。
图 5.
Precision change curve of training on two groups of data models
两组数据模型训练阶段的分期准确率变化曲线
统计学习与深度学习在PSG分类任务上的主要障碍之一是样本种类的不平衡问题[24],通常情况下在N1期的睡眠阶段很少见,模型对该类别进行的参数迭代少,所以其预测效果差[25]。所以,一种解决方法是重新对模型评价的损失函数进行加权,使得模型在数量较少的样本上的出错成本更大;另一种更为常用的办法是平衡采样。但在PSG信号的采集中,由于需要对样本的前后信息特征进行提取,因此无法单独提取每个类别进行样本数量均衡,所以可以采用实验结果增加惩罚性权重评价等方法。由于标准精度度量认为,任何预测错误都有相同的代价,所以需要通过引入平衡F分数(balanced F score,F1 score)与科恩卡帕(Cohen’s kappa)系数等评价指标,来获得将某类别错误预测为其它类别时具有惩罚成本的评分。其中基础的卡帕(kappa)系数,计算公式如式(3)、式(4)所示:
 |
3 |
 |
4 |
其中,nS1和nS2分别是真实值和预测值在第S个类别的个数,还引入了总体预测准确率(accuracy,Acc),基准(baseline,Base)是随机打乱现有的预测样本数量分布得到的平均正确率,N为总体样本数。
在Cohen’s kappa系数中,1−Acc可以理解为错误值(error),其公式如式(5)所示:
 |
5 |
此外,还分别计算了实验结果的F1 score值和加权F1 score(weighted F1 score,W-F1 score)值,并在如下四种子数据集中进行了训练与验证:① SHDB: 6通道EEG数据(SHDB EEG);② HMCSDB:6通道EEG数据(HMCSDB EEG);③ SHDB:6通道EEG数据 + 双通道EMG数据 + 单通道EOG数据,共9通道(HMCSDB EEG + EMG + EOG);④ HMCSDB:6通道EEG数据 + 双通道EMG数据 + 单通道EOG数据,共9通道(SHDB EEG + EMG + EOG)。其混淆矩阵图如图6所示,评分结果如表2所示。
图 6.
Confusion matrix of staging results of each data set and subset
各数据集及子集分期结果的准确率混淆矩阵图
表 2. Comparison of evaluation scores of different channels.
不同通道评估得分对比
| 数据集 | 通道 | Acc | Cohen’s kappa |
W-F1 score |
F1 score |
| SHDB | EEG | 0.79 | 0.69 | 0.68 | 0.77 |
| HMCSDB | EEG | 0.77 | 0.64 | 0.69 | 0.76 |
| SHDB | EEG + EMG + EOG | 0.84 | 0.77 | 0.71 | 0.84 |
| HMCSDB | EEG + EMG + EOG | 0.82 | 0.74 | 0.74 | 0.81 |
由实验结果的混淆矩阵可得,模型在W、REM、N2、N3四个睡眠分期上准确度较高,在相比仅有EEG信号时,增加EMG、EOG通道会提升在上述四个分期的准确度,而N1期由于样本量较少,特征提取信息较少,其分期准确度无明显提升。如表2所示,两组数据集中9通道数据实验模型的医师Cohen’s kappa值分别为0.77、0.74,这与文献[26]报道的来自中、美两国的医生按2014年AASM标准手工分期得到的Cohen’s kappa值(0.75±0.11)相接近,由此可得本实验提出的Self Attention-CNN-Bi GRU算法模型在多通道信号下对睡眠分期的学习策略可行,并且通过Bi GRU结构使模型相较于LSTM网络减少冗余参数,因而计算负担较低、更具实时应用的潜力。
为了验证自注意力机制的加权参数在多通道PSG信号上对模型分期准确度提升效果,分别在相同的9通道PSG数据集且同等实验环境下进行了不同模型对比,其评分结果如表3所示。表3中,Bi GRU与Bi LSTM的效果要优于常规GRU与LSTM,且在引入自注意力机制后,准确度与可靠性评分有明显提升。此外Bi GRU虽然在准确度上略低于Bi LSTM,但在加入双向结构与自注意力机制下其Cohen’s kappa值要优于Bi LSTM,这是由于在N1期样本较少,特征提取信息较少,参数过于复杂,Bi LSTM造成欠拟合,使得N1准确度相对较低;而对其余W、REM、N2、N3等样本数量较多的分期类别,则其评分有所提升。
表 3. Comparison of scores of different models.
不同模型得分对比
| 模型 | Acc | Cohen’ kappa |
W-F1 score |
F1 score |
| CNN- LSTM | 0.78 | 0.65 | 0.68 | 0.73 |
| CNN-GRU | 0.77 | 0.64 | 0.70 | 0.76 |
| CNN-Bi LSTM | 0.80 | 0.71 | 0.73 | 0.77 |
| CNN-Bi GRU | 0.79 | 0.73 | 0.69 | 0.75 |
| Self-attention- CNN-Bi LSTM | 0.86 | 0.69 | 0.74 | 0.82 |
| Self-attention- CNN-Bi GRU | 0.84 | 0.77 | 0.71 | 0.84 |
6. 结束语
针对临床医师手工视觉进行PSG数据睡眠阶段分期耗时长等问题,本文提出一种基于自注意力机制与Bi GRU的新型自动分期深度学习模型。实验结果证明,本文所提模型设计的动态稀疏性自注意力机制适用于不同患者多通道PSG自动睡眠分期且能够取得较为优异的效果,并且优于在单通道或者多通道EEG信号上的效果。但是实验结果也表明,本文模型在N1阶段的分类性能低于其它阶段(W、N2、N3和REM),主要因为N1期持续时间较短、样本数量少,而临床医师在此阶段的分类准确性也较其它阶段低。本文通过引入惩罚性评价指标来降低其影响,此问题需要在进一步的实验中整合更多医师手工分类的PSG数据及标签以增加N1期样本数量,并结合更多医师间不同评分者相互指数来进一步验证其准确度。或者是在不增加样本数量情况下单独对N1期过采样,使用合成少数类过采样法(synthetic minority oversampling technique,SMOTE)等启发式方法及其变种如临界(borderline) SMOTE、SVM SMOTE,来改进不平衡学习从而提高分类准确性和可靠性。
此外,对于PSG数据的非电生理部分,如鼻息鼾声等数据,本实验尚未纳入模型训练。对于暂未证实的信号间空间联系、时序性调整、信号频谱图的图像分析等问题也尚未考虑,在未来的工作中可以开展相关研究。
重要声明
利益冲突声明:本文全体作者均声明不存在利益冲突。
作者贡献声明:何长乐是本研究的实验设计者和实验研究的执行人,完成数据分析,论文初稿的写作与修改;刘颖指导论文写作,提出修改意见;季曹珺与苑成梅参与数据采集和实验指导;章浩伟是项目的构思者及负责人,指导实验设计、数据分析、论文写作与修改。全体作者都阅读并同意最终的文本。
伦理声明:本研究通过了上海市精神卫生中心伦理委员会的审批(批文编号:2020-23)。
Funding Statement
上海市申康发展中心重大临床研究项目-青年项目(SHDC2020CR4074,SHDC12016205);上海市科委科技创新行动计划(20Y11906600);上海理工大学医工交叉项目(1021308424); 上海市精神卫生中心睡眠障碍特色学科(2017-TSXK-02)
Shanghai Shenkang Development Center;Shanghai Municipal Commission Science and Technology;University of Shanghai for Science and Technology;Shanghai Mental Health Center
Contributor Information
浩伟 章 (Haowei ZHANG), Email: howiezh@aliyun.com.
曹珺 季 (Caojun JI), Email: jicaojun1985@163.com.
References
- 1.Rechtschaffen A, Kales A. A manual of standardized terminology, techniques and scoring system for sleep stages in human subjects. Los Angeles: UCLA Brain Information Service/Brain Research Institute, 1968.
- 2.Berry R B, Brooks R, Gamaldo C, et al AASM scoring manual updates for 2017 (version 2. 4) . J Clin Sleep Med. 2017;13(5):665–666. doi: 10.5664/jcsm.6576. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Stepnowsky C, Levendowski D, Popovic D, et al Scoring accuracy of automated sleep staging from a bipolar electroocular recording compared to manual scoring by multiple raters. Sleep Medicine. 2013;14(11):1199–1207. doi: 10.1016/j.sleep.2013.04.022. [DOI] [PubMed] [Google Scholar]
- 4.Şen B, Peker M, Çavuşoğlu A, et al A comparative study on classification of sleep stage based on EEG signals using feature selection and classification algorithms. Journal of medical systems. 2014;38(3):18. doi: 10.1007/s10916-014-0018-0. [DOI] [PubMed] [Google Scholar]
- 5.Cervantes J, Garcia-Lamont F, Rodríguez-Mazahua L, et al A comprehensive survey on support vector machine classification: applications, challenges and trends. Neurocomputing. 2020;408:189–215. doi: 10.1016/j.neucom.2019.10.118. [DOI] [Google Scholar]
- 6.Lee C S, Cheang P Y S, Moslehpour M Predictive analytics in business analytics: decision tree. Advances in Decision Sciences. 2022;26(1):1–29. doi: 10.47654/v26y2022i1p1-30. [DOI] [Google Scholar]
- 7.Mei S H, Ji J Y, Hou J H, et al Learning sensor-specific spatial-spectral features of hyperspectral images via convolutional neural networks. IEEE Transactions on Geoscience and Remote Sensing. 2017;55(8):4520–4533. doi: 10.1109/TGRS.2017.2693346. [DOI] [Google Scholar]
- 8.Yu Y, Si X, Hu C, et al A review of recurrent neural networks: LSTM cells and network architectures. Neural Comput. 2019;31(7):1235–1270. doi: 10.1162/neco_a_01199. [DOI] [PubMed] [Google Scholar]
- 9.Längkvist M, Karlsson L, Loutfi A Sleep stage classification using unsupervised feature learning. Advances in Artificial Neural Systems. 2012:107046. [Google Scholar]
- 10.Supratak A, Dong H, Wu C, et al DeepSleepNet: A model for automatic sleep stage scoring based on raw single-channel EEG. IEEE Trans Neural Syst Rehabil Eng. 2017;25(11):1998–2008. doi: 10.1109/TNSRE.2017.2721116. [DOI] [PubMed] [Google Scholar]
- 11.Zhang L D, Fabbri D, Upender R, et al Automated sleep stage scoring of the sleep heart health study using deep neural networks. Sleep. 2019;42(11):zsz159. doi: 10.1093/sleep/zsz159. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Gao S, Huang Y F, Zhang S, et al Short-term runoff prediction with GRU and LSTM networks without requiring time step optimization during sample generation. Journal of Hydrology. 2020;589:125188. doi: 10.1016/j.jhydrol.2020.125188. [DOI] [Google Scholar]
- 13.Alvarez-Estevez D, Rijsman R M Inter-database validation of a deep learning approach for automatic sleep scoring. PLoS One. 2021;16(8):e0256111. doi: 10.1371/journal.pone.0256111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Mousavi S M, Langston C A, Horton S P Automatic microseismic denoising and onset detection using the synchrosqueezed continuous wavelet transform. Geophysics. 2016;81(4):V341–V355. doi: 10.1190/geo2015-0598.1. [DOI] [Google Scholar]
- 15.Yildirim O, Baloglu U B, Acharya U R A deep learning model for automated sleep stages classification using PSG signals. International Journal of Environmental Research and Public Health. 2019;16(4):599. doi: 10.3390/ijerph16040599. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Hochreiter S, Schmidhuber J Long short-term memory. Neural Comput. 1997;9(8):1735–1780. doi: 10.1162/neco.1997.9.8.1735. [DOI] [PubMed] [Google Scholar]
- 17.Shahid F, Zameer A, Muneeb M Predictions for COVID-19 with deep learning models of LSTM, GRU and Bi-LSTM. Chaos Solitons Fractals. 2020;140:110212. doi: 10.1016/j.chaos.2020.110212. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Vaswani A, Shazeer N, Parmar N, et al Attention is all you need. Proceedings of the 31st International Conference on Neural Information Processing Systems. 2017:6000–6010. [Google Scholar]
- 19.Kuo C E, Liao P Y, Lin Y S A Self-attention-based ensemble convolution neural network approach for sleep stage classification with merged spectrogram//2021 Asia-Pacific Signal and Information Processing Association Annual Summit and Conference (APSIPA ASC) IEEE. 2021:1262–1268. [Google Scholar]
- 20.梁斌, 刘全, 徐进, 等 基于多注意力卷积神经网络的特定目标情感分析. 计算机研究与发展. 2017;54(08):1724–1735. doi: 10.7544/issn1000-1239.2017.20170178. [DOI] [Google Scholar]
- 21.张兰霞, 胡文心. 基于双向GRU神经网络和双层注意力机制的中文文本中人物关系抽取研究. 计算机应用与软件, 2018, 35(11): 130-135, 189.
- 22.Wang S H, Muhammad K, Hong J, et al Alcoholism identification via convolutional neural network based on parametric ReLU, dropout, and batch normalization. Neural Computing & Applications. 2020;32(3):665–680. [Google Scholar]
- 23.Chang Z, Zhang Y, Chen W Electricity price prediction based on hybrid model of adam optimized LSTM neural network and wavelet transform. Energy. 2019;187:115804. doi: 10.1016/j.energy.2019.07.134. [DOI] [Google Scholar]
- 24.Chambon S, Galtier M N, Arnal P J, et al A deep learning architecture for temporal sleep stage classification using multivariate and multimodal time series. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 2018;26(4):758–769. doi: 10.1109/TNSRE.2018.2813138. [DOI] [PubMed] [Google Scholar]
- 25.Zaharchuk G, Gong E, Wintermark M, et al Deep learning in neuroradiology. AJNR Am J Neuroradiol. 2018;39(10):1776–1784. doi: 10.3174/ajnr.A5543. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Deng S J, Zhang X, Zhang Y, et al Interrater agreement between American and Chinese sleep centers according to the 2014 AASM standard. Sleep and Breathing. 2019;23(2):719–728. doi: 10.1007/s11325-019-01801-x. [DOI] [PubMed] [Google Scholar]






