Abstract
脑电信号具有高时间分辨率的特征,各类脑电信号分析方法近年来发展迅速。脑电微状态分析方法能够研究毫秒级范围内的大脑变化,同时也可呈现脑电信号在拓扑层面上的分布,从而反映全脑的不连续和非线性特征。经历三十多年的丰富和完善,脑电微状态分析已经渗透到脑科学相关的多个研究领域。本文总结了脑电微状态分析方法的基本原理,系统阐述了微状态特征参数改变、微状态与脑功能网络的关系以及微状态特征提取与分类在脑疾病和脑认知方面的主要应用进展,期望能够为该领域的研究人员提供一定的参考。
Keywords: 脑电信号, 微状态分析, 脑疾病, 脑认知
Abstract
Electroencephalogram (EEG) is characterized by high temporal resolution, and various EEG analysis methods have developed rapidly in recent years. The EEG microstate analysis method can be used to study the changes of the brain in the millisecond scale, and can also present the distribution of EEG signals in the topological level, thus reflecting the discontinuous and nonlinear characteristics of the whole brain. After more than 30 years of enrichment and improvement, EEG microstate analysis has penetrated into many research fields related to brain science. In this paper, the basic principles of EEG microstate analysis methods are summarized, and the changes of characteristic parameters of microstates, the relationship between microstates and brain functional networks as well as the main advances in the application of microstate feature extraction and classification in brain diseases and brain cognition are systematically described, hoping to provide some references for researchers in this field.
Keywords: Electroencephalogram signals, Microstate analysis, Brain disease, Brain cognition
0. 引言
21世纪被称为脑科学时代,各种探测大脑神经活动的新技术蓬勃发展,特别是功能磁共振成像、功能性近红外光谱、脑电图等医学影像技术为医学、心理学等方面的研究提供了有效手段。脑电图具有毫秒级的时间分辨率,能够对神经活动进行非侵入性评估,且脑电图检测价格便宜,便于床旁监测,目前已普遍应用于大脑相关疾病诊断及认知功能评估中。脑电信号分析方法近年来日趋成熟,在时域、频域、时频域及空间域等多个层面得到了广泛应用[1-2]。1987年Lehmann等[3]在一项开创性研究中提出脑电信号可以解析为有限数量的几类亚稳态,这些离散状态被命名为“微状态”,可以由表征电位分布的脑地形图直观表示,一般每个微状态持续60~120 ms。尽管在多通道记录仪中会采集到大量脑电信号,但约70%左右的信号仅由少数微状态便可表示。诸多研究均证实了这一结论并得到了四种主要微状态模型,分别将其标记为微状态A、B、C和D,部分研究中出现的微状态E和F可归类为这四种主要状态的亚型。与其他分析方法不同,脑电微状态分析可以同时考虑来自所有电极的电压信号以计算大脑功能状态的全局表征,在高时间分辨率下识别全局脑功能状态的不连续以及非线性变化,有助于揭示大脑神经活动的产生及发展机制。
微状态反映了脑电信号的诸多神经生理学特征,随着微状态分析方法的不断丰富与完善,为脑电信号提供了新的量化方法。研究表明,不同脑疾病和脑认知状态会直接影响脑电微状态的时间序列特征,因此脑电微状态分析已经成为研究脑疾病和脑认知产生原理及发展机制的一种有效方法。本文以脑电微状态分析及应用为切入点,首先介绍了微状态的基本分析流程和评估指标,而后总结归纳了脑疾病和脑认知相关的脑电微状态在特征参数变化、与脑功能网络的相互关系以及特征提取分类等方面的主要研究及应用进展,最后提出目前脑电微状态研究存在的主要问题并对未来发展趋势进行了展望,期望为脑疾病与脑认知领域的研究人员深入探究大脑神经活动的相关机制提供一定参考。
1. 脑电微状态分析方法
1.1. 微状态基本分析流程
微状态分析主要包含四个关键步骤,如图1所示。第一步,依据单个受试者各电极通道电位值计算某个时刻脑电信号的全局场功率(global field power,GFP),GFP(以符号GFP表示)的定义如式(1)所示:
图 1.
Flow chart of microstate analysis
微状态分析流程图
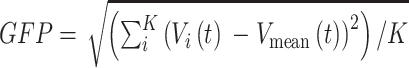 |
1 |
其中,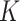 表示电极通道数,
表示电极通道数, 表示第
表示第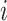 个电极的电位时间序列,
个电极的电位时间序列,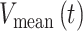 表示所有电极的电位平均值时间序列。
表示所有电极的电位平均值时间序列。
进一步提取GFP极大值时间序列,由于GFP极大值时刻的脑地形图具有最大信噪比,因此位于两个极大值之间的脑地形图具有相似的结构。
第二步,利用K均值聚类算法从GFP极大值时间序列中随机选取四个脑地形图作为初始聚类中心;将其余地形图分别与初始聚类中心进行比较,并标记与所选初始聚类中心最相关的脑地形图;而后计算新的聚类中心,重复该步骤直到聚类中心所能代表的全部脑电信号的百分比不再改善,此时所得到的四个聚类中心即为“微状态模型”[4]。
第三步,根据所有受试者“微状态模型”计算组内“微状态模型”,从而得到四类脑地形图相应地被标记为微状态A、B、C和D。其中,微状态A、B、C和D的脑地形图空间构型分别呈现出右额左后方向、左额右后方向、额枕中线方向和额中线方向[5]。
第四步,利用空间相关性对四类“微状态模型”和原始脑电数据进行竞争性拟合,将原始脑电数据每个时刻用相关性最高的微状态进行标记,得到脑地形图随时间的变化过程,从而进一步提取微状态特征参数进行分析。
1.2. 微状态主要评估参数
微状态时间序列包含着丰富的神经生理学信息。在微状态分析中,描述大脑状态变化的参数主要有全局解释方差、平均持续时间、覆盖率、频率和马尔可夫链。微状态的全局解释方差,是指给定微状态所能代表的全部脑电信号的百分比。每个微状态的平均持续时间,是给定微状态在出现并保持稳定的平均时间长度。微状态的覆盖率,指给定微状态的持续时间与微状态总持续时间之比。频率,是某一微状态出现并保持稳定期间平均每秒的出现次数。从一个微状态到任何其他微状态的转换概率是非随机的,因此微状态之间的转换序列具有潜在的重要意义,而转换概率的统计信息通常用马尔可夫链来表示。
2. 脑电微状态特征参数研究
2.1. 脑疾病相关的微状态参数改变
微状态A和微状态B优先在彼此之间进行转换,但在抑郁症和精神分裂症中这种模式会被破坏,反映了情感障碍和精神障碍之间具有潜在的共同神经异常特征[6-7]。抑郁症患者微状态A的平均持续时间减少,频率大幅度增高,微状态A和微状态B到微状态C的转换增加。且有研究表明,抑郁症状越严重,微状态A的出现频率越高[8]。焦虑症患者微状态A覆盖率增高,与抑郁症情况相反,当微状态A的频率增高时,表明焦虑的临床症状得到改善[9]。微状态B的平均持续时间增高与认知疲劳有关,从而引起某些临床症状。帕金森患者微状态B的平均持续时间和频率均显著增高,其平均持续时间会随认知水平的增加逐渐恢复到正常水平[4, 10]。双相情感障碍患者由于微状态B到微状态C和D的转换增加,导致微状态B的平均持续时间、频率和覆盖率均减少,并且微状态B的平均持续时间与双向情感障碍症状呈负相关[11]。此外,焦虑症、阿尔茨海默病和轻度认知障碍的临床表现与微状态B的平均持续时间之间也存在类似的负相关关系[9, 12]。
微状态C和微状态D在精神分裂症患者中的改变已经被诸多研究所证实。通常精神分裂症患者微状态C的平均持续时间和频率均增高,尤其是未接受药物治疗首次发作的患者微状态C的频率更高,而微状态D的平均持续时间和频率均减少[13-14]。此外,研究发现精神分裂症微状态C到微状态D的转换增加,而微状态D到微状态C的转换减少,因此推测精神分裂症患者微状态C的频繁出现可能以牺牲微状态D为代价[7]。微状态C在健康成人闭眼放松时占主导地位,有研究表明癫痫发作会导致微状态C的发生频率减少,其可能的原因是患者对环境的认知−情感评估出现障碍[15]。微状态D的异常与注意力下降有关,与精神分裂症相似,睡眠行为障碍也会导致微状态D的平均持续时间和频率减少,并且疾病严重程度与微状态D的平均持续时间和频率呈负相关[16]。常见脑疾病微状态参数的改变如表1所示,其中“减少”或“增高”表示患者组与对照组之间的差异具有统计学意义,“—”表示两组之间的差异无统计学意义。综上所述,不同脑疾病微状态参数的改变具有各自的特异性,为微状态作为脑疾病检测的神经生物学标志物提供了一定的依据。
表 1. Summary of changes in microstate parameters of brain diseases.
脑疾病微状态参数变化汇总
| 文献 | 疾病类型 | 微状态A | 微状态B | 微状态C | 微状态D | |||||||||||
| 平均持续时间 | 频率 | 覆盖率 | 平均持续时间 | 频率 | 覆盖率 | 平均持续时间 | 频率 | 覆盖率 | 平均持续时间 | 频率 | 覆盖率 | |||||
| [6] | 抑郁症 | 减少 | 增高 | — | — | — | — | — | — | — | 减少 | 减少 | 减少 | |||
| [8] | 重度抑郁症 | — | — | — | 增高 | 减少 | — | — | 增高 | — | 减少 | — | 减少 | |||
| [7] | 早期精神病 | 增高 | — | — | — | — | — | 增高 | — | — | 减少 | — | — | |||
| [9] | 焦虑症 | 增高 | — | — | 增高 | 减少 | — | 增高 | — | — | 增高 | — | — | |||
| [4] | 帕金森 | 增高 | 增高 | — | 增高 | 增高 | 增高 | — | 减少 | 减少 | 减少 | 减少 | — | |||
| [10] | 帕金森 | 增高 | 增高 | — | — | 增高 | 增高 | 增高 | 减少 | — | 减少 | 减少 | 减少 | |||
| [11] | 双相情感障碍 | — | — | — | 减少 | 减少 | 减少 | — | — | — | — | — | — | |||
| [12] | 阿尔茨海默病 | — | — | — | 增高 | 增高 | — | — | — | 减少 | — | — | — | |||
| [12] | 轻度认知障碍 | — | 增高 | 增高 | 增高 | — | 增高 | — | — | — | — | — | — | |||
| [13] | 精神分裂症 | — | 增高 | 增高 | 减少 | — | 减少 | 增高 | 增高 | — | 减少 | — | — | |||
| [14] | 精神分裂症 | 减少 | 增高 | — | 减少 | — | — | 增高 | — | — | 减少 | — | — | |||
| [15] | 癫痫 | 增高 | 增高 | 增高 | 减少 | 减少 | — | 减少 | 减少 | 减少 | — | — | — | |||
| [16] | 睡眠行为障碍 | 减少 | — | — | — | 增高 | 增高 | — | 增高 | — | 减少 | — | 减少 | |||
2.2. 认知任务相关的微状态参数改变
脑电微状态反映了意识的基本组成,也被称为“思想的原子”。Poskanzer等[17]通过单词对的重复记忆任务,发现微状态C的平均持续时间、频率、覆盖率和全局解释方差均减少,微状态D的相应参数均增高。Muthukrishnan等[18]在一项关于高负荷视觉空间工作记忆的研究中发现,记忆测试前一刻大脑的微状态可以大致决定记忆结果的准确性,即当测试前一刻大脑呈现微状态C时,出现错误的概率明显升高,呈现微状态D时正确率更高,这一研究结果支持了微状态C与消极任务密切相关和微状态D与积极任务密切相关之间的反比关系。工作记忆能力可能会随年龄的增加而减弱,近年来相关研究报道了工作记忆任务中与年龄相关的脑电微状态参数差异。研究结果显示,与成年人相比,老年人微状态C的频率减少,微状态D的频率和平均持续时间增高,微状态C和微状态D之间的转换概率降低[19]。Zanesco等[20]研究得出了相似的结论,即微状态平均持续时间与年龄成正比,发生频率与年龄成反比,该结果体现了组织功能在正常衰老过程中条理性降低,随机性增加。
注意力是反映认知能力的另一重要组成部分,心算任务在反映注意力方面有着巨大优势。Kim等[21]将脑电微状态应用于心算任务来评估受试者的任务表现。与静息状态相比,表现良好的受试者在任务期间微状态C的平均持续时间和频率减少,微状态D的平均持续时间和频率增高,表明微状态特征可以反映任务完成情况。除心算任务外,D'Croz-Baron等[22]设计了听觉和视觉任务进行感官刺激,以研究不同状态下脑电微状态的改变。结果显示,听觉刺激下微状态D的频率和覆盖率均增高,视觉任务下微状态B的频率增高,微状态C的平均持续时间和频率均减少。注意力和想象之间有着千丝万缕的联系。Zanesco等[23]通过对有修禅经验的人进行冥想训练,发现其脑电微状态A、B、C和D的平均持续时间均减少,GFP降低。Faber等[24]进一步将冥想细分为无定向心理和超越两个阶段,即无目标导向的冥想状态和注意力集中的冥想状态。在无定向心理阶段,微状态A的频率减少,微状态D的频率增高。与无定向心理相比,超越阶段表现出微状态C的平均持续时间和频率均显著减少,这反映了超越阶段更集中的注意力和更少的评价性处理。不同认知任务下脑电微状态参数的变化如表2所示,其中“减少”或“增高”表示认知任务组与对照组之间的差异具有统计学意义,“—”表示两组之间的差异无统计学意义。综上所述,在脑认知研究方面,微状态C和微状态D是最受影响的两种状态,在任务主导下微状态C的各项参数呈减小趋势,而微状态D的参数变化则相反。
表 2. Changes of microstate parameters in different task states.
不同任务态微状态参数的改变
| 文献 | 认知任务 | 微状态A | 微状态B | 微状态C | 微状态D | |||||||||||
| 平均持续时间 | 频率 | 覆盖率 | 平均持续时间 | 频率 | 覆盖率 | 平均持续时间 | 频率 | 覆盖率 | 平均持续时间 | 频率 | 覆盖率 | |||||
| [17] | 重复单词工作记忆 | — | — | — | — | — | — | 减少 | 减少 | 减少 | 增高 | 增高 | 增高 | |||
| [21] | 心算任务 | — | — | — | 减少 | — | — | 减少 | — | 减少 | 增高 | 增高 | 增高 | |||
| [22] | 听觉任务 | — | — | — | — | — | — | — | — | — | — | 增高 | 增高 | |||
| [22] | 视觉任务 | — | — | — | — | 增高 | — | 减少 | 减少 | — | — | — | — | |||
| [23] | 冥想训练 | 减少 | — | — | 减少 | — | — | 减少 | — | — | 减少 | — | — | |||
| [24] | 无定向心理 | — | 减少 | — | — | — | — | — | — | — | — | 增高 | — | |||
| [24] | 超越 | — | — | — | — | — | — | 减少 | 减少 | — | — | — | — | |||
3. 脑电微状态与脑功能网络
3.1. 脑疾病相关微状态与功能网络的关系
脑疾病早期在未出现结构变化前更多地表现为大脑动态网络的破坏,每个微状态都与多个静息状态脑网络的活动有关。目前关于微状态与脑功能网络间的联系已形成广泛共识,即微状态A、B、C和D分别与听觉网络、视觉网络、凸显网络和注意力网络密切相关。微状态A与双侧颞上回和颞中回等语音处理相关区域的活动有关。诸多研究认为左侧颞叶和左侧岛叶是微状态A的主要产生区域,内侧前额叶皮层和左侧枕叶主要影响微状态A的空间构型[8]。很多疾病均与颞叶功能网络异常有关,如抑郁症、轻度认知障碍和阿尔茨海默病等[6, 12]。阿尔茨海默病患者大脑颞叶最先出现β-淀粉样蛋白沉积,从而使得固有的神经元网络被破坏,并且患者颞叶的功能改变存在于疾病的各个阶段。微状态B与视觉网络功能完整性之间具有密切联系,涉及双侧枕叶皮层与其他皮层下结构的连接,进一步阐明了枕骨区域在神经退行性过程中的作用。最典型的代表是阿尔茨海默病和双相情感障碍,患者听觉网络和视觉网络的连通性均增加,并且由于认知障碍导致大脑活动更加集中于视觉功能[11]。微状态C反映了凸显网络的活动变化,与双侧颞回、扣带皮层后部和岛叶部分激活呈正相关。睡眠行为障碍患者凸显网络异常激活,相反帕金森患者认知疲劳和认知水平降低表现为凸显网络区域活动性降低[4]。此外,微状态C也反映了默认模式网络(default mode network,DMN)的激活。DMN是自我聚焦和自我参照处理过程中涉及的主要网络之一,诸多学者已经证实DMN在自我参照过程的异常与抑郁症、焦虑症和精神分裂症密切相关[6, 25]。微状态D被认为与背侧注意力网络有关(dorsal attention network,DAN),该状态主要来源于额顶控制网络区域。抑郁症中的反刍、精神分裂症中的思维障碍、帕金森中的认知疲劳以及癫痫患者脑功能异常与额顶、注意力和执行网络的固有功能相关联,为微状态D作为神经退行性疾病和精神疾病网络活动受损的标志物提供了依据[26]。此外,睡眠行为障碍患者微状态D的动力学模式被破坏,额顶控制网络的同步性发生系统性变化,这一改变在非快速眼动睡眠期间更为明显[16]。不同疾病所涉及的脑功能网络变化如表3所示。
表 3. Effects of brain diseases on connectivity of brain functional networks.
脑疾病对脑功能网络连通性的影响
| 文献 | 疾病 | 微状态类 | 相关功能网络 |
| [6] | 抑郁症 | A、C | DMN和额顶叶网络到楔前叶的连接性增加,DMN内部连接性增加 |
| [8] | 抑郁症 | A | 额边缘系统和DMN活动性改变,带状盖网络功能连接中断 |
| [12] | 阿尔茨海默病和 轻度认知障碍 |
A、B、C | 两种疾病DMN连接异常,阿尔茨海默病患者视觉相关网络激活,顶叶功能连接受到抑制 |
| [11] | 双相情感障碍 | B、C、D | 视觉网络与凸显网络和注意力网络间的连接更加密切 |
| [9] | 焦虑症 | C | 视觉网络和DAN之间的转换频率较低,视觉网络与凸显网络的连接更加密切 |
| [25] | 焦虑症 | C | DMN和认知控制网络间信息交流更加密切 |
| [7] | 早期精神病 | C、D | DMN、后内侧和前扣带皮层连通性受到影响,视觉和听觉网络之间以及凸显和注意力网络之间的转换更加随机 |
| [4] | 帕金森 | D | 背侧前扣带皮层延伸到额上回异常激活,双侧额下皮层网络活动性降低 |
| [26] | 癫痫 | C、D | 凸显网络受到抑制,视觉网络和DMN连接异常 |
| [16] | 睡眠行为障碍 | D | 额顶颞网络功能连接抑制,凸显网络和视觉网络间异常激活 |
3.2. 认知任务相关微状态与功能网络的关系
认知过程中多个大脑网络之间相互影响,从而产生目标导向的行为和更高阶的认知。脑网络参数改变的本质是脑网络结构及其连通性发生了变化。Seitzman等[27]试图通过行为操纵来改变四种典型微状态的时间特征,当参与者从闭眼状态过渡到睁眼状态时,微状态B的频率和覆盖率显著增高,验证了微状态B与视觉网络相关的假设。相反,与静息态结果相比,在视觉任务下微状态C的出现减少,D' Croz-Baron等[22]的视觉任务试验中也发现了这一现象。此外Seitzman等[27]和Poskanzer等[17]分别在连续减法任务和单词记忆期间也发现微状态C有所减少,这与该状态支持认知控制的观点相矛盾。但这些学者认为微状态C主要反映DMN的活动,前扣带回是DMN的一个重要枢纽,工作记忆检索期间角回、后扣带回、楔前叶相对活跃,而前额皮质则不活跃,使得DMN总体呈现为任务负向网络,在执行认知任务期间网络活动减少。有关数字冥想训练的研究发现,经过特定周期的冥想训练后,微状态C的平均持续时间增加,同时与DMN和DAN相关的双侧额上回等区域的活动增强[28]。微状态D在认知任务期间无论是睁眼还是闭眼均呈增加趋势,表明微状态D与DAN有关,尤其在高脑力工作任务时DAN中的信息传递效率极大提高[29]。另一项与听觉任务相关的研究结果显示,微状态D的频率和覆盖率均增高,额顶网络被激活[22]。此外,有研究表明,老年人在进行心算任务时脑电微状态C增加,微状态D减少,与感觉处理网络随年龄增长表现出功能连通性增强,而高阶处理网络随年龄增长表现出功能连通性降低相对应[19]。不同认知任务的脑功能网络连通性变化如表4所示。
表 4. Effects of cognitive tasks on connectivity of functional brain networks.
认知任务对脑功能网络连通性的影响
4. 脑电微状态特征提取与分类
脑电微状态多个特征信息的综合利用有助于提升对疾病发生和发展的理解,通过对微状态特征进行多变量分析,可以创建更完善的模型来揭示单变量分析所未检测到的差异,其结果的可靠性和有效性也可得到进一步提升。Kim等[30]将微状态A的频率、GFP,微状态B的平均持续时间、频率、GFP,微状态C的平均持续时间、频率、覆盖率、GFP,以及微状态D的平均持续时间、频率、覆盖率、GFP作为分类特征,结合机器学习算法用以区分精神分裂症患者和健康受试者,结果表明其分类准确率高达76.62%,高于传统脑电特征分类结果。随后Baradits等[31]将微状态A、B、C、D的平均持续时间、频率和覆盖率以及AB、AC、AD、BA、BC、BD、CA、CB、DA、DB间的转换概率作为分类特征对精神分裂症患者和健康受试者进行分类,其分类准确率进一步提高到82.7%。轻度认知障碍和阿尔茨海默病之间有许多相似的临床表征,认知障碍往往容易发展成阿尔茨海默病。以微状态A、B、C、D的平均持续时间、频率和覆盖率为特征对阿尔茨海默病患者和健康受试者进行分类的准确率为69.8%,同时对轻度认知障碍患者和健康受试者分类的准确率为58.7%[32]。自Gotman[33]首次提出机器学习在癫痫研究及应用方面具有巨大的潜在优势以来,多种特征提取方法被用于预测癫痫发作并获得了较高的准确率。Ahmadi等[34]利用不同频段下的脑电微状态特征对癫痫和精神性非癫痫发作患者进行分类,结果显示β频段下微状态覆盖率可作为对两种疾病进行分类的重要特征,其分类准确率达到68.8%。目前尽管脑电微状态已经在疾病分类和诊断研究中得到一定应用,但许多疾病的相关研究还十分欠缺,仍存在巨大的探索空间。
脑电微状态分析在认知科学领域也逐渐显露出良好的应用前景,尤其是在运动想象任务中能够获得比其他特征更高的分类准确率,极大促进了脑机接口相关临床研究的发展。李昭阳等[35]通过采集动态图像视觉想象任务下受试者的脑电信号,并将微状态A和微状态B的平均持续时间、频率、覆盖率作为输入特征对不同视觉任务进行分类,最高分类准确率可达90%。Kim等[22]将脑电微状态应用于心算任务来评估受试者任务表现,提取微状态D的平均持续时间、频率和覆盖率作为特征对表现良好和表现不佳的受试者进行分类,其分类准确率为75.3%。Li等[36]近期一项研究中将新元素Teager能量算子与脑电微状态相结合,通过微状态参数特征捕获两个运动图像任务之间的差异,获得了高达93.93%的平均分类准确率。此外,脑电微状态特征用于区分人在不同任务下的警戒水平也取得了初步的研究成果[37]。目前脑电微状态在脑认知领域的研究体现出了前所未有的优势,但仍处于探索阶段,有待学者们进一步开展深入研究。
5. 总结与展望
脑电微状态反映了亚稳态电位分布脑地形图的空间构型,不同的微状态代表不同的大脑功能。微状态分析方法在自身不断丰富和发展的同时,还与其他方法相结合,为脑科学研究提供了新思路,如微状态与光谱特征相结合显示了光谱功率对GFP极大值的影响,循环神经网络为微状态序列探索和预测脑动力学提供了可靠的方法补充,微状态与动态脑功能网络相结合可进一步探索脑网络的分化与整合机制等[29, 38]。尽管近年来脑电微状态分析在脑疾病和脑认知等方面取得了一些研究成果,但是相当一部分研究仍比较浅显,还有很多实质性的问题尚未解决,如微状态聚类的正确数目、最佳分类方法以及分类时的阈值选取等。此外,脑电本身具有复杂性,无法精确定位来反映大脑深部少量乃至单个神经元的电活动,并且个体差异性较大,又易受到认知行为和思维状态的影响,诸多认知行为的神经机制尚未明确。目前研究显示几种脑电微状态的平均持续时间、频率和覆盖率的增加分别与视觉、语言和主观感受加工有关,但又不局限于这些功能,仍需要更多的研究来进一步明晰其内在的复杂联系。随着人们对大脑研究的不断深入,在前人研究的基础上,又提出了许多新的问题,开辟了诸多全新的领域,有助于人们不断探究大脑未知领域,进而造福人类健康福祉。
重要声明
利益冲突声明:本文全体作者均声明不存在利益冲突。
作者贡献声明:王海力负责资料收集、文章撰写、文章修改;尹宁和徐桂芝对文章框架和主题提供了指导性的意见,并负责文章修改。
Funding Statement
国家自然科学基金项目(51707055, 51737003)
References
- 1.黄海云, 蔡跃新, 李远清 基于脑电信号的耳鸣患者静息态频谱图及注意力研究. 生物医学工程学杂志. 2021;38(3):492–497. [Google Scholar]
- 2.Jadav G M, Lerga J, Tajduhar I Adaptive filtering and analysis of EEG signals in the time-frequency domain based on the local entropy. Eurasip J Adv Sig Pr. 2020;2020(6):1187–1188. [Google Scholar]
- 3.Lehmann D, Ozaki H, Pal I EEG alpha map series: brain micro-states by space-oriented adaptive segmentation. Electroencephalogr Clin Neurophysiol. 1987;67(3):271–288. doi: 10.1016/0013-4694(87)90025-3. [DOI] [PubMed] [Google Scholar]
- 4.Chu C G, Wang X, Cai L H, et al Spatiotemporal EEG microstate analysis in drug-free patients with Parkinson's disease. NeuroImage Clin. 2020;25:102132. doi: 10.1016/j.nicl.2019.102132. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Michel C M, Koenig T. EEG microstates as a tool for studying the temporal dynamics of whole-brain neuronal networks: a review. Neuroimage, 2017, 180(Pt B): 577-593.
- 6.Murphy M, Whitton A E, Deccy S, et al Abnormalities in electroencephalographic microstates are state and trait markers of major depressive disorder. Neuropsychopharmacology. 2020;45(12):2030–2037. doi: 10.1038/s41386-020-0749-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Murphy M, Stickgold R, Öngür D Electroencephalogram microstate abnormalities in early-course psychosis. Biol Psychiatry Cogn Neurosci Neuroimaging. 2020;5(1):35–44. doi: 10.1016/j.bpsc.2019.07.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Damborská A, Tomescu M I, Honzírková E, et al EEG resting-state large-scale brain network dynamics are related to depressive symptoms. Front Psychiatry. 2019;10:548–557. doi: 10.3389/fpsyt.2019.00548. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Al Zoubi O, Mayeli A, Tsuchiyagaito A, et al EEG microstates temporal dynamics differentiate individuals with mood and anxiety disorders from healthy subjects. Front Hum Neurosci. 2019;13:56–66. doi: 10.3389/fnhum.2019.00056. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Hanoglu L, Toplutas E, Saricaoglu M, et al Therapeutic role of repetitive transcranial magnetic stimulation in Alzheimer's and Parkinson's disease: electroencephalography microstate correlates. Front Neurosci. 2022;16:798558. doi: 10.3389/fnins.2022.798558. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Vellante F, Ferri F, Baroni G, et al. Euthymic bipolar disorder patients and EEG microstates: a neural signature of their abnormal self-experience?. J Affect Disord, 2020, 272: 326-334.
- 12.Lian H, Li Y J, Li Y X Altered EEG microstate dynamics in mild cognitive impairment and Alzheimer's disease. Clin Neurophysiol. 2021;132(11):2861–2869. doi: 10.1016/j.clinph.2021.08.015. [DOI] [PubMed] [Google Scholar]
- 13.Mackintosh A J, Borgwardt S, Studerus E, et al EEG microstate differences in medicated vs. medication-naive first-episode psychosis patients. Front Psychiatry. 2020;11:600606. doi: 10.3389/fpsyt.2020.600606. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Pan Zhilin, Xiong Dongsheng, Xiao Huisi, et al The effects of repetitive transcranial magnetic stimulation in patients with chronic schizophrenia: insights from EEG microstates. Psychiatry Research. 2021;299:113866. doi: 10.1016/j.psychres.2021.113866. [DOI] [PubMed] [Google Scholar]
- 15.Jiang Y B, Zhu M Y, Hu Y, et al Altered resting-state electroencephalography microstates in idiopathic generalized epilepsy: a prospective case-control study. Front Neurol. 2021;12:710952. doi: 10.3389/fneur.2021.710952. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Peng A, Wang R, Huang J, et al Abnormalities of resting-state electroencephalographic microstate in rapid eye movement sleep behavior disorder. Front Hum Neurosci. 2021;15:728405. doi: 10.3389/fnhum.2021.728405. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Poskanzer C, Denis D, Herrick A, et al Using EEG microstates to examine post-encoding quiet rest and subsequent word-pair memory. Neurobiol Learn Mem. 2020;181:107424. doi: 10.1016/j.nlm.2021.107424. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Muthukrishnan S P, Ahuja N, Mehta N, et al Functional brain microstate predicts the outcome in a visuospatial working memory task. Behav Brain Res. 2016;314(1):134–142. doi: 10.1016/j.bbr.2016.08.020. [DOI] [PubMed] [Google Scholar]
- 19.Jabès A, Klencklen G, Ruggeri P, et al Resting-state EEG microstates parallel age-related differences in allocentric spatial working memory performance. Brain Topogr. 2021;34(4):442–460. doi: 10.1007/s10548-021-00835-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Zanesco A P, King B G, Skwara A C, et al Within and between-person correlates of the temporal dynamics of resting EEG microstates. NeuroImage. 2020;211(1):116631. doi: 10.1016/j.neuroimage.2020.116631. [DOI] [PubMed] [Google Scholar]
- 21.Kim K, Duc N T, Choi M, et al EEG microstate features according to performance on a mental arithmetic task. Sci Rep. 2021;11(1):343–356. doi: 10.1038/s41598-020-79423-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.D'Croz-Baron D F, Bréchet L, Baker M, et al Auditory and visual tasks influence the temporal dynamics of EEG microstates during post-encoding rest. Brain Topogr. 2021;34(1):19–28. doi: 10.1007/s10548-020-00802-4. [DOI] [PubMed] [Google Scholar]
- 23.Zanesco A P, Skwara A C, King B G, et al Meditation training modulates brain electric microstates and felt states of awareness. Hum Brain Mapp. 2021;42(10):3228–3252. doi: 10.1002/hbm.25430. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Faber P L, Travis F, Milz P, et al EEG microstates during different phases of transcendental meditation practice. Cogn Process. 2017;18(3):307–314. doi: 10.1007/s10339-017-0812-y. [DOI] [PubMed] [Google Scholar]
- 25.Pan D N, Hoid D, Gu R L, et al Emotional working memory training reduces rumination and alters the EEG microstate in anxious individuals. Neuroimage Clin. 2020;28:102488. doi: 10.1016/j.nicl.2020.102488. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Liu H, Tang H, Wei W, et al Altered peri-seizure EEG microstate dynamics in patients with absence epilepsy. Seizure. 2021;88(1):15–21. doi: 10.1016/j.seizure.2021.03.020. [DOI] [PubMed] [Google Scholar]
- 27.Seitzman B A, Abell M, Bartley S C, et al Cognitive manipulation of brain electric microstates. Neuroimage. 2017;146(1):533–543. doi: 10.1016/j.neuroimage.2016.10.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Bréchet L, Ziegler D A, Simon A J, et al Reconfiguration of electroencephalography microstate networks after breath-focused, digital meditation training. Brain Connect. 2021;11(2):146–155. doi: 10.1089/brain.2020.0848. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Guan K, Zhang Z, Chai X, et al EEG based dynamic functional connectivity analysis in mental workload tasks with different types of information. IEEE Trans Neural Syst Rehabil Eng. 2022;30:632–642. doi: 10.1109/TNSRE.2022.3156546. [DOI] [PubMed] [Google Scholar]
- 30.Kim K, Duc N T, Choi M, et al EEG microstate features for schizophrenia classification. PLoS One. 2021;16(5):e0251842. doi: 10.1371/journal.pone.0251842. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Baradits M, Bitter I, Czobor P Multivariate patterns of EEG microstate parameters and their role in the discrimination of patients with schizophrenia from healthy controls. Psychiatry Res. 2020;288(1):112938. doi: 10.1016/j.psychres.2020.112938. [DOI] [PubMed] [Google Scholar]
- 32.Musaeus C S, Engedal K, Høgh P, et al Changes in the left temporal microstate are a sign of cognitive decline in patients with Alzheimer's disease. Brain Behav. 2020;10(6):e01630. doi: 10.1002/brb3.1630. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Gotman J Automatic recognition of epileptic seizures in the EEG. Electroencephalography and Clinical Neurophysiology. 1982;54(5):530–540. doi: 10.1016/0013-4694(82)90038-4. [DOI] [PubMed] [Google Scholar]
- 34.Ahmadi N, Pei Y, Carrette E, et al EEG-based classification of epilepsy and PNES: EEG microstate and functional brain network features. Brain Inform. 2020;7(1):6. doi: 10.1186/s40708-020-00107-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.李昭阳, 伏云发 基于EEG微状态方法的视觉想象识别研究. 计算机工程与科学. 2021;43(3):465–472. [Google Scholar]
- 36.Li Y B, Chen M, Sun S, et al Exploring differences for motor imagery using Teager energy operator-based EEG microstate analyses. J Integr Neurosci. 2021;20(2):411–417. doi: 10.31083/j.jin2002042. [DOI] [PubMed] [Google Scholar]
- 37.Krylova M, Alizadeh S, Izyurov I, et al Evidence for modulation of EEG microstate sequence by vigilance level. NeuroImage. 2021;224(1):117393. doi: 10.1016/j.neuroimage.2020.117393. [DOI] [PubMed] [Google Scholar]
- 38.Li Y, Shi W, Liu Z, et al Effective brain state estimation during propofol-induced sedation using advanced EEG microstate spectral analysis. IEEE J Biomed Health Inform. 2020;25(4):978–987. doi: 10.1109/JBHI.2020.3008052. [DOI] [PubMed] [Google Scholar]



