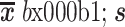Abstract
临床上,觉醒事件主要由睡眠技师手动标注,该方法耗时,且主观性强。本研究通过构建基于多尺度卷积和自注意力的卷积神经网络,用1 min单通道脑电信号作为模型的输入,实现端到端的觉醒事件自动检测。研究结果表明,相较于基线模型,本文所提出的方法的精确召回曲线下面积和受试者操作特征曲线下面积均提升约7%。此外,单模态和多模态对比结果显示,单通道脑电信号可实现觉醒事件的有效检测,而简单的多种模态拼接不能提升模型的性能。最后,基于本文所提出的模型,本研究在同一数据库上又实现了自动睡眠分期(平均准确率73%),展示了模型较好的扩展性。本研究为实现可靠的便携式睡眠监测提供了解决方案,同时任务迁移的使用也为临床睡眠数据的自动分析开辟了新道路。
Keywords: 觉醒事件检测, 脑电图, 多尺度卷积, 自注意力, 阻塞型睡眠呼吸暂停
Abstract
In clinical, manually scoring by technician is the major method for sleep arousal detection. This method is time-consuming and subjective. This study aimed to achieve an end-to-end sleep-arousal events detection by constructing a convolutional neural network based on multi-scale convolutional layers and self-attention mechanism, and using 1 min single-channel electroencephalogram (EEG) signals as its input. Compared with the performance of the baseline model, the results of the proposed method showed that the mean area under the precision-recall curve and area under the receiver operating characteristic were both improved by 7%. Furthermore, we also compared the effects of single modality and multi-modality on the performance of the proposed model. The results revealed the power of single-channel EEG signals in automatic sleep arousal detection. However, the simple combination of multi-modality signals may be counterproductive to the improvement of model performance. Finally, we also explored the scalability of the proposed model and transferred the model into the automated sleep staging task in the same dataset. The average accuracy of 73% also suggested the power of the proposed method in task transferring. This study provides a potential solution for the development of portable sleep monitoring and paves a way for the automatic sleep data analysis using the transfer learning method.
Keywords: Arousal events detection, Electroencephalogram, Multi-scale convolution, Self-attention, Obstructive sleep apnea
0. 引言
人的一生中有三分之一的时间是在睡眠中度过的,睡眠质量的好坏直接影响人们的身体健康、心情和生活质量[1]。阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是一种常见的睡眠呼吸障碍,成年人群中该病的发病率约为9%~38%[2-3]。频繁觉醒是OSA患者常见的临床特征之一。觉醒对于OSA患者有两方面的影响:① 生理方面。OSA患者发生呼吸暂停或低通气时,会引起机体短暂缺氧,致使大脑自发产生觉醒,进而刺激上呼吸道肌肉上提来吸入气体,即觉醒有助于促进呼吸暂停事件的终止。从这个角度分析,觉醒的发生具有减缓因呼吸暂停引起的不良后果的作用[4]。此外,频繁的觉醒会使自主神经不稳定,引起交感神经兴奋,导致睡眠结构片段化,睡眠不解乏,进一步使患者出现白天嗜睡的症状[5]。有研究显示,在睡眠过程中,仅频繁觉醒就可导致患者操作能力降低、情绪低落[6-7],以及主观和客观困倦的增加。觉醒对OSA 患者临床症状发病机制的研究至关重要,因此觉醒的识别和判读具有重大的临床意义。② 疾病诊断。OSA的严重程度是由睡眠呼吸暂停低通气指数(apnea-hypopnea index,AHI)来反映的,即每小时睡眠过程中发生呼吸暂停和低通气的次数。美国睡眠研究会(American academy of sleep medicine,AASM)最新判读规则(v2.6)推荐,低通气的判断需在气流下降的同时,伴有血氧饱和度下降或觉醒,因此觉醒事件的判读与OSA严重程度的评估直接相关[8]。
觉醒状态是可能导致清醒或仅引起一过性睡眠中断的短暂现象[9]。AASM(v2.6)将觉醒事件定义为:在睡眠过程中的非快速眼动(non rapid eye movement,NREM)期,如果脑电图(electroencephalogram,EEG)频率相较于背景波发生突然改变,这种改变包括α波、θ波或频率大于16 Hz(纺锤波除外)的波,至少持续3 s,且频率改变前有不少于10 s的稳定睡眠,则可将该状态判读为觉醒[4]。相较于NREM期觉醒事件的判读,快速眼动(rapid eye movement,REM)期觉醒事件的判读还需至少1 s颏肌电图(electromyogram,EMG)波幅的增高。多导睡眠图(polysomnography,PSG)监测是临床进行睡眠分析(睡眠分期、觉醒事件判读、呼吸事件和腿动事件判定)的主要手段[10]。标准PSG监测包括多种生理信号,如EEG、EMG、心电图(electrocardiogram,ECG)、眼电图、口鼻气流、鼾声、胸腹式呼吸运动、体位和血氧饱和度等。临床上,觉醒的判读主要由睡眠技师手动完成,该方法耗时、耗力,且对从业人员的经验和专业技能要求较高,主观性较强,导致较低的评分者信度[11]。因此,发展觉醒事件自动检测算法,有助于缓解从业者工作压力,并为相关睡眠疾病的评估和诊断提供重要信息。
深度学习方法的出现及其在生物医学信号处理上的成熟应用,为解决上述这些问题提供了更多的技术手段和途径。EEG信号是觉醒事件人工判读的“金标准”。此外,临床表征和近年来的一些研究表明,ECG和呼吸气流(airflow)等信号也与觉醒事件的检测密切相关[12-13]。Howe-Patterson等[14]构建了循环—卷积神经网络(convolutional neural network,CNN),用PSG中的12个通道信号作为模型的输入。该方法在测试集上所得的精确召回曲线下面积 (area under the precision-recall curve,AUPRC)为54%。Zabihi等[15]基于5个通道的电生理信号,构建一维CNN模型,在公开数据集上获得31%的AUPRC。Miller等[16]通过构建卷积-反卷积网络,使用13个通道的电生理信号,在所用的数据库上获得36.9%的AUPRC。这些研究虽均基于原始信号,但所使用的通道数目较多,致使模型复杂度高,计算开销大。Olesen等[17]基于单通道EEG信号,使用迁移学习方法实现觉醒事件的自动检测,其所得F1分数为69.4%。Chien等[18]同样基于单通道EEG信号,但其需要复杂的特征提取步骤,同时模型的性能受所提取的特征种类和分类器的选择影响较大。综上,现有关于觉醒事件自动检测的研究主要存在以下问题:
(1)模型结构复杂,计算开销大。现有相关研究中大多使用多模态信号作为模型的输入,无论是何种多模态融合方式,都会使模型的复杂度和计算开销成倍增加,但模型性能并没有得到相应程度的提升。
(2)单一模态和多模态对觉醒事件检测性能的差异并没有提及。多模态的使用涉及到模态融合方式的问题,不同的多模态融合方式会对结果产生较大的影响。如果只是单纯的多种模态简单拼接,其模型的性能相比单一模态,可能不会提升很多,甚至出现负增长,而现有研究并没有对比基于金标准的EEG信号和基于多模态这两种不同输入对模型性能的影响。
(3)模型可扩展性低。睡眠技师在临床工作中,对睡眠数据进行分析时,需兼顾睡眠分期、觉醒事件检测、呼吸事件检测、腿动事件检测等多种任务,因此模型的可扩展性对临床实际应用非常重要。而现有研究中的算法模型大都专一性较强,未考虑模型的可扩展性。
为解决以上问题,本研究拟构建模块化的CNN模型,探究单通道原始EEG信号在觉醒事件自动检测任务中的性能,以及同一模型扩展到其他相关任务上的可能性,为实现轻量级的便携式睡眠监测和高效的睡眠数据自动分析奠定基础。
1. 数据与方法
1.1. 数据来源
本研究使用的呼吸暂停、减肥手术和持续气道正压(The apnea,bariatric surgery and continuous positive airway pressure,ABC)睡眠数据库(网址为:https://sleepdata.org/datasets/abc),由匹兹堡大学组织建立,旨在评估减肥手术和持续气道正压通气两种治疗方式对患有II型肥胖合并OSA患者的疗效差异 [19]。该数据库的下载和使用需向美国国家睡眠研究库提交申请,本研究已获得数据的下载和使用许可。ABC数据库包含49位患者[年龄:(49.2±9.5)岁,范围:27~65岁;男/女:28/21;身体质量指数:34.3~45.3 kg/m2;AHI:13.0~129.5 次/h;觉醒指数(arousal index,ARI):19.7~124.6 次/h]的整夜PSG记录,数据采集自2011—2014年,共包括三个队列(基线、9个月后随访和18个月后随访)。本研究仅使用基线数据,即患者在进行相应的干预方式之前所采集的PSG。每个PSG记录了AASM推荐的36个导联信号,双极导联的参考电极为Fpz,EEG信号的采样频率为256 Hz,不同模态信号的采样频率不同,这些PSG的时长为7~9 h。
1.2. 数据预处理
数据预处理包含以下步骤:
(1)信号提取。经本文作者前期研究发现,相较于前额和枕区,中央区(C3、C4)能够较好地反映EEG信号的变化特点,且C4为AASM推荐的中央区记录导联,所以本研究首先从49个PSG记录中提取出C4-Fpz信号。
(2)信号重采样。为了之后和其它数据库的同类数据结果做对比,本文对该信号进行200 Hz的重采样。
(3)信号分割。30 s为AASM手动评分规则中推荐使用的帧长,但在临床工作中,通常会出现觉醒跨帧的情况,即一个觉醒事件的持续时间横跨两个相邻的帧[8]。因此本研究使用60 s滑动窗口和30 s的步长对C4-Fpz信号进行样本分割,分割后的每个样本形状为(1,12 000)。此外,为了避免因睡眠起始和结束时包含过多清醒(wake,W)期导致准确率偏高的现象,删除了PSG记录两端多余的W期信号,只保留了睡眠开始和结束后5 min的清醒时间。
(4)标签生成。临床上常见的觉醒事件可分为四类:自发觉醒、呼吸事件相关觉醒、腿动相关觉醒和周期性腿动相关觉醒。据本研究调查,对于OSA患者,呼吸事件相关觉醒在所有觉醒事件中占比最高,且该数据库对觉醒的标注,并没有区分所属类别。因此,在生成标签过程中,当人工评分的觉醒事件出现在60 s睡眠期时间窗内,且持续至少3 s时,该样本对应的标签为“1”;否则,为“0”。如图1所示为出现觉醒事件(方框标注)和正常睡眠状态下中央区EEG信号的示例。
图 1.
Examples of central EEG signals during sleep-arousal and normal sleep states
觉醒和正常睡眠状态下中央区EEG信号示例
1.3. 模型结构
基于本课题组前期睡眠分期的研究工作[20],本研究提出的卷积注意力模型结构及对比模型结构如图2所示。图2中的“卷积注意力模型”结构,主要包括多尺度卷积和自注意力(self-attention,SA)块。首先,N个(1,12 000)的样本(表示为I)输入到多尺度卷积中。本研究相较于文献[20],引入了多尺度卷积;其次,将多尺度卷积提取的特征输入到普通的卷积块中;然后,将卷积块提取的高级特征(表示为F)输送到SA块中;最后,使用全局平均池化(global average pooling,GAP)层将SA输出的特征转换为特征向量,并对当前样本是否包含觉醒事件进行检测。下面将依次介绍多尺度卷积和SA块的工作原理。
图 2.
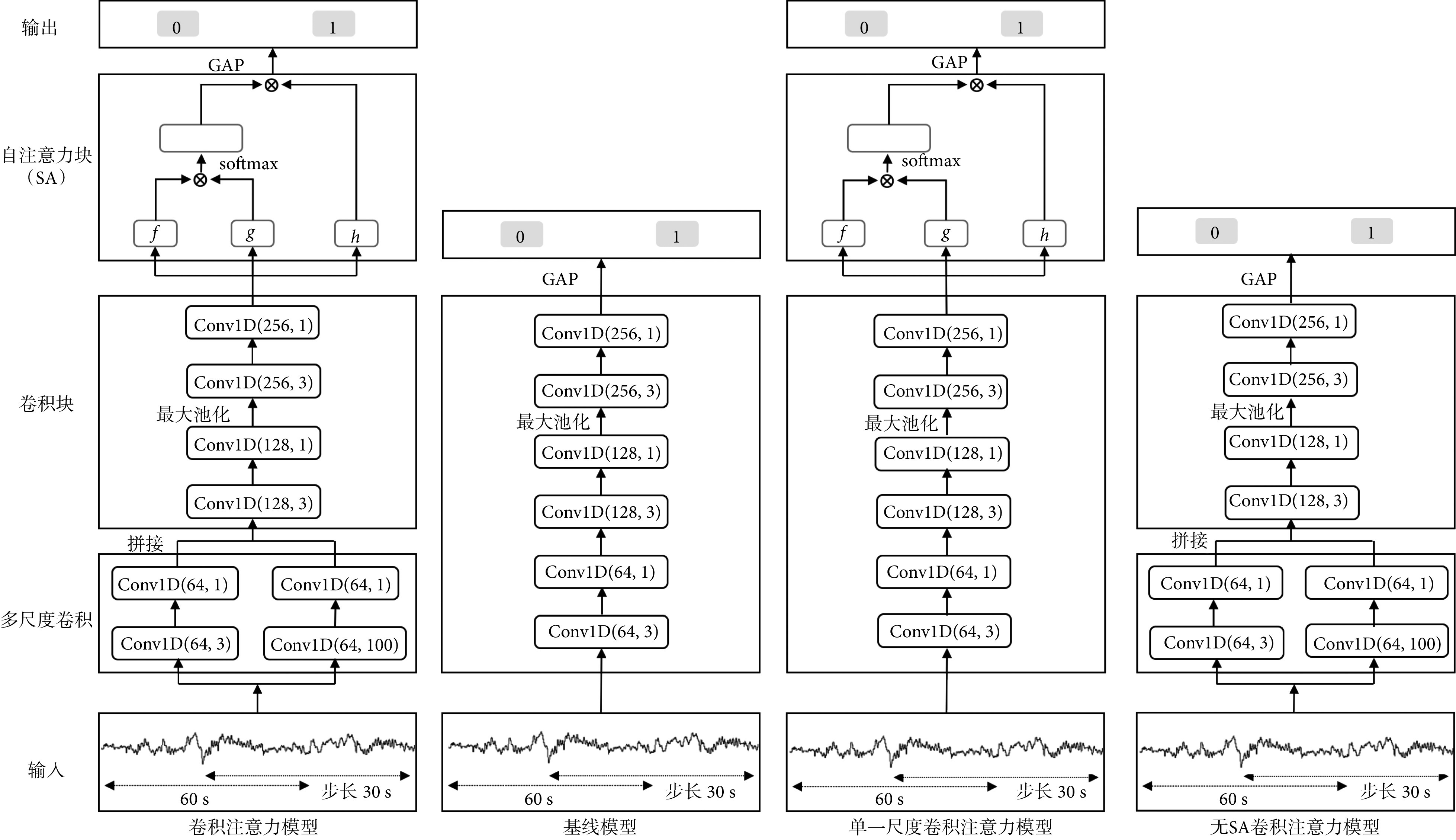
Model structures of the convolutional self-attention model and its variants
卷积注意力模型及其变体的结构
(1)多尺度卷积。多尺度卷积的计算过程如式(1)~式(3)所示。本文用Conv1D(m, n)表示卷积核数为m,卷积核大小为n的一维卷积层。如图2“卷积注意力模型”所示,模型的输入I分别与Conv1D(64,3)和Conv1D(64,100)进行卷积。其中,前者用来提取EEG信号中的时间信息(Bmin),后者用来提取EEG信号的频率特征(Bmax)。随后,将这两种类型的特征拼接起来(concatenate,Concat),形成特征集合(B)。
 |
1 |
 |
2 |
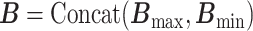 |
3 |
(2)SA块。SA已被成功应用到自然语言处理等任务中[21-22]。首先,由卷积块(卷积块中各个卷积层的m和n如图2所示)形成的特征图被映射为三组向量f、g和h。其次,将f和g向量点乘(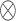 ),并除以h的维度(d)的开方。然后,用归一化指数函数(softmax)计算特征图的注意力权重(O)。该过程如式(4)~式(7)所示。
),并除以h的维度(d)的开方。然后,用归一化指数函数(softmax)计算特征图的注意力权重(O)。该过程如式(4)~式(7)所示。
 |
4 |
 |
5 |
 |
6 |
 |
7 |
GAP的有效性已在本课题组之前的研究中得到验证[20, 23]。本研究使用GAP将SA块的每个输出映射为特征值,进一步构成特征向量。最后,分类层根据该特征向量计算出有、无觉醒的概率,并给出预测结果。
2. 实验与结果
2.1. 实验
本研究使用7折交叉验证来评估算法的鲁棒性,即将49位患者的PSG数据平均分成7组,每折交叉验证中,其中一组作为测试集,其余6组用做训练集和验证集,如此循环7次,使每个PSG数据都能经过独立测试。模型在训练过程中,用回调函数(callback)来保存验证集上获得最高准确率时模型的权重,并用该权重对预留样本进行测试。此外,为了避免过拟合,同时节省训练时间,模型的训练还使用早停策略(early stopping)。模型的批训练大小和迭代次数分别设置为128和200。模型分别使用自适应估计(adaptive moment estimation,Adam)和多分类交叉熵损失函数(categorical_crossentropy)作为优化器和损失函数。平均准确率、F1分数常作为衡量二分类模型精确度的指标;且现有关于觉醒事件自动检测的文献多用AUPRC和受试者操作特征曲线下面积 (area under the receiver operating characteristic,AUROC)来评价所提出方法的性能,分别表示精确度—召回率曲线下的面积和真阳率—假阳率组成的曲线下的面积,其值越大,说明模型对阳性样本和阴性样本的区分度越高。基于此,本研究除了准确率外,还使用F1分数、AUPRC、AUROC共4个指标对模型的性能进行全面的评价。
2.2. 卷积注意力模型与其变体的结果对比
为了验证模型设计中多尺度卷积和SA块的有效性,本研究首先设置基线模型,其模型结构如图2中“基线模型”所示。对比图2“卷积注意力模型”,基线模型无多尺度卷积和SA块。其次,图2中“单一尺度卷积注意力模型”和“无SA卷积注意力模型”作为“卷积注意力模型”的变体,分别去除了“卷积注意力模型”中多尺度卷积的Conv1D(64,100)和SA块,以此验证多尺度卷积和SA块对觉醒事件自动检测的有效性。模型的输入和其它参数均与卷积注意力模型相同。
卷积注意力模型及其变体在测试集上的平均性能如表1所示。对比可知,本研究所提出的卷积注意力模型在相同的测试集上表现最好,且比基线模型的AUPRC和AUROC均提升约7%。① 与基线模型相比,单一尺度卷积注意力模型在四个评价指标上均有提升,平均提升率为6%;与卷积注意力模型相比,单一尺度卷积注意力模型在测试集上的性能下降约3%。此对比结果表明,多尺度卷积的设计有助于提升模型对觉醒和非觉醒的识别能力。② 与基线模型相比,无SA卷积注意力模型在测试集上的各个性能指标同样都有提升,且最大提升率4%;对比于卷积注意力模型,在同样的测试集上,无SA卷积注意力模型在所有评价指标上的性能均有所下降,且平均降低4%。这一对比结果证明了SA在本研究任务上的优势。③ 将单一尺度卷积注意力模型和无SA卷积注意力模型的性能进行对比,前者的平均结果优于后者,虽然平均提升率小于2%,但说明SA对模型性能的影响更大。
表 1. Average results of automatic detection of arousal events based on the convolutional self-attention model and its variants( ).
).
基于卷积注意力模型及其变体的觉醒事件自动检测平均结果( )
)
| 网络模型 | 准确率(%) | F1分数(%) | AUPRC(%) | AUROC(%) |
| 卷积注意力模型 | 81.9 ± 5.0 | 74.9 ± 12.6 | 68.1 ± 17.2 | 78.9 ± 6.5 |
| 30 s-卷积注意力模型 | 81.9 ± 8.0 | 64.3 ± 13.3 | 55.7 ± 17.2 | 75.0 ± 7.0 |
| 基线模型 | 74.2 ± 9.0 | 65.8 ± 13.9 | 60.7 ± 18.9 | 72.3 ± 7.8 |
| 单一尺度卷积注意力模型 | 79.2 ± 6.7 | 71.3 ± 12.2 | 65.2 ± 17.7 | 76.5 ± 6.4 |
| 无SA卷积注意力模型 | 78.3 ± 8.0 | 70.4 ± 14.2 | 63.9 ± 18.7 | 75.3 ± 7.3 |
此外,为了验证时间窗对模型性能的影响,基于所提出的卷积注意力模型,本研究又对单通道EEG信号进行30 s分割。分割后的样本其训练集和测试集的划分与前文60 s样本完全相同,由此保证对比的有效性。基于30 s时间窗的觉醒事件自动检测结果如表1(30 s-卷积注意力模型)所示。可以看出,模型以30 s和60 s两种不同时长的EEG信号作为输入样本时,在测试集上获得相同的准确率。需注意的是,因觉醒事件的跨帧出现,以30 s和60 s的时间窗分割EEG信号时所得到的觉醒和非觉醒样本和标签会有所不同。30 s分割得到觉醒和非觉醒样本数分别为14 502和31 324,不同类别的样本数目并不平衡。60 s分割后两类样本所占比例几乎一致(觉醒:20 839,非觉醒:25 963)。大量研究指出,使用准确率对类别不平衡任务性能的评价是不够的,还需借用其它指标进行更合理充分的评估。基于30 s样本的输入的模型结果可能受到样本类别不平衡的影响,其F1分数、AUPRC和AUROC均有下降,尤其在F1分数和AUPRC上,平均下降约12%。
2.3. 人工标注和自动检测所得ARI的比较
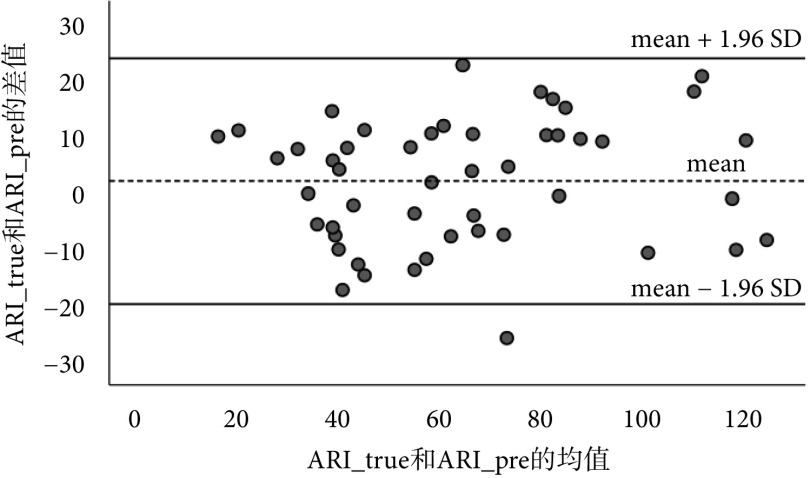
ARI作为睡眠质量评估的一个重要指标,在正常人群中,随着年龄的增长而增加[24]。为了评估本文模型预测的ARI(ARI_pre)和人工评分得到的ARI(ARI_true)的一致性程度,本研究使用由布兰德-奥特曼(Bland-Altman)提出的Bland-Altman差异图,对两者的一致性测量进行可视化,如图3所示。图3的横坐标为两种方法的平均值,纵坐标为两种方法的差值。中间线条表示差值的平均值(mean),上下线条为95%一致性界限的上下限。如果散点基本均落在95%一致性区间,即1.96个标准差(standard deviation,SD)范围内,则说明一致性情况良好。
图 3.
Bland-Altman plot of consistency test for arousal detection between manual method and the automatic method proposed in this research
人工评分和本研究提出的自动觉醒检测方法两者一致性检验的Bland-Altman图
49个样本的ARI_true和ARI_pre平均值分别为64.42和62.39。使用配对t检验对两种方法所得的ARI值进行差异分析,结果显示两者之间的差异无统计学意义(P = 0.198 > 0.05),说明两种测量方法具有一致性。此外,图3中的散点数据大都分布于95%置信区间内(近1个特例),进一步反映两种方法在测试数据上具有较好的一致性,同时表明本研究所提出的觉醒事件自动检测方法有望达到人工评分的水平。
2.4. 卷积注意力网络与其他模型结果对比
为进一步显示所构建的卷积注意力模型的优势,使用与本研究相同的样本,本研究将本文的结果与基于文献[14, 25-26]中提出的三种典型深度学习模型所得的结果进行对比。为了降低模型开销,且与本研究所用数据样本量匹配,在进行对比实验时,本研究对三个模型的原始结构进行适当修改:将文献[14]提出的深度循环CNN(deep recurrent CNN,DRCNN)中的前两个模块的数量分别减至1和3;将DRCNN和文献[25]中所构建模型(DeepSleep2.0)的输入通道数设置为1;将文献[26]中构建的深度神经网络(deep neural networks, DNNs)中的第二个池化残差块的模块数量改为3。基于修改后的对比模型,七折交叉验证的平均结果如表2所示。
表 2. Average results comparison of automatic detection of arousal events based on the convolutional self-attention model and the models in references [14, 25-26] ( ).
).
| 网络模型 | 准确率(%) | F1分数(%) | AUPRC(%) | AUROC(%) |
| 卷积注意力网络 | 81.9 ± 5.0 | 74.9 ± 12.6 | 68.1 ± 17.2 | 78.9 ± 6.5 |
| DRCNN | 80.5 ± 5.2 | 69.4 ± 13.0 | 62.5 ± 19.8 | 65.1 ± 8.2 |
| DeepSleep 2.0 | 75.3 ± 6.7 | 68.0 ± 13.3 | 60.1 ± 21.4 | 63.4 ± 11.7 |
| DNNs | 78.6 ± 6.1 | 72.6 ± 11.4 | 65.3 ± 19.6 | 70.2 ± 9.5 |
由表2可知,相较于其他文献中使用的模型,本研究提出的卷积注意力模型,在相同数据集上的测试结果最好。上述文献中DRCNN和DeepSleep2.0网络是基于多模态信号输入设计的,模型的复杂度相对较高,当使用本研究的单通道EEG信号作为这两个模型的输入时,模型的性能会有所下降。此外,DRCNN和DeepSleep2.0模型结构的顶层皆为双向长短时记忆网络(long short term memory network,LSTM),其模型性能均好于DeepSleep2.0网络,但LSTM的加入增加了模型的训练时长。
3. 讨论
本研究提出了一种基于CNN的觉醒事件自动检测方法,模型的设计中引入多尺度卷积和SA块。此外,考虑到临床实际中觉醒事件的跨帧出现,且EEG信号是手动觉醒评分的金标准,本研究采用60 s时间窗的单通道EEG信号作为模型的输入,来实现觉醒事件的自动检测。在开源睡眠数据库上的测试结果显示了本研究所提出方法的有效性。以下针对研究过程中出现的问题进行讨论。
(1)模态选择。现有关于觉醒自动检测的研究大多基于多通道EEG信号或多模态的组合,借助于ECG、EMG信号等提供的辅助信息来提高算法的性能。本研究在前人研究的基础上,基于图2中的卷积注意力模型,探究了分别基于EEG、ECG、airflow三种单模态的觉醒事件自动检测方法,以及基于EEG、ECG和airflow的多模态觉醒事件自动检测。在进行单模态觉醒事件检测实验时,首先从PSG中分别提取三种单模态信号,并按照前文1.2节对三种模态数据进行预处理。为了消除不同模态量纲差异的影响,对每个样本三种不同模态的数据进行归一化。然后,基于所构建的模型,使用每种模态预处理后的数据对模型进行训练和测试,进而得到模型在不同单模态下觉醒事件自动检测的性能。针对基于多模态信号的觉醒检测对比实验,首先从PSG记录中同时提取EEG、ECG、airflow三种信号,并对三种模态信号按行拼接。然后,对该多模态信号做数据截断,生成新的训练样本。最后,用二维卷积层替换卷积注意力模型中的Conv1D(m,n),并用生成的多模态数据对模型进行训练和测试,以得到模型在多模态信号融合时觉醒事件自动检测的性能。
如图4所示,为模型分别以不同单模态信号和多模态信号为输入时,七折交叉验证的平均结果。由图4可知,基于单模态EEG信号的模型在所用数据上可获得最好的性能;以多模态信号为输入时,模型的性能仅次于单模态EEG信号;而以单模态ECG信号作为模型输入样本时,检测性能较差。这些对比结果进一步表明,单通道EEG信号在觉醒事件自动检测任务上的可靠性和可行性。虽然多模态的输入可以从多个维度为目标任务提供信息,但因其模态结合方式的多样性,对结果影响较大,且模型的计算开销比单一模态信号的输入大很多,因此后续研究需要统筹模型性能和计算开销,选择合理、合适的模态执行目标任务检测。
图 4.
Comparison of automatic detection results of arousal events obtained from the proposed model based on different kinds of modality signals
本研究所提出模型基于不同模态信号的输入所得觉醒事件自动检测结果的对比
(2)时间窗选取。时间窗对觉醒事件自动检测性能影响较大。因人工标注过程中,觉醒事件经常跨帧出现,30 s的分割会使阳性率降低,由此导致睡眠质量评估和呼吸事件检测结果过于乐观。以60 s为时间窗进行样本分割,能充分考虑觉醒事件的完整性和EEG信号的连续性,长时程的输入有助于模型学习到EEG信号序列前后的相关性,因此本研究认为基于60 s时间窗的数据分割有助于提升觉醒事件自动检测性能。
(3)模型灵活性。临床上,觉醒事件检测和睡眠分期的金标准都是EEG信号,因此本研究试图将该模型应用在睡眠分期任务上。针对自动睡眠分期任务,由于输入样本时长为60 s,即两个连续的睡眠帧,睡眠分期标签的生成规则为:若两个连续睡眠帧的专家分期相同,该期即为对应60 s样本的标签;若该样本为睡眠过度阶段,其标签为分期最高的睡眠期,例如若相邻两个期中的一个为W期,另一个为NREM 1~3期(N1~N3)或REM期,则该样本的标签为对应的睡眠期;若相邻两个期分别是N2和N3,则该60 s样本对应的标签为“3”(N3期);若相邻两个睡眠期分别为N3和REM,则对应样本的标签为“5”(REM期)。此外,在模型的设置上,除了输出层(神经元个数为5)与前文所构建的卷积注意力模型不同外,其余模型结构及参数设置均不变。在此基础上,对睡眠分期任务进行训练和测试。经七折交叉验证后,模型在测试集上所得的平均准确率和F1分数分别为73%和75%。这一结果表明所设计的模型具有很强的灵活性及可扩展性,为实现睡眠大数据的多任务分析奠定了基础。
4. 结论
觉醒指数是睡眠质量评估的重要指标,尤其对于OSA患者,觉醒事件的检测至关重要。本研究提出一种模块化的卷积注意力模型进行觉醒事件的自动检测,该方法使用60 s单通道EEG信号作为模型的输入,在开源睡眠数据库上获得较好的测试结果,证明了多尺度卷积和SA在觉醒事件自动检测任务上的可行性。此外,本研究探究了不同模态信号对模型觉醒事件检测性能的影响,验证了单通道EEG信号对觉醒自动检测的优势,结果显示,简单多模态信号拼接并不能提升模型的性能,甚至起相反作用。最后,所提出的模型具有小型、紧凑、可扩展性强的优点,将其迁移到自动睡眠分期任务上,实现了较高准确率的自动睡眠分期,为进一步实现睡眠数据自动分析领域任务迁移和多任务结合奠定基础。
重要声明
利益冲突声明:本文全体作者均声明不存在利益冲突
作者贡献声明:李凡主要负责数据分析、论文撰写和修改;许艳主要负责文献查询和整理;张斌和丛丰裕主要负责论文指导及审校。
Funding Statement
国家自然科学基金资助项目(91748105, 81471742);国家重点研发计划资助项目(2021YFC2501500)
National Natural Science Foundation of China; National Key Research and Development Program of China
References
- 1.Vaccaro A, Kaplan Dor Y, Nambara K, et al Sleep loss can cause death through accumulation of reactive oxygen species in the gut. Cell. 2020;181(6):1307–1328. doi: 10.1016/j.cell.2020.04.049. [DOI] [PubMed] [Google Scholar]
- 2.Benjafield A V, Ayas N T, Eastwood P R, et al Estimation of the global prevalence and burden of obstructive sleep apnoea: a literature-based analysis. The Lancet Respiratory Medicine. 2019;7(8):687–698. doi: 10.1016/S2213-2600(19)30198-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Senaratna C V, Perret J L, Lodge C J, et al Prevalence of obstructive sleep apnea in the general population: a systematic review. Sleep Medicine Reviews. 2017;34(70):70–81. doi: 10.1016/j.smrv.2016.07.002. [DOI] [PubMed] [Google Scholar]
- 4.Berry R B, Gleeson K Respiratory arousal from sleep: mechanisms and significance. Sleep. 1997;20(8):654–675. doi: 10.1093/sleep/20.8.654. [DOI] [PubMed] [Google Scholar]
- 5.董霄松. 2006北京国际睡眠医学论坛//觉醒和呼吸性微觉醒的判读及其临床意义,北京: 中华医学会继续教育部, 2006: 174–176.
- 6.曹征涛, 杨军, 朱莹莹, 等 一种基于微动敏感床垫的识别与呼吸事件相关的微觉醒的新算法. 仪器仪表学报. 2008;29(4):378–381. [Google Scholar]
- 7.Barbé None, Pericás J, Muñoz A, et al Automobile accidents in patients with sleep apnea syndrome: an epidemiological and mechanistic study. Am J Respir Crit Care Med. 1998;158(1):18–22. doi: 10.1164/ajrccm.158.1.9709135. [DOI] [PubMed] [Google Scholar]
- 8.Berry R B, Quan S F, Abreu A R, et al. The AASM manual for the scoring of sleep and associated events: rules, terminology and technical specifications. Version 2.6. Darien: Americal Academy of Sleep Medicine, 2020.
- 9.Mccormick D A, Bal T Sleep and arousal: thalamocortical mechanisms. Annual Review of Neuroscience. 1997;20:185. doi: 10.1146/annurev.neuro.20.1.185. [DOI] [PubMed] [Google Scholar]
- 10.中国医师协会神经内科医师分会睡眠障碍专业委员会, 中国睡眠研究会睡眠障碍专业委员会, 中华医学会神经病学分会睡眠障碍学组 中国成人多导睡眠监测技术操作规范及临床应用专家共识. 中华医学杂志. 2018;98(47):3825–3831. doi: 10.3760/cma.j.issn.0376-2491.2018.47.004. [DOI] [Google Scholar]
- 11.Bonnet M H, Doghramji K, Roehrs T, et al The scoring of arousal in sleep: reliability, validity, and alternatives. Journal of Clinical Sleep Medicine. 2007;3(2):133–145. doi: 10.5664/jcsm.26815. [DOI] [PubMed] [Google Scholar]
- 12.Li A, Chen S, Quan S F, et al A deep learning-based algorithm for detection of cortical arousal during sleep. Sleep. 2020;43(12):zsaa120. doi: 10.1093/sleep/zsaa120. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Simonnet M, Gourvennec B, BillotI R. Connected heart rate sensors to monitor sleep quality: electrodes, chest belt and smartwatch users acceptability//2016 IEEE 1st International Conference on Connected Health: Applications, Systems and Engineering Technologies (CHASE), Washington: IEEE, 2016: 344–345.
- 14.Howe-Patterson M, Pourbabaee B, Benard F. Automated detection of sleep arousals from polysomnography data using a dense convolutional neural network//2018 Computing in Cardiology Conference (CinC), Maastricht: IEEE, 2018. DOI: 10.22489/CinC.2018.232.
- 15.Zabihi M, Rad A B, Kiranyaz S, et al. 1D convolutional neural network models for sleep arousal detection. ArXiv, 2019. DOI: 10.48550/arXiv.1903.01552
- 16.Miller D, Ward A, Bambos N. Automatic sleep arousal identification from physiological waveforms using deep learning// 2018 Computing in Cardiology Conference (CinC), Maastricht: IEEE, 2018. DOI: 10.22489/CinC.2018.242.
- 17.Olesen A N, Jennum P, Mignot E, et al. Deep transfer learning for improving single-EEG arousal detection//42nd Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC), Montreal: IEEE, 2020: 99-103.
- 18.Chien Y R, Wu C H, Taso H W Automatic sleep-arousal detection with single-lead EEG using stacking ensemble learning. Sensors. 2021;21(18):6049. doi: 10.3390/s21186049. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Zhang G Q, Cui L, Mueller R, et al The national sleep research resource: towards a sleep data commons. Journal of the American Medical Informatics Association. 2018;25(10):1351–1358. doi: 10.1093/jamia/ocy064. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Li F, Yan R, Mahini R, et al. End-to-end sleep staging using convolutional neural network in raw single-channel EEG. Biomedical Signal Processing and Control, 2021. DOI: 10.1016/j.bspc.2020.102203.
- 21.Vaswani A, Shazeer N, Parmar N, et al. Attention is all you need//Neural Information Processing Systems (NIPS), Long Beach, 2017: 6000–6010. DOI: 10.48550/arXiv.1706.03762.
- 22.Cheng Jianpeng, Dong L, Lapata M. Long short-term memory-networks for machine reading// Proceedings of the 2016 Conference on Empirical Methods in Natural Language Processing (EMNLP), Austin, 2016: 551–561. DOI: 10.18653/v1/d16-1053.
- 23.Li F, Tang H, Shang S, et al Classification of heart sounds using convolutional neural network. Applied Sciences. 2020;10(11):3956. doi: 10.3390/app10113956. [DOI] [Google Scholar]
- 24.Bonnet M H, Arand D L EEG arousal norms by age. Journal of Clinical Sleep Medicine. 2007;3(3):271–274. doi: 10.5664/jcsm.26796. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Fonod R DeepSleep 2. 0: automated sleep arousal segmentation via deep learning. AI. 2022;3(1):164–179. [Google Scholar]
- 26.He R, Wang K, Zhao N, et al. Identification of arousals with deep neural networks (DNNs) using dfferent physiological signals//2018 Computing in Cardiology Conference (CinC), Maastricht: IEEE, 2018. DOI: 10.22489/CinC.2018.060.