RESUMEN
Please Note: The following translation has been supplied by the authors, and was not reviewed nor published by Proceedings B.
La transmisión de Trypanosoma cruzi, el agente etiológico de la enfermedad de Chagas, por medio de excrementos provenientes de insectos triatominos es extremamente ineficiente. Sin embargo, este parásito surge con frecuencia y ha infectado millones de personas y animales domésticos. Aquí, reunimos los resultados de los estudios realizados en Arequipa, Perú y sus alrededores sobre la transmisión de T. cruzi. En repetidas ocasiones observamos colonias con gran número de insectos triatominos (>1000) con alta prevalencia de infección (>85%). Por medio de la inoculación de cobayos (“cuyes”), los cuales son importantes portadores de T. cruzi en Perú, y su posterior uso para alimentar a los insectos triatominos, demostramos que aunque la mayoría de animales controlan la parasitemia rápidamente, un subconjunto de ellos permanece altamente infeccioso a vectores por varios meses. Sin embargo, sostenemos que la presencia de huéspedes persistentemente infecciosos es insuficiente para explicar la prevalencia de T. cruzi observada en colonias de vectores. Nosotros postulamos que las lluvias estacionales, cuyos efectos incluyen la fluctuación en el precio de comida para el cuy (alfalfa), lo que a su vez conlleva al consumo de los mismos en los fiestas locales anuales y así aumenta la concentración de vectores en pequeñas subpoblaciones de animales mantenidos para reproducción y puede propulsar la transmisión de T. cruzi a través de colonias de vectores que permanecen en el área, y crear una fuerza de infección considerable para un patógeno cuya transmisión podría desaparecer en otras situaciones.
Palabras Clave: Cuellos de Botella, Cuyes, Triatoma infestans, Trypanosoma cruzi, Enfermedad de Chagas
INTRODUCCIÓN
El mal de Chagas afecta a millones de personas en toda Latinoamérica. La transmisión del agente etiológico, Trypanosoma cruzi, a huéspedes mamíferos por medio del contacto con los excrementos provenientes de insectos triatominos infectados fue descrita hace más de cien años [1]. Si bien el parásito puede ser adquirido oralmente (por medio de la ingestión de insectos o productos alimenticios contaminados con heces de insectos), congénitamente, o por medio de transfusiones de sangre, la transmisión por vectores es responsable para por la mayoría de los casos [2]. La transmisión por medio de vectores ocurre cuando las heces contaminadas de triatominos ingresan al huésped por el sitio de picadura o por medio de sus membranas mucosas. Este tipo de transmisión es muy ineficiente—para que la transmisión sea exitosa, el insecto debe no sólo defecar en el huésped durante o poco después de haberse alimentado, pero el huésped debe también rascarse inadvertidamente y llevar el parásito a través de la picadura o ponerlo en contacto con una membrana mucosa [3,4]. Trabajos anteriores han estimado que en promedio, más de 1400 picaduras de triatominos infectados son necesarias para causar una infección nueva de T. cruzi en cuyes [5], mientras que más de 1700 picaduras son necesarias para infectar un ser humano [4].
La ineficiencia de la transmisión de vectores a huéspedes lleva a una paradoja aún sin resolver en modelos de transmisión de T. cruzi. A pesar de que T. cruzi es demasiado difícil de contraer, en muchas comunidades, la prevalencia de la infección en humanos excede el 40% [6–9]. Esta prevalencia podría surgir potencialmente si un gran número de vectores infecciosos se encuentran en contacto cercano con una población huésped. ¿Cómo podría el número de vectores infectados alcanzar tales niveles, si infectarse es tan difícil para los huéspedes?
Aquí describimos nuestra detección, a través de un estudio transversal conducido en los alrededores de la ciudad de Arequipa, Perú, de colonias del vector Triatoma infestans altamente infectadas, cuya prevalencia parasitaria muchas veces alcanza 80% (Figura 1). Todas las colonias altamente infectadas fueron obtenidas en corrales de cuyes, los cuales son comúnmente criados para consumo humano en esa región. En las siguientes secciones, presentamos varias hipótesis que tratan de explicar la alta prevalencia de T. cruzi en estos insectos. Exploramos cada hipótesis por medio de modelos matemáticos basados en los modelos de Ross y MacDonald usados para la transmisión de malaria [10–13]. Guiados por los resultados de estos modelos, realizamos una serie de estudios de laboratorio para evaluar los mecanismos alternativos mediante los cuales la infección parasitaria de vectores podría alcanzar los altos niveles obtenidos en nuestros estudios de campo.
Figura 1.
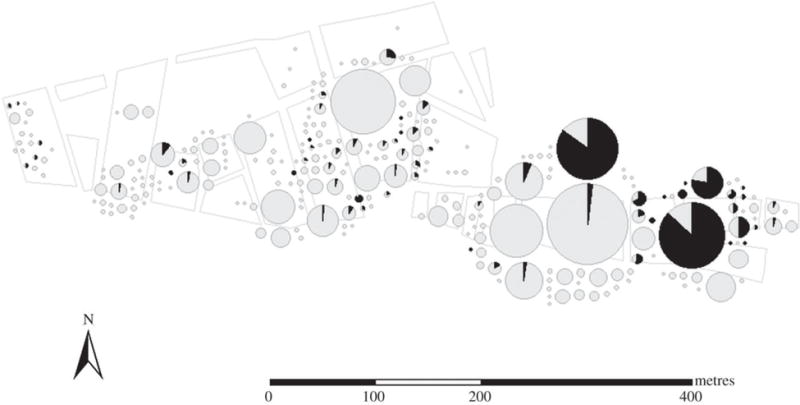
Distribución espacial del estado de infección de T. cruzi de colonias de T. infestans colectadas en la comunidad de Villa La joya, Arequipa, Perú, entre agosto y noviembre de 2008. Colonias vectores son representadas por gráficos circulares escalados por el número de vectores (desde 1 hasta 1414) colectados en cada sitio. La proporción de insectos triatominos infectados con T. cruzi es mostrada en negro.
Hipótesis I: T. cruzi es transmitido entre insectos por medio de coprofagia, sin pasar por un huésped mamífero y portador intermediario
Un posible proceso que podría aumentar la prevalencia del parásito en colonias vectores es la transmisión directa entre insectos, sin necesidad de un huésped mamífero intermediario. La ingestión de heces, conocida como coprofagia, es un mecanismo por el cual esta transmisión horizontal podría ocurrir. T. infestans depende de bacterias simbióticas en su tracto digestivo para digerir la sangre de la que se alimenta [14,15]. Los insectos no nacen con estos simbiontes. Por el contrario, los adquieren por medio de la ingestión de excrementos provenientes de otros insectos [16]. Una observación aislada [17] incrementó la posibilidad de que T. infestans pueda también adquirir T. cruzi por esta ruta, aunque la frecuencia de estas infecciones pareció baja. Aun así, la eficiencia de la transmisión vía coprofagia puede ser dependiente de la cepa, y una cepa particular de T. cruzi puede haberse adaptado a la transmisión por coprofagia. Para evaluar el potencial de transmisión coprófaga en la dinámica de transmisión, modificamos el modelo Ross-MacDonald y calculamos la fuerza coprófaga de infección, necesaria para producir la prevalencia parasitaria observada en las poblaciones vectores. Luego realizamos un experimento para examinar si dichos valores de fuerza coprófaga de la infección pueden ocurrir.
En adición a la coprofagia, puede que haya la posibilidad de que T. cruzi pueda ser transmitido de un insecto a otro por medio de ‘cleptohemodeipnonismo’, el cual es un comportamiento en el que una ninfa falta de alimento perfora el exoesqueleto de una ninfa alimentada, e ingiere su hemolinfa [18]. Una revisión del rol del ‘cleptohemodeipnonismo’ en la transmisión de T. cruzi por T. infestans concluyó que era improbable que este fuera de importancia epidemiológica [19] debido a la rareza de este comportamiento. Con base en nuestras observaciones, ese comportamiento es igualmente inusual entre T. infestans locales; por lo tanto, no investigamos si el ‘cleptohemodeipnonismo’ puede haber llevado a la alta prevalencia de T. cruzi en las poblaciones de vectores que observamos.
Hipótesis II. Una especie reservorio aparte de los cuyes está conduciendo la transmisión de T. cruzi a través de vectores recogidos cerca a corrales de cuyes
Contribuyendo aún más a la paradoja de poblaciones vectores altamente infectadas en los corrales de cuyes, está la baja prevalencia de infección entre los cuyes que se encuentran en estos corrales. En nuestras inspecciones encontramos solamente entre 2 y 5% de los animales mostrando signos serológicos de infección, determinados por medio de ensayos por inmunoabsorción ligados a enzimas (ELISAs). Con base en estos resultados, hipotetizamos que los vectores pueden ser infectados cuando se alimentan de otras especies huéspedes, quizás otros roedores que sean atraídos a la comida en estos recintos [20]. Para evaluar esta posibilidad, realizamos análisis molecular de la sangre ingerida por los insectos que fueron obtenidos de las colonias vectores altamente infectadas.
Hipótesis III. Huéspedes persistentemente infecciosos conducen el parásito a través de poblaciones vectores
Después de haber adquirido T. cruzi de un vector, los huéspedes mamíferos experimentan un periodo temporal de parasitemia durante el cual los parásitos circulantes se hacen presentes en la sangre periférica. Durante este periodo de parasitemia, el cual es típicamente breve, los animales son capaces de infectar a otros vectores. Estudios previos de la transmisión de T. cruzi en animales, incluyendo cuyes [21], ratones [22], y perros [23] han sido en gran parte realizados en la ausencia de vectores, con la excepción de la aplicación controlada de insectos como método xenodiagnóstico [24], y por lo tanto deben depender de las cantidades de parásitos en la sangre periférica como aproximaciones de la infecciosidad a vectores. Nosotros razonamos que este mecanismo puede ser imperfecto, y enmascarar una heterogeneidad significante entre los huéspedes en su habilidad de infectar insectos. Por consiguiente, realizamos estudios para medir el número de triatominos infectados por diferentes cuyes durante el curso de la infección. Documentamos una heterogeneidad significativa entre los animales y su habilidad de controlar el parásito, e identificamos un número de individuos persistentemente infecciosos los cuales infectaron vectores mucho después de que otros animales hubieran controlado al parásito. Hipotetizamos que la presencia de dichos cuyes persistentemente infecciosos en poblaciones de campo podría potencialmente incrementar la transmisión y prevalencia de la infección de vectores más allá de lo esperado en una población huésped homogénea. Para evaluar esta hipótesis, usamos el modelo RossMacDonald [12,13], e incluimos heterogeneidad entre los hospederos en la duración de su infecciosidad. Procedemos a evaluar la posibilidad de que dichos hospederos pudieran conducir el parásito a los altos niveles observados en las colonias de vectores recogidas en el campo.
Hipótesis IV. El sacrificio estacional de las poblaciones de hospederos conduce el parasitismo a través de las colonias de insectos, por medio de la concentración de vectores en un pequeño grupo de hospederos
Los cuyes son alimentados principalmente con alfalfa, el cual contiene prácticamente, todos los nutrientes que estos necesitan para un crecimiento óptimo [25]. La alfalfa es un cultivo muy dependiente del agua [26], y su precio fluctúa marcadamente con la disponibilidad de este recurso. En el 2009, el año siguiente a nuestro muestreo de vectores, el precio de la alfalfa se triplicó durante los meses de Mayo, Junio y Julio (Figura 2). Usando información de grupos focales y entrevistas a profundidad conducidas durante nuestro estudio [27], encontramos que la triplicación del precio del alfalfa llevo a muchos residentes a sacrificar la mayoría de los cuyes, reteniendo sólo unos pocos para poder reponer la población cuando esto fuera económicamente factible. Evaluamos el efecto de estos cuellos de botella en la población hospedera por medio de una simulación basada en el modelo Ross-MacDonald.
Figura 2.
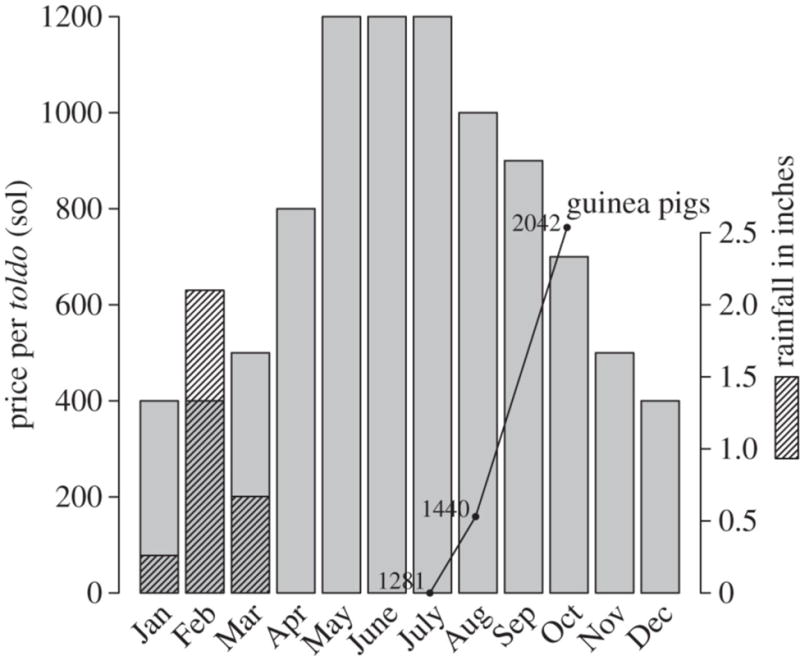
Precios mensuales de alfalfa en Arequipa, Perú, durante el año 2009. Los precios se encuentran en la moneda peruana (el Sol) y son medidas por toldo, una medida local usada en transacciones de alfalfa. Precipitación mensual en Arequipa por el mismo año (en pulgadas) es mostrada en las barras discontinuadas, con escala proveída en el eje derecho. La población de cuy en el área de estudio, estimada por entrevistas conducidas en julio, agosto y octubre del año previo, es sobrepuesta para demostrar la correlación inversa con la tendencia anual en el precio de la alfalfa. Los datos de los cuyes están en la escala del eje izquierdo, pero se encuentran acodados con el propósito de que el tamaño de la población en julio esté en el eje.
MÉTODOS
Datos de campo
Encuestas entomológicas fueron conducidas en el distrito La Joya de la ciudad de Arequipa, Perú entre los meses de Agosto y Noviembre de 2008. Una búsqueda llevada a cabo por una persona, por un periodo de una hora, en busca de triatominos, la cual incluyó el examen sistemático de espacios de vida humana y de animales, fue conducida en todos los hogares participantes [28]. Un spray de Tetrametrina (Sapolio Mata Moscas©) fue usado para desalojar los lugares en los que los insectos se escondían. Los especímenes de T. infestans capturados fueron transportados al laboratorio de campo para enfermedades zoonóticas Universidad Peruana Cayetano Heredia/University of Pennsylvania basado en Arequipa. El número, estadio evolutivo, y sexo (para los adultos) de los insectos recogidos fueron documentados en el sitio de colección de los mismos. Los contenidos intestinales de los insectos fueron examinados microscópicamente a 400× para la detección de T. cruzi [29,30].
Experimento 1: Transmisión de T. cruzi por medio de coprofagia
Para estimar la proporción de transmisión de T. cruzi vía coprofagia, colocamos 30 huevos de T. infestans incubados en colonias, en contenedores pequeños con un solo adulto. Realizamos diez réplicas de este experimento; cinco con adultos infectados y cinco con adultos no infectados como controles. Ambos insectos, infectados y controles, fueron capturados en poblaciones de campo en Arequipa, Perú. Permitimos que los huevos maduraran a ninfas de tercer estadio, alimentándolos dos veces por semana en pollos sin infecciones, y examinamos sus heces, microscópicamente para detectar T. cruzi. La espera a que los insectos alcanzaran el tercer estadio, otorgó el tiempo adecuado para que el parásito se desarrollara en el vector y facilitó el examen microscópico para identificar el parásito, ya que la extracción de heces es más fácil en insectos más grandes.
Experimento 2. Identificación de las comidas de sangre
Usando reacciones en cadena de polimerasa (PCR), específicas para especies y descritas en [31], identificamos las especies de los hospederos que proveyeron la sangre tomada por los vectores. La muestra fue de 36 ninfas de segundo estadio obtenidas de colonias vectores de T. cruzi altamente infectadas (prevalencia >75%) en corrales de cuyes. Seleccionamos la misma cantidad de insectos que dieron resultados positivos y negativos para la presencia de T. cruzi (18 de cada grupo). Usamos ninfas de segundo estadio, ya que estos habrían tomado muy pocas comidas de sangre, lo cual reduce (pero no elimina) la posibilidad de identificar el hospedero de estas comidas de sangre que fue responsable por haber infectado al vector. Identificar T. cruzi por medio del microscopio puede ser difícil, especialmente en insectos más jóvenes en los cuáles el parásito habría tenido menos tiempo de replicarse a altos números. Por lo tanto, realizamos PCR, usando los métodos descritos en [32].
Experimento 3. Midiendo la duración de la parasitemia del T. cruzi y la infecciosidad de los cuyes a los vectores en el curso de la infección
Infectamos 8 cuyes po r vía intradérmica con una cepa de T. cruzi nativa con una concentración de 106/100μl. Cada semana, extrajimos la sangre de todos los animales y contamos los parásitos usando una cámara de Neubauer, la cual consiste de una lámina portaobjetos de vidrio con un área cuadriculada y es comúnmente usada para contar células sanguíneas. Cada animal fue expuesto a 20 ninfas de quinto estadio por medio de la aplicación de una pequeña caja de xenodiagnóstico, hecha de madera, cubierta de un tul, en la cual los insectos fueron colocados y la caja colocada en el abdomen del animal. Los insectos fueron alimentados a saciedad. Los cuyes no fueron anestesiados durante el proceso. Cuarenta y cinco días después de cada comida, realizamos una evaluación microscópica en busca de parásitos en todos los vectores, lo cual nos permitió conocer la probabilidad de transmisión de los cuyes a los vectores durante el curso de la infección.
Modelo Ross-MacDonald, sus extensiones, y simulación
Siguiendo el modelo Ross-MacDonald de malaria [10–13], elaboramos un modelo para determinar la transmisión de T. cruzi entre hospederos y vectores, usando parámetros provenientes de la literatura y nuestros estudios previos (Tabla 1). El modelo básico incluye cierto número de asunciones simplificadoras: es asumido que la población es constante, homogénea, y aislada, previniendo nacimiento y migración. Los hospederos se vuelven susceptibles a una infección recurrente después de haber despejado a los parásitos. La población de vectores es de igual manera homogénea y sin experimentar migración, y cada vector se alimenta de manera aleatoria del suministro de hospederos disponibles [33]. Usamos notación estándar para representar la proporción de hospederos infectados (X) y vectores (Y) [13]. En esta ecuación, en la cual m es la razón de proporcionalidad de vectores entre hospederos, a es la tasa de picadura del vector, b es la eficiencia de transmisión de vectores a los hospederos, y 1/r es la duración del periodo infeccioso en los hospederos, el cambio en la proporción de huéspedes infectados es:
| Ec. 1 |
Tabla 1.
Valores de los parámetros para modelo modificado de Ross-MacDonald y para modelos de simulación.
| Parámetro | Descripción | Valor de Modelo RossMacDonald [Rango en análisis de sensibilidad] | Valor del modelo de simulación a | Fuentes |
|---|---|---|---|---|
| a | Razón de mordidas: número de picaduras en hospedero por vector por día | 1/14 [0.0625–1] | Poisson (1/14) | Estimado de la alimentación en laboratorio (datos sin publicar) |
|
| ||||
| m | Vectores por hospedero | 100 [80–200] | 100; 500 durante periodos de cuello de botella | [46] |
| n | Duración de periodo de incubación del parásito en el vector (días) | 45 [10–60] | 45b | – |
| g | Probabilidad diaria de mortalidad de vector | .005 [0.001–0.01] | Poisson (.005) | [47] |
| b | Probabilidad de infección de vector infectado a hospedero susceptible | .00068 [0.0005–0.001] | .00068* | [5] |
| c | Probabilidad de infección de hospedero infeccioso a vector susceptible | 0.49 [0.35–1.0] | Obtenido de animales en experimento 3 | [48] |
|
| ||||
| 1/r | Duración de parasitemia en el hospedero (días) | 55 [40–100] | Obtenido de animales en experimento 3 | [21] |
Los análisis de sensibilidad para la simulación estocástica son mostrados en el material suplementario (Figura S6)
Hemos observado a parásitos que alcanzan densidades de equilibrio en los vectores, aproximadamente 45 días después de que los vectores ingirieran una comida de sangre infecciosa. Por lo tanto modelamos la infecciosidad de vectores (b) como una función logística, y con una infecciosidad que en aproximadamente 45 días, alcanzó un valor máximo local de 0.00068.
Similarmente, el cambio en la proporción de vectores infectados es descrito con la siguiente ecuación:
| Ec. 2 |
Donde c es la eficiencia de transmisión de hospederos a vectores, g es la tasa de mortalidad de los vectores, y n es la duración del periodo de incubación del parásito en el vector. La prevalencia de equilibrio del parásito entre vectores y hospederos puede ser obtenida para esta versión del modelo Ross-MacDonald por medio de las siguientes ecuaciones [12,13]:
| Ec. 3 |
| Ec. 4 |
| Ec. 5 |
En tiempo continuo, e iniciando estas ecuaciones con un hospedero infeccioso singular, la prevalencia aumenta monótonamente y la prevalencia de equilibrio en los vectores es equivalente a la prevalencia máxima. La sensibilidad de la prevalencia máxima en vectores a cada parámetro del modelo se muestra en Figura S1.
Extensión para incluir coprofagia
Modificamos el modelo base de Ross-MacDonald para incluir adquisición de T. cruzi por insectos sin infección por medio de la ingestión de heces contaminadas. La proporción de cambio de la prevalencia de vector se convierte en:
| Ec. 6 |
, en donde el parámetro δ representa la fuerza diaria de la infección coprófaga. Conducimos este modelo en un rango de valores de δ.
Simulación estocástica del modelo de Ross-MacDonald con cuellos de botella en población de hospederos
Para considerar los efectos de las fluctuaciones en las poblaciones hospederas más fácilmente, desarrollamos una simulación estocástica basada en el modelo Ross-MacDonald (detalles del modelo, figura y código se encuentran en los Materiales suplementarios). Simulamos la prevalencia esperada de infección en hospederos y vectores en una comunidad de 10 hospederos y 1000 vectores, usando parámetros de la literatura y de los datos colectados en nuestros estudios de laboratorio en Perú (Tabla 1). Procedimos a introducir cuellos de botella en la población hospedera para imitar la reducción estacional en las poblaciones del cuy. Evaluamos los efectos de los cuellos de botellas de varias duraciones (14, 30, 60, 90 y 180 días). Asumimos, siguiendo a Cohen y Gurtler [34], que el tamaño de la población vector es una función del tamaño de la población hospedera de la estación previa. De esta forma, el número de vectores en la colonia no experiencia un decremento significativo sino hasta después del periodo del cuello de botella. En un análisis de sensibilidad, exploramos el efecto de un “cuello de botella de vectores” en el cual la población de insectos triatominos disminuye simultáneamente con el cuello de botella del cuy. También exploramos diferentes tamaños de poblaciones vectores y hospederos antes de y durante los cuellos de botella.
RESULTADOS
Encuesta entomológica
Los insectos triatominos infectados con T. cruzi fueron hallados a lo largo del área inspeccionada (Figura 1). Catorce colonias grandes (>100 insectos, excluyendo huevos y ninfas de primer estadio) fueron colectadas, y diez de estas colonias incluyeron insectos infectados con T. cruzi (Material suplementario). La prevalencia del parásito en estas colonias cuantiosas fue persistentemente bimodal. En dos de las colonias de mayor tamaño, 544 de 639 (85.1%) y 628 de 723 (86.9%) insectos estaban infectados. Ambas colonias fueron colectadas en corrales de cuy. Una tercera colonia, de menor tamaño, y que exhibió una alta prevalencia de parásitos (128 de 165, 77.6%), también fue colectada en corrales de cuy. La prevalencia de la siguiente colonia más infectada fue, en contraste, solo 6.4% (15 insectos infectados de 234). Este patrón bimodal de prevalencia de T. cruzi entre vectores en colonias cuantiosas, es consistente a través de docenas de otras colonias grandes examinadas a lo largo de la campaña de control en Arequipa (datos proporcionados en el Material Suplementario, Tabla S1).
Hipótesis I: T. cruzi es transmitido entre insectos, sin pasar por un hospedero mamífero y portador intermediario, por medio de coprofagia
Nuestro modelo muestra que tasas diarias de transmisión coprófaga relativamente pequeñas pueden resultar en alta prevalencia de infección. A medida en que la fuerza de transmisión coprófaga aumenta, la prevalencia de infección se acerca a una asíntota cuyo valor está relacionado con la probabilidad de que el vector sobreviva el periodo de incubación del parásito. Para los parámetros que consideramos (descritos en Tabla 1), la prevalencia de equilibrio en vectores no excede Y = 86% aún cuando la coprofagia es muy frecuente. Debido a la forma asintótica de la curva, un valor de 0.08 para δ generaría una prevalencia de equilibrio de 80% mientras que un valor de 0.46 sería necesario para generar una prevalencia de 85% (Material Suplementario).
En el experimento que midió la velocidad real de transmisión de la infección por medio de coprofagia, 150 huevos de insectos triatominos (en cinco experimentos replicados) fueron expuestos a T. cruzi en las heces de insectos adultos. Un total de 119 individuos sobrevivieron hasta el tercer estadio. Ninguno de estos insectos adquirió T. cruzi por medio de coprofagia. La velocidad de transmisión coprófaga, aún si no es cero, claramente está por debajo del valor requerido para producir una prevalencia de infección alta en nuestro modelo. Concluimos que la coprofagia no explica la presencia de colonias de vectores altamente infectadas.
Hipótesis II. Una especie reservorio aparte de los cuyes está conduciendo la transmisión de T. cruzi a través de vectores recogidos cerca a corrales de cuyes
Los cuyes representaron la vasta mayoría (34/36) de comidas de sangre identificadas en los insectos de segundo estadio provenientes de las colonias altamente infectadas encontradas alrededor de los corrales de cuyes (Tabla S2). El ADN de la comida de sangre en dos insectos no fue ampliado con ninguno de los iniciadores usados en el ensayo. De esta manera, es improbable que especies portadoras que no sean cuyes estén produciendo un grado de infección significativo en los vectores observados. Todos los insectos en los cuales T. cruzi fue detectado por medio del microscopio fueron confirmados por PCR; interesantemente, el PCR también fue positivo para la mayoría (13/18) de insectos en los que el parásito no fue identificado usando el microscopio, sugiriendo que la prevalencia de infección entre los insectos en estos corrales de cuyes era mayor que 85%.
Hipótesis III. Hospederos persistentemente infecciosos conducen el parásito a través de las poblaciones vectores
Algunos cuyes retuvieron la habilidad de infectar insectos por varios meses (Figura 3, Material suplementario, Figura S2). Los datos del experimento 3 proveyeron estimaciones de la probabilidad de transmisión de T. cruzi del cuy hospedero a los vectores en el transcurso de la infección, los cuáles incorporamos en un modelo Ross-MacDonald estocástico. Los resultados de las simulaciones sugieren que los cuyes persistentemente infecciosos tuvieron poco efecto en la prevalencia máxima de la infección de T. cruzi en colonias vectores (Material Suplementario, Figura S3). Inicialmente, este descubrimiento fue sorprendente, pero se volvió muy intuitivo al considerar la corta duración de la vida del cuy cuando es criado para el consumo humano—la mayoría de estos son comidos alrededor de los cuatros meses de vida. La relevancia de una infecciosidad prolongada en cualquier de los cuyes es limitada por la breve duración de su vida. Sin embargo, la presencia de cuyes persistentemente infecciosos de hecho causó una persistencia más larga de la infección de T. cruzi en las poblaciones vectores de nuestras simulaciones. En la ausencia de estos animales, la infección en los vectores persistió por una mediana de 357 días. La mediana del tiempo de persistencia se elevó a 442 días, un aumento de casi tres meses, en la situación extrema en la cual todos los cuyes en un recinto eran persistentemente infecciosos.
Figura 3.
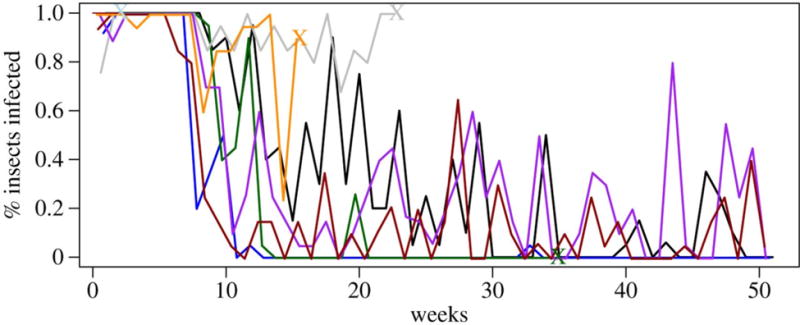
La variabilidad observada en el porcentaje de triatominos infectados (de conjuntos de 20 insectos expuestos) después de alimentarse semanalmente de ocho cuyes infectados experimentalmente en el transcurso de un año. Los cuyes fueron inoculados inicialmente con 106/100μl de una cepa local de T. cruzi.
Hipótesis IV: Los cuellos de botella aumentan la prevalencia de infección en vectores
Al incluir catástrofes poblacionales o “cuellos de botella” en nuestras simulaciones estocásticas, se produjeron varias poblaciones vectores con prevalencia de T. cruzi mayor a 85% (Figuras 4 & S5). Durante cada cuello de botella, una población, inicialmente de 10 cuyes, disminuyó a sólo dos miembros por un periodo de tiempo (mientras el número de vectores fue mantenido constante en 1000). Catástrofes en las poblaciones de hospederos que duraron tan poco como dos semanas, fueron capaces de incrementar la prevalencia de infección en vectores a más de 85%, aunque la probabilidad de alcanzar esta alta prevalencia aumentó cuando la duración del cuello de botella fue por lo menos dos meses.
Figura 4.
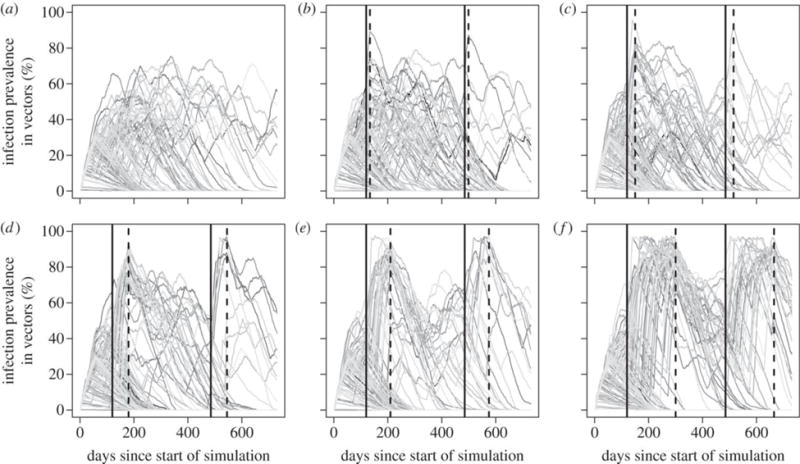
Curso de tiempo simulado del Trypanosoma cruzi en colonias de Triatoma infestans. Las simulaciones rastrearon 1.000 vectores y una población huésped de diez cuyes que disminuyó a dos huéspedes durante los periodos de cuellos de botella. Un total de 1.000 simulaciones réplicas fueron conducidas por cada duración del cuello de botella. Panel A: Ningún cuello de botella presente. Panel B–F: Duraciones de cuello de botella de 14, 30, 60, 90 y 180 días, respectivamente. Las líneas solidas verticales indican el comienzo del cuello de botella mientras que las líneas discontinuas indican el final de los mismos.
Al variar el tamaño de las poblaciones hospederas dentro y fuera del periodo del cuello de botella, el patrón resultante de infección entre vectores también varió, de tal manera que un cuello de botella más drástico causó un comportamiento más bimodal en las tasas máximas de infección en la población vector (Material suplementario, Figura S4). Los resultados de análisis adicionales, y que consideraron dinámicas más detalladas en la población vector, incluyendo cuellos de botella en las poblaciones hospederas en secuencia con los cuellos de botella en sus poblaciones vectores son presentados en el Material suplementario (Figura S5b). En el evento de un cuello de botella en la población vector, una prevalencia de infección de T. cruzi con valor de 85% aún puede ocurrir, pero con una frecuencia mucho más baja. Análisis de sensibilidad adicionales para los parámetros de la simulación son mostrados en la Figura S6. Síntesis: Nuestros descubrimientos nos permiten descartar varios mecanismos que hipotetizamos para explicar la alta prevalencia de T. cruzi observada en poblaciones vectores. La infección de vectores no parece ser causada por hospederos portadores diferentes a los cuyes. Aunque los modelos matemáticos sugieren que la coprofagia podría producir alta prevalencia en poblaciones de insectos, la transmisión horizontal de T. cruzi entre vectores por medio de la ingestión de heces no fue observada en nuestros experimentos. Mientras la presencia de hospederos persistentemente infecciosos no produce la prevalencia de T. cruzi observada, puede que estos animales desempeñen un papel en mantener al parásito en las poblaciones vectores durante periodos de tiempo más largos. Los cuellos de botella en poblaciones hospederas, aún aquellos de duración breve, pueden llevar a altos niveles de infección de T. cruzi entre los vectores triatominos.
DISCUSIÓN
Fluctuaciones en las poblaciones de vectores pueden tener efectos enormes en la transmisión de patógenos transmitidos por vectores [35]. Aun un ciclo de transmisión improbable e inestable puede propulsar un patógeno a altas frecuencias en poblaciones vectores, y a su vez crear un riesgo significante para animales y humanos cuando el número de hospederos es fluctuante. Documentamos con precisión este escenario, en el cual los cuellos de botella en la población de cuyes llevan a una alta prevalencia de T. cruzi en las poblaciones de insectos triatominos, y por último intensifican el riesgo de enfermedad de Chagas en los hogares. Fuera de los Andes, el papel de los cuyes (y de roedores en general) en la transmisión doméstica de T. cruzi es probablemente menor [36] (ver [37]). Las dinámicas que describimos—incluyendo la concentración de vectores en un número limitado de animales hospederos, son comunes. En hogares pequeños, las poblaciones de animales domésticos son raramente estables. El nacimiento y muerte impredecible de estos animales crea fluctuaciones en la razón del número de vectores alimentándose de cualquier hospedero, un parámetro clave en el modelo Ross-MacDonald. En la escala de un hogar con sólo un puñado de hospederos, estas fluctuaciones son lo suficientemente poderosas para empezar epidemias. Es probable que el efecto del cambio en la razón entre vectores y huéspedes en la prevalencia de patógenos sea especialmente pronunciado para insectos triatominos y otros vectores que son relativamente sésiles.
Las causas proximales de los cuellos de botella en poblaciones domésticas de cuyes en el sur de Perú son claras. En los meses de junio, julio y agosto, una seria de días feriados locales, regionales y nacionales son celebrados en Arequipa con cuyadas—grandes asados de cuyes. Durante estos feriados, los cuyes en esta región tienen una esperanza de vida similar a la de los pavos en los Estados Unidos en noviembre. Mientras estos festivales son la causa proximal de la disminución en las poblaciones del cuy, la razón por la cual estos festivales son celebrados con el consumo de cuyes en vez de otros animales es probablemente económica: el precio de la alfalfa se eleva abruptamente antes de esta temporada (Figura 2) y lleva a que la manutención de grandes poblaciones de cuyes se vuelva económicamente contraproducente. Las causas definitivas de las fluctuaciones en las poblaciones de hospederos están relacionadas con el agua y el clima. Arequipa se encuentra en una región árida, y la ciudad y las tierras agrícolas en sus alrededores dependen de lluvias y deshielo en altitudes más altas. Aunque puede que el precio del alfalfa sea afectado por varios factores, incluyendo la demanda del mismo por parte de la industria ganadera, este es afectado fundamentalmente por la disponibilidad estacional del agua. Las fuerzas que llevan a los cuellos de botella en poblaciones domésticas de cuyes en Perú se están agravando. Los glaciares andinos, los cuales son fuente de agua para la región, están disminuyendo [38] mientras que las poblaciones de personas y actividades agrícolas continúan aumentando. Es posible que estas fuerzas, si trabajan en concierto, hagan que la cría de cuyes sea económicamente inviable— un cambio que disminuiría la transmisión de T. cruzi en la región, pero también privaría a una gran población de una importante fuente de proteína. Alternativamente, una transición de la cría de cuy a cría de pollos podría ocurrir. Los pollos no portan T. cruzi, pero pueden sostener grandes poblaciones vectores. Fluctuaciones en poblaciones de pollos pueden, de esta forma, llevar a que los vectores busquen hospederos alternativos y a potencialmente concentrarse alrededor de un portador mamífero de T. cruzi competente [34]. Esto llevaría a unas dinámicas de transmisión de parásitos a través de vectores similares a estas que describimos aquí.
Nuestro modelo es intencionalmente limitado en alcance. Nos enfocamos sólo en explicar los altos porcentajes de infección de vectores vistos en varias colonias de gran tamaño, y no examinamos las grandes variaciones en la prevalencia de T. cruzi entre diferentes hogares. Interesantemente, encontramos colonias grandes en las cuales muy pocos insectos (< 7%) albergaban el parásito, y estas colonias estaban alrededor de colonias de vectores que estaban altamente infectadas. Una explicación para esa observación es que, por casualidad, en algunos hogares, sólo los cuyes que no han sido infectados sobreviven el sacrificio estacional. A pesar del cuello de botella de la población huésped, la prevalencia de infección en vectores permanecería baja en estos corrales de cuyes. Alternativamente, es posible que algunas colonias vectores grandes sean altamente infectadas, por medio de las dinámicas de cuellos de botella que describimos, y que insectos de estas colonias migren a otras colonias grandes cercanas en las que el parásito aún no hubiera emergido. Otra limitación de nuestro estudio es que nuestros modelos son sensibles al parámetro que describe la probabilidad de transmisión de un vector infectado a un hospedero susceptible (Figura S1). Esta eficiencia de transmisión, la cual asumimos es bastante baja, es extremamente difícil de medir directamente. En su lugar, este valor ha sido estimado usando fórmulas que combinan estimaciones separadas y posiblemente erróneas de la incidencia de nuevas infecciones de T. cruzi en hospederos: la frecuencia de las picaduras de vectores y la prevalencia de T. cruzi en los vectores [4,5]. Si las estimaciones de este parámetro resultan ser equivocadas, nuestras conclusiones acerca de la transmisión de T. cruzi necesitarían ser re-evaluadas.
Observamos heterogeneidad de la infecciosidad entre los cuyes que fueron infectados experimentalmente con T. cruzi. Mientras nuestros modelos sugieren que la presencia de cuyes persistentemente infecciosos es por sí sola insuficiente para conducir al parásito hasta los niveles observados en las colonias vectores de campo, puede que estos animales sean muy importantes en la introducción de dicho parásito y su manutención en una metapoblación. La infecciosidad prolongada no está limitada a los cuyes. Cuando técnicas xenodiagnósticas son utilizados para evaluar al estado de infección de T. cruzi, los resultados son típicamente heterogéneos entre los individuos de una misma especie [39]. Lo mismo sucede con humanos—las primeras pruebas clínicas para tratamientos de la enfermedad de Chagas fueron evaluadas por xenodiagnosis, y algunos individuos en el grupo de control permanecieron infecciosos a insectos por un periodo de tiempo extendido [40,41]. No es claro por qué algunos individuos son persistentemente infecciosos mientras otros controlan al parásito.
En general, los tripanosomas son conocidos por sus mecanismos complejos de evasión inmune de un huésped [42]. La naturaleza estocástica de los mecanismos evasivos podría llevar a la heterogeneidad de parasitemia entre algunos individuos. La infección simultánea con parásitos adicionales también puede disminuir la habilidad de un individuo para controlar al T. cruzi [43]. Diferencias genéticas pueden explicar parcialmente la parasitemia elevada o prolongada [44]; un descubrimiento que puede ser de particular relevancia para cuyes domésticos.
Nuestros descubrimientos sugieren que la transmisión de T. cruzi en hogares podría ser disminuida por medio de la prevención de cuellos de botella en las poblaciones huéspedes. La ecología de transmisión de T. cruzi es altamente variable. La casta de vectores y huéspedes del parásito varía de un hábitat a otro. Para el caso específico de transmisión por T. infestans en el sur de Perú, las infecciones podrían potencialmente ser disminuidas por medio de medidas económicas para estabilizar y mantener el precio de la alfalfa, y de este modo mitigar situaciones en las que grandes poblaciones de insectos se encuentran concentrados en un pequeño número de cuyes infectados. Medidas de control que son más directas y fáciles de implementar ya se llevan a cabo a través de gran parte del sur de Perú [45]. Intentos para controlar las fluctuaciones en poblaciones de hospederos por medio de métodos tradicionales serían más relevantes para aquellas áreas difíciles de alcanzar. Las condiciones que permiten la emergencia o re-emergencia del parásito pueden ser eliminadas, por lo menos en algunos contextos, por medio de la identificación y manejo de los conductores de los cuellos de botella en las poblaciones hospederas en otras áreas afectadas por la enfermedad de Chagas.
Acknowledgments
Miembros del Chagas Disease Working Group en Arequipa, quienes contribuyeron y facilitaron este trabajo incluyen Jesús Pinto Caballero, Maritza Calderón, Lily Chou Chu, Fernando Málaga, Andy Catacora, Karina Oppe, Juan Cornejo del Carpio, Edith Málaga, Danitza Pamo, Vitaliano Cama, Malwina Niemierko, Caryn Bern and Robert Gilman. Agradecemos las contribuciones invaluables del Ministerio de Salud del Perú (MINSA), la Dirección General de Salud de las Personas (DGSP), la Estrategia Sanitaria Nacional de Prevención y Control de Enfermedades Metaxénicas y Otras Transmitidas por Vectores (ESNPCEMOTVS), la Dirección General de Salud Ambiental (DIGESA), el Gobierno Regional de Arequipa, la Gerencia Regional de Salud de Arequipa (GRSA), la Pan American Health Organization (PAHO/OPS) y la Canadian International Development Agency (CIDA).
Declaración de financiamiento: Financiamiento para estos estudios provino de National Institutes of Health NIAID P50 AI074285 y 5R01 AI101229.
Footnotes
Traducido por: Maria Arevalo Gonzalez, Ricardo Castillo-Neyra y Cesar Naquira-Velarde
Declaración ética: El Comité Institucional de Ética para Uso de Animales de la Universidad Peruana Cayetano Heredia revisó y aprobó el protocol de manejo animal para este estudio (#57822).
Intereses en competencia: Los autores no tienen interés en competencia.
Contribución de los autores: Todos los autores contribuyeron al diseño, conducción e interpretación de uno o más de los estudios aquí reportados.
Referencias
- 1.Chagas C. Nova tripanozomiaze humana: estudos sobre a morfolojiaeo ciclo evolutivo do Schizotrypanumcruzi n. gen., n sp., ajente etiolojico de nova entidad e morbida do homem. Memórias do Instituto Oswaldo Cruz. 1909;1:159–218. [Google Scholar]
- 2.Tarleton RL, Reithinger R, Urbina JA, Kitron U, Gürtler RE. The challenges of Chagas disease—Grim outlook or glimmer of hope? PLoS medicine. 2007;4:e332. doi: 10.1371/journal.pmed.0040332. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Rabinovich JE, Wisnivesky-Colli C, Solarz ND, Gurtler RE. Probability of transmission of Chagas disease by Triatoma infestans (Hemiptera: Reduviidae) in an endemic area of Santiago del Estero, Argentina. Bull World Health Organ. 1990;68:737–46. [PMC free article] [PubMed] [Google Scholar]
- 4.Nouvellet P, Dumonteil E, Gourbiere S. The improbable transmission of Trypanosoma cruzi to human: the missing link in the dynamics and control of Chagas disease. PLoS Negl Trop Dis. 2013;7:e2505. doi: 10.1371/journal.pntd.0002505. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Catala SS, Gorla DE, Basombrio MA. Vectorial transmission of Trypanosoma cruzi: an experimental field study with susceptible and immunized hosts. Am J Trop Med Hyg. 1992;47:20–26. doi: 10.4269/ajtmh.1992.47.20. [DOI] [PubMed] [Google Scholar]
- 6.Breniere SF, Bosseno MF, Noireau F, Yacsik N, Liegeard P, Aznar C, Hontebeyrie M. Integrate study of a Bolivian population infected by Trypanosoma cruzi, the agent of Chagas disease. Mem Inst Oswaldo Cruz. 2002;97:289–95. doi: 10.1590/s0074-02762002000300002. [DOI] [PubMed] [Google Scholar]
- 7.Feliciangeli MD, Campbell-Lendrum D, Martinez C, Gonzalez D, Coleman P, Davies C. Chagas disease control in Venezuela: lessons for the Andean region and beyond. Trends Parasitol. 2003;19:44–9. doi: 10.1016/s1471-4922(02)00013-2. [DOI] [PubMed] [Google Scholar]
- 8.Samuels AM, Clark EH, Galdos-Cardenas G, Wiegand RE, Ferrufino L, Menacho S, Gil J, Spicer J, Budde J, Levy MZ, Bozo RW, Gilman RH, Bern C, the Working Group on Chagas Disease in Bolivia and Peru Epidemiology of and Impact of Insecticide Spraying on Chagas Disease in Communities in the Bolivian Chaco. PLoS Negl Trop Dis. 2013;7:e2358. doi: 10.1371/journal.pntd.0002358. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Pless M, Juranek D, Kozarsky P, Steurer F, Tapia G, Bermudez H. The epidemiology of Chagas’ disease in a hyperendemic area of Cochabamba, Bolivia: a clinical study including electrocardiography, seroreactivity to Trypanosoma cruzi, xenodiagnosis, and domiciliary triatomine distribution. Am J Trop Med Hyg. 1992;47:539–46. doi: 10.4269/ajtmh.1992.47.539. [DOI] [PubMed] [Google Scholar]
- 10.Ross R. Theprevention of malaria. Dutton: 1910. [Google Scholar]
- 11.Macdonald G. The epidemiology and control of malaria. The Epidemiology and Control of Malaria 1957 [Google Scholar]
- 12.Smith DL, McKenzie FE. Statics and dynamics of malaria infection in Anopheles mosquitoes. Malar J. 2004;3:13. doi: 10.1186/1475-2875-3-13. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Smith DL, McKenzie FE, Snow RW, Hay SI. Revisiting the basic reproductive number for malaria and its implications for malaria control. PLoS biology. 2007;5:e42. doi: 10.1371/journal.pbio.0050042. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Dias E. Estudos sobre o Schizotrypanum cruzi. Memórias do Instituto Oswaldo Cruz. 1934;28:1–110. [Google Scholar]
- 15.Duncan J. On a bactericidal principle present in the alimentary canal of insects and arachnids. Parasitology. 1926;18:238–252. [Google Scholar]
- 16.Beard C, Dotson E, Pennington P, Eichler S, Cordon-Rosales C, Durvasula R. Bacterial symbiosis and paratransgenic control of vector-borne Chagas disease. Int J Parasitol. 2001;31:621–627. doi: 10.1016/s0020-7519(01)00165-5. [DOI] [PubMed] [Google Scholar]
- 17.Schaub GA. Direct transmission of Trypanosoma cruzi between vectors of Chagas’ disease. Acta Trop. 1988;45:11–19. [PubMed] [Google Scholar]
- 18.RYCKMAN RE. Recent observations of cannibalism in Triatoma (Hemiptera: Reduviidae) J Parasitol. 1951;37:433–434. [PubMed] [Google Scholar]
- 19.Phillips N. Experimental studies on the quantitative transmission of Trypanosoma cruzi: aspects of the rearing, maintenance and testing of vector material, and of the origin and course of infection in the vector. Ann trop Med Parasit. 1960;54:397–414. doi: 10.1080/00034983.1960.11686003. [DOI] [PubMed] [Google Scholar]
- 20.Ayaqui R, Córdova E. Infección natural de roedores sinantrópicos por Trypanosoma cruzi Chagas. Acta Med Agustina. 1990;1:66–70. [Google Scholar]
- 21.Castro-Sesquen YE, Gilman RH, Yauri V, Angulo N, Verastegui M, Velásquez DE, Sterling CR, Martin D, Bern C. Cavia porcellus as a Model for Experimental Infection by Trypanosomacruzi. The American journal of pathology. 2011;179:281–288. doi: 10.1016/j.ajpath.2011.03.043. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Tarleton R, Koller B, Latour A, Postan M. Susceptibility of β2-microglobulin-deficient mice to Trypanosoma cruzi infection. 1992 doi: 10.1038/356338a0. [DOI] [PubMed] [Google Scholar]
- 23.Guedes PMdM, Veloso VM, Tafuri WL, Galvão LMdC, Carneiro CM, Lana Md, Chiari E, Ataide Soares K, Bahia MT. The dog as model for chemotherapy of the Chagas’ disease. Acta Trop. 2002;84:9–17. doi: 10.1016/s0001-706x(02)00139-0. [DOI] [PubMed] [Google Scholar]
- 24.Machado EMdM, Fernandes AJ, Murta SMF, Vitor RWdA, Camilo Júnior DJ, Pinheiro SW, Lopes ER, Adad SJ, Romanha ÁJ, Dias JCP. A study of experimental reinfection by Trypanosoma cruzi in dogs. 2001 doi: 10.4269/ajtmh.2001.65.958. [DOI] [PubMed] [Google Scholar]
- 25.Sánchez Reyes C. Crianza y comercialización de cuyes. Granja y negocios 2002 [Google Scholar]
- 26.Water Conservation Factsheet: Crop Coefficients for Use in Irrigation Scheduling. 2001. [Google Scholar]
- 27.Bayer AM, Hunter GC, Gilman RH, Carpio Del, Cornejo Juan G, Náquira C, Bern C, Levy MZ. Chagas disease, migration and community settlement patterns in Arequipa, Peru. PLoS neglected tropical diseases. 2009;3:e567. doi: 10.1371/journal.pntd.0000567. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Levy MZ, Bowman NM, Kawai V, Waller LA, del Carpio JGC, Benzaquen EC, Gilman RH, Bern C. Periurban Trypanosoma cruzi–infected Triatoma infestans, Arequipa, Peru. Emerging infectious diseases. 2006;12:1345. doi: 10.3201/eid1209.051662. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Gurtler RE, Chuit R, Cecere MC, Castanera MB, Cohen JE, Segura EL. Household prevalence of seropositivity for Trypanosoma cruzi in three rural villages in northwest Argentina: environmental, demographic, and entomologic associations. Am J Trop Med Hyg. 1998;59:741–9. doi: 10.4269/ajtmh.1998.59.741. [DOI] [PubMed] [Google Scholar]
- 30.Delgado S, Castillo Neyra R, Quispe Machaca VR, Ancca Juárez J, ChouChu L, Verastegui MR, Moscoso Apaza GM, Bocángel CD, Tustin AW, Sterling CR, Comrie AC, Náquira C, Cornejo del Carpio JG, Gilman RH, Bern C, Levy MZ. A History of Chagas Disease Transmission, Control, and Re-Emergence in Peru-Rural La Joya, Peru. PLoS Negl Trop Dis. 2011;5:e970. doi: 10.1371/journal.pntd.0000970. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Pizarro JC, Stevens L. A new method for forensic DNA analysis of the blood meal in Chagas disease vectors demonstrated using Triatoma infestans from Chuquisaca, Bolivia. PLoS One. 2008;3:e3585. doi: 10.1371/journal.pone.0003585. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Virreira M, Torrico F, Truyens C, Alonso-Vega C, Solano M, Carlier Y, Svoboda M. Comparison of polymerase chain reaction methods for reliable and easy detection of congenital Trypanosoma cruzi infection. Am J Trop Med Hyg. 2003;68:574–582. doi: 10.4269/ajtmh.2003.68.574. [DOI] [PubMed] [Google Scholar]
- 33.Smith DL, Battle KE, Hay SI, Barker CM, Scott TW, McKenzie FE. Ross, Macdonald, and a theory for the dynamics and control of mosquito-transmitted pathogens. PLoS pathogens. 2012;8:e1002588. doi: 10.1371/journal.ppat.1002588. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Cohen JE, Gürtler RE. Modeling house hold transmission of American trypanosomiasis. Science. 2001;293:694–698. doi: 10.1126/science.1060638. [DOI] [PubMed] [Google Scholar]
- 35.Ostfeld RS, Canham CD, Oggenfuss K, Winchcombe RJ, Keesing F. Climate, deer, rodents, and acorns as determinants of variation in lyme-disease risk. PLoS Biol. 2006;4:e145. doi: 10.1371/journal.pbio.0040145. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Gascon J, Bern C, Pinazo M. Chagas disease in Spain, the United States and other non-endemic countries. Acta Trop. 2010;115:22–27. doi: 10.1016/j.actatropica.2009.07.019. [DOI] [PubMed] [Google Scholar]
- 37.Grijalva MJ, Terán D, Dangles O. Dynamics of Sylvatic Chagas Disease Vectors in Coastal Ecuador Is Driven by Changes in Land Cover. PLoS neglected tropical diseases. 2014;8:e2960. doi: 10.1371/journal.pntd.0002960. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Fraser B. Melting in the Andes: Goodbye glaciers. Nature. 2012;491:180–182. doi: 10.1038/491180a. [DOI] [PubMed] [Google Scholar]
- 39.Gürtler R, Cecere M, Lauricella M, Cardinal M, Kitron U, Cohen J. Domestic dogs and cats as sources of Trypanosoma cruzi infection in rural northwestern Argentina. Parasitology. 2007;134:69–82. doi: 10.1017/S0031182006001259. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Cerisola J, Rohwedder R, Segura E, Del Prado C, Alvarez M, De Martini G. El xenodiagnóstico Normatización. Instituto Nacional de Diagnóstico e Investigación de la Enfermedad de Chagas (INDIECH); Buenos Aires, Argentina: 1974. [Google Scholar]
- 41.Cerisola JA, Silva N, Prata A, Schenone H, Rohwedder R. Evaluación mediante xenodiagnostico de la efectividad del nifurtimox en la infección chagásica crónica humana. Bol Chil Parasitol. 1977;32:51–62. [PubMed] [Google Scholar]
- 42.Donelson JE, Hill KL, El-Sayed N. Multiple mechanisms of immune evasion by African trypanosomes. Mol Biochem Parasitol. 1998;91:51–66. doi: 10.1016/s0166-6851(97)00209-0. [DOI] [PubMed] [Google Scholar]
- 43.Lass S, Hudson PJ, Thakar J, Saric J, Harvill E, Albert R, Perkins SE. Generating super-shedders: co-infection increases bacterial load and egg production of a gastrointestinal helminth. Journal of The Royal Society Interface. 2013;10 doi: 10.1098/rsif.2012.0588. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Wrightsman R, Krassner S, Watson J. Genetic control of responses to Trypanosoma cruzi in mice: multiple genes influencing parasitemia and survival. Infect Immun. 1982;36:637–644. doi: 10.1128/iai.36.2.637-644.1982. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Buttenheim AM, Paz-Soldan V, Barbu C, Skovira C, Quintanilla Calderon J, Mollesaca Riveros LM, Cornejo JO, Small DS, Bicchieri C, Naquira C, Levy MZ. Is participation contagious? Evidence from a household vector control campaign in urban Peru. J Epidemiol Community Health. 2014;68:103–109. doi: 10.1136/jech-2013-202661. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Basombrio MA, Gorla D, Catala S, Segura MA, Mora MC, Gomez L, Nasser J. Number of vector bites determining the infection of guinea pigs with Trypanosoma cruzi. Mem Inst Oswaldo Cruz. 1996;91:421–423. doi: 10.1590/s0074-02761996000400006. [DOI] [PubMed] [Google Scholar]
- 47.Cruz-Pacheco G, Esteva L, Vargas C. Control measures for Chagas disease. Math Biosci. 2012;237:49–60. doi: 10.1016/j.mbs.2012.03.005. [DOI] [PubMed] [Google Scholar]
- 48.Gurtler RE, Cecere MC, Castanera MB, Canale D, Lauricella MA, Chuit R, Cohen JE, Segura EL. Probability of infection with Trypanosoma cruzi of the vector Triatoma infestans fed on infected humans and dogs in northwest Argentina. Am J Trop Med Hyg. 1996;55:24–31. [PubMed] [Google Scholar]


