Abstract
Die vorliegenden Leitlinien des European Resuscitation Council zur Versorgung und Reanimation des Neugeborenen nach der Geburt beruhen auf dem International Liaison Committee on Resuscitation (ILCOR) 2020 Consensus on Science and Treatment Recommendations (CoSTR) for Neonatal Life Support (NLS). Sie beinhalten Empfehlungen zur Versorgung und Reanimation des reifen Neugeborenen und zur Stabilisierung des Frühgeborenen. Sie umfassen den aktualisierten Algorithmus zur Reanimation des Neugeborenen, die Vorbereitungen vor der Versorgung eines Neugeborenen, die Themen Training und Ausbildung, Wärmemanagement, Empfehlungen zum Abnabeln, die initiale Beurteilung und Einschätzung des Neugeborenen, das Atemwegsmanagement, inklusive einer Notfallbeatmung, und die Kreislaufunterstützung im Falle einer vollen Reanimation. Darüber hinaus finden sich Empfehlungen zur Kommunikation mit den Eltern und ethische Überlegungen, in welchen Situationen erwogen werden soll, auf Reanimationsmaßnahmen zu verzichten bzw. Reanimationsmaßnahmen nicht fortzuführen.
Zusatzmaterial online
Zusätzliche Informationen sind in der Online-Version dieses Artikels (10.1007/s10049-021-00894-w) enthalten.
Schlüsselwörter: Neugeborenenreanimation, Stabilisierung, Notfallbeatmung, Thoraxkompresssionen, Notfallzugänge
Abstract
The European Resuscitation Council has produced these newborn life support guidelines, which are based on the International Liaison Committee on Resuscitation (ILCOR) 2020 Consensus on Science and Treatment Recommendations (CoSTR) for Neonatal Life Support. The guidelines cover the management of the term and preterm infant. The topics covered include an algorithm to aid a logical approach to resuscitation of the newborn, factors before delivery, training and education, thermal control, management of the umbilical cord after birth, initial assessment and categorisation of the newborn infant, airway and breathing and circulation support, communication with parents, considerations when withholding and discontinuing support.
Keywords: Newborn Resuscitation, Stabilisation, Ventilation, Chest Compressions, Vascular Access
Einführung und Geltungsbereich
Die vorliegenden Leitlinien basieren auf dem „International Liaison Committee on Resuscitation (ILCOR) 2020 Consensus on Science and Treatment Recommendations (CoSTR) for Neonatal Life Support (NLS)“ [1]. Zur Erstellung dieser ERC-Leitlinien wurden die ILCOR-Empfehlungen von den ERC-NLS-Leitlinien-Verfassern für Themen, die vom ILCOR 2020 CoSTR nicht berücksichtigt wurden, zusätzlich durch weitere Literaturrecherchen ergänzt. Teilweise basieren Empfehlungen in diesen Leitlinien auf dem Expertenkonsens der ERC-Leitlinien-Verfasser.
Diese Leitlinien zur Versorgung und Reanimation des Neugeborenen nach der Geburt wurden von den Verfassern der NLS-Leitlinien im Konsens erstellt. Die für die Leitlinienentwicklung verwendete Methodik findet sich in der Zusammenfassung [2]. Die Leitlinien wurden im Oktober 2020 zunächst zur öffentlichen Kommentierung veröffentlicht. Die eingegangenen Kommentare wurden von den NLS-Leitlinien-Verfassern gesichtet und bewertet und das Dokument wurde entsprechend aktualisiert. Die vorliegende Fassung der Leitlinien wurde der ERC-Generalversammlung am 10. Dezember 2020 vorgelegt und von dieser zur Publikation freigegeben.
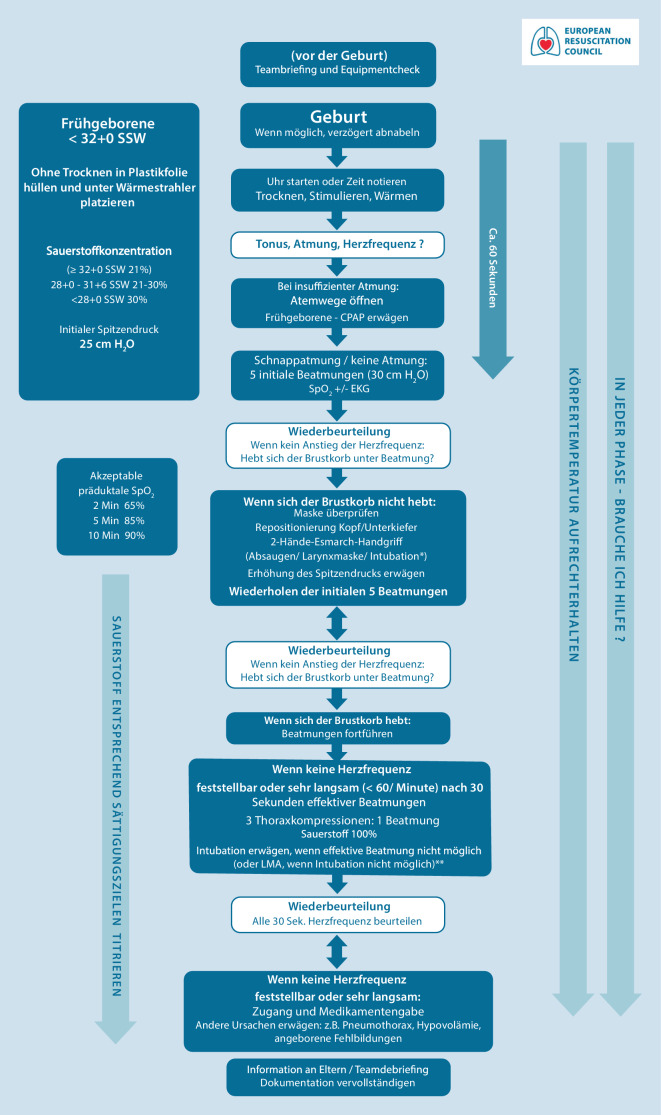
Die Kernaussagen des Kapitels sind in Abb. 1 zusammengefasst.
Neugeborene und COVID-19
Der ERC hat Leitlinien zur Versorgung und Reanimation des Neugeborenen im Zusammenhang mit COVID-19 (SARS-CoV-2) erstellt [3]. Diese basieren auf einem ILCOR CoSTR und einem systematischen Review [4, 5]. Die Erkenntnisse, welche Risiken für mit SARS-CoV-2 infizierte Neugeborene bestehen, und insbesondere auch die Risiken für Personen, die eventuell infizierte Neugeborene versorgen, sich selbst zu infizieren oder das Virus zu übertragen, entwickeln sich stetig weiter. Empfehlungen für Präventionsmaßnahmen zur Verhinderung einer Infektionsübertragung und -ausbreitung, insbesondere für medizinisches Personal während der Versorgung von COVID-19-Patienten, finden sich in den o. g. Publikationen des ERC. Darüber hinaus müssen selbstverständlich aktuelle nationale Leitlinien und Empfehlungen für die Prävention der Infektionsübertragung und Behandlung von Patienten mit COVID-19 berücksichtigt werden.
Zusammenfassung der Änderungen seit den Leitlinien 2015
Abnabeln
Es wird empfohlen, frühestens eine Minute nach der Geburt, idealerweise nach der Belüftung der Lunge, abzunabeln. Wenn ein verzögertes Abnabeln nicht möglich ist, soll bei Frühgeborenen ab 28 + 0 Schwangerschaftswochen ein Ausstreifen der Nabelschnur in Erwägung gezogen werden.
Spitzendruck für die Beatmung von Frühgeborenen
Für Frühgeborene vor 32 + 0 Schwangerschaftswochen wird ein initialer Spitzendruck von 25 cm H2O empfohlen.
Mekonium
Bei nichtvitalen Neugeborenen mit mekoniumhaltigem Fruchtwasser wird weder ein sofortiges tracheales Absaugen unter Sicht noch eine Laryngoskopie empfohlen, da dies das Öffnen der Lunge und eventuell notwendige Beatmungen verzögern kann.
Raumluft/Sauerstoff bei der Versorgung von Frühgeborenen
Während der Versorgung und Atemunterstützung von Frühgeborenen ab 32 + 0 Schwangerschaftswochen und reifen Neugeborenen soll mit 21 % Sauerstoff (Raumluft) begonnen werden. Von der Schwangerschaftswoche 28 + 0 bis 31 + 6 sollen 21 bis 30 % Sauerstoff als Startkonzentration verwendet werden und für Frühgeborene unter 28 + 0 Schwangerschaftswochen wird eine Startsauerstoffkonzentration von 30 % empfohlen. Bei Frühgeborenen unter 32 + 0 Schwangerschaftswochen soll die Sauerstoffkonzentration im Verlauf so titriert werden, dass ab 5 Lebensminuten eine Sauerstoffsättigung > 80 % erreicht wird. Niedrigere Sättigungswerte zu diesem Zeitpunkt führen möglicherweise zu einem schlechteren Outcome.
Initiale Beatmungshübe und assistierte Beatmung
Zeigt ein Neugeborenes unter Beatmung keine klinische Verbesserung, werden u. a. eine Erhöhung des Spitzendrucks und weitere Manöver zur Optimierung der Beatmung empfohlen (z. B. Zwei-Hände-Esmarch oder Guedel-Tubus). Auch eine Larynxmaske kann erwogen werden. Werden alle diese Manöver konsequent durchgeführt, ist eine Intubation zunächst selten erforderlich (Anmerkung der AutorInnen der deutschen Fassung).
Larynxmaske
Eine Larynxmaske kann als alternativer Atemweg bei Neugeborenen ab 34 + 0 Schwangerschaftswochen (ca. 2000 g, wobei eine erfolgreiche Verwendung bei Neugeborenen ab 1500 g beschrieben wurde) in Erwägung gezogen werden, wenn eine effektive Maskenbeatmung nicht gelingt oder eine tracheale Intubation nicht erfolgreich oder nicht durchführbar ist.
Thoraxkompressionen
Wenn Thoraxkompressionen erforderlich sind, soll die verabreichte Sauerstoffkonzentration auf 100 % erhöht werden. Hebt sich der Thorax unter den Beatmungen während der Thoraxkompressionen nicht effektiv, soll überprüft werden, ob eine Intubation sinnvoll und möglich erscheint.
Gefäßzugang
Die Nabelvene wird weiterhin als Zugangsweg der 1. Wahl bevorzugt. Der intraossäre Zugang ist eine alternative Methode für den Notfallzugang und die Gabe von Medikamenten und Flüssigkeit.
Adrenalin
Wenn die Herzfrequenz unter effektiven Beatmungen und Thoraxkompressionen nicht steigt, ist eine intravenöse Gabe von 10 bis 30 µg/kg Körpergewicht (KG) Adrenalin empfohlen. Diese kann bei ausbleibendem Erfolg alle 3–5 min wiederholt werden.
Glukose
Bei länger dauernden Reanimationsmaßnahmen kann eine intravenöse Gabe von 250 mg/kgKG Glukose verabreicht werden (z. B. 2,5 ml/kgKG 10 %ige Glukoselösung), um die Wahrscheinlichkeit einer Hypoglykämie zu verringern.
Prognose
Zeigt ein reanimationspflichtiges Neugeborenes nach 10 bis 20 min technisch korrekt durchgeführter Reanimationsmaßnahmen keinen Spontankreislauf, ist dies mit einem hohen Risiko für ein schlechtes neurologisches Outcome verbunden. In diesen Situationen sollen Eltern in die weiteren Therapieentscheidungen mit einbezogen werden. Wenn es unter Ausschöpfung maximaler Reanimationsmaßnahmen und nach Ausschluss reversibler Ursachen zu keiner klinischen Verbesserung kommt, kann es sinnvoll sein, im Team und mit den Eltern einen möglichen Therapieabbruch zu besprechen.
Empfehlungen für die klinische Praxis
Pränatale Faktoren
Anpassung an das Leben nach der Geburt
Der Übergang vom intra- zum extrauterinen Leben erfolgt für die meisten Neugeborenen problemlos. Einige Neugeborene benötigen allerdings unterstützende, stabilisierende Maßnahmen während oder nach der Geburt, bei nur sehr wenigen müssen tatsächlich Reanimationsmaßnahmen durchgeführt werden. Bis zu 85 % aller Neugeborenen atmen nach der Geburt spontan, ohne dabei unterstützt werden zu müssen, bei weiteren 10 % setzt eine Spontanatmung unter Trocknen und taktiler Stimulation ein. Etwa 5 % aller Neugeborenen müssen initial beatmet werden. Die Intubationsraten nach der Geburt variieren zwischen 0,4 und 2 %. Weniger als 0,3 % der Neugeborenen benötigen Thoraxkompressionen und nur 0,05 % eine Adrenalingabe.
Risikofaktoren
Zahlreiche Risikofaktoren können die Wahrscheinlichkeit der Notwendigkeit von stabilisierenden Maßnahmen nach der Geburt erhöhen (Abb. 2).
Bei einer Geburt anwesendes Personal
Jedes Neugeborene kann, auch überraschend, nach der Geburt unterstützende Maßnahmen benötigen. Daher sind lokale Leitlinien erforderlich, die, basierend auf aktueller Praxis und klinischer Qualitätsprüfung, unter Berücksichtigung von Risikofaktoren für jede Geburt festlegen, welches Personal grundsätzlich anwesend sein soll. Als Leitfaden kann gelten:
Für jede Entbindung soll in der Reanimation von Neugeborenen trainiertes Personal anwesend sein.
Sind unterstützende Maßnahmen für das Neugeborene notwendig, soll Personal zur Verfügung stehen, das ausschließlich für die Versorgung des Neugeborenen zuständig ist.
Jede geburtshilfliche Abteilung soll über ein Notfallprotokoll verfügen, das Alarmierungsstrukturen klar regelt und eine schnelle Verfügbarkeit von in Neugeborenenreanimation ausgebildetem und trainiertem Personal zu jeder Zeit gewährleistet.
Material und Umgebung
Notwendiges Material und alle Geräte müssen regelmäßig überprüft und einsatzbereit sein.
Wann immer möglich, sollen die Umgebung und das notwendige Material noch vor der Entbindung des Kindes vorbereitet werden. Checklisten können eine effektive Vorbereitung erleichtern.
Die Versorgung eines Neugeborenen soll in einer warmen, gut beleuchteten, zugluftfreien Umgebung stattfinden. Das Neugeborene soll (wenn verfügbar) unter einem Heizstrahler auf eine gerade und glatte Fläche gelegt werden.
Sämtliches zur Reanimation notwendige Material (insbesondere Equipment zur Beatmung und Monitoring) muss leicht verfügbar sein.
Zusätzliches Material und Geräte, die bei längeren Reanimationsmaßnahmen erforderlich sein könnten, sollen leicht zugänglich sein.
Geplante Hausgeburten
Hausgeburten sollen idealerweise immer von zwei in Geburtshilfe erfahrenen und ausgebildeten Personen durchgeführt werden.
Mindestens eine der beiden Personen muss in der Durchführung von Maskenbeatmung und Thoraxkompressionen bei Neugeborenen trainiert und erfahren sein.
Von Land zu Land finden sich unterschiedliche Empfehlungen, wer bei einer geplanten Hausgeburt anwesend sein soll. Ist die Entscheidung für eine geplante Hausgeburt in Abstimmung mit dem ärztlichen Team und der Hebamme gefallen, gelten jedoch grundsätzlich auch im häuslichen Umfeld die Standards der Neugeborenenversorgung bezüglich initialer Beurteilung des Neugeborenen, stabilisierender Maßnahmen und einer mitunter notwendigen Reanimation.
Bereits bei der Planung einer Hausgeburt müssen die werdenden Eltern darüber aufgeklärt werden, dass aufgrund der schwierigen Verfügbarkeit weiterer Hilfe und erweiterten Notfallequipments eine Reanimation in häuslicher Umgebung zwangsläufig nicht im gleichen Umfang wie im klinischen Setting durchgeführt werden kann.
- Findet eine Geburt außerhalb der üblichen klinischen Entbindungsbereiche statt, soll als Mindestausstattung für die Versorgung des Neugeborenen folgendes Equipment zur Verfügung stehen:
- saubere Handschuhe für das versorgende Team,
- gewärmte, trockene Tücher und Laken, um das Neugeborene warm zu halten,
- ein Stethoskop zur Überprüfung der Herzfrequenz,
- ein Hilfsmittel zur sicheren, assistierten Beatmung (z. B. ein Beatmungsbeutel), mit einer Beatmungsmaske in der passenden Größe,
- sterile Instrumente zum Klemmen und später sicheren Durchtrennen der Nabelschnur.
Da unerwartete Geburten außerhalb des klinischen Umfelds vor allem das Personal des Rettungsdiensts betreffen, soll dieses grundsätzlich auf die Versorgung von Neugeborenen vorbereitet und trainiert sein.
Personen, die geplante Hausgeburten durchführen, sollen vorbereitete Notfallpläne für schwierige Situationen haben.
Briefing
Wann immer möglich, soll vor jeder Geburt ein Teambriefing durchgeführt werden. Dies dient dazu, Zuständigkeiten zu klären, das notwendige Material zu überprüfen und möglicherweise vorhersehbare Maßnahmen zur Versorgung des Neugeborenen bereits im Vorfeld zu planen.
Die Rollen und Zuständigkeiten im Team sollen eindeutig verteilt werden. Checklisten sind hier hilfreich.
Sind Reanimationsmaßnahmen vorauszusehen, sollen auch die Eltern auf eine möglicherweise notwendige Reanimation vorbereitet werden.
Ausbildung und Training
Alle mit der Versorgung und Reanimation von Neugeborenen betrauten Personen müssen die aktuellen Versorgungstrategien zur Stabilisierung und Reanimation von Neu- und Frühgeborenen kennen und über die notwendigen technischen Fertigkeiten und nichttechnischen Fähigkeiten für die Versorgung von kritisch kranken Neugeborenen verfügen.
Krankenhäuser und geburtshilfliche Abteilungen, die Geburten durchführen, müssen über strukturierte Ausbildungs- und Trainingsprogramme verfügen, die es Mitarbeitern ermöglichen, die für die Versorgung und Reanimation von Neugeborenen erforderlichen Kenntnisse zu erlangen und die notwendigen Fertigkeiten regelmäßig zu trainieren.
Der Inhalt und die Organisation solcher Ausbildungs- und Trainingsprogramme können je nach den Bedürfnissen der Mitarbeiterinnen und Mitarbeiter und der Klinik variieren.
- Zu den empfohlenen Inhalten solcher Ausbildungs- und Trainingsprogramme gehören:
- Regelmäßige Praxis und Training.
- Team- und Leadership-Training.
- Multimodale Ansätze.
- Simulationsbasiertes Teamtraining.
- Direktes und unmittelbares Feedback bezüglich der technischen Fertigkeiten (z. B. durch Trainer oder Reanimationsgeräte mit Feedbackfunktion).
- Zielgerichtete, konstruktive Nachbesprechungen (Debriefings) zur generellen Verbesserung der Teamperformance.
- Idealerweise soll das Training häufiger als einmal pro Jahr wiederholt werden.
- Auffrischungsveranstaltungen können bestimmte technische Fertigkeiten, nichttechnische Fähigkeiten und Feedback umfassen.
Wärmemanagement
Standards
Die Körpertemperatur des Neugeborenen soll nach der Geburt regelmäßig beurteilt werden. Die Temperatur bei Aufnahme ist sowohl ein Prädiktor für das Outcome als auch ein Qualitätsindikator der Versorgung und soll immer dokumentiert werden.
Die Temperatur von Neugeborenen soll zwischen 36,5 und 37,5 °C gehalten werden.
Sowohl Hypothermie (≤ 36,0 °C) als auch Hyperthermie (> 38,0 °C) sollen während der Versorgung von Neugeborenen vermieden werden. Eine therapeutische Hypothermie kann nach einer erfolgreichen Reanimation in Betracht gezogen werden (siehe „Weitere Versorgung nach erfolgreicher Reanimation“ [6]).
Umgebung
Schützen Sie das Kind vor Zugluft. Stellen Sie sicher, dass die Fenster geschlossen sind und die Klimaanlage adäquat eingestellt wurde.
Der Raum, in dem das Neugeborene versorgt wird (Kreißsaal oder OP), soll eine Temperatur zwischen 23 und 25 °C haben.
Für die Versorgung von Frühgeborenen ≤ 28 + 0 Schwangerschaftswochen soll die entsprechende Raumtemperatur bei > 25 °C liegen.
Reifgeborene und Frühgeborene > 32 Schwangerschaftswochen
Trocknen Sie das Kind sofort nach der Geburt sorgfältig ab. Um weiteren Wärmeverlust zu vermeiden, werden Kopf und Körper des Neugeborenen, unter Aussparung des Gesichts, mit einem warmen, trockenen Tuch bedeckt.
Wenn keine Wiederbelebungsmaßnahmen erforderlich sind, kann das nackte Neugeborene der Mutter auf die Brust gelegt werden, und beide werden mit einem Tuch oder einer Decke zugedeckt. Eine kontinuierliche sorgfältige Beobachtung von Kind und Mutter ist insbesondere bei Frühgeborenen und wachstumsretardierten Neugeborenen erforderlich, um sicherzustellen, dass beide nicht auskühlen und eine normale Körpertemperatur halten.
Benötigt das Neugeborene unterstützende Maßnahmen oder ist eine Reanimation notwendig, wird das Neugeborene zur weiteren Versorgung unter einem vorgewärmten Heizstrahler auf einer warmen, ebenen Fläche platziert.
Frühgeborene ≤ 32 Schwangerschaftswochen
Frühgeborene vor 32 + 0 Schwangerschaftswochen sollen unter Aussparung des Gesichts komplett in eine durchsichtige Plastikfolie gehüllt werden. Dabei wird das Kind vorher nicht abgetrocknet und so eingehüllt unter einem Wärmestrahler platziert.
Soll das Neugeborene verzögert abgenabelt werden und es ist zu diesem Zeitpunkt kein Heizstrahler verfügbar, sind andere wärmende Maßnahmen (wie unten aufgeführt) erforderlich, um das Neugeborene, während es noch mit der Plazenta verbunden ist, vor Auskühlung zu schützen.
Bei Frühgeborenen vor 32 + 0 Schwangerschaftswochen kann eine Kombination aus mehreren Maßnahmen für ein effektives Wärmemanagement, wie z. B. eine generelle Erhöhung der Raumtemperatur, zusätzliche warme Tücher und eine vorgewärmte Mütze sowie eine Wärmematte, notwendig sein.
Ein direkter Hautkontakt mit der Mutter nach der Geburt ist auch bei weniger reifen Neugeborenen möglich, allerdings ist bei Frühgeborenen oder wachstumsretardierten Neugeborenen besondere Sorgfalt geboten, um eine Unterkühlung in jedem Fall zu vermeiden.
Bei Neugeborenen, die eine Atemunterstützung benötigen, soll die Verwendung von erwärmtem und befeuchtetem Atemgas in Betracht gezogen werden.
Es hat sich gezeigt, dass die Etablierung eines Programms zur Qualitätsverbesserung, das die Verwendung von Checklisten und ein kontinuierliches Feedback an das Team umfasst, die Unterkühlung zum Zeitpunkt der Aufnahme bei Frühgeborenen signifikant reduziert.
Geburten außerhalb des Krankenhauses
Neugeborene, die unerwartet außerhalb der üblichen klinischen Entbindungsbereiche geboren werden, haben ein höheres Risiko für Unterkühlung. Dies kann mit einem schlechteren Outcome verbunden sein.
Für Neugeborene, die außerhalb der üblichen Entbindungsbereiche geboren werden, ist es möglicherweise sinnvoll, sie nach dem Trocknen zunächst in eine Plastikfolie zu hüllen und diese dann mit Stoffwindeln zu umwickeln. Alternativ können gesunde Neugeborene ab 30 Schwangerschaftswochen nach dem Trocknen zugedeckt der Mutter (vorausgesetzt, dass diese selbst normotherm ist) nackt auf die Brust gelegt werden, um während des Transports die Temperatur zu halten (Anmerkung der AutorInnen der deutschen Fassung: In den deutschsprachigen Ländern ist ein Transport des Kindes auf dem Arm der Mutter aus versicherungsrechtlichen Gründen nicht üblich). Neugeborene sollen zugedeckt und vor Zugluft geschützt sorgfältig überwacht werden, um eine Unterkühlung zu vermeiden und sicherzustellen, dass Atemwege und Atmung nicht beeinträchtigt sind.
Abnabeln
Unbeeinträchtigte Neugeborene, die keine Reanimationsmaßnahmen benötigen, sollen verzögert, frühestens nach 1 min, abgenabelt werden. In diesen Fällen kann es darüber hinaus vorteilhaft sein, noch länger mit dem Abnabeln zu warten.
Das Abnabeln soll idealerweise erst nach der Belüftung der Lunge erfolgen.
Unter Umständen können die ersten unterstützenden Maßnahmen nach der Geburt noch bei intakter Nabelschnur vorgenommen werden, sofern sie sicher und effektiv durchführbar sind und ein effektives Wärmemanagement gewährleistet ist.
Wenn ein verzögertes Abnabeln nicht möglich ist, kann das Ausstreifen der Nabelschnur bei Neugeborenen ab 28 + 0 Schwangerschaftswochen in Betracht gezogen werden.
Vor der Geburt sollen mit den Eltern die möglichen Vorgehensweisen beim Abnabeln und die zugrunde liegenden Überlegungen diesbezüglich besprochen werden.
Initiale Beurteilung
Abb. 3
Die initiale Beurteilung des Neugeborenen nach der Geburt kann bereits vor dem Abnabeln (auf Basis folgender Parameter und zumeist in der angegeben Reihenfolge) erfolgen:
Muskeltonus (und Hautkolorit).
Qualität der Spontanatmung.
Herzfrequenz.
Die simultane Erfassung der oben genannten Parameter dient dazu, den Ausgangszustand zu beurteilen, die Notwendigkeit unterstützender Maßnahmen bzw. einer Reanimationspflichtigkeit einzuschätzen und damit auch den optimalen Abnabelungszeitpunkt zu bestimmen.
Die regelmäßige Wiederbeurteilung von Atmung und Herzfrequenz ist erforderlich, um möglichst rasch und effektiv zu erkennen, ob das Neugeborene eine physiologische Anpassung zeigt oder mitunter im Verlauf weiterführende unterstützende Maßnahmen notwendig sind.
Bereits in dieser Phase muss unbedingt darauf geachtet werden, dass das Neugeborene vor Auskühlung geschützt wird.
Taktile Stimulation
Bereits die ersten Maßnahmen während der Beurteilung können genutzt werden, um das Neugeborene zu stimulieren und damit das Einsetzen einer Spontanatmung zu fördern:
Trocknen Sie das Neugeborene ab.
Stimulieren Sie es dabei sanft, indem Sie z. B. über die Fußsohlen streichen oder über den Rücken reiben. Vermeiden Sie unbedingt eine zu aggressive Stimulation.
Muskeltonus und Hautkolorit
Ein deutlich hypotones Neugeborenes benötigt wahrscheinlich unterstützende Beatmungen.
Das Hautkolorit ist nur sehr schlecht zur Beurteilung der Sauerstoffsättigung geeignet. Eine Zyanose kann grundsätzlich schwer zu erkennen sein. Eine ausgeprägte Blässe kann auf einen Schock hinweisen, seltener auf einen Blutverlust und eine Hypovolämie. Besteht der Verdacht auf einen Blutverlust müssen umgehend Maßnahmen diesbezüglich geplant und unternommen werden.
Atmung
- Atmet das Neugeborene? – Beurteilen Sie die Atemfrequenz, die Atemarbeit/Anstrengungen bzw. Atemtiefe und achten Sie auf symmetrische Bewegungen des Brustkorbs, um die Spontanatmung zu bewerten als:
- Suffizient.
- Insuffizient/pathologische Atemmuster – wie Schnappatmung oder Stöhnen.
- Fehlend.
Herzfrequenz
- Bestimmen Sie die Herzfrequenz mit einem Stethoskop und einem Sättigungsmonitor +/− EKG (für das spätere kontinuierliche Monitoring).
- Schnell (≥ 100/min) – normal.
- Langsam (60–100/min) – mögliche Hypoxie.
- Sehr langsam/nicht vorhanden (< 60/min) – kritisch, Hypoxie wahrscheinlich.
Wenn das Neugeborene nach der initialen Beurteilung und unter taktiler Stimulation keine suffiziente Spontanatmung zeigt und/oder die Herzfrequenz nicht ansteigt (und/oder nach anfänglichem Anstieg wieder sinkt), muss mit einer Atemunterstützung begonnen werden.
Einteilung von Neugeborenen auf Basis der initialen klinischen Beurteilung
Anhand der initialen klinischen Beurteilung lassen sich Neugeborene in drei Gruppen einteilen:
1.
(Abb. 4a)
Guter Muskeltonus.
Suffiziente Atmung/kräftiges Schreien.
Herzfrequenz ≥ 100/min.
Beurteilung: zufriedenstellende Anpassung – die Atmung muss nicht unterstützt werden. Die Herzfrequenz ist zufriedenstellend.
Maßnahmen:
Verzögertes Abnabeln.
Trocknen und in warme Tücher einwickeln.
Das Neugeborene verbleibt bei der Mutter und kann ihr auf die Brust gelegt werden. Es wird darauf geachtet, dass beide nicht auskühlen.
Bei stabilen Neugeborenen ist ein früher Hautkontakt auf der Brust der Mutter grundsätzlich anzustreben.
2.
(Abb. 4b)
Reduzierter Muskeltonus.
Insuffiziente Spontanatmung oder Apnoe.
Herzfrequenz < 100/min.
Beurteilung: beeinträchtigte Anpassung – die Atmung muss unterstützt werden, die langsame Herzfrequenz kann auf eine Hypoxie hinweisen.
Maßnahmen:
Verzögern Sie das Abnabeln nur, wenn das Neugeborene trotzdem effektiv versorgt werden kann.
Trocknen und stimulieren Sie das Neugeborene und wickeln Sie es in ein warmes Tuch.
Öffnen Sie die Atemwege.
Belüften Sie die Lunge und beatmen Sie das Neugeborene.
Beurteilen Sie regelmäßig Veränderungen der Herzfrequenz und Atmung sowie die Effektivität Ihrer Beatmung.
Wenn die Herzfrequenz nicht steigt, fahren Sie mit der Beatmung fort.
Möglicherweise ist weitere Hilfe erforderlich.
3.
(Abb. 4c)
Schlaffer Muskeltonus („floppy“) +/− Blässe.
Insuffiziente Spontanatmung oder Apnoe.
Herzfrequenz < 60/min oder nicht nachweisbar.
Beurteilung: schwer beeinträchtigte bzw. nicht erfolgte Anpassung – die Atmung muss umgehend unterstützt werden, die Herzfrequenz deutet auf eine schwere Hypoxie hin.
Maßnahmen:
Sofort abnabeln und zur Weiterversorgung auf eine Reanimationseinheit legen. Verzögern Sie das Abnabeln auch hier nur, wenn Sie das Kind trotzdem effektiv versorgen bzw. reanimieren können.
Trocknen und stimulieren Sie das Neugeborene und wickeln Sie es in ein warmes Tuch.
Öffnen Sie die Atemwege.
Belüften Sie die Lunge und beatmen Sie das Neugeborene.
Beurteilen Sie regelmäßig die Herzfrequenz und Atmung, sowie die Effektivität Ihrer Beatmung.
Fahren Sie mit den im Algorithmus zur Neugeborenenreanimation beschriebenen weiteren Reanimationsmaßnahmen in Abhängigkeit vom klinischen Zustand des Kindes fort.
Sehr wahrscheinlich wird zusätzliche Hilfe benötigt.
Frühgeborene
Für die Reanimation von Neugeborenen gelten die gleichen oben beschriebenen Prinzipien.
Erwägen Sie alternative/ergänzende Maßnahmen zum Wärmeerhalt, z. B. die Verwendung einer Polyethylenfolie.
Wenn das Frühgeborene spontan atmet, unterstützen Sie die Atmung mittels CPAP.
Erwägen Sie ein kontinuierliches Monitoring (Pulsoxymetrie +/− EKG) anstatt einer intermittierenden klinischen Beurteilung (z. B. durch wiederholtes Tasten des Pulses oder durch Auskultation).
Die Reanimation des Neugeborenen – Newborn Life Support
Setzen Sie nach der initialen Beurteilung und den ersten Maßnahmen zur Atemunterstützung die Beatmung fort, wenn
das Neugeborene keine suffiziente und regelmäßige Spontanatmung entwickelt oder
die Herzfrequenz weiter unter 100/min liegt.
Bei den meisten Neugeborenen ist nach dem Öffnen der Atemwege lediglich eine kurze Maskenbeatmung notwendig, damit sich das Neugeborene erholt und eine suffiziente Spontanatmung einsetzt. Alle weiteren Maßnahmen werden jedoch erfolglos bleiben, wenn diese ersten beiden Schritte, das Öffnen der Atemwege und die Belüftung der Lunge, nicht erfolgreich durchgeführt wurden.
Atemwege
Beginnen Sie mit Reanimationsmaßnahmen, wenn die initiale Beurteilung zeigt, dass das Neugeborene keine suffiziente Spontanatmung hat oder die Herzfrequenz < 100/min liegt (Abb. 5).
Das Öffnen und das Offenhalten der Atemwege sind initial und im weiteren Verlauf die entscheidenden Maßnahmen, um das Einsetzen einer suffizienten Spontanatmung zu unterstützen. Auch alle Reanimationsmaßnahmen (wie Beatmungen und Thoraxkompressionen) können nur erfolgreich sein, wenn die Atemwege suffizient geöffnet wurden und offen gehalten werden.
Techniken zum Öffnen der Atemwege
Lagern Sie das Neugeborene in Rückenlage mit dem Kopf in Neutralposition (Abb. 6a).
Um die Atemwege eines hypotonen Neugeborenen zu öffnen bzw. offen zu halten und die Leckage unter Maskenbeatmung zu verringern, ist das Vorziehen des Unterkiefers (Esmarch-Handgriff) die entscheidende Maßnahme (Abb. 6b). Die Durchführung des Esmarch-Handgriffs mit zwei Händen ermöglicht dabei ein noch besseres Vorziehen des Unterkiefers und eine noch effektivere Maskenbeatmung. Für die manuelle Beatmung wird dann allerdings eine zweite Person benötigt.
Die Verwendung eines Guedel-Tubus (oropharyngeale Atemwegshilfe) kann bei reifen Neugeborenen hilfreich sein, wenn die Beatmung Schwierigkeiten bereitet oder die oberen Atemwege anatomisch verlegt sind, z. B. bei Patienten mit einer ausgeprägten Mikrognathie. Bei Frühgeborenen ≤ 34 + 0 Schwangerschaftswochen sollen Guedel-Tuben nur mit Vorsicht verwendet werden, da sie selbst eine Atemwegsobstruktion hervorrufen oder verstärken können.
Ein Wendl-Tubus (nasopharyngeale Atemwegshilfe) kann ebenfalls in Betracht gezogen werden, wenn Schwierigkeiten beim Offenhalten der Atemwege oder der Maskenbeatmung bestehen.
Verlegung der Atemwege
Eine Obstruktion der oberen Atemwege kann ihre Ursache, insbesondere bei Frühgeborenen, in einer falschen Kopfposition, einem generell verminderten Atemwegstonus und/oder einer Engstellung des Larynx haben.
Echte mechanische Hindernisse sind selten. Ein Absaugen der oberen Atemwege ist nur erforderlich, wenn – nach Ausschluss aller anderen Ursachen für eine insuffiziente Beatmung – unter direkter Sicht Schleim, Käseschmiere, Mekonium oder Blutgerinnsel als die Ursache der Atemwegsobstruktion im Pharynx identifiziert werden können.
Das Absaugen des Pharynx soll dann unter direkter Sicht, idealerweise mit einem Laryngoskop und einem großlumigen Katheter erfolgen.
Mekonium
Bei nichtvitalen Neugeborenen mit mekoniumhaltigem Fruchtwasser besteht ein erhebliches Risiko, dass diese weiterführende Reanimationsmaßnahmen benötigen. Zumeist ist in diesen Situationen daher ein erfahrenes neonatologisches Versorgungsteam erforderlich, das über Erfahrung und Training in der Reanimation von Neugeborenen verfügt.
Da ein routinemäßiges tracheales Absaugen der Atemwege in diesen Situationen wahrscheinlich den Beginn effektiver Beatmungen verzögert, ist es nicht mehr empfohlen. Derzeit gibt es keine wissenschaftlichen Belege, die die Vorteile eines routinemäßigen trachealen Absaugens nahelegen. Daher soll bei nicht oder nicht suffizient atmenden Neugeborenen mit mekoniumhaltigem Fruchtwasser so schnell wie möglich ohne Verzögerungen mit einer Beatmung begonnen werden.
Sollte sich allerdings zeigen, dass sich der Brustkorb unter Beatmung nicht hebt bzw. die Beatmung ineffektiv erscheint, muss jetzt eine Obstruktion der Atemwege mit Mekonium als Ursache ausgeschlossen werden. In diesem Fall soll eine Absaugung unter direkter Sicht in Erwägung gezogen werden. Eine tracheale Intubation, sowie ein tracheales Absaugen ist allerdings nur selten notwendig, um die Atemwegsobstruktion zu beheben.
Initiale Beatmungshübe und assistierte Beatmung
Belüftung der Lunge
Abb. 7
Bei apnoischen oder nicht suffizient atmenden Neugeborenen soll so schnell wie möglich, idealerweise innerhalb der ersten 60 s nach der Geburt, mit einer Maskenbeatmung begonnen werden.
Verwenden Sie eine Beatmungshilfe, die eine Überdruckbeatmung ermöglicht, zusammen mit einer Maske passender Größe mit guter Passform.
Geben Sie fünf initiale Beatmungshübe mit einer verlängerten Inspirationszeit von 2 bis 3 s.
Starten Sie bei reifen Neugeborenen mit einem Spitzendruck von 30 cm H2O und beginnen Sie mit 21 % Sauerstoff (Raumluft). Für Frühgeborene vor 32 + 0 Schwangerschaftswochen soll der anfängliche Spitzendruck auf 25 cm H2O reduziert werden und die Beatmung mit 21–30 % Sauerstoff begonnen werden (siehe auch „Raumluft/Sauerstoff“).
Beurteilung
- Überprüfen Sie die Herzfrequenz
- Ein rascher Anstieg der Herzfrequenz (innerhalb von 30 s) oder eine stabil-hohe Herzfrequenz sind der beste Hinweis für eine erfolgreiche Belüftung der Lungen und Oxygenierung.
- Eine langsame oder sehr langsame Herzfrequenz deutet normalerweise auf eine anhaltende Hypoxie hin und hat ihre Ursache zumeist in einer ineffektiven Beatmung.
- Überprüfen Sie daher, ob sich der Thorax bewegt.
- Eine sichtbare passive Thoraxexkursion unter Beatmung deutet auf einen freien Atemweg und ein adäquates Tidalvolumen hin.
- Wenn sich der Thorax nicht hebt, kann dies auf eine Obstruktion der Atemwege oder einen unzureichenden Spitzendruck und ein inadäquates Tidalvolumen zur Belüftung der Lunge hinweisen.
Brustkorbhebung unter Beatmung
Abb. 8

Wenn sich der Brustkorb hebt und die Herzfrequenz unter Beatmung ansteigt:
Setzen Sie die kontinuierliche Beatmung fort, bis das Neugeborene eine suffiziente Spontanatmung zeigt und die Herzfrequenz über 100/min liegt.
Beatmen Sie idealerweise mit einer Frequenz von 30 Beatmungen/min mit einer Inspirationszeit von weniger als einer Sekunde.
Reduzieren Sie den Spitzendruck im Verlauf, wenn sich der Thorax ausreichend hebt.
Überprüfen Sie die Herzfrequenz und die Atmung mindestens alle 30 s.
Erwägen Sie eine Atemwegssicherung (Larynxmaske/Tubus), wenn das Neugeborene auch unter langer Beatmung keine suffiziente Spontanatmung entwickelt oder eine Maskenbeatmung (trotz Maßnahmen zur Optimierung der Maskenbeatmung, wie 2‑Hände-Esmarch-Handgriff und Verwendung von Atemwegshilfen, s. unten) nicht effektiv ist.
Keine Brustkorbhebung unter Beatmung
Kommt es zu keinem Anstieg der Herzfrequenz und der Thorax hebt sich nicht unter Beatmung, dann
überprüfen Sie, ob das Equipment, das zur Beatmung verwendet wird, ordnungsgemäß funktioniert.
Optimieren Sie die Kopfposition und das Vorziehen des Unterkiefers (Esmarch-Handgriff).
Überprüfen Sie die Größe, Positionierung und Dichtigkeit der Beatmungsmaske.
- Erwägen Sie alternative Atemwegs- und Beatmungstechniken:
- 2‑Helfer-Esmarch-Handgriff.
- Inspektion des Mund-Rachen-Raums und ggf. Absaugen unter Sicht, um eine mechanische Atemwegsobstruktion zu beseitigen.
- Verwendung eines Guedel- (oder Wendel‑)Tubus oder einer Larynxmaske.
- Eine tracheale Intubation ist zu diesem Zeitpunkt nur selten notwendig. (Anmerkung der AutorInnen der deutschen Fassung).
Erwägen Sie zudem eine schrittweise Erhöhung des Spitzendrucks.
Wird ein Gerät zur Messung von Spitzendruck, Tidalvolumen und Leckage unter Beatmung verwendet (sog. „Atemfunktionsmonitoring“), überprüfen Sie, ob das ausgeatmete Tidalvolumen (VT) nicht zu niedrig oder zu hoch ist (Zielbereich 5 bis 8 ml/kgKG).
Wenn sich der Brustkorb jetzt hebt:
Wiederholen Sie die 5 Beatmungen mit verlängerter Inspirationszeit von 2 bis 3 s.
Beurteilen Sie kontinuierlich die Herzfrequenz und die Thoraxbewegungen.
Wird tatsächlich eine tracheale Intubation oder die Verwendung einer Larynxmaske in Erwägung gezogen, muss dies durch in der erweiterten Atemwegssicherung erfahrenes Personal mit für diese Patientengruppe geeignetem Material erfolgen. Andernfalls wird mit der Maskenbeatmung fortgefahren und weitere Hilfe gerufen.
Ohne eine effektive Belüftung der Lunge werden Thoraxkompressionen unwirksam sein. Kommt es daher zu keinem Anstieg der Herzfrequenz unter Beatmung muss unbedingt zunächst die Effektivität der Beatmungen anhand suffizienter Thoraxbewegungen oder anderer Parameter, die eine effektive Beatmung anzeigen (z. B. mittels Atemfunktionsmonitoring), sichergestellt werden, bevor zu Thoraxkompressionen übergegangen werden darf.
Positiver endexspiratorischer Druck (PEEP) und kontinuierlicher positiver Atemwegsdruck (CPAP), Hilfsmittel zur assistierten Beatmung und Atemwegshilfen
Kontinuierlicher positiver Atemwegsdruck (CPAP) und positiver endexspiratorischer Druck (PEEP)
Bei spontan atmenden Frühgeborenen soll zunächst eine Atemunterstützung mittels CPAP nach der Geburt, entweder über eine Maske oder nasale Prongs, erwogen werden.
Müssen Frühgeborene tatsächlich beatmet werden („positive pressure ventilation“, PPV), sollte dies mit einem Gerät erfolgen, dass eine konstante und kontinuierliche PEEP-Applikation von mindestens 5–6 cm H2O unter Beatmung erlaubt.
Hilfsmittel zur assistierten Beatmung
Stellen Sie sicher, dass eine Maske in passender Größe verwendet wird, um eine gute Dichtigkeit zwischen Maske und Gesicht zu gewährleisten.
Verwenden Sie zur Beatmung, vor allem von Frühgeborenen, idealerweise ein flow-basiertes T‑Stück-System, welches Beatmungen mit einem standardisierten Spitzendruck und PEEP sowie die Möglichkeit eines reinen CPAP bietet.
Wird das Neugeborene lediglich mittels CPAP bei der Atmung unterstützt, können nasale Prongs geeigneter Größe hier eine sinnvolle Alternative zu CPAP-Masken darstellen.
Wird ein sich selbst füllender Beatmungsbeutel zur Beatmung verwendet, soll dieser ein ausreichendes Beutelvolumen aufweisen, um ausreichend hohe Tidalvolumen unter Beatmung zu erreichen. Bei Verwendung eines Beatmungsbeutels ist allerdings auch darauf zu achten, dass keine zu hohen Tidalvolumen verabreicht werden. Ein CPAP kann über einen selbstfüllenden Beatmungsbeutel nicht verabreicht werden.
Larynxmaske (LMA)
- Die Verwendung einer Larynxmaske kann erwogen werden:
- Bei Neugeborenen ab 34 + 0 Schwangerschaftswochen (entspricht etwa 2000 g – wobei Larynxmasken auch bei Frühgeborenen ab 1500 g erfolgreich eingesetzt werden konnten).
- Wenn eine Beutel-Maske-Beatmung nicht suffizient gelingt.
- Wenn eine Intubation aufgrund angeborener Anomalien, mangelnder Ausrüstung oder mangelnder Fähigkeiten nicht möglich ist oder eine erfolgreiche Intubation unter den gegebenen Bedingungen als zu unsicher beurteilt wird.
- Als Alternative zu einer trachealen Intubation.
Trachealtubus
- Eine tracheale Intubation kann in mehreren Phasen während der Reanimation eines Neugeborenen in Betracht gezogen werden:
- Wenn alle Manöver zur Optimierung einer Maskenbeatmung (wie oben beschrieben) nicht erfolgreich sind.
- Bei längerer Beatmung, um den Atemweg zu sichern.
- Wenn ein Absaugen der unteren Atemwege notwendig erscheint, um eine vermutete Obstruktion der Trachea zu beseitigen.
- Unter länger andauernden Reanimationsmaßnahmen.
- Unter besonderen Umständen (z. B. bei einer angeborenen Zwerchfellhernie oder zur Surfactant-Gabe).
Um eine tracheale Tubuslage zu überprüfen, soll eine endtidale CO2-Messung verwendet werden.
Tuben unterschiedlicher Größe sollen immer verfügbar sein. Die ideale Tubusgröße ermöglicht eine suffiziente Belüftung bei möglichst geringer Leckage und geringstem Trauma der Atemwege.
Tab. 1
Die Verwendung eines Atemfunktionsmonitorings kann ebenfalls dazu beitragen, eine tracheale Tubuslage zu verifizieren. Darüber hinaus kann mit diesem eine suffiziente Ventilation (adäquates exspiratorisches Tidalvolumen etwa 5 bis 8 ml/kgKG) und eine minimale Leckage bestätigt werden.
Die Verwendung eines Videolaryngoskops kann für die tracheale Intubation hilfreich sein.
Im Verlauf soll die korrekte Tubuslage (tracheale Lage und Tubustiefe) durch eine Bildgebung bestätigt werden.
| Gestationsalter (Wochen) |
Länge an den Lippen (cm) |
Außendurchmesser (mm) |
|---|---|---|
| 23–24 | 5,5 | 2,5 |
| 25–26 | 6,0 | 2,5 |
| 27–29 | 6,5 | 2,5 |
| 30–32 | 7,0 | 3,0 |
| 33–34 | 7,5 | 3,0 |
| 35–37 | 8,0 | 3,5 |
| 38–40 | 8,5 | 3,5 |
| 41–43 | 9,0 | 4,0 |
Für eine ungefähre Einführtiefe bei nasaler Intubation noch 1 cm addieren
Raumluft/Sauerstoff
Während der Reanimation eines Neugeborenen sollen ein Sauerstoffmischer und eine Pulsoxymetrie verwendet werden.
Innerhalb der ersten 5 Lebensminuten nach der Geburt soll das Neugeborene eine Sauerstoffsättigung zeigen, die über dem 25. Perzentil für gesunde Neugeborene liegt (Tab. 2).
Wenn trotz effektiver Beatmungen kein Anstieg der Herzfrequenz erfolgt oder die Sättigung niedrig bleibt, soll die Sauerstoffkonzentration stufenweise erhöht werden, um eine ausreichende präduktale Sauerstoffsättigung zu erreichen.
Überprüfen Sie die inspiratorische Sauerstoffkonzentration und die damit erreichte Sättigung regelmäßig (z. B. alle 30 s) und passen Sie die Sauerstoffkonzentration ggf. an, um sowohl eine Hypoxie als auch eine Hyperoxie zu vermeiden.
Verringern Sie die inspiratorische Sauerstoffkonzentration, wenn die präduktale (rechte Hand) Sättigung 95 % überschreitet.
| Zeit nach der Geburt (min) | Unterer SpO2-Grenzwert (%) |
|---|---|
| 2 | 65 |
| 5 | 85 |
| 10 | 90 |
Reife Neugeborene und Frühgeborene ab 32 + 0 Schwangerschaftswochen
Beginnen Sie bei reifen Neugeborenen und Frühgeborenen über 32 + 0 Schwangerschaftswochen, die nach der Geburt eine Atemunterstützung benötigen, mit einer Sauerstoffkonzentration von 21 % (Raumluft).
Frühgeborene vor 32 + 0 Schwangerschaftswochen
- Reanimationsmaßnahmen sollen je nach Gestationsalter mit Raumluft oder mit einer niedrigen Sauerstoffkonzentration begonnen werden:
- ≥ 32 + 0 SSW: 21 %
- 28 + 0 bis 31 + 6 SSW: 21–30 %
- < 28 + 0 SSW: 30 %
Bei Frühgeborenen vor 32 + 0 Schwangerschaftswochen soll eine Sauerstoffsättigung unter 80 % und/oder eine Bradykardie im Alter von 5 min unbedingt vermieden werden, da beides mit einem schlechteren Outcome verbunden ist.
Thoraxkompressionen
Beurteilung der Notwendigkeit von Thoraxkompressionen
Abb. 9a
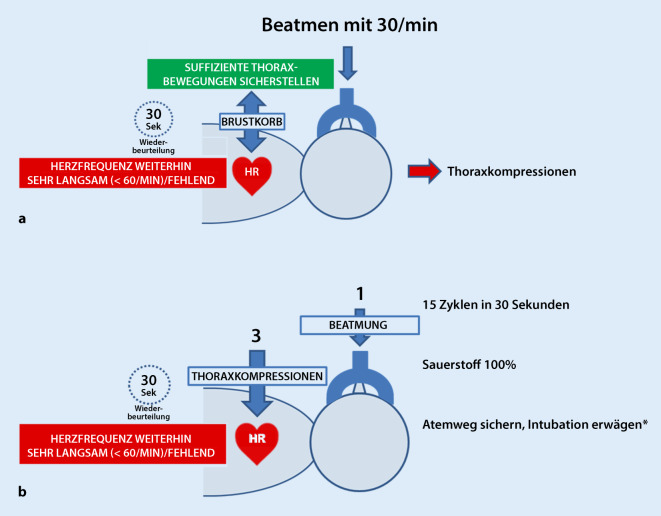
Wenn die Herzfrequenz nach 30 s suffizienter Beatmung sehr langsam bleibt (< 60/min) oder fehlt, beginnen Sie mit Thoraxkompressionen.
- Sobald Thoraxkompressionen durchgeführt werden:
- Erhöhen Sie die inspiratorische Sauerstoffkonzentration auf 100 %.
- Verständigen Sie, falls nicht bereits geschehen, umgehend weitere fachkundige Hilfe.
Durchführung von Thoraxkompressionen
Abb. 9b
Führen Sie Thoraxkompressionen und Beatmungen in einem Verhältnis von drei Thoraxkompressionen zu einer Beatmung synchronisiert durch. Die Kompressionsfrequenz soll etwa bei 120/min liegen (Ergänzung der AutorInnen der deutschen Fassung), so lassen sich etwa 15 Zyklen von Thoraxkompressionen und Ventilationen in 30 s erreichen.
Umgreifen Sie für die Thoraxkompressionen nach Möglichkeit den Thorax und verwenden Sie die 2‑Daumen-Technik. Der Druckpunkt soll unterhalb der gedachten Linie zwischen den Mamillen liegen (Ergänzung der AutorInnen der deutschen Fassung).
Die Kompressionstiefe soll bei etwa 1/3 des Thoraxdurchmessers liegen (Ergänzung der AutorInnen der deutschen Fassung).
Beurteilen Sie den Erfolg der Maßnahmen alle 30 s.
Anmerkung der Autoren der deutschen Fassung: Im Originaltext steht an dieser Stelle der Satz: „If the heart rate remains very slow or absent, continue but ensure that the airway is secured (e.g. intubate the trachea if competent and not done already).“ Für die AutorInnen der deutschen Fassung impliziert diese Formulierung einen zu starken Aufforderungscharakter und die AutorInnen möchten darauf hinweisen, dass es keine Evidenz dafür gibt, dass eine Intubation zu diesem Zeitpunkt das Outcome eines reanimationspflichtigen Neugeborenen tatsächlich verbessert. Darüber hinaus besteht Übereinkunft, dass die Fertigkeit eine Intubation, insbesondere im Rahmen einer Neugeborenenreanimation, sicher und effektiv durchzuführen, begrenzt ist und in den letzten Jahren zudem durch neue Versorgungsstrategien in der Neonatologie noch deutlich abgenommen hat. Die AutorInnen der deutschen Fassung möchten daher festhalten: Wenn sich der Brustkorb unter Beatmung zwischen den Thoraxkompressionen hebt, muss sehr gut abgewogen werden, ob eine Intubation zu diesem Zeitpunkt tatsächlich einen Vorteil bedeutet. Möglicherweise führt eine Intubation zu diesem Zeitpunkt zu einer Beeinträchtigung der Reanimationsmaßnahmen und zu einer Verzögerung weiterer Maßnahmen (z. B. Legen eines Notfallzugangs und Medikamentengabe). Mitunter kann eine Intubation zu diesem Zeitpunkt, insbesondere wenn sie nicht schnell und sicher durchgeführt werden kann, das Outcome des Neugeborenen verschlechtern.
Passen Sie die inspiratorische Sauerstoffkonzentration an die Sauerstoffsättigung an, wenn mit der Pulsoxymetrie ein plausibler Wert gemessen werden kann.
Erwägen Sie
Gefäßzugang und Medikamente.
Gefäßzugang
Peripherer Zugang
Während der Reanimation eines Neugeborenen nach der Geburt ist der periphervenöse Zugang für die Verabreichung von Medikamenten wahrscheinlich schwierig herzustellen und insgesamt suboptimal.
Nabelvenenkatheter
Die Nabelvene bietet bei Neugeborenen im Allgemeinen einen schnellen Gefäßzugang und soll als Methode der ersten Wahl während der Reanimation in Erwägung gezogen werden.
Der Nabelvenenkatheter muss vor der Verwendung entlüftet werden und als „geschlossenes System“ verwendet werden, um Luftembolien während des Einführens zu vermeiden, falls das Kind z. B. durch eine Schnappatmung einen ausreichenden intrathorakalen Unterdruck erzeugt.
Überprüfen Sie die korrekte Lage durch Aspiration von Blut über den Katheter, bevor Sie Medikamente oder Flüssigkeiten verabreichen.
Im Notfall kann eine saubere und nicht zwingend sterile Arbeitsweise ausreichend sein.
Ein Gefäßzugang über die Nabelvene kann eventuell einige Tage nach der Geburt noch möglich sein und kann unter Umständen bei einer postnatalen Verschlechterung als Zugangsweg in Erwägung gezogen werden.
Intraossärer Zugang
Der intraossäre (i.o.) Zugang stellt eine alternative Methode für den Notfallzugang zur Gabe von Medikamenten und Flüssigkeiten dar.
Gefäßzugang während der postnatalen Anpassung oder weiteren Versorgung nach erfolgreicher Reanimation („post-resuscitation care“)
Wenn nach erfolgreicher Reanimation ein venöser Zugang erforderlich ist, kann ein peripherer Gefäßzugang ausreichend sein, sofern nicht mehrere Infusionen zur gleichen Zeit erforderlich sind. In diesem Fall ist wahrscheinlich ein zentraler Gefäßzugang vorzuziehen.
Der intraossäre Zugang kann kurzfristig ausreichend sein, wenn kein anderer Gefäßzugang möglich ist.
Medikamente
Während der Durchführung von Reanimationsmaßnahmen
Medikamente werden während der Reanimation von Neugeborenen nur sehr selten benötigt und die Evidenz bezüglich ihrer Wirksamkeit ist begrenzt. Bleibt die Herzfrequenz trotz suffizienter Beatmung und Thoraxkompressionen für 30 s unter 60/min, kann die Gabe folgender Medikamente erwogen werden:
- Adrenalin
- Indikation: Wenn die Herzfrequenz trotz suffizienter Beatmung und Thoraxkompressionen weiter unter 60/min liegt.
- Applikationsweg: Bevorzugt intravenös oder intraossär
- Dosis: 10–30 µg/kgKG (0,1–0,3 ml/kgKG 1:10.000 Adrenalin [1000 µg in 10 ml]).
- Tracheale Gabe: Wenn das Neugeborene intubiert ist und kein anderer Zugang verfügbar ist.
- Tracheale Dosis: 50–100 µg/kgKG.
- Wiederholte Gaben alle 3–5 min, wenn die Herzfrequenz < 60/min bleibt.
- Glukose
- Indikation: Zur Verringerung der Wahrscheinlichkeit des Auftretens einer Hypoglykämie unter prolongierter Reanimation.
- Applikationsweg: Intravenös oder intraossär
- Dosis: 250 mg/kgKG als Bolus (2,5 ml/kgKG 10 %ige Glukoselösung)
- Volumentherapie
- Indikation: Bei Verdacht auf Blutverlust oder Schock, der nicht auf andere Reanimationsmaßnahmen anspricht.
- Applikationsweg: Intravenös oder intraossär
- Dosis: 10 ml/kgKG Rh-negatives Blut der Gruppe 0 oder isotonische kristalloide Lösung.
- Natriumbikarbonat
- Indikation: Kann bei längerer, erfolgloser Reanimation unter suffizienter Beatmung in Betracht gezogen werden, um eine intrakardiale Azidose günstig zu beeinflussen.
- Applikationsweg: Intravenös oder intraossär
- Dosis: 1–2 mmol/kgKG Natriumbikarbonat (2–4 ml/kgKG 4,2 %ige Lösung), langsame intravenöse Gabe.
In Situationen lang anhaltender Apnoe
- Naloxon
- Indikation: Neugeborene von Müttern, bei welchen eine Opioidgabe bekannt ist, die trotz effektiver Reanimationsmaßnahmen bei gutem Herzzeitvolumen apnoisch bleiben.
- Applikationsweg: Intramuskulär (i.m.)
- Dosis: 200 µg als Initialdosis
- Achtung: Naloxon ist nur kurz wirksam, daher ist im Verlauf ein kontinuierliches Monitoring der Atmung entscheidend.
Wenn sich das Neugeborene trotz suffizienter Reanimationsmaßnahmen nicht erholt
Ziehen Sie andere Faktoren in Betracht, die eine erfolgreiche Reanimation verhindern können und zunächst therapiert werden müssen, z. B. einen Pneumothorax, eine Hypovolämie, angeborene Anomalien oder auch ein Equipmentproblem etc.
Weitere Versorgung nach erfolgreicher Reanimation („post-resuscitation care“)
Auch nach anfänglicher Stabilisierung können sich Neugeborene nach einer Reanimation im weiteren Verlauf erneut klinisch verschlechtern. Sobald Atmung und Kreislauf stabilisiert sind, muss das Neugeborene daher an einen Ort verlegt werden, an dem eine engmaschige Überwachung und weitere intensivmedizinische Therapie erfolgen kann.
Glukose
Überwachen Sie den Glukosespiegel nach der Reanimation engmaschig.
Protokolle und Leitlinien zur Behandlung und zum Management des Blutzuckerspiegels nach Reanimation sollen vorhanden sein.
Verhindern Sie hyper- und hypoglykämische Phasen.
Verhindern Sie große Schwankungen der Blutglukosewerte.
Erwägen Sie eine Glukoseinfusion, um eine Hypoglykämie zu vermeiden.
Wärmemanagement
Halten Sie die Körperkerntemperatur des Neugeborenen zwischen 36,5 und 37,5 °C, wenn das Neugeborene die Kriterien für eine therapeutische Hypothermie (siehe unten) nicht erfüllt, und
wärmen Sie das Neugeborene aktiv, wenn die Temperatur unter diesen Zielbereich fällt.
Therapeutische Hypothermie
Nach erfolgreicher Reanimation soll erwogen werden, Neugeborene, die klinische und/oder biochemische Hinweise auf ein signifikant erhöhtes Risiko für die Entwicklung einer mittelschweren oder schweren hypoxisch-ischämische Enzephalopathie aufweisen, einer therapeutischen Hypothermie von 33 bis 34 °C zuzuführen.
Die Einschlusskriterien für eine therapeutische Hypothermie müssen klar definiert und dokumentiert sein. Dazu gehören Nabelschnurblutgasanalysen und der neurologische Status des Neugeborenen.
Sorgen Sie für einen sicheren Transport in eine Einrichtung, in der die erforderliche Behandlung sicher und effektiv durchgeführt werden kann und das Neugeborene kontinuierlich überwacht werden kann.
Die Durchführung einer therapeutischen Hypothermie ohne Berücksichtigung entsprechender Einschlusskriterien ist wahrscheinlich sogar eher schädlich (siehe Wärmemanagement).
Prognose (Dokumentation)
Erstellen Sie eine ausführliche Dokumentation, die den Zustand des Neugeborenen nach der Geburt, den Verlauf der Reanimation, alle eingeleiteten Maßnahmen in ihrer zeitlichen Reihenfolge und die Veränderungen des klinischen Zustands des Neugeborenen während der Durchführung dieser Maßnahmen berücksichtigt. Nur in Zusammenschau aller verfügbaren Befunde ist eine Einschätzung der Prognose, ggf. unter zusätzlicher Verwendung spezieller Prognosetools, möglich.
Kommunikation mit den Eltern
Wenn die Durchführung von unterstützenden Maßnahmen bereits vor der Geburt wahrscheinlich ist
Wann immer möglich, soll die Entscheidung zur aktiven Versorgung z. B. eines extremen Frühgeborenen oder eines Neugeborenen mit einer komplexen klinischen Symptomatik in enger Absprache mit den Eltern und erfahrenen Pädiatern, Hebammen und Geburtshelfern getroffen werden.
Besprechen Sie bereits vor der Entbindung möglichst alle denkbaren Optionen für die Versorgung, einschließlich der potenziellen Notwendigkeit von Reanimationsmaßnahmen und auch der Grenzen der Versorgung und Prognose, um im Konsens mit allen Beteiligten einen Plan für die Geburt zu entwickeln.
Dokumentieren Sie alle Diskussionen und Entscheidungen sorgfältig in der Krankenakte der Mutter vor der Entbindung und nach der Geburt in der Krankenakte des Neugeborenen.
Für jede Geburt
Wenn unterstützende Maßnahmen bzw. Reanimationsmaßnahmen nach der Geburt erforderlich sind, ist es sinnvoll, Eltern und engen Bezugspersonen zu ermöglichen, bei diesen Maßnahmen anwesend zu sein, wann immer die Situation und die Infrastruktur dies zulassen.
Bezüglich der Entscheidung, ob Eltern während dieser Phase anwesend sein können, sollen sowohl die Bedürfnisse des Teams, das die Reanimation durchführt, als auch die Bedürfnisse der Eltern berücksichtigt werden.
Unabhängig davon, ob die Eltern bei der Reanimation anwesend sind, muss sichergestellt sein, dass die Eltern über den Zustand des Kindes und die Behandlung ihres Kindes wann immer möglich informiert werden.
Das Miterleben der Reanimation des eigenen Kindes ist für Eltern eine extrem belastende Situation. Wenn es die Situation zulässt, kann es hilfreich für die Eltern sein, wenn ein Mitglied des Teams die Eltern während der Reanimation betreut und immer wieder über den Zustand des Kindes und die durchgeführten Maßnahmen informiert.
Ermöglichen Sie den Eltern, so bald wie möglich nach der Entbindung oder auch einer Reanimation, selbst wenn Wiederbelebungsmaßnahmen nicht erfolgreich waren, ihr Kind zu halten bzw. Haut-zu-Haut-Kontakt mit ihrem Neugeborenen herzustellen.
Klären Sie die Eltern über alle durchgeführten Maßnahmen auf und erklären Sie auch, warum diese so schnell wie möglich nach der Geburt notwendig waren.
Stellen Sie sicher, dass alle Ereignisse und auch alle nachfolgenden Gespräche mit den Eltern gut dokumentiert sind.
Bieten Sie den Eltern auch im weiteren Verlauf Gespräche an, die den Eltern helfen sollen, die Ereignisse zu reflektieren, zu begreifen und in der Folge auch aufarbeiten zu können.
Ziehen Sie zusätzliche Unterstützung für die Eltern (z. B. psychologisch oder seelsorgerisch) nach der Geburt bzw. nach erfolgter Reanimation in Erwägung.
Verzicht auf und Beendigung von Reanimationsmaßnahmen
Empfehlungen bezüglich des Verzichts auf oder der Beendigung von Reanimationsmaßnahmen müssen grundsätzlich immer auf Basis aktueller nationaler und regionaler Outcomedaten interpretiert und getroffen werden.
Wann immer Reanimationsmaßnahmen abgebrochen, zurückgenommen oder begründet vorenthalten werden, muss das Therapieziel auf das Wohlbefinden und ein Sterben in Würde für das Neugeborene und dessen Familie geändert werden.
Diese Entscheidungen sollen idealerweise immer unter Einbeziehung erfahrener NeonatologInnen bzw. KinderärztInnen getroffen werden.
Beendigung von Reanimationsmaßnahmen
Regionale und nationale Organisationen legen zumeist Empfehlungen zur Beendigung von Reanimationsmaßnahmen fest.
Wenn bei einem gerade geborenen Neugeborenen die Herzfrequenz länger als 10 min nicht nachweisbar ist, beurteilen Sie alle klinischen Faktoren (z. B. Schwangerschaftswoche, Fehlbildungen) und überprüfen Sie die Effektivität der Reanimationsmaßnahmen. Holen Sie sich darüber hinaus die Ansichten der anderen Teammitglieder in Bezug auf die weitere Fortsetzung der Reanimationsmaßnahmen ein.
Wenn die Herzfrequenz eines Neugeborenen nach der Geburt länger als 20 min nicht nachweisbar ist, obwohl alle Reanimationsmaßnahmen technisch korrekt durchgeführt werden und reversible Ursachen ausgeschlossen wurden, kann es angemessen sein, eine Beendigung der Wiederbelebungsmaßnahmen zu erwägen.
Wenn es unter Durchführung technisch korrekter Reanimationsmaßnahmen lediglich zu einer teilweisen Verbesserung des klinischen Zustands bzw. zu einem unzureichenden Anstieg der Herzfrequenz kommt, ist eine Entscheidung deutlich schwieriger zu treffen. Es kann in diesen Situationen angebracht sein, das Neugeborene zunächst auf die Intensivstation zu verlegen und in Zusammenschau aller weiteren Befunde einen Abbruch der lebenserhaltenden Maßnahmen erst in weiterer Folge in Erwägung zu ziehen, sofern sich der klinische Zustand des Neugeborenen nicht bessert.
Wenn eine lebenserhaltende Behandlung nicht durchgeführt oder beendet wird, muss eine angemessene palliative Therapie („Comfort Care“) im Vordergrund stehen.
Verzicht auf Reanimationsmaßnahmen
Auch Entscheidungen über das Nichtdurchführen lebenserhaltender Maßnahmen sollen idealerweise nur in Absprache mit den Eltern und auf Basis aktueller nationaler und regionaler Outcomedaten getroffen werden.
In Situationen, in denen eine extrem hohe (> 90 %) prognostizierte neonatale Sterblichkeit und eine inakzeptabel hohe Morbidität bei den überlebenden Neugeborenen wahrscheinlich ist, ist die Einleitung von Reanimationsmaßnahmen und ein aktives (überlebensorientiertes) Management normalerweise nicht angemessen.
Eine Wiederbelebung ist fast immer unter Bedingungen angezeigt, die mit einer hohen Überlebensrate (> 50 %) und einer als akzeptabel erachteten Morbidität verbunden sind. Dies schließt die meisten Neugeborenen mit einem Gestationsalter von ≥ 24 + 0 Schwangerschaftswochen (es sei denn, es bestehen Hinweise auf eine schwerwiegende fetale Beeinträchtigung, wie eine schwere intrauterine Infektion oder eine Hypoxie bzw. Ischämie) sowie die Mehrzahl der kongenitalen Fehlbildungen mit ein. Reanimationsmaßnahmen sollen im Allgemeinen auch in Situationen eingeleitet werden, in denen Ungewissheit über das Outcome besteht und keine Möglichkeit bestand, in vorherigen Gesprächen mit den Eltern ihre Sichtweise zu erfahren.
Unter Bedingungen mit geringer prognostizierter Überlebenschance (< 50 %) und hoher Morbidität und in der Folge mit einer hohen Belastung durch medizinische Behandlungen für das Kind sollen die Wünsche der Eltern hinsichtlich einer aktiven (überlebensorientierten) Versorgung eingeholt und in der Regel unterstützt werden.
Wissenschaftliche Grundlagen, auf deren Basis die Empfehlungen für die Praxis zur Versorgung und Reanimation des Neugeborenen beruhen
Pränatale Faktoren
Anpassung an das Leben nach der Geburt
Die Geburt bedeutet große physiologische Veränderungen während des Übergangs vom fetalen zum extrauterinen Leben. Damit ein adäquater Gasaustausch erfolgen kann, muss Flüssigkeit aus den Lungen entfernt werden und diese müssen belüftet werden [8]. Dieses kritische Ereignis löst eine Folge voneinander abhängiger kardiopulmonaler Veränderungen aus, die den Übergang zum extrauterinen Leben ermöglichen [9]. Spontane Atemanstrengungen (Unterdruck) oder eine weniger effektive künstliche Beatmung (Überdruck) sind unerlässlich, um den notwendigen transpulmonalen Druck zu erzeugen, der erforderlich ist, um die mit Flüssigkeit gefüllte Lunge zu belüften, und eine adäquate funktionelle Residualkapazität herzustellen und aufrechtzuerhalten [10, 11].
Die meisten, aber nicht alle Neugeborenen erleben diese Anpassungsphase an das extrauterine Leben völlig ohne Probleme. Einige Neugeborene zeigen Schwierigkeiten bei der Anpassung und müssen, wenn nicht umgehend unterstützende Maßnahmen unternommen werden, letztlich mitunter wiederbelebt werden. Neuere, groß angelegte Beobachtungsstudien weisen darauf hin, dass etwa 85 % aller reifen Neugeborenen nach der Geburt ohne Unterstützung spontan atmen. Bei etwa 10 % setzt unter Trocknen, taktiler Stimulation, Öffnen der Atemwege und/oder Anwendung von CPAP oder PEEP eine Spontanatmung ein, während ca. 5 % eine Überdruckbeatmung benötigen. Die Intubationsraten variieren je nach Studie zwischen 0,4 und 2 %. Weniger als 0,3 % benötigen Thoraxkompressionen und nur ca. 0,05 % eine Adrenalingabe [12–18].
Risikofaktoren
Zahlreiche mütterliche und kindliche prä- und intrapartale Faktoren können das Risiko einer komplizierten Geburt erhöhen bzw. zu einer beeinträchtigten Anpassung führen oder postnatale Reanimationsmaßnahmen notwendig machen. In einem kürzlich durchgeführten ILCOR-Evidenz-Update bestätigen die neuesten Studien zuvor bereits identifizierte Risikofaktoren, die die Wahrscheinlichkeit der Notwendigkeit unterstützender Maßnahmen nach der Geburt erhöhen [1, 19–28]. Bisher gibt es allerdings kein universell gültiges Modell zur Vorhersage des Risikos für Reanimationsmaßnahmen nach der Geburt oder der Notwendigkeit unterstützender Maßnahmen während der Anpassungsphase. Die Liste der Risikofaktoren in den Leitlinien kann daher nur unvollständig sein.
Eine elektive Sectio caesarea am Geburtstermin ohne weitere Risikofaktoren scheint das Risiko für Reanimationsmaßnahmen beim Neugeborenen nicht zu erhöhen [20, 29, 30]. Nach neuerlicher Sichtung relevanter Studien und Überprüfung der Evidenz bleiben die ILCOR-Empfehlungen daher unverändert: Wird ein Neugeborenes am Termin durch Kaiserschnitt unter Regionalanästhesie entbunden, soll eine Person anwesend sein, die eine assistierte Beatmung durchführen kann. Es ist nicht erforderlich, dass eine Person mit Erfahrung in der Intubation von Neugeborenen primär bei dieser Geburt anwesend ist [1].
Bei einer Geburt anwesendes Personal
Die Notwendigkeit von stabilisierenden Maßnahmen oder von Reanimationsmaßnahmen ist nicht immer vor der Geburt vorherzusehen. Daher müssen diejenigen, die eine Geburt durchführen, in der Lage sein, zumindest initiale Reanimationsmaßnahmen effektiv anzuwenden, obwohl zumeist keine dieser Maßnahmen notwendig sind. Darüber hinaus ist entscheidend, dass weitere Unterstützung, wenn sie benötigt wird, schnell verfügbar ist. Die Erfahrung und Fertigkeiten dieses Teams und deren schnelle Verfügbarkeit können das Outcome beeinflussen [31]. Unterschiedliche Institutionen haben sehr unterschiedliche Richtlinien, wann und welche Personen bereits im Voraus bei einer Geburt anwesend sein sollen. Das hat möglicherweise sehr unterschiedliche Patientenoutcomes zur Folge [32]. So ergab ein prospektives Audit von 56 kanadischen neonatologischen Abteilungen, dass nach den zu diesem Zeitpunkt geltenden Leitlinien in 76 % der Fälle Reanimationsmaßnahmen unvorhergesehen durchgeführt werden mussten [33]. In einer Reihe von Videoaufzeichnungen von Reanimationen in zwei norwegischen Level-III-Abteilungen war die Reanimationspflichtigkeit bei 32 % der Reanimationen nicht erwartet [34]. In einer einzelnen neonatologischen Abteilung eines kanadischen Krankenhauses wurden etwa 65 % aller Geburten in Anwesenheit des neonatologischen Teams durchgeführt, bei nur 22 % dieser Neugeborenen war eine mechanische Beatmung notwendig, bei 4,6 % mussten überraschend Reanimationsmaßnahmen durchgeführt werden [19].
Material und Umgebung
Das verfügbare, für die Reanimation von Neugeborenen notwendige Material kann ortsabhängig unterschiedlich sein. Alle Personen, die dieses Material verwenden, müssen sich daher etwaiger Limitationen bewusst sein. Es existieren Vorschläge zur Standardisierung einer optimalen Ausstattung und Organisation eines Reanimationsraums für Neugeborene [35]. Allerdings konnten bisher keine publizierten Arbeiten eine Outcomeverbesserung aufgrund spezifischer Vorkehrungen zeigen. Die Leitlinien basieren daher auf internationalen Expertenmeinungen [1, 36].
Geplante Hausgeburten
Ein systematischer Review von 8 Studien mit insgesamt 14.637 geplanten Hausgeburten mit geringem Risiko im Vergleich zu 30.177 geplanten Krankenhausgeburten mit geringem Risiko hat gezeigt, dass die Risiken für Morbidität und Mortalität für das Neugeborene vergleichbar waren [37]. Diejenigen, die Hausgeburten durchführen, müssen sich allerdings darüber im Klaren sein, dass Neugeborene bei einer Geburt in häuslichem Umfeld trotz erfolgter geringer Risikoeinschätzung möglicherweise trotzdem Reanimationsmaßnahmen benötigen können, und müssen zwingend auf diese vorbereitet sein [36].
Briefing & Checklisten
Ein Briefing vor der Geburt mit Rollenzuweisung zur Verbesserung der Teamarbeit und -dynamik wird empfohlen [38], obwohl es bisher keine Evidenz für ein verbessertes klinisches Outcome gibt [39]. Ebenso kann die Verwendung von Checklisten während Briefings (und Debriefings) zur Verbesserung der Teamkommunikation und des Teamprozesses beitragen. Auch diesbezüglich ist die Evidenz, inwiefern sich dadurch das klinische Outcome verbessern lässt, bisher begrenzt [40, 41]. Ein kürzlich durchgeführter Review im Rahmen eines ILCOR-Scoping-Verfahrens untersuchte die Auswirkung von Briefings und Debriefings auf das Outcome bei Neugeborenenreanimation und kam zu dem Schluss, dass Briefings oder Debriefings das kurzfristige klinische Outcome von Neugeborenen sowie die Teamperformance verbessern können. Die Auswirkungen auf das Langzeitoutcome sind jedoch weiterhin unklar [1].
Ein Briefing der Familie vor der Entbindung kann die Erwartungen und das Verständnis über die Ereignisse und Entscheidungen und die Interaktion mit dem versorgenden Team erheblich beeinflussen. Daher ist eine Kontaktaufnahme mit den Eltern im Vorfeld der Geburt, inklusive eines Briefings, häufig Bestandteil nationaler Empfehlungen zur Kommunikation mit Eltern (siehe Abschnitt „Kommunikation mit den Eltern“) [35].
Ausbildung und Training
Eine Metaanalyse zur Reanimation bei Erwachsenen ergab, dass die Teilnahme eines oder mehrerer Mitarbeiter an einem Advanced-Life-Support-Kurs das Patientenoutcome verbessert [42]. Die Forschung zu Trainingsmethoden in der Neugeborenenreanimation entwickelt sich zwar stetig weiter, jedoch sind aufgrund der Heterogenität der Studien und nicht standardisierter Outcomeparameter bisher keine belastbaren Aussagen über die Auswirkung verschiedener Trainingsmethoden auf das klinische Outcome möglich [43–45].
Für die Teilnehmer von Reanimations- oder Auffrischungskursen kann ein häufigeres und zeitlich verteiltes Training („spaced learning“) eine Alternative zu einem Training sein, das nur zu einem einzigen Termin angeboten wird („massed learning“) (schwache Empfehlung, sehr schwacher Evidenzgrad) [46]. Lediglich intermittierendes, seltenes Training ohne regelmäßige Auffrischungen führt in jedem Fall zu einem schnellen Verlust der zur Reanimation von Neugeborenen notwendigen Fähigkeiten und Fertigkeiten [47]. Ein häufiges und kurzes simulationsbasiertes Training vor Ort in einem „low-resource setting“ konnte hingegen zumindest das Überleben innerhalb der ersten 24 Lebensstunden von Patienten verbessern [48]. Zwei Beobachtungsstudien, in denen Videoaufzeichnungen von realen Reanimationen anhand von Checklisten analysiert wurden, zeigten ein häufiges Abweichen von den in strukturierten Leitlinien zur Neugeborenenreanimation empfohlenen Maßnahmen und Vorgehensweisen [17, 49]. Dies legt nahe, dass ein Training in Neugeborenenreanimation in jedem Fall häufiger als einmal pro Jahr erfolgen soll. Allerdings ist das optimale Trainingsintervall noch nicht bekannt [50, 51].
In den ERC-Leitlinien von 2015 wurde ein strukturiertes Ausbildungs- und Trainingsprogramm zur Reanimation von Neugeborenen empfohlen und durch zwei systematische Reviews und Metaanalysen bestätigt [36]. Ein Cochrane-Review von 14 Studien (18.080 Geburten) zeigte allerdings nur wenig Evidenz, dass durch ein solches Training die frühe Sterblichkeit von Neugeborenen gesenkt werden kann (typisches RR 0,88; 95 %-CI 0,78–1,00) [52]. Ergebnisse einer Metaanalyse von 20 Studien, in denen die Zeiträume vor und nach Reanimationstraining verglichen wurden, mit 1.653.805 eingeschlossenen Geburten zeigten eine Verringerung der perinatalen Mortalität um 18 % (RR 0,82; 95 %-CI 0,74–0,91). Die Ergebnisse dieser Studie mussten jedoch hinsichtlich des Risikos eines Bias und aufgrund des Studiendesigns bezüglich ihrer Aussagekraft herabgestuft werden [45]. Grundsätzlich ist der optimale Trainingsinhalt bzw. das optimale Kursprogramm für Neugeborenenreanimationskurse vor allem von der Organisationsstruktur der Institution und den Bedürfnissen der zu trainierenden Personen abhängig.
Ein kürzlich durchgeführter systematischer ILCOR-Review untersuchte mehrere Studien zu Teamtrainings in Neugeborenenreanimation [53–57]. Regelmäßiges Üben und Skill-Trainings führten zu einer Verbesserung der Teamperformance und Patientensicherheit, da TeilnehmerInnen durch wiederholtes Üben ermöglicht wurde, ihre Fähigkeiten auf individueller Ebene und im Team zu verbessern. Spezifische Team- und Leadership-Trainings sollen daher Bestandteil der Advanced-Life-Support-Kurse für professionelle Helfer sein (schwache Empfehlung, sehr schwacher Evidenzgrad) [39].
Multimodale Ansätze für Schulungen in Neugeborenenreanimation sind wahrscheinlich am sinnvollsten und effektivsten für das Lernen, insbesondere wenn sie simulationsbasiertes Training mit einem Schwerpunkt auf konstruktivem Feedback der Performance beinhalten [44, 52, 58–62]. Das Feedback kann dabei aus verschiedenen Quellen bezogen werden, z. B. vom Trainer, der Reanimations- bzw. Simulationspuppe selbst oder digital (z. B. Video, Audio, Atemfunktionsmonitoring etc.) [39, 62–64]. Die Wertigkeit von Virtual Reality, Online-Schulungen und Brettspielen ist für die Vermittlung von Trainingsinhalten zur Reanimation noch unbekannt. Ein Review von 12 Spielen mit Inhalten zur Reanimation von Neugeborenen hat gezeigt, dass diese Spiele möglicherweise Wissen, Fähigkeiten und die Einhaltung des Reanimationsalgorithmus verbessern können [65].
Feedbackgeräte, die Informationen zur Qualität von Reanimationsmaßnahmen anzeigen, können darüber hinaus z. T. auch in realen Situationen verwendet werden, um die Effektivität von Maßnahmen und die Einhaltung von Algorithmen zu verbessern [39, 66, 67]. Auf Basis der verfügbaren Daten wird eine konstruktive Nachbesprechung der individuellen und der Teamperformance bei Reanimationen sowohl von Erwachsenen als auch von Kindern grundsätzlich empfohlen (schwache Empfehlung, sehr schwacher Evidenzgrad) [39, 68–71]. Dies gilt auch für die Reanimation von Neugeborenen [55, 72, 73].
Wärmemanagement
Nackte, feuchte Neugeborene können ihre Körpertemperatur in einem Raum, selbst wenn dieser sich für Erwachsene angenehm warm anfühlt, nicht halten. Die Mechanismen und Auswirkungen von Kältestress für das Neugeborene und die Strategien, wie dieser vermieden werden kann, wurden bereits intensiv untersucht [74, 75]. Wärmeverlust kann durch Konvektion, Wärmeleitung, Wärmeabstrahlung und Verdunstung auftreten. Neugeborene reagieren daher sehr sensibel auf einen Wärmeverlust und kühlen ohne schützende Maßnahmen sehr schnell aus. Kälte bedeutet grundsätzlich Stress für das Neugeborene, senkt den arteriellen Sauerstoffpartialdruck und erhöht das Risiko einer metabolischen Azidose. Kritisch kranke Neugeborene sind dabei besonders anfällig. Durch das sofortige Abtrocknen und Einwickeln in warme Tücher kann ein starker Wärmeverlust bei den meisten Neugeborenen vermieden werden. Die Aufnahmetemperatur von nichtasphyktischen Neugeborenen ist grundsätzlich ein starker Prädiktor für Mortalität und Morbidität [76, 77]. Daher empfehlen die aktuellen ILCOR-Leitlinien, dass die Temperatur bei Aufnahme als Prädiktor für das Outcome sowie als Qualitätsindikator (starke Empfehlung, mäßiger Evidenzgrad) immer dokumentiert werden soll [51].
Frühgeborene reagieren besonders sensibel auf einen Wärmeverlust. Die Folge können schwerwiegende Komplikationen wie intraventrikuläre Blutungen, Beatmungsbedarf oder Hypoglykämien sein. In einigen Studien war ein Wärmeverlust auch mit Late-onset-Sepsen verbunden [51]. In einer europäischen Kohortenstudie mit 5697 Neugeborenen unter 32 Schwangerschaftswochen, die auf eine Neugeborenenstation aufgenommen wurden, war eine Temperatur bei Aufnahme < 35,5 °C mit einer erhöhten Mortalität in den ersten 28 Lebenstagen assoziiert [78]. Für jede Abnahme der Temperatur bei Aufnahme um 1 °C unter den empfohlenen Zielbereich von 36,5 bis 37,5 °C ist ein Anstieg der Mortalität um 28 % beschrieben [79].
Ein Cochrane-Review mit 46 Studien und 3850 Neugeborenenpaaren („matched pairs“) vor 32 Schwangerschaftswochen, bei denen keine Wiederbelebung erforderlich war, kam zu dem Ergebnis, dass der Haut-an-Haut-Kontakt mit der Mutter die Wärme wirksam aufrechterhalten kann (schwacher Evidenzgrad). Auch die Bindung zur Mutter sowie die Stillrate wurden verbessert (schwacher bis mäßiger Evidenzgrad) [80]. Allerdings haben die meisten Studien zu diesem Thema eine geringe Fallzahl, sind häufig nicht verblindet und weisen oft eine deutliche Heterogenität der Gruppen auf. Ein Haut-an-Haut-Kontakt ist auch für Frühgeborene oder wachstumsretardierte Neugeborene möglich. Allerdings ist bei diesen besondere Sorgfalt geboten, um eine Unterkühlung zu vermeiden. In einer Beobachtungsstudie an einem einzigen Zentrum wurden 55 Neugeborene zwischen 28 + 0 und 32 + 6 Schwangerschaftswochen in zwei Gruppen entweder mit Haut-an-Haut-Kontakt oder konventioneller Wärmebehandlung randomisiert und die mittlere Hauttemperatur gemessen. In der Haut-an-Haut-Gruppe war die Temperatur eine Stunde nach der Geburt um 0,3 °C niedriger (36,3 °C ±0,52; p = 0,03) [81]. Weitere Studien zu diesem Thema sind in Durchführung [82].
Nach einer kürzlich durchgeführten Evidenzaktualisierung des ILCOR, einschließlich eines systematischen Cochrane-Reviews von 25 Studien, darunter 2433 Frühgeborene und Neugeborene mit niedrigem Geburtsgewicht, bleiben die Behandlungsempfehlungen bezüglich des Wärmemanagements gegenüber 2015 unverändert [77]. Es wird empfohlen, dass die Körpertemperatur bei Neugeborenen zwischen 36,5 und 37,5 °C gehalten werden soll, um den metabolischen Stress des Neugeborenen zu verringern (starke Empfehlung, sehr schwacher Evidenzgrad) [1, 51]. Für Frühgeborene vor 32 Schwangerschaftswochen wird zusätzlich zur Verwendung eines Heizstrahlers eine Kombination von weiteren Maßnahmen empfohlen. Diese können aus einer Erhöhung der Umgebungstemperatur auf 23–25 °C, gewärmten Decken, der Verwendung von Plastikfolie ohne vorheriges Abtrocknen, gewärmten Mützen und Wärmematratzen bestehen, um den Wärmeverlust bis zur Aufnahme auf der Neugeborenenintensivstation (NICU) zu verringern (schwache Empfehlung, sehr schwacher Evidenzgrad) [1]. Für Neugeborene unter 28 Schwangerschaftswochen soll die Raumtemperatur idealerweise sogar über 25 °C liegen [74, 75, 83]. Sind keine externen Wärmequellen verfügbar, kann es sinnvoll sein, Frühgeborene zunächst, ohne sie abzutrocknen, in Plastikfolie einzuhüllen und dann mit warmen Windeln zu umwickeln [74, 75, 84].
Auch eine Hyperthermie (> 38,0 °C) soll vermieden werden, da dies ebenfalls mit potenziellen Risiken verbunden ist (schwache Empfehlung, sehr schwacher Evidenzgrad) [1, 51]. Neugeborene fiebernder Mütter haben eine höhere Inzidenz von postnatalen Atemstörungen, Krampfanfällen und Zerebralparesen. Auch die frühe neonatale Sterblichkeit scheint erhöht [85–87]. Tiermodellstudien haben darüber hinaus gezeigt, dass eine Hyperthermie während oder nach einer Ischämie mit einer Vergrößerung des neurologischen Schadens verbunden ist [87].
Eine effektive Überwachung der Köpertemperatur von Neugeborenen ist entscheidend, um Kältestress für diese zu vermeiden. Die Evidenz bezüglich der optimalen Platzierung von Temperatursonden bei Neugeborenen im Kreißsaal ist jedoch begrenzt. In einer Beobachtungsstudie mit 122 Frühgeborenen zwischen 28 und 36 Schwangerschaftswochen, randomisiert bezüglich der Positionierung einer Temperatursonde, wurden am Rücken, Thorax oder axillär vergleichbare Temperaturen gemessen [31]. Bisher gibt es keine publizierten Studien zur vergleichenden Verwendung von Rektaltemperatursonden.
Die Verwendung angewärmter und befeuchteter Atemgase während der Atemunterstützung können das Auftreten einer mäßigen Hypothermie bei Frühgeborenen reduzieren [88]. Eine Metaanalyse von zwei RCT mit 476 Neugeborenen vor 32 Schwangerschaftswochen ergab, dass angewärmte und befeuchtete Atemgase unmittelbar nach der Entbindung die Wahrscheinlichkeit einer Hypothermie bei Frühgeborenen um 36 % verringerten (95 %-CI 17–50 %) (hoher Evidenzgrad) [89, 90]. Es ist unklar, ob auch weitere Outcomeparameter dadurch verbessert wurden. Es konnte kein signifikanter Anstieg des Hyperthermierisikos oder ein Unterschied in der Mortalität zwischen den Gruppen mit befeuchteten und nicht befeuchteten Atemgasen nachgewiesen werden.
Programme zur Qualitätsverbesserung, einschließlich der Verwendung von Checklisten und des kontinuierlichen Feedbacks an die versorgenden Teams, haben gezeigt, dass sich damit die Unterkühlung bei der Aufnahme von Frühgeborenen ebenfalls signifikant reduzieren lässt [83, 91].
Abnabeln
Der Begriff „verzögertes Abnabeln“ („delayed“ oder „deferred cord clamping“, DCC) ist bisher zeitlich nicht klar und allgemein anerkannt definiert. „Verzögertes Abnabeln“ bedeutet lediglich, dass das Abnabeln nicht unmittelbar nach der Geburt des Kindes erfolgt. In neueren systematischen Reviews und Metaanalysen wurde für das frühe oder sofortige Abnabeln („early“ oder „immediate cord clamping“, ICC) ein Zeitraum kleiner als 30 s nach der Geburt definiert. Verzögertes Abnabeln wurde als Zeitraum ab 30 s nach der Geburt oder auch basierend auf physiologischen Parametern (z. B. nach einem Ende der Nabelschnurpulsationen oder nach dem Einsetzen einer Spontanatmung), exklusive eines Ausstreichens der Nabelschnur, definiert [92, 93].
Physiologie des Abnabelns
Beobachtungsdaten, physiologische Studien, Tiermodelle und einige klinische Studien legen nahe, dass das sofortige Abnabeln derzeit weit verbreitet ist und hauptsächlich zur Vorbeugung von postpartalen Blutungen bei Müttern eingeführt wurde. Dabei wurden die potenziellen Nachteile eines frühen Abnabelns bisher möglicherweise unterschätzt [94, 95]. Sofortiges Abnabeln reduziert jedoch die ventrikuläre Vorlast signifikant und erhöht damit gleichzeitig die linksventrikuläre Nachlast [9, 96]. Die Auswirkungen eines frühen Abnabelns wurden in Beobachtungsstudien und experimentellen Tiermodellen [97] beschrieben und zeigen eine Abnahme der Herzgröße für 3–4 Herzzyklen [98] verbunden mit einer Bradykardie [99].
Unterschiede bezüglich der Schwangerschaftswoche
Bei Neugeborenen führt das verzögerte Abnabeln zur Übertragung von ungefähr 30 ml/kgKG Blut aus der Plazenta zum Kind [100]. Dies verbessert den Eisenstatus und die hämatologischen Werte in den ersten 3 bis 6 Lebensmonaten bei allen Neugeborenen und verringert den Transfusionsbedarf bei Frühgeborenen [101, 102]. Bedenken hinsichtlich einer Polyzythämie und damit verbundenen therapiepflichtigen Hyperbilirubinämie bei verzögertem Abnabeln scheinen sich in randomisierten Studien nicht zu bestätigen. Bedenken hinsichtlich der Position des Neugeborenen, in Relation zum Plazentaniveau, bei noch intakter Nabelschnur, scheinen ebenfalls unbegründet zu sein. Die Auswirkungen der Uteruskontraktion und der Lungenexpansion scheinen einen größeren Einfluss auf die Durchblutung der Nabelschnur zu haben als die Schwerkraft [103, 104].
In einer ILCOR-Metaanalyse von 23 Studien mit 3514 eingeschlossenen Neugeborenen wurde das sofortige Abnabeln mit einem verzögerten Abnabeln von mindestens 30 s bei Frühgeborenen vor 34 Schwangerschaftswochen verglichen. Die Neugeborenen, die verzögert abgenabelt wurden, zeigten dabei eine lediglich marginal verbesserte Überlebensrate (RR 1,02; 95 %-CI 0,993 bis 1,04) (mäßiger Evidenzgrad) [92]. Allerdings konnte die frühe kardiovaskuläre Stabilität verbessert werden, was sich an einer geringeren Notwendigkeit einer inotropen Unterstützung (RR 0,36; 95 %-CI 0,17 bis 0,75) und einem höheren niedrigsten mittleren Blutdruck in den ersten 12–24 Lebensstunden zeigte (MD 1,79 mm Hg; 95 %-CI 0,53 bis 3,05). Die verzögert abgenabelten Neugeborenen hatten zudem bessere hämatologische Werte: Der maximale Hämatokrit war nach 24 Lebensstunden (MD 2,63; 95 %-CI 1,85 bis 3,42) und nach 7 Lebenstagen (MD 2,70; 95 %-CI 1,88 bis 3,52) höher als in der Vergleichsgruppe. Die Neugeborenen benötigten insgesamt weniger Bluttransfusionen (MD −0,63; 95 %-CI −1,08 bis −0,17). Es konnten keine Auswirkungen auf Komplikationen der Frühgeburtlichkeit, wie schwere intraventrikuläre Blutungen, nekrotisierende Enterokolitis oder chronische Lungenerkrankungen, beobachtet werden. Auch waren keine offensichtlichen nachteiligen Auswirkungen auf andere Outcomeparameter weder bei den Neugeborenen noch den Müttern zu beobachten (mäßiger bis hoher Evidenzgrad). In Untergruppenanalysen schien sich eine fast lineare Beziehung zwischen dem Überleben bis zur Entlassung und der Dauer des verspäteten Abnabelns zu zeigen: Verzögerung beim Abnabeln für ≤ 1 min, RR 1,00 (95 %-CI 0,97–1,04); 1 bis 2 min, RR 1,03 (95 %-CI 1,00–1,05); für > 2 min, RR 1,07 (95 %-CI 0,99–1,15). Keines dieser Ergebnisse war aufgrund der relativ geringen Anzahl an Patienten allerdings statistisch signifikant.
Für Frühgeborene und späte Frühgeborene („late preterms“) aktualisierte eine ILCOR-Metaanalyse von 33 Studien (5236 Neugeborene), die eine verzögerte Abnabelung mit einer sofortigen Abnabelung für diese Patientengruppe verglich, die Ergebnisse einer früheren Cochrane-Studie aus dem Jahr 2013 [93, 105]. Die Analyse zeigte keinen signifikanten Effekt auf die Mortalität (RR 2,54; 95 %-CI 0,50 bis 12,74; 4 Studien, 537 Neugeborene) oder die Notwendigkeit für Reanimationsmaßnahmen (RR 5,08; 95 %-CI 0,25 bis 103,58; 3 Studien, 329 Neugeborene). Es zeigten sich verbesserte frühe hämatologische Werte und eine Verbesserung allgemeiner Kreislaufparameter (Hämoglobin ≤ 24 Lebensstunden [MD 1,17 g∙dl−1; 95 %-CI 0,48 bis 1,86, 9 Studien, 1352 Neugeborene]) und 7 Tage nach der Geburt (MD 1,11 g∙dl−1; 95 %-CI 0,40 bis 1,82, 3 Studien, 695 Neugeborene), aber keine Auswirkungen auf eine längerfristige Anämie. Der aktualisierte Review zeigte darüber hinaus keine deutlichen Unterschiede bezüglich der Notwendigkeit einer Phototherapie (RR 1,28; 95 %-CI 0,90 bis 1,82) (schwacher oder sehr schwacher Evidenzgrad). Die Analyse lieferte keine eindeutigen Ergebnisse in Bezug auf das längerfristige neurologische Outcome.
Zum optimalen Abnabelungszeitpunkt sind weitere Studien erforderlich. Die meisten Studien verwenden derzeit eine zeitliche Definition für den Zeitpunkt des Abnabelns. Es gibt daher nicht genügend Daten, um eine „physiologische“ Abnabelung (d. h. nach dem Einsetzen der Atmung) [106] zu empfehlen, auch wenn dies möglicherweise vorteilhaft sein könnte [107]. Physiologische Studien legen allerdings nahe, dass die beobachtete hypoxische und bradykarde Antwort nach sofortigem Abnabeln nicht zu beobachten ist, wenn das Abnabeln erst nach den ersten Atemzügen erfolgt [97, 99, 108].
Bezüglich der Frage, wie sinnvoll die Durchführung von Reanimationsmaßnahmen bei intakter Nabelschnur ist, sind ebenso weitere Studien erforderlich. In den meisten Studien zum verzögerten Abnabeln wurden reanimationspflichtige Neugeborene bisher ausgeschlossen, da die Reanimationsmaßnahmen nur entfernt von der Mutter durchgeführt werden konnten. Mittlerweile sind zwar Geräte verfügbar, die die Durchführung von Reanimationsmaßnahmen an der Seite der Mutter ermöglichen. Erste Studien zeigen, dass bei solchen Neugeborenen eine verzögerte Abnabelung durchführbar ist [109–111]. Der optimale Abnabelungszeitpunkt bleibt für reanimationspflichtige Neugeborene allerdings weiterhin unklar.
Ausstreichen der Nabelschnur („cord milking“)
Ein verzögertes Abnabeln ist kontraindiziert, wenn der Blutfluss über die Plazenta durch eine Ruptur, einen Nabelschnurprolaps, bei einer Placenta praevia, einem Nabelschnurabriss oder einer mütterlichen Blutung beeinträchtigt ist oder sein kann. In diesen Situationen wurde ein Ausstreichen der Nabelschnur bei intakter oder auch bereits durchtrennter Nabelschnur bisher als Alternative angesehen. Beim Ausstreichen der intakten Nabelschnur wird die Nabelschnur drei bis fünf Mal Richtung Neugeborenes ausgestrichen. Ein Neugeborenes kann dadurch bis zu 50 ml zusätzliches „Plazentablut“ erhalten. Der Blutfluss in Richtung des Neugeborenen ist in diesem Fall schneller als der passive Blutfluss während der physiologischen Kontraktionen des Uterus. Nach dem Ausstreichen wird die Nabelschnur geklemmt und durchtrennt und das Neugeborene kann zum Versorgungsbereich gebracht werden [112].
Beim Ausstreichen der bereits durchtrennten Nabelschnur wird das Neugeborene abgenabelt und sofort zum Versorgungsbereich gebracht. Das Ausstreichen erfolgt dann während der Stabilisierung oder unter Reanimationsmaßnahmen. Aus der durchtrennten Nabelschnur wird eine Nabelschnurlänge von etwa 25 cm in Richtung Neugeborenes ausgestrichen. Das übertragene Blutvolumen ist in diesem Fall geringer als beim Ausstreichen der intakten Nabelschnur, resultiert für das Neugeborene jedoch immerhin in noch etwa 25 ml „zusätzlichem“ Blutvolumen [113].
Bei Frühgeborenen vor 34 Schwangerschaftswochen zeigt das Ausstreichen einer intakten Nabelschnur nur vorübergehende Vorteile gegenüber einem sofortigen Abnabeln, u. a. eine geringere Notwendigkeit inotroper Medikamente, weniger Bluttransfusionen und höhere Hämoglobin- und Hämatokritwerte am ersten Lebenstag (jedoch nicht nach sieben Lebenstagen). Es gab keine Unterschiede bezüglich schwerer Morbiditäten bei diesen Neugeborenen (schwacher bis mäßiger Evidenzgrad). Ein Vorteil gegenüber einer verzögerten Abnabelung konnte allerdings ebenso nicht nachgewiesen werden [92]. In Metaanalysen zeigten sich keine Auswirkungen auf die Gesamtmortalität (RR 0,99; 95 %-CI 0,95–1,02). Allerdings musste eine große Studie über das Ausstreichen bei intakter Nabelschnur im Vergleich zur verzögerten Abnabelung vorzeitig abgebrochen werden, da eine Subgruppenanalyse eine Erhöhung an schweren intraventrikulären Blutungen (RD 16 %; 95 %-CI 6 bis 26 %; p = 0,002) bei Frühgeborenen vor 28 Schwangerschaftswochen zeigte, bei denen die intakte Nabelschnur ausgestrichen wurde [114].
Aufgrund der begrenzten Datenlage sind derzeit keine Metaanalysen und damit keine Aussagen bezüglich des Ausstreichens der Nabelschnur bei reifen Neugeborenen und späten Frühgeborenen möglich [93].
Initiale Beurteilung
Initiale Beurteilung
Der APGAR-Score ist nicht geeignet und wurde dafür auch nicht entwickelt, um zu entscheiden, ob ein Neugeborenes Reanimationsmaßnahmen benötigt [115]. Eine rasche und simultane Beurteilung einzelner Komponenten des Scores, wie Atemfrequenz, Herzfrequenz und Muskeltonus, ist jedoch hilfreich, um unmittelbar nach der Geburt einschätzen zu können, ob ein Neugeborenes unterstützende Maßnahmen benötigt oder reanimiert werden muss.
Taktile Stimulation
Zahlreiche Methoden der taktilen Stimulation sind beschrieben, die optimale Methode ist jedoch unbekannt [116, 117]. Frühgeborene werden scheinbar häufig nicht stimuliert [117–120], jedoch zeigte eine RCT in einem einzelnen Zentrum bei 51 Frühgeborenen zwischen 28 und 32 Schwangerschaftswochen, dass standardisierte wiederholte Stimulationsmaßnahmen (im Gegensatz zu Stimulationsmaßnahmen, die nur durchgeführt wurden, wenn dies vom Versorgenden als notwendig erachtet wurde) die Atemanstrengung verringerten und die Sauerstoffsättigung verbesserten (SpO2 87,6 ± 3,3 % gegenüber 81,7 ± 8,7 %; p = 0,007) [121]. Im Rahmen einer multizentrischen Beobachtungsstudie in Tansania mit 86.624 eingeschlossenen reifen bzw. nahezu reifen Neugeborenen konnte gezeigt werden, dass nach Einführung eines Basistrainings zur Neugeborenenreanimation und damit verbundener häufigerer Stimulation der Neugeborenen nach der Geburt dies mit einer erhöhten Überlebensrate in den ersten 24 Lebensstunden verbunden war [122].
Muskeltonus und Hautfarbe
Gesunde Neugeborene sind bei Geburt zyanotisch, beginnen jedoch im Allgemeinen innerhalb von etwa 30 s nach dem Einsetzen einer suffizienten Atmung zunehmend rosig zu werden [123]. Eine periphere Zyanose ist häufig und ist an sich zumeist kein Hinweis für eine Hypoxie. Eine anhaltende Blässe trotz Beatmung kann auf eine signifikante Azidose oder seltener auf eine Hypovolämie mit deutlicher peripherer Vasokonstriktion hinweisen. Eine rosige obere Körperhälfte bei zyanotischer unterer Körperhälfte kann ein Zeichen für einen Rechts-links-Shunt über einen offenen Ductus sein.
Anhand des Hautkolorits lässt sich die periphere Sättigung eines Neugeborenen grundsätzlich nur sehr unzuverlässig einschätzen. Die Beurteilung der Oxygenierung soll daher idealerweise unter Zuhilfenahme einer Pulsoxymetrie erfolgen. Insgesamt gibt es nur wenige Studien zur klinischen Beurteilung des Hautkolorits bei Neugeborenen. In einer Beobachtungsstudie, an der 27 Ärzte teilnahmen, die anhand von Videos von Frühgeborenen mit bekannten Sättigungswerten die periphere Sättigung visuell einschätzen sollten, zeigten sich kaum Übereinstimmungen, mit Fehleinschätzungen im Sinne einer Unter- als auch Überschätzung der peripheren Sättigung [124].
Atmung
Fehlendes kräftiges Schreien nach der Geburt kann auf eine Apnoe zurückzuführen sein. Darüber hinaus kann es aber auch ein Hinweis für eine insuffiziente Atmung sein und die Notwendigkeit von unterstützenden Maßnahmen anzeigen. In einer Beobachtungsstudie mit 19.977 Neugeborenen kurz nach der Geburt in 4 ländlichen Krankenhäusern in Nepal waren von 11 % der Neugeborenen, die postnatal kein kräftiges Schreien zeigten, etwa die Hälfte apnoisch. Ungefähr 10 % der Neugeborenen, die nicht schrien, aber zunächst als spontan atmend beurteilt wurden, zeigten im weiteren Verlauf eine Apnoe. Das Fehlen eines kräftigen Schreiens nach der Geburt, bei allerdings vorhandener Atmung, war mit einer 12-fach erhöhten Morbidität in diesem Setting verbunden [125].
Bei Frühgeborenen kann eine suffiziente Atmung häufig schwer zu beurteilen sein, da die Atemanstrengungen sehr diskret sein können und daher oft übersehen werden [123, 126]. Eine als unzureichend empfundene Atmung führt dann häufig zur Einleitung entsprechender Maßnahmen. So wurden in einer retrospektiven videobasierten Beobachtungsstudie mit 62 Frühgeborenen, die vor 28 Schwangerschaftswochen oder mit einem Geburtsgewicht von < 1000 g geboren wurden, 80 % der beurteilten Frühgeborenen nachträglich als atmend eingestuft. Alle diese Kinder erhielten eine Atemunterstützung mittels CPAP oder wurden intubiert [127].
Herzfrequenz
Die Bestimmung der Herzfrequenz unmittelbar nach der Geburt ist hilfreich, um den initialen klinischen Zustand des Neugeborenen einzuschätzen. Im weiteren Verlauf der Versorgung ist die Herzfrequenz der sensitivste klinische Parameter, um den Erfolg von durchgeführten Maßnahmen (z. B. von Beatmungen) zu beurteilen [128–130]. Aufgrund fehlender Studien ist es weiterhin nicht möglich, Grenzwerte der Herzfrequenz auf einer wissenschaftlichen Basis zu definieren, die spezifische unterstützende Maßnahmen bzw. Reanimationsmaßnahmen nach sich ziehen sollen. Die Grenzen von 100/min bzw. 60/min sind im Wesentlichen pragmatischer Natur [131].
Bei Reifgeborenen mit suffizienter Atmung, die verzögert abgenabelt werden, liegt die Herzfrequenz normalerweise über 100/min [130]. In einer Beobachtungsstudie mit 1237 reifen bzw. nahezu reifen Neugeborenen, die in einer ländlichen Umgebung wiederbelebt wurden, waren die initial gemessenen Herzfrequenzen bei der Geburt zweigipflig um 60 und 165/min verteilt. Eine Beatmung erhöhte die Herzfrequenz bei den meisten der bradykarden Neugeborenen letztlich auf einen Median von 161/min. Initiale und auch im weiteren Verlauf niedrige Herzfrequenzen waren mit einem schlechteren Outcome assoziiert [132]. Bei Frühgeborenen vor 30 + 0 Schwangerschaftswochen stabilisierte sich die Herzfrequenz erst, wenn sie ungefähr 120/min erreicht hatte, in einigen Fällen sogar erst bei einer Herzfrequenz von > 150/min [133].
Die Auskultation mit dem Stethoskop ist eine kostengünstige und simple Methode und ermöglicht eine einigermaßen genaue und schnelle Beurteilung der Herzfrequenz. In Kreißsaalstudien bei Neugeborenen mit geringem Risiko war die Bestimmung der Herzfrequenz innerhalb von 14 (10–18) Sekunden möglich (Median [IQR]). Allerdings wurden die auskultatorischen Herzfrequenzwerte im Vergleich zum EKG bzw. zur Pulsoxymetrie zwischen −9 (±7)/min bzw. −14 (±21)/min unterschätzt (mittlere Differenz [95 %-CI]) [134, 135].
Die Palpation eines Pulses an der Basis der Nabelschnur kann schnell gelingen (schwieriger an der A. brachialis oder A. femoralis). Wird ein schneller Puls > 100/min getastet, kann dieser auch als zuverlässig angesehen werden. Allerdings ist das Tasten des Pulses (insbesondere in einer Notfallsituation, Anmerkung der Übersetzer) häufig ungenau und die Herzfrequenz wird mitunter erheblich unterschätzt. Dies kann dann in weiterer Folge zur Einleitung unnötiger Maßnahmen führen [135, 136].
Eine kontinuierliche Überwachung der Herzfrequenz liefert darüber hinaus eine dynamischere Anzeige der Herzfrequenz und ist daher, insbesondere während der Durchführung von Reanimationsmaßnahmen, einer intermittierenden Messung (z. B. durch Pulstasten oder Auskultation) vorzuziehen. Eine Pulsoxymetrie (idealerweise an der rechten Hand) kann eine genaue Herzfrequenz sowie Informationen zur peripheren Sättigung liefern. Insbesondere initial können die angezeigten Werte allerdings unter den durch ein EKG gemessenen Werten liegen und damit die Herzfrequenz unterschätzen: In einer Studie mit 53 Neugeborenen lagen die über das Pulsoxymeter angezeigten Herzfrequenzwerte in den ersten 2 min signifikant niedriger als die über das EKG angezeigten Werte (81 [60–109]/min gegenüber 148 [83–170]/min nach 90 s [p < 0,001]) [137]. Bei längerer Abnahmezeit näherten sich die über Pulsoxymetrie gemessenen Herzfrequenzwerte an die des EKG und Unterschiede lagen nur noch bei −2 (26)/min (Mittelwert [SD]) [138]. Insgesamt kann es darüber hinaus länger dauern, bis über die Pulsoxymetrie verlässliche Werte angezeigt werden, als über eine Auskultation [139]. Ob es tatsächlich einen Vorteil bedeutet, zunächst das Kind [140] oder erst den Pulsoxymetriesensor [141] mit dem Gerät zu verbinden ist unklar. Zumeist kann ein verwertbares Signal innerhalb der ersten 15 s nach dem Anschließen der Pulsoxymetrie erzielt werden. Periphere Minderperfusion, Signalausfall, Bewegungen, Arrhythmien und Umgebungsbeleuchtung können die Signalqualität der Pulsoxymetrie beeinträchtigen. Bei schlechter Signalqualität können falsch-niedrige Werte über eine Pulsoxymetrie angezeigt werden [142–144].
Es hat sich damit gezeigt, dass das EKG eine praktikable und schnelle Möglichkeit für eine exakte Bestimmung der Herzfrequenz ist. Insbesondere in den ersten zwei Minuten nach der Geburt kann es Werte einige Sekunden schneller und zuverlässiger als die Pulsoxymetrie anzeigen [143, 144]. In zwei RCT zeigte sich eine schnellere Anzeige der Herzfrequenz mittels EKG verglichen mit der Pulsoxymetrie mit einem Mittelwert (SD) von 66 (20) gegenüber 114 (39) Sekunden und einem Median (IQR) von 24 (19–39) gegenüber 48 (36–69) Sekunden, beide p = 0,001 [134, 145].
Eine kürzlich durchgeführte Aktualisierung der ILCOR-Evidenzanalyse kam zu dem Schluss, dass die seit 2015 identifizierten sieben neuen Studien (2 systematische Reviews, 2 RCT und 3 Beobachtungsstudien) die vorherigen Empfehlungen für Neugeborene, die eine Reanimation benötigen, stützten [1]. Das EKG kann verwendet werden, um eine schnelle und genaue Schätzung der Herzfrequenz zu ermöglichen (schwache Empfehlung, schwacher Evidenzgrad) [51, 146].
Die Verwendung eines EKG hat natürlich auch Limitationen. Es kann selbstverständlich die Pulsoxymetrie nicht ersetzen, da über die Pulsoxymetrie zusätzliche Informationen über die Perfusion und Oxygenierung gewonnen werden können. Bei einer pulslosen elektrischen Aktivität (PEA) zum Beispiel [147] kann ein EKG eine vermeintlich ausreichende Herzfrequenz anzeigen, obwohl kein ausreichender kardialer Auswurf besteht. Neuere Technologien wie „trockene“ Elektroden können die Signalqualität verbessern. Methoden wie Plethysmographie und Doppler können möglicherweise eine schnelle, zuverlässige, auswurfbasierte Bestimmung der Herzfrequenz ermöglichen, eine klinische Validierung ist jedoch noch erforderlich, bevor sie empfohlen werden können [143, 144].
Atemwege
Atemwege
Durch eine zu starke Flexion (Beugung) und Extension (Überstreckung) kann der Atemweg des Neugeborenen verlegt werden [148]. Allerdings ist die tatsächliche Evidenz zu den Mechanismen der Atemwegsobstruktion beim Neugeborenen noch begrenzt. Eine retrospektive Analyse von MRT-Bildern der Atemwege von 53 sedierten Säuglingen zwischen 0 und 4 Monaten, bei denen eine kraniale MRT-Untersuchung durchgeführt werden musste, zeigte, dass z. B. bei einer Überstreckung des Kopfs eine Obstruktion der oberen Atemwege auf Höhe der Zunge durch die Verschiebung der posterioren Atemwegsteile in Richtung anterior hervorgerufen werden kann [149]. Daher wird die Lagerung des Kopfs in Neutralposition bevorzugt, um eine optimale Durchgängigkeit der Atemwege zu gewährleisten.
Esmarch-Handgriff
Es gibt keine Studien zum Esmarch-Handgriff beim Neugeborenen. Studien an Kindern zeigen, dass ein Vorziehen des Unterkiefers den Pharyngealraum vergrößert, indem die Epiglottis von der posterioren Pharyngealwand abgehoben wird. Dadurch verringert sich die Einengung im Larynxbereich [150]. Manuelle Beatmungstechniken für zwei Helfer (2-Hände-Esmarch-Handgriff) sind denen einzelner Helfer überlegen [148].
Oropharyngeale/nasopharyngeale Atemwegshilfen
Bei Kindern konnte in Studien nachgewiesen werden, dass ein Guedel-Tubus (oropharyngeale Atemwegshilfe) erfolgreich zum Offenhalten der Atemwege eingesetzt werden kann [151]. Für Neugeborene nach der Geburt existieren solche Studien bisher nicht. In einer randomisierten Studie mit 137 Frühgeborenen, in der der Gasfluss über eine Beatmungsmaske unter Beatmung gemessen wurde, beeinträchtigte ein Guedel-Tubus die Beatmung häufiger, als wenn kein Guedel-Tubus verwendet wurde (81 % vs. 64 %; p = 0,03; teilweise 70 % vs. 54 %; p = 0,04) [152]. Nichtsdestotrotz kann ein Guedel-Tubus, da durch ihn die Zunge von den posterioren Atemwegen angehoben wird und der Atemweg so geöffnet wird, eine Beatmung erleichtern, wenn eine Beatmung erschwert ist und sich allein durch z. B. einen 2‑Hände-Esmarch-Handgriff nicht verbessern lässt. Ein Wendl-Tubus (nasopharyngeale Atemwegshilfe) kann bei angeborenen Fehlbildungen zum Offenhalten der oberen Atemwege hilfreich sein [153]. Auch bei Frühgeborenen nach der Geburt konnte er erfolgreich angewendet werden [154].
Verlegung der Atemwege
Wenn sich ein Neugeborenes schwer beatmen lässt, ist die Ursache zunächst häufig unklar. Ursache kann z. B. eine falsche Kopfposition, eine Engstellung des Larynx oder auch, insbesondere bei Frühgeborenen, ein zu fester Druck der Beatmungsmaske auf Mund und Nase des Kindes sein. So konnten Crawshaw et al. in einem Tiermodell des Frühgeborenen mittels Phasenkontrast-Röntgen zeigen, dass sich der Larynx und die Epiglottis bei nicht belüfteten Lungen und insuffizienten Atemmustern überwiegend geschlossen (adduziert) zeigten. Dies erschwerte eine intermittierende Überdruckbeatmung (IPPV) deutlich und der Larynx öffnete sich erst nach einer erfolgreichen Einatmung und Entfaltung der Lunge [155]. Unter Verwendung eines Atemfunktionsmonitorings konnte in einer Beobachtungsstudie mit 56 Frühgeborenen vor 32 Schwangerschaftswochen eine signifikante Leckage unter Maskenbeatmung (> 75 %) und/oder eine Obstruktion unter Beatmung (75 %) bei 73 % der manuell beatmeten Frühgeborenen während der ersten 2 min beobachtet werden [156].
Normale Lungenflüssigkeit und Sekrete sind für gewöhnlich hingegen keine Ursachen für eine Obstruktion der oberen Atemwege. Neugeborene müssen daher nach der Geburt nicht routinemäßig aus dem Oropharynx abgesaugt werden.
Oropharyngeales und nasopharyngeales Absaugen
Ein oropharyngeales oder nasopharyngeales Absaugen bei Neugeborenen führt nicht unbedingt zu einer Verbesserung der Atemfunktion, im Gegenteil, mitunter verzögert es dringend notwendigere Maßnahmen oder führt sogar mitunter zu einem verzögerten Einsetzen der Spontanatmung. Nebenwirkungen, v. a. eines ausgedehnten Absaugens, können Reizungen der Schleimhäute, Laryngospasmus, Apnoe, vagale Bradykardie, Hypoxämie, Entsättigung und ein beeinträchtigter zerebraler Blutfluss sein [157–161]. Ein kürzlich durchgeführtes ILCOR-Scoping von 10 Studien (8 RCT, 1 Beobachtungsstudie und 1 Fallstudie) mit mehr als 1500 nahezu bzw. reifen Neugeborenen zum Absaugen von klarer Flüssigkeit zeigte keine neuen Erkenntnisse, die eine Änderung der aktuellen Empfehlungen zum Absaugen erforderlich machen würden: Ein routinemäßiges postnatales oropharyngeales und nasopharyngeales Absaugen bei Neugeborenen mit klarem oder mekoniumgefärbtem Fruchtwasser wird nicht empfohlen (sehr schwacher Evidenzgrad – herabgestuft wegen Bias-Risiko, Studiendesign und Ungenauigkeit) [1]. Wenn ein Absaugen notwendig erscheint, soll dies unter direkter Sicht erfolgen, idealerweise mit einem Laryngoskop und einem großlumigen Katheter.
Es gibt nur wenige Studien, die die Effektivität unterschiedlicher Methoden und Werkzeuge zum Absaugen von Neugeborenen untersucht haben. In einer In-vitro-Studie mit simuliertem Mekonium zeigte sich die Überlegenheit des Yankauer-Katheters beim Entfernen von soliden Partikeln im Vergleich zu flexiblen Kathetern mit größerem Lumen (12–14 F) und manuellen, ballförmigen Handabsaugern („bulb suction device“). Die meisten Geräte konnten zwar Flüssigkeiten entfernen, die einzigen Geräte, mit denen sich simuliertes partikelhaltiges Mekonium absaugen ließ, waren der Yankauer-Katheter und ein ballförmiger Handabsauger. Grundsätzlich sind Handabsauger weniger effektiv, haben aber den Vorteil, dass sie keine externe Vakuumquelle benötigen. Herkömmliche Absaugkatheter mit kleinem Lumen zeigten sich deutlich weniger effektiv [162]. Der Yankauer-Katheter bietet den Vorteil, dass er einhändig verwendet werden kann (Dies richtet sich selbstverständlich nach dem verwendeten Absaugsystem, Anmerkung der Übersetzer) und ein effektives Absaugen bereits mit geringem Vakuumsog möglich ist und somit möglicherweise weniger Schleimhautschädigungen verursacht. Ein Mekoniumaspirator, der an einen Trachealtubus konnektiert werden kann, funktioniert auf ähnliche Weise und kann ebenfalls verwendet werden, um partikelhaltiges Material aus der Luftröhre zu entfernen. Ein Sog von 150 mm Hg (20 kPa) ist zum Absaugen in den meisten Fällen ausreichend und soll nicht überschritten werden [163].
Mekonium
Leicht mekoniumgefärbtes Fruchtwasser ist häufig und führt im Allgemeinen zu keinen größeren Problemen während der Anpassungsphase. Zähes mekoniumhaltiges Fruchtwasser ist deutlich seltener, immer aber ein Indikator für perinatalen Stress und ein Alarmsignal, da möglicherweise Reanimationsmaßnahmen notwendig sind.
Vitale Neugeborene mit mekoniumhaltigem Fruchtwasser profitieren weder von einem intrapartalen Absaugen noch einer routinemäßigen postnatalen Intubation und einem trachealen Absaugen [164, 165]. Eine Abnahme der Intubationen im Kreißsaal bei Neugeborenen mit Mekonium hat in retrospektiven registerbasierten Studien keine Erhöhung der Morbidität gezeigt [166, 167]. Ein systematischer ILCOR-Review von drei RCT mit 449 Neugeborenen und einer Beobachtungsstudie mit 231 Neugeborenen konnte keine Vorteile einer sofortigen Laryngoskopie mit oder ohne tracheales Absaugen im Vergleich zur sofortigen Durchführung von Reanimationsmaßnahmen ohne Laryngoskopie belegen (RR 0,99; 95 %-CI 0,93–1,06; p = 0,87) [1]. Parallele Metaanalysen einschließlich einer weiteren RCT mit 132 Neugeborenen kamen zu ähnlichen Ergebnissen [168–170]. Eine Untersuchung der Folgen der Änderungen der Empfehlungen zur Versorgung von hypotonen Neugeborenen mit mekoniumhaltigem Fruchtwasser ergab bei 1138 dieser Neugeborenen, bei denen ein Absaugen zugunsten einer sofortigen Beatmung unterlassen wurde, weniger Aufnahmen auf der NICU und keinen Anstieg der Inzidenz eines Mekoniumaspirationssyndroms [171].
Ein routinemäßiges Absaugen hypotoner Neugeborener bedeutet damit für die meisten dieser Neugeborenen wahrscheinlich keinen Vorteil und kann letztlich vor allem den Beginn effektiver Beatmungen verzögern. Nur eine sehr kleine Gruppe von hypotonen Neugeborenen benötigt möglicherweise ein Absaugen von Mekonium unter direkter Laryngoskopie (mit oder ohne Intubation), um eine Atemwegsobstruktion durch Mekonium zu beseitigen und eine anschließende Beatmung zu ermöglichen. Daher empfehlen die ILCOR-Leitlinien, bei apnoischen oder insuffizient atmenden Neugeborenen mit mekoniumhaltigem Fruchtwasser auf eine routinemäßige sofortige direkte Laryngoskopie und/oder Absaugen nach der Geburt zu verzichten, um so schnell wie möglich mit Beatmungen beginnen zu können (schwache Empfehlung, schwacher Evidenzgrad) [1].
Bei Neugeborenen mit respiratorischer Beeinträchtigung aufgrund einer Mekoniumaspiration wird darüber hinaus eine routinemäßige Surfactant-Gabe oder bronchiale Lavage mit Kochsalz oder Surfactant im Kreißsaal nicht empfohlen [172, 173].
Initiale Beatmungshübe und assistierte Beatmung
Wenn ein Neugeborenes nach der Geburt insuffizient oder nicht atmet, hat die Belüftung der Lunge oberste Priorität und darf nicht verzögert werden. Eine Beobachtungsstudie in ressourcenarmen Regionen zeigte, dass es durchschnittlich etwa 80 ± 55 s nach der Geburt dauerte, bis mit einer notwendigen Beatmung begonnen wurde. Jede weitere 30-sekündige Verzögerung der Beatmung führte bei apnoischen Neugeborenen zu einem Anstieg der Morbidität/Mortalität um jeweils 16 % (p = 0,045) [12]. Bei reifen Neugeborenen soll die assistierte Beatmung mit Raumluft begonnen werden [174].
Spitzendruck und Inspirationsdauer
Bei Neugeborenen können die Spontanatmung oder assistierte initiale Beatmungshübe zur Etablierung einer funktionellen Residualkapazität (FRC) führen [11, 175]. Ist eine assistierte Beatmung notwendig, sind optimaler Inspirationsdruck, Inspirationszeit und Tidalvolumen zur Herstellung einer effektiven FRC weiterhin unklar und zudem abhängig von physiologisch-anatomischen Faktoren und technischen Gegebenheiten. Weiterhin besteht eine intensive Diskussion, ob längere Inspirationszeiten insbesondere für das initiale Öffnen der Lunge einen Vorteil bedeuten könnten. Darüber hinaus stehen auch weiterhin deutlich verlängerte Inspirationszeiten unter Beatmung („sustained inflations“) für die Versorgung von Neugeborenen in Diskussion (s. unten) [1]. Die aktuellen NLS-Leitlinien des ERC empfehlen weiterhin verlängerte Inspirationszeiten für die initialen Beatmungen, auch wenn es bisher keine Evidenz weder für Vor- noch für Nachteile gegenüber anderen empfohlenen Ansätzen gibt. Sobald die Atemwege geöffnet sind, sollen daher zunächst fünf initiale Beatmungshübe mit einer verlängerten Inspirationszeit über 2–3 s durchgeführt werden, um die Entfaltung der Lunge und die Etablierung einer FRC zu unterstützen [51, 175–177].
Der optimale initial notwendige Inspirationsdruck, um die Lunge zu entfalten, ist unbekannt. Inspirationsdrücke von 30 cm H2O reichen bei apnoischen reifen Neugeborenen normalerweise aus, um die häufig noch mit Flüssigkeit gefüllte Lunge effektiv zu öffnen. Allerdings wurde die Empfehlung für diesen Spitzendruck für die initialen Beatmungen lediglich aus historischen Studien mit einer begrenzten Anzahl von Neugeborenen abgeleitet [175, 178, 179]. Eine neuere prospektive Studie mit 1237 reifen und nahezu reifen Neugeborenen, die in einer ländlichen Umgebung unter Verwendung einer Beutel-Maske-Beatmung ohne PEEP beatmet wurden, legt nahe, dass teilweise noch höhere initiale Beatmungsdrücke erforderlich sein können. Für eine erfolgreiche Stabilisierung waren hier mediane Spitzendrücke von 37 cm H2O erforderlich [180]. Bei Frühgeborenen deutet eine kritische Überprüfung der verfügbaren Daten darauf hin, dass die bisher empfohlenen initialen Inspirationsdrücke von 20 cm H2O möglicherweise ebenfalls häufig zu niedrig sind, um eine effektive Öffnung der Lunge zu erreichen [177, 181–183]. Für die Beatmung von Frühgeborenen ist daher wahrscheinlich ebenfalls ein höherer initialer Inspirationsdruck von 25 cm H2O sinnvoll. Da der Atemwegswiderstand bei noch geringerem Durchmesser der Atemwege deutlich ansteigt, benötigen einige Frühgeborene insbesondere für die initialen Beatmungen und die Entfaltung der Lunge möglicherweise einen noch höheren Druck als 25 cm H2O.
Studien weisen darauf hin, dass die Zeit bis zum Einsetzen der Spontanatmung umgekehrt mit dem Spitzendruck und der Dauer der Inspirationszeiten korreliert [176]. Wenn das Neugeborene nicht komplett apnoisch ist, sondern Atemanstrengungen zeigt, ist eine synchronisierte Beatmung wahrscheinlich am effektivsten [183]. Das Tidalvolumen von assistierten Überdruckbeatmungen kann dann jedoch das von spontanen Atemzügen überschreiten [126, 184]. Insgesamt ist das Durchführen von synchronisierten Beatmungen beim Neugeborenen während der Erstversorgung allerdings schwierig durchzuführen [185].
Eine kürzlich durchgeführte Beobachtungsstudie mit Frühgeborenen vor 32 Schwangerschaftswochen zeigte, dass in dieser Patientengruppe allein das Aufdrücken einer Maske zur Unterstützung der Atmung bei spontan atmenden Frühgeborenen zu einer Apnoe führen konnte [186]. Die Bedeutung dieses Effekts auf das Outcome ist derzeit jedoch noch unklar [187].
Beatmung
Auch bezüglich der optimalen Beatmungsfrequenz während der Reanimation von Neugeborenen besteht nur eine geringe Evidenz. In einer Beobachtungsstudie mit 434 maskenbeatmeten späten Frühgeborenen und Reifgeborenen konnten mit einer Beatmungsfrequenz von 30/min adäquate Tidalvolumina ohne das Auftreten einer Hypokapnie erreicht werden. Eine Beatmungsfrequenz von 30/min mit Tidalvolumina von 10–14 ml/kgKG war dabei mit der höchsten CO2-Clearance assoziiert [188]. In einer Beobachtungsstudie mit 215 reifen und nahezu reifen Neugeborenen zeigte sich ein nichtlinearer Zusammenhang zwischen den verabreichten Tidalvolumina und der Herzfrequenz. Das zur Erhöhung der Herzfrequenz erforderliche minimale Tidalvolumen lag hier bei 6,0 ml/kgKG (3,6–8,0). Bei einem verabreichten Atemzugvolumen von 9,3 ml/kgKG stieg die Herzfrequenz am schnellsten und auf die höchsten Werte [129].
Das zur Etablierung einer funktionellen Residualkapazität erforderliche Tidalvolumen kann das ausgeatmete Volumen überschreiten, nach Foglia et al. sind mehr als 12 ml/kgKG für Reifgeborene möglich [185]. Das ausgeatmete Tidalvolumen steigt während der ersten Beatmungshübe im Rahmen der Lungenentfaltung an, die Compliance nimmt zu und die FRC wird etabliert [180]. In den meisten Fällen sollte es möglich sein, den Spitzendruck im Verlauf zu reduzieren, sobald die Lungen vollständig entfaltet sind. Ein überhöhtes Tidalvolumen soll dann nach Möglichkeit vermieden werden [185].
Es gibt keine publizierten Studien, die auf eine optimale Inspirationszeit während einer assistieren Überdruckbeatmung im Verlauf hinweisen. Längere Inspirationszeiten ermöglichen eventuell niedrigere Spitzendrücke [185]. Beobachtungsstudien an spontan atmenden Neugeborenen haben gezeigt, dass diese nach der erfolgreichen Entfaltung der Lungen etwa mit einer Frequenz von 30 bis 40 Atemzügen/min und unabhängig vom Atemmuster mit einer Inspirationszeit von 0,3 bis 0,4 s spontan atmen [189].
Beurteilung einer effektiven Beatmung
Der sofortige Anstieg der Herzfrequenz ist im Allgemeinen das beste klinische Zeichen einer erfolgreichen Öffnung der Lunge und einer effektiven Beatmung [128, 129]. Bei den meisten Neugeborenen kommt es unter Beatmung innerhalb von 30 s nach der Lungenentfaltung zu einem raschen Anstieg der Herzfrequenz [190]. Dabei zeigen Thoraxbewegungen zumeist ausreichende Tidalvolumina an. Bei Frühgeborenen können die Thoraxbewegungen allerdings deutlich diskreter und damit weniger offensichtlich sein [191]. Übermäßige Thoraxexkursionen während der Überdruckbeatmung können ein Hinweis auf ein zu großes Tidalvolumen sein, welches vermieden werden soll. Wenn die Herzfrequenz steigt, jedoch keine Spontanatmung einsetzt, muss weiter beatmet werden.
Ein Ausbleiben des Herzfrequenzanstiegs ist höchstwahrscheinlich auf eine unzureichende Öffnung der Atemwege oder ineffektive Beatmung zurückzuführen. Die Ursachen können in einer suboptimalen Maskenposition oder einer Leckage liegen [184, 192, 193], möglicherweise muss die Kopfposition korrigiert werden [148]. Um ein suffizientes Inspirations‑/Tidalvolumen zu erreichen, muss möglicherweise auch der Inspirationsdruck erhöht werden [180]. Bei Frühgeborenen kann bereits ein übermäßiger Druck mit der Maske auf das Gesicht eine effektive Beatmung behindern. Auch eine Engstellung des Larynx kann bei diesen möglicherweise die Ursache für eine insuffiziente Beatmung sein [10, 155, 156, 194].
Die Durchführung eines Zwei-Hände-Esmarch-Handgriffs kann die Maskenleckage bei der Beatmung von Reif- und Frühgeborenen reduzieren und ist dem Halten der Maske mit nur einer Hand überlegen. (Für die Beatmung selbst wird dann eine zweite Person benötigt, Anmerkung der Übersetzer) [193, 195]. Die Verwendung von weiteren Atemwegshilfen zum Optimieren einer assistierten Beatmung ist an anderer Stelle beschrieben (siehe „PEEP und CPAP/Beatmungsgeräte zur assistierten Beatmung/Atemwegshilfen“).
Ob Flüssigkeiten oder andere Fremdkörper in den Atemwegen tatsächlich eine klinisch relevante Atemwegsobstruktion nach der Geburt verursachen können, ist nicht bekannt. Allerdings ist dies natürlich für Mekonium, Blut, Schleim, Käseschmiere nicht grundsätzlich ausgeschlossen [196].
Deutlich verlängerte Inspirationszeiten > 5 s („sustained inflations“, SI)
Einige tierexperimentelle Studien konnten einen positiven Effekt von deutlich verlängerten Inspirationszeiten auf die Etablierung der funktionellen Residualkapazität zeigen [197, 198]. Ein systematischer Cochrane-Review, der initiale Inspirationszeiten > 1 s gegenüber Standardinspirationszeiten ≤ 1 s vergleicht, wurde 2020 aktualisiert. 8 RCT mit insgesamt 941 Neugeborenen erfüllten die Einschlusskriterien für den primären Vergleich der Verwendung von deutlich verlängerten Inspirationszeiten ohne Thoraxkompressionen (SI > 5 Sekunden). Die verlängerten Inspirationen dauerten 15 bis 20 s bei 20 bis 30 cm H2O. In keiner der Studien wurden verlängerte Inspirationen von ≤ 5 s verwendet. Die Beatmungen mit deutlich verlängerten Inspirationszeiten zeigten im Vergleich zu Beatmungen mit normaler Inspirationszeit dabei weder eine Verbesserung der Mortalität während der Kreißsaalversorgung (schwacher Evidenzgrad – Einschränkungen im Studiendesign und Ungenauigkeit) noch während des gesamten Krankenhausaufenthalts (mäßiger Evidenzgrad – Einschränkungen im Studiendesign). Auch für die sekundären Endpunkte Intubation, Bedarf an Atemunterstützung oder bronchopulmonale Dysplasie boten Beatmungen mit deutlich verlängerten Inspirationszeiten keine Vorteile (mäßiger Evidenzgrad) [199].
Eine große multizentrische RCT, die nicht in diese Analyse einbezogen wurde, analysierte die Auswirkungen von SI gegenüber IPPV („intermittent positive pressure ventilation“) bei extremen Frühgeborenen (23–26 Schwangerschaftswochen) und kam zu dem Schluss, dass eine Versorgungsstrategie mit zwei verlängerten Inspirationen von 15 s das Risiko für bronchopulmonale Dysplasie oder Tod im Alter von 36 Wochen nicht reduzierte. Die Studie umfasste 460 von ursprünglich 600 geplanten Frühgeborenen, wurde jedoch aufgrund einer übermäßigen frühen Sterblichkeit in der SI-Gruppe, welche möglicherweise auf Reanimationsmaßnahmen zurückzuführen war, vorzeitig abgebrochen. In der SI-Gruppe waren innerhalb der ersten 48 Lebensstunden 16 Frühgeborene (7,4 %) verstorben, im Gegensatz zu 3 Frühgeborenen (1,4 %) in der Standardversorgungsgruppe (bereinigte Risikodifferenz [aRD] 5,6 % [95 %-CI 2,1 bis 9,1 %]; p = 0,002). Dies konnte jedoch nicht direkt den verlängerten Inspirationszeiten zugeschrieben werden [200].
Eine kürzlich durchgeführter systematischer ILCOR-Review in Bezug auf Beatmungen mit verlängerter Inspirationszeit identifizierte 10 infrage kommende RCT, einschließlich der oben genannten, mit 1509 Neugeborenen [1]. Für den primären Outcomeparameter Tod vor Entlassung konnte kein signifikanter Vorteil oder Schaden durch die Verwendung von verlängerten Inspirationen > 1 s (tatsächlich > 5 s) im Vergleich zur Überdruckbeatmung mit Inspirationen von ≤ 1 s festgestellt werden (sehr schwacher Evidenzgrad – herabgestuft wegen Bias-Risiko und Inkonsistenz). Es wurden keine Studien identifiziert, die über die sekundären kritischen Endpunkte eines langfristigen neurologischen Outcomes oder Todes in weiterer Folge berichteten. Eine Subgruppenanalyse verschiedener verlängerter Inspirationszeiten (6–15 s 9 RCT, 1300 Neugeborene, > 15 s 2 RCT, 222 Neugeborene) und verschiedener Inspirationsdrücke (> 20 mm H2O 6 RCT, 803 Neugeborene, ≤ 20 mm H2O 699 Neugeborene) zeigte keinen signifikanten Nutzen oder Schaden durch verlängerte Inspirationen im Vergleich zu IPPV von ≤ 1 s (herabgestuft wegen Bias-Risiko, Ungenauigkeit und Inkonsistenz).
In Subgruppenanalysen, in denen verlängerte Inspirationen > 1 s mit Inspirationen von ≤ 1 s bei Frühgeborenen vor 28 + 0 Schwangerschaftswochen verglichen wurden, gab es bei 5 RCT, in die 862 Neugeborene eingeschlossen waren, eine schwache Evidenz für einen potenziellen Schaden (RR 1,38; 95 %-CI 1,00–1,91) (herabgestuft wegen Bias-Risiko und Ungenauigkeit). Bei Neugeborenen von 28 + 1 bis 31 + 6 Schwangerschaftswochen zeigten 4 RCT mit 175 Frühgeborenen eine sehr geringe Evidenz für keinen signifikanten Nutzen oder Schaden (RR 1,33; 95 %-CI 0,22–8,20) (herabgestuft wegen Bias-Risiko und schwerwiegender Ungenauigkeiten). Keine der Studien untersuchte verlängerte Inspirationszeiten < 5 s und auch für reifere Neugeborene lagen keine publizierten Daten vor.
Weitere Subgruppenanalysen ausschließlich der Studien mit einem hohen Risiko des Bias (9 RCT, 1390 Neugeborene, RR 1,24; 95 %-CI 0,92–1,68), Studien mit nur einer einzelnen verlängerten Inspiration (9 RCT, 1402 Neugeborene, RR 1,17; 95 %-CI 0,88–1,55) und solche mit SI nur über eine Beatmungsmaske (9 RCT, 1441 Neugeborene, RR 1,06; 95 %-CI 0,61–1,39) konnten keinen Unterschied im Outcome bei deutlich verlängerten Inspirationen gegenüber normalen Inspirationszeiten nachweisen (schwacher Evidenzgrad, herabgestuft wegen Bias-Risiko und Ungenauigkeit).
Die aktuellen ILCOR-Behandlungsempfehlungen legen daher nahe, dass die routinemäßige Anwendung von verlängerten Inspirationszeiten ≥ 5 s nicht für Frühgeborene empfohlen werden kann, die aufgrund einer insuffizienten Atmung oder einer Bradykardie eine assistierte Beatmung benötigen (schwache Empfehlung, schwacher Evidenzgrad). Verlängerte Inspirationen können jedoch weiterhin im Rahmen von Studien in Erwägung gezogen werden. Die aktuelle Studienlage erlaubt derzeit keine spezifischen Empfehlungen zur Dauer der Inspirationszeit bei späten Frühgeborenen oder Reifgeborenen. Für eine solche Empfehlung war die Gesamtzahl der untersuchten Neugeborenen nicht ausreichend, um einen Effekt von verlängerten Inspirationen sicher einschätzen zu können. Es sind größere Studien erforderlich, um festzustellen, ob verlängerte Inspirationen letztlich mehr Nutzen oder Schaden bedeuten [1].
Es gibt ebenfalls keine randomisierten Studien, die die Verwendung von initialen Beatmungshüben von ≤ 1 s und von 2 bis 3 s vergleichen. Eine kürzlich durchgeführte RCT mit 60 Frühgeborenen vor 34 Schwangerschaftswochen, bei welchen die initialen Beatmungen mit einer verlängerten Inspirationszeit von 2 bis 3 s oder mit einer einzelnen verlängerten Inspirationszeit von 15 s durchgeführt wurden, zeigte keine Unterschiede im Minutenvolumen oder im endtidalen CO2 [201]. Neugeborene, die verlängerte Inspirationen erhielten, zeigten früher eine Atemanstrengung (Median 3,5 [Range 0,2–59] gegenüber Median 12,8 [Range 0,4–119] Sekunden, p = 0,001). Verlängerte Inspirationen waren darüber hinaus mit einer kürzeren Beatmungsdauer in den ersten 48 Lebensstunden verbunden (Median 17 [Range 0–48] gegenüber Median 32,5 [Range 0–48] Stunden, p = 0,025).
PEEP und CPAP/Beatmungsgeräte zur assistierten Beatmung/Atemwegshilfen
PEEP (positiver endexspiratorischer Druck)
Tiermodellstudien haben gezeigt, dass große Atemzugvolumina nach der Geburt bereits zu einer Schädigung der unreifen Lunge führen können [202, 203]. Dagegen kann die Aufrechterhaltung eines positiven endexspiratorischen Drucks (PEEP) unmittelbar nach der Geburt zu einer Verringerung von Lungenschäden beitragen [204, 205]. Wenngleich eine weitere Studie zu diesem Thema keinen Nutzen eines frühen PEEP diesbezüglich belegen konnte [206]. Unstrittig ist jedoch, dass die Verabreichung eines PEEP unmittelbar nach der Geburt die Lungenentfaltung, die funktionelle Residualkapazität, die Compliance, den Gasaustausch und insbesondere die Oxygenierung verbessert [207, 208]. Ein PEEP lässt sich sehr zuverlässig unter Zuhilfenahme von druckbegrenzten Beatmungshilfen mit einem kontinuierlichen Gasfluss, z. B. mit einem T‑Stück-System applizieren.
Ein kürzlich durchgeführter ILCOR-Review zweier randomisierter Studien und einer quasirandomisierten Studie (sehr schwacher Evidenzgrad), welche die Beatmung über ein T‑Stück-System mit der Beatmung mit einem sich selbst füllenden Beatmungsbeutel verglichen, ergab eine vergleichbare Mortalität sowie vergleichbare Inzidenzen bezüglich chronischer Lungenerkrankungen [1]. Fünf Minuten nach der Geburt zeigten 80 Frühgeborene vor 29 Schwangerschaftswochen keinen Unterschied der SPO2-Werte (61 % [13–72 %] gegenüber 55 % [42–67 %]; p = 0,27) [209]. Es wurde ebenfalls kein Unterschied beim Erreichen einer Herzfrequenz > 100/min bei 1027 Frühgeborenen nach 26 Schwangerschaftswochen festgestellt (1 [0,5–1,6] gegenüber 1 [0,5–1,8]; p = 0,068; min [IQR]) [210]. Bei der Verwendung eines T‑Stück-Systems zeigte sich jedoch eine Reduktion der Intubationsraten im Kreißsaal (86 [17 %] gegenüber 134 [26 %], OR 0,58 [95 %-CI 0,4–0,8]; p = 0,002). Der maximal verwendete Spitzendruck betrug 26 (2) cm H2O mit T‑Stück-Systemen gegenüber 28 (5) cm H2O bei sich selbst füllenden Beuteln (SIB) (P < 0,001; Mittelwert [SD]).
In einer quasirandomisierten Studie mit 90 Frühgeborenen in der 34. (3,7) (mean (SD)) Schwangerschaftswoche war die Dauer der Überdruckbeatmung im Kreißsaal mit T‑Stück-Systemen mit 30 Sekunden (30–60) gegenüber 60 Sekunden (30–90) (Median [IQR]; (p < 0,001)) deutlich geringer [211]. In der Gruppe der Frühgeborenen, die mit sich selbst füllenden Beatmungsbeuteln beatmet wurden, musste ein höherer Anteil letztlich intubiert werden (34 % vs. 15 %; p = 0,04). In einer großen multizentrischen Beobachtungsstudie mit 1962 Frühgeborenen zwischen 23 und 33 Schwangerschaftswochen verbesserte sich die Überlebenswahrscheinlichkeit und es wurden weniger bronchopulmonale Dysplasien (BPD) beobachtet, wenn die Frühgeborenen nach der Geburt eine Beatmung mit PEEP erhalten hatten (OR = 1,38; 95 %-CI 1,06 bis 1,80) [212].
Alle Reif- und Frühgeborenen, die trotz adäquater erster unterstützender Maßnahmen apnoisch bleiben, müssen eine Überdruckbeatmung erhalten. Die ILCOR-Leitlinien empfehlen gegenüber 2015 unverändert, dass für die initialen Beatmungshübe bei Frühgeborenen während der Reanimation im Kreißsaal eine Beatmung mit einem positiven endexspiratorischen Druck (PEEP) erfolgen soll (schwache Empfehlungen, schwacher Evidenzgrad) [1]. Es wird empfohlen, die Überdruckbeatmung von Frühgeborenen zunächst mit einem PEEP von ca. 5–6 cm H2O durchzuführen. Aufgrund fehlender Evidenz können zum jetzigen Zeitpunkt keine klaren Empfehlungen zum PEEP-Niveau für reife Neugeborene gegeben werden [51, 146].
CPAP (kontinuierlicher positiver Atemwegsdruck)
Ein systematischer Cochrane-Review, der die Verabreichung eines kontinuierlichen positiven Atemwegsdrucks (CPAP) bei Frühgeborenen vor 32 Schwangerschaftswochen innerhalb der ersten 15 Lebensminuten untersuchte, zeigte in 7 RCT mit 3123 Frühgeborenen, dass die Notwendigkeit einer weiteren Beatmungsunterstützung reduziert werden konnte. Allerdings war die Evidenz nicht ausreichend, um eine präventive CPAP-Therapie mit einer Sauerstofftherapie und anderen unterstützenden Maßnahmen zu vergleichen [213]. Die Studienergebnisse mussten aufgrund erheblicher Heterogenität, Ungenauigkeit und mangelnder Verblindung auf einen schwachen Evidenzgrad herabgestuft werden. In drei dieser Studien mit insgesamt 2354 Frühgeborenen, die eine CPAP-Therapie mit assistierter Beatmung verglichen, reduzierte ein prophylaktischer nasaler CPAP bei sehr unreifen Frühgeborenen den Bedarf an mechanischer Beatmung und Surfactant-Gaben. Ebenso waren die Inzidenz von BPD und der kombinierte Outcomeparameter Tod oder BPD reduziert (Evidenz aufgrund von Ungenauigkeit herabgestuft).
Ein weiterer systematischer Review umfasste vier RCT, von denen drei ebenfalls in den Cochrane-Review einbezogen wurden [214]. Die gepoolte Analyse zeigte für Frühgeborene, die einen nasalen CPAP erhalten hatten, einen signifikanten Nutzen für das kombinierte Outcome von Tod oder BPD oder beiden Parametern unabhängig voneinander nach 36 Wochen (RR 0,91; 95 %-CI 0,84 bis 0,99; RD 0,04; 95 %-CI −0,07 bis 0,00; NNT 25).
Nach der Überprüfung der aktuellen Evidenz bleiben die ILCOR-Empfehlungen gegenüber 2015 damit unverändert. Für spontan atmende Frühgeborene mit Atemnotsyndrom, die postnatal eine Atemunterstützung benötigen, wird empfohlen, zunächst eine Atemunterstützung mittels CPAP anstelle einer primären Intubation und Überdruckbeatmung durchzuführen (schwache Empfehlung, mäßiger Evidenzgrad) [1, 51, 146]. Bezüglich der Atemunterstützung mittels CPAP bei reifen Neugeborenen nach der Geburt sind weiterhin nur sehr wenige Daten verfügbar [215, 216]. In jedem Fall ist bei einer CPAP-Therapie bei Reif- und nahezu Reifgeborenen im Kreißsaal besondere Sorgfalt geboten, da in retrospektiven Kohortenstudien eine CPAP-Therapie bei diesen Kindern möglicherweise mit einer erhöhten Inzidenz von Pneumothoraces verbunden war [217–219].
Hilfsmittel zur assistierten Beatmung
Eine effektive Beatmung beim Neugeborenen kann mit einem flow-abhängigen Beutel (Anästhesiebeutel), einem sich selbstfüllenden Beatmungsbeutel oder einem T‑Stück-System mit Druckbegrenzung durchgeführt werden [209, 210, 220–222]. Mit einem T‑Stück-System kann im Gegensatz zu sich selbst füllenden Beatmungsbeuteln ein stabiler und kontinuierlicher PEEP unter Beatmung oder auch ein reiner CPAP verabreicht werden. Möglicherweise ist dies der entscheidende Faktor, der die Unterschiede in Bezug auf das Outcome zwischen den beiden Geräten erklärt (siehe Abschnitt „PEEP“).
Ein T‑Stück-System bietet viele Vorteile, hat aber den Nachteil, dass zum Betrieb eine Flow-Quelle zwingend notwendig ist. Im Gegensatz dazu hat der sich selbst füllende Beatmungsbeutel den Vorteil, dass er (zumindest für eine Beatmung mit Raumluft, Anmerkung der Übersetzer) verwendet werden kann, auch ohne an eine Flow-Quelle angeschlossen zu sein. Zur Vermeidung hoher Beatmungsdrücke verfügen neonatologische und pädiatrische selbstfüllende Beatmungsbeutel über Überdruckventile. Diese sind allerdings strömungsabhängig und die unter Beatmung erzeugten Spitzendrücke können den vom Hersteller angegebenen Öffnungsdruck der Ventile von normalerweise 30–40 cm H2O deutlich überschreiten, wenn der Beutel schnell und kräftig komprimiert wird [223, 224]. Im Vergleich zu sich selbst füllenden Beatmungsbeuteln ist mit Anästhesiebeuteln mehr Training erforderlich, um suffiziente Beatmungen mit einem adäquaten Spitzendruck und PEEP zu erreichen. In einer manikinbasierten Beobachtungsstudie mit 50 Ärzten bestanden deutliche technische Schwierigkeiten in der Verwendung des Anästhesiebeutels im Gegensatz zum sich selbst füllenden Beutel [225].
Ein qualitativer Review fand 30 Studien, in denen T‑Stück-Systeme mit anderen manuellen Beatmungsgeräten für Neugeborene verglichen wurden. Die Mehrheit dieser Studien wurden allerdings mit Reanimationspuppen und nur 2 Studien mit echten Neugeborenen durchgeführt [156, 209]. Wird ein T‑Stück-System verwendet, lassen sich im Vergleich zu selbstfüllenden Beuteln und Anästhesiebeuteln deutlich konstantere Spitzendrücke applizieren, die zudem dem angestrebten Zielspitzendruck am nächsten liegen [226–230]. Ähnliches konnte bezüglich des PEEP beobachtet werden. Der mittels T‑Stück-Systemen verabreichte PEEP lag näher am angestrebten PEEP-Zielwert. Möglicherweise konnte durch die Verwendung des druckbegrenzten T‑Stück-Systems, da die Tidalvolumina im Vergleich kleiner und weniger variabel waren als bei der Verwendung eines selbstfüllenden Beutels, die Gefahr eines Volutraumas reduziert werden [227–230]. T‑Stück-Systeme lieferten darüber hinaus, unabhängig von der Erfahrung des Anwenders, konstantere Inspirationszeiten als selbstfüllende Beatmungsbeutel. Verlängerte Inspirationszeiten konnten bei Verwendung eines T‑Stück-Systems ebenfalls zuverlässiger erreicht werden [231]. T‑Stück-Systeme haben allerdings auch Limitationen. Die Beatmung unter Reanimation eines Neugeborenen ist insgesamt ein sehr dynamischer Prozess, bei dem die Beatmungsintensität an die sich möglicherweise verändernde klinische Situation des Neugeborenen angepasst werden muss. Dabei ist es bei der Verwendung eines T‑Stück-Systems, im Gegensatz zur Verwendung selbstfüllender Beatmungsbeutel oder Anästhesiebeutel, schwerer, im Verlauf auftretende Compliance-Änderungen wahrzunehmen [232]. Ein zu fest zugeschraubtes PEEP-Ventil kann darüber hinaus irrtümlich und unbemerkt zur Verabreichung eines zu hohen PEEP führen [233]. Bei der Verwendung eines T‑Stück-Systems dauert es mitunter länger als bei der Verwendung eines selbstfüllenden Beutels oder eines Anästhesiebeutels, den Inspirationsdruck unter Reanimation anzupassen. Darüber hinaus kann die Leckage über die Maske bei Verwendung eines T‑Stück-Systems größer sein [229, 230] und Änderungen der Gasflussrate können bei den Flow-abhängigen T‑Stück-Systemen erhebliche Auswirkungen auf den Spitzendruck, den PEEP [234–237] und die Leckage der Maske haben [234]. Die richtige Einstellung und Verwendung eines T‑Stück-Systems erfordert zwar wahrscheinlich mehr Training, bei regelmäßiger Verwendung lässt sich damit allerdings selbst von unerfahreneren Anwendern eine gleichmäßigere Beatmung als mit selbstfüllenden Beatmungsbeuteln erreichen [238].
Mit einem selbstfüllenden Beatmungsbeutel kann grundsätzlich kein CPAP verabreicht werden und selbst mit einem PEEP-Ventil ist die Verabreichung eines konstanten endexspiratorischen Drucks wahrscheinlich kaum möglich [226–228, 239–242]. Die Produkteigenschaften verschiedener T‑Stück-Systeme und auch selbstfüllender Beatmungsbeutel variieren erheblich, mit Auswirkungen während ihrer Verwendung [243]. Ein neueres vertikales Design von sich selbstfüllenden Beatmungsbeuteln und eine überarbeitete Maske bieten möglicherweise Vorteile in der Handhabung und bei der Verwendung eines endexspiratorischen Drucks [190, 244–246].
Zusätzlich zu den 1107 Neugeborenen in den beiden in die Analyse von 2015 eingeschlossenen RCT [209, 210] identifizierte ein kürzlich durchgeführter ILCOR-Scoping-Review, der ebenfalls T‑Stück-Systeme mit selbstfüllenden Beatmungsbeuteln verglich [1, 247], in einem weiteren RCT (n = 90) [211] und einer großen Beobachtungsstudie (n = 1962) eine erhebliche Anzahl zusätzlicher Patienten. Die Studien unterschieden sich hinsichtlich der untersuchten Populationen (zwei Studien untersuchten Reif- und Frühgeborene [210, 211], zwei Studien nur Frühgeborene) [209, 212]. Die Ergebnisse finden sich im Abschnitt „PEEP“ und deuten bei Verwendung eines T‑Stück-Systems, insbesondere bei Frühgeborenen, auf ein verbessertes Überleben und einen geringeren Intubationsbedarf und eine BPD hin.
Auch wenn sich die Evidenz zwar weiter in Richtung der bevorzugten Verwendung von T‑Stück-Systemen zu verschieben scheint, kam die ILCOR Task Force zu dem Schluss, dass die Empfehlungen zur Verwendung von T‑Stück-Systemen von 2015 bis zur Durchführung eines weiteren systematischen Reviews vorerst unverändert bleiben [1]. Der wissenschaftliche Konsens ergab 2015, dass die Verwendung von T‑Stück-Systemen geringfügige, aber statistisch nicht signifikante Vorteile in Bezug auf das Einsetzen einer Spontanatmung hat [51].
Beatmungsmasken im Vergleich zu nasopharyngealen Tuben
Eine Maskenbeatmung kann aufgrund eines potenziell großen und variablen Maskenlecks und eines damit verbundenen reduzierten applizierten Tidalvolumens immer wieder zu Problemen führen. Ursache für Leckagen sind zumeist eine nicht optimal ausgewählte Maskengröße sowie eine insuffiziente Beatmungstechnik. In Studien an Reanimationspuppen mit einem T‑Stück-System und verschiedenen Maskentypen zeigten 50 freiwillige untersuchte Personen eine variable Maskenleckage von bis zu 80 % während der Beatmung. Eine Verbesserung der Leckage stellte sich nach einer schriftlichen Anleitung und der Demonstration alternativer Maskenhaltetechniken ein [192, 193]. Unter Verwendung eines Atemfunktionsmonitorings konnten Schmölzer et al. bei 56 Frühgeborenen in 73 % der Fälle unterschiedliche Grade der Obstruktion (≥ 75 %) und/oder eine Leckage (> 75 %) während der ersten zwei Minuten unter Beatmung zeigen [156].
Eine Alternative zur Maskenbeatmung könnte die Beatmung über einen nasopharyngealen Tubus sein. In einer Beobachtungsstudie zeigte sich allerdings, dass bei der Verwendung eines mononasalen Nasopharyngealtubus eine Überdruckbeatmung insgesamt später begonnen wurde, eine größere Leckage zu beobachten war und häufiger Obstruktionen der Atemwege auftraten. Zudem waren die verabreichten Tidalvolumina häufiger unzureichend und die SpO2-Werte waren insgesamt niedriger [248]. Zwei randomisierte Studien mit 507 Frühgeborenen vor 31 Schwangerschaftswochen ergaben bei Beatmung mit Maske oder unter Verwendung eines mononasalen nasopharyngealen Tubus allerdings keinen Unterschied bezüglich der Intubationsraten im Kreißsaal [154, 249].
Larynxmaske
Eine Larynxmaske (LMA) kann zur Beatmung eines Neugeborenen verwendet werden, insbesondere wenn eine Maskenbeatmung nicht suffizient oder eine tracheale Intubation nicht erfolgreich oder nicht möglich ist [51]. Ein kürzlich durchgeführter systematischer Review von sieben Studien (794 Neugeborene) zeigte im Vergleich zu einer Beutel-Maske-Beatmung kürzere Beatmungszeiten und eine geringere Notwendigkeit trachealer Intubationen bei Verwendung einer LMA (schwacher bis mäßiger Evidenzgrad) [250]. Allerdings war die Beutel-Maske-Beatmung bei mehr als 80 % der eingeschlossenen Neugeborenen effektiv. Die Effizienz der LMA war vergleichbar mit der einer trachealen Intubation (sehr schwacher bis schwacher Evidenzgrad), was darauf hinweist, dass eine LMA möglicherweise eine Alternative sein könnte, wenn eine tracheale Intubation nicht gelingt oder wenn eine Intubation aufgrund fehlenden Equipments oder fehlender Erfahrung in der sicheren Intubation eines Neugeborenen fehlt.
Da verfügbare Studien nur Früh- und Neugeborene mit einem Geburtsgewicht von > 1500 g bzw. über 34 Schwangerschaftswochen einschlossen, stehen bisher keine Daten bezüglich der Verwendung einer LMA bei kleineren Frühgeborenen zur Verfügung [250, 251]. Es liegen derzeit darüber hinaus ebenfalls weder Daten zur LMA bei Neugeborenen mit mekoniumhaltigem Fruchtwasser oder unter Thoraxkompressionen noch bezüglich der Verabreichung von trachealen Notfallmedikamenten vor.
Tracheale Intubation
Die Durchführung und der Zeitpunkt einer trachealen Intubation sind vor allem abhängig von den Fähigkeiten und der Erfahrung der Versorgenden mit einer Notfallintubation von Neugeborenen.
Formeln zur Einführungstiefe eines Tubus können unzuverlässig sein [252, 253]. In Tab. 1 sind geeignete gewichtsabhängige Einführtiefen für die orale Intubation (und Tubusgrößen), die aus Beobachtungsdaten basierend auf der Schwangerschaftswoche abgeleitet wurden, aufgeführt [254]. Bei nasaler Intubation im Vergleich zu einer oralen Intubation erhöht sich die Einführtiefe durchschnittlich um etwa 1 cm zu den jeweils angegebenen Werten [255]. In der Regel werden bei Neugeborenen Tuben ohne Cuff verwendet. Es gibt bisher keine publizierten Daten, die für eine routinemäßige Verwendung von gecufften Trachealtuben während der Reanimation von Neugeborenen sprechen würden. Während einer perioperativen Beatmung bei Neugeborenen < 3 kgKG haben sie sich allerdings als sinnvoll erwiesen [256].
Der Durchmesser des engsten Teils der Atemwege variiert mit dem Gestationsalter und der Größe des Neugeborenen. Darüber hinaus variieren auch die Außendurchmesser der Tuben (bei identischem Innendurchmesser) je nach Hersteller und Tubustyp [257]. Die Außendurchmesser der verwendeten Tuben sollen dem Anwender bekannt sein und idealerweise sollen immer Tuben unterschiedlicher Größen zur Verfügung stehen, um den idealen Tubus situationsabhängig auswählen zu können. Der Tubus mit der idealen Größe für das entsprechende Früh- oder Neugeborene ermöglicht eine ausreichende Belüftung bei möglichst geringer Leckage und möglichst geringem Trauma der Atemwege. Ein Tubus mit zu geringem Durchmesser kann zwar in der richtigen Position platziert sein, insbesondere bei einer geringen Lungencompliance und in Verbindung mit einer wahrscheinlich ausgeprägten Tubusleckage werden suffiziente Beatmungen jedoch kaum möglich sein. Eine Schätzung der erforderlichen Tubusgröße gelingt zumeist mit der Formel: Tubusgröße ≤ Gestationsalter/10 [258].
Die Platzierung des Tubus in der Trachea muss während der Intubation unter Sicht erfolgen und die korrekte tracheale Lage muss klinisch überprüft und Tubuslage und -tiefe im Idealfall radiologisch bestätigt werden. Die Markierungen an den Enden der Trachealtuben, die bei der korrekten Platzierung des Tubus helfen sollen, variieren leider abhängig vom Hersteller und Modell erheblich [259]. Bei der Verwendung von Tuben unterschiedlicher Hersteller bzw. unterschiedlichen Modellen innerhalb einer Institution müssen diese Unterschiede bekannt und die Anwender mit diesen vertraut sein. Die Tubusposition kann sich während der Tubusfixierung erneut ändern [254]. Ein systematischer Review zu unterschiedlichen Methoden zur Tubuslagekontrolle zeigte eine bessere Validierung objektiver Beurteilungen der Tubusposition als subjektive Beurteilungen, wie z. B. die visuelle Beurteilung von Thoraxexkursionen [260]. Nach trachealer Intubation und unter Überdruckbeatmung sind ein sofortiger Anstieg der Herzfrequenz und der Nachweis eines endtidalen CO2 (etCO2) gute Anzeichen für eine tracheale Tubuslage [260].
Endtidales CO2 und Atemfunktionsmonitoring
Zusätzlich zur klinischen Beurteilung einer trachealen Tubuslage wird der Nachweis des endtidalen CO2 (etCO2) bei Neugeborenen mit aufrechter Kreislauffunktion nach der Intubation empfohlen [51]. Selbst bei extremen Frühgeborenen mit sehr geringem Geburtsgewicht [261, 262] kann der Nachweis eines endtidalen CO2 eine tracheale Tubuslage bei aufrechter Kreislauffunktion schneller und sicherer bestätigen als eine alleinige klinische Beurteilung [262, 263]. Neugeborene unter Reanimationsmaßnahmen waren aus den vorliegenden Studien ausgeschlossen. Wenn kein etCO2 nachgewiesen werden kann, deutet dies stark auf eine Fehlintubation in den Ösophagus oder eine Dislokation hin [261, 263]. Falsch-negative etCO2-Werte wurden im Kreislaufstillstand [261] und bei Frühgeborenen mit einem sehr geringen Geburtsgewicht (VLBW) beobachtet, selbst wenn etCO2-Detektoren verwendet wurden, die einen etCO2-Nachweis auch bei geringen Tidalvolumina erlauben [264]. Ein reduzierter oder fehlender Lungenblutfluss oder eine Obstruktion der Trachea können trotz korrekter Platzierung des Tubus einen Nachweis von etCO2 möglicherweise verhindern. Beim Neugeborenen fehlen Erkenntnisse, inwiefern Medikamente einen etCO2-Nachweis beeinträchtigen können. Studien an Erwachsenen legen jedoch nahe, dass Medikamente wie Adrenalin und Bikarbonat den etCO2-Nachweis beeinflussen können [265]. Ein unzureichender Spitzendruck, um eine ausreichende FRC zu etablieren und ein ausreichendes exspiratorisches Tidalvolumen zu erzeugen, könnte ebenfalls Grund für eine fehlende etCO2-Detektion sein. Ein fehlender etCO2-Nachweis kann trotz korrekter Tubuslage dann zu einer Extubationsentscheidung führen. Wenn Zweifel an der Zuverlässigkeit der etCO2-Detektion bestehen, soll die Lage des Tubus durch direkte Laryngoskopie bestätigt werden.
Sowohl qualitative (kolorimetrische) als auch quantitative (Haupt- oder Nebenstrommessung) Methoden wurden bei Neugeborenen zum etCO2-Nachweis erfolgreich eingesetzt [266]. Studien bei Erwachsenen legen nahe, dass eine quantitative Kapnographie beim Nachweis des etCO2 empfindlicher sein kann als eine kolorimetrische Bestimmung. Da jedoch keine Validitätsdaten zur Haupt- oder Nebenstrommessung bei Neugeborenen vorliegen, ist bei der Verwendung einer quantitativen Kapnographie Vorsicht geboten [265, 267, 268].
Eine Flow-Messung kann ebenfalls hilfreich sein, um eine tracheale Lage des Tubus zu bestätigen. In einer randomisierten, kontrollierten Studie konnte die tracheale Lage des Tubus mithilfe eines Flow-Sensors schneller und zuverlässiger als durch eine Kapnographie nachgewiesen werden [269].
Auch bei nicht intubierten Patienten kann ein Monitoring des Atemflusses/-volumens [270] und des etCO2 [271, 272] durchgeführt werden. Die Anwendbarkeit einer quantitativen Kapnographie unter Maskenbeatmung wurde nachgewiesen, möglicherweise sind die dargestellten etCO2-Werte allerdings nur wenig zuverlässig [272]. Bezüglich der Verwendung von etCO2-Detektoren zur Beurteilung der Beatmung mit anderen Hilfsmitteln zur assistierten Beatmung (z. B. nasopharyngeale Tuben, LMA) während der Überdruckbeatmung im Kreißsaal stehen keine Daten zur Verfügung.
Videolaryngoskopie
Ein systematischer Review zur Verwendung der Videolaryngoskopie bei Neugeborenen zeigte, dass die Videolaryngoskopie den Erfolg einer trachealen Intubation im ersten Versuch erhöht, aber die Zeit bis zur Intubation oder die Anzahl der Intubationsversuche nicht verringert (mäßiger bis sehr schwacher Evidenzgrad). Die eingeschlossenen Studien wurden jedoch mit Ärzten in Ausbildung durchgeführt, was den potenziellen Stellenwert der Videolaryngoskopie für Ausbildung und Training unterstreicht. Weitere gut konzipierte und ausreichend aussagekräftige RCT sind erforderlich, um den Nutzen, die Sicherheit und die Kosteneffizienz der Videolaryngoskopie für die tracheale Intubation bei Neugeborenen für Personen in Ausbildung und für in der direkten Laryngoskopie Erfahrene zu bestätigen [273]. Die Effektivität der Videolaryngoskopie während Reanimationsmaßnahmen wurde bisher nicht untersucht.
Raumluft/Sauerstoff
Reifgeborene und späte Frühgeborene ab 35 Schwangerschaftswochen
Ein kürzlich durchgeführter ILCOR CoSTR empfiehlt, bei Reifgeborenen und späten Frühgeborenen (ab 35 Schwangerschaftswochen), die bei der Geburt eine Atemunterstützung erhalten, mit 21 % Sauerstoff (Raumluft) zu beginnen (schwache Empfehlung, schwacher Evidenzgrad) [1]. Es wird davon abgeraten, mit 100 % inspiratorischer Sauerstoffkonzentration zu beginnen (starke Empfehlung, schwacher Evidenzgrad). Ein systematischer Review und eine Metaanalyse von 5 RCT und 5 Quasi-RCT, die insgesamt 2164 Patienten einschlossen, zeigte für Neugeborene ab 35 Schwangerschaftswochen, die eine Atemunterstützung bei der Geburt mit anfänglich Raumluft statt 100 % Sauerstoff erhielten, eine relative Verringerung der Kurzzeitmortalität um 27 % (RR = 0,73; 95 %-CI 0,57 bis 0,94) [174]. Unterschiede in Bezug auf neurologische Entwicklungsstörungen oder eine hypoxisch-ischämische Enzephalopathie konnten nicht nachgewiesen werden (schwacher bis sehr schwacher Evidenzgrad).
Die Verwendung niedrigerer Sauerstoffkonzentrationen kann bei einer vorliegenden Lungenerkrankung allerdings zu einer insuffizienten Sauerstoffversorgung führen [274]. Im Gegensatz dazu kann eine sehr hohe Sauerstoffkonzentration bei reifen Neugeborenen möglicherweise mit einer verzögert einsetzenden Spontanatmung verbunden sein [275]. Sauerstoff soll daher individuell so titriert werden, dass eine angemessene präduktale Sättigung erreicht wird. Wird zusätzlicher Sauerstoff verwendet, soll die verabreichte Sauerstoffkonzentration, sobald es möglich ist, wieder reduziert werden [276–278].
Frühgeborene unter 35 Schwangerschaftswochen
In einem systematischen ILCOR-Review und einer Metaanalyse von 10 RCT und vier Kohortenstudien wurden insgesamt 5697 Frühgeborene vor 35 Schwangerschaftswochen eingeschlossen, die bei der Geburt eine Atemunterstützung erhielten. Bei initial verabreichten niedrigen oder höheren Sauerstoffkonzentrationen zeigten sich in Bezug auf die Kurz- oder Langzeitmortalität (n = 968; RR = 0,83 [95 %-CI 0,50 bis 1,37]), auf neurologische Entwicklungsstörungen oder andere relevante frühgeburtsspezifische Morbiditäten keine statistisch signifikanten Vor- oder Nachteile [279]. Die ILCOR-Empfehlungen schlagen daher für diese Kinder vor, initial eher niedrige (21–30 %) als höhere (60–100 %) Sauerstoffkonzentrationen zu verwenden (schwache Empfehlung, sehr schwacher Evidenzgrad). Der vorgeschlagene Bereich von 21 bis 30 % entspricht dabei den in den klinischen Studien verwendeten niedrigen Sauerstoffkonzentrationen. Die Sauerstoffkonzentration soll anhand der präduktalen peripheren Sättigung mittels Pulsoxymetrie titriert werden (schwache Empfehlung, schwacher Evidenzgrad) [1].
Im Gegensatz zu Reifgeborenen führt die Verwendung von zusätzlichem Sauerstoff, um eine ausreichende Oxygenierung zu erreichen, bei Frühgeborenen zu vermehrten Atemanstrengungen. In einer tierexperimentellen Studie [280] und einer RCT mit 52 Frühgeborenen vor 30 Schwangerschaftswochen [281] führte eine Stabilisierung mit inital höheren Sauerstoffkonzentrationen (100 % gegenüber 30 %) zu vermehrten Atemanstrengungen, einer verbesserten Oxygenierung und einer kürzer notwendigen Maskenbeatmung. Das Atemminutenvolumen war mit 100 % Sauerstoff (146,34 ± 112,68 ml/kgKG/min) signifikant höher als mit 30 % (74,43 ± 52,19 ml/kgKG/min, p = 0,014).
In einem kürzlich veröffentlichten europäischen Konsensus wurde die Verwendung einer initialen Sauerstoffkonzentration von 30 % für Frühgeborene vor 28 Schwangerschaftswochen, von 21 bis 30 % für Frühgeborene von 28 bis 31 Schwangerschaftswochen und von 21 % für Frühgeborene ab 32 Schwangerschaftswochen und reife Neugeborene empfohlen [282].
Zielsauerstoffsättigung
Der empfohlene Zielbereich der peripheren Sauerstoffsättigung ist für Früh- und Reifgeborene gleich und basiert auf zeitbasierten Werten für die präduktale Sättigung bei gesunden Reifgeborenen bei Raumluft [7]. Konsensempfehlungen schlagen vor, sich bezüglich der Zielwerte dem Interquartilbereich anzunähern [283] oder das 25. Perzentil der Normalverteilung als untersten Grenzwert zu verwenden ([51]; Abb. 10).
Ein systematischer Review von 8 RCT mit 768 Frühgeborenen vor 32 Wochen mit niedrigen (≤ 30 %) gegenüber höheren (≥ 60 %) initial verabreichten Sauerstoffkonzentrationen ergab, dass das Nichterreichen einer Mindest‑SpO2 von 80 % nach fünf Minuten mit einem doppelten Risiko zu versterben (OR 4,57; 95 %-CI 1,62 bis 13,98; p < 0,05), einer niedrigen Herzfrequenz (mittlere Differenz −8,37; 95 %-CI −15,73 bis −1,01; p < 0,05) sowie einem höheren Risiko für schwere intraventrikuläre Blutungen (OR 2,04; 95 %-CI 1,01 bis 4,11; p < 0,05) verbunden war [284]. Es ist allerdings unklar, ob die Ursache in der Schwere der Grunderkrankung oder an der während der Stabilisierung verabreichten Sauerstoffkonzentration lag.
Die derzeit verfügbaren Daten legen nahe, dass fast alle Frühgeborenen vor 32 Schwangerschaftswochen in den ersten fünf Minuten nach der Geburt eine Sauerstoffgabe erhalten müssen, um die allgemein empfohlenen Ziele für die Sauerstoffsättigung zu erreichen [7, 278, 284]. Insbesondere in den ersten Minuten der Versorgung eines Frühgeborenen vor 32 Schwangerschaftswochen kann es jedoch schwierig sein, die Sauerstoffkonzentration so zu titrieren, dass diese Zielbereiche zu jeder Zeit eingehalten werden [285, 286]. In einer individualisierten Patientenanalyse von 706 in die RCT aufgenommenen Frühgeborenen erreichten nur 12 % fünf Minuten nach der Geburt den angestrebten Grenzwert von 80 % präduktaler peripherer Sättigung [284].
Titrierung von Sauerstoff
Um Hypoxien, Hyperoxien und Bradykardien während der Versorgung Früh- oder Neugeborener möglichst zu vermeiden, muss die initial gewählte verabreichte Sauerstoffkonzentration im Verlauf stetig überprüft werden und an die in Abhängigkeit von der Zeit angestrebten peripheren präduktalen Sättigungswerte angepasst und entsprechend titriert werden. Ein kürzlich durchgeführter Review ergab, dass die zugeführte Sauerstoffkonzentration daher alle 30 s überprüft und gegebenenfalls korrigiert werden soll [287].
Bei Verwendung eines T‑Stück-Systems für die Atemunterstützung oder Beatmung liegt ein wichtiger technischer Aspekt für die Titrierung von Sauerstoff darin, dass es im Median 19 s (IQR 0–57) dauert, bis sich die am Sauerstoffmischer gewählte Sauerstoffkonzentration am distalen Ende des T‑Stück-Systems einstellt [288]. Obwohl die Ursachen dieser Verzögerung insgesamt unklar sind, scheint ein guter Maskensitz, verbunden mit nur einer geringen Leckage, die Zeit bis zum Erreichen der am Sauerstoffmischer eingestellten Sauerstoffkonzentration am distalen Ende des T‑Stück-Systems deutlich zu verlängern.
Kreislaufunterstützung
Eine Kreislaufunterstützung mit Thoraxkompressionen ist nur dann wirksam, wenn die Lunge zuvor erfolgreich entfaltet wurde und Sauerstoff zum Herzen transportiert werden kann. Die Beatmung kann allerdings durch Thoraxkompressionen beeinträchtigt werden. Daher muss eine effektive Beatmung sichergestellt sein, bevor mit Thoraxkompressionen begonnen wird [289].
Am effektivsten werden Thoraxkompressionen durchgeführt, indem der Thorax mit beiden Händen umgriffen wird. Die zwei Daumen liegen dabei auf dem unteren Drittel des Brustbeins und die anderen Finger liegen auf dem Rücken (Zwei-Daumen-Technik) [290–293]. Diese Technik erzeugt einen höheren Blutdruck und koronaren Perfusionsdruck als die alternative Zwei-Finger-Technik [294, 295]. In einer Studie an Reanimationspuppen war das Aufeinanderlegen der Daumen am Brustbein effektiver als das Nebeneinanderlegen, verursachte aber eine frühere Ermüdung [296]. Bei der Thoraxkompression wird der Brustkorb zunächst auf ungefähr ein Drittel des anterior-posterioren Durchmessers komprimiert und anschließend wieder vollständig entlastet [297–301]. Thoraxkompressionen „über Kopf“ scheinen dabei genauso effektiv zu sein wie Kompressionen von der Seite des Neugeborenen [302].
Ein aktueller ILCOR-Review zur Evidenz identifizierte 19 seit 2015 veröffentlichte Studien zu Thoraxkompressionen, darunter einen systematischen Review und 18 RCT, bei denen es sich allerdings ausschließlich um Studien an Reanimationspuppen handelte [303]. Es wurde keine neue Evidenz dafür gefunden, die Empfehlungen von 2015 zu ändern. Thoraxkompressionen sollen beim Neugeborenen weiterhin bevorzugt mit der Zwei-Daumen-Technik durchgeführt werden (schwache Empfehlung, sehr schwacher Evidenzgrad) [1]. Neuere Techniken, z. B. die Positionierung der Daumen in einem Winkel von 90° zum Thorax oder die sog. „Klopffinger“-Technik, sind bisher nur an Reanimationspuppen beschrieben worden. Weitere Studien sind erforderlich, um einen Vorteil dieser Techniken gegenüber der Zwei-Daumen-Technik zu belegen [1, 304].
Um das effektivste Verhältnis von Thoraxkompressionen zu Ventilationen für die Reanimation von Neugeborenen zu ermitteln, wurde eine Aktualisierung der Evidenz durch das ILCOR durchgeführt [1]. Dabei wurden 13 seit 2015 veröffentlichte Studien als relevant befunden. Vier Studien mit Neugeborenen-Reanimationspuppen, in denen alternative Kompressions‑/Ventilationsverhältnisse bzw. asynchrone Ventilationsstrategien untersucht wurden, zeigten keinen Vorteil gegenüber einer Reanimation mit einem Verhältnis von drei Thoraxkompressionen zu einer Ventilation. In mehreren tierexperimentellen Studien wurde die Durchführung von Thoraxkompressionen während einer anhaltenden Inspiration der Lunge mit dem etablierten 3:1-Verhältnis verglichen. Es wurden dabei keine konstant klaren Vorteile festgestellt. Einige Studien sind diesbezüglich allerdings noch nicht abgeschlossen.
Die ILCOR-Empfehlungen von 2015 für das Verhältnis von drei Kompressionen zu einer Ventilation (insgesamt etwa 90 Kompressionen und 30 Ventilationen pro Minute) bleiben daher unverändert (schwache Empfehlung, sehr schwacher Evidenzgrad) [1, 51, 146]. Kompressionen und Ventilationen müssen koordiniert werden, um eine gleichzeitige Durchführung zu vermeiden [305]. Eine Entlastungsphase, die etwas länger als die Kompressionsphase ist, bietet theoretische Vorteile. Die Qualität der Thoraxkompressionen und der Ventilationen ist wahrscheinlich wichtiger als die Frequenz [306].
Eine Beeinträchtigung des Gasaustauschs ist zumeist die Ursache für einen postnatalen Herz-Kreislauf-Stillstand. Daher sollen Neugeborene nach der Geburt prinzipiell im Verhältnis von drei Kompressionen zu einer Ventilation reanimiert werden.
Wenn angenommen wird, dass der Kreislaufstillstand kardialen Ursprungs ist, kann auch in einem Verhältnis von z. B. 15:2 reanimiert werden. Dies ist allerdings bei einem beobachteten Kreislaufstillstand im späteren Verlauf wahrscheinlicher als unmittelbar nach der Geburt.
Wenn Thoraxkompressionen aufgrund einer anhaltend sehr langsamen oder fehlenden Herzfrequenz durchgeführt werden müssen, ist es wahrscheinlich sinnvoll, den zugeführten Sauerstoff auf 100 % zu erhöhen. Es gibt jedoch keine Studien am Menschen, welche dies belegen. Studien am Tiermodell zeigten keinen Vorteil für die Erhöhung des zugeführten Sauerstoffs auf 100 % während der kardiopulmonalen Reanimation [307–313].
Die Herzfrequenz soll spätestens 30 s nach Beginn der kardiopulmonalen Reanimation und im weiteren Verlauf regelmäßig überprüft werden, solange kein kontinuierliches Monitoring wie ein EKG oder eine Pulsoxymetrie etabliert wurde. Thoraxkompressionen sollen durchgeführt werden, bis die Herzfrequenz über 60/min liegt. Nur ein weiterer kontinuierlicher Anstieg der Herzfrequenz bedeutet eine tatsächliche klinische Verbesserung. Eine stabile Kreislaufsituation zeigt sich meist erst ab einer Herzfrequenz von etwa 120/min [132, 133].
Eine Messung des ausgeatmeten Kohlendioxids und eine Pulsoxymetrie können hilfreich sein, um die Rückkehr des Spontankreislaufs (ROSC) anzuzeigen [314–317]. Für die Verwendung einzelner Feedbacksysteme besteht beim Neugeborenen im klinischen Einsatz keine Evidenz. Die Extrapolation aus der Erwachsenen- und Kindermedizin wurde bei Neugeborenen aus verschiedenen Gründen als fehleranfällig beschrieben [51, 146, 267].
Gefäßzugang
Peripherer Zugang
Es konnten keine Studien zur Verwendung von periphervenösen Zugängen bei Neugeborenen unter Reanimation identifiziert werden. Eine retrospektive Analyse von 70 stabilen Frühgeborenen in einem einzigen Zentrum zeigte, dass ein periphervenöser Zugang in den meisten Fällen (61/70) beim ersten Versuch erfolgreich war [318].
Nabelvenenkatheter und intraossärer Zugang (i.o.)
In einem systematischen Review wurden keine Vergleiche zwischen Nabelvenenkathetern, periphervenösen Zugängen und intraossären Zugängen für die Verabreichung von Medikamenten bei Neugeborenen gefunden [1]. Es konnten keine Fallserien oder Fallberichte zur Verwendung eines intraossären Zugangs im Kreißsaal identifiziert werden. Der Nabelvenenkatheter ist im Rahmen der Neugeborenenreanimation als Gefäßzugang der ersten Wahl anerkannt. Der intraossäre Zugang kann eine sinnvolle Alternative sein, vor allem dann, wenn ein Nabelvenenkatheter nicht möglich ist oder die Geburt in einer anderen Umgebung als dem Kreißsaal erfolgt (schwache Empfehlung, sehr schwacher Evidenzgrad).
Ein systematischer Review zur Verwendung von intraossären Zugängen bei Neugeborenen identifizierte 12 Fallberichte und eine Fallserie über die Anwendung von 41 intraossären Zugängen bei Neugeborenen, die verschiedene Medikamente, einschließlich Adrenalin und Volumen bekamen [319]. Obwohl gezeigt wurde, dass der intraossäre Zugang eine praktische Alternative zum Nabelvenenkatheter darstellt, können signifikante Komplikationen auftreten. Dazu gehören Frakturen der Tibia, Osteomyelitis und Extravasate von Flüssigkeiten und Medikamenten, die zu einem Kompartmentsyndrom und einer Amputation führen können [1].
Für Neugeborene unmittelbar nach der Geburt gibt es insgesamt nur eine begrenzte Evidenz für den Einsatz, die optimale Punktionsstelle sowie die Art des intraossären Zugangs [320]. Simulationsstudien im Kreißsaal zeigten, dass der intraossäre Zugang schneller zu etablieren und zu verwenden ist als der Nabelvenenkatheter [321].
Die Entscheidung über die Methode des Zugangs ist grundsätzlich abhängig von der Verfügbarkeit, der Ausrüstung, dem Training und der Erfahrung des Anwenders [1].
Medikamente
Bei der Reanimation des Neugeborenen sind selten Medikamente notwendig [13, 14]. Im Allgemeinen führt eine ausgeprägte Hypoxie letztlich zu einer Bradykardie und die entscheidende Maßnahme für die erfolgreiche Reanimation eines Neugeborenen ist zumeist, die mit Flüssigkeit gefüllte Lunge zu öffnen und eine suffiziente Beatmung durchzuführen. Steigt die Herzfrequenz jedoch trotz suffizienter Beatmungen und Thoraxkompressionen nicht über 60/min, ist es sinnvoll, die Verwendung von Medikamenten in Betracht zu ziehen.
Das Wissen über den Einsatz von Medikamenten bei der Reanimation von Neugeborenen beschränkt sich weitgehend auf retrospektive Studien sowie auf die Extrapolation von Untersuchungen bei Erwachsenen und Tieren [322].
Adrenalin
Ein aktueller systematischer Review identifizierte zwei Beobachtungsstudien mit 97 Neugeborenen, die Dosierungen und Applikationswege von Adrenalin verglichen [323]. Es gab keine Unterschiede zwischen intravenös und tracheal verabreichtem Adrenalin für den primären Endpunkt Tod bei Entlassung aus dem Krankenhaus (RR = 1,03; 95 %-CI 0,62 bis 1,71), für das Ausbleiben eines ROSC (1 Studie; 50 Neugeborene) oder einer wiederholten Adrenalingabe (2 Studien; 97 Neugeborene). Es gab keine Unterschiede in Bezug auf das Outcome bei zwei verschiedenen trachealen Dosierungen (1 Studie). Es wurden keine Studien bei Neugeborenen gefunden, die sich mit der venösen Gabe oder dem Dosierungsintervall befassten (sehr schwacher Evidenzgrad). Trotz des Fehlens valider Humandaten bei Neugeborenen erscheint eine Adrenalingabe sinnvoll, wenn trotz effektiver Beatmungen und Thoraxkompressionen die Herzfrequenz nicht über 60/min ansteigt. Laut ILCOR-Behandlungsempfehlungen soll Adrenalin in einer Anfangsdosis von 10 bis 30 µg/kgKG (0,1–0,3 ml/kgKG 1:10.000 Adrenalin [1000 µg in 10 ml]) intravenös verabreicht werden (schwache Empfehlung, sehr schwacher Evidenzgrad). Wenn noch kein Gefäßzugang verfügbar ist, wird die tracheale Gabe von Adrenalin in einer höheren Dosis von 50 bis 100 µg/kgKG (0,5–1,0 ml/kgKG von 1:10.000 Adrenalin [1000 µg in 10 ml]) empfohlen (schwache Empfehlung, sehr schwacher Evidenzgrad). Eine tracheale Adrenalingabe soll das Legen eines Gefäßzugangs jedoch nicht verzögern (schwache Empfehlung, sehr schwacher Evidenzgrad). Bleibt die Herzfrequenz weiter unter 60/min, werden weitere Adrenalingaben – vorzugsweise intravenös/intraossär – alle 3–5 min empfohlen (schwache Empfehlung, sehr schwacher Evidenzgrad). Zeigt eine tracheale Adrenalingabe keine Wirkung, wird eine umgehende intravenöse Gabe empfohlen, sobald ein venöser Zugang zur Verfügung steht, unabhängig davon, wann zuvor das letzte Adrenalin tracheal verabreicht wurde (schwache Empfehlung, sehr schwacher Evidenzgrad) [1].
Glukose
Eine Hypoglykämie ist ein wichtiger zusätzlicher Risikofaktor für eine perinatale zerebrale Schädigung [324]. Endogene Glykogenspeicher werden bei längerer Hypoxie schnell aufgebraucht. In einer Studie zeigten Neugeborene mit perinataler Asphyxie vor der Gabe von Glukose im Kreißsaal signifikant niedrige Blurzuckerwerte (1,9 ± 0,6 mmol/l vs. 3,2 ± 0,3 mmol/l) [325]. Daher ist es bei längerer Reanimation möglicherweise sinnvoll, einen Bolus von 250 mg/kgKG (2,5 ml/kgKG 10 %ige Glukoselösung) zu verabreichen. Nach erfolgreicher Wiederbelebung sollen Maßnahmen eingeleitet werden, um sowohl eine Hypoglykämie als auch eine Hyperglykämie zu verhindern (siehe „Weitere Versorgung nach erfolgreicher Reanimation“).
Volumenersatz
Ein aktuelles ILCOR-Evidenz-Update [1] konnte keine weiteren Humanstudien identifizieren, aber eine einzelne RCT im Tiermodell, die die CoSTR-Empfehlungen von 2010 unterstützte [36, 276]. Ein frühzeitiger Volumenersatz soll bei Neugeborenen mit Blutverlust, die nicht auf Reanimationsmaßnahmen ansprechen, erfolgen. Wenn der Verdacht auf einen Blutverlust besteht oder das Neugeborene Zeichen für einen Schock zeigt (ausgeprägte Blässe, schlechte Hautperfusion, schwacher Puls) und nicht angemessen auf andere Reanimationsmaßnahmen reagiert, soll ein Volumenersatz durch eine isotonische, kristalloide Lösung oder durch eine Gabe von Erythrozytenkonzentrat erwogen werden. Allerdings sind Blutverluste, die beim Neugeborenen eine akute Hypovolämie verursachen, eher selten. Es gibt wenig Erkenntnisse, die eine Flüssigkeitsgabe ohne Hinweis auf einen Blutverlust unterstützen, wenn das Neugeborene nicht auf Beatmung, Thoraxkompressionen und Adrenalin reagiert. Da der Blutverlust jedoch nicht offensichtlich sein kann und die Unterscheidung zwischen normovolämischen asphyktischen Neugeborenen im Schock und hypovolämischen Neugeborenen problematisch sein kann, kann eine Volumengabe in diesen Situationen grundsätzlich in Erwägung gezogen werden [1].
Steht kein geeignetes Blut zur Verfügung (d. h. Rh-negatives Blut der Gruppe 0), sind isotone kristalloide Lösungen, anstelle von Albumin, die Volumentherapeutika der ersten Wahl zur Verbesserung des intravasalen Volumens. Zunächst kann ein Bolus von 10 ml/kgKG verabreicht werden. Bei Erfolg muss der Bolus möglicherweise wiederholt werden, um eine klinische Verbesserung aufrechtzuerhalten. Bei der Reanimation von Frühgeborenen ist ein Volumenbolus nur sehr selten notwendig und die schnelle Verabreichung großer Volumina ist mit der Gefahr von intraventrikulären und pulmonalen Blutungen verbunden [326].
Natriumbikarbonat
Wenn ein Spontankreislauf und ein suffizientes Herzzeitvolumen trotz suffizienter Beatmung und adäquater Thoraxkompressionen nicht wiederhergestellt werden kann, verbessert der Ausgleich einer intrakardialen Azidose möglicherweise die Myokardfunktion und begünstigt die Herstellung eines ROSC. Es stehen nicht ausreichend Daten zur Verfügung, um die routinemäßige Gabe von Natriumbikarbonat bei der Reanimation des Neugeborenen zu empfehlen. Die Hyperosmolarität und die kohlendioxiderzeugende Eigenschaft von Natriumbikarbonat können die Myokard- und Gehirnfunktion darüber hinaus beeinträchtigen [327].
Ein aktueller Evidenzreview [1] ergab, dass es keine Gründe gibt, die Empfehlungen von 2010 bezüglich einer Natriumbikarbonatgabe im Rahmen einer Neugeborenenreanimation zu ändern [36, 276]. Die Verwendung von Natriumbikarbonat wird während einer kurzen kardiopulmonalen Reanimation nicht empfohlen. Die Anwendung kann jedoch bei längerem Kreislaufstillstand, der nicht auf eine andere Therapie anspricht, in Betracht gezogen werden. Natriumbikarbonat soll in jedem Fall erst nach suffizienter Beatmung und adäquaten Thoraxkompressionen gegeben werden. Es kann langsam intravenös in einer Dosis von 1 bis 2 mmol/kgKG Natriumbikarbonat (2–4 ml/kgKG 4,2 %ige Lösung) verabreicht werden.
Naloxon
Es gibt keinerlei Evidenz dafür, dass die Gabe von Naloxon klinisch relevante Vorteile bei Neugeborenen mit Atemdepression aufgrund einer Hypoxie bringt [328, 329]. Aktuelle Empfehlungen unterstützen die Verwendung von Naloxon während der Reanimation daher nicht. Der Schwerpunkt soll hingegen immer auf einer effektiven Unterstützung der Atmung liegen.
Bei Neugeborenen von Müttern, die unter der Geburt eine Analgesie mit Opioiden erhalten haben, die trotz effektiver Reanimationsmaßnahmen bei gutem Herzzeitvolumen apnoeisch bleiben, kann eine initiale intramuskuläre Dosis von 200 µg Naloxon, unabhängig vom Gewicht, in Erwägung gezogen werden. Eine intramuskuläre Gabe von Naloxon führt zu einer konstanten Plasmakonzentration über circa 24 h [330]. Neugeborene mit einer Atemdepression durch Opioide können nach Gabe von Naloxon eine Rebound-Tachypnoe zeigen [331].
Weitere Versorgung nach erfolgreicher Reanimation („post-resuscitation care“)
Hypo- und Hyperglykämie
Eine perinatale Hypoxie beeinträchtigt die metabolische Anpassung und die Aufrechterhaltung der zerebralen Energieversorgung in vielerlei Hinsicht. Deutlich erniedrigte Blutzuckerspiegel im Kreißsaal fördern die Ketogenese [325]. Hypoglykämien sind grundsätzlich bei perinataler Hypoxie häufig zu beobachten. So hatte ein Viertel der Neugeborenen mit mittelschwerer bis schwerer hypoxisch-ischämischer Enzephalopathie (HIE), die einem nationalen Hypothermieregister gemeldet wurden, einen Blutzuckerwert von weniger als 2,6 mmol/l [332].
Ergebnisse aus tierexperimentellen Studien deuten darauf hin, dass eine hypoxiebedingte zerebrale Schädigung sowohl durch eine Hypoglykämie als auch durch eine Hyperglykämie verstärkt wird [333–335]. Bei Neugeborenen mit HIE ist ein frühes pathologisches Blutzuckerprofil (d. h. Hypoglykämien, Hyperglykämien oder schwankende Blutzuckerwerte) im Vergleich zur Normoglykämie mit deutlichen Mustern von zerebralen Schädigungen im MRT assoziiert [325]. Hyperglykämien und schwankende Blutzuckerwerte waren im amplitudenintegrierten EEG zudem mit einer pathologischen globalen Gehirnfunktion und Krampfanfällen assoziiert [336].
Sowohl Hypoglykämie als auch Hyperglykämie waren in der CoolCap-Studie [337] mit einem schlechten neurologischen Outcome verbunden. Bei Neugeborenen mit perinataler Hypoxie besteht ein eindeutiger Zusammenhang zwischen einer initialen Hypoglykämie und einem schlechten neurologischen Outcome [338, 339].
Ein aktueller ILCOR-Evidenzreview zum Blutzuckermanagement nach erfolgreicher Reanimation konnte keine systematischen Reviews oder RCT speziell zum Management der Blutzuckerwerte in den ersten Lebensstunden identifizieren [1]. Seit 2015 wurden 13 nichtrandomisierte Studien oder Beobachtungsstudien veröffentlicht, in denen untersucht wurde, ob die Aufrechterhaltung einer Normoglykämie während oder unmittelbar nach Reanimation das Outcome verbessert.
Die aktualisierte Leitlinie empfiehlt für Neugeborene, die prolongierte Reanimationsmaßnahmen benötigen, eine entsprechende Überwachung und Therapie der Blutzuckerwerte, um den Blutzuckerspiegel im Normbereich zu halten. Es sollen Protokolle für das Management des Blutzuckerspiegels verwendet werden, um sowohl eine Hypo- als auch eine Hyperglykämie und große Schwankungen der Blutzuckerwerte zu vermeiden. Das Evidenzupdate legt der Forschung nahe, dass die Entwicklung optimaler Protokolle für das Management des Blutzuckerspiegels und die optimalen Zielbereiche der Blutzuckerwerte von Früh- und Reifgeborenen nach erfolgreicher Reanimation hohe Priorität haben sollen. Insgesamt erfolgte keine Änderung der vorherigen Empfehlung, dass eine intravenöse Glukoseinfusion kurz nach der Reanimation in Betracht gezogen werden soll, um eine Hypoglykämie zu vermeiden (schwacher Evidenzgrad) [340].
Erwärmen
Falls keine Indikation für eine therapeutische Hypothermie besteht, soll eine Hypothermie nach der Geburt aufgrund der Evidenz für ein schlechtes Outcome korrigiert werden [78, 79]. Neugeborene sollen dann grundsätzlich in einem normalen Temperaturbereich gehalten werden.
Ein aktueller ILCOR-Evidenzreview konnte zeigen, dass seit den vorherigen Leitlinien keine zusätzlichen systematischen Reviews oder RCT veröffentlicht wurden [1]. Zwei retrospektive Beobachtungsstudien mit 182 Patienten [341] und 98 Patienten [342] wurden identifiziert, die untersuchten, ob eine schnelle oder langsame Wiedererwärmung bei Neugeborenen mit Hypothermie (≤ 36 °C bei Aufnahme) das Outcome verändert. Nach Elimination von Störfaktoren zeigten die Ergebnisse beider Studien, dass die kritischen und relevanten Outcomeparameter durch die Geschwindigkeit der Wiedererwärmung nicht beeinflusst werden. Aus einer weiteren Studie lässt sich allerdings ableiten, dass eine schnelle Wiedererwärmung das Risiko für ein Atemnotsyndrom verringert [341]. Dies führte zu der Schlussfolgerung, dass keine neue Evidenz für eine Änderung des ILCOR-Konsensus von 2015 besteht und dass jede Empfehlung für eine schnelle (0,5 °C/h oder mehr) oder langsame Wiedererwärmung (0,5 °C/h oder weniger) von ungewollt hypothermen Neugeborenen (Temperatur unter 36 °C) spekulativ wäre [276, 340, 343].
Therapeutische Hypothermie
Das Thema therapeutische Hypothermie wurde im Rahmen des aktuellen ILCOR-Prozesses nicht erneut evaluiert. Ein Cochrane-Review mit 11 randomisierten, kontrollierten Studien und 1505 Reifgeborenen und späten Frühgeborenen ergab, dass die therapeutische Hypothermie zu einer statistisch signifikanten und klinisch relevanten Verringerung des kombinierten Outcomes von Mortalität oder schwerer neurologischer Entwicklungsstörung bis zum Alter von 18 Monaten führte (typisches RR 0,75; 95 %-CI 0,68 bis 0,83; typische RD −0,15; 95 %-CI −0,20 bis −0,10). Daher sollen Reifgeborene oder späte Frühgeborene mit einer mittelschweren bis schweren hypoxisch-ischämischen Enzephalopathie einer therapeutischen Hypothermie zugeführt werden [344]. Die Kühlung soll nach klar definierten, evidenzbasierten Protokollen auf einer Neugeborenenintensivstation mit der Möglichkeit einer multidisziplinären Versorgung begonnen und durchgeführt werden. Die Behandlung soll innerhalb von 6 h nach der Geburt begonnen werden, die Zieltemperatur soll zwischen 33,5 und 34,5 °C liegen und für 72 h andauern. Die Wiedererwärmung soll über mindestens vier Stunden erfolgen. Eine RCT mit vier Armen, in die 364 Neugeborene eingeschlossen wurden und randomisiert länger (120 h) oder tiefer (32 °C) gekühlt wurden, ergab keinen Hinweis auf den Nutzen einer längeren Kühlung oder niedrigerer Temperaturen [345]. Tierexperimentelle Daten deuten stark darauf hin, dass die Wirksamkeit der Kühlung mit einem frühzeitigen Beginn der Therapie zusammenhängt. Auch eine 6 bis 24 h nach der Geburt eingeleitete Hypothermie kann noch von Vorteil sein. Bei einem späteren Beginn als sechs Stunden postnatal ist die Effektivität der Maßnahme allerdings unklar [346]. Eine solche Therapieentscheidung liegt im Ermessen des Behandlungsteams und soll individuell getroffen werden. Die derzeitige Evidenz reicht nicht aus, um eine routinemäßige therapeutische Hypothermie bei Neugeborenen mit leichter Enzephalopathie zu empfehlen [347].
Prognose (Dokumentation)
Dieses Thema wurde im Rahmen des aktuellen ILCOR-Prozesses nicht evaluiert. Es wurden keine systematischen oder Scoping-Reviews identifiziert.
Der APGAR-Score war als „einfache, gebräuchliche, eindeutige Klassifikation des Neugeborenen nach der Geburt“ gedacht und soll „als Diskussionsgrundlage und zum Vergleich verschiedener geburtshilflicher Praktiken, Verfahren zur mütterlichen Schmerztherapie und zur Beurteilung der Effektivität von Reanimationsmaßnahmen“ dienen (Betonung durch die Leitlinienautoren) [115]. Auch wenn der APGAR-Score weiterhin im klinischen Alltag, für wissenschaftliche Studien und als prognostisches Hilfsmittel verwendet wird, wird seine Eignung durch die hohe inter- und intrapersonelle Variabilität bei seiner Erhebung zunehmend infrage gestellt. In einer retrospektiven Studie mit 42 Neugeborenen zwischen 23 und 40 Schwangerschaftswochen stellten O’Donnell et al. eine signifikante Diskrepanz (durchschnittlich 2,4 Punkte) zwischen Beobachtern, die den APGAR anhand von Videos der Geburten retrospektiv bewerteten, im Vergleich zum bei der Geburt anwesenden Team, fest [348].
Eine geringe Korrelation mit dem Outcome erklärt sich teilweise aus einer mangelnden Übereinkunft darüber, wie der APGAR-Score von Neugeborenen, bei welchen Maßnahmen zur Stabilisierung oder Reanimation notwendig sind oder bei Frühgeburtlichkeit bewertet werden soll. Es wurden Variationen des APGAR-Scores vorgeschlagen, die den Reifegrad und durchgeführte Interventionen berücksichtigen, z. B. eine „spezifizierte“, „erweiterte“ und „kombinierte“ Version. Diese Versionen haben möglicherweise eine genauere Vorhersagefähigkeit in Bezug auf das Outcome von Frühgeborenen und Reifgeborenen im Vergleich zum herkömmlichen Score, ihre Verwendung ist jedoch wenig verbreitet [349, 350].
Kommunikation mit den Eltern
Die Grundsätze für die Notwendigkeit einer guten Kommunikation mit den Eltern leiten sich aus dem klinischen Konsens ab und wurden in europäischen und britischen Leitlinien publiziert [351, 352].
Mortalität und Morbidität bei Neugeborenen variieren je nach Region, ethnischer Zugehörigkeit und Verfügbarkeit von Ressourcen [353–355]. Sozialwissenschaftliche Studien zeigen, dass Eltern an Entscheidungen zur Wiederbelebung oder zur Beendigung der lebenserhaltenden Maßnahmen bei stark beeinträchtigten Neugeborenen beteiligt sein möchten [356, 357]. Lokale Überlebens- und Outcomedaten sind wichtig für eine angemessene Beratung der Eltern. Der institutionelle Ansatz zum Management (zum Beispiel an der Grenze der Lebensfähigkeit) wirkt sich dabei auf die Ergebnisse bei überlebenden Neugeborenen aus [358].
Europäische Leitlinien unterstützen die Anwesenheit der Familie während einer kardiopulmonalen Reanimation [359]. Familienmitgliedern wird, vor allem im Kreißsaal, zunehmend auch die Möglichkeit angeboten, auch während einer Reanimation anwesend zu sein. Der Wunsch der Eltern, bei der Reanimation anwesend zu sein, soll wann immer möglich unterstützt werden [1, 360, 361].
Es gibt nicht genügend Evidenz, um diesbezüglich einen Einfluss auf das Outcome des Patienten oder der Familie nachzuweisen. Einige Eltern bewerten die Möglichkeit, bei der Reanimation ihres Neugeborenen anwesend zu sein, als positive Erfahrung. Sowohl bei versorgenden Personen als auch bei Familienmitgliedern kann allerdings auch eine Sorge hinsichtlich einer Auswirkung auf die Teamperformance wahrgenommen werden (schwache Empfehlung, sehr schwacher Evidenzgrad) [1, 361].
In einem Review eines einzelnen Zentrums zum Geburtsmanagement unterstützten die interviewten Eltern das oben beschriebene Vorgehen, einige fanden es aber schwierig, eine Reanimation zu beobachten [362]. Die beteiligten Kliniker waren der Ansicht, dass die unmittelbare Nähe die Kommunikation mit den Eltern verbesserte. Befragungen deuteten aber darauf hin, dass möglicherweise Unterstützung und Training im Umgang mit solchen Situationen für die Teams notwendig sind [363]. In einer retrospektiven, auf einem Fragebogen basierenden Umfrage zur Arbeitsbelastung von Ärzten während der Reanimation, schien die Arbeitsbelastung durch die Anwesenheit von Eltern als geringer wahrgenommen zu werden [364].
Qualitative Evidenz unterstreicht die Notwendigkeit der Unterstützung nach, wie auch immer gearteten, kritischen Situationen rund um die Geburt, da diese Erlebnisse um die Geburt sonst eine negative Erfahrung mit posttraumatischen Folgen sein können [365, 366]. Die Eltern sollen die Möglichkeit haben zu reflektieren, Fragen zu Einzelheiten der Reanimation zu stellen und sollen über verfügbare Unterstützungsangebote (z. B. psychologisch oder seelsorgerisch) informiert werden [360]. Es kann hilfreich sein, den Eltern und engen Bezugspersonen die Möglichkeit zu geben, das Erlebte und Gesehene zu einem späteren Zeitpunkt erneut zu besprechen [365, 366].
Verzicht und Beendigung von Reanimationsmaßnahmen
Beendigung von Reanimationsmaßnahmen
Ein nach 10 bis 20 min fehlender Spontankreislauf (fehlender ROSC) trotz technisch korrekt durchgeführter Reanimationsmaßnahmen ist bei Neugeborenen nach der Geburt mit einem hohen Mortalitätsrisiko und einem hohen Risiko schwerer neurologischer Entwicklungsstörungen bei den Überlebenden verbunden. Eine bestimmte Dauer der Reanimation ist allerdings nicht mit einer bestimmten Mortalität oder einem bestimmten Grad einer neurologischen Beeinträchtigung assoziiert.
Wenn die Herzfrequenz länger als 10 min nicht nachweisbar war, muss das Outcome nicht zwangsläufig schlecht sein [367–369]. In einem aktuellen systematischen ILCOR-Review aus 13 Studien mit 277 Neugeborenen wurde für das Überleben ohne Beeinträchtigung der neurologischen Entwicklung eine schwache Evidenz (herabgestuft durch das Risiko von Bias und Inkonsistenzen) ermittelt. Von allen 277 Neugeborenen starben 69 % vor der letzten Nachuntersuchung, 18 % überlebten mit mittelschwerer bis schwerer Beeinträchtigung der neurologischen Entwicklung und 11 % überlebten ohne mittelschwere oder schwere Beeinträchtigung der neurologischen Entwicklung (bei 2 % lagen keine Follow-up-Daten vor) [1]. Für die Entscheidung zum Fortführen einer Reanimation kann es hilfreich sein, klinische Faktoren, die Effektivität der Reanimationsmaßnahmen und die Ansichten der Teammitglieder zu berücksichtigen [370].
Wenn ein Neugeborenes trotz korrekt durchgeführter Reanimationsmaßnahmen und unter Ausschluss reversibler Ursachen auch 20 min nach der Geburt keinen Spontankreislauf zeigt, kann es angemessen sein, eine Reanimation zu beenden (schwache Empfehlung, sehr schwacher Evidenzgrad) [1].
Die Entscheidung, eine Reanimation zu beenden, ist prinzipiell eine medizinische Entscheidung. Die Familie soll während der Reanimation nach Möglichkeit engmaschig informiert werden und, wenn dies wahrscheinlich erscheint, auch über ein mögliches Versterben des Kindes trotz der durchgeführten Reanimationsmaßnahmen aufgeklärt werden. Bei extremen Frühgeborenen sind längere Reanimationen mit geringeren Überlebensraten und einer höheren Morbidität verbunden. Die Entscheidung zum Abbruch einer Reanimation soll hier individuell getroffen werden [371, 372].
Verzicht auf Reanimationsmaßnahmen
In Situationen, in denen bei den überlebenden Neugeborenen eine extrem hohe Wahrscheinlichkeit für eine hohe Mortalität und schwere Morbidität angenommen werden muss, kann es sinnvoll sein, Reanimationsmaßnahmen nicht zu beginnen, insbesondere wenn im Vorfeld die Möglichkeit besteht, die Sichtweisen der Eltern diesbezüglich zu hören. Dies kann z. B. für extrem unreife Frühgeborene (Gestationsalter unter 22 Wochen und/oder Geburtsgewicht unter 350 g) [373] und für komplexe Fehlbildungen, wie z. B. eine Anenzephalie oder eine bilaterale Nierenagenesie, zutreffen.
Der Verzicht auf Reanimationsmaßnahmen oder das Beenden lebenserhaltender Maßnahmen während der Reanimation oder im weiteren Verlauf wird allgemein als ethisch gleichwertig angesehen. Verantwortliches medizinisches Personal soll daher nicht zögern, die Fortführung einer lebenserhaltenden Therapie zu beenden, wenn diese nicht im besten Interesse des Kindes ist [373]. Entscheidungen, eine Reanimation abzubrechen oder nicht durchzuführen, sollen im Idealfall daher immer erfahrenes neonatologisches bzw. pädiatrisches Personal mit einbeziehen.
Einzelfallentscheidungen sollen im interdisziplinären geburtshilflichen-neonatologischen Team, unter Berücksichtigung der Sichtweisen der Eltern, plausibel und koordiniert getroffen werden. In Situationen mit geringer Überlebenswahrscheinlichkeit (< 50 %), relativ hoher Morbiditätsrate und einer hohen zu erwartenden gesundheitlichen Belastung für das Kind sollen die elterlichen Wünsche hinsichtlich einer Reanimation eingeholt und im Allgemeinen unterstützt werden [352].
Supplementary Information
Acknowledgments
Korrespondierender Übersetzer
Dr. Jens Christian SchwindtAustrian Resuscitation Council Graz, Österreich Jens.Schwindt@neugeborenenreanimation.at
Danksagung
Die Übersetzung dieses Kapitels wurde von Dr. med. Beate Grass, Dr. med. Stefan Schäfer, Dr. Ulrich Kreth sowie Dr. Jens Christian Schwindt geleistet.
Einhaltung ethischer Richtlinien
Interessenkonflikt
C.C. Roehr declares speaker honorarium from Chiesi and funding from the National Institute for Health Research. J. Madar declares occasional advice to Laerdal Medical and Brayden on Newborn Resuscitation Equipment. H. Ersda declares research funding for Safer Births project from Laerdal foundation, Governmental, World Bank, Global Financing Facility and Laerdal Global Health. C. Morley declares honorarium from Dräger and Chiesi, and his role of consultant for Fisher and Paykel and Laerdal. T. Szczapa declares educational funding from GE and Chiesi. C. Skåre declares funding from Government and ZOLL foundation. A. te Pas is science advisor for CONCORD neonatal; he is patent holder of the Concord resuscitation table. M. Rüdiger declares his role of consultant for surfactant study Chiesi. J.P. Wyllie declares NIH grant as coapplicant for “Baby-OSCAR” project. S. Ainsworth, D. Trevisanuto, B. Urlesberger and D. Wilkinson declare that they have no competing interests. [Stand 10. Mai, Originalartikel in Resucitation]
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes
John Madar: ERC NLS Science & Education Committee
Charles C. Roehr: ERC NLS Science & Education Committee
Jonathan P. Wyllie: ILCOR Neonatal Task Force
Die Leitlinien wurden mit dem generischen Maskulin übersetzt. Bitte beachten Sie, dass alle Personenbezeichnungen gleichermaßen für beide Geschlechter gelten.
Die Übersetzung beruht auf der Version vom 29.01.2021. Bis zur Publikation des englischen Originals in Resuscitation wurden in manchen Kapiteln Literaturstellen korrigiert oder andere Änderungen vorgenommen, die den Sinn nicht wesentlich ändern.
Literatur
Verwendete Literatur
- 1.Wyckoff MH, Wyllie J, Aziz K, et al. Neonatal life support 2020 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations. Resuscitation. 2020;156:A156–A187. doi: 10.1016/j.resuscitation.2020.09.015. [DOI] [PubMed] [Google Scholar]
- 2.Perkins GD, Graesner JT, Semeraro F, et al. European Resuscitation Council guidelines 2021—executive summary. Resuscitation. 2021;161:1–60. doi: 10.1016/j.resuscitation.2021.02.003. [DOI] [PubMed] [Google Scholar]
- 3.Nolan JP, Monsieurs KG, Bossaert L, et al. European Resuscitation Council COVID-19 guidelines executive summary. Resuscitation. 2020;153:45–55. doi: 10.1016/j.resuscitation.2020.06.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Perkins GD, Morley PT, Nolan JP, et al. International Liaison Committee on Resuscitation: COVID-19 consensus on science, treatment recommendations and task force insights. Resuscitation. 2020;151:145–147. doi: 10.1016/j.resuscitation.2020.04.035. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Couper K, Taylor-Phillips S, Grove A, et al. COVID-19 in cardiac arrest and infection risk to rescuers: a systematic review. Resuscitation. 2020;151:59–66. doi: 10.1016/j.resuscitation.2020.04.022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Nolan JP, Sandroni C, Böttiger BW, et al. Postreanimationsbehandlung. Leitlinien des European Resuscitation Council und der European Society of Intensive Care Medicine 2021. Notfall Rettungsmed. 2021 doi: 10.1007/s10049-021-00892-y. [DOI] [Google Scholar]
- 7.Dawson JA, Kamlin CO, Vento M, et al. Defining the reference range for oxygen saturation for infants after birth. Pediatrics. 2010;125(6):e1340–e1347. doi: 10.1542/peds.2009-1510. [DOI] [PubMed] [Google Scholar]
- 8.te Pas AB, Davis PG, Hooper SB, Morley CJ. From liquid to air: breathing after birth. J Pediatr. 2008;152(5):607–611. doi: 10.1016/j.jpeds.2007.10.041. [DOI] [PubMed] [Google Scholar]
- 9.Hooper SB, Polglase GR, Roehr CC. Cardiopulmonary changes with aeration of the newborn lung. Paediatr Respir Rev. 2015;16(3):147–150. doi: 10.1016/j.prrv.2015.03.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Dekker J, van Kaam AH, Roehr CC, et al. Stimulating and maintaining spontaneous breathing during transition of preterm infants. Pediatr Res. 2019 doi: 10.1038/s41390-019-0468-7. [DOI] [PubMed] [Google Scholar]
- 11.Hooper SB, Siew ML, Kitchen MJ, te Pas AB. Establishing functional residual capacity in the non-breathing infant. Semin Fetal Neonatal Med. 2013;18(6):336–343. doi: 10.1016/j.siny.2013.08.011. [DOI] [PubMed] [Google Scholar]
- 12.Ersdal HL, Mduma E, Svensen E, Perlman JM. Early initiation of basic resuscitation interventions including face mask ventilation may reduce birth asphyxia related mortality in low-income countries: a prospective descriptive observational study. Resuscitation. 2012;83(7):869–873. doi: 10.1016/j.resuscitation.2011.12.011. [DOI] [PubMed] [Google Scholar]
- 13.Perlman JM, Risser R. Cardiopulmonary resuscitation in the delivery room: associated clinical events. Arch Pediatr Adolesc Med. 1995;149(1):20–25. doi: 10.1001/archpedi.1995.02170130022005. [DOI] [PubMed] [Google Scholar]
- 14.Barber CA, Wyckoff MH. Use and efficacy of endotracheal versus intravenous epinephrine during neonatal cardiopulmonary resuscitation in the delivery room. Pediatrics. 2006;118(3):1028–1034. doi: 10.1542/peds.2006-0416. [DOI] [PubMed] [Google Scholar]
- 15.Halling C, Sparks JE, Christie L, Wyckoff MH. Efficacy of intravenous and endotracheal epinephrine during neonatal cardiopulmonary resuscitation in the delivery room. J Pediatr. 2017;185:232–236. doi: 10.1016/j.jpeds.2017.02.024. [DOI] [PubMed] [Google Scholar]
- 16.Bjorland PA, Øymar K, Ersdal HL, Rettedal SI. Incidence of newborn resuscitative interventions at birth and short-term outcomes: a regional population-based study. BMJ Paediatr Open. 2019;3(1):e000592. doi: 10.1136/bmjpo-2019-000592. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Skare C, Boldingh AM, Kramer-Johansen J, et al. Video performance-debriefings and ventilation-refreshers improve quality of neonatal resuscitation. Resuscitation. 2018;132:140–146. doi: 10.1016/j.resuscitation.2018.07.013. [DOI] [PubMed] [Google Scholar]
- 18.Niles DE, Cines C, Insley E, et al. Incidence and characteristics of positive pressure ventilation delivered to newborns in a US tertiary academic hospital. Resuscitation. 2017;115:102–109. doi: 10.1016/j.resuscitation.2017.03.035. [DOI] [PubMed] [Google Scholar]
- 19.Aziz K, Chadwick M, Baker M, Andrews W. Ante- and intra-partum factors that predict increased need for neonatal resuscitation. Resuscitation. 2008;79(3):444–452. doi: 10.1016/j.resuscitation.2008.08.004. [DOI] [PubMed] [Google Scholar]
- 20.Annibale DJ, Hulsey TC, Wagner CL, Southgate WM. Comparative neonatal morbidity of abdominal and vaginal deliveries after uncomplicated pregnancies. Arch Pediatr Adolesc Med. 1995;149(8):862–867. doi: 10.1001/archpedi.1995.02170210036006. [DOI] [PubMed] [Google Scholar]
- 21.Liljestrom L, Wikstrom AK, Agren J, Jonsson M. Antepartum risk factors for moderate to severe neonatal hypoxic ischemic encephalopathy: a Swedish national cohort study. Acta Obstet Gynecol Scand. 2018;97(5):615–623. doi: 10.1111/aogs.13316. [DOI] [PubMed] [Google Scholar]
- 22.Lee J, Lee JH. A clinical scoring system to predict the need for extensive resuscitation at birth in very low birth weight infants. BMC Pediatr. 2019;19(1):197. doi: 10.1186/s12887-019-1573-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Londero AP, Rossetti E, Pittini C, Cagnacci A, Driul L. Maternal age and the risk of adverse pregnancy outcomes: a retrospective cohort study. BMC Pregnancy Childbirth. 2019;19(1):261. doi: 10.1186/s12884-019-2400-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Bajaj M, Natarajan G, Shankaran S, et al. Delivery room resuscitation and short-term outcomes in moderately preterm infants. J Pediatr. 2018;195:33–38.e2. doi: 10.1016/j.jpeds.2017.11.039. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Yangthara B, Horrasith S, Paes B, Kitsommart R. Predictive factors for intensive birth resuscitation in a developing-country: a 5-year, single-center study. J Matern Fetal Neonatal Med. 2020;33(4):570–576. doi: 10.1080/14767058.2018.1497602. [DOI] [PubMed] [Google Scholar]
- 26.Berazategui JP, Aguilar A, Escobedo M, et al. Risk factors for advanced resuscitation in term and near-term infants: a case-control study. Arch Dis Child Fetal Neonatal Ed. 2017;102(1):F44–F50. doi: 10.1136/archdischild-2015-309525. [DOI] [PubMed] [Google Scholar]
- 27.Berhan Y, Haileamlak A. The risks of planned vaginal breech delivery versus planned caesarean section for term breech birth: a meta-analysis including observational studies. BJOG. 2016;123(1):49–57. doi: 10.1111/1471-0528.13524. [DOI] [PubMed] [Google Scholar]
- 28.Foo XY, Greer RM, Kumar S. Impact of maternal body mass index on intrapartum and neonatal outcomes in Brisbane, Australia, 2007 to 2013. Birth. 2016;43(4):358–365. doi: 10.1111/birt.12246. [DOI] [PubMed] [Google Scholar]
- 29.Parsons SJ, Sonneveld S, Nolan T. Is a paediatrician needed at all Caesarean sections? J Paediatr Child Health. 1998;34(3):241–244. doi: 10.1046/j.1440-1754.1998.00207.x. [DOI] [PubMed] [Google Scholar]
- 30.Gordon A, McKechnie EJ, Jeffery H. Pediatric presence at cesarean section: justified or not? Am J Obstet Gynecol. 2005;193(3 Pt 1):599–605. doi: 10.1016/j.ajog.2005.06.013. [DOI] [PubMed] [Google Scholar]
- 31.Bensouda B, Boucher J, Mandel R, Lachapelle J, Ali N. 24/7 in house attending staff coverage improves neonatal short-term outcomes: a retrospective study. Resuscitation. 2018;122:25–28. doi: 10.1016/j.resuscitation.2017.11.045. [DOI] [PubMed] [Google Scholar]
- 32.Tu JH, Profit J, Melsop K, et al. Relationship of hospital staff coverage and delivery room resuscitation practices to birth asphyxia. Am J Perinatol. 2017;34(3):259–263. doi: 10.1055/s-0036-1586505. [DOI] [PubMed] [Google Scholar]
- 33.Mitchell A, Niday P, Boulton J, Chance G, Dulberg C. A prospective clinical audit of neonatal resuscitation practices in Canada. Adv Neonatal Care. 2002;2(6):316–326. doi: 10.1053/adnc.2002.36831. [DOI] [PubMed] [Google Scholar]
- 34.Skare C, Boldingh AM, Nakstad B, et al. Ventilation fraction during the first 30s of neonatal resuscitation. Resuscitation. 2016;107:25–30. doi: 10.1016/j.resuscitation.2016.07.231. [DOI] [PubMed] [Google Scholar]
- 35.Sawyer T, Lee HC, Aziz K. Anticipation and preparation for every delivery room resuscitation. Semin Fetal Neonatal Med. 2018;23(5):312–320. doi: 10.1016/j.siny.2018.06.004. [DOI] [PubMed] [Google Scholar]
- 36.Wyllie J, Bruinenberg J, Roehr CC, et al. European Resuscitation Council guidelines for resuscitation 2015 section 7 resuscitation and support of transition of babies at birth. Resuscitation. 2015;95:248–262. doi: 10.1016/j.resuscitation.2015.07.029. [DOI] [PubMed] [Google Scholar]
- 37.Rossi AC, Prefumo F. Planned home versus planned hospital births in women at low-risk pregnancy: a systematic review with meta-analysis. Eur J Obstet Gynecol Reprod Biol. 2018;222:102–108. doi: 10.1016/j.ejogrb.2018.01.016. [DOI] [PubMed] [Google Scholar]
- 38.Halamek LP, Cady RAH, Sterling MR. Using briefing, simulation and debriefing to improve human and system performance. Semin Perinatol. 2019;43(8):151178. doi: 10.1053/j.semperi.2019.08.007. [DOI] [PubMed] [Google Scholar]
- 39.Greif R, Bhanji F, Bigham BL, et al. Education, implementation, and teams: 2020 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations. Resuscitation. 2020;156:A188–A239. doi: 10.1016/j.resuscitation.2020.09.014. [DOI] [PubMed] [Google Scholar]
- 40.Bennett SC, Finer N, Halamek LP, et al. Implementing delivery room checklists and communication standards in a multi-neonatal ICU quality improvement collaborative. Jt Comm J Qual Patient Saf. 2016;42(8):369–376. doi: 10.1016/s1553-7250(16)42052-0. [DOI] [PubMed] [Google Scholar]
- 41.Katheria A, Rich W, Finer N. Development of a strategic process using checklists to facilitate team preparation and improve communication during neonatal resuscitation. Resuscitation. 2013;84(11):1552–1557. doi: 10.1016/j.resuscitation.2013.06.012. [DOI] [PubMed] [Google Scholar]
- 42.Lockey A, Lin Y, Cheng A. Impact of adult advanced cardiac life support course participation on patient outcomes—a systematic review and meta-analysis. Resuscitation. 2018;129:48–54. doi: 10.1016/j.resuscitation.2018.05.034. [DOI] [PubMed] [Google Scholar]
- 43.Huang J, Tang Y, Tang J, et al. Educational efficacy of high-fidelity simulation in neonatal resuscitation training: a systematic review and meta-analysis. BMC Med Educ. 2019;19(1):323. doi: 10.1186/s12909-019-1763-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Rakshasbhuvankar AA, Patole SK. Benefits of simulation based training for neonatal resuscitation education: a systematic review. Resuscitation. 2014;85(10):1320–1323. doi: 10.1016/j.resuscitation.2014.07.005. [DOI] [PubMed] [Google Scholar]
- 45.Patel A, Khatib MN, Kurhe K, Bhargava S, Bang A. Impact of neonatal resuscitation trainings on neonatal and perinatal mortality: a systematic review and meta-analysis. BMJ Paediatr Open. 2017;1(1):e000183. doi: 10.1136/bmjpo-2017-000183. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Yeung J, Djarv T, Hsieh MJ, et al. Spaced learning versus massed learning in resuscitation—a systematic review. Resuscitation. 2020;156:61–71. doi: 10.1016/j.resuscitation.2020.08.132. [DOI] [PubMed] [Google Scholar]
- 47.Mosley CM, Shaw BN. A longitudinal cohort study to investigate the retention of knowledge and skills following attendance on the newborn life support course. Arch Dis Child. 2013;98(8):582–586. doi: 10.1136/archdischild-2012-303263. [DOI] [PubMed] [Google Scholar]
- 48.Mduma E, Ersdal H, Svensen E, Kidanto H, Auestad B, Perlman J. Frequent brief on-site simulation training and reduction in 24-h neonatal mortality—an educational intervention study. Resuscitation. 2015;93:1–7. doi: 10.1016/j.resuscitation.2015.04.019. [DOI] [PubMed] [Google Scholar]
- 49.Yamada NK, Yaeger KA, Halamek LP. Analysis and classification of errors made by teams during neonatal resuscitation. Resuscitation. 2015;96:109–113. doi: 10.1016/j.resuscitation.2015.07.048. [DOI] [PubMed] [Google Scholar]
- 50.Finn JC, Bhanji F, Lockey A, et al. Part 8: education, implementation, and teams: 2015 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations. Resuscitation. 2015;95:e203–e224. doi: 10.1016/j.resuscitation.2015.07.046. [DOI] [PubMed] [Google Scholar]
- 51.Wyllie J, Perlman JM, Kattwinkel J, et al. Part 7: neonatal resuscitation: 2015 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations. Resuscitation. 2015;95:e169–e201. doi: 10.1016/j.resuscitation.2015.07.045. [DOI] [PubMed] [Google Scholar]
- 52.Dempsey E, Pammi M, Ryan AC, Barrington KJ. Standardised formal resuscitation training programmes for reducing mortality and morbidity in newborn infants. Cochrane Database Syst Rev. 2015;9:CD009106. doi: 10.1002/14651858.CD009106.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Thomas EJ, Taggart B, Crandell S, et al. Teaching teamwork during the Neonatal Resuscitation Program: a randomized trial. J Perinatol. 2007;27(7):409–414. doi: 10.1038/sj.jp.7211771. [DOI] [PubMed] [Google Scholar]
- 54.Thomas EJ, Williams AL, Reichman EF, Lasky RE, Crandell S, Taggart WR. Team training in the neonatal resuscitation program for interns: teamwork and quality of resuscitations. Pediatrics. 2010;125(3):539–546. doi: 10.1542/peds.2009-1635. [DOI] [PubMed] [Google Scholar]
- 55.Nadler I, Sanderson PM, Van Dyken CR, Davis PG, Liley HG. Presenting video recordings of newborn resuscitations in debriefings for teamwork training. BMJ Qual Saf. 2011;20(2):163–169. doi: 10.1136/bmjqs.2010.043547. [DOI] [PubMed] [Google Scholar]
- 56.Rovamo L, Nurmi E, Mattila MM, Suominen P, Silvennoinen M. Effect of a simulation-based workshop on multidisplinary teamwork of newborn emergencies: an intervention study. BMC Res Notes. 2015;8:671. doi: 10.1186/s13104-015-1654-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Rosen MA, DiazGranados D, Dietz AS, et al. Teamwork in healthcare: key discoveries enabling safer, high-quality care. Am Psychol. 2018;73(4):433–450. doi: 10.1037/amp0000298. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Soar J, Monsieurs KG, Ballance JH, et al. European Resuscitation Council guidelines for resuscitation 2010 section 9. Principles of education in resuscitation. Resuscitation. 2010;81(10):1434–1444. doi: 10.1016/j.resuscitation.2010.08.014. [DOI] [PubMed] [Google Scholar]
- 59.Mundell WC, Kennedy CC, Szostek JH, Cook DA. Simulation technology for resuscitation training: a systematic review and meta-analysis. Resuscitation. 2013;84(9):1174–1183. doi: 10.1016/j.resuscitation.2013.04.016. [DOI] [PubMed] [Google Scholar]
- 60.Levett-Jones T, Lapkin S. A systematic review of the effectiveness of simulation debriefing in health professional education. Nurse Educ Today. 2014;34(6):e58–e63. doi: 10.1016/j.nedt.2013.09.020. [DOI] [PubMed] [Google Scholar]
- 61.Garden AL, Le Fevre DM, Waddington HL, Weller JM. Debriefing after simulation-based non-technical skill training in healthcare: a systematic review of effective practice. Anaesth Intensive Care. 2015;43(3):300–308. doi: 10.1177/0310057X1504300303. [DOI] [PubMed] [Google Scholar]
- 62.Greif R, Lockey AS, Conaghan P, Lippert A, De Vries W, Monsieurs KG. European Resuscitation Council guidelines for resuscitation 2015 section 10: principles of education in resuscitation. Resuscitation. 2015;95:287–300. doi: 10.1016/j.resuscitation.2015.07.032. [DOI] [PubMed] [Google Scholar]
- 63.Mazza A, Cavallin F, Cappellari A, et al. Effect of a short training on neonatal face-mask ventilation performance in a low resource setting. PLoS One. 2017;12(10):e0186731. doi: 10.1371/journal.pone.0186731. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.O’Currain E, Thio M, Dawson JA, Donath SM, Davis PG. Respiratory monitors to teach newborn facemask ventilation: a randomised trial. Arch Dis Child Fetal Neonatal Ed. 2019;104(6):F582–F586. doi: 10.1136/archdischild-2018-316118. [DOI] [PubMed] [Google Scholar]
- 65.Ghoman SK, Patel SD, Cutumisu M, et al. Serious games, a game changer in teaching neonatal resuscitation? A review. Arch Dis Child Fetal Neonatal Ed. 2020;105(1):98–107. doi: 10.1136/archdischild-2019-317011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Schmolzer GM, Morley CJ, Kamlin O. Enhanced monitoring during neonatal resuscitation. Semin Perinatol. 2019;43(8):151177. doi: 10.1053/j.semperi.2019.08.006. [DOI] [PubMed] [Google Scholar]
- 67.van Vonderen JJ, van Zanten HA, Schilleman K, et al. Cardiorespiratory monitoring during neonatal resuscitation for direct feedback and audit. Front Pediatr. 2016;4:38. doi: 10.3389/fped.2016.00038. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.Edelson DP, Litzinger B, Arora V, et al. Improving in-hospital cardiac arrest process and outcomes with performance debriefing. Arch Intern Med. 2008;168(10):1063–1069. doi: 10.1001/archinte.168.10.1063. [DOI] [PubMed] [Google Scholar]
- 69.Wolfe H, Zebuhr C, Topjian AA, et al. Interdisciplinary ICU cardiac arrest debriefing improves survival outcomes. Crit Care Med. 2014;42(7):1688–1695. doi: 10.1097/CCM.0000000000000327. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 70.Couper K, Kimani PK, Davies RP, et al. An evaluation of three methods of in-hospital cardiac arrest educational debriefing: the cardiopulmonary resuscitation debriefing study. Resuscitation. 2016;105:130–137. doi: 10.1016/j.resuscitation.2016.05.005. [DOI] [PubMed] [Google Scholar]
- 71.Bleijenberg E, Koster RW, de Vries H, Beesems SG. The impact of post-resuscitation feedback for paramedics on the quality of cardiopulmonary resuscitation. Resuscitation. 2017;110:1–5. doi: 10.1016/j.resuscitation.2016.08.034. [DOI] [PubMed] [Google Scholar]
- 72.Morley CJ. Monitoring neonatal resuscitation: Why is it needed? Neonatology. 2018;113(4):387–392. doi: 10.1159/000487614. [DOI] [PubMed] [Google Scholar]
- 73.Skare C, Calisch TE, Saeter E, et al. Implementation and effectiveness of a video-based debriefing programme for neonatal resuscitation. Acta Anaesthesiol Scand. 2018;62(3):394–403. doi: 10.1111/aas.13050. [DOI] [PubMed] [Google Scholar]
- 74.Trevisanuto D, Testoni D, de Almeida MFB. Maintaining normothermia: why and how? Semin Fetal Neonatal Med. 2018;23(5):333–339. doi: 10.1016/j.siny.2018.03.009. [DOI] [PubMed] [Google Scholar]
- 75.Chitty H, Wyllie J. Importance of maintaining the newly born temperature in the normal range from delivery to admission. Semin Fetal Neonatal Med. 2013;18(6):362–368. doi: 10.1016/j.siny.2013.08.002. [DOI] [PubMed] [Google Scholar]
- 76.Javaudin F, Hamel V, Legrand A, et al. Unplanned out-of-hospital birth and risk factors of adverse perinatal outcome: findings from a prospective cohort. Scand J Trauma Resusc Emerg Med. 2019;27(1):26. doi: 10.1186/s13049-019-0600-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 77.McCall EM, Alderdice F, Halliday HL, Vohra S, Johnston L. Interventions to prevent hypothermia at birth in preterm and/or low birth weight infants. Cochrane Database Syst Rev. 2018;2:CD004210. doi: 10.1002/14651858.CD004210.pub5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 78.Wilson E, Maier RF, Norman M, et al. Admission hypothermia in very preterm infants and neonatal mortality and morbidity. J Pediatr. 2016;175:61–67.e4. doi: 10.1016/j.jpeds.2016.04.016. [DOI] [PubMed] [Google Scholar]
- 79.Laptook AR, Salhab W, Bhaskar B, Neonatal Research Network Admission temperature of low birth weight infants: predictors and associated morbidities. Pediatrics. 2007;119(3):e643–e649. doi: 10.1542/peds.2006-0943. [DOI] [PubMed] [Google Scholar]
- 80.Moore ER, Bergman N, Anderson GC, Medley N. Early skin-to-skin contact for mothers and their healthy newborn infants. Cochrane Database Syst Rev. 2016;11:CD003519. doi: 10.1002/14651858.CD003519.pub4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Linner A, Klemming S, Sundberg B, et al. Immediate skin-to-skin contact is feasible for very preterm infants but thermal control remains a challenge. Acta Paediatr. 2020;109(4):697–704. doi: 10.1111/apa.15062. [DOI] [PubMed] [Google Scholar]
- 82.Linner A, Westrup B, Lode-Kolz K, et al. Immediate parent-infant skin-to-skin study (IPISTOSS): study protocol of a randomised controlled trial on very preterm infants cared for in skin-to-skin contact immediately after birth and potential physiological, epigenetic, psychological and neurodevelopmental consequences. BMJ Open. 2020;10(7):e038938. doi: 10.1136/bmjopen-2020-038938. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 83.Manani M, Jegatheesan P, DeSandre G, Song D, Showalter L, Govindaswami B. Elimination of admission hypothermia in preterm very low-birth-weight infants by standardization of delivery room management. Perm J. 2013;17(3):8–13. doi: 10.7812/TPP/12-130. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 84.Belsches TC, Tilly AE, Miller TR, et al. Randomized trial of plastic bags to prevent term neonatal hypothermia in a resource-poor setting. Pediatrics. 2013;132(3):e656–e661. doi: 10.1542/peds.2013-0172. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 85.Lieberman E, Eichenwald E, Mathur G, Richardson D, Heffner L, Cohen A. Intrapartum fever and unexplained seizures in term infants. Pediatrics. 2000;106(5):983–988. doi: 10.1542/peds.106.5.983. [DOI] [PubMed] [Google Scholar]
- 86.Grether JK, Nelson KB. Maternal infection and cerebral palsy in infants of normal birth weight. JAMA. 1997;278(3):207–211. doi: 10.1001/jama.1997.03550030047032. [DOI] [PubMed] [Google Scholar]
- 87.Kasdorf E, Perlman JM. Hyperthermia, inflammation, and perinatal brain injury. Pediatr Neurol. 2013;49(1):8–14. doi: 10.1016/j.pediatrneurol.2012.12.026. [DOI] [PubMed] [Google Scholar]
- 88.te Pas AB, Lopriore E, Dito I, Morley CJ, Walther FJ. Humidified and heated air during stabilization at birth improves temperature in preterm infants. Pediatrics. 2010;125(6):e1427–e1432. doi: 10.1542/peds.2009-2656. [DOI] [PubMed] [Google Scholar]
- 89.Meyer MP, Owen LS, te Pas AB. Use of heated humidified gases for early stabilization of preterm infants: a meta-analysis. Front Pediatr. 2018;6:319. doi: 10.3389/fped.2018.00319. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 90.McGrory L, Owen LS, Thio M, et al. A randomized trial of conditioned or unconditioned gases for stabilizing preterm infants at birth. J Pediatr. 2018;193:47–53. doi: 10.1016/j.jpeds.2017.09.006. [DOI] [PubMed] [Google Scholar]
- 91.DeMauro SB, Douglas E, Karp K, et al. Improving delivery room management for very preterm infants. Pediatrics. 2013;132(4):e1018–e1025. doi: 10.1542/peds.2013-0686. [DOI] [PubMed] [Google Scholar]
- 92.Seidler T. Umbilical Cord management at preterm birth (< 34 weeks): systematic review and meta-analysis. Pediatrics. 2021;147(3):e20200576. doi: 10.1542/peds.2020-0576. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 93.Gomersall CD. Umbilical cord management at term and late preterm birth: a systematic review and meta-analysis. Pediatrics. 2021;147(3):e2020015404. doi: 10.1542/peds.2020-015404. [DOI] [PubMed] [Google Scholar]
- 94.Hooper SB, te Pas AB, Lang J, et al. Cardiovascular transition at birth: a physiological sequence. Pediatr Res. 2015;77(5):608–614. doi: 10.1038/pr.2015.21. [DOI] [PubMed] [Google Scholar]
- 95.Hooper SB, Binder-Heschl C, Polglase GR, et al. The timing of umbilical cord clamping at birth: physiological considerations. Matern Health Neonatol Perinatol. 2016;2:4. doi: 10.1186/s40748-016-0032-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 96.Bhatt S, Alison BJ, Wallace EM, et al. Delaying cord clamping until ventilation onset improves cardiovascular function at birth in preterm lambs. J Physiol. 2013;591(8):2113–2126. doi: 10.1113/jphysiol.2012.250084. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 97.Polglase GR, Dawson JA, Kluckow M, et al. Ventilation onset prior to umbilical cord clamping (physiological-based cord clamping) improves systemic and cerebral oxygenation in preterm lambs. PLoS One. 2015;10(2):e0117504. doi: 10.1371/journal.pone.0117504. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 98.Peltonen T. Placental transfusion—advantage an disadvantage. Eur J Pediatr. 1981;137(2):141–146. doi: 10.1007/BF00441306. [DOI] [PubMed] [Google Scholar]
- 99.Brady JP, James LS. Heart rate changes in the fetus and newborn infant during labor, delivery, and the immediate neonatal period. Am J Obstet Gynecol. 1962;84:1–12. doi: 10.1016/0002-9378(62)90663-4. [DOI] [PubMed] [Google Scholar]
- 100.Farrar D, Airey R, Law GR, Tuffnell D, Cattle B, Duley L. Measuring placental transfusion for term births: weighing babies with cord intact. BJOG. 2011;118(1):70–75. doi: 10.1111/j.1471-0528.2010.02781.x. [DOI] [PubMed] [Google Scholar]
- 101.Strauss RG, Mock DM, Johnson KJ, et al. A randomized clinical trial comparing immediate versus delayed clamping of the umbilical cord in preterm infants: short-term clinical and laboratory endpoints. Transfusion. 2008;48(4):658–665. doi: 10.1111/j.1537-2995.2007.01589.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 102.Rabe H, Reynolds G, Diaz-Rossello J. A systematic review and meta-analysis of a brief delay in clamping the umbilical cord of preterm infants. Neonatology. 2008;93(2):138–144. doi: 10.1159/000108764. [DOI] [PubMed] [Google Scholar]
- 103.Vain NE, Satragno DS, Gorenstein AN, et al. Effect of gravity on volume of placental transfusion: a multicentre, randomised, non-inferiority trial. Lancet. 2014;384(9939):235–240. doi: 10.1016/S0140-6736(14)60197-5. [DOI] [PubMed] [Google Scholar]
- 104.Hooper SB, Crossley KJ, Zahra VA, et al. Effect of body position and ventilation on umbilical artery and venous blood flows during delayed umbilical cord clamping in preterm lambs. Arch Dis Child Fetal Neonatal Ed. 2017;102(4):F312–F319. doi: 10.1136/archdischild-2016-311159. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 105.McDonald SJ, Middleton P, Dowswell T, Morris PS. Effect of timing of umbilical cord clamping of term infants on maternal and neonatal outcomes. Cochrane Database Syst Rev. 2013;7:CD004074. doi: 10.1002/14651858.CD004074.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 106.Hooper SB, Polglase GR, te Pas AB. A physiological approach to the timing of umbilical cord clamping at birth. Arch Dis Child Fetal Neonatal Ed. 2015;100(4):F355–F360. doi: 10.1136/archdischild-2013-305703. [DOI] [PubMed] [Google Scholar]
- 107.Ersdal HL, Linde J, Mduma E, Auestad B, Perlman J. Neonatal outcome following cord clamping after onset of spontaneous respiration. Pediatrics. 2014;134(2):265–272. doi: 10.1542/peds.2014-0467. [DOI] [PubMed] [Google Scholar]
- 108.Brouwer E, Knol R, Vernooij ASN, et al. Physiological-based cord clamping in preterm infants using a new purpose-built resuscitation table: a feasibility study. Arch Dis Child Fetal Neonatal Ed. 2019;104(4):F396–F402. doi: 10.1136/archdischild-2018-315483. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 109.Katheria AC, Brown MK, Faksh A, et al. Delayed cord clamping in newborns born at term at risk for resuscitation: a feasibility randomized clinical trial. J Pediatr. 2017;187:313–317.e1. doi: 10.1016/j.jpeds.2017.04.033. [DOI] [PubMed] [Google Scholar]
- 110.Duley L, Dorling J, Pushpa-Rajah A, et al. Randomised trial of cord clamping and initial stabilisation at very preterm birth. Arch Dis Child Fetal Neonatal Ed. 2018;103(1):F6–F14. doi: 10.1136/archdischild-2016-312567. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 111.Knol R, Brouwer E, van den Akker T, et al. Physiological-based cord clamping in very preterm infants—randomised controlled trial on effectiveness of stabilisation. Resuscitation. 2020;147:26–33. doi: 10.1016/j.resuscitation.2019.12.007. [DOI] [PubMed] [Google Scholar]
- 112.McAdams RM, Fay E, Delaney S. Whole blood volumes associated with milking intact and cut umbilical cords in term newborns. J Perinatol. 2018;38(3):245–250. doi: 10.1038/s41372-017-0002-x. [DOI] [PubMed] [Google Scholar]
- 113.Upadhyay A, Gothwal S, Parihar R, et al. Effect of umbilical cord milking in term and near term infants: randomized control trial. Am J Obstet Gynecol. 2013;208(2):120.e1–120.e6. doi: 10.1016/j.ajog.2012.10.884. [DOI] [PubMed] [Google Scholar]
- 114.Katheria A, Reister F, Essers J, et al. Association of umbilical cord milking vs delayed umbilical cord clamping with death or severe intraventricular hemorrhage among preterm infants. JAMA. 2019;322(19):1877–1886. doi: 10.1001/jama.2019.16004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 115.Apgar V. A proposal for a new method of evaluation of the newborn infant. Curr Res Anesth Analg. 1953;32(4):260–267. [PubMed] [Google Scholar]
- 116.Baik-Schneditz N, Urlesberger B, Schwaberger B, et al. Tactile stimulation during neonatal transition and its effect on vital parameters in neonates during neonatal transition. Acta Paediatr. 2018;107(6):952–957. doi: 10.1111/apa.14239. [DOI] [PubMed] [Google Scholar]
- 117.Dekker J, Martherus T, Cramer SJE, van Zanten HA, Hooper SB, te Pas AB. Tactile stimulation to stimulate spontaneous breathing during stabilization of preterm infants at birth: a retrospective analysis. Front Pediatr. 2017;5:61. doi: 10.3389/fped.2017.00061. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 118.Pietravalle A, Cavallin F, Opocher A, et al. Neonatal tactile stimulation at birth in a low-resource setting. BMC Pediatr. 2018;18(1):306. doi: 10.1186/s12887-018-1279-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 119.van Henten TMA, Dekker J, te Pas AB, Zivanovic S, Hooper SB, Roehr CC. Tactile stimulation in the delivery room: Do we practice what we preach? Arch Dis Child Fetal Neonatal Ed. 2019;104(6):F661–F662. doi: 10.1136/archdischild-2018-316344. [DOI] [PubMed] [Google Scholar]
- 120.Gaertner VD, Flemmer SA, Lorenz L, Davis PG, Kamlin COF. Physical stimulation of newborn infants in the delivery room. Arch Dis Child Fetal Neonatal Ed. 2018;103(2):F132–F136. doi: 10.1136/archdischild-2016-312311. [DOI] [PubMed] [Google Scholar]
- 121.Dekker J, Hooper SB, Martherus T, Cramer SJE, van Geloven N, te Pas AB. Repetitive versus standard tactile stimulation of preterm infants at birth—a randomized controlled trial. Resuscitation. 2018;127:37–43. doi: 10.1016/j.resuscitation.2018.03.030. [DOI] [PubMed] [Google Scholar]
- 122.Msemo G, Massawe A, Mmbando D, et al. Newborn mortality and fresh stillbirth rates in Tanzania after helping babies breathe training. Pediatrics. 2013;131(2):e353–e360. doi: 10.1542/peds.2012-1795. [DOI] [PubMed] [Google Scholar]
- 123.van Vonderen JJ, Roest AA, Siew ML, Walther FJ, Hooper SB, te Pas AB. Measuring physiological changes during the transition to life after birth. Neonatology. 2014;105(3):230–242. doi: 10.1159/000356704. [DOI] [PubMed] [Google Scholar]
- 124.O’Donnell CP, Kamlin CO, Davis PG, Carlin JB, Morley CJ. Clinical assessment of infant colour at delivery. Arch Dis Child Fetal Neonatal Ed. 2007;92(6):F465–F467. doi: 10.1136/adc.2007.120634. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 125.Ashish KC, Lawn JE, Zhou H, et al. Not crying after birth as a predictor of not breathing. Pediatrics. 2020;145(6):e20192719. doi: 10.1542/peds.2019-2719. [DOI] [PubMed] [Google Scholar]
- 126.Schilleman K, van der Pot CJ, Hooper SB, Lopriore E, Walther FJ, te Pas AB. Evaluating manual inflations and breathing during mask ventilation in preterm infants at birth. J Pediatr. 2013;162(3):457–463. doi: 10.1016/j.jpeds.2012.09.036. [DOI] [PubMed] [Google Scholar]
- 127.O’Donnell CP, Kamlin CO, Davis PG, Morley CJ. Crying and breathing by extremely preterm infants immediately after birth. J Pediatr. 2010;156(5):846–847. doi: 10.1016/j.jpeds.2010.01.007. [DOI] [PubMed] [Google Scholar]
- 128.Linde JE, Perlman JM, Oymar K, et al. Predictors of 24-h outcome in newborns in need of positive pressure ventilation at birth. Resuscitation. 2018;129:1–5. doi: 10.1016/j.resuscitation.2018.05.026. [DOI] [PubMed] [Google Scholar]
- 129.Linde JE, Schulz J, Perlman JM, et al. The relation between given volume and heart rate during newborn resuscitation. Resuscitation. 2017;117:80–86. doi: 10.1016/j.resuscitation.2017.06.007. [DOI] [PubMed] [Google Scholar]
- 130.Linde JE, Schulz J, Perlman JM, et al. Normal newborn heart rate in the first five minutes of life assessed by dry-electrode electrocardiography. Neonatology. 2016;110(3):231–237. doi: 10.1159/000445930. [DOI] [PubMed] [Google Scholar]
- 131.Saugstad OD. New guidelines for newborn resuscitation—a critical evaluation. Acta Paediatr. 2011;100(8):1058–1062. doi: 10.1111/j.1651-2227.2011.02301.x. [DOI] [PubMed] [Google Scholar]
- 132.Eilevstjonn J, Linde JE, Blacy L, Kidanto H, Ersdal HL. Distribution of heart rate and responses to resuscitation among 1237 apnoeic newborns at birth. Resuscitation. 2020;152:69–76. doi: 10.1016/j.resuscitation.2020.04.037. [DOI] [PubMed] [Google Scholar]
- 133.Yam CH, Dawson JA, Schmolzer GM, Morley CJ, Davis PG. Heart rate changes during resuscitation of newly born infants < 30 weeks gestation: an observational study. Arch Dis Child Fetal Neonatal Ed. 2011;96(2):F102–F107. doi: 10.1136/adc.2009.180950. [DOI] [PubMed] [Google Scholar]
- 134.Murphy MC, De Angelis L, McCarthy LK, O’Donnell CPF. Comparison of infant heart rate assessment by auscultation, ECG and oximetry in the delivery room. Arch Dis Child Fetal Neonatal Ed. 2018;103(5):F490–F492. doi: 10.1136/archdischild-2017-314367. [DOI] [PubMed] [Google Scholar]
- 135.Kamlin CO, O’Donnell CP, Everest NJ, Davis PG, Morley CJ. Accuracy of clinical assessment of infant heart rate in the delivery room. Resuscitation. 2006;71(3):319–321. doi: 10.1016/j.resuscitation.2006.04.015. [DOI] [PubMed] [Google Scholar]
- 136.Owen CJ, Wyllie JP. Determination of heart rate in the baby at birth. Resuscitation. 2004;60(2):213–217. doi: 10.1016/j.resuscitation.2003.10.002. [DOI] [PubMed] [Google Scholar]
- 137.van Vonderen JJ, Hooper SB, Kroese JK, et al. Pulse oximetry measures a lower heart rate at birth compared with electrocardiography. J Pediatr. 2015;166(1):49–53. doi: 10.1016/j.jpeds.2014.09.015. [DOI] [PubMed] [Google Scholar]
- 138.Kamlin CO, Dawson JA, O’Donnell CP, et al. Accuracy of pulse oximetry measurement of heart rate of newborn infants in the delivery room. J Pediatr. 2008;152(6):756–760. doi: 10.1016/j.jpeds.2008.01.002. [DOI] [PubMed] [Google Scholar]
- 139.Katheria A, Rich W, Finer N. Electrocardiogram provides a continuous heart rate faster than oximetry during neonatal resuscitation. Pediatrics. 2012;130(5):e1177–e1181. doi: 10.1542/peds.2012-0784. [DOI] [PubMed] [Google Scholar]
- 140.O’Donnell CP, Kamlin CO, Davis PG, Morley CJ. Obtaining pulse oximetry data in neonates: a randomised crossover study of sensor application techniques. Arch Dis Child Fetal Neonatal Ed. 2005;90(1):F84–F85. doi: 10.1136/adc.2004.058925. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 141.Louis D, Sundaram V, Kumar P. Pulse oximeter sensor application during neonatal resuscitation: a randomized controlled trial. Pediatrics. 2014;133(3):476–482. doi: 10.1542/peds.2013-2175. [DOI] [PubMed] [Google Scholar]
- 142.Narayen IC, Smit M, van Zwet EW, Dawson JA, Blom NA, te Pas AB. Low signal quality pulse oximetry measurements in newborn infants are reliable for oxygen saturation but underestimate heart rate. Acta Paediatr. 2015;104(4):e158–e163. doi: 10.1111/apa.12932. [DOI] [PubMed] [Google Scholar]
- 143.Johnson PA, Cheung PY, Lee TF, O’Reilly M, Schmolzer GM. Novel technologies for heart rate assessment during neonatal resuscitation at birth—a systematic review. Resuscitation. 2019;143:196–207. doi: 10.1016/j.resuscitation.2019.07.018. [DOI] [PubMed] [Google Scholar]
- 144.Anton O, Fernandez R, Rendon-Morales E, Aviles-Espinosa R, Jordan H, Rabe H. Heart rate monitoring in newborn babies: a systematic review. Neonatology. 2019;116(3):199–210. doi: 10.1159/000499675. [DOI] [PubMed] [Google Scholar]
- 145.Katheria A, Arnell K, Brown M, et al. A pilot randomized controlled trial of EKG for neonatal resuscitation. PLoS One. 2017;12(11):e0187730. doi: 10.1371/journal.pone.0187730. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 146.Perlman JM, Wyllie J, Kattwinkel J, et al. Part 7: neonatal resuscitation: 2015 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations. Circulation. 2015;132(16 Suppl 1):S204–S241. doi: 10.1161/CIR.0000000000000276. [DOI] [PubMed] [Google Scholar]
- 147.Luong D, Cheung PY, Barrington KJ, et al. Cardiac arrest with pulseless electrical activity rhythm in newborn infants: a case series. Arch Dis Child Fetal Neonatal Ed. 2019;104(6):F572–F574. doi: 10.1136/archdischild-2018-316087. [DOI] [PubMed] [Google Scholar]
- 148.Chua C, Schmolzer GM, Davis PG. Airway manoeuvres to achieve upper airway patency during mask ventilation in newborn infants—an historical perspective. Resuscitation. 2012;83(4):411–416. doi: 10.1016/j.resuscitation.2011.11.007. [DOI] [PubMed] [Google Scholar]
- 149.Bhalala US, Hemani M, Shah M, et al. Defining optimal head-tilt position of resuscitation in neonates and young infants using magnetic resonance imaging data. PLoS One. 2016;11(3):e0151789. doi: 10.1371/journal.pone.0151789. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 150.von Ungern-Sternberg BS, Erb TO, Reber A, Frei FJ. Opening the upper airway—airway maneuvers in pediatric anesthesia. Paediatr Anaesth. 2005;15(3):181–189. doi: 10.1111/j.1460-9592.2004.01534.x. [DOI] [PubMed] [Google Scholar]
- 151.Rechner JA, Loach VJ, Ali MT, Barber VS, Young JD, Mason DG. A comparison of the laryngeal mask airway with facemask and oropharyngeal airway for manual ventilation by critical care nurses in children. Anaesthesia. 2007;62(8):790–795. doi: 10.1111/j.1365-2044.2007.05140.x. [DOI] [PubMed] [Google Scholar]
- 152.Kamlin COF, Schmolzer GM, Dawson JA, et al. A randomized trial of oropharyngeal airways to assist stabilization of preterm infants in the delivery room. Resuscitation. 2019;144:106–114. doi: 10.1016/j.resuscitation.2019.08.035. [DOI] [PubMed] [Google Scholar]
- 153.Abel F, Bajaj Y, Wyatt M, Wallis C. The successful use of the nasopharyngeal airway in Pierre Robin sequence: an 11-year experience. Arch Dis Child. 2012;97(4):331–334. doi: 10.1136/archdischild-2011-301134. [DOI] [PubMed] [Google Scholar]
- 154.Kamlin CO, Schilleman K, Dawson JA, et al. Mask versus nasal tube for stabilization of preterm infants at birth: a randomized controlled trial. Pediatrics. 2013;132(2):e381–e388. doi: 10.1542/peds.2013-0361. [DOI] [PubMed] [Google Scholar]
- 155.Crawshaw JR, Kitchen MJ, Binder-Heschl C, et al. Laryngeal closure impedes non-invasive ventilation at birth. Arch Dis Child Fetal Neonatal Ed. 2018;103(2):F112–F119. doi: 10.1136/archdischild-2017-312681. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 156.Schmolzer GM, Dawson JA, Kamlin CO, O’Donnell CP, Morley CJ, Davis PG. Airway obstruction and gas leak during mask ventilation of preterm infants in the delivery room. Arch Dis Child Fetal Neonatal Ed. 2011;96(4):F254–F257. doi: 10.1136/adc.2010.191171. [DOI] [PubMed] [Google Scholar]
- 157.Bancalari A, Diaz V, Araneda H. Effects of pharyngeal suction on the arterial oxygen saturation and heart rate in healthy newborns delivered by elective cesarean section. J Neonatal Perinatal Med. 2019;12(3):271–276. doi: 10.3233/NPM-180137. [DOI] [PubMed] [Google Scholar]
- 158.Kelleher J, Bhat R, Salas AA, et al. Oronasopharyngeal suction versus wiping of the mouth and nose at birth: a randomised equivalency trial. Lancet. 2013;382(9889):326–330. doi: 10.1016/S0140-6736(13)60775-8. [DOI] [PubMed] [Google Scholar]
- 159.Cordero L, Jr, Hon EH. Neonatal bradycardia following nasopharyngeal stimulation. J Pediatr. 1971;78(3):441–447. doi: 10.1016/S0022-3476(71)80224-X. [DOI] [PubMed] [Google Scholar]
- 160.Gungor S, Kurt E, Teksoz E, Goktolga U, Ceyhan T, Baser I. Oronasopharyngeal suction versus no suction in normal and term infants delivered by elective cesarean section: a prospective randomized controlled trial. Gynecol Obstet Invest. 2006;61(1):9–14. doi: 10.1159/000087604. [DOI] [PubMed] [Google Scholar]
- 161.Modarres Nejad V, Hosseini R, Sarrafi Nejad A, Shafiee G. Effect of oronasopharyngeal suction on arterial oxygen saturation in normal, term infants delivered vaginally: a prospective randomised controlled trial. J Obstet Gynaecol. 2014;34(5):400–402. doi: 10.3109/01443615.2014.897312. [DOI] [PubMed] [Google Scholar]
- 162.Zareen Z, Hawkes CP, Krickan ER, Dempsey EM, Ryan CA. In vitro comparison of neonatal suction catheters using simulated ‘pea soup’ meconium. Arch Dis Child Fetal Neonatal Ed. 2013;98(3):F241–F243. doi: 10.1136/archdischild-2012-302495. [DOI] [PubMed] [Google Scholar]
- 163.Bent RC, Wiswell TE, Chang A. Removing meconium from infant tracheae. What works best? Am J Dis Child. 1992;146(9):1085–1089. doi: 10.1001/archpedi.1992.02160210087028. [DOI] [PubMed] [Google Scholar]
- 164.Foster JP, Dawson JA, Davis PG, Dahlen HG. Routine oro/nasopharyngeal suction versus no suction at birth. Cochrane Database Syst Rev. 2017;4:CD010332. doi: 10.1002/14651858.CD010332.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 165.Wiswell TE, Gannon CM, Jacob J, et al. Delivery room management of the apparently vigorous meconium-stained neonate: results of the multicenter, international collaborative trial. Pediatrics. 2000;105(1 Pt 1):1–7. doi: 10.1542/peds.105.1.1. [DOI] [PubMed] [Google Scholar]
- 166.Edwards EM, Lakshminrusimha S, Ehret DEY, Horbar JD. NICU admissions for meconium aspiration syndrome before and after a National Resuscitation Program suctioning guideline change. Children (Basel) 2019;6(5):68. doi: 10.3390/children6050068. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 167.Kalra VK, Lee HC, Sie L, Ratnasiri AW, Underwood MA, Lakshminrusimha S. Change in neonatal resuscitation guidelines and trends in incidence of meconium aspiration syndrome in California. J Perinatol. 2020;40(1):46–55. doi: 10.1038/s41372-019-0529-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 168.Trevisanuto D, Strand ML, Kawakami MD, et al. Tracheal suctioning of meconium at birth for non-vigorous infants: a systematic review and meta-analysis. Resuscitation. 2020;149:117–126. doi: 10.1016/j.resuscitation.2020.01.038. [DOI] [PubMed] [Google Scholar]
- 169.Phattraprayoon N, Tangamornsuksan W, Ungtrakul T. Outcomes of endotracheal suctioning in non-vigorous neonates born through meconium-stained amniotic fluid: a systematic review and meta-analysis. Arch Dis Child Fetal Neonatal Ed. 2021;106(1):31–38. doi: 10.1136/archdischild-2020-318941. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 170.Kumar A, Kumar P, Basu S. Endotracheal suctioning for prevention of meconium aspiration syndrome: a randomized controlled trial. Eur J Pediatr. 2019;178(12):1825–1832. doi: 10.1007/s00431-019-03463-z. [DOI] [PubMed] [Google Scholar]
- 171.Oommen VI, Ramaswamy VV, Szyld E, Roehr CC. Resuscitation of non-vigorous neonates born through meconium-stained amniotic fluid: post policy change impact analysis. Arch Dis Child Fetal Neonatal Ed. 2020 doi: 10.1136/archdischild-2020-319771. [DOI] [PubMed] [Google Scholar]
- 172.Dargaville PA, Copnell B, Mills JF, et al. Fluid recovery during lung lavage in meconium aspiration syndrome. Acta Paediatr. 2013;102(2):e90–e93. doi: 10.1111/apa.12070. [DOI] [PubMed] [Google Scholar]
- 173.Dargaville PA, Copnell B, Mills JF, et al. Randomized controlled trial of lung lavage with dilute surfactant for meconium aspiration syndrome. J Pediatr. 2011;158(3):383–389.e2. doi: 10.1016/j.jpeds.2010.08.044. [DOI] [PubMed] [Google Scholar]
- 174.Welsford M, Nishiyama C, Shortt C, et al. Room air for initiating term newborn resuscitation: a systematic review with meta-analysis. Pediatrics. 2019;143(1):e20181825. doi: 10.1542/peds.2018-1825. [DOI] [PubMed] [Google Scholar]
- 175.Vyas H, Milner AD, Hopkin IE, Boon AW. Physiologic responses to prolonged and slow-rise inflation in the resuscitation of the asphyxiated newborn infant. J Pediatr. 1981;99(4):635–639. doi: 10.1016/S0022-3476(81)80279-X. [DOI] [PubMed] [Google Scholar]
- 176.Harris C, Bhat P, Murthy V, Milner AD, Greenough A. The first breath during resuscitation of prematurely born infants. Early Hum Dev. 2016;100:7–10. doi: 10.1016/j.earlhumdev.2016.05.009. [DOI] [PubMed] [Google Scholar]
- 177.Bhat P, Hunt K, Harris C, Murthy V, Milner AD, Greenough A. Inflation pressures and times during initial resuscitation in preterm infants. Pediatr Int. 2017;59(8):906–910. doi: 10.1111/ped.13319. [DOI] [PubMed] [Google Scholar]
- 178.Vyas H, Field D, Milner AD, Hopkin IE. Determinants of the first inspiratory volume and functional residual capacity at birth. Pediatr Pulmonol. 1986;2(4):189–193. doi: 10.1002/ppul.1950020403. [DOI] [PubMed] [Google Scholar]
- 179.Boon AW, Milner AD, Hopkin IE. Lung expansion, tidal exchange, and formation of the functional residual capacity during resuscitation of asphyxiated neonates. J Pediatr. 1979;95(6):1031–1036. doi: 10.1016/S0022-3476(79)80304-2. [DOI] [PubMed] [Google Scholar]
- 180.Ersdal HL, Eilevstjonn J, Perlman J, et al. Establishment of functional residual capacity at birth: observational study of 821 neonatal resuscitations. Resuscitation. 2020;153:71–78. doi: 10.1016/j.resuscitation.2020.05.033. [DOI] [PubMed] [Google Scholar]
- 181.Hird MF, Greenough A, Gamsu HR. Inflating pressures for effective resuscitation of preterm infants. Early Hum Dev. 1991;26(1):69–72. doi: 10.1016/0378-3782(91)90045-5. [DOI] [PubMed] [Google Scholar]
- 182.Lamberska T, Luksova M, Smisek J, Vankova J, Plavka R. Premature infants born at < 25 weeks of gestation may be compromised by currently recommended resuscitation techniques. Acta Paediatr. 2016;105(4):e142–e150. doi: 10.1111/apa.13178. [DOI] [PubMed] [Google Scholar]
- 183.Murthy V, D’Costa W, Shah R, et al. Prematurely born infants’ response to resuscitation via an endotracheal tube or a face mask. Early Hum Dev. 2015;91(3):235–238. doi: 10.1016/j.earlhumdev.2015.02.004. [DOI] [PubMed] [Google Scholar]
- 184.Kaufman J, Schmolzer GM, Kamlin CO, Davis PG. Mask ventilation of preterm infants in the delivery room. Arch Dis Child Fetal Neonatal Ed. 2013;98(5):F405–F410. doi: 10.1136/archdischild-2012-303313. [DOI] [PubMed] [Google Scholar]
- 185.Foglia EE, te Pas AB. Effective ventilation: the most critical intervention for successful delivery room resuscitation. Semin Fetal Neonatal Med. 2018;23(5):340–346. doi: 10.1016/j.siny.2018.04.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 186.Kuypers K, Lamberska T, Martherus T, et al. The effect of a face mask for respiratory support on breathing in preterm infants at birth. Resuscitation. 2019;144:178–184. doi: 10.1016/j.resuscitation.2019.08.043. [DOI] [PubMed] [Google Scholar]
- 187.O’Donnell CPF. Face mask respiratory support for preterm infants: Takes their breath away? Resuscitation. 2019;144:189–190. doi: 10.1016/j.resuscitation.2019.09.017. [DOI] [PubMed] [Google Scholar]
- 188.Holte K, Ersdal HL, Eilevstjønn J, et al. Predictors for expired CO2 in neonatal bag-mask ventilation at birth: observational study. BMJ Paediatr Open. 2019;3(1):e000544. doi: 10.1136/bmjpo-2019-000544. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 189.te Pas AB, Wong C, Kamlin CO, Dawson JA, Morley CJ, Davis PG. Breathing patterns in preterm and term infants immediately after birth. Pediatr Res. 2009;65(3):352–356. doi: 10.1203/PDR.0b013e318193f117. [DOI] [PubMed] [Google Scholar]
- 190.Thallinger M, Ersdal HL, Francis F, et al. Born not breathing: a randomised trial comparing two self-inflating bag-masks during newborn resuscitation in Tanzania. Resuscitation. 2017;116:66–72. doi: 10.1016/j.resuscitation.2017.04.012. [DOI] [PubMed] [Google Scholar]
- 191.Poulton DA, Schmolzer GM, Morley CJ, Davis PG. Assessment of chest rise during mask ventilation of preterm infants in the delivery room. Resuscitation. 2011;82(2):175–179. doi: 10.1016/j.resuscitation.2010.10.012. [DOI] [PubMed] [Google Scholar]
- 192.Wood FE, Morley CJ, Dawson JA, et al. Assessing the effectiveness of two round neonatal resuscitation masks: study 1. Arch Dis Child Fetal Neonatal Ed. 2008;93(3):F235–F237. doi: 10.1136/adc.2007.117713. [DOI] [PubMed] [Google Scholar]
- 193.Wood FE, Morley CJ, Dawson JA, et al. Improved techniques reduce face mask leak during simulated neonatal resuscitation: study 2. Arch Dis Child Fetal Neonatal Ed. 2008;93(3):F230–F234. doi: 10.1136/adc.2007.117788. [DOI] [PubMed] [Google Scholar]
- 194.Martherus T, Oberthuer A, Dekker J, et al. Supporting breathing of preterm infants at birth: a narrative review. Arch Dis Child Fetal Neonatal Ed. 2019;104(1):F102–F107. doi: 10.1136/archdischild-2018-314898. [DOI] [PubMed] [Google Scholar]
- 195.Tracy MB, Klimek J, Coughtrey H, et al. Mask leak in one-person mask ventilation compared to two-person in newborn infant manikin study. Arch Dis Child Fetal Neonatal Ed. 2011;96(3):F195–F200. doi: 10.1136/adc.2009.169847. [DOI] [PubMed] [Google Scholar]
- 196.Soar J, Maconochie I, Wyckoff MH, et al. 2019 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations. Resuscitation. 2019;145:95–150. doi: 10.1016/j.resuscitation.2019.10.016. [DOI] [PubMed] [Google Scholar]
- 197.Klingenberg C, Sobotka KS, Ong T, et al. Effect of sustained inflation duration; resuscitation of near-term asphyxiated lambs. Arch Dis Child Fetal Neonatal Ed. 2013;98(3):F222–F227. doi: 10.1136/archdischild-2012-301787. [DOI] [PubMed] [Google Scholar]
- 198.te Pas AB, Siew M, Wallace MJ, et al. Effect of sustained inflation length on establishing functional residual capacity at birth in ventilated premature rabbits. Pediatr Res. 2009;66(3):295–300. doi: 10.1203/PDR.0b013e3181b1bca4. [DOI] [PubMed] [Google Scholar]
- 199.Bruschettini M, O’Donnell CP, Davis PG, Morley CJ, Moja L, Calevo MG. Sustained versus standard inflations during neonatal resuscitation to prevent mortality and improve respiratory outcomes. Cochrane Database Syst Rev. 2020;3:CD004953. doi: 10.1002/14651858.CD004953.pub4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 200.Kirpalani H, Ratcliffe SJ, Keszler M, et al. Effect of sustained inflations vs intermittent positive pressure ventilation on bronchopulmonary dysplasia or death among extremely preterm infants: the SAIL randomized clinical trial. JAMA. 2019;321(12):1165–1175. doi: 10.1001/jama.2019.1660. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 201.Hunt KA, Ling R, White M, et al. Sustained inflations during delivery suite stabilisation in prematurely-born infants—a randomised trial. Early Hum Dev. 2019;130:17–21. doi: 10.1016/j.earlhumdev.2019.01.005. [DOI] [PubMed] [Google Scholar]
- 202.Björklund LJ, Ingimarsson J, Curstedt T, et al. Manual ventilation with a few large breaths at birth compromises the therapeutic effect of subsequent surfactant replacement in immature lambs. Pediatr Res. 1997;42(3):348–355. doi: 10.1203/00006450-199709000-00016. [DOI] [PubMed] [Google Scholar]
- 203.Ingimarsson J, Björklund LJ, Curstedt T, et al. Incomplete protection by prophylactic surfactant against the adverse effects of large lung inflations at birth in immature lambs. Intensive Care Med. 2004;30(7):1446–1453. doi: 10.1007/s00134-004-2227-3. [DOI] [PubMed] [Google Scholar]
- 204.Muscedere JG, Mullen JB, Gan K, Slutsky AS. Tidal ventilation at low airway pressures can augment lung injury. Am J Respir Crit Care Med. 1994;149(5):1327–1334. doi: 10.1164/ajrccm.149.5.8173774. [DOI] [PubMed] [Google Scholar]
- 205.Naik AS, Kallapur SG, Bachurski CJ, et al. Effects of ventilation with different positive end-expiratory pressures on cytokine expression in the preterm lamb lung. Am J Respir Crit Care Med. 2001;164(3):494–498. doi: 10.1164/ajrccm.164.3.2010127. [DOI] [PubMed] [Google Scholar]
- 206.Polglase GR, Hillman NH, Pillow JJ, et al. Positive end-expiratory pressure and tidal volume during initial ventilation of preterm lambs. Pediatr Res. 2008;64(5):517–522. doi: 10.1203/PDR.0b013e3181841363. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 207.Probyn ME, Hooper SB, Dargaville PA, et al. Positive end expiratory pressure during resuscitation of premature lambs rapidly improves blood gases without adversely affecting arterial pressure. Pediatr Res. 2004;56(2):198–204. doi: 10.1203/01.PDR.0000132752.94155.13. [DOI] [PubMed] [Google Scholar]
- 208.te Pas AB, Siew M, Wallace MJ, et al. Establishing functional residual capacity at birth: the effect of sustained inflation and positive end-expiratory pressure in a preterm rabbit model. Pediatr Res. 2009;65(5):537–541. doi: 10.1203/PDR.0b013e31819da21b. [DOI] [PubMed] [Google Scholar]
- 209.Dawson JA, Schmolzer GM, Kamlin CO, et al. Oxygenation with T-piece versus self-inflating bag for ventilation of extremely preterm infants at birth: a randomized controlled trial. J Pediatr. 2011;158(6):912–918.e1-2. doi: 10.1016/j.jpeds.2010.12.003. [DOI] [PubMed] [Google Scholar]
- 210.Szyld E, Aguilar A, Musante GA, et al. Comparison of devices for newborn ventilation in the delivery room. J Pediatr. 2014;165(2):234–239.e3. doi: 10.1016/j.jpeds.2014.02.035. [DOI] [PubMed] [Google Scholar]
- 211.Thakur A, Saluja S, Modi M, et al. T-piece or self inflating bag for positive pressure ventilation during delivery room resuscitation: an RCT. Resuscitation. 2015;90:21–24. doi: 10.1016/j.resuscitation.2015.01.021. [DOI] [PubMed] [Google Scholar]
- 212.Guinsburg R, de Almeida MFB, de Castro JS, et al. T-piece versus self-inflating bag ventilation in preterm neonates at birth. Arch Dis Child Fetal Neonatal Ed. 2018;103(1):F49–F55. doi: 10.1136/archdischild-2016-312360. [DOI] [PubMed] [Google Scholar]
- 213.Subramaniam P, Ho JJ, Davis PG. Prophylactic nasal continuous positive airway pressure for preventing morbidity and mortality in very preterm infants. Cochrane Database Syst Rev. 2016;6:CD001243. doi: 10.1002/14651858.CD001243.pub3. [DOI] [PubMed] [Google Scholar]
- 214.Schmolzer GM, Kumar M, Pichler G, Aziz K, O’Reilly M, Cheung PY. Non-invasive versus invasive respiratory support in preterm infants at birth: systematic review and meta-analysis. BMJ. 2013;347:f5980. doi: 10.1136/bmj.f5980. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 215.Poets CF, Rüdiger M. Mask CPAP during neonatal transition: too much of a good thing for some term infants? Arch Dis Child Fetal Neonatal Ed. 2015;100(5):F378–F379. doi: 10.1136/archdischild-2015-308236. [DOI] [PubMed] [Google Scholar]
- 216.Claassen CC, Strand ML. Understanding the risks and benefits of delivery room CPAP for term infants. Pediatrics. 2019;144(3):e20191720. doi: 10.1542/peds.2019-1720. [DOI] [PubMed] [Google Scholar]
- 217.Hishikawa K, Goishi K, Fujiwara T, Kaneshige M, Ito Y, Sago H. Pulmonary air leak associated with CPAP at term birth resuscitation. Arch Dis Child Fetal Neonatal Ed. 2015;100(5):F382–F387. doi: 10.1136/archdischild-2014-307891. [DOI] [PubMed] [Google Scholar]
- 218.Clevenger L, Britton JR. Delivery room continuous positive airway pressure and early pneumothorax in term newborn infants. J Neonatal Perinatal Med. 2017;10(2):157–161. doi: 10.3233/NPM-171694. [DOI] [PubMed] [Google Scholar]
- 219.Smithhart W, Wyckoff MH, Kapadia V, et al. Delivery room continuous positive airway pressure and pneumothorax. Pediatrics. 2019;144(3):e20190756. doi: 10.1542/peds.2019-0756. [DOI] [PubMed] [Google Scholar]
- 220.Cole AF, Rolbin SH, Hew EM, Pynn S. An improved ventilator system for delivery-room management of the newborn. Anesthesiology. 1979;51(4):356–358. doi: 10.1097/00000542-197910000-00019. [DOI] [PubMed] [Google Scholar]
- 221.Allwood AC, Madar RJ, Baumer JH, Readdy L, Wright D. Changes in resuscitation practice at birth. Arch Dis Child Fetal Neonatal Ed. 2003;88(5):F375–F379. doi: 10.1136/fn.88.5.F375. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 222.Hoskyns EW, Milner AD, Hopkin IE. A simple method of face mask resuscitation at birth. Arch Dis Child. 1987;62(4):376–378. doi: 10.1136/adc.62.4.376. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 223.Oddie S, Wyllie J, Scally A. Use of self-inflating bags for neonatal resuscitation. Resuscitation. 2005;67(1):109–112. doi: 10.1016/j.resuscitation.2005.05.004. [DOI] [PubMed] [Google Scholar]
- 224.Ganga-Zandzou PS, Diependaele JF, Storme L, et al. Is Ambu ventilation of newborn infants a simple question of finger-touch? Arch Pediatr. 1996;3(12):1270–1272. doi: 10.1016/S0929-693X(97)85940-4. [DOI] [PubMed] [Google Scholar]
- 225.Kanter RK. Evaluation of mask-bag ventilation in resuscitation of infants. Am J Dis Child. 1987;141(7):761–763. doi: 10.1001/archpedi.1987.04460070063025. [DOI] [PubMed] [Google Scholar]
- 226.Bennett S, Finer NN, Rich W, Vaucher Y. A comparison of three neonatal resuscitation devices. Resuscitation. 2005;67(1):113–118. doi: 10.1016/j.resuscitation.2005.02.016. [DOI] [PubMed] [Google Scholar]
- 227.Kelm M, Proquitte H, Schmalisch G, Roehr CC. Reliability of two common PEEP-generating devices used in neonatal resuscitation. Klin Padiatr. 2009;221(7):415–418. doi: 10.1055/s-0029-1233493. [DOI] [PubMed] [Google Scholar]
- 228.Dawson JA, Gerber A, Kamlin CO, Davis PG, Morley CJ. Providing PEEP during neonatal resuscitation: Which device is best? J Paediatr Child Health. 2011;47(10):698–703. doi: 10.1111/j.1440-1754.2011.02036.x. [DOI] [PubMed] [Google Scholar]
- 229.O’Donnell CP, Davis PG, Lau R, Dargaville PA, Doyle LW, Morley CJ. Neonatal resuscitation 2: an evaluation of manual ventilation devices and face masks. Arch Dis Child Fetal Neonatal Ed. 2005;90(5):F392–F396. doi: 10.1136/adc.2004.064691. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 230.Tracy MB, Klimek J, Coughtrey H, et al. Ventilator-delivered mask ventilation compared with three standard methods of mask ventilation in a manikin model. Arch Dis Child Fetal Neonatal Ed. 2011;96(3):F201–F205. doi: 10.1136/adc.2009.169730. [DOI] [PubMed] [Google Scholar]
- 231.Klingenberg C, Dawson JA, Gerber A, Kamlin CO, Davis PG, Morley CJ. Sustained inflations: comparing three neonatal resuscitation devices. Neonatology. 2011;100(1):78–84. doi: 10.1159/000322983. [DOI] [PubMed] [Google Scholar]
- 232.Kattwinkel J, Stewart C, Walsh B, Gurka M, Paget-Brown A. Responding to compliance changes in a lung model during manual ventilation: perhaps volume, rather than pressure, should be displayed. Pediatrics. 2009;123(3):e465–e470. doi: 10.1542/peds.2008-2012. [DOI] [PubMed] [Google Scholar]
- 233.Finer NN, Rich WD. Unintentional variation in positive end expiratory pressure during resuscitation with a T-piece resuscitator. Resuscitation. 2011;82(6):717–719. doi: 10.1016/j.resuscitation.2011.02.017. [DOI] [PubMed] [Google Scholar]
- 234.te Pas AB, Schilleman K, Klein M, Witlox RS, Morley CJ, Walther FJ. Low versus high gas flow rate for respiratory support of infants at birth: a manikin study. Neonatology. 2011;99(4):266–271. doi: 10.1159/000318663. [DOI] [PubMed] [Google Scholar]
- 235.Schmolzer GM, Bhatia R, Morley CJ, Davis PG. Choice of flow meter determines pressures delivered on a T-piece neonatal resuscitator. Arch Dis Child Fetal Neonatal Ed. 2010;95(5):F383. doi: 10.1136/adc.2009.179713. [DOI] [PubMed] [Google Scholar]
- 236.Schilleman K, Schmolzer GM, Kamlin OC, Morley CJ, te Pas AB, Davis PG. Changing gas flow during neonatal resuscitation: a manikin study. Resuscitation. 2011;82(7):920–924. doi: 10.1016/j.resuscitation.2011.02.029. [DOI] [PubMed] [Google Scholar]
- 237.Hinder M, McEwan A, Drevhammer T, Donaldson S, Tracy MB. T-piece resuscitators: How do they compare? Arch Dis Child Fetal Neonatal Ed. 2019;104(2):F122–F127. doi: 10.1136/archdischild-2018-314860. [DOI] [PubMed] [Google Scholar]
- 238.Roehr CC, Kelm M, Proquitte H, Schmalisch G. Equipment and operator training denote manual ventilation performance in neonatal resuscitation. Am J Perinatol. 2010;27(9):753–758. doi: 10.1055/s-0030-1254236. [DOI] [PubMed] [Google Scholar]
- 239.Morley CJ, Dawson JA, Stewart MJ, Hussain F, Davis PG. The effect of a PEEP valve on a Laerdal neonatal self-inflating resuscitation bag. J Paediatr Child Health. 2010;46(1–2):51–56. doi: 10.1111/j.1440-1754.2009.01617.x. [DOI] [PubMed] [Google Scholar]
- 240.Hartung JC, Schmolzer G, Schmalisch G, Roehr CC. Repeated thermo-sterilisation further affects the reliability of positive end-expiratory pressure valves. J Paediatr Child Health. 2013;49(9):741–745. doi: 10.1111/jpc.12258. [DOI] [PubMed] [Google Scholar]
- 241.Hartung JC, Wilitzki S, Thio-Lluch M, te Pas AB, Schmalisch G, Roehr CC. Reliability of single-use PEEP-valves attached to self-inflating bags during manual ventilation of neonates—an in vitro study. PLoS One. 2016;11(2):e0150224. doi: 10.1371/journal.pone.0150224. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 242.Thio M, Dawson JA, Crossley KJ, et al. Delivery of positive end-expiratory pressure to preterm lambs using common resuscitation devices. Arch Dis Child Fetal Neonatal Ed. 2019;104(1):F83–F88. doi: 10.1136/archdischild-2017-314064. [DOI] [PubMed] [Google Scholar]
- 243.Tracy MB, Halliday R, Tracy SK, Hinder MK. Newborn self-inflating manual resuscitators: precision robotic testing of safety and reliability. Arch Dis Child Fetal Neonatal Ed. 2019;104(4):F403–F408. doi: 10.1136/archdischild-2018-315391. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 244.Rafferty AR, Johnson L, Davis PG, Dawson JA, Thio M, Owen LS. Neonatal mannequin comparison of the Upright self-inflating bag and snap-fit mask versus standard resuscitators and masks: leak, applied load and tidal volumes. Arch Dis Child Fetal Neonatal Ed. 2018;103(6):F562–F566. doi: 10.1136/archdischild-2017-313701. [DOI] [PubMed] [Google Scholar]
- 245.Narayanan I, Mendhi M, Bansil P, Coffey PS. Evaluation of simulated ventilation techniques with the upright and conventional self-inflating neonatal resuscitators. Respir Care. 2017;62(11):1428–1436. doi: 10.4187/respcare.05328. [DOI] [PubMed] [Google Scholar]
- 246.Gomo ØH, Eilevstjønn J, Holte K, Yeconia A, Kidanto H, Ersdal HL. Delivery of positive end-expiratory pressure using self-inflating bags during newborn resuscitation is possible despite mask leak. Neonatology. 2020;117(3):341–348. doi: 10.1159/000507829. [DOI] [PubMed] [Google Scholar]
- 247.Roehr CC, Davis PG, Weiner GM, Wyllie J, Wyckoff MH, Trevisanuto D. T-piece resuscitator or self-inflating bag during neonatal resuscitation: a scoping review. Pediatr Res. 2020 doi: 10.1038/s41390-020-1005-4. [DOI] [PubMed] [Google Scholar]
- 248.van Vonderen JJ, Kamlin CO, Dawson JA, Walther FJ, Davis PG, te Pas AB. Mask versus nasal tube for stabilization of preterm infants at birth: respiratory function measurements. J Pediatr. 2015;167(1):81–85.e1. doi: 10.1016/j.jpeds.2015.04.003. [DOI] [PubMed] [Google Scholar]
- 249.McCarthy LK, Twomey AR, Molloy EJ, Murphy JF, O’Donnell CP. A randomized trial of nasal prong or face mask for respiratory support for preterm newborns. Pediatrics. 2013;132(2):e389–e395. doi: 10.1542/peds.2013-0446. [DOI] [PubMed] [Google Scholar]
- 250.Bansal SC, Caoci S, Dempsey E, Trevisanuto D, Roehr CC. The laryngeal mask airway and its use in neonatal resuscitation: a critical review of where we are in 2017/2018. Neonatology. 2018;113(2):152–161. doi: 10.1159/000481979. [DOI] [PubMed] [Google Scholar]
- 251.Qureshi MJ, Kumar M. Laryngeal mask airway versus bag-mask ventilation or endotracheal intubation for neonatal resuscitation. Cochrane Database Syst Rev. 2018;3:CD003314. doi: 10.1002/14651858.CD003314.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 252.Leung C. Optimal insertion depth for endotracheal tubes in extremely low-birth-weight infants. Pediatr Crit Care Med. 2018;19(4):328–331. doi: 10.1097/PCC.0000000000001492. [DOI] [PubMed] [Google Scholar]
- 253.Uygur O, Öncel MY, Şimşek GK, et al. Is nasal septum-tragus length measurement appropriate for endotracheal tube intubation depth in neonates? A randomized controlled study. Am J Perinatol. 2019 doi: 10.1055/s-0039-3400982. [DOI] [PubMed] [Google Scholar]
- 254.Kempley ST, Moreiras JW, Petrone FL. Endotracheal tube length for neonatal intubation. Resuscitation. 2008;77(3):369–373. doi: 10.1016/j.resuscitation.2008.02.002. [DOI] [PubMed] [Google Scholar]
- 255.Shukla HK, Hendricks-Munoz KD, Atakent Y, Rapaport S. Rapid estimation of insertional length of endotracheal intubation in newborn infants. J Pediatr. 1997;131(4):561–564. doi: 10.1016/s0022-3476(97)70062-3. [DOI] [PubMed] [Google Scholar]
- 256.Thomas RE, Rao SC, Minutillo C, Hullett B, Bulsara MK. Cuffed endotracheal tubes in infants less than 3 kg: a retrospective cohort study. Paediatr Anaesth. 2018;28(3):204–209. doi: 10.1111/pan.13311. [DOI] [PubMed] [Google Scholar]
- 257.Fayoux P, Devisme L, Merrot O, Marciniak B. Determination of endotracheal tube size in a perinatal population: an anatomical and experimental study. Anesthesiology. 2006;104(5):954–960. doi: 10.1097/00000542-200605000-00011. [DOI] [PubMed] [Google Scholar]
- 258.Sherman JM, Nelson H. Decreased incidence of subglottic stenosis using an “appropriate-sized” endotracheal tube in neonates. Pediatr Pulmonol. 1989;6(3):183–185. doi: 10.1002/ppul.1950060311. [DOI] [PubMed] [Google Scholar]
- 259.Gill I, O’Donnell CP. Vocal cord guides on neonatal endotracheal tubes. Arch Dis Child Fetal Neonatal Ed. 2014;99(4):F344. doi: 10.1136/archdischild-2014-306028. [DOI] [PubMed] [Google Scholar]
- 260.Schmolzer GM, O’Reilly M, Davis PG, Cheung PY, Roehr CC. Confirmation of correct tracheal tube placement in newborn infants. Resuscitation. 2013;84(6):731–737. doi: 10.1016/j.resuscitation.2012.11.028. [DOI] [PubMed] [Google Scholar]
- 261.Aziz HF, Martin JB, Moore JJ. The pediatric disposable end-tidal carbon dioxide detector role in endotracheal intubation in newborns. J Perinatol. 1999;19(2):110–113. doi: 10.1038/sj.jp.7200136. [DOI] [PubMed] [Google Scholar]
- 262.Repetto JE, Donohue PK, Baker SF, Kelly L, Nogee LM. Use of capnography in the delivery room for assessment of endotracheal tube placement. J Perinatol. 2001;21(5):284–287. doi: 10.1038/sj.jp.7210534. [DOI] [PubMed] [Google Scholar]
- 263.Hosono S, Inami I, Fujita H, Minato M, Takahashi S, Mugishima H. A role of end-tidal CO2 monitoring for assessment of tracheal intubations in very low birth weight infants during neonatal resuscitation at birth. J Perinat Med. 2009;37(1):79–84. doi: 10.1515/JPM.2009.017. [DOI] [PubMed] [Google Scholar]
- 264.Garey DM, Ward R, Rich W, Heldt G, Leone T, Finer NN. Tidal volume threshold for colorimetric carbon dioxide detectors available for use in neonates. Pediatrics. 2008;121(6):e1524–e1527. doi: 10.1542/peds.2007-2708. [DOI] [PubMed] [Google Scholar]
- 265.Sandroni C, De Santis P, D’Arrigo S. Capnography during cardiac arrest. Resuscitation. 2018;132:73–77. doi: 10.1016/j.resuscitation.2018.08.018. [DOI] [PubMed] [Google Scholar]
- 266.Hawkes GA, Finn D, Kenosi M, et al. A randomized controlled trial of end-tidal carbon dioxide detection of preterm infants in the delivery room. J Pediatr. 2017;182:74–78.e2. doi: 10.1016/j.jpeds.2016.11.006. [DOI] [PubMed] [Google Scholar]
- 267.Scrivens A, Zivanovic S, Roehr CC. Is waveform capnography reliable in neonates? Arch Dis Child. 2019;104(7):711–715. doi: 10.1136/archdischild-2018-316577. [DOI] [PubMed] [Google Scholar]
- 268.Mactier H, Jackson A, Davis J, et al. Paediatric intensive care and neonatal intensive care airway management in the United Kingdom: the PIC-NIC survey. Anaesthesia. 2019;74(1):116–117. doi: 10.1111/anae.14526. [DOI] [PubMed] [Google Scholar]
- 269.van Os S, Cheung PY, Kushniruk K, O’Reilly M, Aziz K, Schmolzer GM. Assessment of endotracheal tube placement in newborn infants: a randomized controlled trial. J Perinatol. 2016;36(5):370–375. doi: 10.1038/jp.2015.208. [DOI] [PubMed] [Google Scholar]
- 270.Schmolzer GM, Morley CJ, Wong C, et al. Respiratory function monitor guidance of mask ventilation in the delivery room: a feasibility study. J Pediatr. 2012;160(3):377–381.e2. doi: 10.1016/j.jpeds.2011.09.017. [DOI] [PubMed] [Google Scholar]
- 271.Leone TA, Lange A, Rich W, Finer NN. Disposable colorimetric carbon dioxide detector use as an indicator of a patent airway during noninvasive mask ventilation. Pediatrics. 2006;118(1):e202–e204. doi: 10.1542/peds.2005-2493. [DOI] [PubMed] [Google Scholar]
- 272.Kong JY, Rich W, Finer NN, Leone TA. Quantitative end-tidal carbon dioxide monitoring in the delivery room: a randomized controlled trial. J Pediatr. 2013;163(1):104–108.e1. doi: 10.1016/j.jpeds.2012.12.016. [DOI] [PubMed] [Google Scholar]
- 273.Lingappan K, Arnold JL, Fernandes CJ, Pammi M. Videolaryngoscopy versus direct laryngoscopy for tracheal intubation in neonates. Cochrane Database Syst Rev. 2018;6:CD009975. doi: 10.1002/14651858.CD009975.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 274.Oei JL, Kapadia V. Oxygen for respiratory support of moderate and late preterm and term infants at birth: Is air best? Semin Fetal Neonatal Med. 2020;25(2):101074. doi: 10.1016/j.siny.2019.101074. [DOI] [PubMed] [Google Scholar]
- 275.Davis PG, Tan A, O’Donnell CP, Schulze A. Resuscitation of newborn infants with 100 % oxygen or air: a systematic review and meta-analysis. Lancet. 2004;364(9442):1329–1333. doi: 10.1016/S0140-6736(04)17189-4. [DOI] [PubMed] [Google Scholar]
- 276.Wyllie J, Perlman JM, Kattwinkel J, et al. Part 11: neonatal resuscitation: 2010 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations. Resuscitation. 2010;81(Suppl 1):e260–e287. doi: 10.1016/j.resuscitation.2010.08.029. [DOI] [PubMed] [Google Scholar]
- 277.Vento M, Moro M, Escrig R, et al. Preterm resuscitation with low oxygen causes less oxidative stress, inflammation, and chronic lung disease. Pediatrics. 2009;124(3):e439–e449. doi: 10.1542/peds.2009-0434. [DOI] [PubMed] [Google Scholar]
- 278.Mariani G, Dik PB, Ezquer A, et al. Pre-ductal and post-ductal O2 saturation in healthy term neonates after birth. J Pediatr. 2007;150(4):418–421. doi: 10.1016/j.jpeds.2006.12.015. [DOI] [PubMed] [Google Scholar]
- 279.Welsford M, Nishiyama C, Shortt C, et al. Initial oxygen use for preterm newborn resuscitation: a systematic review with meta-analysis. Pediatrics. 2019;143(1):e20181828. doi: 10.1542/peds.2018-1828. [DOI] [PubMed] [Google Scholar]
- 280.Dekker J, Hooper SB, Croughan MK, et al. Increasing respiratory effort with 100 % oxygen during resuscitation of preterm rabbits at birth. Front Pediatr. 2019;7:427. doi: 10.3389/fped.2019.00427. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 281.Dekker J, Martherus T, Lopriore E, et al. The effect of initial high vs. low FiO2 on breathing effort in preterm infants at birth: a randomized controlled trial. Front Pediatr. 2019;7:504. doi: 10.3389/fped.2019.00504. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 282.Sweet DG, Carnielli V, Greisen G, et al. European consensus guidelines on the management of respiratory distress syndrome—2019 update. Neonatology. 2019;115(4):432–450. doi: 10.1159/000499361. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 283.Wyckoff MH, Aziz K, Escobedo MB, et al. Part 13: neonatal resuscitation: 2015 American Heart Association guidelines update for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation. 2015;132(18 Suppl 2):S543–S560. doi: 10.1161/CIR.0000000000000267. [DOI] [PubMed] [Google Scholar]
- 284.Oei JL, Finer NN, Saugstad OD, et al. Outcomes of oxygen saturation targeting during delivery room stabilisation of preterm infants. Arch Dis Child Fetal Neonatal Ed. 2018;103(5):F446–F454. doi: 10.1136/archdischild-2016-312366. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 285.Goos TG, Rook D, van der Eijk AC, et al. Observing the resuscitation of very preterm infants: Are we able to follow the oxygen saturation targets? Resuscitation. 2013;84(8):1108–1113. doi: 10.1016/j.resuscitation.2013.01.025. [DOI] [PubMed] [Google Scholar]
- 286.White LN, Thio M, Owen LS, et al. Achievement of saturation targets in preterm infants < 32 weeks’ gestational age in the delivery room. Arch Dis Child Fetal Neonatal Ed. 2017;102(5):F423–F427. doi: 10.1136/archdischild-2015-310311. [DOI] [PubMed] [Google Scholar]
- 287.Kapadia V, Oei JL. Optimizing oxygen therapy for preterm infants at birth: Are we there yet? Semin Fetal Neonatal Med. 2020;25(2):101081. doi: 10.1016/j.siny.2020.101081. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 288.Dekker J, Stenning FJ, Willms L, Martherus T, Hooper SB, te Pas AB. Time to achieve desired fraction of inspired oxygen using a T-piece ventilator during resuscitation of preterm infants at birth. Resuscitation. 2019;136:100–104. doi: 10.1016/j.resuscitation.2019.01.024. [DOI] [PubMed] [Google Scholar]
- 289.Huynh T, Hemway RJ, Perlman JM. Assessment of effective face mask ventilation is compromised during synchronised chest compressions. Arch Dis Child Fetal Neonatal Ed. 2015;100(1):F39–F42. doi: 10.1136/archdischild-2014-306309. [DOI] [PubMed] [Google Scholar]
- 290.Millin MG, Bogumil D, Fishe JN, Burke RV. Comparing the two-finger versus two-thumb technique for single person infant CPR: a systematic review and meta-analysis. Resuscitation. 2020;148:161–172. doi: 10.1016/j.resuscitation.2019.12.039. [DOI] [PubMed] [Google Scholar]
- 291.Houri PK, Frank LR, Menegazzi JJ, Taylor R. A randomized, controlled trial of two-thumb vs two-finger chest compression in a swine infant model of cardiac arrest. Prehosp Emerg Care. 1997;1(2):65–67. doi: 10.1080/10903129708958789. [DOI] [PubMed] [Google Scholar]
- 292.David R. Closed chest cardiac massage in the newborn infant. Pediatrics. 1988;81(4):552–554. doi: 10.1542/peds.81.4.552. [DOI] [PubMed] [Google Scholar]
- 293.Menegazzi JJ, Auble TE, Nicklas KA, Hosack GM, Rack L, Goode JS. Two-thumb versus two-finger chest compression during CRP in a swine infant model of cardiac arrest. Ann Emerg Med. 1993;22(2):240–243. doi: 10.1016/S0196-0644(05)80212-4. [DOI] [PubMed] [Google Scholar]
- 294.Whitelaw CC, Slywka B, Goldsmith LJ. Comparison of a two-finger versus two-thumb method for chest compressions by healthcare providers in an infant mechanical model. Resuscitation. 2000;43(3):213–216. doi: 10.1016/S0300-9572(99)00145-8. [DOI] [PubMed] [Google Scholar]
- 295.Udassi S, Udassi JP, Lamb MA, et al. Two-thumb technique is superior to two-finger technique during lone rescuer infant manikin CPR. Resuscitation. 2010;81(6):712–717. doi: 10.1016/j.resuscitation.2009.12.029. [DOI] [PubMed] [Google Scholar]
- 296.Lim JS, Cho Y, Ryu S, et al. Comparison of overlapping (OP) and adjacent thumb positions (AP) for cardiac compressions using the encircling method in infants. Emerg Med Clin North Am. 2013;30(2):139–142. doi: 10.1136/emermed-2011-200978. [DOI] [PubMed] [Google Scholar]
- 297.Christman C, Hemway RJ, Wyckoff MH, Perlman JM. The two-thumb is superior to the two-finger method for administering chest compressions in a manikin model of neonatal resuscitation. Arch Dis Child Fetal Neonatal Ed. 2011;96(2):F99–F101. doi: 10.1136/adc.2009.180406. [DOI] [PubMed] [Google Scholar]
- 298.Phillips GW, Zideman DA. Relation of infant heart to sternum: its significance in cardiopulmonary resuscitation. Lancet. 1986;1(8488):1024–1025. doi: 10.1016/S0140-6736(86)91284-5. [DOI] [PubMed] [Google Scholar]
- 299.Saini SS, Gupta N, Kumar P, Bhalla AK, Kaur H. A comparison of two-fingers technique and two-thumbs encircling hands technique of chest compression in neonates. J Perinatol. 2012;32(9):690–694. doi: 10.1038/jp.2011.167. [DOI] [PubMed] [Google Scholar]
- 300.You Y. Optimum location for chest compressions during two-rescuer infant cardiopulmonary resuscitation. Resuscitation. 2009;80(12):1378–1381. doi: 10.1016/j.resuscitation.2009.08.013. [DOI] [PubMed] [Google Scholar]
- 301.Meyer A, Nadkarni V, Pollock A, et al. Evaluation of the Neonatal Resuscitation Program’s recommended chest compression depth using computerized tomography imaging. Resuscitation. 2010;81(5):544–548. doi: 10.1016/j.resuscitation.2010.01.032. [DOI] [PubMed] [Google Scholar]
- 302.Cheung PY, Huang H, Xu C, et al. Comparing the quality of cardiopulmonary resuscitation performed at the over-the-head position and lateral position of neonatal manikin. Front Pediatr. 2019;7:559. doi: 10.3389/fped.2019.00559. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 303.Douvanas A, Koulouglioti C, Kalafati M. A comparison between the two methods of chest compression in infant and neonatal resuscitation. A review according to 2010 CPR guidelines. J Matern Fetal Neonatal Med. 2018;31(6):805–816. doi: 10.1080/14767058.2017.1295953. [DOI] [PubMed] [Google Scholar]
- 304.Rodriguez-Ruiz E, Martinez-Puga A, Carballo-Fazanes A, Abelairas‐Gómez C, Rodríguez‐Nuñez A. Two new chest compression methods might challenge the standard in a simulated infant model. Eur J Pediatr. 2019;178(10):1529–1535. doi: 10.1007/s00431-019-03452-2. [DOI] [PubMed] [Google Scholar]
- 305.Berkowitz ID, Chantarojanasiri T, Koehler RC, et al. Blood flow during cardiopulmonary resuscitation with simultaneous compression and ventilation in infant pigs. Pediatr Res. 1989;26(6):558–564. doi: 10.1203/00006450-198912000-00006. [DOI] [PubMed] [Google Scholar]
- 306.Dean JM, Koehler RC, Schleien CL, et al. Improved blood flow during prolonged cardiopulmonary resuscitation with 30 % duty cycle in infant pigs. Circulation. 1991;84(2):896–904. doi: 10.1161/01.CIR.84.2.896. [DOI] [PubMed] [Google Scholar]
- 307.Linner R, Werner O, Perez-de-Sa V, Cunha-Goncalves D. Circulatory recovery is as fast with air ventilation as with 100 % oxygen after asphyxia-induced cardiac arrest in piglets. Pediatr Res. 2009;66(4):391–394. doi: 10.1203/PDR.0b013e3181b3b110. [DOI] [PubMed] [Google Scholar]
- 308.Lipinski CA, Hicks SD, Callaway CW. Normoxic ventilation during resuscitation and outcome from asphyxial cardiac arrest in rats. Resuscitation. 1999;42(3):221–229. doi: 10.1016/S0300-9572(99)00083-0. [DOI] [PubMed] [Google Scholar]
- 309.Perez-de-Sa V, Cunha-Goncalves D, Nordh A, et al. High brain tissue oxygen tension during ventilation with 100 % oxygen after fetal asphyxia in newborn sheep. Pediatr Res. 2009;65(1):57–61. doi: 10.1203/PDR.0b013e31818a01a4. [DOI] [PubMed] [Google Scholar]
- 310.Solevag AL, Dannevig I, Nakstad B, Saugstad OD. Resuscitation of severely asphyctic newborn pigs with cardiac arrest by using 21 % or 100 % oxygen. Neonatology. 2010;98(1):64–72. doi: 10.1159/000275560. [DOI] [PubMed] [Google Scholar]
- 311.Temesvari P, Karg E, Bodi I, et al. Impaired early neurologic outcome in newborn piglets reoxygenated with 100 % oxygen compared with room air after pneumothorax-induced asphyxia. Pediatr Res. 2001;49(6):812–819. doi: 10.1203/00006450-200106000-00017. [DOI] [PubMed] [Google Scholar]
- 312.Walson KH, Tang M, Glumac A, et al. Normoxic versus hyperoxic resuscitation in pediatric asphyxial cardiac arrest: effects on oxidative stress. Crit Care Med. 2011;39(2):335–343. doi: 10.1097/CCM.0b013e3181ffda0e. [DOI] [PubMed] [Google Scholar]
- 313.Yeh ST, Cawley RJ, Aune SE, Angelos MG. Oxygen requirement during cardiopulmonary resuscitation (CPR) to effect return of spontaneous circulation. Resuscitation. 2009;80(8):951–955. doi: 10.1016/j.resuscitation.2009.05.001. [DOI] [PubMed] [Google Scholar]
- 314.Berg RA, Henry C, Otto CW, et al. Initial end-tidal CO2 is markedly elevated during cardiopulmonary resuscitation after asphyxial cardiac arrest. Pediatr Emerg Care. 1996;12(4):245–248. doi: 10.1097/00006565-199608000-00002. [DOI] [PubMed] [Google Scholar]
- 315.Bhende MS, Thompson AE. Evaluation of an end-tidal CO2 detector during pediatric cardiopulmonary resuscitation. Pediatrics. 1995;95(3):395–399. doi: 10.1542/peds.95.3.395. [DOI] [PubMed] [Google Scholar]
- 316.Bhende MS, Karasic DG, Karasic RB. End-tidal carbon dioxide changes during cardiopulmonary resuscitation after experimental asphyxial cardiac arrest. Am J Emerg Med. 1996;14(4):349–350. doi: 10.1016/S0735-6757(96)90046-7. [DOI] [PubMed] [Google Scholar]
- 317.Chalak LF, Barber CA, Hynan L, Garcia D, Christie L, Wyckoff MH. End-tidal CO2 detection of an audible heart rate during neonatal cardiopulmonary resuscitation after asystole in asphyxiated piglets. Pediatr Res. 2011;69(5 Pt 1):401–405. doi: 10.1203/PDR.0b013e3182125f7f. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 318.Baik-Schneditz N, Pichler G, Schwaberger B, Mileder L, Avian A, Urlesberger B. Peripheral intravenous access in preterm neonates during postnatal stabilization: feasibility and safety. Front Pediatr. 2017;5:171. doi: 10.3389/fped.2017.00171. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 319.Scrivens A, Reynolds PR, Emery FE, et al. Use of intraosseous needles in neonates: a systematic review. Neonatology. 2019;116(4):305–314. doi: 10.1159/000502212. [DOI] [PubMed] [Google Scholar]
- 320.Wagner M, Olischar M, O’Reilly M, et al. Review of routes to administer medication during prolonged neonatal resuscitation. Pediatr Crit Care Med. 2018;19(4):332–338. doi: 10.1097/PCC.0000000000001493. [DOI] [PubMed] [Google Scholar]
- 321.Schwindt EM, Hoffmann F, Deindl P, Waldhoer TJ, Schwindt JC. Duration to establish an emergency vascular access and how to accelerate it: a simulation-based study performed in real-life neonatal resuscitation rooms. Pediatr Crit Care Med. 2018;19(5):468–476. doi: 10.1097/PCC.0000000000001508. [DOI] [PubMed] [Google Scholar]
- 322.Antonucci R, Antonucci L, Locci C, Porcella A, Cuzzolin L. Current challenges in neonatal resuscitation: What is the role of adrenaline? Paediatr Drugs. 2018;20(5):417–428. doi: 10.1007/s40272-018-0300-6. [DOI] [PubMed] [Google Scholar]
- 323.Isayama T, Mildenhall L, Schmölzer GM, et al. The route, dose, and interval of epinephrine for neonatal resuscitation: a systematic review. Pediatrics. 2020;146(4):e20200586. doi: 10.1542/peds.2020-0586. [DOI] [PubMed] [Google Scholar]
- 324.Matterberger C, Baik-Schneditz N, Schwaberger B, et al. Blood glucose and cerebral tissue oxygenation immediately after birth—an observational study. J Pediatr. 2018;200:19–23. doi: 10.1016/j.jpeds.2018.05.008. [DOI] [PubMed] [Google Scholar]
- 325.Basu SK, Ottolini K, Govindan V, et al. Early glycemic profile is associated with brain injury patterns on magnetic resonance imaging in hypoxic ischemic encephalopathy. J Pediatr. 2018;203:137–143. doi: 10.1016/j.jpeds.2018.07.041. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 326.Finn D, Roehr CC, Ryan CA, Dempsey EM. Optimising intravenous volume resuscitation of the newborn in the delivery room: practical considerations and gaps in knowledge. Neonatology. 2017;112(2):163–171. doi: 10.1159/000475456. [DOI] [PubMed] [Google Scholar]
- 327.Katheria AC, Brown MK, Hassan K, et al. Hemodynamic effects of sodium bicarbonate administration. J Perinatol. 2017;37(5):518–520. doi: 10.1038/jp.2016.258. [DOI] [PubMed] [Google Scholar]
- 328.Moe-Byrne T, Brown JVE, McGuire W. Naloxone for opioid-exposed newborn infants. Cochrane Database Syst Rev. 2018;10:CD003483. doi: 10.1002/14651858.CD003483.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 329.Guinsburg R, Wyckoff MH. Naloxone during neonatal resuscitation: acknowledging the unknown. Clin Perinatol. 2006;33(1):121–132. doi: 10.1016/j.clp.2005.11.017. [DOI] [PubMed] [Google Scholar]
- 330.Moreland TA, Brice JE, Walker CH, Parija AC. Naloxone pharmacokinetics in the newborn. Br J Clin Pharmacol. 1980;9(6):609–612. doi: 10.1111/j.1365-2125.1980.tb01088.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 331.van Vonderen JJ, Siew ML, Hooper SB, de Boer MA, Walther FJ, te Pas AB. Effects of naloxone on the breathing pattern of a newborn exposed to maternal opiates. Acta Paediatr. 2012;101(7):e309–e312. doi: 10.1111/j.1651-2227.2012.02649.x. [DOI] [PubMed] [Google Scholar]
- 332.Azzopardi D, Strohm B, Linsell L, et al. Implementation and conduct of therapeutic hypothermia for perinatal asphyxial encephalopathy in the UK—analysis of national data. PLoS One. 2012;7(6):e38504. doi: 10.1371/journal.pone.0038504. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 333.Vannucci RC, Vannucci SJ. Cerebral carbohydrate metabolism during hypoglycemia and anoxia in newborn rats. Ann Neurol. 1978;4(1):73–79. doi: 10.1002/ana.410040114. [DOI] [PubMed] [Google Scholar]
- 334.Vannucci RC, Nardis EE, Vannucci SJ. Cerebral metabolism during hypoglycemia dn asphyxia in newborn dogs. Biol Neonate. 1980;38(5–6):276–286. doi: 10.1159/000241377. [DOI] [PubMed] [Google Scholar]
- 335.Park WS, Chang YS, Lee M. Effects of hyperglycemia or hypoglycemia on brain cell membrane function and energy metabolism during the immediate reoxygenation-reperfusion period after acute transient global hypoxia-ischemia in the newborn piglet. Brain Res. 2001;901(1–2):102–108. doi: 10.1016/S0006-8993(01)02295-8. [DOI] [PubMed] [Google Scholar]
- 336.Pinchefsky EF, Hahn CD, Kamino D, et al. Hyperglycemia and glucose variability are associated with worse brain function and seizures in neonatal encephalopathy: a prospective cohort study. J Pediatr. 2019;209:23–32. doi: 10.1016/j.jpeds.2019.02.027. [DOI] [PubMed] [Google Scholar]
- 337.Basu SK, Kaiser JR, Guffey D, et al. Hypoglycaemia and hyperglycaemia are associated with unfavourable outcome in infants with hypoxic ischaemic encephalopathy: a post hoc analysis of the CoolCap Study. Arch Dis Child Fetal Neonatal Ed. 2016;101(2):F149–F155. doi: 10.1136/archdischild-2015-308733. [DOI] [PubMed] [Google Scholar]
- 338.Salhab WA, Wyckoff MH, Laptook AR, Perlman JM. Initial hypoglycemia and neonatal brain injury in term infants with severe fetal acidemia. Pediatrics. 2004;114(2):361–366. doi: 10.1542/peds.114.2.361. [DOI] [PubMed] [Google Scholar]
- 339.Nadeem M, Murray DM, Boylan GB, Dempsey EM, Ryan CA. Early blood glucose profile and neurodevelopmental outcome at two years in neonatal hypoxic-ischaemic encephalopathy. BMC Pediatr. 2011;11:10. doi: 10.1186/1471-2431-11-10. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 340.Perlman JM, Wyllie J, Kattwinkel J, et al. Neonatal resuscitation: 2010 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations. Pediatrics. 2010;126(5):e1319–e1344. doi: 10.1542/peds.2010-2972B. [DOI] [PubMed] [Google Scholar]
- 341.Rech Morassutti F, Cavallin F, Zaramella P, Bortolus R, Parotto M, Trevisanuto D. Association of rewarming rate on neonatal outcomes in extremely low birth weight infants with hypothermia. J Pediatr. 2015;167(3):557–561.e1–2. doi: 10.1016/j.jpeds.2015.06.008. [DOI] [PubMed] [Google Scholar]
- 342.Feldman A, De Benedictis B, Alpan G, La Gamma EF, Kase J. Morbidity and mortality associated with rewarming hypothermic very low birth weight infants. J Neonatal Perinatal Med. 2016;9(3):295–302. doi: 10.3233/NPM-16915143. [DOI] [PubMed] [Google Scholar]
- 343.Perlman JM, Wyllie J, Kattwinkel J, et al. Part 11: neonatal resuscitation: 2010 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations. Circulation. 2010;122(16 Suppl 2):S516–S338. doi: 10.1161/CIRCULATIONAHA.110.971127. [DOI] [PubMed] [Google Scholar]
- 344.Jacobs SE, Berg M, Hunt R, Tarnow-Mordi WO, Inder TE, Davis PG. Cooling for newborns with hypoxic ischaemic encephalopathy. Cochrane Database Syst Rev. 2013;1:CD003311. doi: 10.1002/14651858.CD003311.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 345.Shankaran S, Laptook AR, Pappas A, et al. Effect of depth and duration of cooling on deaths in the NICU among neonates with hypoxic ischemic encephalopathy: a randomized clinical trial. JAMA. 2014;312(24):2629–2639. doi: 10.1001/jama.2014.16058. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 346.Laptook AR, Shankaran S, Tyson JE, et al. Effect of therapeutic hypothermia initiated after 6 hours of age on death or disability among newborns with hypoxic-ischemic encephalopathy: a randomized clinical trial. JAMA. 2017;318(16):1550–1560. doi: 10.1001/jama.2017.14972. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 347.Kariholu U, Montaldo P, Markati T, et al. Therapeutic hypothermia for mild neonatal encephalopathy: a systematic review and meta-analysis. Arch Dis Child Fetal Neonatal Ed. 2020;105(2):225–228. doi: 10.1136/archdischild-2018-315711. [DOI] [PubMed] [Google Scholar]
- 348.O’Donnell CP, Kamlin CO, Davis PG, Carlin JB, Morley CJ. Interobserver variability of the 5-minute Apgar score. J Pediatr. 2006;149(4):486–489. doi: 10.1016/j.jpeds.2006.05.040. [DOI] [PubMed] [Google Scholar]
- 349.Rudiger M, Braun N, Aranda J, et al. Neonatal assessment in the delivery room—Trial to Evaluate a Specified Type of Apgar (TEST-Apgar) BMC Pediatr. 2015;15:18. doi: 10.1186/s12887-015-0334-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 350.Dalili H, Nili F, Sheikh M, Hardani AK, Shariat M, Nayeri F. Comparison of the four proposed Apgar scoring systems in the assessment of birth asphyxia and adverse early neurologic outcomes. PLoS One. 2015;10(3):e0122116. doi: 10.1371/journal.pone.0122116. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 351.Bossaert LL, Perkins GD, Askitopoulou H, et al. European resuscitation council guidelines for resuscitation 2015: section 11. The ethics of resuscitation and end-of-life decisions. Resuscitation. 2015;95:302–311. doi: 10.1016/j.resuscitation.2015.07.033. [DOI] [PubMed] [Google Scholar]
- 352.Nuffield Council on Bioethics (2006) Critical care decisions in fetal and neonatal medicine: ethical issues. https://www.nuffieldbioethics.org/publications/neonatal-medicine-and-care
- 353.Harrington DJ, Redman CW, Moulden M, Greenwood CE. The long-term outcome in surviving infants with Apgar zero at 10 minutes: a systematic review of the literature and hospital-based cohort. Am J Obstet Gynecol. 2007;196(5):463.e1–463.e5. doi: 10.1016/j.ajog.2006.10.877. [DOI] [PubMed] [Google Scholar]
- 354.Ely DM, Driscoll AK. Infant mortality in the United States, 2018: data from the period linked birth/infant death file. Natl Vital Stat Rep. 2020;69(7):1–18. [PubMed] [Google Scholar]
- 355.Numerato D, Fattore G, Tediosi F, et al. Mortality and length of stay of very low birth weight and very preterm infants: a EuroHOPE study. PLoS One. 2015;10(6):e0131685. doi: 10.1371/journal.pone.0131685. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 356.Lee SK, Penner PL, Cox M. Comparison of the attitudes of health care professionals and parents toward active treatment of very low birth weight infants. Pediatrics. 1991;88(1):110–114. doi: 10.1542/peds.88.1.110. [DOI] [PubMed] [Google Scholar]
- 357.Gillam L, Sullivan J. Ethics at the end of life: Who should make decisions about treatment limitation for young children with life-threatening or life-limiting conditions? J Paediatr Child Health. 2011;47(9):594–598. doi: 10.1111/j.1440-1754.2011.02177.x. [DOI] [PubMed] [Google Scholar]
- 358.Rysavy MA, Li L, Bell EF, et al. Between-hospital variation in treatment and outcomes in extremely preterm infants. N Engl J Med. 2015;372(19):1801–1811. doi: 10.1056/NEJMoa1410689. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 359.Mentzelopoulos SD, Couper K, Van de Voorde P, et al. European Resuscitation Council guidelines 2021: ethics of resuscitation and end of life decisions. Resuscitation. 2021;161:408–432. doi: 10.1016/j.resuscitation.2021.02.017. [DOI] [PubMed] [Google Scholar]
- 360.Fulbrook P, Latour J, Albarran J, et al. The presence of family members during cardiopulmonary resuscitation: European Federation of Critical Care Nursing Associations, European Society of Paediatric and Neonatal Intensive Care and European Society of Cardiology Council on Cardiovascular Nursing and Allied Professions joint position statement. Eur J Cardiovasc Nurs. 2007;6(4):255–258. doi: 10.1016/j.ejcnurse.2007.07.003. [DOI] [PubMed] [Google Scholar]
- 361.Dainty KN, Atkins DL, Breckwoldt J, et al. Family presence during resuscitation in paediatric cardiac arrest: a systematic review. Resuscitation. 2021;162:20–34. doi: 10.1016/j.resuscitation.2021.01.017. [DOI] [PubMed] [Google Scholar]
- 362.Sawyer A, Ayers S, Bertullies S, et al. Providing immediate neonatal care and resuscitation at birth beside the mother: parents’ views, a qualitative study. BMJ Open. 2015;5(9):e008495. doi: 10.1136/bmjopen-2015-008495. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 363.Yoxall CW, Ayers S, Sawyer A, et al. Providing immediate neonatal care and resuscitation at birth beside the mother: clinicians’ views, a qualitative study. BMJ Open. 2015;5(9):e008494. doi: 10.1136/bmjopen-2015-008494. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 364.Zehnder E, Law BHY, Schmolzer GM. Does parental presence affect workload during neonatal resuscitation? Arch Dis Child Fetal Neonatal Ed. 2020;105(5):559–561. doi: 10.1136/archdischild-2020-318840. [DOI] [PubMed] [Google Scholar]
- 365.Harvey ME, Pattison HM. Being there: a qualitative interview study with fathers present during the resuscitation of their baby at delivery. Arch Dis Child Fetal Neonatal Ed. 2012;97(6):F439–F443. doi: 10.1136/archdischild-2011-301482. [DOI] [PubMed] [Google Scholar]
- 366.Harvey ME, Pattison HM. The impact of a father’s presence during newborn resuscitation: a qualitative interview study with healthcare professionals. BMJ Open. 2013;3(3):e002547. doi: 10.1136/bmjopen-2013-002547. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 367.Shah P, Anvekar A, McMichael J, Rao S. Outcomes of infants with Apgar score of zero at 10 min: the West Australian experience. Arch Dis Child Fetal Neonatal Ed. 2015;100(6):F492–F494. doi: 10.1136/archdischild-2014-307825. [DOI] [PubMed] [Google Scholar]
- 368.Zhang Y, Zhu J, Liu Z, et al. Intravenous versus intraosseous adrenaline administration in out-of-hospital cardiac arrest: a retrospective cohort study. Resuscitation. 2020;149:209–216. doi: 10.1016/j.resuscitation.2020.01.009. [DOI] [PubMed] [Google Scholar]
- 369.Zhong YJ, Claveau M, Yoon EW, et al. Neonates with a 10-min Apgar score of zero: outcomes by gestational age. Resuscitation. 2019;143:77–84. doi: 10.1016/j.resuscitation.2019.07.036. [DOI] [PubMed] [Google Scholar]
- 370.Torke AM, Bledsoe P, Wocial LD, Bosslet GT, Helft PR. CEASE: a guide for clinicians on how to stop resuscitation efforts. Ann Am Thorac Soc. 2015;12(3):440–445. doi: 10.1513/AnnalsATS.201412-552PS. [DOI] [PubMed] [Google Scholar]
- 371.Foglia EE, Weiner G, de Almeida MFB, et al. Duration of resuscitation at birth, mortality, and neurodevelopment: a systematic review. Pediatrics. 2020;146(3):e20201449. doi: 10.1542/peds.2020-1449. [DOI] [PubMed] [Google Scholar]
- 372.Haines M, Wright IM, Bajuk B, et al. Population-based study shows that resuscitating apparently stillborn extremely preterm babies is associated with poor outcomes. Acta Paediatr. 2016;105(11):1305–1311. doi: 10.1111/apa.13503. [DOI] [PubMed] [Google Scholar]
- 373.Wilkinson D, Savulescu J. A costly separation between withdrawing and withholding treatment in intensive care. Bioethics. 2014;28(3):127–137. doi: 10.1111/j.1467-8519.2012.01981.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
Weiterführende Literatur
- 374.Bottoms SF, Paul RH, Mercer BM, et al. Obstetric determinants of neonatal survival: antenatal predictors of neonatal survival and morbidity in extremely low birth weight infants. Am J Obstet Gynecol. 1999;180(3 Pt 1):665–669. doi: 10.1016/S0002-9378(99)70270-X. [DOI] [PubMed] [Google Scholar]
- 375.Brumbaugh JE, Hansen NI, Bell EF, et al. Outcomes of extremely preterm infants with birth weight less than 400 g. JAMA Pediatr. 2019;173(5):434–445. doi: 10.1001/jamapediatrics.2019.0180. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 376.Costeloe KL, Hennessy EM, Haider S, Stacey F, Marlow N, Draper ES. Short term outcomes after extreme preterm birth in England: comparison of two birth cohorts in 1995 and 2006 (the EPICure studies) BMJ. 2012;345:e7976. doi: 10.1136/bmj.e7976. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 377.Mactier H, Bates SE, Johnston T, et al. Perinatal management of extreme preterm birth before 27 weeks of gestation: a framework for practice. Arch Dis Child Fetal Neonatal Ed. 2020;105(3):232–239. doi: 10.1136/archdischild-2019-318402. [DOI] [PubMed] [Google Scholar]
- 378.Manktelow BN, Seaton SE, Field DJ, Draper ES. Population-based estimates of in-unit survival for very preterm infants. Pediatrics. 2013;131(2):e425–e432. doi: 10.1542/peds.2012-2189. [DOI] [PubMed] [Google Scholar]
- 379.Marlow N, Bennett C, Draper ES, Hennessy EM, Morgan AS, Costeloe KL. Perinatal outcomes for extremely preterm babies in relation to place of birth in England: the EPICure 2 study. Arch Dis Child Fetal Neonatal Ed. 2014;99(3):F181–F188. doi: 10.1136/archdischild-2013-305555. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 380.Medlock S, Ravelli AC, Tamminga P, Mol BW, Abu-Hanna A. Prediction of mortality in very premature infants: a systematic review of prediction models. PLoS One. 2011;6(9):e23441. doi: 10.1371/journal.pone.0023441. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 381.Swamy R, Mohapatra S, Bythell M, Embleton ND. Survival in infants live born at less than 24 weeks’ gestation: the hidden morbidity of non-survivors. Arch Dis Child Fetal Neonatal Ed. 2010;95(4):F293–F294. doi: 10.1136/adc.2009.171629. [DOI] [PubMed] [Google Scholar]
- 382.Tyson JE, Parikh NA, Langer J, Green C, Higgins RD. Intensive care for extreme prematurity—moving beyond gestational age. N Engl J Med. 2008;358(16):1672–1681. doi: 10.1056/NEJMoa073059. [DOI] [PMC free article] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.