Abstract
炎性衰老是机体在衰老的过程中出现慢性、系统性、可控的促炎性反应状态,这种低度慢性炎症与许多衰老相关疾病联系紧密。近年来,炎性衰老在炎症中的作用机制成为治疗和预防炎症性疾病的新方向。本文就炎性衰老及其在牙周炎中的作用进行综述,为研究牙周炎发生发展的机制和治疗方法提供新的思路。
Keywords: 牙周炎, 炎性衰老, 炎性小体, 衰老相关疾病
Abstract
Inflammaging is the chronic, systematic, and controllable upregulation of a pro-inflammation state with advancing age. Chronic low-grade inflammation accompanied by sustained stimuli is correlated with various age-related diseases (ARDs). Recent studies on ARDs have prompted further research interest in the inner mechanisms underlying inflammaging to establish prevention and treatment plans for inflammatory diseases. In this article, we discuss inflammaging and its significant role in periodontitis.
Keywords: periodontitis, inflammaging, inflammasome, age-related diseases
牙周炎是一类常见的慢性口腔炎症疾病,我国人群患病率高达90%,其中10%~15%成年人罹患重度牙周炎[1]。牙周组织的健康状态不仅与口腔健康相关,更是和全身重要系统有着密切联系。但是牙周炎发病机制不明,近年研究表明,炎性衰老是机体在衰老的过程中出现慢性、系统性、可控的促炎性反应状态,这种低度慢性炎症与许多衰老相关疾病联系紧密。炎性衰老在慢性炎症性疾病中扮演着重要的角色,通过改善或逆转炎性衰老来减轻或阻止牙周组织的破坏,可能是牙周炎临床治疗和机制研究的新思路。本文依据牙周病国际分类标准[2],对常见几种牙周炎的疾病内在机制和炎性衰老的关系作一概述,为牙周炎发生发展的机制和治疗方法提供新的研究思路。
1. 炎性衰老
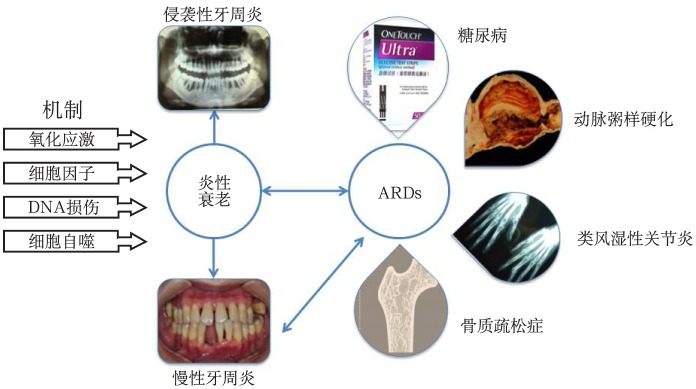
炎性衰老(inflammaging)由Franceschi等[3]于2000年首次提出,指机体在衰老的过程中出现的慢性促炎性反应状态,具有低度、可控、无症状、慢性和系统性5个特点。这种低度慢性炎症表现为机体全身或局部器官对病原体刺激进行性反应性下降,促炎症状态加速机体衰老进程,而机体衰老亦加重炎症反应的发展,形成恶性循环。炎性衰老是机体衰老进程速率和寿命的一个决定因素,与2型糖尿病、胰岛素抵抗、动脉粥样硬化、骨质疏松、关节炎、牙周炎等多种慢性炎症疾病[4]–[5]密切相关(图1)。这些疾病也称为衰老相关疾病(age-related diseases, ARDs),伴随慢性亚临床炎症症状和免疫功能紊乱,威胁患者健康状况。全身健康状况与牙周炎发生发展息息相关。衰老过程中,当机体出现某些衰老相关性疾病时,牙周局部慢性炎症常伴随机体组织、器官的衰老而加速,衰老与炎症互为因果,相互促进(图1)。
图 1. 炎性衰老、ARDs及牙周炎相互作用.
Fig 1 Inflammaging and ARDs in periodontitis
2. 炎性衰老的机制
炎性衰老的机制研究正逐渐受到人们的重视,目前引起炎性衰老的机制主要有氧化应激学说、细胞因子学说、DNA损伤学说和自噬学说[2]。但炎性衰老机制、生物学标志物、疾病评价体系和临床干预手段在牙周炎中的研究还十分欠缺。因此,揭示炎性衰老的分子机制对干预牙周疾病的发生具有重要意义。
2.1. 氧化应激学说
机体随年龄增长免疫系统退化、免疫能力下降,在慢性抗原性应激原的刺激下机体呈现高促炎症反应状态,可导致炎性衰老。氧化应激促进活性氧簇(reactive oxygen species,ROS)产生,线粒体或细胞内外的其他部位产生的活性氧引起线粒体成分的损伤并引发降解,破坏了自由基的产生和清除动态平衡,还通过激活核因子κB(nuclear factor-kappa B,NF-κB)通路、促进细胞因子产生[6]、改变遗传结构[7]等方式,放大炎症级链反应,产生更多自由基,阻滞细胞正常周期,形成自由基-炎症-衰老-自由基恶性循环加速衰老进程。
2.2. 细胞因子学说
促炎症细胞因子在慢性炎症所致机体炎性衰老中发挥重要作用。细胞衰老后分泌炎症因子、蛋白酶、化学因子和细胞因子,如白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)、前列腺素E2(prostaglandin E2,PGE2)、干扰素β(interferon-beta,IFN-β)、干扰素γ(interferon-gamma,IFN-γ)等,这些因子又称为衰老相关分泌表型[8](senescence-associated secretory phenotype,SASP),是重要的炎性衰老致病因素。SASP通过激活促炎转录,进而激活WAF1/Cipl[9]和NF-κB两条炎症重要信号通路[10],使机体处于高促炎症反应状态,并通过一系列因子的慢性分泌驱动ARDs的发展,同时衰老的机体促炎因子增多、抗炎因子减少,表现为过度的促炎反应,进而加速衰老。
2.3. DNA损伤学说
活性氧自由基和促炎细胞因子可通过改变遗传结构方式,促进炎性衰老,慢性炎症过程中损伤DNA的堆积可使干细胞和基质成纤维细胞分化为促炎症细胞因子表达细胞,使多层状细胞因子网络崩溃,导致炎性衰老。DNA损伤促使促炎症诱导细胞衰老,激活NF-κB,产生TNF-α、IL-6、IL-1等炎症因子,通过巨噬细胞等免疫细胞在局部和全身放大炎症级联信号加速衰老[11]。
2.4. 自噬学说
真核细胞可以通过自噬清除有害物质维持细胞稳态和正常代谢,而衰老个体自噬能力逐渐下降,细胞内衰弱的线粒体和蛋白质等堆积,致使不稳定溶酶体产生和释放活性氧化产物,从而激活炎性小体(inflammasome),如炎性小体NLRP3(NLR family pyrin domain containing 3)[12],进而IL-1β和IL-18前体剪切释放增加,加强炎症级联反应,加速细胞炎性衰老。
3. 牙周炎中的炎性衰老
3.1. 慢性牙周炎
不同的牙周炎具有不同的发展和转归,但慢性炎症导致的细胞凋亡、组织损伤和炎性衰老是各类牙周炎的共同结果。慢性牙周炎是所有牙周炎中最常见的一类,常见的致病菌[13]有牙龈卟啉单胞菌(Porphyromonas gingivalis,P. gingivalis)、福赛斯坦纳菌(Tannerella forsythia,T. forsythia)和中间普雷沃菌(Prevotella intermedia,P. intermedia)等。慢性牙周炎病因复杂,随着年龄增加发病率增高,机体炎性衰老可能发挥了重要作用。中性粒细胞、单核细胞、巨噬细胞等免疫细胞是抗牙周致病菌的关键防线,慢性牙周炎患者中性粒细胞趋化至损伤组织,龈沟液检出TNF-α、IFN-γ、IL-1、IL-6、IL-8等SASP水平增高[14],M1型巨噬细胞比例明显增加[15],机体处于慢性促炎状态。研究[16]发现,持续低浓度的致病菌脂多糖(lipopolysaccharide,LPS)刺激使单核细胞p21通路上调,持续释放SASP,诱导氧化应激反应并损伤DNA结构,继而加速细胞衰老过程。增龄性改变不仅仅阻碍正常细胞生长周期,也影响了机体正常应对不良刺激的能力。对比老龄和年轻小鼠巨噬细胞极化[17]发现,年龄差异影响着骨髓巨噬细胞静息状态下的氧化应激水平,老年M1型巨噬细胞显著上调TNF-α表达。尽管在慢性牙周炎中,牙周局部会启动免疫应答,但这种免疫作用并不能持续维持机体免疫能力,而慢性存在的抗原和应激原使得牙周局部防御能力广泛性削弱,继而细胞凋亡、老化,应答能力下降,最终加速牙周组织的衰老进程,导致慢性牙周炎症迁延不愈。
3.2. 侵袭性牙周炎
侵袭性牙周炎是一组特殊牙周疾病,表现为进展迅速的牙齿位移和松脱,其病因机制不清,给临床治疗和患者精神状态均带来不利影响。侵袭性牙周炎患者龈沟液粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GMCSF)分泌高于正常人群[18],白细胞毒素启动牙周组织快速进展性炎性反应,升高IL-1、PGE2等炎症因子水平[19]。侵袭性牙周炎早期就具有快速进展性的临床病理特征。临床试验[20]表明,相较于慢性牙周炎者,侵袭性牙周炎患者体内激增的氧化应激水平与剧烈变化的临床指标密切相关。尽管患者大多在相对年轻时即发病,但仍然存在SASP分泌增多、细胞器裂解增多、衰老线粒体堆积的现象,最终ROS大量生成,急性期蛋白(C-reactive protein,CRP)分泌增多,细胞提前步入炎性衰老的进程。CRP增加不仅仅是衰老相关疾病的重要指标之一[21],其含量更是与年轻者侵袭性牙周炎严重程度呈正相关[22]。侵袭性牙周炎时牙周组织过度的免疫应答削弱了上皮细胞防御能力,加重了骨组织、软组织损伤,并催化了细胞凋亡进程[23]。因此,侵袭性牙周炎是炎性衰老在牙周局部的重要体现,但目前关于此类牙周炎与炎性衰老的机制研究报道较少,尚待更多的进一步研究。
3.3. 伴有全身疾病的牙周炎
3.3.1. 糖尿病相关性牙周炎
糖尿病尤其是2型糖尿病(type 2 diabetes mellitus,T2DM)是最常见的ARDs之一,患者的预期寿命明显低于健康同龄人[24]。牙周炎是糖尿病重要并发症之一,糖尿病患者口腔内往往都能检出牙周组织慢性炎症的表现。糖尿病患者早期即出现了复杂性降低、变异性和炎症发生共同增加等衰老表现,表明糖尿病可能加速了老化。目前已知氧化应激和内质网应激与糖尿病并发症发生密切相关。氧化应激通过促进产生ROS,改变细胞氧化还原状态,影响自由基的清除,逐渐打破氧化/抗氧化反应平衡,最终产生大量SASP,放大了炎症级链反应,形成自由基-炎症-衰老-自由基恶性循环。Patil等[25]进行临床试验发现,伴有T2DM的慢性牙周炎患者表现出增强的氧化应激,且探诊深度和血清ROS水平存在正相关关系。最新研究[26]亦证实了伴随糖尿病的牙周炎面临更严重的线粒体氧化应激,糖尿病牙周炎大鼠ATP产量降低,线粒体DNA拷贝数减少,电子传递链复合体基因表达减少,同时伴有严重的骨质破坏和牙周组织细胞凋亡。内质网应激是蛋白质正确折叠和分泌外排之间的失衡,导致错误折叠的蛋白质产生,破坏内质网稳态。大量糖基化终产物(advanced glycation endoproducts,AGEs)的累积是影响糖尿病牙周炎的主要因素之一。AGEs可通过诱导人牙周膜细胞内质网应激反应,上调NF-κB的表达,促进NF-κB从细胞质向细胞核的迁移,并增加促炎趋化因子IL-6和IL-8的表达[27]。IL-1/NLRP3等炎性小体通路调控糖尿病患者衰老进程,其中内皮细胞衰老尤为显著[28]。单纯牙周炎时因为长期接受全身应激原和局部微生物刺激,机体呈慢性低度持续感染,氧化应激、DNA损伤等促进SASP的分泌,SASP干扰了体内血糖稳态的维持,是年龄相关胰岛素抵抗增加的潜在调节因子,在伴随糖尿病时,高血糖又作为另一重刺激原加剧炎症衰老进程,也推进了个体老龄化的进度。
3.3.2. 伴动脉粥样硬化的牙周炎
动脉粥样硬化(arteriosclerosis,AS)表现出血管内皮细胞增殖减少,不可逆生长停滞和凋亡,活性氧、DNA损伤,氧化应激等炎性衰老的特征。AS的形成与慢性炎症感染相关。研究[29]发现,AS斑块病损处能检测出牙周相关致病菌,包括P. gingivalis、T. forsythia、P. intermedia等,牙周病原菌除可直接损害动脉内皮完整性外,还可通过产生基质酶、LPS等毒力因子间接作用破坏免疫防御。同时,AS患者常伴有脂质代谢障碍,可导致免疫系统负担加重,诱发长期迁延的慢性低度炎症反应,促进内皮细胞、淋巴细胞衰老进程。研究证实,P. gingivalis表面热休克蛋白60(heat shock protein 60,HSP60)与人体HSP60有结构同源性[30],其交叉作用参与了动脉粥样硬化形成,临床试验[31]表明,患有高脂血症的慢性牙周炎患者脂质过氧化和DNA损伤程度增加,而探诊深度、临床附着水平和BOP水平也均高于慢性牙周炎患者。另一方面,细胞衰老也可以促进动脉粥样硬化。通过对老龄和年轻ApoE-/-小鼠骨祖细胞进行体外研究发现,祖细胞随年龄增长进展性出现缺陷,加速了AS疾病病程[32]。由此可见,伴AS的牙周炎患者更易早期发生局部牙周组织以及全身血管内皮等范围的炎性衰老。
3.3.3. 伴类风湿关节炎的牙周炎
类风湿关节炎(rheumatoid arthritis,RA)累及手、足小关节,以炎性滑膜炎为主,是一类典型ARDs。RA局部表现出炎性因子和基质金属蛋白酶(matrix metalloproteinase,MMP)的上调。间质中促炎症因子IL-1β、TNF-α和RANKL高水平表达,抑炎症因子随着炎症进展低水平表达,组织中基质金属蛋白酶抑制物表达下降,最终造成软硬组织的严重破坏。有研究[33]表明,牙周炎和RA患者龈沟液中均表现出增高的MMP-8和MMP-13,MMPs的检出在RA患者龈沟液中更为显著。伴RA的牙周炎,也是一种由滑膜中关节炎性抗原的识别引起的自身免疫综合征,RA免疫介导的组织损伤和自我耐受性也是炎性衰老的重要原因之一,滑膜细胞和间质免疫细胞在抵抗刺激原的过程中逐渐走向衰亡,启动凋亡程序,造成组织损伤。在自身免疫和炎症反应稳态均失衡的情况下,伴RA的牙周病患者更倾向于早期出现细胞、组织以至于整个机体的衰老。
3.3.4. 伴其他疾病
炎性衰老也与其他遗传、代谢和免疫相关疾病具有密切联系,如唐氏综合征、帕金森综合征、获得性免疫缺陷综合征和掌跖角化症等。其中唐氏综合征和帕金森综合征常影响患者口腔卫生保健的依从性,进而难以维持良好的牙周健康,慢性牙周炎患病率也随之升高。而获得性免疫缺陷综合征则是在感染HIV病毒发病后自身细胞免疫系统彻底崩溃,除了表现出更严重的牙周炎易感性,更是伴随各系统免疫缺陷,引起机体各个组织的急剧炎性衰老。掌跖角化症-牙周病综合征作为发病机制不明确的常染色体显性遗传病,被认为与组织蛋白酶C突变有关,患者常更早地表现出严重的侵袭性牙周炎,难以及时干预。
4. 炎性衰老在牙周炎中的作用展望
炎性衰老与牙周炎的发病过程密切相关。随年龄增长,体内微环境固有免疫和适应性免疫功能缺陷的复杂性大大增加,局部炎性衰老也会反作用于个体衰老进程。目前,炎性衰老在各类牙周炎的作用机制报道相对较少,针对炎性衰老的治疗方法来减缓牙周炎亦尚未有报道。相信对其进一步研究将有助于明确牙周炎的发病机制,并提供新的治疗理念。如果炎性衰老及SASP在牙周炎的关键作用得到证实,针对清除衰老细胞或对抗SASP有害作用的治疗方法,可能是治疗牙周炎的合适替代治疗方案。
Funding Statement
[基金项目] 国家自然科学基金(81200794,81371149);国家临床重点专科建设项目(牙周病科,2010);四川省国际科技合作与交流研发项目(2017HH0078)
Supported by: The National Natural Science Foundation of China (81200794, 81371149); National Key Clinical Specialist Construction Programs of China (Periodontics, 2010); International Scientific Cooperation and Exchanges Project of Sichuan Province (2017HH0078).
References
- 1.Pihlstrom BL, Michalowicz BS, Johnson NW. Periodontal diseases[J] Lancet. 2005;366(9499):1809–1820. doi: 10.1016/S0140-6736(05)67728-8. [DOI] [PubMed] [Google Scholar]
- 2.Armitage GC. Development of a classification system for periodontal diseases and conditions[J] Ann Periodontol. 1999;4(1):1–6. doi: 10.1902/annals.1999.4.1.1. [DOI] [PubMed] [Google Scholar]
- 3.Franceschi C, Bonafè M, Valensin S, et al. Inflamm-aging. An evolutionary perspective on immunosenescence[J] Ann N Y Acad Sci. 2000;908:244–254. doi: 10.1111/j.1749-6632.2000.tb06651.x. [DOI] [PubMed] [Google Scholar]
- 4.Franceschi C, Campisi J. Chronic inflammation (inflammaging) and its potential contribution to age-associated diseases[J] J Gerontol A Biol Sci Med Sci. 2014;69(Suppl 1):S4–S9. doi: 10.1093/gerona/glu057. [DOI] [PubMed] [Google Scholar]
- 5.Ebersole JL, Graves CL, Gonzalez OA, et al. Aging, inflammation, immunity and periodontal disease[J] Periodontol 2000. 2016;72(1):54–75. doi: 10.1111/prd.12135. [DOI] [PubMed] [Google Scholar]
- 6.Bhatti JS, Kumar S, Vijayan M, et al. Therapeutic strategies for mitochondrial dysfunction and oxidative stress in age-related metabolic disorders[J] Prog Mol Biol Transl Sci. 2017;146:13–46. doi: 10.1016/bs.pmbts.2016.12.012. [DOI] [PubMed] [Google Scholar]
- 7.Taeb M, Mortazavi-Jahromi S, Jafarzadeh A, et al. An in vitro evaluation of anti-aging effect of guluronic acid (G2013) based on enzymatic oxidative stress gene expression using healthy individuals PBMCs[J] Biomed Pharmacother. 2017;90:262–267. doi: 10.1016/j.biopha.2017.03.066. [DOI] [PubMed] [Google Scholar]
- 8.Ritschka B, Storer M, Mas A, et al. The senescence-associated secretory phenotype induces cellular plasticity and tissue regeneration[J] Genes Dev. 2017;31(2):172–183. doi: 10.1101/gad.290635.116. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Succoio M, Comegna M, D'Ambrosio C, et al. Proteomic analysis reveals novel common genes modulated in both replicative and stress-induced senescence[J] J Proteom. 2015;128:18–29. doi: 10.1016/j.jprot.2015.07.010. [DOI] [PubMed] [Google Scholar]
- 10.Chien Y, Scuoppo C, Wang X, et al. Control of the senescence-associated secretory phenotype by NF-κB promotes senescence and enhances chemosensitivity[J] Genes Dev. 2011;25(20):2125–2136. doi: 10.1101/gad.17276711. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Olivieri F, Albertini MC, Orciani M, et al. DNA damage response (DDR) and senescence: shuttled inflamma-miRNAs on the stage of inflamm-aging[J] Oncotarget. 2015;6(34):35509–35521. doi: 10.18632/oncotarget.5899. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Spadaro O, Goldberg EL, Camell CD, et al. Growth hormone receptor deficiency protects against age-related NLRP3 inflammasome activation and immune senescence[J] Cell Rep. 2016;14(7):1571–1580. doi: 10.1016/j.celrep.2016.01.044. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Darveau RP, Tanner A, Page RC. The microbial challenge in periodontitis[J] Periodontol 2000. 1997;14:12–32. doi: 10.1111/j.1600-0757.1997.tb00190.x. [DOI] [PubMed] [Google Scholar]
- 14.Shimizu T, To M, Kamata Y, et al. Human β-defensin-2 and interleukin-1β expression in response to Porphyromonas gingivalis challenge in mice transplanted with periodontitic human gingiva[J] Microb Pathog. 2017;107:38–43. doi: 10.1016/j.micpath.2017.03.008. [DOI] [PubMed] [Google Scholar]
- 15.Yu T, Zhao L, Huang X, et al. Enhanced activity of the macrophage M1/M2 phenotypes and phenotypic switch to M1 in periodontal infection[J] J Periodontol. 2016;87(9):1092–1102. doi: 10.1902/jop.2016.160081. [DOI] [PubMed] [Google Scholar]
- 16.Mytych J, Romerowicz-Misielak M, Koziorowski M. Long-term culture with lipopolysaccharide induces dose-dependent cytostatic and cytotoxic effects in THP-1 monocytes[J] Toxicol In Vitro. 2017;42:1–9. doi: 10.1016/j.tiv.2017.03.009. [DOI] [PubMed] [Google Scholar]
- 17.Gibon E, Loi F, Córdova LA, et al. Aging affects bone marrow macrophage polarization: relevance to bone healing[J] Regen Eng Transl Med. 2016;2(2):98–104. doi: 10.1007/s40883-016-0016-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Gunpinar S, Alptekin NO, Dundar N. Gingival crevicular fluid levels of monocyte chemoattractant protein-1 in patients with aggressive periodontitis[J] Oral Dis. 2017;23(6):763–769. doi: 10.1111/odi.12658. [DOI] [PubMed] [Google Scholar]
- 19.Kantarci A, Oyaizu K, Van Dyke TE. Neutrophil-mediated tissue injury in periodontal disease pathogenesis: findings from localized aggressive periodontitis[J] J Periodontol. 2003;74(1):66–75. doi: 10.1902/jop.2003.74.1.66. [DOI] [PubMed] [Google Scholar]
- 20.Acquier AB, De Couto Pita AK, Busch L, et al. Parameters of oxidative stress in saliva from patients with aggressive and chronic periodontitis[J] Redox Rep. 2017;22(3):119–126. doi: 10.1080/13510002.2016.1198104. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Michaud M, Balardy L, Moulis G, et al. Proinflammatory cytokines, aging, and age-related diseases[J] J Am Med Dir Assoc. 2013;14(12):877–882. doi: 10.1016/j.jamda.2013.05.009. [DOI] [PubMed] [Google Scholar]
- 22.Goyal L, Bey A, Gupta ND, et al. Comparative evaluation of serum C-reactive protein levels in chronic and aggressive periodontitis patients and association with periodontal disease severity[J] Contemp Clin Dent. 2014;5(4):484–488. doi: 10.4103/0976-237X.142816. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Shahabuddin N, Boesze-Battaglia K, Lally ET. Trends in susceptibility to aggressive periodontal disease[J] Int J Dent Oral Health. 2016;2(4) doi: 10.16966/2378-7090.197. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Kalyani RR, Golden SH, Cefalu WT. Diabetes and aging: unique considerations and goals of care[J] Diabetes Care. 2017;40(4):440–443. doi: 10.2337/dci17-0005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Patil VS, Patil VP, Gokhale N, et al. Chronic periodontitis in type 2 diabetes mellitus: oxidative stress as a common factor in periodontal tissue injury[J] J Clin Diagn Res. 2016;10(4):BC12–BC16. doi: 10.7860/JCDR/2016/17350.7542. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Sun X, Mao Y, Dai P, et al. Mitochondrial dysfunction is involved in the aggravation of periodontitis by diabetes[J] J Clin Periodontol. 2017;44(5):463–471. doi: 10.1111/jcpe.12711. [DOI] [PubMed] [Google Scholar]
- 27.Xu J, Xiong M, Huang B, et al. Advanced glycation end products upregulate the endoplasmic reticulum stress in human periodontal ligament cells[J] J Periodontol. 2015;86(3):440–447. doi: 10.1902/jop.2014.140446. [DOI] [PubMed] [Google Scholar]
- 28.Prattichizzo F, De Nigris V, La Sala L, et al. “Inflammaging” as a druggable target: a senescence-associated secretory phenotype-centered view of type 2 diabetes[J] Oxid Med Cell Longev. 2016;2016:1810327. doi: 10.1155/2016/1810327. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Mahalakshmi K, Krishnan P, Arumugam SB. “Association of periodontopathic anaerobic bacterial co-occurrence to atherosclerosis”—A cross-sectional study[J] Anaerobe. 2017;44:66–72. doi: 10.1016/j.anaerobe.2017.02.003. [DOI] [PubMed] [Google Scholar]
- 30.Wang JC, Bennett M. Aging and atherosclerosis: mechanisms, functional consequences, and potential therapeutics for cellular senescence[J] Circ Res. 2012;111(2):245–259. doi: 10.1161/CIRCRESAHA.111.261388. [DOI] [PubMed] [Google Scholar]
- 31.Fentoğlu Ö, Kırzıoğlu FY, Bulut MT, et al. Evaluation of lipid peroxidation and oxidative DNA damage in patients with periodontitis and hyperlipidemia[J] J Periodontol. 2015;86(5):682–688. doi: 10.1902/jop.2015.140561. [DOI] [PubMed] [Google Scholar]
- 32.Rauscher FM, Goldschmidt-Clermont PJ, Davis BH, et al. Aging, progenitor cell exhaustion, and atherosclerosis[J] Circulation. 2003;108(4):457–463. doi: 10.1161/01.CIR.0000082924.75945.48. [DOI] [PubMed] [Google Scholar]
- 33.Biyikoğlu B, Buduneli N, Kardeşler L, et al. Gingival crevicular fluid MMP-8 and -13 and TIMP-1 levels in patients with rheumatoid arthritis and inflammatory periodontal disease[J] J Periodontol. 2009;80(8):1307–1314. doi: 10.1902/jop.2009.090130. [DOI] [PubMed] [Google Scholar]