Résumé
Introduction
La viscosupplémentation du liquide synovial par injections intra articulaires (IA) d'acide hyaluronique (AH), est un traitement symptomatique bien connu dans la gonarthrose. La question se pose de savoir si les traitements par injection unique (mono-injection) peuvent présenter autant d'efficacité que les multi-injections (3 à 5).
Méthodes
Une méta-analyse des résultats publiés pour les essais de mono-injections IA de AH a été réalisée. Le critère d'efficacité retenu a été le sous-score douleur de l'indice Western Ontario and MacMaster universities (WOMAC A). Toutes les conceptions d’études ont été admises, depuis les essais randomisés contrôlés jusqu'aux études observationnelles ouvertes à simple bras. Une recherche extensive a été effectuée à partir de PubMed, Google, Google Scholar, et des listes de références trouvées dans les méta-analyses récentes, pour obtenir tous les articles publiés avant fin avril 2018. Les profils des populations furent analysés en termes d’âge, de sexe, d'indice de masse corporelle (IMC) et de stade radiologique selon Kellgren-Lawrence (KL). Les résultats d'injection IA unique de placebo, ont été pris en compte pour créer une base permettant des comparaisons post-hoc. Chaque bras AH IA étudié a été comparé à un bras placebo IA (seul ou mixé), de manière à présenter un profil KL similaire, contrôlé à l'aide du test Chi2. Les tailles de l'effet (ES) avec intervalles de confiance (IC 95%) et p-valeurs furent calculées et synthétisées pour chacune des visites de contrôle à 1, 2, 3 et 6 mois. En parallèle, une approche globale a été utilisée afin de représenter les variations par rapport à la baseline, pour chacun des sous-groupes étudiés.
Résultats
En partant de 1 547 citations, 28 études ont été incluses dans la méta-analyse, décrivant 4 129 patients traités par mono-injection: 3 360 ont reçu de l'AH IA et 769 patients ont reçu du placebo IA. Le patient moyen (SD) traité par AH IA était âgé de 61,2 (9,6) ans dont 63% de femmes, avec un IMC de 28,0 (4,1) kg/m2, et un stade radiologique à 47% KL III pour 3% KL IV. Un bon appariement du profil KL a été obtenu pour 26 des 31 bras AH IA. Sur l'ensemble de la population AH IA, ES = 0,30 (0,25; 0,35) à 3 mois et ES = 0,39 (0,33; 0,44) à 6 mois. Dans une analyse restreinte, après élimination des cas aberrants, des KL mal appariés et des bras actifs < 30 patients, les résultats sont restés inchangés, ES = 0,29 (0,23; 0,34) et ES = 0,40 (0,34; 0,45) à 3 et 6 mois respectivement, tandis que l'hétérogénéité était améliorée.
Discussion
Il existe certainement des limites à la méthode de comparaison post-hoc versus placebo, appliquée à des essais individuels. Mais pour chaque synthèse par sous-groupe ou groupe, les résultats ont été confirmés en utilisant plusieurs approches statistiques et différentes méthodes de pondération. Cette méta-analyse suggère que les résultats des mono-injections sont similaires à ceux des multi-injections d'acide hyaluronique intra articulaire en termes de soulagement de la douleur, dans le traitement de la gonarthrose.
Keywords: La viscosupplémentation, la gonarthrose
Abréviations: AH, Acide Hyaluronique (ou hyaluronate de sodium); ES, Taille d'effet (« d » de Cohen); IA, Intra articulaire; IC, Intervalle de Confiance; IMC, Indice de Masse Corporelle (Kg/m2); KL, Kellgren-Lawrence (Echelle radiologique de l'arthrose); MCID, Différence Minimale Cliniquement Importante; MD, Différence Moyenne; MSC, Cellules Souche Mésenchymateuses; NA, Non disponible (donnée manquante); NS, Non significatif; OA, Ostéoarthrose; PRISMA, Preferred Reporting Items for Systematic Reviews and Meta-Analyses; PRGF, Plasma Riche en Facteurs de Croissance; PRP, Plasma Riche en Plaquettes; RCT, Essai Contrôlé Randomisé; SD, Ecart-type; SDD, Plus Petite Différence Détectable; SE, Erreur-type; SMD, Différence Moyenne Standardisée; UE, Union Européenne; VS, Viscosupplémentation; WOMAC, Western Ontario & McMaster universities
Introduction
Contexte
La viscosupplémentation (VS) du liquide synovial par injections intra articulaires (IA) d'acide hyaluronique (AH) est un traitement symptomatique bien connu de la gonarthrose, depuis plus de 30 années. Couramment, le traitement consistait en une série de 3 à 5 injections réalisées à une semaine d'intervalle, mais plus récemment – au cours des 10 à 15 dernières années – des protocoles consistant en une injection unique ont été proposés. La question se pose de savoir si les traitements par injection unique (mono-injection) peuvent présenter autant d'efficacité que les multi-injections, particulièrement si l'on compare au placebo injecté.
Objectifs
Evaluer l'efficacité d'une injection IA unique d'AH, dans le traitement symptomatique de la gonarthrose, en comparant les résultats cliniques obtenus dans différents essais utilisant comme critère le sous-score de la douleur de l'indice Western Ontario and MacMaster universities (WOMAC A), aux résultats obtenus par une injection unique de placebo.
Une méta-analyse des études publiées fut réalisée, en collectant la plus grande quantité de résultats cliniques disponibles. Aucune revue systématique n'a été envisagée.
Méthodes
Les méthodes furent adaptées à partir des recommandations du groupe PRISMA.1.
Protocole et enregistrement
Le protocole demandait d'extraire et d'exploiter tous les résultats des études publiées utilisant le WOMAC A, sans limiter l'investigation aux essais contrôlés randomisés (RCT). En conséquence, avec l'inclusion de tous types d’études, un haut niveau d’évidence n’était pas revendiqué pour cette méta-analyse et aucun enregistrement n’était nécessaire.
Critères d’éligibilité
L'inclusion a été effectuée pour les articles satisfaisant aux critères suivants:
-
•
Etudes cliniques prospectives chez les patients humains souffrant de gonarthrose, avec toutes les conceptions admises, depuis les RCT en double aveugle jusqu'aux études ouvertes à simple bras. Tous les types de comparateurs étaient autorisés: placebo injecté (solution saline), autre AH IA (mono-injection ou multi-injections), ou tout autre traitement alternatif (de préférence injecté). Au minimum, une comparaison versus baseline était exigée.
-
•
Au moins un bras de la population traité par une injection IA unique d'AH, positionné en tant que produit analysé ou en tant que contrôle.
-
•
Résultat du WOMAC A – seul critère pris en compte dans cette méta-analyse – avec au moins deux mesures effectuées : l'une à l'inclusion (baseline) et l'autre lors du suivi.
-
•
Profil des patients connu, avec les données renseignées pour l’âge, l'indice de masse corporelle (IMC), la distribution des stades radiologiques de Kellgren-Lawrence (KL), et l'antériorité de la gonarthrose – afin de pouvoir évaluer la comparabilité entre les groupes.
-
•
Résultats quantitatifs permettant l'analyse, de préférence donnés par la moyenne, l’écart-type (SD) l'erreur-type (SE), et le nombre de patients, pour chaque mesure.
-
•
Résultats qualitatifs donnés par leur fréquence (pourcentage ou population).
Les comparateurs placebo injecté, furent analysés de manière identique, et leurs résultats mixés selon différentes combinaisons pour coïncider avec le profil des patients de chaque essai. Les autres bras comparateurs de ces études, tels que les corticostéroïdes, les multi-injections d'AH ou les traitements alternatifs – ex : plasma riche en facteurs de croissance (PRGF) – ne furent pas pris en compte dans cette analyse.
Sources d'information
Une recherche systématique a été effectuée pour sélectionner les résultats appropriés, tous publiés avant fin avril 2018. Aucune limitation n'a été imposée vers le passé, car le concept de l'injection unique est relativement récent pour la VS dans la gonarthrose. Aucune restriction n’était imposée vis à vis du pays où chaque étude a été réalisée, mais seuls les articles publiés en anglais ont été pris en compte. Les articles ont été sélectionnés parmi les références trouvées dans PubMed, Google, Google Scholar, et à partir des méta-analyses récentes.2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12. Les mots-clés suivants ont été utilisés, associés séquentiellement, de manière à limiter la liste des citations convenablement orientées : single, hyaluronic acid, sodium hyaluronate, intra-articular, injection, knee, osteoarthritis, viscosupplementation, cross-linked, G-F 20, Hylan, Synvisc-One, Durolane, NASHA, Monovisc, Gel-200, clinical trial.
Recherche et sélection des études
Une première sélection fut effectuée après examen rapide des titres et des résumés, puis les textes complets furent évalués pour déterminer leur éligibilité. Un soin particulier fut pris pour éliminer les publications en double, à différents niveaux de la recherche. Les essais sur l'animal, les tests de laboratoire, les articles généraux, les revues, les méta-analyses, les recommandations (guidelines), ou les opinions d'auteurs furent aussi éliminés.
Au final, les articles ne furent pas inclus s'ils décrivaient:
-
•
Un contexte différent de la pratique courante de la VS dans la gonarthrose: autre articulation, chirurgie ou autre pathologie associée.
-
•
Un protocole de multi-injections (plus d'une injection IA par traitement).
-
•
Un essai clinique réalisé avec un produit non-approuvé en tant que mono-injection d'AH IA : Union Européenne (UE) ou USA.
-
•
Une combinaison planifiée de traitements, sans utilisation d'AH IA seul.
-
•
ou, des données insuffisantes pour le WOMAC A.
Traitement des données
Les données tirées des articles furent prises en compte telles que publiées et aucune question n'a été adressée à aucun des auteurs. Un gros effort a été accompli pour inclure toutes les études possibles: lorsque nécessaire et justifié, SE et SD furent estimés à partir de la p-valeur, ou encore les valeurs furent mesurées sur les graphiques disponibles. Aucune évaluation alternative de la douleur ne fut admise pour compenser ou compléter des données manquantes pour le WOMAC A.
Les données ont été acquises et traitées sous MS Excel. L'interprétation fut faite selon la description contenue dans chaque étude. L'enregistrement des données a été faite par bras étudié tant pour les mono-injections IA AH que pour les injections de comparateur placebo. Ces données comprenaient la taille de la population étudiée, le profil moyen des patients à l'inclusion (nombre, sexe, âge, IMC, antériorité de l'arthrose, les sous-scores (SD) du WOMAC A à chaque temps d'observation, depuis l'inclusion jusqu’à la dernière visite de contrôle. Pour une évaluation claire, tous les scores ont été ramenés sur une échelle 0-100, et les temps d'observation ont été reclassés en mois M1 (2-5 semaines), M2 (6-9 semaines), M3 (10-18 semaines) et M6 (22-26 semaines).
De nombreuses études ne comprenaient pas leur propre bras de contrôle avec placebo IA, et notre approche a consisté à utiliser les résultats disponibles de placebo IA comme une base de données indépendante, et par conséquent à sélectionner le meilleur comparateur placebo, en se basant sur les profils KL. Un appariement correct a été contrôlé par le test Chi2 et considéré comme satisfaisant lorsque la p-valeur était > 0.05. Chaque essai randomisé contrôlé a conservé son propre comparateur placebo.
Résumé des mesures
Dans une première phase, chaque essai individuel et son placebo associé furent comparés. Les variations depuis la baseline (inclusion) furent calculées avec SD pour chacune des populations, et revues à chaque visite (M1, M2, M3 and M6). Ensuite la comparaison versus placebo fut réalisée, en calculant la différence de variation depuis la baseline, SD et SE groupés, la taille d'effet (ES) – selon la définition « d » de Cohen13 avec son intervalle de confiance (IC 95%) – et la p-valeur.
Synthèse des résultats
Dans une seconde phase, différentes méthodes de regroupement ont été testées. En utilisant le logiciel MIX 2.0 de Biostat XL (effet fixe, pondération selon l'inverse de la variance), une synthèse à chaque temps de visite fut proposée, représentant les résultats sous la forme de graphiques en forêt. L'efficacité clinique fut donc évaluée pour chaque essai individuel, à partir de la différence absolue par rapport au placebo (pertinente ou non) et de la significativité statistique de cette différence (p-valeur). Aussi, une ES égale à 0,2 fut a priori considérée comme « petite » ; 0,5 comme « moyenne » et 0,8 comme « importante ».13 L'hétérogénéité fut évaluée à partir des graphiques en entonnoir et des indicateurs I2 et τ2.
Analyse complémentaire
Selon une approche séparée, les mono-injections d'AH furent regroupées par produit afin de constituer des sous-groupes de plus de 500 patients. Les AH restantes furent regroupées dans un sous-groupe dénommé « autres AH ». Des comparaisons furent réalisées entre chaque sous-groupe (produit) et son placebo apparié. Finalement, une synthèse fut réalisée pour toutes les mono-injections d'AH. Des graphiques furent établis pour illustrer ces résultats, représentant les variations de score depuis la baseline et aussi la taille d'effet en fonction du temps, selon le concept de la trajectoire thérapeutique.2
Risques de biais à l'intérieur ou entre les études
Aucune revue systématique des caractéristiques des études n'a été faite. Notre intention était d'explorer largement les données existantes, et tous les types d’études ont été admis. En conséquence, les facteurs tels que la présence d'un bras de contrôle, la technique d'attribution, ou la qualité de l'insu, ne pouvaient être pris en compte. Pour évaluer le risque de biais, nous avons d'abord utilisé les graphiques en entonnoir pour identifier les résultats aberrants et les possibles biais de publication, mis en évidence par l'asymétrie du graphique. Ensuite, pour limiter le risque de biais de sélection, un soin particulier a été apporté à la qualité de l'appariement entre chaque bras actif et le bras placebo proposé. En résumé pour les essais inclus, les anormalités furent analysées pour les études aux résultats aberrants ou autres biais potentiels, et par les tests d'hétérogénéité. Ceci nous a permis d’écarter plusieurs essais, ainsi que décrit plus loin dans les résultats.
Résultats
Sélection des essais
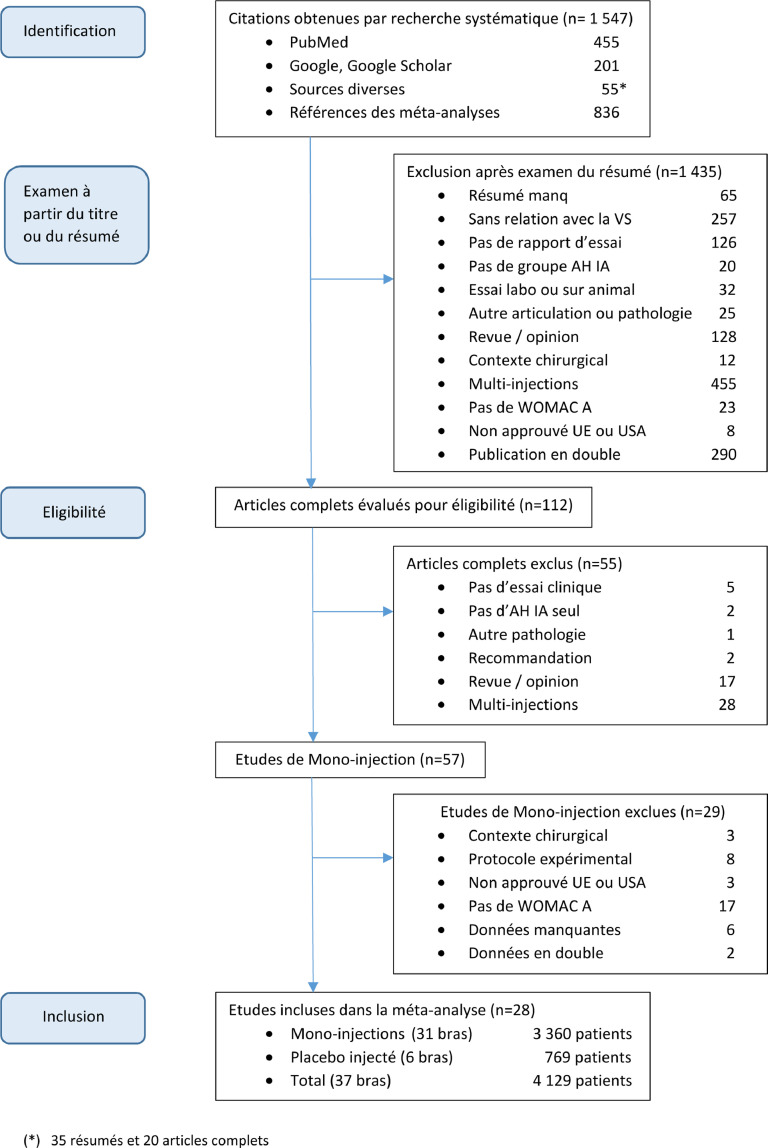
Les résultats de la sélection des essais sont décrits par l'organigramme (Figure 1). La recherche a été initiée avec PubMed, continuée avec Google, et à la suite avec Google Scholar. En complément, 55 citations diverses (35 résumés et 20 articles complets) ont été ajoutées à partir de diverses sources. Au final, cette recherche de listes de références a généré de nombreux doublons, qui ont été éliminés durant notre process de sélection. Au total, 1 547 citations ont été identifiées. Après filtrage à partir des titres et des résumés et retrait des publications en double, 112 articles complets et d'intérêt, ont été évalués pour leur éligibilité. A partir de là, 57 articles contenaient des données de mono-injection d'AH IA.14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70 Au final, 28 essais ont été inclus,43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70 tandis que 29 études ont été retirées pour une ou plusieurs des raisons suivantes:
-
•
3 essais étaient associés à la chirurgie: reconstruction du ligament croisé antérieur,26,28 ou arthroscopie.27
-
•
8 décrivaient des traitements expérimentaux à partir de produits conçus pour des injections multiples: injection unique,26, 27, 28 ou grosse injection regroupant plusieurs seringues,29, 30, 31 plus petite injection,32 ou retraitement.33
-
•
3 étaient relatifs à des produits non-approuvés pour la VS en UE ou aux USA.16,17,34
-
•
17 ne proposaient aucun résultat pour le WOMAC A.14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30
-
•
6 comportaient des données manquantes: ni SD ni SE,35, 36, 37, 38 aucun score à l'inclusion (fixé arbitrairement à 100% = biais majeur),39 ou données inappropriées (ratio de population pour un gain > 15 mm ou 40%).40
-
•
2 proposaient des données en duplicata41,42 respectivement identiques à.43,60
Figure 1.
Organigramme de la recherche
En résumé, 25 des 28 études incluses furent identifiées avec succès à partir de PubMed (19 dès la première recherche), 3 à partir de Google et aucune complémentaire à partir des autres sources.
Caractéristiques des études et appariement du placebo
Parmi des 28 études incluses, 8 étaient des études observationnelles à bras unique, et 20 étaient des RCT. Parmi ceux-ci, 14 étaient décrits en double aveugle. Les 6 autres RCT, 49,55,57,59,64,65 présentaient de nombreuses différences dans les traitements (telles que le nombre d'injections) et, bien qu'il semble possible d'avoir été en aveugle côté patient, il n'est pas certain que l’évaluation ait été réalisée par un investigateur aveugle. Les comparateurs utilisés dans les 20 RCT étaient:
-
•
Solution saline IA (placebo) pour 6 études.43,51,52,60,61,62
-
•
Préparation autologue IA pour 4 études:56,57,64,65 PRP, PRGF ou MSC.
-
•
Ozone IA pour 1 étude.64
- •
-
•
Autre mono-injection IA d'AH pour 3 études, ici analysées en bras séparés,45,46,48 ou ignorées pour deux autres produits expérimentaux, non approuvés.45
-
•
Multi-injection IA d'AH pour 4 études.54,55,59,70 Pour conserver le même nombre d'injections par patient dans les deux bras étudiés, on a utilisé des simulacres d'injection à partir de seringues vides dans une étude,54 et des injections de solution saline dans une autre étude.70
Dans le Tableau 1, les études ont été classées en sous-groupes (Synvisc-One, Durolane, et autres produits), pour permettre des synthèses intermédiaire et globale. Les bras actifs furent identifiés de #1 à #31. Chaque citation référencée est décrite par le nom de l'auteur principal et plus loin dans le document, nous avons rajouté l'année de publication, telle que décrite dans la citation. Chaque nom d'auteur sous-ligné correspond à un RCT.
Tableau 1.
Etudes sélectionnées et profils des patients
| ID | Auteur | Suivi semaines | mono-injections | N par bras | Sexe % | Age (SD) années | IMC (SD) kg/m2 | KL % |
Antériorité années | |
|---|---|---|---|---|---|---|---|---|---|---|
| III | IV | |||||||||
| #1 | Chevalier43 | 26 | Synvisc-One | 124 | 74 | 63,6 (12,6) | 29,1 (4,8) | 49 | 0 | 6,5 (6,4) |
| #2 | Pal44 | 52 | Synvisc-One | 394 | 72 | 57,6 (9,8) | 27,7 (4,5) | 57 | 0 | 1,4 (2,8) |
| #3 | Petrella45 | 26 | Synvisc-One | 32 | 50 | 59,0 (12,0) | 29,0 (3,8) | 44 | 0 | 5,8 (4,7) |
| #4 | Dreiser46 | 26 | Synvisc-One | 147 | 61 | 66,6 (10,7) | 26,3 (2,8) | 24 | 0 | 6,9 (6,7) |
| #5 | Tammachote47 | 26 | Synvisc-One | 50 | 86 | 62,6 (10,0) | 26,3 | 44 | 14 | NA |
| #6 | Sun48 | 26 | Synvisc-One | 59 | 71 | 62,5 (10,0) | 25,2 (4,2) | 34 | 0 | 5,2 (4,6) |
| #7 | De Campos49 | 26 | Synvisc-One | 52 | 75 | 61,0 (12,0) | 30,0 (5,2) | 34 | 25 | NA |
| #8 | Kearey50 | 52 | Synvisc-One | 119 | 66 | 60,2 (11,3) | 30,9 (6,4) | 55 | 0 | 5,3 (6,2) |
| Sous-groupe | 26 | Synvisc-One | 977 | 70 | 60,8 (9,5) | 28,0 (4,0) | 47 | 2 | 4,0 | |
| #9 | Altman51 | 26 | Durolane | 172 | 46 | 62,9 (10) | 30,3 (5,0) | 53 | 23 | 5,0 |
| #10 | Arden52 | 6 | Durolane | 108 | 55 | 64,5 (15,9) | 27,2 (5,6) | 67 | 0 | 2,2 (2,2) |
| #11 | Leighton53 | 26 | Durolane | 218 | 51 | 61,9 (9,6) | 28,2 (4,2) | 69 | 0 | 4,7 (5,4) |
| #12 | Zhang54 | 26 | Durolane | 161 | 74 | 60,2 (8,1) | NA | 42 | 0 | 3,9 (5,3) |
| #13 | Estades-Rubio55 | 26 | Durolane | 27 | 52 | 52,9 (13,9) | 30,0 (4,5) | 19 | 0 | 2,1 (1,2) |
| #14 | Louis56 | 13 | Durolane | 24 | 54 | 48,5 (11,5) | 27,0 (2,9) | NA | NA | 8,4 (8,4) |
| #15 | Vaquerizo57 | 48 | Durolane | 48 | 54 | 64,8 (7,7) | 31,0 (4,6) | 44 | 19 | NA |
| Sous-groupe | 26 | Durolane | 758 | 56 | 61,6 (8,9) | 28,9 (4,2) | 55 | 7 | 4,4 | |
| #16 | Baron58 | 26 | Arthrum 75 | 218 | 56 | 62,9 (12,6) | 27,2 (4,3) | 46 | 0 | 4,1 (5,4) |
| #17 | Diraçoglu59 | 26 | Monovisc | 20 | 80 | 58,0 (7,0) | 30,5 (4,9) | NA | NA | NA |
| #18 | Hangody60 | 26 | Monovisc | 150 | 66 | 59,2 (8,6) | 28,4 (4,5) | 18 | 1 | NA |
| #19 | Hangody60 | 26 | Cingal | 149 | 65 | 57,5 (8,4) | 28,9 (4,7) | 19 | 0 | NA |
| #20 | Strand61 | 13 | Gel-One | 247 | 60 | 60,9 (10,2) | 28,3 (4,1) | 53 | 0 | NA |
| #21 | Takamura62 | 26 | Gel-One | 152 | 58 | 61,0 (9,4) | NA | 44 | 0 | 0,6 (0,6) |
| #22 | Borras-Verdera63 | 26 | Ostenil-Plus | 80 | NA | > 40 | NA | 100 | 0 | NA |
| #23 | Dreiser46 | 26 | Ostenil-Plus | 143 | 73 | 67,1 (9,7) | 26,4 (2,9) | 31 | 0 | 5,4 (5,4) |
| #24 | Duymus64 | 52 | Ostenil-Plus | 34 | 97 | 60,3 (9,1) | 28,4 (3,6) | 29 | 0 | NA |
| #25 | Lamo-Espinosa65 | 52 | Hyalone | 10 | 30 | 60,3 (4,4) | 29,6 (3,4) | 20 | 40 | 6,0 (4,4) |
| #26 | Conrozier66 | 26 | Happy-cross | 40 | 73 | 60,7 (13,9) | 28,6 (5,0) | 43 | 25 | NA |
| #27 | Monet67 | 28 | Happy-cross | 53 | 66 | 62,6 (12,3) | 27,5 (5,2) | 43 | 19 | 4,5 (3,0) |
| #28 | Bashaireh68 | 39 | Crespine-gel | 84 | 37 | 55,8 (9,3) | 30,5 (4,9) | 56 | 1 | NA |
| #29 | Sun48 | 26 | Hya-Joint-Plus | 62 | 77 | 62,7 (8,4) | 24,7 (3,3) | 35 | 0 | 5,4 (4,4) |
| #30 | Tuan69 | 26 | Hya-Joint-Plus | 46 | 80 | 65,1 (9,3) | 24,0 (3,6) | 41 | 0 | NA |
| #31 | Ha70 | 15 | Hyruan-One | 137 | 81 | 62,0 (8,6) | 25,1 (2,9) | 43 | 0 | 4,0 (4,0) |
| Sous-groupe | 26 | autres AH IA | 1625 | 65 | 61,3 (10,0) | 27,7 (4,1) | 42 | 2 | 3,2 | |
| Total mono-injections | tous AH IA | 3360 | 63 | 61,2 (9,6) | 28,0 (4,1) | 47 | 3 | 3,7 | ||
Les caractéristiques des profils moyens des patients, sont données par bras dans le Tableau 1, pour les patients ayant reçu une mono-injection d'AH IA, et dans le Tableau 2, pour les patients ayant reçu le placebo injecté IA. Il y avait de grosses différences de taille de population, allant de 10 à 394 (moyenne 108) par bras actif. La durée du suivi variait de 6 à 52 semaines, majoritairement à 26 semaines. Etant limités à 26 semaines pour les bras placebo, il n'a pas été possible de réaliser de comparaison, sur une durée plus longue. Les profils patient étaient assez homogènes, en termes d’âge et d'IMC, mais il y avait de gros écarts sur les proportions de stades KL, variant de 0% à 81% pour les stades I-II, avec présence de stades IV allant de 0% à 40%, ce qui est très élevé. Ceci a justifié lors du traitement des données, le choix d'apparier en priorité les stades KL, lors de la sélection de chaque bras placebo, et de cette manière réduire le risque de biais lors de chaque comparaison. Pour les bras placebo, il y avait moins de population disponible, mais en associant entre eux les bras placebo, on a pu déterminer des profils intermédiaires, comme montré dans la seconde partie du Tableau 2. De la même manière que pour les bras actifs, les profils des bras placebo étaient homogènes en termes d’âge et d'IMC.
Tableau 2.
Bras placebo sélectionnés et profils des patients
| ID | Auteur | Suivi semaines | Comparateur placebo IA | N par bras | Sexe % | Age (SD) années | IMC (SD) kg/m2 | KL % |
Antériorité années | |
|---|---|---|---|---|---|---|---|---|---|---|
| III | IV | |||||||||
| A | Altman51 | 26 | solution saline | 174 | 64 | 63,3 (10,0) | 29,5 (5,0) | 52 | 26 | 6,5 |
| C | Chevalier43 | 26 | solution saline | 129 | 68 | 62,5 (9,2) | 29,8 (5,7) | 60 | 1 | 5,8 (5,4) |
| S | Strand61 | 13 | solution saline | 128 | 60 | 60,3 (10,0) | 28,7 (3,8) | 49 | 0 | NA |
| A’ | Arden52 | 6 | solution saline | 110 | 46 | 60,9 (20,5) | 27,5 (6,1) | 64 | 0 | 3,1 (3,1) |
| H | Hangody60 | 26 | solution saline | 69 | 74 | 58,0 (9,0) | 29,1 (4,5) | 20 | 0 | NA |
| T | Takamura62 | 26 | solution saline | 159 | 62 | 62,8 (8,9) | NA | 42 | 0 | 0,7 (0,5) |
| Bras associés | ||||||||||
| A+C | 26 | solution saline | 303 | 66 | 63,0 (9,7) | 29,6 (5,3) | 55 | 15 | 6,2 | |
| A+A’ | 26 | solution saline | 284 | 57 | 62,4 (15,0) | 28,7 (5,4) | 56 | 16 | 5,2 | |
| A+T | 26 | solution saline | 333 | 63 | 63,1 (9,5) | 30,3 (5,0) | 47 | 14 | 3,7 | |
| C+S | 26 | solution saline | 257 | 64 | 61,4 (9,6) | 29,2 (4,9) | 55 | 0 | 5,8 | |
| C+A’ | 26 | solution saline | 239 | 58 | 61,8 (15,4) | 28,7 (5,9) | 62 | 0 | 4,6 | |
| C+T | 26 | solution saline | 288 | 65 | 62,7 (9,0) | 29,8 (5,7) | 50 | 0 | 3,0 | |
| H+T | 26 | solution saline | 228 | 66 | 61,3 (8,9) | 29,1 (4,5) | 36 | 0 | 0,7 | |
| A+C+S | 26 | solution saline | 276 | 64 | 62,2 (9,8) | 29,3 (4,9) | 53 | 11 | 6,2 | |
| C+S+A’ | 26 | solution saline | 367 | 59 | 61,3 (13,8) | 28,7 (5,3) | 57 | 0 | 4,6 | |
| C+S+H | 26 | solution saline | 326 | 66 | 60,7 (9,5) | 29,2 (4,8) | 47 | 0 | 5,8 | |
| A+C+S+A’ | 26 | solution saline | 541 | 60 | 61,9 (12,7) | 29,0 (5,2) | 56 | 8 | 5,4 | |
| C+S+H+T | 26 | solution saline | 485 | 65 | 61,4 (9,3) | 29,2 (4,8) | 46 | 0 | 3,0 | |
| C+S+H+T+A’ | 26 | solution saline | 595 | 62 | 61,3 (12,1) | 28,8 (5,2) | 49 | 0 | 3,0 | |
| A+C+S+H+T+A’ | 26 | solution saline | 769 | 62 | 61,7 (11,7) | 29,0 (5,1) | 50 | 6 | 4,1 | |
L'appariement des bras placebo avec les bras actifs est décrit dans le Tableau 3. Les stades KL sont détaillés en nombre de patients pour les stades I+II, III et IV. Le test Chi2 a été utilisé pour générer la p-valeur en comparant les profils, étude par étude. Les différences significatives furent mises en évidence par p-valeur < 0,05. Une bonne concordance des profils a été obtenue pour 26 des 29 bras; parmi les échecs, le bras #22 était très atypique avec 100% stade III, sans possibilité d'appariement. Deux bras #14 and #17, sans profil KL défini, furent attribués à des placebos moyens basés sur des populations présumées similaires. Clairement, le risque d'inadéquation entre un bras actif et son placebo existe, et nous avons pris des précautions pour minimiser les biais dans les résultats.
Tableau 3.
Appariement des bras placebo selon le profil KL des patients
| Mono-injection AH IA |
Comparateur IA |
Statistiques |
||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ID | Auteur | N | KL | KL | KL | Placebo | N | KL | KL | KL | Chi2 | p-valeur |
| I-II | III | IV | I-II | III | IV | |||||||
| #1 | Chevalier43 | 123 | 63 | 60 | 0 | C | 129 | 51 | 78 | 1 | 4,42 | 0,11 |
| #2 | Pal44 | 394 | 171 | 223 | 0 | C+S | 258 | 116 | 141 | 1 | 1,72 | 0,42 |
| #3 | Petrella45 | 32 | 18 | 14 | 0 | C+S C+S+A’ |
258 368 |
116 156 |
141 211 |
1 1 |
1,54 2,35 |
0,46 0,31 |
| #4 | Dreiser46 | 147 | 112 | 35 | 0 | H+T | 228 | 147 | 81 | 0 | 5,74* | 0,017 |
| #5 | Tammachote47 | 50 | 21 | 22 | 7 | A+C+S A+C+S+A’ |
432 541 |
155 195 |
231 301 |
46 46 |
1,68 3,13 |
0,43 0,21 |
| #6 | Sun48 | 59 | 39 | 20 | 0 | C+T | 289 | 143 | 145 | 1 | 5,53 | 0,063 |
| #7 | De Campos49 | 52 | 21 | 18 | 13 | A+T | 333 | 131 | 157 | 45 | 5,51 | 0,064 |
| #8 | Kearey50 | 115 | 50 | 65 | 0 | C+S | 258 | 116 | 141 | 1 | 0,54 | 0,77 |
| Sous-groupe Synvisc-One | 972 | 495 | 457 | 20 | C+S+H | 327 | 171 | 155 | 1 | 4,74 | 0,093 | |
| #9 | Altman51 | 172 | 40 | 92 | 40 | A | 174 | 39 | 90 | 45 | 0,32 | 0,85 |
| #10 | Arden52 | 108 | 33 | 75 | 0 | A’ | 110 | 40 | 70 | 0 | 0,83* | 0,36 |
| #11 | Leighton53 | 218 | 71 | 147 | 0 | C C+A’ |
129 239 |
51 91 |
78 148 |
1 1 |
3,40 2,42 |
0,18 0,30 |
| #12 | Zhang54 | 161 | 94 | 67 | 0 | C+S+H | 327 | 171 | 155 | 1 | 2,02 | 0,36 |
| #13 | Estades-Rubio55 | 27 | 22 | 5 | 0 | C+T | 289 | 143 | 145 | 1 | 10,1 | 0,006 |
| #14 | Louis56 | 24 | NA | NA | NA | A+C | 304 | 90 | 168 | 46 | NA | NA |
| #15 | Vaquerizo57 | 48 | 18 | 21 | 9 | A | 174 | 39 | 90 | 45 | 4,60 | 0,10 |
| Sous-groupe Durolane | 734 | 278 | 407 | 49 |
A+C+S A+C+S+A’ |
432 542 |
155 195 |
231 301 |
46 46 |
5,75 1,68 |
0,056 0,43 |
|
| #16 | Baron58 | 217 | 118 | 99 | 0 | C+S+H+T C+S+H+T+A’ |
486 596 |
263 303 |
222 292 |
1 1 |
0,45 1,12 |
0,80 0,57 |
| #17 | Diraçoglu59 | 20 | NA | NA | NA | A+C+S | 431 | 155 | 231 | 46 | NA | NA |
| #18 | Hangody60 | 150 | 122 | 27 | 1 | H | 69 | 55 | 14 | 0 | 0,61 | 0,74 |
| #19 | Hangody60 | 149 | 120 | 29 | 0 | H | 69 | 55 | 14 | 0 | 0,02* | 0,89 |
| #20 | Strand61 | 247 | 115 | 132 | 0 | S | 128 | 65 | 63 | 0 | 0,60* | 0,44 |
| #21 | Takamura62 | 152 | 85 | 67 | 0 | T | 159 | 92 | 67 | 0 | 0,12* | 0,73 |
| #22 | Borras-Verdera63 | 80 | 0 | 80 | 0 | A A+A’ |
174 284 |
39 79 |
90 160 |
45 45 |
57,7 53,0 |
<0,001 <0,001 |
| #23 | Dreiser46 | 143 | 98 | 45 | 0 | H+T | 228 | 147 | 81 | 0 | 0,65* | 0,42 |
| #24 | Duymus64 | 34 | 24 | 10 | 0 | H | 69 | 55 | 14 | 0 | 1,06* | 0,30 |
| #25 | Lamo-Espinosa65 | 10 | 4 | 2 | 4 | A | 174 | 39 | 90 | 45 | 3,86 | 0,14 |
| #26 | Conrozier66 | 40 | 13 | 17 | 10 | A | 174 | 39 | 90 | 45 | 1,92 | 0,38 |
| #27 | Monet67 | 53 | 20 | 23 | 10 | A | 174 | 39 | 90 | 45 | 5,06 | 0,080 |
| #28 | Bashaireh68 | 84 | 36 | 47 | 1 | C+S C+S+A’ |
258 368 |
116 156 |
141 211 |
1 1 |
0,78 1,33 |
0,68 0,51 |
| #29 | Sun48 | 62 | 40 | 22 | 0 | C+T | 289 | 143 | 145 | 1 | 4,74 | 0,093 |
| #30 | Tuan69 | 46 | 27 | 19 | 0 | C+S | 258 | 116 | 141 | 1 | 3,07 | 0,22 |
| #31 | Ha70 | 137 | 78 | 59 | 0 | C+T | 289 | 143 | 145 | 1 | 2,45 | 0,29 |
| Sous-groupe autres AH | 1625 | 900 | 678 | 26 | C+S+H | 327 | 171 | 155 | 1 | 5,73 | 0,057 | |
| Toutes mono-injections | 3360 | 1673 | 1542 | 95 |
C+S+H+T C+S+H+T+A’ |
486 596 |
263 303 |
222 292 |
1 1 |
2,16* 0,02* |
0,14 0,89 |
|
(*) Groupement KL III+IV (df=1)
Résultats des études individuelles et synthèse
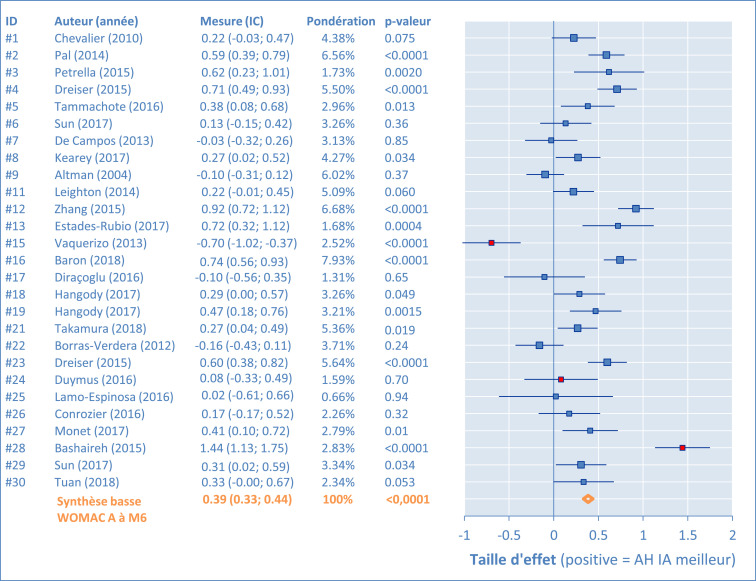
Les résultats des comparaisons individuelles versus placebo pour le WOMAC A, sont représentés dans les Figures 2, 3, 4 et 5 sous la forme de graphiques en forêt à M1, M2, M3, et M6, pour l'ensemble des études. Les barres représentent les intervalles de confiance (IC 95%). Les résultats positifs sont en faveur du produit AH IA. Dans les tableaux inclus, chaque étude est identifiée (ID, nom de l'auteur, année de publication) et la taille de l'effet ES est fournie (IC 95%). En complément, le pourcentage de pondération dans la synthèse et la p-valeur sont aussi donnés.
Figure 5.
WOMAC A (douleur): Comparaison mono-injection AH IA vs placebo IA à M6
Figure 2.
WOMAC A (douleur): Comparaison mono-injection AH IA vs placebo IA à M1
Figure 3.
WOMAC A (douleur): Comparaison mono-injection AH IA vs placebo IA à M2
Figure 4.
WOMAC A (douleur): Comparaison mono-injection AH IA vs placebo IA à M3
On a observé des différences importantes entre les études, qui ont justifié d’évaluer l'hétérogénéité. Dans un premier temps ceci a été réalisé par des graphiques en entonnoirs à M1, M2, M3 et M6 (Figure 6). Les résultats aberrants, #15, #24 et #28, furent clairement identifiés et les points qui les représentent sont remplis en rouge sur les graphiques (en entonnoir et en forêt). Aucune dissymétrie importante n'a été détectée par les graphiques en entonnoir, et la distribution des scores reste équilibrée autour de la moyenne générale (ligne verticale).
Figure 6.
Graphiques en entonnoir,
Les résultats de synthèse donnés par les graphiques en forêt, ont été obtenus par pondération selon la variance inverse (IV) en effet fixe par le logiciel MIX 2.0. D'autres résultats de synthèse donnés dans les Tableaux 4 et 5, ont été calculés à chaque durée de suivi à M1, M2, M3 et M6, en exprimant la différence de variation (MD) depuis la baseline (échelle 0-100), et les indicateurs d'hétérogénéité: I2 est le ratio d'hétérogénéité vraie (modéré à 50% et élevé à 75%) et τ2 mesure l'hétérogénéité entre études, ici en unités sans dimension, (faible à 0,04, modérée à 0,09 et élevée à 0,16)3.
Tableau 4.
Populations sélectionnées et tests d'hétérogénéité
| Suivi | N (groupe AH) | Différence de variation / baseline |
Taille d'effet (ES) (IC 95%) | Statistiques |
|||
|---|---|---|---|---|---|---|---|
| MD | SD | p-valeur | I2 | τ2 | |||
| Analyse étendue (toutes études) | |||||||
| M1 | 2502 | 3,18 | 19,7 | 0,17 (0,12; 0,22) | <0,0001 | 87 % | 0,13 |
| M2 | 1887 | 4,27 | 21,0 | 0,21 (0,15; 0,28) | <0,0001 | 85 % | 0,11 |
| M3 | 3014 | 6,56 | 22,2 | 0,30 (0,25; 0,35) | <0,0001 | 84 % | 0,11 |
| M6 | 2728 | 8,41 | 21,3 | 0,39 (0,33; 0,44) | <0,0001 | 88 % | 0,18 |
| Analyse limitée (sans #15, #24, #28) | |||||||
| M1 | 2384 | 2,13 | 19,7 | 0,12 (0,07; 0,18) | 0,0001 | 81 % | 0,09 |
| M2 | 1803 | 3,11 | 21,1 | 0,16 (0,10; 0,23) | <0,0001 | 76 % | 0,06 |
| M3 | 2896 | 5,76 | 22,2 | 0,27 (0,22; 0,32) | <0,0001 | 80 % | 0,09 |
| M6 | 2562 | 8,27 | 21,4 | 0,39 (0,33; 0,44) | <0,0001 | 81 % | 0,11 |
| Analyse réduite (sans #4, #13, #14, #15, #17, #22, #24, #25, #28) | |||||||
| M1 | 2127 | 2,65 | 19,8 | 0,14 (0,08; 0,20) | <0,0001 | 75 % | 0,06 |
| M2 | 1698 | 3,86 | 21,5 | 0,19 (0,12; 0,26) | <0,0001 | 71 % | 0,05 |
| M3 | 2605 | 6,36 | 22,4 | 0,29 (0,23; 0,34) | <0,0001 | 74 % | 0,06 |
| M6 | 2296 | 8,59 | 21,5 | 0,40 (0,34; 0,45) | <0,0001 | 78 % | 0,09 |
Tableau 5.
Analyse par sous-groupe et tests d'hétérogénéité
| Suivi | N (groupe AH) | Différence de variation / baseline |
Taille d'effet (ES) (IC 95%) | Statistiques |
|||
|---|---|---|---|---|---|---|---|
| MD | SD | p-valeur | I2 | τ2 | |||
| Sous-groupe Synvisc-One | |||||||
| M1 | 843 | 3,10 | 19,5 | 0,16 (0,07; 0,25) | 0,0007 | 79 % | 0,07 |
| M2 | 206 | 1,97 | 20,5 | 0,10 (-0,07; 0,26) | 0,26 | 72 % | 0,08 |
| M3 | 962 | 5,71 | 22,2 | 0,26 (0,17; 0,34) | <0,0001 | 68 % | 0,04 |
| M6 | 959 | 8,17 | 20,8 | 0,39 (0,30; 0,48) | <0,0001 | 74 % | 0,07 |
| Sous-groupe Durolane (sans #15) | |||||||
| M1 | 199 | -4,48 | 18,8 | -0,24 (-0,43; -0,05) | 0,013 | NS | NS |
| M2 | 525 | 1,87 | 22,0 | 0,09 (-0,04; 0,21) | 0,17 | 55 % | 0,03 |
| M3 | 569 | 5,46 | 22,1 | 0,25 (0,14; 0,36) | <0,0001 | 91 % | 0,22 |
| M6 | 531 | 9,34 | 21,6 | 0,43 (0,31; 0,55) | <0,0001 | 93 % | 0,32 |
| Sous-groupe autres AH IA (sans #24, #28) | |||||||
| M1 | 1342 | 2,72 | 20,0 | 0,14 (0,06; 0,21) | 0,0004 | 81 % | 0,10 |
| M2 | 1072 | 4,04 | 21,0 | 0,19 (0,11; 0,28) | <0,0001 | 84 % | 0,09 |
| M3 | 1365 | 5,94 | 22,4 | 0,27 (0,19; 0,34) | <0,0001 | 79 % | 0,10 |
| M6 | 1072 | 7,82 | 21,8 | 0,36 (0,28; 0,44) | <0,0001 | 78 % | 0,09 |
Dans le Tableau 4, le premier groupe de résultats correspond à l'analyse étendue, qui regroupe la totalité des essais. Le second groupe présente l'analyse limitée après élimination des études anormales (retrait de #15, #24 et #28). Finalement, l'analyse réduite est proposée, après élimination des études dont le bras actif comportait moins de 30 patients ou dont l'appariement a été défaillant (retrait de #4, #13, #14, #17, #22 and #25). Ceci fut réalisé afin d’évaluer l'incidence sur les scores (MD, ES), et si l'hétérogénéité pouvait être améliorée par le retrait des études les plus incertaines. A l’évidence, les scores restaient stables tandis qu'une nette amélioration était enregistrée à la fois sur I2 (réduit de -10 à -12%) et sur τ2 (réduit de -0,05 à -0,09). Si l'hétérogénéité vraie I2 restait élevée de 71 à 78%, l'hétérogénéité entre études a été clairement ramenée à un niveau acceptable.
Pour résumer, les mono-injections IA d'AH ont été constatées statistiquement meilleures que le placebo IA (p < 0,001) à chaque durée d'observation, pour le traitement symptomatique (douleur) de la gonarthrose. La taille d'effet (ES) atteignait 0,39 ou 0,40 à M6, ce qui est cliniquement pertinent.
Risque de biais
Il y avait des risques probables de biais dans plusieurs études. En premier lieu, pour les études aux résultats anormaux, pouvant induire la suspicion:
-
•
#15:57 Dans cette étude de préparation autologue (PRGF), Durolane a été utilisé comme contrôle, et pour la première fois dans notre expérience de la VS, absolument aucune amélioration n’était observée par rapport à la baseline, mais plutôt une légère dégradation dans le bras IA AH (confirmée dans le graphique).
-
•
#24:64 Dans cette étude de traitements alternatifs (préparation autologue PRP ou ozone IA), l'Ostenil-Plus a été utilisé comme contrôle. Après observation d'une réponse à l'AH IA anormalement bénéfique à M1 et M3, l'effet fut brutalement réduit, devenant insignifiant à M6, ce qui est surprenant.
-
•
#28:68 Dans cette étude ouverte bien documentée, un énorme effet placebo a été observé, et malgré un bon appariement du profil KL, notre comparateur placebo s'est révélé inapproprié. Selon nous, il n'y avait pas forcément de biais dans cette étude, mais peut-être un déficit dans nos données disponibles.
Dans l'analyse réduite, avec le retrait des études de profil KL mal appariées au placebo, ou de population faible (< 30 patients/bras), l'hétérogénéité entre études a été améliorée, confirmant la solidité du score moyen, inchangé par rapport à l'analyse étendue. Nous considérons donc le risque de biais comme acceptable, sans incidence sur ce résultat de synthèse.
Analyses par sous-groupes
Les résultats des sous-groupes sont décrits dans le Tableau 5. Les ES obtenues à M3 et M6 pour les sous-groupes Synvisc-One et Durolane sont proches de celles présentées au Tableau 4 pour l'analyse limitée. L’évaluation de Synvisc-One était basée sur 8 bras d'essais et Durolane sur 5 bras, après retrait de l’étude #15. Comme montré dans les graphiques en forêt des Figures 2 à 5, il y a des différences entre essais, à l'intérieur de chaque sous-groupe. Cette synthèse par sous-groupe permet de conclure que ces deux produits présentent des performances similaires, aucun n’étant constaté meilleur que l'autre. A M1 et M2, les résultats sont moins consistants en raison des populations réduites et des difficultés pour définir le comparateur placebo idéal. Quelques améliorations des indicateurs d'hétérogénéité I2 et τ2, ont été observées pour le sous-groupe Synvisc-One, mais aucune pour le sous-groupe Durolane.
Discussion
Recoupement des méthodes
Deux approches ont été utilisées pour atteindre le résultat synthétique final d'une ES versus placebo injecté pour les mono-injections IA d'AH.
Dans la première approche, nous avions à évaluer ES (IC 95%) pour chaque essai et donc sélectionner un bras placebo convenable pour apparier les profils KL. Ensuite, la méta-analyse fut réalisée avec MIX 2.0, procurant des résultats en ES (IC 95%), une représentation graphique en forêt, et une synthèse basée sur la méthode à effet fixe.
Dans la seconde approche dite « globale », nous avons d'abord rassemblé les variations depuis la baseline pour chaque sous-groupe, en pondérant selon la taille de population de chaque essai. Puis, après sélection du placebo assemblé, appariant les profils KL, nous avons calculé ES (IC 95%) pour chaque sous-groupe. Bien qu'elle ne procure pas ES individuellement pour chaque essai, cette méthode nous a permis de représenter graphiquement les variations du WOMAC A depuis la baseline, comme une fonction du temps (Figure 7), en comparant chaque sous-groupe avec son placebo. Les différences ont toujours été significativement en faveur de l'AH IA à chaque durée, de M1 à M6. On peut voir l'importance de l'effet du placebo IA et sa part contribuant à l'amélioration du patient, comme ceci a été souligné par Altman,10 et Bannuru.6,9,11
Figure 7.
Variations depuis baseline par sous-groupe et groupe
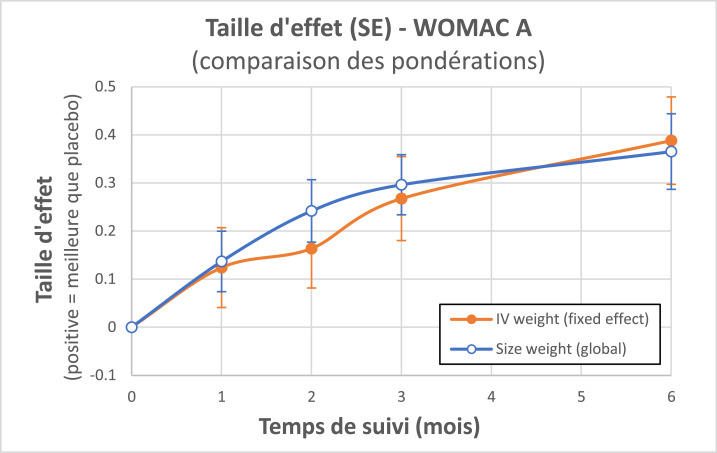
Finalement, comme illustré par la Figure 8, les différences n’étaient pas si grandes entre ces méthodes, quantifiant ES de 0,37 à 0,39 (maximum à M6) dans la comparaison vs placebo IA. En termes de différences des variations de score (MD) selon les populations analysées (Tableau 4), nous avons obtenu MD = 8,27 à 8,59 mm sur l’échelle 0-100 mm. Ceci apparait comme cliniquement pertinent, étant supérieur à la fois à la différence minimale cliniquement importante (MCDI = 7,5 mm pour l'amélioration) et à la plus petite différence détectable (SDD = 8,1 mm), définies par Angst.71
Figure 8.
Taille d'effet en fonction du temps: comparaison des méthodes de pondération
Résumé et niveau de preuve
D'un point de vue de la médecine basée sur les preuves, notre méta-analyse ne peut prétendre atteindre un niveau I ou II, parce que toutes les conceptions d'essais ont été acceptées, depuis les RCT en double-aveugle jusqu'aux études observationnelles ouvertes. Notre objectif était de rechercher la plus grande base de données et d’être proche de la vie réelle. Nous pensons que c'est un succès d'avoir réuni plus de 4 000 patients dans cette méta-analyse et qu'ainsi une bonne représentativité des mono-injections IA d'AH a été obtenue.
Pour répondre à la question de l'efficacité relative d'une mono-injection d'AH IA, comparée à des injections multiples, nous avons comparé nos résultats avec ceux obtenus sur la douleur (WOMAC A et/ou EVA) dans d'autres méta-analyses,2, 3, 4, 5, 6 où la grande majorité des données provenait de traitements à injections multiples:
-
•
Bannuru2 a trouvé ES = 0,46 (0,28; 0,65) avec I2 = 75% à M2, et ES = 0,25 (0,15; 0,36) avec I2 = 60% à M3.
-
•
Rutjes3 a trouvé ES = 0,37 (0,28; 0,46) avec τ2 = 0,09.
-
•
Colen4 a trouvé MD = 10,20 mm (4,42; 15,97) avec I2 = 92%.
-
•
Miller5 a trouvé SMD = 0,43 (0,36; 0,60) avec I2 = 73 % à 4-13 semaines et SMD = 0,38 (0,21; 0,55) avec I2 = 75% à 14-26 semaines.
-
•
Bannuru6 a trouvé ES=0,34 (0,26; 0,42).
Selon la taille d'effet (ES ou SMD), tous ces résultats sont très proches des nôtres et l'hétérogénéité est présente à niveau comparable. Les différences entre produits ont été étudiées par Colen,4 mais ces résultats sont limités à quelques produits en multi-injection injections. Plus récemment, Altman8 a étudié ES selon le poids moléculaire (Mw) et trouvé ES = 0,52 (0,48; 0,56) pour les Mw élevés (> 3 MDa) et ES = 0,31 (0,20; 0,42) pour les Mw modérés (1,5 – 3 MDa). Nos résultats du Tableau 5 sont en gros comparables, mais un peu plus faibles pour les sous-groupes de Mw élevé Synvisc-One et Durolane, et un peu plus forts pour le sous-groupe des autres AH IA de Mw modéré. En d'autres termes, nous avons trouvé peu de différence entre les produits de Mw élevé ou modéré.
Pour résumer, dans le traitement symptomatique de la gonarthrose par injections IA d'AH, les résultats des mono-injections montrent une efficacité similaire à celle des multi-injections en termes de MD, ES (ou SMD) et p-valeur lors de la comparaison avec le placebo IA.
Limites
Il y a de nombreuses limites à notre analyse, y compris la réalisation de comparaisons post-hoc versus placebo, lorsqu'aucun contrôle placebo n’était disponible. Les données exploitées furent obtenues à partir de multiples études, originaires de différents pays, avec des patients et des médecins différents. Ceci a induit des possibilités de différence sans relation avec les traitements utilisés, avec un risque de biais, en particulier au niveau des essais individuels; cependant, pour chaque synthèse par sous-groupe, basée sur une population plus importante, les résultats furent comparés de manière appropriée et confirmés en utilisant de multiples approches statistiques et méthodes de pondération.
Conclusions
Les résultats de cette méta-analyse suggèrent que les mono-injections d'AH procurent des résultats similaires à ceux des multi-injections d'AH IA en termes de soulagement de la douleur dans le traitement de la gonarthrose.
Remerciements
L'auteur remercie le Professeur Thierry Thomas, rhumatologue, chef du service de Rhumatologie, CHU, St Etienne, France, pour ses conseils avisés dans la conception de cette méta-analyse, l'interprétation des résultats, et la rédaction de cet article.
Conflits d'intérêt
Cette méta-analyse a été intégralement sponsorisée par LCA Pharmaceutical, Chartres, France. Aucune contribution du gouvernement ni d'aucune autre organisation n'a été utilisée. Patrice Vincent est employé et actionnaire de LCA Pharmaceutical.
Références
- 1.Moher D., Liberati A., Tetzlaff J., Altman D.G. the PRISMA group. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. PLoS Medicine. July 2009;6(7) doi: 10.1371/journal.pmed.1000097. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Bannuru R.R., Natov N.S., Dasi U.R., Schmid C.H., McAlindon T.E. Therapeutic trajectory following intra-articular hyaluronic acid injection in the treatment of knee osteoarthritis – meta-analysis. Osteoarthritis Cartilage. 2011;19:611–619. doi: 10.1016/j.joca.2010.09.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Rutjes A.W.S., Jüni P., da Costa B.R., Trelle S., Nüesch E., Reichenbach S. Viscosupplementation for Osteoarthritis of the Knee. A systematic review and meta-analysis. Annals of Internal Medicine. 2012;157(3):180–191. doi: 10.7326/0003-4819-157-3-201208070-00473. [DOI] [PubMed] [Google Scholar]
- 4.Colen S., Van den Bekerom, Mulier M., Haverkamp D. Hyaluronic acid in the treatment of knee osteoarthritis. A systematic review and meta-analysis wirh emphasis on the efficacy of different products. Biodrugs. 2012;26(4):257–268. doi: 10.2165/11632580-000000000-00000. [DOI] [PubMed] [Google Scholar]
- 5.Miller L.E., Block J.E. US-approved intra-articular hyaluronic acid injections are safe and effective in patients with knee osteoarthritis: Systematic review and meta-analysis of randomized, saline-controlled trials. Clinical medicine insights Arthritis and musculoskeletal disorders. 2013;6:57–63. doi: 10.4137/CMAMD.S12743. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Bannuru R.R., Schmid C.H., Kent D.M., Vaysbrot E.E., Wong J.B., McAlindon T.E. Comparative Effectiveness of Pharmacologic Interventions for Knee Osteoarthritis - A Systematic Review and Network Meta-analysis. Annals of Internal Medicine. 2015;162(1):46–55. doi: 10.7326/M14-1231. [DOI] [PubMed] [Google Scholar]
- 7.Campbell K.A., Erickson B.J., Saltzman B.M., Mascarenhas R., Bach Jr B.R., Cole B.J., Verma N.N. Is local viscosupplementation injection clinically superior to other therapies in the treatment of osteoarthritis of the knee: A systematic review of overlapping meta-analyses. J of Arthroscopic and Related Surgery. 2015;10:1–10. doi: 10.1016/j.arthro.2015.03.030. [DOI] [PubMed] [Google Scholar]
- 8.Altman R.D., Bedi A., Karlsson J., Sancheti P., Schemitsch E. Product differences in intra-articular hyaluronic acids for osteoarthritis of the knee. The American Journal of Sports and Medicine. 2015;44(8):2158–2165. doi: 10.1177/0363546515609599. [DOI] [PubMed] [Google Scholar]
- 9.Bannuru R.R., McAlindon T.E., Sullivan M.C., Wong J.B., Kent D.M., Schmid C.H. Effectiveness and implications of alternative placebo treatments. A systematic review and network meta-analysis of osteoarthritis trials. Ann Intern Med. 2015;163(5):365–372. doi: 10.7326/M15-0623. [DOI] [PubMed] [Google Scholar]
- 10.Altman R.D., Devji T., Bhandari M., Fierlinger A., Niazi F., Christensen R. Clinical benefit of intra-articular saline as a comparator in clinical trials of knee osteoarthritis treatments: a systematic review and meta-analysis of randomized trials. Seminars in Arthritis and Rheumatism. 2016;46:151–159. doi: 10.1016/j.semarthrit.2016.04.003. [DOI] [PubMed] [Google Scholar]
- 11.Bannuru R.R., Osani M., Vaysbrot E.E., McAlindon T.E. Comparative safety profile of hyaluronic acid products for knee osteoarthritis: a systematic review and network meta-analysis. Osteoarthritis and Cartilage. 2016;24:2022–2041. doi: 10.1016/j.joca.2016.07.010. [DOI] [PubMed] [Google Scholar]
- 12.Bellamy N., Campbell J., Robinson V., Gee T., Bourne R., Wells G. Viscosupplementation for the treatment of osteoarthritis of the knee. Cochrane Database Syst Rev. 2006 Apr 19;(2) doi: 10.1002/14651858.CD005321.pub2. Review. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Cohen J. Lawrence Erlbaum Associates; Hillsdale, NJ: 1988. Statistical power analysis for the behavioral sciences (2nd edition) [Google Scholar]
- 14.Lindqvist U., Tolmachev V., Kairemo K., Astrom G., Jonsson E., Lundqvist H. Elimination of stabilised hyaluronan from the knee joint in healthy men. Clin Pharmacokinet. 2002;41(8):603–613. doi: 10.2165/00003088-200241080-00004. [DOI] [PubMed] [Google Scholar]
- 15.Skwara A., Ponelis R., Tibesku C.O., Rosenbaum D., Fuchs-Winkelmann S. Gait patterns after intra-articular treatment of patients with osteoarthritis of the knee – Hyaluronan versus triamcinolone: a prospective, randomized, doubleblind, monocentric study. Eur J Med Res. 2009;14:157–164. doi: 10.1186/2047-783X-14-4-157. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.ClinicalTrials.gov. Identifier: NCT00988091. Investigation of 1.2% sodium hyaluronate for treatment of painful chronic osteoarthritis of the knee. https://clinicaltrials.gov/ct2/show/study/NCT00988091?sect=X01256.
- 17.Palmieri B., Rottigni V., Iannitti T. Preliminary study of highly cross-linked hyaluronic acid-based combination therapy for management of knee osteoarthritis-related pain. Drug Design, Development & Therapy. 2013;7:7–12. doi: 10.2147/DDDT.S37330. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.McGrath A.F., McGrath A.M., Jessop Z.M., Gandham S., Datta G., Dawson-Bowling S., Cannon S.R. A comparison of intra-articular hyaluronic acid competitors in the mild to moderate knee osteoarthritis. J Arthritis. 2013;2:108. [Google Scholar]
- 19.Yan C.H., Chan W.L., Yuen W.H., Yung P.S., Ip K.Y., Fan J.C., Chiu K.Y. Efficacy and safety of hylan G-F 20 injection in treatment of knee osteoarthritis in Chinese patients: results of a prospective, multicentre, longitudinal study. Hong Kong Med J. 2015 Aug;21(4):327–332. doi: 10.12809/hkmj144329. Epub 2015 Jun 19. [DOI] [PubMed] [Google Scholar]
- 20.Saturveithan C., Premganesh G., Fakhrizzaki S., Mahathir M., Karuna K., Rauf K., William H., Akmal H., Sivapathasundaram N., Jaspreet K. Intra-articular hyaluronic acid (HA) and platelet rich plasma (PRP) versus hyaluronic acid (HA) injection alone in patients with grade III and IV knee osteoarthritis (OA): a retrospective study on functional outcome. Malaysian Orthopaedic Journal. 2016;10(2):35–40. doi: 10.5704/MOJ.1607.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Rosen J., Sancheti P., Fierlinger A., Niazi F., Johal H., Bedi A. Cost-effectiveness of different forms of intra-articular injections for the treatment of osteoarthritis of the knee. Adv Ther. 2016;33:998–1011. doi: 10.1007/s12325-016-0331-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Das Saubhik, Narendran Saurabh, Singh Navin Kumar. How efficacious are intra-articular viscosupplements in the management of early osteoarthritis? A detailed comparative study with various outcome measures. International Journal of Orthopaedics Sciences. 2017;3(1):426–430. [Google Scholar]
- 23.Hafez M.A., Askar M., Nabeel A., Hassan K.O., Khalifa A.M.S. Comparison between four types of single-dose hyaluronic acid in patients with knee osteoarthritis: a randomized control trial. Remedy Open Access. 2017;2(article 1063):1–4. [Google Scholar]
- 24.Henrotin Y., Berenbaum F., Chevalier X., Marty M., Richette P., Rannou F. Reduction of the serum levels of a specific biomarker of cartilage degradation (Coll2-1) by hyaluronic acid (KARTILAGE® CROSS) compared to placebo in painful knee osteoarthritis patients: the EPIKART study, a pilot prospective comparative randomized double blind trial. BMC Musculoskeletal Disorders. 2017;18:222. doi: 10.1186/s12891-017-1585-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Conrozier T., Jerosch J., Beks P., Kemper F., Euller-Ziegler L., Bailleul F., Chevalier X. Prospective, multi-centre, randomised evaluation of the safety and efficacy of five dosing regimens of viscosupplementation with hylan G-F 20 in patients with symptomatic tibio-femoral osteoarthritis: a pilot study. Arch Orthop Trauma Surg. 2009 Mar;129(3):417–423. doi: 10.1007/s00402-008-0601-2. Epub 2008 Mar 26. [DOI] [PubMed] [Google Scholar]
- 26.Di Martino A., Tentoni F., Di Matteo B., Cavicchioli A., Lo Presti M., Filardo G., Zaffagnini S., Marcacci M., Kon E. Early viscosupplementation after anterior cruciate ligament reconstruction: A randomized controlled trial. The American Journal of Sports Medicine. 2016;44(10):2572–2578. doi: 10.1177/0363546516654909. [DOI] [PubMed] [Google Scholar]
- 27.Filardo G., Di Matteo B., Tentoni F., Cavicchioli A., Di Martino A., Lo Presti M., Iacono F., Kon E., Marcacci M. No effects of early viscosupplementation after arthroscopic partial menisectomy: A randomized controlled trial. The American Journal of Sports Medicine. 2016;44(12):3119–3125. doi: 10.1177/0363546516660070. [DOI] [PubMed] [Google Scholar]
- 28.Wang Y., Shimmin A., Ghosh P., Marks P., Linklater J., Connell D., Hall S., Skerrett D., Itescu S., Cicuttini F.M. Safety, tolerability, and joint structural outcomes of a single intra-articular injection of allogeneic mesenchymal precursor cells in patients following anterior cruciate ligament reconstruction: a controlled double-blind randomized trial. Arthritis Research and Therapy. 2017;19:180. doi: 10.1186/s13075-017-1391-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Suppan V.K.L., Wei C.Y., Siong T.C., Mei T.M., Chern W.B., Nanta Kumar V.K., Sheng K.R., Rao A.S. Randomized controlled trial comparing efficacy of conventional and new larger dose of intra-articular viscosupplementation in management of knee osteoarthritis. Journal of Orthopaedic Surgery. 2017;25(3):1–6. doi: 10.1177/2309499017731627. [DOI] [PubMed] [Google Scholar]
- 30.Yengkhom J.S., Nongmaithem R.S., Chongrellen Chiru M.S., Thakur K.B., Debnath U. Efficacy of single-dose intra-articular injection of high-molecular-weight hyaluronic acid in patients suffering from primary osteoarthritis of the knee. Indian Journal of Physical Medicine and Rehabilitation. 2017;28(3):89–94. (Sept) [Google Scholar]
- 31.Zoboli A.A.C., de Rezende M.U., de Campos G.C., Pasqualin T., Frucchi R., de Camargo O.P. Prospective randomized clinical trial : single and weekly viscosupplementation. Acta Ortop Bras. 2013;21(5):271–275. doi: 10.1590/S1413-78522013000500006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Ozcamdalli M., Misir A., Kizkapan T.B., Uzun E., Duygulu F., Yazici A., Kafadar I.H. Comparison of intra-articular injection of hyaluronic acid and N-acetyl cysteine in the treatment of knee osteoarthritis: A pilot study. Cartilage. 2017;8(4):384–390. doi: 10.1177/1947603516675915. journals.sagepub.com/CAR [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Strand V., Lim S., Takamura J. Evidence of safety of retreatment with a single intra-articular injection of Gel-200 for treatment of osteoarthritis of the knee from double-blind pivotal and open-label retreatment clinical trials. BMC Musculoskeletal Disorders. 2016;17:240. doi: 10.1186/s12891-016-1101-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Ohtori S., Orita S., Yamauchi K., Eguchi Y., Ochiai N., Kishida S., Kuniyoshi K., Aoki Y., Nakamura J., Ishikawa T., Miyagi M., Kamoda H., Suzuki M., Kubota G., Sakuma Y., Oikawa Y., Inage K., Sainoh T., Sato J., Shiga Y., Abe K., Fujimoto K., Kanamoto H., Toyone T., Inoue G., Takahashi K. Efficacy of direct injection of etanercept into knee joints for pain in moderate and severe knee osteoarthritis. Yonsei Med J. 2015 Sep;56(5):1379–1383. doi: 10.3349/ymj.2015.56.5.1379. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Khanasuk Y., Dechmaneenin T., Tanavalee A. Prospective randomized trial comparing the efficacy of single 6-mL injection of hylan G-F 20 and hyaluronic acid for primary knee arthritis: a preliminary study. J Med Assoc Thai. 2012;95(Suppl.10):S92–S97. [PubMed] [Google Scholar]
- 36.Polacco A., Beomonte-Zobel B., Polacco M., Scarlata S., Gasparro F., Del Vescovo R., Scarciolla L. The effect of intra-articular hyaluronic acid (Sinovial One) on knee osteoarthritis: a preliminary study. European Journal of Inflammation. 2013;11(3):847–853. [Google Scholar]
- 37.Hussain S., Rather H., Qayoom A. Efficacy, tolerability and adverse events of single-shot intra-articular hyaluronic acid injection in knee osteoarthritis. J Trauma Treat. 2015;4:3. [Google Scholar]
- 38.Lee J.K., Choi C.H., Oh K.J., Kyung H.S., Yoo J.H., Ha C.W., Bin S.I., Kang S.B., Kim M.K., Lee J.H., Lee M.C. Safety and efficacy of bi-annual intra-articular LBSA0103 injections in patients with knee osteoarthritis. Rheumatology International. 2017 doi: 10.1007/s00296-017-3803-5. (August) [DOI] [PubMed] [Google Scholar]
- 39.Dernek B., Duymus T.M., Koseoglu P.K., Aydin T., Kesiktas F.N., Aksoy C., Mutlu S. Efficacy of single-dose hyaluronic acid productd with two different structures with early-stage knee osteoarthritis. J Phys Ther Sci. 2016 Nov;28(11):3036–3040. doi: 10.1589/jpts.28.3036. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.MONOVISC™ Summary of safety and effectiveness data – main study: protocol 0702. PMA application number: P090031 February 25, 2014. https://www.accessdata.fda.gov/cdrh_docs/pdf9/P090031B.pdf.
- 41.Frampton J.E. Hylan GF-20 single-injection formulation. Drugs Aging. 2010;27(1):77–85. doi: 10.2165/11203900-000000000-00000. [DOI] [PubMed] [Google Scholar]
- 42.Belzile E.L., Deakon R.T., Vannabouathong C., Bhandari M., Lamontagne M., McCormack R. Cost-utility of a single-injection combined corticosteroid-hyaluronic acid formulation vs a 2-injection regimen of sequential corticosteroid and hyaluronic acid injections. Clinical Medicine Insights: Arthritis and Musculoskeletal Disorders. 2017;10:1–10. doi: 10.1177/1179544117712993. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Chevalier X., Jerosch J., Goupille P., van Dijk N., Luyten F.P., Scott D.L., Bailleul F., Pavelka K. Single, intra-articular treatment with 6 ml hylan G-F 20 in patients with symptomatic primary osteoarthritis of the knee: a randomised, multicentre, double-blind, placebo controlled trial. Ann Rheum Dis. 2010 Jan;69(1):113–119. doi: 10.1136/ard.2008.094623. Online first March 2009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Pal S., Thuppal S., Reddy K.J., Avasthi S., Aggarwal A., Bansal H., Mohanasundaram S., Bailleul F. Long-term (1-year) safety and efficacy of a single 6-mL injection of hylan G-F 20 in indian patients with symptomatic knee osteoarthritis. Bentham: Open Rheumatology Journal. 2014;8:54–68. doi: 10.2174/1874312901408010054. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Petrella R.J., Emans P.J., Alleyne J., Dellaert F., Gill D.P., Maroney M. Safety and performance of Hydros and Hydros-TA for knee osteoarthritis: a prospective, multicenter, randomized, double-blind feasibility trial. BMC Musculoskelet Disord. 2015 Mar 18;16:57. doi: 10.1186/s12891-015-0513-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Dreiser R.L., Avouac B., Bardin T.Efficacy of one intra-articular injection of 2% natural sodium hyaluronate is non-inferior to chemically crosslinked hylan G-F 20 in the treatment of painful tibiofemoral osteoarthritis. P 308, WCO-IOF-ESCEO World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases, 26-29 March 2015, Milan, Italy
- 47.Tammachote N., Kanitnate S., Yakumpor T., Panichkul P. Intra-Articular, Single-Shot Hylan G-F 20 Hyaluronic Acid Injection Compared with Corticosteroid in Knee Osteoarthritis: A Double-Blind, Randomized Controlled Trial. J Bone Joint Surg Am. 2016 Jun 1;98(11):885–892. doi: 10.2106/JBJS.15.00544. [DOI] [PubMed] [Google Scholar]
- 48.Sun S.F., Hsu C.W., Lin H.S., Liou I.H., Chen Y.H., Hung C.L. Comparison of single intra-articular injection of novel hyaluronan (Hya-Joint Plus) with Synvisc-One for Knee Osteoarthritis: A randomized, controlled, double-blind trial of efficacy and safety. J Bone Joint Surg Am. 2017 Mar 15;99(6):462–471. doi: 10.2106/JBJS.16.00469. [DOI] [PubMed] [Google Scholar]
- 49.De Campos G.C., Rezende M.U., Pailo A.F., Frucchi R., Camargo O.P. Adding triamcinolone improves viscosupplementation: A randomized clinical trial. Clin Orthop Relat Res. 2013;471:613–620. doi: 10.1007/s11999-012-2659-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Keary P., Popple A.E., Warren J., Davis T., Bellamy N., for the LOBRAS study group Improvement in condition-specific and generic quality of life outcomes in patients with knee osteoarthritis following Synvisc-One: Results from the LOBRAS study. Current Medical Research and Opinion. 2017 doi: 10.1080/03007995.2016.1260533. [DOI] [PubMed] [Google Scholar]
- 51.Altman R.D., Akermark C., Beaulieu A.D., Schnitzer T., Durolane International Study Group Efficacy and safety of a single intra-articular injection of non-animal stabilized hyaluronic acid (NASHA) in patients with osteoarthritis of the knee. Osteoarthritis Cartilage. 2004 Aug;12(8):642–649. doi: 10.1016/j.joca.2004.04.010. [DOI] [PubMed] [Google Scholar]
- 52.Arden N.K., Akermark C., Andersson M., Todman M.G., Altman R.D. A randomized saline-controlled trial of NASHA hyaluronic acid for knee osteoarthritis. Current Medical Research and Opinion. 2014;30(2):279–286. doi: 10.1185/03007995.2013.855631. [DOI] [PubMed] [Google Scholar]
- 53.Leighton R., Akermark C., Therrien R., Richardson J.B., Andersson M., Todman M.G., Arden N.K., DUROLANE Study Group NASHA hyaluronic acid vs. methylprednisolone for knee osteoarthritis: a prospective, multi-centre, randomized, non-inferiority trial. Osteoarthritis and Cartilage. 2014;22(1):17–25. doi: 10.1016/j.joca.2013.10.009. (Jan)Epub 2013 Nov 1. [DOI] [PubMed] [Google Scholar]
- 54.Zhang H., Zhang K., Zhang X., Zhu Z., Yan S., Sun T., Guo A., Jones J., Steen R.G., Shan B., Zhang J., Lin J. Comparison of two hyaluronic acid formulations for safety and efficacy (CHASE) study in knee osteoarthritis: a multicenter, randomized, double-blind, 26-week non-inferiority trial comparing Durolane to Artz. Arthritis Res Ther. 2015 Mar 10;17:51. doi: 10.1186/s13075-015-0557-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Estades-Rubio F.J., Reyes-Martín A., Morales-Marcos V., Garcia-Piriz M., Garcia-Vera J.J., Pera¡n M., Marchal J.A., Montanez-Heredia E. Knee Viscosupplementation: Cost-effectiveness analysis between stabilized hyaluronic acid in a single injection versus five injections of standard hyaluronic acid. Int J Mol Sci. 2017 Mar 17;18(3) doi: 10.3390/ijms18030658. pii: E658. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Louis M.L., Magalon J., Jouve E., Bornet C.E., Mattei J.C., Chagnaud C., Rochwerger A., Veran J., Sabatier F. Growth factors levels determine efficacy of platelets rich plasma injections in knee osteoarthritis : a randomized double blind non-inferiority trial compared with viscosupplementation. Arthroscopy. 2018 Jan 20 doi: 10.1016/j.arthro.2017.11.035. pii: S0749-8063(17)31481-0. [DOI] [PubMed] [Google Scholar]
- 57.Vaquerizo V., Plasencia M.A., Arribas I., Seijas R., Padilla S., Orive G., Anitua E. Comparison of intra-articular injections of plasma rich in growth factors (PRGF-Endoret) versus Durolane hyaluronic acid in the treatment of patients with symptomatic osteoarthritis: a randomized controlled trial. Arthroscopy. Oct 2013;29(10):1635–1643. doi: 10.1016/j.arthro.2013.07.264. [DOI] [PubMed] [Google Scholar]
- 58.Baron D., Flin C., Porterie J., Despaux J., Vincent P. Hyaluronic acid single injection in knee osteoarthritis : a multi-center open prospective study (ART-ONE 75) with placebo post-hoc comparison. Current Therapeutic Research. 2018;88C:35–46. doi: 10.1016/j.curtheres.2018.04.001. https://doi.org/10.1016.j.curtheres.2018.04.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Diraçoglu D., Tunçay T.B., Sahbaz T., Aksoy C. Single versus multiple dose hyaluronic acid: Comparison of the results. J Back Musculoskelet Rehabil. 2016 Nov 21;29(4):881–886. doi: 10.3233/BMR-160714. [DOI] [PubMed] [Google Scholar]
- 60.Hangody L., Szody R., Lukasik P., Zgadzaj W., Lenart E., Dokoupilova E., Bichovsk D., Berta A., Vasarhelyi G., Ficzere, Hangody G., Stevens G., Szendroi M.Intraarticular injection of a cross-linked sodium hyaluronate combined with triamcinolone hexacetonide (Cingal) to provide symptomatic relief of osteoarthritis of the knee: A randomized, double-blind, placebo-controlled multicenter clinical trial. Cartilage 2017: 1-8 journals.sagepub.com/CAR. doi: 10.1177/1947603517703732. [DOI] [PMC free article] [PubMed]
- 61.Strand V., Baraf H.S., Lavin P.T., Lim S., Hosokawa H. A multicenter, randomized controlled trial comparing a single intra-articular injection of Gel-200, a new cross-linked formulation of hyaluronic acid, to phosphate buffered saline for treatment of osteoarthritis of the knee. Osteoarthritis Cartilage. 2012 May;20(5):350–356. doi: 10.1016/j.joca.2012.01.013. Epub 2012 Feb 1. [DOI] [PubMed] [Google Scholar]
- 62.Takamura J., Takayuki S., Strand V. A single intra-articular injection of Gel-200 for treatment of symptomatic osteoarthritis of the knee is more effective than phosphate buffered saline at 6 months; a sub-group analysis of a multicenter, randomized controlled trial. Cartilage. 2018:1–6. doi: 10.1177/1947603518768015. journals.sagepub.com/CAR [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Borras-Verdera A., Calcedo-Bernal V., Ojeda-Levenfeld J., Clavel-Sainz C. Efficacy and safety of a single intra-articular injection of 2% hyaluronic acid and mannitol in knee osteoarthritis over a 6-month period. Rev Esp Cir Ortop Tramatol. 2012;56(4):274–280. doi: 10.1016/j.recot.2012.02.004. [DOI] [PubMed] [Google Scholar]
- 64.Duymus T.M., Mutlu S., Dernek B., Komur B., Aydogmus S., Kesiktas F.N.Choice of intra-articular injection in treatment of knee osteoarthritis: platelet-rich plasma, hyaluronic acid or ozone options. Knee Surg Sports Traumatol Arthrose. doi: 10.1007/s00167-016-4110-5. [DOI] [PubMed]
- 65.Lamo-Espinosa J.M., Mora G., Blanco J.F., Granero-Molto F., Nunez-Cordoba J.M., Sanchez-Echenique C., Bondia J.M., Damaso Aquerreta J., Andreu E.J., Ornilla E., Villaron E.M., Valenti-Azcarate A., Sanchez-Guijo F., del Canizo M.C., Valenti-Nin J.R., Prosper F. Intra-articular injections of two different doses of autologous bone marrow mesenchymal stem cells versus hyaluronic acid in the treatment of knee osteoarthritis: multicenter randomized controlled clinical trial (phase I/II) J Translational Medicine. 2016;14:246. doi: 10.1186/s12967-016-0998-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Conrozier T., Bozgan A.M., Bossert M., Sondag M., Lohse-Walliser A., Balblanc J.C. Standardized follow-up of patients with symptomatic knee osteoarthritis treated with a single intra-articular injection of a combination of cross-linked hyaluronic acid and mannitol. Clin Med Insights Arthritis Musculoskelet Disord. 2016 Sep 25;9:175–179. doi: 10.4137/CMAMD.S39432. eCollection 2016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 67.Monet M., Bozgan A.M., Conrozier T. Safety and efficacy of single intra-articular injection of a cross-linked hyaluronic acid/mannitol formulation (Happycross™) in knee osteoarthritis results of a prospective observational study in daily practice conditions. Ortho & Rheum Open Access J. 2017;5(3) OROAJ.MS.ID.555664. [Google Scholar]
- 68.Bashaireh K., Naser Z., Hawadya K.A., Sorour S., Al-Khateeb R.N. Efficacy and safety of cross-linked hyaluronic acid single injection on osteoarthritis of the knee: a post-marketing Phase IV study. Drug Des Devel Ther. 2015 Apr 8;9:2063–2072. doi: 10.2147/DDDT.S81524. eCollection 2015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69.Tuan S., Liou I., Su H., Tsai Y., Chen G., Sun S. Improvement of self-reported functional scores and thickening of quadriceps and femoral intercondylar cartilage under ultrasonography after single intra-articular injection of a novel cross-linked hyaluronic acid in the treatment of knee osteoarthritis. Journal of Back and Musculoskeletal Rehabilitation. 2018;1:1–10. doi: 10.3233/BMR-170950. [DOI] [PubMed] [Google Scholar]
- 70.Ha C.W., Park Y.B., Choi C.H., Kyung H.S., Lee J.H., Doo Yoo J., Yoo J.H., Choi C.H., Kim C.W., Kim H.C., Oh K.J., Bin S.I., Lee M.C. Efficacy and safety of single injection of cross-linked sodium hyaluronate vs. three injections of high molecular weight sodium hyaluronate for osteoarthritis of the knee: a double-blind, randomized, multi-center, non-inferiority study. BMC Musculoskeletal Disorders. 2017;18:223. doi: 10.1186/s12891-017-1591-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 71.Angst F., Aeschlimann A., Stucki G. Smallest Detectable and Minimal Clinically Important Differences for rehabilitation intervention with their implication for required sample sizes unsing WOMAC and SF-36 Quality of Life measurement instruments in patients with osteoarthritis of the lower extremities. Arthritis Care & Research. 2001;45:384–391. doi: 10.1002/1529-0131(200108)45:4<384::AID-ART352>3.0.CO;2-0. [DOI] [PubMed] [Google Scholar]