Abstract
Objective Our goal was to evaluate the modulation of the synovial fluid cells (SFC) from patients with and without osteoarthritis (OA) by bone morphogenetic protein 4 (BMP-4), Smad-3 and transforming growth factor beta (TGF-β).
Methods Synovial fluid was collected from patients submitted to knee arthroscopy or replacement and were centrifuged to isolate cells from the fluid. Cells were cultured for 21 days and characterized as mesenchymal stem cells (MSCs) according to the criteria of the International Society of Cell Therapy. Then, we performed an [3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide] assay (MTT) assay after exposing cells with and without OA to TGF-β, Smad3 and BMP-4 pathway inhibitors and to different concentrations of BMP4.
Results Exposure to the TGF-β, Smad3 and BMP-4 inhibitors modifies the mitochondrial activity of the SFCs. The activity of the SFCs is modified by influences of increasing concentrations of BMP4, but there is no difference in cellular activity between patients with and without OA.
Conclusion TGF-β, Smad3 and BMP-4 modulate the activity of SFCs from patients with and without knee OA.
Keywords: mesenchymal stem cells, osteoarthritis, synovial fluid cells, TGF-β pathway
Introduction
Cellular therapy has been studied due to its potential application for the treatment of articular cartilage lesions and osteoarthritis (OA). 1 2 3 4 In this context, mesenchymal stem cells (MSCs) have been proven useful in tissue regeneration and treatment of many diseases. 3 Synovial fluid also holds a resident MSC population, which is increased in patients with OA. 5 Moreover, it was demonstrated that the number of cells was proportional to the severity of knee OA. 6
Transforming growth factor beta (TGF-β) seems to have central role in OA development, whether as a protective factor initially or taking part in the pathogenesis of the disease. 7 The TGF-β superfamily is a group of secreted polypeptides, including TGF-β1, 2, 3, activins, inhibin, bone morphogenetic proteins (BMPs), and growth and differentiation factors. 8 9 It acts in all steps of chondrogenesis and is the main trigger through mesenchymal precursors. 10 11 12 In the first stages of chondrocytes differentiation, TGF-β seems to have a stimulatory role. However, in the final stages, its action inhibits chondrocyte terminal differentiation. 12 13 Bone morphogenetic proteins are involved in all steps of chondrogenesis and are essential to endochondral ossification. Besides, many BMPs have been detected both in normal and osteoarthritic cartilage. 9
Senescence has impacts in both TGF-β and BPM pathways due to a decrease in receptors expression, and to a reduction in Smad3 activation. This could explain the close relationship between senescence and OA development. 14 Osteoarthritis patients have elevated levels of BMP-2 15 and BMP-7 16 in plasma and synovial fluid compared with healthy individuals. Besides, BMP-7 levels are correlated to OA radiographic progression magnitude. 17 However, the expression of BMP-4, which stimulates the synthesis of extracellular matrix in chondrocytes, is decreased in OA and rheumatoid arthritis (RA) synovial tissues, indicating an imbalance of joint homeostasis in joint disease. 18 The goal of the present study was to evaluate the role of BMP-4, Smad3 and TGF-β on synovial fluid cells (SFCs) viability from patients with and without OA.
Methods
Population and Collection of Synovial Fluid
The population of the present study was composed of patients submitted to knee surgical treatment in our Institute. Eligible patients from both genders were divided in two groups: patients without knee OA (W/O OA), Kellgren-Lawrence = 0, and patients with knee OA (W/OA), Kellgren-Lawrence > 2. Patients with knee infection, autoimmune diseases or submitted to prior surgery on the knee were excluded. Knee OA was graded according to the Kellgren and Lawrence classification using standard standing radiographs. 19 One milliliter of synovial fluid was collected from the knee joint from patients W/O OA at the beginning of the arthroscopy by syringe aspiration, just after the confection of the portals, and two milliliters from the knee joint of patients W/OA by syringe aspiration after arthrotomy. The present study was performed in line with the principles of the Declaration of Helsinki, and approval was granted by the Institutional Ethics Board (CAAE 08663912.3.0000.5273).
Isolation and Culture of Synovial Fluid Cells
Synovial fluid specimens were firstly centrifuged at 16,6 g for 5 minutes at room temperature, and then centrifuged at 1,600 g for 5 minutes at 4°C. The supernatant was stored in 1 mL aliquots at - 80°C for further analysis. The pellet from the first centrifugation was suspended in Iscove's Modified Dulbecco's Medium (IMDM, Sigma, Saint Louis, MO, USA) supplemented with 10% fetal bovine serum (FBS, Gibco, Thermo Fisher, Waltham, MA, USA). Cells were seeded at 5 to 7 × 10 5 cells per T-75 cm 2 culture flasks. After 24 hours, the cells were washed once with serum-free medium and the medium was changed. Cell cultures were maintained at 37°C in a humidified atmosphere containing 5% CO 2 . The medium was changed every 2 days. Cells were harvested and replated for expansion at 80% of confluence until the 3 rd passage. The identity SFCs was evaluated according to the protocol defined by the International Society of Cell Therapy 20 and was described in a previous study. 21
SFC Mitochondrial Activity by MTT
To evaluate the mitochondrial activity of the SFCs exposed to different BMP-4 concentrations, an essay of mitochondrial activity by MTT (3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyltetrazolium bromide) was performed. In a 96-well plate, 5 × 10 3 of SFCs from patients W/O OA ( n = 3) and W/OA ( n = 3) were seeded in 200 μL of medium/well and exposed to progressive concentrations of BMP-4 (0.1 nM, 0.5 nM, 2 nM and 10 nM), and were maintained at 37°C in a humidified atmosphere containing 5% CO 2 .
The control of mitochondrial activity of the SFCs from patients W/O OA ( n = 3) and W/OA ( n =3) was evaluated by the blockade of BMP-4, TGFβ and Smad3 pathways. As such, the SFCs were cultivated in the presence of the specific inhibitors of the targets Smad3 (Smad3 SiS3 566405, Millipore, Burlington, Massachusetts, EUA), BMP-4 (BMP inhibitor II DMH1 203646, Merckmillipore, Burlington, Massachusetts, EUA) and TGFβ (TGF-β1 R1 kinase 616451, Merckmillipore, Burlington, Massachusetts, EUA) at 10 nM.
After cell adherence, the culture medium was substituted by Iscove's medium (Sigma-Aldrich, San Luis, Missouri, EUA) supplemented with 1% fetal bovine serum (Sigma-Aldrich, San Luis, Missouri, EUA) containing the specific inhibitors for each treatment. The SFCs were treated with 100 µL of the respective control and experimental solutions at 37°C in a humidified atmosphere containing 5% CO 2 for 24, 48 and 72 hours. Then, the SFCs were washed twice with 200 µL PBS 1x sterile at 37°C, and 100 µL of the MTT solution (0,5mg/mL) was added to each well. The plate was maintained at 37°C in a humidified atmosphere containing 5% CO 2 for 4 hours.
After this period, the MTT solution was removed and 100 µL Dimethyl sulfoxide (DMSO) was added. The plate was agitated for 20 minutes before spectrophotometric analysis at 570 nM wavelength using the Glomaxmulti detection system (Glomaxmulti, detection System, Promega, Madison, Wisconsin, EUA). Analysis of the mitochondrial activity of the SFCs was measured after 24, 48 and 72 hours of exposure to each specific inhibitor and control. Control of mitochondrial activity was determined by MTT both by a well containing only medium with BMP-4 without cells (control/factor), and by wells containing only medium and cells, but without BMP-4.
Statistical Analysis
The MTT data were exported from the Glomaxmulti detection system (Glomaxmulti, detection System, Promega, Madison, Wisconsin, EUA) to a Microsoft Excel (Microsoft Corporation, Redmond, WA, USA) spreadsheet, analyzed in GraphPad Prism for Windows 6.0 (San Diego, California, EUA) and presented as average ± standard deviation (SD). To compare groups, two-way analysis of variance (ANOVA) was used, followed by one-tail unpaired Student t-test . Data were considered significant when p < 0.05.
Results
BMP-4 Modulates SFCs Viability
Mitochondrial activity by MTT did not evidence any differences between the samples of patients with and without knee OA when analyzed in each experimental situation, independent of BMP-4 concentration (p > 0.05). When the data were analyzed in relation to the rising concentrations of BMP-4, we verified that the mitochondrial activity of the SFCs from patients with OA increased progressively according to the exposition to higher concentrations of BMP-4 (0.1 nM 264.4 ± 11,94 versus 0.5 nM 562.8 ± 26.17, p < 0.0001; 0.5 nM 562.8 ± 26.17 versus 2 nM 1157 ± 40.45, p < 0.0001), decreasing at the exposure to the concentration of 10 nM (2 nM 1157 ± 40.45 versus 10 nM 124,9 ± 14.62, p < 0.0001), showing toxicity. The same was observed for the mitochondrial activity of the SFCs from patients without OA (0.1 nM 141.7 ± 20.83 versus 0.5 nM 496.3 ± 62.44, p < 0.0001; 0.5 nM 496.3 ± 62.44 versus 2 nM 1134 ± 69.22, p < 0.0001; 2 nM 1134 ± 69.22 versus 10 nM 168.2 ± 20.33, p < 0.0001) ( Figure 1 ).
Fig. 1.

Evaluation of mitochondrial activity of SFCs exposed to different concentrations of BMP-4. Comparison of the cellular viability of SFCs from patients with (W/OA) and without OA (W/O OA) exposed to different concentrations of BMP-4 did not show statistically significant differences between the groups ( p > 0.05), although mitochondrial activity has increased up to 2nM ( p < 0.001) and decreased at 10 nM ( p < 0.001) in both groups. Control/Cells: Well containing only cells without BMP-4; Control/Factor: Wells containing medium with BMP-4 without cells; * p < 0.001.
TGF-β, Smad3 and BMP-4 Inhibitors Control SFC Mitochondrial Activity
In the next step, we measured the mitochondrial activity of the SFCs after exposure to TGF-β, Smad3 and BMP-4 inhibitors by MTT (3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyltetrazolium bromide) assay. The SFCs from patients with and without knee OA were exposed to TGF-β (TGF-β1 R1 kinase 616451), Smad3 (Smad3 SiS3 566405) and BMP-4 (BMP inhibitor II DMH1 203646) inhibitors at the concentration of 10 nM. Then, mitochondrial activity was measured after 24, 48 and 72 hours.
The analysis ( Figure 2 ) evidenced a decrease of SFCs without OA activity after 24 hours in the presence of the TGF-β inhibitor (W/O OA 202.1 ± 6.09 versus W/O OA + TGF-β inhibitor 175.7 ± 9.56; n = 3/group; p = 0.016) and an increase of SFCs activity after 48 hours (W/O OA 190 ± 6.5 versus W/O OA + TGF-β inhibitor 242 ± 2.5; n = 3/group; p < 0.0001). No differences were found after 72 hours (W/O OA 134.3 ± 5.1 versus W/O OA + TGF-β inhibitor 135 ± 3.01; n = 3/group; p > 0.05). Regarding the SFCs from patients with OA, the analysis showed an increase of the SFC activity only after 48 hours in the presence of the TGF-β inhibitor (W/OA 215 ± 2.14 versus W/OA + TGF-β inhibitor 229.3 ± 4.16; n = 3/group; p = 0.0046). No differences were found after 24 hours (W/OA 175.2 ± 17.72 versus W/OA + TGF-β inhibitor 173.9 ± 10.34; n = 3/group; p > 0.05) and 72 hours (W/OA 140.7 ± 3.2 versus W/OA + TGF-β inhibitor 144 ± 3.6; n = 3/group; p > 0.05).
Fig. 2.
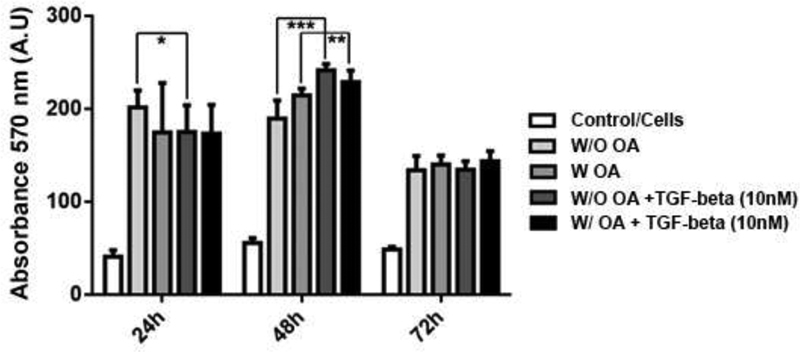
Mitochondrial activity of SFCs after TGF-β inhibitor treatment. A reduction of mitochondrial activity was observed in SFCs of W/O OA subjects after TGF-β inhibitor treatment for 24 hours ( p = 0.016) and an increase after 48 hours ( p < 0.0001), while no differences were found after 72 hours ( p > 0.05). On the other hand, the SFCs of W/OA subjects showed an increase in activity only after 48 hours in the presence of the inhibitor ( p = 0.0046), but no differences were observed after 24 hours and 72 hours ( p > 0.05).
The SFCs without OA activity reduced after 24 hours in the presence of the Smad3 inhibitor (W/O OA 202.1 ± 6.09 versus W/O OA + Smad3 inhibitor 189.7 ± 3.39; n = 3/group; p = 0.046), but it increased after 48 hours (W/O OA 190 ± 6.5 versus W/O OA + Smad3 inhibitor 224 ± 4.04; n = 3/group; p = 0.0002) and 72 hours (W/O OA 134.3 ± 5.17 versus W/O OA + Smad3 inhibitor 158 ± 6.5; n = 3/group; p = 0.006) in the presence of the Smad3 inhibitor. In relation to the SFCs from patients with OA, the analysis evidenced reduction of the activity only after 72 hours in the presence of the Smad3 inhibitor (W/OA 162 ± 3.7 versus W/OA + Smad3 inhibitor 151 ± 2; n = 3/group; p = 0.0102), No differences were found after 24 hours (W/OA 180 ± 7.4 versus W/OA + Smad3 inhibitor 318.2 ± 5.99; n = 3/group; p > 0.05) and 48 hours (W/OA 212.3 ± 6.5 versus W/OA + Smad3 inhibitor 206.7 ± 5.8; n = 3/group; p > 0.05) ( Figure 3 ).
Fig. 3.

Mitochondrial activity of SFCs after Smad3 inhibitor treatment. The activity of the SFCs of W/O OA subjects reduced after 24 hours of treatment using Smad3 inhibitor ( p = 0.046) but increased after 48 hours ( p = 0.0002) and 72 hours ( p = 0.006). On the other hand, the SFCs of W/OA subjects showed a reduction in activity only after 72 hours in the presence of the Smad3 inhibitor ( p = 0.0102), but no differences were found after 24 and 48 hours ( p > 0.05).
The SFCs without OA activity increased after 48 hours (W/O OA 134.3 ± 5.17 versus W/O + BMP-4 inhibitor 177.3 ± 14.45; n = 3/group; p = 0.0064) and 72 hours (W/O 173.3 ± 1.83 versus W/O + BMP-4 inhibitor 243.7 ± 13.15; n = 3/group; p < 0.0001) in the presence of the BMP-4 inhibitor. The SFCs with OA activity also increased after 48 hours (W/OA 159 ± 3.21 versus W/OA + BMP-4 inhibitor 218 ± 8.94; n = 3/group; p < 0.0001) and 72 hours (W/OA 158 ± 2.29 versus. BMP-4 inhibitor 240.3 ± 0.83; n = 3/group; p < 0.0001) in the presence of the BMP-4 inhibitor. There were no differences in the activity of the SFCs without OA (W/O 179.9 ± 16.27 versus W/O + BMP-4 inhibitor 156.8 ± 16.27; n = 3/group; p > 0.05) and with OA (W/OA 140.1 ± 14.59 versus BMP-4 inhibitor 172.9 ± 21.15; n = 3/group; p > 0.05) after 24 hours) in the presence of the BMP-4 inhibitor ( Figure 4 ).
Fig. 4.

Mitochondrial activity of SFCs after BMP4 inhibitor treatment. The activity of the SFCs of W/O OA subjects increased after 48 hours ( p = 0.0064) and 72 hours ( p < 0.0001) of treatment with the BMP-4 inhibitor. The activity of the SFCs of W/OA subjects also increased after 48 hours ( p < 0.0001) and 72 hours in the presence of the BMP-4 inhibitor ( p < 0.0001). There were no differences in activity neither between the SFCs of W/O OA nor W/OA subjects after treatment with BMP-4 inhibitor after 24 hours ( p > 0.05).
Discussion
We have previously documented that osteoarthritic synovial fluid modulates SFC viability in vitro . 21 Hence, we decided to investigate if the metabolic activity of SFCs could be modulated by BMP-4, Smad3 and TGF-β, due to the importance of these pathways in chondrogenesis.
Bone morphogenetic protein 4 stimulates aggrecan and collagen type II synthesis and suppresses chondrogenic hypertrophy, suggesting that it may be promising agent for cartilage repair induction. Bone morphogenetic protein modulation can be useful in chronic joint diseases since it can help the equilibrium between joint destruction and repair. 22 To elucidate how SFCs behave in the presence of exogenous BMP-4, in the present study, we showed that the metabolic activity of SFCs increases after exposure to progressive BMP-4 concentrations from 0.1 to 2 nM, suggesting that the SFCs are responding to BMP-4 induction in order to promote repair, maybe by stimulation of chondrogenic commitment, decreasing at 10 nM, which seems to be a concentration at which the system is already saturated, no longer influencing the fate of the SFCs. Moreover, there were no differences in this activity when comparing SFCs from patients with and without OA, indicating that, despite the inflammatory influence of OA on SFCs, they still maintain the ability to respond to BMP-4 signaling.
On the other hand, we also observed that mitochondrial activity raised after 48 and 72 hours in the presence of the BMP-4 inhibitor. It is widely known that BMP-4 modulates chondrogenesis and endochondral ossification, 23 and also participates in signaling for chondrocyte proliferation and hypertrophy to apoptosis and angiogenesis, which allows osteoblasts migration and ossification. Bone morphogenetic protein 4 receptor blockade led to decreased expression of BMP-4 signaling, and raised the metabolic activity of SFCs, suggesting that the chondrogenic step of SFC differentiation remained in the proliferative stage, which could explain the increased metabolic activity of SFCs. Despite the importance of BMP-4, we did not find studies regarding its influence on the behavior of SFCs . Other studies, however, verified that pretreatment of SFCs with TNF-α 24 and IL-1β 25 promoted their proliferation. Our results indicated that SFCs treatment both with BMP-4 or BMP-4 inhibitor may influence SFCs proliferation, depending on the magnitude of the stimuli.
The presence of TGF-β in the synovial fluid of patients with OA has an important role in the recruitment of MSC. Besides, synovial fluid from patients with OA can stimulate the expansion of MSC in culture of synovium cells of patients with OA, through stimulation of cell migration. 26 Another study showed that the continuous expression of TGF-β1 over synovium MSC stimulated their proliferation and chondrogenic potential. 27
During chondrogenesis, TGF-β is important for chondrocyte differentiation at the early stages and, ultimately, in chondrogenic induction, it inhibits terminal chondrocyte differentiation. 12 Moreover, TGF-β promotes growth, maintenance and articular cartilage repair through a fine regulation of its signaling pathway, which targets a set of transcription and growth factors. 28 Regulated cell phenomena include proliferation, migration, inflammation, carcinogenesis, extracellular matrix expression, protein synthesis and degradation, up to immune system functions. Therefore, many authors have affirmed that TGF-β pathway signaling has a central role in the development of OA. 7 12 14 29 As we observed in the present study, TGF-β blockade promoted a dynamic change in mitochondrial activity. In the first 24 hours, a reduction was observed in patients without OA in the presence of the TGF-β inhibitor. Smad3 receptor inhibition decreased activity only in the SFCs from patients without OA. Surprisingly, after 48 hours of inhibition, activity increased in the SFCs from patients with and without OA in the presence of the TGF-β inhibitor. Smad3 inhibition promoted an increase in the activity of SFCs only from patients without OA in this same period. After 72 hours of exposure to the TGF-β inhibitor, activity was similar in both group of SFCs, but it was increased in the presence of the Smad3 inhibitor in the case of SFCs from patients without OA and decreased in the ones with OA.
Conclusion
In conclusion, there are no differences in the mitochondrial activity of SFCs from patients with and without OA, independent of the BMP-4 concentration to which they have been exposed. Moreover, the activity of SFCs from patients with and without OA is modulated by TGF-β, Smad 3 and BMP-4 inhibitors.
Agradecimentos
Os autores agradecem ao Conselho Nacional de Desenvolvimento Científico e Tecnológico, à Fundação de Apoio à Pesquisa do Estado do Rio de Janeiro e ao Ministério da Saúde pelo apoio.
Acknowledgements
The authors thank the Conselho Nacional de Desenvolvimento Científico e Tecnológico , the Fundação de Apoio à Pesquisa do Estado do Rio de Janeiro and the Ministério da Saúde for the support.
Conflitos de Interesse Os autores declaram não haver conflitos de interesse.
Contribuições autorais
de Sousa EB Conceito e projeto, fornecimento de material de estudo ou pacientes, coleta e montagem de dados, análise e interpretação de dados, redação de manuscritos, aprovação final do manuscrito.
Moura Neto V.: Análise e interpretação de dados, aprovação final do manuscrito.
Aguiar D. P.: Conceito e projeto, coleta e montagem de dados, análise e interpretação de dados, redação de manuscritos, aprovação final do manuscrito.
Todos os autores leram e aprovaram o manuscrito final.
Author Contributions
de Souza E. B.: Concept and design, provision of study material or patients, collection and assembly of data, data analysis and interpretation, manuscript writing, final approval of the manuscript.
Moura Neto V.: Data analysis and interpretation, final approval of the manuscript.
Aguiar D. P.: Concept and design, collection and assembly of data, data analysis and interpretation, manuscript writing, final approval of the manuscript.
All authors read and approved the final manuscript.
Trabalho desenvolvido na Divisão de Ensino e Pesquisa, Instituto Nacional de Ortopedia e Traumatologia Jamil Haddad, Rio de Janeiro, RJ, Brasil.
Work developed at the Divisão de Ensino e Pesquisa, Instituto Nacional de Ortopedia e Traumatologia Jamil Haddad, Rio de Janeiro, RJ, Brazil.
Referências
- 1.Gupta P K, Das A K, Chullikana A, Majumdar A S. Mesenchymal stem cells for cartilage repair in osteoarthritis. Stem Cell Res Ther. 2012;3(04):25. doi: 10.1186/scrt116. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Johnson K, Zhu S, Tremblay M S.A stem cell-based approach to cartilage repair Science 2012336(6082):717–721. [DOI] [PubMed] [Google Scholar]
- 3.Barry F, Murphy M. Mesenchymal stem cells in joint disease and repair. Nat Rev Rheumatol. 2013;9(10):584–594. doi: 10.1038/nrrheum.2013.109. [DOI] [PubMed] [Google Scholar]
- 4.Pers Y M, Ruiz M, Noël D, Jorgensen C. Mesenchymal stem cells for the management of inflammation in osteoarthritis: state of the art and perspectives. Osteoarthritis Cartilage. 2015;23(11):2027–2035. doi: 10.1016/j.joca.2015.07.004. [DOI] [PubMed] [Google Scholar]
- 5.Jones E A, Crawford A, English A. Synovial fluid mesenchymal stem cells in health and early osteoarthritis: detection and functional evaluation at the single-cell level. Arthritis Rheum. 2008;58(06):1731–1740. doi: 10.1002/art.23485. [DOI] [PubMed] [Google Scholar]
- 6.Sekiya I, Ojima M, Suzuki S. Human mesenchymal stem cells in synovial fluid increase in the knee with degenerated cartilage and osteoarthritis. J Orthop Res. 2012;30(06):943–949. doi: 10.1002/jor.22029. [DOI] [PubMed] [Google Scholar]
- 7.van der Kraan P M, Goumans M J, Blaney Davidson E, ten Dijke P. Age-dependent alteration of TGF-β signalling in osteoarthritis. Cell Tissue Res. 2012;347(01):257–265. doi: 10.1007/s00441-011-1194-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Keller B, Yang T, Chen Y. Interaction of TGFβ and BMP signaling pathways during chondrogenesis. PLoS One. 2011;6(01):e16421. doi: 10.1371/journal.pone.0016421. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Mariani E, Pulsatelli L, Facchini A. Signaling pathways in cartilage repair. Int J Mol Sci. 2014;15(05):8667–8698. doi: 10.3390/ijms15058667. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Leonard C M, Fuld H M, Frenz D A, Downie S A, Massagué J, Newman S A. Role of transforming growth factor-beta in chondrogenic pattern formation in the embryonic limb: stimulation of mesenchymal condensation and fibronectin gene expression by exogenenous TGF-beta and evidence for endogenous TGF-beta-like activity. Dev Biol. 1991;145(01):99–109. doi: 10.1016/0012-1606(91)90216-p. [DOI] [PubMed] [Google Scholar]
- 11.Song J J, Aswad R, Kanaan R A. Connective tissue growth factor (CTGF) acts as a downstream mediator of TGF-beta1 to induce mesenchymal cell condensation. J Cell Physiol. 2007;210(02):398–410. doi: 10.1002/jcp.20850. [DOI] [PubMed] [Google Scholar]
- 12.van der Kraan P M, Blaney Davidson E N, Blom A, van den Berg W B. TGF-beta signaling in chondrocyte terminal differentiation and osteoarthritis: modulation and integration of signaling pathways through receptor-Smads. Osteoarthritis Cartilage. 2009;17(12):1539–1545. doi: 10.1016/j.joca.2009.06.008. [DOI] [PubMed] [Google Scholar]
- 13.Ballock R T, Heydemann A, Wakefield L M, Flanders K C, Roberts A B, Sporn M B. TGF-beta 1 prevents hypertrophy of epiphyseal chondrocytes: regulation of gene expression for cartilage matrix proteins and metalloproteases. Dev Biol. 1993;158(02):414–429. doi: 10.1006/dbio.1993.1200. [DOI] [PubMed] [Google Scholar]
- 14.van Caam A, Madej W, Thijssen E. Expression of TGFβ-family signalling components in ageing cartilage: age-related loss of TGFβ and BMP receptors. Osteoarthritis Cartilage. 2016;24(07):1235–1245. doi: 10.1016/j.joca.2016.02.008. [DOI] [PubMed] [Google Scholar]
- 15.Liu Y, Hou R, Yin R, Yin W. Correlation of bone morphogenetic protein-2 levels in serum and synovial fluid with disease severity of knee osteoarthritis. Med Sci Monit. 2015;21:363–370. doi: 10.12659/MSM.892160. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Honsawek S, Chayanupatkul M, Tanavalee A. Relationship of plasma and synovial fluid BMP-7 with disease severity in knee osteoarthritis patients: a pilot study. Int Orthop. 2009;33(04):1171–1175. doi: 10.1007/s00264-009-0751-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Caron M M, Emans P J, Cremers A. Hypertrophic differentiation during chondrogenic differentiation of progenitor cells is stimulated by BMP-2 but suppressed by BMP-7. Osteoarthritis Cartilage. 2013;21(04):604–613. doi: 10.1016/j.joca.2013.01.009. [DOI] [PubMed] [Google Scholar]
- 18.Bramlage C P, Häupl T, Kaps C. Decrease in expression of bone morphogenetic proteins 4 and 5 in synovial tissue of patients with osteoarthritis and rheumatoid arthritis. Arthritis Res Ther. 2006;8(03):R58. doi: 10.1186/ar1923. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Kellgren J H, Lawrence J S. Radiological assessment of osteo-arthrosis. Ann Rheum Dis. 1957;16(04):494–502. doi: 10.1136/ard.16.4.494. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Dominici M, Le Blanc K, Mueller I. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 2006;8(04):315–317. doi: 10.1080/14653240600855905. [DOI] [PubMed] [Google Scholar]
- 21.de Sousa E B, Dos Santos Junior G C, Aguiar R P. Osteoarthritic Synovial Fluid Modulates Cell Phenotype and Metabolic Behavior In Vitro. Stem Cells Int. 2019;2019:8.169172E6. doi: 10.1155/2019/8169172. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Miljkovic N D, Cooper G M, Marra K G. Chondrogenesis, bone morphogenetic protein-4 and mesenchymal stem cells. Osteoarthritis Cartilage. 2008;16(10):1121–1130. doi: 10.1016/j.joca.2008.03.003. [DOI] [PubMed] [Google Scholar]
- 23.Carreira A C, Alves G G, Zambuzzi W F, Sogayar M C, Granjeiro J M. Bone Morphogenetic Proteins: structure, biological function and therapeutic applications. Arch Biochem Biophys. 2014;561:64–73. doi: 10.1016/j.abb.2014.07.011. [DOI] [PubMed] [Google Scholar]
- 24.Shioda M, Muneta T, Tsuji K. TNFα promotes proliferation of human synovial MSCs while maintaining chondrogenic potential. PLoS One. 2017;12(05):e0177771. doi: 10.1371/journal.pone.0177771. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Matsumura E, Tsuji K, Komori K, Koga H, Sekiya I, Muneta T. Pretreatment with IL-1β enhances proliferation and chondrogenic potential of synovium-derived mesenchymal stem cells. Cytotherapy. 2017;19(02):181–193. doi: 10.1016/j.jcyt.2016.11.004. [DOI] [PubMed] [Google Scholar]
- 26.Zhang S, Muneta T, Morito T, Mochizuki T, Sekiya I. Autologous synovial fluid enhances migration of mesenchymal stem cells from synovium of osteoarthritis patients in tissue culture system. J Orthop Res. 2008;26(10):1413–1418. doi: 10.1002/jor.20659. [DOI] [PubMed] [Google Scholar]
- 27.Kim Y I, Ryu J S, Yeo J E. Overexpression of TGF-β1 enhances chondrogenic differentiation and proliferation of human synovium-derived stem cells. Biochem Biophys Res Commun. 2014;450(04):1593–1599. doi: 10.1016/j.bbrc.2014.07.045. [DOI] [PubMed] [Google Scholar]
- 28.Finnson K W, Chi Y, Bou-Gharios G, Leask A, Philip A. TGF-b signaling in cartilage homeostasis and osteoarthritis. Front Biosci (Schol Ed) 2012;4:251–268. doi: 10.2741/S266. [DOI] [PubMed] [Google Scholar]
- 29.Plaas A, Velasco J, Gorski D J. The relationship between fibrogenic TGFβ1 signaling in the joint and cartilage degradation in post-injury osteoarthritis. Osteoarthritis Cartilage. 2011;19(09):1081–1090. doi: 10.1016/j.joca.2011.05.003. [DOI] [PubMed] [Google Scholar]






