Abstract
Objetivo
Analizar la frecuencia de coinfecciones entre los virus gripales y el SARS-CoV-2, además de las diferencias en la evolución (riesgo de mortalidad, ingreso hospitalario o en intensivos) de los pacientes infectados por el virus del SARSCoV-2 según vacunación o no vacunación de la gripe en la temporada 2021-2022.
Método
Estudio retrospectivo observacional de base poblacional en una cohorte de 19.850 pacientes diagnosticados de COVID-19 entre el 1 de junio de 2021 y 28 de febrero de 2022 en la isla de Gran Canaria.
Resultados
Fueron vacunados de la gripe 1.789 personas, el 9% del total de pacientes diagnosticados de COVID-19. 13.676 personas (68,9%) contaban con pauta completa de vacunación del COVID-19. En el periodo comprendido entre el 1 de junio de 2021 y 28 de febrero de 2022 se registraron 8 casos de coinfección gripe y COVID-19. Hipertensión (18,5%), asma (12,8%) y diabetes (7,2%) fueron las comorbilidades más frecuentes. Hubo 147 defunciones (0,7%). Las personas de mayor edad ([OR] 1,11 IC 95% 1,09-1,13) y con cáncer ([OR] 4,21 IC 95% 2,58-6,89) tuvieron mayor riesgo de fallecer por COVID-19 (p<0,05). El sexo femenino fue considerado un factor protector ([OR] 0,61 IC 95% 0,40-0,92).
Conclusiones
La edad avanzada, el sexo masculino y el cáncer fueron factores pronósticos independientes de mortalidad. Tres dosis de la vacuna del SARS-CoV-2 y la vacuna de la gripe fueron altamente efectivas para prevenir muertes e ingresos relacionados con COVID-19. Estos hallazgos sugieren que la vacunación contra la gripe puede ayudar a controlar la pandemia.
Palabras clave: COVID-19, gripe, vacunas, infección, inmunidad
Abstract
Objectives
To analyze the frequency of influenza and SARS-CoV-2 co-infections, as well as the differences in the course of disease (risk of mortality, hospital and intensive care admissions) in patients infected with the SARS-CoV-2 virus in relation to flu vaccination status in the 2021-2022 season.
Methodology
Population-based observational retrospective study in a cohort of 19,850 patients diagnosed with COVID-19 between June 1, 2021 and February 28, 2022 on the island of Gran Canaria.
Results
A total of 1,789 patients (9%) diagnosed with COVID-19 had received flu vaccinations. 13,676 people (68.9%) had a full course of COVID-19 vaccinations. In the period between June 1, 2021 and February 28, 2022, 8 cases of flu and COVID-19 coinfection were recorded. Hypertension (18.5%), asthma (12.8%) and diabetes (7.2%) were the most frequent comorbidities. There were 147 deaths (0.7%). Older patients ([OR] 1.11 95% CI 1.09-1.13) and people with cancer ([OR] 4.21 95% CI 2.58-6.89) had a higher risk of dying from COVID-19 (p<0.05). Female sex was noted as a protective factor ([OR] 0.61 95% CI 0.40-0.92).
Conclusions
Old age, male sex and cancer were independent prognostic factors for mortality. Three doses of SARSCoV-2 vaccines and influenza vaccines were highly effective in preventing COVID-19-related deaths and hospital admissions. These findings suggest that flu vaccination can help control the pandemic.
Keywords: COVID-19, flu, vaccines, infection, immunity
INTRODUCCIÓN
Desde diciembre de 2019 la enfermedad por coronavirus 2019 (COVID-19) ha sido una emergencia de salud pública internacional [1]. En todo el mundo ha habido más de 636 millones de casos de COVID-19 y más de 6,6 millones de muertes a 3 de noviembre de 2022 [2].
El coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2) imita el virus de la influenza en cuanto a la presentación clínica, mecanismo de transmisión y coincidencia estacional. Por lo tanto, la coinfección por ambos virus es factible [3].
La gripe es una enfermedad de etiología viral que se presenta como epidemias anuales en los meses invernales y de forma pandémica de manera ocasional. Aunque en general es una enfermedad leve y autolimitada, cuando afecta a población de edad avanzada o con patologías crónicas puede aumentar la mortalidad [4,5].
La estrategia más efectiva para prevenir la enfermedad por el virus influenza es la vacunación, mitigando la carga sobre los sistemas de salud. Sin embargo, ha sido un desafío mantener los servicios de vacunación contra el virus influenza durante la pandemia por SARS-CoV-2 al haber tenido ésta el potencial de interrumpir los programas de vacunación en muchos países [6]. Por otro lado, las medidas para reducir la transmisión de SARS-CoV-2 también han sido efectivas para reducir la transmisión de otros virus respiratorios endémicos [7,8].
La efectividad vacunal frente a infección confirmada por laboratorio fue moderada (50-60%) frente al a los virus A(H1N1) pdm09 y B, y baja o nula, dependiendo del grupo de edad, frente al virus A(H3N2). Se ha estimado un impacto muy positivo del programa de vacunación antigripal en España en la temporada 2019-20 entre los mayores de 64 años. La vacuna antigripal fue capaz de prevenir en este grupo de edad un 26% de hospitalizaciones, un 40% de admisiones en UCI (Unidades de Cuidados Intensivos) y un 37% de defunciones por todas las causas atribuibles a gripe que ocurren en hospitales [9]. La coinfección con virus de influenza se asoció con mayores probabilidades de recibir ventilación mecánica invasiva en comparación con la monoinfección por SARS-CoV-2 [10].
Este estudio analizó las características epidemiológicas y clínicas de los casos de COVID-19 vacunados de la gripe en Gran Canaria. Se analizaron las posibles diferencias en la evolución (ingreso hospitalario, ingreso en UCI y mortalidad) de los pacientes infectados por el virus del SARS-CoV-2 vacunados y no vacunados de la gripe en la temporada 2021-2022. Se determinó la frecuencia de coinfecciones entre los virus gripales y el SARS-CoV-2.
MÉTODOS
Tipo de estudio. Estudio retrospectivo observacional de base poblacional en una cohorte de 19.850 pacientes de 12 o más años de edad diagnosticados de COVID-19 entre el 1 de junio de 2021 y el 28 de febrero de 2021 en Gran Canaria.
Criterios de inclusión. Caso COVID-19 confirmado: paciente que cumple criterio clínico de caso sospechoso con PDIA (prueba diagnóstica de infección activa) positiva, o bien, paciente asintomático con PDIA positiva e IgG negativa o no realizada. Caso sospechoso: paciente con infección respiratoria aguda de aparición súbita de cualquier gravedad que cursa con fiebre, tos o disnea. Otros síntomas como odinofagia, anosmia, ageusia, dolor muscular, diarrea, dolor torácico o cefalea, entre otros, se consideraron también síntomas de sospecha. El criterio de exclusión fue edad <12 años.
Obtención y fuente de los datos. Se han identificado todos los pacientes vacunados frente al SARS-CoV-2 en Gran Canaria (periodo 28 de diciembre de 2020 a 31 de diciembre de 2021) mediante el registro REGVACU (Registro de Vacunación frente al SARS-CoV-2 en España). Se identificaron todos los casos de COVID-19 en Gran Canaria notificados a ReVeCa (Red de Vigilancia Epidemiológica de Canarias) en el periodo compren-dido entre el 1 de junio de 2021 y el 28 de febrero de 2022). La información clínica de los pacientes diagnosticados de COVID-19 y su estatus de vacunación antigripal se obtuvo de la historia clínica electrónica de Atención Primaria, DRAGO-AP.
Se consideró como vacunación antigripal a aquella persona que ha recibido una dosis de vacuna frente a la gripe en la temporada estacional indicada. La campaña de vacunación contra la gripe de la temporada 2021-2022 comenzó en Canarias el 28 de octubre de 2022. Los grupos diana fueron: mayores de 60 años, embarazadas, enfermos crónicos de cualquier edad, personal sanitario y cuidadores de personas vulnerables.
Variables. La principal variable de resultado fue la mortalidad. La vacunación antigripal fue la principal variable independiente. Covariables de control fueron: edad, sexo, comorbilidades subyacentes (asma, cáncer, demencia, diabetes, enfermedad coronaria, Enfermedad Pulmonar Obstructiva Crónica o EPOC, Insuficiencia Cardiaca Congestiva o ICC, hipertensión arterial o HTA y obesidad), tratamiento inmunosupresor, fechas de la primera, segunda y dosis de refuerzo o booster de la vacuna del COVID-19 y tipo de vacuna (Pfizer, Moderna, Astrazeneca, Janssen).
Definiciones. Se clasificó como diabetes: glucemia basal ≥126 mg/dl o con tratamiento antidiabético; obesidad: IMC ≥30 kg/m2; HTA: presión arterial sistólica ≥140 mmHg y/o presión arterial diastólica ≥90 mmHg, o con tratamiento antihipertensivo.
Pauta vacunal completa para COVID-19. Paciente que haya recibido 2 dosis de vacuna distanciadas un mínimo de 19 días si la primera dosis fue BNT162b2 ARNm (Pfizer-BioNTech), 21 días tratándose de ChAdOx1 nCoV-19 (AstraZeneca-Universidad Oxford) o 25 días tratándose de ARNm-1273 (Moderna), y que haya transcurrido un mínimo desde la última dosis de 7 días si la última dosis fue de Pfizer, o 14 días si fue de Astra-Zeneca o Moderna. También se consideraron completamente vacunadas aquellas personas que recibieron una dosis de Ad26. COV2.S (Janssen) hace más de 14 días y aquellas de ≤65 años que habiendo pasado la enfermedad han recibido una dosis de cualquier vacuna, superado el periodo mínimo igual al establecido para las segundas dosis. En la pauta heteróloga en la que se utiliza AstraZeneca en primera dosis y vacunas ARNm en segunda, se consideró completamente vacunado tras 7 días si la segunda dosis fue con Pfizer, o 14 días si fue con Moderna [11].
Análisis estadístico. Se realizó análisis descriptivo de los resultados utilizando medidas de frecuencia y porcentajes para las variables categóricas. El análisis bivariante para las variables cualitativas se realizó mediante la prueba de la χ2, utilizando la razón de verosimilitud (Likelihood Ratio) cuando fue necesario. El nivel de significación estadística utilizado fue el 5% (p<0,05). El tratamiento estadístico de los datos se realizó mediante la aplicación estadística Statistical Package for the Social Sciences (SPSS), v28.
Estudio aprobado por el comité de Ética para la Investigación Clínica del Hospital Universitario de Gran Canaria Dr. Negrín (número de registro 2021-356-1 COVID19). Se llevó a cabo de acuerdo con las leyes y reglamentos locales, con la Declaración de Helsinki, Fortaleza y las Buenas Prácticas Clínicas.
RESULTADOS
En el periodo comprendido entre el 1 de junio de 2021 y el 31 de diciembre de 2021 se vacunaron de la gripe 1.789 personas (9,0%) del total de pacientes diagnosticados de COVID-19. 13.676 personas (68,9%) fueron vacunadas con la pauta completa de COVID-19.
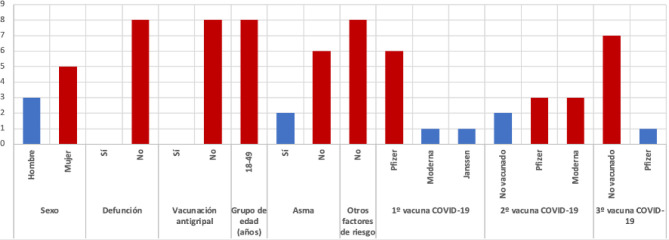
En el periodo comprendido entre el 1 de junio de 2021 y 28 de febrero de 2022 se registraron 8 casos de coinfección gripe y SARS-CoV-2. En la figura 1 se muestra la descripción de estas coinfecciones según las covariables analizadas.
Figura 1.
Descripción de la frecuencia de coinfecciones por el virus de la gripe y del SARS-CoV-2 (n=8).
En la tabla 1 se muestra el análisis bivariable entre vacunación antigripal y las principales covariables del estudio. El sexo femenino, los grupos de población de mayor edad (≥70 años), las personas en tratamiento inmunosupresor y las que precisaron ingreso hospitalario se asociaron a mayor tasa de vacunación antigripal.
Tabla 1.
Análisis bivariable. Asociaciones entre las principales covariables del estudio y la vacunación antigripal en 1.789 personas vacunadas de un total de 19.850 participantes.
| Variables | N casos | Vacunación gripe SÍ (%) | Vacunación gripe NO (%) | Odds Ratio (IC) | P valor |
|---|---|---|---|---|---|
| Sexo Hombre Mujer |
9.344 10.506 |
727 (7,8) 1062 (10,1) |
8.617 (92,2) 9.444 (89,9) |
1 1,33 (1,21 -1,47) |
0,000 |
| Defunciones Si No |
147 19.703 |
11 (7,5) 1.778 (9) |
136 (92,5) 19.725 (91) |
0,82 (0,44-1,51) 1 |
0,516 |
| Grupos de edad 18-49 50-69 >=70 |
13.884 4.619 1.347 |
533 (3,8) 712 (15,4) 544 (40,4) |
13.351 (96,2) 3.907 (84,6) 803 (59,6) |
0,01 (0,00-0,01) 0,11 (0,07-0,15) 1 |
0,000 0,000 Ref |
| Ventilación mecánica Si No |
60 19790 |
7 (11,7) 1782 (9) |
53 (88,3) 18.008 (91) |
1,34 (0,61-2,94) 1 |
0,472 |
| Ingreso en Unidad de Cuidados Intensivos Si No |
208 19642 |
22 (10,6) 1767 (9) |
186 (89,4) 17.875 (91) |
1,20 (0,77-1,87) 1 |
0,428 |
| Ingreso hospitalario Si No |
831 19.019 |
138 (16,6) 1.651 (8,7) |
693 (83,4) 17.368 (91,3) |
2,10 (1,73-2,53) 1 |
0,000 |
| Tratamiento inmunosupresor Si No |
330 19.520 |
84 (25,5) 1.705 (8,7) |
246 (74,5) 17.815 (91,3) |
3,57 (2,77-4,59) 1 |
0,000 |
En el modelo de regresión logística multivariable (tabla 2) encontramos que las personas de mayor edad, hombres y con cáncer, tenían mayor probabilidad de fallecer por COVID-19. Otras variables asociadas a mayor probabilidad de defunción fueron el ingreso hospitalario y precisar ventilación mecánica durante el ingreso (p<0,05). La tercera dosis de la vacuna contra el SARS-CoV-2 se asoció a menor riesgo de fallecer (Odds Ratio 0,17, IC 95% 0,08–0,35; p< 0,05), también fue protectora la vacuna antigripal (Odds Ratio 0,36, IC 95% 0,17–0,78; p< 0,05). No se encontró asociación con asma, EPOC, HTA, obesidad, diabetes, pauta de vacunación completa contra el virus del SARS-CoV-2 o ingreso en UCI (p>0,05).
Tabla 2.
Análisis multivariable. Asociaciones de mortalidad en las 1.789 vacunados de la gripe entre la población de 19.850
| Variable | Muerte y análisis de regresión logística (IC95%) | P valor |
|---|---|---|
| Sexo | ||
| Mujer Hombre |
0,61 (0,40-0,92) 1 (Ref.) |
0,000 |
| Edad (años) | 1,11 (1,10-1,13) | 0,000 |
| Asma | ||
| Sí No |
1,17 (0,62-2,20) 1 (Ref.) |
0,635 |
| Cáncer | ||
| Sí No |
4,21 (2,58-6,89) 1 (Ref.) |
0,000 |
| Diabetes | ||
| Sí No |
0,92 (0,59-1,45) 1 (Ref.) |
0,722 |
| Enfermedad pulmonar obstructiva crónica | ||
| Sí No |
0,67 (0,34-1,34) 1 (Ref.) |
0,261 |
| Hipertensión arterial | ||
| Sí No |
1,05 (0,66-1,65) 1 (Ref.) |
0,843 |
| Obesidad | ||
| Sí No |
0,64 (0,13-3,13) 1 (Ref.) |
0,585 |
| Pauta de vacunación completa | ||
| Sí No |
0,82 (0,52-1,32) 1 (Ref.) |
0,419 |
| Booster | ||
| Sí No |
0,17 (0,08-0,35) 1 (Ref.) |
0,000 |
| Vacuna de la gripe | ||
| Sí No |
0,36 (0,17-0,78) 1 (Ref.) |
0,010 |
| Ingreso hospitalario | ||
| Sí No |
15,95 (9,57-26,56) 1 (Ref.) |
0,000 |
| Ventilación mecánica | ||
| Sí No |
4,30 (1,57-11,82) 1 (Ref.) |
0,005 |
| Ingreso en Unidad de Cuidados Intensivos | ||
| Sí No |
1.64 (0,88-3,07) 1 (Ref.) |
0,122 |
DISCUSIÓN
Se observó que la evolución de la temporada de gripe 2021-22 fue más similar a la temporada inmediatamente anterior 2020-21, que a las temporadas más lejanas. Desde el comienzo de la temporada y a 28 de febrero de 2022 se encontraron 142 virus de la Gripe: 136 son Virus A [96 (AH3), 1 (AH3N2), 17 (AH1pdm09), 4 (AH1N1pdm09) y 23 (ANS)]. Solo se encontró un virus B [12].
En la temporada 2020-2021 se vacunaron en Canarias 492.889 personas, un 71,8% de la población diana [13]. Se espera que esta cifra sea similar en la temporada 2021-22 [14]. A medida que se levanten las restricciones de salud pública es más probable que ocurran coinfecciones de virus respiratorios, entre ellos el SARS-CoV-2 [10]. No ha podido demostrarse definitivamente si estas coinfecciones determinan una mayor gravedad de la COVID-19. El estudio inicial de Ding et al [15] sobre infecciones mixtas SARS-CoV-2/gripe no mostró empeoramiento o peor pronóstico que la infección en solitario. Sin embargo, un amplio estudio del Servicio de Salud Pública inglés demostró que, a pesar de que las coinfecciones son escasas, los pacientes coinfectados con ambos virus presentan 2,4 veces más riesgo de fallecer que los que se infectan sólo por uno, dato especialmente relevante en >65 años entre los cuales fallecen más del 50% de los coinfectados [16]. Estos datos apoyan la necesidad de proteger a la población en general, especialmente a los grupos de riesgo, para evitar posibles coin-fecciones («la tormenta perfecta»), que parecen incrementar significativamente la morbilidad y mortalidad [17]. De acuerdo con esta hipótesis, Marín-Hernández et al [18] han estudiado la relación entre vacunación antigripal en >65 años y evolución de la COVID-19 en Italia, hallando una intensa correlación entre mayor porcentaje de vacunación y menor número de fallecidos por COVID-19. Otro amplio estudio realizado en Italia demuestra una asociación inversa significativa entre cobertura vacunal frente a la gripe, tasa de seroprevalencia poblacional frente al SARS-CoV-2 (difusión de la infección), prevalencia de pacientes hospitalizados, ingresos en UCI y número de fallecimientos atribuibles al virus, estimando que un aumento del 1% en la cobertura vacunal de personas >65 años evitaría 350 ingresos hospitalarios y 2.000 fallecimientos en el país [19]. Otro estudio realizado en Brasil sobre 90.000 pacientes diagnosticados de COVID-19, 31,1% vacunados frente a la gripe, confirmó que los vacunados antes o durante la epidemia del SARS-CoV-2 presentaron menor mortalidad y menos ingresos en UCI [20].
Una posible explicación sería que la vacuna antigripal protegiera parcialmente frente a la infección por SARS-CoV-2. Ello ocurriría si la vacuna estimulara la inmunidad innata frente a otros virus respiratorios. El sistema inmune local respiratorio provocaría una intensa y rápida respuesta que dificultaría otras infecciones víricas respiratorias [5]. Desde el punto de vista inmunológico, la vacuna antigripal está diseñada para inducir una respuesta adaptativa de larga duración median-te la producción de anticuerpos neutralizantes y células T de respuesta. A pesar de la escasa similitud genética entre los virus gripales y el SARS-CoV-2, es posible que algunos linfocitos T-CD8+ reconozcan epítopos menores presentes en ellos. Sin embargo, debido a la extraordinaria diversidad antigénica de los virus gripales, la producción de anticuerpos neutralizantes y de células T frente a otros virus ARN, incluido el SARS-CoV-2, parece poco probable [21]. Por ello, según Fink et al [20], el mecanismo más probable de los posibles beneficios de la vacunación sería la inmunidad innata inducida por ella. Además, algunas vacunas, probablemente también la antigripal, inducen mecanismos inmunoterapéuticos no específicos que incrementan la respuesta del huésped frente a otros patógenos a través de un proceso complejo denominado «entrenamiento inmune» (trained immunity) [5].
Otra explicación no virológica al efecto protector de la vacuna antigripal podría ser que los porcentajes más elevados de vacunación se dieran en estratos socioeconómicos elevados, que presentaran un mejor estado previo de salud. También es posible que esta correlación se deba al azar o al comportamiento epidemiológico de otros virus respiratorios [18].
La vacunación antigripal debe seguir implementándose e intensificarse ya que reduce la prevalencia de la enfermedad, la gravedad de sus síntomas y disminuye hospitalizaciones e ingresos en UCI; aliviando la presión asistencial en todo el ámbito sanitario y permitiendo una mejor atención hacia enfermos con otras patologías. Dada la escasa experiencia en la vacunación antigripal de enfermos de COVID-19, es recomendable que aquellas personas que presenten sintomatología compatible o confirmación de laboratorio para el SARS-CoV-2, retrasen la vacunación antigripal hasta que se hayan recuperado totalmente, recordándoles la necesidad de incorporarse posteriormente al programa vacunal [18, 22, 23]. En definitiva, la vacunación antigripal anual sigue siendo la mejor y, quizás, única herramienta costo-efectiva de salud pública, con un impacto demostrado sobre la epidemiología y prevención de la gripe estacional. Otros autores proponen aumentar las tasas de vacunación antigripal para evitar la coinfección de la gripe con SARS-CoV-2 [24].
Kuderer NM et al [25] indicaron una asociación entre el cáncer y tasas de mortalidad más elevadas. Los pacientes con cáncer pueden estar inmunocomprometidos debido a la terapia antineoplásica, medicamentos de apoyo y las propiedades inmunosupresoras del propio cáncer. Estos hallazgos son congruentes con los resultados de nuestro estudio en el que la prevalencia del cáncer activo como comorbilidad entre los pacientes diagnosticados con COVID-19 fue del 3,2%, identificándose en el análisis multivariable como un factor independiente asociado a la mortalidad.
Los pacientes vacunados son los de mayor edad y comorbilidad, factores que se asocian a una mayor mortalidad en los pacientes COVID-19 sin influir la vacunación antigripal. Múltiples estudios encontraron la edad como un factor de riesgo independiente de mortalidad en pacientes COVID-19, que podría explicarse por la inmunosenescencia [26]. En concordancia con otros estudios, nuestros pacientes con elevada comorbilidad presentaron una mortalidad significativamente mayor que aquellos con comorbilidad baja [27].
Nuestro estudio tiene algunas limitaciones. No hemos incluido datos analíticos que podrían asociarse a una mayor mortalidad como sugieren diversos estudios [9], pero nuestro objetivo era valorar la vacunación antigripal y otras comorbilidades en el riesgo de mortalidad en pacientes diagnosticados de COVID-19. Tampoco se han tenido en cuenta los tratamientos administrados durante el ingreso hospitalario, por su heterogeneidad y escaso nivel de evidencia en estudios publicados [28]. Adicionalmente, la situación epidemiológica puede haber condicionado los criterios de ingreso y disponibilidad de camas y haber influido en los resultados de mortalidad [29].
En este sentido, el Gripómetro (herramienta de conocimiento de la cobertura de vacunación antigripal en tiempo real) se presenta como una herramienta práctica y de gran utilidad que puede ser especialmente importante en momentos como el 2021-2022 y sucesivas temporadas, en las que la gripe podría coexistir con la COVID-19. La vacuna antigripal es un arma clave complementaria, en el contexto de crisis sanitaria del COVID-19, para evitar un posible colapso de la atención sanitaria [30].
En conclusión, la edad avanzada, el sexo masculino, la ausencia de dosis de refuerzo de la vacuna del COVID-19, el ingreso hospitalario o en UCI, la ausencia de la vacuna de la gripe y el cáncer fueron factores pronósticos independientes de mortalidad lo que podría ayudar a los médicos a identificar los pacientes con mal pronóstico para su manejo y tratamiento. Se justifican más estudios sobre el papel de la vacunación de la gripe en el transcurso de la enfermedad por COVID-19, que serán vitales para la investigación y el desarrollo de una vacuna más eficaz. A todas las personas elegibles se les debe ofrecer la vacunación, incluidos aquellos con infección previa por SARS-CoV-2, para reducir su riesgo de infección futura.
FINANCIACIÓN
Agradecemos la colaboración y financiación de las siguientes entidades: Fundación DISA y Fundación Española de Calidad Asistencial, sin quienes este estudio no se habría podido realizar, y a todas las personas que voluntariamente participaron en el estudio.
CONFLICTO DE INTERESES
Los autores declaran no tener conflicto de intereses.
References
- 1.Guan W, Ni Z, Hu Y, et al. Clinical Characteristics of Coronavirus Disease 2019 in China N Engl J Med. 2020;382(18):1708-1720. DOI: 10.1056/NEJMoa2002032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.WHO Coronavirus (COVID-19) Dashboard. (Accessed November 03, 2022). Available at: https://covid19.who.int
- 3.Cuadrado-Payán E, Montagud-Marrahi E, Torres-Elorza M, et al. SARS-CoV-2 and influenza virus co-infection. Lancet. 2020;395(10236):e84. doi: 10.1016/S0140-6736(20)31052-7 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Sakamoto H, Ishikane M, Ueda P. Seasonal influenza activity during the SARS-CoV-2 outbreak in Japan. JAMA. 2020;323:196971. doi: 10.1001/jama.2020.6173. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Reina J. La vacunación de la gripe en el tiempo del SARS-CoV-2. Med Clin. 2021; 156 (1): 17–9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Wang X, Kulkarni D, Dozier M, Hartnup K, Paget J, Campbell H, et al. Influenza vaccination strategies for 2020-21 in the context of COVID-19. J Glob Health. 2020;10(2):21102. doi: 10.7189/jogh.10.021102. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Olsen SJ, Azziz-Baumgartner E, Budd AP, et al. Decreased influenza activity during the COVID-19 pandemic-United States, Australia, Chile, and South Africa, 2020. Am J Transplant. 2020;20(12):3681-3685. doi: 10.1111/ajt.16381 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Gómez GB, Mahé C, Chaves SS. Uncertain effects of the pandemic on respiratory viruses. Science. 2021;372(6546):1043-1044. doi: 10.1126/science.abh3986 [DOI] [PubMed] [Google Scholar]
- 9.Instituto de Salud Carlos III . Informe de Vigilancia de la Gripe en España. Temporada 2019-2020. Sistema de Vigilancia de la Gripe en España. Available at: https://www.isciii.es/QueHacemos/Servicios/VigilanciaSaludPublicaRENAVE/EnfermedadesTransmisibles/Paginas/Informes-anuales.aspx
- 10.Swets MC, Russell CD, Harrison EM, et al. SARS-CoV-2 co-infection with influenza viruses, respiratory syncytial virus, or adenoviruses. Lancet. 2022;S0140-6736(22)00383-X. doi: 10.1016/S0140-6736(22)00383-X [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.De Vacunaciones de la P de P y R. Estrategia de vacunación frente a COVID–19 en España [Internet]. Gob.es. Available at: https://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/covid19/docs/COVID-19_Actualizacion8_EstrategiaVacunacion.pdf [Google Scholar]
- 12.Dirección General de Salud Pública de Canarias . Vigilancia epidemiológica de gripe mediante la red centinela de Atención Primaria. Información de la semana 8. [Accessed 03-Nov-2022]. Available at: https://www3.gobiernodecanarias.org/sanidad/scs/content/1bd37a6a-8919-11e5-b2b0-c78c964924e4/InformeSemanalGripeRCC.pdf
- 13.Ministerio de Sanidad . Tabla 13. Coberturas de vacunación frente a gripe en ≥ 65 años, personas de 60-64 años, embarazadas y personal sanitario. Comunidades autónomas. Campaña 2020-2021. [Accessed 03-Nov-2022]. Available at: https://www.sanidad.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/calendario-y-coberturas/coberturas/docs/Todas_las_tablas2020.pdf
- 14.Ministerio de Sanidad . Recomendaciones del Ministerio de Sanidad para la vacunación frente a la gripe 2021-22. [Accessed 03-Nov-2022]. Available at: https://vacunasaep.org/profesionales/noticias/gripe-recomendaciones-ministerio-sanidad-2021-22
- 15.Ding Q, Lu P, Fan Y, Xia Y, Liu M. The clinical characteristics of pneumonia patients coinfected with 2019 novel coronavirus and influenza virus in Wuhan, China. J Med Virol. 2020;92(9):1549-1555. doi: 10.1002/jmv.25781. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Lacobucci G. Covid-19: risk of death more tan doubled in people who also has flu, English data show. Br Med J. 2020;370:m3720. Doi : 10.1136/bmj.m3720 [DOI] [PubMed] [Google Scholar]
- 17.Belongia EA, Osterholm MT. COVID-19 and flu, a perfect storm. Science. 2020;368(6496):1163. doi: 10.1126/science.abd2220. [DOI] [PubMed] [Google Scholar]
- 18.Marín-Hernández D, Schwartz RE, Nixon DF. Epidemiological evidence for association between higher influenza vaccine uptake in the elderly and lower COVID-19 deaths in Italy. J Med Virol. 2021;93(1):64-65. doi: 10.1002/jmv.26120. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Amato M, Werba JP, Frigerio B, Coggi D, Sansaro D, Ravani A, et al. Relationship between influenza vaccination coverage rate and Covid-19 outbreak: an italian ecological study. Vaccines. 2020;8:535. doi: 10.3390/vaccines8030535. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.F ink G, Orlova-Fink N, Schindler T, Grist S, Ferrer AP, Daubenberger C, et al. Inactivated trivalent influenza vaccine is associated with lower mortality among Covid-19 patients in Brazil. BMJ Evid Based Med. 2020;bmjebm-2020-111549. doi: 10.1136/bmjebm-2020-111549. [DOI] [PubMed]
- 21.Plotkin SA. Updates on immunologic correlates of vaccine-induced protection. Vaccine. 2020; 38:2250–7. doi: 10.1016/j.vaccine.2019.10.046. [DOI] [PubMed] [Google Scholar]
- 22.Stowe J, Tessier E, Zhao H, Guy R, Muller-Pebody B, Zambon Met al. Interactions between SARS-CoV-2 and influenza and the impact of coinfection on disease severity: a test negative design. Int J Epidemiol. 2021;50(4):1124-1133. doi: 10.1093/ije/dyab081 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Ministerio de Sanidad y Bienestar . Vacunación frente a gripe y covid-19. Ponencia de Programa y Registro de Vacunaciones. 2020.
- 24.Zanettini C, Omar M, Dinalankara W, Luidy E, Colantuoni E, Luidy Imada E, et al.Influenza Vaccination and COVID-19 Mortality in the USA: An Ecological Study. Vaccines (Basel). 2021;9:427. doi: 10.3390/vaccines9050427.4 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Kuderer NM, Choueiri TK, Shah DP, Shyr Y, Rubinstein SM, Rivera DR. Clinical impact of COVID-19 on patients with cancer (CCC19): a cohort study. Lancet. 2020;395:1907–1918. doi: 10.1016/S0140-6736(20)31187-9 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Sun H, Ning R, Tao Y, Yu C, Deng X, Zhao C, et al. Risk Factors for Mortality in244 Older Adults With COVID-19 in Wuhan, China: A Retrospective Study. J Am Geriatr Soc 2020;68:E19–23. doi: 10.1111/jgs.16533. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Guan WJ, Liang WH, Zhao Y, Liang HR, Chen ZS, Li YM, et al. Comorbidity and its impact on 1590 patients with COVID-19 in China: a nationwide analysis. Eur Respir J. 2020;55. doi: 10.1183/13993003.00547-2020.9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Reina J, López de Bilbao C, Riera M. Prevalence of influenza B Yamagata lineage in adults in the 2017-2018 flu season. Predominio de la gripe B linaje Yamagata en los adultos en la temporada gripal 2017>-2018. Med Clin (Barc). 2020;154(1):29-30. doi: 10.1016/j.medcli.2018.09.003 [DOI] [PubMed] [Google Scholar]
- 29.Fernández Ibáñez JM, Morales Ballesteros MDC, Fernández Anguita MJ, Galindo Andúgar MÁ, Arias Arias Á, Barberá-Farré JR.. Influence of influenza vaccine and comorbidity on the evolution of hospitalized COVID-19 patients [published online ahead of print, 2021 Jun 16]. Med Clin (Barc). 2021;S0025-7753(21)00325-0. doi: 10.1016/j.medcli.2021.06.003 [DOI] [Google Scholar]
- 30.Díez-Domingo J, Redondo Margüello E, Ortiz de Lejarazu Leonardo R, et al. A tool for early estimation of influenza vaccination coverage in Spanish general population and healthcare workers in the 2018-19 season: the Gripómetro. BMC Public Health. 2022;22(1):825. doi: 10.1186/s12889-022-13193-x [DOI] [PMC free article] [PubMed] [Google Scholar]