Zusammenfassung
Hintergrund Die obere Extremität und insbesondere die Hand sind für die Interaktion des Menschen mit seiner Umwelt von entscheidender Bedeutung – schwere Verletzungen oder Amputationen gehen daher mit einem erheblichen Funktionsverlust einher und beeinträchtigen die Lebensqualität der Patienten sehr. Wenn biologische Rekonstruktionsversuche nicht zu einem ausreichenden Erfolg führen oder nicht möglich sind, kommt der bionischen Rekonstruktion eine Schlüsselrolle in der Versorgung dieser Patienten zu. Konventionelle myoelektrische Prothesen werden über zwei Signale gesteuert, die über Oberflächenelektroden im Bereich der Stumpfmuskulatur abgeleitet werden. Insbesondere bei hohen Amputationen ist die Prothesensteuerung dann nur sehr eingeschränkt und umständlich möglich. Die Operationsmethode der Targeted Muscle Reinnervation (TMR) bietet hier einen innovativen Lösungsansatz: Die großen Armnerven, die durch Amputation ihre Zielorgane verloren haben, werden auf neue Zielmuskeln im Bereich des Amputationsstumpfes transferiert. Dadurch können kognitive Steuersignale etabliert werden, welche eine deutlich verbesserte Prothesensteuerung ermöglichen.
Patienten/Material und Methoden Es erfolgte eine selektive Literaturrecherche zum Thema TMR und bionische Rekonstruktion mit Aufarbeitung und Diskussion relevanter Arbeiten, unter Berücksichtigung der klinischen Erfahrungen unserer Forschungsgruppe. Zusätzlich wird ein klinischer Patientenfall vorgestellt.
Ergebnisse Die bionische Rekonstruktion in Kombination mit TMR ermöglicht eine intuitive Prothesensteuerung mit simultaner Bewegung verschiedener prothetischer Freiheitsgrade und bietet zudem einen neuen Ansatz in der Therapie von Neurom- und Phantomschmerzen. Langfristiger Erfolg erfordert ein hohes Maß an Patientencompliance und intensives Signaltraining während der prothetischen Rehabilitationsphase. Trotz technologischer Fortschritte bestehen weiterhin Herausforderungen, insbesondere hinsichtlich der Signalüberleitung und der sensiblen Integration bionischer Prothesen.
Schlussfolgerung Die Operationstechnik der TMR stellt einen bedeutenden Fortschritt der prothetischen Versorgung von Amputierten dar. Durch selektive Nerventransfers zur Signalmultiplikation und -amplifikation ermöglicht sie, das Potential myoelektrischer Prothesen weiter auszuschöpfen und die Therapie dieser speziellen Patientengruppe zu verbessern. Entwicklungen im Bereich der externen Prothesenkomponenten, Verbesserungen der skelettalen Anbindung durch Osseointegration und flüssigere Signalübertragung durch drahtlose, vollständig implantierte Elektrodensysteme werden sowohl hinsichtlich der Bewegungspräzision, als auch des Embodiments deutliche Fortschritte in der bionischen Rekonstruktion ermöglichen.
Schlüsselwörter: Nerventransfer, bionische Rekonstruktion, prosthesis
Abstract
Background The upper extremity and particularly the hands are crucial for patients in interacting with their environment, therefore amputations or severe damage with loss of hand function significantly impact their quality of life. In cases where biological reconstruction is not feasible or does not lead to sufficient success, bionic reconstruction plays a key role in patient care. Classical myoelectric prostheses are controlled using two signals derived from surface electrodes in the area of the stump muscles. Prosthesis control, especially in high amputations, is then limited and cumbersome. The surgical technique of Targeted Muscle Reinnervation (TMR) offers an innovative solution: The major arm nerves that have lost their target organs due to amputation are rerouted to muscles in the stump area. This enables the establishment of cognitive control signals that allow significantly improved prosthesis control.
Patients/Materials and Methods A selective literature review on TMR and bionic reconstruction was conducted, incorporating relevant articles and discussing them considering the clinical experience of our research group. Additionally, a clinical case is presented.
Results Bionic reconstruction combined with Targeted Muscle Reinnervation enables intuitive prosthetic control with simultaneous movement of various prosthetic degrees of freedom and the treatment of neuroma and phantom limb pain. Long-term success requires a high level of patient compliance and intensive signal training during the prosthetic rehabilitation phase. Despite technological advances, challenges persist, especially in enhancing signal transmission and integrating natural sensory feedback into bionic prostheses.
Conclusion TMR surgery represents a significant advancement in the bionic care of amputees. Employing selective nerve transfers for signal multiplication and amplification, opens up possibilities for improving myoelectric prosthesis function and thus enhancing patient care. Advances in the area of external prosthetic components, improvements in the skeletal connection due to osseointegration and more fluid signal transmission using wireless, fully implanted electrode systems will lead to significant progress in bionic reconstruction, both in terms of precision of movement and embodiment.
Key words: nerve transfer, bionic reconstruction, Targeted Muscle Reinnervation, Prothese
Einleitung
Die obere Extremität und speziell die Hand ist unverzichtbar, um uns eine aktive Gestaltung unserer Umwelt zu ermöglichen. Unsere Hände sind dabei viel mehr als nur ausführende Organe, sie spielen eine entscheidende Rolle, wie wir unsere Umgebung und nicht zuletzt unser eigenes Körperbild „erfassen“ und „begreifen“. Ausgeprägte Verletzungen der oberen Extremität, die mit einer Amputation oder Funktionsverlust einhergehen, beeinträchtigen Patienten somit in einer Unzahl von Lebensbereichen und bedeuten jedenfalls einen markanten Einschnitt in die Lebensqualität mit erheblichen psychosozialen Konsequenzen 1 . Zu den häufigen schweren Arbeitsverletzungen der Hand zählen Quetschtraumen, Verbrennungen, Frakturen oder Verletzungen welche in seltenen Fällen auch zu Amputationen der Hand oder gar des ganzen Armes führen können 2 . Bei der Versorgung dieser schweren Verletzungen und ihrer Folgen spielt die prothetische Rekonstruktion eine wichtige Rolle, wobei letztendlich das Wiedererlangen der Lebensqualität im Fokus steht. Dabei gewinnt diese auch in Situationen ohne primär notwendige Amputation an Bedeutung, beispielsweise nach massiven Schädigungen des Weichteils 3 4 oder des Plexus brachialis 5 .
Obwohl konventionelle ästhetische oder eigenkraft-gesteuerte Prothesen heutzutage je nach Indikation und Amputationsniveau weiterhin Verwendung finden, gewinnt der Einsatz bionischer, also Biologie und Technik verbindender, myoelektrischer Prothesen zunehmend an Bedeutung. In den vergangenen Jahren wurden wichtige Entwicklungen im Bereich der Schnittstelle zwischen Mensch und Maschine erzielt und damit die Steuerungsmöglichkeiten entscheidend verbessert 6 7 . Diese Entwicklung spiegelt nicht nur innovativen akademischen Fortschritt wider, sondern bieten auch eine tatsächliche Verbesserung der Lebensqualität für die Betroffenen. Das ist auch in der Tragepräferenz der Betroffenen bezüglich myoelektrischer (34%) verglichen mit eigenkraft-gesteuerten (30%) oder ästhetischen (23%) Prothesen erkennbar 8 , auch wenn diese Entwicklungen auf die Nutzungsraten konventioneller myoelektrischen Prothesensysteme selbst noch keinen positiven Einfluss zu nehmen scheinen 9 . Im folgenden Beitrag sollen die Möglichkeiten und Herausforderungen der bionischen Rekonstruktion in Kombination mit der chirurgischen Technik der Targeted Muscle Reinnervation (TMR) aufgezeigt sowie aktuelle und zukunftsweisende Entwicklungen in diesem Bereich vorgestellt werden.
Konventionelle Prothesenversorgung der oberen Extremität
Die Steuerung konventioneller myoelektrischer Prothesen erfolgt durch zwei Muskelsignale, die von zwei separat innervierten Muskeln oder Muskelgruppen der bestehenden Stumpfmuskulatur aufgenommen werden. Die Auswahl der ableitenden Muskeln variiert je nach Amputationshöhe. Bei transradialen Amputationen werden dafür üblicherweise das Flexoren- und Extensorenkompartiment verwendet, bei transhumeralem Extremitätenverlust der M. biceps brachii und M. triceps brachii und bei glenohumeralen Amputationen dienen der M. pectoralis major und der M. latissimus dorsi als Signalgeber. Die Muskelaktivität wird über Oberflächen-EMG-Elektroden, die im Prothesenschaft verbaut oder direkt auf der Haut angebracht sind, aufgenommen und an die Prothese weitegeleitet. Die Ansteuerung der unterschiedlichen Prothesengelenke – ob Ellbogen-, Hand- oder Fingergelenk – wird üblicherweise durch Kokontraktion beider Muskeln umgeschaltet und anschließend die einachsige Bewegung (bspw. Flexion und Extension im Ellenbogen) des jeweiligen Gelenks in der entsprechenden Ebene mithilfe derselben Muskelkontraktionen gesteuert. Dies bedeutet, dass die gleiche Muskelkontraktion verschiedene prothetische Funktionen lenkt und daher eine kombinierte, gleichzeitige Bewegung mehrerer prothetischer Gelenke unmöglich ist. Der Einsatz erfordert für den Patienten somit größtmögliche Konzentration und Aufmerksamkeit, welche Gelenkebene er gerade ansteuert. Intuitive, sprich durch an die ursprüngliche Bewegung gedachte (z. B. Hand schließen), natürliche und flüssige Bewegungsabläufe sind mit dieser Form der Prothesensteuerung nicht möglich 10 11 . Deshalb bedeutet der Gebrauch der Prothese für die Patienten oftmals eine zu geringe Funktionalitätssteigerung im Alltag, sodass diese im Verlauf nur noch für die notwendigsten Tätigkeiten genützt oder ganz auf die Prothese Verzichtet wird 11 12 . Die Ablehnungsraten myoelektrischer Prothesen der oberen Extremität liegt bei durchschnittlich 32% bei Kindern und 23% bei Erwachsenen 12 .
Neben der Amputationsversorgung kann eine bionische Prothese, wie oben bereits erwähnt, auch bei anderen Indikationen Anwendung finden. Ausgeprägte Weichteil- und Knochenschädigungen, sowie Defekte der neuronalen Strukturen führen nicht zwangsläufig zu einer notwendigen Amputation der betroffenen Extremität, können aber mit schwerwiegenden Einschränkungen bis zum völligen Funktionsverlust einhergehen und zudem die Ursache chronischer Schmerzen sein 3 4 5 . In ausgewählten Fällen kann eine elektive Amputation der funktionslosen Extremität mit einer anschließenden bionischen Rekonstruktion in Betracht gezogen werden. Für die Patienten ist es oftmals eine schwierige, tiefgreifende Entscheidung sich von der Hand zu trennen, gerade dann, wenn die Extremität zuvor mittels aufwendiger chirurgischer Maßnahmen erhalten werden konnte. Maßgeblich ist daher, die Patienten bei dieser Entscheidungsfindung bestmöglich zu begleiten und zu beraten 13 14 . Dabei kann die Anpassung einer Hybridprothese, also einer myoelektrischen Handprothese, die an der beeinträchtigten Hand befestigt wird, helfen, dem Patienten eine Vorstellung der Vorteile der möglichen Prothesenhand zu geben (siehe Abb. 1 ) 13 15 . Wichtig ist an dieser Stelle zu betonen, dass die bionische Versorgung nicht als Ersatz einer biologischen Rekonstruktion gesehen werden darf. Vielmehr bietet sie sich als zusätzliches Werkzeug der rekonstruktiven Möglichkeiten für eine austherapierten Hand an, um eine gewisse Extremitätenfunktion im Alltag zu erwirtschaften. Von essenzieller Bedeutung bei der bionischen Rekonstruktion ist die richtige Indikationsstellung im Einzelfall. Aufgrund der vielversprechenden Resultate kann die Entscheidung zur bionischen Rekonstruktion fallweise auch auf Patienten mit angeborenen Extremitätenfehlbildungen erweitert werden 16 .
Abb. 1.
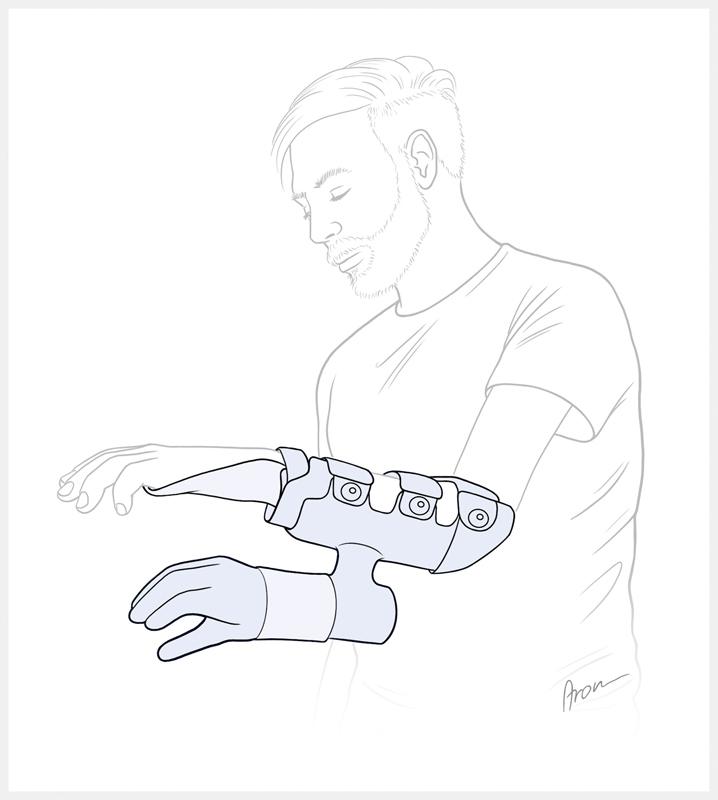
Schematische Darstellung einer Hybridprothese. Eine myoelektrische Handprothese wird an der funktionslosen Hand befestigt, um dem Patienten die Vorstellung einer Prothesenversorgung zu ermöglichen. (Quelle: Illustrationen von Aron Cserveny – www.sciencevisual.at)
Bei einigen unserer Patienten zeigt sich nach erfolgter bionischer Rekonstruktion auch eine Besserung des Phantomschmerzes, also des Schmerzempfindens in der amputierten Gliedmaße. Ursächlich scheint das visuelle Feedback einer funktionsfähigen Hand zu sein, ähnlich wie bei einer Spiegeltherapie und der damit verbundenen Reintegration der verlorenen Gliedmaße in das Körperbild.
Targeted Muscle Reinnervation in der bionischen Rekonstruktion
Die TMR wurde erstmals 2004 von Kuiken et al. konzeptualisiert und beschreibt eine chirurgische Technik zur Multiplikation und Amplifikation der verfügbaren Muskelsignale für die prothetische Steuerung 17 . Im Rahmen dieses Eingriffes werden die großen Nerven des Armes, also der N. medianus, N. ulnaris, N. radialis und je nach Amputationshöhe auch der N. musculocutaneus, die aufgrund der Amputation ihre Zielorgane verloren haben, auf neue Zielmuskeln im Stumpfbereich verlagert (siehe Abb. 2 ) 18 . Ausschlaggebend ist hierbei neben einer präoperativen klinischen Untersuchung und Bildgebung zur Planung des Operationskonzepts auch intraoperativ eine Qualitätseinschätzung der Nervenfaszikel vorzunehmen und damit den Funktionsverlust der Nerven, beispielsweise durch eine proximale Avulsion, soweit möglich auszuschließen. Eine Identifikation mittels Stimulation ist durch den angesprochenen Verlust des Zielorgans nicht mehr möglich. Bei Unversehrtheit des Plexus brachialis sowie der entsprechenden Zielmuskeln hat sich eine standardisierte Nerventransfermatrix durchgesetzt (siehe Tab. 1 2 ) 18 , wobei diese bei der Operationsplanung im Hinblick auf die kürzeste Reinnervationsstrecke patientenspezifisch zu adaptieren ist. Wo nicht ausreichend Zielmuskeln für eine Reinnervation zur Verfügung stehen, kann ein freier funktioneller Muskeltransfer in den Stumpfbereich in Betracht gezogen werden, um zusätzliche Signale zu liefern 5 . So können beispielsweise mit einem Transfer des M. gracilis ein, beziehungsweise durch territoriale Differenzierung des Muskels 19 , wenn notwendig, auch zwei weitere Signale gewonnen werden. Nach abgeschlossener Reinnervation der Muskel durch die transferierten Nerven, können diese angesteuert und die erzeugten Muskelkontraktionen als Signale zur Prothesensteuerung abgeleitet werden. Zur zusätzlichen Verbesserung der Signalqualität und -isolierung werden die neu innervierten Muskeln lokal transpositioniert, um eine Überlagerung zu vermeiden und zusätzlich, so erforderlich, ein subkutaner Fett-Faszienlappen zur Signalseparation eingebracht. Zuletzt wird die Haut über dem Zielmuskeln gründlich entfettet 20 . Postoperativ hat sich ein strukturierter Rehabilitationsprozess unter Zuhilfenahme von EMG-Biofeedback als hilfreich erwiesen, um den Lernprozess der kognitiven Ansteuerung der neuen neuromuskulären Einheiten zu unterstützen und zu beschleunigen 21 .
Abb. 2.
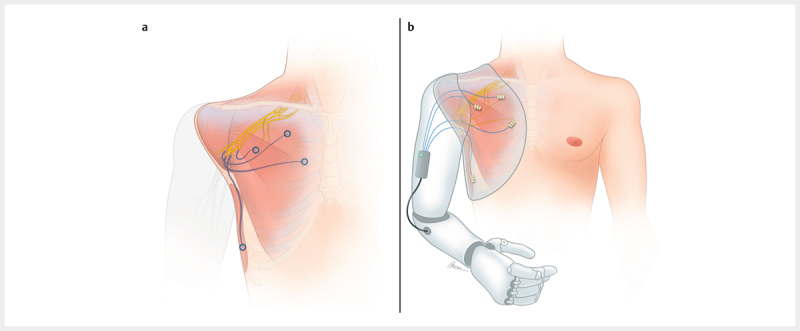
Die TMR bezeichnet die chirurgische Umlagerung der Hauptnerven des Arms auf die Muskulatur im Stumpfbereich ( a ), um die verfügbaren Muskelsignale zur Prothesensteuerung zu vermehren ( b ). (Quelle: Illustrationen von Aron Cserveny – www.sciencevisual.at )
Tab. 1 Nerventransfermatrix bei glenohumeraler Amputation“
| Zielmuskel | Nerv | Prothesenfunktion |
|---|---|---|
| M. pectoralis major pars clavicularis | N. musculocutaneus | Ellenbogenflexion |
| M. pectoralis major pars sternocostalis | N. medianus | Umwendbewegung |
| M. pectoralis major pars abdominalis | N. medianus | Umwendbewegung |
| M. pectoralis minor | N. ulnaris | Hand schließen |
| M. latissimus dorsi | N. radialis | Ellenbogenextension |
| M. infraspinatus | R. prof. n. radialis | Hand öffnen |
Nerventransfermatrix bei glenohumeraler Amputation 18
Tab. 2 Nerventransfermatrix bei transhumeraler Amputation“
| Zielmuskel | Nerv | Prothesenfunktion |
|---|---|---|
| M. biceps caput logum | N. musculocutaneus | Ellenbogenflexion |
| M. biceps caput breve | N. ulnaris | Hand schließen |
| M. brachialis | N. medianus | Pronation |
| M. triceps caput longum/mediale | N. radialis | Ellenbogenextension |
| M. triceps caput laterale | geteilter R. prof. n. radialis | Hand öffnen |
| M. brachioradialis | geteilter R. prof. n. radialis | Supination |
Nerventransfermatrix bei transhumeraler Amputation 18
Ziel der so erzeugten Signalmultiplikation ist für jede Gelenkebene der Prothese ein separates Myosignal zu schaffen. Dadurch wird eine simultane Bewegung der verschiedenen prothetischen Freiheitsgrade erreicht und die mühselige Notwendigkeit, zwischen den verschiedenen Bewegungsebenen umzuschalten, vermieden. Darüber hinaus ermöglicht die Koppelung der Signalableitung und Prothesenbewegung an die ursprünglich vom Nerv vermittelte motorische Funktion, wie beispielsweise Ableitung des Signals für Faustschluss über dem nun vom N. ulnaris innervierten Muskel, ein intuitives Bewegungsmuster. In der Literatur ist eine Verbesserung der Prothesenfunktion auch nach TMR bei transradialen Amputationen in Kombination mit Mustererkennungsalgorithmen beschrieben 22 23 . Diese Algorithmen sind maschinelle Lernalgorithmen, zur Erkennung der Aktivitätsmuster der verschiedenen aufgezeichneten EMG-Signale 22 . An dieser Stelle sei erwähnt, dass TMR ausschließlich zur Verbesserung der Prothesensteuerung bei unseren Patienten nach transradialer Amputation kaum Anwendung findet, da die vorhandenen Myosignale meist ausreichend zur differenzierten Steuerung der Handfunktion sind. Vielmehr ist unserer Erfahrung nach eine genaue Trennung der verschiedenen Signale auf engem Raum im Bereich der extrinsischen Handmuskulatur am Unterarm, zumindest mit den zum jetzigen Zeitpunkt genutzten Oberflächenelektroden, nicht eindeutig möglich.
Gleichzeitig lassen sich durch die bei der TMR durchgeführten Nerventransfers auch Neuromschmerzen effektiv behandeln, da die vorhandenen Neurome reseziert und die Nerven auf die motorischen Äste der entsprechenden Muskeln verlagert werden. Die Nerven erhalten ein neues Zielorgan, wodurch erstens einer erneuten Neurombildung vorgebeugt 24 25 und zweitens auch eine Linderung des vorhandenen Phantomschmerzes von den Patienten angegeben wird 25 . Diese Effekte sind ebenso bei transradial Amputierten zu beobachten 26 , weshalb TMR zur Schmerz- und Neuromtherapie bei diesen Patienten auch an unserer Klinik durchgeführt wird. Eine effektive Neuromprävention im Stumpfbereich ist wesentlich 27 , um den Patienten ein schmerzfreies Tragen der Prothese zu ermöglichen.
Alternative Versorgungsmöglichkeiten
Neben myoelektrischen Prothesen kann die Versorgung von Amputationen der oberen Extremität auch mit rein passiven oder durch Eigenkraft gesteuerte („body-powered“) Prothesen erfolgen.
Passive, ästhetische Prothesen werden häufig für distale Defekte, beispielsweise nach Finger- oder Daumenverlust, verwendet, können zum Beispiel als Gegenhalt aber auch einen gewissen funktionellen Wert besitzen. Auch Eigenkraftprothesen finden je nach geographischer Region und Amputationshöhe noch Anwendung, werden aber zumindest in Europa zunehmend von myoelektrischen Prothesen als Standardversorgung der oberen Extremität abgelöst 8 28 .
Eine weitere Möglichkeit zur Wiederherstellung der oberen Extremitätenfunktion ist eine Rekonstruktion im Sinne einer Handtransplantation. 1998 in Frankreich das erste Mal erfolgreich durchgeführt 29 , bietet eine als Allograft transplantierte Hand durchaus Vorteil verglichen mit einer Prothese. Sie ermöglicht die Rekonstruktion einer sensiblen Hand, einer präzisen und intuitiven motorischen Funktion mit guten Langzeitergebnissen, sowie der Körperintegrität 30 31 . Nach erfolgter Transplantation ist jedoch eine lebenslange Immunsuppression zum Erhalt der Hand mit entsprechenden Folgen, wie erhöhtes Risiko für Infektionen, Neoplasien oder Organversagen, notwendig 32 . Diese Risiken, die dennoch mit einer hohen Rate an Transplantatversagen einhergehen 33 , verhindern derzeit eine breite Anwendung, auch wenn nach einer Handtransplantation wie angeführt eine ausgezeichnete Handfunktion und damit eine deutliche Verbesserung der Lebensqualität erreicht werden kann. In Abwägung der genannten gesundheitlichen Auswirkungen und Vorteile einer Handtransplantation wird eine bilaterale Amputation der oberen Extremität, sowie im Einzelfall eine Amputation mit zusätzlichem Verlust der Sehkraft als Indikation genannt 31 .
Vorteile und Herausforderungen der bionischen Rekonstruktion in Kombination mit TMR
Der Einsatz bionischer Rekonstruktionstechniken ermöglicht die Wiederherstellung natürlicherer Bewegungsmuster und -abläufe. Verglichen mit konventionellen Prothesenversorgungen zeichnet sich der bionische Ansatz durch eine erhöhte Präzision sowie eine intuitive Anwendung im Alltag aus, insbesondere nach TMR bei Amputationen oberhalb des Ellenbogens. Neben den funktionellen Benefits wurde zuvor schon auf die lindernde Wirkung bezüglich Phantom- und Neuromschmerz hingewiesen. Darüber hinaus werden nach prothetischer Versorgung im Allgemeinen 34 und spezifisch nach bionischer Rekonstruktion auch positive Effekte auf die mentale Gesundheit beobachtet 14 35 . Gerade bei hohen Amputationen der oberen Extremität können wir nach bionischer Versorgung inklusive TMR derartige Auswirkungen beobachten. Durch die intuitiven und simultanen Bewegungsabläufe erfolgt die Bewegungsaufführung immer unbewusster, wodurch die Fokussierung des Patienten auf seinen Defekt und damit der der Krankheit gegebene Raum reduziert wird. Diese Entwicklung ist ein wichtiger Bestandteil die neue, künstliche Extremität in das eigene Körperbild zu integrieren und den Verlust der verlorenen zu kompensieren.
Durch Integration technischer Lösungsansätze zur Rekonstruktion biologischer Defekte ergeben sich neben den genannten positiven Aspekten auch Herausforderungen bezüglich der Kompatibilität dieser beiden Systeme. Während manche Probleme, wie beispielsweise das notwendige Umschalten zwischen den Gelenkebenen durch Kokontraktionen, durch TMR chirurgisch gelöst werden konnten 17 und sich Datenextraktion und -verarbeitung der Signale durch technologische Fortschritte wie Mustererkennung verbessert haben 7 , bestehen andere Schwierigkeiten nach wie vor. Allen voran betrifft das den Versuch, neben einer efferenten auch eine afferente Funktionskomponente, also eine gewisse prothesenvermittelte Sensibilität, zu erreichen. Gegenwärtig nehmen Patienten ihre Prothese vor allem durch visuelles Feedback wahr, beziehungsweise geben diskrete Motorengeräusche zusätzlich Rückmeldungsmöglichkeiten. Das langfristige Ziel muss jedoch eine sensible und direkte propriozeptive Rückkoppelung sein. Erste Ansätze diesbezüglich sind zurzeit Gegenstand der Forschung 36 37 , eine Lösung zur Integration einer ansatzweise natürlichen, multimodalen Sensibilität mit akzeptabler Latenzzeit in die prothetische Versorgung ist zum jetzigen Zeitpunkt allerdings noch nicht absehbar.
Zur Optimierung der klinischen Ergebnisse nach bionischer Rekonstruktion ist neben chirurgischer Leistung und technischer Innovation auch der Patient selbst gefordert. In der Nachbehandlung muss der Patient unter therapeutischer Anleitung lernen, die einzelnen Muskelsignale gezielt zur Prothesensteuerung zu aktivieren. Dazu ist gerade in der anfänglich kognitiv sehr fordernden und dadurch zeitweise auch frustranen Periode eine hohe Patientencompliance im anspruchsvollen Rehabilitationsprozess notwendig. Besonders effektiv ist während dieser Zeit ein intensives Signaltraining mit EMG-Feedback 21 38 , wobei dieses erst nach Regeneration der Nerven in den Muskel, in der Regel etwa drei bis sechs Monate nach der TMR Operation, sinnvoll ist. Bei dem Training erhalten die Patienten eine visuelle Rückmeldung ihrer Muskelaktivität, wodurch die Ansteuerung selektiver Muskelsignale leichter zu erfassen ist und die motorisch-kognitiven Lernprozesse gefördert werden. Zu Beginn ist es hilfreich, die gedachte Bewegung gleichzeitig mit der gesunden Gegenseite auszuführen. Das erleichtert dem Patienten die Bewegung des Phantomarms und hilft dem Therapeuten die gedachte Bewegung zu erkennen. Mittels EMG kann in dieser Phase zusätzlich die bestmögliche Positionierung der Oberflächenelektroden im Stumpfbereich bestimmt werden, um Interferenzen benachbarter Muskeln zu minimieren und die Signalqualität zu optimieren. Üblicherweise ist die Nervenregeneration nach etwa neun Monaten abgeschlossen, innerhalb dieses Zeitraumes müssen die korrekten Elektrodenpositionen gelegentlich angepasst werden. Die Nachbehandlung einer bionischen Rekonstruktion erfordert dementsprechend Zeit, hohe Patientenmotivation und vor allem Expertise.
Klinische Ergebnisse und Ausblick
Der Erfolg einer prothetischen Versorgung kann am besten daran gemessen werden, ob die Prothese im Alltag auch tatsächlich getragen und genutzt wird. Den größten Einfluss darauf haben Funktionalität und Tragekomfort des Schafts 39 . Auf beide Parameter wirkt sich eine bionische Rekonstruktion inklusive TMR Operation positiv aus. So wird sowohl die Neurombildung im Stumpfbereich verhindert beziehungsweise therapiert 24 25 , als auch die Funktion der Prothese, verglichen mit einer Zweisignalsteuerung, verbessert 10 . Dennoch lehnt auch dann etwa ein Drittel der Patienten eine regelmäßige Anwendung ab 10 . Das unterstreicht erneut die Notwendigkeit weiterer Fortschritte und Verbesserungen, um die Akzeptanz und damit die Nutzungsrate bei Patienten zu steigern.
Ein Ansatzpunkt ist die momentan standardmäßig eingesetzte Schaftversorgung als Schnittstelle zwischen Stumpf und Prothese, da diese sowohl unkomfortabel als auch bezüglich der Signalübertragung mittels Oberflächenelektroden unbeständig ist. Dafür verantwortlich ist neben der klassischen Begleitproblematik eines Prothesenschafts, wie erhöhte Feuchtigkeitsbildung durch Transpiration, auch die unbeständige Stumpfposition im Schaft, die zu Weichteilverschiebungen und Kontaktstörungen bei der Signalableitung führt. Das Konzept der Osseointegration (OI), also der prothetischen Anbindung direkt an den Knochen, macht einen großen, den Stumpf umfassenden Schaft obsolet und ermöglicht gleichzeitig maximalen Erhalt der Beweglichkeit 40 . Insbesondere bei Patienten mit sehr kurzem Stumpf nach gelenksnaher Amputation, bei denen konventionelle Schaftversorgungen zum Verlust jeglicher Restfunktion des Gelenks führen, bietet die OI eine Möglichkeit das Gelenk auch funktionell zu erhalten. Unsere Forschungsgruppe konnte so bereits Patienten mit einer Restlänge des Humerus von etwa 6 cm oder der Unterarmknochen von etwa 7 cm erfolgreich mittels OI behandeln und dadurch ein aktives Schulter-beziehungsweise Ellenbogengelenk erhalten. Das Infektrisiko aufgrund des perkutanen Durchtritts wie auch die anspruchsvolle Technik und hohe Kosten sind noch limitierende Faktoren für eine breite Implementierung der OI. In manchen Situationen entscheidet sich der Patient auch aus anderen spezifischen Gründen gegen eine OI. Beispielsweise ist bei einem langen Amputationsstumpf eine weitere Rückkürzung notwendig, um eine sinnvolle Anwendung der Prothese nach OI zu ermöglichen. Ein weiterer Gewebsverlust wird in seltenen Fällen nach Verlust der Extremität aber vom Patienten nicht akzeptiert. Zum jetzigen Zeitpunkt werden die Muskelsignale zur Prothesensteuerung mit Oberflächenelektroden erfasst. Die Nachteile dieser Methode sind mannigfaltig und oben ausführlich beschrieben. Durch intramuskuläre Implantation der Elektroden kann das Signal direkt am Muskel aufgenommen und kabellos weitergeleitet werden. Dadurch ist eine selektive Signalaufnahme ohne Interferenzen benachbarter Muskelsignale und ohne Beeinträchtigung durch Weichteilverschiebungen möglich. Diesbezüglich gibt es bereits vielversprechende erste Tierversuchsstudien 41 und erste klinische Daten 42 . Darüber hinaus konnte von unserer Forschungsgruppe die Langzeitverträglichkeit und Effektivität eines solchen Systems bestätigt und eine langfristig stabile und intuitive Prothesensteuerung nachgewiesen werden 43 . Insgesamt war die Funktionalität im Vergleich zur konventionellen transkutanen EMG-basierten Kontrolle verbessert. Außerdem konnte der Rehabilitationsstart nach TMR frühzeitig erfolgen, da die ersten Muskelsignale nach der Reinnervation früher registriert wurden.
Klinisches Fallbeispiel
Der Prozess der prothetischen Versorgung, sowie erzielbare Ergebnisse sollen nachfolgend anhand eines Patientenbeispiels veranschaulicht werden. Bei dem Patienten handelt es sich um einen 52-jährigen Mann, der im Rahmen eines Arbeitsunfalls von einem LKW überrollt wurde. Aufgrund der schweren Verletzungen des linken Armes war eine Rekonstruktion nicht möglich und eine transhumerale Amputation notwendig. Der Patient erlangte im postoperativen Verlauf eine gute Funktion im Schultergelenk, litt aber unter Phantombeschwerden der linken Hand und vor allem Neuromschmerzen im Stumpfbereich, die das Tragen einer konventionellen Schaftprothese verhinderten.
Zur optimalen Versorgung des Patienten wurde daher die Indikation zur TMR Operation zur Neuromtherapie und Signalvermehrung, kombiniert mit einer OI zum Erhalt seiner Schulterfunktion und Maximierung der Signalqualität für eine spätere bionische Prothese gestellt (siehe Abb. 3 ). Sechs Wochen postoperativ konnte im Rahmen der Nachbehandlung mit einem vorsichtigen Belastungstraining der OI begonnen werden, welches innerhalb von weiteren zwölf Wochen auf Vollbelastung gesteigert wurde. Währenddessen wurde bereits mit der Signalfeststellung und -training begonnen und der Patient konnte etwa sieben Monate nach dem Eingriff vier Signale gezielt und selektiv ansteuern. Damit erfolgte eine Umstellung der bisherigen Probeversorgung auf die endgültige myoelektrische Prothese.
Abb. 3.
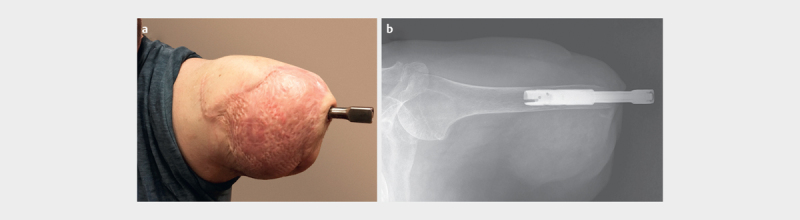
Der Amputationsstumpf nach durchgeführter TMR Operation kombiniert mit einer Osseointegration ( a ). Bei der Operation wurde der N. medianus auf den M. brachialis, der N. ulnaris auf das Caput breve bicipitis und der R. profundus n. radialis auf das Caput laterale tricipitis transferiert. Das Röntgenbild zeigt die Fixierung des Implantats im Humerus mit einer Restlänge von etwa 20 cm ( b ).
Mit vier Signalen kann der Patient seine Prothese intuitiv und in verschiedenen Gelenksebenen simultan ansteuern (siehe Abb. 4 ). Mit zwei Signalen (Caput longum bicipitis und tricipitis) steuert er die Ellbogenflexion beziehungsweise -extension und mit den anderen beiden (Caput breve bicipitis und Caput laterale tricipitis) das Öffnen und Schließen der Hand. Zusätzlich kann er über Kokontraktion zwischen der Steuerung der Handfunktion und Pro- und Supination umschalten. Gleichzeitig ist durch die OI eine weite Einfassung des Stumpfes mit Einbezug des Schultergelenks und allen verbundenen Nachteilen nicht notwendig. Der Patient trägt und nutzt die Prothese regelmäßig und beschreibt sie als große Hilfe im Alltag. Die bionische Rekonstruktion ermöglichte diesem Patienten nicht nur eine ästhetische und deutliche funktionelle Verbesserung, sondern auch eine Reintegration der verlorenen Extremität in das eigene Körperbild (siehe Abb. 5 ).
Abb. 4.
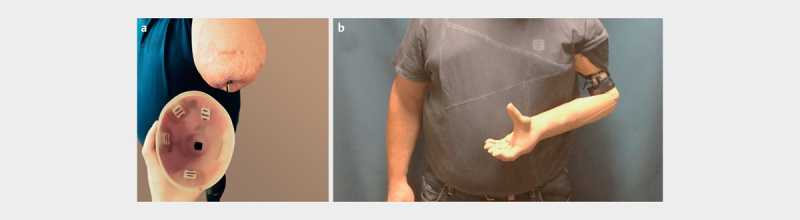
Endgültige Prothesenversorgung des Patienten mit direkt im Schaft verbauten Oberflächenelektroden zur Signaldetektion über dem Caput longum und laterale tricipitis und dem Caput longum und breve bicipitis ( a ). Mit vier Signalen können Ellbogen- und Hand-beziehungsweise Fingergelenke simultan angesteuert werden ( b ).
Abb. 5.

Die prothetische Versorgung dient dem Patienten bei verschiedenen, sowohl fein- ( a ) als auch grobmotorischen ( b ) Tätigkeiten im Alltag als Hilfshand.
Fazit
Die Technik der TMR ist ein bedeutender Fortschritt im Bereich der myoelektrischen Amputationsversorgung. Durch Amplifikation und Multiplikation der nutzbaren Muskelsignale durch entsprechende selektive Nerventransfers wird eine intuitive, dem natürlichen Bewegungsmuster nahekommende Prothesensteuerung ermöglicht. Gleichzeitig können Phantom- und Neuromschmerzen reduziert werden, indem den großen Nerven der oberen Extremität ein neues Regenerationsziel und eine neue Aufgabe gegeben wird. Nichtsdestotrotz wird das volle Potenzial an TMR-vermittelten Möglichkeiten aufgrund der genutzten transkutanen Schnittstellen zwischen Muskel und Maschine nicht zur Gänze ausgeschöpft. Implantierbare Elektroden haben in mehreren Studien bereits vielversprechende Ergebnisse bezüglich der Vorteile in Funktion, Stabilität und Kompatibilität gezeigt, finden derzeit aber noch keine Anwendung im klinischen Alltag. Zusätzlich kann mittels OI die Schnittstelle verbessert, klassische Begleitproblematiken einer konventionellen Schaftversorgung reduziert und gerade bei sehr kurzen Amputationsstümpfen die Bewegungsfreiheit der vorhandenen Gelenke erhalten werden. Die Integration dieser therapeutischen Ansätze schafft die Grundlage einer lebensnahen Prothesenversorgung, wobei hierfür noch auf einen Durchbruch im Bereich der sensiblen, afferenten Rekonstruktion zu hoffen ist.
Fördermittel
European Research Council — http://dx.doi.org/10.13039/501100000781;
Autorinnen/Autoren
Leopold Harnoncourt.

begann sein Medizinstudium 2016 an der Medizinischen Universität Wien. Nach seinem Studienabschluss und der Absolvierung seiner Diplomarbeit, die sich mit Muskelstammzellen bei Spastizität und Nerventransfers befasste, ist er seit Herbst 2022 als wissenschaftlicher Mitarbeiter und PhD-Student im Klinischen Labor für Bionische Extremitätenrekonstruktion tätig. Seine Forschungsprojekte konzentrieren sich auf die Regenerationsmuster nach bestimmten Nerventransfers und sensorische Filet-Lappen der unteren Extremität.
Footnotes
Interessenkonflikt Die Autorinnen/Autoren geben an, dass kein Interessenkonflikt besteht.
Literatur
- 1.Belon H P, Vigoda D F. Emotional adaptation to limb loss. Phys Med Rehabil Clin N Am. 2014;25:53–74. doi: 10.1016/j.pmr.2013.09.010. [DOI] [PubMed] [Google Scholar]
- 2.Oleske D M, Hahn J J. Work-related injuries of the hand: data from an occupational injury/illness surveillance system. J Community Health. 1992;17:205–219. doi: 10.1007/BF01321653. [DOI] [PubMed] [Google Scholar]
- 3.von Schroeder H P, Botte M J. Crush syndrome of the upper extremity. Hand Clin. 1998;14:451–456. [PubMed] [Google Scholar]
- 4.Naidu S H, Heppenstall R B. Compartment syndrome of the forearm and hand. Hand Clin. 1994;10:13–27. [PubMed] [Google Scholar]
- 5.Aszmann O C, Roche A D, Salminger S et al. Bionic reconstruction to restore hand function after brachial plexus injury: a case series of three patients. Lancet. 2015;385:2183–2189. doi: 10.1016/S0140-6736(14)61776-1. [DOI] [PubMed] [Google Scholar]
- 6.Aszmann O C, Dietl H, Frey M. Selektive Nerventransfers zur verbesserten Steuerung myoelektrischer Armprothesen. Handchir Mikrochir Plast Chir. 2008;40:60–65. doi: 10.1055/s-2007-989415. [DOI] [PubMed] [Google Scholar]
- 7.Roche A D, Rehbaum H, Farina D et al. Prosthetic Myoelectric Control Strategies: A Clinical Perspective. Current Surgery Reports. 2014;2:44. doi: 10.1007/s40137-013-0044-8. [DOI] [Google Scholar]
- 8.Ostlie K, Lesjo I M, Franklin R J et al. Prosthesis use in adult acquired major upper-limb amputees: patterns of wear, prosthetic skills and the actual use of prostheses in activities of daily life. Disabil Rehabil Assist Technol. 2012;7:479–493. doi: 10.3109/17483107.2011.653296. [DOI] [PubMed] [Google Scholar]
- 9.Salminger S, Stino H, Pichler L H et al. Current rates of prosthetic usage in upper-limb amputees – have innovations had an impact on device acceptance? Disabil Rehabil. 2022;44:3708–3713. doi: 10.1080/09638288.2020.1866684. [DOI] [PubMed] [Google Scholar]
- 10.Salminger S, Sturma A, Roche A D et al. Outcomes, Challenges, and Pitfalls after Targeted Muscle Reinnervation in High-Level Amputees: Is It Worth the Effort? Plast Reconstr Surg. 2019;144:1037e–1043e. doi: 10.1097/PRS.0000000000006277. [DOI] [PubMed] [Google Scholar]
- 11.Farina D, Aszmann O. Bionic limbs: clinical reality and academic promises. Sci Transl Med. 2014;6:257ps212. doi: 10.1126/scitranslmed.3010453. [DOI] [PubMed] [Google Scholar]
- 12.Biddiss E A, Chau T T. Upper limb prosthesis use and abandonment: a survey of the last 25 years. Prosthet Orthot Int. 2007;31:236–257. doi: 10.1080/03093640600994581. [DOI] [PubMed] [Google Scholar]
- 13.Hruby L A, Sturma A, Mayer J A et al. Algorithm for bionic hand reconstruction in patients with global brachial plexopathies. J Neurosurg. 2017;127:1163–1171. doi: 10.3171/2016.6.JNS16154. [DOI] [PubMed] [Google Scholar]
- 14.Hruby L A, Pittermann A, Sturma A et al. The Vienna psychosocial assessment procedure for bionic reconstruction in patients with global brachial plexus injuries. PLoS One. 2018;13:e0189592. doi: 10.1371/journal.pone.0189592. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Hruby L A, Gstoettner C, Sturma A et al. Bionic Upper Limb Reconstruction: A Valuable Alternative in Global Brachial Plexus Avulsion Injuries-A Case Series. J Clin Med. 2020;9(1):23. doi: 10.3390/jcm9010023. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Salminger S, Roche A D, Sturma A et al. Improving arm function by prosthetic limb replacement in a patient with severe arthrogryposis multiplex congenita. J Rehabil Med. 2016;48:725–728. doi: 10.2340/16501977-2123. [DOI] [PubMed] [Google Scholar]
- 17.Kuiken T A, Dumanian G A, Lipschutz R D et al. The use of targeted muscle reinnervation for improved myoelectric prosthesis control in a bilateral shoulder disarticulation amputee. Prosthet Orthot Int. 2004;28:245–253. doi: 10.3109/03093640409167756. [DOI] [PubMed] [Google Scholar]
- 18.Salminger S, Sturma A, Herceg M et al. Prothetische Rekonstruktion hoher Amputationen der oberen Extremität. Orthopade. 2015;44:413–418. doi: 10.1007/s00132-015-3113-0. [DOI] [PubMed] [Google Scholar]
- 19.Frey M, Giovanoli P, Tzou C H et al. Dynamic reconstruction of eye closure by muscle transposition or functional muscle transplantation in facial palsy. Plast Reconstr Surg. 2004;114:865–875. doi: 10.1097/01.prs.0000133028.02303.16. [DOI] [PubMed] [Google Scholar]
- 20.Kuiken T A, Lowery M M, Stoykov N S. The effect of subcutaneous fat on myoelectric signal amplitude and cross-talk. Prosthet Orthot Int. 2003;27:48–54. doi: 10.3109/03093640309167976. [DOI] [PubMed] [Google Scholar]
- 21.Sturma A, Stamm T, Hruby L A et al. Rehabilitation of high upper limb amputees after Targeted Muscle Reinnervation. J Hand Ther. 2022;35:58–66. doi: 10.1016/j.jht.2020.10.002. [DOI] [PubMed] [Google Scholar]
- 22.Kuiken T A, Miller L A, Turner K et al. A Comparison of Pattern Recognition Control and Direct Control of a Multiple Degree-of-Freedom Transradial Prosthesis. IEEE J Transl Eng Health Med. 2016;4:2.100508E6. doi: 10.1109/JTEHM.2016.2616123. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Simon A M, Turner K L, Miller L A et al. Myoelectric prosthesis hand grasp control following targeted muscle reinnervation in individuals with transradial amputation. PLoS One. 2023;18:e0280210. doi: 10.1371/journal.pone.0280210. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Souza J M, Cheesborough J E, Ko J H et al. Targeted muscle reinnervation: a novel approach to postamputation neuroma pain. Clin Orthop Relat Res. 2014;472:2984–2990. doi: 10.1007/s11999-014-3528-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Dumanian G A, Potter B K, Mioton L M et al. Targeted Muscle Reinnervation Treats Neuroma and Phantom Pain in Major Limb Amputees: A Randomized Clinical Trial. Ann Surg. 2019;270:238–246. doi: 10.1097/SLA.0000000000003088. [DOI] [PubMed] [Google Scholar]
- 26.Pierrie S N, Gaston R G, Loeffler B J. Targeted Muscle Reinnervation for Prosthesis Optimization and Neuroma Management in the Setting of Transradial Amputation. J Hand Surg Am. 2019;44:525 e521–525 e528. doi: 10.1016/j.jhsa.2018.11.019. [DOI] [PubMed] [Google Scholar]
- 27.Aszmann O C, Moser V, Frey M. Die Behandlung chronisch schmerzhafter Neurome mittels End-zu-Seit Neurorraphie. Handchir Mikrochir Plast Chir. 2010;42:225–232. doi: 10.1055/s-0030-1255053. [DOI] [PubMed] [Google Scholar]
- 28.Kyberd P J, Hill W. Survey of upper limb prosthesis users in Sweden, the United Kingdom and Canada. Prosthet Orthot Int. 2011;35:234–241. doi: 10.1177/0309364611409099. [DOI] [PubMed] [Google Scholar]
- 29.Errico M, Metcalfe N H, Platt A. History and ethics of hand transplants. JRSM Short Rep. 2012;3:74. doi: 10.1258/shorts.2012.011178. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Lucio M J, Horta R. Hand Transplantation-Risks and Benefits. J Hand Microsurg. 2021;13:207–215. doi: 10.1055/s-0040-1715427. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Salminger S, Roche A D, Sturma A et al. Hand Transplantation Versus Hand Prosthetics: Pros and Cons. Curr Surg Rep. 2016;4:8. doi: 10.1007/s40137-016-0128-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Pollard M S. Hand transplantation--risks of immunosuppression. J Hand Surg Br. 2001;26:517. doi: 10.1054/jhsb.2001.0671. [DOI] [PubMed] [Google Scholar]
- 33.Shores J T, Brandacher G, Lee WP A. Hand and upper extremity transplantation: an update of outcomes in the worldwide experience. Plast Reconstr Surg. 2015;135:351e–360e. doi: 10.1097/PRS.0000000000000892. [DOI] [PubMed] [Google Scholar]
- 34.Mayer A, Kudar K, Bretz K et al. Body schema and body awareness of amputees. Prosthet Orthot Int. 2008;32:363–382. doi: 10.1080/03093640802024971. [DOI] [PubMed] [Google Scholar]
- 35.Aszmann O C, Vujaklija I, Roche A D et al. Elective amputation and bionic substitution restore functional hand use after critical soft tissue injuries. Sci Rep. 2016;6:34960. doi: 10.1038/srep34960. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Raspopovic S, Capogrosso M, Petrini F M et al. Restoring natural sensory feedback in real-time bidirectional hand prostheses. Sci Transl Med. 2014;6:222ra219. doi: 10.1126/scitranslmed.3006820. [DOI] [PubMed] [Google Scholar]
- 37.Tan D W, Schiefer M A, Keith M W et al. A neural interface provides long-term stable natural touch perception. Sci Transl Med. 2014;6:257ra138. doi: 10.1126/scitranslmed.3008669. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Sturma A, Roche A D, Gobel P et al. A surface EMG test tool to measure proportional prosthetic control. Biomed Tech (Berl) 2015;60:207–213. doi: 10.1515/bmt-2014-0022. [DOI] [PubMed] [Google Scholar]
- 39.Schultz A E, Baade S P, Kuiken T A. Expert opinions on success factors for upper-limb prostheses. J Rehabil Res Dev. 2007;44:483–489. doi: 10.1682/jrrd.2006.08.0087. [DOI] [PubMed] [Google Scholar]
- 40.Branemark R, Branemark P I, Rydevik B et al. Osseointegration in skeletal reconstruction and rehabilitation: a review. J Rehabil Res Dev. 2001;38:175–181. [PubMed] [Google Scholar]
- 41.Gstoettner C, Festin C, Prahm C et al. Feasibility of a Wireless Implantable Multi-electrode System for High-bandwidth Prosthetic Interfacing: Animal and Cadaver Study. Clin Orthop Relat Res. 2022;480:1191–1204. doi: 10.1097/CORR.0000000000002135. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Pasquina P F, Evangelista M, Carvalho A J et al. First-in-man demonstration of a fully implanted myoelectric sensors system to control an advanced electromechanical prosthetic hand. J Neurosci Methods. 2015;244:85–93. doi: 10.1016/j.jneumeth.2014.07.016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Salminger S, Sturma A, Hofer Cet al. Long-term implant of intramuscular sensors and nerve transfers for wireless control of robotic arms in above-elbow amputees Sci Robot2019 Jul 174(32) 10.1126/scirobotics.aaw6306 [DOI] [PubMed] [Google Scholar]


