Abstract
目的
探讨凋亡相关基因细胞周期蛋白D2(CCND2)在甲状腺乳头状癌中的表达及其与临床病理的联系。
方法
通过公共数据库TCGA、TIMER 2.0和UALCAN获取CCND2的表达情况;采用ROC曲线对甲状腺乳头状癌(PTC)组织和癌旁组织进行鉴别;使用基因本体功能注释(GO)对CCND2相关差异基因(DEGs)进行富集分析;使用TIMER数据库和CIBERSORT数据源分析甲状腺癌中CCND2的肿瘤免疫浸润情况;采用RT-qPCR和Western blot检测人甲状腺正常细胞系Nthy-ori-3-1和人甲状腺乳头状癌细胞系TPC-1、BCPAP中CCND2表达量;采用免疫组织化学SABC法检测PTC及癌旁组织中CCND2表达,并探讨其与临床病理的联系。
结果
TCGA、TIMER2.0、UALCAN分析显示,与癌旁组织相比,CCND2 mRNA在甲状腺癌中高表达(P<0.001),并且与Stage分期、性别、年龄、病理亚型及区域淋巴结受累情况有关(P<0.05);ROC结果显示,截断值为4.983时,CCND2的灵敏度、特异度和准确度分别为83.6%、94.9%和78.5%;GO分析表明CCND2的差异表达与免疫功能有关;TIMER数据库显示,CCND2表达与B细胞、CD4+T细胞、巨噬细胞呈正相关(partial.cor>0,P<0.001),而与CD8+T细胞呈负相关(partial.cor<0,P<0.01)。CIBERSORT数据库显示,CCND2表达与B细胞记忆渗透水平、CD4+T细胞记忆激活状态、M2巨噬细胞表达水平、肥大细胞静息状态和肥大细胞激活状态显著相关(P<0.05)。RT-qPCR及Western blot结果显示,CCND2在细胞系TPC-1、BCPAP中的表达量高于Nthy-ori-3-1(P<0.01)。免疫组织化学结果显示,CCND2在PTC中的阳性表达高于癌旁组织(P<0.05)且与肿瘤大小、淋巴结转移及TNM分期相关(P<0.05)。
结论
PTC中CCND2表达上调可能与肿瘤进展及免疫细胞浸润密切相关。
Keywords: 甲状腺乳头状癌, 细胞周期蛋白D2, 生物信息学, 肿瘤免疫浸润
Abstract
Objective
To investigate cyclin D2 (CCND2) expression in papillary thyroid carcinoma (PTC) and its association with the clinicopathological features.
Methods
The public databases TCGA, TIMER 2.0 and UALCAN were used to explore CCND2 expression level in PTC and adjacent tissues, and its diagnostic value for PTC was analyzed using ROC curves. GO enrichment analysis of CCND2-related differentially expressed genes (DEGs) in PTC was performed, and tumor immune infiltration of CCND2 in thyroid cancer was analyzed using TIMER database and CIBERSORT data source. RT-qPCR and Western blot were used to detect CCND2 expression in normal human thyroid cell line Nthy-ori-3-1 and human PTC cell lines TPC-1 and BCPAP. CCND2 expression was also detected in clinical specimens of PTC and adjacent tissues by immunohistochemistry, and its correlation with clinicopathological features of the patients were analyzed.
Results
Informatic analysis revealed significantly higher CCND2 mRNA expression in thyroid cancer than in the adjacent tissues (P<0.001) in close correlation with tumor stage, gender, age, pathological subtype, and lymph node involvement (P<0.05). ROC curve analysis showed that at the cutoff value of 4.983, the diagnostic sensitivity, specificity, and accuracy of CCND2 expression for PTC was 83.6%, 94.9%, and 78.5%, respectively. CCND2 expression was positively correlated with B cells, CD4+ T cells, and macrophages (P<0.001) and negatively with CD8+ T cells (P<0.01), and also correlated with memory B-cell infiltration, CD4+ T-cell memory activation, M2 macrophages, resting mast cells, and mast cell activation (P<0.05). RT-qPCR, Western blot and immunohistochemistry showed significantly higher CCND2 expression in the PTC cells than in Nthy-ori-3-1 cells (P<0.01) and also in clinical PTC tissues than in the adjacent tissues (P<0.05) in correlation with tumor size, lymph node metastasis and TNM stage (P<0.05).
Conclusion
CCND2 overexpression is closely correlated with tumor progression and immune cell infiltration in PTC patients..
Keywords: papillary thyroid carcinoma, Cyclin D2, bioinformatics, tumor immune infiltration
甲状腺癌(THCA)在过去几十年里,发病率在全球范围内大幅增加[1]。它的增长率远超其他恶性肿瘤[2]。其中甲状腺乳头状癌(PTC)约占甲状腺癌的85%~90%,虽然其预后较好[3],但仍有10%~20%不良病理亚型及局部晚期的患者具有复发、耐药、远处转移和局部侵袭的特点,且对放射性碘治疗不敏感,导致患者的生存期变短[4]。因此寻求新的治疗靶点加以提前干预,对患者的预后及指导治疗有极其重要的影响。
细胞周期蛋白D2(CCND2)作为凋亡家族的基因,在细胞周期调节、分化和恶性转化中起关键作用,从而参与肿瘤的发生与发展[5]。研究表明,肿瘤免疫微环境中激活的免疫细胞分泌促炎因子和趋化因子,其可能与肿瘤的进展相关[6]。然而,CCND2在甲状腺相关细胞系中的表达情况尚未见报道,甲状腺癌中CCND2表达与免疫浸润的关系也未曾有研究。本研究拟探讨PTC中CCND2表达情况及细胞免疫浸润的作用,为PTC诊断和寻求新的免疫治疗靶点提供理论支持。
1. 资料和方法
1.1. 数据的获取与处理
从TCGA数据库(https://portal.gdc.cancer.gov/)中获取甲状腺癌转录组数据及相应患者的临床数据,其中包含59例癌旁样本数据和512例甲状腺癌样本数据。
1.2. CCND2在甲状腺癌中的差异表达及其与临床、病理的关系
通过TIMER 2.0(http:// timer.cistrome.org/)评估CCND2在不同恶性肿瘤中的表达情况;通过采用TCGA中CCND2的表达数据分析其在THCA中的mRNA表达;通过UALCAN数据库(http://ualcan.path.uab.edu/analysis.html)检测THCA中CCND2的mRNA表达量及与肿瘤分期、性别、年龄、病理亚型及区域淋巴结受累情况之间的关系。
1.3. CCND2相关差异基因的筛选
根据CCND2的表达量将样品分为高、低表达两组,使用limma软件包、mRNA表达谱和R软件(v4.2.1)中的Wilcoxon秩和t检验(|log2FC|>1,FDR<0.05)来分析与CCND2相关的具有显著差异表达的基因(DEGs)。
1.4. CCND2相关差异基因的GO功能富集
对全部DEGs按照P<0.05、FDR q值<0.05进行基因本体功能注释(GO)富集分析,然后通过R软件包如ggplot2、Dose等可视化它们之间的相互作用。
1.5. CCND2表达水平与甲状腺癌肿瘤浸润免疫细胞(TIICs)的关系
通过TIMER(https://cistrome.shinyapps.io/timer/)探索CCND2在甲状腺癌中的表达水平与免疫细胞(B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞、树突状细胞)浸润水平的关系;通过应用CIBERSORT(http://cibersort. stanford.edu/)对6种免疫细胞亚型在甲状腺癌标本的浸润水平进行检测,采用Wilcoxon秩和检验(P<0.05)比较高危组和低危组免疫细胞浸润水平的差异。
1.6. 细胞株、主要试剂及仪器
人甲状腺正常细胞株Nthy-ori-3-1、人甲状腺乳头状癌细胞株TPC-1、BCPAP、胎牛血清(武汉普诺赛生命科技有限公司),兔抗人CCND2(武汉三鹰生物技术有限公司),NovoStart ®SYBR qPCR SuperMix Plus试剂盒(苏州近岸蛋白质科技股份有限公司),BCA蛋白浓度测定试剂盒(GLPBIO),山羊抗兔IgG二抗(江苏亲科生物研究中心有限公司)。
1.7. 细胞培养
Nthy-ori-3-1、TPC-1及BCPAP细胞均培养于含10%胎牛血清(FBS)和1%青霉素-链霉素的RPMI 1640培养基中,放置于5%CO2,37 ℃恒温培养箱中培养,细胞贴壁后融合度>90%,以0.25%的胰蛋白酶消化细胞,根据需要进行传代培养,取对数期细胞用于后续研究。
1.8. 实验标本
收集2020年1月~2022年10月锦州医科大学附属第一医院PTC患者的癌组织及其癌旁组织(距癌灶2 cm内)标本116例。收集性别、年龄、肿瘤直径、病灶数量、有无腺外侵犯、淋巴结转移与否、TNM分期信息。本研究经锦州医科大学附属第一医院伦理委员会审核批准(审批号:KYLL202453),患者签署知情同意书。
1.9. RT-qPCR检测
通过离心柱miRNA(microRNA)提取试剂盒从细胞中提取总RNA,使用novoprotein反转录试剂盒合成cDNA,根据novoprotein试剂盒说明书配置RT-qPCR反应体系,程序为95 ℃预变性60 s,95 ℃ 20 s、60 ℃ 45 s,40次循环,65 ℃退火5s,95 ℃延展5 s。以GAPDH作为内参,引物序列为:CCND2 F:AGGCAGAAGACAGGAACT;R:TAGACTCAGCACCAACCA,GAPDH F:CTGCCCAGAACATCATCC;R:CTCAGATGCCTGCTTCAC,相对表达水平用2-ΔΔCt法进行定量,实验至少重复3次。
1.10. Western blot检测
从细胞中获得的蛋白质使用添加了苯甲基磺酰氟(PMSF)的放射免疫沉淀法缓冲液(RIPA)提取。使用BCA蛋白浓度测定试剂盒对蛋白浓度进行定量。蛋白质在10%SDS-PAGE凝胶上进行电泳分离,电转移到PVDF膜上。用5%牛血清白蛋白(BSA)TBST(TBS+ Tween 20)封闭膜,然后与抗CCND2的一抗孵育,β-Tubulin作为内对照,4 ℃过夜。然后,将膜与山羊抗兔辣根过氧化物酶(HPR)标记的二抗IgG在室温孵育90 min,洗膜后加入ECL显色试剂,避光显影。采用Image J软件分析细胞中目的蛋白相对表达水平,实验至少重复3次。
1.11. 免疫组化SABC法检测CCND2的蛋白表达
将所收集的116例PTC和癌旁组织进行免疫组化检测,使用10%甲醛溶液固定组织,常规脱水、透明、蜡包埋,以厚度为4 μm连续切片、微波修复、3%过氧化氢孵育、血清封闭。依次添加一抗(4 ℃过夜),二抗,DAB显色后,苏木精复染后常规脱水透明中性胶封口。PBS取代一抗作为阴性对照。
1.12. 统计学分析
采用R软件(V4.2.1)、Image J、Image Pro Plus、GraphPad Prism 8.4.3进行数据整理与分析绘图,应用SPSS 26.0进行统计学分析,用非参数Wilcoxon秩和检验评价CCND2在肿瘤组织和正常组织中差异表达的意义,通过Fisher精确检验进行GO富集显著性分析,用受试者工作特征曲线(ROC)法分析肿瘤组织中CCND2表达水平对PTC的诊断效能,采用Mann-Whitney -Wilcoxon检验比较高危组和低危组免疫细胞浸润水平的差异,采用单因素方差分析检测CCND2在甲状腺相关细胞系的表达水平,应用t检验分析平均光密度,以P<0.05为差异具有统计学意义。所有实验均独立重复3次。
2. 结果
2.1. CCND2在甲状腺癌患者中的表达及其相关差异基因
通过TIMER2.0数据库评估CCND2在人类实体肿瘤的转录含量,结果显示CCND2在甲状腺癌中高表达(图1A)。通过UALCAN数据库,以THCA为搜索项检索到564例样品,经分析显示,THCA组织(n=505)中CCND2 mRNA表达水平高于癌旁组织(n=59,P<0.001,图1B)。经Wilcoxon秩和检验显示CCND2在THCA组织(n=512)中的表达水平显著高于癌旁组织(n=59,P<0.001,图1C),且同一样本下肿瘤组织和正常组织中CCND2的表达有显著差异(P<0.001,图1D)。按照筛选条件,共获得535个差异表达基因,其中与CCND2呈正相关(NME8、BMX等)有204个,呈负相关(PPY、AKR1B10等)有331个,其中红色代表正相关,蓝色代表负相关(图1E)。
图1.

CCND2在甲状腺癌中的表达差异及相关差异基因
Fig.1 Differential expressions of CCND2 and related genes in thyroid cancer. A: CCND2expression in different types of cancer investigated with the Tumor Immune Estimation Resource (TIMER) database. B: CCND2 expression in THCA was examined by using the UALCAN database; C: Analysis of CCND2 expression in THCA and adjacent normal tissues in the TCGA database; D: Analysis of CCND2 expression in THCA and paired adjacent normal tissues in TCGA database; E: Expression heatmap of differential gene related to CCND2. ***P<0.001
2.2. CCND2表达与临床病理相关性分析
通过UALCAN数据库,依据CCND2与多种临床病理变量的相关性分析显示(图2A~E):与癌旁组织相比,CCND2在THCA中的表达与肿瘤Stage分期显著相关,其中4期样品中CCND2的表达显著增加(P<0.001);CCND2表达量的增加与性别、区域淋巴结受累情况显著相关(P<0.001);同时CCND2的表达与年龄、病理亚型的关系同样密切,CCND2在21~80岁的表达显著增加(P<0.001),同时CCND2在经典型甲状腺乳头状癌、高型甲状腺乳头状癌、滤泡型甲状腺乳头状癌的表达显著(P<0.001)。
图2.

CCND2表达与临床病理相关性分析
Fig.2 Correlation analysis of CCND2 expression with tumor stage (A), gender (B), lymph node metastasis (C), age (D) and tumor histology (E). *P<0.05, ***P<0.001 vs Normal group
2.3. 肿瘤组织中CCND2表达水平对PTC的诊断效能
ROC曲线分析表明,AUC值为0.921(95% CI:0.897~0.944)。在截断值为4.983时,CCND2的灵敏度、特异度和准确度分别为83.6%、94.9%和78.5%。阳性预测值为99.3%,阴性预测值为40.0%(图3)。
图3.
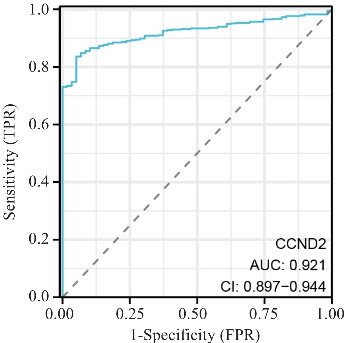
肿瘤组织中CCND2表达水平对PTC诊断效能的ROC曲线
Fig.3 ROC curve of CCND2 expression levels in tumor tissues for PTC diagnosis.
2.4. CCND2相关差异基因的功能富集分析
GO富集分析发现,BP主要与体液免疫反应、细胞识别、B细胞调节、补体激活等功能相关,CC主要与免疫蛋白复合物、质膜外侧细胞有关,MF主要与抗原结合、免疫受体蛋白结合、糖胺聚糖肝素结合、跨膜转运活性等功能有关(图4A、B)。
图4.

差异表达基因的功能富集分析
Fig.4 Functional enrichment analysis of differentially expressed genes. A: GO enrichment analysis; B: GO enrichment analysis
2.5. CCND2的表达水平与免疫细胞浸润的关系
通过TIMER数据库探讨CCND2的表达与6种免疫浸润细胞之间的关系。经Spearman相关性分析表明,CCND2的表达与B细胞、CD4+T细胞、巨噬细胞呈正相关(partial.cor>0,P<0.001),与CD8+T细胞呈负相关(partial.cor<0,P<0.001),与中性粒细胞、树突状细胞无关(P>0.05,图5A)。随后使用CIBERSORT评估甲状腺癌患者中CCND2相关风险评分与上述6种免疫细胞亚型的关系,结果显示:风险评分与B细胞记忆渗透水平(P<0.01)、CD4+T细胞记忆激活状态(P<0.05)、M2巨噬细胞表达水平(P<0.01)、肥大细胞静息状态(P<0.05)和肥大细胞激活状态(P<0.05)显著相关,与低风险组相比,高风险组表现出更高的M2巨噬细胞表达水平及肥大细胞静息状态;而高风险组的B细胞记忆渗透水平、CD4+T细胞记忆激活状态及肥大细胞激活状态则低于低风险组(图5B)。
图5.

CCND2的表达水平与TIICs的关系
Fig.5 Relationship between expression levels of CCND2 and TIICs. A: Correlation analyses of CCND2 with the infiltration of different immune cells using the TIMER database; B: Difference in infiltration fractions of 22 immune cell subsets in high- and low-risk groups. Red, the high-risk group and blue, low-risk group. *P<0.05, **P<0.01 vs groups.
2.6. CCND2在Nthy-ori-3-1、TPC-1及BCPAP细胞中的表达
RT-qPCR检测结果显示,与人甲状腺正常细胞系Nthy-ori-3-1相比,CCND2在人甲状腺乳头状癌细胞系TPC-1、BCPAP中高表达(P<0.01,图6A);Western blot检测结果显示,与Nthy-ori-3-1相比,CCND2在TPC-1、BCPAP中高表达,差异具有统计学意义(P<0.01,图6B、C)。
图6.

CCND2在Nthy-ori-3-1、TPC-1和BCPAP中的表达
Fig.6 Expression of CCND2 in Nthy-ori-3-1, TPC-1, and BCPAP cells. A: RT-qPCR for detecting mRNA expression of CCNDD2. B: Western blot of CCND2 and β-tubulin (loading control). C: Relative expression level of CCND2/β-tubulin. Data are expressed as Mean±SD. **P<0.01.
2.7. CCND2在PTC及癌旁组织中的表达
CCND2主要定位于细胞膜或者细胞质,CCND2在癌组织中的阳性表达率73.28%(85/116)高于癌旁组织15.51%(18/116),差异有统计学意义(χ2=78.381,P<0.001,图7A、B)。经采用平均光密度分析得出,CCND2在癌组织中表达的平均光密度值明显高于癌旁组织(P<0.001,图7C)。
图7.

CCND2在PTC组织和癌旁组织表达情况代表图及平均光密度
Fig.7 Expression of CCND2 in PTC tissues and adjacent tissues detected by immunohistochemistry (Original magnification:×200). A: Normal tissue. B: PTC tissue. C: Expression levels calculated with average optical density (AOD). ***P<0.001.
2.8. CCND2表达与PTC患者临床病理特征的关系
经免疫组化SABC法检测发现,与癌旁正常组织相比,PTC肿瘤组织中CCND2表达与肿瘤大小(P<0.05)、淋巴结是否转移(P<0.01)及TNM分期(P<0.001)相关,与性别、年龄、是否多灶性及有无腺外侵犯无关(P>0.05,表1)。
表1.
CCND2表达与PTC患者临床病理特征的关系
Tab.1 Relationship between CCND2 expression and clinicopathological characteristics of PTC patients [n (%)]
| Clinicopathological parameters | n | CCND2 positive | χ2 | P | |
|---|---|---|---|---|---|
| Gender | Male | 32 | 22 (68.75) | 0.4622 | 0.4966 |
| Female | 84 | 63 (75.00) | |||
| Age (year) | <55 | 79 | 55 (69.62) | 1.9627 | 0.1612 |
| ≥55 | 37 | 30 (81.08) | |||
| Tumor size (cm) | <1 | 76 | 50 (65.79) | 4.6911 | 0.0303 |
| ≥1 | 40 | 35 (75.00) | |||
| Multifocal | Yes | 40 | 26 (65.00) | 2.1353 | 0.1439 |
| No | 76 | 59 (77.63) | |||
| Extraglandular invasion | Yes | 13 | 11 (84.62) | 0.9614 | 0.3268 |
| No | 103 | 74 (71.84) | |||
| Lymphatic metastasis | Yes | 43 | 38 (88.37) | 7.9520 | 0.0048 |
| No | 73 | 47 (64.38) | |||
| TNM staging | I-II | 100 | 70 (70.00) | 12.1309 | 0.0005 |
| III-IV | 16 | 15 (93.75) |
3. 讨论
CCND2由12-13号染色体上的基因编码,是一个高度保守的细胞周期蛋白家族成员,在控制细胞周期中起着关键作用[7]。既往研究表明[8-11],CCND2在肝癌、乳腺癌、非小细胞肺癌、星形细胞瘤中存在表达异常,并参与调控细胞生长、细胞周期、迁移和侵袭等各种生物进程。Dai等[12]研究发现,CCND2过表达会通过影响细胞周期而促进鼻咽癌细胞的增殖和转移,并与不良预后有关。
经公共数据库TCGA、TIMER2.0、UALCAN分析,与癌旁组织相比,CCND2 mRNA在甲状腺癌中高表达,同时CCND2表达与Stage分期、病理亚型及区域淋巴结受累情况有关,提示CCND2可能参与肿瘤形成和进展。Chen等[13]研究表明,LncRNA GAS8-AS1通过调控miR-135b-5p/CCND2轴抑制PTC细胞生长。还有研究表明,CCND2由MiR-1靶向调节从而发挥致癌作用[14]。而CCND2作为作用靶点其在甲状腺乳头状癌细胞系中的表达情况尚未报道。本研究则通过体外细胞实验发现,CCND2在甲状腺乳头状癌细胞系中表达升高,提示CCND2在肿瘤发生发展过程中发挥重要作用。Yuan等[15]通过RT-qPCR检测细针穿刺获取的甲状腺癌组织,发现CCND2 mRNA在甲状腺癌组织中高表达。与本研究结果一致。本研究进一步从蛋白水平证实CCND2在甲状腺乳头状癌组织中高表达并与肿瘤大小、淋巴结转移及TNM分期有关,进一步证实CCND2可能对促进PTC恶性进展存在一定影响。
研究发现,癌症的发生与发展与免疫功能失调关系密切[16]。肿瘤免疫微环境(TME)包括TME吞噬细胞及活性肿瘤细胞[17, 18]。实体肿瘤中的免疫细胞浸润是TME相关致癌机制中的关键因素[19],肿瘤细胞可通过调节TME影响细胞凋亡,从而发挥促癌效应和抵抗治疗的作用[20]。因此甲状腺癌中CCND2表达与免疫浸润相关的促癌关系也有待探索。本研究通过GO富集分析显示,CCND2差异表达与免疫功能相关。经TIMER、CIBERSORT分析显示,甲状腺癌患者中CCND2表达与多种肿瘤浸润相关的免疫细胞(B细胞、CD4+T细胞、巨噬细胞、CD8+T细胞、肥大细胞)有关,提示CCND2的高表达可能通过细胞免疫浸润发挥作用。
本研究中ROC曲线分析结果显示,截断值为4.983时,其灵敏度、特异度和准确度分别为83.6%、94.9%、78.5%,提示CCND2基因可作为一种诊断性肿瘤标志物, 以PTC组织中CCND2表达水平为标准区别PTC和正常组织具有可行性。
综上所述,CCND2在PTC中表达上调并可能参与了肿瘤的发生、发展,同时也与肿瘤免疫浸润关系密切,故CCND2有望成为诊断PTC的潜在生物标志物及新的临床治疗靶点,对进一步应用于PTC的临床诊断、预后和靶向治疗提供了新思路。本研究未能进一步阐述CCND2相关的细胞免疫浸润作用机制,并缺少动物实验验证,其促癌作用机制仍需进一步探讨。
基金资助
辽宁省科技厅自然科学基金(2021-MS-333)
参考文献
- 1. Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI: 10.3322/caac.21492 [DOI] [PubMed] [Google Scholar]
- 2. 任 丽, 邹明远, 朱行春, 等. 姜黄素通过Keap1-Nrf2通路抑制甲状腺乳头状癌B-CPAP细胞的增殖、迁移及侵袭[J]. 南方医科大学学报, 2023, 43(8): 1356-62. [Google Scholar]
- 3. Mao JX, Zhang QH, Zhang HY, et al. Risk factors for lymph node metastasis in papillary thyroid carcinoma: a systematic review and meta-analysis[J]. Front Endocrinol, 2020, 11: 265. DOI: 10.3389/fendo.2020.00265 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4. Dotinga M, Vriens D, van Velden FHP, et al. Reinducing radioiodine-sensitivity in radioiodine-refractory thyroid cancer using lenvatinib (RESET): study protocol for a single-center, open label phase II trial[J]. Diagnostics: Basel, 2022, 12(12): 3154. DOI: 10.3390/diagnostics12123154 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. Zhang XW, Xiong H, Duan JL, et al. The prognostic significance of the BIN1 and CCND2 gene in adult patients with acute myeloid leukemia[J]. Indian J Hematol Blood Transfus, 2022, 38(3): 481-91. DOI: 10.1007/s12288-021-01479-w [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. Conway JW, Braden J, Wilmott JS, et al. The effect of organ-specific tumor microenvironments on response patterns to immunotherapy[J]. Front Immunol, 2022, 13: 1030147. DOI: 10.3389/fimmu.2022.1030147 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. Zhong L, Li YS, Xiong L, et al. Small molecules in targeted cancer therapy: advances, challenges, and future perspectives[J]. Signal Transduct Target Ther, 2021, 6: 201. DOI: 10.1038/s41392-021-00572-w [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8. Li X, Fang J, Wei G, et al. CircMMP9 accelerates the progression of hepatocellular carcinoma through the miR-149/CCND2 axis[J]. J Gastrointest Oncol, 2022, 13(4): 1875-88. DOI: 10.21037/jgo-22-677 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. Wang D, Zhang Y, Che YQ. CCND2 mRNA expression is correlated with R-CHOP treatment efficacy and prognosis in patients with ABC-DLBCL[J]. Front Oncol, 2020, 10: 1180. DOI: 10.3389/fonc.2020.01180 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. Yue Q, Xu Y, Deng X, et al. Circ-PITX1 promotes the progression of non-small cell lung cancer through regulating the miR-1248/CCND2 axis[J]. Onco Targets Ther, 2021, 14: 1807-19. DOI: 10.2147/ott.s286820 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. Richardson TE, Walker JM. CCND2 amplification is an independent adverse prognostic factor in IDH-mutant lower-grade astrocytoma[J]. Clin Neuropathol, 2021, 40(4): 209-14. DOI: 10.5414/np301354 [DOI] [PubMed] [Google Scholar]
- 12. Dai W, Shi Y, Hu W, et al. Long noncoding RNA FAM225B facilitates proliferation and metastasis of nasopharyngeal carcinoma cells by regulating miR-613/CCND2 axis[J]. Bosn J Basic Med Sci, 2022, 22(1): 77-86. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. Chen N, Yin D, Lun B, et al. LncRNA GAS8-AS1 suppresses papillary thyroid carcinoma cell growth through the miR-135b-5p/CCND2 axis[J]. Biosci Rep, 2019, 39(1): BSR20181440. DOI: 10.1042/bsr20181440 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. Leone V, D’Angelo D, Rubio I, et al. MiR-1 is a tumor suppressor in thyroid carcinogenesis targeting CCND2, CXCR4, and SDF-1α[J]. J Clin Endocrinol Metab, 2011, 96(9): E1388-98. DOI: 10.1210/jc.2011-0345 [DOI] [PubMed] [Google Scholar]
- 15. Yuan S, Liu Z, Yu S, et al. CCND2 and miR-206 as potential biomarkers in the clinical diagnosis of thyroid carcinoma by fine-needle aspiration cytology[J]. World J Surg Oncol, 2023, 21(1): 22. DOI: 10.1186/s12957-023-02899-w [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. Abbott M, Ustoyev Y. Cancer and the immune system: the history and background of immunotherapy[J]. Semin Oncol Nurs, 2019, 35(5): 150923. DOI: 10.1016/j.soncn.2019.08.002 [DOI] [PubMed] [Google Scholar]
- 17. Kołat D, Kałuzińska Ż, Bednarek AK, et al. Determination of WWOX function in modulating cellular pathways activated by AP-2α and AP-2γ transcription factors in bladder cancer[J]. Cells, 2022, 11(9): 1382. DOI: 10.3390/cells11091382 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18. Varricchi G, Loffredo S, Marone G, et al. The immune landscape of thyroid cancer in the context of immune checkpoint inhibition[J]. Int J Mol Sci, 2019, 20(16): E3934. DOI: 10.3390/ijms20163934 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. Zhang J, Gao J, Cui J, et al. Tumor-associated macrophages in tumor progression and the role of traditional Chinese medicine in regulating TAMs to enhance antitumor effects[J]. Front Immunol, 2022, 13: 1026898. DOI: 10.3389/fimmu.2022.1026898 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20. Morana O, Wood W, Gregory CD. The apoptosis paradox in cancer[J]. Int J Mol Sci, 2022, 23(3): 1328. DOI: 10.3390/ijms23031328 [DOI] [PMC free article] [PubMed] [Google Scholar]


