Abstract
目的
探讨在周期性牵张力作用下葡萄糖调节蛋白78(GRP78)对牙周膜成纤维细胞成骨分化的影响,并阐述其机制。
方法
应用FlexCell 5000细胞应力装置模拟牙齿正畸受力环境;应用流式细胞术细胞分选技术获得牙周膜成纤维细胞GRP78高表达细胞和GRP78低表达细胞;采用基因转染技术敲减GRP78、c-Src的表达以及过表达c-Src;蛋白质印迹实验检测成骨转录因子Runt相关基因2(RUNX2)、锌指结构转录因子(Osterix)以及成骨标志蛋白骨钙蛋白(OCN)、骨桥蛋白(OPN)的表达;免疫共沉淀实验检测GRP78与c-Src激酶的相互作用;茜素红染色实验检测细胞矿化结节的形成。
结果
GRP78在牙周膜成纤维细胞呈异质性表达,流式分选实验获得GRP78高表达和GRP78低表达细胞。周期性牵张力处理后,与GRP78低表达细胞相比,GRP78高表达细胞成骨分化能力及c-Src激酶磷酸化水平均升高,差异具有统计学意义(P<0.05);GRP78与c-Src激酶存在相互作用;与对照组相比,过表达c-Src组细胞成骨分化能力升高(P<0.05),sic-Src组细胞成骨分化能力降低(P<0.05)。
结论
GRP78通过与c-Src激酶相互作用并上调其表达,进而促进周期性牵张力诱导的牙周膜成纤维细胞成骨分化。
Keywords: 周期性牵张力, 成骨分化, 牙周膜成纤维细胞, 葡萄糖调节蛋白78
Abstract
Objective
This study aims to investigate the influence of glucose regulated protein (GRP) 78 on osteoblast differentiation in periodontal ligament fibroblasts (PDLFs) under cyclic mechanical stretch and determine the underlying mechanism.
Methods
FlexCell 5000 cell mechanical device was applied to simulate the stress environment of orthodontic teeth. GRP78High and GRP78Low subpopulation were obtained by flow sorting. Gene transfection was performed to knockdown GRP78 and c-Src expression and overexpress c-Src. Western blot analysis was used to detect the protein expression of Runt-related gene 2 (RUNX2), Osterix, osteocalcin (OCN), and osteopontin (OPN). Immunoprecipitation assay was used to determine the interaction of GRP78 with c-Src. The formation of cellular mineralized nodules was determined by alizarin red staining.
Results
GRP78 was heterogeneously expressed in PDLFs, and GRP78High and GRP78Low subpopulations were obtained by flow sorting. The osteogenic differentiation ability and phosphorylation level of c-Src kinase in the GRP78High subpopulation were significantly increased compared with those in GRP78Low subpopulation after cyclic mechanical stretch (P<0.05). GRP78 interacted with c-Src in PDLFs. The overexpression c-Src group showed significantly increased osteogenic differentiation ability than the vector group (P<0.05), and the sic-Src group showed significantly decreased osteogenic differentiation ability (P<0.05) after cyclic mechanical stretch.
Conclusion
GRP78 upregulates c-Src expression by interacting with c-Src kinase and promotes osteogenic differentiation under cyclic mechanical stretch in PDLFs.
Keywords: cyclic mechanical stretch, osteogenic differentiation, periodontal ligament fibroblasts, glucose regulated protein 78
正畸治疗牙齿移动过程中,牙周组织发生生物学改建,包括压应力区的骨吸收和张应力区的骨形成。牙周膜位于牙齿和牙槽骨之间,是机械力的感受器和效应器[1]–[2]。牙周膜成纤维细胞(periodontial ligment fibroblasts,PDLFs)是牙周膜中主要构成细胞,并且是一个异质性细胞群,将感受到的力学信号转化为细胞内的生物学信号,参与牙周组织的改建和再生[3]–[5]。葡萄糖调节蛋白(glucose regulated protein,GRP)78属于热休克蛋白70家族,其蛋白结构包括两个域,分别是位于肽链N端的ATP酶结构域和位于肽链C端的肽结合结构域,肽结合结构域的活性中心由4个反向平行的β折叠和1个α螺旋构成,具有结合非折叠蛋白质小肽的能力,参与体内多种重要复合物的形成[6]–[8]。GRP78可参与细胞表面信号转导,细胞表面GRP78与α2-巨球蛋白的相互作用可激活ERK1/2、p38-MAPK、PI3K信号通路诱导的细胞增殖和分化[9]。基于PDLFs的异质性及在正畸力作用下对牙周组织改建的重要作用,本研究构建了GRP78红色绿色双荧光启动子质粒并转染到PDLFs中,流式分选获得GRP78高表达和GRP78低表达细胞,从PDLFs异质性的角度探讨GRP78参与牵张力作用下调控PDLFs成骨分化的分子机制。
1. 材料和方法
1.1. 细胞和主要试剂
人牙周膜成纤维细胞株(浙江美森细胞科技有限公司),碱性磷酸酶(alkaline phosphatase,ALP)活性检测试剂盒(上海碧云天生物技术有限公司),MEM培养基(Hyclone公司,美国),ALP染色试剂盒、茜素红染液(北京索莱宝科技有限公司),胎牛血清(CLARK Bioscience公司,美国),BioFlex Culture Plate(collagenⅠ)、FlexCell 5000细胞应力加载系统(FlexCell公司,美国),骨桥蛋白(osteopontin,OPN)、骨钙素(osteocalcin,OCN)抗体(Santa Cruz公司,美国),GRP-78、Src羧基端(c-Src)激酶、磷酸化Src羧基端(p-c-Src)激酶、成骨转录因子Runt相关基因2(Runt related gene 2,RUNX2)、β-actin抗体(Cell Signaling Technology公司,美国),锌指结构转录因子(Osterix)抗体(Abcam公司,美国),角蛋白(cytokeratin)、波形蛋白(Vimentin)、成纤维细胞特异性蛋白1(北京博奥森生物技术有限公司),GRP78敲减(siGRP78)质粒、c-Src敲减(sic-Src)质粒、c-Src过表达质粒、GRP78启动子质粒(上海吉凯基因医学科技股份有限公司)。
1.2. 实验方法
1.2.1. PDLFs鉴定
将2×104个PDLFs细胞接种于共聚焦显微镜培养皿,37 °C、5%CO2细胞培养箱中孵育24 h,弃掉原培养基,磷酸盐缓冲液(phosphate buffer saline,PBS)清洗3遍,4%多聚甲醛室温孵育15 min,PBS清洗3遍,0.2%TritionX-100冰上孵育20 min,PBS清洗3遍,5%牛血清白蛋白封闭30 min,加入一抗角蛋白、波形蛋白、成纤维细胞特异性蛋白1于4 °C孵育过夜,PBS清洗3遍,加入二抗室温孵育2 h,Hoechst33342孵育10 min,PBS清洗3遍,显微镜下观察并拍照。
1.2.2. 细胞应力加载
将PDLFs细胞接种于BioFlex 6孔板,加入含10%胎牛血清的MEM培养基,37 °C、5%CO2培养箱继续培养,待细胞密度达到90%时,应用FlexCell 5000细胞应力装置模拟牙齿正畸受力环境,检测PDLFs在周期性牵张力作用下成骨分化潜能。运行Flexsoft软件,设置加载力学参数为:正弦波、形变率10%、频率0.5 Hz[10]。根据预实验结果牵张力加载时间设置为12 h。
1.2.3. ALP活性检测
细胞周期性牵张力处理后收集样本,按ALP试剂盒说明书进行操作,检测ALP活性。
1.2.4. 细胞转染
取对数生长期PDLFs细胞,胰酶消化后将细胞接种于10 cm培养皿,待细胞密度生长至60%~70%后进行转染。转染前将细胞用不含抗生素的完全培养基过夜培养,按照聚乙烯亚胺(polyethylenimine,PEI)转染说明书进行操作。将20 µg CMV-RFP-PGL3-GFP或CMV-RFP-PGL3-GFP-GRP-78质粒和40 µL PEI试剂分别加入到500 µL Opti-MEM中轻轻混匀静置5 min,用移液器将含20 µg质粒的500 µL Opti-MEM滴加到含40 µL PEI的Opti-MEM中,充分混匀后静置20 min,然后滴加到培养皿中混匀,将细胞放回培养箱继续培养48 h用于后续实验。应用GRP78高表达(GRP78High)细胞转染siGR-P78质粒、sic-Src质粒,应用GRP78低表达(GR-P78Low)细胞转染c-Src过表达质粒。
1.2.5. 流式细胞术细胞分选
PDLFs细胞转染GRP78启动子质粒72 h后胰酶消化收集细胞,3 mL PBS缓冲液洗涤细胞,1 000 r/min离心3 min后弃上清,用含1%血清的PBS缓冲液重悬细胞,制成1×107个/mL细胞悬液,300目滤网过滤细胞悬液,流式细胞仪分选分别收集GRP78High细胞和GRP78Low细胞。
1.2.6. 蛋白质印迹(Western blot)实验
细胞周期性牵张力处理后收集样本,用RIPA buffer裂解细胞,BCA蛋白定量试剂盒进行蛋白定量;常规电泳、封闭,一抗孵育、洗膜、HRP标记的二抗孵育;化学发光显色液显色,测定RUNX2、Osterix、OCN、OPN、GRP78、c-Src、p-c-Src的表达。
1.2.7. 免疫共沉淀实验
收集细胞样本,加入1 mL含有蛋白酶抑制剂的裂解液,离心取上清,加入20 µL Protein A/G免疫沉淀磁珠,4 °C旋转混合仪慢速旋转1~2 h,清除非特异性结合,蛋白上清中加入2 µg抗体,并设置同型对照,4 °C旋转混合仪慢速旋转过夜。再加入20 µL Protein A/G免疫沉淀磁珠,4 °C旋转混合仪慢速旋转2 h。免疫沉淀磁珠转移至新的1.5 mL离心管中,加入1×SDS Loading Buffer,涡旋混匀后于95 °C热变性,磁力架收集磁珠,上清转移至新的1.5 mL离心管中,保存于−20 °C冰箱或直接用于蛋白质印迹检测。
1.2.8. ALP染色实验
细胞周期性牵张力处理后接种于6孔板继续培养7 d,弃去培养液,PBS清洗干净,细胞固定液处理15 min,按照ALP染色试剂盒说明书配制孵育液,滴加配制好的孵育液20 min,蒸馏水清洗干净,显微镜下观察并拍照。
1.2.9. 茜素红染色实验
细胞周期性牵张力处理后接种于6孔板继续培养21 d,弃去培养液,PBS清洗干净,4%多聚甲醛固定15 min,PBS清洗3遍,加入茜素红染色液孵育30 min,蒸馏水清洗干净,显微镜下观察并拍照。
1.3. 统计学分析
采用SPSS 19.0软件对数据进行统计学分析,计量资料采用均数±标准差表示,两组间数据比较采用t检验,P<0.05为差异具有统计学意义。
2. 结果
2.1. PDLFs的鉴定结果
免疫荧光染色结果显示,PDLFs角蛋白染色阴性(图1A),波形蛋白染色阳性(图1B),成纤维细胞特异性蛋白1染色阳性(图1C)。
图 1. PDLFs的鉴定 免疫荧光染色 × 400.
Fig 1 Identification of PDLFs immunofluorescence staining × 400
A:角蛋白染色阴性;B:波形蛋白染色阳性;C:成纤维细胞特异性蛋白1染色阳性。
2.2. 周期性牵张力促进PDLFs成骨分化
细胞周期性牵张力处理后,ALP活性检测实验结果显示,与未处理组相比,周期性牵张力处理组细胞ALP活性升高,差异具有统计学意义(P<0.05)(图2A)。蛋白质印迹实验结果显示,与未处理组相比,周期性牵张力处理组细胞成骨转录因子RUNX2、Osterix及成骨分化标志蛋白OCN、OPN的蛋白表达水平升高,差异具有统计学意义(P<0.05)(图2B)。ALP染色实验结果显示,周期性牵张力处理组细胞质内出现蓝色颗粒状或片状沉淀物,而未处理组细胞质内未见蓝色颗粒状沉淀物(图2C)。茜素红染色实验结果显示,周期性牵张力处理组可见成簇的红色颗粒样钙化结节,而未处理组无钙化结节形成(图2D)。以上结果表明周期性牵张力促进PDLFs成骨分化。
图 2. 周期性牵张力对PDLFs成骨分化的影响.
Fig 2 Effect of cyclic mechanical stretch on osteogenic differentiation of PDLFs
A:ALP活性检测;B:蛋白质印迹实验RUNX2、Osterix、OPN、OCN蛋白表达;C:ALP染色 倒置荧光显微镜 × 200;D:茜素红染色 倒置荧光显微镜 × 200。*P<0.05,**P<0.01。
2.3. 流式细胞术分选获得PDLFs GRP78High细胞和GRP78Low细胞
采用细胞转染技术将GRP78启动子双荧光分选质粒转染到PDLFs细胞,倒置显微镜下观察结果显示,绿色荧光蛋白GRP78在PDLFs中呈异质性表达;流式细胞术细胞分选结果显示,GRP78呈高荧光和低荧光强度表达,成功分离占总细胞含量10%的GRP78High细胞和10%的GRP78Low细胞;蛋白质印迹实验对分选细胞进行鉴定,结果显示,GRP78蛋白在GRP78High细胞中的表达水平高于GRP78Low细胞(图3)。
图 3. 获取PDLFs GRP78High细胞和GRP78Low细胞.
Fig 3 Obtained GRP78High subpopulation and GRP78Low subpopulation in PDLFs
A:PDLFs转染红色绿色双荧光启动子质粒 倒置荧光显微镜 × 200;B:流式细胞术细胞分选;C:分选后鉴定GRP78蛋白表达。
2.4. GRP78High细胞成骨分化潜能高于GRP78Low细胞
ALP染色实验结果显示,与GRP78Low细胞相比,GRP78High细胞质中蓝染颗粒明显增多(图4A);茜素红染色结果显示,与GRP78Low细胞相比,GRP78High细胞中可见连接成片的红色钙化结节(图4B);蛋白质印迹实验结果显示,GRP78High与GRP78Low细胞相比,RUNX2、Osterix、OPN和OCN蛋白表达水平升高,差异具有统计学意义(P<0.05)(图4C)。结果表明在周期性牵张力作用下GRP78High细胞成骨分化潜能高于GRP78Low细胞。
图 4. GRP78High细胞成骨分化能力高于GRP78Low细胞.
Fig 4 GRP78High subpopulation demonstrated superior osteogenic potential compared with GRP78Low subpopulation
A:ALP染色 倒置荧光显微镜 × 200;B:茜素红染色 倒置荧光显微镜 × 200;C:蛋白质印迹实验RUNX2、Osterix、OPN、OCN蛋白表达。*P<0.05。
2.5. GRP78对c-Src激酶磷酸化水平的影响
为探明在周期性牵张力作用下GRP78High细胞成骨分化潜能高于GRP78Low细胞的机制,应用蛋白质印迹实验检测细胞c-Src激酶的活性,结果显示,与GRP78Low细胞相比,GRP78High细胞c-Src激酶的总蛋白水平无明显变化,但p-c-Src水平升高,差异具有统计学意义(P<0.05)(图5A)。基因转染技术抑制GRP78High细胞的GRP-78表达水平,结果显示,与对照组相比,siGRP78组细胞p-c-Src水平降低,差异具有统计学意义(P<0.05)(图5B)。
图 5. GRP78对c-Src激酶磷酸化水平的影响.
Fig 5 The effect of GRP78 on the phosphorylation Levels of the c-Src kinase
A: c-Src蛋白表达;B:抑制GRP78表达对c-Src蛋白表达的影响。*P<0.05,**P<0.01。
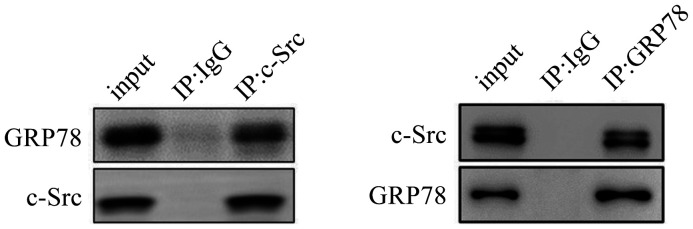
2.6. GRP78与c-Src激酶相互作用
应用免疫共沉淀实验检测GRP78与c-Src的相互作用,结果显示,GRP78与c-Src存在内源性相互作用(图6),推测GRP78与c-Src的相互作用促进了GRP78High细胞c-Src磷酸化水平。
图 6. 免疫共沉淀实验检测GRP78与c-Src相互作用.
Fig 6 Co-immunoprecipitation assay was applied for detecting the interaction between GRP78 and c-Src
input为阳性对照;IP:IgG为同型对照(阴性对照),免疫沉淀IgG抗体;IP:GRP78为免疫沉淀GRP78抗体。
2.7. 过表达c-Src促进GRP78Low细胞成骨分化
为探明GRP78与c-Src相互作用对PDLFs成骨分化影响的分子机制,应用GRP78Low细胞过表达c-Src(图7A)。蛋白质印迹实验结果显示,与空载体对照组相比,c-Src过表达组成骨转录因子RUNX2和Osterix以及成骨标志蛋白OPN和OCN的蛋白表达水平均升高,差异具有统计学意义(P<0.05)(图7B);ALP染色结果显示,c-Src过表达组与空载体对照组相比染色强度升高(图7C),茜素红染色结果与之一致(图7D)。
图 7. 过表达c-Src对GRP78Low细胞成骨分化的影响.
Fig 7 Effect of overexpression of c-Src on osteogenic differentiation of GRP78Low subpopulation
A:GRP78Low细胞过表达c-Src;B:蛋白质印迹实验检测RUNX2、Osterix、OPN、OCN蛋白表达;C:ALP染色 倒置荧光显微镜 × 200;D:茜素红染色 倒置荧光显微镜 × 200。*P<0.05,**P<0.01。
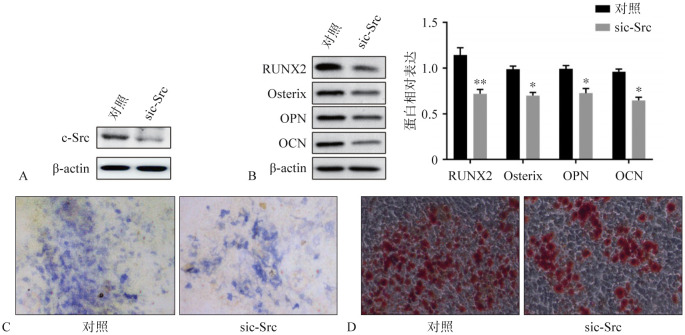
2.8. 沉默c-Src抑制GRP78High细胞成骨分化
基因转染技术抑制GRP78High细胞c-Src激酶的表达水平(图8A)。蛋白质印迹实验结果显示,与对照组相比,sic-Src组成骨转录因子RUNX2和Osterix以及成骨标志蛋白OCN和OPN的蛋白表达水平均降低,差异具有统计学意义(P<0.05)(图8B)。ALP染色结果显示,与对照组相比,sic-Src组染色强度降低(图8C),茜素红染色结果也与之一致(图8D)。以上结果表明,c-Src激酶通过对成骨分化转录因子RUNX2和Osterix以及成骨分化标志蛋白OPN、OCN的调节参与PDLFs成骨分化过程。
图 8. 沉默c-Src对GRP78High细胞成骨分化的影响.
Fig 8 Effect of knockdown c-Src on osteogenic differentiation of GRP78High subpopulation
A:GRP78High细胞敲减c-Src;B:蛋白质印迹实验检测RUNX2、Osterix、OPN、OCN蛋白表达;C:ALP染色 倒置荧光显微镜 × 200;D:茜素红染色 倒置荧光显微镜 × 200。*P<0.05,**P<0.01。
3. 讨论
PDLFs是构成牙周膜的主体细胞,其数量远多于牙周膜干细胞(periodontal Ligament stem cells,PDLSCs),并且具有干细胞的特性。PDLSCs可向PDLFs分化,PDLFs亦可诱导干细胞分化[11]–[12]。PDLFs也是一种对机械力敏感的细胞,在机械力作用下具有成骨分化潜能[13]。因此PDLFs的成骨分化潜能决定了牙周骨组织的改建速度。研究[14]表明,在正畸牙齿移动过程中,正畸力通过Ephrin-B2-EphB4信号通路调控PDLFs成骨分化过程参与牙槽骨改建。任大鹏[15]研究表明,周期性张应力刺激促进PDLFs成骨基因SP7、OCN和骨唾液酸蛋白(bone sialoprotein,BSP)的转录进而促进PDLFs成骨分化。本研究也发现,体外应用10%形变率的周期性牵张力刺激PDLFs,成骨转录因子RUNX2和Osterix以及成骨标志蛋白OCN和OPN的蛋白表达水平均显著上调。
在牙周膜中存在表型独特、功能各异的成纤维细胞亚群,不同的亚群可能分泌不同型的胶原、细胞因子等,进而影响细胞增殖、分化等生物学行为[16]。目前从细胞亚群的角度探讨细胞分化能力的差异备受关注。脂肪来源的间充质干细胞具有较高的异质性,以ALP+/CD73+为标志可以鉴定出一个具有增强成骨分化潜能的细胞亚群[17]。
p75神经营养因子受体(p75 neurotrophin receptor,p75NTR)可用于分离骨向分化潜能较好的同质的PDLSCs,p75NTR+PDLSCs较p75NTR-PDLSCs具备更高的骨向分化潜能[18]。然而在PDLFs成骨分化潜能的研究中从细胞亚群的角度探讨细胞分化能力的差异报道较少。
牙本质基质蛋白1(dentin matrix protein 1,DMP1)及其受体GRP78定位于牙周膜细胞的祖细胞中,并且GRP78与DMP1可以相互作用并形成复合物以囊泡运输的方式转运到细胞核中进而促进PDLSCs成骨分化[19]。研究[20]表明miR-30d-5p通过GRP78参与调控骨髓间充质干细胞分化和矿化功能。为此本研究构建了GRP78红色绿色双荧光启动子质粒,检测GRP78在PDLFs中的表达,结果证实在PDLFs中存在GRP78高表达亚群和低表达亚群,并且在周期性牵张力作用下GRP78高表达亚群细胞成骨分化能力显著高于GRP78低表达亚群细胞。
本实验进一步研究发现,GRP78高表达亚群c-Src激酶的磷酸化水平显著高于GRP78低表达亚群,且GRP78可以与c-Src激酶相互作用。c-Src激酶属于非受体酪氨酸激酶,参与多种细胞信号通路,包括诱导DNA合成、细胞增殖和细胞骨架重组等,也是骨代谢中的关键信号分子[21]–[22]。c-Src激酶在骨代谢中的作用已在c-Src缺陷小鼠中得到证实,骨质疏松动物模型中使用c-Src激酶抑制剂也证实了c-Src激酶在骨代谢中的重要作用[23]–[24]。在成骨细胞分化中,c-Src激酶增加了成骨转录因子Osterix蛋白质稳定性、成骨活性和转录活性[25]。为了进一步验证c-Src激酶与PDLFs成骨分化的关系,本研究分别在GRP78低表达亚群细胞中过表达c-Src,在GRP78高表达亚群细胞中敲减c-Src的表达,结果显示c-Src与成骨转录因子RUNX2和Osterix以及成骨标志蛋白OCN和OPN呈正向调控关系,ALP染色实验和茜素红染色实验也证实在牵张力作用下c-Src促进PDLFs成骨分化。
综上所述,本研究首次从GRP78基因异质性表达的角度证实,在周期性牵张力作用下,GRP78通过与c-Src激酶相互作用上调其表达并促进PDLFs成骨分化。本研究仅在细胞水平进行了相关检测与分析,初步证实了GRP78与c-Src激酶存在相互作用,这种相互作用是否为直接作用以及与c-Src激酶相互作用的结构域还有待进一步验证,后续将构建动物模型进行更深入的研究。本研究将为进一步了解正畸治疗中PDLFs成骨分化的生物学机制以及为临床正畸治疗加速牙周组织改建提供理论依据。
Funding Statement
[基金项目] 辽宁省教育厅基础研究项目(JYTJCZR2020073);辽宁省教育厅面上项目(LJKZ0803)
Supported by: Basic Research Project of Liaoning Provincial Education Department (JYTJCZR2020073); General Project of Liaoning Provincial Education Department (LJKZ0803)
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.Huelter-Hassler D, Tomakidi P, Steinberg T, et al. Orthodontic strain affects the Hippo-pathway effector YAP concomitant with proliferation in human periodontal ligament fibroblasts[J] Eur J Orthod. 2017;39(3):251–257. doi: 10.1093/ejo/cjx012. [DOI] [PubMed] [Google Scholar]
- 2.Jin Y, Ding L, Ding Z, et al. Tensile force-induced PDGF-BB/PDGFRβ signals in periodontal ligament fibroblasts activate JAK2/STAT3 for orthodontic tooth movement[J] Sci Rep. 2020;10(1):11269. doi: 10.1038/s41598-020-68068-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Mohanakumar A, Vijay GL, Vijayaraghavan N, et al. Morphological alterations, activity, mRNA fold changes, and aging changes before and after orthodontic force application in young and adult human-derived periodontal ligament cells[J] Eur J Orthod. 2021;43(6):690–696. doi: 10.1093/ejo/cjab025. [DOI] [PubMed] [Google Scholar]
- 4.Jia R, Yi Y, Liu J, et al. Cyclic compression emerged dual effects on the osteogenic and osteoclastic status of LPS-induced inflammatory human periodontal ligament cells according to loading force[J] BMC Oral Health. 2020;20(1):7. doi: 10.1186/s12903-019-0987-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Tantilertanant Y, Niyompanich J, Everts V, et al. Cyclic tensile force stimulates BMP9 synthesis and in vitro mineralization by human periodontal ligament cells[J] J Cell Physiol. 2019;234(4):4528–4539. doi: 10.1002/jcp.27257. [DOI] [PubMed] [Google Scholar]
- 6.Li T, Fu J, Cheng J, et al. New progresses on cell surface protein HSPA5/BiP/GRP78 in cancers and COVID-19[J] Front Immunol. 2023;14:1166680. doi: 10.3389/fimmu.2023.1166680. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.麻 庆乐, 卢 德赵. 葡萄糖调节蛋白78的研究进展[J] 生命科学. 2017;29(4):331–335. [Google Scholar]; Ma QL, Lu DZ. Research progress on GRP78[J] Chin Bullet Life Sci. 2017;29(4):331–335. [Google Scholar]
- 8.Kuo LJ, Huang CY, Cheng WL, et al. Glucose-regulated protein 78 mediates the anticancer efficacy of shikonin in hormone-refractory prostate cancer cells[J] Tumour Biol. 2015;36(7):5063–5070. doi: 10.1007/s13277-015-3157-0. [DOI] [PubMed] [Google Scholar]
- 9.Farshbaf M, Khosroushahi AY, Mojarad-Jabali S, et al. Cell surface GRP78: an emerging imaging marker and therapeutic target for cancer[J] J Control Release. 2020;328:932–941. doi: 10.1016/j.jconrel.2020.10.055. [DOI] [PubMed] [Google Scholar]
- 10.Li L, Han M, Li S, et al. Cyclic tensile stress during physiological occlusal force enhances osteogenic differentiation of human periodontal ligament cells via ERK1/2-Elk1 MAPK pathway[J] DNA Cell Biol. 2013;32(9):488–497. doi: 10.1089/dna.2013.2070. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.屠 腾, 赵 萤, 牛 静, et al. 力生长因子调控牙周膜干细胞向牙周膜成纤维细胞分化的作用及机制研究[J] 医用生物力学. 2021;36(S1):106. [Google Scholar]; Tu T, Zhao Y, Niu J, et al. Role and mechanism of force growth factor in regulating the differentiation of periodontal membrane stem cells to periodontal membrane fibroblasts[J] J Med Biomech. 2021;36(S1):106. [Google Scholar]
- 12.代 媛媛, 原 工杰, 余 桂戎, et al. 间接共培养诱导大鼠骨髓间充质干细胞向牙周膜成纤维样细胞分化[J] 临床口腔医学杂志. 2010;26(5):275–277. [Google Scholar]; Dai YY, Yuan GJ, Yu GR, et al. Induction effect on the differentiation of rat bone marrow mesenchymal stem cells co-cultured with periodontal ligament fibroblasts[J] J Clin Stomatol. 2010;26(5):275–277. [Google Scholar]
- 13.宋 京, 任 大鹏, 颜 世果, et al. 细胞外信号调节蛋白激酶1/2在介导周期性牵张力对牙周膜细胞成骨分化中的作用[J] 华西口腔医学杂志. 2017;35(5):520–526. [Google Scholar]; Song J, Ren DP, Yan SG, et al. The role of extracellular signal regulated kinase 1/2 in mediating osteodifferentiation of human periodontal ligament cells induced by cyclic stretch[J] West China J Stomatol. 2017;35(5):520–526. doi: 10.7518/hxkq.2017.05.015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Diercke K, Kohl A, Lux CJ, et al. Strain-dependent up-regulation of ephrin-B2 protein in periodontal ligament fibroblasts contributes to osteogenesis during tooth movement[J] J Biol Chem. 2011;286(43):37651–37664. doi: 10.1074/jbc.M110.166900. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.任 大鹏. ERK1/2-Runx2信号通路介导周期性张应力作用下牙周膜成纤维细胞成骨分化的机制研究[D] 济南: 山东大学; 2016. [Google Scholar]; Ren DP. Role of ERK1/2-Runx2 pathway in osteodiffe-rentiation of human periodontal ligament fibroblasts induced by cyclic stretch[D] Jinan: Shandong Uuiversity; 2016. [Google Scholar]
- 16.张 春艳, 郭 大伟, 宋 玲, et al. 人牙周膜成纤维细胞的生物力学研究[J] 中国卫生产业. 2015;12(24):195–198. [Google Scholar]; Zhang CY, Guo DW, Song L, et al. Biomechanical studies of human periodontal membrane fibroblasts[J] China Health Industry. 2015;12(24):195–198. [Google Scholar]
- 17.Canepa DD, Casanova EA, Arvaniti E, et al. Identification of ALP+/CD73+ defining markers for enhanced osteogenic potential in human adipose-derived mesenchymal stromal cells by mass cytometry[J] Stem Cell Res Ther. 2021;12(1):7. doi: 10.1186/s13287-020-02044-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Li J, Zhao M, Wang Y, et al. p75NTR optimizes the osteogenic potential of human periodontal ligament stem cells by up-regulating α1 integrin expression[J] J Cell Mol Med. 2020;24(13):7563–7575. doi: 10.1111/jcmm.15390. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Merkel A, Chen Y, George A. Endocytic trafficking of DMP1 and GRP78 complex facilitates osteogenic differentiation of human periodontal ligament stem cells[J] Front Physiol. 2019;10:1175. doi: 10.3389/fphys.2019.01175. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.李 光, 李 杰, 张 平. 微小RNA-30d-5p通过葡萄糖调节蛋白78调控骨髓基质细胞成骨分化的机制[J] 解剖学报. 2023;54(2):195–201. [Google Scholar]; Li G, Li J, Zhang P. Mechanism of microRNA-30d-5p regulating osteogenic differentiation of bone marrow stromal cells through glucose-regulated 78[J] Acta Anatom Sinica. 2023;54(2):195–201. [Google Scholar]
- 21.Schreiber C, Saraswati S, Harkins S, et al. Loss of ASA-P1 in mice impairs adipogenic and osteogenic differentiation of mesenchymal progenitor cells through dysregulation of FAK/Src and AKT signaling[J] PLoS Genet. 2019;15(6):e1008216. doi: 10.1371/journal.pgen.1008216. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Wei HM, Wang JC, Xu ZM, et al. Corrigendum: hepatoma cell-derived extracellular vesicles promote liver cancer metastasis by inducing the differentiation of bone marrow stem cells through microRNA-181d-5p and the FAK/Src Pathway[J] Front Cell Dev Biol. 2021;9:760373. doi: 10.3389/fcell.2021.760373. [DOI] [PMC free article] [PubMed] [Google Scholar] [Retracted]
- 23.Park HJ, Gholam-Zadeh M, Yoon SY, et al. Estrogen decreases cytoskeletal organization by forming an ERα/SHP2/c-Src complex in osteoclasts to protect against ovariectomy-induced bone loss in mice[J] Antioxidants (Basel) 2021;10(4):619. doi: 10.3390/antiox10040619. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Id Boufker H, Lagneaux L, Najar M, et al. The Src inhibitor dasatinib accelerates the differentiation of human bone marrow-derived mesenchymal stromal cells into osteoblasts[J] BMC Cancer. 2010;10:298. doi: 10.1186/1471-2407-10-298. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Choi YH, Han Y, Lee SH, et al. Src enhances osteogenic differentiation through phosphorylation of Osterix[J] Mol Cell Endocrinol. 2015;407:85–97. doi: 10.1016/j.mce.2015.03.010. [DOI] [PubMed] [Google Scholar]