Abstract
目的
探讨川续断皂苷VI(AVI)对小鼠克罗恩病(CD)样结肠炎的肠上皮细胞凋亡和肠屏障的影响及其作用机制。
方法
将30只雄性C57BL/6小鼠随机分成对照组(WT组)、2,4,6-三硝基苯磺酸诱导模型组(TNBS组)、AVI药物治疗组(AVI组,150 mg/kg),每组10只。通过监测小鼠体质量、测量结肠长度、疾病活动度(DAI)评分、HE染色、AB-PAS染色、组织炎症评分、ELISA和RT-qPCR实验,验证AVI对小鼠结肠炎的缓解作用。采用TNF-α诱导Caco-2细胞建立体外凋亡模型,分为Control组、TNF-α组、AVI组(250 μmol/L)。CCK-8实验检测AVI对Caco-2细胞活力的影响。采用免疫荧光、TUNEL实验和Western blotting检测AVI对小鼠肠上皮细胞和Caco-2细胞屏障损伤与凋亡的改善情况。利用网络药理学预测AVI干预CD的分子机制可能与PI3K/AKT/NF-κB通路有关,Western blotting检测体内外通路的蛋白表达,以及经PI3K/AKT通路激活剂(Recilisib)和AKT1 siRNA转染干预细胞后,通过TUNEL实验和Western blotting验证其对细胞凋亡的调控作用。
结果
AVI能明显地缓解小鼠体质量降低、结肠缩短、DAI与组织炎症评分的增加、肠绒毛和杯状细胞的损伤,以及炎症因子的高表达(P<0.05)。AVI浓度在0~250 μmol/L时对Caco-2细胞活力无影响。体内外实验证实,AVI可阻断紧密连接蛋白的缺失,减少肠上皮细胞的凋亡(P<0.05)。KEGG富集通路分析发现AVI干预CD可能与抑制PI3K/AKT/NF-κB通路活化有关,在体内外模型证实AVI干预后p-PI3K、p-AKT和p-p65的表达降低(P<0.05)。此外,Recilisib干预后可逆转AVI对通路的抑制作用和抗凋亡作用(P<0.05),AKT1 siRNA转染细胞后证实PI3K/AKT通路可介导下游NF-κB信号的活化(P<0.05)。
结论
AVI可通过拮抗肠上皮细胞的凋亡和减轻肠屏障损伤,达到改善TNBS诱导的CD小鼠结肠炎的目的,其机制可能与AVI负向调控PI3K/AKT/NF-κB有关。
Keywords: 克罗恩病, 川续断皂苷VI, 凋亡, 肠屏障, PI3K/AKT/NF-κB
Abstract
Objective
To investigate the effects of asperosaponin VI (AVI) on intestinal epithelial cell apoptosis and intestinal barrier function in a mouse model of Crohn's disease (CD)-like colitis and explore its mechanisms.
Methods
Male C57BL/6 mice with TNBS-induced CD-like colitis were treated with saline or AVI (daily dose 150 mg/kg) by gavage for 6 days. The changes in body weight, colon length, DAI scores, and colon pathologies of the mice were observed, and the expressions of inflammatory factors and tight injunction proteins were detected using ELISA and RT-qPCR. The effects of AVI on barrier function and apoptosis of mouse intestinal epithelial cells and TNF‑α‑treated Caco-2 cells were analyzed using immunofluorescence staining, TUNEL assay, and Western blotting. Network pharmacology, TUNEL assay, and Western blotting were performed to explore and validate the therapeutic mechanisms of AVI for CD.
Results
In the mouse models of CD-like colitis, AVI significantly improved body weight loss, colon shortening and DAI and tissue inflammation scores, alleviated intestinal villi and goblet cell injuries, and lowered the expressions of inflammatory factors. AVI treatment significantly reduced the loss of tight junction proteins and apoptosis in both mouse intestinal epithelial cells and TNF‑α-stimulated Caco-2 cells. KEGG enrichment pathway analysis suggested that the therapeutic effect of AVI on CD was associated with inhibition of PI3K/AKT/NF-κB pathway activation, which was confirmed by lowered expressions of p-PI3K, p-AKT, and p-p65 in AVI-treated mouse models and Caco-2 cells. In Caco-2 cells, Recilisib significantly blocked the inhibitory effect of AVI on the PI3K/AKT/NF-κB pathway and TNF-α-induced apoptosis, and AKT1 knockdown experiment confirmed the role of the PI3K/AKT pathway for mediating the activation of downstream NF-κB signaling.
Conclusion
AVI can improve TNBS-induced CD-like colitis in mice by reducing intestinal epithelial cell apoptosis and intestinal barrier damage via inhibiting the PI3K/AKT/NF-κB signaling pathway.
Keywords: Crohn's disease, asperosaponin VI, apoptosis, intestinal barrier, PI3K/AKT/NF-κB signaling pathway
克罗恩病(CD)是一种慢性、持续性且破坏性强的肉芽肿性疾病,疾病反复发作且多数无法治愈,严重影响了患者的生存质量,给患者家庭和世界都带来严重的负担[1-4]。CD发病多见腹痛、腹泻、体质量减轻,肠内症状表现为免疫系统异常、肠道菌群紊乱等多种因素可导致的肠黏膜上皮细胞的凋亡及肠屏障的破坏[5-7]。肠上皮细胞作为肠道物理屏障,可抵御肠内有害物质的侵袭,而肠道炎症会加剧细胞凋亡并损害肠屏障的功能和结构,而肠屏障是肠黏膜防御系统中的重要防线,其是治疗CD的一种有效途径[8-10]。目前的治疗方式多是手术和临床用药,常用药物为免疫调节剂、皮质类固醇类药物及生物制剂等,但CD不同发展阶段的药物效果参差不齐,且毒副作用大[11]。所以寻找有效且副作用小的药物对于治疗CD是至关重要的,中药来源的化合物在治疗CD方面表现出优势,且被广泛应用于CD的治疗当中[12]。川续断皂苷VI(AVI)是一种来源于中药川续断的干燥根中的三萜皂苷类化合物,具有抗细胞凋亡、抗抑郁等药理作用[13, 14]。先前的研究发现AVI可通过激活单磷酸腺苷激活的蛋白激酶 (AMPK)通路减轻过敏性气道炎症以及保护小鼠免受酒精诱导的肝脂肪变性和肝损伤[15, 16]。
目前AVI在CD方面的研究尚未报道,所以推测AVI具有治疗CD的潜力,也为CD的治疗提供新的药物选择。本研究拟采用2,4,6-三硝基苯磺酸(TNBS)诱导的CD样结肠炎模型和肿瘤坏死因子α(TNF-α)诱导的Caco-2细胞模型探讨AVI对小鼠肠道炎症、肠屏障和肠上皮细胞凋亡的影响,并采用网络药理学技术和体内外实验验证AVI对CD的作用机制。
1. 材料和方法
1.1. 材料
1.1.1. 动物及细胞
选择30只6~8周龄,体质量20~25 g,健康雄性的SPF级C57BL/6小鼠(江苏集萃药康生物科技股份有限公司)。小鼠自由饮食在恒温、恒湿、12 h∶12 h昼夜交替的环境。本实验经蚌埠医科大学伦理委员会批准(伦理批号:伦科批字〔2024〕第270号)。人结肠腺癌细胞株(Caco-2,中国医学科学院肿瘤细胞库)。
1.1.2. 试剂
Asperosaponin Ⅵ(分析标准品,纯度≥98%,上海源叶科技有限公司);TNF-α、TNBS、牛血清白蛋白(BSA)(Sigma);HE染色试剂盒、AB-PAS染色试剂盒、Liprofectamine 2000转染试剂盒(北京索莱宝科技有限公司);酶联免疫吸附试验(ELISA)试剂盒(武汉博士德生物工程公司);Trizol试剂(Thermo Fisher);cDNA反转试剂盒、RT-qPCR试剂盒(Takara);BCA蛋白试剂盒(碧云天);ZO-1、Claudin-1、MUC2、p65、p-p65、山羊抗兔IgG H&L (FITC)、山羊抗小鼠IgG H&L (FITC)、山羊抗兔IgG H&L(Alexa Flour®555)抗体(Abcam);Bax、Bcl-2、AKT与p-AKT(Proteintech);PI3K、p-PI3K与C-caspase3(Cell Signaling Technology);RIPA裂解液、β-actin、CCK-8试剂、TUNEL细胞凋亡检测试剂盒(Servicebio);HRP标记山羊抗兔IgG和HRP标记山羊抗鼠IgG(中杉金桥);Recilisib(MCE);MEM培养基、胎牛血清(FBS)(Gibco);AKT1 siRNA(Santa Cruz Biotechnology)。
1.2. 方法
1.2.1. TNBS诱导动物模型建立及分组
30只小鼠随机分为3组,分别为对照组(WT组)、TNBS诱导模型组(TNBS组)、AVI药物治疗组(AVI组,150 mg/kg),10只/组。造模前所有小鼠禁食不禁水24 h,造模当天称取小鼠体质量并记录。TNBS组和AVI组小鼠经腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉,头朝下置于仰卧位开始用甘油润滑肛门,将连接注射器的聚乙烯软管(3.5 F)经肛门旋转推入直肠3 cm处,静推100 µL 2.5% TNBS酒精溶液诱导模型(5%TNBS与无水乙醇等体积配置),WT组静推等体积生理盐水,倒立放置5 min。造模后,AVI组灌胃100 μL的AVI(150 mg/kg)进行干预,给药1 次/d,连续6 d。WT组和TNBS组每日给予同体积的生理盐水。造模第7天麻醉后处死小鼠,取小鼠结肠组织,所有结肠经长度测量后沿纵轴切开一半放置在福尔马林中浸泡备用,一半刮取肠黏膜冻存于-80℃用作后续实验。
1.2.2. Caco-2细胞培养及分组处理
Caco-2细胞用含79% MEM、20%胎牛血清(FBS)和1%青霉素-链霉素的培养基在37 ℃、5%CO2的培养箱进行培养,每48 h换一次培养基,待细胞长至70%~80%,经胰酶消化和重悬,进行传代和后续实验。实验随机分为对照组(Control组)、TNF-α诱导模型组(TNF-α组)、TNF-α+AVI给药组(AVI组)、TNF‑α+AVI+通路激活剂Recilisib组(Recilisib组),TNF-α+AKT1 siRNA组(si-AKT组)。Control组为正常培养不经任何处理的细胞组;TNF-α组为100 ng/mL的TNF-α处理细胞24 h[17];AVI组为TNF-α(100 ng/mL)与AVI(250 μmol/L)共同培养干预Caco-2细胞24 h;Recilisib组为TNF‑α(100 ng/mL)、AVI(250 μmol/L)与Recilisib(10 μmol)共同干预细胞24 h[18],si-AKT组为Caco-2细胞经AKT1 siRNA(10 μmol)转染24 h后再经TNF-α处理24 h[19, 20]。
1.2.3. 小鼠体质量、结肠长度及疾病活动度的评估
每天固定时间称取小鼠体质量,观察粪便及隐血情况。取检当天测量小鼠直肠近肛门处到回盲部的长度并记录,根据肠炎疾病活动度指数(DAI)评分标准评估肠炎症状,DAI=(体质量指数分数+大便性状分数+便血情况分数)/3[21],评分范围为0~4分,评分的高低说明小鼠肠炎的程度。
1.2.4. HE染色及AB-PAS染色评估小鼠结肠组织病理变化
结肠在福尔马林中固定后,经过卷曲、脱水、石蜡包埋和切成3 μm厚度的石蜡切片。HE染色和AB-PAS染色均按照试剂盒进行操作,然后用中性树脂进行封片,经显微镜扫描观察结肠绒毛、隐窝和结肠黏膜杯状细胞等病变情况。对结肠进行组织病理学评分[22],评分范围为0~4分:0分无炎症无隐窝损伤;1分为少量炎症细胞侵犯黏膜层,基底层隐窝出现1/3的损伤;2分为中等量的炎症细胞侵犯黏膜下层,基底层隐窝出现2/3的损伤;3分为大量炎症细胞透过肠道壁,隐窝缺失严重;4分为肠绒毛结构严重紊乱,隐窝结构消失,分值越高说明小鼠结肠炎越严重。
1.2.5. ELISA检测小鼠结肠组织炎症因子蛋白表达情况
根据0.1 g小鼠肠黏膜加1 mL的RIPA裂解液裂解,组织匀浆器制备成匀浆,12 000 r/min离心10 min后取上清液,按照ELISA试剂盒说明书操作,酶标仪测量A 450 nm,根据标准曲线计算出结肠组织炎症因子白细胞介素-1β(IL-1β)与TNF-α的蛋白含量。
1.2.6. RT-qPCR检测小鼠结肠组织炎症介质的mRNA表达水平
使用Trizol法将各组小鼠的结肠黏膜研磨成匀浆,提取结肠组织的总RNA,根据反转录试剂盒操作将RNA反转录成相应的cDNA,RT-qPCR采用TB Green聚合酶链式反应试剂盒进行检测。测量结肠组织中的IL-1β和TNF-α的mRNA水平。PCR反应条件:预变性95 ℃ 30 s;变性95 ℃ 5 s,退火60 ℃ 30 s,40个循环,以GAPDH为内参,采用2-△△CT法计算炎症基因相对定量结果。PCR引物均由上海生工合成,IL-1β上游:5'-G AAATGCCACCTTTTGACAGTG-3',下游:5'-TGGA TGCTCTCATCAGGACAG-3';TNF-α上游:5'-CAGG CGGTGCCTATGTCTC-3',下游:5'-CGATCACCCCG AAGTTCAGTAG-3';GAPDH上游:5'-AGGTCGGTG TGAACGGATTTG-3',下游:5'-GGGGTCGTTGATG GCAACA-3'。
1.2.7. CCK-8检测AVI对Caco-2细胞活力的影响
取上述对数期细胞,用细胞计数仪测量细胞数量,在96孔板内以1×104/孔进行铺板,待细胞长至70%~80%吸去孔内培养基,PBS洗2遍,每孔加入100 μL AVI(0、5、10、25、50、75、100、150、250、500 μmol/L)。干预24 h后每孔加入10 μL的CCK-8试剂在37℃培养箱孵育1 h,酶标仪测量每孔A 450 nm,并按公式:细胞活力=(A 加药组-A 空白组)/(A 对照组-A 空白组)×100%计算细胞活力。空白组、对照组、加药组各设5个复孔,实验重复3次。
1.2.8. 免疫荧光检测AVI对结肠肠屏障和Caco-2单层细胞屏障功能的影响
取小鼠结肠石蜡切片,经烤片、脱蜡水化、纯水洗涤、抗原修复后,5% BSA封闭1 h,孵育抗体(ZO-1,1∶200;Claudin-1,1∶400;MUC2,1∶200),4 ℃过夜。第2天恢复室温后,PBS清洗3遍,室温孵育二抗[山羊抗兔IgG H&L (FITC),1∶1000;山羊抗小鼠IgG H&L (FITC),1∶1000]2 h,DAPI(1 μg/mL)复染细胞核8 min,PBS清洗后用70%甘油封片,Leica倒置荧光显微镜拍照。Caco-2细胞以2×105/孔铺在六孔板内,细胞长至70%~80%后,经4%多聚甲醛进行固定30 min、0.2%的Triton X-100通透15 min、5% BSA封闭30 min后,其余步骤同上。
1.2.9. TUNEL染色观察AVI对肠上皮细胞和Caco-2细胞凋亡的改善作用
经脱蜡水化处理后的石蜡切片和固定与通透的Caco-2细胞按照TUNEL染色试剂盒说明书操作,染色结束用70%甘油封片,倒置荧光显微镜拍照。每组随机选取6张图片,计算细胞凋亡率:细胞凋亡率(%)=(凋亡细胞数/总细胞数)×100%。
1.2.10. Western blotting检测结肠黏膜和Caco-2细胞中屏障蛋白、凋亡蛋白及通路蛋白的表达
取小鼠结肠黏膜组织和Caco-2细胞,加入RIPA裂解液和蛋白酶抑制剂,匀浆后12 000 r/min离心10 min取上清液。用BCA试剂盒测量总蛋白浓度,根据浓度将结肠和Caco-2细胞蛋白裂解液与蛋白上样缓冲液(终浓度为1×)配置,100 ℃变性10 min。采用SDS-PAGE电泳分离蛋白,电泳完成后转膜至PVDF膜上。用5%BSA封闭1 h,孵育一抗(ZO-1,1∶1000;Claudin-1,1∶1000;MUC2,1∶1000;Bcl-2,1∶1000;Bax,1∶2000;C-caspase3,1∶1000;PI3K,1∶1000;p-PI3K,1∶1000;AKT,1∶1000;p-AKT,1∶2000;p65,1∶1000;p-p65,1∶2000;β-actin,1∶3000),4 ℃摇床孵育过夜。第2天取出TBST洗膜3次,室温孵育HRP标记的山羊抗兔IgG(1∶3000)和HRP标记的山羊抗小鼠IgG(1∶3000)2 h,TBST洗膜3次后用ECL发光液显色,在凝胶成像系统中采集图片分析结果,用Image J软件测量目的蛋白的相对表达量。
1.2.11. 网络药理学分析
利用在线平台Pubchem搜索川续断皂苷VI(Asperosaponin Ⅵ)的SMILES结构式,将此结构式输入到在线平台SEA数据库(https://sea.bkslab.org/)、Swiss TargetPrediction数据库(http://swisstargetprediction.ch/)、Super-PRED数据库(https://prediction.charite.de/index.php)并在Uniprot数据库进行转换,经筛选合并去重后获得药物预测靶点。以疾病模型“Crohn's disease”为关键词进行搜索,利用在线平台GeneCards数据库(https://www.genecards.org/)、DISGENET数据库(https://www.disgenet.com/)、CTD数据库(https://ctdbase.org/)经筛选合并去重后获得疾病预测靶点。通过在线平台Venny 2.1(https://bioinfogp.cnb.csic.es/tools/venny/index.html)收集交集靶点。将交集靶点导入STRING数据库(https://string-db.org/),建立药物靶蛋白-疾病靶蛋白互作网络(PPI)。运用软件Cytoscape3.9.1对该网络进行网络拓扑学分析。将共同靶点导入到在线平台DAVID数据库(https://david.ncifcrf.gov/tools.jsp)进行京都基因与基因组百科全书(KEGG)富集分析。将富集的数据通过在线平台微生信(http://www.bioinformatics.com.cn/)进行可视化处理。
1.2.12. 统计学分析
利用软件SPSS 26.0对以上实验数据进行分析统计,计量资料以均数±标准差表示,组间差异比较采用单因素方差分析或t检验,以P<0.05时认为差异具有统计学意义。每组实验重复3次。
2. 结果
2.1. AVI能够缓解由TNBS引发的小鼠结肠炎症状。
相对于TNBS组,AVI组小鼠的平均体质量在第4天开始增加(P<0.05,图1A),取检前DAI评分降低(P<0.05,图1B)。
图1.

AVI干预对TNBS模型小鼠疾病状态的影响
Fig.1 Effect of AVI intervention on body weight and disease activity in mice with TNBS-induced CD-like colitis. A: Changes of body weight. B: Changes of DAI scores. WT: Wild type group; TNBS: TNBS-induced model group; AVI: AVI treatment group. *P<0.05 vs WT group. # P<0.05 vs TNBS group.
2.2. AVI可缓解TNBS诱导的肠道炎症损伤及降低炎症介质的表达
与TNBS组相比,AVI组小鼠结肠长度增加,结肠充血情况改善(P<0.05,图2A、B);组织病理学评分发现,AVI组评分低于TNBS组(P<0.05,图2C)。HE结果显示,TNBS组小鼠结肠肠绒毛结构紊乱,隐窝破坏严重,并伴有大量炎症细胞的浸润,而其在AVI组给药后明显得到改善(图2D)。AB-PAS结果显示,TNBS组小鼠结肠组织杯状细胞大量减少,酸性黏液蛋白分泌减少,中性黏液蛋白分泌增多,给药后的AVI组症状显著改善(图2E)。ELISA和RT-qPCR结果进一步证实AVI可降低IL-1β与TNF-α炎症因子蛋白(P<0.05,图3A、B)及mRNA含量(P<0.05,图3C、D)的表达水平。
图2.

AVI干预对TNBS模型小鼠肠道炎症的影响
Fig.2 Effect of AVI on intestinal inflammation in the mouse models. A, B: Comparison of colon lengths among the groups. C: Histopathological score of the colon. D: HE staining of colon tissue in different groups. E: AB-PAS staining of colon tissue in different groups. *P<0.05 vs WT group. #P<0.05 vs TNBS group. Scale bar=50 μm.
图3.
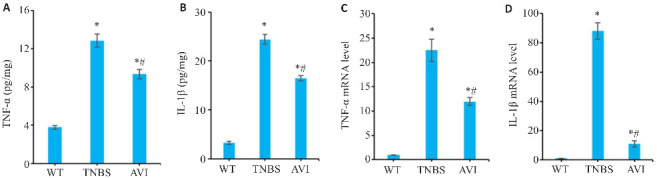
AVI干预对TNBS模型小鼠肠道炎症因子的影响
Fig.3 Effect of AVI on intestinal inflammatory factors in the mouse models. A, B: ELISA results of TNF‑α and IL-1β in the intestinal mucosa of the mice. C, D: TNF-α and IL-1β mRNA expression in the intestinal mucosa of the mice detected by RT-qPCR. *P<0.05 vs WT group. # P<0.05 vs TNBS group.
2.3. AVI对Caco-2细胞活性的影响
AVI在浓度为0~250 μmol/L时培养24 h对Caco-2细胞的增殖无明显毒性,在AVI浓度为500 μmol/L时细胞活力下降(P<0.05,图4)。
图4.

不同浓度的AVI作用24 h对Caco-2细胞活力的影响
Fig.4 Changes in viability of Caco-2 cells after treatment with different concentrations of AVI for 24 h. *P<0.05 vs 0 μmol/L.
2.4. AVI可减轻结肠肠屏障及Caco-2单层细胞屏障的损伤
免疫荧光结果显示,体内实验小鼠TNBS组紧密连接蛋白ZO-1、Claudin-1及黏液蛋白MUC2出现缺失,甚至ZO-1、Claudin-1出现移位情况,而其在AVI干预后得到了明显恢复(图5A)。Western blotting实验显示AVI干预后屏障蛋白表达增加(P<0.05,图5B、C)。体外模型中,与TNF-α组相比,AVI可减轻TNF-α诱导的单层细胞屏障损伤(图6A),增加ZO-1和Claudin-1蛋白表达(P<0.05,图6B、C)。
图5.

AVI干预对TNBS模型小鼠结肠炎肠屏障的影响
Fig.5 Effect of AVI on intestinal barrier function in mice with TNBS-induced colitis. A: Immunofluorescence staining for detecting ZO-1, claudin-1 and MUC2 in the mouse colon (Scale bar=50 μm). B, C: Relative expression levels of ZO-1, Claudin-1 and MUC2 proteins in intestinal mucosa detected by Western blotting. *P<0.05 vs WT group. # P<0.05 vs TNBS group.
图6.

AVI干预对TNF-α诱导的Caco-2细胞屏障损伤的影响
Fig.6 Effect of AVI on the barrier damage of Caco-2 cells induced by TNF-α. A: Immunofluorescence staining for detecting expressions of ZO-1 and claudin-1 in Caco-2 cells (Scale bar=50 μm). B, C: Relative expression levels of ZO-1 and claudin-1 proteins in Caco-2 cells detected by Western blotting. *P<0.05 vs Control group. # P<0.05 vs TNF-α group.
2.5. AVI可减轻肠上皮细胞及Caco-2细胞的过度凋亡
TUNEL染色结果显示,与TNBS组相比,AVI组小鼠肠上皮细胞凋亡率下降(P<0.05,图7A、B);体外实验发现AVI组Caco-2细胞凋亡数量少于TNF-α组(P<0.05,图8A、B)。Western blotting实验分析发现AVI在体内(P<0.05,图7C、D)和体外(P<0.05,图8C、D)可下调Bax、C-caspase3的蛋白水平,上调Bcl-2的蛋白水平。
图7.

AVI干预对TNBS模型小鼠肠上皮细胞凋亡的影响
Fig.7 Effect of AVI on intestinal epithelial cell apoptosis in mice with TNBS-induced colitis. A: TUNEL staining of the colon tissue. B: Apoptosis rate of the intestinal epithelial cells (Scale bar=50 μm). C, D: Western blotting for detecting relative expression levels of Bcl-2, Bax and C-caspase3 in colonic mucosa. *P<0.05 vs WT group. # P<0.05 vs TNBS group.
图8.

AVI干预对TNF-α诱导的凋亡模型中Caco-2细胞凋亡的影响
Fig.8 Effect of AVI on apoptosis in TNF-α-induced Caco-2 cells. A: TUNEL staining of Caco-2 cells (Scale bar=50 μm). B: Apoptosis rate of Caco-2 cells. C, D: Relative expression levels of Bcl-2, Bax and C-caspase-3 in Caco-2 cells detected by Western blotting.*P<0.05 vs Control group. # P<0.05 vs TNF-α group.
2.6. 网络药理学分析结果
Venny图结果显示,AVI与CD的预测交集靶点共有68个(图9A),数据经STRING数据库与Cytoscape软件分析建立药物靶蛋白-疾病靶蛋白互作网络(PPI)图与拓扑学分析,结果显示共有273条边,平均节点的数值为8.03(图9B、C)。从DAVID数据库分析获得的KEGG通路富集预测发现,PI3K/AKT/NF-κB通路与AVI治疗CD具有关联性(图9D)。
图9.

网络药理学分析结果
Fig.9 Network pharmacology analysis results. A: Venn diagram of the intersection between CD genes and AVI genes. B, C: PPI network diagram. D: Results of KEGG pathway enrichment analysis for the intersection genes between AVI and CD.
2.7. AVI可能通过调节PI3K/AKT/NF-κB 通路对抗肠上皮细胞和Caco-2细胞的凋亡
与TNBS诱导的小鼠(图10A、B)及TNF-α诱导的Caco-2细胞(图10C、D)相比, AVI组p-PI3K、p-AKT及p-p65蛋白水平均下降(P<0.05)。
图10.

AVI干预对体内和体外PI3K/AKT/NF-κB通路的影响
Fig.10 Effect of AVI on the PI3K/AKT/NF-κB pathway in the mouse models and in Caco-2 cells. A, B: Relative expression levels of PI3K, p-PI3K, AKT, p-AKT, p65 and p-p65 proteins in mouse colon tissue detected by Western blotting (*P<0.05 vs WT group; # P<0.05 vs TNBS group). C, D: Relative expression levels of PI3K, p-PI3K, AKT, p-AKT, p65 and p-p65 proteins in Caco-2 cells detected by Western blotting (*P<0.05 vs Control group. # P<0.05 vs TNF-α group).
2.8. AVI通过阻断PI3K/AKT/NF-κB通路的活化,减少肠上皮细胞的凋亡
与AVI组对比,Recilisib组细胞中的p-PI3K、 p-AKT及p-p65蛋白表达上调,而si-AKT干预后p-PI3K表达升高,p-AKT及p-p65蛋白表达降低(P<0.05,图11A、B)。此外,Recilisib组Caco-2细胞的凋亡数量增加,以及Bax和C-caspase3表达上调,Bcl-2表达降低;而si-AKT组则结果相反(P<0.05,图11C~F)。
图11.

Recilisib对AVI治疗肠上皮细胞凋亡及AKT1 siRNA对体外凋亡模型的影响
Fig.11 Effect of Recilisib and AKT1 siRNA on apoptosis of AVI-treated Caco-2 cells. A, B: Relative expression levels of PI3K, p-PI3K, AKT, p-AKT, p65 and p-p65 proteins detected by Western blotting. C: TUNEL staining of Caco-2 cells (Scale bar=50 μm). D: Apoptosis rate of Caco-2 cells. E, F: Relative expression levels of Bcl-2, Bax, and C-caspase3 proteins detected by Western blotting. *P<0.05 vs AVI group, # P<0.05 vs Recilisib group.
3. 讨论
CD作为一种慢性透壁性疾病,可引起患者从口腔到肛门的病变,并导致肠外并发症累及眼部、关节与皮肤等部位,早期先进疗法的使用和靶向新技术的开展使CD的治疗进入新时代,未来将先进疗法同其他药物相结合,可有助于改善CD治疗的预后[23]。本研究通过体内外实验,发现AVI可能通过负向调控PI3K/AKT/NF-κB信号通路来减轻肠上皮细胞凋亡,缓解肠屏障的损伤达到治疗结肠炎的目的。
近些年中药治疗CD的热度不断上升,国内外学者也相继报道中药在CD方面发挥的显著疗效。课题组前期研究发现中药青钱柳中的三萜类化合物阿江榄仁酸通过抑制TLR4激活诱导的肠上皮细胞凋亡和调节肠道菌群组成来保护肠屏障,达到治疗CD的目的[24]。苏超等[25]发现人参皂苷衍生物AD-1是从人参中提取的新型衍生物,可通过抗炎以及抑制NLRP3炎症小体活化来减轻TNBS诱导的急性IBD。AVI是中药川续断中的三萜皂苷类化合物,可通过降低炎症因子TNF-α、IL-6、IL-4和IL-13的蛋白表达发挥抗炎特性;在小鼠骨骼肌损伤的研究中,AVI可通过GSK-3β信号传导调节细胞凋亡和自噬来减轻骨骼肌损伤并促进再生[16, 26]。AVI的抗炎抗凋亡的药用价值彰显着其对CD的治疗潜力。本研究初次摸索了AVI在TNBS诱导的CD模型结肠炎中产生的影响,发现AVI处理后的TNBS诱导的小鼠结肠长度变长、平均体质量显著增加、DAI及组织病理学评分有所降低,炎症细胞浸润减少,结肠隐窝结构显著改善。这些数据可见AVI可改善TNBS诱导的CD样结肠炎。CD炎症浸润的特征是免疫细胞应答,从而产生大量的促炎细胞因子,IL-1β与TNF-α主要由Th1细胞分泌,这些促炎细胞因子可促进CD患者肠道纤维化使肠腔狭窄,并加剧肠上皮的损伤[27, 28]。于是我们再次验证AVI在TNBS模型小鼠中的抗炎作用,发现AVI可显著降低炎症因子IL-1β与TNF-α的蛋白含量和mRNA的表达水平。研究发现受损的肠屏障是CD的一个关键的致病因素,肠屏障的受损可加速肠道有害物质对肠黏膜的侵袭[8]。本研究通过体内外模型验证了AVI可改善ZO-1和Claudin-1的缺失和移位,在TNBS模型中AVI还可改善黏液蛋白MUC2的缺失,达到保护黏液屏障的目的,并促进ZO-1、Claudin-1和MUC2的蛋白表达。上述结果表明AVI在结肠炎中可发挥抗炎以及保护肠屏障的作用,但AVI通过何种途径发挥作用需进一步明确。
过度的肠上皮细胞凋亡会导致肠屏障的破坏,使凋亡的上皮细胞恢复正常水平成为治疗CD的一种策略[10, 29]。本研究验证AVI是否在CD中发挥抗凋亡作用,从而保护肠屏障的完整性,通过体内外模型实验,发现经AVI处理后的TNBS诱导的小鼠结肠上皮细胞和TNF-α诱导的Caco-2细胞凋亡率及促凋亡蛋白Bax和C-caspase3显著下降,抗凋亡蛋白Bcl-2表达上升。以上数据也重现了AVI的抗凋亡作用,以及AVI可通过保护肠屏障来治疗CD的这一途径,但AVI抗凋亡的作用机制尚需进一步研究。
基于网络药理学技术预测AVI改善CD样结肠炎的作用机制。通过在线平台及应用软件分析AVI与CD作用的交集靶点,发现AVI治疗CD可能与调控PI3K/AKT/NF-κB通路具有内在联系。PI3K/AKT通路是一条经典的信号通路,在调节细胞生长、增殖、自噬和细胞凋亡中发挥主要作用[30]。据报道NF-κB可作为PI3K/AKT通路的下游转录因子,激活PI3K/AKT通路可进而激活NF-κB,促进胰腺癌的发展和上皮间质转化[31-33]。刘兴隆等[34]研究发现人参败毒散内治、榆瑞灌肠液外治及内外合治方法可通过抑制PI3K/AKT/NF-κB通路的激活发挥抗炎、抗凋亡作用来改善TNBS诱导的大鼠肠屏障的损伤。李多等[35]发现复方黄柏液能通过调节NF-κB介导PI3K/AKT通路改善TNBS诱导的大鼠结肠炎性病变。根据网络药理学结果分析和既往研究发现PI3K/AKT/NF-κB通路成为治疗CD的一个有效靶点,本研究探究AVI能否通过调控PI3K/AKT/NF-κB通路发挥抗肠上皮凋亡,保护肠屏障的作用。利用免疫印迹实验,结果发现经AVI处理后的体内外模型组,p-PI3K、p-AKT及p-p65表达均下调。在体外模型中,与AVI组相比,PI3K/AKT信号通路激活剂(Recilisib)会导致Bcl-2表达下降,以及p-PI3K、p-AKT、p-p65、Bax和C-caspase3的表达升高,而经si-AKT干预后除p-PI3K的表达升高外其余表达均显著下降,说明AVI抑制PI3K/AKT/NF-κB通路的激活发挥拮抗肠上皮细胞凋亡作用,以及PI3K/AKT通路可介导下游NF-κB信号的活化。上述结果提示,AVI可通过负向调控PI3K/AKT/NF-κB通路发挥保护肠屏障的作用,进而可应用于治疗TNBS诱导的CD结肠炎的目的。
本研究可为临床治疗CD提供新的选择,也为CD的靶向治疗提供有力证据,同时挖掘了AVI在抗肠上皮细胞凋亡的药用价值及生物学机制,拓宽了AVI在临床应用中的治疗范围。但本实验仍存在以下不足:本实验体内模型采用TNBS诱导,但TNBS诱导的小鼠结肠炎症状并不能完全等同于临床CD患者肠炎症状;本研究仅探讨了AVI可通过调控PI3K/AKT/NF-κB通路发挥抗肠炎的作用,但不能排除AVI可通过其他途径来发挥作用。
综上所述,AVI能够负向调控PI3K/AKT/NF-κB通路的激活,从而对抗肠道上皮细胞的凋亡,减少肠道屏障的损害,进而实现对TNBS诱导的小鼠结肠炎的治疗作用,这为CD的靶向治疗进一步提供有力证据。
基金资助
国家自然科学基金(81902078);安徽高校自然科学研究项目重大项目(KJ2020ZD49);安徽高校自然科学研究项目创新团队项目(2023AH010067);蚌埠医科大学第一附属医院高水平科技创新团队(BYYFY2022TD002);蚌埠医学院“512人才培育计划”项目(by51201103)
Supported by National Natural Science Foundation of China (81902078).
参考文献
- 1. Feuerstein JD, Cheifetz AS. Crohn disease: epidemiology, diagnosis, and management[J]. Mayo Clin Proc, 2017, 92(7): 1088-103. [DOI] [PubMed] [Google Scholar]
- 2. Torres J, Mehandru S, Colombel JF, et al. Crohn's disease[J]. Lancet, 2017, 389(10080): 1741-55. [DOI] [PubMed] [Google Scholar]
- 3. Keyashian K, Dehghan M, Sceats L, et al. Comparative incidence of inflammatory bowel disease in different age groups in the United States[J]. Inflamm Bowel Dis, 2019, 25(12): 1983-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4. Hutfless S, Jasper RA, Chen PH, et al. Burden of Crohn's disease in the United States Medicaid population, 2010-2019[J]. Clin Gastroenterol Hepatol, 2024, 22(5): 1087-97.e6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. Gomollón F, Dignass A, Annese V, et al. 3rd European evidence-based consensus on the diagnosis and management of Crohn's disease 2016: part 1: diagnosis and medical management[J]. J Crohns Colitis, 2017, 11(1): 3-25. [DOI] [PubMed] [Google Scholar]
- 6. Lin K, Zheng WY, Guo MY, et al. The intestinal microbial metabolite acetyl l-carnitine improves gut inflammation and immune homeostasis via CADM2[J]. Biochim Biophys Acta Mol Basis Dis, 2024, 1870(4): 167089. [DOI] [PubMed] [Google Scholar]
- 7. Vesci L, Tundo G, Soldi S, et al. A novel Lactobacillus brevis fermented with a vegetable substrate (AL0035) counteracts TNBS-induced colitis by modulating the gut microbiota composition and intestinal barrier[J]. Nutrients, 2024, 16(7): 937. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8. Kuo WT, Shen L, Zuo L, et al. Inflammation-induced occludin downregulation limits epithelial apoptosis by suppressing caspase-3 expression[J]. Gastroenterology, 2019, 157(5): 1323-37. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. Petagna L, Antonelli A, Ganini C, et al. Pathophysiology of Crohn's disease inflammation and recurrence[J]. Biol Direct, 2020, 15(1): 23. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. Zhang J, Cen L, Zhang XF, et al. MPST deficiency promotes intestinal epithelial cell apoptosis and aggravates inflammatory bowel disease via AKT[J]. Redox Biol, 2022, 56: 102469. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. Torres J, Bonovas S, Doherty G, et al. ECCO guidelines on therapeutics in Crohn's disease: medical treatment[J]. J Crohns Colitis, 2020, 14(1): 4-22. [DOI] [PubMed] [Google Scholar]
- 12. Yuan S, Wang Q, Li J, et al. Inflammatory bowel disease: an overview of Chinese herbal medicine formula-based treatment[J]. Chin Med, 2022, 17(1): 74. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. Li CM, Tian JW, Li GS, et al. Asperosaponin VI protects cardiac myocytes from hypoxia-induced apoptosis via activation of the PI3K/Akt and CREB pathways[J]. Eur J Pharmacol, 2010, 649(1/2/3): 100-7. [DOI] [PubMed] [Google Scholar]
- 14. Jiang X, Yi SN, Liu Q, et al. Asperosaponin VI ameliorates the CMS-induced depressive-like behaviors by inducing a neuroprotective microglial phenotype in hippocampus via PPAR‑γ pathway[J]. J Neuroinflammation, 2022, 19(1): 115. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15. Wei LL, Luo H, Jin Y, et al. Asperosaponin VI protects alcohol-induced hepatic steatosis and injury via regulating lipid metabolism and ER stress[J]. Phytomedicine, 2023, 121: 155080. [DOI] [PubMed] [Google Scholar]
- 16. Xuan LL, Yang S, Ren LL, et al. Akebia saponin D attenuates allergic airway inflammation through AMPK activation[J]. J Nat Med, 2024, 78(2): 393-402. [DOI] [PubMed] [Google Scholar]
- 17. Couto M, Andrade N, Magro F, et al. Taurocholate uptake by Caco-2 cells is inhibited by pro-inflammatory cytokines and butyrate[J]. Cytokine, 2023, 169: 156307. [DOI] [PubMed] [Google Scholar]
- 18. Lu JJ, Shi XJ, Fu Q, et al. New mechanistic understanding of osteoclast differentiation and bone resorption mediated by P2X7 receptors and PI3K-Akt-GSK3β signaling[J]. Cell Mol Biol Lett, 2024, 29(1): 100. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. Wang ZY, Chen JY, Babicheva A, et al. Endothelial upregulation of mechanosensitive channel Piezo1 in pulmonary hypertension[J]. Am J Physiol Cell Physiol, 2021, 321(6): C1010-C1027. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20. George B, Gui B, Raguraman R, et al. AKT1 transcriptomic landscape in breast cancer cells[J]. Cells, 2022, 11(15): 2290. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21. Dai YX, Lu QL, Li PY, et al. Xianglian Pill attenuates ulcerative colitis through TLR4/MyD88/NF‑κB signaling pathway[J]. J Ethnopharmacol, 2023, 300: 115690. [DOI] [PubMed] [Google Scholar]
- 22. Li CL, Liu MG, Deng L, et al. Oxyberberine ameliorates TNBS-induced colitis in rats through suppressing inflammation and oxidative stress via Keap1/Nrf2/NF‑κB signaling pathways[J]. Phytomedicine, 2023, 116: 154899. [DOI] [PubMed] [Google Scholar]
- 23. Dolinger M, Torres J, Vermeire S. Crohn's disease[J]. Lancet, 2024, 403(10432): 1177-91. [DOI] [PubMed] [Google Scholar]
- 24. Zhang ZN, Zuo LG, Song X, et al. Arjunolic acid protects the intestinal epithelial barrier, ameliorating Crohn's disease-like colitis by restoring gut microbiota composition and inactivating TLR4 signalling[J]. Phytomedicine, 2024, 123: 155223. [DOI] [PubMed] [Google Scholar]
- 25. 苏 超, 包 阔, 李佳威, 等. 人参皂苷衍生物AD-1通过抑制NLRP3炎症小体活化改善TNBS诱导的小鼠急性IBD[J]. 中国免疫学杂志, 2023, 39(11): 2305-10, 2317. [Google Scholar]
- 26. Yang XR, Liang J, Shu Y, et al. Asperosaponin VI facilitates the regeneration of skeletal muscle injury by suppressing GSK-3β-mediated cell apoptosis[J]. J Cell Biochem, 2024, 125(1): 115-26. [DOI] [PubMed] [Google Scholar]
- 27. Jang DI, Lee AH, Shin HY, et al. The role of tumor necrosis factor alpha (TNF-α) in autoimmune disease and current TNF-α inhibitors in therapeutics[J]. Int J Mol Sci, 2021, 22(5): 2719. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28. Lenti MV, Santacroce G, Broglio G, et al. Recent advances in intestinal fibrosis[J]. Mol Aspects Med, 2024, 96: 101251. [DOI] [PubMed] [Google Scholar]
- 29. Kim JT, Napier DL, Kim J, et al. Ketogenesis alleviates TNF‑α-induced apoptosis and inflammatory responses in intestinal cells[J]. Free Radic Biol Med, 2021, 172: 90-100. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30. Liu LQ, Yan MJ, Yang R, et al. Adiponectin attenuates lipopolysaccharide-induced apoptosis by regulating the Cx43/PI3K/AKT pathway[J]. Front Pharmacol, 2021, 12: 644225. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31. Lin CY, Tsai PH, Kandaswami CC, et al. Role of tissue transglutaminase 2 in the acquisition of a mesenchymal-like phenotype in highly invasive A431 tumor cells[J]. Mol Cancer, 2011, 10: 87. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32. Chalabi-Dchar M, Cassant-Sourdy S, Duluc C, et al. Loss of somatostatin receptor subtype 2 promotes growth of KRAS-induced pancreatic tumors in mice by activating PI3K signaling and overexpression of CXCL16[J]. Gastroenterology, 2015, 148(7): 1452-65. [DOI] [PubMed] [Google Scholar]
- 33. Guo Q, Jin YZ, Chen XY, et al. NF‑κB in biology and targeted therapy: new insights and translational implications[J]. Signal Transduct Target Ther, 2024, 9(1): 53. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34. 刘兴隆, 张培旭, 熊珮宇, 等. 基于PI3K/Akt/NF-κB通路探讨人参败毒散、榆瑞灌肠液内外合治干预溃疡性结肠炎大鼠肠黏膜损伤的作用机制[J]. 中国实验方剂学杂志, 2023, 29(19): 42-51. [Google Scholar]
- 35. 李 多, 彭 昭, 张泽天, 等. 复方黄柏液通过PI3K/Akt/NF-κB信号通路逆转大鼠溃疡性结肠炎[J]. 中国老年学杂志, 2023, 43(9): 2241-4. [Google Scholar]


