Abstract
目的
探究AKBA联合阿霉素对三阴性乳腺癌细胞MDA-MB-231在增殖、迁移、侵袭和凋亡上的协同抑制作用,并通过网络药理学分析AKBA作用乳腺癌的下游信号通路。
方法
MDA-MB-231细胞体外培养,CCK-8法分别检测AKBA和阿霉素(ADR)作用MDA-MB-231细胞48 h的半抑制浓度(IC50),SynergyFinder在线网站(https://synergyfinder.fimm.fi)分析AKBA联合阿霉素的协同指数和最佳协同浓度。设置实验分组,对照组:MDA-MB-231正常培养;AKBA组:MDA-MB-231+AKBA(22.5 μmol/L)处理48 h;ADR组:MDA-MB-231+(0.84 μmol/L)处理48 h;AKBA+ADR组:MDA-MB-231+AKBA(22.5 μmol/L)+ADR(0.84 μmol/L)处理48 h,使用克隆形成实验、Transwell迁移和侵袭、划痕实验检测AKBA联合阿霉素抑制细胞迁移和侵袭的能力,采用Western blotting和qPCR实验检测凋亡相关基因的表达情况,将4~5周龄Balb/c nude小鼠随机分为4组(6只/组),建立裸鼠异种移植瘤模型,对照组:腹腔注射200 μL 0.9%生理盐水;AKBA组:腹腔注射200 μL50 mg/kg的AKBA;ADR组:腹腔注射200 μL 2.5 mg/kg的ADR;AKBA+ADR组:腹腔注射200 μL50 mg/kg的AKBA和2.5 mg/kg的ADR等量混合溶液,检测各组抑瘤率,HE染色检测组织病理情况,并通过网络药理学分析预测AKBA作用于乳腺癌的下游靶点和信号通路。
结果
AKBA对MDA-MB-231细胞作用48 h的IC50为45.15±0.97 μmol/L,ADR的IC50为0.42±0.99 μmol/L;SynergyFinder证实AKBA与ADR联合具有协同作用(ZIP>10);相较于对照组、AKBA组和阿霉素组,AKBA+ADR组明显抑制TNBC细胞增殖活性(P<0.0001),集落形成数量减少更多(P<0.05);相较对照组、AKBA和ADR组,AKBA+ADR组明显减弱细胞划痕愈合率(P<0.01);较对照组、AKBA组和ADR组,AKBA+ADR组所致细胞迁移至下室的数量减少更多(P<0.01);与对照组和AKBA或ADR单独使用相比,AKBA+ADR组抑制MDA-MB-231细胞侵袭基质胶能力增强(P<0.05);较AKBA或ADR单独作用,AKBA+ADR组在mRNA和蛋白水平上调Bax、Caspase-3剪切体和下调Bcl-2的表达更多(P<0.05);AKBA组、ADR组和AKBA+ADR组的抑瘤率分别为23.80%、52.73%和81.83%(P<0.01),AKBA+ADR组相比于ADR组对小鼠脏器造成的毒性损伤更小;网络药理学预测AKBA通过PTGS2影响乳腺癌进展。
结论
AKBA联合阿霉素能够显著抑制TNBC细胞MDA-MB-231的增殖、迁移和侵袭,并促进细胞凋亡,在裸鼠体内抑制移植瘤生长并减轻阿霉素的毒性作用。
Keywords: AKBA, 乙酰基-11-酮基-β-乳香酸, 三阴性乳腺癌, 阿霉素
Abstract
Objective
To investigate the synergistic inhibitory effects of AKBA and doxorubicin on malignant phenotype of triple-negative breast cancer (TNBC) MDA-MB-231 cells.
Methods
CCK-8 assay was used to determine the 48-h IC50 of AKBA and doxorubicin in MDA-MB-231 cells, and SynergyFinder was employed to calculate the synergistic index and the optimal concentrations of the two agents. MDA-MB-231 cells treated with AKBA (22.5 μmol/L), doxorubicin (0.84 μmol/L) or their combination were examined for changes in cell proliferation, migration, invasion and apoptosis using Transwell migration, scratch assay, clone generation, RT-qPCR and Western blotting. Network pharmacology analysis was conducted to identify the downstream targets of AKBA in TNBC. In nude mouse models bearing subcutaneous MDA-MB-231 cell xenografts, the effects of normal saline, AKBA (50 mg/kg), doxorubicin (2.5 mg/kg), and AKBA combined with doxorubicin on xenograft growth and histopathology were observed.
Results
The IC50 of AKBA and doxorubicin in MDA-MB-231 cells at 48 h was 45.15±0.97 μmol/L and 0.42±0.99 μmol/L, respectively. SynergyFinder confirmed the synergistic effect of AKBA and ADR with a ZIP>10. The combined treatment with AKBA and doxorubicin significantly inhibited the proliferation, migration and invasion, promoted apoptosis of MDA-MB-231 cells, and effectively suppressed xenograft growth in nude mice. Network pharmacology analysis predicted that AKBA affects the progression of TNBC through its downstream target AKBA.
Conclusion
AKBA combined with doxorubicin inhibits proliferation, migration and invasion, promotes apoptosis of MDA-MB-231 cells and suppresses MDA-MB-231 cell xenograft growth in nude mice. The combined use of AKBA can attenuate the toxic effects of doxorubicin in nude mice.
Keywords: AKBA, acetyl-11-keto‑β‑boswellic acid, triple-negative breast cancer, doxorubicin
基于目前免疫组化的检测结果,乳腺癌分子分型大致可分为激素受体阳性型即雌激素受体(ER)或孕激素受体(PR)阳性、人类表皮生长因子受体-2(HER-2)阳性型及三阴性乳腺癌(TNBC)[1]。TNBC由于缺乏ERα、PR和HER-2治疗的靶点而限制了内分泌治疗,具有恶性侵袭性表型和较差的预后[2]。TNBC还与患者的早期复发转移情况以及远处器官如脑、肝脏、胃等的转移风险呈正向线性关系,TNBC晚期患者的生存时间和身心健康均受到了极其严重的侵蚀和影响[3]。由于内分泌治疗对TNBC效果甚微,TNBC晚期患者主要采用化疗放射治疗,其目的是抑制肿瘤细胞增殖,从而减少侵袭和转移[4]。
阿霉素(ADR)是一类蒽环类广谱抗肿瘤的抗生素,临床上主要用于乳腺癌、小细胞肺癌、胃癌、肝癌、淋巴瘤、白血病等肿瘤的化疗[5]。但该药物在化疗过程中产生具有明显的心脏毒性、骨髓抑制、肝毒性、肾毒性等不良反应,以心脏毒性最常见,以及在肿瘤化疗过程中易对阿霉素产生多药耐药性而限制其临床应用[6, 7]。因此,目前临床上迫切需要开发有效的联合治疗方案来缓解阿霉素的化疗毒副作用并改进治疗效果。
乙酰基-11-酮基-β-乳香酸(AKBA)是从乳香的树胶成分中提取到的一种五环三萜类化合物,是天然乳香中极具活性的成分之一,可调节多种分子靶标,包括多种激酶、转录因子、酶受体、生长因子及其他参与细胞增殖及凋亡的分子[8-10]。AKBA可抑制胶质母细胞瘤、前列腺癌、胰腺癌、肺癌和胃癌的细胞增殖,通过调节肿瘤进展中发挥关键作用的基因/信号通路从而抗肿瘤发展[11-15]。此外,AKBA可通过抑制核转录因子κB(NF-κB)信号通路阻止破骨细胞形成,并增强肿瘤坏死因子(TNF)和阿霉素诱导的细胞凋亡,抑制TNF诱导的细胞侵袭[16]。
AKBA可以在化疗增敏上发挥逆转耐药的作用,AKBA在长春新碱(VCR)诱导耐药的人回盲部腺癌细胞中下调了多药耐药蛋白-1(MDR1)表达,促进耐VCR结肠癌细胞中VCR的细胞毒性增加和减弱P-糖蛋白(P-gp)在癌细胞中的活性[17]。AKBA还可提高卵巢癌细胞对紫杉醇的敏感性,逆转癌细胞的多药耐药[18]。在乳腺癌中,AKBA已被证实具有抗炎功效并促进乳腺癌MCF-7细胞凋亡,但是对TNBC细胞的影响机制有待研究[19, 20]。AKBA作为广泛应用于肿瘤治疗的传统中药乳香的活性成分,其与阿霉素联合治疗的研究还相对较少。我们的前期研究显示,AKBA和阿霉素在抑制TNBC细胞MDA-MB-231的增殖上存在协同作用,我们发现联合组相较于对照组和单药组,可以更明显的抑制TNBC细胞的迁移和侵袭能力,并促进细胞凋亡。然而,AKBA联合阿霉素调节乳腺癌进展的分子机制尚需深入阐明,为临床改进乳腺癌联合化疗方案提供新的思路。
本研究验证了AKBA与阿霉素在抑制TNBC细胞增殖中存在协同作用,发现AKBA联合阿霉素能够明显抑制TNBC细胞MDA-MB-231增殖、转移、侵袭和促进凋亡,通过网络药理学筛选出了AKBA影响乳腺癌进展的下游信号通路和靶点,并且建立了裸鼠异种移植瘤模型来验证联合药物在体内抑制肿瘤生长的功效和减轻阿霉素毒性作用。这对解析AKBA在乳腺癌中的抑癌机制和作用靶点并且建立中西药联合应用的临床个性化治疗具有重要意义。
1. 材料和方法
1.1. 材料
1.1.1. 细胞
本文所用细胞均购自上海信裕生物科技有限公司,包括MCF-10A(正常乳腺上皮细胞,RRID:CVCL_0598)和MDA-MB-231(三阴性乳腺癌细胞,RRID:CVCL_0062)。
1.1.2. 试剂
AKBA(MCE) 10 mg和盐酸阿霉素(MCE)50 mg,按照实际说明书稀释比例溶于二甲亚砜(DMSO,成都市科隆化学品有限公司)分别制成浓度为5 mmol/L和10 mmol/L的母液置于-20 ℃冻库冰冻保存,以细胞培养基稀释浓度为100 μmol/L的工作液使用。特级胎牛血清、0.25 %胰蛋白酶溶液、RPMI 1640培养基(含谷氨酰胺,上海逍鹏生物科技有限公司);MCF-10A细胞专用培养基(武汉普诺赛生命科技有限公司);PBS磷酸盐缓冲液干粉、20× TBST缓冲液、青链霉素混合液(×100)细胞培养专用、结晶紫染色液1%、4%多聚甲醛(北京索莱宝科技有限公司);TRIzol试剂(赛默飞世尔科技公司);三氯甲烷、异丙醇、无水乙醇(成都市科隆化学品公司);TransScript® Uni All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal)、PerfectStart® Green qPCR SuperMix(北京全式金生物技术有限公司);DEPC水(DNase、RNase free,上海碧云天生物技术股份有限公司);裂解液(强)、蛋白酶磷酸酶抑制剂混合物(50×)、蛋白定量试剂盒、蛋白上样缓冲液(5×)、超敏ECL化学发光检测试剂盒(上海碧云天生物技术股份有限公司);PAGE凝胶快速制备试剂盒、三色预染蛋白marker10-250kDa(上海雅酶生物医药科技有限公司);GAPDH抗体、兔二抗、鼠二抗、BCL2、Bax、Caspase-3、Caspase-9抗体(武汉三鹰生物技术有限公司);苏木素、伊红Y(Sigma);二甲苯(成都市科隆化学品有限公司);中性树脂胶(北京雷根生物技术有限公司);CCK-8试剂(Selleck);Matrigel基质胶、8.0 µm孔径聚碳酸酯膜小室(Corning)。
1.1.3. 仪器
低速离心机(安徽嘉文仪器装备有限公司);Centrifuge 5424低温离心机(Eppendorf);二氧化碳培养箱(Thermo Fisher Scientific);Olympus IX71倒置相差荧光显微镜、生物显微镜BX43(Olympus);电子天平(梅特勒-托利多上海仪器有限公司);微量分光光度计(Thermo Fisher Scientific);恒温金属浴(杭州博日科技有限公司);Bio-rad T100 PCR仪、CFX96荧光定量PCR仪、化学发光成像系统(Bio-rad);酶标仪(美国伯腾仪器有限公司);垂直电泳仪、湿式转膜仪(上海天能科技有限公司);新型小容量全温度恒温培养振荡器(上海智城分析仪器制造有限公司);恒温水浴锅(天津市泰斯特仪器有限公司);石蜡切片机、光学显微镜、徕卡显微成像系统、切片刀(Leica);盖玻片、载玻片(江苏世泰实验器材有限公司);流式细胞仪(美国艾森生物有限公司)。
1.2. 方法
1.2.1. 细胞培养
采用含有10%特级胎牛血清和1%双抗的RPMI 1640混合培养基培养正常乳腺上皮细胞株MCF-10A和三阴性乳腺癌细胞株MDA-MB-231。所有细胞均在无菌细胞培养瓶中培养,操作过程严格无菌操作,培养瓶放在5%二氧化碳、37 ℃和相对湿度为70%~80%的培养箱中孵育。待细胞生长融合至80%~90%再进行后续实验。
1.2.2. CCK-8增殖实验
消化并收集生长状态良好的MCF-10A和MDA-MB-231细胞,流式细胞仪计数后按照MCF-10A细胞密度6000 /孔,MDA-MB-231细胞密度9000 /孔,100 μL/孔细胞悬液,设置3个复孔,接种至96孔板。24 h细胞贴壁后,以换液的形式按30、40、50、60、70 μmol/L的浓度梯度加入含AKBA的完全培养基,按0.25、0.5、1、2、4 μmol/L浓度梯度加入含阿霉素的完全培养基或AKBA、阿霉素混合完全培养基。再将培养板放入培养箱中分别培养24 h、48 h,配置含10% CCK-8的培养基,以换液的形式加入。再将培养板放入培养箱中孵育3 h。酶标仪测定吸光值A 450 nm。按公式([(As-Ab)/(Ac-Ab)]×100%)分别计算两种药物在24 h、48 h对细胞作用的存活率,导入GraphPad Prism 9.0软件作非线性拟合曲线并计算两种药物作用细胞48 h的IC50值。As:实验孔吸光度(含细胞、培养基、CCK-8溶液和药物溶液);Ac:对照孔吸光度(含细胞、培养基、CCK-8溶液,不含药物);Ab:空白孔吸光度(含培养基、CCK-8溶液,不含细胞、药物)。
1.2.3. SynergyFinder分析AKBA与阿霉素联合的协同指数
按照1/4IC50、1/2IC50、IC50、2倍IC50和4倍IC50对应浓度的阿霉素和AKBA进行联合后,使用CCK-8实验检测联合药物作用于MDA-MB-231细胞48 h后的细胞抑制率并将所得数据导入Synergy Finder在线网站(https://synergyfinder.fimm.fi)计算药物协同评分。零相互作用势(ZIP)可用于评价两药是否存在协同作用,ZIP分数小于-10视为两药拮抗,ZIP分数大于-10但小于10视为两药作用相加,ZIP分数大于10视为两药存在协同作用。
1.2.4. 克隆形成实验
确定作用浓度后,将细胞分组为对照组(完培细胞,CTL)、AKBA组(22.5 μmol/L,AKBA)、阿霉素组(0.84 μmol/L,ADR)、AKBA+阿霉素组(22.5 μmol/L AKBA+0.84 μmol/L ADR,AKBA+ADR)。以2×105/孔接种在6孔板中,24 h细胞贴壁后,以换液的形式加入含AKBA的完全培养基、含阿霉素的完全培养基或AKBA、阿霉素混合完全培养基,培养48 h。取出细胞消化下来,每组按800/孔重新接种到6孔板中并连续培养10~15 d直至肉眼可见明显细胞集落时,进行4%多聚甲醛固定和1%结晶紫染色。PBS冲洗六孔板直至背景干净,晾干水分拍照,使用Image J软件进行统计分析。
1.2.5. 伤口愈合实验
实验分组同上。用马克笔在六孔板背面对准直尺间隔1 cm横向对孔画线,每孔3条平行线。消化对数期生长细胞并配置含10%胎牛血清的完全培养基混悬细胞,将1×106/孔细胞接种于六孔板,以第2天六孔板内细胞融合至90%为宜。用200 μL枪头配合移液器垂直于背面横线对细胞层竖直划线,形成伤痕。用2 mL PBS清洗脱落的细胞,更换含一定浓度的AKBA、阿霉素和AKBA联合阿霉素无血清细胞培养液继续培养细胞,倒置显微镜下观察各组细胞并拍摄0 h照片和记录定点,在培养24 h和48 h后继续使用倒置显微镜拍照,获得24 h和48 h的迁移情况。使用Image J软件测定各组细胞和各个时间的划痕间距,计算细胞迁移率。
1.2.6. Transwell迁移实验
移开Transwell孔板中的上室,在每个下室中加入600 μL 含20% FBS的完全培养基。细胞消化后离心,用含10% FBS的完全培养基重悬细胞,吸取含3×104/100 μL的细胞悬液加入每个小室内。用镊子轻移上室至每个下室中,使下室培养基刚好没过上室底部。将Transwell 孔板放于37 ℃培养箱中培养24 h。弃去培养液,PBS清洗小室2遍,4%多聚甲醛固定30 min。弃去多聚甲醛,稍微风干小室后,1%结晶紫染色10 min,用PBS清洗数遍直至背景干净,用棉签轻轻擦拭掉上层未迁移细胞,自然晾干小室。使用显微镜拍摄小室底部迁移细胞,直径上取4个视野。使用 Image J软件处理并进行统计学分析。
1.2.7. Transwell侵袭实验
实验前从-20 ℃冰箱中取出Matrigel基质胶,放于4 ℃冰箱过夜融化固态Matrigel基质胶为液态。使用提前预冷的实验器材,在低温条件下用无血清培养基按1∶8的比例稀释Matrigel基质胶,混匀后加60 μL稀释后的基质胶至Transwell小室,37 ℃放置1.5 h使Matrigel基质胶凝固成薄胶。在下室中加入600 μL含20% FBS的完全培养基。用含10% FBS的完全培养基重悬细胞,吸取100 μL 含3×104个细胞的悬液加入小室内。移动上室至下室上方,使下室培养基刚好没过上室底部。将Transwell孔板放于37 ℃培养箱中培养48 h。后续处理方式同Transwell迁移实验。
1.2.8. 实时荧光定量PCR技术(RT-qPCR)
取对数生长期细胞消化离心,PBS清洗1遍,加入1 mL Trizol试剂提取总RNA,使用微量分光光度计测定样品RNA浓度并记录。按照TransScript®一步法逆转录试剂盒说明书配制逆转录RNA体系,充分混匀瞬离后上机合成cDNA作为qPCR体系模板。所有引物由生工生物工程公司合成(表1),使用PerfectStart® Green qPCR SuperMix试剂盒提供的体系配制进行RT-qPCR反应,将八联管放置于CFX96荧光定量PCR仪中按94 ℃-30 s,94 ℃-5 s,60 ℃-30 s(40-45 cycle)的反应条件运行。每个引物设置3个复孔。
表1.
引物序列
Tab.1 Primer sequences for RT-qPCR
| Gene | Primer sequence 5'-3' |
|---|---|
| Caspase-3 |
Forward: TATTCCACAGCACCTGGTTA Reverse: CAATACATGGAATCTGTTTCTT |
| Bax |
Forward: CCTCAGGATGCGTCCACCAAGA Reverse: TGTGTCCACGGCGGCAATCA |
| Bcl-2 |
Forward: GTGTGTGGAGAGCGTCAACC Reverse: TCTTCAGAGACAGCCAGGAGAA |
| GAPDH |
Forward: GGAGCGAGATCCCTCCAAAAT Reverse: GGCTGTTGTCATACTTCTCATGG |
| PTGS2 |
Forward: CTGGCGCTCAGCCATACAG Reverse: CGCACTTATACTGGTCAAATCCC |
1.2.9. Western blotting
待细胞生长至汇合度为60%时,按照实验分组对照组、AKBA组、阿霉素组、AKBA+阿霉素组分别给予不给药、22.5 μmol/L AKBA、0.84 μmol/L ADR和22.5 μmol/L AKBA+0.84 μmol/L ADR处理48 h。收集消化细胞,PBS清洗1遍,按照RIPA蛋白裂解液:蛋白酶抑制剂:磷酸酶抑制剂=50∶1∶1的比例配制裂解液,每组加入300 μL,充分混匀震荡,冰上裂解2 h。超声裂解后按照12 000 r/min 4 ℃离心15 min。取样本上清液,稀释5倍,BCA法检测蛋白浓度并定量。定量后样本与5×Loading buffer按照4∶1比例稀释混合,100 ℃加热处理蛋白10 min,-20 ℃保存。用雅酶制胶试剂盒制成12.5%浓度的SDS-PAGE凝胶,拔去制胶梳,按照60 μg定量上样蛋白样本,加入电泳液没过电泳槽底部金属丝,按照恒压80 V-30 min,120 V-60 min开始跑胶。样本跑到凝胶底部后,湿转法200 mA-2 h转移蛋白至PVDF膜上,期间放置冰袋降温。转完膜后,5%脱脂奶粉37 ℃封闭PVDF膜1 h,加入对应一抗(1∶1000稀释)4 ℃孵育过夜,TBST摇床清洗5 min,5遍,HRP兔/鼠二抗(1∶5000稀释)室温摇床孵育2 h,TBST清洗5 min,5遍,在膜上滴加超敏ECL发光液曝光成像,Image J分析目的条带的灰度值并进行统计学分析。
1.2.10. 裸鼠异种移植瘤模型建立
实验动物为购自北京维通利华实验动物技术有限公司的SPF级雌性Balb/C nude裸鼠24只(4~5周龄,体质量16~18 g),实验动物生产许可证号:SCXK(京)2021-0006。将生长状态良好的MDA-MB-231细胞消化离心,并用PBS调整细胞密度为2.5×107/mL。在无菌条件下,用1 mL注射器抽取0.2 mL制备好的MDA-MB-231细胞悬液,于小鼠右侧腋窝皮下进行接种。10 d后小鼠皮下出现肉眼可见结节,将24只小鼠随机分为4组:对照组、AKBA组、阿霉素组、AKBA+阿霉素组,每组6只。对照组每只给予腹腔注射200 μL 0.9%生理盐水,AKBA组每只给予腹腔注射200 μL 50 mg/kg溶于0.5%羧甲基纤维素钠的AKBA,阿霉素组每只给予腹腔注射200 μL 2.5 mg/kg溶于按照3.98%DMSO:30%聚乙二醇200:66.02% 0.9%生理盐水比例配制助溶剂的阿霉素,AKBA+阿霉素组每只给予腹腔注射200 μL 50 mg/kg的AKBA和2.5 mg/kg阿霉素的混合溶液,每隔3 d给药1次,共给药8次。3 d/次称量记录小鼠体质量,并用游标卡尺测量移植瘤的长径(a,mm)和短径(b,mm)。给药3周后,麻醉后用颈椎脱臼法处死小鼠,摘除移植瘤,剔除筋膜,放于准备好的纸上待拍照片;计算肿瘤体积(V)=a×b2/2和测量肿瘤重量;取肿瘤、心、肝、脾、肾等组织,4%多聚甲醛固定用于HE染色。本研究所有动物实验经成都中医药大学实验动物福利伦理委员会批准(伦理批号:2024026)。
1.2.11. 组织HE染色
包埋:4%多聚甲醛固定的组织样本,经流水冲洗后,进行组织修块,放入病理包埋塑料筐中进行梯度酒精脱水、二甲苯透明、浸蜡和包埋。切片:采用Leica RM2235切片机将组织切成5 µm厚的薄片,在温水中展片,并固定于载玻片上。染色:切片脱蜡至水,苏木精-伊红染色,梯度酒精脱水后经二甲苯透明,中性树脂胶封片。在显微镜下进行质检,观察组织切片的完整性及着色性。
1.2.12. 网络药理学分析
通过PubChem(https://pubchem.ncbi.nlm.nih.gov)获取AKBA的平面、3D化学结构和Canonical SMILES,将平面结构和Canonical SMILES导入SwissTargetPrediction(http://www.swisstargetprediction.ch)检索AKBA作用靶点,在GeneCard数据库(https://www.genecards.org)输入关键词“breast cancer”,得到一组乳腺癌相关靶点,绘制维恩图(http://bioinformatics.psb.ugent.be/webtools/Venn/)筛选AKBA和乳腺癌靶点的交集,将交集导入STRING数据库(https://string-db.org)按默认参数寻找潜在靶点的互作关系,把结果导入Cytoscape 3.9.1(https://cytoscape.org/)创建蛋白互作(protein-protein interaction,PPI)PPI网络,通过计算degree和介数中心度识别AKBA作用乳腺癌的关键靶点。将AKBA-乳腺癌核心靶点导入DAVID(https://david.ncifcrf.gov),获得GO富集分析和KEGG结果,利用在线作图网站(http://www.bioinformatics.com.cn)绘制GO-KEGG下游通路富集分析图。
1.2.13. 统计学分析
实验数据均应用SPSS 26.0软件分析处理,采用GraphPad Prism 9.5.0软件绘制实验图。至少独立重复3次所有实验。计量资料2组间比较选择独立样本t检验,大于两组选择单因素方差分析,统计变量以均数±标准差表示,全部统计学检验均为双尾检验,P<0.05认为差异具有统计学意义。
2. 结果
2.1. AKBA联合阿霉素抑制MDA-MB-231细胞呈现协同作用关系
AKBA对MDA-MB-231和正常乳腺上皮MCF-10A细胞的增殖率起抑制作用,且作用时间48 h的细胞增殖率明显低于24 h,呈时间-剂量依赖性(MDA-MB-231,P<0.0001;MCF-10A,P<0.05,图1A),在MDA-MB-231细胞AKBA作用48 h的半抑制率(IC50)值为45.15±0.97 μmol/L,MCF-10A细胞AKBA作用48 h的IC50值为77.61±0.83 μmol/L;阿霉素作用48 h后对MDA-MB-231和MCF-10A的增殖抑制作用也明显高于24 h,呈时间-剂量依赖性(P<0.0001,图1B),在MDA-MB-231细胞ADR作用48 h的IC50值为0.42±0.99 μmol/L,MCF-10A细胞ADR作用48 h的IC50值为0.28±0.49 μmol/L。
图1.

CCK-8和Synergy Finder检测AKBA联合ADR对MDA-MB-231细胞增殖活性的影响以及药物联合协同指数
Fig.1 CCK-8 assay and SynergyFinder detection of the effect of AKBA combined with ADR on proliferation of MDA-MB-231 cells and drug combination synergy indices. A: Viability of AKBA-treated MDA-MB-231 and MCF-10A cells at 24 and 48 h. B: Viability of ADR-treated MDA-MB-231 and MCF-10A cells at 24 and 48 h. C: Synergistic indices of the combination of AKBA and ADR determined with Synergy Finder. D: Low concentrations of AKBA combined with different concentrations of ADR inhibit proliferation of MDA-MB-231 cells. E: Proliferation of MDA-MB-231 cells treated with saline, AKBA, ADR and AKBA+ADR for 72 h. *P<0.05, **P<0.01, ****P<0.0001.
Synergy Finder显示ZIP分数为10.079,AKBA与ADR呈协同作用关系,在起协同作用的浓度范围内,AKBA最低浓度为22.5 μmol/L,因此选择AKBA的最低有效浓度22.5 μmol/L作为后续实验最佳组合浓度(图1C)。当AKBA浓度为22.5 μmol/L,ADR浓度为0.84 μmol/L时,作用48 h,与ADR单独作用相比,MDA-MB-231细胞存活率明显降低(P<0.0001,图1D)。MDA-MB-231细胞在AKBA和ADR作用72 h后,生长速度急剧下降(P<0.0001,图1E)。
2.2. AKBA联合阿霉素抑制MDA-MB-231细胞增殖和迁移
与对照组相比,AKBA和ADR组生成的细胞集落数减少,细胞增殖能力受到抑制,而AKBA单药、ADR单药和联合组对比的话,AKBA+ADR组表现出更强的细胞增殖抑制能力(P<0.05,图2A)。AKBA组和ADR组伤口愈合速度明显慢于对照组,而AKBA联合ADR组抑制MDA-MB-231细胞平面迁移的能力更强,划痕愈合速度减弱(P<0.01,图2B)。对照组迁移至下室的细胞数量明显高于AKBA和ADR组,而AKBA+ADR组发生迁移的数量最少,低于单药组和对照组(P<0.01,图2C)。
图2.

AKBA联合ADR对TNBC细胞增殖和迁移的影响
Fig.2 Effect of AKBA combined with ADR on TNBC cell proliferation and migration. A: Clone formation assay in each group. B: Scratch assay for assessing migration ability of TNBC cells (Original magnification: ×40). C: Transwell migration assay of TNBC cells treated with AKBA combined with ADR (×100). *P<0.05, **P<0.01, ***P<0.001, ****P<0.0001 vs CTL; # P<0.05, ## P<0.01, ### P<0.001.
2.3. AKBA联合阿霉素抑制MDA-MB-231细胞侵袭并促进凋亡
AKBA+ADR组穿透基质胶到达下室的细胞数量最少,在4组中抑制细胞侵袭能力最强(P<0.05,图3A)。qPCR结果显示,相比于对照组,AKBA和ADR组细胞抑凋亡基因Bcl-2的mRNA表达下调,但AKBA+ADR组抑制Bcl-2表达能力更强(P<0.05),联合组上调促凋亡基因Bax和Caspase-3的mRNA表达最强(P<0.001,P<0.01,图3B)。Western blotting实验结果显示,相较于对照组,AKBA和ADR单药组下调了Bcl-2并促进了Bax和Caspase-3剪切体蛋白质水平的表达,联合组相比于单药组下调Bcl-2和促进Bax、Caspase-3剪切体表达的作用更强(P<0.05,图3C)。
图3.

AKBA联合ADR对TNBC细胞侵袭和凋亡的影响
Fig.3 Effect of AKBA combined with ADR on TNBC cell invasion and apoptosis. A: Transwell invasion assay for assessing the ability of TNBC cells to invade stromal gel (×100). B: RT-qPCR for detecting mRNA expressions of apoptosis-related genes in TNBC cells. C: Western blotting for detecting expressions of apoptosis-related proteins in TNBC cells. *P<0.05, **P<0.01, ***P<0.001, ****P<0.0001 vs CTL; # P<0.05, ## P<0.01, ### P<0.001, #### P<0.0001.
2.4. AKBA联合阿霉素抑制裸鼠体内MDA-MB-231细胞移植瘤生长
不同实验组的小鼠的体质量差异无统计学意义(P>0.05,图4A),移植瘤在裸鼠体内均逐日增长,但是AKBA和ADR组相较于对照组,移植瘤生长速度和体积受到了抑制,抑瘤率分别为23.80%和52.73%,联合组相比于单药组和对照组则是呈现明显的抑制MDA-MB-231细胞肿瘤生长的趋势,移植瘤的体积降低,抑瘤率达到81.83%(P<0.0001,图4A)。在肿瘤组织中,各组中均可见脂肪空泡和肿瘤细胞浸润性生长,对照组约有70%的肿瘤细胞凝固性坏死,破坏肌肉和脂肪组织明显,AKBA组和ADR组分别有约30%和15%的坏死,而AKBA+ADR组凝固性坏死组织约为10%,明显减轻肿瘤坏死;在心脏组织中,对照组部分有心外膜炎症性坏死,心肌细胞空泡化,ADR组有较严重的心内膜下炎性水肿、心肌细胞空泡化和炎性细胞浸润,AKBA组和AKBA+ADR组未见明显的病理变化;肾脏组织中,AKBA组和ADR组有部分空泡化和炎细胞浸润,联合组与对照组无较大差异;肝脏组织中,ADR组可见多灶性炎性坏死、纤维化,AKBA组和对照组未见明显炎症浸润,联合组则偶见单个肝细胞坏死伴炎性细胞浸润;肺脏组织中,各组均有部分出血现象(图4B)。
图4.

AKBA联合ADR对TNBC细胞裸鼠移植瘤生长的影响以及脏器毒性作用
Fig.4 Effect of AKBA combined with ADR on TNBC xenograft growth and its organ toxicity in nude mice. A: Observation of the tumor-bearing mice and the dissected tumors on day 27 and changes of body weight of the mice and tumor volume over time (black arrows indicate the time points of drug administration). B: HE staining for examining tumor histopathology and evaluating toxic effects of AKBA combined with ADR in the heart, liver, kidney, and lungs of the nude mice (×10). *P<0.05, **P<0.01, ***P<0.001, ****P<0.0001 vs CTL; ## P<0.01, ### P<0.001, #### P<0.0001 vs AKBA group; † P<0.05, †† P<0.01 vs ADR group
2.5. 网络药理学筛选分析AKBA作用于MDA-MB-231细胞的下游靶点
将SwissTargetPrediction获得的100个AKBA相关靶点和GeneCard获得的17622个乳腺癌相关靶点取交集绘制韦恩图,共获得AKBA作用乳腺癌的潜在靶点88个(图5A)。根据STRING数据库和Cytoscape绘制潜在靶点的互作关系(图5B),经过MCODE算法得出3个模块、18个节点和31条连接,其中degree最高的是PTGS2(图5C)。将所得AKBA作用乳腺癌的核心靶点导入DAVID并绘制GO富集分析(图5D)和KEGG通路分析气泡图,发现AKBA影响乳腺癌的靶点主要富集在代谢通路、花生四烯酸代谢、类固醇激素的生物合成通路和内质网膜通路等(图5E)。qPCR结果显示,AKBA和ADR单药组相较于对照组,均明显下调网络药理学所预测的AKBA作用靶点PTGS2在mRNA水平的表达,AKBA+ADR组则相对于单药组,抑制PTGS2的mRNA表达更强(P<0.05,图5F)。
图5.
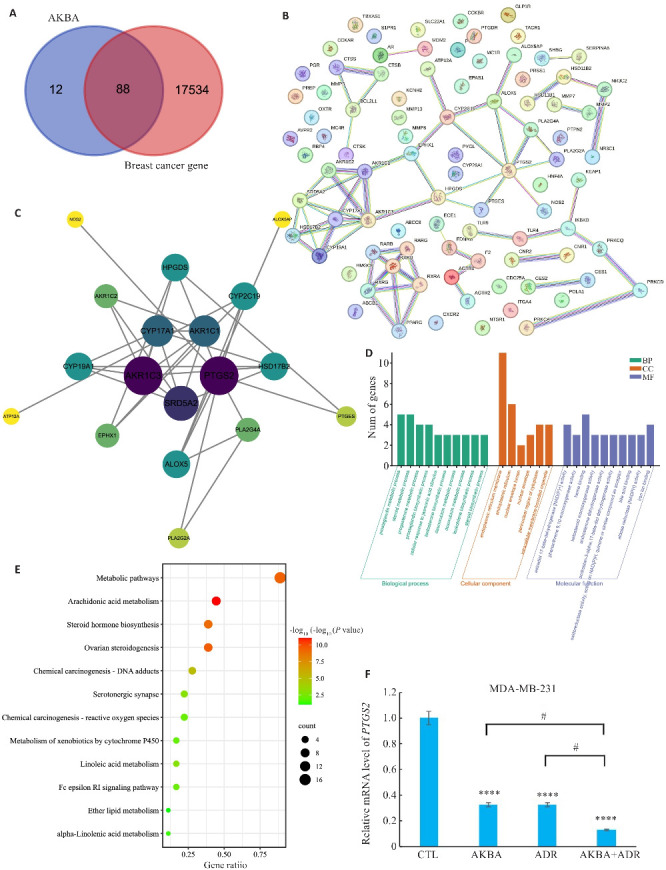
网络药理学分析筛选AKBA作用乳腺癌的下游通路和靶点
Fig.5 Network pharmacological analysis of downstream pathways and targets of AKBA in breast cancer. A: Venn diagram of intersected targets of AKBA and breast cancer. B: Protein interaction network obtained by STRING analysis of the intersected targets. C: Protein-protein interaction (PPI) network created was by Cytoscape for identifying the key targets of AKBA in breast cancer. D, E: Bubble diagram of KEGG pathway enrichment analysis of the biological process (BP), cellular composition (CC), molecular function (MF), GeneRatio, ratio of differential genes in KEGG pathway to the total differential genes. F: RT-qPCR of mRNA expression of the predicted target PTGS2 in each group. ****P<0.0001 vs CTL; # P<0.05.
3. 讨论
目前早诊断的TNBC多采取手术治疗为主,化学治疗为辅的临床方案,这可以有效杀灭淋巴结和远处脏器的亚临床微小转移灶,因此在TNBC治疗进程中化疗顺利的重要性不言而喻[21]。AKBA作为乳香的活性提取物,相较传统中药成分复杂的特点,AKBA及其衍生物调控肿瘤和炎症进展的成分靶点更易挖掘,而AKBA具有抑制肿瘤细胞生长、迁移并促进凋亡的作用以及联合西药发挥化疗增敏的效果也已在文献中报道[18,22-24]。研究表明,AKBA通过抑制maspin/AKT/FOXO1/p21轴增强肺癌RA549细胞的放射敏感性,抑制增殖和诱导细胞凋亡并停滞细胞周期[14]。AKBA处理脑膜瘤细胞后具有明显细胞毒性,对脑膜瘤细胞杀伤的IC50浓度在2-8 μmol/L范围[25]。研究发现,AKBA抑制胶质母细胞瘤U251和U87-MG细胞的迁移、侵袭和集落形成,促进凋亡蛋白Caspase-3/7的活性以及 Caspase-3和PARP剪切体的表达并降低线粒体膜电位,同时抑制裸鼠体内U87-MG细胞移植瘤生长[11]。此外,AKBA对ER+乳腺癌MCF-7细胞增殖抑制和激活Caspase-8和Caspase-9凋亡途径的作用在浓度为100 μg/mL时显著提高[20]。但由于AKBA在TNBC中的影响机制和抗癌作用目前报道较少,我们以TNBC细胞系MDA-MB-231为研究对象,通过CCK-8实验检测得出AKBA显著抑制TNBC细胞的增殖活性并且呈时间-剂量依赖性,而AKBA对正常乳腺上皮MCF-10A细胞毒性作用也明显低于TNBC细胞。TNBC是乳腺癌亚型中最具侵袭性的一类,其转移复发率高也是导致患者预后不良的因素之一[26]。为了验证AKBA是否能够抑制TNBC细胞迁移和侵袭,我们采用transwell迁移、侵袭以及伤口愈合实验检测了TNBC的平面和3D迁移能力以及侵袭基质胶能力,结果发现AKBA具有抑制TNBC细胞迁移和侵袭的作用,并且在转录和蛋白质水平发现AKBA上调了促凋亡基因Bax和Caspase-3表达,下调了抗凋亡基因Bcl-2的表达。本研究结果与其他文献报道的AKBA抗肿瘤作用一致,AKBA能够通过介导转移、侵袭和凋亡途径来调控三阴性乳腺癌进展。
阿霉素作为乳腺癌常见的一线化疗药物,其强劲的抑癌功能同时也伴随着严重的化疗后毒副作用,这可能是通过活性氧生成和拓扑异构酶2的直接途径以及其他方式造成的心脏损害等毒性反应[27]。目前研究显示,中药单体成分联合阿霉素的化疗方案能够增强对肿瘤细胞的损伤并逆转阿霉素诱导衰老所致的耐药[28-30]。AKBA在浓度10~50 μmol/L内呈剂量依赖性地与阿霉素协同介导内源性ROS生成途径和凋亡来诱导前列腺癌PC3细胞程序性死亡,促进阿霉素化疗增敏[12]。为了验证AKBA是否能像其他中药单体一般与阿霉素联合,对TNBC细胞产生更强的损伤作用,我们利用SynergyFinder对它们的协同作用情况进行了评价,结果显示两药联合的ZIP分数大于10,这表明AKBA联合阿霉素是协同的关系,我们从协同作用最强的区域选择了最低AKBA浓度,验证了随着阿霉素浓度增高,相比于阿霉素单独作用,低浓度的AKBA能够不断增强阿霉素对48 h内TNBC存活率的抑制强度,以此确定了AKBA和阿霉素联合时对TNBC细胞杀伤最强的作用浓度。我们接下来用细胞增殖-时间曲线和克隆形成实验证实了与对照组和单药组相比,随着作用时间延长,AKBA+ADR组细胞增殖率下降更为明显。我们之后重点研究了联合组相较于单药组,在TNBC迁移、侵袭和凋亡途径上AKBA是否也能同样增强阿霉素抑制MDA-MB-231生物学行为的能力。细胞表型实验结果表明,AKBA+ADR组抑制TNBC细胞迁移和侵袭的能力显著提高。联合组对接种于裸鼠身上的TNBC移植瘤也呈现了更强的肿瘤生长抑制率,AKBA还帮助缓解了阿霉素所致的心脏毒性并且无明显的不良反应。但不足的是,我们尚未探讨AKBA单药以及联合阿霉素后对TNBC裸鼠肺肝转移的抑制情况,这也是我们后续实验需要研究的方向。通过进行qPCR和Western blotting实验,我们发现AKBA+ADR组促进TNBC凋亡的能力显著提高,在mRNA水平和蛋白水平上一致上调Bax、Caspase-3剪切体并下调Bcl-2表达,表明AKBA和ADR可能是通过调控上游靶点在转录水平的表达来促进凋亡途径发生的。
AKBA在调节肿瘤和炎症进展过程中可通过广泛作用于下游成分靶点和调控信号通路进而影响细胞增殖转移、化疗增敏、自噬、铁死亡和活性氧生成等生物学行为[31-33]。AKBA通过JNK/MAPK和NF-κB信号通路在DSS诱导的结肠炎中提供保护[34]。AKBA联合顺铂通过上调肺癌A549细胞p27和p21 mRNA 水平,促进A549细胞的自噬并增强了细胞对顺铂敏感[32]。为探讨AKBA联合阿霉素抑制TNBC细胞增殖和诱导凋亡的潜在分子机制,我们通过网络药理学分析预测出的AKBA作用于乳腺癌的主要靶点有PTGS2、AKR1C3、SRD5A2、CYP17A1和AKR1C1,AKBA影响乳腺癌的下游信号通路主要富集在代谢通路和花生四烯酸代谢等,其中degree最高的核心靶点为PTGS2/COX-2。前列腺素内过氧化物合酶2(PTGS2),又称环氧合酶-2(COX-2),是一种诱导型的短寿命酶,参与细胞稳态、血管生成和细胞间信号传导。COX-2的过表达与前列腺素E2(PGE2)水平增加有关,而高PGE2水平与乳腺癌发生存在联系[35-37]。我们通过qPCR实验发现AKBA和阿霉素单药组相较对照组均能下调PTGS2,而联合组对PTGS2 mRNA表达水平抑制最强,这表明AKBA可能是通过下调PTGS2及相关作用靶点来抑制TNBC进展,我们下一步的研究方向将针对AKBA作用TNBC的下游分子靶点,通过敲低PTGS2基因表达和挽救实验来验证AKBA是否通过调节PTGS2及相关靶点介导TNBC增殖、迁移和凋亡等行为。此外,在胃癌中, AKBA联合AKT抑制剂MK2206在体外和裸鼠体内下调p-AKT和COX-2表达,进而抑制胃癌细胞增殖迁移和肿瘤生长[15]。AKBA还能通过Nrf2/HO-1氧化应激途径减少ROS的产生,显著减轻急性胰腺炎氧化应激诱导的损伤[38]。但是在TNBC中COX-2以及相关花生四烯酸代谢信号通路的表达是否也能被AKBA抑制来缓解肿瘤疼痛和炎症,还需要进一步的研究支持。
综上所述,本研究探讨了AKBA联合阿霉素抑制TNBC细胞MDA-MB-231增殖、转移、侵袭和促进凋亡的作用机制,通过网络药理学筛选AKBA作用于乳腺癌的下游靶点和信号通路,并且建立裸鼠异种移植瘤模型来验证AKBA联合阿霉素在体内抑制肿瘤生长的功效和减轻毒性作用。本研究对解析AKBA在乳腺癌中的抑癌机制和作用靶点并且建立中西药联合应用的临床个性化治疗具有重要意义。
基金资助
四川省中医药管理局科研项目(2024MS563)
参考文献
- 1. Asleh K, Riaz N, Nielsen TO. Heterogeneity of triple negative breast cancer: current advances in subtyping and treatment implications[J]. J Exp Clin Cancer Res, 2022, 41(1): 265. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2. Abu-Khalaf M, Wang C, Zhang ZC, et al. Genomic aberrations in circulating tumor DNAs from palbociclib-treated metastatic breast cancer patients reveal a novel resistance mechanism[J]. Cancers, 2022, 14(12): 2872. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. Keenan TE, Tolaney SM. Role of immunotherapy in triple-negative breast cancer[J]. J Natl Compr Canc Netw, 2020, 18(4): 479-89. [DOI] [PubMed] [Google Scholar]
- 4. Kwakman JJM, Bond MJG, Demichelis RM, et al. Adjuvant chemotherapy in patients with clinically node-negative but pathologically node-positive rectal cancer in the Netherlands: a retrospective analysis[J]. Eur J Cancer, 2024, 197: 113466. [DOI] [PubMed] [Google Scholar]
- 5. Kciuk M, Gielecińska A, Mujwar S, et al. Doxorubicin-an agent with multiple mechanisms of anticancer activity[J]. Cells, 2023, 12(4): 659. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. Yu J, Wang CX, Kong Q, et al. Recent progress in doxorubicin-induced cardiotoxicity and protective potential of natural products[J]. Phytomedicine, 2018, 40: 125-39. [DOI] [PubMed] [Google Scholar]
- 7. Pugazhendhi A, Edison TNJI, Velmurugan BK, et al. Toxicity of Doxorubicin (Dox) to different experimental organ systems[J]. Life Sci, 2018, 200: 26-30. [DOI] [PubMed] [Google Scholar]
- 8. 孙春萌, 王雅恬. 中国药科大学高质量完成药用辅料标准相关研究课题[J]. 中国药科大学学报, 2020, 51(2): 137. [Google Scholar]
- 9. 刘 迪, 张冰洋, 姚 铁, 等. 乳香化学成分及药理作用研究进展[J]. 中草药, 2020, 51(22): 5900-14. [Google Scholar]
- 10. 哈瑞雯, 周海燕, 詹志来, 等. 乳香化学成分、药理作用研究进展及质量标志物的预测分析[J]. 中华中医药学刊, 2021, 39(11): 94-107. [Google Scholar]
- 11. Li W, Liu JY, Fu WQ, et al. 3-O-acetyl-11-keto-β-boswellic acid exerts anti-tumor effects in glioblastoma by arresting cell cycle at G2/M phase[J]. J Exp Clin Cancer Res, 2018, 37(1): 132. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12. Verma M, Fatima S, Saeed M, et al. Anti-proliferative, pro-apoptotic, and chemosensitizing potential of 3-acetyl-11-keto‑β-boswellic acid (AKBA) against prostate cancer cells[J]. Mol Biotechnol, 2024. DOI: 10.1007/s12033-024-01089-7. [DOI] [PubMed] [Google Scholar]
- 13. Yang YT, Guo YL, Luo H, et al. Metabolomics-based discovery of XHP as a CYP3A4 inhibitor against pancreatic cancer[J]. Front Pharmacol, 2023, 14: 1164827. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. Gong C, Li W, Wu J, et al. AKBA inhibits radiotherapy resistance in lung cancer by inhibiting maspin methylation and regulating the AKT/FOXO1/p21 axis[J]. J Radiat Res, 2023, 64(1): 33-43. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15. Sun MX, He XP, Huang PY, et al. Acetyl-11-keto-β-boswellic acid inhibits proliferation and induces apoptosis of gastric cancer cells through the phosphatase and tensin homolog/Akt/cyclooxygenase-2 signaling pathway[J]. World J Gastroenterol, 2020, 26(38): 5822-35. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. Takada Y, Ichikawa H, Badmaev V, et al. Acetyl-11-keto-beta-boswellic acid potentiates apoptosis, inhibits invasion, and abolishes osteoclastogenesis by suppressing NF-kappa B and NF-kappa B-regulated gene expression[J]. J Immunol, 2006, 176(5): 3127-40. [DOI] [PubMed] [Google Scholar]
- 17. Xue X, Chen F, Liu AX, et al. Reversal of the multidrug resistance of human ileocecal adenocarcinoma cells by acetyl-11-keto‑β-boswellic acid via downregulation of P-glycoprotein signals[J]. Biosci Trends, 2016, 10(5): 392-9. [DOI] [PubMed] [Google Scholar]
- 18. Lu J, Wang YC, Shi ZJ, et al. 3-acetyl-11-keto-beta-boswellic acid decreases the malignancy of taxol resistant human ovarian cancer by inhibiting multidrug resistance (MDR) proteins function[J]. Biomedecine Pharmacother, 2019, 116: 108992. [DOI] [PubMed] [Google Scholar]
- 19. Jiang XF, Liu YS, Zhang GJ, et al. Acetyl-11-keto-β-boswellic acid inhibits precancerous breast lesion MCF-10AT cells via regulation of LINC00707/miR-206 that reduces estrogen receptor‑Α[J]. Cancer Manag Res, 2020, 12: 2301-14. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20. Ahmed SA, Al-Shanon AF, Al-Saffar AZ, et al. Antiproliferative and cell cycle arrest potentials of 3-O-acetyl-11-keto‑β‑boswellic acid against MCF-7 cells in vitro [J]. J Genet Eng Biotechnol, 2023, 21(1): 75. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21. Siegel R, Miller KD, Wagle NS, et al. Cancer statistics, 2023[J]. CA Cancer J Clin, 2023, 73(1): 17-48. [DOI] [PubMed] [Google Scholar]
- 22. Lauß J, Kappacher C, Isser O, et al. Species-Specific quantification of bioactive boswellic acids in Boswellia resin using NIR spectroscopy, HPLC and Multivariate data analysis[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2024, 316: 124384. [DOI] [PubMed] [Google Scholar]
- 23. Ammon HPT. Boswellic extracts and 11-keto‑β‑boswellic acids prevent type 1 and type 2 diabetes mellitus by suppressing the expression of proinflammatory cytokines[J]. Phytomedicine, 2019, 63: 153002. [DOI] [PubMed] [Google Scholar]
- 24. Pan D, Wang Q, Tang SY, et al. Acetyl-11-keto-beta-boswellic acid inhibits cell proliferation and growth of oral squamous cell carcinoma via RAB7B-mediated autophagy[J]. Toxicol Appl Pharmacol, 2024, 485: 116906. [DOI] [PubMed] [Google Scholar]
- 25. Park YS, Lee JH, Bondar J, et al. Cytotoxic action of acetyl-11-keto-beta-boswellic acid (AKBA) on meningioma cells[J]. Planta Med, 2002, 68(5): 397-401. [DOI] [PubMed] [Google Scholar]
- 26. Sparger CC, Hernandez AE, Rojas KE, et al. Axillary management and long-term oncologic outcomes in breast cancer patients with clinical N1 disease treated with neoadjuvant chemotherapy[J]. World J Surg Oncol, 2024, 22(1): 199. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27. Lin XX, Wu GM, Wang S, et al. Bibliometric and visual analysis of doxorubicin-induced cardiotoxicity[J]. Front Pharmacol, 2023, 14: 1255158. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28. Moon JY, Manh Hung LV, Unno T, et al. Nobiletin enhances chemosensitivity to adriamycin through modulation of the akt/GSK3β/β⁻Catenin/MYCN/MRP1 signaling pathway in A549 human non-small-cell lung cancer cells[J]. Nutrients, 2018, 10(12): 1829. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29. Li YX, Zhai ZH, Li H, et al. Guajadial reverses multidrug resistance by inhibiting ABC transporter expression and suppressing the PI3K/Akt pathway in drug-resistant breast cancer cells[J]. Chem Biol Interact, 2019, 305: 98-104. [DOI] [PubMed] [Google Scholar]
- 30. Smoots SG, Schreiber AR, Jackson MM, et al. Overcoming doxorubicin resistance in triple-negative breast cancer using the class I-targeting HDAC inhibitor bocodepsin/OKI-179 to promote apoptosis[J]. Breast Cancer Res, 2024, 26(1): 35. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31. Zhou J, Li XY, Han ZY, et al. Acetyl-11-keto‑β‑boswellic acid restrains the progression of synovitis in osteoarthritis via the Nrf2/HO-1 pathway[J]. Acta Biochim Biophys Sin, 2024. DOI: 10.3724/abbs.2024102. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32. Lv MH, Zhuang XB, Zhang Q, et al. Acetyl-11-keto-β‑boswellic acid enhances the cisplatin sensitivity of non-small cell lung cancer cells through cell cycle arrest, apoptosis induction, and autophagy suppression via p21-dependent signaling pathway[J]. Cell Biol Toxicol, 2021, 37(2): 209-28. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33. Yang YH, Li W, Ren LW, et al. S670, an amide derivative of 3-O-acetyl-11-keto‑β‑boswellic acid, induces ferroptosis in human glioblastoma cells by generating ROS and inhibiting STX17-mediated fusion of autophagosome and lysosome[J]. Acta Pharmacol Sin, 2024, 45(1): 209-22. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34. Zhang P, Jiang H. Acetyl-11-keto‑β‑boswellic acid confers protection in DSS-induced colitis via the JNK-p38 MAPK and NF-κB signaling pathways[J]. Adv Biol, 2023, 7(6): e2200247. [DOI] [PubMed] [Google Scholar]
- 35. Finetti F, Travelli C, Ercoli J, et al. Prostaglandin E2 and cancer: insight into tumor progression and immunity[J]. Biology, 2020, 9(12): 434. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36. Hashemi Goradel N, Najafi M, Salehi E, et al. Cyclooxygenase-2 in cancer: a review[J]. J Cell Physiol, 2019, 234(5): 5683-99. [DOI] [PubMed] [Google Scholar]
- 37. Ganz PA, Goodwin PJ. Breast cancer survivorship: where are we today[J]? Adv Exp Med Biol, 2015, 862: 1-8. [DOI] [PubMed] [Google Scholar]
- 38. Yuan CC, Dong XW, Xu SX, et al. AKBA alleviates experimental pancreatitis by inhibiting oxidative stress in Macrophages through the Nrf2/HO-1 pathway[J]. Int Immunopharmacol, 2023, 121: 110501. [DOI] [PubMed] [Google Scholar]


