Abstract
目的
探讨PHPS1通过对口腔鳞状细胞癌细胞ROS/酪氨酸磷酸酶SHP-2/AMPK活性进而促进PD-L1丝氨酸磷酸化进而加速肿瘤凋亡的机制研究,分析腺苷酸活化蛋白激酶(AMPK)对于低氧环境下肿瘤内血管生成的影响。
方法
6~8周龄健康裸鼠16只,皮下移植瘤模型分为Control组和PHPS1组, 8只/组,培育14 d后观察肿瘤的生长情况,并将其切片进行HE染色固定并拍照。将人口腔鳞状细胞癌Ca9-22细胞系培养后分为Control组、PHPS1组、Control+Compound C组(Compound C为AMPK抑制剂)、PHPS1+Compound C组在1%低氧环境下培养,通过Western blotting对细胞内SHP-2、AMPK、HIF-1α、PD-L1、caspase-8、caspase-3和BAX含量进行检测。
结果
裸鼠成瘤与血管新生实验结果显示PHPS1抑制了裸鼠体内肿瘤生长和血管新生(P<0.05)。Western blotting分析显示PHPS1降低了SHP-2、HIF-1α、PD-L1、ERK2、STAT3和VEGF的表达,同时增加了AMPK的表达(P<0.05)。加入AMPK抑制剂后,PHPS1对HIF-1α和PD-L1的抑制作用减弱(P<0.05)。此外,PHPS1促进了caspase-3、caspase-8、PD-L1 S195磷酸化和Bax蛋白的表达,这些效应在加入AMPK抑制剂后也有所减弱(P<0.05)。HE染色结果表明PHPS1组肿瘤血管生成数量减少(P<0.01)。
结论
在缺氧环境下可以通过调节SHP-2/AMPK活性进而促进PD-L1丝氨酸磷酸化进而加速肿瘤凋亡。
Keywords: SHP-2, AMPK, 口腔鳞状细胞癌, PD-L1
Abstract
Objective
To investigate the mechanism of PHPS1 for promoting apoptosis of oral squamous cell carcinoma cells and the role of AMPK in regulating tumor angiogenesis under hypoxic conditions.
Methods
Human oral squamous cell carcinoma Ca9-22 cells cultured in hypoxic conditions (1% O2) were inoculated subcutaneously in 16 nude mice, which were divided into control group and PHPS1 group (n=8) for treatment with 10% DMSO and 10% PHPS1 respectively. Tumor growth in the mice was monitored till 14 days after the treatment, and the xenografts were examined pathologically using HE staining. In Ca9-22 cells cultured in 1% O2, the effect of PHPS1, compound C (an AMPK inhibitor), and their combination on expressions of SHP-2, AMPK, HIF-1α, PD-L1, caspase-8, caspase-3 and BAX were evaluated using Western blotting.
Results
In the tumor-bearing nude mice, PHPS1 treatment significantly inhibited tumor growth and neovascularization. HE staining showed significantly reduced tumor angiogenesis in PHPS1-treated mice. In Ca9-22 cells in hypoxic cultures, PHPS1 treatment significantly decreased the expression levels of SHP-2, HIF-1α, PD-L1, ERK2, STAT3 and VEGF and increased the expression of AMPK. The inhibitory effects of PHPS1 on HIF-1α and PD-L1 were obviously attenuated by the addition of compound C. PHPS1 also enhanced the expressions of caspase-3, caspase-8 and Bax proteins and increased the phosphorylation levels of PD-L1 and S195 in Ca9-22 cells, and these effects were effectively attenuated by compound C.
Conclusion
PHPS1 can enhance PD-L1 serine phosphorylation by regulating SHP-2/AMPK activity to promote apoptosis of oral squamous cell carcinoma cells under hypoxic conditions.
Keywords: SHP-2, mitogen-activated protein kinase, oral squamous cell carcinoma, PD-L1
口腔鳞状细胞癌(OSCC)是发生在口腔部位的恶性肿瘤,是头颈部常见的恶性肿瘤之一[1]。目前对于口腔鳞状细胞癌的治疗方法包括手术治疗、放射性疗法等[2, 3]。治疗方法的选择以及治疗的效果主要取决于肿瘤的分期和扩散程度,从早期诊断的治愈率较高,到晚期的治疗效果较差,同时也更容易出现并发症[4]。口腔鳞状细胞癌的复发和转移是治疗中的关键问题。即使在初次治疗成功后,仍可能发生癌细胞的复发和扩散[5]。因此,深入研究口腔鳞状细胞癌的分子机制并探索新的治疗靶点具有重要意义。
SHP-2是一种非受体、普遍存在的蛋白酪氨酸磷酸酶,具有相对保守的结构和功能。它通常被描述为一种调节癌细胞存活和增殖的致癌基因[6]。其主要功能是通过去磷酸化的方式调节细胞内多个信号通路[7]。SHP-2可通过对STAT3/ERK通路进行刺激从而激活中立细胞中的VEGF,增强其新生血管的能力。SHP-2在多个细胞信号传导通路中发挥作用,包括表皮生长因子受体(EGFR)和细胞内骨架组分(如F-actin)等。在某些肿瘤类型中,SHP-2的异常激活或突变会促进肿瘤的发展[8]。
AMPK是一种重要的细胞能量传感激酶,参与调控细胞的能量代谢和生存[9]。它可以被细胞内的AMP/ATP比例升高所激活。在癌症中,AMPK的活性和功能具有复杂的作用。早期研究显示,AMPK的激活可能对口腔鳞状细胞癌的治疗具有潜在的益处[10]。AMPK的活化可以抑制癌细胞的增殖并诱导凋亡,因此可能对口腔鳞状细胞癌起到抑制作用[11]。
SHP-2与AMPK之间存在相互作用,并且AMPK的活性可能部分依赖于SHP-2的磷酸酶活性[12]。PHPS1是一种具有细胞渗透性的SHP-2抑制剂,可以抑制SHP-2的磷酸化,并激活AMPK,从而促进caspase-3、caspase-8的表达,进而促进肿瘤细胞的凋亡[13, 14]。然而,PHPS1在口腔鳞状细胞癌中的作用及其分子机制尚未阐明。特别是在缺氧微环境下,PHPS1对口腔鳞状细胞癌细胞的影响及其与SHP-2/AMPK信号通路的关系仍不清楚。基于此,本研究拟在缺氧条件下探讨PHPS1通过调控OSCC细胞内ROS/SHP-2/AMPK活性,促进PD-L1丝氨酸磷酸化进而加速肿瘤凋亡的分子机制。这一研究将为深入理解口腔鳞状细胞癌发生发展机制提供新的视角,同时为口腔鳞状细胞癌的靶向治疗提供潜在的新靶点和策略。
1. 材料和方法
1.1. 实验材料
人口腔鳞状细胞癌Ca9-22细胞(广州吉妮欧生物科技有限公司)。内皮细胞HUVEC(上海细胞生物学研究所细胞库)。SPF级6~8周龄健康BALB/c-nu裸鼠16只,体质量16~20 g,雄性,购自河南斯克贝斯生物科技有限公司。期间自由获取食物和水,动物房恒温24 ℃,相对湿度60%。胎牛血清164210-50(普诺赛);DMEM培养基、青霉素-链霉素 (10 000 U/mL)、无血清培养基 (SFM)和Lipofectamine™ 3000转染试剂、DMSO(赛默飞世尔科技公司);PHPS1(selleck);AMPK抑制剂(Compound C)、SHP-2抗体(1∶1000)、ERK2抗体(1∶1000)、STAT3抗体(1∶1000)、AMPK抗体(1∶1000)、HIF-1α抗体(1∶1000)、VEGF抗体(1∶1000)、PD-L1抗体(1∶1000)、BAX抗体(1∶2000)、caspase-3抗体(1∶5000)、caspase-8抗体(1∶3000)、GAPDH抗体-Loading Control(1∶10000)(Abcam)。
1.2. 实验方法
1.2.1. 细胞系培养及分组
将细胞培养在DMEM培养基中,并补充10%胎牛血清,100 U/mL青霉素和100 mg/mL链霉素。细胞在37 ℃下培养于1%O2,5%CO2和 94% N2的加湿的培养箱中培养。将对数期的细胞分为4组:Control组、PHPS1组、Control+Compound C组(Compound C为AMPK抑制剂)、PHPS1+Compound C组。Control组不进行额外处理,PHPS1组加入25 μL PHPS1进行培养,Control+ Compound C组在Control组的基础上加入50 µmol/L Compound C进行培养,PHPS1+Compound C组在PHPS1组的基础上加入50 µmol/L Compound C进行培养。
1.2.2. 共培养系统
当人口腔鳞状细胞癌细胞Ca9-22和内皮细胞HUVEC都处于对数期生长时,将二者接种于同一培养基中构建共培养体系。选择1%低氧培养后,对数生长期的Ca9-22细胞,并在收集细胞的前1 d晚上更换新鲜的培养基。用胰酶处理细胞后加入无血清培养基制成细胞悬液。将细胞悬液与高浓度基质胶在4℃环境中按1∶1的比例稀释,得到终浓度为4×107/mL的细胞悬液[15]。
1.2.3. 裸鼠模型建立及分组
基于独立样本t检验,设定显著性水平α=0.05,检验效能1-β=0.8,并根据先前研究或预实验估计效应量和标准差。使用样本量计算公式n=2[(Zα/2+Zβ)2 σ2] /d2,其中Zα/2=1.96,Zβ=0.84。假设σ=0.5,d=0.8,代入计算得出每组需要至少6.125只小鼠,向上取整为7只。考虑10%的可能损失率,每组应为8只。在裸鼠左侧腋窝处皮下注射细胞悬液,接种时应注意使针头深度在皮下约1 cm处,以减少注射后的细胞悬液溢出。与接种点的距离要小于针头的长度以确保不刺穿皮肤或肌肉层。接种时间在1 h内完成。将16只裸鼠皮下移植瘤模型分为control组、PHPS1组,8只/组,control组注入0.02 mL的10%DMSO,PHPS1组注入0.02 mL的10%PHPS1。在动物房中培养14 d后观察其肿瘤大小形态变化,在肿瘤体积不超过1000 mm³之前,对裸鼠进行安乐死,并取出肿瘤进行拍照。期间自由获取食物和水,动物房恒温24 ℃,相对湿度60%。本实验通过河北医科大学第四医院动物实验伦理审查(伦理审批号:IACUC-4th Hos Hebmu-)。
1.2.4. 裸鼠肿瘤生长情况
每天观察裸鼠状态、死亡情况及肿瘤生长情况,饲养14 d后测量皮下移植瘤的最大长径(a)和横径(b),计算移植瘤的体积。
1.2.5. 血管新生实验
对所有耗材进行预冷,将基质胶静置于4 ℃冰上(冻融操作均在冰上进行)。吸取200 μL基质胶加入24孔板,平铺一层胶液后放入培养箱中静置30 min,待其形成凝胶后将人脐静脉内皮细胞(HUVEC)消化并调整浓度为5×104/mL。加入细胞悬液50 μL/孔,铺好基质胶后再加入各组Ca9-22细胞和HUVEC共培养上清液1 mL并将完全培养基补足至3 mL。培养8 h后取出于光学显微镜下观察。随机取10个视野利用ImageJ 对形成的小管进行分析,并测量各组小管节点数量。
1.2.6. HE染色实验
在肿瘤体积超过1000 mm³之前,对裸鼠进行安乐死,并取出肿瘤进行拍照并进行切片脱蜡处理。将去水后的切片放入血红素水溶液中染色数分钟。在酸水及氨水中分色,各数秒钟。流水冲洗1 h后浸入蒸馏水片刻。通过浓度递减的乙醇(100%、90%、80%、70%)进行脱水处理(每种浓度各10 min)。放入酒精伊红染色液染色3 min,染色后的切片经纯乙醇处理脱水,再经二甲苯处理使切片透明性增加。将经处理过后的透明切片封固入中性树脂。在光学显微镜下进行观察。
1.2.7. Western blotting实验
提取各组细胞总蛋白,用Bradford 法测定蛋白质浓度。蛋白上样量为50 μg,12% SDS PAGE 1.5 h 后,将蛋白转移到PVDF膜,用1% BSA封闭过夜,分别加入一抗SHP-2、ERK2、STAT3、AMPK、HIF-1α、VEGF、PD-L1、BAX、caspase-3、caspase-8,37 ℃孵育2 h,TBST漂洗,加入二抗37 ℃孵育1 h,TBST漂洗,采用ECL 化学发光法显影,用Image J软件分析条带灰度值。实验重复3次。
1.3. 统计学方法
采用GraphPad Prism 9.0软件,计量资料采用均数±标准差表示,两样本比较采用t检验,多组样本比较采用单因素方差分析,以P<0.05表示差异有统计学意义。
2. 结果
2.1. 裸鼠肿瘤生长情况
裸鼠荷瘤实验结果显示,PHPS1组肿瘤体积明显小于Control组,差异有统计学意义(P<0.05,图1)。
图1.

PHPS1对裸鼠肿瘤生长的影响
Fig.1 Effect of PHPS1 on tumor growth in nude mice. A: Comparison of tumor growth between the two groups. B: Comparison of tumor volume between the two groups (Mean±SD). **P<0.05.
2.2. HE染色观察PHPS1通过对SHP-2和AMPK作用对肿瘤生长的影响
HE染色实验结果显示,加入PHPS1的小鼠体内肿瘤血管生成数量小于Control组的小鼠。Control组和PHPS1组肿瘤血管生成数量,后者较前者减小,差异有统计学意义(P<0.01,图2)。
图2.

PHPS1对口腔鳞状细胞癌细胞生长影响
Fig.2 Effect of PHPS1 on angiogenesis in oral squamous cell carcinoma xenografts in nude mice in control and PHPS1 groups. A: HE staining of the tumor sections (Scale bar=100 μm). B: Number of neovessels in the two groups (Mean±SD). ***P<0.01.
2.3. 在缺氧环境中PHPS1可以抑制口腔鳞状细胞癌细胞的血管新生
血管新生实验的结果显示,PHPS1组血管新生数量低于Control组,差异有统计学意义(P<0.05);在加入AMPK抑制剂后Control+Compound C组和PHPS1+Compound C组的血管新生数量高于PHPS1组,差异有统计学意义(P<0.05)。PHPS1对肿瘤中血管形成有抑制作用,在加入AMPK抑制剂后,未加入PHPS1的一组新生血管增加(P<0.05,图3)。
图3.

PHPS1对口腔鳞状细胞癌细胞血管新生能力的影响
Fig.3 Effect of PHPS1 on angiogenesis in oral squamous cell carcinoma cells. A: Angiogenesis of Ca9-22 cells in different groups assessed by tube formation assay (Scale bar=500 μm). B: Number of neovessels in each group (Mean±SD). **P<0.05.
2.4. Western blotting检测各组裸鼠肿瘤细胞中SHP-2、AMPK、HIF-1α、PD-L1、ERK1/2、STAT3、VEGF蛋白表达情况
Western blotting结果显示,control组p-SHP-2;HIF-1α;PD-L1;p-ERK1/2;p-STAT3;VEGF蛋白表达水平高于PHPS1组,但p-AMPK蛋白表达水平低于PHPS1组(P<0.05,图4)。
图4.

PHPS1对ROS通路相关蛋白的影响
Fig.4 Effect of PHPS1 on expressions of ROS pathway-related proteins in Ca9-22 cells. A: Western blotting of p-SHP-2, p-AMPK, HIF-1α, PD-L1, p-ERK1/2, p-STAT3, and VEGF protein expression in Ca9-22 cells in control and PHPS1 groups. B: Comparison of protein expression levels between control and PHPS1 groups (Mean±SD). **P<0.05.
2.5. Western blotting检测体外培养各组Ca9-22细胞中SHP-2、AMPK、HIF-1α、PD-L1蛋白表达情况
Western blotting结果显示,在低氧环境下,加入PHPS1的两组中SHP-2蛋白表达和未加入的两组没有显著差异,Control组和Control+Compound C组SHP-2蛋白表达高于PHPS1组和PHPS1+Compound C组(P<0.05)。加入AMPK抑制剂后,Control+Compound C组和PHPS1+Compound C组HIF-1α;PD-L1蛋白表达水平高于加入抑制剂前的Control组和PHPS1组(P<0.05)。Control+Compound C组和PHPS1+Compound C组AMPK蛋白表达含量低于加入抑制剂前的Control组和PHPS1组(P<0.05)。在加入AMPK抑制剂后对SHP-2磷酸化的抑制作用没有明显性改变;AMPK相对蛋白表达明显变弱。PHPS1对HIF-1α和PD-L1的抑制作用依然显著,但与加入AMPK抑制剂前相对比其对HIF-1α和PD-L1的抑制能力明显下降(P<0.05,图5)。
图5.

AMPK抑制剂对p-SHP-2、p-AMPK、HIF-1α、PD-L1蛋白表达情况的影响
Fig.5 Effect of AMPK inhibitor on expressions of p-SHP-2, p-AMPK, HIF-1α, and PD-L1 proteins. A: Western blotting of p-SHP-2, p-AMPK, HIF-1α, and PD-L1 protein expression in Ca9-22 cells in different groups. B: Comparison of the protein expression levels. **P<0.05.
2.6. Western blotting检测PHPS1通过对SHP-2和AMPK作用可促进PD-L1 S195磷酸化从而促进肿瘤细胞凋亡
Western blotting结果显示,在1%低氧环境下加入PHPS1后,PHPS1组caspase-3;caspase-8;PD-L1 S195磷酸化;Bax蛋白表达明显高于Control组(P<0.05)。在加入AMPK抑制剂后Control+Compound C组和PHPS1+Compound C组caspase-3;caspase-8;PD-L1 S195磷酸化;Bax蛋白表达水平低于Control组和PHPS1组(P<0.05,图6)。
图6.
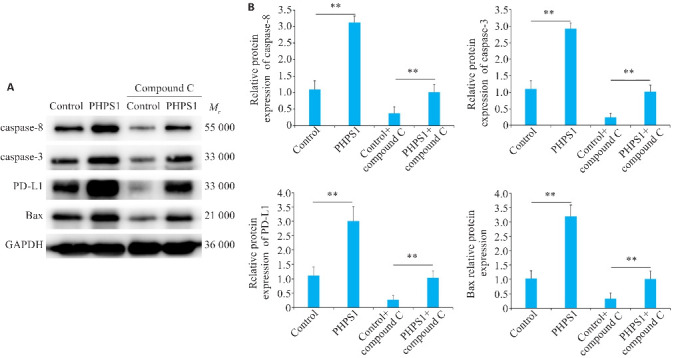
AMPK抑制剂对capase-3、caspase-8、PD-L1、BAX蛋白表达情况影响
Fig.6 Effect of AMPK inhibitor on expressions of caspase-3, caspase-8, PD-L1, and BAX proteins. A: Western blotting of caspase-3, caspase-8, PD-L1 S195 phosphorylation and Bax protein expressions in Ca9-22 cells in different groups. B: Comparison of the protein expression levels. **P<0.05.
通过与Grb2和SHP-2的相互作用,EGFR能够激活SHP-2的磷酸酶活性,AMPK对于细胞凋亡起着重要的调节作用,PHPS1可通过抑制SHP-2表达同时促进AMPK表达从而促进PD-L1 S195磷酸化,对肿瘤细胞凋亡有着正向作用(图7)。
图7.
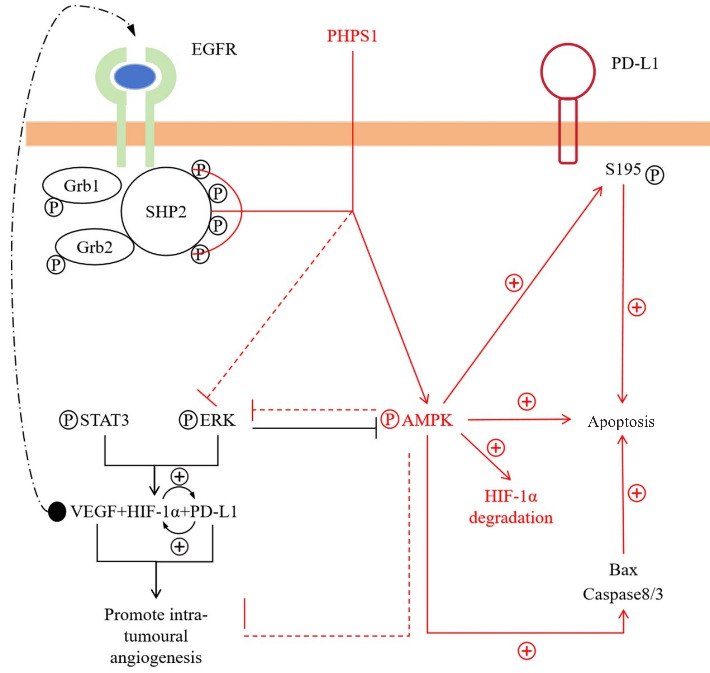
PHPS1靶向ROS/SHP-2/AMPK活性进而促进PD-L1丝氨酸磷酸化进而加速肿瘤凋亡的机制示意图
Fig.7 Schematic diagram illustrating the mechanism by which PHPS1 targets the ROS/SHP-2/AMPK pathway, thereby promoting serine phosphorylation of PD-L1 and accelerating tumor apoptosis.
3. 讨论
本研究探讨了PHPS1在OSCC中通过调控ROS/SHP-2/AMPK通路促进PD-L1丝氨酸磷酸化,进而加速肿瘤细胞凋亡的分子机制。这一机制的阐明不仅丰富了本研究对肿瘤信号传导路径的理解,还为潜在的临床治疗策略提供了新思路。
本研究利用Ca9-22细胞和HUVEC细胞的共培养系统,以及在裸鼠中的体内实验,系统性地评估了PHPS1在OSCC中的作用。PHPS1抑制了肿瘤的生长和血管新生。实验证明,PHPS1处理后的小鼠肿瘤体积明显减小,与不处理组相比差异有统计学意义。这一发现与Sobierajska等[16]关于肿瘤生长依赖于血管生成的理论相一致。此外,PHPS1对HUVEC细胞中管状结构形成的抑制也支持了其在阻碍肿瘤新生血管形成方面的潜力。在HE染色和血管新生实验中,本研究观察到PHPS1组血管生成的减少,这提示PHPS1可通过影响肿瘤微环境中的血管生成过程来抑制肿瘤的发展。通过Western blotting分析,检测了多种蛋白质的表达水平。PHPS1组SHP-2、HIF-1α、ERK2、STAT3和VEGF的表达下调,而AMPK的表达上调。这些分子的变化提示PHPS1可能通过多条信号通路进行协同作用,综合抑制肿瘤的生长和扩散。
SHP-2是细胞内一种非受体型蛋白酪氨酸磷酸酶,在细胞增殖、分化和生存信号中扮演着重要角色[17, 18]。本研究表明,PHPS1能够显著降低SHP-2的活性。EGFR信号具有促进细胞增殖和抑制细胞死亡的作用[19],因此SHP-2的下调可通过削弱EGFR信号传导来减少肿瘤的生长动能。另一方面,AMPK作为细胞的能量感应器,其激活通常反映细胞内能量状态的改变[20]。PHPS1对AMPK的上调作用可能通过多个路径促进细胞凋亡。这包括通过抑制mTOR通路、增强自噬、及激活细胞应激反应等机制[21]。此外,AMPK的活性增加也可影响下游PD-L1的丝氨酸磷酸化,从而间接改变肿瘤细胞的免疫特性[22]。PHPS1通过SHP-2/AMPK信号通路显著影响了PD-L1的磷酸化水平。之前有研究[23]指出PD-L1是免疫检查点抑制剂的靶点,过表达与肿瘤免疫逃逸机制有关。本研究首次揭示了PD-L1特定丝氨酸位点的磷酸化能够促进肿瘤细胞凋亡,这为其功能提供了新的维度。这也与Chen等[24]关于PD-L1在T细胞活化过程中的作用相辅相成。PD-L1在肿瘤免疫逃逸过程中起到关键作用,其在免疫细胞与肿瘤细胞间的相互作用中通过抑制T细胞活性来促进肿瘤生长[25]。本研究报告了PHPS1可通过促进AMPK磷酸化,进而促进PD-L1 S195磷酸化的现象。PD-L1磷酸化可能影响其在膜上的定位和功能,从而干扰其抑制免疫的能力,这为PHPS1在抑制肿瘤免疫逃逸中的潜在作用提供了分子基础。通过Western blotting分析,本研究观察到PHPS1处理显著增加了促凋亡蛋白如caspase-3、caspase-8和Bax的表达,这表明PHPS1在促进细胞凋亡中起到了重要作用。在1%低氧环境下,PHPS1处理组中PD-L1 S195磷酸化的增加进一步支持了其在诱导凋亡路径中的位置。Hanahan[26]等关于细胞凋亡逃逸的描述与本研究观察一致,强调了凋亡诱导作为抗肿瘤策略的重要性。
本研究的一个重要发现是PHPS1对血管生成的显著抑制效应。这种效应通过抑制STAT3/ERK通路进而降低VEGF的表达实现,VEGF是调控血管生成的关键因子[27, 28]。通过降低肿瘤组织中VEGF的水平,PHPS1能够有效减少血管生成,从而限制肿瘤的血液供应和营养摄取。另外,肿瘤微环境中的低氧条件(由HIF-1α调节)通常驱动侵袭性行为和转移能力的增强[29, 30]。PHPS1对HIF-1α表达的抑制进一步表明其可能通过改善肿瘤内的氧气和营养氛围来削弱肿瘤的发展潜能。
综上所述,PHPS1通过多重信号通路调控及影响肿瘤微环境,在OSCC治疗中展现出广阔的应用潜力。对其作用机制的深层次理解不仅能加速新型抗癌药物的开发,还能为目前癌症治疗方法的创新提供新的思路和方向。这一领域的持续研究必将为提高临床治疗效果、改善患者预后作出重要贡献。
基金资助
2023年度医学科学研究重点课题计划项目(20230157);2019年河北省政府资助临床医学优秀人才培养项目
参考文献
- 1. Renu K, Vinayagam S, Veeraraghavan VP, et al. Molecular crosstalk between the immunological mechanism of the tumor microenvironment and epithelial-mesenchymal transition in oral cancer[J]. Vaccines, 2022, 10(9): 1490. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2. Grégoire V, Grau C, Lapeyre M, et al. Target volume selection and delineation (T and N) for primary radiation treatment of oral cavity, oropharyngeal, hypopharyngeal and laryngeal squamous cell carcinoma[J]. Oral Oncol, 2018, 87: 131-7. [DOI] [PubMed] [Google Scholar]
- 3. Porceddu SV, Daniels C, Yom SS, et al. Head and neck cancer international group (HNCIG) consensus guidelines for the delivery of postoperative radiation therapy in complex cutaneous squamous cell carcinoma of the head and neck (cSCCHN)[J]. Int J Radiat Oncol Biol Phys, 2020, 107(4): 641-51. [DOI] [PubMed] [Google Scholar]
- 4. Woo SB. Oral epithelial dysplasia and premalignancy[J]. Head Neck Pathol, 2019, 13(3): 423-39. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. Bai YC, Boath J, White GR, et al. The balance between differentiation and terminal differentiation maintains oral epithelial homeostasis[J]. Cancers, 2021, 13(20): 5123. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. Niogret C, Birchmeier W, Guarda G. SHP-2 in lymphocytes' cytokine and inhibitory receptor signaling[J]. Front Immunol, 2019, 10: 2468. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. Wu XL, Guan SY, Lu YG, et al. Macrophage-derived SHP-2 inhibits the metastasis of colorectal cancer via Tie2-PI3K signals[J]. Oncol Res, 2023, 31(2): 125-39. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8. Feng GS. Shp2-mediated molecular signaling in control of embryonic stem cell self-renewal and differentiation[J]. Cell Res, 2007, 17(1): 37-41. [DOI] [PubMed] [Google Scholar]
- 9. Spaulding HR, Yan Z. AMPK and the adaptation to exercise[J]. Annu Rev Physiol, 2022, 84: 209-27. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. Ciccarese F, Zulato E, Indraccolo S. LKB1/AMPK pathway and drug response in cancer: a therapeutic perspective[J]. Oxid Med Cell Longev, 2019, 2019: 8730816. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. Hsu CC, Peng DN, Cai Z, et al. AMPK signaling and its targeting in cancer progression and treatment[J]. Semin Cancer Biol, 2022, 85: 52-68. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12. Karampitsakos T, Galaris A, Barbayianni I, et al. SH2 domain-containing phosphatase-SHP2 attenuates fibrotic responses through negative regulation of mitochondrial metabolism in lung fibroblasts[J]. Diagnostics, 2023, 13(6): 1166. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. Jiang JH, Hu BJ, Chung CS, et al. SHP2 inhibitor PHPS1 ameliorates acute kidney injury by Erk1/2-STAT3 signaling in a combined murine hemorrhage followed by septic challenge model[J]. Mol Med, 2020, 26(1): 89. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. Salem IH, Plante S, Gounni AS, et al. A shift in the IL-6/STAT3 signalling pathway imbalance towards the SHP2 pathway in severe asthma results in reduced proliferation process[J]. Cell Signal, 2018, 43: 47-54. [DOI] [PubMed] [Google Scholar]
- 15. Tan SZ, Li DP, Zhu X. Cancer immunotherapy: pros, cons and beyond[J]. Biomed Pharmacother, 2020, 124: 109821. [DOI] [PubMed] [Google Scholar]
- 16. Sobierajska K, Ciszewski WM, Sacewicz-Hofman I, et al. Endothelial cells in the tumor microenvironment[J]. Adv Exp Med Biol, 2020, 1234: 71-86. [DOI] [PubMed] [Google Scholar]
- 17. Xu ZY, Guo CY, Ye QL, et al. Endothelial deletion of SHP2 suppresses tumor angiogenesis and promotes vascular normalization[J]. Nat Commun, 2021, 12(1): 6310. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18. Chen H, Cresswell GM, Libring S, et al. Tumor cell-autonomous SHP2 contributes to immune suppression in metastatic breast cancer[J]. Cancer Res Commun, 2022, 2(10): 1104-18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. Zhao H, Ren XJ, Kong RY, et al. Auxilin regulates intestinal stem cell proliferation through EGFR[J]. Stem Cell Reports, 2022, 17(5): 1120-37. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20. Herzig S, Shaw RJ. AMPK: guardian of metabolism and mitochondrial homeostasis[J]. Nat Rev Mol Cell Biol, 2018, 19(2): 121-35. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21. Chun Y, Kim J. AMPK-mTOR signaling and cellular adaptations in hypoxia[J]. Int J Mol Sci, 2021, 22(18): 9765. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22. Cha JH, Yang WH, Xia WY, et al. Metformin promotes antitumor immunity via endoplasmic-reticulum-associated degradation of PD-L1[J]. Mol Cell, 2018, 71(4): 606-20. e7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23. Cha JH, Chan LC, Li CW, et al. Mechanisms controlling PD-L1 expression in cancer[J]. Mol Cell, 2019, 76(3): 359-70. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24. Chen DS, Mellman I. Elements of cancer immunity and the cancer-immune set point[J]. Nature, 2017, 541(7637): 321-30. [DOI] [PubMed] [Google Scholar]
- 25. Yao H, Lan J, Li CS, et al. Inhibiting PD-L1 palmitoylation enhances T-cell immune responses against tumours[J]. Nat Biomed Eng, 2019, 3(4): 306-17. [DOI] [PubMed] [Google Scholar]
- 26. Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646-74. [DOI] [PubMed] [Google Scholar]
- 27. Mabeta P, Steenkamp V. The VEGF/VEGFR axis revisited: implications for cancer therapy[J]. Int J Mol Sci, 2022, 23(24): 15585. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28. Wang ZQ, Zhao P, Tian KH, et al. TMEM9 promotes lung adenocarcinoma progression via activating the MEK/ERK/STAT3 pathway to induce VEGF expression[J]. Cell Death Dis, 2024, 15(4): 295. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29. Lee SH, Golinska M, Griffiths JR. HIF-1-independent mechanisms regulating metabolic adaptation in hypoxic cancer cells[J]. Cells, 2021, 10(9): 2371. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30. Ma S, Lu CC, Yang LY, et al. ANXA2 promotes esophageal cancer progression by activating MYC-HIF1A-VEGF axis[J]. J Exp Clin Cancer Res, 2018, 37(1): 183. [DOI] [PMC free article] [PubMed] [Google Scholar]


