Abstract
This 2023 Clinical Practice Guideline provides the biomedical definition of death based on permanent cessation of brain function that applies to all persons, as well as recommendations for death determination by circulatory criteria for potential organ donors and death determination by neurologic criteria for all mechanically ventilated patients regardless of organ donation potential. This Guideline is endorsed by the Canadian Critical Care Society, the Canadian Medical Association, the Canadian Association of Critical Care Nurses, Canadian Anesthesiologists’ Society, the Canadian Neurological Sciences Federation (representing the Canadian Neurological Society, Canadian Neurosurgical Society, Canadian Society of Clinical Neurophysiologists, Canadian Association of Child Neurology, Canadian Society of Neuroradiology, and Canadian Stroke Consortium), Canadian Blood Services, the Canadian Donation and Transplantation Research Program, the Canadian Association of Emergency Physicians, the Nurse Practitioners Association of Canada, and the Canadian Cardiovascular Critical Care Society.
Supplementary Information
The online version contains supplementary material available at 10.1007/s12630-023-02431-4.
Keywords: brain death, circulatory death, death, deceased organ donation, definition of death, neurologic death
Résumé
Ces Lignes directrices de pratique clinique 2023 Lignes directrices de pratique clinique dicale du décès basée sur l’arrêt permanent de la fonction cérébrale qui s’applique à toute personne, ainsi que des recommandations pour la détermination du décès par des critères circulatoires pour des donneurs d’organes potentiels et des recommandations pour la détermination du décès par des critères neurologiques pour tous les patients sous ventilation mécanique, indépendamment de leur potentiel de donneur d’organes. Les présentes Lignes directrices sont approuvées par la Société canadienne de soins intensifs, l’Association médicale canadienne, l’Association canadienne des infirmiers/infirmières en soins intensifs, la Société canadienne des anesthésiologistes, la Fédération des sciences neurologiques du Canada (représentant la Société canadienne de neurologie, la Société canadienne de neurochirurgie, la Société canadienne de neurophysiologie clinique, l’Association canadienne de neurologie pédiatrique, la Société canadienne de neuroradiologie et le Consortium neurovasculaire canadien), la Société canadienne du sang, le Programme de recherche en don et transplantation du Canada, l’Association canadienne des médecins d’urgence, l’Association des infirmières et infirmiers praticiens du Canada, et la Société canadienne de soins intensifs cardiovasculaires (CANCARE) et la Société canadienne de pédiatrie.
Mots-clés: mort cérébrale, décès cardiocirculatoire, décès, don d’organes après décès, définition du décès, décès neurologique
Executive summary
This Clinical Practice Guideline was funded by Health Canada and was developed as a partnership between the Canadian Critical Care Society, Canadian Blood Services, and the Canadian Medical Association. The project’s objectives were to develop a unified brain-based definition of death and update the criteria for its determination after devastating brain injury or circulatory arrest. The definition of death should apply to all persons in all circumstances. The scope for the criteria for determining death is limited to potential organ donors who will undergo death determination by circulatory criteria (DCC), in addition to all mechanically ventilated patients who will undergo death determination by neurologic criteria (DNC), regardless of organ donation potential. The Guideline applies to adults and children and replaces previously published Canadian recommendations. For the purposes of this Guideline, the pediatric age group refers to newborns (37 weeks corrected gestational age to less than two months), infants (two months to less than one year), and children (one year to less than 18 yr).
The reporting of this Guideline is in accordance with the Reporting Items for Practice Guidelines in Healthcare (RIGHT) Checklist.1 By design, the guideline development panel consisted of critical care nurses and physicians (adult and pediatric), radiologists, neurologists, neurointensivists, anesthesiologists, ethicists, lawyers, patient family, public partners, and methodologists with expertise in guideline development using Grading of Recommendations, Assessment, Development, and Evaluation (GRADE). Following a review of the literature, a draft definition was created by the project-steering committee and then reviewed and revised by the guideline panel using an adaptation of the Nominal Group Technique.2 To develop the criteria for determining death, a scoping review of international death determination guidelines was performed, from which the panel derived and prioritized clinical questions to be addressed. Identified clinical questions were divided into one of three general categories: actionable patients, intervention, comparator, outcomes (PICO) questions subjected to the comprehensive GRADE approach, good practice statements, and foundational medical principles. Seven working groups (definition of death, death determination by neurologic criteria, ancillary investigations, death determination by circulatory criteria, whole brain vs brainstem death, legal and ethical considerations, stakeholder engagement) reviewed all materials and developed guidance for practice accepted by all panel members with final endorsement by the steering committee. The definition of death, foundational medical principles, good practice statements, and recommendations for death determination by circulatory and neurologic criteria are summarized below. A detailed description of the background, methods, evidence summaries, and rationales can be found online in the full text. As per GRADE methodology, recommendations are labeled as “strong” or “weak.” The word “recommend” indicates strong recommendations and “suggest” indicates weak recommendations.
Definition of death
Death is defined as the permanent cessation of brain function (i.e., brain function is lost, will not resume spontaneously, and will not be restored through intervention) and is characterized by the complete absence of any form of consciousness (wakefulness and awareness) and the absence of brainstem reflexes, including the ability to breathe independently. This can result from cessation of blood circulation to the brain after circulatory arrest and/or from devastating brain injury. Residual brain cell activity that is not associated with the presence of consciousness or brainstem function does not preclude death determination (e.g., posterior pituitary antidiuretic hormone release, temperature control, or cellular-level neuronal activity). Death cannot be declared if there is any level of consciousness remaining and/or residual brainstem function regardless of how diminished.
Death determination by circulatory criteria (DCC)
Death determination by circulatory criteria is made based on the absence of extracranial circulation that leads to the permanent absence of intracranial (brain) circulation (foundational medical principle).
We recommend that continuous invasive arterial blood pressure monitoring is used to confirm of permanent cessation of circulation for patients who are potential organ donors undergoing DCC (strong recommendation, moderate certainty in evidence).
We suggest that continuous electrocardiogram (ECG) monitoring be used to confirm of permanent cessation of circulation in situations where the use of invasive arterial blood pressure monitoring is not possible for patients who are potential organ donors undergoing DCC (weak recommendation, moderate certainty in evidence).
We recommend that an arterial pulse pressure ≤ 5 mm Hg and within the error of measurement of clinical monitoring equipment is used to confirm permanent cessation of circulation for patients with an indwelling arterial cathether who are potential organ donors undergoing DCC (strong recommendation, very low certainty in evidence).
We recommend that a minimum of five minutes of observation time is used to confirm permanent cessation of circulation for patients who are potential organ donors undergoing controlled donation after DCC (strong recommendation, moderate certainty in evidence).
We recommend that a minimum of ten minutes of observation time is used to confirm permanent cessation of circulation for patients who are potential organ donors undergoing uncontrolled donation after DCC (strong recommendation, low certainty in evidence).
Death determination by neurologic criteria (DNC)
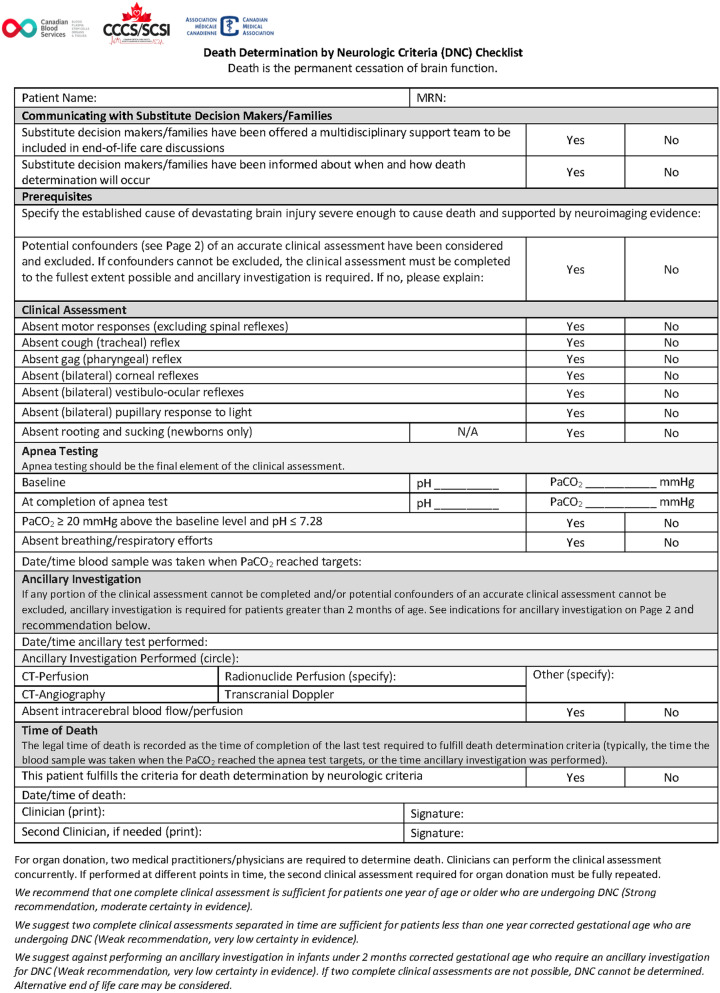
The following prerequisites must be met before conducting a valid clinical assessment for DNC: there must be an established cause of devastating brain injury severe enough to cause death and supported by neuroimaging evidence, and potential confounders of an accurate clinical assessment must have been considered and excluded (foundational medical principle).
Death determination by neurologic criteria is primarily a clinical assessment that requires all three of the following: 1) absence of consciousness shown by a lack of wakefulness and awareness in response to stimuli, 2) absence of brainstem function as shown by cranial nerve testing, and 3) absence of the capacity to breathe shown by formal apnea testing (foundational medical principle).
All components of the clinical assessment for DNC must be performed to the fullest extent possible. If a valid clinical assessment is fully performed, complete, and consistent with death, then this is sufficient for death determination. Ancillary investigation alone is not sufficient to determine death and will not override a clinical assessment that is inconsistent with death (foundational medical principle).
A clinical assessment is necessary but not sufficient for DNC in patients with isolated infratentorial brain injury without supratentorial involvement. Ancillary investigation is required to determine death in this scenario (foundational medical principle).
We suggest delaying the clinical assessment for at least 48 hr from the time of return of spontaneous circulation post-cardiac arrest for patients with hypoxic-ischemic injury who do not have imaging evidence consistent with devastating brain injury undergoing DNC (weak recommendation, low certainty in evidence).
We suggest ensuring a core body temperature of ≥ 36 °C for patients undergoing DNC (weak recommendation, very low certainty in evidence).
We suggest using either quantitative pupillometry or clinical pupil assessment for patients undergoing DNC (weak recommendation, low certainty in evidence).
We recommend against the addition of oculocephalic reflex testing to vestibulo-ocular reflex testing as part of the clinical assessment for patients undergoing DNC (strong recommendation, moderate certainty in evidence).
We recommend that one complete clinical assessment is sufficient for patients one year of age or older who are undergoing DNC (strong recommendation, moderate certainty in evidence).
We suggest two complete clinical assessments separated in time are sufficient for patients less than one-year corrected gestational age who are undergoing DNC (weak recommendation, very low certainty in evidence).
Apnea testing
We suggest using an arterial CO2 partial pressure (PaCO2) threshold of ≥ 60 mm Hg (and ≥ 20 mm Hg above baseline) when performing apnea testing for patients undergoing DNC (weak recommendation, very low certainty of evidence).
We suggest using either positive pressure (continuous positive airway pressure) or passive oxygenation when performing the apnea test for patients undergoing DNC (weak recommendation, low certainty in evidence).
We suggest using exogenously administered CO2 for patients undergoing DNC who have a high pre-test probability for cardiorespiratory instability that could prevent successful completion of the apnea test or who fail to complete the apnea test because of cardiorespiratory instability (weak recommendation, low certainty in evidence).
Ancillary investigation—adults
We suggest performing computed tomography (CT) perfusion, CT angiography, transcranial Doppler, or a radionuclide brain perfusion study employing a lipophilic radiopharmaceutical (with or without tomographic imaging) in adult patients who require ancillary investigation for DNC (weak recommendation, very low to moderate certainty in evidence).
We suggest against performing electroencephalography (EEG), brainstem auditory evoked potentials (BAEP), somatosensory evoked potentials (SSEP), a radionuclide brain flow only study employing a lipophobic radiopharmaceutical, four-vessel cerebral angiography, or magnetic resonance imaging in adult patients who require ancillary investigation for DNC (weak recommendation, very low certainty in evidence).
Ancillary investigation—pediatrics
We suggest performing a radionuclide brain perfusion study employing a lipophilic radiopharmaceutical such as 99mTc-hexamethyl propylenamine oxime (HMPAO) or equivalent (which incorporates both a flow and parenchymal phase) with or without tomographic imaging in pediatric patients who require ancillary investigation for DNC (weak recommendation, low certainty in evidence).
We suggest performing a radionuclide brain flow study employing a lipophobic radiopharmaceutical such as 99mTc-diethylene-triamine-pentaacetate acid (DTPA), 99mTc-glucoheptonate (GHA), 99mTc-technetium-pertechnetate, or equivalent (which incorporate only a flow phase) when a study employing a lipophilic radiopharmaceutical cannot be performed, in pediatric patients who require ancillary investigation for DNC (weak recommendation, low certainty in evidence).
We suggest against performing EEG, transcranial Doppler, BAEP, SSEP, computer tomography (CT) angiography, and four-vessel angiography in pediatric patients who require ancillary investigation for DNC (weak recommendation, very low certainty in evidence).
We suggest against performing ancillary investigation in infants under two months corrected gestational age who require ancillary investigation for DNC (weak recommendation, very low certainty in evidence).
Good practice statements
The following good practice statements are applicable to both DCC and DNC unless otherwise stated:
A multidisciplinary support team (e.g., nurses, social worker, psychologists, spiritual care advisors, religious officials, and donor coordinators where applicable) should be included in care discussions as early as possible when it is suspected that a patient may progress to death.
Any clinician participating in death determination must have the requisite skills, training, and knowledge of death determination processes and procedures.
Physicians supervising and interpreting radiologic ancillary investigation for DNC should be trained in neuroradiology with experience in the performance and interpretation of the specific examination being conducted. For CT angiography, radiologists should have required experience in using the correct protocol and scale. For CT perfusion, radiologists should have requisite training in performance and interpretation of this investigation.
Physicians supervising and interpreting radionuclide ancillary investigation for DNC should be residency trained in nuclear medicine with experience in the performance and interpretation of the specific examination being conducted.
In all cases of potential organ donation, clinicians determining death must not have an association or active involvement in transplant procedures, organ allocation, or care of the intended transplant recipients.
Where appropriate, assessment for DNC should be made in all persons with devastating brain injuries who are believed to meet these criteria, regardless of organ donation potential.
The cause of devastating brain injury should be supported by neuroimaging evidence consistent with the established cause.
A standardized checklist should be used for death determination and documentation.
Fulfillment of all phases of death determination must be clearly documented by the most responsible physician in the patient’s medical record.
Physicians supervising and interpreting transcranial Doppler testing for DNC should be adequately trained in neurosonography with experience in the performance and interpretation of the specific examination being conducted.
Communicating with substitute decision makers/family members
Given substitute decision makers/families and the public may struggle with understanding DNC,3,4 much of the information below is related to DNC. In relation to DCC, clinicians should help families to be prepared for the time-sensitive process of determining death and the observation period that is focused on confirmation of permanent cessation of circulation.
Consent for DNC testing should neither be required nor requested. Nevertheless, clinicians can facilitate family members understanding and acceptance of DNC, which may also improve bereavement outcomes. Specific considerations include 1) using clear and consistent language for DNC, 2) preparing substitute decision makers/families early for what typically happens during and following DNC, 3) acknowledging that what substitute decision makers/families see (e.g., the patient’s chest rising and falling) and feel (e.g., patient’s warm body temperature) may make it challenging to understand DNC, 4) anticipating and clarifying the meaning of spinal-mediated motor responses, 5) repeating information (e.g., over several encounters) to improve substitute decision makers’/families’ comprehension, 6) using multimodal communication methods, (e.g., offer to show images when possible and/or provide written information, such as family-focused information aids), 7) inviting substitute decision makers/families to witness the clinical assessment of DNC, and 8) providing opportunities for family to perform rituals that accompany transitions from life to death.
There are legitimate reasons to allow for reasonable accommodation of substitute decision maker/family resistance to DNC.5 The resistance to DNC may be framed in terms of legal rights like religious freedom, or it may relate to factors like shock, grief, or misunderstanding or mistrust of death determination. It is not advisable to exempt patients with objecting substitute decision makers/families from death determination procedures given the need for clinicians to be able to assess the vital status of patients in their care. Nevertheless, in exceptional circumstances, delaying the removal of ventilation and other somatic supports after DNC for a relatively short period of time (i.e., a matter of days) may be considered.
Key differences from previous Canadian recommendations
This Guideline will result in changes to Canadian practice in several key areas:
Definition of death
A single definition of death based on the permanent cessation of brain function.
For death determination by circulatory criteria
-
2.
The use of continuous invasive arterial blood pressure monitoring and an arterial pulse pressure ≤ 5 mm Hg are required to confirm permanent cessation of circulation. ECG may be considered in circumstances where an indwelling arterial cathether is not reliable or not inserted. Other noninvasive monitoring devices should not be used.
-
3.
A ten-minute observation time for confirmation of permanent cessation of circulation in patients undergoing uncontrolled donation after DCC.
-
4.
Permanent cessation of intracranial (brain) circulation must be maintained should any postmortem organ donation interventions be deployed.
For death determination by neurologic criteria
-
5.
The cause of devastating brain injury should be supported by neuroimaging evidence consistent with the established cause.
-
6.
A 48-hr delay after return of spontaneous circulation post-cardiac arrest in patients with hypoxic-ischemic injury who do not have imaging evidence consistent with devastating brain injury before conducting the clinical assessment for DNC.
-
7.
Removal of the oculocephalic reflex as part of the clinical assessment for DNC.
-
8.
Core body temperature of ≥ 36 °C (rather than ≥ 34 °C) before performing the clinical assessment for DNC.
-
9.
Apnea testing recommendations that include passive oxygenation, continuous positive airway pressure, or exogenous CO2 administration.
-
10.
Infratentorial brain injury without significant supratentorial involvements does not fulfill DNC criteria and requires ancillary investigation.
-
11.
Adult ancillary investigation recommendations now include transcranial Doppler, CT perfusion, CT angiography, or a radionuclide lipophilic perfusion study. Four-vessel angiography is no longer recommended.
-
12.
Pediatric ancillary investigation favors radionuclide lipophilic perfusion study and if unavailable, a lipophobic radionuclide flow study. Four-vessel angiography is no longer recommended.
-
13.
Ancillary investigation is no longer recommended for infants less than two months corrected gestational age.
-
14.
A minimum of 24 hr between clinical assessment for infants less than two months of age is advised. The time interval may be extended according to physician judgment.
Conclusion
This Guideline provides a biomedical definition of death based on permanent cessation of brain function and defines terms integral to its use. It provides recommendations for DNC for all mechanically ventilated patients as well as recommendations for DCC for potential organ donors. Strategies and approaches for interacting and communicating with substitute decision makers/families are also provided. This Guideline is intended to encourage uniformity and improve clarity and confidence in death determination practices in Canada.
Glossary of terms/abbreviations
| Accepted medical practice | Standards of medical practice that are based on credible scientific evidence published in peer-reviewed, medical literature generally recognized by the relevant medical community. Could include, but is not limited to, physician specialty society recommendations or guidelines, the views of physicians practicing in the relevant clinical area, and other relevant factors. |
| Ancillary investigation | In DNC, an ancillary investigation is a test of brain blood flow and perfusion as an alternate test to the clinical assessment that otherwise, for any reason, cannot be conducted or is unreliable (confounding conditions cannot be resolved, or the full clinical assessment cannot be performed). |
| Autoresuscitation | The unassisted resumption of spontaneous circulation. |
| Brain death | Refers to DNC defined as the permanent cessation of brain function and characterized by the absence of consciousness, brainstem reflexes, and the ability to breathe independently. |
| Brain function | The brain’s vital functions include consciousness and behavior, coordination and control of movement, and the ability to breathe. |
| Brainstem function | Refers to brainstem reflexes including the capacity to breathe without mechanical support and the generation of consciousness arising from the reticular activating system. |
| Clinical assessment |
Variably referred to as clinical examination or physical examination. A direct, measurable observation or examination of the patient. A clinical assessment for DNC requires all of the following: - absence of consciousness shown by a lack of arousal and awareness in response to external stimuli, and - absence of brainstem function as shown by cranial nerve testing, and - absence of the capacity to breathe shown by formal apnea testing The clinical assessment must be completed to the fullest extent possible (including bilateral motor responses, bilateral brainstem reflexes, and apnea testing), meaning all aspects of the assessment must be completed unless they are unable to be performed because of a pre-existing condition (e.g., anophthalmia), acquired conditions (e.g., cervical spine injury), or safety (e.g., instability precluding conduct or completion of apnea testing). The clinical assessment for death determination by circulatory criteria requires tests showing the permanent cessation of circulation to the brain. |
| Confounding conditions | Circumstances during which a diagnostic test or clinical assessment may become unreliable and require repetition over time or application of an ancillary investigation. |
| Consciousness | Awareness, including capacity for sensory perception or coordinated responsiveness to the external environment, and wakefulness. |
| Death declaration | The point at which a health care professional, having determined that an individual is dead, formally states this finding and confirms the legally stated time of death. |
| Death determination | The processes and tests required to determine death in accordance with accepted medical practice as described in national clinical practice guidelines in Canada. |
| Death determination by circulatory criteria (DCC) | The process of determining death of an individual based on circulatory criteria. |
| Death determination by neurologic criteria (DNC) | The process of determining death of an individual based on neurologic criteria. |
| Devastating brain injury | Brain injury (trauma, subarachnoid hemorrhage, stroke, hypoxic injury, etc.) that is assessed as an immediate threat to life or incompatible with good functional recovery, no effective treatments remain and where early limitation or withdrawal of therapy is being considered with an emphasis on end-of-life care. |
| Donation after death determination by circulatory criteria (DCD) |
Refers to the recovery of organs for transplantation from individuals after DCC. Previously referred to as donation after cardiac death, donation after cardiocirculatory death, nonheart beating organ donation, donation after circulatory determination of death, and donation after cardiorespiratory arrest. The following categories of the modified Maastricht Classification for organ donation are considered in this Guideline: • Category II: uncontrolled donation after DCC where there has been a sudden, unexpected irreversible cardiac arrest with unsuccessful resuscitation. This can occur in or out of hospital; • Category III: controlled donation after DCC following planned withdrawal of life-sustaining measures (WLSM) where cardiac arrest is anticipated; • Category V: controlled donation after DCC following medical assistance in dying where cardiac arrest is anticipated See complete list of Maastricht categories for further details on controlled and uncontrolled DCD (Thuong M, Ruiz A, Evrard P, et al. New classification of donation after circulatory death donors definitions and terminology. Transpl Int 2016; 29: 749). |
| Foundational medical principles (FMPs) | Unlike existing actionable statements, FMPs are statements that reflect stakeholders’ collective understanding of principles that form the underpinnings for the medical, legal, and ethical frameworks of death determination in Canada. These statements were meant to describe fundamental aspects of death determination that were necessary and based on historical and evolving concepts and practices rather than on formal assessment of an evidence base. |
| Infratentorial brain injury | A brainstem and/or cerebellar lesion due to infratentorial pathology such as ischemic or hemorrhagic stroke. |
| Isolated brainstem death | An infratentorial brain injury for which DNC are fulfilled, although there may be ancillary evidence of preserved supratentorial/cerebral blood flow, perfusion, or neurophysiologic function. |
| Observation time |
The period of time after cessation of circulation that is required to ensure the cessation of circulation is permanent for DCC. Variably referred to as the “hands-off” or “no-touch” period. |
| Permanent | Pertaining to a function or condition that will not return to its previous state. In the context of death determination, refers to loss of a function that will not resume spontaneously (on its own) and will not be restored through intervention. |
| Prerequisites | Patient-related clinical, laboratory, or imaging requirements that must be fulfilled prior to application of diagnostic tests or conducting a clinical assessment for death determination. |
| Somatic support |
Interventions used to maintain function of the body and organs excluding the brain, after DNC. Variably referred to as mechanical, physiologic, or organ support. |
| Spinal motor reflexes | Spontaneous or reflex motor responses/movements that are based on spinal cord function alone without any transmission to and from the brainstem and cerebrum. May include plantar flexor/extensor responses, triple flexion response, abdominal reflex, cremasteric reflex, tonic-neck reflexes, isolated jerks of the upper extremities, unilateral extension-pronation movements, asymmetric ophisthotonic posturing of trunk, undulating toe flexion, myoclonus, respiratory-like movements, quadricep contraction, and leg movements mimicking periodic leg movement. |
| Withdrawal of life-sustaining measures |
In the context of end-of-life care, a consensual decision to discontinue treatment that would otherwise prolong life without reversing the underlying life-threatening condition. The measures most frequently withdrawn are mechanical ventilation, inotropic/vasopressor support of hemodynamic function, and mechanical circulatory support. During this process, comfort measures for the dying patient are the focus. Variably referred to as withdrawal of life-sustaining therapies/treatment or withdrawal of life-sustaining interventions. |
| Whole brain death | Determination of death based on cessation of brainstem function requiring demonstration of brainstem and cerebral involvement. |
While respectfully acknowledging that there are many different philosophical, religious, and cultural beliefs related to the concept of death, health care professionals require a legally recognized biomedical definition of death. The criteria for death determination are based on measurable biological indicators and procedures that must be performed to satisfy the definition. While the determination of death should be universally accurate and timely in all cases, criteria are especially critical for ensuring the legal and ethical practice of deceased organ donation where the immediate consequence of death determination is organ recovery.6
In Canada, definitions of death may be found in provincial/territorial statutes and vary from province to province.7 When a definition is included within this legislation, death is either defined as cessation of brain function, or includes brain death. Otherwise, it is left to the common law definition adopted by judges, who have so far accepted cessation of brain or cardiorespiratory function. In the majority of provinces, criteria for death determination in the context of organ donation are delegated by statutes to accepted medical practice. Previous Canadian death determination guidelines that form the basis of accepted medical practice describe death as arising after cessation of brain function (previously referred to as the neurologic determination of death or brain death),8 circulatory function (previously referred to as cardiocirculatory death, or circulatory death)9 and both circulatory and brain function.10 Henceforth, this historical nomenclature will be replaced by death determination by neurologic criteria (DNC) and death determination by circulatory criteria (DCC).
Medical, legal, and ethical issues have emerged, all of which collectively provided strong impetus for review and update of the guidelines, including
Development of international standards to harmonize international practices for DNC11
Advances in knowledge and emerging evidence related to physiology of the dying process after withdrawal of life-sustaining measures (WLSM) for DCC12 and the use of ancillary investigation for DNC
Recent legal cases in Ontario where families challenged DNC and the accepted medical guidelines13,14
Advances in technological support of organ function to support life prior to death, or preserve organs after death.15
In response, Health Canada funded a project entitled, “A Brain-Based Definition of Death and Criteria for its Determination After Arrest of Circulation or Neurologic Function in Canada,” a partnership between Canadian Blood Services, the Canadian Critical Care Society, and the Canadian Medical Association. The project’s objectives were to develop a unified brain-based definition of death and update the criteria for its determination after devastating brain injury or circulatory arrest.
The biomedical definition of death and the medical procedures for death determination by neurologic and circulatory criteria should be consistent within provinces/territories and across the country. Variation on this matter of fundamental medical and legal significance may lead to incongruencies, confusion, and mistrust. A brain-based definition of death is consistent with the approach recommended by the Law Reform Commission of Canada in 198116 (and endorsed at that time by the medical community) to define all death in terms of the cessation of brain function, and to allow for that state to be determined by neurologic or circulatory criteria.6,7 All Canadian jurisdictions already accept death defined in neurologic terms. A brain-based definition of death further refines the medical approach by defining death solely based on the cessation of brain function and offers clear procedures for determining death by neurologic and circulatory criteria.
The updated recommendations outlined for Canadian death determination practice in this Guideline were created following a 16-year gap for the adult DNC1 and organ donation after DCC2 recommendations and five-year gap in pediatric organ donation after DCC recommendations.10 In the interim, not only it has the volume of evidence available to inform recommendations increased, but, since 2006, so has the required rigor for the process of guideline development.
This Guideline replaces the previously published Canadian recommendations, identified below:
2006 Severe brain injury to neurologic determination of death: Canadian forum recommendations8 (complete document)
2006 National recommendations for donation after cardiocirculatory death in Canada: Donation after cardiocirculatory death in Canada9 (sections: 2. Death and the minimum criteria to proceed with organ donation; 5.1 g Donation-based interventions)
2017 Canadian guidelines for controlled pediatric donation after circulatory determination of death10 (section: Minimum standards required for death determination in pediatric donation after DCC).
It is expected that the clinical practice recommendations, developed by a multidisciplinary guideline development panel that included patient-family partners and the public, based on contemporary medical and legal understandings of the biological basis of death and endorsed by multiple Canadian health care organizations, will encourage uniformity, and improve clarity and confidence in death determination practices across Canada.
In addition to this Clinical Practice Guideline, the evidence reviews used to inform this project are included in the Special Issue (Table 1). Several supporting documents are also contained in the Electronic Supplementary Material (ESM) (Table 2).
Table 1.
Titles of articles included in the Journal’s Special Issue on Death Determination in Canada
| Article title | Article type |
|---|---|
| 1. A brain-based definition of death and criteria for its determination after arrest of circulation or neurologic function in Canada: a clinical practice guideline (this article) | Special Article |
| 2. Editors’ Note: The evolution of critical care content in the Journal and a “special” Special Issue | Editors’ Note |
| 3. Answering global challenges to the determination of death: consensus-building leadership from Canada (Guest Editors)61 | Editorial |
| 4. An updated practice guideline for death determination: one giant leap for the field led by Canada | Editorial |
| Definition of death | |
| 5. Rationale for revisions to the definition of death and criteria for its determination in Canada6 | Special Article |
| 6. Legal considerations for the definition of death in the 2023 Canadian Brain-Based Definition of Death Clinical Practice Guideline7 | Review Article |
| 7. Balancing values: implications of a brain-based definition of death for pluralism in Canada62 | Reflections |
| 8. Does infratentorial brain injury fulfill death determination by neurologic criteria in Canada?31 | Review Article |
| 9. What does “brainstem death” mean? A review of international protocols26 | Report of Original Investigation |
| 10. The reticular activating system: a narrative review of discovery, evolving understanding, and relevance to current formulations of brain death30 | Review Article |
| Criteria for death determination | |
| 11. Consent for death determination by neurologic criteria in Canada: an analysis of legal and ethical authorities, and consensus-based working group recommendations32 | Special Article |
| 12. Monitoring cessation of circulation for death determination by circulatory criteria: a systematic review40 | Review Article |
| 13. Brain-based arterial pulse pressure threshold for death determination: a systematic review41 | Review Article |
| 14. Autoresuscitation after circulatory arrest: an updated systematic review42 | Review Article |
| 15. Variability in criteria for death determination in the intensive care unit63 | Report of Original Investigation |
| 16. Potential pharmacological confounders in the setting of death determined by neurologic criteria: a narrative review44 | Review Article |
| 17. Ancillary investigations for death determination in infants and children: a systematic review and meta-analysis47 | Review Article |
| 18. Radionuclide scintigraphy as an ancillary test for death determination in infants under two months of age54 | Correspondence |
| 19. Diagnostic accuracy of ancillary tests for death determination by neurologic criteria: a systematic review and meta-analysis46 | Review Article |
| 20. Ancillary radionuclide perfusion studies in the determination of death by neurologic criteria: methods, interpretation, lexicon—a user guide for the clinician51 | Review Article |
| Communicating with substitute decision makers/families | |
| 21. Death determination by neurologic criteria—what do families understand?3 | Report of Original Investigation |
| 22. When is a person dead? The Canadian public’s understanding of death and death determination: a nationwide survey4 | Report of Original Investigation |
| 23. Navigating disagreement and conflict in the context of a brain-based definition of death5 | Review Article |
| 24. Trust and conflict in death determination—reflections on the legacy of Taquisha McKitty64 | Reflections |
| Future research | |
| 25. Knowledge gaps in the definition and determination of death58 | Reflections |
| 26. Delayed recovery from severe refractory intracranial hypertension due to expansion of skin and pericranium stretch after decompressive craniectomy | Case Report |
| 27. Implications of the updated Canadian Death Determination Guidelines for organ donation interventions that restore circulation after determination of death by circulatory criteria65 | Reflections |
| 28. Nontherapeutic research with imminently dying and recently deceased study populations: addressing practice and ethical challenges39 | Reflections |
Table 2.
Supporting documents available as eAppendices in the Electronic Supplementary Material
|
1. Development panel 2. Scoping review 3. Definitions of death in national and international guidelines and legislation 4. Search strategies 5. Guideline development methodology 6. Spiritual care professionals discussion report 7. Evidence summaries and recommendation rationales: death determination by circulatory criteria 8. Managing pharmacological confounders in death determination by neurologic criteria 9. Clinical assessment for death determination by neurologic criteria 10. Evidence summaries and recommendation rationales: death determination by neurologic criteria 11. Knowledge gaps |
Scope
The scope of this Clinical Practice Guideline is limited to the criteria for death determination in the following circumstances:
Potential organ donors who will undergo DCC, including the following categories of the modified Maastricht Classification for organ donation:17
-
‐
Category II: uncontrolled donation after DCC where there has been a sudden, unexpected irreversible cardiac arrest with unsuccessful resuscitation. This can occur in or out of hospital;
-
‐
Category III: controlled donation after DCC following planned WLSM where cardiac arrest is anticipated;
-
‐
Category V: controlled donation after DCC following medical assistance in dying (MAID) where cardiac arrest is anticipated;
Mechanically ventilated patients who will undergo DNC, regardless of organ donation potential.
For the purposes of this Guideline, the pediatric age group refers to newborns (from 37 weeks corrected gestational age to less than two months), infants (from two months to less than one year), and children (from one year to less than 18 yr).
The Guideline has been developed for use by health care professionals, hospital administrators, health care professional societies, organ donation organizations, and policy makers involved in death determination. Its implementation will impact patients, families, and the general public.
The definition of death should apply to all persons in all circumstances. It is acknowledged that the vast majority of deaths occur in people not eligible for organ donation, after circulatory arrest in both prehospital and hospital settings, as well as long-term care facilities and at home. Due to the aforementioned scope and depth of this project, it was not feasible to engage with professional communities who determine death after circulatory arrest external to organ donation. Nevertheless, it is recognized that this Guideline, given its rigorous development process, may influence best practices for determining death in all circumstances, including those beyond the scope of this initiative.
Methods
The reporting of this Guideline conforms with the RIGHT checklist.1 The guideline development panel consisted of critical care nurses and physicians (adult and pediatric), radiologists, neurologists, neurointensivists, anesthesiologists, ethicists, lawyers, patient family and public partners, and methodologists with expertise in guideline development using GRADE methodology.18 The panel members were selected by the steering committee and invited to participate based on specialty, expertise, professional society representation, gender, geography, and racial diversity. A complete list of guideline development panel members is available in ESM eAppendix 1.
We divided panel members into seven working groups: 1) definition of death, 2) death determination by circulatory criteria, 3) death determination by neurologic criteria, 4) ancillary investigations, 5) whole brain vs brainstem death, 6) legal and ethical considerations, and 7) stakeholder engagement.
Definition of death
To develop the definition of death, the definitions of death in national and international death determination guidelines were reviewed in Ovid MEDLINE (1946 to 5 June 2020) on 6 June 2020, using controlled vocabulary (MeSH) and text words for the following concepts: death (including neurologic and circulatory death), definitions, and guidelines. Additional searches were conducted in international guideline sources from the Canadian Agency for Drugs and Technologies in Health (CADTH) Grey Matters checklist as well as professional society websites used in a previous review of death determination guidelines for circulatory arrest.19 Results were limited to English and French records published since 2003. Additional searches of gray literature, including professional society websites and legal databases were also conducted. Full details are available in ESM eAppendices 2 and 3.
A draft definition was created by the project-steering committee and reviewed and revised by the guideline development group using an adaptation of the nominal group technique.2 Guideline group members were divided into small groups to discuss the proposed death definition, concepts, and terminology. Opinions and proposed changes generated by the groups were discussed in plenary sessions. Revisions were made by the definition of death working group. Further feedback was obtained from public focus groups, for which a 90-sec medically illustrated educational video1 was produced in English and French to explain the concept of a brain-based definition of death. Subsequent edits were made after further reviews and consensus was achieved by the guideline development panel.
Foundational medical principles, recommendations, and good practice statements
The panel derived and prioritized clinical questions to be addressed as part of the Guideline after a review of documents retrieved by a systematic scoping review of death determination guidelines (see ESM eAppendix 2). Identified clinical questions were divided into one of three general categories: actionable PICO questions, good practice statements, and foundational medical principles. Actionable PICOs were subjected to the comprehensive GRADE approach,20 while good practice statements are well-recognized constructs that are used for recommendations and are not amenable to formal ratings of quality of evidence.21 To provide clinical guidance addressing specific clinical questions that are informed by medical, legal, and ethical considerations outside the scope of traditional clinical practice guideline development, we created a new form of statement called foundational medical principles (FMPs). Unlike existing actionable statements, these statements reflect stakeholders’ collective understanding of principles that form the underpinnings for the medical, legal, and ethical frameworks of death determination in Canada. These statements were meant to describe fundamental aspects of death determination that were necessary and based on historical and evolving concepts and practices rather than on formal assessment of an evidence base. Foundational medical principles were proposed by members of the guideline development steering committee, then iteratively reviewed, and approved by all members of the guideline panel. We incorporated patient partner input at each step.
Panel members rated outcomes of interest based on perceived importance to patients for clinical decision-making on a scale of 1 (not important) to 9 (critically important) and worked with an information specialist to systematically review the literature for studies examining each of the 14 PICO questions. For the neurologic and circulatory PICO questions, we searched MEDLINE Ovid, EMBASE Ovid, Cochrane Central Register of Controlled Trials, and Science Citation Index Expanded via Web of Science from inception to present. For the ancillary investigation questions, searches were conducted according to the PRESS Peer guidelines on 5 February 2022, in the databases above (excluding Science Citation Index) and in CINAHL Ebsco (see Search Strategies in ESM eAppendix 4 for full details of all search strategies).
For each PICO question, two investigators screened titles and abstracts and subsequently full-text manuscripts independently and in duplicate using Covidence® (Veritas Health Innovation Ltd., Melbourne, VIC, Australia) and insightScope® (Ottawa, ON, Canada) software. Similarly, multiple investigators performed data extraction independently and in duplicate for each included study. We generated an evidence profile for each of the PICO questions.22 Where necessary, additional evidence profiles were created to summarize the literature specific to the subgroup populations being considered. Following GRADE methodology, certainty in each outcome was rated as high, moderate, low, or very low.23
Recommendations were generated using the GRADE Evidence-to-Decision framework, which considers the certainty in the evidence, the balance between desirable and undesirable effects, patient values and preferences, resource use, health equity, acceptability, and feasibility.24 We designated recommendations as strong (using the phrasing “we recommend”) or weak (using the phrasing “we suggest”).25 Table 3 describes the implications of the strength of a recommendation.
Table 3.
Implications of strong and weak recommendations for different users of guidelines From Rochwerg et al.66 that was modified from Guyatt GH et al.20
| Strong recommendation | Weak recommendation | |
|---|---|---|
| For patients | Most individuals in this situation would want the recommended course of action and only a small proportion would not. | The majority of individuals in this situation would want the suggested course of action, but many would not. |
| For clinicians | Most individuals should receive the recommended course of action. Adherence to this recommendation according to the Guideline could be used as a quality criterion or performance indicator. Formal decision aids are not likely to be needed to help individuals make decisions consistent with their values and preferences. | Recognize that different choices will be appropriate for different patients, and that you must help each patient arrive at a management decision consistent with their values and preferences. Decision aids may well be useful helping individuals making decisions consistent with their values and preferences. Clinicians should expect to spend more time with patients when working towards a decision. |
| For policy makers | The recommendation can be adapted as policy in most situations including for the use as performance indicators. | Policy making will require substantial debates and involvement of many stakeholders. Policies are also more likely to vary between regions. Performance indicators would have to focus on the fact that adequate deliberation about the management options has taken place. |
The final wording of recommendations, good practice statements, and FMPs was reviewed and approved by all panel members (see ESM eAppendix 5 for a complete description of the guideline methodology). In total, five FMPs, 20 recommendations (six strong, 14 weak), and nine good practice statements were generated (Table 4).
Table 4.
Clinical Practice Guideline recommendations
| Foundational medical principles | |
| DCC is made based on the absence of extracranial circulation that leads to the permanent absence of intracranial (brain) circulation. | |
| The following prerequisites must be met before conducting a valid clinical assessment for DNC: there must be an established cause of devastating brain injury severe enough to cause death and supported by neuroimaging evidence, and potential confounders of an accurate clinical assessment must have been considered and excluded. | |
| DNC is primarily a clinical assessment that requires all three of the following: 1) absence of consciousness shown by a lack of wakefulness and awareness in response to stimuli, 2) absence of brainstem function as shown by cranial nerve testing, and 3) absence of the capacity to breathe shown by formal apnea testing. | |
| All components of the clinical assessment for DNC must be performed to the fullest extent possible. If a valid clinical assessment is fully performed, complete, and consistent with death, then this is sufficient for death determination. Ancillary investigation alone is not sufficient to determine death and will not override a clinical assessment that is inconsistent with death. | |
| A clinical assessment is necessary but not sufficient for DNC in patients with isolated infratentorial brain injury without supratentorial involvement. Ancillary investigation is required to determine death in this scenario. | |
| Death determination by circulatory criteria | |
| We recommend that continuous invasive arterial blood pressure monitoring be used to confirm permanent cessation of circulation for patients who are potential organ donors undergoing DCC (strong recommendation, moderate certainty in evidence). | |
| We suggest that continuous electrocardiogram monitoring be used to confirm of permanent cessation of circulation in situations where the use of invasive arterial blood pressure monitoring is not possible for patients who are potential organ donors undergoing DCC (weak recommendation, moderate certainty in evidence). | |
| We recommend that an arterial pulse pressure of ≤ 5 mm Hg and within the error of measurement of clinical monitoring equipment be used to confirm permanent cessation of circulation for patients with an indwelling arterial cathether who are potential organ donors undergoing DCC (strong recommendation, very low certainty in evidence). | |
| We recommend a that minimum of five minutes observation be used to confirm permanent cessation of circulation for patients who are potential organ donors undergoing controlled donation after DCC (strong recommendation, moderate certainty in evidence). | |
| We recommend that a minimum of ten minutes of observation time be used to confirm permanent cessation of circulation for patients who are potential organ donors undergoing uncontrolled donation after DCC (strong recommendation, low certainty in evidence). | |
| Death determination by neurologic criteria | |
| We suggest delaying the clinical assessment for at least 48 hr from the time of return of spontaneous circulation post-cardiac arrest for patients with hypoxic-ischemic injury who do not have imaging evidence consistent with devastating brain injury undergoing DNC (weak recommendation, low certainty in evidence). | |
| We suggest ensuring a core body temperature of ≥ 36 °C for patients undergoing DNC (weak recommendation, very low certainty in evidence). | |
| We suggest using either quantitative pupillometry or clinical pupil assessment for patients undergoing DNC (weak recommendation, low certainty in evidence). | |
| We recommend against the addition of oculocephalic reflex testing to vestibulo-ocular reflex testing as part of the clinical assessment for patients undergoing DNC (strong recommendation, moderate certainty in evidence). | |
| We recommend that one complete clinical assessment is sufficient for patients one year of age or older who are undergoing DNC (strong recommendation, moderate certainty in evidence). | |
| We suggest that two complete clinical assessments separated in time are sufficient for patients less than one-year corrected gestational age who are undergoing DNC (weak recommendation, very low certainty in evidence). | |
| Apnea testing | |
| We suggest using a PaCO2 threshold of ≥ 60 mm Hg (and ≥ 20 mm Hg above baseline) when performing apnea testing for patients undergoing DNC (weak recommendation, very low certainty of evidence). | |
| We suggest using either positive pressure (continuous positive airway pressure) or passive oxygenation when performing the apnea test for patients undergoing DNC (weak recommendation, low certainty in evidence). | |
| We suggest using exogenously administered CO2 for patients undergoing DNC who have a high pre-test probability for cardiorespiratory instability that could prevent successful completion of the apnea test or who fail to complete the apnea test because of cardiorespiratory instability (weak recommendation, low certainty in evidence). | |
| Ancillary investigation—adults | |
| We suggest performing CT perfusion, CT angiography, transcranial Doppler, or a radionuclide brain perfusion study employing a lipophilic radiopharmaceutical (with or without tomographic imaging) in adult patients who require ancillary investigation for DNC (weak recommendation, very low to moderate certainty in evidence). | |
| We suggest against performing EEG, BAEP, SSEP, a radionuclide brain flow only study employing a lipophobic radiopharmaceutical, four-vessel cerebral angiography, or magnetic resonance imaging in adult patients who require ancillary investigation for DNC (weak recommendation, very low certainty in evidence). | |
| Ancillary investigation—pediatrics | |
| We suggest performing a radionuclide brain perfusion study employing a lipophilic radiopharmaceutical such as 99mTc-HMPAO or equivalent (which incorporates both a flow and parenchymal phase) with or without tomographic imaging in pediatric patients who require ancillary investigation for DNC (weak recommendation, low certainty in evidence). | |
| We suggest performing a radionuclide brain perfusion study employing a lipophobic radiopharmaceutical such as 99mTc-DTPA, 99mTc-GHA, 99mTc-pertechnetate or equivalent (which incorporate only a flow phase) when a study employing a lipophilic radiopharmaceutical cannot be performed in pediatric patients who require ancillary investigation for DNC (weak recommendation, low certainty in evidence). | |
| We suggest against performing EEG, transcranial Doppler, BAEP, SSEP, CT angiography, and four-vessel angiography in pediatric patients who require ancillary investigation for DNC (weak recommendation, very low certainty in evidence). | |
| We suggest against performing ancillary investigation in infants under 2 months corrected gestational age who require ancillary investigation for DNC (weak recommendation, very low certainty in evidence). | |
| Good practice statements | |
| A multidisciplinary support team (e.g., nurses, social workers, psychologists, spiritual carers, religious officials, and donor coordinators where applicable) should be included in care discussions as early as possible when it is suspected that a patient may progress to death. | |
| Any clinician participating in death determination must have the requisite skills, training, and knowledge of death determination processes and procedures. | |
| In all cases of potential organ donation, clinicians determining death must not have an association or active involvement in transplant procedures, organ allocation, or care of the intended transplant recipients. | |
| Where appropriate, assessment for DNC should be made in all persons with devastating brain injuries who are believed to meet these criteria, regardless of organ donation potential. | |
| The cause of devastating brain injury should be supported by neuroimaging evidence consistent with the established cause. | |
| A standardized checklist should be used for death determination and documentation. | |
| Fulfillment of all phases of death determination must be clearly documented by the most responsible physician in the patient’s medical record. | |
| Physicians supervising and interpreting radiologic ancillary investigation for DNC should be trained in neuroradiology with experience in the performance and interpretation of the specific examination being conducted. For CT angiography, radiologists should have required experience in using the correct protocol and scale. For CT perfusion, radiologists should have requisite training in performance and interpretation of this investigation. | |
| Physicians supervising and interpreting radionuclide ancillary investigation for DNC should be residency trained in nuclear medicine with experience in the performance and interpretation of the specific examination being conducted. | |
| Physicians supervising and interpreting transcranial Doppler testing for DNC should be adequately trained in neurosonography with experience in the performance and interpretation of the specific examination being conducted. |
BAEP = brainstem auditory evoked potentials; CT = computer tomography; DCC = death determination by circulatory criteria; DNC = death determination by neurologic criteria; EEG = electroencephalography; SSEP = somatosensory evoked potentials; DTPA = diethylene-triamine-pentaacetate acid; GHA = glucoheptonate; HMPAO = hexamethyl propylenamine oxime
Whole brain vs brainstem death
Deliberations among the whole brain vs brainstem working group were informed by an international guideline review of brainstem death,26 a systematic review of infratentorial brain injury and isolated brainstem death among patients suspected of DNC,27 an Alberta outcome study of death after infratentorial stroke,28 a survey of Canadian intensivists,29 and a scoping review of the role of the reticular activating system in consciousness and DNC.30 Guidance was generated through multiple working group meetings during which conclusions and rationales were presented and revised, before being shared with and accepted by the guideline development panel.31
Legal and ethical considerations
The legal and ethics working group formed four subgroups focused on more specific questions—the rationale for a brain-based definition of death, legal implications of a brain-based definition of death, consent for DNC testing, and mitigating and navigating conflict. These groups conducted literature searches, including existing policy documents of key medical organizations, reviewed legal databases in Canada, the USA, and the UK, and in the case of consent for DNC testing, followed up with involved attorneys to obtain nonpublic records. Theoretical analysis and critical reflection on core ideas, key positions, relevant values and principles, and a range of possible and actual cases/situations, further informed an iterative discussion-based consensus process among the working group and then the guideline development panel to achieve consensus on the direction provided. Further details are available in the relevant publications.5–7,32
Stakeholder engagement
It was determined at the outset of the project that the stakeholder engagement working group would develop an extensive patient family and public partnership strategy as described previously.33 This involved a particular selection of participants, as well as training and support throughout the entire guideline development process. To better understand the Canadian public’s perspectives on how death is determined in Canada, the stakeholder engagement working group conducted a nationwide cross-sectional survey evaluating understanding of how death is determined, acceptance of neurologic and circulatory death determination, and interest and preferred strategies in learning more about the topic. Further details are available in the relevant publication.4 In addition, to describe substitute decision maker/family perspectives of DNC (in the context of organ donation) in Canadian intensive care units (ICUs), the stakeholder engagement working group analyzed data collected from a qualitative study that conducted semistructured, in-depth interviews with substitute decision maker/family members who were asked to make an organ donation decision on behalf of their loved one. Further details are available in the relevant publication.3
Finally, the project team engaged hospital-based spiritual care leaders in a series of small discussion groups. Participants from across the country were invited to participate through the Canadian Association for Spiritual Care. Discussions were focused on their professional experience with and perspectives on supporting substitute decision makers/families at end of life, as well as approaches to knowledge translation for both substitute decision makers/families and health care professionals. See Spiritual Care Professionals Discussion Report in ESM eAppendix 6 for further details and the outcomes of these discussions.
Definition of death
The death of a person has profound social and legal implications and initiates a number of events, including family grieving, disposition of final remains, burial proceedings, and estate settlement. It also terminates any legal obligation to provide mechanical ventilation and continued somatic support and allows for postmortem organ and tissue donation, and autopsy. While there are many different philosophical, religious, and cultural beliefs related to the concept of death, medical professionals require a legally recognized, operational, biomedical definition that is applicable to all persons.6 This is especially critical for ensuring the ethical practice of organ donation and adherence to the “dead donor rule,” and where organ recovery is contingent on accurate and timely death determination.
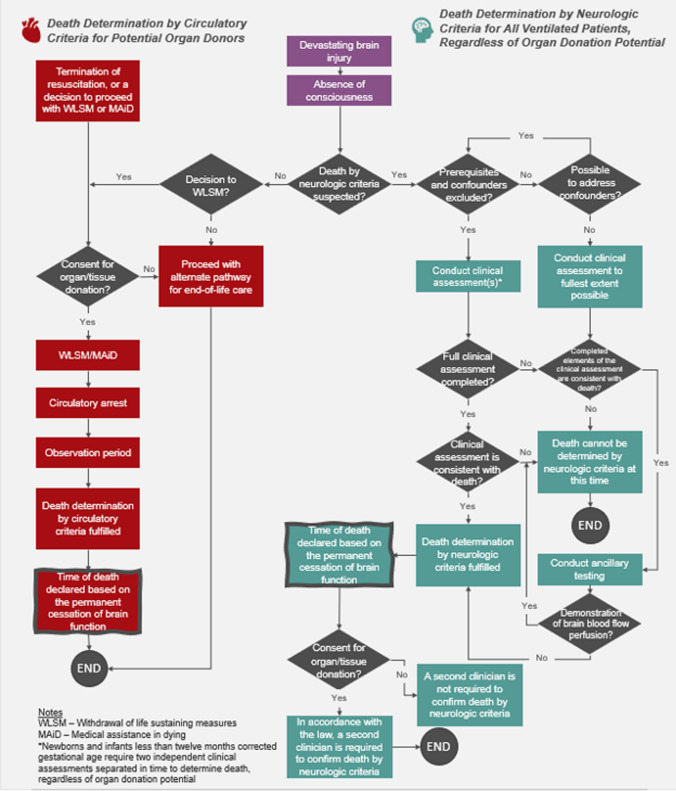
At the legal level, death is defined in varying ways among the provinces and territories, within a mixture of statutes and common law.7 Nevertheless, all Canadian jurisdictions currently accept death defined in neurologic terms even if circulatory function is present because of mechanical ventilation and somatic support. This reflects a long-standing recognition that the brain is the fundamental and essential organ that makes key human functions of consciousness, self-awareness, and cognition possible. Driven by advances in medical technologies and increased understanding of the physiology of the dying process, a growing medical and societal consensus holds that, from a biomedical perspective, all death is brain based.11,16,34,35 While death can be determined using either circulatory or neurologic criteria (see Fig. 1), both are based on a definition that reflects the central importance of brain function as the dividing line between life and death.
Fig. 1.
Death determination process overview
Aperçu du processus de détermination du décès
Death is defined as the permanent cessation of brain function
The permanent cessation of brain function is characterized by the complete absence of any form of consciousness and the absence of brainstem reflexes, including the ability to breathe independently. This can result from cessation of blood circulation to the brain after circulatory arrest and/or from devastating brain injury. A person has died once it has been determined that brain function has been permanently lost, (i.e., brain function is lost, will not resume spontaneously, and will not be restored through intervention).6,11
Functionally, and to aid in the public’s understanding, the cessation of brain function equates to functions of the brain, including the brainstem, and means the person is
without consciousness, and is unable to ever regain this, and
unable to breathe on their own (unaided by a mechanical ventilator), and
unable to experience any pain, and
unable to communicate or interact in any capacity, and
unable to feel, see, hear, and
unaware of their surroundings.
It is important to note that there may be differences between when death occurs, when death is determined (in accordance with the criteria outlined below), and when death is documented and formally declared.
The cessation of brain function is shown by the following conditions:
The complete absence of consciousness, defined by the total absence of wakefulness and awareness of one’s internal or external environment. In the absence of consciousness, there is no ability to interact with or consciously respond to stimuli.
The absence of brainstem reflexes including the ability to make respiratory efforts/breathe independently (without mechanical ventilation), indicating the cessation of brainstem function.
Death can be determined using two categories of criteria:
Death determination by circulatory criteria (DCC):
The loss of circulation in the body results in rapid cessation of brain circulation, perfusion, and function.36 Determining the permanent loss of circulation to the brain, thus, serves as a surrogate for the loss of brain function. Determination of death in these cases is reliant upon ensuring that the appropriate amount of time has passed after cessation of circulation to preclude unassisted resumption of spontaneous circulation to the brain.
-
2.
Death determination by neurologic criteria (DNC):
For patients with devastating brain injuries where breathing is supported by mechanical ventilation, death is determined by the complete absence of consciousness shown by lack of wakefulness and awareness in response to stimuli, absence of brainstem function shown by cranial nerve testing, and absence of the capacity to breath shown by apnea testing.
Demonstrating total disintegration of brain cells or absence of all residual biological activities is not required for death determination. Residual brain cell activity that is not associated with presence of consciousness or any brainstem function does not preclude death determination. Examples include posterior pituitary antidiuretic hormone release, temperature control, or cellular-level neuronal activity.6
Death cannot be declared if there is any level of consciousness remaining and/or residual brainstem function regardless of how diminished. This would include patients with unresponsive wakefulness syndrome37 or in persistent vegetative or minimally conscious states.38
A brain-based definition of death provides an updated approach using different terms than the existing legal definitions of brain death. Ideally, to avoid any confusion over differences in wording, the law should be amended to coincide with the Clinical Practice Guideline’s definition of death.
Death determination by circulatory criteria
| Death determination by circulatory criteria is made based on the absence of extracranial circulation that leads to the permanent absence of intracranial (brain) circulation (foundational medical principle). |
Death determination by circulatory criteria in the context of organ donation is predicated on the FMP that, if the absence of circulation to the brain is permanent, the loss of brain function is permanent, and death is declared. Permanent cessation of intracranial (brain) circulation must be maintained should any postmortem interventions (i.e., interventions carried out after death determination that are used for organ preservation as part of organ donation procedures) be used.39
Recommendations
A list of DCC recommendations is summarized in Table 4. The full description of evidence with citations and rationales supporting these recommendations can be found in ESM eAppendix 7. In addition, the corresponding evidence has been synthesized in three systematic reviews have been published.40–42 We considered a number of subgroups including MAID, uncontrolled donation after DCC, newborns, and pediatrics. Unless explicitly stated otherwise, the recommendations apply across all subgroups.
Monitoring devices
|
We recommend that continuous invasive arterial blood pressure monitoring is used to confirm permanent cessation of circulation for patients who are potential organ donors undergoing DCC (strong recommendation, moderate certainty in evidence). We suggest that continuous electrocardiogram monitoring is used to confirm permanent cessation of circulation in situations where the use of an indwelling arterial cathether is not possible for patients who are potential organ donors undergoing DCC (weak recommendation, moderate certainty in evidence). |
To minimize the risks of both false-positive events (determining someone dead who is alive) and false-negative events (determining someone is not dead who is) for DCC, use of a well-functioning indwelling arterial catheter is required. Continuous invasive arterial blood pressure monitoring is an objective measure that is easily interpreted and commonly used in the ICU setting. Since ECG activity persists in some patients whose circulation has permanently ceased,12,43 when continuous invasive arterial blood pressure monitoring is used, no other confirmation of cessation of circulation, such as electrical asystole, is required. Auscultation or palpation should not be used to assess lack of circulation but could be applied to verify that an observed flat invasive arterial blood pressure waveform corresponds to the clinical state.
Exceptionally, clinicians could consider the use of ECG monitoring for absent cardiac electrical activity as a surrogate for absent circulation, if invasive arterial blood pressure monitoring is not possible for technical reasons (e.g., inability to obtain a calibrated and reliable indwelling arterial cathether), refusal by surrogate decision makers for pediatric or neonatal cases, or refusal by potential organ donors in the case of MAID. Isoelectric ECG may be as good as, or better, at identifying cessation of circulation as an invasive arterial blood pressure tracing; there is moderate certainty in evidence that ECG monitoring carries a low risk of false positives but high risk of false negatives. Nevertheless, the high risk of false negatives is only transient, and DCC becomes 100% specific and sensitive with time. Although outcomes for organ donation were judged by the panel to be out of scope, we acknowledge that use of ECG monitoring for DCC may unnecessarily prolong the time to determine death. This risk and its potential consequences, along with the risks of indwelling arterial cathether placement, should be shared with patients and/or surrogate decision makers so that they can make informed choices. The DCC working group considered other noninvasive monitoring devices (e.g., Doppler, echocardiography, palpation of pulse); however, given a lack of suitable evidence, none were deemed suitable for this purpose.
Cessation of circulation
| We recommend that an arterial pulse pressure of ≤ 5 mm Hg and within the error of measurement of clinical monitoring equipment is used to confirm permanent cessation of circulation for patients with an indwelling arterial cathether who are potential organ donors undergoing DCC (strong recommendation, very low certainty in evidence). |
Since no direct evidence exists to inform this recommendation, the panel considered indirect evidence that reported on brain perfusion as it relates to arterial pulse pressure during cardiopulmonary resuscitation and at the end of life—two contexts that are similar to those of controlled and uncontrolled donation after DCC. Death determination by circulatory criteria working group members agreed that an arterial pulse pressure of ≤ 5 mm Hg, rather than an arterial pulse pressure of 0 mm Hg, is recommended because the lower threshold for accurate detection of arterial pulse pressure using clinical monitoring systems is not well established at very low pulse pressures and an arterial pulse pressure ≤ 5 mm Hg maintained for one minute is not associated with resumptions of circulatory function beyond five minutes.12 It is acknowledged that, in the absence of pulsatility, there is no systolic–diastolic variation in arterial blood pressure, and thus, a pulse pressure of zero infers mechanical asystole. Death determination by circulatory criteria at pulse pressures > 5 mm Hg carries a potential risk of declaring death in a person with persistent brain activity. Given the potential harm associated with using a higher threshold of pulse pressure (declaring someone dead who is not), the DCC working group felt this justified a strong recommendation despite the very low certainty in evidence. In select cases where ECG rather than invasive continuous arterial blood pressure monitoring is used for death determination, an isoelectric ECG indicates cessation of circulation.
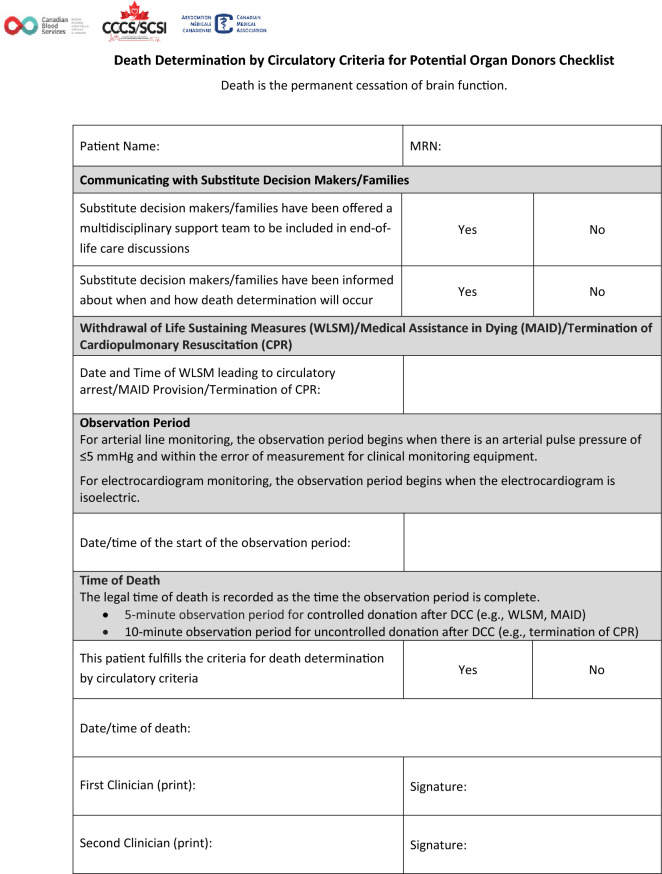
Observation time
|
We recommend that a minimum of five minutes of observation time is used to confirm permanent cessation of circulation for patients who are potential organ donors undergoing controlled donation after DCC (strong recommendation, moderate certainty in evidence). We recommend that a minimum of ten minutes of observation time is used to confirm of permanent cessation of circulation for patients who are potential organ donors undergoing uncontrolled donation after DCC (strong recommendation, low certainty in evidence). |
Evidence pertaining to the context of WLSM in the ICU shows that a five-minute observation period is associated with no false positives, even among controlled donation after DCC donors. In the context of uncontrolled donation after DCC, evidence suggests that there may be false positives if the time of the observation period is shorter than ten minutes, possibly related to residual effect of inotropic agents or cardiopulmonary interactions from mechanical ventilation applied during the resuscitation phase. While considering the potential importance to patients, families, and clinicians of determining death in a timely manner, the DCC working group felt that a shorter observation period (< 5 min for controlled donation after DCC and < 10 min for uncontrolled donation after DCC) was associated with important uncertainty, even though evidence indicates that resumptions of cardiac activity and circulation are transient during these time periods.
During the observation period, there must be continuous observation of the patient and the monitoring devices by the two clinicians determining death. Anything that interferes with continuous observation of the patient must be avoided. The patient should not be moved or transported during the observation period. The observation period must be restarted if any signs of persisting or returning circulation (e.g., an increase in arterial pulse pressure > 5 mm Hg, breathing, or motor responses) are observed. A return of ECG activity without a concomitant return of arterial pulse pressure > 5 mm Hg should not trigger restarting the observation period. Nevertheless, in the cases where ECG alone is used as a surrogate for monitoring for circulation and the arterial blood pressure cannot be confirmed, the observation period must be restarted in response to a return of ECG activity. Restarting the observation period may be required more than once. Once the observation period has been completed, no further clinical assessment is required, death is declared, and monitors may be removed.
Time of death and documentation
For DCC, the legal time of death is recorded as the time when the observation period is complete.
Fulfillment of all phases of death determination must be clearly documented by the most responsible physician in the patient’s medical record (good practice statement). A standardized checklist should be used for death determination and documentation (good practice statement).
Clinician qualifications
Any clinician participating in death determination must have the requisite skills, training, and knowledge of death determination processes and procedures (good practice statement). Two clinicians are required to perform DCC in potential organ donors. One clinician must be a physician with full and current licensure for independent medical practice by the college of physicians and surgeons or licensing authority in the relevant Canadian jurisdiction. The second clinician may be a physician on an educational register (e.g., residents, fellows), or a nurse practitioner, if in accordance with jurisdictional regulations. Both clinicians must possess the requisite skill and knowledge in DCC, including the ability to interpret monitoring devices being used; a particular level of specialty certification is not required. In addition, both clinicians determining death must not have an association or active involvement in transplant procedures, organ allocation, or care of the intended transplant recipients.
Death determination by neurologic criteria
The criteria outlined in this Guideline are designed to prevent errors in the determination of death. The duty of the clinician determining DNC is to never conclude that a patient is dead if they are not. When there is clinical doubt, the patient cannot be declared deceased. If the clinician is uncertain because of potential confounding conditions or any component of the clinical assessment, neuroimaging, electrophysiology, or ancillary investigations, then death should not be determined.
Where appropriate, assessment for DNC should be made in all persons with devastating brain injuries who are suspected to meet these criteria, regardless of organ donation potential (good practice statement).
| The following prerequisites must be met before conducting a valid clinical assessment for DNC: an established cause of devastating brain injury severe enough to cause death and supported by neuroimaging evidence, and potential confounders of an accurate clinical assessment must have been considered and excluded (foundational medical principle). |
The absence of consciousness is not sufficient evidence of a devastating brain injury. There must be a clear and proximate cause by history and neuroimaging that fully explains the loss of consciousness. If confounding conditions cannot be resolved or excluded, the clinical assessment alone is not sufficient to determine death and ancillary investigation is required. Table 5 provides a summary of potential confounding conditions for DNC. Guidance for managing pharmacological confounders in DNC is available in ESM eAppendix 8 along with a publication by Kanji and Williamson (Table 6).44
|
Death determination by neurologic criteria is primarily a clinical assessment that requires all three of the following: 1) the absence of consciousness shown by a lack of arousal and awareness in response to external stimuli, 2) absence of brainstem function as shown by cranial nerve testing, and 3) absence of the capacity to breathe shown by formal apnea testing (foundational medical principle). All components of the clinical assessment for DNC must be performed to the fullest extent possible (see Table 6). If a valid clinical assessment is fully performed, complete, and consistent with death, then this is sufficient for death determination. Ancillary investigation alone is not sufficient to determine death and will not override a clinical assessment that is inconsistent with death (foundational medical principle). |
Table 5.
Potential confounding conditions for death determination by neurologic criteria
| Confounder | Considerations |
|---|---|
| Hypothermia (either as part of TTM treatment or after environmental exposure, e.g., cold-water drowning) |
Prior to clinical assessment, the patient should have a minimum core temperature of ≥ 36 °C, as defined by core temperature as measured by esophageal, bladder, rectal, or central venous or arterial catheter temperature. There is a clinical distinction between therapeutic or induced hypothermia vs transient hypothermia that may arise in patients who have lost thermoregulation after suspected DNC. After induced hypothermia (applied for neuroprotection or to purposely alter brain metabolism), or prehospital environmental exposure ≤ 34 °C, a 24-hr waiting period is advised after rewarming to 36 °C prior to conducting the clinical assessment for DNC The clinical assessment for DNC may occur immediately after rewarming to 36 °C after transient hypothermia (e.g., after suspected loss of thermoregulation in suspected death by neurologic criteria) if supported by appropriate clinical judgment. Refer to Core Body Temperature Recommendation. |
| Severe facial trauma, ocular trauma or skull fractures (including basal skull fracture with hemotympanum) | May interfere with pupillary response, and oculovestibular reflexes, cranial pain response. |
| Decompressive craniectomy | Should be considered a potential confounding condition requiring more observation time or ancillary investigation. |
| Spinal cord injury | May confound corporal pain response, apnea test. |
| Anophthalmia, ocular trauma | Interferes with pupillary, corneal, and oculovestibular reflexes. |
|
Severe metabolic/endocrine/electrolyte imbalances/abnormalities including but not limited to: • Hyper/hyponatremia • Hypophosphatemia • Hypoglycemia • Hyper/hypomagnesemia • Hypokalemia • Hyper/hypothyroidism • Liver and/or renal dysfunction |
Severe metabolic, acid-base, and endocrine derangements that could affect the examination should be corrected. If these derangements cannot be corrected and are judged to be potentially contributing to the loss of brain function, ancillary investigation should be considered. Hypernatremia may commonly arise during ICU treatment but does not contribute to the cause of devastating brain injury. If the primary etiology does not fully explain the clinical picture, and if in the treating physician’s judgment hypernatremia may play a role, it should be corrected. |
| Unresuscitated shock (i.e., severe hypotension and/or shock that has not been adequately treated with volume resuscitation or vasoactive agents) | Prior to clinical assessment, adults should have a systolic blood pressure ≥ 100 mm Hg, or a mean arterial pressure ≥ 60 mm Hg (with use of vascular volume, vasopressors, and/or inotropes as needed). Pediatric patients should have age-appropriate targets. |
| Pharmacological neuromuscular blockade potentially accounting for motor unresponsiveness | Pharmacological paralysis can be excluded through use of a train-of-four stimulator if available, or assessment of the presence of deep tendon reflexes if a train-of-four stimulator is not available. |
| Neuromuscular disorders | For pre-existing severe or acquired neuromuscular disorder, such as amyotrophic lateral sclerosis, Guillain-Barré syndrome or a pre-existing severe sensory neuropathy, or phrenic nerve injury, ancillary investigation should be performed. |
|
Pharmacological confounders including: • Therapeutic or neuroprotective sedatives (e.g., benzodiazepines, propofol, barbiturates) and opioids administered to patients during resuscitative efforts • Drugs taken in an overdose setting e.g., illicit substances, alcohol, muscle relaxants, antidepressants, antiepileptics |
A blood and/or urine toxicology screen can be used diagnostically to establish the presence or absence of potentially confounding drugs. If serum concentrations of drugs can be quantified and supratherapeutic concentrations are identified, clinical assessments may be confounded. Therapeutic ranges of drug levels are not considered confounding. Serial measurements can be used to trend drug concentration over time until they decrease below supratherapeutic levels when neurologic assessments may be more reliable. If alcohol intoxication is suspected or confirmed, the alcohol blood level should be ≤ 80 mg·dL-1 at the time of death determination. In the absence of quantitative or qualitative therapeutic drug monitoring, allow a minimum of five elimination half-lives to pass before the clinical assessment is made. Additional waiting time should be added where drug clearance is expected to be prolonged (e.g., renal or hepatic dysfunction, obesity, hypothermia, prolonged exposure or drug delivery via continuous infusions). If there is uncertainty about reduced drug clearance or unknown drug exposures additional time is required or performing ancillary investigation may be considered. |
| Infratentorial brain injury |
If brain injury remains isolated to the brainstem without supratentorial involvement, ancillary investigation is required. Refer to foundational medical principles |
| Various conditions | There have been several reports of reversible mimics of DNC in the setting of diffuse leptomeningeal carcinomatosis, rabies encephalitis, and botulism. |
Adapted from the World Brain Death Project11 and Canadian 2006 Guideline8 for DNC. Further details about pharmacological confounders in the setting of DNC have been published by Kanji and Williamson.44
DNC = death determination by neurologic criteria; ICU = intensive care unit; TTM = targeted temperature management
Table 6.
Components of the clinical assessment for DNC
|
• Absence of consciousness (wakefulness and awareness) • Brainstem reflexes - Pupillary reflexes - OVR - Corneal reflex - Gag and cough reflexes - Sucking and rooting reflexes (for newborns) • Motor responses to painful stimuli • Apnea testing |
DNC = death determination by neurologic criteria; OVR = oculovestibular reflexes
If any portion of the clinical assessment cannot be completed, the remainder of the assessment must be completed to the fullest extent possible. Specific details on how to perform the clinical assessment are available in ESM eAppendix 9, based on the World Brain Death Project.11 In cases where the clinical assessment cannot be completed, if the completed elements are consistent with cessation of brain function, ancillary investigation is required to determine death. See Table 7 for indications for ancillary investigation.
Table 7.
Indications for ancillary investigation
|
• Inability to complete a valid clinical assessment, including apnea testing • Confounding conditions that cannot be resolved • Uncertainty in interpretation of possible spinally mediated movements • Isolated infratentorial brain injury without supratentorial involvement • Substitute decision makers/family request, or to provide additional information to assist understanding of DNC |
DNC = death determination by neurologic criteria
If ancillary investigation is indicated and performed for DNC (e.g., unresolved confounders, incomplete clinical assessment) and shows the presence of brain blood flow/perfusion, death cannot be determined at that time. If unresolved confounders persist, or the clinical assessment continues to be incomplete, the same recommended ancillary investigation should be repeated. If the confounders have been resolved and the clinical assessment can be fully completed, the ancillary investigation need not be repeated.
It is recognized that diagnostic neuroimaging, electrophysiologic studies, and brain flow/perfusion studies may have been performed during neuroprotective phases of care and at different times after causative devastating brain injury. Once prerequisites are fulfilled and a valid clinical assessment is completed to sufficiently determine death, any preceding diagnostic imaging tests that show the presence of brain blood flow/perfusion/activity do not necessarily preclude DNC.
Should any preceding diagnostic imaging show the absence of brain blood flow/perfusion, once prerequisites are fulfilled and a clinical assessment is completed to the fullest extent possible, and the completed elements are consistent with DNC, additional ancillary investigation is not required to determine death so long as this diagnostic imaging modality is a recommended ancillary investigation.
Ancillary investigation has known limitations,45,46 including potential technical issues in the performance of the test that may have an impact on reliability. Since DNC is fundamentally a clinical assessment, ancillary investigation alone is not sufficient for the determination of death in the absence of a clinical assessment performed to the fullest extent possible.
If the clinician is uncertain regarding potential confounding conditions, any component of the clinical assessment, neuroimaging, electrophysiology, or ancillary investigation, then death should not be determined. Under these conditions, it is advisable to repeat evaluations at another time, seek expert consultation, or pursue other forms of end-of-life care.
| A clinical assessment is necessary but not sufficient for DNC in patients with isolated infratentorial brain injury without supratentorial involvement. Ancillary investigation is required to determine death (foundational medical principle). |
If ancillary investigation shows the presence of brain blood flow/perfusion, death cannot be determined at that time. Demonstration of preserved brain blood flow/perfusion in a patient with an isolated infratentorial brain injury does not fulfill the definition of death in Canada.
If the clinical assessment remains consistent with cessation of brain function in the absence of significant supratentorial involvement, the same recommended ancillary investigation should be repeated.
For patients with infratentorial brain injury who have neuroimaging evidence of significant supratentorial involvement consistent with the concept of whole brain death, for instance, hydrocephalus and/or signs of herniation, a complete and valid clinical assessment is sufficient for DNC.
Recommendations
Table 4 summarizes a list of DNC recommendations. The full description of evidence with citations and rationales supporting these recommendations can be found in ESM eAppendix 10. In addition, two systematic reviews have been published.46,47 All recommendations apply to pediatric and adult patients, unless explicitly stated otherwise.
Clinical assessment after return of spontaneous circulation post-cardiac arrest
| We suggest delaying the clinical assessment for at least 48 hr from the time of return of spontaneous circulation post-cardiac arrest for patients with hypoxic-ischemic injury who do not have imaging evidence consistent with devastating brain injury undergoing DNC (weak recommendation, low certainty in evidence). |
This recommendation is aimed at post-cardiac arrest patients where initial imaging lacks evidence of a devastating brain injury and where this imaging may not have been repeated. Brainstem reflexes can return in the first 24-hr post-return of spontaneous circulation (ROSC)1 and cerebral edema with or without herniation cannot be equated with DNC. This group of patients is at a greater risk of a false-positive death determination. Given the absence of direct evidence, the DNC working group considered indirect evidence from a systematic review of predictors of poor neurologic outcomes. The results in patients undergoing targeted temperature management (TTM) could not be differentiated from those who did not. A conservative 48-hr delay in clinical assessment after ROSC was judged to be safe, feasible, and allowing for elimination of confounders. Physicians may wish to shorten the delay by performing repeat imaging to confirm radiological evidence of devastating brain injury or by conducting ancillary investigation.
For patients with secondary cardiac arrest associated with other forms of primary devastating brain injury such as traumatic brain injury, massive ischemic stroke, or intracerebral hemorrhage, imaging in these cases almost always confirms the etiology of the clinical picture, especially if there is evidence of cerebral edema, mass effect, and herniation. In these cases, a 24-hr delay before conducting the clinical assessment for DNC may be considered.
The cause of devastating brain injury should be supported by neuroimaging evidence consistent with the established cause (good practice statement).
Core body temperature
| We suggest ensuring a core body temperature of ≥ 36 °C for patients undergoing DNC (weak recommendation, very low certainty in evidence). |
We could not identify any comparative data indicating superiority of one temperature threshold over another for the accuracy of DNC. Temperature, specifically hypothermia, may affect the DNC clinical assessment via depression of brain metabolism and function, or indirectly through the accumulation of confounding drugs from temperature-related changes in pharmacokinetics. With high emphasis on avoiding false-positive determination (i.e., declaring someone dead who is not yet dead) a cautious and clinically feasible approach to temperature considerations in DNC is suggested.
In cases of prehospital environmental exposure or induced hypothermia for neuroprotection at ≤ 34 °C, waiting 24 hr after return to normothermia is advised.11
Pupillary assessment
| We suggest using either quantitative pupillometry or clinical pupil assessment for patients undergoing DNC (weak recommendation, low certainty in evidence). |
In spite of varied quality, the current evidence points to improved accuracy with quantitative pupillometry relative to clinical assessment for pupillary response in generalized brain injuries. Nevertheless, in DNC where the pre-test probability is high, improved accuracy with pupillometry has not been shown in the limited direct evidence available. In addition, ICU access to quantitative pupillometry may not be routinely available. When performing clinical assessment of pupils for the purpose of a complete evaluation of coma, including the possibility of death, then this assessment should be performed meticulously.
Vestibulo-ocular reflex
| We recommend against the addition of oculocephalic reflex testing to vestibulo-ocular reflex testing as part of the clinical assessment for patients undergoing DNC (strong recommendation, moderate certainty in evidence). |
The available evidence shows that the oculocephalic reflex (OCR), also known as “doll’s eyes sign” has much lower specificity than the vestibulo-ocular reflex (VOR), also known as “cold caloric testing,” and the VOR is very sensitive for DNC. Thus, on the balance of the evidence, the DNC working group determined that the addition of OCR testing to VOR testing risks confounding the death determination without improving sensitivity or specificity. The DNC working group felt that, since the evidence does not support the use of OCR testing for DNC, if testing of the VOR cannot be completed, the clinical assessment is deemed incomplete and ancillary investigation is required.
Apnea testing
|
We suggest using a PaCO2 threshold of ≥ 60 mm Hg (and ≥ 20 mm Hg above baseline) when performing apnea testing for patients undergoing DNC (weak recommendation, very low certainty of evidence). We suggest using either positive pressure (continuous positive airway pressure) or passive oxygenation when performing the apnea test for patients undergoing DNC (weak recommendation, low certainty in evidence). We suggest using exogenously administered CO2 for patients undergoing DNC who have a high pre-test probability for cardiorespiratory instability that could prevent successful completion of the apnea test or who fail to complete the apnea test because of cardiorespiratory instability (weak recommendation, low certainty in evidence). |
The apnea test should be the last test performed as part of the clinical assessment. Although it is important to mitigate against failure to complete apnea testing, there are no studies that describe the influence of positive pressure on the accuracy of DNC. Minimal differences are shown in the available studies between passive and positive pressure oxygenation techniques regarding duration or ability to complete apnea testing. The weak recommendation to use positive pressure in appropriate circumstances is based in part on clinical judgment that, despite adequate preparation (preoxygenation, recruitment maneuver, adequate perfusion), the apnea test may not be able to be completed with passive oxygenation alone in patients who have significant oxygen requirements and lung pathology. Alternatively, some clinicians may choose only to apply positive pressure in circumstances where conventional methods of apnea testing have failed. Typically, 10 cm H2O is used as the level of continuous pressure. For apnea testing, while the patient remains attached to the mechanical ventilator, clinicians should be aware of the potential for ventilator autocycling that may be misinterpreted as patient-initiated breathing.
We found no studies that directly addressed the question of whether a PaCO2 threshold of 60 mm Hg vs higher for the apnea test would improve the accuracy of death determination. Given the long-standing and near universal acceptance for a CO2 threshold of ≥ 60 mm Hg (and ≥ 20 mm Hg above baseline) during the apnea test, we found no evidence to support changing the current threshold. The weak recommendation reflects the expert opinion of the panel rather than direct evidence. It is important to note that the CO2 thresholds suggested above require a corresponding drop in pH ≤ 7.28. The thresholds suggested above do not apply to patients with chronic CO2 retention who may require higher PaCO2 levels to stimulate respiratory efforts (≥ 20 mm Hg above the patient’s baseline). For patients who are dependent on hypoxic drive or have a history suggestive of chronic respiratory insufficiency and responsiveness to only supranormal levels of CO2, physicians must exercise caution in interpreting apnea test results. If the physician cannot be sure of the validity of the apnea test, an ancillary investigation should be performed.
Exogenous CO2 administration can shorten the duration of apnea testing and has the potential to reduce the risk of physiologic instability, reduce the potential for incomplete tests, and avoid the need for ancillary investigation. There were no undesirable effects of CO2 augmentation identified in the reviewed studies and potential for CO2 overshoot can be mitigated through careful, frequent CO2 monitoring. CO2 augmentation adds complexity (specialized clinical and technical expertise) to the apnea test, which does not appear to improve the test sensitivity nor specificity. Techniques and protocols for augmenting CO2 during apnea testing vary significantly. CO2 augmentation can be accomplished by adding CO2 into the mechanical ventilator circuit or by extracorporeal membrane oxygenation using a carbogen mixture (97% O2/3% CO2).
Experience with exogenous CO2 may be limited in various centers. An alternative method to shorten the duration of apnea testing is to decrease the minute ventilation by ≥ 50% to attain a PaCO2 level ≥ 20 mm Hg above baseline prior to switching to continuous positive airway pressure (CPAP) or passive oxygenation.48
Number of clinical assessments
|
We recommend that one complete clinical assessment is sufficient for for patients one year of age or older who are undergoing DNC (strong recommendation, moderate certainty in evidence). We suggest two complete clinical assessments separated in time are sufficient for patients less than one-year corrected gestational age who are undergoing DNC (weak recommendation, very low certainty in evidence). |
In many Canadian provinces, existing provincial and territorial laws indicate that, for the purposes of a postmortem transplant, death should be determined by at least two physicians in accordance with accepted medical practice. The available evidence shows that the congruence between DNC assessments is extremely high over a wide variation in patients and settings. The undesirable effects of requiring two DNC assessments separated in time include prolonging ICU stay, nontherapeutic interventions, and suffering for substitute decision makers/families. If there is a legal requirement for two examiners to agree on the death determination, these assessments can be done concurrently. Nevertheless, if the determinations are performed at different times, a full clinical examination, including apnea testing, must be performed at each determination.
Newborns and infants were under-represented in the published literature; however, experts noted that current practice typically consists of two clinical assessments for DNC. For newborns, there may be a differing pathophysiology of neurologic death where open fontanelles can potentially alter the pathway of increased intracranial pressure leading to whole brain ischemia that ultimately results in neurologic death in patients with a fixed intracranial space. A recent unpublished, non-peer-reviewed UK report of potential reversal of DNC in this age group suggests more caution should be made regarding the clinical assessment in this age group.49,50 For this reason, along with limited direct evidence, a lack of collective experience with DNC in this age group, and a desire to promote maximum safeguarding of the determination of death in these very young patients, the panel suggests two complete clinical assessments at different times for newborns and infants less than one year of age. There is no recommended minimum time interval between clinical assessments; however, a minimum of 24 hr between assessments for newborns (less than two months corrected gestational age) is advisable given the inability to use ancillary investigation for DNC in this age group. The time interval may be extended according to physician judgment.
Ancillary investigation—adults (age ≥ 18 yr)
|
We suggest performing CT perfusion, CT angiography, transcranial Doppler, or a radionuclide brain perfusion study employing a lipophilic radiopharmaceutical (with or without tomographic imaging) in adult patients who require ancillary investigation for DNC (weak recommendation, very low to moderate certainty in evidence). We suggest against performing EEG, BAEP, SSEP, a radionuclide brain flow only study employing a lipophobic radiopharmaceutical, four-vessel cerebral angiography, or magnetic resonance imaging in adult patients who require ancillary investigation for DNC (weak recommendation, very low certainty in evidence). |
The ancillary investigation working group evaluated the following ancillary investigations for use in adult patients: CT angiography (four-point, seven-point, and ten-point scales), CT perfusion, radionuclide studies (99mTc-pertechnetate angiography, 99mTc-HMPAO with single-photon emission-computed tomography [SPECT] and 99mTc-HMPAO without SPECT), transcranial Doppler ultrasound, four-vessel cerebral angiography, magnetic resonance imaging with time-of-flight angiography, EEG, and BAEP.
CT perfusion was suggested based on an acceptable false-negative rate and low undesirable effects due to an acceptable false-positive rate. There is likely variability in the acceptability of this test among key stakeholders because of its novelty, variable availability across Canadian hospitals, and heterogeneous operator training and level of expertise. Diagnostic criteria are based on visual inspection of the perfusion scan modalities that should show matched decrease in cerebral blood flow and cerebral blood volume in the entire brain.
CT angiography is suggested based on false-negative and false-positive rates, stakeholder acceptability, widespread availability in most Canadian hospitals with ICUs, and widespread radiologist training in CT angiography. Computer tomography angiography diagnostic criteria should be based on a two-phase CT angiogram using the ten-point scale applied to the late acquisition phase, which studies opacification of both supratentorial and infratentorial vessels.
A radionuclide brain perfusion study employing a lipophilic agent with planar or SPECT imaging is suggested based on high desirable effects because of an acceptable false-negative rate. Widespread acceptance is anticipated based on historical use, availability in most Canadian hospitals with ICUs, and widespread nuclear imaging specialist training in radionuclide perfusion imaging. The absence of intracranial radionuclide uptake on planar or tomographic imaging including assessment of the posterior fossa and brainstem to the extent possible, such as with use of lateral planar or tomographic imaging, is necessary for DNC. When flow images are also obtained during injection of the lipophilic radiopharmaceutical, there should also be no visualization of the anterior and middle cerebral arteries. Information regarding the methods for conducting nuclear medicine studies performed for ancillary investigation in DNC has been published by Zuckier.51
Transcranial Doppler ultrasound is suggested as it was considered to have high desirable effects based on an acceptable false-negative rate and low undesirable effects based on acceptable false-positive rates. The resource requirements for this test were judged to be low (moderate savings) with variability in the acceptability notably due to its reliance on operator expertise, novelty as a test for DNC, and heterogeneity of ultrasound diagnostic criteria in the evidence base. Moreover, this test may not be performed reliably in a significant proportion (~10%) of patients with inadequate bone windows. There may be limited availability in Canadian hospitals and heterogeneous operator training that may not reflect the level of expertise found in the evidence base for our recommendation. Visual inspection of blood flow patterns should show oscillatory/reverberating flow (i.e., a retrograde diastolic flow in the presence of a systolic anterograde flow), systolic spikes, or no flow in a patient with documented flow in a previous transcranial Doppler ultrasound study, in the anterior (minimally the middle cerebral arteries) and the vertebrobasilar (minimally the basilar artery) circulations for DNC using transcranial Doppler ultrasound.52,53 A formal ultrasound exam should be performed and interpreted by an expert with formal neurosonography training. Point-of-care ultrasonography is discouraged for DNC since studies that determined accuracy of this ancillary investigation were generally performed by experienced operators.
A radionuclide brain flow study (typically employing a lipophobic radiopharmaceutical) is not suggested in view of significant false-negative rates and significant false-positive rates. Lipophilic agents are preferred to show perfusion and tissue uptake.
Although EEG was viewed to have high desirable effects based on an acceptable false-negative rate and moderate undesirable effects due to an acceptable false-positive rate, concerns on test validity in the presence of confounders to the clinical examination such as persistent intoxication and sedation, and the inability to detect deep cerebrum and brainstem function led to the suggestion against its use.
Brainstem auditory evoked potentials are not suggested in view of low desirable effects based on a high false-negative rate and high undesirable effects due to a high false-positive rate.
Despite its historical use, four-vessel cerebral angiography is no longer suggested in view of moderate desirable effects based on an acceptable false-negative rate and high undesirable effects in the absence of data on test specificity. The resource requirements for this test were also judged to be moderate to high compared with alternative diagnostic tests.
Magnetic resonance imaging with time-of-flight angiography is not suggested in view of moderate desirable effects based on a significant false-negative rate and moderate undesirable effects due to a significant false-positive rate.
Ancillary investigation—pediatrics (age < 18 yr)
|
We suggest performing a radionuclide brain perfusion study employing a lipophilic radiopharmaceutical such as 99mTc-HMPAO or equivalent (which incorporates both a flow and parenchymal phase) with or without tomographic imaging in pediatric patients who require ancillary investigation for DNC (weak recommendation, low certainty in evidence). We suggest performing a radionuclide brain flow study employing a lipophobic radiopharmaceutical such as 99mTc-DTPA, 99mTc-GHA, 99mTc-pertechnetate, or equivalent (which incorporate only a flow phase) when a study employing a lipophilic radiopharmaceutical cannot be performed in pediatric patients who require ancillary investigation for DNC (weak recommendation, low certainty in evidence). We suggest against performing EEG, transcranial Doppler, BAEP, SSEP, CT angiography, and four-vessel angiography in pediatric patients who require ancillary investigation for DNC (weak recommendation, very low certainty in evidence). We suggest against performing ancillary investigation in infants under two months corrected gestational age who require ancillary investigation for DNC (weak recommendation, very low certainty in evidence). |
The ancillary investigation working group evaluated the following ancillary investigations for use in pediatric patients: EEG, transcranial Doppler, BAEP, SSEP, radionuclide studies, CT angiography, and four-vessel angiography. Considerations of cost were felt to be negligible between all ancillary investigations evaluated.
Given the absence of specific data for CT angiography and four-vessel angiography in pediatrics, we extrapolated from the adult literature with adjudication by pediatric practitioners. CT angiography was assessed as accurate only when adult data were included for determination of specificity. Computer tomography angiography has a very serious risk of indirect bias and was deemed unable to be extrapolated to infants and young children, so the working group suggested against CT angiography.
With the inclusion of pediatric-specific studies, the ancillary investigation working group emphasized that the only ancillary investigations that were acceptable to key stakeholders were radionuclide scans, with the use of lipophilic agents as first choice given their ability to detect both flow and tissue uptake.
Specificity data were not available from either pediatric or adult studies for four-vessel angiography. Given this, the increased risk of thromboembolic, and the technical difficulty in performing four-vessel angiography in infants and younger children, the undesirable effects were noted to outweigh the desirable; thus, we recommend against the use of four-vessel angiography for pediatric patients who require ancillary investigation for DNC.
There were no studies in infants and children evaluating magnetic resonance imaging with angiography.
It was noted that the accuracy of EEG can be confounded by sedating medications and hypothermia, and cannot detect deep cerebrum or brainstem electrical function, and as such may require serial examinations thereby delaying the determination of death. Therefore, the working group suggested against their use.
Further studies are required before considering transcranial Doppler, BAEP, and somatosensory evoked potentials in the pediatric population. Transcranial Doppler ultrasound studies are needed, which standardize the vessels under investigation and evaluate waveform and flow in bilateral middle cerebral arteries, bilateral anterior cerebral arteries, and basilar and vertebral arteries.
In addition, further studies are required to better understand the effectiveness of ancillary investigation for DNC in infants (less than two months corrected gestational age).54 All infants, but particularly those in this age group, have open fontanelles and unfused cranial sutures that possess the capacity for increased intracranial compliance. These anatomical differences have the potential to alter cerebral hemodynamics and the accuracy of ancillary investigations that evaluate brain blood flow and perfusion compared with older children and adults who have rigid skulls. At present, the available evidence is not sufficiently robust to confidently suggest ancillary investigation be used to determine death in these patients, even if this precludes DNC in situations where ancillary investigation would otherwise be required. The absence of a valid ancillary investigation in this age group increases the rigour of the determination. As such, if two complete clinical assessments are not possible for infants less than two months corrected gestational age (e.g., unresolved confounders, inability to complete the clinical assessment) DNC cannot be determined. Alternative end-of-life care may be considered.
Summary of pediatric-specific considerations for death determination by neurologic criteria
For the purposes of this Guideline, the pediatric age group refers to newborns (from 37 weeks corrected gestational age to less than two months), infants (from two months to less than one year), and children (from one year to less than 18 yr). Pediatric-specific recommendations have been described above and are repeated here for convenience.
| We suggest that two complete clinical assessments separated in time are sufficient for patients less than one-year corrected gestational age who are undergoing DNC (weak recommendation, very low certainty in evidence). |
For newborns, the clinical assessment must include the sucking and rooting reflex.
For infants less than two months corrected gestational age, caution should be taken with regard to the clinical assessment. A minimum of 24 hr between assessments is advisable, though the time interval may be extended according to physician judgment.
For children greater than one year of age, the adult recommendations for the clinical assessment apply.
|
We suggest performing a radionuclide brain perfusion study employing a lipophilic radiopharmaceutical such as 99mTc-HMPAO or equivalent (which incorporates both a flow and parenchymal phase) with or without tomographic imaging in pediatric patients who require ancillary investigation for DNC (weak recommendation, low certainty in evidence). We suggest performing a radionuclide brain flow study employing a lipophobic radiopharmaceutical such as 99mTc-DTPA, 99mTc-GHA, 99mTc-pertechnetate or equivalent (which incorporate only a flow phase) when a study employing a lipophilic radiopharmaceutical cannot be performed in pediatric patients who require ancillary investigation for DNC (weak recommendation, low certainty in evidence). We suggest against performing EEG, transcranial Doppler, BAEP, SSEP, CT angiography, and four-vessel angiography in pediatric patients who require ancillary investigation for DNC (weak recommendation, very low certainty in evidence). We suggest against performing ancillary investigation in infants under 2 months corrected gestational age who require ancillary investigation for DNC (weak recommendation, very low certainty in evidence). |
Time of death and documentation
For DNC, the legal time of death is recorded as the time of completion of the last test required to fulfill death determination criteria. When legislation requires that death must be determined by two medical practitioners/physicians for the purposes of organ donation, the legal time of death in Canada is still marked by the time at the first determination. In consideration of substitute decision makers/families, any potential for delay between the completion of testing, the review and interpretation of the test results, and death declaration by the most responsible physician should be minimized.
When DNC is established by clinical assessment and ancillary investigation is not required, the apnea test should be the final element of the clinical assessment. The time of death is the time the blood sample was taken when the PaCO2 reached the apnea test targets, with the understanding that results still need to be formally interpreted and then documented by the most responsible physician.
If ancillary investigation is required, the time of death is documented as the time that the ancillary investigation was completed, with the understanding that results still need to be formally interpreted by neuroimaging experts and then documented by the most responsible physician.
If steps occur out of the recommended sequence, (e.g., ancillary investigation is performed prior to the clinical assessment), the time of death is recorded as the time the last required test is performed (i.e., when all required elements/criteria are fulfilled).
In many provincial jurisdictions, legislation states that for the purposes of organ donation, death must be determined by two medical practitioners/physicians in accordance with accepted medical practice. As noted in the 2006 Death Determination Guideline,8 and confirmed here, there is no clear biomedical reason for a second clinician or a second clinical assessment. Therefore, in line with the law, in the setting of organ donation, two medical practitioners/physicians can perform the clinical assessment concurrently. If performed at different points in time, the second clinical assessment required for organ donation must be fully repeated. In the absence of organ donation, there is no requirement for a second clinician or second clinical assessment. Therefore, the legal time of death in Canada is marked by the first determination of death.
If a valid clinical assessment is completed and the results confirm DNC, but additional tests are performed for nonmedical reasons that are beyond the requirements for death determination (e.g., at the request of family, in response to a legal challenge), these additional tests do not alter the declared time of death.
Fulfillment of all phases of death determination must be clearly documented by the most responsible physician in the patient’s medical record (good practice statement). A standardized checklist should be used for death determination and documentation (good practice statement).
Clinician qualifications
Any clinician participating in death determination must have the requisite skills, training, and knowledge of death determination processes and procedures (good practice statement). For DNC, clinicians must have the following: full and current licensure for independent medical practice by the college of physicians and surgeons or licensing authority in the relevant Canadian jurisdiction; requisite skill and knowledge in the management of patients with devastating brain injury and in DNC; no particular level of specialty certification.
For organ donation, the second clinician may be a nurse practitioner, if in accordance with jurisdictional regulations, provided they have the requisite skill and knowledge in DNC. Both clinicians determining death must not have an association or active involvement in transplant procedures, organ allocation, or care of the intended transplant recipients (good practice statement).
Physicians supervising and interpreting radiologic ancillary investigation for DNC should be trained in neuroradiology with experience in the performance and interpretation of the specific examination being conducted. For CT angiography, radiologists should have required experience in using the correct protocol and scale. For CT perfusion, radiologists should have requisite training in performance and interpretation of this investigation (good practice statement).
Physicians supervising and interpreting radionuclide ancillary investigation for DNC should be residency trained in nuclear medicine with experience in the performance and interpretation of the specific examination being conducted (good practice statement).
Physicians supervising and interpreting transcranial Doppler testing for DNC should be adequately trained in neurosonography with experience in the performance and interpretation of the specific examination being conducted (good practice statement). Transcranial Doppler is a complex physiologic test in vascular medicine requiring in-depth skill, training, and understanding of cerebrovascular anatomy, physiology, and a variety of clinically diverse pathological conditions. While there are currently no clear professional society guidelines for minimum expertise, informal point-of-care ultrasound experience is not sufficient.
Communicating with substitute decision makers/families
Supporting a loved one through the dying process often places overwhelming emotional and psychological burdens on substitute decision makers/families. A multidisciplinary support team (e.g., nurses, social workers, psychologists, spiritual care advisors, religious officials, and donor coordinators where applicable) should be included in care discussions as early as possible when it is suspected that a patient may progress to death (good practice statement).
Given that substitute decision makers/families and the public may struggle with understanding DNC,3,4 much of the information below is related to DNC. In relation to DCC, families should be prepared for the time-sensitive process of determining death and the observation period that is focused on confirmation of permanent cessation of circulation.
Communication about death determination by neurologic criteria
Clinicians can facilitate family members understanding and acceptance of DNC, which may also improve bereavement outcomes.3,55,56 It is important to recognize that, for many family members, understanding unfolds over time rather than in one isolated meeting. Specific considerations include 1) using clear and consistent language for DNC; 2) preparing substitute decision makers/families early for what typically happens during and following DNC; 3) acknowledging that what substitute decision makers/families see (e.g., the patient’s chest rising and falling) and feel (e.g., the patient’s warm body temperature) may make it challenging to understand DNC; 4) anticipating and clarifying the meaning of spinal-mediated motor responses; 5) repeating information (e.g., over several encounters) to improve substitute decision makers/families comprehension; 6) using multimodal communication methods (e.g., offer to show images when possible and/or provide written information, such as family-focused information aids); 7) inviting substitute decision makers/families to witness the clinical assessment for DNC; and 8) providing opportunities for family to perform rituals that accompany transitions from life to death, noting that while the “clinical journey” for a patient may be ending, their spiritual or relational journeys, for example, may continue.5,57
Extensive interviews with family members found that families who witnessed the process of DNC, specifically the bedside clinical assessment including observing the apnea test, was a critical moment to provide concrete understanding and often assisted with closure.3
Consent for death determination by neurologic criteria
Consent for DNC testing should neither be required nor requested. The overwhelming weight of legal and ethical authority holds that clinicians are not required to obtain family consent before performing DNC testing.32 It is essential that clinicians be able to assess the vital status of patients in their care, as this is part of the proper delivery of health care.
Clinicians should have discussions with substitute decision makers/families to provide information about when and how DNC will occur. This includes information about what typically follows DNC such as the removal of ventilation and other somatic support.32
Mitigating and navigating disagreement or conflict
Disagreement or conflict may arise in the context of DNC, given both the nature of what this means for substitute decision makers/families and health care professionals. The legal/ethics working group identified the following primary sources of disagreement or conflict: 1) grief, unexpected events, and needing time to process these events; 2) misunderstanding of DNC; (3) lack of trust in health care professionals, organizations, or systems; and/or 4) having religious, spiritual, and philosophical differences regarding defining and determining death.5
Strategies/approaches that assist with navigating these situations in respectful, compassionate ways should be implemented.3,5 These include but are not limited to 1) ensuring best practices in communicating with substitute decision makers/family members’ as described above are implemented; 2) further training for health care teams with respect to DNC, engaging in difficult discussions, cultural safety, and trauma-informed care; 3) offering and/or involving additional supports, such as spiritual carers, ethics, social workers, Indigenous advisors or elders; and, 4) affording families the opportunity to discuss beliefs and values around death and death determination. If disagreement or conflict persists, an ethics consultation may be warranted.
Declaration of death and the legal time of death
The legal time of death has important implications. Prior to the time of death, legal obligations related to the treatment of a living person apply. Once death has been determined and declared, psychosocial rites may occur and legal obligations change. Time of death has legal implications for wills and the distribution of estates, family relationship status, and life insurance proceeds. It terminates any legal obligation to provide continued somatic support, and permits postmortem organ and tissue donation, autopsy, disposition of final remains, and burial proceedings.
Clinicians should acknowledge and explain that there may be differences between when death occurs, when death is determined (testing), and when death is documented and formally declared, per DCC and DNC described above. In patients with DCC, these events occur in close proximity; therefore, the legal time of death is readily understood by substitute decision makers/families and health care professionals. Nevertheless, time of death in patients with DNC is subject to misunderstanding by substitute decision makers/families and health care professionals, as artificial breathing and heart function are maintained before, during, and after death determination. Death has already occurred and death determination testing and declaration confirms this after the fact.
Other circumstances may add to confusion, as there may also be differences in the time when the final component of the determination is completed vs when it is formally interpreted or reported vs when the most responsible physician reviews the information. In addition, a patient may have DNC declared at one center and is then transferred to another center for organ donation and undergoes repeated testing that are not required to determine death.
Reasonable accommodation
There are legitimate reasons to allow for reasonable accommodation of substitute decision maker/family resistance to DNC.5 The resistance to DNC may be framed in terms of legal rights like religious freedom, or it may relate to factors like misunderstanding or mistrust of the death determination, shock, or grief. Even in the absence of objections to DNC, it is currently common practice to temporarily delay removal of ventilation and other somatic supports to allow substitute decision makers/families time for acceptance of the death determination, end-of-life wishes, and observances.
It is not advisable to exempt patients with objecting substitute decision makers/families from death determination procedures given the need for clinicians to be able to assess the vital status of patients in their care. Nevertheless, in exceptional circumstances, delaying the removal of ventilation and other somatic supports after DNC for a relatively short period of time may be considered (i.e., a matter of days).5,7 The specific length of time will depend on and should be sensitive to, the circumstances of each case, including if medical resources are urgently needed to safeguard the life or health of another patient. Given these considerations, health care organizations should develop policies that outline the process and steps involved in addressing situations where there is ongoing or escalating conflict about DNC and/or the removal of ventilation and other somatic supports. These policies should include input from patients and families as part of their development and/or review.
Other guidelines
In 2020, the World Brain Death Project (WBDP) published a comprehensive evidence-informed guideline for DNC practice.11 In many areas, our updated recommendations are in alignment with the previously published Canadian guidelines8–10 and the WBDP recommendations, but the strength of each of the recommendations has now been explicitly linked to the quality of the evidence informing them. In addition, patient-family members and the public were included as panel members in the development of this Guideline. The current recommendations will result in changes to Canadian practice in several key areas.
Definition of death
A single definition of death based on the permanent cessation of brain function.
For death determination by circulatory criteria
-
2.
The use of continuous invasive arterial blood pressure monitoring and an arterial pulse pressure ≤ 5 mm Hg are required to confirm permanent cessation of circulation. Electrocardiography may be considered in circumstances where an indwelling arterial cathether is not reliable or not inserted. Other noninvasive monitoring devices should not be used.
-
3.
A ten-minute observation time for confirmation of permanent cessation of circulation in patients undergoing uncontrolled donation after DCC.
-
4.
Permanent cessation of intracranial (brain) circulation must be maintained should any postmortem organ donation interventions be deployed.
For death determination by neurologic criteria
-
5.
The cause of devastating brain injury should be supported by neuroimaging evidence consistent with the established cause.
-
6.
A 48-hr delay after ROSC post-cardiac arrest in patients with hypoxic-ischemic injury who do not have imaging evidence consistent with devastating brain injury before conducting the clinical assessment for DNC.
-
7.
Removal of the oculocephalic reflex as part of the clinical assessment for DNC.
-
8.
Core body temperature of ≥ 36 °C (rather than ≥ 34 °C) before performing the clinical assessment for DNC.
-
9.
Apnea testing recommendations that include passive oxygenation, continuous positive airway pressure, or exogenous CO2 administration.
-
10.
Infratentorial brain injury without significant supratentorial involvements does not fulfill DNC criteria and requires ancillary investigation.
-
11.
Adult ancillary investigation recommendations now include transcranial Doppler, CT perfusion, CT angiography, or a radionuclide lipophilic perfusion study. Four-vessel angiography is no longer recommended.
-
12.
Pediatric ancillary investigation favors radionuclide lipophilic perfusion study and if unavailable, a lipophobic radionuclide flow study. Four-vessel angiography is no longer recommended.
-
13.
Ancillary investigation is no longer recommended for infants less than two months corrected gestational age.
-
14.
A minimum of 24 hr between clinical assessment for infants less than two months of age is advised. The time interval may be extended according to physician judgement.
Knowledge gaps
Difficulties in conducting randomized clinical trials and large-scale studies in this area have resulted in a lack of robust data for DNC and DCC. Most research has been predominantly observational in design, and many important clinical questions could not be answered with direct evidence. Data specific to pediatrics, patients undergoing MAID, and patients with decompressive craniectomy is generally unavailable. Areas for future research have been identified,58 which include but are not limited to minimal pulse pressures for brain perfusion, activity, and function; prediction and time progression from brain injury to death; and clinical assessment testing including apnea testing and ancillary investigation performance and quality. Further exploration on family experiences and perspectives about WLSM and death determination would also be valuable. A list of knowledge gaps identified throughout the project is available in ESM eAppendix 11.
Strengths and limitations of the Guideline
To develop this Guideline, we used a rigorous process that incorporated multidisciplinary national and international experts, included public and family partners, adhered to GRADE methodology, and carefully managed panel member’s competing interests. Our process included detailed review and consideration of complex legal and ethical matters as well as a comprehensive stakeholder engagement strategy. At the same time, we acknowledge limitations including the lack of direct evidence to support some of the recommendations and low or very low certainty in evidence for most of the outcomes and comparisons of interest. We restricted the search strategy and screening criteria to those studies published in English or French, and thus, may have missed evidence published in other languages. The foundational medical principles, a new type of guidance developed as part of this process, were not subject to GRADE methodology; however, given their historical position in the medical, legal, and ethical frameworks of death determination in Canada, these principles were created to address an important need that did not fit within GRADE methods. With the evolution of both the evidence base and the Canadian legal landscape, revision of the foundational medical principles may be necessary. Finally, we acknowledge that the definition of death outlined here requires cessation of brain function as defined by the complete absence of any form of consciousness, and absence of brainstem reflexes including the ability to breathe independently. Residual brain cell activity that is not associated with activation of consciousness or any brain stem function does not preclude death determination including posterior pituitary antidiuretic hormone release, temperature control, or cellular-level neuronal activity. We advocate that this is consistent with some existing legal definitions of death, which require cessation of “all” brain function, although some may take a contrary position. Further discussion of the consistency of the definition stated with existing law is available in the relevant publication.7
Implementation
This 2023 Guideline contains practice-changing recommendations that will require extensive engagement with multiple stakeholder groups (health care professionals, hospital administrators, organ donation organizations, policy makers, patients, families, and the public) to facilitate education of those impacted by the recommendations and ensure consistent adoption into hospital protocols. To facilitate implementation of these recommendations into practice, we have created detailed protocols for DNC (see ESM eAppendix 9) as well as a checklist for DCC (Fig. 2) and a checklist for DNC (Fig. 3).2 Additional knowledge translation efforts will need to be multipronged, including engagement of professional societies and stakeholder organizations.
Fig. 2.
Death determination by circulatory criteria for potential organ donors checklist
Liste de contrôle pour la détermination du décès selon des critères circulatoires pour les donneurs d’organes potentiels
Fig. 3.
Death determination by neurologic criteria checklist
Liste de contrôle pour la détermination du décès selon des critères neurologiques
We made evidence-based recommendations about the appropriateness of specific ancillary investigations. We also made good practice statements regarding the expertise and qualifications required to perform such tests but did not make specific recommendations for how to do so. Clinicians performing these tests should refer to guidelines from their respective professional associations.
Typically, guidelines require review every two to five years to assess whether they need updating.59,60 Regular monitoring of the literature should be done with updates triggered by any of the following: new evidence on the existing benefits and harms of interventions; changes in outcomes considered important; changes in available interventions; changes in evidence that current practice is optimal; changes in values placed on outcomes; or changes in resources available for health care.
Conclusion
This 2023 Clinical Practice Guideline provides a biomedical definition of death based on permanent cessation of brain function and defines terms integral to its use. It provides recommendations for DNC for all mechanically ventilated patients and recommendations for DCC for potential organ donors. Strategies and approaches for interacting and communicating with substitute decision makers/families are provided. It is hoped that this Guideline will encourage uniformity and improve clarity and confidence in death determination practices in Canada.
Author contributions
Sam D. Shemie, Lindsay C. Wilson, Laura Hornby, Sylvia Torrance, and Bram Rochwerg initiated and designed the guideline development process. All authors contributed to the analysis and interpretation of the data and information gathered. All authors drafted the manuscript, and reviewed and revised it critically.
Acknowledgments
Sincere thanks go to Joanne Brennan, Heather Brewster, Kennedy Elliott-Pohl—our donor family members, as well as Robert Carignan—our public representative, and member of the Canadian Medical Association Patient Voice, whose experiential perspectives kept this initiative focused on the overarching purpose—providing high-quality end-of-life care for mechanically ventilated patients undergoing DNC, and potential organ donors undergoing DCC. We would like to acknowledge the information services support we received to design and execute the search strategies for the systematic reviews used to inform this Guideline: Robin Featherstone, MLIS, Information Specialist and Research Librarian, Dagmara Chojecki, MLIS, Information Specialist and Research Librarian, Daniela Ziegler, MSI, Librarian, Direction de l’enseignement et de l’Académie du Centre hospitalier de l’Université de Montréal. The authors also express their gratitude to Katie O’Hearn, MSc, and James Dayre McNally, MD, from the Children’s Hospital of Eastern Ontario Research Institute for their support in using the InsightScope® platform. We appreciate the support we received with citation screening and data abstraction for the systematic reviews used to inform this Guideline: Jorden Arbour, MD, Department of Emergency Medicine, University of Manitoba, Nedaa Aldairi, MD, Pediatric Intensivist, AlHabib Medical Group, Romina Alhooeinazari, BASc, Ryerson University, Conall Francoeur, MDCM, Department of Pediatrics, CHU de Québec - Université Laval Research Center, Lalida Kongkiattikul, MD, Pediatric Critical Care, Faculty of Medicine, Chulalongkorn University, Supun Kotteduwa Jayawarden, MD, BSc, Faculty of Medicine, University of British Columbia, Abdullah Malik, HBSc, University of Toronto, Christina Maratta, MDCM, MPH, Interdepartmental Division of Critical Care, Department of Pediatrics, University of Toronto, Anna-Lisa V. Nguyen, BHSc, Faculty of Health Sciences, McMaster University, Jaewoo (Jason) Park, MD, University of Manitoba, Julie Abou Samra, Medical Student, Faculty of Medicine, Université Laval, Ryan V. Sandarage, MD, BSc, Faculty of Medicine, University of British Columbia, Jonah Shemie, BSc, University College Cork, Krista Wollny, RN, PhD, Community Health Sciences, University of Calgary; Alberta Children’s Hospital Research Institute, Belinda Yee, MD, BSc, University of British Columbia, Austin Zaloum, MD, Department of Neurology and Neurosurgery, McGill University. We would like to recognize the support received to better understand pharmacological confounders in DNC, as well as substitute decision maker experiences at end-of-life, respectively: Salmaan Kanji, PharmD, Clinical Pharmacy Specialist, The Ottawa Hospital; Associate Scientist, The Ottawa Hospital Research Institute; University of Ottawa (Medicine); University of Montreal (Pharmacy), Amanda van Beinum, PhD, University of Ottawa. Finally, we would also like to acknowledge the medical animation that was created to describe death to the public: Devon Stuart, MA, CMI, Devon Medical Art LLC.
Disclosures
All panel members were required to complete a disclosure form declaring any potential direct or indirect competing interests prior to their involvement in the project. Disclosure forms were collected again at project completion, prior to publication. Declarations were reviewed by members of the steering committee. Several panel members have professional roles in organ donation administration, affiliations with governmental not-for-profit entities, or have received funding for scientific research. In addition, three panel members (M. Chassé, T. Gofton, M. Slessarev) were the lead investigators on studies that were used to generate our recommendations but had not yet been peer reviewed at the time of submission. No panel member was judged to have a relevant competing interest. This Guideline has been endorsed by the Canadian Critical Care Society, the Canadian Medical Association, the Canadian Association of Critical Care Nurses, Canadian Anesthesiologists’ Society, the Canadian Neurological Sciences Federation (representing the Canadian Neurological Society, Canadian Neurosurgical Society, Canadian Society of Clinical Neurophysiologists, Canadian Association of Child Neurology, Canadian Society of Neuroradiology, and Canadian Stroke Consortium), Canadian Blood Services, the Canadian Donation and Transplantation Research Program, the Canadian Association of Emergency Physicians, the Nurse Practitioners Association of Canada, and the Canadian Cardiovascular Critical Care Society.
Funding statement
This Clinical Practice Guideline has been made possible through a financial contribution from Health Canada through the Organ Donation and Transplantation Collaborative (The Collaborative), and developed as a partnership between the Canadian Critical Care Society, Canadian Blood Services, and the Canadian Medical Association.
The Collaborative is an initiative led by Health Canada with provinces and territories (except Québec), Canadian Blood Services, patients, families, clinicians, and researchers. The Collaborative’s vision is to improve organ donation and transplantation systems across Canada.
The Canadian Critical Care Society (CCCS) is the national, not-for-profit specialty society for critical care physicians, representing Adult and Paediatric Critical Care Medicine physicians in Canada. The practice of critical care medicine in Canada is multidisciplinary and CCCS members hold base specialty certifications in anesthesia, medicine, pediatrics, emergency medicine or surgery and some surgical subspecialties such as cardiac surgery and neurosurgery. Its mission is to promote and enhance critical care medicine in Canada. The CCCS espouses the philosophy of collaborative multidisciplinary practice to promote research, education, and patient care in Critical Care Medicine. To that end, the Society is involved in critical care medicine education in association with the Royal College of Physicians and Surgeons of Canada, and in critical care medicine research with the Canadian Critical Care Trials Group.
The Canadian Medical Association (CMA) has been the national voice of Canada’s medical profession since 1867. The CMA works with physicians, residents, and medical students on issues that matter to the profession and the health of Canadians. The CMA advocates for policy and programs that drive meaningful change for physicians and their patients. Guided by its impact 2040 strategy, the CMA focuses on creating strong and accessible health systems, fostering wellbeing and diversity in medical culture, and ensuring every person in Canada has an equal opportunity to be healthy.
Canadian Blood Services is a national, not‐for-profit charitable organization that manages the supply of blood and blood products in all provinces and territories in Canada (with the exception of Quebec) and oversees the Canadian Blood Services Stem Cell Registry. In 2008, Canadian Blood Services became responsible for national activities related to organ and tissue donation and transplantation (OTDT), which includes: national system development and operation of interprovincial organ sharing programs. Canadian Blood Services is not responsible for the management or funding of any Canadian organ donation organization or transplant program. Canadian Blood Services works with the OTDT community to improve the system for all Canadians.
Health Canada, the CCCS, Canadian Blood Services, and the CMA, assume no responsibility and shall not be liable for any direct, indirect, special, incidental, or consequential damages, losses or injuries, foreseen or unforeseen, whatsoever or howsoever occurring, which might result from the implementation, use, or misuse of any information or guidance in this Clinical Practice Guideline. The Guideline must be assessed in the context of a full review of applicable medical, legal, and ethical requirements in any individual case.
Prior conference presentations
Canadian Anesthesiologists' Society Annual Meeting (June 2022, Halifax, NS, Canada); Specialist in End-of-Life Care, Neuroprognostication and Donation Symposium (November 2022, Calgary, AB, Canada,); Critical Care Canada Forum (November 2022, Toronto, ON, Canada).
Editorial responsibility
This submission was handled by Dr. Stephan K. W. Schwarz, Editor-in-Chief, Canadian Journal of Anesthesia.
Electronic Supplementary Material
eAppendix 1 Guideline development panel
eAppendix 2 Scoping review
eAppendix 3 Definitions of death in national and international guidelines and legislation
eAppendix 4 Search strategies
eAppendix 5 Guideline development methodology
eAppendix 6 Spiritual care professionals discussion report: impacts and implementation of a brain-based definition of death
eAppendix 7 Evidence summaries and recommendation rationales: death determination by circulatory critiera
eAppendix 8 Managing pharmacological confounders in death determination by neurologic criteria
eAppendix 9 Clinical asessment for death determination by neurologic criteria
eAppendix 10 Evidence summaries and recommendation rationales: death determination by neurologic criteria
eAppendix 11 Knowledge gaps
Synthèse
Les Lignes directrices de pratique clinique ont été financées par Santé Canada et ont été élaborées dans le cadre d’un partenariat entre la Société canadienne de soins intensifs, la Société canadienne du sang et l’Association médicale canadienne. Les objectifs de ce projet étaient d’élaborer une définition unifiée du décès basée sur le cerveau et de mettre à jour les critères de sa détermination après une lésion cérébrale dévastatrice ou un arrêt circulatoire. La définition du décès devrait s’appliquer à toutes les personnes en toutes circonstances. La portée des critères de détermination du décès est limitée aux donneurs d’organes potentiels qui répondront aux critères pour une détermination du décès selon des critères circulatoires (DCC), ainsi qu’à tous les patients sous ventilation mécanique qui seront soumis à une détermination du décès selon des critères neurologiques (DCN), quel que soit le potentiel de don d’organes. Les Lignes directrices s’appliquent aux adultes et aux enfants et remplacent les recommandations canadiennes publiées précédemment. Aux fins des présentes Lignes directrices, le groupe d’âge pédiatrique désigne les nouveau-nés (âge gestationnel corrigé de 37 semaines à moins de deux mois), les nourrissons (de deux mois à moins d’un an) et les enfants (d’un an à moins de 18 ans).
La rédaction des présentes Lignes directrices est conforme à la Liste de contrôle RIGHT (Reporting Items for Practice Guidelines in Healthcare).1 Le comité d’élaboration des lignes directrices était à dessein composé d’infirmières et de médecins en soins intensifs (adultes et pédiatriques), de radiologistes, de neurologues, de neurointensivistes, d’anesthésiologistes, d’éthiciens, d’avocats, de familles de patients, de partenaires publics et de méthodologistes ayant une expertise dans l’élaboration de lignes directrices à l’aide de l’outil GRADE (Grading of Recommendations, Assessment, Development and Evaluation). À la suite d’un examen de la littérature, le comité directeur du projet a créé une ébauche de définition, qui a ensuite été examinée et révisée par le comité d’élaboration des lignes directrices à l’aide d’une adaptation de la Technique du groupe nominal.2 Pour élaborer les critères de détermination du décès, une étude de portée des lignes directrices internationales sur la détermination du décès a été réalisée, à partir de laquelle le comité a établi et classé par ordre de priorité les questions cliniques à traiter. Les questions cliniques identifiées ont été divisées en trois catégories générales, soit : les questions recevables portant sur les patients, l’intervention, le comparateur et les résultats (PICO en anglais) soumises à l’approche globale GRADE; les énoncés de bonnes pratiques; et les principes médicaux fondamentaux. Sept groupes de travail (définition du décès, détermination de du décès par critères neurologiques, examens auxiliaires, détermination du décès par critères circulatoires, décès du cerveau entier vs du tronc cérébral, considérations juridiques et éthiques, et mobilisation des intervenants) ont examiné tous les documents et élaboré des lignes directrices de pratique acceptées par tous les membres du comité avec l’approbation finale du comité directeur. Ci-dessous sont présentés un résumé de la définition du décès, les principes médicaux fondamentaux, les énoncés de bonnes pratiques et les recommandations pour la détermination du décès selon des critères circulatoires et neurologiques. Une description détaillée du contexte, des méthodes, des résumés des données probantes et des justifications peut être consultée en ligne dans le texte intégral. Conformément à la méthodologie GRADE, les recommandations sont étiquetées comme « fortes » ou « faibles ». Le terme « recommander » et ses formes conjuguées indiquent des recommandations fortes, et le terme « suggérer » et ses formes conjuguées indiquent des recommandations faibles.
Définition du décès
Le décès est défini comme l’arrêt permanent de la fonction cérébrale (c.-à-d. que la fonction cérébrale est perdue, ne reprendra pas spontanément et ne sera pas restaurée par une intervention) et se caractérise par l’absence totale de toute forme de conscience (éveil et perception) et l’absence de réflexes du tronc cérébral, y compris de la capacité de respirer de façon autonome. Cela peut résulter de l’arrêt de la circulation sanguine vers le cerveau après un arrêt circulatoire et/ou d’une lésion cérébrale dévastatrice. L’activité résiduelle des cellules cérébrales qui n’est pas associée à la présence de conscience ou à la fonction du tronc cérébral n’empêche pas la détermination du décès (p. ex. libération d’hormones antidiurétiques par l’hypophyse postérieure, contrôle de la température ou activité neuronale au niveau cellulaire). Le décès ne peut pas être déclaré s’il y a un niveau quelconque de conscience restante et/ou une fonction résiduelle du tronc cérébral, peu importe sa réduction.
Détermination du décès selon des critères circulatoires (DCC)
La détermination du décès selon des critères circulatoires se fait sur la base de l’absence de circulation extracrânienne, qui conduit à l’absence permanente de circulation intracrânienne (cérébrale) (principe médical fondamental).
Nous recommandons qu’une surveillance invasive continue de la tension artérielle soit utilisée pour confirmer l’arrêt permanent de la circulation chez les patients qui sont des donneurs d’organes potentiels soumis à un DCC (recommandation forte, données probantes de certitude modérée).
Nous suggérons qu’une surveillance continue par électrocardiogramme (ECG) soit utilisée pour confirmer l’arrêt permanent de la circulation lorsque l’utilisation d’une surveillance invasive de la tension artérielle n’est pas possible chez les patients qui sont des donneurs d’organes potentiels soumis à un DCC (recommandation faible, données probantes de certitude modérée).
Nous recommandons qu’une pression pulsée artérielle ≤ 5 mm Hg et dans la marge d’erreur de mesure de l’équipement de surveillance clinique soit utilisée pour confirmer l’arrêt permanent de la circulation chez les patients munis d’une canule artérielle qui sont des donneurs d’organes potentiels soumis à un DCC (recommandation forte, données probantes de certitude très faible).
Nous recommandons qu’un minimum de cinq minutes d’observation soit utilisé pour confirmer l’arrêt permanent de la circulation chez les patients qui sont des donneurs d’organes potentiels soumis à un don contrôlé après un DCC (recommandation forte, données probantes de certitude modérée).
Nous recommandons qu’un minimum de dix minutes d’observation soit utilisé pour confirmer l’arrêt permanent de la circulation chez les patients qui sont des donneurs d’organes potentiels soumis à un don non contrôlé après un DCC (recommandation forte, données probantes de certitude faible).
Détermination du décès selon des critères neurologiques (DCN)
Les conditions préalables suivantes doivent être remplies avant de procéder à une évaluation clinique valide pour un DCN : il doit y avoir une cause établie de lésion cérébrale dévastatrice suffisamment grave pour causer le décès et appuyée par des données de neuroimagerie, et les facteurs confondants potentiels d’une évaluation clinique précise doivent avoir été pris en compte et exclus (principe médical fondamental).
La détermination du décès selon des critères neurologiques consiste principalement en une évaluation clinique qui nécessite les trois éléments suivants : 1) une absence de conscience démontrée par un manque d’éveil et de perception en réponse à des stimuli, 2) une absence de fonction du tronc cérébral telle que démontrée par l’évaluation des nerfs crâniens, et 3) une absence de la capacité de respirer telle que démontrée par un test d’apnée formel (principe médical fondamental).
Toutes les composantes de l’évaluation clinique pour un DCN doivent être réalisées dans la mesure du possible. Si une évaluation clinique valide est entièrement réalisée, complète et compatible avec le décès, elle est alors suffisante pour déterminer le décès. Les examens auxiliaires seuls ne sont pas suffisants pour déterminer le décès et ne priment pas sur une évaluation clinique incompatible avec le décès (principe médical fondamental).
Une évaluation clinique est nécessaire mais insuffisante pour établir un DCN chez les patients présentant une lésion cérébrale infratentorielle isolée sans atteinte supratentorielle. Des examens auxiliaires sont nécessaires pour déterminer le décès dans un tel cas (principe médical fondamental).
Nous suggérons de retarder l’évaluation clinique d’au moins 48 heures à compter du moment de reprise de la circulation spontanée après un arrêt cardiaque chez les patients présentant une atteinte hypoxique-ischémique dont les données d’imagerie ne sont pas compatibles avec une lésion cérébrale dévastatrice et soumis à un DCN (recommandation faible, données probantes de certitude faible).
Nous suggérons de garantir une température corporelle centrale de ≥ 36 °C pour les patients soumis à un DCN (recommandation faible, données probantes de certitude très faible).
Nous suggérons d’utiliser soit la pupillométrie quantitative, soit l’évaluation clinique pupillaire pour les patients soumis à un DCN (recommandation faible, données probantes de certitude faible).
Nous recommandons de ne pas ajouter de test du réflexe oculocéphalique au test du réflexe vestibulo-oculaire dans le cadre de l’évaluation clinique des patients soumis à un DCN (recommandation forte, données probantes de certitude modérée).
Nous recommandons qu’une seule évaluation clinique complète soit suffisante pour les patients âgés d’un an ou plus soumis à un DCN (recommandation forte, données probantes de certitude modérée).
Nous suggérons que deux évaluations cliniques complètes séparées dans le temps soient suffisantes pour les patients dont l’âge gestationnel corrigé est inférieur à un an qui sont soumis à un DCN (recommandation faible, données probantes de certitude très faible).
Test d’apnée
Nous suggérons d’utiliser un seuil de pression partielle de CO2 artériel (PaCO2) de ≥ 60 mm Hg (et ≥ 20 mm Hg au-dessus de la valeur de base) lors de la réalisation d’un test d’apnée chez les patients soumis à un DCN (recommandation faible, données probantes de certitude très faible).
Nous suggérons d’utiliser soit la pression positive (pression positive continue), soit l’oxygénation passive lors de la réalisation du test d’apnée chez les patients soumis à un DCN (recommandation faible, données probantes de certitude faible).
Nous suggérons d’utiliser du CO2 administré de manière exogène pour les patients soumis à un DCN qui ont une probabilité pré-test élevée d’instabilité cardiorespiratoire pouvant empêcher la complétion du test d’apnée ou qui ne peuvent pas compléter le test d’apnée en raison d’une instabilité cardiorespiratoire (recommandation faible, données probantes de certitude faible).
Examens auxiliaires – adultes
Nous suggérons de réaliser une tomodensitométrie de perfusion, une angiographie par tomodensitométrie, une échographie Doppler transcrânienne ou une étude de perfusion cérébrale nucléaire utilisant un produit radiopharmaceutique lipophile (avec ou sans imagerie tomographique) chez les patients adultes nécessitant des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude très faible à modérée).
Nous suggérons de ne pas réaliser d’électroencéphalographie (EEG), de test des potentiels évoqués auditifs du tronc cérébral, de test des potentiels évoqués somatosensoriels, d’étude sur la circulation cérébrale nucléaire uniquement utilisant un produit radiopharmaceutique lipophobe, d’angiographie cérébrale à quatre vaisseaux ou d’imagerie par résonance magnétique chez les patients adultes nécessitant des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude très faible).
Examens auxiliaires – pédiatrie
Nous suggérons de réaliser une étude de perfusion cérébrale nucléaire utilisant un produit radiopharmaceutique lipophile tel que le 99mTc-hexa-méthyl-propylène-amine oxime (HMPAO) ou son équivalent (qui incorpore à la fois une phase de circulation et une phase parenchymateuse) avec ou sans imagerie tomographique chez les patients pédiatriques nécessitant des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude faible).
Nous suggérons de réaliser une étude de circulation cérébrale nucléaire utilisant un produit radiopharmaceutique lipophobe tel que l’acide 99mTc-diéthylène-triamine-pentaacétate (DTPA), le 99mTc-glucoheptonate (GHA), le 99mTc-technétium-pertechnétate, ou un équivalent (qui n’incorpore qu’une phase de circulation) lorsqu’un examen utilisant un produit radiopharmaceutique lipophile ne peut pas être réalisé, chez les patients pédiatriques qui nécessitent des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude faible).
Nous suggérons de ne pas réaliser d’EEG, d’échographie Doppler transcrânienne, de test des potentiels évoqués auditifs du tronc cérébral, de test des potentiels évoqués somatosensoriels, d’angiographie par tomodensitométrie ou d’angiographie à quatre vaisseaux chez les patients pédiatriques nécessitant des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude très faible).
Nous suggérons de ne pas réaliser d’examen auxiliaire chez les nourrissons de moins de deux mois d’âge gestationnel corrigé qui nécessitent des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude très faible).
Énoncés de bonnes pratiques
Les énoncés de bonnes pratiques suivants s’appliquent à la fois au DCC et au DCN, sauf indication contraire :
Une équipe de soutien multidisciplinaire (p. ex. personnel infirmier, travailleurs sociaux, psychologues, intervenants en soins spirituels, responsables religieux et coordonnateurs de dons, le cas échéant) devrait participer aux discussions en matière de soins le plus rapidement possible lorsqu’on soupçonne qu’un patient peut évoluer vers un décès.
Tout clinicien participant à une détermination de décès doit posséder les compétences, la formation et les connaissances requises en matière de processus et de procédures de détermination du décès.
Les médecins qui supervisent et interprètent les examens radiologiques auxiliaires pour un DCN devraient être formés en neuroradiologie et avoir de l’expérience dans la réalisation et l’interprétation de l’examen spécifique réalisé. Pour l’angiographie par tomodensitométrie, les radiologistes devraient posséder l’expérience requise dans l’utilisation du protocole et de l’échelle appropriés. Pour la tomodensitométrie de perfusion, les radiologistes devraient posséder la formation requise quant à l’exécution et l’interprétation de cet examen.
Les médecins qui supervisent et interprètent les examens nucléaires auxiliaires pour un DCN devraient avoir complété une résidence en médecine nucléaire et avoir de l’expérience dans la réalisation et l’interprétation de l’examen spécifique réalisé.
Dans tous les cas de don potentiel d’organes, les cliniciens qui déterminent le décès ne doivent pas avoir d’association ou de participation active aux procédures de transplantation, à l’attribution d’organes ou aux soins des receveurs de greffe prévus.
Le cas échéant, l’évaluation pour un DCN devrait être réalisée chez toutes les personnes atteintes de lésions cérébrales dévastatrices qui sont considérées comme répondant à ces critères, quel que soit le potentiel de don d’organes.
La cause d’une lésion cérébrale dévastatrice doit être étayée par des données de neuroimagerie compatibles avec la cause établie.
Une liste de contrôle normalisée devrait être utilisée pour la détermination et la documentation du décès.
L’accomplissement de toutes les phases de détermination d’un décès doit être clairement documenté par le médecin responsable dans le dossier médical du patient.
Les médecins qui supervisent et interprètent les examens d’échographie Doppler transcrânienne pour un DCN devraient être formés adéquatement en neurosonologie et avoir de l’expérience dans la réalisation et l’interprétation de l’examen spécifique réalisé.
Communication avec les mandataires spéciaux et/ou membres de la famille
Étant donné que les mandataires spéciaux, les familles et le public pourraient avoir de la difficulté à comprendre un DCN,3,4 une grande partie de l’information ci-dessous est liée au DCN. En ce qui concerne le DCC, les cliniciens devraient aider les familles à se préparer à la nature urgente du processus de détermination du décès et à la période d’observation axée sur la confirmation de l’arrêt permanent de la circulation.
Le consentement pour les examens effectués dans le cadre d’un DCN ne devrait être ni requis ni demandé. Néanmoins, les cliniciens peuvent faciliter la compréhension et l’acceptation d’un DCN par les membres de la famille, ce qui peut également améliorer les issues du processus de deuil. Les considérations particulières comprennent : 1) l’utilisation d’un langage clair et cohérent concernant le DCN, 2) la préparation à l’avance des mandataires spéciaux et des familles aux étapes typiques pendant et après un DCN, 3) la reconnaissance du fait que ce que les mandataires spéciaux et les familles voient (p. ex., la poitrine du patient qui s’élève et descend) et ressentent (p. ex., la température corporelle chaude du patient) peut rendre difficile la compréhension d’un DCN, 4) l’anticipation et la clarification de la signification des réponses motrices spinales, 5) la répétition de l’information (p. ex., au fil de plusieurs rencontres) pour améliorer la compréhension des mandataires spéciaux et des familles, 6) le recours à des méthodes de communication multimodales (p. ex., proposer de montrer des images lorsque cela est possible et/ou fournir de l’information écrite, comme des outils d’information destinés aux familles), 7) l’invitation des mandataires spéciaux et des familles à assister à l’évaluation clinique du DCN, et 8) l’offre à la famille d’occasions pour accomplir des rituels qui accompagnent les transitions de la vie à la mort.
Il existe des raisons légitimes de permettre des aménagements raisonnables pour accommoder la résistance au DCN des mandataires spéciaux et des familles.5 La résistance au DCN peut être formulée en termes de droits légaux comme la liberté de religion, ou elle peut être liée à des facteurs tels que le choc, le chagrin, l’incompréhension ou la méfiance à l’égard de la détermination du décès. Il n’est pas conseillé d’exempter les patients dont les mandataires spéciaux ou les familles s’opposent des procédures de détermination du décès : en effet, les cliniciens doivent être en mesure d’évaluer l’état vital des patients dont ils prennent soin. Néanmoins, dans des circonstances exceptionnelles, on peut envisager de retarder le retrait de la ventilation et d’autres assistances somatiques après un DCN pendant une période relativement courte (c.-à-d. quelques jours).
Principales différences par rapport aux recommandations canadiennes antérieures
Ces Lignes directrices entraîneront des changements dans les pratiques canadiennes dans plusieurs domaines clés :
La définition du décès
Une définition unique du décès basée sur l’arrêt permanent de la fonction cérébrale.
Pour la détermination du décès selon des critères circulatoires
-
2.
L’utilisation d’une surveillance invasive continue de la tension artérielle et d’une pression pulsée artérielle ≤ 5 mm Hg sont nécessaires pour confirmer l’arrêt définitif de la circulation. L’ECG peut être envisagé dans les cas où une canule artérielle n’est pas fiable ou n’est pas insérée. D’autres méthodes de surveillance non invasives ne doivent pas être utilisées.
-
3.
Un temps d’observation de dix minutes pour confirmer l’arrêt définitif de la circulation chez les patients impliqués par un don non contrôlé après un DCC.
-
4.
L’arrêt permanent de la circulation intracrânienne (cérébrale) doit être maintenu si des interventions de don d’organes post-mortem sont effectuées.
Pour la détermination du décès selon des critères neurologiques
-
5.
La cause d’une lésion cérébrale dévastatrice doit être étayée par des données de neuroimagerie compatibles avec la cause établie.
-
6.
Un délai de 48 heures à compter du moment de reprise de la circulation spontanée après un arrêt cardiaque chez les patients présentant une atteinte hypoxique-ischémique dont les données d’imagerie ne sont pas compatibles avec une lésion cérébrale dévastatrice avant de réaliser l’évaluation clinique pour un DCN.
-
7.
Le retrait du réflexe oculocéphalique comme élément de l’évaluation clinique pour un DCN.
-
8.
Une température corporelle centrale de ≥ 36°C (au lieu de ≥ 34°C) avant d’effectuer l’évaluation clinique pour un DCN.
-
9.
Des recommandations pour les tests d’apnée qui incluent l’oxygénation passive, la pression positive continue ou l’administration de CO2 exogène.
-
10.
Une lésion cérébrale infratentorielle sans atteinte supratentorielle significative ne répond pas aux critères de DCN et nécessite des examens auxiliaires.
-
11.
Les recommandations d’examens auxiliaires chez l’adulte comprennent maintenant l’échographie Doppler transcrânienne, la tomodensitométrie de perfusion, l’angiographie par tomodensitométrie ou une étude de perfusion cérébrale nucléaire avec utilisation d’un agent lipophile. L’angiographie à quatre vaisseaux n’est plus recommandée.
-
12.
Les examens auxiliaires pédiatriques privilégient une étude de perfusion nucléaire avec utilisation d’un agent lipophile et, si elle n’est pas disponible, une étude de circulation cérébrale nucléaire avec utilisation d’un agent lipophobe. L’angiographie à quatre vaisseaux n’est plus recommandée.
-
13.
Les examens auxiliaires ne sont plus recommandés pour les nourrissons de moins de deux mois d’âge gestationnel corrigé.
-
14.
Un minimum de 24 heures entre chaque évaluation clinique pour les nourrissons de moins de deux mois est conseillé. L’intervalle de temps peut être prolongé selon le jugement du médecin.
Conclusion
Les présentes Lignes directrices fournissent une définition biomédicale du décès fondée sur l’arrêt permanent de la fonction cérébrale et définissent les termes qui font partie intégrante de son utilisation. Elles fournissent des recommandations pour le DCN pour tous les patients ventilés mécaniquement ainsi que des recommandations pour le DCC pour les donneurs d’organes potentiels. Des stratégies et des approches pour interagir et communiquer avec les mandataires spéciaux et/ou les familles sont également proposées. Les présentes Lignes directrices visent à encourager l’uniformité et à améliorer la clarté et la confiance à l’égard des pratiques de détermination du décès au Canada.
Glossaire des termes et abréviations
| Assistance somatique |
Interventions utilisées pour maintenir la fonction du corps et des organes à l’exclusion du cerveau, après un DCN. Variablement appelé soutien mécanique, physiologique ou organique. |
| Autoréanimation | La reprise non assistée de la circulation spontanée. |
| Conditions confondantes | Circonstances au cours desquelles un test diagnostique ou une évaluation clinique peut devenir peu fiable et nécessiter une répétition au fil du temps ou la réalisation d’un examen auxiliaire. |
| Conditions préalables | Exigences cliniques, de laboratoire ou d’imagerie liées au patient qui doivent être remplies avant l’application de tests diagnostiques ou la réalisation d’une évaluation clinique pour la détermination du décès. |
| Conscience | La perception, y compris la capacité d’impression sensorielle ou de réactivité coordonnée à l’environnement extérieur, et l’éveil. |
| Décès du cerveau entier | Détermination du décès fondée sur l’arrêt de la fonction du tronc cérébral nécessitant la démonstration d’une atteinte du tronc cérébral et de l’encéphale. |
| Décès isolé du tronc cérébral | Une lésion cérébrale infratentorielle pour laquelle les conditions de DCN sont remplies, bien qu’il puisse y avoir des données aux examens auxiliaires appuyant la préservation de circulation sanguine, de perfusion ou de fonction neurophysiologique supratentorielle/cérébrale. |
| Déclaration de décès | Le moment où un professionnel de la santé, après avoir déterminé qu’une personne est décédée, déclare officiellement cette constatation et confirme l’heure légale du décès. |
| Détermination du décès | Les processus et tests requis pour déterminer le décès conformément aux pratiques médicales acceptées telles que décrites dans les lignes directrices nationales de pratique clinique au Canada. |
| Détermination du décès selon des critères circulatoires (DCC) | Processus de détermination du décès d’une personne en fonction de critères circulatoires. |
| Détermination du décès selon des critères neurologiques (DCN) | Processus de détermination du décès d’une personne en fonction de critères neurologiques. |
| Don après détermination du décès par des critères circulatoires (DDC) |
Fait référence à la récupération d’organes pour la transplantation sur des individus après un DCC. Auparavant appelé don après un décès cardiaque, don après un décès cardiocirculatoire, don d’organes sans battement cardiaque, don après un décès circulatoire et don après un arrêt cardiorespiratoire. Les catégories suivantes de la classification modifiée de Maastricht pour le don d’organes sont prises en compte dans les présentes Lignes directrices : • Catégorie II : don non contrôlé après DCC en cas d’arrêt cardiaque irréversible soudain et inattendu avec réanimation infructueuse. Cela peut se produire à l’intérieur ou hors de l’hôpital; • Catégorie III : don contrôlé après DCC à la suite de l’interruption des traitements de maintien des fonctions vitales en cas d’arrêt cardiaque anticipé; • Catégorie V : don autorisé après DCC à la suite de l’aide médicale à mourir où un arrêt cardiaque est anticipé. Voir la liste complète des catégories de Maastricht pour plus de détails sur le DDC contrôlé et non contrôlé (Thuong M, Ruiz A, Evrard P, et al. New classification of donation after circulatory death donors definitions and terminology. Transpl Int 2016; 29: 749). |
| Évaluation clinique |
Variablement appelé examen clinique ou examen physique. Une observation ou un examen direct et mesurable du patient. Une évaluation clinique pour un DCN nécessite tous les éléments suivants : - l’absence de conscience démontrée par un manque d’éveil et de perception en réponse à des stimuli externes; et - l’absence de fonction du tronc cérébral telle que démontrée par l’évaluation des nerfs crâniens; et - l’absence de capacité à respirer telle que démontrée par un test formel d’apnée. L’évaluation clinique doit être réalisée dans toute la mesure du possible (y compris les réponses motrices bilatérales, les réflexes du tronc cérébral bilatéraux et les tests d’apnée), ce qui signifie que tous les aspects de l’évaluation doivent être complétés à moins qu’ils ne puissent être réalisés en raison d’une affection préexistante (p. ex. anophtalmie), d’affections acquises (p. ex. lésion de la colonne cervicale) ou pour des raisons de sécurité (p. ex. instabilité empêchant la réalisation ou la complétion du test d’apnée). L’évaluation clinique pour la détermination du décès par des critères circulatoires nécessite des tests montrant l’arrêt définitif de la circulation vers le cerveau. |
| Examens auxiliaires | Dans le DCN, un examen auxiliaire est un test de circulation sanguine cérébrale ou de la perfusion cérébrale en tant que test alternatif à l’évaluation clinique qui, autrement, pour quelque raison que ce soit, ne peut pas être réalisée ou n’est pas fiable (en raison de conditions confondantes qui ne peuvent pas être résolues ou si l’évaluation clinique complète ne peut pas être réalisée). |
| Fonction cérébrale | Les fonctions vitales du cerveau comprennent la conscience et le comportement, la coordination et le contrôle du mouvement, et la capacité de respirer. |
| Fonction du tronc cérébral | Fait référence aux réflexes du tronc cérébral, y compris la capacité de respirer sans soutien mécanique et la génération de conscience découlant du système d’activation réticulaire. |
| Interruption des thérapies de maintien des fonctions vitales |
Dans le contexte des soins de fin de vie, décision consensuelle d’interrompre un traitement qui, autrement, prolongerait la vie sans inverser la condition sous-jacente potentiellement mortelle. Les mesures les plus fréquemment retirées sont la ventilation mécanique, le soutien par inotropes/vasopresseurs de la fonction hémodynamique et l’assistance circulatoire mécanique. Au cours de ce processus, les mesures de confort pour le patient mourant sont au centre des préoccupations. Appelé de façon variable l’interruption des thérapies ou des traitements de maintien des fonctions vitales ou l’interruption des interventions de maintien des fonctions vitales. |
| Lésion cérébrale dévastatrice | Lésion cérébrale (traumatisme, hémorragie sous-arachnoïdienne, accident vasculaire cérébral, atteinte hypoxique, etc.) qui est considérée comme une menace immédiate à la vie ou incompatible avec une bonne récupération fonctionnelle, pour laquelle aucun traitement efficace ne subsiste et où la limitation précoce ou l’arrêt du traitement est envisagé en mettant l’accent sur les soins de fin de vie. |
| Lésion cérébrale infratentorielle | Une lésion du tronc cérébral et/ou du cervelet due à une pathologie infratentorielle telle qu’un accident vasculaire cérébral ischémique ou hémorragique. |
| Mort cérébrale | Fait référence au DCN défini comme l’arrêt permanent de la fonction cérébrale et caractérisé par l’absence de conscience, de réflexes du tronc cérébral et de la capacité de respirer de manière autonome. |
| Permanent | Se rapportant à une fonction ou une condition qui ne reviendra pas à son état précédent. Dans le contexte de la détermination du décès, fait référence à la perte d’une fonction qui ne reprendra pas spontanément (d’elle-même) et ne sera pas restaurée par une intervention. |
| Pratique médicale acceptée | Normes de pratique médicale fondées sur des données probantes scientifiques crédibles publiées dans des publications médicales évaluées par des pairs et généralement reconnues par la communauté médicale concernée. Pourrait inclure, sans toutefois s’y limiter, les recommandations ou les lignes directrices de sociétés de médecins spécialistes, les points de vue de médecins exerçant dans le domaine clinique pertinent et d’autres facteurs pertinents. |
| Principes médicaux fondamentaux (PMF) | Contrairement aux énoncés réalisables existants, les PMF sont des énoncés qui reflètent la compréhension collective des intervenants des principes qui constituent les fondements des cadres médical, juridique et éthique de la détermination du décès au Canada. Ces énoncés visent à décrire les aspects fondamentaux de la détermination du décès qui étaient nécessaires et fondés sur des concepts et des pratiques historiques et en évolution plutôt que sur une évaluation formelle d’une base de données probantes. |
| Réflexes moteurs spinaux | Réponses/mouvements spontanés ou réflexes basés uniquement sur la fonction de la moelle épinière sans aucune transmission vers et depuis le tronc cérébral et le cerveau. Peut inclure des réponses de flexion/extension plantaire, un réflexe de triple flexion, un réflexe abdominal, un réflexe crémastérien, des réflexes toniques du cou, des secousses isolées des membres supérieurs, des mouvements unilatéraux d’extension-pronation, une position opisthotonique asymétrique du tronc, une flexion ondulante des orteils, des myoclonies, des mouvements semblables à la respiration, une contraction du quadriceps et des mouvements des jambes imitant les mouvements périodiques des jambes. |
| Temps d’observation |
La période de temps après l’arrêt de la circulation qui est nécessaire pour s’assurer que l’arrêt de la circulation est permanent pour un DCC. Variablement appelée période « sans intervention » ou « sans contact ». |
Tout en reconnaissant respectueusement qu’il existe de nombreuses croyances philosophiques, religieuses et culturelles différentes liées au concept du décès, les professionnels de la santé exigent une définition biomédicale légalement reconnue du décès. Les critères de détermination du décès sont fondés sur des indicateurs biologiques mesurables et des procédures qui doivent être appliquées pour satisfaire à la définition. Alors que la détermination du décès devrait être universellement exacte et opportune dans tous les cas, les critères sont particulièrement essentiels pour garantir la pratique légale et éthique du don d’organes d’un donneur décédé lorsque la conséquence immédiate de la détermination du décès est la collecte d’organes.6
Au Canada, les définitions de décès peuvent se trouver dans les lois provinciales et territoriales et varient d’une province à l’autre.7 Lorsqu’une définition est incluse dans une telle loi, le décès est soit défini comme la cessation de la fonction cérébrale, ou la définition inclut la mort cérébrale. Sinon, la définition qui prévaut est celle du common law adoptée par la magistrature, qui a jusqu’à présent accepté l’arrêt de la fonction cérébrale ou cardiorespiratoire. Dans la majorité des provinces, les critères de détermination du décès dans le contexte du don d’organes sont délégués par la loi à la pratique médicale reconnue. Les lignes directrices canadiennes antérieures sur la détermination du décès qui constituent le fondement de la pratique médicale acceptée décrivent le décès comme survenant après la cessation de la fonction cérébrale (auparavant appelé le décès neurologique ou la mort cérébrale),8 de la fonction circulatoire (auparavant appelée décès cardiocirculatoire ou décès circulatoire)9 et des fonctions cardiocirculatoires et cérébrales combinées.10 Dorénavant, cette nomenclature historique sera remplacée par détermination du décès selon des critères neurologiques (DCN) et détermination du décès selon des critères circulatoires (DCC).
Des questions médicales, juridiques et éthiques ont émergé, qui ont toutes collectivement justifié la révision et la mise à jour des lignes directrices, notamment :
L’élaboration de normes internationales pour harmoniser les pratiques internationales en matière de DCN;11
Des progrès dans les connaissances et de nouvelles données probantes liées à la physiologie du processus de la mort après l’interruption des traitements de maintien des fonctions vitales pour le DCC12 et l’utilisation d’examens auxiliaires pour le DCN;
Des cas juridiques récents en Ontario où des familles ont contesté le DCN et les directives médicales acceptées; et13,14
Des progrès dans le soutien technologique de la fonction des organes pour soutenir la vie avant la mort ou préserver les organes après la mort.15
En réponse, Santé Canada a financé un projet intitulé « Définition uniformisée de la mort cérébrale et de critères fondés sur des données probantes pour sa détermination au Canada », un partenariat entre la Société canadienne du sang, la Société canadienne de soins intensifs et l’Association médicale canadienne. Les objectifs du projet étaient d’élaborer une définition unifiée de la mort cérébrale et de mettre à jour les critères de sa détermination après une lésion cérébrale dévastatrice ou un arrêt circulatoire.
La définition biomédicale du décès et les procédures médicales pour déterminer le décès selon des critères neurologiques et circulatoires devraient être uniformes dans les provinces, les territoires et dans l’ensemble du pays. Toute variation sur cette question d’importance médicale et juridique fondamentale peut conduire à des incongruités, de la confusion et de la méfiance. Une définition cérébrale du décès est conforme à l’approche recommandée par la Commission de réforme du droit du Canada en 198116 (et approuvée à l’époque par la communauté médicale) pour définir tout décès en termes de cessation de la fonction cérébrale, et pour permettre que cet état soit déterminé par des critères neurologiques ou circulatoires.6,7 Toutes les provinces et tous les territoires canadiens acceptent déjà le décès défini en termes neurologiques. Une définition cérébrale du décès affine davantage l’approche médicale en définissant le décès uniquement en fonction de la cessation de la fonction cérébrale et offre des procédures claires pour déterminer le décès selon des critères neurologiques et circulatoires.
Les recommandations mises à jour pour la pratique canadienne de détermination du décès dans ces Lignes directrices ont été développées à la suite d’un délai de 16 ans après les recommandations pour un DCN adulte1 et pour le don d’organes après un DCC,2 et un délai de cinq ans après les recommandations pour le don d’organes pédiatrique après un DCC.10 Entre-temps, non seulement le volume de données probantes disponibles pour éclairer les recommandations a augmenté, mais depuis 2006, la rigueur requise pour le processus d’élaboration des lignes directrices a également augmenté.
Les présentes Lignes directrices remplacent les recommandations canadiennes publiées précédemment, qui sont indiquées ci-dessous :
En 2006, De l’atteinte cérébrale grave au diagnostic de décès neurologique : recommandations issues du Forum canadien8 (document complet);
En 2006, Recommandations nationales pour le don après un décès d’origine cardiocirculatoire : Le don après un décès d’origine cardiocirculatoire au Canada9 (sections : 2. Décès et critères minimums pour procéder à un don d’organes; 5.1 g Interventions en vue d’un don);
En 2017, Lignes directrices canadiennes sur le don après décès selon des critères circulatoires contrôlé en milieu pédiatrique10 (section : Normes minimales requises pour la détermination du décès dans le don pédiatrique après un DCC).
On s’attend à ce que les directives de pratique clinique, élaborées par un comité multidisciplinaire d’élaboration de lignes directrices comprenant des partenaires patients-familles et le public, fondées sur les interprétations médicales et juridiques contemporaines des fondements biologiques du décès et approuvées par de nombreux organismes de soins de santé canadiens, favoriseront l’uniformité et amélioreront la clarté et la confiance dans les pratiques de détermination du décès partout au Canada.
En plus des présentes Lignes directrices de pratique clinique, les évaluations de données probantes utilisées pour éclairer ce projet sont incluses dans le Numéro spécial (tableau 1). Plusieurs documents à l’appui figurent également dans le Matériel électronique supplémentaire (MES) (tableau 2).
Tableau 1.
Titres des articles inclus dans le Numéro spécial du Journal sur la détermination du décès au Canada
| Titre de l’article | Type d’article |
|---|---|
| 1. Une définition cérébrale du décès et des critères pour sa détermination après l’arrêt de la circulation ou de la fonction neurologique au Canada : des lignes directrices de pratique clinique 2023 (cet article) | Article spécial |
| 2. Note de la rédaction : L’évolution du contenu portant dédié aux soins intensifs dans le Journal et un numéro spécial « spécial » | Note de la rédaction |
| 3. Relever les défis mondiaux liés à la détermination du décès : le leadership canadien en matière de création de consensus (rédacteurs invités)61 | Éditorial |
| 4. Mise à jour des Lignes directrices de pratique pour la détermination du décès : un pas de géant dans ce domaine mené par le Canada | Éditorial |
| Définition de la mort | |
| 5. Justification des révisions apportées à la définition du décès et à ses critères de détermination au Canada6 | Article spécial |
| 6. Considérations juridiques pour la définition du décès dans les Lignes directrices canadiennes de pratique clinique pour la détermination du décès cérébral de 20237 | Article de revue |
| 7. Équilibrer les valeurs : implications d’une définition cérébrale du décès pour le pluralisme au Canada62 | Réflexions |
| 8. Les lésions cérébrales infratentorielles répondent-elles à la détermination du décès selon des critères neurologiques au Canada?31 | Article de revue |
| 9. Que signifie « mort du tronc cérébral »? Un examen des protocoles internationaux26 | Compte rendu de recherches originales |
| 10. Le système d’activation réticulaire : un compte rendu narratif de sa découverte, de l’évolution de sa compréhension et de sa pertinence pour les formulations actuelles de la mort cérébrale30 | Article de revue |
| Critères pour la détermination du décès | |
| 11. Le consentement pour la détermination du décès selon des critères neurologiques au Canada : analyse de la jurisprudence et des considérations éthiques, et recommandations consensuelles du groupe de travail32 | Article spécial |
| 12. Surveillance de l’arrêt de la circulation pour la détermination du décès selon des critères circulatoires : une revue systématique40 | Article de revue |
| 13. Seuil de pression pulsée artérielle basé sur le cerveau pour la détermination du décès : une revue systématique41 | Article de revue |
| 14. Autoréanimation après un arrêt circulatoire : une revue systématique mise à jour42 | Article de revue |
| 15. Variabilité des critères de détermination du décès aux soins intensifs63 | Compte rendu de recherches originales |
| 16. Facteurs confondants pharmacologiques potentiels dans le contexte d’un décès déterminé selon des critères neurologiques : un compte rendu narratif44 | Article de revue |
| 17. Examens auxiliaires pour la détermination du décès chez les nourrissons et les enfants : revue systématique et méta-analyse47 | Article de revue |
| 18. La scintigraphie nucléaire comme examen auxiliaire pour la détermination du décès chez les nourrissons de moins de deux mois54 | Correspondance |
| 19. Précision diagnostique des examens auxiliaires pour le décès déterminé selon des critères neurologiques : une revue systématique et une méta-analyse46 | Article de revue |
| 20. Examens auxiliaires de perfusion nucléaire pour la détermination du décès selon des critères neurologiques : méthodes, interprétation et lexique – un guide de l’utilisateur à l’intention du clinicien51 | Article de revue |
| Communication avec les mandataires spéciaux et/ou les membres de la famille | |
| 21. Détermination du décès selon des critères neurologiques – que comprennent les familles?3 | Compte rendu de recherches originales |
| 22. Quand une personne est-elle décédée? La compréhension du public canadien du décès et de la détermination du décès : une enquête nationale4 | Compte rendu de recherches originales |
| 23. Se frayer un chemin entre désaccords et conflits dans le contexte d’une définition cérébrale du décès5 | Article de revue |
| 24. Confiance et conflit dans la détermination du décès – réflexions sur l’héritage de Taquisha McKitty64 | Réflexions |
| Recherches futures | |
| 25. Lacunes dans les connaissances sur la définition et la détermination du décès58 | Réflexions |
| 26. Répercussions de la mise à jour des Lignes directrices canadiennes sur la détermination du décès pour les interventions de don d’organes qui rétablissent la circulation après la détermination du décès selon des critères circulatoires65 | Présentation de cas |
| 27. Recherche non thérapeutique auprès de populations à l’étude mourantes ou récemment décédées : comment relever les défis pratiques et éthiques39 | Réflexions |
Tableau 2.
Documents justificatifs disponibles en tant qu’annexes électroniques dans le matériel électronique supplémentaire
|
1. Comité de développement 2. Étude de portée 3. Définitions du décès dans les directives et législations nationales et internationales 4. Stratégies de recherche 5. Méthodologie d’élaboration des lignes directrices 6. Rapport de discussion des professionnels des soins spirituels 7. Résumés des données probantes et justification des recommandations : détermination du décès selon des critères circulatoires 8. Gestion des facteurs confondants pharmacologiques dans la détermination du décès selon des critères neurologiques 9. Évaluation clinique pour la détermination du décès selon des critères neurologiques 10. Résumés des données probantes et justification des recommandations : détermination du décès selon des critères neurologiques 11. Lacunes dans les connaissances |
Champ d’application
Le champ d’application des présentes Lignes directrices de pratique clinique se limite aux critères de détermination du décès dans les circonstances suivantes :
Les donneurs d’organes potentiels qui seront soumis à un DCC, y compris les catégories suivantes de la classification modifiée de Maastricht pour le don d’organes :17
-
-
Catégorie II : don non contrôlé après DCC en cas d’arrêt cardiaque irréversible soudain et inattendu avec réanimation infructueuse. Cela peut se produire à l’intérieur ou hors de l’hôpital;
-
-
Catégorie III : don contrôlé après DCC à la suite d’une interruption planifiée des thérapies de maintien des fonctions vitales en cas d’arrêt cardiaque anticipé;
-
-
Catégorie V : don contrôlé après DCC à la suite de l’aide médicale à mourir (AMM) lorsqu’un arrêt cardiaque est anticipé.
Patients ventilés mécaniquement qui seront soumis à une DCN, indépendamment du potentiel de don d’organes.
Aux fins des présentes Lignes directrices, le groupe d’âge pédiatrique désigne les nouveau-nés (à partir d’un âge gestationnel corrigé de 37 semaines et jusqu’à moins de deux mois), les nourrissons (de deux mois à moins d’un an) et les enfants (d’un an à moins de 18 ans).
Les Lignes directrices ont été élaborées à l’intention des professionnels de la santé, des administrateurs d’hôpitaux, des sociétés de professionnels de la santé, des organismes de don d’organes et des décideurs qui participent à la détermination des décès. Leur mise en œuvre aura un impact sur les patients, les familles et le grand public.
La définition du décès devrait s’appliquer à toutes les personnes en toutes circonstances. Il est reconnu que la grande majorité des décès surviennent chez des personnes non admissibles au don d’organes, après un arrêt circulatoire en milieu préhospitalier et hospitalier, ainsi que dans les établissements de soins de longue durée et à domicile. En raison du champ d’application et de la profondeur susmentionnées de ce projet, il n’a pas été possible de collaborer avec les communautés professionnelles qui déterminent le décès après un arrêt circulatoire en dehors du don d’organes. Néanmoins, il est reconnu que les présentes Lignes directrices, compte tenu de leur processus d’élaboration rigoureux, peuvent influer sur les pratiques exemplaires pour déterminer le décès en toutes circonstances, y compris celles qui dépassent la portée de cette initiative.
Méthode
La rédaction de ces Lignes directrices est conforme à la liste de contrôle RIGHT.1 Le comité d’élaboration des lignes directrices était composé d’infirmières et de médecins en soins intensifs (adultes et pédiatriques), de radiologistes, de neurologues, de neurointensivistes, d’anesthésiologistes, d’éthiciens, d’avocats, de familles de patients, de partenaires publics et de méthodologistes ayant une expertise dans l’élaboration de lignes directrices conformément à l’outil GRADE.18 Les membres du comité ont été choisis par le comité directeur et invités à participer en fonction de leur spécialité, de leur expertise, de leur représentation professionnelle, de leur sexe, de leur provenance géographique et de leur diversité raciale. Une liste complète des membres du comité d’élaboration des lignes directrices est disponible dans l’annexe électronique 1 en MES.
Nous avons divisé les membres du comité en sept groupes de travail : 1) la définition du décès, 2) la détermination du décès selon des critères circulatoires, 3) la détermination du décès selon des critères neurologiques, 4) les examens auxiliaires, 5) le décès du cerveau entier par rapport au décès du tronc cérébral, 6) les considérations juridiques et éthiques, et 7) la mobilisation des intervenants.
La définition du décès
Pour élaborer la définition du décès, les définitions de la mort dans les lignes directrices nationales et internationales sur la détermination du décès ont été examinées dans la base de données Ovid MEDLINE (de 1946 au 5 juin 2020) le 6 juin 2020, en utilisant un vocabulaire contrôlé (MeSH) et des mots textuels pour les concepts suivants en anglais : death (y compris le décès neurologique et circulatoire), definitions et guidelines (soit décès, définitions et lignes directrices). D’autres recherches ont été réalisées dans les sources de lignes directrices internationales de la liste de vérification Matière grise de l’Agence canadienne des médicaments et des technologies de la santé (ACMTS) ainsi que dans les sites internet de sociétés professionnelles utilisés dans un examen antérieur des lignes directrices sur la détermination du décès pour les arrêts circulatoires.19 Les résultats se limitaient aux documents en anglais et en français publiés depuis 2003. D’autres recherches dans la littérature grise, y compris les sites internet des sociétés professionnelles et les bases de données juridiques, ont également été menées. Tous les détails sont disponibles dans les annexes électroniques 2 et 3 en MES.
Une ébauche de définition a été créée par le comité directeur du projet, puis examinée et révisée par le comité d’élaboration des lignes directrices à l’aide d’une adaptation de la technique du groupe nominal.2 Les membres du groupe des lignes directrices ont été séparés en petits groupes pour discuter de la définition, des concepts et de la terminologie proposés pour le décès. Les avis et les propositions de modifications émanant de ces groupes ont été discutés lors de séances plénières. Des révisions ont été apportées par le groupe de travail sur la définition du décès. D’autres commentaires ont été obtenus auprès de groupes de discussion publics, pour lesquels une vidéo éducative de 90 secondes comportant des illustrations médicales3 a été produite en anglais et en français afin d’expliquer le concept d’une définition cérébrale du décès. Des modifications subséquentes ont été apportées après d’autres révisions et un consensus a été atteint par le comité d’élaboration des lignes directrices.
Principes médicaux fondamentaux, recommandations et énoncés de bonnes pratiques.
Le comité a dérivé et hiérarchisé les questions cliniques à traiter dans le cadre des Lignes directrices après un examen des documents récupérés par une étude systématique de portée des lignes directrices sur la détermination du décès (voir l’annexe électronique 2 en MES). Les questions cliniques identifiées ont été divisées en trois catégories générales, soit : les questions recevables portant sur les patients, l’intervention, le comparateur et les résultats (PICO en anglais), les énoncés de bonnes pratiques, et les principes médicaux fondamentaux. Les PICO recevables ont été soumises à l’approche globale GRADE,20 tandis que les énoncés de bonnes pratiques sont des concepts bien reconnus qui sont utilisés pour les recommandations et ne se prêtent pas à des évaluations formelles de la qualité des données probantes.21 Afin de fournir des conseils cliniques sur des questions cliniques spécifiques qui sont éclairées par des considérations médicales, juridiques et éthiques en dehors de la portée de l’élaboration de lignes directrices de pratique clinique traditionnelles, nous avons créé une nouvelle forme d’énoncé appelée les principes médicaux fondamentaux (PMF). Contrairement aux énoncés réalisables existants, ces énoncés reflètent la compréhension collective des intervenants des principes qui constituent les fondements des cadres médical, juridique et éthique de la détermination du décès au Canada. Ces énoncés visaient à décrire les aspects fondamentaux de la détermination du décès qui étaient nécessaires et fondés sur des concepts et des pratiques historiques et en évolution plutôt que sur une évaluation formelle d’une base de données probantes. Les principes médicaux fondamentaux ont été proposés par les membres du comité directeur chargé de l’élaboration des lignes directrices, puis examinés de façon itérative et approuvés par tous les membres du comité d’élaboration du guide. Nous avons intégré les commentaires des patients partenaires à chaque étape.
Les membres du comité ont évalué les résultats d’intérêt en fonction de l’importance perçue pour les patients pour la prise de décision clinique sur une échelle de 1 (pas important) à 9 (importance critique) et ont travaillé avec un spécialiste de l’information pour examiner systématiquement la littérature et en tirer les études examinant chacune des 14 questions touchant aux PICO. Pour les questions touchant aux PICO neurologiques et circulatoires, nous avons effectué des recherches dans les bases de données MEDLINE Ovid, EMBASE Ovid, Cochrane Central Register of Controlled Trials et Science Citation Index Expanded via Web of Science de leur création jusqu’à aujourd’hui. Pour les questions touchant aux examens auxiliaires, les recherches ont été effectuées conformément aux directives PRESS Peer le 5 février 2022, dans les bases de données ci-dessus (à l’exclusion du Science Citation Index) et dans CINAHL Ebsco (voir Stratégies de recherche dans l’annexe électronique 4 en MES pour plus de détails sur toutes les stratégies de recherche).
Pour chaque question PICO, deux chercheurs ont examiné les titres et les résumés, puis les manuscrits en texte intégral, de façon indépendante et en double à l’aide des logiciels Covidence® (Veritas Health Innovation Ltd., Melbourne, VIC, Australie) et insightScope® (Ottawa, ON, Canada). De la même manière, plusieurs investigateurs ont effectué l’extraction des données de façon indépendante et en double pour chaque étude incluse. Nous avons généré un profil de données probantes pour chacune des questions PICO.22 Au besoin, des profils de données probantes supplémentaires ont été créés pour résumer la littérature propre aux populations des sous-groupes considérés. Conformément à la méthodologie GRADE, la certitude de chaque critère d’évaluation a été jugée élevée, modérée, faible ou très faible.23
Les recommandations ont été formulées à l’aide du cadre Evidence-to-Decision (des données probantes à la décision) de la méthodologie GRADE, qui tient compte de la certitude des données probantes, de l’équilibre entre les effets souhaitables et indésirables, des valeurs et des préférences des patients, de l’utilisation des ressources, de l’équité en santé, de l’acceptabilité et de la faisabilité.24 Nous avons désigné les recommandations comme fortes (en utilisant la formulation « nous recommandons ») ou faibles (en utilisant la formulation « nous suggérons »).25 Le tableau 3 décrit les implications de la force d’une recommandation.
Tableau 3.
Implications des recommandations fortes et faibles pour les différents utilisateurs des Lignes directrices Tiré de Rochwerg et coll.66 qui a été modifié à partir de Guyatt GH et coll.20
| Recommandation forte | Recommandation faible | |
|---|---|---|
| Pour les patients | La plupart des personnes dans cette situation choisiraient la mesure recommandée, et seule une très faible proportion ne la choisirait pas. | La majorité des personnes dans cette situation voudraient suivre le plan d’action suggéré, mais beaucoup ne le voudraient pas. |
| Pour les cliniciens | La plupart des personnes devraient recevoir le plan d’action recommandé. Le respect de cette recommandation conformément aux Lignes directrices pourrait être utilisé comme critère de qualité ou indicateur de performance. Des outils formels d’aide à la prise de décision ne seront probablement pas nécessaires pour assister les individus à prendre une décision qui respecte leurs valeurs et leurs préférences. | Il convient de reconnaître que différents choix conviendront à différents patients et que vous devez aider chaque patient à parvenir à une décision de prise en charge qui respectera ses propres valeurs et préférences. Les outils d’aide à la prise de décision pourraient être utiles pour aider les personnes à prendre des décisions qui respectent leurs valeurs et leurs préférences. Les cliniciens doivent s’attendre à passer plus de temps avec les patients lorsqu’ils cheminent vers une décision. |
| Pour les responsables de l’élaboration des politiques | La recommandation peut être adaptée en tant que politique dans la plupart des situations, y compris pour l’utiliser comme indicateur de performance. | L'élaboration d’une politique nécessitera de nombreuses discussions et la participation de nombreuses parties intéressées. Les politiques sont également plus susceptibles de varier d’une région à l’autre. Les indicateurs de performance devraient être axés sur le fait que les options de prise en charge ont fait l’objet de délibérations adéquates. |
Le libellé final des recommandations, des énoncés de bonnes pratiques et des PMF a été examiné et approuvé par tous les membres du comité (voir l’annexe électronique 5 en MES pour une description complète de la méthodologie des Lignes directrices). Au total, cinq PMF, 20 recommandations (six fortes, 14 faibles) et neuf énoncés de bonnes pratiques ont été produits (tableau 4).
Tableau 4.
Recommandations des Lignes directrices de pratique clinique
| Principes médicaux fondamentaux | |
| Le DCC se fait sur la base de l’absence de circulation extracrânienne, qui conduit à l’absence permanente de circulation intracrânienne (cérébrale). | |
| Les conditions préalables suivantes doivent être remplies avant de procéder à une évaluation clinique valide pour le DCN : il doit y avoir une cause établie de lésion cérébrale dévastatrice suffisamment grave pour causer le décès et appuyée par des données de neuroimagerie, et les facteurs confondants potentiels d’une évaluation clinique précise doivent avoir été pris en compte et exclus. | |
| Le DCN consiste principalement en une évaluation clinique qui nécessite les trois éléments suivants : 1) une absence de conscience démontrée par un manque d’éveil et de perception en réponse à des stimuli externes; 2) une absence de fonction du tronc cérébral telle que démontrée par une évaluation des nerfs crâniens; et 3) une absence de la capacité de respirer telle que démontrée par un test d’apnée formel. | |
| Toutes les composantes de l’évaluation clinique pour un DCN doivent être réalisées dans la mesure du possible. Si une évaluation clinique valide est entièrement réalisée, complète et compatible avec le décès, elle est alors suffisante pour déterminer le décès. Les examens auxiliaires seuls ne sont pas suffisants pour déterminer le décès et ne primeront pas sur une évaluation clinique incompatible avec le décès. | |
| Une évaluation clinique est nécessaire mais insuffisante pour établir un DCN chez les patients présentant une lésion cérébrale infratentorielle isolée sans atteinte supratentorielle. Des examens auxiliaires sont nécessaires pour déterminer le décès dans un tel cas. | |
| Détermination du décès selon des critères circulatoires | |
| Nous recommandons qu’une surveillance invasive continue de la tension artérielle soit utilisée pour confirmer l’arrêt permanent de la circulation chez les patients qui sont des donneurs d’organes potentiels soumis à un DCC (recommandation forte, données probantes de certitude modérée). | |
| Nous suggérons qu’une surveillance continue par électrocardiogramme soit utilisée pour confirmer l’arrêt permanent de la circulation lorsque l’utilisation d’une surveillance invasive de la tension artérielle n’est pas possible chez les patients qui sont des donneurs d’organes potentiels soumis à un DCC (recommandation faible, données probantes de certitude modérée). | |
| Nous recommandons qu’une pression pulsée artérielle ≤ 5 mm Hg et dans la marge d’erreur de mesure de l’équipement de surveillance clinique soit utilisée pour confirmer l’arrêt permanent de la circulation chez les patients munis d’une canule artérielle qui sont des donneurs d’organes potentiels soumis à un DCC (recommandation forte, données probantes de certitude très faible). | |
| Nous recommandons qu’un minimum de cinq minutes d’observation soit utilisé pour confirmer l’arrêt permanent de la circulation chez les patients qui sont des donneurs d’organes potentiels soumis à un don contrôlé après un DCC (recommandation forte, données probantes de certitude modérée). | |
| Nous recommandons qu’un minimum de dix minutes d’observation soit utilisé pour confirmer l’arrêt permanent de la circulation chez les patients qui sont des donneurs d’organes potentiels soumis à un don non contrôlé après un DCC (recommandation forte, données probantes de certitude faible). | |
| Détermination du décès selon des critères neurologiques | |
| Nous suggérons de retarder l’évaluation clinique d’au moins 48 heures à compter du moment de reprise de la circulation spontanée après un arrêt cardiaque chez les patients présentant une atteinte hypoxique-ischémique dont les données d’imagerie ne sont pas compatibles avec une lésion cérébrale dévastatrice soumis à un DCN (recommandation faible, données probantes de certitude faible). | |
| Nous suggérons de garantir une température corporelle centrale de ≥ 36°C pour les patients soumis à un DCN (recommandation faible, données probantes de certitude très faible). | |
| Nous suggérons d’utiliser soit la pupillométrie quantitative, soit l’évaluation clinique pupillaire pour les patients soumis à un DCN (recommandation faible, données probantes de certitude faible). | |
| Nous recommandons de ne pas ajouter de test du réflexe oculocéphalique au test du réflexe vestibulo-oculaire dans le cadre de l’évaluation clinique des patients soumis à un DCN (recommandation forte, données probantes de certitude modérée). | |
| Nous recommandons qu’une seule évaluation clinique complète soit suffisante pour les patients âgés d’un an ou plus qui sont soumis à un DCN (recommandation forte, données probantes de certitude modérée). | |
| Nous suggérons que deux évaluations cliniques complètes séparées dans le temps soient suffisantes pour les patients dont l’âge gestationnel corrigé est inférieur à un an qui sont soumis à un DCN (recommandation faible, données probantes de certitude très faible). | |
| Test d’apnée | |
| Nous suggérons d’utiliser un seuil de pression partielle de CO2 (PaCO2) de ≥ 60 mm Hg (et ≥ 20 mm Hg au-dessus de la valeur de base) lors de la réalisation d’un test d’apnée chez les patients soumis à un DCN (recommandation faible, données probantes de certitude très faible). | |
| Nous suggérons d’utiliser soit la pression positive (pression positive continue), soit l’oxygénation passive lors de la réalisation du test d’apnée chez les patients soumis à un DCN (recommandation faible, données probantes de certitude faible). | |
| Nous suggérons d’utiliser du CO2 administré de manière exogène pour les patients soumis à un DCN qui ont une probabilité pré-test élevée d’instabilité cardiorespiratoire pouvant empêcher la complétion du test d’apnée ou qui ne peuvent pas compléter le test d’apnée en raison d’une instabilité cardiorespiratoire (recommandation faible, données probantes de certitude faible). | |
| Examens auxiliaires – adultes | |
| Nous suggérons de réaliser une tomodensitométrie de perfusion, une angiographie par tomodensitométrie, une échographie Doppler transcrânienne ou une étude de perfusion cérébrale nucléaire utilisant un produit radiopharmaceutique lipophile (avec ou sans imagerie tomographique) chez les patients adultes nécessitant des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude très faible à modérée). | |
| Nous suggérons de ne pas réaliser d’EEG, de test des potentiels évoqués auditifs du tronc cérébral, de test des potentiels évoqués somatosensoriels, d’étude sur la circulation cérébrale nucléaire uniquement utilisant un produit radiopharmaceutique lipophobe, d’angiographie cérébrale à quatre vaisseaux ou d’imagerie par résonance magnétique chez les patients adultes nécessitant des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude très faible). | |
| Examens auxiliaires – pédiatrie | |
| Nous suggérons de réaliser une étude de perfusion cérébrale nucléaire utilisant un produit radiopharmaceutique lipophile tel que le 99mTc-HMPAO ou son équivalent (qui incorpore à la fois une phase de circulation et une phase parenchymateuse) avec ou sans imagerie tomographique chez les patients pédiatriques nécessitant des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude faible). | |
| Nous suggérons de réaliser une étude de circulation cérébrale nucléaire utilisant un produit radiopharmaceutique lipophobe tel que le 99mTc-DTPA, le 99mTc-GHA, le 99mTc-pertechnétate, ou un équivalent (qui n’incorpore qu’une phase de circulation) lorsqu’un examen utilisant un produit radiopharmaceutique lipophile ne peut pas être réalisé, chez les patients pédiatriques qui nécessitent des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude faible). | |
| Nous suggérons de ne pas réaliser d’EEG, d’échographie Doppler transcrânienne, de test des potentiels évoqués auditifs du tronc cérébral, de test des potentiels évoqués somatosensoriels, d’angiographie par tomodensitométrie et d’angiographie à quatre vaisseaux chez les patients pédiatriques nécessitant des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude très faible). | |
| Nous suggérons de ne pas réaliser d’examen auxiliaire chez les nourrissons de moins de 2 mois d’âge gestationnel corrigé qui nécessitent des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude très faible). | |
| Énoncés de bonnes pratiques | |
| Une équipe de soutien multidisciplinaire (p. ex. personnel infirmier, travailleurs sociaux, psychologues, intervenants en soins spirituels, responsables religieux et coordonnateurs de dons, le cas échéant) devrait participer aux discussions en matière de soins le plus rapidement possible lorsqu’on soupçonne qu’un patient peut évoluer vers un décès. | |
| Tout clinicien participant à une détermination de décès doit posséder les compétences, la formation et les connaissances requises en matière de processus et de procédures de détermination du décès. | |
| Dans tous les cas de don potentiel d’organes, les cliniciens qui déterminent le décès ne doivent pas avoir d’association ou de participation active aux procédures de transplantation, à l’attribution d’organes ou aux soins des receveurs de greffe prévus. | |
| Le cas échéant, l’évaluation pour un DCN devrait être réalisée chez toutes les personnes atteintes de lésions cérébrales dévastatrices qui sont considérées comme répondant à ces critères, quel que soit le potentiel de don d’organes. | |
| La cause d’une lésion cérébrale dévastatrice doit être étayée par des données de neuroimagerie compatibles avec la cause établie. | |
| Une liste de contrôle normalisée devrait être utilisée pour la détermination et la documentation du décès. | |
| L’accomplissement de toutes les phases de détermination d’un décès doit être clairement documenté par le médecin responsable dans le dossier médical du patient. | |
| Les médecins qui supervisent et interprètent les examens radiologiques auxiliaires pour un DCN devraient être formés en neuroradiologie et avoir de l’expérience dans la réalisation et l’interprétation de l’examen spécifique réalisé. Pour l’angiographie par tomodensitométrie, les radiologistes devraient posséder l’expérience requise dans l’utilisation du protocole et de l’échelle appropriés. Pour la tomodensitométrie de perfusion, les radiologistes devraient posséder la formation requise quant à l’exécution et l’interprétation de cet examen. | |
| Les médecins qui supervisent et interprètent les examens nucléaires auxiliaires pour un DCN devraient avoir complété une résidence en médecine nucléaire et avoir de l’expérience dans la réalisation et l’interprétation de l’examen spécifique réalisé. | |
| Les médecins qui supervisent et interprètent les examens d’échographie Doppler transcrânienne pour un DCN devraient être formés adéquatement en neurosonologie et avoir de l’expérience dans la réalisation et l’interprétation de l’examen spécifique réalisé. |
DCC = détermination du décès selon des critères circulatoires; DCN = détermination du décès selon des critères neurologiques; EEG = électroencéphalographie; DTPA = acide diéthylène-triamine-pentaacétate; GHA = glucoheptonate; HMPAO = hexaméthylpropylénamine oxime
Décès du cerveau entier vs décès du tronc cérébral
Les délibérations du groupe de travail sur le décès du cerveau entier vs le décès du tronc cérébral ont été guidées par un examen des lignes directrices internationales sur le décès du tronc cérébral,26 une revue systématique des lésions cérébrales infratentorielles et du décès isolé du tronc cérébral chez les patients suspectés de DCN,27 une étude albertaine sur le décès après un accident vasculaire cérébral infratentoriel,28 un sondage auprès des intensivistes canadiens,29 et une étude de portée sur le rôle du système d’activation réticulaire dans la conscience et le DCN.30 L’orientation a été générée au cours de multiples réunions du groupe de travail au cours desquelles les conclusions et les justifications ont été présentées et révisées, avant d’être communiquées au comité d’élaboration des lignes directrices et acceptées par celui-ci.31
Considérations juridiques et éthiques
Le groupe de travail sur les questions juridiques et éthiques a formé quatre sous-groupes axés sur des questions plus spécifiques : la justification d’une définition cérébrale du décès, les implications juridiques d’une définition cérébrale du décès, le consentement aux tests de DCN et le désamorçage et la gestion des conflits. Ces groupes ont effectué des recherches documentaires, en incluant notamment les documents de politique existants d’organisations médicales clés, examiné des bases de données juridiques au Canada, aux États-Unis et au Royaume-Uni et, dans le cas du consentement aux tests de DCN, ont fait un suivi auprès des avocats impliqués pour obtenir des dossiers non publics. L’analyse théorique et la réflexion critique sur les idées fondamentales, les positions clés, les valeurs et les principes pertinents, ainsi qu’un éventail de cas et de situations possibles et réels, ont également éclairé un processus de consensus itératif fondé sur la discussion au sein du groupe de travail, puis du comité d’élaboration des lignes directrices afin de parvenir à un consensus sur l’orientation fournie. De plus amples détails sont disponibles dans les publications pertinentes.5–7,32
Mobilisation des parties prenantes
Il a été déterminé dès le début du projet que le groupe de travail sur la mobilisation des intervenants élaborerait une vaste stratégie de partenariat avec les patients, les familles et le public, tel que décrit précédemment.33 Cela a nécessité une sélection particulière de participants, ainsi qu’une formation et un soutien tout au long du processus d’élaboration des Lignes directrices. Afin de mieux comprendre les points de vue du public canadien sur la façon dont le décès est déterminé au Canada, le groupe de travail sur la mobilisation des intervenants a mené un sondage transversal national évaluant la compréhension de la façon dont le décès est déterminé, l’acceptation de la détermination du décès neurologique et circulatoire, ainsi que l’intérêt et les stratégies préférées pour en apprendre davantage sur le sujet. De plus amples détails sont disponibles dans la publication pertinente.4 De plus, pour décrire les points de vue des mandataires spéciaux et des familles sur le DCN (dans le contexte du don d’organes) dans les unités de soins intensifs (USI) canadiennes, le groupe de travail sur la mobilisation des intervenants a analysé les données recueillies dans le cadre d’une étude qualitative qui a mené des entrevues semi-structurées et approfondies avec des mandataires spéciaux et des membres de familles à qui on a demandé de prendre une décision en matière de don d’organes au nom de leur proche. De plus amples détails sont disponibles dans la publication pertinente.3
Enfin, l’équipe du projet a fait participer des responsables des soins spirituels en milieu hospitalier à une série de petits groupes de discussion. Des participants de partout au pays ont été invités à participer par l’entremise de l’Association canadienne de soins spirituels. Les discussions ont porté sur leur expérience professionnelle et leurs points de vue sur le soutien aux mandataires spéciaux et aux familles en fin de vie, ainsi que sur les approches d’application des connaissances pour les mandataires spéciaux, les familles et les professionnels de la santé. Voir le rapport de discussion des professionnels des soins spirituels dans l’annexe électronique 6 en MES pour plus de détails et les conclusions de ces discussions.
Définition du décès
Le décès d’une personne a de profondes implications sociales et juridiques et déclenche un certain nombre d’événements, y compris le deuil familial, la disposition de la dépouille, les procédures d’inhumation et le règlement de la succession. Le décès met également fin à toute obligation légale de fournir une ventilation mécanique et une assistance somatique continue, permet le don post-mortem d’organes et de tissus, ainsi que l’autopsie. Tout en reconnaissant qu’il existe de nombreuses croyances philosophiques, religieuses et culturelles différentes liées au concept du décès, les professionnels de la santé exigent une définition biomédicale opérationnelle et légalement reconnue du décès applicable à toutes les personnes.6 Cela est particulièrement important pour garantir une pratique éthique du don d’organes et le respect de la « règle du donneur décédé », ainsi que lorsque le prélèvement d’organes dépend de la détermination précise et opportune du décès.
Sur le plan juridique, la mort est définie de différentes façons d’une province et d’un territoire à l’autre, dans un mélange de lois et de common law.7 Néanmoins, toutes les administrations canadiennes acceptent actuellement le décès défini en termes neurologiques, même si la fonction circulatoire est présente en raison d’une ventilation mécanique ou une assistance somatique. Cela reflète une reconnaissance de longue date que le cerveau est l’organe fondamental et essentiel qui rend possibles les fonctions humaines clés de la conscience, de la conscience de soi et de la cognition. Poussé par les progrès des technologies médicales et une meilleure compréhension de la physiologie du processus de la mort, un consensus médical et sociétal croissant soutient que, d’un point de vue biomédical, tout décès est cérébral.11,16,34,35 Bien que le décès puisse être déterminé à l’aide de critères circulatoires ou neurologiques (voir la figure 1), ces deux types sont basés sur une définition qui reflète l’importance fondamentale de la fonction cérébrale en tant que ligne de démarcation entre la vie et la mort.
Le décès est défini comme l’arrêt permanent de la fonction cérébrale
L’arrêt permanent de la fonction cérébrale se caractérise par l’absence totale de toute forme de conscience et l’absence de réflexes du tronc cérébral, y compris de la capacité de respirer de manière autonome. Cela peut résulter de l’arrêt de la circulation sanguine vers le cerveau après un arrêt circulatoire et/ou d’une lésion cérébrale dévastatrice. Une personne est décédée une fois qu’il a été déterminé que la fonction cérébrale a été perdue de façon permanente (c.-à-d. que la fonction cérébrale est perdue, ne reprendra pas spontanément et ne sera pas rétablie par une intervention).6,11
Sur le plan fonctionnel, et pour aider le public à comprendre, l’arrêt de la fonction cérébrale équivaut à des fonctions du cerveau, y compris du tronc cérébral, et signifie que la personne est :
sans conscience, et est incapable de jamais la retrouver; et
incapable de respirer par elle-même (sans l’aide d’un ventilateur mécanique); et
incapable d’éprouver de la douleur; et
incapable de communiquer ou d’interagir à quelque titre que ce soit; et
incapable de sentir, de voir, d’entendre; et
inconsciente de son environnement.
Il est important de noter qu’il peut y avoir des différences entre le moment où le décès survient, le moment où le décès est déterminé (conformément aux critères décrits ci-dessous) et le moment où le décès est documenté et officiellement déclaré.
L’arrêt de la fonction cérébrale est démontré par :
L’absence totale de conscience, définie par l’absence totale d’éveil et de perception de son environnement interne ou externe. En l’absence de conscience, il n’y a aucune capacité à interagir ou répondre consciemment aux stimuli.
L’absence de réflexes du tronc cérébral, y compris de la capacité de faire des efforts respiratoires et/ou de respirer indépendamment (sans ventilation mécanique), indiquant l’arrêt de la fonction du tronc cérébral.
Le décès peut être déterminé à l’aide de deux catégories de critères :
Détermination du décès selon des critères circulatoires (DCC) :
La perte de circulation dans le corps entraîne un arrêt rapide de la circulation, de la perfusion et de la fonction cérébrales.36 La détermination de la perte permanente de circulation vers le cerveau sert donc de substitut à la perte de fonction cérébrale. Dans ces cas, la détermination du décès s’appuie sur l’assurance qu’un intervalle de temps approprié s’est écoulé après l’arrêt de la circulation pour exclure toute reprise non assistée de la circulation spontanée vers le cerveau.
-
2.
Détermination du décès selon des critères neurologiques (DCN) :
Chez les patients atteints de lésions cérébrales dévastatrices où la respiration est soutenue par la ventilation mécanique, le décès est déterminé par l’absence totale de conscience démontrée par le manque d’éveil et de perception en réponse à des stimuli, l’absence de fonction du tronc cérébral démontrée par l’évaluation des nerfs crâniens, et l’absence de la capacité de respirer démontrée par le test d’apnée.
Il n’est pas nécessaire de démontrer la désintégration totale des cellules cérébrales ou l’absence de toute activité biologique résiduelle pour déterminer le décès. L’activité résiduelle des cellules cérébrales qui n’est pas associée à la présence de conscience ou à une fonction du tronc cérébral n’exclut pas la détermination du décès. Les exemples incluent la libération d’hormones antidiurétiques par l’hypophyse postérieure, le contrôle de la température ou l’activité neuronale au niveau cellulaire.6
Le décès ne peut pas être déclaré s’il y a un niveau quelconque de conscience restante et/ou une fonction résiduelle du tronc cérébral, peu importe sa réduction. Cela inclut les patients atteints d’un syndrome d’éveil non répondant37 ou dans des états végétatifs persistants ou en état de conscience minimale.38
Une définition cérébrale du décès procure une approche contemporaine utilisant des termes différents des définitions juridiques existantes sur la mort cérébrale. Idéalement, pour éviter toute confusion liée aux différences de formulation, la loi devrait être modifiée pour coïncider avec la définition du décès figurant dans ces Lignes directrices de pratique clinique.
Détermination du décès selon des critères circulatoires
| La détermination du décès selon des critères circulatoires est basée sur l’absence de circulation extracrânienne qui conduit à l’absence permanente de circulation intracrânienne (cérébrale) (principe médical fondamental). |
La détermination du décès selon des critères circulatoires, dans le contexte du don d’organes, repose sur le PMF selon lequel, si l’absence de circulation vers le cerveau est permanente, la perte de la fonction cérébrale est permanente et le décès est déclaré. L’arrêt permanent de la circulation intracrânienne (cérébrale) doit être maintenu si des interventions post-mortem (c.-à-d. des interventions effectuées après la détermination du décès qui sont utilisées pour la préservation d’organes dans le cadre des procédures de don d’organes) sont utilisées.39
Recommandations
Une liste des recommandations sur le DCC est résumée au tableau 4. La description complète des données probantes, accompagnée de citations et de justifications à l’appui de ces recommandations, se trouve à l’annexe électronique 7 en MES. En outre, les données probantes correspondantes ont été résumées dans trois revues systématiques publiées.40–42 Nous avons pris en compte un certain nombre de sous-groupes, y compris l’aide médicale à mourir, le don non contrôlé après DCC, les nouveau-nés et la pédiatrie. Sauf indication contraire explicite, les recommandations s’appliquent à tous les sous-groupes.
Dispositifs de surveillance
|
Nous recommandons qu’une surveillance invasive continue de la tension artérielle soit utilisée pour confirmer l’arrêt permanent de la circulation chez les patients qui sont des donneurs d’organes potentiels soumis à un DCC (recommandation forte, données probantes de certitude modérée). Nous suggérons qu’une surveillance continue par électrocardiogramme (ECG) soit utilisée pour confirmer l’arrêt permanent de la circulation lorsque l’utilisation d’une canule artérielle n’est pas possible chez les patients qui sont des donneurs d’organes potentiels soumis à un DCC (recommandation faible, données probantes de certitude modérée). |
Pour minimiser les risques de faux positifs (c.-à-d. déterminer qu’une personne vivante est décédée) et de faux négatifs (c.-à-d. déterminer qu’une personne décédée est vivante) pour le DCC, l’utilisation d’une canule artérielle fonctionnelle est nécessaire. La surveillance invasive et continue de la tension artérielle est une mesure objective facilement interprétée et couramment utilisée dans le contexte des soins intensifs. Étant donné que l’activité à l’ECG persiste chez certains patients dont la circulation a cessé définitivement,12,43 lorsque la surveillance invasive et continue de la tension artérielle est utilisée, aucune autre confirmation de l’arrêt de la circulation, telle qu’une asystole électrique, n’est requise. L’auscultation ou la palpation ne doivent pas être utilisées pour évaluer l’absence de circulation, mais peuvent être appliquées pour vérifier qu’un tracé de tension artérielle plat documenté invasivement correspond à l’état clinique.
Exceptionnellement, les cliniciens peuvent envisager l’utilisation d’une surveillance par ECG avec l’absence d’activité électrique cardiaque comme substitut d’une absence de circulation, si la surveillance invasive de la tension artérielle n’est pas possible pour des raisons techniques (p. ex. incapacité d’obtenir une canule artérielle calibrée et fiable), en raison d’un refus par les mandataires spéciaux pour les cas pédiatriques ou néonataux, ou d’un refus par les donneurs d’organes potentiels dans le cas d’AMM. L’ECG isoélectrique peut être aussi bon, voire meilleur, pour identifier un arrêt de la circulation qu’un tracé invasif de la tension artérielle; il existe des données probantes de certitude modérée indiquant que la surveillance par ECG comporte un faible risque de faux positifs, mais un risque élevé de faux négatifs. Néanmoins, le risque élevé de faux négatifs n’est que transitoire et le DCC devient 100 % spécifique et sensible au fil du temps qui passe. Bien que les issues sur le don d’organes aient été jugées par le comité comme étant hors sujet, nous reconnaissons que l’utilisation de la surveillance par ECG pour le DCC peut prolonger inutilement le délai de détermination du décès. Ce risque et ses conséquences potentielles, ainsi que les risques liés à la mise en place d’une canule artérielle, devraient être communiqués aux patients et/ou aux mandataires spéciaux afin qu’ils puissent faire des choix éclairés. Le groupe de travail sur le DCC a examiné d’autres dispositifs de surveillance non invasifs (p. ex. Doppler, échocardiographie, palpation du pouls); toutefois, en l’absence de données probantes appropriées, aucune n’a été jugée appropriée à cette fin.
Arrêt de la circulation
| Nous recommandons qu’une pression pulsée artérielle ≤ 5 mm Hg et dans la marge d’erreur de mesure de l’équipement de surveillance clinique soit utilisée pour confirmer l’arrêt permanent de la circulation chez les patients munis d’une canule artérielle qui sont des donneurs d’organes potentiels soumis à un DCC (recommandation forte, données probantes de certitude très faible). |
Comme il n’existe aucune donnée probante directe pour éclairer cette recommandation, le comité a examiné les données probantes indirectes portant sur la perfusion cérébrale étant donné qu’elle est liée à la pression pulsée artérielle pendant la réanimation cardiorespiratoire et en fin de vie – deux contextes similaires à ceux du don contrôlé et non contrôlé après un DCC. Les membres du groupe de travail s’intéressant à la détermination du décès selon des critères circulatoires ont convenu qu’une pression pulsée artérielle ≤ 5 mm Hg, plutôt qu’une pression pulsée artérielle de 0 mm Hg, soit recommandée, parce que le seuil inférieur pour la détection précise de la pression pulsée artérielle à l’aide de systèmes de surveillance clinique n’est pas bien établi à des pressions pulsées très faibles et qu’une pression pulsée artérielle ≤ 5 mm Hg maintenue pendant une minute n’est pas associée à une reprise de la fonction circulatoire au-delà de cinq minutes.12 Il est reconnu qu’en l’absence de pulsatilité, il n’y a pas de variation systolique-diastolique de la tension artérielle et donc une pression pulsée de zéro implique une asystole mécanique. La détermination du décès selon des critères circulatoires à des pressions pulsées > 5 mm Hg comporte un risque potentiel de déclaration de décès chez une personne ayant une activité cérébrale persistante. Compte tenu des dommages potentiels associés à l’utilisation d’un seuil plus élevé de pression pulsée (c.-à-d. déclarer une personne décédée alors qu’elle ne l’est pas), le groupe de travail sur le DCC a estimé que cela justifiait une recommandation forte malgré le très faible niveau de certitude des données probantes. Dans certains cas où l’ECG plutôt qu’une surveillance invasive continue de la tension artérielle est utilisé pour la détermination du décès, un ECG isoélectrique indique un arrêt de la circulation.
Temps d’observation
|
Nous recommandons qu’un minimum de cinq minutes d’observation soit utilisé pour confirmer l’arrêt permanent de la circulation chez les patients qui sont des donneurs d’organes potentiels soumis à un don contrôlé après un DCC (recommandation forte, données probantes de certitude modérée). Nous recommandons qu’un minimum de dix minutes d’observation soit utilisé pour confirmer l’arrêt permanent de la circulation chez les patients qui sont des donneurs d’organes potentiels soumis à un don non contrôlé après un DCC (recommandation forte, données probantes de certitude faible). |
Les données probantes relatives au contexte de l’arrêt des thérapies de maintien des fonctions vitales aux soins intensifs montrent qu’une période d’observation de cinq minutes est associée à l’absence de faux positifs, même parmi les donneurs pour dons contrôlés après un DCC. Dans le contexte d’un don non contrôlé après un DCC, les données probantes suggèrent qu’il peut y avoir des faux positifs si la durée de la période d’observation est inférieure à dix minutes, possiblement en raision de l’effet résiduel des agents inotropes ou des interactions cardiopulmonaires de la ventilation mécanique appliquée pendant la phase de réanimation. Tout en tenant compte de l’importance potentielle pour les patients, les familles et les cliniciens de déterminer le décès en temps opportun, le groupe de travail dédié au DCC a estimé qu’une période d’observation plus courte (< 5 min pour le don contrôlé après un DCC et < 10 minutes pour un don non contrôlé après un DCC) était associée à une incertitude importante, même si les données probantes indiquent que les reprises de l’activité cardiaque et de la circulation sont transitoires pendant ces périodes.
Pendant la période d’observation, les deux cliniciens déterminant le décès doivent observer continuellement le patient et les dispositifs de surveillance. Toute interférence avec l’observation continue du patient doit être évitée. Le patient ne doit pas être déplacé ou transporté pendant la période d’observation. La période d’observation doit être recommencée en cas de documentation de signes de persistance ou de retour de la circulation (p. ex. augmentation de la pression pulsée artérielle > 5 mm Hg, respiration ou réponses motrices). Un retour de l’activité à l’ECG sans retour concomitant de la pression pulsée artérielle > 5 mm Hg ne devrait pas déclencher de réinitialisation de la période d’observation. Néanmoins, dans les cas où l’ECG seul est utilisé comme substitut pour la surveillance de la circulation et que la tension artérielle ne peut être confirmée, la période d’observation doit être recommencée en réponse à un retour de l’activité à l’ECG. La réinitialisation de la période d’observation peut être nécessaire plus d’une fois. Une fois la période d’observation terminée, aucune autre évaluation clinique n’est requise, le décès est déclaré et les moniteurs peuvent être retirés.
Heure du décès et documentation
Pour un DCC, le moment légal du décès enregistré correspond au moment où la période d’observation a pris fin.
L’accomplissement de toutes les phases de détermination du décès doit être clairement documenté par le médecin responsable dans le dossier médical du patient (énoncé de bonne pratique). Une liste de contrôle normalisée devrait être utilisée pour la détermination et la documentation du décès (énoncé de bonne pratique).
Qualifications des cliniciens
Tout clinicien participant à la détermination du décès doit posséder les compétences, la formation et les connaissances requises en matière de processus et de procédures de détermination du décès (énoncé de bonne pratique). Deux cliniciens sont nécessaires pour déterminer un DCC chez des donneurs d’organes potentiels. Un clinicien doit être un médecin titulaire d’un permis d’exercice complet et à jour pour exercer la médecine de façon indépendante par le collège des médecins et chirurgiens ou l’autorité de délivrance des permis dans la province ou le territoire canadien concerné. Le deuxième clinicien peut être un médecin inscrit au registre des études (p. ex. résidents, fellows) ou un.e infirmier.ère praticien.ne, si leur statut est conforme aux règlements provinciaux. Les deux cliniciens doivent posséder les compétences et les connaissances requises en matière de DCC, y compris la capacité d’interpréter les appareils de surveillance utilisés; un niveau particulier de certification spécialisée n’est pas requis. De plus, les cliniciens qui déterminent le décès ne doivent pas avoir d’association ou de participation active aux procédures de transplantation, à l’attribution d’organes ou aux soins des receveurs de greffe prévus.
Détermination du décès selon des critères neurologiques
Les critères énoncés dans les présentes Lignes directrices visent à prévenir les erreurs dans la détermination du décès. Le devoir du clinicien qui accomplit un DCN est de ne jamais conclure qu’un patient est décédé s’il ne l’est pas. En cas de doute clinique, le patient ne peut pas être déclaré décédé. Si le clinicien est incertain en raison de conditions confondantes potentielles ou de toute composante de l’évaluation clinique, de la neuroimagerie, de l’électrophysiologie ou des examens auxiliaires, le décès ne devrait pas être déterminé.
Le cas échéant, une évaluation pour le DCN devrait être réalisée chez toutes les personnes atteintes de lésions cérébrales dévastatrices qui sont soupçonnées de répondre à ces critères, quel que soit le potentiel de don d’organes (énoncé de bonne pratique).
| Les conditions préalables suivantes doivent être remplies avant de procéder à une évaluation clinique valide pour le DCN : il doit y avoir une cause établie de lésion cérébrale dévastatrice suffisamment grave pour causer le décès et appuyée par des données de neuroimagerie, et les facteurs confondants potentiels d’une évaluation clinique précise doivent avoir été pris en compte et exclus (principe médical fondamental). |
L’absence de conscience ne constitue pas une preuve suffisante de lésion cérébrale dévastatrice. Il doit y avoir une cause claire et proche dans le temps établie par l’histoire de la maladie actuelle et la neuroimagerie qui explique pleinement la perte de conscience. Si les conditions confondantes ne peuvent être résolues ou exclues, l’évaluation clinique seule n’est pas suffisante pour déterminer le décès et un examen auxiliaire est nécessaire. Le tableau 5 fournit un résumé des conditions confondantes potentielles pour le DCN. Des conseils pour la prise en charge des facteurs confondants pharmacologiques dans le DCN sont disponibles dans l’annexe électronique 8 en MES avec une publication de Kanji et Williamson (tableau 6).44
|
La détermination du décès selon des critères neurologiques consiste principalement en une évaluation clinique qui nécessite les trois éléments suivants : 1) une absence de conscience démontrée par un manque d’éveil et de perception en réponse à des stimuli externes; 2) une absence de fonction du tronc cérébral telle que démontrée par l’évaluation des nerfs crâniens; et 3) une absence de la capacité de respirer telle que démontrée par un test d’apnée formel (principe médical fondamental). Toutes les composantes de l’évaluation clinique pour un DCN doivent être réalisées dans la mesure du possible (voir tableau 6). Si une évaluation clinique valide est entièrement réalisée, complète et compatible avec le décès, elle est alors suffisante pour déterminer le décès. Les examens auxiliaires seuls ne sont pas suffisants pour déterminer le décès et ne priment pas sur une évaluation clinique incompatible avec le décès (principe médical fondamental). |
Tableau 5.
Conditions confondantes potentielles pour la détermination du décès selon des critères neurologiques
| Facteur confondant | Considérations |
|---|---|
| Hypothermie (dans le cadre du traitement CCT ou après une exposition environnementale, p. ex. noyade en eau froide) |
Avant l’évaluation clinique, le patient doit avoir une température centrale minimale de ≥ 36°C, telle que définie par la température centrale mesurée par la température œsophagienne, vésicale, rectale ou centrale (cathéter veineux ou artériel central). Il existe une distinction clinique entre l’hypothermie thérapeutique ou hypothermie induite et l’hypothermie transitoire pouvant survenir chez les patients ayant perdu la capacité de thermorégulation après une suspicion de DCN. Après une hypothermie induite (appliquée à des fins de neuroprotection ou pour modifier délibérément le métabolisme cérébral) ou une exposition environnementale préhospitalière ≤ 34°C, une période d’attente de 24 heures est conseillée après le réchauffement à 36°C avant de procéder à l’évaluation clinique pour un DCN. L’évaluation clinique pour un DCN peut survenir immédiatement après le réchauffement à 36 °C après une hypothermie transitoire (p. ex. après une perte soupçonnée de thermorégulation suite à un décès présumé selon des critères neurologiques) si elle est étayée par un jugement clinique approprié. Reportez-vous à la Recommandation relative à la température corporelle centrale. |
| Traumatisme facial grave, traumatisme oculaire ou fracture du crâne (y compris fracture de la base du crâne avec hémotympan) | Peut interférer avec la réponse pupillaire, et les réflexes oculovestibulaires, la réponse à la douleur crânienne. |
| Craniectomie décompressive | Devrait être considérée comme une condition confondante potentielle nécessitant plus de temps d’observation ou un examen auxiliaire. |
| Lésion médullaire | Peut altérer la réponse à la douleur corporelle et le test d’apnée. |
| Anophtalmie, traumatisme oculaire | Interfère avec les réflexes pupillaires, cornéens et oculovestibulaires. |
|
Déséquilibres/anomalies métaboliques/endocriniens/électrolytiques sévères, y compris, mais sans s’y limiter : • Hyper/hyponatrémie • Hypophosphatémie • Hypoglycémie • Hyper/hypomagnésémie • Hypokaliémie • Hyper/hypothyroïdie • Insuffisance hépatique et/ou rénale |
Les troubles métaboliques, acido-basiques et endocriniens sévères qui pourraient affecter l’examen doivent être corrigés. Si ces troubles ne peuvent pas être corrigés et sont jugés comme contribuant potentiellement à la perte de la fonction cérébrale, un examen auxiliaire devrait être envisagé. L’hypernatrémie peut souvent survenir pendant le traitement aux soins intensifs, mais ne contribue pas à la cause d’une lésion cérébrale dévastatrice. Si l’étiologie primaire n’explique pas complètement le tableau clinique et si, de l’avis du médecin traitant, l’hypernatrémie peut jouer un rôle, elle doit être corrigée. |
| Choc non réanimé (c.-à-d. hypotension sévère et/ou choc qui n’a pas été traité adéquatement avec une réanimation volémique ou des agents vasoactifs) | Avant l’évaluation clinique, les adultes devraient avoir une tension artérielle systolique ≥ 100 mm Hg, ou une tension artérielle moyenne ≥ 60 mm Hg (avec utilisation de volume intravasculaire, de vasopresseurs et/ou d’inotropes au besoin). Les cibles pour les patients pédiatriques devraient être adaptées à leur âge. |
| Bloc neuromusculaire pharmacologique pouvant expliquer l’absence de réponse motrice | La paralysie pharmacologique peut être exclue par l’utilisation d’un stimulateur de train-de-quatre si disponible, ou par l’évaluation de la présence de réflexes tendineux profonds si un stimulateur de train-de-quatre n’est pas disponible. |
| Maladies neuromusculaires | Pour les troubles neuromusculaires graves ou acquis préexistants, tels que la sclérose latérale amyotrophique, le syndrome de Guillain-Barré ou une neuropathie sensorielle sévère préexistante, ou une lésion du nerf phrénique, un examen auxiliaire doit être réalisé. |
|
Facteurs confondants pharmacologiques, notamment : • Sédatifs thérapeutiques ou neuroprotecteurs (p. ex. benzodiazépines, propofol, barbituriques) et opioïdes administrés aux patients pendant les efforts de réanimation • Substances prises en cas de surdose, p. ex. substances illicites, alcool, relaxants musculaires, antidépresseurs, antiépileptiques |
Un dépistage toxicologique sanguin et/ou urinaire peut être utilisé à des fins diagnostiques pour établir la présence ou l’absence de médicaments potentiellement confondants. Si les concentrations sériques de médicaments peuvent être quantifiées et des concentrations suprathérapeutiques sont identifiées, les évaluations cliniques peuvent être sujettes à des facteurs confondants. Les fourchettes thérapeutiques des concentrations de médicaments ne sont pas considérées comme confondantes. Les mesures en série peuvent être utilisées pour établir les tendances de la concentration de médicaments au fil du temps jusqu’à ce qu’elles diminuent en dessous des niveaux suprathérapeutiques, moment où les évaluations neurologiques pourront être plus fiables. Si une intoxication alcoolique est suspectée ou confirmée, le taux d’alcool dans le sang doit être ≤ 80 mg·dL-1 au moment de la détermination du décès. En l’absence d’une surveillance thérapeutique quantitative ou qualitative des médicaments, laissez passer au moins cinq demi-vies d’élimination avant que l’évaluation clinique ne soit réalisée. Un temps d’attente supplémentaire devrait être ajouté lorsque lorsqu’on s’attend à ce que l’élimination du médicament soit prolongée (p. ex. insuffisance rénale ou hépatique, obésité, hypothermie, exposition prolongée ou administration continue du médicament par perfusion). S’il y a une incertitude quant à une réduction de l’élimination des médicaments ou concernant des expositions médicamenteuses inconnues, un délai supplémentaire est nécessaire ou la réalisation d’un examen auxiliaire peut être envisagée. |
| Lésion cérébrale infratentorielle |
Si la lésion cérébrale reste isolée au tronc cérébral sans atteinte supratentorielle, un examen auxiliaire est nécessaire. Voir les principes médicaux fondamentaux |
| Conditions diverses | Plusieurs comptes rendus de présentations cliniques imitant un DCN qui se sont avérées réversibles ont été rapportés dans le cadre de carcinomatose leptoméningée diffuse, d’encéphalite rabique et de botulisme. |
Adapté du World Brain Death Project11 et des lignes directrices canadiennes de 20068 pour le DCN. De plus amples détails sur les facteurs confondants pharmacologiques dans le cadre d’un DCN ont été publiés par Kanji et Williamson.44
DCN = détermination du décès par des critères neurologiques; USI = unité de soins intensifs; CCT = contrôle ciblé de la température
Tableau 6.
Composantes de l’évaluation clinique pour un DCN
| • Absence de conscience (éveil et perception) | |
| • Réflexes du tronc cérébral | |
| - Réflexes pupillaires | |
| - RVO | |
| - Réflexe cornéen | |
| - Réflexes nauséeux/pharyngé et de toux | |
| - Réflexes de succion et des points cardinaux (pour les nouveau-nés) | |
| • Réponses motrices aux stimuli douloureux | |
| • Test d’apnée |
DCN = détermination du décès selon des critères neurologiques; RVO = réflexes vestibulo-oculaires
Si une partie de l’évaluation clinique ne peut être complétée, le reste de l’évaluation doit l’être dans la mesure du possible. Des détails spécifiques sur la façon de réaliser l’évaluation clinique sont disponibles dans l’annexe électronique 9 en MES, basée sur le World Brain Death Project.11 Dans les cas où l’évaluation clinique ne peut être complétée, si les éléments complétés sont compatibles avec l’arrêt de la fonction cérébrale, un examen auxiliaire est nécessaire pour déterminer le décès. Voir le tableau 7 pour les indications relatives aux examens auxiliaires.
Tableau 7.
Indications pour un examen auxiliaire
|
• Incapacité de compléter une évaluation clinique valide, y compris un test d’apnée • Conditions confondantes qui ne peuvent pas être résolues • Incertitude dans l’interprétation des mouvements possiblement spinaux • Lésion cérébrale infratentorielle isolée sans atteinte supratentorielle • Demande des mandataires spéciaux et/ou de la famille, ou de fourniture de renseignements supplémentaires pour aider à comprendre un DCN |
DCN = Détermination du décès selon des critères neurologiques
Si un examen auxiliaire est indiqué et réalisé pour le DCN (p. ex. facteurs confondants non résolus, évaluation clinique incomplète) et montrent la présence d’une circulation sanguine cérébrale ou d’une perfusion cérébrale, le décès ne peut être déterminé à ce moment-là. Si des facteurs confondants non résolus persistent ou si l’évaluation clinique continue d’être incomplète, le même examen auxiliaire recommandé doit être répété. Si les facteurs confondants ont été résolus et que l’évaluation clinique peut être entièrement terminée, il n’est pas nécessaire de répéter l’examen auxiliaire.
Il est reconnu que la neuroimagerie diagnostique, les études électrophysiologiques et les études sur la circulation cérébrale et la perfusion cérébrale peuvent avoir été réalisées pendant les phases neuroprotectrices des soins et à différents moments après une lésion cérébrale dévastatrice causale. Une fois que les conditions préalables sont remplies et qu’une évaluation clinique valide est réalisée pour déterminer le décès, tout test d’imagerie diagnostique précédent qui montre la présence d’une circulation sanguine, d’une perfusion ou d’une activité cérébrale n’écarte pas nécessairement un DCN.
Si une imagerie diagnostique précédente montre une absence de circulation sanguine cérébrale ou de perfusion cérébrale, une fois que les conditions préalables sont remplies et qu’une évaluation clinique est réalisée dans la mesure du possible, et que les éléments complétés sont compatibles avec un DCN, un examen auxiliaire supplémentaire n’est pas nécessaire pour déterminer le décès tant que la modalité d’imagerie diagnostique utilisée est un examen auxiliaire recommandé.
Les examens auxiliaires ont des limites connues,45,46 y compris des problèmes techniques potentiels dans l’exécution de l’examen qui peuvent avoir une incidence sur leur fiabilité. Étant donné que le DCN est fondamentalement une évaluation clinique, l’examen auxiliaire seul n’est pas suffisant pour déterminer le décès en l’absence d’une évaluation clinique réalisée dans la mesure du possible.
Si le clinicien est incertain en raison de conditions confondantes potentielles ou de toute composante de l’évaluation clinique, de la neuroimagerie, de l’électrophysiologie ou des examens auxiliaires, alors le décès ne devrait pas être déterminé. Dans ces conditions, il est conseillé de répéter les évaluations à un autre moment, de consulter des experts ou de considérer d’autres formes de soins de fin de vie.
| Une évaluation clinique est nécessaire mais insuffisante pour établir un DCN chez les patients présentant une lésion cérébrale infratentorielle isolée sans atteinte supratentorielle. Des examens auxiliaires sont nécessaires pour déterminer le décès (principe médical fondamental). |
Si un examen auxiliaire montre la présence d’une circulation sanguine cérébrale ou d’une perfusion cérébrale, le décès ne peut pas être déterminé à ce moment-là. La démonstration d’une préservation de circulation sanguine cérébrale ou de perfusion cérébrale chez un patient atteint d’une lésion cérébrale infratentorielle isolée ne répond pas à la définition de décès au Canada.
Si l’évaluation clinique reste compatible avec l’arrêt de la fonction cérébrale en l’absence d’atteinte supratentorielle significative, le même examen auxiliaire recommandé devrait être répété.
Pour les patients atteints d’une lésion cérébrale infratentorielle qui présentent des signes à la neuroimagerie d’une atteinte supratentorielle significative compatible avec le concept de décès du cerveau entier, par exemple une hydrocéphalie et/ou des signes d’engagement cérébral, une évaluation clinique complète et valide est suffisante pour un DCN.
Recommandations
Le tableau 4 résume une liste des recommandations pour le DCN. La description complète des données probantes, accompagnée de citations et de justifications à l’appui de ces recommandations, se trouve à l’annexe électronique 10 en MES. En outre, deux revues systématiques ont été publiées.46,47 Toutes les recommandations s’appliquent aux patients pédiatriques et adultes, sauf indication contraire explicite.
Évaluation clinique après le retour de la circulation spontanée après un arrêt cardiaque
| Nous suggérons de retarder l’évaluation clinique d’au moins 48 heures à compter du moment de reprise de la circulation spontanée après un arrêt cardiaque chez les patients présentant une atteinte hypoxique-ischémique qui ne présentent pas de données d’imagerie compatibles avec une lésion cérébrale dévastatrice soumis à un DCN (recommandation faible, données probantes de certitude faible). |
Cette recommandation s’adresse aux patients ayant subi un arrêt cardiaque pour lesquels l’imagerie initiale ne démontre pas d’évidences de lésion cérébrale dévastatrice et lorsque cette imagerie peut ne pas avoir été répétée. Les réflexes du tronc cérébral peuvent revenir dans les 24 heures suivant le retour à une circulation spontanée,1 et l’œdème cérébral avec ou sans engagement cérébral ne peut être considéré égal à un DCN. Ce groupe de patients est plus à risque d’une détermination de décès faussement positive. Compte tenu de l’absence de données probantes directes, le groupe de travail sur le DCN a examiné les données probantes indirectes d’une revue systématique des prédicteurs de mauvaises issues neurologiques. Les issues chez les patients bénéficiant d’un contrôle ciblé de la température n’étaient pas différentes de celles des patients qui n’en ont pas bénéficié. Un délai prudent de 48 heures dans l’évaluation clinique après un retour de la circulation spontanée a été jugé sécuritaire, réalisable et utile pour éliminer ce facteur confondant. Les médecins souhaitant raccourcir ce délai peuvent répéter l’imagerie pour mettre en évidence des signes radiologiques d’une lésion cérébrale dévastatrice ou réaliser un examen auxiliaire.
Pour les patients atteints d’un arrêt cardiaque secondaire dans le contexte d’autres formes de lésion cérébrale dévastatrice primaire telle qu’un traumatisme cérébral, un accident vasculaire cérébral ischémique massif ou une hémorragie intracérébrale, l’imagerie dans ces cas confirme presque toujours l’étiologie du tableau clinique, surtout s’il existe des signes d’œdème cérébral, d’effet de masse et d’engagement cérébral. Dans ces cas, un délai de 24 heures avant de procéder à l’évaluation clinique pour un DCN peut être envisagé.
La cause d’une lésion cérébrale dévastatrice doit être étayée par des données de neuroimagerie compatibles avec la cause établie (énoncé de bonne pratique).
Température corporelle centrale
| Nous suggérons de garantir une température corporelle centrale de ≥ 36°C pour les patients soumis à un DCN (recommandation faible, données probantes de certitude très faible). |
Nous n’avons pas pu identifier de données comparatives indiquant la supériorité d’un seuil de température par rapport à un autre pour l’exactitude d’un DCN. La température, en particulier l’hypothermie, peut affecter l’évaluation clinique d’un DCN par la dépression du métabolisme et de la fonction cérébrale, ou indirectement par l’accumulation de médicaments confondants provenant de changements pharmacocinétiques liés à la température. En mettant fortement l’accent sur la nécessité d’éviter une détermination faussement positive (c.-à-d. déclarer une personne décédée alors qu’elle ne l’est pas encore), une approche prudente et cliniquement réalisable des considérations de température pour le DCN est suggérée.
En cas d’exposition environnementale préhospitalière ou d’hypothermie induite à des fins de neuroprotection à ≤ 34°C, il est conseillé d’attendre 24 heures après le retour à la normothermie.11
Évaluation pupillaire
| Nous suggérons d’utiliser soit la pupillométrie quantitative, soit l’évaluation clinique pupillaire pour les patients soumis à un DCN (recommandation faible, données probantes de certitude faible). |
Bien que de qualité variable, les données probantes actuelles indiquent une amélioration de la précision avec la pupillométrie quantitative par rapport à l’évaluation clinique de la réponse pupillaire dans les lésions cérébrales globales. Néanmoins, dans les cas de DCN où la probabilité pré-test est élevée, aucune amélioration de la précision avec la pupillométrie n’a été démontrée dans les données probantes limitées disponibles. En outre, la pupillométrie quantitative peut ne pas être universellement accessible aux soins intensifs. Lors de l’évaluation clinique pupillaire dans le but d’un examen complet du coma, y compris de la possibilité de décès, cette évaluation doit alors être réalisée méticuleusement.
Réflexe vestibulo-oculaire
| Nous recommandons de ne pas ajouter de test du réflexe oculocéphalique au test du réflexe vestibulo-oculaire dans le cadre de l’évaluation clinique des patients soumis à un DCN (recommandation forte, données probantes de certitude modérée). |
Les données probantes disponibles montrent que le réflexe oculocéphalique (ROC), également connu sous le nom de « phénomène des yeux de poupée », a une spécificité beaucoup plus faible que le réflexe vestibulo-oculaire (RVO), également connu sous le nom de « test calorique à froid », et que le RVO est très sensible pour le DCN. Ainsi, en considérant les données probantes, le groupe de travail sur le DCN a déterminé que l’ajout du test du ROC au test de RVO risquait d’ajouter de la confusion à la détermination du décès sans améliorer la sensibilité ou la spécificité. Le groupe de travail sur le DCN a estimé que, puisque les données probantes n’appuient pas l’utilisation du test du ROC pour le DCN, si le test du RVO ne peut pas être complété, l’évaluation clinique est jugée incomplète et un examen auxiliaire est requis.
Test d’apnée
|
Nous suggérons d’utiliser un seuil de PaCO2 de ≥ 60 mm Hg (et ≥ 20 mm Hg au-dessus de la valeur de base) lors de la réalisation d’un test d’apnée chez les patients soumis à un DCN (recommandation faible, données probantes de certitude très faible). Nous suggérons d’utiliser soit la pression positive (pression positive continue), soit l’oxygénation passive lors de la réalisation du test d’apnée chez les patients soumis à un DCN (recommandation faible, (données probantes de certitude faible). Nous suggérons d’utiliser du CO2 administré de manière exogène pour les patients soumis à un DCN qui ont une probabilité pré-test élevée d’instabilité cardiorespiratoire pouvant empêcher la complétion du test d’apnée ou qui ne peuvent pas compléter le test d’apnée en raison d’une instabilité cardiorespiratoire (recommandation faible, données probantes de certitude faible). |
Le test d’apnée doit être le dernier test effectué dans le cadre de l’évaluation clinique. Bien qu’il soit important de prévenir l’échec du test d’apnée, il n’existe aucune étude décrivant l’influence de la pression positive sur la précision du DCN. Des différences minimes sont montrées dans les études disponibles entre les techniques d’oxygénation passive et en pression positive en ce qui concerne la durée ou la capacité à réaliser le test d’apnée. La faible recommandation d’utiliser une pression positive dans des circonstances appropriées repose en partie sur le jugement clinique selon lequel, malgré une préparation adéquate (préoxygénation, manœuvre de recrutement, perfusion adéquate), le test d’apnée pourrait ne pas pouvoir être complété par une oxygénation passive seule chez les patients qui ont des besoins importants en oxygène et une pathologie pulmonaire. Alternativement, certains cliniciens pourraient préférer appliquer une pression positive uniquement dans les circonstances où les méthodes conventionnelles de test d’apnée ont échoué. En règle générale, un niveau de pression continue de 10 cm H2O est utilisé. Pour les tests d’apnée, tant que le patient reste attaché au ventilateur mécanique, les cliniciens doivent être conscients du potentiel de recyclage automatique du ventilateur, qui pourrait être interprété à tort comme une respiration initiée par le patient.
Nous n’avons trouvé aucune étude abordant directement la question de savoir si un seuil de PaCO2 de 60 mm Hg vs un seuil plus élevé pour le test d’apnée améliorerait la précision de la détermination du décès. Compte tenu de l’acceptation quasi universelle et de longue date d’un seuil de CO2 de ≥ 60 mm Hg (et ≥ 20 mm Hg au-dessus de la valeur de base) pendant le test d’apnée, nous n’avons trouvé aucune donnée probante justifiant une modification du seuil actuel. La faible recommandation reflète l’opinion d’experts du comité plutôt que des données probantes directes. Il est important de noter que les seuils de CO2 suggérés ci-dessus nécessitent une baisse correspondante du pH ≤ 7,28. Les seuils suggérés ci-dessus ne s’appliquent pas aux patients atteints de rétention chronique de CO2 qui pourraient nécessiter une PaCO2 plus élevée pour stimuler les efforts respiratoires (≥ 20 mm Hg au-dessus de la valeur de base du patient). Pour les patients qui dépendent de la pulsion hypoxique ou qui ont des antécédents évocateurs d’insuffisance respiratoire chronique et de réactivité seulement à des niveaux supranormaux de CO2, les médecins doivent faire preuve de prudence dans l’interprétation des résultats des tests d’apnée. Si le médecin ne peut être certain de la validité du test d’apnée, un examen auxiliaire doit être réalisé.
L’administration de CO2 exogène peut raccourcir la durée des tests d’apnée et a le potentiel de réduire le risque d’instabilité physiologique, de diminuer le risque de tests incomplets et d’éviter la nécessité d’un examen auxiliaire. Les études examinées n’ont pas identifié d’effets indésirables d’une augmentation de CO2, et le potentiel de suradministration de CO2 peut être atténué par une surveillance prudente et fréquente du CO2. L’augmentation du CO2 ajoute de la complexité (expertise clinique et technique spécialisée) au test d’apnée, ce qui ne semble pas améliorer la sensibilité ni la spécificité du test. Les techniques et protocoles pour augmenter le CO2 pendant le test d’apnée varient considérablement. L’augmentation du CO2 peut être réalisée en ajoutant du CO2 dans le circuit du ventilateur mécanique ou par oxygénation par membrane extracorporelle à l’aide d’un mélange carbogène (97 % O2/3 % CO2).
L’expérience avec l’administration de CO2 exogène pourrait être limitée dans certains centres. Une autre méthode pour raccourcir la durée du test d’apnée consiste à diminuer la ventilation minute de ≥ 50 % pour atteindre un taux de PaCO2 ≥ 20 mm Hg au-dessus de la valeur de base avant de passer à la ventilation en pression positive continue ou à l’oxygénation passive.48
Nombre d’évaluations cliniques
|
Nous recommandons qu’une seule évaluation clinique complète soit suffisante pour les patients âgés d’un an ou plus qui sont soumis à un DCN (recommandation forte, données probantes de certitude modérée). Nous suggérons que deux évaluations cliniques complètes séparées dans le temps soient suffisantes pour les patients dont l’âge gestationnel corrigé est inférieur à un an qui sont soumis à un DCN (recommandation faible, données probantes de certitude très faible). |
Dans de nombreuses provinces canadiennes, les lois provinciales et territoriales existantes indiquent que, aux fins d’une greffe post-mortem, le décès devrait être déterminé par au moins deux médecins conformément à la pratique médicale reconnue. Les données probantes disponibles montrent que la congruence entre les évaluations de DCN est extrêmement élevée, même avec une importante hétérogénéité de patients et de milieux. Les effets indésirables de la nécessité de deux évaluations pour le DCN séparées dans le temps comprennent la prolongation du séjour aux soins intensifs, l’administration d’interventions non thérapeutiques et la souffrance des mandataires spéciaux et familles. S’il existe une obligation légale que deux examinateurs s’entendent sur la détermination du décès, ces évaluations peuvent être effectuées simultanément. Néanmoins, si les déterminations sont réalisées à des moments différents, un examen clinique complet, comprenant un test d’apnée, doit être réalisé à chaque détermination.
Les nouveau-nés et les nourrissons étaient sous-représentés dans la littérature publiée; cependant, les experts ont noté que la pratique actuelle consiste généralement en deux évaluations cliniques pour le DCN. Pour les nouveau-nés, il pourrait y avoir une physiopathologie différente du décès neurologique, où l’ouverture des fontanelles pourrait potentiellement modifier la voie d’augmentation de la pression intracrânienne conduisant à une ischémie cérébrale totale qui entraîne finalement le décès neurologique chez les patients ayant un volume intracrânien fixe. Un récent compte rendu britannique non publié, non révisé par des pairs, a rapporté un revirement potentiel du DCN dans ce groupe d’âge, ce qui suggère qu’il faut faire preuve d’une plus grande prudence en ce qui concerne l’évaluation clinique dans ce groupe d’âge.49,50 Pour cette raison, en plus des données probantes directes limitées, d’un manque d’expérience collective avec le DCN dans ce groupe d’âge et d’un désir de promouvoir une protection maximale de la détermination du décès chez ces très jeunes patients, le comité suggère de réaliser deux évaluations cliniques complètes à des moments différents pour les nouveau-nés et les nourrissons de moins d’un an. Il n’y a pas d’intervalle de temps minimal recommandé entre les évaluations cliniques; cependant, un minimum de 24 heures entre les évaluations pour les nouveau-nés (moins de deux mois d’âge gestationnel corrigé) est recommandé étant donné l’impossibilité de recourir à des examens auxiliaires pour le DCN dans ce groupe d’âge. L’intervalle de temps peut être prolongé selon le jugement du médecin.
Examens auxiliaires – adultes (âgés ≥ 18 ans)
|
Nous suggérons de réaliser une tomodensitométrie de perfusion, une angiographie par tomodensitométrie, une échographie Doppler transcrânienne ou une étude de perfusion cérébrale nucléaire utilisant un produit radiopharmaceutique lipophile (avec ou sans imagerie tomographique) chez les patients adultes nécessitant des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude très faible à modérée). Nous suggérons de ne pas réaliser d’EEG, de test des potentiels évoqués auditifs du tronc cérébral, de test des potentiels évoqués somatosensoriels, d’étude sur la circulation cérébrale nucléaire uniquement utilisant un produit radiopharmaceutique lipophobe, d’angiographie cérébrale à quatre vaisseaux ou d’imagerie par résonance magnétique chez les patients adultes nécessitant des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude très faible). |
Le groupe de travail sur les examens auxiliaires a évalué les examens auxiliaires suivants pour une administration chez les patients adultes : angiographie par tomodensitométrie (échelles de quatre points, sept points et dix points), tomodensitométrie de perfusion, études nucléaires (angiographie avec 99mTc-pertechnétate, 99mTc-HMPAO avec tomodensitométrie par émission monophotonique et 99mTc-HMPAO sans tomodensitométrie par émission monophotonique), échographie Doppler transcrânienne, angiographie cérébrale à quatre vaisseaux, imagerie par résonance magnétique avec angiographie par temps de vol, EEG et test des potentiels évoqués auditifs du tronc cérébral.
La tomodensitométrie de perfusion a été suggérée en fonction d’un taux acceptable de faux négatifs et de faibles effets indésirables, en raison d’un taux acceptable de faux positifs. Il existe probablement une variabilité dans l’acceptabilité de cet examen parmi les principaux intervenants en raison de sa nouveauté, de sa disponibilité variable dans les hôpitaux canadiens, et de l’hétérogénéité dans la formation et le niveau d’expertise des cliniciens le réalisant. Les critères diagnostiques sont basés sur l’inspection visuelle des modalités d’imagerie de perfusion qui devraient montrer une diminution correspondante de la circulation sanguine cérébrale et du volume sanguin cérébral dans l’ensemble du cerveau.
L’angiographie par tomodensitométrie est suggérée en fonction des taux de faux négatifs et de faux positifs, de l’acceptabilité des intervenants, de sa disponibilité dans la plupart des hôpitaux canadiens dotés d’unités de soins intensifs et de la formation généralisée des radiologistes en angiographie par tomodensitométrie. Les critères diagnostiques de l’angiographie par tomodensitométrie devraient être basés sur une angiographie par tomodensitométrie en deux phases utilisant l’échelle de dix points appliquée à la phase d’acquisition tardive, qui étudie l’opacification des vaisseaux supratentoriels et infratentoriels.
Une étude de perfusion cérébrale nucléaire utilisant un agent lipophile avec imagerie planaire ou une tomodensitométrie par émission monophotonique est suggérée en fonction des effets désirables élevés, en raison d’un taux acceptable de faux négatifs. On s’attend à une acceptation en raison de son utilisation historique, de sa disponibilité dans la plupart des hôpitaux canadiens dotés d’unités de soins intensifs et de la formation généralisée des nucléistes médicaux en imagerie de perfusion nucléaire. L’absence d’absorption intracrânienne des agents radionucléides sur l’imagerie plane ou tomographique, y compris l’évaluation de la fosse postérieure et du tronc cérébral dans la mesure du possible, par exemple avec l’utilisation de l’imagerie latérale plane ou tomographique, est nécessaire pour un DCN. Lorsque des images de circulation sont également obtenues lors de l’injection du produit radiopharmaceutique lipophile, les artères cérébrales antérieures et moyennes ne devraient pas être visualisables. Des informations concernant les méthodes de réalisation des études de médecine nucléaire effectuées pour les examens auxiliaires dans le DCN ont été publiées par Zuckier.51
L’échographie Doppler transcrânienne est suggérée car elle a été considérée comme ayant des effets désirables élevés sur la base d’un taux acceptable de faux négatifs et de faibles effets indésirables basés sur des taux acceptables de faux positifs. Les besoins en ressources pour ce test ont été jugés bas (économies modérées) avec une variabilité dans l’acceptabilité, notamment en raison de sa dépendance à l’expertise du clinicien, de sa nouveauté en tant qu’examen pour le DCN et de l’hétérogénéité des critères diagnostiques échographiques dans les données probantes. De plus, cet examen peut ne pas être réalisé de façon fiable dans une proportion significative (~10 %) de patients présentant des fenêtres osseuses inadéquates. Il se peut que la disponibilité de cet examen soit limitée dans les hôpitaux canadiens et que l’hétérogénéité de la formation des cliniciens ne reflète peut-être pas le niveau d’expertise trouvé dans les données probantes à l’appui de notre recommandation. L’inspection visuelle des schémas de circulation sanguine devrait montrer un flux réverbérant (c.-à-d. un flux diastolique rétrograde en présence d’un flux systolique antérograde), des pics systoliques ou l’absence de flux chez un patient avec un flux documenté dans une échographie Doppler transcrânienne antérieure, dans les circulations antérieure (au minimum les artères cérébrales moyennes) et vertébrobasilaire (au minimum l’artère basilaire) pour un DCN s’appuyant sur l’échographie Doppler transcrânienne.52,53 Une échographie formelle doit être réalisée et interprétée par un expert ayant une formation formelle en neurosonographie. L’échographie au point d’intervention, communément appelée échographie au chevet, est déconseillée pour le DCN puisque les études qui ont déterminé l’exactitude de cet examen auxiliaire ont généralement été réalisées par des cliniciens expérimentés.
Une étude de circulation cérébrale nucléaire (utilisant généralement un produit radiopharmaceutique lipophobe) n’est pas suggérée compte tenu des taux significatifs de faux négatifs et des taux significatifs de faux positifs. Les agents lipophiles sont préférés pour montrer la perfusion et l’absorption tissulaire.
Bien que l’EEG ait été considéré comme ayant des effets désirables élevés en raison d’un taux acceptable de faux négatifs et d’effets indésirables modérés en raison d’un taux acceptable de faux positifs, des préoccupations concernant la validité du test en présence de facteurs confondants à l’examen clinique, tels qu’une intoxication persistante ou une sédation, et l’incapacité de détecter la fonction des structures cérébrales profondes et du tronc cérébral, ont conduit à la suggestion de ne pas l’utiliser pour le DCN.
Les potentiels évoqués auditifs du tronc cérébral ne sont pas suggérés en raison des faibles effets désirables basés sur un taux élevé de faux négatifs et des effets indésirables élevés dus à un taux élevé de faux positifs.
Malgré son utilisation historique, l’angiographie cérébrale à quatre vaisseaux n’est plus suggérée en raison des effets souhaitables modérés basés sur un taux acceptable de faux négatifs et des effets indésirables élevés en l’absence de données sur la spécificité de cet examen. Les ressources nécessaires pour cet examen ont également été jugées comme étant modérées à élevées par rapport à d’autres examens auxiliaires.
L’imagerie par résonance magnétique avec angiographie par temps de vol n’est pas suggérée compte tenu des effets désirables modérés basés sur un taux significatif de faux négatifs et des effets indésirables modérés dus à un taux significatif de faux positifs.
Examens auxiliaires – pédiatrie (âgés < 18 ans)
|
Nous suggérons de réaliser une étude de perfusion cérébrale nucléaire utilisant un produit radiopharmaceutique lipophile tel que le 99mTc-HMPAO ou son équivalent (qui incorpore à la fois une phase de circulation et une phase parenchymateuse) avec ou sans imagerie tomographique chez les patients pédiatriques nécessitant des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude faible). Nous suggérons de réaliser une étude de circulation cérébrale nucléaire utilisant un produit radiopharmaceutique lipophobe tel que le 99mTc-DTPA, le 99mTc-GHA, le 99mTc-pertechnétate, ou un équivalent (qui n’incorpore qu’une phase de circulation) lorsqu’un examen utilisant un produit radiopharmaceutique lipophile ne peut pas être réalisé chez les patients pédiatriques qui nécessitent des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude faible). Nous suggérons de ne pas réaliser d’EEG, d’échographie Doppler transcrânienne, de test des potentiels évoqués auditifs du tronc cérébral, de test des potentiels évoqués somatosensoriels, d’angiographie par tomodensitométrie et d’angiographie à quatre vaisseaux chez les patients pédiatriques nécessitant des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude très faible). Nous suggérons de ne pas réaliser d’examen auxiliaire chez les nourrissons de moins de deux mois d’âge gestationnel corrigé qui nécessitent des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude très faible). |
Le groupe de travail sur les examens auxiliaires a évalué les examens auxiliaires suivants pour une administration chez les patients pédiatriques : EEG, échographie Doppler transcrânienne, test des potentiels évoqués auditifs du tronc cérébral, test des potentiels évoqués somatosensoriels, études nucléaires, angiographie par tomodensitométrie et angiographie à quatre vaisseaux. Les considérations de coût ont été jugées négligeables entre tous les examens auxiliaires évalués.
Compte tenu de l’absence de données spécifiques pour l’angiographie par tomodensitométrie et l’angiographie à quatre vaisseaux en pédiatrie, nous avons extrapolé à partir de la littérature adulte et impliqué le jugement des cliniciens en pédiatrie. L’angiographie par tomodensitométrie n’a été évaluée comme étant précise que lorsque des données adultes ont été incluses pour déterminer la spécificité. L’angiographie par tomodensitométrie présente un risque très sérieux de biais indirect et a été jugée impossible à extrapoler aux nourrissons et aux jeunes enfants, de telle sorte que le groupe de travail a suggéré de ne pas utiliser d’angiographie par tomodensitométrie.
Avec l’inclusion d’études pédiatriques spécifiques, le groupe de travail sur les examens auxiliaires a souligné que les seuls examens auxiliaires acceptables pour les principaux intervenants étaient les études nucléaires, avec l’utilisation d’agents lipophiles comme premier choix étant donné leur capacité à détecter à la fois la circulation et l’absorption tissulaire.
Des données sur la spécificité n’étaient pas disponibles dans les études pédiatriques ou adultes pour l’angiographie à quatre vaisseaux. Compte tenu de cela, du risque accru de thromboembolie et de la difficulté technique à réaliser une angiographie à quatre vaisseaux chez les nourrissons et les jeunes enfants, les effets indésirables ont été jugés comme l’emportant sur les effets désirables et nous recommandons donc de ne pas utiliser l’angiographie à quatre vaisseaux pour les patients pédiatriques nécessitant un examen auxiliaire pour un DCN.
Aucune étude n’a été menée chez les nourrissons et les enfants évaluant l’imagerie par résonance magnétique avec angiographie.
Il a été noté que l’exactitude de l’EEG peut être confondue par les médicaments sédatifs et l’hypothermie, ne peut pas détecter la fonction électrique profonde du cerveau ou du tronc cérébral, et peut nécessiter des examens en série, retardant ainsi la détermination du décès. Le groupe de travail a donc suggéré de ne pas l’utiliser.
D’autres études sont nécessaires avant d’envisager l’échographie Doppler transcrânienne, le test des potentiels évoqués auditifs du tronc cérébral et le test des potentiels évoqués somatosensoriels dans la population pédiatrique. Des études sur l’échographie Doppler transcrânienne sont nécessaires pour normaliser les vaisseaux étudiés et évaluer la forme d’onde et la circulation dans les artères cérébrales moyennes bilatérales, les artères cérébrales antérieures bilatérales et les artères basilaires et vertébrales.
De plus, d’autres études sont nécessaires pour mieux comprendre l’efficacité des examens auxiliaires pour le DCN chez les nourrissons (âge gestationnel corrigé de moins de deux mois).55 Tous les nourrissons, mais particulièrement ceux de ce groupe d’âge, ont des fontanelles ouvertes et des sutures crâniennes non fusionnées qui possèdent la faculté d’augmenter la compliance intracrânienne. Ces différences anatomiques ont le potentiel de modifier l’hémodynamie cérébrale et la précision des examens auxiliaires qui évaluent la circulation sanguine cérébrale et la perfusion cérébrale par rapport aux enfants plus âgés et aux adultes qui ont des crânes rigides. À l’heure actuelle, les données probantes disponibles ne sont pas suffisamment rigoureuses pour suggérer avec confiance qu’un examen auxiliaire soit réalisé pour déterminer le décès chez ces patients, même si cela exclut un DCN dans des situations où un examen auxiliaire serait autrement requis. L’absence d’examen auxiliaire valide dans ce groupe d’âge augmente la rigueur de la détermination. Donc, si deux évaluations cliniques complètes ne sont pas possibles pour les nourrissons de moins de deux mois d’âge gestationnel corrigé (p. ex. facteurs confondants non résolus, incapacité de compléter l’évaluation clinique), le décès selon des critères neurologiques ne peut pas être déterminé. D’autres soins de fin de vie peuvent être envisagés.
Résumé des considérations propres à l’enfant pour la détermination du décès selon des critères neurologiques
Aux fins des présentes Lignes directrices, le groupe d’âge pédiatrique désigne les nouveau-nés (à partir d’un âge gestationnel corrigé de 37 semaines à moins de deux mois), les nourrissons (de deux mois à moins d’un an) et les enfants (d’un an à moins de 18 ans). Des recommandations spécifiques à la pédiatrie ont été décrites ci-dessus et sont répétées ici pour plus de commodité.
| Nous suggérons que deux évaluations cliniques complètes séparées dans le temps soient suffisantes pour les patients dont l’âge gestationnel corrigé est inférieur à un an qui sont soumis à un DCN (recommandation faible, données probantes de certitude très faible). |
Pour les nouveau-nés, l’évaluation clinique doit inclure le réflexe de succion et le réflexe des points cardinaux.
Pour les nourrissons dont l’âge gestationnel corrigé est inférieur à deux mois, des précautions doivent être prises en ce qui concerne l’évaluation clinique. Un minimum de 24 heures entre les évaluations est conseillé, bien que l’intervalle de temps puisse être prolongé selon le jugement du médecin.
Pour les enfants de plus d’un an, les recommandations pour l’évaluation clinique chez les adultes s’appliquent.
|
Nous suggérons de réaliser une étude de perfusion cérébrale nucléaire utilisant un produit radiopharmaceutique lipophile tel que le 99mTc-HMPAO ou son équivalent (qui incorpore à la fois une phase de circulation et une phase parenchymateuse) avec ou sans imagerie tomographique chez les patients pédiatriques nécessitant des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude faible). Nous suggérons de réaliser une étude de circulation cérébrale nucléaire utilisant un produit radiopharmaceutique lipophobe tel que le 99mTc-DTPA, le 99mTc-GHA, le 99mTc-pertechnétate, ou un équivalent (qui n’incorpore qu’une phase de circulation) lorsqu’un examen utilisant un produit radiopharmaceutique lipophile ne peut pas être réalisé chez les patients pédiatriques qui nécessitent des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude faible). Nous suggérons de ne pas réaliser d’EEG, d’échographie Doppler transcrânienne, de test des potentiels évoqués auditifs du tronc cérébral, de test des potentiels évoqués somatosensoriels, d’angiographie par tomodensitométrie et d’angiographie à quatre vaisseaux chez les patients pédiatriques nécessitant des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude très faible). Nous suggérons de ne pas réaliser d’examen auxiliaire chez les nourrissons de moins de 2 mois d’âge gestationnel corrigé qui nécessitent des examens auxiliaires pour un DCN (recommandation faible, données probantes de certitude très faible). |
Heure du décès et documentation
Pour un DCN, l’heure légale du décès enregistrée correspond à l’heure d’achèvement du dernier examen requis pour satisfaire aux critères de détermination du décès. Lorsque la loi exige que le décès soit déterminé par deux médecins à des fins de don d’organes, l’heure légale du décès au Canada est toujours l’heure de la première détermination. Par respect pour les mandataires spéciaux et/ou les familles, toute possibilité de retard entre la fin des tests, entre l’examen et l’interprétation des résultats des tests et la déclaration de décès par le médecin responsable devrait être réduite au minimum.
Lorsque le DCN est établi par une évaluation clinique et qu’un examen auxiliaire n’est pas requis, le test d’apnée devrait être l’élément final de l’évaluation clinique. L’heure du décès est le moment où l’échantillon de sang démontrant que la PaCO2 a atteint les cibles du test d’apnée a été prélevé, malgré que ces résultats dussent bien sûr être formellement interprétés puis documentés par le médecin responsable.
Si des examens auxiliaires sont nécessaires, l’heure du décès est documentée comme le moment où l’examen auxiliaire a été terminé, étant entendu que les résultats doivent encore être interprétés formellement par des experts en neuroimagerie, puis documentés par le médecin responsable.
Si des étapes se produisent en dehors de la séquence recommandée (p. ex., un examen auxiliaire est réalisé avant l’évaluation clinique), l’heure du décès enregistrée est l’heure où le dernier examen requis est réalisé (c.-à-d. lorsque tous les éléments ou critères requis sont remplis).
Dans de nombreuses provinces, la législation stipule qu’aux fins d’un don d’organes, le décès doit être déterminé par deux médecins conformément à la pratique médicale reconnue. Comme il est indiqué dans les Recommandations de 2006 sur la détermination du décès,8 et confirmé ici, il n’existe pas de raison biomédicale claire pour justifier l’implication d’un deuxième clinicien ou une deuxième évaluation clinique. Par conséquent, conformément à la loi, dans le cadre du don d’organes, deux cliniciens peuvent réaliser l’évaluation clinique simultanément. Si elle est réalisée à différents moments, la deuxième évaluation clinique requise pour le don d’organes doit être entièrement répétée. En l’absence de don d’organes, il n’est pas nécessaire d’avoir un deuxième clinicien ou une deuxième évaluation clinique. Donc, l’heure légale du décès au Canada est celle de la première détermination du décès.
Si une évaluation clinique valide est réalisée et que les résultats confirment le DCN, mais que des examens supplémentaires sont réalisés pour des raisons non médicales qui dépassent les exigences pour la détermination du décès (p. ex., à la demande de la famille, en réponse à une contestation judiciaire), ces examens supplémentaires ne modifient pas l’heure déclarée du décès.
L’accomplissement de toutes les phases de détermination du décès doit être clairement documenté par le médecin responsable dans le dossier médical du patient (énoncé de bonne pratique). Une liste de contrôle normalisée devrait être utilisée pour la détermination et la documentation du décès (énoncé de bonne pratique).
Qualifications des cliniciens
Tout clinicien participant à la détermination du décès doit posséder les compétences, la formation et les connaissances requises en matière de processus et de procédures de détermination du décès (énoncé de bonne pratique). Pour un DCN, les cliniciens doivent détenir : un permis d’exercice complet et à jour de la pratique médicale indépendante octroyé par le collège des médecins et chirurgiens ou l’autorité de délivrance des permis dans la province ou le territoire canadien pertinent; les compétences et connaissances requises dans la prise en charge des patients atteints de lésions cérébrales dévastatrices et dans le DCN; aucun niveau particulier de certification de spécialisation.
Pour le don d’organes, le deuxième clinicien peut être un.e infirmier.ère praticien.ne, si cela est conforme aux règlements de la province ou du territoire, à condition que cette personne possède les compétences et les connaissances requises en matière de DCN. Les deux cliniciens qui déterminent le décès ne doivent pas avoir d’association ou de participation active aux procédures de transplantation, à l’attribution d’organes ou aux soins des receveurs de greffe prévus (énoncé de bonne pratique).
Les médecins qui supervisent et interprètent les examens radiologiques auxiliaires pour un DCN devraient être formés en neuroradiologie et avoir de l’expérience dans la réalisation et l’interprétation de l’examen spécifique réalisé. Pour l’angiographie par tomodensitométrie, les radiologistes devraient posséder l’expérience requise dans l’utilisation du protocole et de l’échelle appropriés. Pour la tomodensitométrie de perfusion, les radiologistes devraient posséder la formation requise quant à l’exécution et l’interprétation de cet examen (énoncé de bonne pratique).
Les médecins qui supervisent et interprètent les examens nucléaires auxiliaires pour un DCN devraient avoir suivi une résidence en médecine nucléaire et avoir de l’expérience dans la réalisation et l’interprétation de l’examen spécifique réalisé (énoncé de bonne pratique).
Les médecins qui supervisent et interprètent les échographies Doppler transcrânienne pour un DCN devraient être formés adéquatement en neurosonologie et avoir de l’expérience dans la réalisation et l’interprétation de l’examen spécifique réalisé (énoncé de bonne pratique). L’échographie Doppler transcrânienne est un examen physiologique complexe en médecine vasculaire nécessitant des compétences, une formation et une compréhension approfondies de l’anatomie cérébrovasculaire, de la physiologie et d’une variété de conditions pathologiques cliniquement diverses. Bien qu’il n’existe actuellement aucune ligne directrice claire émise par une société professionnelle décrivant l’expertise minimale nécessaire, l’expérience informelle en échographie au point d’intervention, communément appelée échographie au chevet, n’est pas suffisante.
Communication avec les mandataires spéciaux et/ou les membres de la famille
Soutenir un être cher tout au long du processus de décès impose souvent un fardeau émotionnel et psychologique écrasant aux mandataires spéciaux et aux familles. Une équipe de soutien multidisciplinaire (p. ex. personnel infirmier, travailleurs sociaux, psychologues, intervenants en soins spirituels, responsables religieux et coordonnateurs de dons, le cas échéant) devrait participer aux discussions en matière de soins le plus rapidement possible lorsqu’on soupçonne qu’un patient peut évoluer vers le décès (énoncé de bonne pratique).
Étant donné que les mandataires spéciaux, les familles et le public pourraient avoir de la difficulté à comprendre un DCN,3,4 une grande partie de l’information ci-dessous est liée au DCN. En ce qui concerne le DCC, les familles devraient être préparées à la nature urgente du processus de détermination du décès et de la période d’observation axée sur la confirmation de l’arrêt permanent de la circulation.
Communication au sujet de la détermination du décès selon des critères neurologiques
Les cliniciens peuvent faciliter la compréhension et l’acceptation du DCN par les membres de la famille, ce qui pourrait également améliorer les issues du deuil.3,55,56 Il est important de reconnaître que, pour de nombreux membres de la famille, la compréhension se développe au fil du temps plutôt que lors d’une rencontre isolée. Les considérations particulières comprennent : 1) l’utilisation d’un langage clair et cohérent concernant le DCN; 2) la préparation à l’avance des mandataires spéciaux et des familles aux étapes typiques pendant et après un DCN; 3) la reconnaissance du fait que ce que les mandataires spéciaux et les familles voient (p. ex., la poitrine du patient qui s’élève et descend) et ressentent (p. ex., la température corporelle chaude du patient) peut rendre difficile la compréhension d’un DCN; 4) l’anticipation et la clarification de la signification des réponses motrices spinales; 5) la répétition de l’information (p. ex., au fil de plusieurs rencontres) pour améliorer la compréhension des mandataires spéciaux et des familles; 6) le recours à des méthodes de communication multimodales (p. ex., proposer de montrer des images lorsque cela est possible et/ou fournir de l’information écrite, comme des outils d’information destinés aux familles); 7) l’invitation des mandataires spéciaux et des familles à assister à l’évaluation clinique du DCN; et 8) l’offre à la famille d’occasions pour accomplir des rituels qui accompagnent les transitions de la vie à la mort, en prenant note que, bien que le « voyage clinique » d’un patient puisse arriver à sa fin, son voyage spirituel et relationnel, par exemple, pourrait se poursuivre.5,57
Des entrevues approfondies avec des membres de la famille ont révélé que, pour les familles qui ont été témoins du processus de DCN, en particulier de l’évaluation clinique au chevet du patient, y compris de l’observation du test d’apnée, ces instants ont constitué un moment crucial pour donner une compréhension concrète et ont souvent aidé les familles à tourner la page.3
Consentement pour la détermination du décès selon des critères neurologiques
Le consentement pour les examens pour un DCN ne devrait être ni requis ni demandé. Le poids écrasant de l’autorité légale et éthique soutient que les cliniciens ne sont pas tenus d’obtenir le consentement de la famille avant d’effectuer des tests pour un DCN.32 Il est essentiel que les cliniciens soient en mesure d’évaluer l’état vital des patients dont ils s’occupent, car cela fait partie de la prestation adéquate des soins de santé.
Les cliniciens devraient avoir des discussions avec les mandataires spéciaux et/ou les familles pour fournir des informations sur le moment où et la façon dont le DCN se produira. Cela inclut des informations sur ce qui suit généralement un DCN, comme le retrait de la ventilation et d’autres assistances somatiques.32
Désamorcer et gérer les désaccords ou les conflits
Des désaccords ou des conflits peuvent survenir dans le contexte d’un DCN, compte tenu de la nature de ce que cela signifie pour les mandataires spéciaux, les familles et les professionnels de la santé. Le groupe de travail sur le droit et l’éthique a cerné les principales sources de désaccord ou de conflit suivantes : 1) le deuil, les événements imprévus et le besoin de temps pour assimiler ces événements; 2) une mauvaise compréhension du DCN; (3) le manque de confiance envers les professionnels, les organisations ou les systèmes de soins de santé; et/ou 4) le fait d’arborer des différences religieuses, spirituelles et philosophiques concernant la définition et la détermination de la mort.5
Des stratégies et des approches qui aident à aborder ces situations avec respect et compassion devraient être mises en œuvre.3,5 Celles-ci comprennent, sans toutefois s’y limiter : 1) veiller à ce que les pratiques exemplaires en matière de communication avec les mandataires spéciaux et/ou les membres de la famille, telles que décrites ci-dessus, soient mises en œuvre; 2) la formation continue des équipes de soins de santé en ce qui concerne le DCN, la participation à des discussions difficiles, la sécurité culturelle et les soins tenant compte des traumatismes; 3) offrir ou impliquer des soutiens supplémentaires, tels que des soignants spirituels, des membres de l’éthique, des travailleurs sociaux, des conseillers autochtones ou des aînés; et 4) donner aux familles l’occasion de discuter de leurs croyances et valeurs entourant la mort et la détermination du décès. Si le désaccord ou le conflit persiste, une consultation en éthique peut être justifiée.
Déclaration de décès et heure légale du décès
L’heure légale du décès a des implications importantes. Avant l’heure du décès, les obligations légales liées au traitement d’une personne vivante s’appliquent. Une fois que le décès a été déterminé et déclaré, des rites psychosociaux peuvent survenir et les obligations légales changent. L’heure du décès a des répercussions juridiques sur les testaments et la répartition des successions, la situation familiale et les produits d’assurance-vie. Elle met fin à toute obligation légale de fournir une assistance somatique continue et autorise le don post-mortem d’organes et de tissus, l’autopsie, la disposition de la dépouille et les procédures d’inhumation.
Les cliniciens doivent reconnaître et expliquer qu’il peut y avoir des différences entre le moment où le décès survient, le moment où le décès est déterminé (tests) et le moment où le décès est documenté et officiellement déclaré, selon le DCC et le DCN, différences décrites ci-dessus. Chez les patients soumis à un DCC, ces événements se produisent dans une proximité temporelle; par conséquent, l’heure légale du décès est facilement comprise par les mandataires spéciaux, les familles et les professionnels de la santé. Néanmoins, l’heure du décès chez les patients soumis à un DCN est sujette à des malentendus de la part des mandataires spéciaux, des familles et des professionnels de la santé, car la respiration artificielle et la fonction cardiaque sont maintenues avant, pendant et après la détermination du décès. Le décès est déjà survenu et les tests de détermination et la déclaration de décès le confirment après coup.
D’autres circonstances peuvent ajouter à la confusion, car il peut également y avoir des différences dans l’heure où l’élément final de la détermination est terminé vs l’heure à laquelle il est formellement interprété ou documenté vs l’heure à laquelle le médecin responsable examine l’information. En outre, le DCN peut avoir été déclaré pour un patient dans un centre, puis ce patient est transféré dans un autre centre pour un don d’organes et subit à nouveau des tests qui ne sont pas nécessaires pour déterminer le décès.
Aménagements raisonnables
Il existe des raisons légitimes de permettre des aménagements raisonnables pour accommoder la résistance au DCN des mandataires spéciaux et des familles.5 La résistance au DCN peut être formulée en termes de droits légaux comme la liberté de religion, ou elle peut être liée à des facteurs tels que l’incompréhension ou la méfiance à l’égard de la détermination du décès, le choc ou le chagrin. Même en l’absence d’objections à un DCN, il est actuellement courant de retarder temporairement le retrait de la ventilation et d’autres assistances somatiques pour donner aux mandataires spéciaux et aux familles le temps d’accepter la détermination du décès, respecter les souhaits de fin de vie et effectuer les observances.
Il n’est pas conseillé d’exempter des procédures de détermination du décès les patients dont les mandataires spéciaux ou les familles s’y opposent : en effet, les cliniciens doivent être en mesure d’évaluer l’état vital des patients dont ils prennent soin. Néanmoins, dans des circonstances exceptionnelles, on peut envisager de retarder le retrait de la ventilation et d’autres assistances somatiques après un DCN pendant une période relativement courte (c.-à-d. quelques jours).5,7 La durée spécifique dépendra des circonstances de chaque cas et devrait être sensible à celles-ci, y compris si des ressources médicales sont nécessaires de toute urgence pour protéger la vie ou la santé d’un autre patient. Compte tenu de ces considérations, les organismes de soins de santé devraient élaborer des politiques qui décrivent le processus et les étapes nécessaires pour traiter les situations où il y a un conflit continu ou croissant au sujet du DCN et/ou du retrait de la ventilation et d’autres assistances somatiques. Dans le cadre de leur élaboration et de leur examen, ces politiques devraient inclure les commentaires des patients et des familles.
Autres lignes directrices
En 2020, le World Brain Death Project (WBDP) a publié des lignes directrices complètes fondées sur des données probantes pour la pratique du DCN.11 Dans de nombreux domaines, nos recommandations contemporaines sont en accord avec les lignes directrices canadiennes publiées précédemment8–10 et les recommandations du WBDP, mais la force de chacune des recommandations est maintenant explicitement liée à la qualité des données probantes qui l’appuie. De plus, les membres de la famille des patients et le public ont été inclus en tant que membres du comité dans l’élaboration de ces Lignes directrices. Les recommandations actuelles entraîneront des changements aux pratiques canadiennes dans plusieurs domaines clés.
La définition du décès
Une définition unique du décès basée sur l’arrêt permanent de la fonction cérébrale.
Pour la détermination du décès selon des critères circulatoires
-
2.
L’utilisation d’une surveillance invasive continue de la tension artérielle et d’une pression pulsée artérielle ≤ 5 mm Hg sont nécessaires pour confirmer l’arrêt définitif de la circulation. L’électrocardiogramme peut être envisagé dans les cas où une canule artérielle n’est pas fiable ou n’est pas insérée. D’autres dispositifs de surveillance non invasifs ne devraient pas être utilisés.
-
3.
Un temps d’observation de dix minutes pour confirmer l’arrêt définitif de la circulation chez les patients soumis à un don non contrôlé après un DCC.
-
4.
L’arrêt permanent de la circulation intracrânienne (cérébrale) doit être maintenu si des interventions de don d’organes post-mortem sont effectuées.
Pour la détermination du décès selon des critères neurologiques
-
5.
La cause d’une lésion cérébrale dévastatrice doit être étayée par des données de neuroimagerie compatibles avec la cause établie.
-
6.
Un délai de 48 heures à compter du moment de retour de la circulation spontanée après un arrêt cardiaque chez les patients présentant une atteinte hypoxique-ischémique dont les données d’imagerie ne sont pas compatibles avec une lésion cérébrale dévastatrice avant de réaliser l’évaluation clinique pour un DCN.
-
7.
Le retrait du réflexe oculocéphalique comme élément de l’évaluation clinique du DCN.
-
8.
Une température corporelle centrale de ≥ 36°C (au lieu de ≥ 34°C) avant de réaliser l’évaluation clinique pour un DCN.
-
9.
Des recommandations pour les tests d’apnée qui incluent l’oxygénation passive, la pression positive continue ou l’administration de CO2 exogène.
-
10.
Une lésion cérébrale infratentorielle sans atteinte supratentorielle significative ne répond pas aux critères de DCN et nécessite un examen auxiliaire.
-
11.
Les recommandations d’examens auxiliaires chez l’adulte comprennent maintenant l’échographie Doppler transcrânienne, la tomodensitométrie de perfusion, l’angiographie par tomodensitométrie ou une étude de perfusion cérébrale nucléaire avec utilisation d’un agent lipophile. L’angiographie à quatre vaisseaux n’est plus recommandée.
-
12.
Les examens auxiliaires pédiatriques privilégient une étude de perfusion nucléaire avec utilisation d’un agent lipophile et, si elle n’est pas disponible, une étude de circulation cérébrale nucléaire avec utilisation d’un agent lipophobe. L’angiographie à quatre vaisseaux n’est plus recommandée.
-
13.
Les examens auxiliaires ne sont plus recommandés pour les nourrissons de moins de deux mois d’âge gestationnel corrigé.
-
14.
Un minimum de 24 heures entre chaque évaluation clinique pour les nourrissons de moins de deux mois est conseillé. L’intervalle de temps peut être prolongé selon le jugement du médecin.
Lacunes dans les connaissances
Les difficultés à mener des études cliniques randomisées et des études à grande échelle dans ce domaine ont entraîné un manque de données rigoureuses pour le DCN et le DCC. La plupart des recherches sont principalement de nature observationnelle et de nombreuses questions cliniques importantes n’ont pas pu être résolues par des données probantes directes. Les données spécifiques à la population pédiatrique, aux patients bénéficiant de l’AMM et aux patients ayant subi une craniectomie décompressive sont généralement manquantes. Des domaines de recherche future ont été identifiés,58 qui comprennent, entre autres : les pressions pulsées minimales pour la perfusion, l’activité et la fonction cérébrales; la prédiction et la progression temporelle de la lésion cérébrale au décès; et les tests d’évaluation clinique, y compris les tests d’apnée et la performance et la qualité des examens auxiliaires. Une exploration plus approfondie des expériences et des perspectives familiales sur l’interruption des thérapies de maintien des fonctions vitales et la détermination du décès serait également utile. Une liste des lacunes dans les connaissances relevées tout au long du projet est disponible à l’annexe électronique 11 en MES.
Forces et limites de ces Lignes directrices
Pour élaborer ces Lignes directrices, nous avons utilisé un processus rigoureux qui a intégré des experts nationaux et internationaux de multiples disciplines, inclus des partenaires publics et familiaux, adhéré à la méthodologie GRADE et soigneusement géré les conflits d’intérêt des membres du comité. Notre processus comprenait un examen détaillé et la prise en compte de questions juridiques et éthiques complexes ainsi qu’une stratégie globale de mobilisation des intervenants. En même temps, nous reconnaissons les limites, notamment le manque de données probantes directes à l’appui de certaines des recommandations et la certitude faible ou très faible des données probantes pour la plupart des issues et des comparaisons d’intérêt. Nous avons limité la stratégie de recherche et les critères de sélection aux études publiées en anglais ou en français, et il se peut donc que nous ayons manqué des données probantes publiées dans d’autres langues. Les principes médicaux fondamentaux, un nouveau type d’orientation élaboré dans le cadre de ce processus, n’étaient pas assujettis à la méthodologie GRADE; toutefois, compte tenu de leur position historique dans les cadres médical, juridique et éthique de la détermination du décès au Canada, ces principes ont été créés pour répondre à un besoin important qui ne cadrait pas avec les méthodes GRADE. Selon l’évolution de la base de données probantes et du paysage juridique canadien, il pourrait être nécessaire de réviser les principes médicaux fondamentaux. Enfin, nous reconnaissons que la définition du décès décrite ici exige l’arrêt de la fonction cérébrale telle que définie par l’absence totale de toute forme de conscience et l’absence de réflexes du tronc cérébral, y compris la capacité de respirer de manière autonome. L’activité résiduelle des cellules cérébrales qui n’est pas associée à la présence de conscience ou à toute fonction du tronc cérébral n’empêche pas la détermination du décès, y compris la libération d’hormones antidiurétiques par l’hypophyse postérieure, le contrôle de la température ou l’activité neuronale au niveau cellulaire. Nous soutenons que cela est conforme à certaines définitions juridiques existantes du décès, qui exigent l’arrêt de « toutes » les fonctions cérébrales, bien que certains puissent adopter une position contraire. Une analyse plus approfondie de la cohérence de la définition énoncée avec le droit existant est disponible dans la publication pertinente.7
Mise en œuvre
Ces Lignes directrices 2023 contiennent des recommandations qui changeront la pratique et qui nécessiteront une collaboration approfondie avec de multiples groupes d’intervenants (professionnels de la santé, administrateurs d’hôpitaux, organismes de don d’organes, décideurs, patients, familles et public) afin de faciliter l’éducation des personnes touchées par les recommandations et d’assurer une adoption uniforme dans les protocoles hospitaliers. Pour faciliter la mise en pratique de ces recommandations, nous avons créé des protocoles détaillés pour le DCN (voir annexe électronique 9 en MES) ainsi qu’une liste de contrôle pour le DCC (figure 2) et une liste de contrôle pour le DCN (figure 3).4 D’autres efforts d’application des connaissances devront être déployés sur plusieurs fronts, y compris la participation des sociétés professionnelles et des organisations d’intervenants.
Nous avons formulé des recommandations fondées sur des données probantes quant à la pertinence d’examens auxiliaires spécifiques. Nous avons également émis des énoncés de bonnes pratiques concernant l’expertise et les qualifications requises pour réaliser de tels examens, mais nous n’avons pas formulé de recommandations spécifiques sur la façon d’y parvenir. Les cliniciens qui réalisent ces examens devraient consulter les lignes directrices de leurs associations professionnelles respectives.
En règle générale, les lignes directrices doivent être examinées tous les deux à cinq ans pour déterminer si elles doivent être mises à jour.59,60 Une surveillance régulière de la littérature devrait être effectuée avec des mises à jour motivées par l’un des éléments suivants : nouvelles données probantes sur les avantages et les inconvénients existants des interventions; changements dans les issues jugées importantes; changements dans les interventions disponibles; changements dans les données probantes selon lesquelles la pratique actuelle est optimale; changements dans les valeurs attribuées aux issues; ou changements dans les ressources disponibles pour les soins de santé.
Conclusion
Les présentes Lignes directrices de pratique clinique 2023 fournissent une définition biomédicale du décès fondée sur l’arrêt permanent de la fonction cérébrale et définissent les termes qui font partie intégrante de leur utilisation. Elles fournissent des recommandations pour le DCN pour tous les patients ventilés mécaniquement ainsi que des recommandations pour le DCC pour les donneurs d’organes potentiels. Des stratégies et des approches pour interagir et communiquer avec les mandataires spéciaux et/ou les familles sont proposées. Nous espérons que les présentes Lignes directrices encourageront l’uniformité et amélioreront la clarté et la confiance à l’égard des pratiques de détermination du décès au Canada.
Contributions des auteurs
Sam D. Shemie, Lindsay C. Wilson, Laura Hornby, Sylvia Torrance et Bram Rochwerg ont initié et établi le processus d’élaboration de ces Lignes directrices. Tous les auteurs ont contribué à l’analyse et à l’interprétation des données et des informations recueillies. Tous les auteurs ont rédigé le manuscrit, l’ont examiné et révisé de manière critique.
Remerciements
Nous remercions sincèrement Joanne Brennan, Heather Brewster, Kennedy Elliott-Pohl – nos membres des familles de donneurs, ainsi que Robert Carignan – notre représentant public et membre de la Voix des patients de l’Association médicale canadienne, dont les perspectives et l’expérience ont permis à cette initiative de se concentrer sur l’objectif primordial : fournir des soins de fin de vie de haute qualité aux patients ventilés mécaniquement soumis à un DCN et aux donneurs potentiels d’organes soumis à un DCC.
Nous tenons à reconnaître le soutien des services d’information que nous avons reçu pour concevoir et exécuter les stratégies de recherche pour les revues systématiques utilisées pour informer les présentes Lignes directrices : Robin Featherstone, MLIS, spécialiste de l’information et bibliothécaire de recherche, Dagmara Chojecki, MLIS, spécialiste de l’information et bibliothécaire de recherche, Daniela Ziegler, MSI, bibliothécaire, Direction de l’enseignement et de l’Académie du Centre hospitalier de l’Université de Montréal. Les auteurs expriment également leur gratitude à Katie O’Hearn, MSc, et James Dayre McNally, MD, de l’Institut de recherche du Centre hospitalier pour enfants de l’est de l’Ontario pour leur soutien dans l’utilisation de la plateforme InsightScope®. Nous apprécions le soutien que nous avons reçu pour la sélection des citations et l’extraction des données pour les revues systématiques utilisées pour éclairer ces Lignes directrices : Jorden Arbour, M.D., Département de médecine d’urgence, Université du Manitoba, Nedaa Aldairi, MD, intensiviste pédiatrique, AlHabib Medical Group, Romina Alhooeinazari, B.Sc., Université Ryerson, Conall Francoeur, MDCM, Département de pédiatrie, CHU de Québec - Centre de recherche de l’Université Laval, Lalida Kongkiattikul, MD, Soins intensifs pédiatriques, Faculté de médecine, Université Chulalongkorn, Supun Kotteduwa Jayawarden, MD, B.Sc., Faculté de médecine, Université de la Colombie-Britannique, Abdullah Malik, HBSc, Université de Toronto, Christina Maratta, MDCM, MPH, Division interdépartementale des soins intensifs, Département de pédiatrie, Université de Toronto, Anna-Lisa V. Nguyen, BHSc, Faculté des sciences de la santé, Université McMaster, Jaewoo (Jason) Park, M.D., Université du Manitoba, Julie Abou Samra, étudiante en médecine, Faculté de médecine, Université Laval, Ryan V. Sandarage, MD, B.Sc., Faculté de médecine, Université de la Colombie-Britannique, Jonah Shemie, BSc, University College Cork, Krista Wollny, inf., Ph.D., Sciences de la santé communautaire, Université de Calgary; Institut de recherche de l’Hôpital pour enfants de l’Alberta, Belinda Yee, M.D., B.Sc., Université de la Colombie-Britannique, Austin Zaloum, M.D., Département de neurologie et de neurochirurgie, Université McGill, Nous tenons à souligner le soutien reçu pour mieux comprendre les facteurs confondants pharmacologiques dans le DCN, ainsi que les expériences des mandataires spéciaux en fin de vie, respectivement : Salmaan Kanji, PharmD, spécialiste en pharmacie clinique, Hôpital d’Ottawa; scientifique associé, Institut de recherche de l’Hôpital d’Ottawa; Université d’Ottawa (médecine); Université de Montréal (pharmacie), Amanda van Beinum, PhD., Université d’Ottawa, Enfin, nous tenons également à souligner l’animation médicale qui a été créée pour décrire le décès au public : Devon Stuart, MA, CMI, Devon Medical Art LLC.
Déclaration
Tous les membres du comité devaient remplir un formulaire de divulgation déclarant tout conflit d’intérêt direct ou indirect potentiel avant de participer au projet. Les formulaires de divulgation ont été recueillis de nouveau à la fin du projet, avant la publication. Les déclarations ont été examinées par les membres du comité directeur. Plusieurs membres du comité occupent des postes professionnels dans l’administration des dons d’organes, sont affiliés à des entités gouvernementales à but non lucratif ou ont reçu des fonds pour la recherche scientifique. De plus, trois membres du comité (M. Chassé, T. Gofton et M. Slessarev) étaient les chercheurs principaux d’études qui ont servi à formuler nos recommandations, mais qui n’avaient pas encore fait l’objet d’une révision par les pairs au moment de la soumission. Aucun membre du comité n’a été jugé comme ayant un conflit d’intérêt pertinent.
Les présentes Lignes directrices sont approuvées par la Société canadienne de soins intensifs, l’Association médicale canadienne, l’Association canadienne des infirmiers/infirmières en soins intensifs, la Société canadienne des anesthésiologistes, la Fédération des sciences neurologiques du Canada (représentant la Société canadienne de neurologie, la Société canadienne de neurochirurgie, la Société canadienne de neurophysiologie clinique, l’Association canadienne de neurologie pédiatrique, la Société canadienne de neuroradiologie et le Consortium neurovasculaire canadien), la Société canadienne du sang, le Programme de recherche en don et transplantation du Canada, l’Association canadienne des médecins d’urgence, l’Association des infirmières et infirmiers praticiens du Canada, la Société canadienne de soins intensifs cardiovasculaires (CANCARE) et la Société canadienne de pédiatrie.
Déclaration de financement
Ces Lignes directrices de pratique clinique ont pu voir le jour grâce à une contribution financière de Santé Canada par l’entremise de la Collaboration en matière de dons et de greffes d’organes (la Collaboration), et été élaborées dans le cadre d’un partenariat entre la Société canadienne de soins intensifs, la Société canadienne du sang et l’Association médicale canadienne.
La Collaboration est une initiative dirigée par Santé Canada avec les provinces et les territoires (à l’exception du Québec), la Société canadienne du sang, les patients, les familles, les cliniciens et les chercheurs. La vision de la Collaboration est d’améliorer les systèmes de don et de transplantation d’organes partout au Canada.
La Société canadienne de soins intensifs (SCSI) est la société nationale sans but lucratif spécialisée des médecins en soins intensifs, représentant les intensivistes adultes et pédiatriques au Canada. La pratique de la médecine des soins intensifs au Canada est multidisciplinaire et les membres de la SCSI détiennent des certifications de spécialisation de base en anesthésiologie, en médecine interne, en pédiatrie, en médecine d’urgence ou en chirurgie et certaines surspécialités chirurgicales telles que la chirurgie cardiaque et la neurochirurgie. Sa mission est de promouvoir et d’améliorer la médecine de soins intensifs au Canada. La SCSI adhère à la philosophie d’une pratique multidisciplinaire collaborative pour promouvoir la recherche, l’éducation et les soins aux patients en médecine des soins intensifs. À cette fin, la Société participe à l’éducation en médecine des soins intensifs en association avec le Collège royal des médecins et chirurgiens du Canada, et à la recherche en médecine des soins intensifs avec le Groupe canadien de recherche en soins intensifs.
L’Association médicale canadienne (AMC) est le porte-parole national de la profession médicale canadienne depuis 1867. L’AMC travaille avec les médecins, les résidents et les étudiants en médecine sur des questions importantes pour la profession et la santé des Canadiens. L’AMC défend des politiques et des programmes qui entraînent des changements significatifs pour les médecins et leurs patients. Guidée par sa stratégie Retombées 2040, l’AMC met l’accent sur la création de systèmes de santé solides et accessibles, la promotion du bien-être et de la diversité dans la culture médicale et l’assurance que chaque personne au Canada a une chance égale d’être en santé.
La Société canadienne du sang est un organisme de bienfaisance national sans but lucratif qui gère l’approvisionnement en sang et en produits sanguins dans toutes les provinces et tous les territoires du Canada (à l’exception du Québec) et supervise le Registre de donneurs de cellules souches de la Société canadienne du sang. En 2008, la Société canadienne du sang est devenue responsable des activités nationales liées au don et à la transplantation d’organes et de tissus, qui comprennent l’élaboration d’un système national et la gestion de programmes interprovinciaux de partage d’organes. La Société canadienne du sang n’est pas responsable de la gestion ou du financement d’un organisme canadien de dons d’organes ou d’un programme de transplantation. La Société canadienne du sang collabore avec la communauté des dons et transplantations d’organes et de tissus afin d’améliorer le système pour tous les Canadiens.
Santé Canada, la SCSI, la Société canadienne du sang et l’AMC n’assument aucune responsabilité et ne peuvent être tenues responsables des dommages, pertes ou blessures directs, indirects, spéciaux, accessoires ou consécutifs, prévus ou imprévus, quels qu’ils soient ou autres, qui pourraient résulter de la mise en œuvre, de l’utilisation ou de la mauvaise utilisation de toute information ou ligne directrice contenue dans les présentes Lignes directrices de pratique clinique. Les présentes Lignes directrices doivent être évaluées dans le contexte d’un examen complet des exigences médicales, juridiques et éthiques applicables dans chaque cas individuel.
Présentations antérieures dans le cadre de conférences
Congrès annuel de la Société canadienne des anesthésiologistes (juin 2022, Halifax, N.-É., Canada); Symposium des Spécialistes des soins de fin de vie, du neuropronostic et du don (novembre 2022, Calgary, AB, Canada); Forum de Soins intensifs Canada (novembre 2022, Toronto, ON, Canada)
Responsabilité éditoriale
Ce manuscrit a été traité par Dr Stephan K.W. Schwarz, rédacteur en chef, Journal canadien d'anesthésie.
Matériel électronique supplémentaire
Annexe électronique 1 Groupe d’experts chargé de l’élaboration des lignes directrices
Annexe électronique 2 Étude de portée
Annexe électronique 3 Définitions du décès dans les directives et législations nationales et internationales
Annexe électronique 4 Stratégies de recherche
Annexe électronique 5 Méthodologie d’élaboration des lignes directrices
Annexe électronique 6 Rapport de discussion des professionnels des soins spirituels : répercussions et mise en œuvre d’une définition cérébrale du décès
Annexe électronique 7 Résumés des données probantes et justification des recommandations : détermination du décès selon des critères circulatoires
Annexe électronique 8 Gestion des facteurs confondants pharmacologiques dans la détermination du décès selon des critères neurologiques
Annexe électronique 9 Évaluation clinique pour la détermination du décès selon des critères neurologiques
Annexe électronique 10 Résumés des données probantes et justification des recommandations : détermination du décès selon des critères neurologiques
Annexe électronique 11 Lacunes dans les connaissances
Supplementary Information
Below is the link to the electronic supplementary material.
Footnotes
Canadian Blood Services. Brain-based definition of death and evidence-based criteria for its determination after arrest of circulation or neurologic function in Canada, 2021. Available from URL: https://professionaleducation.blood.ca/en/organs-and-tissues/practices-guidelines-and-initiatives/deceased-donation/brain-based-definition-death (accessed January 2023).
Canadian Blood Services. Brain-based definition of death and evidence-based criteria for its determination after arrest of circulation or neurologic function in Canada, 2021. Available from URL: https://professionaleducation.blood.ca/en/organs-and-tissues/practices-guidelines-and-initiatives/deceased-donation/brain-based-definition-death (accessed January 2023).
Société canadienne du sang. Définition uniformisée de la mort cérébrale et de critères fondés sur des données probantes pour sa détermination au Canada, 2021. Disponible à partir de l’URL : https://professionaleducation.blood.ca/fr/organes-et-tissus/pratiques-et-directives/don-provenant-de-personnes-decedees/definition-mort (consulté en janvier 2023).
Société canadienne du sang. Définition uniformisée de la mort cérébrale et de critères fondés sur des données probantes pour sa détermination au Canada, 2021. Disponible à partir de l’URL : https://professionaleducation.blood.ca/fr/organes-et-tissus/pratiques-et-directives/don-provenant-de-personnes-decedees/definition-mort (consulté en janvier 2023).
Publisher's Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
References
- 1.Chen Y, Yang K, Marušic A, et al. A reporting tool for practice guidelines in health care: the RIGHT statement. Ann Intern Med. 2017;166:128–132. doi: 10.7326/m16-1565. [DOI] [PubMed] [Google Scholar]
- 2.Delbecq AL, Van de Ven AH, Gustafson DH. Group Techniques for Program Planning: A Guide to Nominal Group and Delphi Processes. Glenview: Scott Foresman; 1975.
- 3.Sarti AJ, Sutherland S, Meade M, et al. Death determination by neurologic criteria—what do families understand? Can J Anesth 2023; 10.1007/s12630-023-02416-3. [DOI] [PMC free article] [PubMed]
- 4.Sarti AJ, Honarmand K, Sutherland S, et al. When is a person dead? The Canadian public’s understanding of death and death determination: a nationwide survey. Can J Anesth 2023; 10.1007/s12630-023-02409-2. [DOI] [PMC free article] [PubMed]
- 5.Simpson C, Lee-Ameduri K, Hartwick M, et al. Navigating disagreement and conflict in the context of a brain-based definition of death. Can J Anesth 2023; 10.1007/s12630-023-02417-2. [DOI] [PMC free article] [PubMed]
- 6.Murphy NB, Hartwick M, Wilson LC, et al. Rationale for revisions to the definition of death and criteria for its determination in Canada. Can J Anesth 2023; 10.1007/s12630-023-02407-4. [DOI] [PMC free article] [PubMed]
- 7.Chandler JA, Pope TM. Legal considerations for the definition of death in the 2023 Canadian Brain-Based Definition of Death Clinical Practice Guideline. Can J Anesth 2023; 10.1007/s12630-023-02410-9. [DOI] [PMC free article] [PubMed]
- 8.Shemie SD, Doig C, Dickens B, et al. Severe brain injury to neurological determination of death: Canadian forum recommendations. CMAJ. 2006;174:S1–3. doi: 10.1503/cmaj.045142. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Shemie SD, Baker AJ, Knoll G, et al. National recommendations for donation after cardiocirculatory death in Canada: donation after cardiocirculatory death in Canada. CMAJ. 2006;175:S1. doi: 10.1503/cmaj.060895. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Weiss MJ, Hornby L, Rochwerg B, et al. Canadian guidelines for controlled pediatric donation after circulatory determination of death–summary report. Pediatr Crit Care Med. 2017;18:1035–1046. doi: 10.1097/pcc.0000000000001320. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Greer DM, Shemie SD, Lewis A, et al. Determination of brain death/death by neurologic criteria: the World Brain Death project. JAMA. 2020;324:1078–1097. doi: 10.1001/jama.2020.11586. [DOI] [PubMed] [Google Scholar]
- 12.Dhanani S, Hornby L, van Beinum A, et al. Resumption of cardiac activity after withdrawal of life-sustaining measures. N Engl J Med. 2021;384:345–352. doi: 10.1056/nejmoa2022713. [DOI] [PubMed] [Google Scholar]
- 13.Morlani et al. vs Haddara, 2021 ONSC 7288 (Ontario Superior Court of Justice). Available from URL: https://canlii.ca/t/jk476 (accessed December 2022).
- 14.McKitty vs Hayani, 2017 ONSC 4125 (Ontario Superior Court of Justice). Available from URL: https://canlii.ca/t/hmnjp (accessed December 2022).
- 15.Shemie SD, Gardiner D. Circulatory arrest, brain arrest and death determination. Front Cardiovasc Med. 2018;5:15. doi: 10.3389/fcvm.2018.00015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Law Reform Commission of Canada. Report on the criteria for the determination of death, report 15, 1981. Available from URL: https://thaddeuspope.com/images/LRC_Report15.pdf (accessed December 2022).
- 17.Thuong M, Ruiz A, Evrard P, et al. New classification of donation after circulatory death donors definitions and terminology. Transpl Int. 2016;29:749–759. doi: 10.1111/tri.12776. [DOI] [PubMed] [Google Scholar]
- 18.Guyatt GH, Oxman AD, Vist GE, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 2008;336:924–926. doi: 10.1136/bmj.39489.470347.ad. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Dhanani S, Hornby L, Ward R, Shemie S. Variability in the determination of death after cardiac arrest: a review of guidelines and statements. J Intensive Care Med. 2012;27:238–252. doi: 10.1177/0885066610396993. [DOI] [PubMed] [Google Scholar]
- 20.Guyatt GH, Oxman AD, Kunz R, et al. Going from evidence to recommendations. BMJ. 2008;336:1049–1051. doi: 10.1136/bmj.39493.646875.ae. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Guyatt GH, Alonso-Coello P, Schunemann HJ, et al. Guideline panels should seldom make good practice statements: guidance from the GRADE Working Group. J Clin Epidemiol. 2016;80:3–7. doi: 10.1016/j.jclinepi.2016.07.006. [DOI] [PubMed] [Google Scholar]
- 22.Guyatt G, Oxman AD, Akl EA, et al. GRADE guidelines: 1. Introduction—GRADE evidence profiles and summary of findings tables. J Clin Epidemiol. 2011;64:383–394. doi: 10.1016/j.jclinepi.2010.04.026. [DOI] [PubMed] [Google Scholar]
- 23.Balshem H, Helfand M, Schünemann HJ, et al. GRADE guidelines: 3. Rating the quality of evidence. J Clin Epidemiol. 2011;64:401–406. doi: 10.1016/j.jclinepi.2010.07.015. [DOI] [PubMed] [Google Scholar]
- 24.Li SA, Alexander PE, Reljic T, et al. Evidence to decision framework provides a structured "roadmap" for making GRADE guidelines recommendations. J Clin Epidemiol. 2018;104:103–112. doi: 10.1016/j.jclinepi.2018.09.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Atkins D, Best D, Briss PA, et al. Grading quality of evidence and strength of recommendations. BMJ. 2004;328:1490. doi: 10.1136/bmj.328.7454.1490. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Spears WE, Lewis A, Bakkar A, et al. What does "brainstem death" mean? A review of international protocols. Can J Anesth 2023; 10.1007/s12630-023-02428-z. [DOI] [PubMed]
- 27.Briard JN, Plourde G, Nitulescu R, et al. Infratentorial brain injury among patients suspected of death by neurologic criteria: a systematic review and meta-analysis. Neurology 2022: 10.1212/wnl.0000000000201449 [DOI] [PubMed]
- 28.Kramer AH, Kromm JA, Doig CJ, Chassé M, Couillard PL. Neurological determination of death following infratentorial stroke: a population-based cohort study. Can J Neurol Sci. 2022;49:553–559. doi: 10.1017/cjn.2021.177. [DOI] [PubMed] [Google Scholar]
- 29.Chassé M, Neves Briard J, Yu M, et al. Clinical evaluation and ancillary testing for the diagnosis of death by neurologic criteria: a cross-sectional survey of Canadian intensivists. Can J Anesth. 2022;69:353–363. doi: 10.1007/s12630-021-02166-0. [DOI] [PubMed] [Google Scholar]
- 30.Taran S, Gros P, Gofton T, et al. The reticular activating system: a narrative review of discovery, evolving understanding, and relevance to current formulations of brain death. Can J Anesth 2023; 10.1007/s12630-023-02421-6. [DOI] [PMC free article] [PubMed]
- 31.Shemie SD, Neves Briard J, Boyd JG, et al. Infratentorial brain injury and death by neurologic criteria in Canada: a narrative review. Can J Anesth 2023; 10.1007/s12630-023-02427-0. [DOI] [PMC free article] [PubMed]
- 32.Pope TM, Chandler JA, Hartwick M. Consent for determination of death by neurologic criteria in Canada: an analysis of legal and ethical authorities, and consensus-based working group recommendations. Can J Anesth 2023; 10.1007/s12630-023-02430-5. [DOI] [PMC free article] [PubMed]
- 33.Healey A, van Beinum A, Hornby L, et al. Patient engagement in a Canadian consensus forum for heart donation after circulatory determination of death. Can J Anesth. 2020;67:1738–1748. doi: 10.1007/s12630-020-01808-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Shemie SD, Hornby L, Baker A, et al. International guideline development for the determination of death. Intensive Care Med. 2014;40:788–797. doi: 10.1007/s00134-014-3242-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Omelianchuk A, Bernat J, Caplan A, et al. Revise the Uniform Determination of Death Act to align the law with practice through neurorespiratory criteria. Neurology. 2022;98:532–536. doi: 10.1212/wnl.0000000000200024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Pana R, Hornby L, Shemie SD, Dhanani S, Teitelbaum J. Time to loss of brain function and activity during circulatory arrest. J Crit Care. 2016;34:77–83. doi: 10.1016/j.jcrc.2016.04.001. [DOI] [PubMed] [Google Scholar]
- 37.Porcaro C, Nemirovsky IE, Riganello F, et al. Diagnostic developments in differentiating unresponsive wakefulness syndrome and the minimally conscious state. Front Neurol 2021; 12: 778951. 10.3389/fneur.2021.778951 [DOI] [PMC free article] [PubMed]
- 38.Racine E, Rodrigue C, Bernat JL, Riopelle R, Shemie SD. Observations on the ethical and social aspects of disorders of consciousness. Can J Neurol Sci. 2010;37:758–768. doi: 10.1017/s0317167100051416. [DOI] [PubMed] [Google Scholar]
- 39.Murphy NB, Weijer C, Lalgudi Ganesan S, et al. Nontherapeutic research with imminently dying and recently deceased study populations: addressing practical and ethical challenges. Can J Anesth 2023; 10.1007/s12630-023-02414-5. [DOI] [PMC free article] [PubMed]
- 40.Klowak JA, Nguyen ALV, Hornby L, et al. Diagnostic test accuracy for cessation of circulation during death determination: a systematic review. Can J Anesth 2023; 10.1007/s12630-023-02424-3. [DOI] [PMC free article] [PubMed]
- 41.Lalgudi Ganesan S, Hornby L, Weiss M, et al. Brain-based arterial pulse pressure threshold for death determination: a systematic review. Can J Anesth 2023; 10.1007/s12630-023-02425-2. [DOI] [PMC free article] [PubMed]
- 42.Zorko DJ, Shemie J, Hornby L, et al. Autoresuscitation after circulatory arrest: an updated systematic review. Can J Anesth 2023; 10.1007/s12630-023-02411-8. [DOI] [PMC free article] [PubMed]
- 43.Dhanani S, Hornby L, Ward R, et al. Vital signs after cardiac arrest following withdrawal of life-sustaining therapy: a multicenter prospective observational study. Crit Care Med. 2014;42:2358–2369. doi: 10.1097/ccm.0000000000000417. [DOI] [PubMed] [Google Scholar]
- 44.Kanji S, Williamson D, Hartwick M. Potential pharmacological confounders in the setting of death determined by neurologic criteria: a narrative review. Can J Anesth 2023; 10.1007/s12630-023-02415-4. [DOI] [PMC free article] [PubMed]
- 45.Plourde G, Briard JN, Shemie SD, Shankar JJS, Chassé M. Flow is not perfusion, and perfusion is not function: ancillary testing for the diagnosis of brain death. Can J Anesth. 2021;68:953–961. doi: 10.1007/s12630-021-01988-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Neves Briard J, Nitulescu R, Lemoine É, et al. Diagnostic accuracy of ancillary tests for death by neurological criteria: a systematic review and meta-analysis. Can J Anesth 2023; 10.1007/s12630-023-02426-1. [DOI] [PMC free article] [PubMed]
- 47.McKinnon NK, Maratta C, Zuckier LS, et al. Ancillary investigations for death determination in infants and children: a systematic review and meta-analysis. Can J Anesth 2023; 10.1007/s12630-023-02418-1. [DOI] [PMC free article] [PubMed]
- 48.Ahlawat A, Carandang R, Heard SO, Muehlschlegel S. The modified apnea test during brain death determination: an alternative in patients with hypoxia. J Intensive Care Med. 2016;31:66–69. doi: 10.1177/0885066615599086. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Dyer C. Baby who was pronounced dead has since begun to breathe, High Court judge discloses. BMJ 2022; 378: o1831. 10.1136/bmj.o1831 [DOI] [PubMed]
- 50.Dyer C. Guidance on confirming death in infants is reviewed after court case. BMJ. 2022; 378: o2124. 10.1136/bmj.o2124
- 51.Zuckier LS, McKinnon NK. Ancillary radionuclide perfusion studies in the determination of death by neurologic criteria: methods, interpretation, and lexicon—a user guide for the clinician. Can J Anesth 2023; 10.1007/s12630-023-02420-7. [DOI] [PMC free article] [PubMed]
- 52.Alexandrov AV, Sloan MA, Tegeler CH, et al. Practice standards for transcranial Doppler (TCD) ultrasound. Part II. Clinical indications and expected outcomes. J Neuroimaging 2012; 22: 215–24. 10.1111/j.1552-6569.2010.00523.x [DOI] [PubMed]
- 53.Alexandrov AV, Sloan MA, Wong LK, et al. Practice standards for transcranial Doppler ultrasound: part I–test performance. J Neuroimaging. 2007;17:11–18. doi: 10.1111/j.1552-6569.2006.00088.x. [DOI] [PubMed] [Google Scholar]
- 54.McKinnon NK, Basmaji J. Radionuclide scintigraphy as an ancillary test for death determination in infants under two months of age. Can J Anesth 2023; 10.1007/s12630-023-02419-0. [DOI] [PubMed]
- 55.Kentish-Barnes N, Chevret S, Cheisson G, et al. Grief symptoms in relatives who experienced organ donation requests in the ICU. Am J Respir Crit Care Med. 2018;198:751–758. doi: 10.1164/rccm.201709-1899oc. [DOI] [PubMed] [Google Scholar]
- 56.Kentish-Barnes N, Siminoff LA, Walker W, et al. A narrative review of family members' experience of organ donation request after brain death in the critical care setting. Intensive Care Med. 2019;45:331–342. doi: 10.1007/s00134-019-05575-4. [DOI] [PubMed] [Google Scholar]
- 57.Takaoka A, Honarmand K, Vanstone M, et al. Organ donation at the end of life: experiences from the 3 Wishes project. J Intensive Care Med. 2021;36:404–412. doi: 10.1177/0885066619900125. [DOI] [PubMed] [Google Scholar]
- 58.Maitre G, Shemie SD, Baker A, et al. Knowledge gaps in the definition and determination of death. Can J Anesth 2023; 10.1007/s12630-023-02422-5. [DOI] [PMC free article] [PubMed]
- 59.Shekelle P, Woolf S, Grimshaw JM, Schünemann HJ, Eccles MP. Developing clinical practice guidelines: reviewing, reporting, and publishing guidelines; updating guidelines; and the emerging issues of enhancing guideline implementability and accounting for comorbid conditions in guideline development. Implementation Sci. 2012;7:62. doi: 10.1186/1748-5908-7-62. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Vernooij RWM, Sanabria AJ, Solà I, Alonso-Coello P, Martínez García L. Guidance for updating clinical practice guidelines: a systematic review of methodological handbooks. Implementation Sci. 2014;9:3. doi: 10.1186/1748-5908-9-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Gardiner D, Greer DM, Bernat JL, Meade MO, Opdam H, Schwarz SKW. Answering global challenges to the determination of death: consensus-building leadership from Canada. Can J Anesth 2023; 10.1007/s12630-023-02423-4. [DOI] [PubMed]
- 62.Murphy NB, Chandler JA, Hartwick M, et al. Balancing values: implications of a brain-based definition of death for pluralism in Canada. Can J Anesth 2023; 10.1007/s12630-023-02408-3. [DOI] [PMC free article] [PubMed]
- 63.Shemie J, Scales NB, Sucha E, et al. Variability in criteria for death determination in the intensive care unit. Can J Anesth 2023; 10.1007/s12630-023-02412-7. [DOI] [PMC free article] [PubMed]
- 64.Stewart S, McKitty A, Chidwick P, Healey A, van Beinum A. Trust and conflict in death determination—reflections on the legacy of Taquisha McKitty. Can J Anesth 2023; 10.1007/s12630-023-02443-0. [DOI] [PMC free article] [PubMed]
- 65.Murphy NB, Weijer C, Slessarev, Chandler JA, Gofton T. Implications of the updated Canadian Death Determination Guidelines for organ donation interventions that restore circulation after determination of death by circulatory criteria. Can J Anesth 2023; 10.1007/s12630-023-02413-6. [DOI] [PMC free article] [PubMed]
- 66.Rochwerg B, Alhazzani W, Jaeschke R. Clinical meaning of the GRADE rules. Intensive Care Med. 2014;40:877–879. doi: 10.1007/s00134-014-3273-0. [DOI] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.