Abstract
Introducción.
La enfermedad de Parkinson (EP) es un trastorno neurodegenerativo multisistémico que afecta aproximadamente al 1% de la población mayor de 55 años, con una edad media de aparición a los 60 años y una prevalencia en rápido crecimiento.
Desarrollo.
La EP es una enfermedad progresiva, caracterizada por presentar síntomas motores y no motores combinados que afectan a la vida diaria de los pacientes. Sin embargo, tanto la presentación como la progresión clínica de la enfermedad son muy variables. A pesar de que ningún tratamiento ha demostrado clínicamente un efecto neuroprotector convincente, la mayoría de los síntomas motores son aceptablemente manejados con fármacos dopaminérgicos. Más de 50 años después de su introducción, la levodopa sigue siendo el tratamiento más eficaz para tratar los síntomas motores de la EP, que mantiene los beneficios a nivel motor durante todo el curso de la enfermedad. Sin embargo, después de un período variable de entre dos y cinco años desde el inicio del tratamiento, suelen aparecer fluctuaciones en la respuesta motora y no motora a las distintas dosis de la medicación. La identificación precoz y el tratamiento adecuado de estas fluctuaciones tienen un fuerte impacto positivo en la calidad de vida de los pacientes. El control de las fluctuaciones, frecuentemente acompañadas por movimientos involuntarios, requiere ajustes periódicos de la medicación y el uso de adyuvantes con acción dopaminérgica y no dopaminérgica, siguiendo las recomendaciones de un experto.
Conclusiones.
El objetivo principal de este artículo es ofrecer una guía práctica actualizada para neurólogos sobre el uso de agentes dopaminérgicos desde la etapa inicial de la EP. Sobre todo, durante el período crítico después de la fase de ’luna de miel’, cuando la aparición de variaciones en los síntomas presentados por cada paciente requiere el ajuste personalizado de la medicación existente.
Palabras clave: Algoritmo, Enfermedad de Parkinson, Fluctuaciones motoras, Inhibidores de la MAO-B, Levodopa, Tratamiento
Introducción
La enfermedad de Parkinson (EP) es un trastorno degenerativo crónico que, actualmente, carece de cura [1,2]. Por esta razón, los objetivos principales del tratamiento de la EP son mantener al paciente funcionalmente independiente durante el mayor tiempo posible, intentar mejorar tanto los síntomas motores como los no motores y encontrar un equilibrio entre la opción más eficiente y la menos perjudicial. La finalidad fundamental de cualquier programa de manejo es mejorar la calidad de vida del paciente [3].
Cada vez es más claro que la EP no es una patología con una única característica clínica, sino un síndrome compuesto por múltiples condiciones patológicas, resultado de diferentes mecanismos neurodegenerativos subyacentes [4,5]. Consecuentemente, el desarrollo de terapias más personalizadas podría verse facilitado [6]. Más allá de las variantes genéticas específicas con fenotipos característicos (que incluyen edad de aparición, distonía, complicaciones motoras, discinesia y discapacidad cognitiva) [7], diferentes subtipos motores han sido definidos en la EP esporádica [6,8-10]. Éstos incluyen el subtipo con predominio de temblores y el que presenta inestabilidad postural con trastornos de la marcha [11-13].
Otro tipo de clasificación de la EP, basado en el análisis agrupado de las características clínicas y marcadores biológicos de los pacientes con EP inicial (pacientes en estadios iniciales de la enfermedad), ha definido tres variantes dependiendo de la presentación de la enfermedad, el efecto de la medicación dopaminérgica sobre los síntomas motores y la progresión de la patología [8]. El subtipo con ’predominio motor medio’ se presenta con más frecuencia (49-53%) y está caracterizado por aparecer en edad joven, tener una buena respuesta al tratamiento y una progresión lenta de la enfermedad. Le sigue el subtipo ’intermedio’ (35-39%), caracterizado por una edad intermedia de aparición, síntomas motores y no motores moderados, respuesta al tratamiento dopaminérgico de moderada a buena y progresión moderada. Finalmente, el subtipo ’maligno difuso’ parece menos frecuente (9-16%), y presenta una edad de aparición variable, trastornos del sueño en fase REM, discapacidad cognitiva media, hipotensión postural, síntomas motores graves, problemas posturales tempranos y progresión rápida de deficiencias motoras y cognitivas [6]. Al mismo tiempo, es posible observar un déficit dopaminérgico profundo, un incremento de la atrofia en las redes neuronales y un perfil del líquido cefalorraquídeo similar al del Alzheimer [6].
Aunque la denervación dopaminérgica es esencial en la aparición y progresión de síntomas motores y no motores [14], las anomalías en otros neurotransmisores son también clave en el desarrollo de estos síntomas y pueden detectarse en fases tempranas de la EP. La alteración de la inervación colinérgica, junto con las deficiencias noradrenérgicas y de serotonina, está asociada con varios síntomas no motores, como ansiedad, depresión, discapacidad cognitiva, psicosis y trastornos del sueño [15- 18]. La hiperactividad glutamatérgica, seguida de desnervación dopaminérgica, está también implicada en la aparición de estos síntomas, junto con complicaciones motoras, desarrollo de discinesias inducidas por levodopa y muerte celular excitotóxica de neuronas dopaminérgicas en la substantia nigra pars compacta [19,20]. Por lo tanto, es simplista considerar que el tratamiento terapéutico de la EP debería limitarse sólo a tratar de restaurar el funcionamiento normal del circuito ganglionar corticobasal, abordando únicamente el déficit dopaminérgico.
Mientras que las terapias para personas con EP (PcEP) portadoras de una mutación genética hereditaria han sido evaluadas en ensayos clínicos, focalizados en inhibidores de cinasas para tratar la EP asociada a LRRK2 o en la potenciación de la actividad glucocerebrosidasa en la EP asociada a GBA [21,22], no está claro si el subtipo esporádico de la EP debería tratarse de manera diferencial.
Una mejor comprensión de los mecanismos subyacentes de esta enfermedad, junto con la identificación de diferentes fenotipos con implicación en el diagnóstico, la respuesta esperada al tratamiento y la prognosis, ayudará a los médicos a incorporar tratamientos personalizados dentro de la práctica clínica diaria [6].
Mientras tanto, es importante reconocer que la EP es un trastorno altamente heterogéneo y que no existe una única solución para todos los casos [8]. Por lo tanto, el tratamiento debería ser: a) individualizado, basado en la edad del paciente, con presunción de fenotipo motor, considerando el estado cognitivo y mental, el grado de disrupción funcional, las expectativas, y las condiciones laborales y sociales; y b) adaptado y corregido periódicamente, basado en la respuesta inicial al tratamiento y en los eventuales efectos adversos [3].
Tratamiento inicial para los síntomas motores
Enfoque neuroprotector
Los tratamientos neuroprotectores están enfocados a prevenir o detener la progresión de la enfermedad y las lesiones secundarias, al detener o retrasar la pérdida de neuronas. El desarrollo de un tratamiento neuroprotector que cambie el curso natural de una enfermedad con una intervención es el objetivo de cualquier enfermedad neurodegenerativa [3]. Los mecanismos más comunes responsables de la neurodegeneración incluyen el estrés oxidativo, la excitotoxicidad, la disfunción mitocondrial, la acumulación de hierro, la apoptosis, el déficit de factores neurotróficos, la inflamación y la acumulación de proteínas patógenas agregadas [23-26]. Se han hipotetizado diferentes mecanismos de neuroprotección para los inhibidores de la monoaminooxidasa B (IMAO-B), como la selegilina y la rasagilina [27]. Entre ellos se incluyen la prevención de la producción de especies reactivas de oxígeno y el aumento de los factores neurotróficos y antiapoptósicos [28]. Sin embargo, los estudios clínicos no han podido demostrar tales efectos beneficiosos [27]. Un ensayo clínico en el que se retrasó el inicio del tratamiento con rasagilina mostró algunos resultados indirectos interesantes, pero no se consideraron pruebas suficientes de neuroprotección [3,29].
Ninguno de los compuestos desarrollados recientemente ha demostrado de forma concluyente que se modifique la progresión de la EP. Los ensayos clínicos dirigidos a evitar la acumulación de α-sinucleína con inmunoterapia parecían prometedores [3,30]. Si bien hay varios estudios en curso, los recientes fracasos por alcanzar los objetivos primarios (cambios significativos frente a placebo en la puntuación total de la Movement Disorder Society-Sponsored–Unified Parkinson’s Disease Rating Scale) han disminuido, en cierta medida, el entusiasmo original por esta estrategia [31]. En realidad, una limitación común de cualquier estrategia modificadora de la enfermedad en la EP es la falta de biomarcadores fiables capaces de relacionar los mecanismos de acción de la intervención con la fisiopatología de la enfermedad [3,32].
Intervenciones farmacológicas
El tratamiento de primera elección para las PcEP se centra en la sustitución farmacológica de la dopamina, que mejora los síntomas y la calidad de vida [3]. Aunque no hay pruebas concluyentes de que un tratamiento sintomático más temprano pueda modificar el curso de la enfermedad, no hay ninguna razón de peso para retrasar el tratamiento dopaminérgico en un paciente que presenta cierta discapacidad. Como se demostró en el estudio LEAP, el inicio temprano del tratamiento se asocia potencialmente con efectos positivos en la calidad de vida de las PcEP, incluso cuando la incapacidad sea imperceptible. No obstante, no es obligatorio iniciar un tratamiento sintomático en los sujetos que presentan síntomas detectables no acompañados por incapacidad [29].
Los pacientes que necesitan terapia farmacológica pueden iniciar el tratamiento con cualquiera de los medicamentos disponibles: IMAO-B, agonistas dopaminérgicos y preparados de levodopa/carbidopa o levodopa/benseracida. Según numerosas guías y revisiones de la evidencia, varias estrategias diferentes pueden ser eficaces; pero, actualmente, no existe un consenso oficial que favorezca ninguna estrategia específica [33]. Dado que no hay datos comparativos suficientes para apoyar una línea de tratamiento concreta, deberían aplicarse terapias individualizadas [3].
La monoterapia con IMAO-B suele ser bien tolerada en la EP de novo, pero se limita a períodos cortos de tiempo en individuos con una discapacidad muy leve. Los agonistas dopaminérgicos –como los preparados orales de ropinirol o pramipexol y el parche transdérmico de rotigotina– presentan un efecto sintomático más sólido y prolongado [27,33]. Se ha demostrado que las PcEP que toleran la monoterapia con agonistas dopaminérgicos en sus primeros años de tratamiento presentan menos incidencias de fluctuaciones motoras y discinesias que las tratadas inicialmente con levodopa. Sin embargo, con la progresión de la enfermedad, su eficacia disminuye y la mayoría de las PcEP, si no todas, necesitarán levodopa después de tres a cinco años de tratamiento [27]. Al reexaminar los estudios comparativos pivotales de los agonistas dopaminérgicos frente a levodopa en la EP inicial, se sugirió recientemente que, en lugar de retrasar las discinesias, los agonistas dopaminérgicos eran en su mayoría incapaces de extender su efecto más allá de un período de tiempo relativamente corto. Como consecuencia, proporcionaban menos beneficio global que la levodopa, aunque el grupo tratado con levodopa tenía significativamente más discinesias [34,35]. En la dosis más alta tolerable, los agonistas dopaminérgicos mostraron una menor eficacia en la mejora de los síntomas motores y de la calidad de vida, tuvieron un perfil de efectos secundarios menos seguro que la levodopa y pudieron haber inducido o empeorado las discinesias una vez que la PcEP necesitó levodopa oral concurrente [27,34,35]. Si bien no debemos exagerar y demonizar este valioso grupo de fármacos, el uso de agonistas dopaminérgicos para mejorar los síntomas de la EP inicial debe evaluarse teniendo en cuenta su menor potencia relativa y su mayor riesgo general de efectos secundarios en comparación con la levodopa [27], concretamente, psicosis, somnolencia diurna excesiva, edema en las piernas y trastornos del control de los impulsos [36,37]. Las PcEP deberían ser cuidadosamente monitorizadas, ya que estos efectos secundarios podrían conllevar un riesgo de consecuencias económicas, legales y psicosociales catastróficas, así como síntomas de abstinencia graves, como ansiedad y deseo de tomar la medicación cuando las PcEP intentan interrumpir el uso de los fármacos prescritos [38].
Hasta hace poco, las directrices clínicas para el tratamiento de la EP solían recomendar el uso preferente de agonistas de la dopamina sobre la levodopa como terapia inicial. Esto se basaba, principalmente, en la creencia no fundamentada de que la levodopa podría promover el estrés oxidativo y acelerar tanto las complicaciones motoras como la progresión de la enfermedad. A pesar de que las directrices recientes recomiendan la levodopa como la terapia más eficaz para el tratamiento de la EP [33,39], la tendencia a evitar el inicio de la levodopa basándose en estas creencias, la ’levodopafobia’, sigue presente en la práctica clínica y puede ser perjudicial o causar retrasos innecesarios en la mejora de los síntomas parkinsonianos y la calidad de vida [29,40]. En este sentido, tres grandes estudios (ELLDOPA, PD-MED y LEAP) evaluaron la levodopa como tratamiento de novo para la EP y ninguno aportó pruebas significativas en su contra [4,27,29, 41]. Además, las observaciones realizadas en pacientes de EP del África subsahariana que tenían dificultades para acceder a la medicación y permanecían sin tratamiento, demostraron que retrasar el tratamiento no reducía la probabilidad de tener complicaciones motoras y discinesias [34]. Por lo tanto, no existe ninguna contraindicación para prescribir levodopa a las PcEP recién diagnosticadas, ni tampoco hay ninguna indicación para considerar a la levodopa como la última opción de tratamiento después de que otros fármacos dopaminérgicos hayan resultado insuficientes para controlar los síntomas motores.
Dado que las fluctuaciones y las discinesias están relacionadas con la duración de la enfermedad y no con la exposición acumulada a la levodopa, ya no se recomienda retrasar el tratamiento con este fármaco [34]. No obstante, el tratamiento crónico con dosis elevadas de preparados de levodopa de vida media corta sigue asociado al desarrollo de discinesias, especialmente en las PcEP más jóvenes [42], y debe evitarse para aumentar innecesariamente el riesgo de complicaciones motoras [4,29,34].
Intervenciones no farmacológicas
Existe una creciente evidencia que apoya el papel de las actividades físicas y mentales en la mejora de los resultados motores (marcha, postura, equilibrio, habla y deglución) y no motores (estado de ánimo, cognición) en la EP. Entre ellas figuran el ejercicio aeróbico, el entrenamiento cognitivo, la concentración y el yoga, la danza y el entrenamiento del equilibrio. Estas actividades deben considerarse una parte integral del manejo multidisciplinar de la EP, además de ser útiles y aconsejables desde las primeras fases de la enfermedad [43-47].
Tratamiento de síntomas específicos en la enfermedad de Parkinson inicial: temblores
Si bien se ha recomendado probar agentes anticolinérgicos como el trihexifenidilo en pacientes con EP relativamente jóvenes con predominio sintomatológico de temblores, no hay suficiente evidencia de su utilidad. Al mismo tiempo, su uso puede asociarse a efectos secundarios adversos, especialmente relacionados con la cognición [48,49].
Ciertas diferencias interindividuales recientemente descubiertas en la respuesta del temblor estático al tratamiento dopaminérgico han demostrado que el temblor en reposo puede resultar sensible o resistente a la dopamina. Por esta razón, es importante no forzar dosis excesivas de medicación dopaminérgica durante el tratamiento de las PcEP [50].
Algoritmo de tratamiento para la enfermedad de Parkinson inicial
Existen muchos enfoques para iniciar el tratamiento sintomático en la EP. Los algoritmos publicados son simples guías asistenciales que corren el riesgo de excluir a las PcEP del proceso de toma de decisiones. Las PcEP deberían ser informadas de las distintas posibilidades terapéuticas y advertidas sobre la inexistencia de un único tratamiento [8]. La finalidad de los distintos algoritmos es la mejora y el mantenimiento de la calidad de vida, con un esfuerzo continuo por equilibrar el pragmatismo con el rigor basado en la evidencia. Asimismo, las PcEP deberían ser informadas de que la combinación de fármacos de diferentes clases para obtener beneficios complementarios es una práctica común en la EP que no se correlaciona necesariamente con la gravedad de la enfermedad.
Todos los fármacos antiparkinsonianos tienen efectos secundarios que pueden reducir significativamente la calidad de vida de las PcEP. Por lo tanto, es muy importante evaluar las condiciones de salud de las PcEP e identificar y abordar adecuadamente los efectos secundarios específicos del tipo de fármaco o de la combinación de fármacos utilizada. El inicio del tratamiento con levodopa permite una mejora sustancial de la calidad de vida en comparación con los fármacos que presentan resultados menos predecibles [27,29]. Entre los agentes dopaminérgicos disponibles, la levodopa promueve una mejor respuesta funcional, pero aumenta el riesgo de provocar discinesias en dosis elevadas [27,34]. Por este motivo, una estrategia útil podría ser empezar con dosis bajas de levodopa (no más de 300 o 400 mg/día) dosificando hasta alcanzar el umbral terapéutico, y reservar otros fármacos como tratamientos complementarios para etapas posteriores durante el trascurso de la enfermedad [51]. La mayoría de los pacientes con EP inicial, independientemente de su grado de discapacidad, mostrarán un beneficio motor consistente y una buena tolerancia a la medicación si ésta se dosifica lentamente (durante un período de dos a tres semanas) hasta 100 mg de levodopa tres veces al día (Figura). Puede aconsejarse a los pacientes que tomen domperidona durante unos días si experimentan náuseas. Dosis superiores a 30 mg de domperidona al día sólo deben prescribirse tras considerar cuidadosamente sus posibles efectos cardiotóxicos [52].
Figura.
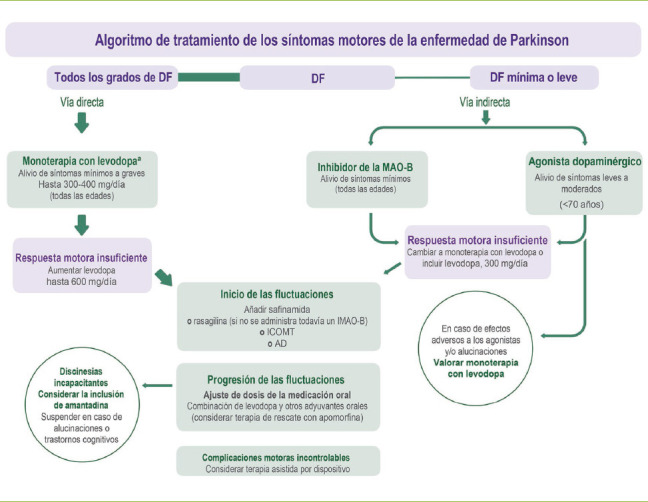
Algoritmo de tratamiento. DF: discapacidad funcional; ICOMT: inhibidores de la catecol-O-metiltransferasa: IMAO-B:inhibidores de la monoaminooxidasa B; MAO-B: monoaminooxidasa B. a Hasta donde se sabe, todos los sujetos con EP, en algún momento, necesitarán tratamiento con levodopa; no hay ninguna razón suficiente para evitar la prescripción de levodopa desde las primeras fases de la enfermedad o para retrasar su introducción a expensas de la funcionalidad del paciente.
Probar el tratamiento con un IMAO-B podría estar justificado en los pacientes que presenten una discapacidad mínima. A los pacientes que presentan una discapacidad leve y no tienen antecedentes de enfermedades cardiovasculares, psicosis, depresión, insuficiencia renal o hepática [53] y son conscientes del riesgo incrementado que tienen los agonistas dopaminérgicos de causar efectos secundarios (y aun así prefieren no tomar tres dosis diarias de levodopa), se les podría ofrecer una prueba con agonistas dopaminérgicos (Figura).
Si la progresión de la enfermedad da lugar a una respuesta motora insuficiente, tanto los pacientes tratados como los no tratados con levodopa podrían sustituir o combinar sus terapias actuales con dosis de levodopa no superiores a 600 mg/día. Dependiendo de la discapacidad del paciente, sería posible administrar un IMAO-B y/o un agonista dopaminérgico junto con 300 mg/día como máximo de levodopa (Figura). Aunque algunos efectos secundarios son idiosincrásicos, la probabilidad de experimentar efectos adversos aumenta con la cantidad de medicación tomada (especialmente con dosis altas de agonistas dopaminérgicos) [53]. Por lo tanto, si se notifican efectos secundarios de los agonistas dopaminérgicos, éstos deberían reemplazarse por la monoterapia con levodopa.
Una vez que se observan fluctuaciones de la respuesta por primera vez, se sugiere combinar los tratamientos anteriores con safinamida, inhibidores de la catecol-O-metiltransferasa (ICOMT) o agonistas dopaminérgicos. También es posible la administración de rasagilina en combinación con levodopa si no se ha prescrito un IMAO-B anteriormente. La intensificación y el aumento de la frecuencia de las fluctuaciones de la respuesta requerirán un ajuste de la medicación oral y podrían incluir levodopa combinada con fármacos adyuvantes. En este punto, debe considerarse una terapia de rescate con apomorfina. Si se producen discinesias incapacitantes, debe considerarse cuidadosamente la administración de amantadina teniendo en cuenta sus efectos secundarios.
Progresión de la enfermedad y reducción de la ventana terapéutica
Las PcEP recién diagnosticadas e iniciadas en el tratamiento dopaminérgico suelen experimentar una fase de ’luna de miel’ de tres a cinco años, durante la cual los síntomas de la enfermedad no son demasiado incapacitantes [54,55]. Sin embargo, la EP es una enfermedad clínicamente heterogénea con mucha variación interindividual que incluye formas de progresión rápida y lenta [34,56]. El fenotipo motor y la respuesta motora a la medicación no son fijos y pueden cambiar con la progresión de la enfermedad, y presentar un aumento a lo largo del tiempo del porcentaje de casos con un fenotipo motor sin temblores [57].
Con la progresión de la EP, los preparados sin levodopa, como los IMAO-B y los agonistas dopaminérgicos, tanto solos como en combinación, suelen mostrar limitaciones para proporcionar una buena respuesta motora. De esta forma, después de dos o tres años de tratamiento, la mayoría de los pacientes necesitará iniciar el tratamiento con levodopa [33]. Estos pacientes, y los que hasta entonces sólo habían tomado levodopa, suelen notar una disminución de la duración de los beneficios de cada dosis con el paso del tiempo [35,58,59]. Si bien la levodopa proporciona un beneficio terapéutico a lo largo de todo el trascurso de la EP [60], serán necesarias dosis más altas y más frecuentes en algún momento del tratamiento. La discinesia inducida por la levodopa se observa con frecuencia y suele producirse en el momento de máxima concentración de levodopa en el cerebro [4,34].
Cuando se prescribe por primera vez, la levodopa suele administrarse tres veces al día, lo que proporciona concentraciones adecuadas de dopamina durante las horas del día [61,62]. El deterioro gradual de la respuesta motora a cada dosis de levodopa, acompañado de la reaparición de síntomas motores entre cada dosis (temblor, bradicinesia, rigidez y problemas de la marcha), suele denominarse ’wearing off’ o ’end-of-dose deterioration’ [63,64]. También pueden aparecer síntomas no motores, como ansiedad, fatiga, tristeza, sudoración, disnea, dolor, piernas inquietas, parestesias y otros síntomas que son más difíciles de definir para el paciente o de reconocer como fluctuantes [60,65].
Todos estos problemas están relacionados, principalmente, con la farmacocinética y la farmacodinámica del uso de levodopa a largo plazo [58,59,62]. La progresión de la enfermedad se asocia a una disminución de la llamada ’respuesta de larga duración’ a la levodopa y a una incapacidad para almacenar el exceso de dopamina acumulado por las dosis repetidas de medicación dopaminérgica [58, 59]. Una vez que esta respuesta de larga duración ha disminuido considerablemente o se ha perdido, la corta vida media plasmática de los preparados actuales de levodopa es insuficiente para cubrir la llamada ’respuesta de corta duración’ (respuesta antiparkinsoniana paralela a los niveles plasmáticos de levodopa) [58].
Durante la fase de agotamiento de la dopamina en la EP, las dosis intermitentes de levodopa dan lugar a marcadas fluctuaciones en los niveles de dopamina estriada, al contrario de los niveles estables que se encuentran en condiciones normales [66]. La disponibilidad sináptica pulsátil de la dopamina conduce a cambios moleculares y neurofisiológicos subyacentes a la aparición de las fluctuaciones motoras [58,66]. Este fenómeno, que puede verse aún más complicado por el vaciado gástrico errático de la levodopa, se considera responsable de la respuesta de ’wearing off’ [58,66]. A su vez, los cambios progresivos de receptores y neurotransmisores que se producen en el cerebro, asociados a la estimulación dopaminérgica fásica, se consideran responsables de las discinesias [34,67]. Varios estudios preclínicos y clínicos muestran una mejoría de las discinesias con fármacos antiglutamatérgicos [68-70]. Se ha demostrado que la hiperfunción de las vías glutamatérgicas y de los receptores del N-metil-D-aspartato en las neuronas eferentes estriadas también está asociada a la estimulación dopaminérgica crónica no fásica que contribuye a la patogenia de las discinesias [34,54,71].
Por el contrario, las pruebas aportadas por estudios como COPPADIS o CamPaIGN demostraron que las complicaciones motoras son relativamente comunes después de dos años de EP y no confieren necesariamente un pronóstico negativo [72,73]. Así pues, tras un período variable de buena respuesta al tratamiento dopaminérgico, generalmente entre dos y cinco años [54,55], y sin tener en cuenta la modalidad de inicio del tratamiento, se produce una reducción progresiva de la ventana terapéutica de las dosis de levodopa hasta en el 50% de los pacientes. Éstos suelen desarrollar fluctuaciones en la respuesta a la farmacoterapia dopaminérgica, acompañadas o no de discinesias [59,60].
Reconocimiento de las fluctuaciones en la respuesta a la levodopa
Los primeros signos de reaparición de los síntomas parkinsonianos no están bien establecidos ni son los mismos para todas las PcEP que experimentan el fenómeno de ’wearing off’ [60]. Mientras que para algunas personas los primeros signos se caracterizan por el retorno de los síntomas motores parkinsonianos clásicos, para otras, los síntomas no motores también podrían surgir de forma independiente o combinada [60,65]. Los médicos deberían preguntar rutinariamente sobre la presencia recurrente de estos signos próximos o en el momento de la siguiente dosis de la medicación [60]. Los estudios clínicos que utilizan escalas adecuadas han demostrado que estas fluctuaciones pueden producirse, incluso, de forma subclínica en pacientes que, por lo demás, niegan padecerlas cuando se les pregunta [61,74].
Se ha propuesto una herramienta para identificar y cuantificar el paralelismo entre las fluctuaciones neuropsiquiátricas y las motoras con el fin de facilitar la autoevaluación del estado de las PcEP durante las fases de on-off [75]. Para ello, los pacientes y sus cuidadores deben registrar una historia clínica detallada para identificar diferentes problemas, como la infradosificación, los signos motores y no motores, las fluctuaciones y los efectos secundarios de la medicación [54]. A su vez, el uso de diarios de autoinforme y dispositivos portátiles podría servir de ayuda en el análisis de los síntomas recurrentes de las PcEP.
Tratamiento de las fluctuaciones de la respuesta
Se pueden aplicar varias estrategias cuando la fase de ’luna de miel’ termina y los pacientes empiezan a experimentar una respuesta de ’wearing off’ a la medicación dopaminérgica [1,3,76]. Las más utilizadas son: a) la fragmentación de la dosis de levodopa oral para ajustar el momento y la cantidad de dosis; y b) el aumento de la vida media de la levodopa entre dosis utilizando fármacos adyuvantes [1,3,54,76].
Fragmentar la dosificación de la levodopa podría ayudar durante un período de tiempo limitado –por ejemplo, tomar cuatro en lugar de tres dosis de levodopa–, ya que el paciente suele necesitar una modificación de la cantidad total de levodopa diaria para evitar dosis ineficaces y discinesias [77,78]. En cuanto al uso de medicamentos adyuvantes, la administración estable de levodopa en el cerebro podría ayudar a restaurar los niveles fisiológicos de dopamina y reducir el riesgo de fluctuaciones motoras [34]. Las terapias combinadas de levodopa con IMAO-B, ICOMT o agonistas dopaminérgicos mejoran la transmisión dopaminérgica, reducen las dosis necesaria de levodopa y muestran un mejor control de las complicaciones motoras que puedan surgir como consecuencia del perfil farmacocinético subóptimo de la levodopa convencional [56,58,79]. Además, los agentes de doble efecto, como la safinamida, un IMAO-B y modulador del glutamato, deberían poder ayudar a reducir las discinesias inducidas por la levodopa en pacientes con EP moderada o grave [69,80].
Una opción práctica y útil para los pacientes que empiezan a presentar fluctuaciones de cualquier tipo es el uso de medicación adyuvante (Figura) [54]. Ésta puede ayudar a mantener un número limitado de dosis diarias (tres o cuatro), con menos riesgo de dosis ineficaces y una cantidad relativamente baja de levodopa diaria total, si bien no evita el aumento del riesgo de discinesias [76]. Los medicamentos complementarios incluyen el uso de IMAO-B (selegilina o rasagilina), ICOMT (entacapona o opicapona), agonistas dopaminérgicos (ropinirol, pramipexol o parche transdérmico de rotigotina) o fármacos combinados, como la safinamida (IMAO-B + modulador glutamatérgico) [33,69,77]. En un estudio reciente se ha observado que el uso de agonistas dopaminérgicos o IMAO-B como terapia adyuvante inicial es preferible al uso de ICOMT. Los IMAO-B presentaron un control de la enfermedad equivalente al de los agonistas dopaminérgicos, por lo que debería darse más importancia al uso de estos inhibidores [81].
Los estudios doble ciego y observacionales a gran escala han demostrado que la safinamida se tolera bien y tiene un efecto beneficioso sobre algunos de los síntomas no motores que acompañan a la EP, así como un posible efecto beneficioso a largo plazo sobre las discinesias relacionado con sus propiedades moduladoras glutamatérgicas [69,82]. También puede utilizarse en combinación con la amantadina [69,82].
Existen nuevas preparaciones de levodopa en proceso para optimizar las terapias con levodopa oral y superar las limitaciones de las formulaciones convencionales, al tiempo que proporcionan un control sintomático eficaz [62,74,83,84].
Diferentes preparaciones de levodopa se han probado en pacientes con EP avanzada [62,84]. Aun así, los estudios futuros deberán intentar correlacionar los niveles plasmáticos estables de levodopa con un efecto protector frente a las fluctuaciones.
Es posible que llegue un momento en el que la medicación administrada en forma de comprimidos, cápsulas o parches ya no funcione bien para controlar las fluctuaciones motoras y las discinesias. Es entonces cuando se pueden considerar otras posibles soluciones, como la estimulación cerebral profunda, el gel intestinal continuo de levodopa-carbidopa y la infusión subcutánea continua de apomorfina [85,86].
Conclusiones
En la actualidad, las terapias disponibles pretenden preservar la autonomía de las PcEP durante el mayor tiempo posible. Por este motivo, las PcEP en la fase inicial de la EP deberían comenzar su tratamiento tan pronto como se detecte cualquier discapacidad, independientemente de la medicación de elección. Con la progresión de la enfermedad se prescriben de forma rutinaria diferentes combinaciones de levodopa, IMAO-B o safinamida, agonistas dopaminérgicos y amantadina para controlar adecuadamente los síntomas motores y no motores de la EP, y reducir al mínimo los posibles efectos secundarios. Desafortunadamente, el fenómeno de ’wearing off’ es difícil de evitar en las PcEP que reciben tratamiento con levodopa durante varios años. Si bien existe un esfuerzo global para ampliar la biodisponibilidad de la levodopa, los médicos deberían prestar especial atención a la aparición de cualquier fluctuación de los síntomas de la EP mediante un control rutinario de sus pacientes. Por el momento, el uso de medicación complementaria debería ayudar a recuperar un estado estable de la enfermedad. Dada la creciente evidencia de respuestas variables que dependen del tipo de paciente, en necesario continuar con investigaciones clínicas adicionales para ayudar a definir algoritmos personalizados de tratamiento.
Agradecimientos:
Agradezco las lecciones prácticas y humanitarias recibidas de mis pacientes. CDM Barcelona (España) proporcionó apoyo profesional de redacción médica y editorial, financiado por Zambon (España).
Funding Statement
Fuente de financiación: El autor no recibió apoyo financiero para la investigación y/o la autoría de este artículo. Zambon (España) financió la publicación de este artículo.