Abstract
烟酰胺是烟酸的酰胺形式,也是烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD+)的前体之一,可以作为膳食补充剂或临床治疗药物,用于补充体内的NAD+水平,参与机体细胞代谢、DNA修复等关键功能。烟酰胺成本低廉、来源广泛、生物安全性好,还具有抗菌、抗炎、调节细胞免疫等多重生物功能,对皮肤疾病、神经变性疾病等具有明显的改善作用。然而,目前大部分有关烟酰胺的研究仍停留在实验室阶段,本文将对烟酰胺在口腔及全身疾病预防和治疗中的作用和机制进行综述,探究烟酰胺作为临床治疗药物的潜能,为烟酰胺在不同疾病防治中的临床应用提供一定的依据和参考,并对其未来的研究和应用前景进行展望。
Keywords: 烟酰胺, 皮肤疾病, 神经变性疾病, 高磷血症, 口腔疾病
Abstract
Nicotinamide (NAM) is the amide form of niacin and one of the precursors of nicotinamide adenine dinucleotide (NAD+). NAM can be used as a dietary supplement or clinical therapeutic drug to replenish NAD+ levels in the human body and participate in key bodily functions such as cellular metabolism and DNA repair. NAM has the advantage of low cost, wide availability, and sound biosafety. It also has multiple biological functions, including antibacterial effect, anti-inflammatory effect, and modulation of cellular immunity, producing significant ameliorative effects on skin and neurodegenerative diseases. However, most studies on NAM are still at the laboratory stage. Herein we reviewed the role and mechanism of NAM in the prevention and treatment of oral and systemic diseases, explored its potential as clinical therapeutic medication, provided some basis and references for the clinical application of nicotinamide in the prevention and treatment of various diseases, and discussed its prospects for future research and application.
Keywords: Nicotinamide, Skin diseases, Neurodegenerative diseases, Hyperphosphatemia, Mouth diseases
烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD+)是细胞能量代谢的基础,直接或间接影响细胞代谢途径、DNA修复、染色质重塑、细胞免疫等关键的细胞功能,也是多种酶的共同底物[1]。细胞内NAD+水平失调与心血管疾病、肥胖、神经变性病变、衰老等病理过程息息相关[2]。因此,稳定的NAD+水平对确保细胞稳态至关重要。
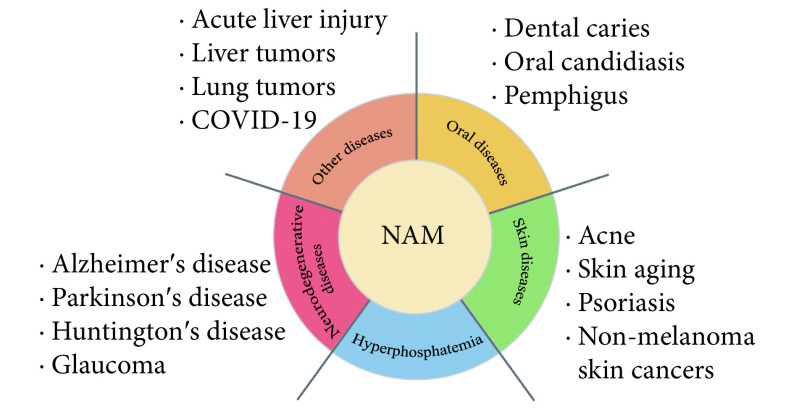
烟酰胺(nicotinamide, NAM)是NAD+的重要前体之一,补充NAD+前体是恢复和维持细胞内NAD+水平的有效途径。自1974年ELVEHJEM等[3]报道使用NAM治疗糙皮病后,NAM已被证实具有在临床上用于多种疾病的预防和治疗的潜力(图1)。本文将针对NAM对口腔及全身疾病的防治作用的最新研究进行综述。
图 1.
NAM's potential for the treatment and prevention of a wide range of diseases
NAM具有防治多种疾病的潜力
1. NAM来源及安全性
NAM是水溶性维生素B3(烟酸)的酰胺形式,在肉类、鱼类、豆类、蘑菇、坚果和谷物等食物中较为常见。体内NAM通过烟酰胺磷酸核糖基转移酶(NAMPT)直接转化为烟酰胺单核苷酸(NMN),然后在烟酰胺/烟酸单核苷酸腺苷酸转移酶(NMNAT)的帮助下与ATP结合生成NAD+(图2),在NAD+的合成中起核心作用[4]。
图 2.
Metabolic process of NAM in vivo
NAM的体内代谢过程
PARPs: poly (ADP-ribose) polymerases; NAMPT: nicotinamide phosphoribosyltransferase; PRPP: α-D-5-phosphoribosyl-1-pyrophosphate; NMN: nicotinamide mononucleotide; NMNAT: nicotinamide mononucleotide adenylyltransferase.
NAM作为膳食补充剂和临床治疗药物的双重身份引起了人们对其长期使用的效应性和安全性的思考。欧洲NAM糖尿病干预试验(ENDIT)让儿童每天接受25~50 mg/kg的NAM治疗并持续了5年,未报告不良反应[5]。合并非酒精性脂肪肝的糖尿病患者每日补充1 g的NAM用于改善患者代谢异常和生活质量,被证明是安全有效的[6]。
成人NAM摄入量若超过3 g/d则有潜在毒性,可能会引起可逆性的肝脏毒性、腹泻、血小板降低等不良反应,停药后症状立即消失[7]。一般治疗剂量的NAM安全性高、毒副作用小,但仍需对长期及高剂量使用NAM的安全性和副作用进行进一步的评估。
2. NAM在口腔疾病中的应用
口腔疾病是最好发的疾病之一,极大地影响了患者的生活质量,并加重了全球的疾病和经济负担。研究证实,NAM可以通过调节免疫、抑制Sirtuins蛋白家族的去乙酰化功能等机制发挥抗微生物作用[8],用于防治口腔感染性疾病。龋病是一种发病率极高的口腔慢性感染性疾病,变异链球菌是主要致龋菌[9]。LIN等[10]通过体内外实验证明NAM可以抑制变异链球菌生物膜形成能力等多重致龋毒力,具有防治龋病的潜能。白色念珠菌(Candida albicans, C. a)是口腔中常见的机会致病性真菌,不仅是口腔念珠菌病的主要病原体[11],还与牙周病、成人及低龄儿童龋等口腔疾病的发生发展有关[12-13]。gin4是维持C. a细胞壁完整性至关重要的基因,XING等[14]研究发现,缺乏gin4基因的白色念珠菌突变体对NAM高度敏感。此外,NAM还可以抑制组蛋白H3的去乙酰化酶HST3的表达,增强两性霉素B对C.a及其他念珠菌属的抗真菌活性[15]。
天疱疮是皮肤或黏膜出现水泡溃疡的自身免疫性疾病,口腔是其较早出现病损的部位。NAM可通过抗炎作用阻断水疱形成的过程,已有不少NAM联合四环素等抗生素成功治疗天疱疮的案例。例如,增殖型天疱疮是寻常型天疱疮的一种罕见变种,占所有天疱疮疾病的1%~2%,患者皮肤皱褶部位和口腔黏膜上会出现特征性增殖斑块。在一例使用米诺环素联合NAM治疗增殖型天疱疮的病例报告中[16],用药4周即可改善口腔病变,且停药后对既往口腔黏膜受累部位进行直接免疫荧光检测,结果仍为阴性。相较于治疗天疱疮常规使用的全身性皮质类固醇和免疫抑制剂,NAM参与的联合用药具有毒性更低,患者依从性更好的优势。
3. NAM在全身疾病中的应用
3.1. 皮肤疾病
维生素B3的缺乏会引起糙皮病,NAM对包括痤疮、皮肤老化、银屑病、非黑色素瘤皮肤癌在内的皮肤疾病的防治作用已被大量研究证实,具体如下。
3.1.1. 痤疮
痤疮是一种多因素引起的皮肤慢性炎症性疾病,毛囊角化过度、痤疮丙酸杆菌的定植及雄激素诱导的皮脂腺过度分泌均可导致病损部位的炎症反应。NAM能够抑制痤疮丙酸杆菌生物膜的形成[17],通过核转录因子κB(NF-κB)和MAPK途径抑制体外角质形成细胞和痤疮炎症模型中IL-8的产生,发挥抗炎作用[18]。NASR等[19]用Soluplus载体制备的含10%NAM的局部外用制剂与4%NAM凝胶相比,减少痤疮病变的效果更为显著(分别为61.3%±9.16%和42.14%±9.22%)。ABD-ALLAH等[20]制备了一种载有烟酰胺的壳聚糖纳米颗粒,局部外用后,烟酰胺在皮肤的沉积量高达68%,且临床试验结果显示,与未治疗的区域相比,该颗粒减少了73%的炎症性痤疮病变,可以成为痤疮患者临床治疗方案之一。
3.1.2. 皮肤老化
皮肤老化可分为时间引起的自然老化和紫外线导致的光老化。NAM及其衍生物已被证明可以刺激弹性蛋白和原纤维蛋白表达,直接抑制细胞外基质蛋白水解酶的活性,用于对抗皮肤衰老[21]。在二维人类原代角质细胞体外培养模型和三维器官型皮肤模型中,NAM还可阻止紫外线照射或过氧化氢诱导引起的DNA损伤和能量代谢的下降,对人类表皮光老化和氧化应激具有保护作用[22]。紫外线照射等原因引起的皮肤色素沉着也是皮肤老化的临床特征之一。PARK等[23]制作的含NAM的制剂可降低黑色素细胞的酪氨酸酶活性和黑色素产生。补充NAM可恢复细胞NAD+水平和线粒体能量,减弱氧化应激和炎症反应,增强细胞外基质和皮肤屏障,有效抑制皮肤色素沉着过程[24]。
3.1.3. 银屑病
银屑病是常见的免疫细胞介导的慢性炎症性疾病,不仅局限于关节和皮肤,还具有深远的全身影响,可伴例如心血管疾病、糖尿病、慢性肾病等多种并发症。甲氨蝶呤具有强大的抗增殖和抗炎作用,在银屑病的药物治疗中占有重要的地位。YANG等[25]研究了一种神经酰胺、甲氨蝶呤和NAM共载的脂质体在银屑病小鼠模型中的治疗效果,NAM的加入不仅增加了甲氨蝶呤的溶解度,还减少了促炎因子的产生,为银屑病的治疗提供了一种安全有效的策略。在另一项研究中,连续12周仅外用4%NAM也能改善银屑病的面积和严重程度[26]。局部NAM制剂可能是银屑病治疗方案中的良好辅助剂,但仍需更多的试验证明NAM对银屑病的治疗效果并探究其可能造成的不良反应。
3.1.4. 非黑色素瘤皮肤癌
非黑色素瘤皮肤癌(non-melanoma skin cancer, NMSC)是最常见的皮肤癌类型之一。紫外线照射及其引起的DNA损伤和细胞能量消耗被认为是皮肤癌的主要病因[27]。抗原呈递细胞在应答紫外线诱导的DNA损伤后,产生白介素(IL)-10,下调免疫反应,免疫抑制在皮肤癌的发生中也发挥了重要的作用。
NAM可以通过增强DNA的修复,调节由紫外线照射产生的炎症环境,减少紫外线诱导的免疫抑制保护皮肤。研究表明,紫外线辐射可以直接以环丁烷嘧啶二聚体(cyclobutane pyrimidine dimmers, CPDs)的形式诱导角质形成细胞中的DNA损伤,并通过产生例如8oxoG的活性氧,形成氧化性DNA损伤。THOMPSON等[28]发现用NAM处理暴露于紫外线的HaCaT角质细胞时,CPDs和8oxoG均有所降低,NAM可能是通过增加用于DNA修复的ATP的可用性、促进计划外的DNA合成,发挥DNA修复功能。相比于具有致畸风险的阿维A,HOEGLER等[29]推荐NAM作为NMSC的一线预防药物。
3.2. 神经变性疾病
神经变性疾病是神经细胞进行性退化和死亡引起的异质性疾病。NAM的神经保护作用主要体现在以下两个方面:①NAM可作为NAD+的前体恢复神经元细胞内的NAD+和ATP水平,为细胞代谢提供能量;②NAM能够调控多种酶和蛋白,保护神经元细胞免受氧化应激、细胞凋亡和坏死。因此,NAM可用于多种神经变性疾病的防治。
3.2.1. 阿尔茨海默病(Alzheimer's disease, AD)
AD是痴呆症的主要原因,胞外淀粉样蛋白-β (Aβ) 肽沉积形成斑块,和胞内tau蛋白过度磷酸化形成神经原纤维缠结是AD的两大神经病理学特征。聚ADP-核糖聚合酶-1〔poly (ADP-ribose) polymerase-1, PARP-1〕可以修复DNA损伤,但PARP-1的过度激活会耗尽细胞的NAD+和ATP并导致被称为Parthanatos的细胞死亡[30]。IERACI等[31]在小鼠皮下注射乙醇诱导发育中的小脑出现大量的神经变性和死亡,NAM的处理可以减少乙醇暴露后PARP-1的过度激活及随后的神经变性。REHMAN等[32]则在小鼠脑室内注射Aβ1-42后用250 mg/kg NAM处理1周,研究结果表明,NAM可以改善活性氧介导的神经炎症、神经变性和神经毒性,具有明确的神经保护作用。
3.2.2. 帕金森病(Parkinson's disease, PD)
PD是一种病理生理学特征表现为纤维状α-突触核蛋白积累的快速发展的神经变性疾病,线粒体功能障碍和氧化应激在PD的发病机制中发挥重要的作用。ANDERSON等[33]构建了急性和亚急性1-甲基-4-苯基-1,2,3,6-四氢吡给药PD小鼠模型,NAM治疗后两种模型小鼠的纹状体多巴胺水平均有恢复,且急性给药模型中NAM的神经保护作用更为显著。然而,HARRISON等[34]发现,NAM呈剂量依赖性加剧了乳胞素对大鼠多巴胺能神经元的损伤,并不能提供预计的神经保护作用。因此,NAM是否能有效防治PD,还需要更多的实验和临床研究支持。
3.2.3. 亨廷顿病(Huntington's disease, HD)
HD是由亨廷顿 (htt) 基因中编码多聚谷氨酰胺的CAG-CAA重复扩增引起的常染色体显性神经变性疾病,突变亨廷顿蛋白的表达会导致神经元生理学的进行性破坏。NAM可以通过改善能量失衡、减少氧化应激、增加抗氧化酶水平,预防和改善3-硝基丙酸诱导的HD大鼠的运动功能障碍,同时,NAM的治疗减少了乳酸脱氢酶的水平并防止了纹状体内的神经元死亡[35]。HD不仅与基因表达失调有关,还存在线粒体功能障碍。HATHORN等[36]发现NAM可以增加脑源性神经营养因子的表达,增强线粒体生物发生中主要调节因子过氧化物酶体增殖物激活受体γ辅激活因子1α的活化,改善HD小鼠的运动缺陷,具有治疗HD的潜力。
3.2.4. 青光眼
青光眼是一种以视网膜神经节细胞(retinal ganglion cell, RGC)死亡和神经轴突退化为特征的眼部神经变性疾病,是导致不可逆性失明的主要原因。眼压升高是青光眼的重要危险因素,也是医疗和外科干预手段的主要目标。
WILLIAMS等[37]研究发现NAD+水平的下降,会增加RGC对代谢损伤的敏感性,揭示了新陈代谢改变在青光眼易感性中的关键作用,并提出通过补充NAM提高NAD+水平来保护青光眼患者的观点。在小鼠的饮食中加入NAM后,即使小鼠的眼压持续升高,RGC的丢失也会停止,并且在测试的最高剂量NAM下,94%的小鼠眼睛没有出现青光眼,小鼠患青光眼的风险下降了。
除可在青光眼的防治中发挥作用外,HUI等[38]还探索了NAM对已接受药物治疗的青光眼患者内层视网膜功能的影响,纳入研究的57名青光眼患者接受了12周的口服NAM或口服安慰剂治疗,通过比较明视负波反应参数值得出结论,服用NAM组的患者内层视网膜功能得到更好的改善。
3.3. 高磷血症
磷酸盐是维持骨骼健康的主要因素之一,正常的磷酸盐平衡对于包括骨矿化在内的许多生理过程至关重要。慢性肾功能不全进展过程的晚期常发生高磷血症,长期高磷血症会加重终末期肾病患者的肾性骨营养不良、血管钙化等,且死亡风险也会增高[39]。
1998年,SHIMODA等[40]在使用尼三醇(一种烟酸的衍生物)治疗透析患者低高密度脂蛋白胆固醇血症时,发现该药可以降低血清磷水平。此后,烟酸及其衍生物的降磷作用在一系列研究中得到证实,NAM也被提议作为磷酸盐结合剂的替代药物[41]。NAM主要通过抑制两种钠-磷酸盐协同转运蛋白(分别是位于肾小管的2a型NaPi-2a和位于小肠的2b型NaPi-2b),发挥降磷作用。短期(12周)或长期(52周)口服NAM均能显著改善透析患者高磷血症[42-43]。在一项单中心双盲随机对照试验中[44],NAM可以降低成纤维细胞生长因子23的水平,减缓Klotho下降速度,并有效降低患者的血磷水平。LENGLET等[45]评估和比较了NAM与司维拉姆对长期血液透析治疗患者血清磷的影响。除具有与司维拉姆相当的降磷作用外,NAM的成本仅为司维拉姆的1/20,且每日服用药片数量更少(约为司维拉姆的1/4),但NAM组不良反应的发生更频繁,NAM主要代谢产物N-甲基-2-吡啶酮-5-甲酰胺(2PY)的积累可能具有尚未明确的毒性作用。因此,未来的研究还需进一步探索NAM用于治疗高磷血症的安全性,并特别关注2PY积累的影响。
3.4. 其他疾病
除前文所述疾病外,一些研究还探索了烟酰胺对如急性肝损伤、非皮肤癌类癌症、COVID-19等疾病的防治作用。例如,XU等[46]发现,NAM可以通过提高肝脏内NAD+水平,防止对乙酰氨基酚诱导的小鼠急性肝损伤。NAM还具有抗肝细胞癌活性,能阻断肿瘤诱导剂胰岛素样生长因子-1的基因和蛋白质表达,影响肿瘤发生关键蛋白核因子相关因子-2和蛋白激酶B间的平衡,减少肝脏肿瘤的数量和大小[47]。在一例使用苯并(a)芘诱导小鼠肺部肿瘤的动物实验中,单独补充NAM或与布地奈德联合给药均能抑制早、晚期肺腺瘤的形成及多样性,且NAM还可有效预防肺部肿瘤的晚期癌变,或可被开发为临床肺肿瘤化学预防及治疗药物[48]。此外,由于COVID-19患者体内的促炎环境可使免疫调节剂芳烃受体(AhR)激活[49],受AhR调节的PARP-1的过度激活又可导致细胞死亡,BADAWY[50]认为,以NAM为代表的PARP-1靶向抑制剂也许能成为COVID-19免疫疗法的选择之一。
4. 结语与展望
NAM是水溶性维生素B3的酰胺形式,可以通过抑制微生物的生长,补充细胞内NAD+的水平,抑制PARP等关键酶的活性,调节细胞免疫反应,增强DNA修复能力等多种作用机制,在口腔及全身疾病的预防和治疗中发挥作用,具有广阔的应用前景。然而,烟酰胺相关制剂的开发和应用不仅需要实验室的数据支持,还有赖于精准的临床试验证据,且具体作用机制也有待进一步阐明。此外,虽然现有研究表明,正常剂量的NAM口服给药是安全有效的,但缺乏大剂量及长期使用NAM的安全性和副作用的深入研究,并限制了它的实际应用。口腔疾病是生命过程中十分常见且多发的一类疾病,目前NAM在该领域的研究相对匮乏且局限于龋病、天疱疮及口腔念珠菌病,未来研究方向可涉足例如牙周病、口腔癌等其他常见口腔疾病,为NAM用于口腔疾病临床治疗奠定基础。
综上所述,烟酰胺在多种疾病的防治上展现出显著的优势和广泛的前景,开展更全面且高质量的,针对NAM的安全性和对疾病防治作用和机制的基础和临床研究,具有重要的意义,将为NAM作为口腔及全身疾病防治药物提供重要的理论依据和参考。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
国家自然科学基金(No. 32170046)资助
Contributor Information
紫雪 雷 (Zi-xue LEI), Email: 632248882@qq.com.
学东 周 (Xue-dong ZHOU), Email: zhouxd@scu.edu.cn.
References
- 1.LI C, WU L E Risks and rewards of targeting NAD+ homeostasis in the brain. Mech Ageing Dev. 2021;198:111545. doi: 10.1016/j.mad.2021.111545. [DOI] [PubMed] [Google Scholar]
- 2.RAJMAN L, CHWALEK K, SINCLAIR D A Therapeutic potential of NAD-boosting molecules: the in vivo evidence. Cell Metab. 2018;27(3):529–547. doi: 10.1016/j.cmet.2018.02.011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.ELVEHJEM C A, MADDEN R J, STRONG F M, et al The isolation and identification of the anti-black tongue factor. Nutr Rev. 1974;32(2):48–50. doi: 10.1111/j.1753-4887.1974.tb06263.x. [DOI] [PubMed] [Google Scholar]
- 4.COVARRUBIAS A J, PERRONE R, GROZIO A, et al NAD+ metabolism and its roles in cellular processes during ageing. Nat Rev Mol Cell Biol. 2021;22(2):119–141. doi: 10.1038/s41580-020-00313-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.GALE E A, BINGLEY P J, EMMETT C L, et al European nicotinamide diabetes intervention trial (ENDIT): a randomised controlled trial of intervention before the onset of type 1 diabetes. Lancet. 2004;363(9413):925–931. doi: 10.1016/S0140-6736(04)15786-3. [DOI] [PubMed] [Google Scholar]
- 6.El-KADY R R, ALI A K, El WAKEEL L M, et al Nicotinamide supplementation in diabetic nonalcoholic fatty liver disease patients: randomized controlled trial. Ther Adv Chronic Dis. 2022;13:20406223221077960. doi: 10.1177/20406223221077958. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.KNIP M, DOUEK I F, MOORE W P T, et al Safety of high-dose nicotinamide: A review. Diabetologia. 2000;43(11):1337–1345. doi: 10.1007/s001250051536. [DOI] [PubMed] [Google Scholar]
- 8.RYMARCHYK S, KANG W, CEN Y Substrate-dependent sensitivity of SIRT1 to nicotinamide inhibition. Biomolecules. 2021;11(2):312. doi: 10.3390/biom11020312. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.徐欣, 周学东 龋病病因学研究与临床诊疗新进展. 中华口腔医学杂志. 2021;56(1):3–9. doi: 10.3760/cma.j.cn112144-20201102-00548. [DOI] [Google Scholar]
- 10.LIN Y, GONG T, MA Q, et al Nicotinamide could reduce growth and cariogenic virulence of Streptococcus mutans. J Oral Microbiol. 2022;14(1):2056291. doi: 10.1080/20002297.2022.2056291. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.VILA T, SULTAN A S, MONTELONGO-JAUREGUI D, et al Oral candidiasis: a disease of opportunity. J Fungi (Basel) 2020;6(1):E15. doi: 10.3390/jof6010015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.XIAO J, HUANG X, ALKHERS N, et al Candida albicans and early childhood caries: a systematic review and meta-analysis. Caries Res. 2018;52(1/2):102–112. doi: 10.1159/000481833. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.DU Q, REN B, HE J, et al Candida albicans promotes tooth decay by inducing oral microbial dysbiosis. ISME J. 2021;15(3):894–908. doi: 10.1038/s41396-020-00823-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.XING X, LIAO Z, TAN F, et al Effect of nicotinamide against Candida albicans. Front Microbiol. 2019;10:595. doi: 10.3389/fmicb.2019.00595. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.YAN Y, LIAO Z, SHEN J, et al Nicotinamide potentiates amphotericin B activity against Candida albicans. Virulence. 2022;13(1):1533–1542. doi: 10.1080/21505594.2022.2119656. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Von KÖCKRITZ A, STÄNDER S, ZEIDLER C, et al Successful monotherapy of pemphigus vegetans with minocycline and nicotinamide. J Eur Acad Dermatol Venereol. 2017;31(1):85–88. doi: 10.1111/jdv.13779. [DOI] [PubMed] [Google Scholar]
- 17.SHIH Y H, LIU D, CHEN Y C, et al Activation of deoxyribonuclease ⅰ by nicotinamide as a new strategy to attenuate tetracycline-resistant biofilms of Cutibacterium acnes. Pharmaceutics. 2021;13(6):819. doi: 10.3390/pharmaceutics13060819. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.GRANGE P A, RAINGEAUD J, CALVEZ V, et al Nicotinamide inhibits Propionibacterium acnes-induced IL-8 production in keratinocytes through the NF-kappaB and MAPK pathways. J Dermatol Sci. 2009;56(2):106–112. doi: 10.1016/j.jdermsci.2009.08.001. [DOI] [PubMed] [Google Scholar]
- 19.NASR M, KARANDIKAR H, ABDEL-AZIZ R T A, et al Novel nicotinamide skin-adhesive hot melt extrudates for treatment of acne. Expert Opin Drug Deliv. 2018;15(12):1165–1173. doi: 10.1080/17425247.2018.1546287. [DOI] [PubMed] [Google Scholar]
- 20.ABD-ALLAH H, ABDEL-AZIZ R T A, NASR M Chitosan nanoparticles making their way to clinical practice: a feasibility study on their topical use for acne treatment. Int J Biol Macromol. 2020;156:262–270. doi: 10.1016/j.ijbiomac.2020.04.040. [DOI] [PubMed] [Google Scholar]
- 21.PHILIPS N, CHALENSOUK-KHAOSAAT J, GONZALEZ S Simulation of the elastin and fibrillin in non-irradiated or UVA radiated fibroblasts, and direct inhibition of elastase or matrix metalloptoteinases activity by nicotinamide or its derivatives. J Cosmet Sci. 2018;69(1):47–56. [PubMed] [Google Scholar]
- 22.TAN C Y R, TAN C L, CHIN T, et al Nicotinamide prevents UVB- and oxidative stress-induced photoaging in human primary keratinocytes. J Invest Dermatol. 2022;142(6):1670–1681.e12. doi: 10.1016/j.jid.2021.10.021. [DOI] [PubMed] [Google Scholar]
- 23.PARK H J, BYUN K A, OH S, et al The combination of niacinamide, vitamin C, and PDRN mitigates melanogenesis by modulating nicotinamide nucleotide transhydrogenase. Molecules. 2022;27(15):4923. doi: 10.3390/molecules27154923. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.BOO Y C Mechanistic basis and clinical evidence for the applications of nicotinamide (niacinamide) to control skin aging and pigmentation. Antioxidants (Basel) 2021;10(8):1315. doi: 10.3390/antiox10081315. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.YANG X, TANG Y, WANG M, et al Co-delivery of methotrexate and nicotinamide by cerosomes for topical psoriasis treatment with enhanced efficacy. Int J Pharm. 2021;605:120826. doi: 10.1016/j.ijpharm.2021.120826. [DOI] [PubMed] [Google Scholar]
- 26.El-KHALAWANY M, NOUH A H, KADAH A S, et al Evaluation of safety and efficacy of topical 4% nicotinamide in treatment of psoriasis; among a representative sample of Egyptians (an analytical observational study) Dermatol Ther. 2022;35(9):e15734. doi: 10.1111/dth.15734. [DOI] [PubMed] [Google Scholar]
- 27.TENG Y, YU Y, LI S, et al Ultraviolet radiation and basal cell carcinoma: an environmental perspective. Front Public Health. 2021;9:666528. doi: 10.3389/fpubh.2021.666528. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.THOMPSON B C, HALLIDAY G M, DAMIAN D L Nicotinamide enhances repair of arsenic and ultraviolet radiation-induced DNA damage in HaCaT keratinocytes and ex vivo human skin. PLoS One. 2015;10(2):e0117491. doi: 10.1371/journal.pone.0117491. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.HOEGLER K M, KHACHEMOUNE A Is the first-line systemic chemoprevention of nonmelanoma skin cancer nicotinamide or acitretin? Int J Dermatol. 2021;60(6):749–750. doi: 10.1111/ijd.15442. [DOI] [PubMed] [Google Scholar]
- 30.SALECH F, PONCE D P, PAULA-LIMA A C, et al Nicotinamide, a poly [ADP-ribose] polymerase 1 (PARP-1) inhibitor, as an adjunctive therapy for the treatment of Alzheimer's disease. Front Aging Neurosci. 2020;12:255. doi: 10.3389/fnagi.2020.00255. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.IERACI A, HERRERA D G Nicotinamide inhibits ethanol-induced Caspase-3 and PARP-1 over-activation and subsequent neuro-degeneration in the developing mouse cerebellum. Cerebellum. 2018;17(3):326–335. doi: 10.1007/s12311-017-0916-z. [DOI] [PubMed] [Google Scholar]
- 32.REHMAN I U, AHMAD R, KHAN I, et al Nicotinamide ameliorates amyloid beta-induced oxidative stress-mediated neuroinflammation and neurodegeneration in adult mouse brain. Biomedicines. 2021;9(4):408. doi: 10.3390/biomedicines9040408. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.ANDERSON D W, BRADBURY K A, SCHNEIDER J S Broad neuroprotective profile of nicotinamide in different mouse models of MPTP-induced parkinsonism. Eur J Neurosci. 2008;28(3):610–617. doi: 10.1111/j.1460-9568.2008.06356.x. [DOI] [PubMed] [Google Scholar]
- 34.HARRISON I F, POWELL N M, DEXTER D T The histone deacetylase inhibitor nicotinamide exacerbates neurodegeneration in the lactacystin rat model of Parkinson's disease. J Neurochem. 2019;148(1):136–156. doi: 10.1111/jnc.14599. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.SIDHU A, DIWAN V, KAUR H, et al Nicotinamide reverses behavioral impairments and provides neuroprotection in 3-nitropropionic acid induced animal model of Huntington's disease: implication of oxidative stress-poly(ADP-ribose) polymerase pathway. Metab Brain Dis. 2018;33(6):1911–1921. doi: 10.1007/s11011-018-0297-0. [DOI] [PubMed] [Google Scholar]
- 36.HATHORN T, SNYDER-KELLER A, MESSER A Nicotinamide improves motor deficits and upregulates PGC-1α and BDNF gene expression in a mouse model of Huntington's disease. Neurobiol Dis. 2011;41(1):43–50. doi: 10.1016/j.nbd.2010.08.017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.WILLIAMS P A, HARDER J M, FOXWORTH N E, et al Nicotinamide and WLDS act together to prevent neurodegeneration in glaucoma. Front Neurosci. 2017;11:232. doi: 10.3389/fnins.2017.00232. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.HUI F, TANG J, WILLIAMS P A, et al Improvement in inner retinal function in glaucoma with nicotinamide (vitamin B3) supplementation: a crossover randomized clinical trial. Clin Exp Ophthalmol. 2020;48(7):903–914. doi: 10.1111/ceo.13818. [DOI] [PubMed] [Google Scholar]
- 39.VERVLOET M G, Van BALLEGOOIJEN A J Prevention and treatment of hyperphosphatemia in chronic kidney disease. Kidney Int. 2018;93(5):1060–1072. doi: 10.1016/j.kint.2017.11.036. [DOI] [PubMed] [Google Scholar]
- 40.SHIMODA K, AKIBA T, MATSUSHIMA T, et al Niceritrol decreases serum phosphate levels in chronic hemodialysis patients. Nihon Jinzo Gakkai Shi. 1998;40(1):1–7. doi: 10.2329/perio.40.1. [DOI] [PubMed] [Google Scholar]
- 41.ZHANG Y, MA T, ZHANG P Efficacy and safety of nicotinamide on phosphorus metabolism in hemodialysis patients. Medicine (Baltimore) 2018;97(41):e12731. doi: 10.1097/MD.0000000000012731. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.KETTELER M, WIECEK A, ROSENKRANZ A R, et al Modified-release nicotinamide for the treatment of hyperphosphataemia in haemodialysis patients: 52-week efficacy and safety results of the phase Ⅲ randomised controlled NOPHOS trial. Nephrol Dial Transplant. 2022:gfac206. doi: 10.1093/ndt/gfac206. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.KETTELER M, WIECEK A, ROSENKRANZ A R, et al Efficacy and safety of a novel nicotinamide modified-release formulation in the treatment of refractory hyperphosphatemia in patients receiving hemodialysis—a randomized clinical trial. Kidney Int Rep. 2021;6(3):594–604. doi: 10.1016/j.ekir.2020.12.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.LIU X Y, YAO J R, XU R, et al Investigation of nicotinamide as more than an anti-phosphorus drug in chronic hemodialysis patients: a single-center, double-blind, randomized, placebo-controlled trial. Ann Transl Med. 2020;8(8):530. doi: 10.21037/atm.2020.03.228. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.LENGLET A, LIABEUF S, El ESPER N, et al Efficacy and safety of nicotinamide in haemodialysis patients: the NICOREN study. Nephrol Dial Transplant. 2017;32(5):870–879. doi: 10.1093/ndt/gfw042. [DOI] [PubMed] [Google Scholar]
- 46.XU J, ZHANG L, JIANG R, et al Nicotinamide improves NAD+ levels to protect against acetaminophen-induced acute liver injury in mice. Hum Exp Toxicol. 2021;40(11):1938–1946. doi: 10.1177/09603271211014573. [DOI] [PubMed] [Google Scholar]
- 47.Al-GAYYAR M M H, BAGALAGEL A, NOOR A O, et al The therapeutic effects of nicotinamide in hepatocellular carcinoma through blocking IGF-1 and effecting the balance between Nrf2 and PKB. Biomed Pharmacother. 2019;112:108653. doi: 10.1016/j.biopha.2019.108653. [DOI] [PubMed] [Google Scholar]
- 48.GALBRAITH A R, SEABLOOM D E, WUERTZ B R, et al Chemo-prevention of lung carcinogenesis by dietary nicotinamide and inhaled budesonide. Cancer Prev Res. 2019;12(2):69–78. doi: 10.1158/1940-6207.CAPR-17-0402. [DOI] [PubMed] [Google Scholar]
- 49.HUANG C, WANG Y, LI X, et al Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497–506. doi: 10.1016/S0140-6736(20)30183-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.BADAWY A A B Immunotherapy of COVID-19 with poly (ADP-ribose) polymerase inhibitors: starting with nicotinamide. Biosci Rep. 2020;40(10):BSR20202856. doi: 10.1042/BSR20202856. [DOI] [PMC free article] [PubMed] [Google Scholar]