Abstract
目的
探讨中国女性不同时期体质量指数(body mass index, BMI)及成年期增重与肥胖相关乳腺癌风险标志物的关联,为乳腺癌防控策略的制定提供参考。
方法
基于西南社区女性乳腺癌筛查随访队列,采用横断面研究设计,采用序贯抽样从中抽取符合条件的筛查对象作为研究对象,收集基本危险因素信息,测定身高、体质量及血浆标志物水平。采用多元线性回归分别分析成年早期(20岁)、成年后期BMI及成年期增重与标志物的关联。标志物浓度均进行自然对数转换后纳入模型。
结果
442名对象的平均年龄49 (45, 54)岁,平均成年早期、后期BMI为21.47 (19.56, 23.11) kg/m2、24.10 (22.59, 25.97) kg/m2,平均成年期增重6.60 (2.00, 11.00) kg。成年后期BMI与脂联素水平呈负向相关(β=−0.026,95%CI:−0.045~−0.008,P=0.006),与C反应蛋白(β=0.095,95%CI:0.054~0.137,P <0.001)及瘦素受体水平(β=0.090,95%CI:0.063~0.117,P <0.001)呈正向相关,暂未发现与抵抗素及胰岛素样生长因子结合蛋白-3的关联。成年早期BMI仅与成年后期胰岛素样生长因子结合蛋白-3水平负向相关(β=−0.039,95%CI:−0.068~−0.010,P=0.009)。进一步分析自20岁以来的成年期增重情况发现,成年期年均增重与脂联素水平存在负向关联,与其他4种标志物水平存在正向关联。此外,成年期增重>5.00 kg组的脂联素水平较体质量稳定组更低(β=−0.185,95%CI:−0.320~−0.049,P=0.008),胰岛素样生长因子结合蛋白-3(β=0.389,95%CI:0.183~0.594,P <0.001)及瘦素受体(β=0.245,95%CI:0.048~0.442,P=0.015)水平更高。
结论
成年期增重与肥胖相关乳腺癌风险标志物的变化密切相关,女性应在整个成年期保持体质量稳定,且最好增重不超过5.00 kg。
Keywords: 体质量指数, 成年期增重, 乳腺癌, 标志物
Abstract
Objective
To investigate the associatiojn of body mass index (BMI) at different stages of life and weight gain in adulthood with obesity-related breast cancer risk biomarkers and to provide evidence for formulating policies concerning the prevention and control of breast cancer.
Methods
A cross-sectional study was designed based on the follow-up cohort of southwest China community-based breast cancer screening of women. Using sequential sampling, eligible participants were enrolled from the cohort as the subjects of the study. Information on the basic risk factors was collected and the height, weight, and plasma biomarker levels were measured. Multiple linear regression model was applied to analyze the associations of early adulthood BMI (defined as the BMI of the participant at age 20), adulthood BMI (defined as the BMI measured at the time of enrollment), and weight gain in adulthood with the biomarkers. The concentrations of the biomarkers were incorporated in the model after log transformation.
Results
The average age of the 442 participants was 49 (45, 54) years old, the average early adulthood BMI and adulthood BMI were 21.47 (19.56, 23.11) and 24.10 (22.59, 25.97) kg/m2, respectively, and the average weight gain in adulthood was 6.60 (2.00, 11.00) kg. Adulthood BMI was negatively associated with adiponectin level (β=−0.026, 95% CI: −0.045-−0.008, P=0.006), and positively associated with C-reactive protein level (β=0.095, 95% CI: 0.054-0.137, P<0.001) and leptin receptor level (β=0.090, 95% CI: 0.063-0.117, P<0.001). No association was found between adulthood BMI and resistin levels or between adulthood BMI and insulin-like growth factor-binding protein-3 levels. BMI in early adulthood was found to be negatively associated with only insulin-like growth factor-binding protein-3 levels (β=−0.039, 95% CI: −0.068-−0.010, P=0.009). Further analysis of adulthood weight gain after the age of 20 revealed that average annual weight gain in adulthood was negatively associated with adiponectin levels and positively associated with 4 other biomarkers. Furthermore, compared with those of women whose weight remained stable, the adiponectin level of women whose weight gain in adulthood exceeded 5.00 kg was much lower (β=−0.185, 95% CI: −0.320-−0.049, P=0.008), while their insulin-like growth factor-binding protein-3 (β=0.389, 95% CI: 0.183-0.594, P<0.001) and leptin receptor (β=0.245, 95% CI: 0.048-0.442, P=0.015) levels were higher.
Conclusion
Weight gain in adulthood is strongly associated with the changes in obesity-related breast cancer risk biomarkers. Women should maintain a stable weight throughout adulthood and it is preferred that their weight gain should not exceed 5.00 kg.
Keywords: Body mass index, Weight gain in adulthood, Breast cancer, Biomarker
2020年中国女性乳腺癌新发病例数达42万,居女性恶性肿瘤发病首位[1]。同时,成年女性超重肥胖率也从2002年的30.30%增长至2012年的41.60%[2]。世界卫生组织将超重和肥胖定义为可能损害健康的异常或过度脂肪组织堆积,并将其列为绝经后乳腺癌的明确危险因素[3]。脂肪组织可分泌大量具有生物活性的脂肪细胞因子,常见的有脂联素、抵抗素、瘦素及其受体等。脂肪细胞因子通路的功能障碍被认为是肥胖诱发乳腺癌的主要原因之一,其循环水平的改变能较好地指示乳腺癌的风险,可作为肥胖相关的乳腺癌风险标志物[4-5]。目前国内较多研究已表明需控制体质量以预防乳腺癌,但关于体质量管理的起始年龄及控制程度尚无明确结论。因此,本研究利用中国西南社区女性乳腺癌筛查随访队列的基线横断面资料,分别探讨成年早期/后期体质量指数(body mass index, BMI)及成年期增重与肥胖相关乳腺癌风险标志物的关联,以期为肥胖相关的乳腺癌防控策略的制定提供参考。
1. 对象与方法
1.1. 研究对象
中国西南社区女性乳腺癌筛查随访队列由2019年4–6月在成都市某医院参加“两癌筛查”检查的35~64岁女性组成,本研究从中序贯纳入442名参与者作为研究对象。样本量测算依据参照本课题组前期对瘦素指标的研究结果,采用独立两样本均数比较的样本量计算公式,同时考虑到其他指标的差异度及随访时间较长,再将计算得到的样本量扩增至2倍,因此至少需要400例样本。样本的纳入与排除标准如下:①纳入标准:自愿参与本研究并接受问卷调查和空腹静脉血采集,汉族女性,本地居住3年以上。②排除标准:患感染性疾病、精神障碍、认知障碍及恶性肿瘤等重大疾病者。本研究通过四川大学华西第四医院(华西公共卫生学院)伦理委员会审查,研究对象均签署知情同意书。
1.2. 调查内容
利用项目组制定的乳腺癌常见环境危险因素调查表,由统一培训的调查员面对面询问研究对象的相关信息,包括一般人口学特征(年龄、文化水平、职业)、生殖生育史(初潮年龄、绝经状态、活产)、不良生活行为习惯(吸烟、饮酒)及20岁时体质量等。采用临床统一标准,测量身高、体质量,计算BMI,即BMI=体质量/身高2。体质量单位为kg,身高单位为m,BMI单位为kg/m2。
1.3. 样本采集与实验室检测
于筛查当日早晨,采集5 mL空腹血液样本于EDTA抗凝管,及时分离上层血浆,放于−80 ℃保存。本项目组前期的系统综述研究[6]及乳腺癌病例对照研究[7],验证确定了中国女性的5个肥胖相关乳腺癌风险标志物,即脂联素、抵抗素、胰岛素样生长因子结合蛋白-3、C反应蛋白和瘦素受体。采用双抗体夹心酶联免疫吸附测定法(enzyme-linked immunosorbent assay, ELISA)检测标志物浓度,试剂盒购自武汉伊莱瑞特生物科技有限公司。采用酶标仪(美国Thermo公司)检测反应孔板在450 nm波长处的光密度值(OD)值,采用Curve Expert 1.4软件绘制标准曲线并计算标志物表达水平。
1.4. 变量定义
成年早期、后期BMI分别定义为20岁时、入组时的BMI。基于中国人群的超重肥胖划分标准[8],将随访人群根据BMI划分为四组:低体质量组(<18.50 kg/m2)、正常体质量组(18.50~<23.90 kg/m2)、超重组(23.90~<28.00 kg/m2)及肥胖组(≥28.00 kg/m2)。成年期增重量定义为入组时体质量与20岁时体质量的差值,根据差值分为三组:参照组(体质量变化在2.50 kg内),2.50~<5.00 kg组(增重超过2.50 kg但不足5.00 kg)、≥5.00 kg组(增重5.00 kg及以上)。由于低体质量组样本量太少(n=7),故未将该组数据纳入基本特征分析及BMI与肥胖相关乳腺癌风险标志物浓度的关联分析;成年期减重量大于2.50 kg的研究对象(n=33),不纳入增重分组与标志物浓度的关联分析。
1.5. 统计学方法
本研究基于基线的横断面调查资料进行分析。对于近似服从正态分布的定量资料采用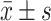 进行描述,不同肥胖分组的组间比较采用方差分析;对于不服从正态分布的定量资料采用中位数(四分位数间距)进行描述,组间比较采用Mann-Whitney U检验;定性资料用百分比(%)表示,组间比较采用χ2检验;对于不符合正态分布的标志物水平,经自然对数转换后呈正态分布,进而采用方差分析进行组间比较。标志物浓度均进行自然对数转换后纳入分析,采用多元线性回归模型,分析成年早期BMI和成年后期BMI与各标志物浓度对数值间的关系,BMI分别以连续型变量和分类变量的形式纳入模型。同时,采用多元线性回归模型,将增重以连续型变量和分类变量的形式分别纳入模型,进一步分析成年期增重每增加1 kg和不同程度的增重分组与各标志物浓度对数值间的关系。此外还对年均增重(即增重总量/时间)进行分析。以上分析均构建2种分析模型:模型1:调整入组时年龄;模型2:在模型1的基础上进一步调整潜在的混杂因素,包括文化水平、职业、初潮年龄、绝经状态、活产经历、吸烟、饮酒及20岁时BMI(仅在增重分析模型中矫正)。通过计算β值及其95%置信区间(confidence interval, CI)来评价BMI与各标志物浓度对数值间的关系,置信区间包含0说明BMI与标志物浓度无关,同时也报告了双侧检验P值,检验水准α=0.05,所有统计学分析使用R-4.1.0软件完成。
进行描述,不同肥胖分组的组间比较采用方差分析;对于不服从正态分布的定量资料采用中位数(四分位数间距)进行描述,组间比较采用Mann-Whitney U检验;定性资料用百分比(%)表示,组间比较采用χ2检验;对于不符合正态分布的标志物水平,经自然对数转换后呈正态分布,进而采用方差分析进行组间比较。标志物浓度均进行自然对数转换后纳入分析,采用多元线性回归模型,分析成年早期BMI和成年后期BMI与各标志物浓度对数值间的关系,BMI分别以连续型变量和分类变量的形式纳入模型。同时,采用多元线性回归模型,将增重以连续型变量和分类变量的形式分别纳入模型,进一步分析成年期增重每增加1 kg和不同程度的增重分组与各标志物浓度对数值间的关系。此外还对年均增重(即增重总量/时间)进行分析。以上分析均构建2种分析模型:模型1:调整入组时年龄;模型2:在模型1的基础上进一步调整潜在的混杂因素,包括文化水平、职业、初潮年龄、绝经状态、活产经历、吸烟、饮酒及20岁时BMI(仅在增重分析模型中矫正)。通过计算β值及其95%置信区间(confidence interval, CI)来评价BMI与各标志物浓度对数值间的关系,置信区间包含0说明BMI与标志物浓度无关,同时也报告了双侧检验P值,检验水准α=0.05,所有统计学分析使用R-4.1.0软件完成。
2. 结果
2.1. 基本情况
见表1。本组研究对象平均年龄49(45,54)岁,小学及初中文化水平占比86.65%,退休或待业占比56.79%,平均初潮年龄14(13,15)岁,45.70%的对象已绝经,98.87%的对象生育过孩子,现在吸烟和饮酒分别占0.90%和3.62%;成年后期BMI平均24.10(22.59,25.97) kg/m2,成年早期BMI平均 21.47(19.56,23.11) kg/m2,成年期平均增重6.60(2.00,11.00) kg;脂联素、抵抗素、C反应蛋白、胰岛素样生长因子结合蛋白-3及瘦素受体的质量浓度依次为8.42(5.93, 11.47) μg/mL、10.73(4.61, 21.84) ng/mL、0.79(0.31, 1.80) μg/mL、0.36(0.20, 0.59) μg/mL、12.18(6.30, 18.62) ng/mL。年龄、成年早期BMI、成年期增重、脂联素、C反应蛋白及瘦素受体水平在不同成年后期(即入组时)BMI组间的差异有统计学意义(P<0.05)。
表 1. Basic characteristics of participant groups of different adulthood BMI.
基于成年后期BMI分组的对象基本特征描述
| Characteristic | Total (n=442) |
Adulthood BMI group# | P | ||
| 18.50≤BMI< 23.90 kg/m2 (n=205) |
23.90≤BMI< 28.00 kg/m2 (n=181) |
BMI≥28.00 kg/m2
(n=156) |
|||
| Age/yr., median (P25, P75) | 49 (45, 54) | 48 (44, 53) | 50 (46, 54) | 52 (47, 55) | 0.008 |
| Highest education attained/case (%) | 0.471 | ||||
| Primary school or lower | 19 (4.30) | 9 (4.39) | 8 (4.42) | 2 (4.08) | |
| Primary and junior high school | 383 (86.65) | 175 (85.37) | 157 (86.74) | 46 (93.88) | |
| Senior high school and college | 40 (9.05) | 21 (10.24) | 16 (8.84) | 1 (2.04) | |
| Occupation | 0.460 | ||||
| Administration/case (%) | 16 (3.62) | 6 (2.93) | 10 (5.53) | 0 (0.00) | |
| Manufacturing, construction, service, business, and farming/case (%) | 154 (34.84) | 76 (37.07) | 63 (34.81) | 18 (36.74) | |
| Unemployed, retired and others/case (%) | 251 (56.79) | 113 (55.12) | 103 (56.91) | 30 (61.22) | |
| Age of menarche (median [P25, P75]) | 14 (13, 15) | 14 (13, 15) | 14 (13, 15) | 13 (12, 14) | 0.182 |
| Postmenopause/case (%) | 202 (45.70) | 85 (41.46) | 87 (48.07) | 27 (55.10) | 0.162 |
| Live birth(s)/case (%) | 437 (98.87) | 202 (99.02) | 180 (100.00) | 48 (97.96) | 0.247 |
| Smoking/case (%) | 4 (0.90) | 3 (1.49) | 0 (0.00) | 1 (0.23) | 0.175 |
| Drinking/case (%) | 16 (3.62) | 5 (2.46) | 8 (4.44) | 3 (6.12) | 0.334 |
| Anthropometric measures (median [P25, P75]) | |||||
| Adulthood BMI/(kg/m2, at enrollment) | 24.10 (22.59, 25.97) | 22.44 (21.26, 23.18) | 25.51 (24.65, 26.44) | 29.14 (28.60, 30.30) | <0.001 |
| Early adulthood BMI/(kg/m2, at 20 yr.) | 21.47 (19.56, 23.11) | 20.45 (18.97, 22.22) | 22.03 (20.31, 23.50) | 23.81 (21.93, 25.30) | <0.001 |
| Adulthood weight gain/(kg, weight at enrollment− weight at 20 yr.) | 6.60 (2.00, 11.00) | 3.40 (0.00, 7.50) | 8.50 (5.00, 12.60) | 13.60 (8.40, 19.00) | <0.001 |
| Biomarkers (median [P25, P75]) | |||||
| Adiponectin/(μg/mL) | 8.42 (5.93, 11.47) |
8.79 (6.41, 11.76) |
8.35 (5.63, 11.16) |
7.53 (5.11, 10.37) |
0.009 |
| Resistin/(ng/mL) | 10.73 (4.61, 21.84) |
10.07 (3.78, 20.70) |
10.16 (5.06, 23.41) |
11.87 (5.40, 20.42) |
0.210 |
| C-reactive protein/(μg/mL) | 0.79 (0.31, 1.80) |
0.52 (0.24, 1.20) |
0.86 (0.41, 1.84) |
1.54 (0.88, 3.06) |
<0.001 |
| Insulin-like growth factor binding protein-3/(μg/mL) | 0.36 (0.20, 0.59) |
0.35 (0.20, 0.59) |
0.37 (0.19, 0.60) |
0.36 (0.24, 0.53) |
0.508 |
| Soluble leptin receptor/(ng/mL) | 12.18 (6.30, 18.62) |
9.24 (5.01, 15.43) |
14.50 (8.40, 20.67) |
24.16 (10.92, 27.59) |
<0.001 |
2.2. 成年早期及成年后期BMI与肥胖相关乳腺癌风险标志物浓度的关联
多元线性回归分析显示,成年后期BMI每增加1 kg/m2与脂联素水平存在负向关联(β=−0.026,95%CI:−0.045~−0.008,P=0.006)、与C反应蛋白(β=0.095,95%CI:0.054~0.137,P<0.001)及瘦素受体水平(β=0.090,95%CI:0.063~0.117,P<0.001)存在正向关联,暂未发现与抵抗素及胰岛素样生长因子结合蛋白-3的关联。超重组及肥胖组的脂联素水平均低于正常体质量组(超重:β=−0.109,95%CI:−0.217~−0.001,P=0.049;肥胖:β=−0.231,95%CI:−0.399~−0.063,P=0.007),但C反应蛋白(超重:β=0.405,95%CI:0.164~0.647,P=0.001;肥胖:β=0.832,95%CI:0.459~1.206,P<0.001)及瘦素受体(超重:β=0.333,95%CI:0.171~0.496,P<0.001; 肥胖:β=0.548,95%CI:0.297~0.799,P<0.001)水平均高于正常体质量组,见表2。而成年早期BMI仅与成年后期胰岛素样生长因子结合蛋白-3水平呈负向相关(β=−0.039,95%CI:−0.068~−0.010,P=0.009),且相比于正常体质量组,低体质量组C反应蛋白水平升高(β=0.503,95%CI:0.128~0.878,P=0.009),暂未发现与其他标志物的关联,见表3。
表 2. Associations of adulthood BMI with the concentration of obesity-related breast cancer risk biomarkers.
成年后期BMI与肥胖相关乳腺癌风险标志物浓度的关联
| Model | Adiponectin | Resistin | C-reactive protein | Insulin-like growth factor binding protein-3 |
Soluble leptin receptor | |||||||||
| β (95% CI) | P | β (95% CI) | P | β (95% CI) | P | β (95% CI) | P | β (95% CI) | P | |||||
| # Low weight group (n=7) was not included in this analysis. Model 1 was adjusted for age at enrollment (continuous); Model 2 was adjusted for age at enrollment (continuous), highest education attained (primary school or lower, primary and junior high school, and senior high school and college), occupation (administration; manufacturing, construction, service, business, and farming; unemployed, retired and others), age of menarche (<14 or ≥14 years old), menopause status (premenopausal or postmenopausal), history of livebirth(s) (yes or no), smoking (yes or no) and drinking (yes or no). | ||||||||||||||
| Model 1# | ||||||||||||||
| Normal weight | Reference | Reference | Reference | Reference | Reference | |||||||||
| Overweight | −0.102 (−0.207, 0.003) | 0.056 | 0.010 (−0.213, 0.232) | 0.933 | 0.410 (0.174, 0.647) | 0.001 | 0.021 (−0.144, 0.185) | 0.805 | 0.338 (0.177, 0.498) | <0.001 | ||||
| Obese | −0.236 (−0.399, −0.073) | 0.005 | 0.017 (−0.328, 0.363) | 0.921 | 0.902 (0.535, 1.268) | <0.001 | 0.068 (−0.187, 0.322) | 0.602 | 0.592 (0.343, 0.840) | <0.001 | ||||
| ΔBMI (per 1 kg/m2) | −0.028 (−0.045, −0.010) | 0.002 | 0.013 (−0.025, 0.050) | 0.502 | 0.103 (0.063, 0.143) | <0.001 | 0.011 (−0.016, 0.039) | 0.424 | 0.093 (0.067, 0.120) | <0.001 | ||||
| Model 2# | ||||||||||||||
| Normal weight | Reference | Reference | Reference | Reference | Reference | |||||||||
| Overweight | −0.109 (−0.217, −0.001) | 0.049 | 0.008 (−0.201, 0.217) | 0.938 | 0.405 (0.164, 0.647) | 0.001 | 0.024 (−0.143, 0.191) | 0.776 | 0.333 (0.171, 0.496) | <0.001 | ||||
| Obese | −0.231 (−0.399, −0.063) | 0.007 | 0.011 (−0.312, 0.334) | 0.947 | 0.832 (0.459, 1.206) | <0.001 | 0.023 (−0.234, 0.281) | 0.858 | 0.548 (0.297, 0.799) | <0.001 | ||||
| ΔBMI (per 1 kg/m2) | −0.026 (−0.045, −0.008) | 0.006 | 0.015 (−0.020, 0.051) | 0.398 | 0.095 (0.054, 0.137) | <0.001 | 0.008 (−0.020, 0.037) | 0.573 | 0.090 (0.063, 0.117) | <0.001 | ||||
表 3. Associations of early adulthood BMI with the concentration of obesity-related breast cancer risk biomarkers.
成年早期BMI与肥胖相关乳腺癌风险标志物浓度的关联
| Model | Adiponectin | Resistin | C-reactive protein | Insulin-like growth factor binding protein-3 |
Soluble leptin receptor | |||||||||
| β (95% CI) | P | β (95% CI) | P | β (95% CI) | P | β (95% CI) | P | β (95% CI) | P | |||||
| Model 1, Adjusted for age at enrollment (continuous); Model 2, adjusted for age at enrollment (continuous), education (less than primary school, primary and junior high school, and senior high school and college), occupation (administration; manufacturing, construction, service, business, and farming; unemployed, retired, and others), age of menarche (<14 or ≥14 years old), menopause status (premenopausal, postmenopausal), history of livebirth (yes or no), smoking (yes or no) and drinking (yes or no). | ||||||||||||||
| Model 1 | ||||||||||||||
| Normal weight | Reference | Reference | Reference | Reference | Reference | |||||||||
| Low weight | −0.035 (−0.199, 0.128) |
0.669 | 0.084 (−0.256, 0.424) |
0.627 | 0.457 (0.090, 0.824) |
0.015 | 0.193 (−0.055, 0.441) |
0.127 | 0.162 (−0.088, 0.412) |
0.205 | ||||
| Overweight | 0.001 (−0.136, 0.138) |
0.990 | 0.076 (−0.213, 0.364) |
0.606 | 0.121 (−0.191, 0.432) |
0.447 | −0.304 (−0.515, −0.094) |
0.005 | 0.128 (−0.084, 0.340) |
0.235 | ||||
| Obese | 0.072 (−0.356, 0.500) |
0.742 | −0.438 (−1.329, 0.453) |
0.335 | 0.378 (−0.584, 1.340) |
0.440 | 0.374 (−0.276, 1.025) |
0.259 | 0.158 (−0.498, 0.813) |
0.637 | ||||
| ΔBMI (per 1 kg/m2) | 0.007 (−0.012, 0.026) |
0.457 | −0.030 (−0.069, 0.009) |
0.135 | −0.007 (−0.050, 0.036) |
0.746 | −0.040 (−0.069, −0.011) |
0.007 | 0.007 (−0.022, 0.036) |
0.638 | ||||
| Model 2 | ||||||||||||||
| Normal weight | Reference | Reference | Reference | Reference | Reference | |||||||||
| Low weight | −0.027 (−0.195, 0.140) |
0.748 | 0.139 (−0.185, 0.463) |
0.399 | 0.503 (0.128, 0.878) |
0.009 | 0.173 (−0.079, 0.425) |
0.179 | 0.158 (−0.095, 0.411) |
0.220 | ||||
| Overweight | 0.012 (−0.128, 0.152) |
0.865 | 0.088 (−0.185, 0.361) |
0.526 | 0.110 (−0.206, 0.425) |
0.495 | −0.298 (−0.510, −0.086) |
0.006 | 0.126 (−0.087, 0.339) |
0.246 | ||||
| Obese | 0.077 (−0.359, 0.513) |
0.730 | −0.471 (−1.313, 0.370) |
0.271 | 0.306 (−0.668, 1.279) |
0.538 | 0.421 (−0.233, 1.076) |
0.206 | 0.136 (−0.522, 0.794) |
0.685 | ||||
| ΔBMI (per 1 kg/m2) | 0.009 (−0.010, 0.029) |
0.330 | −0.031 (−0.068, 0.006) |
0.106 | −0.013 (−0.056, 0.031) |
0.568 | −0.039 (−0.068, −0.010) |
0.009 | 0.006 (−0.023, 0.035) |
0.701 | ||||
2.3. 成年期增重与肥胖相关乳腺癌风险标志物浓度的关联
多元线性回归分析显示,在控制了20岁BMI及其他混杂因素后,成年期每增重1 kg与成年后期脂联素水平存在负向关联(β=−0.012,95%CI:−0.021~−0.004,P=0.006),与抵抗素(β=0.019,95%CI:−0.001~0.036,P=0.036)、C反应蛋白(β=0.026,95%CI:0.006~0.046,P=0.012)、胰岛素样生长因子结合蛋白-3(β=0.023,95%CI:0.010~0.037,P=0.001)及瘦素受体水平(β=0.020,95%CI:0.007~0.033,P=0.003)存在正向关联。同时,成年期年均每增重1 kg均与标志物浓度变化相关。此外,将对象按成年期增重的程度划分为3组后发现,增重≥5.00 kg组的脂联素水平相较于体质量稳定组更低(β=−0.185,95%CI:−0.320~−0.049,P=0.008)、胰岛素样生长因子结合蛋白-3(β=0.389,95%CI:0.183~0.594,P<0.001)及瘦素受体(β=0.245,95%CI:0.048~0.442,P=0.015)水平相较于体质量稳定组更高,见表4。
表 4. Associations of adulthood weight gain with the concentration of obesity-related breast cancer risk biomarkers#.
成年期增重与肥胖相关乳腺癌风险标志物浓度的关联#
| Variable | Adiponectin | Resistin | C-reactive protein | Insulin-like growth factor binding protein-3 |
Soluble leptin receptor | |||||||||
| β (95% CI) | P | β (95% CI) | P | β (95% CI) | P | β (95% CI) | P | β (95% CI) | P | |||||
| # Adjusted for age at enrollment (continuous), highest education attained (primary school or lower, primary and junior high school, senior high school, and college), occupation (administration; manufacturing, construction, service, business, and farming; unemployed, retired, and others), age of menarche (<14 or ≥14 years old), menopause status (premenopausal or postmenopausal), history of livebirth(s) (yes or no), smoking (yes or no), drinking (yes or no) and BMI at 20 years old (continuous). | ||||||||||||||
| −2.50-<2.50 kg | Reference | Reference | Reference | Reference | Reference | |||||||||
| 2.50-<5.00 kg | −0.189 (−0.383, 0.006) |
0.057 | 0.202 (−0.170, 0.573) |
0.286 | 0.179 (−0.257, 0.615) |
0.420 | 0.176 (−0.116, 0.468) |
0.237 | 0.152 (−0.127, 0.432) |
0.285 | ||||
| ≥5.00 kg | −0.185 (−0.320, −0.049) |
0.008 | 0.212 (−0.049, 0.474) |
0.111 | 0.171 (−0.136, 0.478) |
0.275 | 0.389 (0.183, 0.594) |
<0.001 | 0.245 (0.048, 0.442) |
0.015 | ||||
| Continuous (per 1 kg) | −0.012 (−0.021, −0.004) |
0.006 | 0.019 (0.001, 0.036) |
0.036 | 0.026 (0.006, 0.046) |
0.012 | 0.023 (0.010, 0.037) |
0.001 | 0.020 (0.007, 0.033) |
0.003 | ||||
|
Average annual weight gain (per 1 kg/year) |
−0.338 (−0.591, −0.084) |
0.009 | 0.717 (0.220, 1.213) |
0.005 | 0.595 (0.024, 1.167) |
0.041 | 0.739 (0.351, 1.128) |
<0.001 | 0.508 (0.139, 0.877) |
0.007 | ||||
3. 讨论
本研究利用西南地区社区女性乳腺癌筛查随访队列的基线资料,探讨不同阶段的肥胖暴露及成年期增重与肥胖相关乳腺癌风险标志物的关联。研究结果显示,成年后期BMI与脂联素水平存在负向关联、与C反应蛋白及瘦素受体水平存在正向关联,而成年早期BMI仅与胰岛素样生长因子结合蛋白-3水平存在负向关联。成年期增重除与上述标志物水平变化相关外,还与抵抗素及胰岛素样生长因子结合蛋白-3水平呈正向关联。相较于体质量保持稳定的女性,成年期增重5.00 kg及以上女性的有害标志物水平更高。
本研究中关注的肥胖相关乳腺癌风险标志物是一类主要由白色脂肪组织的脂肪细胞分泌的常见脂肪细胞因子。肥胖个体中过度肥大的脂肪细胞可以引起循环脂肪细胞因子异常分泌,从而导致促炎细胞因子与抗炎细胞因子的失衡,诱发机体的慢性低度炎症状态,进而促进有丝分裂及血管生成等过程,同时抑制细胞凋亡,诱导乳腺癌的发生发展[9]。本研究发现,成年后期超重及肥胖人群中有害的促炎脂肪因子过量分泌,包括瘦素受体及C反应蛋白,而有益的抗炎脂肪因子-脂联素分泌不足。这与GUI等[10]对11项观察性研究进行meta分析的发现一致,相对于BMI<25 kg/m2组,BMI>25 kg/m2组的脂联素水平明显更低(SMD=–1.19, 95%CI: –2.00~–0.39)。此外,CHOI等[11]对4项横断面研究进行荟萃分析也发现,女性BMI与CRP的对数浓度值高度正相关(r=0.53, 95%CI: 0.45~0.60),与GUI等[10]的结果一致,暂未发现抵抗素及胰岛素样生长因子结合蛋白-3水平与成年后期BMI相关。脂联素是一种内源性胰岛素增敏剂,可以通过抑制促炎细胞因子的分泌、促进抗炎细胞因子的释放和增加AMPK活性,进而降低乳腺癌的发生风险[12]。瘦素受体是胞外区短链型受体,为血液循环中主要的瘦素结合蛋白,决定瘦素生物活性,而目前关于瘦素及瘦素受体水平与乳腺癌风险的关系尚无明确结论[13]。以CRP为主要代表的慢性低度炎症状态被认为是癌症的标志,炎症可以通过产生自由基和诱发DNA损伤以及促进转化细胞的存活,来参与乳腺癌的发生发展过程[14]。
体质量通常会随着年龄的增长而增加,女性从成年早期到成年后期体质量增加尤为明显。大量研究表明,相较于成年期某一年龄的体质量,成年期增重可以更好地反映女性一生中过余脂肪堆积的情况[15],且与肿瘤、心血管疾病、2型糖尿病等慢性病和过早死亡的风险显著相关[16]。本研究发现成年早期BMI与成年后期肥胖相关乳腺癌风险标志物的关联甚微,但成年期增重与脂联素水平呈负向关联、与C反应蛋白、抵抗素、胰岛素样生长因子结合蛋白-3及瘦素受体水平呈正向关联,且成年期年均增重越大,促炎标志物越高,抗炎标志物越低。以上研究结果表明,相较于成年后期或早期BMI,自20岁以来的成年期增重与肥胖相关乳腺癌风险标志物水平更为相关,提示女性应从成年早期开始关注体质量变化情况,而不是仅仅关注目前的体质量。国内目前暂无相关研究报道,但本研究与欧洲国家的研究发现了一致的结论,AHONEN等[17]对500名平均年龄46岁的芬兰女性分析发现,成年期增重的分位数改变与脂联素水平呈负相关关系,而与C反应蛋白水平呈正相关;GENTILE等[18]对390名30~69岁意大利女性分析发现,与成年期非增重组(−9~0 kg)相比,成年期增重14~22 kg与C反应蛋白水平显著升高(>1.5 mg/L)相关(OR=3.40, 95%CI: 1.01~11.42)。此外,本研究还发现相较于体质量保持稳定的女性,成年期增重5.00 kg及以上的女性在成年后期拥有更差的肥胖相关乳腺癌风险标志物谱,即有害的促炎脂肪因子分泌增多。本研究提示,由于成年期每年的增重可能相对较小,不易引起重视,但整个成年期间累积增加总量却可能很大,女性应在整个成年期保持体质量稳定,且最好增重不超过5.00 kg,以控制肥胖相关乳腺癌风险标志物的正常分泌,进而降低乳腺癌的发生风险。
本研究首次在中国女性中评估不同时期的肥胖及成年期增重与肥胖相关乳腺癌风险标志物的关联,研究结果对我国成年女性体质量控制措施的制定提供了参考,对今后乳腺癌的精准预防具有重要的公共卫生学意义。但也存在不足:本研究样本来源于中国西南地区,尽管研究对象的平均成年期增重6.72 kg,与我国CKB项目中全国10个抽样地区207863名(49.40±8.90)岁女性成年期(自25岁以来)增重4.90 kg接近[19],但仍远小于上海女性健康研究中70106名(52.46±9.07)岁女性成年期(自20岁以来)增重9.94 kg[20],这在一定程度上表明了本研究结果的外推性受限,未来研究需扩大样本地区来源,验证本研究结果;其次,影响肥胖相关乳腺癌风险标志物水平的因素众多,研究中虽然控制了年龄、文化水平、职业、初潮年龄、绝经状态、活产、吸烟及饮酒等较为重要的因素,但受数据所限,仍有潜在因素未纳入分析,在后续研究中应充分考虑;最后,本研究为横断面研究设计,在因果关联判定上缺乏效力,研究结果需在进一步的队列数据中进行验证。综上所述,成年期增重与肥胖相关乳腺癌风险标志物的变化密切相关,建议我国女性应在整个成年期保持体质量稳定,且最好增重不超过5.00 kg,以降低乳腺癌的发生风险。
* * *
作者贡献声明 周敏和李佳圆负责论文构思、审读与编辑写作,李佳圆负责数据审编和经费获取,郝宇负责正式分析,周敏、郝宇、赵洵颖和李星月负责调查研究,李星月负责研究方法,周敏负责研究项目管理,付萍、严兰平和李佳圆负责提供资源,周敏和郝宇负责初稿写作。所有作者已经同意将文章提交给本刊,且对要发表的版本进行最终定稿,并同意对工作的所有方面负责。
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
国家自然科学基金(No. 81874282)资助
Contributor Information
敏 周 (Min ZHOU), Email: 443420544@qq.com.
佳圆 李 (Jiayuan LI), Email: lijiayuan@scu.edu.cn.
References
- 1.SUNG H, FERLAY J, SIEGEL R L, et al Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021;71(3):209–249. doi: 10.3322/caac.21660. [DOI] [PubMed] [Google Scholar]
- 2.PAN X F, WANG L, PAN A Epidemiology and determinants of obesity in China. Lancet Diabetes Endocrinol. 2021;9(6):373–392. doi: 10.1016/S2213-8587(21)00045-0. [DOI] [PubMed] [Google Scholar]
- 3.The World Cancer Research Fund/American, Institute for Cancer Research. Diet, nutrition, physical activity and breast cancer. 2017: 124.
- 4.ASSIRI A M A, KAMEL H F M Evaluation of diagnostic and predictive value of serum adipokines: leptin, resistin and visfatin in postmenopausal breast cancer. Obes Res Clin Pract. 2016;10(4):442–453. doi: 10.1016/j.orcp.2015.08.017. [DOI] [PubMed] [Google Scholar]
- 5.SANTILLÁN-BENÍTEZ J G, MENDIETA-ZERÓN H, GÓMEZ-OLIVÁN L M, et al The tetrad BMI, leptin, leptin/adiponectin (L/A) ratio and CA 15-3 are reliable biomarkers of breast cancer. J Clin Lab Anal. 2013;27(1):12–20. doi: 10.1002/jcla.21555. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.WU X, ZHANG X, HAO Y, et al Obesity-related protein biomarkers for predicting breast cancer risk: an overview of systematic reviews. Breast Cancer. 2021;28(1):25–39. doi: 10.1007/s12282-020-01182-0. [DOI] [PubMed] [Google Scholar]
- 7.DIAO S, WU X, ZHANG X, et al Obesity-related proteins score as a potential marker of breast cancer risk. Sci Rep. 2021;11(1):8230. doi: 10.1038/s41598-021-87583-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.ZHOU B F; Cooperative Meta-Analysis Group of the Working Group on Obesity in China Predictive values of body mass index and waist circumference for risk factors of certain related diseases in Chinese adults-study on optimal cut-off points of body mass index and waist circumference in Chinese adults. Biomed Environ Sci. 2002;15(1):83–96. [PubMed] [Google Scholar]
- 9.OUCHI N, PARKER J L, LUGUS J J, et al Adipokines in inflammation and metabolic disease. Nat Rev Immunol. 2011;11(2):85–97. doi: 10.1038/nri2921. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.GUI Y, PAN Q, CHEN X, et al The association between obesity related adipokines and risk of breast cancer: a meta-analysis. Oncotarget. 2017;8(43):75389–75399. doi: 10.18632/oncotarget.17853. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.CHOI J, JOSEPH L, PILOTE L Obesity and C-reactive protein in various populations: a systematic review and meta-analysis. Obes Rev. 2013;14(3):232–244. doi: 10.1111/obr.12003. [DOI] [PubMed] [Google Scholar]
- 12.FANTUZZI G Adipose tissue, adipokines, and inflammation. J Allergy Clin Immunol. 2005;115(5):911–919. doi: 10.1016/j.jaci.2005.02.023. [DOI] [PubMed] [Google Scholar]
- 13.SCHAAB M, KRATZSCH J The soluble leptin receptor. Best Pract Res Clin Endocrinol Metab. 2015;29(5):661–670. doi: 10.1016/j.beem.2015.08.002. [DOI] [PubMed] [Google Scholar]
- 14.JIANG X, SHAPIRO D J The immune system and inflammation in breast cancer. Mol Cell Endocrinol. 2014;382(1):673–682. doi: 10.1016/j.mce.2013.06.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.KEUM N, GREENWOOD D C, LEE D H, et al Adult weight gain and adiposity-related cancers: a dose-response meta-analysis of prospective observational studies. J Natl Cancer Inst. 2015;107(2):djv088. doi: 10.1093/jnci/djv088. [DOI] [PubMed] [Google Scholar]
- 16.ZHENG Y, MANSON J E, YUAN C, et al Associations of weight gain from early to middle adulthood with major health outcomes later in life. JAMA. 2017;318(3):255–272. doi: 10.1001/jama.2017.7092. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.AHONEN T, VANHALA M, KAUTIAINEN H, et al Sex differences in the association of adiponectin and low-grade inflammation with changes in the body mass index from youth to middle age. Gend Med. 2012;9(1):1–8. doi: 10.1016/j.genm.2012.01.002. [DOI] [PubMed] [Google Scholar]
- 18.GENTILE M, PANICO S, RUBBA F, et al Obesity, overweight, and weight gain over adult life are main determinants of elevated hs-CRP in a cohort of Mediterranean women. Eur J Clin Nutr. 2010;64(8):873–878. doi: 10.1038/ejcn.2010.69. [DOI] [PubMed] [Google Scholar]
- 19.周密, 祝楠波, 余灿清, 等 中国人群成年期体重变化现况分析. 中华流行病学杂志. 2019;40(5):510–514. doi: 10.3760/cma.j.issn.0254-6450.2019.05.004. [DOI] [PubMed] [Google Scholar]
- 20.MA X, BEEGHLY-FADIEL A, SHU X O, et al Anthropometric measures and epithelial ovarian cancer risk among Chinese women: results from the Shanghai Women's Health Study. Br J Cancer. 2013;109(3):751–755. doi: 10.1038/bjc.2013.384. [DOI] [PMC free article] [PubMed] [Google Scholar]


