Abstract
目的
探索腹部手术患者围术期多种体温特征与异体红细胞输注的关联性。
方法
回顾性分析2019年10月–2021年7月于四川大学华西医院行腹部手术的患者资料,患者核心体温由穿戴式无线体温传感器围术期全程连续监测,计算进入手术室至麻醉结束后24 h内的体温最低值、体温最大跌幅、低体温持续时长占比、时间加权平均温度、36 ℃曲线下面积和37 ℃曲线下面积。采用限制性立方样条结合多因素logistic回归模型评估上述6种体温特征与围术期异体红细胞输注的关联。
结果
共有3119例患者纳入研究,其中异体红细胞输注率为2.8%。限制性立方样条模型显示,异体红细胞输注与围术期体温最低值(Poverall=0.048)和36 ℃曲线下面积有关(Poverall=0.026),非线性检验无统计学意义;其他体温特征关联无统计学意义。根据模型结果取截点对体温特征分组,多因素logistic回归显示体温最低值<35.5 ℃(OR=2.47,95%CI:1.21~5.03)、36 ℃曲线下面积≥100 ℃·min(OR=2.24,95%CI:1.09~4.58)与围术期异体红细胞输注需求增加有关。
结论
低体温与围术期异体红细胞输注需求增加有关,并且存在时间维度上的累积效应。针对出血风险高的患者应注意避免围术期体温过低、减少低体温的累积暴露量,以降低输血需求。
Keywords: 腹部手术, 围术期低体温, 输血, 可穿戴设备, 生命体征
Abstract
Objective
To explore the correlation between six characteristics of perioperative hypothermia and allogeneic red blood cell (RBC) transfusions in patients who underwent abdominal surgeries.
Methods
Patients who underwent abdominal surgeries at West China Hospital, Sichuan University between October 2019 and July 2021 were retrospectively enrolled. A wearable wireless temperature sensor was used to continuously monitor the core body temperature of patients throughout the perioperative period. The perioperative temperature nadir, maximum temperature loss, percentage of time with hypothermia, time-weighted average temperature, area under the curve (AUC) at 36 ℃, and AUC at 37 ℃ were calculated for the period from entering the operation room to 24 hours after the end of anesthesia. The restricted cubic spline (RCS) and multiple logistic regression models were used to explore the correlation between these temperature characteristics and perioperative allogeneic RBC transfusions.
Results
A total of 3119 patients were included in the study, with an allogeneic RBC transfusion rate of 2.8%. The RCS model showed that allogeneic RBC transfusion was associated with the perioperative temperature nadir (Poverall=0.048) and AUC at 36 ℃ (Poverall=0.026) and no statistical significance was found in the nonlinear test. The association between allogeneic RBC transfusions and other temperature characteristics was not statistically significant. According to the RCS model results, cut-off points were taken to form groups based on the body temperature characteristics. Multivariate logistic regression showed that the perioperative temperature nadir<35.5 ℃ (odds ratio [OR]=2.47, 95% confidence interval [CI]: 1.21-5.03) and AUC at 36 ℃≥100 ℃·min (OR=2.24, 95% CI:1.09-4.58) were associated with increased demand for allogeneic RBC transfusion.
Conclusion
Hypothermia is associated with an increased need for perioperative allogeneic RBC transfusions and has a cumulative effect over time. For patients at high risk of bleeding, attention should be paid to the prevention of perioperative hypothermia and reduction in the cumulative exposure to hypothermia, thereby reducing the need for blood transfusion.
Keywords: Abdominal surgery, Perioperative hypothermia, Blood transfusion, Wearable device, Vital signs
外科手术患者在围手术期可出现不同程度的体温降低,非医疗计划导致的手术患者核心体温低于36 ℃时被称为围术期非计划性低体温(inadvertent perioperative hypothermia, IPH)[1]。腹部手术患者由于麻醉药物损害体温调节功能、术中体腔暴露、腹腔冲洗等因素,IPH的发生率约37.2%~64.7%[2]。研究报道IPH与多种并发症密切相关,包括凝血功能障碍、术中出血量和输血需求增加等[3]。因此,世界卫生组织提出将维持体温正常作为患者围术期十大安全目标[4]。近年来研究者主要关注体温在时间维度上的特征,例如低体温曲线下面积(area under the curve, AUC)[5]、时间加权平均(time-weighted average, TWA)温度[6]等,以更好地衡量低体温的严重程度。但是哪种低体温的特征与输血需求关联最密切尚不清楚。且既往研究主要集中于术中低体温与输血,但由于手术室周转快、患者在手术室停留时间有限,较少研究关注患者返回病房后延续的低体温和术后输血的关系[7]。因此,本研究将探索围术期多种低体温特征与输血的关联性,以期为合理指导围术期保温提供新的证据。
1. 对象与方法
1.1. 研究对象
本研究采用队列研究方法,于2019年8月在四川大学华西医院胆道外科病房及麻醉手术中心建设基于穿戴设备的核心体温围术期全流程智能监测系统,将在该病房住院接受腹部手术、知情同意佩戴无线体温传感器的患者纳入队列,提取该队列中2019年10月–2021年7月的患者数据。纳入标准为全麻下行腹部手术、有连续体温监测数据者,排除标准为术中或术后24 h内体温数据缺失超过20%、急诊手术、经皮穿刺手术、术前合并影响体温的代谢性疾病或感染性发热、术前血红蛋白基线资料缺失者,以及排除同一患者的第二次手术记录。本研究通过四川大学华西医院生物医学伦理委员会审查(2021年审第59号)。病房护士在患者入院时向其介绍研究方案并取得知情同意,所有纳入研究者均签署知情同意书。
1.2. 体温监测方法
应用穿戴式无线体温传感器iThermonitor®(北京睿仁医疗科技有限公司生产,型号WT705)进行体温监测。体温传感器粘贴于患者腋下,跟随患者在病房、手术室、麻醉恢复室等护理单元之间移动,获取围术期全程、连续的体温数据。该设备采集腋窝温度后利用人工智能算法拟合核心温度,前期临床一致性测试表明其测得腋窝温度经算法处理后与食管核心体温平均相差(0.14±0.26) ℃[8],是一种具有较好精确度与可行性的围术期体温监测方法[9-10]。本研究将体温数据导出后标准化处理为每分钟一个数据点,根据设备自带的佩戴质量评分剔除传感器未佩戴或脱落期间的体温数据,并参考文献的算法[5],识别体温时间序列数据中连续两次测量差值>0.5 ℃的非平滑波动,对异常数据予以剔除。缺失或异常数据占比超过20%的病例予以剔除,不超过20%则对缺失值采用邻近值填补。
1.3. 观察指标
1.3.1. 围术期低体温
参考英国国家卫生与临床优化研究所(National Institute for Health and Clinical Excellence, NICE)成人手术患者低体温预防与管理指南[11],低体温可能发生于围术期任何时间,其界定的围术期为麻醉开始前1 h至麻醉结束后24 h。因此,本研究选择患者从进入手术室至麻醉结束后24 h内的连续体温记录进行分析,低体温定义为体温<36 ℃、持续5 min以上。通过文献回顾,拟分析6种围术期体温特征与异体红细胞输注的剂量反应关系,包括:体温最低值、体温最大跌幅(进入手术室时体温-体温最低值)、TWA温度(体温曲线下面积/监测时间),以及低体温持续时长占比(低体温持续时间/体温监测时间)、36 ℃ AUC(36 ℃以下、体温曲线以上区域面积)、37 ℃ AUC(37 ℃以下、体温曲线以上区域面积)。
1.3.2. 结局指标
本研究的结局指标为围术期输注异体红细胞,根据电子病历系统中输血医嘱及其执行时间,统计患者进入手术室至术后24 h内的输注异体红细胞事件及输注量。异体红细胞输注指征为血红蛋白<70 g/L,如术中失血量大或情况紧急则根据失血量及患者情况估计输血量。术中由麻醉医生及手术医生共同决定患者是否需要输血,术后则由外科医生决定是否输血。
1.3.3. 数据获取方式
项目组在四川大学华西医院信息中心大数据平台建设围术期生命体征数据库。在数据库中根据科室、手术日期及手术名称配置检索策略,患者手术后自动入组;根据预先设计的字段链接从医院电子病历系统中抓取患者诊疗信息,包含患者基本信息、诊断、手术、实验室检查及护理记录等。每条记录均经人工审查及核对后保存,数据修改记录可追踪。
1.4. 统计学方法
连续变量服从正态分布采用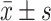 描述,组间比较采用t检验;不服从正态分布则采用中位数(四分位数)描述,组间比较采用Mann-Whitney U检验;分类变量采用频数、百分率表示,组间比较采用卡方检验。采用限制性立方样条函数(restricted cubic spline, RCS)评估不同体温特征与异体红细胞输注的剂量反应关系,设置3个节点,分别为体温特征的10%、50%、90%分位数[5];根据曲线截点将连续体温变量转换为分类变量,以围术期输注异体红细胞为二分类变量构建logistic回归模型,采用受试者工作特征(receiver operating characteristic, ROC)曲线评估模型性能。在变量筛选过程中,首先纳入单因素分析P<0.1的变量,检验变量的多重共线性,剔除方差膨胀因子(variance inflation factor, VIF)>5的变量(术中输液量VIF=5.837);随后通过向后逐步回归筛选变量,其中性别、年龄、体质量指数(body mass index, BMI)、是否恶性肿瘤、手术目标器官、术前合并肝硬化因关联无统计学意义被排除,以精简多因素回归模型。最终模型中校正的混杂因素包括术前血红蛋白、术前脾功能亢进、ASA评分、手术方式、手术时长、术中失血量。统计分析软件为R 4.1.1、Matlab 2021b及SPSS 26.0,α双侧=0.05。
描述,组间比较采用t检验;不服从正态分布则采用中位数(四分位数)描述,组间比较采用Mann-Whitney U检验;分类变量采用频数、百分率表示,组间比较采用卡方检验。采用限制性立方样条函数(restricted cubic spline, RCS)评估不同体温特征与异体红细胞输注的剂量反应关系,设置3个节点,分别为体温特征的10%、50%、90%分位数[5];根据曲线截点将连续体温变量转换为分类变量,以围术期输注异体红细胞为二分类变量构建logistic回归模型,采用受试者工作特征(receiver operating characteristic, ROC)曲线评估模型性能。在变量筛选过程中,首先纳入单因素分析P<0.1的变量,检验变量的多重共线性,剔除方差膨胀因子(variance inflation factor, VIF)>5的变量(术中输液量VIF=5.837);随后通过向后逐步回归筛选变量,其中性别、年龄、体质量指数(body mass index, BMI)、是否恶性肿瘤、手术目标器官、术前合并肝硬化因关联无统计学意义被排除,以精简多因素回归模型。最终模型中校正的混杂因素包括术前血红蛋白、术前脾功能亢进、ASA评分、手术方式、手术时长、术中失血量。统计分析软件为R 4.1.1、Matlab 2021b及SPSS 26.0,α双侧=0.05。
2. 结果
2.1. 一般资料
从围术期生命体征数据库中获得全麻下腹部手术、接受连续体温监护者3661例,排除术中或术后24 h内体温数据缺失超过20%者243例、急诊手术89例、经皮穿刺手术30例、术前感染性发热7例、合并甲状腺功能亢进或减退者15例、同一患者的第二次手术记录10例、术前血红蛋白基线资料缺失者148例,最终纳入分析3119例。患者平均年龄(52.5±14.1)岁,女性占比58.9%。手术部位以胆囊、胆管为主,占比73.5%,其余包括肝脏、胰腺、脾脏、胃肠及其他腹腔组织;手术方式以腹腔镜为主,占比76.1%;诊断为恶性肿瘤的患者构成比为21.2%;麻醉时长与手术时长的中位数分别为99 min、57 min,23.6%的患者术中接受充气保温毯主动加温。围术期低体温发生率为45.7%(1425/3119),围术期体温最低值、TWA体温的平均值分别为36 ℃和36.7 ℃,围术期体温最大跌幅的中位数为0.4 ℃。
共87例(2.8%)患者围术期输注了异体红细胞,其中75例(2.4%)患者在术中输注,输注量的中位数及范围为3.0(1.5~9) U;16例(0.5%)患者在术后24 h内输注(含4例术中及术后均输血者),输注量的中位数及范围为2.0(1.5~6) U。围术期是否输注异体红细胞的两组患者中年龄、BMI、性别、合并症(肝硬化和脾功能亢进)、恶性肿瘤、ASA评分、术前血红蛋白、手术方式、手术目标器官、麻醉时长、手术时长、术中失血量、术中输液量差异具有统计学意义(P<0.01)。两组患者IPH发生率及体温特征差异有统计学意义,详见表1。
表 1. Demographic and clinical data and body temperature characteristics of the patients.
患者人口学资料、临床资料及体温特征比较
| Characteristic | Overall (n=3119) |
Allogeneic red blood cell transfusions (n=87) |
No allogeneic red blood cell transfusion (n=3032) |
P |
| BMI: body mass index; ASA: American Society of Anaesthesiologists; IPH: inadvertent perioperative hypothermia; TWA: time-weighted average temperature; AUC: area under the time-temperature curve. # Median (P25, P75). | ||||
| Age/yr. | 52.5±14.1 | 56.9±13.9 | 52.4±14.1 | 0.003 |
| BMI/(kg/m2) | 23.5±3.2 | 22.4±3.1 | 23.5±3.1 | 0.001 |
| Female/case (%) | 1837 (58.9) | 40 (46.0) | 1797 (59.3) | 0.013 |
| Comorbidities/case (%) | ||||
| Chronic pulmonary disease | 72 (2.3) | 1 (1.1) | 71 (2.3) | 0.713 |
| Chronic heart disease | 82 (2.6) | 2 (2.3) | 80 (2.6) | 0.845 |
| Hypertension | 447 (14.3) | 13 (14.9) | 434 (14.3) | 0.869 |
| Diabetes mellitus | 193 (6.2) | 8 (9.2) | 185 (6.1) | 0.238 |
| Hepatic cirrhosis | 201 (6.4) | 14 (16.1) | 187 (6.2) | <0.001 |
| Hypersplenism | 70 (2.2) | 11 (12.6) | 59 (1.9) | <0.001 |
| Renal failure | 19 (0.6) | 2 (2.3) | 17 (0.6) | 0.097 |
| Thyroid disease | 33 (1.1) | 1 (1.1) | 32 (1.1) | 0.609 |
| Malignant tumor/case (%) | 660 (21.2) | 63 (72.4) | 597 (19.7) | <0.001 |
| ASA score (1/2/3)/case | 73/2592/454 | 0/48/39 | 73/2544/415 | <0.001 |
| Preoperative hemoglobin/(g/L) | 133.6±17.4 | 114.1±23.0 | 134.1±16.9 | <0.001 |
| Laparoscopic surgery/case (%) | 2373 (76.1) | 9 (10.3) | 2364 (78.0) | <0.001 |
| Target organ/case (%) | <0.001 | |||
| Gallbladder or bile ducts | 2294 (73.5) | 23 (26.4) | 2271 (74.9) | |
| Liver | 593 (19.0) | 36 (41.3) | 557 (18.4) | |
| Pancreas | 130 (4.2) | 14 (16.1) | 116 (3.8) | |
| Spleen | 44 (1.4) | 10 (11.5) | 34 (1.1) | |
| Stomach or intestine | 22 (0.7) | 3 (3.4) | 19 (0.6) | |
| Other abdominal tissue | 36 (1.2) | 1 (1.1) | 35 (1.2) | |
| Duration of anesthesia#/min | 99 (76, 192) | 330 (275, 441) | 97 (75, 179) | <0.001 |
| Duration of surgery#/min | 57 (38, 127) | 249 (200, 351) | 55 (37, 119) | <0.001 |
| Intraoperative blood loss#/mL | 10 (5, 50) | 500 (200, 800) | 10 (5, 50) | <0.001 |
| Intraoperative infusion#/mL | 500 (400, 1300) | 2500 (1740, 3800) | 500 (400, 1100) | <0.001 |
| Active warming/case (%) | 737 (23.6) | 81 (93.1) | 656 (21.6) | <0.001 |
| Incidence of IPH/case (%) | 1425 (45.7) | 58 (66.7) | 1367 (45.1) | <0.001 |
| Temperature nadir/℃ | 36.0±0.5 | 35.7±0.5 | 36.0±0.4 | 0.002 |
| Maximum temperature loss#/℃ | 0.4 (0.2, 0.7) | 0.7 (0.4, 1.2) | 0.4 (0.2, 0.7) | <0.001 |
| TWA temperature/℃ | 36.7±0.3 | 36.8±0.3 | 36.7±0.3 | 0.04 |
| Duration of hypothermia#/min | 0 (0, 147) | 145 (0, 365) | 0 (0, 142) | <0.001 |
| Percentage of time with IPH#/% | 4.0 (0, 13) | 9.1 (0, 21.4) | 3.5 (0, 12.4) | 0.001 |
| AUC at 36 ℃#/(℃·min) | 0 (0, 22.1) | 12.0 (0, 123.4) | 0 (0, 20.7) | <0.001 |
| AUC at 37 ℃#/(℃·min) | 428 (255, 685) | 606.3 (315.4, 901.8) | 425.2 (253.7, 681.2) | <0.001 |
2.2. 围术期多种体温特征与异体红细胞输注的剂量反应关系
分别将6种体温特征作为连续变量纳入RCS模型,结果(图1)显示,校正混杂因素后围术期体温最低值与围术期异体红细胞输注的关联有统计学意义(Poverall=0.048),围术期体温最低值在36 ℃以下随着体温递减而异体红细胞输注需求递增;尽管36 ℃以上随着体温升高存在异体红细胞输注需求增加的趋势,但该体温区间内关联无统计学意义,RCS模型非线性检验Pnonlinear=0.096,提示不存在统计学意义上的非线性关系(图1A)。36 ℃ AUC与围术期异体红细胞输注呈线性相关(Poverall=0.026,Pnonlinear=0.357,图1E)。其他体温特征,包括围术期体温最大跌幅、TWA温度、低体温持续时长占比、37 ℃ AUC与围术期异体红细胞输注未发现具有统计学意义的相关性。
图 1.

Dose-responsive associations between characteristics of perioperative hypothermia and allogeneic red blood cell transfusions by restricted cubic spline models
围术期多种体温特征与异体红细胞输注的剂量反应关系曲线
A, Perioperative temperature nadir. B, Maximum temperature loss. C, Perioperative time-weighted average temperature. D, Percentage of time with temperature below 36 ℃. E, AUC at 36 ℃. F, AUC at 37 ℃. Shaded regions represent 95% confidence intervals of the odds ratio.
2.3. 围术期多种体温特征与异体红细胞输注的多因素回归模型
根据RCS曲线评估截点,将连续体温变量转换为分类变量,分别纳入围术期体温最低值和36 ℃ AUC构建两个多因素logistic回归模型,见表2。如模型1所示,围术期体温最低值<35.5 ℃相较于体温≥36 ℃围术期输注异体红细胞的风险增加2.47倍(OR=2.47, 95%CI:1.21~5.03; P=0.013),ROC曲线下面积0.971(95%CI: 0.955~0.987)。如模型2所示,与未发生围术期低体温者相比,围术期体温36 ℃ AUC≥100 ℃·min与异体红细胞输注风险增加正相关(OR=2.24, 95%CI:1.09~4.58; P=0.028),ROC曲线下面积0.971(95%CI: 0.954~0.987)。两个模型的ROC曲线下面积均为0.971,提示在校正相同的混杂因素后围术期体温最低值和36 ℃ AUC对异体红细胞输注的预测性能相当。
表 2. The association between characteristics of perioperative hypothermia and allogeneic red blood cell transfusions by multivariable logistic regression models.
围术期低体温特征与异体红细胞输注的多因素 logistic回归模型
| Model 1* | Model 2† | |||||
| Variable | Adjusted OR (95% CI) | P | Variable | Adjusted OR (95% CI) | P | |
| * Model 1: AUC=0.971 (95% CI: 0.955-0.987); † Model 2: AUC=0.971 (95% CI: 0.954-0.987). OR: odds ratio; CI: confidence interval. | ||||||
| Temperature nadir | AUC at 36 ℃ | |||||
| ≥36 ℃ | 1.0 (Ref) | 0 ℃·min | 1.0 (Ref) | |||
| 35.5-35.9 ℃ | 0.99 (0.51-1.96) | 0.983 | 0.1-99.9 ℃·min | 1.07 (0.55-2.09) | 0.846 | |
| <35.5 ℃ | 2.47 (1.21-5.03) | 0.013 | ≥100.0 ℃·min | 2.24 (1.09-4.58) | 0.028 | |
| P for trend | 0.021 | P for trend | 0.020 | |||
| Hypersplenism | 2.87 (1.09-7.61) | 0.034 | Hypersplenism | 2.67 (1.01-7.01) | 0.047 | |
| Hemoglobin | 0.33 (0.25-0.44) | <0.001 | Hemoglobin | 0.33 (0.25-0.44) | <0.001 | |
| ASA score | 2.08 (1.17-3.71) | 0.013 | ASA score | 2.01 (1.12-3.60) | 0.018 | |
| Laparoscopy | 0.22 (0.10-0.52) | 0.001 | Laparoscopy | 0.23 (0.10-0.54) | 0.001 | |
| Duration of surgery | 1.39 (1.15-1.68) | 0.001 | Duration of surgery | 1.37 (1.14-1.66) | 0.001 | |
| Intraoperative blood loss | 2.21 (1.81-2.70) | <0.001 | Intraoperative blood loss | 2.19 (1.79-2.68) | <0.001 | |
3. 讨论
随着围术期医学[12]理念的发展,手术室麻醉与护理对患者的体温管理正逐步从术中向涵盖术前、术中、术后连续性全过程的监测与防护转变[13]。有研究发现,即使采取了保温措施,手术后24 h内低体温仍然是常见且持续的[14],患者术后出血和输血也常发生在24 h内[7]。因此,本研究将术后低温关注的时间窗从术中扩展至围术期,采用已验证精确度的可穿戴体温监测设备跟随患者全程移动,并借助医院信息平台建设围术期生命体征数据库,获取了从患者进入手术室到术后24 h的连续体温监测与输血记录,并进一步分析了围术期多种低体温特征与异体红细胞输注的关联性。
研究结果显示,在多种围术期低体温特征中,围术期体温的最低值和36 ℃ AUC与异体红细胞输注的关联有统计学意义。通过RCS曲线分析体温最低值与异体红细胞输注的剂量反应关系,取截点为35.5 ℃,多因素回归模型显示体温最低值<35.5 ℃显著增加围术期异体红细胞输注需求(OR=2.47, 95%CI: 1.21~5.03)。体外研究[15]报道,低于35.5 ℃的低温环境可损害血液样本中的凝血酶活性,延长外源性和内源性途径凝血时间。一项meta分析[16]显示即使轻微的低体温也会损害凝血功能,35.5 ℃的低体温可增加输血风险22%,本研究与上述结果相符。XU等[2]在meta分析中比较了当低体温分别定义为36 ℃、35.5 ℃、35 ℃时的不良事件,但三种温度阈值下消化道手术术中出血与正常体温组差异无统计学意义,可能与该研究亚组分析的样本量较小有关。
本研究在围术期低体温持续时间及其百分比与异体红细胞输注之间未观察到有统计学意义的关联性,但36 ℃ AUC>100 ℃·min与更高的异体红细胞输注需求相关(OR=2.24, 95%CI: 1.09~4.58)。AUC是体温低于36 ℃的幅度和持续时间的综合指标,更好地表征了患者暴露于低体温的严重程度。如先前报道,低体温改变凝血酶活性存在时间维度上的累积效应,进而导致凝血功能障碍[17]。结合本研究结果,提示凝血功能紊乱可能归因于低体温在较低水平(<35.5 ℃)持续的剂量累积,而低体温持续在轻度水平(例如35.5~36 ℃)可能不会增加输血风险。SUN等[5]则以术中体温在37 ℃以下的面积为指标,结果显示其与输血需求呈U型非线性关系,AUC小于0.25 ℃·h(OR=1.34, 95%CI: 1.04~1.73)或大于8 ℃·h(OR=1.41, 95%CI: 1.08~1.84)与红细胞输注量增加显著相关,提示除了低体温暴露外,若体温处于接近37 ℃的较高水平也可能增加输血风险。本研究同样发现围术期体温在37 ℃以下的面积与异体红细胞输注的U型曲线关系,但关联无统计学意义。
TWA温度被认为可以更好地衡量患者在手术期间的平均低体温暴露量[6]。有研究者推测,低体温对凝血功能的影响与持续时间密切相关,因此考虑TWA温度可能更有意义[18]。LEE等[7]也曾报道,术中TWA温度<36 ℃与非体外循环冠脉搭桥术患者红细胞输注需求增加有关(OR=1.49,95%CI:1.07~2.42)。但在本研究中围术期TWA温度与异体红细胞输注的关联无统计学意义,可能与本研究扩展TWA温度的计算时间至术后24 h有关。尽管本研究更充分地追踪了术后数小时内持续的低体温,但由于患者术后体温逐渐恢复提高了围术期TWA温度的平均值,缩小了不同个体围术期平均低体温暴露剂量的差异。在本研究中,AUC与TWA温度都是包含了时间维度的指标,但仅AUC与异体红细胞输注的关系有统计学意义,提示与围术期低体温平均暴露量相比,计算低体温的累积暴露量可能有助于更准确地预测输血风险。
尽管本研究预先认为体温从基线下跌的幅度可以更好地代表患者个体化的体温丢失量,但研究结果显示其与异体红细胞输注的相关性并不显著。分析可能的原因在于,麻醉后体温降低的主要机制是从核心到外周的热量重分布[1],在重分布热量相同的情况下,术前基线体温较高的患者有较多的热量储备,因此比基线体温低的患者更能耐受温度损失[19]。一项meta分析[16]结果显示,核心温度降低1 ℃显著增加失血量约20%,实际上该研究中,低体温患者与正常体温患者的体温中位数分别处于35.6 ℃与36.6 ℃。因此,对于基础温度较高的患者,即使存在较大的跌幅,但若核心体温并未跌落到35.6 ℃以下,影响凝血功能的可能性仍相对较小,因此围术期体温最大跌幅与输血风险的关联并不显著。
本研究的局限性在于,作为回顾性观察研究,仅分析了多种低体温特征与异体红细胞输注的相关性,而无法验证其因果关系。在研究对象方面,研究纳入了胆道、肝脏、胰腺等腹部手术人群,但其中胆道手术占比较高,未来可进一步增加其他类型的腹部手术。在结局指标方面,前期研究报道低体温也可能与术中出血量增加有关,但本研究数据来源于临床真实世界的医疗记录,术中出血量由医护人员主观评估,对出血量的记录可能不够精确,而输血有准确的医嘱和护理记录可以追踪,因此为确保结局指标的准确性,仅将围术期输注异体红细胞作为结局指标,未评估低体温与失血量的关系。在输血指征方面,本研究为单中心研究,对患者均统一按照我院外科手术输血指导原则及输血管理制度进行管理,但不同医疗组对输血指征的具体应用仍然可能存在轻微差异,可能有潜在的偏倚。未来可进一步通过设计更严格的前瞻性随机对照研究探索不同体温特征对凝血功能的影响。
综上,随着无创连续体温监测技术的进步,在低体温的评估中更多引入时间维度的信息,探索围术期体温变化的新规律、IPH的新定义,有助于指导为不同人群提供更加精准的体温管理。对于有凝血功能障碍或大出血倾向的患者,有必要采取相应的保温措施,提高术前热量储备、增高体温最低值、减少低体温的累积暴露量,以降低出血风险和异体红细胞输注需求。
* * *
作者贡献声明 刘雨薇负责论文构思、研究方法和初稿写作,梁诗琪负责数据审编和可视化,范美龄负责调查研究,龚仁蓉负责研究项目管理和审读与编辑写作,李卡负责提供资源和监督指导。所有作者已经同意将文章提交给本刊,且对将要发表的版本进行最终定稿,并同意对工作的所有方面负责。
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
四川省科技厅重点研发计划项目(No. 2021YFS0150和No. 2023YFS0066)资助
Contributor Information
雨薇 刘 (Yuwei LIU), Email: liuyuwei@wchscu.cn.
仁蓉 龚 (Renrong GONG), Email: gongrenrong@163.com.
卡 李 (Ka LI), Email: lika127@126.com.
References
- 1.SESSLER D I Mild periopaerative hypothermia. N Engl J Med. 1997;336(24):1730–1737. doi: 10.1056/NEJM199706123362407. [DOI] [PubMed] [Google Scholar]
- 2.XU H, WANG Z, GUAN X, et al Safety of intraoperative hypothermia for patients: meta-analyses of randomized controlled trials and observational studies. BMC Anesthesiol. 2020;20(1):202. doi: 10.1186/s12871-020-01065-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.SESSLER D I Temperature monitoring and perioperative thermoregulation. Anesthesiology. 2008;109(2):318–328. doi: 10.1097/ALN.0b013e31817f6d76. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.WHO Guidelines for Safe Surgery 2009: Safe surgery saves lives. Geneva: World Health Organization, 2009. https://pubmed.ncbi.nlm.nih.gov/23762968/.
- 5.SUN Z, HONAR H, SESSLER D I, et al Intraoperative core temperature patterns, transfusion requirement, and hospital duration in patients warmed with forced air. Anesthesiology. 2015;122(2):276–285. doi: 10.1097/aln.0000000000000551. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.WALTERS M J, TANIOS M, KOYUNCU O, et al Intraoperative core temperature and infectious complications after colorectal surgery: a registry analysis. J Clin Anesth. 2020;63:109758. doi: 10.1016/j.jclinane.2020.109758. [DOI] [PubMed] [Google Scholar]
- 7.LEE B R, SONG J W, KWAK Y L, et al The influence of hypothermia on transfusion requirement in patients who received clopidogrel in proximity to off-pump coronary bypass surgery. Yonsei Med J. 2014;55(1):224–231. doi: 10.3349/ymj.2014.55.1.224. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.PEI L, HUANG Y, MAO G, et al Axillary temperature, as recorded by the ithermonitor WT701, well represents core temperature in adults having noncardiac surgery. Anesth Analg. 2018;126(3):833–838. doi: 10.1213/ane.0000000000002706. [DOI] [PubMed] [Google Scholar]
- 9.LIU Y, LIU C, GAO M, et al Evaluation of a wearable wireless device with artificial intelligence, iThermonitor WT705, for continuous temperature monitoring for patients in surgical wards: a prospective comparative study. BMJ Open. 2020;10(11):e039474. doi: 10.1136/bmjopen-2020-039474. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.SESSLER D I Perioperative temperature monitoring. Anesthesiology. 2020;134(1):111–118. doi: 10.1097/aln.0000000000003481. [DOI] [PubMed] [Google Scholar]
- 11.Hypothermia: prevention and management in adults having surgery. London: National Institute for Health and Care Excellence (NICE), 2016. https://pubmed.ncbi.nlm.nih.gov/32134602/.
- 12.王天龙 推动麻醉学向围术期医学的转变. 北京医学. 2017;39(6):549–550. doi: 10.15932/j.0253-9713.2017.06.001. [DOI] [Google Scholar]
- 13.马正良, 易杰 围手术期患者低体温防治专家共识(2017) 协和医学杂志. 2017;8(6):352–358. doi: 10.3969/j.issn.1674-9081.2017.06.007. [DOI] [Google Scholar]
- 14.KARALAPILLAI D, STORY D, HART G K, et al Postoperative hypothermia and patient outcomes after major elective non-cardiac surgery. Anaesthesia. 2013;68(6):605–611. doi: 10.1111/anae.12129. [DOI] [PubMed] [Google Scholar]
- 15.NITSCHKE T, GROENE P, ACEVEDO A C, et al Coagulation under mild hypothermia assessed by thromboelastometry. Transfus Med Hemother. 2021;48(4):203–209. doi: 10.1159/000513922. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.RAJAGOPALAN S, MASCHA E, NA J, et al The effects of mild perioperative hypothermia on blood loss and transfusion requirement. Anesthesiology. 2008;108(1):71–77. doi: 10.1097/01.anes.0000296719.73450.52. [DOI] [PubMed] [Google Scholar]
- 17.LAU A, LOWLAAVAR N, COOKE E M, et al Effect of preoperative warming on intraoperative hypothermia: a randomized-controlled trial. Can J Anaesth. 2018;65(9):1029–1040. doi: 10.1007/s12630-018-1161-8. [DOI] [PubMed] [Google Scholar]
- 18.张震, 郭海云, 侯武刚, 等 围手术期低体温研究进展. 解放军医学杂志. 2023;48(4):476–481. doi: 10.11855/j.issn.0577-7402.2023.04.0476. [DOI] [Google Scholar]
- 19.HORN E P, BEIN B, BÖHM R, et al The effect of short time periods of pre-operative warming in the prevention of peri-operative hypothermia. Anaesthesia. 2012;67(6):612–617. doi: 10.1111/j.1365-2044.2012.07073.x. [DOI] [PubMed] [Google Scholar]


