Abstract
Classes de Recomendação
Classe I: Condições para as quais há evidências conclusivas e, na sua falta, consenso geral de que o procedimento é seguro e útil/eficaz.
Classe II: Condições para as quais há evidências conflitantes e/ou divergência de opinião sobre a segurança e utilidade/eficácia do procedimento.
Classe IIa: Peso ou evidência/opinião a favor do procedimento. A maioria aprova.
Classe IIb: Segurança e utilidade/eficácia menos estabelecidas, havendo opiniões divergentes.
Classe III: Condições para as quais há evidências e/ou consenso de que o procedimento não é útil/eficaz e, em alguns casos, pode ser prejudicial.
Níveis de Evidência
Nível A: Dados obtidos a partir de múltiplos estudos randomizados de bom porte, concordantes e/ou de metanálise robusta de estudos randomizados.
Nível B: Dados obtidos a partir de metanálise menos robusta, a partir de um único estudo randomizado e/ou de estudos observacionais.
Nível C: Dados obtidos de opiniões consensuais de especialistas.
| Diretriz Brasileira de Ergometria em Crianças e Adolescentes – 2024 | |
|---|---|
| O relatório abaixo lista as declarações de interesse conforme relatadas à SBC pelos especialistas durante o período de desenvolvimento deste posicionamento, 2023-2024. | |
| Especialista | Tipo de relacionamento com a indústria |
| Andréa Maria Gomes Marinho Falcão | Nada a ser declarado |
| Antonio Carlos Avanza Júnior | Nada a ser declarado |
| Carlos Alberto Cordeiro Hossri | Nada a ser declarado |
| Carlos Alberto Cyrillo Sellera | Nada a ser declarado |
| José Luiz Barros Pena | Nada a ser declarado |
| Luiz Eduardo Fonteles Ritt | Declaração financeira
A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: - Boehringer Lilly: Jardiance; Novonordis: pesquisador em estudos; AstraZeneca; Novartis; Bayer; Bristol; Pfizer. B - Financiamento de pesquisas sob sua responsabilidade direta/pessoal (direcionado ao departamento ou instituição) provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: - MDI Medical. Outros relacionamentos Financiamento de atividades de educação médica continuada, incluindo viagens, hospedagens e inscrições para congressos e cursos, provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: - Novo Nordisk: Ozempic |
| Maria Eulália Thebit Pfeiffer | Nada a ser declarado |
| Mauricio Milani | Nada a ser declarado |
| Odilon Gariglio Alvarenga de Freitas | Nada a ser declarado |
| Odwaldo Barbosa e Silva | Nada a ser declarado |
| Ricardo Vivacqua Cardoso Costa | Nada a ser declarado |
| Rodrigo Imada | Nada a ser declarado |
| Susimeire Buglia | Nada a ser declarado |
| Tales de Carvalho | Nada a ser declarado |
| William Azem Chalela | Nada a ser declarado |
Parte 1 – Indicações, Aspectos Legais e Formação em Ergometria
1. Introdução
O Teste Ergométrico ou Teste de Exercício (TE) é um exame médico complementar, no qual o indivíduo é submetido a um esforço físico programado e individualizado, com a finalidade de avaliar as respostas clínica, hemodinâmica, autonômica, eletrocardiográfica, metabólica indireta e eventualmente enzimática. Recebe a denominação de Teste Cardiopulmonar de Exercício (TCPE) quando são adicionados ao TE parâmetros ventilatórios e a análise dos gases no ar expirado. A denominação Ergometria contempla o TE e o TCPE. 1
Em crianças e adolescentes, o TE e o TCPE são métodos de avaliação diagnóstica, prognóstica e do desempenho cardiorrespiratório em diversas situações clínicas. São procedimentos considerados seguros e de custo-efetividade comprovada na população pediátrica. 1
No Brasil, as anomalias congênitas e as doenças cardiovasculares (DCV) representam nas crianças, respectivamente, a segunda e a nona causa de morte. Nos adolescentes, as DCV são a terceira maior causa de morte, e as anomalias congênitas são a oitava causa. Esses dados demonstram a importância do cuidado da saúde cardiovascular (CV) na população pediátrica. 2
O Ministério da Saúde do Brasil segue como definição de adolescência a prescrita pela Organização Mundial da Saúde (OMS), que caracteriza o período de vida entre 10 e 19 anos. Entretanto, a legislação brasileira considera como adolescente a pessoa que estiver na faixa etária entre 12 e 18 anos. Publicações científicas também adotam outras faixas etárias para crianças (1 a 13 anos) e adolescentes (13 a 18 anos). 3 – 5
Esta diretriz buscou consolidar as informações mais recentes das publicações científicas sobre TE/TCPE em crianças e adolescentes quanto às indicações, contraindicações, riscos, aspectos metodológicos, respostas hemodinâmicas e eletrocardiográficas, critérios diagnósticos e particularidades dos exames em doenças específicas na população pediátrica. Adicionalmente, foram abordadas as variáveis ventilatórias e metabólicas provindas da análise dos gases expirados no TCPE e, também, TE e TCPE associados a métodos de imagem.
Ao longo do documento, enfatizamos as particularidades dos exames considerando a faixa etária do paciente, sexo, composição corporal, níveis de aptidão física e estados de saúde CV e pulmonar basais. 6 – 12
A presente diretriz tem o potencial de se tornar forte referência e relevante fonte de consultas para os cardiologistas, visando à difusão do TE e do TCPE na perspectiva de aprimorar a saúde CV de crianças e adolescentes.
2. Indicações e Contraindicações do TE e do TCPE em Crianças e Adolescentes
2.1. Indicações Gerais do TE
O TE na população pediátrica é uma ferramenta que contribui para o diagnóstico e avaliação da repercussão de DCV (congênitas, genéticas e adquiridas), estratificação de risco, determinação de prognóstico, ajustes terapêuticos e liberação/prescrição de exercícios, inclusive na reabilitação cardiovascular (RCV).
As indicações e objetivos gerais do TE na população pediátrica são: 6 – 12
Avaliar sintomas relacionados ao esforço.
Avaliar o comportamento hemodinâmico [pressão arterial (PA), frequência cardíaca (FC), duplo-produto (DP), resistência arterial periférica etc.].
Identificar respostas anormais ao esforço em crianças e adolescentes com DCV congênitas e adquiridas (valvopatias, cardiomiopatias etc.), pulmonares ou de outros órgãos.
Detectar isquemia miocárdica decorrente de anomalias coronárias congênitas, ateromatose (muito rara) ou no contexto da doença de Kawasaki.
Reconhecer as arritmias cardíacas quanto ao tipo, densidade e complexidade.
Avaliar o comportamento da pré-excitação e canalopatias ao esforço.
Estabelecer o prognóstico em determinadas DCV, inclusive através de exames seriados.
Na indicação e ajustes terapêuticos.
Avaliar a condição aeróbica, a tolerância ao esforço e o condicionamento físico.
Fornecer subsídios para a liberação e prescrição de exercícios físicos, incluindo RCV e atividades esportivas.
2.2. Indicações do TE em Situações Clínicas Específicas
Apresentaremos as situações clínicas específicas nas quais o TE tem sua efetividade estudada e testada, permitindo determinar o grau de indicação e nível de recomendação estabelecidos na literatura.
2.2.1. Na Suspeita de Isquemia Miocárdica e Doença Arterial Coronariana
Em crianças e adolescentes, a isquemia miocárdica e doença arterial coronariana (DAC) apresentam etiologias diferentes das encontradas nos adultos. Nesse contexto, o TE apresenta reconhecida utilidade na investigação diagnóstica, no seguimento, em decisões terapêuticas e na estratificação de risco ( Tabela 1 ). 6 , 13 , 14
Tabela 1. Indicações do TE na suspeita de isquemia miocárdica e doença arterial coronariana em crianças e adolescentes.
| Indicação | GR | NE |
|---|---|---|
| Na doença de Kawasaki, para investigação de arritmias esforço-induzidas, avaliação funcional, quantificação de repercussão de lesões coronarianas, estratificação de risco e liberação para exercícios. 15 – 18 | I | B |
| Investigação de queixa de dor torácica anginosa típica. 6 , 13 , 14 , 19 , 20 | I | C |
| Avaliação de isquemia miocárdica residual e tolerância ao esforço após o tratamento cirúrgico para correção da transposição das grandes artérias. 21 – 23 | I | C |
| Após cirurgia em artéria coronária (operação de troca arterial, procedimento de Ross, substituição da aorta ascendente, correção da síndrome de Bland-White-Garland), para detecção de isquemia miocárdica e arritmias esforço-induzidas e liberação de exercícios incluindo RCV. 6 , 24 – 27 | IIa | B |
| Nas anomalias das artérias coronárias para triagem, investigação de isquemia esforço-induzida, indicação de correção cirúrgica e liberação para exercícios físicos. 28 , 29 | IIa | B |
| Avaliação da capacidade funcional e decisão terapêutica de paciente em que outro método tenha detectado isquemia miocárdica. 6 , 30 | IIb | B |
| Na ponte miocárdica, para investigação de sintomas e arritmias esforço-induzidas e estratificação de risco. 31 , 32 | IIb | B |
| Seguimento de pacientes com arterite de Takayasu ou lúpus eritematoso sistêmico, para investigação de doença arterial coronariana secundária. 33 , 34 | IIb | C |
| Diagnóstico de DAC em pacientes com BRE, WPW, ritmo de MP e terapêutica com digitálicos. | III | B |
| Investigação de dor torácica tipicamente não anginosa. 13 , 35 , 36 | III | B |
| Na doença de Kawasaki, TE sem outro método associado, para avaliação de isquemia miocárdica. 37 | III | C |
GR: grau de recomendação; NE: nível de evidência; RCV: reabilitação cardiovascular; DAC: doença arterial coronariana; BRE: bloqueio de ramo esquerdo; WPW: síndrome de Wolff-Parkinson-White; MP: marca-passo; TE: teste ergométrico.
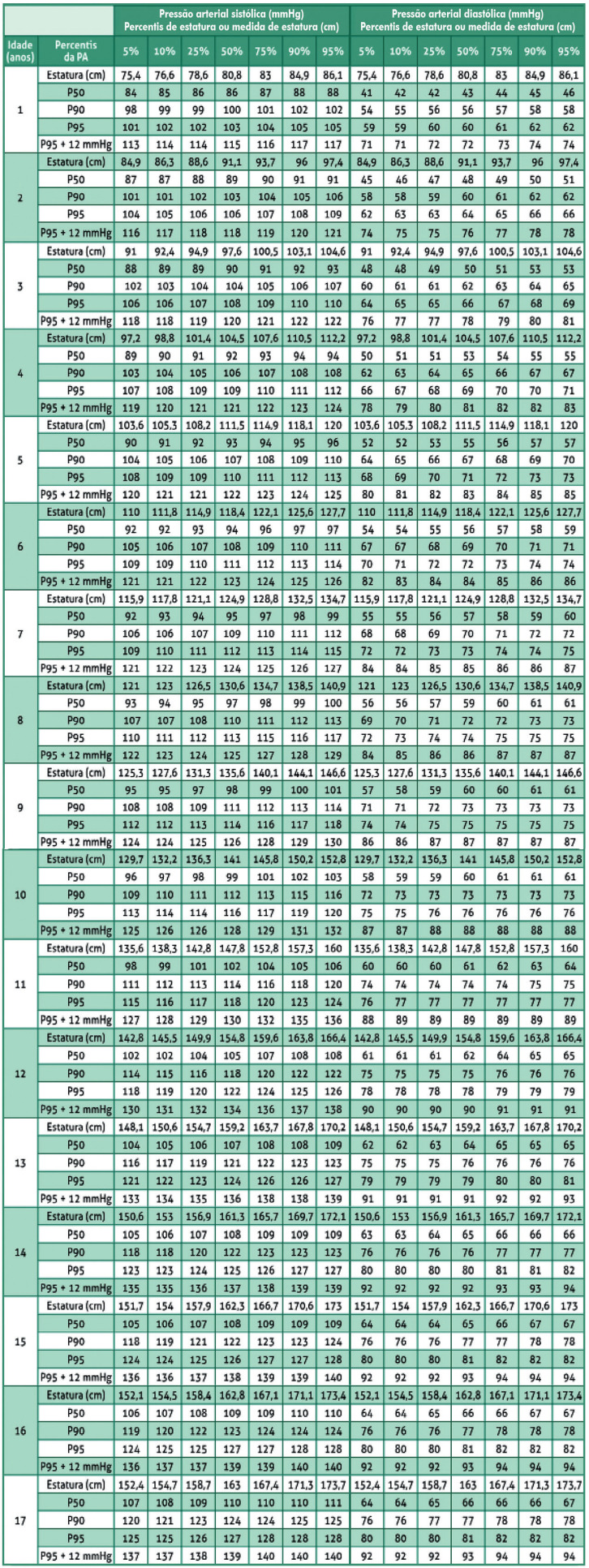
2.2.2. Indicações na Hipertensão Arterial Sistêmica
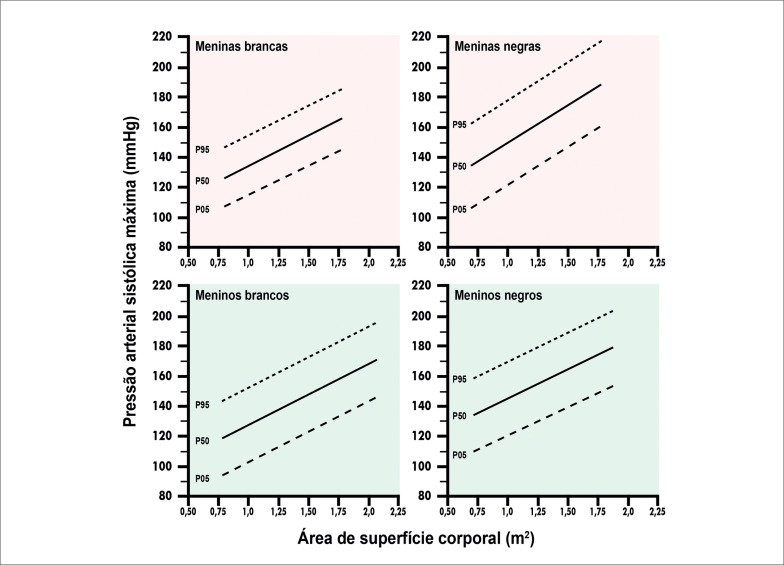
O TE permite a avaliação do comportamento pressórico ao esforço e diagnóstico de hipertensão arterial na população pediátrica, com e sem cardiopatia congênita (CC). O comportamento da pressão arterial (PA) durante o TE tem poder preditivo adicional às medidas esporádicas no consultório ( Tabela 2 ). 38
Tabela 2. Indicações do TE na hipertensão arterial sistêmica em crianças e adolescentes.
| Indicação | GR | NE |
|---|---|---|
| Avaliação do comportamento da PA ao esforço (com ou sem cardiopatia) para diagnóstico de HAS. 41 – 43 | I | C |
| Avaliação pré-participação de hipertensos para esporte competitivo. 44 , 45 | I | B |
| Suspeita de hipertensão do avental branco. 41 , 46 | IIa | B |
| Avaliação da resposta terapêutica e estratificação de risco em hipertensos. 4 , 47 , 48 | IIa | B |
| Após correção de coarctação da aorta, para avaliação do comportamento pressórico, índice tornozelo-braquial pós-esforço e estratificação de risco de hipertensão. * 8 , 49 – 51 | IIa | B |
| Suspeita de hipertensão mascarada em adolescente. 41 , 52 , 53 | IIa | C |
| Avaliação de pacientes com HAS descompensada. 11 | III | C |
GR: grau de recomendação; NE: nível de evidência; PA: pressão arterial; HAS: hipertensão arterial sistêmica.
Exame associado adicionalmente ao TE em esteira ergométrica com avaliação do índice tornozelo-braquial em repouso e pós-esforço.
A hipertensão na infância está relacionada ao risco elevado de DCV, aterosclerose, hipertrofia ventricular esquerda (HVE) e insuficiência renal no adulto. 39 , 40
2.2.3. Indicações em Assintomáticos
Estudos realizados nos últimos anos vêm elucidando o papel do TE na avaliação de pacientes pediátricos assintomáticos e em relação à sua utilidade na estratificação de risco e determinação prognóstica ( Tabela 3 ).
Tabela 3. Indicações do TE em crianças e adolescentes assintomáticos.
| Indicação | GR | NE |
|---|---|---|
| Triagem e acompanhamento nas hiperlipidemias genéticas e/ou presença de aterosclerose carotídea. 54 – 56 | IIa | B |
| História familiar de morte súbita inexplicada em indivíduos jovens. 57 , 58 | IIa | B |
| Assintomáticos com fatores de risco cardiometabólico na avaliação da aptidão cardiorrespiratória. * 59 – 61 | IIa | C |
| Assintomáticos, aparentemente saudáveis, em avaliação pré-participação de exercício físico como lazer e/ou esporte recreacional. 62 | III | C |
GR: grau de recomendação; NE: nível de evidência.
Vide estratificação de risco pré-TE (Parte 2, Sessão 2).
2.2.4. Indicações em Atletas
O TE em crianças e adolescentes atletas permite avaliar a aptidão cardiorrespiratória (ACR), o comportamento hemodinâmico e o diagnóstico/repercussão de eventuais DCV ( Tabela 4 ). 8 , 63 , 64
Tabela 4. Indicações do TE em crianças e adolescentes atletas.
| Indicação | GR | NE |
|---|---|---|
| Investigação de sintomas relacionados ao esforço. 8 , 64 | I | A |
| Doenças e condições de alto risco de morte súbita cardíaca. 64 – 66 | I | C |
| Diagnóstico e seguimento de asma esforço-induzida. 67 , 68 | IIa | B |
| Diagnóstico e seguimento de hipertensão arterial sistêmica. 44 , 53 , 69 | IIa | B |
| Diabetes tipo I para investigação de sintomas, avaliação da aptidão cardiorrespiratória e estratificação de risco. 70 – 72 | IIa | B |
| Diagnóstico e seguimento de cardiomiopatias. 73 , 74 | IIa | B |
| Avaliação pré-participação de esporte competitivo em assintomáticos, sem fatores de risco e aparentemente saudáveis. 8 | III | B |
GR: grau de recomendação; NE: nível de evidência.
2.2.5. Indicações nas Cardiopatias Congênitas
A prevalência mundial de CC varia entre 2,4 e 13,7 por 1.000 nascidos vivos, sendo que a maioria (85%) atinge a idade adulta. 75 , 76 Habitualmente, as crianças com CC, mesmo quando reparadas, são menos ativas fisicamente, inclusive por superproteção familiar. 77 , 78 Até 15 a 20% dos pacientes com CC apresentam algum comprometimento valvar, sendo as valvopatias isoladas aórtica (bicúspide, estenótica) e pulmonar as mais comuns. 79 – 81
O TE é recomendado para avaliação clínica, determinação da ACR, decisões terapêuticas, seguimento, estratificação de risco/prognóstico e liberação/prescrição de programas de exercícios, inclusive na RCV ( Tabela 5 ). 7 , 9 , 82 – 85
Tabela 5. Indicações do TE nas cardiopatias congênitas em crianças e adolescentes.
| Indicação | GR | NE |
|---|---|---|
| Avaliação da aptidão cardiorrespiratória e estratificação de risco/prognóstico na CC acianótica, pré e pós-operatório de cirurgia corretiva. 7 , 10 , 86 , 87 | IIa | B |
| Avaliação da aptidão cardiorrespiratória e estratificação de risco/prognóstico na CC cianótica após cirurgia corretiva. 7 , 86 , 87 | IIa | B |
| Avaliação do comportamento de arritmia e estratificação de risco. 82 , 83 , 88 | IIa | B |
| Prescrição e adequação de programa de exercícios, incluindo programa de reabilitação cardiovascular. 89 , 90 | IIa | B |
| Após cirurgia de Fontan, para avaliação da aptidão cardiorrespiratória e estratificação de risco/prognóstico. 84 , 91 , 92 | IIa | B |
| IC compensada após tratamento intervencionista para ajustes terapêuticos, estratificação de risco/prognóstico e liberação/prescrição de reabilitação cardiovascular. 93 , 94 | IIa | B |
| Avaliação de sintomas desencadeados ou agravados pelo esforço. 95 , 96 | IIa | C |
| Em assintomáticos, após reparo de tetralogia de Fallot, para avaliação de eventual substituição da valva pulmonar. 97 , 98 | IIb | B |
| Na tetralogia de Fallot reparada, para estratificação de risco/prognóstico. 99 , 100 | IIb | B |
| Na transposição corrigida das grandes artérias, para avaliação da aptidão cardiorrespiratória e estratificação de risco/prognóstico. 101 , 102 | IIb | B |
| Na doença de Fabry, para avaliação da aptidão cardiorrespiratória. 103 , 104 | IIb | B |
| Avaliação do grau de dessaturação com o esforço na CC cianótica clinicamente estável. * 7 | IIb | B |
| CC com IC descompensada. | III | C |
| CC cianótica descompensada. | III | C |
GR: grau de recomendação; NE: nível de evidência; CC: cardiopatia congênita; IC: insuficiência cardíaca.
Recomenda-se realizar exame adicional de monitorização oximétrica não invasiva concomitantemente ao TE.
2.2.6. Indicações no Contexto das Arritmias e Distúrbios de Condução
O TE está indicado no contexto das arritmias e distúrbios de condução em crianças e adolescentes para a avaliação de sintomas, diagnóstico de arritmias, definição de condutas terapêuticas, estratificação de risco e prescrição de exercícios físicos ( Tabela 6 ). 9 , 11 , 105 – 109
Tabela 6. Indicações do TE no contexto das arritmias e distúrbios de condução em crianças e adolescentes.
| Indicação | GR | NE |
|---|---|---|
| Palpitação, síncope, pré-sincope, equivalente sincopal, mal-estar indefinido ou palidez relacionada ao esforço físico e/ou imediatamente após. 105 , 110 , 111 | I | B |
| Na suspeita de taquicardia ventricular paroxística catecolaminérgica. 112 , 113 | I | B |
| No BAVT congênito, para avaliação da resposta ventricular e consequente indicação de implante de marca-passo. 114 , 115 | I | B |
| No BAVT congênito, para escolha do tipo de marca-passo através da avaliação da resposta da frequência atrial. 116 , 117 | I | C |
| Avaliação e diagnóstico de disfunção do nó sinusal secundária a CC ou após correção cirúrgica. 118 , 119 | IIa | B |
| Eficácia da terapêutica farmacológica e/ou ablação de arritmia. 7 , 120 , 121 | IIa | B |
| Arritmia conhecida e controlada, para liberação e prescrição de exercícios físicos (incluindo reabilitação cardiovascular). 122 , 123 | IIa | B |
| Na síndrome do QT longo, para confirmação diagnóstica, estratificação de risco, avaliação de potencial arritmogênico e ajustes terapêuticos. 57 , 109 , 124 | IIa | B |
| Na suspeita de síndrome de Brugada, para auxílio diagnóstico e estratificação de risco. 125 – 127 | IIa | B |
| Avaliação da resposta da frequência cardíaca em portador de marca-passo com biossensor. 7 , 116 , 120 , 128 | IIa | C |
| Avaliação do comportamento de via anômala (pré-excitação) e do potencial arritmogênico. 7 , 120 , 121 | IIb | B |
| Portador de marca-passo de frequência fixa. | III | B |
| BAVT não congênito. | III | B |
| Avaliação de extrassístoles atriais e/ou ventriculares isoladas em crianças e adolescentes aparentemente saudáveis, sem comorbidades ou queixas. 7 , 120 , 129 | III | C |
| Arritmia não controlada, sintomática ou com comprometimento hemodinâmico. | III | C |
GR: grau de recomendação; NE: nível de evidência; BAVT: bloqueio atrioventricular total; CC: cardiopatia congênita.
2.2.7. Indicações em Valvopatias nas Crianças e Adolescentes
As valvopatias representam importante porcentagem das doenças cardíacas na população pediátrica, seja de origem congênita ou adquirida. A doença cardíaca reumática (DCR) e seu comprometimento valvar é uma das principais causas de morbidade e mortalidade cardíaca entre crianças nos países subdesenvolvidos e em desenvolvimento. Em 2019, cerca de 40 milhões de casos de DCR foram relatados em todo o mundo, com 2.789.443 novos casos e 305.651 mortes anualmente. 130 , 131
A valvopatia pode gerar distúrbios hemodinâmicos dependendo do grau de acometimento valvar e miocárdico. As lesões estenóticas geralmente cursam com sobrecarga de pressão da câmara cardíaca envolvida, enquanto as lesões regurgitantes acarretam sobrecarga de volume. Muitas lesões são mistas, resultando em sobrecarga de pressão e volume, com potencial para desenvolvimento de insuficiência cardíaca (IC). Também é comum a ocorrência de valvopatias secundárias à cardiomiopatias adquiridas, miocardites e IC. Evolutivamente, o aumento do estresse da parede ventricular causa estiramento e fibrose miocárdica, resultando em cicatrizes com potencial arritmogênico. As arritmias podem complicar o quadro clínico da valvopatia e aumentar a morbimortalidade nas crianças e adolescentes. 132 – 134
A Tabela 7 apresenta as indicações do TE em valvopatias específicas em crianças e adolescentes e os respectivos graus de recomendação.
Tabela 7. Indicações do TE em valvopatias nas crianças e adolescentes.
| Indicação | GR | NE |
|---|---|---|
| Em valvopatia discreta/moderada para avaliação de sintomas, arritmias, aptidão cardiorrespiratória e liberação de exercícios físicos. 81 , 135 | I | B |
| EAo, EAo supravalvular e estenose subaórtica, para avaliação de sintomas, na estratificação de risco e definição de intervenção. 81 , 134 , 136 | IIa | B |
| IAo compensada, moderada a grave, para avaliação de sintomas e aptidão cardiorrespiratória, indicação de intervenção e liberação de exercícios. 137 , 138 | IIa | B |
| Valva aórtica bicúspide, para avaliação da resposta inotrópica e estratificação de risco. 62 , 139 | IIa | B |
| Pós-intervenção valvar, para avaliação de sintomas, aptidão cardiorrespiratória, prognóstico e liberação de exercícios. 140 , 141 | IIa | B |
| EAo ou mitral grave sintomática, para avaliação da aptidão cardiorrespiratória. | III | B |
GR: grau de recomendação; NE: nível de evidência; IAo: insuficiência aórtica; EAo: estenose aórtica.
2.2.8. Indicações em Crianças e Adolescentes com Cardiopatias Adquiridas e Cardiomiopatias
As cardiomiopatias em crianças abrangem uma ampla gama de doenças que se manifestam como doença primária ou secundária a doenças sistêmicas (exemplos: distúrbio neuromuscular, secundária a HIV e COVID-19). 142 – 144
As cardiomiopatias têm incidência anual estimada de 1,1 a 1,5 casos por 100.000 pacientes da faixa etária de 0 a 18 anos. 145 Podem cursar com IC sistólica e/ou diastólica progressivas. A IC afeta 0,87 a 7,4 por 100.000 crianças e tem uma mortalidade em 5 anos de 40%. 146 Nesses pacientes e nos recuperados de miocardites, o TE é indicado no acompanhamento clínico, decisões terapêuticas e prescrição/adequação de programa de exercícios ( Tabela 8 ). 6 , 143 , 147 , 148
Tabela 8. Indicações do TE em crianças e adolescentes com cardiopatias adquiridas e cardiomiopatias.
| Indicação | GR | NE |
|---|---|---|
| Jovens recuperados de miocardite (incluindo viral), após 6 meses, para avaliação de arritmias esforço-induzidas. 62 , 149 , 150 | IIa | B |
| IC compensada secundária a cardiopatia para avaliação prognóstica, ajustes terapêuticos e liberação/prescrição de exercícios (incluindo reabilitação cardiovascular). 151 – 153 | IIa | B |
| Cardiomiopatia hipertrófica, para avaliação da aptidão cardiorrespiratória e de marcadores prognósticos (sintomas, arritmia ventricular e resposta inotrópica). 154 – 157 | IIa | B |
| Nas cardiomiopatias compensadas (exemplos: doença de Chagas e amiloidose), para seguimento e ajustes terapêuticos. 158 , 159 | IIb | B |
| Após transplante cardíaco, para avaliação da aptidão cardiorrespiratória, liberação/prescrição de programa de exercícios (incluindo reabilitação cardiovascular). 160 , 161 | IIb | B |
| Miocardite e pericardite agudas ou IC descompensada. | III | B |
| Diagnóstico de insuficiência cardíaca. | III | C |
| Seleção para transplante cardíaco pelo TE (com base nos valores de VO2 estimados e não medidos). | III | C |
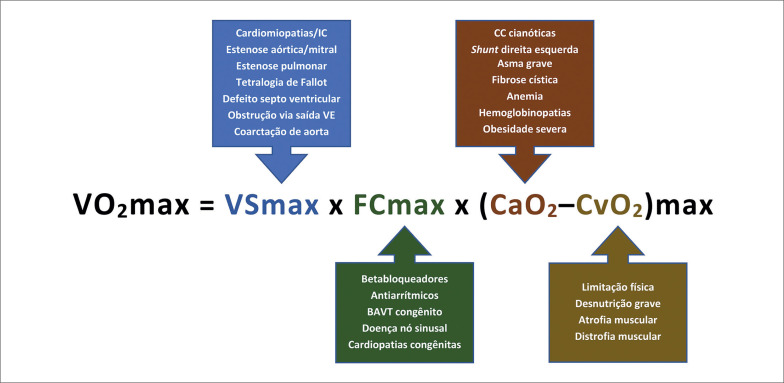
GR: grau de recomendação; NE: nível de evidência; IC: insuficiência cardíaca; VO2: consumo de oxigênio; TE: teste ergométrico.
2.2.9. Outras Situações Clínicas em Crianças e Adolescentes
Há outras situações clínicas em que o TE está indicado no diagnóstico, avaliar a ACR e o estado hemodinâmico, auxiliar nas decisões terapêuticas e estratificar o risco em doenças específicas ( Tabela 9 ).
Tabela 9. Indicações do TE em outras situações clínicas de crianças e adolescentes.
| Indicação | GR | NE |
|---|---|---|
| Na suspeita de asma e obstrução laríngea esforço-induzidas e adequação de programa de exercícios. 162 – 164 | IIa | B |
| Após pelo menos 6 meses de miocardite ou pericardite recuperadas (incluindo por COVID-19), para avaliação pré-participação/liberação de prática de esportes. 150 , 165 , 166 | IIa | B |
| Anemia falciforme, para esclarecimento de sintomas, avaliar a aptidão cardiorrespiratória e liberar/prescrever exercícios físicos. 167 , 168 | IIa | C |
| Na hipertensão arterial pulmonar primária, para avaliação de sintomas, aptidão cardiorrespiratória e estratificação de risco/prognóstico. 169 , 170 | IIb | B |
| Pacientes em hemodiálise e pós-transplante renal, para prescrição e adequação de programa de exercícios (incluindo reabilitação cardiovascular). 171 – 173 | IIb | B |
| Avaliação de risco e prognóstico em pacientes oncológicos com suspeita de cardiotoxicidade. 104 , 174 , 175 | IIb | B |
| Após pelo menos 6 meses de recuperação de síndrome inflamatória multissistêmica (incluindo miocardite e pericardite) secundária a COVID-19. 150 , 165 | IIb | C |
GR: grau de recomendação; NE: nível de evidência.
2.3. Indicações do TCPE nas Crianças e Adolescentes
O TCPE, além das informações obtidas no TE, possibilita a avaliação dos volumes pulmonares (ergoespirometria) e a análise dos gases no ar expirado com a mensuração direta do consumo de oxigênio (VO2) e produção de dióxido de carbono (VCO2). 100 , 176 , 177 Dessa forma, o TCPE pode ajudar a identificar a fisiopatologia da dispneia inexplicável, identificar características fisiopatológicas específicas de doenças e fornecer informações relevantes para decisões terapêuticas. 11 , 178
Temos como indicações gerais do TCPE em crianças e adolescentes: 100 , 176 – 178
Todas as indicações do TE descritas nesta diretriz em que seja necessária a quantificação das variáveis ventilatórias e metabólicas de maneira direta.
Aprimoramento da avaliação de sinais e/ou sintomas cardiorrespiratórios esforço-induzidos (dispneia, estridor laríngeo, sibilos etc.).
Avaliação aprimorada de doenças cardíacas (CC, valvopatias, IC, cardiomiopatias, arritmias), pulmonares e de outros órgãos (anemia falciforme, insuficiência renal, doenças neurodegenerativas etc.).
Contribuição para indicação e seguimento de tratamentos cirúrgicos específicos.
Avaliação da eficácia e ajustes terapêuticos.
Avaliação da ACR na indicação de transplante cardíaco.
Avaliação pré-participação e seguimento no esporte competitivo.
Avaliação prognóstica nas doenças cardiovasculares, pulmonares e em outros órgãos.
Pré-participação e seguimento na RCV.
As indicações específicas do TCPE e respectivos graus de recomendação e nível de evidência encontram-se na Tabela 10 .
Tabela 10. Principais indicações específicas para TCPE em crianças e adolescentes.
| Indicação | GR | NE |
|---|---|---|
| Avaliação de aptidão cardiorrespiratória. 176 , 179 | I | A |
| Ajuste de intensidade de treinamento aeróbico em esporte competitivo. 63 , 149 , 177 , 180 , 181 | I | A |
| Liberação e prescrição de exercícios em programa de reabilitação cardiovascular. 141 , 182 – 184 | I | A |
| Seleção de candidatos ao transplante cardíaco. * 185 , 186 | I | A |
| Avaliação de dispneia ou asma esforço-induzidas. 178 , 179 , 187 , 188 | I | B |
| CC cianótica. ** 81 , 100 , 189 | I | B |
| Seguimento após transplante cardíaco. ** 190 – 192 | I | B |
| Doença de Kawasaki e arterite de Takayasu estabilizadas, para avaliação da aptidão cardiorrespiratória e liberação/prescrição de exercícios, incluindo reabilitação cardiovascular. 15 , 17 , 18 , 193 | I | C |
| Lesões assintomáticas de shunt direita-esquerda. ** 184 , 194 , 195 | IIa | A |
| Hipertensão arterial pulmonar. ** 169 , 196 – 198 | IIa | A |
| Lesões valvares regurgitantes moderadas a graves assintomática. ** 81 , 199 , 200 | IIa | B |
| Estenose aórtica grave assintomática. ** 81 , 199 , 200 | IIa | B |
| Fibrose cística, para avaliação da aptidão cardiorrespiratória e prognóstico. 67 , 201 , 202 | IIa | B |
| Doenças neuromusculares (esclerose múltipla, distrofia muscular de Becker e de Duchenne), para avaliação da aptidão cardiorrespiratória e prescrição de exercícios na reabilitação. 203 – 206 | IIa | B |
| Cardiomiopatia hipertrófica obstrutiva moderada assintomática. ** 207 – 209 | IIa | B |
| Avaliação de pacientes em tratamento oncológico na suspeita de cardiotoxicidade, estratificação de risco e liberação/prescrição de exercícios. 104 , 174 , 175 , 210 | IIa | B |
| Lesões obstrutivas leves a moderadas do coração direito. ** 81 , 199 , 211 | IIb | B |
| Após correção cirúrgica de CC, assintomática, estável hemodinamicamente. ** 212 , 213 | IIb | B |
GR: grau de recomendação; NE: nível de evidência; CC: cardiopatia congênita.
Em indivíduos com idade, tamanho corporal, capacidade de compreensão e adaptação/colaboração imprescindíveis à correta realização do exame.
Para avaliação da aptidão cardiorrespiratória, decisões terapêuticas e prognóstico.
2.4. Indicações do TE e TCPE Associados a Métodos de Imagem
2.4.1. Cintilografia de Perfusão Miocárdica
A cintilografia de perfusão miocárdica na população pediátrica tem seu papel estabelecido na avaliação de perfusão/viabilidade miocárdica e função ventricular. Pode ser útil na identificação de isquemia induzível ou residual, anormalidade do movimento de parede ventricular e estratificação de risco ( Tabela 11 ).
Tabela 11. Indicações da cintilografia miocárdica em crianças e adolescentes.
| Indicação | GR | NE |
|---|---|---|
| Avaliação tardia da doença de Kawasaki com comprometimento coronariano (com ou sem sintomas). 18 , 214 – 217 | I | C |
| Seguimento pós-operatório da transposição das grandes artérias, para pesquisa de isquemia miocárdica, estratificação de risco e indicação de reintervenção. 22 , 214 , 220 – 222 | IIa | B |
| Avaliação tardia da doença de Kawasaki sem comprometimento coronariano. 18 , 30 , 214 , 218 , 219 | IIb | B |
| Cardiomiopatia hipertrófica, para pesquisa de isquemia, estratificação de risco e manejo terapêutico. 214 , 223 | IIb | B |
| Pós-transplante cardíaco, para avaliação de doença vascular do enxerto. 214 , 224 , 225 | IIb | C |
| Na tetralogia de Fallot, após cirurgia de Fontan, para identificação de isquemia residual. 225 , 226 | IIb | C |
| Identificação de isquemia/fibrose miocárdica em pacientes com origem anômala da artéria coronária esquerda (origem na artéria pulmonar). 225 , 227 , 228 | IIb | C |
GR: grau de recomendação; NE: nível de evidência.
2.4.2. Indicações da Ecocardiografia sob Estresse
Na população pediátrica, a ecocardiografia sob estresse (EcoE) é mais comumente utilizada para a detecção de isquemia em pacientes com DAC, na doença de Kawasaki e origem anômala de coronárias. Outras indicações pediátricas incluem: pós-transplante cardíaco; cardiopatias congênitas para avaliação da resposta hemodinâmica e miocárdica; detecção precoce de disfunção miocárdica em populações específicas (exemplo: uso de antraciclinas); avaliação da resposta funcional do ventrículo direito (VD) e pressão da artéria pulmonar ( Tabela 12 ). 229 – 233
Tabela 12. Indicações do ecocardiograma sob estresse em crianças e adolescentes com sintomas ou DCV 234 , 235 .
| Indicação | GR | NE |
|---|---|---|
| Pesquisa de insuficiência coronária em crianças pós-transplante cardíaco tardio. 160 , 236 – 238 | IIa | B |
| Avaliação tardia da doença de Kawasaki com comprometimento coronariano. 239 , 240 | IIa | B |
| No pós-operatório de cirurgia de Jatene, de origem e trajetos anormais das artérias coronárias e de fístulas coronário-cavitárias. 241 , 242 | IIa | B |
| Avaliação da função ventricular nas cardiomiopatias e nas insuficiências valvares (mitral e aórtica). 229 , 232 , 243 | IIa | B |
| Pacientes oncológicos com suspeita de cardiotoxicidade, para avaliação da função ventricular. 233 , 244 , 245 | IIa | B |
| Avaliação da função ventricular no pós-transplante. 160 , 237 , 238 , 246 | IIa | B |
| Pacientes sob risco de doença coronariana aterosclerótica precoce (hipercolesterolemia familiar homozigótica, diabetes mellitus I etc.). 247 , 248 | IIb | B |
| Pesquisa de insuficiência coronária na atresia pulmonar com septo ventricular íntegro ou estenose aórtica supravalvar. 229 , 249 | IIb | B |
| Avaliação do gradiente de pressão na cardiomiopatia hipertrófica e nas estenoses valvares (pulmonar e aórtica). 229 , 231 , 250 , 251 | IIb | B |
| Avaliação pós-operatória de cirurgias em plano atrial para transposição dos grandes vasos e de correção da tetralogia de Fallot. 222 , 252 , 253 | IIb | B |
GR: grau de recomendação; NE: nível de evidência.
2.5. Contraindicações Relativas e Absolutas do TE e TCPE em Crianças e Adolescentes
O TE/TCPE em população pediátrica não é um exame isento de riscos de complicações ou eventos adversos. Em algumas situações clínicas, o risco dos exames atinge uma magnitude que supera o benefício das informações obtidas, contraindicando-os. O TE em população pediátrica tem baixa morbidade e mortalidade, sendo que a incidência geral de complicações varia entre 0,5 e 1,79%. 7 , 11 , 254 , 255 As complicações mais frequentes: dor torácica (0,69%), tontura ou síncope (0,29%), hipotensão (0,35%) e arritmias graves (0,46%). 254 Em crianças e adolescentes com CC, a incidência de taquicardia ventricular (TV) variou de 1,9 a 7,3%. 256 , 257
2.5.1. Contraindicações Relativas do TE e TCPE em Crianças e Adolescentes
São situações clínicas de alto-risco ( Quadro 1 ) para a execução do TE/TCPE em população pediátrica e exigem a realização do exame em ambiente hospitalar (com pediatra emergencista de retaguarda) e adoção de cuidados especiais. Esses cuidados incluem: adequação de protocolos e carga de esforço a ser atingida; monitorização da saturação de oxigênio (oximetria); presença de pessoal e equipamento para possível reprogramação de marca-passo (MP)/cardioversor-desfibrilador implantável (CDI); etc. 6 – 11
Quadro 1. Contraindicações relativas e precauções na realização do TE e TCPE em crianças e adolescentes 1 , 6 – 11 .
| Ambiente hospitalar + cuidados especiais |
|---|
| Estenoses valvares graves em assintomáticos * |
| Insuficiências valvares graves em assintomáticos * |
| Cardiopatias congênitas complexas (cianóticas ou acianóticas) |
| Hipertensão pulmonar moderada/grave |
| Síndromes arrítmicas genéticas (QT longo, taquicardia catecolaminérgica e síndrome de Brudaga) documentadas |
| Suspeita de arritmias complexas (taquiarritmias e bradiarritmias) |
| Síncope por provável etiologia arritmogênica ou suspeita de bloqueio atrioventricular de alto grau esforço-induzido |
| Cardiomiopatia arritmogênica de ventrículo direito ** 258 , 259 |
| Marca-passo e CDI |
| Cardiomiopatia dilatada/restritiva com IC ou arritmia, quando estáveis clinicamente |
| Cardiomiopatia hipertrófica obstrutiva assintomática, com gradiente de repouso grave * |
| Obstrução grave da via de saída do ventrículo direito ou ventrículo esquerdo, quando assintomáticas * |
| Insuficiência cardíaca congestiva estável (Classe II ou III da NYHA) |
| TCPE na seleção de candidatos ao transplante cardíaco |
| Insuficiência renal dialítica |
| Suspeita de obstrução grave das vias aéreas * |
| SpO2 >85% em repouso, em ar ambiente, em uso de oxigênio suplementar * |
NYHA: New York Heart Association; CDI: cardioversor-desfibrilador implantável; IC: insuficiência cardíaca; TCPE: teste cardiopulmonar de exercício; SpO2: saturação arterial de oxigênio.
Situação onde o risco/benefício do exame deverá ser criteriosamente avaliada.
Na suspeita e/ou para confirmação diagnóstica e investigação do desaparecimento da arritmia ventricular.
2.5.2. Contraindicações Absolutas do TE e TCPE em Crianças e Adolescentes
As situações apresentadas no Quadro 2 são consideradas contraindicações absolutas, não devendo ser realizado o TE/TCPE em crianças e adolescentes. 7 , 9 , 11 , 105 , 181 , 188 , 260
Quadro 2. Contraindicações absolutas do TE e TCPE em crianças e adolescentes 1 , 7 , 9 , 11 , 105 , 181 , 188 , 260 .
| Contraindicações absolutas |
|---|
| Enfermidade aguda, febril ou grave |
| Deficiência mental ou física com incapacidade de se exercitar adequadamente |
| Intoxicação medicamentosa |
| Deslocamento recente de retina, em fase de recuperação |
| Distúrbios hidroeletrolíticos e metabólicos não corrigidos |
| Hipertireoidismo descontrolado |
| Diabetes mellitus descompensada |
| Estenoses valvares graves sintomáticas |
| Insuficiências valvares graves sintomáticas |
| Cardiopatia congênita descompensada |
| Insuficiência cardíaca descompensada |
| Infarto do miocárdio recente |
| Embolia pulmonar aguda ou infarto pulmonar * |
| Febre reumática ativa, com ou sem cardite |
| Miocardite, pericardite ou endocardite agudas |
| Doença de Kawasaki na fase aguda |
| Arritmia cardíaca não controlada |
| Síndrome de Marfan com suspeita de dissecção aórtica |
| Aneurisma de aorta ou em outras artérias com indicação de intervenção |
| Hipertensão arterial sistêmica grave não controlada |
| Cardiomiopatia hipertrófica com história de síncope e/ou arritmia complexa |
| Estágio final de fibrose cística |
| Marca-passo unicameral, ventricular, sem resposta de frequência (VVI) |
| SpO2 ≤85% em repouso, em ar ambiente, com ou sem uso de oxigênio suplementar |
SpO2: saturação arterial de oxigênio.
Recente ou na fase crônica com grande repercussão clínica/hemodinâmica.
3. Aspectos Legais da Prática do TE e TCPE em Crianças e Adolescentes
Além dos aspectos legais e éticos do TE e TCPE já apresentados na Diretriz Brasileira de Ergometria para população adulta, devem ser considerados os aspectos específicos para a população pediátrica descritos a seguir. 1
3.1. Aspectos Legais da Prática do TE e TCPE
O TE e o TCPE são métodos não invasivos, com baixo risco de complicações em populações não selecionadas, fácil acessibilidade e reprodutibilidade. Por se tratarem de ato médico, são regidos pelo Código de Ética Médica e, assim, o médico deve conhecer as possíveis implicações éticas e jurídicas devidamente abordadas no próprio Código de Ética Médica do Conselho Federal de Medicina (CFM), Código Civil Brasileiro, Código de Proteção ao Consumidor e demais leis vigentes ( Anexo 1 ). 261 – 264
3.2. Condições Imprescindíveis à Realização do TE e TCPE em Crianças e Adolescentes
Baseado no exposto, são necessárias adoções de condições imprescindíveis às crianças e aos adolescentes:
O TE e o TCPE são atos médicos, de exclusiva competência do médico habilitado, inscrito no Conselho Regional de Medicina e apto ao exercício profissional. O Departamento de Ergometria, Exercício, Cardiologia Nuclear e Reabilitação Cardiovascular da Sociedade Brasileira de Cardiologia (DERC/SBC) recomenda que o médico possua Título de Especialista em Cardiologia e Título de Atuação em Ergometria da Associação Médica Brasileira (AMB) devidamente registrados no CFM e tenha realizado treinamento em TE/TCPE em população pediátrica.
Em se tratando de exame com potencial risco de complicações (que embora raras, inclui morte), quando realizado em menores de idade ou legalmente incapazes, recomenda-se que um dos pais ou seu representante legal permaneça na sala de exame. O médico executante deve reconhecer o adolescente, entre 12 e 18 anos de idade, como indivíduo possivelmente capaz e atendê-lo de forma diferenciada, respeitando sua individualidade, mantendo uma postura centrada na orientação e participação do adolescente.
É obrigatória a obtenção prévia de termo de consentimento livre e esclarecido (TCLE) assinado por um dos pais ou responsável legal. No exame em adolescente, recomenda-se que o mesmo seja incluído no processo de decisão, de forma a obter sua concordância na realização do exame dando seu assentimento livre e esclarecido (ALE). Caso haja recusa na assinatura do TCLE e/ou do ALE, o médico executante não poderá realizar o exame. Quando se tratar de pesquisa científica, tanto o TCLE quanto o ALE são obrigatórios. O termo assentimento é empregado para diferenciá-lo do consentimento, que é fornecido por pessoas adultas e totalmente capazes para tomar decisões.
O local destinado à realização dos exames deve dispor dos equipamentos adaptados à população pediátrica, bem como de equipamentos/medicamentos essenciais para o atendimento de emergências nessa população, conforme recomenda esta diretriz. 265 – 268
O médico executante deverá seguir expressamente as recomendações das autoridades públicas e sanitárias e das entidades médicas referentes às possíveis endemias, epidemias e pandemias, assim como as normas dos núcleos de segurança do paciente. 269 – 271
Todos os procedimentos pertinentes ao TE e TCPE descritos nesta diretriz devem ser observados e cumpridos.
O TE e o TCPE somente devem ser realizados com a solicitação formal médica.
Avaliar a presença de contraindicações relativas e absolutas para a realização do exame.
Na eventualidade de eventos adversos de natureza grave decorrentes do exame, o médico executante assumirá o suporte ao paciente até contato efetivo com o médico assistente e/ou eventual encaminhamento ao serviço de emergência. Sugere-se, em casos de evento fatal, a comunicação e solicitação de parecer da comissão de ética e do Conselho Regional de Medicina.
Orientar os pais/responsável legal a retornar ao médico solicitante para as devidas condutas. Caso seja arguido pelo paciente, pais ou seu representante legal sobre o resultado do exame, o médico executante deverá prestar as informações pertinentes.
A remuneração pelo exame realizado deve contemplar honorários médicos justos e todos os custos operacionais.
A realização de TE e/ou TCPE envolve a obtenção e o tratamento de dados sensíveis dos pacientes, devendo os serviços de ergometria respeitarem a Lei Geral de Proteção de Dados (LGPD) e legislações do CFM. 272 – 274
3.3. Termo de Consentimento e de Assentimento para o TE e TCPE em Crianças e Adolescentes
O modelo e o processo de obtenção de TCLE para a realização de TE e TCPE devem observar os critérios norteadores do Código de Ética Médica e Recomendação do CFM N° 1/2016, assinado por um dos pais ou pelo representante legal. 275 No caso de adolescentes, é também recomendada a obtenção do ALE.
4. Condições Imprescindíveis à Capacitação em TE/TCPE em População Pediátrica
O TE/TCPE na população pediátrica é diferente dos exames realizados em adultos devido à prevalência específica de DCV (incluindo cardiopatias congênitas), às adequações de protocolos e parâmetros necessários aos exames, bem como às particularidades envolvidas na interpretação, no diagnóstico e definição de prognóstico.
Recomenda-se que os cardiologistas passem por capacitação/treinamento específico em TE/TCPE em população pediátrica: 276 , 277
O treinamento poderá ocorrer durante (simultâneo) ou após a formação na área de atuação em ergometria (consultar a Parte 1, Sessão 4 da Diretriz Brasileira de Ergometria em População Adulta), de maneira adicional e complementar, incorporando as cargas horárias e os requisitos abaixo descritos. Esse treinamento não substitui a formação na área de atuação em ergometria, não confere titulação adicional e não cria nova área de atuação. 1
O treinamento deverá ocorrer em instituição com serviço de ergometria atuante na população pediátrica, legalmente constituído, com inscrição nos órgãos públicos, documentação sanitária e registros regulares e atualizados. Essa instituição poderá ser submetida a processo de cadastramento, avaliação e credenciamento por parte do DERC/SBC.
Como pré-requisito obrigatório ao treinamento, o candidato deverá ter concluído Residência Médica em Cardiologia ou ser detentor do Título de Especialista em Cardiologia da AMB/CFM e estar em formação ou possuir o Título na Área de Atuação em Ergometria da AMB/CFM.
O treinamento deverá permitir que o cardiologista adquira experiência no TE e TCPE em população pediátrica (crianças e adolescentes), de modo a ser responsável pela organização de serviços, realização e interpretação desses exames. O programa deverá ser teórico-prático, com carga horária mínima de 100 horas.
-
O programa teórico poderá ser feito na própria instituição ou em parceria com o DERC/SBC, devendo incluir no mínimo todos os tópicos e assuntos abordados nesta diretriz. Recomenda-se conteúdo programático teórico adicional:
-
–
Revisão das DCV em crianças e adolescentes (incluindo cardiopatias congênitas), seus tratamentos e exames complementares.
-
–
Revisão das medicações utilizadas em população pediátrica e ajustes posológicos.
-
–
Fisiologia cardiovascular e fisiologia do exercício em população pediátrica saudável e com doenças cardíacas (incluindo cardiopatias congênitas não reparadas, tratadas ou sob tratamento paliativo).
-
–
O treinamento prático deverá corresponder a pelo menos 80% do período total do treinamento, devendo contemplar TE e TCPE. Deve ocorrer sob supervisão direta e presencial de preceptor que possua Título de Especialista em Cardiologia, Título da Área de Atuação em Ergometria e experiência na realização dos exames em população pediátrica. O treinamento prático deve ter uma proporção de um preceptor para no máximo dois alunos.
É recomendado o treinamento regular em atendimento de urgências correspondendo aos cursos de Pediatric Advanced Life Support (PALS) e de Advanced Cardiovascular Life Support (ACLS).
A instituição deverá se responsabilizar pela elaboração e submissão da avaliação dos alunos, durante e/ou ao final do programa do treinamento. Recomenda-se transparência nas avaliações, definindo previamente os critérios objetivos que serão exigidos. Caso não haja aprovação, sugere-se que a instituição forneça opções de treinamento adicional para sanar pendências, seguido de nova avaliação. A instituição deverá fornecer certificado oficial ao aluno aprovado e declaração de cumprimento de todos os itens correspondentes ao treinamento teórico-prático.
É imprescindível que, após o término da formação, haja participação periódica em eventos científicos/programas de atualização em TE e TCPE em crianças e adolescente, em âmbito nacional e/ou internacional, para aperfeiçoamento constante dos conhecimentos adquiridos.
Parte 2 – Teste Ergométrico
1. Metodologia do TE em Crianças e Adolescentes
1.1. Condições Básicas para a Programação do TE/TCPE
1.1.1. Equipe
O TE/TCPE deve ser realizado por médico habilitado, com experiência no método em crianças e adolescentes e com treinamento em PALS.
Profissionais da área de saúde (auxiliar de enfermagem ou técnica de enfermagem ou enfermeira) que estejam auxiliando o médico executante deverão estar treinados no cuidado de crianças e adolescentes, bem como no auxílio ao atendimento de eventuais emergências nessa população. 265 – 268
Nos casos de TE/TCPE em pacientes com cardiopatias congênitas complexas ou de risco aumentado de complicações (vide Quadro 1 ), recomenda-se a realização do exame em ambiente hospitalar com pediatra emergencista de retaguarda.
A instituição e/ou o médico executante deverão orientar e treinar adequadamente outros possíveis profissionais envolvidos no TE/TCPE na marcação/orientação do exame, higienização de equipamentos, limpeza da área física e cuidado/transporte de pacientes.
1.1.2. Área Física
Ambiente planejado, adequadamente iluminado e ventilado, com dimensões suficientes para a acomodação de todos equipamentos do TE/TCPE (incluindo maca, cadeiras para paciente e acompanhante e carro de emergência) e a aparelhagem adicional necessária aos exames em crianças e adolescentes. Deve permitir circulação de pelo menos quatro pessoas (no mínimo de 10 m 2 ), com temperatura ambiente entre 18 e 22 oC, sendo desejável umidade relativa do ar em pelo menos 40%. É necessária a presença de um dos pais ou responsável legal na sala de exame. 264 , 278 – 284
1.1.3. Equipamentos
Equipamentos básicos recomendados: ergômetro; sistema de ergometria com monitor para observação do eletrocardiograma (ECG); impressora (ou acesso para servidor de impressão); esfigmomanômetro calibrado e estetoscópio; termômetro de parede e higrômetro; oxímetro digital; cadeiras destinadas ao paciente, acompanhante e médico; maca ou cama; carro de emergência (se sala única); cilindro de oxigênio (junto ao carro de emergência) ou ponto de oxigênio em cada sala de TE/TCPE; aspirador portátil (junto ao carro de emergência) ou ponto de aspiração em cala sala; lixeiras (lixo comum e hospitalar). 149 , 264 , 278 – 280 , 285 , 286
Os equipamentos devem ser customizados para a população pediátrica:
-
Os ergômetros devem ser adaptados à idade, estatura e peso da criança/adolescente:
-
–
Esteira ergométrica com barras laterais de segurança e barra frontal com altura ajustável para permitir o apoio das mãos de crianças de menor estatura. Deve permitir velocidade inicial menor para que as crianças mais novas se adaptem à caminhada.
-
–
Colocar tapete acolchoado no chão, logo após o final da esteira, para proteção da criança.
-
–
A bicicleta ergométrica deve permitir ajustes na altura do banco, na altura e posição do guidão, no tamanho da alça do pedal e menor frenagem para adaptação ao ato de pedalar em crianças mais novas.
-
–
Sugere-se a utilização de arnês de segurança em crianças mais novas, constituído por conjunto de tiras ligadas entre si, envolvendo o tronco e a cintura, fixadas na esteira ou suporte próprio.
-
–
No TCPE, utilizar máscara facial ou sistema bucal para população pediátrica, que permita os necessários ajustes.
Eletrodo de monitorização cardíaca infantil/pediátrico (em crianças mais novas). Em adolescentes com maior estatura e circunferência torácica, poderá ser utilizado eletrodo de monitorização cardíaca para adultos.
Conjunto de manguitos de vários tamanhos para aferição da PA em população pediátrica. 287
Sistema de ergometria que adote os critérios e parâmetros para a população pediátrica e que permita ampliação do ECG para adequada visualização do sinal.
Em caso de realização de oximetria não invasiva simultaneamente/adicionalmente ao TE/TCPE, utilizar sensores de modelo pediátrico.
1.1.4. Material e Medicamentos para Emergência Médica
O serviço deverá manter disponível um carro de emergência pediátrica, com material e medicação para suporte básico e avançado de vida, no local de realização do TE e/ou TCPE, conforme padronização do carro de emergência da Diretriz de Ressuscitação Cardiopulmonar e Cuidados Cardiovasculares de Emergência da Sociedade Brasileira de Cardiologia (Quadro 17.3 – Padronização do carro de emergência pediátrica na unidade de internação, terapia intensiva e pronto-socorro). 266
1.1.5. Orientações ao Paciente e Pais/Responsáveis na Marcação do TE/TCPE
É necessário fornecer à família e ao paciente orientações no momento da marcação (idealmente por escrito) sobre o preparo pré-teste que permitirá a execução adequada do exame. Quando o exame for de crianças muito novas, sugere-se orientar os pais a explicarem as recomendações de modo a obter uma maior cooperação.
O paciente deverá vir descansado para o exame (evitar realizar esforços físicos no dia do exame).
Evitar jejum ou alimentação excessiva antes do exame; fazer uma refeição leve 2 horas antes. Não consumir bebidas com cafeína (incluindo refrigerante) no dia do exame.
O paciente deverá comparecer com roupas confortáveis para a prática de exercícios físicos: shorts (ou bermuda), camiseta e calçado esportivo (de preferência tênis; evitar sapatos abertos ou sandálias). Recomenda-se que adolescente do sexo feminino utilize sutiã ou top .
Trazer o pedido médico do exame.
Sugere-se trazer TE/TCPE realizado anteriormente.
A suspensão ou manutenção de uso de medicações ficará a critério do médico assistente do paciente.
Um dos pais ou representante legal deverá acompanhar a criança/adolescente na realização do exame.
No caso de TCPE, orientar o paciente que será necessário o uso de máscara facial durante o exame, o que não interfere na respiração.
Observação: no caso de adolescentes, verificar se fazem uso de bebida alcoólica e/ou tabagismo (mesmo que esses sejam proibidos por lei) e, quando for o caso, orientar a interrupção para a realização do exame.
1.1.6. Orientações ao Paciente e Pais/Responsáveis no Momento da Realização do Exame
Quando a criança/adolescente e seus pais (ou representante legal) chegarem para a realização do exame, todo o procedimento deve ser explicado em linguagem e termos de modo que ambos possam entender. A criança e os pais devem ter a oportunidade de realizar todas as perguntas que desejarem visando esclarecer qualquer possível dúvida sobre o exame. 11
A equipe deve demonstrar à criança/adolescente o modo de utilização do ergômetro e deixar claro que o exame normalmente não provoca dor e pode ser até divertido. Orientar os pais de que a criança/adolescente:
-
–
Realizará um esforço físico (andar na esteira ou pedalar), dentro das suas habilidades e capacidade, podendo interromper o esforço a qualquer momento que ela desejar ou precisar.
-
–
O médico e a equipe realizarão vários procedimentos necessários à monitorização e registro dos dados do exame.
-
–
Com o esforço, poderão ocorrer sintomas como cansaço e outros associados às doenças da criança/adolescente.
1.1.7. Orientações quanto ao Uso de Medicações
Diferentemente do que ocorre em adultos, são raras as indicações de suspensão de medicações para a realização do TE/TCPE em crianças e adolescentes. Geralmente, a população pediátrica só faz uso de medicamentos de comprovada necessidade para o controle e estabilidade clínica de suas doenças. Quando necessária, a suspensão deve ser indicada pelo médico assistente da criança/adolescente, levando em consideração os riscos envolvidos. Para determinação do período de suspensão considerar o tempo de eliminação de cada medicamento e suas variações na faixa etária pediátrica. 6 – 12
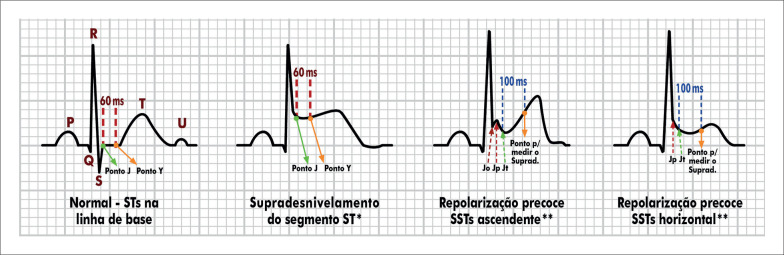
Nos pacientes com asma, a manutenção do uso de medicamentos deve considerar a indicação do exame. 288 Na suspensão de outras medicações considerar possíveis interferências no desempenho físico, na resposta cronotrópica, no limiar de isquemia e angina, na resposta do segmento ST, nas arritmias esforço-induzidas etc.
1.2. Procedimentos Básicos para a Realização do Exame
O TE/TCPE em crianças é mais desafiador do que em adolescentes, especialmente naquelas com comprometimento crônico da saúde. As dificuldades em testá-las surgem por três razões: 289
Tamanho corporal muito pequeno mesmo quando o equipamento é adaptado à população pediátrica.
Capacidade física muito baixa, dificultando a adaptação, mesmo com a utilização de protocolos com pequenos incrementos da carga de esforço.
Geralmente apresentam um menor período de atenção, menor motivação durante exames longos e baixa colaboração, tornando difícil diferenciar a limitação ao esforço de falta de cooperação.
1.2.1. Fase Pré-teste, Avaliação Inicial, Exame Físico Sumário e Específico
Recomenda-se ao médico executante avaliar a indicação do exame e os sintomas atuais do paciente, constatar se as orientações pré-teste foram cumpridas, realizar anamnese e exame físico dirigidos aos sistemas cardiovascular e pulmonar ( Quadro 3 ). 264 , 279 , 280
Quadro 3. Recomendações quanto à anamnese e exame físico dirigido em paciente pediátrico 1 , 264 , 279 , 280 .
| Anamnese | Exame Físico |
|---|---|
| Sintomas atuais * | Ectoscopia geral (anemia, faces sindrômicas, palidez cutânea, cianose) |
| Antecedentes patológicos/cirúrgicos ** | FC/PA *3 |
| História familiar de morte súbita ou doença arterial coronariana precoce ** | Ausculta cardíaca e pulmonar |
| Fatores de risco (vide Parte 2, Sessão 2 – Estratificação de Risco Pré-TE) ** | Oximetria não invasiva *4 |
| Medicações em uso ** | Pulsos periféricos e índice tornozelo-braquial *5 |
| Tolerância ao esforço físico * | |
| Realizou TE/TCPE anteriormente? Teve alguma anormalidade? ** |
TE: teste ergométrico; TCPE: teste cardiopulmonar de esforço; FC: frequência cardíaca; PA: pressão arterial.
Verificados tanto com a criança/adolescentes quanto com seus pais/representante legal.
Verificados principalmente através de informações dos pais/representante legal.
Utilizar manguito adequado a circunferência do membro superior.
Exame adicional. Indicado principalmente nos casos de cardiopatia congênita cianótica, insuficiência cardíaca, valvopatas, pós-COVID.
Exame adicional. Indicado na investigação de coarctação de aorta, síndrome de Takotsubo e claudicação de membros inferiores.
É imprescindível verificar a possibilidade de eventuais contraindicações relativas e absolutas para a realização do TE/TCPE, bem como informações sobre tratamentos realizados anteriormente (especialmente nos casos de CC). Não é recomendado o uso de escore clínico pré-teste de adultos (não são validados para a população pediátrica).
1.2.2. Sistema de Monitoração e Registro Eletrocardiográfico
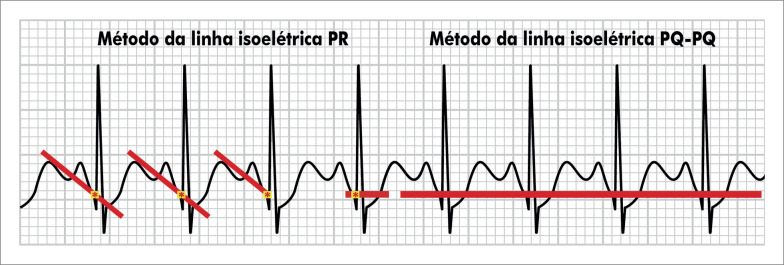
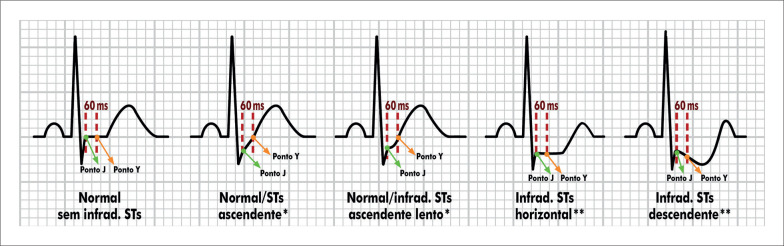
A monitorização contínua do ECG e a realização de registros são obrigatórios em todas as etapas do exame (repouso, esforço e recuperação). Recomenda-se a utilização de sistema computadorizado de ergometria para a monitorização do ECG e de software que permita a obtenção, registro e interpretação de dados em população pediátrica. Sugere-se utilizar eletrodo para monitorização de ECG de longa duração, hipoalergênico, extra-aderente e em crianças pequenas utilizar o eletrodo infantil/pediátrico. 264 , 279 , 280
Recomenda-se seguir as orientações da Diretriz Brasileira de Ergometria para a População Adulta quanto ao número de derivações a serem utilizadas (12 ou 13) e ao posicionamento dos eletrodos. Nos sistemas de 12 derivações utilizar o posicionamento clássico de Mason-Likar ou sua versão modificada preservando CM5. Nos sistemas de 13 derivações utilizar o posicionamento das derivações clássicas com adição de CM5. Não é mais recomendado o uso de sistemas de três derivações, tendo em vista a superioridade dos sistemas com 12, 13 ou mais derivações. 1
Os procedimentos de preparo da pele são similares aos dos adultos, inclusive quanto à eventual necessidade de retirada de excesso de pelos nos adolescentes do sexo masculino nas regiões de fixação dos eletrodos. Em crianças pequenas, no momento da limpeza da pele com álcool, devido à maior sensibilidade, deve-se ter o cuidado de evitar o excesso de abrasão da pele e, também, assegurar que o procedimento não indica recebimento de uma injeção (muitas crianças associam compressas com álcool a injeções). Pode-se utilizar um colete ou uma camisa de rede para ajudar a manter os eletrodos e fios firmemente no lugar.
1.2.3. Ergômetros
A escolha do ergômetro deve ser individualizada levando-se em conta a idade da criança e adolescente, estatura, capacidade de adaptação, segurança e eventuais limitações físicas. São três os principais tipos de ergômetros utilizados no TE/TCPE: bicicleta ergométrica, esteira ergométrica e cicloergômetro de braço. Tanto a bicicleta ergométrica quanto a esteira produzem cargas máximas adequadas, confiáveis e reprodutíveis, permitindo a coleta de informações diagnósticas e de desempenho físico. 290
1.2.3.1. Bicicleta Ergométrica
A utilização de bicicleta ergométrica (cicloergômetro de membros inferiores) é mais frequente em crianças a partir dos 6 anos de idade. Crianças que não estão acostumadas ao ciclismo geralmente apresentam:
-
–
Fadiga muscular precoce nos membros inferiores, podendo não atingir o esforço máximo.
-
–
Dificuldade em manter a cadência do pedalar entre 40 e 70 rotações por minuto (rpm).
-
–
Dificuldade em manter os pés nos pedais, mesmo quando ajustados para o tamanho da criança.
Para acomodar adequadamente as crianças e adolescentes na bicicleta ergométrica, deve-se ajustar a altura do assento, a altura e a posição do guidão e o tamanho da alça do pedal. Crianças e adolescentes com estatura ≥125 cm poderão realizar o TE/TCPE em bicicleta ergométrica padrão para adultos. 200 A utilização de bicicleta ergométrica é preferida quando for necessária uma avaliação mais precisa da PA.
1.2.3.2. Esteira Ergométrica
O TE/TCPE em esteira ergométrica é possível em crianças a partir dos 3 anos de idade, pois as mesmas estão mais familiarizadas com o andar rápido ou até mesmo correr. Entretanto, o esforço na esteira não é uma forma natural de caminhar, sendo recomendável previamente avaliar a capacidade de adaptação e a coordenação ao ergômetro. Recomenda-se ajustar a altura da barra frontal de apoio conforme a estatura da criança.
Em TE de crianças muito pequenas ou limitadas sugere-se: 6 – 12
-
–
Utilização de arnês de segurança de modo a proteger a criança em caso de mal súbito ou desequilíbrio.
-
–
Utilização de grades laterais e tapete acolchoado colocado no chão ao final da esteira para proteção da criança.
-
–
Permanência de um membro extra da equipe executora, posicionado imediatamente atrás da esteira, para auxílio e proteção da criança durante o esforço.
O TE em esteira geralmente apresenta consumo máximo de oxigênio (VO2max) ≈10% superior ao obtido na bicicleta ergométrica. 291 – 293
1.2.3.3. Cicloergômetro de Braço
Em nosso meio, o cicloergômetro de braço é raramente utilizado em crianças e adolescentes. Geralmente, é empregado em pacientes com deficiência de mobilidade nos membros inferiores causada por lesão medular (torácica ou lombar superior), amputação de membro inferior, meningocele, espinha bífida etc. 294 , 295
O TE com cicloergômetro de braço, usando um protocolo de rampa validado, permite avaliar adequadamente a aptidão cardiorrespiratória de crianças e adolescentes. 295 , 296
1.2.4. Escolha do Protocolo
A escolha do protocolo deve ser individualizada considerando a finalidade do exame, a prática de atividades físicas diárias, eventuais limitações físicas e visando tempo de esforço de ≈10 minutos (entre 6 e 12 minutos). O protocolo também deverá respeitar as características do paciente: idade, tamanho corporal, capacidade de adaptação ao incremento de carga de esforço etc. 6
Os protocolos são divididos quanto à forma do esforço:
-
Incrementais (aumento gradativo de carga):
-
–
Escalonado (em degraus): com aumento de cargas em estágio (etapas) em tempo predeterminado (a cada um ou mais minutos por estágio).
-
–
Rampa: com incrementos pequenos de carga, frequentes (tendendo a linear) e em curtos intervalos de tempo (incrementos em segundos, sempre inferiores a 1 minuto).
-
–
Sem incremento (carga fixa): sem aumento de cargas. Em esteira ergométrica, mantém velocidade e inclinação fixas. 1 , 12 , 285
1.2.4.1. Protocolos para Bicicleta Ergométrica
Os principais protocolos para bicicleta ergométrica são apresentados na Tabela 13 . A carga de trabalho realizada na bicicleta normalmente é expressa em watts (W). A maioria dos protocolos requer uma cadência de pedalar entre 50 e 60 rpm, limitando a variação entre 40 e 70 rpm.
Tabela 13. Comparação dos principais protocolos para bicicleta ergométrica.
| Protocolo | Indicado para | Carga inicial | Incremento de carga |
|---|---|---|---|
| Balke | Crianças e adolescentes saudáveis | 25 W | 25 W a cada 2 minutos |
| Astrand 299 | Crianças e adolescentes | 25 W | 25 W a cada 3 minutos |
| McMaster * 300 | Crianças ** e adolescentes *** | 12,5 W a 25 W | 5 modos de incremento, dependendo da estatura e do sexo, a cada 2 minutos |
| James * 301 , 302 | Crianças e adolescentes, ativos | 33 W | 3 modos de incremento, dependendo da área de superfície corporal, a cada 3 minutos |
| Godfrey * 303 , 304 | Crianças* e adolescentes | 10 W a 20 W | 3 modos de incremento, dependendo da estatura, a cada 1 minuto |
| Rampa 297 , 305 | Todas as populações sendo o ideal para atletas | 10 W a 20 W | 5 a 20 W a cada 1 minuto. Subdividir o aumento em valores iguais e o incremento em intervalos regulares (<60 segundos) **** |
Vide Tabela 14 para descrição detalhada dos protocolos;
Baseado na estatura, correspondendo a crianças a partir dos 6 anos de idade;
Pacientes com doenças cardíacas, pulmonares ou musculares podem exigir reduções na carga inicial de trabalho;
Exemplo: protocolo de rampa com incremento de carga de 15 W a cada 1 minuto = aumentar a carga em 5 W a cada 20 segundos.
Os protocolos de Balke e de Astrand apresentam a desvantagem de serem fixos, não considerarem o tamanho corporal, podendo ser muito intensos para crianças mais novas (principalmente as cardiopatas).
Nos protocolos de McMaster, James e Godfrey, as cargas iniciais e os incrementos são feitos de acordo com o tamanho corporal [estatura ou área de superfície corporal (ASC)] e/ou sexo ( Tabela 14 ). Em adolescentes, utilizam-se elevadas cargas de esforço, o que pode ser uma limitação para os sedentários ou doentes (cardiopatas, pneumopatas etc.). 297 , 298
Tabela 14. Descrição dos Protocolos de Godfrey, McMaster e James para bicicleta ergométrica 300 – 304 .
| Protocolo de Godfrey
Estágio: 1 min Ritmo: 60 rpm |
Protocolo de McMaster
Estágio: 2 min Ritmo: 50 rpm |
Protocolo de James
Estágio: 3 min Ritmo: 60-70 rpm |
|||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Altura
<120 cm * |
Altura
120-150 cm * |
Altura
>150 cm * |
Altura
≤119,9 cm * |
Altura
120-139,9 cm * |
Altura
140-159,9 cm * |
Altura
≥160 cm (masc) |
Altura
≥160 cm (femin) |
ASC <1,0 * | ASC
1,0-1,2 * |
ASC >1,2 * | |
| Tempo (min) | 10 W/est | 15 W/est | 20 W/est | 12,5 W/est | 25 W/est | 50 W/est | 50 W/est | 25 W/est | 16,5 W/est | 33 W/est | 49,5 W/est |
| 0 | 10 W | 15 W | 20 W | 12,5 W | 12,5 W | 25 W | 25 W | 25 W | 33 W | 33 W | 33 W |
| 1 | 10 W | 15 W | 20 W | ||||||||
| 2 | 20 W | 30 W | 40 W | 25 W | 37,5 W | 50 W | 75 W | 50 W | |||
| 3 | 30 W | 45 W | 60 W | 49,5 W | 66 W | 82,5 W | |||||
| 4 | 40 W | 60 W | 80 W | 37,5 W | 62,5 W | 75 W | 125 W | 75 W | |||
| 5 | 50 W | 75 W | 100 W | ||||||||
| 6 | 60 W | 90 W | 120 W | 50 W | 87,5 W | 100 W | 175 W | 100 W | 66 W | 99 W | 132 W |
| 7 | 70 W | 105 W | 140 W | ||||||||
| 8 | 80 W | 120 W | 160 W | 62,5 W | 112,5 W | 125 W | 225 W | 125 W | |||
| 9 | 90 W | 135 W | 180 W | 82,5 W | 132 W | 181,5 W | |||||
| 10 | 100 W | 150 W | 200 W | 75 W | 137,5 W | 150 W | 275 W | 150 W | |||
| 11 | 110 W | 165 W | 220 W | ||||||||
| 12 | 120 W | 180 W | 240 W | 87,5 W | 162,5 W | 175 W | 325 W | 175 W | 99 W | 165 W | 231 W |
| 13 | 130 W | 195 W | 260 W | ||||||||
| 14 | 140 W | 210 W | 280 W | 100 W | 187,5 W | 200 W | 375 W | 200 W | |||
| 15 | 150 W | 225 W | 300 W | 115,5 W | 198 W | 280,5 W | |||||
| 16 | 160 W | 240 W | 320 W | 112,5 W | 212,5 W | 225 W | 425 W | 225 W | |||
| 17 | 170 W | 255 W | 340 W | ||||||||
| 18 | 180 W | 270 W | 360 W | 125 W | 237,5 W | 250 W | 475 W | 250 W | 132 W | 231 W | 330 W |
| 19 | 190 W | 285 W | 380 W | ||||||||
| 20 | 200 W | 300 W | 400 W | 137,5 W | 262,5 W | 275 W | 525 W | 275 W | |||
ASC: área de superfície corporal – metros quadrados (m2); W: Watts; min: minuto; rpm: rotações por minuto; est: estágio; cm: centímetro; masc: masculino; femin: feminino.
Para ambos os sexos.
1.2.4.2. Protocolos para Esteira Rolante
1.2.4.2.1. Protocolos Escalonados
1.2.4.2.1.1. Protocolo de Bruce
É o protocolo escalonado mais utilizado ( Tabela 15 ). É mais apropriado para o TE em crianças sem cardiopatia grave e em adolescentes aparentemente saudáveis, inclusive pré-escolares. Pode ser utilizado em TE seriados para a comparação de dados à medida que a criança cresce. Desvantagens potenciais:
Tabela 15. Principais protocolos escalonados para a população pediátrica e suas características 1 , 7 , 306 .
| Estágio | Bruce | Bruce modificado | Ellestad | Balke | Naugthon | Naugthon modificado | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Min | mph/km/h | E% | Min | mph/km/h | E% | Min | mph/km/h | E% | Min | mph/km/h | E% | Min | mph/km/h | E% | Min | mph/km/h | E% | |
| 01 | 3 | 1,7/2,7 | 10 | 3 | 1,7/2,7 | 0 | 3 | 1,7/2,7 | 10 | 1 | 3,5/5,6 | 1 | 2 | 1,0/1,6 | 0 | 2 | 3,0/4,8 | 0 |
| 02 | 6 | 2,5/4,0 | 12 | 6 | 1,7/2,7 | 5 | 5 | 3,0/4,8 | 10 | 2 | 3,5/5,6 | 2 | 4 | 2,0/3,2 | 0 | 4 | 3,0/4,8 | 2,5 |
| 03 | 9 | 3,4/5,5 | 14 | 9 | 1,7/2,7 | 10 | 7 | 4,0/6,4 | 10 | 3 | 3,5/5,6 | 3 | 6 | 2,0/3,2 | 3,5 | 6 | 3,0/4,8 | 5,0 |
| 04 | 12 | 4,2/6,7 | 16 | 12 | 2,5/4,0 | 12 | 10 | 5,0/8,0 | 10 | 4 | 3,5/5,6 | 4 | 8 | 2,0/3,2 | 7,0 | 8 | 3,0/4,8 | 7,5 |
| 05 | 15 | 5,0/8,0 | 18 | 15 | 3,4/5,5 | 14 | 12 | 6,0/9,7 | 15 | 5 | 3,5/5,6 | 5 | 10 | 2,0/3,2 | 10,5 | 10 | 3,0/4,8 | 10 |
| 06 | 18 | 5,5/8,8 | 20 | 18 | 4,2/6,7 | 16 | 14 | 7,0/9,6 | 15 | 6 | 3,5/5,6 | 6 | 12 | 2,0/3,2 | 14,0 | 12 | 3,0/4,8 | 12,5 |
| 07 | 21 | 6,0/9,7 | 22 | 21 | 5,0/8,0 | 18 | 16 | 8,0/11,2 | 15 | 7 a 21 | 3,5/5,6 | +1%/min * | 14 | 2,0/3,2 | 17,5 | 14 | 3,0/4,8 | 15,0 |
| 08 | 24 | 6,5/10,5 | 24 | 24 | 5,5/8,8 | 20 | 18 | 9,0/12,8 | 15 | 22 | 3,5/5,6 | 22,0 | 16 | 2,0/3,2 | 21,0 | 16 | 3,0/4,8 | 17,5 |
Min.: minutos; mph: milhas por hora; km/h: quilômetros por hora; E%: elevação/inclinação da esteira (em %); MET: metabolic equivalent of task (equivalente metabólico da tarefa).
Aumentar 1% na inclinação a cada minuto do exame (velocidade constante).
-
–
Em crianças mais novas ou mais limitadas, os incrementos de esforço entre os estágios podem ser muito grandes, levando frequentemente à desistência no primeiro minuto de um novo estágio.
Pode ser demasiadamente longo em jovens treinados/atletas, causando, inclusive, tédio.
1.2.4.2.1.2. Protocolo de Bruce Modificado
O protocolo de Bruce modificado, sem inclinação inicial, é mais adequado para crianças menores ou mais limitadas fisicamente. É utilizado em crianças a partir de 3 anos, portadoras de cardiopatia ou pneumopatia. A maior limitação é que após o terceiro estágio ocorrem incrementos abruptos de esforço a cada estágio (semelhante ao Protocolo de Bruce).
1.2.4.2.1.3. Protocolo de Ellestad
Emprega aumentos expressivos de velocidade, sendo indicado preferencialmente para adolescentes fisicamente ativos e atletas. As principais limitações desse protocolo são: altas velocidades em cargas iniciais, dificultando a adaptação de quem não está acostumado a correr; dificuldade para realização de medições pressóricas.
1.2.4.2.1.4. Protocolo de Balke
O protocolo de Balke incorpora uma velocidade constante da esteira (3,5 mph) com inclinação crescente de 1% a cada minuto. É mais adequado para crianças obesas, crianças muito novas, cronicamente doentes e/ou muito limitadas. 7 , 306
Uma desvantagem é que, em pacientes fisicamente ativos, a duração do exame é muito longa. Para esses pacientes, é preferível a versão modificada do protocolo de Balke (" running Balke ") utilizando velocidade constante mais rápida, visando a manter o tempo de esforço entre 8 e 10 minutos.
1.2.4.2.1.5. Protocolo de Naughton
Existem várias adaptações do protocolo de Naughton para a população pediátrica, variando a velocidade inicial e inclinação, envolvendo pequenos incrementos de carga por estágio, permitindo melhor adaptação de crianças menores e/ou com limitações físicas. Não deve ser utilizado em crianças e adolescentes saudáveis por prolongar demasiadamente o exame. 307
1.2.4.2.2. Protocolo em Rampa
O protocolo em rampa pode ser totalmente individualizado às características da criança/adolescente, variando a velocidade, a inclinação (iniciais e finais) e a duração do exame. Permite a melhor determinação do consumo máximo de oxigênio (direto ou estimado), limiares ventilatórios, medição ou estimativa da potência máxima, avaliação das causas da limitação do esforço, avaliação de isquemia e arritmias. Deverá manter a meta de duração do exame entre 8 e 12 minutos com a inclinação da rampa ajustada ao tamanho e às habilidades físicas da criança.
Em crianças cardiopatas, sugere-se programar o protocolo com velocidade inicial de 1 km/hora (sem inclinação) e, posteriormente, realizar pequenos e constantes incrementos na intensidade do esforço.
A Tabela 16 apresenta a individualização do protocolo de rampa baseada em estudo na população infanto-juvenil brasileira, que se mostrou mais confortável do que o protocolo de Bruce. 121
Tabela 16. Individualização do protocolo em rampa por sexo e faixa etária, baseado em estudo na população pediátrica brasileira.
| Faixa etária (anos) | Sexo feminino | Sexo masculino | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Velocidade (km/h) | Inclinação (%) | VO2max | Velocidade (km/h) | Inclinação (%) | VO2max | |||||
| Inicial | Final | Inicial | Final | Média ± DP | Inicial | Final | Inicial | Final | Média ± DP | |
| 4-7 | 3,0 | 6,5 | 4,0 | 14,0 | 39,4±4,7 | 3,5 | 7,5 | 5,0 | 15,0 | 45,3±9,2 |
| 8-11 | 3,5 | 7,0 | 5,0 | 15,0 | 43,9±6,2 | 4,0 | 8,0 | 5,0 | 15,0 | 48,6±7,9 |
| 12-14 | 4,0 | 8,0 | 5,0 | 15,0 | 48,3±7,3 | 4,0 | 8,5 | 6,0 | 16,0 | 53,2±9,0 |
| 15-17 | 4,0 | 8,0 | 5,0 | 15,0 | 47,8±10,1 | 4,5 | 9,0 | 6,0 | 16,0 | 55,1±9,4 |
DP: desvio padrão; km/h: quilômetros por hora; VO2max: consumo máximo de oxigênio. Duração final prevista de 10 minutos. Adaptado de: Silva et al. Teste ergométrico em crianças e adolescentes: maior tolerância ao esforço com o protocolo em rampa. 121
1.2.5. Monitorização da Frequência Cardíaca
A FC é monitorada e medida diretamente do traçado eletrocardiográfico durante todas as fases do TE/TCPE. Recomenda-se o registro da FC, pelo menos no pré-esforço, ao final de cada estágio de protocolo escalonado ou a cada 2 minutos em protocolo de rampa e na recuperação (1, 2, 4 e 6 minutos). Caso necessário, o registro deve ser mantido por tempo maior na recuperação.
Recomenda-se a realização de ECG convencional de 12 derivações de forma adicional, precedendo o TE/TCPE. O ECG convencional é um exame complementar que permite avaliar a condição cardíaca, podendo, inclusive, contribuir para a eventual contraindicação do exame. O ECG convencional de 12 derivações é um procedimento médico previsto na Classificação Brasileira Hierarquizada de Procedimentos Médicos (Código: 4.01.01.01-0). 1 , 278 , 308
No TE, conceitua-se como: 95 , 264
-
–
FC máxima (FCmax) é aquela atingida em nível de exaustão ao esforço.
-
–
FC de pico (FCpico) é a maior FC observada no pico do esforço, mesmo que não haja exaustão.
É importante ressaltar que, em crianças aparentemente saudáveis, a FCmax praticamente não muda ao longo da infância, sendo, portanto, limitado o uso das equações de regressão para estimar a FCmax na população pediátrica (predição menos precisa e dispersão média entre 5 e 10 bpm). Na adolescência, por volta dos 16 anos, a FCmax começa a declinar a uma taxa de 0,7 ou 0,8 bpm por ano de idade. 177
Sugere-se a adoção de um valor médio de FC máxima prevista para toda a faixa etária pediátrica (crianças e adolescentes) correspondendo a 197 bpm, e uma FC submáxima prevista de 180 bpm (valor correspondente a −2 desvios padrão). 309 , 310
Na eventualidade de uso de equações para estimar a FCmax na população pediátrica, considerar que: 309 , 311
-
–
Equação de Karvonen (FCmax = 220 – idade) geralmente superestima a FCmax. 312 , 313
-
–
Equação de Tanaka [FCmax = 208 – (0,7 x idade)] pode tanto subestimar quanto superestimar a FCmax, sendo considerada a equação de melhor precisão. 311 , 314 , 315
-
–
Equação de Nikolaidis [FCmax = 223 – (1,44 x idade)], que foi elaborada para atletas adolescentes, também não se mostrou adequada. 315 , 316
1.2.6. Monitorização da Pressão Arterial Sistêmica
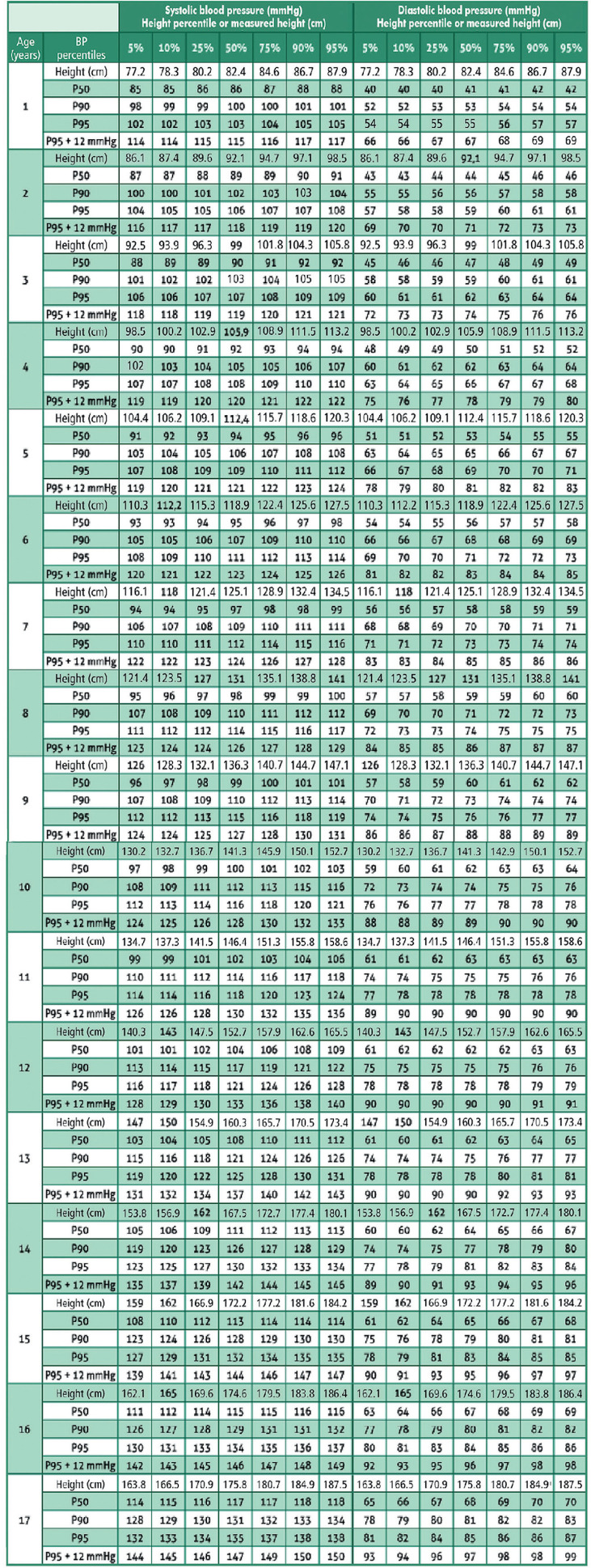
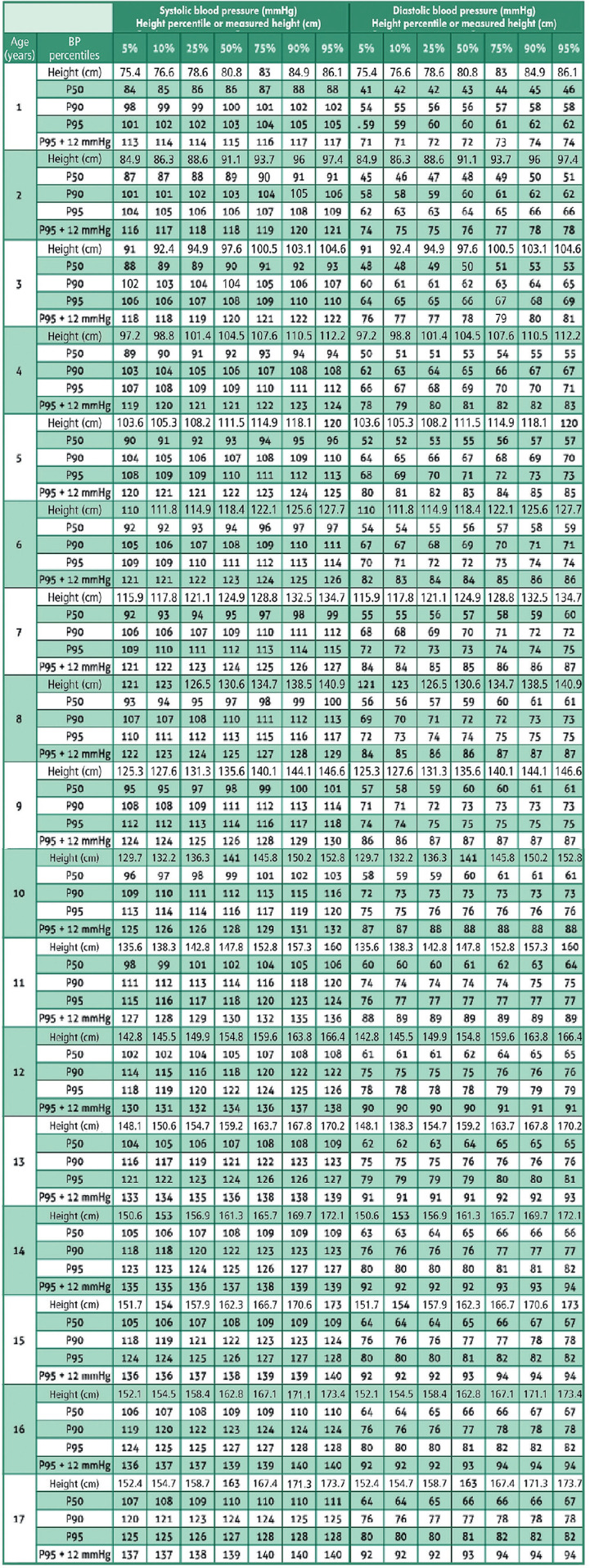
A medida da PA deve ser executada em todas as fases do TE (pré-teste, esforço e recuperação) por médico devidamente treinado e com experiência em população pediátrica.
A medição manual com utilização de esfigmomanômetro aneroide é a mais utilizada. Medições com equipamentos semiautomáticos e/ou automáticos são possíveis, entretanto podem não fornecer medições precisas em determinadas circunstâncias devido a: 317 , 318
-
–
Presença de excesso de movimento e vibração que ocorre comumente em crianças mais novas.
-
–
Alguns dispositivos funcionam medindo a PA média e calculando as PA sistólica (PAS) e diastólica (PAD) por meio de algoritmos, que podem apresentar limitações na avaliação da PAD em crianças por não distinguirem as fases IV e V de Korotkoff. 319 , 320
-
–
A maioria dos equipamentos automáticos não foi validada na população pediátrica para medições em repouso e esforços intensos. 4
Independentemente do método de medição adotado, utilizar manguito de velcro com dimensões adequadas ao tamanho do braço do paciente. A largura do manguito deve ser de pelo menos 40% da circunferência do braço e cobrir de 80 a 100% do comprimento do braço. 4 , 321 Recomendamos a utilização das dimensões do manguito preconizadas nas "Diretrizes Brasileiras de Medidas da Pressão Arterial Dentro e Fora do Consultório – 2023" e "Diretrizes Brasileiras de Hipertensão Arterial – 2020" ( Tabela 17 ). 319 , 322
Tabela 17. Dimensões do manguito de acordo com a circunferência do braço.
| Circunferência do braço | Largura do manguito | Comprimento da bolsa |
|---|---|---|
| ≤6 cm | 3 cm | 6 cm |
| 6-15 cm | 5 cm | 15 cm |
| 16-21 cm | 8 cm | 21 cm |
| 22-26 cm | 10 cm | 24 cm |
| 27-34 cm | 13 cm | 30 cm |
| 35-44 cm | 16 cm | 38 cm |
Adaptado de: Feitosa ADM et al. Brazilian Guidelines for In-office and Out-of-office Blood Pressure Measurement – 2023. 319
O esfigmomanômetro e os manguitos devem ser limpos e inspecionados regularmente para evitar problemas técnicos que limitem a qualidade e precisão das medidas. 323
Na medição manual, deve-se observar os sons de Korotkoff considerando que:
-
–
A PAS corresponde ao reaparecimento do fluxo sanguíneo (fase I de Korotkoff).
-
–
A PAD corresponde ao ponto em que o som se abafa (Korotkoff fase IV). A fase IV é usada no lugar da fase V (desaparecimento dos sons) porque, em crianças, na maioria das vezes, os sons de Korotkoff são percebidos até 0 mmHg.
No pré-teste, preferencialmente realizar as medições da PA:
-
–
Em repouso, em posição sentada, com o braço apoiado ao nível do coração.
-
–
Na posição em que a criança/adolescente realizará o esforço físico.
Recomenda-se a medição da PA ao final de cada estágio de protocolo escalonado ou a cada 2 minutos em protocolo de rampa e na recuperação (1, 2, 4 e 6 minutos). Caso haja necessidade, realizar medições por tempo maior na recuperação. Reavaliar sempre que houver discrepâncias ou dúvidas em relação às medições.
Contraindica-se a medição da PA no membro superior com fístula arteriovenosa, esvaziamento ganglionar, trombose, linfedema e/ou coarctação de aorta.
2. Estratificação de Risco Pré-TE
Estudos e diretrizes têm trazido novas informações sobre fatores de risco CV na infância, sua relação com aterosclerose e DCV prematuras e também índices e escores de risco específicos para doenças [por exemplo: índice de massa corporal (IMC); 324 doença de Kawasaki; 37 lúpus eritematoso sistêmico (LES) 325 ]. O risco em crianças e adolescentes também pode ser descrito com base na magnitude do risco de doença aterosclerótica na população geral. 59 , 61 , 326
No pré-teste, recomenda-se a estratificação de risco para DCV em população pediátrica baseada na presença de doenças ( Tabela 18 ). 59 Os índices e escores específicos para doenças devem ser utilizados quando julgados pertinentes.
Tabela 18. Estratificação de risco da população pediátrica baseada na presença de doenças.
| Categoria | Condição |
|---|---|
| Alto risco | HF homozigótica, DM1, DM2, doença renal terminal, doença de Kawasaki com aneurismas persistentes, vasculopatia de transplante de órgão sólido, sobrevivente de câncer infantil (receptor de células-tronco). |
| Risco moderado | Obesidade grave, HF heterozigótica, hipertensão confirmada, coarctação de aorta, Lp(a) aumentada, DRC pré-dialítica, EAo, sobrevivente de câncer infantil (radiação torácica). |
| Risco leve | Obesidade, resistência à insulina com comorbidades (dislipidemia, DHGNA, SOP), hipertensão do avental branco, CMH e outras cardiomiopatias, hipertensão pulmonar, condições inflamatórias crônicas (ARJ, LES, doença inflamatória intestinal, HIV), após cirurgia de correção de artérias coronárias anômalas ou transposição dos grandes vasos da base, câncer infantil (somente quimioterapia cardiotóxica), doença de Kawasaki com aneurismas regredidos (EzMax ≥5). |
HF: hipercolesterolemia familiar; DM1: diabetes mellitus tipo 1; DM2: diabetes mellitus tipo 2; EAo: estenose aórtica; DRC: doença renal crônica; CMH: cardiomiopatia hipertrófica; ARJ: artrite reumatoide juvenil; Lp(a): lipoproteína (a); DHGNA: doença hepática gordurosa não alcoólica; SOP: síndrome do ovário policístico; LES: lúpus eritematoso sistêmico; HIV: síndrome de imunodeficiência adquirida; EzMax: pontuação z máxima no escore em qualquer momento durante o curso da doença. Adaptado de: de Ferranti et al. Cardiovascular Risk Reduction in High-Risk Pediatric Patients: A Scientific Statement From the American Heart Association. 59
Em adolescentes, além da estratificação de risco por doença, sugere-se verificar a presença de fatores de risco CV tradicionais: perfil lipídico; tabagismo; história familiar de DAC precoce em parentes de 1° grau (homens ≤55 anos; mulheres ≤65 anos); PA; IMC; glicemia de jejum; histórico de atividade física. 59
Estudos têm reforçado a relevância de fatores de risco cardiometabólico na população pediátrica: PAS, PAD, circunferência abdominal, IMC, soma das quatro dobras cutâneas, triglicerídeos (TG), colesterol total (CoT), colesterol ligado às lipoproteínas alta densidade (HDL-C), colesterol ligado às lipoproteínas de baixa densidade (LDL-C), relação CoT/HDL-C, glicemia, insulinemia, escore de avaliação do modelo homeostático (HOMA-score) e aptidão cardiorrespiratória (mL/kg/min; estimado ou medido). 60 A determinação da aptidão cardiorrespiratória aumenta a precisão da quantificação do risco, sendo preconizada principalmente quando presentes outros fatores. 327 – 329
Na maioria das doenças cardíacas congênitas, existe um maior risco de DCV adquirida precocemente (desde a infância até a fase adulta jovem), vide Tabela 19 . As crianças e adolescentes nessas condições apresentam maior risco de complicações durante o TE/TCPE. 59 , 82 , 83 , 88 , 119 , 330 – 333
Tabela 19. Risco de desenvolvimento de doenças cardiovasculares associadas às doenças cardíacas congênitas.
| DCC | Doença arterial coronariana | Doença cerebrovascular | Doença vascular periférica | Arritmias cardíacas |
|---|---|---|---|---|
| CIA/CIV reparados | Desconhecido se há aumento de risco. | Aumento do risco se houver shunt residual. | Desconhecido se há aumento de risco. | Risco aumentado de taquicardia juncional e arritmia ventricular. |
| Valva aórtica bicúspide | Risco potencial após procedimento de Ross com reimplante de artérias coronárias. | Desconhecido se há aumento de risco. | Aumento do risco relacionado ao aneurisma da aorta. | Risco potencial de arritmia ventricular. |
| Coarctação da aorta | Risco aumentado, relacionado à aterosclerose acelerada e hipertensão tardia. | Aumento do risco relacionado à hipertensão residual ou aneurismas intracranianos. | Aumento do risco relacionado à coarctação residual ou aneurisma da aorta. | Risco de arritmias malignas e morte súbita em seguimento de 10 anos. |
| Anomalia de Ebstein | Desconhecido se há aumento de risco. | Risco aumentado se houver shunt interatrial. | Desconhecido se há aumento de risco. | Risco aumentado de taquicardia por reentrada atrioventricular. |
| Tetralogia de Fallot | O aumento do risco pode estar relacionado às anomalias coronarianas. | Risco aumentado se houver shunt intracardíaco residual. | Aumento do risco relacionado à dilatação da aorta. | Risco aumentado de taquiarritmias atriais, taquicardia juncional e arritmias ventriculares que podem surgir décadas após a cirurgia. |
| TGA | Aumento do risco relacionado à redução da reserva de fluxo coronariano, espessamento da íntima proximal e anomalias coronarianas. | No switch atrial, aumento do risco se houver vazamento residual do reparo. | No switch atrial, o aumento do risco pode estar relacionado a cateterizações anteriores. No switch arterial, aumento do risco relacionado à dilatação neoaórtica. | Risco de arritmias malignas e morte súbita. Nos pacientes adultos com TGA corrigida, risco aumentado de arritmia ventricular e morte súbita cardíaca. |
| Fontan | Aumento do risco relacionado às anomalias coronarianas. | Aumento do risco se houver fenestração do Fontan. | Aumento do risco relacionado a pressões venosas do Fontan e cateterizações anteriores. | Maior risco de flutter atrial nos primeiros 30 dias após cirurgia. No período pós-operatório tardio, são comuns taquicardias atriais por mecanismo de reentrada ( flutter e FA, taquicardia reentrante intra-atrial). Risco aumentado de arritmia ventricular. |
| CC cianótica | Risco potencial reduzido. | Aumento do risco relacionado à eritrocitose secundária e síndrome de hiperviscosidade. | Aumento do risco relacionado à eritrocitose secundária e síndrome de hiperviscosidade. | Risco maior de QTc prolongado e de arritmia ventricular. |
| Síndrome de Eisenmenger | Risco potencial reduzido. | Aumento do risco relacionado à eritrocitose secundária e síndrome de hiperviscosidade. | Aumento do risco relacionado à eritrocitose secundária e síndrome de hiperviscosidade. | Risco aumentado de arritmias e morte súbita. |
CC: cardiopatia congênita; CIA: comunicação interatrial; CIV: comunicação interventricular; FA: fibrilação atrial; DCC: doença cardíaca congênita; QTc: intervalo QT corrigido; TGA: transposição das grandes artérias. Adaptado de: Ferranti et al. Cardiovascular Risk Reduction in High-Risk Pediatric Patients: A Scientific Statement from the American Heart Association. 59
3. Respostas Clínicas, Hemodinâmicas, Eletrocardiográficas ao Esforço
3.1. Respostas Clínicas
3.1.1. Tolerância ao Esforço
A determinação da tolerância ao esforço permite quantificar a intensidade do esforço físico e os sintomas (cansaço, dispneia, fadiga dos membros inferiores e outros sintomas). A tolerância ao esforço pode ser quantificada de forma objetiva, em qualquer faixa etária, através da potência desenvolvida em watts, duração do esforço ou equivalente metabólico (do inglês, metabolic equivalent of task – MET). Quando comparadas aos adultos, as crianças toleram melhor esforço físico de curta duração e são menos fatigáveis durante exercícios dinâmicos. 334
A quantificação subjetiva pode ser feita através da escala de esforço percebido (EEP), como a escala de Borg, escala de Borg modificada, tabela de avaliação do esforço infantil ilustrada (P-CERT) ou escala OMINI. 335 , 336 Todas as escalas apresentam limitações relacionadas ao grau de desenvolvimento cognitivo das crianças e dos adolescentes: 337 , 338
-
–
Crianças de 0 a 3 anos não conseguem avaliar adequadamente seu esforço percebido mesmo durante atividades diárias.
-
–
Dos 4 aos 7 anos, as crianças progressivamente passam a ser capazes de avaliar as alterações sensoriais periféricas dos exercícios, entretanto a quantificação de EEP é menos precisa. 339
-
–
Dos 8 aos 12 anos, as crianças são capazes de estimar a intensidade de esforço e distinguir a origem das alterações sensoriais referentes às diferentes partes do seu corpo. O tipo de exercício e a EEP utilizada podem influenciar na resposta relatada, principalmente em esforços intensos. 337 , 340 – 342
-
–
Durante a adolescência, a EEP é útil, entretanto sua relação com a FC atingida é menos pronunciada do que em adultos. 341 , 343 , 344
A tabela P-CERT foi projetada para avaliar o esforço percebido de crianças de 6 a 9 anos, utilizando escala perceptiva com texto e imagens ilustrativas, melhorando a correlação com a FC atingida, sendo de uso limitado em crianças sem condições de leitura. 345 – 347
A escala de esforço percebida OMNI utiliza ilustrações de crianças de ambos os sexos realizando exercícios físicos (andar, pedalar, subir escada, nadar etc.) em várias intensidades, facilitando a compreensão e colaboração da criança. 348 – 350
3.1.2. Aptidão Cardiorrespiratória/Capacidade Funcional
A avaliação da ACR/capacidade funcional em crianças e adolescentes é um importante instrumento clínico para quantificação de sintomas, avaliação prognóstica e avaliação de resposta a tratamentos. Também serve para quantificar as disfunções CV e pulmonares e suas repercussões em crianças portadoras de CC ou adquiridas. 80
A ACR pode ser avaliada:
-
–
De maneira indireta no TE, através do VO2 máximo (VO2max) estimado, expresso em METs e seu respectivo percentual em relação ao previsto para a idade.
-
–
De maneira direta no TCPE, através da apresentação do VO2 mensurado e seu respectivo percentual em relação ao valor previsto para a idade. 351
As crianças saudáveis apresentam respostas cardiorrespiratórias e metabólicas diferentes das observadas em adultos. Normalmente, durante o esforço máximo, apresentam respostas cronotrópicas maiores, inotrópicas menores, menor eficiência CV e ventilatória. No entanto, as crianças apresentam maior eficiência metabólica e níveis semelhantes de capacidade de esforço quando comparadas aos adultos. 352 , 353
A ACR é influenciada por idade, sexo, nível de atividade física diária, obesidade, presença de cardiopatias e pneumopatias, tratamentos instituídos etc. 80 , 91 , 354
Crianças com CC ou cardiopatias adquiridas frequentemente apresentam comprometimento de sua ACR, independentemente de estarem em pré-operatório, pós-operatório ou acompanhamento de longo prazo. Esse comprometimento pode estar associado à cardiopatia primária, aos tratamentos dessa cardiopatia, à hipoatividade/sedentarismo e fatores comportamentais (tal como a superproteção dos pais). Adolescentes com CC podem ter conceito errôneo sobre níveis seguros e desejáveis de atividade física, mantendo o círculo vicioso de sedentarismo. 355 – 357
A Figura 1 apresenta as doenças pediátricas, fatores fisiopatológicos e situações clínicas (comorbidades, tratamentos etc.) que comprometem os componentes específicos da equação de Fick utilizada para a determinação da ACR (VO2max). 355
Figura 1. Doenças pediátricas que afetam componentes específicos da equação de Fick, comprometendo a aptidão cardiorrespiratória. VSmax: volume sistólico máximo durante o exercício; FCmax: frequência cardíaca máxima; (CaO2-CvO2)max: diferença arteriovenosa do conteúdo de oxigênio; CaO2: conteúdo arterial de oxigênio; CvO2: conteúdo venoso de oxigênio; CC: cardiopatia congênita; BAVT: bloqueio atrioventricular total; IC: insuficiência cardíaca; VE: ventrículo esquerdo. Adaptado de: Bar-Or O. Pathophysiological Factors Which Limit the Exercise Capacity of the Sick Child. 355 .
3.1.3. Sintomas, Ectoscopia e Ausculta
A observação clínica de sintomas, a ectoscopia e o exame físico durante o TE/TCPE são fundamentais nas crianças e adolescentes ( Quadro 3 ), pois:
-
–
Crianças mais novas apresentam limitações quanto ao esforço percebido e à interpretação de suas alterações sensoriais periféricas. 337 , 338 , 358
-
–
A queixa de cansaço constitui a principal razão de interrupção do esforço na população pediátrica, requerendo correlação com os achados físicos (padrão respiratório, sinais de tiragem intercostal, dispneia etc.), inclusive para a determinação da tolerância ao esforço e classe funcional.
-
–
A ocorrência de dor torácica esforço-induzida requer avaliação e caracterização pormenorizadas, auxiliando no diagnóstico diferencial de possíveis origens não cardíacas (exemplo: asma esforço-induzida). A dor anginosa típica está geralmente associada à origem anômala de coronárias, estenose aórtica e doença de Kawasaki. 15 , 35 , 37 , 359 , 360
-
–
No pré-teste, especialmente em crianças com CC e valvopatias, os pulsos femorais e periféricos devem ser palpados para identificar alterações de amplitude, atraso radiofemoral e possíveis obstruções. 361 , 362
-
–
A ausculta cardíaca realizada logo após o pico do esforço permitirá avaliar a ocorrência de novos sopros cardíacos ou modificações do padrão de sopros da ausculta pré-teste. Frequentemente, crianças e adolescentes têm B3 audível na ausculta basal, e caso surja durante o exercício, geralmente é considerada adaptação fisiológica sem correlação com cardiopatia estrutural. 363 – 365 A ocorrência de sopro sistólico e/ou desdobramento de B3 está frequentemente associada às CC e valvopatias. 362 , 366
-
–
Quanto à ausculta do aparelho respiratório, a ocorrência de roncos e sibilos pulmonares pode indicar broncoespasmo esforço-induzido associado à asma. 367 A ausculta de estridor inspiratório e/ou sibilos na parte superior do tórax e também na região da traqueia pode auxiliar no diagnóstico de obstrução laríngea esforço-induzida. Nesses casos, recomenda-se a visualização das estruturas laríngeas através de laringoscopia, que contribui para o diagnóstico do tipo de obstrução laríngea e para a condução da crise obstrutiva. 368 , 369
Particularidades dos sintomas, ectoscopia e ausculta durante o TE e TCPE na população pediátrica: 177 , 361 , 362 , 370
-
–
Crianças e adolescentes sedentários podem apresentar aumento desproporcional da frequência respiratória (FR) em relação à intensidade de esforço e dispneia. O exame físico geralmente é normal, sem sinais de causas restritivas ou obstrutivas para a dispneia. 286 , 371
-
–
Crianças com anormalidades da parede torácica (por exemplo: escoliose, pectus excavatum e pectus carinatum ) podem apresentar dispneia esforço-induzida e, dependendo da gravidade da deformidade, processo restritivo. 372 – 375
-
–
Na distrofia muscular e outras miopatias, é comum a ocorrência de dispneia e baixa tolerância ao esforço associada à doença pulmonar restritiva e ao comprometimento da musculatura respiratória. 203 – 206
-
–
Crianças com cardiomiopatia hipertrófica obstrutiva podem apresentar dor torácica esforço-induzida associada à isquemia miocárdica. Geralmente, na ausculta cardíaca realizada no pré-teste, observa-se um sopro cardíaco mais intenso na posição ortostática ou após manobra de Valsalva. 13
-
–
Crianças com hipertensão arterial pulmonar (HAP) podem apresentar dor torácica esforço-induzida, sendo esse o sintoma inicial mais comum da HAP na forma idiopática. 196 , 376 , 377
-
–
Nas cardiomiopatias dilatadas, pode ocorrer dor torácica geralmente associada à fadiga intensa ao esforço. Também é necessária atenção quanto à possibilidade de dessaturação e ocorrência de cianose. 378 , 379
-
–
A estenose pulmonar grave pode produzir dor torácica opressiva associada à isquemia miocárdica. 87 , 380 , 381
-
–
As estenoses valvar aórtica, supra-aórtica e subaórtica podem causar dor torácica esforço-induzida, tontura e fadiga. Essas crianças geralmente têm sopro de ejeção rude, às vezes acompanhado por clique de ejeção em válvula aórtica bicúspide. 134 , 382 , 383
-
–
Em crianças, as taquicardias supraventriculares e ventriculares geralmente se apresentam como palpitação, que pode ser exacerbada pelo esforço e, também, cursar com dor torácica breve e aguda. 361 , 370 , 384
3.2. Respostas Hemodinâmicas
3.2.1. Frequência Cardíaca
3.2.1.1. Frequência Cardíaca de Repouso
A FC de repouso, em condição basal, diminui com o aumento da idade e varia de uma média de 85 bpm aos 4 anos para 60 bpm aos 16 anos. Essa redução da FC é diretamente relacionada ao declínio da taxa metabólica da criança com o envelhecer. 385 – 387 Os valores de FC de repouso (mínima e máxima) devem ser correlacionados aos previstos para as faixas etárias pediátricas.
Na população pediátrica, a bradicardia em repouso geralmente é observada em atletas altamente treinados, secundária aos medicamentos (particularmente betabloqueadores), no hipotireoidismo e na disfunção do nó sinusal. 370 , 388 , 389 A taquicardia sinusal em repouso geralmente ocorre em: condições de calor/clima quente; hipertireoidismo; anemia; obesidade; ansiedade pré-teste; taquicardia sinusal inapropriada, raramente estando associada à taquiarritmia supraventricular. 390 – 393
Em crianças com cardiomiopatia dilatada, a FC de repouso mais elevada associa-se ao risco de morte e à necessidade de transplante cardíaco. O controle medicamentoso da FC associou-se à melhora da função ventricular e evolução da doença. 394 – 396
3.2.1.2. Resposta Cronotrópica
A avaliação da resposta cronotrópica é fundamental no esforço e na fase de recuperação. Em crianças e adolescentes, durante um TE progressivo, a FC aumenta linear e proporcionalmente ao VO2, desde os níveis basais até a FCpico. A FC máxima geralmente não é afetada pelo nível de aptidão cardiorrespiratória ou sexo, permanecendo constante ao longo dos anos pediátricos. Entretanto, em TE seriado, à medida que a criança cresce, observa-se redução da FC submáxima em determinada carga de trabalho. 8 , 177 , 397 , 398
Na recuperação, normalmente ocorre uma queda progressiva da FC com retorno ao padrão basal até o 6° minuto. No 1 ° minuto da recuperação, adolescentes aparentemente saudáveis do sexo masculino apresentam redução de ≈44 bpm e do sexo feminino ≈36 bpm. Crianças do sexo masculino também costumam apresentar maior redução da FC no 1 ° minuto da recuperação do que as do sexo feminino. 302 , 352 , 399 Crianças com excesso de peso e/ou com menor resistência ao esforço geralmente apresentam recuperação mais lenta da FC no 1 ° minuto. 400 , 401
Pacientes com disfunção do nó sinusal (DNS) ou no pós-operatório de CC podem não aumentar adequadamente sua FC com o esforço e terem FCpico menor. O aumento lento na FC à medida que a intensidade do trabalho aumenta é normalmente observado em jovens atletas treinados. A resposta cronotrópica deprimida na população pediátrica geralmente ocorre no elevado grau de tônus vagal, DNS, pós-operatório de CC, uso de medicamentos como betabloqueadores, bloqueadores dos canais de cálcio e antiarrítmicos. 177 , 389 , 400
A Tabela 20 apresenta os termos referentes ao comportamento da FC no TE/TCPE em população pediátrica, bem como os respectivos critérios e possíveis interpretações.
Tabela 20. Definições, critérios e interpretação do comportamento da FC no TE/TCPE em crianças e adolescentes.
| Termo | Critérios | Interpretação | |
|---|---|---|---|
| Comportamento da FC no ECG de repouso | |||
| Comportamento normal da FC | ECG de repouso com FC entre a mínima e máxima prevista para a faixa etária ( Tabela 24 ). | Crianças e adolescentes em ritmo sinusal. | |
| Bradicardia sinusal em repouso | ECG de repouso com FC abaixo da mínima esperada para a faixa etária ( Tabela 24 ). | Comum em adolescentes atletas e vagotônicos, assintomáticos.
Caso secundária à utilização de betabloqueador ou antiarrítmico, referir essa interferência no laudo. Em pacientes que não utilizam medicações inotrópicas negativas, avaliar possibilidade de doença do nó sinusal ou outras causas secundárias (exemplo: hipotireoidismo). Afastar BAV de segundo grau e BAV avançado. |
|
| Taquicardia sinusal em repouso | ECG de repouso com FC acima da máxima esperada para a faixa etária ( Tabela 24 ). | Usualmente encontrada em pacientes obesos, com elevado grau de ansiedade, no hipertireoidismo, na anemia e após ingestão excessiva de cafeína ou álcool. | |
| Comportamento da FC ao esforço | |||
| Resposta cronotrópica normal | Atingir pelo menos a FC submáxima prevista de 180 bpm (valor correspondente a −2 desvios padrão) entre 8 e 12 minutos de esforço.
*
ou Na eventualidade de uso de equações para estimar a FCmax (equação de Tanaka ou equação de Karvonen), atingir ≥80% da FCmax prevista entre 8 e 12 minutos de esforço. ** |
Os valores médios previstos para toda a faixa etária pediátrica (crianças e adolescentes) da FC máxima é 197 bpm e da FC submáxima de 180 bpm, são contantes, não sendo afetados pelo nível de ACR, sexo e idade. 8 , 177 , 397 , 398 , 402 , 403 | |
| Queda da FC intraesforço | Queda da FC com a progressão do esforço associada a sinais e sintomas sugestivos de baixo débito cardíaco (fadiga extrema, tontura, queda de PAS etc.). | Critério de interrupção do esforço. 7 , 11 | |
| Resposta cronotrópica deprimida ou incompetência cronotrópica *** | Relativamente comum em crianças após correção cirúrgica de CC. Associa-se a redução da tolerância ao esforço, pior ACR e maior morbidade em cardiopatas. 177 , 405 – 409 Em pacientes com Fontan, associa-se à disfunção do nó sinusal. 401 | ||
| Platô da FC intraesforço | Manutenção assintomática da FC (durante 1 a 2 estágios) e subsequente incremento com a continuidade do esforço. | Pode ocorrer em crianças aparentemente saudáveis, não tendo significado clínico. | |
| Comportamento da FC na recuperação | |||
| Comportamento normal da FC na recuperação | Na recuperação, normalmente ocorre uma queda progressiva da FC com retorno ao padrão basal até o 6 ° minuto. | Quando em ritmo sinusal. Crianças do sexo masculino costumam apresentar maior redução da FC no 1 ° minuto da recuperação do que as do sexo feminino. 302 , 352 , 399 | |
| Recuperação lenta da FC (pós-esforço) | Avaliado através do ΔFC 1 ° min = FCmax esforço – FC no 1 ° minuto recuperação. | Comum após cirurgia de Fontan. 410 Em crianças com CC, pode estar associada à incompetência cronotrópica. Pode ser explicada pela reativação lenta da atividade vagal, retirada tardia da atividade simpática e/ou baixa ACR. 410 – 415 | |
| Não há consenso sobre o valor do ΔFC, geralmente considerado anormal se ≤35 bpm. 302 , 352 | |||
| Queda súbita e acentuada da FC na recuperação | Geralmente assintomática. Não há consenso sobre o valor de referência, mas geralmente corresponde a queda >55 bpm no primeiro minuto da recuperação. | Achado comum em crianças mais novas e atletas pediátricos. 416 , 417 | |
ECG: eletrocardiograma; FC: frequência cardíaca; bpm: batimentos por minuto; PAS: pressão arterial sistólica; BAV: bloqueio atrioventricular; CC: cardiopatia congênita; TE: teste ergométrico; ACR: aptidão cardiorrespiratória.
FC submáxima prevista para toda a faixa etária pediátrica (crianças e adolescentes).
Os valores de FC máxima podem apresentar variação individual significativa entre 5 e 10 bpm.
Descrever o uso de medicamentos que possam afetar o comportamento da FC.
3.2.2. Resposta da Pressão Arterial
O comportamento da PA é uma variável importante do TE/TCPE em população pediátrica, por refletir as adaptações do débito cardíaco e resistência vascular periférica com o esforço. 418 , 419
Em relação à avaliação da PA no pré-teste, em repouso, recomenda-se a adoção dos critérios de PA da Tabela 21 , baseados na Diretriz Brasileira de Hipertensão, que consideram a idade, o sexo e o percentil de estatura das crianças e adolescentes (consultar Anexos 2 e 3 ). 322
Tabela 21. Definição da pressão arterial em repouso no TE/TCPE de acordo com a faixa etária 322 .
| Crianças de 1 a <13 anos de idade | Crianças com idade ≥13 anos |
|---|---|
| PA em repouso normal: <P90 para idade, sexo e estatura. | PA em repouso normal: <120/<80 mmHg. |
PA em repouso elevada:
|
PA em repouso elevada:
|
Em relação ao comportamento da PA com o esforço, normalmente observa-se um aumento progressivo da PAS, que contribui para o aumento do débito cardíaco, cuja magnitude está diretamente relacionada à intensidade do esforço. Os valores de PAS atingidos no pico do esforço (PASpico), mesmo que não estejam associados à exaustão física (esforço máximo), também são proporcionais à idade (quanto maior a idade, maior a PASpico), à ASC (quanto maior a área, maior a PASpico) e à PAS no pré-teste. A PAS máxima (PASmax) é considerada a PAS medida no esforço máximo. Entretanto, ocasionalmente, pacientes pediátricos aparentemente saudáveis podem apresentar apenas discreto aumento da PAS com o esforço. 403 , 420
A ASC tem sido utilizada como critério para definição do percentil de normalidade e avaliação do comportamento da PAS. Por exemplo, crianças do mesmo sexo e idade com ASC diferentes terão comportamento distintos da PASmax: a criança com ASC de 1,25 m 2 apresentará PASmax de 140 mmHg, enquanto outra com ASC de 1,75 m 2 atingirá 160 mmHg. 421 , 422
A PASmax/PASpico, ou quando medida imediatamente após a interrupção do esforço, são consideradas padrão de avaliação da capacidade inotrópica cardíaca. Alterações do comportamento da PA são úteis para diagnóstico, definição terapêutica e estratificação de risco em crianças e adolescentes com CC, valvopatias, IC ou suspeita de hipertensão arterial sistêmica (HAS). 53 , 418 , 419
No período de recuperação, observa-se um declínio progressivo da PAS com retorno aos níveis de repouso em cerca de 6 minutos. Após esse período, a PAS geralmente permanece mais baixa do que os níveis pré-esforço por várias horas. 423
A PAD normalmente permanece constante com o esforço, independentemente de idade e sexo, devido à vasodilatação esforço-induzida. O limite de variação da PAD situa-se em torno de ±10 mmHg. Pode ocorrer queda discreta da PAD em crianças aparentemente saudáveis. 424
Estudo em adolescentes brasileiros normotensos sobre o comportamento da PA no TE demonstrou aumento da PAS e queda da PAD durante o esforço em todas as faixas etárias e ambos os sexos. 425 Outros estudos demonstraram que o incremento da PAS e a resposta cronotrópica foram significativamente menores em crianças portadoras de CC complexas e cardiomiopatia dilatada. 155 , 395 , 426
A ausência de aumento adequado da PAS com o esforço pode ser indicativa de possível disfunção cardíaca. A queda persistente da PAS com a progressão do esforço pode estar relacionada à IC ou obstrução de via de saída do ventrículo esquerdo (exemplos: estenose aórtica grave, cardiomiopatia hipertrófica assimétrica).
Estudos nacionais e internacionais buscaram avaliar o comportamento da PA em crianças e adolescentes submetidas ao TE e definir valores de referência e equações preditivas desse comportamento. Devido à grande heterogeneidade das populações estudadas e dos resultados obtidos, ainda não foi possível estabelecer um critério único de normalidade para o comportamento da PA no TE. 38 , 305 , 403 , 419 , 422 , 425 , 427 , 428
Para a avaliação da PASmax, sugerimos a utilização de:
-
–
Equação de predição baseada em sexo e idade ( Tabela 22 ) para a faixa etária de 7 a 17 anos; ou
-
–
Normograma baseado no sexo e ASC ( Figura 2 ) para a faixa etária de 6 a 15 anos.
Tabela 22. Valores preditos da PASpico baseados em modelo de regressão linear para idade e sexo.
| PASpico (mmHg) | ||||||
|---|---|---|---|---|---|---|
| Idade | Meninos | Meninas | ||||
| P90 | P95 | Média prevista | P90 | P95 | Média prevista | |
| 7 | 161 | 167 | 132 | 169 | 174 | 142 |
| 8 | 166 | 171 | 136 | 170 | 175 | 143 |
| 9 | 170 | 176 | 141 | 172 | 177 | 145 |
| 10 | 175 | 180 | 145 | 173 | 178 | 146 |
| 11 | 179 | 185 | 150 | 174 | 179 | 147 |
| 12 | 184 | 189 | 154 | 176 | 181 | 149 |
| 13 | 188 | 194 | 159 | 177 | 182 | 150 |
| 14 | 192 | 198 | 163 | 178 | 184 | 151 |
| 15 | 197 | 203 | 168 | 180 | 185 | 153 |
| 16 | 201 | 207 | 172 | 181 | 186 | 154 |
| 17 | 206 | 212 | 177 | 183 | 188 | 156 |
| Fórmulas * | PAS P95 =
135,40 + 4,48 x idade PAS P90 = 129,75 + 4,48 x idade PAS média prevista = 100,39 + 4,48 x idade |
PAS P95 =
164,39 + 1,37 x idade PAS P90 = 159,21 + 1,37 x idade PAS média prevista = 132,27 + 1,37 x idade |
||||
P: percentil; PAS: pressão arterial sistólica.
Idade em anos. Adaptado de: Sasaki T et al. Blood Pressure Response to Treadmill Cardiopulmonary Exercise Test in Children with Normal Cardiac Anatomy and Function. 424
Figura 2. Nomogramas de comportamento da pressão arterial sistólica máxima em relação ao sexo, raça e área de superfície corporal. A linha contínua representa o percentil 50 (P50) da pressão arterial sistólica. A linha tracejada superior representa o percentil 95 (P95), enquanto a linha tracejada inferior representa o percentil 5 (P05). Área de superfície corporal (m2). Adaptado de: Alpert BS et al. Responses to Ergometer Exercise in a Healthy Biracial Population of Children. 422 .
Os critérios recomendados para a avaliação e descrição do comportamento da PA no TE em crianças e adolescentes são apresentados na Tabela 23 .
Tabela 23. Comportamento da pressão arterial ao TE/TCPE em crianças e adolescentes.
| Termo | Critérios ** |
|---|---|
| PA normal em repouso | |
| PA elevada em repouso |
|
| Resposta normal da PA ao esforço e recuperação |
|
| Hipertensão pré-teste com resposta normal da PA ao esforço |
|
| Resposta hipertensiva/exagerada ao esforço |
|
| Hipotensão/queda da PA intraesforço **** |
|
| Reserva pressórica deprimida | ΔPAS = PASpico esforço – PAS repouso.
424
|
| Resposta normal da PA na recuperação |
|
PA: pressão arterial; PAS: pressão arterial sistólica; PAD: pressão arterial diastólica; ΔPAS: variação da PAS com o esforço; P: percentil; ♂ = masculino; ♀ = feminino.
Descrever se a resposta da PA é em vigência de uso ou não de anti-hipertensivos.
Relatar a tabela de referência e o valor do percentil utilizados.
Raramente crianças e adolescentes sem doença cardíaca clinicamente significativa apresentarão hipotensão esforço-induzida; pode estar relacionada à desidratação, dose inadequada de anti-hipertensivo ou esforço extenuante prolongado.
Particularidades da resposta da PA no TE em população pediátrica:
-
–
Hipertensão do avental branco: geralmente apresentam resposta exagerada da PAS com o esforço, podendo representar um estado pré-hipertensivo. 46
-
–
Risco futuro de hipertensão: há evidências de que a resposta exagerada da PA ao esforço em crianças e adolescentes aparentemente saudáveis seja preditora de HAS futura. 429 , 430
-
–
Associação com HVE: resposta hipertensiva da PAS e/ou da PAD em crianças e adolescentes normotensos (principalmente naqueles com história familiar de hipertensão) se correlacionam com grau de HVE. 47 , 431 – 433
-
–
Estenose aórtica: à medida que a estenose da valva aórtica (subvalvar ou supravalvar) se torna mais grave, o aumento da PAS ao esforço é significativamente menor. Na estenose grave, a elevação da PAS geralmente situa-se entre 10 e 20 mmHg. 134 , 383 , 434 , 435 Raramente ocorre queda da PAS no esforço, que se relaciona ao comprometimento da função ventricular (gradiente >70 mmHg). 436 O ΔPAS ao esforço ≥35 mmHg demonstrou melhor prognóstico. 437
-
–
Cardiomiopatia hipertrófica (CMH) : o ΔPAS ao esforço <20 mmHg ou queda da PAS >20 mmHg em crianças e adolescentes estão associados ao maior risco de morte cardíaca. 155 , 438
-
–
Coarctação da aorta ( CoAo ): após correção cirúrgica bem-sucedida, até um terço dos pacientes permanece ou se torna hipertenso. A reposta hipertensiva ao esforço é comum, mesmo na ausência de obstrução residual significativa. 49 , 439 , 440
-
–
Atletas: a elevação da PAS em crianças e adolescentes fisicamente ativos costuma ser mais lenta do que em sedentários e obesos. 441 Adolescentes aparentemente saudáveis e altamente treinados geralmente apresentam ΔPAS maior do que os não treinados. Equações para predição da PAS em atletas (entre 10 e 18 anos) em qualquer momento do TE: 442
Sexo masculino: PAS esforço (mmHg) = −1,92 × idade + 0,55 × carga de trabalho + 120,84
Sexo feminino: PAS esforço (mmHg) = −0,88 × idade + 0,48 × carga de trabalho + 111,22
Observação: idade em anos; carga de trabalho em watts (W).
3.2.3. Duplo-Produto
O duplo-produto (DP) expressa o VO2 miocárdico, sendo calculado através da multiplicação da FC pela PAS a qualquer momento do TE/TCPE:
Em crianças e adolescentes, o DP em repouso geralmente é influenciado pelo sexo (menor no sexo feminino), pelos índices antropométricos (IMC, relação cintura quadril e percentual de gordura corporal) e nível de ACR. O Anexo 4 apresenta informações sobre valores do DP em repouso e no pico do esforço de população pediátrica aparentemente saudável, com IC e com CoAo. 428 , 443 , 444
Comportamento do DP:
-
–
Em crianças aparentemente saudáveis, correlacionou-se positivamente com a idade.
-
–
No segundo estágio de protocolo incremental e no pico do esforço, é útil na previsão de hipertensão sistólica na adolescência, independentemente da PAS de repouso e dos fatores de risco CV convencionais. 445
-
–
Pacientes com doença de Kawasaki apresentam DP máximo significativamente menor. 15
3.3. Respostas Eletrocardiográficas
Para a adequada análise, descrição e interpretação das respostas eletrocardiográficas na população pediátrica, recomenda-se:
-
–
Verificar o posicionamento e a correta fixação dos eletrodos para minimizar erros e artefatos. 446 , 447
-
–
Considerar os efeitos dos filtros de ECG que estiverem sendo utilizados (alta, média, baixa frequência) para a estabilização da linha de base, redução de artefatos musculares e de rede elétrica. Em adolescentes, utilizar filtros de alta frequência de no mínimo 150 Hz e, em crianças, até 250 Hz. Filtros com frequências mais baixas podem interferir na captação das espículas de MP. 308 , 448 , 449
-
–
Sugere-se utilizar sistemas de medições automatizados para os intervalos, durações e amplitudes das ondas e segmentos do ECG adaptados e validados para a população pediátrica. 11 , 188 , 450
-
–
Utilizar a normatização para a emissão de laudos eletrocardiográficos da Diretriz da Sociedade Brasileira de Cardiologia sobre a Análise e Emissão de Laudos Eletrocardiográficos – 2022 e os valores de referência dos principais parâmetros eletrocardiográficos ajustados às diversas faixas etárias da população pediátrica ( Tabela 24 ). 308 , 451
-
–
Revisar os valores das medidas automatizadas de modo a afastar erros por possíveis interferências, artefatos ou anormalidades do traçado subjacente. 452 , 453
-
–
Descrever de maneira detalhada e contextualizada o registro eletrocardiográfico para a população pediátrica e suas doenças.
Tabela 24. Valores de referência dos principais parâmetros eletrocardiográficos em repouso de crianças e adolescentes.
| 1-3 anos | 3-5 anos | 5-8 anos | 8-12 anos | 12-16 anos | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Mín | Máx | Mín | Máx | Mín | Máx | Mín | Máx | Mín | Máx | |
| FC (bpm) | 89 | 152 | 73 | 137 | 65 | 133 | 62 | 130 | 60 | 120 |
| P Dll amplitude (mV) | 0,07 | 0,25 | 0,03 | 0,25 | 0,04 | 0,25 | 0,03 | 0,25 | 0,03 | 0,25 |
| P duração (ms) | 63 | 113 | 67 | 102 | 73 | 108 | 78 | 117 | 78 | 122 |
| SâP | -12 | 19 | -13 | 69 | -54 | 72 | -17 | 76 | -24 | 76 |
| PRi Dll (ms) | 80 | 150 | 80 | 160 | 90 | 160 | 90 | 170 | 90 | 180 |
| SâQRS | 7 | 102 | 6 | 104 | 10 | 139 | 6 | 116 | 9 | 128 |
| QRS V5 (ms) | 30 | 80 | 30 | 70 | 30 | 80 | 40 | 90 | 40 | 90 |
| Q aVF (mV) | 0,00 | 0,32 | 0,00 | 0,29 | 0,00 | 0,25 | 0,00 | 0,27 | 0,00 | 0,24 |
| Q V1 (mV) | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 |
| Q V6 (mV) | 0,00 | 0,28 | 0,01 | 0,33 | 0,01 | 0,46 | 0,01 | 0,28 | 0,00 | 0,29 |
| R V1 (mV) | 0,20 | 1,80 | 0,10 | 1,80 | 0,10 | 1,40 | 0,10 | 1,20 | 0,10 | 1,00 |
| R V6 (mV) | 0,60 | 2,30 | 0,80 | 2,50 | 0,80 | 2,60 | 0,90 | 2,50 | 0,70 | 2,30 |
| S V1 (mV) | 0,10 | 2,10 | 0,20 | 2,20 | 0,30 | 2,30 | 0,30 | 2,50 | 0,30 | 2,20 |
| S V6 (mV) | 0,00 | 0,70 | 0,00 | 0,60 | 0,00 | 0,40 | 0,00 | 0,40 | 0,00 | 0,40 |
| T V1 (mV) | -0,60 | -0,10 | -0,60 | 0,00 | -0,50 | 0,20 | -0,40 | 0,30 | -0,40 | 0,30 |
| T V6(mV) | 0,10 | 0,60 | 0,15 | 0,70 | 0,20 | 0,75 | 0,20 | 0,70 | 0,10 | 0,70 |
| R/S V1 | 0,10 | 4,30 | 0,03 | 2,70 | 0,02 | 2,00 | 0,02 | 1,90 | 0,02 | 1,80 |
| R/S V6 | 0,30 | 27,00 | 0,60 | 30,00 | 0,90 | 30,00 | 1,50 | 33,00 | 1,40 | 39,00 |
| QTc (ms) | 381 | 455 | 377 | 448 | 365 | 447 | 365 | 447 | 362 | 449 |
Mín: mínima; Máx: máxima; ms: milissegundos; mV: milivolts; FC: frequência cardíaca; bpm: batimentos por minuto; PRi: intervalo PR; QTc: intervalo QT corrigido; SâP: eixo da onda P; SâQRS: eixo dos complexos QRS. Adaptado de: Samesima N et al. Diretriz da Sociedade Brasileira de Cardiologia sobre a Análise e Emissão de Laudos Eletrocardiográficos – 2022. 308
Quanto ao ECG na população pediátrica: 451
-
–
Deve ser avaliado de acordo com a idade da criança. Crianças menores apresentam padrão precordial com domínio do VD e, com a progressão dos anos, assume padrão do ECG do adulto com predomínio fisiológico do VE.
-
–
Nas CC, o ECG reflete as alterações anatômicas e suas repercussões hemodinâmicas sobre as câmaras cardíacas.
-
–
As deformidades torácicas, má posição cardíaca e/ou alterações do ritmo cardíaco limitam a interpretação.
3.3.1. ECG de Repouso
Existem alterações no ECG de repouso em crianças e adolescentes que estão associadas a condições patológicas, maior risco de complicações durante o TE/TCPE e risco de morte súbita ( Tabela 25 ). Essas alterações podem interferir na interpretação de alterações esforço-induzidas.
Tabela 25. Alterações no ECG de repouso em crianças e adolescentes associadas a condições patológicas, maior risco de complicações ao TE/TCPE e risco de morte súbita 64 , 462 .
| Componente do ECG | Alteração | Associação |
|---|---|---|
| Onda P | Aumento, sobrecarga do átrio esquerdo: porção negativa da onda P na derivação V1 com profundidade ≥0,1 mV e duração ≥0,04 s. | Valvopatia; CC. |
| Aumento, sobrecarga do átrio direito (SAD): onda P pontiaguda nas derivações II e III ou V1 com amplitude ≥0,25 mV. | Valvopatia; CC. | |
| Complexo QRS | Desvio do eixo do plano frontal: para direita ≥ +120° ou esquerda −30° a -90°. | CC; CMD; distúrbio da condução intraventricular. |
| Aumento de amplitudes: amplitude da onda R ou S em uma das derivações dos membros ≥2 mV, onda S na derivação V1 ou V2 ≥3 mV, ou onda R na derivação V5 ou V6 ≥3 mV. | CC; HVE; valvopatia. | |
| Ondas Q anormais (duração ≥0,04 s ou ≥25% da altura da onda R subsequente) ou padrão QS em duas ou mais derivações. | CMH; CMD; VENC; miocardite; IAM prévio. | |
| Bloqueio de ramo direito ou esquerdo com duração de QRS ≥0,12 s. | CMD; CMH; VENC; sarcoidose; miocardite; CC. | |
| Onda épsilon (deflexão positiva no final do QRS nas derivações V1 e V2). | CAVD. | |
| Segmento ST, Onda T e QTc | Infradesnivelamento do segmento ST. | CC; CMH; CMD; VENC; CAVD; miocardite. |
| Inversão ou achatamento da onda T em duas ou mais derivações (derivações laterais). | CMH; CMD; VENC; CAVD; miocardite. | |
| Prolongamento do intervalo QT corrigido pela frequência cardíaca >0,44 s em no sexo masculino e >0,46 s no sexo feminino. | Síndrome do QT longo. | |
| Anormalidades de ritmo e condução | Batimentos ventriculares prematuros ou arritmias ventriculares mais graves. | CMH; CMD; VENC; CAVD; miocardite; sarcoidose. |
| Taquicardias supraventriculares, flutter atrial ou fibrilação atrial. | Doença miocárdica ou elétrica. | |
| Intervalo PR curto (<0,12 s) com ou sem onda "delta". | WPW; síndrome do PR curto. | |
| Bradicardia sinusal com frequência cardíaca de repouso ≤40 bpm. | CC; doença do nó sinusal; doença miocárdica ou elétrica. | |
| Bloqueio atrioventricular de primeiro (PR ≥0,21 s), segundo ou terceiro grau. | Doença miocárdica ou elétrica; bloqueio atrioventricular congênito. |
BRE: bloqueio de ramo esquerdo; CAVD: cardiomiopatia arritmogênica do ventrículo direito; IAM: infarto agudo do miocárdio; CMD: cardiomiopatia dilatada; CMH: cardiomiopatia hipertrófica; VENC: ventrículo esquerdo não compactado; CC: cardiomiopatia congênita; WPW: Síndrome de Wolff-Parkinson-White; HVE: hipertrofia ventricular esquerda; QTc: intervalo QT corrigido.
O padrão de repolarização precoce (PRP) é comum na população pediátrica, devendo ser contextualizado: 454 , 455
-
–
O padrão ascendente difuso é comum entre os jovens, naqueles de etnia europeia, sendo encontrado igualmente em ambos os sexos e sem correlação aparente com arritmias atriais ou ventriculares. 456
-
–
Atletas pediátricos costumam apresentar ponto J com entalhe e segmento ST rapidamente ascendente e côncavo, principalmente nas derivações ínfero-laterais. Outras alterações: bradicardia sinusal em repouso, aumento da voltagem da onda R em derivações precordiais e periféricas, aumento do índice Sokolow. 457
-
–
Nos atletas com idade ≥14 anos, sugere-se utilizar os critérios de Seattle para o aprimoramento diagnóstico do PRP. 458 – 460
Outras causas de PRP: padrão de ST juvenil, hipotermia ou hipertermia, hipocalcemia, hiperpotassemia, doença pericárdica (pericardite, cisto pericárdico, tumor pericárdico), tumor do miocárdio (lipoma), cardiomiopatia hipertensiva, isquemia miocárdica, timoma, cardiomiopatia arritmogênica do VD, cardiomiopatia de Takotsubo, miocardite e doença de Chagas. 458 , 459 , 461
3.3.2. Respostas ao Esforço e Recuperação
Na população pediátrica saudável, as respostas eletrocardiográficas do TE/TCPE (esforço e recuperação) são geralmente diferentes das observadas em adultos, inclusive quanto aos critérios de isquemia, cujas particularidades serão apresentadas a seguir.
3.3.2.1. Onda P e Intervalo PR
No ECG de repouso, as ondas P representam a despolarização atrial e são melhor visualizadas em DII e V1. A condução normal do nó sinoatrial resultará em uma onda P positiva nas derivações I, II e aVF. A amplitude máxima da onda P não muda significativamente durante a infância ( Tabela 24 ), e sua duração geralmente é <100 ms. É considerada como anormal se amplitude >0,25 mV (2,5 mm) em DII, em qualquer idade. 450 , 463 – 465
Em crianças, os critérios de amplitude e duração na hipertrofia atrial só devem ser aplicados quando o ritmo for sinusal com eixo de onda P entre 0 e 90°. Onda P com amplitude >0,25 mV (2,5 mm) sugere aumento do átrio direito. Onda P entalhada e alargada (duração >110 ms) em DII e/ou bifásica em V1 com deflexão terminal negativa >40 ms sugere aumento do átrio esquerdo. 466 , 467
A dispersão da onda P corresponde à diferença entre os valores máximo e mínimo de duração das ondas P nas derivações do ECG. A dispersão da onda P e a duração máxima da onda P no ECG de repouso são úteis para avaliar o padrão de distribuição do impulso sinusal, os tempos de condução intra e interatrial, apresentando valor preditivo positivo (VPP) para arritmias em crianças com CC. 468 , 469
O intervalo PR (PRi) varia com a faixa etária da criança (vide Tabela 24 ). Seu limite inferior encontra-se entre 80 e 90 ms, e o limite superior entre 150 e 180 ms. Principais alterações quanto à duração do PRi:
-
–
Prolongado geralmente associado a CC, miocardite e hipercalemia.
-
–
Curto, associado a síndrome de Wolff-Parkinson-White (WPW) e suas variantes, e doença de armazenamento de glicogênio.
Durante o TE, geralmente observam-se:
-
–
Aumento da amplitude da onda P. Em crianças aparentemente saudáveis, de ambos os sexos entre 5 e 12 anos (média 10,3 anos), a amplitude da onda P no pico do esforço pode atingir 2,57±0,76 mm (ECG de repouso: 1,84±0,48 mm; p<0,001). 470
-
–
Diminuição progressiva do PRi com o aumento da FC por aceleração na transmissão dos potenciais através dos átrios e do nó atrioventricular (ativação simpática). No pico do esforço, o PRi geralmente situa-se entre 100 e 140 ms. 177
-
–
Na recuperação, frequentemente observa-se aumento da duração do PRi com diminuição da FC, que podem estar associadas a arritmia sinusal, curtos períodos de ritmo juncional e ritmo atrial ectópico.
Respostas anormais durante o TE:
-
–
Duração prolongada da onda P, duração máxima da onda P aumentada e aumento da dispersão da onda P no ECG de repouso têm sido descritas associadas à comunicação interatrial ostium secundum em crianças saudáveis, hipertrofia atrial, estenose pulmonar, tetralogia de Fallot, síndrome de Eisenmenger, pós-cirurgia de Fontan, bloqueio interatrial, cardiomiopatia induzida pela quimioterapia, arritmias, hipertensão e infecções virais. 464 , 468 , 471 – 475
-
–
Ritmo atrial ectópico (ondas P invertidas nas derivações II e/ou aVF) no ECG de repouso, normalmente retorna ao ritmo sinusal com o esforço/aumento da FC. A persistência do ritmo atrial ectópico geralmente é observada em pacientes com CC. 476 , 477
-
–
Em crianças e adolescentes com bloqueio atrioventricular (BAV) de primeiro grau acentuado (PRi extremamente prolongado) no ECG de repouso e sua persistência com a progressão do esforço, costumam ocorrer intolerância ao esforço, palpitações, pré-síncope e síncope associados ao fenômeno de dissociação atrioventricular, diagnosticando a pseudossíndrome do marca-passo. 478 , 479
3.3.2.2. Onda Q
A onda Q apresenta comportamento distinto durante as fases de crescimento da criança. Crianças na faixa etária de 6 meses a 3 anos podem apresentar ondas Q anormais (em DIII e V6) de até 0,6 a 0,8 mV. A amplitude da onda Q atinge seu máximo por volta dos 3 a 5 anos, com subsequente diminuição, mas sem normalizar. 450 , 451 , 463 , 480 , 481
Em crianças aparentemente saudáveis, entre 8 e 16 anos, as ondas Q em V6 podem atingir até 0,23 a 0,5 mV. Em adolescentes, sugere-se adotar os "Critérios Internacionais" em detrimento dos "Critérios de Seattle" quanto às ondas Q patológicas, em que: 482 , 483
-
–
Nos "Critérios de Seattle", ondas Q patológicas são definidas como >3 mm de profundidade ou >40 ms de duração em duas ou mais derivações (excluindo derivações DIII e aVR). 460
-
–
Nos "Critérios Internacionais", as ondas Q patológicas são definidas como uma relação Q/R ≥0,25 ou uma onda Q ≥40 ms de duração em duas ou mais derivações (excluindo DIII e aVR). 484
-
–
A adoção dos "Critérios Internacionais" resultou em redução de ≈84% de ondas Q patológicas falso-positivas, em consequência do aumento da voltagem dos complexos QRS secundários à prática esportiva e/ou baixa impedância em adolescentes magros. 485 , 486
Particularidades da onda Q:
-
–
Na avaliação pré-teste, ondas Q anormais no ECG de repouso sugerem via acessória a ser confirmada. Ondas Q patológicas isoladas nas derivações V1 e V2 geralmente são decorrentes de posicionamento inadequado dos eletrodos. A ocorrência de ondas Q patológicas em duas ou mais derivações contíguas pode estar associada a cardiomiopatia dilatada, CMH, VE não compactado e infarto prévio (decorrente de doença de Kawasaki, origem anômala de coronárias etc.). 476 , 484 , 487 , 488
-
–
Em estudo caso-controle com 44 pacientes com doença de Kawasaki (DK), idade de 7,7±4,8 anos, 22 pacientes foram submetidos a TE para investigação de isquemia miocárdica, dos quais 50% apresentaram alterações isquêmicas (7 com onda Q anormal) com DAC significativa à cineangiocoronariografia. O escore de gravidade das lesões coronarianas no SPECT foi significativamente maior naquelas com ondas Q anormais (51,0±38,8 versus 20,0±12,1, p<0,05). 489
3.3.2.3. Onda R e Onda S
Em crianças >3 anos de idade (similarmente ao observado em adultos), observa-se ativação ventricular normal no plano horizontal (derivações precordiais), com onda S dominante em V1, amplitudes de R e S semelhantes em V2 e V3 e ondas R dominantes de V4 a V6. 490
Ao esforço, em crianças aparentemente saudáveis, a amplitude da onda R em derivações nas quais é normalmente proeminente (V5 e V6) geralmente diminui em média 5 mm, entretanto, a amplitude da onda R pode permanecer inalterada ou mesmo aumentar. As respostas da amplitude da onda R aparentemente não têm significado diagnóstico, diferentemente do que ocorre na população adulta. 470 , 491
No ECG de repouso de crianças, a observação de onda R >25 mm em V6, onda Q >5 mm em V6 e onda S >20 mm em V1 sugere HVE. No esforço, a onda S geralmente mantém sua amplitude ou apresenta pequeno aumento, enquanto, na recuperação, costuma ocorrer aumento. 470
Particularidades das ondas R e S na população pediátrica:
-
–
Estudo em 170 crianças negras aparentemente saudáveis de 7 a 14 anos (idade média de 10,5 anos; 56% do sexo feminino) para determinar o padrão de resposta eletrocardiográfica infantil ao esforço, demonstrou que a amplitude da onda R diminuiu de 27±8 para 22±8 mm (p<0,01), e a amplitude da onda S aumentou de 6,9±4,4 para 7,8±5 mm (p<0,01). 491
-
–
Estudo em 46 adolescentes (idade média 16,1 anos; sexo masculino) para avaliar a mudança na amplitude da onda R (em V5) durante TE demonstrou que nos normotensos ocorreu redução progressiva da amplitude da onda R (de até 3,8 mm), enquanto nos hipertensos não houve redução (p<0,001). 492
-
–
Estudo em 55 adolescentes (idade média 15,9 anos; 29 com HAS) para avaliação do efeito de terapia farmacológica no comportamento da amplitude da onda R durante TE demonstrou que, após 16 semanas de tratamento, a amplitude apresentou redução com padrão similar ao dos normotensos. 493
-
–
A duração do QRS normalmente permanece estável ou diminui ligeiramente durante o esforço progressivo.
3.3.2.4. Onda T e Onda U
Na infância, o padrão da onda T, particularmente nas derivações precordiais, é diferente dos adultos, havendo mudança progressiva no eixo da onda T com a idade. A persistência de onda T positiva em V1 ou V3R além da primeira semana de vida geralmente ocorre na hipertrofia ventricular direita (HVD). Geralmente, a onda T permanece negativa em V1 e V3R na faixa etária de 12 a 16 anos. 494 , 495
Na primeira infância, a onda T é frequentemente negativa nas derivações V2 e V3, positivando com a progressão da idade. Na faixa etária de 8 a 12 anos, apenas 5 a 10% apresentam ondas T negativas em V2. 496 – 499 Em V5 e V6, a onda T geralmente é positiva em todas as faixas etárias. 388 , 500
Presença de onda T negativa no ECG de repouso:
-
–
São consideradas anormais se em duas ou mais derivações contíguas (excluindo V1, aVR e DIII) e com uma profundidade de ≥1 mm. Nas derivações ínfero-laterais (DII, DIII, aVF, V4-V6) geralmente está associada a CMH e HVE. 501 – 503 Nos atletas adolescentes, em derivações laterais também costuma associar-se a hipertrofia e deslocamento apical dos músculos papilares, podendo ser normal. 504 – 506
-
–
Assimétricas ou bifásicas, sem depressão do segmento ST e nas derivações V1–V4 são relativamente comuns em adolescentes assintomáticos (idade <16 anos) e atletas jovens negros. 484 , 496 , 501 , 507
-
–
Em derivações anteriores precedida de elevação do ponto J com supradesnivelamento do segmento ST (SSTs) estão presentes em até 25% dos atletas jovens afro-caribenhos, sendo característica do "coração do atleta negro". 501 , 508 , 509 Entretanto, a ocorrência de SSTs sem elevação do ponto J precedendo a onda T negativa pode estar associada a cardiomiopatia. 508 , 510
-
–
Em derivações inferiores e anteriores (V1–V3) seguidas de ondas T positivas em V5 (fenômeno da descontinuidade da onda T) estão geralmente associadas a cardiomiopatia arritmogênica do ventrículo direito (CAVD). 511 , 512
Particularidades da onda T no TE:
-
–
Em crianças saudáveis, a duração da onda T diminui progressivamente com o esforço. Enquanto a amplitude geralmente diminui no esforço leve, subsequentemente aumenta com a progressão do esforço, podendo ultrapassar a amplitude basal no pico do esforço (em V5, de 4,8 mm em repouso para 7,3 mm). 177 , 470 , 491 , 500
-
–
O TE é normalmente utilizado para avaliação do comportamento da onda T negativa e sua associação com arritmia esforço-induzida, inclusive em atletas adolescentes. 462 , 484 , 504 , 513
-
–
Na população pediátrica com onda T negativa, assintomática e sem cardiopatias, é frequente a ocorrência de "pseudonormalização da onda T" (positivação da onda T) de forma total (em todas as derivações) ou parcial (em derivações laterais). Esse comportamento é geralmente benigno, não estando associado a risco de eventos. 514 , 515
-
–
Em atletas jovens com onda T negativa, a ocorrência de TV ou aumento da densidade de extrassístoles ventriculares (EVs) esforço-induzidas é considerada sugestiva de cardiomiopatia arritmogênica. 516 , 517
-
–
Na síndrome do QT longo congênito (SQTL), pode ocorrer alternância da onda T associada a incompetência cronotrópica, taquiarritmias ventriculares e comportamento paradoxal do QTi (aumentando em vez de diminuir). 6
3.3.2.5. Segmento ST/Infradesnivelamento do Segmento ST
As alterações esforço-induzidas do segmento ST têm sido utilizadas para identificar isquemia miocárdica em crianças, adolescentes e adultos. Na população pediátrica, o critério para isquemia é diferente dos critérios em adultos, correspondendo ao infradesnivelamento do segmento ST (ISTs), de morfologia horizontal (retificado) ou descendente ≥1 mm (≥0,10 mV) medido no ponto Y (em 60 ms do ponto J) em relação à linha de base. 7 , 11 , 177 , 300
Nessa população, são utilizados dois critérios de definição de linha de base para a medição do ISTs ( Figura 3 ): 7 , 11
Figura 3. Métodos de definição da linha de base isoelétrica para medição de alterações do segmento ST. Independentemente do método utilizado, as linhas de base encontradas possuem pontos semelhantes para a medição/quantificação de eventuais desnivelamentos do segmento ST. *Ponto no qual se deve basear a medição do infradesnivelamento pelo método da linha isoelétrica PR.
Método da linha isoelétrica PR: a linha de base (linha isoelétrica PR) é sobreposta ao segmento PR do complexo QRS para identificar o ponto J.
Método da linha isoelétrica PQ-PQ: a linha de base é estipulada conectando os pontos PQ de pelo menos três complexos QRS consecutivos para identificar o ponto J.
O infradesnivelamento isolado do ponto J (sem ISTs) esforço-induzido não deve ser valorizado no diagnóstico de isquemia. Na população pediátrica assintomática e aparentemente saudável, o infradesnivelamento do ponto J pela linha isoelétrica PQ foi observado em 9% dos meninos e em 18% das meninas, enquanto que, pela linha isoelétrica PR, foi de 2,3% em ambos os sexos.
Na população pediátrica aparentemente saudável, é considerado normal e não isquêmico o infradesnivelamento do segmento ST esforço-induzido (ISTE) ( Figura 4 ) com: 7 , 11 , 300
Figura 4. Comportamento do segmento ST e tipos de infradesnivelamento. Infrad.: infradesnivelamento; STs: segmento ST. O infradesnivelamento do segmento ST de qualquer morfologia (<1 mm no ponto Y), principalmente se apresentar normalização precoce (no primeiro minuto da recuperação), é considerado normal (não isquêmico). *Ascendente (depressão do ponto J seguido de infradesnível do segmento ST rapidamente ascendente e sem depressão no ponto Y medido em 60 ms do ponto J) ou ascendente lento (ponto J infradesnivelado com segmento ST ascendendo lentamente além do ponto Y) são considerados normais, não isquêmicos. **Horizontal (retificado) ou descendente, com ISTs ≥1 mm (≥0,10 mV) medido no ponto Y, são considerados alterados, isquêmicos.
-
–
Morfologia ascendente (depressão do ponto J seguido de infradesnível do segmento ST rapidamente ascendente e sem depressão no ponto Y, medido em 60 ms do ponto J) ou ascendente lento (ponto J infradesnivelado com segmento ST ascendendo lentamente além do ponto Y).
-
–
Qualquer morfologia com infradesnível <1 mm no ponto Y, principalmente se apresentar normalização precoce (no primeiro minuto da recuperação).
As seguintes situações invalidam a interpretação de alterações da repolarização quanto à isquemia: síndrome de WPW; variantes da síndrome de pré-excitação; BRE; MP artificial estimulando o ventrículo; ISTs ≥1 mm no ECG de repouso; terapêutica com digitálicos; ECG com qualidade técnica insatisfatória. 7
Particularidades do ISTE na população pediátrica:
-
–
ISTE não associado à isquemia por DAC pode ocorrer na hiperventilação, distúrbios hidroeletrolíticos, anemia, pectus excavatum e prolapso da válvula mitral (PVM). 177 , 286
-
–
Na estenose aórtica valvar adquirida, o ISTE ocorre em ≈83% dos pacientes, estando relacionado à pressão sistólica do VE, ao gradiente de saída do VE e ao desequilíbrio entre oferta-consumo de O2. Após a correção cirúrgica da estenose aórtica valvar grave, costuma ocorrer redução ou desaparecimento do ISTE. 434 , 518 , 519
-
–
Na estenose aórtica congênita, também é comum a ocorrência de ISTE. Entretanto, após cirurgia de Ross, não ocorre redução significativa do ISTE. Após valvotomia aórtica (cirúrgica ou por balão), tem sido observado aumento do ISTE. 140
-
–
Após cirurgia de Fontan, na síndrome do coração esquerdo hipoplásico (SCEH), o ISTE que ocorre em ≈48% dos pacientes não está associado à disfunção ventricular, DAC ou anormalidades de origem coronariana. 520
-
–
A isquemia esforço-induzida em pacientes com CMH associa-se ao maior risco de morte súbita cardíaca (MSC) [risco relativo (RR): 3,32; intervalo de confiança de 95% (IC95%): 1,27-8,70] e de morte por todas as causas e/ou transplante (RR: 4,86; IC95%: 1,69-13,99). 157
3.3.2.6. Supradesnivelamento do Segmento ST
O supradesnivelamento do segmento ST esforço-induzido (SSTE) é definido como uma elevação do segmento ST ≥1,0 mm (≥0,10 mV) em 60 ms após o ponto J, ocorrendo em duas ou mais derivações, independentemente de presença de onda Q ( Figura 5 ). 1 , 7 , 521
Figura 5. Padrões de supradesnivelamento do segmento ST incluindo a repolarização precoce. STs: segmento ST; Suprad.: supradesnivelamento; SSTs: supradesnivelamento do segmento ST; ms: milissegundos. *Supradesnivelamento do segmento ST esforço-induzido (≥1,0 mm medido a 60 ms após o ponto J). **No padrão de repolarização precoce, o supradesnivelamento do segmento ST deve ser medido a 100 ms após o ponto Jt, sendo também utilizado para avaliar o padrão de supradesnivelamento (ascendente, horizontal/descendente).
Na população pediátrica, o SSTE geralmente está associado a: isquemia miocárdica grave (geralmente transmural) em pacientes com DK, origem anômala de coronárias, após cirurgia de reimplante de coronárias, entre outras; espasmo da artéria coronária por angina vasoespástica/Prinzmetal; aneurisma ventricular esquerdo; isquemia peri-infarto. 521 – 524
Sugere-se a utilização da descrição das derivações comprometidas por manifestações isquêmicas: 1 , 308
V1, V2, V3 (provável parede anterosseptal).
V1, V2, V3 e V4 (provável parede anterior).
V3, V4 ou V3-V5 (provável parede anterior localizada).
V4, V5, V6, D1 e aVL (provável parede ântero-lateral).
V1 a V6, D1 e aVL (provável parede anterior extensa).
V5 e V6 (provável parede lateral).
D1 e aVL (provável parede lateral alta).
D2, D3 e aVF (provável parede inferior).
Particularidades do SSTE: 1 , 7 , 521
-
–
No ECG de repouso, a presença de SSTs geralmente está associada a padrão de repolarização precoce, síndrome de Brugada (SBr), miocardite/pericardite e infarto prévio (com onda Q patológica).
-
–
Nos padrões de repolarização precoce e de SBr, geralmente observa-se a redução/desaparecimento do SSTs com o esforço. 126 , 525 , 526
-
–
O SSTE ≥0,3 mV (3 mm) em derivações sem ondas Q é critério de interrupção do esforço.
3.3.2.7. Repolarização Precoce
A repolarização precoce, na maioria dos pacientes, é uma variante assintomática e benigna do ECG, com elevação do ponto J e supradesnivelamento característico do segmento ST. Entretanto, parte dos pacientes apresenta quadro clínico e padrões eletrocardiográficos específicos de repolarização precoce que estão associados a MSC, configurando a síndrome de repolarização precoce. O padrão de repolarização precoce (PRP) pode ser observado em 1 a 13% da população geral. 527 , 528
As particularidades do ECG de repouso no PRP são: 529 , 530
Duração dos complexos QRS <120 ms.
Presença de entalhe ou de ligadura no final do QRS em inclinação descendente de onda R proeminente. Se houver um entalhe, ele deve ficar totalmente acima da linha de base. O início de uma ligadura (Jo) também deve estar acima da linha de base ( Figura 5 ).
O ponto Jp (pico do entalhe do ponto J) deve ser ≥0,1 mV em duas ou mais derivações contíguas do ECG, exceto de V1 a V3. 531
Atletas pediátricos costumam apresentar ponto J com entalhe e segmento ST rapidamente ascendente e côncavo, principalmente nas derivações ínfero-laterais. Outras alterações: bradicardia sinusal em repouso, aumento da voltagem da onda R em derivações precordiais e periféricas e aumento do índice Sokolow. 457
Nos atletas com idade ≥14 anos, sugere-se utilizar os critérios de Seattle para o aprimoramento diagnóstico. 458 – 460 , 484 , 501 , 532
No PRP, o SSTs deve ser medido a 100 ms após o ponto Jt (final do entalhe do ponto J). Além da magnitude do supradesnivelamento, deve ser descrito o seu padrão: 454 , 455
-
–
"repolarização precoce com segmento ST ascendente", quando o segmento ST estiver inclinado para cima e seguido por uma onda T vertical.
-
–
"repolarização precoce com segmento ST horizontal ou descendente", quando o segmento ST for horizontal ou descendente (inclinado descendente).
Comportamento e significado do PRP no TE:
-
–
Comum em adolescentes, geralmente apresenta redução progressiva com o esforço, podendo ocorrer seu desaparecimento em cargas moderadas. O PRP com SSTs ascendente rápido, em derivações ântero-laterais, tem sido encontrado em atletas. 533
-
–
Em TE realizado após MSC abortada, arritmia ventricular sustentada e/ou síncope inexplicada, observou-se PRP persistente ao esforço. 534
-
–
A ocorrência de TV polimórfica esforço-induzida é marcador de alto risco para MSC. 527 , 535
-
–
Na população em geral, o retorno do PRP na recuperação é progressivo e lento. 536 , 537
3.3.2.8. Intervalo QT
O intervalo QT (QTi) é medido do início do QRS ao término da onda T, representando a duração total da atividade elétrica ventricular. 538 – 540
A avaliação do QTi durante o esforço e recuperação apresenta vários desafios em crianças e adolescentes:
-
–
A medição precisa do QTi é, muitas vezes, dificultada pelo retorno irregular da porção terminal da onda T à linha de base.
-
–
Em FC elevada, é comum observar a fusão das ondas T e P, dificultando identificar o final da onda T.
O aumento da velocidade de repolarização miocárdica ventricular associada ao esforço se reflete na diminuição progressivamente do QTi até o esforço máximo, aumentando linearmente na recuperação. 541
Devido à variação do QTi com a FC, recomenda-se corrigir o QTi pela FC (QTc) segundo a fórmula de Bazzet:
*QT medido em milissegundos e distância entre RR em segundos.
A Tabela 24 apresenta os valores de referência do QTc por faixa etária pediátrica.
A fórmula ideal de ajuste do QTc no TE permanece controversa. A interpretação do QTc e sua comparação aos resultados dos estudos da literatura dependem da fórmula utilizada. 124 , 542 – 544
Em estudos que investigam alterações de repolarização (por exemplo, nas síndromes do QT longo, defeitos cardíacos congênitos ou na avaliação de novos medicamentos), a fórmula de Bazzet apresenta limitações para FC <60 bpm ou >90 bpm, situações em que se sugere a utilização das fórmulas de Fridericia ou Framingham: 308 , 544 – 546
Em crianças de 1 a 15 anos, um QTc >440 ms é considerado o limite superior/limítrofe, enquanto o QTc >460 ms é considerado prolongado (independente do sexo). O QTc é considerado curto quando <340 ms. 308 , 451
A avaliação do comportamento do QTc tem importância no diagnóstico da SQTL congênita, na qual o seu aumento pode ocorrer durante o esforço e a recuperação.
Particularidades do QTi e do QTc na população pediátrica:
-
–
O QTi na recuperação aumenta à medida que a FC diminui em ≈15 ms a cada redução de 10 batimentos na FC, retornando ao padrão de repouso em torno de 4 a 5 minutos. 547
-
–
Em crianças com QTc limítrofe/escore de Schwartz intermediário, o TE permite estratificar o risco, selecionando as que devem ser submetidas a testes genéticos de modo seletivo. 57 , 547 – 549
-
–
O QTc absoluto ≥460 ms na recuperação ou com aumento paradoxal do QTc (ΔQTc = QTc recuperação – QTc basal, com valor ≥30 ms), distinguiu pacientes com SQTL1 com fenótipo manifesto do tipo oculto. 542
-
–
Na triagem para SQTL em crianças, o uso da fórmula de Bazett associa-se a elevado número de falsos-positivos, especialmente se a FC estiver aumentada. Nesses casos, sugere-se utilizar a fórmula de Fridericia. 544
3.3.3. Distúrbios Condução Atrioventricular, Intraventricular e da Formação do Impulso na População Pediátrica
3.3.3.1. Distúrbios Condução Atrioventricular
Em crianças e adolescentes, o BAV de primeiro grau e o BAV de segundo grau Mobitz tipo I geralmente estão associados à atividade parassimpática acentuada, sendo comum em adolescentes altamente treinados e em indivíduos que possuem tônus vagal acentuado. No ECG de repouso, é observado em 0,65 a 1,1% das crianças e em até 12% de adolescentes aparentemente saudáveis. 550 , 551 Geralmente, desaparecem com o esforço progressivo devido à retirada da atividade vagal e o aumento da atividade simpática. Raramente são desencadeados pelo esforço. 105
O BAV de segundo grau tipo II geralmente representa doença do sistema de condução AV (infranodal). Raramente é encontrado em atletas jovens aparentemente saudáveis. Pode estar associado ao bloqueio de ramo e ser secundário à cirurgia cardíaca prévia. O TE é útil na identificação do nível anatômico do bloqueio AV e estratificação de risco. 552 , 553
Na população pediátrica, o BAV de terceiro grau ou completo: 108 , 115 , 554 , 555
-
–
No bloqueio atrioventricular total (BAVT) congênito, há indicação de MP definitivo: sintomáticos; FC de repouso <55 bpm ou <70 bpm quando associado à cardiopatia estrutural. A Tabela 28 apresenta as principais causas de BAVT. 107 , 114
-
–
O TE pode ser realizado no BAVT congênito se não houver doenças (congênitas ou não) que reduzam a segurança do paciente.
-
–
O TE é empregado para documentar a sintomatologia, avaliar o aumento da resposta do escape ventricular, determinar eventual ocorrência de ectopias e sua repercussão hemodinâmica.
-
–
Muitos pacientes podem apresentar ACR normal.
-
–
Não devem ser utilizadas equações de predição de VO2max e nem de FCmax.
-
–
Existe variabilidade considerável na FC de escape que pode ser gerada pelo marca-passo ventricular intrínseco, normalmente entre 50 e 145 bpm.
-
–
A evolução natural do BAVT congênito consiste no declínio progressivo das frequências ventriculares ao longo da vida. No ECG de repouso, entre 6 e 10 anos, observa-se FC média de 50 bpm; entre 16 e 20 anos, de 45 bpm; e acima de 40 anos, de 38 bpm.
-
–
Fadiga, dispneia, tontura e ectopias ventriculares esforço-induzidas foram responsáveis por 26,5% dos implantes de MP. 556
-
–
A ectopia esforço-induzida é frequente (50 a 70% dos pacientes) e associou-se ao aumento de risco de morte súbita.
-
–
Nos pacientes com BAVT e graves anormalidades estruturais cardíacas a morte súbita, geralmente está associada a arritmia ventricular complexa. O BAVT localizado no sistema His-Purkinje apresenta pior prognóstico. 116 , 557 , 558
Tabela 28. Etiologia das bradiarritmias na população pediátrica 575 , 578 , 583 – 585 .
| Bradicardia sinusal/juncional | |
|---|---|
| Origem | Causas |
| Adaptativa | Hipervagotonia em atletas altamente treinados; indivíduos com tônus vagal acentuado. |
| Respiratória | Hipóxia; apneia/bradicardia da prematuridade. |
| Cardíaca | Disfunção do nó sinusal (hereditária ou secundária); cardiopatias congênitas; defeito do septo atrial; após cirurgia cardíaca/reparo transcateter. |
| Genética | Distúrbios hereditários progressivos da condução cardíaca: SCN5A, TBX5, SCN1B-LOF, CASQ2, HCN4 etc. |
| Neurocardiogênica | Aumento do tônus vagal; reflexo de Bezold-Jarisch; situacional (tosse, crises de retenção da respiração, sono etc.); estimulação esofágica, nasofaríngea, peritoneal ou retal. |
| Neurológica | Aumento da pressão intracraniana; malformação de Chiari. |
| Psiquiátrica | Anorexia nervosa. |
| Endócrina | Hipotireoidismo. |
| Medicamentosa | Betabloqueadores; agonistas alfa-2; fentanil; fenilefrina; metoxamina. |
| Miscelânia | Hipotermia. Hipoglicemia. Anormalidades eletrolíticas: hipo/hipercalemia; hipo/hipercalcemia; hipomagnesemia. |
| Bloqueio atrioventricular total/terceiro grau | |
| Origem | Causas |
| Cardíaca | Congênito; cardiopatias congênitas; distúrbios genéticos; síndrome do QT longo; transposição das grandes artérias; cirurgia cardíaca; doença arterial coronariana. |
| Imunológica | Doença do tecido conjuntivo materno; lúpus eritematoso sistêmico; síndrome de Sjögren. |
| Infecciosa | Miocardite; endocardite; doença de Lyme; doença de Chagas; difteria; rubéola; caxumba; triquinose; febre maculosa; vírus da imunodeficiência humana; doença reumática aguda. |
| Metabólica | Síndrome de Kearns-Sayre; deficiência de carnitina; doença de armazenamento de glicogênio. |
| Miscelânia | Distrofia muscular; cardiomiopatia eosinofílica; idiopática. |
3.3.3.2. Distúrbios da Condução Intraventricular
Anormalidades da condução intraventricular podem estar associadas à doença sistêmica ou cardiopatia subjacente.
O bloqueio de ramo direito (BRD) é comum em crianças aparentemente saudáveis (entre 6 e 17 anos), com incidência variando de 0,16 a 2,9%, sendo mais comum no sexo feminino. O BRD pode também ocorrer: na anomalia de Ebstein (prevalência entre 80 e 95%); defeito do septo atrial (DSA) do tipo ostium secundum (entre ≈90 e 100%); na displasia arritmogênica do VD; após cirurgia de correção da ToF (≈11%) ou do defeito do septo ventricular (DSV; ≈6%). O BRD associado ao bloqueio divisional anterossuperior esquerdo (BDASE) ocorre principalmente nas CC com defeitos do coxim endocárdico. A presença de BRD no ECG de repouso invalida a interpretação de alterações do segmento ST ao esforço apenas nas derivações de V1–V3. 1 , 7 , 279 , 370 , 553
No bloqueio do ramo esquerdo (BRE) no ECG de repouso deve ser feito o diagnóstico diferencial com WPW (via acessória de parede livre direita). Como achado isolado, o BRE em adolescente é raro e pode estar associado a doença progressiva do sistema de condução intraventricular, com ou sem cardiomiopatia. Também pode ser observado após cirurgia da via de saída do VE. A presença de BRE no ECG de repouso é uma limitação para a análise do segmento ST em relação à isquemia miocárdica, com redução da especificidade e acurácia do TE. 7 , 149 , 388 , 559
Os distúrbios da condução intraventricular esforço-induzidos, caracterizados por bloqueio do ramo direito ou do ramo esquerdo, raramente ocorrem na população pediátrica. Sua ocorrência tem sido observada tanto em crianças aparentemente saudáveis quanto naquelas com cardiopatia estrutural. 177
3.3.3.3. Distúrbios da Formação do Impulso
É comum a ocorrência de anormalidades do ritmo cardíaco em pacientes pediátricos, com e sem DCV. Frequentemente, as arritmias são isoladas, transitórias, episódicas e assintomáticas. As classificações quanto a morfologia, interrelações e densidade são similares às aplicadas para adultos e encontram-se descritas na Diretriz Brasileira de Ergometria em População Adulta – 2024. 1 , 149 , 278 , 280
Principais marcadores de risco para desenvolvimento de arritmias esforço-induzidas: disfunção grave do VE; MP; história de arritmia ou distúrbio do ritmo; ritmo basal não sinusal; CC; cirurgia de correção de CC. 105 , 560 , 561 Estudo demonstrou que 28% dos pacientes pediátricos submetidos ao TE desenvolveram anormalidades do ritmo cardíaco, sendo 3% clinicamente importantes (TV, taquicardia supraventricular, BAV de segundo grau, fibrilação atrial etc.), associadas a disfunção grave de VE e história prévia de arritmia. 105
3.3.3.3.1. Arritmias Ventriculares
No ECG de repouso da população pediátrica, as EVs monomórficas isoladas ocorrem com uma frequência de 0,3 a 2,2%. Nas crianças assintomáticas, sem doença cardíaca subjacente, com ECG normal e sem história familiar de MSC, essa arritmia é quase sempre benigna. As EVs tendem a desaparecer com o crescimento da criança. 562 – 565
O TE está indicado para avaliação de arritmias ventriculares em crianças e adolescentes com:
-
–
EVs (isoladas ou pareadas) identificadas em ECG durante consulta.
-
–
Palpitação, taquicardia, síncope, convulsões e/ou tonturas durante a prática de esportes ou outras atividades físicas.
-
–
Suspeita de canalopatias, via anômala ou TV catecolaminérgica.
O TE fornece informações úteis quanto ao comportamento das EVs e riscos associados. EVs são consideradas benignas quando apresentarem redução de sua densidade ou supressão com o esforço em consequência da taquicardia sinusal. 279 , 390 , 566 , 567
Crianças aparentemente saudáveis ocasionalmente apresentam raras EVs isoladas esforço-induzidas que podem ser consideradas benignas. Entretanto, a ocorrência de EVs frequentes, polimórficas ou complexas (pareadas e TV não sustentadas) sugerem instabilidade elétrica ventricular.
A TV é rara na população pediátrica. Quando presente, geralmente está associada a cardiopatia estrutural (particularmente na HVE), hereditária (TV polimórfica catecolaminérgica), relacionada a distúrbios elétricos (SQTL) ou idiopática (em jovens aparentemente saudáveis).
As arritmias ventriculares malignas geralmente ocorrem precocemente no esforço devido à excitação elétrica desencadeada pela atividade simpática. Nesses casos, há risco aumentado de taquiarritmias hemodinamicamente instáveis e MSC. 565 , 566
3.3.3.3.2. Arritmias Supraventriculares
As extrassístoles atriais isoladas no ECG de repouso geralmente são benignas e desaparecem com o esforço. 568 As extrassístoles supraventriculares (ESVs) isoladas ocorrem em ≈2% das crianças aparentemente saudáveis e em ≈4% das crianças com lesões estruturais cardíacas. 569
Paciente assintomáticos com ESVs isoladas esforço-induzidas geralmente apresentam boa evolução. Entretanto, extrassístoles atriais esforço-induzidas em crianças com história de síncope ou taquicardia inexplicada requerem maior atenção, pois podem ser gatilho para episódio de taquicardia supraventricular. 568
A incidência de taquicardia paroxística supraventricular (TPSV) em crianças é de 0,1 a 0,4%, e os principais tipos de apresentação, de acordo com a idade, encontram-se na Tabela 26 . 570
Tabela 26. Prevalência da TPSV em crianças e adolescentes de acordo com a idade 570 .
| Tipo | >1 a <10 anos | 10 a 18 anos | >18 anos |
|---|---|---|---|
| Via anômala | 60-65% | 50-60% | 40-50% |
| Reentrada nodal | 15-20% | 20-50% | 50-70% |
| Atrial ectópica | 4-6% | 3-4% | 3% |
Em crianças, a taquicardia supraventricular esforço-induzida (TPSV-EI) é rara, geralmente associada a reentrada por via de condução ventricular dentro do nó AV ou por via extranodal acessória (pré-excitação ventricular, síndrome de WPW). Em crianças e adolescentes sintomáticos, a TPSV-EI ocorreu em 12% dos TE. 569
O correto diagnóstico de TPSV-EI em FC elevadas é desafiador pela dificuldade na identificação de alterações nas ondas P, mesmo com complexos QRS normais ( Tabela 27 e Figura 6 ). Na população pediátrica, geralmente o achado inicial da TPSV associa-se ao aumento inesperado e abrupto da FC e/ou outras respostas inadequadas da FC com a modificação da carga de esforço. 570 , 571
Tabela 27. Características eletrocardiográficas das taquicardias (sinusal e supraventriculares) na população pediátrica 570 , 571 .
| Tipo | Onda P | PR > RP’ | FC (bpm) | BAV | Tipo | Idade de início | Particularidades |
|---|---|---|---|---|---|---|---|
| Taquicardia sinusal | Sim, padrão sinusal | -- | > FCmax prevista para idade | Não | NP | Qualquer | Valores de referência FCmax na Tabela 24 . |
| Taquicardia sinusal inapropriada | Sim, padrão sinusal | -- | >100 | Não | P ou PE | >15 anos | Com queixa de palpitações e associada à ansiedade, tontura, pré-síncope e síncope. |
| Taquicardia atrial focal/TEA | Onda P invertida/entalhada e duração >90 ms em V1 | Não | Frequência atrial >150% da FC média prevista | Sim | I | ≈7 anos | Pode evoluir para taquicardiomiopatia, geralmente reversível com o controle da arritmia. 572 , 573 |
| Taquicardia atrial multifocal | Várias morfologias | -- | >100 | Não | P | Qualquer | Presença de pelo menos três morfologias de ondas P e três intervalos PR diferentes. |
| Taquicardia juncional * | Pode apresentar-se sem onda P visível (dentro ou após o QRS) | -- | >100 | Não | P ou I | ≈1 ano | Congênita é rara e, nos pacientes sem cirurgia cardíaca prévia, pode ser refratária à terapia com alta morbimortalidade. Após cirurgia cardíaca, ocorre em até 5% dos pacientes. 574 |
| Reentrada NS | Padrão sinusal | Não | 170-300 | Sim | P | Qualquer | -- |
| Reentrada atrioventricular antidrômica | Não visível | Sim | 170-200 | Não | P | >6 anos | ECG de repouso geralmente com onda delta. Complexos QRS durante a taquicardia são alargados e aberrantes, podendo mimetizar taquicardia ventricular. |
| Reentrada atrioventricular ortodrômica | Morfologia diversa, dependendo da localização da via acessória | Sim | 220-360 | Não | P | <3 meses ou >6 anos | O QRS da taquicardia geralmente é estreito e a onda P retrógrada. |
| TJRP | Negativas em derivações inferiores | Não | <170 | Não | I | ≈6 anos | -- |
| Reentrada intra-atrial | Oscilante tipo flutter | -- | 160-220 | Sim | I | ≈12 anos | -- |
BAV: bloqueio atrioventricular; NS: nó sinusal; TJRP: taquicardia juncional reciprocante persistente; TEA: taquicardia ectópica atrial; NP: não é paroxística, acelera e termina gradualmente; P: paroxística; I: incessante; PE: persistente; FC: frequência cardíaca; FCmax: frequência cardíaca máxima; ECG: eletrocardiograma. *Também denominada como taquicardia ectópica juncional.
Figura 6. Diagnósticos de ritmo taquicárdico não sinusal na população pediátrica. 570 , 571 Taq.: taquicardia; Taq. sinusal inap.: taquicardia sinusal inapropriada; Taq. reent. nodal: taquicardia por reentrada nodal; Taq. reent. AV: taquicardia por reentrada atrioventricular; Taq. jncional RP: taquicardia juncional reciprocante persistente; Taq. reent. SA: taquicardia por reentrada sinoatrial (reentrante do nódulo sinusal).
Flutter e fibrilação atrial (FA) são relativamente comuns em crianças portadoras de cardiomiopatias e CC. O flutter atrial pode ser conduzido para os ventrículos na proporção de 1:1 (frequência ventricular >300 bpm) ou na proporção de 2:1 (frequência entre 150 e 200 bpm). O flutter atrial atípico (com ondas P mais lentas, arredondadas, de menor voltagem e separadas por linha isoelétrica) é uma arritmia potencialmente letal, geralmente presente em cardiopatias complexas.
A FA esforço-induzida é incomum em crianças, podendo ocorrer de forma paroxística e assintomática nas cardiopatias.
3.3.3.3.3. Bradiarritmias/Disfunção do Nó Sinusal
A bradiarritmia na população pediátrica é definida como uma FC abaixo do menor valor normal para a idade (vide Tabela 24 ). Manifesta-se, comumente, como bradicardia sinusal, ritmo juncional (de escape) ou ritmo decorrente de BAV (segundo grau, avançado ou total). 370 , 575 – 578
Cerca de 15 a 25% das crianças assintomáticas saudáveis podem apresentar arritmia sinusal, ritmo atrial ectópico, ritmo atrial multifocal e ritmo juncional. O ritmo juncional é comum na população pediátrica com tônus vagal acentuado, ocorrendo em ≈45% das crianças entre 7 e 10 anos, em ≈13% dos meninos entre 10 e 13 anos (durante o sono) e em ≈20% dos adolescentes atletas. 579
A DNS é caracterizada pelo espectro de distúrbios eletrocardiográficos e eletrofisiológicos que envolvem o nó sino-atrial e suas conexões com uma ou mais das seguintes alterações do ECG: bradicardia sinusal, bradicardia juncional, parada ou pausa sinusal, bloqueio sino-atrial, ritmos de substituição etc. Crianças com DNS podem ser completamente assintomáticas ou podem apresentar queixa de fraqueza, palidez, pré-síncope/síncope ou IC. A DNS sintomática normalmente requer implante de MP. 576 , 580 – 582
As principais causas de bradiarritmias na população pediátrica são apresentadas na Tabela 28 . Na população pediátrica, as bradiarritmias podem desencadear aos esforços: dor torácica, dor precordial típica, fadiga, dispneia, intolerância aos esforços, palpitações, tontura, síncope e IC. 577 , 578 , 582
Marcadores de risco elevado de morbimortalidade na população pediátrica com bradiarritmias: 576 , 578 , 582
-
–
Histórico de sopro cardíaco ou CC.
-
–
Síncope, especialmente desencadeada por esforços, ruídos altos, medo ou estresse emocional extremo.
-
–
Lipotimia ou síncope sem sintomas premonitórios ou fatores precipitantes.
-
–
Dor torácica, palpitações ou dispneia.
-
–
História familiar de MSC, SQTL, perda auditiva neurossensorial e implante de MP.
-
–
Uso de medicamentos que podem resultar em bradicardia.
Particularidades do TE/TCPE nas bradiarritmias e DNS na população pediátrica:
-
–
Fornece informações sobre a capacidade do nó sinusal e nó AV de responderem ao aumento da atividade adrenérgica com o esforço. 43
-
–
Permite avaliar sintomas esforço-induzidos, a resposta cronotrópica ao esforço, arritmias associadas, ACR e estratificação de risco. 43 , 404 , 586
-
–
Em pacientes com bradicardia em repouso, a ocorrência de resposta cronotrópica normal auxilia afastar a DNS.
-
–
Pacientes com CC complexa geralmente apresentam DNS associada, incompetência cronotrópica e comprometimento da ACR. 189 , 587 , 588
-
–
Pacientes com defeito do septo atrial geralmente apresentam incompetência cronotrópica após reparo transcateter ou cirúrgico. 589 , 590
-
–
Na ToF reparada é frequente a incompetência cronotrópica e a disfunção grave do nó sinusal, que ocorrem em ≈4% dos pacientes. 591
-
–
Na cirurgia de Fontan a incompetência cronotrópica ocorre em até 62% dos pacientes e contribui para o comprometimento da ACR. 592 , 593
3.4. Avaliação Metabólica Indireta
3.4.1. VO2/Aptidão Cardiorrespiratória/Classificação Funcional
No TE, a determinação indireta (estimativa) do consumo de oxigênio (VO2) é considerada a principal avaliação metabólica ao esforço. O VO2 é um dos principais parâmetros de gravidade das CC, sendo relevante para estratificação de risco e prognóstico. Recomenda-se a apresentação dos resultados do VO2 em mL/kg/min (também aceitável mL.kg-1.min-1). Também pode ser expresso por meio do equivalente metabólico (do inglês, metabolic equivalent of task - MET). Cada 1 MET corresponde a 3,5 mL/kg/min de VO2. 1
O consumo máximo de oxigênio (VO2max) expressa a maior quantidade de oxigênio extraído do ar inspirado durante a realização de TE considerado de esforço máximo (exemplos: sinais ou sintomas de exaustão física; incapacidade de prosseguir o esforço etc.). No TE em que não houver as características de um esforço máximo, o VO2 obtido deve ser denominado VO2pico. 1
Até os 12 anos de idade, não há diferenças significativas no VO2max em relação aos sexos. Após essa idade, os adolescentes do sexo masculino podem alcançar valores de VO2 até 25 a 30% maiores do que os observados no sexo feminino. 22
A aptidão cardiorrespiratória (ACR)/classificação funcional é uma estratificação de desempenho físico baseada no VO2max (estimado no TE e medido no TCPE). Quanto à obtenção do valor de VO2max previsto, sugere-se a adoção de tabelas de referência específicas para a faixa etária pediátrica (crianças e adolescentes), baseadas em sexo, idade e IMC. A utilização de tabelas de referências específicas para CC e/ou doença pulmonar é útil e contribui para a estratificação de risco ( Anexo 4 ). 80 , 176
Na eventualidade de uso de equações para estimar o VO2max previsto na população pediátrica, considerar:
-
Para bicicleta ergométrica, protocolo escalonado: 594
-
–
Masculino: VO2max previsto = peso x (50,75 – 0,372 x idade)
-
–
Feminino: VO2max previsto = (peso + 43) x (22,78 – 0,17 x idade)
Quando o peso real for maior que o previsto para idade e sexo, o peso previsto deve ser utilizado nas equações: peso previsto para sexo masculino = (0,79 x estatura) – 60,7; peso previsto para sexo feminino = (0,65 x estatura) – 42,8. Idade em anos; estatura em centímetros; peso em kg.
-
–
-
Para esteira ergométrica (teste incremental): 594
VO2max previsto = (0,046 x estatura) – (0,021 x idade) – (0,62 x sexo) – 4,31
Sendo que: sexo masculino = 0 e sexo feminino = 1; idade em anos; estatura em centímetros.
-
Bicicleta ergométrica, protocolo de rampa. Crianças e adolescentes saudáveis entre 12 e 17 anos: 595 , 596
Sendo a estatura em centímetros, e a massa corporal em quilogramas. Se o IMC for ≤ ao percentil 85 para a idade, utilizar a massa corporal real. Se o IMC for > que o percentil 85 para a idade, utilizar a massa corporal corrigida, através da estimativa do valor da massa corporal correspondente ao percentil 85 para a idade.
Devido à grande heterogeneidade da população pediátrica, inclusive entre países, ainda não foi possível estabelecer uma classificação unificada de normalidade para o VO2 e o nível de ACR. 595
Em crianças portadoras de cardiomiopatia, CC, IC e valvopatias, sugere-se aplicar, no pré-teste, a avaliação para determinação da classificação funcional de acordo com a faixa etária: Ross modificada (crianças <6 anos) ou a New York Heart Association (NYHA) (crianças >6 anos) – vide Tabela 29 . 379 , 793
Tabela 29. Classificações funcional baseada na história clínica, por faixa etária 379 , 793 .
| Classe | Ross modificada para crianças <6 anos | NYHA para crianças >6 anos |
|---|---|---|
| I | Sem limitações ou sintomas. | Sem limitações na atividade física. |
| II | Lactentes: taquipneia leve ou sudorese com alimentação. Crianças maiores: dispneia aos esforços. | Pode apresentar fadiga, palpitações, dispneia ou angina durante o exercício moderado, mas não durante o repouso. |
| III | Lactentes: taquipneia ou sudorese acentuada com a alimentação. Tempos de alimentação prolongados com déficits de crescimento. Crianças mais velhas: dispneia acentuada aos esforços. | Sintomas com esforço mínimo. Limitação acentuada da atividade física. |
| IV | Sintomas em repouso, tais como taquipneia, retrações, grunhidos ou sudorese. | Incapaz de realizar qualquer atividade física porque normalmente apresentam sintomas de IC em repouso e que pioram com qualquer esforço. |
NYHA: New York Heart Association; IC: insuficiência cardíaca.
A Tabela 30 apresenta a proposta de classificação da ACR para população brasileira, pelo VO2max, por sexo, para a faixa etária de 10 a 14 anos. 597 A Tabela 31 apresenta o comportamento da ACR nas principais cardiopatias e cardiomiopatias congênitas na população pediátrica.
Tabela 30. Classificação da aptidão cardiorrespiratória pelo VO2 máximo (mL/kg/min) medido diretamente no TCPE para a faixa etária de 10 a 14 anos.
| Sexo feminino | Sexo masculino | |
|---|---|---|
| Muito fraca | <33,0 | <38,7 |
| Fraca | 33,0-36,4 | 38,7-43,3 |
| Regular | 36,5-38,7 | 43,4-47,9 |
| Boa | 38,8-42,4 | 48,0-52,2 |
| Excelente | 42,5 | 52,3 |
Adaptado de: Rodrigues AN et al. Maximum oxygen uptake in adolescents as measured by cardiopulmonary exercise testing: a classification proposal. 597
Tabela 31. Comportamento da aptidão cardiorrespiratória nas cardiopatias e cardiomiopatias congênitas em crianças e adolescentes 10 , 79 , 80 , 95 .
| Cardiopatia/cardiomiopatia congênita | Aptidão cardiorrespiratória |
|---|---|
| DSA ou DSV, pequenos e não reparados | Normal. |
| DSA grande, não reparado | Levemente reduzida. |
| DSA ou DSV, reparados | Normal ou levemente reduzida. |
| DSA ou DSV, grandes e reparados | Normal ou levemente reduzida. |
| Obstrução da via de saída ventrículo esquerdo | Normal, exceto em casos graves. |
| ToF reparada | Leve a moderadamente reduzida. |
| TGA – cirurgia/interruptor arterial | Normal ou levemente reduzida. |
| TGA – cirurgia/interruptor atrial | Moderadamente reduzida. |
| PCA com HAP | Moderada a acentuadamente reduzida. |
| Síndrome de Eisenmenger | Acentuadamente reduzida. |
| Ventrículo único | Moderada a acentuadamente reduzida. |
| Cirurgia de Fontan | Moderada a acentuadamente reduzida. |
| BAVT congênito | Pode ser normal ou leve a moderadamente reduzida. |
| CMH | Leve a acentuadamente reduzida. |
| EAo congênita moderada/grave | Leve a acentuadamente reduzida. |
| Válvula aórtica bicúspide * | Leve a acentuadamente reduzida. |
| Prolapso da válvula mitral | Pode ser normal ou leve a moderadamente reduzida. |
DSA: defeito do septo atrial; DSV: defeito do septo ventricular; ToF: tetralogia de Fallot; TGA: transposição das grandes artérias; PCA: persistência do canal arterial; HAP: hipertensão arterial pulmonar; CMH: cardiomiopatia hipertrófica; BAVT: bloqueio atrioventricular total; EAo: estenose valvar aórtica.
Com EAo moderada/grave, com insuficiência aórtica ou com CoAo associadas.
4. Critérios para Interrupção do Esforço (Clínicos, Hemodinâmicos, Eletrocardiográficos)
Os principais critérios de interrupção do esforço em população pediátrica são apresentados na Tabela 32 . 7 , 11 , 176 , 177 A interrupção também pode ocorrer em outras situações não descritas, mas consideradas de risco de intercorrências graves e que deverão ser detalhadas no laudo do exame.
Tabela 32. Critérios de interrupção do esforço no TE/TCPE em população pediátrica 7 , 11 , 176 , 177 .
| Parâmetro | Critérios |
|---|---|
| Objetivo do exame | Os achados diagnósticos foram atingidos, e a continuação do esforço não fornecerá informação adicional relevante. 7 |
| Sintomatologia * | Sinais ou sintomas indicam que a continuação do esforço pode comprometer o bem-estar do paciente:
|
| Exame físico/variáveis cardiovasculares e respiratórias |
|
| Eletrocardiográficas |
|
| Outras |
|
PAS: pressão arterial sistólica; PAD: pressão arterial diastólica; FC: frequência cardíaca; CDI: cardioversor-desfibrilador implantável; SpO2: saturação de oxigênio por oximetria digital.
Crianças, principalmente entre 3 e 7 anos, podem apresentar limitações (associadas ao grau de desenvolvimento cognitivo) para avaliar adequadamente as alterações sensoriais periféricas decorrentes do esforço, sua intensidade e sintomas associados.
Queda da pressão arterial sistólica no esforço com valor inferior ao da PAS de repouso ou aumento inicial da PAS no esforço e subsequente queda ≥20 mmHg.
Em crianças e adolescentes aparentemente saudáveis e sem intercorrências ou sintomas durante o esforço. Nas cardiomiopatias e CC, atentar para repercussões hemodinâmicas e sintomas, principalmente se a PAS exceder 200 mmHg e a PAD exceder 110 mmHg.
5. Elaboração do Laudo do TE
O laudo do TE de crianças e adolescentes deve seguir o mesmo padrão de estruturação e requisitos mínimos recomendados para o laudo do TE apresentado na Diretriz Brasileira de Ergometria em População Adulta – 2024: 1
Descrição dos dados gerais do exame.
Dados observados, mensurados e registrados.
Relatório descritivo do TE.
Conclusões.
Registros eletrocardiográficos.
Adicionalmente, recomenda-se:
-
–
Não utilizar escores de risco pré- e pós-teste específicos para população adulta em população pediátrica, pois os mesmos não são válidos ou extrapoláveis.
-
–
Referir ajustes nos protocolos, critérios e variáveis referentes às características das crianças e adolescentes (tais como doenças, idade, sexo, IMC, superfície corporal, medicações em uso etc.).
-
–
Preferencialmente, apresentar os valores de referência utilizados para as variáveis medidas.
-
–
Quando pertinente e disponível, comentar os achados em relação às doenças de base, incluindo prognóstico e riscos.
-
–
Em caso de TE seriado, quando possível, realizar comentário sobre a evolução dos achados.
6. TCPE de Crianças e Adolescentes
6.1. Respostas Metabólicas, Ventilatórias e de Trocas Gasosas em Crianças e Adolescentes
6.1.1. Metabolismo Celular, Resposta Fisiológica e Hormonal ao Exercício
Crianças e adolescentes apresentam respostas metabólicas ao esforço diferentes das dos adultos. As reservas de trifosfato de adenosina (ATP) e fosfocreatina não estão relacionadas à idade. Os níveis de glicogênio muscular em repouso são menores em crianças, atingindo na adolescência os níveis de adultos. 1 , 598 , 599
Na comparação com adultos, a massa muscular em crianças é menor, com diferente utilização de fontes de energia e distintas adaptações metabólicas/hormonais e maior dependência da oxidação da gordura, repercutindo em grande mobilização de ácidos graxos livres. A liberação de glicerol e o aumento do hormônio do crescimento em crianças pré-adolescentes corroboram esses achados. 600 , 601
A imaturidade do metabolismo anaeróbico lático em crianças, com atividade glicolítica reduzida, decorre de: 598 , 599 , 602
-
–
Diferenças na tipagem das fibras musculares esqueléticas com maiores proporções de fibras de contração lenta (tipo I) do que em adultos não treinados.
-
–
A via anaeróbia lática para ressíntese de ATP geralmente está reduzida em indivíduos jovens durante esforços de alta intensidade.
-
–
Em crianças pré-púberes, observam-se atividade reduzida das enzimas fosfofrutoquinase-1 e lactato desidrogenase e produção limitada de lactato muscular em relação aos adultos.
Portanto, crianças e adolescentes adaptam-se bem ao exercício prolongado, moderado e intenso, apresentando rápida recuperação após o esforço. 603 , 604
Em crianças, as adaptações hormonais para a utilização do substrato energético durante exercício prolongado apresentam menor redução dos níveis de insulina, com aumento das catecolaminas e glucagon. Essa resposta corresponde à regulação menos efetiva da glicemia com maior risco de hipoglicemia. 598 , 605 , 606
Na fase do estirão de crescimento pubertário, ocorre a liberação de hormônios (exemplo: somatotropina, fatores de crescimento semelhantes à insulina e hormônios esteroides sexuais) responsáveis por mudanças na composição corporal e aumento da massa corporal magra, acarretando melhora da aptidão e desempenho físico, particularmente de natureza anaeróbica. 599 , 607 – 609
6.1.2. Ventilação Pulmonar, Gases no Ar Expirado, Espirometria e Variáveis Derivadas
As principais variáveis do TCPE (metabólicas, ventilação pulmonar, gases no ar expirado, espirometria e variáveis derivadas) na população pediátrica e suas respectivas unidades e interpretações encontram-se na Tabela 33 . As diferenças de comportamento das variáveis entre crianças e adultos constam na Tabela 34 . 1 , 11 , 176 , 179 , 610
Tabela 33. Principais variáveis do TCPE e respectivas interpretações 11 , 176 , 179 , 610 , 611 .
| Parâmetros do TCPE | Sigla/abreviatura | Unidade | Interpretações |
|---|---|---|---|
| Consumo de oxigênio | VO2 | mL/kg/min | É definido como o volume de O2 extraído do ar inspirado em um determinado período de tempo. Pode ser obtido pela equação de Fick ( Figura 1 ). |
| Consumo máximo de oxigênio previsto | VO2max previsto | mL/kg/min | Sugere-se utilização de tabelas de VO2max previsto por faixa etária e sexo, em população aparentemente saudável ou com cardiopatia ( Anexo 4 ). |
| Consumo de oxigênio no pico do esforço | VO2pico | mL/kg/min | Nível máximo de VO2 medido durante o TCPE. Pode ser expresso como % do VO2max previsto (padrões de idade e sexo correspondentes). É considerado normal quando >20 mL/kg/min. Se >80% do previsto, indica aptidão cardiorrespiratória adequada. |
| Consumo máximo de oxigênio | VO2max | mL/kg/min | Platô de VO2 obtido apesar do aumento da intensidade do esforço (esforço máximo). Pode ser expresso como % do VO2max previsto. |
| Limiar ventilatório 1 /limiar anaeróbico | LV1/LA | mL/kg/min ou
% do VO2max previsto |
O LV1 corresponde ao valor do VO2 acima do qual a produção de energia passa a contar com crescente participação do metabolismo anaeróbico lático. Pode ser expresso como % do VO2max previsto (normalmente ocorre >40% do VO2pico). É o ponto a partir do qual ocorre aumento desproporcional de VEmin e VCO2 em relação ao VO2. |
| Ventilação por minuto | VEmin | L/min | Ventilação (com base no volume corrente e frequência respiratória) durante o esforço. Em indivíduos saudáveis, o valor da VEmin é mais do que suficiente para manter a PaCO2 em qualquer carga de trabalho. Na insuficiência cardíaca, a perfusão pulmonar é alterada e a VEmin aumenta, o que se correlaciona com mau prognóstico. |
| Equivalente ventilatório de O2 | VE/VO2 | - | VE/VO2 corresponde ao número de litros de ar que estão sendo respirados para cada litro de absorção de O2. |
| Equivalente ventilatório de CO2 | VE/VCO2 | - | VE/VCO2 corresponde ao número de litros de ar que estão sendo respirados para eliminar 1 litro de CO2. Os valores normais são geralmente <30. |
| Eficiência ventilatória (ventilação/produção de CO2) | Inclinação VE/VCO2 | - | Durante o TCPE incremental normal, a VEmin se correlaciona linearmente com o VCO2. A inclinação VE/VCO2 em indivíduos normais é de cerca de 25 a 30. Também chamada de eficiência ventilatória, aumenta na insuficiência cardíaca, hipertensão pulmonar e/ou doenças pulmonares intrínsecas e se correlaciona com o prognóstico. |
| Inclinação da eficiência da captação do oxigênio | OUES | L/min | Relação logarítmica entre VO2 e VEmin durante o TCPE (VO2 = a log10 VEmin + b, onde a = valor de referência de OUES calculado). Quanto mais acentuada a inclinação, melhor a eficiência ventilatória. O valor de OUES depende da idade e da área de superfície corporal. Sugere-se expressar esse valor para a área de superfície corporal ou peso corporal. OUES/área de superfície corporal ≥1.200 ou OUES ≥35/peso corporal (kg) correlaciona-se com o VO2pico >80% do previsto. O valor de OUES diminui significativamente em crianças com CC e doença vascular pulmonar. |
| Pulso de oxigênio | PuO2 | mL/kg/min/bpm | É obtido pela divisão do VO2 pela FC (VO2/FC), refletindo a quantidade de O2 que é transportada a cada sístole cardíaca, tendo relação direta com o volume sistólico, permitindo avaliar a função do ventrículo esquerdo. O valor absoluto normal do PuO2 é >80%. |
| Quociente respiratório | QR | - | Também conhecido como razão de trocas respiratórias, corresponde à razão entre VCO2 e o VO2, permitindo identificar a intensidade do esforço e o macronutriente utilizado para gerar energia. O TCPE pode ser considerado máximo quando o QR é ≥1,10. |
| Oximetria de pulso | SpO2 | % | Deve ser >95% ao longo do TE/TCPE. O declínio nos níveis de oxigenação da hemoglobina <90% indica capacidade prejudicada de aumentar adequadamente a transferência de oxigênio alvéolo-pulmonar para o capilar sanguíneo durante o esforço. A diminuição de ≥4% é considerada dessaturação, ocorrendo mais comumente em pacientes com anormalidade de difusão pulmonar. Outras anormalidades como shunts da direita para a esquerda ou incompatibilidade entre ventilação e perfusão, podem resultar em dessaturação associada ao esforço. |
| Relação de consumo de oxigênio pela taxa de trabalho | ΔVO2/ΔWR | mL/min/W | Reflete a capacidade muscular de extrair O2 e gerar ATP. Em determinado momento do esforço, o achatamento da curva e/ou queda do valor do ΔVO2/ΔWR (<10 mL/min/W) sugerem problema no transporte de O2 (isquemia miocárdica/disfunção ventricular). |
| Pressão parcial expiratória final de dióxido de carbono | PETCO2 | mmHg | Obtida a partir da medida da FECO2, refletindo a PaCO2. Durante o esforço, a PETCO2 aumenta de 3 a 8 mm e, subsequentemente, diminui levemente até o esforço máximo. O seu valor varia de 36 a 42 mmHg na ausência de doenças pulmonares. A PETCO2 medida no LV1 correlaciona-se com o DC, refletindo a gravidade da IC crônica. Valores reduzidos indicam incompatibilidade ventilação/perfusão e pior prognóstico. A PETCO2 <36 é encontrada na CC com shunt direita-esquerda, padrão ventilatório taquipneico e na IC com resposta atenuada do DC ao esforço. |
| Ventilação voluntária máxima | VVM | L/min | É o volume máximo de ar em repouso mobilizado no esforço voluntário em um minuto. Pode ser calculada pelas fórmulas: no sexo feminino VVM = VEF1 X 35; no sexo masculino VVM = VEF1 X 40. |
| Reserva ventilatória máxima | RV máxima | - | É a relação entre a VVM em repouso e a VEmin máxima no esforço. Crianças saudáveis têm uma RV de pelo menos 11 L/min ou 20 a 40% de sua VVM. RV máxima <30% sugere limitação ventilatória, sendo útil no diagnóstico diferencial de dispneia relacionada à IC e às doenças respiratórias crônicas. |
| Volume expirado forçado no 1° segundo | VEF1 | % | VEF1 é o volume expirado medido no primeiro segundo durante a manobra de capacidade vital forçada (CVF – volume obtido em uma única inspiração máxima seguida de uma expiração também máxima). O VEF1 é uma das principais variáveis no diagnóstico de distúrbio ventilatório obstrutivo (asma esforço-induzido, broncoespasmo esforço-induzido etc.). |
TCPE: teste cardiopulmonar de exercício; O2: oxigênio; CO2: dióxido de carbono; PaCO2: pressão parcial de CO2; FC: frequência cardíaca; ATP: trifosfato de adenosina; VCO2: produção de dióxido de carbono; DC: débito cardíaco; CC: cardiopatia congênita; IC: insuficiência cardíaca; CFV: capacidade vital forçada.
Tabela 34. Comparação das variáveis cardiovasculares, ventilatórias e metabólicas do TCPE entre crianças e adultos, durante esforços em qualquer intensidade (em níveis submáximo e máximo) 1 , 11 , 176 , 179 , 599 , 610 .
| Variável | Comparação com adultos * | Esforço submáximo | Esforço máximo | |||
|---|---|---|---|---|---|---|
| Crianças | Adultos | Crianças | Adultos | |||
| Cardiovascular | ||||||
| VO2pico (mL/kg/min) | Mais alto | ↑↑ | ↑ | ↑↑ | ↑ | |
| FCpico (bpm) | Mais alta | ↑↑ | ↑ | ↑↑ | ↑ | |
| Volume sistólico (mL/bpm) | Mais baixo | ↑ | ↑↑ | ↑ | ↑↑ | |
| Débito cardíaco (L/min) | Mais baixo | ↑ | ↑↑ | ↑ | ↑↑ | |
| Diferença arteriovenosa O2 | Mais alta no esforço submáximo | ↑↑ | ↑ | ↑ | ↑↑ | |
| Pressão arterial sistólica e diastólica | Mais baixa | ↑ | ↑↑ | ↑ | ↑↑ | |
| Pulmonar | ||||||
| Frequência respiratória (respirações/min) | Mais alta | ↑↑ | ↑ | ↑↑ | ↑ | |
| Volume corrente (L) | Mais baixo | ↑ | ↑↑ | ↑ | ↑↑ | |
| VEmin pico (L/min) | Mais baixo | ↑ | ↑↑ | ↑ | ↑↑ | |
| VE/VCO2 ** | Mais alta | ↑↑ | ↑ | ↑↑ | ↑ | |
| VE/VO2 ** | Mais alta | ↑↑ | ↑ | ↑↑ | ↑ | |
| Metabólica | ||||||
| Oxidação de gordura | Mais alta | - | - | - | - | |
| Oxidação de carboidratos | Mais baixa | - | - | - | - | |
| Pico de lactato sanguíneo | Mais baixo | - | - | - | - | |
| Capacidade glicolítica | Mais baixa | - | - | - | - | |
| Capacidade alática | Mais baixa | - | - | - | - | |
| Depuração de lactato | Mesma | - | - | - | - | |
= aumento;
= aumento de maior magnitude;
FC: frequência cardíaca; VO2: consumo de oxigênio; O2: oxigênio; VEmin: ventilação por minuto; VE: ventilação pulmonar; VCO2: produção de dióxido de carbono.
Independente da intensidade do esforço.
Equivalentes ventilatórios que determinam a eficiência ventilatória.
6.1.2.1. Consumo de Oxigênio (VO2)
A ACR através da medida direta do VO2pico ou VO2max no TCPE é considerada a principal variável metabólica ao esforço. O VO2 nos limiares ventilatórios (principalmente no primeiro limiar ventilatório – LV1) tem importância diagnóstica e prognóstica em crianças e adolescentes. O VO2 no LV1 e o VO2max são geralmente superiores aos observados em adultos. 1 , 177 , 286 , 594
No caso de um esforço máximo, a ACR da criança pode ser avaliada através do VO2pico (mL/kg/min), considerado dentro dos limites da normalidade quando ≥2 DP. Em adolescentes, não se recomenda adotar o valor de 80% do VO2max previsto como limite inferior da normalidade, pois poderia estar superestimado.
A capacidade anaeróbica de crianças é menor do que em adultos, mesmo que seja expressa por unidade de massa corporal total ou magra.
Em testes submáximos, nem sempre é possível avaliar a ACR com base no VO2pico. Outros parâmetros do TCPE, como o LV1 e a inclinação da eficiência do VO2, podem ser usados para fornecer uma melhor definição da aptidão.
O descondicionamento físico geralmente é caracterizado como capacidade reduzida de transporte de oxigênio pelo sistema CV e/ou eficiência reduzida na extração periférica de oxigênio acarretando um LV1 precoce. A observação de LV1 <50% do VO2max previsto está associada ao descondicionamento físico e <40% geralmente está relacionada a doença com comprometimento significativo da ACR. 1 , 177 , 286 , 594
6.1.2.2. Pulso de Oxigênio (PuO2)
O pulso de O2 (PuO2 = VO2/FC) é uma variável não invasiva que reflete o débito cardíaco, sendo útil na avaliação da disfunção ventricular, com ou sem isquemia associada. Normalmente, o PuO2 aumenta com o esforço devido ao incremento linear da FC e VO2, estabilizando-se em platô próximo ao esforço máximo. 1 , 177 , 286 , 594
A diminuição no PuO2 (normal ≥2 DP) em cargas submáximas sugere disfunção ventricular, sendo indicativo de um volume sistólico ejetado reduzido. Essa diminuição, associada à queda no ΔVO2/ΔWR, indica disfunção ventricular grave, frequentemente de natureza isquêmica.
No TCPE, a combinação de PuO2 diminuído no pico do esforço (<2 DP do previsto), LV1 diminuído (<40 a 50% do VO2max previsto), VO2pico diminuído e aumento rápido da FC, pode estar associada ao descondicionamento físico.
6.1.2.3. Quociente Respiratório (Relação VCO2/VO2)
Na população pediátrica o quociente respiratório (QR) em repouso varia de 0,70 a 0,85. Durante o esforço progressivo, após LV1, o VCO2 aumenta desproporcionalmente em relação ao VO2, o que se traduz em um aumento no QR, em função das modificações de substratos energéticos. É fundamental que o QR seja avaliado no ponto do VO2pico, pois os seus valores continuam a aumentar após a interrupção do esforço, inclusive no início da fase de recuperação. Quando o QR é ≥1,1, o TCPE preenche as condições para ser considerado máximo. 1 , 177 , 286 , 594
Em populações pediátricas, a FCpico e o QR no pico do esforço (QRpico) são recomendados como critérios objetivos para avaliar a qualidade do esforço realizado. Considera-se como ideal:
-
–
Atingir FC ≥180 bpm no VO2pico (ou pelo menos ≥95% da FCmax prevista).
-
–
Atingir QR de pelo menos 1,00 no VO2pico. Esse valor representa o limite inferior da normalidade no TCPE em bicicleta ergométrica.
O QR no VO2pico ≥1,00 caracteriza utilização exclusiva de carboidrato (glicose), fornecendo energia por meio de metabolismo predominantemente anaeróbico. Valores de QR <1,00 no VO2pico podem indicar um esforço submáximo ou podem ser patológicos (por exemplo: pneumopatia; CC cianótica descompensada; doença de armazenamento de glicogênio). Em crianças e adolescentes aparentemente saudáveis, os valores de QR diminuirão dentro de 2 a 3 minutos na recuperação. 1 , 177 , 286 , 594
6.1.2.4. Inclinação da Eficiência da Captação do Oxigênio
A inclinação da eficiência da captação do oxigênio (OUES: do inglês oxygen uptake efficiency slope ) é uma relação não linear da resposta ventilatória ao esforço, correspondendo ao aumento absoluto do VO2 associado ao aumento da ventilação pulmonar (VE). Expressa a eficiência da extração alveolar do O2 no ar ventilado. Sugere-se apresentar os valores de OUES relativos à ASC, peso ou à massa livre de gordura. 612 – 621 O Anexo 4 apresenta informações sobre os valores/percentis de OUES e equações de predição para população pediátrica aparentemente saudável. 622
Um estudo brasileiro envolvendo crianças saudáveis e portadores de CC sugere o uso de OUES indexada ao peso (OUES/kg) e propôs que o valor de OUES >35 está relacionado com capacidade funcional normal. 623 Entretanto, estudo multicêntrico internacional encontrou pontos de corte do valor de OUES de 38,4 para meninos e 31,0 para meninas. 624
O valor de OUES submáximo correlaciona-se com o VO2pico, VEpico e VO2 do LV1, sendo uma medida válida para a determinação da ACR e a estratificação de risco em testes submáximos. 613 , 625 , 626
6.1.2.5. Equivalente Ventilatório de O2 e CO2
No TCPE, os equivalentes ventilatórios de O2 (VE/VO2) e de CO2 (VE/VCO2) indicam, respectivamente, a ventilação por minuto (VEmin) necessária para consumir 1 L/min de O2 e produzir/eliminar 1 L/min de CO2. Durante o esforço progressivo, a razão VE/VO2 diminui até o LV1, a partir do qual aumenta progressivamente, com inflexões positivas nas curvas no LV1 e LV2. A razão VE/VCO2 diminui até o LV2, aumentando em seguida.
Os equivalentes ventilatórios contribuem para a avaliação da eficiência cardiorrespiratória, identificação dos limiares ventilatórios, tendo valor diagnóstico e prognóstico na população pediátrica com CC, IC e HAP. Anormalidades cardiocirculatórias com baixo débito cardíaco apresentam uma inclinação acentuada na curva de VE/VCO2. A relação VE/VO2 costuma estar elevada na IC.
Em estudo com 700 pacientes (entre 5 e 18 anos), divididos em aparentemente saudáveis e portadores de CC, a inclinação da curva de VE/VCO2 foi significativamente maior nos cardiopatas (maior aumento nos pacientes com obstrução de via de saída de VD). Esse estudo sugere 29 como ponto de corte de normalidade. 624 , 627
6.1.2.6. Outras Considerações sobre Variáveis Ventilatórias e Metabólicas 1 , 177 , 286 , 594
A ventilação por minuto (VEmin) aumenta com o progredir do esforço, dependendo da intensidade da carga imposta, do condicionamento físico e relacionando-se ao VO2 e VCO2.
A FR excessiva pode ser indicativa de sedentarismo ou de anormalidades na mecânica ventilatória. A FR nas crianças costuma ser maior do que a observada nos adultos, sendo de ≈65 incursões respiratórias/min em crianças de 5 a 8 anos e ≈50 a 55 incursões respiratórias/min em crianças >11 anos.
Em comparação com os adultos, as crianças apresentam uma maior relação entre a FR e o volume corrente (VC), geralmente associada à redução da ventilação/perfusão. Essa situação é comumente observada em algumas CC cianóticas.
A limitação ventilatória é tradicionalmente definida por reserva ventilatória (RV) <20% durante o esforço. Crianças saudáveis têm RV ≥11 L/min ou de 20 a 40% de sua ventilação voluntária máxima (VVM). 179 , 628
Equações de predição da RV:
VVM: ventilação voluntária máxima
VEF1: volume expiratório forçado em um segundo
RV: reserva ventilatória
VEmax: ventilação máxima de esforço
A RV contribui para o diagnóstico diferencial entre doença cardíaca e doença pulmonar. A RV baixa é característica de doença pulmonar primária e doença pulmonar obstrutiva, enquanto a RV elevada ocorre em condições CV que limitam o desempenho físico. 629
Em geral, as crianças com doenças pulmonares restritivas têm capacidade de esforço reduzida (baixo VO2pico e baixo VO2 no LV1) e aumento do VC (50% da capacidade vital e/ou 80% da capacidade inspiratória), com RV relativamente baixa. 630 Qualquer aumento adicional na VEmin é devido a um aumento da FR. Se houver limitação ventilatória durante o esforço, a saturação arterial de oxigênio (SpO2) diminui com o aumento de carga de trabalho. 1 , 177 , 286 , 594
Na HAP, ocorre redução acentuada da eficiência ventilatória, com relações VE/VO2 e VE/VCO2 elevadas, indicando trocas gasosas anormais nos pulmões. 631
O PETO2 e PETCO2 refletem as tensões gasosas arteriais. O PETCO2 baixo associado a elevações do PETO2 e do QR indica hiperventilação.
Queda ≥5% na SpO2 durante o TE/TCPE é definida como uma hipoxemia esforço-induzida. Queda de 10 pontos em relação à saturação de repouso associada a sintomas ou SpO2 <85% são critérios para interrupção do esforço. A dessaturação é considerada grave quando a SpO2 for <80% e estiver acompanhada de sinais e sintomas de hipoxemia grave, ocorrendo geralmente em crianças com doenças pulmonares graves ou IC. 260 , 594
7. Elaboração do Laudo do TCPE em Crianças e Adolescentes
O laudo do TCPE de crianças e adolescentes deve seguir o mesmo padrão de estruturação do laudo de adulto apresentado na Diretriz Brasileira de Ergometria em População Adulta – 2024. 1
No TCPE, o laudo deve conter, resumidamente, as principais variáveis ergoespirométricas (hemodinâmicas, ventilatórias e metabólicas), com descrição das alterações que foram determinantes para a interrupção do esforço e eventuais diagnósticos e prognósticos.
No laudo, devem constar:
-
–
A apresentação da FC, PA, comportamento eletrocardiográfico, VO2 e equivalente metabólico (MET), relacionando-os aos valores previstos para a faixa etária e sexo.
-
–
A apresentação do limiar anaeróbio ventilatório (LV1) normalizado para a massa corporal (expresso como porcentagem do VO2pico atingido e VO2max previsto), relacionando-o à FC e carga de esforço.
-
–
ACR aferida e sua repercussão em relação às indicações e achados do exame.
-
–
Quando pertinente, apresentar os valores de normalidade utilizados em relação ao sexo, idade, peso, IMC e presença ou não de doenças.
Observação: as informações referidas nos itens anteriores têm grande relevância diagnóstica e prognóstica, sendo aplicáveis na prescrição de exercícios físicos, particularmente na RCV.
Parte 3 – Particularidades do TE/TCPE em Condições Clínicas Específicas
1. Cardiopatias Congênitas e Cardiopatias Adquiridas
Dentro das indicações mais comuns do TE/TCPE na população infantil e de adolescentes/adultos jovens, estão as abordagens clínicas, hemodinâmicas e eletrocardiográficas em portadores de CC, especialmente após a correção parcial ou completa do defeito cardíaco. A ACR pode estar baixa em pacientes com CC complexas (mesmo em pacientes supostamente assintomáticos), especialmente na hipertensão arterial pulmonar (HAP) e IC crônica. 77 , 632 , 633
A Tabela 35 apresenta o comportamento das principais variáveis do TE/TCPE em relação às doenças CV mais prevalentes na faixa etária pediátrica.
Tabela 35. Principais variáveis do TE/TCPE e seu comportamento nas doenças cardiovasculares na população pediátrica.
| Variável | Interpretação | Doenças cardiovasculares |
|---|---|---|
| FCmax | ↓ na incompetência cronotrópica | CC corrigida; SQTL; transplante cardíaco. |
| ↓ em uso de betabloqueador/antiarrítmico | CC/CM com insuficiência cardíaca; arritmia. | |
| Pressão arterial sistólica | ↓ na disfunção ventricular | CC; CM; CM hipertrófica; HAP. |
| ↑ na resposta hipertensiva | Coarctação da aorta; hipertensão essencial. | |
| ECG | Arritmia esforço-induzida | CC; arritmias primárias; BAVT. |
| Alterações isquêmicas da repolarização | Doença de Kawasaki; anomalias coronarianas (congênitas ou pós-reparo). | |
| Outras alterações induzidas pelo esforço | SQTL; Síndrome de Brugada; WPW. | |
| VO2max/VO2pico | ↓ na disfunção cardiopulmonar e/ou descondicionamento físico | CC; CM; HAP; potenciais receptores de transplante cardíaco; bloqueio atrioventricular total. |
| Pulso de oxigênio | ↓ na disfunção ventricular e isquemia miocárdica | CC; IC; CCPT; CM; doença de Kawasaki; anomalias coronarianas e valvares. |
| Saturação de oxigênio | ↓ na doença pulmonar, shunts cardíacos e/ou pulmonares | CC cianótica; IC; asma brônquica; fibrose pulmonar. |
| VE/VO2 e VE/VCO2 | ↑ na ineficiência ventilatória (anormalidades da ventilação/perfusão) | CC com insuficiência cardíaca ou shunt direita-esquerda; Fallot operado; HAP. |
= diminui;
= aumenta;
CC: cardiopatia congênita; CM: cardiomiopatia, ECG: eletrocardiograma; SQTL: síndrome do QT longo; HAP: hipertensão arterial pulmonar; CCPT: conexão cavopulmonar total; VE: ventilação minuto; VCO2: produção de dióxido de carbono; VO2: consumo de oxigênio; WPW: Síndrome de Wolff-Parkinson-White; VO2max: consumo máximo de oxigênio (mL/kg/min); VO2pico: VO2 obtido nos exames que não houver as características de um esforço máximo; FCmax: frequência cardíaca máxima; VE/VCO2: equivalente ventilatório de dióxido de carbono; VE/VO2: equivalente ventilatório de oxigênio; VO2max: BAVT: bloqueio atrioventricular total; IC: insuficiência cardíaca. Adaptado de: Massin MM. The role of exercise testing in pediatric cardiology. 6
1.1. Defeitos do Septo Atrial
Nos defeitos do septo atrial/comunicação interatrial (DSA) a maioria dos pacientes permanece assintomática durante a maior parte da infância, mesmo em presença de grande shunt esquerda para a direita (esquerda-direita). São cinco os tipos principais de DSA: ostium secundum, ostium primum , seio venoso, defeitos do seio coronário e forame oval patente. Esses defeitos serão tratados como uma entidade única (DSA) em relação ao TE, pois os sintomas, comportamento das variáveis e interpretações são semelhantes, dependendo do predomínio do shunt (se direita-esquerda ou esquerda-direita), tamanho do defeito e presença de HAP e/ou IC. 634 , 635
Particularidades do ECG de repouso na DSA em população pediátrica: 370 , 388 , 636 , 637
-
–
Na maioria dos pacientes, a amplitude e a duração da onda P são normais. No ostium secundum , costumam ocorrer ondas P apiculadas em DII por aumento do átrio direito.
-
–
No ostium secundum e nos shunts esquerda-direita significativos, pode ocorrer prolongamento do PRi (BAV de 1 ° grau) e atraso na condução intraventricular (padrão de BRD) associado à HVD.
-
–
Após o reparo cirúrgico de DSA tipo ostium secundum , geralmente ocorre diminuição da duração e dispersão da onda P, sem atingir os níveis normais.
-
–
Após reparo transcateter, observa-se regressão parcial ou completa das anormalidades do ECG na maioria dos pacientes. 638 , 639
-
–
Após reparo cirúrgico de defeitos do tipo seio venoso, observa-se taxa relativamente alta de DNS (6%) e FA (14%). 640
Particularidades do TE/TCPE no DSA não corrigido:
-
–
Crianças geralmente têm ACR preservada. 641
-
–
Adolescentes e adultos jovens podem apresentar redução da ACR, principalmente quando sintomáticos. Nesses pacientes, observa-se redução de até 60% do VO2max previsto. 610
-
–
Pacientes com DSA assintomáticos, sem sobrecarga de volume e função normal de VD em repouso, podem apresentar aumento significativo da pós-carga e/ou disfunção do VD esforço-induzidas. 642
-
–
A inclinação VE/VCO2 geralmente é normal. Entretanto, nos pacientes com DSA associado à IC, disfunção do VD, HAP e/ou doença pulmonar, a inclinação pode aumentar devido à incompatibilidade ventilação-perfusão. 610 , 627
Particularidades do TE após o reparo do DSA:
-
–
No reparo cirúrgico precoce após 6 meses, observa-se ACR normal, que se mantém durante a vida adulta. 643 – 645
-
–
Sintomas associados às arritmias e/ou dispneia esforço-induzidas são raros e determinantes da gravidade da CC. 646 , 647
-
–
A ocorrência de resposta cronotrópica deprimida (incompetência cronotrópica) é mais frequente após reparo cirúrgico do que após reparo transcateter. 589 , 590
-
–
Após o reparo cirúrgico, a capacidade aeróbica geralmente é reduzida e o desempenho do VD é significativamente menor. 648
-
–
Reparos cirúrgicos em idade mais avançada (adolescência) e/ou em presença de HAP geralmente evoluem com menor ACR e maior incidência de arritmias atriais esforço-induzidas. 649 , 650
-
–
Arritmias esforço-induzidas em crianças após reparo da DSA são raras, podendo manifestar-se como bradicardia sinusal, taquicardia sinusal, taquicardia supraventricular, batimentos atriais prematuros, batimentos prematuros ventriculares, DNS, BAV, flutter atrial e FA. 651 – 654
-
–
Outras particularidades encontram-se na Tabela 36 .
Tabela 36. Comportamento das principais variáveis do TE/TCPE nos defeitos do septo atrial/comunicação interatrial reparados e não reparados.
| Parâmetros TE/TCPE | DSA não reparado | DSA reparado |
|---|---|---|
| ECG de repouso | Geralmente, observam-se aumento da duração e amplitude da onda P, aumento do PRi e duração do QRS (padrão BRD). 655 , 656 Raramente ocorre BAV (primeiro e segundo grau). |
|
| Sintomas esforço-induzidos | Raros em crianças, mas, quando presentes, estão relacionados à gravidade de HAP e/ou IC.
634
Mais comuns em adolescentes e adultos, podendo comprometer a aptidão cardiorrespiratória. |
|
| VO2max (mL/kg/min) | Normal em crianças, a menos que tenham descondicionamento físico.
Diminuído, dependente da gravidade de HAP e/ou IC. |
|
| FCmax | Normal. Na mutação NKX 2.5 (rara), pode ocorrer bradiarritmia por disfunção do nó sinusal e/ou disfunção do nó atrioventricular. 668 | |
| Arritmia esforço-induzida | Rara em crianças. Mais frequente em adolescentes e/ou na HAP. | |
| Oximetria de pulso (SpO2, %) | Diminuída no shunt direita-esquerda e/ou na HAP. |
|
| Ventilação por minuto (VE, L/min) | Aumentada. |
|
| Pulso de oxigênio (mL) | Normal; diminuído na IC. |
|
| VE/VO2 | Aumentada. |
|
| VE/VCO2 | Aumentada. |
|
| Pressão parcial de CO2 expirado (PETCO2, mmHg) | Normal; diminuído no shunt direita-esquerda. |
|
CC: cardiopatia congênita; CM: cardiomiopatia, ECG: eletrocardiograma; HAP: hipertensão arterial pulmonar; IC: insuficiência cardíaca; BRD: bloqueio de ramo direito; VE/VCO2: equivalente ventilatório de dióxido de carbono; VE/VO2: equivalente ventilatório de oxigênio; VO2max: consumo máximo de oxigênio; PRi: intervalo PR; TE: teste ergométrico; TCPE: teste cardiopulmonar de exercício; DSA: defeito do septo atrial; BAV: bloqueio atrioventricular; BAVT: bloqueio atrioventricular total; FC: frequência cardíaca. Adaptado de: Amedro et al. Atrial septal defect and exercise capacity: value of cardio-pulmonary exercise test in assessment and follow-up. 610
1.2. Defeito do Septo Ventricular
A ausculta cardíaca no pré-teste pode permitir a detecção dos defeitos do septo ventricular (DSV). Os sopros são tipicamente descritos como holossistólicos (pansistólicos). O grau do sopro depende da velocidade do fluxo, com defeitos menores sendo mais ruidosos e podendo causar frémito. 671
O ECG de repouso geralmente reflete o grau de anormalidade hemodinâmica do DSV: 388 , 672 , 673
-
–
Se normal, sugere pequeno DSV, isolado e com pequeno shunt esquerda-direita.
-
–
O padrão de HVE com aumento de átrio esquerdo indica um shunt esquerda-direita moderado/grave, mas sem HAP.
-
–
O padrão combinado de HVE e HVD, com complexos QRS bifásicos, de grande amplitude nas derivações periféricas e precordiais médias (padrão de Katz-Wachtel), é frequentemente encontrado em pacientes com DSV grande e grau variável de HAP.
-
–
Na HAP acentuada (exemplo: síndrome de Eisenmenger), observa-se predomínio de padrão de HVD, desvio do eixo do QRS para direita e aumento do átrio direito.
-
–
Aproximadamente 10% dos pacientes com DSV apresentam BRD (completo ou incompleto).
-
–
Mesmo em pacientes com pequenos DSV, o risco de arritmia grave e morte súbita é maior do que em crianças aparentemente saudáveis.
-
–
A minoria dos pacientes submetidos a reparo transcateter do DSV perimembranoso pode evoluir com BRD, BDASE e BAVT.
Particularidades do DSV no TE/TCPE:
-
–
DSV pequenos na população pediátrica geralmente apresentam shunt esquerda-direita hemodinamicamente insignificante, inclusive durante o esforço, não comprometendo significativamente a capacidade funcional. 674
-
–
Crianças com comunicação interventricular (CIV) patente ou reparada cirurgicamente geralmente têm ACR normal, apesar de discreto comprometimento da resposta cronotrópica. 9 , 675
-
–
Adultos jovens com DSV pequenos não reparados na infância podem evoluir com ACR comprometida relacionada ao tamanho do shunt e disfunção biventricular. 676 , 677
-
–
O reparo cirúrgico de DSV importante nos primeiros 2 anos de vida reduz o risco de persistência de sintomas e de desenvolvimento de anormalidades cardiopulmonares, secundários à disfunção ventricular e/ou doença vascular pulmonar progressiva. 678
-
–
HAP antes do reparo e/ou persistente após o reparo reduz a tolerância ao esforço e piora a qualidade de vida. 679 , 680
-
–
Na síndrome de Eisenmenger, geralmente observa-se comprometimento acentuado da ACR e risco aumentado de morte súbita. 681 , 682
-
–
Outras particularidades encontram-se na Tabela 37 .
Tabela 37. Comportamento das principais variáveis do TE/TCPE no defeito do septo ventricular reparado e não reparado.
| Parâmetros TE/TCPE | DSV não reparado | DSV reparado |
|---|---|---|
| Alterações hemodinâmicas com maior risco de complicações esforço-induzidas | Grande shunt esquerda-direita; dilatação VE, com função de VE comprometida; insuficiência aórtica; doença vascular pulmonar/HAP; síndrome de Eisenmenger. |
|
| ECG de repouso | Geralmente, reflete o grau de anormalidade hemodinâmica do DSV (vide texto). |
|
| Sintomas esforço-induzidos | O DSV pequeno* e sem insuficiência aórtica geralmente é assintomático;
675
Grandes defeitos, HAP, IC e/ou síndrome de Eisenmenger são sintomáticos. |
|
| VO2max | Na CIV patente pequena geralmente normal;
Reduzido nos defeitos grandes, HAP e/ou síndrome de Eisenmenger. |
|
| FCmax | Geralmente discreto comprometimento da resposta cronotrópica. A disfunção do nó sinusal requerendo colocação de marca-passo ocorre em 4% dos pacientes. |
|
| Arritmia esforço-induzida | Rara em defeitos pequenos. Frequente nos grandes defeitos, IC, HAP e síndrome de Eisenmenger. | |
| Oximetria de pulso | Normal nos pequenos defeitos. Diminuída nos grandes defeitos, no shunt direita-esquerda, na síndrome de Eisenmenger e/ou na HAP. |
|
| LV1 | Geralmente reduzido. 691 |
|
| VEmin (L/min) | Geralmente reduzida. |
|
| VE/VO2 | Aumentada nos grandes defeitos e na síndrome de Eisenmenger. |
|
| VE/VCO2 | Aumentada nos grandes defeitos e na síndrome de Eisenmenger. |
|
FCmax: frequência cardíaca máxima; HAP: hipertensão arterial pulmonar; IC: insuficiência cardíaca; BRD: bloqueio de ramo direito; BRE: bloqueio de ramo esquerdo; VEmin: ventilação por minuto; VO2max: consumo máximo de oxigênio; VE/VCO2: equivalente ventilatório de dióxido de carbono; VE/VO2: equivalente ventilatório de oxigênio; VD: ventrículo direito; VE: ventrículo esquerdo; TE: teste ergométrico; TCPE: teste cardiopulmonar de exercício; DSV: defeito do septo ventricular; BDASE: bloqueio divisional anterossuperior esquerdo; BAVT: bloqueio atrioventricular total; CIV: comunicação interventricular; FC: frequência cardíaca; LV1: primeiro limiar ventilatório. *DSV pequenos com shunt esquerda-direita <50%, sem sinais de sobrecarga de volume do VE e pressão da artéria pulmonar normal.
1.3. Persistência do Canal Arterial
As manifestações clínicas da persistência do canal arterial (PCA) dependem principalmente da quantidade de fluxo sanguíneo da aorta para a artéria pulmonar e ocorrência de HAP secundária. 692
O TE/TCPE contribui com o acompanhamento clínico e com as decisões terapêuticas nas várias formas e apresentações da PCA: 693 , 694
-
–
Nas "silenciosas" (inaudíveis) e pequenas (pequeno shunt esquerda-direita, sem repercussão hemodinâmica), para confirmação da condição assintomática, esclarecimento de sintomas esforço-induzidos e de alterações eletrocardiográficas.
-
–
Nas com repercussão hemodinâmica ou com HAP leve/moderada, a cada 12 a 24 meses, como parte do acompanhamento clínico seriado e adjuvante na decisão de intervenções.
-
–
Caso haja HAP, realizar o exame para verificar a ocorrência de dessaturação dos membros inferiores, um critério de gravidade e possível contraindicação para o fechamento do canal. 695 – 697
-
–
Adolescentes e adultos jovens com PCA grave (com aumento de câmara do lado esquerdo, HAP grave e contraindicação para o fechamento do canal arterial) e/ou síndrome de Eisenmenger devem realizar o exame a cada 6 a 12 meses, para ajustes terapêuticos da IC e/ou HAP.
-
–
Nas crianças e adolescentes com PCA grave e que evoluíram para IC avançada, o TCPE contribui particularmente na indicação de transplante cardíaco.
-
–
Após correção, visando avaliar a persistência de sintomas, PCA residual, HAP residual e complicações cirúrgicas, tais como obstrução da artéria pulmonar esquerda e coarctação de aorta.
-
–
Na avaliação pré-participação, para exercícios e esportes em pacientes com PCA silenciosa/pequena ou após correção evoluindo sem HAP. 695
O exame físico pré-teste dos pacientes com PCA não corrigida varia de acordo com o tamanho do canal arterial e sua repercussão. Na PCA silenciosa o exame físico é normal. 698
O ECG de repouso na PCA: 370 , 388
-
–
Nos shunts menores, o ECG geralmente é normal.
-
–
Nos shunts moderados/grandes, geralmente observam-se taquicardia sinusal ou FA, sobrecarga atrial esquerda (SAE), HVE e ISTs. 698
-
–
Quando grande e com HAP, apresenta frequentemente sinais de dilatação do átrio direito e hipertrofia biventricular.
-
–
Normalmente ocorre ritmo sinusal e BAV de I grau em ≈10% dos casos. Raramente observam-se BAV de II grau, BRE e BRD.
Particularidades do TE/TCPE na PCA em crianças e adolescentes:
-
–
Nas silenciosas, geralmente são assintomáticos, sem sequelas hemodinâmicas ou anatômicas, com função pulmonar e ACR normais. Raramente apresentam intolerância ao esforço ou têm doença reativa das vias aéreas esforço-induzida. 693
-
–
PCA com HAP geralmente apresenta comprometimento significativo da capacidade aeróbica, queda da saturação de oxigênio com o esforço (geralmente >10%), redução dos valores de VO2pico e menor inclinação de VE/VCO2, correlacionados diretamente com a gravidade da HAP. Os sintomas esforço-induzidos mais frequentes são dispneia, dor torácica, tontura e palpitação (arritmia ventricular). 197 , 377 , 699
-
–
É necessária a monitorização da SpO2 nas extremidades superiores e inferiores, inclusive para a confirmação de ocorrência de dessaturação dos membros inferiores esforço-induzida. 695
-
–
Após correção cirúrgica, assintomáticos geralmente apresentam FCpico menor do que os aparentemente saudáveis. Em alguns pacientes, pode ocorrer incompetência cronotrópica. 700
-
–
Assintomáticos após correção (transcateter ou cirúrgica), sem evidências de cardiopatia estrutural (doença valvar, arritmia ou hipertrofia ventricular) e de doença pulmonar, geralmente apresentam comportamento pressórico normal e ACR preservada. 700
-
–
Pacientes após correção cirúrgica complicada por paralisia da prega vocal esquerda podem apresentar estridor laríngeo grave e obstrução laríngea esforço-induzidos. 701 , 702
-
–
Nascidos extremamente prematuros (<28 semanas de gestação ou peso ao nascer <1.000 g) e submetidos a correção cirúrgica, quando adolescentes, podem apresentar, ao TCPE, função pulmonar e ACR reduzidas. 701
1.4. Tetralogia de Fallot
A tetralogia de Fallot [(do inglês tetralogy of Fallot (ToF)] clássica consiste em um grupo de quatro defeitos: CIV; estenose pulmonar; hipertrofia VD; aorta cavalgante conectada tanto no VE quanto no VD. Existem variações da apresentação, incluindo ToF com atresia pulmonar e com agenesia da válvula pulmonar. 703 , 704
Os desfechos de longo prazo na ToF reparada são muitos e graves, exigindo acompanhamento regular. 705 A incidência de MSC arrítmica é estimada em 1 a 5%. Os principais fatores associados são: duração do QRS >180 ms; disfunção sistólica ou diastólica do VE; ventriculectomia; pressão diastólica final do VE ≥12 mmHg; história de arritmia supraventricular; taquicardia ventricular não sustentada (TVNS); TV induzível no estudo eletrofisiológico (EEF). 388 , 706 – 708
O TE/TCPE apresenta papel relevante no seguimento, estratificação de risco, decisões terapêuticas e avaliação da repercussão das complicações pós-cirúrgicas: insuficiência pulmonar residual; insuficiência aórtica (IAo); dilatação e/ou disfunção do VD; estenose residual da artéria pulmonar; obstrução da via de saída do VD; arritmias complexas; IC. 100 , 709
O exame físico no pré-teste da ToF reparada é importante para investigação de lesões anatômicas residuais e avaliar condições de risco potencial de complicações durante o exame. 370
Particularidades do ECG de repouso na ToF reparada: 388 , 706 – 708 , 710
-
–
O aumento do átrio direito é observado em ≈30 a 50% dos pacientes.
-
–
O padrão mais prevalente é o de BRD com ou sem BDASE. Geralmente, o BRD é assintomático e não requer intervenção. 711 , 712
-
–
A duração do QRS >150 ms está associada à disfunção de VD e insuficiência valvar pulmonar significativa no pós-operatório tardio.
-
–
Arritmias supraventriculares, incluindo distúrbios de condução sinoatrial, FA e flutter atrial são encontradas em um terço dos pacientes.
-
–
São frequentes as arritmias ventriculares, incluindo TVNS.
Particularidades do TE/TCPE na ToF ( Tabela 38 ):
Tabela 38. Comportamento das principais variáveis do TE/TCPE na ToF reparada e suas repercussões 100 , 716 .
| Parâmetros TE/TCPE | Comportamento | Interpretação/repercussão |
|---|---|---|
| Complicações pós-cirúrgicas com maior risco de eventos no exame | Insuficiência pulmonar residual; insuficiência aórtica; dilatação e/ou disfunção do VD; estenose residual da artéria pulmonar; obstrução da via de saída do VD; arritmias complexas; IC. 717 |
|
| VO2max | Geralmente, o VO2max e o VO2 no LV1 estão reduzidos;*
A média da %VO2pico prevista é de 68±2,8% (IC95%: 62,3-74%). 716 Na resposta cronotrópica normal, o VO2max apresenta-se menos reduzido. Redução mais acentuada é observada na persistência da HAP, IC, insuficiência aórtica, obstrução de via de saída de VD. A insuficiência pulmonar residual e a idade do reparo influenciam na redução do VO2max. 718 |
|
| Frequência cardíaca máxima | Geralmente é menor do que em crianças saudáveis, sendo frequente a incompetência cronotrópica. A disfunção grave do nó sinusal ocorre em 4% dos pacientes. 591 | |
| Arritmia ventricular esforço-induzida | Geralmente relacionada ao reparo tardio e à função ventricular direita deprimida. |
|
| Oximetria de pulso | Normal nos pequenos defeitos residuais.
Diminuída nos grandes defeitos, no shunt direita-esquerda, na síndrome de Eisenmenger e/ou na HAP e IC. |
|
| Pulso de O2 | Geralmente, mantém-se diminuído (em ≈85,3% dos casos). Em ≈10,3% dos pacientes, aumenta; e em ≈4,4%, ocorre redução adicional. 715 , 716 |
|
| VE/VCO2 | Normalmente, um pouco aumentada.
Na IC observa-se grande aumento. |
|
| OUES | Normalmente o valor está pouco alterado, mas com redução importante do VO2max.
Valores de OUES mais baixos estão associados a disfunção ventricular. 715 |
|
HAP: hipertensão arterial pulmonar; IC: insuficiência cardíaca; VD: ventrículo direito; VO2max: consumo máximo de oxigênio; VE/VCO2: equivalente ventilatório de dióxido de carbono; O2: oxigênio; VE: ventilação/minuto; OUES: inclinação da eficiência da captação do oxigênio (do inglês oxygen uptake efficiency slope ); VO2: consumo de oxigênio; VO2pico: VO2 obtido nos exames nos quais não houver as características de um esforço máximo; LV1: limiar ventilatório 1; IC95%: intervalo de confiança de 95%; NYHA: New York Heart Association. *Após correção cirúrgica completa e com bons resultados, sem CIV residual e gradiente de pressão entre VD e artéria pulmonar <20 mmHg.
-
–
Pacientes após correção cirúrgica com bons resultados (sem CIV residual e gradiente de pressão entre VD e a artéria pulmonar <20 mmHg geralmente são assintomáticos em repouso.
-
–
Após a correção cirúrgica completa, geralmente não se observam grandes limitações físicas nas atividades do cotidiano. Entretanto, frequentemente o TCPE mostra valores reduzidos de VO2max e de VO2 no LV1. 713
-
–
Crianças e adolescentes que mantém resposta cronotrópica normal apresentam maior ACR e reserva da FC, mesmo quando com insuficiência pulmonar e disfunção sistólica do VD no repouso. 714
-
–
Adolescentes apresentam redução na ACR relacionada aos volumes sistólicos biventriculares e volume diastólico final do VE indexado à ASC. O valor de OUES e do PuO2pico também estão relacionados aos volumes sistólicos biventriculares. 715
-
–
Após a correção cirúrgica, a PAS em membro superior, a PAS central e o índice de rigidez arterial apresentam comportamento normal ao esforço. 591
-
–
Em pacientes assintomáticos após correção da ToF, evoluindo com estenose pulmonar grave e diminuição da ACR, deve-se considerar a troca valvar. 81
-
–
Pode ocorrer arritmia ventricular esforço-induzida (AVEI), geralmente relacionada ao reparo tardio, disfunção do VD e risco aumentado de eventos CV.
1.5. Transposição das Grandes Artérias
A transposição das grandes artérias (TGA) é uma CC cianótica grave, incompatível com a vida, requerendo obrigatoriamente a existência de shunt intracardíaco (forame oval patente, comunicação interatrial ou CIV) e/ou shunt extracardíaco (PCA ou circulação colateral broncopulmonar). 723
A TGA pode ser dividida em: 724 , 725
-
–
Simples, sem defeitos cardíacos adicionais ao shunt .
-
–
Complexa, com lesão adicional associada: obstrução da via de saída do VE (≈25% dos pacientes); anomalias das válvulas mitral e tricúspide; anomalias de artérias coronárias; nos pacientes com CIV (≈50%), observam-se estenose ou atresia pulmonar, sobreposição de uma válvula atrioventricular ou CoAo.
A TGA requer tratamento cirúrgico logo após o nascimento ou no máximo nos primeiros meses de vida. Desde o final da década de 1980, tem-se preconizado a realização de cirurgia de troca (CT) arterial (cirurgia de Jatene) em vez da cirurgia de troca atrial (Mustard/Senning). Nos casos de TGA complexa, podem ser necessárias outras formas de abordagem cirúrgica (exemplos: Rastelli e Nikaidoh). 724 , 726 , 727
Os pacientes necessitam de acompanhamento a longo prazo, pois é frequente a ocorrência de complicações: reintervenção em até 25% (devido a estenose da artéria pulmonar, obstrução de artéria coronária, dilatação da raiz da aorta e/ou IAo); disfunção do VD; bradiarritmias e taquiarritmias; DAC; morte súbita. 726 , 728 , 729
O TE/TCPE apresenta papel relevante no acompanhamento após reparo: 22 , 723 , 724 , 726 , 729 , 730
-
–
Recomenda-se a realização a cada 3 a 5 anos, como parte da investigação de isquemia miocárdica assintomática, principalmente nos pacientes submetidos a CT arterial.
-
–
Investigação de episódios de síncope e palpitações, geralmente decorrentes de arritmias secundárias à isquemia miocárdica, obstrução da via de saída de VD e/ou disfunção do VE. As arritmias ocorrem em 2,4 a 9,6% dos pacientes e associam-se a risco de MSC.
-
–
Investigação de queixa de alterações na tolerância às atividades físicas habituais ou sintomas de dor torácica esforço-induzida, geralmente associadas ao declínio da função do VE, DAC e obstrução da artéria pulmonar.
-
–
Para a estratificação de risco, prognóstico e liberação/prescrição de reabilitação cardiovascular.
O ECG de repouso varia com a técnica de reparo e sintomatologia do paciente. Na CT atrial é comum a observação de: DNS; ritmo juncional; distúrbios de condução atrioventricular; hipertrofia do VD e desvio do eixo para a direita; ondas Q nas derivações precordiais direitas. Na CT arterial, geralmente observa-se ritmo sinusal (91,1%) e, raramente, ritmo atrial ectópico (5,4%) ou ritmo juncional (3,6%). Também não se costumam evidenciar sinais de isquemia ou extrassistolia. 724 , 731
Particularidades do TE/TCPE após reparo da TGA:
-
–
Independentemente do procedimento adotado no reparo, os pacientes geralmente apresentam algum grau de comprometimento da ACR (%VO2pico previsto de 87,5±2,9%). 21 Entretanto, mesmo com a aptidão levemente reduzida, os pacientes geralmente encontram-se em classe funcional I da NYHA. 723 , 728
-
–
Pacientes submetidos a CT arterial têm melhor tolerância ao esforço em comparação com aqueles submetidos a CT atrial. 723 , 732
-
–
Pacientes submetidos a CT arterial e reparo de CIV ou com obstrução residual de via de saída de VD apresentam maior comprometimento da ACR. 23 , 733
-
–
Na fase tardia da CT arterial, a FCmax geralmente é normal ou levemente diminuída (FCmax: 92±2% do previsto). 21 , 23 A incompetência cronotrópica na fase tardia ocorre entre ≈5 e 34% dos pacientes. A DNS geralmente é secundária ao comprometimento da artéria do nó sinusal durante septostomia por balão ou mesmo CT arterial. 728 , 733
-
–
Na fase tardia da CT arterial, geralmente a PAS é normal no repouso e no esforço. A PAD geralmente apresenta valores menores no repouso e no pico do esforço. 731
-
–
Na fase tardia da CT arterial, geralmente observa-se redução do pulso de O2 com VO2pico normal (sem redução da ACR). A boa correlação entre o valor de OUES e VO2pico permite o seu uso nos pacientes que não atingiram o esforço máximo. 626 , 734
-
–
Na fase tardia da CT atrial (Mustard ou Senning): geralmente observam-se: arritmia ventricular (repouso e esforço); redução da fração de ejeção do VD (em até 84% dos pacientes); redução do pulso de O2 e do LV1; normalização lenta do pulso de O2 na recuperação; retenção prolongada de CO2 com subsequente hiperpneia. 729 , 735 , 736
-
–
Exames seriados na fase tardia da CT atrial evidenciam redução progressiva do VO2pico e pulso de O2 na infância e adolescência, sugerindo incapacidade de aumentar o volume sistólico.
-
–
Na fase tardia da CT atrial, o VO2pico e pulso de O2 permanecem relativamente estáveis nos adultos jovens. Entretanto, quando ocorre acentuação da disfunção do VD observam-se declínio rápido no pulso de O2, piora da tolerância ao esforço, arritmias e deterioração clínica com IC. 737 , 738
-
–
A ocorrência de arritmias no pós-operatório precoce de CT atrial representa risco de arritmias na fase tardia (RR: 3,8; IC95%: 1,5-9,5) e de desenvolvimento de IC (RR: 8,1; IC95%: 2,2-30,7). 739
-
–
Na fase tardia da CT atrial, é comum observar FCpico reduzida e a ocorrência de incompetência cronotrópica. 735 , 740
-
–
Independentemente da técnica de reparo, o ISTE é raro, mas, caso preencha os critérios para isquemia miocárdica, deve-se prosseguir na investigação de DAC (geralmente assintomática; acometendo 2 a 11,3% dos pacientes). 741
1.6. Cirurgia de Fontan
A cirurgia de Fontan é um procedimento paliativo nas CC com um único ventrículo funcional, permitindo uma quase normalização da saturação arterial e a remoção da sobrecarga crônica de volume. A história natural dos pacientes com cirurgia de Fontan é caracterizada por aumento progressivo da resistência vascular periférica, subsequente redução do débito cardíaco, hipertensão venosa crônica, estase periférica e congestão no sistema linfático. As principais complicações são: cianose, intolerância aos esforços físicos, IC, ascite, arritmias, disfunção hepática, enteropatia perdedora de proteínas, bronquite e anormalidades da coagulação. A ocorrência de IC na cirurgia de Fontan é comum e progressiva, podendo ser sistólica, diastólica ou ambas. Fatores contribuintes para desenvolvimento de IC: disfunção ventricular diastólica, resistência vascular pulmonar aumentada, taquicardia atrial, insuficiência valvar e shunts com sobrecarga de volume. 742 – 744
O TE/TCPE é útil no acompanhamento dos pacientes com cirurgia de Fontan, tendo em vista: 744
-
–
Quantificar a ACR e inferir sobre fatores limitantes ao esforço.
-
–
Avaliar reserva respiratória, ventilação-perfusão, SpO2, resposta cronotrópica e arritmias, que contribuem para a limitação aos esforços e complicações tardias.
-
–
Ajustes terapêuticos, inclusive o fechamento da fenestração (por hipóxia sistêmica excessiva) e indicação de implante de MP (por doença do nó sinusal/incompetência cronotrópica grave). 745 , 746
-
–
O TCPE contribui na seleção de candidatos ao transplante cardíaco.
-
–
A estratificação de risco, prognóstico e liberação/prescrição de RCV. 747 – 750
-
–
Estratégia de vigilância intensiva de adolescentes com realização do exame a cada 1 a 3 anos, devido ao alto risco de IC e morte precoce segundo a American Heart Association . 744
Particularidades do TE/TCPE na cirurgia de Fontan:
-
–
Nos pacientes com IC e/ou SpO2 baixa em repouso, recomenda-se a realização do exame a nível hospitalar com adoção de cuidados especiais: adequação de protocolos/carga de esforço, monitorização SpO2 etc.
-
–
A ACR é predominantemente reduzida com VO2max atingindo ≈60 a 65% do previsto. 92 , 747 , 751
-
–
A ACR nos pacientes com cirurgia de Fontan pode ser classificada de acordo com a %VO2 prevista atingida: capacidade severamente prejudicada se <50%; moderadamente prejudicada entre 50 e 60%; ligeiramente prejudicada entre 60 e 80%; limítrofe entre 80 e 90%; normal se >90%. 752
-
–
É comum a SpO2 em repouso ser baixa (inclusive com níveis <90%). A SpO2 no esforço geralmente cai para <90% por descompensação dos mecanismos de controle da cianose e aumento do retorno venoso de sangue dessaturado. 588
-
–
Crianças e adolescentes comumente apresentam, ao esforço, incompetência cronotrópica e reserva cronotrópica diminuída. O tipo de procedimento paliativo, o subtipo de ventrículo dominante e/ou a anatomia cardíaca subjacente afetam o grau de incompetência cronotrópica. Geralmente, o comportamento da FC na recuperação é normal. 753 , 754
-
–
A PAS repouso mantém-se inalterada, enquanto a PAD aumenta significativamente no pós-operatório. No esforço, os comportamentos da PAS e da PAD são normais, consistentes com a carga de esforço, atingindo geralmente >85% da PAS predita para faixa etária. 755
-
–
O aumento na duração e na dispersão da onda P no ECG de repouso associam-se ao risco de taquiarritmias atriais sustentadas (acometendo de 9,4 a 20% dos pacientes; incluindo FA e taquicardia reentrante intra-atrial). 756 , 757
-
–
A ocorrência de extrassistolia ventricular é rara, podendo ser decorrente de piora da função ventricular ou secundária a distúrbios eletrolíticos/medicamentosos. Cerca de 3 a 12% dos pacientes evoluem tardiamente com TV. 758 , 759
-
–
As arritmias esforço-induzidas são raras e geralmente desaparecem com a suspensão do esforço. 751
-
–
O ECG de repouso geralmente apresenta padrão de HVE, sobrecarga ventricular e ISTs significativo (>1,0 mm). Frequentemente, observa-se aumento do ISTs com o esforço, entretanto sem associação com DAC. 520 , 760
-
–
Geralmente, observa-se redução do pulso de O2, do LV1, da ventilação pulmonar, do QR e incompetência cronotrópica (em até 62% dos pacientes). Essas alterações associadas à função ventricular sistólica comprometida se correlacionam com pior ACR. 588 , 592 , 593 , 761
-
–
A diminuição de reserva cardíaca, VO2pico, OUES e incompetência cronotrópica identificam pacientes com maior risco de morte e necessidade de transplante cardíaco. 91 , 748 , 749 , 762 , 763
-
–
Em adolescentes, a ventilação oscilatória ao esforço (EOV do inglês, exercise oscilatory ventilation ) está associada ao aumento do risco de morte/transplante (RR: 3,9; IC95%: 1,5-10,0). 764
-
–
Em adolescentes, foram marcadores de risco de hospitalização em 2 anos (por IC, arritmia e outras complicações): OUES ≤45% (RR: 7,645; IC95%: 2,317-25,230); inclinação VE/VCO2 ≥37 (RR: 10,777; IC95%: 1,378-84,259). 765
1.7. Cardiomiopatia Hipertrófica
A CMH é uma doença genética com padrão autossômico dominante (penetrância incompleta e expressividade variável), apresentando miócitos hipertrofiados, desorganizados e separados por áreas de fibrose intersticial. A hipertrofia cardíaca é geralmente assimétrica, envolvendo mais comumente o septo interventricular basal subjacente à valva aórtica. Ocasionalmente, restringe-se a outras regiões cardíacas, como o ápice, porção média e parede posterior do VE. A CMH pode ser classificada em primária, se a mutação nos genes sarcoméricos representar a causa da doença, e em secundária, se associada a causa não sarcomérica. 766 , 767
Na infância, a idade média de início é de 8,9 anos, sendo mais frequente no sexo masculino. O risco de MSC em pacientes pediátricos é de ≈1 a 7% ao ano. Em adolescentes com história familiar de MSC, o tempo médio após o diagnóstico para evento cardíaco maior (incluindo morte, MSC) ou intervenção cardíaca (miectomia e/ou CDI) é de ≈18 meses. 768 – 770
Os sintomas geralmente resultam de quatro condições fisiopatológicas: disfunção ventricular diastólica, obstrução ao fluxo de saída do VE, isquemia miocárdica e arritmias cardíacas. 770
Nesse contexto, o TE/TCPE é útil na estratificação de risco e manejo clínico, principalmente em crianças >7 anos, por serem de maior risco. Aproximadamente um terço dos pacientes com CMH apresenta obstrução da via de saída de ventrículo esquerdo (VSVE) em repouso intensificada com o esforço, um terço tem obstrução esforço-induzida e o outro terço tem HVE sem obstrução (em repouso ou esforço-induzida). 771
Em pacientes com obstrução da VSVE, geralmente é audível um sopro rude mesossistólico, de grau 3-4/6, mais alto entre o ápice e a borda esternal esquerda. O sopro aumenta de intensidade quando o volume do VE diminui durante a manobra de Valsalva, ao assumir a posição ereta e durante e imediatamente após o esforço. 771
Particularidades do ECG de repouso na CMH: 388 , 772
-
–
Alterado em 75 a 95% dos pacientes, mesmo quando sem ou apenas leve obstrução da VSVE.
-
–
Presença de SAE.
-
–
As anormalidades mais comuns são o padrão de HVE, ondas Q profundas, ISTs e alterações da onda T.
-
–
De 2 a 5% dos pacientes exibem pré-excitação e podem apresentar arritmias supraventriculares nodais AV e síndrome de WPW. 768
Particularidades do TE/TCPE na CMH:
-
–
Auxilia nas decisões sobre o escalonamento das terapias, principalmente se os sintomas não forem claros baseados na história clínica.
-
–
Geralmente evidencia baixa ACR.
-
–
Pacientes com obstrução grave da VSVE geralmente apresentam pressão diastólica ventricular elevada e dispneia esforço-induzida. Nos casos mais graves, pode ocorrer franca IC aguda.
-
–
A síncope esforço-induzida ou no início da recuperação decorre de obstrução grave da VSVE, com ou sem arritmia ventricular associada.
-
–
Frequentemente ocorre dor torácica isquêmica, que pode ou não ter as características anginosas típicas.
-
–
Resposta anormal da PA ao esforço, caracterizada por aumento da PAS <25 mmHg ou queda >10 mmHg, estão associadas ao risco aumentado de MSC. 154 , 438 , 773
-
–
O TE anormal associa-se a maior risco de morte por todas as causas e/ou transplante: resposta isquêmica (RR: 4,86; IC95%: 1,69-13,99) e resposta pressórica deprimida (RR: 3,19; IC95%: 1,32-7,71). A isquemia esforço-induzida também foi associada de forma independente com MSC (RR: 3,32; IC95%: 1,27-8,70). 157
-
–
ESVs e EVs esforço-induzidas são frequentes, podendo ocorrer TVNS em 20 a 30% dos pacientes.
-
–
A ocorrência de arritmia esforço-induzida (atrial e/ou ventricular) em qualquer densidade está associada ao risco aumentado de transplante cardíaco, implante de CDI e MSC (RR: 5,8; IC95%: 1,3-26,7). 157 , 773
-
–
A FA é encontrada em ≈25% dos pacientes com CMH, sendo mal tolerada e frequentemente responsável por sintomas de IC ao esforço.
-
–
A ACR comprometida (%VO2pico geralmente <80%) correlacionou-se com disfunção diastólica ao ecocardiograma. 207
-
–
O TCPE mensura diretamente a ACR, sendo relevante na avaliação de pacientes com sintomas graves, particularmente para a indicação de transplante cardíaco. 774 A redução do VO2pico <50% dos valores previstos para idade e sexo deve ser considerada no processo de indicação do transplante. 775
-
–
O VO2pico, pulso de O2 e FCpico geralmente estão reduzidos com piora gradual ao longo do tempo. 207 A %VO2pico prevista ≤60% é marcadora de risco de IC e MSC. 770
1.8. Doença de Kawasaki
A doença de Kawasaki (DK) é uma vasculite sistêmica aguda que afeta principalmente crianças <5 anos do sexo masculino (proporção ≈1,5:1). É a maior causa de DAC adquirida em crianças, sendo mais frequente no Japão. 37 , 776
A complicação mais relevante da DK aguda é o desenvolvimento de anormalidades vasculares em artérias de pequeno a médio calibre (principalmente no coração), caracterizada por três processos interligados: arterite necrotizante; vasculite subaguda/crônica; proliferação miofibroblástica luminal. A DAC pode se desenvolver durante a fase de cicatrização do episódio agudo ou mesmo tardiamente. Mesmo crianças com DK sem evidência de lesões coronarianas apresentam menor reserva de fluxo coronariano, com maior resistência coronariana total. 777 , 778
O risco de desenvolvimento de aneurismas em artérias coronárias (AAC) é de ≈25% dos casos não tratados e 5% dos casos adequadamente tratados. Os AAC podem se manifestar inicialmente como uma ectasia e progredir para dilatação moderada (5 a 8 mm de diâmetro) ou mesmo na forma de grandes aneurismas (>8 mm). Os AAC são classificados comparando os diâmetros dos das artérias coronárias indexadas em unidades de desvio padrão da média pela área de superfície corporal (escore Z). Essa classificação é recomendada para o tronco da coronária esquerda, descendente anterior (DA) e coronária direita (CD). A classificação considera o AAC como: ausente se o escore Z for <2; dilatação isolada se 2 a <2,5; aneurisma pequeno se ≥2,5 a <5,0; médio se ≥5,0 a <10,0 e dimensão absoluta <8 mm; grande ou gigante se for ≥10,0 (ou dimensão absoluta ≥8 mm). Os aneurismas grandes e/ou gigantes não regridem, raramente se rompem e quase sempre contêm trombos, que podem inclusive calcificar ou se tornar oclusivos. 37 , 776
Crianças com AAC podem evoluir na fase tardia da DK (FT-DK) com trombose, doença isquêmica miocárdica, infarto e morte súbita (≈0,2 a 0,8% nos primeiros 10 anos após a DK). As complicações mais frequentes da FT-DK são a doença isquêmica miocárdica (4,6 eventos/1.000 pessoas-ano) e arritmias ventriculares (4,5/1.000 pessoas-ano). Pacientes na FT-DK necessitam de acompanhamento regular e adoção de protocolos de estratificação de risco e de prevenção de complicações, sendo o TE/TCPE útil nesse contexto. 779 – 781
O ECG de repouso varia conforme as complicações decorrentes da fase aguda da DK. Em pacientes com AAC ou após infarto agudo do miocárdio (IAM) na fase aguda, é comum a observação de ondas Q patológicas e alterações do segmento ST/onda T associadas às áreas de isquemia e/ou de necrose. Recomenda-se avaliar a dispersão do QTi (QTd), que quando alterada está associada a sequelas coronarianas e maior risco de arritmia ventricular durante o seguimento. 487 , 782 , 783
Principais indicações do TE/TCPE na DK: 18 , 37
-
–
Na FT-DK, para investigação de sintomas sugestivos de isquemia (GR-NE: I-C).
-
–
Na população pediátrica, não devem ser indicados isoladamente para investigação de isquemia miocárdica esforço-induzida. Nesses casos, recomenda-se a associação com método de imagem.
-
–
Em pacientes com AAC com suspeita de eventos isquêmicos, sintomas esforço-induzidos ou baixa tolerância aos esforços (GR-NE: I-C).
-
–
Em pacientes com AAC, na avaliação pré-participação de esportes competitivos ou atividades de alta intensidade, buscando detectar arritmias esforço-induzidas (GR-NE: IIa-C).
-
–
No acompanhamento de crianças e adolescentes submetidos a revascularização (cirúrgica e/ou percutânea), para avaliação da ACR, ajustes terapêuticos e progressão da DAC/reestenose. 784
-
–
Para estratificação de risco/prognóstico e liberação/prescrição de RCV (GR-NE: I-B).
Particularidades do TE/TCPE na DK:
-
–
Em pacientes sintomáticos, auxilia no processo de indicação de revascularização. São considerados fatores de má evolução as arritmias esforço-induzidas e/ou baixa tolerância ao esforço (<3 METs) associada a sintomas (angina e dispneia). 18 , 37
-
–
Pacientes na FT-DK e com DAC moderada a grave podem apresentar doença do nó sinusal e distúrbios da condução atrioventricular. 785
-
–
Pacientes na FT-DK com escore Z ≥2,0 na DA proximal ou CD geralmente apresentam redução dos METs atingidos proporcionalmente ao grau do escore, menores níveis de ACR, QR, PAS máxima e duplo-produto (DP) máximo, quando comparados aos pacientes com escore Z <2,0. 15 , 786 A redução da ACR geralmente é mais grave em adolescentes com DK. 16 , 17
-
–
Pacientes na FT-DK com AAC e sem defeitos de perfusão miocárdica apresentam respostas da FC, PAS e PAD ao esforço similares às de pacientes sem AAC. Entretanto, os pacientes com AAC e defeitos de perfusão miocárdica costumam apresentar menor FC no 1 ° minuto da recuperação e menor PAD (no 1 ° e no 5 ° minuto da recuperação), que são achados de pior prognóstico. 398
-
–
ISTE é comum na FT-DK, entretanto, com baixa sensibilidade e alta especificidade para lesões coronarianas obstrutivas. 18 , 787
-
–
Pacientes na FT-DK raramente apresentam arritmias ventriculares esforço-induzidas (relacionadas ao escore Z ≥5). Arritmias ventriculares complexas e TV esforço-induzidas estão associadas a AAC grandes, TV prévia, CDI, DAC, pós-IAM (geralmente após 10 anos) e pós-cirurgia de revascularização do miocárdio (CRVM). 560 , 788
-
–
A QTd ao esforço geralmente é alterada na FT-KD, independentemente da QTd em repouso ou de sequelas coronárias. Essa alteração representa risco de desenvolvimento de arritmias esforço-induzidas. 789
2. Insuficiência Cardíaca/Transplante Cardíaco
No Brasil, em 2017, a prevalência de IC na faixa etária dos 5 a 14 anos foi de 34,1/100.000 crianças. 790 Na população pediátrica com CC, a prevalência varia de 6,2% a 39%. A IC na população pediátrica apresenta alta morbidade e taxa de mortalidade intra-hospitalar variando entre 7 e 26%. 791 , 792
As principais causas de IC na população pediátrica são apresentadas na Tabela 39 . A apresentação clínica da IC está relacionada à idade: lactentes e crianças pequenas apresentam dificuldade na alimentação, cianose, taquipneia, taquicardia sinusal e diaforese; crianças maiores e adolescentes apresentam fadiga, falta de ar, taquipneia e intolerância aos exercícios, dor abdominal, oligúria e edema de membros inferiores. A gravidade da IC deve ser classificada de acordo com a faixa etária através das classificações modificada de Ross (crianças <6 anos) e/ou NYHA (crianças >6 anos) – vide Tabela 39 . 379 , 793
Tabela 39. Principais causas da insuficiência cardíaca na população pediátrica 794 , 795 .
| Tipo das causas | Exemplos |
|---|---|
| Mutações genéticas | Lamin A-C; proteína C de ligação à miosina; troponina I; tafazzin (síndrome de Barth); distrofina; LAMP2 (doença de Danon); distúrbios mitocondriais; titina; desmina. |
| Miocardite | Enterovírus; parvovírus; adenovírus; influenza; vírus Epstein-Barr; vírus da imunodeficiência humana; citomegalovírus; varicela; caxumba; doença de células gigantes; doença de Lyme; micoplasma; doença de Chagas. |
| Isquemia | Origem anômala da artéria coronária; doença de Kawasaki com aneurismas coronarianos. |
| Distúrbios metabólicos | Distúrbios da oxidação de ácidos graxos; distúrbios do armazenamento de glicogênio (por exemplo: Pompe); deficiência de carnitina. |
| Doença cardíaca estrutural | Doença valvular; cardiopatia congênita. |
| Distúrbios endócrinos | Hipotireoidismo; tireotoxicose; feocromocitoma; doenças de armazenamento de glicogênio. |
| Distúrbios hematológicos | Deficiência de ferro; anemia falciforme; hemocromatose; talassemia. |
| Doenças autoimunes | Lúpus eritematoso sistêmico; dermatomiosite; cardiomiopatia reumática. |
| Agentes cardiotóxicos | Antraciclina; ciclofosfamida; radiação. |
A IC direita não é comum em crianças, mas pode estar associada a CC, incluindo ToF, TGA, DSA, anomalia de Ebstein, cardiomiopatia arritmogênica do VD e disfunção ventricular na fisiopatologia do ventrículo único. As duas principais causas de IC terminal na população pediátrica são as cardiomiopatias e CC, cada uma contribuindo com cerca de metade dos casos de transplante cardíaco (TCard). O TCard na população pediátrica representa 13% de todos os transplantes, e mais de 60% dos receptores sobrevivem por pelo menos 10 anos. 191 , 796 , 797
Indicações do TE/TCPE na IC em população pediátrica: 182 , 797 – 800
-
–
A determinação da ACR e a avaliação do comportamento das variáveis do TCPE fornecem informações objetivas sobre o estado funcional do coração, pulmões e musculatura periférica, evolução da IC e auxiliam nas decisões terapêuticas. 6
-
–
O TCPE deve fazer parte da avaliação de pacientes (idade ≥6 a 8 anos) com cardiomiopatia e IC (GR-NE: IIa-C).
-
–
O TCPE deve ser usado para determinar a causa da limitação cardiorrespiratória ao esforço em pacientes com sintomas de IC (GR-NE: IIa-C).
-
–
Em pacientes com IC em estágio C, o VO2pico <50% do previsto associado a grave limitação ao esforço constitui a base para eventual indicação de TCard (GR-NE: IIa-C).
-
–
Avaliação pré-participação e a estratificação de risco precedendo programa de treinamento físico/RCV (GR-NE: I-C).
-
–
Na avaliação em pacientes com dispositivo de suporte e/ou após TCard, para determinação da ACR, estratificação de risco, avaliação seriada do enxerto e prescrição de programa de atividades (incluindo reabilitação e atividades físicas escolares) (GR-NE: IIa-C).
-
–
Nos pacientes com suspeita de cardiotoxicidade (quimioterapia/radioterapia) no diagnóstico diferencial de dispneia, rastreamento de disfunção cardíaca (inclusive subclínica), estratificação de risco, ajustes terapêuticos e prescrição/liberação de exercícios físicos e reabilitação. 801
O ECG de repouso na IC é inespecífico, mas frequentemente anormal, podendo apresentar hipertrofia de VE, sobrecarga VD e/ou VE, alterações do segmento ST e/ou da onda T. Distúrbios do ritmo são comuns, incluindo taquicardia sinusal, taquicardia supraventricular, FA/ flutter atrial, BAV e TV. Os distúrbios da condução intraventricular ou prolongamento do QTc geralmente estão associados à disfunção ventricular, IC e cardiopatia estrutural (CC ou cardiomiopatia avançada). 559 , 802 Na cardiomiopatia idiopática, a presença de BRE e SAE correlacionam-se com risco aumentado de mortalidade. 379 , 803
Particularidades do TE/TCPE na IC:
-
–
Normalmente, são feitos em vigência de medicações em uso, inclusive antiarrítmicos e betabloqueadores. A suspensão pode desencadear piora do quadro clínico e maior risco de complicações durante o exame. Pacientes em uso de antiarrítmico são mais graves e apresentam maior risco de MSC em acompanhamento de 5 anos (RR: 3,0; IC95%: 1,1-8,3). 803
-
–
Crianças com IC secundária a cardiomiopatia dilatada idiopática apresentam no LV1 e no pico do esforço: valores significativamente menores de PAS, VC, VO2, VCO2 e VEmin; valores aumentados do VE/VO2 e VE/CO2; anormalidade do pulso O2; inclinação do VE/VCO2 no pico do esforço significativamente maior. As variáveis permitem a quantificação da redução da ACR e os eventuais mecanismos limitantes ao esforço. 804
-
–
O TCPE seriado em crianças com cardiomiopatia dilatada demonstrou risco de hospitalização por IC descompensada, suporte circulatório/TCard e morte nas que apresentaram redução de 10 mmHg na PASpico (RR: 1,41; IC95%: 1,12-1,79) ou redução de 10% na %VO2pico previsto (RR: 1,59; IC95%: 1,16-2,17). 805
-
–
VO2pico <44% do previsto em crianças com circulação biventricular associou-se a risco maior de morte ou deterioração da IC (RR: 5,1; IC95%: 1,9-13,5). 806
-
–
Embora rara, deve-se atentar para a possibilidade de desenvolvimento de IC descompensada aguda esforço-induzida, com necessidade de intervenção imediata/cuidados intensivos. 800
-
–
Na fase tardia de quimioterapia (10 anos) com antraciclina (dose cumulativa >300 mg/m2) ≈32% dos pacientes evoluíram com comprometimento da ACR (%VO2max previsto <80%) e disfunção cardíaca subclínica. 798
Particularidades do TE/TCPE no TCard na população pediátrica:
-
–
Na avaliação dos receptores de TCard, sugere-se a conversão das variáveis (VO2, FCpico, carga de trabalho etc.) em porcentagem prevista para a idade, sexo e/ou peso, de modo a permitir comparações seriadas e aos dados disponíveis na literatura.
-
–
VO2pico ≤62% do previsto em pacientes com IC está fortemente associado ao risco de TCard e morte em 2 anos (RR: 10,78; IC95%: 4,04-27,98). 807
-
–
Crianças com circulação biventricular apresentam risco de morte, necessidade de suporte circulatório e TCard de urgência quando o VO2pico <50% do previsto (RR: 4,7; IC95%: 1,8-12,3) e a inclinação de VE/VCO2 ≥34 (RR: 3,2; IC95%: 1,2-8,4). 806
-
–
O TCPE faz parte da investigação detalhada necessária para a seleção de TCard, sendo o VO2pico <50% do previsto indicação Classe I. 808 Outras indicações são VO2 <14 mL/kg/min (sem uso de betabloqueador) e VO2 <12 mL/kg/min (em uso de betabloqueador). 809
-
–
Após o TCard, geralmente observa-se comprometimento da ACR, tanto na fase imediata quanto 3 a 6 anos após o transplante, mas de maneira estável. Quanto menor for a idade do paciente no momento do transplante, maiores serão os valores de VO2pico. A carga máxima de trabalho diminuída (<75% do valor previsto) é frequentemente observada. O comportamento seriado da FC (repouso, pico e reserva cronotrópica), da PAS e VO2pico fornecem informações quanto à reinervação (geralmente com estabilidade ou aumento de valores) e evolução do enxerto, sendo a redução progressiva do VO2pico associada à perda do enxerto devido à vasculopatia. 810 , 811
-
–
A FC em receptores de TCard geralmente em repouso é maior e, no pico do esforço, é menor (variando entre 66 e 86% da FCmax prevista). A FC no 1 ° e 3 ° minuto da recuperação, está diminuída nos pacientes com denervação persistente. 191
-
–
Em média, 57% dos receptores apresentam evidências de reinervação autonômica (predominantemente simpática) associada a melhor ACR, maior sobrevida e estabilidade do enxerto. Pacientes com denervação autonômica geralmente evoluem com incompetência cronotrópica. O descondicionamento e efeitos secundários do tratamento de imunossupressão também podem afetar a ACR. 182 , 191 , 409 , 811
-
–
O TCPE realizado no pós-operatório imediato de TCard (1 ° mês) em uma série de pacientes demonstrou valores reduzidos do VO2 no LV1 e no pico do esforço (ambos com valores abaixo do previsto). 192
-
–
O TCPE seriado em pós-operatório tardio de TCard demonstrou que, no primeiro exame (≈3 anos), a %VO2 atingida foi de 59,3% e a %FCmax foi de 75,8%, permanecendo diminuída em exame subsequente (≈5 anos). 810
-
–
Comportamento de outras variáveis do TCPE nos receptores TCard: a VEmin pico geralmente é reduzida; a carga de trabalho é menor (variando de 60 a 66%); o VO2pico variou em 56±14% do previsto. 191
3. Arritmias Cardíacas
3.1. Síndrome do QT Longo Congênito
A síndrome do QT longo congênito (SQTL) é uma doença genética caracterizada por prolongamento do intervalo QTc (QTc >440 ms no sexo masculino e QTc >460 ms no feminino), com prevalência de 1:2.000 a 1:5.000. Pode causar síncopes, arritmias ventriculares e parada cardíaca. A idade média de apresentação da síndrome é de 14 anos, apresentando taxa anual de MSC entre 0,33% e 0,9%. A SQTL deve ser investigada em crianças e adolescentes com esse quadro clínico, antecedentes familiares de morte súbita e/ou diagnóstico de SQTL. Na SQTL tipo 1, o gatilho mais importante de arritmias é o exercício físico. Os critérios de Schwartz são recomendados para o diagnóstico de SQTL em população pediátrica e adulta. 812 – 814
É recomendado que o QTi seja mensurado nas derivações D2 e V5. 82 O prolongamento do QTi em ECG de repouso é a principal forma diagnóstica da síndrome. Entretanto, de 20 a 25% dos pacientes com SQTL confirmada têm intervalo QTc normal no repouso. 6 , 308 A fórmula ideal de ajuste do QTc no TE permanece controversa (vide sessão "3.3.2.8. Intervalo QT" desta diretriz). A interpretação do QTc depende da fórmula utilizada. 124 , 542 – 544 A Tabela 24 apresenta os valores de referência do QTc por faixa etária pediátrica.
A Diretriz de Arritmias Cardíacas em Crianças e Cardiopatias Congênitas indica o TE em: 82
Pacientes com escore de Schwartz igual a 3,0 (probabilidade intermediária), quando o prolongamento do intervalo QTc na recuperação do exame agrega valor para o diagnóstico. 57
Familiares assintomáticos com QTc de repouso <440 ms.
Pacientes sem fenótipo ou genótipo definido para adequação terapêutica.
Avaliação de sintomas inespecíficos ao esforço.
O TE pode revelar incompetência cronotrópica, alternância da onda T, taquiarritmias ventriculares ou comportamento paradoxal do QTi no esforço e/ou recuperação (aumentando em vez de diminuir). 57 , 813 , 815
O QTc na fase de recuperação tem sido preconizado devido à dificuldade da medição do intervalo QT em FC elevadas. O QTc é medido em 3 a 4 minutos da fase de recuperação, sendo o aumento de ≥30 ms considerado significativo. 109 , 542 , 548 , 816
Na avaliação de eficácia terapêutica (com betabloqueador) em pacientes com SQTL, o objetivo é determinar se há redução da resposta cronotrópica e/ou supressão de arritmias no esforço máximo. 817 – 819
3.2. Síndrome de Brugada
A síndrome de Brugada (SBr) é uma canalopatia hereditária autossômica dominante (mutações principalmente no gene SCN5A) causada por um defeito dos canais de sódio no epicárdio do VD. Apresenta ECG com padrão típico de elevação do segmento ST nas derivações precordiais direitas (V1-V3) com risco aumentado de morte súbita. A prevalência da SBr na população pediátrica é baixa (≈1 em 20.000), sendo a maioria assintomática. Alguns pacientes aparentemente saudáveis apresentam expressão precoce da doença, sendo a manifestação inicial a DNS e arritmias atriais. A SBr também pode manifestar-se com síncope, arritmias ventriculares potencialmente letais [TV polimórfica/fibrilação ventricular (FV)] e parada cardíaca (durante o sono e/ou desencadeada por hipertermia e/ou medicações). 820 , 821
São fatores de risco para eventos arrítmicos recorrentes: história prévia de morte súbita abortada ou síncope; DNS; arritmias atriais; distúrbio na condução intraventricular; grande onda S em DI; presença de mutação SCN5A em adolescente. 822 Alguns medicamentos e substâncias são potencialmente desencadeadores de eventos arrítmicos: antiarrítmicos, bloqueadores dos canais de sódio, antidepressivos tricíclicos, anestésicos locais, álcool, cocaína etc. (consulte lista completa no site www.brugadadrugs.org ). 823 , 824
Suspeitar da SBr quando, no ECG de repouso, for observado nas derivações V1 e V2: 308 , 825
-
–
Tipo 1 – SSTs ≥2 mm, seguido de onda T descendente e negativa (semelhante a barbatana de tubarão). Esses achados são diagnósticos para a SBr tipo 1.
-
–
Tipos 2 e 3 (também denominadas não-tipo I) – SSTs com onda T ascendente e positiva, respectivamente com 2 mm e <2 mm, sugerem a presença da canalopatia, porém exigem investigação adicional.
Outro critério diagnóstico da SBr é escore de Shanghai ≥3,5 desde que inclua um ou mais critérios eletrocardiográficos. 824 , 826
Particularidades do TE/TCPE na SBr:
-
–
A partir dos 6 ou 7 anos de idade, o exame está indicado para investigar incompetência cronotrópica, considerada uma manifestação de DNS. A incompetência cronotrópica ocorre em ≈7% dos pacientes. Cerca de 30% das crianças sintomáticas apresentam história de FA e DNS. 820 , 827
-
–
Geralmente, observa-se atenuação do SSTs no pico do esforço, seguida de seu reaparecimento durante a fase de recuperação. 126 , 525 , 526
-
–
Alguns pacientes (geralmente com mutação SCN5A) apresentam aumento na elevação do segmento ST (≥0,05 mV) no pico do esforço e, principalmente, na fase inicial de recuperação (associada ao aumento do tônus parassimpático). Esse aumento é considerado fator de risco para eventos cardíacos, especialmente para pacientes com história de síncope e nos assintomáticos. 126 , 526 , 828
-
–
Pode ocorrer aumento da densidade e complexidade de arritmias ventriculares com o esforço.
-
–
No acompanhamento de crianças com SBr, os exames podem ser considerados para avaliar sintomas como síncope e palpitações. 824
3.3. Taquicardia Ventricular Polimórfica Catecolaminérgica
A taquicardia ventricular polimórfica catecolaminérgica (TVPC) é uma síndrome arrítmica hereditária (canalopatia) manifestada por TV bidirecional, TV polimórfica e/ou FV, desencadeada por estímulos adrenérgicos (esforço físico ou estresse emocional). A TVPC normalmente ocorre em corações estrutural e funcionalmente normais. 829 A prevalência é de ≈1:5.000/10.000 pessoas, com ocorrência familiar de ≈30% dos casos. Ela pode ser autossômica dominante (mutações do gene RyR2) e, mais raramente, recessiva (principalmente mutações nos genes CASQ2, TRDN e CALM1-3). A idade média de expressão da doença é ≈10 anos, sendo os principais sintomas tontura, palpitações e pré-síncope, que podem progredir para síncope, hipotonia, convulsão e MSC. A morte súbita ocorre em 30 a 50% dos pacientes na faixa etária entre 20 e 30 anos. Até 30% dos pacientes com TVPC tem história familiar de síncope esforço-induzida, convulsão ou morte súbita. 830 – 832
O TE/TCPE é a ferramenta diagnóstica mais relevante na suspeita de TVPC, tendo papel primordial na orientação da terapia dos casos confirmados, inclusive quanto à prática de exercícios físicos.
O exame físico pré-teste geralmente é normal. Suspeitar de pacientes com história prévia de episódios de síncope que foram caracterizados como eventos vasovagais ou de causa neurológica (principalmente epilepsia), considerando que, nesses casos, pode ter ocorrido atraso no estabelecimento do diagnóstico da TVPC. 829
O ECG de repouso geralmente apresenta ritmo sinusal com FC normal ou bradicardia sinusal (≈20% dos pacientes), sem anormalidades da condução atrioventricular ou intraventricular e QTc normal. Alguns pacientes podem apresentar ondas U proeminentes e arritmias supraventriculares acompanhadas de DNS. 308 , 833 , 834
Particularidades do TE/TCPE na TVPC:
-
–
Na suspeita, realizar em ambiente hospitalar e com cuidados especiais (contraindicação relativa ao exame – vide Quadro 1 ) devido às possíveis complicações esforço-induzidas. 835
-
–
A ocorrência de sintomas esforço-induzidos típicos (tontura, palpitações, pré-síncope, síncope e MSC) geralmente está associada a arritmia ventricular complexa.
-
–
Inicialmente, ocorrem EVs isoladas. À medida que o esforço continua, as EVs evoluem para bigeminismo ventricular seguido de complexos polimórficos. Se o esforço for interrompido nesta fase, é provável que os complexos ventriculares desapareçam gradualmente. Essa arritmia pode ser a única anormalidade observada em alguns pacientes com TVPC levemente afetados pela doença. Caracteristicamente, a FC durante a qual ocorrem as EVs situa-se entre 100 e 130 bpm, sendo tipicamente reprodutíveis. 829
-
–
Certas características das EVs podem, potencialmente, ajudar a distinguir a TVPC de arritmias ventriculares em controles saudáveis: densidade maior de EVs; primeiras EVs em carga de esforço intensa (≥10 METs); EVs com padrão de BRE e eixo inferior; bigeminismo ou trigeminismo no pico de esforço; duração dos complexos QRS >120 ms; intervalo de acoplamento >400 ms; desaparecimento das EVs no primeiro minuto da recuperação. 836 , 837
-
–
A complexidade e densidade da arritmia ventricular pode piorar com a progressão das cargas de esforço, sendo a FC associada a ocorrência da TV geralmente de ≈192 bpm. A ocorrência de TV bidirecional esforço-induzida, com rotação de 180° no eixo dos complexos QRS (batimento a batimento), é altamente característica de TVPC. O desenvolvimento de TV polimórfica seguida de FV ocorre em ≈7% dos exames. 838
-
–
Pacientes com TVPC e incompetência cronotrópica apresentam arritmia ventricular com maior densidade e complexidade, síncope e/ou parada cardíaca mais frequentemente quando comparados aos com resposta cronotrópica normal. 408
-
–
Alguns pacientes com TVPC podem apresentar taquiarritmias supraventriculares esforço-induzidas (incluindo FA), as quais não são diagnósticas da síndrome. 839
-
–
Exame com TV bidirecional ou polimórfica é altamente preditivo de TVPC (especificidade de 97%), tendo associação significativa com mutação genética. No entanto, a sensibilidade costuma ser de ≈50%, não permitindo descartar o diagnóstico de TVPC somente com um único exame normal, principalmente em crianças na primeira infância. 112 , 840
-
–
Em pacientes com suspeita de TVPC e TE/TCPE anterior normal, é possível a utilização de protocolos modificados de " sprint " (alta carga de esforço desde o início do exame em cicloergômetro e duração de 3 a 6 minutos) ou de " burst " (esforço de alta intensidade, desde o início do exame, equivalente ao estágio máximo alcançado no TE anterior) na tentativa de desmascarar a síndrome. Apenas 28% dos portadores da variante patogênica RyR2 apresentam TE anormal em protocolo padrão. Entretanto, no protocolo modificado verificam-se 83% de exames anormais. 113 , 839 , 841
-
–
A realização do exame é fundamental na triagem familiar de parentes de primeiro grau (e se possível de segundo grau), devido à gravidade das manifestações clínicas, prognóstico desfavorável e possibilidade de identificação precoce de portadores assintomáticos que se beneficiariam de terapêutica específica. O rastreamento geralmente é feito em protocolo atenuado. É importante observar que alguns pacientes com TVPC podem ter um exame normal na primeira infância, que pode tornar-se positivo posteriormente. Portanto, é indicado o acompanhamento regular e exames seriados. 82 , 842 – 844
-
–
O acompanhamento seriado com TE/TCPE é obrigatório para avaliar a efetividade da terapêutica instituída no controle da arritmia ventricular e na manutenção da FC em níveis inferiores ao limiar desencadeante. Os exames são feitos em vigência de medicação (inclusive betabloqueador). Em pacientes que mantenham arritmias ventriculares esforço-induzidas na forma pareada, TV não sustentada, TV polimórfica ou bidirecional, deve-se avaliar a terapia adicional (com flecainamida). Caso persista a AVEI e/ou os sintomas, deve-se considerar CDI, com ou sem denervação simpática cardíaca esquerda. 842 , 845 – 847
-
–
O exame também deve ser feito na avaliação pré-participação de exercícios físicos como lazer. Assintomáticos por um período mínimo de 3 meses (incluindo pacientes com CDI), com exame sem qualquer ectopia ventricular ou arritmia e mantendo o tratamento medicamentoso adequado, poderão ser liberados para exercícios físicos como lazer (de intensidade baixa a moderada). Durante os exercícios físicos, os pacientes deverão permanecer abaixo da FC correspondente ao limiar desencadeante das arritmias. Considerar também a necessidade de evitar desidratação, distúrbios eletrolíticos e hipertermia. 829 , 848
3.4. Cardiomiopatia Arritmogênica Ventricular/Displasia Arritmogênica do Ventrículo Direito
A cardiomiopatia arritmogênica ventricular (CAV) é uma cardiomiopatia hereditária caracterizada pela substituição fibroadiposa dos miócitos ventriculares, resultando em anormalidades elétricas, disfunção cardíaca, IC, arritmias ventriculares e/ou morte súbita. Embora se manifeste predominantemente no VD (displasia arritmogênica do VD – CAVD), é uma doença pancardíaca. Nos adolescentes que se tornaram sintomáticos, o envolvimento biventricular é o mais comum. A prevalência na população geral é de ≈1:5.000, afetando mais o sexo masculino (proporção ≈3:1). Representa uma das causas mais comuns de morte súbita juvenil, principalmente entre atletas. 849 – 851
Na população pediátrica, a apresentação da CAV varia com a idade, sexo e herança genética, sendo as principais manifestações: FV/MSC, geralmente a primeira manifestação da doença em adolescentes; queixa de palpitações e síncope; IC como primeira manifestação clínica nos pré-púberes (≈37% com envolvimento biventricular) ou nos estágios avançados da doença (alta prevalência). 852 , 853
A CAVD em crianças ≤12 anos apresenta evolução desfavorável com alta incidência de eventos cardíacos, incluindo transplante cardíaco e arritmias ventriculares graves. Em jovens, exercícios físicos extenuantes (estimulação adrenérgica) podem atuar como modificador fenotípico da CAV, tornando-se gatilho para arritmias malignas e MSC. 854 , 855
Nos casos suspeitos, recomenda-se a utilização dos critérios diagnósticos da CAV revisados da Força-Tarefa Internacional de 2010 (FIT-2010) e também os "critérios de Padua" (CPa). Nas crianças, os critérios eletrocardiográficos do FIT-2010 apresentam menor aplicabilidade, subestimando a ocorrência de CAV. Os CPa melhoram a acurácia nas crianças pelo uso da ressonância magnética cardíaca (RMC), estratificando a doença pelas variantes fenotípicas (dominante direita, dominante esquerda e variante biventricular). 856 – 858
Particularidades do TE/TCPE na CAV:
-
–
Corrado et al. propuseram a atualização dos CPa, incluindo o TE como parte da avaliação clínica não invasiva, visando a registrar a densidade e morfologia das arritmias ventriculares. Portanto, caso ocorra arritmia ventricular durante o exame, recomenda-se registrar sua densidade, morfologia dos complexos QRS ectópicos e o comportamento em cada fase (repouso, esforço e recuperação). 856
-
–
Arritmias ventriculares esforço-induzidas são relativamente comuns, sendo consideradas típicas da CAVD a TV monomórfica com padrão de BRE. Entretanto, a ausência ou supressão de arritmias ventriculares ao esforço não exclui o diagnóstico da CAVD. 258 , 859
-
–
Outras indicações: na investigação inicial; auxilio nas decisões terapêuticas; em adolescentes na avaliação pré-participação esportiva; diferenciação entre alterações miocárdicas na CAV daquelas relacionadas ao remodelamento fisiológico dos atletas; prescrição/restrição de exercícios nos pacientes com diagnóstico firmado; otimização da vigilância médica de portadores assintomáticos com genes da doença. 258 , 516 , 860 , 861
-
–
Deve fazer parte da avaliação periódica (a cada 6 meses) em adolescentes e adultos jovens com diagnóstico firmado, que realizam exercícios/esportes recreativos de baixa/moderada intensidade, para avaliação da capacidade funcional e estratificação de risco. O exame não deve ser realizado durante os períodos mais sintomáticos da doença ("fases quentes"). A presença de sintomas ou arritmias esforço-induzidas devem resultar em recomendações mais conservadoras e maiores restrições das atividades físicas. 62 , 862
-
–
Na maioria dos pacientes, são encontradas anormalidades no ECG de repouso que, em muitos casos, precedem as anormalidades estruturais. Pacientes sintomáticos geralmente apresentam ECG mais alterado do que os assintomáticos. Principais alterações em pacientes >14 anos: presença de ondas T invertidas nas derivações precordiais direitas (de V1-V3 ou além), na ausência de BRD; ondas épsilon (entre 7 e 30% dos pacientes); arritmias ventriculares. 863 , 864
-
–
A intolerância aos esforços é uma das manifestações dos pacientes com IC, sendo o exame indicado para avaliar a ACR e quantificar o grau de comprometimento. 865
-
–
Observou-se no TE em adolescentes e adultos jovens com CAVD: sintomas esforço-induzidos (dor torácica limitante, dispneia grave, pré-síncope e palpitações) em 11,4%; pseudonormalização das ondas T em 40,0%; ISTE em 8,6%; aumento da densidade da ectopia ventricular em 31,4% e TV não sustentada em 11,4%. 516
-
–
Pacientes com sintomas (palpitações e síncope) e/ou TV esforço-induzidas devem avançar na investigação diagnóstica da CAV em caráter de urgência. 866
-
–
Pacientes assintomáticos portadores de mutações no gene PKP2 e ECG de repouso normal podem apresentar ondas épsilon esforço-induzidas. 861 , 867
-
–
Anormalidades esforço-induzidas da despolarização ventricular são comuns em portadores assintomáticos de genes: ondas épsilon (em 14%); aumento na duração da ativação terminal dos complexos QRS (≥55 ms; em 32%); arritmias ventriculares esforço-induzidas com eixo superior do QRS (em 57%). 861
-
–
O TCPE é útil em crianças e adolescentes que evoluíram com IC (geralmente por envolvimento biventricular) para estratificação prognóstica, ajustes terapêuticos e seleção de pacientes para terapias avançadas da IC (transplante cardíaco ou dispositivos de assistência ventricular). 852 , 868
3.5. Bloqueio Atrioventricular Total (Congênito e na Infância)
O bloqueio atrioventricular total (BAVT) é definido como congênito se diagnosticado no útero, no nascimento ou no primeiro mês de vida; como BAVT na infância se diagnosticado entre o primeiro mês e 18 ° ano de vida. O BAVT adquirido decorre de situação aguda, reversível ou não. A prevalência do BAVT congênito é de 1 para 15.000 a 20.000 nascidos vivos (60% sexo feminino), com malformação cardíaca em ≈25 a 50% dos casos. 107 , 869
Mais da metade dos BAVTs congênitos são causados por autoanticorpos que, em fetos suscetíveis, danificam os cardiomiócitos e o tecido de condução do nó AV. As gestantes podem ser assintomáticas sendo que, ≈⅓ tinham diagnóstico prévio de doença reumática (principalmente LES e artrite reumatóide). A prevalência é de 2 a 5% das gestações com anticorpos anti-Ro/SSA positivos (o mais comum) e/ou anti-La/SSB. A taxa de recorrência em gravidez subsequente é de 12 a 25%. O BAVT congênito está associado a mortalidade de ≈16 a 30% (predominante intraútero e nos primeiros meses de vida) e ao desenvolvimento de cardiomiopatia dilatada (em 5 a 30% dos casos). 107 , 870 , 871
O BAVT na infância geralmente decorre de BAVT congênito não diagnosticado anteriormente, BAVT adquirido, por doença de condução cardíaca progressiva hereditária (associada a mutações nos genes SCN5A, SCN1B, SCN10A, TRPM4 e KCNK17) ou idiopático. Na maioria dos casos, não está associado com doença cardíaca estrutural ou doença autoimune. 583
Pacientes com BAVT congênito isolado (sem malformação cardíaca associada) requerem acompanhamento clínico criterioso. Inicialmente, são assintomáticos, podendo desenvolver cardiomiopatia dilatada por disfunção ventricular secundária a bradicardia, sendo essa a principal causa de morbidade e mortalidade. A bradicardia significativa e/ou episódios de Stokes-Adams são as principais indicações para implante de MP. 872
O BAVT adquirido geralmente é decorrente de: trauma cirúrgico (em 3 a 8% dos pacientes com CC) ou durante procedimento transcateter; processos infecciosos agudos ou crônicos; miocardite; cardite reumática aguda; febre reumática aguda; doença de Chagas; anormalidades metabólicas (hipotireoidismo); processos infiltrativos; mecanismo neurocardiogênico patológico. Embora o BAVT adquirido seja raro e potencialmente transitório, o TE/TCPE é útil para a estratificação de risco e no processo de indicação de MP. 107
Nos pacientes com BAVT, o TE está indicado para investigar a sintomatologia, avaliar o aumento da resposta do escape ventricular, determinar eventual ocorrência de ectopias e documentar a repercussão hemodinâmica. 114 , 554
Particularidades do TE no BAVT:
-
–
No ECG de repouso, observa-se, no BAVT de origem supra-hissiana, complexos QRS do escape ventricular com duração normal (e nos casos adquiridos, semelhante ao do ECG anterior ao BAVT); nos de origem infra-hissiana, os complexos QRS são largos. O prolongamento do QTi em pacientes com BAVT congênito geralmente é uma manifestação fenotípica de SQTL congênito latente, sendo fator de risco para síncope e/ou morte súbita. 115 , 873
-
–
A evolução natural do BAVT congênito consiste no declínio progressivo das frequências ventriculares ao longo da vida. No ECG de repouso, entre 6 e 10 anos, observa-se FC média de 50 bpm e, entre 16 e 20 anos, de 45 bpm. 556
-
–
A ACR fornece informações relevantes sobre o estado de saúde e a capacidade de realizar atividades físicas adequadas à idade. A ACR comprometida, com ou sem sintomas esforço-induzidos, é um dos critérios para indicação de implante de MP.
-
–
Principais sintomas esforço-induzidos: intolerância ao esforço, dispneia, pré-síncope, síncope, Stokes-Adams (principalmente se o QTi for prolongado). 556 , 874
-
–
Não são recomendadas a utilização de equações de predição de VO2max e da FCmax.
-
–
O aumento da atividade simpática sem o correspondente aumento efetivo da FC pelo ritmo de escape pode resultar em arritmias ventriculares complexas e complicações graves, principalmente se associado a CC ou IC. Reserva cronotrópica <50 bpm associada ou não a capacidade funcional reduzida (<7 METs) associa-se com má evolução e necessidade de implante de MP. A AVEI é frequente (50 a 70% dos pacientes) com sua densidade e complexidade relacionadas à duração dos complexos QRS e ao aumento da idade (independente da resposta da FC ao esforço). O BAVT localizado no sistema His-Purkinje está associado a ocorrência de ectopia ventricular esforço-induzida, com maior risco de morte súbita. 115 , 555 , 557
-
–
Fadiga, dispneia, tontura e ectopias ventriculares esforço-induzidas foram responsáveis por ≈26,5% dos implantes de MP. Nos pacientes assintomáticos, outras indicações foram bradicardia pronunciada persistente (inclusive ao esforço) e/ou QTc prolongado. 107 , 115
Particularidades do TE/TCPE após implante de MP no BAVT:
-
–
O TE permite investigar sintomas esforço-induzidos, avaliar a ACR, avaliar o comportamento da frequência atrial do paciente, verificar a efetividade da programação da resposta de frequência de estimulação, avaliar possíveis falhas esforço-induzidas do MP e contribuir para eventual atualização do MP dupla-câmara/transvenoso. 872 , 875 , 876
-
–
Após o implante do MP, ≈20% das crianças permanecem sintomáticas e/ou com comprometimento da ACR. Essa situação ocorre principalmente nos MP em modo de estimulação VVIR (epicárdico) no ápice do VD. 877
-
–
Geralmente, a definição do local de estimulação (epicárdico ou transvenoso) dependerá do peso do paciente. A abordagem epicárdica será necessária se o peso for <10 a 15 kg, enquanto a utilização da via transvenosa será possível nos pacientes com >20 kg. Em pacientes com peso entre 15 e 20 kg pode-se utilizar qualquer um dos dois locais de implante. A estimulação transvenosa em dupla-câmara apresenta melhores resultados quanto à ACR. 872 , 878
-
–
Crianças com MP com eletrodo único posicionado no ápice do VD podem evoluir com dessincronização da ativação e contração do VE, resultando em diminuição da função do VE, redução da ACR e incompetência cronotrópica. A estimulação apical crônica do VD pode evoluir para IC em ≈7% das crianças. 879
-
–
Pacientes com estimulação apical do VE apresentam maiores VO2pico, tempo de esforço, FCpico, índice cronotrópico e menos sintomas esforço-induzidos do que os pacientes com estimulação apical do VD. 877
4. Isquemia Miocárdica
A isquemia miocárdica na população pediátrica geralmente é parte de um conjunto de condições e doenças (congênitas ou adquiridas), que podem provocar obstrução da circulação coronariana (dinâmica ou fixa) e/ou disfunção da microcirculação (vide Tabela 40 ). Embora a isquemia não seja frequente, é um evento grave e com risco de morte, necessitando investigação diagnóstica adequada, monitoramento de sua evolução e das doenças associadas. 19 , 20 , 880
Tabela 40. Principais condições para isquemia miocárdica na população pediátrica 19 , 20 , 880 – 882 .
| Mecanismos | Patologias |
|---|---|
| Aterosclerose | DAC em sobreviventes de CC até idades mais avançadas. |
| DAC em CC por aumento de fatores de risco coronariano, por exemplo, coarctação de aorta reparada com hipertensão persistente. | |
| DAC precoce por hipercolesterolemia familiar, doença renal crônica avançada/insuficiência renal terminal e lúpus eritematoso sistêmico. | |
| Cirurgia de reimplante coronário | Transposição de grandes vasos com cirurgia de troca arterial. |
| Coronária esquerda anômala da artéria pulmonar (ALCAPA) com reimplante coronariano. | |
| Doença da valva aórtica em pacientes submetidos à cirurgia de Ross. | |
| Aneurismas da aorta ascendente em pacientes que necessitam de substituição da raiz da aorta proximal. | |
| Compressão da artéria coronária | Origem anômala da artéria coronária direita ou esquerda no seio oposto, com trajeto interarterial/intramural. |
| Colocação de stent na artéria pulmonar proximal ou implante de válvula pulmonar percutânea comprimindo uma artéria coronária. | |
| Válvula percutânea (TAVI) na posição aórtica, obstruindo o óstio coronário. | |
| Ponte intramiocárdica. | |
| VD sistêmico | TGA corrigida. |
| TGA com reparo de switch atrial (Mustard ou Senning). | |
| Fístulas coronarianas | Fístula coronária. |
| Atresia pulmonar com septo ventricular íntegro, VD hipoplásico e fístula coronariana para VD. | |
| Síndrome de Williams | Aortopatia supra-aórtica com estreitamento da artéria coronária. |
CC: cardiopatia congênita; VD: ventrículo direito: TGA: transposição das grandes artérias; DAC: doença arterial coronariana; TAVI: implante percutâneo de válvula.
A DAC aterosclerótica na população pediátrica geralmente está associada a situações que causam aterosclerose prematura:
Hipercolesterolemia familiar, distúrbio genético autossômico dominante do metabolismo do colesterol. Afeta 1:250 indivíduos em sua forma heterozigótica, causando aterosclerose prematura em adolescentes e adultos jovens. 59 , 883 , 884
Doença renal crônica (DRC) avançada principalmente na insuficiência renal terminal/dialítica. A calcificação coronariana é frequente, sendo associada a uremia, metabolismo anormal, aumento do fator de crescimento de fibroblastos 23 (FGF23) e deficiência do fator Klotho. Crianças com DRC apresentam alta prevalência de fatores de risco para DCV aterosclerótica, igualmente ao observado em adultos. A American Heart Association estratifica os pacientes pediátricos com DRC na categoria de alto risco para o desenvolvimento de DCV precoce e DAC aterosclerótica manifesta antes dos 30 anos de idade. 885 , 886
Lúpus eritematoso sistêmico (LES) é uma doença autoimune com padrão de inflamação sistêmica (em crises), sendo o dano tecidual causado por autoanticorpos, criação de imunocomplexos e/ou deposição de autoanticorpos. O LES está associado a aterosclerose acelerada, DAC, doença arterial periférica (DAP), valvopatia, miocardite, disfunção do VE (nas crianças com LES ativo) e risco aumentado de eventos CV. A aterosclerose precoce decorre da hiperleptinemia e de anormalidades da regulação imunológica, da função das células endoteliais e do reparo vascular. A DAC pode ocorrer em qualquer estágio do LES, sendo os indivíduos mais jovens os de maior risco. 887 – 890
Marcadores de alto risco para isquemia miocárdica em crianças/adolescentes com queixa de dor torácica: exame físico CV anormal (exemplos: sopro cardíaco, cianose, alterações de pulso periférico etc.); dor torácica ou síncope aos esforços; dor precordial associada a palpitações; anormalidades eletrocardiográficas; história familiar de arritmias, morte súbita ou distúrbios genéticos; histórico de cirurgia ou intervenções cardíacas; TCard; história de DK; história de hipercolesterolemia familiar; diagnóstico de DRC e LES. 20
O ECG de repouso visa evidenciar arritmias, alterações da condução e do segmento ST/onda T (podem sugerir pericardite, miocardite ou alteração coronariana) e sinais de HVE. A presença de BRE, WPW e MP interferirão na análise das alterações da repolarização quanto à isquemia durante o TE. 7
Particularidades do TE/TCPE na isquemia miocárdica:
-
–
Indicado na investigação de dor torácica em crianças e adolescentes com alto risco de eventos CV isquêmicos ( Tabela 40 ).
-
–
Os parâmetros como VO2pico, anormalidades no pulso de O2, inclinação VE/VCO2 e relação VO2/carga de trabalho (ΔVO2/ΔWR) ajudam no diagnóstico do comprometimento miocárdico, decisões terapêuticas e liberação/prescrição de atividades físicas. 179
-
–
As anomalias congênitas das artérias coronárias são causas conhecidas e frequentes de isquemia esforço-induzida: origem anômala da aorta ou da artéria pulmonar, orifício anormal, curso arterial intra ou intermural (entre a aorta e a artéria pulmonar). 891
-
–
Após correção cirúrgica dessas anomalias, é indicado para estratificação de risco e ajustes terapêuticos: aumento do orifício coronariano, reimplante com e sem extensão das artérias coronárias, translocação da artéria pulmonar e revascularização miocárdica. 891
-
–
Após procedimentos de troca arterial e procedimento de Ross, para estratificação de risco de isquemia pós-operatória precoce e disfunção miocárdica. A isquemia coronariana tardia pode exigir reoperação. 891 , 892
-
–
Em pacientes com síndrome do coração esquerdo hipoplásico e cirurgia de Fontan, a incidência de ISTE foi de 48%, sem registro de mortes em acompanhamento por ≈2 anos. Os pacientes investigados adicionalmente não apresentaram defeitos de perfusão reversíveis ou DAC obstrutiva. 520
-
–
Pacientes avaliados quanto a lesão residual da artéria coronária após cirurgia corretiva [devido a TGA, origem anômala ou origem anômala da artéria coronária esquerda da artéria pulmonar ( anomalous origin of the left coronary artery from the pulmonary artery – ALCAPA)], o ISTE apresentou sensibilidade de 100% e especificidade de 81% para lesão grave residual (>50%). Os marcadores de risco para lesão grave foram dor torácica esforço-induzida (RR: 4,72; IC95%: 1,23-18,17) e via intramural inicial da coronária (RR: 4,37; IC95%: 1,14-16,81). 893
-
–
Crianças com ponte miocárdica e CMH apresentaram menor tempo de esforço, menor PASpico (redução média 17±27 mmHg), maior dispersão do QTc (104±46 ms) e ISTE (mediana 5 mm). No seguimento de 7,1±5,4 anos, observou-se dor torácica em 60% dos pacientes, TV em 80% e parada cardíaca com ressuscitação em 50%. 894
5. Lesões Valvares
5.1. Estenose Aórtica Congênita
A estenose valvar aórtica (EAo) congênita é um defeito cardíaco que causa obstrução hemodinamicamente fixa e significativa da via de saída do VE. Corresponde a ≈3 a 6% das CC, sendo mais frequente no sexo masculino (proporção entre 3:1 e 5:1). Cerca de 15 a 20% dos pacientes com EAo apresentam outras CC associadas, sendo as principais a PCA, CoAo e DSV. 895
A valva aórtica unicúspide é frequentemente observada na EAo crítica, possuindo um orifício excêntrico com comissura patente ou orifício central sem comissura. As valvas aórticas bicúspides geralmente estão associadas à dilatação da aorta ascendente, ocorrendo aumento de tamanho e alterações degenerativas com o envelhecimento. 370 , 896
A EAo no início da infância geralmente é grave (crítica) e está associada à insuficiência do VE, sinais de baixo débito cardíaco, IC, cardiomegalia, edema pulmonar, palidez cutânea ou pele acinzentada, hipotensão e dispneia. A maioria das crianças e adolescentes com EAo discreta permanece assintomática, apresentando crescimento e desenvolvimento normais. Sintomas de dispneia, angina ou síncope, particularmente aos esforços, ocorrem em ≈10% da população pediátrica entre 5 e 15 anos. O início de sintomas requer avaliação imediata por causa do risco de morte súbita (≈1 a 10% nos pacientes com EAo moderada/grave). Cerca de 2 a 4% de todos os atletas jovens com MSC apresentavam EAo. 181
A EAo congênita está associada ao desenvolvimento de HVE e ao aumento do risco de DCV. A EAo supravalvar, mais comumente associada à síndrome de Williams, pode conferir risco CV aumentado devido à sua associação com estenoses coronarianas, isquemia miocárdica, síncope esforço-induzidas e estenose das artérias renais, que pode causar hipertensão secundária. 81
No ECG de repouso, as alterações eletrocardiográficas não são diagnósticas de EAo nem sensíveis para determinação do seu grau de gravidade. Entretanto, a observação de HVE e ISTs ≥2 mm é indicadora relativamente sensível de EAo grave. Na EAo moderada/grave, é comum a observação de arritmias ventriculares. A dispersão do QT é prolongada em crianças (particularmente nas com arritmia), sendo o grau de prolongamento relacionado com o gradiente de pressão e o índice de massa do VE. 388 , 897 , 898
Particularidades do TE/TCPE na EAo congênita:
-
–
Na EAo moderada/grave sintomática, está contraindicado.
-
–
É indicado na EAo que apresenta gradiente médio em repouso <30 mmHg ou gradiente de pico <50 mmHg.
-
–
EAo moderada para avaliação pré-participação de atividades esportivas devendo: atingir nível de esforço compatível com a atividade desejada, demonstrar ACR satisfatória, resposta normal da PAS e ausências de sintomas, de ISTs e de taquiarritmias ventriculares. 181
-
–
Pacientes assintomáticos com EAo moderada/grave geralmente apresentam comprometimento da ACR, principalmente se o gradiente sistólico do VE ≥30 mmHg. O grau de comprometimento relaciona-se com a área valvar aórtica em repouso. 436 , 899
-
–
A maioria dos pacientes assintomáticos com EAo moderada apresenta aumento moderado na PAS (<25 mmHg).
-
–
A variação da PAS entre esforço e basal (ΔPAS) depende do grau da estenose, sendo menor na EA grave (ΔPAS = 21,6 mmHg) do que na moderada (ΔPAS = 32 mmHg). 900
-
–
Na EAo moderada/grave, pode ocorrer ISTE, queda ou aumento inadequado da PAS e arritmias esforço-induzidas. 437
-
–
A gravidade da EAo está associada ao ISTE com odds ratio (OR) 12,0 (IC95%: 3,0-49,0). O ISTE está relacionado à pressão sistólica do VE, ao gradiente de fluxo de saída do VE (principalmente se ≥70 mmHg) e relação comprometida da oferta-demanda de O2. 436 , 518 , 899
-
–
Na EAo supravalvar, geralmente ocorrem arritmias ventriculares complexas e acentuação de ISTs com o esforço (indicativa de isquemia miocárdica). 434
-
–
Após tratamento cirúrgico, observam-se redução do ISTE, aumentos do ΔPAS e da ACR. 519
5.2. Insuficiência Aórtica
Na insuficiência aórtica (IAo), ocorre aumento do volume diastólico final do VE, elevação do estresse na parede e hipertrofia miocárdica compensatória. Raramente ocorre como lesão isolada, estando frequentemente associada à EAo (inclusive após intervenção cirúrgica ou transcateter) ou DSV. A válvula aórtica bicúspide é a causa mais comum de IAo. 896
A IAo crônica geralmente é bem tolerada, sendo que a maioria das crianças permanecem assintomáticas. Entretanto, na IAo moderada/grave, é comum o desenvolvimento de sintomas significativos e/ou disfunção do VE, exigindo intervenção cirúrgica. A IAo grave resulta em volumes sistólicos e diastólicos finais do VE muito aumentados, geralmente evoluindo com disfunção progressiva. Na IAo grave, as pressões diastólicas reduzidas na raiz da aorta podem prejudicar o fluxo coronário. 901 – 905
O ECG de repouso na IAo moderada/grave geralmente apresenta padrão de HVE e, na fase crônica, alterações do segmento ST e onda T. 388
Particularidades do TE/TCPE na IAo: 903 , 904 , 906
-
–
Indicado para avaliação de sintomas, ACR, isquemia esforço-induzida, ajustes terapêuticos e liberação/prescrição de exercícios físicos.
-
–
Pacientes que desenvolvem sinais ou sintomas de IC, isquemia esforço-induzida e/ou declínio da função do VE geralmente necessitam de intervenção cirúrgica.
-
–
Pacientes com IAo moderada ou grave apresentam comprometimento das respostas cronotrópica e pressórica (inclusive com queda pressórica intraesforço). Verifica-se também maior incidência de ectopias e ISTE.
-
–
Em atletas, é indicado para confirmar eventuais sintomas, avaliar a tolerância ao esforço e resposta da PA, sendo esses parâmetros relevantes para eventual liberação para prática esportiva. O TE deve pelo menos atingir nível de atividade compatível com a prática esportiva pretendida.
-
–
Atletas assintomáticos, com IAo discreta a moderada, VE sem disfunção e TE normal podem participar de todos os esportes competitivos (GR-NE: I-C).
-
–
A participação em atividades esportivas recreativas na IAo moderada/grave poderá ser considerada para pacientes assintomáticos com a fração de ejeção do ventrículo esquerdo (FEVE) >50%, VE não dilatado (<35 mm/m2) e TE normal (GR-NE: IIB-C).
5.3. Válvula Aórtica Bicúspide
A válvula aórtica bicúspide (VAoB) é uma malformação congênita que pode ocorrer tanto como lesão isolada quanto em associação com CC. A prevalência de VAoB isolada na população geral é de cerca de 1 a 2%, enquanto, nos pacientes com CoAo, é de 50 a 85% e, na síndrome de Turner, de 15 a 30%. A VAoB é comum em doenças cromossômicas tais como a síndrome de Down (trissomia 21), DiGeorge (22q11), síndrome de Edwards (trissomia 18) e também em outras síndromes genéticas: síndrome de Williams, de Holt-Oram, Marfan (4,7%) e de Loeys-Dietz (8,8%). 139 , 330 , 907
Anormalidades da raiz aórtica, junção sinotubular e aorta ascendente ocorrem como parte dessa malformação. As dilatações da raiz e da aorta ascendente são comuns, mesmo em pacientes que não apresentam estenose ou insuficiência. Na EAo, é maior o risco de desenvolver dilatação aórtica grave na adolescência e início da idade adulta. Na síndrome de Marfan com VAoB e dilatação da aorta, há maior risco de ruptura aórtica espontânea. A maioria das crianças com VAoB é assintomática até a vida adulta. Em coortes pediátricas selecionadas com VAoB, mas sem estenose grave ou CC concomitante, <5% requerem intervenções valvares antes da vida adulta. 139 , 330 , 907
Particularidades do TE/TCPE na VAoB:
-
–
Está indicado para avaliação de sintomas e ACR de pacientes que evoluíram com EAo moderada/grave, IAo ou CoAo associadas. 370
-
–
Adolescentes com VAoB e síndrome de Williams geralmente apresentam: tempo total de esforço reduzido; resposta cronotrópica acelerada; resposta hipertensiva da PAS ao esforço; ausência de ISTE. 908
-
–
As indicações para valvoplastia por balão incluem EAo grave, pico do gradiente sistólico em repouso ≥50 mmHg sem sintomas ou ≥40 mmHg com angina, síncope e alterações do segmento ST em repouso ou esforço-induzidas. 909
5.4. Estenose Pulmonar
A estenose pulmonar (EP) é um estreitamento da válvula pulmonar, geralmente por fusão dos seus folhetos, com obstrução da via de saída do VD e redução do fluxo sanguíneo para as artérias pulmonares. É a forma mais comum de obstrução da via de saída do VD (90% dos casos). 910 , 911
A gravidade da EP determina as condutas terapêuticas, inclusive necessidade de intervenção cirúrgica e/ou transcateter. Classificação da EP através do gradiente de pressão do VD para a artéria pulmonar: discreta entre 10 e 30 mmHg; moderada entre >30 e 60 mmHg; grave >60 mmHg ou pressão em VD maior que a pressão sistêmica. 910 , 912 , 913
Crianças com EP discreta, com septo interventricular íntegro (EP isolada), geralmente não apresentam sintomas, mantêm ACR normal, podendo ocorrer regressão espontânea da estenose com a idade. Pacientes com EP moderada, especialmente sintomáticos, evoluem com piora da hipertrofia de VD, da obstrução da via de saída e disfunção ventricular, necessitando tratamento intervencionista. A EP grave ocorre principalmente na infância, frequentemente evoluindo com disfunção do VD, IC, insuficiência tricúspide e cianose, requerendo tratamento intervencionista precoce. 370 , 911 Na EP isolada, em acompanhamento por 13,5 anos, ocorreu aumento de mortalidade geral (RR: 4,67; IC95%: 3,61-5,99). Pacientes com diagnóstico precoce (0 a 1 ano) tiveram o maior risco de mortalidade (RR: 10,99; IC95%: 7,84-15,45). 910 , 912 , 913
Após intervenção valvular, a sobrevida livre de eventos a longo prazo é >90%. As complicações incluem insuficiência valvar pulmonar com possível sobrecarga de volume do VD (≈⅓ dos pacientes) e reestenose em 5 a 10% dos pacientes, especialmente no primeiro ano após a intervenção. 911 , 914 , 915
O ECG de repouso na EP isolada discreta geralmente é normal, entretanto, crianças podem apresentar inversão de ondas T nas derivações precordiais direitas. Na moderada/grave, geralmente observa-se padrão de hipertrofia do VD, sobrecarga atrial direita (onda P pulmonale ), desvio do eixo QRS para direita e BRD. 388 , 911
Particularidades do TE/TCPE na EP isolada:
-
–
É útil na avaliação pré-participação em programas de exercícios físicos, auxilia na avaliação de sintomas fornecendo informações diretas sobre a capacidade do VD em manter o débito cardíaco durante condições de aumento da carga de trabalho. A pressão sistólica do VD, avaliada através de ecocardiografia de estresse físico, normalmente é elevada em repouso, aumentando durante o esforço. 87 , 906
-
–
Quanto à ACR geralmente: na estenose discreta está normal; na moderada cursa com redução; na grave evolui com redução acentuada, sendo sintomática e com pior qualidade de vida; melhora após a intervenção. 916 – 918
-
–
A resposta cronotrópica geralmente é normal, independente da gravidade da estenose. 87
-
–
É muito rara a ocorrência de ISTE e podem ocorrer arritmias esforço-induzidas. 919
-
–
O TCPE após ≈8 anos de valvoplastia pulmonar por balão em EP grave demonstrou comportamento normal do VO2pico (32,63±8,38 mL/kg/min), FCpico (174,88±5,01 bpm), queda da FC 1 ° minuto da recuperação (28,04±4,70 bpm), PASpico (164,02±11,03 mmHg), PADpico (84,42±7,63 mmHg), CVF (2,56±0,39 L) e VEF1 (2,43±0,34 L). 380 Arritmia ventricular monomórfica esforço-induzida ocorreu em 10,9% e nenhuma criança apresentou alteração do segmento ST. 900
5.5. Insuficiência Pulmonar
A insuficiência pulmonar (IP) costuma ser assintomática e bem tolerada na infância. Entretanto, raramente, a IP pode agravar-se progressivamente causando dilatação e disfunção do VD, intolerância aos exercícios, TV e MSC. Pacientes com IP discreta/moderada geralmente são assintomáticos. Na IP grave, frequentemente observa-se intolerância aos esforços com dispneia, devido à incapacidade em aumentar o débito do VD. Se houver insuficiência do VD, pode ocorrer congestão hepática, ascite e edema de membros inferiores. A remodelação atrial e ventricular direita confere maior risco de arritmia com tontura e/ou síncope. Sintomas esforço-induzidos, intolerância progressiva aos esforços, IC e arritmias sustentadas são marcadores de má evolução que indicam a necessidade de intervenção/reparo da válvula. 97 , 709 , 920
O ECG de repouso pode revelar desvio do eixo dos complexos QRS para direita, padrão de hipertrofia do VD e BRD. Na IP grave, é comum a ocorrência de arritmias. 177
Particularidades TE/TCPE na IP:
-
–
Em coorte retrospectiva, crianças submetidas à cirurgia de troca valvar pulmonar e/ou revisão do conduto valvulado, com melhor ACR no pré-operatório (VO2pico previsto ≥70%), evoluíram com menor tempo de internação. 921
-
–
Em coorte retrospectiva, a substituição da válvula pulmonar após a correção tardia de ToF demonstrou melhora do volume do VD. Cerca de 28% dos pacientes atingiram a normalização do volume sistólico final do VD, mas sem melhora significativa da ACR. 712
-
–
Após implante percutâneo da válvula pulmonar, em pacientes com IP associada a outras CC, foi demonstrado que não houve melhora do VO2pico, QR e pulso de O2. Na análise multivariada, a redução do gradiente da via de saída do ventrículo direito foi o único preditor de melhora do VO2pico. 922
-
–
Pacientes com IP grave, assintomáticos, sem sobrecarga significativa do volume do VD, sem arritmias, com função sistólica do VD e TE normal podem ser considerados para a prática esportiva recreativa. 681
5.6. Estenose Mitral
Os defeitos específicos da válvula mitral na estenose valvar mitral (EM) são divididos com base na relação com seu anel, incluindo componentes valvares, supravalvares e subvalvares (cordas tendíneas e músculos papilares). A apresentação clínica varia com base no grau da obstrução valvar e sua associação com insuficiência mitral (IM), HAP secundária, doenças pulmonares e/ou outras lesões cardíacas. 923
A EM congênita raramente ocorre na forma isolada, geralmente associando-se com CoAo, EAo e CC (anomalia de Ebstein, cor triatriatum , ToF etc.). Se a estenose for moderada a grave, os sintomas geralmente aparecerão no primeiro ou segundo ano de vida: déficit de crescimento, sibilância e grau variado de dispneia e palidez. 924
No ECG de repouso, geralmente observam-se padrão de hipertrofia VD, desvio do eixo dos complexos QRS para direita e ondas P bífidas ou pontiagudas indicativas de SAE. A ocorrência de FA é muito rara.
Particularidades TE/TCPE na EM:
-
–
Pacientes com EM discreta a moderada podem ser assintomáticos mesmo em exercícios extenuantes.
-
–
Na EM não corrigida, é indicado na avaliação pré-participação para a confirmação do estado assintomático, devendo atingir pelo menos o nível da atividade compatível com a prática esportiva pretendida. 681
-
–
Na EM moderada, para a liberação de atividades de baixa e moderada intensidade, o TE deve ser normal. Recomenda-se acompanhamento anual com o TE. 681
-
–
Em EM moderada/grave, o aumento da FC e do débito cardíaco ao esforço podem acarretar aumento do gradiente, das pressões dos capilares pulmonares e da HAP, causando baixa tolerância ao esforço, piora de sintomas e, eventualmente, edema agudo de pulmão. 46
-
–
Após 6 meses de valvoplastia, verificou-se melhora na ACR e aumento do débito cardíaco. 47
5.7. Insuficiência Mitral
A insuficiência mitral (IM) é uma lesão valvar com fluxo retrógrado sanguíneo do VE para o átrio esquerdo e subsequente sobrecarga de volume no VE. Para a manutenção do débito cardíaco, podem ocorrer alterações compensatórias, como aumento da força contrátil e HVE. A IM pode progredir, causar remodelamento ventricular e, eventualmente, dilatação difusa e disfunção do VE. A sobrecarga crônica do átrio e VE prejudica a drenagem sanguínea pelas veias pulmonares, causando congestão pulmonar e sintomas de IC. A IM congênita é uma doença rara na infância, com frequente associação a outras lesões cardíacas (em até 60% dos casos). 132 , 925
A IM discreta não produz sintomas, sendo o único sinal anormal a ausculta de sopro holossistólico apical. A insuficiência grave resulta em sintomas que podem aparecer em qualquer idade, incluindo baixo desenvolvimento físico, infecções respiratórias frequentes, fadiga aos esforços, edema pulmonar e IC congestiva.
A liberação/recomendação de exercícios físicos/prática esportiva depende da gravidade da IM, do grau de dilatação do VE, da função sistólica do VE e da HAP. Exercícios estáticos com grandes aumentos da PA podem resultar em aumento do volume regurgitante e das pressões capilares pulmonares, sendo potencialmente deletérios. 681 , 926
O ECG de repouso na IM moderada/grave geralmente mostra ondas P bífidas (SAE) e sinais de HVE. Nos casos mais graves, é possível observar padrão de HVD.
Particularidades do TE/TCPE na IM:
-
–
Discreta, geralmente não provoca comprometimento da ACR.
-
–
Discreta/moderada compensada, geralmente os pacientes são assintomáticos, com boa tolerância aos esforços e ACR normal, podendo permanecer assim por anos. 927
-
–
Adolescentes com IM grave, assintomáticos, poderão ser liberados para atividades de baixa intensidade, caso apresentem TE normal, função do VE preservada em repouso, pressão arterial pulmonar <50 mmHg e ausência de arritmia ventricular esforço-induzida. 681
-
–
IM grave com disfunção de VE cursa com sintomas de IC, intolerância ao esforço e baixa ACR. O TCPE auxilia na estratificação de risco, ajustes terapêuticos e na eventual indicação de transplante cardíaco.
-
–
Após troca ou reparo valvar para avaliação da ACR, ajustes terapêuticos e liberação/prescrição de atividades físicas incluindo reabilitação.
5.8. Prolapso da Válvula Mitral
O prolapso da válvula mitral (PVM) caracteriza-se por protrusão sistólica dos folhetos da válvula mitral no átrio esquerdo, com ou sem IM. Tem predisposição genética, podendo ser primário ("não sindrômico") ou secundário ("sindrômico") a distúrbios do tecido conjuntivo: síndrome de Marfan, síndrome de Loeys-Dietz, síndrome de Ehlers-Danlos, osteogênese imperfeita, pseudoxantoma elástico e síndrome de osteoartrite. Pode ser também observado na CMH. Na população pediátrica, é frequentemente considerado benigno e assintomático. Quando sintomático, as principais queixas são: palpitações, tontura, dor torácica, dispneia, pré-síncope e síncope. 132 , 928
O PVM em atletas adolescentes e adultos jovens, com degeneração mixomatosa da válvula, é causa relevante de MSC arritmogênica (PVM arritmogênico), com incidência anual de ≈0,2 a 1,9%. A presença de prolapso nos dois folhetos da valva, IM moderada/grave e arritmia ventricular são marcadores de maior risco de eventos. Adolescentes e mulheres jovens com espessamento dos folhetos mitrais e/ou prolapso de ambos os folhetos podem apresentar predisposição aumentada para arritmias complexas e MSC arritmogênica. 929 – 931
O ECG de repouso é normal na maioria dos pacientes, entretanto, pode apresentar ondas T negativas em derivações de parede inferior, EVs com padrão de BRD e prolongamento do QTi (principalmente em atletas). Nos pacientes com IM crônica, pode ser observado padrão de SAE, sobrecarga ventricular esquerda (SVE) e ISTs. 931 – 933
Particularidades do TE no PVM:
-
–
É útil para avaliação de sintomas, determinação da tolerância ao esforço, detecção de arritmias esforço-induzidas e liberação/prescrição de exercícios físicos (incluindo atividades esportivas competitivas). 926 , 934
-
–
Intolerância ao esforço e ACR reduzida são frequentes. 935
-
–
Mesmo quando a ACR é normal, pacientes apresentam menor DP no pico do esforço. 935 , 936
-
–
As arritmias ventriculares esforço-induzidas com padrão de BRD e/ou complexas são marcadores de risco nos pacientes com suspeita de PVM arritmogênico. 934 , 937
-
–
Cerca de 38% dos adolescentes atletas com arritmias ventriculares apresentaram EVs com morfologia do BRD em repouso e/ou esforço-induzidas. 938
-
–
Na IM moderada/grave associada, há risco aumentado de morbimortalidade quando a função sistólica do VE e a ACR estão comprometidas. Nesses pacientes, deve ser considerado o reparo ou substituição da válvula. 370
6. Dispneia e Intolerância aos Esforços
6.1. Dispneia Esforço-Induzida
A dispneia esforço-induzida (DEI) é uma manifestação clínica muito comum em crianças e adolescentes, caracterizada por falta de ar, esforço respiratório, aumento da FR e desconforto torácico. É uma sensação subjetiva que pode ter várias etiologias subjacentes mesmo na ausência de doenças detectáveis. Representa motivo para interrupção do esforço em ≈52% das crianças. Mais de 14% dos adolescentes aparentemente saudáveis experimenta episódio de DEI anualmente. 178 , 939 – 941
Os mecanismos e a fisiopatologia da dispneia envolvem interações entre o sistema cardiorrespiratório e respostas neurais. Acredita-se que a dispneia seja causada pela discordância entre a ventilação e o impulso respiratório neural. Inicialmente, as alterações respiratórias decorrentes do esforço ocorrem predominantemente por meio de aumentos do volume corrente (VC) e após atingir aproximadamente 50% da capacidade vital pelo aumento da FR. A taquipneia inicia-se quando se atinge o platô do VC. Fatores ventilatórios, incluindo desconforto torácico, trabalho respiratório intenso e distúrbios ventilatórios (com ruídos audíveis como estridor e chiado) podem contribuir para a sensação de dispneia e sua gravidade. 78 , 939
Principais causas de DEI: asma, broncoespasmo, obstrução laríngea e disfunção das cordas vocais esforço-induzidas; anormalidades restritivas da parede torácica; doenças metabólicas (exemplos: doença de McArdle, hipotireoidismo etc.); miastenia grave; doenças CV incluindo CC, cardiomiopatias, IC, HAS, valvopatias e arritmias. 78 , 939 , 942
Particularidades do TE/TCPE na DEI:
-
–
Indicado para esclarecimento de sintomas e mecanismos envolvidos na dispneia, avaliação da ACR, decisões terapêuticas e para liberar/prescrever exercícios físicos.
-
–
Sugere-se a utilização de escala visual de dispneia de Dalhousie e escala de percepção de esforço, visando quantificar o grau de comprometimento e repercussão da dispneia. 178 , 943 , 944
-
–
A percepção da dispneia deve ser correlacionada com a carga de esforço, VO2 e ventilação pulmonar em que surgiram e também no momento de sua intensidade máxima. 945
-
–
No TCPE, para investigação diagnóstica, deve-se realizar espirometria basal seguida de protocolo de esforço incremental máximo, com repetição da espirometria na recuperação.
-
–
A saturação arterial de oxigênio deve ser monitorada continuamente via oximetria de pulso (SpO2), sendo as reduções >5% indicativas de hipoxemia esforço-induzida.
-
–
Se associada a sibilância ou ruído respiratório audível, a DEI está frequentemente associada a asma ou broncoespasmo esforço-induzido.
-
–
DEI com dor torácica, redução acentuada da eficiência ventilatória, com relações VE/VO2 e VE/VCO2 elevadas, indica trocas gasosas anormais, geralmente associadas a HAP. 631
-
–
DEI devido a doenças pulmonares restritivas associam-se a ACR reduzida (VO2 baixo no LV1 e no pico do esforço) e reserva ventilatória relativamente baixa. 630
-
–
Dispneia inexplicada com sensação de sufocamento, associada à hiperventilação, sem dessaturação ou alterações das trocas gasosas, geralmente está associada a distúrbio psicogênico e/ou transtorno do pânico. 629 , 946
6.2. Broncoespasmo Esforço-Induzido
O broncoespasmo esforço-induzido (BEI) é um fenômeno obstrutivo agudo e transitório do fluxo aéreo. Manifesta-se, geralmente, 5 a 15 minutos após a interrupção do esforço. Os sintomas são inespecíficos e de leve a moderada intensidade: aperto no peito, dor torácica, dor abdominal, tosse isolada, sibilância e dispneia. Muito raramente, ocorrem episódios graves com insuficiência respiratória que pode causar morte. 947 , 948
Embora anteriormente tenha se usado o termo "asma esforço-induzida" (AEI) como sinônimo da BEI, não é mais recomendado fazê-lo, pois tratam-se de entidades diferentes, inclusive quanto aos critérios de diagnóstico e tratamento. Na AEI, ocorre hiperatividade brônquica e inflamação crônicas, enquanto o BEI representa o estreitamento transitório das vias aéreas (sempre associado aos esforços físicos), podendo ocorrer, inclusive, em pacientes não asmáticos. A AEI se beneficia do tratamento com corticosteroides para controlar a inflamação crônica subjacente, enquanto o BEI, na maioria dos casos, requer administração de um β2-agonista de ação curta antes dos esforços físicos. 948 , 949
Na população pediátrica, os fatores de risco para BEI são: dermatite atópica; sensibilização a alérgenos internos; níveis elevados de IgE (sazonal e perene); fatores ambientais (exposição ao ar frio, altas pressões atmosféricas, umidade e poluentes); em crianças asmáticas, a inflamação eosinofílica das vias aéreas e os níveis de fração de óxido nítrico exalado [FeNO >20 partículas por bilhão (ppb) em pacientes sem uso de corticoide e >12 ppb nos que estão em uso]. 947 , 948 , 950
O BEI é observado em 40 a 90% das crianças asmáticas, especialmente naquelas com asma grave não controlada farmacologicamente. A prevalência na população pediátrica varia entre 7% e 35% e, nos adolescentes atletas, é de ≈23,1%. A associação de BEI e obstrução laríngea esforço-induzida ocorre em 4,8% dos adolescentes, sendo mais prevalente no sexo masculino (64,7%). 164 , 951
Particularidades do TE/TCPE no BEI:
-
–
O TCPE está indicado para diagnóstico do BEI, avaliação da ACR e determinação dos fatores limitantes ao esforço, avaliação da gravidade da hiperinsuflação dinâmica e avaliação da resposta às intervenções terapêuticas. 952
-
–
O TCPE realizado com a finalidade específica de diagnóstico do BEI é também conhecido como teste de provocação brônquica por exercício. Geralmente, é realizado em esteira ergométrica, na qual há maior propensão ao BEI.
-
–
Recomenda-se utilizar protocolo com carga fixa de esforço em alta intensidade para provocar aumento rápido da ventilação e evitar a refratariedade ao desenvolvimento de broncoespasmo. Inicia-se com uma inclinação de 5,5% e aumento rápido da velocidade para atingir em 2 minutos pelo menos 80% da capacidade máxima prevista, devendo então ser mantida a carga de esforço. Esforço incremental utilizado nos protocolos de Bruce (esteira) ou Godfrey (bicicleta) são menos efetivos para desencadear o BEI. 953
-
–
Buscar atingir a carga máxima de esforço e/ou 80 a 90% da FCmax estimada entre 6 e 8 minutos. Em relação às condições do ambiente da sala, manter a temperatura entre 20 e 25 °C e a umidade relativa <50% (ar seco). 952 , 954
-
–
Cerca de 50% dos pacientes asmáticos sem história de BEI e ≈40% de atópicos (sem asma) podem apresentar BEI ao TE.
-
–
É recomendável o uso de broncodilatadores antes do TE/TCPE nos casos de avaliação terapêutica.
-
–
O diagnóstico e a quantificação da gravidade do BEI são estabelecidos pelas alterações da função pulmonar esforço-induzidas, independentemente da ocorrência de sintomas.
-
–
O VEF1 deve ser medido no repouso e na recuperação (em 5, 10, 15 e 30 minutos após o esforço). Diferença >10% entre o valor de VEF1 de repouso e o menor valor de VEF1 nos primeiros 30 minutos após o esforço estabelece o diagnóstico de BEI. 163
-
–
A gravidade do BEI pode ser classificada baseada na queda percentual do VEF1 em relação ao nível de repouso: leve, se for ≥10% mas <25%. Moderada se ≥25% mas <50%; grave se ≥50%. 163
-
–
Pacientes com BEI leve geralmente necessitam de mais de um exame para confirmar o diagnóstico. 950 , 955
-
–
Caso ocorram sintomas moderados/intensos durante ou após o esforço, mesmo na ausência de queda significativa do VEF1, preconiza-se o uso de broncodilatador, o qual também pode ser necessário ao final do exame caso o VEF1 não retorne a um valor de queda menor que 10% do VEF1 de repouso. 953
6.3. Obstrução Laríngea Esforço-Induzida
A obstrução laríngea esforço-induzida (OLEI) é caracterizada como obstrução transitória das vias aéreas superiores, que ocorre tipicamente a nível supraglótico, seguida frequentemente por acometimento glótico, causando redução do fluxo de ar e dispneia aos esforços. A causa da OLEI é desconhecida, sendo os fatores de risco mais relevantes: asma; doença do refluxo gastroesofágico; doenças/fatores anatômicos das vias aéreas superiores (exemplo: disfunção de cordas vocais); hereditariedade; fatores ambientais (piora em ar frio e úmido); estresse psicológico; atividade física/esportiva em alta intensidade. É causa importante de problemas respiratórios e disfunção das vias aéreas superiores em atletas adolescentes. Para o manejo e tratamento adequados, é necessário afastar outras possíveis causas dos sintomas, tais como asma, BEI e hiper-reatividade das vias aéreas. 956 – 958
Em geral, a prevalência de OLEI varia com a idade (mais frequente entre 11 e 18 anos), sexo (maior no sexo feminino na proporção 3:1) e nível atlético (maior em atletas competitivos de alto rendimento). Em adolescentes atletas, a prevalência é de 8,1%, sendo comum a associação com AEI (em 14 a 38% dos atletas). 164 , 951 , 959
Os pacientes geralmente apresentam aos esforços: dispneia; desconforto respiratório; aperto na garganta; sensação de asfixia; aperto na parte superior do tórax; dor torácica; respiração ruidosa e com estridor; alterações na voz e rouquidão; tosse; inspiração prolongada; ataques de hiperventilação; reações de pânico. Atletas podem referir apenas a sensação de "respiração mais difícil". 960 , 961
Particularidades do TE/TCPE na OLEI:
-
–
Em relação aos exames para confirmação diagnóstica de OLEI, recomenda-se a realização em ambiente hospitalar com equipe multidisciplinar (incluindo otorrinolaringologista) e condições adequadas para atendimento das possíveis complicações.
-
–
TE com laringoscopia nasal flexível, contínua e em esforço de alta intensidade é reconhecido como o "padrão-ouro" para o diagnóstico da OLEI. Envolve a colocação de um videolaringoscópio flexível (com gravação contínua) para a visualização da laringe em tempo real. Além do diagnóstico, permite avaliar a gravidade do fechamento laríngeo no momento mais sintomático e avaliar a eficácia terapêutica. 962 , 963
-
–
Idealmente em atletas, o ergômetro e protocolo de esforço devem ser o mais compatível com a atividade esportiva praticada, visando a alcançar a capacidade máxima de esforço, atingindo a maior ventilação possível.
-
–
O exame será positivo se o paciente reproduzir seus sintomas laríngeos (associado idealmente a um platô no VO2 e/ou da resposta da FC – teste máximo) e imagem registrando a presença, o local e o grau da obstrução laríngea. Na presença de obstrução supraglótica e glótica concomitante, o local em que a obstrução ocorrer primeiro deve ser especificado. 956 , 964
-
–
O TCPE combinado com a laringoscopia contínua permite a avaliação simultânea das variáveis respiratórias e metabólicas, contribuindo para o diagnóstico diferencial de outras causas de DEI. 958 , 965
-
–
Principais variáveis no TCPE a serem registradas na suspeita de OLEI: ventilação pulmonar, VO2pico, QR e loops de volume de fluxo. 956
-
–
Geralmente, os sintomas ocorrem próximo ao pico do esforço, são mais evidentes durante a fase inspiratória, podendo estar associados a estridor (sibilância/assobio ao inspirar). Geralmente desaparecem dentro de 2 a 3 minutos após a interrupção do esforço, podendo persistir por mais tempo nos pacientes que mantiverem a hiperventilação. 956 , 963
-
–
Caso os sintomas/sinais iniciais não sejam reconhecidos ou haja atraso na interrupção do esforço, pode ocorrer laringoespasmo, que resulta do fechamento exacerbado da glote, impedindo totalmente a ventilação. É uma situação muito rara, ocorrendo tardiamente aos sintomas da OLEI que cursa com dessaturação, bradicardia e cianose central, requerendo tratamento imediato.
6.4. Asma Esforço-Induzida
A asma é uma doença inflamatória crônica heterogênea caracterizada por uma limitação do fluxo das vias aéreas, reversível espontaneamente ou após tratamento. As principais queixas são chiado/sibilância, falta de ar, aperto no peito e tosse, sendo frequentemente desencadeados por emoções, poeira e/ou exposição a alérgenos. Frequentemente, também se observa redução da ACR, DEI, fadiga e redução da qualidade de vida. A prevalência de sintomas de asma entre adolescentes no Brasil é de ≈20 a 23%, uma das mais elevadas do mundo, sendo que apenas 12% têm diagnóstico prévio de asma. 966 – 968
A asma esforço-induzida (AEI) é uma restrição das vias aéreas em pacientes que já apresentam uma hiperatividade brônquica e inflamação persistente (pacientes asmáticos), enquanto, no BEI, a restrição das vias aéreas é temporária, principalmente em não asmáticos. A AEI é desencadeada pelo ar frio e seco durante exercícios, causando desidratação da mucosa das vias aéreas com o aumento da osmolaridade, contração da musculatura lisa brônquica, influxo de eosinófilos/mastócitos e liberação de mediadores inflamatórios (leucotrienos, histamina, IL- 8, triptase e prostaglandinas). A AEI é observada em ≈40 a 90% das crianças asmáticas, especialmente naquelas com asma grave não controlada farmacologicamente. Principais queixas: tosse, chiado, aperto no peito e falta de ar incomum ou excesso de muco ocorrendo após exercício aeróbico extenuante e contínuo. Os sintomas geralmente começam a se manifestar 5 a 8 minutos após o início do exercício contínuo ou em 2 a 5 minutos nos casos de exercícios de alta intensidade. A AEI costuma ser confirmada em espirometria, realizada antes e após o TE/TCPE. 948 , 949 , 969
A AEI frequentemente acarreta limitações significativas nas atividades físicas/esportes, entretanto, o exercício regular nos pacientes com controle adequado da asma é recomendado, inclusive para evitar a obesidade e outros fatores agravantes da asma. Em pacientes com AEI, é aconselhável o uso de um β2-agonista de ação curta, 5 a 20 minutos antes dos exercícios. Adicionalmente, para o tratamento da asma, pode ser necessário o uso diário de corticosteroides inalados, antagonistas dos receptores de leucotrienos ou drogas estabilizadoras de mastócitos. 947 , 969
Particularidades do TE/TCPE na asma e AEI:
-
–
A resposta dos asmáticos ao esforço depende do grau de obstrução das vias aéreas e da reversibilidade. Durante o esforço, a VEmin sofre aumento para atender as demandas metabólicas musculares. O aumento no VC é o mecanismo dominante na ventilação baixa a moderada. Aumentos adicionais da VEmin em altos níveis de esforço são devidos principalmente ao aumento na FR. 947 , 969
-
–
Na asma controlada, o esforço geralmente é interrompido devido à fadiga periférica, embora certo grau de limitação do fluxo expiratório também possa ocorrer. Normalmente, a RV não é esgotada e o fluxo máximo não é alcançado, mesmo durante o esforço máximo. 969 , 970
-
–
Em ≈30% dos pacientes com asma grave ocorre restrição ventilatória significativa e comprometimento da ACR. Pacientes com VEF1 <80% apresentam menor RV. A queda percentual do VEF1 correlaciona-se com valores aumentados do VE/VO2 e VE/VCO2. 967 , 971 , 972
-
–
A maioria dos pacientes não apresenta hipoxemia ou hipercapnia clinicamente significativa.
-
–
Os aumentos da desigualdade ventilação/perfusão, da tensão alvéolo-arterial de oxigênio e do espaço morto fisiológico parecem estar associados à presença de broncoespasmo. 947 , 969
-
–
Pacientes com obstrução grave e pouco reversível das vias aéreas podem apresentar restrição mecânica na ventilação e sintomas esforço-induzidos que mimetizam doença pulmonar obstrutiva crônica (DPOC). 954 , 969
-
–
Pacientes com asma e/ou BEI associado geralmente apresentam estridor/sibilos expiratórios com a dispneia/sintomas atingindo sua maior intensidade entre 3 e 15 minutos após a interrupção do esforço. Por essa razão, alterações anormais da função pulmonar necessárias para estabelecer o diagnóstico de asma e/ou BEI são avaliadas em espirometria na fase pós-esforço através principalmente do VEF1.
-
–
O TCPE é realizado como parte do teste de provocação brônquica por exercício. Geralmente, é realizado em esteira ergométrica, na qual há maior propensão à AEI. Na população pediátrica, tem-se preferido o critério de redução do VEF1 ≥12% (em vez de ≥10%) por sua maior especificidade, com VPP do exame de 94% e acurácia de 70%. 966 , 968
7. Anemia/Doença Falciforme
Doença falciforme (DF) é uma hemoglobinopatia genética, autossômica recessiva, resultante de defeitos na estrutura da hemoglobina (Hb), associados ou não a defeitos em sua síntese. As mutações herdadas podem ser: homozigóticas (SS, genótipo denominado como anemia falciforme); heterozigótico simples (traço falciforme) com um gene normal da Hb associado a um gene variante; heterozigótico composto com gene variante (SC, SD, SE, S betatalassemia, S alfatalassemia ou S mut) em combinação com defeito estrutural ou de síntese da Hb, denominada genericamente de talassemia. Estima-se que 4% da população brasileira tenha o traço falciforme e que 25.000 a 30.000 pessoas tenham a anemia falciforme (SS) ou talassemia. 973
Na DF, a Hb defeituosa hipossolúvel (HbS), quando desoxigenada nos leitos capilares leva à falcização dos glóbulos vermelhos, causando hemólise, anemia crônica normocítica e episódios de vaso-oclusão com isquemia associada. A DF apresenta alta taxa de morbimortalidade, com eventos agudos potencialmente letais: crises vaso-oclusivas (crises falcêmicas) com dor intensa, lesões isquêmicas teciduais e possíveis danos em todos os órgãos, incluindo acidente vascular cerebral (AVC), nefropatia, retinopatia, úlceras em membros inferiores, priapismo, necrose avascular etc.; e a síndrome torácica aguda (STA), cujas principais causas no adulto são embolia gordurosa, infecção pulmonar, crise asmática, infarto do arcabouço ósseo torácico e trombose in situ/embolia da artéria pulmonar, que geralmente precede os desfechos fatais. 974
Nas crianças, é comum a observação de hipoxemia crônica persistente com SpO2 <94%. Quando adequadamente diagnosticadas e tratadas, quase todas as crianças com anemia falciforme sobrevivem até a idade adulta, mas com redução na expectativa de vida (≈20 anos).
A DF geralmente cursa com intolerância aos exercícios e redução da ACR devido a: 168 , 975
-
–
Baixos níveis de atividade física por dores articulares crônicas.
-
–
Exacerbação de resposta pró-inflamatória em consequência de exercícios intensos.
-
–
Redução da capacidade de transporte de O2 relacionada ao baixo nível de Hb.
-
–
Disfunção cardíaca resultante de anemia crônica.
-
–
Disfunção do parênquima pulmonar causada por episódios repetidos de STA.
-
–
Doença vascular pulmonar e HAP.
-
–
Doença vascular periférica/miopatia devido à oclusão microvascular frequente e repetida.
A DF pode evoluir com cardiomiopatia restritiva (CMR), caracterizada por disfunção diastólica do VE com função sistólica normal e dilatação do átrio esquerdo. Essa combinação resulta em HAP secundária leve, velocidade elevada do jato regurgitante da valva tricúspide e aumento de mortalidade. Lesões isquêmicas do sistema de condução, fibrose e extensa dilatação das câmaras cardíacas são potenciais etiologias para arritmia e MSC na CMR. 976 , 977
Indicações do TE/TCPE na DF em crianças e adolescentes:
-
–
O TCPE permite avaliar ACR, eventuais limitações aos esforços e prescrever exercícios físicos, inclusive na RCV. 978 , 979
-
–
A avaliação da função pulmonar (incluindo o VEF1 e relação VEF1/CVF) deve ser feita a cada 1 a 3 anos devido à alta prevalência de disfunção pulmonar restritiva (em ≈26% dos pacientes), obstrutiva (em ≈35 a 39%) e hiper-reatividade das vias aéreas (em 70%). Intervalos mais curtos de repetição devem ser adotados, especialmente nos pacientes com dispneia persistente, história de asma e/ou sibilos recorrentes ou elevações acentuadas dos marcadores hemolíticos. 980 , 981
-
–
Episódios dolorosos agudos durante o exame são raros (0,43 a 1% dos pacientes). 979
-
–
É comum a ocorrência de alterações isquêmicas transitórias e dessaturação durante o exame, mas que não resultam em arritmias ou outras complicações. 979 Geralmente, metade dos pacientes apresenta ISTE, dos quais 31% com DAC.
-
–
Pacientes com anemia geralmente apresentam FC elevada, VE/VCO2 aumentado, anormalidade do pulso de O2, reduções VO2 no LV1 e no pico do esforço.
-
–
Em ⅔ dos pacientes que evoluem com doença vascular pulmonar apresentam limitação ao esforço com anormalidades nas trocas gasosas: diferença alvéolo-arterial da tensão de oxigênio (PaO2) >30 mmHg, relação anormal entre espaço morto e VC (VD/VT) e valores muito altos de VE/VCO2.
-
–
Observa-se declínio do VEF1 de 0,3% a cada ano, independente do sexo, presença de asma, concentração de Hb, incidência de dor aguda intensa, episódios de STA e de terapia com hidroxiuréia. 982
-
–
Crianças com STA geralmente apresentam menor capacidade pulmonar total (CPT) e redução de VEF1. A idade e o sexo masculino estão associados a menores valores de VEF1 e da relação VEF1/CVF. 981
-
–
Geralmente, observa-se recuperação lenta da FC no 1 ° ao 5 ° minutos pós-esforço, independentemente da ACR. A recuperação lenta da FC sugere comprometimento da atividade vagal, que piora com o aumento da idade. 983
-
–
Pacientes com Hb-SS apresentaram saturação média de oxigênio, CVF e %VEF1 menores, sendo o resultado anormal da espirometria em ≈70,4% dos pacientes causado por defeitos predominantemente restritivos. 984
-
–
A oximetria de pulso geralmente subestima a saturação arterial, mas em valores clinicamente insignificantes. Esse achado em parte é devido à carboxiemoglobina (COHb) e metemoglobina (MetHb) elevadas na DF. A co-oximetria de pulso não invasiva pode auxiliar na medição dos níveis de COHb e MetHb e melhorar a precisão da determinação da saturação. 985
-
–
A dessaturação de oxigênio esforço-induzida é observada em ≈18% das crianças com talassemia e em ≈34% das crianças com anemia falciforme. 986
Parte 4 – Teste Ergométrico Associado aos Métodos de Imagem em Cardiologia
1. Estresse Cardiovascular Associado aos Métodos de Imagem em Cardiologia
1.1. Imagem Nuclear/Cintilografia Perfusional Miocárdica
A cardiologia nuclear permite a avaliação de perfusão e viabilidade miocárdica, função ventricular, perfusão pulmonar e detecção de processos inflamatórios na população pediátrica. 214 , 987
A utilização da cintilografia perfusional miocárdica (CPM; do inglês Single Photon Emission Computed Tomography "SPECT") é limitada devido à radiação ionizante e seu potencial impacto ao longo da vida, particularmente em portadores de CC. O aumento de risco de câncer dá-se pela radiossensibilidade inerente às crianças. 988
A evolução tecnológica na última década e o desenvolvimento de protocolos com baixas doses de radiação dedicados às crianças abrem novas perspectivas para o uso de imagem nuclear em pediatria. 214
É cada vez mais crescente o emprego da ressonância magnética cardíaca (RMC) associada à perfusão miocárdica na população pediátrica. A RMC é considerada o método de escolha para quantificação dos volumes biventriculares e da função ventricular, especialmente do VD. A viabilidade e a isquemia também podem ser avaliadas pela tomografia por emissão de pósitrons/tomografia cardíaca (PET/CT). 988 , 989
A história do paciente e o planejamento da aquisição das imagens são essenciais para garantir a viabilidade e valor diagnóstico dos exames. Detalhes da anatomia cardíaca, procedimentos cirúrgicos e percutâneos prévios ajudam a distinguir achados normais dos patológicos. A dose de radionuclídeo é baseada no peso da criança, no protocolo e nos métodos de aquisição de imagem. Preferencialmente, deve-se realizar primeiro a geração de imagens de estresse. Recomenda-se a utilização de câmeras para SPECT, PET ou imagem híbrida de última geração. 987 , 990
Em nosso meio, são utilizadas as modalidades de estresse físico ou farmacológico (dipiridamol, adenosina ou dobutamina), que apresentam sensibilidade e especificidade semelhantes na análise das imagens de perfusão. A escolha da modalidade de estresse depende principalmente da idade da criança e de limitações ou contraindicações para a realização de esforço físico ( Figura 7 ). As principais contraindicações das modalidades de estresse são apresentadas na Tabela 41 . O monitoramento por oximetria de pulso é recomendado nos pacientes com CC, particularmente nos casos de shunt direita-esquerda e/ou malformações arteriovenosas pulmonares. 214 , 243 , 991 , 992
Figura 7. Seleção do método de imagem cardiovascular e protocolo de estresse em pacientes pediátricos com cardiopatia congênita e suspeita de isquemia. Exemplos de causa de obstrução dinâmica: artérias coronárias anômalas, compressão de stents, pontes miocárdicas e vasoespasmo. Exemplos de causa de obstrução fixa: obstrução coronária aterosclerótica, estreitamento cirúrgico dos óstios coronários e espessamento da íntima. Exemplos de causa de disfunção microvascular: manipulação cirúrgica das artérias coronárias na cirurgia de troca arterial, hipercolesterolemia familiar e lúpus eritematoso sistêmico. * Métodos de imagem cardiovascular apresentados sequencialmente, conforme a escolha do estressor. ** Disponível no Brasil somente em pesquisa; *** Não disponível no momento no Brasil. Eco estresse: ecocardiografia sob estresse; RMC: ressonância magnética cardíaca; PET: tomografia por emissão de pósitrons; SPECT: tomografia computadorizada por emissão de fóton (do inglês Single Photon Emission Computed Tomography); N-13 = amônia N-13; Rb-82: rubídio-82; Tc-99m: tecnécio 99m; Gad: gadolínio. Adaptado de: Partington SL et al. Clinical applications of radionuclide imaging in the evaluation and management of patients with congenital heart disease. 987 .
Tabela 41. Contraindicações das modalidades de estresse cardiovascular em população pediátrica 214 , 243 , 991 , 992 .
| Estresse | Contraindicações |
|---|---|
| Estresse físico | Vide contraindicações absolutas para TE/TCPE – Quadro 2. |
| Vasodilatadores (dipiridamol/adenosina) | Bloqueios atrioventriculares avançados; hipotensão; hipertensão acentuada; bradicardia sinusal; doença broncoconstritiva ou broncoespástica ativa com uso regular de inaladores; hipersensibilidade conhecida aos vasodilatadores. |
| Dobutamina | Hipertensão grave; angina instável; estenose valvar aórtica grave; arritmias complexas; cardiomiopatia hipertrófica obstrutiva; miocardite; endocardite; pericardite. |
| Atropina | Glaucoma de ângulo estreito; miastenia grave; uropatia obstrutiva; distúrbios gastrointestinais. |
Metodologia do estresse físico para a CPM: 993
-
–
É feito através do TE ou TCPE, adicionando maior valor diagnóstico e prognóstico aos métodos de imagem por abordar parâmetros clínicos, hemodinâmicos, metabólicos e eletrocardiográficos.
-
–
As escolhas do ergômetro e do protocolo seguem os mesmos critérios utilizados nos exames de TE/TCPE em crianças e adolescentes, que constam nesta diretriz.
Metodologia dos estresses farmacológicos para a CPM:
-
–
As doses dos estressores farmacológicos (dipiridamol, dobutamina e adenosina) para crianças são as mesmas utilizadas em adultos. A realização dos estresses deve seguir as orientações gerais para adultos. 1
-
–
Independentemente do estressor, deve-se monitorizar os sinais e sintomas clínicos e registrar ECG, PA e FC durante todo o exame.
-
–
A adenosina é um estressor farmacológico que causa vasodilatação coronariana, administrado por via intravenosa (infusão contínua, 140 μg.kg-1.min-1, por 4 a 6 min). Seus efeitos colaterais geralmente são leves e desaparecem rapidamente após a interrupção/término da infusão: broncoespasmo, devido à ativação dos receptores A2B e A3; BAV, devido à ativação de receptores A1; vasodilatação periférica, por ativação dos receptores A2B; rubor, dispneia e náusea. 990 , 994 , 995 A metil-xantina (cafeína) contida em alimentos, bebidas e medicamentos interfere com a adenosina (vide Anexo 5 ), devendo ser suspensa pelo menos 12 horas antes do exame. 995
-
–
O dipiridamol é um vasodilatador coronariano que age por inibição da enzima adenosina-deaminase, degrada a adenosina endógena, bloqueia a recaptação da adenosina pela membrana celular com aumento da concentração extracelular, causando a vasodilatação coronária e sistêmica. A dose preconizada é de 0,56 mg.kg-1, até o máximo de 60 mg diluídos em 50 mL de soro fisiológico, com administração intravenosa em 4 minutos, podendo ser realizada manualmente (sem bomba de infusão). Sua meia-vida biológica é de ≈45 minutos. Os principais efeitos colaterais são a dor torácica, cefaleia e tontura, podendo ser revertidos com a administração de aminofilina intravenosa, feita somente 2 minutos após a injeção do radiotraçador. 993 , 995 – 998 As metil-xantinas (vide Anexo 5 ) devem ser suspensas pelo menos 24 horas antes do exame. 995
-
–
A dobutamina promove a elevação do consumo de oxigênio miocárdico, com administração intravenosa em bomba de infusão. A dose inicial é de 5 a 10 μg.kg-1.min-1 em 3 minutos, sendo seguida por doses incrementais de 20 μ g.kg-1.min-1, 30 μ g.kg-1.min-1 até o máximo de 40 μ g.kg-1.min-1. 999 , 1000 Nos pacientes que não alcançarem a FC submáxima e sem evidências de isquemia, pode-se associar atropina intravenosa na dose de 0,01 mg.kg-1 (dose unitária máxima de 0,25 mg). 996 O radiotraçador deve ser injetado na FC alvo (geralmente definida como 85% da FCmax para a idade) mantendo-se a infusão de dobutamina por mais 1 minuto. A reversão dos efeitos adversos é feita com betabloqueadores de ação curta (por exemplo: metoprolol ou esmolol), injetados via intravenosa após o primeiro minuto da administração do radiotraçador. 1001
-
–
Avaliar a necessidade de restrição de volume a ser infundido em paciente com IC, cardiomiopatias, CC complexas e insuficiência renal.
-
–
Além do médico habilitado responsável pelo exame, sugere-se o acompanhamento por pediatra.
Particularidades na perfusão miocárdica:
-
TGA: as mortalidades precoce e tardia estão associadas às complicações coronarianas. 1002 , 1003 No seguimento pós-operatório, a indicação de reintervenção baseia-se mais na presença de isquemia pela CPM do que nos achados angiográficos. 220 , 1004
Defeitos de perfusão diagnosticados pela CPM ocorrem em 5 a 24% dos pacientes após correção cirúrgica, podendo persistir por mais de 10 anos ( Figura 7 ). Lesões angiográficas após correção nem sempre estão associadas a processo estenótico em evolução. 1005 , 1006
A CPM inicial permite triar os pacientes quanto à evolução: se normal, geralmente ocorre estabilização/resolução da isquemia com o tempo; se anormal geralmente corresponde à piora da isquemia. 22 , 1007 , 1008
-
DK: a CPM é útil e segura no seguimento da progressão da estenose coronariana, com sensibilidade de 90% e especificidade entre 85 e 100% na detecção de isquemia. 218 , 998 Cerca de 12 a 19% das crianças com aneurismas coronários têm padrão perfusional anormal (fibrose e/ou isquemia). 216 , 219 , 398
A CPM está indicada no acompanhamento tardio (de 1 a 5 anos) de crianças com aneurismas coronarianos (incluindo aneurismas pequenos e/ou resolvidos) e/ou sintomas/disfunção ventricular ( Figura 7 ). 18 , 37 , 214
Em adolescentes com história de DK na infância, a PET com amônia N-13 demonstrou diminuição na reserva coronariana por disfunção endotelial de longo prazo. 1009 , 1010
-
Cardiomiopatias:
-
–
Na CMH, a CPM auxilia na pesquisa de isquemia, estratificação de risco e manejo terapêutico. 223 A isquemia miocárdica pode estar relacionada à diminuição da perfusão subendocárdica nos segmentos hipertrofiados, compressão de pequenos vasos intramurais e ponte miocárdica. 214 , 1011 Acredita-se que a isquemia microvascular esteja envolvida na disfunção sistólica e diastólica. 223 , 1012 Os defeitos de perfusão miocárdica na CPM com 99mTc-MIBI podem refletir um processo isquêmico, sendo importante preditor de eventos clínicos adversos e morte. 223
-
–
Na cardiomiopatia dilatada, a CPM é raramente empregada, pois a etiologia isquêmica é rara em crianças. Em situações especiais, como na anemia falciforme, a avaliação da função microvascular pode auxiliar na identificação do possível mecanismo de dano ventricular (dilatação e/ou disfunção do VE). 214 , 1013
-
–
Transplante cardíaco: a principal complicação a longo prazo após o transplante é a doença vascular do enxerto (DVE), causa relevante de morte e retransplante. Na DVE, a CPM permite avaliar o envolvimento de artérias coronárias (distais e proximais) na disfunção sistólica e o aumento das pressões de enchimento do VE. 224 , 1014
1.2. Ecocardiografia sob Estresse
A ecocardiografia sob estresse (EcoE) é uma técnica de imagem cardiovascular que fornece imagens cardíacas em tempo real permitindo avaliar: anatomia cardíaca; função sistólica e diastólica; áreas de isquemia miocárdica; reserva coronariana; e estratificar o risco nas valvopatias, IC e CC (reparadas ou não). As principais indicações da EcoE na prática da cardiologia pediátrica encontram-se na Tabela 12 .
Vantagens da EcoE: disponível em nosso meio; na maioria dos pacientes, pode ser realizada sem sedação; não gera exposição à radiação, situação relevante no monitoramento periódico de CC. Principais limitações: janelas acústicas inadequadas em crianças com déficit de crescimento (secundário a CC) ou por alterações torácicas pós-cirúrgicas; arritmias cardíacas complexas (exemplos: TV, BAVT etc.); necessidade de uso de medicamentos que podem afetar os parâmetros do exame (betabloqueadores, diuréticos, antiarrítmicos etc.). A Tabela 41 apresenta as principais contraindicações das modalidades de estresse CV utilizados na EcoE.
Para a adequada aquisição e interpretação das imagens ecocardiográficas, recomenda-se avaliar a existência de cardiopatias (principalmente CC), o quadro clínico do paciente, história prévia de cirurgias e utilização de MP/CDI.
Os principais estressores utilizados na população pediátrica são o físico (TE) e o farmacológico. O agente farmacológico (dobutamina) é mais utilizado em crianças menores, enquanto o exercício físico é preferido em crianças ≥8 anos, cooperativas e com habilidades para se exercitar em esteira ou bicicleta ( Tabela 42 ). Independente do estressor, deve-se monitorizar os sinais e sintomas clínicos, bem como registrar ECG, PA e FC durante todo o exame. 234 , 235
Tabela 42. Vantagens e desvantagens das diferentes modalidades de estresse em população pediátrica 234 , 235 .
| Esforço (TE) * | Dobutamina | |
|---|---|---|
| Idade preconizada | ≥8 anos | Qualquer idade |
| Anestesia/sedação | Não | Se indispensável, em <6 anos |
| Resposta da frequência cardíaca | Geralmente submáxima | FC alvo (geralmente submáxima) |
| Resposta da pressão arterial | Resposta máxima | Variável |
| Inotropismo máximo | Sim | Sim |
| Retorno venoso | Aumento | Sem aumento/diminuição |
| Aquisição de imagens | Possibilidade de artefatos ** | Mais fácil |
| Aptidão cardiorrespiratória | Sim | Não |
| Repercussão funcional | Sim | Não |
| Risco de complicações | Baixo | Baixo |
| Disponibilidade da modalidade de estresse | Moderada | Alta |
Teste ergométrico em esteira, cicloergômetro de mesa ou bicicleta ergométrica.
Artefatos respiratórios e por movimentação.
Achados indicativos para interrupção do estresse: aparecimento de sintomas (exemplo: angina limitante); ocorrência ou piora de anormalidade contrátil da parede ventricular; ISTs ≥2 mm; queda da PAS >15 mmHg; arritmia complexa e/ou com repercussão hemodinâmica; alcançar FC alvo; atingir a dose máxima do estressor farmacológico; outros efeitos adversos de agente farmacológico.
1.2.1. Metodologia do Estresse Farmacológico
1.2.1.1. Dobutamina 229 , 234 , 1015 , 1016
A dobutamina é o agente farmacológico mais utilizado na população pediátrica. Tem efeito inotrópico e cronotrópico positivo, aumentando a demanda de O2 pelo miocárdio. Quando essa demanda não é atendida, causa isquemia miocárdica e anormalidades da motilidade da parede ventricular. Em contraste com o estresse físico, não acarreta aumentos do retorno venoso e da pré-carga, gerando maior alteração nas dimensões diastólicas finais do VE. Permite uma recuperação mais lenta da FC, com aquisição de imagens por tempo maior. 243
Em crianças <8 anos, a EcoE com dobutamina pode requerer anestesia geral ou sedação profunda. As imagens são adquiridas no repouso e após cada aumento na dose do estressor.
Os protocolos da EcoE com dobutamina são semelhantes aos protocolos para adultos. Geralmente, a infusão de dobutamina começa com 5 μ g.kg-1.min-1 com aumento da dose em intervalos de 3 a 5 minutos (para 10, 20, 30, 40 e 50 μ g.kg-1.min-1). A FC alvo geralmente é definida como 85% da FCmax para a idade. Caso não se atinja a FC alvo com a dose máxima de dobutamina, pode-se administrar simultaneamente, a cada 1 a 2 minutos, atropina na dose de 0,01 mg.kg-1 (limites: 0,25 mg por dose; dose máxima total de 1 a 2 mg). 243 Na avaliação da reserva contrátil cardíaca, a dobutamina pode ser usada em doses baixas/moderadas (entre 5 e 20 μ g.kg-1.min-1) em infusão contínua. 229
Os efeitos colaterais incluem: palpitações, náuseas, cefaleia, calafrios, urgência urinária, ansiedade, angina, hipotensão, hipertensão e arritmia. Os efeitos colaterais geralmente desaparecem com o término/suspensão da infusão, devido à meia-vida curta da dobutamina. Esmolol (dose de 0,5 mg.kg-1) deve estar disponível para reverter reações adversas mais intensas e/ou isquemia. 249
1.2.1.2. Vasodilatadores 229 , 234 , 1016
A EcoE com vasodilatador (adenosina ou dipiridamol) induz o aumento do fluxo coronariano, sendo utilizada na avaliação de motilidade miocárdica, isquemia e viabilidade miocárdica. A adenosina é infundida em uma dose máxima de 140 μ g.kg-1.min-1, com imagens simultâneas durante 4 minutos.
O dipiridamol é administrado em duas etapas, com imagens contínuas: a primeira etapa com uma dose de 0,56 mg.kg-1 durante 4 min; a segunda etapa é realizada se não houver efeitos adversos, utilizando dose de 0,28 mg.kg-1 em 2 minutos. A aminofilina deve estar disponível para reverter reações adversas ao dipiridamol.
1.2.2. Metodologia do Estresse Físico 1015 , 1017
A EcoE com estresse físico é realizada em crianças ≥8 anos, capazes de realizar o TE. O esforço físico é um estressor fisiológico, devendo ser o método preferencial, sempre que possível. 229 O estresse físico permite aumentar a FC, a função contrátil, a PA e o retorno venoso ao coração e determinar o VO2 e débito cardíaco.
Os ergômetros mais utilizados na EcoE são a esteira ergométrica e cicloergômetro (vertical, supino e semissupino) utilizando protocolos específicos. A ecocardiografia basal deve ser obtida em decúbito dorsal e também na posição em que será realizado o estresse físico. Quando utilizada a esteira, a aquisição de imagens ecocardiográficas é realizada antes do esforço e imediatamente após o término do esforço (dentro de 60 a 90 s). No caso do cicloergômetro, é realizada antes e durante todas as fases do esforço (incluindo o pico). A aquisição de imagens durante o esforço é mais desafiadora em relação a artefatos de movimento e respiração.
Além disso, como a FC em crianças pode cair muito rapidamente durante a recuperação, a interpretação dos resultados pode ser comprometida. Para obter informações durante o esforço, o teste em bicicleta é mais adequado.
Além dos achados indicativos para interrupção do estresse apresentados no início desta sessão, recomenda-se observar os critérios de interrupção do esforço constantes na Tabela 42 .
ANEXOS
Anexo 1. Principais leis e resoluções pertinentes ao TE e TCPE em crianças e adolescentes
| Aspectos legais | Referência |
|---|---|
| O médico guardará sigilo a respeito das informações de que detenha conhecimento no desempenho de suas funções, com exceção dos casos previstos em lei.
É vedado:
|
Código de Ética Médica – Resoluções N ° 2.217/2018, 2.222/2018 e 2.226/2019 do CFM. 1018 – 1020 |
| Determina que, para a área de atuação em ergometria, é necessária: formação de 1 (um) ano; ter concluído Residência Médica em Cardiologia para realizar a formação; após formação, realizar concurso da AMB/Sociedade Brasileira de Cardiologia para obtenção do Título de Atuação; pré-requisito para o concurso, além da formação, ter o Título de Especialista em Cardiologia da AMB. | Resolução N ° 2.380/2024 do CFM/Portaria CME N ° 1/2024. 1021 |
| Considerando ser recomendável a obtenção prévia de termo de consentimento livre e esclarecido assinado pelo paciente ou seu representante legal, no caso de menores de 18 anos de idade.
Considerando que, em se tratando de menores de idade, o seu representante legal deva permanecer na sala de exame. O teste ergométrico deve ser individualizado e realizado, em todas as suas etapas, por médico habilitado e capacitado para atender a emergências cardiovasculares, tornando imprescindível, para tal, sua presença física na sala. Por ser ato médico privativo, caracteriza-se como falta ética a delegação para outros profissionais da realização do teste ergométrico. As condições adequadas para a realização do teste ergométrico estão previstas no Manual de Fiscalização do CFM. |
Resolução N ° 2.021/13 do CFM. 1022 |
| Critérios norteadores da propaganda em medicina, conceituando os anúncios, a divulgação de assuntos médicos, o sensacionalismo, a autopromoção e as proibições referentes à matéria. | Resolução N ° 2.336/2023 do CFM. 1023 |
| Garantir a privacidade e a confidencialidade dos dados e informações armazenadas digitalmente dos pacientes; organizar bancos de dados seguros e confiáveis; garantir a transmissão de dados e informações em segurança; fazer cópia de segurança na medida da possibilidade. | Resolução N ° 1.821/2007 do CFM. 272 |
| Art. 226. A família, base da sociedade, tem especial proteção do Estado.
§ 4° Entende-se, também, como entidade familiar a comunidade formada por qualquer dos pais e seus descendentes. Art. 229. Os pais têm o dever de assistir, criar e educar os filhos menores, e os filhos maiores têm o dever de ajudar e amparar os pais na velhice, carência ou enfermidade. |
Constituição da República Federativa do Brasil. 1024 |
| "Art. 5. A menoridade cessa aos 18 anos completos, quando a pessoa fica habilitada à prática de todos os atos da vida civil.
Parágrafo único. Cessará, para os menores, a incapacidade:
|
Código Civil Brasileiro – Lei 10.406 de 2002. 1025 |
Capítulo III, Art. 6° – São direitos básicos do consumidor:
|
Código de Proteção ao Consumidor – Direitos Básicos do Consumidor – Lei N ° 8.078 de 11 de setembro de 1990. 1026 , 1027 |
Art.: artigo; CFM: Conselho Federal de Medicina; CME: Comissão Mista de Especialidades; AMB: Associação Médica Brasileira.
Anexo 2. Quadro de valores da pressão arterial de repouso para meninos de acordo com idade e percentil de estatura 322
PA: pressão arterial; P: percentil. Adaptado de: Barroso WKS et al. Brazilian Guidelines of Hypertension – 2020. 322
Anexo 3. Quadro de valores da pressão arterial de repouso para meninas de acordo com idade e percentil de estatura
PA: pressão arterial; P: percentil. Adaptado de: Barroso WKS et al. Brazilian Guidelines of Hypertension – 2020. 322
Anexo 4. Dados relacionados à aptidão cardiorrespiratória (VO2max previsto), duplo-produto e OUES em população pediátrica aparentemente saudável e com cardiopatia
| Material | Faixa etária (anos) | Localização na publicação | DOI da publicação | Disponível em |
|---|---|---|---|---|
| Aparentemente saudável: | ||||
| Gráficos de percentis de VO2max por sexo e idade. 176 | 8-18 | Figura 2 | 10.1513/AnnalsATS.201611-912FR | https://www.atsjournals.org/doi/10.1513/AnnalsATS.201611-912FR |
| Gráficos de percentis de VO2max por sexo e idade. 1028 | 12-18 | Figura 2 e Figura 3 | 10.1016/j.amepre.2011.07.005 | https://linkinghub.elsevier.com/retrieve/pii/S0749-3797(11)00491-0 |
| Tabela de VO2max por sexo e faixa etária na população brasileira. 1029 | 7-12
e 13-19 |
Tabela 6 | 10.5935/2359-4802.20190057 | https://www.scielo.br/j/ijcs/a/x8bB3qQHQKCXHRbZRbpXMrm/?lang=en |
| Tabela DP em repouso e DP pico em altitude moderadamente elevada. 1030 | 4-18 | Tabela 3 | 10.1016/j.acmx.2013.04.003 | https://www.elsevier.es/es-revista-archivos-cardiologia-mexico-293-articulo-cardiopulmonary-exercise-testing-in-healthy-S1405994013000621 |
| Gráfico de percentis de OUES (por sexo e idade) e equações de previsão. 622 | 8-19 | Figura 2 e Tabela 2 | 10.1177/2047487315611769 | https://academic.oup.com/eurjpc/article-lookup/doi/10.1177/2047487315611769 |
| Gráfico do comportamento médio de OUES (por sexo e idade). 614 | 7-18 | Figura 1 | 10.1123/pes.22.3.431 | https://journals.humankinetics.com/doi/10.1123/pes.22.3.431 |
| Cardiopata: | ||||
| Gráfico e tabelas por sexo dos percentis de VO2max/VO2pico e %VO2previsto em pacientes com corações univentriculares, tetralogia de Fallot, transposição das grandes artérias e outras cardiopatias. 1031 | 6-18 | Tabela 1 , Tabela 2 e Figura 2 | 10.1007/s00431-022-04648-9 | https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9829639/ |
| Tabela e gráficos de associação entre VO2max e FCmax em crianças e adolescentes com CC. 80 | 6-18 | Tabela 1 , Figura 2 e Figura 4 | 10.5935/abc.20170125 | https://www.ncbi.nlm.nih.gov/pmc/articles/pmid/28876372/ |
| Tabela e gráficos do VO2pico de crianças e adolescentes saudáveis e com CC. 1032 | 8-16 | Tabela 7 , Figura 3 e Figura 4 | 10.1007/s004210050612 | https://link.springer.com/article/10.1007/s004210050612 |
| Gráfico e equação de predição de valores de DP nas duas primeiras décadas de vida e em comparação com pacientes com coarctação de aorta reparada. 428 | 12,6±2,96
e 13,0±3,2 anos |
Tabela 2 e Figura 3 | 10.1080/14779072.2017.1385392 | https://www.tandfonline.com/doi/epdf/10.1080/14779072.2017.1385392?needAccess=true |
| Tabela com comportamento do DP (repouso e pico do esforço) em relação a sobrevida de crianças com insuficiência cardíaca secundária à cardiomiopatia dilatada idiopática. 1033 | 8,6±1,9 anos | Tabelas 2 e 3 | 10.1016/j.ejheart.2008.04.009 | https://onlinelibrary.wiley.com/doi/epdf/10.1016/j.ejheart.2008.04.009 |
| Tabela e gráficos do comportamento de OUES por sexo e corrigido pelo peso na população pediátrica aparentemente saudável e em 10 cardiopatias congênitas. 624 | 5-18 | Tabela 2 , Figura 2 e Figura 3 | 10.1136/archdischild-2019-317724 | https://adc.bmj.com/lookup/pmidlookup?view=long&pmid=32732318 |
| Tabela de valores de referência de OUES/kg por idade na diferenciação entre capacidade funcional preservada ou anormal, em crianças e adolescentes, com e sem CC. 623 | 4-21 | Tabela 5 e Tabela 6 | 10.1177/2047487318807977 | https://academic.oup.com/eurjpc/article-lookup/doi/10.1177/2047487318807977 |
VO2max: consumo máximo de oxigênio; DP: duplo-produto; DP pico: duplo-produto no pico do esforço; OUES: inclinação da eficiência da captação do oxigênio (OUES: do inglês oxygen uptake efficiency slope); FCmax: frequência cardíaca máxima; CC: cardiopatia congênita ; VO2pico: maior VO2obtido no teste ergométrico que não houver as características de um esforço máximo.
Anexo 5. Principais bebidas, alimentos e medicamentos que contêm cafeína
| Cafés |
|
| Chás - em geral |
|
| Refrigerantes e sucos |
|
| Energéticos – em geral |
|
| Petiscos Cafeinados |
|
| Sorvetes |
|
| Chocolates e bebidas |
|
| Medicamentos |
|
Nota: Os produtos e marcas listados são os mais frequentemente disponíveis no mercado brasileiro. Os mesmos cuidados se aplicam a produtos similares brasileiros. Adaptado de: Henzlova MJ et al. ASNC imaging guidelines for SPECT nuclear cardiology procedures: Stress, protocols, and tracers. 995
Footnotes
Realização: Departamento de Ergometria, Exercício, Cardiologia Nuclear e Reabilitação Cardiovascular (DERC) da Sociedade Brasileira de Cardiologia (SBC)
Conselho de Normatizações e Diretrizes responsável: Carisi Anne Polanczyk (Coordenadora), Humberto Graner Moreira, Mário de Seixas Rocha, Jose Airton de Arruda, Pedro Gabriel Melo de Barros e Silva – Gestão 2022-2023
Estas Diretrizes se prestam a informar e não a substituir o julgamento clínico do médico que, em última análise, deve determinar o tratamento apropriado para seus pacientes.
Referências
- 1.Carvalho T, Freitas OGA, Chalela WA, Hossri CAC, Milani M, Buglia S, Precoma DB, et al. Diretriz Brasileira de Ergometria em População Adulta – 2024. Arq. Bras. Cardiol . 2024;121(3):e20240110. doi: 10.36660/abc.20240110. [DOI] [PubMed] [Google Scholar]
- 2.Brasil. Ministério da Saúde . Diretrizes nacionais para a atenção integral à saúde de adolescentes e jovens na promoção, proteção e recuperação da saúde . Brasília (DF): Ministério da Saúde; 2010. ISBN: 978-85-334-1680-2. [Google Scholar]
- 3.Brasil . Diário Oficial da União . Brasília (DF): Jul 16, 1990. Lei no 8.069, de 13 de julho de 1990. Dispõe sobre o Estatuto da Criança e do Adolescente e dá outras providências. [Google Scholar]
- 4.Bouhanick B, Sosner P, Brochard K, Mounier-Véhier C, Plu-Bureau G, Hascoet S, et al. Hypertension in Children and Adolescents: A Position Statement from a Panel of Multidisciplinary Experts Coordinated by the French Society of Hypertension. Front Pediatr . 2021;9:680803–680803. doi: 10.3389/fped.2021.680803. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Macêdo VC. Atenção integral à saúde da criança: políticas e indicadores de saúde . Recife: Ed. Universitária da UFPE; 2016. ISBN: 978-85-415-0853-7. [Google Scholar]
- 6.Massin MM. The Role of Exercise Testing in Pediatric Cardiology. Arch Cardiovasc Dis . 2014;107(5):319–327. doi: 10.1016/j.acvd.2014.04.004. [DOI] [PubMed] [Google Scholar]
- 7.Washington RL, Bricker JT, Alpert BS, Daniels SR, Deckelbaum RJ, Fisher EA, et al. Guidelines for Exercise Testing in the Pediatric Age Group. From the Committee on Atherosclerosis and Hypertension in Children, Council on Cardiovascular Disease in the Young, the American Heart Association. Circulation . 1994;90(4):2166–2179. doi: 10.1161/01.cir.90.4.2166. [DOI] [PubMed] [Google Scholar]
- 8.Connuck DM. The Role of Exercise Stress Testing in Pediatric Patients with Heart Disease. Prog Pediatr Cardiol . 2005;20(1):45–52. doi: 10.1016/j.ppedcard.2004.12.004. [DOI] [Google Scholar]
- 9.ten Harkel AD, Takken T. Exercise Testing and Prescription in Patients with Congenital Heart Disease. Int J Pediatr . 2010;2010:791980–791980. doi: 10.1155/2010/791980. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Edelson JB, Burstein DS, Paridon S, Stephens P. Exercise Stress Testing: A Valuable Tool to Predict Risk and Prognosis. Prog Pediatr Cardiol . 2019;54:101130–101130. doi: 10.1016/j.ppedcard.2019.101130. [DOI] [Google Scholar]
- 11.Paridon SM, Alpert BS, Boas SR, Cabrera ME, Caldarera LL, Daniels SR, et al. Clinical Stress Testing in the Pediatric Age Group: A Statement from the American Heart Association Council on Cardiovascular Disease in the Young, Committee on Atherosclerosis, Hypertension, and Obesity in Youth. Circulation . 2006;113(15):1905–1920. doi: 10.1161/CIRCULATIONAHA.106.174375. [DOI] [PubMed] [Google Scholar]
- 12.Valderrama P, Carugati R, Sardella A, Flórez S, De Carlos Back I, Fernández C, et al. Guía SIAC 2024 sobre rehabilitación cardiorrespiratoria en pacientes pediátricos con cardiopatías congénitas. Rev Esp Cardiol . 2024:S0300893224000770–S0300893224000770. doi: 10.1016/j.recesp.2024.02.017. [DOI] [Google Scholar]
- 13.Friedman KG, Kane DA, Rathod RH, Renaud A, Farias M, Geggel R, et al. Management of Pediatric Chest Pain using a Standardized Assessment and Management Plan. Pediatrics . 2011;128(2):239–245. doi: 10.1542/peds.2011-0141. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Borns J, Gräni C, Kadner A, Gloeckler M, Pfammatter JP. Symptomatic Coronary Anomalies and Ischemia in Teenagers - Rare but Real. Front Cardiovasc Med . 2020;7:559794–559794. doi: 10.3389/fcvm.2020.559794. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Tuan SH, Li MH, Hsu MJ, Tsai YJ, Chen YH, Liao TY, et al. Cardiopulmonary Function, Exercise Capacity, and Echocardiography Finding of Pediatric Patients with Kawasaki Disease: An Observational Study. Medicine . 2016;95(2):e2444. doi: 10.1097/MD.0000000000002444. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Lin KL, Liou IH, Chen GB, Sun SF, Weng KP, Li CH, et al. Serial Exercise Testing and Echocardiography Findings of Patients with Kawasaki Disease. Front Pediatr . 2022;10:847343–847343. doi: 10.3389/fped.2022.847343. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Yang TH, Lee YY, Wang LY, Chang TC, Chang LS, Kuo HC. Patients with Kawasaki Disease have Significantly Low Aerobic Metabolism Capacity and Peak Exercise Load Capacity during Adolescence. Int J Environ Res Public Health . 2020;17(22):8352–8352. doi: 10.3390/ijerph17228352. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Fukazawa R, Kobayashi J, Ayusawa M, Hamada H, Miura M, Mitani Y, et al. JCS/JSCS 2020 Guideline on Diagnosis and Management of Cardiovascular Sequelae in Kawasaki Disease. Circ J . 2020;84(8):1348–1407. doi: 10.1253/circj.CJ-19-1094. [DOI] [PubMed] [Google Scholar]
- 19.Cava JR, Sayger PL. Chest Pain in Children and Adolescents. Pediatr Clin North Am . 2004;51(6):1553–1568. doi: 10.1016/j.pcl.2004.07.002. [DOI] [PubMed] [Google Scholar]
- 20.Reddy SR, Singh HR. Chest Pain in Children and Adolescents. Pediatr Rev . 2010;31(1):e1–e9. doi: 10.1542/pir.31-1-e1. [DOI] [PubMed] [Google Scholar]
- 21.van Wijk SW, Driessen MM, Meijboom FJ, Doevendans PA, Schoof PH, Breur HM, et al. Left Ventricular Function and Exercise Capacity after Arterial Switch Operation for Transposition of the Great Arteries: A Systematic Review and Meta-Analysis. Cardiol Young . 2018;28(7):895–902. doi: 10.1017/S1047951117001032. [DOI] [PubMed] [Google Scholar]
- 22.Tsuda T, Baffa JM, Octavio J, Robinson BW, Radtke W, Mody T, et al. Identifying Subclinical Coronary Abnormalities and Silent Myocardial Ischemia after Arterial Switch Operation. Pediatr Cardiol . 2019;40(5):901–908. doi: 10.1007/s00246-019-02085-4. [DOI] [PubMed] [Google Scholar]
- 23.Kuebler JD, Chen MH, Alexander ME, Rhodes J. Exercise Performance in Patients with D-Loop Transposition of the Great Arteries after Arterial Switch Operation: Long-Term Outcomes and Longitudinal Assessment. Pediatr Cardiol . 2016;37(2):283–289. doi: 10.1007/s00246-015-1275-5. [DOI] [PubMed] [Google Scholar]
- 24.Brothers JA. Introduction to Anomalous Aortic Origin of a Coronary Artery. Congenit Heart Dis . 2017;12(5):600–602. doi: 10.1111/chd.12497. [DOI] [PubMed] [Google Scholar]
- 25.Raisky O, Bergoend E, Agnoletti G, Ou P, Bonnet D, Sidi D, et al. Late Coronary Artery Lesions after Neonatal Arterial Switch Operation: Results of Surgical Coronary Revascularization. Eur J Cardiothorac Surg . 2007;31(5):894–898. doi: 10.1016/j.ejcts.2007.02.003. [DOI] [PubMed] [Google Scholar]
- 26.Brothers JA, McBride MG, Marino BS, Tomlinson RS, Seliem MA, Pampaloni MH, et al. Exercise Performance and Quality of Life Following Surgical Repair of Anomalous Aortic Origin of a Coronary Artery in the Pediatric Population. J Thorac Cardiovasc Surg . 2009;137(2):380–384. doi: 10.1016/j.jtcvs.2008.08.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Samos F, Fuenmayor G, Hossri C, Elias P, Ponce L, Souza R, et al. Exercise Capacity Long-Term after Arterial Switch Operation for Transposition of the Great Arteries. Congenit Heart Dis . 2016;11(2):155–159. doi: 10.1111/chd.12303. [DOI] [PubMed] [Google Scholar]
- 28.Cheitlin MD, MacGregor J. Congenital Anomalies of Coronary Arteries: Role in the Pathogenesis of Sudden Cardiac Death. Herz . 2009;34(4):268–279. doi: 10.1007/s00059-009-3239-0. [DOI] [PubMed] [Google Scholar]
- 29.Meijer FMM, Egorova AD, Jongbloed MRM, Koppel C, Habib G, Hazekamp MG, et al. The Significance of Symptoms before and after Surgery for Anomalous Aortic Origin of Coronary Arteries in Adolescents and Adults. Interact Cardiovasc Thorac Surg . 2021;32(1):122–129. doi: 10.1093/icvts/ivaa234. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Lim CW, Ho KT, Quek SC. Exercise Myocardial Perfusion Stress Testing in Children with Kawasaki Disease. J Paediatr Child Health . 2006;42(7):419–422. doi: 10.1111/j.1440-1754.2006.00891.x. [DOI] [PubMed] [Google Scholar]
- 31.Feld H, Guadanino V, Hollander G, Greengart A, Lichstein E, Shani J. Exercise-Induced Ventricular Tachycardia in Association with a Myocardial Bridge. Chest . 1991;99(5):1295–1296. doi: 10.1378/chest.99.5.1295. [DOI] [PubMed] [Google Scholar]
- 32.Corban MT, Hung OY, Eshtehardi P, Rasoul-Arzrumly E, McDaniel M, Mekonnen G, et al. Myocardial Bridging: Contemporary Understanding of Pathophysiology with Implications for Diagnostic and Therapeutic Strategies. J Am Coll Cardiol . 2014;63(22):2346–2355. doi: 10.1016/j.jacc.2014.01.049. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Mohan S, Poff S, Torok KS. Coronary Artery Involvement in Pediatric Takayasu's Arteritis: Case Report and Literature Review. Pediatr Rheumatol Online J . 2013;11(1):4–4. doi: 10.1186/1546-0096-11-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Saling LJ, Raptis DA, Parekh K, Rockefeller TA, Sheybani EF, Bhalla S. Abnormalities of the Coronary Arteries in Children: Looking beyond the Origins. Radiographics . 2017;37(6):1665–1678. doi: 10.1148/rg.2017170018. [DOI] [PubMed] [Google Scholar]
- 35.Sumski CA, Goot BH. Evaluating Chest Pain and Heart Murmurs in Pediatric and Adolescent Patients. Pediatr Clin North Am . 2020;67(5):783–799. doi: 10.1016/j.pcl.2020.05.003. [DOI] [PubMed] [Google Scholar]
- 36.Saleeb SF, Li WY, Warren SZ, Lock JE. Effectiveness of Screening for Life-Threatening Chest Pain in Children. Pediatrics . 2011;128(5):e1062–e1068. doi: 10.1542/peds.2011-0408. [DOI] [PubMed] [Google Scholar]
- 37.McCrindle BW, Rowley AH, Newburger JW, Burns JC, Bolger AF, Gewitz M, et al. Diagnosis, Treatment, and Long-Term Management of Kawasaki Disease: A Scientific Statement for Health Professionals from the American Heart Association. Circulation . 2017;135(17):e927–e999. doi: 10.1161/CIR.0000000000000484. [DOI] [PubMed] [Google Scholar]
- 38.Hacke C, Weisser B. Reference Values for Exercise Systolic Blood Pressure in 12- to 17-Year-Old Adolescents. Am J Hypertens . 2016;29(6):747–753. doi: 10.1093/ajh/hpv178. [DOI] [PubMed] [Google Scholar]
- 39.Pool LR, Aguayo L, Brzezinski M, Perak AM, Davis MM, Greenland P, et al. Childhood Risk Factors and Adulthood Cardiovascular Disease: A Systematic Review. J Pediatr . 2021;232:118.e23–126.e23. doi: 10.1016/j.jpeds.2021.01.053. [DOI] [PubMed] [Google Scholar]
- 40.Celermajer DS, Ayer JG. Childhood Risk Factors for Adult Cardiovascular Disease and Primary Prevention in Childhood. Heart . 2006;92(11):1701–1706. doi: 10.1136/hrt.2005.081760. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Lurbe E, Agabiti-Rosei E, Cruickshank JK, Dominiczak A, Erdine S, Hirth A, et al. 2016 European Society of Hypertension Guidelines for the Management of High Blood Pressure in Children and Adolescents. J Hypertens . 2016;34(10):1887–1920. doi: 10.1097/HJH.0000000000001039. [DOI] [PubMed] [Google Scholar]
- 42.Özdemir G, Köşger P, Uçar B. Evaluation of Blood Pressure Responses to Treadmill Exercise Test in Normotensive Children of Hypertensive Parents. Turk J Pediatr . 2020;62(6):1035–1048. doi: 10.24953/turkjped.2020.06.016. [DOI] [PubMed] [Google Scholar]
- 43.Rhodes J, Tikkanen AU, Jenkins KJ. Exercise Testing and Training in Children with Congenital Heart Disease. Circulation . 2010;122(19):1957–1967. doi: 10.1161/CIRCULATIONAHA.110.958025. [DOI] [PubMed] [Google Scholar]
- 44.Baker-Smith CM, Pietris N, Jinadu L. Recommendations for Exercise and Screening for Safe Athletic Participation in Hypertensive Youth. Pediatr Nephrol . 2020;35(5):743–752. doi: 10.1007/s00467-019-04258-y. [DOI] [PubMed] [Google Scholar]
- 45.Wuestenfeld JC, Baersch F, Ruedrich P, Paech C, Wolfarth B. Blood Pressure Response to Dynamic Exercise Testing in Adolescent Elite Athletes, What is Normal? Front Pediatr . 2022;10:974926–974926. doi: 10.3389/fped.2022.974926. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Kavey RE, Kveselis DA, Atallah N, Smith FC. White Coat Hypertension in Childhood: Evidence for End-Organ Effect. J Pediatr . 2007;150(5):491–497. doi: 10.1016/j.jpeds.2007.01.033. [DOI] [PubMed] [Google Scholar]
- 47.Schultz MG, Park C, Fraser A, Howe LD, Jones S, Rapala A, et al. Submaximal Exercise Blood Pressure and Cardiovascular Structure in Adolescence. Int J Cardiol . 2019;275:152–157. doi: 10.1016/j.ijcard.2018.10.060. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Huang Z, Fonseca R, Sharman JE, Park C, Chaturvedi N, Howe LD, et al. The Influence of Fitness on Exercise Blood Pressure and its Association with Cardiac Structure in Adolescence. Scand J Med Sci Sports . 2020;30(6):1033–1039. doi: 10.1111/sms.13645. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Luitingh TL, Lee MGY, Jones B, Kowalski R, Aguero SW, Koleff J, et al. A Cross-Sectional Study of the Prevalence of Exercise-Induced Hypertension in Childhood Following Repair of Coarctation of the Aorta. Heart Lung Circ . 2019;28(5):792–799. doi: 10.1016/j.hlc.2018.03.015. [DOI] [PubMed] [Google Scholar]
- 50.Foulds HJA, Giacomantonio NB, Bredin SSD, Warburton DER. A Systematic Review and Meta-Analysis of Exercise and Exercise Hypertension in Patients with Aortic Coarctation. J Hum Hypertens . 2017;31(12):768–775. doi: 10.1038/jhh.2017.55. [DOI] [PubMed] [Google Scholar]
- 51.Panzer J, Bové T, Vandekerckhove K, De Wolf D. Hypertension after Coarctation Repair - A Systematic Review. Transl Pediatr . 2022;11(2):270–279. doi: 10.21037/tp-21-418. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Huang Z, Sharman JE, Fonseca R, Park C, Chaturvedi N, Smith GD, et al. Masked Hypertension and Submaximal Exercise Blood Pressure among Adolescents from the Avon Longitudinal Study of Parents and Children (ALSPAC) Scand J Med Sci Sports . 2020;30(1):25–30. doi: 10.1111/sms.13525. [DOI] [PubMed] [Google Scholar]
- 53.Alvarez-Pitti J, Herceg-Čavrak V, Wójcik M, Radovanović D, Brzeziński M, Grabitz C, et al. Blood Pressure Response to Exercise in Children and Adolescents. Front Cardiovasc Med . 2022;9:1004508–1004508. doi: 10.3389/fcvm.2022.1004508. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Cuchel M, Bruckert E, Ginsberg HN, Raal FJ, Santos RD, Hegele RA, et al. Homozygous Familial Hypercholesterolaemia: New Insights and Guidance for Clinicians to Improve Detection and Clinical Management. A Position Paper from the Consensus Panel on Familial Hypercholesterolaemia of the European Atherosclerosis Society. Eur Heart J . 2014;35(32):2146–2157. doi: 10.1093/eurheartj/ehu274. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Farnier M, Civeira F, Descamps O, FH Expert Working Group How to Implement Clinical Guidelines to Optimise Familial Hypercholesterolaemia Diagnosis and Treatment. Atheroscler Suppl . 2017;26:25–35. doi: 10.1016/S1567-5688(17)30022-3. [DOI] [PubMed] [Google Scholar]
- 56.Wiegman A, Gidding SS, Watts GF, Chapman MJ, Ginsberg HN, Cuchel M, et al. Familial Hypercholesterolaemia in Children and Adolescents: Gaining Decades of Life by Optimizing Detection and Treatment. Eur Heart J . 2015;36(1):2425–2437. doi: 10.1093/eurheartj/ehv157. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Patel TM, Kamande SM, Jarosz E, Bost JE, Hanumanthaiah S, Berul CI, et al. Treadmill Exercise Testing Improves Diagnostic Accuracy in Children with Concealed Congenital Long QT Syndrome. Pacing Clin Electrophysiol . 2020;43(12):1521–1528. doi: 10.1111/pace.14085. [DOI] [PubMed] [Google Scholar]
- 58.Zeppenfeld K, Tfelt-Hansen J, Riva M, Winkel BG, Behr ER, Blom NA, et al. 2022 ESC Guidelines for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death. Eur Heart J . 2022;43(40):3997–4126. doi: 10.1093/eurheartj/ehac262. [DOI] [PubMed] [Google Scholar]
- 59.Ferranti SD, Steinberger J, Ameduri R, Baker A, Gooding H, Kelly AS, et al. Cardiovascular Risk Reduction in High-Risk Pediatric Patients: A Scientific Statement from the American Heart Association. Circulation . 2019;139(13):e603–e634. doi: 10.1161/CIR.0000000000000618. [DOI] [PubMed] [Google Scholar]
- 60.Stavnsbo M, Resaland GK, Anderssen SA, Steene-Johannessen J, Domazet SL, Skrede T, et al. Reference Values for Cardiometabolic Risk Scores in Children and Adolescents: Suggesting a Common Standard. Atherosclerosis . 2018;278:299–306. doi: 10.1016/j.atherosclerosis.2018.10.003. [DOI] [PubMed] [Google Scholar]
- 61.de Ferranti SD, Steinberger J, Ameduri R, Baker A, Gooding H, Kelly AS, Mietus-Snyder M, Mitsnefes MM, Peterson AL, St-Pierre J, Urbina EM, Zachariah JP, Zaidi AN. Cardiovascular Risk Reduction in High-Risk Pediatric Patients: A Scientific Statement From the American Heart Association. Circulation . 2019 Mar 26;139(13):e603–e634. doi: 10.1161/CIR.0000000000000618. [DOI] [PubMed] [Google Scholar]
- 62.Pelliccia A, Sharma S, Gati S, Bäck M, Börjesson M, Caselli S, et al. 2020 ESC Guidelines on Sports Cardiology and Exercise in Patients with Cardiovascular Disease. Eur Heart J . 2021;42(1):17–96. doi: 10.1093/eurheartj/ehaa605. [DOI] [PubMed] [Google Scholar]
- 63.Ghorayeb N, Stein R, Daher DJ, Silveira ADD, Ritt LEF, Santos DFPD, et al. The Brazilian Society of Cardiology and Brazilian Society of Exercise and Sports Medicine Updated Guidelines for Sports and Exercise Cardiology - 2019. Arq Bras Cardiol . 2019;112(3):326–368. doi: 10.5935/abc.20190048. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.Corrado D, Pelliccia A, Bjørnstad HH, Vanhees L, Biffi A, Borjesson M, et al. Cardiovascular Pre-Participation Screening of Young Competitive Athletes for Prevention of Sudden Death: Proposal for a Common European Protocol. Consensus Statement of the Study Group of Sport Cardiology of the Working Group of Cardiac Rehabilitation and Exercise Physiology and the Working Group of Myocardial and Pericardial Diseases of the European Society of Cardiology. Eur Heart J . 2005;26(5):516–524. doi: 10.1093/eurheartj/ehi108. [DOI] [PubMed] [Google Scholar]
- 65.Zorzi A, Vessella T, De Lazzari M, Cipriani A, Menegon V, Sarto G, et al. Screening Young Athletes for Diseases at Risk of Sudden Cardiac Death: Role of Stress Testing for Ventricular Arrhythmias. Eur J Prev Cardiol . 2020;27(3):311–320. doi: 10.1177/2047487319890973. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Maron BJ, Doerer JJ, Haas TS, Tierney DM, Mueller FO. Sudden Deaths in Young Competitive Athletes: Analysis of 1866 Deaths in the United States, 1980-2006. Circulation . 2009;119(8):1085–1092. doi: 10.1161/CIRCULATIONAHA.108.804617. [DOI] [PubMed] [Google Scholar]
- 67.Teoh OH, Trachsel D, Mei-Zahav M, Selvadurai H. Exercise Testing in Children with Lung Diseases. Paediatr Respir Rev . 2009;10(3):99–104. doi: 10.1016/j.prrv.2009.06.004. [DOI] [PubMed] [Google Scholar]
- 68.Welsh L, Roberts RG, Kemp JG. Fitness and Physical Activity in Children with Asthma. Sports Med . 2004;34(13):861–870. doi: 10.2165/00007256-200434130-00001. [DOI] [PubMed] [Google Scholar]
- 69.McCambridge TM, Benjamin HJ, Brenner JS, Cappetta CT, Demorest RA, Gregory AJ, et al. Athletic Participation by Children and Adolescents who have Systemic Hypertension. Pediatrics . 2010;125(6):1287–1294. doi: 10.1542/peds.2010-0658. [DOI] [PubMed] [Google Scholar]
- 70.Faulkner MS, Michaliszyn SF, Hepworth JT. A Personalized Approach to Exercise Promotion in Adolescents with Type 1 Diabetes. Pediatr Diabetes . 2010;11(3):166–174. doi: 10.1111/j.1399-5448.2009.00550.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 71.Kosinski C, Besson C, Amati F. Exercise Testing in Individuals with Diabetes, Practical Considerations for Exercise Physiologists. Front Physiol . 2019;10:1257–1257. doi: 10.3389/fphys.2019.01257. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 72.King KM, McKay T, Thrasher BJ, Wintergerst KA. Maximal Oxygen Uptake, VO2 Max, Testing Effect on Blood Glucose Level in Adolescents with Type 1 Diabetes Mellitus. Int J Environ Res Public Health . 2022;19(9):5543–5543. doi: 10.3390/ijerph19095543. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 73.Pieles GE, Oberhoffer R. The Assessment of the Paediatric Athlete. J Cardiovasc Transl Res . 2020;13(3):306–312. doi: 10.1007/s12265-020-10005-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 74.Sarto P, Zorzi A, Merlo L, Vessella T, Pegoraro C, Giorgiano F, et al. Serial versus Single Cardiovascular Screening of Adolescent Athletes. Circulation . 2021;143(17):1729–1731. doi: 10.1161/CIRCULATIONAHA.120.053168. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 75.Virani SS, Alonso A, Aparicio HJ, Benjamin EJ, Bittencourt MS, Callaway CW, et al. Heart Disease and Stroke Statistics-2021 Update: A Report from the American Heart Association. Circulation . 2021;143(8):e254–e743. doi: 10.1161/CIR.0000000000000950. [DOI] [PubMed] [Google Scholar]
- 76.Liu Y, Chen S, Zühlke L, Black GC, Choy MK, Li N, et al. Global Birth Prevalence of Congenital Heart Defects 1970-2017: Updated Systematic Review and Meta-Analysis of 260 Studies. Int J Epidemiol . 2019;48(2):455–463. doi: 10.1093/ije/dyz009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 77.Zaqout M, Vandekerckhove K, De Wolf D, Panzer J, Bové T, François K, et al. Determinants of Physical Fitness in Children with Repaired Congenital Heart Disease. Pediatr Cardiol . 2021;42(4):857–865. doi: 10.1007/s00246-021-02551-y. [DOI] [PubMed] [Google Scholar]
- 78.Chlif M, Ammar MM, Said NB, Sergey L, Ahmaidi S, Alassery F, et al. Mechanism of Dyspnea during Exercise in Children with Corrected Congenital Heart Disease. Int J Environ Res Public Health . 2021;19(1):99–99. doi: 10.3390/ijerph19010099. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 79.Abassi H, Gavotto A, Picot MC, Bertet H, Matecki S, Guillaumont S, et al. Impaired Pulmonary Function and its Association with Clinical Outcomes, Exercise Capacity and Quality of Life in Children with Congenital Heart Disease. Int J Cardiol . 2019;285:86–92. doi: 10.1016/j.ijcard.2019.02.069. [DOI] [PubMed] [Google Scholar]
- 80.Schaan CW, Macedo ACP, Sbruzzi G, Umpierre D, Schaan BD, Pellanda LC. Functional Capacity in Congenital Heart Disease: A Systematic Review and Meta-Analysis. Arq Bras Cardiol . 2017;109(4):357–367. doi: 10.5935/abc.20170125. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Baumgartner H, Bonhoeffer P, De Groot NM, Haan F, Deanfield JE, Galie N, et al. ESC Guidelines for the Management of Grown-Up Congenital Heart Disease (New Version 2010) Eur Heart J . 2010;31(23):2915–2957. doi: 10.1093/eurheartj/ehq249. [DOI] [PubMed] [Google Scholar]
- 82.Magalhães LP, Guimarães I, Melo SL, Mateo E, Andalaft RB, Xavier L, et al. Diretriz de Arritmias Cardíacas em Crianças e Cardiopatias Congênitas Sobrac e DCC - CP. Arq Bras Cardiol . 2016;107(1 Suppl 3):1–58. doi: 10.5935/abc.20160103. [DOI] [PubMed] [Google Scholar]
- 83.Khairy P, van Hare GF, Balaji S, Berul CI, Cecchin F, Cohen MI, et al. PACES/HRS Expert Consensus Statement on the Recognition and Management of Arrhythmias in Adult Congenital Heart Disease: Developed in Partnership between the Pediatric and Congenital Electrophysiology Society (PACES) and the Heart Rhythm Society (HRS). Endorsed by the Governing Bodies of PACES, HRS, the American College of Cardiology (ACC), the American Heart Association (AHA), the European Heart Rhythm Association (EHRA), the Canadian Heart Rhythm Society (CHRS), and the International Society for Adult Congenital Heart Disease (ISACHD) Heart Rhythm . 2014;11(10):e102–e165. doi: 10.1016/j.hrthm.2014.05.009. [DOI] [PubMed] [Google Scholar]
- 84.Ohuchi H, Negishi J, Miike H, Toyoshima Y, Morimoto H, Fukuyama M, et al. Positive Pediatric Exercise Capacity Trajectory Predicts Better Adult Fontan Physiology Rationale for Early Establishment of Exercise Habits. Int J Cardiol . 2019;274:80–87. doi: 10.1016/j.ijcard.2018.06.067. [DOI] [PubMed] [Google Scholar]
- 85.Holst KA, Said SM, Nelson TJ, Cannon BC, Dearani JA. Current Interventional and Surgical Management of Congenital Heart Disease: Specific Focus on Valvular Disease and Cardiac Arrhythmias. Circ Res . 2017;120(6):1027–1044. doi: 10.1161/CIRCRESAHA.117.309186. [DOI] [PubMed] [Google Scholar]
- 86.Diller GP, Dimopoulos K, Okonko D, Li W, Babu-Narayan SV, Broberg CS, et al. Exercise Intolerance in Adult Congenital Heart Disease: Comparative Severity, Correlates, and Prognostic Implication. Circulation . 2005;112(6):828–835. doi: 10.1161/CIRCULATIONAHA.104.529800. [DOI] [PubMed] [Google Scholar]
- 87.Steinberger J, Moller JH. Exercise Testing in Children with Pulmonary Valvar Stenosis. Pediatr Cardiol . 1999;20(1):27–31. doi: 10.1007/s002469900389. [DOI] [PubMed] [Google Scholar]
- 88.Al-Khatib SM, Stevenson WG, Ackerman MJ, Bryant WJ, Callans DJ, Curtis AB, et al. 2017 AHA/ACC/HRS Guideline for Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol . 2018;72(14):e91–e220. doi: 10.1016/j.jacc.2017.10.054. [DOI] [PubMed] [Google Scholar]
- 89.Callaghan S, Morrison ML, McKeown PP, Tennyson C, Sands AJ, McCrossan B, et al. Exercise Prescription Improves Exercise Tolerance in Young Children with CHD: A Randomised Clinical Trial. Open Heart . 2021;8(1):e001599. doi: 10.1136/openhrt-2021-001599. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 90.Gauthier N, Reynolds L, Curran T, O’Neill J, Gauvreau K, Alexander ME. FORCE Risk Stratification Tool for Pediatric Cardiac Rehabilitation and Fitness Programs. Pediatr Cardiol . 2023;44(6):1302–1310. doi: 10.1007/s00246-022-03010-y. [DOI] [PubMed] [Google Scholar]
- 91.Fernandes SM, Alexander ME, Graham DA, Khairy P, Clair M, Rodriguez E, et al. Exercise Testing Identifies Patients at Increased Risk for Morbidity and Mortality Following Fontan Surgery. Congenit Heart Dis . 2011;6(4):294–303. doi: 10.1111/j.1747-0803.2011.00500.x. [DOI] [PubMed] [Google Scholar]
- 92.Paridon SM, Mitchell PD, Colan SD, Williams RV, Blaufox A, Li JS, et al. A Cross-Sectional Study of Exercise Performance During the First 2 Decades of Life after the Fontan Operation. J Am Coll Cardiol . 2008;52(2):99–107. doi: 10.1016/j.jacc.2008.02.081. [DOI] [PubMed] [Google Scholar]
- 93.Kantor PF, Redington AN. Pathophysiology and Management of Heart Failure in Repaired Congenital Heart Disease. Heart Fail Clin . 2010;6(4):497–506. doi: 10.1016/j.hfc.2010.06.002. [DOI] [PubMed] [Google Scholar]
- 94.Moffett BS, Chang AC. Future Pharmacologic Agents for Treatment of Heart Failure in Children. Pediatr Cardiol . 2006;27(5):533–551. doi: 10.1007/s00246-006-1289-0. [DOI] [PubMed] [Google Scholar]
- 95.Marcadet DM, Pavy B, Bosser G, Claudot F, Corone S, Douard H, et al. French Society of Cardiology Guidelines on Exercise Tests (Part 2): Indications for Exercise Tests in Cardiac Diseases. Arch Cardiovasc Dis . 2019;112(1):56–66. doi: 10.1016/j.acvd.2018.07.001. [DOI] [PubMed] [Google Scholar]
- 96.Barry OM, Gauvreau K, Rhodes J, Reichman JR, Bourette L, Curran T, et al. Incidence and Predictors of Clinically Important and Dangerous Arrhythmias During Exercise Tests in Pediatric and Congenital Heart Disease Patients. JACC Clin Electrophysiol . 2018;4(10):1319–1327. doi: 10.1016/j.jacep.2018.05.018. [DOI] [PubMed] [Google Scholar]
- 97.Ammash NM, Dearani JA, Burkhart HM, Connolly HM. Pulmonary Regurgitation after Tetralogy of Fallot Repair: Clinical Features, Sequelae, and Timing of Pulmonary Valve Replacement. Congenit Heart Dis . 2007;2(6):386–403. doi: 10.1111/j.1747-0803.2007.00131.x. [DOI] [PubMed] [Google Scholar]
- 98.Geva T. Repaired Tetralogy of Fallot: the Roles of Cardiovascular Magnetic Resonance in Evaluating Pathophysiology and for Pulmonary Valve Replacement Decision Support. J Cardiovasc Magn Reson . 2011;13(1):9–9. doi: 10.1186/1532-429X-13-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 99.Müller J, Hager A, Diller GP, Derrick G, Buys R, Dubowy KO, et al. Peak Oxygen Uptake, Ventilatory Efficiency and QRS-Duration Predict Event Free Survival in Patients Late after Surgical Repair of Tetralogy of Fallot. Int J Cardiol . 2015;196:158–164. doi: 10.1016/j.ijcard.2015.05.174. [DOI] [PubMed] [Google Scholar]
- 100.Dallaire F, Wald RM, Marelli A. The Role of Cardiopulmonary Exercise Testing for Decision Making in Patients with Repaired Tetralogy of Fallot. Pediatr Cardiol . 2017;38(6):1097–1105. doi: 10.1007/s00246-017-1656-z. [DOI] [PubMed] [Google Scholar]
- 101.Mahle WT, McBride MG, Paridon SM. Exercise Performance after the Arterial Switch Operation for D-Transposition of the Great Arteries. Am J Cardiol . 2001;87(6):753–758. doi: 10.1016/s0002-9149(00)01496-x. [DOI] [PubMed] [Google Scholar]
- 102.Giardini A, Hager A, Lammers AE, Derrick G, Müller J, Diller GP, et al. Ventilatory Efficiency and Aerobic Capacity Predict Event-Free Survival in Adults with Atrial Repair for Complete Transposition of the Great Arteries. J Am Coll Cardiol . 2009;53(17):1548–1555. doi: 10.1016/j.jacc.2009.02.005. [DOI] [PubMed] [Google Scholar]
- 103.Tuan SH, Chiu PC, Liou IH, Lu WH, Huang HY, Wu SY, et al. Serial Analysis of Cardiopulmonary Fitness and Echocardiography in Patients with Fabry Disease Undergoing Enzyme Replacement Therapy. J Rehabil Med Clin Commun . 2020;3:1000028–1000028. doi: 10.2340/20030711-1000028. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 104.Powell AW, Nagarajan R, Mays WA, Chin C, Knilans TK, Knecht SK, et al. Cardiopulmonary Aerobic Fitness Assessment During Maximal and Submaximal Exercise Testing in Pediatric Oncology Patients after Chemotherapy. Am J Clin Oncol . 2018;41(11):1058–1061. doi: 10.1097/COC.0000000000000422. [DOI] [PubMed] [Google Scholar]
- 105.Ghosh RM, Gates GJ, Walsh CA, Schiller MS, Pass RH, Ceresnak SR. The Prevalence of Arrhythmias, Predictors for Arrhythmias, and Safety of Exercise Stress Testing in Children. Pediatr Cardiol . 2015;36(3):584–590. doi: 10.1007/s00246-014-1053-9. [DOI] [PubMed] [Google Scholar]
- 106.Shah MJ, Silka MJ, Silva JNA, Balaji S, Beach CM, Benjamin MN, et al. 2021 PACES Expert Consensus Statement on the Indications and Management of Cardiovascular Implantable Electronic Devices in Pediatric Patients. Indian Pacing Electrophysiol J . 2021;21(6):367–393. doi: 10.1016/j.ipej.2021.07.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 107.Baruteau AE, Pass RH, Thambo JB, Behaghel A, Le Pennec S, Perdreau E, et al. Congenital and Childhood Atrioventricular Blocks: Pathophysiology and Contemporary Management. Eur J Pediatr . 2016;175(9):1235–1248. doi: 10.1007/s00431-016-2748-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 108.Blank AC, Hakim S, Strengers JL, Tanke RB, van Veen TA, Vos MA, et al. Exercise Capacity in Children with Isolated Congenital Complete Atrioventricular Block: Does Pacing Make a Difference? Pediatr Cardiol . 2012;33(4):576–585. doi: 10.1007/s00246-012-0176-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 109.Takahashi K, Nabeshima T, Nakayashiro M, Ganaha H. QT Dynamics During Exercise in Asymptomatic Children with Long QT Syndrome Type 3. Pediatr Cardiol . 2016;37(5):860–867. doi: 10.1007/s00246-016-1360-4. [DOI] [PubMed] [Google Scholar]
- 110.Winder MM, Marietta J, Kerr LM, Puchalski MD, Zhang C, Ware AL, et al. Reducing Unnecessary Diagnostic Testing in Pediatric Syncope: A Quality Improvement Initiative. Pediatr Cardiol . 2021;42(4):942–950. doi: 10.1007/s00246-021-02567-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 111.Massin MM, Malekzadeh-Milani S, Benatar A. Cardiac Syncope in Pediatric Patients. Clin Cardiol . 2007;30(2):81–85. doi: 10.1002/clc.28. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 112.Giudicessi JR, Ackerman MJ. Exercise Testing Oversights Underlie Missed and Delayed Diagnosis of Catecholaminergic Polymorphic Ventricular Tachycardia in Young Sudden Cardiac Arrest Survivors. Heart Rhythm . 2019;16(8):1232–1239. doi: 10.1016/j.hrthm.2019.02.012. [DOI] [PubMed] [Google Scholar]
- 113.Roston TM, Kallas D, Davies B, Franciosi S, Souza AM, Laksman ZW, et al. Burst Exercise Testing Can Unmask Arrhythmias in Patients with Incompletely Penetrant Catecholaminergic Polymorphic Ventricular Tachycardia. JACC Clin Electrophysiol . 2021;7(4):437–441. doi: 10.1016/j.jacep.2021.02.013. [DOI] [PubMed] [Google Scholar]
- 114.Teixeira RA, Fagundes AA, Baggio JM, Oliveira JCD, Medeiros PDTJ, Valdigem BP, et al. Diretriz Brasileira de Dispositivos Cardíacos Eletrônicos Implantáveis – 2023. Arq Bras Cardiol . 2023;120:e20220892. doi: 10.36660/abc.20220892. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 115.Bordachar P, Zachary W, Ploux S, Labrousse L, Haissaguerre M, Thambo JB. Pathophysiology, Clinical Course, and Management of Congenital Complete Atrioventricular Block. Heart Rhythm . 2013;10(5):760–766. doi: 10.1016/j.hrthm.2012.12.030. [DOI] [PubMed] [Google Scholar]
- 116.Silka MJ, Shah MJ, Silva JNA, Balaji S, Beach CM, Benjamin MN, et al. 2021 PACES Expert Consensus Statement on the Indications and Management of Cardiovascular Implantable Electronic Devices in Pediatric Patients: Executive Summary. Heart Rhythm . 2021;18(11):1925–1950. doi: 10.1016/j.hrthm.2021.07.051. [DOI] [PubMed] [Google Scholar]
- 117.Beaufort-Krol GC, Stienstra Y, Bink-Boelkens MT. Sinus Node Function in Children with Congenital Complete Atrioventricular Block. Europace . 2007;9(9):844–847. doi: 10.1093/europace/eum116. [DOI] [PubMed] [Google Scholar]
- 118.European Society of Cardiology (ESC); European Heart Rhythm Association (EHRA) Brignole M, Auricchio A, Baron-Esquivias G, Bordachar P, et al. 2013 ESC Guidelines on Cardiac Pacing and Cardiac Resynchronization Therapy: The Task Force on Cardiac Pacing and Resynchronization Therapy of the European Society of Cardiology (ESC). Developed in Collaboration with the European Heart Rhythm Association (EHRA) Europace . 2013;15(8):1070–1118. doi: 10.1093/europace/eut206. [DOI] [PubMed] [Google Scholar]
- 119.Hernández-Madrid A, Paul T, Abrams D, Aziz PF, Blom NA, Chen J, et al. Arrhythmias in Congenital Heart Disease: A Position Paper of the European Heart Rhythm Association (EHRA), Association for European Paediatric and Congenital Cardiology (AEPC), and the European Society of Cardiology (ESC) Working Group on Grown-up Congenital Heart Disease, Endorsed by HRS, PACES, APHRS, and SOLAECE. Europace . 2018;20(11):1719–1753. doi: 10.1093/europace/eux380. [DOI] [PubMed] [Google Scholar]
- 120.Gibbons RJ, Balady GJ, Beasley JW, Bricker JT, Duvernoy WF, Froelicher VF, et al. ACC/AHA Guidelines for Exercise Testing: Executive Summary. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on Exercise Testing) Circulation . 1997;96(1):345–354. doi: 10.1161/01.cir.96.1.345. [DOI] [PubMed] [Google Scholar]
- 121.Silva OB, Saraiva LCR, Sobral DC., Filho Teste Ergométrico em Crianças e Adolescentes: Maior Tolerância ao Esforço com o Protocolo em Rampa. Arq Bras Cardiol . 2007;89(6):355–360. doi: 10.1590/S0066-782X2007001800007. [DOI] [Google Scholar]
- 122.Tikkanen AU, Oyaga AR, Riaño OA, Álvaro EM, Rhodes J. Paediatric Cardiac Rehabilitation in Congenital Heart Disease: A Systematic Review. Cardiol Young . 2012;22(3):241–250. doi: 10.1017/S1047951111002010. [DOI] [PubMed] [Google Scholar]
- 123.Rhodes J, Curran TJ, Camil L, Rabideau N, Fulton DR, Gauthier NS, et al. Impact of Cardiac Rehabilitation on the Exercise Function of Children with Serious Congenital Heart Disease. Pediatrics . 2005;116(6):1339–1345. doi: 10.1542/peds.2004-2697. [DOI] [PubMed] [Google Scholar]
- 124.Ogawa Y, Tanaka T, Kido S. Reproducibility of Corrected QT Interval in Pediatric Genotyped Long QT Syndrome. Pediatr Int . 2016;58(11):1246–1248. doi: 10.1111/ped.13120. [DOI] [PubMed] [Google Scholar]
- 125.Corcia MCG. Brugada Syndrome - Minimizing Overdiagnosis and Over Treatment in Children. Curr Opin Cardiol . 2022;37(1):80–85. doi: 10.1097/HCO.0000000000000941. [DOI] [PubMed] [Google Scholar]
- 126.Masrur S, Memon S, Thompson PD. Brugada Syndrome, Exercise, and Exercise Testing. Clin Cardiol . 2015;38(5):323–326. doi: 10.1002/clc.22386. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 127.Subramanian M, Prabhu MA, Harikrishnan MS, Shekhar SS, Pai PG, Natarajan K. The Utility of Exercise Testing in Risk Stratification of Asymptomatic Patients with Type 1 Brugada Pattern. J Cardiovasc Electrophysiol . 2017;28(6):677–683. doi: 10.1111/jce.13205. [DOI] [PubMed] [Google Scholar]
- 128.Crosson JE, Callans DJ, Bradley DJ, Dubin A, Epstein M, Etheridge S, et al. PACES/HRS Expert Consensus Statement on the Evaluation and Management of Ventricular Arrhythmias in the Child with a Structurally Normal Heart. Heart Rhythm . 2014;11(9):e55–e78. doi: 10.1016/j.hrthm.2014.05.010. [DOI] [PubMed] [Google Scholar]
- 129.Porcedda G, Brambilla A, Favilli S, Spaziani G, Mascia G, Giaccardi M. Frequent Ventricular Premature Beats in Children and Adolescents: Natural History and Relationship with Sport Activity in a Long-Term Follow-Up. Pediatr Cardiol . 2020;41(1):123–128. doi: 10.1007/s00246-019-02233-w. [DOI] [PubMed] [Google Scholar]
- 130.Craik N, Hla T, Cannon J, Moore H, Carapetis JR, Sanyahumbi A. In: Streptococcus pyogenes: Basic Biology to Clinical Manifestations [Internet] 2nd ed. Ferretti JJ, Stevens DL, Fischetti VA, editors. Oklahoma City (OK): University of Oklahoma Health Sciences Center; 2022. Oct 08, Global Disease Burden of Streptococcus pyogenes. 2022 Aug 21 [updated 2022 Oct 4] Chapter 21. [PubMed] [Google Scholar]
- 131.Nascimento BR, Beaton AZ, Nunes MC, Diamantino AC, Carmo GA, Oliveira KK, et al. Echocardiographic Prevalence of Rheumatic Heart Disease in Brazilian Schoolchildren: Data from the PROVAR Study. Int J Cardiol . 2016;219:439–445. doi: 10.1016/j.ijcard.2016.06.088. [DOI] [PubMed] [Google Scholar]
- 132.Iddawela S, Joseph PJS, Ganeshan R, Shah HI, Olatigbe TAT, Anyu AT, et al. Paediatric Mitral Valve Disease - From Presentation to Management. Eur J Pediatr . 2022;181(1):35–44. doi: 10.1007/s00431-021-04208-7. [DOI] [PubMed] [Google Scholar]
- 133.Saxena A. Evaluation of Acquired Valvular Heart Disease by the Pediatrician: When to Follow, When to Refer for Intervention? Part I. Indian J Pediatr . 2015;82(11):1033–1041. doi: 10.1007/s12098-015-1796-1. [DOI] [PubMed] [Google Scholar]
- 134.Santana S, Gidding SS, Xie S, Jiang T, Kharouf R, Robinson BW. Correlation of Echocardiogram and Exercise Test Data in Children with Aortic Stenosis. Pediatr Cardiol . 2019;40(7):1516–1522. doi: 10.1007/s00246-019-02177-1. [DOI] [PubMed] [Google Scholar]
- 135.Decker JA. Arrhythmias in Paediatric Valvar Disease. Cardiol Young . 2014;24(6):1064–1070. doi: 10.1017/S1047951114001978. [DOI] [PubMed] [Google Scholar]
- 136.Singh GK. Aortic Stenosis. Indian J Pediatr . 2002;69(4):351–358. doi: 10.1007/BF02723222. [DOI] [PubMed] [Google Scholar]
- 137.Rhodes J, Fischbach PS, Patel H, Hijazi ZM. Factors Affecting the Exercise Capacity of Pediatric Patients with Aortic Regurgitation. Pediatr Cardiol . 2000;21(4):328–333. doi: 10.1007/s002460010074. [DOI] [PubMed] [Google Scholar]
- 138.Tretter JT, Langsner A. Timing of Aortic Valve Intervention in Pediatric Chronic Aortic Insufficiency. Pediatr Cardiol . 2014;35(8):1321–1326. doi: 10.1007/s00246-014-1019-y. [DOI] [PubMed] [Google Scholar]
- 139.D’Ascenzi F, Valentini F, Anselmi F, Cavigli L, Bandera F, Benfari G, et al. Bicuspid Aortic Valve and Sports: From the Echocardiographic Evaluation to the Eligibility for Sports Competition. Scand J Med Sci Sports . 2021;31(3):510–520. doi: 10.1111/sms.13895. [DOI] [PubMed] [Google Scholar]
- 140.Mitchell BM, Strasburger JF, Hubbard JE, Wessel HU. Serial Exercise Performance in Children with Surgically Corrected Congenital Aortic Stenosis. Pediatr Cardiol . 2003;24(4):319–324. doi: 10.1007/s00246-002-0281-6. [DOI] [PubMed] [Google Scholar]
- 141.Carvalho T, Milani M, Ferraz AS, Silveira ADD, Herdy AH, Hossri CAC, et al. Brazilian Cardiovascular Rehabilitation Guideline - 2020. Arq Bras Cardiol . 2020;114(5):943–987. doi: 10.36660/abc.20200407. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 142.Kantor PF, Kleinman JA, Ryan TD, Wilmot I, Zuckerman WA, Addonizio LJ, et al. Preventing Pediatric Cardiomyopathy: A 2015 Outlook. Expert Rev Cardiovasc Ther . 2016;14(3):321–339. doi: 10.1586/14779072.2016.1129899. [DOI] [PubMed] [Google Scholar]
- 143.Lodato V, Parlapiano G, Calì F, Silvetti MS, Adorisio R, Armando M, et al. Cardiomyopathies in Children and Systemic Disorders when is it Useful to Look beyond the Heart? J Cardiovasc Dev Dis . 2022;9(2):47–47. doi: 10.3390/jcdd9020047. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 144.Choudhry S, Puri K, Denfield SW. An Update on Pediatric Cardiomyopathy. Curr Treat Options Cardiovasc Med . 2019;21(8):36–36. doi: 10.1007/s11936-019-0739-y. [DOI] [PubMed] [Google Scholar]
- 145.Lee TM, Hsu DT, Kantor P, Towbin JA, Ware SM, Colan SD, et al. Pediatric Cardiomyopathies. Circ Res . 2017;121(7):855–873. doi: 10.1161/CIRCRESAHA.116.309386. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 146.Watanabe K, Shih R. Update of Pediatric Heart Failure. Pediatr Clin North Am . 2020;67(5):889–901. doi: 10.1016/j.pcl.2020.06.004. [DOI] [PubMed] [Google Scholar]
- 147.Putschoegl A, Auerbach S. Diagnosis, Evaluation, and Treatment of Myocarditis in Children. Pediatr Clin North Am . 2020;67(5):855–874. doi: 10.1016/j.pcl.2020.06.013. [DOI] [PubMed] [Google Scholar]
- 148.Ditaranto R, Caponetti AG, Ferrara V, Parisi V, Minnucci M, Chiti C, et al. Pediatric Restrictive Cardiomyopathies. Front Pediatr . 2022;9:745365–745365. doi: 10.3389/fped.2021.745365. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 149.American College of Sports MedicineLiguori G, Feito Y, Fountaine C, Roy B, editors. ACSM's Guidelines for Exercise Testing and Prescription . 11th ed. Philadelphia: Wolters Kluwer; 2021. ISBN-13: 9781975150181. [Google Scholar]
- 150.Jone PN, John A, Oster ME, Allen K, Tremoulet AH, Saarel EV, et al. SARS-CoV-2 Infection and Associated Cardiovascular Manifestations and Complications in Children and Young Adults: A Scientific Statement from the American Heart Association. Circulation . 2022;145(19):e1037–e1052. doi: 10.1161/CIR.0000000000001064. [DOI] [PubMed] [Google Scholar]
- 151.Masood IR, Detterich J, Cerrone D, Lewinter K, Shah P, Kato R, et al. Reduced Forced Vital Capacity and the Number of Chest Wall Surgeries are Associated with Decreased Exercise Capacity in Children with Congenital Heart Disease. Pediatr Cardiol . 2022;43(1):54–61. doi: 10.1007/s00246-021-02692-0. [DOI] [PubMed] [Google Scholar]
- 152.Buys R, Cornelissen V, van de Bruaene A, Stevens A, Coeckelberghs E, Onkelinx S, et al. Measures of Exercise Capacity in Adults with Congenital Heart Disease. Int J Cardiol . 2011;153(1):26–30. doi: 10.1016/j.ijcard.2010.08.030. [DOI] [PubMed] [Google Scholar]
- 153.van der Bom T, Winter MM, Groenink M, Vliegen HW, Pieper PG, van Dijk AP, et al. Right Ventricular End-Diastolic Volume Combined with Peak Systolic Blood Pressure During Exercise Identifies Patients at Risk for Complications in Adults with a Systemic Right Ventricle. J Am Coll Cardiol . 2013;62(10):926–936. doi: 10.1016/j.jacc.2013.06.026. [DOI] [PubMed] [Google Scholar]
- 154.Decker JA, Rossano JW, Smith EO, Cannon B, Clunie SK, Gates C, et al. Risk Factors and Mode of Death in Isolated Hypertrophic Cardiomyopathy in Children. J Am Coll Cardiol . 2009;54(3):250–254. doi: 10.1016/j.jacc.2009.03.051. [DOI] [PubMed] [Google Scholar]
- 155.Sadoul N, Prasad K, Elliott PM, Bannerjee S, Frenneaux MP, McKenna WJ. Prospective Prognostic Assessment of Blood Pressure Response During Exercise in Patients with Hypertrophic Cardiomyopathy. Circulation . 1997;96(9):2987–2991. doi: 10.1161/01.cir.96.9.2987. [DOI] [PubMed] [Google Scholar]
- 156.Rowin EJ, Maron BJ, Olivotto I, Maron MS. Role of Exercise Testing in Hypertrophic Cardiomyopathy. JACC Cardiovasc Imaging . 2017;10(11):1374–1386. doi: 10.1016/j.jcmg.2017.07.016. [DOI] [PubMed] [Google Scholar]
- 157.Conway J, Min S, Villa C, Weintraub RG, Nakano S, Godown J, et al. The Prevalence and Association of Exercise Test Abnormalities with Sudden Cardiac Death and Transplant-Free Survival in Childhood Hypertrophic Cardiomyopathy. Circulation . 2023;147(9):718–727. doi: 10.1161/CIRCULATIONAHA.122.062699. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 158.Santens B, van de Bruaene A, de Meester P, D’Alto M, Reddy S, Bernstein D, et al. Diagnosis and Treatment of Right Ventricular Dysfunction in Congenital Heart Disease. Cardiovasc Diagn Ther . 2020;10(5):1625–1645. doi: 10.21037/cdt-20-370. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 159.Roche SL, Redington AN. The Failing Right Ventricle in Congenital Heart Disease. Can J Cardiol . 2013;29(7):768–778. doi: 10.1016/j.cjca.2013.04.018. [DOI] [PubMed] [Google Scholar]
- 160.Bovard JM, Souza AM, Harris KC, Human DG, Hosking MCK, Potts JE, et al. Physiological Responses to Exercise in Pediatric Heart Transplant Recipients. Med Sci Sports Exerc . 2019;51(5):850–857. doi: 10.1249/MSS.0000000000001889. [DOI] [PubMed] [Google Scholar]
- 161.Chen AC, Rosenthal DN, Couch SC, Berry S, Stauffer KJ, Brabender J, et al. Healthy Hearts in Pediatric Heart Transplant Patients with an Exercise and Diet Intervention via Live Video Conferencing-Design and Rationale. Pediatr Transplant . 2019;23(1):e13316. doi: 10.1111/petr.13316. [DOI] [PubMed] [Google Scholar]
- 162.Pichara NL, Sacilotto L, Scanavacca MI, Cardoso AF, Soares BMAF, Falcochio PPPF, et al. Evaluation of a New treadmill Exercise Protocol To Unmask Type 1 Brugada Electrocardiographic Pattern: Can We Improve Diagnostic Yield? Europace . 2023;25(7):euad157–euad157. doi: 10.1093/europace/euad157. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 163.Parsons JP, Hallstrand TS, Mastronarde JG, Kaminsky DA, Rundell KW, Hull JH, et al. An Official American Thoracic Society Clinical Practice Guideline: Exercise-Induced Bronchoconstriction. Am J Respir Crit Care Med . 2013;187(9):1016–1027. doi: 10.1164/rccm.201303-0437ST. [DOI] [PubMed] [Google Scholar]
- 164.Johansson H, Norlander K, Berglund L, Janson C, Malinovschi A, Nordvall L, et al. Prevalence of Exercise-Induced Bronchoconstriction and Exercise-Induced Laryngeal Obstruction in a General Adolescent Population. Thorax . 2015;70(1):57–63. doi: 10.1136/thoraxjnl-2014-205738. [DOI] [PubMed] [Google Scholar]
- 165.Sperotto F, Friedman KG, Son MBF, van der Pluym CJ, Newburger JW, Dionne A. Cardiac Manifestations in SARS-CoV-2-Associated Multisystem Inflammatory Syndrome in Children: A Comprehensive Review and Proposed Clinical Approach. Eur J Pediatr . 2021;180(2):307–322. doi: 10.1007/s00431-020-03766-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 166.Powell AW, Urbina EM, Orr WB, Hansen JE, Baskar S. EKG Abnormalities in a Youth Athlete Following COVID-19: It's Not Always Myocarditis! Pediatr Cardiol . 2022;43(8):1922–1925. doi: 10.1007/s00246-022-02935-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 167.Olorunyomi OO, Liem RI, Hsu LL. Motivators and Barriers to Physical Activity Among Youth with Sickle Cell Disease: Brief Review. Children . 2022;9(4):572–572. doi: 10.3390/children9040572. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 168.Connes P, Machado R, Hue O, Reid H. Exercise Limitation, Exercise Testing and Exercise Recommendations in Sickle Cell Anemia. Clin Hemorheol Microcirc . 2011;49(1):151–163. doi: 10.3233/CH-2011-1465. [DOI] [PubMed] [Google Scholar]
- 169.Galiè N, Humbert M, Vachiery JL, Gibbs S, Lang I, Torbicki A, et al. 2015 ESC/ERS Guidelines for the Diagnosis and Treatment of Pulmonary Hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT) Eur Respir J . 2015;46(4):903–975. doi: 10.1183/13993003.01032-2015. [DOI] [PubMed] [Google Scholar]
- 170.Chen YJ, Tu HP, Lee CL, Huang WC, Yang JS, Li CF, et al. Comprehensive Exercise Capacity and Quality of Life Assessments Predict Mortality in Patients with Pulmonary Arterial Hypertension. Acta Cardiol Sin . 2019;35(1):55–64. doi: 10.6515/ACS.201901_35(1).20180608A. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 171.Derakhshan A, Derakhshan D, Amoozgar H, Shakiba MA, Basiratnia M, Fallahzadeh MH. Exercise Test in Pediatric Renal Transplant Recipients and its Relationship with their Cardiac Function. Pediatr Transplant . 2014;18(3):246–253. doi: 10.1111/petr.12229. [DOI] [PubMed] [Google Scholar]
- 172.Clark CG, Cantell M, Crawford S, Hamiwka LA. Accelerometry-Based Physical Activity and Exercise Capacity in Pediatric Kidney Transplant Patients. Pediatr Nephrol . 2012;27(4):659–665. doi: 10.1007/s00467-011-2054-z. [DOI] [PubMed] [Google Scholar]
- 173.Painter P, Krasnoff J, Mathias R. Exercise Capacity and Physical Fitness in Pediatric Dialysis and Kidney Transplant Patients. Pediatr Nephrol . 2007;22(7):1030–1039. doi: 10.1007/s00467-007-0458-6. [DOI] [PubMed] [Google Scholar]
- 174.Powell AW, Urbina EM, Madueme P, Rotz S, Chin C, Taylor MD, et al. Abnormal Maximal and Submaximal Cardiopulmonary Exercise Capacity in Pediatric Stem Cell Transplant Recipients Despite Normal Standard Echocardiographic Parameters: A Pilot Study. Transplant Cell Ther . 2022;28(5):263.e1–263.e5. doi: 10.1016/j.jtct.2022.02.019. [DOI] [PubMed] [Google Scholar]
- 175.Caru M, Laverdière C, Lemay V, Drouin S, Bertout L, Krajinovic M, et al. Maximal Cardiopulmonary Exercise Testing in Childhood Acute Lymphoblastic Leukemia Survivors Exposed to Chemotherapy. Support Care Cancer . 2021;29(2):987–996. doi: 10.1007/s00520-020-05582-y. [DOI] [PubMed] [Google Scholar]
- 176.Takken T, Bongers BC, van Brussel M, Haapala EA, Hulzebos EHJ. Cardiopulmonary Exercise Testing in Pediatrics. Ann Am Thorac Soc . 2017;14(Suppl 1):S123–S128. doi: 10.1513/AnnalsATS.201611-912FR. [DOI] [PubMed] [Google Scholar]
- 177.Rowland TW. American College of Sports Medicine, North American Society for Pediatric Exercise Medicine, editors. Cardiopulmonary Exercise Testing in Children and Adolescents . Champaign: Human Kinetics; 2018. ISBN: 9781492544487. [Google Scholar]
- 178.Goddard T, Sonnappa S. The Role of Cardiopulmonary Exercise Testing in Evaluating Children with Exercise Induced Dyspnoea. Paediatr Respir Rev . 2021;38:24–32. doi: 10.1016/j.prrv.2020.08.002. [DOI] [PubMed] [Google Scholar]
- 179.van Brussel M, Bongers BC, Hulzebos EHJ, Burghard M, Takken T. A Systematic Approach to Interpreting the Cardiopulmonary Exercise Test in Pediatrics. Pediatr Exerc Sci . 2019;31(2):194–203. doi: 10.1123/pes.2018-0235. [DOI] [PubMed] [Google Scholar]
- 180.Barker AR, Armstrong N. Exercise Testing Elite Young Athletes. Med Sport Sci . 2011;56:106–125. doi: 10.1159/000320642. [DOI] [PubMed] [Google Scholar]
- 181.Takken T, Giardini A, Reybrouck T, Gewillig M, Hövels-Gürich HH, Longmuir PE, et al. Recommendations for Physical Activity, Recreation Sport, and Exercise Training in Paediatric Patients with Congenital Heart Disease: A Report from the Exercise, Basic & Translational Research Section of the European Association of Cardiovascular Prevention and Rehabilitation, the European Congenital Heart and Lung Exercise Group, and the Association for European Paediatric Cardiology. Eur J Prev Cardiol . 2012;19(5):1034–1065. doi: 10.1177/1741826711420000. [DOI] [PubMed] [Google Scholar]
- 182.Tikkanen AU, Berry E, Le Count E, Engstler K, Sager M, Esteso P. Rehabilitation in Pediatric Heart Failure and Heart Transplant. Front Pediatr . 2021;9:674156–674156. doi: 10.3389/fped.2021.674156. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 183.Amedro P, Picot MC, Moniotte S, Dorka R, Bertet H, Guillaumont S, et al. Correlation Between Cardio-Pulmonary Exercise Test Variables and Health-Related Quality of Life Among Children with Congenital Heart Diseases. Int J Cardiol . 2016;203:1052–1060. doi: 10.1016/j.ijcard.2015.11.028. [DOI] [PubMed] [Google Scholar]
- 184.Villaseca-Rojas Y, Varela-Melo J, Torres-Castro R, Vasconcello-Castillo L, Mazzucco G, Vilaró J, et al. Exercise Capacity in Children and Adolescents with Congenital Heart Disease: A Systematic Review and Meta-Analysis. Front Cardiovasc Med . 2022;9:874700–874700. doi: 10.3389/fcvm.2022.874700. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 185.Corrà U, Piepoli MF. Summary Statement on Cardiopulmonary Exercise Testing in Chronic Heart Failure due to Left Ventricular Dysfunction Recommendations for Performance and Interpretation. Monaldi Arch Chest Dis . 2007;68(1):1–7. doi: 10.4081/monaldi.2007.464. [DOI] [PubMed] [Google Scholar]
- 186.Bacal F, Marcondes-Braga FG, Rohde LEP, Xavier JL, Jr, Brito FS, Moura LAZ, et al. 3ª Diretriz Brasileira de Transplante Cardíaco. Arq Bras Cardiol . 2018;111(2):230–289. doi: 10.5935/abc.20180153. [DOI] [PubMed] [Google Scholar]
- 187.Guazzi M, Adams V, Conraads V, Halle M, Mezzani A, Vanhees L, et al. EACPR/AHA Scientific Statement. Clinical Recommendations for Cardiopulmonary Exercise Testing Data Assessment in Specific Patient Populations. Circulation . 2012;126(18):2261–2274. doi: 10.1161/CIR.0b013e31826fb946. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 188.Takken T, Ulu HS, Hulzebos EHJ. Clinical Recommendations for Cardiopulmonary Exercise Testing in Children with Respiratory Diseases. Expert Rev Respir Med . 2020;14(7):691–701. doi: 10.1080/17476348.2020.1752195. [DOI] [PubMed] [Google Scholar]
- 189.Miliaresis C, Beker S, Gewitz M. Cardiopulmonary Stress Testing in Children and Adults with Congenital Heart Disease. Cardiol Rev . 2014;22(6):275–278. doi: 10.1097/CRD.0000000000000039. [DOI] [PubMed] [Google Scholar]
- 190.Giardini A, Fenton M, Derrick G, Burch M. Impairment of Heart Rate Recovery after Peak Exercise Predicts Poor Outcome after Pediatric Heart Transplantation. Circulation . 2013;128(11 Suppl 1):S199–S204. doi: 10.1161/CIRCULATIONAHA.112.000369. [DOI] [PubMed] [Google Scholar]
- 191.Peterson S, Su JA, Szmuszkovicz JR, Johnson R, Sargent B. Exercise Capacity Following Pediatric Heart Transplantation: A Systematic Review. Pediatr Transplant . 2017;21(5) doi: 10.1111/petr.12922. [DOI] [PubMed] [Google Scholar]
- 192.Chiu HH, Wu MH, Wang SS, Lan C, Chou NK, Chen SY, et al. Cardiorespiratory Function of Pediatric Heart Transplant Recipients in the Early Postoperative Period. Am J Phys Med Rehabil . 2012;91(2):156–161. doi: 10.1097/PHM.0b013e318238a0b1. [DOI] [PubMed] [Google Scholar]
- 193.Astley C, Gil S, Clemente G, Terreri MT, Silva CA, Campos LMA, et al. Poor Physical Activity Levels and Cardiorespiratory Fitness Among Patients with Childhood-Onset Takayasu Arteritis in Remission: A Cross-Sectional, Multicenter Study. Pediatr Rheumatol Online J . 2021;19(1):39–39. doi: 10.1186/s12969-021-00519-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 194.Schaar B, Feldkötter M, Nonn JM, Hoppe B. Cardiorespiratory Capacity in Children and Adolescents on Maintenance Haemodialysis. Nephrol Dial Transplant . 2011;26(11):3701–3708. doi: 10.1093/ndt/gfr014. [DOI] [PubMed] [Google Scholar]
- 195.Wadey CA, Weston ME, Dorobantu DM, Pieles GE, Stuart G, Barker AR, et al. The Role of Cardiopulmonary Exercise Testing in Predicting Mortality and Morbidity in People with Congenital Heart Disease: A Systematic Review and Meta-Analysis. Eur J Prev Cardiol . 2022;29(3):513–533. doi: 10.1093/eurjpc/zwab125. [DOI] [PubMed] [Google Scholar]
- 196.Weatherald J, Farina S, Bruno N, Laveneziana P. Cardiopulmonary Exercise Testing in Pulmonary Hypertension. Ann Am Thorac Soc . 2017;14(Suppl 1):S84–S92. doi: 10.1513/AnnalsATS.201610-788FR. [DOI] [PubMed] [Google Scholar]
- 197.Abumehdi MR, Wardle AJ, Nazzal R, Charalampopoulos A, Schulze-Neick I, Derrick G, et al. Feasibility and Safety of Cardiopulmonary Exercise Testing in Children with Pulmonary Hypertension. Cardiol Young . 2016;26(6):1144–1150. doi: 10.1017/S1047951115001961. [DOI] [PubMed] [Google Scholar]
- 198.Humbert M, Kovacs G, Hoeper MM, Badagliacca R, Berger RMF, Brida M, et al. 2022 ESC/ERS Guidelines for the Diagnosis and Treatment of Pulmonary Hypertension. Eur Heart J . 2022;43(38):3618–3731. doi: 10.1093/eurheartj/ehac237. [DOI] [PubMed] [Google Scholar]
- 199.Reybrouck T, Mertens L. Physical Performance and Physical Activity in Grown-Up Congenital Heart Disease. Eur J Cardiovasc Prev Rehabil . 2005;12(5):498–502. doi: 10.1097/01.hjr.0000176510.84165.eb. [DOI] [PubMed] [Google Scholar]
- 200.Takken T, Blank AC, Hulzebos EH, van Brussel M, Groen WG, Helders PJ. Cardiopulmonary Exercise Testing in Congenital Heart Disease: Equipment and Test Protocols. Neth Heart J . 2009;17(9):339–344. doi: 10.1007/BF03086280. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 201.Lang RL, Stockton K, Wilson C, Russell TG, Johnston LM. Exercise Testing for Children with Cystic Fibrosis: A Systematic Review. Pediatr Pulmonol . 2020;55(8):1996–2010. doi: 10.1002/ppul.24794. [DOI] [PubMed] [Google Scholar]
- 202.Urquhart DS, Saynor ZL. Exercise Testing in Cystic Fibrosis: Who and Why? Paediatr Respir Rev . 2018;27:28–32. doi: 10.1016/j.prrv.2018.01.004. [DOI] [PubMed] [Google Scholar]
- 203.van den Akker LE, Heine M, van der Veldt N, Dekker J, de Groot V, Beckerman H. Feasibility and Safety of Cardiopulmonary Exercise Testing in Multiple Sclerosis: A Systematic Review. Arch Phys Med Rehabil . 2015;96(11):2055–2066. doi: 10.1016/j.apmr.2015.04.021. [DOI] [PubMed] [Google Scholar]
- 204.Klaren RE, Sandroff BM, Fernhall B, Motl RW. Comprehensive Profile of Cardiopulmonary Exercise Testing in Ambulatory Persons with Multiple Sclerosis. Sports Med . 2016;46(9):1365–1379. doi: 10.1007/s40279-016-0472-6. [DOI] [PubMed] [Google Scholar]
- 205.Bartels B, Takken T, Blank AC, van Moorsel H, van der Pol WL, de Groot JF. Cardiopulmonary Exercise Testing in Children and Adolescents with Dystrophinopathies: A Pilot Study. Pediatr Phys Ther . 2015;27(3):227–234. doi: 10.1097/PEP.0000000000000159. [DOI] [PubMed] [Google Scholar]
- 206.Abresch RT, Han JJ, Carter GT. Rehabilitation Management of Neuromuscular Disease: The Role of Exercise Training. J Clin Neuromuscul Dis . 2009;11(1):7–21. doi: 10.1097/CND.0b013e3181a8d36b. [DOI] [PubMed] [Google Scholar]
- 207.Przybylski R, Fischer IR, Gauvreau K, Alexander ME, Shafer KM, Colan SD, et al. Assessment of Exercise Function in Children and Young Adults with Hypertrophic Cardiomyopathy and Correlation with Transthoracic Echocardiographic Parameters. Pediatr Cardiol . 2022;43(5):1037–1045. doi: 10.1007/s00246-022-02822-2. [DOI] [PubMed] [Google Scholar]
- 208.Bayonas-Ruiz A, Muñoz-Franco FM, Ferrer V, Pérez-Caballero C, Sabater-Molina M, Tomé-Esteban MT, et al. Cardiopulmonary Exercise Test in Patients with Hypertrophic Cardiomyopathy: A Systematic Review and Meta-Analysis. J Clin Med . 2021;10(11):2312–2312. doi: 10.3390/jcm10112312. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 209.Magrì D, Mastromarino V, Gallo G, Zachara E, Re F, Agostoni P, et al. Risk Stratification in Hypertrophic Cardiomyopathy. Insights from Genetic Analysis and Cardiopulmonary Exercise Testing. J Clin Med . 2020;9(6):1636–1636. doi: 10.3390/jcm9061636. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 210.Tsuda T, Kernizan D, Glass A, D’Aloisio G, Hossain J, Quillen J. Cardiopulmonary Exercise Testing Characterizes Silent Cardiovascular Abnormalities in Asymptomatic Pediatric Cancer Survivors. Pediatr Cardiol . 2023;44(2):344–353. doi: 10.1007/s00246-022-02995-w. [DOI] [PubMed] [Google Scholar]
- 211.Herdy AH, Ritt LE, Stein R, Araújo CG, Milani M, Meneghelo RS, et al. Cardiopulmonary Exercise Test: Background, Applicability and Interpretation. Arq Bras Cardiol . 2016;107(5):467–481. doi: 10.5935/abc.20160171. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 212.Takajo D, Kota V, Balakrishnan PPL, Gayanilo M, Sriram C, Aggarwal S. Longitudinal Changes in Exercise Capacity in Patients Who Underwent Ross Procedure and Mechanical Aortic Valve Replacement: Does the Type of Surgery Matter? Pediatr Cardiol . 2021;42(5):1018–1025. doi: 10.1007/s00246-021-02575-4. [DOI] [PubMed] [Google Scholar]
- 213.Egbe A, Miranda W, Connolly H, Dearani J. Haemodynamic Determinants of Improved Aerobic Capacity after Tricuspid Valve Surgery in Ebstein Anomaly. Heart . 2021;107(14):1138–1144. doi: 10.1136/heartjnl-2020-317756. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 214.Venet M, Friedberg MK, Mertens L, Baranger J, Jalal Z, Tlili G, et al. Nuclear Imaging in Pediatric Cardiology: Principles and Applications. Front Pediatr . 2022;10:909994–909994. doi: 10.3389/fped.2022.909994. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 215.Abe T, Tsuda E, Sugiyama H, Kiso K, Yamada O. Risk Factors of Non-Sustained Ventricular Tachycardia by Technetium-Perfusion Imaging in Patients with Coronary Artery Lesions Caused by Kawasaki Disease. J Cardiol . 2019;73(5):358–362. doi: 10.1016/j.jjcc.2018.12.007. [DOI] [PubMed] [Google Scholar]
- 216.Kashyap R, Mittal BR, Bhattacharya A, Manojkumar R, Singh S. Exercise Myocardial Perfusion Imaging to Evaluate Inducible Ischaemia in Children with Kawasaki Disease. Nucl Med Commun . 2011;32(2):137–141. doi: 10.1097/MNM.0b013e3283411c67. [DOI] [PubMed] [Google Scholar]
- 217.Abe M, Fukazawa R, Ogawa S, Watanabe M, Fukushima Y, Kiriyama T, et al. Usefulness of Single Photon Emission Computed Tomography/Computed Tomography Fusion-Hybrid Imaging to Evaluate Coronary Artery Disorders in Patients with a History of Kawasaki Disease. J Nippon Med Sch . 2016;83(2):71–80. doi: 10.1272/jnms.83.71. [DOI] [PubMed] [Google Scholar]
- 218.Mostafa MS, Sayed AO, Al Said YM. Assessment of Coronary Ischaemia by Myocardial Perfusion Dipyridamole Stress Technetium-99 m Tetrofosmin, Single-Photon Emission Computed Tomography, and Coronary Angiography in Children with Kawasaki Disease: Pre- and Post-Coronary Bypass Grafting. Cardiol Young . 2015;25(5):927–934. doi: 10.1017/S1047951114001292. [DOI] [PubMed] [Google Scholar]
- 219.Zanon G, Zucchetta P, Varnier M, Vittadello F, Milanesi O, Zulian F. Do Kawasaki Disease Patients Without Coronary Artery Abnormalities Need a Long-Term Follow-Up? A Myocardial Single-Photon Emission Computed Tomography Pilot Study. J Paediatr Child Health . 2009;45(7):419–424. doi: 10.1111/j.1440-1754.2009.01531.x. [DOI] [PubMed] [Google Scholar]
- 220.Sugiyama H, Tsuda E, Ohuchi H, Yamada O, Shiraishi I. Chronological Changes in Stenosis of Translocated Coronary Arteries on Angiography after the Arterial Switch Operation in Children with Transposition of the Great Arteries: Comparison of Myocardial Scintigraphy and Angiographic Findings. Cardiol Young . 2016;26(4):638–643. doi: 10.1017/S104795111500075X. [DOI] [PubMed] [Google Scholar]
- 221.Bernsen MLE, Koppes JCC, Straver B, Verberne HJ. Left Ventricular Ischemia after Arterial Switch Procedure: Role of Myocardial Perfusion Scintigraphy and Cardiac CT. J Nucl Cardiol . 2020;27(2):651–658. doi: 10.1007/s12350-019-01738-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 222.Kumar K, Sharma A, Patel C, Ramakrsihnan S, Das S, Sangdup T, et al. Feasibility and Utility of Adenosine Stress Echocardiography in Children Following Post-Arterial Switch Operation: A Comparison with Technetium 99m-Sestamibi Myocardial Perfusion SPECT (MPS) Pediatr Cardiol . 2021;42(4):891–897. doi: 10.1007/s00246-021-02557-6. [DOI] [PubMed] [Google Scholar]
- 223.Ziolkowska L, Boruc A, Sobielarska-Lysiak D, Grzyb A, Petryka-Mazurkiewicz J, Mazurkiewicz Ł, et al. Prognostic Significance of Myocardial Ischemia Detected by Single-Photon Emission Computed Tomography in Children with Hypertrophic Cardiomyopathy. Pediatr Cardiol . 2021;42(4):960–968. doi: 10.1007/s00246-021-02570-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 224.Maiers J, Hurwitz R. Identification of Coronary Artery Disease in the Pediatric Cardiac Transplant Patient. Pediatr Cardiol . 2008;29(1):19–23. doi: 10.1007/s00246-007-9038-6. [DOI] [PubMed] [Google Scholar]
- 225.Sundaram PS, Padma S. Role of Myocardial Perfusion Single Photon Emission Computed Tomography in Pediatric Cardiology Practice. Ann Pediatr Cardiol . 2009;2(2):127–139. doi: 10.4103/0974-2069.58314. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 226.Priyadarshini A, Saxena A, Patel C, Paul VK, Lodha R, Airan B. Myocardial Perfusion Abnormalities in Patients Occurring More than 1 Year After Successful Univentricular (Fontan Surgery) and Biventricular Repair (Complete Repair of Tetralogy of Fallot) Pediatr Cardiol . 2013;34(4):786–794. doi: 10.1007/s00246-012-0531-1. [DOI] [PubMed] [Google Scholar]
- 227.Goo HW. Anomalous Origin of the Coronary Artery from the Pulmonary Artery in Children and Adults: A Pictorial Review of Cardiac Imaging Findings. Korean J Radiol . 2021;22(9):1441–1450. doi: 10.3348/kjr.2021.0034. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 228.Chen ML, Lo HS, Chao IM, Su HY. Dipyridamole Tl-201 Myocardial Single Photon Emission Computed Tomography in the Functional Assessment of Anomalous Left Coronary Artery from the Pulmonary Artery. Clin Nucl Med . 2007;32(12):940–943. doi: 10.1097/RLU.0b013e3181597668. [DOI] [PubMed] [Google Scholar]
- 229.Cifra B, Dragulescu A, Border WL, Mertens L. Stress Echocardiography in Paediatric Cardiology. Eur Heart J Cardiovasc Imaging . 2015;16(10):1051–1059. doi: 10.1093/ehjci/jev159. [DOI] [PubMed] [Google Scholar]
- 230.Araujo JJ. Stress Echocardiography in Pediatric and Adult Congenital Heart Disease: A Complement in Anatomical and Functional Assessment. Curr Probl Cardiol . 2021;46(3):100762–100762. doi: 10.1016/j.cpcardiol.2020.100762. [DOI] [PubMed] [Google Scholar]
- 231.Dasgupta S, Friedman H, Allen N, Stark M, Ferguson E, Sachdeva R, et al. Exercise stress Echocardiography: Impact on Clinical Decision-Making in Pediatric Patients. Echocardiography . 2019;36(5):938–943. doi: 10.1111/echo.14326. [DOI] [PubMed] [Google Scholar]
- 232.Mcleod G, Shum K, Gupta T, Chakravorty S, Kachur S, Bienvenu L, et al. Echocardiography in Congenital Heart Disease. Prog Cardiovasc Dis . 2018;61(5):468–475. doi: 10.1016/j.pcad.2018.11.004. [DOI] [PubMed] [Google Scholar]
- 233.Li VW, So EK, Wong WH, Cheung YF. Myocardial Deformation Imaging by Speckle-Tracking Echocardiography for Assessment of Cardiotoxicity in Children During and after Chemotherapy: A Systematic Review and Meta-Analysis. J Am Soc Echocardiogr . 2022;35(6):629–656. doi: 10.1016/j.echo.2022.01.017. [DOI] [PubMed] [Google Scholar]
- 234.Pellikka PA, Arruda-Olson A, Chaudhry FA, Chen MH, Marshall JE, Porter TR, et al. Guidelines for Performance, Interpretation, and Application of Stress Echocardiography in Ischemic Heart Disease: From the American Society of Echocardiography. J Am Soc Echocardiogr . 2020;33(1):1.e8–41.e8. doi: 10.1016/j.echo.2019.07.001. [DOI] [PubMed] [Google Scholar]
- 235.Morhy SS, Barberato SH, Lianza AC, Soares AM, Leal GN, Rivera IR, et al. Position Statement on Indications for Echocardiography in Fetal and Pediatric Cardiology and Congenital Heart Disease of the Adult - 2020. Arq Bras Cardiol . 2020;115(5):987–1005. doi: 10.36660/abc.20201122. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 236.Dedieu N, Greil G, Wong J, Fenton M, Burch M, Hussain T. Diagnosis and Management of Coronary Allograft Vasculopathy in Children and Adolescents. World J Transplant . 2014;4(4):276–293. doi: 10.5500/wjt.v4.i4.276. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 237.Yeung JP, Human DG, Sandor GG, de Souza AM, Potts JE. Serial Measurements of Exercise Performance in Pediatric Heart Transplant Patients Using Stress Echocardiography. Pediatr Transplant . 2011;15(3):265–271. doi: 10.1111/j.1399-3046.2010.01467.x. [DOI] [PubMed] [Google Scholar]
- 238.Cifra B, Dragulescu A, Brun H, Slorach C, Friedberg MK, Manlhiot C, et al. Left Ventricular Myocardial Response to Exercise in Children After Heart Transplant. J Heart Lung Transplant . 2014;33(12):1241–1247. doi: 10.1016/j.healun.2014.07.011. [DOI] [PubMed] [Google Scholar]
- 239.Noto N, Kamiyama H, Karasawa K, Ayusawa M, Sumitomo N, Okada T, et al. Long-Term Prognostic Impact of Dobutamine Stress Echocardiography in Patients with Kawasaki Disease and Coronary Artery Lesions: A 15-Year Follow-Up Study. J Am Coll Cardiol . 2014;63(4):337–344. doi: 10.1016/j.jacc.2013.09.021. [DOI] [PubMed] [Google Scholar]
- 240.Tedla BA, Burns JC, Tremoulet AH, Shimizu C, Gordon JB, El-Said H, et al. Exercise Stress Echocardiography in Kawasaki Disease Patients with Coronary Aneurysms. Pediatr Cardiol . 2023;44(2):381–387. doi: 10.1007/s00246-022-03037-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 241.Thompson WR. Stress Echocardiography in Paediatrics: Implications for the Evaluation of Anomalous Aortic Origin of the Coronary Arteries. Cardiol Young . 2015;25(8):1524–1530. doi: 10.1017/S1047951115002012. [DOI] [PubMed] [Google Scholar]
- 242.Binka E, Zhao N, Wood S, Zimmerman SL, Thompson WR. Exercise-Induced Abnormalities of Regional Myocardial Deformation in Anomalous Aortic Origin of the Right Coronary Artery. World J Pediatr Congenit Heart Surg . 2020;11(6):712–719. doi: 10.1177/2150135120947689. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 243.Moscatelli S, Bianco F, Cimini A, Panebianco M, Leo I, Bucciarelli-Ducci C, et al. The Use of Stress Cardiovascular Imaging in Pediatric Population. Children . 2023;10(2):218–218. doi: 10.3390/children10020218. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 244.von Scheidt F, Pleyer C, Kiesler V, Bride P, Bartholomae S, Krämer J, et al. Left Ventricular Strain Analysis During Submaximal Semisupine Bicycle Exercise Stress Echocardiography in Childhood Cancer Survivors. J Am Heart Assoc . 2022;11(14):e025324. doi: 10.1161/JAHA.122.025324. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 245.Novo G, Santoro C, Manno G, Di Lisi D, Esposito R, Mandoli GE, et al. Usefulness of Stress Echocardiography in the Management of Patients Treated with Anticancer Drugs. J Am Soc Echocardiogr . 2021;34(2):107–116. doi: 10.1016/j.echo.2020.10.002. [DOI] [PubMed] [Google Scholar]
- 246.Perez MT, Rizwan R, Gauvreau K, Daly KP, Deng ES, Blume ED, et al. Prognostic Value of Exercise Stress Echocardiography in Pediatric Cardiac Transplant Recipients. J Am Soc Echocardiogr . 2022;35(11):1133.e2–1138.e2. doi: 10.1016/j.echo.2022.07.006. [DOI] [PubMed] [Google Scholar]
- 247.Wang Z, Yang Y, Li Z, Zhang X, Lin J, Wang L. Analysis of Coronary Flow Haemodynamics in Homozygous Familial Hypercholesterolaemic Adolescents with aortic Supravalvular Stenosis. Cardiol Young . 2013;23(2):219–224. doi: 10.1017/S1047951112000704. [DOI] [PubMed] [Google Scholar]
- 248.Hensel KO, Grimmer F, Roskopf M, Jenke AC, Wirth S, Heusch A. Subclinical Alterations of Cardiac Mechanics Present Early in the Course of Pediatric Type 1 Diabetes Mellitus: A Prospective Blinded Speckle Tracking Stress Echocardiography Study. J Diabetes Res . 2016;2016:2583747–2583747. doi: 10.1155/2016/2583747. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 249.Kimball TR. Pediatric Stress Echocardiography. Pediatr Cardiol . 2002;23(3):347–357. doi: 10.1007/s00246-001-0198-5. [DOI] [PubMed] [Google Scholar]
- 250.Gaitonde M, Jones S, McCracken C, Ferguson ME, Michelfelder E, Sachdeva R, et al. Evaluation of Left Ventricular Outflow Gradients During Staged Exercise Stress Echocardiography Helps Differentiate Pediatric Patients with Hypertrophic Cardiomyopathy from Athletes and Normal Subjects. Pediatr Exerc Sci . 2021;33(4):196–202. doi: 10.1123/pes.2020-0217. [DOI] [PubMed] [Google Scholar]
- 251.El Assaad I, Gauvreau K, Rizwan R, Margossian R, Colan S, Chen MH. Value of Exercise Stress Echocardiography in Children with Hypertrophic Cardiomyopathy. J Am Soc Echocardiogr . 2020;33(7):888–894. doi: 10.1016/j.echo.2020.01.020. [DOI] [PubMed] [Google Scholar]
- 252.Bhatt SM, Wang Y, Elci OU, Goldmuntz E, McBride M, Paridon S, et al. Right Ventricular Contractile Reserve Is Impaired in Children and Adolescents with Repaired Tetralogy of Fallot: An Exercise Strain Imaging Study. J Am Soc Echocardiogr . 2019;32(1):135–144. doi: 10.1016/j.echo.2018.08.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 253.Roche SL, Grosse-Wortmann L, Friedberg MK, Redington AN, Stephens D, Kantor PF. Exercise Echocardiography Demonstrates Biventricular Systolic Dysfunction and Reveals Decreased Left Ventricular Contractile Reserve in Children after Tetralogy of Fallot Repair. J Am Soc Echocardiogr . 2015;28(3):294–301. doi: 10.1016/j.echo.2014.10.008. [DOI] [PubMed] [Google Scholar]
- 254.Alpert BS, Verrill DE, Flood NL, Boineau JP, Strong WB. Complications of Ergometer Exercise in Children. Pediatr Cardiol . 1983;4(2):91–96. doi: 10.1007/BF02076332. [DOI] [PubMed] [Google Scholar]
- 255.Bricker JT, Traweek MS, Smith RT, Moak JP, Vargo TA, Garson A., Jr Exercise-Related Ventricular Tachycardia in Children. Am Heart J . 1986;112(1):186–188. doi: 10.1016/0002-8703(86)90704-0. [DOI] [PubMed] [Google Scholar]
- 256.Nagashima M, Baba R, Goto M, Nishabata K, Nagano Y. Exercise-Induced Ventricular Tachycardia without Demonstrable Heart Disease in Childhood. Acta Paediatr Jpn . 1996;38(5):495–499. doi: 10.1111/j.1442-200x.1996.tb03533.x. [DOI] [PubMed] [Google Scholar]
- 257.Garson A, Jr, Gillette PC, Gutgesell HP, McNamara DG. Stress-Induced Ventricular Arrhythmia after Repair of Tetralogy of Fallot. Am J Cardiol . 1980;46(6):1006–1012. doi: 10.1016/0002-9149(80)90359-8. [DOI] [PubMed] [Google Scholar]
- 258.Sequeira IB, Kirsh JA, Hamilton RM, Russell JL, Gross GJ. Utility of Exercise Testing in Children and Teenagers with Arrhythmogenic Right Ventricular Cardiomyopathy. Am J Cardiol . 2009;104(3):411–413. doi: 10.1016/j.amjcard.2009.03.056. [DOI] [PubMed] [Google Scholar]
- 259.Fujino M, Miyazaki A, Furukawa O, Somura J, Yoshida Y, Hayama Y, et al. Electrocardiographic Features of Arrhythmogenic Right Ventricular Cardiomyopathy in School-Aged Children. Heart Vessels . 2021;36(6):863–873. doi: 10.1007/s00380-020-01754-2. [DOI] [PubMed] [Google Scholar]
- 260.Radtke T, Crook S, Kaltsakas G, Louvaris Z, Berton D, Urquhart DS, et al. ERS Statement on Standardisation of Cardiopulmonary Exercise Testing in Chronic Lung Diseases. Eur Respir Rev . 2019;28(154):180101–180101. doi: 10.1183/16000617.0101-2018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 261.Min JK, Gilmore A, Jones EC, Berman DS, Stuijfzand WJ, Shaw LJ, et al. Cost-Effectiveness of Diagnostic Evaluation Strategies for Individuals with Stable Chest Pain Syndrome and Suspected Coronary Artery Disease. Clin Imaging . 2017;43:97–105. doi: 10.1016/j.clinimag.2017.01.015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 262.Carmo PBD, Magliano CADS, Rey HCV, Camargo GC, Trocado LFL, Gottlieb I. Cost-Effectiveness Analysis of CCTA in SUS, as Compared to Other Non-Invasive Imaging Modalities in Suspected Obstructive CAD. Arq Bras Cardiol . 2022;118(3):578–585. doi: 10.36660/abc.20201050. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 263.Banerjee A, Newman DR, van den Bruel A, Heneghan C. Diagnostic Accuracy of Exercise Stress Testing for Coronary Artery Disease: A Systematic Review and Meta-Analysis of Prospective Studies. Int J Clin Pract . 2012;66(5):477–492. doi: 10.1111/j.1742-1241.2012.02900.x. [DOI] [PubMed] [Google Scholar]
- 264.Fletcher GF, Ades PA, Kligfield P, Arena R, Balady GJ, Bittner VA, et al. Exercise Standards for Testing and Training: A Scientific Statement from the American Heart Association. Circulation . 2013;128(8):873–934. doi: 10.1161/CIR.0b013e31829b5b44. [DOI] [PubMed] [Google Scholar]
- 265.Conselho Federal de Medicina . Diário Oficial da União . Brasília: Sep 18, 2017. Resolução CFM no 2.153/2016. Altera o anexo da resolução CFM n.2056/2013 e dispõe a nova redação do manual de vistoria de fiscalização da medicina no Brasil. [Google Scholar]
- 266.Bernoche C, Timerman S, Polastri TF, Giannetti NS, Siqueira AWDS, Piscopo A, et al. Atualização da Diretriz de Ressuscitação Cardiopulmonar e Cuidados Cardiovasculares de Emergência da Sociedade Brasileira de Cardiologia - 2019. Arq Bras Cardiol . 2019;113(3):449–663. doi: 10.5935/abc.20190203. [DOI] [PubMed] [Google Scholar]
- 267.Merchant RM, Topjian AA, Panchal AR, Cheng A, Aziz K, Berg KM, et al. Part 1: Executive Summary: 2020 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation . 2020;142(16 suppl 2):S337–S357. doi: 10.1161/CIR.0000000000000918. [DOI] [PubMed] [Google Scholar]
- 268.Guimarães HP, Timerman S, Rodrigues RDR, Corrêa TD, Schubert DUC, Freitas AP, et al. Position Statement: Cardiopulmonary Resuscitation of Patients with Confirmed or Suspected COVID-19 - 2020. Arq Bras Cardiol . 2020;114(6):1078–1087. doi: 10.36660/abc.20200548. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 269.Brasil . Diário Oficial da União . Brasília: Sep 20, 1990. Lei no 8.080, de 19 de setembro de 1990. Dispõe sobre as condições para a promoção, proteção e recuperação da saúde, a organização e o funcionamento dos serviços correspondentes e dá outras providências. [Google Scholar]
- 270.Grossman GB, Sellera CAC, Hossri CAC, Carreira LTF, Avanza AC, Jr, Albuquerque PF, et al. Position Statement of the Brazilian Society of Cardiology Department of Exercise Testing, Sports Exercise, Nuclear Cardiology, and Cardiovascular Rehabilitation (DERC/SBC) on Activities Within its Scope of Practice During the COVID-19 Pandemic. Arq Bras Cardiol . 2020;115(2):284–291. doi: 10.36660/abc.20200797. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 271.Bittencourt MS, Generoso G, Melo PHMC, Peixoto D, Miranda ÉJFP, Mesquita ET, et al. Statement - Protocol for the Reconnection of Cardiology Services with Patients During the COVID-19 Pandemic - 2020. Arq Bras Cardiol . 2020;115(4):776–799. doi: 10.36660/abc.20201004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 272.Conselho Federal de Medicina . Diário Oficial da União . Brasília: Nov 23, 2007. Resolução CFM no 1.821/2007. Aprova as normas técnicas concernentes à digitalização e uso dos sistemas informatizados para a guarda e manuseio dos documentos dos prontuários dos pacientes, autorizando a eliminação do papel e a troca de informação identificada em saúde. [Google Scholar]
- 273.Brasil . Diário Oficial da União . Brasília: Dec 28, 2018. Lei n ° 13.787, de 27 de dezembro de 2018. Dispõe sobre a digitalização e a utilização de sistemas informatizados para a guarda, o armazenamento e o manuseio de prontuário de paciente. [Google Scholar]
- 274.Brasil . Diário Oficial da União . Brasília: Aug 15, 2018. Lei n ° 13.709, de 14 de agosto de 2018. Lei Geral de Proteção de Dados Pessoais (LGPD) [Google Scholar]
- 275.Conselho Federal de Medicina . Recomendação CFM No 1/2016. Dispõe sobre o processo de obtenção de consentimento livre e esclarecido na assistência médica . Brasília: Conselho Federal de Medicina; Jan 21, 2016. [Google Scholar]
- 276.Sousa MR, Mourilhe-Rocha R, Paola AA, Köhler I, Feitosa GS, Schneider JC, et al. 1st Guidelines of the Brazilian Society of Cardiology on Processes and Skills for Education in Cardiology in Brazil--Executive Summary. Arq Bras Cardiol . 2012;98(2):98–103. doi: 10.1590/S0066-782X2012000200001. [DOI] [PubMed] [Google Scholar]
- 277.Rodgers GP, Ayanian JZ, Balady G, Beasley JW, Brown KA, Gervino EV, et al. American College of Cardiology/American Heart Association Clinical Competence Statement on Stress Testing: A Report of the American College of Cardiology/American Heart Association/American College of Physicians-American Society of Internal Medicine Task Force on Clinical Competence. J Am Coll Cardiol . 2000;36(4):1441–1453. doi: 10.1016/s0735-1097(00)01029-9. [DOI] [PubMed] [Google Scholar]
- 278.Serra S, Leão R. Teste Ergométrico, Teste Cardiopulmonar de Exercício, Cardiologia Nuclear, Reabilitação Cardiopulmonar e Metabólica e Cardiologia do Esporte e do Exercício . Rio de Janeiro: Guanabara Koogan; 2019. ISBN-10: 8535293493; ISBN-13: 978-8535293494. [Google Scholar]
- 279.Thomas GS, Wann LS, Ellestad MH, editors. Ellestad's Stress Testing: Principles and Practice . 6th ed. New York: Oxford University Press; 2018. ISBN-13: 9780190225483. [Google Scholar]
- 280.Froelicher VF, Myers J. Manual of Exercise Testing . Philadelphia: Mosby; 2007. ISBN-10: 0815133642; ISBN-13: 9780815133643. [Google Scholar]
- 281.Ikäheimo TM. Cardiovascular Diseases, Cold Exposure and Exercise. Temperature . 2018;5(2):123–146. doi: 10.1080/23328940.2017.1414014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 282.No M, Kwak HB. Effects of Environmental Temperature on Physiological Responses During Submaximal and Maximal Exercises in Soccer Players. Integr Med Res . 2016;5(3):216–222. doi: 10.1016/j.imr.2016.06.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 283.Valtonen RIP, Kiviniemi A, Hintsala HE, Ryti NRI, Kenttä T, Huikuri HV, et al. Cardiovascular Responses to Cold and Submaximal Exercise in Patients with Coronary Artery Disease. Am J Physiol Regul Integr Comp Physiol . 2018;315(4):R768–R776. doi: 10.1152/ajpregu.00069.2018. [DOI] [PubMed] [Google Scholar]
- 284.Zhao J, Lorenzo S, An N, Feng W, Lai L, Cui S. Effects of Heat and Different Humidity Levels on Aerobic and Anaerobic Exercise Performance in Athletes. J Exerc Sci Fit . 2013;11(1):35–41. doi: 10.1016/j.jesf.2013.04.002. [DOI] [Google Scholar]
- 285.Marcadet DM, Pavy B, Bosser G, Claudot F, Corone S, Douard H, et al. French Society of Cardiology Guidelines on Exercise Tests (Part 1): Methods and Interpretation. Arch Cardiovasc Dis . 2018;111(12):782–790. doi: 10.1016/j.acvd.2018.05.005. [DOI] [PubMed] [Google Scholar]
- 286.Wasserman K, editor. Principles of Exercise Testing and Interpretation: Including PATHOPHYSIOLOGY and Clinical Applications . 5th ed. Philadelphia: Wolters Kluwer; 2012. ISBN-10: 1609138996; ISBN-13: 9781609138998. [Google Scholar]
- 287.Sociedade Brasileira de Pediatria . Departamento Científico de Nefrologia. Manual de Orientação. Hipertensão arterial na infância e adolescência . 2. São Paulo: Sociedade Brasileira de Pediatria; Apr, 2019. Disponível em: https://www.sbp.com.br/fileadmin/user_upload/21635c-MO_-_Hipertensao_Arterial_Infanc_e_Adolesc.pdf . [Google Scholar]
- 288.Crapo RO, Casaburi R, Coates AL, Enright PL, Hankinson JL, Irvin CG, et al. Guidelines for Methacholine and Exercise Challenge Testing-1999. This Official Statement of the American Thoracic Society was Adopted by the ATS Board of Directors, July 1999. Am J Respir Crit Care Med . 2000;161(1):309–329. doi: 10.1164/ajrccm.161.1.ats11-99. [DOI] [PubMed] [Google Scholar]
- 289.Hebestreit H. Exercise Testing in Children - What Works, what doesn‘t, and Where to Go? Paediatr Respir Rev . 2004;(5 Suppl A):S11–S14. doi: 10.1016/s1526-0542(04)90002-4. [DOI] [PubMed] [Google Scholar]
- 290.Chang RR, Gurvitz M, Rodriguez S, Hong E, Klitzner TS. Current Practice of Exercise Stress Testing among Pediatric Cardiology and Pulmonology Centers in the United States. Pediatr Cardiol . 2006;27(1):110–116. doi: 10.1007/s00246-005-1046-9. [DOI] [PubMed] [Google Scholar]
- 291.Turley KR, Wilmore JH. Cardiovascular Responses to Treadmill and Cycle Ergometer Exercise in Children and Adults. J Appl Physiol . 1997;83(3):948–957. doi: 10.1152/jappl.1997.83.3.948. [DOI] [PubMed] [Google Scholar]
- 292.Forbregd TR, Aloyseus MA, Berg A, Greve G. Cardiopulmonary Capacity in Children During Exercise Testing: The Differences Between Treadmill and Upright and Supine Cycle Ergometry. Front Physiol . 2019;10:1440–1440. doi: 10.3389/fphys.2019.01440. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 293.Bar-Yoseph R, Porszasz J, Radom-Aizik S, Stehli A, Law P, Cooper DM. The Effect of Test Modality on Dynamic Exercise Biomarkers in Children, Adolescents, and Young Adults. Physiol Rep . 2019;7(14):e14178. doi: 10.14814/phy2.14178. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 294.Oliveira A, Jácome C, Marques A. Physical Fitness and Exercise Training on Individuals with Spina Bifida: A Systematic Review. Res Dev Disabil . 2014;35(5):1119–1136. doi: 10.1016/j.ridd.2014.02.002. [DOI] [PubMed] [Google Scholar]
- 295.Widman LM, Abresch RT, Styne DM, McDonald CM. Aerobic Fitness and Upper Extremity Strength in Patients Aged 11 to 21 Years with Spinal Cord Dysfunction as Compared to Ideal Weight and Overweight Controls. J Spinal Cord Med . 2007;(Suppl 1):S88–S96. doi: 10.1080/10790268.2007.11754611. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 296.Kouwijzer I, Valize M, Valent LJM, Comtesse PGP, van der Woude LHV, Groot S. The Influence of Protocol Design on the Identification of Ventilatory Thresholds and the Attainment of Peak Physiological Responses During Synchronous Arm Crank Ergometry in Able-Bodied Participants. Eur J Appl Physiol . 2019;119(10):2275–2286. doi: 10.1007/s00421-019-04211-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 297.Tanner CS, Heise CT, Barber G. Correlation of the Physiologic Parameters of a Continuous Ramp versus an Incremental James Exercise Protocol in Normal Children. Am J Cardiol . 1991;67(4):309–312. doi: 10.1016/0002-9149(91)90566-4. [DOI] [PubMed] [Google Scholar]
- 298.Octavio JM, Folk AL, Falini L, Xie S, Goudie BW, Gidding SS, et al. Standardization of a Continuous Ramp Ergometer Protocol for Clinical Exercise Testing in Children. Pediatr Cardiol . 2019;40(4):834–840. doi: 10.1007/s00246-019-02079-2. [DOI] [PubMed] [Google Scholar]
- 299.Kalski L, Wannack M, Wiegand S, Wolfarth B. Comparison of Two Methods of Cardiopulmonary Exercise Testing for Assessing Physical Fitness in Children and Adolescents with Extreme Obesity. Eur J Pediatr . 2022;181(6):2389–2397. doi: 10.1007/s00431-022-04434-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 300.Rowland TW, Tighe DA. In: Pocket Guide Stress Test . Second edition. Tighe DA, Gentile BA, Chung EK, editors. Hoboken, New York: Wiley; 2020. Pediatric Exercise Testing; pp. 281–299. ISBN: 9781119481751. [Google Scholar]
- 301.James FW, Kaplan S, Glueck CJ, Tsay JY, Knight MJ, Sarwar CJ. Responses of Normal Children and Young Adults to Controlled Bicycle Exercise. Circulation . 1980;61(5):902–912. doi: 10.1161/01.cir.61.5.902. [DOI] [PubMed] [Google Scholar]
- 302.Washington RL, van Gundy JC, Cohen C, Sondheimer HM, Wolfe RR. Normal Aerobic and Anaerobic Exercise Data for North American School-Age Children. J Pediatr . 1988;112(2):223–233. doi: 10.1016/s0022-3476(88)80059-3. [DOI] [PubMed] [Google Scholar]
- 303.Godfrey S. Exercise Testing in Children: Applications in Health and Disease . Philadelphia: Saunders; 1974. ISBN-10: 0721641423; ISBN-13: 9780721641423. [Google Scholar]
- 304.Godfrey S, Davies CT, Wozniak E, Barnes CA. Cardio-Respiratory Response to Exercise in Normal Children. Clin Sci . 1971;40(5):419–431. doi: 10.1042/cs0400419. [DOI] [PubMed] [Google Scholar]
- 305.Burstein DS, McBride MG, Min J, Paridon AA, Perelman S, Huffman EM, et al. Normative Values for Cardiopulmonary Exercise Stress Testing Using Ramp Cycle Ergometry in Children and Adolescents. J Pediatr . 2021;229:61–69. doi: 10.1016/j.jpeds.2020.09.018. [DOI] [PubMed] [Google Scholar]
- 306.Marinov B, Kostianev S, Turnovska T. Modified Treadmill Protocol for Evaluation of Physical Fitness in Pediatric Age Group-Comparison with Bruce and Balke Protocols. Acta Physiol Pharmacol Bulg . 2003;27(2-3):47–51. [PubMed] [Google Scholar]
- 307.Patterson JA, Naughton J, Pietras RJ, Gunnar RM. Treadmill Exercise in Assessment of the Functional Capacity of Patients with Cardiac Disease. Am J Cardiol . 1972;30(7):757–762. doi: 10.1016/0002-9149(72)90151-8. [DOI] [PubMed] [Google Scholar]
- 308.Samesima N, God EG, Kruse JCL, Leal MG, Pinho C, França FFAC, et al. Brazilian Society of Cardiology Guidelines on the Analysis and Issuance of Electrocardiographic Reports - 2022. Arq Bras Cardiol . 2022;119(4):638–680. doi: 10.36660/abc.20220623. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 309.Pedroni AS, Schiavo A, Macedo E, Campos NE, Winck AD, Heinzmann-Filho JP. Predictive Maximal Heart Rate Equations in Child and Adolescent Athletes: A Systematic Review. Fisioter Em Mov . 2018;31(1):1–9. doi: 10.1590/1980-5918.031.ao31. [DOI] [Google Scholar]
- 310.Gelbart M, Ziv-Baran T, Williams CA, Yarom Y, Dubnov-Raz G. Prediction of Maximal Heart Rate in Children and Adolescents. Clin J Sport Med . 2017;27(2):139–144. doi: 10.1097/JSM.0000000000000315. [DOI] [PubMed] [Google Scholar]
- 311.Cicone ZS, Holmes CJ, Fedewa MV, MacDonald HV, Esco MR. Age-Based Prediction of Maximal Heart Rate in Children and Adolescents: A Systematic Review and Meta-Analysis. Res Q Exerc Sport . 2019;90(3):417–428. doi: 10.1080/02701367.2019.1615605. [DOI] [PubMed] [Google Scholar]
- 312.Mahon AD, Marjerrison AD, Lee JD, Woodruff ME, Hanna LE. Evaluating the Prediction of Maximal Heart Rate in Children and Adolescents. Res Q Exerc Sport . 2010;81(4):466–471. doi: 10.1080/02701367.2010.10599707. [DOI] [PubMed] [Google Scholar]
- 313.Machado FA, Denadai BS. Validity of Maximum Heart Rate Prediction Equations for Children and Adolescents. Arq Bras Cardiol . 2011;97(2):136–140. doi: 10.1590/s0066-782x2011005000078. [DOI] [PubMed] [Google Scholar]
- 314.Caputo EL, Silva MC, Rombaldi A. Comparação da Frequência Cardíaca Máxima Obtida por Diferentes Métodos. Rev Educ FísicaUEM . 2012;23(2):277–284. doi: 10.4025/reveducfis.v23i2.12311. [DOI] [Google Scholar]
- 315.Nikolaidis PT. Maximal Heart Rate in Soccer Players: Measured versus Age-Predicted. Biomed J . 2015;38(1):84–89. doi: 10.4103/2319-4170.131397. [DOI] [PubMed] [Google Scholar]
- 316.Nikolaidis PT. Age-Predicted vs. Measured Maximal Heart Rate in Young Team Sport Athletes. Niger Med J . 2014;55(4):314–320. doi: 10.4103/0300-1652.137192. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 317.Muntner P, Shimbo D, Carey RM, Charleston JB, Gaillard T, Misra S, et al. Measurement of Blood Pressure in Humans: A Scientific Statement from the American Heart Association. Hypertension . 2019;73(5):e35–e66. doi: 10.1161/HYP.0000000000000087. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 318.Flynn JT, Urbina EM, Brady TM, Baker-Smith C, Daniels SR, Hayman LL, Mitsnefes M, Tran A, Zachariah JP, Atherosclerosis, Hypertension, and Obesity in the Young Committee of the American Heart Association Council on Lifelong Congenital Heart Disease and Heart Health in the Young; Council on Cardiovascular Radiology and Intervention; Council on Epidemiology and Prevention; Council on Hypertension; and Council on Lifestyle and Cardiometabolic Health Ambulatory Blood Pressure Monitoring in Children and Adolescents: 2022 Update: A Scientific Statement From the American Heart Association. Hypertension . 2022 Jul;79(7):e114–e124. doi: 10.1161/HYP.0000000000000215. [DOI] [PubMed] [Google Scholar]
- 319.Feitosa ADM, Barroso WKS, Mion D, Junior, Nobre F, Mota-Gomes MA, Jardim PCB, et al. Brazilian Guidelines for In-Office and Out-of-Office Blood Pressure Measurement – 2023. Arq Bras Cardiol . 2024;121(4):e20240113. doi: 10.36660/abc.20240113i. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 320.Gersak G, Zemva A, Drnovsek J. A Procedure For Evaluation of Non-Invasive Blood Pressure Simulators. Med Biol Eng Comput . 2009;47(12):1221–1228. doi: 10.1007/s11517-009-0532-2. [DOI] [PubMed] [Google Scholar]
- 321.Nerenberg KA, Zarnke KB, Leung AA, Dasgupta K, Butalia S, McBrien K, et al. Hypertension Canada‘s 2018 Guidelines for Diagnosis, Risk Assessment, Prevention, and Treatment of Hypertension in Adults and Children. Can J Cardiol . 2018;34(5):506–525. doi: 10.1016/j.cjca.2018.02.022. [DOI] [PubMed] [Google Scholar]
- 322.Barroso WKS, Rodrigues CIS, Bortolotto LA, Mota-Gomes MA, Brandão AA, Feitosa ADM, et al. Brazilian Guidelines of Hypertension - 2020. Arq Bras Cardiol . 2021;116(3):516–658. doi: 10.36660/abc.20201238. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 323.Mion D, Pierin AM. How Accurate are Sphygmomanometers? J Hum Hypertens . 1998;12(4):245–248. doi: 10.1038/sj.jhh.1000589. [DOI] [PubMed] [Google Scholar]
- 324.Friedemann C, Heneghan C, Mahtani K, Thompson M, Perera R, Ward AM. Cardiovascular Disease Risk in Healthy Children and Its Association with Body Mass Index: Systematic Review and Meta-Analysis. BMJ . 2012;345:e4759. doi: 10.1136/bmj.e4759. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 325.Medeiros PBS, Salomão RG, Teixeira SR, Rassi DM, Rodrigues L, Aragon DC, et al. Disease Activity Index is Associated with Subclinical Atherosclerosis in Childhood-Onset Systemic Lupus Erythematosus. Pediatr Rheumatol Online J . 2021;19(1):35–35. doi: 10.1186/s12969-021-00513-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 326.Berger JH, Faerber JA, Chen F, Lin KY, Brothers JA, O‘Byrne ML. Adherence with Lipid Screening Guidelines in Children with Acquired and Congenital Heart Disease: An Observational Study Using Data from the MarketScan Commercial and Medicaid Databases. J Am Heart Assoc . 2022;11(7):e024197. doi: 10.1161/JAHA.121.024197. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 327.Stavnsbo M, Skrede T, Aadland E, Aadland KN, Chinapaw M, Anderssen SA, et al. Cardiometabolic Risk Factor Levels in Norwegian Children Compared to International Reference Values: The ASK Study. PLoS One . 2019;14(8):e0220239. doi: 10.1371/journal.pone.0220239. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 328.Welser L, Lima RA, Silveira JF, Andersen LB, Pfeiffer KA, Renner JDP, et al. Cardiometabolic Risk Factors in Children and Adolescents from Southern Brazil: Comparison to International Reference Values. J Pediatr Endocrinol Metab . 2021;34(10):1237–1246. doi: 10.1515/jpem-2021-0023. [DOI] [PubMed] [Google Scholar]
- 329.Reuter CP, Renner JDP, Silveira JFC, Silva PT, Lima RA, Pfeiffer KA, et al. Clustering of Cardiometabolic Risk Factors and the Continuous Cardiometabolic Risk Score in Children from Southern Brazil: A Cross-Sectional Study. J Diabetes Metab Disord . 2021;20(2):1221–1228. doi: 10.1007/s40200-021-00845-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 330.Kumar S, Stevenson WG, Tedrow UB. Bicuspid Aortic Valve Supporting Supravalvular "Substrate" for Multiple Ventricular Tachycardias. HeartRhythm Case Rep . 2017;3(3):155–158. doi: 10.1016/j.hrcr.2016.09.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 331.Videbæk J, Laursen HB, Olsen M, Høfsten DE, Johnsen SP. Long-Term Nationwide Follow-Up Study of Simple Congenital Heart Disease Diagnosed in Otherwise Healthy Children. Circulation . 2016;133(5):474–483. doi: 10.1161/CIRCULATIONAHA.115.017226. [DOI] [PubMed] [Google Scholar]
- 332.van der Ven JPG, van den Bosch E, Bogers AJCC, Helbing WA. Current Outcomes and Treatment of Tetralogy of Fallot. F1000Res . 2019;8 doi: 10.12688/f1000research.17174.1. F1000 Faculty Rev-1530. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 333.Lotfy WN, Samra NM, Al Ghwass ME, Amin SA, AboElnour SI. Repolarization Patterns in Congenital Heart Disease. Pediatr Cardiol . 2016;37(7):1235–1240. doi: 10.1007/s00246-016-1422-7. [DOI] [PubMed] [Google Scholar]
- 334.Souron R, Carayol M, Martin V, Piponnier E, Duché P, Gruet M. Differences in Time to Task Failure and Fatigability Between Children and Young Adults: A Systematic Review and Meta-Analysis. Front Physiol . 2022;13:1026012–1026012. doi: 10.3389/fphys.2022.1026012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 335.Tolusso DV, Dobbs WC, Esco MR. The Predictability of Peak Oxygen Consumption Using Submaximal Ratings of Perceived Exertion in Adolescents. Int J Exerc Sci . 2018;11(4):1173–1183. [PMC free article] [PubMed] [Google Scholar]
- 336.Martins R, Assumpção MS, Schivinski CIS. Percepção de Esforço e Dispneia em Pediatria: Revisão das Escalas de Avaliação. Med Ribeirão Preto . 2014;47(1):25–35. doi: 10.11606/issn.2176-7262.v47i1p25-35. [DOI] [Google Scholar]
- 337.Groslambert A, Mahon AD. Perceived Exertion: Influence of Age and Cognitive Development. Sports Med . 2006;36(11):911–928. doi: 10.2165/00007256-200636110-00001. [DOI] [PubMed] [Google Scholar]
- 338.Kasai D, Parfitt G, Tarca B, Eston R, Tsiros MD. The Use of Ratings of Perceived Exertion in Children and Adolescents: A Scoping Review. Sports Med . 2021;51(1):33–50. doi: 10.1007/s40279-020-01374-w. [DOI] [PubMed] [Google Scholar]
- 339.Gammon C, Pfeiffer KA, Pivarnik JM, Moore RW, Rice KR, Trost SG. Age-Related Differences in OMNI-RPE Scale Validity in Youth: A Longitudinal Analysis. Med Sci Sports Exerc . 2016;48(8):1590–1594. doi: 10.1249/MSS.0000000000000918. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 340.Robertson RJ, Goss FL, Boer N, Gallagher JD, Thompkins T, Bufalino K, et al. OMNI Scale Perceived Exertion at Ventilatory Breakpoint in Children: Response Normalized. Med Sci Sports Exerc . 2001;33(11):1946–1952. doi: 10.1097/00005768-200111000-00022. [DOI] [PubMed] [Google Scholar]
- 341.Robertson RJ, Goss FL, Aaron DJ, Utter AC, Nagle E. Omni Scale Rating of Perceived Exertion at Ventilatory Breakpoint by Direct Observation of Children‘s Kinematics. Percept Mot Skills . 2007;104(3 Pt 1):975–984. doi: 10.2466/pms.104.3.975-984. [DOI] [PubMed] [Google Scholar]
- 342.Robertson RJ, Goss FL, Aaron DJ, Tessmer KA, Gairola A, Ghigiarelli JJ, et al. Observation of Perceived Exertion in Children Using the OMNI Pictorial Scale. Med Sci Sports Exerc . 2006;38(1):158–166. doi: 10.1249/01.mss.0000190595.03402.66. [DOI] [PubMed] [Google Scholar]
- 343.Pfeiffer KA, Pivarnik JM, Womack CJ, Reeves MJ, Malina RM. Reliability and Validity of the Borg and OMNI Rating of Perceived Exertion Scales in Adolescent Girls. Med Sci Sports Exerc . 2002;34(12):2057–2061. doi: 10.1097/00005768-200212000-00029. [DOI] [PubMed] [Google Scholar]
- 344.Schmitz G. Moderators of Perceived Effort in Adolescent Rowers During a Graded Exercise Test. Int J Environ Res Public Health . 2020;17(21):8063–8063. doi: 10.3390/ijerph17218063. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 345.Groslambert A, Hintzy F, Hoffman MD, Dugué B, Rouillon JD. Validation of a Rating Scale of Perceived Exertion in Young Children. Int J Sports Med . 2001;22(2):116–119. doi: 10.1055/s-2001-11340. [DOI] [PubMed] [Google Scholar]
- 346.Williams JG, Eston R, Furlong B. CERT: A Perceived Exertion Scale for Young Children. Percept Mot Skills . 1994;79(3 Pt 2):1451–1458. doi: 10.2466/pms.1994.79.3f.1451. [DOI] [PubMed] [Google Scholar]
- 347.Roemmich JN, Barkley JE, Epstein LH, Lobarinas CL, White TM, Foster JH. Validity of PCERT and OMNI Walk/Run Ratings of Perceived Exertion. Med Sci Sports Exerc . 2006;38(5):1014–1019. doi: 10.1249/01.mss.0000218123.81079.49. [DOI] [PubMed] [Google Scholar]
- 348.Robertson RJ, Goss FL, Boer NF, Peoples JA, Foreman AJ, Dabayebeh IM, et al. Children‘s OMNI Scale of Perceived Exertion: Mixed Gender and Race Validation. Med Sci Sports Exerc . 2000;32(2):452–458. doi: 10.1097/00005768-200002000-00029. [DOI] [PubMed] [Google Scholar]
- 349.Utter AC, Robertson RJ, Nieman DC, Kang J. Children‘s OMNI Scale of Perceived Exertion: Walking/Running Evaluation. Med Sci Sports Exerc . 2002;34(1):139–144. doi: 10.1097/00005768-200201000-00021. [DOI] [PubMed] [Google Scholar]
- 350.Muyor JM. Exercise Intensity and Validity of the Ratings of Perceived Exertion (Borg and OMNI Scales) in an Indoor Cycling Session. J Hum Kinet . 2013;39:93–101. doi: 10.2478/hukin-2013-0072. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 351.Haapala EA, Gao Y, Hartikainen J, Rantalainen T, Finni T. Associations of Fitness, Motor Competence, and Adiposity with the Indicators of Physical Activity Intensity During Different Physical Activities in Children. Sci Rep . 2021;11(1):12521–12521. doi: 10.1038/s41598-021-92040-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 352.Prado DM, Braga AM, Rondon MU, Azevedo LF, Matos LD, Negrão CE, et al. Cardiorespiratory Responses During Progressive Maximal Exercise Test in Healthy Children. Arq Bras Cardiol . 2010;94(4):493–499. doi: 10.1590/s0066-782x2010005000007. [DOI] [PubMed] [Google Scholar]
- 353.Lintu N, Tompuri T, Viitasalo A, Soininen S, Laitinen T, Savonen K, et al. Cardiovascular Fitness and Haemodynamic Responses to Maximal Cycle Ergometer Exercise Test in Children 6-8 Years of Age. J Sports Sci . 2014;32(7):652–659. doi: 10.1080/02640414.2013.845681. [DOI] [PubMed] [Google Scholar]
- 354.Lintu N, Viitasalo A, Tompuri T, Veijalainen A, Hakulinen M, Laitinen T, et al. Cardiorespiratory Fitness, Respiratory Function and Hemodynamic Responses to Maximal Cycle Ergometer Exercise Test in Girls and Boys Aged 9-11 Years: The PANIC Study. Eur J Appl Physiol . 2015;115(2):235–243. doi: 10.1007/s00421-014-3013-8. [DOI] [PubMed] [Google Scholar]
- 355.Bar-Or O. Pathophysiological Factors Which Limit the Exercise Capacity of the Sick Child. Med Sci Sports Exerc . 1986;18(3):276–282. doi: 10.1249/00005768-198606000-00004. [DOI] [PubMed] [Google Scholar]
- 356.Lunt D, Briffa T, Briffa NK, Ramsay J. Physical Activity Levels of Adolescents with Congenital Heart Disease. Aust J Physiother . 2003;49(1):43–50. doi: 10.1016/s0004-9514(14)60187-2. [DOI] [PubMed] [Google Scholar]
- 357.van Deutekom AW, Lewandowski AJ. Physical Activity Modification in Youth with Congenital Heart Disease: A Comprehensive Narrative Review. Pediatr Res . 2021;89(7):1650–1658. doi: 10.1038/s41390-020-01194-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 358.Robertson RJ, Goss FL, Andreacci JL, Dubé JJ, Rutkowski JJ, Snee BM, et al. Validation of the Children's OMNI RPE Scale for Stepping Exercise. Med Sci Sports Exerc . 2005;37(2):290–298. doi: 10.1249/01.mss.0000149888.39928.9f. [DOI] [PubMed] [Google Scholar]
- 359.Hanson CL, Hokanson JS. Etiology of Chest Pain in Children and Adolescents Referred to Cardiology Clinic. WMJ . 2011;110(2):58–62. [PubMed] [Google Scholar]
- 360.Loiselle KA, Lee JL, Gilleland J, Campbell R, Simpson P, Johnson G, et al. Factors Associated with Healthcare Utilization Among Children with Noncardiac Chest Pain and Innocent Heart Murmurs. J Pediatr Psychol . 2012;37(7):817–825. doi: 10.1093/jpepsy/jss055. [DOI] [PubMed] [Google Scholar]
- 361.Otto CM, Bonow RO. Valvular Heart Disease: A Companion to Braunwald's Heart Disease . 5th ed. Philadelphia: Elsevier; 2021. ISBN-10: 0323546331; ISBN-13: 978-0323546331. [Google Scholar]
- 362.Cruz EM, Ivy D, Jaggers J. Pediatric and Congenital Cardiology, Cardiac Surgery, and Intensive Care . London: Springer Reference; 2014. ISBN-10: 3030622924; ISBN-13: 978-3030622923. [Google Scholar]
- 363.Tavel ME. The Appearance of Gallop Rhythm after Exercise Stress Testing. Clin Cardiol . 1996;19(11):887–891. doi: 10.1002/clc.4960191109. [DOI] [PubMed] [Google Scholar]
- 364.Cumming GR, Everatt D, Hastman L. Bruce Treadmill Test in Children: Normal Values in a Clinic Population. Am J Cardiol . 1978;41(1):69–75. doi: 10.1016/0002-9149(78)90134-0. [DOI] [PubMed] [Google Scholar]
- 365.Zhong LS, Guo XM, Xiao SZ, Wang D, Wu WZ. The Third Heart Sound After Exercise in Athletes: An Exploratory Study. Chin J Physiol . 2011;54(4):219–224. doi: 10.4077/CJP.2011.AMM049. [DOI] [PubMed] [Google Scholar]
- 366.Etoom Y, Ratnapalan S. Evaluation of Children with Heart Murmurs. Clin Pediatr . 2014;53(2):111–117. doi: 10.1177/0009922813488653. [DOI] [PubMed] [Google Scholar]
- 367.Nudel DB, Diamant S, Brady T, Jarenwattananon M, Buckley BJ, Gootman N. Chest Pain, Dyspnea on Exertion, and Exercise Induced Asthma in Children and Adolescents. Clin Pediatr . 1987;26(8):388–392. doi: 10.1177/000992288702600802. [DOI] [PubMed] [Google Scholar]
- 368.Balkissoon R, Kenn K. Asthma: Vocal Cord Dysfunction (VCD) and Other Dysfunctional Breathing Disorders. Semin Respir Crit Care Med . 2012;33(6):595–605. doi: 10.1055/s-0032-1326959. [DOI] [PubMed] [Google Scholar]
- 369.Dunn NM, Katial RK, Hoyte FCL. Vocal Cord Dysfunction: A Review. Asthma Res Pract . 2015;1:9–9. doi: 10.1186/s40733-015-0009-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 370.Shaddy RE, Penny DJ, Feltes TF, Cetta F, Mital S, Moss FH. Moss and Adams’ Heart Disease in Infants, Children, and Adolescents . 10th ed. Philadelphia: Lippincott Williams & Wilkins; 2022. ISBN-10: 1975116607; ISBN-13: 978-1975116606. [Google Scholar]
- 371.Marinov B, Kostianev S, Turnovska T. Ventilatory Efficiency and Rate of Perceived Exertion in Obese and Non-Obese Children Performing Standardized Exercise. Clin Physiol Funct Imaging . 2002;22(4):254–260. doi: 10.1046/j.1475-097x.2002.00427.x. [DOI] [PubMed] [Google Scholar]
- 372.Jaroszewski DE, Farina JM, Gotway MB, Stearns JD, Peterson MA, Pulivarthi VSKK, et al. Cardiopulmonary Outcomes after the Nuss Procedure in Pectus Excavatum. J Am Heart Assoc . 2022;11(7):e022149. doi: 10.1161/JAHA.121.022149. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 373.Del Frari B, Sigl S, Schwabegger AH, Blank C, Morawetz D, Gassner E, et al. Impact of Surgical Treatment of Pectus Carinatum on Cardiopulmonary Function: A Prospective Study. Eur J Cardiothorac Surg . 2021;59(2):382–388. doi: 10.1093/ejcts/ezaa335. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 374.Malek MH, Coburn JW. Strategies for Cardiopulmonary Exercise Testing of Pectus Excavatum Patients. Clinics . 2008;63(2):245–254. doi: 10.1590/s1807-59322008000200014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 375.Martínez-Llorens J, Ramírez M, Colomina MJ, Bagó J, Molina A, Cáceres E, et al. Muscle Dysfunction and Exercise Limitation in Adolescent Idiopathic Scoliosis. Eur Respir J . 2010;36(2):393–400. doi: 10.1183/09031936.00025509. [DOI] [PubMed] [Google Scholar]
- 376.Müller J, Heck PB, Ewert P, Hager A. Noninvasive Screening for Pulmonary Hypertension by Exercise Testing in Congenital Heart Disease. Ann Thorac Surg . 2017;103(5):1544–1549. doi: 10.1016/j.athoracsur.2016.09.038. [DOI] [PubMed] [Google Scholar]
- 377.Yetman AT, Taylor AL, Doran A, Ivy DD. Utility of Cardiopulmonary Stress Testing in Assessing Disease Severity in Children with Pulmonary Arterial Hypertension. Am J Cardiol . 2005;95(5):697–699. doi: 10.1016/j.amjcard.2004.10.056. [DOI] [PubMed] [Google Scholar]
- 378.Hsu DT, Canter CE. Dilated Cardiomyopathy and Heart Failure in Children. Heart Fail Clin . 2010;6(4):415–432, vii. doi: 10.1016/j.hfc.2010.05.003. [DOI] [PubMed] [Google Scholar]
- 379.Kantor PF, Lougheed J, Dancea A, McGillion M, Barbosa N, Chan C, et al. Presentation, Diagnosis, and Medical Management of Heart Failure in Children: Canadian Cardiovascular Society guidelines. Can J Cardiol . 2013;29(12):1535–1552. doi: 10.1016/j.cjca.2013.08.008. [DOI] [PubMed] [Google Scholar]
- 380.Teng LY, Tsai SW, Hsiao CY, Sung WH, Lin KL. Cardiopulmonary Function Assessment in Children with Pulmonary Valve Stenosis. Front Pediatr . 2022;9:802645–802645. doi: 10.3389/fped.2021.802645. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 381.Linglart L, Gelb BD. Congenital Heart Defects in Noonan Syndrome: Diagnosis, Management, and Treatment. Am J Med Genet C Semin Med Genet . 2020;184(1):73–80. doi: 10.1002/ajmg.c.31765. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 382.Kipps AK, McElhinney DB, Kane J, Rhodes J. Exercise Function of Children with Congenital Aortic Stenosis Following Aortic Valvuloplasty During Early Infancy. Congenit Heart Dis . 2009;4(4):258–264. doi: 10.1111/j.1747-0803.2009.00304.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 383.Yilmaz G, Ozme S, Ozer S, Tokel K, Celiker A. Evaluation by Exercise Testing of Children with Mild and Moderate Valvular Aortic Stenosis. Pediatr Int . 2000;42(1):48–52. doi: 10.1046/j.1442-200x.2000.01179.x. [DOI] [PubMed] [Google Scholar]
- 384.Issa ZF. Clinical Arrhythmology and Electrophysiology: A Companion to Baunwald's Heart Disease . 3rd ed. Philadelphia: Elsevier; 2018. ISBN-10: 0323523560; ISBN-13: 978-0323523561. [Google Scholar]
- 385.Fleming S, Thompson M, Stevens R, Heneghan C, Plüddemann A, Maconochie I, et al. Normal Ranges of Heart Rate and Respiratory Rate in Children from Birth to 18 Years of Age: A Systematic Review of Observational Studies. Lancet . 2011;377(9770):1011–1018. doi: 10.1016/S0140-6736(10)62226-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 386.Hao G, Halbert J, Su S, Bagi Z, Robinson V, Thayer J, et al. Rapid Decline of Resting Heart Rate Trajectories from Childhood to Young Adulthood is Paradoxically Associated with Increased Cardiac Mass. Acta Cardiol . 2021;76(10):1117–1123. doi: 10.1080/00015385.2020.1871262. [DOI] [PubMed] [Google Scholar]
- 387.Sarganas G, Rosario AS, Neuhauser HK. Resting Heart Rate Percentiles and Associated Factors in Children and Adolescents. J Pediatr . 2017;187:174–181. doi: 10.1016/j.jpeds.2017.05.021. [DOI] [PubMed] [Google Scholar]
- 388.Surawicz B, Knilans TK, Chou T-C. Chou's Electrocardiography in Clinical Practice: Adult and Pediatric . 6th ed. Philadelphia: Elsevier; 2008. ISBN-10: 1416037748; ISBN-13: 978-1416037743. [Google Scholar]
- 389.Park MK. Park's Pediatric Cardiology for Practitioners . 6th ed. Philadelphia: Elsevier; 2014. ISBN-10: 0323169511; ISBN-13: 978-0323169516. [Google Scholar]
- 390.Zipes DP, Jalife J, Stevenson WG, editors. Cardiac Electrophysiology: From Cell to Bedside . 7th edn. Philadelphia: Elsevier; 2018. ISBN-10: 0323447333; ISBN-13: 978-0323447331. [Google Scholar]
- 391.Yusuf S, Camm AJ. Deciphering the Sinus Tachycardias. Clin Cardiol . 2005;28(6):267–276. doi: 10.1002/clc.4960280603. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 392.Kwok SY, So HK, Choi KC, Lo AF, Li AM, Sung RY, et al. Resting Heart Rate in Children and Adolescents: Association with Blood Pressure, Exercise and Obesity. Arch Dis Child . 2013;98(4):287–291. doi: 10.1136/archdischild-2012-302794. [DOI] [PubMed] [Google Scholar]
- 393.Farah BQ, Christofaro DG, Balagopal PB, Cavalcante BR, Barros MV, Ritti-Dias RM. Association between Resting Heart Rate and Cardiovascular Risk Factors in Adolescents. Eur J Pediatr . 2015;174(12):1621–1628. doi: 10.1007/s00431-015-2580-y. [DOI] [PubMed] [Google Scholar]
- 394.Rossano JW, Kantor PF, Shaddy RE, Shi L, Wilkinson JD, Jefferies JL, et al. Elevated Heart Rate and Survival in Children with Dilated Cardiomyopathy: A Multicenter Study from the Pediatric Cardiomyopathy Registry. J Am Heart Assoc . 2020;9(15):e015916. doi: 10.1161/JAHA.119.015916. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 395.Bonnet D, Berger F, Jokinen E, Kantor PF, Daubeney PEF. Ivabradine in Children with Dilated Cardiomyopathy and Symptomatic Chronic Heart Failure. J Am Coll Cardiol . 2017;70(10):1262–1272. doi: 10.1016/j.jacc.2017.07.725. [DOI] [PubMed] [Google Scholar]
- 396.Adorisio R, Cantarutti N, Ciabattini M, Amodeo A, Drago F. Real-World Use of Carvedilol in Children with Dilated Cardiomyopathy: Long-Term Effect on Survival and Ventricular Function. Front Pediatr . 2022;10:845406–845406. doi: 10.3389/fped.2022.845406. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 397.Bourque JM, Beller GA. Value of Exercise ECG for Risk Stratification in Suspected or Known CAD in the Era of Advanced Imaging Technologies. JACC Cardiovasc Imaging . 2015;8(11):1309–1321. doi: 10.1016/j.jcmg.2015.09.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 398.Gravel H, Curnier D, Dallaire F, Fournier A, Portman M, Dahdah N. Cardiovascular Response to Exercise Testing in Children and Adolescents Late after Kawasaki Disease According to Coronary Condition Upon Onset. Pediatr Cardiol . 2015;36(7):1458–1464. doi: 10.1007/s00246-015-1186-5. [DOI] [PubMed] [Google Scholar]
- 399.Mahon AD, Anderson CS, Hipp MJ, Hunt KA. Heart Rate Recovery from Submaximal Exercise in Boys and Girls. Med Sci Sports Exerc . 2003;35(12):2093–2097. doi: 10.1249/01.MSS.0000099180.80952.83. [DOI] [PubMed] [Google Scholar]
- 400.Ellestad MH. Stress Testing: Principles and Practice . 5th ed. Oxford: Oxford University Press; 2003. ISBN-10: 0195159284; ISBN-13: 978-0195159288. [Google Scholar]
- 401.Claessen G, La Gerche A, Van De Bruaene A, Claeys M, Willems R, Dymarkowski S, et al. Heart Rate Reserve in Fontan Patients: Chronotropic Incompetence or Hemodynamic Limitation? J Am Heart Assoc . 2019;8(9):e012008. doi: 10.1161/JAHA.119.012008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 402.Braden DS, Carroll JF. Normative Cardiovascular Responses to Exercise in Children. Pediatr Cardiol . 1999;20(1):4–10. doi: 10.1007/s002469900380. [DOI] [PubMed] [Google Scholar]
- 403.Riopel DA, Taylor AB, Hohn AR. Blood Pressure, Heart Rate, Pressure-Rate Product and Electrocardiographic Changes in Healthy Children During Treadmill Exercise. Am J Cardiol . 1979;44(4):697–704. doi: 10.1016/0002-9149(79)90290-x. [DOI] [PubMed] [Google Scholar]
- 404.Norozi K, Wessel A, Alpers V, Arnhold JO, Binder L, Geyer S, et al. Chronotropic Incompetence in Adolescents and Adults with Congenital Heart Disease After Cardiac Surgery. J Card Fail . 2007;13(4):263–268. doi: 10.1016/j.cardfail.2006.12.002. [DOI] [PubMed] [Google Scholar]
- 405.von Scheidt F, Meier S, Krämer J, Apitz A, Siaplaouras J, Bride P, et al. Heart Rate Response During Treadmill Exercise Test in Children and Adolescents with Congenital Heart Disease. Front Pediatr . 2019;7:65–65. doi: 10.3389/fped.2019.00065. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 406.Yoshida Y, Maeda J, Fukushima H, Tokita N, Yamagishi H, Tokumura M. Chronotropic Incompetence to Exercise in Anorexia Nervosa Patients During the Body-Weight Recovery Phase as an Index of Insufficient Treatment. Heart Vessels . 2019;34(4):711–715. doi: 10.1007/s00380-018-1282-6. [DOI] [PubMed] [Google Scholar]
- 407.Heiberg J, Nyboe C, Hjortdal VE. Permanent Chronotropic Impairment after Closure of Atrial or Ventricular Septal Defect. Scand Cardiovasc J . 2017;51(5):271–276. doi: 10.1080/14017431.2017.1337216. [DOI] [PubMed] [Google Scholar]
- 408.Franciosi S, Roston TM, Perry FKG, Knollmann BC, Kannankeril PJ, Sanatani S. Chronotropic Incompetence as a Risk Predictor in Children and Young Adults with Catecholaminergic Polymorphic Ventricular Tachycardia. J Cardiovasc Electrophysiol . 2019;30(10):1923–1929. doi: 10.1111/jce.14043. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 409.Singh NM, Loomba RS, Kovach JR, Kindel SJ. Chronotropic Incompetence in Paediatric Heart Transplant Recipients with Prior Congenital Heart Disease. Cardiol Young . 2019;29(5):667–671. doi: 10.1017/S1047951119000714. [DOI] [PubMed] [Google Scholar]
- 410.Ohuchi H, Hamamichi Y, Hayashi T, Watanabe T, Yamada O, Yagihara T, et al. Post-Exercise Heart Rate, Blood Pressure and Oxygen Uptake Dynamics in Pediatric Patients with Fontan Circulation Comparison with Patients after Right Ventricular Outflow Tract Reconstruction. Int J Cardiol . 2005;101(1):129–136. doi: 10.1016/j.ijcard.2004.11.008. [DOI] [PubMed] [Google Scholar]
- 411.Ohuchi H, Hasegawa S, Yasuda K, Yamada O, Ono Y, Echigo S. Severely Impaired Cardiac Autonomic Nervous Activity after the Fontan Operation. Circulation . 2001;104(13):1513–1518. doi: 10.1161/hc3801.096326. [DOI] [PubMed] [Google Scholar]
- 412.Ohuchi H, Watanabe K, Kishiki K, Wakisaka Y, Echigo S. Heart Rate Dynamics During and After Exercise in Postoperative Congenital Heart Disease Patients. Their Relation to Cardiac Autonomic Nervous Activity and Intrinsic Sinus Node Dysfunction. Am Heart J . 2007;154(1):165–171. doi: 10.1016/j.ahj.2007.03.031. [DOI] [PubMed] [Google Scholar]
- 413.Singh TP, Curran TJ, Rhodes J. Cardiac Rehabilitation Improves Heart Rate Recovery Following Peak Exercise in Children with Repaired Congenital Heart Disease. Pediatr Cardiol . 2007;28(4):276–279. doi: 10.1007/s00246-006-0114-0. [DOI] [PubMed] [Google Scholar]
- 414.Ohuchi H, Suzuki H, Yasuda K, Arakaki Y, Echigo S, Kamiya T. Heart Rate Recovery After Exercise and Cardiac Autonomic Nervous Activity in Children. Pediatr Res . 2000;47(3):329–335. doi: 10.1203/00006450-200003000-00008. [DOI] [PubMed] [Google Scholar]
- 415.Shwaish NS, Malloy-Walton L, Feldman K, Teson KM, Watson JS, Yeh HW, et al. Heart Rate Recovery Following Exercise Testing in Pediatric Patients with Acyanotic Repaired Congenital Heart Disease. Pediatr Cardiol . 2022;43(4):790–795. doi: 10.1007/s00246-021-02788-7. [DOI] [PubMed] [Google Scholar]
- 416.Buchheit M, Duché P, Laursen PB, Ratel S. Postexercise Heart Rate Recovery in Children: Relationship with Power Output, Blood pH, and Lactate. Appl Physiol Nutr Metab . 2010;35(2):142–150. doi: 10.1139/H09-140. [DOI] [PubMed] [Google Scholar]
- 417.Lazic JS, Dekleva M, Soldatovic I, Leischik R, Suzic S, Radovanovic D, et al. Heart Rate Recovery in Elite Athletes: The Impact of Age and Exercise Capacity. Clin Physiol Funct Imaging . 2017;37(2):117–123. doi: 10.1111/cpf.12271. [DOI] [PubMed] [Google Scholar]
- 418.Wanne OP, Haapoja E. Blood Pressure During Exercise in Healthy Children. Eur J Appl Physiol Occup Physiol . 1988;58(1-2):62–67. doi: 10.1007/BF00636604. [DOI] [PubMed] [Google Scholar]
- 419.Clarke MM, Zannino D, Stewart NP, Glenning JP, Pineda-Guevara S, Kik J, et al. Normative Blood Pressure Response to Exercise Stress Testing in Children and Adolescents. Open Heart . 2021;8(2):e001807. doi: 10.1136/openhrt-2021-001807. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 420.Klasson-Heggebø L, Andersen LB, Wennlöf AH, Sardinha LB, Harro M, Froberg K, et al. Graded Associations Between Cardiorespiratory Fitness, Fatness, and Blood Pressure in Children and Adolescents. Br J Sports Med . 2006;40(1):25–29. doi: 10.1136/bjsm.2004.016113. discussion 25-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 421.Takken T, Blank AC, Hulzebos EH, van Brussel M, Groen WG, Helders PJ. Cardiopulmonary Exercise Testing in Congenital Heart Disease: (Contra)Indications and Interpretation. Neth Heart J . 2009;17(10):385–392. doi: 10.1007/BF03086289. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 422.Alpert BS, Flood NL, Strong WB, Dover EV, DuRant RH, Martin AM, et al. Responses to Ergometer Exercise in a Healthy Biracial Population of Children. J Pediatr . 1982;101(4):538–545. doi: 10.1016/s0022-3476(82)80696-3. [DOI] [PubMed] [Google Scholar]
- 423.Havasi K, Maróti Z, Jakab A, Raskó I, Kalmár T, Bereczki C. Reference Values for Resting and Post Exercise Hemodynamic Parameters in a 6-18 Year Old Population. Sci Data . 2020;7(1):26–26. doi: 10.1038/s41597-020-0368-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 424.Sasaki T, Kawasaki Y, Takajo D, Sriram C, Ross RD, Kobayashi D. Blood Pressure Response to Treadmill Cardiopulmonary Exercise Test in Children with Normal Cardiac Anatomy and Function. J Pediatr . 2021;233:169–174. doi: 10.1016/j.jpeds.2021.02.043. [DOI] [PubMed] [Google Scholar]
- 425.Becker MMC, Silva OB, Moreira IEG, Victor EG. Arterial Blood Pressure in Adolescents During Exercise Stress Testing. Arq Bras Cardiol . 2007;88(3):329–333. doi: 10.1590/s0066-782x2007000300012. [DOI] [PubMed] [Google Scholar]
- 426.Sumitomo N, Ito S, Harada K, Kobayashi H, Okuni M. Treadmill Exercise Test in Children with Cardiomyopathy and Postmyocarditic Myocardial Hypertrophy. Heart Vessels . 1986;2(1):47–50. doi: 10.1007/BF02060245. [DOI] [PubMed] [Google Scholar]
- 427.Alpert BS, Dover EV, Booker DL, Martin AM, Strong WB. Blood Pressure Response to Dynamic Exercise in Healthy Children--Black vs White. J Pediatr . 1981;99(4):556–560. doi: 10.1016/s0022-3476(81)80253-3. [DOI] [PubMed] [Google Scholar]
- 428.Kaafarani M, Schroer C, Takken T. Reference Values for Blood Pressure Response to Cycle Ergometry in the First Two Decades of Life: Comparison with Patients with a Repaired Coarctation of the Aorta. Expert Rev Cardiovasc Ther . 2017;15(12):945–951. doi: 10.1080/14779072.2017.1385392. [DOI] [PubMed] [Google Scholar]
- 429.Hansen HS, Hyldebrandt N, Nielsen JR, Froberg K. Exercise Testing in Children as a Diagnostic tool of Future Hypertension: The Odense Schoolchild Study. J Hypertens Suppl . 1989;7(1):S41–S42. doi: 10.1097/00004872-198902001-00012. [DOI] [PubMed] [Google Scholar]
- 430.Lauer RM, Burns TL, Clarke WR, Mahoney LT. Childhood Predictors of Future Blood Pressure. Hypertension . 1991;18(3 Suppl):I74–I81. doi: 10.1161/01.hyp.18.3_suppl.i74. [DOI] [PubMed] [Google Scholar]
- 431.Muñoz S, Soltero I, Onorato E, Pietri C, Zambrano F. Morphological and Functional Parameters of the Left Ventricle (Mass, Wall Thickness and End-Systolic Stress) in School Children with Different Levels of Blood Pressure, at Rest and During Maximal Exercise. Acta Cient Venez . 1990;41(2):106–113. [PubMed] [Google Scholar]
- 432.Goble MM, Schieken RM. Blood Pressure Response to Exercise. A Marker for Future Hypertension? Am J Hypertens . 1991;4(11):617S–620S. doi: 10.1093/ajh/4.11s.617s. [DOI] [PubMed] [Google Scholar]
- 433.Schultz M, Park C, Sharman J, Fraser A, Howe L, Lawlor D, et al. Exaggerated Exercise Blood Pressure is Associated with Higher Left Ventricular Mass in Adolescence. The Avon Longitudinal Study of Parents and Children. J Hypertens . 2016;34(Suppl 1):e55. doi: 10.1097/01.hjh.0000499992.80444.b7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 434.Cyran SE, James FW, Daniels S, Mays W, Shukla R, Kaplan S. Comparison of the Cardiac Output and Stroke Volume Response to Upright Exercise in Children with Valvular and Subvalvular Aortic Stenosis. J Am Coll Cardiol . 1988;11(3):651–658. doi: 10.1016/0735-1097(88)91545-8. [DOI] [PubMed] [Google Scholar]
- 435.Atwood JE, Kawanishi S, Myers J, Froelicher VF. Exercise Testing in Patients with Aortic Stenosis. Chest . 1988;93(5):1083–1087. doi: 10.1378/chest.93.5.1083. [DOI] [PubMed] [Google Scholar]
- 436.James FW, Schwartz DC, Kaplan S, Spilkin SP. Exercise Electrocardiogram, Blood Pressure, and Working Capacity in Young Patients with Valvular or Discrete Subvalvular Aortic Stenosis. Am J Cardiol . 1982;50(4):769–775. doi: 10.1016/0002-9149(82)91232-2. [DOI] [PubMed] [Google Scholar]
- 437.Alpert BS, Kartodihardjo W, Harp R, Izukawa T, Strong WB. Exercise Blood Pressure Response--a Predictor of Severity of Aortic Stenosis in Children. J Pediatr . 1981;98(5):763–765. doi: 10.1016/s0022-3476(81)80839-6. [DOI] [PubMed] [Google Scholar]
- 438.Norrish G, Cantarutti N, Pissaridou E, Ridout DA, Limongelli G, Elliott PM, et al. Risk Factors for Sudden Cardiac Death in Childhood Hypertrophic Cardiomyopathy: A Systematic Review and Meta-Analysis. Eur J Prev Cardiol . 2017;24(11):1220–1230. doi: 10.1177/2047487317702519. [DOI] [PubMed] [Google Scholar]
- 439.Donazzan L, Crepaz R, Stuefer J, Stellin G. Abnormalities of Aortic Arch Shape, Central Aortic Flow Dynamics, and Distensibility Predispose to Hypertension after Successful Repair of Aortic Coarctation. World J Pediatr Congenit Heart Surg . 2014;5(4):546–553. doi: 10.1177/2150135114551028. [DOI] [PubMed] [Google Scholar]
- 440.Madueme PC, Khoury PR, Urbina EM, Kimball TR. Predictors of Exaggerated Exercise-Induced Systolic Blood Pressures in Young Patients After Coarctation Repair. Cardiol Young . 2013;23(3):416–422. doi: 10.1017/S1047951112001114. [DOI] [PubMed] [Google Scholar]
- 441.Huang Z, Park C, Chaturvedi N, Howe LD, Sharman JE, Hughes AD, et al. Cardiorespiratory Fitness, Fatness, and the Acute Blood Pressure Response to Exercise in Adolescence. Scand J Med Sci Sports . 2021;31(8):1693–1698. doi: 10.1111/sms.13976. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 442.Szmigielska K, Szmigielska-Kapłon A, Jegier A. Blood Pressure Response to Exercise in Young Athletes Aged 10 to 18 Years. Appl Physiol Nutr Metab . 2016;41(1):41–48. doi: 10.1139/apnm-2015-0101. [DOI] [PubMed] [Google Scholar]
- 443.Katamba G, Musasizi A, Kinene MA, Namaganda A, Muzaale F. Relationship of Anthropometric Indices with Rate Pressure Product, Pulse Pressure and Mean Arterial Pressure Among Secondary Adolescents of 12-17 Years. BMC Res Notes . 2021;14(1):101–101. doi: 10.1186/s13104-021-05515-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 444.Mota J, Soares-Miranda L, Silva JM, Dos Santos SS, Vale S. Influence of Body Fat and Level of Physical Activity on Rate-Pressure Product at Rest in Preschool Children. Am J Hum Biol . 2012;24(5):661–665. doi: 10.1002/ajhb.22294. [DOI] [PubMed] [Google Scholar]
- 445.Grøntved A, Brage S, Møller NC, Kristensen PL, Wedderkopp N, Froberg K, et al. Hemodynamic Variables During Exercise in Childhood and Resting Systolic Blood Pressure Levels 6 Years Later in Adolescence: The European Youth Heart Study. J Hum Hypertens . 2011;25(10):608–614. doi: 10.1038/jhh.2010.103. [DOI] [PubMed] [Google Scholar]
- 446.García-Niebla J, Llontop-García P, Valle-Racero JI, Serra-Autonell G, Batchvarov VN, de Luna AB. Technical Mistakes During the Acquisition of the Electrocardiogram. Ann Noninvasive Electrocardiol . 2009;14(4):389–403. doi: 10.1111/j.1542-474X.2009.00328.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 447.Pérez-Riera AR, Barbosa-Barros R, Daminello-Raimundo R, de Abreu LC. Main Artifacts in Electrocardiography. Ann Noninvasive Electrocardiol . 2018;23(2):e12494. doi: 10.1111/anec.12494. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 448.Luo S, Johnston P. A Review of Electrocardiogram Filtering. J Electrocardiol . 2010;43(6):486–496. doi: 10.1016/j.jelectrocard.2010.07.007. [DOI] [PubMed] [Google Scholar]
- 449.Buendía-Fuentes F, Arnau-Vives MA, Arnau-Vives A, Jiménez-Jiménez Y, Rueda-Soriano J, Zorio-Grima E, et al. High-Bandpass Filters in Electrocardiography: Source of Error in the Interpretation of the ST Segment. ISRN Cardiol . 2012;2012:706217–706217. doi: 10.5402/2012/706217. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 450.Dickinson DF. The Normal ECG in Childhood and Adolescence. Heart . 2005;91(12):1626–1630. doi: 10.1136/hrt.2004.057307. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 451.Pastore CA, Pinho JA, Pinho C, Samesima N, Pereira HG, Filho, Kruse JC, et al. III Diretrizes da Sociedade Brasileira de Cardiologia Sobre Análise e Emissão de Laudos Eletrocardiográficos. Arq Bras Cardiol . 2016;106(4 Suppl 1):1–23. doi: 10.5935/abc.20160054. [DOI] [PubMed] [Google Scholar]
- 452.Kligfield P, Badilini F, Denjoy I, Babaeizadeh S, Clark E, De Bie J, et al. Comparison of Automated Interval Measurements by Widely Used Algorithms in Digital Electrocardiographs. Am Heart J . 2018;200:1–10. doi: 10.1016/j.ahj.2018.02.014. [DOI] [PubMed] [Google Scholar]
- 453.Lux RL. Basis and ECG Measurement of Global Ventricular Repolarization. J Electrocardiol . 2017;50(6):792–797. doi: 10.1016/j.jelectrocard.2017.07.008. [DOI] [PubMed] [Google Scholar]
- 454.Ahmed H, Czosek RJ, Spar DS, Knilans TK, Anderson JB. Early Repolarization in Normal Adolescents is Common. Pediatr Cardiol . 2017;38(4):864–872. doi: 10.1007/s00246-017-1594-9. [DOI] [PubMed] [Google Scholar]
- 455.Surawicz B, Parikh SR. Prevalence of Male and Female Patterns of Early Ventricular Repolarization in the Normal ECG of Males and Females from Childhood to Old Age. J Am Coll Cardiol . 2002;40(10):1870–1876. doi: 10.1016/s0735-1097(02)02492-0. [DOI] [PubMed] [Google Scholar]
- 456.Safa R, Thomas R, Karpawich PP. Electrocardiographic Early Repolarization Characteristics and Clinical Presentations in the Young: A Benign Finding or Worrisome Marker for Arrhythmias. Congenit Heart Dis . 2017;12(1):99–104. doi: 10.1111/chd.12410. [DOI] [PubMed] [Google Scholar]
- 457.Halasz G, Cattaneo M, Piepoli M, Biagi A, Romano S, Biasini V, et al. Early Repolarization in Pediatric Athletes: A Dynamic Electrocardiographic Pattern with Benign Prognosis. J Am Heart Assoc . 2021;10(16):e020776. doi: 10.1161/JAHA.121.020776. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 458.Pickham D, Zarafshar S, Sani D, Kumar N, Froelicher V. Comparison of Three ECG Criteria for Athlete Pre-Participation Screening. J Electrocardiol . 2014;47(6):769–774. doi: 10.1016/j.jelectrocard.2014.07.019. [DOI] [PubMed] [Google Scholar]
- 459.Sharma S, Drezner JA, Baggish A, Papadakis M, Wilson MG, Prutkin JM, et al. International Recommendations for Electrocardiographic Interpretation in Athletes. J Am Coll Cardiol . 2017;69(8):1057–1075. doi: 10.1016/j.jacc.2017.01.015. [DOI] [PubMed] [Google Scholar]
- 460.Drezner JA, Ackerman MJ, Anderson J, Ashley E, Asplund CA, Baggish AL, et al. Electrocardiographic Interpretation in Athletes: The ‘Seattle Criteria’. Br J Sports Med . 2013;47(3):122–124. doi: 10.1136/bjsports-2012-092067. [DOI] [PubMed] [Google Scholar]
- 461.Antzelevitch C, Yan GX, Ackerman MJ, Borggrefe M, Corrado D, Guo J, et al. J-Wave Syndromes Expert Consensus Conference Report: Emerging Concepts and Gaps in Knowledge. Europace . 2017;19(4):665–694. doi: 10.1093/europace/euw235. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 462.Sharma S, Drezner JA, Baggish A, Papadakis M, Wilson MG, Prutkin JM, et al. International Recommendations for Electrocardiographic Interpretation in Athletes. Eur Heart J . 2018;39(16):1466–1480. doi: 10.1093/eurheartj/ehw631. [DOI] [PubMed] [Google Scholar]
- 463.Rijnbeek PR, Witsenburg M, Schrama E, Hess J, Kors JA. New Normal Limits for the Paediatric Electrocardiogram. Eur Heart J . 2001;22(8):702–711. doi: 10.1053/euhj.2000.2399. [DOI] [PubMed] [Google Scholar]
- 464.Cismaru G, Lazea C, Mureşan L, Gusetu G, Rosu R, Pop D, et al. Validation of Normal P-Wave Parameters in a Large Unselected Pediatric Population of North-Western Romania: Results of the CARDIOPED Project. Dis Markers . 2021;2021:6657982–6657982. doi: 10.1155/2021/6657982. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 465.Dilaveris P, Raftopoulos L, Giannopoulos G, Katinakis S, Maragiannis D, Roussos D, et al. Prevalence of Interatrial Block in Healthy School-Aged Children: Definition by P-Wave Duration or Morphological Analysis. Ann Noninvasive Electrocardiol . 2010;15(1):17–25. doi: 10.1111/j.1542-474X.2009.00335.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 466.Ng C, Ahmad A, Budhram DR, He M, Balakrishnan N, Mondal T. Accuracy of Electrocardiography and Agreement with Echocardiography in the Diagnosis of Pediatric Left Atrial Enlargement. Sci Rep . 2020;10(1):10027–10027. doi: 10.1038/s41598-020-66987-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 467.Yoshinaga M, Iwamoto M, Horigome H, Sumitomo N, Ushinohama H, Izumida N, et al. Standard Values and Characteristics of Electrocardiographic Findings in Children and Adolescents. Circ J . 2018;82(3):831–839. doi: 10.1253/circj.CJ-17-0735. [DOI] [PubMed] [Google Scholar]
- 468.Hallioglu O, Aytemir K, Celiker A. The Significance of P Wave Duration and P Wave Dispersion for Risk Assessment of Atrial Tachyarrhythmias in Patients with Corrected Tetralogy of Fallot. Ann Noninvasive Electrocardiol . 2004;9(4):339–344. doi: 10.1111/j.1542-474X.2004.94569.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 469.Saleh A, Shabana A, El Amrousy D, Zoair A. Predictive Value of P-Wave and QT Interval Dispersion in Children with Congenital Heart Disease and Pulmonary Arterial Hypertension for the Occurrence of Arrhythmias. J Saudi Heart Assoc . 2019;31(2):57–63. doi: 10.1016/j.jsha.2018.11.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 470.Malakan Rad E, Karimi M, Momtazmanesh S, Shabanian R, Saatchi M, Asbagh PA, et al. Exercise-Induced Electrocardiographic Changes After Treadmill Exercise Testing in Healthy Children: A Comprehensive Study. Ann Pediatr Cardiol . 2021;14(4):449–458. doi: 10.4103/apc.apc_254_20. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 471.Ho TF, Chia EL, Yip WC, Chan KY. Analysis of P Wave and P Dispersion in Children with Secundum Atrial Septal Defect. Ann Noninvasive Electrocardiol . 2001;6(4):305–309. doi: 10.1111/j.1542-474x.2001.tb00123.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 472.Bornaun HA, Yılmaz N, Kutluk G, Dedeoğlu R, Öztarhan K, Keskindemirci G, et al. Prolonged P-Wave and QT Dispersion in Children with Inflammatory Bowel Disease in Remission. Biomed Res Int . 2017;2017:6960810–6960810. doi: 10.1155/2017/6960810. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 473.Ece I, Üner A, Ballı Ş, Oflaz MB, Kibar AE, Sal E. P-Wave and QT Interval Dispersion Analysis in Children with Eisenmenger Syndrome. Turk Kardiyol Dern Ars . 2014;42(2):154–160. doi: 10.5543/tkda.2014.68704. [DOI] [PubMed] [Google Scholar]
- 474.Arslan D, Cimen D, Guvenc O, Oran B, Yilmaz FH. Assessment of P-Wave Dispersion in Children with Atrial Septal Aneurysm. Cardiol Young . 2014;24(5):918–922. doi: 10.1017/S1047951113001431. [DOI] [PubMed] [Google Scholar]
- 475.Kocaoglu C, Sert A, Aypar E, Oran B, Odabas D, Arslan D, et al. P-Wave Dispersion in Children with Acute Rheumatic Fever. Pediatr Cardiol . 2012;33(1):90–94. doi: 10.1007/s00246-011-0096-4. [DOI] [PubMed] [Google Scholar]
- 476.Goodacre S, McLeod K. ABC of Clinical Electrocardiography: Paediatric Electrocardiography. BMJ . 2002;324(7350):1382–1385. doi: 10.1136/bmj.324.7350.1382. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 477.Blaufox AD, Sleeper LA, Bradley DJ, Breitbart RE, Hordof A, Kanter RJ, et al. Functional Status, Heart Rate, and Rhythm Abnormalities in 521 Fontan Patients 6 to 18 Years of Age. J Thorac Cardiovasc Surg . 2008;136(1):100–107. doi: 10.1016/j.jtcvs.2007.12.024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 478.Ogunlade O, Akintomide AO, Ajayi OE, Eluwole OA. Marked First Degree Atrioventricular Block: An Extremely Prolonged PR Interval Associated with Atrioventricular Dissociation in a Young Nigerian Man with Pseudo-Pacemaker Syndrome: A Case Report. BMC Res Notes . 2014;7:781–781. doi: 10.1186/1756-0500-7-781. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 479.Barold SS, Ilercil A, Leonelli F, Herweg B. First-Degree Atrioventricular Block. Clinical Manifestations, Indications for Pacing, Pacemaker Management & Consequences During Cardiac Resynchronization. J Interv Card Electrophysiol . 2006;17(2):139–152. doi: 10.1007/s10840-006-9065-x. [DOI] [PubMed] [Google Scholar]
- 480.Davignon A, Rautaharju P, Boisselle E, Soumis F, Mégélas M, Choquette A. Normal ECG Standards for Infants and Children. Pediatr Cardiol . 1980;1:123–131. doi: 10.1007/BF02083144. [DOI] [Google Scholar]
- 481.Semizel E, Oztürk B, Bostan OM, Cil E, Ediz B. The Effect of Age and Gender on the Electrocardiogram in Children. Cardiol Young . 2008;18(1):26–40. doi: 10.1017/S1047951107001722. [DOI] [PubMed] [Google Scholar]
- 482.Hyde N, Prutkin JM, Drezner JA. Electrocardiogram Interpretation in NCAA Athletes: Comparison of the ‘Seattle’ and ‘International’ Criteria. J Electrocardiol . 2019;56:81–84. doi: 10.1016/j.jelectrocard.2019.07.001. [DOI] [PubMed] [Google Scholar]
- 483.Weiss M, Rao P, Johnson D, Billups T, Taing C, LaNoue M, et al. Physician Adherence to ‚Seattle‘ and ‚International‘ ECG Criteria in Adolescent Athletes: An Analysis of Compliance by Specialty, Experience, and Practice Environment. J Electrocardiol . 2020;60:98–101. doi: 10.1016/j.jelectrocard.2020.04.005. [DOI] [PubMed] [Google Scholar]
- 484.Drezner JA, Sharma S, Baggish A, Papadakis M, Wilson MG, Prutkin JM, et al. International Criteria for Electrocardiographic Interpretation in Athletes: Consensus Statement. Br J Sports Med . 2017;51(9):704–731. doi: 10.1136/bjsports-2016-097331. [DOI] [PubMed] [Google Scholar]
- 485.Drezner JA, Owens DS, Prutkin JM, Salerno JC, Harmon KG, Prosise S, et al. Electrocardiographic Screening in National Collegiate Athletic Association Athletes. Am J Cardiol . 2016;118(5):754–759. doi: 10.1016/j.amjcard.2016.06.004. [DOI] [PubMed] [Google Scholar]
- 486.Riding NR, Salah O, Sharma S, Carré F, George KP, Farooq A, et al. ECG and Morphologic Adaptations in Arabic Athletes: Are the European Society of Cardiology's Recommendations for the Interpretation of the 12-Lead ECG Appropriate for this Ethnicity? Br J Sports Med . 2014;48(15):1138–1143. doi: 10.1136/bjsports-2012-091871. [DOI] [PubMed] [Google Scholar]
- 487.Nakanishi T, Takao A, Kondoh C, Nakazawa M, Hiroe M, Matsumoto Y. ECG Findings after Myocardial Infarction in Children After Kawasaki Disease. Am Heart J . 1988;116(4):1028–1033. doi: 10.1016/0002-8703(88)90155-x. [DOI] [PubMed] [Google Scholar]
- 488.Campbell MJ, Zhou X, Han C, Abrishami H, Webster G, Miyake CY, et al. Electrocardiography Screening for Hypertrophic Cardiomyopathy. Pacing Clin Electrophysiol . 2016;39(9):944–950. doi: 10.1111/pace.12913. [DOI] [PubMed] [Google Scholar]
- 489.Fukuda T. Myocardial Ischemia in Kawasaki Disease; Evaluation by Dipyridamole Stress Thallium-201 (Tl-201) Myocardial Imaging and Exercise Stress Test. Kurume Med J . 1992;39(4):245–255. doi: 10.2739/kurumemedj.39.245. [DOI] [PubMed] [Google Scholar]
- 490.Mikrou P, Shivaram P, Kanaris C. How to Interpret the Paediatric 12-Lead ECG. Arch Dis Child Educ Pract Ed . 2022;107(4):279–287. doi: 10.1136/archdischild-2021-322428. [DOI] [PubMed] [Google Scholar]
- 491.Thapar MK, Strong WB, Miller MD, Leatherbury L, Salehbhai M. Exercise Electrocardiography of Health Black Children. Am J Dis Child . 1978;132(6):592–595. doi: 10.1001/archpedi.1978.02120310056011. [DOI] [PubMed] [Google Scholar]
- 492.Falkner B, Lowenthal DT, Affrime MB, Hamstra B. Changes in R Wave Amplitude During Aerobic Exercise Stress Testing in Hypertensive Adolescents. Am J Cardiol . 1982;50(1):152–156. doi: 10.1016/0002-9149(82)90022-4. [DOI] [PubMed] [Google Scholar]
- 493.Falkner B, Lowenthal DT, Affrime MB, Hamstra B. R-Wave Amplitude Change During Aerobic Exercise in Hypertensive Adolescents after Treatment. Am J Cardiol . 1983;51(3):459–463. doi: 10.1016/s0002-9149(83)80080-0. [DOI] [PubMed] [Google Scholar]
- 494.Lambrechts L, Fourie B. How to Interpret an Electrocardiogram in Children. BJA Educ . 2020;20(8):266–277. doi: 10.1016/j.bjae.2020.03.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 495.Garson A. The Electrocardiogram in Infants and Children: A Systematic Approach . Philadelphia: Lea & Febiger; 1983. ISBN: 9780812108729. [Google Scholar]
- 496.Malhotra A, Dhutia H, Gati S, Yeo TJ, Dores H, Bastiaenen R, et al. Anterior T-Wave Inversion in Young White Athletes and Nonathletes: Prevalence and Significance. J Am Coll Cardiol . 2017;69(1):1–9. doi: 10.1016/j.jacc.2016.10.044. [DOI] [PubMed] [Google Scholar]
- 497.Kirchhof P, Fabritz L. Anterior T-Wave Inversion Does Not Convey Short-Term Sudden Death Risk: Inverted Is the New Normal. J Am Coll Cardiol . 2017;69(1):10–12. doi: 10.1016/j.jacc.2016.11.011. [DOI] [PubMed] [Google Scholar]
- 498.Anselmi F, Cangiano N, Fusi C, Berti B, Franchini A, Focardi M, et al. The Determinants of Positivization of Anterior T-Wave Inversion in Children. J Sports Med Phys Fitness . 2021;61(11):1548–1554. doi: 10.23736/S0022-4707.20.11874-7. [DOI] [PubMed] [Google Scholar]
- 499.D’Ascenzi F, Anselmi F, Berti B, Capitani E, Chiti C, Franchini A, et al. Prevalence and Significance of T-Wave Inversion in Children Practicing Sport: A Prospective, 4-Year Follow-Up Study. Int J Cardiol . 2019;279:100–104. doi: 10.1016/j.ijcard.2018.09.069. [DOI] [PubMed] [Google Scholar]
- 500.Tipple M. Interpretation of Electrocardiograms in Infants and Children. Images Paediatr Cardiol . 1999;1(1):3–13. [PMC free article] [PubMed] [Google Scholar]
- 501.Migliore F, Zorzi A, Michieli P, Perazzolo Marra M, Siciliano M, et al. Prevalence of Cardiomyopathy in Italian Asymptomatic Children with Electrocardiographic T-Wave Inversion at Preparticipation Screening. Circulation . 2012;125(3):529–538. doi: 10.1161/CIRCULATIONAHA.111.055673. [DOI] [PubMed] [Google Scholar]
- 502.Stein R, Malhotra A. T Wave Inversions in Athletes: A Variety of Scenarios. J Electrocardiol . 2015;48(3):415–419. doi: 10.1016/j.jelectrocard.2015.01.011. [DOI] [PubMed] [Google Scholar]
- 503.Calò L, Sperandii F, Martino A, Guerra E, Cavarretta E, Quaranta F, et al. Echocardiographic Findings in 2261 Peri-Pubertal Athletes with or without Inverted T Waves at Electrocardiogram. Heart . 2015;101(3):193–200. doi: 10.1136/heartjnl-2014-306110. [DOI] [PubMed] [Google Scholar]
- 504.Abela M, Sharma S. Abnormal ECG Findings in Athletes: Clinical Evaluation and Considerations. Curr Treat Options Cardiovasc Med . 2019;21(12):95–95. doi: 10.1007/s11936-019-0794-4. [DOI] [PubMed] [Google Scholar]
- 505.De Lazzari M, Zorzi A, Bettella N, Cipriani A, Pilichou K, Cason M, et al. Papillary Muscles Abnormalities in Athletes with Otherwise Unexplained T-Wave Inversion in the ECG Lateral Leads. J Am Heart Assoc . 2021;10(3):e019239. doi: 10.1161/JAHA.120.019239. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 506.Papadakis M, Basavarajaiah S, Rawlins J, Edwards C, Makan J, Firoozi S, et al. Prevalence and Significance of T-Wave Inversions in Predominantly Caucasian Adolescent Athletes. Eur Heart J . 2009;30(14):1728–1735. doi: 10.1093/eurheartj/ehp164. [DOI] [PubMed] [Google Scholar]
- 507.Abela M, Yamagata K, Buttigieg L, Xuereb S, Bonello J, Soler JF, et al. The Juvenile ECG Pattern in Adolescent Athletes and Non-Athletes in a National Cardiac Screening Program (BEAT-IT) Int J Cardiol . 2023;371:508–515. doi: 10.1016/j.ijcard.2022.09.005. [DOI] [PubMed] [Google Scholar]
- 508.Calore C, Zorzi A, Sheikh N, Nese A, Facci M, Malhotra A, et al. Electrocardiographic Anterior T-Wave Inversion in Athletes of Different Ethnicities: Differential Diagnosis between Athlete's Heart and Cardiomyopathy. Eur Heart J . 2016;37(32):2515–2527. doi: 10.1093/eurheartj/ehv591. [DOI] [PubMed] [Google Scholar]
- 509.McClean G, Riding NR, Pieles G, Sharma S, Watt V, Adamuz C, et al. Prevalence and Significance of T-Wave Inversion in Arab and Black Paediatric Athletes: Should Anterior T-Wave Inversion Interpretation be Governed by Biological or Chronological Age? Eur J Prev Cardiol . 2019;26(6):641–652. doi: 10.1177/2047487318811956. [DOI] [PubMed] [Google Scholar]
- 510.D’Ascenzi F, Anselmi F, Adami PE, Pelliccia A. Interpretation of T-Wave Inversion in Physiological and Pathological Conditions: Current State and Future Perspectives. Clin Cardiol . 2020;43(8):827–833. doi: 10.1002/clc.23365. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 511.Sato A, Saiki H, Kudo M, Takizawa Y, Kuwata S, Nakano S, et al. Chronological T-Wave Alternation before and after the Onset of Arrhythmogenic Right Ventricular Cardiomyopathy. Ann Noninvasive Electrocardiol . 2022;27(6):e12965. doi: 10.1111/anec.12965. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 512.Imamura T, Sumitomo N, Muraji S, Yasuda K, Nishihara E, Iwamoto M, et al. Impact of the T-Wave Characteristics on Distinguishing Arrhythmogenic Right Ventricular Cardiomyopathy from Healthy Children. Int J Cardiol . 2021;323:168–174. doi: 10.1016/j.ijcard.2020.08.088. [DOI] [PubMed] [Google Scholar]
- 513.Şengül FS, Şahin GT, Özgür S, Kafalı HC, Akıncı O, Güzeltaş A, et al. Clinical Features and Arrhythmic Complications of Patients with Pediatric-Onset Arrhythmogenic Right Ventricular Dysplasia. Anatol J Cardiol . 2019;22(2):60–67. doi: 10.14744/AnatolJCardiol.2019.56985. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 514.Hoyt WJ, Jr, Ardoin KB, Cannon BC, Snyder CS. T-Wave Reversion in Pediatric Patients During Exercise Stress Testing. Congenit Heart Dis . 2015;10(2):E68–E72. doi: 10.1111/chd.12216. [DOI] [PubMed] [Google Scholar]
- 515.Gupta A, Bansal N, Jour LS, Clark BC. Utility of Exercise Stress Testing in Pediatric Patients with T-Wave Inversions. Pediatr Cardiol . 2022;43(4):713–718. doi: 10.1007/s00246-021-02776-x. [DOI] [PubMed] [Google Scholar]
- 516.Zaidi A, Sheikh N, Jongman JK, Gati S, Panoulas VF, Carr-White G, et al. Clinical Differentiation between Physiological Remodeling and Arrhythmogenic Right Ventricular Cardiomyopathy in Athletes with Marked Electrocardiographic Repolarization Anomalies. J Am Coll Cardiol . 2015;65(25):2702–2711. doi: 10.1016/j.jacc.2015.04.035. [DOI] [PubMed] [Google Scholar]
- 517.Finocchiaro G, Papadakis M, Dhutia H, Zaidi A, Malhotra A, Fabi E, et al. Electrocardiographic Differentiation between ‘Benign T-Wave Inversion’ and Arrhythmogenic Right Ventricular Cardiomyopathy. Europace . 2019;21(2):332–338. doi: 10.1093/europace/euy179. [DOI] [PubMed] [Google Scholar]
- 518.Kveselis DA, Rocchini AP, Rosenthal A, Crowley DC, Dick M, Snider AR, et al. Hemodynamic Determinants of Exercise-Induced ST-Segment Depression in Children with Valvar Aortic Stenosis. Am J Cardiol . 1985;55(9):1133–1139. doi: 10.1016/0002-9149(85)90650-2. [DOI] [PubMed] [Google Scholar]
- 519.Whitmer JT, James FW, Kaplan S, Schwartz DC, Knight MJ. Exercise Testing in Children before and after Surgical Treatment of Aortic Stenosis. Circulation . 1981;63(2):254–263. doi: 10.1161/01.cir.63.2.254. [DOI] [PubMed] [Google Scholar]
- 520.Kyle WB, Denfield SW, Valdes SO, Penny DJ, Bolin EH, Lopez KN. Assessing ST Segment Changes and Ischemia During Exercise Stress Testing in Patients with Hypoplastic Left Heart Syndrome and Fontan Palliation. Pediatr Cardiol . 2016;37(3):545–551. doi: 10.1007/s00246-015-1312-4. [DOI] [PubMed] [Google Scholar]
- 521.Katircibaşi MT, Koçum HT, Tekin A, Erol T, Tekin G, Baltali M, et al. Exercise-Induced ST-Segment Elevation in Leads Avr and V1 for the Prediction of Left Main Disease. Int J Cardiol . 2008;128(2):240–243. doi: 10.1016/j.ijcard.2007.05.022. [DOI] [PubMed] [Google Scholar]
- 522.Hirai K, Ousaka D, Kuroko Y, Kasahara S. Exercise-Induced Ischemic ST-Segment Elevation in Anomalous Origin of the Right Coronary Artery from the Left Sinus of Valsalva with an Intramural Course and Blocked Coronary Bypass. Cureus . 2022;14(12):e32418. doi: 10.7759/cureus.32418. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 523.Sueda S. Young Vasospastic Angina Patients Less than 20 Years Old. Circ J . 2019;83(9):1925–1928. doi: 10.1253/circj.CJ-19-0433. [DOI] [PubMed] [Google Scholar]
- 524.Sucato V, Novo G, Saladino A, Rubino M, Caronna N, Luparelli M, et al. Ischemia in Patients with no Obstructive Coronary Artery Disease: Classification, Diagnosis and Treatment of Coronary Microvascular Dysfunction. Coron Artery Dis . 2020;31(5):472–476. doi: 10.1097/MCA.0000000000000855. [DOI] [PubMed] [Google Scholar]
- 525.Amin AS, Groot EA, Ruijter JM, Wilde AA, Tan HL. Exercise-Induced ECG Changes in Brugada Syndrome. Circ Arrhythm Electrophysiol . 2009;2(5):531–539. doi: 10.1161/CIRCEP.109.862441. [DOI] [PubMed] [Google Scholar]
- 526.Makimoto H, Nakagawa E, Takaki H, Yamada Y, Okamura H, Noda T, et al. Augmented ST-Segment Elevation During Recovery from Exercise Predicts Cardiac Events in Patients with Brugada Syndrome. J Am Coll Cardiol . 2010;56(19):1576–1584. doi: 10.1016/j.jacc.2010.06.033. [DOI] [PubMed] [Google Scholar]
- 527.Bourier F, Denis A, Cheniti G, Lam A, Vlachos K, Takigawa M, et al. Early Repolarization Syndrome: Diagnostic and Therapeutic Approach. Front Cardiovasc Med . 2018;5:169–169. doi: 10.3389/fcvm.2018.00169. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 528.Ji HY, Hu N, Liu R, Zhou HR, Gao WL, Quan XQ. Worldwide Prevalence of Early Repolarization Pattern in General Population and Physically Active Individuals: A Meta-Analysis. Medicine . 2021;100(22):e25978. doi: 10.1097/MD.0000000000025978. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 529.Patton KK, Ellinor PT, Ezekowitz M, Kowey P, Lubitz SA, Perez Met, et al. Electrocardiographic Early Repolarization: A Scientific Statement from the American Heart Association. Circulation . 2016;133(15):1520–1529. doi: 10.1161/CIR.0000000000000388. [DOI] [PubMed] [Google Scholar]
- 530.Macfarlane PW, Antzelevitch C, Haissaguerre M, Huikuri HV, Potse M, Rosso R, et al. The Early Repolarization Pattern: A Consensus Paper. J Am Coll Cardiol . 2015;66(4):470–477. doi: 10.1016/j.jacc.2015.05.033. [DOI] [PubMed] [Google Scholar]
- 531.Junttila MJ, Sager SJ, Tikkanen JT, Anttonen O, Huikuri HV, Myerburg RJ. Clinical Significance of Variants of J-Points and J-Waves: Early Repolarization Patterns and Risk. Eur Heart J . 2012;33(21):2639–2643. doi: 10.1093/eurheartj/ehs110. [DOI] [PubMed] [Google Scholar]
- 532.Koch S, Cassel M, Linné K, Mayer F, Scharhag J. ECG and Echocardiographic Findings in 10-15-Year-Old Elite Athletes. Eur J Prev Cardiol . 2014;21(6):774–781. doi: 10.1177/2047487312462147. [DOI] [PubMed] [Google Scholar]
- 533.Spratt KA, Borans SM, Michelson EL. Early Repolarization: Normalization of the Electrocardiogram with Exercise as a Clinically useful Diagnostic Feature. J Invasive Cardiol . 1995;7(8):238–242. [PubMed] [Google Scholar]
- 534.Bastiaenen R, Raju H, Sharma S, Papadakis M, Chandra N, Muggenthaler M, et al. Characterization of Early Repolarization During Ajmaline Provocation and Exercise Tolerance Testing. Heart Rhythm . 2013;10(2):247–254. doi: 10.1016/j.hrthm.2012.10.032. [DOI] [PubMed] [Google Scholar]
- 535.Refaat MM, Hotait M, Tseng ZH. Utility of the Exercise Electrocardiogram Testing in Sudden Cardiac Death Risk Stratification. Ann Noninvasive Electrocardiol . 2014;19(4):311–318. doi: 10.1111/anec.12191. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 536.Nouraei H, Rabkin SW. The Effect of Exercise on the ECG Criteria for Early Repolarization Pattern. J Electrocardiol . 2019;55:59–64. doi: 10.1016/j.jelectrocard.2019.03.005. [DOI] [PubMed] [Google Scholar]
- 537.Barbosa EC, Bomfim AS, Barbosa PRB, Ginefra P. Ionic Mechanisms and Vectorial Model of Early Repolarization Pattern in the Surface Electrocardiogram of the Athlete. Ann Noninvasive Electrocardiol . 2008;13(3):301–307. doi: 10.1111/j.1542-474X.2008.00235.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 538.Rabkin SW, Cheng XB. Nomenclature, Categorization and Usage of Formulae to Adjust QT Interval for Heart Rate. World J Cardiol . 2015;7(6):315–325. doi: 10.4330/wjc.v7.i6.315. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 539.Sundaram S, Carnethon M, Polito K, Kadish AH, Goldberger JJ. Autonomic Effects on QT-RR Interval Dynamics after Exercise. Am J Physiol Heart Circ Physiol . 2008;294(1):H490–H497. doi: 10.1152/ajpheart.00046.2007. [DOI] [PubMed] [Google Scholar]
- 540.Magnano AR, Holleran S, Ramakrishnan R, Reiffel JA, Bloomfield DM. Autonomic Nervous System Influences on QT Interval in Normal Subjects. J Am Coll Cardiol . 2002;39(11):1820–1826. doi: 10.1016/s0735-1097(02)01852-1. [DOI] [PubMed] [Google Scholar]
- 541.Viitasalo M, Rovamo L, Toivonen L, Pesonen E, Heikkilä J. Dynamics of the QT Interval During and After Exercise in Healthy Children. Eur Heart J . 1996;17(11):1723–1728. doi: 10.1093/oxfordjournals.eurheartj.a014757. [DOI] [PubMed] [Google Scholar]
- 542.Horner JM, Horner MM, Ackerman MJ. The Diagnostic Utility of Recovery Phase Qtc During Treadmill Exercise Stress Testing in the Evaluation of Long QT Syndrome. Heart Rhythm . 2011;8(11):1698–1704. doi: 10.1016/j.hrthm.2011.05.018. [DOI] [PubMed] [Google Scholar]
- 543.Gervasi SF, Bianco M, Palmieri V, Cuccaro F, Zeppilli P. QTc Interval in Adolescents and Young Athletes: Influence of Correction Formulas. Int J Sports Med . 2017;38(10):729–734. doi: 10.1055/s-0043-108997. [DOI] [PubMed] [Google Scholar]
- 544.Andršová I, Hnatkova K, Helánová K, Šišáková M, Novotný T, Kala P, et al. Problems with Bazett Qtc Correction in Paediatric Screening of Prolonged Qtc Interval. BMC Pediatr . 2020;20(1):558–558. doi: 10.1186/s12887-020-02460-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 545.de Veld L, van der Lely N, Hermans BJM, van Hoof JJ, Wong L, Vink AS. Qtc Prolongation in Adolescents with Acute Alcohol Intoxication. Eur J Pediatr . 2022;181(7):2757–2770. doi: 10.1007/s00431-022-04471-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 546.Benatar A, Decraene T. Comparison of Formulae for Heart Rate Correction of QT Interval in Exercise Ecgs from Healthy Children. Heart . 2001;86(2):199–202. doi: 10.1136/heart.86.2.199. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 547.Berger WR, Gow RM, Kamberi S, Cheung M, Smith KR, Davis AM. The QT and Corrected QT Interval in Recovery after Exercise in Children. Circ Arrhythm Electrophysiol . 2011;4(4):448–455. doi: 10.1161/CIRCEP.110.961094. [DOI] [PubMed] [Google Scholar]
- 548.Aziz PF, Wieand TS, Ganley J, Henderson J, Patel AR, Iyer VR, et al. Genotype- and Mutation Site-Specific QT Adaptation During Exercise, Recovery, and Postural Changes in Children with Long-QT Syndrome. Circ Arrhythm Electrophysiol . 2011;4(6):867–873. doi: 10.1161/CIRCEP.111.963330. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 549.Miyazaki A, Sakaguchi H, Matsumura Y, Hayama Y, Noritake K, Negishi J, et al. Mid-Term Follow-Up of School-Aged Children with Borderline Long QT Interval. Circ J . 2017;81(5):726–732. doi: 10.1253/circj.CJ-16-0991. [DOI] [PubMed] [Google Scholar]
- 550.Dickinson DF, Scott O. Ambulatory Electrocardiographic Monitoring in 100 Healthy Teenage Boys. Br Heart J . 1984;51(2):179–183. doi: 10.1136/hrt.51.2.179. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 551.Bexton RS, Camm AJ. First Degree Atrioventricular Block. Eur Heart J . 1984;5(Suppl A):107–109. doi: 10.1093/eurheartj/5.suppl_a.107. [DOI] [PubMed] [Google Scholar]
- 552.Viitasalo MT, Kala R, Eisalo A. Ambulatory Electrocardiographic Findings in Young Athletes between 14 and 16 Years of Age. Eur Heart J . 1984;5(1):2–6. doi: 10.1093/oxfordjournals.eurheartj.a061546. [DOI] [PubMed] [Google Scholar]
- 553.Cruz EM, Ivy D, Jaggers J, editors. Pediatric and Congenital Cardiology, Cardiac Surgery and Intensive Care . London: Springer; 2020. ISBN-10: 3030622940; ISBN-13: 978-3030622947. [Google Scholar]
- 554.Karpawich PP, Gillette PC, Garson A, Jr, Hesslein PS, Porter CB, McNamara DG. Congenital Complete Atrioventricular Block: Clinical and Electrophysiologic Predictors of Need for Pacemaker Insertion. Am J Cardiol . 1981;48(6):1098–1102. doi: 10.1016/0002-9149(81)90326-x. [DOI] [PubMed] [Google Scholar]
- 555.Reybrouck T, Eynde BV, Dumoulin M, Van der Hauwaert LG. Cardiorespiratory Response to Exercise in Congenital Complete Atrioventricular Block. Am J Cardiol . 1989;64(14):896–899. doi: 10.1016/0002-9149(89)90838-2. [DOI] [PubMed] [Google Scholar]
- 556.Michaëlsson M, Jonzon A, Riesenfeld T. Isolated Congenital Complete Atrioventricular Block in Adult Life. A Prospective Study. Circulation . 1995;92(3):442–449. doi: 10.1161/01.cir.92.3.442. [DOI] [PubMed] [Google Scholar]
- 557.Winkler RB, Freed MD, Nadas AS. Exercise-Induced Ventricular Ectopy in Children and Young Adults with Complete Heart Block. Am Heart J . 1980;99(1):87–92. doi: 10.1016/0002-8703(80)90317-8. [DOI] [PubMed] [Google Scholar]
- 558.Kertesz NJ, Fenrich AL, Friedman RA. Congenital Complete Atrioventricular Block. Tex Heart Inst J . 1997;24(4):301–307. [PMC free article] [PubMed] [Google Scholar]
- 559.O’Connor M, McDaniel N, Brady WJ. The Pediatric Electrocardiogram Part III: Congenital Heart Disease and Other Cardiac Syndromes. Am J Emerg Med . 2008;26(4):497–503. doi: 10.1016/j.ajem.2007.08.004. [DOI] [PubMed] [Google Scholar]
- 560.Aggarwal V, Sexson-Tejtal K, Lam W, Valdes SO, De la Uz CM, Kim JJ, et al. The Incidence of Arrhythmias During Exercise Stress Tests among Children with Kawasaki Disease: A Single-Center Case Series. Congenit Heart Dis . 2019;14(6):1032–1036. doi: 10.1111/chd.12864. [DOI] [PubMed] [Google Scholar]
- 561.Priromprintr B, Rhodes J, Silka MJ, Batra AS. Prevalence of Arrhythmias During Exercise Stress Testing in Patients with Congenital Heart Disease and Severe Right Ventricular Conduit Dysfunction. Am J Cardiol . 2014;114(3):468–472. doi: 10.1016/j.amjcard.2014.05.019. [DOI] [PubMed] [Google Scholar]
- 562.Beaufort-Krol GC, Dijkstra SS, Bink-Boelkens MT. Natural History of Ventricular Premature Contractions in Children with a Structurally Normal Heart: Does Origin Matter? Europace . 2008;10(8):998–1003. doi: 10.1093/europace/eun121. [DOI] [PubMed] [Google Scholar]
- 563.Sharma N, Cortez D, Imundo JR. High Burden of Premature Ventricular Contractions in Structurally Normal Hearts: to Worry or Not in Pediatric Patients? Ann Noninvasive Electrocardiol . 2019;24(6):e12663. doi: 10.1111/anec.12663. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 564.Abadir S, Blanchet C, Fournier A, Mawad W, Shohoudi A, Dahdah N, et al. Characteristics of Premature Ventricular Contractions in Healthy Children and their Impact on Left Ventricular Function. Heart Rhythm . 2016;13(11):2144–2148. doi: 10.1016/j.hrthm.2016.07.002. [DOI] [PubMed] [Google Scholar]
- 565.Drago F, Leoni L, Bronzetti G, Sarubbi B, Porcedda G. Premature Ventricular Complexes in Children with Structurally Normal Hearts: Clinical Review and Recommendations for Diagnosis and Treatment. Minerva Pediatr . 2017;69(5):427–433. doi: 10.23736/S0026-4946.17.05031-9. [DOI] [PubMed] [Google Scholar]
- 566.Wiles HB. Exercise Testing for Arrhythmia: Children and Adolescents. Prog Pediatr Cardiol . 1993;2(2):51–60. doi: 10.1016/1058-9813(93)90018-U. [DOI] [Google Scholar]
- 567.Rozanski JJ, Dimich I, Steinfeld L, Kupersmith J. Maximal Exercise Stress Testing in Evaluation of Arrhythmias in Children: Results and Reproducibility. Am J Cardiol . 1979;43(5):951–956. doi: 10.1016/0002-9149(79)90358-8. [DOI] [PubMed] [Google Scholar]
- 568.Biondi EA. Focus on Diagnosis: Cardiac Arrhythmias in Children. Pediatr Rev . 2010;31(9):375–379. doi: 10.1542/pir.31-9-375. [DOI] [PubMed] [Google Scholar]
- 569.Draper DE, Giddins NG, McCort J, Gross GJ. Diagnostic Usefulness of Graded Exercise Testing in Pediatric Supraventricular Tachycardia. Can J Cardiol . 2009;25(7):407–410. doi: 10.1016/s0828-282x(09)70503-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 570.Vignati G, Annoni G. Characterization of Supraventricular Tachycardia in Infants: Clinical and Instrumental Diagnosis. Curr Pharm Des . 2008;14(8):729–735. doi: 10.2174/138161208784007752. [DOI] [PubMed] [Google Scholar]
- 571.Manole MD, Saladino RA. Emergency Department Management of the Pediatric Patient with Supraventricular Tachycardia. Pediatr Emerg Care . 2007;23(3):176–185. doi: 10.1097/PEC.0b013e318032904c. [DOI] [PubMed] [Google Scholar]
- 572.Kang KT, Etheridge SP, Kantoch MJ, Tisma-Dupanovic S, Bradley DJ, Balaji S, et al. Current Management of Focal Atrial Tachycardia in Children: A Multicenter Experience. Circ Arrhythm Electrophysiol . 2014;7(4):664–670. doi: 10.1161/CIRCEP.113.001423. [DOI] [PubMed] [Google Scholar]
- 573.Dohain AM, Lotfy W, Abdelmohsen G, Sobhy R, Abdelaziz O, Elsaadany M, et al. Functional Recovery of Cardiomyopathy Induced by Atrial Tachycardia in Children: Insight from Cardiac Strain Imaging. Pacing Clin Electrophysiol . 2021;44(3):442–450. doi: 10.1111/pace.14186. [DOI] [PubMed] [Google Scholar]
- 574.Kylat RI, Samson RA. Junctional Ectopic Tachycardia in Infants and Children. J Arrhythm . 2019;36(1):59–66. doi: 10.1002/joa3.12282. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 575.Wallace MJ, El Refaey M, Mesirca P, Hund TJ, Mangoni ME, Mohler PJ. Genetic Complexity of Sinoatrial Node Dysfunction. Front Genet . 2021;12:654925–654925. doi: 10.3389/fgene.2021.654925. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 576.Semelka M, Gera J, Usman S. Sick Sinus Syndrome: A Review. Am Fam Physician . 2013;87(10):691–696. [PubMed] [Google Scholar]
- 577.Hawks MK, Paul MLB, Malu OO. Sinus Node Dysfunction. Am Fam Physician . 2021;104(2):179–185. [PubMed] [Google Scholar]
- 578.Baruteau AE, Perry JC, Sanatani S, Horie M, Dubin AM. Evaluation and Management of Bradycardia in Neonates and Children. Eur J Pediatr . 2016;175(2):151–161. doi: 10.1007/s00431-015-2689-z. [DOI] [PubMed] [Google Scholar]
- 579.Drago F, Battipaglia I, Di Mambro C. Neonatal and Pediatric Arrhythmias: Clinical and Electrocardiographic Aspects. Card Electrophysiol Clin . 2018;10(2):397–412. doi: 10.1016/j.ccep.2018.02.008. [DOI] [PubMed] [Google Scholar]
- 580.Joung B, Chen PS. Function and Dysfunction of Human Sinoatrial Node. Korean Circ J . 2015;45(3):184–191. doi: 10.4070/kcj.2015.45.3.184. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 581.Manoj P, Kim JA, Kim S, Li T, Sewani M, Chelu MG, et al. Sinus Node Dysfunction: Current Understanding and Future Directions. Am J Physiol Heart Circ Physiol . 2023;324(3):H259–h278. doi: 10.1152/ajpheart.00618.2022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 582.Shah MJ, Silka MJ, Silva JNA, Balaji S, Beach CM, Benjamin MN, et al. 2021 PACES Expert Consensus Statement on the Indications and Management of Cardiovascular Implantable Electronic Devices in Pediatric Patients. Cardiol Young . 2021;31(11):1738–1769. doi: 10.1017/S1047951121003413. [DOI] [PubMed] [Google Scholar]
- 583.Baruteau AE, Probst V, Abriel H. Inherited Progressive Cardiac Conduction Disorders. Curr Opin Cardiol . 2015;30(1):33–39. doi: 10.1097/HCO.0000000000000134. [DOI] [PubMed] [Google Scholar]
- 584.Villarreal-Molina T, García-Ordóñez GP, Reyes-Quintero ÁE, Domínguez-Pérez M, Jacobo-Albavera L, Nava S, et al. Clinical Spectrum of SCN5A Channelopathy in Children with Primary Electrical Disease and Structurally Normal Hearts. Genes . 2021;13(1):16–16. doi: 10.3390/genes13010016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 585.Mangrum JM, DiMarco JP. The Evaluation and Management of Bradycardia. N Engl J Med . 2000;342(10):703–709. doi: 10.1056/NEJM200003093421006. [DOI] [PubMed] [Google Scholar]
- 586.Norozi K, Wessel A, Alpers V, Arnhold JO, Geyer S, Zoege M, et al. Incidence and Risk Distribution of Heart Failure in Adolescents and Adults with Congenital Heart Disease after Cardiac Surgery. Am J Cardiol . 2006;97(8):1238–1243. doi: 10.1016/j.amjcard.2005.10.065. [DOI] [PubMed] [Google Scholar]
- 587.Reybrouck T, Weymans M, Stijns H, van der Hauwaert LG. Exercise Testing after Correction of Tetralogy of Fallot: The Fallacy of a Reduced Heart Rate Response. Am Heart J . 1986;112(5):998–1003. doi: 10.1016/0002-8703(86)90312-1. [DOI] [PubMed] [Google Scholar]
- 588.Takken T, Tacken MH, Blank AC, Hulzebos EH, Strengers JL, Helders PJ. Exercise Limitation in Patients with Fontan Circulation: A Review. J Cardiovasc Med . 2007;8(10):775–781. doi: 10.2459/JCM.0b013e328011c999. [DOI] [PubMed] [Google Scholar]
- 589.Massin MM, Dessy H, Malekzadeh-Milani SG, Khaldi K, Topac B, Edelman R. Chronotropic Impairment after Surgical or Percutaneous Closure of Atrial Septal Defect. Catheter Cardiovasc Interv . 2009;73(4):564–567. doi: 10.1002/ccd.21857. [DOI] [PubMed] [Google Scholar]
- 590.Pfammatter JP, Zanolari M, Schibler A. Cardiopulmonary Exercise Parameters in Children with Atrial Septal Defect and Increased Pulmonary Blood Flow: Short-Term Effects of Defect Closure. Acta Paediatr . 2002;91(1):65–70. doi: 10.1080/080352502753457987. [DOI] [PubMed] [Google Scholar]
- 591.Hock J, Häcker AL, Reiner B, Oberhoffer R, Hager A, Ewert P, et al. Functional Outcome in Contemporary Children and Young Adults with Tetralogy of Fallot after Repair. Arch Dis Child . 2019;104(2):129–133. doi: 10.1136/archdischild-2017-314733. [DOI] [PubMed] [Google Scholar]
- 592.Zajac A, Tomkiewicz L, Podolec P, Tracz W, Malec E. Cardiorespiratory Response to Exercise in Children after Modified Fontan Operation. Scand Cardiovasc J . 2002;36(2):80–85. doi: 10.1080/140174302753675348. [DOI] [PubMed] [Google Scholar]
- 593.Talavera MM, Manso B, Ramos PC, Puras MJR, Rodriguez AJW, Vinuesa PGG. Determinants of Oxygen Uptake and Prognostic Factors in Cardiopulmonary Exercise Test in Patients with Fontan Surgery. Cardiol Young . 2022;32(8):1285–1288. doi: 10.1017/S1047951121004054. [DOI] [PubMed] [Google Scholar]
- 594.American Thoracic Society; American College of Chest Physicians ATS/ACCP Statement on Cardiopulmonary Exercise Testing. Am J Respir Crit Care Med . 2003;167(2):211–277. doi: 10.1164/rccm.167.2.211. [DOI] [PubMed] [Google Scholar]
- 595.Takken T, Mylius CF, Paap D, Broeders W, Hulzebos HJ, Van Brussel M, et al. Reference Values for Cardiopulmonary Exercise Testing in Healthy Subjects - an Updated Systematic Review. Expert Rev Cardiovasc Ther . 2019;17(6):413–426. doi: 10.1080/14779072.2019.1627874. [DOI] [PubMed] [Google Scholar]
- 596.Blanchard J, Blais S, Chetaille P, Bisson M, Counil FP, Huard-Girard T, et al. New Reference Values for Cardiopulmonary Exercise Testing in Children. Med Sci Sports Exerc . 2018;50(6):1125–1133. doi: 10.1249/MSS.0000000000001559. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 597.Rodrigues AN, Perez AJ, Carletti L, Bissoli NS, Abreu GR. Maximum Oxygen Uptake in Adolescents as Measured by Cardiopulmonary Exercise Testing: A Classification Proposal. J Pediatr . 2006;82(6):426–430. doi: 10.2223/JPED.1533. [DOI] [PubMed] [Google Scholar]
- 598.Boisseau N, Delamarche P. Metabolic and Hormonal Responses to Exercise in Children and Adolescents. Sports Med . 2000;30(6):405–422. doi: 10.2165/00007256-200030060-00003. [DOI] [PubMed] [Google Scholar]
- 599.Prado DM, Dias RG, Trombetta IC. Cardiovascular, Ventilatory, and Metabolic Parameters During Exercise: Differences between Children and Adults. Arq Bras Cardiol . 2006;87(4):e149–e155. doi: 10.1590/s0066-782x2006001700035. [DOI] [PubMed] [Google Scholar]
- 600.Almeida PF, Neto, Silva LFD, Miarka B, Medeiros JA, Medeiros RCDSC, Teixeira RPA, et al. Influence of Advancing Biological Maturation on Aerobic and Anaerobic Power and on Sport Performance of Junior Rowers: A Longitudinal Study. Front Physiol . 2022;13:892966–892966. doi: 10.3389/fphys.2022.892966. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 601.Mero A, Jaakkola L, Komi PV. Relationships between Muscle Fibre Characteristics and Physical Performance Capacity in Trained Athletic Boys. J Sports Sci . 1991;9(2):161–171. doi: 10.1080/02640419108729877. [DOI] [PubMed] [Google Scholar]
- 602.Fellmann N, Coudert J. Physiology of Muscular Exercise in Children. Arch Pediatr . 1994;1(9):827–840. [PubMed] [Google Scholar]
- 603.Rowland TW, Auchinachie JA, Keenan TJ, Green GM. Physiologic Responses to Treadmill Running in Adult and Prepubertal Males. Int J Sports Med . 1987;8(4):292–297. doi: 10.1055/s-2008-1025672. [DOI] [PubMed] [Google Scholar]
- 604.Bessa AL, Oliveira VN, Agostini GG, Oliveira RJ, Oliveira AC, White GE, et al. Exercise Intensity and Recovery: Biomarkers of Injury, Inflammation, and Oxidative Stress. J Strength Cond Res . 2016;30(2):311–319. doi: 10.1519/JSC.0b013e31828f1ee9. [DOI] [PubMed] [Google Scholar]
- 605.Guth LM, Rogowski MP, Guilkey JP, Mahon AD. Carbohydrate Consumption and Variable-Intensity Exercise Responses in Boys and Men. Eur J Appl Physiol . 2019;119(4):1019–1027. doi: 10.1007/s00421-019-04091-z. [DOI] [PubMed] [Google Scholar]
- 606.Montfort-Steiger V, Williams CA. Carbohydrate Intake Considerations for Young Athletes. J Sports Sci Med . 2007;6(3):343–352. [PMC free article] [PubMed] [Google Scholar]
- 607.Isacco L, Duché P, Boisseau N. Influence of Hormonal Status on Substrate Utilization at Rest and During Exercise in the Female Population. Sports Med . 2012;42(4):327–342. doi: 10.2165/11598900-000000000-00000. [DOI] [PubMed] [Google Scholar]
- 608.Xu Y, Wen Z, Deng K, Li R, Yu Q, Xiao SM. Relationships of Sex Hormones with Muscle Mass and Muscle Strength in Male Adolescents at Different Stages of Puberty. PLoS One . 2021;16(12):e0260521. doi: 10.1371/journal.pone.0260521. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 609.Almeida PF, Neto, Dantas PMS, Pinto VCM, Cesário TM, Campos NMR, Santana EE, et al. Biological Maturation and Hormonal Markers, Relationship to Neuromotor Performance in Female Children. Int J Environ Res Public Health . 2020;17(9):3277–3277. doi: 10.3390/ijerph17093277. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 610.Amedro P, Guillaumont S, Bredy C, Matecki S, Gavotto A. Atrial Septal Defect and Exercise Capacity: Value of Cardio-Pulmonary Exercise Test in Assessment and Follow-Up. J Thorac Dis . 2018;10(Suppl 24):S2864–S2873. doi: 10.21037/jtd.2017.11.30. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 611.Das BB. A Systematic Approach for the Interpretation of Cardiopulmonary Exercise Testing in Children with Focus on Cardiovascular Diseases. J Cardiovasc Dev Dis . 2023;10(4):178–178. doi: 10.3390/jcdd10040178. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 612.Tang Y, Luo Q, Liu Z, Ma X, Zhao Z, Huang Z, et al. Oxygen Uptake Efficiency Slope Predicts Poor Outcome in Patients with Idiopathic Pulmonary Arterial Hypertension. J Am Heart Assoc . 2017;6(7):e005037. doi: 10.1161/JAHA.116.005037. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 613.Bongers BC, Hulzebos HJ, Blank AC, van Brussel M, Takken T. The Oxygen Uptake Efficiency Slope in Children with Congenital Heart Disease: Construct and Group Validity. Eur J Cardiovasc Prev Rehabil . 2011;18(3):384–392. doi: 10.1177/1741826710389390. [DOI] [PubMed] [Google Scholar]
- 614.Akkerman M, van Brussel M, Bongers BC, Hulzebos EH, Helders PJ, Takken T. Oxygen Uptake Efficiency Slope in Healthy Children. Pediatr Exerc Sci . 2010;22(3):431–441. doi: 10.1123/pes.22.3.431. [DOI] [PubMed] [Google Scholar]
- 615.Davies LC, Wensel R, Georgiadou P, Cicoira M, Coats AJ, Piepoli MF, et al. Enhanced Prognostic Value from Cardiopulmonary Exercise Testing in Chronic Heart Failure by Non-Linear Analysis: Oxygen Uptake Efficiency Slope. Eur Heart J . 2006;27(6):684–690. doi: 10.1093/eurheartj/ehi672. [DOI] [PubMed] [Google Scholar]
- 616.Baba R, Kubo N, Morotome Y, Iwagaki S. Reproducibility of the Oxygen Uptake Efficiency Slope in Normal Healthy Subjects. J Sports Med Phys Fitness . 1999;39(3):202–206. [PubMed] [Google Scholar]
- 617.van Laethem C, Bartunek J, Goethals M, Nellens P, Andries E, Vanderheyden M. Oxygen Uptake Efficiency Slope, a New Submaximal Parameter in Evaluating Exercise Capacity in Chronic Heart Failure Patients. Am Heart J . 2005;149(1):175–180. doi: 10.1016/j.ahj.2004.07.004. [DOI] [PubMed] [Google Scholar]
- 618.van Laethem C, De Sutter J, Peersman W, Calders P. Intratest Reliability and Test-Retest Reproducibility of the Oxygen Uptake Efficiency Slope in Healthy Participants. Eur J Cardiovasc Prev Rehabil . 2009;16(4):493–498. doi: 10.1097/HJR.0b013e32832c88a8. [DOI] [PubMed] [Google Scholar]
- 619.Hollenberg M, Tager IB. Oxygen Uptake Efficiency Slope: An Index of Exercise Performance and Cardiopulmonary Reserve Requiring Only Submaximal Exercise. J Am Coll Cardiol . 2000;36(1):194–201. doi: 10.1016/s0735-1097(00)00691-4. [DOI] [PubMed] [Google Scholar]
- 620.Sun XG, Hansen JE, Stringer WW. Oxygen Uptake Efficiency Plateau Best Predicts Early Death in Heart Failure. Chest . 2012;141(5):1284–1294. doi: 10.1378/chest.11-1270. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 621.Sun XG, Hansen JE, Stringer WW. Oxygen Uptake Efficiency Plateau: Physiology and Reference Values. Eur J Appl Physiol . 2012;112(3):919–928. doi: 10.1007/s00421-011-2030-0. [DOI] [PubMed] [Google Scholar]
- 622.Bongers BC, Hulzebos EH, Helbing WA, Harkel ADT, van Brussel M, Takken T. Response Profiles of Oxygen Uptake Efficiency During Exercise in Healthy Children. Eur J Prev Cardiol . 2016;23(8):865–873. doi: 10.1177/2047487315611769. [DOI] [PubMed] [Google Scholar]
- 623.Hossri CA, Souza IPA, Oliveira JS, Mastrocola LE. Assessment of Oxygen-Uptake Efficiency Slope in Healthy Children and Children with Heart Disease: Generation of Appropriate Reference Values for the OUES Variable. Eur J Prev Cardiol . 2019;26(2):177–184. doi: 10.1177/2047487318807977. [DOI] [PubMed] [Google Scholar]
- 624.Gavotto A, Vandenberghe D, Abassi H, Huguet H, Macioce V, Picot MC, et al. Oxygen Uptake Efficiency Slope: A Reliable Surrogate Parameter for Exercise Capacity in Healthy and Cardiac Children? Arch Dis Child . 2020;105(12):1167–1174. doi: 10.1136/archdischild-2019-317724. [DOI] [PubMed] [Google Scholar]
- 625.Tsai YJ, Li MH, Tsai WJ, Tuan SH, Liao TY, Lin KL. Oxygen Uptake Efficiency Slope and Peak Oxygen Consumption Predict Prognosis in Children with Tetralogy of Fallot. Eur J Prev Cardiol . 2016;23(10):1045–1050. doi: 10.1177/2047487315623405. [DOI] [PubMed] [Google Scholar]
- 626.Los Monteros CTE, Van der Palen RLF, Hazekamp MG, Rammeloo L, Jongbloed MRM, Blom NA, ET AL. Oxygen Uptake Efficiency Slope is Strongly Correlated to VO2peak Long-Term after Arterial Switch Operation. Pediatr Cardiol . 2021;42(4):866–874. doi: 10.1007/s00246-021-02554-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 627.Gavotto A, Huguet H, Picot MC, Guillaumont S, Matecki S, Amedro P. The VE/VCo2Slope: A Useful Tool to Evaluate the Physiological Status of Children with Congenital Heart Disease. J Appl Physiol . 2020;129(5):1102–1110. doi: 10.1152/japplphysiol.00520.2020. [DOI] [PubMed] [Google Scholar]
- 628.Borel B, Leclair E, Thevenet D, Beghin L, Gottrand F, Fabre C. Mechanical Ventilatory Constraints During Incremental Exercise in Healthy and Cystic Fibrosis Children. Pediatr Pulmonol . 2014;49(3):221–229. doi: 10.1002/ppul.22804. [DOI] [PubMed] [Google Scholar]
- 629.Toma N, Bicescu G, Enache R, Dragoi R, Cinteza M. Cardiopulmonary Exercise Testing in Differential Diagnosis of Dyspnea. Maedica . 2010;5(3):214–218. [PMC free article] [PubMed] [Google Scholar]
- 630.Rowland TW, Rowland TW. Children's Exercise Physiology . 2nd ed. Champaign: Human Kinetics; 2005. ISBN-10: 0736051449; ISBN-13: 978-0736051446. [Google Scholar]
- 631.Cooper CB, Storer TW. Exercise Testing and Interpretation: A Practical Approach . Cambridge: Cambridge University Press; 2001. ISBN-13: 978-0521648424. [Google Scholar]
- 632.Guirgis L, Khraiche D, Ladouceur M, Iserin L, Bonnet D, Legendre A. Cardiac Performance Assessment During Cardiopulmonary Exercise Test can Improve the Management of Children with Repaired Congenital Heart Disease. Int J Cardiol . 2020;300:121–126. doi: 10.1016/j.ijcard.2019.10.032. [DOI] [PubMed] [Google Scholar]
- 633.Mestre NM, Reychler G, Goubau C, Moniotte S. Correlation between Cardiopulmonary Exercise Test, Spirometry, and Congenital Heart Disease Severity in Pediatric Population. Pediatr Cardiol . 2019;40(4):871–877. doi: 10.1007/s00246-019-02084-5. [DOI] [PubMed] [Google Scholar]
- 634.Geva T, Martins JD, Wald RM. Atrial Septal Defects. Lancet . 2014;383(9932):1921–1932. doi: 10.1016/S0140-6736(13)62145-5. [DOI] [PubMed] [Google Scholar]
- 635.Alkashkari W, Albugami S, Hijazi ZM. Current Practice in Atrial Septal Defect Occlusion in Children and Adults. Expert Rev Cardiovasc Ther . 2020;18(6):315–329. doi: 10.1080/14779072.2020.1767595. [DOI] [PubMed] [Google Scholar]
- 636.Anbarasan S, Swaminathan N, Shankar GR, Majella J CM. Electrocardiographic Changes in Ostium Secundum Atrial Septal Defect- before and after Shunt Closure- A Retrospective Cohort Analysis. J Assoc Physicians India . 2022;70(1):11–12. [PubMed] [Google Scholar]
- 637.Kharouf R, Luxenberg DM, Khalid O, Abdulla R. Atrial Septal Defect: Spectrum of Care. Pediatr Cardiol . 2008;29(2):271–280. doi: 10.1007/s00246-007-9052-8. [DOI] [PubMed] [Google Scholar]
- 638.Schenck MH, Sterba R, Foreman CK, Latson LA. Improvement in Noninvasive Electrophysiologic Findings in Children after Transcatheter Atrial Septal Defect Closure. Am J Cardiol . 1995;76(10):695–698. doi: 10.1016/s0002-9149(99)80199-4. [DOI] [PubMed] [Google Scholar]
- 639.Di Bernardo S, Berger F, Fasnacht M, Bauersfeld U. Impact of Right Ventricular Size on ECG after Percutaneous Closure of Atrial Septal Defect with Amplatzer Septal Occluder. Swiss Med Wkly . 2005;135(43-44):647–651. doi: 10.4414/smw.2005.11067. [DOI] [PubMed] [Google Scholar]
- 640.Jost CHA, Connolly HM, Danielson GK, Bailey KR, Schaff HV, Shen WK, et al. Sinus Venosus Atrial Septal Defect: Long-Term Postoperative Outcome for 115 Patients. Circulation . 2005;112(13):1953–1958. doi: 10.1161/CIRCULATIONAHA.104.493775. [DOI] [PubMed] [Google Scholar]
- 641.Rhodes J, Patel H, Hijazi ZM. Effect of Transcatheter Closure of Atrial Septal Defect on the Cardiopulmonary Response to Exercise. Am J Cardiol . 2002;90(7):803–806. doi: 10.1016/s0002-9149(02)02620-6. [DOI] [PubMed] [Google Scholar]
- 642.van de Bruaene A, de Meester P, Buys R, Vanhees L, Delcroix M, Voigt JU, et al. Right Ventricular Load and Function During Exercise in Patients with Open and Closed Atrial Septal Defect Type Secundum. Eur J Prev Cardiol . 2013;20(4):597–604. doi: 10.1177/2047487312444372. [DOI] [PubMed] [Google Scholar]
- 643.Matthys D. Pre- and Postoperative Exercise Testing of the Child with Atrial Septal Defect. Pediatr Cardiol . 1999;20(1):22–25. doi: 10.1007/s002469900387. [DOI] [PubMed] [Google Scholar]
- 644.Cuypers JA, Opić P, Menting ME, Utens EM, Witsenburg M, Helbing WA, et al. The Unnatural History of an Atrial Septal Defect: Longitudinal 35 Year Follow Up after Surgical Closure at Young Age. Heart . 2013;99(18):1346–1352. doi: 10.1136/heartjnl-2013-304225. [DOI] [PubMed] [Google Scholar]
- 645.Roos-Hesselink JW, Meijboom FJ, Spitaels SE, van Domburg R, van Rijen EH, Utens EM, et al. Excellent Survival and Low Incidence of Arrhythmias, Stroke and Heart Failure Long-Term after Surgical ASD Closure at Young Age. A Prospective Follow-Up Study of 21-33 Years. Eur Heart J . 2003;24(2):190–197. doi: 10.1016/s0195-668x(02)00383-4. [DOI] [PubMed] [Google Scholar]
- 646.Hirth A, Reybrouck T, Bjarnason-Wehrens B, Lawrenz W, Hoffmann A. Recommendations for Participation in Competitive and Leisure Sports in Patients with Congenital Heart Disease: A Consensus Document. Eur J Cardiovasc Prev Rehabil . 2006;13(3):293–299. doi: 10.1097/01.hjr.0000220574.22195.d6. [DOI] [PubMed] [Google Scholar]
- 647.Jategaonkar S, Scholtz W, Schmidt H, Fassbender D, Horstkotte D. Cardiac Remodeling and Effects on Exercise Capacity after Interventional Closure of Atrial Septal Defects in Different Adult Age Groups. Clin Res Cardiol . 2010;99(3):183–191. doi: 10.1007/s00392-009-0105-2. [DOI] [PubMed] [Google Scholar]
- 648.Möller T, Brun H, Fredriksen PM, Holmstrøm H, Peersen K, Pettersen E, et al. Right Ventricular Systolic Pressure Response During Exercise in Adolescents Born with Atrial or Ventricular Septal Defect. Am J Cardiol . 2010;105(11):1610–1616. doi: 10.1016/j.amjcard.2010.01.024. [DOI] [PubMed] [Google Scholar]
- 649.Huysmans HA, Vrakking M, van Boven WJ. Late Follow-Up after Surgical Correction of Atrial Septal Defect of the Secundum Type. Z Kardiol . 1989;78(Suppl 7):43–45. [PubMed] [Google Scholar]
- 650.Mandelik J, Moodie DS, Sterba R, Murphy D, Rosenkranz E, Medendorp S, et al. Long-Term Follow-Up of Children after Repair of Atrial Septal Defects. Cleve Clin J Med . 1994;61(1):29–33. doi: 10.3949/ccjm.61.1.29. [DOI] [PubMed] [Google Scholar]
- 651.Xu YJ, Qiu XB, Yuan F, Shi HY, Xu L, Hou XM, et al. Prevalence and Spectrum of NKX2.5 Mutations in Patients with Congenital Atrial Septal Defect and Atrioventricular Block. Mol Med Rep . 2017;15(4):2247–2254. doi: 10.3892/mmr.2017.6249. [DOI] [PubMed] [Google Scholar]
- 652.Komar M, Przewłocki T, Olszowska M, Sobień B, Stępniewski J, Podolec J, et al. Conduction Abnormality and Arrhythmia after Transcatheter Closure of Atrial Septal Defect. Circ J . 2014;78(10):2415–2421. doi: 10.1253/circj.CJ-14-0456. [DOI] [PubMed] [Google Scholar]
- 653.Al-Anani SJ, Weber H, Hijazi ZM. Atrioventricular Block after Transcatheter ASD Closure using the Amplatzer Septal Occluder: Risk Factors and Recommendations. Catheter Cardiovasc Interv . 2010;75(5):767–772. doi: 10.1002/ccd.22359. [DOI] [PubMed] [Google Scholar]
- 654.Jin M, Ding WH, Wang XF, Guo BJ, Liang YM, Xiao YY, et al. Value of the Ratio of Occluder Versus Atrial Septal Length for Predicting Arrhythmia Occurrence after Transcatheter Closure in Children with Ostium Secundum Atrial Septal Defect. Chin Med J . 2015;128(12):1574–1578. doi: 10.4103/0366-6999.158291. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 655.Cenk M, Akalın F, Şaylan BÇ, Ak K. P Wave Dispersion in Assessment of Dysrhythmia Risk in Patients with Secundum Type Atrial Septal Defect and the Effect of Transcatheter or Surgical Closure. Cardiol Young . 2020;30(2):263–270. doi: 10.1017/S1047951119002828. [DOI] [PubMed] [Google Scholar]
- 656.Kamphuis VP, Nassif M, Man SC, Swenne CA, Kors JA, Vink AS, et al. Electrical Remodeling after Percutaneous Atrial Septal Defect Closure in Pediatric and Adult Patients. Int J Cardiol . 2019;285:32–39. doi: 10.1016/j.ijcard.2019.02.020. [DOI] [PubMed] [Google Scholar]
- 657.Javadzadegan H, Toufan M, Sadighi AR, Chang JM, Nader ND. Comparative Effects of Surgical and Percutaneous Repair on P-Wave and Atrioventricular Conduction in Patients with Atrial Septal Defect--Ostium Secundum Type. Cardiol Young . 2013;23(1):132–137. doi: 10.1017/S1047951112000418. [DOI] [PubMed] [Google Scholar]
- 658.Grignani RT, Tolentino KM, Rajgor DD, Quek SC. Longitudinal Evaluation of P-Wave Dispersion and P-Wave Maximum in Children after Transcatheter Device Closure of Secundum Atrial Septal Defect. Pediatr Cardiol . 2015;36(5):1050–1056. doi: 10.1007/s00246-015-1119-3. [DOI] [PubMed] [Google Scholar]
- 659.Roushdy AM, Attia H, Nossir H. Immediate and Short Term Effects of Percutaneous Atrial Septal Defect Device Closure on Cardiac Electrical Remodeling in Children. Egypt Heart J . 2018;70(4):243–247. doi: 10.1016/j.ehj.2018.02.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 660.Kaya MG, Baykan A, Dogan A, Inanc T, Gunebakmaz O, Dogdu O, et al. Intermediate-Term Effects of Transcatheter Secundum Atrial Septal Defect Closure on Cardiac Remodeling in Children and Adults. Pediatr Cardiol . 2010;31(4):474–482. doi: 10.1007/s00246-009-9623-y. [DOI] [PubMed] [Google Scholar]
- 661.Baspinar O, Sucu M, Koruk S, Kervancioglu M, Ustunsoy H, Deniz H, et al. P-Wave Dispersion between Transcatheter and Surgical Closure of Secundum-Type Atrial Septal Defect in Childhood. Cardiol Young . 2011;21(1):15–18. doi: 10.1017/S1047951110001307. [DOI] [PubMed] [Google Scholar]
- 662.Asakai H, Weskamp S, Eastaugh L, d’Udekem Y, Pflaumer A. Atrioventricular Block after ASD Closure. Heart Asia . 2016;8(2):26–31. doi: 10.1136/heartasia-2016-010745. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 663.Karwot B, Białkowski J, Szkutnik M, Zyła-Frycz M, Skiba A, Kusa J, et al. Iatrogenic Cardiac Arrhythmias Following Transcatheter or Surgical Closure of Atrial Septal Defect in Children. Kardiol Pol . 2005;62(1):35–43. [PubMed] [Google Scholar]
- 664.Norozi K, Gravenhorst V, Hobbiebrunken E, Wessel A. Normality of Cardiopulmonary Capacity in Children Operated on to Correct Congenital Heart Defects. Arch Pediatr Adolesc Med . 2005;159(11):1063–1068. doi: 10.1001/archpedi.159.11.1063. [DOI] [PubMed] [Google Scholar]
- 665.Fredriksen PM, Veldtman G, Hechter S, Therrien J, Chen A, Warsi MA, et al. Aerobic Capacity in Adults with Various Congenital Heart Diseases. Am J Cardiol . 2001;87(3):310–314. doi: 10.1016/s0002-9149(00)01364-3. [DOI] [PubMed] [Google Scholar]
- 666.Kobayashi Y, Nakanishi N, Kosakai Y. Pre- and Postoperative Exercise Capacity Associated with Hemodynamics in Adult Patients with Atrial Septal Defect: A Retrospective Study. Eur J Cardiothorac Surg . 1997;11(6):1062–1066. doi: 10.1016/s1010-7940(96)01131-1. [DOI] [PubMed] [Google Scholar]
- 667.Menting ME, van den Bosch AE, McGhie JS, Cuypers JA, Witsenburg M, Geleijnse ML, et al. Ventricular Myocardial Deformation in Adults after Early Surgical Repair of Atrial Septal Defect. Eur Heart J Cardiovasc Imaging . 2015;16(5):549–557. doi: 10.1093/ehjci/jeu273. [DOI] [PubMed] [Google Scholar]
- 668.Rozqie R, Satwiko MG, Anggrahini DW, Sadewa AH, Gunadi, Hartopo AB, et al. NKX2-5 Variants Screening in Patients with Atrial Septal Defect in Indonesia. BMC Med Genomics . 2022;15(1):91–91. doi: 10.1186/s12920-022-01242-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 669.Doğan E, Gerçeker E, Vuran G, Murat M, Karahan C, Zihni C, et al. Evaluation of Arrhythmia Prevalence, Management, and Risk Factors in Patients with Transcatheter and Surgically Closed Secundum Atrial Septal Defects. Turk Kardiyol Dern Ars . 2023;51(1):50–55. doi: 10.5543/tkda.2022.98384. [DOI] [PubMed] [Google Scholar]
- 670.Vecht JA, Saso S, Rao C, Dimopoulos K, Grapsa J, Terracciano CM, et al. Atrial Septal Defect Closure is Associated with a Reduced Prevalence of Atrial Tachyarrhythmia in the Short to Medium Term: A Systematic Review and Meta-Analysis. Heart . 2010;96(22):1789–1797. doi: 10.1136/hrt.2010.204933. [DOI] [PubMed] [Google Scholar]
- 671.Penny DJ, Vick GW., 3rd Ventricular Septal Defect. Lancet . 2011;377(9771):1103–1112. doi: 10.1016/S0140-6736(10)61339-6. [DOI] [PubMed] [Google Scholar]
- 672.Doshi U, Wang-Giuffre E. Congenital Heart Defects - Recent Advances . London: IntechOpen; 2022. Ventricular Septal Defects: A Review. [DOI] [Google Scholar]
- 673.Spicer DE, Hsu HH, Co-Vu J, Anderson RH, Fricker FJ. Ventricular Septal Defect. Orphanet J Rare Dis . 2014;9:144–144. doi: 10.1186/s13023-014-0144-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 674.Binkhorst M, van de Belt T, Hoog M, van Dijk A, Schokking M, Hopman M. Exercise Capacity and Participation of Children with a Ventricular Septal Defect. Am J Cardiol . 2008;102(8):1079–1084. doi: 10.1016/j.amjcard.2008.05.063. [DOI] [PubMed] [Google Scholar]
- 675.Gabriel HM, Heger M, Innerhofer P, Zehetgruber M, Mundigler G, Wimmer M, et al. Long-Term Outcome of Patients with Ventricular Septal Defect Considered not to Require Surgical Closure During Childhood. J Am Coll Cardiol . 2002;39(6):1066–1071. doi: 10.1016/s0735-1097(02)01706-0. [DOI] [PubMed] [Google Scholar]
- 676.Eckerström F, Rex CE, Maagaard M, Heiberg J, Rubak S, Redington A, et al. Cardiopulmonary Dysfunction in Adults with a Small, Unrepaired Ventricular Septal Defect: A Long-Term Follow-Up. Int J Cardiol . 2020;306:168–174. doi: 10.1016/j.ijcard.2020.02.069. [DOI] [PubMed] [Google Scholar]
- 677.Maagaard M, Heiberg J, Asschenfeldt B, Ringgaard S, Hjortdal VE. Does Functional Capacity Depend on the Size of the Shunt?. A Prospective, Cohort Study of Adults with Small, Unrepaired Ventricular Septal Defects. Eur J Cardiothorac Surg . 2017;51(4):722–727. doi: 10.1093/ejcts/ezw420. [DOI] [PubMed] [Google Scholar]
- 678.Wolfe RR, Bartle L, Daberkow E, Harrigan L. Exercise Responses in Ventricular Septal Defect. Prog Pediatr Cardiol . 1993;2(3):24–29. doi: 10.1016/1058-9813(93)90052-2. [DOI] [Google Scholar]
- 679.Latus H, Wagner I, Ostermayer S, Kerst G, Kreuder J, Schranz D, et al. Hemodynamic Evaluation of Children with Persistent or Recurrent Pulmonary Arterial Hypertension Following Complete Repair of Congenital Heart Disease. Pediatr Cardiol . 2017;38(7):1342–1349. doi: 10.1007/s00246-017-1667-9. [DOI] [PubMed] [Google Scholar]
- 680.Johnson BN, Fierro JL, Panitch HB. Pulmonary Manifestations of Congenital Heart Disease in Children. Pediatr Clin North Am . 2021;68(1):25–40. doi: 10.1016/j.pcl.2020.09.001. [DOI] [PubMed] [Google Scholar]
- 681.Shah SS, Mohanty S, Karande T, Maheshwari S, Kulkarni S, Saxena A. Guidelines for Physical Activity in Children with Heart Disease. Ann Pediatr Cardiol . 2022;15(5-6):467–488. doi: 10.4103/apc.apc_73_22. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 682.Frank DB, Hanna BD. Pulmonary Arterial Hypertension Associated with Congenital Heart Disease and Eisenmenger Syndrome: Current Practice in Pediatrics. Minerva Pediatr . 2015;67(2):169–185. [PMC free article] [PubMed] [Google Scholar]
- 683.Lei YQ, Lin WH, Lin SH, Xie WP, Liu JF, Chen Q, et al. Influence of Percutaneous Catheter Intervention for Congenital Perimembranous Ventricular Septal Defects in Children on the Cardiac Conduction System and Associated Risk Factors: a Meta-Analysis. J Cardiothorac Surg . 2022;17(1):19–19. doi: 10.1186/s13019-022-01751-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 684.Wu Z, Yang P, Xiang P, Ji X, Tian J, Li M. Left Anterior Fascicular Block after Transcatheter Closure of Ventricular Septal Defect in Children. Front Cardiovasc Med . 2021;8:609531–609531. doi: 10.3389/fcvm.2021.609531. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 685.Karadeniz C, Atalay S, Demir F, Tutar E, Ciftci O, Ucar T, et al. Does Surgically Induced Right Bundle Branch Block Really Effect Ventricular Function in Children after Ventricular Septal Defect Closure? Pediatr Cardiol . 2015;36(3):481–488. doi: 10.1007/s00246-014-1037-9. [DOI] [PubMed] [Google Scholar]
- 686.van Lier TA, Harinck E, Hitchcock JF, Moulaert AJ, van Mill GJ. Complete Right Bundle Branch Block after Surgical Closure of Perimembranous Ventricular Septal Defect. Relation to Type of Ventriculotomy. Eur Heart J . 1985;6(11):959–962. doi: 10.1093/oxfordjournals.eurheartj.a061794. [DOI] [PubMed] [Google Scholar]
- 687.Pedersen TA, Andersen NH, Knudsen MR, Christensen TD, Sørensen KE, Hjortdal VE. The Effects of Surgically Induced Right Bundle Branch Block on Left Ventricular Function after Closure of the Ventricular Septal Defect. Cardiol Young . 2008;18(4):430–436. doi: 10.1017/S1047951108002357. [DOI] [PubMed] [Google Scholar]
- 688.Houyel L, Vaksmann G, Fournier A, Davignon A. Ventricular Arrhythmias after Correction of Ventricular Septal Defects: Importance of Surgical Approach. J Am Coll Cardiol . 1990;16(5):1224–1228. doi: 10.1016/0735-1097(90)90557-6. [DOI] [PubMed] [Google Scholar]
- 689.Chen CA, Wang JK, Lin MT, Chiu HH, Hsu JY, Lin SM, et al. Exercise Capacity and Ventricular Remodeling after Transcatheter Ventricular Septal Defect Closure in Asymptomatic or Minimally Symptomatic Adolescents and Adults. Circ Cardiovasc Interv . 2020;13(6):e008813. doi: 10.1161/CIRCINTERVENTIONS.119.008813. [DOI] [PubMed] [Google Scholar]
- 690.Bergmann M, Germann CP, Nordmeyer J, Peters B, Berger F, Schubert S. Short- and Long-term Outcome after Interventional VSD Closure: A Single-Center Experience in Pediatric and Adult Patients. Pediatr Cardiol . 2021;42(1):78–88. doi: 10.1007/s00246-020-02456-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 691.Lu YS, Chou CC, Tseng YH, Lin KL, Chen CH, Chen YJ. Cardiopulmonary Functional Capacity in Taiwanese Children with Ventricular Septal Defects. Pediatr Neonatol . 2023;64(5):554–561. doi: 10.1016/j.pedneo.2023.02.003. [DOI] [PubMed] [Google Scholar]
- 692.Heuchan AM, Clyman RI. Managing the Patent Ductus Arteriosus: Current Treatment Options. Arch Dis Child Fetal Neonatal Ed . 2014;99(5):F431–F436. doi: 10.1136/archdischild-2014-306176. [DOI] [PubMed] [Google Scholar]
- 693.Backes CH, Hill KD, Shelton EL, Slaughter JL, Lewis TR, Weisz DE, et al. Patent Ductus Arteriosus: A Contemporary Perspective for the Pediatric and Adult Cardiac Care Provider. J Am Heart Assoc . 2022;11(17):e025784. doi: 10.1161/JAHA.122.025784. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 694.Stout KK, Daniels CJ, Aboulhosn JA, Bozkurt B, Broberg CS, Colman JM, et al. 2018 AHA/ACC Guideline for the Management of Adults with Congenital Heart Disease: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol . 2019;73(12):1494–1563. doi: 10.1016/j.jacc.2018.08.1028. [DOI] [PubMed] [Google Scholar]
- 695.Baumgartner H, De Backer J, Babu-Narayan SV, Budts W, Chessa M, Diller GP, et al. 2020 ESC Guidelines for the Management of Adult Congenital Heart Disease. Eur Heart J . 2021;42(6):563–645. doi: 10.1093/eurheartj/ehaa554. [DOI] [PubMed] [Google Scholar]
- 696.Sharma A, Parasa SK, Gudivada KK, Gopinath R. Differential Cyanosis and Undiagnosed Eisenmenger's Syndrome: The Importance of Pulse Oximetry. Anesth Essays Res . 2014;8(2):233–235. doi: 10.4103/0259-1162.134518. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 697.Bhalgat PS, Pinto R, Dalvi BV. Transcatheter Closure of Large Patent Ductus Arteriosus with Severe Pulmonary Arterial Hypertension: Short and Intermediate Term Results. Ann Pediatr Cardiol . 2012;5(2):135–140. doi: 10.4103/0974-2069.99614. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 698.Brandão LES, Silva RMFL, Lopes RM, Martins CN. Patent Ductus Arteriosus: Update Review. CA . 2020;9(4):5–14. doi: 10.9734/ca/2020/v9i430140. 2017. [DOI] [Google Scholar]
- 699.Rausch CM, Taylor AL, Ross H, Sillau S, Ivy DD. Ventilatory Efficiency Slope Correlates with Functional Capacity, Outcomes, and Disease Severity in Pediatric Patients with Pulmonary Hypertension. Int J Cardiol . 2013;169(6):445–448. doi: 10.1016/j.ijcard.2013.10.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 700.Huang HY, Wang SP, Tuan SH, Li MH, Lin KL. Cardiopulmonary Function Findings of Pediatric Patients with Patent Ductus Arteriosus. Medicine . 2021;100(35):e27099. doi: 10.1097/MD.0000000000027099. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 701.Engan M, Engeset MS, Sandvik L, Gamlemshaug OCO, Engesæter IØ, Øymar K, et al. Left Vocal Cord Paralysis, Lung Function and Exercise Capacity in Young Adults Born Extremely Preterm with a History of Neonatal Patent Ductus Arteriosus Surgery - a National Cohort Study. Front Pediatr . 2022;9:780045–780045. doi: 10.3389/fped.2021.780045. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 702.Røksund OD, Clemm H, Heimdal JH, Aukland SM, Sandvik L, Markestad T, et al. Left Vocal Cord Paralysis after Extreme Preterm Birth, a New Clinical Scenario in Adults. Pediatrics . 2010;126(6):e1569–e1577. doi: 10.1542/peds.2010-1129. [DOI] [PubMed] [Google Scholar]
- 703.Karl TR, Stocker C. Tetralogy of Fallot and Its Variants. Pediatr Crit Care Med . 2016;17(8 Suppl 1):S330–S336. doi: 10.1097/PCC.0000000000000831. [DOI] [PubMed] [Google Scholar]
- 704.Wilson R, Ross O, Griksaitis MJ. Tetralogy of Fallot. BJA Educ . 2019;19(11):362–369. doi: 10.1016/j.bjae.2019.07.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 705.Gupta U, Polimenakos AC, El-Zein C, Ilbawi MN. Tetralogy of Fallot with Atrioventricular Septal Defect: Surgical Strategies for Repair and Midterm Outcome of Pulmonary Valve-Sparing Approach. Pediatr Cardiol . 2013;34(4):861–871. doi: 10.1007/s00246-012-0558-3. [DOI] [PubMed] [Google Scholar]
- 706.Cohen MI, Khairy P, Zeppenfeld K, Van Hare GF, Lakkireddy DR, Triedman JK. Preventing Arrhythmic Death in Patients with Tetralogy of Fallot: JACC Review Topic of the Week. J Am Coll Cardiol . 2021;77(6):761–771. doi: 10.1016/j.jacc.2020.12.021. [DOI] [PubMed] [Google Scholar]
- 707.Possner M, Tseng SY, Alahdab F, Bokma JP, Lubert AM, Khairy P, et al. Risk Factors for Mortality and Ventricular Tachycardia in Patients with Repaired Tetralogy of Fallot: a Systematic Review and Meta-analysis. Can J Cardiol . 2020;36(11):1815–1825. doi: 10.1016/j.cjca.2020.01.023. [DOI] [PubMed] [Google Scholar]
- 708.Geva T, Mulder B, Gauvreau K, Babu-Narayan SV, Wald RM, Hickey K, et al. Preoperative Predictors of Death and Sustained Ventricular Tachycardia after Pulmonary Valve Replacement in Patients with Repaired Tetralogy of Fallot Enrolled in the INDICATOR Cohort. Circulation . 2018;138(19):2106–2115. doi: 10.1161/CIRCULATIONAHA.118.034740. [DOI] [PubMed] [Google Scholar]
- 709.Śpiewak M, Petryka-Mazurkiewicz J, Mazurkiewicz Ł, Miłosz-Wieczorek B, Kowalski M, Biernacka EK, et al. The Impact of Pulmonary Regurgitation on Right Ventricular Size and Function in Patients with Repaired Tetralogy of Fallot and Additional Haemodynamic Abnormalities. Pol J Radiol . 2020;85:e607–e612. doi: 10.5114/pjr.2020.101058. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 710.Villafañe J, Feinstein JA, Jenkins KJ, Vincent RN, Walsh EP, Dubin AM, et al. Hot Topics in Tetralogy of Fallot. J Am Coll Cardiol . 2013;62(23):2155–2166. doi: 10.1016/j.jacc.2013.07.100. [DOI] [PubMed] [Google Scholar]
- 711.Udink ten Cate FE, Sreeram N, Brockmeier K. The Pathophysiologic Aspects and Clinical Implications of Electrocardiographic Parameters of Ventricular Conduction Delay in Repaired Tetralogy of Fallot. J Electrocardiol . 2014;47(5):618–624. doi: 10.1016/j.jelectrocard.2014.07.005. [DOI] [PubMed] [Google Scholar]
- 712.Lumens J, Fan CS, Walmsley J, Yim D, Manlhiot C, Dragulescu A, et al. Relative Impact of Right Ventricular Electromechanical Dyssynchrony Versus Pulmonary Regurgitation on Right Ventricular Dysfunction and Exercise Intolerance in Patients after Repair of Tetralogy of Fallot. J Am Heart Assoc . 2019;8(2):e010903. doi: 10.1161/JAHA.118.010903. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 713.Kotby AA, Elnabawy HM, El-Guindy WM, Abd Elaziz RF. Assessment of Exercise Testing after Repair of Tetralogy of Fallot. ISRN Pediatr . 2012;2012:324306–324306. doi: 10.5402/2012/324306. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 714.Bhatt SM, Elci OU, Wang Y, Goldmuntz E, McBride M, Paridon S, et al. Determinants of Exercise Performance in Children and Adolescents with Repaired Tetralogy of Fallot using Stress Echocardiography. Pediatr Cardiol . 2019;40(1):71–78. doi: 10.1007/s00246-018-1962-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 715.Leonardi B, Gentili F, Perrone MA, Sollazzo F, Cocomello L, Kikina SS, et al. Cardiopulmonary Exercise Testing in Repaired Tetralogy of Fallot: Multiparametric Overview and Correlation with Cardiac Magnetic Resonance and Physical Activity Level. J Cardiovasc Dev Dis . 2022;9(1):26–26. doi: 10.3390/jcdd9010026. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 716.Alborikan S, Pandya B, Von Klemperer K, Walker F, Cullen S, Badiani S, et al. Cardiopulmonary Exercise Test (CPET) in Patients with Repaired Tetralogy of Fallot (Rtof); A Systematic Review. Int J Cardiol Congenit Heart Dis . 2020;1:100050–100050. doi: 10.1016/j.ijcchd.2020.100050. [DOI] [Google Scholar]
- 717.Leonardi B, Calvieri C, Perrone MA, Di Rocco A, Carotti A, Caputo M, et al. Risk Factors of Right Ventricular Dysfunction and Adverse Cardiac Events in Patients with Repaired Tetralogy of Fallot. Int J Environ Res Public Health . 2021;18(19):10549–10549. doi: 10.3390/ijerph181910549. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 718.Carvalho JS, Shinebourne EA, Busst C, Rigby ML, Redington AN. Exercise Capacity after Complete Repair of Tetralogy of Fallot: Deleterious Effects of Residual Pulmonary Regurgitation. Br Heart J . 1992;67(6):470–473. doi: 10.1136/hrt.67.6.470. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 719.Ercisli M, Vural KM, Gokkaya KN, Koseoglu F, Tufekcioglu O, Sener E, et al. Does Delayed Correction Interfere with Pulmonary Functions and Exercise Tolerance in Patients with Tetralogy of Fallot? Chest . 2005;128(2):1010–1017. doi: 10.1378/chest.128.2.1010. [DOI] [PubMed] [Google Scholar]
- 720.Chang YL, Kuan TH, Chen CH, Tsai YJ, Chen GB, Lin KL, et al. Differences in Cardiopulmonary Fitness between Boy and Girls with Repaired Tetralogy of Fallot. Front Pediatr . 2022;10:911825–911825. doi: 10.3389/fped.2022.911825. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 721.Samman A, Schwerzmann M, Balint OH, Tanous D, Redington A, Granton J, et al. Exercise Capacity and Biventricular Function in Adult Patients with Repaired Tetralogy of Fallot. Am Heart J . 2008;156(1):100–105. doi: 10.1016/j.ahj.2008.02.005. [DOI] [PubMed] [Google Scholar]
- 722.Meadows J, Powell AJ, Geva T, Dorfman A, Gauvreau K, Rhodes J. Cardiac Magnetic Resonance Imaging Correlates of Exercise Capacity in Patients with Surgically Repaired Tetralogy of Fallot. Am J Cardiol . 2007;100(9):1446–1450. doi: 10.1016/j.amjcard.2007.06.038. [DOI] [PubMed] [Google Scholar]
- 723.Haeffele C, Lui GK. Dextro-Transposition of the Great Arteries: Long-Term Sequelae of Atrial and Arterial Switch. Cardiol Clin . 2015;33(4):543–558. doi: 10.1016/j.ccl.2015.07.012. [DOI] [PubMed] [Google Scholar]
- 724.Warnes CA. Transposition of the Great Arteries. Circulation . 2006;114(24):2699–2709. doi: 10.1161/CIRCULATIONAHA.105.592352. [DOI] [PubMed] [Google Scholar]
- 725.Kutty S, Danford DA, Diller GP, Tutarel O. Contemporary Management and Outcomes in Congenitally Corrected Transposition of the Great Arteries. Heart . 2018;104(14):1148–1155. doi: 10.1136/heartjnl-2016-311032. [DOI] [PubMed] [Google Scholar]
- 726.Kirzner J, Pirmohamed A, Ginns J, Singh HS. Long-Term Management of the Arterial Switch Patient. Curr Cardiol Rep . 2018;20(8):68–68. doi: 10.1007/s11886-018-1012-9. [DOI] [PubMed] [Google Scholar]
- 727.Spigel Z, Binsalamah ZM, Caldarone C. Congenitally Corrected Transposition of the Great Arteries: Anatomic, Physiologic Repair, and Palliation. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu . 2019;22:32–42. doi: 10.1053/j.pcsu.2019.02.008. [DOI] [PubMed] [Google Scholar]
- 728.Khairy P, Clair M, Fernandes SM, Blume ED, Powell AJ, Newburger JW, et al. Cardiovascular Outcomes after the Arterial Switch Operation for D-Transposition of the Great Arteries. Circulation . 2013;127(3):331–339. doi: 10.1161/CIRCULATIONAHA.112.135046. [DOI] [PubMed] [Google Scholar]
- 729.Baysa SJ, Olen M, Kanter RJ. Arrhythmias Following the Mustard and Senning Operations for Dextro-Transposition of the Great Arteries: Clinical Aspects and Catheter Ablation. Card Electrophysiol Clin . 2017;9(2):255–271. doi: 10.1016/j.ccep.2017.02.008. [DOI] [PubMed] [Google Scholar]
- 730.Tsuda T, Bhat AM, Robinson BW, Baffa JM, Radtke W. Coronary Artery Problems Late after Arterial Switch Operation for Transposition of the Great Arteries. Circ J . 2015;79(11):2372–2379. doi: 10.1253/circj.CJ-15-0485. [DOI] [PubMed] [Google Scholar]
- 731.Hövels-Gürich HH, Kunz D, Seghaye M, Miskova M, Messmer BJ, von Bernuth G. Results of Exercise Testing at a Mean Age of 10 Years after Neonatal Arterial Switch Operation. Acta Paediatr . 2003;92(2):190–196. doi: 10.1111/j.1651-2227.2003.tb00525.x. [DOI] [PubMed] [Google Scholar]
- 732.Fredriksen PM, Pettersen E, Thaulow E. Declining Aerobic Capacity of Patients with Arterial and Atrial Switch Procedures. Pediatr Cardiol . 2009;30(2):166–171. doi: 10.1007/s00246-008-9291-3. [DOI] [PubMed] [Google Scholar]
- 733.Giardini A, Khambadkone S, Rizzo N, Riley G, Napoleone CP, Muthialu N, et al. Determinants of Exercise Capacity after Arterial Switch Operation for Transposition of the Great Arteries. Am J Cardiol . 2009;104(7):1007–1012. doi: 10.1016/j.amjcard.2009.05.046. [DOI] [PubMed] [Google Scholar]
- 734.Takajo D, Sriram CS, Mahadin D, Aggarwal S. Exercise Capacity after Arterial Switch Operation in Patients with D-Transposition of Great Arteries: Does the Coronary Artery Anatomy Matter? Pediatr Cardiol . 2022;43(8):1752–1760. doi: 10.1007/s00246-022-02912-1. [DOI] [PubMed] [Google Scholar]
- 735.Paul MH, Wessel HU. Exercise Studies in Patients with Transposition of the Great Arteries after Atrial Repair Operations (Mustard/Senning): A Review. Pediatr Cardiol . 1999;20(1):49–55. doi: 10.1007/s002469900395. [DOI] [PubMed] [Google Scholar]
- 736.Giardini A, Specchia S, Coutsoumbas G, Donti A, Gargiulo G, Bonvicini M, et al. Recovery Kinetics of Oxygen Uptake is Abnormally Prolonged in Patients with Mustard/Senning Repair for Transposition of the Great Arteries. Pediatr Cardiol . 2005;26(6):821–826. doi: 10.1007/s00246-005-0884-9. [DOI] [PubMed] [Google Scholar]
- 737.Buys R, Budts W, Reybrouck T, Gewillig M, Vanhees L. Serial Exercise Testing in Children, Adolescents and Young Adults with Senning Repair for Transposition of the Great Arteries. BMC Cardiovasc Disord . 2012;12:88–88. doi: 10.1186/1471-2261-12-88. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 738.Sabbah BN, Arabi TZ, Shafqat A, Abdul Rab S, Razak A, Albert-Brotons DC. Heart Failure in Systemic Right Ventricle: Mechanisms and Therapeutic Options. Front Cardiovasc Med . 2023;9:1064196–1064196. doi: 10.3389/fcvm.2022.1064196. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 739.Cuypers JA, Eindhoven JA, Slager MA, Opić P, Utens EM, Helbing WA, et al. The Natural and Unnatural History of the Mustard Procedure: Long-Term Outcome Up to 40 Years. Eur Heart J . 2014;35(25):1666–1674. doi: 10.1093/eurheartj/ehu102. [DOI] [PubMed] [Google Scholar]
- 740.Reybrouck T, Eyskens B, Mertens L, Defoor J, Daenen W, Gewillig M. Cardiorespiratory Exercise Function after the Arterial Switch Operation for Transposition of the Great Arteries. Eur Heart J . 2001;22(12):1052–1059. doi: 10.1053/euhj.2000.2425. [DOI] [PubMed] [Google Scholar]
- 741.Baldo MNF, Trad HS, Silva TJD, Jr, Manso PH. Evaluation of Coronary Circulation after Arterial Switch Operation. Arq Bras Cardiol . 2021;116(6):1111–1116. doi: 10.36660/abc.20200095. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 742.Kutty S, Jacobs ML, Thompson WR, Danford DA. Fontan Circulation of the Next Generation: Why It's Necessary, What it Might Look Like. J Am Heart Assoc . 2020;9(1):e013691. doi: 10.1161/JAHA.119.013691. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 743.Mazza GA, Gribaudo E, Agnoletti G. The Pathophysiology and Complications of Fontan Circulation. Acta Biomed . 2021;92(5):e2021260. doi: 10.23750/abm.v92i5.10893. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 744.Rychik J, Atz AM, Celermajer DS, Deal BJ, Gatzoulis MA, Gewillig MH, et al. Evaluation and Management of the Child and Adult with Fontan Circulation: A Scientific Statement from the American Heart Association. Circulation . 2019;140(6):e234–e284. doi: 10.1161/CIR.0000000000000696. [DOI] [PubMed] [Google Scholar]
- 745.Greenleaf CE, Lim ZN, Li W, LaPar DJ, Salazar JD, Corno AF. Impact on Clinical Outcomes from Transcatheter Closure of the Fontan Fenestration: A Systematic Review and Meta-Analysis. Front Pediatr . 2022;10:915045–915045. doi: 10.3389/fped.2022.915045. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 746.Mendel B, Christianto C, Setiawan M, Siagian SN, Prakoso R. Pharmacology Management in Improving Exercise Capacity of Patients with Fontan Circulation: A Systematic Review and Meta-analysis. Curr Cardiol Rev . 2022;18(5):34–49. doi: 10.2174/1573403X18666220404101610. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 747.Haley JE, Davis C. Exercising with a Single Ventricle: Limitations and Therapies. J Cardiovasc Dev Dis . 2022;9(6):167–167. doi: 10.3390/jcdd9060167. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 748.Udholm S, Aldweib N, Hjortdal VE, Veldtman GR. Prognostic Power of Cardiopulmonary Exercise Testing in Fontan Patients: A Systematic Review. Open Heart . 2018;5(1):e000812. doi: 10.1136/openhrt-2018-000812. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 749.Ohuchi H, Negishi J, Noritake K, Hayama Y, Sakaguchi H, Miyazaki A, et al. Prognostic Value of Exercise Variables in 335 Patients after the Fontan Operation: A 23-Year Single-Center Experience of Cardiopulmonary Exercise Testing. Congenit Heart Dis . 2015;10(2):105–116. doi: 10.1111/chd.12222. [DOI] [PubMed] [Google Scholar]
- 750.Scheffers LE, Berg LEMV, Ismailova G, Dulfer K, Takkenberg JJM, Helbing WA. Physical Exercise Training in Patients with a Fontan Circulation: A Systematic Review. Eur J Prev Cardiol . 2021;28(11):1269–1278. doi: 10.1177/2047487320942869. [DOI] [PubMed] [Google Scholar]
- 751.Driscoll DJ, Durongpisitkul K. Exercise Testing after the Fontan Operation. Pediatr Cardiol . 1999;20(1):57–59. doi: 10.1007/s002469900397. [DOI] [PubMed] [Google Scholar]
- 752.Tran DL, Gibson H, Maiorana AJ, Verrall CE, Baker DW, Clode M, et al. Exercise Intolerance, Benefits, and Prescription for People Living with a Fontan Circulation: The Fontan Fitness Intervention Trial (F-FIT)-Rationale and Design. Front Pediatr . 2022;9:799125–799125. doi: 10.3389/fped.2021.799125. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 753.Hedlund ER, Söderström L, Lundell B. Appropriate Heart Rate During Exercise in Fontan Patients. Cardiol Young . 2020;30(5):674–680. doi: 10.1017/S1047951120000761. [DOI] [PubMed] [Google Scholar]
- 754.Powell AW, Veldtman G. Heart Rate Responses During Exercise by Dominant Ventricle in Pediatric and Young Adult Patients with a Fontan Circulation. Can J Cardiol . 2020;36(9):1508–1515. doi: 10.1016/j.cjca.2019.10.042. [DOI] [PubMed] [Google Scholar]
- 755.La Gerche A, Gewillig M. What Limits Cardiac Performance during Exercise in Normal Subjects and in Healthy Fontan Patients? Int J Pediatr . 2010;2010:791291–791291. doi: 10.1155/2010/791291. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 756.Wong T, Davlouros PA, Li W, Millington-Sanders C, Francis DP, Gatzoulis MA. Mechano-Electrical Interaction Late after Fontan Operation: Relation between P-Wave Duration and Dispersion, Right Atrial Size, and Atrial Arrhythmias. Circulation . 2004;109(19):2319–2325. doi: 10.1161/01.CIR.0000129766.18065.DC. [DOI] [PubMed] [Google Scholar]
- 757.Tuzcu V, Ozkan B, Sullivan N, Karpawich P, Epstein ML. P Wave Signal-Averaged Electrocardiogram as a New Marker for Atrial Tachyarrhythmias in Postoperative Fontan Patients. J Am Coll Cardiol . 2000;36(2):602–607. doi: 10.1016/s0735-1097(00)00737-3. [DOI] [PubMed] [Google Scholar]
- 758.Stephenson EA, Lu M, Berul CI, Etheridge SP, Idriss SF, Margossian R, et al. Arrhythmias in a Contemporary Fontan Cohort: Prevalence and Clinical Associations in a Multicenter Cross-Sectional Study. J Am Coll Cardiol . 2010;56(11):890–896. doi: 10.1016/j.jacc.2010.03.079. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 759.Deal BJ. Late Arrhythmias Following Fontan Surgery. World J Pediatr Congenit Heart Surg . 2012;3(2):194–200. doi: 10.1177/2150135111436314. [DOI] [PubMed] [Google Scholar]
- 760.Rydberg A, Rask P, Teien DE, Hörnsten R. Electrocardiographic ST Segment Depression and Clinical Function in Children with Fontan Circulation. Pediatr Cardiol . 2003;24(5):468–472. doi: 10.1007/s00246-002-0374-2. [DOI] [PubMed] [Google Scholar]
- 761.Goldstein BH, Connor CE, Gooding L, Rocchini AP. Relation of Systemic Venous Return, Pulmonary Vascular Resistance, and Diastolic Dysfunction to Exercise Capacity in Patients with Single Ventricle Receiving Fontan Palliation. Am J Cardiol . 2010;105(8):1169–1175. doi: 10.1016/j.amjcard.2009.12.020. [DOI] [PubMed] [Google Scholar]
- 762.Diller GP, Giardini A, Dimopoulos K, Gargiulo G, Müller J, Derrick G, et al. Predictors of Morbidity and Mortality in Contemporary Fontan Patients: Results from a Multicenter Study Including Cardiopulmonary Exercise Testing in 321 Patients. Eur Heart J . 2010;31(24):3073–3083. doi: 10.1093/eurheartj/ehq356. [DOI] [PubMed] [Google Scholar]
- 763.de Los Monteros CTE, Harteveld LM, Kuipers IM, Rammeloo L, Hazekamp MG, Blom NA, et al. Prognostic Value of Maximal and Submaximal Exercise Performance in Fontan Patients <15 Years of Age. Am J Cardiol . 2021;154:92–98. doi: 10.1016/j.amjcard.2021.05.049. [DOI] [PubMed] [Google Scholar]
- 764.Nathan AS, Loukas B, Moko L, Wu F, Rhodes J, Rathod RH, et al. Exercise Oscillatory Ventilation in Patients with Fontan Physiology. Circ Heart Fail . 2015;8(2):304–311. doi: 10.1161/CIRCHEARTFAILURE.114.001749. [DOI] [PubMed] [Google Scholar]
- 765.Chen CA, Chen SY, Chiu HH, Wang JK, Chang CI, Chiu IS, et al. Prognostic Value of Submaximal Exercise Data for Cardiac Morbidity in Fontan Patients. Med Sci Sports Exerc . 2014;46(1):10–15. doi: 10.1249/MSS.0b013e31829f8326. [DOI] [PubMed] [Google Scholar]
- 766.Lipshultz SE, Law YM, Asante-Korang A, Austin ED, Dipchand AI, Everitt MD, et al. Cardiomyopathy in Children: Classification and Diagnosis: A Scientific Statement from the American Heart Association. Circulation . 2019;140(1):e9–e68. doi: 10.1161/CIR.0000000000000682. [DOI] [PubMed] [Google Scholar]
- 767.Monda E, Rubino M, Lioncino M, Di Fraia F, Pacileo R, Verrillo F, et al. Hypertrophic Cardiomyopathy in Children: Pathophysiology, Diagnosis, and Treatment of Non-sarcomeric Causes. Front Pediatr . 2021;9:632293–632293. doi: 10.3389/fped.2021.632293. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 768.Marian AJ, Braunwald E. Hypertrophic Cardiomyopathy: Genetics, Pathogenesis, Clinical Manifestations, Diagnosis, and Therapy. Circ Res . 2017;121(7):749–770. doi: 10.1161/CIRCRESAHA.117.311059. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 769.Norrish G, Kaski JP. The Risk of Sudden Death in Children with Hypertrophic Cardiomyopathy. Heart Fail Clin . 2022;18(1):9–18. doi: 10.1016/j.hfc.2021.07.012. [DOI] [PubMed] [Google Scholar]
- 770.Gallo G, Mastromarino V, Limongelli G, Calcagni G, Maruotti A, Ragni L, et al. Insights from Cardiopulmonary Exercise Testing in Pediatric Patients with Hypertrophic Cardiomyopathy. Biomolecules . 2021;11(3):376–376. doi: 10.3390/biom11030376. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 771.Ommen SR, Mital S, Burke MA, Day SM, Deswal A, Elliott P, et al. 2020 AHA/ACC Guideline for the Diagnosis and Treatment of Patients with Hypertrophic Cardiomyopathy: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation . 2020;142(25):e558–e631. doi: 10.1161/CIR.0000000000000937. [DOI] [PubMed] [Google Scholar]
- 772.Maskatia SA. Hypertrophic Cardiomyopathy: Infants, Children, and Adolescents. Congenit Heart Dis . 2012;7(1):84–92. doi: 10.1111/j.1747-0803.2011.00613.x. [DOI] [PubMed] [Google Scholar]
- 773.Edelson JB, Stanley HM, Min J, Burstein DS, Lane-Fall M, O’Malley S, et al. Cardiopulmonary Exercise Testing in Pediatric Patients With Hypertrophic Cardiomyopathy. JACC Adv . 2022;1(4):100107–100107. doi: 10.1016/j.jacadv.2022.100107. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 774.Edelson JB, Burstein D, Stanley H, Shah M, Mc Bride MW, Stephens P, et al. Abstract 13535: Cardiopulmonary Exercise Testing in Pediatric Patients with Hypertrophic Cardiomyopathy. Circulation . 2020;142(Suppl 3) doi: 10.1161/circ.142.suppl_3.13535. [DOI] [Google Scholar]
- 775.Thakkar K, Karajgi AR, Kallamvalappil AM, Avanthika C, Jhaveri S, Shandilya A, et al. Sudden Cardiac Death in Childhood Hypertrophic Cardiomyopathy. Dis Mon . 2023;69(4):101548–101548. doi: 10.1016/j.disamonth.2023.101548. [DOI] [PubMed] [Google Scholar]
- 776.Rajasekaran K, Duraiyarasan S, Adefuye M, Manjunatha N, Ganduri V. Kawasaki Disease and Coronary Artery Involvement: A Narrative Review. Cureus . 2022;14(8):e28358. doi: 10.7759/cureus.28358. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 777.Koyama Y, Miura M, Kobayashi T, Hokosaki T, Suganuma E, Numano F, et al. A Registry Study of Kawasaki Disease Patients with Coronary Artery Aneurysms (KIDCAR): A Report on a Multicenter Prospective Registry Study Three Years after Commencement. Eur J Pediatr . 2023;182(2):633–640. doi: 10.1007/s00431-022-04719-x. [DOI] [PubMed] [Google Scholar]
- 778.Brogan P, Burns JC, Cornish J, Diwakar V, Eleftheriou D, Gordon JB, et al. Lifetime Cardiovascular Management of Patients with Previous Kawasaki Disease. Heart . 2020;106(6):411–420. doi: 10.1136/heartjnl-2019-315925. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 779.Robinson C, Chanchlani R, Gayowsky A, Brar S, Darling E, Demers C, et al. Cardiovascular Outcomes in Children with Kawasaki Disease: A Population-Based Cohort Study. Pediatr Res . 2023;93(5):1267–1275. doi: 10.1038/s41390-022-02391-3. [DOI] [PubMed] [Google Scholar]
- 780.Tsuda E, Yamada O. Clinical Course and Outcomes in Patients with Left Ventricular Dysfunction Due to Myocardial Infarction after Kawasaki Disease. Pediatr Cardiol . 2023;44(1):187–195. doi: 10.1007/s00246-022-02971-4. [DOI] [PubMed] [Google Scholar]
- 781.Miura M, Kobayashi T, Kaneko T, Ayusawa M, Fukazawa R, Fukushima N, et al. Association of Severity of Coronary Artery Aneurysms in Patients with Kawasaki Disease and Risk of Later Coronary Events. JAMA Pediatr . 2018;172(5):e180030. doi: 10.1001/jamapediatrics.2018.0030. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 782.Zhu F, Ang JY. 2021 Update on the Clinical Management and Diagnosis of Kawasaki Disease. Curr Infect Dis Rep . 2021;23(3):3–3. doi: 10.1007/s11908-021-00746-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 783.Dahdah N, Jaeggi E, Fournier A. Long-Term Changes in Depolarization and Repolarization after Kawasaki Disease. Pediatr Res . 2003;53:162–162. doi: 10.1203/00006450-200301000-00049. [DOI] [PubMed] [Google Scholar]
- 784.Salsano A, Liao J, Miette A, Capoccia M, Mariscalco G, Santini F, et al. Surgical Myocardial Revascularization Outcomes in Kawasaki Disease: Systematic Review and Meta-Analysis. Open Med (Wars) . 2021;16(1):375–386. doi: 10.1515/med-2021-0242. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 785.Sumitomo N, Karasawa K, Taniguchi K, Ichikawa R, Fukuhara J, Abe O, et al. Association of Sinus Node Dysfunction, Atrioventricular Node Conduction Abnormality and Ventricular Arrhythmia in Patients with Kawasaki Disease and Coronary Involvement. Circ J . 2008;72(2):274–280. doi: 10.1253/circj.72.274. [DOI] [PubMed] [Google Scholar]
- 786.Tuan SH, Su HT, Chen CH, Liou IH, Weng TP, Chen GB, et al. Analysis of Exercise Capacity of Children with Kawasaki Disease by a Coronary Artery Z Score Model (ZSP Version 4) Derived by the Lambda-Mu-Sigma Method. J Pediatr . 2018;201:128–133. doi: 10.1016/j.jpeds.2018.05.036. [DOI] [PubMed] [Google Scholar]
- 787.Paridon SM, Galioto FM, Vincent JA, Tomassoni TL, Sullivan NM, Bricker JT. Exercise Capacity and Incidence of Myocardial Perfusion Defects after Kawasaki Disease in Children and Adolescents. J Am Coll Cardiol . 1995;25(6):1420–1424. doi: 10.1016/0735-1097(95)00003-m. [DOI] [PubMed] [Google Scholar]
- 788.Tsuda E, Hirata T, Matsuo O, Abe T, Sugiyama H, Yamada O. The 30-Year Outcome for Patients after Myocardial Infarction Due to Coronary Artery Lesions Caused by Kawasaki Disease. Pediatr Cardiol . 2011;32(2):176–182. doi: 10.1007/s00246-010-9838-y. [DOI] [PubMed] [Google Scholar]
- 789.Gravel H, Dahdah N, Fournier A, Mathieu MÈ, Curnier D. Ventricular Repolarisation During Exercise Challenge Occurring Late after Kawasaki Disease. Pediatr Cardiol . 2012;33(5):728–734. doi: 10.1007/s00246-012-0201-3. [DOI] [PubMed] [Google Scholar]
- 790.Oliveira GMM, Brant LCC, Polanczyk CA, Malta DC, Biolo A, Nascimento BR, et al. Cardiovascular Statistics - Brazil 2021. Arq Bras Cardiol . 2022;118(1):115–373. doi: 10.36660/abc.20211012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 791.Burstein DS, Shamszad P, Dai D, Almond CS, Price JF, Lin KY, et al. Significant Mortality, Morbidity and Resource Utilization Associated with Advanced Heart Failure in Congenital Heart Disease in Children and Young Adults. Am Heart J . 2019;209:9–19. doi: 10.1016/j.ahj.2018.11.010. [DOI] [PubMed] [Google Scholar]
- 792.Adebiyi EO, Edigin E, Shaka H, Hunter J, Swaminathan S. Pediatric Heart Failure Inpatient Mortality: A Cross-Sectional Analysis. Cureus . 2022;14(7):e26721. doi: 10.7759/cureus.26721. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 793.Hsu DT, Pearson GD. Heart Failure in Children: Part II: Diagnosis, Treatment, and Future Directions. Circ Heart Fail . 2009;2(5):490–498. doi: 10.1161/CIRCHEARTFAILURE.109.856229. [DOI] [PubMed] [Google Scholar]
- 794.Price JF. Congestive Heart Failure in Children. Pediatr Rev . 2019;40(2):60–70. doi: 10.1542/pir.2016-0168. [DOI] [PubMed] [Google Scholar]
- 795.Rosenthal D, Chrisant MR, Edens E, Mahony L, Canter C, Colan S, et al. International Society for Heart and Lung Transplantation: Practice Guidelines for Management of Heart Failure in Children. J Heart Lung Transplant . 2004;23(12):1313–1333. doi: 10.1016/j.healun.2004.03.018. [DOI] [PubMed] [Google Scholar]
- 796.Rossano JW, Singh TP, Cherikh WS, Chambers DC, Harhay MO, Hayes D, Jr, et al. The International Thoracic Organ Transplant Registry of the International Society for Heart and Lung Transplantation: Twenty-Second Pediatric Heart Transplantation Report - 2019; Focus Theme: Donor and Recipient Size Match. J Heart Lung Transplant . 2019;38(10):1028–1041. doi: 10.1016/j.healun.2019.08.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 797.Castaldi B, Cuppini E, Fumanelli J, Di Candia A, Sabatino J, Sirico D, et al. Chronic Heart Failure in Children: State of the Art and New Perspectives. J Clin Med . 2023;12(7):2611–2611. doi: 10.3390/jcm12072611. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 798.Wolf CM, Reiner B, Kühn A, Hager A, Müller J, Meierhofer C, et al. Subclinical Cardiac Dysfunction in Childhood Cancer Survivors 10-Years Follow-Up Correlates with Cumulative Anthracycline Dose and is Best Detected by Cardiopulmonary Exercise Testing, Circulating Serum Biomarker, Speckle Tracking Echocardiography, and Tissue Doppler Imaging. Front Pediatr . 2020;8:123–123. doi: 10.3389/fped.2020.00123. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 799.Hauser M, Gibson BS, Wilson N. Diagnosis of Anthracycline-Induced Late Cardiomyopathy by Exercise-Spiroergometry and Stress-Echocardiography. Eur J Pediatr . 2001;160(10):607–610. doi: 10.1007/s004310100830. [DOI] [PubMed] [Google Scholar]
- 800.Loss KL, Shaddy RE, Kantor PF. Recent and Upcoming Drug Therapies for Pediatric Heart Failure. Front Pediatr . 2021;9:681224–681224. doi: 10.3389/fped.2021.681224. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 801.Hegazy M, Ghaleb S, Das BB. Diagnosis and Management of Cancer Treatment-Related Cardiac Dysfunction and Heart Failure in Children. Children (Basel) . 2023;10(1):149–149. doi: 10.3390/children10010149. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 802.Mah K, Chen S, Chandhoke G, Kantor PF, Stephenson E. QTc and QRS Abnormalities are Associated with Outcome in Pediatric Heart Failure. Pediatr Cardiol . 2022;43(8):1903–1912. doi: 10.1007/s00246-022-02932-x. [DOI] [PubMed] [Google Scholar]
- 803.Masarone D, Valente F, Rubino M, Vastarella R, Gravino R, Rea A, et al. Pediatric Heart Failure: A Practical Guide to Diagnosis and Management. Pediatr Neonatol . 2017;58(4):303–312. doi: 10.1016/j.pedneo.2017.01.001. [DOI] [PubMed] [Google Scholar]
- 804.Guimarães GV, Bellotti G, Mocelin AO, Camargo PR, Bocchi EA. Cardiopulmonary Exercise Testing in Children with Heart Failure Secondary to Idiopathic Dilated Cardiomyopathy. Chest . 2001;120(3):816–824. doi: 10.1378/chest.120.3.816. [DOI] [PubMed] [Google Scholar]
- 805.Chen CK, Manlhiot C, Russell JL, Kantor PF, McCrindle BW, Conway J. The Utility of Cardiopulmonary Exercise Testing for the Prediction of Outcomes in Ambulatory Children with Dilated Cardiomyopathy. Transplantation . 2017;101(10):2455–2460. doi: 10.1097/TP.0000000000001672. [DOI] [PubMed] [Google Scholar]
- 806.Lytrivi ID, Blume ED, Rhodes J, Dillis S, Gauvreau K, Singh TP. Prognostic Value of Exercise Testing During Heart Transplant Evaluation in Children. Circ Heart Fail . 2013;6(4):792–799. doi: 10.1161/CIRCHEARTFAILURE.112.000103. [DOI] [PubMed] [Google Scholar]
- 807.Giardini A, Fenton M, Andrews RE, Derrick G, Burch M. Peak Oxygen Uptake Correlates with Survival Without Clinical Deterioration in Ambulatory Children with Dilated Cardiomyopathy. Circulation . 2011;124(16):1713–1718. doi: 10.1161/CIRCULATIONAHA.111.035956. [DOI] [PubMed] [Google Scholar]
- 808.Canter CE, Shaddy RE, Bernstein D, Hsu DT, Chrisant MR, Kirklin JK, et al. Indications for Heart Transplantation in Pediatric Heart Disease: A Scientific Statement from the American Heart Association Council on Cardiovascular Disease in the Young; the Councils on Clinical Cardiology, Cardiovascular Nursing, and Cardiovascular Surgery and Anesthesia; and the Quality of Care and Outcomes Research Interdisciplinary Working Group. Circulation . 2007;115(5):658–676. doi: 10.1161/CIRCULATIONAHA.106.180449. [DOI] [PubMed] [Google Scholar]
- 809.Kucera F, Fenton M. Cardiac Transplantation in Children. Paediatr Child Health . 2017;27:58–63. doi: 10.1016/j.paed.2016.12.001. [DOI] [Google Scholar]
- 810.Davis JA, McBride MG, Chrisant MR, Patil SM, Hanna BD, Paridon SM. Longitudinal Assessment of Cardiovascular Exercise Performance After Pediatric Heart Transplantation. J Heart Lung Transplant . 2006;25(6):626–633. doi: 10.1016/j.healun.2006.02.011. [DOI] [PubMed] [Google Scholar]
- 811.Vanderlaan RD, Conway J, Manlhiot C, McCrindle BW, Dipchand AI. Enhanced Exercise Performance and Survival Associated with Evidence of Autonomic Reinnervation in Pediatric Heart Transplant Recipients. Am J Transplant . 2012;12(8):2157–2163. doi: 10.1111/j.1600-6143.2012.04046.x. [DOI] [PubMed] [Google Scholar]
- 812.Wang M, Peterson DR, Pagan E, Bagnardi V, Mazzanti A, McNitt S, et al. Assessment of Absolute Risk of Life-Threatening Cardiac Events in Long QT Syndrome Patients. Front Cardiovasc Med . 2022;9:988951–988951. doi: 10.3389/fcvm.2022.988951. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 813.Schnell F, Behar N, Carré F. Long-QT Syndrome and Competitive Sports. Arrhythm Electrophysiol Rev . 2018;7(3):187–192. doi: 10.15420/aer.2018.39.3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 814.Lankaputhra M, Voskoboinik A. Congenital Long QT Syndrome: A Clinician's Guide. Intern Med J . 2021;51(12):1999–2011. doi: 10.1111/imj.15437. [DOI] [PubMed] [Google Scholar]
- 815.Yang Y, Lv TT, Li SY, Liu P, Gao QG, Zhang P. Utility of Provocative Testing in the Diagnosis and Genotyping of Congenital Long QT Syndrome: A Systematic Review and Meta-Analysis. J Am Heart Assoc . 2022;11(14):e025246. doi: 10.1161/JAHA.122.025246. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 816.Schwartz PJ, Crotti L. QTc Behavior During Exercise and Genetic Testing for the Long-QT Syndrome. Circulation . 2011;124(20):2181–2184. doi: 10.1161/CIRCULATIONAHA.111.062182. [DOI] [PubMed] [Google Scholar]
- 817.Krahn AD, Laksman Z, Sy RW, Postema PG, Ackerman MJ, Wilde AAM, et al. Congenital Long QT Syndrome. JACC Clin Electrophysiol . 2022;8(5):687–706. doi: 10.1016/j.jacep.2022.02.017. [DOI] [PubMed] [Google Scholar]
- 818.Kwok SY, Pflaumer A, Pantaleo SJ, Date E, Jadhav M, Davis AM. Ten-Year Experience in Atenolol Use and Exercise Evaluation in Children with Genetically Proven Long QT Syndrome. J Arrhythm . 2017;33(6):624–629. doi: 10.1016/j.joa.2017.08.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 819.Han L, Liu F, Li Q, Qing T, Zhai Z, Xia Z, et al. The Efficacy of Beta-Blockers in Patients with Long QT Syndrome 1-3 According to Individuals‘ Gender, Age, and QTc Intervals: A Network Meta-analysis. Front Pharmacol . 2020;11:579525–579525. doi: 10.3389/fphar.2020.579525. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 820.Corcia MCG, Asmundis C, Chierchia GB, Brugada P. Brugada Syndrome in the Paediatric Population: A Comprehensive Approach to Clinical Manifestations, Diagnosis, and Management. Cardiol Young . 2016;26(6):1044–1055. doi: 10.1017/S1047951116000548. [DOI] [PubMed] [Google Scholar]
- 821.Krahn AD, Behr ER, Hamilton R, Probst V, Laksman Z, Han HC. Brugada Syndrome. JACC Clin Electrophysiol . 2022;8(3):386–405. doi: 10.1016/j.jacep.2021.12.001. [DOI] [PubMed] [Google Scholar]
- 822.Michowitz Y, Milman A, Andorin A, Sarquella-Brugada G, Corcia MCG, Gourraud JB, et al. Characterization and Management of Arrhythmic Events in Young Patients with Brugada Syndrome. J Am Coll Cardiol . 2019;73(14):1756–1765. doi: 10.1016/j.jacc.2019.01.048. [DOI] [PubMed] [Google Scholar]
- 823.Behere SP, Weindling SN. Brugada Syndrome in Children - Stepping Into Unchartered Territory. Ann Pediatr Cardiol . 2017;10(3):248–258. doi: 10.4103/apc.APC_49_17. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 824.Peltenburg PJ, Hoedemaekers YM, Clur SAB, Blom NA, Blank AC, Boesaard EP, et al. Screening, Diagnosis and Follow-Up of Brugada Syndrome in Children: A Dutch Expert Consensus Statement. Neth Heart J . 2023;31(4):133–137. doi: 10.1007/s12471-022-01723-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 825.Crosson JE, Nies M. Brugada Syndrome in Children. Expert Rev Cardiovasc Ther . 2015;13(2):173–181. doi: 10.1586/14779072.2015.999765. [DOI] [PubMed] [Google Scholar]
- 826.Kawada S, Morita H, Antzelevitch C, Morimoto Y, Nakagawa K, Watanabe A, et al. Shanghai Score System for Diagnosis of Brugada Syndrome: Validation of the Score System and System and Reclassification of the Patients. JACC Clin Electrophysiol . 2018;4(6):724–730. doi: 10.1016/j.jacep.2018.02.009. [DOI] [PubMed] [Google Scholar]
- 827.Conte G, Dewals W, Sieira J, de Asmundis C, Ciconte G, Chierchia GB, et al. Drug-Induced Brugada Syndrome in Children: Clinical Features, Device-Based Management, and Long-Term Follow-Up. J Am Coll Cardiol . 2014;63(21):2272–2279. doi: 10.1016/j.jacc.2014.02.574. [DOI] [PubMed] [Google Scholar]
- 828.Matsuo K, Kurita T, Inagaki M, Kakishita M, Aihara N, Shimizu W, et al. The Circadian Pattern of the Development of Ventricular Fibrillation in Patients with Brugada Syndrome. Eur Heart J . 1999;20(6):465–470. doi: 10.1053/euhj.1998.1332. [DOI] [PubMed] [Google Scholar]
- 829.Abbas M, Miles C, Behr E. Catecholaminergic Polymorphic Ventricular Tachycardia. Arrhythm Electrophysiol Rev . 2022;11:e20. doi: 10.15420/aer.2022.09. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 830.Kallas D, Lamba A, Roston TM, Arslanova A, Franciosi S, Tibbits GF, et al. Pediatric Catecholaminergic Polymorphic Ventricular Tachycardia: A Translational Perspective for the Clinician-Scientist. Int J Mol Sci . 2021;22(17):9293–9293. doi: 10.3390/ijms22179293. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 831.Song J, Luo Y, Jiang Y, He J. Advances in the Molecular Genetics of Catecholaminergic Polymorphic Ventricular Tachycardia. Front Pharmacol . 2021;12:718208–718208. doi: 10.3389/fphar.2021.718208. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 832.Kim CW, Aronow WS, Dutta T, Frenkel D, Frishman WH. Catecholaminergic Polymorphic Ventricular Tachycardia. Cardiol Rev . 2020;28(6):325–331. doi: 10.1097/CRD.0000000000000302. [DOI] [PubMed] [Google Scholar]
- 833.Miyata K, Ohno S, Itoh H, Horie M. Bradycardia Is a Specific Phenotype of Catecholaminergic Polymorphic Ventricular Tachycardia Induced by RYR2 Mutations. Intern Med . 2018;57(13):1813–1817. doi: 10.2169/internalmedicine.9843-17. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 834.Aizawa Y, Komura S, Okada S, Chinushi M, Aizawa Y, Morita H, et al. Distinct U Wave Changes in Patients with Catecholaminergic Polymorphic Ventricular Tachycardia (CPVT) Int Heart J . 2006;47(3):381–389. doi: 10.1536/ihj.47.381. [DOI] [PubMed] [Google Scholar]
- 835.Stiles MK, Wilde AAM, Abrams DJ, Ackerman MJ, Albert CM, Behr ER, et al. 2020 APHRS/HRS Expert Consensus Statement on the Investigation of Decedents with Sudden Unexplained Death and Patients with Sudden Cardiac Arrest, and of their Families. Heart Rhythm . 2021;18(1):e1–e50. doi: 10.1016/j.hrthm.2020.10.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 836.Inoue YY, Aiba T, Kawata H, Sakaguchi T, Mitsuma W, Morita H, et al. Different Responses to Exercise Between Andersen-Tawil Syndrome and Catecholaminergic Polymorphic Ventricular Tachycardia. Europace . 2018;20(10):1675–1682. doi: 10.1093/europace/eux351. [DOI] [PubMed] [Google Scholar]
- 837.Blich M, Marai I, Suleiman M, Lorber A, Gepstein L, Boulous M, et al. Electrocardiographic Comparison of Ventricular Premature Complexes During Exercise Test in Patients with CPVT and Healthy Subjects. Pacing Clin Electrophysiol . 2015;38(3):398–402. doi: 10.1111/pace.12574. [DOI] [PubMed] [Google Scholar]
- 838.Sumitomo N, Harada K, Nagashima M, Yasuda T, Nakamura Y, Aragaki Y, et al. Catecholaminergic Polymorphic Ventricular Tachycardia: Electrocardiographic Characteristics and Optimal Therapeutic Strategies to Prevent Sudden Death. Heart . 2003;89(1):66–70. doi: 10.1136/heart.89.1.66. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 839.Pflaumer A, Davis AM. Guidelines for the Diagnosis and Management of Catecholaminergic Polymorphic Ventricular Tachycardia. Heart Lung Circ . 2012;21(2):96–100. doi: 10.1016/j.hlc.2011.10.008. [DOI] [PubMed] [Google Scholar]
- 840.Marjamaa A, Hiippala A, Arrhenius B, Lahtinen AM, Kontula K, Toivonen L, et al. Intravenous Epinephrine Infusion Test in Diagnosis of Catecholaminergic Polymorphic Ventricular Tachycardia. J Cardiovasc Electrophysiol . 2012;23(2):194–199. doi: 10.1111/j.1540-8167.2011.02188.x. [DOI] [PubMed] [Google Scholar]
- 841.Wangüemert F, Calero CB, Pérez C, Campuzano O, Beltran-Alvarez P, Scornik FS, et al. Clinical and Molecular Characterization of a Cardiac Ryanodine Receptor Founder Mutation Causing Catecholaminergic Polymorphic Ventricular Tachycardia. Heart Rhythm . 2015;12(7):1636–1643. doi: 10.1016/j.hrthm.2015.03.033. [DOI] [PubMed] [Google Scholar]
- 842.Imberti JF, Underwood K, Mazzanti A, Priori SG. Clinical Challenges in Catecholaminergic Polymorphic Ventricular Tachycardia. Heart Lung Circ . 2016;25(8):777–783. doi: 10.1016/j.hlc.2016.01.012. [DOI] [PubMed] [Google Scholar]
- 843.van der Werf C, Nederend I, Hofman N, van Geloven N, Ebink C, Frohn-Mulder IM, et al. Familial Evaluation in Catecholaminergic Polymorphic Ventricular Tachycardia: Disease Penetrance and Expression in Cardiac Ryanodine Receptor Mutation-Carrying Relatives. Circ Arrhythm Electrophysiol . 2012;5(4):748–756. doi: 10.1161/CIRCEP.112.970517. [DOI] [PubMed] [Google Scholar]
- 844.Shimamoto K, Ohno S, Kato K, Takayama K, Sonoda K, Fukuyama M, et al. Impact of Cascade Screening for Catecholaminergic Polymorphic Ventricular Tachycardia Type 1. Heart . 2022;108(11):840–847. doi: 10.1136/heartjnl-2021-320220. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 845.Roston TM, Jones K, Hawkins NM, Bos JM, Schwartz PJ, Perry F, et al. Implantable Cardioverter-Defibrillator Use in Catecholaminergic Polymorphic Ventricular Tachycardia: A Systematic Review. Heart Rhythm . 2018;15(12):1791–1799. doi: 10.1016/j.hrthm.2018.06.046. [DOI] [PubMed] [Google Scholar]
- 846.Peltenburg PJ, Pultoo SNJ, Tobert KE, Bos JM, Lieve KVV, Tanck M, et al. Repeatability of Ventricular Arrhythmia Characteristics on the Exercise-Stress Test in RYR2-Mediated Catecholaminergic Polymorphic Ventricular Tachycardia. Europace . 2023;25(2):619–626. doi: 10.1093/europace/euac177. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 847.Roston TM, Vinocur JM, Maginot KR, Mohammed S, Salerno JC, Etheridge SP, et al. Catecholaminergic Polymorphic Ventricular Tachycardia in Children: Analysis of Therapeutic Strategies and Outcomes from an International Multicenter Registry. Circ Arrhythm Electrophysiol . 2015;8(3):633–642. doi: 10.1161/CIRCEP.114.002217. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 848.Heidbuchel H, Arbelo E, D’Ascenzi F, Borjesson M, Boveda S, Castelletti S, et al. Recommendations for Participation in Leisure-Time Physical Activity and Competitive Sports of Patients with Arrhythmias and Potentially Arrhythmogenic Conditions. Part 2: Ventricular Arrhythmias, Channelopathies, and Implantable Defibrillators. Europace . 2021;23(1):147–148. doi: 10.1093/europace/euaa106. [DOI] [PubMed] [Google Scholar]
- 849.Gandjbakhch E, Redheuil A, Pousset F, Charron P, Frank R. Clinical Diagnosis, Imaging, and Genetics of Arrhythmogenic Right Ventricular Cardiomyopathy/Dysplasia: JACC State-of-the-Art Review. J Am Coll Cardiol . 2018;72(7):784–804. doi: 10.1016/j.jacc.2018.05.065. [DOI] [PubMed] [Google Scholar]
- 850.Corcia MCG, Motonaga KS. Pediatric Arrhythmogenic Right Ventricular Cardiomyopathy: They May Be Small, But They Pack a Big Punch. JACC Clin Electrophysiol . 2022;8(3):319–321. doi: 10.1016/j.jacep.2021.09.014. [DOI] [PubMed] [Google Scholar]
- 851.Te Riele ASJM, James CA, Calkins H, Tsatsopoulou A. Arrhythmogenic Right Ventricular Cardiomyopathy in Pediatric Patients: An Important but Underrecognized Clinical Entity. Front Pediatr . 2021;9:750916–750916. doi: 10.3389/fped.2021.750916. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 852.Cicenia M, Drago F. Arrhythmogenic Cardiomyopathy: Diagnosis, Evolution, Risk Stratification and Pediatric Population-Where Are We? J Cardiovasc Dev Dis . 2022;9(4):98–98. doi: 10.3390/jcdd9040098. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 853.Surget E, Maltret A, Raimondi F, Fressart V, Bonnet D, Gandjbakhch E, et al. Clinical Presentation and Heart Failure in Children with Arrhythmogenic Cardiomyopathy. Circ Arrhythm Electrophysiol . 2022;15(2):e010346. doi: 10.1161/CIRCEP.121.010346. [DOI] [PubMed] [Google Scholar]
- 854.Smedsrud MK, Chivulescu M, Forså MI, Castrini I, Aabel EW, Rootwelt-Norberg C, et al. Highly Malignant Disease in Childhood-Onset Arrhythmogenic Right Ventricular Cardiomyopathy. Eur Heart J . 2022;43(45):4694–4703. doi: 10.1093/eurheartj/ehac485. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 855.James CA, Bhonsale A, Tichnell C, Murray B, Russell SD, Tandri H, et al. Exercise Increases Age-Related Penetrance and Arrhythmic Risk in Arrhythmogenic Right Ventricular Dysplasia/Cardiomyopathy-Associated Desmosomal Mutation Carriers. J Am Coll Cardiol . 2013;62(14):1290–1297. doi: 10.1016/j.jacc.2013.06.033. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 856.Corrado D, Marra MP, Zorzi A, Beffagna G, Cipriani A, Lazzari M, et al. Diagnosis of Arrhythmogenic Cardiomyopathy: The Padua Criteria. Int J Cardiol . 2020;319:106–114. doi: 10.1016/j.ijcard.2020.06.005. [DOI] [PubMed] [Google Scholar]
- 857.DeWitt ES, Chandler SF, Hylind RJ, Ladouceur VB, Blume ED, VanderPluym C, et al. Phenotypic Manifestations of Arrhythmogenic Cardiomyopathy in Children and Adolescents. J Am Coll Cardiol . 2019;74(3):346–358. doi: 10.1016/j.jacc.2019.05.022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 858.Etoom Y, Govindapillai S, Hamilton R, Manlhiot C, Yoo SJ, Farhan M, et al. Importance of CMR Within the Task Force Criteria for the Diagnosis of ARVC in Children and Adolescents. J Am Coll Cardiol . 2015;65(10):987–995. doi: 10.1016/j.jacc.2014.12.041. [DOI] [PubMed] [Google Scholar]
- 859.Schmied C, Brunckhorst C, Duru F, Haegeli L. Exercise Testing for Risk Stratification of Ventricular Arrhythmias in the Athlete. Card Electrophysiol Clin . 2013;5:53–64. doi: 10.1016/j.ccep.2012.11.003. [DOI] [Google Scholar]
- 860.Hamilton RM, Fidler L. Right Ventricular Cardiomyopathy in the Young: An Emerging Challenge. Heart Rhythm . 2009;6(4):571–575. doi: 10.1016/j.hrthm.2009.01.026. [DOI] [PubMed] [Google Scholar]
- 861.Perrin MJ, Angaran P, Laksman Z, Zhang H, Porepa LF, Rutberg J, et al. Exercise Testing in Asymptomatic Gene Carriers Exposes a Latent Electrical Substrate of Arrhythmogenic Right Ventricular Cardiomyopathy. J Am Coll Cardiol . 2013;62(19):1772–1779. doi: 10.1016/j.jacc.2013.04.084. [DOI] [PubMed] [Google Scholar]
- 862.Martínez-Solé J, Sabater-Molina M, Braza-Boïls A, Santos-Mateo JJ, Molina P, Martínez-Dolz L, et al. Facts and Gaps in Exercise Influence on Arrhythmogenic Cardiomyopathy: New Insights from a Meta-Analysis Approach. Front Cardiovasc Med . 2021;8:702560–702560. doi: 10.3389/fcvm.2021.702560. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 863.Landry CH, Fatah M, Connelly KA, Angaran P, Hamilton RM, Dorian P. Evaluating the 12-Lead Electrocardiogram for Diagnosing ARVC in Young Populations: Implications for Preparticipation Screening of Athletes. CJC Open . 2020;3(4):498–503. doi: 10.1016/j.cjco.2020.12.011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 864.Miljoen H, Spera F, Van Kolen K, Saenen J, Claessen G, Huybrechts W, et al. Electrocardiographic Phenotype of Exercise-Induced Arrhythmogenic Cardiomyopathy: A Retrospective Observational Study. Front Cardiovasc Med . 2022;9:1052174–1052174. doi: 10.3389/fcvm.2022.1052174. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 865.Scheel PJ, 3rd, Florido R, Hsu S, Murray B, Tichnell C, James CA, et al. Safety and Utility of Cardiopulmonary Exercise Testing in Arrhythmogenic Right Ventricular Cardiomyopathy/Dysplasia. J Am Heart Assoc . 2020;9(3):e013695. doi: 10.1161/JAHA.119.013695. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 866.Towbin JA, McKenna WJ, Abrams DJ, Ackerman MJ, Calkins H, Darrieux FCC, et al. 2019 HRS Expert Consensus Statement on Evaluation, Risk Stratification, and Management of Arrhythmogenic Cardiomyopathy. Heart Rhythm . 2019;16(11):e301–e372. doi: 10.1016/j.hrthm.2019.05.007. [DOI] [PubMed] [Google Scholar]
- 867.Adler A, Perrin MJ, Spears D, Gollob MH. Epsilon Wave Uncovered by Exercise Test in a Patient with Desmoplakin-Positive Arrhythmogenic Right Ventricular Cardiomyopathy. Can J Cardiol . 2015;31(6):819.e1–819.e2. doi: 10.1016/j.cjca.2015.01.025. [DOI] [PubMed] [Google Scholar]
- 868.Chungsomprasong P, Hamilton R, Luining W, Fatah M, Yoo SJ, Grosse-Wortmann L. Left Ventricular Function in Children and Adolescents with Arrhythmogenic Right Ventricular Cardiomyopathy. Am J Cardiol . 2017;119(5):778–784. doi: 10.1016/j.amjcard.2016.11.020. [DOI] [PubMed] [Google Scholar]
- 869.Manolis AA, Manolis TA, Melita H, Manolis AS. Congenital Heart Block: Pace Earlier (Childhood) than Later (Adulthood) Trends Cardiovasc Med . 2020;30(5):275–286. doi: 10.1016/j.tcm.2019.06.006. [DOI] [PubMed] [Google Scholar]
- 870.Jaeggi ET, Hamilton RM, Silverman ED, Zamora SA, Hornberger LK. Outcome of Children with Fetal, Neonatal or Childhood Diagnosis of Isolated Congenital Atrioventricular Block. A Single Institution's Experience of 30 Years. J Am Coll Cardiol . 2002;39(1):130–137. doi: 10.1016/s0735-1097(01)01697-7. [DOI] [PubMed] [Google Scholar]
- 871.Moak JP, Barron KS, Hougen TJ, Wiles HB, Balaji S, Sreeram N, et al. Congenital Heart Block: Development of Late-Onset Cardiomyopathy, a Previously Underappreciated Sequela. J Am Coll Cardiol . 2001;37(1):238–242. doi: 10.1016/s0735-1097(00)01048-2. [DOI] [PubMed] [Google Scholar]
- 872.Sülü A, Kafalı HC, Kamalı H, Genç SB, Onan IS, Haydin S, et al. Clinical Characteristics and Mid-term Follow-up in Children with Isolated Complete Atrioventricular Block. Anatol J Cardiol . 2023;27(2):106–112. doi: 10.14744/AnatolJCardiol.2022.2235. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 873.Sumiyoshi M, Nakata Y, Yasuda M, Tokano T, Ogura S, Nakazato Y, et al. Clinical and Electrophysiologic Features of Exercise-Induced Atrioventricular Block. Am Heart J . 1996;132(6):1277–1281. doi: 10.1016/s0002-8703(96)90476-7. [DOI] [PubMed] [Google Scholar]
- 874.Fischbach PS, Frias PA, Strieper MJ, Campbell RM. Natural History and Current Therapy for Complete Heart Block in Children and Patients with Congenital Heart Disease. Congenit Heart Dis . 2007;2(4):224–234. doi: 10.1111/j.1747-0803.2007.00106.x. [DOI] [PubMed] [Google Scholar]
- 875.Chandler SF, Fynn-Thompson F, Mah DY. Role of Cardiac Pacing in Congenital Complete Heart Block. Expert Rev Cardiovasc Ther . 2017;15(11):853–861. doi: 10.1080/14779072.2017.1376655. [DOI] [PubMed] [Google Scholar]
- 876.Motonaga KS, Punn R, Axelrod DM, Ceresnak SR, Hanisch D, Kazmucha JA, et al. Diminished Exercise Capacity and Chronotropic Incompetence in Pediatric Patients with Congenital Complete Heart Block and Chronic Right Ventricular Pacing. Heart Rhythm . 2015;12(3):560–565. doi: 10.1016/j.hrthm.2014.11.036. [DOI] [PubMed] [Google Scholar]
- 877.Siddharth CB, Relan J. Is Left Ventricular Superior to Right Ventricular Pacing in Children with Congenital or Postoperative Complete Heart Block? Interact Cardiovasc Thorac Surg . 2021;33(1):131–135. doi: 10.1093/icvts/ivab048. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 878.Villain E. Pediatric Cardiac Pacing: Indications, Implant Techniques, Pacing Mode. Ann Cardiol Angeiol . 2005;54(1):2–6. doi: 10.1016/j.ancard.2004.11.006. [DOI] [PubMed] [Google Scholar]
- 879.Vanagt WY, Prinzen FW, Delhaas T. Physiology of Cardiac Pacing in Children: The Importance of the Ventricular Pacing Site. Pacing Clin Electrophysiol . 2008;31(Suppl 1):S24–S27. doi: 10.1111/j.1540-8159.2008.00950.x. [DOI] [PubMed] [Google Scholar]
- 880.Chen L, Duan H, Li X, Yang Z, Jiao M, Sun K, et al. The Causes of Chest Pain in Children and the Criteria for Targeted Myocardial Enzyme Testing in Identifying the Causes of Chest Pain in Children. Front Cardiovasc Med . 2021;8:582129–582129. doi: 10.3389/fcvm.2021.582129. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 881.Anderson BR, Vetter VL. Arrhythmogenic Causes of Chest Pain in Children. Pediatr Clin North Am . 2010;57(6):1305–1329. doi: 10.1016/j.pcl.2010.09.005. [DOI] [PubMed] [Google Scholar]
- 882.Boon AW, Forton J. How to Evaluate a Child with Chest Pain. Curr Paediatr . 2004;14(1):64–70. doi: 10.1016/j.cupe.2003.09.003. [DOI] [Google Scholar]
- 883.Guardamagna O, Abello F, Saracco P, Baracco V, Rolfo E, Pirro M. Endothelial Activation, Inflammation and Premature Atherosclerosis in Children with Familial Dyslipidemia. Atherosclerosis . 2009;207(2):471–475. doi: 10.1016/j.atherosclerosis.2009.06.006. [DOI] [PubMed] [Google Scholar]
- 884.Narverud I, Retterstøl K, Iversen PO, Halvorsen B, Ueland T, Ulven SM, et al. Markers of Atherosclerotic Development in Children with Familial Hypercholesterolemia: A Literature Review. Atherosclerosis . 2014;235(2):299–309. doi: 10.1016/j.atherosclerosis.2014.05.917. [DOI] [PubMed] [Google Scholar]
- 885.Mitsnefes MM. Cardiovascular Complications of Pediatric Chronic Kidney Disease. Pediatr Nephrol . 2008;23(1):27–39. doi: 10.1007/s00467-006-0359-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 886.Paoli S, Mitsnefes MM. Coronary Artery Calcification and Cardiovascular Disease in Children with Chronic Kidney Disease. Curr Opin Pediatr . 2014;26(2):193–197. doi: 10.1097/MOP.0000000000000059. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 887.Shen CC, Chung HT, Huang YL, Yeh KW, Huang JL. Coronary Artery Dilation Among Patients with Paediatric-Onset Systemic Lupus Erythematosus. Scand J Rheumatol . 2012;41(6):458–465. doi: 10.3109/03009742.2012.694470. [DOI] [PubMed] [Google Scholar]
- 888.Mavrogeni S, Smerla R, Grigoriadou G, Servos G, Koutsogeorgopoulou L, Karabela G, et al. Cardiovascular Magnetic Resonance Evaluation of Paediatric Patients with Systemic Lupus Erythematosus and Cardiac Symptoms. Lupus . 2016;25(3):289–295. doi: 10.1177/0961203315611496. [DOI] [PubMed] [Google Scholar]
- 889.Khositseth A, Prangwatanagul W, Tangnararatchakit K, Vilaiyuk S, Su-Angka N. Myocardial Performance Index in Active and Inactive Paediatric Systemic Lupus Erythematosus. Clin Exp Rheumatol . 2017;35(2):344–500. [PubMed] [Google Scholar]
- 890.Gazarian M, Feldman BM, Benson LN, Gilday DL, Laxer RM, Silverman ED. Assessment of Myocardial Perfusion and Function in Childhood Systemic Lupus Erythematosus. J Pediatr . 1998;132(1):109–116. doi: 10.1016/s0022-3476(98)70494-9. [DOI] [PubMed] [Google Scholar]
- 891.Takahashi T, Nakano S, Shimazaki Y, Kaneko M, Hirata N, Nakamura T, et al. Long-Term Appraisal of Coronary Bypass Operations in Familial Hypercholesterolemia. Ann Thorac Surg . 1993;56(3):499–505. doi: 10.1016/0003-4975(93)90887-n. [DOI] [PubMed] [Google Scholar]
- 892.Bergoënd E, Raisky O, Degandt A, Tamisier D, Sidi D, Vouhé P. Myocardial Revascularization in Infants and Children by Means of Coronary Artery Proximal Patch Arterioplasty or Bypass Grafting: A Single-Institution Experience. J Thorac Cardiovasc Surg . 2008;136(2):298–305. doi: 10.1016/j.jtcvs.2008.02.059. [DOI] [PubMed] [Google Scholar]
- 893.Auriau J, Belhadjer Z, Panaioli E, Derridj N, Jais JP, Gaudin R, et al. Exercise Electrocardiogram for Risk-Based Screening of Severe Residual Coronary Lesion in Children After Coronary Surgery. Arch Cardiovasc Dis . 2022;115(12):656–663. doi: 10.1016/j.acvd.2022.10.001. [DOI] [PubMed] [Google Scholar]
- 894.Yetman AT, McCrindle BW, MacDonald C, Freedom RM, Gow R. Myocardial Bridging in Children with Hypertrophic Cardiomyopathy--a Risk Factor for Sudden Death. N Engl J Med . 1998;339(17):1201–1209. doi: 10.1056/NEJM199810223391704. [DOI] [PubMed] [Google Scholar]
- 895.Singh GK. Congenital Aortic Valve Stenosis. Children (Basel) . 2019;6(5):69–69. doi: 10.3390/children6050069. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 896.Kliegman R, Behrman RE, Nelson WE, editors. Nelson Textbook of Pediatrics . 20th ed. Phialdelphia: Elsevier; 2016. ISBN-10: 1455775665; ISBN-13: 978-1455775668. [Google Scholar]
- 897.Atalay S, Imamoğlu A, Tutar HE, Altuğ N. Relation of Mass/Volume Ratio to ECG Abnormalities and Symptoms in Children with Aortic Stenosis/Insufficiency. Angiology . 1999;50(2):131–136. doi: 10.1177/000331979905000206. [DOI] [PubMed] [Google Scholar]
- 898.Piorecka-Makula A, Werner B. Prolonged QT Dispersion in Children with Congenital Valvular Aortic Stenosis. Med Sci Monit . 2009;15(10):CR534–CR538. [PubMed] [Google Scholar]
- 899.Naik R, Kunselman A, Wackerle E, Johnson G, Cyran SE, Chowdhury D. Stress Echocardiography: A Useful Tool for Children with Aortic Stenosis. Pediatr Cardiol . 2013;34(5):1237–1243. doi: 10.1007/s00246-013-0635-2. [DOI] [PubMed] [Google Scholar]
- 900.Guo Y, Zhou A, Sun K, Li F, Gao W, Huang M, et al. Exercise Capacity Evaluation after Percutaneous Balloon Pulmonary Valvuloplasty in Children with Pulmonary Valve Stenosis. Zhonghua Xin Xue Guan Bing Za Zhi . 2007;35(1):55–58. doi: 10.3760/j:issn:0253-3758.2007.01.014. [DOI] [PubMed] [Google Scholar]
- 901.Fishbein GA, Fishbein MC. Pathology of the Aortic Valve: Aortic Valve Stenosis/Aortic Regurgitation. Curr Cardiol Rep . 2019;21(8):81–81. doi: 10.1007/s11886-019-1162-4. [DOI] [PubMed] [Google Scholar]
- 902.Akinseye OA, Pathak A, Ibebuogu UN. Aortic Valve Regurgitation: A Comprehensive Review. Curr Probl Cardiol . 2018;43(8):315–334. doi: 10.1016/j.cpcardiol.2017.10.004. [DOI] [PubMed] [Google Scholar]
- 903.Albertí JFF, Mora MN, López AC, Pericàs P, Márquez LP, Montero FJC, et al. Changes in the Severity of Aortic Regurgitation at Peak Effort During Exercise. Int J Cardiol . 2017;228:145–148. doi: 10.1016/j.ijcard.2016.11.168. [DOI] [PubMed] [Google Scholar]
- 904.Généreux P, Stone GW, O’Gara PT, Marquis-Gravel G, Redfors B, Giustino G, et al. Natural History, Diagnostic Approaches, and Therapeutic Strategies for Patients with Asymptomatic Severe Aortic Stenosis. J Am Coll Cardiol . 2016;67(19):2263–2288. doi: 10.1016/j.jacc.2016.02.057. [DOI] [PubMed] [Google Scholar]
- 905.Hraška V, Photiadis J, Zartner P, Haun C. In: Pediatric and Congenital Cardiology, Cardiac Surgery, and Intensive Care . Cruz EM, Ivy D, Jaggers J, editors. London: Springer Reference; 2014. Congenital Aortic Valve Stenosis and Regurgitation; pp. 1577–1598. [DOI] [Google Scholar]
- 906.Pelliccia A, Fagard R, Bjørnstad HH, Anastassakis A, Arbustini E, Assanelli D, et al. Recommendations for Competitive Sports Participation in Athletes with Cardiovascular Disease: A Consensus Document from the Study Group of Sports Cardiology of the Working Group of Cardiac Rehabilitation and Exercise Physiology and the Working Group of Myocardial and Pericardial Diseases of the European Society of Cardiology. Eur Heart J . 2005;26(14):1422–1445. doi: 10.1093/eurheartj/ehi325. [DOI] [PubMed] [Google Scholar]
- 907.Rodrigues I, Agapito AF, de Sousa L, Oliveira JA, Branco LM, Galrinho A, et al. Bicuspid Aortic Valve Outcomes. Cardiol Young . 2017;27(3):518–529. doi: 10.1017/S1047951116002560. [DOI] [PubMed] [Google Scholar]
- 908.Kececioglu D, Kotthoff S, Vogt J. Williams-Beuren Syndrome: A 30-Year Follow-Up of Natural and Postoperative Course. Eur Heart J . 1993;14(11):1458–1464. doi: 10.1093/eurheartj/14.11.1458. [DOI] [PubMed] [Google Scholar]
- 909.Feltes TF, Bacha E, Beekman RH, 3rd, Cheatham JP, Feinstein JA, Gomes AS, et al. Indications for Cardiac Catheterization and Intervention in Pediatric Cardiac Disease: A Scientific Statement from the American Heart Association. Circulation . 2011;123(22):2607–2652. doi: 10.1161/CIR.0b013e31821b1f10. [DOI] [PubMed] [Google Scholar]
- 910.Kwiatkowski DM, Hanley FL, Krawczeski CD. Right Ventricular Outflow Tract Obstruction: Pulmonary Atresia with Intact Ventricular Septum, Pulmonary Stenosis, and Ebstein's Malformation. Pediatr Crit Care Med . 2016;17(8 Suppl 1):S323–S329. doi: 10.1097/PCC.0000000000000818. [DOI] [PubMed] [Google Scholar]
- 911.Guidelines for the Management of Congenital Heart Diseases in Childhood and Adolescence. Cardiol Young . 2017;27(S3):S1–S105. doi: 10.1017/S1047951116001955. [DOI] [PubMed] [Google Scholar]
- 912.Arunamata A, Goldstein BH. Right Ventricular Outflow Tract Anomalies: Neonatal Interventions and Outcomes. Semin Perinatol . 2022;46(4):151583–151583. doi: 10.1016/j.semperi.2022.151583. [DOI] [PubMed] [Google Scholar]
- 913.Skoglund K, Rosengren A, Lappas G, Fedchenko M, Mandalenakis Z. Long-Term Survival in Patients with Isolated Pulmonary Valve Stenosis: A Not so Benign Disease? Open Heart . 2021;8(2):e001836. doi: 10.1136/openhrt-2021-001836. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 914.Galian-Gay L, Gordon B, Marsal JR, Rafecas A, Domènech AP, Castro MA, et al. Determinants of Long-Term Outcome of Repaired Pulmonary Valve Stenosis. Rev Esp Cardiol . 2020;73(2):131–138. doi: 10.1016/j.rec.2019.02.014. [DOI] [PubMed] [Google Scholar]
- 915.Devanagondi R, Peck D, Sagi J, Donohue J, Yu S, Pasquali SK, et al. Long-Term Outcomes of Balloon Valvuloplasty for Isolated Pulmonary Valve Stenosis. Pediatr Cardiol . 2017;38(2):247–254. doi: 10.1007/s00246-016-1506-4. [DOI] [PubMed] [Google Scholar]
- 916.de Meester P, Buys R, Van De Bruaene A, Gabriels C, Voigt JU, Vanhees L, et al. Functional and Haemodynamic Assessment of Mild-To-Moderate Pulmonary Valve Stenosis at Rest and During Exercise. Heart . 2014;100(17):1354–1359. doi: 10.1136/heartjnl-2014-305627. [DOI] [PubMed] [Google Scholar]
- 917.Reybrouck T, Rogers R, Weymans M, Dumoulin M, Vanhove M, Daenen W, et al. Serial Cardiorespiratory Exercise Testing in Patients with Congenital Heart Disease. Eur J Pediatr . 1995;154(10):801–806. doi: 10.1007/BF01959785. [DOI] [PubMed] [Google Scholar]
- 918.Müller J, Engelhardt A, Fratz S, Eicken A, Ewert P, Hager A. Improved Exercise Performance and Quality of Life after Percutaneous Pulmonary Valve Implantation. Int J Cardiol . 2014;173(3):388–392. doi: 10.1016/j.ijcard.2014.03.002. [DOI] [PubMed] [Google Scholar]
- 919.Driscoll DJ, Wolfe RR, Gersony WM, Hayes CJ, Keane JF, Kidd L, et al. Cardiorespiratory Responses to Exercise of Patients with Aortic Stenosis, Pulmonary Stenosis, and Ventricular Septal Defect. Circulation . 1993;87(2 Suppl):I102–I113. [PubMed] [Google Scholar]
- 920.Chatrath N, Papadakis M. Physical Activity and Exercise Recommendations for Patients with Valvular Heart Disease. Heart . 2022;108(24):1938–1944. doi: 10.1136/heartjnl-2021-319824. [DOI] [PubMed] [Google Scholar]
- 921.Gauthier N, Muter A, Rhodes J, Gauvreau K, Nathan M. Better Preoperative Exercise Function is Associated with Shorter Hospital Stay After Paediatric Pulmonary Valve Replacement or Conduit Revision. Cardiol Young . 2021;31(10):1636–1643. doi: 10.1017/S1047951121000743. [DOI] [PubMed] [Google Scholar]
- 922.Lurz P, Giardini A, Taylor AM, Nordmeyer J, Muthurangu V, Odendaal D, et al. Effect of Altering Pathologic Right Ventricular Loading Conditions by Percutaneous Pulmonary Valve Implantation on Exercise Capacity. Am J Cardiol . 2010;105(5):721–726. doi: 10.1016/j.amjcard.2009.10.054. [DOI] [PubMed] [Google Scholar]
- 923.Baird CW, Marx GR, Borisuk M, Emani S, del Nido PJ. Review of Congenital Mitral Valve Stenosis: Analysis, Repair Techniques and Outcomes. Cardiovasc Eng Technol . 2015;6(2):167–173. doi: 10.1007/s13239-015-0223-0. [DOI] [PubMed] [Google Scholar]
- 924.Nobuyoshi M, Arita T, Shirai S, Hamasaki N, Yokoi H, Iwabuchi M, et al. Percutaneous Balloon Mitral Valvuloplasty: A Review. Circulation . 2009;119(8):e211–e219. doi: 10.1161/CIRCULATIONAHA.108.792952. [DOI] [PubMed] [Google Scholar]
- 925.Petek BJ, Baggish AL. Valvular Heart Disease in Athletes. Curr Treat Options Cardiovasc Med . 2021;23(11):69–69. doi: 10.1007/s11936-021-00950-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 926.Bonow RO, Nishimura RA, Thompson PD, Udelson JE, American Heart Association Electrocardiography and Arrhythmias Committee of Council on Clinical Cardiology, Council on Cardiovascular Disease in Young, Council on Cardiovascular and Stroke Nursing, Council on Functional Genomics and Translational Biology, and American College of Cardiology Eligibility and Disqualification Recommendations for Competitive Athletes with Cardiovascular Abnormalities: Task Force 5: Valvular Heart Disease: A Scientific Statement From the American Heart Association and American College of Cardiology. Circulation . 2015;132(22):e292–e297. doi: 10.1161/CIR.0000000000000241. [DOI] [PubMed] [Google Scholar]
- 927.Bonow RO, Nikas D, Elefteriades JA. Valve Replacement for Regurgitant Lesions of the Aortic or Mitral Valve in Advanced Left Ventricular Dysfunction. Cardiol Clin . 1995;13(1):73-83, 85. [PubMed] [Google Scholar]
- 928.Delling FN, Vasan RS. Epidemiology and Pathophysiology of Mitral Valve Prolapse: New Insights Into Disease Progression, Genetics, and Molecular Basis. Circulation . 2014;129(21):2158–2170. doi: 10.1161/CIRCULATIONAHA.113.006702. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 929.Korovesis TG, Koutrolou-Sotiropoulou P, Katritsis DG. Arrhythmogenic Mitral Valve Prolapse. Arrhythm Electrophysiol Rev . 2022;11:e16. doi: 10.15420/aer.2021.28. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 930.Vriz O, Landi I, Eltayeb A, Limongelli G, Mos L, Delise P, et al. Mitral Valve Prolapse and Sudden Cardiac Death in Athletes at High Risk. Curr Cardiol Rev . 2023;19(3):e201222212066. doi: 10.2174/1573403X19666221220163431. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 931.Alenazy A, Eltayeb A, Alotaibi MK, Anwar MK, Mulafikh N, Aladmawi M, et al. Diagnosis of Mitral Valve Prolapse: Much More than Simple Prolapse. Multimodality Approach to Risk Stratification and Therapeutic Management. J Clin Med . 2022;11(2):455–455. doi: 10.3390/jcm11020455. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 932.Basso C, Marra MP, Rizzo S, De Lazzari M, Giorgi B, Cipriani A, et al. Arrhythmic Mitral Valve Prolapse and Sudden Cardiac Death. Circulation . 2015;132(7):556–566. doi: 10.1161/CIRCULATIONAHA.115.016291. [DOI] [PubMed] [Google Scholar]
- 933.Nalliah CJ, Mahajan R, Elliott AD, Haqqani H, Lau DH, Vohra JK, et al. Mitral Valve Prolapse and Sudden Cardiac Death: A Systematic Review and Meta-Analysis. Heart . 2019;105(2):144–151. doi: 10.1136/heartjnl-2017-312932. [DOI] [PubMed] [Google Scholar]
- 934.Cavarretta E, Peruzzi M, Versaci F, Frati G, Sciarra L. How to Manage an Athlete with Mitral Valve Prolapse. Eur J Prev Cardiol . 2021;28(10):1110–1117. doi: 10.1177/2047487320941646. [DOI] [PubMed] [Google Scholar]
- 935.Chung JH, Tsai YJ, Lin KL, Weng KP, Huang MH, Chen GB, et al. Comparison of Cardiorespiratory Fitness Between Patients with Mitral Valve Prolapse and Healthy Peers: Findings from Serial Cardiopulmonary Exercise Testing. J Cardiovasc Dev Dis . 2023;10(4):167–167. doi: 10.3390/jcdd10040167. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 936.Huang MH, Tuan SH, Tsai YJ, Huang WC, Huang TC, Chang ST, et al. Comparison of the Results of Cardiopulmonary Exercise Testing Between Healthy Peers and Pediatric Patients with Different Echocardiographic Severity of Mitral Valve Prolapse. Life . 2023;13(2):302–302. doi: 10.3390/life13020302. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 937.Basso C, Iliceto S, Thiene G, Marra MP. Mitral Valve Prolapse, Ventricular Arrhythmias, and Sudden Death. Circulation . 2019;140(11):952–964. doi: 10.1161/CIRCULATIONAHA.118.034075. [DOI] [PubMed] [Google Scholar]
- 938.Steriotis AK, Nava A, Rigato I, Mazzotti E, Daliento L, Thiene G, et al. Noninvasive Cardiac Screening in Young Athletes with Ventricular Arrhythmias. Am J Cardiol . 2013;111(4):557–562. doi: 10.1016/j.amjcard.2012.10.044. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 939.Bhatia R, Abu-Hasan M, Weinberger M. Exercise-Induced Dyspnea in Children and Adolescents: Differential Diagnosis. Pediatr Ann . 2019;48(3):e121–e127. doi: 10.3928/19382359-20190219-02. [DOI] [PubMed] [Google Scholar]
- 940.Hengeveld VS, van der Kamp MR, Thio BJ, Brannan JD. The Need for Testing-The Exercise Challenge Test to Disentangle Causes of Childhood Exertional Dyspnea. Front Pediatr . 2022;9:773794–773794. doi: 10.3389/fped.2021.773794. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 941.Johansson H, Emtner M, Janson C, Nordang L, Malinovschi A. The Course of Specific Self-Reported Exercise-Induced Airway Symptoms in Adolescents with and Without Asthma. ERJ Open Res . 2020;6(4):00349–02020. doi: 10.1183/23120541.00349-2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 942.Hseu A, Sandler M, Ericson D, Ayele N, Kawai K, Nuss R. Paradoxical Vocal Fold Motion in Children Presenting with Exercise Induced Dyspnea. Int J Pediatr Otorhinolaryngol . 2016;90:165–169. doi: 10.1016/j.ijporl.2016.09.007. [DOI] [PubMed] [Google Scholar]
- 943.Pianosi PT, Huebner M, Zhang Z, McGrath PJ. Dalhousie Dyspnea and Perceived Exertion Scales: Psychophysical Properties in Children and Adolescents. Respir Physiol Neurobiol . 2014;199:34–40. doi: 10.1016/j.resp.2014.04.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 944.Pianosi PT, Huebner M, Zhang Z, Turchetta A, McGrath PJ. Dalhousie Pictorial Scales Measuring Dyspnea and Perceived Exertion during Exercise for Children and Adolescents. Ann Am Thorac Soc . 2015;12(5):718–726. doi: 10.1513/AnnalsATS.201410-477OC. [DOI] [PubMed] [Google Scholar]
- 945.Stickland MK, Neder JA, Guenette JA, O‘Donnell DE, Jensen D. Using Cardiopulmonary Exercise Testing to Understand Dyspnea and Exercise Intolerance in Respiratory Disease. Chest . 2022;161(6):1505–1516. doi: 10.1016/j.chest.2022.01.021. [DOI] [PubMed] [Google Scholar]
- 946.Parshall MB, Schwartzstein RM, Adams L, Banzett RB, Manning HL, Bourbeau J, et al. An Official American Thoracic Society statement: Update on the Mechanisms, Assessment, and Management of Dyspnea. Am J Respir Crit Care Med . 2012;185(4):435–452. doi: 10.1164/rccm.201111-2042ST. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 947.Lin LL, Huang SJ, Ou LS, Yao TC, Tsao KC, Yeh KW, et al. Exercise-Induced Bronchoconstriction in Children with Asthma: An Observational Cohort Study. J Microbiol Immunol Infect . 2019;52(3):471–479. doi: 10.1016/j.jmii.2017.08.013. [DOI] [PubMed] [Google Scholar]
- 948.Klain A, Indolfi C, Dinardo G, Contieri M, Decimo F, Del Giudice MM. Exercise-Induced Bronchoconstriction in Children. Front Med . 2022;8:814976–814976. doi: 10.3389/fmed.2021.814976. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 949.Aggarwal B, Mulgirigama A, Berend N. Exercise-Induced Bronchoconstriction: Prevalence, Pathophysiology, Patient Impact, Diagnosis and Management. NPJ Prim Care Respir Med . 2018;28(1):31–31. doi: 10.1038/s41533-018-0098-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 950.Dreßler M, Friedrich T, Lasowski N, Herrmann E, Zielen S, Schulze J. Predictors and Reproducibility of Exercise-Induced Bronchoconstriction in Cold Air. BMC Pulm Med . 2019;19(1):94–94. doi: 10.1186/s12890-019-0845-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 951.Ersson K, Mallmin E, Malinovschi A, Norlander K, Johansson H, Nordang L. Prevalence of Exercise-Induced Bronchoconstriction and Laryngeal Obstruction in Adolescent Athletes. Pediatr Pulmonol . 2020;55(12):3509–3516. doi: 10.1002/ppul.25104. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 952.Boutou AK, Daniil Z, Pitsiou G, Papakosta D, Kioumis I, Stanopoulos I. Cardiopulmonary Exercise Testing in Patients with Asthma: What is its Clinical Value? Respir Med . 2020;167:105953–105953. doi: 10.1016/j.rmed.2020.105953. [DOI] [PubMed] [Google Scholar]
- 953.Hallstrand TS, Leuppi JD, Joos G, Hall GL, Carlsen KH, Kaminsky DA, et al. ERS Technical Standard on Bronchial Challenge Testing: Pathophysiology and Methodology of Indirect Airway Challenge Testing. Eur Respir J . 2018;52(5):1801033–1801033. doi: 10.1183/13993003.01033-2018. [DOI] [PubMed] [Google Scholar]
- 954.Randolph C. Diagnostic Exercise Challenge Testing. Curr Allergy Asthma Rep . 2011;11(6):482–490. doi: 10.1007/s11882-011-0225-4. [DOI] [PubMed] [Google Scholar]
- 955.Anderson SD, Pearlman DS, Rundell KW, Perry CP, Boushey H, Sorkness CA, et al. Reproducibility of the Airway Response to an Exercise Protocol Standardized for Intensity, Duration, and Inspired air Conditions, in Subjects with Symptoms Suggestive of Asthma. Respir Res . 2010;11(1):120–120. doi: 10.1186/1465-9921-11-120. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 956.Liyanagedera S, McLeod R, Elhassan HA. Exercise Induced Laryngeal Obstruction: A Review of Diagnosis and Management. Eur Arch Otorhinolaryngol . 2017;274(4):1781–1789. doi: 10.1007/s00405-016-4338-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 957.Welsh L, Giannini A, Massie J. Exercise-Induced Laryngeal Obstruction in Children and Adolescents: Are we Listening? Arch Dis Child Educ Pract Ed . 2021;106(2):66–70. doi: 10.1136/archdischild-2020-319454. [DOI] [PubMed] [Google Scholar]
- 958.Clemm HH, Olin JT, McIntosh C, Schwellnus M, Sewry N, Hull JH, et al. Exercise-Induced Laryngeal Obstruction (EILO) in Athletes: A Narrative Review by a Subgroup of the IOC Consensus on ‘Acute Respiratory Illness in the Athlete’. Br J Sports Med . 2022;56(11):622–629. doi: 10.1136/bjsports-2021-104704. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 959.Hull JH, Walsted ES, Pavitt MJ, Menzies-Gow A, Backer V, Sandhu G. High Prevalence of Laryngeal Obstruction During Exercise in Severe Asthma. Am J Respir Crit Care Med . 2019;199(4):538–542. doi: 10.1164/rccm.201809-1734LE. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 960.Walsted ES, Faisal A, Jolley CJ, Swanton LL, Pavitt MJ, Luo YM, et al. Increased Respiratory Neural Drive and Work of Breathing in Exercise-Induced Laryngeal Obstruction. J Appl Physiol (1985) . 2018;124(2):356–363. doi: 10.1152/japplphysiol.00691.2017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 961.Hilland M, Røksund OD, Sandvik L, Haaland Ø, Aarstad HJ, Halvorsen T, et al. Congenital Laryngomalacia is Related to Exercise-Induced Laryngeal Obstruction in Adolescence. Arch Dis Child . 2016;101(5):443–448. doi: 10.1136/archdischild-2015-308450. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 962.Olin JT, Clary MS, Fan EM, Johnston KL, State CM, Strand M, et al. Continuous Laryngoscopy Quantitates Laryngeal Behaviour in Exercise and Recovery. Eur Respir J . 2016;48(4):1192–1200. doi: 10.1183/13993003.00160-2016. [DOI] [PubMed] [Google Scholar]
- 963.Giraud L, Wuyam B, Destors M, Atallah I. Exercise-Induced Laryngeal Obstruction: From Clinical Examination to Continuous Laryngoscopy During Exercise. Eur Ann Otorhinolaryngol Head Neck Dis . 2021;138(6):479–482. doi: 10.1016/j.anorl.2021.02.005. [DOI] [PubMed] [Google Scholar]
- 964.Tervonen H, Niskanen MM, Sovijärvi AR, Hakulinen AS, Vilkman EA, Aaltonen LM. Fiberoptic Videolaryngoscopy During Bicycle Ergometry: A Diagnostic Tool for Exercise-Induced Vocal Cord Dysfunction. Laryngoscope . 2009;119(9):1776–1780. doi: 10.1002/lary.20558. [DOI] [PubMed] [Google Scholar]
- 965.Engan M, Hammer IJ, Bekken M, Halvorsen T, Fretheim-Kelly ZL, Vollsæter M, et al. Reliability of Maximum Oxygen Uptake in Cardiopulmonary Exercise Testing with Continuous Laryngoscopy. ERJ Open Res . 2021;7(1):00825–02020. doi: 10.1183/23120541.00825-2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 966.Carvalho-Pinto RM, Cançado JED, Pizzichini MMM, Fiterman J, Rubin AS, Cerci A, Neto, et al. 2021 Brazilian Thoracic Association Recommendations for the Management of Severe Asthma. J Bras Pneumol . 2021;47(6):e20210273. doi: 10.36416/1806-3756/e20210273. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 967.Hengeveld VS, Keijzer PB, Diamant Z, Thio BJ. An Algorithm for Strategic Continuation or Restriction of Asthma Medication Prior to Exercise Challenge Testing in Childhood Exercise Induced Bronchoconstriction. Front Pediatr . 2022;10:800193–800193. doi: 10.3389/fped.2022.800193. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 968.de Jong CCM, Pedersen ESL, Mozun R, Goutaki M, Trachsel D, Barben J, et al. Diagnosis of Asthma in Children: The Contribution of a Detailed History and Test Results. Eur Respir J . 2019;54(6):1901326–1901326. doi: 10.1183/13993003.01326-2019. [DOI] [PubMed] [Google Scholar]
- 969.Del Giacco SR, Firinu D, Bjermer L, Carlsen KH. Exercise and asthma: An overview. Eur Clin Respir J . 2015 Nov 03;2:27984–27984. doi: 10.3402/ecrj.v2.27984. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 970.Carlsen KH, Hem E, Stensrud T. Asthma in Adolescent Athletes. Br J Sports Med . 2011;45(16):1266–1271. doi: 10.1136/bjsports-2011-090591. [DOI] [PubMed] [Google Scholar]
- 971.Dajani AS, Taubert KA, Takahashi M, Bierman FZ, Freed MD, Ferrieri P, et al. Report from the Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease, Council on Cardiovascular Disease in the Young, American Heart Association. Circulation . 1994;89(2):916–922. doi: 10.1161/01.cir.89.2.916. [DOI] [PubMed] [Google Scholar]
- 972.Schindel CS, Schiwe D, Heinzmann-Filho JP, Gheller MF, Campos NE, Pitrez PM, et al. Determinants of Exercise Capacity in Children and Adolescents with Severe Therapy-Resistant Asthma. J Asthma . 2022;59(1):115–125. doi: 10.1080/02770903.2020.1833915. [DOI] [PubMed] [Google Scholar]
- 973.Sudário LC, Kroger FL, Paula NCS, Santos OF, Cintra RB, Rodrigues DOW. Sickle Cell Disease and Social Security Aspects. Braz J Health Ver . 2020;3(6):18259–18270. doi: 10.34119/bjhrv3n6-225. [DOI] [Google Scholar]
- 974.Kavanagh PL, Fasipe TA, Wun T. Sickle Cell Disease: A Review. JAMA . 2022;328(1):57–68. doi: 10.1001/jama.2022.10233. [DOI] [PubMed] [Google Scholar]
- 975.van Beers EJ, van der Plas MN, Nur E, Bogaard HJ, van Steenwijk RP, Biemond BJ, et al. Exercise Tolerance, Lung Function Abnormalities, Anemia, and Cardiothoracic Ratio in Sickle Cell Patients. Am J Hematol . 2014;89(8):819–824. doi: 10.1002/ajh.23752. [DOI] [PubMed] [Google Scholar]
- 976.Colombatti R, Maschietto N, Varotto E, Grison A, Grazzina N, Meneghello L, et al. Pulmonary Hypertension in Sickle Cell Disease Children Under 10 Years of Age. Br J Haematol . 2010;150(5):601–609. doi: 10.1111/j.1365-2141.2010.08269.x. [DOI] [PubMed] [Google Scholar]
- 977.Niss O, Quinn CT, Lane A, Daily J, Khoury PR, Bakeer N, et al. Cardiomyopathy with Restrictive Physiology in Sickle Cell Disease. JACC Cardiovasc Imaging . 2016;9(3):243–252. doi: 10.1016/j.jcmg.2015.05.013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 978.Liem RI, Akinosun M, Muntz DS, Thompson AA. Feasibility and Safety of Home Exercise Training in Children with Sickle Cell Anemia. Pediatr Blood Cancer . 2017;64(12) doi: 10.1002/pbc.26671. [DOI] [PubMed] [Google Scholar]
- 979.Smith KN, Baynard T, Fischbach PS, Hankins JS, Hsu LL, Murphy PM, et al. Safety of Maximal Cardiopulmonary Exercise Testing in Individuals with Sickle Cell Disease: A Systematic Review. Br J Sports Med . 2022;56(13):764–769. doi: 10.1136/bjsports-2021-104450. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 980.Arteta M, Campbell A, Nouraie M, Rana S, Onyekwere OC, Ensing G, et al. Abnormal Pulmonary Function and Associated Risk Factors in Children and Adolescents with Sickle Cell Anemia. J Pediatr Hematol Oncol . 2014;36(3):185–189. doi: 10.1097/MPH.0000000000000011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 981.De A, Williams S, Yao Y, Jin Z, Brittenham GM, Kattan M, et al. Acute Chest Syndrome, Airway Inflammation and Lung Function in Sickle Cell Disease. PLoS One . 2023;18(3):e0283349. doi: 10.1371/journal.pone.0283349. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 982.Willen SM, Cohen R, Rodeghier M, Kirkham F, Redline SS, Rosen C, et al. Age is a Predictor of a Small Decrease in Lung Function in Children with Sickle Cell Anemia. Am J Hematol . 2018;93(3):408–415. doi: 10.1002/ajh.25003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 983.Alvarado AM, Ward KM, Muntz DS, Thompson AA, Rodeghier M, Fernhall B, et al. Heart Rate Recovery is Impaired After Maximal Exercise Testing in Children with Sickle Cell Anemia. J Pediatr . 2015;166(2):389.e1–393.e1. doi: 10.1016/j.jpeds.2014.10.064. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 984.Dei-Adomakoh YA, Afriyie-Mensah JS, Forson A, Adadey M, Ndanu TA, Acquaye JK. Lung Function Abnormalities in Sickle Cell Anaemia. Adv Hematol . 2019;2019:1783240–1783240. doi: 10.1155/2019/1783240. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 985.Caboot JB, Jawad AF, McDonough JM, Bowdre CY, Arens R, Marcus CL, et al. Non-Invasive Measurements of Carboxyhemoglobin and Methemoglobin in Children with Sickle Cell Disease. Pediatr Pulmonol . 2012;47(8):808–815. doi: 10.1002/ppul.22504. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 986.Waltz X, Romana M, Lalanne-Mistrih ML, Machado RF, Lamarre Y, Tarer V, et al. Hematologic and Hemorheological Determinants of Resting and Exercise-Induced Hemoglobin Oxygen Desaturation in Children with Sickle Cell Disease. Haematologica . 2013;98(7):1039–1044. doi: 10.3324/haematol.2013.083576. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 987.Partington SL, Valente AM, Landzberg M, Grant F, Di Carli MF, Dorbala S. Clinical Applications of Radionuclide Imaging in the Evaluation and Management of Patients with Congenital Heart Disease. J Nucl Cardiol . 2016;23(1):45–63. doi: 10.1007/s12350-015-0185-5. [DOI] [PubMed] [Google Scholar]
- 988.Fogel MA, Anwar S, Broberg C, Browne L, Chung T, Johnson T, et al. Society for Cardiovascular Magnetic Resonance/European Society of Cardiovascular Imaging/American Society of Echocardiography/Society for Pediatric Radiology/North American Society for Cardiovascular Imaging Guidelines for the use of Cardiovascular Magnetic Resonance in Pediatric Congenital and Acquired Heart Disease: Endorsed by The American Heart Association. J Cardiovasc Magn Reson . 2022;24(1):37–37. doi: 10.1186/s12968-022-00843-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 989.Biko DM, Collins RT, 2nd, Partington SL, Harris M, Whitehead KK, Keller MS, et al. Magnetic Resonance Myocardial Perfusion Imaging: Safety and Indications in Pediatrics and Young Adults. Pediatr Cardiol . 2018;39(2):275–282. doi: 10.1007/s00246-017-1752-0. [DOI] [PubMed] [Google Scholar]
- 990.Milanesi O, Stellin G, Zucchetta P. Nuclear Medicine in Pediatric Cardiology. Semin Nucl Med . 2017;47(2):158–169. doi: 10.1053/j.semnuclmed.2016.10.008. [DOI] [PubMed] [Google Scholar]
- 991.Ermis P. Stress Echocardiography: An Overview for Use in Pediatric and Congenital Cardiology. Congenit Heart Dis . 2017;12(5):624–626. doi: 10.1111/chd.12495. [DOI] [PubMed] [Google Scholar]
- 992.Lai WW, Mertens L, Cohen M, Geva T, editors. Echocardiography in Pediatric and Congenital Heart Disease: From Fetus to Adult . 2th ed. Chichester: John Wiley & Sons; 2015. ISBN-10: 0470674644; ISBN-13: 978-0470674642. [Google Scholar]
- 993.Mastrocola LE, Amorim BJ, Vitola JV, Brandão SCS, Grossman GB, Lima RSL, et al. Update of the Brazilian Guideline on Nuclear Cardiology - 2020. Arq Bras Cardiol . 2020;114(2):325–429. doi: 10.36660/abc.20200087. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 994.Boknik P, Eskandar J, Hofmann B, Zimmermann N, Neumann J, Gergs U. Role of Cardiac A2A Receptors Under Normal and Pathophysiological Conditions. Front Pharmacol . 2021;11:627838–627838. doi: 10.3389/fphar.2020.627838. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 995.Henzlova MJ, Duvall WL, Einstein AJ, Travin MI, Verberne HJ. ASNC Imaging Guidelines for SPECT Nuclear Cardiology Procedures: Stress, Protocols, and Tracers. J Nucl Cardiol . 2016;23(3):606–639. doi: 10.1007/s12350-015-0387-x. [DOI] [PubMed] [Google Scholar]
- 996.Chalela WA, Moffa PJ, Meneghetti JC. Estresse Cardiovascular: Princípios e Aplicações Clínicas . São Paulo: Roca; 2004. ISBN-10: 8572415130; ISBN-13: 978-8572415132. [Google Scholar]
- 997.Kim C, Kwok YS, Heagerty P, Redberg R. Pharmacologic Stress Testing for Coronary Disease Diagnosis: A Meta-Analysis. Am Heart J . 2001;142(6):934–944. doi: 10.1067/mhj.2001.119761. [DOI] [PubMed] [Google Scholar]
- 998.Fukuda T, Ishibashi M, Shinohara T, Miyake T, Kudoh T, Saga T. Follow-Up Assessment of the Collateral Circulation in Patients with Kawasaki Disease Who Underwent Dipyridamole Stress Technetium-99m Tetrofosmin Scintigraphy. Pediatr Cardiol . 2005;26(5):558–564. doi: 10.1007/s00246-004-0726-1. [DOI] [PubMed] [Google Scholar]
- 999.Geleijnse ML, Elhendy A, Fioretti PM, Roelandt JR. Dobutamine Stress Myocardial Perfusion Imaging. J Am Coll Cardiol . 2000;36(7):2017–2027. doi: 10.1016/s0735-1097(00)01012-3. [DOI] [PubMed] [Google Scholar]
- 1000.Dilsizian V, Narula J, editors. Atlas of Nuclear Cardiology . 4th ed. New York: Springer; 2013. ISBN-13: 978-3030498849. [Google Scholar]
- 1001.Pahl E, Duffy CE, Chaudhry FA. The Role of Stress Echocardiography in Children. Echocardiography . 2000;17(5):507–512. doi: 10.1111/j.1540-8175.2000.tb01171.x. [DOI] [PubMed] [Google Scholar]
- 1002.Fricke TA, Bell D, Daley M, d‘Udekem Y, Brizard CP, Alphonso N, et al. The Influence of Coronary Artery Anatomy on Mortality After the Arterial Switch Operation. J Thorac Cardiovasc Surg . 2020;160(1):191.e1–199.e1. doi: 10.1016/j.jtcvs.2019.11.146. [DOI] [PubMed] [Google Scholar]
- 1003.van Wijk SWH, van der Stelt F, Ter Heide H, Schoof PH, Doevendans PAFM, Meijboom FJ, et al. Sudden Death Due to Coronary Artery Lesions Long-term After the Arterial Switch Operation: A Systematic Review. Can J Cardiol . 2017;33(9):1180–1187. doi: 10.1016/j.cjca.2017.02.017. [DOI] [PubMed] [Google Scholar]
- 1004.Noel CV, Krishnamurthy R, Masand P, Moffett B, Schlingmann T, Cheong BY, et al. Myocardial Stress Perfusion MRI: Experience in Pediatric and Young-Adult Patients Following Arterial Switch Operation Utilizing Regadenoson. Pediatr Cardiol . 2018;39(6):1249–1257. doi: 10.1007/s00246-018-1890-z. [DOI] [PubMed] [Google Scholar]
- 1005.Sterrett LE, Schamberger MS, Ebenroth ES, Siddiqui AR, Hurwitz RA. Myocardial Perfusion and Exercise Capacity 12 Years After Arterial Switch Surgery for D-Transposition of the Great Arteries. Pediatr Cardiol . 2011;32(6):785–791. doi: 10.1007/s00246-011-9975-y. [DOI] [PubMed] [Google Scholar]
- 1006.Hauser M, Bengel FM, Kühn A, Sauer U, Zylla S, Braun SL, et al. Myocardial Blood Flow and Flow Reserve After Coronary Reimplantation in Patients After Arterial Switch and Ross Operation. Circulation . 2001;103(14):1875–1880. doi: 10.1161/01.cir.103.14.1875. [DOI] [PubMed] [Google Scholar]
- 1007.Pizzi MN, Franquet E, Aguadé-Bruix S, Manso B, Casaldáliga J, Cuberas-Borrós G, et al. Long-Term Follow-Up Assessment After the Arterial Switch Operation for Correction of Dextro-Transposition of the Great Arteries by Means of Exercise Myocardial Perfusion-Gated SPECT. Pediatr Cardiol . 2014;35(2):197–207. doi: 10.1007/s00246-013-0759-4. [DOI] [PubMed] [Google Scholar]
- 1008.Rickers C, Sasse K, Buchert R, Stern H, van den Hoff J, Lübeck M, et al. Myocardial Viability Assessed by Positron Emission Tomography in Infants and Children After the Arterial Switch Operation and Suspected Infarction. J Am Coll Cardiol . 2000;36(5):1676–1683. doi: 10.1016/s0735-1097(00)00891-3. [DOI] [PubMed] [Google Scholar]
- 1009.Tsuno K, Fukazawa R, Kiriyama T, Imai S, Watanabe M, Kumita S, et al. Peripheral Coronary Artery Circulatory Dysfunction in Remote Stage Kawasaki Disease Patients Detected by Adenosine Stress 13N-Ammonia Myocardial Perfusion Positron Emission Tomography. J Clin Med . 2022;11(4):1134–1134. doi: 10.3390/jcm11041134. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1010.Hauser M, Bengel F, Kuehn A, Nekolla S, Kaemmerer H, Schwaiger M, et al. Myocardial Blood Flow and Coronary Flow Reserve in Children with „Normal" Epicardial Coronary Arteries After the Onset of Kawasaki Disease Assessed by Positron Emission Tomography. Pediatr Cardiol . 2004;25(2):108–112. doi: 10.1007/s00246-003-0472-9. [DOI] [PubMed] [Google Scholar]
- 1011.Maron MS, Olivotto I, Maron BJ, Prasad SK, Cecchi F, Udelson JE, et al. The Case for Myocardial Ischemia in Hypertrophic Cardiomyopathy. J Am Coll Cardiol . 2009;54(9):866–875. doi: 10.1016/j.jacc.2009.04.072. [DOI] [PubMed] [Google Scholar]
- 1012.Rosa SA, Lopes LR, Fiarresga A, Ferreira RC, Mota Carmo M. Coronary Microvascular Dysfunction in Hypertrophic Cardiomyopathy: Pathophysiology, Assessment, and Clinical Impact. Microcirculation . 2021;28(1):e12656. doi: 10.1111/micc.12656. [DOI] [PubMed] [Google Scholar]
- 1013.Hallioglu O, Gunay EC, Unal S, Erdogan A, Balci S, Citirik D. Gated Myocardial Perfusion Scintigraphy in Children with Sickle Cell Anemia: Correlation with Echocardiography. Rev Esp Med Nucl . 2011;30(6):354–359. doi: 10.1016/j.remn.2011.02.003. [DOI] [PubMed] [Google Scholar]
- 1014.Kindel SJ, Law YM, Chin C, Burch M, Kirklin JK, Naftel DC, et al. Improved Detection of Cardiac Allograft Vasculopathy: A Multi-Institutional Analysis of Functional Parameters in Pediatric Heart Transplant Recipients. J Am Coll Cardiol . 2015;66(5):547–557. doi: 10.1016/j.jacc.2015.05.063. [DOI] [PubMed] [Google Scholar]
- 1015.Neskovic AN. Stress Echocardiography Essential Guide and DVD . New York: Healthcare; 2010. ISBN-10: 0367384094; ISBN-13: 978-0367384098. [Google Scholar]
- 1016.Lancellotti P, Pellikka PA, Budts W, Chaudhry FA, Donal E, Dulgheru R, et al. The Clinical Use of Stress Echocardiography in Non-Ischaemic Heart Disease: Recommendations from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. J Am Soc Echocardiogr . 2017;30(2):101–138. doi: 10.1016/j.echo.2016.10.016. [DOI] [PubMed] [Google Scholar]
- 1017.Barberato SH, Romano MMD, Beck ALS, Rodrigues ACT, Almeida ALC, Assunção BMBL, et al. Position Statement on Indications of Echocardiography in Adults - 2019. Arq Bras Cardiol . 2019;113(1):135–181. doi: 10.5935/abc.20190129. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1018.Conselho Federal de Medicina . Diário Oficial da União . Brasília: Nov 01, 2018. Resolução CFM no 2.217/2018. Aprova o código de ética médica. [Google Scholar]
- 1019.Conselho Federal de Medicina . Diário Oficial da União . Brasília: Dec 11, 2018. pp. 179–179. Resolução CFM no 2.222/2018. Corrige erro material do Código de Ética Médica (Resolução CFM n ° 2.217/2018) publicado no D.O.U. de 1 de novembro de 2018, Seção I. [Google Scholar]
- 1020.Conselho Federal de Medicina . Diário Oficial da União . Brasília: Apr 5, 2019. Resolução CFM No 2.226/2019. Revoga a Resolução CFM n ° 1.649/2002, os artigos 4 ° e 5 ° e seu parágrafo único da Resolução CFM n ° 2.170/2017 e altera o artigo 72 do Código de Ética Médica, que proíbem descontos em honorários médicos através de cartões de descontos e a divulgação de preços das consultas médicas de forma exclusivamente interna. [Google Scholar]
- 1021.Conselho Federal de Medicina . Diário Oficial da União . Brasília: Jun 24, 2024. Resolução CFM no 2.380/2024. Homologa a Portaria CME n ° 1/2024, que atualiza a relação de especialidades e áreas de atuação médicas aprovadas pela Comissão Mista de Especialidades. [Google Scholar]
- 1022.Conselho Federal de Medicina . Diário Oficial da União . Brasília: Sep 27, 2013. Resolução CFM no 2.021/2013. A realização do teste ergométrico é ato médico, devendo ser feito, em todas as suas etapas, por médico habilitado e capacitado, apto a atender as ocorrências cardiovasculares, sendo falta ética sua delegação para outros profissionais da área da saúde, de 20 de junho de 2013. [Google Scholar]
- 1023.Conselho Federal de Medicina . Diário Oficial da União . Brasília: Resolução CFM No 2.336/2023. Dispõe sobre publicidade e propaganda médicas. 13/09/2023. Edição: 175. Seção: 1. Página: 312. [Google Scholar]
- 1024.Brasil . Constituição da República Federativa do Brasi de 1988 . Brasília: Oct 5, 1988. [Google Scholar]
- 1025.Brasil . Diário Oficial da União . Brasília: Jan 11, 2002. Lei n ° 10.406, de 10 de janeiro de 2002. Institui o Código Civil. [Google Scholar]
- 1026.Brasil . Diário Oficial da União . Brasília: Sep 12, 1990. Lei no 8.078, de 11 de setembro de 1990. Dispõe sobre a proteção do consumidor e dá outras providências. [Google Scholar]
- 1027.Brasil . Diário Oficial da União . Brasília: Dec 9, 2012. Lei no 12.741, de 8 de dezembro de 2012. Dispõe sobre as medidas de esclarecimento ao consumidor, de que trata o § 5 ° do artigo 150 da Constituição Federal; altera o inciso III do art. 6 ° e o inciso IV do art. 106 da Lei n ° 8.078, de 11 de setembro de 1990 - Código de Defesa do Consumidor. [Google Scholar]
- 1028.Eisenmann JC, Laurson KR, Welk GJ. Aerobic Fitness Percentiles for U.S. Adolescents. Am J Prev Med . 2011;41(4 Suppl 2):S106–S110. doi: 10.1016/j.amepre.2011.07.005. [DOI] [PubMed] [Google Scholar]
- 1029.Almeida AEM, Santander IRMF, Campos MIM, Nascimento JA, Nascimento JA, Ritt LEF, et al. Classification System for Cardiorespiratory Fitness Based on a Sample of the Brazilian Population. Int J Cardiovasc Sci . 2019;32(4):343–354. doi: 10.5935/2359-4802.20190057. [DOI] [Google Scholar]
- 1030.Ilarraza-Lomelí H, Castañeda-López J, Myers J, Miranda I, Quiroga P, Rius M-D, et al. Cardiopulmonary exercise testing in healthy children and adolescents at moderately high altitude. Arch Cardiol México . 2013;83:176–182. doi: 10.1016/j.acmx.2013.04.003. [DOI] [PubMed] [Google Scholar]
- 1031.van Genuchten WJ, Helbing WA, Ten Harkel ADJ, Fejzic Z, Md IMK, Slieker MG, et al. Exercise Capacity in a Cohort of Children with Congenital Heart Disease. Eur J Pediatr . 2023;182(1):295–306. doi: 10.1007/s00431-022-04648-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1032.Fredriksen PM, Ingjer F, Nystad W, Thaulow E. A Comparison of VO2(peak) Between Patients with Congenital Heart Disease and Healthy Subjects, all Aged 8-17 Years. Eur J Appl Physiol Occup Physiol . 1999;80(5):409–416. doi: 10.1007/s004210050612. [DOI] [PubMed] [Google Scholar]
- 1033.Guimarães GV, d’Avila VM, Camargo PR, Moreira LFP, Luces JRL, Bocchi EA. Prognostic value of cardiopulmonary exercise testing in children with heart failure secondary to idiopathic dilated cardiomyopathy in a non-β-blocker therapy setting. Eur J Heart Fail . 2008;10:560–565. doi: 10.1016/j.ejheart.2008.04.009. [DOI] [PubMed] [Google Scholar]