









Il processo di “valutazione” è riconosciuto dalla comunità scientifica come strumento indispensabile per il miglioramento della qualità dell’assistenza sanitaria. Nel mondo delle valutazioni, l’Health Technology Assessment (HTA) riveste un ruolo centrale in quanto ha l’obiettivo di supportare la formulazione di politiche sanitarie sicure ed efficaci, incentrate sui pazienti e volte ad acquisire il massimo valore [1, 2].
Secondo la definizione più recente proposta, nel 2020, dal Network Internazionale delle Agenzie di HTA (INAHTA), l’HTA è un processo multidisciplinare che utilizza una metodologia rigorosa per determinare il valore di una tecnologia sanitaria nelle diverse fasi del suo ciclo vitale, con lo scopo di informare il processo decisionale al fine di promuovere un sistema sanitario equo, efficiente e di alta qualità [3]. La nuova definizione è accompagnata da quattro note esplicative [3] quali:
nota 1: una tecnologia sanitaria è un intervento sviluppato per prevenire, diagnosticare o trattare condizioni mediche; promuovere la salute; fornire riabilitazione; o organizzare la fornitura di servizi sanitari. Pertanto, l’intervento da valutare può essere un test, un dispositivo, un farmaco, un vaccino, una procedura, un programma sanitario o un sistema assistenziale;
nota 2: il processo di valutazione è formale, sistematico e trasparente ed utilizza una metodologia rigorosa al fine di sistematizzare le migliori evidenze scientifiche disponibili;
nota 3: le dimensioni del valore di una tecnologia sanitaria possono essere valutate esaminando l’impatto dell’utilizzo di una tecnologia sanitaria rispetto alle alternative disponibili. Queste dimensioni includono l’efficacia clinica, la sicurezza, i costi e le implicazioni economiche, etiche, sociali, culturali e legali, gli aspetti organizzativi e ambientali come implicazioni più ampie per il paziente, i caregivers, gli operatori sanitari e la popolazione generale. Il valore complessivo può variare a seconda della prospettiva adottata, delle parti interessate coinvolte e del contesto considerato;
nota 4: l’HTA può essere applicato in diversi fasi del ciclo vitale di una tecnologia sanitaria, ovvero in fase di pre-commercializzazione, durante il processo di approvazione, in fase post-marketing, fino alla fase di disinvestimento di una tecnologia sanitaria.
Le caratteristiche salienti dell’HTA sono rappresentate dalla sua multidisciplinarietà e interdisciplinarietà, indispensabili per analizzare da più prospettive l’impatto della tecnologia sanitaria e dalle sue finalità di veicolo delle informazioni scientifiche al mondo decisionale [2]. Altro aspetto fondamentale del processo di HTA è la sistematicità: alimentano una valutazione HTA, infatti, le evidenze scientifiche adeguatamente raccolte, analizzate e sintetizzate [1]. Tali evidenze riguardano diversi aspetti della tecnologia, descritti dallo European Network per l’Health Technology Assessment (EUnetHTA) in un core model di nove domini, tool prodotto con l’obiettivo di standardizzare processi e contenuti dell’HTA [4]. Tali domini comprendono: il problema di salute e l’uso corrente della tecnologia, le caratteristiche della tecnologia, la sicurezza, l’efficacia, i costi e la valutazione economica, gli aspetti organizzativi, etici, sociali e, infine, quelli legali [4].
Il processo di HTA prevede le seguenti fasi: definizione della policy question; elaborazione del protocollo di HTA; definizione delle domande di ricerca sulle diverse dimensioni/domini da valutare, ricerca delle evidenze scientifiche; analisi e sistematizzazione delle evidenze scientifiche disponibili; revisione/appraisal esterna; stesura del report di HTA; pubblicazione e dissemination del report di HTA; uso del report di HTA; aggiornamento del report di HTA [5] ed eventuale reassessment della tecnologia oggetto di valutazione [6].
L’HTA ha, quindi, un ruolo chiave nel fornire le informazioni evidence based necessarie affinché i decision makers prendano le giuste decisioni al fine di promuovere un sistema sanitario equo, efficiente e di alta qualità [7]. Inoltre, l’HTA si configura come strumento di governance, in quanto consente di guidare in maniera razionale i sistemi sanitari. Il governo dell’innovazione in sanità, infatti, deve basarsi sulla conoscenza delle potenzialità, i vantaggi e gli svantaggi dell’utilizzo delle diverse tecnologie, al fine di poter valutare il beneficio effettivo derivante dal loro impiego [8]. L’HTA ha, quindi, un ruolo chiave nella promozione di un approccio basato sulle evidenze per l’ottimizzazione delle tecnologie, al fine di migliorare la sicurezza, la qualità e l’uso appropriato delle risorse in sanità. In un contesto come quello attuale, infatti, al fine di coniugare sostenibilità e accesso all’innovazione secondo la prospettiva della Value Based Health Care (VBHC), appare indispensabile introdurre, diffondere ed implementare strumenti evidence-based, orientati alla razionalizzazione delle risorse disponibili, secondo logiche di equità sociale ed efficienza allocativa [9]. Per affrontare le sfide attuali del nostro Servizio Sanitario Nazionale (SSN) occorre, quindi, riorganizzare il sistema tenendo in considerazione le esigenze di tutti gli stakeholders e ponendo al centro il “valore”.
Nel 2019 l’Expert Panel on Effective Ways of Investing in Health (EXPH), istituito dalla Commissione Europea, ha approvato un importante documento dal titolo Opinion on Defining value in Value-Based Healthcare [10]. L’EXPH propone l’assistenza sanitaria basata sul valore come un concetto completo fondato su quattro “pilastri del valore”: un’assistenza adeguata per raggiungere gli obiettivi personali dei pazienti (valore personale), il conseguimento di migliori risultati possibili con le risorse disponibili (valore tecnico), un’equa distribuzione delle risorse tra tutti i gruppi di pazienti (valore allocativo) e il contributo dell’assistenza sanitaria alla partecipazione e alla connessione sociale (valore sociale).
In un contesto come quello attuale, quindi, secondo la prospettiva della VBHC, appare indispensabile introdurre, diffondere ed implementare strumenti evidence-based come l’HTA [10]. Anche la Sanità Pubblica deve avvalersi di tale strumento per supportare scelte di valore per l’intera popolazione e tra i suoi principali campi di interesse ritroviamo la prevenzione primaria delle malattie infettive (vaccinazione). Anche il Piano Nazionale di Prevenzione Vaccinale (PNPV) 2017-2019 [11], così come il nuovo PNPV 2023-2025 [12], recependo le raccomandazioni dell’Organizzazione Mondiale della Sanità (OMS) del 2005 [13], hanno richiamato l’HTA come elemento indispensabile per la valutazione delle vaccinazioni da offrire alla popolazione.
Oggi la principale sfida del SSN è rispondere efficacemente al crescente bisogno di salute della popolazione attraverso l’allocazione efficiente di risorse sanitarie e la creazione di valore sia per il singolo sia per la comunità. Occorre, pertanto, proporre e promuovere in maniera esplicita e fattiva un cambiamento culturale necessario per affrontare le nuove sfide del Sistema Salute. Tra queste, le Istituzioni sanitarie devono oggi confrontarsi, tra le altre, con quelle derivanti dall’incremento della speranza di vita, quindi con il progressivo aumento del numero di soggetti con patologie croniche che nel corso di malattie infettive vaccino-prevenibili possono più frequentemente andare incontro a complicanze o a peggioramento della patologia cronica sottostante; con l’immunosenescenza che, riducendo progressivamente la funzione del sistema immunitario, non garantisce un’adeguata risposta fisiologica alle malattie infettive [14]. La vaccinazione nella popolazione adulta/anziana, quindi, deve diventare una componente chiave delle strategie atte a favorire il mantenimento di un buono stato di salute nel lungo termine, così come anche riportato nella European Immunization Agenda 2030 [15]. Senza un programma vaccinale specificamente mirato sugli adulti a rischio di complicanze e sugli anziani, le malattie infettive in questa popolazione target rimarranno un grande problema per le autorità sanitarie e per la Salute Pubblica anche perché le patologie prevenibili con vaccino hanno impatti molto importanti non solo sul sistema sanitario e socio-assistenziale, ma anche sul sistema produttivo ed economico [16].
Tra le malattie infettive vaccino prevenibili, alcune Lower Respiratory Tract Infections (LRTI), rappresentano una critica possibilità verso complicanze gravi in alcune categorie di soggetti quali, appunto, gli anziani e le persone con comorbosità e malattie croniche. Purtroppo però la conoscenza da parte della popolazione (specialmente quella a rischio) dei benefici derivanti dalla vaccinazione contro tali patologie sono ancora troppo scarse [15].
Le infezioni delle basse vie respiratorie rientrano nelle cosiddette Infezioni Respiratorie Acute (ARI), gruppo di quadri clinici caratterizzati da sintomatologia a carico delle alte o basse vie dell’apparato respiratorio, causati da differenti agenti eziologici. Tali infezioni sono una delle principali cause di morbosità e mortalità in tutto il mondo. Sono malattie ubiquitarie, altamente contagiose che colpiscono individui di tutte le età, con maggiore severità nelle fasce di età infantile ed anziana [17, 18].
La mortalità dovuta alle ARI si stima essere intorno ai 4 milioni di decessi per anno, con una maggiore distribuzione nei Paesi a medio-basso reddito [18]. La diffusione dei patogeni può avvenire per via aerea diretta, attraverso secrezioni respiratorie contaminate quali tosse e starnuti (droplets), o per via aerea indiretta, tramite oggetti contaminati (fomites), o ancora attraverso contatto diretto. La trasmissibilità dei patogeni viene facilitata in spazi chiusi ed in locali con un’alta densità di popolazione. Le epidemie si presentano con maggior frequenza nelle stagioni invernali, più precisamente nel periodo compreso tra ottobre e marzo [19]. Molteplici fattori concorrono nel favorire l’elevata frequenza delle infezioni respiratorie: la numerosità degli agenti eziologici potenzialmente responsabili di queste sindromi, la loro diffusione e la breve durata dell’immunità conseguente alla patologia. La scarsa immunogenicità della maggior parte dei patogeni coinvolti nelle infezioni respiratorie determina, infatti, una breve durata dell’immunità acquisita ed è per questo motivo che nel corso della vita sono possibili reinfezioni da parte dello stesso agente eziologico. Le categorie a più alto rischio di infezione, e quindi a rischio di sviluppare complicanze, sono i bambini, i soggetti anziani e i pazienti immunocompromessi o con patologie croniche [20].
Nell’eziologia delle infezioni delle basse vie respiratorie predominano virus respiratori quali SARS-CoV-2, virus influenzali, virus respiratorio sinciziale (RSV) e batteri come lo Streptococcus pneumoniae (pneumococco). Per questi agenti patogeni abbiamo a disposizione un’arma importante di prevenzione, rappresentata dalla vaccinazione, fortemente raccomandata ormai da molti anni anche dalle Linee Guida internazionali per il management dei pazienti adulti/anziani con LRTIs [21].
La vaccinazione nella popolazione adulta a rischio e anziana, quindi, deve diventare un componente chiave delle strategie atte a favorire, insieme all’implementazione di altri interventi preventivi volti a promuovere uno stile di vita sano, il mantenimento di un buono stato di salute nel lungo termine. Ciò in considerazione delle numerose e solide evidenze che la letteratura scientifica ha prodotto a supporto dei benefici che questo approccio ha su morbosità, mortalità e qualità della vita. Senza un programma vaccinale specificamente mirato sugli adulti di 60 o più anni di età, le malattie infettive in questa popolazione rimarranno un grande problema per la Salute Pubblica, a maggior ragione se teniamo conto dell’ulteriore aumento, previsto nei prossimi anni, della popolazione di età ≥ 65 anni [14].
Tra le LRTIs prevenibili da vaccini, attualmente, un’attenzione particolare è riservata a quelle da RSV, soprattutto alla luce dell’innovazione dirompente che ha caratterizzato gli ultimi anni con lo sviluppo di vaccini specifici, e successiva approvazione, per alcuni di essi, da parte degli enti regolatori.
Recentemente (gennaio 2024) anche il Board del Calendario per la Vita ha pubblicato le sue raccomandazioni sulla vaccinazione contro RSV nella popolazione anziana e negli adulti a rischio [22].
Nel documento del Board, viene sottolineato che le infezioni da RSV in età adulta e anziana possono portare a gravi complicanze respiratorie. Nei pazienti adulti (≥ 60 anni) ospedalizzati, l’infezione da RSV si manifesta spesso come grave malattia delle vie respiratorie inferiori, con alte percentuali di polmonite (66%), necessità di ventilazione meccanica (21%), ammissione in terapia intensiva (18%) e letalità a breve e lungo termine [23]. In generale, RSV gioca un ruolo importante nello sviluppo della polmonite negli adulti anziani ed è stato, in epoca pre-pandemica, la seconda causa più comune di polmonite virale in questa popolazione [24, 25]. Secondo numerosi studi, l’RSV negli adulti anziani potrebbe aver causato dal 3 al 15% dei casi di polmonite acquisita in comunità, dal 9 al 10% delle ammissioni ospedaliere per malattie cardiorespiratorie acute e un eccesso di decessi durante i picchi stagionali [26-28]. Gli adulti che sono a maggior rischio di ricovero associato ad infezione da RSV sono quelli affetti da determinate condizioni mediche, comprese Bronco Pneumopatiaa Cronica Ostruttiva (BPCO), asma, insufficienza cardiaca congestizia, malattia coronarica, malattia cerebrovascolare, diabete mellito e malattia renale cronica, così come i residenti nelle struture di assistenza a lungo termine, i soggetti fragili, di età avanzata (≥ 75 anni) o con immunità compromessa [29].
Sulla base delle evidenze attualmente disponibili, il Board del Calendario per la Vita ha sottolineato come la recente disponibilità di vaccini efficaci e sicuri nei confronti delle patologie causate da RSV rappresenti una opportunità preventiva di grande valore clinico, non essendo stata disponibile finora alcuna valida misura di prevenzione né alcuna terapia specifica. In tale ottica, i vaccini contro RSV costituiscono una risposta ad un bisogno medico finora insoddisfatto [22]. Il Board del Calendario della Vita, sulla base delle evidenze di efficacia e sicurezza ad oggi disponibili, e considerando le informazioni attualmente in fase di raccolta sulla durata della protezione conferita dai vaccini anti-RSV, ne raccomanda l’utilizzo ai soggetti di età pari o superiore ai 75 anni, popolazione nella quale è peraltro molto frequente la co-esistenza di condizioni di cronicità che rendono l’infezione da RSV ancora più a rischio di complicanze gravi [22]. Per le stesse motivazioni, raccomanda l’estensione della vaccinazione ai soggetti affetti da patologie croniche di età superiore o uguale ai 60 anni [22].
Il Board specifica che, complessivamente, le evidenze di efficacia dei vaccini, insieme alle informazioni ancora da raccogliere, indicano un approccio conservativo ma tuttavia proattivo nella raccomandazione di utilizzo dei nuovi vaccini, in modo che le categorie a maggior rischio (per le quali si può prevedere un rapporto di costo-efficacia più favorevole) siano immediatamente protette, in attesa di eventuali estensioni di raccomandazione sulla base dei dati e delle valutazioni che si renderanno disponibili nei prossimi mesi [22].
Si ricorda, che i due vaccini attualmente approvati dall’Agenzia Europea per i Medicinali (European Medicines Agency - EMA) [30, 31] e dall’Agenzia Italiana del Farmaco (AIFA) [32-34] per uso nella popolazione ≥ 60 anni sono prodotti con tecniche di DNA ricombinante e sono, rispettivamente:
il vaccino monovalente RSV A (attività cross-neutralizzante contro RSV B), adiuvato con AS01E (sistema adiuvante contenente monofosoril-lipide A – lipopolisaccaride batterico – e saponina QS21 – estratto da Quillaia saponaria –) [35]. Questo vaccino (Arexvy®), il primo ad aver ricevuto l’approvazione dagli enti regolatori, è indicato per l’immunizzazione attiva per la prevenzione della malattia del tratto respiratorio inferiore (LRTD) provocata da RSV negli adulti di età pari o superiore a 60 anni [36];
il vaccino bivalente RSV A/RSV B, non adiuvato [37]. Questo vaccino (Abrysvo) è indicato per la protezione passiva contro la LRTD causata da RSV nei neonati dalla nascita fino ai 6 mesi di età a seguito dell’immunizzazione della madre durante la gravidanza, e per la immunizzazione attiva dei soggetti di età pari o superiore a 60 anni per la prevenzione della LRTD causata da RSV [38].
Inoltre, il 31 maggio 2024 è stato approvato dalla Food and Drug Administration (FDA) un terzo vaccino anti-RSV basato sulla tecnologia del RNA messaggero (mRNA) formulato insieme a nanoparticelle lipidiche [39, 40]. Questo vaccino (mRNA-1345, mRESVIA) è volto a prevenire la LRTD associata ad RSV negli adulti di età pari o superiore ai 60 anni.
Sulla base del burden delle infezioni da RSV e alla luce della disponibilità di strumenti per la loro prevenzione anche il Ministero della Salute, in data 27 marzo 2024, ha pubblicato una specifica Circolare per indicare le attuali misure di prevenzione e immunizzazione contro RSV [41]. Tuttavia, ad oggi, non esiste ancora una raccomandazione ministeriale su questa vaccinazione.
Nel prossimo futuro sarà importante colmare alcune lacune conoscitive ancora presenti, soprattutto dal punto di vista epidemiologico, per avere dati più consistenti sul carico di malattia da RSV nel nostro paese, e quindi avere una possibilità di valutare con più precisione la dimensione dei casi di malattia prevenibili con la vaccinazione. Inoltre, dovrà essere valutata la persistenza della protezione anche oltre la seconda stagione successiva alla somministrazione dei vaccini, dato che potrà far quantificare un numero di casi prevenibile ancora superiore a quanto evidente oggi [22]. Infine, così come riportato nelle Raccomandazioni del Board del Calendario per la Vita dovranno essere prodotte valutazioni di HTA per i nuovi vaccini al fine di chiarire la sostenibilità organizzattiva ed economica, ma anche la necessità etica dell’offerta della vaccinazione ai gruppi target [22].
Pertanto, in un contesto come quello attuale, al fine di coniugare sostenibilità e accesso all’innovazione, appare indispensabile promuovere l’assessment delle tecnologie sanitarie al fine di razionalizzare le risorse disponibili secondo logiche di efficienza allocativa.
Sulla base delle premesse descritte, il presente report si pone come obiettivo principale quello di effettuare una valutazione del vaccino Arexvy® al fine di analizzarne le principali implicazioni sanitarie, economiche, organizzative, etiche e sociali. Tale valutazione, focalizzata sul contesto di cura italiano, affronta le seguenti tematiche:
il burden clinico-epidemiologico delle infezioni da RSV nella popolazione adulta/anziana;
il vaccino RSVPreF3 OA (Arexvy®): immunogenicità, efficacia e sicurezza;
altri vaccini disponibili per la vaccinazione anti-RSV nella popolazione adulta/anziana;
la valutazione economica dell’introduzione del vaccino RSVPreF3 OA (Arexvy®) in Italia;
gli aspetti strategici dell’offerta della vaccinazione anti-RSV per la popolazione adulta e anziana italiana;
il sistema di sorveglianza delle infezioni respiratorie acute con focus su RSV e il valore dei dati in Sanità;
le nuove sfide per una strategia preventiva efficace, equa ed appropriata contro le infezioni da RSV in Italia;
la vaccinazione nell’adulto/anziano, Regioni a confronto: l’esperienza delle Regioni Calabria, Campania, Puglia, Lazio, Liguria, Sicilia;
l’esitazione vaccinale nella popolazione adulta e anziana;
il valore della vaccinazione nell’adulto/anziano nel quadro più complessivo della Value-Based Healthcare;
l’analisi etica dell’introduzione del vaccino RSVPreF3 OA (Arexvy®) in Italia.
Il report si chiude, infine, con gli elementi chiave per il processo decisionale che sintetizzano quanto descritto nel report. L’elaborazione di questo Report è avvenuta, secondo la metodologia HTA, attraverso la creazione di un gruppo di lavoro multidisciplinare che ha identificato, analizzato e, successivamente, sintetizzato tutte le informazioni disponibili sulla tecnologia sanitaria oggetto di valutazione. Sono state, quindi, eseguite revisioni sistematiche della letteratura scientifica esistente e le evidenze sono state selezionate secondo criteri di inclusione precostituiti, organizzate sulla base dei domini HTA seguendo il Core Model® di EuNetHTA [4]. Coerentemente con l’approccio dell’HTA, la stesura del presente report ha previsto, inoltre, la definizione e l’attivazione di un tavolo multidisciplinare di esperti per discutere e approfondire le tematiche legate alla tecnologia sanitaria oggetto di valutazione. Questa attività ha rappresentato una fase di appraisal, in cui i risultati della ricerca effettuata per l’elaborazione del report sono stati sottoposti all’attenzione di un expert panel che ha fornito indicazioni utili a rifinire e sistematizzare i risultati dello studio e delle evidenze prodotte. La stesura del presente report si è conclusa il 14 giugno 2024.
Il Virus Respiratorio Sinciziale (RSV) è un patogeno noto per il suo impatto significativo sulla salute dei bambini. Tuttavia, negli ultimi anni, la sua rilevanza nelle infezioni respiratorie acute (ARI) negli adulti, soprattutto quelli oltre i 60 anni, è diventata sempre più evidente [1].
Studi recenti hanno rivelato che il tasso di attacco del RSV-ARI negli adulti anziani è circa dell’1,62%, con un tasso di ospedalizzazione stimato allo 0,15%. Questi dati sottolineano la sostanziale presenza e il rischio di ospedalizzazione dovuto all’RSV in questa fascia d’età, che spesso è accompagnata da condizioni mediche preesistenti che possono aggravare il decorso della malattia [1].
Il quadro clinico dell’RSV negli adulti può variare da sintomi lievi di malattie delle vie respiratorie superiori a condizioni più gravi, come la bronchiolite e la polmonite. In particolare, gli adulti anziani possono sperimentare esacerbazioni di malattie croniche, come la BPCO (Broncopneumopatia Cronica Ostruttiva) o l’insufficienza cardiaca congestizia [2].
Attualmente, il trattamento dell’RSV negli adulti si concentra principalmente sulla gestione dei sintomi e sul supporto respiratorio. Non esistono antivirali specifici approvati, anche se sono in corso di sviluppo e sperimentazione diversi farmaci antivirali e immunomodulatori [3].
La recente approvazione di vaccini specifici rende la prevenzione un aspetto cruciale nella gestione dell’RSV, non escludendo le misure non farmacologiche come l’igiene delle mani, il distanziamento sociale durante i mesi di picco di RSV e, per gli ospedali, l’adozione di protocolli per limitare la diffusione nosocomiale del virus [4].
Il fardello dell’RSV negli adulti anziani è tangibile e richiede una maggiore consapevolezza, così come strategie di intervento mirate. L’avanzamento nella ricerca di trattamenti efficaci e vaccini è essenziale per ridurre l’impatto di questa malattia respiratoria acuta in una popolazione vulnerabile e in crescita [5].
L’Health Technology Assessment (HTA) gioca un ruolo cruciale nel guidare le decisioni sanitarie, specialmente in un campo in rapida evoluzione come quello dell’RSV. L’HTA fornisce un’analisi sistematica delle proprietà, degli effetti e degli impatti delle tecnologie sanitarie, fondamentale per informare le politiche sanitarie e le decisioni cliniche. In relazione all’RSV, l’HTA può aiutare a valutare l’efficacia e il rapporto costo-efficacia di nuovi vaccini, terapie antivirali e strategie di prevenzione [6].
Inoltre, l’HTA può fornire informazioni preziose sulla gestione ottimale delle risorse sanitarie, sulla pianificazione dei servizi sanitari e sulla priorità delle iniziative di ricerca, che sono tutte cruciali per affrontare efficacemente l’RSV negli adulti e negli anziani.
In conclusione, mentre l’RSV continua a rappresentare una sfida significativa per la salute pubblica, l’evoluzione delle conoscenze cliniche ed epidemiologiche e l’impiego di strumenti come l’HTA offrono vie promettenti per migliorare la prevenzione, il trattamento e la gestione complessiva dell’RSV nella popolazione adulta e anziana.
RSV è noto per essere una delle cause principali di infezioni respiratorie acute nei bambini e nei neonati, su cui ha un impatto significativo in termini di morbosità e mortalità, specialmente nei paesi in via di sviluppo [7]. Tuttavia, le reinfezioni sono possibili durante tutto l’arco della vita, coinvolgendo tutte le fasce d’età [8]. Recenti studi hanno evidenziato un’incidenza significativa nella popolazione adulta e anziana, specialmente nei pazienti ospedalizzati e in coloro che presentano comorbosità o un sistema immunitario compromesso [2].
Se negli ultimi anni il numero di morti attribuibili a RSV nei bambini al di sotto dei cinque anni si è andata riducendo, i decessi causati da RSV nella popolazione anziana hanno invece registrato un progressivo aumento, sottolineando la necessità di indirizzare la giusta attenzione in termini di sorveglianza e prevenzione anche a una fascia d’età poco attenzionata in precedenza [9].
Uno studio condotto da Shi et al. [5] ha rivelato che l’incidenza annuale di infezioni da RSV negli adulti è stimata intorno a 3-7% e aumenta con l’età, raggiungendo il picco nelle persone di età superiore ai 65 anni. Questo dato è particolarmente rilevante considerando l’invecchiamento della popolazione a livello globale e configura RSV come un “patogeno globale in un mondo che invecchia”, come definito da Falsey [10].
La prevalenza di RSV in adulti e anziani varia in base a fattori geografici e stagionali, ma già studi come quello di Han et al. [11] hanno dimostrato che circa il 10% delle ospedalizzazioni per infezioni respiratorie acute in adulti oltre i 65 anni è causato da RSV. In aggiunta, una metanalisi condotta da Savic e colleghi ha mostrato che, negli adulti al di sopra dei 60 anni, i decessi intraospedalieri riconducibili ad RSV nei paesi ad alto reddito sarebbero annualmente oltre 33.000 [1].
Andando più nello specifico: a livello globale, il tasso di attacco dell’RSV in termini di infezioni respiratorie acute è stimato intorno all’1,62%, con un tasso di ospedalizzazione dello 0,15% e mortalità intraospedaliera del 7,13% [1]. La Figura 1 mostra i tassi di ospedalizzazione per infezioni respiratorie acute e infezioni delle basse vie respiratorie acute causate da RSV nei paesi ad alto reddito, suddivisi per fasce d’età: in entrambi i casi si nota un pattern ad U, con tassi più elevati nelle fasce d’età estreme [12].
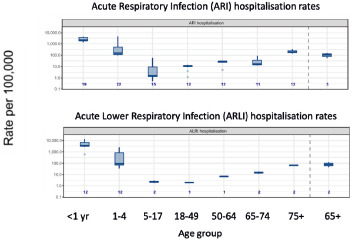
Tassi di RSV per età in paesi ad alto reddito [12].
Negli Stati Uniti ogni anno gli adulti che richiedono assistenza medica per RSV sono circa 5 milioni [13], le ospedalizzazioni ammontano a 177.000 [2] e si contano tra gli 11.000 e i 17.000 decessi [2, 14, 15].
In Europa, ogni anno il numero di ospedalizzazioni associate a RSV negli adulti ammonta in media a 158.229, di cui il 92% riguarda adulti al di sopra de 65 anni [16]. Le percentuali di pazienti ospedalizzati aumentano con l’aumentare dell’età: nella fascia d’età compresa tra i 75 e gli 84 anni si ha una stima media delle ospedalizzazioni pari a 74.519, con un tasso del 2,24%, mentre dagli 85 anni in su si arriva alle 37.904 ospedalizzazioni, con un tasso del 2,99% [16]. Le morti intraospedaliere attribuibili a RSV nei pazienti al di sopra dei 60 anni sono in media 19.527 nel continente europeo [1].
In Asia, ad Hong Kong, uno studio condotto da Lee e colleghi [17] mostra che, durante i momenti di massima diffusione stagionale, l’RSV è stato responsabile del 6-9% delle malattie respiratorie; tra coloro che sono stati ricoverati con RSV, il 72% ha sviluppato complicanze a livello delle basse vie respiratorie, l’11% ha avuto bisogno di supporto ventilatorio e il 9% è deceduto entro 30 giorni. In linea con quanto riportato in precedenza, i pazienti erano in età avanzata (con un’età media di 75 anni) e la maggior parte di loro presentava condizioni mediche preesistenti, con una prevalenza del 36% per le malattie croniche polmonari.
In Italia, uno studio condotto da Domnich e colleghi [18] ha analizzato una coorte di pazienti ospedalizzati positivi per RSV, rivelando che il 70.5% di loro ha sviluppato sintomi severi e che la durata media della degenza era di quasi due settimane (13 giorni). Risultati non dissimili da quelli di un precedente studio di Boattini e colleghi, in cui la durata media della degenza è stata addirittura di 19 giorni e si è prolungata fino a 23 giorni nei pazienti con più di 65 anni. In aggiunta, ben il 30,2% dei pazienti hanno avuto bisogno di ricorrere alla ventilazione meccanica invasiva o non-invasiva, e la mortalità intraospedaliera è stata del 16,3% [19-21].
Questi numeri, già di per sé importanti, assumono ancor più rilevanza se si considera che le infezioni da RSV rimangono ad oggi sottodiagnosticate, per via della sintomatologia aspecifica e sovrapponibile a quella causata da altri virus respiratori [22], della necessità di eseguire test molecolari per confermare l’infezione [23], della possibilità non infrequente di incorrere in falsi negativi nella ricerca tramite PCR [24, 25] e della mancanza di sistemi di sorveglianza dedicati e adeguati [26, 27].
La distribuzione geografica delle infezioni da RSV negli adulti e anziani segue un modello simile a quello osservato nei bambini, con una maggiore incidenza nelle regioni temperate durante i mesi invernali, quando le temperature sono più basse e i livelli di umidità sono relativamente più elevati rispetto al resto dell’anno [28, 29]. Se nell’emisfero nord le epidemie sono più tipiche tra novembre e aprile, nelle aree equatoriali si registra il maggior numero di casi tra agosto e dicembre, e nell’emisfero sud tra aprile e agosto, in accordo con le variazioni climatiche nelle diverse regioni [30]. Entrando più nel dettaglio: in Europa, il maggior numero di casi si verifica tra ottobre e aprile, con un picco tra dicembre e febbraio [31]. Tuttavia, sono stati registrati anche picchi a cadenza biennale nel nord Europa [32]. Nelle regioni tropicali e subtropicali RSV può circolare tutto l’anno, con una stagionalità meno pronunciata e picchi che coincidono con la stagione delle piogge [29, 33, 34]. L’analisi comparativa della stagionalità di RSV in 137 aree geografiche svolta da Bloom-Feshbach e colleghi ha evidenziato la presenza di deboli gradienti latitudinali, con picchi che si verificano più avanti nell’anno solare via via che aumenta la latitudine [32].
Le epidemie stagionali da RSV iniziano in genere prima delle epidemie di influenza e di conseguenza, seppur i rispettivi picchi di incidenza non coincidano, vi sono diversi mesi in cui si ha una sovrapposizione nella circolazione di entrambi i virus, dato importante da tenere in considerazione nel momento in cui si pianificano strategie di prevenzione e management delle infezioni respiratorie acute [35].
Un periodo peculiare per l’analisi della stagionalità di RSV è stato quello della pandemia da Covid 19. A partire da marzo 2020, infatti, l’adozione di misure di prevenzione non farmacologiche quali il distanziamento sociale, la quarantena, l’uso di dispositivi di protezione individuale, l’aumentata promozione dell’igiene delle mani, la riduzione delle occasioni di assembramento e la limitazione dei viaggi intra- e internazionali ha notevolmente influenzato l’epidemiologia dei virus a trasmissione respiratoria. Essendo gli esseri umani gli unici reservoir noti di RSV [36], la circolazione del virus è infatti fortemente influenzata dalla densità di popolazione locale e dalle interazioni sociali in ambienti poco areati, che normalmente tendono ad aumentare durante i mesi invernali a causa delle condizioni meteorologiche avverse, contribuendo al sopracitato picco invernale di infezioni. Le misure preventive adottate durante la pandemia da COVID-19 sembrerebbero così aver contribuito a un più precoce termine dell’epidemia di RSV nella stagione 2019-2020, con una drastica e globale riduzione dei casi [37]. La sua circolazione è rimasta a livelli storicamente bassi per tutto il 2020, presentandosi però in anticipo nella tarda primavera del 2021, in seguito all’allentamento delle misure preventive, e proseguendo più a lungo rispetto agli anni prepandemici. L’anno successivo, l’epidemia di RSV è iniziata più tardi rispetto al 2021-2022 ma comunque in anticipo rispetto alle epidemie pre-pandemiche, suggerendo un ritorno ai picchi invernali tipici della stagionalità pre-pandemica [28]. Nelle stagioni post-pandemiche, inoltre, si sono verificati a livello globale picchi epidemici al di fuori della stagionalità tipica per il virus [37] ed è stato registrato un aumento dei casi di RSV rispetto al periodo pre-pandemico [38]. Una spiegazione potrebbe essere quella del “debito immunologico”, proposta dal Gruppo di Patologia Infettiva Pediatrica della Società Francese di Pediatria [39], secondo cui la mancanza di stimolazione immunitaria per prolungati periodi di tempo a causa delle misure preventive potrebbe aver aumentato il pool dei soggetti vulnerabili, comportando anche un aumento dei casi di patologia severa da RSV.
Analizzare la stagionalità e la distribuzione geografica di RSV è un elemento chiave nella pianificazione delle strategie di prevenzione e controllo, ai fini dell’ottimizzazione delle risorse disponibili e dell’efficientamento delle misure messe in atto [36, 40].
Nel pool della popolazione adulta, una categoria particolarmente a rischio di sviluppare forme gravi di infezione da RSV è quella degli anziani, specialmente se con condizioni di salute preesistenti [2, 41]. Le patologie croniche più frequentemente associate a RSV sono quelle cardiache e polmonari, in particolare insufficienza cardiaca congestizia e BPCO [31, 42, 43], ma anche il diabete e le patologie renali sono piuttosto frequenti tra i pazienti positivi a RSV [44, 45].
L’età avanzata è già di per sé un fattore di rischio significativo. Diversi studi hanno dimostrato che gli adulti di età superiore ai 65 anni hanno una maggiore probabilità di ospedalizzazione e mortalità a seguito di infezione da RSV rispetto agli adulti più giovani [1, 2, 15, 46].
Altra categoria particolarmente a rischio è quella dei pazienti immunocompromessi: patologie tumorali, terapia immunosoppressiva in seguito a trapianto, infezione da HIV, infezioni nosocomiali sono associati a un peggior outcome in seguito a infezione da RSV [31] e una prevalenza di RSV pari all’11,5% [18].
Oltre alle condizioni di salute preesistenti e all’età, ci sono altri fattori di rischio associati all’infezione da RSV negli adulti e anziani. Questi includono l’esposizione a bambini piccoli, particolarmente quelli che frequentano asili o scuole, dove RSV è molto diffuso [2, 8, 47]. Anche essere residenti di una struttura sanitaria di assistenza a lungo termine è un fattore di rischio per outcome severi, per via dell’aumentata circolazione virale in queste strutture e della fragilità di chi vi risiede [48].
Il fumo di sigaretta e l’esposizione a inquinanti atmosferici sono stati identificati come fattori di rischio per infezioni respiratorie più gravi, inclusa quella da RSV [49], specialmente nei soggetti immunocompromessi [50]. Inoltre, la mancanza di vaccinazione antinfluenzale è stata associata a un aumento del rischio di infezioni da RSV, sottolineando l’importanza delle strategie di prevenzione combinata [51].
Le manifestazioni cliniche dell’infezione da RSV negli adulti e negli anziani possono variare e questo rappresenta una sfida in termini di sorveglianza perché molto spesso le infezioni possono essere non diagnosticate per via della sintomatologia lieve o assente, oppure attribuite erroneamente ad altro agente eziologico. Se da una parte, grazie alla memoria immunologica, i soggetti che si reinfettano con RSV da adulti possono essere del tutto asintomatici (pur continuando a costituire un importante reservoir per la trasmissione virale) [36], dall’altra i pazienti più fragili possono sviluppare sintomi anche gravi, con peggioramento di condizioni mediche preesistenti.
I sintomi tipici di infezione da RSV includono tosse, dispnea, febbre, coriza, starnutazione e malessere generale [52]. Nella maggior parte dei casi l’infezione si risolve spontaneamente nell’arco di 1-2 settimane ma può, talvolta, progredire dando patologie respiratorie più severe, come bronchite, bronchiolite e polmonite [53], specialmente nei pazienti al di sopra dei 65 anni [36]. Nei più anziani i sintomi possono essere più aspecifici, manifestandosi come affaticamento, debolezza, confusione mentale [54] o aggravamento di condizioni cardiache o polmonari croniche [2].
Le complicanze dell’infezione da RSV in adulti e anziani includono polmonite, bronchiolite, esacerbazioni di malattie polmonari croniche e insufficienza cardiaca congestizia [2]. Secondo un’analisi di Thompson et al. [15], le complicanze respiratorie sono particolarmente gravi negli anziani con malattie polmonari croniche preesistenti. Inoltre, l’infezione da RSV può esacerbare condizioni cardiache, aumentando il rischio di eventi cardiaci acuti [55].
Andando più nel dettaglio, uno degli studi pionieri nella valutazione dell’impatto di RSV negli adulti [2] ha riportato, in un pool di pazienti ospedalizzati positivi a RSV, polmoniti nel 10,6% dei casi, BPCO nell’11,4%, insufficienza cardiaca congestizia nel 5,4% e asma nel 7,2%.
La mortalità associata all’RSV negli adulti, soprattutto negli anziani, è significativa. Studi come quello di Falsey e colleghi [2] hanno dimostrato che il tasso di mortalità per RSV in adulti ospedalizzati può raggiungere il 7-10%. Questo tasso aumenta notevolmente negli anziani e nei pazienti con comorbosità significative, come evidenziato da un’indagine di Zhou et al. [56], che ha rilevato tassi di mortalità più elevati tra gli anziani con infezioni da RSV rispetto a quelli con infezioni influenzali.
Nella Tabella I sono riportati i dati relativi alle ospedalizzazioni causate da RSV in Spagna, analizzate nell’ambito del programma SiVIRA (Sistema di Vigilanza delle Infezioni Respiratorie Acute), che fornisce un report settimanale della situazione sul territorio nazionale stratificando i dati per fasce d’età (< 1, 1-4, 5-14, 15-44, 45-64, 65-79, ≥ 80). L’impatto sulla salute degli adulti anziani è significativo: il 16,4% del totale dei pazienti ospedalizzati ha tra i 65 e i 79 anni, e gli ultraottantenni rappresentano ben il 26,7%, percentuali piuttosto simili alle fasce più giovani, notoriamente interessate da HIV (19,8% per la fascia 1-4 anni e 26,3% al di sotto di un anno). Insieme al primato per il numero di ospedalizzazioni, gli ultraottantenni detengono anche quello per il maggior numero di morti intraospedaliere, arrivando all’8,7% – in stridente contrasto con i valori fortunatamente quasi nulli delle fasce più giovani – e si collocano al secondo posto per numero di polmoniti (31,2%) dopo la fascia 45-64 anni (31,8%), seguiti dalla fascia 65-79 anni in cui le polmoniti rappresentano il 26,5% del totale, rimarcando il già citato significativo impegno delle vie aeree inferiori che può verificarsi negli adulti positivi a RSV [57].
Ospedalizzazioni da RSV per causa ed età nell’epidemia 2023-2024 in Spagna (da SiVIRA 2024, mod.) [57].
| Ospedalizzazioni | < 1 | 1-4 | 5-14 | 15-44 | 45-64 | 65-79 | ≥ 80 | Totale |
|---|---|---|---|---|---|---|---|---|
| Numero (%) | 273 (26,3%) | 206 (19,8%) | 25 (2,4%) | 16 (1,5%) | 71 (6,8%) | 170 (16,4%) | 277 (26,7%) | 1038 (100%) |
| Polmoniti | 14 (5,9%) | 44 (21,7%) | 8 (32%) | 3 (27,3%) | 21 (31,8%) | 43 (26,5%) | 81 (31,2%) | 214 (22,2%) |
| Ventilazione meccanica | 16 (7,5%) | 3 (1,6%) | 0 (0%) | 0 (0%) | 3 (5,8%) | 3 (2,1%) | 0 (0%) | 25 (3%) |
| Ricoveri in terapia intensiva | 67 (25,8%) | 12 (5,9%) | 2 (8,3%) | 2 (18,2%) | 5 (7,6%) | 12 (7,4%) | 1 (0,4%) | 101 (10,3%) |
| Decessi intraospedalieri | 1 (0,4%) | 0 (0%) | 0 (0%) | 0 (0%) | 1 (1,6%) | 8 (5,2%) | 21 (8,7%) | 31 (3,4%) |
L’impatto clinico dell’infezione da RSV negli adulti anziani sembra avvicinarsi a quello dell’influenza stagionale, con paragonabili livelli di morbilità e mortalità [7]. Il grafico in Figura 2 mostra i risultati dell’analisi condotta negli Stati Uniti da Hansen e colleghi [58], che hanno analizzato i tassi di mortalità per RSV e influenza stratificando i risultati per fasce d’età. Per entrambi i virus le persone al di sopra dei 65 anni si rivelano le più vulnerabili, con tassi di mortalità media ogni 100.000 persone del 14,7 per RSV e del 20,5 per influenza [58]. Recenti studi propongono un impatto di RSV addirittura superiore rispetto a quello dell’influenza, riportando una maggior durata della degenza, un maggior rischio di accesso in terapia intensiva, un più elevato tasso di ventilazione meccanica e un aumentato rischio di mortalità ospedaliera nei pazienti positivi per RSV piuttosto che in quelli positivi per Influenza A e B [42, 44, 52]. Anche la polmonite è più comune nei pazienti con infezione da RSV piuttosto che in quelli con influenza [59]. Sembrerebbe quindi che RSV possa causare decorsi clinici più gravi rispetto ai virus influenzali, specialmente in pazienti anziani e con patologie correlate [42].
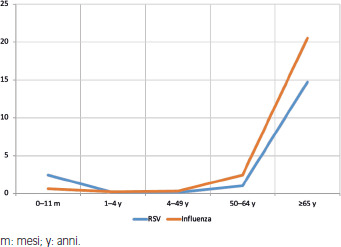
Stima della mortalità per influenza ed RSV negli USA (da (Hansen et al. 2022, mod.) [58].
L’infezione da RSV può avere un impatto significativo sulla qualità della vita degli adulti e degli anziani. Le limitazioni funzionali, la necessità di cure a lungo termine e l’ospedalizzazione possono influenzare negativamente l’indipendenza e il benessere psicosociale. Uno studio di Ackerson e colleghi [60] ha evidenziato come gli adulti più anziani che hanno subito un’infezione da RSV spesso sperimentino un declino nelle attività quotidiane e nella mobilità. In uno studio condotto da Curran e colleghi su un campione di 30 soggetti di almeno 50 anni e con diagnosi di infezione da RSV [61], il 25% ha riportato funzionalità fisica ridotta, il 60% l’impossibilità di dedicarsi ad attività di piacere o hobby, il 93% impatto sul benessere emotivo (riferendo ansia, esaurimento emotivo, sintomi depressivi, sensazione di isolamento sociale) e la totalità dei lavoratori ha riferito un impatto importante sul lavoro (assenteismo – dai 3 giorni alle 3 settimane, ridotta produttività ed efficienza per mancanza di energie). Inoltre, il 63% ha presentato sequele sintomatologiche oltre la fase acuta della malattia, in alcuni casi per oltre un mese dall’esordio dei sintomi.
RSV rappresenta una causa significativa di ospedalizzazione sia nei bambini che negli adulti, in particolare negli anziani. Secondo uno studio di Shi et al. [5], l’RSV è responsabile di circa il 3-10% di tutte le ospedalizzazioni per infezioni respiratorie acute negli adulti. Inoltre, Falsey et al. [2] hanno evidenziato che il tasso di ospedalizzazione per RSV negli adulti oltre i 65 anni è paragonabile a quello dell’influenza.
Nella revisione sistematica svolta da Grace e colleghi [62], un’analisi dei costi delle ospedalizzazioni causate da RSV a livello globale ha rivelato che tale infezione rappresenta un sostanziale burden economico pur essendo sotto-diagnosticato, a causa dei ricoveri prolungati e della necessità di cure intensive ad essa correlabili. È emerso che il costo diretto nazionale in USA per le ospedalizzazioni in tutti gli adulti è di 1,3 miliardi di dollari, e aumenta fino a 4 miliardi di dollari se si considera la popolazione di età ≥ 60 anni. Un successivo confronto dei costi incrementali tra i casi di RSV e i controlli, così come dei costi pre- e post-infezione da RSV, ha dimostrato un sostanziale aumento dei costi causato dall’infezione. Questo burden economico è rilevante a livello globale e richiede di essere attenzionato e arginato, onde evitare di gravare sulle risorse, spesso limitate, dei sistemi sanitari nazionali.
Il burden di RSV nella comunità è anch’esso notevole, soprattutto a causa della sua elevata contagiosità e della suscettibilità di specifici gruppi di popolazione, come neonati, anziani e individui immunocompromessi. Studi come quello di Hall et al. [63] hanno dimostrato che l’RSV è una delle principali cause di visite ambulatoriali e di consultazioni mediche per infezioni respiratorie acute.
Inoltre, l’impatto del RSV sulla comunità non si limita solo all’ambito sanitario. La malattia ha conseguenze economiche significative, inclusa la perdita di produttività a causa dell’assenza dal lavoro sia per malattia personale che per la cura di familiari malati, come evidenziato da Zhou et al. [56].
Il burden ospedaliero e di comunità dell’RSV sottolinea la necessità di strategie efficaci di prevenzione e controllo, inclusa la vaccinazione e l’educazione sulla salute pubblica, per ridurre l’impatto di questa infezione respiratoria sia a livello individuale che collettivo.
Insieme all’influenza stagionale, RSV rappresenta una delle principali cause di infezioni respiratorie, ed è responsabile di un importante burden socioeconomico in tutte le fasce d’età [18].
L’attuale panorama clinico-epidemiologico dell’RSV negli adulti e negli anziani rivela una sfida crescente per i sistemi sanitari globali. L’alta incidenza, le ospedalizzazioni frequenti e le complicanze gravi associate all’RSV in questi gruppi di popolazione richiedono un approccio olistico che consideri sia la prevenzione che il trattamento.
La crescente consapevolezza dell’impatto dell’RSV oltre l’infanzia impone la necessità di strategie di sorveglianza e intervento più efficaci [2, 5]. Rinforzare i sistemi di sorveglianza in modo da individuare precocemente le infezioni da RSV consentirebbe, infatti, di valutare più accuratamente il carico di RSV nella popolazione adulta, così da poter pianificare e mettere in atto strategie di prevenzione e contenimento mirate. L’infezione negli adulti rimane spesso non diagnosticata, per via della sintomatologia aspecifica, della risoluzione dei sintomi prima che il paziente si rivolga al medico, della mancanza di esami di routine raccomandati per le categorie a rischio e i pazienti anziani e fragili, della variabile sensibilità degli esami di laboratorio a seconda che il campione analizzato derivi dalle alte o dalle basse vie respiratorie [64]. D’altra parte, l’esecuzione sistematica di studi prospettici per valutare l’incidenza locale di RSV rappresenta un costo importante sia in termini di tempo che di risorse. Lo sviluppo di sistemi semi-automatizzati di sorveglianza RSV basati su sorveglianza automatizzata, come proposto da Bruyndonckx e colleghi [64], potrebbe rappresentare uno scenario interessante per stimare più efficientemente l’incidenza locale di RSV negli adulti, consentendo di sviluppare politiche di immunizzazione mirate sulla base del setting locale.
Guardando al futuro, è probabile che l’incidenza dell’RSV continui ad aumentare, in parte a causa dell’invecchiamento della popolazione. La ricerca futura dovrebbe concentrarsi sull’identificazione di biomarcatori per una diagnosi precoce e accurata dell’RSV, come suggerito da diversi studi: una diagnostica laboratoristica rapida e ad alta sensibilità si associa infatti a cure più precoci ed efficaci e terapie più adeguate e mirate, elemento fondamentale in un mondo in cui l’uso inappropriato di antibiotici e la conseguente antibiotico-resistenza rappresentano una seria minaccia [35, 54].
Come raccomandato dalla Commissione Europea [65], è fondamentale continuare a costruire e rinforzare sistemi di sorveglianza sostenibili per il rilevamento precoce e il monitoraggio dei trend dei virus respiratori, incluso RSV, e incentivare il monitoraggio dell’impatto dei nuovi farmaci e vaccini disponibili a livello internazionale e aumentare la consapevolezza dei clinici riguardo all’uso delle misure profilattiche per prevenire la progressione dell’infezione a patologia severa.
Per decenni la prevenzione della malattia da virus respiratorio sinciziale (RSV, Respiratory Syncytial Virus) è rimasta un’esigenza di sanità pubblica insoddisfatta [1, 2]. Infatti, come discusso nel Capitolo precedente, RSV è un protagonista indiscusso delle virosi respiratorie stagionali e una delle principali cause delle infezioni respiratorie acute (ARI, Acute Respiratory Infection) e della malattia del tratto respiratorio inferiore (LRTD, Lower Respiratory Tract Disease) sia nei bambini piccoli sia nella popolazione anziana. I primi tentativi di sviluppo di un vaccino contro RSV risalgono agli anni ’60 con la realizzazione di un vaccino inattivato con formalina. Tuttavia, gli studi clinici di questa formulazione fallirono in quanto, nel corso di un’infezione da RSV naturale nei bambini vaccinati, si verificò una severa risposta infiammatoria polmonare che ha portato all’ospedalizzazione di circa l’80% dei bambini vaccinati [3, 4]. Per i decenni successivi, lo sviluppo di un vaccino alternativo è stato quindi ostacolato per motivi di sicurezza [5].
I recenti progressi nell’ambito della biologia molecolare e della biotecnologia hanno permesso di sviluppare candidati vaccinali a subunità, quindi altamente purificati e meno reattogeni [6, 7]. Tale avanzamento scientifico ha culminato con la recente approvazione del primo vaccino contro la malattia causata da RSV sia da parte della Food and Drug Administration (FDA) statunitense [8], sia da parte della European Medicines Agency (EMA) [9], sia da parte dell’Agenzia Italiana del Farmaco (AIFA) [10].
Obiettivo di questo Capitolo è raccogliere e sintetizzare le evidenze scientifiche disponibili su tutti gli aspetti clinici del nuovo vaccino RSVPreF3 OA (Arexvy®) indispensabili per il processo di Health Technology Assessment (HTA). Contestualmente, in seguito a un riassunto della tecnologia e del prodotto, saranno riportati i risultati di una rassegna sistematica di letteratura relativa all’immunogenicità, all’efficacia e alla sicurezza del nuovo vaccino RSVPreF3 OA nella popolazione di età ≥ 60 anni. La progettazione e la stesura del presente Capitolo sono conformi alla metodologia descritta da HTA Core Model® dello European Network for HTA (EUnetHTA) [11] e alle linee guida PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) [12].
L’acido ribonucleico (RNA) di RSV codifica 11 proteine; tra queste solo le proteine superficiali G e F inducono la risposta anticorpale neutralizzante [13, 14]. La glicoproteina G media l’attacco di virus alla cellula ospite e sulla base di essa RSV è diviso in due gruppi o sottotipi, A e B. La proteina F, invece, è responsabile della fusione e quindi dell’entrata del virus nella cellula ospite [14, 15]. A differenza della proteina G, che contiene diverse regioni ipervariabili, la sequenza amminoacidica della proteina F è altamente conservata in entrambi i sottotipi di RSV [16]. Pertanto, la proteina F è considerata l’antigene principale della risposta protettiva nei confronti della popolazione virale circolante [13, 17].
La proteina F esiste in due forme trimeriche, una metastabile in pre-fusione (preF) e una stabile post-fusione (postF) [18]. Come menzionato sopra, i vaccini basati sulla proteina postF sono stati associati a un’efficacia particolarmente bassa [4, 5] poiché gli anticorpi neutralizzanti si formano principalmente contro la proteina preF [19, 20]. La successiva ricerca si è focalizzata, quindi, sulla stabilizzazione conformazionale della proteina preF [18].
L’antigene RSVPreF3 utilizzato nel vaccino rappresenta, quindi, una versione ingegnerizzata della glicoproteina preF, stabilizzata nella sua conformazione mediante l’introduzione dei residui di cisteina che portano alla formazione di un legame disolfuro e al riempimento di cavità idrofobiche [21, 22].
AS01 è un sistema adiuvante vaccinale a base di liposomi contenente due immunostimolanti: 3-O-desacyl-4’-monophosphoryl lipid A (MPL) e la saponina QS-21 [23]. MPL è un derivato detossificato del lipopolisaccaride da Salmonella minnesota, mentre QS-21 è una saponina estratta dalla corteccia dell’albero sudamericano Quillaja saponaria. Essendo un potente agonista dei ricettori Toll-like 4 (TLR4), MPL stimola l’attivazione dell’immunità innata. In particolare, MPL è in grado di attivare direttamente le cellule presentanti l’antigene che esprimono TLR4, stimolando quindi la produzione di citochine. Inoltre, MPL può favorire l’induzione di cellule T antigene specifiche che producono interferone γ (IFN-γ). D’altro canto, QS-21 promuove la risposta anticorpale antigene-specifica e stimola le cellule T CD8+ citotossiche [23, 24].
L’impatto dell’adiuvante AS01 sull’immunogenicità dell’antigene RSVPreF3 è stato analizzato in diversi modelli animali, particolarmente nei topi e nei bovini precedentemente esposti all’infezione da RSV [25]. Nei topi, la formulazione di RSVPreF3 adiuvata con AS01 ha indotto una risposta neutralizzante anti-RSV A e anti-RSV B e una risposta cellulare CD4+ polifunzionale superiori a quelle indotte dalla formulazione non adiuvata. Nei bovini, rispetto alle formulazioni non adiuvata o adiuvata con i sali di alluminio, RSVPreF3 adiuvato con AS01 tendeva a indurre maggiori incrementi pre-/post-vaccinazione nei titoli di anticorpi neutralizzanti RSV A e B. La risposta CD4+ specifica era analogamente superiore [25].
A seconda delle concentrazioni di MPL e QS-21, l’adiuvante AS01 è rappresentato dalle formulazioni AS01E e AS01B, laddove AS01E contiene il 50% in meno di MPL e QS-21 rispetto a AS01B [26]. AS01B, a partire dal 2017, è stato utilizzato in un vaccino ricombinante contro l’herpes zoster [27]. Quest’ultimo è altamente efficace nel prevenire l’herpes zoster e le sue complicanze [28] e, negli Stati Uniti, è stato raccomandato in via preferenziale [29, 30]. Lo sviluppo clinico del vaccino ricombinante contro l’herpes zoster adiuvato con AS01B ha dimostrato un profilo di sicurezza ampiamente accettabile, essendo la maggior parte degli eventi avversi (AE, Adverse Event) transitori e di grado lieve [31]. Infine, uno studio di sorveglianza attiva post-marketing non ha registrato alcun aumento significativo del rischio di AE monitorati sia rispetto ai vaccinati storici con un vaccino contro l’herpes zoster vivo attenuato sia rispetto ai vaccinati contemporanei con altri tipi di vaccini [32]. In sintesi, l’adiuvante AS01 vanta un ottimo safety record pluriennale.
RSVPreF3 OA è un vaccino ricombinate adiuvato con AS01E e viene commercializzato con il nome Arexvy® da GlaxoSmithKline (GSK) Biologicals SA. È attualmente indicato per la prevenzione della LRTD da RSV negli adulti di età ≥ 60 anni. La scheda attuale prevede la somministrazione intramuscolare di un’unica dose da 0,5 mL. La Tabella I riassume le principali caratteristiche di RSVPreF3 OA, come da riassunto delle caratteristiche del prodotto (RCP) aggiornato al 26 giugno 2023 [33].
Le principali caratteristiche tecniche del vaccino RSVPreF OA [33].
| Denominazione | Vaccino per il virus respiratorio sinciziale (RSV) (ricombinante, adiuvato) |
| Nome commerciale | Arexvy® |
| Composizione antigenica | RSVPreF (120 μg) che rappresenta la glicoproteina F di RSV ricombinante e stabilizzata nella conformazione prefusione. RSVPreF3 è prodotto in cellule ovariche di criceto cinese con tecnologia DNA ricombinante |
| Adiuvante | L’adiuvante AS01E è composto da estratto di pianta Quillaja saponaria Molina, frazione 21 (QS-21) (25 μg) e 3-O-desacyl-4’-monofosforil lipide A (MPL) da Salmonella minnesota (25 μg) |
| Eccipienti | Polvere (antigene (RSVPreF3): trealosio diidrato, polisorbato 80 (E 433), potassio diidrogeno fosfato (E 340), potassio fosfato dibasico (E 340). Sospensione (sistema adiuvante AS01E): dioleoile fosfatidilcolina (E 322), colesterolo, cloruro di sodio, sodio fosfato dibasico anidro (E 339), potassio diidrogeno fosfato (E 340), acqua per preparazioni iniettabili |
| Forma farmaceutica | Polvere e sospensione per sospensione iniettabile |
| Indicazioni terapeutiche | L’immunizzazione attiva per la prevenzione della malattia del tratto respiratorio inferiore (LRTD) da RSV negli adulti di età ≥ 60 anni |
| Posologia e modo di somministrazione | Dose singola da 0,5 mL. Somministrazione intramuscolare, preferibilmente nel muscolo deltoide |
| Controindicazioni | Ipersensibilità ai principi attivi o ad uno qualsiasi degli eccipienti elencati |
| Effetti indesiderati | Molto comuni (≥ 1/10): dolore al sito di iniezione, senso di stanchezza (affaticamento), mal di testa, dolori muscolari (mialgia), dolori articolari (artralgia), eritema, indurimento; |
| Comuni (≥ 1/100, < 1/10): arrossamento e gonfiore nel sito di iniezione, febbre, brividi; | |
| Non comuni (≥ 1/1.000, < 1/100): prurito nel sito di iniezione, dolore, sensazione generalizzata di malessere (malessere), linfoadenomegalia o edema delle ghiandole del collo, delle ascelle o dell’inguine (linfoadenopatia), reazione allergica come eruzione cutanea, nausea, vomito, mal di stomaco |
Il modello PICO (Popolazione, Intervento, Confronto, Outcome) [34] è stato utilizzato al fine di formulare i criteri di inclusione. In particolare, in linea con il RCP di RSVPreF3 OA [33], i criteri PICO comprendevano:
P: adulti di età ≥ 60 anni;
I: vaccinazione con RSVPreF3 OA;
C: placebo o qualsiasi altro comparatore attivo o non attivo;
O: immunogenicità, efficacia e frequenza di AE.
La popolazione includeva soggetti di entrambi i sessi, di età ≥ 60 anni, indipendentemente dalle loro caratteristiche cliniche (es., presenza o meno di patologie croniche di base) o sociodemografiche (es., residenza nelle strutture residenziali a lungo termine).
L’intervento consisteva nella vaccinazione con almeno una dose di RSVPreF3 OA. In linea con l’attuale RCP [33], per il caso base abbiamo considerato la vaccinazione con una dose singola di RSVPreF3 OA. Tuttavia, considerando l’incertezza sulla necessità di rivaccinazione [33], abbiamo anche eventualmente incluso gli studi o bracci degli studi clinici randomizzati e controllati (RCT, Randomized Controlled Trial) che analizzavano la rivaccinazione.
Il confronto poteva includere qualsiasi comparatore, come placebo, altre tipologie o formulazioni di vaccini contro RSV e vaccini non RSV.
Infine, gli esiti (outcomes) comprendevano una vasta gamma di effetti riconducibili a una delle seguenti categorie: (i) immunogenicità; (ii) efficacia e (iii) sicurezza. L’immunogenicità è stata definita come la capacità di RSVPreF3 OA di indurre una risposta immune umorale o cellulare [35]. Va sottolineato che attualmente non esiste un correlato di protezione per l’infezione da RSV che sia riconosciuto universalmente [36]. Le prove scientifiche disponibili [37, 38] suggeriscono, tuttavia, che sia la risposta umorale neutralizzante sia la risposta cellulare CD4+ e CD8+ giochino un ruolo cruciale nello sviluppo dell’immunità verso RSV. Un’analisi preliminare della letteratura disponibile ha suggerito l’assenza di protocolli standardizzati per la misurazione della risposta anticorpale [es., test di microneutralizzazione quantificato tramite il saggio immuno-assorbente legato ad un enzima (ELISA, Enzyme-Linked ImmunoSorbent Assay) o la riduzione delle placche] o cellulo-mediata. Infatti, appare che i singoli sviluppatori dei vaccini contro RSV utilizzino i saggi ad hoc. Per tale motivo, non è stato applicato alcun limite sui saggi immunologici utilizzati e la loro descrizione è stata eseguita post hoc. Ove possibile, la risposta immune è stata valutata separatamente per i sottotipi A e B.
L’efficacia clinica (efficacy) è stata definita come riduzione del rischio di esiti clinici correlati a RSV nei soggetti vaccinati e misurata in RCT [39]. Dal momento che la reazione quantitativa a catena della polimerasi inversa (RT-qPCR, Reverse Transcription quantitative Polymerase Chain Reaction) è considerata una metodica di laboratorio di riferimento per l’identificazione del RNA di RSV [40], sono stati considerati eleggibili solo gli esiti clinici associati a RSV confermati tramite RT-qPCR. Abbiamo considerato qualsiasi entità clinica correlata a RSV (es., infezione asintomatica, infezione sintomatica, ARI grave, etc.) purché confermata tramite RT-qPCR.
Conformemente alle buone pratiche cliniche e di farmacovigilanza [41], un evento avverso AE (AE, Adverse Event) è stato definito come “qualsiasi episodio sfavorevole di natura medica che si verifichi in un paziente o in un soggetto partecipante a una sperimentazione clinica al quale sia stato somministrato un prodotto farmaceutico e che non deve avere necessariamente una relazione causale con tale trattamento”. Un AE grave (SAE, Serious Adverse Event) è stato definito come “qualsiasi manifestazione clinica sfavorevole che a qualsiasi dosaggio: sia fatale; metta in pericolo di vita; richieda il ricovero in ospedale oppure il suo prolungamento; porti a invalidità/incapacità persistente o significativa, oppure sia un’anomalia congenita/un difetto alla nascita” [41]. Infine, abbiamo considerato anche gli AE di interesse speciale che includevano l’insorgenza della sindrome di Guillain-Barré e di altre manifestazioni potenzialmente immuno-mediate. Tutti gli AE sono stati categorizzati sulla base del nesso causale, la valutazione del quale è tipicamente eseguita dallo sperimentatore qualificato.
Per gli esiti relativi alla sicurezza, sono stati eleggibili gli AE sia sollecitati (raccolti attivamente) sia quelli non sollecitati (riportati spontaneamente). I primi comprendono tipicamente le reazioni reattogene che vengono raccolte in modo strutturato durante la prima settimana post-vaccinazione [42]. In particolare, abbiamo a priori considerato gli eventi avversi locali/nel sito di iniezione (quali eritema, gonfiore, indurimento, dolore/dolorabilità, ecchimosi) e sistemiche (quali febbre/febbricola, brividi, affaticamento/malessere generale, cefalea, mialgia, artralgia, nausea, vomito, diarrea, inappetenza). Gli AE riportati spontaneamente vengono invece raccolti passivamente per tutta la durata dello studio e comprendono qualsiasi evento medico [42].
In sintesi, sono stati presi in considerazione i seguenti esiti relativi alla reattogenicità, tollerabilità e sicurezza: (i) incidenza (%) di ≥ 1 AE; (ii) incidenza (%) di reazioni avverse locali (totale e per tipologia); (iii) incidenza (%) di reazioni avverse sistemiche (totale e per tipologia); (iv) incidenza (%) di SAE; (v) incidenza (%) di AE di interesse speciale. Tali esiti sono stati estratti per tipologia di trattamento (i.e., RSVPreF3 OA vs comparatore).
Data la recente autorizzazione di RSVPreF3 OA, l’inclusione degli studi osservazionali con l’obiettivo di stimare l’efficacia sul campo (effectiveness) o sorveglianza degli AE post-marketing non è stata prevista.
I manoscritti che rispettavano appieno i criteri di inclusione, sono stati esaminati per i seguenti criteri di esclusione: (i) manoscritti ritenuti ridondanti (es., abstract o protocollo di uno studio pubblicato in extenso; commenti editoriali sugli studi pubblicati); (ii) popolazione dello studio mista (es. adulti in età lavorativa e anziani) senza stratificazione per sottofasce di età; (iii) uso delle formulazioni sperimentali o comunque diverse dal RCP di RSVPreF3 OA; (iv) uso di altri vaccini basati sulla proteina preF.
La ricerca della letteratura disponibile si è basata su un passaggio automatico seguito da quello manuale. La ricerca automatica è stata eseguita da A.D. il 17 ottobre 2023, utilizzando sia le banche dati bibliografiche PubMed (https://pubmed.ncbi.nlm.nih.gov/) e Scopus (https://www.scopus.com/) sia il registro prospettico degli studi clinicaltrials.gov (https://clinicaltrials.gov/). L’algoritmo di ricerca è stato elaborato a seconda della sintassi del motore di ricerca e combinava le parole chiave testuali con i termini MeSH (Medical Subject Headings)/TITLE-ABS-KEY relativi a RSV, vaccinazione e anziani (Tab. II). Alla fine di incrementare la sensibilità, non è stato applicato alcun filtro. La ricerca è stata aggiornata il 1 febbraio 2024.
Strategia di ricerca utilizzata.
| Base dati | Script |
|---|---|
| PubMed | (((“Respiratory Syncytial Viruses”[MeSH Terms] OR “respiratory syncytial” OR “RSV”) AND (“Vaccines”[MeSH Terms] OR “Viral vaccines”[MeSH Terms] OR vaccine* OR immuni*) OR “Respiratory Syncytial Virus Vaccines”[MeSH Terms]) AND (“Adult” [MeSH Terms] OR “Aging”[MeSH Terms] OR “Men”[MeSH Terms] OR “Women”[MeSH Terms] OR “Retirement”[MeSH Terms] OR “Long-term care”[MeSH Terms] OR “Nursing care”[MeSH Terms] OR “Palliative care”[MeSH Terms] OR pension* OR retire* OR adult* OR aged OR elderly OR senior* OR geriatric* OR nursing home*) AND (“GSK” OR “GlaxoSmithKline”)) OR (“RSVpreF3” OR “Arexvy”) |
| Scopus | (TITLE-ABS-KEY ({respiratory syncytial} OR RSV*) AND (vaccine* OR immuni*) AND (older adult* OR elderly) AND ALL (GSK OR GlaxoSmithKline)) OR ALL (RSVpreF3 OR Arexvy) |
| ClinicaTrials.gov | Vaccine | RSV | Adult, Older Adult |
La ricerca manuale backward è stata quindi compiuta, revisionando i riferimenti bibliografici degli studi individuati durante il passaggio precedente. Successivamente, è stata eseguita la ricerca manuale forward, rintracciando tramite la banca dati Google Scholar (https://scholar.google.com/) ulteriori studi che hanno citato i record individuati in precedenza. Inoltre, abbiamo revisionato gli abstract presentati in occasione dei rilevanti congressi/convegni/conferenze delle principali società scientifiche (ESWI, European Scientific Working Group on Influenza; ECCMID, European Society of Clinical Microbiology and Infectious Diseases; RSVVW, ReSViNET Conferences; IDWeek) e dei gruppi consultivi nazionali sulle vaccinazioni (ACIP, Advisory Committee on Immunization Practices; JCVI, Joint Committee on Vaccination and Immunisation). In seguito, sono stati consultati i dossier sottoposti alla revisione dei dati da parte dell’EMA [43] e della FDA [44]. Infine, il titolare dell’autorizzazione all’immissione in commercio di RSVPreF3 OA (GSK) è stato contattato con lo scopo di suggerire ulteriori studi non identificati.
La selezione degli studi è stata compiuta autonomamente da A.D. e da M.S. Eventuali discordanze sono state risolte tramite discussione. In particolare, i risultati della ricerca sono stati raggruppati in un unico foglio di lavoro e i record duplicati sono stati rimossi. In seguito, i titoli e riassunti dei manoscritti rimanenti sono stati sottoposti a screening, al fine di verificare la loro pertinenza agli obiettivi prefissati. I testi integrali dei manoscritti potenzialmente rilevanti sono stati quindi acquisiti e valutati, applicando i criteri di inclusione e di esclusione prestabiliti.
I dati sono stati estratti in un foglio di lavoro da M.S., mentre un controllo incrociato è stato realizzato da A.D. Eventuali discrepanze sono state risolte attraverso discussione. Specificatamente, sono stati estratti i seguenti dati:
riferimento bibliografico completo;
disegno dello studio;
caratteristiche della popolazione dello studio (es., sottofasce di età, fattori di rischio, stato di fragilità e di istituzionalizzazione);
paesi ed emisfero nei quali lo studio è stato condotto;
periodo dello studio e stagione RSV;
comparatore;
scheda vaccinale, numero di dosi ed eventuale co-somministrazione con altri vaccini;
dimensione campionaria;
misure di effetto (valore puntuale nonché il numeratore e il denominatore utilizzati per il suo calcolo) degli esiti di immunogenicità, efficacia e sicurezza prestabiliti con qualsiasi misura di dispersione statistica [es., intervallo di confidenza (IC), deviazione standard (DS), errore standard (ES)] e le loro definizioni;
altre informazioni ritenute rilevanti.
Laddove possibile, ciascun esito clinico estratto è stato caratterizzato per le caratteristiche cliniche e sociodemografiche dei vaccinati (es., sottofasce di età, presenza di comorbilità), sottotipo di RSV (A vs B), stagione e altre caratteristiche ritenute utili.
I dati di interesse mancanti o presentati solo in forma grafica sono stati reperiti attraverso una delle seguenti modalità: (i) incrociando il manoscritto con il corrispettivo record disponibile nel registro clinicaltrials.gov o con il dossier regolatorio; (ii) contattando l’autore per corrispondenza o lo sponsor dello studio.
Il rischio di distorsione dei RCT inclusi è stato valutato separatamente da A.D. e M.S, utilizzando lo strumento Cochrane RoB 2 (Risk of Bias) versione 2. RoB 2 valuta il rischio di distorsione (basso, moderato – “some concerns” e alto) complessivo e in ciascuno dei seguenti domini: (i) distorsioni insorte durante il processo di randomizzazione; (ii) distorsioni dovute a deviazioni rispetto agli interventi previsti; (iii) distorsioni dovute a dati mancanti; (iv) distorsioni nella rilevazione degli esiti e (v) distorsioni nella selezione dei risultati riportati [45]. Il rischio di distorsione è stato valutato solo per gli studi pubblicati in extenso.
I dati estratti sono stati riassunti qualitativamente sia in forma tabellare che grafica. L’analisi quantitativa (metanalisi) non è stata prevista.
Grazie alla ricerca automatica sono stati individuati 398 record (PubMed: n = 143; Scopus: n = 141; clinicaltrials.gov: n = 114). Dopo l’eliminazione dei record duplicati (n = 54), 344 riferimenti bibliografici sono stati sottoposti allo screening dei titoli e degli abstract. In seguito allo screening, otto riferimenti bibliografici sono stati ritenuti potenzialmente eleggibili e quindi valutati in extenso. Un totale di sei studi [46-51] ha soddisfatto tutti i criteri di idoneità e sono stati inclusi nel presente report. L’aggiornamento della ricerca automatica ha permesso di individuare ulteriori tre studi [52-54]. Infine, la ricerca manuale ha identificato altri quattro record che sono stati presentati in occasione di conferenze internazionali [55-58]. L’abstract congressuale di Curran et al. [57] ha esaminato i patient reported outcomes (PRO) e la qualità della vita legata alla salute (HRQoL, Health-Related Quality of Life) nei soggetti con ARI, vaccinati e non, risultati positivi a RSV. Anche se inizialmente non era prevista questa tipologia di esiti, lo studio è stato incluso nell’analisi poiché fornisce ulteriori informazioni utili sulla gravità della malattia e può inoltre informare il dominio etico dell’HTA. Inoltre, l’abstract congressuale di Schwarz et al. [58] riportava lo studio pubblicato [53] e individuato nel passaggio precedente. Tuttavia, è stato deciso di ritenere entrambi i record, dal momento che l’abstract congressuale riportava alcuni dati non riportati nella pubblicazione originale.
Due studi [59, 60] sono stati invece esclusi con le seguenti motivazioni. Il primo [59] è un abstract che ha preceduto la pubblicazione in extenso di Papi et al. [49]. Il secondo studio giapponese di fase I [60] ha valutato l’immunogenicità e la sicurezza della formulazione RSVPreF3 adiuvata con AS01B e quindi diversa dalla formulazione vaccinale attualmente autorizzata. In sintesi, le analisi successive si basano su un totale di 13 pubblicazioni scientifiche [46-58]. L’intero processo di selezione degli studi è riportato nella Figura 1.
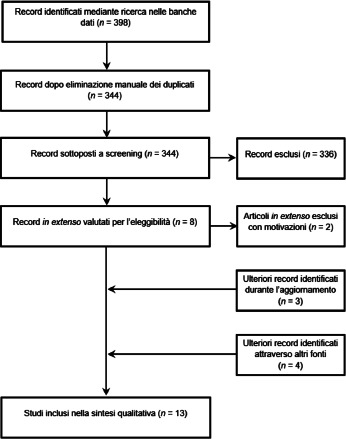
Processo di selezione degli studi.
La Tabella III riassume le principali caratteristiche delle 13 pubblicazioni incluse [46-58]. Queste ultime corrispondono a 8 studi registrativi [46, 48, 49, 51, 53-56], in quanto: (i) lo studio di Sacconnay et al. [47] ha rianalizzato un campione di sieri residui ottenuti nello studio NCT03814590 [46] al fine di valutare alcuni aspetti di immunogenicità incrociata; (ii) lo studio di Feldman et al. [50] rappresenta un’analisi aggiuntiva di Papi et al. [49] volta a valutare l’efficacia e l’immunogenicità di RSVPreF3 OA nei soggetti affetti da alcune patologie croniche; (iii) Ison e colleghi [52] riportano i risultati della seconda stagione dello studio di Papi et al. [49]; (iv) la pubblicazione in extenso [53] e l’abstract congressuale [58] di Schwarz et al. sono stati inclusi entrambi per le ragioni di cui sopra. Tutti gli studi si qualificano come RCT multicentrici (condotti in Paesi diversi) e la maggior parte è di fase III [49-58]. Tre RCT sono stati condotti in cieco (double-blind o observer-blind) [46, 49, 51], mentre i restanti studi erano in aperto (open-label). L’arruolamento al primo studio di fase I/II [46] è iniziato a gennaio 2019. Due studi [49, 53] sono ancora in corso e i loro risultati finali sono attesi nei prossimi anni. Almeno un aspetto di immunogenicità, efficacia e sicurezza è stato riportato rispettivamente in 12 [46-56, 58], tre [49, 50, 52] e 10 [46, 48, 49, 51-56, 58] pubblicazioni (Tab. III).
Caratteristiche principali degli studi inclusi.
| Studio/NCT [Rif.] | Fase | Paese (periodo) | Popolazione dello studio | Obiettivi/esiti riportati | Scheda vaccinale | Dimensione campionaria1 |
|---|---|---|---|---|---|---|
| Leroux-Roels et al. (NCT03814590) [46] | I/II | Stati Uniti, Belgio (01/2019-08/2019) | Adulti 60-80 anni2 | Sicurezza e reattogenicità, immunogenicità | 2 dosi (giorno 1 e 61) | 1.005 |
| Sacconnay et al. (analisi post hoc di [46]) [47] | I/II | Stati Uniti, Belgio (01/2019-08/2019) | Adulti 60-80 anni | Immunogenicità incrociata | 2 dosi (giorno 1 e 61) | 83 |
| Leroux-Roels et al. (NCT04657198) [48] | IIb | Stati Uniti, Belgio (12/2020-10/2021) | Adulti 60-80 anni | Sicurezza, reattogenicità ed immunogenicità dopo la rivaccinazione (dose 3) | 3a dose (18 mesi dopo la 2a dose) | 122 |
| Papi et al. (NCT04886596) [49] | III | Stati Uniti, Belgio, Canada, Estonia, Finlandia, Germania, Italia, Giappone, Corea del Sud, Messico, Polonia, Russia, Sudafrica, Spagna, Regno Unito, Australia, Nuova Zelanda (05/2021-05/2024) | Adulti ≥ 60 anni | Efficacia, immunogenicità, sicurezza e reattogenicità | 1 dose | 24.966 |
| Feldman et al. (analisi secondaria di [49]) [50] | III | Stati Uniti, Belgio, Canada, Estonia, Finlandia, Germania, Italia, Giappone, Corea del Sud, Messico, Polonia, Russia, Sudafrica, Spagna, Regno Unito, Australia, Nuova Zelanda (05/2021-05/2024) | Adulti ≥ 60 anni con o senza patologie croniche di interesse | Efficacia, immunogenicità | 1 dose | 24.966 |
| NCT05059301 [51] | III | Stati Uniti, Canada, Svezia (10/2021-01/2022) | Adulti ≥ 60 anni | Bioequivalenza tra lotti (lot-to-lot consistency) in termini di immunogenicità, sicurezza e reattogenicità | 1 dose | 757 |
| Ison et al. (risultati della seconda stagione dello studio [49]) [52] | III | Stati Uniti, Belgio, Canada, Estonia, Finlandia, Germania, Italia, Giappone, Corea del Sud, Messico, Polonia, Russia, Sudafrica, Spagna, Regno Unito, Australia, Nuova Zelanda (05/2021-05/2024) | Adulti ≥ 60 anni | Efficacia, immunogenicità, sicurezza e reattogenicità | 1 dose | 24.966 |
| Schwarz et al. (NCT04732871) [53, 58] | III | Stati Uniti, Finlandia, Germania, Giappone, Taiwan (02/2021-05/2024) | Adulti ≥ 60 anni | Immunogenicità, persistenza della risposta immune, sicurezza e reattogenicità | 1 dose nel gruppo della vaccinazione singola; 2 dosi nel gruppo della vaccinazione flessibile; 3 dosi nel gruppo della vaccinazione annuale | 1.653 |
| Chandler et al. [54] | III | Nuova Zelanda, Panama, Sudafrica (04/2021-09/2021) | Adulti ≥ 60 anni | Immunogenicità (non inferiorità), sicurezza e reattogenicità della co-somministrazione di RSVPreF OA con il vaccino antinfluenzale quadrivalente a dosaggio standard prodotto su uova (QIVe) | 1 dose di RSVPreF OA e QIVe somministrati nella stessa seduta o 1 dose di QIVe seguita da 1 dose di RSVPreF OA a distanza di 1 mese | 885 |
| Valenciano et al. (NCT05559476) [55] | III | Stati Uniti (10/2022-03/2023) | Adulti ≥ 65 anni | Immunogenicità (non inferiorità), sicurezza e reattogenicità della co-somministrazione di RSVPreF OA con il vaccino antinfluenzale quadrivalente ad alto dosaggio (hdQIV) | 1 dose di RSVPreF OA e hdQIV somministrati nella stessa seduta o 1 dose di hdQIV seguita da 1 dose di RSVPreF OA a distanza di 1 mese | 1.029 |
| Clark et al. (NCT05568797) [56] | III | Belgio, Finlandia, Francia, Regno Unito (10/2022-02/2023) | Adulti ≥ 65 anni | Immunogenicità (non inferiorità), sicurezza e reattogenicità della co-somministrazione di RSVPreF OA con il vaccino antinfluenzale quadrivalente adiuvato con MF59 (aQIV) | 1 dose di RSVPreF OA e aQIV somministrati nella stessa seduta o 1 dose di aQIV seguita da 1 dose di RSVPreF OA a distanza di 1 mese | 1.045 |
| Curran et al. (analisi secondaria di [49]) [57] | III | Stati Uniti, Belgio, Canada, Estonia, Finlandia, Germania, Italia, Giappone, Corea del Sud, Messico, Polonia, Russia, Sudafrica, Spagna, Regno Unito, Australia, Nuova Zelanda (08/2021-03/2024) | Adulti ≥ 60 anni positivi a RSV (infezioni breakthrough) | Patient reported outcomes/qualità della vita legata alla salute | 1 dose | 122 |
| 1: si riferisce al numero di soggetti che sono stati esposti al vaccino o placebo (exposed set); 2: lo studio ha arruolato anche i soggetti di età 18-40 anni. | ||||||
Tutti gli studi sono stati giudicati a basso rischio di confondimento da entrambi i valutatori (A.D. e M.S.) e in tutti i domini.
Lo studio NCT03814590 [46] è un RCT di fase I/II che è stato condotto nel periodo 2019-2020 al fine di valutare la sicurezza, la reattogenicità e l’immunogenicità di diverse formulazioni di RSVPreF3 sia nella popolazione adulta di età 18-40 anni (parte A) sia nella popolazione anziana di età 60-80 anni (parte B). Di conseguenza, sono stati estratti e analizzati solo i dati pertinenti alla popolazione anziana. Lo studio si configura come dose-finding in quanto volto all’identificazione di una formulazione vaccinale ottimale dal punto di vista sia di immunogenicità sia di reattogenicità. All’arruolamento, un totale di 1.005 soggetti anziani è stato randomizzato in 10 gruppi equi (circa 100 soggetti per gruppo). Specificamente, i primi tre gruppi sono stati vaccinati con tre formulazioni di RSVPreF3 OA non adiuvate, nelle quali la quantità di antigene era rispettivamente pari a 30 μg, 60 μg e 120 μg. Altri tre gruppi di anziani hanno ricevuto tre formulazioni (30 μg, 60 μg e 120 μg) di RSVPreF3 adiuvate con AS01E. Ancora altri tre gruppi sono stati vaccinati con tre formulazioni (30 μg, 60 μg e 120 μg) di RSVPreF3 adiuvate con AS01B. Infine, al decimo gruppo è stato somministrato placebo (soluzione salina). La scheda vaccinale prevedeva la somministrazione di 2 dosi a distanza di due mesi (60 giorni). Il periodo di follow-up era di 14 mesi.
Nei primi sette giorni dopo la prima o la seconda vaccinazione, la frequenza degli AE sollecitati era pari al 43,3-52,0% nei soggetti che avevano ricevuto le formulazioni non adiuvate, 71,3-79,0% nei soggetti che avevano ricevuto le formulazioni adiuvate con AS01E, 84,6-88,0% nei soggetti che avevano ricevuto le formulazioni adiuvate con AS01E e il 37,0% nel gruppo placebo (Fig. 2). Tra le reazioni locali, il dolore nel sito di iniezione era il più frequente in assoluto (placebo: 8,0%; formulazioni non adiuvate: 19,6-31,0%; formulazioni adiuvate con AS01E: 59,4-65,0%; formulazioni adiuvate con AS01B: 78,0-81,2%). Per quel che concerne gli AE sistemici, si sono riscontrati più frequentemente: affaticamento (placebo: 24,0%; formulazioni non adiuvate: 20,6-29,0%; formulazioni adiuvate con AS01E: 35,0-40,6%; formulazioni adiuvate con AS01B: 43,7-52,5%) e cefalea (placebo: 13,0%; formulazioni non adiuvate: 12,4-17,0%; formulazioni adiuvate con AS01E: 23,0-27,7%; formulazioni adiuvate con AS01B: 36,6-43,7%). La maggior parte degli AE sollecitati erano di grado lieve. L’incidenza degli AE non sollecitati e degli SAE era simile nel gruppo placebo e nei gruppi di trattamento attivo (Fig. 2). Nessun SAE è stato correlato alla vaccinazione.
Frequenza di eventi avversi sollecitati e non sollecitati (riportati spontaneamente) in seguito alla prima o seconda vaccinazione nello studio di fase I/II, per formulazione vaccinale [46].
L’immunogenicità umorale è stata valutata misurando sia i titoli neutralizzanti verso RSV A e RSV B tramite un test di neutralizzazione sia la concentrazione di immunoglobulina G (IgG) specifica per RSVPreF3 tramite ELISA. La risposta cellulo-mediata è stata valutata, stimando la frequenza delle cellule CD4+ e CD8+ specifiche per RSVPreF3. L’immunogenicità umorale e cellulo-mediata è stata valutata immediatamente prima della 1a dose, a un mese dalla 1a dose, prima della 2a dose (al giorno 61), nonché a distanza di 8 e 14 mesi dalla 1a dose. Immediatamente prima della vaccinazione (giorno 1), tutti i soggetti avevano anticorpi anti-RSV misurabili, suggerendo un’esposizione precedente. Tutte le formulazioni di RSVPreF3 hanno indotto una risposta robusta (P corretto < 0,0001) sia IgG specifica per RSVPreF3 (Fig. 3A) sia neutralizzante verso RSV A (Fig. 3B) e RSV B (Fig. 3C). In particolare, il rapporto tra le concentrazioni medie geometriche (GMC, Geometric Mean Concentration) di IgG specifiche misurate al giorno 31 (i.e., 30 giorni dopo la 1a dose) rispetto al giorno 1 prevaccinazione era pari a 7,2-12,8, 8,2-12,4 e 7,8-11,5 rispettivamente nei gruppi della formulazione non adiuvata, adiuvata con AS01E e adiuvata con AS01B. Non vi è stato osservato alcun aumento dei titoli anticorpali nel gruppo placebo. La quantità di antigene (passando da 30 μg a 120 μg) era positivamente associata con le GMC osservate in tutti i gruppi del trattamento attivo. Tuttavia, non vi è stata alcuna differenza (P corretto > 0,025) tra i gruppi della formulazione RSVPreF3 non adiuvata e i gruppi delle formulazioni adiuvate. La seconda dose del vaccino, somministrata al giorno 61, ha determinato un incremento transitorio di IgG che tuttavia risultava essere inferiore ai livelli post-dose 1. Come atteso, nei tempi successivi (a distanza di 8 e 14 mesi) è stato osservato un progressivo decremento del livello anticorpale che tuttavia era superiore rispetto al periodo di prevaccinazione (Fig. 3A). Il quadro del tutto analogo è stato osservato nei confronti delle medie geometriche dei titoli (GMT, Geometric Mean Titer) neutralizzanti i sottotipi di RSV A (Fig. 3B) e B (Fig. 3C).
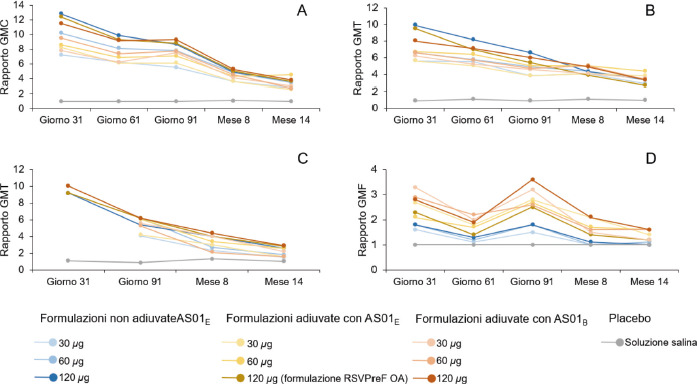
Concentrazione media geometrica (GMC) di IgG specifiche per RSVPreF (A), titolo geometrico medio (GMT) degli anticorpi neutralizzanti RSV A (B) e RSV B (C) e frequenza media geometrica (GMF) di CD4+ specifici per RSVPreF (D) nello studio di fase I/II, per tempo di rilevazione e formulazione vaccinale [46].
D’altronde, l’effetto positivo degli adiuvati si è visto nell’incremento della risposta CD4+ polifunzionale. L’incremento medio geometrico delle frequenze di CD4+ specifiche per RSVPreF3 che esprimevano almeno due marker [tra interleuchina 2 (IL-2), CD40L, fattore di necrosi tumorale α (TNF-α) e IFN-γ] dalla post-dose 1 alla pre-dose 1 era maggiore nei gruppi di anziani che avevano ricevuto le formulazioni adiuvate rispetto a quelli vaccinati con le formulazioni non adiuvate (Fig. 3D). Infine, rispetto al placebo, la vaccinazione con qualunque formulazione di RSVPreF3 non ha aumentato le risposte CD8+.
Sommariamente, sulla base del profilo di sicurezza accettabile e la capacità di indurre risposte umorale e cellulo-mediata robuste, la formulazione RSVPreF3 da 120 μg adiuvata con AS01E e con la scheda vaccinale di una singola dose è stata selezionata per lo sviluppo clinico successivo.
Un campione (1.702/24.966; 6,8%) di soggetti dello studio pivotale sull’efficacia di RSVPreF3 OA [49] ha formato una coorte di immunogenicità prestabilita. La risposta umorale è stata valutata immediatamente prima della vaccinazione (t0) e a un mese dopo la vaccinazione (t1). Sono stati eseguiti i saggi ELISA per la quantificazione di IgG specifiche per RSVPreF3 e il test di neutralizzazione per misurare gli anticorpi neutralizzanti RSV A e B. Nel gruppo dei soggetti vaccinati, è stato osservato un significativo aumento di GMC delle IgG dal t0 al t1 (7.041 vs 91.730) con un incremento medio geometrico pari al fattore 13,1 (IC 95%: 12,3-13,9). Nessun aumento è stato invece osservato nel gruppo placebo (GMC t0: 7.090; GMC t1: 7.045). Analogamente, l’incremento di GMT neutralizzanti RSV A (GMT t0: 918; GMT t1: 9.330) e RSV B (GMT t0: 1.196; GMT t1: 10.179) era rispettivamente di 10,2 (IC 95%: 9,5-11,0) e 8,6 (IC 95%: 8,0-9,2) volte [49].
Feldman et al. [50] ha confrontato la risposta immune umorale un mese dopo una dose di RSVPreF3 OA nei soggetti senza malattie di base e in quelli con almeno una patologia cronica. Nei soggetti senza co-morbilità l’incremento medio di GMT neutralizzanti RSV A e RSV B e di GMC delle IgG specifiche per RSVPreF3 era rispettivamente di 9,8 (IC 95%: 8,9-10,6), 8,3 (IC 95%: 7,7-9,0) e 12,9 (IC 95%: 12,1-13,9) volte. I corrispettivi parametri nei soggetti con almeno una patologia cronica erano comparabili, essendo rispettivamente di 11,0 (IC 95%: 9,6-12,5), 9,1 (IC 95%: 8,1-10,2) e 13,3 (IC 95%: 12,0-14,8) volte [50].
Lo studio di fase III NCT05059301 [51] aveva l’obiettivo di dimostrare la bioequivalenza tra diversi lotti (lot-to-lot consistency) di RSVPreF3 OA. Il criterio di successo era definito come segue: l’IC a due code al 95% dei rapporti di GMC delle IgG specifiche per RSVPreF3 tra ciascun paio di lotti (i.e., lotto 1/lotto 2, lotto 1/lotto 3 e lotto 2/lotto 3) era nell’intervallo 0,67-1,50. In seguito alla randomizzazione 1:1:1, un totale di 757 adulti di età ≥ 60 anni aveva ricevuto una dose di RSVPreF3 OA appartenente a uno dei tre lotti. La bioequivalenza è stata dimostrata: i rapporti tra GMC delle IgG erano pari a 1,06 (IC 95%: 0,94-1,21), 0,92 (IC 95%: 0,81-1,04) e 0,87 (IC 95%: 0,77-0,99) rispettivamente per i confronti lotto 1/ lotto 2, lotto 1/ lotto 3 e lotto 2/ lotto 3. Analogamente, l’incremento geometrico medio delle IgG tra i tre lotti (dal giorno 0 al giorno 31) era del tutto comparabile [lotto 1: 11,84 (IC 95%: 10,53-13,31); lotto 2: 11,29 (IC 95%: 10,12-12,60); lotto 3: 12,46 (IC 95%: 11,13-13,94)] [51].
Lo studio NCT03814590 di fase I/II descritto in precedenza (vedi § “Sviluppo clinico precoce”) [46] ha avuto un’estensione di fase IIb (NCT04657198) [48] progettata con l’obiettivo di valutare l’immunogenicità e la sicurezza della rivaccinazione con RSVPreF3 nei soggetti precedentemente esposti al vaccino. In particolare, 122 soggetti di età compresa tra 60-80 anni che avevano precedentemente ricevuto due dosi di una delle tre formulazioni [30 μg (n = 39), 60 μg (n = 43) o 120 μg (n = 40)] di RSVPreF3 adiuvata con AS01E, sono stati vaccinati con la 3a dose di RSVPreF3 adiuvata con AS01E da 120 μg a distanza di 18 mesi dalla 2a dose (ovverosia 20 mesi dalla 1a dose). Dopo la 2a dose, è stato riportato un progressivo decremento sia degli anticorpi neutralizzanti RSV A e B sia di IgG totali specifiche per RSVPreF3. In seguito alla 3a dose è stato osservato un chiaro effetto booster. Specificatamente, rispetto al mese 20 (immediatamente prima della 3a dose), un mese dopo la 3a dose il rapporto tra GMT neutralizzanti era aumentato di 2,3 volte (4.394,9 vs 1.957,4) nei confronti di RSV A e di 1,8 volte (6.094,3 vs 3.459,6) nei confronti di RSV B. Analogamente, GMC delle IgG specifiche per RSVPreF3 erano aumentate da 20.202,5 al 46.276,5 unità ELISA/ml con un rapporto incrementale pari a 2,3. Per quel che concerne l’immunogenicità cellulo-mediata, la frequenza mediana (per 1 milione di cellule) di CD4+ specifiche per RSVPreF3 che esprimevano almeno due marker (tra IL-2, CD40L, TNF-α e IFN-γ) è passata da 731 al mese 20 a 764 al mese 21 [48].
RCT di fase III NCT04732871 [53, 58] pone l’obiettivo di valutare sia la persistenza di risposta immune sia l’immunogenicità e la sicurezza della rivaccinazione con RSVPreF3 OA. Un totale di 1.653 partecipanti di età ≥ 60 anni sono stati randomizzati in rapporto 3:1:1 in uno dei seguenti gruppi: (i) il gruppo 1 (gruppo della vaccinazione annuale) riceve 3 dosi annuali (al giorno 1, al mese 12 e al mese 24) del vaccino; (ii) il gruppo 2 (gruppo della vaccinazione flessibile) riceve la 1a dose del vaccino al giorno 1 e un’eventuale 2a dose a distanza di 36 mesi dalla prima; (iii) il gruppo 3 (gruppo della vaccinazione unica) riceve solo una dose di RSVPreF3 OA al giorno 1. Lo studio è attualmente in corso e la sua durata prevista è di 36 mesi. Al momento della stesura del presente report HTA, erano disponibili i risultati relativi ai primi 13 mesi di follow-up.
Come dimostra la Tabella IV, una dose di RSVPreF3 OA somministrata al giorno 1 ha indotto una significativa risposta umorale in tutti e tre gruppi. Infatti, rispetto al giorno 1, l’incremento di GMC delle IgG specifiche per RSVPreF3 misurate a un mese dalla vaccinazione era di 11,8-12,6 volte. L’incremento degli anticorpi neutralizzanti RSV A (10,4-10,6 volte) e B (7,4-8,1 volte) era altrettanto notevole e simile tra i gruppi. In seguito, vi è stato un progressivo decremento dei titoli anticorpali che, tuttavia, a distanza di 12 mesi dalla vaccinazione erano 2,3-3,6 volte maggiori rispetto ai titoli prevaccinazione. Infine, a distanza di un mese (mese 13) dalla 2a dose somministrata al gruppo 1 al mese 12, è stato osservato un effetto booster. In particolare, rispetto al mese 12 (i.e., 12 mesi dopo la 1a dose e immediatamente prima la 2a dose), al mese 13 (i.e., a un mese dalla 2a dose) vi è stato un significativo incremento dei titoli anticorpali (sia IgG totali sia anticorpi neutralizzanti) di almeno due volte (Tab. IV). Un quadro del tutto analogo è emerso analizzando la risposta cellulo-mediata [53, 58].
Incremento delle medie geometriche della concentrazione di IgG specifiche per RSVPreF e dei titoli degli anticorpi neutralizzanti RSV A e RSV B nello studio NCT04732871, per tempo di rilevazione e gruppo vaccinale [58].
| Gruppo | Mese post-vaccinazione | |||
|---|---|---|---|---|
| 1 | 6 | 12 | 13 | |
| Incremento delle medie geometriche della concentrazione di IgG specifiche per RSVPreF | ||||
| 1 (vaccinazione annuale)1 | 11,8 | 4,7 | 3,4 | 8,0 |
| 2 (vaccinazione flessibile)2 | 12,6 | 4,8 | 3,6 | – |
| 3 (vaccinazione unica)2 | 12,2 | 4,8 | 3,6 | – |
| Incremento delle medie geometriche titoli degli anticorpi neutralizzanti RSV A | ||||
| 1 (vaccinazione annuale)1 | 10,6 | 4,2 | 3,1 | 6,1 |
| 2 (vaccinazione flessibile)2 | 10,4 | 4,7 | 3,1 | – |
| 3 (vaccinazione unica)2 | 10,6 | 4,7 | 3,1 | – |
| Incremento delle medie geometriche titoli degli anticorpi neutralizzanti RSV B | ||||
| 1 (vaccinazione annuale)1 | 8,1 | 3,5 | 2,4 | 4,1 |
| 2 (vaccinazione flessibile)2 | 7,4 | 3,4 | 2,3 | – |
| 3 (vaccinazione unica)2 | 7,8 | 3,7 | 2,4 | – |
| 1 Al momento della stesura del report, sono state somministrate 2 dosi del vaccino (al giorno 1 e al mese 12); 2 Al momento della stesura del report, è stata somministrata 1 dose del vaccino (al giorno 1). | ||||
Tenendo conto che l’antigene RSVPreF3 è derivato da un singolo ceppo adattato in laboratorio e appartenente al sottotipo A (ceppo RSV A2), risulta importante stabilire l’immunogenicità incrociata del vaccino verso la diversità delle popolazioni di RSV A e RSV B attualmente circolanti. Infatti, sebbene la proteina F presenti un tasso di stabilità genetica relativamente alto, alcune mutazioni puntiformi potrebbero avere un impatto negativo sull’efficacia dei vaccini basati sulla proteina preF. A tale proposito, è stata eseguita un’analisi in vitro [47], nella quale un campione di sieri residui ottenuti nello studio dose-finding descritto in precedenza [48] è stato testato nei confronti di diversi ceppi di RSV A e RSV B. Il test di neutralizzazione è stato eseguito su un totale di 83 paia di sieri (raccolti prima della vaccinazione e un mese dopo la vaccinazione) dei soggetti che avevano ricevuto una dose di RSVPreF3 OA. Al fine di confronto, sono stati analizzati anche 74 paia di sieri dai soggetti che avevano ricevuto una dose della formulazione RSVPreF3 (120 μg) non adiuvata. La risposta neutralizzante è stata valutata nei confronti di sei ceppi RSV antigenicamente distanti, dei quali due erano ceppi prototipi dei sottotipi A e B adattati in laboratorio (RSVA-Lab-M6 noto anche come RSVA Long e RSVB-Lab-M14 noto anche come RSVB 18537), mentre altri quattro (RSVA-Clin-M5 appartenente al genotipo ON1 di RSV A e RSVB-Clin-M13, RSVB-Clin-M14, RSVB-Clin-M16 appartenenti ai genotipi BA di RSV B) erano isolati clinici contemporanei. I soggetti vaccinati con RSVPreF3 OA hanno dimostrato un incremento dei titoli neutralizzanti con un rapporto tra GMT post-vaccinazione/prevaccinazione che variava da 7,3-13,4 a 6,0-9,9 volte. È da notare che la risposta evocata era robusta verso tutti gli isolati clinici senza alcuna differenza significativa. Rispetto ai soggetti vaccinati con la formulazione non adiuvata, quelli che hanno ricevuto una dose di RSVPreF3 OA hanno dimostrato titoli anticorpali maggiori [47].
Tre RCT di fase III [54-56] hanno valutato la possibilità di co-somministrare RSVPreF3 OA con i vaccini antinfluenzali stagionali, analizzando sia l’interferenza immunologica sia un eventuale incremento della reattogenicità. Sono stati utilizzati i principali tipi di vaccini antinfluenzali disponibili per i soggetti anziani, quali il vaccino quadrivalente a dosaggio standard prodotto su uova (QIVe, egg-based Quadrivalent Influenza Vaccine) (NCT04841577) [54], il vaccino quadrivalente ad alto dosaggio (hdQIVe, high-dose Quadrivalent Influenza Vaccine) (NCT05559476) [55] e il vaccino quadrivalente adiuvato con MF59 (aQIV, adjuvanted Quadrivalent Influenza Vaccine) (NCT05568797) [56]. Lo studio di co-somministrazione con QIVe [54] è stato condotto durante la stagione 2021 dell’emisfero sud e ha arruolato i soggetti di età ≥ 60 anni, mentre gli altri due studi [55, 56] sono stati condotti durante la stagione 2022/23 dell’emisfero nord e hanno arruolato i soggetti di età ≥ 65 anni (i.e., in linea con le indicazioni terapeutiche per hdQIV e aQIV negli Stati Uniti). Il disegno dei tre RCT è simile. In particolare, circa mille soggetti sono stati randomizzati in rapporto 1:1 in due gruppi: un gruppo di co-somministrazione i.e., una dose di vaccino antinfluenzale e una dose di RSVPreF3 OA somministrati durante la stessa seduta) e un gruppo di vaccinazione sequenziale (i.e., una dose di vaccino antinfluenzale seguita da una dose di RSVPreF3 OA al giorno 31). Il criterio di successo consisteva nella dimostrazione di non inferiorità in termini della risposta umorale verso ciascuno dei quattro antigeni influenzali [A(H1N1) pdm09, A(H3N2), B/Victoria e B/Yamagata] ed entrambi i sottotipi di RSV. In linea con le raccomandazioni del Center for Biologics Evaluation and Research (CBER) della FDA, la risposta immune è stata definita non inferiore se il limite superiore dell’IC al 95% a due code del rapporto GMT vaccinazione sequenziale/co-somministrazione era ≤ 1,5. L’immunogenicità verso gli antigeni influenzali è stata misurata tramite il saggio di inibizione dell’emoagglutinazione (HAI, HemAgglutination Inhibition), mentre per RSV sono stati quantificati gli anticorpi neutralizzanti RSV A e B.
La Figura 4 riporta i risultati relativi all’obiettivo primario dei tre RCT. Specificatamente, sono dimostrati i rapporti tra GMT del gruppo di vaccinazione sequenziale rispetto a quello di co-somministrazione. Negli studi di co-somministrazione di RSVPreF3 OA con QIVe (Fig. 4A) e con hdQIV (Fig. 4B) il criterio di non-inferiorità è stato raggiunto per tutti gli antigeni influenzali e RSV. Per quel che concerne invece la co-somministrazione di RSVPreF3 OA con aQIV (Fig. 4C), il criterio di non inferiorità è stato raggiunto per tutti gli antigeni eccetto quello di influenza A(H3N2). Infatti, il limite superiore dell’IC al 95% era marginalmente superiore a 1,5 (1,52).
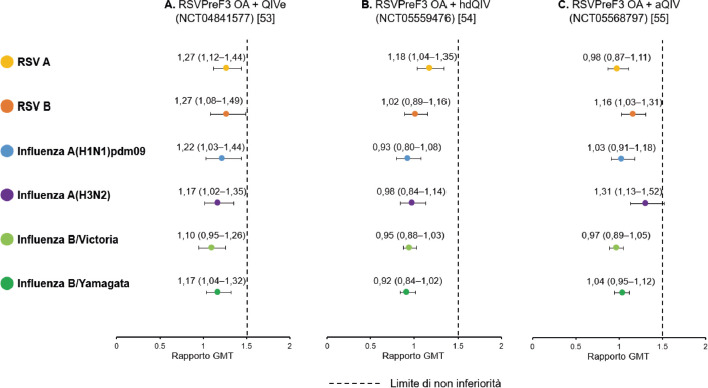
Rapporto tra le medie geometriche dei titoli (GMT) emoagglutino-inibenti (influenza) e neutralizzanti (RSV) del gruppo della vaccinazione antinfluenzale e RSV sequenziale rispetto al gruppo di co-somministrazione, per antigene e tipologia del vaccino antinfluenzale.
Si evince quindi che RSVPreF3 OA può essere co-somministrato con i vaccini antinfluenzali stagionali senza causare un’interferenza clinicamente significativa in termini di risposta immune sia verso RSV che verso i quattro antigeni influenzali. Una leggera diminuzione della magnitudine della risposta emoagglutino-inibente verso il sottotipo A(H3N2) nel caso di co-somministrazione di RSVPreF3 OA con aQIV necessita ulteriori approfondimenti anche al fine di determinare se essa possa avere un significato clinico.
Lo studio pivotale NCT04886596 (noto anche come AReSVi-006) rappresenta il cardine dello sviluppo clinico di RSVPreF3 OA e, grazie ai suoi primi risultati, il vaccino è stato recentemente autorizzato dai principali enti regolatori. Lo studio è iniziato a maggio 2021 e la fine prevista è maggio 2024: si estende, quindi, a tre stagioni RSV dell’emisfero nord e ad almeno due stagioni RSV dell’emisfero sud. La stagione RSV dell’emisfero nord è compresa tra il 1° ottobre il 30 aprile, mentre quella dell’emisfero sud dal 1° marzo al 30 settembre. Al momento della stesura del presente report HTA, erano disponibili i risultati relativi a due stagioni e descritti in tre pubblicazioni diverse [49, 50,52].
Lo studio si configura come multicentrico (278 centri in 17 Paesi), di fase III, randomizzato, controllato con placebo, in cieco (observer-blind). Hanno partecipato allo studio 17 centri italiani. La popolazione dello studio consiste di soggetti di età pari o superiore ai 60 anni. I principali criteri di esclusione comprendevano: (i) immunosoppressione inclusa quella iatrogena, (ii) malattie croniche di grado severo, non stabili o giudicate significative dallo sperimentatore; (iii) demenza e altre patologie della sfera cognitiva; (iv) patologie neurologiche di grado severo o instabili e (v) ipersensibilità a qualsiasi componente del vaccino o al lattice. I soggetti affetti da patologie stabili sono stati considerati arruolabili.
All’arruolamento (giorno 1) e prima dell’inizio della prima stagione RSV, i soggetti sono stati randomizzati in rapporto 1:1 per ricevere una singola dose di RSVPreF3 OA o di placebo (soluzione salina). In seguito alla somministrazione di vaccino o placebo, è stata eseguita una sorveglianza delle ARI sia attiva che passiva. In particolare, tutti i soggetti sono stati istruiti a contattare gli sperimentatori in caso di una sospetta ARI e a pianificare quindi una visita medica con un eventuale tampone nasofaringeo. Inoltre, a partire dal giorno 30, tutti i soggetti sono stati contattati attivamente (ogni due settimane per tutta la stagione RSV e ogni mese per il periodo inter-epidemico) al fine di verificare i casi incidenti di ARI. Tutti i tamponi (raccolti preferibilmente entro 48 ore dall’inizio dei sintomi) sono stati analizzati tramite RT-qPCR per la presenza di RSV A e RSV B.
Lo studio pone come suo obiettivo primario quello di valutare l’efficacia della singola dose di RSVPreF3 OA nel prevenire LRTD causata da RSV nella prima stagione RSV. LRTD è definita come la presenza di almeno due segni o sintomi delle basse vie respiratorie durate per almeno 24 ore (con almeno un segno delle basse vie respiratorie) o di almeno tre sintomi delle basse vie respiratorie durate per altrettanto tempo. L’obiettivo primario è stato predefinito raggiunto se il limite inferiore dell’IC 95% era maggiore del 20%. Un’analisi ad interim è stata pre-specificata al raggiungimento di almeno 35 casi di LRTD da RSV. Per l’analisi ad interim è stata eseguita una correzione statistica dell’errore α (pari al 3,05%) e pertanto l’IC utilizzato per l’obiettivo primario è al 96,95%.
Tra gli obiettivi di efficacia secondari vanno annoverati: (i) l’efficacia della singola dose di RSVPreF3 OA nel prevenire LRTD severa causata da RSV; (ii) l’efficacia della singola dose di RSVPreF3 OA nel prevenire ARI causata da RSV. LRTD severa è una LRTD definita severa dallo sperimentatore o definita tale sulla base della terapia di supporto somministrata. ARI è definita dalla presenza di almeno due segni/sintomi respiratori o dalla presenza di almeno un segno/sintomo respiratorio più almeno un segno/sintomo sistemico per almeno 24 ore. Lo studio ha previsto anche diversi obiettivi relativi all’immunogenicità e alla sicurezza che sono stati trattati nelle corrispettive sezioni.
Durante la prima stagione RSV, 24.966 soggetti sono stati randomizzati in rapporto 1:1 per ricevere una dose RSVPreF3 OA (n = 12.467) o placebo (n = 12.499). L’età media dei partecipanti è stata pari a 69,5 (DS 6,5) anni e il 61,7% di loro era di sesso femminile. La maggior parte (92,2%) dei soggetti è stata arruolata nei Paesi dell’emisfero nord. I due gruppi risultavano del tutto paragonabili per quanto riguarda le caratteristiche sociodemografiche e cliniche (Tab. V).
Caratteristiche sociodemografiche e cliniche della popolazione dello studio pivotale NCT04886596 [49].
| Variabile | Livello | RSVPreF3 OA, n (%) | Placebo, n (%) |
|---|---|---|---|
| Età, anni | Media (DS) | 69,5 (6,5) | 69,6 (6,4) |
| ≥ 70 | 5.504 (44,1) | 5.519 (44,2) | |
| ≥ 80 | 1.017 (8,2) | 1.028 (8,2) | |
| 60 69 | 6.963 (55,9) | 6.980 (55,8) | |
| 70 79 | 4.487 (36,0) | 4.491 (35,9) | |
| Sesso | Femminile | 6.488 (52,0) | 6.427 (51,4) |
| Etnia | Nera | 1.064 (8,5) | 1.101 (8,8) |
| Asiatica | 953 (7,6) | 956 (7,6) | |
| Bianca | 9.887 (79,3) | 9.932 (79,5) | |
| Altro | 563 (4,5) | 510 (4,1) | |
| Emisfero | Nord | 11.496 (92,2) | 11.522 (92,2) |
| Sud | 971 (7,8) | 977 (7,8) | |
| Residenza nelle strutture residenziali a lungo termine | Sì | 161 (1,3) | 148 (1,2) |
| No | 12.306 (98,7) | 12.351 (98,8) | |
| Livello di fragilità | Fragile | 189 (1,5) | 177 (1,4) |
| Pre-fragile | 4.793 (38,4) | 4.781 (38,3) | |
| Robusto (fit) | 7.464 (59,9) | 7.521 (60,2) | |
| Non noto | 21 (0,2) | 20 (0,2) | |
| Indice di comorbilità di Charlson | Media (DS) | 3,2 (1,2) | 3,2 (1,2) |
| Rischio medio/basso | 8.235 (66,1) | 8.368 (66,9) | |
| Rischio alto | 4.232 (33,9) | 4.131 (33,1) | |
| Patologie concomitanti | ≥ 1 | 4.937 (39,6) | 4.864 (38,9) |
| ≥ 1 cardiorespiratoria | 2.496 (20,0) | 2.422 (19,4) | |
| ≥ 1 endocrina/metabolica | 3.200 (25,7) | 3.236 (25,9) |
Durante la prima stagione il periodo di follow-up mediano era pari a 6,7 mesi e sono stati registrati 47 casi di LRTD da RSV confermata tramite RT-qPCR. Di questi, 40 casi erano nel braccio placebo, mentre i restanti 7 casi nel braccio RSVPreF3 OA. L’efficacia vaccinale è stata quindi pari all’82,6% (IC 96,95%: 57,9-94,1%). Pertanto, l’obiettivo primario del limite inferiore dell’IC > 20% è stato ampiamente raggiunto.
Per quel che concerne gli obiettivi di efficacia secondari, l’efficacia RSVPreF3 OA è stata del 94,1% (IC 95%: 62,4-99,9%) nel prevenire LRTD da RSV severa. Infatti, sono stati registrati 17 casi di LRTD severa nel gruppo placebo, mentre solo un caso è stato segnalato nel gruppo vaccinale. RSVPreF3 OA è stato infine efficace nel prevenire ARI da RSV con una stima di efficacia vaccinale pari al 71,7% (IC 95%: 56,2-82,3%).
La Figura 5 riassume le stime di efficacia di RSVPreF3 OA stratificate per esito clinico, sottotipo virale, fascia di età e gruppo di rischio. In breve, l’efficacia vaccinale è stata paragonabile tra i sottotipi di RSV A e B sia nella prevenzione di LRTD (RSV A: 84,6%; RSV B: 80,9%) sia nella prevenzione di ARI (RSV A: 71,9%; RSV B: 70,6%). L’efficacia vaccinale contro LRTD è stata analogamente elevata nei soggetti di età 60-69 (81,0%) e 70-79 (93,8%) anni, così come nei soggetti con almeno una patologia cronica preesistente (94,6%). Tuttavia, un numero molto esiguo di casi nei soggetti di età ≥ 80 anni ha determinato un alto livello di incertezza con gli IC 95% ampi (Fig. 5) [49].
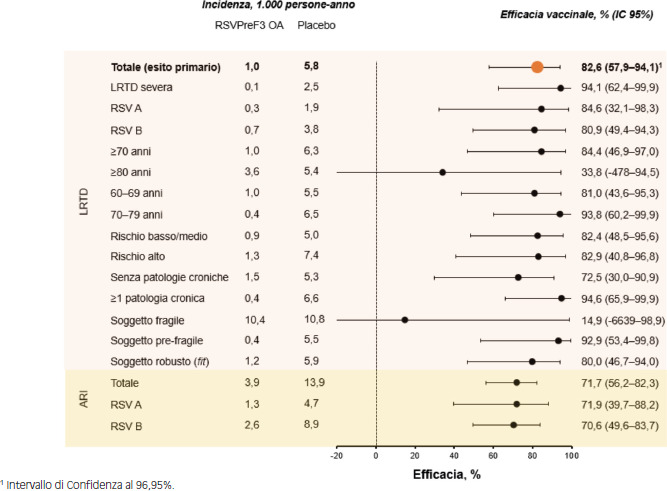
Efficacia di RSVPreF3 OA, per esito clinico, sottotipo virale, fascia di età e gruppo di rischio osservata nello studio pivotale NCT04886596 [49].
Feldman et al. [50] ha analizzato ulteriormente i risultati dello studio AReSVi-006, stratificando l’intera popolazione sulla base della presenza di alcune patologie che aumentano il rischio di una malattia da RSV severa. Infatti, almeno una patologia cronica di interesse [patologie cardiorespiratorie (scompenso cardiaco cronico, qualsiasi patologica broncopolmonare cronica incluse l’asma e la broncopneumopatia cronica ostruttiva) ed endocrino/metaboliche (diabete mellito tipo 1 e 2, malattie croniche epatiche e renali nello stadio avanzato] era presente nel 39,3% (9.801/24.966) della coorte. Il 19,8% (4.938/24966) dei partecipanti aveva almeno due patologie croniche di interesse. Come evidenzia la Figura 6, RSVPreF3 OA ha dimostrato un’efficacia elevata in tutti i soggetti con almeno una malattia cronica. Mentre nei partecipanti senza alcuna patologia cronica di interesse l’efficacia contro LRTD da RSV e contro ARI da RSV era pari rispettivamente al 72,5% (IC 95%: 30,0-90,9%) e al 64,4% (IC 95%: 39,0-80,1%), essa incrementava al 94,6% (IC 95%: 65,9-99,9%) e al 81,0% (IC 95%: 58,9-92,3%) nei soggetti con almeno una malattia cronica [50].
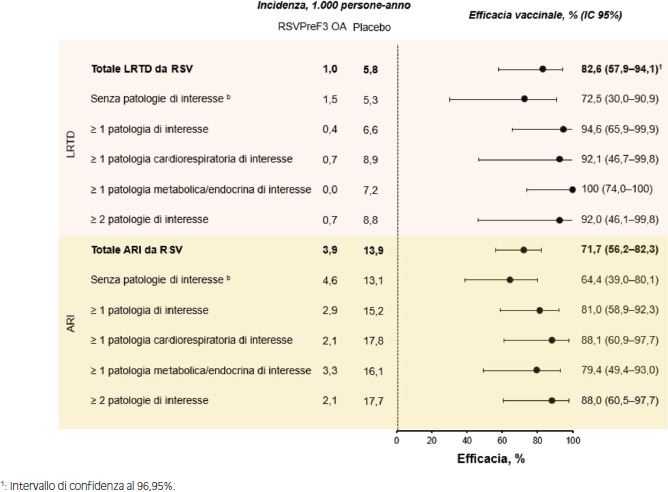
Efficacia di RSVPreF3 OA, per esito clinico e presenza di patologie croniche di interesse osservata nello studio pivotale NCT04886596 [50].
Recentemente, sono stati resi disponibili i dati di efficacia relativi alla seconda stagione (2022/23) RSV [52]. Per la seconda stagione, i soggetti (n = 12.470) che durante la prima stagione avevano ricevuto una dose di RSVPreF3 OA sono stati nuovamente randomizzati per ricevere la 2a dose di RSVPreF3 OA (n = 6.242) o placebo (n = 6.228). Ai partecipanti che durante la prima stagione avevano ricevuto placebo (n = 12.503) sono stati somministrati nuovamente placebo. L’efficacia è stata valutata al 31 marzo 2023, cioè alla fine della seconda stagione.
Le stime dell’efficacia ottenute alla fine della seconda stagione dimostrano che un’unica dose di RSVPreF3 OA (somministrata quindi nella stagione precedente) induce una protezione durevole nei confronti di LRTD. In particolare, l’efficacia cumulativa durante le prime due stagioni è stata del 67,2% (IC 97,5%: 48,2-80,0%) e del 78,8% (IC 97,5%: 52,5-92,0%) nei confronti rispettivamente di qualsiasi LRTD da RSV e LRTD da RSV severa. L’efficacia cumulativa era pari all’80,5% (IC 95%: 54,0-93,2%) contro LRTD da RSV A e pari al 59,7% (IC 95%: 35,8-75,5%) contro LRTD da RSV B. L’analisi stratificata per fascia di età e la presenza delle patologie croniche preesistenti era consistente con i dati dell’intera coorte [60-69 anni: 65,4% (IC 95%: 40,4-80,9%); 70-79 anni: 74,9% (IC 95%: 48,4-89,2); senza patologie croniche: 68,3% (IC 95%: 42,7-83,6%); ≥ 1 patologia cronica: 66,7% (IC 95%: 41,8-82,0%)]. Per quel che concerne la prevenzione di ARI da RSV, l’efficacia di una singola dose era pari al 52.7% (IC 95%: 40,0-63,0%).
L’efficacia della prima dose di RSVPreF3 OA (somministrata pre-stagione 1) e della rivaccinazione (somministrata prima della stagione 2) contro il primo episodio di LRTD da RSV nel corso di due stagioni post-dose 1 è stata pari al 67,1% (IC 97,5%: 48,1-80,0%). Pertanto, l’obiettivo pre-specificato dello studio è stato raggiunto. Invece, l’efficacia della rivaccinazione è stata del 78,8% nei confronti di LRTD da RSV severa e del 60,3% nei confronti di ARI da RSV. Considerando invece solo la stagione 2, l’efficacia della rivaccinazione è stata del 55,9% (IC 95%: 27,9-74,3%) contro LRTD da RSV, del 64,1% (IC 95%: 5,9-89,2%) contro LRTD da RSV severa e del 55,8 (IC 95%: 37,5-69,5%) contro ARI da RSV [52].
In sintesi, lo studio pivotale NCT04886596 ha dimostrato che una singola dose di RSVPreF3 OA è altamente efficace nel prevenire LRTD da RSV A e B (inclusi i casi di LRTD severa) in adulti di età ≥ 60 anni. L’efficacia vaccinale è stata comprovata in diverse sottofasce di età e in diversi gruppi di rischio. La protezione indotta da una singola dose di RSVPreF3 OA perdura per almeno due stagioni RSV [49, 50, 52].
I dati relativi alla reattogenicità, tollerabilità e sicurezza sono stati riportati in dieci pubblicazioni [46, 48, 49, 51-56, 58]. L’analisi qualitativa è stata condotta a seconda del numero di dosi (i.e., prima/unica dose e rivaccinazione) e della co-somministrazione con altri vaccini di routine.
La Tabella VI riporta la frequenza degli AE sollecitati (follow-up 4-7 giorni) e riportati spontaneamente (follow-up 30 giorni o tutta la durata dello studio) in seguito alla prima vaccinazione con RSVPreF3 OA e/o placebo. Rispetto al placebo [46, 49], ≥ 1 AE sollecitato è stato di più frequente riscontro nei gruppi di trattamento attivo con RSVPreF3 OA. Tale differenza è stata maggiormente determinata dagli AE locali. In particolare, il 56-62% dei soggetti vaccinati con RSVPreF3 OA hanno riportato il dolore nel sito di iniezione, mentre la corrispettiva frequenza nei gruppi placebo era pari al 4-9%. Altri AE locali come l’eritema e il gonfiore erano meno frequenti (< 12%). Tra gli AE sollecitati sistemici vanno annoverati l’affaticamento/malessere generale (RSVPreF3 OA: 21-34%; placebo: 16%), il mal di testa (RSVPreF3 OA: 17-27%; placebo: 8-13%), la mialgia (RSVPreF3 OA: 6-34%; placebo: 5-8%) e l’artralgia (RSVPreF3 OA: 6-18%; placebo: 6-7%). È da notare che il riscontro di febbre ≥ 38°C era infrequente (1-2%) tra i soggetti vaccinati. Va, tuttavia, specificato che la quasi totalità degli AE sollecitati sia locali che sistemici era di natura lieve/moderata, transitoria (durata media di 1-2 giorni) e non richiedeva alcun intervento medico (Tab. VI).
Frequenza degli eventi avversi locali (nel sito di iniezione) e sistemici sollecitati e non sollecitati in seguito alla prima/unica dose di RSVPreF3 OA o placebo, per studio.
| Evento avverso | Gruppo | % (n/totale) | ||||
|---|---|---|---|---|---|---|
| Leroux-Roels et al. [46] | Papi et al. [49] | NCT05059301 [51]2 | Schwarz et al. [53]3 | |||
| Sollecitati | ≥ 1 | RSVPreF3 OA | 36,0 (36/100)1 | 71,9 (632/879) | – | – |
| Placebo | 33,0 (33/100)1 | 27,9 (245/878) | – | – | ||
| Dolore | RSVPreF3 OA | 56,0 (56/100) | 60,9 (535/879) | 62,2 (468/752) | 60,5 (996/1,645) | |
| Placebo | 4,1 (4/98) | 9,3 (81/874) | – | – | ||
| Eritema | RSVPreF3 OA | 9,0 (9/100) | 7,5 (66/879) | 11,1 (84/752) | 9,7 (159/1,645) | |
| Placebo | 1,0 (1/98) | 0,8 (7/874) | – | – | ||
| Gonfiore | RSVPreF3 OA | 6,0 (6/100) | 5,5 (48/879) | 7,4 (56/752) | 7,5 (124/1,645) | |
| Placebo | 0 (0/98) | 0,6 (5/874) | – | – | ||
| Affaticamento | RSVPreF3 OA | 21,0 (21/100) | 33,6 (295/879) | 28,5 (215/752) | 31,4 (517/1,646) | |
| Placebo | 16,3 (16/98) | 16,1 (141/878) | – | – | ||
| Febbre | RSVPreF3 OA | 1,0 (1/100) | 2,0 (18/879) | 2,1 (16/752) | 1,5 (25/1,646) | |
| Placebo | 0 (0/98) | 0,3 (3/878) | – | – | ||
| Brividi | RSVPreF3 OA | 3,0 (3/100) | – | – | – | |
| Placebo | 1,0 (1/98) | – | – | – | ||
| Mal di testa | RSVPreF3 OA | 17,0 (17/100) | 27,2 (239/879) | 23,8 (179/752) | 20,4 (336/1,646) | |
| Placebo | 8,2 (8/98) | 12,6 (111/878) | – | – | ||
| Mialgia | RSVPreF3 OA | 6,0 (6/100) | 28,9 (254/879) | 33,1 (249/752) | 33,5 (551/1,646) | |
| Placebo | 5,1 (5/98) | 8,2 (72/878) | – | – | ||
| Artralgia | RSVPreF3 OA | 6,0 (6/100) | 18,1 (159/879) | 14,0 (105/752) | 15,5 (255/1,646) | |
| Placebo | 7,1 (7/98) | 6,4 (56/878) | – | – | ||
| Sintomi gastrointestinali | RSVPreF3 OA | 9,0 (9/100) | – | – | – | |
| Placebo | 10,2 (10/98) | – | – | – | ||
| Non sollecitati | ≥ 1 | RSVPreF3 OA | 36,0 (36/100)1 | 33,0 (4.117/12.467) | 14,3 (108/757) | 12,8 (212/1,653) |
| Placebo | 33,0 (33/100)1 | 17,8 (2.229/12.499) | – | – | ||
| ≥ 1 di grado 3 | RSVPreF3 OA | 1,0 (1/100)1 | 2,0 (246/12.467) | – | 1,2 (20/1,653) | |
| Placebo | 3,0 (3/100)1 | 1,3 (158/12.499) | – | – | ||
| ≥ 1 correlato | RSVPreF3 OA | 8,0 (8/100)1 | 24,9 (3.105/12.467) | – | 3,6 (59/1,653) | |
| Placebo | 9,0 (9/100)1 | 5,8 (731/12.499) | – | – | ||
| ≥ 1 di grado 3 correlato | RSVPreF3 OA | 0 (0/100)1 | 0,9 (112/12.467) | – | – | |
| Placebo | 0 (0/100)1 | 0,2 (25/12.499) | – | – | ||
| ≥ 1 SAE | RSVPreF3 OA | 1,0 (1/100)1 | 4,2 (522/12.467) | 2,8 (21/757) | 3,9 (65/1,653) | |
| Placebo | 1,0 (1/100)1 | 4,0 (506/12.499) | – | – | ||
| ≥ 1 SAE correlato | RSVPreF3 OA | 0 (0/100)1 | 0,1 (10/12.467) | – | 0,1 (1/1,653) | |
| Placebo | 0 (0/100)1 | 0,1 (7/12.499) | – | – | ||
| ≥ 1 di probabile natura immuno-mediata | RSVPreF3 OA | 0 (0/100)1 | 0,3 (40/12.467) | 0,8 (6/757) | 0,4 (7/1,653) | |
| Placebo | 0 (0/100)1 | 0,3 (34/12.499) | – | – | ||
| 1 Comprende anche gli eventi avversi non sollecitati dopo la seconda dose; 2 i dati di tre lotti del vaccino sono stati aggregati; 3 i dati si riferiscono al gruppo della vaccinazione annuale. | ||||||
Per quel che concerne gli AE riportati spontaneamente, il confronto tra i soggetti vaccinati e quelli che hanno ricevuto placebo risulta più bilanciato. L’aumento relativo nei gruppi dei trattati è determinato maggiormente dagli eventi di reattogenicità locale. Gli AE non sollecitati gravi di grado 3 erano infrequenti e similarmente distribuiti tra i bracci RSVPreF3 OA (1-2%) e placebo (1-3%). Tra gli AE di grado 3 < 1% è stato correlato al vaccino. La frequenza di SAE era analogamente simile tra i vaccinati (1-4%) e i soggetti somministrati placebo (1-4%). Soltanto 0,1% di SAE è stato giudicato potenzialmente correlato al vaccino (Tab. VI).
Trattandosi di un vaccino first-in-class, è indispensabile il monitoraggio degli AE di interesse speciale come quelli di probabile natura immuno-mediata. L’incidenza cumulativa di questi ultimi risulta bassa, pari allo 0,4% nel gruppo dei vaccinati e pari allo 0,3% nei soggetti trattati con placebo.
Risultati di quattro pubblicazioni [48, 52, 53, 58] permettono di confrontare direttamente la frequenza degli AE sia sollecitati che non sollecitati in seguito alla prima e le successive vaccinazioni. Come si evince dalla Tabella VII, l’incidenza degli AE è paragonabile tra le prime vaccinazioni e le rivaccinazioni. Analogamente a quanto riportato sopra, il dolore nel sito di iniezione, l’affaticamento, la mialgia e il mal di testa risultano i più frequenti AE sollecitati tra i rivaccinati, mentre gli SAE sono infrequenti.
Confronto tra le frequenze degli eventi avversi locali (nel sito di iniezione) e sistemici sollecitati e non sollecitati in seguito alla prima vaccinazione rispetto alla rivaccinazione con RSVPreF3 OA, per studio.
| Evento avverso | Leroux-Roels et al. [46, 48] | Schwarz et al. [53, 58] | Papi et al. [49], Ison et al. [52] | |||||
|---|---|---|---|---|---|---|---|---|
| Post-dose 1 (n = 100) | Post-dose 2 (n = 95) | Post-dose 3 (n = 40) | Post-dose 1 (n = 1.653) | Post-dose 2 (n = 902) | Post-dose 1 (n = 879/12.467)1 | Post-dose 2 (n = 326/4.966)1 | ||
| Sollecitati | Dolore | 56,0 | 49,5 | 52,5 | 60,5 | 592 | 60,9 | 52,1 |
| Eritema | 9,0 | 7,4 | 2,5 | 9,7 | 102 | 7,5 | 9,8 | |
| Gonfiore | 6,0 | 6,3 | 0 | 7,5 | 82 | 5,5 | 7,1 | |
| Affaticamento | 21,0 | 25,3 | 0 | 31,4 | 322 | 33,6 | 30,1 | |
| Febbre | 1,0 | 1,1 | 0 | 1,5 | 12 | 2,0 | 1,8 | |
| Brividi | 3,0 | 4,2 | 0 | – | – | – | ||
| Mal di testa | 17,0 | 10,5 | 2,5 | 20,4 | 212 | 27,2 | 22,1 | |
| Mialgia | 6,0 | 11,6 | 0 | 33,5 | 322 | 28,9 | 25,2 | |
| Artralgia | 6,0 | 10,5 | 0 | 15,5 | 152 | 18,1 | 16,9 | |
| Sintomi gastrointestinali | 9,0 | 7,4 | 0 | – | – | – | – | |
| Non sollecitati | ≥ 1 | 36,0 | 12,5 | 12,8 | 10,2 | 33,0 | 28,5 | |
| ≥ 1 di grado 3 | 1,0 | 0 | 1,2 | – | 2,0 | 2,2 | ||
| ≥ 1 correlato | 8,0 | 2,5 | 3,6 | – | 24,9 | 19,1 | ||
| ≥ 1 di grado 3 correlato | 0 | 0 | – | – | 0,9 | 1,1 | ||
| ≥ 1 SAE | 1,0 | 0 | 3,9 | 0,8 | 4,2 | 4,2 | ||
| ≥ 1 SAE correlato | 0 | 0 | 0,1 | 0,1 | 0,1 | 0,1 | ||
| ≥ 1 di probabile natura immuno-mediata | 0 | 0 | 0,1 | 0 | 0,3 | 0,3 | ||
| 1: il numero totale di soggetti valutati per gli aventi avversi sollecitati/non sollecitati; 2: i dati sono approssimati al numero intero in quanto presenti solo in forma grafica. | ||||||||
La co-somministrazione di RSVPreF3 OA con i vaccini antinfluenzali disponibili appare clinicamente accettabile [54-56]. Infatti, la frequenza degli AE riportati spontaneamente è simile tra i gruppi di co-somministrazione (11-19%) e quelli di vaccinazione sequenziale, essendo RSVPreF3 OA il vaccino di riferimento (13-24%). Un totale di 1-3% e 2-4% dei soggetti appartenenti rispettivamente ai bracci di co-somministrazione e vaccinazione sequenziale ha riportato un SAE. Rispetto alla vaccinazione sequenziale con RSVPreF3 OA, somministrato un mese dopo l’antinfluenzale, gli AE sollecitati erano leggermente più frequenti nel gruppo di co-somministrazione con una differenza maggiore per il dolore nel sito di iniezione (48-66% vs 39-59%) e l’affaticamento (22-46% vs 18-30%). Considerando la tipologia dei singoli vaccini antinfluenzali, la co-somministrazione di RSVPreF3 OA con aQIV appare più reattogena, specialmente rispetto alla co-somministrazione di RSVPreF3 OA con QIVe (Tab. VIII). Va infine sottolineato che tutti i tre RCT [54-56] sulla co-somministrazione sono in aperto, il che potrebbe in parte determinare la maggiore frequenza degli AE sollecitati nei gruppi di co-somministrazione.
Confronto tra le frequenze (%) degli eventi avversi sollecitati e non sollecitati in seguito alla co-somministrazione di RSVPreF3 OA con uno dei vaccini antinfluenzali o in seguito alla vaccinazione sequenziale (vaccino di riferimento è RSVPreF3 OA), per studio.
| Evento avverso | Chandler et al. [54] | Valenciano et al. [55] | Clark et al. [56] | ||||
|---|---|---|---|---|---|---|---|
| RSVPreF3 OA + QIVe | RSVPreF3 OA | RSVPreF3 OA + hdQIV | RSVPreF3 OA | RSVPreF3 OA + aQIV | RSVPreF3 OA | ||
| Sollecitato | Dolore | 47,9 | 39,1 | 55,6 | 46,3 | 65,9 | 58,8 |
| Eritema | 4,1 | 2,1 | 4,3 | 4,3 | 11,8 | 9,5 | |
| Gonfiore | 3,2 | 1,0 | 4,0 | 4,3 | 8,7 | 6,0 | |
| Affaticamento | 22,4 | 17,9 | 30,5 | 23,5 | 45,7 | 29,9 | |
| Febbre | 2,5 | 1,0 | 2,1 | 2,0 | 2,1 | 1,1 | |
| Mal di testa | 21,7 | 16,2 | 24,3 | 19,0 | 32,2 | 23,7 | |
| Mialgia | 22,1 | 19,6 | 40,2 | 31,3 | 39,0 | 31,9 | |
| Artralgia | 16,2 | 11,2 | 16,1 | 13,0 | 25,8 | 29,9 | |
| Non sollecitato | ≥ 1 | 18,8 | 23,7 | 11,0 | 12,5 | 13,2 | 23,2 |
| ≥ 1 SAE | 3,4 | 4,5 | 1,0 | 1,8 | 1,5 | 2,5 | |
| ≥ 1 di probabile natura immuno-mediata | 1,1 | 0,2 | 0,0 | 0,2 | 0,0 | 0,4 | |
Nell’ambito dello studio pivotale NCT04886596 [49], tra gli obiettivi secondari pre-specificati sono stati annoverati diversi esiti PRO e quelli relativi alla HRQoL. I primi risultati di queste valutazioni sono disponibili nell’abstract congressuale di Curran et al. [57]. A tale proposito, è stata formata una coorte che comprendeva tutti i soggetti che avevano ricevuto vaccino o placebo e che non avevano riportato ARI da RSV nei primi 15 giorni dopo l’iniezione (n = 24.960). Complessivamente, sono stati riportati 27 episodi di ARI da RSV nel gruppo RSVPreF3 OA (0,2%; n = 12,466) e 95 episodi nel gruppo placebo (0,8%; n = 12.494). Questi soggetti hanno compilato tre diversi questionari PRO, quali SF-12 (Short Form-12), EQ-5D (Euro-QoL a 5 dimensioni) e FLU-PRO (inFLUenza PRO). SF-12 e EQ-5D rappresentano le scale ampiamente utilizzate al fine di misurare diverse dimensioni di HRQoL generale e sono state compilate sia all’arruolamento (i.e., prima della stagione RSV) che all’esordio dei sintomi di ARI da RSV. Per l’SF-12 l’esito pre-specificato era quello relativo alla componente di salute fisica che può variare da 0 a 100, laddove il punteggio più alto rappresenta lo stato di salute migliore. Il valore di EQ-5D varia da 0 (pessimo stato di salute paragonabile alla morte) a 1 (perfetto stato di salute) ed equivale quindi alle (dis)utilità. La scala FLU-PRO è invece più specifica per le virosi respiratorie e misura la severità dei sintomi. Flu-PRO è stato compilato per 7 giorni consecutivi a partire dal giorno dell’inizio dei sintomi e l’esito predefinito era il punteggio mediano della dimensione “Torace/Respiratorio”. Il punteggio FLU-PRO varia da 0 a 4 e un valore maggiore indica una maggior gravità dei sintomi.
La mediana dei punteggi massimi di FLU-PRO tra i soggetti vaccinati con RSVPreF3 OA (n = 24) era significativamente inferiore (1,07 vs 1,86; P = 0,026) a quelli dei soggetti che hanno ricevuto placebo (n = 76). Questo risultato indica una minore gravità dei sintomi delle infezioni da RSV breakthrough nei soggetti vaccinati. Analogamente, i punteggi SF-12 PF ed EQ-5D all’esordio dei sintomi tendevano ad essere più alti nei soggetti vaccinati (media dei minimi quadrati rispettivamente 72,16 e 0,8896) rispetto ai soggetti somministrati placebo (media dei minimi quadrati rispettivamente 65,16 e 0,8109) con una differenza pari rispettivamente a 7,00 (IC 95%: -9,86-23,85) e 0,0786 (IC 95%: -0,0340-0,1913). Questo dato indica un impatto minore di RSV sulla HRQoL nei soggetti vaccinati rispetto ai soggetti che hanno ricevuto placebo. Infatti, come dimostra il confronto tra i punteggi pre-stagione vs all’esordio dei sintomi, nei partecipanti che hanno ricevuto placebo il valore medio di disutilità era di 0,0477 (media dei minimi quadrati 0,8586 vs 0,8109). Nei soggetti vaccinati, invece, non vi è stata alcuna diminuzione del punteggio (media dei minimi quadrati 0,8616 vs 0,8896).
Grazie alla ricerca sistematica della letteratura, è stato possibile individuare 13 pubblicazioni scientifiche [46-58], nelle quali sono stati valutati diversi aspetti clinici di RSVpreF3 OA relativi a immunogenicità, persistenza anticorpale, copertura dei ceppi circolanti, efficacia, durata minima della protezione, impatto sulla HRQoL, reattogenicità, tollerabilità e sicurezza. Gli studi sperimentali di fase I-III, giudicati di alta qualità e a rischio basso di distorsione, sono stati condotti su una popolazione di oltre 30mila soggetti di età ≥ 60 anni. Le evidenze generate finora permettono di trarre le seguenti conclusioni:
Una singola dose di RSVpreF3 OA risulta altamente immunogena sia in termini di IgG antigene specifiche totali (con un incremento di concentrazione da prevaccinazione a un mese dopo la vaccinazione pari a 11-13 volte) sia in termini di anticorpi neutralizzanti RSV A e RSV B (con un incremento di concentrazione da prevaccinazione a un mese dopo la vaccinazione pari a 9-10 volte). Inoltre, a differenza delle formulazioni non adiuvate, l’aggiunta dell’adiuvante AS01E ha permesso di indurre una significativa risposta cellulo-mediata. Quest’ultima ha un ruolo cruciale nel processo della clearance virale [60], specialmente nell’anziano. È auspicabile, tuttavia, determinare un valido correlato di protezione nei confronti dell’infezione da RSV.
RSVpreF3 OA, l’antigene del quale è basato su certa sequenza nucleotidica, è altamente immunogeno verso i ceppi di RSV A e B attualmente in circolazione che sono affetti da alcune mutazioni puntiformi della proteina F. Seppure la proteina F sia relativamente stabile (a differenza della proteina G), presenta comunque un certo grado di variabilità ed evoluzione molecolare nei principali siti antigenici che possono eventualmente alterare l’efficacia vaccinale [61]. I risultati disponibili suggeriscono quindi che RSVpreF3 OA può coprire ceppi moderni di RSV A e RSV B, anche quelli antigenicamente distanti.
Una singola dose di RSVpreF3 OA è risultata efficace all’82,6, al 94,1 e al 71,7% nel prevenire rispettivamente qualsiasi LRTD da RSV A e B, LRTD da RSV severa e ARI da RSV. Considerando che l’infezione da RSV (così come le altre virosi respiratorie) non induce l’immunità sterilizzante duratura [62], tali stime di effetto risultano considerevolmente alte. Sono auspicabili futuri studi osservazionali (preferibilmente su un numero maggiore di casi RSV) per quantificare l’efficacia sul campo di RSVpreF3 OA.
L’efficacia di RSVpreF3 OA è stata dimostrata sia in diverse sottofasce di età sia in diversi gruppi di rischio. Questo risultato è importante anche considerando l’incertezza sulle future raccomandazioni nazionali e/o regionali sulla vaccinazione anti-RSV.
Il titolo di anticorpi totali e neutralizzanti in seguito a una singola dose persiste per almeno 13/14 mesi. Infatti, rispetto alla prevaccinazione, i titoli rimangono 2-4 volte superiori. Il dato di immunogenicità risulta in linea con quello di efficacia della singola dose nel prevenire LRTD da RSV durante la seconda stagione: l’efficacia cumulativa della singola dose nelle prime due stagioni era del 67,2 e del 78,8% contro rispettivamente qualsiasi LRTD da RSV e LRTD da RSV severa. La valutazione della risposta immune in seguito alla rivaccinazione indica un effetto booster. I titoli anticorpali in seguito alla 2a dose sono, tuttavia, inferiori rispetto a quelli misurati a un mese dalla 1a dose. Lo studio pivotale non ha dimostrato un benefico clinico della 2a dose in termini di efficacia. Le prove disponibili sulla necessità della rivaccinazione sono quindi insufficienti. È probabile che i risultati della terza (e ultima) stagione dello studio pivotale [49] faranno luce sull’argomento.
Il profilo di sicurezza di RSVpreF3 OA è clinicamente accettabile. Inoltre, il suo profilo di reattogenicità risulta paragonabile a quello di altri vaccini non RSV adiuvati. Infatti, la maggior parte degli AE è transitoria, autorisolutiva, di gravità lieve/moderata. Gli SAE correlati all’utilizzo del vaccino sono particolarmente rari. Tuttavia, essendo il vaccino first-in-class, è indispensabile il continuo monitoraggio post-marketing degli AE, specialmente quelli rari e di particolare interesse (es. sindrome di Guillain-Barré, encefalomielite acuta disseminata).
RSVpreF3 OA può essere co-somministrato con diversi vaccini antinfluenzali attualmente disponibili per gli anziani italiani senza provocare un’interferenza clinicamente significativa sia con l’immunogenicità sia con la frequenza degli AE. Gli studi sulla co-somministrazione di RSVpreF3 OA con il vaccino pneumococcico coniugato 20-valente [63] e con il vaccino ricombinante adiuvato contro l’herpes zoster [64] sono attualmente in corso. È ben noto che dal punto di vista di sanità pubblica, la co-somministrazione è vantaggiosa, in quanto riduce il numero di visite e i costi associati, assicura la vaccinazione tempestiva e riduce le opportunità perse per la vaccinazione [65].
RSVpreF3 OA può attenuare la gravità dei sintomi associati a RSV nelle infezioni breakthrough (i.e., nei soggetti vaccinati) che si traduce in una tendenza alla riduzione dell’impatto dell’infezione da RSV sulla HRQoL. È infatti plausibile che nel caso in cui il vaccino non prevenga l’infezione di per sé, possa diminuire la carica virale. La minor carica virale, a sua volta, spesso è associata a infezioni paucisintomatiche e alla riduzione della gravità dei sintomi e/o delle complicanze.
In sintesi, tenendo conto dell’impatto sociosanitario significativo delle infezioni da RSV nell’anziano e dell’associato unmet need, dei benefici e dei rischi (sia dimostrati che potenziali), la vaccinazione degli adulti italiani di età pari o superiore ai 60 anni con una singola dose di RSVpreF3 OA è raccomandabile. Il rapporto beneficio/rischio risulta infatti positivo per questa popolazione target.
L’infezione da virus respiratorio sinciziale (RSV) è una causa comune di malattia del tratto respiratorio superiore e inferiore in tutto il mondo, con un rischio di malattia grave tra gli anziani che aumenta soprattutto in condizioni di fragilità e di comorbosità. L’importanza di sviluppare vaccini per le popolazioni anziane è data dal fatto che il virus provoca un numero elevato di decessi e ricoveri ogni anno.
Oltre al vaccino Arexvy®, autorizzato dalla European Medicines Agency (EMA) nel maggio 2023 [1], è stato approvato dalla Food and Drug Administration (FDA) nel maggio 2023 e da EMA nell’agosto dello stesso anno anche il vaccino RSVpreF (Abrysvo) [2, 3]. Inoltre, nel maggio 2024 è stato approvato sempre da FDA un terzo vaccino anti-RSV basato sulla tecnologia del RNA messaggero (mRNA) [4].
Altri vaccini hanno visto un arresto nel loro sviluppo come Ad26.RSV.preF (Janssen Vaccines & Prevention B.V.) [5] e MVA-BN RSV (Bavarian Nordic) [6], il primo a causa della scelta da parte della casa produttrice di focalizzarsi sullo sviluppo di altri farmaci e il secondo per non aver soddisfatto i criteri di uno degli endpoint primari nel suo studio di fase III.
Questo capitolo ha l’obiettivo di raccogliere le informazioni riguardanti le caratteristiche di questi vaccini e di sintetizzarne i dati di efficacia e sicurezza, attraverso una revisione sistematica della letteratura a oggi disponibile.
È stata dapprima condotta una revisione narrativa di letteratura, unita alla consultazione di siti istituzionali (FDA, EMA) per raccogliere le informazioni relative alle caratteristiche tecniche e allo stato di avanzamento dello sviluppo dei diversi vaccini contro RSV.
È stata quindi condotta una revisione sistematica della letteratura al fine di identificare gli studi che hanno valutato l’efficacia, la sicurezza e l’immunogenicità degli stessi. Tale revisione è stata svolta in conformità con le linee guida PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analysis) [7].
Al fine di raccogliere dati pertinenti è stata eseguita la ricerca su tre database: PubMed, Cochrane Library e clinicaltrial.gov.
La ricerca di letteratura è stata effettuata il 7 febbraio 2024 per mezzo dell’utilizzo di tre stringhe di ricerca, il più possibile simili tra loro ma adattate a ciascun database (Tab. I).
Stringhe di ricerca utilizzate per la revisione sistematica nei diversi database utilizzati.
| Database | Data della ricerca | Stringa di ricerca |
|---|---|---|
| PubMed | 7 febbraio 2024 | (trial*) AND ((Respiratory Syncytial Virus Vaccin*) OR (RSV Vaccin*) OR (mRNA-1345) OR (MVA-BN-RSV) OR (Ad26.RSV.preF) OR (RSVpreF) OR (MV-012-968)) AND ((safety) OR (toxicity) OR (immunogenicity) OR (antigenicity) OR (effectiveness) OR (efficacy) OR (Reactogenicity) OR (response)) AND ((adult*) OR (elderly) OR (older people) OR (older adult*)) |
| Cochrane Library | 7 febbraio 2024 | (trial*) AND ((Respiratory Syncytial Virus Vaccin*) OR (RSV Vaccin*) OR (mRNA-1345) OR (MVA-BN-RSV) OR (Ad26.RSV.preF) OR (RSVpreF)) AND ((safety) OR (toxicity) OR (immunogenicity) OR (antigenicity) OR (effectiveness) OR (efficacy) OR (Reactogenicity) OR (response)) AND ((adult*) OR (elderly) OR (older people) OR (older adult*)) |
| Clinical Trials | 7 febbraio 2024 | Condition: Respiratory Syncytial Virus |
| Other terms: RSV | ||
| Treatment/Indication: Vaccine | ||
Eligibility Criteria:
|
Sono stati inclusi tutti i trial controllati randomizzati (RCT) che fornissero dati relativi a immunogenicità, sicurezza ed efficacia dei seguenti vaccini contro RSV:
RSVpreF (Pfizer),
mRNA-1345 (Moderna),
e che prendessero in considerazione come popolazione in studio soggetti d’età superiore ai sessant’anni. La scelta di concentrarsi sui due soli vaccini di Pfizer e Moderna è motivata da quanto riportato nel paragrafo dei risultati.
Sono stati quindi esclusi tutti gli studi che consideravano altri vaccini rispetto a quelli sopra citati; gli studi che non fornivano risultati; gli studi non primari; gli studi con una popolazione di riferimento differente da quella riportata nei criteri d’inclusione.
Dopo l’importazione dei record, lo screening degli stessi è stato effettuato mediante l’utilizzo di Rayyan [8], una piattaforma web specializzata che permette a più ricercatori di lavorare simultaneamente a distanza. Per garantire l’affidabilità del processo di selezione, dopo l’esclusione dei duplicati, quattro revisori (CB, EL, CL, MV) hanno esaminato in prima battuta gli articoli basandosi sull’analisi dei titoli e degli abstract. Dopo la prima lettura è seguita una valutazione dei testi completi degli articoli considerati potenzialmente idonei. Tutto il processo è avvenuto in cieco e i conflitti sono stati risolti da un ricercatore senior (CdW).
Gli studi inclusi sono stati inseriti in due tabelle riassuntive, una per ogni vaccino, restituenti diverse variabili, tra cui, per la parte descrittiva, nome del primo autore e anno di pubblicazione, paese di conduzione dello studio, disegno e durata dello studio, popolazione considerata, tipo di vaccino, schedula e modalità di somministrazione, endpoint in studio. Sono stati quindi estratti per ciascun braccio i dati relativi all’immunogenicità, alla sicurezza e all’efficacia.
Per valutare la qualità metodologica degli studi inclusi, è stata utilizzata la seconda versione dello strumento Cochrane risk of bias [9]. Il rischio di bias è stato valutato da quattro ricercatori in maniera indipendente (CB, EL, CL, MV) e i conflitti sono stati risolti da un ricercatore senior (CdW).
Sono stati analizzati per ciascuno studio sei domini: D1, processo di randomizzazione; D2, identificazione e reclutamento dei partecipanti in gruppi; D3, dati mancanti sugli outcome; D4, deviazioni dall’intervento previsto; D5, misurazione dell’outcome.
Il rischio complessivo di bias per ogni studio è stato considerato basso se basso o probabilmente basso in tutti i domini, o alto se alto o probabilmente alto in uno o più domini.
I vaccini analizzati in questo capitolo sono prevalentemente a base di proteina di prefusione F (preF). La glicoproteina F si trova sulla superficie del virus ed è necessaria per l’infezione aiutando lo stesso a penetrare nelle cellule ospiti. La conformazione prefusione è un bersaglio significativo di potenti anticorpi neutralizzanti ed è altamente conservata in entrambi i sottotipi RSV-A e RSV-B. Pertanto, la preF stabilizzata rappresenta un antigene vaccinale chiave. Fa eccezione il vaccino MVA-BN RSV (Bavarian Nordic) che si basa su una combinazione di glicoproteine.
MVA-BN RSV (Bavarian Nordic) e Ad26.RSV.preF (Janssen Vaccines & Prevention B.V.), come giá accennato, hanno visto improvvisamente un arresto del loro sviluppo verso la fine dello scorso anno. Di questi due, solo la Bavarian Nordic ha fornito i dati a sostegno della scelta, adducendo come motivazione il mancato raggiungimento dell’endpoint di efficacia in fase 3. Il rispettivo studio, denominato VANIR, aveva trovato inizio nel 2022 e aveva coinvolto una popolazione di circa 20.000 individui. Il vaccino aveva inoltre ottenuto la Breakthrough Therapy Designation dalla FDA [10], oltre che l’accesso allo schema PRIME dell’EMA nel giugno 2022 [11]. Questo ha fatto in modo che venisse inizialmente preso in considerazione per la ricerca bibliografica. Tuttavia, a fronte dell’ottenimento di un’efficacia del 42,9% soltanto nella prevenzione della malattia delle basse vie respiratorie con almeno tre sintomi, fallendo così l’outcome primario programmato [6], è stato successivamente escluso dalla revisione.
Per quanto riguarda invece Ad26.RSV.preF, la motivazione dietro all’arresto del suo sviluppo non è ben chiara. Anzi, nel suo studio di fase 3, il vaccino aveva ottenuto l’80% di efficacia nella prevenzione della malattia [12], cosa che ha motivato l’inserimento nella stringa di ricerca. La casa produttrice ha addotto motivazioni economiche e non ha aggiunto report più dettagliati [5]. Per lo stop improvviso del suo sviluppo, tale vaccino è stato escluso in un secondo momento.
Di seguito si riportano quindi le caratteristiche (Tab. II) dei prodotti approvati di cui sono stati poi considerati i dati di immunogenicitá, efficacia e sicurezza.
Prospetto di sintesi dei vaccini approvati o in via di approvazione.
| Vaccino | Azienda produttrice | Tipo | Stato regolatorio |
|---|---|---|---|
| RSVpreF | Pfizer | A subunità proteica bivalente non adiuvato composto da due proteine preF | Approvato dalla FDA e da EMA |
| mRNA-1345 | Moderna | Sequenza singola di mRNA codificante per una glicoproteina F di prefusione | Approvato da FDA |
Vaccino a subunità proteica bivalente non adiuvato composto da due proteine preF selezionate per ottimizzare la protezione contro i ceppi RSV-A e RSV-B; è stato approvato dalla FDA nel mese di maggio 2023 [3] e da EMA nell’agosto 2023 [2]: la decisione è stata basata sui dati dello studio clinico registrativo di fase 3 RENOIR [13, 14].
Questo vaccino è costituito da una singola sequenza di mRNA codificante per una glicoproteina F, stabilizzata, di prefusione. Il vaccino utilizza le stesse nanoparticelle lipidiche (LNP) dei vaccini Moderna per COVID-19.
A maggio 2024 il vaccino ha ricevuto l’approvazione da parte di FDA [4] sulla base dei risultati del trial di fase 3 ConquerRSV pubblicati a dicembre 2023 sul The New England Journal of Medicine [15].
La revisione sistematica di letteratura ha restituito un totale di 664 lavori (312 studi da PubMed, 246 da Cochrane e 106 da ClinicalTrials.gov) di cui 124 duplicati, che sono stati esclusi automaticamente. Sono stati, quindi, valutati 540 studi in totale. Alla fine del processo di selezione, sono stati inclusi 6 studi:
Il procedimento di dettaglio viene illustrato nella flowchart riportata in Figura 1, mentre i dati riferiti agli studi inclusi sono riportati in Tabella III.
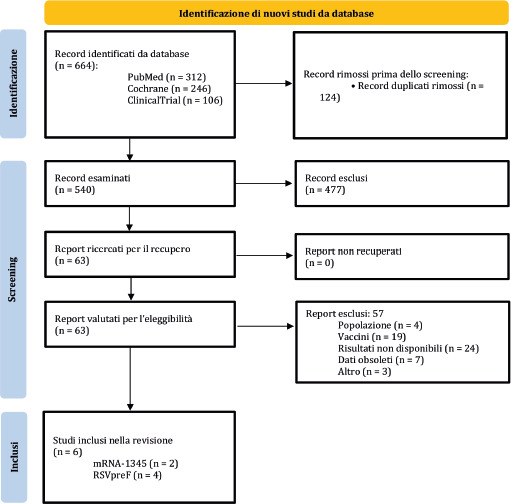
Flowchart del processo di selezione e inclusione degli studi.
Caratteristiche degli studi inclusi.
| Vaccino | Primo autore e anno | Paese | Tipo di studio | Durata dello studio | Popolazione in studio | Intervento |
|---|---|---|---|---|---|---|
| mRNA-1345 | Chen GL 2022 [16] | 31 centri USA | Fase 1 Randomizzato Singolo cieco Controllato con placebo |
Dal 30/09/2020 al 29/06/2024 | 202 soggetti sani di 65-79 aa | Mono-somministrazione IM [G1: 50μg; G2: 100μg; G3: 200μg] |
| mRNA-1345 | Wilson E 2023 [15] | 22 nazioni | Fase 2-3 Randomizzato Doppio cieco Controllato con placebo | Dal 17/11/2021 al 25/08/2025 | 35541 soggetti ≥ 60aa di cui 63,5% di 60–69aa, 30,9% di 70–79aa e 5,6% ≥80aa, 93,1% sani, 6,9% con CHF o COPD | Mono-somministrazione IM [50μg] |
| RSVpreF | Walsh EE 2023 [13] | 240 centri tra Argentina. Canada. Finlandia. Giappone. Paesi Bassi. Sud Africa. USA | Fase 3 Randomizzato Doppio cieco Controllato con placebo Multicentrico |
Dal 31/08/2021 al 30/07/2025 | 34284 soggetti ≥ 60 aa di cui 62,5% di 60–69aa, 31,8% di 70–79aa e 5,6% ≥80aa ≥1 Fattore di rischio 51,6% ≥1 malattia cardiopolmonare cronica 15,3% Sani 48,4% |
Mono-somministrazione IM [120μg] |
| RSVpreF | Pfizer 2022 [19] | 36 centri USA | Fase 1/2 Randomizzato Singolo cieco Controllato con placebo Dose-finding | Dal 18/04/2018 al 29/12/2020 | 532 soggetti sani di 65-85 aa |
I dose IM 1gg / II dose IM 35gg G1: RSV 60 μg + SIIV / Placebo G2: RSV 60 μg + Placebo / SIIV G3: RSV 60 μg + Al[OH]₃ / SIIV / Placebo G4: RSV 60 μg + Al[OH]₃ / Placebo / SIIV G5: RSV 120 μg + SIIV / Placebo G6: RSV 120 μg + Placebo / SIIV G7: RSV 120 μg + Al[OH]₃ / SIIV / Placebo G8: RSV 120 μg + Al[OH]₃ / Placebo / SIIV G9: RSV 240 μg + SIIV / Placebo G10: RSV 240 μg + Placebo / SIIV G11: RSV 240 μg + Al[OH]₃ / SIIV / Placebo G12: RSV 240 μg + Al[OH]₃ / Placebo / SIIV G13: Placebo / Placebo / SIIV |
| RSVpreF | Baber J 2022 [17] | 12 centri Australia | Fase 1/2 Randomizzato Controllato con placebo In cieco per l’osservatore Dose-finding |
Da 05/06/2018 a 19/08/2020 |
317 soggetti sani di 65-85 aa |
Coorte primaria Singola IM 60 μg Al(OH)3 oppure CpG/Al(OH)3 +SIIV 120 μg Al(OH)3 oppure CpG/Al(OH)3 + SIIV 240 μg Al(OH)3 oppure CpG/Al(OH)3 + SIIV oppure senza adiuvante Coorte 0,2 mesi Doppia IM 240 μg CpG/Al(OH)3 |
| RSVpreF | Athan E 2023 [18] | 31 centri Australia | Fase 3 Randomizzato Doppio cieco Controllato con placebo | Dal 13/04/2022 al 12/10/2022 | 1399 soggetti sani ≥ 65 aa | Mono-somministrazione IM [120 μg] G1: RSVpreF-SIIV (1gg); placebo (28.35 gg) G2: SIIV-placebo (1gg); RSVpreF (28-35 gg) |
| IM: intramuscolare; CHF: chronic heart failure; COPD: chronic obstructive pulmonary disease; SIIV: seasonal influence inactivated vaccine. | ||||||
La valutazione della qualità è riportata nel dettaglio in Figura 2. In generale, gli studi valutati hanno tutti riportato un basso rischio di bias. Solamente uno studio [16] ha sollevato qualche preoccupazione nei domini di reclutamento dei partecipanti in gruppi e nel processo di randomizzazione, ottenendo quindi complessivamente un medio rischio di bias. Questo potrebbe essere stato determinato più che da problemi strutturali, dalla forma dello studio, ovvero un abstract, provvisto di risultati ma scarno nella descrizione del metodo.
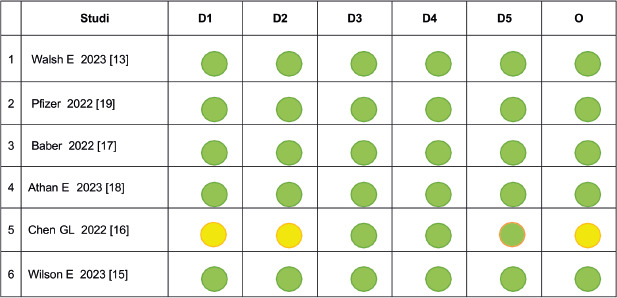
Valutazione della qualità degli studi considerati.
RSVpreF, con nome commerciale Abrysvo, è un vaccino approvato dalla FDA e da EMA per la prevenzione della malattia delle basse vie respiratorie correlata a RSV nella popolazione anziana (≥ 60 anni d’età) e per la protezione passiva nei confronti della stessa nei neonati dalla nascita fino ai 6 mesi di età a seguito dell’immunizzazione della madre durante la gravidanza.
I quattro trial risultati dalla nostra revisione sistematica sono stati condotti tra il 2021 e il 2023 e hanno valutato l’efficacia, la sicurezza e l’immunogenicità del vaccino nella popolazione di riferimento.
Due dei quattro studi, di fase 1 e fase 2 [17, 19], hanno previsto come popolazione 313 e 532 individui rispettivamente, suddivisi per entrambi i trial in una decina di coorti di numero omogeneo, con l’obiettivo di valutare: gli effetti di diverse concentrazioni vaccinali; l’utilità di inserire possibili adiuvanti come idrossido di alluminio (Al(OH)3) e CpG, un agonista del recettore toll-like 9; la co-somministrazione con il vaccino antinfluenzale; l’eventuale efficacia di una dose booster.
I risultati di questi trial di fase 1 e 2 hanno evidenziato che tutte le dosi somministrate si sono dimostrate immunogene. Le medie geometriche dei titoli anticorpali neutralizzanti RSV-A e RSV-B sono aumentate a un mese dalla vaccinazione. La presenza o assenza di Al(OH)3 o CpG non ha dato particolari differenze nella risposta neutralizzante (misurata al mese 1) delle varie formulazioni vaccinali. I dati sono presentati in Tabella IV. Non è stato evidenziato alcun effetto booster dato dalla seconda dose somministrata al mese due, con un aumento della media geometrica di 0,9 per la risposta contro RSV-A e RSV-B dopo un mese dalla seconda somministrazione.
Sintesi dei risultati sull’endpoint dell’immunogenicità.
| Vaccino | Primo autore e anno | Endpoint | Immunogenicità |
|---|---|---|---|
| mRNA-1345 | Chen GL 2022 [16] | Ab neutralizzanti RSV A, RSV B e PreF |
GMFR (1 mese) RSV A: 12,1-16,6 RSV B: 8,7-12,6 PreF: 8,4-12,1 GMFR (6 mesi) RSV A: 4,1-5,8 RSV B: 4,5-5,5 PreF: 4,1-4,7 |
| RSVpreF | Pfizer 2022 [19] | Ab neutralizzanti RSV A e RSV B |
GMT RSV A prima → dopo 1 mese G1: 2129 (1577,8-2872,8) → 16007 (12504,7-20489,7) G2: 2096 (1518,6-2892,0) → 20417 (14920.,6-27937,5) G3: 2064 (1638,5-2598,9) → 14905 (11631,7-19098,2) G4: 2461 (1856,2-3262,5) → 19625 (14184,9-27151,3) G5: 2269 (1708,5-3013,4) → 25065 (19629,1-32006,7) G6: 2269 (1802,6-2855,8) → 22318 (15850,6-31425,6) G7: 2578 (1945,6-3416,6) → 23566 (17457,3-31812,3) G8: 2089 (1535,1-2843,5) → 27600 (21382,5-35624,6) G9: 2203 (1731,5-2802,0) → 22184 (16026,2-30708,8) G10: 1965 (1539,1-2508,5) → 21601 (16659,4-28007,6) G11: 1793 (1351,8-2378,8) → 23510 (17822,0-31013,3) G12: 2734 (1963,5-3807,4) → 25815 (19944,3-33412,8) G13: 1585 (1252,3-2005,5) → 1697 (1250,6-2301,8) RSV B prima → dopo 1 mese G1: 2198 (1573,7-3070,9) → 15172 (10995,0-20936,5) G2: 1862 (1340,9-2586,5) → 20553 (14241,6-29660,2) G3: 1999 (1506,1-2653,9) → 15169 (11469,2-20063,1) G4: 2423 (1840,0-3191,1) → 20421 (13852,5-30105,7) G5: 2314 (1659,8-3225,1) → 24257 (17639,8-33356,3) G6: 2194 (1724,9-2790,8) → 18648 (12034,5-28896,9) G7: 2685 (1949,1-3698,5) → 24158 (16688,4-34969,9) G8: 2032 (1414,4-2920,4) → 30071 (21347,9-42359,2) G9: 2586 (1999,1-3344,0) → 27996 (19063,0-41115,9) G10: 2241 (1689,0-2972,7) → 25080 (17447,2-36052,5) G11: 1635 (1155,3-2313,4) → 24320 (17529,7-33741,2) |
| RSVpreF | Baber J 2022 [17] | Ab neutralizzanti RSV A e RSV B |
Coorte primaria GMFR (1 mese) - RSV A: 4,8-11,6 - RSV B: 4,5-14,1 GMFR (12 mesi) - RSV A: 2,1-3,5 - RSV B: 2,2 a 4,3 Coorte 0,2 mesi GMFR (1 mese) - RSV A: 10,2 - RSV B: 12,3 GMFR (6 mesi) - RSV A: 4,3 - RSV B: 6,4 |
| RSVpreF | Athan E 2023 [18] | Ab neutralizzanti RSV A e B |
GMR (cosomministrazione/somministrazione sequenziale) RSV A: 0,86 RSV B: 0,85 GMFR (RSVpreF + SIIV)/Placebo vs (Placebo + SIIV)/RSVpreF (1 mese) RSV A: 10 vs 11,4 RSV B: 10,1 vs 12 |
| GMT: geometric mean titer; GMR: geometric mean ratio; GMFR: geometric mean fold rise. | |||
Per quanto riguarda la sicurezza vaccinale, la maggior parte degli eventi avversi è stata lieve e più frequente nel braccio sperimentale. Tra gli eventi avversi locali, il più comunemente riportato è stato il dolore al sito di iniezione per il braccio sperimentale, d’entità lieve e transitoria (mediana di 1-6 giorni). I pochi eventi avversi più importanti hanno riguardato le formulazioni a concentrazione vaccinale più alta (240 μg) con o senza la presenza di adiuvanti.
Per quanto concerne gli eventi avversi sistemici, la maggior parte è stata di entità lieve o moderata, senza particolari differenze tra le varie formulazioni. La spossatezza è stata l’evento sistemico più comunemente riportato. Tutto ciò si può leggere in dettaglio nella Tabella V, dedicata all’analisi della sicurezza.
Sintesi dei risultati sull’endpoint della sicurezza e tollerabilità.
| Vaccino | Primo autore e anno | Endpoint | Sicurezza (%) | Sicurezza (%) |
|---|---|---|---|---|
| (braccio sperimentale) | (braccio di controllo) | |||
| mRNA-1345 | Chen GL 2022 [16] | EA locali (7 gg)* EA sistemici (7 gg) |
EA locali (7 gg) dolore sito iniezione: 61,7-78,7% eritema: 0-4,3% gonfiore: 2,1-4,3% ≥ 1 EA sistemici (7 gg): 53,2-78,7% |
EA locali (7 gg) dolore sito iniezione: 12,7% eritema: 0% gonfiore: 0% ≥ 1 EA sistemici (7 gg): 45,5% |
| mRNA-1345 | Wilson E 2023 [15] | EA locali (7gg) EA sistemici (7 gg) SAE (28 gg) |
EA locali (7gg): 58,7% EA sistemici (7 gg): 47,7% SAE (28 gg): 2,8% |
EA locali (7gg): 16,2% EA sistemici (7 gg): 32,9% SAE (28 gg): 2,8% |
| RSVpreF | Walsh EE 2023 [13] | EA locali (7 gg) EA sistemici (7 gg) Qualsiasi EA (30 gg) SAE (fino al 14/07/2022) |
EA locali (7gg): 12% EA sistemici (7 gg): 27% Qualsiasi EA (30 gg): 9% SAE: 2,3% |
EA locali (7gg): 7% EA sistemici (7 gg): 26% Qualsiasi EA (30 gg): 8,5% SAE: 2,3% |
| RSVpreF | Pfizer 2022 [19] | EA locali (14 gg)* EA sistemici (14 gg)* EA (1 mese) MAE (12 mesi) SAE (12 mesi) EA (1 mese dopo II dose) |
EA (1 mese): 5,0-26,2% in base al gruppo MAE (12 mesi): 15-47,5% in base al gruppo SAE (12 mesi): 5-19% in base al gruppo EA (1 mese) dopo II dose: 7,3-32,5% in base al gruppo |
EA (1 mese): 12,2% MAE (12 mesi): 14,6% SAE (12 mesi): 7,3% EA (1 mese) dopo II dose: 17,1% |
| RSVpreF | Baber J 2022 [17] | EA locali (14 gg)* EA sistemici (14 gg)* Qualsiasi EA (1 mese) SAE (12 mesi coorte primaria; 6 mesi coorte 0,2) MAE (12 mesi coorte primaria; 6 mesi coorte 0,2) |
Coorte primaria Qualsiasi EA (1 mese): 59,4-68,8% in base al gruppo SAE (12 mesi): 6,3-16,1% in base al gruppo MAE (12 mesi): 46,9-60% in base al gruppo Coorte 0,2 mesi Qualsiasi EA (1 mese): 65,6% SAE (6 mesi dalla seconda dose): 18,8% MAE (6 mesi dalla seconda dose): 53,1% |
Coorte primaria Qualsiasi EA (1 mese): 60,0% SAE (12 mesi): 10% MAE (12 mesi): 50% Coorte 0,2 mesi Qualsiasi EA (1 mese): 64,5% SAE (6 mesi dalla seconda dose): 16,1% MAE (6 mesi dalla seconda dose): 38,7% |
| RSVpreF | Athan E 2023 [18] | EA locali (7 gg) EA sistemici (7 gg) SAE (1 mese) |
Gruppo cosomministrazione EA locali (7 gg) - RSVpreF + SIIV: 14% - placebo: 7,6% EA sistemici (7 gg) - RSVpre-SIIV: 44,7% - placebo: 31,6% SAE (1 mese) - RSVpreF + SIIV: 1,1% -placebo: 0,3% |
Gruppo somministrazione sequenziale EA locali (7 gg) - SSIV-placebo: 9,1% - RSVpreF da solo: 13,7% EA sistemici (7 gg) - SSIV-placebo: 41,4% - RSVpreF da solo: 34,4% SAE (1 mese) - SIIV+ placebo: 0,9% -RSVpreF da solo: 0,7% |
| * Il dato non è stato riportato in quanto stratificato per tipo di evento. EA: adverse events; SAE: serious adverse events; MAE: medical adverse event. | ||||
Sulla base dei due trial di fase 1 e 2, la dose vaccinale utilizzata nel trial di fase 3, denominato RENOIR [13], è stata di 120 μg (60 μg di antigene RSV-A e 60 μg di antigene RSV-B).
Lo studio RENOIR [13] ha avuto come popolazione in studio 34.284 individui di età ≥ 60 anni, suddivisi in un braccio sperimentale con 17.215 soggetti e uno di controllo con 17.069. In entrambi i gruppi l’età media è stata di 68,3 anni e lo studio ha previsto una singola somministrazione al tempo 0.
Per quanto concerne l’efficacia vaccinale, gli endpoint sono stati suddivisi in malattia respiratoria acuta correlata a RSV; malattia correlata a RSV del basso tratto respiratorio con due o più sintomi; malattia grave correlata a RSV del basso tratto respiratorio, con tre o più sintomi. Di seguito si riportano i risultati, consultabili integralmente in Tabella VI.
Sintesi dei risultati sull’endpoint dell’efficacia.
| Vaccino | Primo autore e anno | Endpoint | Eventi (braccio sperimentale) | Eventi (braccio di controllo) | Efficacia % (CI) |
|---|---|---|---|---|---|
| mRNA-1345 | Wilson E 2023 [15] |
Efficacia (a partire da 14 gg dalla vaccinazione) 1) primo episodio malattia delle vie aeree inferiori correlata a RSV con - 2 o più sintomi - 3 o più sintomi 2) malattia respiratoria acuta con ≥ 1 sintomo respiratorio correlata a RSV 3) primo episodio di malattia delle vie aeree inferiori in base al sottotipo (A o B) |
1) 2 o più sintomi: 9 su 17.572 60-69 aa 8 su 11.168 70-79 aa 1 su 5.440 ≥ 80 aa 0 su 964 Sani 8 su 16.365 CHF o COPD 1 su 1.207 3 o più sintomi: 3 su 17.572 60-69 aa 3 su 11.168 70-79 aa 0 su 5.440 ≥ 80 aa 0 su 964 Sani 2 su 16.365 CHF o COPD 1 su 1.207 2) 26 su 17.572 60-69 aa 20 su 11.168 70-79 aa 6 su 5.440 ≥ 80 aa 0 su 964 Sani 25 su 16.365 CHF o COPD 1 su 1.207 3) RSV A 2 o più sintomi: 3 su 17.572 3 o più sintomi: 1 su 17.572 RSV B 2 o più sintomi: 6 su 17.572 3 o più sintomi: 2 su 17.572 |
1) 2 o più sintomi: 55 su 17.516 60-69 aa 33 su 11.118 70-79 aa 22 su 5.416 ≥ 80 aa 0 su 982 Sani 53 su 16.299 CHF o COPD 2 su 1.217 3 o più sintomi: 17 su 17.516 60-69 aa 11 su 11.118 70 79 aa 6 su 5.416 ≥ 80 aa 0 su 982 Sani 17 su 16.299 CHF o COPD 0 su 1.217 2) 82 su 17.516 60-69 aa 44 su 11.118 70-79 aa 37 su 5.416 ≥ 80 aa 1 su 982 Sani 79 su 16.299 CHF o COPD 3 su 1.217 3) RSV A 2 o più sintomi: 36 su 17.516 3 o più sintomi: 10 su 17.516 RSV B 2 o più sintomi: 19 su 17.516 3 o più sintomi: 7 su 17.516 |
1) 2 o più sintomi: 83,7 (66-92,2) 60-69 aa 76,0 (48,0-88,9) 70-79 aa 95,4 (65,9-99,4) ≥ 80 aa NE (NE-NE) Sani 85,0 (68,4-92,9) CHF o COPD 49,4 (-457,9-95,4) 3 o più sintomi: 82,4 (34,8-95,3) 60-69 aa 72,9 (2,8-92,4) 70-79 aa 100 (NE-100) ≥ 80 aa NE (NE-NE) Sani 88,3 (49,4-97,3) CHF o COPD NE (NE-NE) 2) 68,4 (50,9-79,7) 60-69 aa 54,9 (23,5-73,4) 70-79 aa 83,6 (61,1-93,1) ≥ 80 aa 100,0 (NE-100,0) Sani 68,5 (50,6-79,9) CHF o COPD 66,1 (-225,7-96,5) 3) RSV A 2 o più sintomi: 91,7% (73,0-97,4) 3 o più sintomi: 90,0% (22,0-98,7) RSV B 2 o più sintomi: 68,5% (21,1-87,4) 3 o più sintomi: 71,5% (-37,0-94,1) |
| RSVpreF | Walsh EE 2023 [14] |
Efficacia (a partire da 15 gg dalla vaccinazione) 1) malattia del basso tratto respiratorio correlata a RSV con 2+ sintomi 2) malattia del basso tratto respiratorio correlata a RSV con 3+ sintomi 3) primo episodio di malattia respiratoria acuta correlata a RSV |
n = 16.306 1) 11 (0,07%) 60-69 aa 8 70-79 aa 2 ≥ 80 aa 1 ≥ 1 Fattore di rischio 5 ≥1 CPD 6 Sani 4 2) 2 (0,01%) 60-69 aa 2 70-79 aa 0 ≥ 80 aa 0 ≥ 1 Fattore di rischio 0 ≥ 1 CPD 2 Sani 2 3) 22 (0,13%) 60-69 aa 14 70-79 aa 5 ≥ 80 aa 3 ≥ 1 Fattore di rischio 12 ≥ 1 CPD 10 Sani 4 |
n = 16.308 1) 33 (0,20%) 60-69 aa 19 70-79 aa 9 ≥ 80 aa 5 ≥ 1 Fattore di rischio 17 ≥ 1 CPD 16 Sani 6 2) 14 (0,09%) 60-69 aa 9 70-79 aa 2 ≥ 80 aa 3 ≥1 Fattore di rischio 6 ≥1 CPD 8 Sani 4 3) 58 (0,36%) 60-69 aa 37 70-79 aa 14 ≥ 80 aa 7 ≥ 1 Fattore di rischio 31 ≥ 1 CPD 27 Sani 8 |
1) 66,7 (28,8-85,8) 60-69 aa 57,9 (7,4-85,3) 70-79 aa 77,8 (18,7-98,1) ≥ 80 aa 80,0 (104,3-99,7) ≥ 1 Fattore di rischio 70,6 (10,7-92,4) ≥1 CPD 62,5 (8,4-89,1) Sani 33,3 (213,7-87,9) 2) 85,7 (32,0-98,7) 60-69 aa 77,8 (18,7-98,1) 70-79 aa 100,0 (573,8-100,0) ≥ 80 aa 100.0 (191,2-100,0) ≥ 1 Fattore di rischio 100,0 (2,2-100,0) ≥ 1 CPD 75,0 (39,1-97,9) Sani 50,0 (302,1-96,4) 3) 62,1% (95% IC 37,1-77,9) 60-69 aa 62,2 (28,3-81,1) 70-79 aa 64,3 (4,9-89,9) ≥ 80 aa 57,1 (87,7-92,8) ≥ 1 Fattore di rischio 61,3 (22,5-81,9) ≥ 1 CPD 63,0 (21,0-84,0) Sani 50,0 (86,6-89,0) |
| CHF: congestive heart failure; COPD: chronic obstructive pulmonary disease; CPD: cardiopulmonary disease; NE: no existence. | |||||
L’efficacia vaccinale nella prevenzione della malattia respiratoria acuta associata a RSV è stata del 62,1% (IC 95%, 37,1-77,9) con 22 casi nel braccio vaccinato con RSVpreF e 58 nel braccio placebo.
L’efficacia vaccinale si è assestata a un 66,7% (IC 96,66%, 28,8-85,8) per la malattia correlata a RSV del basso tratto respiratorio con due o più sintomi, con la comparsa della patologia in 11 partecipanti nel braccio sperimentale contro 33 del braccio di controllo.
Per la malattia grave correlata a RSV del basso tratto respiratorio, con tre o più sintomi, l’efficacia vaccinale è stata dell’85,7% (IC 96,66%, 32,0-98,7), con due casi nel gruppo sottoposto a vaccino e 14 nel gruppo placebo.
Nello studio è stata svolta anche un’interessante stratificazione della popolazione in base alle fasce d’età e ai fattori di rischio dei partecipanti. In dettaglio, i gruppi individuati rispetto all’età sono stati tre: 60-69 anni, 70-79 anni, ≥ 80 anni. Per la categoria dei fattori di rischio, invece, è stata presa in considerazione la presenza o no di più fattori di rischio (identificati come attuale uso di tabacco; diabete; malattia polmonare, includendo sia la BPCO che altre patologie polmonari; malattia cardiaca, includendo l’insufficienza cardiaca cronica e altre patologie cardiache; malattie epatiche; malattie renali) e la presenza di malattia cardiopolmonare cronica (identificata come asma; BPCO; insufficienza cardiaca cronica).
Per quanto riguarda la prevenzione della malattia respiratoria acuta associata da RSV, dei 22 casi registrati nel braccio sperimentale, 14 si collocano nella fascia dei 60-69 anni, cinque in quella tra i 70-79 anni e tre casi per gli ultraottantenni con un’efficacia rispettivamente del 62,2% (IC 96,66%, 28,3-81,1), 64,3% (IC 96,66%, 4,9-89,9) e 57,1% (IC 96,66%, 87,7-92,8); 12 casi su 22 hanno colpito individui con fattori di rischio per un’efficacia vaccinale del 61,3%, mentre 10 hanno coinvolto individui con malattia cardiopolmonare con un 63% complessivo d’efficacia.
Rispetto alla malattia del basso tratto respiratorio correlata a RSV con due o più sintomi, degli 11 casi rilevati nel braccio sperimentale, 8 si sono verificati nella fascia dei 60-69 anni, due in quella tra i 70-79 anni e solo un caso negli ultraottantenni con un dato di efficacia del 57,9% (IC 96,66%, 7,4-85,3), 77,8% (IC 96,66%, 18,7-98,1) e 80,0% (IC 96,66%, 10,43-99,7); degli 11 casi totali, cinque hanno riguardato individui con fattori di rischio, per un’efficacia del 70,6%, mentre 6 hanno coinvolto individui con malattia cardiopolmonare con un 62,5% di efficacia (IC 96,66%, 8,4-89,1). Per la prevenzione della alla malattia del basso tratto respiratorio correlata a RSV con tre o più sintomi, i due casi complessivamente registrati nel braccio di intervento hanno riguardato soggetti nella fascia dei 60-69 anni con un 77,8% (IC 96,66%, 18,7-98,1) d’efficacia vaccinale, mentre non si è registrato alcun caso nelle fasce di età maggiore; i due casi hanno visto protagonisti due pazienti affetti da malattia cardiopolmonare cronica per un’efficacia vaccinale del 75% (IC 96,66%, 39,1-97,9), mentre non sono stati registrati casi tra pazienti con più di un fattore di rischio.
Per quanto riguarda infine la sicurezza (Tab. V), l’incidenza degli eventi avversi locali è stata più alta nel braccio sperimentale (12%) rispetto al placebo (7%); la durata mediana degli eventi è stata compresa tra uno e due giorni, con il dolore al sito di iniezione come evento avverso più comunemente riportato dai pazienti. L’incidenza degli eventi avversi sistemici è stata simile in entrambi i bracci (rispettivamente 27 e 26%), con percentuali simili nei due gruppi anche a un mese dal tempo 0 (1,4 e 1,0% di eventi considerati correlati all’iniezione rispettivamente nel braccio interventistico e di controllo).
Eventi avversi gravi o pericolosi per la vita sono stati segnalati nello 0,5% dei riceventi il vaccino e nello 0,4% di coloro che hanno ricevuto il placebo. Alla data di analisi dei dati (luglio 2022), il 2,3% dei soggetti del braccio sperimentale e il 2,3% di quelli del braccio di controllo ha segnalato eventi avversi gravi e tre di questi casi sono stati considerati correlati alla somministrazione avvenuta.
Nel 2023, inoltre, è stato pubblicato un ulteriore articolo [18], che ha avuto l’obiettivo di valutare la sicurezza e l’immunogenicità di RSVpreF quando somministrato in combinazione con il vaccino antinfluenzale quadrivalente adiuvato (Seasonal Influence Inactivated Vaccine - SIIV), denominato FluQuad, negli adulti di età ≥ 65 anni di età.
Lo studio è stato disegnato in due tempi e di 1.403 partecipanti randomizzati, 1.399 hanno ricevuto la prima dose: 702 nel gruppo di co-somministrazione (RSVpreF + SIIV) e 699 nel gruppo di somministrazione sequenziale (SIIV + placebo). Al tempo due (28-35 giorni dopo), i partecipanti erano rispettivamente 688 e 693: il gruppo sperimentale ha a questo punto ricevuto il placebo, mentre chi aveva ricevuto al tempo 1 SIIV + placebo ha ricevuto il vaccino RSVpreF. Non è stato rilevato alcun evento avverso grave riconducibile alla vaccinazione, e, complessivamente, gli eventi avversi registrati, sia locali che sistemici, sono stati tutti lievi o moderati (Tab. V). I rapporti delle medie geometriche (GMFR) sono risultati 0,86 per i titoli neutralizzanti di RSV-A e 0,85 per i titoli neutralizzanti di RSV-B a un mese dopo la somministrazione di RSVpreF e da 0,77 a 0,90 per quanto concerne l’inibizione dell’emoagglutinazione ceppo-specifica un mese dopo l’amministrazione del SIIV (Tab. IV).
I risultati hanno quindi evidenziato un profilo accettabile di sicurezza e tollerabilità di RSVpreF quando somministrato congiuntamente al vaccino antinfluenzale e una non inferiorità della risposta immunitaria rispetto a quando somministrato singolarmente.
In conclusione, il vaccino RSVpreF ha prevenuto la malattia del tratto respiratorio inferiore associata all’RSV e la malattia respiratoria acuta associata all’RSV negli adulti (≥ 60 anni di età) senza particolari problemi di sicurezza.
Dei due studi inclusi nella nostra revisione [15, 16], un trial di fase 1 [16] condotto in modo randomizzato e in singolo cieco, controllato con placebo, ha valutato la sicurezza e l’immunogenicità del vaccino mRNA-1345 in diverse concentrazioni (50, 100 o 200 μg), in un campione di 202 anziani (con età compresa tra 65 e 79 anni) presso 31 centri negli Stati Uniti.
Nel complesso, il vaccino è stato ben tollerato e l’evento avverso locale più comune è stato il dolore nel sito di iniezione, che è stato riscontrato nel 61,7-78,7% dei partecipanti vaccinati con mRNA-1345, rispetto al 12,7% del gruppo placebo. L’insorgenza di eritema e gonfiore è stata meno frequente, rispettivamente nello 0-4,3% e nel 2,1-4,3%, dei soggetti vaccinati con mRNA-1345, mentre non è stata riscontrata nel gruppo placebo. Il 53,2-78,7% dei partecipanti nei gruppi vaccinati con mRNA-1345 ha riportato almeno un evento avverso sistemico, rispetto al 45,5% del gruppo placebo, più comunemente rappresentato da mal di testa, affaticamento, mialgia e artralgia (Tab. V).
Per quanto riguarda l’immunogenicità, mRNA-1345 ha dimostrato di aumentare significativamente i livelli di anticorpi entro il primo mese dalla vaccinazione. Il rapporto geometrico medio (GMFR) a un mese per gli anticorpi neutralizzanti RSV-A si è collocato tra 12,1 e 16,6, mentre per gli anticorpi neutralizzanti RSV-B è stato compreso tra 8,7 e 12,6. Il GMFR a un mese per gli anticorpi leganti PreF si è assestato tra 8,4 e 12,1.
Si è verificato un calo nel livello di anticorpi entro il sesto mese dall’iniezione. Tuttavia, nonostante la diminuzione, il livello si è sempre mantenuto a uno standard di almeno 4,1 volte superiore rispetto ai valori iniziali (GMFR per gli anticorpi neutralizzanti RSV-A e RSV-B di 4,1-5,8, e 4,5-5,5 rispettivamente; GMFR per gli anticorpi leganti a PreF di 4,1-4,7) (Tab. IV). Il trial non ha valutato l’endpoint di efficacia.
Il secondo studio [15] ha valutato la sicurezza e l’efficacia vaccinale della somministrazione di una singola dose nella prevenzione di un primo episodio di malattia del tratto respiratorio inferiore associata a RSV rispetto al placebo, da 14 giorni dopo l’iniezione fino a 12 mesi nella popolazione anziana (≥ 60 anni d’età).
Lo studio è stato condotto in doppio cieco, randomizzato e suddiviso in due fasi: fase 2 e fase 3. Nella prima sono stati randomizzati fino a 2.000 partecipanti in un rapporto 1:1 tra braccio sperimentale e placebo. Nella seconda, la popolazione è stata estesa a 35.541 partecipanti di 22 paesi diversi.
Lo studio ha raggiunto entrambi i suoi endpoint primari di efficacia, con un’efficacia vaccinale dell’83,7% (IC 95,88%, 66,1-92,2) contro la malattia del basso tratto respiratorio da RSV (con due o più sintomi) e un’efficacia vaccinale dell’82,4% (IC 96,36%, 34,8-95,3) contro la malattia grave, caratterizzata da tre o più sintomi (Tab. VI). Sono stati, infatti, rilevati rispettivamente 9 casi su 17.572 per il braccio sperimentale contro 55 su 17.516 per braccio di controllo per quanto riguarda la malattia con due o più sintomi; mentre ne sono stati evidenziati tre per il braccio sperimentale contro 17 per il controllo per quanto concerne la malattia con tre e più sintomi.
Come per lo studio di fase 3 di Pfizer, anche in questo trial è stata stratificata la popolazione in base alle fasce d’età e patologie concomitanti dei pazienti. Anche qui i gruppi per età individuati sono stati tre: 60-69 anni, 70-79 anni, ≥ 80 anni. Per la categoria delle comorbosità, invece, è stata presa in considerazione la presenza o no di più fattori di rischio per la malattia respiratoria (identificati come scompenso cardiaco congestizio, malattia ostruttiva polmonare cronica o entrambe).
Per la prevenzione della malattia con due o più sintomi, i casi si sono distribuiti in maniera differente secondo le fasce d’età come mostrato in Tabella VI con un’efficacia vaccinale del 76% (IC 95,88% 48,0-88,9) tra 60 e 69 anni, del 95,4% (IC 95,88% 65,9-99,4) tra i 70-79 anni e non valutabile per gli ultraottantenni.
Un caso dei 9 registrati nel braccio di intervento ha interessato individui con comorbosità, contro due nel braccio di controllo, testimoniando un’efficacia vaccinale nella prevenzione della malattia con due o più sintomi del 49,4% (IC 95,88% -457,9-95,4) per pazienti fragili.
Per la prevenzione della malattia con tre o più sintomi, dei tre casi rilevati nel braccio di intervento, tutti si sono verificati nella fascia 60-69 anni con un 72,9% (IC 96,36% 2,8-92,4) d’efficacia vaccinale; inoltre, un caso ha riguardato un paziente con comorbosità, mentre nel braccio di controllo nessuno con comorbosità è risultato affetto.
Infine, lo studio ha anche considerato tra gli endpoint di efficacia la comparsa del primo episodio di malattia delle vie aeree inferiori in base al sottotipo di RSV (A o B). Il vaccino si è dimostrato efficace per un 91,7% (IC 95,88% 73,0-97,4) per la prevenzione della malattia da RSV A e per un 68,5% (IC 95,88% 21,1-87,4) per la prevenzione della malattia da RSV B.
Il vaccino è stato ben tollerato con un buon profilo di sicurezza. La maggior parte degli eventi avversi sollecitati sono stati lievi o moderati e sono scomparsi entro uno o due giorni dalla somministrazione. Quelli più comunemente riportati sono stati: dolore al sito di iniezione (56% nel braccio sperimentale contro 13,7% nel braccio di controllo), affaticamento, mal di testa, mialgia e artralgia. Gli eventi avversi sistemici sollecitati sono stati evidenziati nel 47,7% dei pazienti del braccio sperimentale contro il 32,9% del braccio placebo.
L’incidenza degli eventi avversi sollecitati è diminuita in base all’età ed è stata più alta nelle donne rispetto che negli uomini e nelle etnie caucasiche e asiatiche rispetto ad altre etnie.
Per quanto riguarda gli eventi avversi non sollecitati, questi sono stati valutati fino a 28 giorni dopo l’iniezione e hanno riguardato un 20,4% dei partecipanti al braccio sperimentale e un 18,5% di quelli del braccio di controllo.
In conclusione, il vaccino mRNA-1345 si è dimostrato efficace nella prevenzione della malattia respiratoria da RSV e non ha presentato problemi di sicurezza.
Questa revisione si è occupata di valutare i vaccini approvati per la prevenzione della malattia alle basse vie aeree causata da RSV per gli anziani ≥ 60 anni.
Dei quattro vaccini inizialmente considerati, MVA-BN-RSV di Bavarian Nordic e Ad26.RSV.preF di Janssen Vaccines & Prevention B.V., avendo subito una battuta d’arresto nonostante le buone premesse iniziali, sono stati successivamente esclusi lasciando quindi spazio ai soli RSVpreF (Abrysvo) di Pfizer e mRNA-1345 (mRESVIA) di Moderna, il primo giá approvato da FDA ed EMA e il secondo da FDA.
La revisione sistematica ha permesso di analizzare le varie caratteristiche di efficacia, sicurezza e immunogenicità di entrambi. I risultati raccolti hanno mostrato una buona efficacia per entrambi i vaccini, soprattutto per quanto riguarda la malattia grave; inoltre, le evidenze suggeriscono che nessuno dei due solleva particolari preoccupazioni sul fronte della sicurezza e della tollerabilità.
Si può concludere, quindi, che al momento le alternative per la prevenzione dalla malattia causata da RSV sono varie e valide.
Il Virus Respiratorio Sinciziale (RSV), virus stagionale ed altamente contagioso, è una delle principali cause delle infezioni respiratorie acute (ARI) e della malattia del tratto respiratorio inferiore (LRTD) nei neonati e nei bambini di età inferiore ai 5 anni ma anche nella popolazione adulta e anziana, specialmente nei pazienti immunocompromessi o con patologie croniche [1]. La circolazione dell’RSV è altamente stagionale e ha una maggiore incidenza in inverno nei climi temperati [1] mentre in Italia tra ottobre/novembre ed aprile [2], con un picco di ricoveri tra dicembre e febbraio [3].
I sintomi clinici dell’RSV non sono generalmente distinguibili da altri virus respiratori. I sintomi delle vie respiratorie superiori comprendono congestione nasale e mal di gola, durante i primi giorni dopo l’infezione, seguiti da sintomi come tosse, respiro sibilante e difficoltà respiratoria, con possibilità che il virus passi nel tratto respiratorio inferiore [1]. L’infezione da RSV può essere associata a gravi complicazioni respiratorie come polmonite, bronchite ed esacerbazione dell’asma o della broncopneumopatia cronica ostruttiva di base (BPCO) [4, 5] e con complicazioni cardiovascolari come infarto del miocardio, ictus e insufficienza cardiaca [6, 7]. Gli anziani, le persone con malattie croniche, i pazienti sottoposti a trapianto e i pazienti con BPCO sono tra i gruppi maggiormente a rischio di sviluppare una malattia da RSV più grave, generalmente associata a ricovero prolungato, necessità di accesso alla terapia intensiva e, talvolta, anche al decesso [8, 9].
Il carico di malattia attribuibile all’RSV nella popolazione anziana è sostanziale. In uno studio prospettico condotto negli Stati Uniti (USA), è stato stimato che la malattia da RSV si sviluppa ogni anno nel 3-7% degli adulti sani, di età pari o superiore a 65 anni, e nel 4-10% degli adulti ad alto rischio (persone con malattie cardiache o polmonari croniche), rappresentando il 10,6% dei ricoveri per polmonite, l’11,4% per BPCO, il 7,2% per asma e il 5,4% per insufficienza cardiaca congestizia [10]. In una revisione sistematica con meta-analisi che ha indagato il carico di malattia da RSV negli adulti di età pari o superiore a 60 anni, nei paesi ad alto reddito, è stato stimato che in Italia l’RSV è stato responsabile, nel 2019, di oltre 290.000 casi di infezione respiratoria acuta, oltre 26.000 ricoveri ospedalieri e oltre 1.800 decessi ospedalieri [11]. In un’altra revisione sistematica con meta-analisi, invece, in cui è stato indagato il carico di malattia da RSV in Italia, la prevalenza dei casi confermati di RSV è risultata essere pari al 4,5% con una positività al virus più elevata negli anziani (4,4%) rispetto agli adulti in età lavorativa (3,5%); mentre la stima aggregata della mortalità intraospedaliera era pari al 7,2% [12].
In un altro recente studio retrospettivo, condotto in Italia, è stato documentato che nei pazienti di età ≥ 60 anni, ricoverati per RSV, i costi sanitari diretti medi/anno erano pari a € 11.599 per paziente, di cui il 78,9% associato ai ricoveri ospedalieri, il 16,2% alla prescrizione di farmaci e il 4,9% alle prestazioni ambulatoriali [13].
Tuttavia, dai dati di letteratura emerge una importante sottostima del burden clinico-epidemiologico dell’RSV anche associato alle attuali criticità legate ai test diagnostici oggi utilizzati [14] nonché ai limiti degli attuali sistemi di sorveglianza e alla mancata disponibilità di una definizione specifica di “caso” per RSV [15]. È stato stimato, infatti, che il reale carico di ospedalizzazione associato all’RSV potrebbe essere 2,2 volte superiore a quello ad oggi riportato in letteratura [14].
La vaccinazione contro RSV, oggi possibile, rappresenta una risposta di Sanità Pubblica ad un bisogno medico finora insoddisfatto. Il vaccino ricombinante RSVPreF3 (Arexvy®), adiuvato con AS01E, è il primo vaccino ad aver ricevuto l’approvazione dagli enti regolatori per la prevenzione della LRTD da RSV negli adulti di età ≥ 60 anni. Le evidenze ad oggi disponibili dimostrano un ottimo profilo di immunogenicità, efficacia e sicurezza per questo vaccino così come riportato nel Capitolo 2 del presente report.
Recentemente (gennaio 2024) anche il Board del Calendario per la Vita ha pubblicato le sue raccomandazioni sulla vaccinazione contro RSV nella popolazione anziana e negli adulti a rischio [16], sottolineando come la recente disponibilità di vaccini efficaci e sicuri nei confronti delle patologie causate da RSV rappresenti una opportunità preventiva di grande valore clinico, non essendo stata disponibile finora alcuna valida misura di prevenzione né alcuna terapia specifica [16]. Il Board del Calendario della Vita, sulla base delle evidenze di efficacia e sicurezza ad oggi disponibili, e considerando le informazioni attualmente in fase di raccolta sulla durata della protezione conferita dai vaccini anti-RSV, ne raccomanda l’utilizzo ai soggetti di età ≥ 75 anni, popolazione nella quale è peraltro molto frequente la co-esistenza di condizioni di cronicità che rendono l’infezione da RSV ancora più a rischio di complicanze gravi. Per le stesse motivazioni, raccomanda l’estensione della vaccinazione ai soggetti affetti da patologie croniche di età ≥ 60 anni [16].
Sulla base del burden delle infezioni da RSV e alla luce della disponibilità di strumenti per la loro prevenzione anche il Ministero della Salute, in data 27 marzo 2024, ha pubblicato una specifica Circolare per indicare le attuali misure di prevenzione e immunizzazione contro RSV [17]. Tuttavia, ad oggi, non esiste ancora una raccomandazione ministeriale su questa vaccinazione.
Recenti valutazioni economiche pubblicate in letteratura hanno dimostrato che il vaccino adiuvato RSVPreF3 OA potrebbe ridurre sostanzialmente il carico di malattia da RSV negli adulti di età ≥ 60 anni in 11 paesi europei [18], nei soggetti di età ≥ 65 anni in Italia [19], negli adulti di età ≥ 60 anni negli Stati Uniti [20], e negli adulti di età ≥ 60 anni in Giappone [21].
Pertanto, nell’ambito della presente valutazione HTA, l’obiettivo di questo Capitolo è stato quello di valutare l’impatto, sulla salute pubblica, di un programma di vaccinazione con il vaccino adiuvato RSVPreF3 (Arexvy®) nelle due popolazioni in cui il suo utilizzo è stato attualmente raccomandato in Italia, ossia la popolazione di età ≥ 75 anni e la popolazione ≥ 60 anni ad alto rischio (HR), considerando un orizzonte temporale di tre anni corrispondente a tre stagioni RSV consecutive.
In questo Capitolo, pertanto, sarà descritta l’analisi economica del vaccino RSV oggetto di approfondimento del presente report di HTA (RSVPreF3), condotta al fine di valutare i costi sanitari diretti e i benefici potenziali del vaccino, non solo in termini di riduzione dell’incidenza e della gravità delle infezioni da RSV, ma anche relativamente al suo impatto economico a livello nazionale. Attraverso la presentazione dei risultati di un modello economico di costo-efficacia, sarà descritto il valore che RSVPreF3 potrebbe aggiungere alle strategie di immunizzazione attualmente offerte in Italia per la popolazione adulta a rischio e anziana, considerando vari scenari epidemiologici e demografici.
Complessivamente, questo Capitolo intende fornire una sintesi approfondita dell’onere rappresentato dall’RSV e delle potenziali strategie per mitigarlo, con un focus particolare sull’innovazione rappresentata dalla disponibilità di un nuovo vaccino. L’obiettivo è quello di evidenziare l’importanza dei progressi scientifici in ambito vaccinale e di politiche sanitarie informate per affrontare efficacemente questa sfida di Sanità Pubblica.
La modellizzazione dell’impatto clinico ed economico ha previsto l’utilizzo del modello di Costo-Efficacia del Virus Respiratorio Sinciziale per Adulti (ARIEL), modello di Markov statico multi-coorte, precedentemente pubblicato [18-21] ed adattato al setting italiano, al fine di valutare il rapporto di costo-efficacia del vaccino RSVPreF3 OA (programma di vaccinazione con singola dose del vaccino adiuvato RSVPreF3) rispetto alla non vaccinazione. Sulla base della raccomandazione del Board per il Calendario per la Vita, sono state considerate come popolazioni target della vaccinazione anti-RSV i soggetti di età ≥ 75 anni e gli adulti di età ≥ 60 anni affetti da patologie croniche (ad alto rischio, HR). Inoltre, è stato considerato un orizzonte temporale di tre anni, corrispondente a tre stagioni RSV consecutive. La struttura del modello è illustrata nella Figura 1.
Struttura del modello.
Il modello prevede tre stati di salute: “no RSV”, “post-RSV” (persone che hanno superato l’infezione da RSV) e “morte da RSV”. Il modello comprende altresì tre eventi di transizione, RSV-ARI, RSV-URTD (malattia del tratto respiratorio superiore associata a RSV) e RSV-LRTD, ciascuno dei quali può verificarsi come prima infezione nell’arco temporale del modello o come reinfezione nelle stagioni successive, poiché l’infezione da RSV non determina un’immunità persistente. Tutti i soggetti sono entrati nel modello nello stato “no RSV”, potendo poi sperimentare un evento di transizione RSV-ARI (la prima infezione da RSV sperimentata da un dato soggetto all’interno del modello), seguito da eventi di transizione RSV-URTD o RSV-LRTD. Gli individui che transitano attraverso l’evento di transizione RSV-URTD entrano nello stato di salute “post-RSV” e quelli che transitano attraverso l’evento di transizione RSV-LRTD possono entrare nello stato di salute “morte da RSV” o “post-RSV”. A causa della natura statica del modello, i soggetti non possono passare dall’evento di transizione URTD a quello LRTD, mentre nel mondo reale i casi di URTD possono progredire a LRTD e viceversa. Ciò potrebbe comportare una sottostima di alcuni eventi correlati ad RSV nel nostro modello. I soggetti nello stato di salute “post-RSV” possono sperimentare una reinfezione da RSV ed eventi di transizione LRTD e URTD associati in modo simile alla prima infezione. I soggetti negli stati di salute “no RSV” e “post-RSV” potrebbero anche morire per cause non correlate all’RSV, in base alla mortalità della popolazione generale. La durata del ciclo del modello (cycle lenght) è di un mese, riflettendo la natura acuta dell’infezione da RSV. I costi e l’utilizzo delle risorse sanitarie sono stati assegnati agli eventi di transizione RSV-URTD e RSV-LRTD e monitorati in tutto il modello.
Il modello ha confrontato un programma di immunizzazione con una singola dose del vaccino adiuvato RSVPreF3 vs la non vaccinazione, poiché attualmente in Italia non esiste un programma di vaccinazione contro l’RSV. L’orizzonte temporale considerato nel modello è di tre anni, corrispondenti a tre stagioni RSV consecutive. Tale assunzione si basa sui dati dello studio di Fase III AReSVi-006 [22], che mostrano come una dose del vaccino adiuvato RSVPreF3 sia in grado di fornire protezione per due stagioni consecutive, e le analisi di regressione precedentemente pubblicate che indicano una sostanziale protezione residua durante la terza stagione [20, 21]. È stato, inoltre, applicato un tasso di sconto del 3,0% annuo, in linea con le linee guida dell’Agenzia Italiana del Farmaco (AIFA) [23].
È stato ipotizzato che nel caso base il vaccino adiuvato RSVPreF3 OA fosse somministrato nel mese di ottobre, mese indicativo di inizio della stagione RSV in Italia. Non essendo disponibili dati sulla rivaccinazione con il vaccino adiuvato RSVPreF3, la rivaccinazione non è stata considerata nell’analisi. Inoltre, è stato ipotizzato che i pazienti non potessero subire una reinfezione durante la stessa stagione RSV e che potessero diventare nuovamente suscettibili all’infezione nelle stagioni successive. È stato ipotizzato altresì che i casi di RSV-URTD non comportino alcun rischio di mortalità aggiuntivo e che la mortalità correlata a RSV si applichi solo nei casi di RSV-LRTD. Infine, è stato ipotizzato che i casi di RSV-URTD non richiedano cure mediche e quindi non comportino alcun utilizzo di risorse sanitarie. La popolazione italiana considerata nel modello, stratificata per età, è stata ottenuta dai dati dell’Istituto Nazionale di Statistica [24]. I dati utilizzati per popolare il modello sono illustrati in Tabella I.
Data input del modello economico.
| Parametro | Valore del caso base | Fonte | |
|---|---|---|---|
| Popolazione target | Età 60-64 anni | 4.148.914 | [24] |
| Età 65-69 anni | 3.589.273 | ||
| Età 70-74 anni | 3.303.871 | ||
| Età 75-79 anni | 2.754.857 | ||
| Età 80-84 anni | 2.260.028 | ||
| Età 85-89 anni | 1.427.746 | ||
| Età 90-109 anni | 841.670 | ||
| Epidemiologia | |||
| Incidenza media annuale di RSV-ARI medicalmente assistite per persona/anno, per tutte le fasce d’età | 5,7%* | [25] | |
| Proporzione di eventi RSV-ARI che sono LRTD | 47,6%** | Basato su casi medicalmente assistiti da Papi et al., 2023 [26] | |
| Probabilità di complicanze polmonari (polmonite) dopo un evento RSV-LRTD | Età 60-64 anni | 17,10% | [27] |
| Età 65-69 anni | 17,10% | ||
| Età 70-74 anni | 17,10% | ||
| Età 75-79 anni | 32,30% | ||
| Età 80-84 anni | 32,30% | ||
| Età 85-89 anni | 34,90% | ||
| Età 90-109 anni | 34,90% | ||
| Probabilità di complicanze respiratorie (asma o BPCO) dopo un evento RSV-LRTD | Età 60-64 anni | 51,20% | [27] |
| Età 65-69 anni | 51,20% | ||
| Età 70-74 anni | 51,20% | ||
| Età 75-79 anni | 38,70% | ||
| Età 80-84 anni | 38,70% | ||
| Età 85-89 anni | 30,20% | ||
| Età 90-109 anni | 30,20% | ||
| Tasso di mortalità per RSV-LRTD | Età 60-64 anni | 0,27% | (Statens Serum Institute, 2022) [28] |
| Età 65-74 anni | 0,80% | ||
| Età 75-84 anni | 2,50% | ||
| Età 85-109 anni | 4,02% | ||
| Stagionalità per mese | Gennaio | 335% | [29] |
| Febbraio | 139% | ||
| Marzo | 12% | ||
| Aprile | 7% | ||
| Maggio | 0% | ||
| Giugno | 0% | ||
| Luglio | 0% | ||
| Agosto | 0% | ||
| Settembre | 0% | ||
| Ottobre | 30% | ||
| Novembre | 188% | ||
| Dicembre | 488% | ||
| Utilizzo delle risorse sanitarie | |||
| Proporzione di casi di RSV-LRTD che ricevono antibiotici | Età 60-64 anni | 63,10% | [30] |
| Età 65-79 anni | 63,30% | ||
| Età 80-109 anni | 79,30% | ||
| Proporzione di casi di RSV-LRTD con accesso al pronto soccorso | Età 60-64 anni | 5.00% | [31] |
| Età 65-79 anni | 5.00% | ||
| Età 80-109 anni | 5.00% | ||
| Proporzione di casi di RSV-LRTD ricoverati in ospedale | Età 60-64 anni | 3,60% | [31] |
| Età 65-74 anni | 10,90% | ||
| Età 75-109 anni | 18,40% | ||
| Proporzione di casi di RSV-LRTD ricoverati in terapia intensiva | Età 60-64 anni | 0,01% | [31, 32] |
| Età 65-74 anni | 0,02% | ||
| Età 75-109 anni | 0,03% | ||
| Costi unitari per caso RSV-LRTD medicalmente assistitoa | |||
| Visita ambulatoriale | € 96,45 | [33] | |
| Visita d’urgenza | € 280,40 | [34] | |
| Uso di antibiotici | € 84,90 | [35] | |
| Ricovero ospedaliero | € 2.701,59 b | [36] | |
| Ricovero in terapia intensiva | € 8.484,73c | [36] | |
| Costo medio delle risorse sanitarie per evento RSV-LRTD medicalmente assistito | Età 60-64 anni | € 263,13 | |
| Età 65-74 anni | € 560,85 | ||
| Età 75-79 anni | € 866,56 | ||
| Età 80-109 anni | € 880,15 | ||
| * Korsten et al. (2022) [25] specificano che il 31,0% dei casi di RSV sono medicalmente assistiti (proxy per RSV LRTD) e riportano i tassi di incidenza annuale di ARI da RSV nei pazienti Older Adults (OA) assistiti dal medico, osservati in due stagioni: 4,2% (2017-2018) e 7,2% (2018-2019). La media ponderata, utilizzando questi valori, è stata calcolata per l’incidenza dell’evento RSV ARI per persona all’anno nel nostro modello. | |||
| ** Il tasso di incidenza di LRTD correlato a RSV nella popolazione con ARI da RSV nel trial AReSVi-006 [26] è stato utilizzato per calcolare la proporzione di pazienti con ARI-RSV/LRTD da RSV secondo la definizione dello studio. Dalle visite mediche effettuate fino alla fine della seconda stagione vengono riportati 292 casi attribuibili a RSV ARI, 139 dei quali sono RSV LRTD. Pertanto, la percentuale di pazienti con RSV ARI affetti da RSV LRTD utilizzata nel modello è pari al 47,60% (139/292 casi). | |||
| a Costo unitario moltiplicato per la percentuale di casi di RSV-LRTD assistiti dal medico (65,13%) per ricavare il costo di gestione medio di un evento di RSV-LRTD; b Basato sul costo totale medio di DRG 79, DRG 80, DRG 089, DRG 090, DRG 092, DRG093, DRG 096 e DRG 097; c in assenza di dati specifici è stato usato il costo del DRG 475 Diagnoses relating to the respiratory system with mechanical ventilation pari a € 8.158,90, calcolandone l’inflazione. | |||
Nel modello sono stati considerati diversi scenari con diversi tassi di copertura vaccinale. Nei soggetti di età ≥ 75 anni, gli scenari per la copertura vaccinale sono:
56,7%, che è il tasso di vaccinazione contro l’influenza nella stagione 2022-2023 negli adulti di età pari o superiore a 65 anni [38]. Questo valore è stato utilizzato come proxy, poiché si prevede che il vaccino adiuvato RSVPreF3 venga somministrato annualmente insieme alla vaccinazione contro l’influenza stagionale in Italia;
75%, che rappresenta l’obiettivo minimo per la vaccinazione antinfluenzale in Italia [39];
95%, che rappresenta l’obiettivo ottimale per la vaccinazione antinfluenzale in Italia [39].
L’incidenza di RSV-ARI si basa sull’incidenza dei casi di RSV medicalmente assistiti negli anziani, riportata in uno studio europeo [25], e assunta come uguale in tutte le fasce di età (poiché i dati presentati nello studio non sono stratificati per età). L’incidenza annuale delle infezioni da RSV nel modello è stata distribuita nei diversi mesi dell’anno in base al numero di casi di RSV segnalati al mese nella regione Lombardia durante la stagione influenzale 2022-2023 [29] (Tab. I).
Il tasso di incidenza di LRTD correlata a RSV nella popolazione con ARI-RSV è stato assunto al 47,6%, sulla base dei dati dello studio clinico di Fase III [26], ed è stato assunto che il restante 52,4% fosse rappresentato da casi di RSV-URTD (Tab. I).
Le probabilità aggiustate per età di sviluppare complicanze di polmonite, asma o BPCO, associate ad un evento RSV-LRTD, sono state ottenute da uno studio retrospettivo condotto nell’Europa meridionale da Boattini et al. [27] (Tab. I).
La mortalità della popolazione generale per tutte le cause è stata ottenuta dalle tavole di mortalità per età pubblicate dall’Istat nel 2023 [40]. Non essendo disponibili dati specifici sui tassi di mortalità per RSV-LRTD in Italia, sono stati utilizzati come proxy i dati dello Statens Serum Institute in Danimarca che riportavano la probabilità di morte nei pazienti ospedalizzati con RSV-LRTD [28] (Tab. I). I dati danesi della fascia di età 65-74 sono stati utilizzati anche per la fascia di età 60-64 (dati non disponibili per quest’ultima fascia di età). È stato quindi utilizzato il tasso di ospedalizzazione per RSV-LRTD riportato da Belongia et al. [31] moltiplicandolo per il tasso di mortalità intraospedaliera ricavato dai dati danesi al fine di ottenere la probabilità di morte per RSV-LRTD.
Come risorse sanitarie sono state considerate nel modello le visite ambulatoriali, i ricoveri ospedalieri, gli accessi al pronto soccorso, i ricoveri in terapia intensiva e l’uso di antibiotici. È stato ipotizzato che tutti i casi di RSV-URTD non richiedessero cure mediche e pertanto non comportassero costi aggiuntivi in termini di risorse sanitarie assorbite.
Nello studio di Korsten et al. [25] il 31,0% di tutti i casi di RSV-ARI risultano medicalmente assistiti e, pertanto, nel nostro modello è stato assunto che tutti questi casi fossero RSV-LRTD. È stato, inoltre, assunto che dei casi di RSV-ARI inclusi nel modello, il 47,6% fossero casi di RSV-LRTD (come descritto nelle note in Tab. I), e pertanto la percentuale di casi di RSV-LRTD medicalmente assistiti è stata fissata al 65,1% (31,0/47,6%). È stato ipotizzato, quindi, che tutti i casi di RSV-LRTD medicalmente assistiti richiedessero una visita ambulatoriale. La percentuale di casi di RSV-LRTD con accesso al pronto soccorso è stata assunta al 5% secondo quanto riportato nello studio di Belongia et al. [31].
La proporzione dei casi di RSV-LRTD che hanno richiesto il ricovero è stata ricavata da uno studio statunitense [31], in assenza di dati italiani o europei, e la proporzione dei ricoverati in terapia intensiva si è basata su uno studio condotto nel contesto norvegese [32]. L’uso degli antibiotici è stato ottenuto da uno studio condotto su pazienti con metapneumovirus umano [30]. I costi unitari per l’utilizzo delle risorse sanitarie in Italia sono stati ottenuti dalla letteratura scientifica disponibile e dai dati del Ministero della Salute [41], utilizzando l’influenza o la polmonite come proxy laddove non fossero disponibili dati specifici per RSV (Tab. I). Il caso base presupponeva che la durata del ricovero in terapia intensiva fosse di un giorno. I costi unitari sono stati, quindi, moltiplicati per l’utilizzo delle risorse al fine di calcolare, nel modello, i costi medi di utilizzo delle risorse sanitarie per singolo caso di RSV-LRTD (Tab. I). Tutti i costi utilizzati nel modello sono stati corretti considerando il tasso d’inflazione e utilizzando il database Rivaluta di ISTAT, strumento di calcolo rapido delle rivalutazioni monetarie in base all’indice dei prezzi al consumo per le famiglie di operai e impiegati (al netto dei tabacchi) [42].
Il modello ha considerato anche la popolazione italiana adulta di età ≥ 60 anni HR (definita come quella con comorbosità tra cui quelle respiratorie, circolatorie, epatiche, renali o metaboliche (diabete), nonché pazienti con BPCO, asma, insufficienza cardiaca congestizia o immunodeficit). Per la popolazione ≥ 60 anni HR, i dati della popolazione italiana generale sono stati moltiplicati per la percentuale di persone con comorbosità respiratorie, circolatorie, epatiche, renali o metaboliche (diabete), ottenuta dai dati 2021-2022 (ultimi dati disponibili) del sistema Passi d’Argento dell’Istituto Superiore di Sanità [43]. Nello specifico sono state considerate le percentuali relative alle persone con almeno una malattia cronica, stratificate per fasce di età. I dati su questa specifica popolazione target considerata nel modello sono riportati in Tabella II.
Popolazione italiana ad alto rischio di età pari o superiore a 60 anni (HR ≥ 60 anni), considerata nel modello.
| Fascia di età | Popolazione italiana (caso base) [24] | Valori percentuali per la popolazione ad alto rischio (HR) 2021-2022 [43] | Dimensioni della popolazione italiana ad HR |
|---|---|---|---|
| Età 60-64 anni | 4.148.914 | 51,2% | 2.124.244 |
| Età 65-69 anni | 3.589.273 | 51,2% | 1.837.708 |
| Età 70-74 anni | 3.303.871 | 51,2% | 1.691.582 |
| Età 75-79 anni | 2.754.857 | 64,7% | 1.782.392 |
| Età 80-84 anni | 2.260.028 | 64,7% | 1.462.238 |
| Età 85-89 anni | 1.427.746 | 72,2% | 1.030.833 |
| Età 90-109 anni | 841.670 | 72,2% | 607.686 |
Nella popolazione HR ≥ 60 anni, gli scenari per la copertura vaccinale considerati nel modello sono i seguenti:
13,3%, che è il tasso di vaccinazione antinfluenzale nella stagione 2022-2023 negli adulti di età compresa tra 45 e 64 anni [38]. Questo valore è stato utilizzato come proxy, poiché si prevede che il vaccino adiuvato RSVPreF3 OA venga somministrato annualmente insieme alla vaccinazione contro l’influenza stagionale in Italia;
75%, che rappresenta l’obiettivo minimo per la vaccinazione antinfluenzale in Italia [39];
95%, che rappresenta l’obiettivo ottimale per la vaccinazione antinfluenzale in Italia [39].
Il tasso di mortalità per RSV-LRTD è stato aggiustato per la popolazione HR ≥ 60 anni sulla base delle stime del rischio di ospedalizzazione (descritto nella sezione successiva). Inoltre, è stato ipotizzato che gli altri dati epidemiologici per la popolazione di età ≥ 60 anni fossero gli stessi della popolazione di età ≥ 75 anni, a causa della mancanza di dati specifici disponibili.
Sono stati utilizzati dati diversi sul rischio di ospedalizzazione per la popolazione HR di età ≥ 60 anni, considerando due studi che riportavano tassi di ospedalizzazione per i casi di RSV tra gli adulti con comorbosità di età ≥ 60 anni [44, 45] e non essendo disponibili dati specifici per l’Italia. Pertanto, sono stati riportati, nell’analisi condotta, i risultati per i due diversi scenari considerati: uno scenario conservativo che utilizza come data input i valori riportati da Fleming et al. [45], pur essendo uno studio più datato (2015) e uno scenario ottimistico che considera, invece, i dati riportati da Osei-Yeboah et al. nel 2024 [44]. L’aumento relativo del tasso di ospedalizzazione per i pazienti HR rispetto alla popolazione generale è stato calcolato da ciascuno studio e applicato al tasso di ospedalizzazione utilizzato per la popolazione generale nel caso base del modello. Questi tassi di ospedalizzazione sono stati poi applicati ai tassi di mortalità della popolazione generale per i pazienti ospedalizzati con RSV-LRTD al fine di calcolare i dati di input sulla mortalità per la popolazione HR di età ≥ 60 anni. Questi dati sono riassunti in Tabella III.
Dati di input relativi al rischio di ospedalizzazione e alla mortalità per RSV-LRTD nella popolazione HR di età ≥ 60 anni.
| Fascia di età | Tasso di ospedalizzazione della popolazione generale [31] | Rischio relativo applicato | Tasso di ospedalizzazione della popolazione HR | Tasso di mortalità intraospedaliera totale [28] | Tasso di mortalità della popolazione HR |
|---|---|---|---|---|---|
| Fleming et al. 2015 [45] | |||||
| 60-64 anni | 3,60% | 3,40 | 12,24% | 7,38% | 0,90% |
| 65-69 anni | 10,90% | 2.09 | 22,81% | 7,38% | 1,68% |
| 70-74 anni | 10,90% | 2.09 | 22,81% | 7,38% | 1,68% |
| 75-79 anni | 18,40% | 1.44 | 26,58% | 13,60% | 3,61% |
| 80-84 anni | 18,40% | 1.44 | 26,58% | 13,60% | 3,61% |
| 85-89 anni | 18,40% | 1.44 | 26,58% | 21,85% | 5,81% |
| 90-109 anni | 18,40% | 1.44 | 26,58% | 21,85% | 5,81% |
| Osei-Yeboah et al. 2024 [44] | |||||
| 60-64 anni | 3,60% | 2,99 | 10,78% | 7,38% | 0,80% |
| 65-69 anni | 10,90% | 3.10 | 33,76% | 7,38% | 2,49% |
| 70-74 anni | 10,90% | 3.10 | 33,76% | 7,38% | 2,49% |
| 75-79 anni | 18,40% | 2.67 | 49,21% | 13,60% | 6,69% |
| 80-84 anni | 18,40% | 2.67 | 49,21% | 13,60% | 6,69% |
| 85-89 anni | 18,40% | 2.81 | 51,66% | 21,85% | 11,29% |
| 90-109 anni | 18,40% | 2.81 | 51,66% | 21,85% | 11,29% |
Inoltre, è stato ipotizzato che i dati sui costi e sull’utilizzo delle risorse sanitarie per la popolazione di età ≥ 60 anni fossero gli stessi della popolazione di età ≥ 75 anni, a causa della mancanza di dati disponibili.
I dati di efficacia per il vaccino adiuvato RSVPreF3 OA, utilizzato nel modello, hanno considerato un valore di massima efficacia del vaccino e un valore di declino mensile (ossia una diminuzione in punti percentuali dell’efficacia del vaccino ogni mese), con input separati per RSV-ARI e RSV-LRTD. Questi valori sono stati calcolati, sulla base dei dati dello studio clinico di Fase III AReSVi-006 nel corso di due stagioni consecutive [22], con modelli di regressione lineare adattati ai dati dello studio al fine di estrapolare informazioni oltre il periodo di follow-up dello studio clinico [20].
L’analisi ha utilizzato dati mensili sul numero di soggetti, sul numero di casi di RSV-ARI e RSV-LRTD e sul tempo di follow-up considerati in ciascun braccio dello studio (placebo e vaccino adiuvato RSVPreF3 OA). I dati mensili sono stati aggregati fino a quando non sono stati raggiunti almeno otto casi nel braccio placebo e una media ponderata è stata calcolata in base al numero di casi nel gruppo placebo per dare più peso ai mesi con dati più robusti. L’efficacia del vaccino è stata calcolata per RSV-ARI e RSV-LRTD in ogni momento, seguita da una regressione ponderata dei minimi quadrati su entrambi gli endpoint. Le intercettazioni delle regressioni hanno fornito i dati di ingresso dell’efficacia di picco e le pendenze hanno fornito i dati mensili in calo utilizzati nel modello [20]. I risultati sono riportati nella Figura 2 e in Tabella IV.
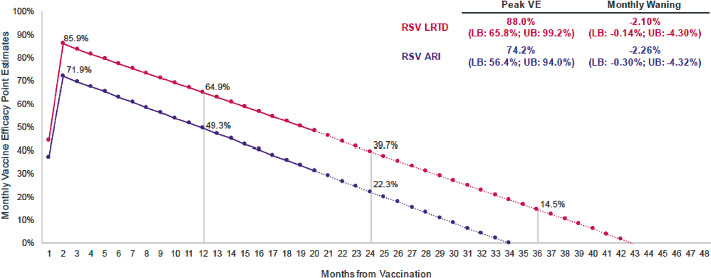
Picco di efficacia del vaccino e input in diminuzione per RSV-ARI e RSV-LRTD utilizzati nel modello (da Molnar et al. 2024, mod.) [20] (http://creativecommons.org/licenses/by-nc/4.0).
Picco di efficacia del vaccino e input in declino utilizzati nel modello (da Molnar et al. 2024, mod.) [20].
| Picco di efficacia del vaccino | Limiti inferiori e superioria | Errore standard | |
|---|---|---|---|
| RSV-ARI | 74,17% | 56,39-94,01% | 9,80% |
| RSV-LRTD | 88,02% | 65,80-99,20% | 9,14% |
| Riduzione mensileb | Limiti inferiori e superioria | Errore standard | |
| RSV-ARI | 2,26% | 0,30-4,32% | 1,04% |
| RSV-LRTD | 2,10% | 0,14-4,30% | 1,13% |
| a 2,5-97,5 percentile; b Riduzione mensile < 24 mesi. | |||
È stata condotta un’analisi di sensibilità deterministica univariata (UDSA) per testare l’effetto della variazione dei valori dei parametri chiave sul numero previsto di casi di RSV-ARI evitati in tutte le fasce di età vaccinando con il vaccino adiuvato RSVPreF3, rispetto a nessuna vaccinazione. Per l’efficacia del vaccino e la relativa diminuzione nel tempo, i valori superiore e inferiore utilizzati nell’analisi di sensibilità sono stati i limiti superiore e inferiore calcolati per i dati di input (Tab. IV). Per gli altri parametri, i valori sono stati variati del 20% al di sopra o al di sotto del caso base, con valori per tutte le età variati insieme.
Per la popolazione HR ≥ 60 anni, sono state condotte due UDSA, utilizzando i dati di input per l’ospedalizzazione riportati da Fleming et al. [45] e Osei-Yeboah et al. [44], rispettivamente.
La Figura 3 mostra il numero stimato di casi di RSV-ARI e RSV-LRTD, ricoveri per RSV-LRTD e costi sanitari diretti correlati a RSV senza vaccinazione e con tassi di copertura del 56,7, 75 e 95% per la vaccinazione con RSVPreF3 adiuvato OA, considerando un orizzonte temporale di tre anni e corrispondente a tre stagioni consecutive di RSV, in persone di età ≥ 75 anni in Italia.
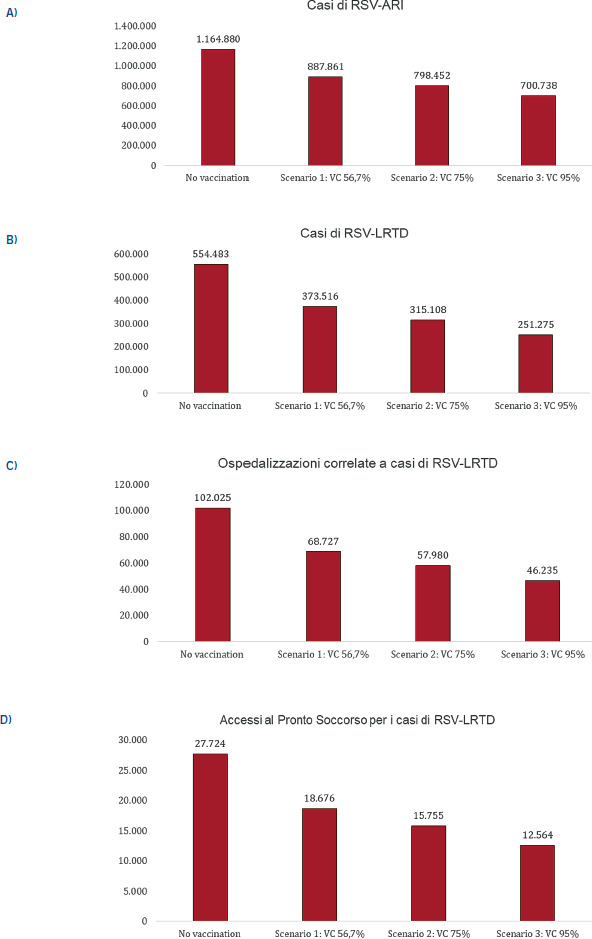
Numeri stimati di (A) casi di RSV-ARI, (B) casi di RSV-LRTD, (C) accessi in pronto soccorso per RSV-LRTD, e (D) ospedalizzazioni per RSV-LRTD, in persone di età ≥ 75 anni in Italia, in un orizzonte temporale di 3 anni, nello scenario senza vaccinazione e in quello con vaccinazione mediante vaccino adiuvato RSVPreF3 OA e considerando tre scenari diversi di copertura vaccinale.
Dall’analisi condotta si evince che la vaccinazione con RSVPreF3 adiuvato, considerando una copertura vaccinale del 56,7%, comporterebbe una riduzione del 24% dei casi di RSV-ARI e una riduzione del 33% dei casi di RSV-LRTD, dei ricoveri e dei costi sanitari diretti (Fig. 3). Le riduzioni previste sarebbero maggiori con tassi di copertura più elevati (Fig. 3).
La Tabella V mostra il numero stimato di casi di RSV-ARI, di RSV-LRTD, visite ambulatoriali, uso di antibiotici, ricoveri, complicanze polmonari (polmoniti) e complicanze di BPCO/asma correlate a RSV-LRTD, decessi legati ad RSV e costi sanitari diretti correlati a eventi di RSV e relative complicanze, nello scenario senza vaccinazione e in un orizzonte temporale di 3 anni, nella popolazione ≥ 75 anni. La Tabella V riporta, inoltre, il numero stimato di ciascun evento evitato e la stima dei costi sanitari diretti evitati vaccinando con il vaccino adiuvato RSVPreF3 OA e considerando tre scenari di copertura vaccinale differenti. Nel caso base, con una copertura vaccinale del 56,7%, la vaccinazione potrebbe evitare 277.019 casi di RSV-ARI, 180.967 casi di RSV-LRTD e 33.298 ricoveri correlati a RSV, con una riduzione dei costi sanitari diretti pari a € 157.755.358. Il numero di eventi evitati e le riduzioni dei costi stimate sarebbero maggiori con tassi di copertura vaccinale più elevati (Tab. V).
Impatto previsto sulla salute pubblica della vaccinazione con il vaccino adiuvato RSVPreF3 OA in Italia, nella popolazione di età ≥ 75 anni, considerando un orizzonte temporale di 3 anni e tre scenari di copertura vaccinale differenti.
| Risultati nello scenario senza vaccinazione | Risultati nello scenario con vaccinazione mediante vaccino adiuvato RSVPreF3 OA | |||
|---|---|---|---|---|
| Copertura vaccinale 56,7% | Copertura vaccinale 75% | Copertura vaccinale 95% | ||
| Popolazione di età ≥ 75 anni | 7.284.301 | |||
| Popolazione vaccinata con vaccino adiuvato RSVPreF3 OA | 4.130.199 | 5.463.226 | 6.920.086 | |
| Risultati su un orizzonte temporale di 3 anni | ||||
| Casi RSV-ARI | 1.164.880 | 277.019 | 366.428 | 464.142 |
| Casi RSV-LRTD | 554.483 | 180.967 | 239.375 | 303.208 |
| Visite ambulatoriali per eventi RSV-LRTD | 361.113 | 117.857 | 155.895 | 197.467 |
| Uso di antibiotici a causa di eventi RSV-LRTD | 404.988 | 132.283 | 174.979 | 221.639 |
| Accessi al Pronto Soccorso per casi di RSV-LRTD | 27,724 | 9,048 | 11,696 | 15,160 |
| Ricoveri per eventi RSV-LRTD | 102.025 | 33.298 | 44.045 | 55.790 |
| Ricoveri in terapia intensiva dovute a RSV-LRTD | 16,528 | 5,394 | 7,135 | 9,038 |
| Complicazioni di polmonite correlate a RSV-LRTD | 183.345 | 59.861 | 79.181 | 100.296 |
| Complicanze di asma/BPCO correlate a RSV-LRTD | 200.702 | 65.430 | 86.548 | 109.627 |
| Morti per RSV | 16.353 | 5.350 | 7.077 | 8.964 |
| Costi sanitari diretti relativi ad eventi e complicanze di RSV-LRTD | 479.173.279 € | 157.755.358 € | 208.671.109 € | 264.316.738 € |
In tale contesto, è stato altresì calcolato, il numero necessario da vaccinare (NNV) con una singola dose del vaccino adiuvato RSVPreF3 OA per prevenire un evento RSV-LRTD nella popolazione ≥ 75 anni. La modalità di calcolo del NNV è la seguente: 1/ (eventi LRTD evitati/popolazione totale vaccinata). L’NNV risulta essere pari a 23 vaccinazioni.
La Figura 4 mostra il numero stimato di casi RSV-ARI, di RSV-LRTD, ricoveri per RSV-LRTD e costi sanitari diretti correlati a RSV nello scenario senza vaccinazione e in quello con vaccinazione con il vaccino adiuvato RSVPreF3, e con tassi di copertura vaccinale del 13,3, 75 e 95%, considerando un orizzonte temporale di 3 anni, corrispondente a tre stagioni consecutive di RSV, nella popolazione HR di età ≥ 60 anni in Italia, e utilizzando i dati di input relativi alle ospedalizzazioni RSV-correlate riportate da Fleming et al. [45] e Osei-Yeboah et al. [44]. Con un tasso di copertura vaccinale del 75%, la vaccinazione potrebbe comportare una riduzione del 31% dei casi di RSV-ARI e una riduzione del 43% dei casi di RSV-LRTD, dei ricoveri ospedalieri e dei costi sanitari diretti.
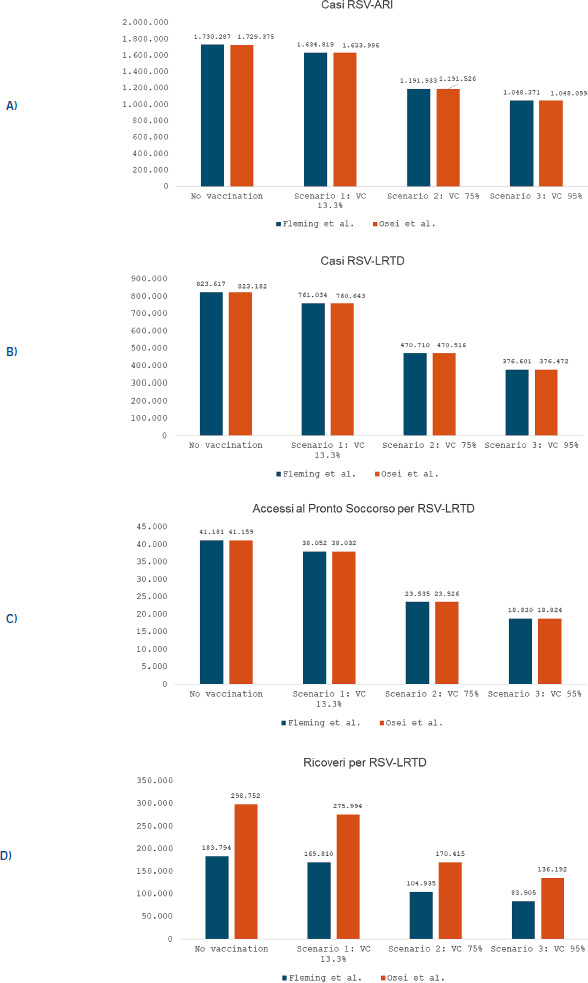
Numeri previsti di (A) casi di RSV-ARI, (B) casi di RSV-LRTD, (C) Accessi al Pronto Soccorso per RSV-LRTD, e (D) ospedalizzazione per RSV-LRTD, nella popolazione HR di età ≥ 60 anni in Italia, e in un orizzonte temporale di 3 anni, nello scenario senza vaccinazione e con vaccinazione (RSVPreF3 OA) e considerando tre scenari differenti di copertura vaccinale. I data input sul rischio di ospedalizzazione considerati sono quelli riportati da Fleming et al. [45] o Osei-Yeboah et al. [44].
La Tabella VI mostra il numero stimato di casi di RSV-ARI, casi di RSV-LRTD, visite ambulatoriali, uso di antibiotici, ricoveri, complicanze polmonari (polmonite) e complicanze di BPCO/asma correlate a RSV-LRTD, decessi da RSV e costi sanitari diretti correlati a RSV e relative complicanze, nello scenario con e senza vaccinazione, in un orizzonte temporale di 3 anni, nella popolazione HR di età ≥ 60 anni in Italia, e considerando entrambe le fonti di data input per le ospedalizzazioni RSV-correlate. Nel caso base, con una copertura vaccinale del 13,3%, la vaccinazione potrebbe evitare 95.468 casi di RSV-ARI, 62.582 casi di RSV-LRTD e 13.984 ricoveri correlati a RSV, con una riduzione dei costi sanitari diretti pari a € 64.126.996, utilizzando i dati sul rischio di ospedalizzazione riportati da Fleming et al. [45]. Utilizzando, invece, i dati sul rischio di ospedalizzazione riportati da Osei-Yeboah et al. [44], e considerando una copertura vaccinale del 13,3%, la vaccinazione potrebbe evitare 95.379 casi di RSV-ARI, 62.539 casi di RSV-LRTD e 22.758 ricoveri correlati a RSV, con una riduzione dei costi sanitari diretti pari a € 99.192.288. Il numero di eventi evitati e la riduzione dei costi sanitari diretti sarebbero maggiori con tassi di copertura vaccinale più elevati, indipendentemente dai dati sul rischio di ospedalizzazione utilizzati (Tab. VI).
Impatto previsto sulla salute pubblica della vaccinazione con il vaccino adiuvato RSVPreF3 OA in Italia, nella popolazione HR di età ≥ 60 anni, su un orizzonte temporale di 3 anni e considerando tre differenti scenari di copertura vaccinale e due fonti differenti di dati di input per il rischio di ospedalizzazione [44, 45].
| Risultati nello scenario senza vaccinazione | Risultati nello scenario con vaccinazione mediante vaccino adiuvato RSVPreF3 OA | |||
|---|---|---|---|---|
| Copertura vaccinale 13,3% | Copertura vaccinale 75% | Copertura vaccinale 95% | ||
| Popolazione HR di età ≥ 60 anni | 10.536.683 | |||
| Popolazione vaccinata con vaccino adiuvato RSVPreF3 OA | 1.401.379 | 7.902.512 | 10.009.849 | |
| Risultati su un orizzonte temporale di 3 anni | ||||
| Dati sul rischio di ospedalizzazione da Fleming et al 2015 [45] | ||||
| Casi RSV-ARI | 1.730.287 | 95.468 | 538.354 | 681.916 |
| Casi RSV-LRTD | 823.617 | 62.582 | 352.907 | 447.016 |
| Visite ambulatoriali per eventi RSV-LRTD | 536.389 | 40.757 | 229.834 | 291.124 |
| Uso di antibiotici a causa di eventi RSV-LRTD | 557.892 | 42.431 | 239.272 | 303.078 |
| Accessi al Pronto Soccorso per RSV-LRTD | 41.181 | 3.129 | 17.645 | 22.351 |
| Ricoveri per RSV-LRTD | 183.794 | 13.984 | 78.860 | 99.889 |
| Ricoveri in Terapia Intensiva per RSV-LRTD | 29.775 | 2.265 | 12.775 | 16.182 |
| Polmoniti correlate a RSV-LRTD | 200.275 | 15.257 | 86.038 | 108.982 |
| Complicazioni di asma/BPCO correlate a RSV-LRTD | 365.314 | 27.712 | 365.314 | 197.944 |
| Morti per RSV | 22.278 | 1.703 | 9.601 | 12.181 |
| Costi sanitari diretti relativi a eventi e complicanze da RSV-LRTD | 835.594.454 € | 64.126.996 € | 361.618.398 € | 458.049.971 € |
| Dati sul rischio di ospedalizzazione da Osei-Yeboah et al. 2024 [44] | ||||
| Casi RSV-ARI | 1.729.375 | 95.379 | 537.849 | 681.275 |
| Casi RSV-LRTD | 823.182 | 62.539 | 352.666 | 446.711 |
| Visite ambulatoriali per RSV-LRTD | 536.106 | 40.730 | 229.678 | 290.925 |
| Uso di antibiotici per RSV-LRTD | 557.575 | 42.400 | 239.096 | 302.855 |
| Accessi al Pronto Soccorso per RSV-LRTD | 41.159 | 3.127 | 17.633 | 22.336 |
| Ricoveri per RSV-LRTD | 298.752 | 22.758 | 128.337 | 162.560 |
| Ricoveri in terapia intensive per RSV-LRTD | 43.398 | 3.687 | 20.791 | 26.335 |
| Polmoniti correlate a RSV-LRTD | 200.139 | 15.244 | 85.963 | 108.886 |
| Complicanze di asma/BPCO correlate a RSV-LRTD | 365.153 | 27.696 | 156.183 | 197.831 |
| Morti per RSV | 38.581 | 2.952 | 16.645 | 21.083 |
| Costi sanitari diretti relativi ad eventi e complicanze da RSV-LRTD | 1.291.055.544 € | 99.192.288 € | 559.355.009 € | 708.516.345 € |
Il numero necessario da vaccinare (NNV) con una singola dose del vaccino adiuvato RSVPreF3 OA per prevenire un evento RSV-LRTD nella popolazione HR di età ≥ 60 anni è pari a 22.
La Figura 5 mostra i risultati dell’UDSA per il numero di casi di RSV-ARI evitati con la vaccinazione con il vaccino adiuvato RSVPreF3 OA in persone di età ≥ 75 anni. Gli input per i tassi in diminuzione e il picco di efficacia del vaccino hanno avuto gli effetti maggiori sui risultati.
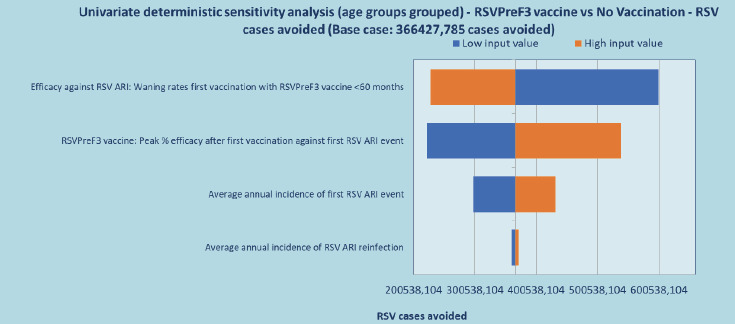
Risultati dell’analisi di sensibilità deterministica univariata per il numero previsto di casi di RSV-ARI evitati vaccinando con il vaccino adiuvato RSVPreF3 OA, persone di età ≥ 75 anni in Italia, in un orizzonte temporale di 3 anni e considerando una copertura vaccinale del 75%.
I risultati UDSA per il numero di casi RSV-ARI evitati nella popolazione HR di età ≥ 60 anni sono riportati, per l’analisi che utilizza i dati sul rischio di ospedalizzazione riportati da Fleming et al. [45] in Figura 6A, e per l’analisi che utilizza il rischio di ospedalizzazione riportato da Osei-Yeboah et al. [44], i risultati sono riportati nella Figura 6B. Entrambe le analisi dimostrano che i parametri che influenzano maggiormente l’impatto di sanità pubblica della vaccinazione con il vaccino adiuvato RSVPreF3 OA sono legati all’efficacia del vaccino stesso. In particolar modo, l’input che incide maggiormente sul risultato è il tasso di riduzione dell’efficacia vaccinale nel tempo (waning rate), seguito dal picco di efficacia vaccinale.
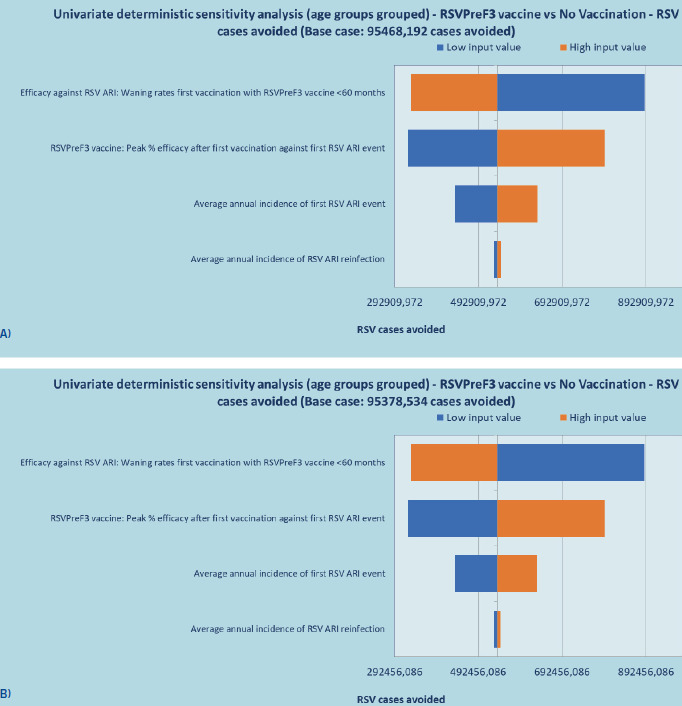
Risultati dell’analisi di sensibilità deterministica univariata per il numero di casi RSV-ARI evitati vaccinando con il vaccino adiuvato RSVPreF3 OA la popolazione italiana HR di età ≥ 60 anni, considerando un orizzonte temporale di 3 anni ed una copertura vaccinale del 75%, con dati sul rischio di ospedalizzazione provenienti da (A) Fleming et al. [45] e (B) Osei-Yeboah et al. [44].
Nelle precedenti sezioni, è stato analizzato l’impatto della vaccinazione anti-RSV in termini di esiti sulla salute pubblica. Contrariamente a quanto fatto in precedenza, in questa sezione, vengono descritti i risultati in termini di rapporto incrementale di costo-efficacia (ICER). I risultati del caso base di costo-efficacia, compresi i costi totali, gli anni di vita persi (LYs), la perdita di QALY e il costo incrementale per QALY per il vaccino RSVPreF3 rispetto a nessuna vaccinazione, sono presentati nella Tabella VII e si basano su tutti gli input descritti nelle precedenti sezioni. L’orizzonte temporale dell’analisi è di 3 anni e la prospettiva nel caso base considera esclusivamente quella del SSN. Nell’analisi del caso base, la vaccinazione con il vaccino adiuvato RSVPreF3 nella popolazione di età ≥ 75 anni in Italia è associata a un incremento di costi pari a € 615.701.990 e a un incremento di 35.491 QALY. Pertanto, l’ICER per il vaccino adiuvato RSVPreF3, rispetto a nessuna vaccinazione, è pari a 17.348 euro per QALY guadagnato. Tale valore è al di sotto della soglia comunemente accettata in Italia e proposta dal NICE (30.000 € per QALY) [46].
Risultati del caso-base.
| Costi totali (€) | LY loss | QALY loss | Inc. costs (€) | Inc. LY | Inc. QALYs | ICER (€/QALY) | |
|---|---|---|---|---|---|---|---|
| Vaccinazione con RSVPreF3 | € 1.094.875.269 | 76.390 | 72.586 | € 615.701.990 | -38.350 | -35.491 | € 17.348 |
| Nessuna vaccinazione | € 479.173.279 | 114,740 | 108,077 | - | - | - | - |
L’incremental cost-effectiveness plan (ICEP) e la cost-effectiveness acceptability curve (CEAC) sono presentate di seguito, rispettivamente nella Figura 7 e nella Figura 8. Le analisi probabilistiche hanno mostrato che i risultati dell’analisi sono associati a un certo grado di incertezza; tuttavia, il 96% e il 100% delle simulazioni si collocano al di sotto delle soglie di 30.000 euro e 50.000 euro di willingness to pay (WTP) rispettivamente, dimostrando che i risultati del rapporto costo-efficacia sono robusti all’incertezza parametrica.
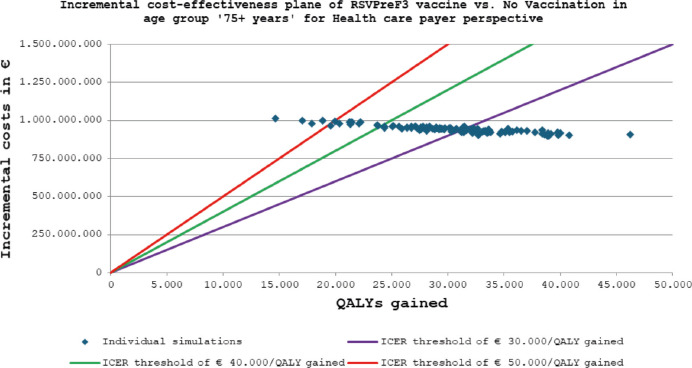
Incremental cost-effectiveness plane.
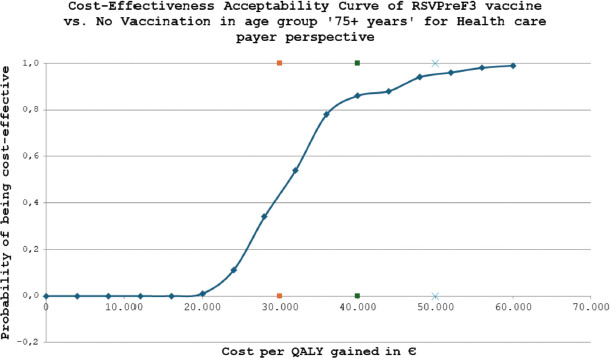
Cost-effectiveness acceptability curve.
I risultati delle analisi di scenario per la popolazione ad alto rischio di età ≥ 60 anni sono riportati in Tabella VIII. Si noti che, mentre il tasso di copertura vaccinale influisce sui costi totali, sui QALY e sui Life years gained (LYG), l’ICER non è influenzato dalla variazione del tasso di copertura, poiché i costi e gli esiti aumentano/diminuiscono proporzionalmente in linea con l’aumento/diminuzione del tasso di copertura vaccinale. Pertanto, mentre l’impatto sulla salute pubblica e l’impatto sul budget sono influenzati dalle variazioni del tasso di copertura vaccinale, non lo è l’analisi di costo-efficacia.
Risultati delle analisi di scenario nella popolazione ad alto rischio.
| Popolazione target | Scenario* | Copertura Vaccinale | Inc. costs (€) | Inc. LYG | Inc. QALYs | ICER (€/QALY) |
|---|---|---|---|---|---|---|
| Caso Base (popolazione generale, 75+) | € 615.701.990 | -38.350 | -35.491 | € 17.348 | ||
| Popolazione HR | Fleming et al. (age 60+) [45] | 13,30% | € 198.307.529 | -15.324 | -14.163 | € 14.002 |
| 75,00% | € 1.118.275.538 | -86.413 | -79.864 | € 14.002 | ||
| 95,00% | € 1.461.482.348 | -109.456 | -101.161 | € 14.002 | ||
| Osei-Yeboah et al. (age 60+) [44] | 13,30% | € 163.242.236 | -24.972 | -22.425 | € 7.280 | |
| 75,00% | € 920.538.927 | -140.822 | -126.455 | € 7.280 | ||
| 95,00% | € 1.166.015.974 | -178.375 | -160.176 | € 7.280 | ||
Questo capitolo riassume la prima ed unica valutazione, ad oggi disponibile, del potenziale impatto sulla salute pubblica di un programma di vaccinazione con una singola dose del vaccino adiuvato RSVPreF3 OA nella popolazione anziana italiana, con un focus anche sulla popolazione over 60 ad alto rischio. I risultati della nostra analisi dimostrano che vaccinando il 56,7% – che è il tasso di vaccinazione contro l’influenza nella stagione 2022-2023 negli adulti di età pari o superiore a 65 anni – degli adulti di età ≥ 75 anni si potrebbero evitare 277.019 casi di RSV-ARI, 180.967 casi di RSV-LRTD e 33.298 ricoveri correlati a RSV, con una riduzione stimata di € 157.755.358 dei costi sanitari diretti, rispetto alla non vaccinazione, in un orizzonte temporale di 3 anni, corrispondente a tre stagioni consecutive di RSV. Riduzioni maggiori sarebbero possibili con tassi di copertura più elevati. Ci si aspetta, infatti, che la vaccinazione del 75% della popolazione di età ≥ 75 anni prevenga 366.428 eventi di RSV-ARI, 239.375 casi di RSV-LRTD e 44.045 ricoveri correlati a RSV, riducendo i costi sanitari diretti di € 208.671.109; invece, con una copertura vaccinale del 95% si potrebbero evitare, secondo le stime ottenute dalla nostra analisi, 464.142 casi di RSV-ARI, 303.208 casi di RSV-LRTD, 55.790 ricoveri correlati a RSV, riducendo i costi sanitari diretti di € 264.316.738.
Nella nostra analisi è stato studiato anche il potenziale impatto sulla salute pubblica della vaccinazione con il vaccino adiuvato RSVPreF3 OA nella popolazione italiana ≥ 60 anni ad alto rischio (HR). Considerando, in questa popolazione target, un tasso di copertura del 13,3% – che è il tasso di vaccinazione antinfluenzale nella stagione 2022-2023 negli adulti di età compresa tra 45 e 64 anni – si potrebbero evitare, in un orizzonte temporale di 3 anni, 95.468 casi di RSV-ARI, 62.582 casi di RSV-LRTD e 13.984 ricoveri correlati a RSV, con una riduzione dei costi sanitari diretti pari a € 64.126.996, utilizzando i dati sul rischio di ospedalizzazione riportati da Fleming et al. [45] (scenario conservativo). Utilizzando, invece, i dati sul rischio di ospedalizzazione riportati da Osei-Yeboah et al. [44] (scenario ottimistico), e considerando una copertura vaccinale del 13,3%, la vaccinazione potrebbe evitare 95.379 casi di RSV-ARI, 62.539 casi di RSV-LRTD e 22.758 ricoveri correlati a RSV, con una riduzione dei costi sanitari diretti pari a € 99.192.288. Il numero di eventi evitati e la riduzione dei costi sanitari diretti sarebbero maggiori con tassi di copertura vaccinale più elevati, indipendentemente dai dati sul rischio di ospedalizzazione utilizzati.
Questi risultati indicano che il raggiungimento di un elevato tasso di copertura vaccinale rappresenta un obiettivo fondamentale per l’implementazione ottimale di un programma di vaccinazione con il vaccino adiuvato RSVPreF3 OA in Italia, in entrambe le popolazioni considerate in questa analisi. Inoltre, la co-somministrazione del vaccino anti-RSV insieme con la vaccinazione contro l’influenza stagionale potrebbe favorire una maggiore adesione alla vaccinazione anti-RSV da parte della popolazione eleggibile, impattando positivamente anche sul sistema organizzativo.
Per quanto concerne, invece, l’analisi di costo efficacia del caso base relativa alla popolazione italiana di età ≥ 75 anni è stato dimostrato che l’ICER per il vaccino adiuvato RSVPreF3, rispetto alla non vaccinazione, risulta essere pari a €17.348 per QALY guadagnato. Tale valore è al di sotto della soglia comunemente accettata in Italia (30.000 € per QALY). La vaccinazione con il vaccino adiuvato RSVPreF3 risulta essere costo-efficace anche nella popolazione di età ≥60 anni HR, con valori di ICER pari a € 14.002 – considerando lo scenario conservativo che utilizza i dati di Fleming et al. 2015 [45] – o di € 7.280 – nello scenario ottimistico che utilizza i dati dello studio di Osei-Yeboah et al. 2024 [44] – per QALY guadagnato.
La nostra analisi, tuttavia, presenta una serie di limitazioni. In primo luogo, la sotto diagnosi dell’infezione da RSV è un problema riconosciuto dalla comunità scientifica internazionale [14] e pertanto i dati di incidenza disponibili in letteratura ed utilizzati per il popolamento del modello economico potrebbero aver sottostimato il reale carico della malattia correlata all’RSV. In secondo luogo, i dati di incidenza disponibili ed utilizzati nel modello non erano stratificati per età e, pertanto, lo stesso tasso di incidenza è stato applicato a tutte le fasce di età considerate. Ciò potrebbe non riflettere la situazione reale se consideriamo che la suscettibilità all’infezione da RSV varia in rapporto all’età. Pertanto, dati più dettagliati sull’incidenza dell’infezione da RSV sarebbero preziosi per analisi future. In terzo luogo, non erano disponibili dati epidemiologici sul burden dell’RSV specifici per il setting nazionale, soprattutto dati sul rischio di ospedalizzazione, sui ricoveri in terapia intensiva o sull’uso di antibiotici. Sono stati, pertanto, utilizzati dati provenienti da altri contesti (Stati Uniti per il rischio di ospedalizzazione, Norvegia per i ricoveri in terapia intensiva) o riferiti ad altri agenti patogeni (metapneumovirus umano per l’uso di antibiotici), al fine colmare queste lacune nei dati. Il problema dell’indisponibilità di dati è stato riscontrato anche per la popolazione ≥ 60 anni HR. L’unico parametro per il quale siamo stati in grado di identificare dati specifici per questa popolazione target è stato il tasso di ospedalizzazione, utilizzato anche per aggiustare il tasso di mortalità. Ovviamente la disponibilità di dati specifici per il setting italiano, riferiti sia alla popolazione anziana che a quella ad alto rischio, consentirebbe di aggiornare l’analisi per produrre risultati più precisi. In quarto luogo, un modello statico, come quello utilizzato in questa analisi, non consente di valutare gli effetti indiretti della vaccinazione. L’immunità di comunità, infatti, può essere inclusa e valutata solo nei modelli dinamici e, pertanto, la sua esclusione da questa analisi potrebbe aver sottostimato il potenziale impatto sulla salute pubblica della vaccinazione con il vaccino adiuvato RSVPreF3 OA. Inoltre, a causa della natura statica del modello, i soggetti inclusi nell’analisi non potevano passare dall’evento di transizione URTD a quello LRTD, mentre nel mondo reale i casi di URTD possono progredire a LRTD e viceversa. Ciò potrebbe aver determinato una sottostima di alcuni eventi correlati ad RSV nel nostro modello. Ancora, utilizzando un approccio conservativo, è stato ipotizzato nella nostra analisi che i casi di RSV-URTD non comportino alcun rischio di mortalità aggiuntivo e che la mortalità correlata a RSV si applichi solo nei casi di RSV-LRTD; è stato anche ipotizzato che i casi di RSV-URTD non si associno a cure mediche e quindi non comportino alcun utilizzo di risorse sanitarie.
In quinto luogo, sempre per mantenere un approccio conservativo per l’analisi, per i dati di efficacia del vaccino adiuvato RSVPreF3 OA, utilizzato nel modello, è stato considerato un valore di massima efficacia del vaccino e un valore di declino mensile (ossia una diminuzione in punti percentuali dell’efficacia del vaccino ogni mese), con input separati per RSV-ARI e RSV-LRTD. Questi valori sono stati calcolati, sulla base dei dati dello studio clinico di Fase III AReSVi-006 nel corso di due stagioni consecutive [22]. Tuttavia, i dati dello studio AReSVi-006 [22] mostrano come una dose del vaccino adiuvato RSVPreF3 sia in grado di fornire protezione per due stagioni consecutive, e le analisi di regressione precedentemente pubblicate indicano una sostanziale protezione residua durante la terza stagione [20, 21].
Infine, questa analisi è stata condotta solo secondo la prospettiva del Servizio Sanitario Nazionale (SSN) e, pertanto, sarebbero necessarie ulteriori analisi per valutare l’impatto sulla salute pubblica della vaccinazione con il vaccino adiuvato RSVPreF3 OA considerando anche la prospettiva sociale e, quindi, l’impatto sui costi indiretti correlati all’RSV.
La presente analisi di costo-efficacia ha offerto uno sguardo approfondito sull’impatto economico e sulla efficacia della vaccinazione RSVPreF3, evidenziando come questa rappresenti un investimento vantaggioso per la salute pubblica. Attraverso i vari scenari, sia per la popolazione anziana che per quella ad alto rischio, è emerso chiaramente che l’ICER del vaccino RSVPreF3 si mantiene costantemente al di sotto delle soglia di accettabilità comunemente riconosciuta in Italia, dimostrando un notevole valore aggiunto in termini di QALY guadagnati rispetto alla non vaccinazione. L’analisi di sensibilità e le curve di accettabilità della cost-effectiveness hanno ulteriormente rafforzato la robustezza di questi risultati, confermando la sostenibilità di tale strategia vaccinale anche in presenza di incertezze parametriche. In conclusione, il vaccino RSVPreF3 non solo si conferma un’opzione efficace per migliorare la qualità della vita e ridurre la mortalità tra le fasce vulnerabili della popolazione, ma rappresenta anche un’alternativa economicamente vantaggiosa (profilo di costo-efficacia favorevole) per il SSN.
I risultati di questa analisi indicano che un programma di vaccinazione che utilizza una dose del vaccino adiuvato RSVPreF3 OA nella popolazione di età ≥ 75 anni e nella popolazione HR ≥ 60 anni, offre il potenziale per una sostanziale riduzione del carico di malattia associato all’RSV negli anziani in Italia e potenziali riduzioni dei costi sanitari diretti per il SSN. Questi risultati potrebbero essere utili per supportare i policy-maker e i professionisti sanitari nel prendere decisioni più consapevoli sulla vaccinazione contro l’RSV in Italia.
Scopo del presente capitolo è valutare gli aspetti strategici che dovranno essere presi in considerazione per valutare l’offerta della vaccinazione anti-RSV alla popolazione adulta e anziana in Italia.
Sono stati raccolti e valutati i seguenti documenti:
position papers e raccomandazioni internazionali attualmente adottati sulla vaccinazione anti-RSV per la popolazione adulta e anziana nel mondo;
il Piano Nazionale Prevenzione Vaccinale 2023-2025;
documenti inerenti ai possibili criteri da prendere in considerazione ed applicare per valutare l’introduzione di nuovi vaccini o strategie vaccinali nel calendario vaccinale.
Inoltre, è stata effettuata una SWOT analisi per valutare i punti di forza (Strengths), le debolezze (Weaknesses), le opportunità (Opportunities) e le minacce (Threats) dell’introduzione della vaccinazione anti-RSV nel calendario vaccinale.
A seguito della disponibilità dei nuovi vaccini contro l’RSV a livello mondiale, diversi Paesi e organismi internazionali hanno fornito le loro raccomandazioni sull’utilizzo di questi interventi preventivi disponibili per la popolazione adulta.
Negli Stati Uniti d’America, il 21 giugno 2023, il Comitato consultivo sulle pratiche di immunizzazione (ACIP) dei Centri per il controllo e la prevenzione delle malattie (CDC) ha raccomandato che gli adulti di età pari o superiore a 60 anni possano ricevere una singola dose di vaccino contro il virus respiratorio sinciziale (RSV), utilizzando il processo decisionale clinico condiviso (PDC / SCDM - shared clinical decision-making) [1].
L’ACIP fornisce consulenza e guida al Direttore del CDC riguardo all’uso dei vaccini e dei relativi agenti per il controllo delle malattie prevenibili mediante vaccinazione nella popolazione degli Stati Uniti. Le raccomandazioni formulate dall’ACIP vengono esaminate dal direttore del CDC e, se adottate, vengono pubblicate come raccomandazioni ufficiali nel Morbidity and Mortality Weekly Report (MMWR) [2].
Il significato di questo tipo di raccomandazione SCDM consiste nel fatto che non esiste una decisione predefinita nel senso che la decisione se vaccinare o meno un individuo può essere presa considerando diversi fattori, tra cui le migliori evidenze disponibili (Evidence-based), le caratteristiche individuali del soggetto ricevente e le proprietà del vaccino stesso in termini di efficacia e di sicurezza, ma anche il potere discrezionale del servizio sanitario di un determinato Paese [3].
Attraverso tale processo gli operatori sanitari e i loro pazienti dovrebbero avviare un dialogo per determinare i vantaggi della vaccinazione contro l’RSV. Questo tipo di raccomandazione è diverso dalle consuete raccomandazioni vaccinali basate sull’età e sul rischio, per le quali la decisione predefinita è quella di vaccinare tutte le persone appartenenti ad una specifica fascia di età o ad un gruppo a rischio. Secondo questa raccomandazione, per la vaccinazione contro l’RSV, la decisione di vaccinare un paziente dovrebbe essere basata più che altro sul singolo individuo e derivare dalla discussione informata tra il paziente e l’operatore sanitario (ovvero chiunque somministri i vaccini, come ad esempio medici medicina generale (MMG), specialisti, assistenti sanitari, infermieri e farmacisti). In definitiva la decisione di somministrare la vaccinazione RSV dovrebbe essere guidata dallo stato di salute del paziente, dalle sue caratteristiche personali, dal rischio di sviluppare una forma severa della malattia da RSV, ma anche dal giudizio clinico dell’operatore sanitario e dal profilo di sicurezza dei vaccini anti-RSV. Pertanto, questo tipo di raccomandazione per la vaccinazione RSV ha lo scopo di consentire agli operatori sanitari e ai pazienti la massima flessibilità in base a ciò che è meglio per ogni singolo individuo [4]. Uno dei rischi delle raccomandazioni condizionali, come l’SCDM, è che negli anziani tali raccomandazioni potrebbero non aumentare sostanzialmente l’adesione alla vaccinazione.
Le persone di età ≥ 60 anni che sono a più alto rischio di sviluppare una forma grave di malattia da RSV includono soggetti con condizioni croniche, come le malattie polmonari, inclusa la malattia polmonare cronica ostruttiva (BPCO) e l’asma; le malattie cardiovascolari, come insufficienza cardiaca e malattia coronarica; una compromissione immunitaria moderata o grave (attribuibile a una condizione medica o al trattamenti con farmaci immunosoppressori); il diabete mellito; condizioni neurologiche o neuromuscolari; disturbi renali, epatici ed ematologici. Sono inoltre a rischio di sviluppare una forma grave di malattia da RSV anche gli adulti di età ≥ 60 anni residenti in case di cura e altre strutture sanitarie di lungo termine. Pertanto, gli adulti di età maggiore o uguale a 60 anni, con almeno una condizione di rischio, possono ricevere la vaccinazione utilizzando un processo decisionale clinico condiviso dato il potenziale beneficio che potrebbero ricevere dalla vaccinazione [1].
Attualmente la vaccinazione contro l’RSV è approvata e raccomandata per la somministrazione in dose singola e non esistono al momento prove sufficienti per determinare la necessità di una seconda dose di vaccino. Inoltre, è ritenuta accettabile la co-somministrazione di vaccini RSV con i vaccini antinfluenzali durante la stessa seduta vaccinale, mentre mancano dati per la co-somministrazione con altri vaccini dell’età adulta (vaccini COVID-19, anti-pneumococco, anti-dTpa, anti-Herpes Zoster ricombinante) [1].
Il Comitato congiunto per la vaccinazione e l’immunizzazione (JCVI) è un comitato di esperti indipendente con base statutaria in Inghilterra e Galles che fornisce consulenza ai governi del Regno Unito su questioni relative all’immunizzazione. JCVI riconosce che esiste un carico significativo di malattia da RSV nella popolazione del Regno Unito e un bisogno insoddisfatto di sanità pubblica che ha un impatto considerevole sul Servizio Sanitario Nazionale (SSN) nei mesi invernali. JCVI ha espresso una dichiarazione in merito ad un programma di immunizzazione contro l’RSV che è stato condiviso con il Dipartimento di sanità e assistenza sociale (DHSC: Department of Health & Social Care) per prendere in considerazione lo sviluppo di una politica di interventi mirati a contrastare l’impatto della circolazione dell’RSV e per consentire un tempo sufficiente per la pianificazione necessaria per un potenziale programma di immunizzazione contro l’RSV. JCVI da diversi anni sta monitorando i vaccini in sviluppo contro l’RSV che potrebbero proteggere anche gli anziani contro l’infezione e la malattia da RSV. Nel 2023 si sono svolte una serie di riunioni del sottocomitato JCVI per l’RSV in cui sono state valutate le prove dei produttori sull’efficacia, la sicurezza e la durata della protezione di questi prodotti vaccinali insieme ai dati clinici ed epidemiologici sull’impatto dell’RSV negli anziani. È stata inoltre considerata l’erogazione del programma di vaccinazione, includendo la capacità di garantire un’elevata adesione vaccinale in diversi gruppi di popolazione e contesti clinici. Sono stati analizzati i modelli sviluppati dalla London School of Hygiene and Tropical Medicine per valutare l’impatto delle potenziali strategie di immunizzazione. In tali valutazioni il rapporto di costo-efficacia risulta un fattore chiave nelle riflessioni del JCVI ed è utilizzato per garantire che le risorse limitate del servizio sanitario vengano utilizzate per massimizzare la salute della popolazione [5]. Il comitato ha rilevato che un programma di vaccinazione contro l’RSV per gli adulti di età pari o superiore a 75 anni potrebbe essere economicamente vantaggioso a un prezzo potenziale che combini il costo del prodotto e della sua somministrazione, sottolineando che questo sarebbe influenzato dalla protezione pluriennale da una singola dose.
Il 22 giugno 2023 il JCVI del Regno Unito ha raccomandato un programma di vaccinazione per RSV per gli anziani di età pari o superiore a 75 anni. JCVI attualmente è favorevole a una campagna una tantum come strategia per questo programma con un’offerta iniziale che copra diverse coorti di età e poi un programma di routine per coloro che compiono 75 anni, la cui erogazione e implementazione saranno determinate attraverso un’ulteriore consultazione tra il SSN inglese, DHSC, UK Health Security Agency e le amministrazioni decentrate. JCVI attualmente non ha una preferenza tra i prodotti vaccinali esaminati poiché l’efficacia risulta comparabile e non esistono studi comparativi che consentano un confronto diretto tra i vaccini disponibili e, quindi, tutti i vaccini autorizzati sul mercato, possono essere considerati in questo momento ugualmente adatti per un programma di immunizzazione verso l’RSV della popolazione adulta più anziana. In conclusione, JCVI suggerisce di sviluppare un programma di immunizzazione contro l’RSV, che sia economicamente vantaggioso, sia per i neonati che per gli anziani [5].
Il 5 settembre 2023, si è espresso anche il Ministero della Salute austriaco che ha raccomandato la vaccinazione contro l’RSV negli anziani di età pari o superiore a 60 anni. Inoltre, sulla base di considerazioni teoriche, la vaccinazione potrebbe essere presa in considerazione anche per persone di età pari o superiore a 18 anni che presentano determinati fattori di rischio. Secondo quanto riportato nel Piano nazionale di vaccinazione austriaco potrebbe essere sensato, infatti, somministrare il vaccino RSV anche prima dei 60 anni in persone immunocompromesse o che hanno una malattia polmonare preesistente, ma i dati attualmente disponibili sono pochi e quindi l’indicazione a vaccinare dovrebbe essere data dopo una precisa valutazione del rapporto rischio-beneficio da parte dei MMG o degli specialisti (tenendo presente che si tratterebbe di un uso off-label) [6].
Considerando l’elevata morbosità e mortalità associata all’infezione da RSV tra i pazienti con fattori di rischio, la mancanza di una terapia antivirale efficace ma anche i dati limitati sull’efficacia del vaccino sugli esiti gravi, soprattutto nei pazienti fragili, in Belgio, il 6 settembre 2023 il Consiglio Superiore della Sanità (CSS) ha concluso che la vaccinazione contro l’RSV dovrebbe essere offerta su base individuale ai pazienti ad alto rischio a partire dai 60 anni di età e con almeno un fattore di rischio di sviluppare una forma grave di malattia da RSV. Per questi soggetti il CSS belga raccomanda una singola dose di vaccino RSV per via intramuscolare [7].
Il 12 settembre 2023, l’istituto norvegese di sanità pubblica si è espresso con la raccomandazione di vaccinare contro l’RSV gli anziani di età pari o superiore a 60 anni, con patologie di base sottostanti [8].
In Svezia la vaccinazione anti-RSV è raccomandata per la stagione 2023/2024 per le persone di età pari o superiore a 75 anni, avendo un rischio più elevato di infezione respiratoria grave causata da RSV, ma anche nei soggetti dai 60 anni di età con alcune malattie di base che aumentano il rischio di problemi cardiaci e polmonari, insufficienza epatica o renale, diabete [9].
A partire da ottobre 2023 anche il Ministero della Salute polacco ha raccomandato la vaccinazione contro l’RSV per gli adulti di età superiore ai 60 anni particolarmente gravati da malattie croniche (asma bronchiale, broncopneumopatia cronica ostruttiva e altre malattie respiratorie croniche, cardiopatia ischemica, insufficienza cardiaca e, aritmie cardiache, diabete, malattie renali croniche), immunodeficienza e residenti in casa di cura [10].
In Irlanda sono in fase di revisione i dati sui vaccini anti-RSV attualmente disponibili per gli adulti per una loro possibile introduzione nel programma di vaccinazione nazionale. Il Royal College dei medici d’Irlanda suggerisce l’introduzione della vaccinazione RSV a partire dai soggetti di età maggiore di 65 anni [11, 12].
A queste raccomandazioni emanate dalle autorità sanitarie dei singoli Paesi (Fig. 1) si aggiungono le raccomandazioni che le Società Scientifiche a livello nazionale hanno espresso attraverso documenti di indirizzo e linee guida.
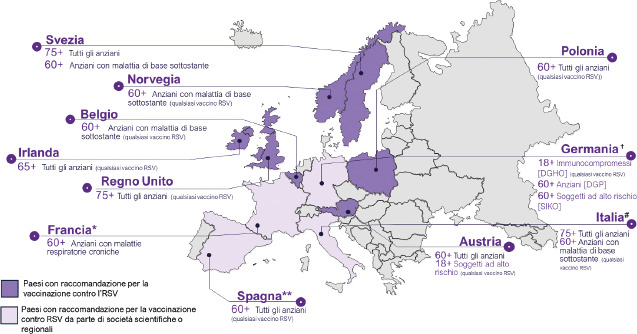
Raccomandazioni per la vaccinazione RSV in Europa (gennaio 2024).
In Francia, ad esempio, le Società scientifiche che si occupano di malattie respiratorie hanno fornito indicazioni vaccinali aggiornate per i pazienti affetti da malattie respiratorie croniche, includendo anche la vaccinazione anti-RSV per i soggetti di età pari o superiore a 60 anni e con malattie respiratorie croniche (Società di pneumologia di lingua francese - French Language Pneumology Society (SPLF); Centro di riferimento per le malattie polmonari rare - Reference centre for rare pulmonary diseases (ORPHA-LUNG); Rete sanitaria francese delle malattie rare: sezione di malattie respiratorie rare (RespiFIL); Gruppo francese per la ricerca e la formazione sulle malattie infettive respiratorie - French Group for Research and Education in Respiratory Infectious Diseases (GREPI) [13-15].
In Germania diverse Società scientifiche hanno fornito una raccomandazione sull’utilizzo dei vaccini anti-RSV. In particolare, la Società tedesca di ematologia e oncologia (Deutsche Gesellschaft für Hämatologie und Onkologie - DGHO) raccomanda la vaccinazione degli immunocompromessi a partire dai 18 anni di età; la Società Scientifica tedesca di Pneumologia (Deutsche Gesellschaft für Pneumologie - DGP) raccomanda la vaccinazione RSV per gli adulti a partire dai 60 anni e la Commissione vaccini per la Sassonia (Sächsische Impfkommission - SIKO) la raccomanda per tutti i soggetti ad elevato rischio di complicanze a partire dai 60 anni [16-18].
In Spagna, il comitato scientifico per COVID-19 e agenti patogeni emergenti dell’Illustre Collegio Ufficiale dei Medici di Madrid (ICOMEM) raccomanda la vaccinazione RSV agli anziani a partire dai 60 anni di età [19].
Infine, a novembre 2023 l’Iniziativa Globale per la broncopneumopatia cronica ostruttiva (GOLD) ha pubblicato il rapporto annuale che rappresenta una linea guida clinica per la diagnosi e la gestione della BPCO in tutto il mondo e tra le novità che vengono riportate viene raccomandata con evidenza di tipo A la vaccinazione RSV in tutti i soggetti dai 60 anni che presentano BPCO [20].
In Figura 1 vengono riportate le raccomandazioni per la vaccinazione RSV per gli adulti in Europa, ma la situazione è in continuo aggiornamento e nei prossimi mesi anche le autorità sanitarie di altri Paesi, come l’Italia, si dovranno esprimere per fornire le proprie raccomandazioni e valutare l’inserimento dei nuovi vaccini anti-RSV nei loro programmi di immunizzazione.
Il 2 agosto 2023 la Conferenza permanente per i rapporti tra lo Stato, le Regioni e le Province Autonome di Trento e di Bolzano ha approvato il nuovo Piano Nazionale Prevenzione Vaccinale 2023-2025 (PNPV 2023-2025) [21].
Nel PNPV 2023-2025 per i soggetti adulti e anziani sono raccomandate le seguenti vaccinazioni:
la vaccinazione antinfluenzale annuale, che è raccomandata agli adulti a partire dal compimento di 60 anni di età, in base alle indicazioni annuali emanate dal Ministero della Salute nella Circolare per la prevenzione e il controllo dell’influenza;
la vaccinazione anti-pneumococcica, che è offerta prioritariamente alla coorte dei soggetti di 65 anni di età ed eventualmente integrata con una schedula sequenziale che prevede prima la somministrazione del vaccino anti-pneumococcico coniugato e successivamente del vaccino polisaccaridico (in funzione del tipo di vaccino coniugato utilizzato);
la vaccinazione anti-Herpes Zoster, che è raccomandata alla coorte dei soggetti di 65 anni di età con la somministrazione di una dose o due dosi in base al tipo di vaccino utilizzato;
la vaccinazione di contro difterite, tetano e pertosse (dTpa) ogni 10 anni, come per tutta la popolazione > 18 anni [21].
Allo stato attuale, così come è stato emanato ad agosto 2023, il Calendario Nazionale Vaccinale del PNPV 2023-2025 non prevede nessuna raccomandazione della vaccinazione anti-RSV per i soggetti di età ≥65 anni di età.
Occorre tuttavia considerare che, le raccomandazioni previste dal Calendario Nazionale Vaccinale del PNPV 2023-2025 hanno l’obiettivo di aggiornare il calendario vaccinale contenuto nel PNPV 2017-2019 e specificatamente di ottimizzare l’organizzazione delle sedute vaccinali, uniformare l’offerta vaccinale delle Regioni e Province Autonome italiane, adattandosi alle nuove caratteristiche di alcuni vaccini e alla disponibilità di nuovi vaccini [21].
In questa ottica nel PNPV 2023-2025 viene previsto di effettuare periodicamente un aggiornamento del calendario vaccinale nazionale con un percorso distinto sia nei tempi che nei contenuti dal PNPV stesso in base all’emergere di nuove esigenze, quali le mutazioni della situazione epidemiologica, la disponibilità di nuove evidenze scientifiche, la disponibilità di nuovi prodotti vaccinali o di profilassi pre-esposizione (come, ad esempio gli anticorpi monoclonali) o di nuove indicazioni fornite dalle autorità competenti. Pertanto, il calendario vaccinale del PNPV è pubblicato separatamente dal PNPV stesso ed è previsto un periodico aggiornamento o conferma delle raccomandazioni incluse [21].
Vista la recente autorizzazione e disponibilità di nuovi vaccini anti-RSV per i soggetti anziani [22-26] e l’incremento delle conoscenze epidemiologiche e del disease burden dell’RSV in Italia e nel mondo in questa fascia di età, nell’aggiornamento del prossimo calendario vaccinale dovrebbe essere adeguatamente valutata la possibilità di introduzione della raccomandazione vaccinale anti-RSV nei soggetti anziani.
Nel processo decisionale relativo all’aggiornamento del calendario vaccinale dovrà essere tenuto in considerazione anche che i vaccini, oltre ai benefici diretti e indiretti loro insiti, sono stati ampiamente riconosciuti anche come uno strumento importante per combattere la resistenza agli antibiotici [21].
In particolare, i vaccini possono contribuire a contrastare l’antibiotico-resistenza in maniera diretta o indiretta. Nel primo caso, vaccinando direttamente contro le infezioni batteriche se ne previene la diffusione e, conseguentemente, si riduce anche l’utilizzo di antibiotici. Tuttavia, anche la somministrazione di vaccini contro i virus (come quelli antinfluenzali e quelli contro l’RSV) può indirettamente essere utile per contrastare l’antibiotico resistenza. Infatti, vaccinando contro le infezioni virali è possibile contribuire al contenimento delle prescrizioni inappropriate degli antibiotici per infezione virali ma anche alla riduzione delle infezioni batteriche che si sovrappongono a quelle virali, con necessità di trattamento antibiotico [21, 27].
Nella valutazione della formulazione di raccomandazioni per il vaccino anti-RSV negli adulti e anziani sarà pertanto importante che tale valore aggiunto della vaccinazione sia preso in considerazione e che, quindi, tale strumento preventivo venga visto anche nell’ottica di contrasto alle infezioni correlate all’assistenza e all’antibiotico-resistenza a livello di Sanità Pubblica.
Per poter procedere ad una attenta valutazione per la raccomandazione della vaccinazione anti-RSV per gli adulti e anziani è imprescindibile la disponibilità di un adeguato sistema di monitoraggio delle malattie infettive e delle coperture vaccinali. Il PNPV 2023-2025, tra i vari obiettivi e strategie, individua la necessità di un miglioramento della attuale sorveglianza delle malattie prevenibili da vaccino. Infatti, la sorveglianza delle malattie infettive viene considerata uno strumento fondamentale per la Sanità Pubblica, permettendo di seguire nel tempo l’andamento e la distribuzione delle infezioni nella popolazione e, se necessario, di intervenire tempestivamente. In particolare, la sorveglianza delle malattie prevenibili da vaccinazione rappresenta la base conoscitiva necessaria per individuare e adottare le opportune azioni di prevenzione e controllo. Dall’altra parte lo stesso sistema di sorveglianza permette di monitorare l’efficacia e l’impatto degli interventi preventivi adottati e il loro tempestivo adeguamento in base ai cambiamenti epidemiologici [21].
In questa ottica il sistema di sorveglianza Influnet dalla stagione influenzale 2022-2023 ha iniziato a registrare e pubblicare i dati relativi ai casi di Sindromi Simil-Influenzali (ILI) attribuibili a RSV nelle diverse fasce di età. Infatti, per andare incontro all’esigenza di un percorso decisionale sugli interventi preventivi anti-RSV e alla sorveglianza del SARS-CoV-2 nella fase post-pandemica, il sistema di sorveglianza Influnet è stato ora potenziato nel sistema di sorveglianza integrata (epidemiologica e virologica) dei casi di sindromi simil-influenzali e dei virus respiratori RespiVirNet [28]. Se da una parte il sistema di monitoraggio delle infezioni respiratorie correlate all’RSV è già stato implementato, dall’altra nel momento in cui la vaccinazione anti-RSV dovesse venire raccomandata, il sistema di registrazione e valutazione delle coperture vaccinali dovrebbe essere quanto più tempestivo possibile per permettere attente valutazioni dell’impatto di questo intervento di prevenzione sia a livello della popolazione adulta e anziana, target del programma di vaccinazione, ma anche a livello di popolazione generale (nell’ottica di valutare anche un possibile impatto indiretto).
Nel nuovo PNPV 2023-2025 viene specificato che la disponibilità di nuovi vaccini o di nuove indicazioni per i vaccini già esistenti e utilizzati rappresenta un’aggiuntiva opportunità per la protezione del singolo individuo ma anche della collettività. Tuttavia, nell’implementazione di nuovi vaccini o di nuove strategie vaccinali possono insorgere problematiche a causa del maggior impegno finanziario da sostenere (acquisto di nuovi vaccini o di dosi aggiuntive di vaccini esistenti, formazione del personale, comunicazione e informazione al Pubblico, ecc.) e questioni di tipo organizzativo. Questi aspetti possono rallentare o frenare l’inserimento dei nuovi vaccini o di nuove raccomandazioni vaccinali nel calendario vaccinale [21].
Il percorso decisionale che porta all’introduzione di una nuova vaccinazione deve quindi soppesare tanti aspetti. Nel PNPV 2023-2025 si sottolinea la “mancata definizione di un processo decisionale standardizzato per l’inserimento delle nuove vaccinazioni nel calendario e dei relativi finanziamenti dedicati alla produzione di analisi indipendenti di costo-efficacia e di HTA che possano essere utilizzate ai fini della valutazione di nuove indicazioni nel calendario vaccinale da parte del NITAG e del Ministero della Salute” [21].
È tuttavia vero che in un precedente PNPV 2012-2014, al fine di operare delle scelte e razionalizzare l’impiego delle limitate risorse disponibili da parte del SSN massimizzando contestualmente i risultati di salute per la popolazione, viene indicata la necessità di stabilire dei “criteri chiari, robusti e condivisi” per supportare i processi decisionali per l’introduzione delle nuove tecnologie vaccinali nei programmi di prevenzione del SSN. L’Health Technology Assessment viene riconosciuto, quindi, come l’approccio valutativo che meglio risponde a queste esigenze valutative [29].
Che l’HTA sia l’approccio più corretto e trasparente per supportare il processo decisionale in ambito sanitario è stato confermato inoltre dal PNPV 2017-2019. In tale documento viene oltretutto sottolineato che proprio in ambito vaccinale questo approccio è importante e necessario perché le vaccinazioni sono un intervento di Sanità Pubblica effettuato sulle persone sane e il cui benefico è intangibile e non sempre adeguatamente percepito (assenza di malattia, riduzione dell’assistenza sanitaria e dei costi diretti e indiretti della malattia). Nella valutazione delle vaccinazioni, quindi, non si devono considerare solo i costi della vaccinazione ma devono essere valutati anche i benefici che esse comportano a breve e lungo termine, così come può essere evidenziato da un approccio di HTA [30].
Nonostante le criticità evidenziate nel PNPV 2023-2025 sulla mancanza di un processo decisionale standardizzato indipendente di HTA, l’importanza di tale approccio resta indiscutibile e supportata dall’introduzione del nuovo Regolamento (UE) 2021/2282 relativo alla valutazione delle tecnologie sanitarie e che modifica la direttiva 2011/24/UE [31]. Tale regolamento sottolinea l’importanza dell’HTA come strumento che garantisca l’introduzione ed utilizzo delle nuove tecnologie nell’ottica della sostenibilità e della promozione dell’innovazione per l’ottenimento dei migliori risultati per i pazienti. Le misure di prevenzione, tra cui i vaccini, rientrano tra le tecnologie sanitarie da sottoporre a valutazione mediante l’HTA. Per i domini clinici (il problema sanitario, la tecnologia sanitaria attuale, le caratteristiche tecniche della tecnologia sanitaria oggetto di valutazione, la sua sicurezza e l’efficacia clinica relativa) sono indicate azioni di valutazione congiunte e condivise (anche se non vincolanti) tra i Paesi europei, ma possono essere effettuate anche analisi cliniche complementari, se necessarie nel processo di HTA nel contesto nazionale. Dal momento che i Paesi europei sono responsabili della definizione della loro politica sanitaria e dell’organizzazione e della fornitura di servizi sanitari e di assistenza medica, le analisi non cliniche (il costo e la valutazione economica della tecnologia sanitaria, gli aspetti etici, organizzativi, sociali e giuridici) sono fortemente dipendenti dal contesto nazionale [31].
Per rispondere alle indicazioni del regolamento europeo dell’HTA, in Italia è stato emanato il Programma Nazionale di Health Technology Assessment dei dispositivi medici per il periodo 2023-2025. Tale documento ha l’obiettivo di programmare a livello nazionale la valutazione critica dell’introduzione delle tecnologie sanitarie nel contesto del SSN, con particolare riferimento ai dispositivi medici [32-34]. Tale programmazione ha permesso di ufficializzare e istituzionalizzare l’HTA nel processo decisionale delle tecnologie sanitarie in Italia, avvalendosi di finanziamenti indipendenti.
Visti i molti vaccini e le nuove piattaforme di immunizzazione che stanno ora arrivando sul mercato o che arriveranno presto in Italia, come quelli contro l’RSV, è auspicabile che tale percorso di istituzionalizzazione dell’HTA, attualmente applicabile solo ai dispositivi medici, sia esteso quanto prima anche al processo decisionale in ambito vaccinale.
Sicuramente, in base alle opinioni di esperti con diverse competenze professionali appartenenti alla comunità scientifica mondiale che si occupa di vaccini, sono quattro i valori di base (core values for vaccine evaluation) che devono essere fortemente tenuti in considerazione nella valutazione dei vaccini e nelle successive procedure decisionali in merito alla loro raccomandazione. Questi valori sono:
l’incidenza dei casi di malattia prevenuti all’anno;
la valutazione di “costo-efficacia” della vaccinazione (compresa l’analisi “costi-benefici” e “costi-utilità”);
la letalità della malattia;
la gravità della malattia (rischio di morbosità e mortalità) [35, 36].
Nell’ottica della valutazione dell’introduzione della raccomandazione vaccinale anti-RSV per gli adulti e anziani diventa, quindi, fondamentale raccogliere e valutare almeno questi dati e, in particolare, quelli sulla severità della malattia in queste specifiche fasce di popolazione.
Per capire bene e adeguatamente i benefici di una nuova vaccinazione occorre tuttavia individuare anche a pieno il valore totale della vaccinazione: oltre al valore tecnico, evidenziabile dall’HTA e dalle valutazioni economiche, diventa oggi sempre più importante valutare anche il valore personale, allocativo e sociale del nuovo vaccino o della nuova strategia vaccinale [37]. In particolare, per la vaccinazione anti-RSV è importante raccogliere gli outcomes clinici riportati direttamente dagli anziani (Patients Reported Outcomes, PRO) e le loro misure di esperienza (Patient-Reported Experience Measures, PREMs). Il coinvolgimento e l’empowerment dei cittadini è, infatti, alla base di un processo decisionale condiviso centrato sul cittadino stesso ed è fortemente correlato al suo stesso successo e impatto. Questo aspetto è particolarmente rilevante per la vaccinazione anti-RSV in quanto oggi il problema di salute correlato all’infezione da RSV e i nuovi vaccini disponibili sono poco conosciuti e soppesati dalla popolazione. Prenderne coscienza da parte della popolazione ma anche da parte degli operatori sanitari e dei decision-makers è preminente. Oltre ad avere autorizzato un vaccino efficace e sicuro è inoltre importante garantire l’accesso alla vaccinazione con una equità di offerta secondo criteri di appropriatezza e innovazione (valore allocativo). Infatti, il successo di un programma di vaccinazione dipende non solo dall’offerta gratuita e appropriata di un vaccino efficace e sicuro, ma anche dall’accettazione e dal facile accesso alla vaccinazione da parte della popolazione target. Infine, uno dei principali fattori di crescita economica e sociale di una nazione è rappresentato da una popolazione sana, in quanto il benessere fisico, psicologico e sociale permette di incrementare la produttività grazie ad una maggiore forza lavoro, retribuzioni più alte, maggiori consumo e risparmio [30]. Il valore sociale della vaccinazione, quindi, si riflette sul positivo impatto sul benessere, la produttività e la coesione sociale della popolazione, senza poi dimenticare la protezione indiretta e comunitaria dell’immunizzazione. Questi ultimi aspetti sociali sono evidenziabili anche quando la vaccinazione, come quella in oggetto, riguarda gli anziani, ovvero una fascia di popolazione che sta uscendo dal mondo del lavoro. Infatti, il ritorno di investimento di tre vaccinazioni (influenza, pneumococco and Herpes zoster) nella popolazione anziana in termini di impatto fiscale sono già stati dimostrati in Italia, rivelando che gli investimenti nella vaccinazione hanno prodotto benefici medi pro-capite fino al doppio del valore dell’investimento in termini di impatto fiscale e fino a sedici volte il valore in termini di perdita di produttività [38].
Tutto questo percorso valutativo della vaccinazione anti-RSV per gli adulti e anziani dovrà essere svolto in tempi brevi. Infatti, in generale il percorso decisionale che porta all’inclusione della vaccinazione nelle raccomandazioni nazionali e regionali richiede molto tempo. Tale processo decisionale parte da una richiesta di valutazione rivolta dal Ministero della Salute al National Immunization Technical Advisory Group (NITAG) [39], che procede alla raccolta delle evidenze scientifiche, al loro assessment e alla proposta di raccomandazioni finali. Il Ministero della Salute e le Conferenza Stato-regioni procedono quindi alla decisione finale e inclusione del nuovo vaccino nel calendario vaccinale, dopo aver ricevuto l’approvazione del Ministero dell’Economia e delle Finanze per la sostenibilità economica del programma vaccinale. In questo contesto la necessità di un consenso unanime delle regioni italiane prima di concedere una decisione finale positiva a livello nazionale e la mancata/scarsa disponibilità economica per l’implementazione della vaccinazione rappresentano le principali barriere ed ostacoli in questo percorso decisionale [40]. Ciò ha portato in passato ad un tempo di accesso della popolazione ad un vaccino dalla sua autorizzazione alla sua raccomandazione pari a 135 mesi (vaccino anti-rotavirus e anti-Herpes Zoster) [41].
Nell’ipotesi di poter beneficiare della vaccinazione anti-RSV per la stagione invernale 2024-2025 sarebbe quindi necessario accorciare i tempi del percorso decisionale, tenendo bene a mente anche i risvolti pratici-organizzativi che possono scaturire dall’emanazione di nuove raccomandazioni vaccinali. Infatti, per poter iniziare la vaccinazione anti-RSV negli anziani, insieme alla vaccinazione anti-influenzale, nell’autunno 2024 occorrerebbe che l’aggiornamento del calendario vaccinale avvenisse quanto prima in modo da permettere alle Regioni di organizzare il programma vaccinale e individuare il fabbisogno regionale e permettere alle aziende farmaceutiche di produrre e fornire i vaccini agli operatori sanitari. Tuttavia, vista la complessità del processo di valutazione e decisionale che porta all’emanazione delle raccomandazioni, l’aggiornamento del calendario vaccinale potrebbe richiedere dei tempi più lunghi di quelli disponibili per poter iniziare l’immunizzazione degli adulti anziani ad autunno 2024. In attesa dell’aggiornamento del calendario vaccinale potrebbe essere, quindi, utile l’emanazione in tempi rapidi di una circolare del Ministero della Salute che permetta alle Regioni e alle aziende farmaceutiche produttrici di vaccini di organizzare la loro attività, in attesa del completamento dell’aggiornamento del calendario vaccinale (Fig. 2).

Possibili tempistiche per l’emanazione di raccomandazioni per la vaccinazione RSV in Italia.
Il principale punto di forza dell’introduzione della raccomandazione vaccinale anti-RSV per gli anziani risiede nella disponibilità di vaccini che si sono dimostrati efficaci e sicuri. In base alle attuali evidenze scientifiche, l’efficacia risulta perdurare nel tempo e, pertanto, presumibilmente questa vaccinazione non necessiterà di somministrazioni annuali, alleggerendo le problematiche organizzative di somministrazione. Inoltre, per la durata della protezione, può essere somministrata in modo svincolato dalla stagionalità tipica della vaccinazione antinfluenzale. Comunque, la co-somministrabilità dei vaccini anti-RSV con altre vaccinazioni previste per l’anziano potrebbe favorirne la compliance. Dall’altra parte, le infezioni da RSV e le relative patologie sono un problema di salute attualmente non ben percepito da parte della popolazione adulta e anziana ma anche da parte degli operatori sanitari. Inoltre, i vaccini anti-RSV sono appena stati autorizzati e, pertanto, non sono ancora conosciuti da parte della popolazione target, così come dagli operatori sanitari. Questi punti di debolezza possono comunque essere superati con opportune campagne di informazione rivolte alla popolazione, di formazione degli operatori sanitari, anche mediante eventi con riconoscimento di Crediti formativi mediante il processo di Educazione Continua in Medicina e naturalmente la promozione della vaccinazione in tutte le opportune occasioni di contatto medico-paziente per valorizzare il processo decisionale clinico condiviso. Questa vaccinazione, tuttavia, si aggiungerebbe a quelle che già sono previste per gli anziani, in particolare quelle annuali, come la vaccinazione anti-influenzale e anti-COVID: ciò potrebbe creare un ostacolo alla somministrazione di un’ulteriore vaccinazione a meno che non venga adeguatamente mostrato alla popolazione target il reale beneficio di questo aggiuntivo strumento di prevenzione.
La vaccinazione anti-RSV ha comunque l’opportunità di rientrare nei programmi di immunizzazione degli anziani che risultano già ben organizzati e che potrebbero fare da traino. Tuttavia, anche in questo contesto di offerta favorevole, talvolta potrebbe essere difficile inserire una ulteriore sessione vaccinale per la popolazione target, specialmente con le limitate risorse del SSN. Infine, il profilo di costo-efficacia favorevole della vaccinazione anti-RSV, attualmente disponibile in Italia, rappresenta un’opportunità di prevenzione importante per i soggetti adulti e anziani a patto che la vaccinazione non venga vista solo come un costo di implementazione.
La Tabella I riporta una SWOT analisi per valutare i punti di forza (Strengths), le debolezze (Weaknesses), le opportunità (Opportunities) e le minacce (Threats) dell’introduzione della vaccinazione anti-RSV nel calendario vaccinale.
SWOT analisi.
| Qualità utili al conseguimento degli obiettivi | Qualità dannose al conseguimento degli obiettivi | |
|---|---|---|
| Elementi interni |
Punti di forza
|
Punti di debolezza
|
| Elementi esterni |
Opportunità
|
Minacce
|
A gennaio 2024, il Board per il Calendario per la Vita, visti l’incidenza e il burden dell’infezione da RSV e considerando i gruppi a maggior rischio di sviluppare complicanze correlate all’infezione da RSV, ha sottolineato come la recente disponibilità di vaccini efficaci e sicuri contro le patologie causate dall’RSV rappresenti una opportunità preventiva di grande valore clinico. Questa nuova possibilità preventiva risulta ancora più importante se si considera che fino ad ora non erano disponibili altre misure preventive e terapeutiche per i soggetti adulti/anziani. Pertanto, con un approccio conservativo, il Board per il Calendario per la Vita raccomanda l’utilizzo immediato dei vaccini anti-RSV alle categorie a maggior rischio in attesa di eventuali estensioni di raccomandazione. La vaccinazione anti-RSV viene quindi raccomandata ai soggetti di età pari o superiore ai 75 anni (popolazione con alta frequenza di comorbosità) e l’estensione della vaccinazione ai soggetti affetti da patologie croniche di età superiore o uguale ai 60 anni (Fig. 1) [42].
La Società Italiana di Igiene, Medicina Preventiva e Sanità Pubblica e la Società Italiana di Malattie Infettive e Tropicali, a febbraio 2024, hanno confermato la raccomandazione del Board per il Calendario per la Vita, raccomandando la vaccinazione negli adulti ≥ 60 anni di età con comorbosità e nei soggetti anziani ≥ 75 anni di età [43].
Si ricorda, infine, che sulla base del burden delle infezioni da RSV e alla luce della disponibilità di strumenti per la loro prevenzione anche il Ministero della Salute, in data 27 marzo 2024, ha pubblicato una specifica Circolare per indicare le attuali misure di prevenzione e immunizzazione contro RSV [44]. Tuttavia, ad oggi, non esiste ancora una raccomandazione ministeriale su questa vaccinazione.
A livello internazionale molte nazioni e società scientifiche hanno già iniziato a raccomandare o a produrre linee guida sulla vaccinazione anti-RSV ai soggetti anziani. In Italia al momento tale vaccinazione non è ancora raccomandata a livello ministeriale ma il Board per il Calendario per la Vita e poi alcune società scientifiche, come la Società Italiana di Igiene, Medicina Preventiva e Sanità Pubblica e la Società Italiana di Malattie Infettive e Tropicali hanno espresso la forte raccomandazione sull’opportunità della vaccinazione anti-RSV nei soggetti anziani e a rischio (adulti ≥60 anni di età con comorbosità e soggetti anziani ≥75 anni di età). In futuro molti aspetti dovranno essere valutati approfonditamente per evidenziarne pienamente il valore. Il processo decisionale dovrà però essere veloce per permettere di poter offrire questo intervento preventivo prima dell’inizio della prossima stagione invernale.
Il virus respiratorio sinciziale (Respiratory Syncytial Virus, RSV), capace di infettare l’apparato respiratorio di individui di ogni età, è una delle principali cause di infezioni respiratorie acute (ARI) nel mondo e, pertanto, rappresenta un problema attuale di Sanità Pubblica [1-4].
RSV appartiene alla famiglia Paramyxoviridae, genere Orthopneumovirus; è un virus a RNA a filamento singolo che contiene 10 geni che codificano per 11 proteine strutturali. Di queste, le glicoproteine G e F svolgono un ruolo di primo piano nell’interazione virus-ospite. Sulla base delle caratteristiche della glicoproteina G, RSV è classificato in due sottogruppi antigenicamente distinti, A (RSV-A) e B (RSV-B) e, in una stagione tipica, entrambi i sottotipi co-circolano, anche se generalmente uno dei due predomina sull’altro [2].
RSV è responsabile di un elevato carico di malattia nei neonati e nei bambini fino a 5 anni di età, infatti, rappresenta una delle principali cause di ricoveri ospedalieri nella popolazione infantile [5-7]. Tuttavia, negli ultimi anni, una raccolta di dati più attenta, ha evidenziato che il carico di malattia negli anziani è altrettanto considerevole [8, 9]. Negli over 60 e nei soggetti con patologie preesistenti può determinare gravi infezioni respiratorie, come la polmonite, con necessità di ricovero ospedaliero [1, 9]. Occorre sottolineare, però, che anche gli anziani non affetti da malattie cronico degenerative sono a rischio di sviluppare la malattia RSV correlata, con complicanze che possono compromettere la loro qualità di vita nel breve, nel medio e nel lungo termine [10, 11]. Di conseguenza, la malattia da RSV comporta un elevato utilizzo dei servizi sanitari: visite ambulatoriali, accesi al pronto soccorso e ospedalizzazioni, sebbene questo impatto non sia ancora stato ben definito [11, 12].
Al fine di contrastare questo problema di salute, negli ultimi anni, la ricerca si è concentrata sullo sviluppo di vaccini nella prospettiva di prevenire le infezioni e le forme gravi di malattia da RSV. Recentemente, sono stati autorizzati in Europa due vaccini indirizzati alla popolazione over 60 [13, 14] e, pertanto, i diversi Paesi dovranno valutarne l’introduzione nel programma di immunizzazione per la popolazione anziana.
Quando una nuova opportunità in ambito preventivo si rende disponibile alcuni aspetti cruciali devono essere considerati [15]:
l’implementazione di sistemi di sorveglianza capaci di valutare il reale carico di malattia nei diversi gruppi di popolazione e l’efficacia sul campo del vaccino anche in associazione ai diversi livelli di copertura vaccinale;
l’attivazione di programmi di formazione rivolti agli operatori sanitari e azioni di sensibilizzazione per la popolazione al fine di ottenere coperture vaccinali soddisfacenti.
Le malattie trasmissibili rappresentano ancora un serio problema per la salute pubblica a causa del loro peso epidemiologico, clinico ed economico. In tale ambito, è necessario che tutte le Nazioni implementino validi ed efficienti sistemi di sorveglianza.
Storicamente, la nascita dei sistemi di sorveglianza risale al 1946, quando le Nazioni Unite istituirono una Commissione per lo sviluppo di un programma di tutela della salute pubblica, che successivamente sarebbe diventata l’Organizzazione Mondiale della Sanità (OMS). La Commissione, consapevole del pericolo pandemico relativo ai virus influenzali, decise di finanziare un Centro mondiale per l’influenza. Questa importante decisione è oggi considerata come la nascita del Global Influenza Program (GIP). Il GIP è ancora oggi una piattaforma globale per la segnalazione, l’analisi e la diffusione delle informazioni sulla sorveglianza dell’influenza. In seguito, nel 1952, l’OMS istituì il sistema di sorveglianza integrata globale che prende il nome di Global Influenza Surveillance and Response System (GISRS). All’interno del GISRS, cui partecipano 110 Paesi, operano quattro Centri di Collaborazione dell’OMS (CC) e sette Essential Regulatory Laboratories (ERL). Un ruolo fondamentale nell’organizzazione è svolto dai Centri Nazionali per l’Influenza (NIC) e dalle istituzioni designate dai Ministeri della Salute nazionali e riconosciute dall’OMS. I NIC si occupano della raccolta dei campioni e delle analisi preliminari e i campioni ritenuti significativi sono inviati ai CC dell’OMS per le analisi genetiche e antigeniche avanzate. La condivisione tempestiva dei campioni biologici è di fondamentale rilevanza per mettere in atto misure preventive su larga scala [16].
Le sorveglianze si devono fondare su sistemi ben coordinati di allarme e risposta a disposizione della Sanità Pubblica e si devono basare su evidenze scientifiche acquisite con studi rigorosi, sulla capacità di intervenire in modo rapido e decisivo e su azioni di comunicazione capaci di fornire informazioni attendibili ai decision-makers e agli stakeholders. Tutte le attività devono essere organizzate in modo da sostenere e rafforzare le funzioni vitali della Sanità Pubblica.
La configurazione di un sistema di sorveglianza dovrebbe essere determinata da specifiche esigenze, partendo da una chiara definizione dell’obiettivo.
Generalmente, i sistemi di sorveglianza sono progettati per svolgere ruoli primari a supporto della Sanità Pubblica, come la rilevazione di epidemie o monitorare la circolazione degli agenti patogeni. Vi sono, però, situazioni particolari nelle quali è necessario modificare o adattare tali sistemi al fine di ottenere dati specifici, come l’individuazione di gruppi a rischio o ottenere informazioni specifiche sui meccanismi di trasmissione dei diversi patogeni.
Recentemente, il 22 maggio 2023, l’OMS ha definito il nuovo concetto di “sorveglianza collaborativa” con l’intento di rafforzare in modo sistematico la capacità e la collaborazione tra il settore sanitario e altri settori nell’ottica di potenziare l’epidemic intelligence e migliorare il processo decisionale [16].
Considerando, nello specifico le infezioni respiratorie, l’OMS focalizza l’attenzione sulla necessità di consolidare le sorveglianze nazionali per migliorare le capacità diagnostiche e laboratoristiche, creare reti collaborative capaci di prevedere, valutare e identificare i rischi derivanti dalle infezioni respiratorie e monitorare l’efficacia delle strategie preventive intraprese [17]. A tale riguardo, l’OMS sottolinea il bisogno di utilizzare i sistemi integrati per monitorare tutti i molteplici aspetti legati all’impatto dei virus respiratori (casi gestiti ambulatorialmente, ospedalizzati, decessi) per disporre di dati “real-time” e capaci di produrre evidenze utili per attivare strategie di prevenzione e contenimento [18].
Inoltre, i dati derivanti dalle sorveglianze dovrebbero essere analizzati congiuntamente con i risultati provenienti da studi epidemiologici sul campo per ottenere una valutazione “reale” del problema di salute capace di supportare i decisori politici nella pianificazione ed implementazione di efficaci e tempestive strategie di Sanità Pubblica [19].
Relativamente al RSV, studi recenti hanno mostrato un cambiamento stagionale nella circolazione del patogeno, in seguito alla pandemia da SARS-CoV-2, sia nell’emisfero settentrionale che in quello meridionale, sollevando la preoccupazione riguardo l’aumento dei casi osservati rispetto al periodo pre-pandemico [19]. Diventa, quindi, sempre più cruciale il ruolo delle reti di sorveglianza.
Come precedentemente descritto, nel vasto scenario della sanità globale, i sistemi di sorveglianza rappresentano un elemento cruciale per la prevenzione e il controllo delle malattie trasmissibili. Il burden crescente di alcuni patogeni respiratori, incluso l’RSV, ha stimolato lo sviluppo e l’implementazione di sistemi di sorveglianza innovativi.
Nel 2016, l’OMS ha avviato uno studio pilota di sorveglianza RSV in quattordici Paesi, avvalendosi del GISRS con lo scopo di creare un sistema stabile di sorveglianza e fornire risultati che potessero guidare le politiche di contenimento e le strategie vaccinali [20-23].
Il primo studio pilota, iniziato nel 2016, aveva tra i diversi obiettivi la comprensione del reale burden delle infezioni correlate a RSV nei vari ambiti sanitari al fine di standardizzare la sorveglianza e fornire dati utili per lo sviluppo dei vaccini. Durante questa fase i Paesi coinvolti raccolsero campioni respiratori in soggetti con ARI appartenenti a tutte le fasce di età. I campioni furono processati nei laboratori di riferimento utilizzando un test rRT-PCR sviluppato e convalidato dal Centers for Disease Control and Prevention (CDC) di Atlanta. A seguito di questa prima fase di studio, nel 2019, fu possibile realizzare protocolli di riferimento RSV, creare l’External Quality Assesment (EQA) per la rilevazione e tipizzazione di RSV, aggiornare la piattaforma di lavoro GISRS e revisionare i criteri di definizione di caso di Severe Acute Respiratory Infection (SARI) [21, 22].
Successivamente, fu condotta una seconda fase di studio (novembre 2018 - ottobre 2021) che aveva come obiettivo quello di: consolidare i risultati inziali, migliorare la sorveglianza nei neonati e nei bambini di età inferiore a 2 anni, acquisire dati sull’incidenza delle ospedalizzazioni per RSV e sull’identificazione e tipizzazione dei differenti ceppi virali. Durante questa fase, fu posta l’attenzione sull’identificazione di eventuali escape mutant e sulla maggiore comprensione di eventuali cambiamenti genetici del virus.
Il GISRS, ideato per fronteggiare l’influenza, si è rivelato una risorsa fondamentale per le emergenze causate da altri patogeni. Infatti, anche durante la pandemia da COVID-19, ha contribuito in modo significativo, sin dall’inizio, all’analisi e al monitoraggio dei casi. Un esempio del contributo del GISRS alla pandemia da COVID-19 è il lavoro del “Global Initiative on Sharing All Influenza Data” (GISAID), da tempo partner del GISRS. GISAID ha avuto un ruolo cruciale nella pubblicazione tempestiva dei primi dati sulla sequenza del SARS-CoV-2, aiutando la comunità scientifica nella comprensione della struttura del nuovo coronavirus e contribuendo allo sviluppo di test diagnostici specifici e di vaccini. È importante sottolineare che il GISRS ha attivato una sorveglianza sentinella integrata per influenza e SARS-CoV-2, guidando la risposta sanitaria per entrambi i virus in modo simultaneo. Inoltre, ha dimostrato di essere un sistema di sorveglianza efficace che può essere utilizzato per diverse emergenze sanitarie. Il suo valore è legato alla capacità di raccogliere e condividere dati in modo rapido e accurato [23].
Dato l’impatto delle infezioni respiratorie acute sulla salute della popolazione mondiale e sulla gestione dei servizi sanitari, alcuni Paesi hanno attivato sistemi di sorveglianza nazionali capaci di monitorare costantemente l’andamento epidemiologico e individuare i diversi patogeni che causano malattia nei differenti periodi dell’anno e nei diversi gruppi di popolazione.
Negli Stati Uniti, con il coordinamento del National Center for Immunization and Respiratory Diseases (NCIRD), è attivo il Sistema di Sorveglianza Nazionale per le Infezioni Respiratorie e Virali (NREVSS) creato negli anni ’80. Il sistema di sorveglianza è costituito da una rete di laboratori finalizzata al monitoraggio della circolazione temporale e geografica dei diversi agenti virali (RSV, virus parainfluenzali, adenovirus, influenza, coronavirus e rotavirus). Nel contesto di tale sistema, i laboratori forniscono al CDC dati settimanali riguardanti il numero complessivo di analisi di laboratorio eseguite, nonché i risultati positivi aggregati. Gli stessi laboratori forniscono dettagli relativi al tipo di campione, al luogo e alla settimana di raccolta ottenendo un’analisi tempestiva dei dati, agevolando così il monitoraggio dei trend stagionali e dei parametri di diffusione dei virus [24].
I dati raccolti dal NREVSS sono pubblici e sono fruibili per gli operatori sanitari, i professionisti della sanità pubblica e la popolazione. Tale strumento di sorveglianza svolge, quindi, un ruolo cruciale nel descrivere i modelli di circolazione temporale e geografica dei virus respiratori ed enterici utili anche per identificare eventuali focolai epidemici. I recenti dati della sorveglianza hanno confermato la modifica dell’andamento tipicamente stagionale delle epidemie da RSV dopo la pandemia da COVID-19 [25].
Inoltre, il Sistema di Sorveglianza Nazionale degli Stati Uniti è supportato dall’attività di altre due reti: il Respiratory Virus Hospitalization Surveillance Network (RESP-NET) e il Respiratory Virus Laboratory Emergency Department Network Surveillance (RESP-LENS).
Il RESP-NET si occupa principalmente della raccolta e analisi dei casi di ospedalizzazione confermati in laboratorio causati da RSV, SARS-CoV-2 e influenza, inclusi i dati di ammissione in terapia intensiva e morte.
I casi sono identificati esaminando i database dei sistemi di sorveglianza pubblici, i flussi di informazioni sanitarie, i database di ammissione in ospedale e di laboratorio e i registri di controllo delle infezioni nei pazienti ospedalizzati con un risultato positivo per RSV.
I tassi presentati sulla dashboard interattiva di RSV-NET possono essere utilizzati per seguire il trend epidemiologico e confrontare le ospedalizzazioni associate a RSV in diversi gruppi di popolazione durante le diverse stagioni (Fig. 1) [26].
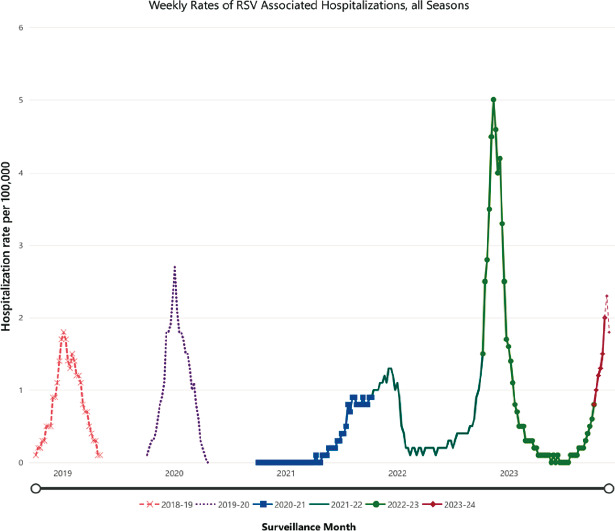
Tassi di ricovero ospedaliero per RSV per 100.000 abitanti (stagioni 2018/19-2023/24) riportati nella “Dashboard RSV-NET” [26] (aggiornamento 21/12/2023).
Il RESP-LENS monitora gli accessi ai Dipartimenti di Emergenza con diagnosi di ARI con richiesta di tampone molecolare per SARS-CoV-2, influenza e RSV. Ciò permette di valutare tempestivamente tutti i casi di ARI, avere una diagnosi confermata in laboratorio e monitorare l’andamento temporale nelle differenti stagioni [26]. La Figura 2 riporta i dati riferiti all’attuale stagione aggiornati al 21/12/2023.
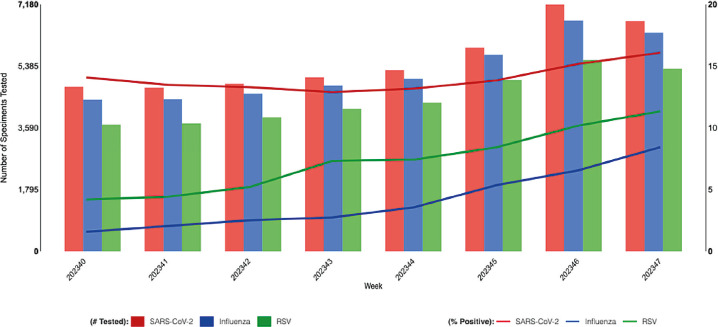
Numero di campioni analizzati e percentuale di positività per settimana [da Respiratory Virus Laboratory Emergency Department Network Surveillance (RESP-LENS) Interactive Dashboard] [26].
L’Australia rappresenta un pilastro storico della rete di sorveglianza dell’OMS, con un ampio ventaglio di attività implementate in tutto il suo territorio (Fig. 3) [27].
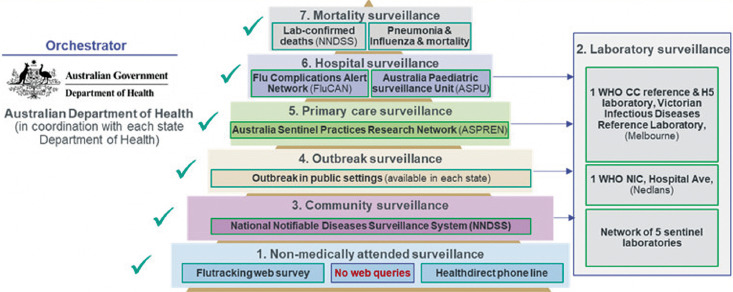
Schema organizzativo del sistema di sorveglianza australiano [27].
Tra le infezioni sottoposte a sorveglianza, l’RSV è divenuta una malattia soggetta a notifica nel 2021 e i casi confermati sono registrati nel sistema nazionale. Le notifiche provengono da varie fonti, tra cui medici, laboratori e ospedali. Una parte significativa della sorveglianza sentinella è gestita da ASPREN (Australian Sentinel Practices Research Network), una rete nazionale di medici di base che segnalano settimanalmente specifiche condizioni mediche con l’obiettivo di fornire un indicatore delle malattie presenti nella comunità, compreso RSV.
La risposta del Canada alle malattie infettive e respiratorie emergenti e riemergenti è condotta dalla Public Health Agency of Canada (PHAC) in collaborazione con province e territori. L’agenzia canadese è dotata di un sistema di sorveglianza che prevede la collaborazione di una rete di partner operanti nella Sanità Pubblica al fine di rilevare i casi di influenza, SARS-CoV-2 e altri agenti respiratori come RSV. In particolare, la sorveglianza RSV, denominata Canadian RSV Surveillance Network (CRSN), è attiva dal 2008, e raccoglie dati sulla diffusione del virus da diverse fonti, tra le quali ospedali, ambulatori e laboratori. Tali informazioni sono utilizzate per monitorare l’andamento dei virus circolanti, identificare le aree per le quali è necessario un intervento di Sanità Pubblica, sviluppare strategie di prevenzione e attivare campagne di sensibilizzazione pubblica [28]. Il team di sorveglianza PHAS produce rapporti settimanali.
In Figura 4 è riportato l’andamento dei campioni positivi per influenza e RSV per settimana di sorveglianza rispetto alla media delle stagioni 2014/2015-2019-2020 [report al 6 gennaio 2024] [28].
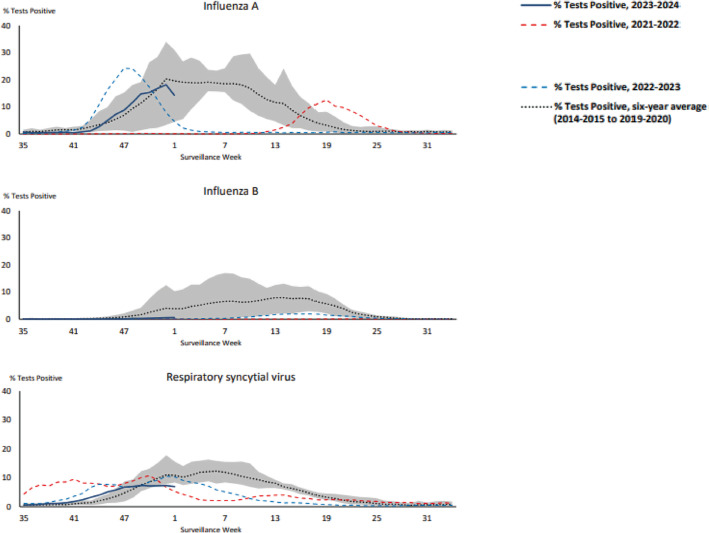
Positività (%) a influenza e RSV per settimana di sorveglianza rispetto alla media delle stagioni 2014/2015-2019-2020 [28].
Nel panorama europeo, l’European Centre for Disease Prevention and Control (ECDC) e l’Ufficio regionale per l’Europa dell’OMS rappresentano i principali organismi coinvolti nei sistemi di sorveglianza.
Nell’ambito della sorveglianza dei virus respiratori, negli ultimi anni, l’OMS/Europa sta attuando un piano di transizione che comprende modifiche rispetto al vecchio approccio, infatti, in collaborazione con l’ECDC, ha recentemente introdotto il report settimanale di sorveglianza dei virus respiratori europei (ERVISS). Questa nuova piattaforma online riporta dati integrati riguardanti l’influenza, SARS-CoV-2 e RSV in tutte le regioni europee dell’OMS, includendo anche gli Stati non appartenenti all’UE. Gli obiettivi di ERVISS comprendono: il monitoraggio della diffusione geografica e dei trend temporali di influenza, SARS-CoV-2, RSV e degli altri virus respiratori; il controllo e la raccolta dei dati riguardanti i casi gravi di malattia, i fattori di rischio associati e il monitoraggio del carico di malattia sui sistemi sanitari; l’osservazione di eventuali cambiamenti e le caratteristiche dei virus respiratori circolanti ed emergenti (in particolare, i cambiamenti virologici dei virus influenzali, di SARS-CoV-2 e di altri virus respiratori) per supportare lo sviluppo di trattamenti e vaccini.
Questi sistemi sono fondamentali per garantire che i virus respiratori siano monitorati in modo integrato e ottimale al fine di indirizzare misure di controllo e prevenzione tempestive e appropriate [29].
In Italia è attivo il consolidato sistema di Sorveglianza InfluNet (attualmente denominato RespiVirNet) che si avvale del contributo di una rete nazionale di Medici di Medicina Generale (MMG) e di Pediatri di Libera scelta (PLS).
Il sistema InfluNet è nato nel 1999 ed è stato istituito per il monitoraggio delle sindromi simil-influenzali (influenza like illness, ILI) e della circolazione dei virus influenzali (tipizzati in laboratorio). Si basava sulla segnalazione di ILI da parte dei medici sentinella, individuati in ogni regione in un numero tale da permettere la sorveglianza di almeno il 2% della popolazione suddivisa per diverse fasce d’età (0-4, 5-14, 15-64 e ≥ 65 anni) e per distribuzione geografica. InfluNet era gestito da due emireti: una coordinata dall’Istituto Superiore di Sanità (ISS) e l’altra dal Centro Interuniversitario per la Ricerca sull’Influenza (CIRI) [30].
Il sistema InfluNet rimase invariato fino alla pandemia influenzale causata dal virus A/H1N1pdm09 del 2009-2010, per poi divenire un sistema di sorveglianza integrata con incluse, oltre alla sorveglianza epidemiologica e virologica delle ILI, altre fonti di dati (accessi in Pronto Soccorso per malattia respiratoria acuta, ospedalizzazioni per polmonite e influenza, casi gravi e decessi da influenza confermata in laboratorio, mortalità in eccesso per tutte le cause di morte, coperture vaccinali) [31].
Dal 2018 InfluNet è coordinato interamente dall’ISS. Attualmente, si persegue la creazione di un sistema di sorveglianza integrato delle infezioni respiratorie acute [32] in grado di fornire informazioni sul carico che queste malattie hanno nella popolazione generale non ospedalizzata, con l’intento di disegnare al meglio le misure preventive, soprattutto le strategie vaccinali. Nella Figura 5 è riportata l’incidenza delle ILI dalla stagione 2009/10 al 2023/24 (aggiornamento 21/12/2023) [33].
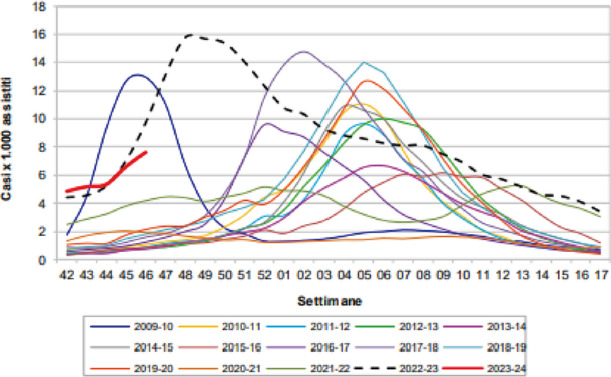
Incidenza settimanale delle ILI in Italia, Stagione 2009/10-2023/24 [33].
Il protocollo RespiVirNet per la stagione 2023-2024 non presenta cambiamenti sostanziali rispetto al protocollo della precedente stagione e richiama la necessità di rafforzare il sistema di sorveglianza soprattutto nelle regioni che non hanno raggiunto la copertura della popolazione da sorvegliare nella stagione precedente. Al fine di ottenere dei dati di rilievo occorre raggiungere una copertura di almeno il 4% della popolazione di ogni regione (4% per ciascuna ASL e per ciascuna fascia di età). Parallelamente, occorre affinare la sorveglianza virologica con la garanzia di raggiungere un numero adeguato di tamponi provenienti dagli assistiti dei medici sentinella, in quanto la sorveglianza virologica non deve essere alimentata dal solo flusso di tamponi ospedalieri.
Il sistema di sorveglianza virologica prevede di raggiungere le seguenti finalità: (i) monitoraggio della circolazione dei diversi tipi (A e B), nonché dei sottotipi (A/H3N2 e A/H1N1) e dei due lineaggi B/Yamagata e B/Victoria di virus influenzali, nelle diverse regioni e nei diversi periodi della stagione epidemica, (ii) monitoraggio della circolazione di altri virus respiratori, tra cui RSV, Rhinovirus, Virus Parainfluenzali, Adenovirus, Metapneumovirus, Bocavirus e altri Coronavirus umani diversi dal SARS-CoV-2 e di eventuali coinfezioni; (iii) valutazione dell’omologia antigenica tra i ceppi epidemici e quelli vaccinali del virus influenzale; (iv) valutazione della suscettibilità dei virus influenzali in circolazione agli antivirali, con particolare riferimento ai farmaci inibitori della neuraminidasi.
Relativamente alle indagini virologiche i laboratori di riferimento territoriali fanno parte della rete internazionale dei laboratori coordinati dall’OMS e della rete europea coordinata dall’ECDC [17].
In Figura 6 è riportato l’andamento settimanale dei campioni risultati positivi per influenza (tipo A e B), RSV (RSV, RSV-A, RSV-B), SARS-CoV-2 e le coinfezioni (stagione 2023/2024) [34].
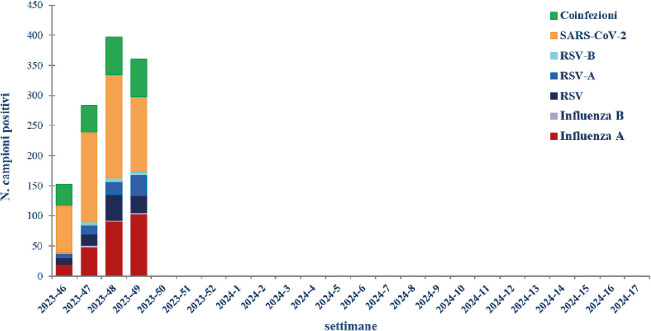
Andamento settimanale dei campioni risultati positivi per influenza A e B, RSV, SARS-CoV-2 e coinfezioni (stagione 2023/2024) [34].
La creazione di tali sistemi richiede un forte impegno da parte delle autorità sanitarie locali, regionali e nazionali, e dovrebbe prevedere il potenziamento della collaborazione di tutti i professionisti coinvolti nel sistema di salute pubblica, specialmente attraverso un investimento per la raccolta, la condivisione e l’integrazione dei dati epidemiologici, clinici e virologici disponibili a livello territoriale.
La pandemia da SARS-CoV-2 ha messo in luce la fragilità dei sistemi di sorveglianza attivi, mostrando come l’emergenza sanitaria ha comportato inevitabili impatti sui vari settori della sanità, inclusa la disponibilità di forza lavoro sanitaria e l’esaurimento delle risorse e dei materiali diagnostici indispensabili per mantenimento dei sistemi di sorveglianza stessi [32].
A seguito dell’emergenza pandemica è stata compresa, quindi, la necessità di avere a disposizione una rete internazionale che possa prontamente rispondere alla raccolta e all’analisi di campioni e che lavori al fianco delle attività di sorveglianza esistenti per il monitoraggio delle infezioni respiratorie acute.
A tal proposito l’OMS e l’ECDC, con la partecipazione degli stati membri, hanno collaborato allo sviluppo di un quadro di sorveglianza strategica che potesse offrire un controllo ampio dei virus respiratori e presentasse i requisiti di resilienza e sostenibilità, ritenuti indispensabili a seguito degli insegnamenti dell’era pandemica [35]. La collaborazione internazionale e la condivisione tempestiva dei dati epidemiologici e di laboratorio sono essenziali per affrontare le sfide emergenti e costruire una robusta difesa contro le minacce infettive in continua evoluzione contribuendo così a preservare la salute della popolazione globale.
L’OMS inserisce tra le “Lessons learned” la pianificazione di attività finalizzate al prepararsi a future sfide di Sanità Pubblica sulle malattie trasmissibili evidenziando che una sorveglianza rafforzata e le capacità di laboratorio sono essenziali per la diagnosi precoce e la risposta alle minacce di virus respiratori emergenti [36]. Inoltre, nel documento dell’OMS si riporta che per un patogeno respiratorio emergente, le informazioni generate dai laboratori e dai sistemi di sorveglianza possono fornire rapidamente informazioni chiave per lo sviluppo di contromisure efficaci [36]. Tale linea di indirizzo rafforza la necessità di disporre di dati raccolti sistematicamente, della loro analisi e interpretazione da utilizzare nella pianificazione, implementazione e valutazione delle politiche di interventi sanitari. Un sistema di sorveglianza delle malattie trasmissibili dovrebbe assolvere essenzialmente ad alcune funzioni chiave: l’allerta precoce di potenziali minacce per la salute pubblica, il monitoraggio dei programmi di contrasto e la contestualizzazione delle misure rispetto alla specificità degli agenti patogeni per programmare in base ai diversi potenziali scenari.
Una delle nuove strategie ipotizzate per migliorare l’efficacia della sorveglianza consiste nell’implementazione di sistemi operativi oltre il periodo stagionale. Tale approccio mira a estendere la raccolta dei casi di ARI per coprire l’intero arco dell’anno, contribuendo così a una sorveglianza più completa e continua. Questa necessità nasce dalla consapevolezza che il modello stagionale RSV è stato fortemente modificato dalla pandemia da SARS-CoV-2 sia nell’emisfero settentrionale che in quello meridionale [19].
Sarebbe interessante, inoltre, considerare l’utilizzo di un sistema comunitario partecipativo a supporto dei sistemi sentinella (territoriali e ospedalieri). Un esempio di sorveglianza partecipativa è il sistema InfluenzaNet che monitora la diffusione e l’impatto dell’influenza e del COVID-19 in Europa e si basa sulle segnalazioni di oltre centomila volontari in 12 Paesi europei [37]. Il sistema, attraverso l’invio settimanale di un questionario, raccoglie i dati di salute autoriportati. A livello italiano il sistema è gestito dal progetto Influweb [38]. L’utilità di un sistema partecipativo risiede nella numerosità del campione e nella capacità di generare dati tempestivi, pur considerando i limiti associati alla modalità di trasmissione dei dati. Inoltre, i costi sono relativamente contenuti.
A complemento dei sistemi di sorveglianza integrata (epidemiologica, di laboratorio, partecipativa) occorre considerare anche sistemi meno specifici, come la “sorveglianza sindromica”, in grado di contribuire ad una gestione efficace ed efficiente delle malattie a trasmissione aerea. Quest’ultimo è uno strumento meno specifico ma altamente sensibile e tempestivo che riguarda i casi clinici per i quali non è possibile effettuare una diagnosi certa ma che presentano segni e sintomi caratteristici delle sindromi respiratorie. Nei territori dove la sorveglianza sindromica è stata implementata il sistema si è rivelato un valido mezzo per la sorveglianza e l’analisi dell’andamento delle epidemie regionali, fornendo dati utili per indirizzare interventi sanitari di tipo preventivo volti a mitigare il diffondersi delle infezioni a livello territoriale [15].
In ambito sanitario la scienza è in continua evoluzione e, negli ultimi decenni, numerose sono state le scoperte che hanno determinato un grande impatto sulla vita delle persone. La medicina consente oggi di offrire agli individui azioni di prevenzione e cura più efficaci con il risultato di aumentare sia l’aspettativa di vita sia il tempo vissuto in buona qualità.
Una Sanità di Valore in linea con il progresso scientifico e tecnologico deve utilizzare lo strumento della ricerca e percepire questa come un vero e proprio investimento. Infatti, è necessario ricordare che non c’è buona assistenza se non si fa una buona ricerca. La ricerca sanitaria deve considerare le priorità e gli obiettivi del Piano Sanitario Nazionale (PSN), aggregando e valorizzando, in una visione unitaria, forze e risorse del Servio Sanitario Nazionale (SSN) e del mondo accademico e scientifico. Pertanto, tutte le istituzioni sono chiamate a dare il loro contributo.
Per quanto riguarda le risorse economiche, è necessario ottimizzare quelle a disposizione e coagulare tutte le forze operanti attraverso l’interazione tra imprese, ricerca pubblica e fondazioni per lo sviluppo di ricerche di rilevante interesse scientifico, economico e sociale.
Nel 1996 Hockey definì in modo molto sintetico che “la ricerca è un’indagine sistematica intrapresa per scoprire fatti o relazioni e raggiungere conclusioni usando un metodo scientifico”. Il metodo scientifico prevede l’applicazione di procedure e strategie in sequenza ordinata di operazioni che il ricercatore esegue per raggiungere una conoscenza; ovvero le caratteristiche indispensabili che una ricerca deve avere affinché possa essere definita scientifica. Tra i principi ai quali si attiene strettamente il ricercatore figurano adeguatezza, precisione, rigore e sistematicità. Fare ricerca non significa la mera applicazione di tecniche più o meno sofisticate per raccogliere dati, ma saper individuare chiari obiettivi e formulare precisi quesiti per ottenere nuove conoscenze [39, 40].
Otto i passaggi sequenziali che caratterizzano lo svolgimento di uno studio: i) definizione del problema e formulazione del quesito, ii) revisione della letteratura, iii) disegno della ricerca, iv) campionamento, v) strumenti di raccolta dati, vi) analisi statistica dei dati, vii) risposta al quesito di ricerca e sua discussione e viii) redazione del rapporto finale e diffusione dei risultati [41, 42].
In ambito sanitario è di fondamentale importanza definire con precisione la tipologia di studio adeguata per raggiungere i risultati attesi individuati in fase di programmazione.
In Figura 7 è riportato l’albero decisionale per la scelta della tipologia di studio da condurre.
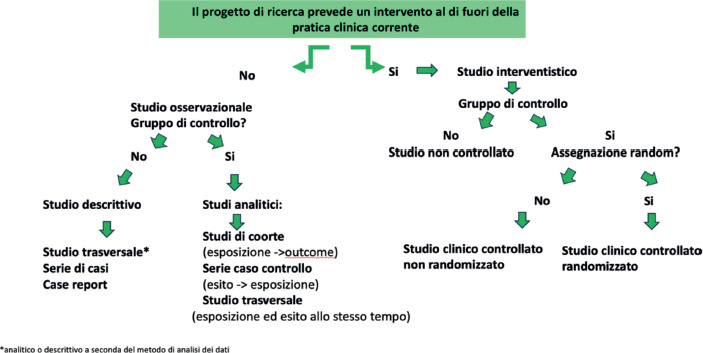
Albero decisionale per la scelta della tipologia di studio.
Gli studi interventistici, utili per verificare un’ipotesi scientifica, prevedono che lo sperimentatore eserciti un intervento attivo, verifichi i cambiamenti dopo l’intervento e valuti se il cambiamento sia effettivamente attribuibile all’intervento stesso. I soggetti arruolati seguono specifiche procedure diagnostiche/terapeutiche/preventive previste dal protocollo di studio. Il modello di riferimento per questo tipo di studi è il Randomized Clinical Trial (RCT) che prevede, per l’assegnazione dei soggetti ai diversi gruppi di studio, l’utilizzo della tecnica di randomizzazione in grado di assicurare l’attribuzione del tutto casuale (random) del soggetto ad un gruppo di trattamento in modo tale che ogni partecipante abbia la stessa probabilità di ricevere il trattamento sperimentale e che tutti i fattori prognostici, noti o non noti, si distribuiscano omogeneamente tra i gruppi. Il controllo è il gruppo che riceve il placebo o altro trattamento terapeutico/preventivo e consente la comparazione dell’esito con il gruppo che riceve il trattamento sperimentale. Per evitare l’interferenza di bias, si utilizza la tecnica del mascheramento o cecità, che, rendendo apparentemente identici i trattamenti tra loro (sperimentale e di confronto), impedisce ad una o più categorie di soggetti (sperimentatore o individuo arruolato) di conoscere il trattamento assegnato a ciascun volontario. Nel mascheramento in singolo cieco il paziente o lo sperimentatore ignorano il trattamento assegnato, nel doppio cieco sia il paziente sia lo sperimentatore ignorano il trattamento, nel triplo cieco il paziente, lo sperimentatore e anche chi analizza i dati non conoscono il gruppo di trattamento. In caso di sperimentazioni con formulazioni o modalità di somministrazione diverse, i trattamenti sono mascherati con la tecnica del doppio placebo.
L’RCT prevede un’analisi statistica complessa “inferenziale” o deduttiva, che consente di estendere le conclusioni dello studio dalla popolazione sperimentale a quella reale con caratteristiche simili per quanto permanga un certo livello di incertezza.
I RCTs sono effettuati in “condizioni ideali” in cui la conservazione e la somministrazione della tecnologia in studio (vaccino, farmaco, dispositivo) sono monitorate e i partecipanti generalmente godono di buona salute. Pertanto, una delle principali criticità dei RCTs riguarda la popolazione di studio poiché i gruppi ad alto rischio come individui con specifiche condizioni croniche e soggetti in politerapia, sono solitamente esclusi, determinando una sovrastima della reale efficacia dell’intervento. Inoltre, generalmente, essendo i RCTs molto costosi, la durata di osservazione è limitata.
In sintesi, occorre valutare con attenzione i risultati derivanti dai RCTs considerando i punti di forza e le criticità (Tab. I) [15].
I diversi tipi di studio con sintetizzati i vantaggi e le criticità.
| Tipo di studio | Punti di forza | Criticità |
|---|---|---|
| Studi Clinici Controllati (RCT) | Validità delle informazioni Comparabilità tra i soggetti appartenenti ai diversi gruppi di studio (es. vaccinati vs non vaccinati/placebo) Accuratezza della codifica dell’outcome prescelto (es. caso confermato in laboratorio, ospedalizzazione, ecc.) |
Popolazione e contesto molto selezionati (difficoltà di generalizzazione dei risultati) Costi molto elevati Tempi di osservazione generalmente brevi Pochi risultati a medio-lungo termine Aspetti etici Impossibilità di rispondere a più quesiti Dati non sempre disponibili tempestivamente |
| Studi di coorte prospettici |
Bias meno probabili nella raccolta dei dati rispetto allo studio retrospettivo Popolazione studiata omogenea Possibilità di monitorare la tecnologia nel tempo Validità dell’informazione Accuratezza della codifica dell’outcome prescelto |
Relativamente costosi Tempo prolungato di osservazione (studi di lunga durata sono associati a un numero significativo di abbandoni e di insorgenza di fattori di confondimento) Dati non disponibili in tempi brevi Possibile modifica dell’esposizione durante il periodo di studio |
| Studi caso-controllo |
Semplici, economici Numerosità del campione Eterogenicità della popolazione Valutazione contemporanea di fattori di rischio multipli Possibilità di studiare condizioni rare, malattie croniche Dati disponibili quasi in tempo reale |
Bias di selezione dei controlli Errata classificazione della malattia (definizione di caso) Bias di informazione Dati mancanti Impossibilità di calcolare l’incidenza |
| Studi trasversali o cross-sectional | Semplice, economico e rapido Dati disponibili quasi in tempo reale Studi di prevalenza con descrizione di molteplici caratteristiche |
Non consente valutazioni causa/effetto Bias di informazione Dati mancanti |
| Serie di casi e case report |
Descrizione di nuove osservazioni Sviluppo di nuove ipotesi Descrizione di casi riferiti a malattie rare Valutazione della sicurezza di una tecnologia (vaccino, farmaco, dispositivo) |
Non consente valutazioni causa/effetto Incapacità di generalizzare il dato |
Per questo motivo, è necessario integrare i risultati degli studi clinici con i dati raccolti “nel mondo reale” (studi osservazionali) per dimostrare la sicurezza, la tollerabilità e l’efficacia della tecnologia (es. vaccino, farmaco) nella popolazione generale e in sottogruppi specifici [15, 43]. Ad esempio, le linee guida sui vaccini antinfluenzali messe appunto dall’European Medicines Agency (EMA) [44] richiedono che studi osservazionali per valutare l’efficacia sul campo (effectiveness) siano condotti come parte dei requisiti post-licenza dai produttori di vaccini. In particolare, alle aziende farmaceutiche viene richiesto di sostituire le prove cliniche annuali di immunogenicità (senza chiare correlazioni di protezione) con l’efficacia del vaccino sul campo. Per raggiungere questo obiettivo, le aziende sono incoraggiate a collaborare con università, enti di ricerca, istituzioni e autorità sanitarie pubbliche.
Considerata per lungo tempo una faticosa ricerca minore, unicamente descrittiva, la ricerca osservazionale è esplosa negli ultimi anni. Questa tipologia di studio osserva un fenomeno senza attuare alcun intervento attivo, non modifica la normale gestione clinica del soggetto, i vaccini o i farmaci sono utilizzati seguendo le indicazioni del prodotto (RCP) e la decisione di somministrare la tecnologia (vaccino o farmaco) è del tutto indipendente dall’inclusione del soggetto nello studio.
Occorre evidenziare come uno degli obiettivi più rilevanti degli studi osservazionali sia la possibilità di confermare il profilo di efficacia di un vaccino/farmaco acquisito con la conduzione di RCTs studiando ampie popolazioni non selezionate. In aggiunta, la real world evidence (RWE) può fornire importanti informazioni sulla sicurezza e la tollerabilità a lungo termine dei vaccini/farmaci e, grazie alla valutazione più estesa di rischi e benefici, può aiutare nell’identificazione di sottogruppi di soggetti/pazienti con un livello di beneficio maggiore. Infine, l’osservazione di dati dal mondo reale può rappresentare un importante strumento per la generazione di nuove ipotesi e fornire idee per la progettazione e conduzione di nuovi RCTs.
A fianco degli innegabili vantaggi degli studi osservazionali occorre valutarne i limiti.
Il primo aspetto da considerare è il disegno dello studio, poiché alcuni errori metodologici si verificano più frequentemente in alcune tipologie (Tab. I).
Gli studi di coorte prospettici sono quelli che offrono maggiori garanzie al fine di raggiungere risultati di alta qualità. Nello specifico, questa tipologia di studio permette al ricercatore di seguire nel tempo un campione di popolazione che differisce per esposizione (es. vaccinati vs non vaccinati) e i principali punti di forza sono: l’eterogeneità della popolazione in studio (rilevante importanza ha la scelta dei criteri di inclusione ed esclusione per ottenere una rappresentatività della popolazione generale), il controllo delle informazioni raccolte da parte del ricercatore e l’accuratezza della codifica dell’outcome prescelto. Contrariamente, le criticità sono legate a: costi elevati, bias correlati al tempo di osservazione (studi di lunga durata sono associati a un numero significativo di abbandoni e di insorgenza di fattori di confondimento), dati non disponibili in tempi brevi e modifica dell’esposizione durante il periodo di studio. Relativamente a quest’ultimo parametro, ad es. per la valutazione dell’effectiveness di un vaccino, è importante conoscere quando il soggetto viene vaccinato, poiché modificando lo stato di immunizzazione, cambia l’esposizione del soggetto.
In riferimento agli studi di coorte retrospettivi i principali vantaggi sono associati al minor costo, alla possibilità di seguire un numero elevato di soggetti (utilizzando anche database elettronici) e a periodi di studio relativamente brevi. Tra le criticità occorre segnalare la possibile presenza di fattori di confondimento (fattori di rischio e altre condizioni di salute) e l’eventuale incompletezza dei dati di esposizione.
Negli studi caso-controllo (studi osservazionali retrospettivi), un gruppo di soggetti malati (casi) e un gruppo di soggetti sani (controlli) sono retrospettivamente confrontati sulla base della loro esposizione. La scelta dei controlli è un aspetto fondamentale, infatti, una selezione inadeguata può determinare un bias di selezione e portare a conclusioni non valide condizionate dall’errore metodologico. Altro aspetto da considerare è l’errata classificazione della malattia (definizione di caso) che potrebbe determinare o una sottostima o una sovrastima dell’effectiveness. Inoltre, ulteriori possibili fattori di confondimento sono rappresentati: dalle condizioni mediche croniche dei soggetti arruolati e i bias di informazione che si verificano quando ci si basa su fonti potenzialmente non attendibili, in particolare, quelle riferite dal soggetto in studio (inesattezza o incompletezza di eventi o esperienze passate). Per questo motivo, è sempre necessario utilizzare tecniche statistiche di analisi che permettano di “aggiustare” i risultati e supportare il ricercatore nella corretta interpretazione del dato. I punti di forza degli studi caso-controllo sono principalmente associati ai costi contenuti, alla numerosità del campione, all’eterogeneità della popolazione in studio e alla possibilità di avere a disposizione dati quasi in tempo reale.
Occorre evidenziare che il valore degli studi secondo la Evidence Based Medicine (EBM) è assegnato in base alla probabilità di conseguire prove utili per le decisioni in Sanità e si basa su un sistema gerarchico di classificazione delle prove, noto come livello di evidenza. È importante ricordare che le evidenze scientifiche disponibili e la loro qualità sono parametri fondamentali nel processo di valutazione delle tecnologie [45].
Nell’ambito della ricerca le revisioni sistematiche offrono il livello più alto di affidabilità dell’evidenza. Sono studi che hanno l’obiettivo di raccogliere e sintetizzare le evidenze disponibili su uno specifico argomento in modo completo, trasparente e riproducibile. La caratteristica delle revisioni sistematiche è quella di utilizzare una metodologia scientifica standardizzata e riproducibile, per ridurre al minimo i rischi di distorsione con la possibilità di stimare l’effetto complessivo di una tecnologia (vaccino, farmaco o dispositivo). Le revisioni sistematiche possono consentire anche una metanalisi. Quest’ultima utilizza una tecnica clinico-statistica quantitativa che permette di combinare i dati di più studi su uno stesso argomento, generando un unico dato conclusivo per rispondere a uno specifico quesito. La combinazione dei dati diminuisce l’imprecisione dei risultati dei singoli studi.
Un elevato livello di fiducia è assegnato anche ai RCTs in quanto progettati per essere oggettivi e caratterizzati da un minor rischio di incorrere in errori sistematici (Tab. I). Il livello più basso è generalmente assegnato al “parere di esperti”.
In Tabella I sono riportati i diversi tipi di studi con evidenziati i punti di forza e i limiti.
In sintesi, solo il dato integrato (RCTs e studi osservazionali), valutato criticamente, può riflettere il reale beneficio di una tecnologia sul carico globale di malattia (visite ambulatoriali, test diagnostici e strumentali, ospedalizzazioni, morti) tenendo conto anche delle variazioni nel tempo in termini di impatto epidemiologico e clinico e di implementazione di strategie di prevenzione e cura, permettendo ai ricercatori di fornire informazioni, basate sul valore, ai policy makers per un’efficace ed efficiente allocazione delle risorse disponibili.
Le evidenze scientifiche rivestono un ruolo cruciale nelle scelte in ambito sanitario e la produzione delle stesse costituisce un tassello imprescindibile per il processo decisionale di valutazione di una tecnologia da parte degli organi competenti.
Il valore dei dati sanitari rappresenta un elemento chiave delle politiche sanitarie incluse quelle della prevenzione. I dati diventano, infatti, valore se inseriti in studi scientifici e sottoposti ad elaborazione, analisi e valutazione critica.
I dati dal mondo reale possono essere raccolti routinariamente da una varietà di possibili fonti, come le schede di dimissione ospedaliera, le cartelle cliniche informatizzate, i dati amministrativi (es. data warehouse regionali), registri di patologia, ecc. Infatti, da tempo, si è consolidata la necessità di utilizzare i dati che derivano dalla pratica assistenziale per approfondimenti sull’effectiveness, per la verifica dell’appropriatezza prescrittiva e per valutazioni di tipo farmaco-economico.
In questo contesto assumono un ruolo nodale i Big data. Quest’ultimi originano dalla raccolta e archiviazione di numerosi dati, che necessitano di essere gestiti, analizzati e interpretati per fornire informazioni utili ai decisori, sia in ambito clinico che organizzativo o politico. I dati per essere considerati Big devono avere almeno tre caratteristiche: variabilità, grandi volumi e velocità di trasmissione.
Il forte interesse per i Big data in Sanità è dovuto al loro potenziale virtualmente rivoluzionario in tutti gli ambiti (cura, prevenzione e promozione della salute). Le valutazioni basate su grandi quantità di dati, infatti, potrebbero portare ad un aumento dell’efficacia e della tempestività della prevenzione, compreso il processo di sensibilizzare della collettività verso stili di vita salutari, ad un miglioramento delle diagnosi e ad un’ottimizzazione delle scelte nei trattamenti.
I dati sanitari contengono numerose informazioni sulla salute della popolazione che possono essere di enorme valore per il sistema, infatti, le strutture sanitare, nel rispetto della normativa vigente, possono incrociarli nell’ottica di estrapolarne informazioni e conoscenza.
Nella maggior parte dei casi, i dati da soli sono di significato limitato; il valore deriva dalla combinazione di più dataset e, dall’analisi di queste combinazioni, possono derivare nuove intuizioni ed indicazioni per la Sanità Pubblica. Occorre precisare che i dati clinici vanno standardizzati e digitalizzati a fini di valutazione e programmazione. Vi è un generale accordo sul fatto che i dati clinici dovrebbero essere raccolti pensando in modo integrato alla prevenzione, alla cura, al governo del sistema e alla ricerca, con un’attenzione sempre maggiore al soggetto/paziente che di fatto origina i dati ed è poi il beneficiario finale di ogni azione sanitaria.
In questo contesto, gli esperti concordano nell’affermare che sarebbe molto utile operare in un quadro amministrativo chiaro, codificare e istituzionalizzare la raccolta e l’analisi dei dati, sviluppare sistemi di analisi e utilizzo del dato amministrativo, mettere questi ultimi a disposizione della Sanità Pubblica e dei policy makers e identificare e valorizzare le best practices.
Ai Big data si associa la possibilità dell’applicazione dell’Intelligenza Artificiale (IA) che non si limita a raccogliere dati ed elaborare tendenze, ma apprende da questi. L’ingente quantità di dati richiede tecnologie sempre più avanzate per trasformarsi in Valore.
L’IA consiste in un insieme eterogeneo di tecniche e metodi volti a costruire sistemi artificiali dotati di capacità cognitive, in grado di riconoscere, classificare, ragionare, diagnosticare e agire. L’IA utilizza algoritmi di apprendimento automatico e analisi dei dati per elaborare grandi quantità di informazioni sanitarie in modo rapido ed accurato, con l’obiettivo di rendere sempre più precise le decisioni e contribuire ad un miglioramento degli esiti di salute dei pazienti.
In ambito sanitario è considerata una forza trasformativa per le sue possibili applicazioni in tutti i campi.
La comunità scientifica dispone di evidenze che riguardano l’utilizzo dell’IA in alcuni settori sanitari [46]. Ad esempio, i sistemi di allerta precoce per la sorveglianza delle malattie possono trarre enormi benefici dall’utilizzo di algoritmi che analizzano in modo sistematico grandi quantità di dati che derivano da fonti differenti. In qualsiasi momento, il Web è inondato di segnalazioni di malattie sotto forma di articoli scientifici, di comunicati stampa, di forum di discussione di professionisti e gruppi di popolazione, ecc. Questi dati possono variare dalla segnalazione di casi di infezione non particolarmente critici a casi di malattia emergente potenzialmente pericolosa.
Grazie agli algoritmi addestrati dall’IA si possono analizzare, filtrare, classificare e aggregare dati su malattie infettive con elevata precisione e velocità. Ad esempio, HealthMap è uno dei sistemi, attivi da circa un decennio, in grado di fornire informazioni rilevanti in tempi assai rapidi [47, 48]. Questa sorveglianza, basata su Internet, ha consentito di rilevare la prima prova della comparsa del virus influenzale A/H1N1pdm09 in Messico ed è stata utilizzata successivamente per monitorare l’epidemia da malattia polmonare svapo-correlata (associata all’utilizzo delle sigarette elettroniche) negli Stati Uniti nel 2019. HealthMap utilizza l’elaborazione del linguaggio naturale per cercare, nelle informazioni sul Web, segnali di eventi di malattie infettive. Gli algoritmi sono addestrati per ignorare il rumore di fondo e analizzare relazioni pertinenti utilizzando uno schema di classificazione “machine learning bayesiano”. Inoltre, HealthMap estrae automaticamente dati geografici che possono essere utilizzati per collegare più report insieme e identificare cluster di malattia. Un vantaggio chiave dell’IA per la sorveglianza delle malattie è possedere la capacità di un monitoraggio contemporaneo in diversi Paesi e avvisare della necessità di una risposta sanitaria pubblica efficace in caso di identificazione di un potenziale focolaio.
Anche l’OMS riconosce le enormi potenzialità dell’IA nell’accelerare la trasformazione digitale dell’assistenza sanitaria e ne promuove un uso sicuro, efficace e responsabile. L’adozione di tecnologie digitali appropriate, accessibili, economiche, sostenibili e incentrate sulla persona, possono contribuire a migliorare la salute di tutti nella prevenzione, diagnosi e cura delle malattie. È fondamentale, però, che i sistemi di IA rispettino elevati standard di qualità e integrità dei dati, siano sicuri ed efficaci e sviluppino un’interfaccia costante tra tutte le parti che compongono l’ecosistema dell’IA per la salute (quali sviluppatori, analisti, produttori, autorità di regolamentazione, utenti, ecc.). A tal riguardo l’OMS ha identificato aree chiave per la definizione di una regolamentazione dell’IA applicata alla salute quali la trasparenza, la gestione del rischio, la qualità dei dati, la privacy e la conformità alla normativa vigente [49].
Un altro argomento che merita un approfondimento è l’importanza della diffusione dei dati in quanto la comunità scientifica sente l’esigenza sempre più forte di promuovere una divulgazione libera e gratuita dei risultati delle ricerche. Infatti, molti studi, in fase di progettazione, sottolineano il valore della disseminazione e della comunicazione dei risultati. Queste attività sono strettamente legate fra loro e permettono di trasferire la conoscenza a specifici target di riferimento e di acquisire visibilità nella comunità scientifica. Senza la disponibilità di efficaci strategie di diffusione dei risultati, un team di ricerca rischia di limitare la condivisione dei dati e tralasciare importanti opportunità per lo studio stesso [50-52].
I risultati delle ricerche possono essere diffusi tramite diversi mezzi, tra i quali le pubblicazioni scientifiche. Negli ultimi anni, questo mondo è cambiato radicalmente, con la progressiva affermazione del modello dell’open access publishing. Grazie a questa modalità editoriale, gli autori pubblicano la versione integrale del proprio manoscritto, accessibile a tutti senza restrizioni; l’articolo può essere condiviso liberamente sulle più comuni piattaforme. Si tratta senza dubbio di un cambiamento significativo per la comunità scientifica e di un beneficio di altissimo valore. I lettori possono accedere a contenuti scientifici gratuitamente e tale possibilità si traduce in un elemento di democratizzazione della scienza. Infine, le riviste full open access sono generalmente disponibili in formato online-only, consentendo di salvaguardare l’ambiente e rispecchiando la caratteristica di ecosostenibilità.
Per favorire la diffusione e la divulgazione dei risultati della ricerca risulta rilevante anche organizzare eventi scientifici come convegni e congressi che, inoltre, favoriscono la condivisione del sapere, la creazione di relazioni tra professionisti e la nascita di nuove idee.
Ultimo punto da considerare è la crescita esponenziale dell’utilizzo del social network per la diffusione della scienza anche all’interno della comunità scientifica. Infatti, negli ultimi anni, sono nati social network con l’obiettivo di facilitare e ampliare la comunicazione della comunità scientifica e l’accesso ai risultati della ricerca. Ad esempio, ResearchGate, nato nel 2008, è una piattaforma che offre la possibilità di condividere esperienze e scoperte di ricercatori, condividere file, rendere disponibili in rete le proprie pubblicazioni, attivare forum e discussioni di gruppo e pubblicizzare eventi scientifici.
Un altro social network utilizzato è LinkedIn, anche se originariamente nato per promuovere il networking e l’assunzione di personale. La svolta è arrivata nel 2021 quando è stata introdotta la possibilità di creare contenuti. Tuttavia, l’evoluzione in tal senso è recente e il trasferimento verso la creazione di contenuti nonché la loro fruizione sta avvenendo in modo graduale. La principale differenza consiste che LinkedIn ha deciso di andare controtendenza puntando sui contenuti “long form” in alternativa ai post caratteristici di altri social network come Twitter (attualmente X). Quest’ultimo permette la pubblicazione di brevi “tweet”. Generalmente, i ricercatori condividono collegamenti ad articoli recenti o appena pubblicati oppure presentazioni e video di congressi.
Le potenzialità offerte dal web hanno permesso di creare reti di collaborazione fra scienziati che travalcano le frontiere spazio-temporali formando comunità di interesse capaci di comporsi rapidamente rispetto a progetti di ricerca o particolari interessi scientifici. Più specificatamente, con la scienza connessa diventa possibile utilizzare le nuove tecnologie per: la creazione di team di ricerca; la definizione di progetti e protocolli di studio; l’organizzazione e la gestione degli articoli scientifici; la ricerca di finanziamenti; l’analisi bibliografica; l’analisi dei dati e la presentazione dei risultati.
La ricerca è un elemento essenziale per la crescita qualitativa del SSN e per il contenimento della spesa attraverso l’efficienza delle prestazioni e delle cure. Gli elementi sui quali è necessario agire sono, da una parte, le risorse umane e, dall’altra, quelle economiche.
L’operatore di Sanità Pubblica deve “assimilare” culturalmente la logica del ricercatore, che è quella di intraprendere un aggiornamento continuo e una buona pratica clinica rivolta alla verifica della qualità delle prestazioni in termini di efficacia, efficienza e umanità.
È possibile cambiare la cultura degli operatori sanitari e orientarla verso la ricerca attraverso una strategia semplice e basata principalmente sul coinvolgimento attivo in progetti trasparenti e condivisi.
Secondo un recente studio il settore sanitario è la prima fonte per la generazione di dati a livello mondiale, con circa il 30% del volume globale [53].
La Sanità genera dati che poi utilizza nell’ottica del miglioramento ed efficientamento dell’erogazione dei servizi, riduzione dei tempi di attesa e semplificazione della comunicazione con i cittadini con l’obiettivo finale di migliorare la salute della popolazione. In questo contesto, gli operatori di Sanità Pubblica sono coinvolti nella tutela della salute collettiva attraverso attività di prevenzione e promozione della salute.
I risultati messi a disposizione dai ricercatori rappresentano la base per migliorare la salute del singolo e della collettività, assicurare i principi e le applicazioni della medicina preventiva, migliorare l’organizzazione e il funzionamento del servizio sanitario con approfondimenti sui temi della qualità e della gestione del rischio clinico. Inoltre, sono utili per facilitare la comprensione dei fenomeni che impattano sulla salute e influenzano l’accesso alla prevenzione e alla cura, per aumentare la conoscenza delle principali logiche gestionali di una moderna azienda sanitaria e per conoscere le implicazioni della professione medica.
Le nuove tecnologie rendono più facile la condivisione delle informazioni, ma al tempo stesso è consistente il potenziale della disinformazione che circola rapidamente anche tra gli operatori sanitari, le istituzioni e le organizzazioni. Pertanto, rispondere alle esigenze del settore sanitario è una sfida per i professionisti della salute che sono chiamati a far fronte a diverse necessità tra le quali cercare di contrastare la disinformazione.
In un settore in continua evoluzione come quello sanitario, la formazione costante è essenziale per garantire la qualità dell’assistenza sanitaria, migliorare gli outcomes per gli assistiti e i pazienti e promuovere lo sviluppo professionale del personale sanitario. A ribadire l’importanza della formazione continua (ECM) nel settore salute è stato il DLgs 502/1992 (integrato dal DLgs 229/1999 e implementato a partire dal 2002) che definisce l’obbligatorietà per medici e professionisti sanitari di seguire un percorso formativo costante (acquisizione di crediti formativi). La formazione continua garantisce che i professionisti siano adeguatamente preparati per affrontare le sfide complesse. Inoltre, contribuisce a rendere il professionista sanitario sicuro delle proprie azioni migliorando anche il rapporto medico-assistito/paziente. Ad esempio, migliorare la conoscenza su argomenti generali come l’efficacia e la sicurezza dei vaccini permette all’operatore di essere più pronto per il counselling e per affrontare particolari domande degli utenti.
Infine, è anche importante evidenziare che la formazione determina un miglioramento delle competenze comunicative e relazionali. I professionisti sanitari devono essere in grado di comunicare in modo efficace con gli assistiti/pazienti, le loro famiglie e i colleghi per fornire un’assistenza di qualità.
La scienza ha, da tempo, dimostrato di essere uno dei motori del progresso umano e, pertanto, è necessario sfruttarne appieno il potenziale. In quest’ottica, è di notevole rilevanza attivare azioni per rendere i risultati della ricerca scientifica accessibili a tutti, vale a dire renderli comprensibili alla collettività.
Inoltre, nel mondo attuale il ruolo attivo della collettività nei programmi di ricerca assume un ruolo strategico poiché per ottenere dati realmente aderenti ai bisogni di salute della popolazione è necessario che la società civile sia coinvolta nelle diverse attività di ricerca. Infine, oggi la diffusione della scienza in tutto lo spazio sociale obbliga i ricercatori a misurarsi con l’accettabilità dei suoi contenuti e del suo impatto da parte della popolazione. La ricerca sarà sostenuta dall’opinione pubblica solo se quest’ultima sarà in grado di coglierne il significato e i potenziali ritorni in termini di nuove opportunità di sviluppo sociale e produttivo. Per fare ciò è indispensabile costruire un “senso comune” della scienza e una cultura positiva nei confronti della ricerca che consenta alla popolazione di appropriarsi di temi non sempre semplici da comprendere.
Nella società basata sulla conoscenza, in cui i nuovi saperi rappresentano l’elemento fondamentale dell’innovazione e dello sviluppo economico e sociale, la divulgazione scientifica assume un’importanza cruciale. Fondamentale, in questo contesto, è definire chiaramente la differenza tra “comunicazione scientifica” e “divulgazione scientifica”: la prima si riferisce alla trasmissione di informazioni relative a risultati ottenuti attraverso una ricerca scientifica fatta a una o più comunità specifiche, la divulgazione, invece, è rivolta al grande pubblico ed è più complessa perché deve rendere l’argomento comprensibile a tutti. Quest’ultima svolge un ruolo fondamentale per il progresso umano su molteplici fronti. In primo luogo, consente la diffusione dei risultati di studi, permettendo alla comunità di conoscere i nuovi sviluppi in campo scientifico e tecnologico. Contribuisce al diffondere della cultura scientifica, all’aumentare della partecipazione e dell’interesse per la scienza e avvicina la collettività alla ricerca di base e applicata. Occorre sottolineare che la scienza non è di facile comprensione per chi non ha adeguate competenze, sia per la complessità intrinseca della materia sia per la terminologia specialistica utilizzata dai ricercatori. Tuttavia, la divulgazione scientifica, utilizzando linguaggi accessibili e semplificati, può e deve essere in grado di rendere comprensibili alla collettività concetti complessi. Un secondo aspetto rilevante è quello relativo alla promozione della consapevolezza sociale su questioni di interesse pubblico. In questo contesto, la divulgazione scientifica serve per sensibilizzare l’opinione pubblica e per promuovere un accesso più equo alla prevenzione, alle cure mediche e alla riabilitazione. Infine, la divulgazione scientifica riveste un ruolo importante come supporto per scelte consapevoli, consentendo ai cittadini di acquisire le conoscenze necessarie per prendere decisioni informate. Di conseguenza, aiuta a contrastare la diffusione di informazioni errate, notizie false, che possono influenzare negativamente le opinioni pubbliche e le decisioni politiche. La “buona informazione” favorisce scelte sanitarie basate sul valore che considerano il benessere globale della persona nell’interesse della collettività. Occorre evidenziare che solo negli ultimi anni gli scienziati hanno cercato di raggiungere la collettività utilizzando canali accessibili ad un ampio pubblico come piattaforme web, blog scientifici, trasmissioni televisive e radiofoniche, social network. Nell’era COVID-19 la crescita è stata esponenziale.
Nello scenario contemporaneo, un ruolo importante è stato acquisito dai social network, che sono stati in grado di accorciare le distanze tra i comunicatori e i riceventi della divulgazione scientifica, estendendo la platea dei fruitori della scienza dai soli “addetti ai lavori” a un pubblico “laico”. In questo contesto, Twitter (attualmente X) merita un’attenzione particolare. Rispettando le previsioni dei ricercatori che, già nel periodo pre-pandemico, avevano pronosticato la possibilità della contaminazione tra social e divulgazione scientifica, durante la pandemia, Twitter ha assunto la connotazione di una vera e propria rete di diffusione di dati scientifici e di collegamento tra ricercatori e tra ricercatori e pubblico “laico” [15, 54]. La piattaforma è diventata un punto di riferimento per la diffusione dei risultati di studi e dell’opinioni sull’andamento della pandemia formando una vera e propria comunità virtuale. A testimonianza di ciò, la rivista Science ha commentato il peso dell’ascesa del social network in campo scientifico come mezzo di divulgazione in tutto il mondo. Ogni nuova informazione è stata “rimbalzata” tra i diversi autori tralasciando i tempi di pubblicazione scientifica canonici e generando una condivisione in tempo reale dei nuovi dati disponibili. Se da una parte ciò ha favorito il progresso scientifico, la mancanza di revisione dei messaggi e la facilità di confusione ha sortito l’effetto di generare talvolta “caos comunicazionale”, soprattutto in coloro che non appartenevano ad ambienti scientifici. Probabilmente, tale strumento, con le opportune modifiche, potrà essere utilizzato a favore della ricerca scientifica sfruttando le sue caratteristiche di tempestività e facilità di collegamento.
In sintesi, la diffusione dei dati della ricerca scientifica anche ad un popolo “laico” è di fondamentale rilevanza per aumentare il livello di fiducia della popolazione verso la scienza, per supportare scelte consapevoli e incentivare gli individui a divenire parte attiva della ricerca stessa.
Le infezioni respiratorie acute rappresentano una sfida significativa per i sistemi sanitari di tutto il mondo, con un impatto sostanziale sulla salute globale.
Tra le infezioni virali del tratto respiratorio, RSV emerge come un agente patogeno di particolare rilevanza, essendo responsabile di un significativo carico di malattia in alcune categorie di popolazione, in particolare in bambini fino a cinque anni d’età, adulti fragili e anziani. Tuttavia, al fine di disporre di un ampio quadro e contestualizzato al panorama italiano, è necessario acquisire nuove informazioni sul reale carico di malattia, poiché questo è un fattore chiave per valutare l’introduzione di nuovi vaccini.
In Italia, si persegue la creazione di un sistema di sorveglianza integrato delle infezioni respiratorie acute in grado di fornire informazioni sul burden epidemiologico e clinico dei diversi patogeni nella popolazione generale e per fasce d’età. Inoltre, si mira a migliorare la collaborazione interna e internazionale per una condivisione tempestiva dei dati epidemiologici e di laboratorio, essenziali per costruire una difesa contro le minacce infettive in continua evoluzione.
Attualmente, la Sanità dispone di un numero considerevole di dati, un bene preziosissimo. Tuttavia, le informazioni per trasformarsi in Valore necessitano di essere gestite in modo adeguato, avvalendosi di infrastrutture tecnologiche robuste, resilienti, performanti e sicure. Una Sanità di “Valore” in linea con il progresso scientifico e tecnologico deve utilizzare lo strumento della ricerca e percepire quest’ultima come un vero e proprio investimento. Infatti, non c’è buona assistenza se non si fa buona ricerca. I dati diventano “Valore” se inseriti in studi scientifici e sottoposti ad elaborazione, analisi e valutazione critica. In tale contesto, l’intelligenza artificiale ha la potenzialità di aiutare l’avanzamento della ricerca, il miglioramento dei sistemi di sorveglianza, la programmazione e la gestione dei servizi sanitari.
Un altro argomento che merita un approfondimento è l’importanza della diffusione dei dati in quanto la comunità scientifica sente l’esigenza sempre più forte di promuovere una divulgazione libera e gratuita dei risultati delle proprie ricerche. Questi ultimi necessitano di essere condivisi a diversi livelli se si intende raggiungere l’obiettivo di migliorare la qualità di vita della popolazione. Lo straordinario impatto di Internet sulla scienza si è manifestato in un cambiamento profondo del rapporto tra scienza e società, poiché la rete consente forme di condivisione non solo tra ricercatori, ma soprattutto con gli utenti finali.
Con la recente autorizzazione di vaccini anti-RSV per l’immunizzazione attiva della popolazione di età ≥ 60 anni, la Sanità Pubblica dovrà valutarne l’introduzione nel calendario vaccinale considerando anche le implicazioni di tipo organizzativo (consultare Capitolo 7 del presente report).
Il virus respiratorio sinciziale (RSV) è uno dei principali agenti eziologici di infezioni respiratorie acute (ARI) ed è storicamente noto per il suo impatto sulla salute nei bambini di età inferiore ai cinque anni, in cui rappresenta la principale causa di bronchioliti [1, 2]. Pur essendo un’importante causa di malattia anche negli adulti con comorbosità e nella popolazione adulta-anziana, l’impatto di RSV in queste fasce di popolazione è stato a lungo sottostimato [1, 3].
Negli ultimi anni si è assistito ad un’inversione di tendenza con un crescente interesse per l’impatto della malattia causato da RSV nella popolazione adulta-anziana anche come conseguenza delle migliorate capacità di sorveglianza epidemiologica. L’introduzione del nuovo sistema di sorveglianza, “RespiVirNet”, ha infatti permesso di integrare la sorveglianza epidemiologica delle sindromi simil-influenzali con la sorveglianza virologica dei virus respiratori, incluso RSV, rendendo possibile la stima di impatto causato da quest’ultimo. Tuttavia, tale maggiore attenzione potrebbe anche essere collegata al fatto che RSV è spesso causa di patologie respiratorie gravi (es. polmoniti) e potenzialmente fatali, anche negli adulti > 60 anni ed, in particolare, in quelli con comorbosità. Bisogna inoltre considerare che, sebbene l’incidenza globale delle infezioni causate da RSV nei bambini 0-5 anni (pari circa a 17 casi per 1.000, 95% IC 10,6-20,2) sia maggiore di quella nella popolazione adulta-anziana (circa 6.3 per 1.000 sopra i 65 anni) [2], quest’ultima rappresenta di fatto, in Italia, una fetta di popolazione circa 5,5 volte maggiore (Istat 2023) ed in continua crescita in tutti i Paesi ad alto reddito.
Inoltre, se si considerano le ospedalizzazioni e i decessi legati a RSV negli over 60, si comprende come l’impatto di RSV sia tutt’altro che trascurabile. Secondo una recente metanalisi, nel 2019, RSV sarebbe stato responsabile di 5,2 milioni di casi di infezioni respiratorie, 470.000 ospedalizzazioni e 33.000 decessi, tra gli adulti over 60, nei paesi industrializzati [1]. In Europa, si registrano annualmente circa 158.000 ospedalizzazioni tra gli adulti (> 18 anni) ed il 92% di queste ospedalizzazioni si verifica tra gli over 65 [5].
Bisogna poi segnalare che la pandemia da SARS-CoV2 ha profondamente modificato l’epidemiologia di molte malattie infettive respiratorie incluso la patologia respiratoria da RSV. In particolare, l’introduzione di misure volte a limitare la diffusione di SARS-CoV2 (distanziamento fisico, utilizzo di mascherine ecc.) ha portato anche alla riduzione della circolazione di altri virus respiratori. Ad esempio, nelle stagioni 2019/2020 e 2021/2022 la circolazione dei virus influenzali si è progressivamente ridotta a livelli minimi con conseguente riduzione dell’impatto clinico [6].
Nella stagione 2022/2023 poi, la riduzione dell’immunità naturale associata all’abolizione delle misure restrittive anti-COVID ha sicuramente contribuito ad un aumento di circolazione di alcuni virus respiratori quali influenza, RSV e SARS-CoV-2 (Fig. 1) [7].
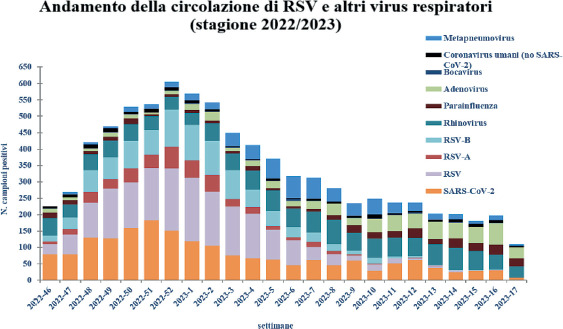
Andamento della circolazione di RSV e altri virus respiratori (stagione 2022/2023) (fonte: ISS, Sorveglianza Virologica dell’Influenza).
Pertanto, lo sviluppo di una strategia preventiva efficace rappresenta un obiettivo fondamentale per limitare il carico di malattia RSV ed, in tal senso, il vaccino costituisce uno strumento importante e innovativo. Tuttavia, per comprendere meglio l’importanza della vaccinazione anti-RSV nella popolazione adulta/anziana può essere utile fare alcune considerazioni di tipo epidemiologico-demografico.
Le stime Istat evidenziano come in Italia nel 2022 la speranza di vita alla nascita fosse di 80,5 anni per gli uomini e 84,8 anni per le donne (Tab. I, Fig. 2) [8].
Speranza di vita alla nascita e a 65 anni per ripartizione geografica. Anno 2022 (dati stimati, in anni) (da ISTAT, mod.).
| Ripartizioni geografiche | 2022 | |||
|---|---|---|---|---|
| Maschi | Femmine | |||
| Alla nascita | Coorte 65 anni | Alla nascita | Coorte 65 anni | |
| Nord-Ovest | 80,8 | 19,0 | 85,1 | 22,2 |
| Nord-Est | 81,1 | 19,3 | 85,4 | 22,4 |
| Centro | 81,0 | 19,2 | 85,2 | 22,3 |
| Sud | 79,6 | 18,4 | 83,9 | 21,3 |
| Isole | 79,5 | 18,3 | 83,7 | 21,2 |
| Italia | 80,5 | 18,9 | 84,8 | 21,9 |
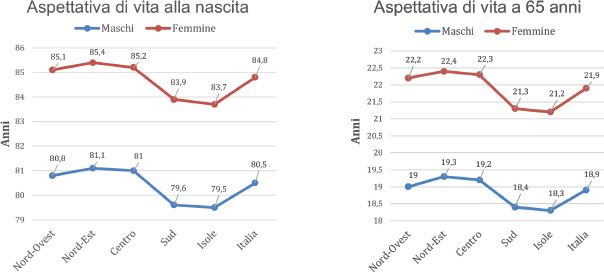
Trend di aspettativa di vita alla nascita ed a 65 anni (da ISTAT, mod.).
Sebbene si siano registrati, in entrambi i sessi, livelli di aspettativa di vita nel 2022 inferiori rispetto a quelli del periodo pre-pandemico ed elevati numeri di decessi (oltre 2 milioni e 150 mila, di cui l’89,7% riguardante persone over 65 negli ultimi tre anni), il processo di invecchiamento della popolazione è proseguito e nel 2022, l’indice di vecchiaia è aumentato di 5 punti percentuali rispetto al 2021, arrivando a 187,9 anziani ogni 100 giovani [9].
Ma quello che risulta più rilevante per quanto riguarda le future sfide della sanità pubblica è che al 1° gennaio 2023 la popolazione ultrasessantacinquenne ammontava ad oltre 14 milioni di persone, rappresentando il 24,1% della popolazione totale [6]. Si registra altresì un incremento degli ultraottantenni, che raggiungono il 7,7% della popolazione totale. Al contrario sono in diminuzione tanto gli individui in età attiva, quanto i più giovani: i 15-64enni scendono a 37 milioni 339 mila (63,4%), mentre i ragazzi fino a 14 anni sono 7 milioni 334 mila (12,5%). Esistono inoltre delle differenze regionali nella distribuzione per fasce di età tra il Nord, il Centro e il Sud Italia.
Alla luce di quanto detto, gli scenari demografici prevedono un consistente aumento dei cosiddetti “grandi anziani” tanto che, nel 2041, si stima un aumento della popolazione ultraottantenne a oltre 6 milioni (+35,2%sul 2021); quella degli ultranovantenni addirittura arriverà a 1,4 milioni (+69,4% sul 2021).
In conclusione, entro il 2050 gli individui con più di 65 anni potrebbero rappresentare il 35% del totale secondo lo scenario più conservativo.
Queste proiezioni pongono molti interrogativi sulla capacità dell’Italia di far fronte a una situazione demografica nuova, mai sperimentata fino ad ora in queste proporzioni, e con possibili significativi impatti sulla sostenibilità del sistema economico e sanitario.
La vaccinazione contro patogeni infettivi che impattano sulla salute del soggetto adulto anziano, in particolare la vaccinazione antinfluenzale, anti-COVID-19, anti-pneumococco e anti-RSV, riducendo le complicanze e le condizioni morbose aggravanti, possono dunque favorire una qualità di vita soddisfacente garantendo alla popolazione un invecchiamento attivo (silver age).
Secondo il Piano Nazionale di Prevenzione Vaccinale (PNPV) 2023-2025, le vaccinazioni raccomandate per i soggetti di età superiore ai 60 anni comprendono la vaccinazione antinfluenzale (annuale), la vaccinazione anti-pneumococcica (schedula sequenziale), la vaccinazione anti-Herpes Zoster (una o due dosi, in base al vaccino) e il richiamo del vaccino anti-dTpa (ogni 10 anni) [10]. Più recentemente, il 15 gennaio 2024, il Board del Calendario per la Vita ha pubblicato un position paper sulla vaccinazione contro RSV nella popolazione anziana e negli adulti a rischio raccomandando la pratica vaccinale ai soggetti di età pari o superiore ai 75 anni e nei soggetti affetti da patologie croniche di età superiore o uguale ai 60 anni [11]. A queste raccomandazioni si aggiungono quelle congiunte SItI-SIMIT del 3 Febbraio 2024 in cui il Board ha ribadito che RSV rappresenta in Italia un bisogno medico insoddisfatto raccomandando di inserire la vaccinazione contro RSV nel calendario vaccinale, offrendo la vaccinazione negli adulti ≥ 60 anni di età con comorbosità e negli anziani ≥75 anni di età [12].
L’Organizzazione Mondiale della Sanità (OMS) ha individuato due obiettivi di copertura vaccinale antinfluenzale per tutti i gruppi target, un obiettivo minimo, che prevede il raggiungimento di livelli di copertura del 75% e un obiettivo ottimale, che prevede il raggiungimento di livelli superiori al 95%.
Secondo gli ultimi dati attualmente disponibili, nella stagione 2022/2023, nei soggetti di età superiore ai 65 anni, sono state somministrate circa 8 milioni di dosi antinfluenzali e sono stati raggiunti livelli di copertura vaccinale pari al 56,7%, in lieve diminuzione rispetto alla stagione precedente (58,1%) (Fig. 3).
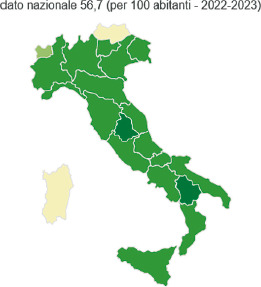
Copertura vaccinale antinfluenzale negli anziani (età ≥ 65 anni), 2022-2023 (fonte: EpiCentro - ISS).
Relativamente alle coperture vaccinali antipneumococciche negli adulti-anziani, a causa dell’assenza di dati ufficiali, queste sono state stimate sulla base di indagini ad hoc e surveys. Secondo lo studio Ipsos PneumoVUE, un sondaggio condotto in nove Paesi europei e che ha coinvolto 9.000 persone, soltanto il 5% degli adulti ad alto rischio ha dichiarato di essersi sottoposto a vaccinazione antipneumococcica [13].
Una survey condotta in Puglia, tra il 2000 e il 2007, per stimare le coperture del vaccino PPV23 nella popolazione over 65, ha evidenziato livelli di copertura annuali inferiori all’8% e cumulativi superiori al 25% [14].
Relativamente alla vaccinazione COVID-19, si deve segnalare che oltre il 90% della popolazione italiana over 60 anni ha effettuato il ciclo vaccinale primario mentre più dell’80% ha effettuato vaccinazione con dose booster (Tab. II).
Focus sulle coperture dei vaccini anti-COVID-19 negli over 60.
| Fascia d’età | Popolazione vaccinata con ciclo vaccinale primario | Popolazione vaccinata con dose booster |
|---|---|---|
| 60-69 | 92,7% | 83,29% |
| 70-79 | 94,2% | 86,84% |
| 80+ | 95,4% | 86,47% |
Offrire servizi vaccinali efficaci, efficienti ed accessibili a tutti è parte essenziale dell’assistenza sanitaria di base e ci consente di raggiungere le coperture vaccinali auspicate in riferimento al PNPV vigente. Gli obiettivi di copertura, per tutti i gruppi target, sono del 75% come obiettivo minimo perseguibile e del 95% come obiettivo ottimale [10]. È quindi necessario individuare tutte le modalità necessarie per il raggiungimento di tali coperture, soprattutto quelle utili per il raggiungimento dei gruppi a rischio. In tal senso la SItI ha recentemente pubblicato un documento dal titolo Le buone pratiche vaccinali per l’Italia in cui ha sottolineato l’importanza che l’offerta vaccinale si ispiri a principi di qualità, costo-efficacia, equità, appropriatezza e sicurezza attraverso percorsi vaccinali costruiti sulla base dei bisogni e delle preferenze degli individui e delle comunità [15].
In accordo con i nuovi LEA che garantiscono la gratuità delle vaccinazioni per i soggetti fragili di tutte le età previste, è auspicabile valutare il mantenimento e il potenziamento di percorsi assistenziali sulla base delle condizioni individuali, per garantire l’equità e la “targetizzazione” dell’offerta vaccinale.
L’adulto anziano over 60 anni, non solo per età, ma anche per presenza di comorbosità, costituisce tra i gruppi di popolazione quello maggiormente esposto alle malattie infettive e quello maggiormente implicato nello sviluppo di complicanze gravi. Considerato l’aumentato rischio in caso di infezione da virus respiratori, è necessario raggiungere il massimo engagement di tale gruppo target anche attraverso collaborazioni che aumentino l’adesione alle vaccinazioni condividendo protocolli di immunizzazione che prevedano percorsi standardizzati.
La standardizzazione dei percorsi vaccinali deve garantire i principi di sicurezza, appropriatezza, equità e qualità dell’offerta, promuovendo la capillarità dei punti vaccinali, semplificando l’accesso, in particolar modo nei casi complessi o con specifiche condizioni di rischio. Attualmente la mancata standardizzazione ha creato disomogeneità tra le procedure e l’offerta vaccinale delle varie regioni e inoltre con l’aumentata disponibilità di nuovi vaccini, i calendari vaccinali regionali sono stati aggiornati senza seguire un razionale concordato a livello nazionale e creando diseguaglianze per la popolazione [9].
Ad oggi il panorama relativo all’organizzazione nazionale dei Servizi Vaccinali, appare fortemente eterogeneo, sia in termini di strutture che di team di professionisti. È sempre più evidente la necessità di differenziare l’offerta vaccinale per le varie fasce di età, sia in termini di percorsi di accesso alle strutture sia nel rispetto del giusto approccio alla persona. In tal senso, il modello organizzativo territoriale delle vaccinazioni è un modello a rete che deve tener conto delle peculiarità delle regioni, garantendo le vaccinazioni attraverso l’organizzazione interna dei Dipartimenti di Prevenzione e/o promuovendo collaborazioni con altre strutture e professionisti opportunamente individuati e formati per l’erogazione delle vaccinazioni ed il raggiungimento degli obiettivi del PNP.
Nella vaccinazione anti-RSV del soggetto adulto-anziano saranno strategici il ruolo della chiamata attiva da parte dei centri vaccinali e del medico di medicina generale (MMG), l’organizzazione di PDTA dei pazienti affetti da patologie croniche, il coinvolgimento degli specialisti ambulatoriali e ospedalieri e di strutture e servizi sociosanitari (RSA, ADI) per i pazienti fragili (PNPV 2023-2025). Tutti questi punti sono stati recentemente sottolineati nel position paper dell’Alleanza Happyageing che ne ha evidenziato il carattere strategico per il raggiungimento degli obiettivi di copertura ed, ancora più importante, di miglioramento dello stato di salute della popolazione [16].
Laddove non fosse realizzabile l’erogazione delle vaccinazioni necessarie direttamente presso il servizio che ha in carico il paziente per la patologia specialistica, neanche attraverso la realizzazione di protocolli interdipartimentali e/o interaziendali, appare fondamentale facilitare le attività di prenotazione ed indirizzo del paziente stesso presso i centri vaccinali territoriali che se ne faranno carico per l’offerta del calendario specifico.
La strategia vaccinale per l’inserimento del nuovo vaccino anti-RSV, prendendo in considerazione queste tematiche, dovrà essere quindi proposta in base allo stato vaccinale del soggetto e delle altre vaccinazioni già previste da somministrare quali antinfluenzale, anti-COVID-19, anti-pneumococcica, anche in considerazione alla situazione epidemiologica della co-circolazione dei virus respiratori [17-20].
Nell’ambito dello scenario suddetto, valutando le possibili strategie, in accordo con il calendario vaccinale, al fine di favorire ampia copertura vaccinale, si potrebbe ipotizzare l’inserimento del vaccino anti-RSV nel soggetto fragile e nella coorte della popolazione adulto-anziana durante la stagione influenzale. L’offerta vaccinale potrebbe essere proposta per questi soggetti a partire dai primi di ottobre per poter garantire la possibilità di ottenere la massima copertura per influenza, COVID-19 ed RSV.
D’altro canto, nella programmazione di un percorso vaccinale standardizzato contro patogeni respiratori, nella medesima seduta vaccinale potrebbero essere cosomministrati il vaccino antinfluenzale stagionale ed il vaccino anti Covid-19 (anche alla luce delle nuove circolari ministeriali), e, successivamente proporre dopo 30 giorni la somministrazione del vaccino anti-RSV, andando per esempio a cosomministrarlo con la vaccinazione antipneumococcica, i cui dati preliminari sulla sicurezza ed efficacia della cosomministrabilità sono in studio.
Chiaramente tale schedula vaccinale “parzialmente destagionalizzata” ed in cosomministrazione con il vaccino antipneumococcico, potrebbe risentire significativamente delle future evidenze scientifiche relative alla durata dell’immunità del nuovo vaccino anti-RSV, oggetto di questa valutazione HTA, che, ad oggi, si estende fino a due stagioni [21].
La cosomministrazione avrebbe come effetto positivo quello di ridurre significativamente le infezioni respiratorie stagionali e, di conseguenza, il carico sul SSN in un periodo (la stagione influenzale) già critico, sia dal punto di vista organizzativo che assistenziale.
In Tabella III viene riproposta l’analisi SWOT relativa a punti di forza, punti di debolezza, opportunità e minacce relativamente all’introduzione di una vaccinazione anti-RSV nella popolazione adulto-anziana.
Analisi SWOT della vaccinazione anti-RSV nel soggetto adulto-anziano.
| Punti di forza | Punti di debolezza | Opportunità | Minacce |
|---|---|---|---|
| Vaccino con ottimo profilo di efficacia e sicurezza | Diversificazione dei setting vaccinali (es. centri vaccinali, farmacie, MMG, ospedali ecc.) | Costo della campagna vaccinale | |
| Riduzione degli accessi per patologie RSV-correlate presso cure primarie | Mancanza di dati sulla durata long-term dell’immunità conferita dal vaccino | Riduzione circolazione RSV | Disponibilità del vaccino e tempestiva sincronia delle forniture |
| Riduzione degli accessi ospedalieri, sia in pronto soccorso che in ricovero, durante la stagione influenzale | Possibile cosomministrazione con altri vaccini | Disponibilità di strutture, risorse umane e tecnologiche che rendano la campagna vaccinale facilmente attuabile | |
| Riduzione costi diretti e indiretti legati all’assistenza sanitaria | Popolazione target potenzialmente molto numerosa | ||
| Difficoltà a raggiungere coperture vaccinali significative (come nel caso di altri vaccini dell’adulto-anziano) |
Per co-somministrazione si intende la somministrazione simultanea di due o più vaccini nell’arco della stessa giornata [22].
La possibilità di co-somministrare più vaccini genera benefici a diversi livelli: individuale, di Sanità Pubblica e collettivo. Riducendo il numero di sedute vaccinali si ottengono molteplici vantaggi; i principali sono: migliore aderenza alla schedula vaccinale, aumento delle coperture vaccinali, riduzione dei costi di gestione dell’ambulatorio vaccinale e beneficio per la collettività associato all’aumento delle coperture vaccinali e alla riduzione dei costi sanitari. Pertanto, la co-somminstrazione può essere considerata un punto fondamentale delle strategie vaccinali pubbliche.
In Europa e in Italia la possibilità di co-somministrazione è indicata nel riassunto delle caratteristiche del prodotto di ogni singolo vaccino. Alla base di ogni co-somministrazione, approvata dagli enti regolatori, vi sono studi clinici che valutano l’eventuale interferenza in termini di immunogenicità ed efficacia nonché la sicurezza e la tollerabilità [23].
Sono molti i vaccini d’uso comune che hanno ad oggi l’indicazione alla co-somministrazione (es. antipneumococcica, antinfluenzale, anti-MPRV), soprattutto in età pediatrica, quando è eseguito il maggior numero di vaccinazioni [10].
Occorre ricordare, però, che la co-somministrazione non è solo una pratica strategica per l’età pediatrica ma per tutti i gruppi di popolazione. Nello specifico, per la popolazione over 60, sono molteplici i vaccini co-somministrabili (antipneumococcica, antiinfluenzale, anti-herpes zoster, anti-SARS-CoV-2) [10].
Considerando il nuovo vaccino RSVPreF3 OA, indicato per l’immunizzazione attiva contro la malattia del tratto respiratorio inferiore (LRTD) provocata da RSV negli adulti di età ≥ 60 anni [24], ad oggi, diversi RCTs sono stati progettati per valutare la possibile co-somministrabilità del prodotto.
Da scheda tecnica [24], RSVPreF3 OA può essere co-somministrato con il vaccino antinfluenzale stagionale, quadrivalente, inattivato, dose standard, non adiuvato [25]. Lo studio di fase III condotto in adulti di età ≥ 60 anni, aveva come obiettivo la valutazione dell’immunogenicità, della reattogenicità e della sicurezza di RSVPreF3 OA co-somministrato con un vaccino antinfluenzale quadrivalente stagionale (FLU-QIV). Nello specifico, i partecipanti (randomizzati 1:1) hanno ricevuto il vaccino RSVPreF3 OA contemporaneamente al vaccino FLU-QIV (gruppo Co-Ad) al giorno 1 o FLU-QIV il giorno 1 seguito da RSVPreF3 OA il giorno 31 (gruppo con somministrazione sequenziale). I risultati di questo RCT hanno mostrato titoli di neutralizzazione verso RSV-A nei soggetti appartenenti al gruppo Co-Ad non inferiori rispetto a quelli osservati nel gruppo che aveva ricevuto una singola dose di RSVPreF3 OA. Questo risultato di non inferiorità immunogenica si manteneva stabile ad un mese dopo la vaccinazione. I risultati relativi ai titoli di neutralizzazione del vaccino FLU-QIV presentavano lo stesso andamento di RSV ed erano simili nei due gruppi. La co-somministrazione è risultata ben tollerata, con un profilo di sicurezza accettabile. Gli eventi avversi locali e sistemici più frequentemente descritti, nel gruppo di co-somministrazione, sono risultati di entità lieve e moderata. Tra questi il dolore nel sito di inoculo è risultato essere l’evento avverso maggiormente segnalato. In media la durata dei sintomi non superava i 3 giorni. Non sono stati evidenziati problemi di sicurezza.
In sintesi, l’RCT ha dimostrato che la risposta immunitaria ottenuta con la co-somministrazione del vaccino RSVPreF3 OA e FLU-QIV non era inferiore alla risposta immunitaria elicitata dalla somministrazione sequenziale, in termini di rapporti GMT per RSV-A, neutralizzazione e titoli HI per ciascun ceppo FLU-QIV. La co-somministrazione di RSVPreF3 OA e FLU-QIV è risultata sicura e ben tollerata.
In un’ottica di inserire la vaccinazione anti-RSV nel calendario vaccinale della popolazione over60 è necessario studiare la possibile co-somministrabilità con i vaccini raccomandati per questo gruppo di popolazione. Infatti, attualmente, sono in corso RCTs progettati con l’obiettivo di valutare la co-somministrazione con: i) i vaccini influenzali stagionali adiuvato e ad alto dosaggio, ii) vaccino anti-herpes-zoster e iii) vaccino antipneumococcico coniugato 20-valente (PCV20).
Relativamente alla co-somministrazione di RSVPreF3 OA con il vaccino antinfluenzale quadrivalente inattivato adiuvato (FLU aQIV) [26], lo studio prevede due gruppi: il primo con co-somministrazione RSVPreF3 OA + FLU aQIV al giorno 1 e il secondo con vaccinazione sequenziale che prevede al giorno 1 immunizzazione con FLU aQIV e al giorno 31 la somministrazione di una dose RSVPreF3 OA. L’obiettivo prevede di valutare la sicurezza, tollerabilità e non inferiorità della risposta immunitaria della somministrazione simultanea dei due vaccini rispetto alla somministrazione in due sedute indipendenti.
L’RCT NCT05559476 [27] ha lo stesso obiettivo dello studio clinico randomizzato precedente con la diversità di considerare come vaccino antinfluenzale quello quadrivalente ad alto dosaggio (FLU-HD).
Come precedentemente evidenziato è fondamentale valutare la co-somministrazione con tutti i vaccini raccomandati per la popolazione di età ≥ 60 anni. Pertanto, è in fase di realizzazione l’RCT NCT05966090 [28] che prevede di valutare l’immunogenicità, la reattogenicità e la sicurezza del vaccino RSVPreF3OA quando somministrato con il vaccino anti-Herpes Zoster (HZ) ricombinante adiuvato, in partecipanti con età ≥ 50 anni, [randomizzati 1:1; gruppo 1 (giorno 1: 1° dose di HZ + RSVPreF3 OA; giorno 61: 2° dose di HZ); gruppo 2 (giorno 1: 1° dose di HZ, giorno 31: vaccino RSVPreF3 OA, giorno 61: 2° dose di HZ)]. Saranno valutate le concentrazioni degli anticorpi anti-gE (espressi come concentrazione media) il mese successivo alla seconda dose del vaccino HZ e i titoli di neutralizzazione di RSV-A e B un mese dopo la somministrazione del vaccino RSVPreF3 OA, nonché la percentuale di eventi avversi, locali o sistemici, nei 7 giorni successivi alla vaccinazione. La valutazione della sicurezza si baserà anche sulla raccolta di eventi avversi seri o non comuni.
Anche la possibile co-somministrazione di RSVPreF3 OA con il vaccino pneumococcico coniugato 20-valente (PCV20) è in fase di valutazione [29]. Al pari degli altri studi, saranno valutati i titoli di anticorpi neutralizzanti RSV-A e B a 30 giorni nel gruppo Co-ad (RSVPreF3 OA + PCV20 al giorno 1) e 61 giorni nel gruppo di controllo (PCV20 al giorno 1 e RSVPreF3 OA al giorno 31) e i titoli di anticorpi opsonofagocitici per ciascuno dei sierotipi del vaccino PCV-20 (al giorno 31 post-vaccinazione). Come i precedenti RCTs verrà, inoltre, valutata la percentuale dei partecipanti che presenterà eventi avversi sollecitati, locali e sistemici, entro 7 giorni dopo ciascun vaccino. Il profilo di sicurezza prevederà anche la valutazione degli eventi non comuni nei 30 giorni successivi alla vaccinazione e degli eventi avversi seri fino al termine dello studio.
Nella pianificazione di una campagna vaccinale, la riduzione delle disuguaglianze tra i diversi gruppi di popolazione rappresenta un obiettivo non meno importante del raggiungimento di un livello di copertura ottimale nella popolazione generale [10].
Numerose ricerche effettuate in diversi Paesi hanno messo in evidenza lo stretto legame esistente tra i livelli di copertura vaccinale e i determinanti sociali di salute [30-34].
Questi studi forniscono un’ulteriore conferma del fatto che le disuguaglianze sociali ed economiche giocano un ruolo fondamentale nel determinare condizioni di iniquità nell’accesso alle vaccinazioni (e in generale ai servizi sanitari).
Il primo passo per limitare l’impatto delle disuguaglianze nell’accesso ai servizi sanitari consiste nell’identificare i fattori responsabili di iniquità e mettere in atto delle strategie di offerta che siano adeguate ai bisogni dei singoli individui.
La campagna vaccinale anti-RSV avrebbe tra i suoi principali destinatari le persone di età superiore ai 60 anni che, in base a una stima approssimativa del reale volume di attività vaccinale antinfluenzali e anti COVID-19, potrebbe effettivamente intercettare almeno la metà dei 18 milioni di over 60 presenti in Italia.
Per poter garantire un equo accesso alla vaccinazione anti-RSV ad una platea così vasta, è quindi necessario tener conto degli specifici fattori che possono rendere questo gruppo di popolazione difficilmente raggiungibile dai servizi sanitari (Hard to Reach Group, HRG).
Tra questi, il basso livello educativo, l’isolamento sociale, la non autosufficienza e la necessità di assistenza continua (circa il 32% degli over 65 presenta gravi patologie croniche e multimorbosità e circa 4 milioni di anziani presentano gravi limitazioni motorie, sensoriali o cognitive) sono alcuni dei fattori che ostacolano il raggiungimento dell’equità di accesso ai servizi sanitari [35].
Inoltre, alla luce del PNPV 2023-2025 che evidenzia la necessità di abbandonare l’approccio passivo per passare ad una logica proattiva di offerta vaccinale si dovrebbe tener conto delle specificità dei diversi gruppi di utenti/pazienti e portare all’elaborazione di strategie e percorsi, anche diversificati, ma comunque centrati sui bisogni di questi ultimi [10].
In particolare, la diversificazione dei percorsi di vaccinazione riguarderebbe:
i luoghi della vaccinazione, in modo da garantire a ciascun utente il setting più adatto;
gli attori della vaccinazione.
In quest’ottica, ad esempio, considerata l’elevata percentuale di patologie croniche tra gli over 60, potrebbe essere utile l’inserimento dell’offerta vaccinale nei PDTA delle patologie a maggiore prevalenza (diabete, scompenso cardiaco, insufficienza renale ecc.). Ciò comporterebbe il coinvolgimento, nel percorso di vaccinazione, del personale medico specialistico, ospedaliero, delle strutture sociosanitarie e socioassistenziali. Inoltre, anche il coinvolgimento del personale delle strutture sociosanitarie e socioassistenziali (quali le RSA) garantirebbe maggiore equità di accesso alla vaccinazione agli anziani non autosufficienti. In tal senso, i dati ISTAT indicano che nei 12.261 presidi residenziali socioassistenziali e sociosanitari attivi in Italia ci sono 210 mila ospiti anziani non autosufficienti, la metà dei quali sono ultra-ottantacinquenni, rappresentando quindi un non trascurabile target di popolazione [36].
I soggetti che non presentano gravi patologie croniche o comorbosità potrebbero, invece, beneficiare della disponibilità di setting vaccinali differenti (Fig. 4) [37]. In tal senso, l’esperienza della pandemia ha mostrato come le farmacie possano rappresentare, per la loro diffusione nel territorio, un valido setting alternativo. Il setting ospedaliero potrebbe essere invece più adatto per la vaccinazione dei soggetti fragili.
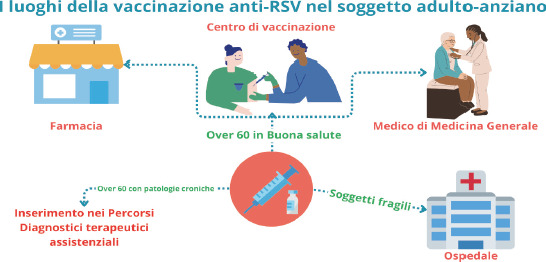
Potenziali setting delle vaccinazioni anti-RSV nel soggetto adulto-anziano e fragile.
In generale, un approccio proattivo anche a livello ospedaliero (“Ospedale che vaccina” come suggerito dal PNPV2023-2025) consentirebbe di offrire la vaccinazione ad individui che hanno già avuto accesso ad altri servizi sanitari (es. ricovero, follow-up ambulatoriale, visita specialistica ecc.), garantendo l’ottimizzazione dei tempi di erogazione degli stessi e la riduzione del numero di spostamenti per necessità sanitarie.
L’estensione dell’offerta vaccinale alle diverse fasi del percorso clinico-assistenziale permetterebbe di intercettare un numero importante di persone che, per i fattori sopracitati, rischierebbe di non accedere alla vaccinazione. Tuttavia, per poter rendere effettivo il coinvolgimento di MMG e personale medico specialistico, territoriale e ospedaliero, è necessario garantire a queste categorie l’accesso all’anagrafe vaccinale.
La vaccinazione rimane uno degli strumenti essenziali e più economici disponibili per garantire la salute e il benessere delle comunità [38]. Il vaccino anti-RSV rappresenta un importante e innovativo strumento per la prevenzione nei confronti delle infezioni da RSV nella popolazione adulta-anziana.
Con l’arrivo in commercio di una nuova offerta vaccinale, risulterà di fondamentale importanza porsi come obiettivo primario una comunicazione efficace da rivolgere alla popolazione target.
La comunicazione in ambito vaccinale deve oggi tenere conto di una molteplicità di obiettivi, destinatari, canali e metodi attraverso i quali essa deve essere realizzata, con la principale finalità di costruire e mantenere la fiducia della popolazione nelle vaccinazioni e nelle istituzioni sanitarie.
Risulta ormai evidente, come analizzato durante la pandemia da COVID-19, che l’alfabetizzazione sanitaria (Health literacy) di una comunità dipenda strettamente dal livello comunicativo che agisce sulla stessa.
L’alfabetizzazione sanitaria corrisponde alla motivazione ed alla capacità delle persone di cercare e comprendere le informazioni sanitarie (Health Literacy funzionale) e nell’interpretare ed utilizzarle (Health Literacy interattiva-critica) per migliorare e mantenere un buono stato di salute. Elevati livelli di alfabetizzazione sanitaria di una popolazione, dunque, corrispondono a migliori esiti di salute e risparmio sulla spesa sanitaria.
Secondo quanto riconosciuto a livello internazionale, la comunicazione di una nuova campagna vaccinale, inclusa quella di promozione della vaccinazione anti-RSV, dovrà lanciare messaggi chiari, semplici, sintetici ma allo stesso tempo precisi, portando la popolazione anziana e fragile a vaccinarsi in modo consapevole e per libera scelta. Attraverso il processo di maturazione della consapevolezza e della libera scelta da parte della popolazione, si potrà infatti cambiare la sensibilità degli stessi nei confronti della vaccinazione, favorendo un cambiamento di prospettiva e considerando la vaccinazione come un’opportunità e non come un obbligo.
Tuttavia, più malattie possiamo prevenire o mitigare attraverso la vaccinazione, come quella causata da RSV, più diventerà fondamentale garantire informazioni accurate sui vaccini.
In virtù di quest’ultimo obiettivo la Commissione Europea negli ultimi anni ha supportato iniziative come la Coalition for Vaccination ed ha lanciato campagne di comunicazione (come United in Protection) per aumentare la consapevolezza sui benefici della vaccinazione, formando gli operatori sanitari su modalità adeguate di comunicazione al fine di migliorare e rendere più efficaci i messaggi rivolti alla popolazione [39, 40]. In tale contesto, il personale sanitario svolge un ruolo chiave nella promozione e mantenimento della salute dei pazienti che sono chiamati ad assistere, tanto nel percorso di cura, tanto nell’attività di educazione sanitaria. Appare evidente come formare le competenze delle istituzioni e dei professionisti sanitari per progettare e attuare pratiche su misura, basate sull’evidenza e incentrate sulle persone, creerà fiducia e risulta essere strumento fondamentale per contrastare l’eventuale disinformazione sulla nuova proposta vaccinale.
Come riportato esplicitamente nel PNPV 2023-2025, ogni operatore sanitario che abbia possibilità di promuovere la vaccinazione anti-RSV (es. ambito specialistico ospedaliero e territoriale), e a maggior ragione chi svolge, a qualsiasi titolo, incarichi per conto del SSN, dovrà essere chiamato a informare, consigliare e promuovere le vaccinazione anti-RSV alla popolazione target, in accordo alle più aggiornate evidenze scientifiche e alle strategie condivise a livello nazionale, sottolineando come la diffusione di informazioni non basate su prove scientifiche sia “moralmente deprecabile, costituisca grave infrazione alla deontologia professionale oltreché essere contrattualmente e legalmente perseguibile”.
Per una comunicazione efficace, sarà importante promuovere un approccio integrato e intersettoriale, ad esempio attraverso interventi basati sui setting di maggior frequentazione della popolazione adulta e fragile (es. nei luoghi di lavoro, nelle comunità per anziani, nelle RSA, nelle comunità religiose etc..) ed incoraggiare la collaborazione tra professionisti sanitari che operano in questi setting (medico competente, MMG, oncologo, geriatra ecc.) con le autorità sanitarie, la società civile ed i media.
Il programma di comunicazione dell’offerta vaccinale anti-RSV dovrà essere quanto più possibile personalizzato e targetizzato. Infatti, anche se la patologia da RSV può colpire potenzialmente l’intera popolazione indipendentemente dall’età, la vaccinazione ha una irrinunciabile importanza strategica soprattutto per alcune categorie.
In riferimento a quanto detto, ad esempio, il successo della campagna di vaccinazione anti-COVID-19 ha trovato fondamento sulla personalizzazione della chiamata e del messaggio veicolato alla popolazione. Dunque, i soggetti in cui l’impatto della patologia da RSV risulta più rilevante e per cui la vaccinazione risulterà più importante (over 60 ed i soggetti con comorbosità che aumentano il rischio di quadri clinici critici) dovranno ricevere un percorso di avvicinamento alla vaccinazione specifico. La comunicazione dovrà in particolare essere, pertanto, adattata alla popolazione adulta-anziana, attraverso un linguaggio e mezzi adeguati.
Quest’obiettivo apparirà raggiungibile attraverso l’ausilio e la collaborazione con i MMG. Quest’ultimi, rappresentando la principale figura di riferimento dell’assistito, potranno attuare, tramite consultazione della banca dati a loro disposizione, una campagna di vaccinazione il più mirata possibile.
Tutte le risorse tecnologiche utilizzate durante la pandemia da COVID-19 per promuovere la vaccinazione (SMS, e-mail, social ecc.), potranno rappresentare un valido supporto nella promozione della vaccinazione anti-RSV. Agli strumenti digitali potranno essere affiancati anche i mezzi più tradizionali come la lettera, gli spot radiofonici e televisivi, gli opuscoli e le infografiche da distribuire nei luoghi di maggiore aggregazione della popolazione adulta-anziana (ambulatori MMG, farmacie, reparti, ambulatori ospedalieri, circoli ricreativi, mezzi di trasporto, chiese ecc.).
Per favorire la sensibilità alla tematica da parte della popolazione target adulta anziana si potrebbero utilizzare come modelli di comunicazione anche personaggi pubblici vicini a questa fascia d’età (es. attori, sportivi ecc.).
La lettera cartacea a domicilio rappresenta un valido strumento di comunicazione per un’offerta vaccinale attiva, specialmente quella rivolta ad una popolazione adulta-anziana poco avvezza agli strumenti digitali.
A sostegno di quest’ultimo strumento, uno studio su 228.000 assistiti MEDICARE ha evidenziato come l’invio a domicilio di una lettera cartacea che offriva la vaccinazione antinfluenzale aumentava i tassi di adesione da parte della popolazione target rispetto al non inviare alcuna lettera [16, 41].
In virtù della nuova opportunità vaccinale con vaccini anti-RSV dovrà essere prevista anche una risposta coerente, tempestiva, trasparente e affidabile degli eventi avversi vaccino-correlati a livello nazionale, regionale e locale, come peraltro raccomandato proprio nel PNPV 2023-2025.
Come per tutte le vaccinazioni entrate da poco in commercio dovrà essere effettuato uno sforzo per comprendere e affrontare le eventuali preoccupazioni che potrebbero subentrare in merito al nuovo vaccino e, al fine di instaurare fiducia nella popolazione, sarà di primaria importanza definire, in collaborazione con AIFA e con la rete dei referenti regionali per la vaccinovigilanza, la migliore modalità per garantire la trasparenza e l’efficienza del sistema di sorveglianza nonché per comunicare i risultati positivi ottenuti e sottolineare i progressi della prevenzione vaccinale.
Per quanto detto, sarà fondamentale formare gli operatori sanitari sulla comunicazione in ambito vaccinale al fine di massimizzare il ruolo che svolgono nell’affrontare l’esitazione vaccinale promuovendo meccanismi di formazione a cascata per dare capillarità alle azioni formative (es. creare collaborazione tra le diverse società scientifiche) nonché organizzare corsi di formazione mirati su counselling vaccinale e comunicazione del rischio in ambito vaccinale.
Sarà necessario sviluppare piani di comunicazione e includere sistemi di monitoraggio dell’opinione pubblica prima e dopo l’introduzione del nuovo vaccino (es. attivazione di un sistema di monitoraggio/sorveglianza dell’esitazione vaccinale specifico per vaccinazione anti-RSV).
Infine, per facilitare la più ampia accessibilità ai servizi vaccinali sarà necessario prevedere siti istituzionali regionali/locali che garantiscano tutte le informazioni su sedi, orari, contatti, modalità di accesso alle attività vaccinali e assicurare il puntuale aggiornamento (Fig. 5).

Esempio di pianificazione e management di una campagna comunicativa di promozione della vaccinazione anti-RSV.
RSV si è dimostrato un patogeno temibile verso il quale fino ad oggi non abbiamo avuto armi efficaci, né dal punto di vista terapeutico (terapie di supporto e non eziologiche) né dal punto di vista preventivo e questo ha determinato, soprattutto negli anziani e nei soggetti fragili, ricadute in ambito sanitario, sociale ed economico. In atto, la nostra esperienza relativa alle campagne di vaccinazioni antinfluenzali, anti-Covid-19 ed anti-pneumococciche nel soggetto adulto-anziano, hanno messo in evidenza come i vaccini costituiscono la forma di prevenzione più efficace nei confronti delle infezioni respiratorie e delle complicanze ad esse correlate [42]. L’OMS, di concerto con un adeguato sistema di sorveglianza delle malattie infettive, ha dichiarato che la pratica vaccinale è un obiettivo prioritario di salute, tanto per i paesi industrializzati quanto per quelli in via di sviluppo.
Inoltre, i vaccini costituiscono uno dei pilastri fondamentali nel contrastare il fenomeno dell’antibiotico-resistenza in vari modi: in maniera diretta, prevenendo le infezioni batteriche e, quindi, limitando l’uso di antibiotici (come nel caso dello pneumococco); in maniera indiretta, riducendo le infezioni virali e limitando sia l’inappropriatezza prescrittiva sia le sovrapposizioni batteriche che richiederebbero un trattamento antibiotico specifico.
Per tale motivo nell’ottica del contrasto alle infezioni correlate all’assistenza e all’antibiotico-resistenza, con l’immissione in commercio di nuovi vaccini, sarà necessario formulare raccomandazioni tempestive sul loro utilizzo, anche sulla base di considerazioni ed evidenze in termini di sanità pubblica.
In una prospettiva futura, alla luce delle recenti evidenze scientifiche sulla prolungata durability dell’immunizzazione attiva conferita dal vaccino ricombinante adiuvato, tale vaccinazione potrebbe proteggere più stagioni andandosi ad uniformare con l’offerta antipneumococcica destagionalizzata.
Appare opportuno, alla prima revisione utile del Calendario Vaccinale del PNPV 2023-2025, inserire tale raccomandazione tra le strategie vaccinali dell’adulto anziano andando ad arricchire ed integrare quelle attualmente esistenti.
Con l’immissione in commercio dei vaccini anti-RSV, avremo a disposizione degli strumenti di prevenzione, che nel breve termine mitigheranno il carico di malattia e nel lungo termine, con la riduzione della circolazione stagionale del patogeno, offriranno una prospettiva favorevole in termini di Sanità Pubblica.
In attesa di un vaccino polivalente che, in un’unica somministrazione stagionale, protegga nei confronti dei principali patogeni respiratori, compreso RSV (vaccino PanFLU), sarà necessario potenziare le reti di sorveglianza individuando i profili evolutivi dei virus circolanti ed emergenti su cui orientare gli strumenti di prevenzione.
La vaccinazione degli adulti e degli anziani è cruciale per proteggere la salute individuale e pubblica, ma spesso riceve meno attenzione rispetto alla vaccinazione pediatrica. Tuttavia, l’esperienza della Regione Calabria offre un’interessante prospettiva su come migliorare la copertura vaccinale in queste fasce di età.
Il Calendario Vaccinale della Regione Calabria, relativamente alle vaccinazioni degli anziani, ha inserito già dal 2015 la vaccinazione antinfluenzale gratuita a partire dal 60° anno di età e (oltre al richiamo anti-dtp ogni 10 anni) ha introdotto al 65° anno la vaccinazione anti-zoster e quella anti-pneumococcica PCV seguita a distanza di almeno 2 mesi da PPV23: al compimento del 70° anno, le stesse vaccinazioni se non effettuale al 65° anno. La vaccinazione contro l’herpes zoster è stata inclusa nel calendario regionale già a partire dal 2015 ma dal 2022 viene offerta utilizzando esclusivamente il vaccino ricombinante adiuvato RZV.
A livello regionale, il servizio a cui è affidata la responsabilità dell’offerta delle vaccinazioni dell’adulto è il Dipartimento di Prevenzione, mentre la somministrazione è condivisa tra il Dipartimento di Prevenzione e i Medici di Medicina Generale (MMG). È opinione condivisa, infatti, che i MMG debbano essere pienamente coinvolti sia nella promozione delle vaccinazioni, laddove le stesse venissero effettuate nei centri Vaccinali, sia nell’esecuzione diretta delle vaccinazioni presso il proprio ambulatorio, sia nell’individuazione dei soggetti a rischio (diabetici, cardiopatici, affetti da patologie polmonari o renali o ematologiche o reumatologiche o oncologiche) che rappresentano, insieme ai soggetti vaccinabili per età anagrafica, una larghissima fascia di popolazione attualmente carente di vaccinazioni adeguate. Il coinvolgimento dei MMG è quindi cruciale per promuovere ed eseguire le vaccinazioni, identificare i soggetti a rischio e facilitare l’accesso ai servizi vaccinali
La Regione Calabria ha adottato una strategia di campagna vaccinale dinamica per l’anziano, certa che un ruolo fondamentale nella buona adesione della popolazione sia rappresentato dalla “chiamata attiva” da parte dei centri vaccinali che invitano alla vaccinazione gli aventi diritto per età anagrafica, convocandoli attraverso l’invio di inviti scritti. La strategia a due coorti adottata dalla Regione Calabria (65enni e 70enni), inoltre, ha un razionale importante: vaccinando i sessantacinquenni, cinque anni dopo la coorte dei settantenni sarà parzialmente già vaccinata, semplificando l’attività, ma l’appuntamento viene mantenuto anche per recuperare quelli non vaccinati cinque anni prima. I non rispondenti alla prima convocazione vengono dunque chiamati una seconda volta cinque anni dopo, dando loro una “seconda occasione”. Viene inoltre garantito il mantenimento del diritto ove già conseguito: il vaccinando facente parte delle coorti di chiamata conserva il diritto anche se non risponde subito alla convocazione, ma si presenta successivamente: quindi, inevitabilmente, nel corso degli anni si vaccinano anche soggetti in età intermedia tra 65 e 70 anni e gli ultrasettantenni non precedentemente vaccinati. L’invio della convocazione mediante lettera produce interessanti effetti di comunicazione perché crea un ulteriore collegamento con i MMG che, quasi sempre, vengono chiamati in causa dai propri pazienti con richieste di chiarimenti e di consigli sull’opportunità di vaccinarsi. Non solo, con questa strategia si ottiene un effetto di comunicazione di massa attraverso la lettura da parte di tante persone dell’invito e si innesca un “passa parola” tra anziani che, pur essendo quasi tutti ormai fuori dal mondo del lavoro, fanno parte di associazioni, di comunità e hanno amici e parenti che, se non compresi tra le persone invitate, si interrogano sul perché anche a loro non sia stata offerta la vaccinazione.
Nella fase di avvio dell’esperienza, nell’ ASP di Reggio Calabria, in un periodo compreso tra febbraio 2016 e dicembre 2017, sono state inviate 7.490 lettere di invito a persone di 65 anni e 6.179 lettere di invito a persone di 70 anni. I tassi di adesione sono stati interessanti in entrambe le coorti: livelli così elevati di copertura vaccinale per HZ e PCV13 non erano mai stati raggiunti prima nella Regione. Tuttavia, il risultato principale è stato, senza dubbio, il tasso significativamente elevato di PCV13 e HZ in co-somministrazione. I due vaccini sono stati co-somministrati in un totale di 2.811 individui: nella coorte di 65 anni, coloro che hanno ricevuto il vaccino HZ (n = 1.693) hanno ricevuto anche il PCV13 (n = 1.617) nel 95,5% dei casi; per la coorte di 70 anni, coloro che hanno ricevuto il vaccino HZ (n = 1.281) hanno ricevuto anche il PCV13 (n = 1.209) nel 94,4% dei casi. Si è colta l’occasione per invitare l’anziano a effettuare successivamente il richiamo dtp o la vaccinazione primaria antitetanica. Questi dati supportano l’ipotesi di un effetto “carry-on” dei vaccini. Questa esperienza ha rappresentato anche il primo studio internazionale sulla co-somministrazione dei due vaccini PCV 13 e HZ in sicurezza: non sono stati, infatti, segnalati eventi avversi tra la popolazione coinvolta. Adesso, naturalmente, seguendo il naturale aggiornamento dei vaccini, vengono utilizzati in co-somministrazione il PCV20 e il vaccino anti-zoster RZV.
Ad oggi questa strategia è ancora attiva in tutta la Regione Calabria, portando a un aumento importante delle coperture vaccinali sia per herpes zoster che per pneumococco rispetto al periodo in cui non si effettuava la chiamata attiva. Ad oggi, la CV per questi due vaccini per l’intera Regione è di circa il 35%. L’esperienza della Regione Calabria evidenzia il potenziale delle strategie innovative per migliorare la copertura vaccinale negli anziani. La “chiamata attiva” ha dimostrato di essere un efficace strumento per coinvolgere la popolazione anziana e migliorare l’accesso alle vaccinazioni.
Nonostante gli sforzi, la Regione Calabria continua ad affrontare importanti sfide nella vaccinazione degli adulti e degli anziani. La carenza di risorse insieme alla persistente limitata consapevolezza sull’importanza delle vaccinazioni, rappresentano ostacoli significativi. Tuttavia, i risultati raggiunti indicano un miglioramento delle coperture vaccinali nelle fasce di età adulta e anziana, suggerendo che le strategie adottate stiano producendo risultati positivi. È necessario un impegno continuo da parte delle autorità sanitarie, del personale sanitario e della comunità per garantire che tutti gli adulti e gli anziani abbiano accesso equo e completo ai servizi vaccinali, contribuendo così a proteggere la salute individuale e pubblica.
La vaccinazione degli adulti e degli anziani è fondamentale per incrementare i livelli di protezione della salute individuale e pubblica. La Regione Campania considera un’interessante prospettiva migliorare la copertura vaccinale in queste fasce di età. Specificamente si rappresenta questa definizione organizzativa con le priorità riportate di seguito.
Nei pazienti a rischio, fragili per età o presenza di altre malattie croniche come la broncopneumopatia cronica ostruttiva (Bpco), il diabete o il rischio cardiovascolare, è più facile avere una infezione che porti a ospedalizzazione.
Prevenire le infezioni in questa tipologia di pazienti è di rilievo assistenziale notevole e a grande impatto socio assistenziale.
Riportiamo di seguito una serie di aspetti ed ambiti socio assistenziali rilevanti che sono in costante monitoraggio ed implementazione.
Le persone che hanno un’immunità compromessa, come gli anziani con Bpco, diabete o malattia cardiovascolare in seguito all’infezione da virus respiratorio sinciziale (RSV), hanno un rischio più alto di sviluppare forme gravi di questa patologia, tanto da richiedere l’ospedalizzazione che, in questi pazienti, è dalle 3 alle 10 volte più frequente.
Avere uno strumento, come il vaccino, che riduce il rischio di ricovero è molto importane. In pazienti con già una patologia cronica come la Bpco, per esempio, un’infezione come quella da RSV può scatenare una riacutizzazione dei sintomi, nonostante un buon controllo farmacologico. Tale condizione può richiedere l’ospedalizzazione e peggiorare il quadro clinico generale: ogni riacutizzazione, infatti, aggrava la progressione della malattia cronica. Dobbiamo prevenire quello che possiamo.
In un momento di particolare diffusione delle sindromi influenzali si ritiene importante sottolineare il rilievo, oltre ai tradizionali vaccini contro influenza, COVID, pneumococco e pertosse, di nuovi strumenti di prevenzione finora non disponibili, rappresentati dai vaccini contro RSV, pneumococco ed herpes-zoster (HZ).
L’RSV, noto come causa di bronchioliti nei bambini piccoli, è anche molto rilevante per la salute degli anziani e degli adulti con malattie croniche, in cui determina spesso complicanze importanti quali polmoniti e bronchiti, ospedalizzazioni e morti.
Si ricorda come nell’inverno dell’anno scorso (2022-2023) in Italia l’RSV abbia rappresentato nella popolazione ultrasessantacinquenne oltre il 21% delle sindromi respiratorie acute, contro il 38% del virus dell’influenza, il 21% di SARS-CoV-2 ed il 20% di tutti gli altri virus respiratori (dati RespiVirNet).
È fondamentale inoltre considerare in termini generali l’importanza delle vaccinazioni. In sintesi si rinnova l’importanza della Campagna di Vaccinazione antinfluenzale quale occasione per l’offerta attiva di altre vaccinazioni rilevanti per la salute dell’adulto, anziano e bambino, quali la vaccinazione anti-HZ e anti-pneumococcica, rammentando che queste ultime dovranno essere offerte attivamente da parte dei medici vaccinatori delle AASSLL in qualsiasi momento dell’anno e senza alcuna stagionalità.
Alle categorie a rischio per patologia ed agli ultrasessantacinquenni è fortemente raccomandata l’offerta attiva di tutti gli altri vaccini che, nel caso dell’occorrenza di malattia, possono creare difficoltà nella diagnosi differenziale con COVID-19 e/o determinare iper affollamento e sovraccarico delle strutture sanitarie (Pronto Soccorso, ambulatori dei Medici curanti).
Tutto quanto riportato rappresenta più aspetti rilevanti, è il caso della vaccinazione anti-pneumococcica, della vaccinazione anti-Difto-Tetano-Pertosse degli adulti, della vaccinazione anti-herpes-zoster negli anziani ed anche delle vaccinazioni anti meningococciche (B, C, ACWY135).
In particolare, relativamente alla vaccinazione anti-Pneumococcica, nei pazienti ad alto rischio di complicazioni e negli anziani, la Regione Campania con le note prot. n. 382266 e 476668/2019 ha ribadito che la vaccinazione anti-pneumococcica, inserita nei LEA, è offerta in maniera attiva e gratuita a:
ultrasessantacinquenni (coorte dei nati nel 1955 e precedenti) l’obiettivo di copertura da perseguire, per tale fascia d’età, anche ai fini dell’adempimento LEA è del 75% (almeno per la I dose di vaccino);
soggetti a rischio per patologia in età pediatrica per i quali la strategia di prevenzione prevede la somministrazione di una prima dose di vaccino coniugato, seguita a distanza di almeno 2 mesi da una dose di vaccino polisaccaridico.
La vaccinazione pneumococcica può essere offerta simultaneamente alla vaccinazione antiinfluenzale (che rappresenta in tale caso una occasione opportuna) ma può pure essere somministrata indipendentemente e in qualsiasi stagione dell’anno, anche perché mentre l’antiinfluenzale deve essere ripetuta ogni stagione, l’anti-pneumococcica viene somministrata secondo le attuali indicazioni di dose singola una sola volta nella vita.
Relativamente alla vaccinazione anti-herpes-zoster, la Regione Campania con nota prot. n. 0305937 del 13/06/2022 ha ribadito che la vaccinazione debba essere offerta attivamente ai soggetti di 65 anni di età e ai soggetti a rischio a partire dai 50 anni di età in presenza di diabete mellito, patologia cardiovascolare, BPCO e soggetti destinati a terapia immunosoppressiva.
L’impegno costante consente alla Regione Campania di affrontare le sfide della vaccinazione degli adulti e degli anziani. La persistente limitata consapevolezza sull’importanza delle vaccinazioni della popolazione, rappresentano ostacoli significativi. I risultati ottenuti indicano, tuttavia, un miglioramento delle coperture vaccinali nelle fasce di età adulta e anziana. È, pertanto, necessario un impegno continuo da parte di tutti gli stakeholders per garantire un accesso equo alle vaccinazioni, anche per la popolazione adulta a rischio e anziana.
La prevenzione primaria mediante immunizzazione può giovare alle persone di tutte le età, ma è fondamentale per chi è a più alto rischio di malattie infettive e delle loro complicanze. Questi soggetti sono in buona parte individui immunocompromessi e soggetti con comorbosità (condizioni mediche croniche cardiovascolari, respiratorie, renali ed epatiche, diabete). Per questo motivo, i soggetti maggiormente a rischio sono anche le persone anziane, maggiormente esposte alle malattie infettive a causa dell’immunosenescenza [1]. Risulta essenziale, quindi, che questi soggetti vengano vaccinati in via prioritaria poiché il loro sistema immunitario presenta una ridotta capacità di risposta alle infezioni e, di conseguenza, hanno maggiori probabilità di sviluppare complicanze che possono comportare sequele a lungo termine, ospedalizzazioni e persino il decesso a causa di malattie che potevano essere prevenute tramite vaccinazione [2]. Per gli adulti a rischio e per gli anziani, quindi, la prevenzione deve essere un obiettivo di salute pubblica e individuale prioritario.
L’Italia rappresenta uno dei paesi più longevi al mondo, posizionandosi tra i paesi dell’Unione Europea al terzo posto con una speranza di vita media alla nascita di 82,7 anni (in crescita rispetto agli 82,3 anni del 2020) ma con profonde differenze tra il Nord e il Sud del paese. L’aspettativa di vita più alta si concentra nelle regioni del centro Nord (al vertice la PA di Trento con 84,2 anni) rispetto a quelle del Sud con la Campania fanalino di coda con 80,9. Per la Puglia l’aspettativa di vita alla nascita è di 82,2 anni, in particolare 80,3 anni per gli uomini e 84,6 anni per le donne [3, 4] (Fig. 1).
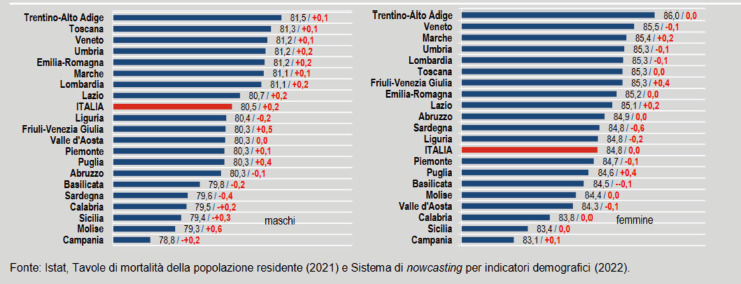
Speranza di vita alla nascita per sesso e Regione. Anno 2022 e variazioni sul 2021 (rosso).
Negli ultimi venti anni, inoltre, è cresciuta tendenzialmente l’incidenza della componente anziana (over 65) in Puglia così come è cresciuta a livello nazionale. Il salto dal 2002 al 2023 è molto evidente in Puglia: +7,9 punti percentuali, dal 15,9 (2002) al 23,8% (2023).
Per avere un quadro sulla “fragilità” della popolazione adulta pugliese dobbiamo rifarci ai dati che l’Istituto Superiore di Sanità (ISS) mette a diposizione attraverso la sorveglianza Passi rivolta alla popolazione compresa nella fascia di età 18-64 anni che si caratterizza come una sorveglianza in sanità pubblica che raccoglie, in continuo e attraverso indagini campionarie, informazioni dalla popolazione italiana adulta sugli stili di vita e fattori di rischio comportamentali connessi all’insorgenza delle malattie croniche non trasmissibili e sul grado di conoscenza e adesione ai programmi di intervento che il paese sta realizzando per la loro prevenzione. Considerando, dunque, i dati raccolti nel biennio 2021-2022 attraverso la sorveglianza Passi [5], il 18% delle persone italiane fra 18 e 69 anni intervistate tra il 2021 e il 2022 ha riferito che, nel corso della vita, un medico ha diagnosticato loro una o più tra le seguenti patologie: insufficienza renale, bronchite cronica, enfisema, insufficienza respiratoria, asma bronchiale, ictus o ischemia cerebrale, diabete, infarto del miocardio, ischemia cardiaca o malattia delle coronarie, altre malattie del cuore, tumori (comprese leucemie e linfomi), malattie croniche del fegato o cirrosi. La condizione di cronicità è più frequente al crescere dell’età (coinvolge il 7% degli adulti con meno di 34 anni, il 13% fra i 35-49enni e il 29% delle persone fra 50 e 69 anni). Inoltre, la cronicità coinvolge di più le persone con status socioeconomico più svantaggiato, con molte difficoltà economiche (28%) o bassa istruzione (35% tra chi ha nessun titolo o la licenza elementare). La condizione di policronicità, ovvero la compresenza di due o più patologie croniche (fra quelle indagate) riguarda, in media, il 4% dei 18-69enni: è più frequente all’aumentare dell’età (viene riferita dall’8% delle persone fra 50 e 69 anni), e tra le persone con status socioeconomico più svantaggiato, per molte difficoltà economiche (9%) o bassa istruzione (11% tra chi ha nessun titolo o la licenza elementare). Relativamente ai dati pugliesi, secondo la sorveglianza Passi, la Puglia mostra percentuali nettamente migliori rispetto alla media nazionale con il 10,2% che dichiara di essere affetto da almeno una patologia cronica, mentre il 2% da almeno due, così come si vede in Figura 2.
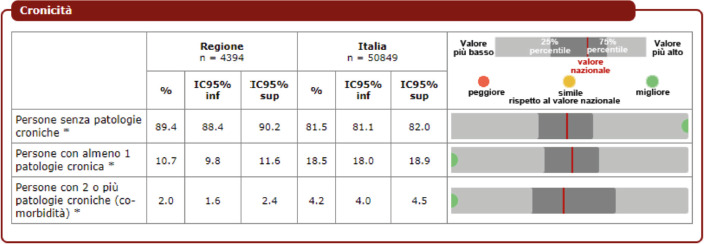
Sorveglianza PASSI. Patologie croniche anni 2021-2022. Confronto Puglia-Italia.
Una società che invecchia può rappresentare non solo un successo ma anche una sfida per la società proprio perché l’effetto negativo del rapido invecchiamento della popolazione è costituito dall’aumento della disabilità legata a malattie croniche non trasmissibili che costituiscono, anche in Italia, uno dei più importanti problemi di sanità pubblica. Se da un lato, quindi, questi dati rappresentano un indubbio successo sul piano della sanità pubblica, in quanto evidenziano una aspettativa di vita molto alta, allo stesso tempo, richiamano l’attenzione sulla necessità di ulteriori interventi di sostegno alle politiche sanitarie e sociali.
Le infezioni da agenti vaccino prevenibili, rappresentano una critica possibilità verso complicanze gravi in alcune categorie di soggetti quali appunto bambini, anziani, persone con comorbosità e malattie croniche. Purtroppo, però la conoscenza da parte della popolazione (specialmente quella a rischio) dei benefici derivati dalla vaccinazione contro certe patologie sono ancora troppo scarse. La vaccinazione nella popolazione adulta/anziana, quindi, deve diventare una componente chiave delle strategie atte a favorire, insieme all’implementazione di altri interventi preventivi volti a promuovere uno stile di vita sano, il mantenimento di un buono stato di salute nel lungo termine.
Molte vaccinazioni, quindi, sono fondamentali per la prevenzione delle malattie infettive nella popolazione adulta e anziana. Il calendario vaccinale dell’adulto/anziano della Regione Puglia riflette le indicazioni nazionali fornite attraverso il Piano Nazionale di Prevenzione Vaccinale (PNPV) 2023-2025 [6]. Considerando la popolazione anziana, così come recitano gli ultimi PNPV, quello del 2017-2019 [7] e quello del 2023-2025 [6] «le vaccinazioni indicate per i soggetti al di sopra dei 65 anni trovano giustificazione e forte raccomandazione in tutti i possibili stati di salute del soggetto». Per gli ultrasessantacinquenni, dunque, è raccomandata la vaccinazione antinfluenzale per ridurre complicanze, ospedalizzazioni e morti dovute a tale infezione. Il vaccino deve essere somministrato ogni anno (periodo ottobre-dicembre). È importante offrire attivamente la vaccinazione con vaccino anti-pneumococcico coniugato seguita da una dose di vaccino polisaccaridico (PCV + PPSV). Va offerta anche la vaccinazione contro l’Herpes Zoster che è in grado di ridurre significativamente l’incidenza dei casi di malattia e della nevralgia post-erpetica, che è una delle complicanze più frequenti e debilitanti della malattia. È opportuno somministrare periodicamente (ogni 10 anni) il vaccino anti difterite-tetano-pertosse e il vaccino anti covid secondo le indicazioni ministeriali relative all’andamento epidemiologico. Anche tra gli ultrasessantacinquenni possono sussistere particolari condizioni di rischio che indichino una raccomandazione per le vaccinazioni contro meningococco, epatite A o epatite B. È inoltre importante verificare l’immunità nei confronti di MPR e varicella, con offerta delle rispettive vaccinazioni in caso di suscettibilità. Nel corso dell’età adulta è opportuna la somministrazione periodica (ogni 10 anni) della vaccinazione difterite-tetano-pertosse ed è importante la verifica dello stato di suscettibilità per morbillo, rosolia, parotite e varicella al fine di vaccinare anche questa fascia di popolazione. Anche in questa fascia di età è importante ribadire la raccomandazione di immunizzare contro l’influenza ad ogni stagione autunnale i soggetti a rischio tra i 19 e i 64 anni. Deve essere rammentata la vaccinazione contro epatite A e pneumococco per le situazioni di rischio. Inoltre, è indicata la vaccinazione contro Herpes zoster nei soggetti a rischio a partire dai 50 anni di età. Nel caso ci siano situazioni di rischio connesse a particolari patologie, è importante raccomandare in questa fascia di età anche le vaccinazioni contro meningite, HPV, epatite B, Hib.
In Puglia è presente una Commissione Regionale Vaccini che sulla base, quindi, delle indicazioni ministeriali provvede ad aggiornare il Calendario Vaccinale per la Vita della Regione Puglia oltre che a dare indicazioni circa eventuali strategie da intraprendere o campagne vaccinali mirate verso particolari target. Esiste, inoltre, un’anagrafe vaccinale regionale, GIAVA, che piano piano si sta condividendo con tutte le figure che ruotano intorno alle vaccinazioni. È importante sottolineare anche che la gestione delle vaccinazioni dell’anziano è in carico ai Medici di Medicina Generale (MMG) e che quelle dell’adulto e dei fragili possono seguire percorsi personalizzati nelle diverse realtà territoriali, passando da una coordinazione da parte dei Dipartimenti di Prevenzione ad una presa in carico da parte degli Specialisti.
Volendo esaminare alcune delle coperture vaccinali (CV) raggiunte in questa fascia di popolazione nella regione Puglia, possiamo considerare, per esempio, i dati che abbiamo a disposizione grazie al report sulla “Sorveglianza dell’influenza in Puglia”, elaborati dall’Osservatorio Epidemiologico della Regione Puglia [8]. La Figura 3 descrive il trend delle coperture vaccinali nei soggetti ultrasessantacinquenni dalla stagione 2008/09 alla stagione 2022/23. Nella stagione 2022/2023 abbiamo assistito a una diminuzione della copertura vaccinale di circa un punto percentuale rispetto alla precedente stagione.
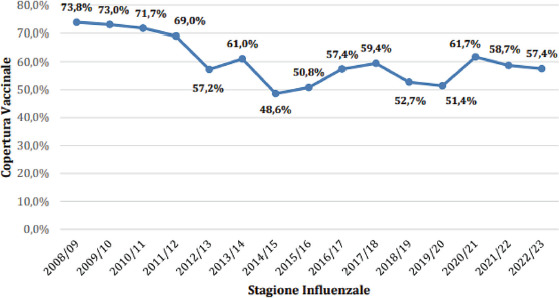
Trend delle coperture vaccinali nei soggetti ultrasessantacinquenni. Regione Puglia, anni 2008-2023.
Rispetto alla CV raggiunta in media in Italia, che è di 56,7%, la Puglia si colloca leggermente al di sopra. Ancora poco conosciute restano le coperture vaccinali dell’anti pneumococcica e dell’anti HZ, mettendo quindi in evidenza un sistema che ancora dimostra numerosi gap da colmare.
Se, invece, andiamo a considerare le CV ottenute dalla sorveglianza Passi, possiamo notare, in Figura 4, come la Puglia si colloca in negativo rispetto all’Italia.
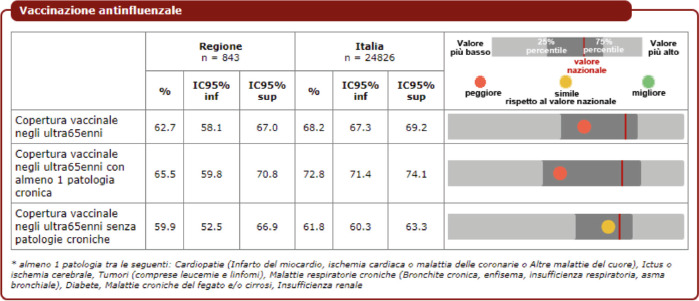
CV antinfluenzale ultrasessantacinquenni Sorveglianza Passi d’Argento. Anni 2021/2022.
Diverse sono le strategie adottate dalle diverse ASL Pugliesi nei confronti di diversi vaccini al fine di innalzare le coperture vaccinali e cercare di raggiungere gli obiettivi di copertura previsti dal PNPV. Riportiamo di seguito alcuni esempi.
Chiamata attiva alle vaccinazioni negli over 65. In Puglia, come già detto, le vaccinazioni per gli adulti over 65 vengono erogate dalla Medicina Generale. Ad oggi, però, l’analisi delle coperture vaccinali regionali di questi vaccini evidenzia livelli sub-ottimali rispetto agli obiettivi del PNPV. Da qui, è nata l’idea, nella ASL di Taranto, di creare un percorso innovativo di affiancamento alla medicina generale per il supporto alla vaccinazione pneumococcica ed anti herpes-zoster, in particolare in fase destagionalizzata con l’obiettivo comune di aumentare disease awareness e sensibilizzazione sul valore della vaccinazione pneumococcica ed anti herpes-zoster nella popolazione over 65 eleggibile alle suddette vaccinazioni. Il progetto prevede la definizione e l’implementazione di un modello innovativo di chiamata attiva, sfruttando i vantaggi del canale digitale, che prevede l’invio di SMS alla popolazione over 65 permettendogli di accedere a tre diversi video:
il cittadino che, durante la progettualità, compie 65 anni (coorte 1959) diventando eleggibile alla vaccinazione pneumococcica ed anti herpes-zoster come indicato da PNPV, ricevendo anche un augurio per il compleanno;
il cittadino tra i 66 ed i 72 anni (coorti dal 1958 al 1952) eleggibile alla vaccinazione pneumococcica ed anti herpes-zoster come indicato da PNPV;
il cittadino over 72 (coorti dal 1951 in poi) eleggibile alla vaccinazione pneumococcica come indicato da PNPV.
A conclusione di ciascun video, il cittadino viene informato che può rivolgersi al suo MMG per prenotare un appuntamento per la vaccinazione oppure, rilasciando il proprio consenso, chiede di essere ricontattato dalla ASL per prenotare un appuntamento. Il progetto, partito l’1 marzo 2024, prevede una durata di un anno.
Open day.
A partire dall’adolescenza, ma in particolare per alcune vaccinazioni come l’HPV e il COVID, diverse realtà territoriali hanno organizzato nel corso degli ultimi anni alcune giornate di Open day rivolte alla popolazione generale. In particolare, durante l’ultima stagione autunnale/invernale, per incentivare la vaccinazione anti-COVID, sono state programmate delle giornate dedicate su libero accesso, come quelle che sono avvenute nella ASL di Lecce (25 gennaio 2024 e 1 e 8 febbraio 2024) organizzate all’Ospedale Fazzi per la somministrazione del vaccino anti-COVID, antinfluenzale, anti-pneumococco e anti Herpes Zoster alla popolazione target. Anche la ASL di Taranto ha riservato un giorno a settimana (il giovedì) a partire dal mese di dicembre 2024 come open day per le vaccinazioni anti-COVID insieme alle altre vaccinazioni previste da calendario per l’anziano e per i soggetti fragili.
Integrazione Ospedale-Territorio per le vaccinazioni dell’adulto fragile.
Anche a livello regionale la tematica delle strategie vaccinali per gruppi di rischio ha catalizzato l’attenzione: un esempio è stato il workshop del 31 maggio 2023 che ha visto protagonisti un gruppo di lavoro di ricercatori e operatori sanitari pugliesi, con la partecipazione della Commissione Regionale vaccini e della sezione Promozione della Salute e del Benessere della Regione Puglia, sulla scorta del DGR 5 ottobre 2021, n. 1589, “Approvazione del nuovo Calendario Vaccinale per la Vita della Regione Puglia – ed. 2021”, durante il quale si è preso atto che nonostante le raccomandazioni e le diverse iniziative per promuovere l’immunizzazione nell’adulto, ad oggi, a distanza di tempo dall’avvio del programma regionale, l’adesione risultava del tutto insoddisfacente con livelli di copertura della popolazione target che non hanno raggiunto i valori attesi. Il Ministero della Salute aveva altresì fornito disposizioni operative aggiuntive a mezzo di nota protocollata n. 35193 del 9 novembre 2023 avente ad oggetto “Ulteriori indicazioni e raccomandazioni per proseguimento delle campagne di vaccinazione autunno-inverno mediante l’implementazione dell’offerta attiva, in un’ottica di prossimità e accessibilità al servizio da parte dei pazienti fragili”. Sulla scorta di tali indicazioni e alla luce delle coperture vaccinali che risultano essere lontane da valori ritenuti soddisfacenti, si è rappresentata in alcune ASL la necessità di sviluppare un protocollo interaziendale, Ospedale-Territorio, in un’ottica di collaborazione tra i vari attori coinvolti al fine di reclutare tramite gli Specialisti Ospedalieri e Distrettuali, i MMG, i PLS, i soggetti fragili destinati a particolari percorsi vaccinali.
Informazione della popolazione e formazione degli Operatori Sanitari.
È importante promuovere lo sviluppo di una vera e propria “cultura vaccinale”, atta a sviluppare nel cittadino una maggiore consapevolezza circa le potenzialità delle vaccinazioni e a contrastare, invece, il diffondersi di fuorvianti falsità e pericolosi pregiudizi. Al fine di aumentare e consolidare sempre più le coperture vaccinali, è necessario, quindi, intraprendere azioni di educazione sanitaria, responsabilizzazione ed empowerment dei cittadini. L’empowerment dei cittadini non è basato solamente sulla capacità dei programmi di prevenzione di raggiungere i soggetti da coinvolgere, ma anche, e soprattutto, sulla formazione degli operatori sanitari. Questi ultimi devono essere fautori dell’interesse individuale e collettivo delle vaccinazioni, instaurando relazioni attente alle esigenze e preoccupazioni dei singoli, basate sul dialogo chiaro e comprensibile. Proprio per questo motivo la Regione Puglia investe molto in comunicazione e in formazione degli operatori sanitari in ambito vaccinale. Tutte le ASL, infatti, organizzano periodicamente convegni/corsi di formazione-aggiornamento per il proprio personale dedicato alle vaccinazioni, così come sono tante le iniziative di comunicazione che le varie realtà territoriali intraprendono sia in ambito sanitario che in luoghi comuni (centri commerciali, piazze, scuole, etc.) rivolte alla popolazione generale ai fini di sviluppare in loro una corretta cultura vaccinale.
L’offerta attiva e gratuita delle vaccinazioni agli adulti/anziani nella Regione Lazio segue le seguenti strategie.
Le campagne di vaccinazione antinfluenzale e anti-COVID-19 vengono garantite presso gli ambulatori dei MMG, dei PLS, nei centri vaccinali, nei punti di somministrazione territoriali (casa della Comunità e poliambulatori) e ospedalieri (progetto l’Ospedale che vaccina) e nelle Farmacie.
La ASL Roma 1 è particolarmente focalizzata sulle strategie di miglioramento dell’offerta di prossimità per vaccinare:
gli operatori sanitari (ormai siamo stabilmente oltre i 9.000);
i diabetici (quest’anno abbiamo registrato un incremento del 21% rispetto allo scorso anno, grazie all’offerta nei centri diabetologici, per cui siamo passati da 3.968 soggetti diabetici vaccinati nella cva 2022-2023 a 4.783 nella cva 2023-2024);
i soggetti con BPCO, che hanno gradito l’offerta direttamente nell’ambulatorio ospedaliero del SFN (dove c’è un grosso centro pneumologico), con un incremento del 30%, per cui siamo passati da 818 soggetti vaccinati nella cva 2022-2023 a 1.065 nella cva 2023-2024);
i soggetti con insufficienza renale e surrenale cronica, che, vaccinati in ambiente ospedaliero, sono passati da 229 soggetti vaccinati nella cva 2022-2023 a 336 nella cva 2023-2024, con un incremento del 47%.
Nella Regione Lazio sono state date direttive per attivare équipe itineranti per vaccinare nelle RSA e nelle Case di riposo.
Nella ASL Roma1 nell’ultima campagna di vaccinazione abbiamo più che raddoppiato le vaccinazioni in queste strutture socio-sanitarie, passando da 445 soggetti vaccinati nella cva 2022-2023 a 925 nella cva 2023-2024.
La campagna di vaccinazione anti-pneumococcica viene garantita presso gli ambulatori dei MMG, dei PLS, nei centri vaccinali e nei punti di somministrazione territoriali (casa della Comunità e poliambulatori) e ospedalieri (progetto l’Ospedale che vaccina).
La campagna di vaccinazione anti-Herpes Zoster viene garantita nei centri vaccinali e nei punti di somministrazione territoriali (Casa della Comunità e Poliambulatori) e ospedalieri (progetto l’Ospedale che vaccina).
La campagna di vaccinazione anti-Papillomavirus viene garantita nei centri vaccinali e nei punti di somministrazione territoriali (Casa della Comunità e Poliambulatori) e ospedalieri (progetto l’Ospedale che vaccina).
Nella ASL Roma1 abbiamo attivato un percorso che prevede l’offerta della vaccinazione anti-HPV nel Presidio dove si effettua lo screening di III livello e nel corso del 2023 abbiamo vaccinato 222 donne sottoposte a conizzazione su 228.
La campagna di vaccinazione antimorbillosa, nel corso dell’emergenza in corso, viene garantita nei centri vaccinali, nei punti di somministrazione territoriali (casa della Comunità e poliambulatori) e ospedalieri (progetto l’Ospedale che vaccina).
Nelle Tabelle I e II si riportano la modalità di offerta e le strategie proposte per il raggiungimento delle coorti degli adulti e degli anziani.
Vaccinazioni offerte gratuitamente agli adulti/anziani secondo i parametri: per età e per condizione di rischio (fragili, individuati in base alla patologia o alle condizioni di vita).
| Vaccinazione | Senza limiti di età | Fragili | Femmine Età >11 anni e < 26 anni | Maschi Età > 11 anni e < 19 anni | Età > 60 anni | Età > 65 anni |
|---|---|---|---|---|---|---|
| Antinfluenzale | x1 | x | x | |||
| Anti-COVID-19 | x | x | ||||
| Anti-pneumococcica (schedula sequenziale PCV20val + PPV23val) | x | x | ||||
| Anti Herpes Zoster | x | x2 | ||||
| Anti-dTpa | x | x | ||||
| MPR-V | x | x3 | ||||
| Antiepatite B | x | |||||
| Antimeningococcica | x | |||||
| Anti-Papillomavirus | x | x | x4 | |||
| 1: a partire dal mese di dicembre si possono vaccinare tutti i cittadini (obiettivo zero rimanenze); 2: a partire dalla coorte 1952; 3: previa valutazione dello stato immunitario; 4: a partire dalla coorte del 2006, i maschi hanno diritto alla gratuità fino a 26 anni. | ||||||
Strategia di offerta vaccinale per erogatore.
| Vaccinazione | Centri vaccinali | MMG | PLS | Punti di somministrazione territoriali | Punti di somministrazione ospedalieri | Farmacie |
|---|---|---|---|---|---|---|
| Antinfluenzale | x | x | x | x | x | x |
| Anti-pneumococcica (schedula sequenziale PCV20val+PPV23val) | x | x | x | x | x | |
| Anti Herpes Zoster | x | x | x | |||
| Anti-dTpa | x | x | x | |||
| MPR-V | x | x | ||||
| Antiepatite B | x | x | ||||
| Antimeningococcica | x | x | x | |||
| Anti-Papillomavirus | x | x |
I vaccini sono un presidio fondamentale per la prevenzione primaria e hanno permesso di conseguire risultati straordinari nel ridurre morbosità e mortalità di numerose malattie trasmissibili prevenibili, rappresentando una consolidata priorità di Sanità Pubblica [1].
Oltre ai benefici per la salute, le vaccinazioni riducono anche l’onere sui sistemi sanitari e offrono un vantaggio significativo di ritorno sull’investimento, sia per l’individuo sia per la società, basti pensare ai risparmi dei costi di tipo diretto e indiretto (perdita delle funzioni quotidiane e dell’indipendenza, perdita di produttività dell’individuo e dei potenziali caregiver ecc.) [2].
I vaccini svolgono anche un’azione chiave nel promuovere un invecchiamento in buona salute durante tutto il corso della vita.
Il rapporto globale sull’invecchiamento dell’Organizzazione Mondiale della Sanità (OMS) delinea le azioni strategiche e la guida per aiutare ad attuare politiche e programmi di prevenzione primaria negli over 65 anni [3].
Occorre evidenziare che all’invecchiamento della popolazione si associa un notevole aumento della prevalenza delle malattie non trasmissibili; nei paesi occidentali come il nostro, circa un adulto su quattro soffre di almeno due patologie croniche, e più della metà degli anziani presenta tre o più patologie [4, 5].
L’invecchiamento si caratterizza per il fenomeno dell’immunosenescenza [6], fase nella quale si osservano le caratteristiche principali di ridotta capacità di rispondere a nuovi antigeni, ovvero accumulo delle cellule T della memoria e stato di infiammazione cronica di basso grado [7].
L’immunosenescenza contribuisce ad aumentare l’incidenza, la morbilità e la mortalità delle diverse infezioni [8, 9].
Il recente manifesto dell’immunizzazione internazionale invita ad agire per migliorare le infrastrutture di immunizzazione e ad aumentare gli investimenti nella promozione della salute e nella conservazione delle fasi della vita attraverso una strategia globale di immunizzazione [8]. L’iniziativa si fonda su tre azioni fondamentali per il miglioramento delle vaccinazioni degli adulti: i) dare priorità all’immunizzazione per tutta la vita come pilastro fondamentale delle strategie di prevenzione; ii) rimuovere le barriere all’accesso per un’immunizzazione per garantire che tutte le persone siano protette; iii) ridurre le disuguaglianze nell’accesso tempestivo, appropriato e conveniente. La progettualità è una leva di advocacy per sensibilizzare sulla necessità di migliorare le strategie di vaccinazione degli adulti e sulla necessità fondamentale di integrazione in tutti i settori sanitari, compreso quello primario e l’assistenza a lungo termine, e il coinvolgimento di operatori multidisciplinari nello sviluppo delle politiche di immunizzazione.
In Italia, il Piano Nazionale di Prevenzione Vaccinale (PNPV) costituisce il documento di riferimento in cui si riconosce, come priorità di sanità pubblica, la riduzione o l’eliminazione del carico delle malattie infettive prevenibili da vaccino, attraverso l’individuazione di strategie efficaci e omogenee da implementare sull’intero territorio nazionale. Rappresenta il documento programmatico attraverso il quale il Ministero della Salute definisce le modalità e gli obiettivi relativi alla prevenzione delle malattie evitabili attraverso la vaccinazione [10].
La Regione Liguria, con Delibera di Giunta Regionale (DGR) n. 284 del 07/04/2017, recepì il PNPV 2017-2019 e con successiva deliberazione n. 34 del 13/04/2017 fornì alle Aziende sanitarie indicazioni operative, per la puntuale ed omogenea applicazione dei suoi contenuti a livello regionale.
Le novità introdotte erano risultate minime poiché la Liguria, da sempre attenta al controllo delle malattie trasmissibili, aveva già aggiornato e implementato le strategie di immunizzazione. Infatti, il precedente Piano Regionale in Prevenzione Vaccinale (PRPV), di cui alla DGR 1701 del 22/12/2014 “Aggiornamento Piano Regionale in Prevenzione Vaccinale” prevedeva per gli anziani l’inserimento del vaccino anti-pneumococcico coniugato 13-valente per alcune coorti di soggetti > 64 anni e l’offerta del vaccino contro l’herpes zoster per i soggetti di 65 anni di età. Relativamente alla malattia da herpes zoster A.Li.Sa., in collaborazione con il Dipartimento di Scienze della Salute dell’Università degli Studi di Genova, ha condotto uno studio retrospettivo di coorte per valutare il carico sanitario dell’Herpes Zoster grave negli adulti ≥ 50 anni residenti in Liguria dal 2015 al 2017 [11]. Sono stati arruolati 437 soggetti nella coorte HZ e 2.622 soggetti nella coorte costituita da soggetti senza HZ; inoltre, sono state identificate come principali condizioni croniche correlate al ricovero per HZ l’aver sofferto di condizione di immunodeficienza, malattie autoimmuni e rare.
I risultati hanno evidenziato incidenze più elevate di malattie autoimmuni (1,4 vs 0,22%, p = 0,002) e gastrointestinali (7,04 vs 3,62%, p = 0,015) dopo il ricovero nella coorte di pazienti con HZ rispetto alla coorte senza HZ. Inoltre, sono state riscontrate incidenze significativamente più elevate dopo il ricovero rispetto al periodo precedente alla malattia per malattie cardiovascolari (11,17 vs 2,09%, p < 0,001), vasculopatia cerebrale (6,13 vs 0,60%, p < 0,001), miocardiopatia non aritmica (4,31 vs 0,59%, p = 0,002) e neuropatia (2,62 vs 0,56%, p = 0,033). La coorte HZ ha mostrato un rischio relativo 10 volte maggiore per la vasculopatia cerebrale, 5 volte maggiore per le malattie cardiovascolari e 7 volte maggiore per la miocardiopatia non aritmica. I risultati dello studio hanno permesso di confermare che l’HZ provoca un impatto sostanziale sugli individui con condizioni croniche e i dati vanno a confermare la necessità di un’implementazione di programmi di vaccinazione contro l’HZ che hanno come target gli anziani e i gruppi ad alto rischio [11].
Un importante aspetto da considerare è che la ricerca scientifica porta allo sviluppo e alla disponibilità di nuovi preparati vaccinali. Ne è esempio la messa in commercio del vaccino ricombinante adiuvato contro herpes zoster. In tale ambito, la Commissione Regionale Vaccini, istituita con DGR n. 451 del 25/05/2021, ha raccomandato la vaccinazione, in virtù della migliore efficacia del nuovo vaccino vivo attenuato anti-HZ, nonché dell’assenza di controindicazioni nei soggetti immunocompromessi a maggior rischio di insorgenza di HZ e relative complicanze, nei: i) soggetti di 65 anni d’età (coorte 1.956 nell’anno 2021 e successive coorti negli anni a seguire), con offerta attiva; ii) soggetti > 50 anni con i seguenti fattori di rischio: diabete mellito, patologia cardiovascolare, BPCO e pazienti destinati a terapia immunosoppressiva; iii) pazienti con condizioni di immunocompromissione; e di mantenere il diritto alla vaccinazione nelle coorti antecedenti al 1956 con il preparato disponibile al momento della chiamata attiva. Tali raccomandazioni sono contenute nella DGR n. 849 del 28/09/2021 ad oggetto “Piano Regionale Prevenzione Vaccinale aggiornamento anno 2021”, in linea con quanto indicato dalla Commissione [12] e sono state aggiornate in seguito come descritto nel seguente paragrafo.
Relativamente alla vaccinazione influenzale, a livello regionale dal 2020 si raccomanda la vaccinazione ai soggetti di età > 60 anni.
Proprio uno studio ligure ha stimato l’impatto epidemiologico e condotto una budget impact analysis dell’introduzione della vaccinazione agli individui di età superiore ai 50 anni nella campagna stagionale di immunizzazione [13].
Le implicazioni dell’abbassamento della soglia di età sono state valutate secondo differenti scenari che coinvolgevano diversi tassi di copertura vaccinale nelle popolazioni a rischio e non a rischio. I risultati hanno evidenziato che abbassare l’età raccomandata per la vaccinazione antinfluenzale a 60 anni consente di raggiungere un’elevata percentuale di soggetti a rischio di sviluppare influenza grave e permette importanti risparmi per il Sistema Sanitario Regionale. Da evidenziare che il modello statico ha incluso anche i costi dell’intero percorso sanitario, rendendo l’analisi più realistica e completa.
Inoltre, un lavoro di Domnich et al., pubblicato nel 2023 [14], partendo dal razionale che le opportunità mancate costituiscono uno dei principali driver di copertura subottimale vaccinale contro l’influenza stagionale e che la co-somministrazione di vaccini è un modo per ridurle, ha valutato le opportunità mancate identificando alcuni correlati socio-strutturali attraverso uno studio di coorte retrospettivo.
Sono stati inclusi i soggetti di età pari o superiore a 65 anni residenti nell’area metropolitana genovese che avevano ricevuto almeno una dose di vaccino contro Covid 2019, pneumococco o herpes zoster durante la stagione influenzale 2022/2023. I risultati hanno messo in luce le opportunità mancate del vaccino influenzale quantificandole del 23,3% per il vaccino COVID-19, il 5,0% per il vaccino pneumococcico e il 13,2% per herpes zoster. Pertanto, durante la stagione influenzale 2022/2023 una percentuale considerevole di anziani ha mancato di vaccinarsi per influenza, scegliendo altre vaccinazioni.
Per incrementare le coperture subottimali periodicamente sono condotte campagne informative sulle modalità di prenotazione e di facilitazione dell’accesso alla vaccinazione attraverso spot trasmessi dalle principali emittenti locali, messaggi pubblicati sulle pagine locali dei principali quotidiani, canali social di Regione Liguria (Instagram e Facebook), banner sulle testate locali on-line e locandine affisse presso farmacie liguri, MMG e PLS e ambulatori delle AASSLL.
Il ventaglio dei canali di prenotazione si è ampliato con la possibilità di usare il CUP telefonico o tramite i punti di prenotazione distrettuali, le Farmacie, i Medici aderenti al servizio CUP e i MMG.
Con l’atto n. 193/CSR è stata sancita l’Intesa, ai sensi dell’articolo 8, comma 6, della legge 5 giugno 2003, n. 131, tra il Governo, le Regioni e le Province autonome di Trento e di Bolzano, sul documento recante “Piano nazionale di prevenzione vaccinale (PNPV) 2023-2025. Punto cardine del nuovo PNPV è il Calendario vaccinale, che oltre a presentare l’offerta vaccinale attivamente e gratuitamente prevista per fascia d’età, contiene le vaccinazioni raccomandate a particolari categorie a rischio (per condizione medica, per esposizione professionale, per eventi occasionali, per vulnerabilità sociali ed economiche)”.
Conseguentemente, Regione Liguria con DGR n. 916 del 25/09/2023 ad oggetto “Recepimento della Intesa Stato-Regione/PP. AA. (Rep. Atti n.193/ CSR 2 agosto 202). “Piano Nazionale di Prevenzione Vaccinale PNPV 2023-2025 e approvazione del Calendario Vaccinale regionale della Liguria, aggiornamento 2023” ha formalmente accettato il nuovo piano e, contestualmente, ha deliberato il nuovo piano regionale prevenzione vaccinale ligure, includendo il calendario per età e quello per età rivolto ai soggetti HIV positivi [15].
Da evidenziare che in precedenza, in vacanza del PNPV aggiornato, la commissione vaccini aveva declinato le indicazioni del PNPV non ancora formalizzato e le priorità in esso individuate; inoltre aveva ridefinito le modalità di offerta della vaccinazione anti herpes-zoster in Liguria al fine di orientare le risorse secondo i principi di massima appropriatezza e quelle dello pneumococco.
In Figura 1 è riportato l’attuale calendario regionale 2023-2025.
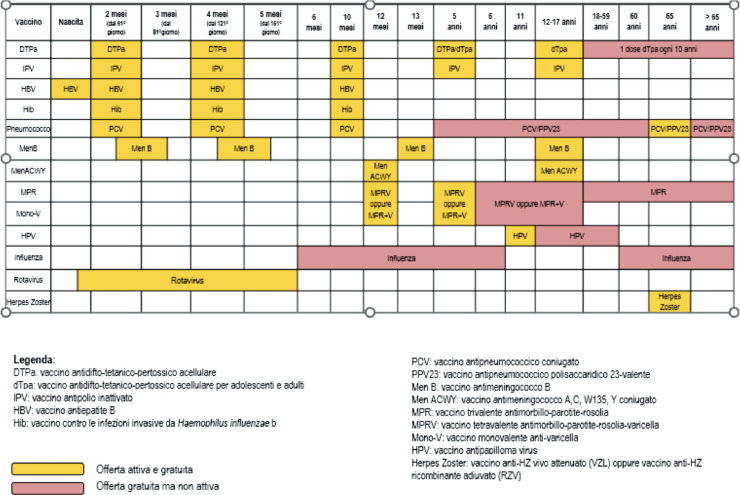
Calendario vaccinale per età.
Relativamente alla vaccinazione pneumococcica il piano regionale prevede l’offerta attiva e gratuita alla fascia d’età dei 65enni (es. coorte di nascita 1958 nel 2023); l’offerta gratuita nei soggetti over 65enni non vaccinati in precedenza; l’offerta gratuita ai soggetti di età > 2 anni appartenenti ai gruppi a rischio con schedula sequenziale (PCV + PPV23: una prima dose di PCV seguita da una dose di PPV23 a distanza di almeno 8 settimane). In caso di utilizzo di PCV 20, in assenza delle patologie o condizioni predisponenti indicate nel PNPV, la schedula sequenziale può non essere applicata.
Per quanto riguarda la vaccinazione anti-HZ l’offerta attiva e gratuita è rivolta ai soggetti di 65 anni di età con due dosi di RZV a distanza di almeno 2 mesi (chiamata attiva per la sola coorte dei 65enni, es. coorte 1.958 nell’anno 2023, con conservazione del diritto alla gratuità) e offerta gratuita ai soggetti con condizioni di rischio o con condizioni di rischio aumentato (clinicamente documentabili) a partire dai 18 anni di età, con una o due dosi a seconda dell’età e del vaccino.
Il dettaglio utile per gli operatori sanitari della raccomandazione indica:
RZV per:
soggetti di età > 65 aa a partire dalla coorte di nascita 1.956;
tutti i soggetti con condizioni di rischio e con condizioni di rischio aumentato di età compresa tra 18 e 49 anni;
soggetti di età > 50 aa con condizioni di rischio aumentato.
ZVL per:
soggetti nati tra il 1952 e il 1955 mai vaccinati in precedenza e in assenza delle condizioni di rischio aumentato;
soggetti di età > 50 aa con condizioni di rischio e in assenza delle condizioni di rischio aumentato.
In Figura 2 è descritto il calendario vaccinale per età nei soggetti HIV+ che sostituisce il precedente calendario, introdotto con DGR 1314/2015; il documento aggiornato ed integrato con le ultime indicazioni nel PRPV-aggiornamento 2023 (DGR 916/2023) riporta le specifiche indicazioni per le vaccinazioni anti-pneumococcica, vaccini a virus vivi attenuati, anti-HPV ecc.
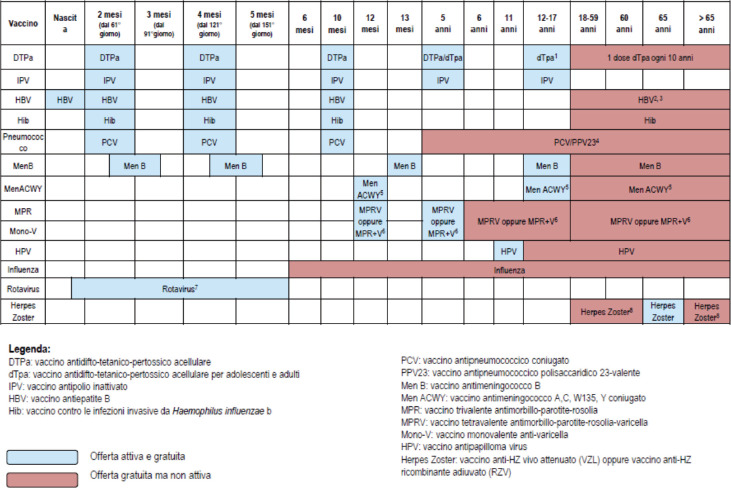
Calendario vaccinale per età per soggetti HIV+.
La prevenzione primaria mediante immunizzazione può giovare alle persone di tutte le età, ed è fondamentale per chi è a più alto rischio di incorrere in malattie infettive e complicanze.
Il nuovo Piano Nazionale di Prevenzione Vaccinale (PNPV) 2023-2025 e di conseguenza il PRPV ha identificato l’offerta gratuita delle vaccinazioni dell’adulto sia per rischio infettivo legato all’età (soggetti con più di 65 anni) sia legato a eventuali malattie o terapie concomitanti che possano comportare un rischio aumentato di infezione. Tali indicazioni rappresentano i Livelli Essenziali di Assistenza (LEA) e sono state recepite in Liguria e integrate nel calendario vaccinale regionale [15].
In Liguria la Commissione Vaccini svolge un ruolo fondamentale di supporto per le raccomandazioni vaccinali, vista la continua evoluzione e disponibilità di preparati.
È noto che le strategie di offerta vaccinale attiva sono oggi principalmente organizzate per età e non per condizione di rischio (chiamate attive e obiettivi di copertura identificati solo per coorti in età avanzata e non per patologia); sussiste tuttora una sostanziale difficoltà nella compliance vaccinale dei soggetti fragili/immunodepressi e permane una focalizzazione della medicina specialistica orientata principalmente al trattamento/terapia della patologia oggetto del percorso di cura e non della prevenzione.
L’offerta ospedaliera con ambulatori dedicati alle vaccinazioni per pazienti a rischio può essere incrementata e il modello ligure da tempo è volto in questa direzione ricercando quelle azioni sinergiche con i diversi professionisti che possono essere la chiave per raggiungere gli obiettivi di copertura vaccinale.
In Italia, il Calendario Vaccinale del Piano Nazionale di Prevenzione Vaccinale (PNPV) attualmente in vigore (2023-2025) non presenta ancora indicazioni per la vaccinazione dell’adulto e dell’anziano contro il Virus Respiratorio Sinciziale (RSV) [1].
Esso, pur rappresentando il documento programmatico attraverso il quale il Ministero della Salute definisce le modalità e gli obiettivi relativi alla prevenzione delle malattie prevenibili attraverso la vaccinazione per tutte le Regioni Italiane, permette alle stesse per via dell’Autonomia dei singoli Servizi Sanitari Regionali, di implementare strategie di prevenzione autonomamente in aggiunta a quelle minime previste nel Piano [1].
Esempio classico di tale strategia, è l’attuale offerta di vaccinazione contro il Meningococco B in adolescenza che è offerta in 10 Regioni Italiane sulle 20 totali, tra cui per l’appunto la Regione Sicilia [2].
Alla luce di quanto detto, la Regione Sicilia ha previsto, entro la fine del 2024, una modifica al proprio Calendario per inserire sia l’immunizzazione passiva neonatale sia la vaccinazione attiva dell’adulto anziano contro RSV [2].
La Regione Sicilia, con Decreto Assessoriale n.122 del 05/10/2023, ha recepito il PNPV 2023-2025, pubblicando in GURS n.43 del 13 Ottobre 2023 l’aggiornamento del Calendario Regionale di Immunizzazione riportato in Figura 1 [2].
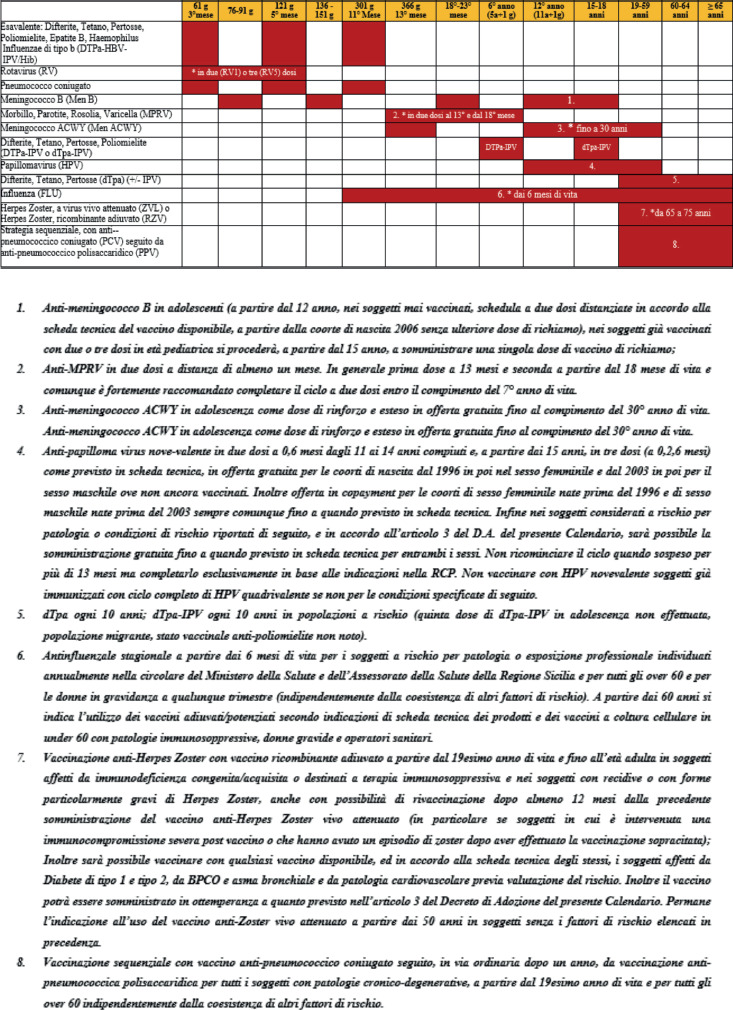
Calendario di Immunizzazione della Regione Sicilia (aggiornato ad ottobre 2023).
Tale aggiornamento in termini di dicitura, con la ridenominazione da Calendario Vaccinale a Calendario di Immunizzazione, voleva predisporre gli operatori sanitari regionali alle successive modifiche che interesseranno l’offerta su scala Regionale, che interessando in particolare la prevenzione dell’RSV prevederanno due modifiche sostanziali:
l’introduzione dell’immunizzazione passiva anti-RSV inizierà in Sicilia a partire dal 1° ottobre 2024 sia in offerta attiva e gratuita per la coorte dei nuovi nati (preferibilmente entro 24 ore dalla nascita nei reparti di Neonatologia della Regione Sicilia per i nati “in stagione ovvero entro il 31 marzo dell’anno successivo), sia nei Centri Vaccinali Regionali, per i nati da aprile a settembre [3, 4];
l’introduzione della vaccinazione anti-RSV in possibile offerta attiva e gratuita (ove sostenibile economicamente) per i soggetti over 60 con patologie cronico degenerative e per tutti i soggetti over 75, indipendentemente dallo stato di salute degli stessi, con uno dei vaccini disponibili ed autorizzati nei soggetti over 60 [5, 7, 8].
Nello specifico, nel soggetto adulto anziano, considerato il notevole impatto epidemiologico e sanitario (in termini di accessi ambulatoriali, accessi al Pronto Soccorso, ospedalizzazioni in reparti ordinari e terapie intensive, decessi) causato da RSV in soggetti over 60 con fragilità e over 75, indipendentemente dallo stato clinico, il Tavolo Tecnico Regionale della Regione Sicilia ha approvato nella riunione di marzo 2024, le modifiche del Calendario di Immunizzazione con l’intenzione di pubblicare la versione aggiornata entro giugno 2024 [2].
L’offerta Siciliana a partire dal 2024, nel soggetto adulto anziano, risulta in linea con le indicazioni del Calendario della Vita Italiano, del Documento Congiunto SItI SIMIT del febbraio 2024 e dell’offerta vaccinale già deliberata in altri Paesi Europei quali UK e Finlandia [8, 9].
Su proposta del Servizio 4 dell’Assessorato alla Salute della Regione Sicilia, i servizi di epidemiologia e prevenzione delle due principali ASP Siciliane (Catania e Palermo), hanno acquisito a prezzo calmierato, 2000 dosi complessive (1.000 per ciascuna ASP) di vaccino proteico adiuvato per la prevenzione dell’RSV.
Lo studio pilota ha il duplice scopo di valutare al meglio i dati di tale innovativo vaccino in “real world” e di valutare le diverse fasi logistiche di organizzazione della campagna vaccinale in setting diversi nei soggetti maggiormente vulnerabili delle principali e più popolose ASP Siciliane.
L’esperienza verrà coordinata scientificamente dalla Sezione di Igiene del Dipartimento PROMISE dell’Università di Palermo con il supporto del Laboratorio di Riferimento Regionale per la diagnostica molecolare delle Patologie Prevenibili da Vaccino dell’Azienda Ospedaliera Universitaria Policlinico di Palermo, dei Servizi di Prevenzione delle ASP di Catania e Palermo e dell’UOC Sociosanitaria dell’ASP Palermo.
La popolazione target dello studio verrà individuata tra gli over 60 fragili per comorbosità (asma cronico e BPCO, cardiopatie croniche, insufficienza renale cronica, immunodepressione) ricoverati presso RSA e/o case di riposo e lungodegenza di Catania, Palermo e rispettive Province.
Inoltre, parte della popolazione target verrà arruolata tra soggetti over 60 fragili per comorbosità (asma cronico e BPCO, cardiopatie croniche, insufficienza renale cronica, immunodepressione), o over 75 sani presso studi di Medici di Medicina Generale delle due ASP coinvolte, purchè i MMG rientrino nella rete di sorveglianza virologica RespiVirNet Regionale.
Potranno essere arruolati tutti i soggetti che su base volontaria vogliano sottoporsi alla vaccinazione anti-RSV adiuvata proposta dal Personale Sanitario delle strutture di lungodegenza ovvero dal proprio MMG.
Le vaccinazioni inizieranno a partire dal mese di aprile/maggio 2024 con l’obiettivo di una immnuizzazione ottimale a partire dalla successiva stagione invernale 2024/2025.
Tale vaccinazione destagionalizzata si auspica possa permettere una migliore organizzazione della già ampia e complessa offerta di vaccinazione durante la stagione fredda contro i principali patogeni respiratori, tra cui spiccano influenza e COVID-19, nonché una migliore adesione alla stessa (per osservare in futuro maggiori coperture vaccinali).
Nello studio pilota è anche prevista una sorveglianza attiva di efficacia della vaccinazione, della durata di 3 stagioni, che nelle strutture di lungodegenza coinvolte, durante la stagione fredda, prevederà il monitoraggio da parte del personale sanitario di eventuali casi isolati o focolai di ILI, mediante l’esecuzione di tampone molecolare da inviare al Laboratorio di Riferimento Regionale della Regione Sicilia del Policlinico di Palermo, sia alla popolazione vaccinata che non vaccinata.
Egualmente i MMG, che già aderiscono alla rete RespiVirNet, svolgeranno il monitoraggio sia dei soggetti vaccinati che di quelli non vaccinati in caso di sintomatologia compatibile con una ILI, durante la stagione fredda, con i medesimi protocolli Ministeriali.
L’esecuzione del tampone molecolare orofaringeo dovrà essere effettuata entro 7 giorni dalla comparsa di sintomatologia associabile a ILI nei pazienti delle strutture coinvolte, o tra gli assistiti dei MMG e permetterà la diagnosi differenziale di diversi patogeni respiratori stagionali quali influenza, SARS-CoV-2, RSV, Adenovirus, Rhinovirus, Metapneumovirus.
La sorveglianza virologica sarà infine essere corredata di relativa e specifica scheda anamnestica sulla sintomatologia specifica della ILI.
Infine si valuteranno eventuali eventi avversi alla vaccinazione (attesi, non attesi, severi) attraverso la compilazione di un diario da parte di ciascun soggetto vaccinato in grado di compilarlo in autonomia o in grado di compilarlo con il supporto di un sanitario.
La Regione Sicilia ha recepito il PNPV 2023-2025, pubblicando in GURS n. 43 del 13 ottobre 2023, in accordo con le indicazioni del PNPV 2023-2025 modificando il proprio Calendario di immunizzazione anche sulla base delle indicazioni del Tavolo Tecnico Vaccini.
Tale tavolo tecnico è costituito da diversi professionisti dell’Assessorato alla Salute, dei Dipartimenti di Prevenzione delle 9 ASP Siciliane, degli Atenei Siciliani, delle Società Scientifiche Regionali e svolge un ruolo fondamentale di supporto per le raccomandazioni vaccinali, anche in base ai frequenti aggiornamenti legati alle approvazioni da parte degli enti Regolatori Europei e Nazionali.
Sulla base di indicazioni di PNPV e Tavolo Tecnico la Regione Siciliana ha declinato l’offerta vaccinale nell’adulto anziano negli ultimi anni come segue (Fig. 1) [2]:
vaccinazione antinfluenzale stagionale in soggetti over 60 (indipendentemente dallo stato di salute degli stessi), in soggetti con comorbosità a partire da 6 mesi di vita, in donne in gravidanza a qualsiasi trimestre, in bambini dai 6 mesi di vita in poi che frequentano comunità scolastiche, in contatti stretti di neonati con meno di 6 mesi di vita o soggetti immunocompromessi (cocoon strategy), in operatori sanitari e di pubblica necessità (operatori scolastici, forze dell’ordine ecc.) senza limitazioni di età;
vaccinazione anti-COVID-19 stagionale aggiornata in soggetti over 60 (indipendentemente dallo stato di salute degli stessi), in soggetti con comorbosità a partire da 18 anni di età, in donne in gravidanza a qualsiasi trimestre, in operatori sanitari senza limitazioni di età;
vaccinazione anti pneumococcica coniugata, seguita routinariamente da vaccinazione antinpneumococcica polisaccaridica dopo un anno, in soggetti over 60 (indipendentemente dallo stato di salute degli stessi), ed in soggetti con più di 18 anni con comorbosità;
vaccinazione anti zoster con vaccino ricombinante adiuvato in soggetti over 18 con immunocompromissione o con insufficienza renale cronica, e in soggetti a partire dai 50 anni affetti da forme severe di BPCO e patologie polmonari croniche, affetti da diabete ed endocrinopatie severe, affetti da cardiopatie severe con episodi ripetuti di Zoster o con un singolo episodio precedente severo (es. Zoster oftalmico);
vaccinazione anti-dTpa ogni 10 anni indipendentemente dall’età e dallo stato di salute del soggetto.
Tale offerta complessiva, che risulta alquanto varia, potrebbe beneficiare di uno schema vaccinale con due vaccinazioni stagionali quali Influenza e COVID (da quanto è emerso nelle precedenti Circolari di Prevenzione dell’Influenza e del COVID), da effettuare preferibilmente a Ottobre/Novembre in cosomministrazione per permettere un singolo accesso al soggetto, e comunque entro Dicembre, ed altre vaccinazioni, tra cui si inserisce perfettamente la nuova vaccinazione anti-RSV, lo Pneumococco, lo Zoster ed il dTpa che possono essere destagionalizzate garantendo una protezione pluriennale [2].
Tuttavia tale offerta, grazie alla possibilità di cosomministrazione tra differenti tipologie di vaccino tra loro, che la Regione Sicilia ha voluto standardizzare in una Tavola Sinottica contenuta nel proprio Calendario di Immunizzazione, permette agli operatori Sanitari dei Dipartimenti di Prevenzione, ai Medici di Medicina Generale, ai Pediatri di Libera Scelta di cosomministrare in singola seduta almeno due vaccinazioni in qualsiasi periodo dell’anno (Fig. 2) [2].
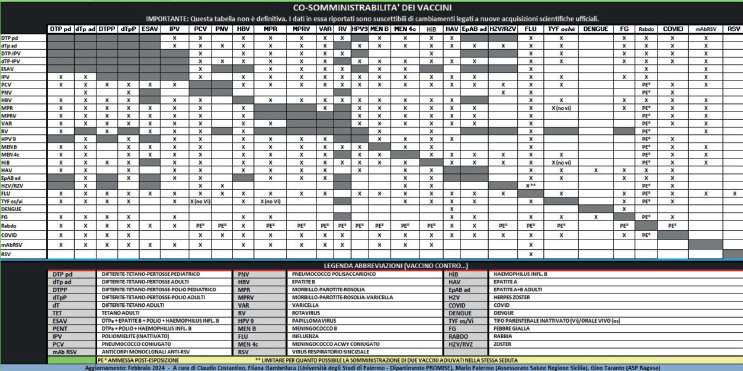
Tabella delle cosomministrazioni del Calendario di Immunizzazione della Regione Sicilia (aggiornata a marzo 2024).
Infine, poiché sempre più l’offerta è legata all’età ma anche alle fragilità, anche la Regione Sicilia ha inserito nel proprio Piano Regionale (in linea con i contenuti del PNPV) l’importanza di implementare l’offerta vaccinale intraospedaliera con ambulatori dedicati alle vaccinazioni per pazienti a rischio ma anche di favorire la vaccinazione presso anche altre strutture di lungodegenza quali RSA/Case di Cura e anche in ADI.
Il nuovo Piano Regionale di Prevenzione ed il Relativo Calendario di Immunizzazione 2023-2025 della Regione Sicilia, si concentra sempre più sull’offerta vaccinale attiva e gratuita dei vaccini disponibili per i soggetti adulti/anziani, andando anche rapidamente ad integrare vaccinazioni non contenute nel PNPV ma che potrebbero rappresentare uno strategico strumento di miglioramento dello stato di salute della propria popolazione come nel caso della vaccinazione contro l’RSV.
La conduzione di studi pilota su setting speciali ma anche la costante sorveglianza dell’andamento del burden di malattia potrebbero rappresentare momenti utili a definire, migliorare e rendere più efficiente l’offerta vaccinale soprattutto in alcuni gruppi target di popolazione altrimenti difficilmente raggiungibili.
Da quando sono stati sviluppati i primi vaccini, sono emerse incertezze da parte della popolazione riguardo alla loro efficacia, e molte persone hanno manifestato scetticismo sia nei confronti dei vaccini stessi che delle istituzioni responsabili delle campagne di vaccinazione [1]. Nonostante le vaccinazioni rappresentino un successo della sanità pubblica, un numero sempre maggiore di individui manifesta una certa esitazione verso questo approccio [2]. Nel 2019, la World Health Organization (WHO) ha identificato l’esitazione vaccinale tra le dieci maggiori minacce per la salute globale [3].
Una definizione di esitazione vaccinale condivisa dalla comunità scientifica è stata elaborata nel 2012 dallo Strategic Advisory Group of Experts on Immunization (SAGE), il gruppo consultivo strategico di esperti sull’immunizzazione che ha il compito di consigliare la WHO sulle politiche e strategie globali nel campo delle vaccinazioni [4]. Inizialmente, una delle priorità del gruppo di lavoro è consistita nel formulare una definizione di esitazione vaccinale, conducendo una serie di attività, comprese discussioni sull’uso del termine e concetti simili nella letteratura scientifica, una revisione sistematica dei determinanti dell’esitazione vaccinale [5], molteplici indagini sul campo da parte di diverse organizzazioni riguardo ai fattori di esitazione e una survey sul tema [6], oltre all’apporto di osservazioni e esperienze personali da parte dei componenti del gruppo di lavoro.
Il gruppo di lavoro ha concluso che l’esitazione vaccinale include le nozioni di indecisione, incertezza, ritardo e riluttanza. Si tratta di un fenomeno complesso descritto come un ritardo o un rifiuto nell’accettare una vaccinazione sebbene i servizi vaccinali siano disponibili. Sebbene la vaccinazione sia generalmente accettata dalla maggior parte delle popolazioni in tutto il mondo, esiste un segmento minoritario che rifiuta specifici vaccini, accettandone altri, oppure ritarda alcune vaccinazioni. La Figura 1 rappresenta l’esitazione vaccinale come un continuum tra coloro che accettano tutti i vaccini senza dubbi e coloro che rifiutano completamente tutti i vaccini senza dubbi: gli individui esitanti corrispondono a un gruppo eterogeneo tra questi due estremi [4]. Larson e colleghi ritengono che il termine “esitazione vaccinale” sia utile nel superare la polarizzazione tra i sostenitori e gli oppositori dei vaccini [5]. Termini come “anti-vaccino” si sono caricati di significati che semplificano e creano divisioni tra i sostenitori dei vaccini e coloro che esitano. Le analisi dei dati sulle attitudini e le credenze moderne sui vaccini confermano una gamma complessa di posizioni che non si limita a una dicotomia [7].
Il continuum dell’esitazione vaccinale (da MacDonald et al. 2015, mod.) [4].
L’esitazione vaccinale può verificarsi quando la copertura vaccinale è bassa a causa di problemi del sistema, come in caso di carenza di approvvigionamento di dosi o in presenza di limitazioni di accesso ai servizi di vaccinazione. Tuttavia, in queste situazioni, l’incertezza non è la principale causa della mancata vaccinazione. È importante distinguere l’incertezza da altre ragioni per cui le persone non si vaccinano in modo adeguato, al fine di scegliere le giuste azioni per affrontare il problema [4].
Una recente revisione narrativa definisce l’esitazione vaccinale non come una condizione statica, ma come un processo decisionale composto da alti e bassi e che cambia nel tempo con diverse influenze lungo il percorso, che talvolta generano incertezza e talvolta spingono verso un’intenzione positiva nei confronti della vaccinazione [8, 9]. In questa direzione, nel 2022, una revisione sistematica ha provato ad aggiornare la definizione di esitazione vaccinale proponendone una nuova: l’esitazione vaccinale come uno stato psicologico di incertezza nelle decisioni riguardo le vaccinazioni. Questa definizione distingue chiaramente l’incertezza dalla decisione effettiva di vaccinarsi, come un concetto a sé stante [10].
Tuttavia, nonostante l’introduzione di nuove definizioni nello scenario della ricerca in merito all’esitazione vaccinale, per la discussione della letteratura esistente è da considerare che la maggior parte degli studi pubblicati ad oggi fanno riferimento alla definizione del SAGE. È da sottolineare però, sebbene la definizione del SAGE sia condivisa dalla comunità scientifica, che le definizioni negli studi che approfondiscono l’esitazione non sono sempre chiare e vengono utilizzate in modi diversi [7]. La complessità del concetto rende difficile l’analisi e la comprensione del problema: occorre tenere a mente il possibile uso di diverse definizioni nei numerosi studi condotti nel momento in cui si considerano dati su epidemiologia e determinanti del fenomeno.
È noto da tempo come l’atteggiamento di esitazione nei confronti dei vaccini possa differire non solo in termini di intensità, con alcune persone che accettano la vaccinazione con dubbi significativi e altre che la rifiutano completamente, ma anche in base al tipo di vaccino. Questo significa che una persona potrebbe essere incerta – ad esempio – riguardo al vaccino antinfluenzale, ma accettare altri vaccini raccomandati, o essere più scettica verso vaccini di più recente introduzione [2]. Da oltre un decennio è chiaro come per una piena comprensione del fenomeno dell’esitazione vaccinale sia necessario considerare da un lato il vaccino specifico e la popolazione target a cui è indirizzato, dall’altro il contesto storico, politico e socio-culturale in cui avviene la vaccinazione [2]. In sintesi, mentre si può discutere la prevalenza generale dell’esitazione vaccinale, quando si tratta di pianificare interventi per promuovere la copertura vaccinale, è cruciale considerare la specificità del vaccino e della popolazione bersaglio. Per comprenderne nel dettaglio l’epidemiologia del fenomeno, non sono sufficienti pertanto studi generici ma diventa necessario condurre studi dedicati a quel particolare vaccino all’interno della popolazione di interesse, considerando il contesto e il periodo temporale in cui si effettuano le analisi.
Più recentemente il report “State of Vaccine Confidence in the European Union in 2022” ha elaborato oltre 25.000 questionari in merito alla fiducia nei confronti delle vaccinazioni indirizzati alla popolazione generale dei 27 stati membri dell’Unione Europea (UE) tra marzo e agosto 2022, conducendo inoltre analisi di confronto con dati registrati per lo stesso progetto nel 2018 e nel 2020. Complessivamente, la fiducia nei vaccini è alta, con 25 stati membri in cui oltre l’80% della popolazione considera i vaccini importanti. Tra il 2018 e il 2020, si è verificato un significativo aumento nell’opinione positiva sui vaccini nell’UE, soprattutto per quanto riguarda il vaccino antinfluenzale. Tuttavia, questo incremento registrato nel 2020 si è successivamente ridimensionato in quanto le percezioni riguardo all’importanza, alla sicurezza e all’efficacia dei vaccini sono diminuite tra il 2020 e il 2022. Nonostante ciò, su scala europea la convinzione che i vaccini siano sicuri rimane più elevata rispetto al 2018 [11].
In particolare, andando ad analizzare i cambiamenti tra il 2018 e il 2022, al fine di valutare anche un eventuale impatto della pandemia da SARS-CoV-2 sull’opinione pubblica, un’accresciuta attitudine positiva sull’importanza dei vaccini si è registrata solo in Polonia. In tutti gli altri paesi dell’Unione Europea, ad eccezione della Svezia in cui non sono stati rilevati cambiamenti, si è evidenziato un minore accordo sull’importanza dell’implementazione di un’appropriata offerta vaccinale. Nello stesso periodo, le percezioni generali sulla sicurezza dei vaccini sono aumentate in Polonia, Francia e Irlanda, ma sono diminuite in 14 paesi. La fiducia nell’efficacia dei vaccini in generale è aumentata solo in Polonia, ma è diminuita in 15 paesi. A titolo esemplificativo, i cambiamenti in punti percentuali in merito all’opinione sull’importanza sono descritti in Figura 2 [11].
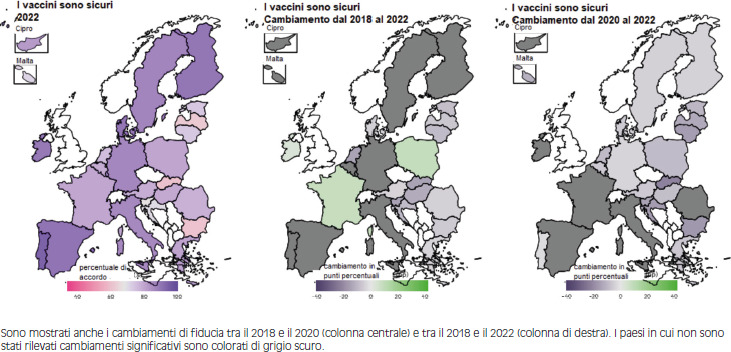
Fiducia nel 2022 (colonna di sinistra) nella sicurezza dei vaccini (da De Figueiredo et al. 2022, mod.) [11].
Sono mostrati anche i cambiamenti di fiducia tra il 2018 e il 2020 (colonna centrale) e tra il 2018 e il 2022 (colonna di destra). I paesi in cui non sono stati rilevati cambiamenti significativi sono colorati di grigio scuro.
È interessante sottolineare che un’analisi delle differenze nella fiducia tra gli anziani (> 65 anni) e i giovani adulti di età compresa tra i 18 e i 34 anni rivela un crescente “divario di fiducia nei vaccini” che richiede attenzione. Questo divario sembra allargarsi nel tempo in molti paesi dell’UE, con gli adulti tra i 18 e i 34 anni che diminuiscono il loro livello di fiducia tra il 2018 e il 2022 [11].
I dati relativi all’Italia sono incoraggianti e mostrano come la fiducia nei vaccini sia molto alta rispetto ad altri Paesi. I dati più recenti, del 2022, riportano che l’85% delle persone ritiene che i vaccini siano sicuri e il 90% pensa che siano efficaci, evidenziando un incremento nella fiducia rispetto alle survey degli anni precedenti. Suddividendo per fasce d’età, si è riscontrata una maggiore percentuale di persone che ritengono che i vaccini siano sicuri o che i vaccini siano efficaci tra i partecipanti con età tra 18 e 24 anni (89 e 94%, rispettivamente) e con età maggiore di 65 anni (89 e 93%, rispettivamente), mentre la percentuale minore si è riscontrata per la fascia tra i 35 e i 44 anni (81 e 85%, rispettivamente) [11].
Sebbene la pandemia abbia contribuito a dare spazio alle vaccinazioni nel dibattito pubblico e prima ancora dell’approvazione del primo vaccino anti-COVID-19 gli oppositori dei vaccini si fossero già preparati a combattere la vaccinazione contro SARS-CoV-2 con manifestazioni e teorie del complotto [12], questi dati fanno emergere come, complessivamente, durante la pandemia non ci sia stato un peggioramento dell’esitazione vaccinale in generale [11]. Inoltre, dati più specifici per l’esitazione nei confronti del vaccino anti-COVID-19 -sicuramente interessante da analizzare considerando una maggiore probabilità di esitazione nei confronti dei vaccini di nuova introduzione [2] – derivanti da uno studio su oltre 23.000 persone in 23 paesi hanno mostrato come nel 2022 l’accettazione del vaccino si attestasse al 79%, contro un 75% del 2021. Tuttavia, lo studio ha sottolineato come il 12% di coloro che avevano già ricevuto il vaccino fossero esitanti o rifiutassero completamente la dose di richiamo. È interessante notare che questa esitazione nei confronti della dose booster sia risultata maggiore nei più giovani. Considerando i dati relativi all’Italia, l’84,6% dei partecipanti italiani ha dichiarato di accettare il vaccino anti-COVID-19 nel 2022 e soltanto il 9,4% si è mostrato esitante nei confronti della dose di richiamo [13].
Inoltre, per approfondire la prevalenza di esitazione vaccinale in Italia, è interessante descrivere i principali risultati di alcuni studi rilevanti condotti a livello nazionale. Dettagli in merito a dati più specifici per la popolazione più anziana verranno discussi nella sezione successiva.
Per quanto riguarda l’esitazione dei genitori riguardo le vaccinazioni pediatriche, in un’indagine condotta dall’Istituto Superiore di Sanità tra dicembre 2015 e giugno 2016 su genitori di bambini tra i 16 e i 36 mesi, l’83,7% ha dichiarato di essere a favore delle vaccinazioni,” il 15,6% si è mostrato “esitante,” e solo lo 0,7% ha dichiarato di essere totalmente contrario [14]. Tuttavia, a testimonianza di una letteratura non pienamente concorde nella valutazione del fenomeno, altri lavori hanno rivelato dati più preoccupanti: in un’altra indagine nazionale condotta tra dicembre 2016 e aprile 2017 su genitori di bambini tra 3 mesi e 7 anni, il 64,0% era a favore dei vaccini,” il 32,4% si è dichiarato “esitante,” e i contrari alle vaccinazioni ammontavano al 3,6% [15], mentre uno studio su donne in gravidanza ha mostrato come solo il 9% credesse completamente nell’efficacia, necessità e sicurezza delle vaccinazioni [16]. Considerando invece la popolazione generale, l’Istituto nazionale per l’analisi delle politiche pubbliche (INAPP) ha intervistato nel 2017 un ampio campione di persone di età superiore ai 15 anni e ha riportato come il 19% ritenesse che i vaccini fossero dannosi e il 10% non avesse fiducia nella comunità scientifica per quanto riguarda i vaccini [17]. Anche nel contesto della pandemia da COVID-19 diversi studi hanno esaminato l’atteggiamento degli italiani verso i vaccini contro il Coronavirus. Un sondaggio condotto prima del primo lockdown nel 2020 ha rilevato che il 29,5% dei partecipanti non si sarebbe vaccinato se fosse stato disponibile un vaccino [18]. Altri studi hanno esaminato l’esitazione durante e dopo il lockdown, rilevando una diminuzione dell’esitazione durante il lockdown stesso, ma una mancata ripresa ai livelli precedenti al lockdown dopo la sua conclusione [19]. Uno studio condotto nel settembre 2020 ha rivelato che il 53,7% degli intervistati sarebbe disposto a farsi vaccinare contro il COVID-19, con percentuali più elevate tra le persone di età pari o superiore a 55 anni [20]. Infine, un recente studio del 2022 su 10.000 residenti italiani ha rilevato che l’83,2% si è vaccinato il prima possibile, l’8,0% ha ritardato la vaccinazione e il 6,7% ha rifiutato di vaccinarsi [21].
Uno dei modelli riconosciuti per spiegare l’esitazione vaccinale si basa sul concetto delle “3 C”, sviluppato da MacDonald e colleghi nel 2015. Questo modello prende in considerazione tre aspetti principali: confidence, complacency e convenience (Fig. 3). Nel primo aspetto, la confidence, si valuta la percezione della sicurezza ed efficacia dei vaccini, la fiducia nei servizi sanitari e nei professionisti che somministrano i vaccini, e la fiducia nelle decisioni dei responsabili politici riguardo ai vaccini necessari. La complacency rappresenta il secondo aspetto e si riferisce al fatto che, quando le persone percepiscono bassi rischi legati a malattie prevenibili tramite vaccinazione, potrebbero non considerare la vaccinazione come un’azione preventiva necessaria. Questo può essere influenzato da altri rischi per la salute che sembrano più rilevanti in quel momento, e il successo dei programmi di vaccinazione potrebbe paradossalmente portare a una sorta di stallo e all’esitazione, in quanto le persone iniziano a valutare i rischi dei vaccini in modo critico quando la malattia diventa meno comune. La terza componente, la convenience riguarda l’accessibilità fisica ai servizi di vaccinazione, l’aspetto economico, l’accessibilità geografica, la comprensibilità delle informazioni relative ai vaccini, e l’attrattiva dei servizi di immunizzazione. La qualità dei servizi, sia nella realtà che nella percezione delle persone, e la disponibilità dei servizi di vaccinazione in luoghi e momenti convenienti e culturalmente accettabili possono influenzare notevolmente le decisioni di vaccinarsi e contribuire all’esitazione vaccinale. In sintesi, il “Modello delle 3 C” fornisce un approccio comprensivo per esaminare i vari fattori che contribuiscono all’esitazione vaccinale, tenendo conto di confidence, complacency e convenience come elementi fondamentali che influenzano le decisioni riguardo alla vaccinazione [4].
Il modello delle 3C (da MacDonald et al. 2015) [4].
Inoltre, il gruppo di lavoro SAGE ha formulato un “Modello dei determinanti dell’esitazione vaccinale”, che ruota attorno a tre dimensioni principali. La prima dimensione, definita “influenze contestuali”, comprende fattori legati al contesto in cui le decisioni sulla vaccinazione vengono prese. Questi fattori possono essere storici, socio-culturali, ambientali, sanitari/istituzionali, economici o politici. Alcuni esempi includono la diffusione di teorie cospirative, convinzioni legate a credenze religiose, esposizione negativa ai media e questioni relative ai diritti umani. La seconda dimensione riguarda le “influenze individuali e di gruppo”. Questo aspetto considera come le decisioni sulla vaccinazione siano influenzate da fattori a livello personale e da dinamiche sociali e di gruppo. Alcuni esempi di queste influenze includono dubbi sulla sicurezza dei vaccini, mancanza di informazioni adeguate, percezione di basso rischio o gravità delle malattie prevenibili, convinzione che i vaccini siano inefficaci, sfiducia verso le istituzioni sanitarie, norme sociali, priorità assegnata alla vaccinazione, resistenza generale alle vaccinazioni, ricorso a metodi di prevenzione alternativi e credenze legate alla contrazione naturale delle malattie. La terza dimensione prende in considerazione “fattori specifici dei vaccini e delle vaccinazioni”. Questi fattori sono direttamente collegati alle caratteristiche specifiche del vaccino o al processo di vaccinazione. Ad esempio, possono includere la percezione della mancanza di necessità medica per un particolare vaccino, difficoltà di accesso ai servizi di vaccinazione, costi associati (in particolare nei casi in cui le vaccinazioni non sono gratuite), mancanza di raccomandazioni da parte dei fornitori di assistenza sanitaria, la novità del vaccino e opinioni contrastanti da parte degli operatori sanitari. Questo modello offre quindi una visione dei molteplici fattori che concorrono a determinare l’esitazione vaccinale, tenendo conto delle influenze contestuali, individuali, di gruppo e delle specificità dei vaccini e delle vaccinazioni [5, 22].
Infine, un altro modello ampiamente utilizzato per analizzare il comportamento legato alla vaccinazione è il modello Capability, Motivation e Opportunity. Questo modello suddivide il comportamento in tre componenti fondamentali. La capability si riferisce alla presenza delle competenze necessarie per apportare modifiche nel proprio comportamento. Questa dimensione comprende la conoscenza, la fiducia nelle proprie capacità, la resilienza, la determinazione e la condizione fisica. La motivation abbraccia l’aspetto motivazionale e distingue tra motivazione riflessiva, basata su ragionamento e consapevolezza, e motivazione automatica, che include comportamenti istintivi e automatici, come le reazioni emotive e le abitudini. Le motivazioni coinvolgono aspetti quali atteggiamenti, percezioni, valutazione del rischio, intenzioni, valori, credenze, emozioni, impulsi, sentimenti e fiducia. L’opportunity rappresenta l’esistenza di situazioni che rendono possibile l’applicazione delle competenze acquisite. Queste opportunità possono essere suddivise in due categorie: opportunità fisiche, che riguardano l’accesso, la disponibilità dei vaccini, la praticità e l’adeguatezza delle vaccinazioni, nonché i diritti e la legislazione; e opportunità sociali, che includono il supporto sociale e culturale, le norme e i valori sociali e culturali [23].
Basandosi principalmente su questi modelli, numerosi lavori si sono occupati di approfondire i determinanti dell’esitazione vaccinale e le barriere alla vaccinazione considerando diversi vaccini e popolazioni. In questa sezione si fornisce una panoramica delle principali revisioni sistematiche degli ultimi anni che hanno affrontato il tema includendo studi condotti in Europa.
I genitori rappresentano inevitabilmente uno dei gruppi di popolazione più studiati quando si discute di esitazione vaccinale nei confronti delle vaccinazioni pediatriche. Tra i determinanti più ricorrenti in letteratura si trova l’opinione in merito l’utilità e l’importanza dei vaccini: avere un’opinione positiva in merito porta alla vaccinazione mentre ritenere che i vaccini siano inutili, insicuri o dannosi rappresenta prevedibilmente una delle principali barriere [24-32]. Inoltre, l’istruzione della madre sembra avere un ruolo chiave in quanto un elevato livello di istruzione può favorire la vaccinazione nei bambini [25-27, 33, 34]. Allo stesso modo una migliore situazione economica sembra essere associata a una minore esitazione [25, 33]. Come importanti driver per le vaccinazioni pediatriche, vengono citati frequentemente anche la fiducia nei servizi sanitari nazionali e nelle politiche governative [25, 29, 32 35] e la raccomandazione della vaccinazione da parte dei medici [25, 26, 36]. Tra le principali barriere studiate, la mancanza di conoscenza [24-27, 30, 31, 35, 36] insieme alla paura degli effetti collaterali [24-26, 30, 31, 35-37] sono emerse come fattori trasversali per numerose vaccinazioni, da quelle più propriamente dell’età pediatrica a quelle dell’età adolescenziale come la vaccinazione contro l’HPV. Infine, anche se meno frequentemente citate all’interno delle revisioni, appaiono importanti l’incoraggiamento da parte di pari [26, 36], la storia di infezione nei genitori nel caso dell’HPV [25, 33], il ruolo dei social media [33], vivere o meno in un’area urbana [31] e le convinzioni religiose [33, 35]. In maniera analoga, un’altra popolazione di interesse è rappresentata dalle donne in stato di gravidanza. Tra i fattori che influenzano positivamente la volontà vaccinale, sono frequentemente citate l’età materna avanzata [24, 38-41], un livello elevato di educazione materna [24, 38-41], la percezione che i vaccini siano utili [24, 39, 42] e la fiducia nel servizio sanitario e nelle politiche sanitarie del governo [24, 39, 43]. La più frequente motivazione che porta a non vaccinare è la paura degli effetti collaterali [38, 39, 44, 45].
Considerando la popolazione generale adulta, numerosi fattori associati alla volontà vaccinale sono comuni a quanto descritto per i genitori e le donne in gravidanza, come ad esempio ritenere che i vaccini siano utili [46-50], o efficaci [46, 50-53], essere stati precedentemente vaccinati [46, 53-55], aver ricevuto consiglio da un medico [50, 53, 54, 56], avere un’adeguata conoscenza [48-50, 54, 55], avere fiducia nella medicina e nel servizio [46, 50, 51, 54] e nelle politiche del governo [47, 53], alti livelli di istruzione e di situazione economica [46, 47, 54, 57, 58], un’età maggiore [46-48, 53, 54, 57]. Allo stesso modo, sono riportate alcune barriere comuni, come ad esempio l’accessibilità alle vaccinazioni [49, 56, 59-61] o le convinzioni religiose [47, 62]. Come elemento di novità maggiormente rilevante rispetto alle popolazioni citate in precedenza, occorre considerare lo stato di salute: avere delle patologie croniche sembra essere associato a una maggiore volontà vaccinale [46, 47, 50, 53, 54, 58], così come uno stato di salute percepito come buono può portare a una maggiore esitazione [50, 51, 54, 63, 64]. Se quindi di per sé una maggiore età e avere una patologia cronica portano ad essere più propensi alle vaccinazioni, occorre approfondire queste sottopopolazioni per capire quali eventuali difficoltà possano incontrare e quali fattori possano renderle esitanti. Pertanto, si approfondiranno queste tematiche nella sezione sezione successiva.
In ultimo, è interessante menzionare i fattori citati più frequentemente che possono influenzare la decisione dei professionisti sanitari di raccomandare le vaccinazioni nella popolazione. I determinanti più comuni che fanno propendere i professionisti per la somministrazione dei vaccini includono il fatto che i medici stessi siano stati vaccinati in precedenza [65, 66], la conoscenza sui vaccini e la loro importanza [65, 66], la percezione del rischio di infezione [66] e alcune professioni (in particolare, coloro che lavorano in reparti pediatrici/neonatali o in ostetricia) [65]. In particolare, da un lato, le principali barriere che ostacolano la raccomandazione da parte degli operatori sanitari includono credenze e preoccupazioni del professionista stesso: i professionisti possono affidarsi a false convinzioni o non avere sufficiente conoscenza in merito ai vaccini [66-68], sottovalutare le malattie prevenibili da vaccino [66], preoccuparsi sulla sicurezza o efficacia dei vaccini [66, 67] e preoccuparsi di sovraccaricare il bambino somministrando più iniezioni durante la stessa visita [68]. Dall’altro, questioni organizzative come la mancanza di tempo [66, 68], la mancanza di raccomandazioni ufficiali a cui fare affidamento o la presenza di programmi di immunizzazione nazionali complessi [66, 68] possono contribuire nell’ostacolare la raccomandazione da parte dei professionisti.
Come anticipato nella sezione precedente, la popolazione adulta con età più avanzata rappresenta una particolare popolazione, più propensa alla vaccinazione rispetto ai più giovani [46-48, 53, 54, 57], ma con possibili fattori associati all’esitazione vaccinale specifici per la propria fascia d’età.
Innanzitutto, numerosi studi si sono occupati di approfondire l’esitazione vaccinale nei confronti del vaccino contro l’influenza. Una revisione di Kan e Zhang del 2018 ha messo in luce come, su 27 studi sull’adesione alla vaccinazione antinfluenzale stagionale tra persone con 60 anni o più, la copertura varia dal 26% all’84%, con solo sette studi che riportano una copertura superiore al 75% e dieci studi con copertura inferiore al 50% (tra cui l’unico studio italiano incluso [69]). I risultati della revisione mostrano tra i fattori chiave influenzanti il comportamento vaccinale le raccomandazioni dei professionisti sanitari, il comportamento passato e le barriere percepite. Gli autori suggeriscono che le strategie di intervento per aumentare la copertura vaccinale dovrebbero coinvolgere il personale medico, fornendo ai pazienti informazioni accurate ed evidence-based sulla vaccinazione antinfluenzale. Le attività di promozione della vaccinazione potrebbero essere organizzate nei centri per anziani, coinvolgendo anziani già vaccinati per condividere le loro esperienze positive, ed inoltre il sostegno familiare e le norme soggettive sembrano influenzare il comportamento vaccinale degli anziani, suggerendo che i familiari dovrebbero essere coinvolti negli interventi. Altre misure potrebbero includere la creazione di cliniche vaccinali dedicate a questa fascia di popolazione, visite domiciliari per gli anziani con problemi di mobilità e l’eliminazione di barriere economiche [50]. Successivamente, Okoli e colleghi hanno condotto una meta-analisi sui dati relativi ai fattori che influenzano l’uptake del vaccino anti-influenzale nella popolazione anziana dal 2000 al 2019, trovando associazioni significative per alcune variabili: avere un’età più avanzata [OR = 1,52, intervallo di confidenza (IC) al 95%: 1,38-1,67], essere di etnia caucasica (OR = 1,30, IC 95%: 1,14-1,49), essere sposati (OR = 1,23, IC 95%: 1,17-1,28), essere non fumatori (OR = 1,28, IC 95%: 1,11-1,47), appartenere a una classe sociale più elevata (OR = 1,20, IC 95%: 1,06-1,36), avere un livello di istruzione più elevato (OR = 1,12, IC 95%: 1,04-1,21), avere un reddito familiare più alto (OR = 1,11, IC 95%: 1,05-1,18), avere una malattia cronica (OR = 1,53, IC 95%: 1,44-1,63), auto-valutarsi in cattiva salute (OR = 1,23, IC 95%: 1,02-1,40) e avere un medico di famiglia (OR = 2,94, IC 95%: 1,79-4,76) [70]. In aggiunta, una revisione pubblicata nel 2022 ha avuto come obiettivo valutare l’esitazione vaccinale degli adulti nei confronti della vaccinazione anti-influenzale e della vaccinazione anti-COVID-19, individuando quattro principali temi alla base dell’esitazione verso entrambe le vaccinazioni: preoccupazioni sulla sicurezza, mancanza di fiducia, percezione della non necessità del vaccino e motivi culturali. Inoltre, vi sono ragioni specifiche di esitazione legate al COVID-19, come la percezione di uno sviluppo affrettato del vaccino, e all’antinfluenzale, come il rifiuto di abituarsi a un vaccino annuale. La revisione ha rivelato che fattori simili a quelli che influenzano le decisioni dei genitori di vaccinare i loro figli riguardano anche le scelte degli adulti. La sicurezza dei vaccini, infatti, è stata la ragione più frequentemente menzionata, e la credenza di non essere suscettibili a una malattia è risultata più influente della percezione sulla sua gravità [71]. L’unico studio italiano incluso in quest’ultima revisione ha evidenziato in un campione di popolazione maggiorenne come principali motivazioni per non vaccinarsi la percezione che i vaccini non siano necessari ma che siano pericolosi e una mancanza di fiducia [72]. Infine, è interessante evidenziare delle pubblicazioni italiane più recenti in merito al vaccino dell’influenza, non incluse nelle sopracitate revisioni. Innanzitutto, uno studio sul territorio nazionale effettuato nel 2021 ha valutato l’adesione alla vaccinazione antinfluenzale nella stagione influenzale 2020/2021, confrontandola con quella della stagione 2019/2020. Il 20,1% dei partecipanti si è vaccinato soltanto nella stagione 2020/2021, mentre il 21,3% in entrambe le stagioni. Considerando i partecipanti con 65 anni o più, è risultato associato all’adesione alla vaccinazione antinfluenzale soltanto un alto livello di istruzione; nei partecipanti con meno di 65 anni invece: un medio o alto livello di istruzione, l’età, avere delle patologie, essere un operatore sanitario o in quiescenza dal lavoro [73]. In ultimo, uno studio condotto nel 2022 su un campione di adulti ha evidenziato che la mancanza di consapevolezza riguardo all’appartenenza ai gruppi target per la vaccinazione antinfluenzale stagionale è risultata significativamente associata a una maggiore probabilità di rifiuto o ritardo nell’accettazione. Inoltre, essere di sesso femminile, avere un’età compresa tra i 45 e i 54 anni, vivere in aree rurali, non possedere un’istruzione di livello accademico, non essere preoccupati riguardo alla possibilità di contrarre l’influenza, percepire la vaccinazione antinfluenzale come non sicura e avere amici o parenti contrari alla vaccinazione sono risultati significativamente associati a una maggiore probabilità di rifiuto della vaccinazione. Gli elementi predittivi in maniera significativa del ritardo nell’accettazione includono la difficoltà nell’accesso alle cure percepita e la residenza nelle regioni meridionali o insulari d’Italia. In aggiunta, l’essere di età superiore ai 65 anni, la residenza nel Nord-Est d’Italia, essere insegnante o operatore sanitario e soffrire di malattie cardiache o diabete hanno significativamente incrementato la probabilità di aderire alla vaccinazione [74].
Come introdotto nel paragrafo precedente, un’altra vaccinazione di interesse per la popolazione adulta e anziana è quella anti-COVID-19. Nel 2021, una meta-analisi ha considerato studi condotti su partecipanti con 60 anni o più, riportando una prevalenza di non disponibilità a vaccinarsi contro il COVID-19 del 27,03% (IC 95%: 15,10-38,95) e una prevalenza di incertezza nel vaccinarsi del 19,33% (IC 95%: 12,28-26,39). Il rischio di rimanere non vaccinati era significativamente più elevato tra le persone di etnia ispanica (OR = 1,197; IC 95%: 1,010-1,418), in caso di bassa istruzione (OR = 1,678; IC 95%: 1,170-2,408) e basso reddito (OR = 1,287; IC al 95%: 1,127-1,469). La meta-analisi tuttavia non ha incluso studi italiani [75]. Considerando tutta la popolazione adulta, AlShurman e colleghi hanno riscontrato nel 2021 un’intenzione vaccinale nei confronti del vaccino anti-COVID-19 tra il 28% (nella Repubblica Democratica del Congo) e il 93% (in Indonesia), con la maggior parte degli studi con un range tra 60 e 93%. Nello specifico, in Italia la prevalenza era del 92%, con una minore volontà vaccinale nella fascia 35-59 anni rispetto il gruppo con età di 60 anni o più [76]. In generale, tra i fattori associati positivamente all’intenzione vaccinale, i più rilevanti erano l’età avanzata, il genere maschile, un alto livello di istruzione, l’etnia caucasica, pensare che i vaccini siano sicuri ed efficaci, la storia di vaccinazione contro l’influenza e il voler proteggersi dalla COVID-19 [77]. Infine, alcuni studi italiani non inclusi nelle precedenti revisioni offrono interessanti prospettive sulla volontà vaccinale della popolazione anziana. Nel contesto dei dati provenienti dalla sorveglianza PASSI D’Argento nel 2020, condotta su un campione di 1.876 partecipanti con 65 anni o più, il 55% di coloro che hanno partecipato ha dichiarato la propria accettazione della vaccinazione anti-COVID-19, mentre il 16% ha manifestato un probabile rifiuto nei confronti del vaccino. Il rimanente 29%, invece, è stato categorizzato come esitante. Questo gruppo di individui esitanti è stato significativamente associato a diversi fattori, tra cui un basso livello di istruzione, l’incertezza riguardo alla gravità delle conseguenze della COVID-19 per loro stessi, la mancanza di preoccupazione per la situazione pandemica, l’assenza di esperienza di perdite tra i propri cari e la non ricezione del vaccino antinfluenzale nell’anno precedente. Il rifiuto del vaccino, in aggiunta ad alcune variabili associate anche all’esitazione, è stato significativamente associato alla mancanza di patologie croniche [78]. Nel 2021, Gallé e colleghi hanno esplorato l’intenzione vaccinale anti-COVID-19 con un campione di 1.041 persone con 65 anni o più nel Sud Italia, riportando che il 92,7% era stato vaccinato o era disposto a sottoporsi alla vaccinazione contro il COVID-19. Tuttavia, meno della metà del campione aveva un atteggiamento favorevole nei confronti dei vaccini e concordava con l’obbligatorietà dell’immunizzazione. La disponibilità a vaccinarsi contro il SARS-CoV-2 risultava correlata positivamente a un livello di istruzione più elevato e al fatto di avere i social media o i mezzi di comunicazione di massa come principale fonte di informazione. Al contrario, si è riscontrata una relazione inversa tra l’accettazione della vaccinazione e il completamento del questionario dopo l’introduzione del green pass, suggerendo che misure obbligatorie, come l’implementazione del green pass, debbano essere affiancate da efficaci strategie di educazione e informazione rivolte alla popolazione target [79]. Più recentemente, nel 2022, Gori e colleghi hanno coinvolto un campione di oltre 10.000 adulti per approfondire l’esitazione vaccinale. Considerando il vaccino anti-COVID-19, l’83,2% ha dichiarato di essersi vaccinato al più presto possibile, l’8,0% ha ritardato la vaccinazione, mentre il 6,7% ha rifiutato di vaccinarsi. In generale, i risultati evidenziano che il ritardo o il rifiuto della vaccinazione contro il COVID-19 erano strettamente associati a diverse caratteristiche: essere di sesso femminile, avere un’età compresa tra i 25 e i 64 anni, avere un livello di istruzione inferiore al diploma di scuola superiore o superiore a una laurea magistrale, e provenire da un’area rurale. Inoltre, è emerso che avere scarsa fiducia nella scienza e/o nel governo, fare uso della medicina alternativa come principale fonte di trattamento e avere l’intenzione di votare per determinati partiti erano caratteristiche associate al ritardare o rifiutare il vaccino. Infine, la principale motivazione riferita per il ritardo o il rifiuto della vaccinazione era la paura degli effetti collaterali del vaccino (circa il 55,0% sia tra coloro che ritardano il vaccino che tra coloro che lo rifiutano) [21].
Sebbene la maggior parte della letteratura scientifica degli ultimi anni si focalizzi su COVID-19 e influenza, sono presenti alcuni dati interessanti in merito alla vaccinazione anti-pneumococco. In particolare, una revisione ha evidenziato un’associazione positiva tra una precedente vaccinazione antinfluenzale e la volontà di ricevere la vaccinazione antipneumococcica. Inoltre, il ruolo degli operatori sanitari nel consigliare, prescrivere o fornire informazioni sulla vaccinazione antipneumococcica è stato identificato come un elemento abilitante in modo coerente in numerosi studi. Diversi fattori, tra cui la mancanza di conoscenza, problemi finanziari e logistici, e preoccupazioni sulla sicurezza ed efficacia del vaccino, sono stati segnalati come ostacoli per gli operatori sanitari nell’ambito della vaccinazione o della raccomandazione della vaccinazione antipneumococcica [80]. In aggiunta, uno studio italiano ha esplorato l’intenzione vaccinale nei confronti del vaccino pneumococcico tramite intervista telefonica, raggiungendo un campione di 600 persone con 65 anni o più. La proporzione di vaccinati era molto bassa (11,2%), con la maggior parte dei partecipanti che dichiarava di non essere ben informata sulle opportunità di vaccinazione, e il 37,7% era non consapevole dell’esistenza della vaccinazione. In aggiunta, i risultati hanno evidenziato che il principale (e più efficace) canale di informazione era rappresentato dagli operatori sanitari, e l’esitazione era correlata positivamente alla percezione del rischio legato alla malattia e negativamente alla percezione del rischio di reazioni avverse al vaccino [81].
In aggiunta, Di Giuseppe e colleghi hanno analizzato la volontà di ricevere la vaccinazione anti-zoster tra adulti e anziani, tramite un campione di persone con più di 65 anni oppure con più di 50 anni e patologie croniche. L’83,2% del campione aveva sentito parlare dell’infezione da Herpes Zoster e conosceva correttamente i principali sintomi della malattia. Solo il 11,8% dei partecipanti aveva sentito parlare della disponibilità di un vaccino contro l’Herpes Zoster in Italia, e, tra questi, il 63,9% sapeva che il vaccino è raccomandato per i pazienti a rischio di età pari o superiore a 50 anni e per gli adulti di età ≥ 65 anni. Il 26,6% dei partecipanti aveva un atteggiamento positivo verso la volontà di ricevere il vaccino contro l’Herpes Zoster. Le persone di età compresa tra 50 e 64 anni, coloro che avevano più di una malattia cronica, coloro che avevano ricevuto almeno una vaccinazione raccomandata, coloro che avevano un atteggiamento positivo sull’utilità del vaccino contro l’Herpes Zoster e coloro che sentivano la necessità di ricevere ulteriori informazioni sul vaccino contro l’Herpes Zoster avevano significativamente maggiori probabilità di avere un atteggiamento positivo verso la volontà di ricevere il vaccino [82].
Inoltre, alcuni studi hanno confrontato l’atteggiamento nei confronti di più vaccinazioni indirizzate alle persone anziane. Wennekes e colleghi hanno condotto dei focus group tra fine 2019 e inizio 2020 coinvolgendo partecipanti con 50 anni o più in Francia, Ungheria, Italia e Olanda. Generalmente, i partecipanti erano a conoscenza delle vaccinazioni contro l’influenza e il tetano, nonché della malattia influenzale stessa. Al contrario, la consapevolezza delle vaccinazioni contro la malattia pneumococcica e l’herpes zoster era bassa. I partecipanti hanno anche espresso la necessità di ulteriori informazioni sulle vaccinazioni, come possibili effetti collaterali, controindicazioni e durata della protezione, sottolineando come le informazioni siano fondamentali per prendere decisioni sulla vaccinazione. I medici di medicina generale sono stati considerati le principali fonti di informazioni sulle vaccinazioni. Considerando in maniera specifica i risultati italiani, è possibile notare una percezione più fiduciosa sulla sicurezza dei vaccini, con scarsa menzione degli effetti collaterali, suggerendo un livello di fiducia maggiore nella sicurezza delle vaccinazioni. Inoltre, alcuni partecipanti in Italia sembrano accettare maggiormente il vaccino antinfluenzale in quanto presentano problemi di salute preesistenti, indicando che la percezione del rischio di contrarre l’influenza potrebbe essere più elevata tra coloro con condizioni mediche preesistenti. Allo stesso tempo, coloro che ritengono che il loro corpo possa superare la malattia o che siano in buona salute potrebbero non vedere la necessità di vaccinarsi. Secondo i partecipanti italiani, i professionisti sanitari, in particolare i medici di medicina generale, giocano un ruolo cruciale nella fornitura di informazioni sui vaccini in Italia. Tuttavia, alcuni partecipanti hanno riferito casi in cui i medici non consigliavano o addirittura sconsigliavano specifici vaccini [83].
In Tabella I sono riassunti i principali fattori che possono influenzare l’intenzione vaccinale nell’anziano, in riferimento alle revisioni e agli studi italiani che hanno preso in considerazione campioni con persone con 60 anni o più menzionati precedentemente [50, 70, 73, 75, 78-82].
Fattori che influenzano l’intenzione vaccinale nell’anziano.
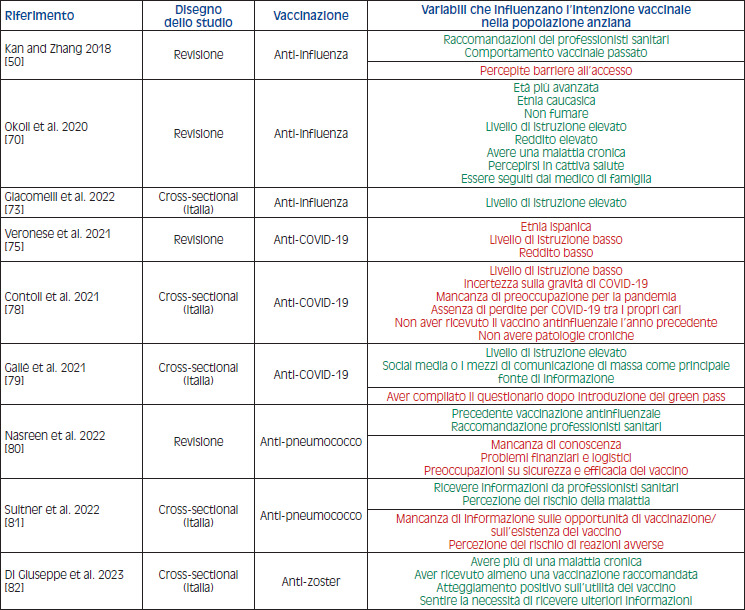
|
| Le variabili in verde scuro favoriscono la vaccinazione; le variabili in rosso scuro sono da considerarsi barriere. |
Infine, occorre considerare un sottogruppo della popolazione adulta con una maggiore propensione nei confronti delle vaccinazioni, ovvero le persone con patologie croniche [46, 47, 50, 53, 54, 58]. Anche in questo caso, l’esitazione vaccinale è influenzata da diverse sfaccettature. Uno dei fattori chiave sembra essere la mancanza di conoscenza approfondita sia sul funzionamento dei vaccini che sulla loro importanza. La mancanza di fiducia nei confronti dei vaccini può derivare da una percezione di scarsa informazione da parte dei professionisti sanitari e dalla preoccupazione per gli effetti collaterali, spesso amplificati da voci sentite attraverso il passaparola o dai media [84-87]. Questi dubbi possono portare le persone a percepire un rischio inferiore nell’acquisire l’infezione rispetto alla vaccinazione [88, 89]. Un secondo problema riguarda la mancanza di fiducia nei confronti degli operatori sanitari da parte dei pazienti [84]. Alcuni studi condotti in Francia evidenziano che i medici di medicina generale non vengono frequentemente consultati dai pazienti, i quali tendono a preferire medici specialisti, e, inoltre, quando i medici di medicina generale vengono consultati, alcuni tra questi possono mostrare esitazione nel raccomandare le vaccinazioni [85, 90]. A tal proposito sembrerebbe che, per molti pazienti con patologie croniche, ricevere il consiglio di uno specialista aumenti maggiormente l’adesione vaccinale, legato anche all’idea che si tratti della figura professionale che meglio conosce la loro situazione e cosa è opportuno fare [85, 90-92]. Inoltre, l’accesso ai vaccini rappresenta un ostacolo importante. Orari e tempi di attesa scomodi, conflitti con altri impegni percepiti come prioritari dai pazienti e la distanza dai centri vaccinali, spesso complicata dalla mancanza di trasporti adeguati, influiscono negativamente sull’adesione alle vaccinazioni [84, 87, 93]. Recentemente, una revisione si è occupata di descrivere la vaccinazione anti-COVID-19 nei pazienti con patologie croniche, trovando una percentuale di persone vaccinate del 65%. Nonostante i pazienti oncologici siano particolarmente a rischio, l’accettazione del vaccino tra questa categoria è molto bassa (52%), in gran parte a causa delle preoccupazioni sull’impatto del vaccino sul loro trattamento. Inoltre, anche i pazienti con malattie reumatiche autoimmuni hanno una bassa probabilità di accettazione (46%), ma gli studi inclusi nella revisione suggeriscono che i pazienti potrebbero essere influenzati positivamente dai consigli dei loro medici [94]. In ultimo, occorre considerare alcuni dati in merito a studi condotti in Italia. Bertoldo e colleghi hanno esplorato la vaccinazione antinfluenzale in pazienti con patologie croniche, coinvolgendo circa 700 adulti (età media 58,6 ± 19,2). Nel complesso, il 64,7% dei partecipanti era consapevole del fatto che l’influenza può essere prevenuta con i vaccini e che i pazienti con patologie croniche sono a rischio elevato di sviluppare complicazioni gravi. Tuttavia, meno della metà del campione (42,1%) aveva ricevuto il vaccino antinfluenzale nella stagione precedente, mentre il 46,9% ha dichiarato la volontà di ricevere la vaccinazione antinfluenzale nella prossima stagione. Le ragioni più frequentemente citate per non aver fatto il vaccino antinfluenzale erano la paura degli effetti collaterali (24,9%) e l’assenza di raccomandazione da parte di un medico (24,2%). L’analisi ha dimostrato come predittori dello stato di vaccinazione l’età più avanzata, l’informazione sul vaccino antinfluenzale ottenuta attraverso la consultazione con un medico e un atteggiamento positivo verso l’utilità della vaccinazione antinfluenzale [88]. In maniera analoga, Napolitano e colleghi hanno indagato le vaccinazioni in circa 400 pazienti con patologie (età media 60,1 ± 16,1). Nel campione esaminato, più della metà (58,2%) dei partecipanti ha dichiarato di aver ricevuto almeno una vaccinazione raccomandata, mentre l’8,9% ne ha ricevute almeno due. I pazienti che ritenevano che le malattie prevenibili con vaccino fossero pericolose per loro, coloro che avevano ricevuto informazioni dai medici e coloro che avevano bisogno di informazioni avevano maggiori probabilità di aver ricevuto almeno una vaccinazione raccomandata. Questo comportamento era meno probabile tra i pazienti sposati, coloro che erano preoccupati per gli effetti collaterali dei vaccini e coloro che soffrivano di insufficienza renale [95].
Affrontare l’esitazione vaccinale e superare le barriere all’accettazione è un compito complesso ma cruciale. Anche se la percentuale di persone esitanti può variare in base al contesto, a seconda del vaccino e nel tempo, è raro che vi siano situazioni completamente immuni da problema. Per contrastare l’esitazione, è necessario individuare, comprendere e intervenire in modo personalizzato, poiché non esiste una soluzione universale per superare tutti gli ostacoli all’accettazione dei vaccini [96]. Le strategie per diminuire l’esitazione vaccinale da un lato coinvolgono i responsabili dei programmi di immunizzazione e gli operatori sanitari, i quali devono essere capaci di riconoscere e affrontare l’esitazione; dall’altro, devono coinvolgere direttamente la popolazione stessa. In questo contesto, MacDonald e colleghi offrono una panoramica sulle strategie evidence-informed da considerare sia a livello di programmi di immunizzazione che a livello individuale [96].
Partendo dal livello dei programmi, occorre innanzitutto identificare l’esitazione nei gruppi di popolazione. Infatti, l’esitazione non è uniforme tra i gruppi di popolazione e cambia a seconda del vaccino e del periodo temporale considerato. I programmi di immunizzazione devono individuare i sottogruppi con bassa adesione e determinare le cause della loro esitazione, in modo da poter implementare interventi mirati per affrontare questi fattori. In secondo luogo, è necessario assicurare che tutti gli operatori sanitari conoscano e utilizzino le migliori pratiche di immunizzazione [96]. Come accennato nella sezione precedente, le convinzioni degli operatori sanitari riguardo all’immunizzazione non sono uniformi e possono influenzare le scelte vaccinali della popolazione. Pertanto, è importante fornire una formazione adeguata partendo dagli studenti di medicina e proseguendo con gli operatori sanitari in servizio per garantire che abbiano conoscenze aggiornate [96]. Nell’ambito degli interventi che possono avere come target i professionisti sanitari, esistono numerosi strumenti che possono aiutare gli operatori a imparare ad affrontare l’esitazione, come ad esempio sessioni educative (in persona o online), condivisione di materiali educativi, valutazione delle performance e feedback, giochi/simulazioni di ruolo e app/giochi online. Tuttavia, è importante sottolineare come siano necessari ulteriori studi per definire con evidenze robuste quali siano gli strumenti più efficaci [97]. Inoltre, altre strategie che dovrebbero essere seguite a livello di programmi includono il coinvolgimento delle scuole, delle comunità locali, promuovendo collaborazioni tra più enti, e dei leader della comunità, come ad esempio i leader religiosi, e il miglioramento della comodità e dell’accesso alla vaccinazione [96]. Infine, le strategie di comunicazione efficaci sono essenziali: i piani di comunicazione devono essere proattivi, concentrarsi sull’ascolto, essere adattati al pubblico di destinazione e utilizzare tecniche di comunicazione adeguate, includendo strategie per affrontare la disinformazione anti-vaccino e campagne di sensibilizzazione mirate e testate [96]. Considerando invece le strategie focalizzate sul singolo individuo, anche in questo caso occorre tenere in considerazione l’importanza della comunicazione: non solo ciò che un operatore sanitario dice riguardo all’immunizzazione ha un’influenza, ma anche il modo in cui lo dice è importante [96]. In merito alla comunicazione, lo studio di Braun et al. ha evidenziato che l’approccio presuntivo è la tecnica più documentata per aumentare l’adesione ai vaccini, mentre l’intervista motivazionale è promettente ma necessita di ulteriori ricerche [98]. Tuttavia, al momento, non esiste evidenza sufficiente per dichiarare definitivamente quale tipo di comunicazione debba essere utilizzato [99]. Ciononostante, è fondamentale continuare a esaminare quali metodi possano essere più efficaci, poiché c’è un legame tra la raccomandazione da parte degli operatori sanitari e la vaccinazione [100], e la relazione medico-paziente rappresenta una chiave per costruire fiducia [101]. Infine, gli operatori sanitari devono ricordare che la paura degli aghi e del dolore durante la vaccinazione è una preoccupazione per molti genitori e bambini, così come per gli adulti [96].
Se da un lato le raccomandazioni fornite da MacDonald e colleghi sono utili per interventi rivolti a tutta la popolazione, dall’altro, alcune revisioni hanno tentato di riunire le evidenze in merito alle strategie per migliorare le coperture vaccinali nella popolazione adulta. Innanzitutto, bisogna considerare il lavoro di revisione di Bach et al., pubblicato nel 2019. Secondo tale revisione, l’utilizzo di brevi messaggi o promemoria via telefono, messaggi di testo o smartphone direttamente ai pazienti può aumentare l’aderenza alle vaccinazioni, sfruttando la tecnologia e i media come strumenti educativi e di promemoria nei programmi di vaccinazione. In aggiunta, ridurre i costi e estendere la copertura assicurativa delle vaccinazioni in alcuni contesti si è dimostrato una strategia efficace per migliorare i tassi complessivi di somministrazione dei vaccini, specialmente tra pazienti non assicurati o sottoposti a copertura limitata e con basso status socioeconomico. L’uso di standing orders e ampliare l’offerta vaccinale in ambienti non tradizionali, come farmacie comunitarie, studi pediatrici, cliniche aziendali e visite domiciliari di assistenza primaria, possono migliorare l’accesso alle vaccinazioni per gli adulti. Inoltre, aumentare la conoscenza e la consapevolezza sull’importanza delle vaccinazioni tra i gruppi minoritari può contribuire all’aumento dell’adesione alle vaccinazioni tra pazienti di diverse origini etniche. Infine, l’educazione dei professionisti sanitari, con o senza il supporto di campioni designati per le immunizzazioni, l’uso del supporto decisionale clinico o la collaborazione con soggetti pubblici e privati hanno dimostrato di affrontare con successo le barriere correlate ai fornitori/pratiche, portando all’incremento dei tassi di immunizzazione [55]. In secondo luogo, in maniera simile, Ecarnot e colleghi hanno esplorato le strategie rivolte alla popolazione adulta. Anche in questo caso, la componente educativa è essenziale: cambiare la percezione pubblica sull’immunizzazione richiede un approccio educativo che coinvolga tutte le fasce d’età, partendo dalla formazione dei giovani studenti e continuando con programmi di educazione continua per gli operatori sanitari. Altre strategie per migliorare l’adesione ai vaccini possono mirare agli elementi che causano coperture ridotte. Approcci basati sulla tecnologia e sulla comunicazione dovrebbero sfruttare il potenziale del mondo moderno e connesso per diffondere messaggi di sanità pubblica e raggiungere direttamente il pubblico attraverso app per smartphone e social media. Questo è particolarmente importante per contrastare i messaggi negativi che guadagnano slancio nell’odierno mondo iperconnesso, il che facilita la formazione di gruppi di individui con opinioni simili che si uniscono per fare pressione. Una presenza online più diffusa e l’uso dei social media potrebbero anche consentire di adattare i messaggi ai pubblici di destinazione, fornendo informazioni adeguate al livello di rischio di un determinato gruppo target. Approcci incentrati sul medico e sul sistema per migliorare l’adesione potrebbero prevedere un aumento del numero di punti di somministrazione dei vaccini e un maggiore utilizzo di altri punti di contatto, come le farmacie comunitarie, per raggiungere un pubblico più ampio, con modelli di rimborso adeguati per garantire che gli operatori sanitari siano incentivati a partecipare. Allo stesso tempo, è essenziale apportare cambiamenti sostanziali nei sistemi sanitari nazionali, sviluppare politiche di salute pubblica favorevoli all’immunizzazione e promuovere la ricerca sui vaccini. Tutto ciò richiede una determinazione politica ferma e una leadership robusta [102].
Oltre alle strategie da tenere in considerazione per contrastare l’esitazione vaccinale nell’età adulta in generale, alcune revisioni si sono occupate di esplorare interventi nella popolazione anziana per migliorare la copertura di specifiche vaccinazioni.
Considerando la vaccinazione antipneumococcica, Kirubarajan e colleghi hanno suddiviso i possibili interventi in tre macroaree: campagne educative, priorità nei piani vaccinali ed interventi nell’assistenza primaria. In merito agli interventi educativi per migliorare la consapevolezza e l’adesione alla vaccinazione pneumococcica in anziani, alcune iniziative erano rivolte ai professionisti sanitari e altre ai pazienti stessi. Questi interventi hanno utilizzato vari mezzi, tra cui video, materiale visivo, rappresentazioni teatrali, consulenze telefoniche, condotte sia da farmacisti che da infermieri. Nel complesso, questi interventi hanno dimostrato di aumentare la conoscenza dei pazienti sulla vaccinazione pneumococcica e, in alcuni casi, di migliorare leggermente i tassi di vaccinazione, con una riduzione clinicamente significativa della malattia pneumococcica in un singolo studio. Inoltre, è emersa l’importanza di fornire informazioni in diverse lingue e materiali chiari. Passando alla seconda macroarea, questi interventi hanno compreso strategie come l’uso di farmacisti per distribuire i vaccini, standing orders per infermieri, algoritmi e protocolli per la distribuzione dei vaccini, e linee guida nazionali sulla vaccinazione. Nel complesso, questi programmi hanno migliorato i tassi di vaccinazione e l’amministrazione corretta dei vaccini pneumococcici. Infine, l’ultima macroarea consisteva in interventi basati sulla medicina generale, con un miglioramento significativo dei tassi di vaccinazione nella maggior parte dei casi. Ad esempio, uno studio ha ridotto le opportunità mancate di vaccinazione pneumococcica attraverso interventi di successo come standing orders per la vaccinazione, promemoria per i medici e relazioni sulle prestazioni. Tuttavia, è importante sottolineare come la revisione metta in luce che sono necessari studi più robusti, come trial clinici randomizzati che confrontino direttamente diversi interventi, al fine di determinare quali siano i più efficaci [103].
Per quanto riguarda la vaccinazione anti-influenzale, Thomas e Lorenzetti hanno condotto una revisione con meta-analisi includendo le strategie che avevano come target finale la popolazione di 60 anni o più. Le strategie per aumentare la domanda nella comunità hanno incluso promemoria o richiami ai pazienti tramite lettera e opuscolo o cartolina postale, e alcune di queste strategie sono state efficaci. Altri interventi come le visite a domicilio, le chiamate telefoniche personalizzate e l’educazione del personale sanitario hanno avuto successo in singoli studi. Tra le strategie efficaci si trovano quindi: promemoria o richiami ai pazienti tramite lettera più opuscolo o cartolina postale, confrontato con i soli promemoria (OR = 1,11, IC 95%: 1,07-1,15); interventi che includevano il coinvolgimento dei pazienti da parte di insegnanti in pensione (OR = 3,33, IC 95%: 1,79-6,22); inviti da parte delle reception delle cliniche (OR = 2,72, IC 95%: 1,55-4,76); educazione dei pazienti da parte di infermieri o farmacisti e somministrazione da parte degli infermieri (OR = 152,95, IC 95%: 9,39-2490,67); consulenza dei pazienti da parte di studenti di medicina (OR = 1,62, IC 95%: 1,11-2,35); e questionari di richiamo multipli (OR = 1,13, IC 95%: 1,03-1,24). Per migliorare l’accesso alla vaccinazione, sono risultate efficaci le strategie che includono le visite a domicilio (OR = 1,30, IC 95%: 1,05-1,61) e la somministrazione gratuita del vaccino (OR = 1,30, IC 95%: 1,05-1,61). Gli interventi efficaci basati su professionisti sanitari o a livello di sistema consistevano in incentivi finanziari per i medici (OR = 2,22, IC 95%: 1,77-2,77), promemoria ai medici per vaccinare tutti i pazienti (OR = 2,47, IC 95%: 1,53-3,99), poster nelle cliniche che presentano i tassi di vaccinazione e incoraggiano la competizione tra i medici (OR = 2,03, IC 95%: 1,86-2,22), revisione delle cartelle cliniche e confronto con i tassi ottenuti dai medici migliori (OR = 3,43, IC 95%: 2,37-4,97) [104].
Inoltre, sempre considerando la vaccinazione anti-influenzale nell’anziano, una revisione condotta nel 2021 ha evidenziato come gli interventi che comprendevano maggiori interazioni dirette con i pazienti, incluse iniziative educative condotte dai professionisti sanitari e raccomandazioni degli stessi, abbiano mostrato associazioni più positive rispetto a interventi meno interattivi, come poster e lettere di promemoria e richiamo. Gli interventi sui professionisti sanitari, tra cui campagne di sensibilizzazione, incentivi, strategie per migliorare l’accessibilità o espansione dei siti di vaccinazione, hanno generalmente mostrato associazioni positive. Infine, è interessante sottolineare come combinare più interventi abbia determinato il successo della strategia in diversi studi e come occorra personalizzare i programmi in quanto le barriere e gli interventi stessi variavano per diversi gruppi di popolazione [105].
Infine, uno studio ha avuto l’obiettivo di mappare, attraverso una revisione della letteratura e un sondaggio condotto tra esperti, le strategie adottate in Italia in ambienti non convenzionali per promuovere la vaccinazione contro virus dell’influenza, pneumococco e il virus dell’herpes zoster tra la popolazione adulta a rischio e gli anziani. La maggior parte delle strategie individuate mirava a promuovere la vaccinazione antinfluenzale, mentre relativamente poche riguardavano le vaccinazioni antipneumococciche e/o contro l’herpes zoster. Le principali strutture coinvolte erano ambulatori ospedalieri, case di riposo e residenze sanitarie. In una percentuale minore di casi, erano coinvolte farmacie, reparti ospedalieri, carceri, stazioni di vaccinazione mobili e strutture socio-sanitarie accreditate. Infine, in alcune strategie individuali, erano coinvolti un centro per il diabete, una parrocchia, una struttura ospedaliera e uno stand in una fiera. Non tutte le strategie prendevano in considerazione entrambi i gruppi target (adulti a rischio e anziani). Infatti, per quanto riguarda le vaccinazioni antinfluenzali e antipneumococciche, la popolazione target principale era composta principalmente da adulti a rischio, mentre nel caso della vaccinazione contro l’herpes zoster, il principale gruppo target erano i soggetti anziani. Tuttavia, lo studio suggerisce come siano necessari ulteriori studi per valutare l’efficacia delle strategie messe in campo [106].
L’adesione alla vaccinazione tra gli adulti, in particolare tra la popolazione anziana, è influenzata da una serie di fattori complessi. In generale, gli anziani mostrano livelli minore di esitazione rispetto a fasce più giovani. Tra gli elementi chiave che possono influenzare l’adesione, un ruolo di rilievo è rappresentato dalle raccomandazioni dei professionisti sanitari, il comportamento vaccinale passato, la necessità di ricevere maggiori informazioni per colmare gap di consapevolezza e conoscenza, nonché un miglioramento dell’accessibilità ai servizi vaccinali. Inoltre, per i pazienti con patologie croniche, l’adesione alle vaccinazioni è influenzata dalla mancanza di conoscenza sui vaccini, dalla mancanza di fiducia nei medici di medicina generale e dagli ostacoli di accesso. Per migliorare l’adesione alla vaccinazione tra gli anziani, è essenziale adottare un approccio multidimensionale che comprenda educare la popolazione anziana sulla vaccinazione, costruire fiducia nei professionisti sanitari e fornire formazione specifica ai professionisti, soprattutto coloro che gestiscono pazienti con patologie croniche, poiché questi ultimi sembrano riporre maggiore fiducia negli specialisti come figura a cui fare riferimento. Inoltre, la rimozione di barriere logistiche che possano ostacolare l’accesso alla vaccinazione è fondamentale. Questo approccio personalizzato alle esigenze della popolazione anziana è cruciale per migliorare le coperture vaccinali. Combinare diverse strategie, come interventi educativi mirati e coinvolgimento dei professionisti sanitari, può aumentare l’efficacia complessiva delle campagne di vaccinazione. Tuttavia, è fondamentale condurre ulteriori studi approfonditi per determinare l’efficacia delle diverse strategie.
In generale, promuovere la vaccinazione tra gli adulti richiede approcci personalizzati che tengano conto delle specifiche esigenze delle diverse fasce di età e categorie di pazienti. Per l’introduzione di un nuovo vaccino è fondamentale considerare che l’atteggiamento di esitazione nei confronti dei vaccini può variare non solo in termini di intensità, ma anche in base al tipo di vaccino e al contesto storico, politico e socio-culturale. È necessario pertanto considerare sia il vaccino specifico che la popolazione target a cui è indirizzato conducendo studi dedicati, tenendo conto del contesto e del periodo temporale in cui vengono effettuate le analisi.
La vaccinazione rappresenta una delle più importanti scoperte scientifiche nella storia della medicina e ha contribuito in modo fondamentale ad incrementare la speranza di vita delle popolazioni di tutto il mondo. Il progresso delle conoscenze ha da un lato chiarito i meccanismi d’azione dei vaccini, dall’altro i progressi degli scorsi decenni nei settori della batteriologia, della virologia, dell’immunologia e della modellistica matematica applicate alle infezioni, hanno aperto orizzonti un tempo impensabili nel campo della ricerca medica. La vaccinazione è stata definita una delle più grandi scoperte mediche mai fatte dall’uomo, la cui importanza è paragonabile, per impatto sulla salute, alla possibilità di fornire acqua potabile alla popolazione [1]. Per questo motivo le vaccinazioni sono valutate sotto l’aspetto scientifico e la loro applicazione su larga scala è stata presa in considerazione in virtù dei loro benefici in termini di risultati epidemiologici e clinici.
Negli ultimi cinquant’anni, a livello mondiale, i vaccini hanno permesso di ridurre di molto l’incidenza di diverse malattie infettive, riducendo drasticamente il tasso di mortalità e le complicanze associate a tali patologie. Secondo gli ultimi dati dell’Organizzazione Mondiale della Sanità (OMS), a livello globale, i vaccini permettono di prevenire 3,5-5 milioni di morti ogni anno [2].
Oltre a ridurre i tassi di mortalità e morbosità e a limitare la diffusione di agenti patogeni, i vaccini svolgono anche un ruolo importante nella lotta alla resistenza antimicrobica [3]. Le vaccinazioni possono essere una delle soluzioni più efficaci per contrastare anche la diffusione di batteri resistenti agli antibiotici in quanto aiutano a ridurre l’uso improprio di antibiotici e prevengono sviluppo e trasmissione di batteri resistenti. Tutto ciò ha un impatto importante anche da un punto di vista economico.
Nonostante il valore e i benefici reali e tangibili siano riconosciuti a livello globale e molte siano state le iniziative introdotte a sostegno delle vaccinazioni negli ultimi anni, in molti Paesi europei si continua a registrare un calo delle coperture, sia in età pediatrica che in età adulta, con importanti ricadute a livello sanitario, sociale ed economico.
Il calo generale dei tassi di copertura può essere in parte attribuibile alla cosiddetta Vaccine Hesitancy (“esitazione vaccinale”), definita dallo Strategic Advisory Group of Experts (SAGE) on Immunization dell’OMS come la tendenza a ritardare o rifiutare la vaccinazione pur in presenza della disponibilità di tale servizio [4]. La Vaccine Hesitancy oggi rappresenta una vera minaccia per la salute e il benessere dei cittadini, determinando effetti rilevanti sull’efficacia dei programmi di immunizzazione all’interno dei Paesi europei.
Un fattore determinante che ha portato all’aumento dello scetticismo nei confronti dei vaccini risiede, infatti, nella divulgazione di informazioni prive di fondamento scientifico, amplificate dall’utilizzo dei social media e del web. Pertanto è urgente e necessario sviluppare competenze organizzative a livello locale, nazionale e globale al fine di identificare, monitorare e indirizzare proattivamente l’esitazione vaccinale e rispondere tempestivamente ai movimenti anti-vaccinazione in caso di disinformazione o di potenziali eventi avversi [5].
Una survey dell’Eurobarometro del 2019 [6] ha messo in luce come in Europa soltanto l’85% dei cittadini ritiene che i vaccini siano efficaci nella prevenzione delle malattie infettive (la percentuale scende al 78% per la popolazione italiana). Allo stesso tempo, quasi la metà della popolazione ha paura degli effetti indesiderati gravi. Solo la metà degli europei intervistati è cosciente del fatto che influenza e meningite possono causare il decesso (rispettivamente 56 e 53%), mentre percentuali ancora minori si riscontrano per epatite (40%), morbillo (37%) e tetano (22%).
Sono preoccupanti i dati che riguardano l’Italia: quasi la metà della popolazione (48 vs il 29% degli europei) ritiene che le vaccinazioni siano importanti solo per i bambini. Un terzo della popolazione è convinto che i vaccini indeboliscano il sistema immunitario o che possano causare la malattia da cui proteggono (34%). Un quarto della popolazione ritiene che non sia importante ricevere le vaccinazioni raccomandate (il dato complessivo europeo è 15%).
Dal documento emerge, quindi, la necessità di intensificare gli sforzi per un’informazione corretta sull’efficacia e la sicurezza dei vaccini e sulla gravità delle malattie prevenibili da vaccino: il persistere di conoscenze errate genera una situazione che porta inevitabilmente alla perdita di fiducia nei confronti delle vaccinazioni come strumento di prevenzione.
Il valore della prevenzione vaccinale va oltre il perimetro della sanità. Le patologie prevenibili con vaccino hanno impatti molto importanti non solo sul sistema sanitario e socio-assistenziale, ma anche sul sistema produttivo ed economico. Peraltro, i benefici derivanti dalle vaccinazioni non sono limitati al miglioramento di situazioni cliniche o epidemiologiche, come la prevenzione di malattie e dei loro esiti, con le conseguenze economiche a questo connesse, ma esse sono anche in grado di promuovere la crescita economica dei Paesi nonché la riduzione della povertà [7].
La vaccinazione contribuisce alla sostenibilità della spesa sanitaria pubblica grazie ai possibili risparmi generati in termini di riduzione di numero di ricoveri, spese per le cure mediche per la malattia e le eventuali complicanze in fase acuta, sequele permanenti, recrudescenze ed epidemie. Riduce, inoltre, la mancata produttività per assenza dal lavoro [8]. Risulta, pertanto, fondamentale valutare i costi della non vaccinazione (es. costi per malattie prevenibili con vaccinazioni consigliate) e realizzare politiche che favoriscano la pratica vaccinale in tutto il mondo. Pertanto, il valore economico delle vaccinazioni, in aggiunta a quello scientifico, è un aspetto che dovrebbe favorirne la massima diffusione. Purtroppo la crisi economica che ha investito i Paesi industrializzati ci induce ad una necessaria razionalizzazione della spesa anche in ambito sanitario, con la conseguente minore propensione all’acquisto e all’implementazione di nuovi vaccini, pur nell’evidenza di una loro sempre maggiore sicurezza ed efficacia. Di fatto l’attenzione dei decisori tende ad orientarsi più verso un’ottica di contenimento piuttosto che verso una di investimento, con il risultato che le vaccinazioni vengono prese in considerazioni immediatamente solo se generatrici di risparmio dal punto di vista del Servizio sanitario e se il ritorno dell’investimento è a breve termine. Tuttavia, programmi di vaccinazione efficaci possono generare risparmi per i sistemi sanitari, liberando risorse da reinvestire per sostenere l’innovazione in sanità [9, 10]. Rispetto ad altri settori, investire in vaccinazione garantisce un notevole ritorno: per 1 dollaro speso se ne risparmiano da 16 $, per i costi della malattia evitati, a 44 $, se si considerano anche l’aumento delle risorse da reinvestire a disposizione dei sistemi sanitari e l’aumento della durata e qualità della vita della popolazione [11].
Peraltro, ai valori clinico-epidemiologico ed economico delle vaccinazioni dovrebbe essere aggiunto anche il valore sociale della pratica vaccinale.
Il fenomeno della protezione comunitaria ottenibile per molti vaccini, a seguito del raggiungimento di un’elevata copertura vaccinale nella popolazione bersaglio, più comunemente nota come “immunità di gregge” o “immunità di comunità”, ha rappresentato da sempre il valore aggiunto della vaccinazione a livello sociale.
Un’elevata copertura vaccinale è in grado di fornire un’immunità di gruppo, proteggendo in questo modo le comunità dai rischi di diffusione delle malattie. Proprio per tale motivo non è pensabile che i benefici della vaccinazione non siano disponibili in modo equo per tutta la popolazione. Ciò costituisce anche la ragione storica delle politiche di obbligo vaccinale che hanno accompagnato le vaccinazioni.
L’immunità di comunità protegge indirettamente gli individui con minore accesso ai programmi di assistenza sanitaria o di vaccinazione nonché coloro che non possono beneficiare direttamente delle vaccinazioni (es. i neonati troppo piccoli per essere vaccinati, i soggetti immunocompromessi, i soggetti immunosenescenti).
Il valore sociale delle vaccinazioni si riflette, quindi, sia sul singolo individuo sia sulla collettività. Per la maggior parte delle malattie, ottenere elevate coperture vaccinali permette infatti di contenere la circolazione del microrganismo responsabile e, conseguentemente, garantisce una protezione alla comunità, cioè anche ai non vaccinati. L’impatto sulla salute della popolazione risulta dunque notevole in termini di contenimento dei danni della malattia o delle sue complicanze (morbosità, mortalità, ricorso a cure mediche, ospedalizzazioni) e di riduzione dei costi sia diretti che indiretti [12].
Le malattie infettive non riconoscono confini geografici e/o politici e tutte, ma in particolare quelle prevenibili da vaccino, richiedono un approccio globale e non localistico per la loro prevenzione ed il loro controllo: le grandi battaglie dell’OMS per l’eliminazione di una malattia infettiva vengono spesso realizzate sulla base di strategie vaccinali globali. Tali strategie richiedono necessariamente l’abbattimento di barriere ideologiche e politiche, ma anche di ostacoli economici e culturali, a favore di un approccio collettivo e globale a difesa della salute delle popolazioni, così come chiaramente esplicitato nella Immunization Agenda 2030 [13].
Anche l’Unione Europea si propone di incentivare lo sviluppo di una comune politica europea di Sanità Pubblica, dal momento che il fenomeno della globalizzazione tende ad allargarsi ed i confini tra Paesi dell’Unione Europea diverranno sempre meno rilevanti [14].
In Italia, il Piano Nazionale per la Prevenzione Vaccinale 2017-2019 [15] ed il suo successivo aggiornamento (PNPV 2023-2025) [16] rappresentano un importante contributo per la tutela della salute pubblica nel nostro Paese, rappresentando uno strumento all’avanguardia che rende l’Italia il Paese europeo con il più completo piano vaccinale.
In definitiva, le vaccinazioni rappresentano un intervento importante di Sanità Pubblica, uno strumento da sostenere con ogni mezzo per scongiurare a tutta la popolazione l’ombra e il peso di malattie infettive che sono, invece, potenzialmente contrastabili.
Per affrontare le sfide attuali dell’assistenza sanitaria mondiale occorre riorganizzare il “sistema salute” tenendo in considerazione le esigenze di tutti gli stakeholders e ponendo al centro il “valore”. Il concetto di valore non deve riferirsi solo agli esiti di salute (outcome) relativi ai costi, ma deve tener conto di quanto bene le risorse siano distribuite a differenti gruppi di popolazione (valore allocativo), di quanto queste risorse siano appropriatamente usate per raggiungere risultati di salute, relativamente ad individui con specifici bisogni, presenti nella popolazione (valore tecnico) e di quanto questi risultati di salute siano allineati al sistema valoriale di ciascun individuo e alle sue preferenze (valore personale).
Nel 2019 anche l’Expert Panel on Effective Ways of Investing in Health (EXPH) istituito dalla Commissione Europea, ha pubblicato un importante documento dal titolo Opinion on Defining value in Value-Based Healthcare [17]. Il gruppo di esperti propone il modello di “quadruple value”, aggiungendo una quarta dimensione del valore: il valore sociale o societal value.
L’EXPH propone, quindi, l’assistenza sanitaria basata sul valore come un concetto completo fondato su quattro value-pillars: un’assistenza adeguata per raggiungere gli obiettivi personali dei pazienti (valore personale), il conseguimento di miglior i risultati possibili con le risorse disponibili (valore tecnico), un’equa distribuzione delle risorse tra tutti i gruppi di pazienti (valore allocativo) e il contributo dell’assistenza sanitaria alla partecipazione e alla connessione sociale (valore sociale). Queste quattro dimensioni del “valore” assicurano i pilastri fondamentali dei sistemi sanitari basati sulla solidarietà: il principio di equità può essere assicurato da un’equa allocazione delle risorse; un’equa distribuzione può essere assicurata dal contributo dell’assistenza sanitaria alla coesione sociale; l’efficienza può essere garantita da un’ottimale allocazione delle risorse; la centralità del paziente e la qualità dell’assistenza possono essere garantite da un’interazione, mirata su benefici per la salute, tra medici e pazienti.
Inoltre, l’EXPH identifica alcune iniziative necessarie per aumentare il “valore” (e ridurre gli sprechi), quali:
implementare iniziative centrate sul paziente, favorendo processi decisionali condivisi;
riallocare le risorse da un’assistenza sanitaria di basso valore ad una di alto valore: disinvestire per reinvestire;
lavorare su inappropriatezza e variazioni ingiustificate;
lottare contro corruzione, frode e uso improprio delle risorse;
aumentare il valore pubblico nella ricerca biomedica e sanitaria;
creare politiche regolatorie per un accesso equo a farmaci di alto valore (ma costosi);
incentivare una più equa distribuzione e un uso più ottimale delle risorse.
Una riallocazione delle risorse da interventi sanitari di basso valore ad interventi di alto valore è percepita dall’Expert Panel come la principale necessità dei sistemi sanitari europei sostenibili e resilienti. Una strategia a lungo termine, promossa da un solido sistema di Governance, è raccomandata al fine di realizzare un cambiamento culturale che consenta di reinvestire risorse in un’assistenza sanitaria di alto valore [17].
Sulla base di quanto descritto, risulta evidente l’esigenza di prendere in esame una Strategia value-based di Immunizzazione Globale, con l’obiettivo di mettere concretamente il cittadino/paziente al centro. Questa esigenza è strettamente collegata all’evidente impatto sociale delle vaccinazioni e alle difficoltà crescenti di Sistemi Sanitari che, seppur attraversati da profonde trasformazioni organizzative e stretti nella morsa di una crescita esponenziale dei bisogni di salute, a fronte di una dotazione essenzialmente isorisorse, sono chiamati ad assicurare una gestione unitaria e integrata delle patologie prevenibili da vaccino.
Questo approccio value(S)-based si sposa perfettamente con l’agenda promossa nel settembre 2019 dalla Commissione Europea e dall’OMS che hanno pubblicato il documento “Dieci azioni verso la vaccinazione per tutti” [18], definendo un vero e proprio decalogo per garantire la vaccinazione per tutti e contrastare, e laddove possibile eliminare, le malattie prevenibili con vaccino. Le dieci azioni prevedono:
Promuovere a livello globale la leadership politica e l’impegno nei confronti della vaccinazione e costruire una collaborazione e una partnership efficace a livello nazionale, regionale e locale con autorità sanitarie, operatori sanitari, società civile, comunità, scienziati e industria per proteggere tutti e ovunque, sostenendo il raggiungimento di elevate coperture vaccinali.
Garantire l’introduzione e l’attuazione di strategie di vaccinazione a livello nazionale in tutti i paesi e il rafforzamento della stabilità finanziaria, in linea con i progressi verso una copertura sanitaria universale.
Creare sistemi di sorveglianza efficaci delle malattie prevenibili da vaccino.
Affrontare le cause all’origine della riluttanza nei confronti dei vaccini, aumentando la fiducia nella vaccinazione, nonché progettando e attuando interventi basati sulle prove.
Sfruttare il potere delle tecnologie digitali, al fine di rafforzare il monitoraggio dell’efficacia dei programmi di vaccinazione.
Sostenere gli sforzi della ricerca per creare costantemente dati sull’efficacia e la sicurezza dei vaccini e sull’impatto dei programmi di vaccinazione.
Proseguire gli sforzi e gli investimenti, compresi nuovi modelli di finanziamento e di incentivi, nel campo della ricerca, dello sviluppo e dell’innovazione di nuovi vaccini.
Attenuare i rischi di carenza di vaccini migliorando i sistemi di monitoraggio, proiezione, acquisto, consegna e stoccaggio dei vaccini e la collaborazione con i produttori e con tutti coloro che prendono parte alla catena di distribuzione, per utilizzare al meglio la capacità di produzione o per aumentare quella esistente.
Incoraggiare i media e i professionisti del settore sanitario a fornire al pubblico informazioni efficaci, trasparenti e obiettive per contrastare le informazioni false e fuorvianti, coinvolgendo anche le piattaforme social e le tecnologiche digitali.
Allineare e integrare la vaccinazione nelle agende globali in materia di sanità e sviluppo, mediante una nuova agenda 2030 in materia di vaccinazione.
Il documento rappresenta un importante atto per rinforzare l’implementazione delle strategie vaccinali già in atto e programmare adeguatamente quelle future. Oltre alla raccomandazione di offrire un supporto politico all’uso della vaccinazione come strumento di salute globale, appaiono rilevanti i temi quali la sostenibilità economica, il monitoraggio delle strategie intraprese, l’uso delle nuove tecnologie digitali, come i sistemi informativi dedicati e le anagrafi vaccinali, di cui i programmi vaccinali possono avvantaggiarsi.
Un altro elemento importante che emerge dalla letteratura scientifica più recente è la necessità di prendere in considerazione il valore complessivo delle vaccinazioni, al fine di promuovere, nel campo delle vaccinazioni, un processo decisionale “value-based” [12, 19, 20].
Il successo delle vaccinazioni, quindi, dipende non solo dalle scelte del Paese, ma anche dall’impegno di tutti gli stakeholders per le rispettive competenze. Per promuovere il benessere dei cittadini e migliorare la buona salute è necessario utilizzare un approccio olistico e definire una visione strategica intersettoriale e multisettoriale. In questa ottica occorre armonizzare il sistema della Prevenzione in ogni Paese, secondo i principi della Salute in tutte le politiche [21], al fine di ridurre le disuguaglianze e i costi sanitari e sociali e garantire uno sviluppo sostenibile, come previsto dall’Agenda 2030 delle Nazioni Unite.
L’attuale quadro epidemiologico, caratterizzato dall’invecchiamento della popolazione, dalla elevata prevalenza delle malattie croniche non trasmissibili, dall’emergenza COVID-19 e ri-emergenza di altre malattie infettive, dai numerosi rischi per la salute correlati a fattori ed esposizioni ambientali, richiede una forte focalizzazione della programmazione strategica sulla prevenzione e sulla promozione della salute.
È necessario, pertanto, che gli operatori sanitari, l’intera Comunità Scientifica, le Istituzioni e l’Industria si impegnino in collaborazioni con i più importanti soggetti della società civile interessati e che siano coinvolti, ciascuno per le proprie possibilità, competenze e responsabilità, per favorire il corretto utilizzo dei vaccini e nel salvaguardare l’indiscusso valore sociale delle vaccinazioni.
La salute è una dimensione fondamentale che è alla base del benessere individuale e collettivo. Il raggiungimento, da parte di tutte le popolazioni, del più alto livello possibile di salute è uno degli obiettivi specificati dall’OMS, oltre che dalla nostra Costituzione, che definisce la salute come diritto fondamentale dell’individuo e interesse della collettività. Il nostro Paese è stato caratterizzato dal continuo miglioramento delle condizioni di salute, con il progressivo incremento della longevità e l’Italia permane nel tempo uno dei paesi con la più alta speranza di vita alla nascita nel contesto europeo. Continui miglioramenti hanno riguardato tutte le fasi della vita, dalla riduzione della mortalità infantile ai consistenti progressi nell’età adulta e senile, contrassegnati anche dall’evoluzione positiva della mortalità evitabile e da incrementi nella qualità della sopravvivenza in età anziana [22].
Nel corso del 2020, tuttavia, il diffondersi della pandemia di coronavirus SARS-CoV-2 su scala mondiale ha rappresentato una delle minacce più importanti per la salute, registrate negli ultimi decenni. L’epidemia ha colpito in modo dirompente soprattutto la popolazione più fragile e anziana [23], aggravando al contempo le disuguaglianze sociali che affliggono il nostro Paese. Tuttavia, l’Italia permane nel tempo uno dei paesi più longevi nel contesto internazionale [24]. I notevoli progressi della sopravvivenza e la contestuale riduzione della fecondità in Italia hanno quindi rivoluzionato la struttura demografica della popolazione, posizionando il nostro paese tra i primi al mondo per invecchiamento della popolazione. Nell’ultimo ventennio, inoltre, il fenomeno dell’invecchiamento in Europa ha subito un’accelerazione: fra il 1990 e il 2012 la percentuale della popolazione over 65 è passata dal 13,7% a oltre il 18% nel 2012. Le proiezioni Eurostat stimano, inoltre, che tale percentuale è destinata ad aumentare, arrivando al 28,6% entro il 2050 [25]. La popolazione italiana 65+ ammonta a 14 milioni 177mila individui già al 1° gennaio 2023, e costituisce il 24,1% della popolazione totale. Inoltre, tra le persone ultraottantenni si rileva un incremento che li porta a 4 milioni 530mila e a rappresentare il 7,7% della popolazione totale [26].
Se da un lato questi dati rappresentano un indubbio successo sul piano della sanità pubblica, in quanto evidenziano una aspettativa di vita molto alta, allo stesso tempo, richiamano l’attenzione sulla necessità di ulteriori interventi di sostegno alle politiche sanitarie e sociali. Una società che invecchia può rappresentare non solo un successo ma anche una sfida per la società. Un effetto negativo del rapido invecchiamento della popolazione è costituito dall’aumento della disabilità legata a malattie croniche non trasmissibili che costituiscono, anche in Italia, uno dei più importanti problemi di sanità pubblica [27].
Invecchiare in buona salute è, pertanto, l’obiettivo prioritario delle strategie nazionali, europee ed internazionali. Le Istituzioni sanitarie devono confrontarsi, quindi, con nuove sfide di salute pubblica, sempre più importanti e derivanti dall’incremento della speranza di vita [28]. Tra queste sfide merita particolare attenzione la più lunga sopravvivenza di pazienti con malattie croniche (cardiopatie, broncopneumopatie, patologie metaboliche e così via) e quindi di soggetti fragili che nel corso di malattie infettive vaccino-prevenibili possono più frequentemente presentare complicanze o andare incontro ad uno scompenso della loro patologia di base, e la cui gestione clinica, oltre ad essere particolarmente complessa, comporta un importante impegno di risorse umane ed economiche. Rilevante risulta essere anche il fenomeno dell’immunosenescenza, associato ad una progressiva riduzione della funzione del sistema immunitario che non garantisce una adeguata risposta fisiologica alle malattie infettive e si associa alla riduzione dell’immunità acquisita nell’infanzia.
Le infezioni da agenti vaccino prevenibili, come alcune Lower Respiratory Tract Infections (LRTIs), rappresentano una critica possibilità verso complicanze gravi in alcune categorie di soggetti quali appunto bambini, anziani, persone con comorbosità e malattie croniche. Purtroppo però la conoscenza da parte della popolazione (specialmente quella a rischio) dei benefici derivati dalla vaccinazione contro tali patologie sono ancora troppo scarse.
Le infezioni delle basse vie respiratorie rientrano nelle cosiddette Infezioni Respiratorie Acute (ARI), gruppo di quadri clinici caratterizzati da sintomatologia a carico delle alte o basse vie dell’apparato respiratorio, causati da differenti agenti eziologici. Tali infezioni sono una delle principali cause di morbosità e mortalità in tutto il mondo. Sono malattie ubiquitarie, altamente contagiose che colpiscono individui di tutte le età, con maggiore severità nelle fasce di età infantile ed anziana [29, 30].
Nell’eziologia delle infezioni delle basse vie respiratorie predominano virus respiratori quali SARS-CoV-2, virus influenzali, virus respiratorio sinciziale (RSV) e batteri come lo Streptococcus pneumoniae (pneumococco). Per questi agenti patogeni abbiamo, oggi, un’arma importante rappresentata dalla vaccinazione, fortemente raccomandata ormai da molti anni anche dalle Lineeguida internazionali per il management dei pazienti adulti/anziani con LRTI [31].
La vaccinazione nella popolazione adulta/anziana deve diventare, quindi, una componente chiave delle strategie atte a favorire, insieme all’implementazione di altri interventi preventivi volti a promuovere uno stile di vita sano, il mantenimento di un buono stato di salute nel lungo termine. Ciò in considerazione delle numerose e solide evidenze che la letteratura scientifica ha prodotto a supporto dei benefici che questo approccio ha su morbosità, mortalità e qualità della vita. Senza un programma vaccinale specificamente mirato sugli adulti di 60 o più anni di età, le malattie infettive in questa popolazione rimarranno un grande problema per le autorità sanitarie e per la Salute Pubblica, a maggior ragione se teniamo conto dell’ulteriore aumento, previsto nei prossimi anni, della popolazione di età ≥ 65 anni.
La Sanità odierna è costantemente alla ricerca di strategie efficaci nell’ambito della prevenzione: fra tutte, la vaccinazione occupa sicuramente un ruolo di assoluta preminenza. Tuttavia, l’attenzione dei Paesi industrializzati si è sempre particolarmente focalizzata sulla vaccinazione della popolazione pediatrica malgrado, negli ultimi anni, lo scenario epidemiologico e demografico sia radicalmente mutato. Le Istituzioni sanitarie, infatti, devono confrontarsi oggi con nuove sfide di salute pubblica, derivanti dall’incremento della speranza di vita.
Sulla base di tali premesse, risulta evidente come sia necessario, oggi più che mai, la messa a punto di strategie efficaci finalizzate ad una adeguata profilassi vaccinale della popolazione adulta/anziana al pari di quella pediatrica [32-37].
Nel marzo 2022 è stato pubblicato uno studio [19] che aveva l’obiettivo di sistematizzare le evidenze scientifiche disponibili sui valori della vaccinazione e che potessero supportare la definizione di un nuovo approccio di immunizzazione basato sul valore [20]. È stata condotta una revisione sistematica della letteratura, applicando, per la prima volta, i quattro pilastri del valore proposti dall’EXPH (personale, allocativo, tecnico e sociale) [17] all’ambito delle vaccinazioni.
Sulla base della metodologia applicata nel nostro precedente lavoro [19], è stata condotta una nuova revisione sistematica di letteratura applicando i quattro pilastri del valore proposti dall’EXPH alla vaccinazione nella popolazione adulta/anziana, e considerando le seguenti dimensioni per ciascun pilastro:
valore personale: outcomes clinici, outcomes riportati direttamente dai pazienti (Patients reported outcome, PRO), misure di esperienza riportate dai pazienti (Patient-Reported Experience Measures, PREMs), coinvolgimento ed empowerment dei cittadini;
valore allocativo: accesso alla vaccinazione, equità nell’offerta, appropriateness, variazioni ingiustificate, innovazione;
valore tecnico: valutazione delle tecnologie sanitarie e modelli per la valutazione economica di vaccini/vaccinazioni;
valore sociale: impatto sul benessere della popolazione e sulla produttività; protezione indiretta e comunitaria; processo decisionale condiviso.
La revisione sistematica è stata condotta secondo le Linee Guida PRISMA [38].
È stata condotta una revisione sistematica di letteratura consultando il database elettronico Pubmed, utilizzando la seguente stringa di ricerca: ((value OR values) AND (Vaccines or Vaccinations) AND (“older adults” OR elderly) AND Europe)). I record trovati sono stati inseriti in un foglio di lavoro Excel dedicato, per essere, successivamente, valutati secondo specifici criteri di inclusione/esclusione. Si è proceduto, quindi, con uno screening per titolo e abstract e, successivamente, con la lettura dei full text degli articoli ritenuti eleggibili. Gli articoli sono stati, inoltre, sottoposti a un processo di snowballing, esaminando i riferimenti bibliografici e le citazioni presenti, al fine di identificare ulteriori articoli rispondenti ai criteri di inclusione.
Sono stati definiti eleggibili tutti gli studi contenenti dati sul concetto di valore associato alla vaccinazione nella popolazione adulta/anziana, condotti a livello europeo, scritti in lingua italiana e in inglese e pubblicati dal 24 dicembre 2010 (data successiva alla pubblicazione del primo articolo sul valore in Sanità, scritto ma M. Porter) [39] al 1° marzo 2024, data di lancio della stringa di ricerca. Sono stati, invece, esclusi studi di cui non era possibile reperire il full text o privi di informazioni pertinenti o sufficienti per le finalità della ricerca, commentary, editoriali, presentazioni a conferenze/convegni e studi condotti su animali o in vitro.
Due ricercatori (L.M., G.E.C.) hanno esaminato, in modo indipendente, gli articoli esitati dalla ricerca bibliografica. In caso di dubbi riguardanti l’inclusione/esclusione di un lavoro, gli stessi sono stati risolti mediante discussione e confronto con un terzo ricercatore (W.R.).
Da tutti gli articoli inclusi sono stati estratti i seguenti dati: autore, anno di pubblicazione, prospettiva dello studio (distinta in europea o nazionale), obiettivo dello studio, tipo di studio, vaccinazione considerata, popolazione target della vaccinazione. Inoltre, per tutti gli studi inclusi sono state raccolte e sistematizzate informazioni sulle principali dimensioni dei quattro pilastri del valore considerati (personale, allocativo, tecnico e sociale).
Dalla revisione di letteratura condotta sono stati selezionati un totale di 279 articoli rispondenti all’obiettivo della ricerca e focalizzati sul contesto europeo. Dopo la selezione per titolo ed abstract, e la lettura dei full-text, sono stati inclusi nella nostra revisione 15 articoli [40-54]. La figura 1 riporta il processo di selezione degli studi, secondo il PRISMA statement [38].
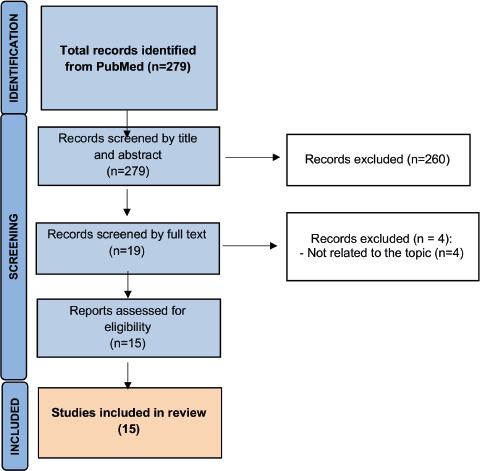
Processo di selezione degli studi secondo il PRISMA statement.
Dei 15 articoli inclusi [40-54], cinque (33,3%) hanno una prospettiva europea [40, 44, 46, 48, 53]; dieci (66,7%) hanno una prospettiva nazionale [41-43, 45, 47, 49-52, 54] e di questi quattro sono stati condotti in Italia [42, 45, 50, 52], due in Spagna [43, 47], uno in Inghilterra [41], due nei Paesi Bassi [49, 54] ed uno in Svezia [51]. Il 73,3% degli studi inclusi (n = 11) sono valutazioni economiche [41-44, 46, 47, 49-52, 54] volte a misurare l’impatto economico di specifici programmi di immunizzazione nella popolazione adulta/anziana. La vaccinazione maggiormente indagata è quella antinfluenzale (53,3%) [40, 41, 44-46, 50, 53, 54], seguita da quella antipneumococcica (33,3%) [42, 43, 47, 49, 51]. In due articoli sono state considerate più vaccinazioni contemporaneamente [48, 52]. Le principali caratteristiche degli studi sono riportati in Tabella I.
Studi inclusi nella revisione sistematica.
| Primo autore, anno di pubblicazione [ref] | Prospettiva europea/Nazione | Obiettivo dello studio | Tipo di studio | Tipo di vaccinazione | Popolazione target della vaccinazione |
|---|---|---|---|---|---|
| de Waure C 2012 [40] | Europea | Valutare il valore economico della vaccinazione antinfluenzale tra gli anziani e i gruppi ad alto rischio | Revisione Sistematica | Vaccinazione antinfluenzale | Anziani (65+) e altri gruppi a rischio |
| Baguelin M 2012 [41] | Nazionale (England) | Valutare l’impatto e il rapporto costo-efficacia del programma di vaccinazione contro l’influenza stagionale esistente in Inghilterra, nel periodo 2000-2009 | Valutazione economica (modello dinamico) | Vaccinazione antinfluenzale | Popolazione generale |
| Boccalini S 2013 [42] | Nazionale (Italia) | Valutare l’impatto clinico ed economico di un programma di vaccinazione antipneumococcica negli anziani in Italia | Valutazione economica (CEA) | Vaccinazione antipneumococcica | Anziani (65+) |
| Pradas R 2013 [43] | Nazionale (Spagna) | Valutare l’impatto clinico ed economico di un programma di vaccinazione antipneumococcica negli over65 in Spagna | Valutazione economica (modello dinamico) | Vaccinazione antipneumococcica | Anziani (65+) |
| Preaud E 2014 [44] | Europea (27 Paesi europei: Austria, Belgio, Bulgaria, Cipro, Repubblica Ceca, Danimarca, Estonia, Francia, Finlandia, Germania, Grecia, Ungheria, Irlanda, Italia, Lettonia, Lituania, Lussemburgo, Malta, Paesi Bassi, Polonia, Portogallo, Romania, Slovacchia, Slovenia, Spagna, Svezia, UK) | Valutare i benefici clinici ed economici annuali della vaccinazione antinfluenzale in 5 gruppi target raccomandati dall’OMS, in 27 paesi dell’Unione Europea | Valutazione economica (modello dinamico) | Vaccinazione antinfluenzale | Gruppi target per la vaccinazione antinfluenzale indicati dall’OMS (bambini 6-23 mesi; persone con patologie croniche; donne in gravidanza; operatori sanitari; anziani over 65) |
| Poscia A 2016 [45] | Nazionale (Italia) | Sistematizzare gli elementi chiave della sostenibilità della vaccinazione antinfluenzale in Italia e formulare raccomandazioni per migliorare gli aspetti organizzativi dei programmi vaccinali | Revisione di letteratura | Vaccinazione antinfluenzale | Anziani (65+) |
| Uhart M 2016 [46] | Europea (5 Paesi Europei: Francia, Germania, Italia, Spagna, UK) | Stimare l’impatto economico e sulla salute pubblica della vaccinazione contro l’influenza stagionale in Europa | Valutazione economica | Vaccinazione antinfluenzale | Popolazione 6 mesi-over 65 anni |
| Rodríguez González-Moro JM 2016 [47] | Nazionale (Spagna) | Valutare l’impatto clinico ed economico di un programma di vaccinazione antipneumococcica nei pazienti 50+ con BPCO, in Spagna | Valutazione economica (CEA) | Vaccinazione antipneumococcica | Adulti a rischio (50+) con BPCO |
| Esposito S 2018 [48] | Europea | Stimare il carico delle malattie prevenibili da vaccino (influenza, malattie da pneumococco, Herpes Zoster) nella popolazione anziana europea, e riassumere i potenziali benefici di salute pubblica delle strategie di vaccinazione per questa popolazione target | Revisione di letteratura | Vaccinazione antinfluenzale, antipneumococcica, anti Herpes Zoster, anti-difetrite, tetano e pertosse | Anziani (65+) |
| Thorrington D 2018 [49] | Nazionale (Paesi Bassi) | Valutare l’impatto clinico ed economico di un programma di vaccinazione antipneumococcica negli adulti 60+ nei Paesi Bassi. | Valutazione economica (CEA) | Vaccinazione antipneumococcica | Adulti 60+ |
| Mennini FS 2018 [50] | Nazionale (Italia) | Valutare i benefici clinici ed economici annuali della vaccinazione antinfluenzale nei gruppi a rischio in Italia | Valutazione economica (CEA) | Vaccinazione antinfluenzale | Popolazione a rischio stratificata nelle seguenti fasce di età: 6 mesi-4 anni, 5-19 anni, 20-49 anni, 50-64 anni, ≥65 anni |
| Wolff E 2020 [51] | Nazionale (Svezia) | Valutare il rapporto di costo-efficacia della vaccinazione pneumococcica negli anziani in Svezia | Valutazione economica (CEA) | Vaccinazione antipneumococcica | Anziani (65+) |
| Ruggeri M 2020 [52] | Nazionale (Italia) | Valutare l’impatto economico e fiscale di tre programmi di vaccinazione (influenza, pneumococco, Herpes Zoster), in Italia | Valutazione economica (Fiscal impact) | Vaccinazione, antinfluenzale, antipneumococcica, anti Herpes Zoster | Adulti in età produttiva |
| Chicoye A 2023 [53] | Europea | Sistematizzare le evidenze disponibili sulle valutazioni economiche di costo-efficacia applicate alla vaccinazione antinfluenzale degli anziani europei | Revisione di letteratura | Vaccinazione antinfluenzale | Anziani (65+) |
| Zeevat F 2023 [54] | Nazionale (Paesi Bassi) | Valutare l’impatto economico di un programma vaccinale per l’influenza nella popolazione anziana dei Paesi Bassi | Valutazione economica | Vaccinazione antinfluenzale | Anziani (65+) |
| CEA: Cost-effectiveness Analysis. | |||||
Per quanto concerne il focus sul valore della vaccinazione nella popolazione adulta/anziana, il 53,3% (n = 8) degli studi inclusi ha indagato aspetti relativi a tre pilastri del valore (personale, tecnico, sociale) [41, 43-45, 49, 50, 52, 53]; il 33,3% degli studi (n = 5), invece, ha affrontato il tema del valore personale, in termini di outcome clinici, e il valore tecnico, in termini di impatto economico della vaccinazione considerata [42, 46, 47, 51, 54]; uno studio [40] ha affrontato il tema del valore tecnico associato a quello sociale, ed un altro studio [48], invece, ha affrontato il tema del valore personale e sociale della vaccinazione nella popolazione target oggetto del nostro approfondimento. Solo uno studio ha posto attenzione ad una specifica popolazione target, quale quella adulta 50+ con BPCO [47]. Nessuno studio ha affrontato il tema del valore allocativo delle vaccinazioni nella popolazione adulta/anziana, sottolineando la necessità di approfondire ulteriormente questo topic, strettamente legato a processi decisionali value-based.
La Tabella II riporta i principali risultati, in termini di studi sui valori della vaccinazione nella popolazione adulta/anziana, condotti a livello europeo ed inclusi nella nostra revisione di letteratura.
Principali informazioni sui valori della vaccinazione nella popolazione adulta/anziana emerse dagli studi inclusi nella revisione di letteratura condotta.
| Primo autore, Anno di pubblicazione [ref] |
Vaccinazione considerata nello studio | Valore personale (outcomes clinici, outcomes riportati dai pazienti, misure di esperienza riportate dai pazienti, coinvolgimento ed empowerment dei cittadini) | Valore allocativo (accesso alla vaccinazione, equità nell’offerta, appropriateness, variazioni ingiustificate, innovazione) | Valore tecnico (valutazione delle tecnologie sanitarie e modelli per la valutazione economica di vaccini/vaccinazioni/driver di costo) | Valore sociale (impatto sul benessere della popolazione e sulla produttività; protezione indiretta e comunitaria; processo decisionale condiviso) |
|---|---|---|---|---|---|
| de Waure 2012 [40] | Vaccinazione antinfluenzale | X (Modello economico) |
X (Impatto sul benessere della popolazione; protezione indiretta e comunitaria) |
||
| Baguelin M 2012 [41] | Vaccinazione antinfluenzale | X (Outcomes clinici) |
X (Modello economico) |
X (Impatto sul benessere della popolazione; protezione indiretta e comunitaria) |
|
| Boccalini S 2013 [42] | Vaccinazione antipneumococcica | X (Outcomes clinici) |
X (Modello economico) |
||
| Pradas R 2013 [43] | Vaccinazione antipneumococcica | X (Outcomes clinici) |
X (Modello economico) |
X (Impatto sul benessere della popolazione; protezione indiretta) |
|
| Preaud E 2014 [44] | Vaccinazione antinfluenzale | X (Outcomes clinici) |
X (Modello economico) |
X (Impatto sul benessere della popolazione) |
|
| Poscia A 2016 [45] | Vaccinazione antinfluenzale | X (Driver di costo) |
X (Impatto sul benessere della popolazione; protezione indiretta e comunitaria) |
||
| Uhart M 2016 [46] | Vaccinazione antinfluenzale | X (Outcomes clinici) |
X (Modello economico) |
||
| Rodríguez González-Moro JM 2016 [47] | Vaccinazione antipneumococcica | X (Outcomes clinici) |
X (Modello economico) |
||
| Esposito S 2018 [48] | Vaccinazione, antinfluenzale, antipneumococcica, anti-HZ, anti-difetrite, tetano, pertosse | X (Outcomes clinici) |
X (Impatto sul benessere della popolazione) |
||
| Thorrington D 2018 [49] | Vaccinazione antipneumococcica | X (Outcomes clinici) |
X (Modello economico) |
X (Impatto sul benessere della popolazione; protezione indiretta) |
|
| Mennini FS 2018 [50] | Vaccinazione antinfluenzale | X (Outcomes clinici) |
X (Modello economico) |
X (Impatto sul benessere della popolazione) |
|
| Wolff E2020 [51] | Vaccinazione antipneumococcica | X (Outcomes clinici) |
X (Modello economico) |
||
| Ruggeri M 2020 [52] | Vaccinazione, antinfluenzale, antipneumococcica, anti-HZ | X (Outcomes clinici) |
X (Modello economico) |
X (Impatto sul benessere della popolazione e sulla produttività) |
|
| Chicoye A 2023 [53] | Vaccinazione antinfluenzale | X (Outcomes clinici) |
X (Modello economico) |
X (Impatto sul benessere della popolazione) |
|
| Zeevat F 2023 [54] | Vaccinazione antinfluenzale | X (Outcomes clinici) |
X (Modello economico) |
Anche se i benefici reali e tangibili delle vaccinazioni sono riconosciuti a livello globale anche nella popolazione adulta e anziana, in molti Paesi, inclusa l’Italia, non si registrano ancora coperture vaccinali adeguate. Inoltre, come si evince dalla nostra revisione di letteratura, il valore complessivo della vaccinazione, ad oggi, non è ancora del tutto riconosciuto.
La nostra revisione di letteratura ha dimostrato, infatti, che i valori personale, tecnico, allocativo e sociale, della vaccinazione nella popolazione adulta/anziana sono stati affrontati, negli ultimi anni e a livello europeo, da un numero limitato di articoli scientifici e nessuno di quelli inclusi nella revisione ha affrontato il valore complessivo della vaccinazione nella nostra popolazione target. La maggior parte degli studi (53,3%) ha indagato aspetti relativi a tre pilastri del valore (personale, tecnico, sociale) [41, 43-45, 49, 50, 52, 53]; il 33,3%, invece, ha affrontato il tema del valore personale, in termini di outcome clinici, e il valore tecnico, in termini di impatto economico della vaccinazione considerata [42, 46, 47, 51, 54]. Un solo studio [40] ha affrontato il tema del valore tecnico associato a quello sociale, ed un altro studio [48] ha affrontato il tema del valore personale e sociale della vaccinazione negli anziani. Nessuno studio ha affrontato, invece, il tema del valore allocativo delle vaccinazioni nella popolazione adulta/anziana, in termini di accessibilità ed equità di accesso alla vaccinazione. Questo risultato richiama l’attenzione sulla necessità di sviluppare ulteriori ricerche su questa dimensione del valore, rilevante sia per i sistemi sanitari che per i cittadini.
Un dato interessante, emerso dalla nostra analisi della letteratura, è che, in atto, il tema del valore sociale della vaccinazione nella popolazione adulta/anziana viene affrontato nell’ambito delle valutazioni economiche dei vaccini o delle vaccinazioni considerate. Il valore sociale, in questi casi, viene incluso nelle valutazioni economiche considerando non solo la prospettiva del SSN ma anche quello della società. Diversi studi, infatti, hanno sottolineato l’importanza di includere nelle valutazioni economiche sui vaccini anche la prospettiva sociale, proprio alla luce del valore sociale della vaccinazione. Secondo de Waure et al. [40], ad esempio, la vaccinazione antinfluenzale negli anziani e nei gruppi ad alto rischio è un intervento costo-efficace dal punto di vista farmacoeconomico, tuttavia è auspicabile una standardizzazione della metodologia applicata nelle valutazioni economiche dei vaccini antinfluenzali al fine di garantire la comparabilità e la trasferibilità dei risultati. Ruggeri et al. [52], invece, sottolineano che nel valutare il valore economico dei vaccini, i decisori dovrebbero adottare una prospettiva sociale completa che tenga anche conto dell’impatto fiscale della malattia infettiva prevenibile da vaccino. I metodi tradizionali volti a stimare il costo della malattia da una prospettiva sociale possono essere migliorati considerando anche l’impatto fiscale, che spiega la diminuzione delle entrate fiscali dovute alla malattia. La potenziale riduzione dell’impatto fiscale associata alle strategie di immunizzazione dovrebbe essere inclusa nella valutazione degli effetti dei nuovi vaccini, aggiungendo questa nuova dimensione alla loro valorizzazione [52].
Il valore sociale delle vaccinazioni è una tematica che, negli ultimi anni, ha visto particolare interesse da parte della comunità scientifica internazionale che sottolinea la necessità di implementare e sviluppare modelli/strumenti per supportare i processi di Health Technology Assessment (HTA) o altri frameworks di valutazione, al fine di riconoscere il valore complessivo della vaccinazione [20, 55].
Nel 2022 Bell et al. [56], ad esempio, hanno proposto un framework economico basato sul valore complessivo della vaccinazione, così come mostrato in Figura 2. Qualche hanno dopo, nel 2023, lo stesso gruppo di ricercatori ha presentato un’analisi, condotta in diversi Paesi, per valutare l’applicazione di questo framework nei processi di valutazione delle vaccinazioni nella popolazione adulta/anziana [57].
Framework del valore dei vaccini dell’Office of Health Economics (OHE) [56].
Come si evince dalla Figura 3, anche in Italia non è stato ancora implementato un processo di valutazione dei vaccini rivolti alla protezione della popolazione a rischio e anziana che tenga conto del valore complessivo offerto dai vaccini disponibili [57].
Applicazione del framework del valore dei vaccini dell’OHE, ai processi di valutazione delle vaccinazioni nella popolazione adulta/anziana in Italia [57].
Sulla base di quanto descritto e di quanto emerso dalla nostra revisione di letteratura è evidente, quindi, come la conoscenza e la comunicazione del valore complessivo della vaccinazione sia fondamentale e necessario per guidare politiche sanitarie in ambito di immunizzazione evidence-based e value-based. Tuttavia, diverse sono le barriere da superare per aumentare le coperture vaccinali nella popolazione adulta a rischio e anziana. Un documento dell’EXPH della CE, pubblicato nel 2018 [58], identifica i principali fattori (barriere e fattori abilitanti) che influenzano l’adozione della vaccinazione nell’Unione Europea e valuta le misure necessarie per migliorare le coperture vaccinali. Secondo gli esperti, le barriere per il raggiungimento di una copertura vaccinale universale includono le preoccupazioni o le paure degli individui sulla sicurezza dei vaccini e sui loro eventi avversi, la mancanza di fiducia nelle vaccinazioni, le norme sociali, l’esposizione a falsi miti che minano la fiducia nei vaccini, l’incapacità di alcuni operatori sanitari di contrastare questi miti e fornire prove ed una adeguata consulenza informata, barriere all’accesso (ad es. scarsa disponibilità, copayments) e incapacità di comprendere i meccanismi sottostanti che riducono la fiducia nelle vaccinazioni. I fattori abilitanti includono, invece, fonti di informazioni affidabili sulla vaccinazione, esposizione a messaggi mediatici positivi, creazione di fiducia nelle istituzioni e nei fornitori, creazione di fiducia nella vaccinazione, facile accesso e disponibilità ai servizi sanitari, facilità di somministrazione, coinvolgimento attivo e impegno da parte degli operatori sanitari e gruppi ad alto rischio [58]. Pertanto, le azioni da implementare per aumentare le coperture vaccinali dovrebbero focalizzarsi su strategie di comunicazione inerenti i benefici della vaccinazione e su un maggior dialogo – con un approccio partecipativo – con i gruppi più esitanti su vaccini e vaccinazioni [55]. Inoltre, le politiche sanitarie dovrebbero essere guidate dal raggiungimento dell’immunità di comunità. La vaccinazione può essere obbligatoria o raccomandata purché si ottengano tassi di copertura elevati per ottenere l’immunità di comunità [58]. È necessario un maggior coinvolgimento dei medici di prossimità (medici di medicina generale e pediatri di libera scelta) per migliorare i tassi di copertura vaccinale in tutte le fasce di età. Tuttavia, un migliore accesso alle vaccinazioni potrebbe essere ottenuto con il coinvolgimento di altri operatori sanitari adeguatamente formati (ad esempio infermieri, farmacisti ecc.), garantendo, in tale modo, maggiore equità di accesso. Ovviamente, gli operatori sanitari dovrebbero essere adeguatamente formati anche sulle migliori modalità di comunicazione e dovrebbero avere una formazione specifica per affrontare le preoccupazioni sui vaccini da parte dei cittadini esitanti, in particolare in relazione alla sicurezza e agli effetti collaterali dei vaccini. Un’altra priorità di azione consiste nel rafforzare i sistemi di monitoraggio e sorveglianza a livello internazionale, nazionale e locale, al fine di garantire dati aggiornati per guidare la politica e la pianificazione sanitaria e implementare, in tal modo, le coperture vaccinali [58].
Inoltre, la comprensione del valore complessivo delle vaccinazioni e la traduzione effettiva di questa conoscenza in tutte le parti interessate è fondamentale per rafforzare le politiche sanitarie e le strategie di immunizzazione a livello globale, nonchè per contrastare la disinformazione sui vaccini e l’esitazione vaccinale [20].
La raccolta e la sintesi delle evidenze scientifiche sul valore delle vaccinazioni rappresenta un primo e fondamentale tassello per promuovere un nuovo approccio di immunizzazione basato sul valore. Aumentare la consapevolezza sul valore delle vaccinazioni è inoltre di grande importanza fintanto che l’esitazione e il sottoutilizzo dei vaccini potranno portare al rischio di gravi epidemie.
Nell’ambito della prevenzione vaccinale, particolare attenzione deve essere rivolta alla vaccinazione della popolazione adulta/anziana. Le malattie infettive non riconoscono confini geografici e/o politici e tutte, ma in particolare quelle prevenibili da vaccino, richiedono un approccio globale e non localistico per la loro prevenzione ed il loro controllo. Tali strategie richiedono necessariamente l’abbattimento di barriere ideologiche e politiche, ma anche di ostacoli economici e culturali, a favore di un approccio collettivo e globale a difesa della salute delle popolazioni più fragili.
Sulla base di quanto descritto e di quanto emerso dalla nostra revisione, risulta evidente l’esigenza di prendere in esame una strategia value-based di immunizzazione rivolta alla popolazione adulta/anziana. Per fare ciò è necessario conoscere e divulgare le evidenze scientifiche sul valore complessivo della vaccinazione, nonché promuovere ed implementare strategie di immunizzazione che tengano conto del valore più ampio e, quindi, personale, tecnico, allocativo e sociale, delle vaccinazioni [59].
Gli operatori sanitari, ed in particolare i professionisti di Sanità Pubblica, l’intera comunità scientifica, le Istituzioni e i decisori si dovranno impegnare, ciascuno per le proprie competenze, per favorire il corretto utilizzo dei vaccini e nel salvaguardare l’indiscusso valore complessivo delle vaccinazioni, patrimonio di tutti i cittadini, indipendentemente dallo stato sociale e dal luogo di residenza.
Il Virus Respiratorio Sinciziale (RSV) è uno dei più frequenti agenti patogeni che causano infezioni respiratorie acute (ARI) [1]. A seguito del contagio, RSV causa – di solito – sintomi lievi o moderati; talora si presentano quadri clinici gravi, anche fatali, in particolare in categorie a rischio quali i bambini nei primi due anni di vita, gli anziani per l’età avanzata e per la presenza di comorbosità, gli immunocompromessi [2, 3].
La famiglia Pneumoviridae, considerata prima del 2016 come sottofamiglia dei Paramyxoviridae, include due specie:
Orthopneumovirus, cui appartengono i due sottotipi di RSV (RSV-A e RSV-B);
Metapneumovirus, cui appartiene il Metapneumovirus umano, hMPV, altro agente eziologico di bronchioliti e polmoniti [4].
RSV è un virus di medie dimensioni (~ 200 nm) e in microscopia elettronica si presenta solitamente in forma sferica, anche se sono state osservate forme filamentose e asimmetriche. È dotato di pericapside e ha un genoma costituito da RNA a singolo filamento negativo, che necessita, quindi, di essere prima trascritto in mRNA. Il genoma contiene 10 geni, che codificano per 11 proteine, di cui 9 strutturali. Le proteine N, L, P e M2-1 costituiscono la ribonucleoproteina (RNP) del capside e la proteina della matrice (M) costituisce la parte interna del pericapside. RSV ha tre proteine integrali di membrana: G (receptor attachment glycoprotein), F (fusion protein) e SH (short hydrophobic protein) [5]. La proteina F viene sintetizzata come precursore inattivo (F0) e dopo ripetuti tagli, forma le proteine di fusione F1 e F2, che – in un fascio di 6 α-eliche – facilitano la fusione di membrana [6]. La proteina F (in conformazione sia pre- che post-fusione) è l’obiettivo comune della immunoprofilassi passiva e attiva.
Trasmessa attraverso goccioline respiratorie o fonti che infettano le alte vie respiratorie attraverso la mucosa nasofaringea o congiuntivale, l’infezione da RSV si presenta generalmente con rinorrea e tosse. Nelle forme più gravi della prima infanzia, RSV può essere causa di sindrome da distress respiratorio acuto [7, 8] e richiedere supporto respiratorio in regime di ricovero ospedaliero.
Negli over 60 o in adulti immunocompromessi e/o con preesistenti morbosità (ad esempio, patologie polmonari e cardiovascolari, diabete mellito, patologie neurologiche, epatiche o renali) [9], RSV può essere responsabile di gravi infezioni del tratto respiratorio inferiore (LRTD, Lower Respiratory Tract Infection) con necessità di un periodo prolungato di ospedalizzazione, possibile esacerbazione della patologia preesistente e talora anche la morte del paziente [10]. L’infezione da RSV non conferisce l’immunità permanente e, pertanto, le persone già esposte possono reinfettarsi più volte nella loro vita.
Il virus RSV è stagionale e, nei Paesi con clima temperato, circola per lo più da novembre a marzo con un picco nel periodo dicembre-gennaio [11] e con una sostanziale sovrapposizione con l’influenza [12].
Dal punto di vista epidemiologico, una revisione sistematica con metanalisi ha evidenziato che nel 2019 – in Paesi ad alto reddito – sono stati registrati circa 5,2 milioni di infezioni da RSV in adulti in età superiore ai 60 anni, 470.000 ricoveri e 33.000 decessi [13]. Negli Stati Uniti, tra gli anni 1999 e 2018, la mortalità più alta si è registrata negli adulti con età superiore ai 75 anni, con un tasso di mortalità di 14,7/100.000 [14].
Si stima che nei Paesi Europei, ogni anno, ci siano circa 160.000 ospedalizzazioni dovute ad infezioni da RSV, soprattutto tra gli anziani. I dati sulla mortalità sono in crescita sia negli adulti sia negli anziani. In Italia si stima che il 4% dei test su campioni respiratori siano positivi per RSV [15]. Questi dati sembrano essere sottostimati, dal momento che non vengono di solito effettuati test molecolari per individuare i patogeni responsabili di infezioni delle vie respiratorie [16].
In Italia, nel periodo 2001-2014 sono stati registrati 57.656 ricoveri ospedalieri per patologie da RSV, confermando l’elevato impatto di questo virus sulla popolazione pediatrica nella fascia di età 0-4 anni, con un picco nei primi 12 mesi di vita. La maggior parte dei ricoveri (88,8%) aveva coinvolto pazienti di età < 1 anno. Il 93% dei ricoveri era dovuto a bronchiolite, il 5% a polmonite e il 2% ad infezioni da RSV non altrimenti specificate [17]. Al fine di evitare eventuali sottostime, l’introduzione del nuovo sistema di sorveglianza, “RespiVirNet”, consente di verificare con maggiore accuratezza l’impatto di RSV nella popolazione grazie all’integrazione della sorveglianza epidemiologica delle sindromi simil-influenzali con la sorveglianza virologica dei virus respiratori, incluso RSV (Cfr. Capitolo 7).
RSV e influenza concorrono, d’altra parte, nel definire l’onere clinico ed economico nei periodi di picco [18, 19]. Nel loro studio su adulti over 60 ospedalizzati, Ackerson et al. hanno trovato che l’infezione da RSV può provocare una maggiore morbosità e mortalità rispetto all’influenza, con un potenziale maggiore impatto sulla sopravvivenza a lungo termine [20].
Per quanto concerne il trattamento, si ricorda – tra gli anticorpi monoclonali – il Palivizumab (nome commerciale Synagis), che trova indicazione, in regime ospedaliero, per il trattamento di: bambini nati con età gestazionale uguale o inferiore alle 35 settimane e con un’età inferiore ai 6 mesi al momento dell’inizio dell’epidemia stagionale di RSV; bambini di età inferiore ai 2 anni che sono stati trattati per displasia broncopolmonare negli ultimi 6 mesi; bambini di età inferiore ai 2 anni con malattia cardiaca congenita emodinamicamente significativa [21].
L’alto costo del Palivizumab, le ristrette indicazioni terapeutiche e la necessità di ripetere – durante il periodo epidemico - la somministrazione a causa della sua breve emivita, hanno portato alla ricerca di altri anticorpi monoclonali. È attualmente disponibile il Nirsevimab, che trova indicazione in tutti i neonati e i bambini alla loro prima stagione di RSV e nei bambini fino a 24 mesi di età che rimangono vulnerabili a malattie gravi attraverso la loro seconda stagione, con lo scopo di prevenire la malattia respiratoria da RSV [22].
Una dose di Nirsevimab è associata a livelli di nAbs (neutralizing Antibodies) dieci volte più alti e prolungati rispetto a Palivizumab, suggerendo che il Nirsevimab può offrire protezione contro RSV per un periodo superiore ad una stagione tipica di RSV pari a circa 150 giorni [23].
A fronte della diffusione e della possibile gravità dell’infezione da RSV, lo sviluppo di vaccini anti-RSV è considerato ormai una priorità. Ad oggi, sono stati messi a punto 24 vaccini contro RSV, compresi i 2 vaccini già autorizzati ovvero il vaccino ricombinante non adiuvato (Abrysvo), e il vaccino ricombinante adiuvato (Arexvy) [24].
Il vaccino ricombinante non adiuvato RSVpreF Abrysvo trova indicazione sia nell’immunizzazione passiva contro la LRTD causata da RSV, nei neonati dalla nascita fino ai 6 mesi di età, a seguito dell’immunizzazione della madre durante la gravidanza (tra 32 e 36 settimane), sia per l’immunizzazione attiva dei soggetti di età pari o superiore ai 60 anni.
Dal 2023, è stato autorizzato negli Stati Uniti, in Europa, Canada e Giappone, anche il vaccino AS01E-adjuvanted RSV prefusion F protein-based vaccine (Arexvy) – oggetto di questa valutazione di HTA (Health Technology Assessment) – per la prevenzione della LRTD causata da RSV in adulti con età uguale o superiore ai 60 anni.
Lo scopo dell’HTA è supportare il processo decisionale nell’assistenza sanitaria fornendo le “migliori” informazioni disponibili. A tale riguardo, l’HTA è stato paragonato a una sorta di “ponte” tra il mondo delle “prove” e il mondo del “processo decisionale” [25]: le evidenze scientifiche vengono raccolte e analizzate in modo sistematico e riproducibile per renderle accessibili e utilizzabili – mediante rapporti di “valutazione” – nel processo decisionale. Esiste, pertanto, una stretta connessione tra HTA ed Evidence-based medicine (EBM).
In tempi più recenti, l’HTA è, inoltre, sempre più legata al concetto della cosiddetta “medicina basata sul valore” (VBM). Focalizzare la pratica medica sul “valore” significa definire il “merito” che ha un intervento medico in base al suo potenziale nel raggiungere un risultato clinico, sociale o finanziario. Il concetto alla base di questo approccio è che un uso “ottimale” delle risorse può essere ottenuto perseguendo i risultati che per il paziente hanno più valore piuttosto che concentrarsi sulla riduzione dei costi in sé. In altre parole, “la medicina basata sul valore, VBM, è una ridefinizione degli obiettivi centrati sul paziente per gli interventi strategici e le politiche di ottimizzazione sanitaria, riducendo il rischio di false economie legate a riduzioni dei costi progettate su obiettivi poco definiti” [26]. Di conseguenza, la recente definizione di HTA include il “valore” come elemento centrale e definisce l’HTA come “un processo multidisciplinare che utilizza metodi espliciti per determinare il valore di una tecnologia sanitaria in diversi punti del suo ciclo di vita” [27].
Le principali domande a cui rispondere in un processo di HTA sono: La tecnologia in esame è clinicamente efficace? È sicura? Quale è il rapporto rischi/benefici? È economicamente vantaggiosa?
Queste domande non coprono, però, l’ampia gamma di questioni e preoccupazioni sollevate dalle tecnologie sanitarie e che devono essere affrontate dai decisori politici. Vanno infatti analizzate anche le questioni etiche, legali e sociali (ELSI, Ethical-Legal-Societal Issues). Ai fini di questa valutazione sarà allora necessario analizzare oltre ai dati di efficacia, sicurezza, impatto economico e organizzativo, anche le eventuali ricadute su salute, qualità di vita, esercizio dell’autonomia del paziente ed equità nell’accesso ai trattamenti [28].
Le differenti tipologie di tecnologie sanitarie (prodotti farmaceutici, vaccini, dispositivi, procedure) possono richiedere varie forme di valutazione. Di conseguenza, è stato sviluppato un gran numero di modelli di analisi. In questa valutazione, si fa riferimento al Core Model, EUnetHTA, che rappresenta la linea guida europea per ogni processo di HTA. Un HTA completo include la valutazione di nove domini quali: problemi di salute e l’uso attuale della tecnologia; descrizione e caratteristiche tecniche della tecnologia; sicurezza; efficacia clinica; costi e valutazione economica; analisi etica; aspetti organizzativi; pazienti e aspetti sociali; aspetti giuridici [29].
In tutti i domini di un HTA l’approccio è basato – come già detto – sulle evidenze, sui dati epidemiologici e sulle revisioni sistematiche. Unica eccezione è il dominio dell’analisi etica che utilizza, invece, un approccio basato sul valore (morale). Mentre alcuni Autori dibattono su come superare il divario tra un approccio basato sull’evidenza e un approccio basato sul valore (morale) [30], è da sottolineare che tutto l’HTA si basa su una scelta di valore. D’altra parte, la ricerca di nuove tecnologie sanitarie muove dall’intenzione “morale” di aiutare i pazienti, migliorare la loro salute e qualità della vita, alleviare la sofferenza e il dolore, ecc. La stessa ricerca epidemiologica, lo studio dei dati di sicurezza ed efficacia, chiama in causa l’etica in relazione – ad esempio – alla metodologia utilizzata e ai criteri di misurazione.
La centralità dell’etica nell’HTA è nota sin dalla sua nascita negli anni ’70. Infatti, l’etica viene chiamata in causa in tutto il processo di HTA e i giudizi di valore ne permeano tutti i livelli diell’HTA [31]. Ne identifichiamo tre: (1) l’etica in HTA, che comprende l’analisi di tutte le questioni etiche sollevate dal ricorso ad una determinata tecnologia sanitaria; (2) etica di HTA, poiché le stesse condizioni in cui si effettua la valutazione può sollevare questioni etiche; (3) etica per HTA, poiché e sempre presente una stretta correlazione sulla modalità con cui vengono studiati i “fatti” (indagine empirica) e i valori. Il recupero, l’esame critico e la sintesi delle prove, ha sempre alla base un’attenzione etica.
Mentre gli altri settori dell’HTA utilizzano metodologie piuttosto uniformi, la valutazione etica dipende dai criteri e dalle metodologie delle diverse correnti di pensiero. Nel 2014, una revisione sistematica ha individuato 43 quadri concettuali o orientamenti pratici per affrontare le questioni etiche nell’analisi delle tecnologie sanitarie [32]. Gli approcci più utilizzati sono: l’approccio dei quattro principi (rispetto dell’esercizio dell’autonomia; non maleficenza, beneficenza e giustizia); casistica; analisi della coerenza. Inoltre, esistono tre approcci specifici di HTA: gli approcci interattivi di HTA partecipativa (iHTA), il modello HTA centrale e l’approccio socratico [33].
In questa analisi, si fa riferimento al cosiddetto “modello triangolare” che si fonda su un approccio etico personalista e che fa perno sul rispetto incondizionato dell’essere umano [34]. Secondo questo approccio, i valori di riferimento nella valutazione etica sono in ordine gerarchico: la difesa della vita fisica, la promozione della salute e della qualità della vita, il rispetto delle scelte libere e responsabili, la ricerca del bene comune. Nell’ambito biomedico, questo approccio si traduce nella valutazione delle conseguenze che l’introduzione/uso di una tecnologia sanitaria può avere sul benessere integrale dell’uomo. L’European Network for HTA cita il modello triangolare tra quelli utilizzabili nell’ambito del dominio etico nel modello HTA Core model 3.0 [35].
Secondo Ekmekci and Güner, inoltre, nell’ambito di una valutazione etica in HTA vanno analizzati sei ambiti: il bilanciamento rischi/benefici; autonomia; rispetto della persona; giustizia ed equità; legislazione; conseguenze etiche dell’HTA [36].
Il Metodo triangolare prevede tre momenti:
raccolta e analisi dei dati di efficacia (immunogenicità, efficacy e effectiveness nel caso di un vaccino), di sicurezza e tollerabilità della tecnologia sanitaria (fase conoscitiva);
valutazione del come la tecnologia sanitaria si rapporti al bene integrale della persona (tutela della vita e della salute; qualità della vita; rispetto dell’autonomia; ricerca del bene comune);
elaborazione del parere etico conclusivo, in cui si fanno emergere anche le eventuali problematicità di tipo etico e che i decision-makers devono tenere presenti nel valutare l’opportunità di introdurre/usare la tecnologia sanitaria in studio (fase prescrittiva) [37].
Da sottolineare che nel caso in esame, la possibilità di disporre di un vaccino che sia immunogenico, efficace e sicuro è già di per sé un importante vantaggio per la vita, la salute e la qualità della vita della popolazione. La vaccinazione può ridurre i costi diretti sanitari (assistenza sanitaria, trattamenti farmacologici, eventuale ricovero ospedaliero) e indiretti (perdita di giornate lavorative o di scuola) necessari in caso di insorgenza della patologia. A livello sociale, è infine possibile ottenere la cosiddetta “immunità di comunità” (herd immunity) ovvero la protezione anche della popolazione non vaccinata e la riduzione della circolazione dell’agente patogeno.
L’analisi etica nell’ambito di questo HTA assume allora una duplice rilevanza: da una parte consente di valutare la tecnologia in esame; dall’altra, di porre l’attenzione sull’importanza della prevenzione vaccinale come esercizio di una duplice responsabilità: verso sé stessi e verso gli altri [38].
Al fine di valutare dal punto di vista etico la tecnologia in esame – Arexvy – verranno analizzati: il rapporto rischi/benefici; i vantaggi in termini di miglioramento della qualità della vita; il rispetto dell’esercizio dell’autonomia da parte del soggetto interessato alla vaccinazione; la possibilità di assicurare l’accesso alla vaccinazione a tutta la popolazione target.
Arexvy è un vaccino adiuvato del Virus Respiratorio Sinciziale (RSV), indicato per prevenire le malattie delle vie aeree inferiori da esso causate in adulti over 60. Si presenta in due fiale, contenenti rispettivamente: il vaccino in polvere bianca e il liquido per la sospensione, contenente l’adiuvante, opalescente da incolore a marrone chiaro. Dopo la ricostituzione, una dose di vaccino contiene 120 μg di glicoproteina F di superficie dell’RSV ricombinante, stabilizzata in una forma trimerica pre-fusione (antigene RSVPreF3). Arexvy viene somministrato intramuscolo, nel deltoide, in singola dose da 0,5 ml.
Il vaccino è prodotto mediante la tecnologia del DNA ricombinante in colture cellulari immortalizzate di epitelio ovarico di criceto cinese, Cricetulus barabensis griseus (Pallas 1773), Chinese Hamster Ovary, CHO. La preparazione include l’adiuvante AS01E, che – in formulazione liposomiale, composta da dioleoil fosfatidilcolina (DOPC) e colesterolo, in tampone fosfato salino – contiene una combinazione di: 25 μg di QS-21, frazione 21 di una saponina (glicoside triterpenico) estratta dalla corteccia della pianta Quillaja saponaria (Molina 1782); e 25 μg di 3-O-deacil-4′-monofosforil lipide A (MPL) derivato dall’endotossina lipopolisaccaride (LPS) detossificata chimicamente di Salmonella enterica sierotipo Minnesota.
Ogni dose contiene inoltre 14,7 mg di trealosio, 4,4 mg di cloruro di sodio, 0,83 mg di diidrogenofosfato di potassio (E 340), 0,26 mg di idrogenofosfato di potassio (E 340), 0,18 mg di polisorbato 80 (E 433), 0,15 mg di idrogenofosfato di disodio (E339), 0,5 mg di Dioleoile fosfatidilcolina (DOPC, E 322) e 0,125 mg di colesterolo.
L’immunizzazione attiva con il vaccino Arexvy ha lo scopo di potenziare la risposta immunitaria specifica cellulo-mediata. Per facilitare il reclutamento e l’attivazione delle APC (antigen presenting cell) deputate alla presentazione degli antigeni specifici contenuti nel vaccino, è presente l’adiuvante AS01E. Una volta che le cellule sono giunte ai linfonodi, lì vengono prodotti i linfociti T CD4+ specifici per RSVPreF3 [39].
L’analisi etica di una tecnologia sanitaria comporta, innanzitutto, la valutazione della sua utilità clinica e della proporzionalità tra i benefici ricercati (efficacia) e i rischi prevedibili (sicurezza).
La protezione offerta da un determinato vaccino viene valutata in base all’immunogenicità, l’efficacia teorica (efficacy) e l’efficacia sul campo o “reale” (effectiveness). L’immunogenicità è la capacità dei vaccini di stimolare la risposta immune umorale o cellulare, mentre efficacy ed effectiveness fanno riferimento alla riduzione proporzionale dei casi di malattia rispettivamente nelle condizioni ideali (i.e., trial clinico) e quelle della “vita reale”, quindi successivamente all’immissione in commercio e all’utilizzo nella popolazione. Inoltre, ciascuno di questi parametri può essere quantificato su scala assoluta (ad esempio, confronto con la non vaccinazione o con il placebo) o relativa (ad esempio, confronto con un altro vaccino).
L’immunogenicità del vaccino è stata valutata dapprima in studi clinici di fase I, in cui tutte le formulazioni in esame hanno indotto sia una robusta risposta di IgG specifiche per RSVPreF3 sia neutralizzante verso RSV-A e RSV-B e successivamente in diversi studi di fase II/III, in cui sono stati osservati aumenti significativi della media geometrica di concentrazione (GMC) di IgG specifiche, della media geometrica dei titoli (GMT) di anticorpi neutralizzanti contro RSV-A e RSV-B e della frequenza mediana di linfociti T CD4+ specifici (Cfr. Capitolo 2, par. Risultati).
L’efficacia del vaccino nel prevenire la LRTD in adulti di età pari o superiore ai 60 anni, è stata determinata attraverso uno studio clinico di fase 3 (RSV OA = ADJ-006, AReSVi-006 ClinicalTrials.gov number NCT04886596), in corso, randomizzato, in cieco per l’osservatore, controllato versus placebo. Lo studio è condotto in 278 centri, diffusi in 17 Paesi (Australia, Belgio, Canada, Corea del Sud, Estonia, Finlandia, Germania, Giappone, Italia, Messico, Nuova Zelanda, Polonia, Regno Unito, Russia, Spagna, Stati Uniti, Sud Africa) e ha coinvolto circa 25.000 partecipanti, suddivisi in quattro gruppi 1:1:1:3, uno per ognuno dei tre lotti di vaccino e un gruppo placebo. L’efficacia del vaccino contro la LRTD è stata osservata per un periodo mediano di 6,7 mesi ed è risultata essere dell’82% (IC 96,95 tra 57,9 e 94,1%) nel gruppo complessivo (età ≥ 60 anni) e superiore sia nei soggetti più anziani (efficacia del 93,8% con IC 95 tra 60,2 e 99,9% nel gruppo 70-79 anni) sia nei soggetti con almeno una comorbosità di interesse (efficacia del 94,6% con IC 95 tra 65,9 99,9). Inoltre si sono verificati 4 casi di LRTD grave, con necessità di supporto respiratorio con ossigeno, nel gruppo placebo e nessun caso nel gruppo di vaccinati. Nell’ambito dello stesso studio è stato osservato che una singola dose di RSVPreF3 OA risulta efficace nella prevenzione delle LRTD da RSV nell’arco di due stagioni in soggetti over 60 e che una rivaccinazione dopo un anno, sebbene ben tollerata, non apporta un significativo vantaggio in termini di efficacia (cfr. Capitolo 2, par. Efficacia clinica).
La sicurezza (safety) del vaccino è stata investigata da diversi studi sperimentali. Nei partecipanti allo studio clinico succitato, le reazioni avverse più comunemente registrate sono state dolore in sede di iniezione (61%), affaticamento (34%), mialgia (29%), cefalea (28%) e artralgia (18%). Nella maggioranza dei casi si è trattato di reazioni di entità lieve e o moderata che si sono risolte nel giro di pochi giorni. Rarissimi casi di eventi avversi di tipo neuro-infiammatorio sono stati riportati in alcuni studi, in cui però mancava un gruppo di comparazione con placebo. Si tratta di un evento di Sindrome di Guillain-Barré (GBS) a seguito della vaccinazione con RSVPreF3 OA e due eventi di encefalomielite acuta disseminata (ADEM) segnalate entro 42 giorni dalla co-somministrazione con il vaccino antinfluenzale. Nel complesso gli studi hanno stabilito un profilo di sicurezza clinicamente accettabile. (Cfr. Capitolo 2)
Per valutare l’impatto dell’introduzione del vaccino sulla salute pubblica sono state effettuate delle stime applicando il modello di Markov. Nello studio di Molnar et al. si è partiti dall’ipotesi di aver somministrato il vaccino a circa 56,7 milioni di adulti di età pari o superiore a 60 anni negli Stati Uniti, ottenendo una riduzione di casi di infezioni sintomatiche da RSV di 2.954.465 casi in 3 anni, inclusi 321.019 casi di polmonite e 16.660 di decessi correlati. La vaccinazione ha inoltre evitato un numero considerevole di ricoveri correlati a RSV (203.891), visite al pronto soccorso (164.060), visite ambulatoriali (1.577.586) e prescrizioni di antibiotici (1.343.915) nel periodo di 3 anni. Questi dati se confermati nella realtà dimostrerebbero un impatto positivo in termini di salute pubblica [40].
Lo studio di Kurai et al. ha stimato che la vaccinazione nella popolazione target in Giappone potrebbe ridurre, in tre anni, di oltre un milione di casi di malattia, 728.000 visite ambulatoriali, 143.000 ricoveri ospedalieri e 6.840 decessi correlati a RSV [41].
Premesso che Arexvy presenta un rapporto benefici attesi (immunogenicità, efficacy ed effectiveness) e tollerabilità/sicurezza favorevole, è necessario valutare anche l’impatto sulla qualità di vita dei soggetti vaccinati in termini di riduzione del carico di malattia e sofferenza, della non autosufficienza, della sospensione/perdita di vita di relazione e di attività lavorativa o scolastica.
Nello studio di Moghadas et al. utilizzando una disponibilità a pagare di 95.000 dollari per QALY guadagnato, risulta che i programmi di vaccinazione potrebbero essere economicamente vantaggiosi per una PPD (prezzo per dose) fino a 127 dollari con Arexvy durante la prima stagione di RSV. Raggiungendo una copertura vaccinale simile alla vaccinazione antinfluenzale del 66% per la popolazione degli anziani negli Stati Uniti, l’impatto sul bilancio dei programmi vaccinali anti RSV al massimo PPD, variava da 6,48 a 6,78 miliardi di dollari. Se i benefici della vaccinazione si estendono a una seconda stagione di RSV, come riportato negli studi clinici, è stata stimata una PPD massima di 235 dollari per Arexvy con impatti sul budget a 2 anni di 11,78 miliardi di dollari [42].
Lo studio di Shoukat et al. utilizzando una disponibilità a pagare di 50.000 dollari canadesi per QALY guadagnato, stima che vaccinando con Arexvy il 90% dei pazienti ospitati in case di cura per lungodegenza in Ontario, Canada, sarebbe conveniente dal punto di vista sociale per un PPD fino a 163 dollari, producendo un valore ICER medio di 49.984 dollari (95% IC: da 47.539 a 52.704 dollari) per QALY guadagnato con un impatto sul budget in due anni di 463.468 dollari per 100.000 anziani. La riduzione dei ricoveri è stata stimata al 7,0% rispetto allo scenario senza vaccinazione. Estendendo il programma per includere gli anziani residenti in comunità con una copertura del 74% simile alla vaccinazione antinfluenzale, Arexvy rimane economicamente vantaggioso per un PPD fino a 139 dollari, con un valore ICER medio di 49.698 dollari (IC al 95%: da 48.022 a 51.388) per QALY guadagnato e un impatto sul budget biennale di 8,63 milioni di dollari. Rispetto allo scenario di assenza di vaccinazione, il programma esteso ha comportato una riduzione del 57,3% dei ricoveri correlati all’RSV [43].
L’impiego preventivo, diagnostico o terapeutico di una tecnologia sanitaria va sempre subordinato all’adesione libera e responsabile del soggetto interessato. Dopo un’informazione completa e comprensibile, va, infatti, rilevato il consenso. È quanto previsto anche dalla Legge 219/2017, che all’articolo 1, comma 3, recita quanto segue: “Ogni persona ha il diritto di conoscere le proprie condizioni di salute e di essere informata in modo completo, aggiornato e a lei comprensibile riguardo alla diagnosi, alla prognosi, ai benefici e ai rischi degli accertamenti diagnostici e dei trattamenti sanitari indicati, nonché riguardo alle possibili alternative e alle conseguenze dell’eventuale rifiuto del trattamento sanitario e dell’accertamento diagnostico o della rinuncia ai medesimi […] Per essere legalmente valido e moralmente accettabile, il consenso dovrà essere specifico, libero e consapevole. Il soggetto interessato deve conoscere il trattamento, i benefici ricercati, i rischi prevedibili e le eventuali alternative”.
Nel caso delle vaccinazioni, le questioni sul consenso informato sono riconducibili a quelle generali di altri trattamenti sanitari, anche se vanno tenuti presenti alcuni elementi specifici. Ad esempio, anche a fronte della necessità di vaccinare ampie fasce della popolazione, il consenso va acquisto solo dopo un’attenta valutazione delle condizioni fisiche e mentali del soggetto da vaccinare e la verifica che le informazioni date siano state comprese. I medici dovranno spiegare i benefici della vaccinazione e la responsabilità morale di accedere alla vaccinazione per proteggere sé stessi e i soggetti più vulnerabili, cercando di migliorare l’adesione alla proposta e prevenedo le cause di esitazione vaccinale (Cfr. Capitolo 8).
La possibilità di disporre di un vaccino, che ha un profilo di efficacia/tollerabilità/sicurezza favorevole, comporta la necessità di renderlo disponibile a quanti rispondono ai criteri stabiliti negli studi clinici. La limitatezza delle risorse disponibili in sanità potrebbe, però, sollevare il problema se sia possibile garantire questo trattamento a tutti. Quali sono i criteri, che dovrebbero guidare, in tal caso, la scelta?
I principi etici di riferimento sono due: il principio di equità e il principio della differenza. Tutti gli esseri umani hanno, infatti, gli stessi diritti (principio di equità), ma non tutti hanno gli stessi bisogni (principio della differenza). Nella prassi clinica, l’essere umano è la misura di ciò che è giusto e la salvaguardia/tutela della salute e della vita è il valore di riferimento. Ne consegue che il valore economico va subordinato al valore clinico della tecnologia e che la valutazione del rapporto rischi/benefici deve precedere sempre quella del rapporto costi/benefici. Nella valutazione dell’impatto economico di Arexvy, vanno presi in considerazione non solo i costi diretti (ospedalizzazione, procedure diagnostiche, trattamenti terapeutici, ecc.) e indiretti (perdita di giorni di lavoro per i pazienti e per i caregivers), ma anche i costi intangibili (dolore e sofferenza, generati dalla condizione di malattia).
Per quanto riguarda il rapporto costo/efficacia di Arexvy, i risultati dell’analisi economica mettono in evidenza che, per gli scenari studiati, il vaccino offre il potenziale per una sostanziale riduzione del carico di malattia associato all’RSV, in Italia, negli anziani e negli adulti over60 ad alto richio, nonché potenziali riduzioni dei costi diretti per il Servizio Sanitario Nazionale (SSN) (Cfr. Capitolo 4). Per questi motivi sarebbe giusto aggiornare il calendario vaccinale del Piano Nazionale di Prevenzione Nazionale (PNPV) inserendo la raccomandazione alla vaccinazione contro RSV per le persone appartenenti alle categorie a rischio per età o per patologia/condizione (Cfr. Capitolo 5).
Sulla base dei dati a disposizione, il giudizio etico è complessivamente positivo. I decision-makers dovranno, comunque, porre particolare attenzione ai seguenti aspetti:
la necessità di predisporre colloqui personalizzati in fase di somministrazione del vaccino, che prendano in esame tutte le variabili legate alla condizione clinica del soggetto interessato;
la verifica di un uguale accesso al vaccino da parte della popolazione over 60;
una specifica attenzione alla farmacovigilanza, con particolare riferimento alle segnalazioni di eventi avversi di tipo neuro-infiammatorio;
l’organizzazione di campagne di educazione vaccinale in modo da sensibilizzare alla vaccinazione anti-RSV, aumentare l’adesione e ridurre le situazioni di esitazione;
l’informazione capillare della popolazione su: rischi delle malattie causate dal RSV, la possibilità di contrarre l’infezione da RSV più di una volta, con la raccomandazione di vaccinarsi contro RSV anche se si è avuta la malattia in passato.
Questo capitolo sintetizza gli aspetti più rilevanti emersi dalla valutazione HTA del vaccino Arexvy®.
Il Virus Respiratorio Sinciziale (RSV) è un patogeno noto per il suo impatto significativo sulla salute dei bambini. Tuttavia, negli ultimi anni, la sua rilevanza nelle infezioni respiratorie acute (ARI) negli adulti, soprattutto quelli oltre i 60 anni, è diventata sempre più evidente. Il quadro clinico dell’RSV negli adulti può variare da sintomi lievi di malattie delle vie respiratorie superiori a condizioni più gravi, come la bronchiolite e la polmonite. In particolare, gli adulti anziani possono sperimentare esacerbazioni di malattie croniche, come la BPCO (Broncopneumopatia Cronica Ostruttiva) o l’insufficienza cardiaca congestizia.
L’incidenza annuale di infezioni da RSV negli adulti è stimata intorno a 3-7% e aumenta con l’età, raggiungendo il picco nelle persone di età superiore ai 65 anni. La prevalenza di RSV in adulti e anziani varia in base a fattori geografici e stagionali, ma diversi studi hanno dimostrato che circa il 10% delle ospedalizzazioni per ARI in adulti oltre i 65 anni è causato da RSV. A livello globale, il tasso di attacco dell’RSV in termini di ARI è stimato intorno all’1,62%, con un tasso di ospedalizzazione dello 0,15% e mortalità intraospedaliera del 7,13%. In Europa, ogni anno il numero di ospedalizzazioni associate a RSV negli adulti ammonta in media a 158.229, di cui il 92% riguarda adulti al di sopra de 65 anni. Le percentuali di pazienti ospedalizzati aumentano con l’aumentare dell’età: nella fascia d’età compresa tra i 75 e gli 84 anni si ha una stima media delle ospedalizzazioni pari a 74.519, con un tasso del 2,24%, mentre dagli 85 anni in su si arriva alle 37.904 ospedalizzazioni, con un tasso del 2,99%. Le morti intraospedaliere attribuibili a RSV nei pazienti al di sopra dei 60 anni sono in media 19.527 nel continente europeo.
Questi numeri, già di per sé importanti, assumono ancor più rilevanza se si considera che le infezioni da RSV rimangono ad oggi sottodiagnosticate, per via della sintomatologia aspecifica e sovrapponibile a quella causata da altri virus respiratori, della necessità di eseguire test molecolari per confermare l’infezione, della possibilità non infrequente di incorrere in falsi negativi nella ricerca tramite PCR e della mancanza di sistemi di sorveglianza dedicati e adeguati.
Dalle evidenze ad oggi disponibili ed analizzate nel presente report di HTA si evince che:
una singola dose di RSVpreF3 OA risulta altamente immunogena sia in termini di IgG antigene specifiche totali (con un incremento di concentrazione da prevaccinazione a un mese dopo la vaccinazione pari a 11-13 volte) sia in termini di anticorpi neutralizzanti RSV A e RSV B (con un incremento di concentrazione da prevaccinazione a un mese dopo la vaccinazione pari a 9-10 volte). Inoltre, a differenza delle formulazioni non adiuvate, l’aggiunta dell’adiuvante AS01E ha permesso di indurre una significativa risposta cellulo-mediata. Quest’ultima ha un ruolo cruciale nel processo della clearance virale, specialmente nell’anziano;
RSVpreF3 OA è altamente immunogeno verso i ceppi di RSV A e B attualmente in circolazione che sono affetti da alcune mutazioni puntiformi della proteina F. I risultati disponibili suggeriscono che RSVpreF3 OA può coprire ceppi moderni di RSV A e RSV B, anche quelli antigenicamente distanti;
una singola dose di RSVpreF3 OA è risultata efficace all’82,6, al 94,1 e al 71,7% nel prevenire rispettivamente qualsiasi LRTD da RSV A e B, LRTD da RSV severa e ARI da RSV;
l’efficacia di RSVpreF3 OA è stata dimostrata sia in diverse sottofasce di età sia in diversi gruppi di adulti a rischio;
il titolo di anticorpi totali e neutralizzanti in seguito a una singola dose persiste per almeno 13/14 mesi. Infatti, rispetto alla prevaccinazione, i titoli rimangono 2-4 volte superiori. Il dato di immunogenicità risulta in linea con quello di efficacia della singola dose nel prevenire LRTD da RSV durante la seconda stagione: l’efficacia cumulativa della singola dose nelle prime due stagioni era del 67,2 e del 78,8% contro rispettivamente qualsiasi LRTD da RSV e LRTD da RSV severa. La valutazione della risposta immune in seguito alla rivaccinazione indica un effetto booster. I titoli anticorpali in seguito alla 2a dose sono, tuttavia, inferiori rispetto a quelli misurati a un mese dalla 1a dose. Lo studio pivotale non ha dimostrato un benefico clinico della 2a dose in termini di efficacia. Le prove disponibili sulla necessità della rivaccinazione sono quindi insufficienti. È probabile che i risultati della terza (e ultima) stagione dello studio pivotale faranno luce sull’argomento;
il profilo di sicurezza di RSVpreF3 OA è clinicamente accettabile. Inoltre, il suo profilo di reattogenicità risulta paragonabile a quello di altri vaccini non RSV adiuvati. Infatti, la maggior parte degli AE è transitoria, autorisolutiva, di gravità lieve/moderata. Gli SAE correlati all’utilizzo del vaccino sono particolarmente rari. Tuttavia, essendo il vaccino first-in-class, è indispensabile il continuo monitoraggio post-marketing degli AE, specialmente quelli rari e di particolare interesse (es. sindrome di Guillain-Barré, encefalomielite acuta disseminata);
RSVpreF3 OA può essere co-somministrato con diversi vaccini antinfluenzali attualmente disponibili per gli anziani italiani senza provocare un’interferenza clinicamente significativa sia con l’immunogenicità sia con la frequenza degli AE. Gli studi sulla co-somministrazione di RSVpreF3 OA con il vaccino pneumococcico coniugato 20-valente e con il vaccino ricombinante adiuvato contro l’herpes zoster sono attualmente in corso. È ben noto che dal punto di vista di sanità pubblica, la co-somministrazione è vantaggiosa, in quanto riduce il numero di visite e i costi associati, assicura la vaccinazione tempestiva e riduce le opportunità perse per la vaccinazione;
RSVpreF3 OA può attenuare la gravità dei sintomi associati a RSV nelle infezioni breakthrough (i.e., nei soggetti vaccinati) che si traduce in una tendenza alla riduzione dell’impatto dell’infezione da RSV sulla HRQoL. È infatti plausibile che nel caso in cui il vaccino non prevenga l’infezione di per sé, possa diminuire la carica virale. La minor carica virale, a sua volta, spesso è associata a infezioni paucisintomatiche e alla riduzione della gravità dei sintomi e/o delle complicanze.
Nell’ambito del presente report HTA è stata condotta una revisione di letteratura al fine di valutare i vaccini approvati per la prevenzione della malattia alle basse vie aeree causata da RSV per gli anziani ≥ 60 anni.
Dei quattro vaccini inizialmente considerati, MVA-BN-RSV di Bavarian Nordic e Ad26.RSV.preF di Janssen Vaccines & Prevention B.V., avendo subito una battuta d’arresto nonostante le buone premesse iniziali, sono stati successivamente esclusi lasciando quindi spazio ai soli RSVpreF (Abrysvo) di Pfizer e mRNA-1345 (mRESVIA) di Moderna, il primo già approvato da FDA ed EMA e il secondo da FDA.
La revisione sistematica ha permesso di analizzare le varie caratteristiche di efficacia, sicurezza e immunogenicità di entrambi. I risultati raccolti hanno mostrato una buona efficacia per entrambi i vaccini, soprattutto per quanto riguarda la malattia grave; inoltre, le evidenze suggeriscono che nessuno dei due solleva particolari preoccupazioni sul fronte della sicurezza e della tollerabilità. Si può concludere, quindi, che al momento le alternative per la prevenzione dalla malattia causata da RSV sono varie e valide.
La modellizzazione dell’impatto clinico ed economico inclusa nel presente report di HTA, ha previsto l’utilizzo del modello di Costo-Efficacia del Virus Respiratorio Sinciziale per Adulti (ARIEL), modello di Markov statico multi-coorte, precedentemente pubblicato ed adattato al setting italiano, al fine di valutare il rapporto di costo-efficacia del vaccino Arexvy® (programma di vaccinazione con singola dose del vaccino adiuvato RSVPreF3) rispetto alla non vaccinazione. Sulla base della raccomandazione del Board per il Calendario per la Vita, sono state considerate come popolazioni target della vaccinazione anti-RSV i soggetti di età ≥75 anni e gli adulti di età ≥ 60 anni affetti da patologie croniche (ad alto rischio, HR). Inoltre, è stato considerato un orizzonte temporale di tre anni, corrispondente a tre stagioni RSV consecutive.
I risultati della nostra analisi hanno dimostrato che vaccinando il 56,7% – tasso di vaccinazione contro l’influenza nella stagione 2022-2023 negli adulti di età pari o superiore a 65 anni – degli adulti di età ≥ 75 anni si potrebbero evitare 277.019 casi di RSV-ARI, 180.967 casi di RSV-LRTD e 33.298 ricoveri correlati a RSV, con una riduzione stimata di € 157.755.358 dei costi sanitari diretti, rispetto alla non vaccinazione, in un orizzonte temporale di 3 anni, corrispondente a tre stagioni consecutive di RSV. Riduzioni maggiori sarebbero possibili con tassi di copertura più elevati.
Nella nostra analisi è stato studiato anche il potenziale impatto sulla salute pubblica della vaccinazione con il vaccino adiuvato Arexvy® nella popolazione italiana ≥ 60 anni ad alto rischio (HR). Considerando, in questa popolazione target, un tasso di copertura del 13,3% – che è il tasso di vaccinazione antinfluenzale nella stagione 2022-2023 negli adulti di età compresa tra 45 e 64 anni – si potrebbero evitare, in un orizzonte temporale di 3 anni, 95.468 casi di RSV-ARI, 62.582 casi di RSV-LRTD e 13.984 ricoveri correlati a RSV, con una riduzione dei costi sanitari diretti pari a € 64.126.996, utilizzando i dati sul rischio di ospedalizzazione riportati da Fleming et al. (2015) (scenario conservativo). Utilizzando, invece, i dati sul rischio di ospedalizzazione riportati da Osei-Yeboah et al. (2024) (scenario ottimistico), e considerando una copertura vaccinale del 13,3%, la vaccinazione potrebbe evitare 95.379 casi di RSV-ARI, 62.539 casi di RSV-LRTD e 22.758 ricoveri correlati a RSV, con una riduzione dei costi sanitari diretti pari a € 99.192.288. Il numero di eventi evitati e la riduzione dei costi sanitari diretti sarebbero maggiori con tassi di copertura vaccinale più elevati, indipendentemente dai dati sul rischio di ospedalizzazione utilizzati.
Questi risultati indicano che il raggiungimento di un elevato tasso di copertura vaccinale rappresenta un obiettivo fondamentale per l’implementazione ottimale di un programma di vaccinazione con il vaccino adiuvato Arexvy® in Italia, in entrambe le popolazioni considerate in questa analisi.
Per quanto concerne, invece, l’analisi di costo efficacia del caso base relativa alla popolazione italiana di età ≥ 75 anni è stato dimostrato che l’ICER per il vaccino adiuvato RSVPreF3, rispetto alla non vaccinazione, risulta essere pari a € 17.348 per QALY guadagnato. Tale valore è al di sotto della soglia comunemente accettata in Italia (30.000 € per QALY). La vaccinazione con il vaccino Arexvy® è risultata costo-efficace anche nella popolazione di età ≥ 60 anni HR, con valori di ICER pari a € 14.002 – considerando lo scenario conservativo che utilizza i dati di Fleming et al. 2015 – o di € 7.280 – nello scenario ottimistico che utilizza i dati dello studio di Osei-Yeboah et al. 2024 – per QALY guadagnato.
La nostra analisi è stata condotta secondo la prospettiva del Servizio Sanitario Nazionale (SSN) e, pertanto, sarebbero necessarie ulteriori analisi per valutare l’impatto sulla salute pubblica della vaccinazione con il vaccino adiuvato Arexvy® considerando anche la prospettiva sociale e, quindi, l’impatto sui costi indiretti correlati all’RSV.
A livello internazionale molte nazioni e società scientifiche hanno già iniziato a raccomandare o a produrre linee guida sulla vaccinazione anti-RSV ai soggetti anziani. In Italia al momento tale vaccinazione non è ancora raccomandata a livello ministeriale ma il Board per il Calendario per la Vita e poi alcune società scientifiche, come la Società Italiana di Igiene, Medicina Preventiva e Sanità Pubblica e la Società Italiana di Malattie Infettive e Tropicali hanno espresso la forte raccomandazione sull’opportunità della vaccinazione anti-RSV nei soggetti anziani a rischio (adulti ≥ 60 anni di età con comorbosità e soggetti anziani ≥ 75 anni di età). In futuro molti aspetti dovranno essere valutati approfonditamente per evidenziarne pienamente il valore. Il processo decisionale dovrà però essere veloce per permettere di poter offrire questo intervento preventivo prima dell’inizio della prossima stagione invernale.
Tra le infezioni virali del tratto respiratorio, RSV emerge come un agente patogeno di particolare rilevanza, essendo responsabile di un significativo carico di malattia in alcune categorie di popolazione, in particolare in bambini fino a cinque anni d’età, adulti fragili e anziani. Tuttavia, al fine di disporre di un ampio quadro e contestualizzato al panorama italiano, è necessario acquisire nuove informazioni sul reale carico di malattia, poiché questo è un fattore chiave per valutare l’introduzione di nuovi vaccini. In Italia si persegue la creazione di un sistema di sorveglianza integrato delle infezioni respiratorie acute in grado di fornire informazioni sul burden epidemiologico e clinico dei diversi patogeni nella popolazione generale e per fasce d’età. Inoltre, si mira a migliorare la collaborazione interna e internazionale per una condivisione tempestiva dei dati epidemiologici e di laboratorio, essenziali per costruire una difesa contro le minacce infettive in continua evoluzione. Attualmente, la Sanità dispone di un numero considerevole di dati, un bene preziosissimo. Tuttavia, le informazioni per trasformarsi in Valore necessitano di essere gestite in modo adeguato, avvalendosi di infrastrutture tecnologiche robuste, resilienti, performanti e sicure. Una Sanità di “Valore” in linea con il progresso scientifico e tecnologico deve utilizzare lo strumento della ricerca e percepire quest’ultima come un vero e proprio investimento. Infatti, non c’è buona assistenza se non si fa buona ricerca. I dati diventano “Valore” se inseriti in studi scientifici e sottoposti ad elaborazione, analisi e valutazione critica. In tale contesto, l’intelligenza artificiale ha la potenzialità di aiutare l’avanzamento della ricerca, il miglioramento dei sistemi di sorveglianza, la programmazione e la gestione dei servizi sanitari. Un altro argomento che merita un approfondimento è l’importanza della diffusione dei dati in quanto la comunità scientifica sente l’esigenza sempre più forte di promuovere una divulgazione libera e gratuita dei risultati delle proprie ricerche. Questi ultimi necessitano di essere condivisi a diversi livelli se si intende raggiungere l’obiettivo di migliorare la qualità di vita della popolazione. Lo straordinario impatto di Internet sulla scienza si è manifestato in un cambiamento profondo del rapporto tra scienza e società, poiché la rete consente forme di condivisione non solo tra ricercatori, ma soprattutto con gli utenti finali.
RSV si è dimostrato un patogeno temibile verso il quale fino ad oggi non abbiamo avuto armi efficaci, né dal punto di vista terapeutico (terapie di supporto e non eziologiche) né dal punto di vista preventivo e questo ha determinato, soprattutto negli anziani e nei soggetti fragili, ricadute in ambito sanitario, sociale ed economico. In atto, la nostra esperienza relativa alle campagne di vaccinazioni antinfluenzali, anti-COVID-19 ed anti-pneumococciche nel soggetto adulto-anziano, hanno messo in evidenza come i vaccini costituiscono la forma di prevenzione più efficace nei confronti delle infezioni respiratorie e delle complicanze ad esse correlate. L’OMS, di concerto con un adeguato sistema di sorveglianza delle malattie infettive, ha dichiarato che la pratica vaccinale è un obiettivo prioritario di salute, tanto per i paesi industrializzati quanto per quelli in via di sviluppo. Inoltre, i vaccini costituiscono uno dei pilastri fondamentali nel contrastare il fenomeno dell’antibiotico-resistenza. Per tale motivo, nell’ottica del contrasto alle infezioni correlate all’assistenza e all’antibiotico-resistenza, con l’immissione in commercio di nuovi vaccini, sarà necessario formulare raccomandazioni tempestive sul loro utilizzo, anche sulla base di considerazioni ed evidenze in termini di sanità pubblica. In una prospettiva futura, alla luce delle recenti evidenze scientifiche sulla prolungata durability dell’immunizzazione attiva conferita dal vaccino ricombinante adiuvato, tale vaccinazione potrebbe proteggere più stagioni andandosi ad uniformare con l’offerta antipneumococcica destagionalizzata.
Appare opportuno, alla prima revisione utile del Calendario Vaccinale del PNPV 2023-2025, inserire tale raccomandazione tra le strategie vaccinali dell’adulto anziano andando ad arricchire ed integrare quelle attualmente esistenti. Con l’immissione in commercio dei vaccini anti-RSV, avremo a disposizione degli strumenti di prevenzione, che nel breve termine mitigheranno il carico di malattia e nel lungo termine, con la riduzione della circolazione stagionale del patogeno, offriranno una prospettiva favorevole in termini di Sanità Pubblica.
L’adesione alla vaccinazione tra gli adulti, in particolare tra la popolazione anziana, è influenzata da una serie di fattori complessi. In generale, gli anziani mostrano livelli minori di esitazione rispetto a fasce più giovani. Tra gli elementi chiave che possono influenzare l’adesione, un ruolo di rilievo è rappresentato dalle raccomandazioni dei professionisti sanitari, il comportamento vaccinale passato, la necessità di ricevere maggiori informazioni per colmare gap di consapevolezza e conoscenza, nonché un miglioramento dell’accessibilità ai servizi vaccinali. Inoltre, per i pazienti con patologie croniche l’adesione alle vaccinazioni è influenzata dalla mancanza di conoscenza sui vaccini, dalla mancanza di fiducia nei medici di medicina generale e dagli ostacoli di accesso. Per migliorare l’adesione alla vaccinazione tra gli anziani, è essenziale adottare un approccio multidimensionale che comprenda educare la popolazione anziana sulla vaccinazione, costruire fiducia nei professionisti sanitari e fornire formazione specifica ai professionisti, soprattutto coloro che gestiscono pazienti con patologie croniche, poiché questi ultimi sembrano riporre maggiore fiducia negli specialisti come figura a cui fare riferimento. Inoltre, la rimozione di barriere logistiche che possano ostacolare l’accesso alla vaccinazione è fondamentale. Questo approccio personalizzato alle esigenze della popolazione anziana è cruciale per migliorare le coperture vaccinali. Combinare diverse strategie, come interventi educativi mirati e coinvolgimento dei professionisti sanitari, può aumentare l’efficacia complessiva delle campagne di vaccinazione. In generale, promuovere la vaccinazione tra gli adulti richiede approcci personalizzati che tengano conto delle specifiche esigenze delle diverse fasce di età e categorie di pazienti.
Anche se i benefici reali e tangibili delle vaccinazioni sono riconosciuti a livello globale anche nella popolazione adulta e anziana, in molti Paesi, inclusa l’Italia, non si registrano ancora coperture vaccinali adeguate. Inoltre, il valore complessivo della vaccinazione, ad oggi, non è ancora del tutto riconosciuto.
La revisione di letteratura condotta nell’ambito del presente HTA, ha dimostrato, infatti, che i valori personale, tecnico, allocativo e sociale, della vaccinazione nella popolazione adulta/anziana sono stati affrontati, negli ultimi anni e a livello europeo, da un numero limitato di articoli scientifici e nessuno di quelli inclusi nella revisione ha affrontato il valore complessivo della vaccinazione nella popolazione adulta/anziana. Poco più della metà degli studi ha indagato aspetti relativi a tre pilastri del valore (personale, tecnico, sociale). Tuttavia, nessuno studio ha affrontato il tema del valore allocativo delle vaccinazioni nella popolazione adulta/anziana, in termini di accessibilità ed equità di accesso alla vaccinazione. Questo risultato richiama l’attenzione sulla necessità di sviluppare ulteriori ricerche su questa dimensione del valore, rilevante sia per i sistemi sanitari che per i cittadini. Un dato interessante, emerso dalla nostra analisi della letteratura, è che, in atto, il tema del valore sociale della vaccinazione nella popolazione adulta/anziana viene affrontato nell’ambito delle valutazioni economiche dei vaccini o delle vaccinazioni considerate. Il valore sociale, in questi casi, viene incluso nelle valutazioni economiche considerando non solo la prospettiva del SSN ma anche quello della società. Diversi studi, infatti, hanno sottolineato l’importanza di includere nelle valutazioni economiche sui vaccini anche la prospettiva sociale, proprio alla luce del valore sociale della vaccinazione.
Il valore sociale delle vaccinazioni è una tematica che, negli ultimi anni, ha visto particolare interesse da parte della comunità scientifica internazionale che sottolinea la necessità di implementare e sviluppare modelli/strumenti per supportare i processi di Health Technology Assessment (HTA) o altri frameworks di valutazione, al fine di riconoscere il valore complessivo della vaccinazione. Purtroppo, però, dai dati disponibili si evince che anche in Italia non è stato ancora implementato un processo di valutazione dei vaccini rivolti alla protezione della popolazione a rischio e anziana che tenga conto del valore complessivo offerto dalla vaccinazione.
Sulla base di quanto emerso dalla nostra revisione è evidente, quindi, come la conoscenza e la comunicazione del valore complessivo della vaccinazione sia fondamentale e necessario per guidare politiche sanitarie in ambito di immunizzazione evidence-based e value-based.
Sulla base dei dati disponibili, il giudizio etico è risultato complessivamente positivo. La possibilità di disporre di un vaccino che ha un profilo di efficacia/tollerabilità/sicurezza favorevole comporta la necessità di renderlo disponibile a quanti rispondono ai criteri stabiliti negli studi clinici. La limitatezza delle risorse disponibili in sanità potrebbe, però, sollevare il problema se sia possibile garantire questo trattamento a tutti.
Per quanto riguarda il rapporto costo/efficacia di Arexvy, i risultati dell’analisi economica mettono in evidenza che, per gli scenari studiati, il vaccino offre il potenziale per una sostanziale riduzione del carico di malattia associato all’RSV, in Italia, negli anziani e negli adulti over60 ad alto richio, nonché potenziali riduzioni dei costi diretti per il SSN. Per questi motivi sarebbe giusto aggiornare il calendario vaccinale dell’attuale PNPV inserendo la raccomandazione alla vaccinazione contro RSV per le persone appartenenti alle categorie a rischio per età o per patologia/condizione.
I decision-makers dovranno, comunque, porre particolare attenzione ai seguenti aspetti:
la necessità di predisporre colloqui personalizzati in fase di somministrazione del vaccino, che prendano in esame tutte le variabili legate alla condizione clinica del soggetto interessato; la verifica di un uguale accesso al vaccino da parte della popolazione over 60;
una specifica attenzione alla farmacovigilanza, con particolare riferimento alle segnalazioni di eventi avversi di tipo neuro-infiammatorio;
l’organizzazione di campagne di educazione vaccinale in modo da sensibilizzare alla vaccinazione anti-RSV, aumentare l’adesione e ridurre le situazioni di esitazione;
l’informazione capillare della popolazione sui rischi delle malattie causate dal RSV, la possibilità di contrarre l’infezione da RSV più di una volta, con la raccomandazione di vaccinarsi contro RSV anche se si è avuta la malattia in passato.
I risultati di questa valutazione di HTA indicano che un programma di vaccinazione che utilizza una dose del vaccino adiuvato RSVPreF3 OA (Arexvy®) nella popolazione di età ≥ 75 anni e nella popolazione ad alto rischio ≥ 60 anni, offre il potenziale per una sostanziale riduzione del carico di malattia associato ad RSV negli adulti/anziani in Italia e potenziali riduzioni dei costi sanitari diretti per il SSN.
Tenendo conto dell’impatto sociosanitario significativo delle infezioni da RSV nella popolazione adulta a rischio e anziana e dell’associato unmet need, la vaccinazione con una singola dose di Arexvy® è raccomandabile anche in Italia. I risultati di questo HTA potrebbero, pertanto, essere utili per supportare i decisori e i professionisti sanitari nel prendere decisioni evidence-based sulla vaccinazione contro l’RSV in Italia.