Classes de Recomendação:
Classe I: Condições para as quais há evidências conclusivas e, na sua falta, consenso geral de que o procedimento é seguro e útil/eficaz.
Classe II: Condições para as quais há evidências conflitantes e/ou divergência de opinião sobre segurança e utilidade/eficácia do procedimento.
Classe IIa: Peso ou evidência/opinião a favor do procedimento. A maioria aprova.
Classe IIb: Segurança e utilidade/eficácia menos estabelecidas, havendo opiniões divergentes.
Classe III: Condições para as quais há evidências e/ou consenso de que o procedimento não é útil/eficaz e, em alguns casos, pode ser prejudicial.
Níveis de Evidência
Nível A: Dados obtidos a partir de múltiplos estudos randomizados de bom porte, concordantes e/ou de metanálise robusta de estudos randomizados.
Nível B: Dados obtidos a partir de metanálise menos robusta, a partir de um único estudo randomizado e/ou de estudos observacionais.
Nível C: Dados obtidos de opiniões consensuais de especialistas.
| Diretriz Brasileira de Ergometria em População Adulta – 2024 | |
|---|---|
| O relatório abaixo lista as declarações de interesse conforme relatadas à SBC pelos especialistas durante o período de desenvolvimento deste posicionamento, 2022/2023. | |
| Especialista | Tipo de relacionamento com a indústria |
| Anderson Donelli da Silveira | Nada a ser declarado |
| Andréa Maria Gomes Marinho Falcão | Nada a ser declarado |
| Antonio Eduardo Monteiro de Almeida | Nada a ser declarado |
| Arnaldo Laffitte Stier Junior | Declaração financeira A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: - Libbs: educação continuada, Ebatz, Vatis. Outros relacionamentos Participação societária de qualquer natureza e qualquer valor economicamente apreciável de empresas na área de saúde, de ensino ou em empresas concorrentes ou fornecedoras da SBC: - Quanta Diagnóstico Curitiba. |
| Artur Haddad Herdy | Nada a ser declarado |
| Carlos Alberto Cordeiro Hossri | Nada a ser declarado |
| Claudia Lucia Barros de Castro | Nada a ser declarado |
| Clea Simone Sabino de Souza Colombo | Nada a ser declarado |
| Dalton Bertolim Precoma | Declaração financeira A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: - Novonordisk: Ozempic; Daiichi-Sankyo: Lixiana; Servier: Vastarel; Astrazeneca: Forxiga. B - Financiamento de pesquisas sob sua responsabilidade direta/pessoal (direcionado ao departamento ou instituição) provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: - Bayer: anticoagulante; Janssen: anticoagulante; Novonordisk: cardiometabolismo; Astrazeneca: insuficiência cardíaca, hipercalcemia, disfunção diastólica; Daiichi-Sankyo: anticoagulante; Cardiol: COVID e miocardite; Servier: coronariopatia crônica. Outros relacionamentos Financiamento de atividades de educação médica continuada, incluindo viagens, hospedagens e inscrições para congressos e cursos, provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: - Novonordisk: cardiometabolismo; Daiichi-Sankyo: anticoagulante; Servier: coronariopatia crônica; Torrent: dislipidemia. Participação societária de qualquer natureza e qualquer valor economicamente apreciável de empresas na área de saúde, de ensino ou em empresas concorrentes ou fornecedoras da SBC: - Área da Saúde: medicina nuclear. |
| Fabio Sandoli de Brito | Nada a ser declarado |
| Felipe Lopes Malafaia | Nada a ser declarado |
| Iran Castro | Nada a ser declarado |
| José Luiz Barros Pena | Nada a ser declarado |
| Josmar de Castro Alves | Nada a ser declarado |
| Leonardo Filipe Benedeti Marinucci | Nada a ser declarado |
| Luiz Eduardo Fonteles Ritt | Declaração financeira A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: - Boeringher Lilly: Jardiance; Novonordis: pesquisador em estudos; Astrazeneca; Novartis; Bayer; Bristol; Pfizer. B - Financiamento de pesquisas sob sua responsabilidade direta/pessoal (direcionado ao departamento ou instituição) provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: - MDI Medical. Outros relacionamentos Financiamento de atividades de educação médica continuada, incluindo viagens, hospedagens e inscrições para congressos e cursos, provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: - Novo Nordisk: Ozempic. |
| Luiz Eduardo Mastrocola | Nada a ser declarado |
| Marcelo Luiz Campos Vieira | Nada a ser declarado |
| Mauricio Milani | Nada a ser declarado |
| Mauro Augusto dos Santos | Nada a ser declarado |
| Miguel Morita Fernandes da Silva | Declaração financeira A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: - Novartis: Entresto; Bayer: Firialta; Astrazeneca: Forxiga; Boehringer: Jardiance. B - Financiamento de pesquisas sob sua responsabilidade direta/pessoal (direcionado ao departamento ou instituição) provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: - Novartis; Bayer. |
| Odilon Gariglio Alvarenga de Freitas | Nada a ser declarado |
| Pedro Ferreira de Albuquerque | Declaração financeira A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: - MMedicine Cursos: aula de Ergometria. Outros relacionamentos Vínculo empregatício com a indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras, assim como se tem relação vínculo empregatício com operadoras de planos de saúde ou em auditorias médicas (incluindo meio período) durante o ano para o qual você está declarando: - Sócio Cooperado da Unimed Maceió Alagoas. |
| Ricardo Quental Coutinho | Nada a ser declarado |
| Ricardo Stein | Outros relacionamentos Financiamento de atividades de educação médica continuada, incluindo viagens, hospedagens e inscrições para congressos e cursos, provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: - Life Genomics |
| Salvador Manoel Serra | Nada a ser declarado |
| Susimeire Buglia | Nada a ser declarado |
| Tales de Carvalho | Nada a ser declarado |
| William Azem Chalela | Nada a ser declarado |
Sumário
Parte 1 – Indicações, Aspectos Legais e Formação em Ergometria 08
1. Introdução 08
2. Indicações e Contraindicações do TE e TCPE, Inclusive Associados a Imagens 08
2.1. Indicações Gerais do TE 08
2.2. Indicações do TE em Situações Clínicas Específicas 09
2.2.1. Indicações do TE na Doença Arterial Coronariana 09
2.2.2. Indicações do TE em Assintomáticos 09
2.2.3. Indicações do TE em Atletas 09
2.2.4. Indicações do TE na Hipertensão Arterial Sistêmica 09
2.2.5. Indicações do TE em Valvopatias 09
2.2.6. Indicações na Insuficiência Cardíaca e nas Cardiomiopatias 11
2.2.7. Indicações do TE no Contexto de Arritmias e Distúrbios de Condução 11
2.2.8. Indicações do TE em Outras Condições Clínicas 12
2.3. Contraindicações Relativas e Absolutas 12
2.3.1. Contraindicações Relativas do TE/TCPE 12
2.3.2. Contraindicações Absolutas do TE/TCPE 14
2.4. Indicações do TCPE 14
2.4.1. Indicações Gerais do TCPE 14
2.4.2. Indicações do TCPE em Situações Clínicas Específicas 14
2.5. Indicações do TE/TCPE Associados a Métodos de Imagem 14
2.5.1. Cintilografia de Perfusão Miocárdica 14
2.5.2. Indicações da Ecocardiografia sob Estresse 15
3. Aspectos Legais e Condições Imprescindíveis para Realização do TE, TCPE e Quando Associados a Exames Cardiológicos de Imagem 16
3.1. Aspectos Legais da Prática do TE e TCPE 16
3.2. Condições Imprescindíveis à Realização do TE e TCPE 16
3.3. Termo de Consentimento para o TE e TCPE 20
3.4. Termo de Consentimento ao TE Associado a Métodos de Imagem 21
4. Aspectos Referentes à Formação na Área de Atuação de Ergometria 21
Parte 2 – Teste Ergométrico 23
1. Metodologia do TE 23
1.1. Condições Básicas para a Realização do TE 23
1.1.1. Equipe 23
1.1.2. Área Física 23
1.1.3. Equipamentos 23
1.1.4. Material para Emergência Médica 24
1.1.5. Medicamentos para Emergência Médica 24
1.1.6. Orientações ao Paciente na Marcação do TE 24
1.2. Procedimentos Básicos para a Realização do TE 24
1.2.1. Fase Pré-teste 24
1.2.2. Avaliação Inicial 25
1.2.3. Exame Físico Sumário e Específico 25
1.2.4. Sistema de Monitorização e Registro Eletrocardiográfico 25
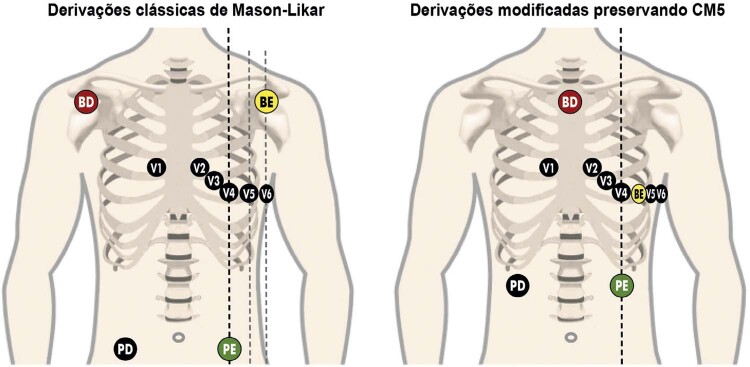
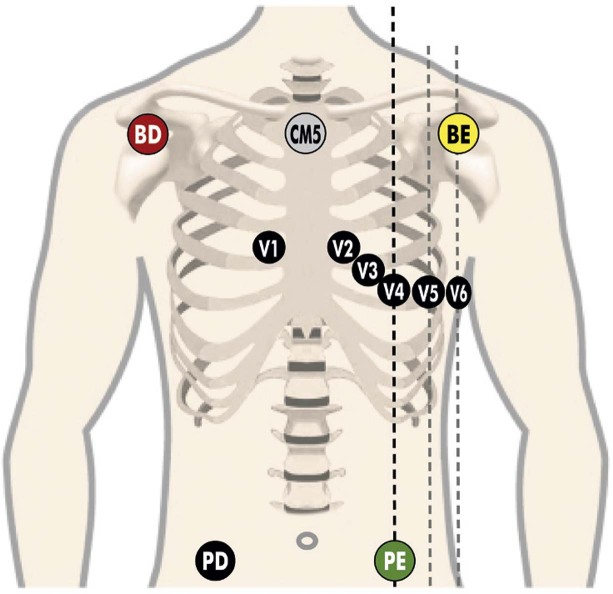
1.2.4.1. Sistemas de Três Derivações 25
1.2.4.2. Sistema de 12 Derivações 25
1.2.4.3. Sistema de 13 ou Mais Derivações 26
1.2.4.4. Preparo da Pele para Monitorização Eletrocardiográfica 26
1.2.4.5. Registros Eletrocardiográficos 26
1.2.5. Monitorização dos Dados Hemodinâmicos 27
1.2.5.1. Monitorização da Frequência Cardíaca 27
1.2.5.2. Monitorização da Pressão Arterial Sistêmica 27
1.2.6. Monitoração de Sinais e Sintomas 27
1.2.7. Profilaxia de Complicações no TE 28
1.3. Ergômetros 28
1.3.1. Cicloergômetro 28
1.3.2. Esteira Ergométrica 28
1.3.3. Cicloergômetro de Braço 28
1.3.4. Outros Ergômetros 28
1.4. Escolha do Protocolo 28
1.4.1. Protocolos para Bicicleta Ergométrica 28
1.4.2. Protocolos para Esteira Ergométrica 29
1.4.2.1. Protocolos Escalonados 29
1.4.2.1.1. Protocolo de Bruce 29
1.4.2.1.2. Protocolo de Bruce Modificado 29
1.4.2.1.3. Protocolo de Ellestad 29
1.4.2.1.4. Protocolo de Naughton 29
1.4.2.2. Protocolo em Rampa 29
1.4.3. Protocolo para Ergômetro de Braços 30
1.4.4. Interrupção/Término do Exame 30
2. Acurácia, Probabilidade e Escores Pré-teste 30
2.1. Probabilidade Pré-teste de DAC 30
2.2. Sensibilidade, Especificidade e Valor Preditivo 30
2.3. Escores e Fatores de Risco DCV Pré-teste 31
3. Respostas Clínicas e Hemodinâmicas ao Esforço na População Adulta 32
3.1. Respostas Clínicas 32
3.1.1. Tolerância ao Esforço 32
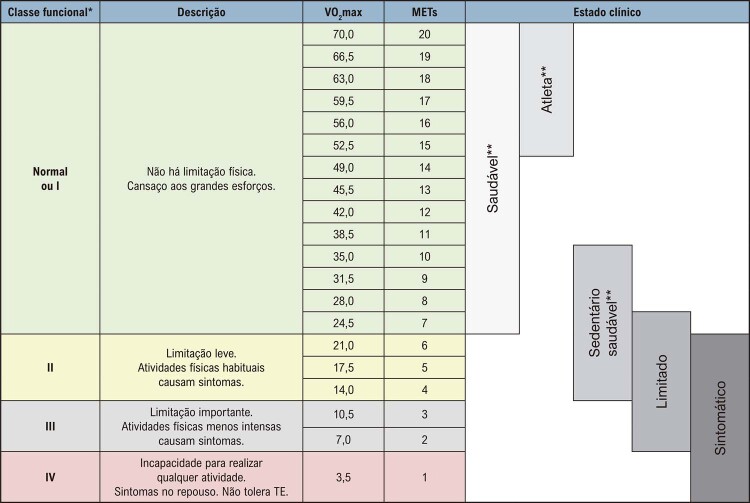
3.1.2. Aptidão Cardiorrespiratória/Classificação Funcional 32
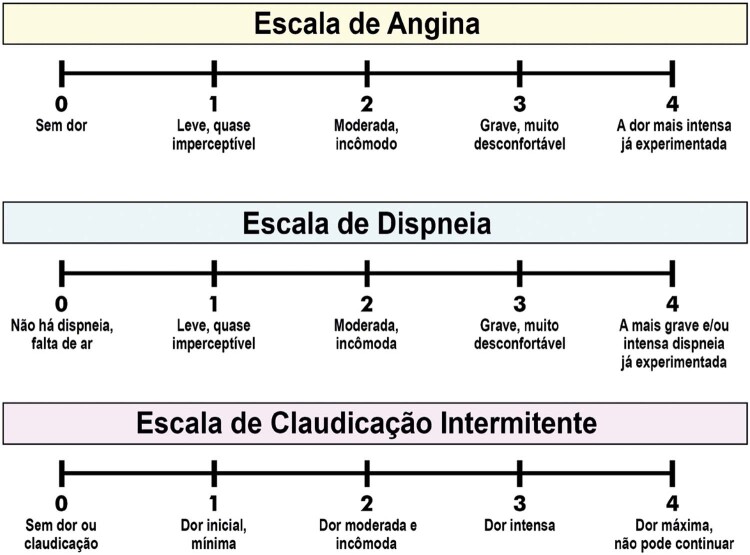
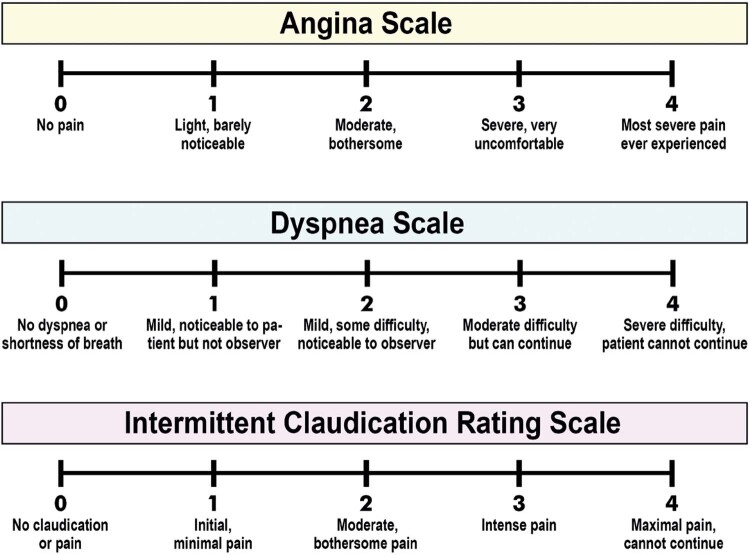
3.1.3. Sintomas 33
3.1.4. Ectoscopia/Ausculta 34
3.2. Respostas Hemodinâmicas 35
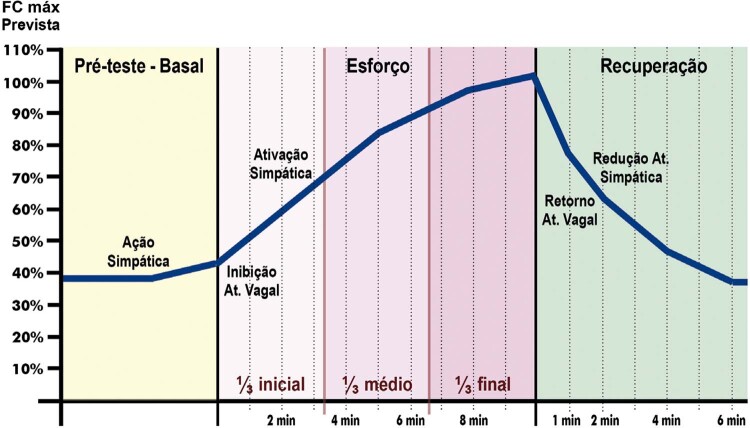
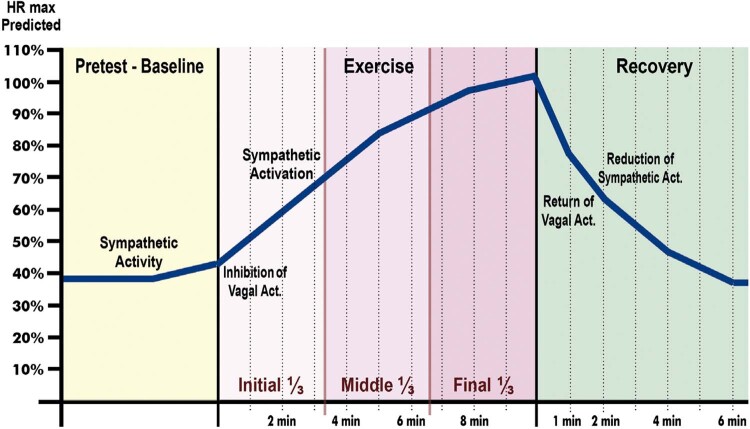
3.2.1. Frequência Cardíaca 35
3.2.1.1. Frequência Cardíaca de Repouso 35
3.2.1.2. Resposta Cronotrópica 35
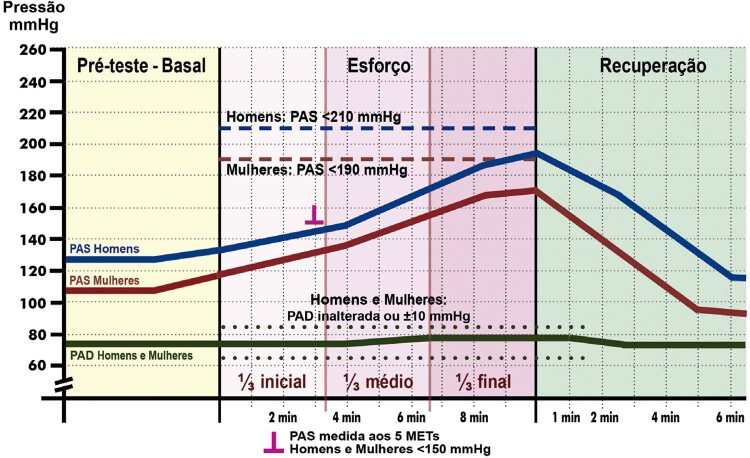
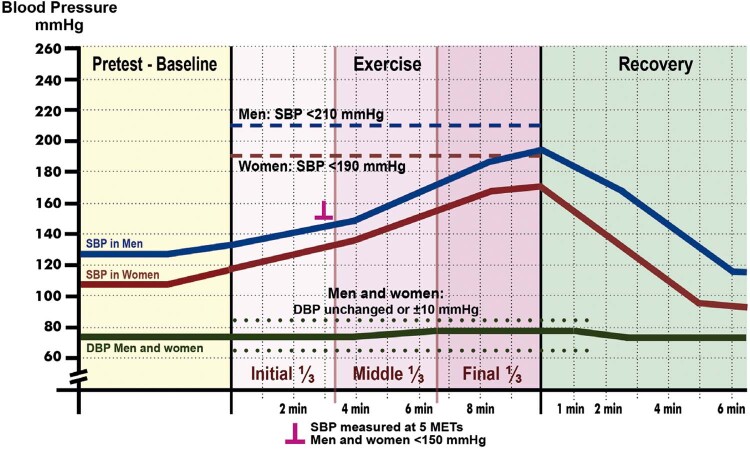
3.2.2. Resposta da Pressão Arterial 36
3.2.3. Duplo-Produto 39
4. Respostas Eletrocardiográficas 41
4.1. Onda P 42
4.1.1. Respostas Normais 42
4.1.2. Respostas Anormais 42
4.2. Intervalo PR/Segmento PR 43
4.2.1. Respostas Normais 43
4.2.2. Respostas Anormais 43
4.3. Onda Q 43
4.3.1. Respostas Normais 43
4.3.2. Respostas Anormais 43
4.4. Onda R 43
4.4.1. Respostas Normais 43
4.4.2. Respostas Anormais 43
4.5. Onda S 44
4.5.1. Respostas Normais 44
4.5.2. Respostas Anormais 44
4.6. Duração QRS 44
4. 6.1. Respostas Normais 44
4.6.2. Respostas Anormais 44
4.7. Fragmentação de QRS em Alta Frequência 44
4.7.1. Respostas Normais 44
4.7.2. Respostas Anormais 45
4.8. Onda T 45
4.8.1. Respostas Normais 45
4.8.2. Respostas Anormais 45
4.9. Onda U 45
4.9.1. Respostas Normais 45
4.9.2. Respostas Anormais 45
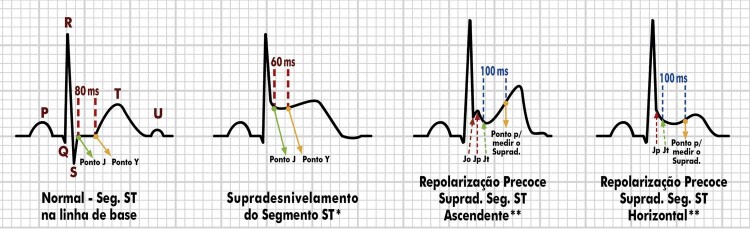
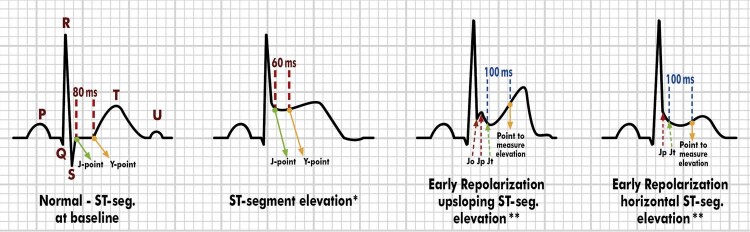
4.10. Repolarização Precoce 46
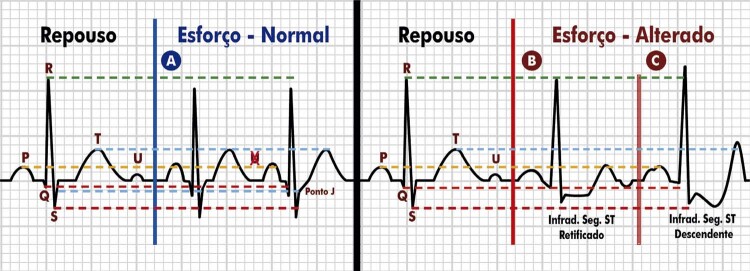
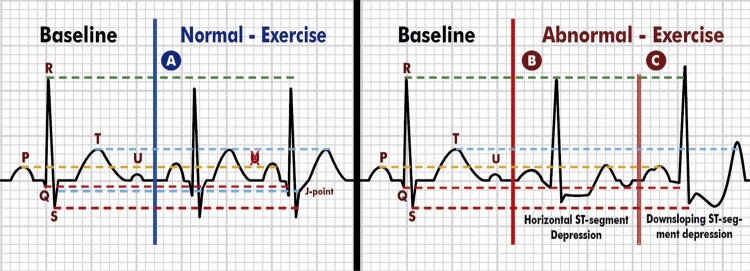
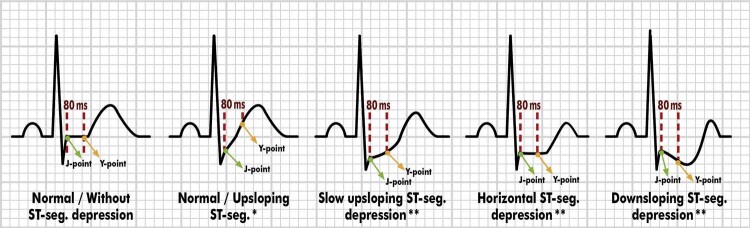
4.11. Supradesnivelamento do Segmento ST 47
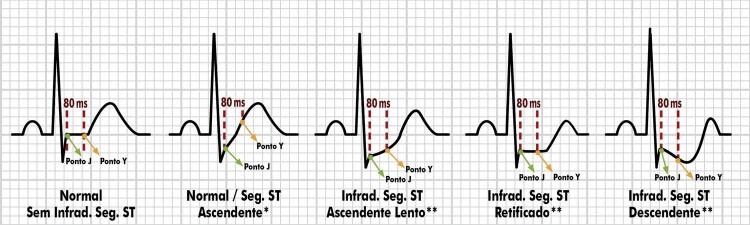
4.12. Ponto J e Infradesnivelamento Ascendente 47
4.13. Infradesnivelamento do Segmento ST: Ascendente Lento, Horizontal e Descendente 48
4.13.1. Sinal de Corcunda do Segmento ST 49
4.14. Normalização de Alterações do Segmento ST 49
4.15. Inclinação ( Slope ) ST/FC, Índice ST/FC, Loop ST/FC e Histerese ST/FC 49
4.15.1. Inclinação ( Slope ) ST/FC 49
4.15.2. Índice ST/FC 49
4.15.3. Loop ST/FC 50
4.15.4. Histerese ST/FC 50
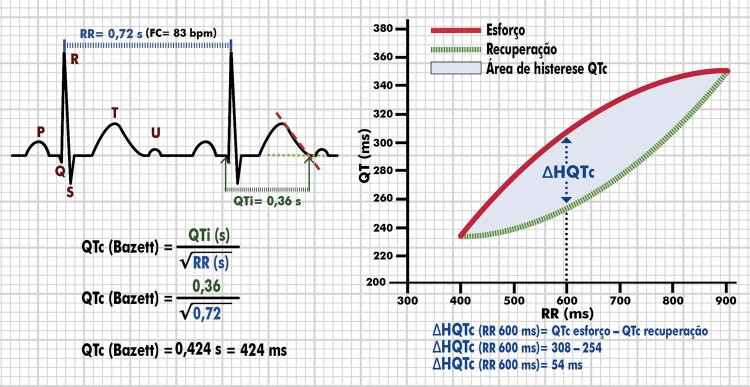
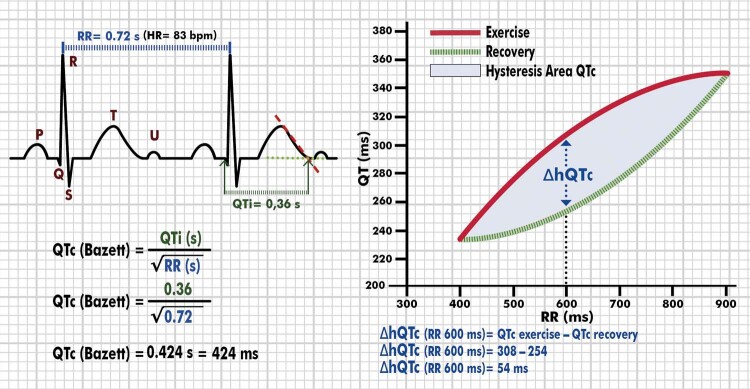
4.16. Intervalo QT/QTc/Histerese QT/Dispersão QT 50
4.17. Distúrbios da Condução Atrioventricular, Intraventricular e da Formação do Impulso 51
4.17.1. Distúrbios da Condução Atrioventricular 51
4.17.1.1. Bloqueio Atrioventricular (BAV) de Primeiro Grau 51
4.17.1.2. Bloqueio Atrioventricular de Segundo Grau Tipo I (Mobitz I) 52
4.17.1.3. Bloqueio Atrioventricular de Segundo Grau Tipo II (Mobitz II) 52
4.17.1.4. Bloqueio Atrioventricular Tipo 2:1/Bloqueio Atrioventricular Avançado ou de Alto Grau/Bloqueio Atrioventricular de Terceiro Grau ou Total 52
4.17.2. Distúrbios da Condução Intraventricular 53
4.17.2.1. Bloqueio de Ramo Esquerdo 53
4.17.2.1.1. Bloqueio do Ramo Esquerdo Preexistente 53
4.17.2.1.2. Bloqueio do Ramo Esquerdo Esforço-induzido 53
4.17.2.2. Bloqueios Divisionais do Ramo Esquerdo 54
4.17.2.3. Bloqueio de Ramo Direito 54
4.17.2.3.1. Bloqueio de Ramo Direito Preexistente 54
4.17.2.3.2. Bloqueio de Ramo Direito Esforço-induzido 54
4.17.3. Distúrbios da Formação do Impulso 55
4.17.3.1. Arritmias Ventriculares 55
4.17.3.2. Arritmias Supraventriculares 57
4.17.3.3. Fibrilação Atrial/Flutter Atrial 57
4.17.3.4. Bradiarritmias/Incompetência Cronotrópica Crônica 58
4.17.3.5. Taquicardia Sinusal Inapropriada 59
4.18. Avaliação Metabólica Indireta 59
4.18.1. VO 2 /METs 59
4.18.2. Déficit Funcional Aeróbico (FAI) 59
4.18.3. Déficit Aeróbio Miocárdico (MAI) 60
4.19. Escores de Risco Pós-teste e Variáveis Prognósticas do TE 60
4.19.1. Escore de Duke 60
4.19.2. Escore de Athenas/Escore QRS 61
4.19.3. Escore de Raxwal e Morise 61
5. Critérios de Interrupção do Esforço 62
6. Elaboração do Laudo do TE 62
6.1. Dados Gerais 62
6.2. Dados Observados, Mensurados e Registrados 62
6.3. Relatório Descritivo 63
6.4. Conclusão 64
6.5. Registros Eletrocardiográficos 64
7. Exames Realizados Simultaneamente e Adicionalmente ao TE 65
7.1. Índice Tornozelo-braquial 65
7.1.1. Realização do Exame ITB 65
7.1.1.1. ITB de Repouso 65
7.1.1.2. ITB Pós-esforço 66
7.1.2. Preparação do Paciente e Técnica de Exame 66
7.2. Oximetria Não Invasiva 67
7.2.1. Equipamentos 67
7.2.2. Procedimentos da Oximetria Não Invasiva 68
7.2.3. Interpretação dos Dados 68
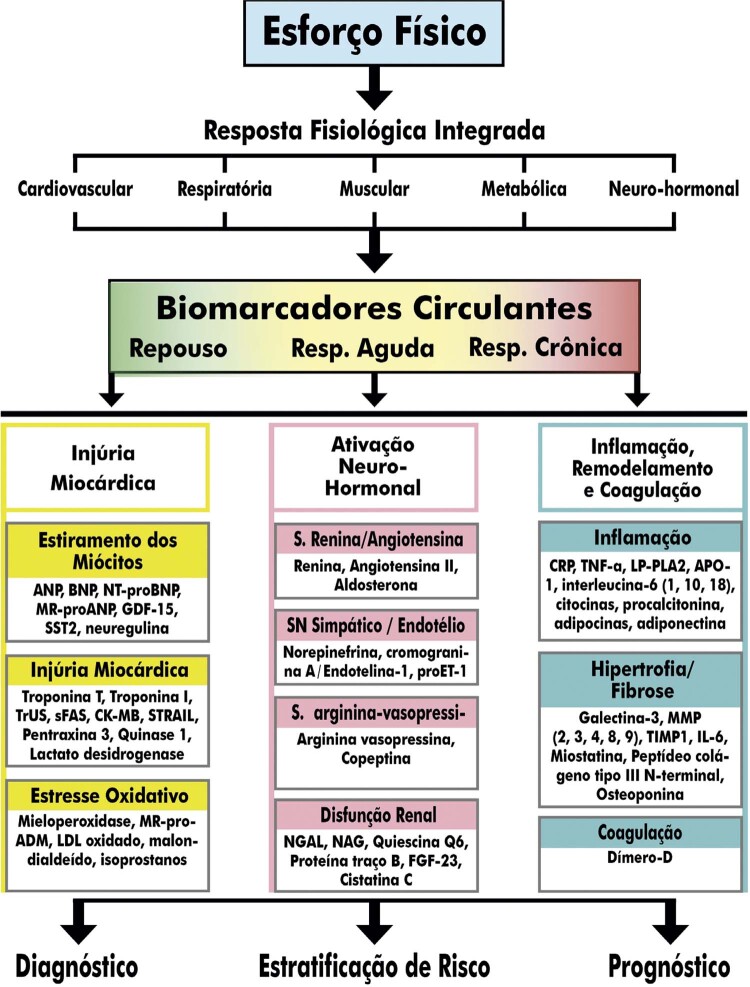
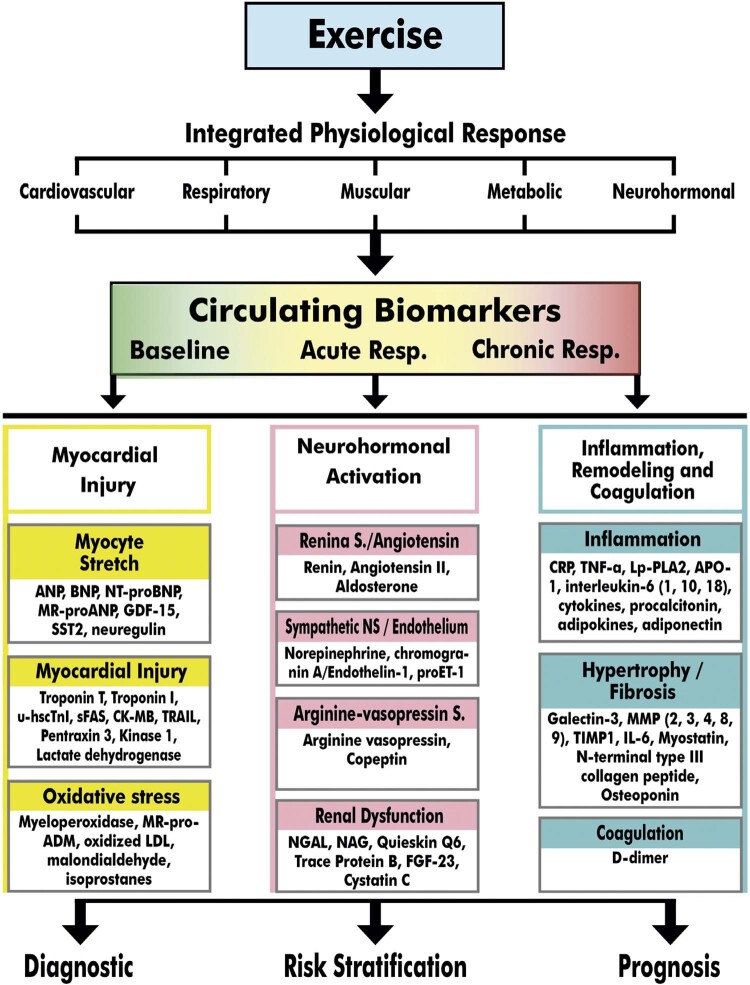
7.3. Biomarcadores e Exames Laboratoriais 69
7.3.1. Lactato Sanguíneo 70
7.3.2. Gasometria Arterial 70
8. Particularidades na Realização e Interpretação do TE em Condições Clínicas Específicas 71
8.1. Dextrocardia/ Situs Inversus 71
8.2. Doença de Chagas/Cardiomiopatia Chagásica 72
8.3. Doença Arterial Periférica 73
8.4. Doença de Parkinson 74
8.5. Doenças Valvares 75
8.5.1. Estenose Aórtica 75
8.5.2. Regurgitação Aórtica 76
8.5.3. Estenose Mitral 76
8.5.4. Regurgitação Mitral 77
8.5.5. Prolapso da Válvula Mitral 77
8.6. TE Pós-revascularização Miocárdica 78
8.6.1. TE após Intervenção Coronária Percutânea 78
8.6.2. TE após Cirurgia de Revascularização Miocárdica 79
Parte 3 – Teste Cardiopulmonar de Exercício 79
1. Introdução 79
2. Fisiologia do Exercício Aplicada ao TCPE 79
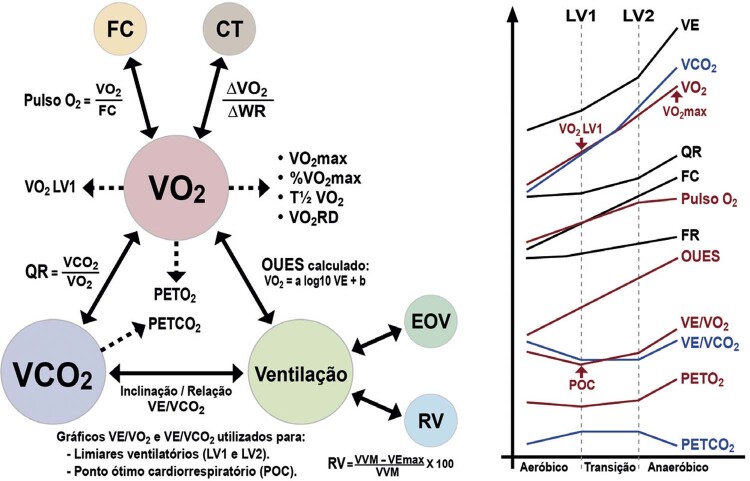
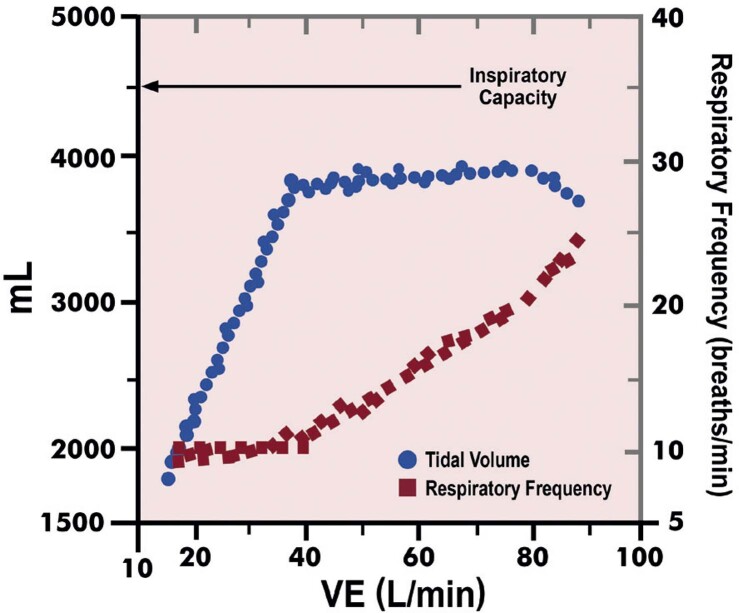
3. Ventilação Pulmonar, Gases no Ar Expirado e Variáveis Derivadas 80
3.1. Ventilação Pulmonar 80
3.1.1. Espirometria Basal 80
3.1.2. Ergoespirometria 81
3.1.3. Reserva Ventilatória 81
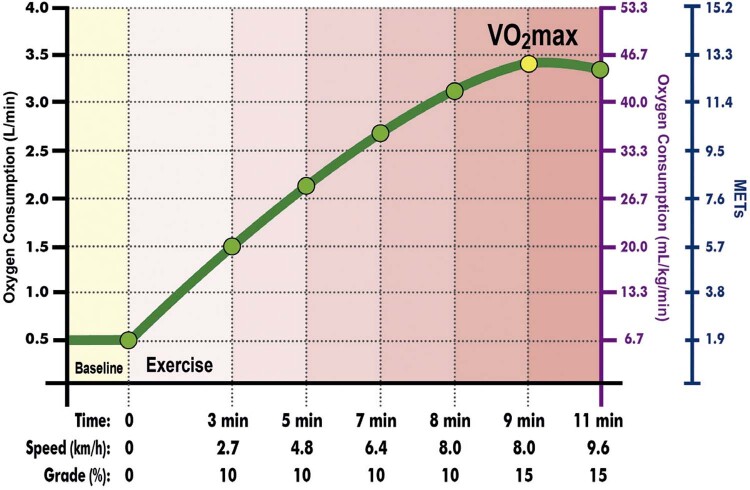
3.2. Consumo de Oxigênio 82
3.3. Produção de Gás Carbônico 82
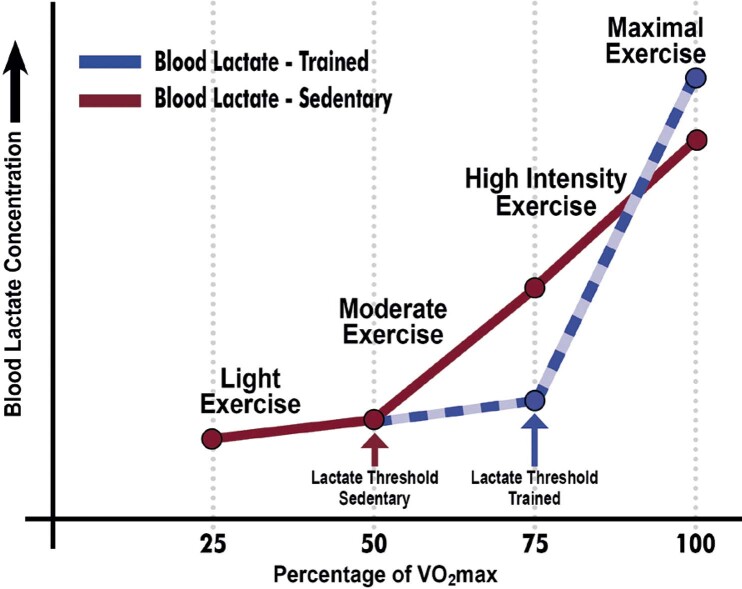
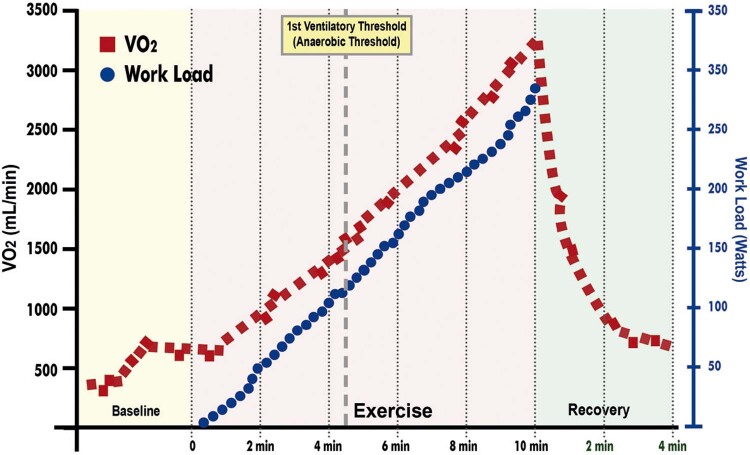
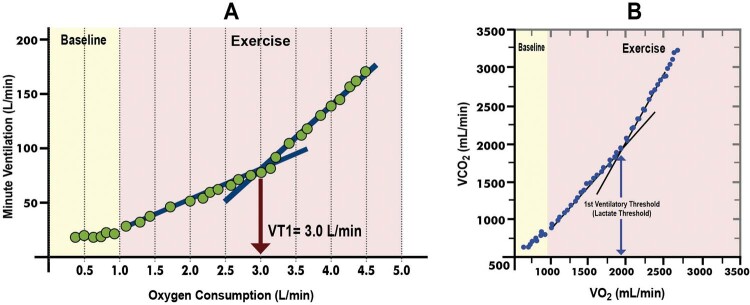
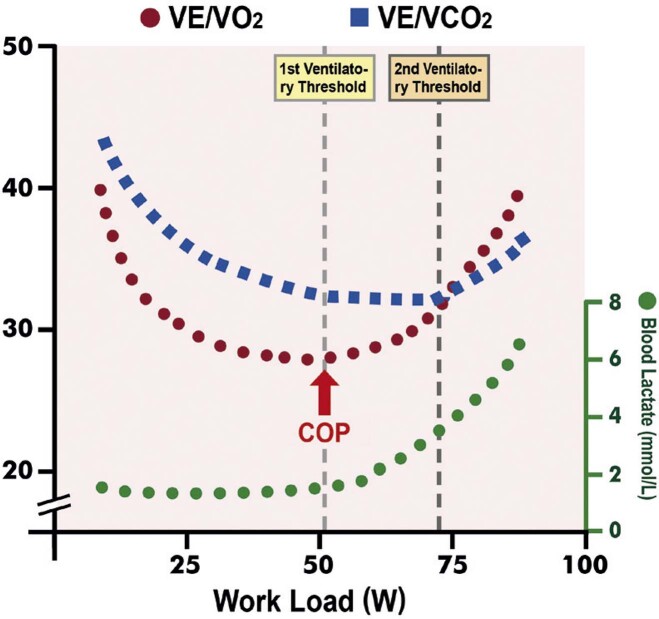
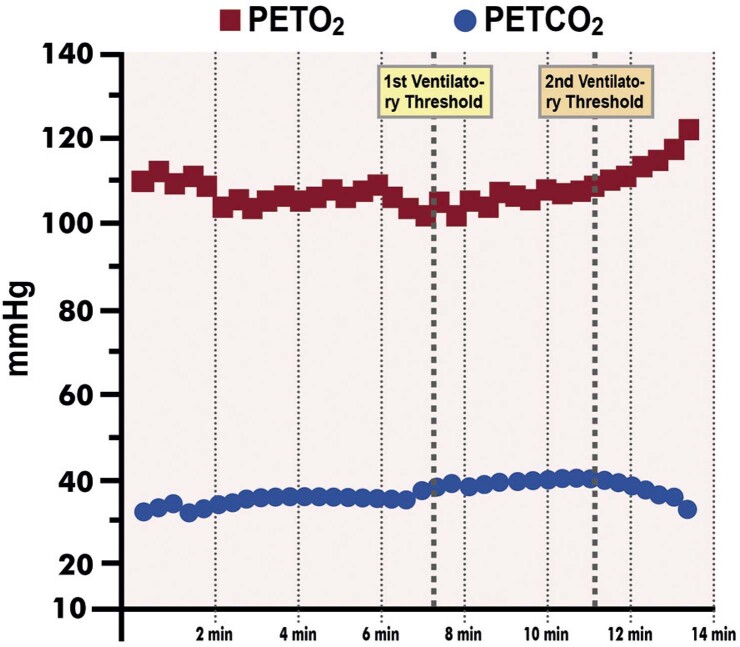
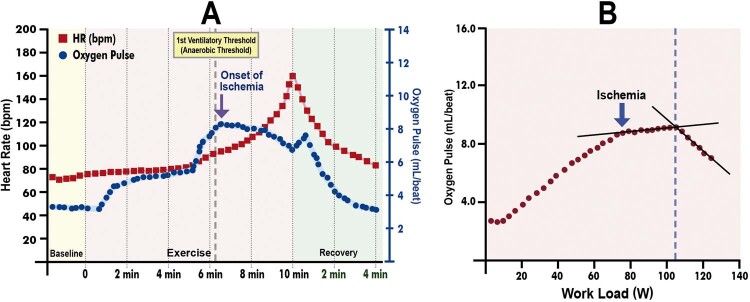
3.4. Limiares Ventilatórios 82
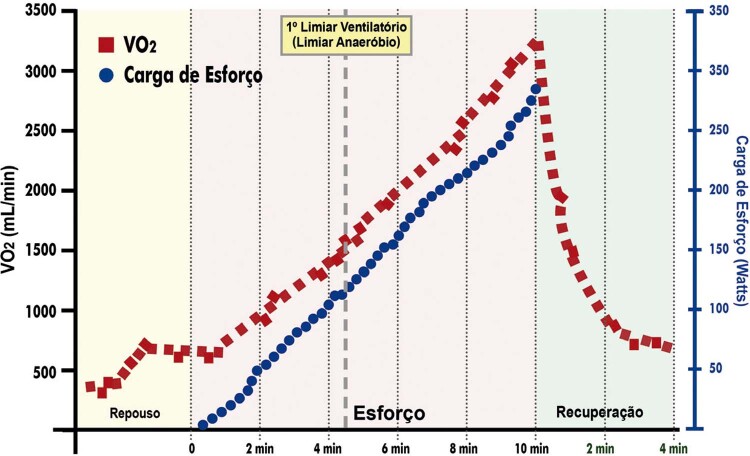
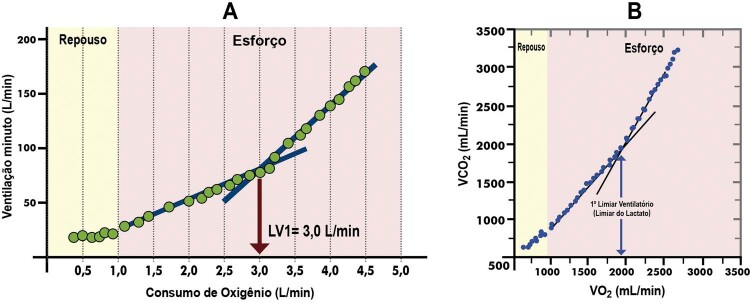
3.4.1. Primeiro Limiar Ventilatório 82
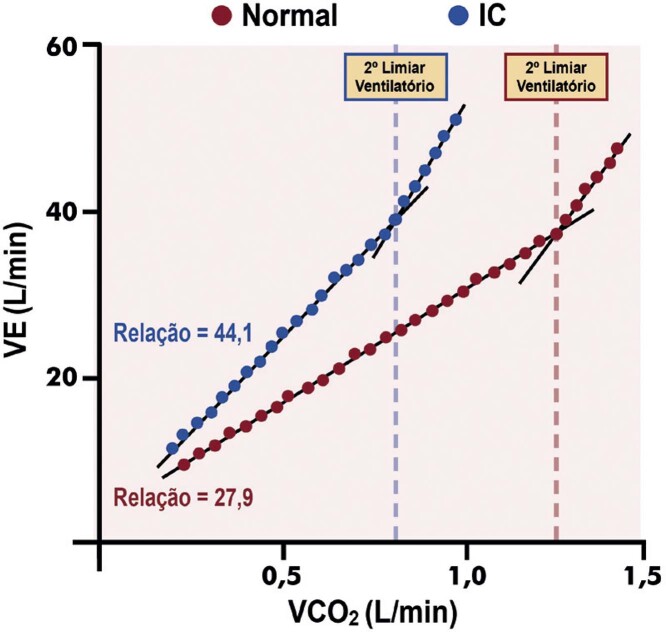
3.4.2. Segundo Limiar Ventilatório 83
3.5. Quociente Respiratório 84
3.6. Equivalentes Ventilatórios de Oxigênio e Gás Carbônico 84
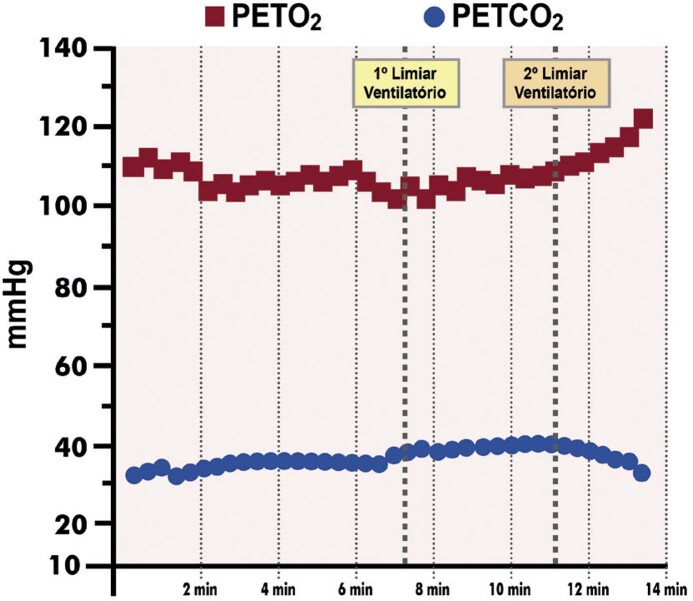
3.7. Pressões Parciais Expiratórias do Oxigênio e Dióxido de Carbono 84
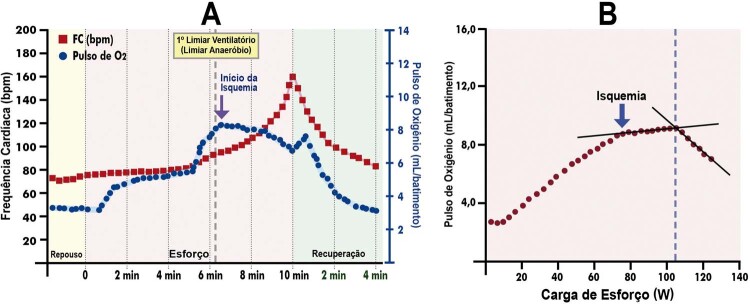
3.8. Pulso de Oxigênio 85
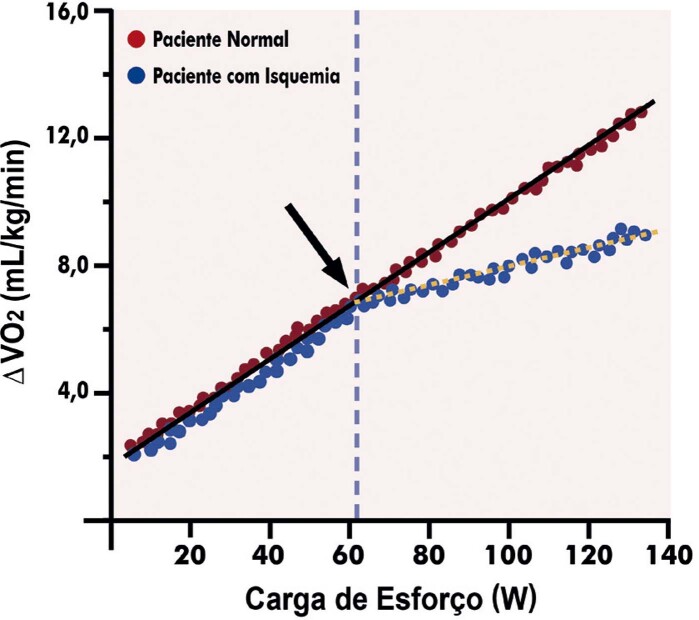
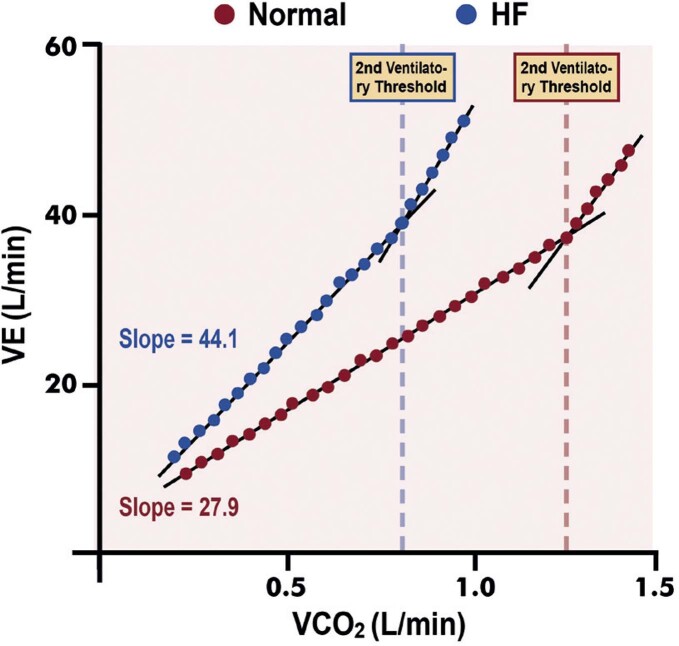
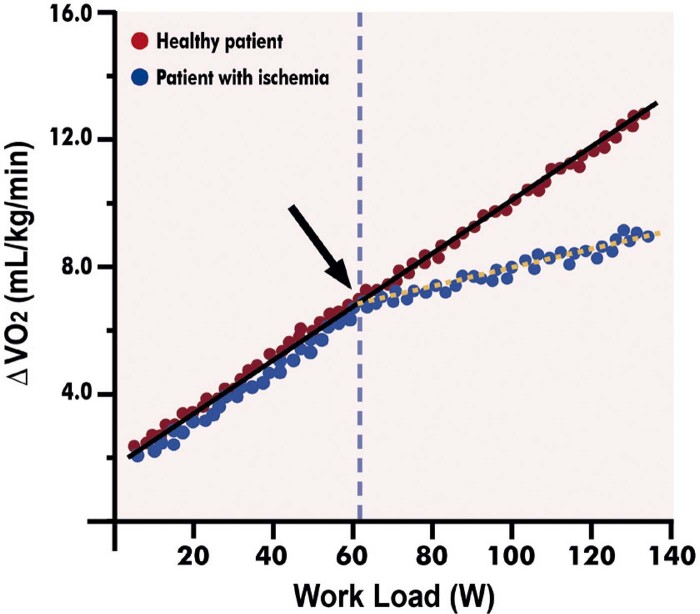
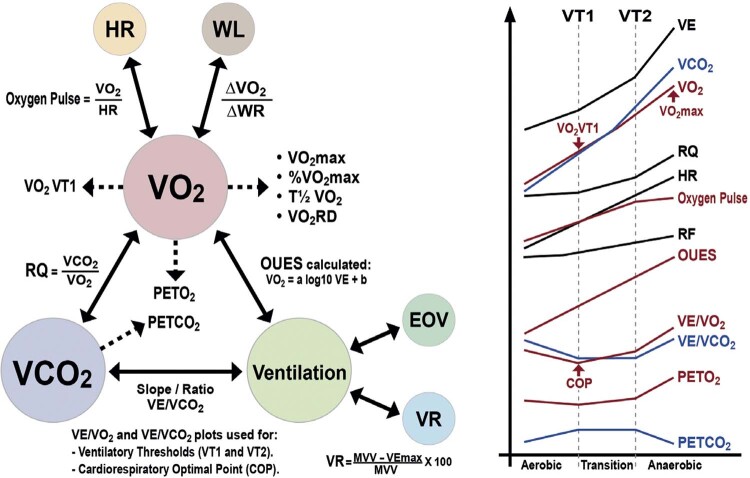
3.9. Relação Delta VO 2 e Delta Carga de Trabalho (ΔVO 2 /ΔWR) 85
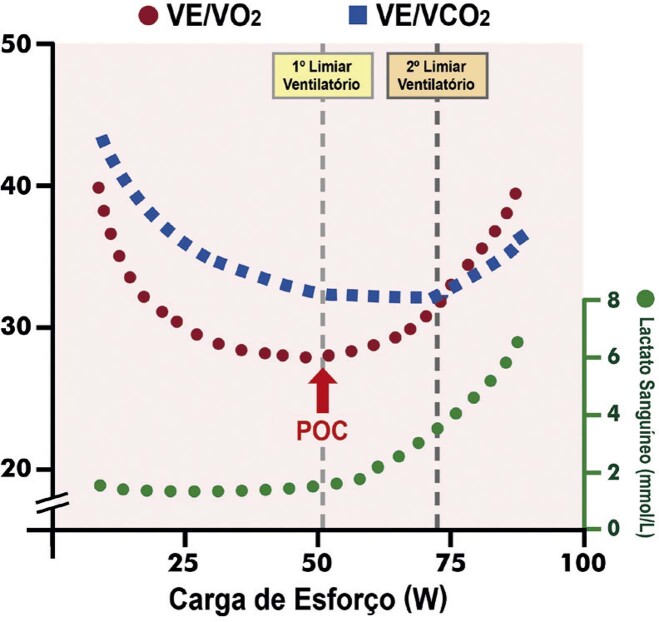
3.10. Ponto Ótimo Cardiorrespiratório 85
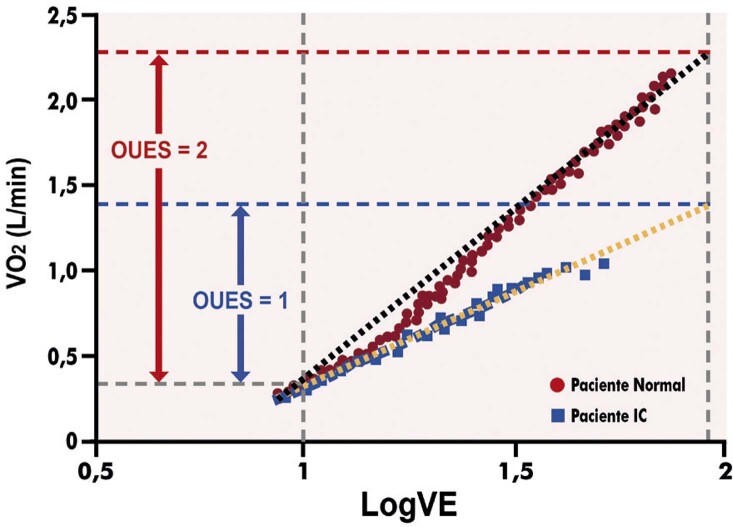
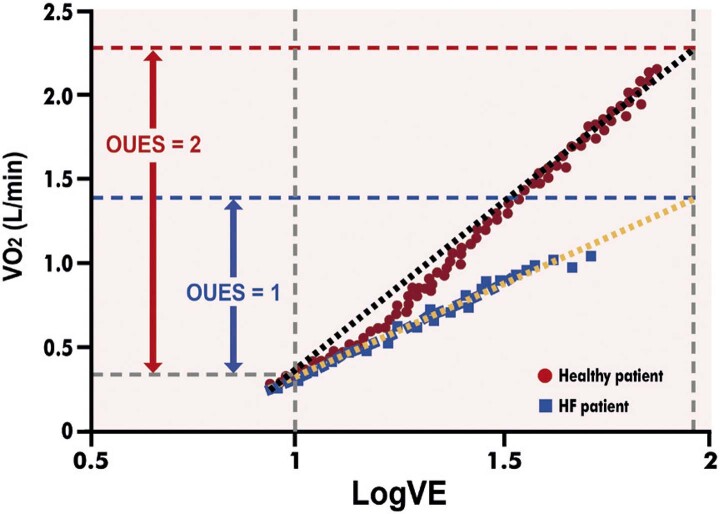
3.11. Inclinação da Eficiência da Captação do Oxigênio (OUES) 86
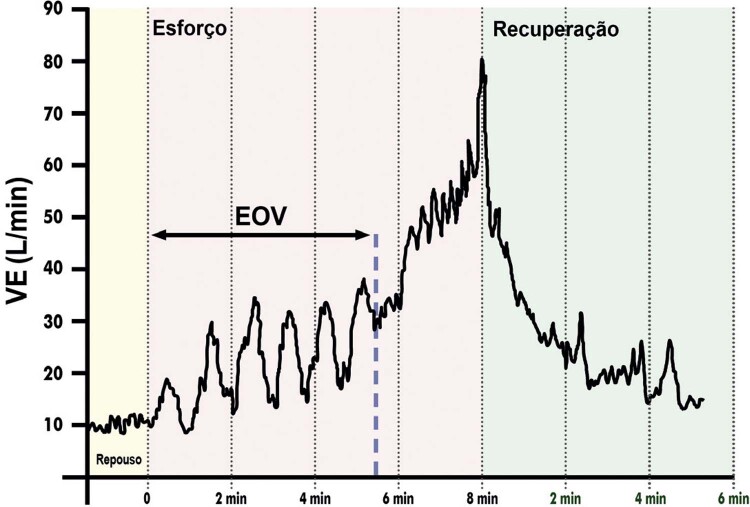
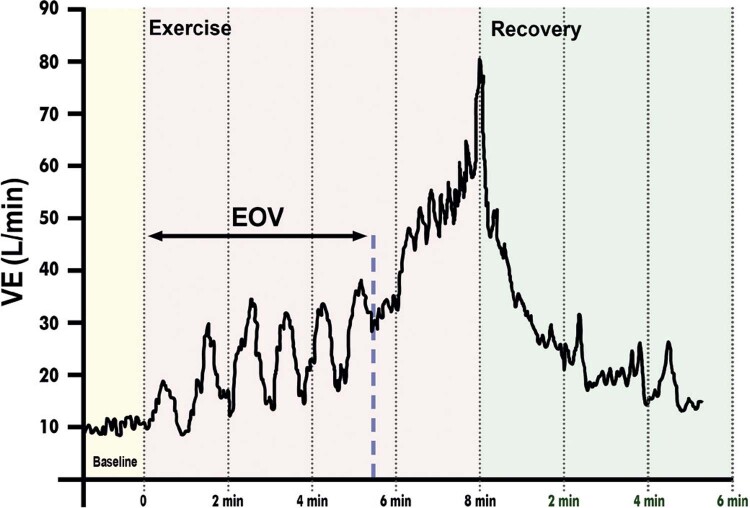
3.12. Ventilação Oscilatória ao Esforço 86
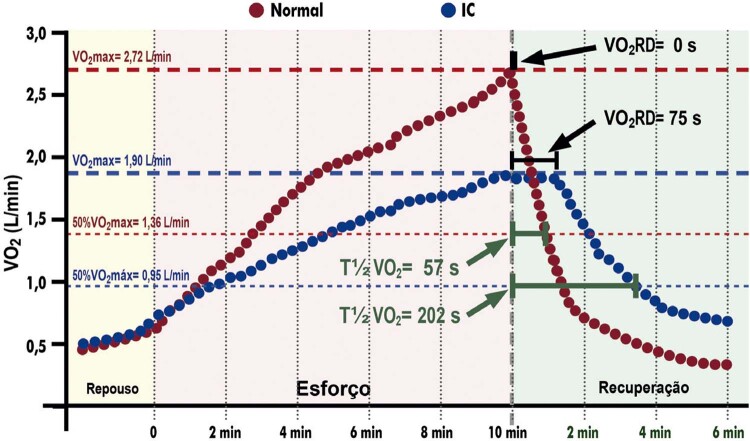
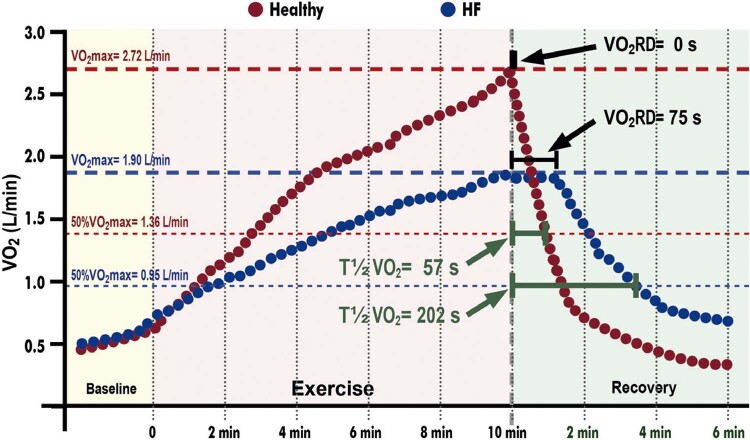
3.13. Tempo de Recuperação do Consumo de Oxigênio 87
3.14. Potência Circulatória e Potência Ventilatória 87
3.15. Valores de Referência de Variáveis do TCPE 88
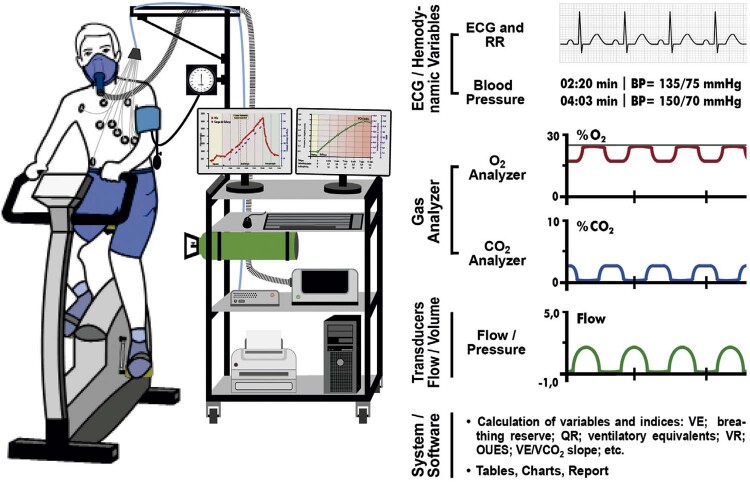
4. Equipamentos e Metodologia 88
4.1. Ergômetros 88
4.2. Transdutores de Fluxo ou Volume de Ar 88
4.3. Analisadores de Gás 88
4.4. Medições das Trocas Gasosas 88
4.5. Procedimentos de Calibração, Controle de Qualidade e Higienização 88
4.6. Protocolos 90
4.7. Software para Análise dos Dados 90
4.8. Recomendações Prévias aos Pacientes 90
5. Realização do TCPE em Algumas Situações Específicas 90
5.1. Insuficiência Cardíaca 90
5.2. Doença Arterial Coronariana 90
5.3. Miocardiopatia Hipertrófica 91
5.4. Valvopatias 91
5.5. Pneumopatias 91
5.5.1. Doença Pulmonar Obstrutiva Crônica 91
5.5.2. Doença Vascular Pulmonar 92
5.6. Diagnóstico Diferencial da Dispneia 93
5.7. Atletas e Exercitantes 94
5.8. Reabilitação Cardiorrespiratória 94
6. Interpretação e Elaboração do Laudo do TCPE 94
Parte 4 – Teste Ergométrico Associado aos Métodos de Imagem em Cardiologia 94
1. Estresses Cardiovasculares Associado aos Métodos de Imagem em Cardiologia 94
1.1. Cintilografia Perfusional Miocárdica 94
1.1.1. Metodologia do Estresse Físico – Teste Ergométrico 94
1.1.1.1. Contraindicações à Realização do Estresse Físico na CPM 95
1.1.1.2. Orientações para Marcação do Estresse Físico na CPM 95
1.1.1.3. Realização do Estresse Físico na CPM 95
1.1.1.4. Interpretação do TE na CPM 96
1.1.2. Metodologia das Provas Farmacológicas 96
1.1.2.1. Fármacos que Promovem Vasodilatação 96
1.1.2.1.1. Dipiridamol 96
1.1.2.1.2. Adenosina 96
1.1.2.2. Fármacos que Promovem a Elevação do Consumo de Oxigênio Miocárdico 97
1.1.3. Metodologia do Estresse Combinado 97
1.1.4. Novos Fármacos 97
1.2. Ecocardiografia sob Estresse 97
1.2.1. Metodologia 98
1.2.1.1. Metodologia do Estresse Físico 98
1.2.1.2. Metodologia do Estresse Farmacológico 98
1.2.1.2.1. Dobutamina 98
1.2.1.2.2. Vasodilatadores 99
1.2.1.3. Agentes de Realce Ultrassonográfico 99
Referências 100
Parte 1 – Indicações, Aspectos Legais e Formação em Ergometria
1. Introdução
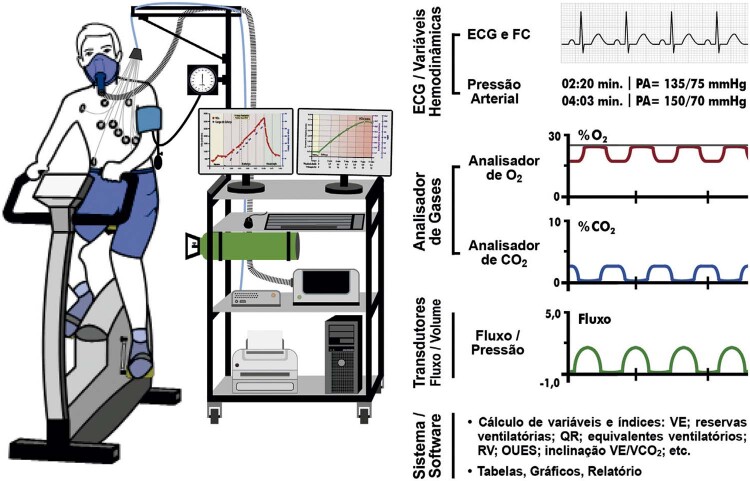
O Teste Ergométrico ou Teste de Exercício (TE) é um exame médico, complementar e rotineiro na prática clínica/cardiológica, no qual o indivíduo é submetido a um esforço físico programado e individualizado, com a finalidade de avaliar as respostas clínica, hemodinâmica, autonômica, eletrocardiográfica, metabólica indireta e eventualmente enzimática. 1 , 2 Recebe a denominação de Teste Cardiopulmonar de Exercício (TCPE) quando, ao realizar o TE, são feitas a avaliação dos parâmetros ventilatórios e a análise dos gases expirados. 3 A denominação Ergometria contempla o TE e o TCPE.
Em linhas gerais, o TE e TCPE:
– Contribuem para o diagnóstico e prognóstico de doenças cardiovasculares, fornecem orientações para a definição das intervenções terapêuticas, auxiliam na adoção de providências relacionadas à prevenção e à prática esportiva, são utilizados nas avaliações periciais médicas e fornecem subsídios para o acompanhamento evolutivo de pacientes. 1 , 3 - 5
– Apresentam alta reprodutibilidade, excelência reconhecida em termos de custo-benefício e custo-efetividade, são passíveis de realização em todas as regiões do Brasil. 1 , 6
– São reconhecidos e legalmente registrados como Área de Atuação em Ergometria pela Comissão Mista de Especialidades médicas. 7
– Têm grande importância como estressor cardiovascular associado aos métodos de imagem em cardiologia, especialmente visando ao diagnóstico e prognóstico da doença cardiovascular isquêmica. 8 , 9
Esta diretriz consolida e atualiza, em um único documento, todas as informações e recomendações presentes nas diretrizes anteriores da SBC sobre o TE e TCPE, abordando novos aspectos não considerados nos documentos anteriores, destacando-se como importantes novidades as informações relacionadas aos exames em população adulta e as necessárias adequações do exame em cenários de síndromes respiratórias agudas. 1 , 2 Esta diretriz será relevante fonte de consultas para os cardiologistas em geral e, de forma especial, para os médicos em formação e atuantes na área de Ergometria.
2. Indicações e Contraindicações do TE e TCPE, Inclusive Associados a Imagens
2.1. Indicações Gerais do TE
O TE está amplamente disponível no Brasil, a um custo acessível e com reconhecida utilidade na prática clínica. 10 , 11 É uma importante ferramenta de diagnóstico, para estratificação de risco e determinação de prognóstico em pacientes com doença cardíaca conhecida ou suspeita. Permite avaliar a repercussão das doenças cardiovasculares e a eficácia de terapêuticas implementadas.
Indicações e objetivos gerais do TE: 1 , 6 , 12 - 18
1) Avaliar sintomas esforço-induzidos.
2) Determinar capacidade funcional.
3) Avaliar o comportamento da pressão arterial.
4) Avaliar o comportamento da frequência cardíaca.
5) Detectar isquemia miocárdica.
6) Reconhecer as arritmias cardíacas quanto ao tipo, densidade e complexidade.
7) Avaliar o comportamento das canalopatias ao esforço.
8) Diagnosticar e estabelecer o prognóstico em determinadas doenças cardiovasculares.
9) Avaliação de indicação de intervenções terapêuticas.
10) Avaliar os resultados de intervenções terapêuticas.
11) Avaliação pré-operatória.
12) Avaliar a aptidão cardiorrespiratória e o condicionamento físico.
13) Contribuir para prescrição de exercícios físicos, inclusive na reabilitação cardiopulmonar.
14) Fornecer subsídios para exames admissionais, periódicos e perícia médica.
O TE pode ser realizado em situações clínicas e doenças nas quais se deseje verificar as condições citadas, respeitando as contraindicações relativas e absolutas.
2.2. Indicações do TE em Situações Clínicas Específicas
Em determinadas situações clínicas específicas, o TE teve sua efetividade estudada e testada, permitindo a determinação do grau e o nível de recomendação de suas indicações, a serem apresentadas nas próximas sessões. 6 , 12 - 14 , 17 , 19
2.2.1. Indicações do TE na Doença Arterial Coronariana
A doença arterial coronariana permanece como uma das principais doenças por sua morbidade e mortalidade, estimando-se que a prevalência de angina entre 65 a 84 anos seja de 12% a 14% nos homens e 10% a 12% nas mulheres. No Brasil, cerca de 30% das mortes são de causa cardiovascular. 20
TE está indicado na investigação de dor precordial de provável origem cardíaca devido a sua relevância, ampla disponibilidade e custo-efetividade, sendo referendado como a escolha ideal pelo Choosing Wisely . 21
A prevalência de DAC assintomática e isquemia silenciosa varia amplamente dependendo da população estudada. Assintomáticos diabéticos apresentam risco relativo (RR) de 2,0 para DAC e a prevalência de TE positivo é de aproximadamente 23% nesses pacientes. 22 , 23
O diagnóstico de isquemia miocárdica silenciosa permite realizar intervenções visando à redução de risco de eventos futuros, inclusive morte. 24
O TE é recomendado para estratificação de risco dos pacientes com DAC estável, definição de prognóstico, eficácia de intervenções e investigação de mudança no quadro clínico. 25 - 27
Mesmo com um TE não isquêmico, os pacientes com suspeita de DAC podem se beneficiar da estratificação de risco aprimorada pelo TE, por meio de variáveis de prognóstico, tais como sintomas esforço-induzidos, capacidade funcional, resposta pressórica e cronotrópica, função autonômica e resposta musculoesquelética. 28
O TE é fundamental em pacientes com DAC para a prescrição inicial de exercícios e subsequentes ajustes na programação de reabilitação cardiovascular ( Tabela 1 ). 17 , 29 , 30
Tabela 1. – Indicações do TE na doença arterial coronariana sintomática e assintomática .
| Indicação | GR | NE |
|---|---|---|
| Pacientes com probabilidade pré-teste intermediária para DAC incluindo aqueles com bloqueio de ramo direito ou infradesnivelamento do segmento ST <1 mm no ECG de repouso 14 , 31 | I | A |
| Diagnóstico diferencial de dor torácica em paciente de baixo risco, estável clínica e hemodinamicamente (após 9 a 12 horas), sem sinais de isquemia eletrocardiográfica e/ou disfunção ventricular e com marcadores sorológicos de necrose normais, na unidade de dor torácica 32 , 33 | I | A |
| Prescrição de exercício e avaliação seriada em programa de reabilitação 29 , 30 | I | A |
| Sintomas atípicos e anormalidades no ECG de repouso (interpretável) para liberação de atividade física de alta intensidade 17 , 34 | I | A |
| Síndromes coronarianas agudas após, no mínimo, 72 horas de completa estabilização clínica e hemodinâmica para estratificação de risco e definição terapêutica 33 , 35 | I | B |
| Pós IAM, não complicado, antes da alta hospitalar, para estratificação de risco e adequação terapêutica 36 , 37 | I | B |
| Avaliação prognóstica na DAC estável* 38 , 39 | I | B |
| Investigação de DAC em pacientes sintomáticos, diabéticos e com ECG interpretável 40 - 42 | I | B |
| Suspeita de angina vasoespástica 43 , 44 | IIa | B |
| Estratificação de risco e definição terapêutica em pacientes de alto risco para DAC 14 , 45 | IIa | B |
| Avaliação de assintomáticos com três ou mais fatores de risco clássicos 46 , 47 | IIa | B |
| Decisão terapêutica em lesões coronarianas intermediárias detectadas na cineangiocoronariografia 14 , 26 | IIa | B |
| Avaliação da eficácia terapêutica farmacológica na DAC 27 , 48 | IIa | B |
| Investigação de alterações de repolarização ventricular (desde que infradesnivelamento <1 mm) no ECG de repouso 6 , 14 | IIa | B |
| Pacientes sintomáticos após revascularização miocárdica (cirurgia ou intervenção coronária percutânea) 49 , 50 | IIa | B |
| Avaliação de assintomáticos após revascularização miocárdica (cirurgia ou intervenção coronária percutânea) para estratificação de risco, ajuste terapêutico, liberação/prescrição de exercícios físicos, inclusive reabilitação 14 , 49 | IIa | B |
| Pré-operatório de paciente com risco intermediário ou alto de complicações** 51 , 52 | IIa | C |
| Investigação de DAC em pacientes com critérios eletrocardiográficos para sobrecarga ventricular esquerda com depressão do segmento ST <1 mm 53 , 54 | IIb | B |
| Avaliação funcional nos casos em que outro método tenha avaliado anatomia coronariana 6 , 14 | IIb | B |
| Perícia médica e/ou avaliação pela medicina do trabalho 55 , 56 | IIb | B |
| Baixa probabilidade de DAC para estratificação de risco cardiovascular 24 | IIb | C |
| Portador assintomático de lesão de TCE ou equivalente conhecido para acompanhamento evolutivo e ajuste/decisões terapêuticas 6 , 14 | IIb | C |
| Síndromes coronarianas agudas não estabilizadas clínica ou hemodinamicamente ou ainda com alterações eletrocardiográficas persistentes ou marcadores de necrose não normalizados 14 , 33 | III | B |
| Pesquisa de DAC em pacientes com BRE, WPW, ritmo de MP, depressão do segmento ST ≥1 mm no ECG de repouso e terapêutica com digitálicos 6 , 14 | III | B |
| Presença de lesão de TCE ou equivalente conhecido sintomático 6 , 14 | III | B |
| GR: grau de recomendação; NE: nível de evidência; ECG: eletrocardiograma; IAM: infarto agudo do miocárdio; DAC: doença arterial coronariana; HAS: hipertensão arterial sistêmica; MP: marca-passo; BRE: bloqueio de ramo esquerdo; TCE: tronco de coronária esquerda; WPW: síndrome de Wolff-Parkinson-White. *Avaliação prognóstica/evolutiva da DAC poderá ser necessária anualmente, de acordo com a condição clínica. **Ver classificação do risco intrínseco da cirurgia de complicações cardíacas da 3ª Diretriz de Avaliação Cardiovascular Perioperatória da Sociedade Brasileira de Cardiologia. 51,52 | ||
2.2.2. Indicações do TE em Assintomáticos
O TE apresenta papel relevante na avaliação de pacientes assintomáticos por permitir determinar o prognóstico e o risco de futuras anormalidades através de suas variáveis (FC, pressão arterial, eletrocardiograma etc.). 57 , 58
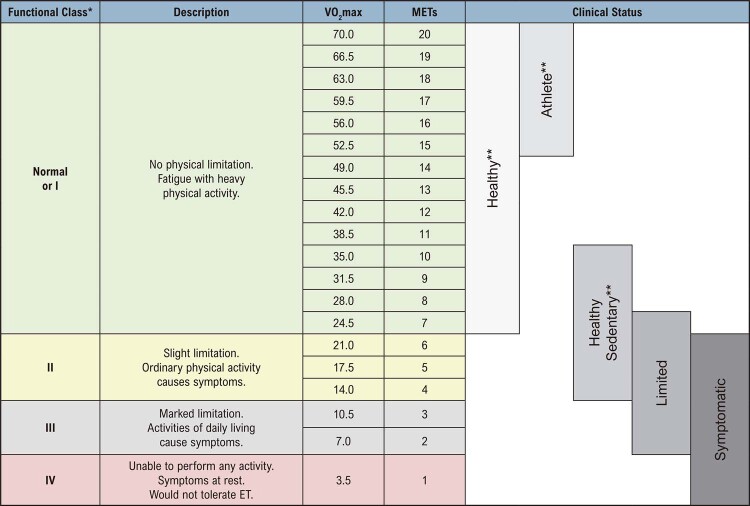
A aptidão cardiorrespiratória (capacidade funcional) determinada no TE é considerada um marcador fundamental de saúde e definidor de metas terapêuticas e preventivas. Em pacientes assintomáticos com comorbidades, auxilia na prescrição de exercícios de modo a promover a saúde e o bem-estar. O TE é viável e seguro mesmo em pacientes com idade avançada e comorbidades significativas. 59 , 60
O TE também aprimora a estratificação de risco de um indivíduo assintomático quanto a estar fisicamente apto para desempenho de suas atividades físicas laborais, sem colocar em risco indevido a si mesmo ou a terceiros ( Tabela 2 ). 61
Tabela 2. – Indicações do TE em pacientes assintomáticos.
| Indicação | GR | NE |
|---|---|---|
| Avaliação de indivíduos com história familiar de DAC precoce (em mulheres <65 anos e em homens <55 anos) – realizar pelo menos um TE até os 40 anos 45 , 62 | I | B |
| Rastreamento de indivíduos com história de morte súbita em familiares de primeiro grau 55 , 63 | IIa | B |
| Avaliação de sedentários diabéticos para diagnóstico de sintoma moderado ou intenso esforço-induzido e/ou prescrição de exercício 41 , 64 , 65 | IIa | B |
| Indivíduos classificados como de alto risco pelo escore de Framingham 1 , 62 | IIa | B |
| Avaliação de indivíduo com ocupação de alto risco e/ou responsável pela vida de outros, tais como pilotos, motoristas profissionais, militares, policiais, bombeiros etc. 14 , 66 | IIa | B |
| Avaliação pré-participativa para atividades de lazer e esporte recreacional em indivíduos ≥60 anos 17 , 34 | IIa | C |
| Pré-operatório de paciente com história familiar de DAC precoce em cirurgia não cardíaca de médio e grande porte 52 , 67 | IIa | C |
| Considerar na avaliação pré-participação para atividades de lazer e esporte recreacional em indivíduos de 35 a 59 anos 17 , 34 | IIb | B |
| Paciente <35 anos, sem fator de risco cardiovascular, para início de programa de atividade física de intensidade leve ou moderada 34 | III | C |
| GR: grau de recomendação; NE: nível de evidência; DAC: doença arterial coronariana; TE: teste ergométrico. | ||
2.2.3. Indicações do TE em Atletas
A atividade física (AF) é definida como qualquer movimento corporal produzido pelo sistema musculoesquelético. O exercício ou treinamento físico é um programa de atividade física estruturada, repetitiva, com objetivo de recuperar, manter ou melhorar um ou mais componentes da aptidão física (cardiorrespiratório, morfológico, muscular, metabólico ou motor). O atleta é indivíduo de qualquer idade, amador ou profissional, que pratique regularmente exercícios físicos, com maior ênfase no desempenho e, eventualmente, participe de competições esportivas. 13 , 34
O TE fornece dados importantes para a cardiologia, medicina esportiva e preventiva quanto à saúde dos atletas de elite, atletas olímpicos, atletas profissionais, atletas competitivos, federados e/ou pertencentes a clubes esportivos, atletas masters e atletas recreativos (atividade de prazer e de lazer). É utilizado na avaliação pré-participação e permite detectar doenças pulmonares e cardiovasculares latentes (p. ex., asma esforço-induzida, hipertensão, isquemia, arritmias etc.), monitorar intervenções e realizar avaliação prognóstica ( Tabela 3 ). 13 , 17 , 34 , 68
Tabela 3. – Indicações do TE em atletas.
| Indicação | GR | NE |
|---|---|---|
| Realizar em indivíduos ≥60 anos ao iniciar atividade de alta intensidade, esportiva e competições esportivas 13 , 17 , 69 | I | B |
| Rastreamento de indivíduos com história de morte súbita em familiares de primeiro grau 13 , 17 , 70 | I | B |
| Indivíduo ≥35 anos com alto risco (escore clínico) em avaliação pré-participação para exercícios de alta intensidade e competições esportivas 13 , 17 , 34 | IIa | A |
| Indivíduos de 35-59 anos, considerar no início do programa de exercício de alta intensidade e competições esportivas 13 , 17 , 34 | IIa | B |
| História familiar de DAC precoce (em mulheres <65 anos e em homens <55 anos) – realizar pelo menos um TE até os 35 anos 13 , 17 , 34 | IIa | B |
| Atleta diabético para diagnóstico de sinais e sintomas esforço-induzidos, estratificação de risco e prognóstico 17 , 40 , 41 , 64 | IIa | B |
| No ajuste de carga de treinamento físico de atletas | III | C |
| Atleta em síndrome de excesso de treinamento sintomática | III | C |
| GR: grau de recomendação; NE: nível de evidência; DAC: doença arterial coronariana. | ||
2.2.4. Indicações do TE na Hipertensão Arterial Sistêmica
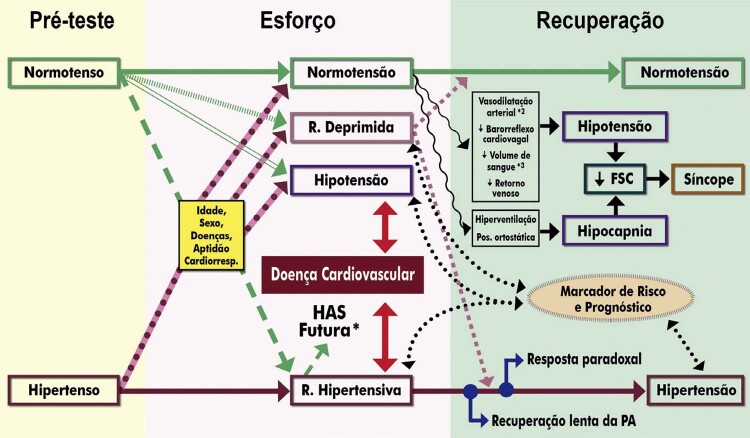
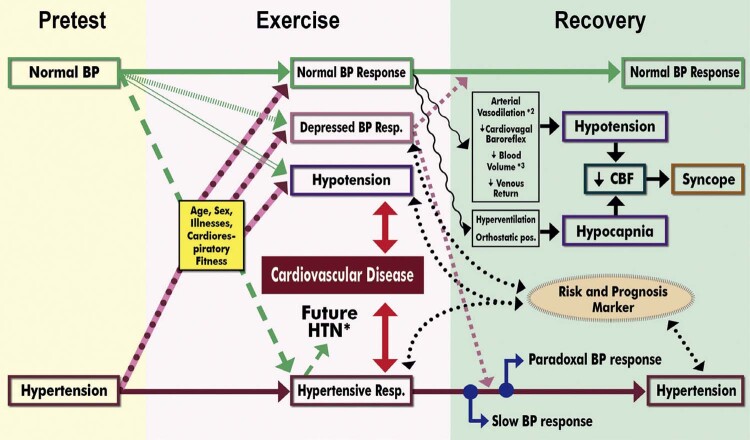
O comportamento da pressão arterial sistólica (PAS) durante o TE é considerado marcador de risco para desenvolvimento de hipertensão, morte por doença cardiovascular e risco de acidente vascular cerebral. 71 - 73 Dados recentes sugerem que a resposta da PA ao exercício de intensidade submáxima tem maior significado clínico e prognóstico do que a PA alcançada no exercício de intensidade máxima. O desempenho físico no TE influi na interpretação da resposta da PA ao exercício. Tanto a hipotensão quanto a PA exagerada servem como marcador prognóstico e indicador de necessidade de investigação de DCV subjacentes ( Tabela 4 ). 74 , 75
Tabela 4. – Indicações do TE na hipertensão arterial sistêmica .
| Indicação | GR | NE |
|---|---|---|
| Avaliação de hipertensos sintomáticos com ECG normal para investigação de DAC 27 , 77 , 78 | I | B |
| Comportamento da PA em pacientes com síndrome metabólica ou diabéticos 79 , 80 | IIa | B |
| Em hipertensos, para avaliação de aptidão cardiorrespiratória, estratificação de risco e liberação para prática esportiva 71 , 76 , 81 , 82 | IIa | B |
| Ajustes da terapêutica farmacológica anti-hipertensiva 83 - 85 | IIa | B |
| Avaliação do comportamento da PA em pacientes sob investigação de hipertensão 86 , 87 | IIa | B |
| Avaliação do comportamento pressórico em hipertensos com DAC para estratificação de risco, ajuste terapêutico e liberação para exercícios físicos 78 , 88 | IIa | B |
| Avaliação de idosos hipertensos para programa de atividade física 29 , 34 , 89 | IIa | C |
| Suspeita de hipotensão arterial esforço-induzida em hipertensos tratados 90 , 91 | IIa | B |
| Comportamento da PA em indivíduos com história familiar de HAS 71 | IIb | B |
| GR: grau de recomendação; NE: nível de evidência; DAC: doença arterial coronariana; HAS: hipertensão arterial sistêmica; PA: pressão arterial; ECG: eletrocardiograma. | ||
Em atletas submetidos ao TE, a resposta da PA indexada à carga de esforço foi superior à PASpico como preditora de mortalidade em homens saudáveis, sendo útil na triagem pré-participação. A resposta hipertensiva ao TE esteve associada ao desenvolvimento de hipertensão em atletas jovens. 76
2.2.5. Indicações do TE em Valvopatias
Na doença valvar, o TE deve ser realizado rotineiramente para esclarecimento de sintomas duvidosos, avaliação de indicadores que contribuam na decisão sobre intervenção e para liberação e prescrição de exercícios ( Tabela 5 ). 92 - 94 O TE é útil para desmascarar os pacientes “pseudoassintomáticos” e permite o acompanhamento seriado de assintomáticos. 94 As intervenções, cirúrgica ou transcateter, são indicadas em pacientes sintomáticos ou com sintomas esforço-induzidos. 94
Tabela 5. – Indicações do TE em valvopatias.
| Indicação | GR | NE |
|---|---|---|
| Em valvopatia leve e moderada, para confirmação de ausência de sintomas, esclarecimento de sintomas, avaliação da capacidade funcional e prescrição de exercícios físicos 93 , 94 , 96 , 97 | I | B |
| Na insuficiência mitral, para esclarecimento de sintomas, avaliação da capacidade funcional, indicação de intervenção e prognóstico 98 - 100 | IIa | A |
| EAo para esclarecimento de sintomas, indicação de intervenção e prognóstico 93 , 94 , 101 , 102 | IIa | A |
| EAo moderada e grave, em paciente assintomático, para avaliação de marcadores de mau prognóstico e indicação de intervenção 93 , 94 , 96 , 101 , 103 | IIa | A |
| No seguimento de IAo para esclarecimento de sintomas, avaliação de capacidade funcional e prognóstico 104 , 105 | IIa | B |
| EM assintomática ou presença de sintomas atípicos ou sintomas discordantes com o grau de estenose 14 , 106 , 107 | IIa | B |
| No seguimento de EAo grave assintomática pelo menos a cada 6 meses para detecção precoce de sintomas, avaliação funcional e indicação de intervenção 93 , 108 , 109 | IIa | B |
| EAo grave, assintomática, com FEVE normal em planejamento familiar para gestação 110 , 111 | IIa | B |
| Avaliação pós-intervenção valvar para esclarecimento de sintomas, avaliação da capacidade funcional, prognóstico e prescrição de exercício (incluindo reabilitação cardiovascular) 93 , 112 | IIa | B |
| Cirurgia não cardíaca para determinação do risco cirúrgico e capacidade funcional 52 , 67 , 113 | IIb | B |
| Nas estenoses ou insuficiências aórtica e mitral, assintomáticas, para determinar a capacidade funcional e prescrição de exercícios 17 , 29 , 114 | IIb | B |
| Investigação de DAC em pacientes com valvopatia grave 115 | III | B |
| EAo ou mitral grave sintomática 93 | III | C |
| GR: grau de recomendação; NE: nível de evidência; EAo: estenose aórtica; IAo: insuficiência aórtica; DAC: doença arterial coronariana; FEVE: fração de ejeção do ventrículo esquerdo. | ||
A prática de exercícios físicos requer avaliação de sintomatologia, capacidade funcional, características da lesão valvar e sua repercussão na função cardíaca. Indivíduos assintomáticos com lesões de gravidade moderada podem se exercitar intensamente se o TE revelar boa capacidade funcional e ausências de isquemia miocárdica, distúrbios hemodinâmicos e arritmias. 95
2.2.6. Indicações na Insuficiência Cardíaca e nas Cardiomiopatias
Na insuficiência cardíaca (IC) e nas cardiomiopatias, o TE é utilizado no esclarecimento de sintomas, avaliação da tolerância ao esforço/classe funcional, avaliação prognóstica, ajustes terapêuticos e prescrição de programas de exercício ( Tabela 6 ). 29 , 116
Tabela 6. – Indicações do TE na insuficiência cardíaca e nas cardiomiopatias .
| Indicação | GR | NE |
|---|---|---|
| Na IC e nas cardiomiopatias compensadas, para prescrição e adequação de programa de exercícios (incluindo programas de reabilitação cardiovascular)* 6 , 13 , 17 , 29 , 119 | IIa | B |
| Na cardiomiopatia hipertrófica e na IC compensada, em protocolo atenuado, para esclarecimento de sintomas, avaliação da capacidade funcional e marcadores prognósticos (sintomas, arritmia ventricular e resposta pressórica) 17 , 29 , 120 , 121 | IIa | B |
| Na cardiomiopatia hipertrófica, de forma seriada, para ajustes de programa de exercícios e atividade esportiva recreacional 6 , 13 , 17 , 29 , 121 | IIa | B |
| Pacientes recuperados e assintomáticos, após 3 a 6 meses de quadro agudo de miocardite, para liberação e prescrição de prática de exercícios 122 , 123 | IIa | B |
| Prescrição e adequação de programa de exercícios (incluindo reabilitação cardiovascular) em pacientes após transplante cardíaco* 13 , 29 , 124 , 125 | IIa | C |
| Na cardiomiopatia hipertrófica ou na IC compensada, de forma seriada, para avaliação do comportamento pressórico e de intervenções terapêuticas 14 , 18 , 119 , 121 | IIa | C |
| Reavaliação periódica após miocardite, nos primeiros 2 anos, para identificar progressão silenciosa da doença e estratificação de risco 115 , 123 , 126 , 127 | IIa | C |
| Seleção para transplante cardíaco pelo TE (com base nos valores de VO 2 estimados e não medidos)** 6 , 115 | III | B |
| Miocardite, pericardite aguda ou IC descompensada 6 , 115 | III | C |
| Diagnóstico de insuficiência cardíaca 6 , 115 | III | C |
| GR: grau de recomendação; NE: nível de evidência; IC: insuficiência cardíaca; VO 2 : consumo de O 2 . *Na indisponibilidade do TCPE. **As variáveis obtidas pelo TCPE são fundamentais para a indicação do transplante cardíaco, permitindo detectar com maior precisão os mecanismos responsáveis pela limitação ao esforço. | ||
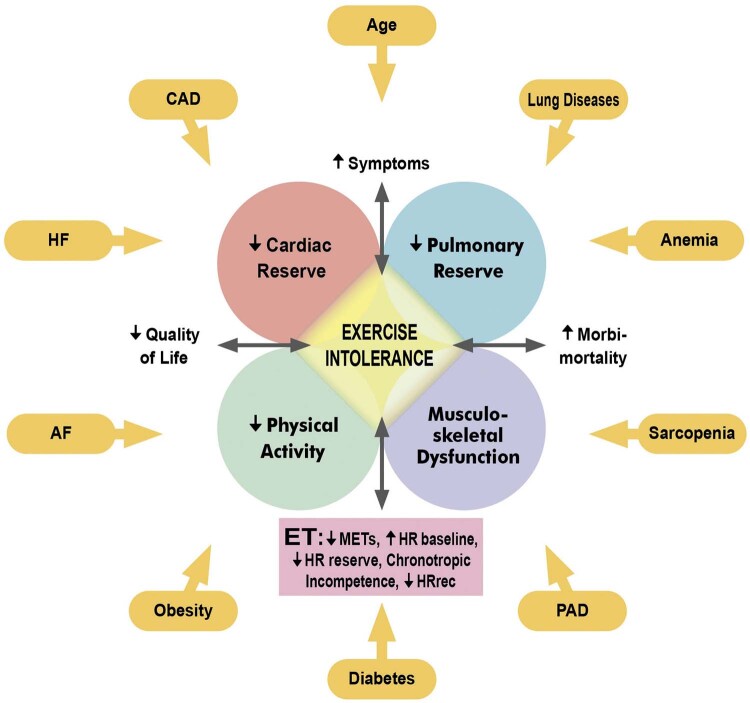
A intolerância ao exercício é uma manifestação típica de pacientes afetados por IC, sendo a classificação funcional e a resposta da FC no TE variáveis importantes de prognóstico. 117 , 118
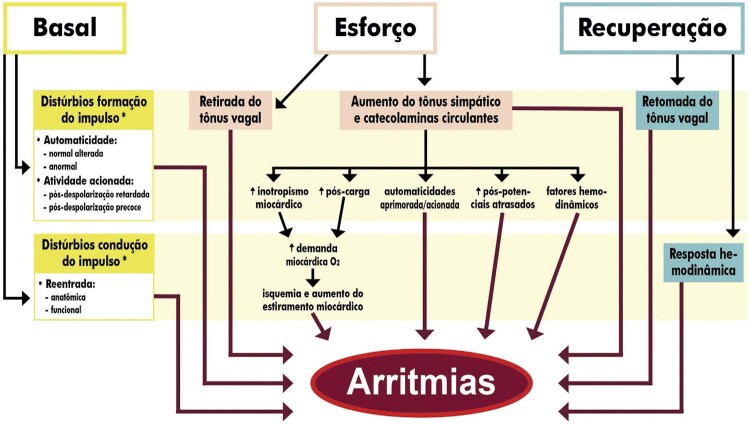
2.2.7. Indicações do TE no Contexto de Arritmias e Distúrbios de Condução
As arritmias esforço-induzidas são frequentemente causadas por diversas doenças cardiovasculares passíveis de avaliação pelo TE. Podem ser totalmente assintomáticas ou cursar com sintomas que variam de palpitações até síncope. O TE permite investigar a sintomatologia, diagnosticar e quantificar (densidade) as arritmias e estratificar o risco de morte súbita cardíaca (MSC). Apresenta, também, papel relevante nos distúrbios de condução atrioventricular e intraventricular na investigação de suas causas, repercussões e decisões terapêuticas ( Tabela 7 ). 63 , 128 - 132
Tabela 7. – Indicações do TE no contexto de arritmias e distúrbios de condução .
| Indicação | GR | NE |
|---|---|---|
| Palpitação, síncope, pré-sincope, equivalente sincopal, mal-estar indefinido ou palidez relacionada ao esforço físico e/ou recuperação 6 , 14 , 133 , 134 | I | B |
| Arritmia assintomática detectada em exame clínico/complementar, para avaliação do comportamento ao esforço e determinação de prognóstico 14 , 39 , 133 , 135 , 136 | I | B |
| No BAVT congênito, para avaliação da resposta ventricular e indicação de marca-passo 131 , 132 , 137 , 138 | I | B |
| Em pacientes com taquicardia ventricular catecolaminérgica, para avaliação de terapêutica farmacológica e indicação de cardiodesfibrilador implantável 132 , 138 , 139 | I | B |
| Na doença do nó sinusal, para avaliação da resposta cronotrópica* 14 , 133 , 134 | I | B |
| Na síndrome do QT longo (sintomática e assintomática), para confirmação diagnóstica, estratificação de risco, avaliação de potencial arritmogênico e de terapêutica 140 , 141 | I | B |
| Suspeita diagnóstica de taquicardia ventricular paroxística catecolaminérgica 115 , 132 , 138 , 139 | I | C |
| No BAVT congênito, para avaliação da resposta atrial e consequente escolha do tipo de marca-passo 131 , 132 , 134 , 138 | I | C |
| Eficácia da terapêutica farmacológica e/ou pós-ablação 131 - 134 , 142 | IIa | B |
| Indicação de implante de marca-passo 14 , 131 , 132 , 138 , 143 | IIa | B |
| Recuperado de parada cardiorrespiratória, estável clinicamente, para liberação e prescrição de exercício físico (recreacional e/ou reabilitação cardiovascular) 13 , 144 - 146 | IIa | B |
| Na síndrome de Brugada (sintomática e assintomática), para confirmação diagnóstica, estratificação de risco e avaliação de potencial arritmogênico e de terapêutica** 147 , 148 | IIa | B |
| Suspeita de incompetência cronotrópica 6 , 14 , 149 - 151 | IIa | B |
| Marca-passo com biossensor, para avaliação do comportamento da frequência cardíaca 131 , 132 , 134 , 137 , 138 , 152 | IIa | B |
| Avaliação de marca-passo, ressincronizador e/ou cardiodesfibrilador implantável, para ajustes de programação 131 , 132 , 134 , 137 , 138 , 152 | IIa | C |
| Rastreamento dos familiares de pacientes com síndrome do QT longo 13 , 140 , 153 , 154 | IIa | B |
| Na arritmia conhecida, controlada, para liberação e prescrição de exercício físico (recreacional e/ou reabilitação cardiovascular) 6 , 13 , 14 , 133 , 134 | IIa | C |
| Em assintomático com cardiomiopatia arritmogênica praticante de exercícios físicos, anualmente 17 , 155 - 157 | IIa | C |
| Na fibrilação atrial persistente (crônica) para avaliação terapêutica, controle da resposta ventricular, estratificação de risco e liberação para exercícios (inclusive reabilitação) 119 , 158 , 159 | IIa | C |
| Avaliação do comportamento de via anômala (pré-excitação) e do potencial arritmogênico 6 , 13 , 14 , 133 , 134 | IIb | B |
| Displasia arritmogênica do ventrículo direito para estratificação de risco e liberação de exercícios físicos 14 , 134 , 135 | IIb | B |
| Em portadores de desfibrilador cardíaco implantável para avaliação funcional, prognóstica, da eficácia terapêutica e liberação para programa de exercícios 131 , 132 , 160 , 161 | IIb | B |
| Rastreamento dos familiares de pacientes com Síndrome de Brugada** 13 , 134 , 147 , 162 | IIb | C |
| Portador de marca-passo de frequência fixa 115 , 133 | III | B |
| BAVT adquirido com baixa resposta da frequência ventricular 115 , 133 | III | B |
| Arritmia não controlada, sintomática ou com comprometimento hemodinâmico 115 , 133 | III | C |
| GR: grau de recomendação; NE: nível de evidência; BAVT: bloqueio atrioventricular total. *Contraindicação absoluta na presença de bloqueio sinoatrial total. **Utilizando derivações precordiais altas e recuperação passiva. | ||
2.2.8. Indicações do TE em Outras Condições Clínicas
A Tabela 8 apresenta outras condições clínicas para as quais o TE é recomendado, visando a avaliação funcional, prescrição de exercícios físicos e ajustes terapêuticos.
Tabela 8. – Indicações do TE em outras condições clínicas reconhecidas .
| Indicação | GR | NE |
|---|---|---|
| Assintomáticos com artéria coronária de origem anômala, para estratificação de risco, definição da conduta terapêutica e para liberação de exercícios físicos/atividades esportivas 13 , 17 , 34 | IIa | B |
| 3 meses após correção cirúrgica de artéria coronária de origem anômala, se assintomático, para liberação de exercícios físicos/atividade esportiva 13 , 17 , 29 , 163 | IIa | C |
| Ponte miocárdica para estratificação de risco, decisão terapêutica e liberação para exercícios físicos 13 , 17 , 29 , 163 , 164 | IIa | C |
| Cardiomiopatia não compactada de VE, assintomática, FEVE ≥40%, em programa de exercícios de baixa a moderada intensidade 17 , 127 , 165 | IIa | C |
| Na doença de Parkinson, para avaliação da tolerância ao esforço e liberação/prescrição de exercícios 19 , 166 , 167 | IIa | B |
| Na anemia falciforme, para avaliar capacidade funcional, estratificação de risco e liberação/prescrição de exercícios 168 - 170 | IIa | C |
| Paciente em tratamento oncológico, para liberação e prescrição de exercícios (inclusive reabilitação) 171 , 172 | IIa | C |
| Avaliação de risco e prognóstico após efeitos colaterais do tratamento de câncer 173 , 174 | IIb | C |
| Na doença arterial periférica, para avaliar claudicação, quantificar a isquemia, estratificar o risco e decisão terapêutica 175 , 176 | I | B |
| Na doença arterial periférica, para avaliar a capacidade funcional, prescrever e adequar programa de exercícios físicos 176 , 177 | I | B |
| Prescrição e adequação de programa de exercícios (incluindo reabilitação cardiovascular) em pacientes em hemodiálise e pós-transplante renal 178 , 179 | IIb | C |
| Aneurisma de aorta ou em outras artérias, assintomático, sem critérios para intervenção, para ajustes terapêuticos (p. ex., otimização tratamento anti-hipertensivo) e liberação/prescrição de exercícios (incluindo reabilitação) 180 | IIa | C |
| Recuperados de acidente vascular cerebral ou ataque isquêmico transitório, estável clinicamente, para ajustes terapêuticos (p. ex., otimização de tratamento anti-hipertensivo) e liberação/prescrição de exercícios 181 | IIb | C |
| No adulto com cardiopatia congênita, estável clinicamente (classe funcional I e II), para prescrição e adequação de programa de exercícios 17 , 182 , 183 | IIb | B |
| GR: grau de recomendação; NE: nível de evidência; VE: ventrículo esquerdo; FEVE: fração de ejeção do ventrículo esquerdo. | ||
2.3. Contraindicações Relativas e Absolutas
O TE geralmente é bem tolerado e seguro quando adequadamente indicado e realizado. Entretanto, situações clínicas específicas podem aumentar os riscos para eventuais complicações, exigindo intervenções médicas imediatas ( Tabela 9 ). O risco de morte cardíaca súbita encontra-se em torno de 1 em 10.000 TE. 6 , 184 , 185
Tabela 9. – Principais eventos e complicações durante o TE.
| Evento | Frequência | Comentários |
|---|---|---|
| Morte súbita cardíaca | 1 para 10.000 exames | Dependente do quadro clínico e comorbidades. 6 , 184 , 185 |
| Taquicardia ventricular esforço-induzida | 0,05-2,3% | Risco aumentado de ocorrência se arritmias ventriculares prévias. Risco aumentado de morte por DCV e por todas as causas. 135 , 186 , 187 Ocorrência frequente na suspeita de TV polimórfica catecolaminérgica, TV da via de saída do ventrículo direito e TV fascicular. 63 , 130 , 188 |
| Taquicardia supraventricular paroxística | 3,4-15% | Risco aumentado de desenvolver FA. 189 Quando reentrante, geralmente exige terapia medicamentosa para interrupção. 129 , 142 , 190 |
| Extrassistolia ventricular esforço-induzida | 2-20% | Quando frequente, risco aumentado de mortalidade (por todas as causas e por DCV) e eventos cardiovasculares. 191 - 195 Mais comum em pacientes com DAC: 7% a 20%. 196 |
| Extrassistolia supraventricular esforço-induzida | 4-25% | Ocorrem em até 10% dos pacientes aparentemente saudáveis e em até 25% dos com DAC. Não está associada a mortalidade cardíaca ou IAM. 189 , 197 , 198 Em idosos, associa-se a maior risco de FA/FluA. 199 , 200 |
| Fibrilação/flutter atrial esforço-induzidos | <1% | Costumam causar repercussão hemodinâmica se a resposta ventricular for exacerbada. 197 , 201 |
| Bloqueio intermitente do ramo esquerdo | 0,4-0,5% | DAC e IC são as causas mais prevalentes. Maior risco de mortalidade por todas as causas e eventos cardiovasculares. 202 , 203 |
| Bloqueio intermitente do ramo direito | 0,25% | Geralmente associado à DAC. 202 - 204 |
| Bradiarritmia/BAVT esforço-induzidos | <0,1% | Na disfunção do nó sinusal, podem ocorrer sintomas de IC e angina. 133 Na bradicardia sinusal esforço-induzida, pode ocorrer síncope devido ao reflexo de Bezold-Jarisch. 205 , 206 BAVT esforço-induzido pode estar associado à isquemia transitória ou doença degenerativa grave do sistema de condução. 207 , 208 |
| Síndrome coronariana aguda | 0,1-0,5% | Requer interrupção imediata do esforço. 6 , 209 , 210 |
| DCV: doença cardiovascular; BAVT: bloqueio atrioventricular avançado/total; DAC: doença arterial coronariana; IC: insuficiência cardíaca; TV: taquicardia ventricular; IAM: infarto agudo do miocárdio; FA: fibrilação atrial; FluA: flutter atrial. | ||
2.3.1. Contraindicações Relativas do TE/TCPE
São situações clínicas de alto risco para a realização do TE/TCPE que exijam a adoção de eventuais condutas preventivas e terapêuticas ( Tabela 10 ). Tais medidas incluem a realização do TE exclusivamente em ambiente hospitalar e cuidados especiais: adequação de protocolos e carga de esforço a ser atingida no TE, rigorosa observação de sintomas, medições mais frequentes da pressão arterial, presença de pessoal e equipamento para reprogramação de marca-passo/CDI.
Tabela 10. – Contraindicações relativas e eventuais condutas no TE/TCPE 1,6,12-17 .
| Ambiente hospitalar + Cuidados especiais | Cuidados especiais |
|---|---|
| Dor torácica aguda: realizar exclusivamente em hospital, idealmente em unidade de dor torácica, seguindo rigorosamente o protocolo | Cardiomiopatia hipertrófica não obstrutiva |
| Estenoses valvares graves em assintomáticos* | Marca-passo unicameral, ventricular, sem resposta de frequência (modo estimulação VVI) |
| Insuficiências valvares graves* | Insuficiência cardíaca compensada avançada (classe III da NYHA) |
| IAM não complicado (a partir do 5º dia e estável clinicamente) | AVC ou ataque isquêmico transitório recente (menos que 2 meses) 9 |
| Angina instável após 72 horas de estabilização* | Aneurisma de aorta ou em outras artérias, sem critérios para intervenção |
| Doença conhecida do tronco da coronária esquerda ou equivalente, em assintomático* | FA ou FluA assintomáticos detectados na avaliação pré-teste, com paciente informando desconhecimento da arritmia** |
| Suspeita de arritmias complexas (taquiarritmias e bradiarritmias), QT longo e síndrome de Brugada | FA (persistente ou crônica) ou FluA crônico com FC elevada em repouso** |
| Síncope por provável etiologia arritmogênica ou suspeita de bloqueio atrioventricular de alto grau ou total esforço-induzido | Gravidez*** |
| Insuficiência renal dialítica | |
| Cardiodesfibrilador implantado (CDI) | |
| Cardiopatias congênitas complexas acianóticas | |
| Hipertensão pulmonar importante ou sintomática* | |
| Cardiomiopatia hipertrófica obstrutiva com gradiente de repouso grave* | |
| Anemia grave (hemoglobina <8,0g/dL)** 211 , 212 | |
| FA: fibrilação atrial; FLuA: flutter atrial; FC: frequência cardíaca. *Situação em que o risco/benefício do exame deverá ser criteriosamente avaliado. **Situação em que o risco/benefício do exame deverá ser criteriosamente avaliado e provavelmente resultará na decisão de adiar ou cancelar o exame. ***Em nível submáximo de esforço, grávidas em situações específicas (p. ex., valvopatias e cardiopatias congênitas), após exclusão das contraindicações clínicas e obstétricas absolutas. Não é recomendado como exame de rotina. 213,214 | |
2.3.2. Contraindicações Absolutas do TE/TCPE
São consideradas contraindicações absolutas, não devendo realizar o TE e o TCPE, a presença das situações constantes no Quadro 1 . 1 , 6 , 12 - 17
Quadro 1. – Contraindicações absolutas do TE e TCPE.
| Contraindicações absolutas do TE e TCPE |
|---|
| – Embolia pulmonar aguda ou infarto pulmonar |
| – Enfermidade aguda, febril ou grave |
| – Deficiência mental ou física que leva à incapacidade de se exercitar adequadamente |
| – Intoxicação medicamentosa |
| – Distúrbios hidroeletrolíticos e metabólicos não corrigidos |
| – Bloqueio atrioventricular de risco para eventos/complicações* |
| – Pressão arterial sistólica persistente em repouso ≥180 mmHg ou pressão arterial diastólica >110 mmHg** |
| – Crise/urgência hipertensiva** |
| – Hipertireoidismo descontrolado |
| – Deslocamento recente de retina, em fase de recuperação*** |
| – Cardiopatias congênitas cianóticas descompensadas |
| – Infarto agudo do miocárdio antes de 5 dias ou com complicações |
| – Angina instável |
| – Arritmias cardíacas não controladas |
| – Estenose aórtica grave sintomática |
| – Insuficiência cardíaca descompensada |
| – Miocardite aguda ou pericardite |
| – Dissecção aguda da aorta |
| – Aneurisma de aorta ou em outras artérias com indicação de intervenção |
| – Doença pulmonar descompensada |
| – Diabetes mellitus descompensado**** |
| *Considera-se como de risco para eventos/complicações: bloqueio atrioventricular de segundo grau tipo II; bloqueio AV 2:1; bloqueio avançado/alto grau; bloqueio atrioventricular de terceiro grau/total (exceto bloqueio atrioventricular total congênito). **Crise hipertensiva: elevação aguda da pressão arterial (PA) sistólica ≥180 mmHg e/ou PA diastólica ≥120 mmHg, que pode resultar ou não em lesões de órgãos-alvo (LOA), que é dividida em urgência hipertensiva (elevação da PA sem LOA e sem risco de morte iminente; isso permite a redução da PA em 24 a 48 horas) e emergência hipertensiva (elevação da PA com LOA aguda ou em progressão e risco imediato de morte; requer redução rápida e gradual da PA em minutos a horas, com medicamentos intravenosos). 215 ***Para retorno à atividade física, principalmente em carga moderada/alta, são necessárias a avaliação e a liberação por parte do oftalmologista. 216,217 ****Caso o paciente com diabetes tipo II tenha feito o automonitoramento da glicemia no pré-teste ou no dia do exame, suspender exercícios físicos se glicemia >300 mg/dL (16,7 mmol/L). Caso o paciente com diabetes tipo I tenha feito o automonitoramento da glicemia, suspender exercícios se glicemia >350 mg/dL; se entre 251-350 mg/dL, sugere-se avaliação prévia de presença de cetonas, pois caso em moderada a grande quantidade, deve-se também suspender o exame. 64,218 |
2.4. Indicações do TCPE
2.4.1. Indicações Gerais do TCPE
As indicações gerais para a realização do TCPE são as mesmas relacionadas ao TE, principalmente quando há necessidade de adicionar as variáveis ventilatórias e metabólicas ( Quadro 2 ).
Quadro 2. – Indicações gerais do TCPE 3,5,219-223 .
| Indicações gerais do TCPE |
|---|
| 1) Doenças e situações em que a adição da determinação direta dos parâmetros ventilatórios e a análise de gases no ar espirado contribuem para avaliação diagnóstica, estratificação de risco e estabelecimento de condutas preventivas e terapêuticas |
| 2) Determinação das causas limitantes do desempenho cardiorrespiratório e mecanismos fisiopatológicos envolvidos |
| 3) Diagnóstico diferencial de dispneia (asma esforço-induzida, IC, DPOC etc.) |
| 4) Doenças cardiovasculares visando ao diagnóstico, prognóstico e ajustes terapêuticos (DAC, CC, IC etc.) |
| 5) Seleção de candidatos ao transplante cardíaco |
| 6) Nas doenças pulmonares (DPOC, asma, enfisema, intersticiais etc.) visando ao diagnóstico, prognóstico e ajustes terapêuticos |
| 7) Resposta terapêutica na hipertensão pulmonar e fibrose cística |
| 8) Outras situações: |
| – Pré-operatório de cirurgia não cardíaca em pneumopata |
| – Avaliação após transplante de pulmão, coração e coração-pulmão |
| – Seleção de modalidade esportiva em atleta competitivo |
| – Teste seriado para ajustes de intensidade de cargas de treinamento em atletas competitivos de atividades predominantemente aeróbicas |
| – Avaliação pericial/medicina do trabalho |
| – Avaliação e prescrição de exercícios para reabilitação cardiovascular, pulmonar e metabólica |
| DPOC: doença pulmonar obstrutiva crônica; CC: cardiopatia congênita; DAC: doença arterial coronariana; IC: insuficiência cardíaca. |
2.4.2. Indicações do TCPE em Situações Clínicas Específicas
Situações clínicas com evidências científicas que possibilitam determinar o grau de recomendação do TCPE são apresentadas na Tabela 11 .
Tabela 11. – Indicações específicas do TCPE.
| Indicação | GR | NE |
|---|---|---|
| Intolerância ao esforço e diagnóstico diferencial de dispneia 14 , 224 , 225 | I | A |
| Paciente pós-síndrome respiratória aguda (incluindo COVID-19), para investigação de dispneia, fadiga crônica e/ou intolerância ao esforço 226 - 228 | I | B |
| Paciente pós-síndrome respiratória aguda (incluindo COVID-19), para determinação da aptidão cardiorrespiratória e liberação/prescrição de exercícios físicos (incluindo reabilitação) 13 , 226 , 227 | I | B |
| Avaliação de broncoespasmo esforço-induzido (associado à prova espirométrica pré e pós-esforço) 219 , 229 - 231 | IIa | B |
| Na IC estável, para determinação da aptidão cardiorrespiratória, estratificação de risco, ajustes terapêuticos e liberação/prescrição de exercícios físicos (incluindo reabilitação) 14 , 232 , 233 | I | A |
| Na IC, para indicação de implante de dispositivo de suporte ventricular ou transplante cardíaco 3 , 14 , 224 , 232 , 234 , 235 | I | B |
| Paciente com DAC, para determinação da aptidão cardiorrespiratória, estratificação de risco, ajustes terapêuticos e liberação/prescrição de exercícios físicos (incluindo reabilitação) 14 , 29 , 236 | I | B |
| Na suspeita de DAC, para investigação diagnóstica, estratificação de risco e decisão terapêutica 237 , 238 | IIa | B |
| Estenose aórtica grave assintomática, para orientar a decisão terapêutica 14 , 93 , 239 , 240 | IIa | B |
| Na doença valvar estável, para determinação da aptidão cardiorrespiratória, ajustes terapêuticos e liberação/prescrição de exercícios físicos (incluindo reabilitação) 13 , 17 , 29 , 163 | IIa | B |
| Doença valvar com quadro clínico não correspondente aos achados ecocardiográficos (exceto na estenose aórtica) 14 , 92 - 94 , 240 | IIa | C |
| Adulto com CC, para avaliação de sintomas, decisões terapêuticas, estratificação de risco e liberação/prescrição de exercícios físicos (incluindo reabilitação) 17 , 30 , 241 , 242 | I | B |
| Avaliação pré-participação de atleta com CC 17 , 241 - 243 | IIa | B |
| Atletas competitivos após revascularização miocárdica ou correção de doença valvar, para estratificação de risco e liberação para retorno ao esporte 17 , 34 | IIa | B |
| Na cardiomiopatia hipertrófica, para avaliar aptidão cardiorrespiratória, estratificação de risco e liberação/prescrição de exercícios físicos (incluindo reabilitação) 14 , 121 , 244 , 245 | IIa | B |
| Hipertensão pulmonar, para diagnóstico e avaliação seriada (em intervalos de 6 a 12 meses) 14 , 246 | I | B |
| Hipertensão pulmonar para investigação de piora de sintomas e estratificação de risco 14 , 246 | IIa | B |
| Pós-embolia pulmonar aguda (após 3 meses), sintomática com discordância entre ventilação/perfusão na cintilografia pulmonar (V/Q scan ), para diagnóstico e seguimento da hipertensão pulmonar 247 | I | B |
| Paciente em tratamento oncológico para estratificação de risco e liberação / prescrição de exercícios (inclusive reabilitação) 248 , 249 | I | B |
| Pré-operatório de cirurgia não cardíaca em pacientes com baixa capacidade funcional (<4 METs) e/ou alto risco cardiovascular 14 , 250 | IIa | B |
| GR: grau de recomendação; NE: nível de evidência; CC: cardiopatia congênita; DAC: doença arterial coronariana; IC: insuficiência cardíaca. | ||
2.5. Indicações do TE/TCPE Associados a Métodos de Imagem
2.5.1. Cintilografia de Perfusão Miocárdica
A cintilografia de perfusão miocárdica (CPM) apresenta indicações nas diversas apresentações clínicas das doenças isquêmicas cardíacas e contribui para definição de sua gravidade. 9 Outras indicações são a avaliação de revascularização em pacientes com viabilidade miocárdica e no pré-operatório em situações específicas ( Tabela 12 ). 26 , 31 , 128 , 251 - 253
Tabela 12. – Escolha de estresse cardiovascular na cintilografia de perfusão do miocárdio 26,31,128,251-253 .
| Indicação | GR | NE |
|---|---|---|
| Estresse físico (TE) desde não haja limitação ou contraindicações ao esforço | I | A |
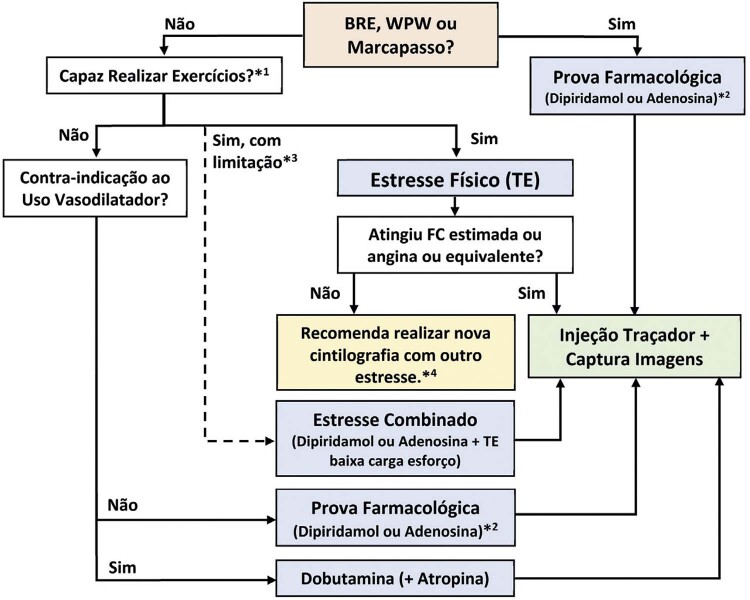
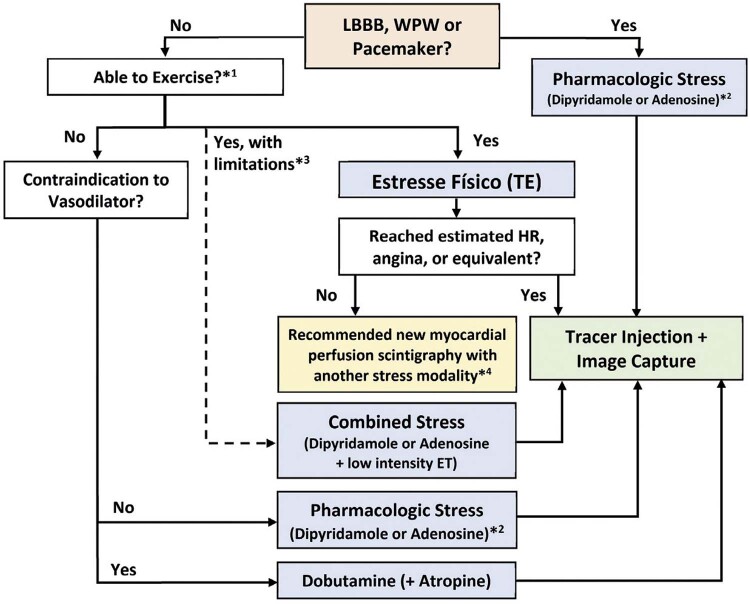
| Prova farmacológica (dipiridamol ou adenosina) nos casos de BRE, síndrome WPW e marca-passo | I | A |
| Prova farmacológica (dipiridamol, adenosina, dobutamina) na contraindicação de realização do estresse físico (TE) | I | A |
| Prova farmacológica (dipiridamol, adenosina, dobutamina) quando existir limitação para o estresse físico (TE) | IIa | A |
| Protocolo combinado: esforço físico de baixa carga de trabalho após a prova farmacológica (dipiridamol ou adenosina) | IIa | A |
| GR: grau de recomendação; NE: nível de evidência; BRE: bloqueio de ramo esquerdo; WPW: síndrome de Wolff-Parkinson-White; TE: teste ergométrico. | ||
Pacientes sintomáticos com risco intermediário para cardiopatia isquêmica são os que mais se beneficiam da CPM para avaliação diagnóstica e prognóstica. Deve ser realizada, preferencialmente, em associação com o esforço físico (estresse físico) desde que o paciente tenha capacidade funcional acima de 5 METs e habilidade para execução do esforço no ergômetro disponível.
Os pacientes com bloqueio de ramo esquerdo (BRE), síndrome de Wolff-Parkinson-White (WPW) e marca-passo devem realizar a CPM com prova farmacológica (dipiridamol ou adenosina). 9
Entre as indicações para a realização de CPM, destacam-se pacientes com baixa capacidade funcional ou condições que impedem a interpretação quanto à presença de isquemia no TE e TCPE. A CPM apresenta melhores resultados na estratificação de risco da DAC em pacientes de alta probabilidade pré-teste de DAC. A CPM deverá ser realizada sob estresse farmacológico nos indivíduos com probabilidade pré-teste intermediária e ECG de repouso que impossibilita interpretar isquemia ou naqueles que não conseguem realizar esforço físico ( Tabela 13 ). 9
Tabela 13. – Critérios para indicação da cintilografia de perfusão do miocárdio em pacientes sintomáticos 9 .
| Indicação | GR | NE | Escore |
|---|---|---|---|
| Alta probabilidade pré-teste de DAC, independentemente do ECG de repouso interpretável e preencha os critérios para estresse físico* | I | A | 8 |
| Probabilidade pré-teste intermediária de DAC, com ECG de repouso não interpretável ou não preencha os critérios para estresse físico* | I | A | 9 |
| Probabilidade pré-teste intermediária de DAC, com ECG de repouso interpretável e preencha os critérios para estresse físico* | IIa | B | 7 |
| Baixa probabilidade pré-teste de DAC, com ECG de repouso não interpretável ou indivíduo que não preencha os critérios para estresse físico* | IIa | B | 7 |
| Baixa probabilidade pré-teste de DAC, com ECG de repouso interpretável e preencha os critérios para estresse físico* | III | C | 3 |
| GR: grau de recomendação; NE: nível de evidência; DAC: doença arterial coronariana; ECG: eletrocardiograma de 12 derivações; SCA: síndrome coronariana aguda. * Estresse físico: tenha capacidade funcional para realização de atividades físicas diárias acima de 5 METs e habilidade para execução do esforço no ergômetro disponível. | |||
Seguindo as recomendações da Diretriz Brasileira de Cardiologia Nuclear, adotamos o escore internacional de indicação: indicação apropriada, se o escore for de 7 a 9; possivelmente apropriada, se o escore for de 4 a 6; raramente apropriada, com escore de 1 a 3. 9
Pacientes assintomáticos sem história de cardiopatia isquêmica e sem TE/TCPE alterado geralmente não se beneficiam da realização da CPM. Os assintomáticos com TE alterado podem se beneficiar da CPM, principalmente se risco intermediário ou alto ( Tabela 14 ). 9 , 254
Tabela 14. – Critérios de indicação da cintilografia de perfusão do miocárdio para pacientes assintomáticos e/ou com exames cardiológicos prévios 9,254 .
| Assintomáticos – detecção de DAC/estratificação de risco | GR | NE | Escore |
|---|---|---|---|
| Baixo risco (critérios ATP III) | III | A | 1 |
| Risco intermediário (critérios ATP III) – ECG não interpretável | IIa | B | 5 |
| Risco intermediário (critérios ATP III) – ECG interpretável | IIb | C | 3 |
| Alto risco (critérios ATP III) | I | A | 7 |
| Alto risco e escore de cálcio (Agatston) entre 100 e 400 | IIa | B | 7 |
| Escore de cálcio (Agatston) > 400 | IIa | B | 7 |
| Escore de Duke de risco elevado (<-11) | I | A | 8 |
| Escore de Duke de risco intermediário (entre -11 e +5) | IIa | B | 7 |
| Escore de Duke de baixo risco (>+5) | III | B | 2 |
| GR: grau de recomendação; NE: nível de evidência; Agatston: escore que define a presença e quantidade de cálcio nas artérias coronárias, caracterizando aterosclerose; ATP III: painel de tratamento em adultos, do programa de detecção, avaliação e tratamento de colesterol elevado em adultos; DAC: doença arterial coronariana. | |||
Em pacientes assintomáticos após intervenção coronária percutânea (ICP) e/ou revascularização cirúrgica do miocárdio, a CPM apresenta relação custo-benefício favorável em seguimentos superiores a 2 e 5 anos, respectivamente. Tais pacientes, caso apresentem sintomas anginosos ou manifestações equivalentes, beneficiam-se da CPM a qualquer momento ( Tabela 15 ). 9 , 31 , 251 , 252 , 254
Tabela 15. – Critérios de indicação da cintilografia de perfusão do miocárdio após procedimentos de revascularização (CRM ou ICP) 9,31,251,252,254 .
| Revascularização percutânea ou cirúrgica prévia | GR | NE | Escore |
|---|---|---|---|
| Sintomáticos a qualquer momento | I | B | 8 |
| Assintomático, CRVM ≥5 anos | IIa | B | 7 |
| Assintomático, CRVM <5 anos | IIb | B | 5 |
| Assintomático, revascularização percutânea ≥2 anos | IIa | B | 6 |
| Assintomático, revascularização percutânea <2 anos | III | C | 3 |
| GR: grau de recomendação; NE: nível de evidência; ICP: intervenção coronária percutânea; CRVM: cirurgia de revascularização miocárdica. | |||
Pacientes com DAC estabelecida e piora dos sintomas (ou com manifestações equivalentes), podem se beneficiar do exame a qualquer momento, com o objetivo principal da quantificação da carga isquêmica (extensão e intensidade dos defeitos) e suporte à decisão terapêutica (GR-NE: I-C). 252
Nos quadros de dor torácica aguda com suspeita de SCA, ECG normal (sem alterações isquêmicas ou necrose) ou ECG não interpretável (BRE, WPW e ritmo de marca-passo) e marcadores de necrose miocárdica (MNM) normais, a CPM em repouso apresenta elevado valor preditivo negativo, permitindo a liberação do paciente da sala de emergência ( Tabela 16 ). 1 , 9 , 33 , 254 - 258
Tabela 16. – Critérios de indicação da cintilografia de perfusão do miocárdio em pacientes com dor torácica aguda ou pós-síndrome coronariana aguda 1,9,33,254-258 .
| Dor torácica aguda (imagem em repouso) | GR | NE | Escore |
|---|---|---|---|
| SCA possível – ECG normal ou ECG não interpretável*; escore TIMI de baixo risco; MNM limítrofes, minimamente e elevados ou normais | IIa | A | 8 |
| SCA possível – ECG normal ou ECG não interpretável*; escore TIMI de alto risco; MNM limítrofes, minimamente elevados ou normais | IIa | A | 7/8 |
| SCA possível – ECG normal ou ECG não interpretável*; MNM iniciais negativos. Dor torácica recente (até 2 horas) ou em evolução | IIa | B | 7 |
| Pós-SCA (infarto com ou sem supradesnível do segmento ST) | GR | NE | Escore |
| Paciente estável pós-IAM com supradesnível do segmento ST para avaliação de isquemia / viabilidade e cateterismo cardíaco não realizado | IIa | B | 8 |
| Paciente estável pós-IAM sem supradesnível do segmento ST para avaliação de isquemia / viabilidade e cateterismo cardíaco não realizado. | IIa | B | 9 |
| GR: grau de recomendação; NE: nível de evidência; BRE: bloqueio do ramo esquerdo; DCA: doença arterial coronariana; ECG: eletrocardiograma de 12 derivações; IAM: infarto agudo do miocárdio; MP: marca-passo; SCA: síndrome coronariana aguda. ECG normal: sem alterações isquêmicas ou de necrose. ECG não interpretável: BRE antigo, ritmo de marca-passo, síndrome de WPW e sobrecarga ventricular esquerda importante; MNM: marcadores de necrose miocárdica. | |||
A pesquisa de viabilidade miocárdica através da CPM auxilia a seleção de pacientes com disfunção ventricular esquerda acentuada, elegíveis para revascularização miocárdica ( Tabela 17 ). 1 , 9 , 31 , 128 , 258 , 259
Tabela 17. – Critérios de indicação da cintilografia de perfusão do miocárdio para avaliação de viabilidade miocárdica 1,9,31,128,258,259 .
| Avaliação de viabilidade miocárdica | GR | NE | Escore |
|---|---|---|---|
| Disfunção ventricular esquerda acentuada, elegível para revascularização | I | A | 9 |
| GR: grau de recomendação; NE: nível de evidência. | |||
As indicações de CPM referentes a investigação de insuficiência cardíaca, arritmias, síncope, pacientes com escore de cálcio elevado (≥400), diabéticos, insuficiência renal crônica ou com história familiar de cardiopatia isquêmica, avaliação de risco pré-operatório em cirurgia não cardíaca e cirurgia vascular estão contempladas na Atualização da Diretriz de Cardiologia Nuclear. 9 , 253
2.5.2. Indicações da Ecocardiografia sob Estresse
O ecocardiograma sob estresse (EcoE) é o método de imagem não invasivo utilizado para diagnóstico, estratificação de risco, prognóstico e avaliação da viabilidade miocárdica na doença arterial coronariana (DAC), valvopatias e cardiomiopatias. 260
Na investigação de isquemia, oferece boa acurácia em pacientes de moderado a alto risco, com leve predomínio da especificidade frente a outros métodos não invasivos de imagem, como a CPM. 260 - 262 Entretanto, o método não deve ser considerado como substituto do TE, e está indicado nos pacientes com limitações ou contraindicações à realização do TE. 262
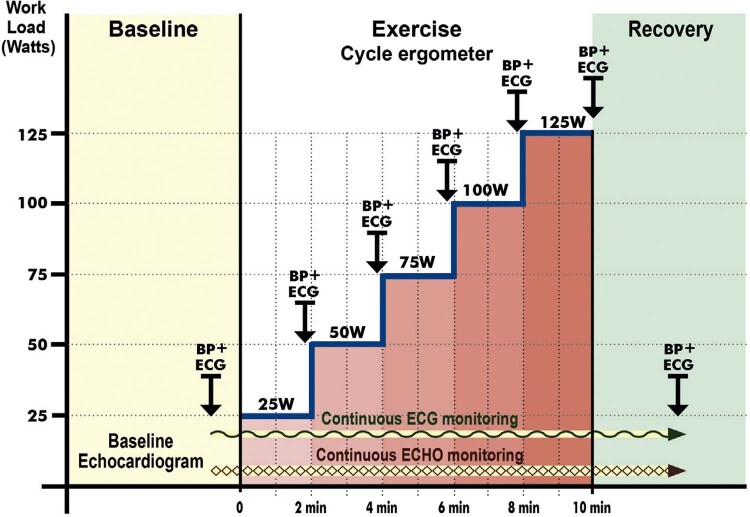
As modalidades de estresse aplicáveis são: físico (em esteira, bicicleta ergométrica ou cicloergômetro de maca); farmacológico com dobutamina (sensibilizada com atropina) ou com vasodilatador (adenosina ou dipiridamol; uso mais raro). Tanto o estresse físico quanto o farmacológico com dobutamina apresentam desempenho diagnóstico similar em relação à isquemia. Entretanto, o estresse físico (GR-NE: I-A) permite melhor interpretação da repercussão funcional, avaliação da aptidão cardiorrespiratória e da disfunção ventricular, além de definição de prognóstico e terapêuticas nas cardiopatias isquêmicas, valvopatias ou cardiomiopatias ( Tabela 18 ). 8 , 260 , 263
Tabela 18. – Vantagens, desvantagens e contraindicações das diferentes modalidades de estresse 8,260,264 .
| Cicloergômetro de maca | Bicicleta ergométrica | Esteira | Dobutamina | |
|---|---|---|---|---|
| Aumenta a demanda miocárdica de oxigênio | Sim | Sim | Sim | Sim |
| Avaliação durante o período de estresse | Sim | Sim | Não | Sim |
| Permite imagens no estresse máximo | Sim | Sim | Não* | Sim |
| Avaliação adequada da gravidade das DCV | Sim | Sim | Sim | Sim |
| Avaliação diagnóstica de isquemia | Sim | Sim | Sim | Sim |
| Aptidão cardiorrespiratória | Sim | Sim | Sim – melhor | Não |
| Repercussão funcional | Sim | Sim | Sim | Não |
| Risco de complicações | Muito baixo | Baixo | Baixo | Baixo |
| Definição de prognóstico | Sim | Sim | Sim | Limitada |
| Disponibilidade da modalidade de estresse | Moderada | Baixa | Alta | Alta |
| Contraindicações | 1) Síndrome coronariana aguda instável ou complicada** 2) Arritmias cardíacas graves (TV e BAVT)** 3) Hipertensão moderada/grave (PAS >180 mmHg)** 4) Alteração EcoB que possa tornar o estresse inseguro** 5) Contraindicações absolutas ao TE (Quadro 1) | Mesmas (1 a 4) e 5) Obstrução significativa de via de saída VE | ||
| DCV: doenças cardiovasculares; TV: taquicardia ventricular; BAVT: bloqueio atrioventricular total; PAS: pressão arterial sistólica de repouso; VE: ventrículo esquerdo. EcoB: ecocardiograma basal. *Aquisição de imagens feita imediatamente após o esforço, o mais rápido possível. **Contraindicações comuns ao estresse físico e dobutamina. | ||||
O EcoE pode ser recomendado para estratificação de risco de pacientes com síndrome coronariana aguda em unidades de dor torácica ( Tabela 19 ), e na investigação da DAC estável ( Tabela 20 ). As principais indicações do EcoE em outras DCV não isquêmicas são apresentadas na Tabela 21 .
Tabela 19. – Indicações do ecocardiograma sob estresse na síndrome coronariana aguda em unidade de dor torácica e internação hospitalar 8,260,261,265 .
| Indicação | GR | NE |
|---|---|---|
| Pacientes com angina instável de baixo risco controlada clinicamente* antes de decidir a estratégia invasiva | IIa | A |
| Para avaliar o significado funcional de obstrução coronariana moderada na angiografia, desde que o resultado interfira na conduta | IIa | C |
| Estratificação de risco após infarto do miocárdio não complicado | IIa | A |
| Investigação de pacientes com suspeita de doença microvascular,** para estabelecer se há alteração segmentar simultânea à angina e alterações eletrocardiográficas | IIa | C |
| Parâmetros de strain e strain rate derivados do speckle tracking como ferramenta adjunta ao wall motion score index , para diagnóstico e/ou prognóstico de doença coronariana aguda 266 | IIa | B |
| Angina instável de alto risco ou na fase aguda do infarto do miocárdio | III | C |
| GR: grau de recomendação; NE: nível de evidência. *Ausência de recorrência da angina, sem sinais de insuficiência cardíaca, sem alterações no eletrocardiograma inicial/seriado e troponina normal. **Dor anginosa típica com alteração ao eletrocardiograma ou prova funcional, na vigência de cinecoronariografia normal. | ||
Tabela 20. – Indicações do ecocardiograma sob estresse em pacientes com suspeita ou doença coronariana conhecida 8,260,265 .
| Indicação | GR | NE |
|---|---|---|
| Investigação de doença coronariana em pacientes com probabilidade pré-teste baixa ou intermediária, incapazes de realizar teste ergométrico e/ou com eletrocardiograma não interpretável | I | B |
| Investigação após teste ergométrico sem definição diagnóstica | I | B |
| Investigação após tomografia coronária com escore de cálcio (Agatston) >400 254 | I | B |
| Investigação após angiografia coronária com lesões intermediárias | I | B |
| Avaliação de viabilidade miocárdica em paciente com disfunção ventricular e elegível à revascularização | I | B |
| Avaliação pré-operatória de cirurgia não cardíaca de paciente com risco intermediário e alto segundo escores de risco* | I | B |
| Na avaliação pré-operatória de cirurgia não cardíaca de risco intermediário, em paciente com um ou mais fatores de risco e/ou em baixa classe funcional (<4 METs) | IIa | B |
| Sintomáticos após revascularização | IIa | B |
| Assintomáticos após revascularização incompleta | IIa | C |
| Ecocardiograma com contraste (microbolhas) adjunto às modalidades de estresse, na investigação de isquemia e viabilidade miocárdica | IIa | B |
| Pré-operatório de cirurgia não cardíaca de risco intermediário e classe funcional ≥4 METs | III | B |
| Substituição inicial ou rotineira de teste ergométrico em paciente com condições físicas e ECG interpretável | III | C |
| GR: grau de recomendação; NE: nível de evidência. MET: equivalente metabólico (do inglês, metabolic equivalent of task); DAC: doença arterial coronariana crônica; TE: teste ergométrico; FEVE: fração de ejeção do ventrículo esquerdo; ECG: eletrocardiograma; CF: classe funcional. *Índices de risco com desfechos cardiovasculares: Índice de Risco Cardíaco Revisado (RCRI, Revised Cardiac Risk Index – de Lee); o índice desenvolvido pelo American College of Physicians (ACP); Estudo Multicêntrico de Avaliação Perioperatória (EMAPO). 52,267-269 | ||
Tabela 21. – Indicações do ecocardiograma sob estresse em pacientes com DCV não isquêmicas .
| Indicação | GR | NE |
|---|---|---|
| Estenose mitral: na discordância entre sintomas e área/gradiente valvar (área mitral >1,5 cm 2 ) 8 , 93 , 265 , 270 | I | C |
| Estenose mitral: em assintomáticos com área <1cm 2 8 , 93 , 265 , 270 | IIa | C |
| Estenose mitral: em assintomáticos com área entre 1 e 1,5cm 2 em programação de gravidez ou cirurgia de maior porte 8 , 93 , 265 , 270 | IIb | C |
| Insuficiência mitral: para avaliar discrepância entre a gravidade da doença valvar e sintomas 8 , 93 , 265 , 270 | IIa | B |
| Insuficiência mitral: quando grave e assintomática, para avaliação de tolerância ao esforço e alterações hemodinâmicas 8 , 93 , 265 , 270 | IIa | B |
| Insuficiência mitral: para avaliar reserva ventricular esquerda 8 , 93 , 265 , 270 | IIb | B |
| Estenose aórtica: quando moderada ou acentuada (estágios B e C1), assintomática, para avaliar sintomas esforço-induzidos, respostas da pressão arterial sistêmica ou pulmonar, comportamento dos gradientes e função ventricular esquerda 8 , 93 , 265 | IIa | B |
| Estenose aórtica: em assintomáticos ou sintomas leves / duvidosos, com baixo fluxo / gradiente e FEVE preservada, na diferenciação de estenose verdadeira de pseudoestenose 8 , 93 , 265 | IIb | B |
| Estenose aórtica: ecocardiograma de esforço ou com dobutamina em EAo grave sintomática 8 , 93 , 265 | III | C |
| Insuficiência aórtica: quando grave, assintomática ou com sintomas duvidosos, para avaliar sintomas esforço-induzidos e capacidade funcional 8 , 93 , 265 | IIa | B |
| Insuficiência aórtica: quando moderada, para esclarecimento de sintomas e exclusão de outras causas 8 , 93 , 265 | IIa | B |
| Insuficiência aórtica: ecocardiograma sob estresse (exercício ou com dobutamina), para quantificar IAo na discordância entre a gravidade da lesão e sintomas 8 , 93 , 265 | III | C |
| Prótese aórtica ou mitral: avaliação de sintomas, confirmação de estenose hemodinamicamente significativa e/ou incompatibilidade paciente-prótese, quando o gradiente transprotético em repouso for leve a moderado (posição aórtica, entre 20-40 mmHg; posição mitral, entre 5-10 mmHg) 265 , 271 | IIa | B |
| Cardiomiopatia hipertrófica: em sintomáticos, com gradiente intraventricular de repouso ou provocável por manobra de Valsalva <50 mmHg, para avaliação do grau de obstrução dinâmica e refluxo mitral durante o esforço 8 , 121 , 272 | I | B |
| Cardiomiopatia hipertrófica: em assintomáticos, sem obstrução dinâmica ao repouso, quando a detecção de gradiente na VSVE é relevante, para orientação de mudança de estilo de vida, mudança profissional e tomada de decisão terapêutica 8 , 121 , 272 | IIb | C |
| Insuficiência cardíaca: para identificar a causa da dispneia, orientar e monitorar a resposta ao tratamento, deterioração clínica, estratificação de risco e reserva contrátil 265 , 273 , 274 | IIa | B |
| Atletas: na suspeita ou sintomas (tontura ou síncope) de obstrução dinâmica com desenvolvimento de gradiente de pressão sistólica intraventricular 265 , 275 , 276 | IIb | B |
| GR: grau de recomendação; NE: nível de evidência; IM: insuficiência mitral; EAo: estenose aórtica; IAo: insuficiência aórtica; FEVE: fração de ejeção do ventrículo esquerdo; VSVE: via de saída do ventrículo esquerdo. | ||
3. Aspectos Legais e Condições Imprescindíveis para Realização do TE, TCPE e Quando Associados a Exames Cardiológicos de Imagem
3.1. Aspectos Legais da Prática do TE e TCPE
O TE e TCPE são métodos não invasivos, com baixo risco de complicações em populações não selecionadas, fácil acessibilidade e reprodutibilidade. 6 , 10 , 11 , 277 Por se tratar de ato médico, são regidos pelo Código de Ética Médica e, assim, o médico deve conhecer as possíveis implicações éticas e jurídicas devidamente abordadas no próprio Código de Ética Médica do Conselho Federal de Medicina (CFM), Código Civil Brasileiro, Código de Proteção ao Consumidor e demais leis vigentes ( Anexo 1 ).
3.2. Condições Imprescindíveis à Realização do TE e TCPE
Diante das particularidades dos métodos e determinações legais estabelecidas, tornam-se imprescindíveis as seguintes condições:
1) Teste ergométrico e o teste cardiopulmonar de exercício são atos médicos, de exclusiva competência do médico habilitado, cuja presença física é obrigatória em todas as etapas do exame. Não há possibilidade de realização de TE e TCPE utilizando qualquer modalidade de telemedicina, laudo à distância ou mais de um exame simultâneo, por um único médico – mesmo que presencialmente. Essa conduta se deve à necessidade de realização de procedimentos e diagnósticos durante todo o exame, de atribuição única e exclusiva dos médicos, bem como atendimento de eventuais complicações / emergências.
2) O médico habilitado executante do exame deve estar inscrito no Conselho Regional de Medicina e apto ao exercício profissional. A recomendação do Departamento de Ergometria, Exercício, Cardiologia Nuclear e Reabilitação Cardiovascular da Sociedade Brasileira de Cardiologia (DERC/SBC) é de que o médico possua Título de Especialista em Cardiologia e Título de Atuação em Ergometria da AMB, ambos devidamente registrados no CFM.
3) O TE e TCPE somente devem ser realizados com a solicitação formal médica.
4) É obrigatória a obtenção prévia de termo de consentimento livre e esclarecido assinado pelo paciente ou seu representante legal, principalmente no caso de menores de 18 anos de idade.
5) Em se tratando de menores de idade ou legalmente incapazes, recomenda-se que o seu representante legal permaneça na sala de exame.
6) O serviço de ergometria deve dispor de todos os equipamentos preconizados para realização do exame, bem como equipamentos / medicamentos para o atendimento de emergências, conforme consta nesta diretriz. 278 - 280
7) O médico executante deverá realizar anamnese sumária, exame físico direcionado e registro eletrocardiográfico no pré-teste. Registrar medicamentos em uso, morbidades e fatores de risco.
8) Avaliar a presença de contraindicações relativas e absolutas para a realização do exame.
9) Na escolha do protocolo de esforço do TE e do TCPE, deverão ser consideradas as condições clínicas do paciente, solicitação médica, disponibilidade de ergômetros e experiência do médico executante.
10) Somente liberar o paciente após a estabilização clínica / hemodinâmica.
11) Na eventualidade de eventos adversos de natureza grave ou fatal decorrentes do exame, o médico executante assumirá o suporte ao paciente até contato efetivo com o médico assistente e/ou eventual encaminhamento ao serviço de emergência. Sugere-se, em casos de evento fatal, a comunicação e solicitação de parecer da comissão de ética e do Conselho Regional de Medicina.
12) Orientar o paciente a retornar ao médico solicitante para as devidas condutas. Caso seja arguido pelo paciente ou seu representante legal sobre o resultado do exame, o médico executante deverá prestar as informações pertinentes.
13) A remuneração pelo exame realizado deve contemplar honorários médicos justos e todos os custos operacionais.
14) O médico executante deverá seguir as recomendações das autoridades públicas e sanitárias e das entidades médicas referentes às eventuais endemias, epidemias e pandemias, assim como as normas dos núcleos de segurança do paciente. 281
15) A realização de TE e/ou TCPE envolve a obtenção e o tratamento de dados sensíveis dos pacientes, devendo os serviços de ergometria respeitarem a Lei Geral de Proteção de Dados (LGPD) e legislações do CFM. 282 - 284
3.3. Termo de Consentimento para o TE e TCPE
O modelo e o processo de obtenção de termo de consentimento livre e esclarecido (TCLE) para a realização de TE e TCPE devem observar os critérios norteadores do Código de Ética Médica e Recomendação do CFM Nº 1/2016. 285
3.4. Termo de Consentimento ao TE Associado a Métodos de Imagem
O TCLE para a realização do TE no ecocardiograma de estresse físico, cintilografia de perfusão do miocárdio e tomografia por emissão de pósitrons deve também observar as determinações dos departamentos e sociedades de especialidades envolvidos, em observância aos critérios norteadores do Código de Ética Médica e Recomendação do CFM Nº 1/2016. 285
4. Aspectos Referentes à Formação na Área de Atuação de Ergometria
A área de atuação em ergometria é homologada pela Comissão Mista de Especialidades (CME) composta pelo CFM, AMB e pela Comissão Nacional de Residência Médica (CNRM). 7 A formação na área de atuação de ergometria busca fornecer aprimoramento profissional aos cardiologistas e, consequentemente, melhora da qualidade dos serviços de diagnóstico cardiológico e do atendimento dos pacientes submetidos ao TE e TCPE.
A formação deverá observar as determinações legais estabelecidas pelas entidades médicas e as seguintes recomendações do DERC/SBC:
1) Ser feita em instituição com serviço de ergometria atuante, legalmente constituído, com inscrição nos órgãos públicos, documentação sanitária e registros regulares e atualizados. A instituição formadora poderá ser submetida a processo de cadastramento, avaliação e de credenciamento por parte do DERC/SBC.
2) É considerado quesito mínimo para constituição de uma instituição formadora a realização rotineira de TE. Adicionalmente, é necessária a realização de TCPE e de ambos os métodos (TE/TCPE) associados a outros métodos de imagem, visando cumprir o programa prático. A instituição formadora poderá estabelecer convênio oficial com outra instituição para realização do treinamento prático em TCPE e/ou TE/TCPE associados aos métodos de imagem.
3) A forma de seleção de participantes para o programa de formação será de livre escolha da instituição, podendo ser por entrevista e/ou prova teórica e/ou prova prática. Recomenda-se a divulgação da seleção através de edital público contendo os pré-requisitos, forma de inscrição no processo, critérios de seleção, cronograma e divulgação do resultado. A instituição deverá garantir um processo justo, equânime e transparente.
4) Como pré-requisito obrigatório à formação em ergometria, o candidato deverá ter concluído Residência Médica em Cardiologia ou ser detentor do Título de Especialista em Cardiologia da AMB/CFM.
5) O programa de formação visa que o cardiologista adquira experiência de modo a ser responsável pela realização, interpretação e organização de serviços de TE e TCPE. O programa será teórico-prático com duração de 12 meses (1 ano) e carga horária mínima de 960 horas (48 semanas com 20 horas semanais de formação e adicionalmente 30 dias reservados para férias).
6) O programa teórico corresponderá a, no mínimo, 10% e, no máximo, 20% da carga horária total, dedicado exclusivamente às atividades teóricas: aulas, seminários, reuniões científicas, congressos, discussões de artigos de revistas (clube de revistas ou de atualização), sessões de discussão clínica/cardiológica e reuniões interpretativas de exames de complementares (não invasivos e invasivos).
7) O programa teórico da instituição deve incluir, no mínimo, todos os tópicos e assuntos abordados nesta diretriz. Sugere-se treinamento em técnicas básicas de pesquisa em exames complementares, noções de metodologia científica, estatística básica, ética e técnicas de comunicação com paciente.
8) O treinamento prático deverá ser sob supervisão direta e presencial de preceptor detentor de Título de Especialista em Cardiologia e Título da Área de Atuação em Ergometria. Os programas devem ter uma proporção mínima de um preceptor para, no máximo, dois participantes.
9) O treinamento prático divide-se em: treinamento inicial sob supervisão direta do preceptor, correspondendo a pelo menos 25% do período do total de horas do programa prático; treinamento sob supervisão indireta, após aprovação no programa sob supervisão direta, correspondendo a pelo menos mais 55% do período total. Recomenda-se que o número de exames do treinamento prático seja na proporção mínima de 70% de TE, 15% de TCPE, de 15% de TE/TCPE associados aos métodos de imagem.
10) Nos programas de formação nos quais o ano adicional em ergometria é reconhecido pelo Ministério da Educação (MEC), mantêm-se todos os pré-requisitos. As atividades devem compreender uma carga horária de 2.880 horas, sendo distribuídas da seguinte maneira: 10% a 20% (288h a 576h) em atividades de cunho teórico e de 80% a 90% (2.304 a 2.592h) em atividades práticas. Nas atividades práticas, recomenda-se que parte dos exames de TE e TCPE seja realizada em associação a outros métodos de imagem, e sugere-se que outra parte em avaliações para programas de reabilitação cardiovascular e de cardiologia do esporte.
11) É recomendado o treinamento regular em atendimento de urgência para uma abordagem otimizada dos pacientes com complicações durante os exames. Esse treinamento correspondendo à realização de curso de Advanced Cardiovascular Life Support (ACLS) ou de Treinamento de Emergências Cardiovasculares Avançado (TECA-A).
12) A instituição formadora poderá fornecer treinamento e/ou formação em outros métodos de diagnóstico e exames cardiológicos independentemente ou simultaneamente à formação em ergometria. Entretanto, caso ocorra essa situação, não poderá haver interferência no programa de formação em ergometria, bem como não será computada como atividade ou carga horária da formação teórica e/ou prática.
13) A instituição deverá elaborar avaliação dos participantes, com critérios próprios, durante e/ou ao final do programa de formação. Recomendando-se manter transparência nas avaliações definindo previamente os critérios objetivos que serão exigidos, e incluir uma autoavaliação com escala de atitudes. Caso não haja aprovação, sugere-se que a instituição forneça opções de treinamento adicional para sanar pendências, seguido de nova avaliação. A instituição deverá fornecer certificado oficial ao participante aprovado, bem como declaração de cumprimento de todos os requisitos aqui apresentados.
14) Após conclusão da formação, a SBC recomenda realizar a prova para obtenção do Título da Área de Atuação em Ergometria da AMB/Sociedade Brasileira de Cardiologia e subsequente registro no CFM. 286
15) É recomendável que, após o término da formação, haja participação periódica em eventos científicos / programas de atualização em TE e TCPE, em âmbito nacional e/ou internacional, para revalidação e aperfeiçoamento constante da habilitação adquirida durante a formação.
Parte 2 – Teste Ergométrico
1. Metodologia do TE
A realização do TE necessita, obrigatoriamente, de obediência às condições metodológicas do exame, visando à segurança do paciente e à obtenção de resultados válidos e reprodutíveis.
1.1. Condições Básicas para a Realização do TE
1.1.1. Equipe
O TE é realizado por médico habilitado, com experiência no método, obrigatoriamente presente na sala do exame, executando um único exame por vez, que deverá emitir o respectivo laudo. O médico executante poderá ser auxiliado por profissionais da área de saúde (auxiliar de enfermagem ou técnica de enfermagem ou enfermeira) especificamente treinados para auxiliar o exame e participar de eventuais atendimentos de emergência. 286 , 287
A instituição e/ou o médico executante deverão orientar e treinar adequadamente outros possíveis profissionais envolvidos no TE quanto a marcação do exame, higienização de equipamentos, limpeza da sala de exame e transporte de pacientes.
1.1.2. Área Física
Ambiente planejado, adequadamente iluminado e ventilado, com dimensões suficientes para acomodação de todos os equipamentos do TE (incluindo maca, cadeira para paciente assentar e carro de emergência), permitindo circulação de pelo menos três pessoas (no mínimo, de 7 m 2 ), com temperatura ambiente mantida entre 18 e 22°C, sendo desejável umidade relativa do ar em pelo menos 40%. 288 - 290
1.1.3. Equipamentos
Equipamentos básicos recomendados: ergômetro; sistema de ergometria com monitor para observação do ECG; impressora (ou acesso para servidor de impressão); esfigmomanômetro calibrado e estetoscópio; termômetro de parede; oxímetro digital; cadeiras destinadas ao paciente e médico; maca ou cama; carro de emergência (se sala única); cilindro de oxigênio (junto ao carro de emergência) ou ponto de oxigênio em cada sala de TE; aspirador portátil (junto ao carro de emergência) ou ponto de aspiração em cada sala de TE; lixeiras (lixo comum e hospitalar). 4 , 13
Antes de cada exame, recomenda-se: 4 , 13
– Limpeza do cabo do aparelho de ECG do TE/TCPE com um tecido embebido em álcool a 70%.
– Limpeza e desinfecção da barra de apoio do ergômetro, selim do cicloergômetro, estetoscópio etc. Utilizar produtos de higienização segundo as rotinas institucionais.
– Preferencialmente, utilizar materiais descartáveis e descarte de maneira adequada e em local apropriado.
1.1.4. Material para Emergência Médica
O serviço deverá manter disponível carro de emergência, para suporte básico e avançado de vida, no local de realização do TE e/ou TCPE. Recomenda-se adotar a padronização do carro de emergência da Diretriz de Ressuscitação Cardiopulmonar e Cuidados Cardiovasculares de Emergência da Sociedade Brasileira de Cardiologia (consulte Quadro 17.2 da referida Diretriz: Padronização do carro de emergência na unidade de terapia intensiva e pronto-socorro). 279
1.1.5. Medicamentos para Emergência Médica
Recomenda-se adotar as medicações para suporte básico e avançado de vida conforme padronização da Diretriz de Ressuscitação Cardiopulmonar e Cuidados Cardiovasculares de Emergência da Sociedade Brasileira de Cardiologia (consulte Quadro 17.2 da referida Diretriz: Padronização do carro de emergência na unidade de terapia intensiva e pronto-socorro). 279
1.1.6. Orientações ao Paciente na Marcação do TE
Recomendações a serem feitas ao paciente: 4 , 13
1) Evitar fumar nas 3 horas antes do exame. 291
2) No dia anterior ao exame e, no dia do exame, não realizar esforços físicos exaustivos e que não sejam habituais.
3) Evitar jejum ou alimentação excessiva antes do exame; fazer uma refeição leve 2 horas antes. Não ingerir bebidas alcoólicas e/ou bebidas energéticas (ricas em cafeína) na véspera e no dia do exame.
4) Comparecer de bermuda ou calça comprida confortável, calçado com solado de borracha e sem salto (de preferência tênis). Para mulheres, aconselha-se utilizar sutiã ou top.
5) Trazer o pedido médico do exame.
6) Sugere-se trazer TE realizados anteriormente.
7) A suspensão ou manutenção de uso de medicações: a critério do médico assistente do paciente.
Em exames para o diagnóstico de DAC, alguns medicamentos devem ser suspensos por interferir no resultado TE ( Tabela 22 ). Essa suspensão não deve ser feita em exames para prescrição de exercícios e avaliação de resposta terapêutica. As suspensões de medicações devem ser feitas com parcimônia e levar em consideração os riscos de descompensação clínica em prol de benefícios adicionais das informações do exame. Algumas medicações podem influir (positiva ou negativamente) na duração do exercício, na carga de esforço atingida, no limiar de isquemia e angina, na ocorrência de dor anginosa, na depressão de segmento ST, no comportamento da FC e PA, no tempo para normalização do infradesnivelamento etc. 6 , 13
Tabela 22. – Tempo recomendado de suspensão de medicações em TE para o diagnóstico de DAC 4,6,13,134 .
| Medicação | Suspensão prévia por |
|---|---|
| Amiodarona | 30 dias |
| Betabloqueadores* | 4 (cardiosseletivos) e 7 dias (outros) |
| Bloqueador de canal de cálcio | 4 dias |
| Outros antiarrítmicos | 3 a 5 dias |
| Digoxina | 7 dias |
| Inibidores da ECA: | |
| • Captopril, enalapril | 1 dia |
| • Outros | 3 dias |
| BRAs | 3 dias |
| Diuréticos de alça** | 3 dias |
| Nitratos | 1 dia |
| Trimetazidina | 2 dias |
| Metildopa e clonidina | 1 dia |
| Minoxidil | 2 dias |
| ECA: enzima conversora de angiotensina; BRAs: bloqueadores de receptores da angiotensina. *Sugere-se realizar a retirada gradual dos betabloqueadores e anti-hipertensivos buscando evitar o fenômeno de rebote. **Considerar com parcimônia a suspensão em caso de insuficiência cardíaca. | |
1.2. Procedimentos Básicos para a Realização do TE 292
1.2.1. Fase Pré-teste
O médico executante deverá constatar se as recomendações para realização do TE foram adequadamente cumpridas pelo paciente e esclarecer possíveis dúvidas quanto ao exame e para obtenção do TCLE. Caso haja recusa pelo paciente em assinar o TCLE, o médico executante não poderá realizar o exame.
1.2.2. Avaliação Inicial
Recomenda-se ao médico executante do TE avaliar: pedido médico, motivo do exame, medicações em uso, sintomas do paciente, realização de anamnese e exame físico dirigidos aos sistemas cardiovascular e respiratório, tendo em vista, inclusive, a identificação de eventuais contraindicações relativas e absolutas para realização do exame ( Tabela 23 ). Deve-se avaliar as atividades cotidianas realizadas pelo paciente, de modo a identificar eventuais limitações e permitir a adequada escolha do protocolo e ergômetro. 6 , 13 , 293
Tabela 23. – Recomendações quanto à anamnese e ao exame físico dirigido 13,115,293 .
| Anamnese | Exame físico |
|---|---|
| Sintomas atuais | Ectoscopia geral (anemia, faces sindrômicas, palidez cutânea) |
| História familiar e fatores de risco | Frequência cardíaca/ pressão arterial |
| Antecedentes patológicos | Ausculta cardíaca e pulmonar |
| Medicações em uso | Oximetria* |
| Tolerância ao esforço físico | Pulsos periféricos e índice tornozelo-braquial** |
| Realizou TE anteriormente? Teve alguma anormalidade? | Exame adicional direcionado à sintomatologia*** |
| Aplicação de escore clínico pré-teste | |
| *Exame adicional ao TE recomendado na ICC, valvopatias, cardiomiopatias e pós-COVID. **Exame adicional ao TE para investigação de doença arterial periférica e claudicação. ***Exemplos ausculta de carótida em idosos com suspeita de síncope, medição da PA nos quatros membros inferiores em caso de coarctação de aorta etc. | |
A hiperventilação no pré-teste não é recomendada, e pode causar desconforto torácico, broncoespasmo e alterações eletrocardiográficas que podem interferir na acurácia do TE. 294
1.2.3. Exame Físico Sumário e Específico
O exame físico deve ser realizado de forma dirigida de acordo com a anamnese previamente realizada. São obrigatórias a realização de auscultas cardíaca e pulmonar e a medição da pressão arterial e FC de repouso.
Ressalta-se a importância das auscultas na avaliação de doenças valvares, na IC, doenças pulmonares, investigação de dispneia e no pós-COVID. Nesses pacientes, recomenda-se avaliar a saturação através de oxímetro digital, pois uma saturação inadequada (SpO 2 ≤92% em ar ambiente), a princípio, contraindica a realização do TE. Uma dessaturação parcial (SpO 2 >92% e <95% em ar ambiente) exige atenção especial com monitorização da oximetria digital durante todo o TE (ver seção Exames Realizados Simultaneamente e Adicionalmente ao TE). 122 , 226 , 228
1.2.4. Sistema de Monitorização e Registro Eletrocardiográfico
A monitorização contínua do eletrocardiograma e a realização de registros são obrigatórias em todas as etapas do TE (repouso, esforço e recuperação). Sugere-se utilização de eletrodo para monitorização de eletrocardiograma de longa duração, hipoalergênico e extra-aderente.
Recomenda-se a utilização de sistema computadorizado de ergometria para a monitorização do ECG e software que permita a obtenção de dados e adequado registro e interpretação do exame. O sistema deverá receber manutenção preventiva conforme legislação vigente, e sugere-se atualização rotineira do sistema. 13 , 115
Recomenda-se a realização de ECG convencional de 12 derivações de forma adicional, precedendo o TE/TCPE. O ECG convencional é um exame complementar não invasivo que permite avaliar a condição cardíaca do indivíduo, podendo contribuir para eventual contraindicação do TE/TCPE prestes a ser realizado. O ECG convencional difere dos registros de ECG no TE por utilizar posicionamento periférico de eletrodos (braços e pernas), em decúbito dorsal, com utilização de filtros de sinal para repouso. O ECG convencional de 12 derivações é um procedimento médico previsto na Classificação Brasileira Hierarquizada de Procedimentos Médicos (Código: 4.01.01.01-0). 295
1.2.4.1. Sistemas de Três Derivações
É composto de uma combinação de duas derivações bipolares (CM5 = obrigatório; aVF ou D2M = D2 modificada) e uma unipolar (normalmente V2). Não é mais recomendado o uso no TE tendo em vista a superioridade dos sistemas com mais derivações. 296
1.2.4.2. Sistema de 12 Derivações
No TE, recomenda-se utilizar o posicionamento de 12 derivações clássicas de Mason-Likar (ou sua versão modificada preservando CM5) ou o posicionamento para 13 derivações. 6 , 297 , 298
Posicionamento dos eletrodos para obtenção das derivações clássicas de Mason-Likar ( Figura 1 ):
Figura 1. – Posicionamento dos eletrodos nas derivações clássicas de Mason-Likar e derivações modificadas preservando CM. BD: braço direito; BE: braço esquerdo; PD: perna direita; PE: perna esquerda.
1) Eletrodo do braço direito é posicionado próximo à raiz do ombro direito, na linha do 2º espaço intercostal direito.
2) Eletrodo do braço esquerdo é posicionado próximo à raiz do ombro esquerdo, na linha do 2º espaço intercostal esquerdo.
3) Eletrodo da perna direita é posicionado na porção mais alta da crista ilíaca direita (preferencialmente, logo abaixo do umbigo, na linha hemiclavicular direita). Esse eletrodo tem importância para a referência de impedância elétrica, qualidade técnica dos traçados, e sua posição não interfere diretamente no triângulo de Einthoven.
4) Eletrodo da perna esquerda é posicionado na porção mais alta da crista ilíaca esquerda (preferencialmente logo abaixo do umbigo, na linha hemiclavicular esquerda).
5) Eletrodos precordiais são posicionados nos pontos de V1 a V6 do ECG clássico:
– V1: no 4º espaço intercostal, na linha paraesternal direita.
– V2: no 4º espaço intercostal, na linha paraesternal esquerda.
– V3: entre os eletrodos V2 e V4.
– V4: no 5º espaço intercostal, na linha hemiclavicular esquerda.
– V5: no 5º espaço intercostal, entre V4 e V6, na linha axilar anterior.
– V6: no 5º espaço intercostal, na linha axilar média.
Observação: Os eletrodos V4, V5 e V6 devem ser colocados no mesmo nível, ao longo de uma linha horizontal que não segue necessariamente o espaço intercostal.
Posicionamento dos eletrodos para obtenção das 12 derivações modificadas preservando CM5 ( Figura 1 ):
1) Eletrodo do braço direito é posicionado junto à fúrcula esternal (manúbrio).
2) Eletrodo do braço esquerdo é posicionado no ponto do V5 do ECG clássico (5º espaço intercostal, na linha axilar anterior).
3) Eletrodo da perna direita é posicionado logo abaixo do rebordo costal direito, na linha hemiclavicular direita (ou na porção mais alta da crista ilíaca direita).
4) Eletrodo da perna esquerda posicionado logo abaixo do rebordo costal esquerdo, na linha hemiclavicular esquerda (ou na porção mais alta da crista ilíaca esquerda).
5) Eletrodos precordiais nos pontos:
– V1, V2, V3, V4 e V6 do ECG clássico.
– V5: é deslocado para o lado esquerdo, posicionado imediatamente antes do V6 clássico.
1.2.4.3. Sistema de 13 ou Mais Derivações
Este sistema é o principal adotado nos equipamentos de ergometria com tecnologia nacional, em que se acrescenta a derivação CM5 as 12 derivações clássicas de Mason-Likar ( Figura 2 ). Essa derivação é obtida com o acréscimo de um eletrodo posicionado junto à fúrcula esternal (manúbrio). 152 , 299
Figura 2. – Posicionamento dos eletrodos no sistema de 13 derivações com CM5. BD: braço direito; BE: braço esquerdo; PD: perna direita; PE: perna esquerda; CM5: eletrodo adicional.
CM5 é considerada a derivação individual de maior sensibilidade para detecção de isquemia miocárdica, entretanto, com discreta piora da especificidade. Permite monitorar a região anterolateral do ventrículo esquerdo. 152
O sistema de 16 derivações com acréscimo de derivações precordiais direitas (V1r, V2r, V3r) não se estabeleceu na prática clínica, apesar de existirem estudos demonstrando melhora significativa de sensibilidade e especificidade do TE, sobretudo para lesões nas coronárias direita e circunflexa. 134
1.2.4.4. Preparo da Pele para Monitorização Eletrocardiográfica
O preparo da pele é fundamental para garantir boa qualidade do traçado eletrocardiográfico. Recomenda-se a limpeza da pele no local de fixação dos eletrodos com gaze embebida em álcool (de 70% a 99%). Em idosos e crianças, deve-se ter maior cuidado com a abrasão devido a maior sensibilidade da pele e propensão a lesões. Nos homens com excesso de pelos nas regiões de fixação dos eletrodos, recomenda-se a realização de tricotomia com lâmina descartável. 299
1.2.4.5. Registros Eletrocardiográficos
Os registros eletrocardiográficos devem ser feitos imediatamente após as aferições da pressão arterial e frequência cardíaca no: repouso (posição supina e ortostática); final de cada estágio do esforço; no pico do esforço; fase de recuperação (tempos de um, dois, quatro e seis minutos, pelo menos, ou até normalização de quaisquer alterações eletrocardiográficas). Registros adicionais devem ser realizados na ocorrência de alterações de ritmo, bloqueios átrio e intraventriculares e do segmento ST.
1.2.5. Monitorização dos Dados Hemodinâmicos
1.2.5.1. Monitorização da Frequência Cardíaca
O comportamento da FC reflete a resposta do sistema autonômico ao esforço, fornecendo informações diagnósticas e prognósticas. 6 , 14 No TE, conceitua-se como:
– Frequência cardíaca máxima (FCmax) de um indivíduo aquela atingida em nível de exaustão ao esforço.
– Frequência cardíaca pico (FCpico) é a maior FC observada no pico do esforço, mesmo que não esteja associada à exaustão física.
Pode-se estimar a FCmax que um indivíduo alcançará no TE por meio de equações de regressão, ajustadas à idade e/ou associada ao sexo. Não há consenso sobre a melhor equação de estimativa da FCmax. As equações mais utilizadas são:
Equações de predição da FCmax para ambos os sexos:
FCmax = 220 – idade (Karvonen et al., 1957) 300
FCmax = 208 – (0,7 × idade) (Tanaka et al., 2001) 301
Equações de predição da FCmax específicas para homens e mulheres:
A FCmax é influenciada pelas condições individuais, o tipo de ergômetro, estado emocional, estado metabólico, capacidade física, uso de fármacos, de dispositivos implantáveis, dentre outros (p. ex., temperatura, umidade relativa do ar etc.). 301 , 303 , 304
Recomenda-se a monitorização contínua da FC durante todo o TE e seu registro associado aos dos traçados do ECG.
1.2.5.2. Monitorização da Pressão Arterial Sistêmica
A medida da pressão arterial deve ser executada por profissionais devidamente treinados e experientes, e pode ser: 13 , 134
– Manual, com utilização do esfigmomanômetro aneroide.
– Semiautomática, com equipamento sem sincronização ao ECG.
– Automática, com equipamento com dupla checagem (auscultatória sincronizada ao ECG).
A medida automática é limitada em velocidades elevadas de esforço, devido ao maior movimento do corpo e instabilidade do braço.
Todas as formas de medição devem utilizar manguito de velcro do tamanho adequado à circunferência do braço e proteção contra excesso de suor (papel toalha ou malha). O estetoscópio e/ou sensor dos equipamentos automáticos devem ser posicionados sobre a artéria braquial.
Recomenda-se a medição da PA em ambos os braços no pré-teste e subsequentes medições (durante o teste e recuperação) no braço com maior nível pressórico (normalmente membro superior esquerdo). Em caso de PA elevada no pré-teste, obter medidas repetidas e acuradas em ambos os braços. 215
Contraindica-se a medição da pressão no membro superior com fístula arteriovenosa, esvaziamento ganglionar, trombose, linfedema e/ou retirada de artéria radial para enxerto. 134 , 305
Recomenda-se a medição da PA, pelo menos, no pré-esforço, ao final de cada estágio de protocolo escalonado ou a cada 2 minutos em protocolo de rampa, quando o paciente atingir 5 METs (ver seção 3.2.2. Resposta da Pressão Arterial), no pico do esforço e na recuperação (1, 2, 4 e 6 minutos). Caso haja necessidade, as medições devem ser mantidas por tempo maior na recuperação. Reavaliar sempre que houver discrepâncias ou dúvidas em relação às medições.
1.2.6. Monitoração de Sinais e Sintomas
Os sinais e sintomas apresentados no repouso, durante o esforço e recuperação devem ser monitorados e descritos no laudo do exame, de forma objetiva, incluindo o motivo de interrupção. Detalhar os sintomas que estejam diretamente relacionados à solicitação do exame.
Monitorar a ocorrência de dor torácica, precordial ou retroesternal, acompanhada ou não por dispneia, caracterizando possível angina desencadeada ao esforço. 306 , 307
A dispneia aos esforços pode estar relacionada à cardiopatia, pneumopatia e asma induzida pelo esforço. 225 , 307 - 309 Quanto à ectoscopia, salienta-se a necessidade de observação de coloração da pele (palidez, cianose) e sudorese, assim como padrão respiratório e de marcha. 175 , 310
1.2.7. Profilaxia de Complicações no TE
Como medidas de profilaxia, recomendamos: 13 , 152
– Respeitar os critérios de realização do TE em nível hospitalar com devida retaguarda.
– Escolher o ergômetro e protocolo adequados para o paciente.
– Permitir, quando necessário, o apoio na barra da esteira por aumentar a segurança do paciente e favorecer obtenção de melhor traçado eletrocardiográfico.
– Observar o comportamento e a postura do paciente sobre o ergômetro.
– Respeitar o limite de tolerância ao esforço referido pelo paciente e os critérios de interrupção.
– Dispor de material adequado para atendimento de possíveis emergências e intercorrências.
1.3. Ergômetros
Os ergômetros utilizados no TE/TCPE são desenvolvidos especificamente para este fim, e devem ter registro na Anvisa. Os principais tipos de ergômetro são: cicloergômetro (bicicleta ergométrica; rolo estacionário); esteira ergométrica; cicloergômetro de braço (ergômetro de braço); dentre outros. No Brasil, os mais utilizados são a esteira ergométrica e a bicicleta ergométrica.
A escolha do ergômetro deve levar em consideração: indicação do TE (p. ex., síncope e taquicardia ventricular catecolaminérgica – preferir ciclo ergômetro); atividade física desenvolvida habitualmente; exames seriados idealmente com a manutenção do ergômetro; disponibilidade do equipamento; limitações físicas do paciente. 4 , 6
1.3.1. Cicloergômetro
A bicicleta ergométrica deve ser preferida em ciclistas, nas limitações neurológicas, visuais ou de equilíbrio e investigações de síncope esforço-induzida (prevenção de quedas). Facilita a medição da pressão arterial e ausculta cardiopulmonar durante o esforço.
O incremento da carga de esforço na bicicleta é feito por meio de frenagem mecânica ou eletromagnética. É considerado ideal manter a velocidade de pedalar em 60 rpm para adequada estimativa do VO 2 por fórmula, mas considerando limitações individuais (exemplo: idade, morbidades, etc.) aceita-se uma variação entre 40 e 70 rpm.
Como principais limitações: em idosos e pessoas não habituadas ao ciclismo, dificuldade de coordenação e manutenção da velocidade constante; em indivíduos não habituados ao ciclismo, são encontrados maior valor de PAS e menores valores de FC e VO 2 (de 5% a 25% menores em relação à esteira). 1 , 292
1.3.2. Esteira Ergométrica
É mais adequada na população em geral por permitir melhor adaptação ao ergômetro. Possibilita atingir maiores valores de FC e VO 2 em comparação ao cicloergômetro. Permite aumentar a carga de esforço por meio da inclinação, de maneira isolada ou em conjunto com o aumento da velocidade. 1
Como principais limitações: maior dificuldade de medida da PA em grandes velocidades; possibilidade de desencadear síndrome vertiginosa; dificuldade de adaptação em pacientes com escalafobia (medo de escadas rolantes) ou medo de esteira rolante; exames cuja indicação envolvam potenciais situações de queda (p. ex., síncope). 134
1.3.3. Cicloergômetro de Braço
É recomendado em indivíduos incapacitados de realizar exercícios com os membros inferiores e em praticantes de atividades esportivas predominantemente de membros superiores. 311 A medida da pressão arterial deve ser realizada na coxa ou em um dos braços, enquanto o outro se mantém ativo. A massa muscular envolvida no esforço é menor. Quando comparado ao TE em esteira, geralmente atinge menores valores de VO 2 e PAS. 312
1.3.4. Outros Ergômetros
Existem outras opções, como esteira adaptada para cadeiras de rodas, remo ergômetro, piscina adaptada com corrente de água etc. Cada ergômetro requer protocolo próprio e individualizado, e fórmulas específicas para estimativa do VO 2 . Devem ser consideradas possíveis variações das respostas hemodinâmicas relacionadas ao ergômetro. 134
1.4. Escolha do Protocolo
Os protocolos podem ser divididos quanto ao tipo do esforço:
1) Incrementais (aumento gradativo de carga):
– Escalonado (em degraus): com aumento de cargas em etapas (estágio) em tempo predeterminado (a cada 1 ou mais minutos por estágio). Normalmente envolve grandes incrementos de carga ao final de cada estágio.
– Rampa: com incrementos pequenos de carga, frequentes (tendendo a linear) e em curtos intervalos de tempo (incrementos em segundos, não podendo atingir 1 minuto).
2) Sem incremento (carga fixa): não realiza aumento de cargas durante todo o exame. Quando realizado em esteira ergométrica, mantém velocidade e inclinação fixas. É realizado com cargas de esforço predeterminadas exclusivamente em situações clínicas específicas (p. ex., na determinação da claudicação inicial e absoluta de membros inferiores; no TE associado ao exame de índice tornozelo-braquial pós-esforço). 1 , 4
A escolha do protocolo deve ser individualizada, levar em conta a indicação do TE, o condicionamento físico, eventuais limitações físicas e visar a um tempo de esforço ideal de 10 minutos (com variações entre 8 e 12 minutos). 1 , 4
1.4.1. Protocolos para Bicicleta Ergométrica
Existem vários protocolos para bicicleta ergométrica, sendo os principais apresentados na Tabela 24 . A carga de trabalho realizada na bicicleta normalmente é expressa em watts (W).
Tabela 24. – Protocolos para bicicleta ergométrica.
| Protocolo | Indicado para | Carga inicial | Incremento de carga |
|---|---|---|---|
| Balke | Jovens e adultos | 25W a 50W* | 25W/2 minutos |
| Astrand | Adultos | 25W | 25W/3 minutos |
| Jones | Sedentários e idosos | 25W | 15W/1 minuto |
| Mellorowicz | Bem condicionados ou atletas | 50W | 50W/2 minutos |
| Rampa | Todas as populações, sendo o ideal para atletas** | 10W a 50W*** | 5 a 50W/1 min. Subdividir o aumento em valores iguais e incremento em intervalos regulares (<60 segundos)**** |
| *Nos indivíduos jovens e sadios, recomenda-se iniciar com 50W; nos limitados, com carga livre; e nos demais, com 25W. **Ajustável à expectativa de desempenho físico e atividades diárias do indivíduo. ***Nos atletas, recomenda-se iniciar com pelo menos 50W; nos limitados, com 10W; e nos demais, com 25W. ****Exemplo: protocolo de rampa com incremento de carga de 15W/1 minuto = aumentar a carga em 5W a cada 20 segundos. | |||
O protocolo mais utilizado é o de Balke. A estimativa do VO 2 máximo (VO 2 max) é calculada pela fórmula: VO 2 max= (12 × carga em watts) + 300/peso em kg.
O protocolo de rampa tem sido mais utilizado em atletas e no TCPE. O VO 2 max também pode ser calculado por fórmulas, sendo a mais utilizada a do ACMS, 313 em que:
Nessa equação, o VO2max relativo ao peso corporal foi estimado por:
1.4.2. Protocolos para Esteira Ergométrica
1.4.2.1. Protocolos Escalonados
1.4.2.1.1. Protocolo de Bruce 4 , 13 , 134
É o protocolo escalonado mais utilizado. É recomendado para adultos e também para idosos sem limitação física e com algum grau de condicionamento físico. O cálculo da estimativa do VO 2 max pode ser feito pelas fórmulas: 13 , 134 , 293
Envolve incrementos abruptos e, em indivíduos sedentários, a mudança de estágio pode provocar desequilíbrios e dificuldades de adaptação. Em atletas, geralmente, os incrementos de carga são pequenos, tornando o exame demasiadamente prolongado.
1.4.2.1.2. Protocolo de Bruce Modificado 13 , 134
Trata-se de uma adaptação do protocolo de Bruce objetivando atender a pacientes adultos e idosos com baixa capacidade física. A adaptação mais conhecida é a sugerida por Shefield ( Tabela 25 ), em que os dois primeiros estágios são de baixa carga e, a partir do terceiro estágio, que corresponde ao primeiro estágio do protocolo de Bruce, segue-se o protocolo original (com incrementos de grandes cargas ao final de cada estágio).
Tabela 25. – Principais protocolos escalonados para esteira rolante e suas características 6,13,134,293 .
| Bruce | Bruce modificado/Sheffield | Ellestad | Naugthon | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Estágio | Min. | mph/km/h | E% | MET | Min. | mph/km/h | E% | MET | Min. | mph/km/h | E% | MET | Min. | mph/km/h | E% | MET |
| 01 | 3 | 1,7/2,7 | 10 | 4,6 | 3 | 1,7/2,7 | 0 | 1,7 | 3 | 1,7/2,7 | 10 | 4,6 | 2 | 1,0/1,6 | 0 | 1,5 |
| 02 | 6 | 2,5/4,0 | 12 | 7,1 | 6 | 1,7/2,7 | 5 | 2,9 | 5 | 3,0/4,8 | 10 | 7,4 | 4 | 2,0/3,2 | 0 | 2,0 |
| 03 | 9 | 3,4/5,5 | 14 | 9,6 | 9 | 1,7/2,7 | 10 | 4,1 | 7 | 4,0/6,4 | 10 | 9,6 | 6 | 2,0/3,2 | 3,5 | 3,0 |
| 04 | 12 | 4,2/6,7 | 16 | 12,0 | 12 | 2,5/4,0 | 12 | 6,7 | 10 | 5,0/8,0 | 10 | 12,0 | 8 | 2,0/3,2 | 7,0 | 4,0 |
| 05 | 15 | 5,0/8,0 | 18 | 14,5 | 15 | 3,4/5,5 | 14 | 10,0 | 12 | 6,0/9,7 | 15 | 14,5 | 10 | 2,0/3,2 | 10,5 | 5,0 |
| 06 | 18 | 5,5/8,8 | 20 | 16,8 | 18 | 4,2/6,7 | 16 | 13,5 | 14 | 7,0/9,6 | 15 | 17,0 | 12 | 2,0/3,2 | 14,0 | 6,0 |
| 07 | 21 | 6,0/9,7 | 22 | 19,3 | 21 | 5,0/8,0 | 18 | 17,5 | 16 | 8,0/11,2 | 15 | 19,0 | 14 | 2,0/3,2 | 17,5 | 7,0 |
| 08 | 24 | 6,5/10,5 | 24 | 22,4 | 24 | 5,5/8,8 | 20 | 20,0 | 18 | 9,0/12,8 | 15 | 21,5 | 16 | 2,0/3,2 | 21,0 | 8,0 |
| Min.: minutos; mph: milhas por hora; km/h: quilômetros por hora; E%: elevação/inclinação da esteira (em %); MET: metabolic equivalent of task (equivalente metabólico da tarefa). | ||||||||||||||||
1.4.2.1.3. Protocolo de Ellestad 13 , 134
Emprega aumentos expressivos de velocidade com inclinação fixa até o 4º estágio. Indicado preferencialmente para jovens, adultos fisicamente ativos e idosos que tenham o hábito de correr.
As limitações desse protocolo consistem em: precocemente, iniciam-se altas velocidades, dificultando adaptação (de quem não está acostumado a correr), e isso pode dificultar as medições pressóricas.
1.4.2.1.4. Protocolo de Naughton 13 , 134 , 293
Envolve pequenos incrementos de carga equivalentes a 1 MET por estágio. Indicado preferencialmente para idosos sedentários e indivíduos com limitações físicas, baixa capacidade física, insuficiência cardíaca compensada, infarto agudo do miocárdio recente e doença arterial periférica de membros inferiores.
Esse protocolo não deve ser utilizado em pacientes ativos, por prolongar demasiadamente o exame, dificultando atingir o esforço máximo.
1.4.2.2. Protocolo em Rampa 4 , 6 , 13
O protocolo em rampa pode ser totalmente individualizado quanto à velocidade e inclinação (iniciais e finais) e duração do exame. Permite a melhor avaliação da aptidão cardiorrespiratória (capacidade aeróbica).
Para definição do limite máximo do esforço suportado pelo paciente, sugere-se utilizar: escala de atividade física diária; questionário de estimava da capacidade funcional máxima (escala de atividade de Duke ou o questionário Veterans Specific Activity Questionaire [VSAQ]). Caso ocorra a sub ou a superestimativa desse limite, pode-se ajustar durante o exame a carga a ser atingida, de modo a manter a meta de duração de 8 a 12 minutos. 13 , 134 , 314
A taxa de incremento de carga depende das velocidades e inclinações iniciais e finais programadas. Em indivíduos sedentários ou com limitações, sugere-se iniciar o TE em baixa velocidade (1,6 a 2,7 km/h) e pouca inclinação (de 0% a 5%). Em indivíduos ativos, sugere-se iniciar o TE em velocidade de 2,7 a 4,0 km/h (de 0% a 5%). 13 , 315 , 316
Para o cálculo do VO 2 , são sugeridas as fórmulas de Foster: 317
1.4.3. Protocolo para Ergômetro de Braços
Habitualmente, o incremento da carga deve ser a metade do utilizado nos protocolos para os membros inferiores. Balady et al. desenvolveram protocolo com carga inicial de 10W, acréscimo de 10W a cada 2 minutos e manutenção de velocidade constante entre 75 e 80rpm. 318
Mitropoulos et al. desenvolveram protocolo com carga inicial de 30W para homens e 20W para mulheres, acréscimo em rampa linear (de 10W/min para homens e 6W/min para mulheres) e um ritmo de 70rpm. 319
1.4.4. Interrupção/Término do Exame
A interrupção parcial do esforço durante o TE/TCPE pode ser feita em casos excepcionais com desaceleração ou mesmo parada do ergômetro brevemente: diante da necessidade de confirmação de níveis pressóricos; ajustes de posicionamento de eletrodos; verificação de ausculta cardiopulmonar; vertigem (para tentativa de readaptação) etc.
Após a fase de esforço, sugere-se realizar recuperação ativa por pelo menos 1 a 3 minutos:
– No cicloergômetro, realizar desaceleração gradual da carga.
– Na esteira ergométrica, realizar inicialmente desaceleração lenta e gradual (da velocidade e inclinação), seguida de manutenção de caminhada a uma velocidade de 1,5 MPH ou 2,4km/h e 2,5% de inclinação. 13 , 152
Independentemente do ergômetro e protocolo, após interromper completamente o esforço, deve-se manter o paciente sentado até o retorno próximo à sua condição basal (pelo menos até o sexto minuto). Em casos de sintomas e/ou incapacidade de realização de recuperação ativa, sugere-se realizar interrupção rápida da velocidade e colocação do paciente em decúbito dorsal.
2. Acurácia, Probabilidade e Escores Pré-teste
A acurácia diagnóstica do TE/TCPE varia de acordo com a doença investigada e sua prevalência, características clínicas do paciente, idade e sexo. Com base nessas informações, podemos selecionar os pacientes que mais se beneficiarão do TE/TCPE para diagnóstico, evitando investigações e intervenções desnecessárias. 277
2.1. Probabilidade Pré-teste de DAC
A probabilidade da existência de DAC varia com idade, sexo, características dos sintomas, fatores de risco e estilo de vida. Para definir a probabilidade, recomenda-se utilizar uma das tabelas de estimativa de risco baseadas na classificação de dor precordial por sexo e idade (Tabelas 26 a 28). Ressalta-se que a frequência de DAC aumenta com a idade.
O TE é mais útil para o diagnóstico de DAC em pacientes com probabilidade pré-teste intermediária (definida como de 10% a 90% na Tabela 26 , ou entre 25% a 75% na Tabela 28 ), pois o resultado terá maior impacto na decisão clínica. 6 , 320
Tabela 26. – Diamond-Forrester and CASS – Estimativa de risco para probabilidade pré-teste de DAC obstrutiva de acordo com classificação de angina 321 .
| Idade (anos) | Sem angina | Angina atípica | Angina típica | |||
|---|---|---|---|---|---|---|
| Homens | Mulheres | Homens | Mulheres | Homens | Mulheres | |
| 30 a 39 | 4 | 2 | 34 | 12 | 76 | 26 |
| 40 a 49 | 13 | 3 | 51 | 22 | 87 | 55 |
| 50 a 59 | 20 | 7 | 65 | 31 | 93 | 73 |
| 60 a 69 | 27 | 14 | 72 | 51 | 94 | 86 |
Tabela 28. – European database – Estimativa de risco para probabilidade pré-teste de DAC obstrutiva em pacientes sintomáticos 45 .
| Idade (anos) | Sem angina | Angina atípica | Angina típica | |||
|---|---|---|---|---|---|---|
| Homens | Mulheres | Homens | Mulheres | Homens | Mulheres | |
| 30 a 39 | 18 | 5 | 29 | 10 | 59 | 28 |
| 40 a 49 | 25 | 8 | 38 | 14 | 69 | 37 |
| 50 a 59 | 34 | 12 | 49 | 20 | 77 | 47 |
| 60 a 69 | 44 | 17 | 59 | 28 | 84 | 58 |
| 70 a 79 | 54 | 24 | 69 | 37 | 89 | 68 |
| >80 | 65 | 32 | 78 | 47 | 93 | 76 |
| Probabilidade de DAC estimada para pacientes com idade 35, 45, 55, 65, 75 e 85 anos. | ||||||
2.2. Sensibilidade, Especificidade e Valor Preditivo
O TE pode ser avaliado sob características de desempenho dos testes diagnósticos baseados em cálculos operacionais de sensibilidade, especificidade, valor preditivo (positivo e negativo) e acurácia ( Figura 3 ).
Figura 3. – Definição de sensibilidade, especificidade, valores preditivos e acurácia. VP: verdadeiro positivo – quando o exame se apresenta positivo e o paciente tem a doença investigada; FP: falso-positivo – quando o exame se apresenta positivo em paciente sem doença; VN: verdadeiro negativo – quando o exame se apresenta negativo e o paciente não tem doença; FN: falso-negativo – quando o exame se apresenta negativo, mas o paciente tem a doença investigada.
Em relação ao TE na investigação de DAC, a maioria dos estudos realizados demonstra sensibilidade entre 61% e 73% (média de 69%) e especificidade entre 69% e 81% (média de 75%). Ressalta-se que as variações nesses valores estão associadas às diferenças nas metodologias e populações estudadas. 6 , 323
O valor preditivo positivo do TE é sempre maior em homens, em todas as faixas etárias, devido à alta prevalência de DAC. 324
As mulheres, em geral, apresentam menor prevalência de DAC e, portanto, maior presença de testes falso-positivos em relação aos homens. 325 Nas mulheres, a idade tem maior influência no VPP, pois ele é mais baixo nas mais jovens (35 a 50 anos = 36%) em comparação às idosas (>65 anos = 68%). 326
No estudo de coorte comparando TE em ambos os sexos, nas mulheres, a utilização da FC máxima, a duração do esforço e o tempo de recuperação de infradesnivelamento do ST permitiram aumento significativo do VPP (aumentando de 47,8 para 61,5%) e VPN (88%) do TE. 327
2.3. Escores e Fatores de Risco DCV Pré-teste
A utilização de escores de risco para doenças cardiovasculares pré-teste visa propiciar uma abordagem individualizada, previsão de possíveis complicações (principalmente em pacientes de risco intermediário e elevado) e, consequentemente, uma análise mais contextualizada dos achados do exame. Essa avaliação é recomendada em adultos e idosos (faixa etária típica de 40-75 anos), devendo ser baseada em um dos escores: European Society of Cardiology Systematic Coronary Risk Evaluation (SCORE2), algoritmos do American College of Cardiology/American Heart Association Atherosclerotic Cardiovascular Disease (ASCVD) ou Escore de Risco Global de Framingham ( Framingham Risk Score ). 328 - 330
Nos adultos jovens (<40 anos), sugere-se a avaliação e os registros dos fatores de risco clássicos: diabetes, tabagismo, dislipidemia, estresse, sedentarismo, obesidade, HAS, história familiar. 331
3. Respostas Clínicas e Hemodinâmicas ao Esforço na População Adulta
3.1. Respostas Clínicas
3.1.1. Tolerância ao Esforço
A tolerância ao esforço é reconhecida como o melhor marcador atual de expectativa de vida, independentemente de idade, sexo, etnia e condições associadas. Durante um TE, pode ser quantificada de forma objetiva pela potência desenvolvida em watts, pela duração do exercício ou pelo equivalente metabólico (em METs). 332
A tolerância ao esforço pode ser quantificada subjetivamente por meio da escala de esforço percebido de Borg ou de Borg modificada ( Figura 4 ) visando medir o nível de intensidade da atividade física, o grau de cansaço, a gravidade de dispneia aos esforços e também a fadiga dos membros inferiores. 333 , 334
Figura 4. – Escalas de esforço percebido de Borg e Borg modificada.
Independentemente da presença de DCV, a baixa tolerância ao esforço se relacionada a taxas mais elevadas de mortalidade e aumento da incidência de IC e DAC. 332
A intolerância ao exercício (IE) é definida como a capacidade prejudicada de realizar atividade física na presença de sintomas, como dispneia e/ou fadiga. 335
Tanto na ICFEr quanto na insuficiência cardíaca com fração de ejeção preservada (ICFEp), a IE associa-se a pior qualidade de vida, hospitalizações mais frequentes e aumento da mortalidade por todas as causas. 116 , 336 Na insuficiência cardíaca diastólica crônica, um dos principais mecanismos de IE é a incompetência cronotrópica que pode ser adequadamente avaliada ao TE. 337
No diabetes mellitus tipo 2 (DM2), a IE também está associada à incompetência cronotrópica, sendo ambas associadas a risco elevado de DCV e morte prematura. 338
A Figura 5 apresenta os principais mecanismos e fatores que contribuem para o surgimento e a progressão da IE.
Figura 5. – Mecanismos e fatores associados ao surgimento e progressão da intolerância ao esforço e papel do TE. DAC: doença arterial coronariana; IC: insuficiência cardíaca; FA: fibrilação atrial; DAP: doença arterial periférica; TE: teste ergométrico; FC: frequência cardíaca; ↓ METs: baixa aptidão cardiorrespiratória; ↑ FC basal: frequência cardíaca basal elevada; ↓ Reserva FC: redução da reserva cronotrópica; ↓ FCrec: recuperação lenta da FC pós-esforço.
TE/TCPE são métodos imprescindíveis para diagnóstico da IE e monitoração de programas de treinamento físico, visando documentar a melhora da tolerância ao exercício, do desempenho cardiopulmonar e consequente redução da morbimortalidade. 339 , 340 O programa de treinamento físico parece ser uma das únicas intervenções potencialmente eficazes e viáveis para a melhora da IE. 338 , 340
3.1.2. Aptidão Cardiorrespiratória/Classificação Funcional
A aptidão cardiorrespiratória (ACR)/classificação funcional no TE é uma estratificação de desempenho físico baseada no consumo de oxigênio (VO 2 ).
O consumo máximo de oxigênio (VO 2 max) expressa a maior quantidade de oxigênio extraído do ar inspirado durante realização de exercício dinâmico que envolva grande massa muscular. Nos TE que não houver as características de um esforço máximo, o VO 2 obtido deve ser denominado VO 2 pico. 13 , 134 , 293
O TE é considerado de esforço máximo quando: 4
– Ocorrerem sinais ou sintomas de exaustão física.
– Incapacidade de prosseguir o esforço.
– Escala de Borg (≥18).
– FC não se eleva mesmo com aumentos da intensidade do esforço.
– Atingir a FCmax prevista (sempre levar em consideração os itens anteriores) ou exceder a FCmax prevista (≥110%).
No TE, o VO 2 é estimado (medida indireta) por meio de fórmulas, enquanto, no TCPE, é mensurado diretamente. A medida indireta costuma superestimar os valores de VO 2 devido às limitações dos estudos que geraram as fórmulas. 341 , 342
Existem várias fórmulas (clássicas e novas) para o cálculo de VO 2 pico previsto baseadas no tipo de ergômetro, por sexo, protocolo, se mãos apoiadas nas barras etc. ( Anexo 2 ). 293 , 343 - 348
O VO 2 é mais frequentemente expresso em mL/kg/min (também aceitável mL.kg - 1 .min - 1 ). Também pode ser expresso por meio do equivalente metabólico (MET), e cada MET corresponde a 3,5 mL/kg/min de VO 2 . 6
Na população em geral, o VO 2 mensurado no cicloergômetro costuma ser menor do que na esteira. O VO 2 max apresenta declínio progressivo a partir dos 30 anos, sendo, em média, de 8% a 10% menor por década. Aos 60 anos, a média de VO 2 max em homens é aproximadamente dois terços daquela de 20 anos. Quando comparadas aos homens, as mulheres costumam apresentar menor VO 2 max devido a valores menores de hemoglobina, volume sanguíneo, volume sistólico e massa muscular. 13 , 134
A classificação funcional ( New York Heart Association ) é utilizada no diagnóstico e no prognóstico, contribuindo para condutas terapêuticas e prescrição de exercícios, estando relacionada ao VO 2 /METs alcançados no TE ( Figura 6 ). 6 , 322
Figura 6. – Valores de VO 2 /METs em relação à classe funcional e estado clínico. 6,232 VO 2 max: consumo máximo de oxigênio; TE: teste ergométrico; MET: metabolic equivalent of task (equivalente metabólico da tarefa). *New York Heart Association. **Dependendo da idade e do nível de atividade física.
3.1.3. Sintomas
Os sintomas durante o TE devem ser descritos minuciosamente e correlacionados com sinais clínicos, resposta hemodinâmica e achados do ECG. Os sintomas que levarem à interrupção da fase de exercício devem ser mencionados com o respectivo grau de percepção do esforço (pela escala de Borg ou Borg modificada) e o desempenho atingido (carga de esforço/METs).
Sugere-se a utilização de escalas para quantificar os sintomas de angina, dispneia e claudicação intermitente, principalmente durante o TCPE. As escalas devem estar visíveis e serem claramente explicadas antes do início do exame ( Figura 7 ). 13 , 292 , 349 , 350
Figura 7. – Escalas para quantificação de angina, dispneia e claudicação intermitente.
No caso de ocorrência de dor torácica, recomenda-se descrever seu caráter, localização, irradiação, fatores de agravamento e alívio, duração, demais sintomas concomitantes e o momento do TE em que ela iniciou e terminou. Recomenda-se que se descreva também se a dor foi limitante ou não, a FC, a PAS e duplo-produto iniciais e respectivos achados do ECG.
A ocorrência de angina típica, progressiva com o incremento das cargas, por si só, é considerada como compatível com resposta isquêmica. 6
Estudo com 10.870 pacientes submetido a TE limitado por sintomas, a angina pectoris típica foi associada a risco aumentado de mortalidade (RR: 2,7; IC 95%: 1,4-5,1; p<0,002) em comparação com dor torácica não anginosa. 351
A ocorrência da dispneia no TE está associada a um aumento significativo na mortalidade por todas as causas, mas não apresenta maiores taxas de isquemia em comparação com os pacientes com dor torácica. 352
Na suspeita de DAP e avaliação de claudicação intermitente, recomenda-se utilizar a escala de dor de claudicação intermitente para quantificar a dor e sua gravidade. Idealmente, o TE deve levar o paciente à dor máxima tolerada e/ou até o momento em que o paciente não puder mais andar (claudicação absoluta). 353
A escala de claudicação intermitente varia de 0 a 4 ( Figura 7 ) e permite identificar a progressão da claudicação durante o TE. Recomenda-se registrar a respectiva carga de esforço, o tempo de exercício e o momento de alívio da dor. 175
Todos os outros sintomas (p. ex., vertigem, tontura, lipotimia, cefaleia) devem ser relatados quanto ao momento de ocorrência, intensidade, duração, relação com PA e FC, bem como outras informações que possibilitem a adequada interpretação.
3.1.4. Ectoscopia/Ausculta
A ocorrência de sudorese e rubor facial é esperada durante esforço físico intenso. A presença de palidez cutânea, acompanhada de sudorese excessiva, cianose ou taquipneia, denota condição patológica. A ocorrência em baixas cargas de esforço, associadas a alterações hemodinâmicas ou modificações eletrocardiográficas (infradesnivelamento ou supradesnivelamento de ST e arritmias complexas), indica maior gravidade. 1
É necessário comparar a ausculta antes e após o esforço, de modo a correlacioná-la aos sinais clínicos observados. A presença de sibilos, roncos ou estertores crepitantes antes do esforço podem contraindicar a realização do TE e, após o esforço, pode significar asma esforço-induzida ou disfunção ventricular. 354 , 355
Na ausculta de novos sopros e/ou agravamento de sopros preexistentes (no esforço ou recuperação), deve-se descrever sua relação com o ciclo cardíaco, localização, qualidade ou tom, intensidade e presença de cliques de ejeção. 356 , 357
O esforço costuma aumentar a intensidade dos sopros regurgitantes originados das câmaras cardíacas esquerdas (regurgitação mitral e aórtica). 92 , 94
O surgimento de B3 ao esforço em homens acima dos 40 anos, na presença de dispneia ou fadiga excessiva, pode estar associado à disfunção ventricular. 358 Em adultos e idosos, o surgimento de B3 logo após o término do exercício frequentemente está associado a disfunção ventricular, infarto prévio e bloqueio de ramo esquerdo. 359
Adultos e atletas jovens costumam apresentar B3 na ausculta basal. Caso surja durante o exercício, é considerada uma adaptação fisiológica, sem correlação com cardiopatia estrutural. 360
3.2. Respostas Hemodinâmicas
Diante do incremento do esforço físico no TE, conceitua-se como: 13 , 134 , 293
– Reserva dromotrópica: aumento da velocidade da condução dos estímulos elétricos cardíacos.
– Reserva inotrópica: capacidade de aumento da função ventricular (eficiência do enchimento e do esvaziamento dos ventrículos) sendo avaliada pelo comportamento da PA sistólica.
– Resistência arterial periférica: capacidade de adaptação dos vasos periféricos (vasodilatação/vasoconstrição), sendo avaliada pelo comportamento da PA diastólica.
– Reserva coronária: capacidade da rede coronária adequar-se ao maior fluxo de sangue devido ao aumento da atividade metabólica do miocárdio.
– Reserva cardíaca: capacidade do coração em elevar seu débito para compensar a maior demanda metabólica da musculatura em exercício, sendo influenciada por todos os parâmetros anteriores.
3.2.1. Frequência Cardíaca
O comportamento da FC permite avaliar a resposta cronotrópica, a reserva cronotrópica, o DP, a regulação autonômica, sendo importante parâmetro diagnóstico e prognóstico.
3.2.1.1. Frequência Cardíaca de Repouso
A faixa de normalidade da FC de repouso (FCR) é de 50 bpm a 99 bpm e verificada a partir do ECG em repouso (sentado ou em decúbito dorsal). A FCR ao TE deve ser valorizada para a interpretação do comportamento da FC, regulação autonômica e definição de prognóstico. 361 , 362
É preditora de DAC, IC, FA, AVC e está associada a risco aumentado de eventos cardiovasculares, morte cardíaca e morte por todas as causas. 363 - 365
Tem sido demonstrado que, no TE, a FCR ≥80 bpm na população geral e a FCR ≥75 bpm em diabéticos com DAC estável estão relacionadas a aumento de mortalidade por todas as causas. 366
Em coorte de 56.634 indivíduos (49% mulheres) sem DAC conhecida ou FA, FCR ≥90 bpm apresentou aumento significativo de mortalidade por todas as causas, sendo que em homens foi independente da aptidão física. 367
3.2.1.2. Resposta Cronotrópica
A resposta cronotrópica normal ao exercício consiste no aumento da FC devido à diminuição do tônus vagal, seguido
por aumento do tônus simpático e consequentes adaptações do fluxo sanguíneo vascular sistêmico. 368
O incremento da FC acompanha o aumento das cargas de esforço e costuma apresentar correlação linear somente com o VO 2 entre 50 e 90% do VO 2 max. Em adultos saudáveis, a FC normalmente aumenta a uma taxa de ≈10 bpm por MET. 134
A retirada vagal é responsável pelo aumento inicial dos 10 a 30 batimentos, sendo o restante geralmente mediado pela atividade simpática. A FC é responsável pela maior parte do aumento do débito cardíaco durante o esforço, particularmente em cargas mais elevadas ( Figura 8 ). 134 , 299
Figura 8. – Comportamento da frequência cardíaca e ajustes autonômicos durante o TE em adultos. FCmax: frequência cardíaca máxima; At.: atividade; min: minuto.
A recuperação da FC (FCrec) durante os primeiros 30 a 60 segundos após o esforço envolve a reativação do sistema parassimpático e progressiva inibição da atividade simpática. A FCrec também pode ser influenciada pelo grau de retorno venoso e resposta dos barorreceptores atriais. O retardo na FCrec é um importante marcador de disfunção autonômica e de risco de mortalidade cardiovascular (CV) e por todas as causas e eventos cardiovasculares maiores. 369
A frequência cardíaca máxima estimada (FCME) não deve ser usada como único critério de interrupção do esforço ou para avaliar a eficácia do TE. De modo geral, existe uma margem de erro (grande dispersão da média) nas fórmulas, variando em ±10 a 15 bpm. O sexo feminino costuma apresentar valores menores de FCME. 301 , 370
A avaliação da resposta cronotrópica através da FCME é limitada na vigência de medicações que interferem na modulação autonômica (antiarrítmicos e betabloqueadores), na FA e flutter atrial, marca-passo com sensores, CDI, BAVT congênito etc. Os principais fatores que interferem na FC máxima atingida no TE encontram-se na Tabela 29 .
Tabela 29. – Fatores que afetam a FC máxima em resposta ao exercício dinâmico .
| Fatores que afetam a FC máxima | |
|---|---|
| Idade | Doença cardiovascular |
| Gênero | Medicamentos |
| Peso corporal | Marca-passo/CDI |
| Repouso prolongado | Arritmias/fibrilação e flutter atrial |
| Tipo de exercício | Anemia |
| Intensidade do esforço atingido | Hipo e hipertireoidismo |
| CDI: cardiodesfibrilador implantável. | |
A Tabela 30 apresenta as variáveis referentes ao comportamento da FC ao TE, enquanto a Tabela 31 apresenta suas definições, critérios e interpretações.
Tabela 30. – Variáveis referentes ao comportamento da FC ao TE .
| Índice | Cálculo | Valores Normalidade |
|---|---|---|
| FC repouso 371 | Verificada no ECG repouso (sentado ou decúbito dorsal) | 50 bpm a 99 bpm |
| FC máxima estimada para idade 300-302 | – Equações predição da FCmax para ambos os sexos:** FCmax = 220 - idade FCmax = 208 - (0,7 × idade) – Equações predição da FCmax específicas:** FCmax para mulheres = 192 - (0,7 × idade) FCmax para homens = 201 - (0,6 × idade) | ≥85% da FCmax estimada |
| Reserva cronotrópica medida 372,373 | RFC = FCmax atingida - FC repouso | Avaliação seriada |
| Reserva cronotrópica prevista para a idade | RFC idade = FCmax estimada para idade – FC repouso | Avaliação seriada |
| Índice cronotrópico (%) | ICr = (FCmax atingida - FC repouso) × 100 (FCmax estimada - FC repouso) | ≥80% |
| FC 1º minuto recuperação ativa* | FCmax atingida - FC recuperação 1 º minuto | >12 bpm |
| FC 1º minuto recuperação passiva (deitado) | FCmax atingida - FC recuperação 1 º minuto | >18 bpm |
| FC 2º minuto recuperação passiva (sentado) | FCmax atingida - FC recuperação 2 º minuto | ≥22 bpm |
| FC: frequência cardíaca; FCmax: frequência cardíaca máxima; ICr: índice cronotrópico; RFC: reserva cronotrópica; *Recuperação ativa em esteira: caminhada na velocidade de 1,5 MPH ou 2,4 km/h e 2,5% de inclinação. **Idade em anos. | ||
Tabela 31. – Definições, critérios e interpretações do comportamento da FC ao TE .
| Termo | Critérios* | Interpretações |
|---|---|---|
| Comportamento da FC no ECG basal | ||
| Comportamento normal da FC | ECG de repouso (sentado ou em decúbito dorsal) com FC de 50 bpm a 99 bpm. | Adulto em ritmo sinusal. |
| Bradicardia sinusal em repouso | ECG de repouso (sentado ou em decúbito dorsal) com FC <50 bpm. | Comum em atletas e jovens vagotônicos, assintomáticos. Caso secundária à utilização de betabloqueador ou antiarrítmico, referir essa interferência no laudo. Em pacientes que não utilizam medicações inotrópicas negativas, avaliar possibilidade de doença do nó sinusal ou outras causas secundárias. Afastar BAV de segundo grau e BAV avançado. |
| Taquicardia sinusal em repouso | ECG de repouso (sentado ou em decúbito dorsal) com FC ≥100 bpm. | Usualmente encontrada em pacientes obesos, com elevado grau de ansiedade, no hipertireoidismo, na anemia e após ingestão excessiva de cafeína ou álcool. |
| Comportamento da FC ao esforço | ||
| Resposta cronotrópica normal | Atingir ≥85% da FCmax estimada entre 8 e 12 minutos de esforço. | Quando em ritmo sinusal. |
| Resposta cronotrópica acentuada | 1) Elevação exacerbada da FC, desproporcional à carga de trabalho, atingindo FC ≥85% da FCmax prevista ou ≥50% de aumento da FC de repouso aos 3,5 METs de esforço, ou 2) Aumento ≥17 bpm no primeiro minuto do esforço em indivíduos normais, ou 3) Aumento ≥15 bpm no primeiro minuto do esforço em coronariopatas. | Usualmente encontrada em sedentários, pacientes com elevado grau de ansiedade, na distonia neurovegetativa, no hipertireoidismo, nas condições que reduzem o volume vascular ou a resistência periférica, na anemia, nas alterações metabólicas, em TE precoces após infarto e/ou cirurgia de revascularização etc. 374 |
| Queda da FC intraesforço | Queda da FC com a progressão do esforço (>10 bpm). | Apesar de rara, apresenta alta correlação com doença isquêmica. 152 |
| Reserva cronotrópica | Este parâmetro deve ser avaliado em TE seriados. Quanto maior a reserva, melhor o estado funcional, o tônus vagal/modulação autonômica e a saúde cardiovascular. | Redução da RFC é fator de risco para mortalidade por DCV. 375 Cada incremento de 1 batimento/min na RFC reduz a incidência de MSC em 1-2% e a incidência de diabetes tipo 2 em 2-3%. 373 , 376 |
| Resposta cronotrópica deprimida ou incompetência cronotrópica | 1) A FC atingida no esforço < que dois desvios padrões da FC máxima prevista, ou 2) Não atingir 85% da FC prevista para idade, ou 3) Índice cronotrópico inferior a 0,80. | Relacionada à diminuição da atividade vagal e associada a risco de mortalidade cardiovascular e por todas as causas. 149 , 151 , 377 , 378 |
| Platô da FC intraesforço | Manutenção da FC mesmo com a progressão do esforço. | Pode ocorrer em mulheres e crianças, sem significado clínico. Pode ocorrer em pacientes com DAC. 134 , 152 |
| Comportamento da FC na recuperação | ||
| Comportamento normal da FC na recuperação | 1) FC 1 º minuto recuperação ativa (>12 bpm), ou 2) FC 1 º minuto recuperação passiva (deitado; >18 bpm), ou 3) FC 2 º minuto recuperação passiva (sentado; ≥22 bpm). | Quando em ritmo sinusal. |
| Recuperação lenta da FC (pós-esforço) | 1) FC 1 º minuto recuperação ativa (≤12 bpm), ou 2) FC 1 º minuto recuperação passiva (deitado; ≤18 bpm), ou 3) FC 2 º minuto recuperação passiva (sentado; ≤21 bpm). | A recuperação lenta da FC está associada à mortalidade cardiovascular e por todas as causas. 38 |
| Queda súbita e acentuada da FC na recuperação | Queda abrupta da FC em qualquer momento da recuperação. | Achado comum em indivíduos bem condicionados fisicamente, incluindo atletas, sendo considerada normal desde que assintomática. 13 |
| FC: frequência cardíaca; FCmax: frequência cardíaca máxima; MSC: morte súbita cardíaca; RFC: reserva cronotrópica; DAC: doença arterial coronariana; DCV: doença cardiovascular; BAV: bloqueio atrioventricular. *Descrever o uso de medicamentos que possam afetar o comportamento da FC. | ||
Particularidades da resposta cronotrópica:
– Coorte em 458 homens (idade 56±8,5; seguimento médio: 6 anos) com DAC demonstrou que o aumento da FC durante o primeiro minuto do esforço no TE ≥12 bpm foi fortemente relacionada à morte cardíaca (RR: 15,6; IC 95%: 2,0-118,7; p<0,001) e IAM não fatal (RR: 5,0; IC 95%: 2,7-9,1; p<0,0001). 379
– Em seguimento de 306 pacientes com estenose aórtica assintomática (idade 65±12 anos, 33% mulheres; seguimento médio de 25 meses), nos casos graves, a elevação rápida e precoce da FC (definida como atingir 85% FC máxima ou aumento ≥50% da FC aos 3,5 METs) associou-se à necessidade de troca valvar (RR: 3,32; IC 95%: 2,03-5,45; p<0,001). 374
3.2.2. Resposta da Pressão Arterial
A avaliação da resposta da pressão arterial (RPA) ao esforço é um importante instrumento diagnóstico, prognóstico e de estratificação de risco cardiovascular. Basicamente, depende do débito cardíaco, da resistência vascular periférica e do uso de medicações. 6 , 380
Em adultos saudáveis, espera-se que o aumento da pressão arterial sistólica (PAS) seja proporcional ao aumento de carga de exercício dinâmico (correspondendo à resposta inotrópica). Com a manutenção da carga de esforço, a PAS se estabiliza após 2 a 3 minutos. 380 , 381 O aumento médio da PAS geralmente é de 10 mmHg/MET. Em indivíduos que atingem carga de esforço >10 METs, deve-se considerar que a elevação da PAS seja de 6,2 mmHg/MET. 6 , 382 Após o esforço, a PAS tende a diminuir gradativamente devido à resposta vagal e rápida redução do débito cardíaco. Em geral, retorna ao padrão de repouso até os 6 minutos de recuperação, podendo ocorrer níveis inferiores aos do pré-exercício por várias horas ( Figura 9 ). 383
Figura 9. – Comportamento da pressão arterial sistólica e diastólica em adultos de ambos os sexos durante o TE. PAS: pressão arterial sistólica; PAD: pressão arterial diastólica; min: minuto.
Durante o esforço, a pressão arterial diastólica (PAD) permanece inalterada ou pode apresentar pequena oscilação (±10 mmHg) devido à queda da resistência arterial periférica. Ocasionalmente, em indivíduos saudáveis, os sons da PAD no esforço podem ser ouvidos até 0 mmHg, sem significar alteração patológica. Nesses casos, recomenda-se utilizar o som da fase IV de Korotkoff (abafamento abrupto de sons que se tornam suaves) para definir o nível de PAD. No início da recuperação, a PAD pode apresentar pequena elevação ou manter-se inalterada. Geralmente, até os 6 minutos da recuperação, tende a retornar aos valores de repouso. 384
Recomenda-se não realizar o TE caso seja constatada hipertensão em repouso com PAS ≥180 e/ou PAD >110 mmHg. Nas medições com esfigmomanômetro, realizar a aproximação dos valores para 5 mmHg. Em medições com equipamentos automáticos considerar os números absolutos. 4 , 6 , 13
A resposta da PAS considerada hipertensiva/exagerada ao esforço é definida como um valor máximo ≥210 mmHg para homens e ≥190 mmHg para mulheres, independentemente de protocolo e/ou ergômetro. 85 , 385 - 387 Em normotensos no basal, essa resposta da PAS está associada a risco maior de desenvolvimento futuro de hipertensão e eventos cardiovasculares ( Tabela 32 ). 388 , 389
Tabela 32. – Comportamento da pressão arterial ao TE em adultos .
| Termo | Critérios | Interpretação |
|---|---|---|
| Resposta normal da PA ao esforço e recuperação* | 1) Repouso PA normal: PAS <140 mmHg e PAD <90 mmHg e 2) Esforço: PAS <210 mmHg para homens e <190 mmHg para mulheres; PAD inalterada ou oscilação de até ±10 mmHg e 3) Recuperação: queda da PAS gradativa até retorno aos padrões de repouso ou pouco inferior ao mesmo. PAD pode apresentar pequena elevação no início ou manter-se inalterada; aos 6 minutos, tende a retornar aos valores de repouso. | Normotensão em repouso, esforço e recuperação. Na ausência de outras alterações do TE, bom prognóstico e baixo risco. 6 , 215 |
| Hipertensão pré-teste com resposta normal da PA ao esforço | 1) PA repouso elevada: PAS ≥140 mmHg e/ou PAD ≥90 mmHg e 2) Esforço: PAS <210 mmHg para homens e <190 mmHg para mulheres; PAD inalterada ou oscilação de até ±10 mmHg e 3) Recuperação: normal. | Normalmente devido à ansiedade e sem associação ao desenvolvimento futuro de HA. 6 , 215 |
| Resposta hipertensiva/exagerada ao esforço | 1) A PA de repouso poderá estar normal ou elevada (PAS ≥140 mmHg e/ou PAD ≥90 mmHg) e 2) Esforço: PAS ≥210 mmHg para homens e ≥190 mmHg para mulheres; elevação de PAD ≥15 mmHg ou PAD >90 mmHg (homens e mulheres).** 85 , 387 Observação: descrever as respostas da PAS e da PAD. | Representa manutenção/agravamento de HA ao esforço. Em pacientes normotensos no repouso, a RHE está associada ao risco de HAS futura. 71 , 387 - 389 , 406 A RHE sistólica está associada a aumento do risco de HVE, IAM, FA, AVC e morte CV. 74 , 405 , 407 , 408 A RHE diastólica está associada ao aumento do risco de DAC e de HA. 73 , 396 |
| Hipotensão/queda da PA intraesforço | 1) Queda na PAS abaixo do valor de repouso sem queda da PAD (normalmente associada à isquemia). 409 2) Queda na PAS e queda da PAD abaixo do valor de repouso (normalmente não está associada à isquemia, e sim a déficit inotrópico do VE [p. ex., valvopatia]). 409 3) PAS com aumento inicial no exercício seguido por uma queda da PAS ≥20 mmHg.*** 115 , 386 , 410 | A hipotensão esforço-induzida é marcador de eventos adversos no TE, de mau prognóstico e útil para definição de intervenções. 403 , 410 A hipotensão sistólica está associada a disfunção ventricular esquerda e débito cardíaco reduzido, sendo um marcador de cardiopatia grave. 405 , 409 Aproximadamente um terço dos pacientes adultos CMH apresentam hipotensão sistólica intraesforço, causada por queda inadequada na resistência vascular sistêmica e baixa reserva de débito cardíaco. Essa hipotensão é definida como uma queda da PAS >20 mmHg. 410 |
| Resposta pressórica deprimida* 4 | 1) Reserva pressórica sistólica (diferença entre a PAS máxima de esforço e PAS de repouso) <35 mmHg na ausência de queda acentuada na PAD, ou 2) Aumento máximo da PAS <140 mmHg, ou 3) Comportamento da PAS em platô (manutenção da PA por 2 ou mais estágios escalonados ou mais de 3 minutos consecutivos em protocolo de rampa) com reserva pressórica sistólica <35 mmHg. 411 | Frequentemente associada a DAC grave e pior prognóstico. 403 Está associada a risco aumentado de eventos cardiovasculares e mortalidade por todas as causas. 412 Na CMH considerar resposta pressórica deprimida como uma falha em aumentar a PAS em pelo menos 20 mmHg do repouso até o pico do esforço. 410 |
| Resposta normal da PA na recuperação* | 1) PAS apresenta redução progressiva. No início da recuperação, a PAD pode apresentar pequena elevação ou manter-se inalterada. Aos 6 minutos, a PAS e a PAD tendem a retornar aos valores de repouso. 2) Relação da PAS do 3º minuto da recuperação / PASpico ≤0,9. 3) PA no quinto minuto da recuperação: PAS <160 mmHg e PAD <90 mmHg. 4) Ausência de hipotensão na recuperação. | Na ausência de outras alterações do TE, bom prognóstico e baixo risco. 383 , 384 , 413 , 414 |
| Resposta paradoxal da PA na recuperação | Relação entre a PAS no 3º minuto da recuperação com a PAS do 1 º minuto da recuperação ≥1. 415 - 417 | Preditora de DAC, IAM, AVC e mortalidade CV. 387 , 418 , 419 |
| Recuperação lenta da PA sistólica na recuperação* 5 | Independe do comportamento da PA de repouso e no esforço: – PAS do 3 º minuto da recuperação/PASpico >0,9. 420 – PA no 5 º minuto da recuperação: PAS ≥160 e PAD ≥90 mmHg. 421 | Tem boa correlação com hipertensão arterial futura e DAC. 420 |
| Hipotensão na recuperação* 5 | Na recuperação, apresentar sensação de desmaio, tontura, náusea, pré-síncope e síncope associada a: – PAS da recuperação com queda >50% da PASmax do esforço ou – PAS da recuperação <90 mmHg. 422 | A hipotensão arterial pós-esforço geralmente ocorre em indivíduos aparentemente sadios. A despeito de aumentar a incidência de arritmias, não tem associação com morbimortalidade CV, sendo mais frequente em indivíduos jovens exercitados até a exaustão. 422 |
| Resposta hipertensiva diastólica na recuperação | PAD no 5 º minuto da recuperação ≥90 mmHg. | Preditora de HA futura, DAC e AVC. 73 , 421 |
| PA: pressão arterial; TE: teste ergométrico; PAS: pressão arterial sistólica; PAD: pressão arterial diastólica; HVE: hipertrofia ventricular esquerda; VE: ventrículo esquerdo; HA: hipertensão arterial; RHE: resposta hipertensiva/exagerada; DAC: doença arterial coronariana; FA: fibrilação atrial; AVC: acidente vascular cerebral; CV: cardiovascular; IC: insuficiência cardíaca; IAM: infarto agudo do miocárdio; PASmax: PAS medida no esforço máximo; PASpico: PAS no pico do esforço mesmo que não esteja associada à exaustão física (esforço máximo). *Se em vigência de medicação, descrever se a resposta do TE é em vigência de uso ou não de drogas com efeito anti-hipertensivo. **O aumento médio da PAS geralmente é de 10 mmHg/MET. Em indivíduos que atingem carga de esforço >10 METs, deve-se considerar que a elevação da PAS seja de 6,2 mmHg/MET. ***Ocasionalmente, indivíduos sem doença cardíaca clinicamente significativa apresentarão hipotensão induzida pelo exercício relacionada a desidratação, dose inadequada da terapia anti-hipertensiva ou exercício extenuante prolongado. Caso assintomática, confirmar a queda da PA em pelo menos mais uma mensuração. * 4 PAS com valor fixo durante a progressão do exercício, em atletas, crianças e adolescentes, e mulheres em fase estrogênica pode ser observada na ausência de doença. * 5 Tanto para recuperação ativa quanto passiva. | ||
A PAS máxima no esforço apresenta valores gradativamente maiores com o avanço da idade. Nas mulheres, a PAS máxima é geralmente menor do que nos homens, tendendo a torna-se semelhante nos idosos. Mulheres jovens podem apresentar resposta em platô da PAS ou mesmo ligeira queda no pico do esforço, sem significado clínico específico. 6 , 87 , 390
A resposta da PAD é considerada anormal quando ocorrer elevação ≥15 mmHg e/ou atingir valor >90 mmHg, partindo-se de valores de PAD normal em repouso. 391 Há fortes evidências científicas, nacionais e internacionais, validando esses critérios de normalidade do comportamento da PAS e PAD durante o TE para o diagnóstico de HAS, avaliação de eficácia terapêutica, associação com DCV e estratificação de risco. 391 - 393
A resposta hipertensiva ao esforço (RHE) é mais comum em idosos e em hipertensos, mesmo quando a PA está bem controlada em repouso. 394 Em hipertensos, a RHE está relacionada com maior risco de IC futura, hipertrofia de VE, disfunção endotelial, disfunção diastólica e eventos cardiovasculares. 392 , 395 , 396
Na ausência de HAS ou outra doença cardiovascular, a ocorrência de RHE não é um fenômeno benigno, sendo os seus principais responsáveis a disfunção endotelial e o aumento da rigidez das grandes artérias. A RHE geralmente está associada a anormalidades funcionais e estruturais do VE, principalmente quando acompanhada de aumento da PA central. 72 , 305 , 387 , 397
Paradoxalmente, estudos em pacientes com DAC (suspeita ou diagnosticada) demonstraram que a ocorrência de RHE foi associada a lesões coronarianas menos graves e menor mortalidade na comparação com os que apresentaram resposta normal da PA. 398 , 399
Sugere-se a medição da PA ao atingir 5 METs de carga de esforço. A PAS ≥150 mmHg é limiar discriminatório de HA, associada a HA sistólica em MAPA de 24 horas e hipertrofia do VE ao ecocardiograma. 400 , 401
Em coorte prospectiva com 6.578 participantes assintomáticos do Lipid Research Clinics Prevalence Study (idade média: 46 anos, 45% mulheres e seguimento médio 20 anos), nos normotensos ou pré-hipertensos no repouso, a PA no segundo estágio de Bruce >180/90 mmHg associou-se ao risco de morte por DCV (PAS RR: 1,96; IC 95%: 1,40 a 2,74; p<0,001/PAD RR: 1,48; IC 95%: 1,06 a 2,06; p=0,02). 75
A hipertensão pré-teste com resposta normal da PA ao esforço é comum em pacientes ansiosos, e geralmente não está associada ao desenvolvimento de HA futura. 215 , 402
Consideram-se como critérios de interrupção do esforço a elevação de PAS >250 mmHg e PAD ≥120 mmHg nos normotensos ou PAD ≥140 mmHg nos hipertensos. 4 , 6 , 13
A ocorrência de hipotensão/queda da PA intraesforço, cuja incidência varia de menos de 2% a 6%, requer intervenção
imediata com a suspensão do esforço por motivos de segurança (risco agudo de evento cardiovascular) e colocação do paciente em decúbito dorsal. As causas mais frequentes são: DAC multiarterial grave com disfunção do VE; cardiomiopatias; obstrução da via de saída do VE; tônus vagal aumentado; hipovolemia; arritmias. Seu VPP é maior em homens do que em mulheres ( Figura 10 ). 403
Figura 10. – Principais comportamentos da pressão arterial durante o TE e suas repercussões. HAS: hipertensão arterial sistêmica; FSC: fluxo sanguíneo cerebral; R. Hipertensiva: resposta hipertensiva; Pos. ortostática: posição ortostática na esteira ergométrica; Cariorresp.: cardiorrespiratória; PA: pressão arterial, *Normotensão no pré-teste com resposta hipertensiva no esforço corresponde a risco de hipertensão arterial sistémica no futuro. * 2 Associada a diminuição da atividade adrenérgica e vasodilatação histamina mediada. * 3 Associado a hipertermia no esforço e desidratação prévia (inclusive secundária a diuréticos).
A hipotensão e a síncope na recuperação podem ter causas diversas, variando de respostas decorrentes de exaustão física em indivíduo aparentemente saudável até situação de anormalidade: obstrução da via de saída do VE (p. ex., EAo e cardiomiopatia hipertrófica obstrutiva); disautonomia; regulação negativa do barorreflexo vagal; Figura 10 ). 74 , 386 , 404 , 405
A Tabela 32 apresenta a definição de termos, critérios de normalidade, interpretação e implicações quanto ao comportamento da PA no TE.
3.2.3. Duplo-Produto
O duplo-produto (DP) expressa o consumo de oxigênio miocárdico (relação linear com a captação de oxigênio pelo miocárdio e o fluxo sanguíneo coronariano). É calculado por meio da multiplicação da frequência cardíaca pela pressão arterial sistólica, a qualquer momento do TE. 6 , 134 , 423
O DP é importante na avaliação dos limiares de angina, alterações eletrocardiográficas (segmento ST e arritmias), eficiência cardiovascular, progressão da aptidão cardiorrespiratória, terapêutica medicamentosa e intervencionistas, sendo marcador de prognóstico
independente da presença de DAC e, portanto, recomenda-se sua utilização de forma seriada. O DP máximo (DPmax), geralmente obtido no pico do TE, se inferior a 25.000 bpm.mmHg, está associado a pior prognóstico. 115 , 134 , 423 , 424
Fatores limitantes da avaliação do DP: uso de betabloqueadores e antiarrítmicos; hipertensão descontrolada; fibrilação e flutter atrial com resposta ventricular não controlada. Não deve ser calculado durante taquiarritmias. 134 , 293 , 299
4. Respostas Eletrocardiográficas 371
Para adequada análise, descrição e interpretação das respostas eletrocardiográficas, recomenda-se:
– Verificação do posicionamento e correta fixação dos eletrodos para minimizar erros e artefatos. 425 , 426
– Utilizar a normatização para emissão de laudos eletrocardiográficos da Diretriz da Sociedade Brasileira de Cardiologia sobre a Análise e Emissão de Laudos Eletrocardiográficos – 2022. 295
– Utilização de sistemas de medições automatizados para intervalos, durações e amplitudes das ondas e segmentos do eletrocardiograma (ECG). 427
– Considerar os efeitos dos filtros de ECG que estiverem sendo utilizados (alta, média, baixa frequência) para a estabilização da linha de base, redução de artefatos musculares e de rede elétrica. Para os filtros de alta frequência de, no mínimo, 150 Hz para os grupos de adultos e adolescentes. Filtros com frequências mais baixas podem interferir na captação das espículas de marca-passos. 295 , 428 , 429
– Revisão dos valores das medidas automatizadas de modo a afastar erros por possíveis interferências, artefatos ou anormalidades do traçado subjacente. 427 , 430
– Descrição detalhada e contextualizada do registro eletrocardiográfico.
4.1. Onda P
4.1.1. Respostas Normais
Em adultos, as ondas P no ECG de repouso, em presença de ritmo sinusal, apresentam-se positivas nas derivações D1, D2 e aVF, eixo vetorial médio de +60° (variando entre 0° e +90°), amplitude máxima de 250 mV (2,5 mm) e duração ≤110 ms. 295
Durante o exercício, normalmente observa-se ( Figura 11 ): 431
Figura 11. – Representação dos principais comportamentos das ondas P, Q, R, S, T, U, intervalo PR, segmentos PR e ST e ponto J durante a fase de esforço do TE. A. Esforço normal: onda P apresenta redução da duração e aumento de amplitude tornando-se apiculada; PRi apresenta redução com o aumento da frequência cardíaca (FC); segmento PR mantém-se inalterado (na linha de base); onda Q apresenta aumento do seu tamanho; onda R apresenta redução de tamanho concomitantemente ao aumento de onda S; ponto J mantém o mesmo nível do basal ou ocorre pequeno infradesnível; segmento ST mantém-se na linha de base ou pode apresentar infradesnivelamento ascendente rápido; onda T mantém seu tamanho e morfologia com componente inicial rápido e componente final lento (pode apresentar pequena diminuição e redução da duração); onda U tende a manter-se positiva no início do esforço e, com aumento da FC, tende a desaparecer. B. Esforço alterado: onda P apresenta aumento da duração e redução de amplitude; PRi mantém-se inalterado mesmo com o aumento da FC; infradesnivelamento do segmento PR >0,5 mm; manutenção da amplitude da onda Q; onda R inalterada mesmo com progressão do esforço e redução da onda S; infradesnivelamento do ponto J associado a infradesnivelamento do segmento ST com morfologia retificada e ponto Y ≥1,0 mm; redução da amplitude da onda T tendendo a simétrica; negativação da onda U. C. Esforço alterado: onda P apresenta aumento da duração tornando-se entalhada; aumento do PRi com o aumento da FC; desaparecimento de onda Q; aumento da amplitude da onda R com redução concomitante de onda S; infradesnivelamento do ponto J associado a infradesnivelamento do segmento ST descendente (ponto Y ≥1,0 mm); aumento da amplitude de onda T, apiculada e simétrica.
– Aumento gradual e linear da amplitude da onda P com a elevação da FC (em derivações inferiores do plano frontal). Esse aumento é, em média, de 100 mV (1 mm).
– Manutenção do eixo vetorial da onda P.
– Normalmente não há alteração na duração da onda P ou raramente um aumento mínimo (≤20 ms).
Comportamento normal da onda P na recuperação:
– No primeiro minuto da recuperação, pode ocorrer aumento adicional da amplitude onda P (atingindo valor superior ao do esforço) mesmo com a redução da FC. Após, ocorre redução progressiva da amplitude e retorno ao padrão basal após o sexto minuto. 432
– A duração da onda P mantém-se inalterada ou raramente apresenta aumento mínimo (≤20 ms) até o terceiro minuto. 433
4.1.2. Respostas Anormais
As principais respostas anormais da onda P são: 431 , 434 , 435
1) Manutenção da amplitude da onda P de repouso, principalmente quanto ao componente negativo (mudanças <0,25 mm), aumenta a sensibilidade (69%) e especificidade (78%) para o diagnóstico de DAC.
2) Aumento da duração da onda P está associada à sobrecarga de pressão atrial esquerda durante isquemia esforço-induzida.
3) Mudança na morfologia da onda P com aumento da amplitude do componente negativo terminal na derivação V1, em 50% do tempo máximo de exercício, foi a alteração mais preditiva de DAC verificada pela cintilografia de perfusão.
4) A dispersão da duração de onda P combinada a infradesnivelamento do segmento ST aumentou a sensibilidade do TE para 79% e VPP para 91%. 436
4.2. Intervalo PR/Segmento PR
4.2.1. Respostas Normais
No ECG de repouso, o segmento PR (PRs) começa com o final da onda P, termina com o início do complexo QRS e é normalmente isoelétrico. Serve como ponte temporal entre a ativação atrial e a ativação ventricular, bem como a recuperação atrial, que costuma ser de muito baixa amplitude e dificilmente detectada, por ocorrer dentro do QRS. Quando utilizada amplificação suficiente ou em presença de BAV de primeiro grau, é possível visualizar a onda de repolarização atrial (onda Ta). O início da onda P até o final da onda Ta equivale ao intervalo QT atrial.
O intervalo PR (PRi – início da P até o início do complexo QRS) normalmente mede 120 a 200 ms, sendo melhor determinado em DII.
O PRs serve como ponto de demarcação da linha de base que será utilizada para a avaliação das alterações do segmento ST e de amplitude de ondas. A linha que une as junções PQ (final do segmento PR e início do complexo QRS) é considerada como “linha de base”, considerando-se pelo menos quatro complexos sucessivos, no mesmo nível horizontal e sem artefatos. Os sistemas computadorizados utilizam algoritmos automatizados, considerando o final do PRs como a linha de base isoelétrica. 1 , 295
No esforço, o PRs encurta e inclina-se discretamente para baixo nas derivações inferiores, enquanto o PRi sofre encurtamento diretamente proporcional à elevação da FC. 437
Na fase inicial de recuperação, o PRi e o PRs são dependentes do grau de condicionamento físico dos pacientes, em que, em homens sedentários, o PRi médio é ≈110 ms e, em atletas, ≈280 ms. 438
4.2.2. Respostas Anormais
As principais alterações de PRs durante o TE são:
– Mesmo em indivíduos normais, pode ocorrer maior inclinação decrescente do PRs atribuída à repolarização atrial exagerada (onda Ta negativa) que, caso persista, no período inicial de repolarização ventricular, causará infradesnivelamento do ponto J e segmento ST (ascendente, falso-positivo, se nas derivações inferiores). 152 , 439
– Infarto atrial esforço-induzido correspondendo a infradesnivelamento do PRs >0,5 mm, normalmente acompanhado de supradesnivelamento do segmento ST (infarto ventricular), e a arritmias atriais. 295 , 440
– Prolongamentos patológicos do PRi serão abordados na seção referente aos bloqueios atrioventriculares.
4.3. Onda Q
4.3.1. Respostas Normais
No ECG de repouso, as ondas Q são consideradas normais quando a sua duração é ≤30 ms e a amplitude é <0,2 mV (em adolescentes, pode atingir até 0,4 mV) o que corresponde a <25% da onda R seguinte. Na derivação D3, a duração da onda Q pode exceder 40 ms, mas raramente atinge 50 ms. A presença de onda Q em V1 é sempre patológica. 295 , 371
No exercício, a onda Q normalmente aumenta significativamente sua amplitude, particularmente em CM5 e derivações laterais. 441
4.3.2. Respostas Anormais
No ECG de repouso, a onda Q é considerada anormal quando, na ausência de bloqueio de ramo e/ou na síndrome de pré-excitação, sua duração é ≥40 ms e/ou amplitude maior que um terço da onda R adjacente (em duas ou mais derivações de uma mesma parede ventricular).
As principais alterações de onda Q durante o TE são:
– Redução de amplitude/desaparecimento da onda Q durante o esforço ou recuperação, podendo indicar isquemia septal e que, quando associada a infradesnivelamento do segmento ST (ISTs), aumenta o VPP para DAC. 441 , 442
– Aumento da amplitude da onda Q associada a ISTs reduz o VPP, aumentando a possibilidade de falsos-positivos. 443
– Aumento da duração da onda Q induzido pelo exercício (de 10±13 ms), em pacientes com DAC uniarterial e IAM recente, está associado à isquemia na cintilografia com tálio. 444
– Ondas Q transitórias podem ser observadas na hipoglicemia, hipercalemia e asma.
4.4. Onda R
4.4.1. Respostas Normais
No ECG de repouso, a duração da onda R dependerá da derivação observada e duração/padrão do complexo QRS. A amplitude de R é variável, aumenta progressivamente nas derivações precordiais, sendo geralmente <27 mm em V5 e V6. 445
Durante o exercício, normalmente ocorre:
– Redução da amplitude média das ondas R perto do esforço máximo (redução de 2,6±1,1 mm). 446 Diminuição acentuada é observada nas derivações laterais (V5 e V6) no exercício máximo e primeiro minuto de recuperação.
– À medida que a onda R diminui em amplitude, observa-se aumento da onda S. 115
4.4.2. Respostas Anormais
No ECG de repouso, pacientes com infarto do miocárdio de parede anterior apresentam onda R com amplitude diminuída ou ausente. 447 , 448
As principais alterações anormais da onda R durante o TE são:
– Aumento na amplitude da onda R decorrentes de alterações de dimensões do VE e isquemia miocárdica. 449 A presença e extensão de isquemia reversível em paciente com DAC correlaciona-se diretamente com o aumento da amplitude da onda R e ISTs. 450 , 451
– A amplitude de R aumenta significativamente nas derivações precordiais durante episódios de isquemia transmural. 452
– Ondas R de baixa amplitude (<10 mm) podem cursar com ISTs de pequena magnitude em relação à real isquemia, interferindo na acurácia do TE para diagnóstico de DAC. 453 , 454
4.5. Onda S
4.5.1. Respostas Normais
No ECG de repouso, a onda S é comumente observada em DI, DII, DIII, aVF, V1 e V2 (em que sua amplitude é maior que a onda R), sendo frequentemente ausente em V5 e V6. Normalmente, a amplitude de S é <0,3 mV (30 mm). 445
Durante o TE, a onda S, na ausência de distúrbio de condução intraventricular, normalmente:
– Tende a aumentar nas derivações ínferolateral (principalmente em aVF e V5; máximo 0,3-0,4 mV) com concomitante redução da onda R. 115 , 455
– No primeiro minuto da recuperação, a amplitude de S permanece a mesma ou apresenta pequena redução. Retorna à amplitude pré-teste entre 3 e 5 minutos de recuperação supina. 455
– A duração média de S apresenta redução progressiva com o incremento do esforço, independentemente de distúrbio de condução intraventricular. 456
4.5.2. Respostas Anormais
As principais anormalidades referentes à onda S são:
– Diminuição da onda S em pacientes com DAC que se associa à isquemia subendocárdica mesmo na ausência de alterações do segmento ST, aumentando a sensibilidade do TE. 457
– Em pacientes sem distúrbio da condução intraventricular, a duração inalterada geralmente associa-se à obstrução significativa em artéria coronária direita (CD) ou artéria circunflexa (CX). 456 , 458
– Aumento significativo da duração (≈12,5±6 ms) é observado em pacientes com obstrução crítica em DA, no bloqueio divisional anterossuperior esquerdo e no bloqueio de ramo direito. 456
4.6. Duração QRS
4.6.1. Respostas Normais
A duração dos complexos QRS geralmente diminui proporcionalmente com o aumento da FC no exercício (redução ≈3,0 a 4,9 ms). Excepcionalmente, em pacientes normais, não ocorre alteração da duração. 459
O cálculo da variação da duração dos complexos QRS (ΔDQRS) corresponde à diferença da duração medida em aVF e V5 imediatamente na suspensão do esforço (início da recuperação) em relação ao repouso. 459 ΔDQRS normal é ≤3 ms. 460
*Medidas em aVF e V5 (ms).
4.6.2. Respostas Anormais
Significado de alterações de ΔDQRS:
– É considerado positivo para isquemia ΔDQRS >3 ms. 460 Em portadores de DAC, a variação está diretamente relacionada ao número de artérias com obstrução significativa (4,8 ms = uma artéria, 7,8 ms = duas e 13,3 = três artérias; p<0,001) e anormalidades de contração segmentar pela ventriculografia radioisotópica (6,7 ms = uma região do VE, 13,5 ms = duas e 21 ms = três regiões; p<0,0001). 461
– ΔDQRS >3 ms na avaliação de DAC melhorou a precisão diagnóstica do TE, independentemente de alterações segmento ST, em comparação à cintilografia de perfusão (sensibilidade 93%, especificidade 71% e VPP 86%). 459
– ΔDQRS >3 ms em mulheres é mais sensível e específico do que as alterações ST-T para a detecção de isquemia. 462 , 463 Estudo anterior mostrou que ΔDQRS alterado em mulheres aumentou sensibilidade (91%), especificidade (89%) e VPP (88%) do TE e, nas mais jovens (27-50 anos), a sensibilidade foi de 80% e especificidade de 83%. 462
– ΔDQRS ≥15 ms em pacientes com cardiopatia isquêmica previu a ocorrência de arritmias ventriculares graves (taquicardia ou fibrilação ventricular) com VPP 73%. Após a revascularização cirúrgica, esses pacientes não apresentaram mais ΔDQRS alterado, e as arritmias foram suprimidas. 464
4.7. Fragmentação de QRS em Alta Frequência
4.7.1. Respostas Normais
Fragmentação de QRS em alta frequência ou QRS em alta frequência (AFQRS) é uma técnica especial de filtragem do ECG (geralmente entre 150 e 250 Hz) que permite analisar os componentes de alta frequência dos complexos QRS. 465
A técnica envolve combinar complexos QRS de uma mesma derivação (avaliando as 12 derivações) ou complexos de quatro derivações (V3, V4, V5 e V6) para formar um complexo precordial médio. Nesses complexos, calcula-se a raiz quadrada média normalizada (RQMN) e/ou a amplitude máxima normalizada (AMN). Esses parâmetros são geralmente avaliados no ECG de repouso, no pico do esforço e na recuperação. 466
Em pessoas saudáveis, a AFQRS é considerada normal quando os valores médios da RQMN são >1 μV nas três etapas do TE (repouso, pico do esforço e recuperação) e se observa aumento da RQMN com o esforço e imediatamente após o esforço (comparado com valor de repouso). 466 , 467
4.7.2. Respostas Anormais
A AFRQS é considerada anormal para isquemia, independentemente de alterações do segmento ST, quando: ocorre redução absoluta ≥1μV ou uma redução relativa ≥50% (entre os valores máximos e mínimos de RQMN) em ≥3 derivações, nos pacientes que atingiram esforço máximo. No esforço submáximo (≤85% da FC máxima prevista), a redução relativa deve ser ajustada linearmente, entre 40% e 50%, de acordo com a razão entre a FC máxima alcançada e a FC prevista. A AFRQS apresenta maior sensibilidade, especificidade e VPP quando comparada às alterações de segmento ST. 468 - 470
AFRQS alterada é geralmente encontrada em pacientes pós IAM com cicatriz miocárdica, na isquemia ou por atraso de condução por ativação não homogêneo dos ventrículos. É um preditor de mortalidade e eventos cardíacos em pacientes com DAC. 467 , 468
AFRQS alterada demonstrou valor diagnóstico incremental quando associada às alterações do segmento ST (VPP 80,4% vs. 74,9% p<0,0001). Análise conjunta da AFRQS e alterações do segmento ST identificou 92,3% dos indivíduos com isquemia significativa. 471
Análise conjunta de AFRQS com ISTs demonstrou VPN de 99% para doença isquêmica grave. Na regressão multivariada, a AFRQS alterada foi fator independente de risco para eventos cardíacos maiores em 2 anos (RR: 2,8; IC 95%: 1,7-4,4; p<0,001). 472
4.8. Onda T
4.8.1. Respostas Normais
No ECG de repouso, a onda T é arredondada, assimétrica, com porção inicial ascendente mais lenta e porção final descendente mais rápida, habitualmente com polaridade semelhante à do QRS e positiva em quase todas as derivações (sempre negativa em aVR). A duração varia de 100 a 300 ms, e sua amplitude é de, no máximo, 5 mm nas derivações periféricas e <15 mm nas precordiais, equivalendo a cerca de 10% a 30% da amplitude total do QRS que a antecede. 473 , 474
Na fase inicial do esforço, ocorre diminuição geral na amplitude da onda T seguida de aumento em cargas de exercício mais altas (retornando ao nível basal), com aumento adicional na fase inicial da recuperação. 455
4.8.2. Respostas Anormais
Na interpretação das alterações de onda T, deve-se considerar as doenças preexistentes (em especial HAS, valvopatias e IRC), fatores de risco e a probabilidade pré-teste de DAC.
No ECG de repouso, as principais alterações das ondas T que podem estar associadas à isquemia:
– Positivas, simétricas, pontiagudas e acompanhadas por onda U (positiva ou negativa). 475
– Negativas, simétricas e pontiagudas em derivações com QRS predominantemente positivo (exceto DIII, aVR e V1). 115
– Padrão bifásico nas derivações torácicas anteriores (V1 a V3), geralmente associado à isquemia miocárdica em quadro de angina instável.
– Achatadas e geralmente inespecíficas, podendo estar associadas à isquemia miocárdica.
Comportamento anormal das ondas T ao esforço:
– Aumento na amplitude (>2,5 mV), simétrica, nas derivações V2 a V4 em pacientes com dor torácica, sendo associada à isquemia grave. 115
– Pseudonormalização de onda T correspondendo à presença de onda T invertida ≥1 mm em qualquer derivação do repouso e que se torna positiva com o pico do esforço, sendo geralmente associada a defeitos reversíveis e fixos na cintilografia de perfusão miocárdica. 476
– Pseudonormalização de onda T associada à inversão da onda U nas derivações torácicas anteriores é altamente indicativa de estenose crítica da DA. 477
– Pseudonormalização de onda T em derivações relacionadas a IAM prévio em baixa carga de esforço se mostrou índice sensível e específico para presença de viabilidade residual. A sensibilidade e a acurácia foram maiores para infartos anteriores. 478 , 479
– Em TE submáximo realizado em fase precoce de angina instável estabilizada ou IM sem onda Q, a pseudonormalização de onda T, independentemente da ocorrência de ISTs, foi preditora de sobrevida em seguimento de 6 meses. 480
– Pseudonormalização de onda T em pacientes com baixa prevalência de DAC é um achado não diagnóstico. 152
4.9. Onda U
4.9.1. Respostas Normais
No ECG de repouso, a onda U é uma deflexão de baixa amplitude e frequência, ocorre após a onda T (geralmente com a mesma polaridade), amplitude proporcional à da onda T (≈5% a 25% da amplitude; média: 0,33 mm), sendo observada melhor em V2 e V3 (≤2 mm), duração de 221±73 ms (<50% da onda T precedente) e mais comumente identificada em FC <95 bpm. É observada em até 50% dos indivíduos normais. No esforço, normalmente mantém duração, amplitude e eixo, sendo difícil identificá-la em FC >120 bpm devido à aproximação das ondas T e P. 481 - 483
4.9.2. Respostas Anormais
Onda U negativa no ECG de repouso é considerada anormal e frequentemente associada a regurgitação mitraI e/ou aórtica, HAS e cardiopatia isquêmica. 484 , 485 Amplitude aumentada pode estar associada a hipopotassemia e uso de medicamentos (digitálicos, amiodarona e quinidina). 483 , 484 , 486
As principais alterações referentes à onda U durante o TE são:
– No basal (positiva), com aumento da amplitude ao esforço (≥0,5 mV) em derivações precordiais, está associada à isquemia miocárdica ínferoposterior, sendo marcador de obstrução significativa em CX ou CD. 487 , 488
– Aparecimento de onda U positiva no esforço e/ou nos primeiros 3 minutos da recuperação está frequentemente associado à obstrução coronariana em artéria CX e/ou CD. 489
– Aparecimento de onda U negativa de amplitude ≥0,5 mV, persistindo por pelo menos 1 minuto durante e/ou após esforço, está associado à DAC grave em DA. 487 , 490
– Aparecimento de onda U negativa é marcador de circulação colateral bem desenvolvida em pacientes com DAC grave ou angina estável. 487 Em derivações precordiais, é marcador de miocárdio viável pós-IAM anterior. 491
– Inversão de onda U esforço-induzida transitória com amplitude ≥0,5 mV, em derivações de parede anterior (V2 a V5), está associada a episódios de isquemia aguda e DAC grave em DA. 492 , 493
4.10. Repolarização Precoce
O padrão de repolarização precoce (PRP) pode ser observado em 1% até 13% da população geral. 494 , 495 Em indivíduos de meia-idade, associou-se a maior risco de morte súbita cardíaca (MSC). 496 , 497
Os critérios para diagnóstico de repolarização precoce no ECG de repouso são: 498 , 499
1) Duração dos complexos QRS <120 ms.
2) Presença de entalhe ou ligadura QRS final na inclinação descendente de uma onda R proeminente. Se houver um entalhe, ele deve ficar totalmente acima da linha de base. O início de uma ligadura (Jo) também deve estar acima da linha de base ( Figura 12 ).
Figura 12. – Padrões de supradesnivelamento do segmento ST incluindo a repolarização precoce. Seg. ST: segmento ST; Suprad. Seg. ST: supradesnivelamento do segmento ST; ms: milissegundos. *Supradesnivelamento do segmento ST esforço-induzido (≥1,0 mm medido a 60 ms após o ponto J). **No padrão de repolarização precoce, o supradesnivelamento do segmento ST deve ser medido a 100 ms após o ponto Jt, e também utilizado para avaliar o padrão de supradesnivelamento (ascendente, horizontal ou descendente).
3) O ponto Jp (pico do entalhe do ponto J) deve ter ≥0,1 mV em 2 ou mais derivações contíguas do ECG de 12 derivações, exceto de V1 a V3. 500
O supradesnivelamento do segmento ST (SSTs) deve ser medido a 100 ms após o ponto Jt (final do entalhe do ponto J). Além da magnitude do supradesnivelamento, deve ser descrito o padrão:
– “Repolarização precoce com segmento ST ascendente”, quando o segmento ST estiver inclinado para cima e seguido por uma onda T vertical.
– “Repolarização precoce com segmento ST horizontal ou descendente”, quando o segmento ST for horizontal ou descendente (inclinado para baixo).
Comportamento e significado do PRP no TE:
– Comum em indivíduos jovens, geralmente apresenta redução progressiva com o esforço, podendo ocorrer seu desaparecimento em cargas moderadas. PRP com SSTs ascendente rápido, em derivações anterolateral, tem sido encontrado em atletas. 501
– Em pacientes sintomáticos (devido a morte súbita cardíaca abortada, arritmia ventricular sustentada e/ou síncope inexplicada), observou-se PRP persistente ao esforço. 502
– O retorno do PRP na recuperação é progressivo, lento e, em aproximadamente 30% dos pacientes, ocorre no 5º minuto. 503 , 504
Marcadores de alto risco verificáveis no TE em pacientes com PRP: 55 , 494
– Ocorrência de TV polimórfica esforço-induzida.
– ISTs horizontal e/ou descendente em derivações inferiores ou ínferolaterais, associadas ao risco de FV idiopática e aumento em três vezes do risco de morte súbita arrítmica. 500
4.11. Supradesnivelamento do Segmento ST
Supradesnivelamento do segmento ST induzido pelo esforço (SSTE) é definido como uma elevação do segmento ST ≥1,0 mm (≥0,10 mV) em 60 ms após o ponto J, ocorrendo em 2 ou mais derivações, independentemente de presença de onda Q ( Figura 12 ). O SSTE pode estar acompanhado de infradesnivelamento recíproco do segmento ST (“imagem em espelho”). 505 , 506
SSTE geralmente está associado a isquemia miocárdica grave (geralmente transmural), espasmo da artéria coronária, angina Prinzmetal, aneurisma ventricular esquerdo, isquemia peri-infarto e anormalidades da movimentação da parede VE. 506 , 507
As derivações nas quais ocorrem SSTE têm correlação com segmentos anatomovasculares do VE. 506 , 508 , 509 Sugere-se a utilização da descrição topográfica de manifestações isquêmicas (Meyers): 295
– Parede anterosseptal: derivações V1, V2, V3.
– Parede anterior: derivações V1, V2, V3 e V4.
– Parede anterior localizada: derivações V3, V4 ou V3-V5.
– Parede anterolateral: derivações V4 a V5, V6, D1 e aVL.
– Parede anterior extensa: V1 a V6, D1 e aVL.
– Parede lateral: derivações V5 e V6.
– Parede lateral alta: D1 e aVL.
– Parede inferior: D2, D3 e aVF.
Os termos “parede posterior” e “dorsal” não deverão mais ser utilizados, em vista das evidências atuais de que as derivações V7 a V9 referem-se à parede lateral.
Trinta por cento dos pacientes com IAM prévio de parede anterior e 15% de parede inferior apresentam SSTE nas derivações envolvidas e seu significado varia com os achados adicionais do TE. 510 , 511 A associação do SSTE em derivações com ondas Q anormais pode representar isquemia residual da área peri-infarto (viabilidade miocárdica), discinesia ventricular ou movimento acinético segmentar do VE. 511 , 512 Entretanto, não permite quantificar o tecido viável justificando investigação adicional por método de imagem para indicar intervenção terapêutica. 512 , 513
Particularidades do SSTE:
– SSTE ≥0,2 mV (2 mm) em derivações sem ondas Q é critério de interrupção do esforço.
– SSTE é mais comumente associado à obstrução proximal grave do que ao espasmo coronariano em artérias não obstruídas. 514 , 515
– SSTE, com ou sem ISTs, foi preditivo da presença, extensão e localização da isquemia miocárdica avaliada por cintilografia de perfusão miocárdica. O SSTE em V1 com ISTs em aVR e V4-V6 associou-se à estenose no tronco da artéria coronária esquerda (TCE) ou em artéria descendente anterior (DA) proximal. 509
– SSTE em aVR apresentou sensibilidade de 100% na detecção de estenose de TCE (especificidade 33,5%) e de 94,3% para a DA (especificidade 26,6%). A associação de SSTE em aVR e V1 reduziu a sensibilidade (74,4% e 65,9%) e aumentou a especificidade (68,5% e 64,4%). 508 , 516
– SSTE em aVR esteve associado a eventos cardíacos adversos maiores (seguimento de 2 anos) em 33% dos pacientes. 517
– Em pacientes pós-IAM uniarterial com angioplastia transluminal coronária percutânea (ATCP) – sem isquemia residual –, o SSTE pode estar associado a microcirculação coronariana prejudicada e menor viabilidade miocárdica. 518
4.12. Ponto J e Infradesnivelamento Ascendente
O ponto J (junção do fim QRS e início do segmento ST) costuma apresentar infradesnivelamento ao esforço, em derivações de parede lateral, retornando gradualmente aos valores pré-exercício na recuperação. O infradesnivelamento do ponto J é mais comum em pacientes idosos e geralmente não se associa a DAC. 519
O infradesnivelamento ascendente do segmento ST – depressão do ponto J seguido de infradesnivel STs rapidamente ascendente e sem depressão no ponto Y (medido em 60 ou 80 ms do ponto J) – é observado em 10% a 20% dos indivíduos normais. Não é considerado critério de diagnóstico de DAC ( Figura 13 ). 519
Figura 13. – Comportamento do segmento ST e tipos de infradesnivelamento. *Ascendente, horizontal ou descente: dependendo da FC no momento de medida, o ponto Y estará em 60 ou 80 ms do ponto J. **Ascendente lento: aferido no ponto Y em 80 ms do ponto J.
4.13. Infradesnivelamento do Segmento ST: Ascendente Lento, Horizontal e Descendente
O infradesnivelamento de ST esforço-induzido (ISTE) é a manifestação eletrocardiográfica mais frequente da isquemia miocárdica (geralmente subendocárdica). A acurácia diagnóstica do ISTE dependerá de idade, sexo, características clínicas do paciente, doenças cardiovasculares preexistentes, prevalência de DAC, intensidade do esforço e FC alcançadas. 277 , 453 , 520 , 521
Consideram-se anormais e sugestivas de isquemia esforço-induzida as seguintes alterações do segmento ST na fase de esforço e/ou recuperação ( Figura 13 ):
1) Infradesnivelamento com morfologia horizontal (retificado) ou descendente, ≥1 mm (aferido no ponto Y). Dependendo da FC no momento de medida, o ponto Y estará em 60 ou 80 ms do ponto J (exemplo: geralmente, em crianças/jovens 60 ms e nos adultos/idosos 80 ms). 6 , 522 , 523
2) Infradesnivelamento com morfologia ascendente lenta (utilizar escores de risco para DCV pré-teste – ver na Parte 2, Seção 2.3):
– ≥1,5 mm, em indivíduos de risco moderado ou alto de doença coronariana.
– ≥2 mm em indivíduos de baixo risco de doença coronariana (aferido no ponto Y em 80 ms do ponto J). 524 - 527
ISTE ascendente lento apresenta menores sensibilidade, especificidade, baixo VPP e mais resultados falsos-positivos quando comparado ao horizontal/descendente.
Particularidades quanto a quantificação e interpretação do ISTE:
– ISTE <1,0 mm não preenche critérios para isquemia miocárdica (não isquêmico).
– Quando houver infradesnivelamento do segmento ST em repouso, na posição ortostática, considerar apenas a depressão adicional de ST durante o esforço.
– A existência de ISTs no repouso ≥1,0 mm reduz a associação de ISTE adicional com DAC obstrutiva. 528 No entanto, em pacientes sob investigação de dor torácica, a presença de IST no repouso não interferiu na acurácia diagnóstica e sensibilidade do TE. 529
– Fatores que influenciam a magnitude de ISTE e gravidade da DAC: probabilidade pré-teste; aptidão cardiorrespiratória; momento do aparecimento; carga de esforço associada; duração e número de derivações com infradesnivelamento; momento de normalização na recuperação. Quanto menor a carga de esforço e DP em que ocorre o ISTE, pior é o prognóstico e maior a probabilidade de DAC multiarterial. 522 , 523 , 530 , 531
– Na repolarização precoce em repouso, caso ocorra ISTE, considerar apenas as alterações abaixo da linha de base.
– Na vigência de bloqueio de ramo direito, não valorizar as alterações secundárias de ISTs nas derivações V1, V2 e V3 quanto à isquemia; a análise e a interpretação de ISTE em outras derivações seguem o padrão convencional descrito nesta seção.
– ISTE associado a angina ou correspondente anginoso esforço-induzido aumenta a sensibilidade do TE, estando associado a DAC grave e pior prognóstico. 532
– ISTE ≥3 mm (0,3 mV), adicional aos valores de repouso, na presença de DAC suspeita ou conhecida, é critério de interrupção do esforço. 6 , 209
– ISTE descendente geralmente está associado à isquemia mais grave quando comparado ao ISTE horizontal. 533 , 534
– A normalização precoce de ISTE anormal no primeiro minuto da recuperação foi associado a menor carga isquêmica e maior probabilidade de “falso-positivo” para DAC. 535 , 536 Entretanto, a persistência do ISTE por período >3 minutos foi associado à DAC grave. A recorrência de ISTE após seu desaparecimento no início da recuperação também indica DAC grave. 4 , 299
– ISTE observado exclusivamente na recuperação apresenta as mesmas acurácias diagnóstica e prognóstica ao constatado no esforço. 537 - 539 Entretanto, a ocorrência de ISTE exclusivamente na recuperação tardia (após terceiro minuto) aumenta a probabilidade de resultado falso-positivo para DAC. 538
Quanto ao infradesnivelamento do segmento ST na estratificação de risco:
– ISTE em assintomáticos, de ambos os sexos, geralmente está associado a maior probabilidade de eventos coronarianos futuros (angina, IAM ou morte cardíaca). 184 , 540 , 541
– Em seguimento de 19 anos, o ISTE associado à baixa capacidade física (<8 METs) apresentou RR 4,8 vezes maior (IC 95%: 2,9-7,9; p=0,013) de morte súbita cardíaca. 541
– Em seguimento de 3,4 anos de pacientes com IST de repouso ≥1,0 mm, somente o ISTE adicional ≥2,0 mm foi significativo na avaliação prognóstica de IAM e morte súbita cardíaca. 542
– Coorte prospectiva de 11.605 pacientes (52,9% masculinos, seguimento médio 6,7 anos), a ocorrência de ISTE (horizontal ou descendente) sem angina típica foi associada a RR de 3,9 (2,7-5,7) de SCA em 1 ano, e nos com angina típica, RR de 20,8 (13,9-31,3). 543
– Estudo prospectivo em 366 mulheres na peri/pós-menopausa (54,4±5,5 anos), com Escore de Framingham de baixo a intermediário risco, seguidas por 5 anos, o ISTE horizontal/descendente ≥1 mm foi fator de risco independente para eventos CV (RR: 10,3; IC 95%: 1,9-61,4; p=0,007). 544
A Tabela 33 apresenta as principais situações e condições que interferem na avaliação das alterações do segmento ST quanto à presença de isquemia miocárdica e DAC.
Tabela 33. – Condições que interferem na interpretação das alterações da repolarização no TE para o diagnóstico de DAC 4,6 .
| Invalidam a interpretação | Interpretação possível com menor acurácia |
|---|---|
| Síndrome de Wolff-Parkinson-White | Onda de repolarização atrial exagerada* |
| Variantes de síndrome de pré-excitação | Prolapso da valva mitral |
| Bloqueio de ramo esquerdo | Cardiomiopatias, valvopatias, pericardite |
| Marca-passo artificial estimulando o ventrículo | Distúrbios metabólicos, hipocalemia |
| Infradesnivelamento do segmento ST ≥1 mm no ECG de repouso | Fármacos anti-isquêmicos, antiarrítmicos e betabloqueadores |
| Terapêutica com digitálicos | Hipertrofia VE no ECG de repouso |
| ECG com qualidade técnica insatisfatória | |
| *Onda Ta negativa que, no período inicial de repolarização ventricular, pode causar infradesnível do ponto J e segmento ST (ascendente, falso-positivo). | |
O TE é considerado não diagnóstico para DAC quando não se atinge 85% da FC máxima prevista na ausência de alterações do segmento ST e/ou angina (ou equivalente anginoso). 4 , 6
4.13.1. Sinal de Corcunda do Segmento ST
O “sinal de corcunda do segmento ST” (SCSST – do inglês “ hump sign ”), também denominado infradesnivelamento com convexidade superior, tem sua origem atribuída às ondas de repolarização atrial exageradas com infradesnível ascendente do STs seguida de onda com morfologia de uma corcunda após o ponto J. 545 , 546 Em indivíduos sem cardiopatia e assintomáticos, tem sido associado à hipertensão de repouso e à resposta hipertensiva exagerada ao esforço, sendo provavelmente resultado “falso-positivo” para DAC obstrutiva e com bom prognóstico. 547
Particularidades do SCSST:
– Foi encontrado associado à disfunção diastólica do VE. 546
– Na cardiomiopatia hipertrófica (seguimento de 5,3 anos), foi considerado fator de risco para morte súbita cardíaca. 548
– Em coorte com 81 pacientes com cardiomiopatia hipertrófica (média 42 anos; 30% mulheres; seguimento 5,3 anos), ocorreu em 52% dos pacientes com taxa de mortalidade CV de 19%. 548
– Em coorte com 237 pacientes não consecutivos (59% homens, média de 41 anos), dos quais 130 com “sinal de corcunda” observou-se forte correlação com a disfunção diastólica do VE (em 88% dos pacientes). 546
O SCSST carece de estudos adicionais para melhor definição de sua aplicabilidade clínica.
4.14. Normalização de Alterações do Segmento ST
Alterações de repolarização presentes em repouso (inversão da onda T e ISTs) podem, durante o esforço, apresentar redução progressiva até a sua normalização (“pseudonormalização do segmento ST”) durante episódios anginosos e na DAC crônica. 549 , 550 Pode estar relacionada aos efeitos de cancelamento de vetores direcionados opostamente às áreas de isquemia. É infrequente e só deve ser considerada quando associada a dor ou equivalente anginoso. 549 , 551
4.15. Inclinação ( Slope ) ST/FC, Índice ST/FC, Loop do ST/FC e Histerese ST/FC
A magnitude do ISTs está associada aos aumentos de cargas de esforço, da FC e da demanda miocárdica de oxigênio, principalmente em presença de DAC. A correlação do ISTs ao comportamento da FC melhora a precisão do TE (VPP) no diagnóstico e estratificação de risco da DAC. 423 , 552
4.15.1. Inclinação ( Slope ) ST/FC
A inclinação ( slope ) ST/FC é calculada por meio de regressão linear correlacionando a magnitude de ISTs (mais frequentemente a 60 ms do ponto J), em cada derivação individualmente (incluindo CM5; excluindo aVR, aVL e V1), com a FC respectiva em cada estágio do TE. 553 O uso prático da inclinação ST/FC requer um protocolo de esforço com pequenos incrementos necessários para o adequado cálculo por regressão. 554
A inclinação ST/FC >2,4 µV/bpm é considerada anormal e valores >6 µV/bpm são sugestivos de DAC grave (DAC triarterial ou TCE). 553
Particularidades da inclinação ST/FC:
– Demonstrou sensibilidade de 78%, especificidade de 93% e acurácia de 89% na identificação de DAC triarterial ou lesão de TCE. 555
– No pico do esforço, em pacientes com suspeita de DAC, quando ≥6,0 µV/bpm identificou DAC triarterial com sensibilidade de 78%, especificidade 97%, VPP de 93% e acurácia de 90%. 556
4.15.2. Índice ST/FC
O índice ST/FC representa a variação do infradesnivelamento do segmento ST (ΔIST) pela variação da FC (ΔFC) em posição ortostática ou sentado, não requer cálculo de regressão e nem protocolo de incremento suave. 557 O índice ST/FC é definido como anormal quando >1,6 µV/bpm. 553 , 557 , 558
Particularidades do índice ST/FC:
– O valor de 4,7 µV/bpm (±4,7) esteve associado à isquemia grave na cintilografia de perfusão miocárdica (pontuação ≥11; p<0,0001) com sensibilidade de 77% e especificidade de 82%. 559
– Aprimorou a predição de risco de eventos coronarianos em homens assintomáticos de alto risco e também em homens e mulheres assintomáticos de baixo risco. 557
4.15.3. Loop ST/FC
O loop ST/FC é um gráfico contínuo refletindo o comportamento do desnível do segmento ST (supra ou infradesnivelamento) em relação à variação da FC na derivação V2 durante o esforço e a cada minuto da recuperação. De acordo com o sentido da rotação do loop ST/FC, os pacientes podem ser divididos em: rotação horária com o desnível mudando mais rapidamente na recuperação; rotação anti-horária com desnível sendo mais prolongado durante a recuperação. 560
Particularidades do loop ST/FC:
– Em pacientes pós IAM, o loop ST/FC com rotação anti-horária apresentou sensibilidade, especificidade e acurácia, respectivamente, de 88%, 73% e 77%, estando fortemente relacionada à isquemia miocárdica na área peri-infarto. 561
– A frequência de amostragem <2 amostras/min pode prejudicar o desempenho no diagnóstico de DAC. 562
4.15.4. Histerese ST/FC
A histerese ST/FC mensura as diferenças entre as áreas de ISTs das fases de recuperação e esforço em relação às FC correspondentes. As amplitudes do segmento ST são medidas em microvolts, a 60 ms do ponto J. 563 , 564 Pode proporcionar maior precisão diagnóstica e prognóstica comparada à análise isolada do ISTs e do índice ST/FC. 563 , 565 , 566
Particularidades da histerese ST/FC:
– Demonstrou 89% de acurácia na detecção de DAC. 563
– Valor de -15 µV permitiu a melhor discriminação diagnóstica de DAC. Nesse estudo, a inclinação de ST/FC de 2,4 µV/bpm e o índice ST/FC de 1,6 µV/bpm também auxiliaram no diagnóstico de DAC. 567
4.16. Intervalo QT/QTc/Histerese QT/Dispersão QT
O intervalo QT (QTi) representa a atividade elétrica ventricular, guarda relação direta com a FC (aumento da FC acarreta encurtamento do QTi), sendo influenciado por alterações neuro-humorais inclusive no esforço. 568 , 569
Devido à variação do QTi com a FC, recomenda-se corrigir o QTi pela FC (QTc):
*QT medido em milissegundos e distância entre RR em segundos.
No ECG basal, o QTc geralmente é corrigido pela fórmula de Bazzet, para FC entre 60 e 90 bpm ( Figura 14 ). Quando FC <60 bpm ou >90 bpm, deve-se utilizar fórmulas como as de Fridericia, Framingham e Hodges. Uma limitação técnica é a dificuldade de aferição exata do QTi em todas as fases do esforço, especialmente com FC mais elevada. 6 , 570 , 571
Figura 14. – Exemplo de avaliação do intervalo QT, QTc e cálculo da histerese do QTc.
No ECG basal, o QTi é prolongado quando >500 ms, e o QTc é normal até ≤450 ms para homens e ≤470 ms para mulheres. 295 , 371 , 572
Normalmente, o QTi diminui desde o início do esforço. Um aumento da FC para 160 bpm reduz o QTi em 25% a 40%. 573 Entretanto, em alguns indivíduos (comumente mulheres), pode haver prolongamento paradoxal do QTi nos primeiros minutos do esforço.
O QTc aumenta no início do esforço, seguido de diminuição progressiva com elevação da FC. Na recuperação, com a queda da FC o QTc retorna ao padrão basal. 574 , 575
A dispersão do QTi (DQTi) é a diferença entre o maior e o menor valor de QTi medidos nas 12 derivações do ECG em determinada fase do TE (esforço ou recuperação).
A histerese do QTc (HQTc) – histerese QT/RR – geralmente é estimada por meio de um dos métodos ( Figura 14 ): 576 , 577
– Variação da HQTc (∆HQTc) estimada pela diferença (em ms) entre o QTi medido em um RR predeterminado (geralmente de 600 ms) medidos no esforço e recuperação. 578
– Área das curvas de HQTc (AHQTc) estimada pela quantificação da diferença das áreas (em ms) das curvas QT/RR ajustadas separadamente para aumento e queda da FC, durante o esforço e recuperação. 579
Mulheres saudáveis apresentam maior variação do QTc durante o esforço e recuperação do que os homens, resultando em uma maior HQTc. 580
Respostas anormais:
– Ausência de diminuição QTc no pico do esforço tem sido associada à isquemia esforço-induzida. Entretanto, não pode ser utilizada como critério único para seu diagnóstico. 581
– Pacientes com DAC estável e TE normal (sem isquemia induzível) apresentam maior risco arrítmico quando o QTc no pico do esforço aumentou significativamente em relação ao basal (de 381 ms para 447 ms; p<0,001). 582
– Em pacientes com alterações isquêmicas do segmento ST, o QTc (fórmula de Bazett; OR: 1,051) e o DQTi (OR: 1,117) medidos no segundo minuto da recuperação foram preditores independentes para DAC crítica. Na recuperação, o QTc ≥404 ms ou o DQTi ≥37 ms aumentou a sensibilidade para 90%. 583
– O prolongamento do QTc esforço-induzido (QTc>440 ms – fórmula de Bazett) possibilitou diferenciar pacientes após IAM com alto risco de morte súbita cardíaca. 584
– Histerese do intervalo QTc (método AHQTc) durante o esforço e a recuperação ≥375 foi preditor independente de isquemia miocárdica (OR: 1,61; IC 95%: 1,22-2,12; p=0,0008). 585
– Histerese do intervalo QTc (método AHQTc) de 11 ms mostrou sensibilidade de 77,9%, especificidade de 85,2%, VPP de 87%, VPN de 75,4% e acurácia superior à do Escore de Duke para detecção de DAC. 586
– Em estudo com 273 pacientes sem IAM (idade 56±9 anos, ambos sexos) o DQTi imediatamente após o esforço (≥60 ms; OR: 2,60; p<0,01) foi preditor de DAC significativa, independentemente do sexo ou da presença de ISTs. 587
– Medidas do QTc no pico do esforço e recuperação (3-4 minutos) contribuem na identificação da SQTL1, sendo recomendadas para sobreviventes de morte súbita cardíaca. 70 , 153 , 588 , 589
– Pacientes com SQTL1 apresentaram aumento máximo do QTc no pico do esforço (DP: ±21 a ±90 ms). Prolongamento do QTc >30 ms no terceiro minuto de recuperação associou-se a 75% de testes genéticos positivos para SQTL1. 140
– Pacientes com SQTL1 apresentaram prolongamento progressivo ou persistente do QTc com o incremento da FC ao esforço. Na SQTL2, ocorreu prolongamento máximo do QTc em FC submáximas (50% da FC máxima prevista), sendo o QTc no pico do esforço significativamente menor do que na SQTL1 (335±45 ms vs . 366±33 ms; p=0,01). 590
– A ocorrência isolada de QTc >480 ms no 4º minuto de recuperação confere 1 ponto no escore de risco da síndrome do QT longo (escore de Schwartz). 591 Algoritmo de triagem combinando o QTc no repouso e aos 4 minutos de recuperação mostrou sensibilidade de 94% e especificidade de 90% para detectar portadores de SQTL. 592
Recomenda-se que os valores do QTi e QTc sejam sempre verificados no ECG basal e, quando normais os seus valores, não precisam ser registrados no laudo do TE. Quando anormais ou em TE para investigação do comportamento do intervalo QT e em pacientes recuperados de morte súbita, o laudo deve incluir os valores de QTc do ECG basal, a fórmula utilizada para correção, o maior valor de QTc observado no esforço, o QTc no pico do esforço e o comportamento do QTc na recuperação (registrar obrigatoriamente o QTc do 4º minuto).
4.17. Distúrbios da Condução Atrioventricular, Intraventricular e da Formação do Impulso
4.17.1. Distúrbios da Condução Atrioventricular
4.17.1.1. Bloqueio Atrioventricular (BAV) de Primeiro Grau
Definido como prolongamento do intervalo PR (PRi) >200 ms (para FC entre 50 e 90 bpm) no ECG basal de adultos. A prevalência varia com a idade: em adultos jovens saudáveis (20 a 30 anos), é de 0,65% a 2%; na população geral, ≈4%; acima dos 60 anos, entre 3% a 5%. Geralmente é assintomático e, em acompanhamento por médio e longo prazo, associou-se a risco ligeiramente aumentado de DAC, IC e FA. 593 - 596 Nos pacientes de alto risco CV, associou-se fortemente a AVC isquêmico, IAM e morte CV. 593 , 595 , 597
Na maioria dos casos, o prolongamento PRi observado no ECG basal sofre normalização com o esforço devido à modulação autonômica. Em saudáveis, o PRi pode atingir até 100 ms com o aumento da FC. 295 , 598 , 599
O BAV de primeiro grau (esforço-induzido ou persistente) é definido como um PRi medido maior que o previsto para a FC. Equações de previsão do PRi médio pela FC:
– PRi médio para FC de 90 a 140 bpm = (-0,287xFC) + 182,9 600
– PRi médio para FC de 60 a 160 bpm = (-0,351xFC) + 176,7 598
Pacientes com bloqueio AV de primeiro grau acentuado (PRi ≥300 ms) no ECG basal podem apresentar durante o TE quadro semelhante ao da síndrome do marca-passo. Tais pacientes são mais propensos a se tornarem sintomáticos em exercícios leves ou moderados devido à falha de adaptação do PRi ao esforço. O PRi não diminui adequadamente com o aumento da FC, causando aproximação excessiva da sístole atrial à sístole ventricular precedente. Alguns desses pacientes sintomáticos, principalmente os com função de VE normal, podem se beneficiar do implante de marca-passo com estimulação de dupla câmara (GR-NE: IIa-B). 601 , 602
O BAV de primeiro grau pode ocorrer no final do esforço ou na recuperação, particularmente na doença oculta do nó AV. Pode estar associado a medicamentos (digital, betabloqueadores, alguns bloqueadores dos canais de cálcio etc.) ou a condições que prolongam o tempo de condução AV (miocardite, doença de Chagas etc.). 439
O FINCAVAS ( Finnish Cardiovascular Study ), com 1.979 pacientes submetidos a TE (seguimento médio 47 meses), demonstrou que o BAV de primeiro grau no 2º minuto da recuperação associou-se ao risco de mortalidade CV (RR contínua: 1,29, p=0,006; RR dicotomizada: 2,41, p=0,045). 603
4.17.1.2. Bloqueio Atrioventricular de Segundo Grau Tipo I (Mobitz I)
Caracteriza-se por alentecimento gradativo da condução AV (fenômeno de Wenckebach) com aumento progressivo do PRi até que a condução AV seja bloqueada. A frequência de bloqueio pode ser variável e ocorrer repetição de ciclos. 604
A presença de BAV Mobitz I no ECG basal em assintomáticos saudáveis não contraindica o TE e geralmente ocorre a normalização da condução AV. Em cardiopatas assintomáticos, deve-se avaliar o benefício de realização do exame. 605 - 607
A manutenção BAV Mobitz I ou seu aparecimento durante o esforço são considerados critérios de interrupção do esforço quando apresentar: sintomas de baixo débito cardíaco ou angina; aumento do número de batimentos bloqueados; redução da FC com a progressão do esforço. 6 , 608 - 610
O BAV Mobitz I com complexos QRS de duração ≥120 ms está associado a bloqueio infranodal AV em 30% a 40% dos pacientes, tendo o mesmo significado prognóstico observado no bloqueio AV de segundo grau tipo II, pois ambos indicam doença grave do sistema His-Purkinje. 131
4.17.1.3. Bloqueio Atrioventricular de Segundo Grau Tipo II (Mobitz II)
No BAV de segundo grau tipo II (BAV Mobitz II), ocorre claudicação súbita da condução AV, sendo a localização do bloqueio na região intra/infra-His-Purkinje. 611
A presença de BAV Mobitz II no ECG basal é critério de contraindicação do TE por estar associado à doença grave no sistema de condução cardíaco e outras cardiopatias. 606
O BAV Mobitz II esforço-induzido é critério de interrupção do esforço por interferir na manutenção do débito cardíaco. 612 , 613 Geralmente está associado à DAC ou à estenose da valva aórtica e pode evoluir para BAVT. 614 , 615
4.17.1.4. Bloqueio Atrioventricular Tipo 2:1 / Bloqueio Atrioventricular Avançado ou de Alto Grau / Bloqueio Atrioventricular de Terceiro Grau ou Total
No BAV tipo 2:1, para cada dois batimentos de origem atrial, um é conduzido e despolariza o ventrículo, e o outro é bloqueado com manutenção de intervalos PP constantes (excluindo o diagnóstico de extrassístoles atriais bloqueadas). BAV tipo 2:1 esforço-induzido é incomum e associa-se à queda do débito cardíaco com possibilidade de dispneia e síncope. A maioria dos pacientes tem histórico de sintomas, e o TE pode ser indicado na investigação e distinção de bloqueio nodal AV e infranodal. O BAV tipo 2:1 pode ser precedido por período de BAV Mobitz tipo I ou tipo II. O BAV tipo 2:1 desencadeado pelo aumento da FC (inclusive aos esforços) geralmente está associado à doença do sistema His-Purkinje. 612 , 616 - 618
No BAV avançado ou de alto grau, existe condução AV em menos da metade dos batimentos atriais, sendo o bloqueio em proporção 3:1, 4:1 ou maior. A presença de condução AV é notada pelo intervalo PR constante em cada batimento que gera um QRS. A maior parte dos BAVs avançados esforço-induzidos localiza-se na região intra/infra-His. 619 , 620
No BAV de terceiro grau ou total (BAVT), não existe correlação entre a atividade elétrica atrial e a ventricular, ocorrendo ondas P bloqueadas que não despolarizaram os ventrículos. Um foco abaixo da região de bloqueio assume o ritmo ventricular. A frequência do ritmo atrial geralmente é maior que a do ritmo de escape. BAVT de origem supra-hissiana apresentam QRS do escape ventricular semelhante ao do ECG basal, enquanto nos de origem infra-hissiana os complexos QRS são largos. 621
BAVT adquirido é uma contraindicação ao TE porque o aumento da atividade simpática sem o correspondente aumento efetivo da FC pode resultar em arritmias ventriculares complexas e complicações graves.
O BAVT esforço-induzido é incomum e pode estar associado à isquemia transitória ou doença degenerativa grave do sistema de condução. Caso ocorra, há indicação absoluta de interrupção do esforço. 207 , 208 , 622
O BAVT congênito tem prevalência de 1 por 15.000 a 20.000 nascidos vivos (60% mulheres). 623 O TE pode ser empregado para ajudar a documentar sintomatologia, avaliar aumento da resposta do escape ventricular, determinar eventual ocorrência de ectopias e a repercussão hemodinâmica do BAVT. BAVT localizado no sistema His-Purkinje apresentou pior prognóstico. A ocorrência de ectopia ventricular esforço-induzida associou-se ao aumento de risco de morte súbita. 624
O TE pode ser realizado em indivíduos com BAVT congênito se não houver coexistência de doenças (congênitas ou não) que reduzam a segurança do TE.
Particularidades do TE no BAVT congênito:
– Muitos pacientes podem apresentar capacidade funcional normal. Não devem ser utilizadas equações de predição de VO 2 max previsto e FCmax prevista. A ectopia esforço-induzida é frequente (50% a 70% dos pacientes). 625 , 626
– A evolução natural do BAVT congênito consiste no declínio progressivo das frequências ventriculares ao longo da vida. No ECG de repouso, entre 6 e 10 anos, observa-se FC média de 50 bpm; entre 16 e 20 anos, de 45 bpm; e acima de 40 anos, de 38 bpm. Adultos com BAVT congênito apresentaram 8% de morte súbita cardíaca como primeiro sintoma do BAVT. Fadiga, dispneia, tontura e ectopias ventriculares esforço-induzidas foram responsáveis por 26,5% dos implantes de marca-passo. 627
4.17.2. Distúrbios da Condução Intraventricular
Os distúrbios de condução intraventricular (bloqueios) podem ser preexistentes ao TE, desenvolver-se ou desaparecer com o esforço, sendo variadas a sua repercussão clínica e associação a cardiopatias.
Os critérios eletrocardiográficos de diagnóstico dos distúrbios da condução intraventricular encontram-se na Diretriz da Sociedade Brasileira de Cardiologia sobre a Análise e Emissão de Laudos Eletrocardiográficos – 2022. 295
4.17.2.1. Bloqueio de Ramo Esquerdo
O bloqueio de ramo esquerdo (BRE) é raro em pacientes <50 anos e quase nunca ocorre em <35 anos, sugerindo tratar-se de um distúrbio adquirido, secundário a DCV. Estudos populacionais demonstraram que a prevalência aumenta de maneira constante a partir dos 50 anos (<1%) atingindo 6% aos 80 anos. 295 , 628 , 629
4.17.2.1.1. Bloqueio do Ramo Esquerdo Preexistente
O BRE no ECG basal é uma limitação para a análise do ISTs, pois geralmente não está associado à isquemia miocárdica, reduzindo a especificidade e a acurácia do TE. 628 , 630 - 632 Em indivíduos normais e saudáveis com BRE, o ISTs no TE pode atingir até 10 mm. O TE pode ser realizado para investigação de sintomas, e a análise de todas as outras variáveis do exame não se encontra prejudicada. 12 , 628
Na vigência de BRE, sugere-se aplicar o escore de diagnóstico de IAM (Sgarbossa) de modo a identificar possível evento adverso agudo durante o TE, em que: 633 , 634
– Supradesnivelamento do segmento ST (SSST) ≥1 mm concordante com o QRS (em derivação com QRS predominantemente positivo) – pontuação = 5.
– ISTs ≥1 mm em V1, V2 ou V3 – pontuação = 3.
– SSST ≥5 mm discordante com o QRS (em derivação com QRS predominantemente negativo) – pontuação = 2.
Interpretação da pontuação do Escore de Sgarbossa em relação ao TE:
– ≥3 = IAM na presença de BRE.
– <3 e >0 = não descarta IAM. Em pacientes de alto risco ou com sintomatologia, realizar avaliação adicional.
– 0 = comportamento esperado do BRE durante o TE.
Para diagnosticar a complicação de IAM em presença de BRE durante o TE, também pode-se utilizar: escore de Sgarbossa modificado; algoritmo de Barcelona; critérios de Smith. 635 - 638
Particularidades do TE em pacientes com BRE preexistente:
– Acarreta importantes efeitos hemodinâmicos: ativação miocárdica assíncrona; comprometimento da função sistólica e diastólica; redução da fração de ejeção. 639 - 641
– Na miocarcardiopatia dilatada com BRE, observa-se um VO 2 pico significativamente menor do que VO 2 max previsto (≈33% inferior; p<0,001). O BRE e a duração do QRS foram preditores de baixa tolerância ao esforço. 642
– O desaparecimento do BRE durante o esforço é situação muito rara geralmente associada a bloqueio de ramo temporário (persiste por dias ou meses) ou transitório (dura apenas segundos ou horas). É considerada observação fortuita e sua relação com o esforço é incerta. Tais bloqueios podem estar associados à cardiopatia ou a condições como doença hipertensiva, febre reumática, embolia pulmonar, hipercalemia e tireotoxicose. 643 , 644
4.17.2.1.2. Bloqueio do Ramo Esquerdo Esforço-induzido
O BRE esforço-induzido (BRE-EI) ocorre em aproximadamente 0,4-0,5% dos pacientes submetidos a TE. 202 , 203 , 645 Seu mecanismo permanece incerto, podendo estar associado a doenças valvares, miocardiopatias, cardiopatias congênitas, defeito primário do sistema de condução, DAC ou mesmo em pacientes sem doenças detectadas. Estudo longitudinal demonstrou que a DAC e a IC foram as causas mais prevalentes. 203
O BRE-EI transitório pode causar dissincronia ventricular esquerda e alterações secundárias no padrão de enchimento reversíveis. 646 , 647 Além disso, pacientes com BRE-EI apresentam risco aumentado de desenvolver BRE permanente, disfunção ventricular e raramente BAVT com necessidade de implante de marca-passo. 203
As principais formas de manifestações clínica do BRE-EI são:
1) Assintomático, tanto no aparecimento quanto no momento de desaparecimento.
2) Dor torácica de início abrupto (normalmente localizada e sem irradiação), intensidade variada (de desconforto a dor severa), simultânea ao aparecimento e melhora concomitante ao desaparecimento e com ECG normal antes e após o BRE. Uma minoria dos pacientes pode apresentar melhora da dor antes do desaparecimento do BRE.
3) Dor precordial típica antes do aparecimento do BRE, que não melhora com seu desaparecimento, geralmente está associada a DAC (principalmente com ISTs precedendo o BRE). 643 , 648
A síndrome de BRE doloroso é constituída por dor torácica associada ao BRE-EI (descrita no item 2, anteriormente), em paciente com função ventricular normal, sem outras possíveis causas e com relação da amplitude das ondas S/T <1,8 (derivações precordiais e parede inferior). O TE tem papel fundamental para o seu diagnóstico. 648 - 652
Particularidades do BRE-EI e das alterações associadas:
– No BRE intermitente ou após o seu desaparecimento, comumente ocorrem inversões profundas e simétricas da onda T (em V1 a V4) nos batimentos normalmente conduzidos. São consequência do próprio BRE constituindo fenômeno elétrico secundário à ativação anormal e não devem ser interpretadas como isquemia miocárdica. 653 - 657
– Durante o período com BRE, a acurácia relacionada às alterações do segmento ST quanto a isquemia miocárdica encontra-se prejudicada. 631
– A ocorrência de ISTs precedendo o início do BRE deve ser valorizada, e sua interpretação não está prejudicada, pois caso preencha critérios de isquemia miocárdica, geralmente está associada a DAC. 648
– Relatos e séries de casos demonstraram que o início do BRE em FC ≤125 bpm tem sido fortemente correlacionado com a presença de DAC obstrutiva. 649 , 658 Quando o BRE-EI ocorreu em FC >125/min, geralmente observou-se cineangiocoronariografia (CAT) normal e um melhor prognóstico. 202 , 659
– Coorte com 25 pacientes com BRE-EI (entre 16.500 TE) identificou um VPP de 72% para DAC e, quando em FC <120 bpm, associou-se à estenose proximal de DA. 660
– A síndrome do BRE doloroso e o BRE-EI em FC >125 bpm geralmente não estão associados à DAC obstrutiva. 648 - 652
– Em estudo com 9.318 pacientes (seguimento médio 6,9 anos), 20 pacientes apresentaram BRE-EI. Os pacientes com DAC (60%) apresentaram pior prognóstico (risco aumentado de morte e IAM). O risco de desenvolvimento de BRE permanente e BAVT foi semelhante nos pacientes com e sem DAC. 648
4.17.2.2. Bloqueios Divisionais do Ramo Esquerdo
Os bloqueios divisionais do ramo esquerdo (BDRE) no ECG basal não impossibilitam a análise de alterações da repolarização ventricular esforço-induzidas quanto à isquemia, entretanto podem diminuir a acurácia do exame. 661 , 662
Os BDRE esforço-induzidos (BDRE-EI) são raros. O mecanismo mais aceito para sua ocorrência é a condução lenta induzida por isquemia em fibras no feixe esquerdo e suas subdivisões, ou nas fibras miocárdicas de Purkinje. 663
Particularidades BDRE-EI:
– Apresentam alta correlação não só com a existência de DAC, mas com a extensão e a gravidade da doença. 661 , 664 - 667
– O posteroinferior esquerdo (BDPI) esforço-induzido tem sido relacionado à DAC em coronária direita ou multiarterial. 668
– O anterossuperior esquerdo (BDAS) e anteromedial esquerdo (BDAM) esforço-induzidos estão associados à DAC em tronco de coronária esquerda ou DA. 669
– No BDAS esforço-induzido, inúmeros relatos de caso documentaram a reversibilidade desse bloqueio após o tratamento intervencionista da obstrução coronariana. 664 , 665 , 670
4.17.2.3. Bloqueio de Ramo Direito
4.17.2.3.1. Bloqueio de Ramo Direito Preexistente
O bloqueio de ramo direito (BRD) ocorre em 0,2% a 3% da população geral. A prevalência aumenta com a idade, sendo maior em homens (≈14,3% em homens >80 anos). 671
O BRD isolado é geralmente benigno, exceto em determinadas cardiopatias (p. ex., miocardiopatia, DAC ou IC), quando se associa a maior mortalidade CV. BRD isolado é comum em indivíduos aparentemente saudáveis. 672 O principal diagnóstico diferencial do ECG com BRD é a síndrome de Brugada. 673 - 675
O BRD no ECG basal invalida a interpretação de alterações do ISTs ao esforço apenas nas derivações de V1 a V3. Geralmente está presente no repouso e aumenta no esforço, sem relação com DAC. Nas demais derivações, a quantificação e a interpretação de ISTE permitem o diagnóstico de isquemia esforço-induzida. 645 , 676 , 677
Particularidades do BRD preexistente:
– Estudo com 3.609 pacientes submetidos ao TE identificou 163 (4,5%) com BRD, dos quais 133 foram seguidos (36% com IAM). O TE apresentou sensibilidade de 27%, especificidade de 87% e acurácia de 62% para DAC. Durante seguimento, observou mortalidade anual de 10%. 678
– Estudo com 23.026 pacientes sem diagnóstico de DCV, 220 (0,96%) com BRD nos quais observou-se maior mortalidade por todas as causas (RR: 1,5; IC 95%: 1,1-2,0; p=0,0058) e por DCV (RR: 1,7, IC 95%: 1,1-2,8; p=0,0178). Os pacientes com BRD apresentaram menor tolerância ao esforço, recuperação mais lenta da FC e maior ocorrência de dispneia. 673
– Coorte com 7.073 adultos submetidos ao TE associado à cintilografia de perfusão miocárdica (seguimento médio 6,7 anos) demonstrou que a mortalidade em 190 pacientes com BRD foi maior que nos sem bloqueio (24% vs. 11%, respectivamente; RR: 1,5; IC 95%: 1,1-2,1; p=0,007), mesmo após ajuste para aptidão cardiorrespiratória, defeitos de perfusão nuclear e outros fatores de risco. O bloqueio divisional do ramo direito não foi associado à mortalidade. 679
– Existem poucos relatos de casos na literatura de desaparecimento do BRD preexistente durante o esforço, e o mecanismo envolvido não é claro. 680 - 682
4.17.2.3.2. Bloqueio de Ramo Direito Esforço-induzido
O BRD esforço-induzido (BRD-EI) ocorre em aproximadamente 0,25% dos pacientes submetidos ao TE, sendo menos frequente que o BRE-EI. Geralmente está associado à DAC. 152 , 202 - 204
Particularidades do BRD-EI:
– A análise das alterações de isquemia durante o período com BRD é semelhante à descrita para pacientes com BRD preexistente.
– Duas coortes avaliando pacientes com BRD-EI identificaram alta prevalência de DAC nesses pacientes, sejam lesões uni ou multiarteriais. 645 , 660
– Em coorte com 8.047 pacientes (seguimento médio de 8,8 anos), os 23 pacientes com BRD-EI apresentaram maior prevalência de DAC e IC e maior risco de morte. 204
– Em coorte com 3.974 homens (idade média de 57,5 anos; seguimento médio 5,9 anos), observou-se 1,9% de BRD-EI, que foi associado a maior risco de morte por todas as causas (p<0,001). 306
4.17.3. Distúrbios da Formação do Impulso
É comum a ocorrência de anormalidades do ritmo cardíaco (ARC) durante o TE em pacientes com e sem DCV. Frequentemente, as arritmias são isoladas, transitórias, episódicas, assintomáticas e geralmente não representam risco de eventos CV. Costumam apresentar grande variabilidade espontânea e circadiana, o que dificulta sua reprodutibilidade. 299
Em presença de ARC, sugere-se a utilização do registro em tempo total do ECG (registro contínuo) para diagnóstico, quantificação e documentação das arritmias.
Em repouso, os principais mecanismos envolvidos na arritmogênese são: reentrada, automaticidade aprimorada/acionada e pós-potencial atrasado. Outros fatores: anormalidades eletrolíticas, alterações no pH, hipóxia, fatores hemodinâmicos (pré e pós-carga, distensão parede VE etc.), modulação autonômica, catecolaminas circulantes, interações medicamentosas e isquemia miocárdica. O exercício pode ser gatilho devido à retirada simultânea da atividade vagal, aumento da atividade simpática, alterações da automaticidade cardíaca e aumento do consumo de oxigênio miocárdico. Na recuperação, ocorrem a retomada súbita do tônus vagal e alterações hemodinâmicas que também podem precipitar arritmias ( Figura 15 ). 63 , 133 , 134 , 142
Figura 15. – Principais mecanismos e fatores envolvidos na arritmogênese durante o TE. *Permanecem como mecanismos durante todas as etapas do TE. ↑ = aumento. O 2 : oxigênio.
No pré-teste, recomenda-se pesquisar possíveis fatores precipitantes e agravantes das arritmias, tais como esforço físico, ingestão excessiva de cafeína e de álcool, tabagismo, uso de drogas recreativas e hipertireoidismo. Caso ocorra ARC durante o TE, recomenda-se correlacionar com os dados do pré-teste e possíveis fatores desencadeantes relacionados ao esforço (p. ex., isquemia). 63 , 133 , 134 , 683
4.17.3.1. Arritmias Ventriculares
O TE é útil para fins de investigação de sintomas sugestivos de arritmia, diagnóstico, comportamento (potencialização e supressão) e prognóstico em pacientes selecionados. 684
A extrassístole ventricular (EV) apresenta-se como batimento ectópico ventricular, prematuro em relação ao intervalo RR anterior, geralmente com pausa pós-extrassistólica. Caso não ocorra modificação na duração do intervalo RR, a EV é chamada de EV interpolada. 63 , 188 , 371 São arritmias comuns na prática clínica que aumentam com a idade e DCV. A prevalência em repouso na população aparentemente saudável é de 1% a 4% e, no TE, de 5% a 34%. Em pacientes com miocardiopatia, a incidência no TE pode atingir ≈90%. 684 , 685
A EV pode ser classificada conforme:
– Morfologia: monomórfica e polimórfica (mais de uma morfologia).
– Inter-relação com os batimentos sinusais e outras EVs:
• Isolada: batimento ectópico ventricular único.
• Pareada (pares ventriculares): dois batimentos ectópicos ventriculares, de mesma morfologia ou diferentes, com intervalo de acoplamento fixo ou variável.
• Em salva: são três ectopias ventriculares seguidas, em série, equivalentes à TVNS.
• Bigeminada: são EVs que alternam com ritmo sinusal na proporção de 1 EV para 1 batimento normal, de forma repetitiva por períodos curtos ou prolongados.
• Trigeminada: são EVs que alternam repetitivamente com o ritmo sinusal na proporção de 1 EV para 2 batimentos normais.
• Quadrigeminada: são EVs que alternam repetitivamente com o ritmo sinusal na proporção de 1 EV para 3 batimentos normais.
– Quanto à frequência. A classificação de Lown e Wolf permite quantificar a arritmia, sendo útil para definição de gravidade (as classes I e II necessitam de monitorização do ECG pelo método Holter):
0: Ausência EV.
I: <30 EVs/h.
II: ≥30 EVs/h.
III: EVs polimórficas.
IVa: EVs pareadas (pares ventriculares).
IVb: taquicardia ventricular (3 ou mais EVs consecutivas).
V: intervalo de acoplamento curto (fenômeno R sobre T).
Na população geral, as EVs são definidas como frequentes quando se observa pelo menos 1 EV em ECG basal de 12 derivações ou ≥30 EVs/h (Classe II de Lown e Wolf – em Holter), estando associadas a aumento do risco CV e mortalidade. 63 , 191
A classificação quanto a morfologia, duração do QRS e inter-relação com os batimentos sinusais e outras EVs pode ser utilizada tanto no ECG basal quanto no TE.
A taquicardia ventricular (TV) corresponde a pelo menos três batimentos ventriculares sucessivos com FC >100 bpm. Classifica-se de acordo com:
– Morfologia dos batimentos: TV monomórfica (TVM) com morfologia uniforme e TV polimórfica (TVP) com três ou mais morfologias.
– Duração: não sustentada (TVNS) se <30 segundos e TV sustentada (TVS) se ≥30 segundos.
– Sintomas e repercussão hemodinâmica: ausentes ou presentes.
Na presença de taquicardias de QRS largo (>120 ms), pode ser necessária a utilização de algoritmos (Brugada ou Vereckei) para o diagnóstico diferencial de taquicardia supraventricular com aberrância de condução. 686
A TV tipo torsades de pointes apresenta QRS largo, polimórfico, “girando” em torno da linha de base, precedida por ciclos longo/curto, relacionada com intervalo QTc longo (congênito ou secundário a fármacos e distúrbios eletrolíticos) e geralmente autolimitada.
Na TV bidirecional, ocorre uma TV com morfologia de bloqueio de ramo direito (raramente BRE) associada a bloqueio alternado das divisões anterossuperior e posteroinferior do ramo esquerdo. O aspecto bidirecional se deve à observação de um batimento ventricular com QRS positivo seguido de outro com QRS negativo, sucessivamente. Geralmente está associada a miocardiopatia avançada grave, quadros de intoxicação digitálica e taquicardia catecolaminérgica familiar.
A arritmia ventricular esforço-induzida (AV-EI) é definida como quaisquer complexos ventriculares prematuros ou taquicardia ventricular durante o esforço e a recuperação. Quando frequente, é marcador de mau prognóstico. 687
Principais definições de AV-EI frequente:
1) Ocorrência de ≥7 EVs/minuto, bigeminismo ou trigeminismo ventricular, pares ou salvas, taquicardia ventricular, flutter ventricular, torsades de pointes ou fibrilação ventricular. 192
2) Quando em qualquer período de 30 segundos no TE, as arritmias ventriculares corresponderem a mais de 10% dos batimentos ou ocorrer TV (com ≥3 EVs consecutivas). 688 , 689
Quando ocorrer AV-EI, recomenda-se informar na conclusão sua forma de apresentação e se é frequente ou não.
Sintomas associados a AV-EI consistem em queixa falha do batimento (palpitação), sensação de aceleração, desconforto torácico, fadiga e tontura. Os sopros de ejeção existentes podem ser exacerbados em virtude do maior volume sistólico e da força contrátil após pausas compensatórias. Nas TVs, a sintomatologia costuma ser mais frequente e intensa. Quando sustentada, a repercussão hemodinâmica é comum e associa-se a queixas de desconforto ou pressão precordial, dor típica, dispneia, palpitações, diaforese, tontura, náusea, pré-síncope e síncope. 690
Particularidades das arritmias ventriculares ao TE:
– AV-EI frequente em qualquer das fases do TE está associada a maior risco de morte por todas as causas e CV, principalmente quando ocorrer na recuperação, sendo ainda maior caso ocorra no esforço e recuperação. 191 - 194 , 196 , 689 , 691
– São de pior prognóstico: EVs polimórficas; EVs com morfologia de via de saída VE; EVs com densidade crescente ao esforço; EVs com intervalo de acoplamento curto. 684 , 692
– Em estudo com 302 pacientes (idade média 54 anos, 152 homens), 22% apresentaram AV-EI frequentes associadas a maior ocorrência de anormalidades perfusionais e ISTs, principalmente em homens (67% vs. 38%; p<0,05). 693
– Na população aparentemente saudável (incluindo atletas), as EVs isoladas em repouso costumam apresentar redução com o esforço, sendo geralmente de bom prognóstico. 694 - 696
– Em atletas com TV-EI (com ≥3 batimentos a ≥120 bpm, sustentada ou não), recomenda-se investigação adicional para investigação diagnóstica e de risco. 136 , 694 , 695
– EVs e AV-EI nas condições arrítmicas familiares (p. ex., síndrome do QT longo) e sensíveis às catecolaminas (p. ex., TV da via de saída do ventrículo direito). 63 , 130 , 188
4.17.3.2. Arritmias Supraventriculares
As arritmias supraventriculares (AS) são relativamente comuns, muitas vezes repetitivas, ocasionalmente persistentes e raramente fatais. Os principais fatores precipitantes de AS são: idade (mais comum em idosos), sexo (mais comum no sexo feminino) e comorbidades associadas (p. ex., hipertensão, valvopatia e miocardiopatias). 697 - 700
A extrassístole supraventricular isolada (ESV) é um batimento ectópico atrial ou juncional precoce que é seguido de despolarização ventricular com morfologia e duração semelhante aos batimentos sinusais precedentes. A taquicardia atrial (TA) constitui ritmo atrial originado em região diversa do nó sinusal, caracterizada pela presença de onda P distinta da sinusal com frequência atrial >100 bpm. É comum a ocorrência de condução AV variável. A taquicardia atrial multifocal (TAMF) apresenta as mesmas características do ritmo atrial multifocal, com frequência atrial >100 bpm.
A taquicardia por reentrada nodal (TRN) comum utiliza o nó AV como parte fundamental do seu circuito e pelo mecanismo de reentrada nodal. Em geral, a onda de ativação atrial está dentro do QRS e não é observada. Nos casos de TRN com QRS alargado, faz-se necessário o diagnóstico diferencial com taquicardias de origem ventricular. Na TRN atípica (incomum), o sentido de ativação é inverso (atrial retrógrada) com intervalo RP maior que o PR.
A taquicardia por reentrada atrioventricular (TRAV) ortodrômica utiliza o sistema de condução normal no sentido anterógrado e uma via acessória no sentido retrógrado. O QRS é estreito e a onda P retrógrada com morfologia diversa dependendo da localização da via acessória e intervalo RP >80 ms.
As taquicardias supraventriculares podem ser classificadas baseadas no RP:
– RP’ curto (habitualmente até 120-140 ms): associadas a TRN forma comum e taquicardia por reentrada via feixe anômalo.
– RP’ longo: associadas a TRN forma incomum, TA e taquicardia de Coumel (reentrada por feixe anômalo de condução retrógrada única).
As AS podem se apresentar com complexo QRS alargado nas seguintes situações:
– Aberrância de condução, em que um estímulo supraventricular (normal ou extrassistólico) que encontra dificuldade de propagação regional no sistema de condução, gerando um QRS com morfologia de bloqueio de ramo.
– Taquicardia supraventricular com aberrância de condução, que é a denominação genérica para as taquicardias supraventriculares de RP’ curto ou longo.
As arritmias supraventriculares (ESV, fibrilação atrial, flutter atrial, TPSV) são comumente induzidas pelo esforço e encontradas em até 10% dos TE de pacientes aparentemente saudáveis e em até 25% daqueles com DAC conhecida ou suspeita. 189 , 197
As ESVs isoladas são frequentes no TE com incidência de 4% a 18%. Normalmente são assintomáticas, inclusive quando esforço-induzidas. As ESVs não apresentam correlação com isquemia miocárdica ou risco de mortalidade CV/IAM. 189 , 197 , 198
ESV isoladas, arritmias sinusais com períodos de bradicardia sinusal e ritmo de marca-passo atrial mutável são relativamente comuns no início do esforço e da recuperação, tanto em pacientes aparentemente saudáveis quanto em cardiopatas. ESVs no ECG basal tendem a se tornar progressivamente menos frequentes com o esforço, sendo geralmente benignas. 6 , 142 , 699 Pacientes idosos com ESVs frequentes ao esforço (>5/estágio) apresentaram maior risco de FA/FluA (RR: 15,23; IC 95%: 4,59-50,56; p<0,001). 199 , 200
A TRAV é mais comum na meia-idade e idosos, enquanto, em adolescentes, observa-se prevalência semelhante de TRAV e TRN. Ambas são raras no TE, apresentam início e término súbitos, FC entre 150 e 250 bpm e geralmente necessitam de adenosina para sua interrupção. 129 , 190
A incidência de pré-excitação manifesta ou padrão WPW na população geral é de 0,1% a 0,3%, sendo a ocorrência de TPSV-EI muito rara. 129 , 701 , 702
A incidência de TPSV-EI varia de 3,4% a 15% em pacientes com AS paroxísticas. 185 , 197 É mais comum em homens idosos, geralmente assintomática, não sustentada, ocorre perto do pico do esforço, não está associada a isquemia esforço-induzida e mortalidade CV. 189 Entretanto, a TPSV-EI geralmente associa-se a palpitação, desconforto torácico, mal-estar, tontura, pré-síncope e dispneia. Mais raramente, pode ocorrer intolerância súbita ao esforço, hipotensão, síncope, sinais de IC e choque. 129 , 703 - 705
Particularidades das arritmias supraventriculares ao TE:
– Indivíduos com TPSV-EI (salva de 3 ou mais batimentos) apresentaram maior risco de FA no seguimento médio de 5,7 anos (RR: 7,6; p<0,001). 189
– Durante episódios de TPSV, pode ocorrer ISTs que geralmente não estão associados à isquemia miocárdica. 706 , 707
– As AS-EI estão mais frequentemente relacionadas à idade avançada, DPOC, ingestão recente de álcool ou ingestão excessiva de cafeína. 6
4.17.3.3. Fibrilação Atrial/Flutter Atrial
Fibrilação atrial (FA) é uma atividade elétrica atrial desorganizada (ondas “f”) com frequência atrial entre 450 e 700 bpm e resposta ventricular variável. 371 Em relação ao repouso, considerar ritmo de FC com:
– Baixa resposta ventricular, quando a FC ≤50 bpm.
– Controle adequado da FC, quando FC entre 51 e 89 bpm.
– Controle leniente (ou inadequado), quando a FC estiver entre 90 e 110 bpm.
– Resposta ventricular elevada, quando a FC >110 bpm. 295
Critérios de classificação da FA: 119
– Paroxística: um episódio de FA que se converte espontaneamente ao ritmo sinusal normal em até 7 dias.
– Persistente: paciente requer cardioversão elétrica ou química/medicamentosa para restaurar o ritmo sinusal.
– Permanente ou crônica: presente por >6 meses ou quando o paciente e o médico decidem não tentar mais restaurar o ritmo sinusal.
Flutter atrial (FluA) é uma atividade elétrica atrial organizada (ondas “F”) dividido em: 133 , 371
– Tipo I (comum ou típico) com ativação no sentido anti-horário, frequência atrial entre 240 e 340 bpm e ondas “F” com aspecto em dentes de serrote (negativas nas derivações inferiores e positivas em V1).
– Tipo II (atípico ou incomum) com ativação no sentido horário, frequência atrial entre 340 e 430 bpm, graus variados de bloqueio AV e ondas “F” alargadas e positivas nas derivações inferiores.
Na FA e no FluA, a determinação da FC deve ser feita a partir de um traçado de ECG de 6s. Geralmente o esforço não provoca aumento na frequência das ondas atriais e o aumento da frequência ventricular depende da condução atrioventricular. Na FA (persistente e crônica) e no FluA crônico, o TE é útil na avaliação de sintomas e reposta da FC, para ajustes terapêuticos e prescrição de exercício/reabilitação. 708 - 712
Preferencialmente, os pacientes devem manter as medicações para o controle de ritmo e/ou frequência ventricular e anticoagulantes para realização do TE. 133
Nos pacientes com FA permanente não tratados, a FC no TE costuma variar de 90 a 170 bpm. Uma FA com FC <60 bpm no ECG de repouso pode estar associada a doença do nó AV, síndrome do nódulo sinusal e uso de drogas que afetam a FC (betabloqueadores e antiarrítmicos). 133
Os pacientes com FA podem ser exercitados com segurança até o esforço máximo, limitado por sintomas, na ausência de outras indicações formais de interrupção. Considera-se adequado o controle medicamentoso da FC quando a resposta cronotrópica for semelhante à dos pacientes em ritmo sinusal. 708 - 711 Aumentos acentuados da FC, atingindo ou superando a FC submáxima já no primeiro estágio do esforço, bem como FCpico >110% da FC máxima prevista (para a idade), necessitam de adequação da terapia farmacológica, por serem preditores de IC e reduzirem a capacidade física. 159 , 713 - 716 Nos pacientes com IC e FA permanente, o ΔFC demonstrou estar relacionado ao desempenho no esforço e morbimortalidade. 158 , 717 , 718
Na vigência de FA, a avaliação de isquemia fica prejudicada, pois as alterações do segmento ST podem ser decorrentes da própria arritmia (baixo VPP). Entretanto, ausência de ISTE confere elevado VPN para isquemia. 713 , 719
A FA permanente, independentemente da doença de base (IC, hipertensão, cardiopatia isquêmica, miocardiopatia ou doença valvar), relacionou-se a VO 2 max abaixo do previsto para a idade. 715 , 717
A conversão para o ritmo sinusal reduziu a FCpico (≈40 bpm) e melhorou a aptidão cardiorrespiratória (≈15%). 720
No FluA crônico, geralmente ocorre modificação do padrão de condução AV com redução do grau de bloqueio e aumento da FC ao esforço. Os sintomas associados ao FluA (fadiga, dispneia, mal-estar) estão relacionados à FC elevada. Embora o FluA com condução AV 1:1 seja raro, é importante reconhecê-lo, pois pode precipitar rápido comprometimento hemodinâmico e síncope. No início da recuperação, geralmente observa-se BAV de segundo grau tipo 1 transitório, seguido de retorno ao padrão basal do ECG. Não é possível avaliar isquemia durante o FluA. 721 - 723
FA e FluA esforço-induzidos (FA-EI e FluA-EI) são raros e ocorrem em <1% dos indivíduos. Durante o TE, pode ocorrer a modificação de FA-EI para FluA-EI e vice-versa, pois uma arritmia pode ser mecanismo desencadeador da outra. 724 Ocorrem em indivíduos aparentemente saudáveis, na doença cardíaca reumática, hipertireoidismo, síndrome de Wolff-Parkinson-White e cardiomiopatia. Ambas costumam causar repercussão hemodinâmica quando a resposta ventricular ao esforço for elevada. Na FA-EI, a avaliação de isquemia fica prejudicada pelo baixo VPP e inviabilizada no FluA-EI. 201 , 725
4.17.3.4. Bradiarritmias/Incompetência Cronotrópica Crônica
Um grupo heterogêneo de indivíduos apresenta FC de repouso inadequadamente baixa, e a maioria é assintomática e desconhece a anormalidade. É comum em atletas de alto rendimento associada ao tônus vagal aumentado. Pode ser secundária ao uso de medicamentos (antiarrítmicos e betabloqueadores), doença intrínseca do tecido nodal (geralmente por isquemia) alterações degenerativas, miocardiopatia atrial e síndrome do nó sinusal. 131 , 726 , 727
Nessa situação, o TE permite analisar a resposta cronotrópica ao estímulo simpático, correlacionar eventuais sintomas relacionados à bradicardia, podendo ser determinante no diagnóstico e terapêutica, incluindo indicação de implante de marca-passo definitivo. 131 , 368
Nos pacientes com bradicardia sinusal não patológica submetidos ao TE, observa-se uma resposta cronotrópica normal, caracterizando-os como indivíduos vagotônicos. Entretanto, nos pacientes com bradicardia sinusal e ocorrência de uma resposta cronotrópica deprimida, geralmente observa-se disfunção do nó sinusal (DisNS). Alguns pacientes com DisNS podem atingir uma FCpico apropriada durante o esforço, mas podem ter uma aceleração muito lenta da FC nos estágios iniciais do protocolo ou apresentarem uma rápida desaceleração da FC no estágio inicial de recuperação. A DisNS pode desencadear sintomas de ICC e angina ao esforço. 133
Nos pacientes com bradicardia sinusal não patológica submetidos ao TE, observa-se uma resposta cronotrópica normal, caracterizando-os como indivíduos vagotônicos.
Pacientes com disfunção do nó sinusal (DisNS) submetidos ao TE podem: apresentar bradicardia sinusal no repouso com ocorrência de resposta cronotrópica deprimida ao esforço; raramente apresentar aceleração muito lenta da FC nos estágios iniciais do protocolo, podendo atingir até a FCmax prevista; muito raramente, apresentarem isoladamente rápida desaceleração da FC no início da recuperação não associada ao bom condicionamento físico. A DisNS pode desencadear sintomas de ICC e angina ao esforço. 133
Alguns pacientes com bradicardia sinusal esforço-induzida também podem apresentar síncope associada a uma queda profunda da PA devido ao reflexo de Bezold-Jarisch. 205 , 206
4.17.3.5. Taquicardia Sinusal Inapropriada
A síndrome da taquicardia sinusal inapropriada (SindTSI) é um distúrbio crônico caracterizado por: 133 , 728
– Aumento da FC sinusal desproporcional à demanda fisiológica: FC diurna em repouso >100 bpm; FC média no Holter de 24 horas >90 bpm; resposta exagerada da FC ao mínimo esforço físico ou estresse emocional.
– Ausência de outras causas que justifiquem a taquicardia sinusal.
– No ECG de repouso, durante a taquicardia sinusal, a onda P apresenta eixo e morfologia semelhantes ao do ritmo sinusal.
– Ocorrência de sintomas associados à taquicardia, tais como palpitações, fadiga, dispneia, intolerância ao exercício e ansiedade.
A maioria dos pacientes com SindTSI consiste em mulheres com ≈38±12 anos. Em uma população de meia-idade, a prevalência da SindTSI (sintomática ou assintomática) é de até 1,2%. Entretanto, na pós-COVID e COVID crônica, a prevalência pode atingir até 20% (idade 40,1±10 anos, 85% mulheres, 83% COVID-19 leve), com ausência de doença cardíaca estrutural, estado pró-inflamatório, lesão de miócitos ou hipóxia. 729 , 730
O curso natural e o prognóstico da SindTSI são geralmente benignos e raramente ocorre cardiomiopatia induzida por taquicardia. Sua associação com condições psiquiátricas não é infrequente. O principal diagnóstico diferencial é com a síndrome de taquicardia postural que é um distúrbio do sistema nervoso autônomo associado à posição ortostática, em que se observa aumento da FC >30 bpm ou FC >120 bpm nos primeiros 10 minutos nessa posição. 731 , 732
O TE é útil na avaliação da SindTSI, pois geralmente mostra aumento precoce e excessivo da FC em resposta a uma carga de esforço mínima (FC >130 bpm em 90 segundos de esforço no protocolo de Bruce) e/ou FCmax alcançada rapidamente. Essa resposta da FC é diferenciada da encontrada nos sedentários pela ocorrência de sintomas. 133 , 733 , 734
4.18. Avaliação Metabólica Indireta
4.18.1. VO 2 /METs
A estimativa da capacidade aeróbica deve, preferencialmente, ser descrita utilizando a quantidade de esforço realizado em METs ou o seu respectivo VO 2 max estimado. Deve-se relatar o valor real alcançado e o respectivo valor percentual previsto. Recomenda-se não expressá-la em número de minutos de esforço ou estágio alcançado, pois essas formas dificultam a interpretação clínica e podem ter grande variação entre os protocolos. 735 , 736
O cálculo do VO 2 e sua conversão para METs, seus valores previstos por idade e sexo e sua significância prognóstica foram descritos anteriormente nesta diretriz.
O TE é indicado para determinar a tolerância ao esforço em indivíduos aparentemente saudáveis, com DCV (cardiopatia isquêmica, IC, miocardiopatias, valvopatias, arritmias, cardiopatias congênitas, DAP etc.) e comorbidades (p. ex., diabetes e DPOC).
Em pacientes adultos com DCV, considera-se como critério de intolerância ao esforço/baixo desempenho físico não atingir:
– Carga de trabalho de 5 METs (capacidade aeróbica estimada). 737
– 15,0 mL/kg/min (capacidade aeróbica medida diretamente pelo TCPE).
Particularidades do VO 2 /METs:
– Considerava-se um marcador de alto risco (mau prognóstico) em adultos atingir no TE <5 METs em mulheres e <7 METs em homens, mas atualmente é preciso avaliar cada indivíduo em relação a sua idade, condicionamento físico e doenças associadas. 735 , 738
– Vários estudos têm demonstrado que pacientes com ≥10 METs ao TE, em especial os idosos, independentemente de isquemia esforço-induzida, apresentaram baixas taxas de eventos cardíacos adversos e mortalidade. 257 , 739 - 742
– A cada 1 MET de aumento na carga de trabalho, ocorreu uma redução de 18% de eventos cardíacos em homens ≥65 anos e de 14% nos <65 anos. 742
4.18.2. Déficit Funcional Aeróbico (FAI)
O déficit funcional aeróbico (do inglês, functional aerobic impairment [FAI]) é a diferença percentual entre o VO 2 max atingido (estimado ou medido) e o VO 2 previsto (para idade, sexo e grau de atividade) por meio de equações de regressão.
O FAI é uma medida que expressa a porcentagem de déficit, ou seja, porcentagem de comprometimento da capacidade funcional aeróbica: 743
Legenda (idade em anos):
– VO2pico: estimado pelo TE ou medido no TCPE.
– Cálculo do VO2 máximo previsto (mL/kg/min):
1) Para sedentários
• Feminino: 42,3 – (0,356 × idade)
• Masculino: 57,8 – (0,445 × idade)
2) Para ativos
• Feminino: 42,9 – (0,312 × idade)
• Masculino: 69,7 – (0,612 × idade)
Desse modo, os valores do FAI podem ser interpretados ( Tabela 34 ):
Tabela 34. – Classificação da capacidade funcional baseado no FAI 744 .
| Classificação | % do FAI |
|---|---|
| Superou o VO 2 previsto (ideal) | Valor negativo* |
| Sem comprometimento significativo | 0-26% |
| Comprometimento leve | 27-40% |
| Comprometimento moderado | 41-54% |
| Comprometimento acentuado | 55-68% |
| Comprometimento extremo | >68% |
| *Quanto maior o valor negativo, melhor a aptidão cardiorrespiratória. | |
– Porcentagem positiva >26%: quanto maior o valor do FAI, maior será o comprometimento da capacidade funcional do paciente.
– De 0% a 26%: não há comprometimento significativo, tendo o paciente atingido o previsto para idade e sexo.
– Porcentagem negativa: o paciente superou o VO 2 previsto. Essa situação é comumente observada em pessoas aparentemente saudáveis e ativas, e em especial em atletas.
Suas principais aplicabilidades são:
– Em TEs seriados, quantifica a evolução da capacidade aeróbica (piora ou melhora).
– Em atletas, para quantificar a progressão de melhoria da capacidade funcional.
– Estimar a aptidão cardiorrespiratória em relação à idade. O FAI com valor positivo representa que o paciente tem uma capacidade aquém da esperada para a sua idade, e vice-versa. 745
– Parâmetro objetivo da evolução da aptidão cardiorrespiratória de pacientes em programas de treinamento físico e reabilitação. 29 , 746 , 747
4.18.3. Déficit Aeróbio Miocárdico (MAI)
O déficit aeróbio miocárdico (do inglês, myocardial aerobic impairment [MAI]) também chamado de déficit ventricular esquerdo (do inglês, left ventricular impairment [LVI]) é uma medida que expressa a porcentagem de comprometimento da capacidade miocárdica, do ventrículo esquerdo, em responder às demandas de uma atividade física baseando-se nas respostas da FC e da PAS. A fórmula de cálculo do MAI é: 748
Legenda:
– DP (duplo-produto) máximo atingido = FCpico × PAS máxima.
– DP máximo previsto em sedentários:
• Feminino: [354 – (0,48 × idade)] × 100
• Masculino: [438 – (1,59 × idade)] × 100
– DP previsto para homens ativos:
DP máximo previsto = [364 – (0,58 × idade)] × 100
Observação: idade em anos. A interpretação do MAI é prejudicada quando ocorrer queda da FC intraesforço e/ou hipotensão/queda da PAS intraesforço (vide Tabelas 31 e 32).
Particularidades do MAI:
– Utilizado em TE seriados para acompanhamento evolutivo após intervenções em pacientes com DAC e valvopatia. 749 , 750
– Coorte de 104 pacientes submetidos a ATCP e 38 com CRVM bem-sucedidas, submetidos ao TE (pré e pós-intervenção; acompanhamento de 2 anos), demonstrou que o MAI melhorou significativamente em ambos os grupos (ATCP de 20,2±17,8% para 9,9±15,8%; CRVM de 31,9±21,7% para 9,9±19,3%). 751
4.19. Escores de Risco Pós-teste e Variáveis Prognósticas do TE
A aplicação de escores pós-teste reduz vícios de interpretação, melhora a acurácia diagnóstica, permite a estimativa prognóstica, fornece estratégias custo-efetivas de manejo de DCV e auxilia médicos não especialistas na interpretação dos resultados. 752 - 755
Escores são desenvolvidos, validados e aplicados em populações específicas. A escolha, cuja justificativa sugere-se constar no relatório do exame, deve ser feita de acordo com as características de cada paciente.
4.19.1. Escore de Duke
O escore de Duke (ED) é um dos escores mais utilizados para avaliação diagnóstica de DAC grave e probabilidade de morbimortalidade. 756 , 757 Está indicado em pacientes sintomáticos, de ambos os sexos, com suspeita de DAC e idade entre 45 e 75 anos. 758 , 759 A aplicação do ED apresenta limitações significativas em assintomáticos, pacientes de baixo risco pré-teste, pós CRVM e após IAM recente. 760 , 761
O ED incorpora apenas 3 variáveis do TE para o seu cálculo: a magnitude do desnível do segmento ST, o tempo de tolerância e a ocorrência de angina ao esforço. A equação de cálculo é: 762
Legenda:
1) Tempo de esforço: minutos de esforço no protocolo de Bruce. Quando utilizado outro protocolo, realizar a conversão dos METs atingidos para o correspondente no protocolo de Bruce para determinar o tempo em minutos.
2) Desnível ST: considerar a depressão ou elevação do segmento ST, medida em milímetros.
3) Angina: valor igual a zero, se ausência de angina; 1 ponto, se ocorreu angina durante o esforço; 2 pontos, se a angina tiver sido limitante.
A pontuação final do ED varia de ≥+15 pontos a ≤-25 pontos, permitindo classificar o risco:
– Alto: escore ≤-11 pontos, indica sobrevida em 5 anos de ≈67% e mortalidade anual ≥5%.
– Intermediário: varia de -10 a +4 pontos, indica uma sobrevida em 5 anos de ≈90%.
– Baixo: ≥+5 pontos, indica uma sobrevida em 5 anos de ≈97% e mortalidade anual ≤1%. 756 , 757
Particularidades do ED:
– No estudo original de elaboração do ED, realizado em homens, 74% classificados como de alto risco tinham DAC oclusiva triarterial ou lesão de tronco de coronária esquerda à cineangiocoronariografia. 762
– Estudo em 976 mulheres e 2.249 homens submetidos ao TE e cineangiocoronariografia demonstrou que mulheres e homens diferiram quanto ao ED (1,6 vs . -0,3; p<0,0001), prevalência de DAC (32% vs. 72%; p<0,001) e mortalidade em 2 anos (1,9% vs . 4,9%; p<0,0001). O ED teve desempenho melhor para excluir DAC em mulheres, principalmente quando classificadas como de baixo risco. 763
– Em estudo prospectivo com 603 pacientes (seguimento por 2 anos), os pacientes com CPM normal e ED de risco baixo a intermediário tiveram menos IAM não fatal, enquanto os de alto risco apresentaram alto risco de IAM e morte CV. 764
– 6.251 pacientes do estudo GISSI-2, realizaram TE 1 mês após IAM e foram estratificados pelo ED. Em acompanhamento por 6 meses, as taxas de mortalidade nos grupos de risco do ED foram: baixo risco = 0,6%; risco intermediário = 1,8% (RR: 2,50; IC 95%:1,47-12,59; p=0,0001); alto risco = 3,4% (RR: 5,13; IC 95%: 3,61-15,55; p=0,0001). 765
4.19.2. Escore de Athenas/Escore QRS
O Escore de Athenas (EAthenas) é um escore pós-teste para avaliação diagnóstica de DAC multiarterial e que pode ser utilizado em ambos os sexos. Não deve ser aplicado nos portadores de bloqueios de ramo (direito ou esquerdo), na sobrecarga ventricular esquerda, na pré-excitação ventricular e no bigeminismo ventricular. 766 - 768
As alterações na amplitude das ondas Q, R e S induzidas pelo esforço são úteis para o diagnóstico de DAC. 769 Em 1990, essas alterações foram reunidas em um escore denominado “Athenas QRS score”, atualmente também denominado Escore QRS (EQRS). 770
É calculado por meio da média da amplitude das ondas Q, R e S em três complexos QRS consecutivos, nas derivações aVF e V5 no repouso e imediatamente após o esforço. Os complexos QS devem ser tratados como onda Q ou onda S. O Escore QRS é calculado pela fórmula: 767 , 769 , 770
Escore QRS (em milímetros) = (ΔR – ΔQ – ΔS)aVF + (ΔR – ΔQ – ΔS)V5
ΔR = média de R em repouso – média de R no pico do esforço
ΔQ = média de Q em repouso – média de Q no pico do esforço
ΔS = média de S em repouso – média de S no pico do esforço
O valor considerado normal do EQRS, em pacientes sem DAC, é >+5 mm.
No TE, o EQRS é considerado anormal quando:
– O valor do EQRS ≤+5 mm prevê a existência DAC obstrutiva, independentemente de alterações do segmento ST, com sensibilidade variando de 75% a 86% e especificidade de 73% a 79%. Os valores do EQRS estão relacionados com a gravidade da DAC; quanto menor for o escore, maior é a probabilidade de estenose coronariana multiarterial significativa. 770 , 771
– Em mulheres EQRS <+5 mm associado a resposta eletrocardiográfica isquêmica aumentou a sensibilidade de 59% para 80%, a especificidade de 40% para 94%, a acurácia de 50% para 87% e reduziu os falsos-positivos de 60% para 6%. 772
– EQRS <+5 mm tem maior capacidade diagnóstica de reestenose quando comparado ao ISTs em pacientes 6 meses após ATCP em vaso único (sensibilidade = 80%, especificidade = 89% e VPP = 77%) e de isquemia após 1 ano de CRVM (sensibilidade = 75%, especificidade = 86% e VPP = 62%). 766 , 773
– EQRS ≤-3 mm prevê estenose coronariana multiarterial após 1 mês de IAM. 774
– EQRS <-4 mm em pacientes com DAC foi preditor independente de mortalidade cardíaca (RR: 11,7; IC 95%: 2,5-55,4; p=0,002). 768
4.19.3. Escore de Raxwal e Morise
O escore de Raxwal e Morise é um escore pós-teste para avaliar a probabilidade de DAC em ambos os sexos, sintomáticos ou assintomáticos. Seu cálculo envolve uma somatória de pontos, conforme mostra a Tabela 35 . 775 , 776
Tabela 35. – Escore de Raxwal e Morise.
| Variáveis | Homens | Mulheres | ||
|---|---|---|---|---|
| Dados | Pontuação | Dados | Pontuação | |
| FC máxima | <100 bpm | 30 | <100 bpm | 20 |
| 100 a 129 bpm | 24 | 100 a 129 bpm | 16 | |
| 130 a 159 bpm | 18 | 130 a 159 bpm | 12 | |
| 160 a 189 bpm | 12 | 160 a 189 bpm | 08 | |
| 190 a 220 bpm | 06 | 190 a 220 bpm | 04 | |
| Infradesnível ST | 1-2 mm | 15 | 1-2 mm | 06 |
| >2 mm | 25 | >2 mm | 10 | |
| Angina intraesforço | Presente | 03 | Presente | 09 |
| Limitante | 05 | Limitante | 15 | |
| Idade | >55 anos | 20 | >65 anos | 25 |
| 40-55 anos | 12 | 50-65 anos | 15 | |
| Relato de angina pré-TE | Definida/típica | 05 | Definida/típica | 10 |
| Provável/atípica | 03 | Provável/atípica | 06 | |
| Não cardíaca | 01 | Não cardíaca | 02 | |
| Diabetes | Presente | 05 | Presente | 10 |
| Dislipidemia | Presente | 05 | Não avaliar | -- |
| Tabagismo | Não avaliar | -- | Presente | 10 |
| Estado estrogênico | Não se aplica | -- | Positivo | - 05 |
| Negativo | + 05 | |||
| Estados estrogênico: negativo = mulheres pós-menopausadas, ooforectomizadas ou sem terapia de reposição hormonal; positivo = mulheres pré-menopausa ou em terapia de reposição hormonal. | ||||
Classificação de probabilidade de DAC pelo escore de Raxwal e Morise:
– Baixa probabilidade: de 0 a 39 pontos.
– Probabilidade intermediária: entre 40 e 60 pontos.
– Alta probabilidade: >60 pontos.
Estudo com 4.640 pacientes (idade média: 50 anos, 53% homens), sem DAC conhecida e submetidos ao TE para avaliar dor torácica, demonstrou que o escore de Raxwal e Morise e o escore de Duke estratificaram adequadamente os pacientes quanto ao risco (baixo, intermediário e alto; p<0,00001). Nesse estudo, o escore de Raxwal e Morise apresentou melhor valor prognóstico para mortalidade por todas as causas. 776
5. Critérios de Interrupção do Esforço
Em termos gerais, a interrupção do esforço é baseada na sintomatologia, nos dados do exame físico, variáveis cardiovasculares, respiratórias e eletrocardiográficas, eventuais falhas na monitorização eletrocardiográfica e outras condições consideradas de risco para intercorrências graves ( Tabela 36 ).
Tabela 36. – Critérios de interrupção do esforço 6,209,210,762,777 .
| Parâmetro | Critérios |
|---|---|
| Sintomatologia | – Exaustão física (Escala de Borg ≥18) – Dor e fadiga da musculatura de membros inferiores – Claudicação de membros inferiores (limitante), ataxia – Vertigem persistente e limitante, náusea, pré-síncope, síncope – Desconforto ou dor torácica crescente com incremento das cargas do esforço (limitante), angina típica (moderada a forte intensidade) – Dispneia precoce e desproporcional à intensidade do esforço |
| Exame físico/variáveis cardiovasculares e respiratórias | – Palidez cutânea e de mucosas, sudorese profusa e desproporcional, má perfusão periférica – Taquipneia desproporcional ao esforço, broncoespasmo, estertores crepitantes em bases pulmonares; aumento de estertores crepitantes em idosos* – Surgimento de sopro cardíaco e/ou de B3 ou B4 – PAS com aumento inicial no esforço seguido por uma queda da PAS ≥20 mmHg. Caso assintomática, confirmar a queda em pelo menos mais uma mensuração – Elevação acentuada da PAS >250 mmHg – Elevação da PAD ≥120 mmHg nos normotensos; elevação da PAD ≥140 mmHg nos hipertensos – Oximetria digital normal no basal seguida de dessaturação (SpO 2 ≤92%) |
| Eletrocardiográficas | – Modificações do segmento ST: infradesnivelamento ≥0,3 mV (3,0 mm) adicionais aos valores de repouso; supradesnivelamento ≥0,2 mV (2,0 mm) em derivação sem evidência de infarto prévio – Taquiarritmia supraventricular não sustentada sintomática ou com repercussão hemodinâmica – Taquiarritmia supraventricular não sustentada, assintomática ou sem repercussão hemodinâmica: individualizar o número de batimentos e repetições, considerando a indicação do TE e doenças de base – Taquiarritmia supraventricular sustentada (≥30 segundos) – Fibrilação atrial ou flutter atrial esforço-induzidos – Taquicardia ventricular não sustentada (≥3 batimentos/<30 segundos)** ou um episódio de TVNS polimórfica – Taquicardia ventricular sustentada (≥30 segundos) – Fibrilação ventricular – BAV de 2 º e 3 º graus esforço-induzidos – Bloqueio de ramo esquerdo esforço-induzido (sintomático ou com repercussão hemodinâmica)*** – Desenvolvimento de bloqueio de ramo quando não puder distinguir de taquicardia ventricular – Portadores de CDI: interromper 10 batimentos abaixo da FC de acionamento do desfibrilador – Queda persistente da FC cardíaca com o incremento de carga |
| Outras | – A pedido do paciente, independentemente da ocorrência de anormalidades – Falência dos sistemas de monitorização e/ou registro eletrocardiográfico – Inadaptação e/ou falta de coordenação ao ergômetro |
| PAS: pressão arterial sistólica; PAD: pressão arterial diastólica; BAV: bloqueio atrioventricular; CDI: cardiodesfibrilador implantável; FC: frequência cardíaca; TVNS: taquicardia ventricular não sustentada. *Em idosos assintomáticos, é comum a presença de crepitações pulmonares no exame basal, sendo a idade o único preditor independente. **Em caso de episódio único de TVNS, individualizar o número de batimentos para a interrupção, levando em consideração a indicação do TE, patologia de base, achados clínicos durante o TE e local de realização (hospitalar ou não). ***Nos casos assintomáticos ou sem repercussão, individualizar a critério do médico executante. | |
6. Elaboração do Laudo do TE
Imediatamente após o término da recuperação, o médico executante do TE deve analisar e interpretar todos os dados pré-teste, sintomatologia, achados e alterações do exame físico, variáveis eletrocardiográficas, medições e registros realizados, intercorrências, escores e informações prognósticas pertinentes. A partir dessas informações, deve-se redigir o laudo do exame seguindo os requisitos mínimos apresentados nesta seção e composto por:
1) Descrição dos dados gerais do exame.
2) Dados observados, mensurados e registrados.
3) Relatório descritivo do TE.
4) Conclusões.
5) Registros eletrocardiográficos.
6.1. Dados Gerais
O laudo do TE deverá apresentar, inicialmente, a descrição das informações gerais inerentes ao paciente (dados gerais), sobre sua condição de saúde, indicações do exame e ergômetro/protocolo:
1) Identificação do paciente: nome, sexo, peso, altura, IMC, registro do paciente no sistema de ergometria (número ou código atribuído ao exame).
2) Condições de saúde do paciente: medicamentos em uso corrente (relatar se houve cumprimento de solicitação de suspensão de medicação feita pelo médico solicitante); fatores de risco para DCV; escore de risco pré-teste.
3) Indicação do exame e/ou CID.
4) Ergômetro, protocolo de esforço e sistema de registro do ECG (12 ou 13 derivações e posição dos eletrodos). Nos protocolos escalonados, sugere-se detalhar todas as variáveis adotadas: duração (mínima, média e máxima); carga (inicial e final) e/ou a velocidade (inicial e final) e inclinação (inicial e final).
5) Observações adicionais facultativas consideradas relevantes, tais como resultados de exames prévios, modelo de marca-passo/CDI etc.
6.2. Dados Observados, Mensurados e Registrados
Após a seção de dados gerais, o laudo deve apresentar os dados de todas as fases do TE (repouso, esforço e recuperação):
1) Tabelas contendo as informações de medições da PAS e PAD (com respectivas FC e sintomas associados) e registros eletrocardiográficos (com FC, METs, PA e DP do momento do registro).
2) Sugere-se utilizar gráficos para avaliação do comportamento das medições da PA (sistólica e diastólica), da FC e do segmento ST.
3) Tabela contendo informações sobre sintomas apresentados e os momentos de início e de melhora (se possível, com a respectivas PA, FC e DP).
4) Dados obtidos sobre: FC de repouso; FC máxima prevista; FC máxima atingida ou pico; FAI; duplo-produto; valor (numérico ou interpretativo) da escala de percepção de esforço (Borg ou Borg Modificada); VO 2 /METs (previsto, atingindo e porcentagem); classificação funcional.
5) Sugere-se a utilização de escore de risco pós-teste com respectiva legenda de interpretação do resultado obtido.
6) Apresentar outras medições, dados, tabelas e gráficos julgados pertinentes: comportamento de variáveis eletrocardiográficas, tais como QTi, QTc, escore de QRS etc.; escala utilizada para a quantificação de angina, dispneia e claudicação intermitente; comportamento de marca-passo e/ou CDI.
7) Exames adicionais ao TE passíveis de agregar valor diagnóstico e prognóstico: oximetria; índice tornozelo-braquial; medições de dosagens sanguíneas.
6.3. Relatório Descritivo
Deve ser elaborado relatório descritivo, ordenado e interpretativo, apresentando resumidamente o comportamento dos dados e variáveis obtidos no TE em todas as suas fases. As informações necessárias para a adequada descrição e interpretação do TE constam nesta diretriz.
O relatório descritivo deve conter:
1) Dados relevantes da avaliação pré-teste do paciente referentes à anamnese dirigida e exame físico (sumário e específico).
2) Comentário breve sobre a adaptação do paciente ao ergômetro e protocolo.
3) Momento e motivo(s) da interrupção do esforço.
4) Descrição sumária das respostas clínicas (sintomas, sinais clínicos, exame físico, tolerância ao esforço) e suas possíveis interpretações. Caso ocorra evento adverso, realizar relato detalhado.
5) Descrição das respostas hemodinâmicas (comportamento da FC, PA, DP e outros parâmetros julgados pertinentes) e interpretação dos resultados.
6) Descrição das respostas eletrocardiográficas. Quando anormais, incluir as respectivas interpretações:
– Ondas e intervalos: onda P, PRi, onda Q, onda R, onda S, complexo QRS, onda T, onda U, QTi, QTc.
– Segmento ST: infradesnivelamento, supradesnivelamento, pseudonormalização ou ausência de mudanças. Descrever quando iniciou, maior magnitude atingida, se há sintomas associados, momento de normalização e se preencheu critérios de isquemia.
– Condução atrioventricular normal ou distúrbio da condução AV (preexistente ou esforço-induzido).
– Condução intraventricular ou distúrbios da condução IV (preexistentes ou esforço-induzidos).
– Arritmias: momento de ocorrência, sintomas associados, repercussão hemodinâmica, comportamento (mudanças na densidade e complexidade em todas as etapas) e eventual momento de desparecimento.
7) Descrição interpretativa da avaliação metabólica indireta: VO 2 /METs, FAI, classificação funcional etc.
8) Comentários pertinentes sobre dados dos escores de risco pré-teste. Caso utilizado o escore de risco pós-teste (facultativo) e variáveis prognósticas do TE (caso aplicável), também apresentar os comentários pertinentes.
9) Particularidades dos resultados obtidos quanto às seguintes condições:
– Clínica específica do paciente (doenças preexistentes, limitações físicas e psicológicas).
– Efeito e interferência de medicações em uso.
– Limitações/interferências na interpretação das variáveis do TE.
No relatório do TE, não é recomendada a liberação de prescrição de exercícios, baseada no desempenho físico atingido. A prescrição de exercícios é de responsabilidade do médico assistente.
Sugere-se:
– Inclusão de um glossário de termos e abreviaturas encontrados no laudo do TE, de modo a permitir a correta compreensão.
– Quando pertinente, interpretação e comparação com TE realizados anteriormente.
– Utilização de sistema de ergometria que facilite a elaboração do relatório descritivo: apresentar ordenadamente todas as possíveis informações a serem relatadas; utilizar frases pré-programadas visando à padronização dos laudos; permitir edição e descrições individualizadas.
– Incorporar relatório complementar de exames adicionais realizados no momento do TE (p. ex., medidas bioquímicas laboratoriais).
6.4. Conclusão
A conclusão deve apresentar, de maneira concisa e clara, informações relacionadas à indicação do exame e eventuais parâmetros anormais relevantes ao diagnóstico e prognóstico do paciente:
1) Comportamento clínico.
2) Resposta pressórica, baseada nos conceitos da Tabela 32 .
3) Comportamento cronotrópico, baseado nos conceitos da Tabela 31 .
4) Arritmias.
5) Resposta eletrocardiográfica incluindo a repolarização ventricular.
6) Classificação funcional.
7) Referir eventuais limitações/interferências na interpretação das variáveis do TE.
Não são recomendadas a utilização das expressões: “teste positivo”, “teste negativo” ou “teste inconclusivo”. Essas expressões são vagas, geralmente restritas a uma única variável (segmento ST), desprezando a interpretação dos múltiplos parâmetros/variáveis necessários para adequados diagnóstico e prognóstico proporcionados pelo TE.
6.5. Registros Eletrocardiográficos
O laudo do TE necessita conter registros que demonstrem a evolução eletrocardiográfica de todas as fases (repouso, esforço e recuperação) e representem as informações pertinentes do relatório descritivo. Sugere-se que os registros sejam realizados em 12 ou 13 derivações e que se faça registro de ritmo contínuo (geralmente DII) para documentação de arritmias. Cada registro de ECG deverá conter a etapa do TE, a velocidade e a amplitude do traçado, a FC e, caso disponível, a PA medida.
É facultativo o registro de complexos médios calculados automaticamente. Evitar quando em presença de artefatos, grande oscilação da linha de base e de arritmias ventriculares por causarem interferência no cálculo.
Sugere-se incorporar tabela com os valores automáticos das medições das ondas, intervalos e segmentos do ECG, desde que relevantes e coerentes com o diagnóstico do TE.
7. Exames Realizados Simultaneamente e Adicionalmente ao TE
7.1. Índice Tornozelo-braquial
O índice tornozelo-braquial (ITB) é um exame não invasivo, de diagnóstico e acompanhamento da doença arterial periférica (DAP) dos membros inferiores. É um forte marcador de aterosclerose, comprometimento funcional, risco cardiovascular e de mortalidade. 778 , 779 Pode identificar pacientes sob risco de complicações nas extremidades dos membros inferiores, passíveis de abordagem preventiva otimizada. 780
O ITB pode ser realizado:
– Em repouso, durante avaliação clínica especializada. É recomendado em pacientes com suspeita clínica ou exame físico sugestivo de DAP (Recomendação I; Nível de evidência B): dor em membros inferiores aos esforços; claudicação intermitente; abolição do pulso e/ou sopro arterial nos membros inferiores; feridas nos membros inferiores que não cicatrizam. É recomendado em pacientes em risco de DAP: DAC ou obstrução arterial aterosclerótica em outras partes do corpo (p. ex., carótidas; subclávia); doença renal crônica; IC; homens e mulheres assintomáticos >65 anos ou <65 anos com alto risco para DCV e também se >50 anos com história familiar de DAP. 780 - 785
– Pós-esforço, associado adicionalmente ao TE em esteira ergométrica (ITB pós-esforço), é útil para estabelecer o diagnóstico de DAP nos pacientes sintomáticos quando o ITB em repouso é normal ou limítrofe. Permite quantificar objetivamente as limitações funcionais atribuíveis aos sintomas, bem como realizar estratificação aprimorada de risco. As indicações encontram-se na Tabela 37 . 780 , 781 , 786 - 788
Tabela 37. – Indicações de realização de ITB pós-esforço associado ao TE em esteira ergométrica .
| Indicação | GR | NE |
|---|---|---|
| Pacientes com sintomas esforço-induzidos em membros inferiores* e ITB em repouso normal ou limítrofe (>0,90 e ≤1,40) para diagnóstico e estratificação de risco 781,788-791 | I | B |
| Pacientes com DAP e ITB em repouso anormal (≤0,90) para avaliação do estado funcional e estratificação prognóstica 781,787,792,793 | IIa | B |
| Pacientes diabéticos assintomáticos com ITB em repouso anormal (≤0,90) para avaliação do estado funcional e estratificação prognóstica 785 | IIb | B |
| Em associação com a medida da pressão transcutânea de oxigênio no esforço para investigação de estenoses arteriais de membros inferiores 794,795 | IIb | B |
| GR: grau de recomendação; NE: nível de evidência. *Sintomas não relacionados às articulações. | ||
7.1.1. Realização do Exame ITB
O exame ITB associado ao TE compreende duas fases: em repouso e pós-esforço em esteira ergométrica.
7.1.1.1. ITB de Repouso
O ITB de repouso é medido com o paciente em decúbito dorsal com a cabeça e calcanhares apoiados, em ambiente com temperatura confortável (19-22°C) após um descanso de 5 a 10 minutos. São realizadas medições da pressão arterial sistólica nos quatro membros utilizando ultrassom Doppler de onda contínua (5-10 MHz): 780 , 781 , 791
– Utilizar manguito adequado para a circunferência e largura dos membros (deve contornar pelo menos 40% da circunferência).
– O manguito deve ser colocado logo acima do tornozelo (evitando áreas com feridas), com sua borda inferior situada 2 cm acima do ponto superior do maléolo medial.
– Gel ecocardiográfico deve ser aplicado sobre o transdutor do Doppler, colocando-o na área do pulso, em ângulo de 45° a 60°. Mover o transdutor até localizar o som mais claro do fluxo arterial. O manguito deve ser inflado progressivamente até 20 mmHg acima do nível de desaparecimento do som. Desinflar lentamente para detectação do reaparecimento do som com registro da PAS correspondente.
– Medir e registrar a PAS nas artérias braquiais de ambos os braços e nas artérias tibial posterior e anterior de ambos os tornozelos (ou pediosa dorsal do mesmo membro que o pulso estiver ausente em uma das tibiais). 796
– Para o cálculo do ITB, utilizar a pressão mais alta encontrada nas medições das artérias de cada perna.
O ITB de cada perna é calculado dividindo a PAS mais alta do tornozelo pela PAS do braço do mesmo lado. 780 Os valores do ITB devem ser registrados com 2 casas decimais. 781
ITB: índice tornozelo-braquial; PAS: pressão arterial sistólica medida com ultrassom Doppler. Numerador: maior pressão arterial sistólica medida em uma das artérias (tibial posterior e anterior; ou pediosa dorsal do mesmo membro que o pulso estiver ausente em uma das tibiais). Denominador: maior pressão braquial medida nos dois membros superiores.
Observação: registrar qual artéria do tornozelo apresentou a maior PAS, pois a medição para cálculo do ITB pós-esforço deverá ser feita na mesma artéria.
Os aparelhos automáticos de medição de pressão arterial não são, na maioria das vezes, válidos para medição da PAS do tornozelo e geralmente superestimam os valores da pressão quando baixa.
O resultado do ITB de repouso deverá ser interpretado de acordo com a finalidade do exame:
– Para diagnóstico de DAP, interprete cada perna separadamente (um ITB de repouso por perna).
– Na estratificação de risco CV, considerar o ITB mais baixo obtido nas duas pernas.
O ITB de repouso é considerado: 780 , 781
– Anormal (baixo): ≤0,90. Em sintomáticos, é critério diagnóstico de DAP com estenose >50%, associada ao risco aumentado de eventos coronarianos, mortalidade CV e mortalidade por total em 10 anos. 781 , 797
– Limítrofe baixo: 0,91-0,99. Não consegue descartar DAP. Se houver sintomas suspeitos de isquemia esforço-induzida de membros inferiores, recomenda-se a realização do ITB pós-esforço. 791
– Normal: 1,00-1,40.
– Alto: >1,40. Representa enrijecimento arterial (calcificação média-intimal) impossibilitando a compressão das artérias. É mais prevalente em idosos (principalmente nos diabéticos ou com DRC), apresenta menor sensibilidade para o diagnóstico de DAP, mas está associado a maior risco de eventos CV e mortalidade. 778
O ITB de repouso apresenta desempenho razoavelmente bom para diagnosticar DAP com sensibilidade de 61% a 73% e especificidade de 83% a 96%. 790 , 798 A sensibilidade é menor em pacientes com diabetes e/ou doença renal crônica (DRC) em estágio avançado devido à frequente ocorrência de calcificação arterial. 785 , 791
7.1.1.2. ITB Pós-esforço
Em pacientes saudáveis, a realização de esforço em esteira ergométrica acarreta aumento progressivo da PAS na circulação central e membros superiores. Entretanto, devido à vasodilatação fisiológica na musculatura dos membros inferiores, ocorre diminuição da PAS ao nível do tornozelo e, consequentemente, leve diminuição do ITB pós-esforço, em média 5% do valor do ITB de repouso. Em pacientes com DAP, ocorre diminuição >20%. 791 , 799
Em 1 a 2 minutos de recuperação, a PAS dos membros inferiores aumenta rapidamente, retornando aos valores pré-esforço. Retorno a pelo menos 90% do valor do ITB de repouso nos primeiros 3 minutos da recuperação descarta DAP (especificidade de 94%). 791 , 799
Na DAP oclusiva (tipicamente dos vasos proximais), a pressão do tornozelo diminui mais acentuadamente com o esforço, e o tempo para retorno ao valor de repouso é prolongado, sendo proporcional à gravidade da DAP. 791
7.1.2. Preparação do Paciente e Técnica de Exame
Adicionalmente às orientações feitas ao paciente para o TE, recomenda-se que:
1) Use roupas que permitam a fácil exposição dos braços e pernas, aplicação dos manguitos necessários e medição da PA.
2) Não utilizar calção/bermuda com pernas apertadas e de tecidos com compressão (bermuda com elastano; bermuda fitness ; bermuda training ; short de corrida run dry etc.).
É feita uma medição basal da PAS nos braços e tornozelos em repouso.
1) O exame deverá ser feito em esteira ergométrica.
2) Protocolo de esforço sem incremento (carga fixa), mantendo caminhada em velocidade de 3,2 km/h (2 mph), com inclinação de 10% a 12,5%, com duração máxima de 5 minutos (para não prejudicar a avaliação do tempo de recuperação do ITB). 801 Para paciente com limitação importante, ajustar a velocidade e/ou inclinação (valores menores).
3) O esforço pode ser interrompido antes caso haja dor em membro inferior e/ou claudicação absoluta (impeditiva).
4) Não realizar recuperação ativa.
5) Todos os parâmetros clínicos, hemodinâmicos, eletrocardiográficos, aptidão cardiorrespiratória e escores deverão ser avaliados conforme preconizado nesta diretriz.
6) Registrar todos os sintomas ocorridos. Sugere-se utilizar escala de percepção subjetiva de esforço (Borg ou Borg modificada) e escala de claudicação intermitente.
7) Após a interrupção do esforço, realizar recuperação passiva com o paciente em decúbito dorsal. A PAS deve ser imediatamente medida nos 2 braços e 2 tornozelos (nas artérias que apresentavam a maior PAS medida para o cálculo do ITB em repouso). Repetir as medições da PAS e cálculo do ITB bilateralmente (por pelo menos 3 vezes) e/ou até o retorno da PAS dos membros inferiores ao valor basal. Registrar todos os valores de PAS obtidos com respectivos momentos de medição e sintomas associados. O cálculo do ITB pós-esforço é feito conforme a equação:
ITB: índice tornozelo-braquial; PAS: pressão arterial sistólica medida com ultrassom Doppler.
Observação: artéria do tornozelo com maior PAS utilizada para cálculo do ITB de repouso. Medir nos 2 tornozelos e calcular o ITB pós-esforço para os 2 membros. Denominador: maior pressão braquial medida nos dois membros superiores.
Recomenda-se o cálculo da variação percentual do ITB em cada membro (individualmente) através da equação:
Os critérios para diagnóstico de DAP ainda não foram totalmente padronizados. Recomenda-se considerar como exame alterado, compatível com diagnóstico de DAP: 780 , 781 , 791 , 799
– ITB pós-esforço <0,90 (sensibilidade 70% a 88% e acurácia de 72% para DAP) 788 , 791 , 795 , 802 ou
– Queda >20% nos valores de ITB pós-esforço em relação ao repouso em um mesmo membro (sensibilidade de 67% e estratificação de risco de mortalidade e eventos CV) 800 , 802 , 803 ou
– Queda de PAS no tornozelo >30 mmHg em relação ao padrão da PAS basal.
Uma limitação do ITB pós-esforço é a presença de ITB de repouso anormalmente alto devido à artéria do tornozelo incompressível (com PAS >250 mmHg) impossibilitando a adequada detecção da doença pelo ITB pós-esforço.
Particularidades do ITB pós-esforço:
– Estudo demonstrou que, em indivíduos com ITB de repouso normal, a adição do ITB pós-esforço identificou 25% a mais de lesões com estenoses significativas (>75%). 802
– Estudo em 619 pacientes (idade média 64,2 anos; 64% homens) com suspeita de DAP e ITB de repouso normal e pós-esforço <0,90 apresentou sensibilidade de 81,7%, especificidade de 94,7%, VPP de 84,8% e VPN de 94,4%. A variação percentual do ITB >20% mostrou 70,4% sensibilidade, 83,4% especificidade, 47,2% VPP e 93% de VPN. 787
7.2. Oximetria Não Invasiva
A oximetria não invasiva (oximetria de pulso) é um exame que visa monitorar continuamente a oxigenação tecidual. Contribui na detecção de hipóxia e de instabilidade hemodinâmica, tanto no repouso quanto no esforço, as quais poderiam passar despercebidas por avaliação clínica isolada. A oximetria não invasiva é um procedimento médico previsto na Classificação Brasileira Hierarquizada de Procedimentos Médicos (Código: 4.14.01.51-4). 804
O oxímetro de pulso convencional monitora de forma contínua, indireta e transcutânea a saturação de oxigênio da hemoglobina no sangue arterial (SpO 2 ) baseando-se na metodologia espectrofotométrica. A determinação da SpO 2 tem como base a média de uma série de medições comparadas a uma curva de calibração interna do equipamento (medições SpO 2 <70% não são confiáveis). 805 , 806
O oxímetro de pulso em vários comprimentos de onda permite medir o monóxido de carbono (CO) ligado à hemoglobina (CO-oximetria), determinar a carboxi-hemoglobina (CO 2 Hb) e a meta-hemoglobina (MetHb), definindo melhor a eventual causa de hipóxia/hipoxemia. 807
O oxímetro também registra a forma de onda associada (onda pletismográfica), correspondendo aos sinais pulsáteis associados aos batimentos cardíacos. A onda pletismográfica é importante na avaliação da qualidade do sinal e interpretação dos dados de saturação ( Figura 16 ): 808
Figura 16. –Comportamento da onda pletismográfica normal (A), na baixa perfusão (B) e na presença de artefatos (movimentação e ruído [C e D]).
– Quando normal, a onda apresenta entalhe dicrótico evidente, associado ao batimento cardíaco.
– Durante baixa perfusão, a onda apresenta-se na forma senoidal típica com baixa amplitude e sem entalhe (mas mantendo associação aos batimentos).
– A presença de arritmias pode tornar a ocorrência das ondas irregulares e, no caso de EVs, a onda pode apresentar-se com amplitude diminuída.
– A presença de artefatos (de ruído ou movimentação) é percebida como uma onda de forma irregular, com múltiplos entalhes e sem uma relação com os batimentos.
A onda pletismográfica tem semelhança com o traçado da pressão arterial invasiva, mas não é um análogo direto da pressão arterial ou do débito cardíaco.
A oximetria de pulso associado ao TE (OxPTE) deve ser realizada durante todas as fases do TE (repouso, esforço e recuperação), assim como já é feito no TCPE. Pode ser realizada tanto na população pediátrica quanto em adultos.
A OxPTE é um exame complementar que aumenta a segurança do TE e permite avaliação mais precisa de sintomas de dispneia e fadiga em populações específicas. A indicação de realização da OxPTE associada ao TE não modifica as suas indicações e graus de recomendação. 809
Como indicações gerais da OxPTE, temos: pacientes com queixa de dispneia aos esforços; doenças pulmonares; cardiomiopatias; CC; IC; valvopatias; pós-COVID. 228 , 810 As principais indicações específicas encontram-se na Tabela 38 .
Tabela 38. – Indicações de realização de oximetria de pulso associada ao TE 219,811 .
| Indicação | GR | NE |
|---|---|---|
| Crianças e adolescentes com cardiopatia congênita (corrigida e não corrigida), cardiomiopatias, insuficiência cardíaca, valvopatias 812,813 | I | B |
| Pacientes pediátricos e adultos em investigação de queixa ou diagnóstico diferencial de dispneia* | IIa | B |
| Pacientes adultos com valvopatia ou cardiomiopatia assintomática | IIb | B |
| Pacientes pediátricos e adultos após infecção respiratória com potencial capacidade de comprometimento da função pulmonar (p. ex., pós-COVID) 228 | IIb | B |
| Pacientes pediátricos e adultos após cirurgia cardíaca (p. ex., troca valvar, revascularização miocárdica) | IIb | B |
| Pacientes adultos com insuficiência cardíaca ou cardiopatia congênita 814 | IIb | B |
| GR: grau de recomendação; NE: nível de evidência.*Nos quais o TCPE não tenha indicação formal de realização ou quando o TCPE não estiver disponível. | ||
7.2.1. Equipamentos
Recomendamos a utilização de oxímetro de pulso com medida de absorção de luz em vários comprimentos de onda, determinação da saturação de O 2 e CO-oximetria, registro da FR e de ondas pletismográficas. Preferir equipamento que tenha calibração/validação para medições durante esforço físico. O oxímetro poderá ser de mesa ou integrado ao computador/sistema do TE. Deverá, preferencialmente, utilizar software de comunicação com o computador, permitindo exportar os dados necessários à elaboração de relatório. 804
Os sensores do oxímetro devem ser de tamanho adequado ao paciente (modelo pediátrico e adulto), com diferentes formas de fixação (p. ex., de dedo; lóbulo da orelha). O cabo do sensor deve ser flexível, de tamanho adequado para movimentação do paciente e com capacidade para suportar tensões. 814 Recomenda-se acompanhar durante o TE (pelo computador ou visor do oxímetro) o comportamento da SpO 2 , FR e ondas plestimográficas. Não se recomenda a utilização de oxímetro de dedo portátil (utilizado em consultas clínicas).
7.2.2. Procedimentos da Oximetria Não Invasiva 804
– Explicar e orientar o paciente sobre todo o procedimento necessário à realização da oximetria.
– Certificar-se de que a área onde será feita a aferição esteja limpa.
– Quando for utilizado sensor de lóbulo da orelha, é necessário remover todas as joias da orelha que possam interferir no encaixe adequado do sensor.
– No caso de sensor de dedo (preferencialmente no dedo indicador), é necessário remover o esmalte das unhas e joias da mão. Não colocar o sensor no membro em que for monitorizar a PA.
– Certificar-se de que o sensor está adequadamente adaptado (sem estar muito solto ou muito apertado).
– Ligar o oxímetro e aguardar o tempo de autocalibração para aferição.
– Aguardar que o oxímetro detecte o pulso, a FR e calcule a saturação de oxigênio. Caso ocorram artefatos e inconstância no sinal, reposicionar o sensor e/ou trocar para outro local do corpo (p. ex., do dedo para o lóbulo da orelha).
Durante a realização do esforço do TE: 815
– Quando for utilizado o sensor de dedo, desencorajar o paciente de segurar firmemente o guidão/barra do ergômetro para evitar ruídos.
– Caso ocorra registro de artefatos frequentes (ruído e/ou movimento), ajustar o sensor e, se necessário, reposicioná-lo.
– Em valores muito alterados em medições sequenciais (sem artefatos como causa), avaliar a presença de sintomas, FR e achados de ausculta pulmonar, de modo a confirmar os achados. 816
7.2.3. Interpretação dos Dados
A FR deverá ser interpretada de acordo com a faixa etária do paciente e carga de esforço desenvolvida. As ondas pletismográficas deverão ser interpretadas durante a realização da monitorização, conforme descrito anteriormente nesta seção.
Quanto à avaliação da SpO 2 basal (em repouso), em ar ambiente, considerar: ≥97% – função pulmonar normal; 96-91% – função pulmonar anormal (leve a moderada); ≤90% – hipoxemia/hipóxia.
Valores de SpO 2 basal <94% são geralmente encontrados em pacientes tabagistas, com doenças pulmonares crônicas, com CC e IC. No caso de hipóxia, verificar a pertinência da suspensão do TE, de acordo com sintomatologia do paciente e quadro clínico. 219
Em adultos, assintomáticos, aparentemente saudáveis, espera-se uma oscilação entre 1% e 4% na saturação de oxigênio durante o esforço. Na recuperação, espera-se desaparecimento dessa oscilação nos primeiros minutos.
Queda de ≥5% de SpO 2 foi associada às variáveis de repouso (homens, idosos, tabagistas), além de menor FC máxima e VO 2 . 816
Tanto nos pacientes pediátricos quanto adultos, hipotensão grave, baixo débito cardíaco, vasoconstrição e hipotermia reduzem o volume pulsátil de sangue nas extremidades do corpo, causando queda da saturação. 817 - 819
Na população pediátrica é considerado critério de interrupção do esforço uma queda progressiva da saturação de oxigênio (<90%) ou queda de 10 pontos na saturação de repouso, associada a sintomas. 820
Existem situações/condições em que a oximetria de pulso pode apresentar medições não confiáveis ( Tabela 39 ). 817
Tabela 39. – Causas e mecanismos de medições de SpO 2 não confiáveis 817-819 .
| 1. Causas de oscilações intermitentes ou incapacidade de medição da SpO 2 |
|---|
| • Má perfusão periférica (p. ex., hipovolemia, vasoconstrição etc.) |
| • Tremores (doença de Parkinson) e edema |
| 2. Causas de SpO 2 falsamente normal ou elevada |
| • Envenenamento por monóxido de carbono |
| • Crises vaso-oclusivas de anemia falciforme |
| 3. Causas de SpO 2 falsamente baixa |
| • Pulsações venosas (fístula arteriovenosa) |
| • Movimento excessivo |
| • Formas hereditárias de hemoglobina anormal |
| • Anemia grave (com hipoxemia concomitante) |
| • Esmalte |
| 4. Causas de SpO 2 falsamente baixa ou alta |
| • Metemoglobinemia |
| • Sulfemoglobinemia |
| • Sepse e choque séptico |
| 5. Causas de CO 2 Hb falsamente baixo, conforme medido na CO-oximetria |
| • Hiperbilirrubinemia grave |
| • Hemoglobina fetal (HbF) |
7.3. Biomarcadores e Exames Laboratoriais
A realização de exames laboratoriais e dosagem de biomarcadores adicionalmente ao TE/TCPE apresenta indicações específicas e, quando concomitantes, recomenda-se que sejam feitos em nível hospitalar. A dosagem do lactato sanguíneo e gasometria arterial são os exames mais frequentemente realizados.
Em pacientes com suspeita de DAC estável, a troponina T cardíaca ultrassensível (TroTUS) tem demonstrado utilidade clínica por seu valor preditivo isolado, bem como quando realizada complementarmente ao TE para diagnóstico de DAC. 821 - 824 Uma TropTUS em repouso >6,0 ng/L foi preditiva para DAC (RR: 2,55; IC 95%: 1,40-4,65; p=0,002) e, quando elevada durante o TE, aumentou a acurácia para 0,71, sendo marcador de risco para eventos cardíacos maiores. 822 , 825
A Figura 17 apresenta outros biomarcadores que vêm sendo estudados nesta última década. Observa-se aumento contínuo das evidências científicas sobre a utilidade, a reprodutibilidade e a aplicabilidade dos biomarcadores, com perspectiva de serem incorporados à prática clínica. 821 , 826 - 830
Figura 17. – Biomarcadores estudados na perspectiva de serem adicionados ao TE/TCPE. S.: sistema; SN: sistema nervoso; ANP: peptídio natriurético atrial; BNP: peptídio natriurético tipo B; NT-proBNP: peptídio natriurético tipo B – fragmento N-terminal inativo; GDF-15: fator-15 de diferenciação e crescimento; SST2: proteína receptora da interleucina-1; TrUS: troponina ultrassensível; CK-Mb: creatinoquinase fração MB; STRAIL: ligante indutor de apoptose relacionado ao fator de necrose tumoral; ADM: adrenomedulina; MR-pro-ADM: pró-adrenomedulina midregional; LDL oxidada: lipoproteína de baixa densidade oxidada; proET-1: peptídos precursores da endotelina 1; NGAL: lipocalina associada com gelatinase de neutrófilos humanos; NAG: N-acetil-Β-D-glucosaminidase; FGF-23: fator de crescimento de fibroblastos 23; CRP: proteína C-reativa; TNF-α: fator de necrose tumoral α; Lp-PLA2: fosfolipase A2 associada à lipoproteína (fator ativador de plaquetas); APO-1: apolipoproteína A-1; TIMP-1: inibidor tecidual de metaloproteinase 1; MMP: metaloproteinase; IL-6: interleucina-6.
Os exames laboratoriais podem ser feitos:
– Fora do TE, podendo ser associados a exames laboratoriais de triagem/rotina.
– No pré-teste, para avaliação do estado basal do paciente.
– No esforço, necessitando de acesso venoso ou arterial puncionado no pré-teste e adequadamente preparado para coletas. Utilizado para avaliação do efeito agudo do esforço sobre o marcador estudado.
– Na recuperação, visando avaliar o efeito tardio do esforço ou retorno à condição de estado basal.
– Em 2 ou mais fases do TE (pré-teste e esforço; pré-teste e recuperação; esforço e recuperação; nas três fases).
Alguns desses biomarcadores são amplamente utilizados na prática clínica, outros ainda não apresentam evidências científicas que sustentem seu uso clínico.
7.3.1. Lactato Sanguíneo
A dosagem dos níveis séricos de lactato (NSL) é um dos melhores indicadores disponíveis para avaliar o metabolismo celular tanto em pacientes com morbidades quanto em atletas. Adicionado ao TE, os NSL podem otimizar a avaliação de doenças como: DAC, DPOC, insuficiência renal crônica e esclerose múltipla. Contribui para prescrição otimizada de exercícios, particularmente no contexto do esporte competitivo e programas de reabilitação ( Tabela 40 ). 831 , 832
Tabela 40. – Indicações de realização de dosagem de lactato e gasometria arterial adicionalmente ao TE/TCPE .
| Indicação | GR | NE |
|---|---|---|
| Dosagem de lactato | ||
| Teste seriado em atletas competitivos de atividades predominantemente aeróbicas para ajustes de intensidade de cargas de treinamento 840,841,855-857 | IIa | B |
| Liberação/prescrição de ajustes na prescrição de exercícios na reabilitação 831,832,855,858 | IIb | A |
| Investigação de síndrome de excesso de treinamento 859,860 | IIb | B |
| Avaliação do metabolismo celular em pacientes com morbidades (p. ex., DAC; DPOC; insuficiência renal crônica; esclerose múltipla) e estratificação de risco* 831,832,855,858 | IIb | B |
| Gasometria arterial | ||
| Investigação de dispneia/hipoxemia e suspeita de dessaturação 861,862 | IIb | B |
| Suspeita de incompatibilidade da relação ventilação/perfusão (p. ex., insuficiência cardíaca, DPOC)* 850,851,853,863 | IIb | B |
| Na DPOC, visando à determinação do volume de espaço morto fisiológico, hiperinsuflação dinâmica e suas inter-relações, para diagnóstico e prognóstico* 854,864 | IIb | B |
| GR: grau de recomendação; NE: nível de evidência; IC: insuficiência cardíaca; DPOC: doença pulmonar obstrutiva crônica; DAC: doença arterial coronariana. *Normalmente associado ao TCPE. | ||
Em pacientes com morbidades, apesar da complexidade das vias bioquímicas relacionadas à cinética do lactato sanguíneo, o NSL tem se mostrado melhor preditor prognóstico que as variáveis derivadas da oxigenação tecidual e o consumo de oxigênio. Nesses pacientes, parte do aumento do NSL pode estar associada à hipoxemia. 833
A concentração normal de lactato no sangue em repouso é <2 mmol/L (18 mg/dL). Pacientes submetidos a TE com carga de esforço progressiva e incremental até a exaustão voluntária apresentam NLS significativamente elevado (≈8-10 mmol/L). O esforço é considerado máximo quando o NSL em adultos for >9 mmol/L (indivíduos normais) ou >5 mmol/L (com morbidades). 834 , 835 Entretanto, é na recuperação (entre 3 e 8 minutos) que são observados os níveis mais altos de lactato (≈15-25 mmol/L). 836
Na medicina esportiva, é onde mais se tem indicado a realização da dosagem de NSL (podendo ser associada ao TCPE), para avaliação seriada do desempenho, ajustes de cargas de treinamento e determinação do limiar de lactato. Sugere-se:
– Utilizar protocolo em bicicleta ergométrica com carga inicial de 40W e incrementos de carga de 40W/4 min. 835
– Quando disponível, adotar protocolo e ergômetro buscando simular a modalidade esportiva praticada, inclusive por permitir manutenção de esforço por período mais prolongado. 837 - 839
– As tabelas de referência do NSL por percentil de acordo com a intensidade de esforço alcançado e/ou modalidade esportiva praticada necessitam de validação na população brasileira.
Em atletas competitivos, pode-se realizar análises adicionais NSL, tais como: comportamento da curva de NSL, padrão de recuperação, concentração máxima de lactato em estado estável, teste de lactato mínimo, entre outros. 840 , 841
7.3.2. Gasometria Arterial
A gasometria arterial (GA), ou análise de gases no sangue arterial, é um exame complementar invasivo que tem por objetivo revelar valores de potencial de hidrogênio (pH) sanguíneo, da pressão parcial de gás carbônico (PaCO 2 ou pCO 2 ) e oxigênio (PaO 2 ), íon-bicarbonato (HCO3) e saturação da oxi-hemoglobina, avaliando principalmente o equilíbrio acidobásico orgânico.
A GA basal (em repouso) permite: avaliar a adequação de ventilação, equilíbrio acidobásico e oxigenação; avaliar a resposta do paciente à terapia e/ou avaliação diagnóstica; monitorar a gravidade e progressão de doenças cardiorrespiratórias e metabólicas. Como indicações gerais da GA associada ao TE/TCPE, temos: 842 , 843
– Avaliação mais precisa de sintomas de dispneia.
– Diagnóstico diferencial de hipoxemia.
– Doenças em que o acréscimo da GA auxiliará no diagnóstico, na segurança e na precisão da avaliação. Exemplos: doenças pulmonares em estágio avançado (DPOC e enfisema); pneumopata em associação à espirometria de repouso.
– Nos atletas de alto rendimento (principalmente masters ).
A indicação de realização da GA adicionalmente ao TE/TCPE não modifica suas indicações e graus de recomendação ( Tabela 40 ).
As coletas de amostras sanguíneas para a GA podem ser feitas por meio de: 844
– Cateter arterial (geralmente na artéria radial) em membro superior, no qual não está sendo medida a PA. A técnica de coleta segue os procedimentos padrões da coleta da GA seguida de heparinização do cateter, de modo a permitir novas coletas.
– Sangue arterializado de lobo de orelha não é recomendado, por apresentar baixa correlação com os valores de PaO 2 e PaCO 2 . 845 , 846
Critérios mínimos para considerar que a carga de esforço atingida foi máxima, baseado na gasometria: 847 , 848
– pH: <7,25.
– Excesso de base: <9 mmol/L (indivíduos normais), <5 mmol/L (com morbidades). 134 , 849
A gasometria arterial é necessária para o cálculo da relação espaço morto em relação ao volume corrente (VD/VT) corrigida pelo espaço morto mecânico durante o TCPE. Essa correção produz resultados quantitativa e qualitativamente diferentes, o que pode ter um impacto importante na interpretação da incompatibilidade V/Q. 850 - 852
Particularidades da GA adicionalmente ao TE/TCPE:
– Na IC, pode ocorrer aumento progressivo da PaCO 2 com o esforço devido à área pulmonar mal ventilada. Na IC grave, o aumento de VD/VT e PaCO 2 na ausência de hipoxemia associa-se a grande incompatibilidade da relação ventilação/perfusão. 850 , 853
– Na ICFEP, pode ocorrer incompatibilidade V/Q e piora na eficiência das trocas gasosas, refletidas por um aumento do VD/VT. 850 , 851
– Em tabagistas, a relação VD/VT elevada (com aumentos compensatórios na ventilação minuto) associa-se a maior grau de dispneia e intolerância ao esforço. 854
8. Particularidades na Realização e Interpretação do TE em Condições Clínicas Específicas
8.1. Dextrocardia/ Situs Inversus
Dextrocardia (DxC) é uma anomalia congênita na qual o coração se posiciona no lado direito do tórax e apresenta inversão de suas câmaras, similar a uma “imagem em espelho” ( situs inversus ). Sua prevalência varia de 1/6.000 a 1/35.000 nascimentos. Quando associada à inversão dos órgãos abdominais, é denominada situs inversus totalis . 865 , 866
Geralmente é assintomática, mas também pode estar associada a malformações cardíacas congênitas, sendo as principais: no situs solitus , discordância atrioventricular com a obstrução da via de saída do ventrículo direito; no situs inversus , dupla via de saída do ventrículo direito com obstrução do trato de saída. 867
DxC não deve ser confundida com dextroposição do coração, situação na qual não há inversão das câmaras cardíacas e o coração está deslocado para o hemitórax direito (devido, por exemplo, a pneumectomia ou grande derrame pleural esquerdo). Nesse caso, não há indicação de modificação da forma de monitorização eletrocardiográfica para o TE. 868
A DxC geralmente é diagnosticada na infância e o paciente costuma informá-la no pré-teste. O seu reconhecimento no exame físico (ausculta de bulhas cardíacas e ictus em hemitórax direito) e/ou alterações no ECG de repouso contribui para evitar eventuais erros diagnósticos.
Deve-se suspeitar de DxC se, no ECG de repouso, houver onda P, QRS e onda T negativas na derivação D1. Nessa situação, deve-se afastar a troca de eletrodos dos membros superiores e verificar a progressão da amplitude das ondas R nas derivações precordiais (na dextrocardia, não aumentam de V1 a V6). 869
Em pacientes sabidamente portadores de DxC, recomenda-se:
1) Documentar o ECG de repouso com os eletrodos nas posições clássicas, considerando que:
1.1) No situs inversus , observa-se: 870 , 871
– Onda P invertida em DI e AVL e uma onda P positiva em AVR devido ao nó sinusal localizado à esquerda (espelhado).
– Ativação ventricular invertida com complexo QRS e onda T negativos em DI. As derivações precordiais direitas espelham as derivações precordiais esquerdas de um coração normal.
– Ondas Q presentes nas derivações precordiais direitas devido à despolarização septal direita-esquerda pelo posicionamento em espelho do coração.
1.2) No situs solitus , observa-se: 870 , 872
– Despolarização atrial progredindo normalmente, independentemente da localização cardíaca (hemitórax direito ou esquerdo).
– Despolarização ventricular no sentido anti-horário e normalmente com ondas Q nas derivações DI, AVL e precordiais esquerdas (devido à despolarização septal apropriada).
1.3) No situs ambíguo e isomerismo à direita, as ondas P podem ter diferentes origens, pois representam a atividade de marca-passos atriais bilaterais. No entanto, o eixo da onda P ainda pode ser normal se o nó sinusal direito atuar como marca-passo dominante. Devido à ausência de um nó sinusal funcional, os pacientes com isomerismo esquerdo apresentam marca-passo atrial ectópico com onda P geralmente anormal. Com a idade, esse marca-passo ectópico sofre desaceleração progressiva da FC e a maioria dos pacientes necessita de implante de marca-passo permanente.
2) No TE, ajustar a monitorização eletrocardiográfica para cada tipo de DxC:
2.1) No situs inversus , tanto os eletrodos dos membros quanto das derivações precordiais devem ser invertidos:
– Na posição do V2 (no 4º espaço intercostal, na linha paraesternal esquerda) colocar o eletrodo V1 (V1R).
– Na posição do V1 (no 4º espaço intercostal, na linha paraesternal direita) colocar o eletrodo V2 (V2R).
– V3R: entre os eletrodos V2R e V4R.
– V4R: no 5º espaço intercostal direito, na linha hemiclavicular direita.
– V5R: no 5º espaço intercostal direito, na linha axilar anterior.
– V6R: no 5º espaço intercostal direito, na linha axilar média.
– Inversão dos eletrodos dos braços e pernas (direita para esquerda e vice-versa).
– Nos sistemas de 13 derivações, a derivação CM5 (manúbrio) é mantida no mesmo local.
– É obrigatório acrescentar no laudo a realização da inversão das posições dos eletrodos e adicionar uma letra R ou letra D (abreviação de direita) depois da denominação das derivações.
2.2) No situs solitus com DxC, os eletrodos das derivações precordiais devem ser invertidos (V1 a V6 posicionados em hemitórax direito, semelhante ao situs inversus ), enquanto os eletrodos dos membros devem permanecer inalterados.
2.3) No situs ambíguo, não se recomenda modificar a posição dos eletrodos do ECG convencional. 872
O TE realizado com os eletrodos nessas posições recomendadas permite a adequada avaliação de todas as variáveis eletrocardiográficas e suas respectivas interpretações.
A prevalência de arritmias em pacientes com DxC é significativamente maior do que na população geral (RR: 2,60; IC 95%: 1,67-4,06; p<0,001), sendo a mais comum a fibrilação atrial/flutter atrial (RR: 3,06; IC 95%: 1,02-9,18; p=0,046). 873
Atentar para a possibilidade de existência de malformações cardíacas associadas à DxC e suas eventuais interferências nas respostas hemodinâmicas, funcionais e no ECG do TE. 870 , 874 , 875
8.2. Doença de Chagas/Cardiomiopatia Chagásica
A doença de Chagas (DCh) continua sendo um grave problema de saúde pública mundial requerendo medidas adequadas para o seu diagnóstico, tratamento e seguimento. Na América Latina, estima-se que ≈6 milhões de pessoas estejam infectadas, das quais 30% a 40% podem cursar com a forma cardíaca com mortalidade ≈24,5 por 1.000 pacientes/ano. 876 , 877
A DCh apresenta amplo espectro de apresentação clínica: forma indeterminada, clinicamente inaparente; cardiomiopatia chagásica (CCh), com comprometimento cardíaco, alterações no ECG e sorologia positiva para Trypanosoma cruzi; e CCh dilatada, com IC e disfunção ventricular. As arritmias cardíacas (síndrome arrítmica) podem ser a única manifestação da CCh, frequentemente ocorrendo em combinação com IC e/ou eventos tromboembólicos. 878 , 879
O TE é útil em todas formas de apresentação da DCh, inclusive devido à existência frequente de comorbidades. Indicações gerais do TE na DCh: 879 , 880
– Avaliação da capacidade funcional, resposta cronotrópica e comportamento pressórico. 881 - 883
– Avaliação de sintomas, inclusive dor torácica. 884
– Avaliação de comorbidades (p. ex., HAS, DAC etc.).
– Detecção e avaliação do comportamento de arritmia (suspeita ou conhecida) e distúrbios da condução atrioventricular. 885
– Estratificação de risco para morte súbita (inclusive como parte dos critérios do escore de Rassi). 878 , 886 , 887
– Avaliação seriada, inclusive em programa de reabilitação para prescrição de exercícios. 888
– Perícia médica e/ou avaliação pela medicina do trabalho. 889
Particularidades da realização do TE na DCh:
– No ECG de repouso, nenhum achado eletrocardiográfico isolado é patognomônico, sendo comuns alterações múltiplas, inclusive decorrentes de comorbidades. 890
– Alterações do ECG de repouso potencialmente relacionadas ao mau prognóstico: ondas Q patológicas (simulando IAM prévio), baixa voltagem dos complexos QRS e alterações primárias da onda T. 886 , 891
– Capacidade funcional relativamente preservada na forma indeterminada e na CCh crônica mesmo em presença de alterações do ECG e função ventricular deprimida. 892 , 893 Comprometimento funcional é preditor de declínio da função cardiovascular, inclusive na forma indeterminada e em estágios iniciais da CCh. Na CCh dilatada, verificou-se que o VO 2 pico foi preditor independente de morte. 883 , 885 , 894
– Recomenda-se adequar o protocolo de esforço à classe funcional, inclusive com eventual utilização de protocolos atenuados.
– Resposta cronotrópica diminuída e/ou incompetência cronotrópica são consideradas manifestações de disfunção autonômica secundária à DCh. Essa disautonomia geralmente associa-se com a densidade e letalidade das arritmias ventriculares. 895 , 896
– Pacientes com DCh na forma indeterminada e na forma digestiva isolada podem apresentar incompetência cronotrópica ou arritmias ventriculares esforço-induzidas. 881 , 897
– Alterações do segmento ST esforço-induzidas podem ser secundárias a aneurisma apical do VE, principalmente na síndrome de dor torácica da DCh. No entanto, essas anormalidades podem ser inerentes à DCh (aguda ou crônica). 898
– Foi demonstrado que a ocorrência de dor precordial associada a alterações isquêmicas de ST (em ECG possível de interpretação) tem VPP de 100% para DAC obstrutiva. 884
– Alterações eletrocardiográficas basais associadas aos distúrbios de condução intraventricular geralmente impossibilitam a adequada avaliação de isquemia pelo segmento ST. 884
– Alterações do ritmo cardíaco no ECG basal são preditoras de gravidade/classe funcional da DCh, enquanto as esforço-induzidas se correlacionam com mortalidade CV. 899 , 900
– Ocorrência de TVNS, em especial nos pacientes com disfunção ventricular esquerda, é preditora de morte súbita cardíaca. 877 , 901 , 902
– Ocorrência de arritmia ventricular esforço-induzida ou aumento de sua densidade em relação ao ECG basal (em mais de 10%) estão associados ao risco de morte CV. 877 , 903
– A morte súbita na CCh, geralmente precipitada pelo esforço, pode ser causada por taquicardia ou fibrilação ventricular, assistolia e BAVT. 904
– Na prescrição de exercício e avaliação seriada em programa de reabilitação, o TE deve ser realizado mantendo as medicações usuais, principalmente para pacientes com drogas cronotrópicas negativas, como betabloqueadores, digitálicos ou antiarrítmicos, para mimetizar a condição em que estarão durante as sessões de treinamento físico. Sugere-se que associe ao TE, a monitorização da saturação de oxigênio e variáveis cardiometabólicas (TCPE) visando melhor quantificação de possíveis limitações. 905
– Na prescrição de exercício/avaliação seriada em programa de reabilitação, o TE deve ser realizado mantendo as medicações de uso corrente (inclusive drogas cronotrópicas negativas) preservando a condição do paciente nas sessões de treinamento físico. 888
8.3. Doença Arterial Periférica
A doença arterial periférica (DAP) é caracterizada por lesões ateroscleróticas das artérias dos membros inferiores que causam redução do fluxo sanguíneo, claudicação intermitente (CI), dor muscular isquêmica esforço-induzida e alívio da dor com o repouso (geralmente dentro de 10 minutos). 175 , 780 Podem ocorrer sintomas atípicos como cãibras e limitações aos esforços sem sintomas claramente associados aos membros inferiores. 906 Estima-se que, no mundo, a DAP afete mais de 200 milhões de pessoas, sendo sua apresentação e progressão dos sintomas influenciadas por sexo, idade e etnia do paciente. A DAP frequentemente ocorre em pacientes tabagistas e diabéticos. 907
A CI ocorre entre 7,5% e 33% dos pacientes, diminuindo progressivamente a capacidade de caminhada, a capacidade funcional e a qualidade de vida. O ITB em repouso é o principal exame para o diagnóstico e estabelecimento da gravidade da DAP, independentemente dos sintomas. 780 , 908
Pacientes com suspeita ou diagnóstico confirmado de DAP apresentam risco aumentado de doença arterial obstrutiva em outras partes do corpo, em especial na artéria subclávia, coronárias e artéria renal. Pacientes com DAP e DAC apresentam pior evolução da doença arterial periférica, aumento de mortalidade CV e por todas as causas. 175 , 176 , 909
Em linhas gerais, o TE é indicado na DAP para avaliar sintomas de claudicação/dor em membros inferiores, quantificar possível isquemia, avaliar a capacidade funcional, estratificação de risco, prescrição de programa de exercícios físicos e ajustes terapêuticos. 175 - 177 , 781 , 801
Particularidades da realização do TE na DAP:
1) Respeitar as orientações pré-teste principalmente quanto à suspensão do tabagismo e evitar esforços físicos antes do TE.
2) No pré-teste, é recomendada a realização do exame vascular, incluindo palpação dos pulsos dos membros inferiores, ausculta de sopros femorais e inspeção das pernas e pés. Os pulsos devem ser avaliados e classificados quanto sua amplitude: 0 = ausente (pulso não palpável); 1 = diminuído (pulso pouco palpável); 2 = normal; 3 = aumentado. Atentar para presença de lesões de pele, agudas ou crônicas, principalmente em diabéticos (pé diabético). 781
3) Recomenda-se utilizar protocolo atenuado de esforço:
– Com carga constante (sem incrementos de velocidade ou inclinação), com velocidade de 2 mph (3,2 km/h) e inclinação de 10% a 12%. Esse protocolo pode não permitir avaliação precisa de indivíduos com DAP e grave limitação funcional por dificuldade em manter o esforço nessa inclinação.
– Ou com incremento de carga de forma escalonada (p. ex., protocolo de Naughton) ou rampa (com velocidade ajustada para incrementos pequenos de carga, pequena ou nenhuma inclinação). Quando utilizado protocolo de rampa, recomenda-se descrever no laudo as velocidades e inclinações, inicial e final, bem como a carga em METs/min programada de modo a permitir reprodutibilidade do protocolo.
4) O paciente deve ser orientado que, caso necessite, poderá utilizar o apoio das mãos nos corrimões da esteira. Registrar no laudo se o paciente fez ou não uso do apoio das mãos.
5) O esforço deve ser interrompido quando o paciente apresentar claudicação de intensidade limitante e/ou dor máxima tolerada em membro inferior. Também poderá ser interrompido por outros sintomas CV (p. ex., dor precordial, dispneia etc.) e demais parâmetros que contraindiquem a continuidade do esforço. 906
6) Registrar detalhadamente todos os sintomas ocorridos, quando, em qual parte (nádega, coxa, panturrilha ou outros) e momento de melhora. Atenção especial para o registro do momento de início da claudicação (claudicação inicial) e da claudicação que limita/impede a caminhada (claudicação absoluta). Sugere-se utilizar escala de percepção subjetiva de esforço (Borg ou Borg modificada) e escala de claudicação intermitente ( Figura 7 ).
7) Na recuperação, realizar novamente o exame vascular (ver item 2) e somente liberar o paciente após o reestabelecimento da condição basal.
8) É imprescindível registrar no laudo a distância máxima de caminhada livre de dor e/ou claudicação, a distância percorrida até a claudicação inicial e/ou absoluta, METs alcançados e capacidade funcional do paciente.
Dependendo do quadro do paciente e julgamento clínico, pode ser necessária a realização, simultânea/adicional ao TE, do exame de ITB pós-esforço, cujas indicações, modo de realização e interpretação constam na Seção 7.1 da Parte 2 desta diretriz.
Particularidades do TE na DAP:
– A Tabela 41 apresenta os principais diagnósticos diferenciais de dor e claudicação esforço-induzidas ao TE quando não provindas da DAP.
Tabela 41. – Dor em membros inferiores e claudicação esforço-induzidas não relacionadas à DAP .
| Doença | Localização | Característica | Esforço | Recuperação | Particularidades |
|---|---|---|---|---|---|
| Claudicação venosa | Perna inteira, mais acentuada na panturrilha | Dor em aperto e súbita | Depois de caminhar | Desaparece lentamente | Alívio com elevação. História de: TVP iliofemoral; edema; sinais de estase venosa |
| Síndrome compartimental crônica | Musculatura da panturrilha | Dor em aperto e explosiva | Após esforço intenso | Desaparece muito lentamente | Alívio com descanso. Mais frequente em atletas com grande massa muscular |
| Estenose espinhal | Frequentemente nádegas bilaterais, perna posterior | Dor e fraqueza | Pode imitar claudicação | Alívio variável, podendo demorar para recuperar | Alívio com flexão da coluna lombar. Piora com o ortostatismo |
| Hérnia de disco/compressão de raiz nervosa | Irradia na extensão da perna | Dor lancinante aguda | Deflagrada ao sentar, ficar em pé ou caminhar | Frequentemente presente em repouso | Pode melhorar com mudança de posição. Frequentemente histórico de lombalgia |
| Artrite do pé/tornozelo | Tornozelo, pé, arco do pé | Dor profunda | Após esforço (independentemente de intensidade) | Alívio lento | Sintomas variáveis em repouso e/ou esforço-induzidos |
| TVP: trombose venosa profunda. Adaptada de: Gerhard-Herman MD et al. 781 | |||||
– Estudos demonstraram que, em pacientes com DAP, as variáveis do TE são úteis para estratificação de risco de eventos cardíacos maiores e mortalidade cardiovascular. 803 , 910
– A redução da capacidade funcional ao TE é forte preditor de mortalidade a longo prazo em pacientes com DAP e supera todos os fatores de risco clássicos (incluindo tabagismo e IC) na estratificação de risco. 177 , 911
– Estudos em pacientes com DAP submetidos ao TE para prescrição e ajustes de programas de exercícios físicos demonstraram melhora da saúde cardiovascular (melhora do comportamento da PA, FC, recuperação da FC e capacidade funcional) e correlacionou-se com melhora no desempenho à caminhada. 781 , 912
8.4. Doença de Parkinson
A doença de Parkinson (DPark) é o segundo distúrbio neurodegenerativo mais comum no mundo, afetando 0,4% das pessoas <40 anos e cerca de 1,6% das pessoas com ≥65 anos. É caracterizada por disfunções motoras clássicas (bradicinesia, rigidez e tremor de repouso), com redução da atividade parassimpática e simpática, em repouso e no esforço. 913 , 914
As disfunções autonômicas e cardiovasculares são comuns na DPark, precedendo a disfunção motora em pelo menos uma década. A DPark geralmente evolui com fadiga, redução da capacidade funcional e baixa qualidade de vida. A presença de corpos de Lewy distribuídos no hipotálamo, centros simpático e parassimpático compromete a modulação autonômica, cronotropismo, inotropismo e resistência vascular periférica. 915 , 916
Na DPark, a regulação anormal da PA pode se manifestar como:
– Hipotensão ortostática (HO) que afeta ≈50% dos pacientes. 917 , 918
– Hipertensão em decúbito dorsal (hipertensão supina – HASup) é definida como PAS >140 mmHg e/ou PAD >90 mmHg quando medida após 5 minutos de repouso supino, tem prevalência de 79% e aumenta a incidência de lesões em órgãos-alvo (fator de risco para AVC e eventos CV maiores). 915 , 919
– Associação de HASup com HO é frequente (95%).
Particularidades do TE na DPark:
1) Atentar para possibilidade de ocorrência de HASup, bem como de HO na fase pré-teste.
2) A individualização do protocolo deve ser cuidadosa. Sugere-se utilizar protocolo atenuado nos pacientes com maior limitação física.
3) Nos pacientes com HO sintomática e/ou história de síncope esforço-induzida, recomenda-se a realização do TE em bicicleta ergométrica visando reduzir o risco de queda.
4) Sugere-se o apoio das mãos nos corrimões da esteira ou guidom da bicicleta, inclusive para redução do tremor de membros superiores.
5) Na DPark inicial ou de leve intensidade, é possível que não haja limitação funcional e comprometimento hemodinâmico relevante. 167 , 920
6) Registrar o comportamento da marcha durante o TE, inclusive se ocorreu ou não episódios de congelamento (quando a deambulação e outros movimentos voluntários podem cessar repentinamente). A marcha característica da DPark é tipo festinação, com diminuição dos passos largos, diminuição da cadência e velocidade de movimentos e distúrbios na amplitude do movimento. 921
7) Pacientes com DPark e HO geralmente têm aumento reduzido da PA ao esforço, podendo apresentar hipotensão esforço-induzida. Esse comportamento da PA, associado à vasoconstrição reduzida em leitos vasculares periféricos, pode acentuar o desequilíbrio metabólico, hipoperfusão tecidual/encefálica, causando maior fadiga e menor tolerância ao esforço. 920 , 922
8) Na DPark sem HO e com capacidade funcional reduzida, geralmente ocorre menor PASpico, menor FCpico e resposta cronotrópica deprimida. 167 , 914 , 923
A prática de exercícios físicos se constitui em abordagem não farmacológica, preventiva e terapêutica, relevante em termos de custo-efetividade, retardando o desenvolvimento de DPark, controlando sintomas (motores e não motores) e reduzindo o risco de eventos CV. 921 , 924 , 925 O TE está indicado para avaliação da aptidão cardiorrespiratória, liberação/prescrição de exercícios físicos, inclusive no contexto da reabilitação cardiovascular. 926 , 927
8.5. Doenças Valvares
O TE é relevante na avaliação dos pacientes com doença valvar (DV) contribuindo para a investigação de sintomas, ajustes terapêuticos, indicação de tratamento invasivo, liberação/prescrição de exercícios físicos, inclusive na reabilitação e prática esportiva. 93 , 94 , 240
Pacientes com DV costumam reduzir as atividades físicas, de forma gradual e imperceptível (sedentarismo), dificultando a percepção de sintomas esforço-induzidos. Nesses pacientes, o TE tem papel fundamental para definição de status assintomático. 17 , 928
Na DV leve, o TE geralmente é bem tolerado e seguro. Entretanto, em algumas situações específicas, pode apresentar maior risco de complicações e eventos adversos, sendo necessária a adoção de medidas preventivas específicas (p. ex., realização em nível hospitalar; utilização de protocolo atenuado etc.) ou até sua contraindicação.
As situações de contraindicação relativa e absoluta foram descritas na Parte 1, Seção 2.3 desta diretriz. Recomenda-se a realização do TE em ambiente hospitalar com suporte cardiológico nos pacientes assintomáticos com lesões valvares graves (estenóticas ou insuficientes), nos pacientes com lesões valvares múltiplas (moderadas/ graves) e com cardiopatia congênita associada.
Adequações na metodologia do TE na DV: 13 , 112 , 293
– A anamnese pré-teste deve avaliar a etiologia, gravidade e evolução da DV, medicação em uso, presença de sintomas e identificação de contraindicações relativas e absolutas.
– Contraindicações absolutas ao TE: indicações claras para intervenção cirúrgica valvar, hipertensão não controlada, arritmias complexas ou doença sistêmica com incapacidade de se exercitar adequadamente. 14 , 929
– No exame físico, além da ausculta cardíaca e pulmonar, realizar a pesquisa de frêmitos e palpação de pulsos periféricos.
– O protocolo deve considerar a capacidade funcional do paciente e evitar grandes incrementos carga de esforço (protocolo atenuado). 930
– No TE seriado, deve-se, preferencialmente, manter o protocolo utilizado anteriormente, visando a comparação de sintomas, comportamento hemodinâmico e capacidade funcional.
– O TE deve ser sintoma-limitante, bem como buscar realizar recuperação ativa.
– São fundamentais a observação, a caracterização e a descrição pormenorizada de todos os sinais e sintomas ocorridos e, em especial, fadiga, dispneia, tontura, dor precordial, palidez e sudorese, por serem critérios de intervenções terapêuticas e de prognóstico. 931
Abordaremos a seguir as particularidades referentes a doença valvar mitral e aórtica devido às suas incidências e disponibilidade de evidências científicas específicas quanto ao TE.
8.5.1. Estenose Aórtica
A estenose valvar aórtica (EAo) tem como principais etiologias a doença reumática, a degenerativa (ou aterosclerótica) e a congênita. É uma das formas mais comuns de valvopatia adquirida e ≈3% da população brasileira >75 anos apresenta EAo grave. 96 , 103
A tríade clássica de sintomas é composta de angina, síncope e dispneia. Após início dos sintomas, é necessária uma intervenção cirúrgica imediata devido à piora no prognóstico e uma sobrevida média de até 2 anos (se não associada a IC). A morte súbita cardíaca é a complicação mais temida, mas raramente observada em pacientes verdadeiramente assintomáticos.
O TE pode ser realizado com segurança em pacientes assintomáticos ou com sintomas leves. 934 É indicado para esclarecer sintomas duvidosos, avaliar a capacidade funcional, confirmar a ausência de sintomas ou diminuição na tolerância ao esforço. Quando normal, indica probabilidade muito baixa de sintomas e/ou complicações no seguimento de 6 a 12 meses. 97 , 935
A incidência de um TE anormal dependerá da gravidade da EAo, variando de 25% a 65%. Metade dos pacientes com EAo grave assintomática apresentará TE anormal. 108 , 936 , 937
As diretrizes nacionais e internacionais consideram os seguintes achados do TE para indicação de substituição cirúrgica da válvula aórtica: 92 - 94 , 109
– Sintomas esforço-induzidos claramente relacionados à estenose aórtica.
– Queda na pressão arterial intraesforço.
– Diminuição da tolerância ao esforço/capacidade funcional.
Particularidades do TE na EAo:
– ECG de repouso na EAo grave geralmente apresenta HVE (em 85% dos casos), associada a alterações secundárias da repolarização ventricular. O ISTs (>1 mm) é observado em cerca de dois terços dos pacientes, mesmo com EAo leve/moderada. Outras alterações: sobrecarga atrial esquerda; bloqueio do ramo esquerdo; FA, principalmente em idosos hipertensos. 112 , 115
– Cerca de um terço dos pacientes assintomáticos no basal desenvolve sintomas ao esforço, indicando alta probabilidade de desenvolvimento de sintomas em repouso e/ou complicações dentro de 12 meses. 935 , 938
– Ocorrência de dispneia em altas cargas de esforço e rápida melhora na recuperação, bem como dispneia em portadores de DPOC (especialmente em idosos), podem ser achados inespecíficos. 112
– Vertigem, pré-síncope e síncope aumentam o VPP para o desenvolvimento dos sintomas em repouso em acompanhamento por 1 ano. 937
– O TE não é útil para a detecção de DAC na EAo (≈20% apresentam DAC obstrutiva assintomática sem ISTE). Metade dos pacientes apresenta ISTE (horizontal ou descendente, >2 mm), sendo marcador de alto risco geralmente não associado a DAC. 934 , 938
– É frequente que os pacientes atinjam a FC submáxima prevista para a idade, mas sem aumento adequado do débito cardíaco (geralmente de apenas 50%). 939
– Aumento precoce da FC (85% da FCmax prevista ou aumento ≥50% da FC nos primeiros 6 minutos), em pacientes com EA grave associou-se à necessidade de troca valvar (RR: 3,21; IC 95%: 1,70-6,08; p<0,001) e, na EA moderada, ao risco de morte por todas as causas (RR: 16,02; IC 95%: 1,83-140,02; p=0,012). 374 , 938
– A resposta pressórica ao esforço é considerada anormal quando ocorrer queda intraesforço ou elevação da PAS <20 mmHg e está associada a maior ocorrência de sintomas. 240 , 930 , 938
– A resposta hipertensiva (exagerada ao esforço) está relacionada a valores elevados de PAS em repouso, maior massa do VE e aumento da rigidez arterial. Entretanto, não se associa a maior incidência de sintomas ou capacidade funcional reduzida. 940 , 941
– Arritmias ventriculares complexas esforço-induzidas são motivo de interrupção do TE, critério de anormalidade do exame e marcador de mau prognóstico. Arritmias ventriculares na recuperação têm correlação limitada com gravidade e prognóstico da EAo. 939 , 942
– Baixa capacidade funcional na EAo grave assintomática associa-se a aumento de mortalidade. 943
8.5.2. Regurgitação Aórtica
A regurgitação aórtica (RAo) pode ser decorrente de uma anomalia primária, como a valva aórtica bicúspide (pacientes jovens) ou por degeneração (em idosos). Pode ser também secundária à cardiopatia reumática (principal causa) ou dilatação da raiz da aorta (hipertensão crônica, síndrome de Marfan etc.). No estudo de Framingham, a prevalência geral foi de 4,9% e de 0,5% de RAo moderada ou grave. 104 , 944
A maioria dos pacientes permanece assintomática durante décadas. Nos assintomáticos com função sistólica de VE normal, a mortalidade é <0,2% ao ano. Com a função deprimida, a maioria desenvolve sintomas (taxa média >25% ao ano) e requer intervenção cirúrgica em 2 a 3 anos. Dispneia, angina ou IC são marcadores de mau prognóstico: mortalidade >10% ao ano no caso de angina e >20% nos casos de IC. Outros preditores de desfechos desfavoráveis são idade, volume sistólico final do VE e aptidão cardiorrespiratória. O início dos sintomas, mesmo que leves, é uma indicação para intervenção cirúrgica, independentemente da função de VE. 102 , 105 , 945
O TE é realizado para esclarecimento de sintomas. A rápida progressão das dimensões ventriculares ou declínio na capacidade funcional em TE seriados é razão para se considerar a abordagem cirúrgica. 97 , 946
Particularidades do TE na RAo:
– O ECG de repouso pode ser normal no início da doença ou mostrar hipertrofia do VE. Inicialmente, com a sobrecarga de volume do VE, ocorrem ondas Q proeminentes nas derivações DI, AVL e de V3 a V6. À medida que a RAo progride, ocorre diminuição das ondas Q com aumento progressivo da amplitude total dos complexos QRS. 112 , 947
– No esforço, é comum a ocorrência de ISTE (>1,0 mm), geralmente não associado com DAC obstrutiva. 948
– Arritmia ventricular esforço-induzida é relativamente comum e têm correlação significativa com o grau de hipertrofia e disfunção do VE. 949
– É muito rara a ocorrência de dispneia em baixa carga de esforço e função sistólica normal. Em pacientes com sintomas esforço-induzidos, atentar para outros sinais de disfunção VE. 950
– Assintomáticos com RAo moderada a grave podem realizar exercícios físicos de maior intensidade, e os com RAo grave, exercícios de intensidade moderada desde que o VE e a aorta não estejam com dilatação e apresentem FE>50%. 951 , 952
8.5.3. Estenose Mitral
A causa mundial mais comum da estenose mitral (EM) é a febre reumática. A EM isolada é duas vezes mais frequente em mulheres do que em homens. Outras causas de EM são raras e incluem anomalias congênitas, exposição prévia a radiação no tórax, mucopolissacaridose, mixoma de átrio esquerdo e calcificação anular mitral secundária ao envelhecimento. Os pacientes geralmente apresentam intolerância ao esforço e IC direita devido ao desenvolvimento de hipertensão pulmonar pós-capilar. 92 , 93 , 240 , 953
O TE é útil para esclarecimento de sintomas duvidosos ou discordantes com a gravidade da EM, tendo revelado a presença de sintomas em até 46% de pacientes com EM moderada a grave antes considerados assintomáticos. O TE permite avaliar a fadiga e aptidão cardiorrespiratória na EM significativa (área valvar ≤1,5 cm 2 ). 931 , 954
Particularidades do TE na EM:
– Deve ser realizado em uso de medicamentos (manter inclusive digoxina e betabloqueador).
– O ECG de repouso geralmente apresenta sobrecarga atrial esquerda, extrassistolia atrial ou fibrilação atrial (intermitente ou persistente). Na EM com HAP grave e/ou de longa duração, podem ser encontrados hipertrofia de ventrículo direito, desvio do eixo para direita e BRD. 112
– No esforço, é comum a ocorrência de aumento exagerado da FC devido à redução do volume sistólico (principalmente na FA). Pode ocorrer ISTE geralmente sem associação com DAC obstrutiva. 955
– Foi demonstrada ocorrência de arritmias ventriculares esforço-induzidas em 60% dos pacientes com EM (20% com arritmia complexa). A incidência e a complexidade não estiveram associadas à gravidade da estenose. 956
– A dispneia tem valor prognóstico, sendo o sintoma mais frequente. A tolerância ao esforço tem boa correlação com a gravidade da lesão. Na EM grave, o aumento da pressão pulmonar com o esforço pode cursar com congestão pulmonar. 106 , 957
– Dor precordial esforço-induzida geralmente está associada à inadequada elevação da PAS (resposta inotrópica deprimida), sem relação com DAC. 106 , 240
8.5.4. Regurgitação Mitral
A regurgitação mitral (RM) primária decorre de uma anormalidade estrutural da válvula (como na cardiopatia reumática), formas degenerativas (doença mixomatosa e deficiência fibroelástica) ou após uma endocardite. A RM secundária (funcional) geralmente ocorre devido à cardiomiopatia dilatada, isquêmica ou secundária a IAM. Afeta ≈24 milhões de pessoas em todo o mundo, com grande variação entre os países. 958 , 959
Na RM, o TE é útil na avaliação de sintomas e determinação da aptidão cardiorrespiratória (principalmente se sintomas duvidosos) e, quando limitada, contribui para a indicação de intervenção cirúrgica. Os sintomas esforço-induzidos têm relação com a gravidade da doença. Nos assintomáticos com aptidão cardiorrespiratória preservada, permite adiar com segurança a correção valvar. 98 - 100
A RM grave evolui com pressões elevadas no átrio esquerdo, HAP secundária, hipertrofia excêntrica com disfunção sistólica do VE. A disfunção do VE geralmente precede a RM moderada/grave com manifestações de dispneia e intolerância esforço-induzida. 960 , 961
RM secundária à isquemia de músculo papilar geralmente está associada a DAC em CX ou CD. Na cardiomiopatia isquêmica ou dilatada, a remodelação do VE e a deformação da válvula mitral podem cursar com RM de pior prognóstico. 962 , 963
Mesmo pacientes com sintomas leves podem descompensar em curto prazo. O início de sintomas indica que os mecanismos compensatórios do VE estão sobrecarregados. 963 , 964
Particularidades do TE na RM:
– ECG de repouso na RM leve normalmente apresenta achatamento ou inversão da onda T nas derivações inferiores. Na moderada/grave, geralmente observa-se sobrecarga atrial esquerda. A SVE ocorre em ≈⅓ dos pacientes e a hipertrofia de ventrículo direito em ≈15%, sendo comum a presença de FA. 965
– As alterações de repolarização esforço-induzidas não permitem a investigação de DAC principalmente se houver SVE e alterações do segmento ST no ECG basal. Mesmo com ECG basal normal, costuma ocorrer ISTE não associado a DAC, que não se relaciona à deterioração clínica/funcional. 966
– Geralmente ocorre arritmia ventricular frequente e complexa (pareadas, TV não sustentada) no esforço e recuperação. 967
– Atingir FCmax e/ou apresentar queda da FC no primeiro minuto da recuperação ≥29 bpm associaram-se a baixo risco de eventos cardíacos. 966
– É comum observar resposta pressórica deprimida da PAS. Em casos mais graves, pode-se observar queda pressórica intraesforço devido à redução do débito cardíaco, indicando necessidade de interrupção imediata do esforço. 931
– A aptidão cardiorrespiratória encontra-se reduzida em ≈20% dos pacientes assintomáticos com RM grave, estando associada com pior prognóstico. 962 , 968
8.5.5. Prolapso da Válvula Mitral
O prolapso da válvula mitral (PVM) é uma doença valvular, de predisposição genética, resultando em alterações mixomatosas dos folhetos da válvula mitral. Sua prevalência está em torno de 2% a 3%, sendo a evolução benigna na maioria dos casos. 969 , 970
O PVM pode ser primário (ou “não sindrômico”) ou secundário (ou “sindrômico”) a distúrbios do tecido conjuntivo (síndrome de Marfan, síndrome de Loeys-Dietz, síndrome de Ehlers-Danlos, osteogênese imperfeita, pseudoxantoma elástico e síndrome de osteoartrite). Também pode ser observado na miocardiopatia hipertrófica. 971
O PVM pode evoluir com progressiva regurgitação mitral por perda da aposição dos seus folhetos, sendo a principal causa de troca mitral cirúrgica por regurgitação em países desenvolvidos. A regurgitação mitral crônica frequentemente associa-se à hipertensão pulmonar com subsequente IC direita, aumento do risco de arritmias (incluindo FA), eventos tromboembólicos e endocardite infecciosa. 95 , 969 , 971
Mulheres jovens com espessamento dos folhetos mitrais e/ou prolapso dos folhetos podem apresentar predisposição aumentada para arritmias complexas e morte súbita cardíaca arritmogênica (PVM arritmogênico), sendo essa a complicação mais temida. Geralmente o ECG basal apresenta ondas T negativas em parede inferior e EVs com padrão de BRD. 970 , 972
PVM é um achado relativamente comum em atletas com evolução geralmente benigna. A presença de regurgitação mitral moderada/grave e arritmia ventricular são marcadores de atletas sob maior risco. 973 , 974
Pacientes com PVM idiopático frequentemente queixam-se de palpitações ou taquicardias esforço-induzidas. Também podem apresentar dispneia, fadiga, tolerância reduzida aos esforços, pré-síncope, síncope e sequelas de AVC.
São marcadores de risco para morte súbita no PVM: sintomas pré-síncope/síncope; doença de Barlow (degeneração mixomatosa do tecido de colágeno); histórico familiar de morte súbita; regurgitação mitral moderada/grave; arritmias ventriculares.
O TE é útil no PVM para avaliação de sintomas, determinação da tolerância ao esforço, detecção de arritmias esforço-induzidos e liberação/prescrição exercícios físicos.
Particularidades do TE no PVM:
– A ausculta cardíaca basal pode ser normal ou evidenciar clique mesossistólico, sopro sistólico tardio ou mesotelessistólico (devido à insuficiência mitral). O sopro sistólico pode estar presente apenas na posição ortostática. 975
– O ECG basal é normal na maioria dos pacientes. Podem ocorrer alterações inespecíficas das ondas T e segmento ST, especialmente nas derivações inferiores. Nos pacientes com regurgitação mitral crônica, pode ser observado padrão de SAE e SVE. 976
– Principais anormalidades durante o esforço:
1) Tolerância ao esforço reduzida geralmente associada a padrão análogo à astenia neurocirculatória (caracterizada por queixa de palpitação, fraqueza, falta de ar, respiração difícil e outras reclamações subjetivas, mesmo em esforço físico leve). 977
2) ISTE que mimetiza fortemente o padrão isquêmico da DAC obstrutiva, geralmente em pacientes com RM associada. O ISTE no PVM apresenta baixa sensibilidade e especificidade para DAC (resultado falso-positivo). 978 , 979
3) As arritmias ventriculares esforço-induzidas com padrão de bloqueio de ramo direito ou complexas (EVs polimórficas, EVs pareadas e/ou TV não sustentada) são marcadores de risco na suspeita de PVM arritmogênico. 974 , 980
8.6. TE Pós-revascularização Miocárdica
O TE no seguimento de pacientes após revascularização cirúrgica do miocárdio (CRVM) ou por intervenção coronária percutânea (ATCP) permite: 6 , 13 , 27 , 134
– Esclarecer sintomas. 45 , 981
– Determinar a aptidão cardiorrespiratória/tolerância aos esforços.
– Avaliar a terapêutica farmacológica.
– Estratificação de risco/prognóstico. 982
– Avaliação da densidade e complexidade de arritmias. 983
– Liberação para retorno a atividades laborais e perícia médica.
– Liberação e prescrição de exercícios físicos (inclusive reabilitação CV). 17 , 29
– Avaliação de reestenose (na ATCP) ou estenose/oclusão de ponte (na CRVM) e/ou progressão da doença arterial coronariana. Nesses casos, o TE não deve ser indicado como forma de avaliação periódica/rotineira de pacientes assintomáticos sem indicações clínicas específicas. 984 - 986
Pontos importantes a serem considerados previamente à realização do TE: 6 , 13 , 293
– Persistência de sintomas mesmo com revascularização completa.
– Se a revascularização foi parcial ou completa.
– Ocorrência e/ou manutenção de disfunção ventricular/IC após a revascularização, particularmente após IAM. 987
– Necessidade de suspensão de medicamentos.
– Nível de atividade física pré e pós-revascularização.
– Análise comparativa de achados hemodinâmicos e eletrocardiográficos em TE/TCPE pré-procedimento e/ou análise de seriada.
8.6.1. TE após Intervenção Coronária Percutânea
De acordo com o tempo decorrido da ATCP, o TE apresenta indicações de reconhecido valor no acompanhamento clínico e evolução da DAC: 6 , 13 , 988
– Entre 1-3 meses: investigação de novos sintomas; avaliação de carga isquêmica residual em ATCP incompleta; adequações na terapêutica medicamentosa; liberação/prescrição de exercícios (inclusive reabilitação); estratificação de risco; perícia médica e/ou avaliação pela medicina do trabalho. 982 , 989 , 990
– 3-6 meses: investigação de manifestações isquêmicas devido a possível reestenose/oclusão de ponte; avaliação de pacientes com ATCP em ponte miocárdica; ajustes terapêuticos. 50 , 991 , 992
– 6-24 meses: avaliação de sintomas; em pacientes com alto risco de eventos CV e progressão de DAC para otimização terapêutica (inclusive não farmacológica). 50 , 984 , 993
– Após 24 meses: acompanhamento evolutivo da DAC e reestenoses, que deve ser seriada nos pacientes de alto risco. 994
Particularidades do TE após ATCP:
– Deve ser limitado por sintomas, inclusive por ser característica fundamental na condução do paciente em programa de reabilitação (≥2 semanas após a alta hospitalar). 29
– Ausência de angina nem sempre traduz revascularização completa. Angina esforço-induzida sugere isquemia residual e/ou reestenose. 50 , 995
– DP <25.000 bpm.mmHg sugere mau resultado ou disfunção ventricular esquerda. A análise comparativa com os valores pré-procedimento é de fundamental importância. Fatores como o infarto intraprocedimento, progressão da DAC, desenvolvimento de colaterais, hipertensão arterial e medicamentos podem interferir no DP. 996
– A normalização do segmento ST após a ATCP é o principal indicador de sucesso da revascularização. Na fase precoce após ATCP (1 a 6 meses), a recorrência de alterações do STs observadas em TE prévio não significa reestenose. A manutenção das alterações prévias, associada à diminuição do DP ou à reversão do TE para isquêmico, é sugestiva de mau prognóstico. Após 6 meses, na suspeita de DAC, um TE positivo pode refletir semioclusão/oclusão de stent , presença de lesões residuais, progressão/aparecimento de novas lesões ateroscleróticas e até áreas de miocárdio em adaptação pós-isquemia aguda. 997
– Após 2 anos de ATCP, a interpretação de ISTE ainda pode ser limitada quando presente DAC multiarterial, revascularização incompleta, infarto prévio e alterações ECG preexistentes (SVE e BRE). Em geral, no TE de pacientes uniarteriais e multiarteriais, constatou-se sensibilidade de 46% e especificidade de 77% (lesões >50%) e sensibilidade de 50% e especificidade de 84% (lesões >70%). 998 , 999
– Prolongamento da duração do QRS no pico do esforço tem se mostrado bom preditor de eventos coronários (em 23±9 meses). 1000
– A maioria dos pacientes aumenta o tempo de tolerância ao esforço (TTE) após a intervenção, que nem sempre traduz revascularização completa ou suficiente. Em TE seriados, a redução do TTE costuma estar associada a reestenose e/ou progressão da DAC. 996 , 1001
8.6.2. TE após Cirurgia de Revascularização Miocárdica
O TE após CRMV permite a avaliação de sintomas, avaliação da aptidão cardiorrespiratória, ajustes terapêuticos e liberação/prescrição de atividades físicas (inclusive reabilitação CV). 27 , 29
Existem duas fases para a indicação do TE após a CRVM: a precoce (<6 meses), com o objetivo de determinar os resultados imediatos da revascularização; e a tardia (>6 meses), para avaliação evolutiva do tratamento. Nos primeiros 5 anos após a CRVM, o TE não está indicado para avaliação seriada de pacientes assintomáticos, sem indicação específica. 1002 , 1003
O TE após CRVM deve ser realizado somente após cerca de 3 meses, visando: 115 , 1004
– Aguardar estabilização do esterno, fonte comum de dor/desconforto torácico e dificuldade respiratória (fator de confusão).
– Adaptações cardiocirculatórias e microcirculatórias como correção da taquicardia, volemia, hematócrito, excesso de catecolaminas e reserva coronária.
– Realização do TE antes desse prazo é segura, mas aumenta o risco de exames falsos-positivos e tem limitada aplicabilidade clínica.
No TE na CRVM completa e com sucesso: 1005
– Pode ocorrer redução de ISTE e/ou normalização do STs.
– Em 30% dos pacientes, pode ocorrer ISTE não associado à obstrução/oclusão da ponte e/ou nova lesão coronariana.
– Enxertos ocluídos podem não causar ISTE compatível com isquemia.
– Na fase recente da CRVM (<6 meses), ISTE sugere trombose nas pontes. Na fase crônica, o ISTE associa-se à aterosclerose na ponte e/ou progressão da DAC. 1006
Nas oclusões de pontes, podem ocorrer:
– Diminuição do tempo tolerância ao esforço, mesmo sem alterações eletrocardiográficas associadas. 1007
– Aumento do DP à custa da elevação da FC máxima.
– DP <25.000 bpm.mmHg após CRVM é sugestivo de obstrução da ponte e/ou disfunção ventricular esquerda.
Particularidade do TE no pós-CRVM:
– A melhora dos sintomas de angina após CRVM decresce com o tempo, em decorrência de claudicação das pontes e/ou progressão da DAC. Cinco anos após CRVM completa, ≈30% dos pacientes retorna com quadro anginoso. 1008
– Em acompanhamento de 435 pacientes pós-CRVM por TE seriado, na revascularização completa, houve melhora significativa da angina, TTE e ISTE no primeiro ano de evolução, com os resultados persistindo até o sexto ano. 1009
– O TTE e o DP máximo foram mais elevados nos primeiros 3 anos de evolução de CRVM completa. 1009 , 1010
Parte 3 – Teste Cardiopulmonar de Exercício
1. Introdução
O teste cardiopulmonar de exercício (TCPE) é método de diagnóstico que proporciona análise conjunta das manifestações clínicas, hemodinâmicas, eletrocardiográficas, ventilatórias e concentrações de gases no ar expirado cujas indicações encontram-se na Seção 2.4. 17 , 219 , 229 , 293 , 1011
O TCPE incorpora em tempo real a mensuração do volume de ar ventilado (VE) pelos transdutores de fluxo e volume de ar (pneumotacógrafo, tubo de Pitot e turbina) e pelo analisador de gases (O 2 e CO 2 ), as frações expiradas de oxigênio (FEO 2 ) e de dióxido de carbono (FECO 2 ), permitindo a obtenção de múltiplas variáveis de interesse clínico ( Figura 18 ), sendo método de valor diagnóstico/prognóstico, excelência em termos de custo-efetividade e relevância na prática clínica e pesquisa. 17 , 29 , 219 , 737 , 1012 , 1013
Figura 18. – Equipamentos no TCPE: transdutores de fluxo e volume de ar, analisadores de O 2 e CO 2 , ECG, estetoscópio/esfigmomanômetro e sistema/software específico.
2. Fisiologia do Exercício Aplicada ao TCPE
Toda atividade física consome energia, requerendo a ressíntese ininterrupta da adenosina trifosfato (ATP), o que na musculatura esquelética ocorre por três vias metabólicas:
– Anaeróbio alático ou ATP-fosfocreatina (PCr): fornece energia imediatamente, porém por muito pouco tempo. Nas atividades muito intensas, o estoque celular de ATP-PCr se esgota em segundos, sendo esse o seu fator limitante.
– Anaeróbio lático ou glicólise anaeróbia: fornece energia a curto prazo, porém por pouco tempo. Nas atividades de grande intensidade com poucos minutos de duração, gera resíduo incremental de ácido lático que repercute em acidose metabólica limitante.
– Aeróbio ou oxidativo, exigindo consumo de O 2 (VO 2 ), fornece energia a longo prazo (fonte “ilimitada” de energia), mantendo esforço físico leve e moderado à custa da desintegração de macronutrientes. 229 , 293 , 1011
Essas três vias metabólicas funcionam integradas e interdependentes, e a recuperação das vias anaeróbicas depende do metabolismo aeróbico ( Figura 19 ).
Figura 19. – Participação integrada e interdependente das vias metabólicas anaeróbicas e aeróbia no esforço físico.
Em relação ao TCPE, devemos considerar que, na transição do repouso para o esforço, há participação concomitante das 3 vias de metabolismo (aeróbico e anaeróbicos alático e lático). Somente após o período de ativação mitocondrial, a via aeróbica se torna predominante.
A partir do primeiro limiar ventilatório (LV1), também denominado limiar anaeróbico ou limiar de lactato ( Figura 20 ), a via anaeróbica lática vai se tornando cada vez mais presente (atividades de moderada para elevada intensidade) com acidose metabólica compensada pela alcalose respiratória. A partir do segundo limiar ventilatório (LV2), também denominado ponto de compensação respiratória (PCR), ocorre acidose metabólica incrementalmente limitante devido à impossibilidade de compensação ventilatória/respiratória, culminando com exaustão física. 219 , 229 , 293 , 1011
Figura 20. – Em sedentários e treinados, o limiar anaeróbio (LV1 – limiar de lactato) relacionado à intensidade do esforço físico (% do VO 2 máximo).
O limiar anaeróbio (LA) tem valor prognóstico em pacientes com IC, sendo relevante na avaliação do desempenho e prescrição de treinamento físico na reabilitação cardiovascular e no esporte. 1014 Com adaptação ao treinamento, o LA é deslocado para a direita, com maior tolerância ao esforço, aproximando-se do VO 2 max.
3. Ventilação Pulmonar, Gases no Ar Expirado e Variáveis Derivadas
3.1. Ventilação Pulmonar
3.1.1. Espirometria Basal
A espirometria basal mede o volume e os fluxos derivados de manobras ventilatórias inspiratórias e expiratórias máximas.
Os parâmetros básicos para a interpretação apropriada dos testes de função pulmonar visando avaliar distúrbios ventilatórios (obstrutivo, restritivo e misto) são: capacidade vital; volume expiratório forçado no primeiro segundo (VEF1); relação VEF1/CVF; capacidade pulmonar total (CPT); e volume residual (VR), cujos valores de normalidade para a população brasileira branca (caucasiana) e negra são mostrados na Tabela 42 . 1015 - 1017
Tabela 42. – Valores de referência de parâmetros básicos da espirometria para a população brasileira adulta, branca e negra .
| Raça Branca | Raça Negra | |||
|---|---|---|---|---|
| Variáveis | Homens | Mulheres | Homens | Mulheres |
| CVF (L) | 4,64±0,77 | 4,42±0,78 | 3,14±0,65 | 3,10±0,52 |
| VEF1 (L) | 3,77±0,67 | 2,56±0,57 | 3,55±0,69 | 2,55±0,48 |
| VEF1/CVF (%) | 81,0±5 | 81,0±5 | 80,3±5,4 | 82,0±5,4 |
| FEF25-75 (L/s) | 3,87±1,20 | 2,70±0,94 | 3,54±1,17 | 2,77±0,93 |
| FEF50 (L/s) | 4,82±1,44 | 3,40±1,14 | 4,39±1,36 | 3,54±1,06 |
| FEF75 (L/s) | 1,58±0,64 | 1,07±0,52 | 1,43±0,63 | 1,11±0,52 |
| PFE (L/s) | 11,1±1,75 | 7,14±1,28 | 9,77±2,07 | 6,73±1,28 |
| Valor ± desvio padrão; CVF: capacidade vital forçada; VEF1: volume expiratório forçado no primeiro segundo; FEF25-75: fluxo expiratório forçado entre 25% e 75%; FEF50: fluxo expiratório forçado de 50%; FEF75: fluxo expiratório; PFE: pico de fluxo expiratório. Adaptada de Pereira CAC et al. 1015 “Novos valores de referência para espirometria forçada em brasileiros adultos de raça branca.” e de Prata TA et al. 1016 “Valores de referência para espirometria forçada em adultos negros no Brasil. | ||||
Variáveis mais utilizadas na prática clínica:
– Capacidade vital (CV): corresponde ao maior volume de ar mobilizado em uma expiração máxima, podendo ser obtida através de manobras forçadas (CVF) ou lentas (menos utilizadas). A CVF corresponde ao volume obtido em uma única inspiração máxima seguida de uma expiração também máxima. No esforço tanto nos sedentários quanto nos ativos, apesar dos grandes aumentos da VE, o VC somente excepcionalmente ultrapassa 60% da CVF. A CVF varia com idade, IMC e gênero, situando-se nos homens entre 4-5 L e nas mulheres entre 3-4 L.
– VEF1: volume de ar exalado no primeiro segundo durante a manobra de CVF. É uma das variáveis mais úteis clinicamente, auxiliando no diagnóstico de distúrbio ventilatório obstrutivo.
– Fluxo expiratório forçado intermediário (FEF25-75): representa o fluxo expiratório forçado médio obtido durante a manobra de CVF, na faixa intermediária entre 25% e 75% da CVF.
– Pico de fluxo expiratório (PFE): corresponde ao fluxo máximo de ar durante a manobra de CVF.
– Curva fluxo-volume: apresentação gráfica do fluxo e volume gerados durante a manobra de CVF, sendo importante para o diagnóstico de determinadas afecções respiratórias, permitindo a identificação visual de padrões obstrutivos, restritivos, amputações de fluxos inspiratórios ou expiratórios e avaliação das respostas ao broncodilatador.
3.1.2. Ergoespirometria
A ventilação pulmonar (VE) em um minuto (L/min) corresponde ao volume total de ar que ventila o trato respiratório, incluindo o espaço morto (VD). É calculada pela fórmula:
VE: ventilação pulmonar (L/min)
FR: frequência respiratória (incursões respiratórias/min)
VC: volume corrente (L/min)
3.1.3. Reserva Ventilatória
Nos adultos jovens e saudáveis, em repouso, a FR costuma ser ≈12 incursões/min e o VC ≈0,5 L/min, resultando em VE = 6 L/min (0,5 L/min × 12 = 6 L/min). Durante esforço físico extenuante, a VE costuma aumentar 17-20 vezes, às custas de FR de 35-45/min. Excepcionalmente, a FR excede 50/min e o VC supera 2 L/min ( Figura 21 ).
Figura 21. – Aumento da ventilação pulmonar (VE) – inicialmente dependente quase exclusivamente do volume corrente (VC) que logo atinge um platô, ficando em seguida dependente apenas do incremento da frequência respiratória (FR).
A reserva ventilatória (RV) corresponde à relação entre a ventilação máxima de exercício (VEmax) e a ventilação voluntária máxima (VVM) em repouso (ambas em L/min; RV = [VVM-VEmax/VVM] x100), sendo o normal de 20% a 40% que corresponde em média a 3.000 mL nos homens e 2.100 mL nas mulheres. A VVM é avaliada por meio de uma respiração rápida e profunda por 15 segundos, extrapolada para o que seria obtido se a manobra persistisse por 1 minuto, oscilando entre 35 e 40 vezes o VEF1. A medida da RV contribui para o diagnóstico diferencial de dispneia. 1011 , 1017 , 1018
Equações de predição:
VVM: ventilação voluntária máxima
VEF1: volume expiratório forçado em um segundo
RV: reserva ventilatória
VEmax: ventilação máxima de exercício
O aumento do VC no esforço ocorre pela utilização adicional dos volumes de reserva inspiratória (VRInsp) e expiratória (VRExp), podendo atingir, respectivamente, 75% a 85% da CPT e 40% da CPT. Esses volumes são determinantes no estabelecimento da VEmax que, em condições normais, fica abaixo de 70% da VVM (resultando em RV entre 20% e 40%). Ressalta-se que em exercícios extenuantes, particularmente em atletas, pode ser utilizado um maior percentual da RV. 219 , 229 , 293 , 1011
3.2. Consumo de Oxigênio
O consumo de oxigênio (VO 2 ) corresponde à diferença entre as concentrações de O 2 do ar inspirado e do ar expirado, sendo a quantidade de O 2 consumido na atividade metabólica ( Figura 22 ). Seus valores podem ser expressos de forma absoluta (L/min) ou, preferencialmente, em valores relativos ao peso corporal mais frequentemente expresso em mL/kg/min (também aceitável mL.kg - 1 .min - 1 ), podendo ser convertido em equivalente metabólico (1 MET = 3,5 mL/kg/min de VO 2 ).
Figura 22. – Em TCPE máximo, consumo de oxigênio (VO 2 ) em valores absolutos (em L/min), relativos (em mL/kg/min) e em equivalentes metabólicos (METs). A característica da curva de VO 2 , com platô no pico de esforço indica que paciente atingiu o VO 2 máximo.
O maior VO 2 obtido no TCPE pode ser considerado:
– VO 2 máximo (VO 2 max) quando, apesar do aumento da carga de esforço, se estabelece um platô de VO 2 , sem elevação ou com apenas um discreto aumento (<50 mL/min ou 2,1 mL/kg/min) – vide Figura 22 .
– VO 2 pico quando o maior valor obtido no final de um esforço exaustivo ocorre na ausência de um platô na curva de VO 2 ( Figura 23 ). 219 , 229 , 293 , 1011
Figura 23. – TCPE, o consumo de oxigênio (VO 2 ) apresentado em valores absolutos* e a carga de trabalho em Watts. VO 2 pico: curva de VO 2 sem platô no pico de esforço indicando que o paciente não atingiu o VO 2 máximo. Figura ilustrativa: na prática, normalmente apresenta-se o valor de VO 2 em valores relativos ao peso corporal.
O VO 2 max é considerado o padrão-ouro na determinação da aptidão cardiorrespiratória (ACR). 1012
3.3. Produção de Gás Carbônico
A produção de gás carbônico (VCO 2 ), no TCPE determinada a partir da FECO 2 , geralmente é expressa em L/min, sendo raramente utilizado isoladamente. Entretanto, as variáveis derivadas de sua medida, como o quociente respiratório (QR) e o equivalente ventilatório de CO 2 (VE/VCO 2 ), têm grande utilidade clínica. 219 , 229 , 293 , 1011
3.4. Limiares Ventilatórios
Os limiares ventilatórios são pontos de transição metabólica, observados nas curvas de VE, VO 2 , VCO 2 e nas suas variáveis derivadas. Podem ser expressos indiretamente em relação ao metabolismo (p. ex., VO 2 em mL/min ou L/min ou em % do VO 2 max) ou à demanda cardiovascular (p. ex., VO 2 em mL/bpm) – vide Figuras 20 e 23. 219 , 229 , 293 , 1011
A identificação dos limiares em pacientes com DCV (como IC e DAC) tem relevante valor prognóstico, contribui para ajustes na terapêutica farmacológica e otimiza a prescrição de exercícios na reabilitação cardiovascular e treinamento físico de indivíduos aparentemente saudáveis, particularmente atletas competitivos de atividades predominantemente aeróbicas. 17 , 219 , 229 , 293 , 1011 , 1014 , 1016
3.4.1. Primeiro Limiar Ventilatório
O 1º limiar ventilatório (LV1), também denominado limiar anaeróbio lático (LA) ou limiar de lactato (LL), marca a aceleração da taxa de acúmulo sustentado de lactato na corrente sanguínea, identificando a transição para uma etapa de crescente e incremental participação do metabolismo anaeróbio lático, mas com acidose metabólica ainda compensada pela alcalose respiratória até atingir o 2º limiar ventilatório (LV2). A sua medida direta se faz por meio da dosagem do lactato sanguíneo (expresso em mmol/L ou mEq/L) e a indireta a partir das medidas do TCPE, podendo ser observado no primeiro ponto de dissociação das curvas VE/VO 2 ( Figura 24A ) e VCO 2 /VO 2 ( Figura 24B ). 219 , 229 , 293 , 1011
Figura 24. – A e B . Limiar Anaeróbio (LV1) determinado a partir das relações VE/VO 2 (A) e VCO 2 /VO 2 (B).
3.4.2. Segundo Limiar Ventilatório
O LV2, também denominado ponto de compensação respiratória (PCR) ou OBLA (do inglês, onset of blood lactate accumulation ), corresponde ao ponto em que ocorre uma segunda inflexão nas curvas de VE e CO 2 em relação à curva de VO 2 , reflexo da acidose metabólica descompensada. Corresponde à transição para o esforço de muito elevada até a máxima intensidade, com grande e incremental acidose metabólica descompensada, evoluindo rapidamente para exaustão física. A partir do LV2 ocorre também incremento desproporcional da VE em relação ao VCO 2, ou seja, dissociação das curvas da VE e da VCO 2 , com aumento da relação VE/VCO 2 . Nesse ponto, nos pacientes com IC, a relação VE/VCO 2 ≥34 indica pior prognóstico ( Figura 25 ). 219 , 229 , 293 , 1011
Figura 25. – Segundo limiar (LV2), a partir do equivalente ventilatório de CO 2 (VE/VCO 2 ) que se encontra anormal em indivíduo com insuficiência cardíaca (IC) e normal em saudável. A relação VE/VCO 2 é preditor de mortalidade e hospitalização na IC, indicando pior prognóstico se relação ≥34.
3.5. Quociente Respiratório
O quociente respiratório (QR) ou razão de trocas respiratórias (R) corresponde à razão entre VCO 2 e o VO 2 , permitindo identificar a intensidade do exercício e o macronutriente utilizado para gerar energia:
– Nas cargas iniciais do TCPE, encontra-se em torno de 0,72 (utilização quase exclusivamente de gordura).
– No LV1 costuma ser ≈0,82 (utilização ≈40% de lipídios e ≈60% de carboidratos).
– No LV2, está em torno de 1,00 (utilização quase exclusiva de carboidratos).
Em intensidades mais elevadas e próximo ao pico do esforço, o VCO 2 supera o VO 2 , tornando o QR incrementalmente superior a 1,00. O QR ≥1,10 é considerado sinal de quase exaustão ou exaustão, permitindo considerar o exame como sendo de esforço máximo. 219 , 229 , 293 , 1011 , 1012
3.6. Equivalentes Ventilatórios de Oxigênio e Gás Carbônico
Os equivalentes ventilatórios de O 2 (VE/VO 2 ) e de CO 2 (VE/VCO 2 ) indicam, respectivamente, a VE necessária para consumir 1 L/min de O 2 e produzir/eliminar 1 L/min de CO 2 . Durante o esforço progressivo, a razão VE/VO 2 diminui até o LV1, a partir do qual progressivamente aumenta, com inflexões positivas nas curvas no LV1 e LV2. A razão VE/VCO 2 diminui até o LV2, aumentando em seguida.
São parâmetros relevantes para avaliação da eficiência cardiorrespiratória, auxiliam na identificação dos limiares e contribuem para os diagnósticos, prognósticos, ajustes no tratamento farmacológico e prescrição de exercícios de várias situações clínicas, principalmente cardiopatia isquêmica e IC ( Figura 26 ). 219 , 229 , 293 , 1011
Figura 26. – Equivalentes ventilatórios de oxigênio (VE/VO 2 ) e de dióxido de carbono (VE/VCO 2 ) relacionados à carga de trabalho e curva de lactato sanguíneo, com visualização dos pontos correspondentes aos limiares ventilatórios (LV1 e LV2) e ponto ótimo cardiorrespiratório (POC).
A curva VE/VCO 2 é considerada preditor de mortalidade e/ou de hospitalização, principalmente em pacientes com IC cardíaca e DPOC. Quanto maior o seu valor, pior o prognóstico ( Figura 25 ).
3.7. Pressões Parciais Expiratórias do Oxigênio e Dióxido de Carbono
A pressão parcial expiratória final de oxigênio (PETO 2 ) é obtida a partir da medida da FEO 2 no ar expirado pelo analisador de gases, sendo habitualmente referida em mmHg (baseada na Lei de Dalton em que a pressão total de uma mistura gasosa é igual à soma das pressões parciais de seus gases componentes).
Normalmente, em repouso e no nível do mar, a PETO 2 é de ≈100 mmHg. No início do esforço, apresenta diminuição transitória (aumento desproporcional de VO 2 em relação à VE), para em seguida aumentar 10 a 30 mmHg até o esforço máximo ( Figura 27 ).
Figura 27. – Pressões parciais expiratórias do oxigênio (PETO 2 ) e dióxido de carbono (PETCO 2 ), com determinação dos limiares ventilatórios (LV1 e LV2).
Foi demonstrado que a PETO 2 , tanto em repouso quanto durante o esforço, correlacionou-se com 4 índices do TCPE comumente anormais em pacientes com disfunção do VE: VO 2 pico; limiar anaeróbico (LV1); relação delta VO 2 com delta carga de trabalho (ΔVO 2 /ΔWR); inclinação aumentada da curva VE/VCO 2 (marcador de incompatibilidade da ventilação com perfusão).
A PETO 2 é maior nos pacientes com função cardiopulmonar prejudicada, sendo o LV1 o estado metabólico que apresenta melhores correlações. 1019
A pressão parcial expiratória final de dióxido de carbono (PETCO 2 ) é obtida a partir da medida da FECO 2 , sendo habitualmente referida em mmHg. Reflete a pressão parcial de dióxido de carbono alveolar e arterial (PaCO 2 ). Normalmente, em repouso e ao nível do mar, a pressão de CO 2 (PCO 2 ) alveolar é de ≈40 mmHg, elevando-se 3-8 mmHg no esforço. Atinge o seu valor máximo no LV2 e, em seguida, diminui até o esforço máximo. A PETCO 2 , assim como a PETO 2 , correlaciona-se com: VO 2 pico; LV1; ∆VO 2 /∆WR; inclinação aumentada da VE/VCO 2 ( Figura 27 ). 1019
A PETCO 2 medida no LV1 (momento de maior estabilidade metabólica) correlaciona-se com o débito cardíaco (DC) e em pacientes com IC crônica, refletindo a gravidade da doença. A sua determinação pode ser comprometida na hiperventilação aguda, no aumento do espaço morto (devido enfisema e outras doenças pulmonares) e na associação de FR elevada com ventilação superficial. 1019 , 1020
No shunt direito-esquerdo esforço-induzido, ocorre aumento abrupto e sustentado da PETCO 2 , com diminuição concomitante da PETO 2 , coincidentes com aumento da VCO 2 /VO 2 e declínio da saturação. 1021 , 1022
3.8. Pulso de Oxigênio
O pulso de oxigênio (PuO 2 ) é obtido pela divisão do VO 2 pela FC (VO 2 /FC) em mL/kg/min/bpm, reflete a quantidade de O 2 que é transportada a cada sístole cardíaca e tem relação direta com o volume sistólico, permitindo avaliar a função do VE. Na isquemia miocárdica, a disfunção do VE pode ser constatada pela resposta do PuO 2 em platô e/ou queda ( Figura 28 A e B). 219 , 229 , 1013 , 1023
Figura 28. – A e B . Apresentação de pulsos de O 2 anormais devido à isquemia miocárdica: A = queda; B = platô.
No estudo ORBITA, dos parâmetros do TCPE, apenas o platô de PuO 2 detectou objetivamente a gravidade da isquemia miocárdica diagnosticada no ecocardiograma sob estresse com dobutamina. 1013
3.9. Relação Delta VO 2 e Delta Carga de Trabalho (ΔVO 2 /ΔWR)
A relação ΔVO 2 /ΔWR fornece uma quantificação fisiológica da taxa de trabalho, FC e VO 2 em que uma isquemia miocárdica se desenvolve, permitindo seu diagnóstico, quantificação e eventual reversibilidade com o tratamento. É mais facilmente determinada em cicloergômetro com protocolo de rampa, sendo expressa em mL/min/W. 219 , 229 , 293 , 1011 , 1024
Em adultos saudáveis, a relação é linear do início ao pico do esforço, com valor ≈10 mL/min/W. 1023 , 1024 Na isquemia esforço-induzida, ocorre disfunção do VE com achatamento da curva ∆VO 2 /∆WR a partir do limiar isquêmico ( Figura 29 ). 1023 , 1024
Figura 29. – Relação ∆VO 2 /∆WR característica da isquemia miocárdica.
3.10. Ponto Ótimo Cardiorrespiratório
O ponto ótimo cardiorrespiratório (POC) corresponde ao valor mínimo da curva VE/VO 2 ( Figura 26 ), sendo uma variável submáxima de fácil utilização. Reflete a eficiência cardiorrespiratória, tem valor preditor de mortalidade cardiovascular e por todas as causas, isoladamente ou associada ao VO 2 max. 1025 , 1026
3.11. Inclinação da Eficiência da Captação do Oxigênio (OUES)
A inclinação da eficiência da captação do oxigênio (do inglês, oxygen uptake efficiency slope [OUES]) é variável de grande reprodutibilidade, derivada inclusive de valores submáximos de VO 2 . É uma relação não linear da resposta ventilatória ao esforço, gerada por regressão logarítmica entre o VO 2 e a VE. De forma simples, pode-se dizer que o OUES corresponde ao aumento absoluto do VO 2 associado a um aumento de 10 vezes da VE. 1014 , 1027 , 1028
a = valor de referência de OUES calculado pelas fórmulas apresentadas no texto
b = valor da intercepção na curva
VE = ventilação pulmonar
Em 2012, Sun et al. 1028 apresentaram fórmulas de previsão do OUES:
– Para homens: 1,178 – (idade × 0,032) + (0,023 × altura [cm]) + (0,008 × peso [kg])
– Para mulheres: 0,61 – (idade × 0,032) + (0,023 × altura [cm]) + (0,008 × peso [kg])
Quanto mais inclinada for a reta ajustada do VO 2 , maior é o valor do OUES e, portanto, maior a eficiência no consumo de O 2 . Pacientes com IC grave apresentam menor eficiência ventilatória com baixos valores do OUES ( Figura 30 ). 1014 , 1027 - 1029
Figura 30. – Eficiência de captação de oxigênio (OUES) em indivíduos com boa eficiência (normal) e baixa eficiência (na insuficiência cardíaca).
O OUES tem valor prognóstico na IC, inclusive isoladamente, quanto ao risco de eventos. 1014 Outros estudos também documentaram o valor prognóstico do OUES comparado a outras variáveis do TCPE. 1027 , 1029
3.12. Ventilação Oscilatória ao Esforço
A ventilação oscilatória ao esforço (do inglês, exercise oscilatory ventilation [EOV]) é um fenômeno anormal, reprodutível, facilmente reconhecível no TCPE submáximo. É caracterizado como uma flutuação cíclica da VE (padrão ventilatório oscilatório >15% do valor médio de VE em repouso) e da cinética de gases expirados, com duração >60% do tempo de esforço. 229 , 1030 - 1034
A EOV é considerada um marcador de gravidade e pior prognóstico na IC, principalmente quando ocorre precocemente e o ciclo dura mais que 1 minuto ( Figura 31 ). 229 , 1026 , 1035
Figura 31. – Ilustração da ventilação oscilatória em TCPE de paciente com grave insuficiência cardíaca (ICFEr).
3.13. Tempo de Recuperação do Consumo de Oxigênio
O tempo de recuperação do consumo de oxigênio (do inglês, recovery delay [RD]), que corresponde à queda do VO 2 na recuperação, tem padrão facilmente reconhecível, contribuindo para prognóstico, ajustes no tratamento farmacológico e prescrição de exercícios na reabilitação cardiovascular e no treinamento esportivo. O T½ corresponde ao tempo necessário para queda de 50% do VO 2 pico, diminuindo com o treinamento físico bem conduzido, enquanto seu aumento associa-se a pior prognóstico nos pacientes com IC ( Figura 32 ). 1011 , 1036 - 1038
Figura 32. – Em indivíduo saudável e paciente com IC, as cinéticas de oxigênio no esforço e recuperação, com seus respectivos T½.
3.14. Potência Circulatória e Potência Ventilatória
A potência circulatória (PC), é o produto da pressão arterial sistólica pico (PASpico) pelo VO 2 max ou pico. A potência ventilatória (PV) é o produto da PASpico dividida pelo VE/VCO 2 . Ambas têm valor prognóstico na ICFEr, independentemente da potência circulatória. A avaliação conjunta melhora a estratificação de risco para desfechos maiores (morte, dispositivo de assistência ventricular, transplante cardíaco). 1039
3.15. Valores de Referência de Variáveis do TCPE
Os resultados obtidos em relação às diversas variáveis do TCPE ( Figura 33 ), sempre que possível, devem ser apresentados relacionando-os aos seus respectivos valores de referência (valores previstos), essencial para as devidas interpretações e conclusões. Sugere-se adotar os valores de referência apresentados nas Tabelas 43 e 44.
Figura 33. – Medidas e variáveis do TCPE e suas principais inter-relações. O sistema/software integra informações e disponibiliza múltiplas variáveis de interesse clínico a partir de medidas: ventilatórias (via transdutores de fluxo e volume do ar inspirado); metabólicas (via análise de gases no ar expirado – VE, FEO 2 e FECO 2 ); hemodinâmicas (ECG, FC, PA). Dessas medidas, são geradas múltiplas variáveis que podem ser analisadas por meio de gráficos. VO 2 : consumo de oxigênio; VCO 2 : produção de CO 2 ; VE: ventilação pulmonar; EOV: ventilação oscilatória ao esforço; RV: reserva ventilatória; VVM: ventilação voluntária máxima; LV1: 1 º limiar ventilatório; LV2: 2 º limiar ventilatório; PETO 2 : pressão parcial expiratória final de oxigênio; PETCO 2 : pressão parcial expiratória final de dióxido de carbono; VO 2 max: consumo máximo de oxigênio; %VO 2 max: porcentagem do consumo máximo de oxigênio; FC: frequência cardíaca; FR: frequência respiratória; CT: carga de trabalho em Watts; VO 2 RD: retardo da recuperação do VO 2 ; OUES: inclinação da eficiência da captação do oxigênio; T½: tempo necessário para queda de 50% do VO 2 pico na recuperação; ΔVO 2 /ΔWR: relação delta VO 2 e delta carga de trabalho; POC: ponto ótimo cardiorrespiratório; Pulso O 2 : pulso de oxigênio; QR: quociente respiratório.
4. Equipamentos e Metodologia
4.1. Ergômetros
Os ergômetros mais utilizados no TCPE são a esteira ergométrica e a bicicleta ergométrica.
Na população em geral, a esteira tem algumas vantagens em relação à bicicleta, tais como: atividade física mais familiar, uso de maior massa muscular, trabalho contra a gravidade causando maior estresse do sistema cardiorrespiratório e, consequentemente, maior VO 2 máximo/pico (≈5-15% maior). Em relação à bicicleta, uma limitação é a dificuldade/imprecisão na determinação da carga de trabalho em Watts. 1040
A bicicleta ergométrica pode ser de frenagem mecânica ou eletromagnética, que é a preferencial por permitir incremento automático com pequenas mudanças na cadência de pedaladas (40-70 rpm). Apresenta menor risco de quedas e menos artefatos favorecendo os registros do ECG e verificação da PA. 1040
Na avaliação de atletas de alto desempenho, o ideal é o uso do ergômetro que seja mais semelhante à atividade esportiva, ou seja, bicicleta ergométrica para os ciclistas e esteira para os corredores. Considerar adicionalmente a experiência da instituição, a familiaridade do atleta e os equipamentos disponíveis (p. ex., remo, tanque e esqui ergômetros). 1011 , 1040
4.2. Transdutores de Fluxo ou Volume de Ar
São recomendados equipamentos homologados que permitam a plena utilização dos principais parâmetros propostos por esta diretriz e sociedades científicas a exemplo das Sociedades Brasileiras de Cardiologia e Pneumologia, a European Respiratory Society e a American Thoracic Society .
Transdutores de fluxo ou volume de ar disponíveis:
– Pneumotacógrafo: transdutor de fluxo que mede a diferença de pressão do ar ventilado através de membrana de baixa resistência.
– Tubo de Pitot: medidor de fluxo que determina a diferença de pressão entre orifícios orientados na direção do fluxo de ar.
– Turbina: transdutor de volume no qual uma turbina ultraleve com contador luminoso de rotações é posicionada no fluxo de ar ventilado.
4.3. Analisadores de Gás
Existem dois tipos principais de analisadores de gás:
1) Espectrômetro de massa, considerado o padrão-ouro, sendo capaz de medir todos os gases coletados. É de alto custo e limitado emprego em modelos comerciais.
2) Analisadores individuais:
– Analisador de CO 2 : baseado na absorção das moléculas de CO 2 por infravermelho.
– Analisadores de O 2 : paramagnético, que utiliza o efeito das moléculas de O 2 em um campo magnético; ou eletroquímico, no qual as reações entre O 2 e um substrato em alta temperatura são medidas por sensor.
4.4. Medições das Trocas Gasosas
Consideramos o VO 2 e o VCO 2 como medida da diferença entre os volumes inspirado e expirado desses gases. Equação do VO 2 :
VInsp: volume de ar inspirado é calculado usando a premissa que a fração expirada e inspirada de nitrogênio permanece constante; VExp: volume de ar expirado; Tempo: minutos em que a medida é realizada; FIO2: concentração de O2 no ar inspirado; FEO2: concentração de O2 no ar expirado.
Métodos para medições das trocas gasosas:
– Câmara de mistura: sistema com válvula respiratória bidirecional e câmara de medição contínua das concentrações de O 2 e CO 2 . São mais acurados para protocolos de carga fixa. Em protocolos incrementais, sua acurácia é semelhante ao sistema respiração-a-respiração.
– Respiração-a-respiração: é o mais utilizado. As concentrações de O 2 e CO 2 são medidas próximas à boca (amostras 50 a 100/min). Para evitar erros de mensuração, requer correções da saturação de vapor, temperatura, pressão atmosférica e do tempo de atraso entre a amostragem e a chegada do gás ao analisador.
4.5. Procedimentos de Calibração, Controle de Qualidade e Higienização
Os procedimentos de calibração e controle de qualidade devem seguir as recomendações do fabricante do dispositivo quanto ao modo, frequência e periodicidade:
– Calibrações de volume e gás (realizadas rotineiramente).
– Calibração volumétrica por meio de seringa de 3 litros (variação volumétrica de até 3% é considerada aceitável).
– Calibração gasosa envolve ar ambiente e cilindro com mistura de CO 2 e O 2 . Equipamentos respiração-a-respiração realizam calibração adicional quanto ao atraso da amostragem e a chegada do gás ao analisador. 1041
Higienização é um processo rotineiro que, além dos aspectos metodológicos em relação ao TE (ver na Parte 2, Seção 1.1.3), deve considerar a higienização constante de mãos, superfícies e dos equipamentos do TCPE, em consonância com os protocolos institucionais e recomendações das autoridades sanitárias. 1042
A calibração e o controle de qualidade visam a qualidade e reprodutibilidade dos exames. Entretanto, existem múltiplos fatores de interferência, tais como mudanças do estado clínico, motivação e curva de adaptação do paciente.
4.6. Protocolos
Os protocolos validados podem ser divididos em:
– Incrementais: escalonados ou em rampa (o mais recomendado para a prática clínica, tanto para cicloergômetro quanto para esteira).
– Sem incremento (carga fixa): empregados em atletas, em pneumopatas para avaliação de curvas fluxo-volume e hiperinsuflação dinâmica. 1043
Os protocolos e critérios para interrupção do esforço são semelhantes aos do TE descritos nesta diretriz.
4.7. Software para Análise dos Dados
O software para o TCPE deve:
– Integrar/relacionar as variáveis do TE aos dados ventilatórios (ergoespirometria) e do analisador de gases, com possibilidade de determinar as variáveis pertinentes ao TCPE.
– Possibilitar a visualização dos dados de modo numérico e gráfico.
– Possibilitar a marcação do limiar anaeróbio, do ponto de compensação respiratória e do esforço máximo.
– Permitir a realização de curvas fluxo-volume em repouso e durante o exame.
– Apresentar os resultados de forma ordenada e clara, incluindo, quando possível, os respectivos valores de referência. 1044
4.8. Recomendações Prévias aos Pacientes
São as mesmas referentes ao TE apresentadas na Seção 1.1.6 da Parte 2 desta diretriz. É obrigatória a assinatura de termo de esclarecimento/consentimento específico para o TCPE.
5. Realização do TCPE em Algumas Situações Específicas
5.1. Insuficiência Cardíaca
O TCPE se constitui em clássica indicação na seleção de pacientes com IC terminal para transplante cardíaco (classe I B): quando em uso de betabloqueadores, VO 2 pico <12,0 mL/kg/min; nos intolerantes aos betabloqueadores, VO 2 pico <14,0 mL/kg/min. 1045 , 1046
Os limiares ventilatórios possibilitam a prescrição ideal de exercícios aeróbicos, particularmente na reabilitação dos pacientes com IC. 17 , 29
Variáveis úteis do TCPE na estratificação de risco e ajustes terapêuticos nos pacientes com IC ( Tabela 45 ):
Tabela 45. – Alterações das variáveis do TCPE em pacientes com IC 223,233,849,850,1034,1057-1059 .
| Variável | Alteração | Utilidade | Interpretação |
|---|---|---|---|
| VO 2 pico | ↓ | Avaliação geral do desempenho ao esforço. Marcador prognóstico de mortalidade | – Classificação de Weber – Indicação transplante cardíaco: uso de betabloqueadores <12,0; nos intolerantes betabloqueadores, <14,0 mL/kg/min |
| VO 2 LV1 | ↓ | Avaliação geral/ ↓ débito cardíaco | – Avaliação da gravidade/prognóstico |
| PuO 2 | ↓ | Débito cardíaco/função do VE | – Relação direta com o volume sistólico. – PuO 2 em platô e/ou queda = disfunção VE |
| Inclinação VE/VCO 2 | ↑ | Incompatibilidade ventilação-perfusão/aumento do tônus simpático | – Preditor de mortalidade e hospitalização – Quanto maior a inclinação, pior prognóstico |
| Relação VE/VCO 2 | ↑ | Marcador prognóstico/doença pulmonar concomitante | – Relação >34 é preditora independente de pior prognóstico |
| ΔVO 2 /ΔWR | ↓ | ↓ Débito cardíaco/ ↓ entrega O 2 | – Disfunção do VE: achatamento da curva ∆VO 2 /∆WR. Marcador prognóstico |
| EOV | Presente | ↓ Débito cardíaco/resposta quimiorreflexa alterada | – Marcador de gravidade/prognóstico, principalmente se precoce e ciclos >1 min |
| PETCO 2 * | ↓ | ↓ Débito cardíaco/ ↑ resposta quimiorreflexa | – Reflete gravidade da doença. |
| POC | ↑ | Variável em esforço submáximo. Reflete a eficiência cardiorrespiratória | – Preditor de mortalidade CV e por todas as causas isoladamente ou associado a outras variáveis – POC ≥36 apresenta maior mortalidade CV e transplante cardíaco urgente |
| OUES | ↓ | Eficiência ventilatória de consumo de O 2 | – Valor prognóstico e risco de eventos |
| Relação VD/VT | ↓ | Aumento do espaço morto com esforço | – Marcador de prognóstico. Associa-se à dispneia esforço-induzida |
| VO 2 pico: consumo de oxigênio no pico do esforço; VO 2 LV1 = consumo de oxigênio no 1º limiar ventilatório (anaeróbio); PuO 2 : pulso de oxigênio; Inclinação VE/VCO 2 = eficiência ventilatória (ventilação/produção de CO 2 ); ΔVO 2 /ΔWR: relação consumo oxigênio pela taxa de trabalho; EOV: ventilação oscilatória ao esforço (do inglês, exercise oscilatory ventilation); PETCO 2 LV1: pressão parcial expiratória final de dióxido de carbono no 1 º limiar ventilatório; POC: ponto ótimo cardiorrespiratório; OUES: inclinação da eficiência da captação do oxigênio (OUES, oxygen uptake efficiency slope); Relação VD/VT: relação espaço morto/volume corrente; CV: cardiovascular. *Melhor avaliado no 1 º limiar ventilatório (LV1). | |||
1) VO 2 max/pico é excelente marcador prognóstico de mortalidade. 1045 - 1048
2) Classificação de Weber baseada no VO 2 max/pico e taxas de mortalidade crescentes: A (VO 2 >20 mL/kg/min), B (16-20 mL/kg/min), C (10-15 mL/kg/min) ou D (<10 mL/kg/min). 1049
3) Valor da relação VE/VCO 2 >34 é preditor independente de pior prognóstico na IC. 1047 , 1048
4) Classificação de risco pela VE/VCO 2 (segundo Arena et al.) para eventos (mortalidade, transplante ou implante de dispositivo de assistência ventricular esquerda) por classe ventilatória (CVent): CVent-I: ≤29; CVent-II: 30,0-35,9; CVent-III: 36,0-44,9; CVent-IV: ≥45,0. A sobrevida livre de eventos para indivíduos em CVent-I, II, III e IV, respectivamente, 97,2%, 85,2%, 72,3% e 44,2% (p<0,001). 1050
5) Escore TCPE: baseado em combinação de variáveis do exame com pontuação >15 associada a elevado risco de eventos: curva VE/VCO 2 >34 = 7 pontos; queda da FC no 1º minuto da recuperação <6 bpm = 4 pontos; OUES <1,47 L/min = 3 pontos; VO 2 pico ≤14 mL/kg/min = 2 pontos; PETCO 2 em repouso <33 mmHg = 2 pontos. 1014 , 1021 , 1022 , 1030
6) Outras variáveis prognósticas utilizadas: VO 2 no LV1, OUES, pulso de oxigênio, EOV e POC. 1014 , 1019 , 1020 , 1025 , 1026 , 1032 , 1033 , 1051 - 1056
5.2. Doença Arterial Coronariana
Na doença arterial coronariana estável, essencialmente, o TCPE possibilita:
– Diagnóstico, discriminação dos aspectos fisiopatológicos e determinação da gravidade da isquemia esforço- induzida. 737 , 1012 , 1013 , 1023 - 1029 , 1035 , 1060 - 1068 , 1069
– Determinação da aptidão cardiorrespiratória (ACR) pela mensuração direta do VO 2 pico/máximo (padrão-ouro). 737 , 1012 , 1069 , 1070
– Contribuição na definição e eventuais ajustes das intervenções terapêuticas. 1013 , 1062 , 1063 , 1065 , 1066 , 1068
– Prescrição individualizada e otimizada de exercícios aeróbicos na reabilitação CV.
Variáveis de diagnóstico e prognóstico na DAC:
– Pulso de oxigênio, curva VE/VCO 2 , PETCO 2 e PETO 2 , ∆VO 2 /∆WR, as quais permitem a detecção da isquemia miocárdica esforço-induzida, dando ao TCPE maior sensibilidade e especificidade em relação ao TE. 1013 , 1023 , 1024 , 1027 - 1029 , 1035 , 1061 - 1068 , 1071
– Variáveis de prognóstico: aptidão cardiorrespiratória (VO 2 max/pico); VO 2 no limiar de angina; POC. 737 , 1012 , 1025 , 1026 , 1069 , 1070
– Pode ocorrer disfunção de VE, persistente ou transitória, com incompatibilidade da ventilação/perfusão (V/Q) por redução do fluxo sanguíneo pulmonar com ventilação adequada. Na disfunção do VE, observa-se anormalidade da PETCO 2 (no LV1), da PETO 2 (no LV1 e no pico do esforço) e dos índices com as quais ambas se correlacionam: VO 2 pico, LV1, ∆VO 2 /∆WR e inclinação aumentada da VE/VCO 2 . 1019 , 1020 , 1027 , 1029 , 1035 , 1060 , 1061
5.3. Miocardiopatia Hipertrófica
No TCPE de pacientes com miocardiopatia hipertrófica (MCH), considerar que ( Tabela 46 ):
Tabela 46. – Alterações das variáveis do TCPE em pacientes com MCH 1057,1074-1077 .
| Variável | Alteração | Utilidade | Interpretação |
|---|---|---|---|
| VO 2 pico | ↓ | Avaliação desempenho ao exercício. Marcador prognóstico de mortalidade | – VO 2 pico <20 mL/kg/min ou <80% do previsto associou-se a pior prognóstico (transplante cardíaco e hospitalização para redução do septo) – VO 2 pico <50% do previsto associou-se à mortalidade geral e CV |
| VO 2 LV1 | ↓ | Avaliação geral/ ↓ débito cardíaco | – Mecanismos semelhantes aos envolvidos na redução do VO 2 pico – Relação direta com volume sistólico |
| PuO 2 | ↓ | Débito cardíaco/fortemente relacionada ao volume sistólico | – Achatamento precoce em torno de 50% a 60% da carga máxima de esforço, devido à redução do volume sistólico – Quanto mais precoce o achatamento do PuO 2 , maior a gravidade da MCH |
| ΔVO 2 /ΔWR | ↓ | ↓ Débito cardíaco/VO 2 | – Preservado ou ligeiramente reduzido na maioria dos pacientes – Redução da inclinação ou inclinação lenta na última parte do esforço sugerem comprometimento diastólico e/ou estágio final da doença – Mudança abrupta na linearidade ΔVO 2 /ΔWR indica isquemia miocárdica associada |
| Relação VE/VCO 2 | ↑ | Prognóstico/mortalidade | – Relação >34 é preditora de mortalidade geral e transplante cardíaco |
| VO 2 pico: consumo de oxigênio no pico do esforço; VO 2 LV1 = consumo de oxigênio no 1 º limiar ventilatório (anaeróbio); PuO 2 : pulso de oxigênio; ΔVO 2 /ΔWR: relação consumo oxigênio pela taxa de trabalho; Relação VE/VCO 2 = eficiência ventilatória (relação ventilação/produção de CO 2 ). | |||
– O VO 2 máximo ou o VO 2 pico (quando não se atinge o QR ≥1,10) têm valor prognóstico. 17 , 29 , 1012 , 1072 , 1073
– É possível identificar os pacientes com obstrução da via de saída de VE esforço-induzida, particularmente pelo pulso de O 2 , permitindo ajustes terapêuticos e da intensidade do exercício na reabilitação CV. 219 , 1021 , 1072 , 1073
5.4. Valvopatias
O TCPE nas valvopatias, particularmente na estenose aórtica (EAo), contribui para avaliação da repercussão clínica-funcional e nas decisões de intervenções terapêuticas. 939 , 1078
Em relação à EAo:
– O prognóstico piora com a presença de sintomas esforço-induzidos.
– TCPE é relevante para o aprimoramento diagnóstico e prognóstico, e diferenciação da limitação ao esforço, principalmente em sedentários, na intolerância ao esforço ou pacientes com múltiplas comorbidades.
– TCPE máximo deve ficar restrito aos pacientes assintomáticos ou questionavelmente sintomáticos, havendo contraindicação absoluta para os indiscutivelmente sintomáticos. 1079 , 1080
5.5. Pneumopatias
5.5.1. Doença Pulmonar Obstrutiva Crônica
A gravidade da doença pulmonar obstrutiva crônica (DPOC) pode ser estabelecida pelos sintomas e dados do teste de função pulmonar (espirometria). No entanto, a espirometria em repouso não permite determinar o grau de intolerância ao esforço. 1081
A incapacidade de aumentar a ventilação para permitir níveis adequados de trocas gasosas (limitação ventilatória) é característica dos quadros pulmonares obstrutivos, mas pode também ocorrer nas doenças restritivas (doenças intersticiais e anormalidades da caixa torácica). A reserva ventilatória (RV) no pico do esforço <15%, principalmente quando o QR <1,00, permite o diagnóstico de limitação ventilatória. 337 , 1081 - 1083
No DPOC, o VO 2 pico é o melhor índice definidor da aptidão cardiorrespiratória (ACR), quando o paciente se exercitou até o seu limite. Adicionalmente, considerar a ocorrência de baixa ACR associada a alta demanda ventilatória e fadiga acentuada em membros inferiores. 1081
A hiperinsuflação pulmonar dinâmica é um dos fatores que podem causar dispneia intolerável durante o exercício. Com o aumento do fluxo respiratório durante o exercício, pode haver aprisionamento aéreo com um aumento progressivo do volume residual e, consequentemente, redução da capacidade inspiratória (CI). Frequentemente, isso ocorre em conjunto com uma redução no volume corrente (VC), indicando que a mecânica ventilatória atingiu seu limite. No TCPE, a hiperinsuflação dinâmica pode ser melhor observada quando são realizadas análises periódicas da curva de fluxo-volume com medida da CI durante o exercício, principalmente quando há desproporção entre a intensidade dos sintomas e o grau de obstrução das vias aéreas. 1081 , 1082
A hiperinsuflação pulmonar dinâmica (HPD), um dos mecanismos ventilatórios que pode causar dispneia intolerável ao esforço, decorre de aumento do fluxo respiratório, aprisionamento aéreo com aumento progressivo do VR, redução no volume corrente (VC), indicando consequente redução da capacidade inspiratória (CI). No TCPE, a HPD pode ser observada por meio de análises periódicas da curva de fluxo-volume com medida da CI, evidenciando desproporção entre a intensidade dos sintomas e o grau de obstrução das vias aéreas. 1081 , 1082
5.5.2. Doença Vascular Pulmonar
A hipertensão arterial pulmonar (HAP), definida por pressão média da artéria pulmonar (PAPmd) ≥25 mmHg, apresenta a dispneia ao esforço como seu sintoma mais precoce. 1084 A PAPmd em repouso frequentemente é normal nos estágios iniciais da doença vascular pulmonar (DVP), só alterando quando mais de 50% da circulação pulmonar estiver obstruída, causando um diagnóstico da tardio HAP. 246 , 1085 - 1092 A identificação da HAP pelo TCPE pode ser feita por método invasivo (padrão-ouro) ou não invasivo ( Tabela 47 ).
Tabela 47. – Comportamento das principais variáveis do TCPE em pacientes com doenças vasculares pulmonares 246,1095-1098 .
| Variável | Hipertensão arterial pulmonar | Hipertensão pulmonar tromboembólica crônica | Doença veno-oclusiva pulmonar |
|---|---|---|---|
| VO 2 pico | ↓ | ↓ | ↓ |
| VO 2 LV1 | ↓ | ↓ | ↓ ↓ |
| PuO 2 | ↓ | ↓ | ↓ |
| Inclinação VE/VCO 2 | ↑ | ↑ ↑ | ↑ ↑ |
| ΔVO 2 /ΔWR | ↓ | ↓ | ↓ |
| PETCO 2 | ↑ | ↑ ↑ | ↑ ↑ |
| SatO 2 | ↓* | ↓ ↓ | ↓ ↓ |
| Relação VD/VT | ↑** | ↑ ↑ | ↑ ↑ |
| VO 2 pico: consumo de oxigênio no pico do esforço; VO 2 LV1 = consumo de oxigênio no 1 º limiar ventilatório (anaeróbio); PuO 2 : pulso de oxigênio; Inclinação VE/VCO 2 = eficiência ventilatória (ventilação/produção de CO 2 ); ΔVO 2 /ΔWR: relação consumo oxigênio pela taxa de trabalho; EOV: ventilação oscilatória ao esforço (do inglês, exercise oscilatory ventilation); PETCO 2 : pressão parcial expiratória final de dióxido de carbono; POC: ponto ótimo cardiorrespiratório; OUES: inclinação da eficiência da captação do oxigênio (OUES, oxygen uptake efficiency slope); Relação VD/VT: relação espaço morto/volume corrente; SatO 2 : saturação arterial de oxigênio. *Queda >3% sem aumento da PaCO 2 (tensão arterial de dióxido de carbono). **Aumento >30% durante o esforço. | |||
O método invasivo, disponível em poucas instituições no mundo, requer uso de cateter na artéria pulmonar para medida direta da PADmed. Seu valor de referência é foi determinado arbitrariamente (>30 mmHg). Esse método não é recomendado para uso rotineiro na detecção precoce de DVP. 1092 - 1094
O método não invasivo é útil na avaliação de paciente com dispneia de etiologia indefinida e/ou suspeita de DVP, considerando que:
– As razões VE/VCO 2 no LV1 e no pico do esforço são muito elevadas na HAP. 1092
– Baixos valores de PETCO 2 no repouso e no esforço, com aumento da PETO 2 , foram associadas à HAP por incompatibilidade da relação V/Q (redução do fluxo sanguíneo pulmonar com ventilação adequada).
– VE/VCO 2 >37 e PETCO 2 <30 mmHg no POC podem indicar DVP, na ausência de hiperventilação aguda.
– Valores excepcionalmente baixos de PETCO 2 (<20 mmHg) sugerem HAP como causa da dispneia ao esforço. 1091
No TCPE utilizado na avaliação da gravidade da HAP estabelecida e na resposta terapêutica:
– Na HAP idiopática, o VO 2 pico <10,4 mL/kg/min e a PASpico <120 mmHg são de pior prognóstico ( Tabela 48 ). 246
Tabela 48. – Avaliação do risco através das variáveis do TCPE em pacientes com HAP 246,1095,1097,1099 .
| Variável | Comportamento com progressão da HAP | Baixo risco (<5%) | Intermediário (5-10%) | Alto risco (>10) |
|---|---|---|---|---|
| Classe funcional | ↓ | I e II | III | IV |
| VO 2 pico (mL/kg/min) | ↓ | >15 | 11-15 | <11 |
| %VO 2 predito | ↓ | >65 | 65-35 | <35 |
| Relação VE/VCO 2 | ↑ | <36 | 36-45 | >45 |
| VO 2 pico: consumo de oxigênio no pico do esforço; %VO 2 predito = porcentagem alcançada do consumo de oxigênio predito; Relação VE/VCO 2 = eficiência ventilatória (relação da ventilação/produção de CO 2 ). | ||||
– VO 2 >15,0 mL/kg/min indica bom prognóstico. 1086 , 1093
– VE/VCO 2 no LV1 (≥54) e no esforço máximo (≥62) indicam pior prognóstico/menor sobrevida. 1089
– Curva VE/VCO 2 menos inclinada (valores mais elevados) é observada na HAP por tromboembolismo pulmonar (TEP) crônico. Valores elevados de VE/VCO 2 em fases precoces do TEP não se associaram à classe funcional/gravidade. 1088
5.6. Diagnóstico Diferencial da Dispneia
O TCPE é ferramenta importante no diagnóstico diferencial da dispneia esforço-induzida (DEI), particularmente nas de causa pulmonar e cardíaca. 219 , 229 , 1018 , 1100 , 1101 A baixa aptidão cardiorrespiratória, comum às prováveis etiologias da DEI, não é bom parâmetro isolado para o diagnóstico diferencial. 219 , 229 - 231 , 1018 , 1100 - 1104
Parâmetros utilizados no diagnóstico diferencial da DEI ao esforço: 219 , 229 - 231 , 1018 , 1100 - 1104
– Eficiência ventilatória avaliada por meio do VE/VO 2 e VE/VCO 2 , reserva ventilatória e relação espaço morto/volume corrente (VD/VT).
– Análise da alça fluxo-volume.
– Saturação arterial de oxigênio, que contribui para detecção dos distúrbios na difusão pulmonar.
Nas doenças pulmonares, a DEI está associada a equivalentes ventilatórios elevados, RV reduzida, aumento da relação VD/VT, PETCO 2 reduzida e dessaturação arterial de oxigênio, observados em conjunto ou separadamente. 219 , 229 - 231 , 1018 , 1100 - 1104
Em relação às limitações ventilatórias da DEI ( Tabela 49 ): 219 , 229 - 231 , 1018 , 1100 - 1104
Tabela 49. – Diagnóstico diferencial das principais causas de dispneia no TCPE 220,222,1018,1108 .
| Variável | Cardíaca | Pulmonar | Vascular-pulmonar | Hiperventilação |
|---|---|---|---|---|
| VO 2 pico | Reduzido | Reduzido | Reduzido | Normal |
| LV1 | Precoce | Normal | Precoce | Normal |
| QR | Normal | Reduzido | Normal/reduzido | Normal/reduzido |
| Relação VE/VCO 2 | Elevado | Elevado | Elevado | Elevado |
| PuO 2 | Reduzido/platô | Normal | Reduzido | Normal |
| SatO 2 | Normal | Queda | Queda | Normal |
| ΔVO 2 /ΔWR | Reduzido | Normal | Reduzido | Normal |
| VO 2 pico: consumo de oxigênio no pico do esforço; LV1 = 1 º limiar ventilatório (anaeróbio); QR: coeficiente respiratório; Relação VE/VCO 2 = eficiência ventilatória (relação ventilação/produção de CO 2 ); PuO 2 : pulso de oxigênio; SatO 2 : saturação arterial de oxigênio por oxímetro; ΔVO 2 /ΔWR: relação consumo oxigênio pela taxa de trabalho. | ||||
– A espirometria precedendo o TCPE permite a detecção e caracterização dos distúrbios ventilatórios (obstrutivos, restritivos e mistos).
– Frequente não detectação do LV1 (com QR <1,0).
– Na interrupção do esforço decorrente da limitação ventilatória em geral observam-se valores baixos de VO 2 e FCpico.
– Redução na saturação arterial de oxigênio >5% (oximetria de pulso) indica limitação pulmonar.
– As razões entre ΔVO 2 /ΔWR e VO 2 /FC (pulso de oxigênio) são normais, exceto quando associado a HAP com débito cardíaco comprometido.
– Na espirometria realizada em até 30 minutos após pico do esforço (pós-esforço), a redução do VEF1 ≥15% indica broncoespasmo esforço-induzido.
Diagnóstico diferencial da DEI por IC: 219 , 229 , 1014 , 1018 - 1020 , 1028 - 1033 , 1035 , 1037 - 1039 , 1048 - 1056 , 1060 , 1061 , 1105
– VE/VCO 2 elevada e VO 2 máximo reduzido, correlacionados com a gravidade da IC.
– Reserva ventilatória preservada, frequentemente sem dessaturação arterial de oxigênio, indica causa cardíaca. Exceção para as cardiopatias congênitas complexas, que cursam com dessaturação.
– Relação VD/VT aumentada e EOV presente indicam pior prognóstico da IC.
Causas cardíacas e pulmonares podem se sobrepor gerando padrões mistos, refletindo efeitos secundários do distúrbio principal ou a associação das comorbidades.
Devido à COVID-19, existem pacientes cursando com dispneia e/ou intolerância ao esforço, inclusive na forma crônica da doença. Nesse contexto, devem ser cogitadas sequelas: fibrose pulmonar, tromboembolismo pulmonar, miocardite, disfunção diastólica e/ou sistólica dos ventrículos, miopatia. 1106 , 1107
5.7. Atletas e Exercitantes
Os atletas compõem uma população heterogênea. Podem ser de modalidades de alta potência aeróbica (maratonista) ou de modalidade primariamente técnica e de pouca exigência física (tiro ao alvo). 1106
O TCPE visa principalmente a:
– Determinação direta do VO 2 , o padrão-ouro na avaliação da aptidão cardiorrespiratória.
– Determinação dos limiares ventilatórios (LV1 e LV2), possibilitando prescrição individualizada e otimizada do treinamento aeróbico. 219 , 229 , 293 , 1011
5.8. Reabilitação Cardiorrespiratória
Na prescrição de exercícios de pacientes na reabilitação cardíaca, devem ser considerados principalmente:
– Determinação da aptidão cardiorrespiratória através do VO 2 máximo. 737 , 1012 , 1069 , 1070
– Os limiares ventilatórios (LV1 e LV2) para definição individualizada da zona de treinamento aeróbico. 17 , 219 , 229 , 293 , 1011
– Os limiares de claudicação de membros inferiores (inicial e absoluta), determinados em esteira ergométrica.
– Na DAP, a utilização de bicicleta ergométrica permitirá melhor avaliação cardiopulmonar.
– O limiar de isquemia e suas repercussões clínicas (angina, arritmias, hipotensão) visando a ajustes finos da terapêutica e da intensidade do exercício. 17 , 29
– Em pacientes com IAM prévio com disfunção do VE, a reabilitação aumenta a PETCO 2 associada à melhora do débito cardíaco. 1019 , 1020
6. Interpretação e Elaboração do Laudo do TCPE
A interpretação e a descrição de todas variáveis do TE devem ser incorporadas ao laudo do TCPE conforme constam nesta diretriz.
Recomenda-se constar no laudo:
– Descrição detalhada do comportamento das variáveis do TCPE, particularmente aquelas alteradas e/ou relacionadas ao motivo de solicitação do exame.
– Valores de referência das variáveis, se disponível com dados da população pertinente ao paciente (idade, sexo, raça, nível de atividade física diária etc.).
– Gráficos e tabelas das variáveis relevantes e suas respectivas interpretações, baseadas na indicação do exame e eventuais diagnósticos.
– Informações referentes à estratificação de risco/prognóstico.
Considerando que a prescrição de exercícios é de responsabilidade do médico assistente, não se recomendada a liberação automática dessa prescrição, baseada exclusivamente no TCPE.
Parte 4 – Teste Ergométrico Associado aos Métodos de Imagem em Cardiologia
1. Estresses Cardiovasculares Associado aos Métodos de Imagem em Cardiologia
Segundo a Atualização da Diretriz Brasileira de Cardiologia Nuclear, o princípio do estresse cardiovascular associado às imagens de perfusão miocárdica e ecocardiografia de estresse consiste em criar heterogeneidade de fluxo sanguíneo entre territórios vasculares irrigados por artérias coronárias normais e com lesões obstrutivas. 1109 , 1110
O TE e as provas farmacológicas, na CPM e no EcoE, são utilizados para avaliação da heterogeneidade de fluxo regional, e as imagens resultantes mostram sensibilidade e especificidade semelhantes para a detecção de DAC. 8 , 1111 , 1112
1.1. Cintilografia Perfusional Miocárdica
As duas modalidades de estresses cardiovasculares existentes (exercício físico ou vasodilatação farmacológica) mostram sensibilidade e especificidade semelhantes para a detecção de DAC pela análise das imagens de perfusão. 9 A Figura 34 apresenta organograma com ordenamento para a escolha da modalidade de estresse a ser aplicada.
Figura 34. – Escolha da modalidade de estresse a ser aplicada na cintilografia perfusional miocárdica para diagnóstico de doença arterial coronariana. BRE: bloqueio de ramo esquerdo; TE: teste ergométrico; WPW: síndrome de Wolff-Parkinson-White; FC: frequência cardíaca; * 1 Capacidade funcional para realizar atividades físicas diárias estimadas >5 METs e habilidade para execução do esforço no ergômetro disponível; * 2 Outra opção: Regadenoson (ainda não disponível no Brasil); * 3 Possibilidade de realização a critério do médico solicitante. * 4 Por ser um exame diagnóstico, necessita realizar uma nova cintilografia sob estresse farmacológico (dipiridamol ou adenosina) ou estresse combinado, visando manter a acurácia do método.
1.1.1. Metodologia do Estresse Físico – Teste Ergométrico
O estresse físico, através do TE ou TCPE, adiciona valor de diagnóstico e prognóstico aos métodos de imagem por abordar parâmetros clínicos, hemodinâmicos e eletrocardiográficos. As peculiaridades metodológicas referentes a cada um dos métodos de imagem abordadas a seguir deverão ser respeitadas e adotadas para obtenção dos melhores resultados. 9 , 762 , 1111
1.1.1.1. Contraindicações à Realização do Estresse Físico na CPM
As contraindicações à realização do estresse físico são as mesmas consideradas em relação ao teste ergométrico descritas na Parte 1, Seção 2.3 desta diretriz.
1.1.1.2. Orientações para Marcação do Estresse Físico na CPM
O preparo para o procedimento do estresse físico envolve:
– Jejum de 3 horas, com refeição leve previamente ao exame.
– Cafeína (metil-xantinas), presente em bebidas, alimentos e medicamentos, deve ser evitada 12 horas antes do exame, similarmente ao estresse com vasodilatador, considerando que alguns exames podem ser convertidos para farmacológico ou híbridos ( Anexo 3 ).
– A descontinuação de medicações que podem interferir no TE/TCPE (em especial antiarrítmicos e antianginosos: betabloqueadores, bloqueadores de canais de cálcio e nitratos) deve seguir o preconizado na Seção 1.1.6 da Parte 2 desta diretriz, sendo delegada ao médico solicitante. 1111
– Recomenda-se ao paciente trazer TE/TCPE realizados recentemente de modo a permitir melhor escolha do protocolo de esforço e comparação entre exames.
– Adotar as demais orientações para realização do TE descritas na Parte 2 desta diretriz.
1.1.1.3. Realização do Estresse Físico na CPM
Na CPM, é necessário acesso venoso prévio ao TE em um dos membros superiores para a injeção do radiofármaco. 6 A injeção deverá ser feita no pico do esforço, que poderá não corresponder à FC máxima prevista, pois deve-se levar em consideração a indicação e objetivo do exame (diagnóstico ou avaliação terapêutica) – GR-NE: IIb-C. 1111
Após essa injeção, deve-se estimular a continuidade do esforço, na mesma carga, por mais um minuto, objetivando a melhor captação miocárdica do radiotraçador. Se for inviável manter a carga, recomenda-se tentar reduzir a velocidade e/ou inclinação do ergômetro antes de interrupção abrupta. 9
Realizar a aquisição das imagens após o término da fase de estresse:
– Com a MIBI- 99 m Tc , entre 30 e 60 minutos (empregado na maioria dos serviços no Brasil).
– No caso do Tálio-201, iniciar no máximo entre 10 a 15 minutos, para evitar que o fenômeno da redistribuição seja significativo. As imagens iniciais ou de distribuição devem ser adquiridas após a injeção do radioisótopo (injeção única) e as tardias (redistribuição) após 3 a 4 horas.
A exposição à radiação pela equipe de realização do TE varia amplamente, dependendo da carga de trabalho e procedimentos de prevenção da instituição, mas a dose efetiva para os médicos executantes do TE geralmente está abaixo dos limites aceitáveis. Recomenda-se a leitura e a adoção de todos os procedimentos preconizados pela Comissão Nacional de Energia Nuclear quanto à CPM.
1.1.1.4. Interpretação do TE na CPM
Todos os marcadores de diagnóstico e prognóstico descritos nesta diretriz quanto ao TE são válidos na interpretação do TE associado à CPM e deverão constar no relatório final. O percentual da FC máxima prevista no momento de injeção do radiofármaco deverá constar do relatório para permitir análise e interpretação da CPM.
1.1.2. Metodologia das Provas Farmacológicas
As provas farmacológicas (PF) são realizadas com: vasodilatadores primários (adenosina e dipiridamol) que causam redistribuição de fluxo coronariano; vasodilatadores como a dobutamina e atropina, que provocam efeitos semelhantes aos observados no exercício com aumento do trabalho miocárdico.
As PF devem ser feitas em pacientes: com limitação física por patologias com comprometimento osteomuscular e neuromuscular impeditivos; em uso de fármacos que interferem no aumento do consumo miocárdico de oxigênio (MVO 2 ) em exames de diagnóstico; com baixa capacidade funcional; IC compensada; BRE e presença de marca-passo artificial; contraindicações para realização do TE.
1.1.2.1. Fármacos que Promovem Vasodilatação
1.1.2.1.1. Dipiridamol
O dipiridamol atua por inibição da enzima adenosina-deaminase, que degrada a adenosina endógena, além de bloquear a recaptação da adenosina pela membrana celular, com consequente aumento da concentração extracelular e vasodilatação coronária e sistêmica. Sua meia-vida biológica é de aproximadamente 45 minutos. A dose preconizada para a realização da CPM é de 0,56 miligramas por quilo por minuto (mg.kg - 1 ), até o máximo de 60 mg diluídos em 50 mL de soro fisiológico, com administração intravenosa (IV) em 4 minutos, que pode ser realizada manualmente sem bomba de infusão. O radiofármaco é administrado pelo mesmo acesso venoso, 2 a 4 minutos após o término do dipiridamol (momento de hiperemia ou vasodilatação máxima). 9 , 1109 - 1111
Os efeitos adversos dos vasodilatadores ocorrem em 50% dos pacientes com dipiridamol e em 80% com a adenosina. No dipiridamol as manifestações são revertidas com a administração de aminofilina intravenosa, na dose de 1 a 2 mg.kg - 1 até 240 mg, 2 minutos após a injeção do radiotraçador. A acurácia para a detecção de DAC é comparável entre os fármacos vasodilatores (sensibilidade e especificidade ≈80-90%) e o estresse físico no TE (sensibilidade e especificidade ≈85-90%). 1113 , 1114
1.1.2.1.2. Adenosina
A adenosina induz vasodilatação coronária por ativação específica dos receptores A 2A da membrana celular, resultando em aumento do fluxo coronário em até 4 a 5 vezes. É utilizada na dose de 140 μg.kg - 1 .min - 1 , administrada obrigatoriamente em bomba de infusão contínua em 6 minutos. O radiofármaco é injetado no 3° minuto por outra via de acesso venoso, devido à meia-vida plasmática ultracurta (2 a 10 segundos), sendo a infusão continuada por mais 3 minutos.
Quando o paciente é muito sintomático ou com alterações isquêmicas no início da infusão da adenosina, pode-se optar por protocolo mais curto de 4 minutos de infusão que mostrou capacidade de detectar isquemia e DAC; o radiofármaco é injetado no 2º minuto e a infusão da adenosina continuada por mais 2 minutos.
Observação clínica e registros de ECG, da PA e FC devem ser contínuos durante e alguns minutos após a prova farmacológica com os vasodilatadores.
Preparo para o procedimento:
– Jejum de 3 horas.
– Evitar o consumo de qualquer produto (alimento ou bebida) contendo metilxantinas (inibidores competitivos dos receptores de adenosina), incluindo café, chás, chocolates, energéticos, refrigerantes ou outras bebidas contendo cafeína, medicamentos (analgésicos, antigripais, relaxantes musculares e anti-inflamatórios que contenham cafeína) nas 12 horas antes do exame.
– No caso de uso de adenosina, a suspensão deve ser por pelo menos 12 horas 1111 antes do exame e, no caso do dipiridamol, por pelo menos 24 horas. 9
– Teofilina deve ser suspensa pelo menos 12 horas antes do exame.
– No uso da adenosina, são necessários dois acessos venosos periféricos: uma via para adenosina e outra para injeção do radiofármaco. No dipiridamol, é necessária apenas uma via de acesso.
– Bomba de infusão para administração da adenosina em dose constante e facultativa no dipiridamol.
– Aminofilina (dose de 1 a 2 mg.kg -1 ou 72 mg a 240 mg) deve ficar prontamente disponível para reversão dos efeitos colaterais graves dos estresses com vasodilatador. No caso de efeitos adversos pelo dipiridamol, utilizar a aminofilina após 2 minutos da injeção do traçador.
Contraindicações: 1110 , 1111 , 1115
1) Relativas: história de doença pulmonar reativa sem crises nos últimos 3 meses; doença do nó sinusal; bradicardia sinusal acentuada; doença carotídea grave bilateral.
2) Absolutas: broncoespasmo em atividade; estado de mal asmático; crises de hiper-reatividade recentes (<3 meses); bloqueio atrioventricular de 2º ou 3º graus sem marca-passo; hipotensão arterial sistólica (<90 mmHg); AVC ou AIT recentes (<2 meses); uso recente (<24 horas) de dipiridamol em pacientes que receberão adenosina.
1.1.2.2. Fármacos que Promovem a Elevação do Consumo de Oxigênio Miocárdico
Esses fármacos representam alternativa para os pacientes que não podem submeter-se ao TE ou provas farmacológicas com dipiridamol ou adenosina. O mais utilizado é a dobutamina, cuja ação é predominante nos receptores beta-1 (ß-1) adrenérgicos com estimulações inotrópica e cronotrópica, menor efeito sobre os receptores beta-2 (ß-2), com resposta de vasodilatação periférica dependente da dose infundida. Produz aumento do débito cardíaco, da FC e da PAS, levando ao aumento do MVO 2 e, consequentemente, à vasodilatação coronariana.
A administração intravenosa da dobutamina é feita em bomba de infusão com dose inicial de 5-10 μg.kg -1 .min -1 por 3 minutos, seguindo-se por doses incrementais de 20 μg.kg -1 .min -1 , 30 μg.kg -1 .min -1 até o máximo de 40 μg.kg -1 .min -1 . 1116 Nos pacientes que não alcançarem a FC submáxima e sem evidências de isquemia, pode-se associar atropina intravenosa na dose de 0,25 a 2 mg. 1110 Se necessário, adicionar manobras de esforço “ handgrip ” (p. ex., compressão manual de uma bola de tênis). O uso precoce de atropina após a fase inicial da dobutamina mostrou-se seguro, reduziu o tempo de infusão e as queixas do paciente durante o estresse, sem alterar a acurácia do exame. 1117
O radiotraçador é injetado na FCpico, com infusão de dobutamina que deve ser continuada por mais 1 minuto.
Durante todo o exame, devem ser monitorados os sinais e sintomas clínicos e registrados ECG, PA e FC. Para a reversão dos efeitos adversos, betabloqueadores de ação curta (p. ex., metoprolol, esmolol) podem ser injetados via intravenosa após o primeiro minuto da injeção do radiotraçador.
Preparo para o procedimento:
– Jejum de 3 horas.
– Descontinuar o uso de betabloqueador por 48 a 72 horas antes da prova com dobutamina.
– Acesso venoso periférico para infusão da dobutamina e radiotraçador.
– Utilizar bomba de infusão para a administração da dobutamina.
– Metoprolol (dose de 5 mg) deve ficar prontamente disponível para reversão dos efeitos colaterais graves da dobutamina, sendo contraindicado em pacientes com história prévia de broncoespasmos graves e na DPOC. Nesses pacientes, preferir o uso do esmolol (em dose única entre 100 e 200 mg) por ser um betabloqueador cardiosseletivo.
Contraindicações:
1) Relativas: aneurismas de aorta abdominal (>5cm de diâmetro), presença de trombos em ventrículo esquerdo, fração de ejeção de VE <25% (aumento de risco de arritmias ventriculares).
2) Absolutas : arritmias cardíacas (fibrilação atrial ou taquicardia ventricular sustentada ou não), estenose aórtica grave, cardiomiopatia hipertrófica obstrutiva, hipotensão sistólica (<90 mmHg), hipertensão arterial sistêmica (>200 mmHg), angina instável ou IAM recente, aneurismas ou dissecção aórtica, insuficiência vascular cerebral sintomática, presença de CDI, alterações metabólicas do potássio. 9
1.1.3. Metodologia do Estresse Combinado
É ideal para pacientes que tenham limitação de exercitar-se ou estão em uso de medicações que impedem o aumento da FC. O estresse combinado não é recomendado em pacientes com bloqueio de ramo esquerdo, WPW e marca-passo.
A associação dos vasodilatadores ao exercício com baixa carga de trabalho (p. ex., até o segundo estágio do protocolo de Bruce ou até ligeiro cansaço) tem evidenciado redução da atividade subdiafragmática (hepática) e melhora na qualidade das imagens. 1118 Também contribui para a diminuição da ocorrência e intensidade dos efeitos adversos do dipiridamol ou adenosina.
Na combinação de baixo nível de exercício com dipiridamol, em pacientes selecionados, pode ser empregado o primeiro estágio do protocolo de Bruce modificado (1,7 mph e 0% de inclinação) por 4 a 6 minutos, logo após a infusão do dipiridamol. O radiofármaco é então injetado durante o esforço, que deve continuar por mais 2 minutos para permitir adequada captação miocárdica, reduzindo os efeitos colaterais e melhorando a qualidade das imagens. Quanto ao preparo para o procedimento, observar as orientações prévias referentes ao estresse físico e com fármacos que promovem vasodilatação.
1.1.4. Novos Fármacos
O agonista seletivo do receptor A 2A que promove vasodilatação coronariana (regadenoson) tem evidenciado hiperemia coronariana adequada e menor intensidade de efeitos sistêmicos (dor torácica e bloqueios atrioventriculares). O regadenoson, ainda não está disponível no Brasil, tem meia-vida biológica curta (2 a 4 minutos na primeira fase), diminui o tempo do exame, minimiza e limita a duração dos efeitos adversos. Pode ser utilizado em pacientes com DPOC ou asma. 1119
A dose intravenosa recomendada do regadenoson é de 0,4 mg (não requer ajuste em relação ao peso), em veia periférica, seguida de flush de 5 mL de solução fisiológica e, após 10 a 20 segundos, administrar o radiofármaco. 1120
1.2. Ecocardiografia sob Estresse
As modalidades de estresse foram comparadas anteriormente nesta diretriz, inclusive quanto aos seus efeitos fisiológicos, resposta hemodinâmica e contraindicações ( Tabela 18 ). Na maioria dos pacientes adultos capazes de se exercitarem, o estresse físico (TE) é considerado a modalidade de escolha para avaliação de isquemia miocárdica.
1.2.1. Metodologia 8,260,265,1121,1122
Inicialmente, deve-se realizar ecocardiograma basal (EcoB) em repouso, antes do início do estresse, incluindo: avaliação da estrutura cardíaca (tamanhos das câmaras e espessura das paredes); análise das valvas cardíacas e seus gradientes; função ventricular segmentar e global.
O EcoB também visa investigar possíveis causas para a sintomatologia do paciente (p. ex., dissecção aórtica) e identificar qualquer condição que possa tornar o estresse inseguro (p. ex., valvopatia grave em paciente sintomático). Nessas circunstâncias, deve-se avaliar criteriosamente a possibilidade de adiamento ou cancelamento do exame sob estresse.
A aquisição, a análise e a interpretação dos dados ecocardiográficos (basal e estresse) deverão seguir o preconizado pelas entidades internacionais 260,265,1121 e diretrizes da SBC: Posicionamento sobre Indicações da Ecocardiografia em Adultos; 8 Posicionamento sobre Indicações da Ecocardiografia em Cardiologia Fetal, Pediátrica e Cardiopatias Congênitas do Adulto; 1121 Normatização dos Equipamentos e Técnicas de Exame para Realização de Exames Ecocardiográficos. 1122
As imagens obtidas em repouso serão comparadas com as obtidas durante e após o estresse. A obtenção de dados em vários ciclos cardíacos no pico de estresse aumenta a precisão da interpretação do exame. Recomenda-se a gravação contínua das imagens de repouso e estresse.
No estresse em esteira, as imagens obtidas em repouso e imediatamente após o exercício devem ser comparadas lado a lado (usando o formato de tela quádrupla). No estresse farmacológico, as imagens no pico de estresse devem ser comparadas com os estágios de repouso, dose baixa e pré-pico ou de recuperação precoce (também utilizando o formato de tela quádrupla).
As imagens ecocardiográficas são geralmente realizadas a partir das incidências paraesternal de eixo longo e curto, e apical de duas e quatro câmaras. Em alguns casos, podem ser utilizados os planos subcostal e apical de eixo longo. Outras incidências e manobras poderão ser necessárias de acordo com a patologia investigada.
A viabilidade é indicada pelo desenvolvimento de espessamento miocárdico ao estresse em segmentos acentuadamente hipocinéticos e acinéticos no repouso. Para a adequada determinação da viabilidade, é necessária observação cuidadosa do espessamento miocárdico desde níveis menores de estresse e evitar que ocorra um rápido aumento da FC com isquemia associada.
Alterações anormais da função diastólica podem ocorrer antes das anormalidades da motilidade sistólica da parede. Quando a detecção de isquemia é o objetivo primário do exame, recomenda-se registrar os parâmetros diastólicos próximo ao pico do esforço ou após a avaliação do movimento da parede.
A avaliação com Doppler em cores da regurgitação mitral na EcoB e durante o pico do esforço pode permitir a detecção de regurgitação mitral isquêmica.
O EcoE tem acurácia semelhante à da tomografia por emissão de pósitrons na detecção de disfunção reversível em pacientes com miocárdio hibernante.
1.2.1.1. Metodologia do Estresse Físico 8,1123
O estresse físico pode ser realizado empregando-se esteira ou cicloergômetro, de acordo com protocolos convencionais para o TE. Na esteira, o protocolo mais empregado é o de Bruce, com as imagens ecocardiográficas sendo adquiridas em repouso e imediatamente após o término do esforço.
No cicloergômetro o paciente pode manter-se em posição vertical (em bicicleta ergométrica) ou em posição supina (cicloergômetro de maca/maca ergométrica). No cicloergômetro de maca com rotação lateral, o paciente pedala em posição inclinada, permitindo maior adaptação do paciente e obtenção de imagens ecocardiográficas de melhor qualidade. O protocolo de esforço mais utilizado (protocolo de Astrand) inicia-se com a carga de 25W com aumento progressivo de 25W a cada 2 ou 3 minutos ( Figura 35 ).
Figura 35. – Representação do ecocardiograma sob estresse físico em cicloergômetro. PA: medida da pressão arterial sistémica; ECG: registro do eletrocardiograma; ECO: ecocardiograma; min: minuto.
A preparação da pele e o local de colocação dos eletrodos para monitorização eletrocardiográfica são os mesmos padronizados para realização do TE. As derivações poderão ser levemente deslocadas (para cima e para baixo), caso estejam interferindo nas janelas acústicas necessárias à realização do ecocardiograma.
Deve-se registrar um ECG de 12 derivações em repouso e a cada 2 minutos (ou estágio do esforço) ao longo do exame (esforço e recuperação). Uma derivação do ECG deverá ser exibida continuamente no monitor do ecocardiógrafo para fornecer referência sobre alterações do segmento ST e arritmias.
A pressão arterial deverá ser medida em repouso, a cada estágio do protocolo de esforço e na recuperação.
A análise e a interpretação dos dados quanto a FC, PA, escores (pré e pós-teste), registros eletrocardiográficos e aptidão cardiorrespiratória são similares às realizadas no TE. Recomenda-se a correlação desses dados aos achados ecocardiográficos.
Embora alguns serviços encerrem o esforço ao se atingir 85% da FC máxima prevista para a idade, recomenda-se a continuidade do esforço até o desenvolvimento de exaustão física (Escala de Borg ≥18) ou que surjam critérios absolutos para a interrupção. Atingir a FC máxima prevista aumenta a sensibilidade do exame e pode revelar anormalidades que ocorreriam apenas com alta carga de trabalho. 8,260,1123
1.2.1.2. Metodologia do Estresse Farmacológico
1.2.1.2.1. Dobutamina 260,1123
O estresse farmacológico com dobutamina (ou dobutamina associada à atropina) é a modalidade alternativa mais utilizada para avaliação de isquemia miocárdica quando o paciente não consegue se exercitar. 1124
A dobutamina geralmente é administrada em doses graduadas, começando em 5 μg.kg -1 .min -1 , com aumentos em intervalos de 3 minutos para 10, 20, 30 e 40 μg.kg -1 .min -1 . As doses de 20 ou 30 μg.kg -1 .min -1 de dobutamina geralmente permitem alcançar a FC alvo (85% da FC máxima prevista para a idade) mais rapidamente e com menos efeitos colaterais, principalmente se a FC não estiver aumentando conforme o esperado.
O uso de dobutamina em baixa dose inicial (2,5 μg.kg -1 .min -1 ) pode facilitar o reconhecimento da viabilidade miocárdica em segmentos anormais no EcoB.
Em pacientes betabloqueados e/ou nos quais não se atingiu a FC máxima prevista, ocorre redução da sensibilidade do EcoE na detecção de isquemia. Nesses casos, a atropina pode ser administrada visando atingir a FC, utilizando doses de 0,25 a 0,50 mg, em intervalos de 1 minuto, conforme necessário (dose total máxima de 2,0 mg). Recomenda-se utilizar a menor dosagem possível para evitar efeitos colaterais, incluindo toxicidade do sistema nervoso central. 1125
Nos idosos, pacientes com pequeno porte corporal e naqueles que já estão próximos da FC máxima prevista, recomenda-se o uso de atropina em dose de 0,25 mg. Também é recomendada uma dose total <1,0 mg em pacientes neuropsiquiátricos, hepatopatas ou com índice de massa corporal inferior a 24 kg/m 2 .
Os desfechos para o término de estresse farmacológico incluem atingir a FC alvo, hipotensão, anormalidades da movimentação de parede do VE (novas ou agravadas), arritmias complexas, hipertensão grave e sintomas intoleráveis.
1.2.1.2.2. Vasodilatadores 260,1123
Testes de estresse com vasodilatadores (dipiridamol ou adenosina) induzem ao aumento do fluxo coronariano e são utilizados preferencialmente para avaliação de perfusão miocárdica. 1126 Também podem ser realizados para avaliação de isquemia e viabilidade miocárdica. A EcoE com vasodilatador tem menor sensibilidade para detecção de DAC do que quando realizada com estresse físico e/ou dobutamina-atropina.
Os agentes vasodilatadores são contraindicados em pacientes com obstrução reativa das vias aéreas, síndrome coronariana aguda instável ou complicada, arritmias cardíacas graves (TV e BAVT) ou hipotensão grave.
O dipiridamol geralmente é administrado em doses de até 0,84 mg/kg, durante 6 a 10 minutos. A administração de atropina ou realização de exercício de preensão manual no pico de infusão aumenta a sensibilidade do exame. 1127
A adenosina em conjunto com ecocardiografia com contraste também pode ser empregada para avaliação de perfusão miocárdica. A taxa de infusão de adenosina é de 140 µg/kg/min, durante 4 a 6 minutos. A adenosina tem uma meia-vida mais curta e, portanto, tempo de ação mais curto que o dipiridamol.
1.2.1.3. Agentes de Realce Ultrassonográfico
Existem três agentes de realce ultrassonográfico com microbolhas comercialmente disponíveis no mundo ( Sonovue ® , Definity ® e Optison ® ), utilizados para melhorar o delineamento da borda endocárdica, a qualidade das imagens e a detecção de DAC pelo EcoE. A administração (seja por bolus ou infusão contínua) visa opacificar toda a cavidade do VE, sem artefatos de redemoinho no ápice ou atenuação dos segmentos basais por sombra acústica. Podem ser, ainda, utilizados como marcadores de perfusão miocárdica.
O uso desses agentes em adultos é seguro, sendo muito rara a ocorrência de reações anafiláticas, mas não é recomendado em gestantes. Os protocolos específicos de administração encontram-se nas diretrizes da ASE de 2018. 1128
Tabela 27. – Duke database – Estimativa de risco para probabilidade pré-teste de DAC obstrutiva de acordo com classificação de angina 322 .
| Idade (anos) | Sem angina | Angina atípica | Angina típica | |||
|---|---|---|---|---|---|---|
| Homens | Mulheres | Homens | Mulheres | Homens | Mulheres | |
| 35 | 3 a 35 | 1 a 19 | 8 a 59 | 2 a 39 | 30 a 88 | 10 a 78 |
| 45 | 9 a 47 | 2 a 22 | 21 a 70 | 5 a 43 | 51 a 92 | 20 a 79 |
| 55 | 23 a 59 | 4 a 21 | 45 a 79 | 10 a 47 | 80 a 95 | 38 a 82 |
| 65 | 49 a 69 | 9 a 29 | 71 a 86 | 20 a 51 | 93 a 97 | 56 a 84 |
| O intervalo apresenta probabilidade de DAC que varia de pacientes de baixo risco (sem diabetes mellitus, não tabagistas ou dislipidemia) até pacientes de alto risco. | ||||||
Tabela 43. – Valores de referência do VO 2 pico, pulso de oxigênio e curva VE/VCO 2 no TCPE .
| Variáveis | Idade | Homens | Mulheres |
|---|---|---|---|
| VO 2 pico (mL/min) | 20-29 | 3,250-2,970 | 2,000-1,840 |
| 30-39 | 2,950-2,690 | 1,820-1,660 | |
| 40-49 | 2,670-2,400 | 1,640-1,490 | |
| 50-59 | 2,380-2,130 | 1,470-1,320 | |
| 60-69 | 2,110-1,840 | 1,300-1,140 | |
| 70-80 | 1,820-1,570 | 1,120-0,940 | |
| Pulso de oxigênio (mL/bpm) | 20-29 | 16,2-15,6 | 10,0-9,6 |
| 30-39 | 15,5-14,9 | 9,6-9,2 | |
| 40-49 | 14,8-14,1 | 9,1-8,7 | |
| 50-59 | 14,0-13,2 | 8,6-8,2 | |
| 60-69 | 13,1-12,2 | 8,1-7,5 | |
| 70-80 | 12,1-11,1 | 7,4-6,7 | |
| Relação VE/VCO 2 | 20-39 | 23,4-25,7 | 26,8-28,3 |
| 40-59 | 25,8-28,1 | 28,4-29,9 | |
| 60-80 | 28,2-30,6 | 30,0-31,6 | |
| Adaptada de Mezzani A. et al. 229 “Cardiopulmonary Exercise Testing: Basics of Methodology and Measurements”. | |||
Tabela 44. – Valores de referência e interpretação das principais variáveis do TCPE .
| Variáveis | Normal | Alterado/comprometimento | ||
|---|---|---|---|---|
| Leve | Moderado | Grave | ||
| %VO 2 pico previsto | ≥100% | 75-99% | 50-74% | <50% |
| %VO 2 pico previsto no LV1 | 40-80% | <40% | ||
| Relação VE/VCO 2 | <30 | 30-35,9 | 36-45 | >45 |
| Pulso de oxigênio no esforço | Aumento | Platô precoce ou diminuição* | ||
| Reserva respiratória | ≥30% | <30%** | ||
| EOV | Ausente | Presente | ||
| VO 2 LV1 | ≥40% VO 2 pico previsto ou 40-60% VO 2 pico medido | <40% VO 2 pico previsto ou do VO 2 pico medido | ||
| PETCO 2 LV1 | Aumento de 3 a 8 mmHg em relação ao valor de repouso | Aumento <3 ou >8 mmHg em relação ao valor de repouso | ||
| EOV: ventilação oscilatória ao esforço; VCO 2 : produção de CO 2 ; VE: ventilação pulmonar; VO 2 : consumo de oxigênio; LV1: 1 º limiar ventilatório. PETCO 2 : pressão parcial expiratória final de dióxido de carbono. *Platô antes do VO 2 máximo. ** Em caso de doença pulmonar. Adaptada de: Marcadet DM et al. 4 “French Society of Cardiology guidelines on exercise tests (part 1): Methods and interpretation” e de Mezzani A, et al. 229 “Cardiopulmonary Exercise Testing: Basics of Methodology and Measurements”. | ||||
*Material suplementar
Para informação adicional, por favor, clique aqui
Footnotes
Realização: Departamento de Ergometria, Exercício, Cardiologia Nuclear e Reabilitação Cardiovascular (DERC) da Sociedade Brasileira de Cardiologia (SBC)
Conselho de Normatizações e Diretrizes responsável: Carisi Anne Polanczyk (Coordenadora), Humberto Graner Moreira, Mário de Seixas Rocha, Jose Airton de Arruda, Pedro Gabriel Melo de Barros e Silva – Gestão 2022-2023
Nota: Estas Diretrizes se prestam a informar e não a substituir o julgamento clínico do médico que, em última análise, deve determinar o tratamento apropriado para seus pacientes.
Referências
- 1.Meneghelo RS, Araújo CG, Stein R, Mastrocolla LE, Albuquerque PF, Serra SM, et al. III Diretrizes da Sociedade Brasileira de Cardiologia sobre Teste Ergométrico. Arq Bras Cardiol . 2010;95(5) Suppl 1:1–26. doi: 10.1590/S0066-782X2010000800001. [DOI] [PubMed] [Google Scholar]
- 2.Andrade J, Brito FS, Vilas-Boas F, Castro I, Oliveira JA, Guimarães JI, et al. II Diretrizes da Sociedade Brasileira de Cardiologia Sobre Teste Ergométrico. Arq Bras Cardiol . 2002;78(suppl 2) doi: 10.1590/S0066-782X2002000800001. [DOI] [PubMed] [Google Scholar]
- 3.Guazzi M, Arena R, Halle M, Piepoli MF, Myers J, Lavie CJ. 2016 Focused Update: Clinical Recommendations for Cardiopulmonary Exercise Testing Data Assessment in Specific Patient Populations. Circulation . 2016;133(24):e694–e711. doi: 10.1161/CIR.0000000000000406. [DOI] [PubMed] [Google Scholar]
- 4.Marcadet D-M, Pavy B, Bosser G, Claudot F, Corone S, Douard H, et al. French Society of Cardiology guidelines on exercise tests (part 1): Methods and interpretation. Arch Cardiovasc. Dis . 2018;111(12):782–790. doi: 10.1016/j.acvd.2018.05.005. [DOI] [PubMed] [Google Scholar]
- 5.Smarz K, Jaxa-Chamiec T, Chwyczko T, Glówczynska R, Jegier A, Niedoszytko P, et al. Cardiopulmonary exercise testing in adult cardiology - expert opinion of the Working Group of Cardiac Rehabilitation and Exercise Physiology of the Polish Cardiac Society. Kardiol Pol . 2019 7-8;77:730–756. doi: 10.33963/KP.14889. [DOI] [PubMed] [Google Scholar]
- 6.Fletcher GF, Ades PA, Kligfield P, Arena R, Balady GJ, Bittner VA, et al. Exercise Standards for Testing and Training: A Scientific Statement From the American Heart Association. Circulation . 2013;128(8):873–934. doi: 10.1161/CIR.0b013e31829b5b44. [DOI] [PubMed] [Google Scholar]
- 7.Conselho Federal de Medicina . Diário Oficial da União . Brasília: Jan 24, 2019. Resolução 2.221 de 23/11/2018. Homologa a Portaria CMF n.1/2018, que atualiza a relação de especialidades e áreas de atuação médicas aprovadas pela Comissão Mista de Especialidades. [Google Scholar]
- 8.Barberato SH, Romano MMD, Beck AL de S, Rodrigues ACT, Almeida ALC de, Assunção BMBL, et al. Position Statement on Indications of Echocardiography in Adults - 2019. Arq Bras Cardiol . 2019;113(1):135–181. doi: 10.5935/abc.20190129. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Mastrocola LE, Amorim BJ, Vitola JV, Brandão SCS, Grossman GB, Lima R de SL, et al. Atualização da Diretriz Brasileira de Cardiologia Nuclear - 2020. Arq Bras Cardiol . 2020;114(2):325–429. doi: 10.36660/abc.20200087. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Min JK, Gilmore A, Jones EC, Berman DS, Stuijfzand WJ, Shaw LJ, et al. Cost-effectiveness of diagnostic evaluation strategies for individuals with stable chest pain syndrome and suspected coronary artery disease. Clin Imaging . 2017;43:97–105. doi: 10.1016/j.clinimag.2017.01.015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Carmo PB, Magliano CA, Rey HCV, Camargo GC, Trocado LFL, Gottlieb I. Análise da Custo-Efetividade da Angiotomografia Coronariana no SUS, em Comparação com Outros Métodos Não Invasivos na Suspeita de DAC Estável. Arq Bras Cardiol . 2021;118(3):578–585. doi: 10.36660/abc.20201050. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Gibbons RJ, Balady GJ, Bricker T, Chaitman B, Fletcher GF, Froelicher VF, et al. ACC/AHA 2002 Guideline update for exercise testing: summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Update the 1997 Exercise Testing Guidelines. Circulation . 2002;106(14):1883–1892. doi: 10.1161/01.CIR.0000034670.06526.15. [DOI] [PubMed] [Google Scholar]
- 13.American College of Sports Medicine. Liguori G, Feito Y, Fountaine C, Roy B.editors . ACSM's guidelines for exercise testing and prescription . 11th ed. Philadelphia: Wolters Kluwer; 2021. 541p. ISBN:1975150198. [Google Scholar]
- 14.Marcadet DM, Pavy B, Bosser G, Claudot F, Corone S, Douard H, et al. French Society of Cardiology guidelines on exercise tests (part 2): Indications for exercise tests in cardiac diseases. Arch Cardiovasc Dis . 2019;112(1):56–66. doi: 10.1016/j.acvd.2018.07.001. [DOI] [PubMed] [Google Scholar]
- 15.Mezzani A, Hamm LF, Jones AM, McBride PE, Moholdt T, Stone JA, et al. Aerobic exercise intensity assessment and prescription in cardiac rehabilitation: a joint position statement of the European Association for Cardiovascular Prevention and Rehabilitation, the American Association of Cardiovascular and Pulmonary Rehabilitation and the Canadian Association of Cardiac Rehabilitation. Eur J Prev Cardiol . 2013;20(3):442–467. doi: 10.1177/2047487312460484. [DOI] [PubMed] [Google Scholar]
- 16.Hansen D, Abreu A, Ambrosetti M, Cornelissen V, Gevaert A, Kemps H, et al. Exercise intensity assessment and prescription in cardiovascular rehabilitation and beyond: why and how: a position statement from the Secondary Prevention and Rehabilitation Section of the European Association of Preventive Cardiology. Eur J Prev Cardiol . 2022;29(1):230–245. doi: 10.1093/eurjpc/zwab007. [DOI] [PubMed] [Google Scholar]
- 17.Pelliccia A, Sharma S, Gati S, Bäck M, Börjesson M, Caselli S, et al. 2020 ESC Guidelines on sports cardiology and exercise in patients with cardiovascular disease. Eur Heart J . 2021;42(1):17–96. doi: 10.1093/eurheartj/ehaa605. [DOI] [PubMed] [Google Scholar]
- 18.Guazzi M, Wilhelm M, Halle M, Van Craenenbroeck E, Kemps H, de Boer RA, et al. Exercise testing in heart failure with preserved ejection fraction: an appraisal through diagnosis, pathophysiology and therapy - A clinical consensus statement of the Heart Failure Association and European Association of Preventive Cardiology of the European Society of Cardiology. Eur J Heart Fail . 2022;24(8):1327–1345. doi: 10.1002/ejhf.2601. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Martignon C, Pedrinolla A, Ruzzante F, Giuriato G, Laginestra FG, Bouça-Machado R, et al. Guidelines on exercise testing and prescription for patients at different stages of Parkinson's disease. Aging Clin Exp Res . 2021;33(2):221–246. doi: 10.1007/s40520-020-01612-1. [DOI] [PubMed] [Google Scholar]
- 20.Oliveira GMM, Brant LCC, Polanczyk CA, Malta DC, Biolo A, Nascimento BR, et al. Estatística Cardiovascular - Brasil 2021. Arq Bras Cardiol . 2022;118(1):115–373. doi: 10.36660/abc.20211012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.American Board of Internal Medicine Foundation. American Society of Nuclear Cardiology [Accessed June 11, 2022]; Stress Tests for Chest Pain. Choosing Wisely 2017 . https://www.choosingwisely.org/patient-resources/stress-tests-for-chest-pain/ [Google Scholar]
- 22.Prasad DS, Kabir Z, Revathi Devi K, Peter PS, Das BC. Prevalence and RIsk factors for Silent Myocardial ischemia (PRISM): A clinico observational study in patients of type 2 diabetes. Indian Heart J . 2019;71(5):400–405. doi: 10.1016/j.ihj.2019.12.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Pereira WVC, Vancea DMM, de Andrade Oliveira R, de Freitas YGPC, Lamounier RN, Silva WS, Júnior, et al. 2022: Position of Brazilian Diabetes Society on exercise recommendations for people with type 1 and type 2 diabetes. 2 Diabetol Metab Syndr . 2023;15(1) doi: 10.1186/s13098-022-00945-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Bourque JM, Beller GA. Value of exercise ECG for risk stratification in suspected or known CAD in the era of advanced imaging technologies. JACC Cardiovasc Imaging . 2015;8(11):1309–1321. doi: 10.1016/j.jcmg.2015.09.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Gulati M, Levy PD, Mukherjee D, Amsterdam E, Bhatt DL, Birtcher KK, et al. 2021 AHA/ACC/ASE/CHEST/SAEM/SCCT/SCMR Guideline for the Evaluation and Diagnosis of Chest Pain: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation . 2021;144(22):e368–e454. doi: 10.1161/CIR.0000000000001029. [DOI] [PubMed] [Google Scholar]
- 26.Cesar L, Ferreira J, Armaganijan D, Gowdak L, Mansur A, Bodanese L, et al. Guideline For Stable Coronary Artery Disease. Arq Bras Cardiol . 2014;103(2) Suppl 2:1–56. doi: 10.5935/abc.2014S004. [DOI] [PubMed] [Google Scholar]
- 27.Knuuti J, Wijns W, Saraste A, Capodanno D, Barbato E, Funck-Brentano C, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J . 2020;41(3):407–477. doi: 10.1093/eurheartj/ehz425. [DOI] [PubMed] [Google Scholar]
- 28.Rozanski A, Berman D. Optimizing the Assessment of Patient Clinical Risk at the Time of Cardiac Stress Testing. JACC Cardiovasc Imaging . 2020;13(2):616–623. doi: 10.1016/j.jcmg.2019.01.038. Pt 2. [DOI] [PubMed] [Google Scholar]
- 29.Carvalho T, Milani M, Ferraz AS, Silveira AD, Herdy AH, Hossri CAC, et al. Diretriz Brasileira de Reabilitação Cardiovascular - 2020. Arq Bras Cardiol . 2020;114(5):943–987. doi: 10.36660/abc.20200407. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J . 2021;42(34):3227–3337. doi: 10.1093/eurheartj/ehab484. [DOI] [PubMed] [Google Scholar]
- 31.Fihn SD, Blankenship JC, Alexander KP, Bittl JA, Byrne JG, Fletcher BJ, et al. 2014 ACC/AHA/AATS/PCNA/SCAI/STS Focused Update of the Guideline for the Diagnosis and Management of Patients With Stable Ischemic Heart Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines, and the American Association for Thoracic Surgery, Preventive Cardiovascular Nurses Association, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. Circulation . 2014;130(19):1749–1767. doi: 10.1161/CIR.0000000000000095. [DOI] [PubMed] [Google Scholar]
- 32.Yiadom MYAB, Kosowsky JM. Management Strategies for Patients with Low-Risk Chest Pain in the Emergency Department. Curr Treat Options Cardiovasc Med . 2011;13(1):57–67. doi: 10.1007/s11936-010-0108-3. [DOI] [PubMed] [Google Scholar]
- 33.Nicolau JC, Feitosa GS, Petriz JL, Furtado RH, Précoma DB, Lemke W, et al. Diretrizes da Sociedade Brasileira de Cardiologia sobre Angina Instável e Infarto Agudo do Miocárdio sem Supradesnível do Segmento ST - 2021. Arq Bras Cardiol . 2021;117(1):181–264. doi: 10.36660/abc.20210180. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Ghorayeb N, Stein R, Daher DJ, Silveira AD, Ritt LEF, Santos DFP, et al. The Brazilian Society of Cardiology and Brazilian Society of Exercise and Sports Medicine Updated Guidelines for Sports and Exercise Cardiology - 2019. Arq Bras Cardiol . 2019;112(3):326–368. doi: 10.5935/abc.20190048. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Gulati M, Levy PD, Mukherjee D, Amsterdam E, Bhatt DL, Birtcher KK, et al. 2021 AHA/ACC/ASE/CHEST/SAEM/SCCT/SCMR Guideline for the Evaluation and Diagnosis of Chest Pain. J Am Coll Cardiol . 2021;78(22):e187–e285. doi: 10.1016/j.jacc.2021.07.053. [DOI] [PubMed] [Google Scholar]
- 36.O'Gara PT, Kushner FG, Ascheim DD, Casey DE, Chung MK, de Lemos JA, et al. 2013 ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation . 2013;127(4):e362–e425. doi: 10.1161/CIR.0b013e3182742cf6. [DOI] [PubMed] [Google Scholar]
- 37.Klimis H, Ferkh A, Brown P, Zecchin R, Altman M, Thomas L. Determinants of Exercise Capacity Following ST-Elevation Myocardial Infarction (STEMI) J Cardiovasc Dev Dis . 2021;8(11):140. doi: 10.3390/jcdd8110140. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Lachman S, Terbraak MS, Limpens J, Jorstad H, Lucas C, Scholte op Reimer W, et al. The prognostic value of heart rate recovery in patients with coronary artery disease: A systematic review and meta-analysis. Am Heart J . 2018 May;199:163–169. doi: 10.1016/j.ahj.2018.02.008. [DOI] [PubMed] [Google Scholar]
- 39.Virani SS, Newby LK, Arnold SV, Bittner V, Brewer LC, Demeter SH, et al. 2023 AHA/ACC/ACCP/ASPC/NLA/PCNA Guideline for the Management of Patients With Chronic Coronary Disease: A Report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation . 2023;148 doi: 10.1161/CIR.0000000000001168. [DOI] [PubMed] [Google Scholar]
- 40.Marx N, Federici M, Schütt K, Müller-Wieland D, Ajjan RA, Antunes MJ, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. European Heart Journal . 2023:ehad192. doi: 10.1093/eurheartj/ehad192. [DOI] [PubMed] [Google Scholar]
- 41.Dun Y, Wu S, Cui N, Thomas RJ, Olson TP, Zhou N, et al. Screening for Asymptomatic Coronary Artery Disease via Exercise Stress Testing in Patients With Type 2 Diabetes Mellitus: A Systematic Review and Meta-Analysis. 770648 Front Cardiovasc Med . 2021 Nov 1;8 doi: 10.3389/fcvm.2021.770648. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Reynolds HR, Diaz A, Cyr DD, Shaw LJ, Mancini GBJ, Leipsic J, et al. Ischemia With Nonobstructive Coronary Arteries. JACC Cardiovasc Imaging . 2023;16(1):63–74. doi: 10.1016/j.jcmg.2022.06.015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Bhatia LC, Singal R, Jain P, Mishra N, Mehra V. Detection of Silent Myocardial Ischaemia in Asymptomatic Diabetic Patients during Treadmill Exercise Testing. High Blood Press Cardiovasc Prev . 2012;19(3):137–142. doi: 10.1007/BF03262463. [DOI] [PubMed] [Google Scholar]
- 44.Beijk MA, Vlastra WV, Delewi R, van de Hoef TP, Boekholdt SM, Sjauw KD, et al. Myocardial infarction with non-obstructive coronary arteries: a focus on vasospastic angina. Neth Heart J . 2019;27(5):237–245. doi: 10.1007/s12471-019-1232-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Montalescot G, Sechtem U, Achenbach S, Andreotti F, Arden C, Budaj A, et al. (Task Force Members) 2013 ESC Guidelines on the management of stable coronary artery disease: The Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J . 2013;34(38):2949–3003. doi: 10.1093/eurheartj/eht296. [DOI] [PubMed] [Google Scholar]
- 46.Aizenberg DJ. Cardiovascular Testing in Asymptomatic Patients. Med Clin North Am . 2016;100(5):971–979. doi: 10.1016/j.mcna.2016.04.004. [DOI] [PubMed] [Google Scholar]
- 47.Jonas DE, Reddy S, Middleton JC, Barclay C, Green J, Baker C, et al. Screening for Cardiovascular Disease Risk With Resting or Exercise Electrocardiography: Evidence Report and Systematic Review for the US Preventive Services Task Force. JAMA . 2018;319(22):2315–2328. doi: 10.1001/jama.2018.6897. [DOI] [PubMed] [Google Scholar]
- 48.Timmis A, Raharja A, Archbold RA, Mathur A. Validity of inducible ischaemia as a surrogate for adverse outcomes in stable coronary artery disease. Heart . 2018;104(21):1733–1738. doi: 10.1136/heartjnl-2018-313230. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Lee SH, Choi KH, Lee JM, Shin D, Hwang D, Kim HK, et al. Residual functional SYNTAX score by quantitative flow ratio and improvement of exercise capacity after revascularization. Catheter Cardiovasc Interv . 2021;97(4):E454–E466. doi: 10.1002/ccd.29118. [DOI] [PubMed] [Google Scholar]
- 50.Kini V, Parks M, Liu W, Waldo SW, Ho PM, Bradley SM, et al. Patient Symptoms and Stress Testing After Elective Percutaneous Coronary Intervention in the Veterans Affairs Health Care System. JAMA Netw Open . 2022;5(6):e2217704. doi: 10.1001/jamanetworkopen.2022.17704. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Kaw R, Nagarajan V, Jaikumar L, Halkar M, Mohananey D, Hernandez AV, et al. Predictive Value of Stress Testing, Revised Cardiac Risk Index, and Functional Status in Patients Undergoing Noncardiac Surgery. J Cardiothorac Vasc Anesth . 2019;33(4):927–932. doi: 10.1053/j.jvca.2018.07.020. [DOI] [PubMed] [Google Scholar]
- 52.Gualandro D, Yu P, Caramelli B, Marques A, Calderaro D, Fornari L, et al. 3rd Guideline For Perioperative Cardiovascular Evaluation on the Brazilian Society of Cardiology. Arq Bras Cardiol . 2017;109(3) Supl 1:1–104. doi: 10.5935/abc.20170140. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Würzburger L, Wiech P, Rossi VA, Neunhäuserer D, Caselli S, Schmied CM, et al. Hypertensive Response to Exercise in Athletes: Unremarkable Finding or Relevant Marker for Future Cardiovascular Complications? 8476751 Int J Hypertens . 2022 Nov 1; doi: 10.1155/2022/8476751. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Zimarino M, Montebello E, Radico F, Gallina S, Perfetti M, Iachini Bellisarii F, et al. ST segment/heart rate hysteresis improves the diagnostic accuracy of ECG stress test for coronary artery disease in patients with left ventricular hypertrophy. Eur J Prev Cardiol . 2016;23(15):1632–1639. doi: 10.1177/2047487316655259. [DOI] [PubMed] [Google Scholar]
- 55.Refaat MM, Hotait M, Tseng ZH. Utility of the Exercise Electrocardiogram Testing in Sudden Cardiac Death Risk Stratification: Utility of Exercise ECG Testing in SCD Risk Stratification. Ann Noninvasive Electrocardiol . 2014;19(4):311–318. doi: 10.1111/anec.12191. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Myung E, Camocardi EC, Domingos J, Neto, Murta GA, Sanches V, Nozaki D, et al. Diretriz Técnica da ANAMT(DT04):acidentes,morte súbita,síncope e trabalho:rastreamento por eletrocardiograma. Rev Bras Med Trab . 2018;16(2):246–252. doi: 10.5327/Z1679443520180270. [DOI] [Google Scholar]
- 57.Sipilä K, Tikkakoski A, Alanko S, Haarala A, Hernesniemi J, Lyytikäinen L-P, et al. Combination of low blood pressure response, low exercise capacity and slow heart rate recovery during an exercise test significantly increases mortality risk. Ann Med . 2019 7-8;51:390–396. doi: 10.1080/07853890.2019.1684550. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Minkkinen M, Nieminen T, Verrier RL, Leino J, Lehtimäki T, Viik J, et al. Prognostic capacity of a clinically indicated exercise test for cardiovascular mortality is enhanced by combined analysis of exercise capacity, heart rate recovery and T-wave alternans. Eur J Prev Cardiol . 2015;22(9):1162–1170. doi: 10.1177/2047487314557190. [DOI] [PubMed] [Google Scholar]
- 59.Forman DE, Arena R, Boxer R, Dolansky MA, Eng JJ, Fleg JL, et al. Prioritizing Functional Capacity as a Principal End Point for Therapies Oriented to Older Adults With Cardiovascular Disease: A Scientific Statement for Healthcare Professionals From the American Heart Association. Circulation . 2017;135(16):e894–e918. doi: 10.1161/CIR.0000000000000483. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Salokari E, Laukkanen JA, Lehtimaki T, Kurl S, Kunutsor S, Zaccardi F, et al. The Duke treadmill score with bicycle ergometer: Exercise capacity is the most important predictor of cardiovascular mortality. Eur J Prev Cardiol . 2019;26(2):199–207. doi: 10.1177/2047487318804618. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Chou R, Arora B, Dana T, Fu R, Walker M, Humphrey L. Screening asymptomatic adults with resting or exercise electrocardiography: a review of the evidence for the U.S. Preventive Services Task Force. Ann Intern Med . 2011;155(6):375–385. doi: 10.7326/0003-4819-155-6-201109200-00006. [DOI] [PubMed] [Google Scholar]
- 62.Greenland P, Alpert JS, Beller GA, Benjamin EJ, Budoff MJ, Fayad ZA, et al. 2010 ACCF/AHA Guideline for Assessment of Cardiovascular Risk in Asymptomatic Adults. J Am Coll Cardiol . 2010;56(25):e50–103. doi: 10.1016/j.jacc.2010.09.001. [DOI] [PubMed] [Google Scholar]
- 63.Al-Khatib SM, Stevenson WG, Ackerman MJ, Bryant WJ, Callans DJ, Curtis AB, et al. 2017 AHA/ACC/HRS Guideline for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Circulation . 2018;138(13):e272–e391. doi: 10.1161/CIR.0000000000000549. [DOI] [PubMed] [Google Scholar]
- 64.Kanaley JA, Colberg SR, Corcoran MH, Malin SK, Rodriguez NR, Crespo CJ, et al. Exercise/Physical Activity in Individuals with Type 2 Diabetes: A Consensus Statement from the American College of Sports Medicine. Med Sci Sports Exerc . 2022;54(2):353–368. doi: 10.1249/MSS.0000000000002800. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 65.Cosentino F, Grant PJ, Aboyans V, Bailey CJ, Ceriello A, Delgado V, et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J . 2020;41(2):255–323. doi: 10.1093/eurheartj/ehz486. [DOI] [PubMed] [Google Scholar]
- 66.Mundwiler J, Schüpbach U, Dieterle T, Leuppi JD, Schmidt-Trucksäss A, Wolfer DP, et al. Association of Occupational and Leisure-Time Physical Activity with Aerobic Capacity in a Working Population. PLoS One . 2017;12(1):e0168683. doi: 10.1371/journal.pone.0168683. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 67.Smilowitz NR, Berger JS. Perioperative Cardiovascular Risk Assessment and Management for Noncardiac Surgery: A Review. JAMA . 2020;324(3):279–290. doi: 10.1001/jama.2020.7840. [DOI] [PubMed] [Google Scholar]
- 68.Budts W, Pieles GE, Roos-Hesselink JW, Sanz de la Garza M, D'Ascenzi F, Giannakoulas G, et al. Recommendations for participation in competitive sport in adolescent and adult athletes with Congenital Heart Disease (CHD): position statement of the Sports Cardiology & Exercise Section of the European Association of Preventive Cardiology (EAPC), the European Society of Cardiology (ESC) Working Group on Adult Congenital Heart Disease and the Sports Cardiology, Physical Activity and Prevention Working Group of the Association for European Paediatric and Congenital Cardiology (AEPC) Eur Heart J . 2020;41(43):4191–4199. doi: 10.1093/eurheartj/ehaa501. [DOI] [PubMed] [Google Scholar]
- 69.Moorman AJ, Dean LS, Yang E, Drezner JA. Cardiovascular Risk Assessment in the Older Athlete. Sports Health . 2021;13(6):622–629. doi: 10.1177/19417381211004877. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 70.Stiles MK, Wilde AAM, Abrams DJ, Ackerman MJ, Albert CM, Behr ER, et al. 2020 APHRS/HRS expert consensus statement on the investigation of decedents with sudden unexplained death and patients with sudden cardiac arrest, and of their families. Heart Rhythm . 2021;18(1):e1–e50. doi: 10.1016/j.hrthm.2020.10.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 71.Jae SY, Franklin BA, Choo J, Choi Y-H, Fernhall B. Exaggerated exercise blood pressure response during treadmill testing as a predictor of future hypertension in men: a longitudinal study. Am J Hypertens . 2015;28(11):1362–1367. doi: 10.1093/ajh/hpv036. [DOI] [PubMed] [Google Scholar]
- 72.Kurl S, Laukkanen JA, Rauramaa R, Lakka TA, Sivenius J, Salonen JT. Systolic Blood Pressure Response to Exercise Stress Test and Risk of Stroke. Stroke . 2001;32(9):2036–2041. doi: 10.1161/hs0901.095395. [DOI] [PubMed] [Google Scholar]
- 73.Lewis GD, Gona P, Larson MG, Plehn JF, Benjamin EJ, O'Donnell CJ, et al. Exercise Blood Pressure and the Risk of Incident Cardiovascular Disease (from the Framingham Heart Study) Am J Cardiol . 2008;101(11):1614–1620. doi: 10.1016/j.amjcard.2008.01.046. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 74.Schultz MG, La Gerche A, Sharman JE. Blood pressure response to exercise and cardiovascular disease. 89 Curr Hypertens Rep . 2017;19(11) doi: 10.1007/s11906-017-0787-1. [DOI] [PubMed] [Google Scholar]
- 75.Weiss SA, Blumenthal RS, Sharrett AR, Redberg RF, Mora S. Exercise Blood Pressure and Future Cardiovascular Death in Asymptomatic Individuals. Circulation . 2010;121(19):2109–2116. doi: 10.1161/CIRCULATIONAHA.109.895292. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 76.Caselli S, Serdoz A, Mango F, Lemme E, Vaquer Seguì A, Milan A, et al. High blood pressure response to exercise predicts future development of hypertension in young athletes. Eur Heart J . 2019;40(1):62–68. doi: 10.1093/eurheartj/ehy810. [DOI] [PubMed] [Google Scholar]
- 77.Bacon SL, Lavoie KL, Campbell TS, Fleet R, Arsenault A, Ditto B. The role of ischaemia and pain in the blood pressure response to exercise stress testing in patients with coronary heart disease. J Hum Hypertens . 2006;20(9):672–678. doi: 10.1038/sj.jhh.1002043. [DOI] [PubMed] [Google Scholar]
- 78.Kones R. Recent advances in the management of chronic stable angina I: Approach to the patient, diagnosis, pathophysiology, risk stratification, and gender disparities. Vasc Health Risk Manag . 2010 Aug 9;6:635–656. doi: 10.2147/VHRM.S7564. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 79.Grotle A-K, Stone AJ. Exaggerated exercise pressor reflex in type 2 diabetes: Potential role of oxidative stress. 102591 Auton Neurosci . 2019 Dec;222 doi: 10.2147/VHRM.S7564. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 80.Schultz MG, Hordern MD, Leano R, Coombes JS, Marwick TH, Sharman JE. Lifestyle Change Diminishes a Hypertensive Response to Exercise in Type 2 Diabetes. Med Sci Sports Exerc . 2011;43(5):764–769. doi: 10.1249/MSS.0b013e3181fcf034. [DOI] [PubMed] [Google Scholar]
- 81.Kokkinos P, Faselis C, Sidossis L, Zhang J, Samuel IBH, Ahmed A, et al. Exercise blood pressure, cardiorespiratory fitness and mortality risk. Prog Cardiovasc Dis . 2021 Aug;67:11–17. doi: 10.1016/j.pcad.2021.01.003. [DOI] [PubMed] [Google Scholar]
- 82.Perçuku L, Bajraktari G, Jashari H, Bytyçi I, Ibrahimi P, Henein MY. The exaggerated systolic hypertensive response to exercise associates cardiovascular events: a systematic review and meta-analysis. Pol Arch Intern Med . 2019;129(12):855–863. doi: 10.20452/pamw.15007. [DOI] [PubMed] [Google Scholar]
- 83.Riaz H, Alashi A, Lang R, Seballos R, Feinleib S, Sukol R, et al. Exaggerated blood pressure response on exercise treadmill testing and longer term outcomes in primary prevention. Eur Heart J Qual Care Clin Outcomes . 2020;6(4):343–344. doi: 10.1093/ehjqcco/qcaa043. [DOI] [PubMed] [Google Scholar]
- 84.Brunel P, Baschiera F, Cifkova R. Exercise testing in hypertensive patients for assessing the cardiovascular protective potential of antihypertensive drugs. Ther Adv Cardiovasc Dis . 2013;7(2):99–108. doi: 10.1177/1753944713476363. [DOI] [PubMed] [Google Scholar]
- 85.Mizuno R, Fujimoto S, Saito Y, Yamazaki M. Clinical importance of detecting exaggerated blood pressure response to exercise on antihypertensive therapy. Heart . 2016;102(11):849–854. doi: 10.1136/heartjnl-2015-308805. [DOI] [PubMed] [Google Scholar]
- 86.Schultz MG, Currie KD, Hedman K, Climie RE, Maiorana A, Coombes JS, et al. The Identification and Management of High Blood Pressure Using Exercise Blood Pressure: Current Evidence and Practical Guidance. 2819 Int J Environ Res Public Health . 2022;19(5) doi: 10.3390/ijerph19052819. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 87.Sharman JE, La Gerche A. Exercise blood pressure: clinical relevance and correct measurement. J Hum Hypertens . 2015;29(6):351–358. doi: 10.1038/jhh.2014.84. [DOI] [PubMed] [Google Scholar]
- 88.Moore MN, Climie RE, Otahal P, Schultz MG. Exercise blood pressure and cardiovascular disease risk: a systematic review and meta-analysis of cross-sectional studies. J Hypertens . 2021;39(12):2395–2402. doi: 10.1097/HJH.0000000000002962. [DOI] [PubMed] [Google Scholar]
- 89.Cornelissen VA, Verheyden B, Aubert AE, Fagard RH. Effects of aerobic training intensity on resting, exercise and post-exercise blood pressure, heart rate and heart-rate variability. J Hum Hypertens . 2010;24(3):175–182. doi: 10.1038/jhh.2009.51. [DOI] [PubMed] [Google Scholar]
- 90.Hietanen H, Pääkkönen R, Salomaa V. Ankle blood pressure as a predictor of total and cardiovascular mortality. 3 BMC Cardiovasc Disord . 2008 Feb 12;8 doi: 10.1186/1471-2261-8-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 91.de Liefde II, Hoeks SE, van Gestel YRBM, Klein J, Verhagen HJM, van Domburg RT, et al. Prognostic value of hypotensive blood pressure response during single-stage exercise test on long-term outcome in patients with known or suspected peripheral arterial disease. Coron Artery Dis . 2008;19(8):603–607. doi: 10.1097/MCA.0b013e328316e9ed. [DOI] [PubMed] [Google Scholar]
- 92.Tarasoutchi F, Montera MW, Ramos AI, Sampaio RO, Rosa VEE, Accorsi TAD, et al. Atualização das Diretrizes Brasileiras de Valvopatias - 2020. Arq Bras Cardiol . 2020;115(4):720–775. doi: 10.36660/abc.20201047. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 93.Otto CM, Nishimura RA, Bonow RO, Carabello BA, Erwin JP, Gentile F, et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation . 2021;143(5):e72–e227. doi: 10.1161/CIR.0000000000000923. [DOI] [PubMed] [Google Scholar]
- 94.Vahanian A, Beyersdorf F, Praz F, Milojevic M, Baldus S, Bauersachs J, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J . 2022;43(7):561–632. doi: 10.1093/eurheartj/ehab395. [DOI] [PubMed] [Google Scholar]
- 95.Gati S, Malhotra A, Sharma S. Exercise recommendations in patients with valvular heart disease. Heart . 2019;105(2):106–110. doi: 10.1136/heartjnl-2018-313372. [DOI] [PubMed] [Google Scholar]
- 96.Abdelghani M, Sardar S, Hamada A. Asymptomatic severe aortic stenosis: contemporary evaluation and management. Heart Views . 2022;23(1):16–21. doi: 10.4103/heartviews.heartviews_34_22. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 97.Bonow RO, Leon MB, Doshi D, Moat N. Management strategies and future challenges for aortic valve disease. Lancet . 2016;387(10025):1312–1323. doi: 10.1016/S0140-6736(16)00586-9. https://doi.org/10.1016/S0140-6736 (16)00586-9 . [DOI] [PubMed] [Google Scholar]
- 98.Lancellotti P, Magne J. Stress testing for the evaluation of patients with mitral regurgitation. Curr Opin Cardiol . 2012;27(5):492–498. doi: 10.1097/HCO.0b013e3283565c3b. [DOI] [PubMed] [Google Scholar]
- 99.Dulgheru R, Marchetta S, Sugimoto T, Go YY, Girbea A, Oury C, et al. Exercise Testing in Mitral Regurgitation. Prog Cardiovasc Dis . 2017;60(3):342–350. doi: 10.1016/j.pcad.2017.10.004. [DOI] [PubMed] [Google Scholar]
- 100.Naji P, Griffin BP, Barr T, Asfahan F, Gillinov AM, Grimm RA, et al. Importance of Exercise Capacity in Predicting Outcomes and Determining Optimal Timing of Surgery in Significant Primary Mitral Regurgitation. J Am Heart Assoc . 2014;3(5):e001010. doi: 10.1161/JAHA.114.001010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 101.Pierard LA, Dulgheru R. Exercise Testing and Stress Imaging in Aortic Valve Disease. 54 Curr Treat Options Cardiovasc Med . 2017;19(7) doi: 10.1007/s11936-017-0551-5. [DOI] [PubMed] [Google Scholar]
- 102.Khanji MY, Ricci F, Galusko V, Sekar B, Chahal CAA, Ceriello L, et al. Management of aortic stenosis: a systematic review of clinical practice guidelines and recommendations. Eur Heart J - Qual Care Clin Outcomes . 2021;7(4):340–353. doi: 10.1093/ehjqcco/qcab016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 103.Généreux P, Stone GW, O'Gara PT, Marquis-Gravel G, Redfors B, Giustino G, et al. Natural History, Diagnostic Approaches, and Therapeutic Strategies for Patients With Asymptomatic Severe Aortic Stenosis. J Am Coll Cardiol. . 2016;67(19):2263–88. doi: 10.1016/j.jacc.2016.02.057. [DOI] [PubMed] [Google Scholar]
- 104.Akinseye OA, Pathak A, Ibebuogu UN. Aortic Valve Regurgitation: A Comprehensive Review. Curr Probl Cardiol . 2018;43(8):315–334. doi: 10.1016/j.cpcardiol.2017.10.004. [DOI] [PubMed] [Google Scholar]
- 105.Kusunose K, Agarwal S, Marwick TH, Griffin BP, Popovic ZB. Decision Making in Asymptomatic Aortic Regurgitation in the Era of Guidelines: Incremental Values of Resting and Exercise Cardiac Dysfunction. Circ Cardiovasc Imaging . 2014;7(2):352–362. doi: 10.1161/CIRCIMAGING.113.001177. [DOI] [PubMed] [Google Scholar]
- 106.Laufer-Perl M, Gura Y, Shimiaie J, Sherez J, Pressman GS, Aviram G, et al. Mechanisms of Effort Intolerance in Patients With Rheumatic Mitral Stenosis. JACC Cardiovasc Imaging . 2017;10(6):622–633. doi: 10.1016/j.jcmg.2016.07.011. [DOI] [PubMed] [Google Scholar]
- 107.Galusko V, Ionescu A, Edwards A, Sekar B, Wong K, Patel K, et al. Management of mitral stenosis: a systematic review of clinical practice guidelines and recommendations. Eur Heart J - Qual Care Clin Outcomes . 2022;8(6):602–618. doi: 10.1093/ehjqcco/qcab083. [DOI] [PubMed] [Google Scholar]
- 108.Çelik M, Milojevic M, Durko AP, Oei FBS, Mahtab EAF, Bogers AJJC. Asymptomatic Patients with Severe Aortic Stenosis and the Impact of Intervention. 35 J Cardiovasc Dev Dis . 2021;8(4) doi: 10.3390/jcdd8040035. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 109.Sevilla T, Revilla-Orodea A, San Román JA. Timing of Intervention in Asymptomatic Patients with Aortic Stenosis. Eur Cardiol Rev . 2021 Sep;16:e32. doi: 10.15420/ecr.2021.11. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 110.Lewey J, Andrade L, Levine LD. Valvular Heart Disease in Pregnancy. Cardiol Clin . 2021;39(1):151–161. doi: 10.1016/j.ccl.2020.09.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 111.Regitz-Zagrosek V, Roos-Hesselink JW, Bauersachs J, Blomström-Lundqvist C, Cífková R, De Bonis M, et al. 2018 ESC Guidelines for the management of cardiovascular diseases during pregnancy. Eur Heart J . 2018;39(34):3165–3241. doi: 10.1093/eurheartj/ehy340. [DOI] [PubMed] [Google Scholar]
- 112.Otto CM, Bonow RO, editors, editors. Valvular heart disease: a companion to Braunwald's heart disease . 5th. Philadelphia(PA): Elsevier; 2021. 9780323546331 [Google Scholar]
- 113.Fleisher LA, Fleischmann KE, Auerbach AD, Barnason SA, Beckman JA, Bozkurt B, et al. 2014 ACC/AHA Guideline on Perioperative Cardiovascular Evaluation and Management of Patients Undergoing Noncardiac Surgery: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation . 2014;130(24):e278–e333. doi: 10.1161/CIR.0000000000000106. [DOI] [PubMed] [Google Scholar]
- 114.Henri C, Piérard LA, Lancellotti P, Mongeon F-P, Pibarot P, Basmadjian AJ. Exercise Testing and Stress Imaging in Valvular Heart Disease. Can J Cardiol . 2014;30(9):1012–1026. doi: 10.1016/j.cjca.2014.03.013. [DOI] [PubMed] [Google Scholar]
- 115.Libby P, Bonow R, Mann D, Tomaselli G, Bhatt D, Solomon S.editors . Braunwald's heart disease: a textbook of cardiovascular medicine . 12th. Philadelphia: Elsevier; 2021. 978-0323824675 [Google Scholar]
- 116.Salzano A, De Luca M, Israr MZ, Crisci G, Eltayeb M, Debiec R, et al. Exercise Intolerance in Heart Failure with Preserved Ejection Fraction. Heart Fail Clin . 2021;17(3):397–413. doi: 10.1016/j.hfc.2021.03.004. [DOI] [PubMed] [Google Scholar]
- 117.Domínguez E, Palau P, Núñez E, Ramón JM, López L, Melero J, et al. Heart rate response and functional capacity in patients with chronic heart failure with preserved ejection fraction: Heart rate response and functional capacity in patients with chronic HfpEF. ESC Heart Fail . 2018;5(4):579–585. doi: 10.1002/ehf2.12281. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 118.Paolillo S, Agostoni P, De Martino F, Ferrazzano F, Marsico F, Gargiulo P, et al. Heart rate during exercise: mechanisms, behavior, and therapeutic and prognostic implications in heart failure patients with reduced ejection fraction. Heart Fail Rev . 2018;23(4):537–545. doi: 10.1007/s10741-018-9712-1. [DOI] [PubMed] [Google Scholar]
- 119.Keteyian SJ, Ehrman JK, Fuller B, Pack QR. Exercise Testing and Exercise Rehabilitation for Patients With Atrial Fibrillation. J Cardiopulm Rehabil Prev . 2019;39(2):65–72. doi: 10.1097/HCR.0000000000000423. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 120.Rowin EJ, Maron BJ, Olivotto I, Maron MS. Role of Exercise Testing in Hypertrophic Cardiomyopathy. JACC Cardiovasc Imaging . 2017;10(11):1374–1386. doi: 10.1016/j.jcmg.2017.07.016. [DOI] [PubMed] [Google Scholar]
- 121.Elliott PM, Anastasakis A, Borger MA, Borggrefe M, Cecchi F, Charron P, et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: The Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC) Eur Heart J . 2014;35(39):2733–2779. doi: 10.1093/eurheartj/ehu284. [DOI] [PubMed] [Google Scholar]
- 122.Mitrani RD, Alfadhli J, Lowery MH, Best TM, Hare JM, Fishman J, et al. Utility of exercise testing to assess athletes for post COVID-19 myocarditis. 100125 Am Heart J Plus . 2022;14 doi: 10.1016/j.ahjo.2022.100125. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 123.Montera MW, Marcondes-Braga FG, Simões MV, Moura LAZ, Fernandes F, Mangine S, et al. Diretriz de Miocardites da Sociedade Brasileira de Cardiologia - 2022. Arq Bras Cardiol . 2022;119(1):143–211. doi: 10.36660/abc.20220412. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 124.Carvalho VO, Bocchi EA, Guimarães GV. Aerobic exercise prescription in adult heart transplant recipients: a review: Aerobic Exercise Prescription in Adult Heart Transplant. Cardiovasc Ther . 2011;29(5):322–326. doi: 10.1111/j.1755-5922.2010.00175.x. [DOI] [PubMed] [Google Scholar]
- 125.Kourek C, Karatzanos E, Nanas S, Karabinis A, Dimopoulos S. Exercise training in heart transplantation. World J Transplant . 2021;11(11):466–479. doi: 10.5500/wjt.v11.i11.466. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 126.Maron BJ, Udelson JE, Bonow RO, Nishimura RA, Ackerman MJ, Estes NAM, et al. Eligibility and Disqualification Recommendations for Competitive Athletes With Cardiovascular Abnormalities: Task Force 3: Hypertrophic Cardiomyopathy, Arrhythmogenic Right Ventricular Cardiomyopathy and Other Cardiomyopathies, and Myocarditis: A Scientific Statement From the American Heart Association and American College of Cardiology. Circulation . 2015;132(22):e273–e280. doi: 10.1161/CIR.0000000000000239. [DOI] [PubMed] [Google Scholar]
- 127.Pelliccia A, Solberg EE, Papadakis M, Adami PE, Biffi A, Caselli S, et al. Recommendations for participation in competitive and leisure time sport in athletes with cardiomyopathies, myocarditis, and pericarditis: position statement of the Sport Cardiology Section of the European Association of Preventive Cardiology (EAPC) Eur Heart J . 2019;40(1):19–33. doi: 10.1093/eurheartj/ehy730. [DOI] [PubMed] [Google Scholar]
- 128.Fihn SD, Gardin JM, Abrams J, Berra K, Blankenship JC, Dallas AP, et al. 2012 ACCF/AHA/ACP/AATS/PCNA/SCAI/STS Guideline for the Diagnosis and Management of Patients With Stable Ischemic Heart Disease: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, and the American College of Physicians, American Association for Thoracic Surgery, Preventive Cardiovascular Nurses Association, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. Circulation . 2012;126(25):e354–e471. doi: 10.1161/CIR.0b013e318277d6a0. [DOI] [PubMed] [Google Scholar]
- 129.Page RL, Joglar JA, Caldwell MA, Calkins H, Conti JB, Deal BJ, et al. 2015 ACC/AHA/HRS Guideline for the Management of Adult Patients With Supraventricular Tachycardia: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Circulation . 2016;133(14):e471–e505. doi: 10.1161/CIR.0000000000000310. [DOI] [PubMed] [Google Scholar]
- 130.Priori SG, Blomström-Lundqvist C, Mazzanti A, Blom N, Borggrefe M, Camm J, et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC)Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC) Eur Heart J . 2015;36(41):2793–2867. doi: 10.1093/eurheartj/ehv316. [DOI] [PubMed] [Google Scholar]
- 131.Glikson M, Nielsen JC, Kronborg MB, Michowitz Y, Auricchio A, Barbash IM, et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. Eur Heart J . 2021;42(35):3427–3520. doi: 10.1093/eurheartj/ehab364. [DOI] [PubMed] [Google Scholar]
- 132.Silka MJ, Shah MJ, Silva JA, Balaji S, Beach C, Benjamin M, et al. 2021 PACES Expert Consensus Statement on the Indications and Management of Cardiovascular Implantable Electronic Devices in Pediatric Patients: Executive Summary. Heart Rhythm . 2021;18(11):1925–1950. doi: 10.1016/j.hrthm.2021.07.051. [DOI] [PubMed] [Google Scholar]
- 133.Issa ZF, Miller JM, Zipes D. Clinical arrhythmology and electrophysiology: a companion to Baunwald's heart disease . 3rd. Philadelphia: Elsevier; 2018. 13:978-0325223561 [Google Scholar]
- 134.Thomas GS, Wann LS, Ellestad MH, editors, editors. Ellestad's stress testing: principles and practice . Sixth. New York (NY): Oxford University Press; 2018. ASIN:B07QH3MR17. [Google Scholar]
- 135.Finocchiaro G, Barra B, Molaro S, Zampieri M, Monje-Garcia L, Evans C, et al. Prevalence and clinical correlates of exercise-induced ventricular arrhythmias in arrhythmogenic right ventricular cardiomyopathy. Int J Cardiovasc Imaging . 2022;38(2):389–396. doi: 10.1007/s10554-021-02395-w. [DOI] [PubMed] [Google Scholar]
- 136.Crescenzi C, Panattoni G, Stazi A, Martino A, Sgueglia M, De Ruvo E, et al. Ventricular arrhythmias and risk stratification of cardiac sudden death in athletes. Minerva Cardioangiol . 2020;68(2):110–122. doi: 10.23736/S0026-4725.20.05178-6. [DOI] [PubMed] [Google Scholar]
- 137.Fischbach PS, Frias PA, Strieper MJ, Campbell RM. Natural History and Current Therapy for Complete Heart Block in Children and Patients with Congenital Heart Disease. Congenit Heart Dis . 2007;2(4):224–234. doi: 10.1111/j.1747-0803.2007.00106.x. [DOI] [PubMed] [Google Scholar]
- 138.Magalhaes LP, Guimaraes ICB, Melo SL, Mateo EIP, Andalaft RB, Xavier LFR. Diretriz de Arritmias Cardíacas em Crianças e Cardiopatias Congênitas SOBRAC e DCC - CP. Arq Bras Cardiol . 2016;107(1) Suppl 3:1–58. doi: 10.5935/abc.20160103. [DOI] [PubMed] [Google Scholar]
- 139.Epstein AE, DiMarco JP, Ellenbogen KA, Estes NA, 3rd, Freedman RA, et al. ACC/AHA/HRS 2008 Guidelines for Device-Based Therapy of Cardiac Rhythm Abnormalities: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the ACC/AHA/NASPE 2002 Guideline Update for Implantation of Cardiac Pacemakers and Antiarrhythmia Devices): Developed in Collaboration With the American Association for Thoracic Surgery and Society of Thoracic Surgeons. Circulation . 2008;117(21):e350–e408. doi: 10.1161/CIRCUALTIONAHA.108.189742. [DOI] [PubMed] [Google Scholar]
- 140.Horner JM, Horner MM, Ackerman MJ. The diagnostic utility of recovery phase QTc during treadmill exercise stress testing in the evaluation of long QT syndrome. Heart Rhythm . 2011;8(11):1698–1704. doi: 10.1016/j.hrthm.2011.05.018. [DOI] [PubMed] [Google Scholar]
- 141.Yang Y, Lv T, Li SY, Liu P, Gao QG, Zhang P. Utility of Provocative Testing in the Diagnosis and Genotyping of Congenital Long QT Syndrome: A Systematic Review and Meta-Analysis. J Am Heart Assoc . 2022;11(14):e025246. doi: 10.1161/JAHA.122.025246. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 142.Zipes DP, Jalife J, Stevenson WG, editors, editors. Cardiac electrophysiology: from cell to bedside . 7th. Philadelphia(PA): Elsevier; 2018. 978-0-323-447-33-1 [Google Scholar]
- 143.Martinelli M, Filho, Zimerman L, Sociedade Brasileira de Cardiologia Diretrizes Brasileiras de Dispositivos Cardíacos Eletrônicos Implantáveis (DCEI) Arq Bras Cardiol . 2007;89(6):e210–e237. doi: 10.1590/S0066-782X2007001800017. [DOI] [Google Scholar]
- 144.Leong KMW, Ng FS, Roney C, Cantwell C, Shun-Shin MJ, Linton NWF, et al. Repolarization abnormalities unmasked with exercise in sudden cardiac death survivors with structurally normal hearts. J Cardiovasc Electrophysiol . 2018;29(1):115–126. doi: 10.1111/jce.13375. [DOI] [PubMed] [Google Scholar]
- 145.Kim C, Jung H, Choi HE, Kang SH. Cardiac Rehabilitation After Acute Myocardial Infarction Resuscitated From Cardiac Arrest. Ann Rehabil Med . 2014;38(6):799–804. doi: 10.5535/arm.2014.38.6.799. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 146.Stephens P. Sudden cardiac death in the young: the value of exercise testing. Cardiol Young . 2017;27(S1):S10–S18. doi: 10.1017/S1047951116002171. [DOI] [PubMed] [Google Scholar]
- 147.Masrur S, Memon S, Thompson PD. Brugada Syndrome, Exercise, and Exercise Testing: Brugada syndrome and exercise. Clin Cardiol . 2015;38(5):323–326. doi: 10.1002/clc.22386. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 148.Morita H, Asada ST, Miyamoto M, Morimoto Y, Kimura T, Mizuno T, et al. Significance of Exercise-Related Ventricular Arrhythmias in Patients With Brugada Syndrome. J Am Heart Assoc . 2020;9(23):e016907. doi: 10.1161/JAHA.120.016907. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 149.Brubaker PH, Kitzman DW. Chronotropic Incompetence: Causes, Consequences, and Management. Circulation . 2011;123(9):1010–1020. doi: 10.1161/CIRCULATIONAHA.110.940577. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 150.Kallergis EM, Nakou ES, Simantirakis EN, Vardas PE. Chronotropic incompetence presenting as sudden sinus slowing during exercise stress test: the pathophysiological mechanisms. Clin Res Cardiol . 2015;104(7):611–613. doi: 10.1007/s00392-015-0830-7. [DOI] [PubMed] [Google Scholar]
- 151.Smart Na Clark H, Brubaker P, Witte KK, Jamil H, Gierula J, et al. Effects of chronotropic incompetence on exercise capacity in people with heart failure versus age-matched controls. Heart Fail Rev . 2022;27(3):795–809. doi: 10.1007/s10741-021-10081-1. [DOI] [PubMed] [Google Scholar]
- 152.Fletcher GF, Balady GJ, Amsterdam EA, Chaitman B, Eckel R, Fleg J, et al. Exercise Standards for Testing and Training: A Statement for Healthcare Professionals From the American Heart Association. Circulation . 2001;104(14):1694–1740. doi: 10.1161/hc3901.095960. [DOI] [PubMed] [Google Scholar]
- 153.Chan CH, Hu YF, Chen PF, Wu IC, Chen SA. Exercise Test for Patients with Long QT Syndrome. Acta Cardiol Sin . 2022;38(2):124–133. doi: 10.6515/ACS.202203_38. 2. 20211101A. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 154.Patel TM, Kamande SM, Jarosz E, Bost JE, Hanumanthaiah S, Berul CI, et al. Treadmill exercise testing improves diagnostic accuracy in children with concealed congenital long QT syndrome. Pacing Clin Electrophysiol . 2020;43(12):1521–1528. doi: 10.1111/pace.14085. [DOI] [PubMed] [Google Scholar]
- 155.Karlsson D, Engvall J, Ando AA, Aneq MÅ. Exercise testing for long-term follow-up in arrhythmogenic right ventricular cardiomyopathy. J Electrocardiol . 2017;50(2):176–183. doi: 10.1016/j.jelectrocard.2016.10.011. [DOI] [PubMed] [Google Scholar]
- 156.Eberly L, Garg L, Vidula M, Reza N, Krishnan S. Running the Risk: Exercise and Arrhythmogenic Cardiomyopathy. 64 Curr Treat Options Cardiovasc Med . 2021;23(10) doi: 10.1007/s11936-021-00943-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 157.Cerrone M. Exercise: a risky subject in arrhythmogenic cardiomyopathy. J Am Heart Assoc . 2018;7(12):e009611. doi: 10.1161/JAHA.118.009611. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 158.Elshazly MB, Wilkoff BL, Tarakji K, Wu Y, Donnellan E, Abi Khalil C, et al. Exercise Ventricular rates, cardiopulmonary exercise performance, and mortality in patients with heart failure with atrial fibrillation. Circ Heart Fail . 2021;14(2):e007451. doi: 10.1161/CIRCHEARTFAILURE.120.007451. [DOI] [PubMed] [Google Scholar]
- 159.Aihara K, Kato Y, Suzuki S, Arita T, Yagi N, Semba H, et al. Prognostic value of the heart rate profile during exercise in patients with atrial fibrillation. Eur J Prev Cardiol . 2018;25(15):1634–1641. doi: 10.1177/2047487318797398. [DOI] [PubMed] [Google Scholar]
- 160.Satoh A, Niwano S, Niwano H, Kamiya K, Kishihara J, Aoyama Y, et al. Prediction of Inappropriate implantable cardioverter-defibrillator therapies through parameters obtained in a simple exercise stress test. Int Heart J . 2012;53(5):276–281. doi: 10.1536/ihj.53.276. [DOI] [PubMed] [Google Scholar]
- 161.Kooiman KM, Knops RE, Olde Nordkamp L, Wilde AAM, de Groot JR. Inappropriate subcutaneous implantable cardioverter-defibrillator shocks due to T-wave oversensing can be prevented: Implications for management. Heart Rhythm . 2014;11(3):426–434. doi: 10.1016/j.hrthm.2013.12.007. [DOI] [PubMed] [Google Scholar]
- 162.Pichara NL, Sacilotto L, Scanavacca MI, Cardoso AF, Soares BMAF, Falcochio PPPF, et al. Evaluation of a new treadmill exercise protocol to unmask type 1 Brugada electrocardiographic pattern: can we improve diagnostic yield? Europace . 2023;25:euad157. doi: 10.1093/europace/euad157. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 163.Durstine JL, Moore GE, Painter PL, S. Roberts, American College of Sports Medicineeditors, editors. ACSM's exercise management for persons with chronic diseases and disabilities . 4th. Champaign, IL: Human Kinetics; 2016. 9781450434140 [Google Scholar]
- 164.Brothers JA, McBride MG, Seliem MA, Marino BS, Tomlinson RS, Pampaloni MH, et al. Evaluation of Myocardial Ischemia After Surgical Repair of Anomalous Aortic Origin of a Coronary Artery in a Series of Pediatric Patients. J Am Coll Cardiol . 2007;50(21):2078–2082. doi: 10.1016/j.jacc.2007.06.055. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 165.Caselli S, Ferreira D, Kanawati E, Di Paolo F, Pisicchio C, Attenhofer Jost C, et al. Prominent left ventricular trabeculations in competitive athletes: A proposal for risk stratification and management. Int J Cardiol . 2016;223:590–595. doi: 10.1016/j.ijcard.2016.08.272. [DOI] [PubMed] [Google Scholar]
- 166.Feng YS, Yang SD, Tan ZX, Wang MM, Xing Y, Dong F, et al. The benefits and mechanisms of exercise training for Parkinson's disease. Life Sci. . 2020;245 doi: 10.1016/j.lfs.2020.117345. 117345. [DOI] [PubMed] [Google Scholar]
- 167.Werner WG, DiFrancisco-Donoghue J, Lamberg EM. Cardiovascular Response to Treadmill Testing in Parkinson Disease. J Neurol Phys Ther . 2006;30(2):68–73. doi: 10.1097/01.NPT.0000282570.78544.00. [DOI] [PubMed] [Google Scholar]
- 168.Connes P, Machado R, Hue O, Reid H. Exercise limitation, exercise testing and exercise recommendations in sickle cell anemia. Clin Hemorheol Microcirc . 2011;49(1-4):151–163. doi: 10.3233/CH-2011-1465. [DOI] [PubMed] [Google Scholar]
- 169.Ahner MM, Motta SB da, Franzoni L. Podemos Realizar o Teste de Esforço Máximo em Esteira em Indivíduos com Doença Falciforme? Arq Bras Cardiol . 2022;118(3):576–577. doi: 10.36660/abc.20220036. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 170.Araújo C, Resende MBS, Tupinambás JT, Dias RCTM, Barros FC, Vasconcelos MCM, et al. Testes Ergométricos em Pacientes com Anemia Falciforme: Segurança, Viabilidade e Possíveis Implicações no Prognóstico. Arq Bras Cardiol . 2022;118(3):565–575. doi: 10.36660/abc.20200437. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 171.Allen SK, Brown V, White D, King D, Hunt J, Wainwright J, et al. Multimodal Prehabilitation During Neoadjuvant Therapy Prior to Esophagogastric Cancer Resection: Effect on Cardiopulmonary Exercise Test Performance, Muscle Mass and Quality of Life: a Pilot Randomized Clinical Trial. Ann Surg Oncol . 2022;29(3):1839–1850. doi: 10.1245/s10434-021-11002-0. [DOI] [PubMed] [Google Scholar]
- 172.Hijazi Y, Gondal U, Aziz O. A systematic review of prehabilitation programs in abdominal cancer surgery. Int J Surg . 2017;39:156–162. doi: 10.1016/j.ijsu.2017.01.111. [DOI] [PubMed] [Google Scholar]
- 173.Ha D, Mazzone PJ, Ries AL, Malhotra A, Fuster M. The Utility of Exercise Testing in Patients with Lung Cancer. J Thorac Oncol . 2016;11(9):1397–1410. doi: 10.1016/j.jtho.2016.04.021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 174.Campbell KL, Winters-Stone KM, Wiskemann J, May AM, Schwartz AL, Courneya KS, et al. Exercise Guidelines for Cancer Survivors: Consensus Statement from International Multidisciplinary Roundtable. Med Sci Sports Exerc . 2019;51(11):2375–2390. doi: 10.1249/MSS.0000000000002116. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 175.Birkett ST, Harwood AE, Caldow E, Ibeggazene S, Ingle L, Pymer S. A systematic review of exercise testing in patients with intermittent claudication: A focus on test standardisation and reporting quality in randomised controlled trials of exercise interventions. PLoS One . 2021;16(5):e0249277. doi: 10.1371/journal.pone.0249277. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 176.Lamberti N, López-Soto PJ, Guerzoni F, Napoli N, Gasbarro V, Zamboni P, et al. Changes in exercise capacity and risk of all-cause mortality in patients with peripheral artery disease: a 10-year retrospective cohort study. Intern Emerg Med . 2020;15(2):289–298. doi: 10.1007/s11739-019-02176-3. [DOI] [PubMed] [Google Scholar]
- 177.Leeper NJ, Myers J, Zhou M, Nead KT, Syed A, Kojima Y, et al. Exercise capacity is the strongest predictor of mortality in patients with peripheral arterial disease. J Vasc Surg . 2013;57(3):728–733. doi: 10.1016/j.jvs.2012.07.051. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 178.Herzog CA, Natwick T, Li S, Charytan DM. Comparative Utilization and Temporal Trends in Cardiac Stress Testing in U.S. Medicare Beneficiaries With and Without Chronic Kidney Disease. JACC Cardiovasc Imaging . 2019;12(8):1420–1426. doi: 10.1016/j.jcmg.2018.04.012. Pt 1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 179.Silva-Filho A, Azoubel L, Barroso R, Carneiro E, Dias-Filho C, Ribeiro R, et al. A Case-control Study of Exercise and Kidney Disease: Hemodialysis and Transplantation. Int J Sports Med . 2019;40(3):209–217. doi: 10.1055/a-0810-8583. [DOI] [PubMed] [Google Scholar]
- 180.Ehrman JK, Fernandez AB, Myers J, Oh P, Thompson PD, Keteyian SJ. Aortic Aneurysm: Diagnosis,Mamagement, Exercise Testing, and Training. J Cardiopulm Rehabil Prev . 2020;40(4):215–223. doi: 10.1097/HCR.0000000000000521. [DOI] [PubMed] [Google Scholar]
- 181.Gäverth J, Parker R, MacKay-Lyons M. Exercise Stress Testing After Stroke or Transient Ischemic Attack: A Scoping Review. Arch Phys Med Rehabil . 2015;96(7):1349–1359.e12. doi: 10.1016/j.apmr.2015.03.005. [DOI] [PubMed] [Google Scholar]
- 182.Dua JS, Cooper AR, Fox KR, Graham Stuart A. Exercise training in adults with congenital heart disease: feasibility and benefits. Int J Cardiol . 2010;138(2):196–205. doi: 10.1016/j.ijcard.2009.01.038. [DOI] [PubMed] [Google Scholar]
- 183.Bredy C, Ministeri M, Kempny A, Alonso-Gonzalez R, Swan L, Uebing A, et al. New York Heart Association (NYHA) classification in adults with congenital heart disease: relation to objective measures of exercise and outcome. Eur Heart J Qual Care Clin Outcomes . 2018;4(1):51–58. doi: 10.1093/ehjqcco/qcx031. [DOI] [PubMed] [Google Scholar]
- 184.Laukkanen JA, Makikallio TH, Rauramaa R, Kurl S. Asymptomatic ST-segment depression during exercise testing and the risk of sudden cardiac death in middle-aged men: a population-based follow-up study. Eur Heart J . 2009;30(5):558–565. doi: 10.1093/eurheartj/ehn584. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 185.Berent R, Auer J, von Duvillard SP, Sinzinger H, Schmid P. Komplikationen bei der Ergometrie. Herz . 2010;35(4):267–272. doi: 10.1007/s00059-011-3449-0. [DOI] [PubMed] [Google Scholar]
- 186.Saini V, Graboys TB, Towne V, Lown B. Reproducibility of exercise-induced ventricular arrhythmia in patients undergoing evaluation for malignant ventricular arrhythmia. Am J Cardiol . 1989;63(11):697–701. doi: 10.1016/0002-9149(89)90254-3. https://doi.org/10.1016/0002-9149 (89)90254-3 . [DOI] [PubMed] [Google Scholar]
- 187.Verdile L, Maron BJ, Pelliccia A, Spataro A, Santini M, Biffi A. Clinical significance of exercise-induced ventricular tachyarrhythmias in trained athletes without cardiovascular abnormalities. Heart Rhythm . 2015;12(1):78–85. doi: 10.1016/j.hrthm.2014.09.009. [DOI] [PubMed] [Google Scholar]
- 188.Cronin EM, Bogun FM, Maury P, Peichl P, Chen M, Namboodiri N, et al. 2019 EHRA/APHRS/LAHRS expert consensus statement on catheter ablation of ventricular arrhythmias. J Arrhythmia . 2019;35(3):323–484. doi: 10.1002/joa3.12185. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 189.Maurer MS, Shefrin EA, Fleg JL. Prevalence and prognostic significance of exercise-induced supraventricular tachycardia in apparently healthy volunteers. Am J Cardiol . 1995;75(12):788–792. doi: 10.1016/s0002-9149(99)80412-3. https://doi.org/10.1016/S0002-9149 (99)80412-3 . [DOI] [PubMed] [Google Scholar]
- 190.Yeh SJ, Lin FC, Wu D. The mechanisms of exercise provocation of supraventricular tachycardia. Am Heart J . 1989;117(5):1041–1049. doi: 10.1016/0002-8703(89)90860-0. https://doi.org/10.1016/0002-8703 (89)90860-0 . [DOI] [PubMed] [Google Scholar]
- 191.Ataklte F, Erqou S, Laukkanen J, Kaptoge S. Meta-Analysis of Ventricular Premature Complexes and Their Relation to Cardiac Mortality in General Populations. Am J Cardiol . 2013;112(8):1263–1270. doi: 10.1016/j.amjcard.2013.05.065. [DOI] [PubMed] [Google Scholar]
- 192.Frolkis JP, Pothier CE, Blackstone EH, Lauer MS. Frequent Ventricular Ectopy after Exercise as a Predictor of Death. N Engl J Med . 2003;348(9):781–790. doi: 10.1056/NEJMoa022353. [DOI] [PubMed] [Google Scholar]
- 193.Refaat MM, Gharios C, Moorthy MV, Abdulhai F, Blumenthal RS, Jaffa MA, et al. Exercise-Induced Ventricular Ectopy and Cardiovascular Mortality in Asymptomatic Individuals. J Am Coll Cardiol . 2021;78(23):2267–2277. doi: 10.1016/j.jacc.2021.09.1366. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 194.Kim J, Kwon M, Chang J, Harris D, Gerson MC, Hwang S-S, et al. Meta-Analysis of Prognostic Implications of Exercise-Induced Ventricular Premature Complexes in the General Population. Am J Cardiol . 2016;118(5):725–732. doi: 10.1016/j.amjcard.2016.06.007. [DOI] [PubMed] [Google Scholar]
- 195.Lindow T, Ekström M, Brudin L, Hedman K, Ugander M. Prognostic implications of structural heart disease and premature ventricular contractions in recovery of exercise. 10265 Sci Rep . 2022;12(1) doi: 10.1038/s41598-022-14535-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 196.Iqbal M, Putra ICS, Kamarullah W, Pranata R, Achmad C, Karwiky G, et al. Revisiting exercise-induced premature ventricular complexes as a prognostic factor for mortality in asymptomatic patients: A systematic review and meta-analysis. 949694 Front Cardiovasc Med . 2022;9 doi: 10.3389/fcvm.2022.949694. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 197.Bunch TJ, Chandrasekaran K, Gersh BJ, Hammill SC, Hodge DO, Khan AH, et al. The prognostic significance of exercise-induced atrial arrhythmias. J Am Coll Cardiol . 2004;43(7):1236–1240. doi: 10.1016/j.jacc.2003.10.054. [DOI] [PubMed] [Google Scholar]
- 198.Beckerman J, Wu T, Jones S, Froelicher VF. Exercise Test-Induced Arrhythmias. Prog Cardiovasc Dis . 2005;47(4):285–305. doi: 10.1016/j.pcad.2005.02.011. [DOI] [PubMed] [Google Scholar]
- 199.Hwang JK, Gwag HB, Park SJ, On YK, Kim JS, Park KM. Frequent atrial premature complexes during exercise: A potent predictor of atrial fibrillation. Clin Cardiol . 2018;41(4):458–464. doi: 10.1002/clc.22895. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 200.Younis A, Nof E, Israel A, Goldenberg I, Sabbag A, Glikson M, et al. Relation of Atrial Premature Complexes During Exercise Stress Testing to the Risk for the Development of Atrial Fibrillation in Patients Undergoing Cardiac Rehabilitation. Am J Cardiol . 2018;122(3):395–399. doi: 10.1016/j.amjcard.2018.04.023. [DOI] [PubMed] [Google Scholar]
- 201.Villanueva-Benito I, Solla-Ruiz I, Pardo-Fresno M, Escribano-Arias JL. Flutter auricular con conducción auriculoventricular 1:1 desencadenada por el esfuerzo. Rev Port Cardiol . 2011;30(7-8):683–684. doi: 10.1016/S0870-2551(11)70008-7. https://doi.org/10.1016/S0870-2551 (11)70008-7 . [DOI] [PubMed] [Google Scholar]
- 202.Grady TA. Prognostic Significance of Exercise-Induced Left Bundle-Branch Block. JAMA . 1998;279(2):153–156. doi: 10.1001/jama.279.2.153. [DOI] [PubMed] [Google Scholar]
- 203.Stein R, Ho M, Oliveira CM, Ribeiro JP, Lata K, Abella J, et al. Bloqueio completo do ramo esquerdo esforço-induzido: prevalência e prognóstico. Arq Bras Cardiol . 2011;97(1):26–32. doi: 10.1590/S0066-782X2011005000054. [DOI] [PubMed] [Google Scholar]
- 204.Stein R, Nguyen P, Abella J, Olson H, Myers J, Froelicher V. Prevalence and Prognostic Significance of Exercise-Induced Right Bundle Branch Block. Am J Cardiol . 2010;105(5):677–680. doi: 10.1016/j.amjcard.2009.10.050. [DOI] [PubMed] [Google Scholar]
- 205.Sakai C, Kawasaki T, Sugihara H, Matoba S. The Bezold-Jarisch reflex in a patient with coronary spastic angina. Ann Noninvasive Electrocardiol . 2020;25(6):e12759. doi: 10.1111/anec.12759. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 206.Gündüz R, Payzin S, Kayikçioglu M, Hasdemir C. Sinus node deceleration during exercise stress testing: Bezold-Jarisch reflex versus sinus node ischemia. Anadolu Kardiyol Derg AKD Anatol J Cardiol . 2004;4(2):181–183. PMID: 15165957. [PubMed] [Google Scholar]
- 207.Yandrapalli S, Harikrishnan P, Ojo A, Vuddanda VLK, Jain D. Exercise induced complete atrioventricular block: Utility of exercise stress test. J Electrocardiol . 2018;51(1):153–155. doi: 10.1016/j.jelectrocard.2017.09.001. [DOI] [PubMed] [Google Scholar]
- 208.Yamazaki S, Kato T, Ushimaru S, Yokoi H, Mani H. Exercise-induced Atrioventricular Block with Coronary Artery Stenosis that Appeared Five Years after Bypass Surgery. Intern Med . 2018;57(3):363–366. doi: 10.2169/internalmedicine.9398-17. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 209.Podrid PJ, Graboys TB, Lown B. Prognosis of Medically Treated Patients with Coronary-Artery Disease with Profound ST-Segment Depression during Exercise Testing. N Engl J Med . 1981;305(19):1111–1116. doi: 10.1056/NEJM198111053051903. [DOI] [PubMed] [Google Scholar]
- 210.Pinkstaff S, Peberdy MA, Kontos MC, Finucane S, Arena R. Quantifying Exertion Level During Exercise Stress Testing Using Percentage of Age-Predicted Maximal Heart Rate, Rate Pressure Product, and Perceived Exertion. Mayo Clin Proc . 2010;85(12):1095–1100. doi: 10.4065/mcp.2010.0357. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 211.Ebner N, Jankowska EA, Ponikowski P, Lainscak M, Elsner S, Sliziuk V, et al. The impact of iron deficiency and anaemia on exercise capacity and outcomes in patients with chronic heart failure. Results from the Studies Investigating Comorbidities Aggravating Heart Failure. Int J Cardiol . 2016 Feb 15;205:6–12. doi: 10.1016/j.ijcard.2015.11.178. [DOI] [PubMed] [Google Scholar]
- 212.Bird JG, Morant K, Al-Souri D, Scott CG, Padang R, McCully RB, et al. Impact of Anemia on Exercise and Pharmacologic Stress Echocardiography. J Am Soc Echocardiogr . 2020;33(9):1067–1076. doi: 10.1016/j.echo.2020.04.003. [DOI] [PubMed] [Google Scholar]
- 213.Wowdzia JB, Davenport MH. Cardiopulmonary exercise testing during pregnancy. Birth Defects Res . 2021;113(3):248–264. doi: 10.1002/bdr2.1796. [DOI] [PubMed] [Google Scholar]
- 214.Campos MSB, Buglia S, Colombo CS, Buchler RD, Brito ASX de, Mizzaci CC, et al. Posicionamento sobre Exercícios Físicos na Gestação e no Pós-Parto - 2021. Arq Bras Cardiol . 2021;117(1):160–180. doi: 10.36660/abc.20210408. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 215.Barroso WKS, Rodrigues CIS, Bortolotto LA, Mota-Gomes MA, Brandão AA, Feitosa AD de M, et al. Brazilian Guidelines of Hypertension - 2020. Arq Bras Cardiol . 2021;116(3):516–658. doi: 10.36660/abc.20201238. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 216.Zhioua R, Ammous I, Errais K, Zbiba W, Ben Younes N, Lahdhiri I, et al. Frequency, Characteristics, and Risk Factors of Late Recurrence of Retinal Detachment. Eur J Ophthalmol . 2008;18(6):960–964. doi: 10.1177/112067210801800617. [DOI] [PubMed] [Google Scholar]
- 217.Sultan ZN, Agorogiannis EI, Iannetta D, Steel D, Sandinha T. Rhegmatogenous retinal detachment: a review of current practice in diagnosis and management. BMJ Open Ophthalmol . 2020;5(1):e000474. doi: 10.1136/bmjophth-2020-000474. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 218.Pereira WVC, Vancea DMM, Oliveira R A, Freitas YGP, Lamounier DRN, Zagury RL, et al. Atividade física e exercício no DM1. Diretriz da Sociedade Brasileira de Diabetes . (Edição 2023) doi: 10.29327/557753.2022-6. [DOI] [Google Scholar]
- 219.Balady GJ, Arena R, Sietsema K, Myers J, Coke L, Fletcher GF, et al. Clinician's Guide to Cardiopulmonary Exercise Testing in Adults: A Scientific Statement From the American Heart Association. Circulation . 2010;122(2):191–225. doi: 10.1161/CIR.0b013e3181e52e69. [DOI] [PubMed] [Google Scholar]
- 220.Stickland MK, Neder JA, Guenette JA, O'Donnell DE, Jensen D. Using Cardiopulmonary Exercise Testing to Understand Dyspnea and Exercise Intolerance in Respiratory Disease. Chest . 2022;161(6):1505–1516. doi: 10.1016/j.chest.2022.01.021. [DOI] [PubMed] [Google Scholar]
- 221.Glaab T, Taube C. Practical guide to cardiopulmonary exercise testing in adults. 9 Respir Res . 2022;23(1) doi: 10.1186/s12931-021-01895-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 222.Leclerc K. Cardiopulmonary exercise testing: a contemporary and versatile clinical tool. Cleve Clin J Med . 2017;84(2):161–168. doi: 10.3949/ccjm.84a.15013. [DOI] [PubMed] [Google Scholar]
- 223.Malhotra R, Bakken K, D'Elia E, Lewis GD. Cardiopulmonary Exercise Testing in Heart Failure. JACC Heart Fail . 2016;4(8):607–616. doi: 10.1016/j.jchf.2016.03.022. [DOI] [PubMed] [Google Scholar]
- 224.Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure. J Am Coll Cardiol . 2022;79(17):e263–e421. doi: 10.1016/j.jacc.2021.12.012. [DOI] [PubMed] [Google Scholar]
- 225.Parshall MB, Schwartzstein RM, Adams L, Banzett RB, Manning HL, Bourbeau J, et al. An Official American Thoracic Society Statement: Update on the Mechanisms, Assessment, and Management of Dyspnea. Am J Respir Crit Care Med . 2012;185(4):435–452. doi: 10.1164/rccm.201111-2042ST. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 226.Singh I, Joseph P, Heerdt PM, Cullinan M, Lutchmansingh DD, Gulati M, et al. Persistent Exertional Intolerance After COVID-19. Chest . 2022;161(1):54–63. doi: 10.1016/j.chest.2021.08.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 227.Besnier F, Bérubé B, Malo J, Gagnon C, Grégoire C-A, Juneau M, et al. Cardiopulmonary Rehabilitation in Long-COVID-19 Patients with Persistent Breathlessness and Fatigue: The COVID-Rehab Study. 4133 Int J Environ Res Public Health . 2022;19(7) doi: 10.3390/ijerph19074133. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 228.Durstenfeld MS, Sun K, Tahir P, Peluso MJ, Deeks SG, Aras MA, et al. Use of Cardiopulmonary Exercise Testing to Evaluate Long COVID-19 Symptoms in Adults: A Systematic Review and Meta-analysis. JAMA Netw Open . 2022;5(10):e2236057. doi: 10.1001/jamanetworkopen.2022.36057. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 229.Mezzani A. Cardiopulmonary Exercise Testing: Basics of Methodology and Measurements. Ann Am Thorac Soc . 2017;14(Supplement 1):S3–S11. doi: 10.1513/AnnalsATS.201612-997FR. [DOI] [PubMed] [Google Scholar]
- 230.Irewall T, Bäcklund C, Nordang L, Ryding M, Stenfors N. High Prevalence of Exercise-induced Laryngeal Obstruction in a Cohort of Elite Cross-country Skiers. Med Sci Sports Exerc . 2021;53(6):1134–1141. doi: 10.1249/MSS.0000000000002581. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 231.Weiler JM, Brannan JD, Randolph CC, Hallstrand TS, Parsons J, Silvers W, et al. Exercise-induced bronchoconstriction update - 2016. J Allergy Clin Immunol . 2016;138(5):1292–1295.e36. doi: 10.1016/j.jaci.2016.05.029. [DOI] [PubMed] [Google Scholar]
- 232.Rohde LEP, Montera MW, Bocchi EA, Clausell NO, Albuquerque DC de, Rassi S, et al. Diretriz Brasileira de Insuficiência Cardíaca Crônica e Aguda. Arq Bras Cardiol . 2018;111(3):436–539. doi: 10.5935/abc.20180190. [DOI] [PubMed] [Google Scholar]
- 233.Mueller S, Haller B, Feuerstein A, Winzer EB, Beckers P, Haykowsky MJ, et al. Peak O2-pulse predicts exercise training-induced changes in peak VO2in heart failure with preserved ejection fraction. ESC Heart Fail . 2022;9(5):3393–3406. doi: 10.1002/ehf2.14070. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 234.Myers J, Arena R, Cahalin LP, Labate V, Guazzi M. Cardiopulmonary Exercise Testing in Heart Failure. Curr Probl Cardiol . 2015;40(8):322–372. doi: 10.1016/j.cpcardiol.2015.01.009. [DOI] [PubMed] [Google Scholar]
- 235.Mehra MR, Canter CE, Hannan MM, Semigran MJ, Uber PA, Baran DA, et al. The 2016 International Society for Heart Lung Transplantation listing criteria for heart transplantation: A 10-year update. J Heart Lung Transplant . 2016;35(1):1–23. doi: 10.1016/j.healun.2015.10.023. [DOI] [PubMed] [Google Scholar]
- 236.Pavy B, Iliou MC, Vergès Patois B, Brion R, Monpère C, Carré F, et al. French Society of Cardiology guidelines for cardiac rehabilitation in adults. Arch Cardiovasc Dis . 2012;105(5):309–328. doi: 10.1016/j.acvd.2012.01.010. [DOI] [PubMed] [Google Scholar]
- 237.Ezzatvar Y, Izquierdo M, Núñez J, Calatayud J, Ramírez-Vélez R, García-Hermoso A. Cardiorespiratory fitness measured with cardiopulmonary exercise testing and mortality in patients with cardiovascular disease: A systematic review and meta-analysis. J Sport Health Sci . 2021;10(6):609–619. doi: 10.1016/j.jshs.2021.06.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 238.Akinci Özyürek B, Savas Bozbas S, Aydinalp A, Bozbas H, Ulubay G. Value of cardiopulmonary exercise testing in the diagnosis of coronary artery disease. Tuberk ve Toraks . 2019;67(2):102–107. doi: 10.5578/tt.68200. [DOI] [PubMed] [Google Scholar]
- 239.Domanski O, Richardson M, Coisne A, Polge A-S, Mouton S, Godart F, et al. Cardiopulmonary exercise testing is a better outcome predictor than exercise echocardiography in asymptomatic aortic stenosis. Int J Cardiol . 2017;227:908–914. doi: 10.1016/j.ijcard.2016.10.070. [DOI] [PubMed] [Google Scholar]
- 240.Baumgartner H, Falk V, Bax JJ, De Bonis M, Hamm C, Holm PJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J . 2017;38(36):2739–2791. doi: 10.1093/eurheartj/ehx391. [DOI] [PubMed] [Google Scholar]
- 241.Mantegazza V, Apostolo A, Hager A. Cardiopulmonary Exercise Testing in Adult Congenital Heart Disease. Ann Am Thorac Soc . 2017;14(Supplement_1):S93–101. doi: 10.1513/AnnalsATS.201611-876FR. [DOI] [PubMed] [Google Scholar]
- 242.Diller G-P, Dimopoulos K, Okonko D, Li W, Babu-Narayan SV, Broberg CS, et al. Exercise Intolerance in Adult Congenital Heart Disease: Comparative Severity, Correlates, and Prognostic Implication. Circulation . 2005;112(6):828–835. doi: 10.1161/CIRCULATIONAHA.104.529800. [DOI] [PubMed] [Google Scholar]
- 243.Müller J, Heck PB, Ewert P, Hager A. Noninvasive Screening for Pulmonary Hypertension by Exercise Testing in Congenital Heart Disease. Ann Thorac Surg . 2017;103(5):1544–1549. doi: 10.1016/j.athoracsur.2016.09.038. [DOI] [PubMed] [Google Scholar]
- 244.Olivotto I, Maron BJ, Montereggi A, Mazzuoli F, Dolara A, Cecchi F. Prognostic value of systemic blood pressure response during exercise in a community-based patient population with hypertrophic cardiomyopathy. J Am Coll Cardiol . 1999;33(7):2044–2051. doi: 10.1016/s0735-1097(99)00094-7. https://doi.org/10.1016/S0735-1097 (99)00094-7 . [DOI] [PubMed] [Google Scholar]
- 245.Monserrat L, Elliott PM, Gimeno JR, Sharma S, Penas-Lado M, McKenna WJ. Non-sustained ventricular tachycardia in hypertrophic cardiomyopathy. J Am Coll Cardiol . 2003;42(5):873–879. doi: 10.1016/s0735-1097(03)00827-1. https://doi.org/10.1016/S0735-1097 (03)00827-1 . [DOI] [PubMed] [Google Scholar]
- 246.Galiè N, Humbert M, Vachiery J-L, Gibbs S, Lang I, Torbicki A, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS)Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT) Eur Heart J . 2016;37(1):67–119. doi: 10.1093/eurheartj/ehv317. [DOI] [PubMed] [Google Scholar]
- 247.Konstantinides SV, Meyer G, Becattini C, Bueno H, Geersing G-J, Harjola V-P, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS) Eur Heart J . 2020;41(4):543–603. doi: 10.1093/eurheartj/ehz405. [DOI] [PubMed] [Google Scholar]
- 248.Foulkes SJ, Howden EJ, Haykowsky MJ, Antill Y, Salim A, Nightingale SS, et al. Exercise for the Prevention of Anthracycline-Induced Functional Disability and Cardiac Dysfunction: The BREXIT Study. Circulation . 2023;147(7):532–545. doi: 10.1161/CIRCULATIONAHA.122.062814. [DOI] [PubMed] [Google Scholar]
- 249.Howden EJ, Bigaran A, Beaudry R, Fraser S, Selig S, Foulkes S, et al. Exercise as a diagnostic and therapeutic tool for the prevention of cardiovascular dysfunction in breast cancer patients. Eur J Prev Cardiol . 2019;26(3):305–315. doi: 10.1177/2047487318811181. [DOI] [PubMed] [Google Scholar]
- 250.Goodyear SJ, Yow H, Saedon M, Shakespeare J, Hill CE, Watson D, et al. Risk stratification by pre-operative cardiopulmonary exercise testing improves outcomes following elective abdominal aortic aneurysm surgery: a cohort study. 10 Perioper Med . 2013;2(1) doi: 10.1186/2047-0525-2-10. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 251.Hendel RC, Berman DS, Di Carli MF, Heidenreich PA, Henkin RE, Pellikka PA, et al. ACCF/ASNC/ACR/AHA/ASE/SCCT/SCMR/SNM 2009 Appropriate Use Criteria for Cardiac Radionuclide Imaging. J Am Coll Cardiol . 2009;53(23):2201–2229. doi: 10.1016/j.jacc.2009.02.013. [DOI] [PubMed] [Google Scholar]
- 252.2014 ESC/EACTS Guidelines on myocardial revascularization The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS)Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI) Eur Heart J . 2014;35(37):2541–2619. doi: 10.1093/eurheartj/ehu278. [DOI] [PubMed] [Google Scholar]
- 253.2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management: The Joint Task Force on non-cardiac surgery: cardiovascular assessment and management of the European Society of Cardiology (ESC) and the European Society of Anaesthesiology (ESA) Eur Heart J . 2014;35(35):2383–2431. doi: 10.1093/eurheartj/ehu282. [DOI] [PubMed] [Google Scholar]
- 254.Wolk MJ, Bailey SR, Doherty JU, Douglas PS, Hendel RC, Kramer CM, et al. ACCF/AHA/ASE/ASNC/HFSA/HRS/SCAI/SCCT/SCMR/STS 2013 Multimodality Appropriate Use Criteria for the Detection and Risk Assessment of Stable Ischemic Heart Disease. J Am Coll Cardiol . 2014;63(4):380–406. doi: 10.1016/j.jacc.2013.11.009. [DOI] [PubMed] [Google Scholar]
- 255.Nicolau J, Timerman A, Marin-Neto J, Piegas L, Dornas C, Franci A, et al. Diretrizes da Sociedade Brasileira de Cardiologia sobre Angina Instável e Infarto Agudo do Miocárdio sem Supradesnível do Segmento ST (II Edição, 2007) - Atualização 2013/2014. Arq Bras Cardiol . 2014;102(3) Suppl 1:1–61. doi: 10.5935/abc.2014S001. [DOI] [PubMed] [Google Scholar]
- 256.Amsterdam EA, Kirk JD, Bluemke DA, Diercks D, Farkouh ME, Garvey JL, et al. Testing of Low-Risk Patients Presenting to the Emergency Department With Chest Pain: A Scientific Statement From the American Heart Association. Circulation . 2010;122(17):1756–1776. doi: 10.1161/CIR.0b013e3181ec61df. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 257.Duvall WL, Savino JA, Levine EJ, Hermann LK, Croft LB, Henzlova MJ. Prospective evaluation of a new protocol for the provisional use of perfusion imaging with exercise stress testing. Eur J Nucl Med Mol Imaging . 2015;42(2):305–316. doi: 10.1007/s00259-014-2864-x. [DOI] [PubMed] [Google Scholar]
- 258.Chalela WA, Camargo EE, Marin-Neto JA, Meneghetti JC. Actualization of the Guideline of the Sociedade Brasileira de Cardiologia on Nuclear Cardiology. Arq Bras Cardiol . 2006;86(Suppl 1):10–35. PMID: 16838682. [PubMed] [Google Scholar]
- 259.Schinkel AFL, Bax JJ, Poldermans D, Elhendy A, Ferrari R, Rahimtoola SH. Hibernating Myocardium: Diagnosis and Patient Outcomes. Curr Probl Cardiol . 2007;32(7):375–410. doi: 10.1016/j.cpcardiol.2007.04.001. [DOI] [PubMed] [Google Scholar]
- 260.Pellikka PA, Arruda-Olson A, Chaudhry FA, Chen MH, Marshall JE, Porter TR, et al. Guidelines for Performance, Interpretation, and Application of Stress Echocardiography in Ischemic Heart Disease: From the American Society of Echocardiography. J Am Soc Echocardiogr . 2020;33(1):1–41.e8. doi: 10.1016/j.echo.2019.07.001. [DOI] [PubMed] [Google Scholar]
- 261.Sicari R, Nihoyannopoulos P, Evangelista A, Kasprzak J, Lancellotti P, Poldermans D, et al. Stress Echocardiography Expert Consensus Statement--Executive Summary: European Association of Echocardiography (EAE) (a registered branch of the ESC) Eur Heart J . 2008;30(3):278–289. doi: 10.1093/eurheartj/ehn492. [DOI] [PubMed] [Google Scholar]
- 262.Romano MMD, Branco M, Moreira HT, Schmidt A, Kisslo J, Maciel BC. Appropriate use of echocardiography and relation to clinical decision making in both inpatients and outpatients in a developing country. Echocardiography . 2018;35(1):9–16. doi: 10.1111/echo.13725. [DOI] [PubMed] [Google Scholar]
- 263.Qian L, Xie F, Xu D, Porter TR. Long-term prognostic value of stress myocardial perfusion echocardiography in patients with coronary artery disease: a meta-analysis. Eur Heart J Cardiovasc Imaging . 2021;22(5):553–562. doi: 10.1093/ehjci/jeaa026. [DOI] [PubMed] [Google Scholar]
- 264.Kusunose K. Clinical application of stress echocardiography for valvular heart disease. J Med Ultrason . 2020;47(1):81–89. doi: 10.1007/s10396-019-00958-y. [DOI] [PubMed] [Google Scholar]
- 265.Lancellotti P, Pellikka PA, Budts W, Chaudhry FA, Donal E, Dulgheru R, et al. The clinical use of stress echocardiography in non-ischaemic heart disease: recommendations from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. Eur Heart J Cardiovasc Imaging . 2016;17(11):1191–1229. doi: 10.1093/ehjci/jew190. [DOI] [PubMed] [Google Scholar]
- 266.Mandoli GE, Pastore MC, Vasilijevaite K, Cameli P, D'Ascenzi F, Focardi M, et al. Speckle tracking stress echocardiography: A valuable diagnostic technique or a burden for everyday practice? Echocardiography . 2020;37(12):2123–2129. doi: 10.1111/echo.14894. [DOI] [PubMed] [Google Scholar]
- 267.Lee TH, Marcantonio ER, Mangione CM, Thomas EJ, Polanczyk CA, Cook EF, et al. Derivation and Prospective Validation of a Simple Index for Prediction of Cardiac Risk of Major Noncardiac Surgery. Circulation . 1999;100(10):1043–1049. doi: 10.1161/01.CIR.100.10.1043. [DOI] [PubMed] [Google Scholar]
- 268.Guidelines for Assessing and Managing the Perioperative Risk from Coronary Artery Disease Associated with Major Noncardiac Surgery. Ann Intern Med . 1997;127(4):309–312. doi: 10.7326/0003-4819-127-4-199708150-00011. [DOI] [PubMed] [Google Scholar]
- 269.Pinho C, Grandini PC, Gualandro DM, Calderaro D, Monachini M, Caramelli B. Multicenter study of perioperative evaluation for noncardiac surgeries in Brazil (EMAPO) Clinics . 2007;62(1):17–22. doi: 10.1590/S1807-59322007000100004. [DOI] [PubMed] [Google Scholar]
- 270.Harb SC, Griffin BP. Mitral Valve Disease: a Comprehensive Review. 73 Curr Cardiol Rep . 2017;19(8) doi: 10.1007/s11886-017-0883-5. [DOI] [PubMed] [Google Scholar]
- 271.Pibarot P, Dumesnil JG, Jobin J, Cartier P, Honos G, Durand L-G. Hemodynamic and physical performance during maximal exercise in patients with an aortic bioprosthetic valve. J Am Coll Cardiol . 1999;34(5):1609–1617. doi: 10.1016/s0735-1097(99)00360-5. https://doi.org/10.1016/S0735-1097 (99)00360-5 . [DOI] [PubMed] [Google Scholar]
- 272.Gersh BJ, Maron BJ, Bonow RO, Dearani JA, Fifer MA, Link MS, et al. 2011 ACCF/AHA Guideline for the Diagnosis and Treatment of Hypertrophic Cardiomyopathy. J Am Coll Cardiol . 2011;58(25):e212–e260. doi: 10.1016/j.jacc.2011.06.011. [DOI] [PubMed] [Google Scholar]
- 273.Harada T, Kagami K, Kato T, Ishii H, Obokata M. Exercise Stress Echocardiography in the Diagnostic Evaluation of Heart Failure with Preserved Ejection Fraction. 87 J Cardiovasc Dev Dis . 2022;9(3) doi: 10.3390/jcdd9030087. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 274.Zile MR, Kjellstrom B, Bennett T, Cho Y, Baicu CF, Aaron MF, et al. Effects of Exercise on Left Ventricular Systolic and Diastolic Properties in Patients With Heart Failure and a Preserved Ejection Fraction Versus Heart Failure and a Reduced Ejection Fraction. Circ Heart Fail . 2013;6(3):508–516. doi: 10.1161/CIRCHEARTFAILURE.112.000216. [DOI] [PubMed] [Google Scholar]
- 275.Picano E, Pellikka PA. Stress echo applications beyond coronary artery disease. Eur Heart J . 2014;35(16):1033–1040. doi: 10.1093/eurheartj/eht350. [DOI] [PubMed] [Google Scholar]
- 276.Cotrim C, Almeida AR, Miranda R, Almeida AG, Cotrim H, Picano E, et al. Stress-Induced Intraventricular Gradients in Symptomatic Athletes During Upright Exercise Continuous Wave Doppler Echocardiography. Am J Cardiol . 2010;106(12):1808–1812. doi: 10.1016/j.amjcard.2010.07.053. [DOI] [PubMed] [Google Scholar]
- 277.Banerjee A, Newman DR, Van den Bruel A, Heneghan C. Diagnostic accuracy of exercise stress testing for coronary artery disease: a systematic review and meta-analysis of prospective studies: Exercise stress testing and coronary artery disease. Int J Clin Pract . 2012;66(5):477–492. doi: 10.1111/j.1742-1241.2012.02900.x. [DOI] [PubMed] [Google Scholar]
- 278.Conselho Federal de Medicina . Diario Oficial Da União . Brasilia: Sep 18, 2017. Resolução No 2.153/2016. Altera o anexo da resolução CFM n.2056/2013 e dispõe a nova redação do manual de vistoria de fiscalização da medicina no Brasil. Seção 1. [Google Scholar]
- 279.Bernoche C, Timerman S, Polastri TF, Giannetti NS, Siqueira AW da S, Piscopo A, et al. Atualização da Diretriz de Ressuscitação Cardiopulmonar e Cuidados Cardiovasculares de Emergência da Sociedade Brasileira de Cardiologia - 2019. Arq Bras Cardiol . 2019;113(3):449–663. doi: 10.5935/abc.20190203. [DOI] [PubMed] [Google Scholar]
- 280.Merchant RM, Topjian AA, Panchal AR, Cheng A, Aziz K, Berg KM, et al. Part 1: Executive Summary: 2020 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation . 2020;142(16) Suppl 2:S337–S357. doi: 10.1161/CIR.0000000000000918. [DOI] [PubMed] [Google Scholar]
- 281.Brasil. Ministério da Saúde . Diario Oficial da União . Brasilia: Sep 20, 1990. Lei No 8.080/1990.Lei Orgânica da Saúde. Dispõe sobre as condições para a promoção, proteção e recuperação da saúde, a organização e o fechamento dos serviços correspondentes e dá outras prioridades. [Google Scholar]
- 282.Conselho Federal de Medicina . Diario Oficial da União . Brasília: Nov 23, 2007. Resolução do Conselho Federal de Medicina No 1.821/2007. Aprova as normas técnicas concernentes a digitalização e o uso dos sistemas informatizados dos documentos dos prontuários dos pacientes.Autorização e eliminação do papel e troca de informação em saúde.informação identificada. [Google Scholar]
- 283.Brasil. Ministério da Saúde . Diario Oficial da União . Brasília: Dec 28, 2018. Lei No 13.787/2018. Dispõe sobre a digitalização e a utilização de sistemas informatizados para a guarda e armazenamento, manuseio do prontuário do paciente. [Google Scholar]
- 284.Brasil . Diário Oficial da União . Brasilia: Aug 14, 2018. Presidência, Lei No 13.709/2018 - Dispõe sobre a proteção de dados pessoais e altera a Lei n.12.965 de 23 de abril de 2014. [Google Scholar]
- 285.Conselho Federal de Medicina . Diario Oficial da União . Brasilia: Jan 21, 2016. Recomendação CFM No 1/2016. Dispõe sobre o processo de obtenção de consentimento livre e esclarecido na assistência médica. [Google Scholar]
- 286.Conselho Federal de Medicina Resolução n.2.221/2018 que homologa a Portaria CME n.1/2018, que atualiza a relação de especialidades e áreas de atuação médicas aprovadas pela Comissão Mista de Especialidades. 67 Diario Oficial da União . 2019 Jan 24; Seção 1. [Google Scholar]
- 287.Conselho Federal de Medicina Resolução No 2.021, de 20 de junho de 2013. A realização do teste ergométrico é ato médico,devendo ser feito, em todas as suas etapas por medico habilitado,apto a attenderas ocorrebcias cardiovasculares sendo falta de etica sua delegação para outros profissionais da saúde . www.semesp.org.br/legislacao/resolucao-cfm n.2.021 de 20/06/2013 . [Google Scholar]
- 288.No M, Kwak H-B. Effects of environmental temperature on physiological responses during submaximal and maximal exercises in soccer players. Integr Med Res . 2016;5(3):216–222. doi: 10.1016/j.imr.2016.06.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 289.Valtonen RIP, Kiviniemi A, Hintsala HE, Ryti NRI, Kenttä T, Huikuri HV, et al. Cardiovascular responses to cold and submaximal exercise in patients with coronary artery disease. Am J Physiol Regul Integr Comp Physiol . 2018;315(4):R768–R776. doi: 10.1152/ajpregu.00069.2018. [DOI] [PubMed] [Google Scholar]
- 290.Zhao J, Lorenzo S, An N, Feng W, Lai L, Cui S. Effects of heat and different humidity levels on aerobic and anaerobic exercise performance in athletes. J Exerc Sci Fit . 2013;11(1):35–41. doi: 10.1016/j.jesf.2013.04.002. [DOI] [Google Scholar]
- 291.Papathanasiou G, Georgakopoulos D, Papageorgiou E, Zerva E, Michalis L, Kalfakakou V, et al. Effects of smoking on heart rate at rest and during exercise, and on heart rate recovery, in young adults. Hellenic J cardiol . 2013 may-Jun;64(3):168–177. PMID: 23685653. [PubMed] [Google Scholar]
- 292.Myers J, Arena R, Franklin B, Pina I, Kraus WE, McInnis K, et al. Recommendations for Clinical Exercise Laboratories: A Scientific Statement From the American Heart Association. Circulation . 2009;119(24):3144–3161. doi: 10.1161/CIRCULATIONAHA.109.192520. [DOI] [PubMed] [Google Scholar]
- 293.Wasserman K, Hansen JE, Sue DY, Stringer W, Sietsema KE, Sion X-G, et al. Principles of exercise testing and interpretation: including pathophysiology and clinical applications . 5th. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins; 2012. 978-16009138998 [Google Scholar]
- 294.Rasmussen K, Engby B, Bagger JP, Henningsen P. Exercise Stress Testing in Angina Patients with Positive Response to Hyperventilation Testing: Influence of the Coronary Artery Tone. Acta Med Scand . 2009;220(2):109–115. doi: 10.1111/j.0954-6820.1986.tb02738.x. [DOI] [PubMed] [Google Scholar]
- 295.Samesima N, God EG, Kruse JCL, Leal MG, Pinho C, França FF de AC, et al. Diretriz da Sociedade Brasileira de Cardiologia sobre a Análise e Emissão de Laudos Eletrocardiográficos - 2022. Arq Bras Cardiol . 2022;119(4):638–680. doi: 10.36660/abc.20220623. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 296.Puurtinen M, Nieminen T, Kähönen M, Lehtimäki T, Lehtinen R, Nikus K, et al. Value of leads V4R and CM5 in the detection of coronary artery disease during exercise electrocardiographic test: V4R and CM5 in detection of CAD. Clin Physiol Funct Imaging . 2010;30(4):308–312. doi: 10.1111/j.1475-097X.2010.00942.x. [DOI] [PubMed] [Google Scholar]
- 297.Mastrocolla LE, Brito AX, Brito FS, Castro I, Godoy M, Alfieri RG, et al. Consenso Nacional de Ergometria. Arq Bras Cardiol . 1995;65(2):191–211. [Google Scholar]
- 298.Mason RE, Likar I. A new system of multiple-lead exercise electrocardiography. Am Heart J . 1966;71(2):196–205. doi: 10.1016/0002-8703(66)90182-7. https://doi.org/10.1016/0002-8703 (66)90182-7 . [DOI] [PubMed] [Google Scholar]
- 299.Froelicher VF, Myers J. Manual of exercise testing . Philadelphia, PA: Mosby; 2007. 349-0323033024 [Google Scholar]
- 300.Karvonen MJ, Kentala E, Mustala O. The effects of training on heart rate; a longitudinal study. Ann Med Exp Biol Fenn . 1957;35(3):307–315. PMID:13470504. [PubMed] [Google Scholar]
- 301.Tanaka H, Monahan KD, Seals DR. Age-predicted maximal heart rate revisited. J Am Coll Cardiol . 2001;37(1):153–156. doi: 10.1016/s0735-1097(00)01054-8. https://doi.org/10.1016/S0735-1097 (00)01054-8 . [DOI] [PubMed] [Google Scholar]
- 302.Calvert AF, Bernstein L, Bailey IK. Physiological Responses to Maximal Exercise in a Normal Australian Population-Comparative Values in Patients with Anatomically Defined Coronary Artery Disease. Aust N Z J Med . 1977;7(5):497–506. doi: 10.1111/j.1445-5994.1977.tb03371.x. [DOI] [PubMed] [Google Scholar]
- 303.Arena R, Myers J, Kaminsky LA. Revisiting age-predicted maximal heart rate: Can it be used as a valid measure of effort? Am Heart J . 2016;173:49–56. doi: 10.1016/j.ahj.2015.12.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 304.Shookster D, Lindsey B, Cortes N, Martin JR. Accuracy of Commonly Used Age-Predicted Maximal Heart Rate Equations. Int J Exerc Sci . 2020;13(7):1242–1250. doi: 10.70252/XFSJ6815. PMID: 33042384; PMCID: PMC7523886. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 305.Kim D, Ha JW. Hypertensive response to exercise: mechanisms and clinical implication. 17 Clin Hypertens . 2016;22 doi: 10.1186/s40885-016-0052-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 306.Prakash M, Myers J, Froelicher VF, Marcus R, Do D, Kalisetti D, et al. Diagnostic exercise tests on 4000 consecutive men. Am Heart J . 2001;142(1):127–135. doi: 10.1067/mhj.2001.115795. [DOI] [PubMed] [Google Scholar]
- 307.Mieres JH, Heller GV, Hendel RC, Gulati M, Boden WE, Katten D, et al. Signs and Symptoms of Suspected Myocardial Ischemia in Women: Results from the What is the Optimal Method for Ischemia Evaluation in WomeN? Trial. J Womens Health . 2011;20(9):1261–1268. doi: 10.1089/jwh.2010.2595. [DOI] [PubMed] [Google Scholar]
- 308.Del Buono MG, Arena R, Borlaug BA, Carbone S, Canada JM, Kirkman DL, et al. Exercise Intolerance in Patients With Heart Failure. J Am Coll Cardiol . 2019;73(17):2209–2225. doi: 10.1016/j.jacc.2019.01.072. [DOI] [PubMed] [Google Scholar]
- 309.Morris MJ, Woods JT, McLaughlin CW. Exertional Dyspnea and Excessive Dynamic Airway Collapse. Immunol Allergy Clin North Am . 2018;38(2):325–332. doi: 10.1016/j.iac.2018.01.006. [DOI] [PubMed] [Google Scholar]
- 310.Abidov A, Rozanski A, Hachamovitch R, Hayes SW, Aboul-Enein F, Cohen I, et al. Prognostic Significance of Dyspnea in Patients Referred for Cardiac Stress Testing. N Engl J Med . 2005;353(18):1889–1898. doi: 10.1056/NEJMoa042741. [DOI] [PubMed] [Google Scholar]
- 311.Bulthuis Y, Drossaers-Bakker W, Oosterveld F, van der Palen J, van de Laar M. Arm Crank Ergometer is Reliable and Valid for Measuring Aerobic Capacity During Submaximal Exercise. J Strength Cond Res . 2010;24(10):2809–2815. doi: 10.1519/JSC.0b013e3181e31242. [DOI] [PubMed] [Google Scholar]
- 312.Zagatto AM, Papoti M, Gobatto CA. Comparação entre ergômetros específico e convencionais na determinação da capacidade aeróbia de mesatenistas. Rev Bras Med Esporte . 2009;15(3):204–208. doi: 10.1590/S1517-86922009000300008. [DOI] [Google Scholar]
- 313.Lang PB, Latin RW, Berg KE, Mellion MB. The accuracy of the ACSM cycle ergometry equation. Med Sci Sports Exerc . 1992;24(2):272–276. PMID:1549019. [PubMed] [Google Scholar]
- 314.Myers J, Do D, Herbert W, Ribisl P, Froelicher VF. A nomogram to predict exercise capacity from a specific activity questionnaire and clinical data. Am J Cardiol . 1994;73(8):591–596. doi: 10.1016/0002-9149(94)90340-9. https://doi.org/10.1016/0002-9149 (94)90340-9 . [DOI] [PubMed] [Google Scholar]
- 315.Silva OB, Saraiva LCR, Sobral DC., Filho Teste ergométrico em crianças e adolescentes: maior tolerância ao esforço com o protocolo em rampa. Arq Bras Cardiol . 2007;89(6) doi: 10.1590/S0066-782X2007001800007. [DOI] [Google Scholar]
- 316.Silva OB, Sobral Filho D. Uma nova Proposta para Orientar a Velocidade e Inclinação no Protocolo em Rampa na Esteira Ergométrica. Arq Bras Cardiol. . 2003;81(1):42–53. doi: 10.1590/S1517-86922012000600004. [DOI] [Google Scholar]
- 317.Foster C, Crowe AJ, Daines E, Dumit M, ]Green MA, Lettau S, et al. Predicting functional capacity during treadmill testing independent of exercise protocol. Med Amp Sci Sports Amp Exerc . 1996;28(6):752–756. doi: 10.1097/00005768-199606000-00014. [DOI] [PubMed] [Google Scholar]
- 318.Balady GJ, Weiner DA, Rose L, Ryan TJ, Erario M. Physiologic responses to arm ergometry exercise relative to age and gender. J Am Coll Cardiol . 1990;16(1):130–135. doi: 10.1016/0735-1097(90)90469-6. https://doi.org/10.1016/0735-1097 (90)90469-6 . [DOI] [PubMed] [Google Scholar]
- 319.Mitropoulos A, Gumber A, Crank H, Klonizakis M. Validation of an Arm Crank Ergometer Test for Use in Sedentary Adults. J Sports Sci Med . 2017;16(4):558–564. PMID: 29238257; PMCID: PMC5721187. [PMC free article] [PubMed] [Google Scholar]
- 320.Diamond GA. Reverend Bayes' silent majority. An alternative factor affecting sensitivity and specificity of exercise electrocardiography. Am J Cardiol . 1986;57(13):1175–1180. doi: 10.1016/0002-9149(86)90694-6. https://doi.org/10.1016/0002-9149 (86)90694-6 . [DOI] [PubMed] [Google Scholar]
- 321.Diamond GA, Forrester JS. Analysis of Probability as an Aid in the Clinical Diagnosis of Coronary-Artery Disease. N Engl J Med . 1979;300(24):1350–1358. doi: 10.1056/NEJM197906143002402. [DOI] [PubMed] [Google Scholar]
- 322.Pryor DB. Value of the History and Physical in Identifying Patients at Increased Risk for Coronary Artery Disease. Ann Intern Med . 1993;118(2):81–90. doi: 10.7326/0003-4819-118-2-199301150-00001. [DOI] [PubMed] [Google Scholar]
- 323.Zou KH, O'Malley AJ, Mauri L. Receiver-Operating Characteristic Analysis for Evaluating Diagnostic Tests and Predictive Models. Circulation . 2007;115(5):654–657. doi: 10.1161/CIRCULATIONAHA.105.594929. [DOI] [PubMed] [Google Scholar]
- 324.Daugherty SL, Magid DJ, Kikla JR, Hokanson JE, Baxter J, Ross CA, et al. Gender differences in the prognostic value of exercise treadmill test characteristics. Am Heart J . 2011;161(5):908–914. doi: 10.1016/j.ahj.2011.01.021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 325.Kohli P, Gulati M. Exercise Stress Testing in Women: Going Back to the Basics. Circulation . 2010;122(24):2570–2580. doi: 10.1161/CIRCULATIONAHA.109.914754. [DOI] [PubMed] [Google Scholar]
- 326.Levisman JM, Aspry K, Amsterdam EA. Improving the Positive Predictive Value of Exercise Testing in Women for Coronary Artery Disease. Am J Cardiol . 2012;110(11):1619–1622. doi: 10.1016/j.amjcard.2012.07.027. [DOI] [PubMed] [Google Scholar]
- 327.Wong YK. Improving the positive predictive value of exercise testing in women. Heart . 2003;89(12):1416–1421. doi: 10.1136/heart.89.12.1416. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 328.SCORE2 working group and ESC Cardiovascular risk collaboration Hageman S, Pennells L, Ojeda F, Kaptoge S, Kuulasmaa K, et al. SCORE2 risk prediction algorithms: new models to estimate 10-year risk of cardiovascular disease in Europe. Eur Heart J . 2021;42(25):2439–2454. doi: 10.1093/eurheartj/ehab309. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 329.Arnett DK, Blumenthal RS, Albert MA, Buroker AB, Goldberger ZD, Hahn EJ, et al. 2019 ACC/AHA Guideline on the Primary Prevention of Cardiovascular Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation . 2019;140(11):e596–e646. doi: 10.1161/CIR.0000000000000678. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 330.Coutinho RQ, Montarroyos UR, Barros IML de, Guimarães MJB, Leão APD, Costa LOBF, et al. Exercise Testing, Family History, and Subclinical Atherosclerosis Markers for Cardiovascular Risk Reclassification in Middle-Aged Women. Int J Cardiovasc Sci . 2021;34(4):383–392. doi: 10.36660/ijcs.20200414. [DOI] [Google Scholar]
- 331.Précoma DB, Oliveira GMM de, Simão AF, Dutra OP, Coelho-Filho OR, Izar MC de O, et al. Updated Cardiovascular Prevention Guideline of the Brazilian Society of Cardiology - 2019. Arq Bras Cardiol . 2019;113(4):787–891. doi: 10.5935/abc.20190204. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 332.McCoy J, Bates M, Eggett C, Siervo M, Cassidy S, Newman J, et al. Pathophysiology of exercise intolerance in chronic diseases: the role of diminished cardiac performance in mitochondrial and heart failure patients. Open Heart . 2017;4(2):e000632. doi: 10.1136/openhrt-2017-000632. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 333.Borg GA. Psychophysical bases of perceived exertion. Med Sci Sports Exerc . 1982;14(5):377–381. PMID: 7154893. [PubMed] [Google Scholar]
- 334.Amorim H, Cadilha R, Parada F, Rocha A. Progression of aerobic exercise intensity in a cardiac rehabilitation program. Rev Port Cardiol . 2019;38(4):281–286. doi: 10.1016/j.repc.2018.07.009. [DOI] [PubMed] [Google Scholar]
- 335.Kitzman DW, Groban L. Exercise Intolerance. Cardiol Clin . 2011;29(3):461–477. doi: 10.1016/j.ccl.2011.06.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 336.Nayor M, Houstis NE, Namasivayam M, Rouvina J, Hardin C, Shah RV, et al. Impaired Exercise Tolerance in Heart Failure With Preserved Ejection Fraction. JACC Heart Fail . 2020;8(8):605–617. doi: 10.1016/j.jchf.2020.03.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 337.Palange P, Ward SA, Carlsen K-H, Casaburi R, Gallagher CG, Gosselink R, et al. Recommendations on the use of exercise testing in clinical practice. Eur Respir J . 2006;29(1):185–209. doi: 10.1183/09031936.00046906. [DOI] [PubMed] [Google Scholar]
- 338.Keytsman C, Dendale P, Hansen D. Chronotropic Incompetence During Exercise in Type 2 Diabetes: Aetiology, Assessment Methodology, Prognostic Impact and Therapy. Sports Med . 2015;45(7):985–995. doi: 10.1007/s40279-015-0328-5. [DOI] [PubMed] [Google Scholar]
- 339.Pandey A, Shah SJ, Butler J, Kellogg DL, Lewis GD, Forman DE, et al. Exercise Intolerance in Older Adults With Heart Failure With Preserved Ejection Fraction. J Am Coll Cardiol . 2021;78(11):1166–1187. doi: 10.1016/j.jacc.2021.07.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 340.Tucker WJ, Angadi SS, Haykowsky MJ, Nelson MD, Sarma S, Tomczak CR. Pathophysiology of Exercise Intolerance and Its Treatment With Exercise-Based Cardiac Rehabilitation in Heart Failure With Preserved Ejection Fraction. J Cardiopulm Rehabil Prev . 2020;40(1):9–16. doi: 10.1097/HCR.0000000000000481. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 341.Kokkinos P, Kaminsky LA, Arena R, Zhang J, Myers J. New Generalized Equation for Predicting Maximal Oxygen Uptake (from the Fitness Registry and the Importance of Exercise National Database) Am J Cardiol . 2017;120(4):688–692. doi: 10.1016/j.amjcard.2017.05.037. [DOI] [PubMed] [Google Scholar]
- 342.Kokkinos P, Kaminsky LA, Arena R, Zhang J, Myers J. A new generalized cycle ergometry equation for predicting maximal oxygen uptake: The Fitness Registry and the Importance of Exercise National Database (FRIEND) Eur J Prev Cardiol . 2018;25(10):1077–1082. doi: 10.1177/2047487318772667. [DOI] [PubMed] [Google Scholar]
- 343.Jones NL. Clinical exercise testing . 4th. Philadelphia: Saunders; 1997. ISBN:072166511X. [Google Scholar]
- 344.Rossi JM, Tebexreni AS, Alves ANF, Abreu FB, Nishio PA, Thomazi MC, et al. Categorias de Aptidão Física Baseadas no VO2max em População Brasileira com Suposto Alto Nível Socioeconômico e sem Cardiopatia Estrutural. Arq Bras Cardiol . 2020;115(3):468–477. doi: 10.36660/abc.20190189. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 345.Myers J, Kaminsky LA, Lima R, Christle JW, Ashley E, Arena R. A Reference Equation for Normal Standards for VO2Max: Analysis from the Fitness Registry and the Importance of Exercise National Database (FRIEND Registry) Prog Cardiovasc Dis . 2017;60(1):21–29. doi: 10.1016/j.pcad.2017.03.002. [DOI] [PubMed] [Google Scholar]
- 346.Almeida AEM, Stefani C M, Nascimento JA, Almeida NM, Santos A C, Ribeiro JP, et al. An Equation for the Prediction of Oxygen Consumption in a Brazilian Population. Arq Bras Cardiol . 2014;103(4):299–307. doi: 10.5935/abc.20140137. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 347.Souza e Silva CG, Kaminsky LA, Arena R, Christle JW, Araújo CGS, Lima RM, et al. A reference equation for maximal aerobic power for treadmill and cycle ergometer exercise testing: Analysis from the FRIEND registry. Eur J Prev Cardiol . 2018;25(7):742–750. doi: 10.1177/2047487318763958. [DOI] [PubMed] [Google Scholar]
- 348.Milani M, Milani JGPO, Cipriano GFB, Castro I, Cipriano G., Junior Reference Standards for Cardiorespiratory Fitness in Brazil: a pooled analysis and overview of heterogeneity in national and international studies. J Cardiopulm Rehabil Prev . 2022;42(5):366–372. doi: 10.1097/HCR.0000000000000690. [DOI] [PubMed] [Google Scholar]
- 349.Myers JN. Perception of chest pain during exercise testing in patients with coronary artery disease. Med Sci Sports Exerc . 1994;26(9):1082–1086. doi: 10.1249/00005768-199409000-00003. [DOI] [PubMed] [Google Scholar]
- 350.Mahler DA, Horowitz MB. Clinica evaluation of exertional dyspnea. Clin Chest Med . 1994;15(2):259–269. https://doi.org/10.1016/S0272-5231 (21)01072-8 . [PubMed] [Google Scholar]
- 351.Jones CR, Pothier CE, Blackstone EH, Lauer MS. Prognostic importance of presenting symptoms in patients undergoing exercise testing for evaluation of known or suspected coronary disease. Am J Med . 2004;117(6):380–389. doi: 10.1016/j.amjmed.2004.06.004. [DOI] [PubMed] [Google Scholar]
- 352.Argulian E, Agarwal V, Bangalore S, Chatterjee S, Makani H, Rozanski A, et al. Meta-Analysis of Prognostic Implications of Dyspnea Versus Chest Pain in Patients Referred for Stress Testing. Am J Cardiol . 2014;113(3):559–564. doi: 10.1016/j.amjcard.2013.10.019. [DOI] [PubMed] [Google Scholar]
- 353.Audat G, Harbonnier M, Leftheriotis G, Abraham P. Comparison of reported symptoms to those produced by treadmill testing in patients with claudication suspected of arterial origin. Int Angiol J Int Union Angiol . 2014;33(4):379–383. PMID: 25056170. [PubMed] [Google Scholar]
- 354.Campisi ES, Schneiderman JE, Owen B, Moraes TJ, Campisi P. Exercise-induced laryngeal obstruction: Quality initiative to improve assessment and management. 109677 Int J Pediatr Otorhinolaryngol . 2019;127 doi: 10.1016/j.ijporl.2019.109677. [DOI] [PubMed] [Google Scholar]
- 355.Røksund OD, Heimdal J-H, Clemm H, Vollsæter M, Halvorsen T. Exercise inducible laryngeal obstruction: diagnostics and management. Paediatr Respir Rev . 2017;21:86–94. doi: 10.1016/j.prrv.2016.07.003. [DOI] [PubMed] [Google Scholar]
- 356.Sato Y, Kawasaki T, Honda S, Harimoto K, Miki S, Kamitani T, et al. Third and Fourth Heart Sounds and Myocardial Fibrosis in Hypertrophic Cardiomyopathy. Circ J . 2018;82(2):509–516. doi: 10.1253/circj.CJ-17-0650. [DOI] [PubMed] [Google Scholar]
- 357.Sakai C, Kawasaki T, Kawamata H, Harimoto K, Shiraishi H, Matoba S. Absent fourth heart sound as a marker of adverse events in hypertrophic cardiomyopathy with sinus rhythm. Ann Noninvasive Electrocardiol . 2022;27(3):e12932. doi: 10.1111/anec.12932. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 358.Mehta NJ, Khan IA. Third heart sound: genesis and clinical importance. Int J Cardiol . 2004;97(2):183–186. doi: 10.1016/j.ijcard.2003.05.031. [DOI] [PubMed] [Google Scholar]
- 359.Tavel ME. The appearance of gallop rhythm after exercise stress testing. Clin Cardiol . 1996;19(11):887–891. doi: 10.1002/clc.4960191109. [DOI] [PubMed] [Google Scholar]
- 360.Zhong L-S, Guo X-M, Xiao S-Z, Wang D, Wu W-Z. The Third Heart Sound after Exercise in Athletes: An Exploratory Study. Chin J Physiology . 2011;54(4):219–224. doi: 10.4077/CJP.2011.AMM049. [DOI] [PubMed] [Google Scholar]
- 361.Seviiri M, Lynch BM, Hodge AM, Yang Y, Liew D, English DR, et al. Resting heart rate, temporal changes in resting heart rate, and overall and cause-specific mortality. Heart . 2018;104(13):1076–1085. doi: 10.1136/heartjnl-2017-312251. [DOI] [PubMed] [Google Scholar]
- 362.Bellenger CR, Fuller JT, Thomson RL, Davison K, Robertson EY, Buckley JD. Monitoring Athletic Training Status Through Autonomic Heart Rate Regulation: A Systematic Review and Meta-Analysis. Sports Med . 2016;46(10):1461–1486. doi: 10.1007/s40279-016-0484-2. [DOI] [PubMed] [Google Scholar]
- 363.Zhang D, Wang W, Li F. Association between resting heart rate and coronary artery disease, stroke, sudden death and noncardiovascular diseases: a meta-analysis. Can Med Assoc J . 2016;188(15):E384–E392. doi: 10.1503/cmaj.160050. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 364.Khan H, Kunutsor S, Kalogeropoulos AP, Georgiopoulou VV, Newman AB, Harris TB, et al. Resting Heart Rate and Risk of Incident Heart Failure: Three Prospective Cohort Studies and a Systematic Meta-Analysis. J Am Heart Assoc . 2015;4(1):e001364. doi: 10.1161/JAHA.114.001364. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 365.Lau K, Malik A, Foroutan F, Buchan TA, Daza JF, Sekercioglu N, et al. Resting Heart Rate as an Important Predictor of Mortality and Morbidity in Ambulatory Patients With Heart Failure: A Systematic Review and Meta-Analysis. J Card Fail . 2021;27(3):349–363. doi: 10.1016/j.cardfail.2020.11.003. [DOI] [PubMed] [Google Scholar]
- 366.Ho JS, FitzGerald SJ, Barlow CE, Cannaday JJ, Kohl HW, Haskell WL, et al. Risk of mortality increases with increasing number of abnormal non-ST parameters recorded during exercise testing. Eur J Cardiovasc Prev Rehabil . 2010;17(4):462–468. doi: 10.1097/HJR.0b013e328336a10d. [DOI] [PubMed] [Google Scholar]
- 367.Aladin AI, Whelton SP, Al-Mallah MH, Blaha MJ, Keteyian SJ, Juraschek SP, et al. Relation of Resting Heart Rate to Risk for All-Cause Mortality by Gender After considering Exercise Capacity (the Henry Ford Exercise Testing Project) Am J Cardiol . 2014;114(11):1701–1706. doi: 10.1016/j.amjcard.2014.08.042. [DOI] [PubMed] [Google Scholar]
- 368.Wilkoff BL, Miller RE. Exercise Testing for Chronotropic Assessment. Cardiol Clin . 1992;10(4):705–717. https://doi.org/10.1016/S0733-8651 (18)30211-X . [PubMed] [Google Scholar]
- 369.Verrier RL, Tan A. Heart rate, autonomic markers, and cardiac mortality. Heart Rhythm . 2009;6(11) Suppl:S68–S75. doi: 10.1016/j.hrthm.2009.07.017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 370.Gulati M, Shaw LJ, Thisted RA, Black HR, Bairey Merz CN, Arnsdorf MF. Heart Rate Response to Exercise Stress Testing in Asymptomatic Women: The St. James Women Take Heart Project. Circulation . 2010;122(2):130–137. doi: 10.1161/CIRCULATIONAHA.110.939249. [DOI] [PubMed] [Google Scholar]
- 371.Pastore C, Pinho J, Pinho C, Samesima N, Pereira-Filho H, Kruse J, et al. III Diretrizes da Sociedade Brasileira de Cardiologia sobre análise e emissão de laudos eletrocardiográficos. Arq Bras Cardiol . 2016;106(4) Suppl 1:1–23. doi: 10.5935/abc.20160054. [DOI] [PubMed] [Google Scholar]
- 372.Claessen G, La Gerche A, Van De Bruaene A, Claeys M, Willems R, Dymarkowski S, et al. Heart Rate Reserve in Fontan Patients: Chronotropic Incompetence or Hemodynamic Limitation? J Am Heart Assoc . 2019;8(9):e012008. doi: 10.1161/JAHA.119.012008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 373.Kurl S, Jae SY, Voutilainen A, Hagnäs M, Laukkanen JA. Exercise heart rate reserve and recovery as risk factors for sudden cardiac death. Prog Cardiovasc Dis . 2021;68:7–11. doi: 10.1016/j.pcad.2021.09.002. [DOI] [PubMed] [Google Scholar]
- 374.Chambers JB, Rajani R, Parkin D, Saeed S. Rapid early rise in heart rate on treadmill exercise in patients with asymptomatic moderate or severe aortic stenosis: a new prognostic marker? Open Heart . 2019;6(1):e000950. doi: 10.1136/openhrt-2018-000950. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 375.Engeseth K, Hodnesdal C, Grundvold I, Liestøl K, Gjesdal K, Erikssen G, et al. Heart rate reserve predicts cardiovascular death among physically unfit but otherwise healthy middle-aged men: a 35-year follow-up study. Eur J Prev Cardiol . 2016;23(1):59–66. doi: 10.1177/2047487314553202. [DOI] [PubMed] [Google Scholar]
- 376.Jae SY, Kurl S, Laukkanen JA, Zaccardi F, Choi Y-H, Fernhall B, et al. Exercise Heart Rate Reserve and Recovery as Predictors of Incident Type 2 Diabetes. Am J Med . 2016;129(5):536.e7–536.e12. doi: 10.1016/j.amjmed.2016.01.014. [DOI] [PubMed] [Google Scholar]
- 377.Savonen KP, Kiviniemi V, Laukkanen JA, Lakka TA, Rauramaa TH, Salonen JT, et al. Chronotropic incompetence and mortality in middle-aged men with known or suspected coronary heart disease. Eur Heart J . 2008;29(15):1896–1902. doi: 10.1093/eurheartj/ehn269. [DOI] [PubMed] [Google Scholar]
- 378.Chauhan VS. Chronotropic Incompetency During Exercise Testing. JACC Clin Electrophysiol . 2016;2(6):653–655. doi: 10.1016/j.jacep.2016.05.003. [DOI] [PubMed] [Google Scholar]
- 379.Falcone C, Buzzi MP, Klersy C, Schwartz PJ. Rapid Heart Rate Increase at Onset of Exercise Predicts Adverse Cardiac Events in Patients With Coronary Artery Disease. Circulation . 2005;112(13):1959–1964. doi: 10.1161/CIRCULATIONAHA.105.545111. [DOI] [PubMed] [Google Scholar]
- 380.Wielemborek-Musial K, Szmigielska K, Leszczynska J, Jegier A. Blood Pressure Response to Submaximal Exercise Test in Adults. BioMed Res Int . 2016;2016:1–8. doi: 10.1155/2016/5607507. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 381.Uehara A, Kurata C, Sugi T, Mikami T, Yamazaki K, Satoh H, et al. Peak Systolic Blood Pressure in Exercise Testing is Associated With Scintigraphic Severity of Myocardial Ischemia in Patients With Exercise-Induced ST-Segment Depression. Jpn Circ J . 2000;64(8):590–594. doi: 10.1253/jcj.64.590. [DOI] [PubMed] [Google Scholar]
- 382.Hedman K, Cauwenberghs N, Christle JW, Kuznetsova T, Haddad F, Myers J. Workload-indexed blood pressure response is superior to peak systolic blood pressure in predicting all-cause mortality. Eur J Prev Cardiol . 2020;27(9):978–987. doi: 10.1177/2047487319877268. [DOI] [PubMed] [Google Scholar]
- 383.Syme AN, Blanchard BE, Guidry MA, Taylor AW, VanHeest JL, Hasson S, et al. Peak Systolic Blood Pressure on a Graded Maximal Exercise Test and the Blood Pressure Response to an Acute Bout of Submaximal Exercise. Am J Cardiol . 2006;98(7):938–943. doi: 10.1016/j.amjcard.2006.05.012. [DOI] [PubMed] [Google Scholar]
- 384.Babbs CF. The origin of Korotkoff sounds and the accuracy of auscultatory blood pressure measurements. J Am Soc Hypertens . 2015;9(12):935–950.e3. doi: 10.1016/j.jash.2015.09.011. [DOI] [PubMed] [Google Scholar]
- 385.Lauer MS. Is There a Relationship between Exercise Systolic Blood Pressure Response and Left Ventricular Mass?: The Framingham Heart Study. Ann Intern Med . 1992;116(3):203. doi: 10.7326/0003-4819-116-3-203. [DOI] [PubMed] [Google Scholar]
- 386.Le V-V, Mitiku T, Sungar G, Myers J, Froelicher V. The Blood Pressure Response to Dynamic Exercise Testing: A Systematic Review. Prog Cardiovasc Dis . 2008;51(2):135–160. doi: 10.1016/j.pcad.2008.07.001. [DOI] [PubMed] [Google Scholar]
- 387.Zafrir B, Aker A, Asaf Y, Saliba W. Blood pressure response during treadmill exercise testing and the risk for future cardiovascular events and new-onset hypertension. J Hypertens . 2022;40(1):143–152. doi: 10.1097/hjh.0000000000002991. [DOI] [PubMed] [Google Scholar]
- 388.Berger A, Grossman E, Katz M, Kivity S, Klempfner R, Segev S, et al. Exercise Blood Pressure and the Risk for Future Hypertension Among Normotensive Middle-Aged Adults. J Am Heart Assoc . 2015;4(4):e001710. doi: 10.1161/JAHA.114.001710. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 389.Ito K, Iwane M, Miyai N, Uchikawa Y, Mugitani K, Mohara O, et al. Exaggerated exercise blood pressure response in middle-aged men as a predictor of future blood pressure: a 10-year follow-up. Clin Exp Hypertens . 2016;38(8):696–700. doi: 10.1080/10641963.2016.1200597. [DOI] [PubMed] [Google Scholar]
- 390.Becker M de MC, Silva OB, Moreira IEG, Victor EG. Pressão arterial em adolescentes durante teste ergométrico. Arq Bras Cardiol . 2007;88(3):329–333. doi: 10.1590/S0066-782X2007000300012. [DOI] [PubMed] [Google Scholar]
- 391.Schultz MG, Sharman JE. Exercise Hypertension. Pulse . 2013;1(3-4):161–176. doi: 10.1159/000360975. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 392.Youn J-C, Kang S-M. Cardiopulmonary Exercise Test in Patients with Hypertension: Focused on Hypertensive Response to Exercise. Pulse . 2015;3(2):114–117. doi: 10.1159/000431107. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 393.Dutra-Marques AC, Rodrigues S, Cepeda FX, Toschi-Dias E, Rondon E, Carvalho JC, et al. Exaggerated Exercise Blood Pressure as a Marker of Baroreflex Dysfunction in Normotensive Metabolic Syndrome Patients. 680195 Front Neurosci . 2021;15 doi: 10.3389/fnins.2021.680195. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 394.Ha J-W, Juracan EM, Mahoney DW, Oh JK, Shub C, Seward JB, et al. Hypertensive response to exercise: a potential cause for new wall motion abnormality in the absence of coronary artery disease. J Am Coll Cardiol . 2002;39(2):323–327. doi: 10.1016/s0735-1097(01)01743-0. https://doi.org/10.1016/S0735-1097 (01)01743-0 . [DOI] [PubMed] [Google Scholar]
- 395.Carneiro HA, Song RJ, Lee J, Schwartz B, Vasan RS, Xanthakis V. Association of Blood Pressure and Heart Rate Responses to Submaximal Exercise With Incident Heart Failure: The Framingham Heart Study. J Am Heart Assoc . 2021;10(7):e019460. doi: 10.1161/JAHA.120.019460. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 396.Sarma S, Howden E, Carrick-Ranson G, Lawley J, Hearon C, Samels M, et al. Elevated exercise blood pressure in middle-aged women is associated with altered left ventricular and vascular stiffness. J Appl Physiol . 2020;128(5):1123–1129. doi: 10.1152/japplphysiol.00458.2019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 397.Schultz MG, Otahal P, Cleland VJ, Blizzard L, Marwick TH, Sharman JE. Exercise-Induced Hypertension, Cardiovascular Events, and Mortality in Patients Undergoing Exercise Stress Testing: A Systematic Review and Meta-Analysis. Am J Hypertens . 2013;26(3):357–366. doi: 10.1093/ajh/hps053. [DOI] [PubMed] [Google Scholar]
- 398.Jurrens TL, From AM, Kane GC, Mulvagh SL, Pellikka PA, McCully RB. An Exaggerated Blood Pressure Response to Treadmill Exercise does not Increase the Likelihood that Exercise Echocardiograms are Abnormal in Men or Women. J Am Soc Echocardiogr . 2012;25(10):1113–1119. doi: 10.1016/j.echo.2012.07.001. [DOI] [PubMed] [Google Scholar]
- 399.Bouzas-Mosquera C, Bouzas-Mosquera A, Peteiro J. Valor pronóstico del incremento de la presión arterial sistólica con el ejercicio en pacientes hipertensos con enfermedad coronaria conocida o sospechada. Med Clínica . 2017;148(2):51–56. doi: 10.1016/j.medcli.2016.09.016. [DOI] [PubMed] [Google Scholar]
- 400.Schultz MG, Picone DS, Nikolic SB, Williams AD, Sharman JE. Exaggerated blood pressure response to early stages of exercise stress testing and presence of hypertension. J Sci Med Sport . 2016;19(12):1039–1042. doi: 10.1016/j.jsams.2016.04.004. [DOI] [PubMed] [Google Scholar]
- 401.Kokkinos P, Pittaras A, Narayan P, Faselis C, Singh S, Manolis A. Exercise Capacity and Blood Pressure Associations With Left Ventricular Mass in Prehypertensive Individuals. Hypertension . 2007;49(1):55–61. doi: 10.1161/01.HYP.0000250759.71323.8b. [DOI] [PubMed] [Google Scholar]
- 402.Bekendam MT, Mommersteeg PMC, Kop WJ, Widdershoven JW, Vermeltfoort IAC. Anxiety and hemodynamic reactivity during cardiac stress testing: The role of gender and age in myocardial ischemia. J Nucl Cardiol . 2021;28(6):2581–2592. doi: 10.1007/s12350-020-02079-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 403.O'Neal WT, Qureshi WT, Blaha MJ, Keteyian SJ, Brawner CA, Al-Mallah MH. Systolic Blood Pressure Response During Exercise Stress Testing: The Henry Ford ExercIse Testing (FIT) Project. J Am Heart Assoc . 2015;4(5):e002050. doi: 10.1161/JAHA.115.002050. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 404.Christou GA, Christou KA, Kiortsis DN. Pathophysiology of Noncardiac Syncope in Athletes. Sports Med . 2018;48(7):1561–1573. doi: 10.1007/s40279-018-0911-7. [DOI] [PubMed] [Google Scholar]
- 405.Laukkanen JA, Kurl S. Blood pressure responses during exercise testing-is up best for prognosis? Ann Med . 2012;44(3):218–224. doi: 10.3109/07853890.2011.560180. [DOI] [PubMed] [Google Scholar]
- 406.Grossman A, Cohen N, Shemesh J, Koren-Morag N, Leibowitz A, Grossman E. Exaggerated Blood Pressure Response to Exercise Is Not Associated With Masked Hypertension in Patients With High Normal Blood Pressure Levels. J Clin Hypertens . 2014;16(4):277–282. doi: 10.1111/jch.12303. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 407.Hedman K, Lindow T, Cauwenberghs N, Carlén A, Elmberg V, Brudin L, et al. Peak exercise SBP and future risk of cardiovascular disease and mortality. J Hypertens . 2022;40(2):300–309. doi: 10.1097/HJH.0000000000003008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 408.Aker A, Saliba W, Hislop E, Zafrir B. Blood pressure measurements during treadmill exercise testing and the risk for the future development of atrial fibrillation. Hypertens Res . 2022;45(9):1496–1504. doi: 10.1038/s41440-022-00920-5. [DOI] [PubMed] [Google Scholar]
- 409.Barlow PA, Otahal P, Schultz MG, Shing CM, Sharman JE. Low exercise blood pressure and risk of cardiovascular events and all-cause mortality: Systematic review and meta-analysis. Atherosclerosis . 2014;237(1):13–22. doi: 10.1016/j.atherosclerosis.2014.08.029. [DOI] [PubMed] [Google Scholar]
- 410.Arbelo E, Protonotarios A, Gimeno JR, Arbustini E, Barriales-Villa R, Basso C, et al. 2023 ESC Guidelines for the management of cardiomyopathies. European Heart Journal . 2023:ehad194. doi: 10.1093/eurheartj/ehad194. [DOI] [PubMed] [Google Scholar]
- 411.Fitzgerald BT, Ballard EL, Scalia GM. Estimation of the Blood Pressure Response With Exercise Stress Testing. Heart Lung Circ . 2019;28(5):742–751. doi: 10.1016/j.hlc.2018.04.279. [DOI] [PubMed] [Google Scholar]
- 412.Hedman K, Kaminsky LA, Sabbahi A, Arena R, Myers J. Low but not high exercise systolic blood pressure is associated with long-term all-cause mortality. BMJ Open Sport Exerc Med . 2021;7(2):e001106. doi: 10.1136/bmjsem-2021-001106. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 413.Kirkendall WM, Burton AC, Epstein FH, Freis ED. Recommendations for Human Blood Pressure Determination by Sphygmomanometers. Circulation . 1967;36(6):980–988. doi: 10.1161/01.CIR.36.6.980. [DOI] [PubMed] [Google Scholar]
- 414.Pickering TG, Hall JE, Appel LJ, Falkner BE, Graves J, Hill MN, et al. Recommendations for Blood Pressure Measurement in Humans and Experimental Animals: Part 1: Blood Pressure Measurement in Humans: A Statement for Professionals From the Subcommittee of Professional and Public Education of the American Heart Association Council on High Blood Pressure Research. Circulation . 2005;111(5):697–716. doi: 10.1161/01.CIR.0000154900.76284.F6. [DOI] [PubMed] [Google Scholar]
- 415.Alihanoglu YI, Yildiz BS, Kilic ID, Uludag B, Demirci EE, Zungur M, et al. Impaired Systolic Blood Pressure Recovery and Heart Rate Recovery After Graded Exercise in Patients With Metabolic Syndrome. Medicine (Baltimore) . 2015;94(2):e428. doi: 10.1097/MD.0000000000000428. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 416.McHam SA, Marwick TH, Pashkow FJ, Lauer MS. Delayed systolic blood pressure recovery after graded exercise. J Am Coll Cardiol . 1999;34(3):754–759. doi: 10.1016/s0735-1097(99)00269-7. https://doi.org/10.1016/S0735-1097 (99)00269-7 . [DOI] [PubMed] [Google Scholar]
- 417.Huang C-L, Su T-C, Chen W-J, Lin L-Y, Wang W-L, Feng M-H, et al. Usefulness of Paradoxical Systolic Blood Pressure Increase After Exercise as a Predictor of Cardiovascular Mortality. Am J Cardiol . 2008;102(5):518–523. doi: 10.1016/j.amjcard.2008.04.027. [DOI] [PubMed] [Google Scholar]
- 418.Hsu JC, Chu PS, Su TC, Lin LY, Chen WJ, Hwang JS, et al. Predictors for coronary artery disease in patients with paradoxical systolic blood pressure elevation during recovery after graded exercise. Int J Cardiol . 2007;119(2):274–276. doi: 10.1016/j.ijcard.2006.07.160. [DOI] [PubMed] [Google Scholar]
- 419.Laukkanen JA, Willeit P, Kurl S, Mäkikallio TH, Savonen K, Ronkainen K, et al. Elevated systolic blood pressure during recovery from exercise and the risk of sudden cardiac death. J Hypertens . 2014;32(3):659–666. doi: 10.1097/HJH.0000000000000066. [DOI] [PubMed] [Google Scholar]
- 420.Taylor AJ, Beller GA. Postexercise systolic blood pressure response: clinical application to the assessment of ischemic heart disease. Am Fam Physician . 1998;58(5):1126–1130. PMID: 9787278. [PubMed] [Google Scholar]
- 421.Yosefy C, Jafari J, Klainman E, Brodkin B, Handschumacher MD, Vaturi M. The prognostic value of post-exercise blood pressure reduction in patients with hypertensive response during exercise stress test. Int J Cardiol . 2006;111(3):352–357. doi: 10.1016/j.ijcard.2005.07.039. [DOI] [PubMed] [Google Scholar]
- 422.Kim TH, Jang HJ, Kim S, Cho SY, Song KS, Pickett C, et al. A new test for diagnosing vasovagal syncope: Standing after treadmill test with sublingual nitrate administration. PLoS One . 2017;12(6):e0179631. doi: 10.1371/journal.pone.0179631. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 423.Kligfield P, Lauer MS. Exercise Electrocardiogram Testing: Beyond the ST Segment. Circulation . 2006;114(19):2070–2082. doi: 10.1161/CIRCULATIONAHA.105.561944. [DOI] [PubMed] [Google Scholar]
- 424.Villella M, Villella A, Barlera S, Franzosi MG, Maggioni AP. Prognostic significance of double product and inadequate double product response to maximal symptom-limited exercise stress testing after myocardial infarction in 6296 patients treated with thrombolytic agents. Am Heart J . 1999;137(3):443–452. doi: 10.1016/s0002-8703(99)70490-4. https://doi.org/10.1016/S0002-8703 (99)70490-4 . [DOI] [PubMed] [Google Scholar]
- 425.Sheppard JP, Barker TA, Ranasinghe AM, Clutton-Brock TH, Frenneaux MP, Parkes MJ. Does modifying electrode placement of the 12 lead ECG matter in healthy subjects? Int J Cardiol . 2011;152(2):184–191. doi: 10.1016/j.ijcard.2010.07.013. [DOI] [PubMed] [Google Scholar]
- 426.Pérez-Riera AR, Barbosa-Barros R, Daminello-Raimundo R, de Abreu LC. Main artifacts in electrocardiography. Ann Noninvasive Electrocardiol . 2018;23(2):e12494. doi: 10.1111/anec.12494. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 427.Kligfield P, Badilini F, Denjoy I, Babaeizadeh S, Clark E, De Bie J, et al. Comparison of automated interval measurements by widely used algorithms in digital electrocardiographs. Am Heart J . 2018;200:1–10. doi: 10.1016/j.ahj.2018.02.014. [DOI] [PubMed] [Google Scholar]
- 428.Luo S, Johnston P. A review of electrocardiogram filtering. J Electrocardiol . 2010;43(6):486–496. doi: 10.1016/j.jelectrocard.2010.07.007. [DOI] [PubMed] [Google Scholar]
- 429.Buendía-Fuentes F, Arnau-Vives MA, Arnau-Vives A, Jiménez-Jiménez Y, Rueda-Soriano J, Zorio-Grima E, et al. High-Bandpass Filters in Electrocardiography: Source of Error in the Interpretation of the ST Segment. ISRN Cardiol . 2012;2012:1–10. doi: 10.5402/2012/706217. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 430.Kligfield P, Badilini F, Rowlandson I, Xue J, Clark E, Devine B, et al. Comparison of automated measurements of electrocardiographic intervals and durations by computer-based algorithms of digital electrocardiographs. Am Heart J . 2014;167(2):150–9.e1. doi: 10.1016/j.ahj.2013.10.004. [DOI] [PubMed] [Google Scholar]
- 431.Pandya A, Ellestad MH, Crump R. Time Course of Changes in P-Wave Duration during Exercise. Cardiology . 1996;(4):343–346. doi: 10.1159/000177117. [DOI] [PubMed] [Google Scholar]
- 432.Myrianthefs MM, Ellestad MH, Startt-Selvester RH, Crump R. Significance of signal-averaged P-wave changes during exercise in patients with coronary artery disease and correlation with angiographic findings. Am J Cardiol . 1991;68(17):1619–1624. doi: 10.1016/0002-9149(91)90319-g. https://doi.org/10.1016/0002-9149 (91)90319-G . [DOI] [PubMed] [Google Scholar]
- 433.Barutcu I, Esen AM, Ozdemir R, Acikgoz N, Turkmen M, Kirma C. Effect of treadmill exercise testing on P wave duration and dispersion in patients with isolated myocardial bridging. Int J Cardiovasc Imaging . 2009;25(5):465–470. doi: 10.1007/s10554-009-9435-4. [DOI] [PubMed] [Google Scholar]
- 434.Agnieszka Wsol, Wioletta Wydra, Marek Chmielewski, Andrzej Swiatowiec, Marek Kuch. Increased sensitivity of prolonged P-wave during exercise stress test in detection of angiographically documented coronary artery disease. Cardiol J . 2017;24(2):159–166. doi: 10.5603/CJ.a2016.0099. [DOI] [PubMed] [Google Scholar]
- 435.Koyuncu I, Tuluce K, Tuluce SY, Koyuncu B, Eyuboglu M, Gursul E, et al. Diagnostic value of combining heart rate recovery and P-wave changes with exercise-induced changes in the ST segments for prediction of myocardial ischaemia. Acta Cardiol . 2015;70(4):422–429. doi: 10.1080/AC.70.4.3094651. [DOI] [PubMed] [Google Scholar]
- 436.Maganis JC, Gupta B, Gamie SH, LaBarbera JJ, Startt-Selvester RH, Ellestad MH. Usefulness of P-Wave Duration to Identify Myocardial Ischemia During Exercise Testing. Am J Cardiol . 2010;105(10):1365–1370. doi: 10.1016/j.amjcard.2009.12.060. [DOI] [PubMed] [Google Scholar]
- 437.Nakamoto T, Matsukawa K, Murata J, Komine H. Beat-to-Beat Modulation of Atrioventricular Conduction during Dynamic Exercise in Humans. Jpn J Physiol . 2005;55(1):37–51. doi: 10.2170/jjphysiol.R2089. [DOI] [PubMed] [Google Scholar]
- 438.Cabasson A, Meste O, Blain G, Bermon S. Quantifying the PR Interval Pattern During Dynamic Exercise and Recovery. IEEE Trans Biomed Eng . 2009;56(11):2675–2683. doi: 10.1109/TBME.2009.2028694. [DOI] [PubMed] [Google Scholar]
- 439.Moleiro F, Misticchio F, Mendoza I, Rodriguez A, Castellanos A, Myerburg RJ. Paradoxical behavior of PR interval dynamics during exercise and recovery and its relationship to cardiac memory at the atrioventricular node. J Electrocardiol . 2001;34(1):31–34. doi: 10.1054/jelc.2001.22027. [DOI] [PubMed] [Google Scholar]
- 440.Lu MLR, De Venecia T, Patnaik S, Figueredo VM. Atrial myocardial infarction: A tale of the forgotten chamber. Int J Cardiol . 2016;202:904–909. doi: 10.1016/j.ijcard.2015.10.070. [DOI] [PubMed] [Google Scholar]
- 441.O'Hara MJ, Subramanian VB, Davies AB, Raftery EB. Changes of Q wave amplitude during exercise for the prediction of coronary artery disease. Int J Cardiol . 1984;6(1):35–45. doi: 10.1016/0167-5273(84)90244-4. https://doi.org/10.1016/0167-5273 (84)90244-4 . [DOI] [PubMed] [Google Scholar]
- 442.Furuse T, Mashiba H, Jordan JW, O'Donnell J, Morris SN, McHenry PL. Usefulness of Q-wave response to exercise as a predictor of coronary artery disease. Am J Cardiol . 1987;59(1):57–60. doi: 10.1016/s0002-9149(87)80069-3. https://doi.org/10.1016/S0002-9149 (87)80069-3 . [DOI] [PubMed] [Google Scholar]
- 443.Barold SS, Falkoff MD, Ong LS, Heinle RA. Significance of Transient Electrocardiographic Q Waves in Coronary Artery Disease. Cardiol Clin . 1987;5(3):367–380. https://doi.org/10.1016/S0733-8651 (18)30527-7 . [PubMed] [Google Scholar]
- 444.Michaelides A, Dilaveris P, Psomadaki Z, Theoharis A, Andrikopoulos G, Richter D, et al. Exercise-induced prolongation of the infarct-related Q-waves as a marker of myocardial viability in the infarcted area. Int J Cardiol . 2004 2-3;94:261–267. doi: 10.1016/j.ijcard.2003.04.028. [DOI] [PubMed] [Google Scholar]
- 445.Meek S. ABC of clinical electrocardiography: Introduction. II---Basic terminology. BMJ . 2002;324(7335):470–473. doi: 10.1136/bmj.324.7335.470. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 446.De Hert S, Vrints C, Vanagt E, Snoeck J. Diagnostic value of R wave amplitude changes during exercise testing after myocardial infarction. Eur Heart J . 1986;7(9):760–764. doi: 10.1093/oxfordjournals.eurheartj.a062137. [DOI] [PubMed] [Google Scholar]
- 447.Isobe S, Takada Y, Ando A, Ohshima S, Yamada K, Nanasato M, et al. Increase in Electrocardiographic R-Waves After Revascularization in Patients With Acute Myocardial Infarction. Circ J . 2006;70(11):1385–1391. doi: 10.1253/circj.70.1385. [DOI] [PubMed] [Google Scholar]
- 448.Isobe S, Okada M, Ando A, Nanasato M, Nonokawa M, Izawa H, et al. Clinical significance of changes in electrocardiographic R-wave voltage on chest leads in patients with acute anterior myocardial infarction. J Electrocardiol . 2002;35(3):173–180. doi: 10.1054/jelc.2002.33761. [DOI] [PubMed] [Google Scholar]
- 449.Baron DW, Ilsley C, Sheiban I, Poole-Wilson PA, Rickards AF. R wave amplitude during exercise. Relation to left ventricular function and coronary artery disease. Heart . 1980;44(5):512–517. doi: 10.1136/hrt.44.5.512. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 450.Kaoukis A, Dritsas A, Theodorakos A, Koutelou M, Cokkinos DV. Correlation between R wave amplitude, exercise ischemic electrocardiographic indices and thallium-201 imaging defects in patients with known coronary artery disease. Int J Cardiol . 2007;117(3):413–414. doi: 10.1016/j.ijcard.2006.05.057. [DOI] [PubMed] [Google Scholar]
- 451.Frass M, Glogar D, Probst P, Schuster J, Kaindl F. R-wave amplitude changes during exercise stress testing: Patients with dilative cardiomyopathy compared to patients with coronary artery disease. J Electrocardiol . 1987;20(3):260–271. doi: 10.1016/s0022-0736(87)80025-0. https://doi.org/10.1016/S0022-0736 (87)80025-0 . [DOI] [PubMed] [Google Scholar]
- 452.Sinno MCN, Kowalski M, Kenigsberg DN, Krishnan SC, Khanal S. R-wave amplitude changes measured by electrocardiography during early transmural ischemia. J Electrocardiol . 2008;41(5):425–430. doi: 10.1016/j.jelectrocard.2007.12.008. [DOI] [PubMed] [Google Scholar]
- 453.Gianrossi R, Detrano R, Mulvihill D, Lehmann K, Dubach P, Colombo A, et al. Exercise-induced ST depression in the diagnosis of coronary artery disease. A meta-analysis. Circulation . 1989;80(1):87–98. doi: 10.1161/01.CIR.80.1.87. [DOI] [PubMed] [Google Scholar]
- 454.Hollenberg M, Go M, Masse BM, Wisneski JA, Gertz EW. Influence of R-wave amplitude on exercise-induced ST depression: Need for a "gain factor" correction when interpreting stress electrocardiograms. Am J Cardiol . 1985;56(1):13–17. doi: 10.1016/0002-9149(85)90557-0. https://doi.org/10.1016/0002-9149 (85)90557-0 . [DOI] [PubMed] [Google Scholar]
- 455.Wolthuis RA, Froelicher VF, Hopkirk A, Fischer JR, Keiser N. Normal electrocardiographic waveform characteristics during treadmill exercise testing. Circulation . 1979;60(5):1028–1035. doi: 10.1161/01.CIR.60.5.1028. [DOI] [PubMed] [Google Scholar]
- 456.Michaelides AP, Boudoulas H, Vyssoulis GP, Skouros C, Toutouzas PK. Exercise-induced S-wave prolongation in left anterior descending coronary artery stenosis. Am J Cardiol . 1992;70(18):1407–1411. doi: 10.1016/0002-9149(92)90290-f. https://doi.org/10.1016/0002-9149 (92)90290-F . [DOI] [PubMed] [Google Scholar]
- 457.Turkmen M, Barutcu I, Esen AM, Karakaya O, Esen O, Basaran Y. Comparison of Exercise QRS Amplitude Changes in Patients with Slow Coronary Flow Versus Significant Coronary Stenosis. Jpn Heart J . 2004;45(3):419–428. doi: 10.1536/jhj.45.419. [DOI] [PubMed] [Google Scholar]
- 458.Michaelides AP, Fourlas CA, Giannopoulos N, Aggeli K, Andrikopoulos GK, Tsioufis K, et al. Significance of QRS Duration Changes in the Evaluation of ST-Segment Depression Presenting Exclusively During the Postexercise Recovery Period. Ann Noninvasive Electrocardiol . 2006;11(3):241–246. doi: 10.1111/j.1542-474X.2006.00110.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 459.Cantor A, Goldfarb B, Aszodi A, Battler A. QRS Prolongation Measured by a New Computerized Method: A Sensitive Marker for Detecting Exercise-Induced Ischemia. Cardiology . 1997;88(5):446–452. doi: 10.1159/000177394. [DOI] [PubMed] [Google Scholar]
- 460.Cantor A, Goldfarb B, Aszodi A, Battler A. Ischemia detection after myocardial infarction: Diagnostic value of exercise-induced qrs duration changes evaluated by a new computerized method. J Electrocardiol . 1998;31(1):9–15. doi: 10.1016/s0022-0736(98)90002-4. https://doi.org/10.1016/S0022-0736 (98)90002-4 . [DOI] [PubMed] [Google Scholar]
- 461.Michaelides A, Ryan JM, VanFossen D, Pozderac R, Boudoulas H. Exercise-induced QRS prolongation in patients with coronary artery disease: A marker of myocardial ischemia. Am Heart J . 1993;126(6):1320–1325. doi: 10.1016/0002-8703(93)90529-i. https://doi.org/10.1016/0002-8703 (93)90529-I . [DOI] [PubMed] [Google Scholar]
- 462.Cantor A, Goldfarb B, Mai O, Battler A. Ischemia detection in women: The diagnostic value of exercise QRS duration changes. J Electrocardiol . 1998;31(4):271–277. doi: 10.1016/s0022-0736(98)90011-5. https://doi.org/10.1016/S0022-0736 (98)90011-5 . [DOI] [PubMed] [Google Scholar]
- 463.Yosefy C, Cantor A, Reisin L, Efrati S, Ilia R. The diagnostic value of QRS changes for prediction of coronary artery disease during exercise testing in women: false-positive rates. Coron Artery Dis . 2004;15(3):147–154. doi: 10.1097/00019501-200405000-00003. [DOI] [PubMed] [Google Scholar]
- 464.Berntsen RF, Gjestvang FT, Rasmussen K. QRS prolongation as an indicator of risk of ischemia-related ventricular tachycardia and fibrillation induced by exercise. Am Heart J . 1995;129(3):542–548. doi: 10.1016/0002-8703(95)90283-x. https://doi.org/10.1016/0002-8703 (95)90283-X . [DOI] [PubMed] [Google Scholar]
- 465.Abboud S, Zlochiver S. High-frequency QRS electrocardiogram for diagnosing and monitoring ischemic heart disease. J Electrocardiol . 2006;39(1):82–86. doi: 10.1016/j.jelectrocard.2005.09.007. [DOI] [PubMed] [Google Scholar]
- 466.Beker A, Pinchas A, Erel J, Abboud S. Analysis of High Frequency QRS Potential During Exercise Testing in Patients with Coronary Artery Disease and in Healthy Subjects. Pacing Clin Electrophysiol . 1996;19(12):2040–2050. doi: 10.1111/j.1540-8159.1996.tb03277.x. Pt 1. [DOI] [PubMed] [Google Scholar]
- 467.Amit G, Granot Y, Abboud S. Quantifying QRS changes during myocardial ischemia: Insights from high frequency electrocardiography. J Electrocardiol . 2014;47(4):505–511. doi: 10.1016/j.jelectrocard.2014.03.006. [DOI] [PubMed] [Google Scholar]
- 468.Lipton JA, Warren SG, Broce M, Abboud S, Beker A, Sörnmo L, et al. High-frequency QRS electrocardiogram analysis during exercise stress testing for detecting ischemia. Int J Cardiol . 2008;124(2):198–203. doi: 10.1016/j.ijcard.2007.02.002. [DOI] [PubMed] [Google Scholar]
- 469.Rosenmann D, Mogilevski Y, Amit G, Davrath LR, Tzivoni D. High-frequency QRS analysis improves the specificity of exercise ECG testing in women referred for angiography. J Electrocardiol . 2013;46(1):19–26. doi: 10.1016/j.jelectrocard.2012.08.007. [DOI] [PubMed] [Google Scholar]
- 470.Toledo E, Lipton JA, Warren SG, Abboud S, Broce M, Lilly DR, et al. Detection of stress-induced myocardial ischemia from the depolarization phase of the cardiac cycle-a preliminary study. J Electrocardiol . 2009;42(3):240–247. doi: 10.1016/j.jelectrocard.2008.12.023. [DOI] [PubMed] [Google Scholar]
- 471.Balfour PC, Gonzalez JA, Shaw PW, Caminero MP, Holland EM, Melson JW, et al. High-frequency QRS analysis to supplement ST evaluation in exercise stress electrocardiography: Incremental diagnostic accuracy and net reclassification. J Nucl Cardiol . 2020;27(6):2063–2075. doi: 10.1007/s12350-018-01530-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 472.Schaerli N, Abächerli R, Walter J, Honegger U, Puelacher C, Rinderknecht T, et al. Incremental value of high-frequency QRS analysis for diagnosis and prognosis in suspected exercise-induced myocardial ischaemia. Eur Heart J Acute Cardiovasc Care . 2020;9(8):836–847. doi: 10.1177/2048872619842988. [DOI] [PubMed] [Google Scholar]
- 473.Wagner GS, Macfarlane P, Wellens H, Josephson M, Gorgels A, Mirvis DM, et al. AHA/ACCF/HRS Recommendations for the Standardization and Interpretation of the Electrocardiogram. J Am Coll Cardiol . 2009;53(11):1003–1011. doi: 10.1016/j.jacc.2008.12.016. [DOI] [PubMed] [Google Scholar]
- 474.Surawicz B, Knilans TK, Chou T-C. Chou's electrocardiography in clinical practice: adult and pediatric . 6th ed. Philadelphia, PA: Saunders/Elsevier; 2008. ISBN:9781437711028. [Google Scholar]
- 475.Luna AB, Zareba W, Fiol M, Nikus K, Birnbaum Y, Baranowski R, et al. Negative T Wave in Ischemic Heart Disease: A Consensus Article: Negative T Wave in Ischemic Heart Disease. Ann Noninvasive Electrocardiol . 2014;19(5):426–441. doi: 10.1111/anec.12193. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 476.Lavie CJ, Oh JK, Mankin HT, Clements IP, Giuliani ER, Gibbons RJ. Significance of T-Wave Pseudonormalization during Exercise. Chest . 1988;94(3):512–516. doi: 10.1378/chest.94.3.512. [DOI] [PubMed] [Google Scholar]
- 477.Hasegawa K, Sawayama T, Inoue S, Nezuo S, Tadaoka S, Tanaka J, et al. Exercise induced precordial T wave normalization associated with U wave inversion in detection of left anterior descending artery stenosis. Kokyu Junkan . 1991;39(10):1015–1020. PMID:174867. [PubMed] [Google Scholar]
- 478.Mobilia G, Zanco P, Desideri A, Neri G, Alitto F, Suzzi G, et al. T wave normalization in infarct-related electrocardiographic leads during exercise testing for detection of residual viability. J Am Coll Cardiol . 1998;32(1):75–82. doi: 10.1016/s0735-1097(98)00205-8. https://doi.org/10.1016/S0735-1097 (98)00205-8 . [DOI] [PubMed] [Google Scholar]
- 479.Altun A, Durmus-Altun G, Birsin A, Gultekin A, Tatli E, Ozbay G. Normalization of Negative T Waves in the Chronic Stage of Q Wave Anterior Myocardial Infarction as a Predictor of Myocardial Viability. Cardiology . 2005;103(2):73–78. doi: 10.1159/000082051. [DOI] [PubMed] [Google Scholar]
- 480.Bednarz B, Wolk R, Mazurek T, Stec S, Chamiec T. Event-free survival in patients after an acute coronary event with exercise-induced normalization of the T-wave. Clin Cardiol . 2001;24(8):564–569. doi: 10.1002/clc.4960240808. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 481.Rautaharju PM, Surawicz B, Gettes LS. AHA/ACCF/HRS Recommendations for the Standardization and Interpretation of the Electrocardiogram. J Am Coll Cardiol . 2009;53(11):982–991. doi: 10.1016/j.jacc.2008.12.014. [DOI] [PubMed] [Google Scholar]
- 482.Surawicz B. U Wave: Facts, Hypotheses, Misconceptions, and Misnomers. J Cardiovasc Electrophysiol . 1998;9(10):1117–1128. doi: 10.1111/j.1540-8167.1998.tb00890.x. [DOI] [PubMed] [Google Scholar]
- 483.Fereniec M, Stix G, Kania M, Mroczka T, Maniewski R. An Analysis of the U-Wave and Its Relation to the T-Wave in Body Surface Potential Maps for Healthy Subjects and MI Patients: U-Wave and T-Wave Analysis in BSPM. Ann Noninvasive Electrocardiol . 2014;19(2):145–156. doi: 10.1111/anec.12110. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 484.di Bernardo D. Origin on the electrocardiogram of U-waves and abnormal U-wave inversion. Cardiovasc Res . 2002;53(1):202–208. doi: 10.1016/s0008-6363(01)00439-4. https://doi.org/10.1016/S0008-6363 (01)00439-4 . [DOI] [PubMed] [Google Scholar]
- 485.Reinig MG, Harizi R, Spodick DH. Electrocardiographic T- and U-Wave Discordance. Ann Noninvasive Electrocardiol . 2005;10(1):41–46. doi: 10.1111/j.1542-474X.2005.00596.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 486.Correale E, Battista R, Ricciardiello V, Martone A. The negative U wave: A pathogenetic enigma but a useful, often overlooked bedside diagnostic and prognostic clue in ischemic heart disease: The negative U wave: A pathogenetic enigma but a useful, often overlooked bedside diagnostic and prognostic clue in ischemic heart disease. Clin Cardiol . 2004;27(12):674–677. doi: 10.1002/clc.4960271203. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 487.Miwa K, Nakagawa K, Hirai T, Inoue H. Exercise-induced U-wave alterations as a marker of well-developed and well-functioning collateral vessels in patients with effort angina. J Am Coll Cardiol . 2000;35(3):757–763. doi: 10.1016/s0735-1097(99)00394-0. https://doi.org/10.1016/S0735-1097 (99)00394-0 . [DOI] [PubMed] [Google Scholar]
- 488.Chikamori T, Yamada M, Takata J, Furuno T, Yamasaki F, Doi YL. Exercise-induced prominent U waves as a marker of significant narrowing of the left circumflex or right coronary artery. Am J Cardiol . 1994;74(5):495–499. doi: 10.1016/0002-9149(94)90912-1. https://doi.org/10.1016/0002-9149 (94)90912-1 . [DOI] [PubMed] [Google Scholar]
- 489.Hayat NHJ, Salman H, Daimee MA, Thomas CS. Abolition of exercise induced positive U-wave after coronary angioplasty: clinical implication. Int J Cardiol . 2000;73(3):267–272. doi: 10.1016/s0167-5273(00)00234-5. https://doi.org/10.1016/S0167-5273 (00)00234-5 . [DOI] [PubMed] [Google Scholar]
- 490.Jian-ling S, Ying Z, Yu-lian G, Li-juan X, Ji-hong G, Xiao-ying L. Coronary heart disease diagnosis bases on the change of different parts in treadmill exercise test ECG. Cell Biochem Biophys . 2013;67(3):969–975. doi: 10.1007/s12013-013-9591-y. [DOI] [PubMed] [Google Scholar]
- 491.Miwa K, Igawa A, Nakagawa K, Hirai T, Fujita M, Inoue H. Exercise-induced negative U waves in precordial leads as a marker of viable myocardium in patients with recent anterior myocardial infarction. Int J Cardiol . 2000;73(2):149–156. doi: 10.1016/s0167-5273(00)00168-6. https://doi.org/10.1016/S0167-5273 (00)00168-6 . [DOI] [PubMed] [Google Scholar]
- 492.Kodama K, Hiasa G, Ohtsuka T, Ikeda S, Hashida H, Kuwahara T, et al. Transient U Wave Inversion During Treadmill Exercise Testing in Patients with Left Anterior Descending Coronary Artery Disease. Angiology . 2000;51(7):581–589. doi: 10.1177/000331970005100706. [DOI] [PubMed] [Google Scholar]
- 493.Matsuguchi T, Koiwaya Y, Hakagaki O, Takeshita A, Nakamura M. Transient U wave inversion during variant angina. Am Heart J . 1984;108(4):899–904. doi: 10.1016/0002-8703(84)90452-6. Pt 1. https://doi.org/10.1016/0002-8703 (84)90452-6 . [DOI] [PubMed] [Google Scholar]
- 494.Bourier F, Denis A, Cheniti G, Lam A, Vlachos K, Takigawa M, et al. Early Repolarization Syndrome: Diagnostic and Therapeutic Approach. 169 Front Cardiovasc Med . 2018;5 doi: 10.3389/fcvm.2018.00169. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 495.Ji HY, Hu N, Liu R, Zhou HR, Gao WL, Quan XQ. Worldwide prevalence of early repolarization pattern in general population and physically active individuals: A meta-analysis. Medicine (Baltimore) . 2021;100(22):e25978. doi: 10.1097/MD.0000000000025978. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 496.Liu L, Tang N, Bi W, Zhang M, Deng X, Cheng Y. Association Between Temporal Changes in Early Repolarization Pattern With Long-Term Cardiovascular Outcome: A Population-Based Cohort Study. J Am Heart Assoc . 2022;11(6):e022848. doi: 10.1161/JAHA.121.022848. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 497.Cheng Y, Zhao X, Pan S, Pan J, Zhang M, Li Z. Association of early repolarization pattern with cardiovascular outcomes in middle-aged population: A cohort study. Clin Cardiol . 2020;43(12):1601–1608. doi: 10.1002/clc.23488. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 498.Patton KK, Ellinor PT, Ezekowitz M, Kowey P, Lubitz SA, Perez M, et al. Electrocardiographic Early Repolarization: A Scientific Statement From the American Heart Association. Circulation . 2016;133(15):1520–1529. doi: 10.1161/CIR.0000000000000388. [DOI] [PubMed] [Google Scholar]
- 499.Macfarlane PW, Antzelevitch C, Haissaguerre M, Huikuri HV, Potse M, Rosso R, et al. The Early Repolarization Pattern. J Am Coll Cardiol . 2015;66(4):470–477. doi: 10.1016/j.jacc.2015.05.033. [DOI] [PubMed] [Google Scholar]
- 500.Junttila MJ, Sager SJ, Tikkanen JT, Anttonen O, Huikuri HV, Myerburg RJ. Clinical significance of variants of J-points and J-waves: early repolarization patterns and risk. Eur Heart J . 2012;33(21):2639–2643. doi: 10.1093/eurheartj/ehs110. [DOI] [PubMed] [Google Scholar]
- 501.Spratt KA, Borans SM, Michelson EL. Early repolarization: normalization of the electrocardiogram with exercise as a clinically useful diagnostic feature. J Invasive Cardiol . 1995;7(8):238–242. PMID: 10158115. [PubMed] [Google Scholar]
- 502.Bastiaenen R, Raju H, Sharma S, Papadakis M, Chandra N, Muggenthaler M, et al. Characterization of early repolarization during ajmaline provocation and exercise tolerance testing. Heart Rhythm . 2013;10(2):247–254. doi: 10.1016/j.hrthm.2012.10.032. [DOI] [PubMed] [Google Scholar]
- 503.Nouraei H, Rabkin SW. The effect of exercise on the ECG criteria for early repolarization pattern. J Electrocardiol . 2019;55:59–64. doi: 10.1016/j.jelectrocard.2019.03.005. [DOI] [PubMed] [Google Scholar]
- 504.Barbosa EC, Bomfim AS, Benchimol-Barbosa PR, Ginefra P. Ionic Mechanisms and Vectorial Model of Early Repolarization Pattern in the Surface Electrocardiogram of the Athlete. Ann Noninvasive Electrocardiol . 2008;13(3):301–307. doi: 10.1111/j.1542-474X.2008.00235.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 505.Okin PM, Bergman G, Kligfield P. Effect of ST segment measurement point on performance of standard and heart rate-adjusted ST segment criteria for the identification of coronary artery disease. Circulation . 1991;84(1):57–66. doi: 10.1161/01.CIR.84.1.57. [DOI] [PubMed] [Google Scholar]
- 506.Tuna Katircibasi M, Tolga Koçum H, Tekin A, Erol T, Tekin G, Baltali M, et al. Exercise-induced ST-segment elevation in leads aVR and V1 for the prediction of left main disease. Int J Cardiol . 2008;128(2):240–243. doi: 10.1016/j.ijcard.2007.05.022. [DOI] [PubMed] [Google Scholar]
- 507.Chaitman BR, Waters DD, Théroux P, Hanson JS. S-T segment elevation and coronary spasm in response to exercise. Am J Cardiol . 1981;47(6):1350–1358. doi: 10.1016/0002-9149(81)90268-x. https://doi.org/10.1016/0002-9149 (81)90268-X . [DOI] [PubMed] [Google Scholar]
- 508.Beinart R, Matetzky S, Shechter M, Fefer P, Rozen E, Beinart T, et al. Stress-induced ST-segment elevation in patients without prior Q-wave myocardial infarction. J Electrocardiol . 2008;41(4):312–317. doi: 10.1016/j.jelectrocard.2007.12.005. [DOI] [PubMed] [Google Scholar]
- 509.Akil S, Sunnersjö L, Hedeer F, Hedén B, Carlsson M, Gettes L, et al. Stress-induced ST elevation with or without concomitant ST depression is predictive of presence, location and amount of myocardial ischemia assessed by myocardial perfusion SPECT, whereas isolated stress-induced ST depression is not. J Electrocardiol . 2016;49(3):307–315. doi: 10.1016/j.jelectrocard.2016.03.016. [DOI] [PubMed] [Google Scholar]
- 510.Murray DP, Tan LB, Salih M, Weissberg P, Murray RG, Littler WA. Reciprocal change, exercise-induced ST segment depression and coronary anatomy: Are they related in the post-infarct patient? Clin Sci . 1988;74(6):621–627. doi: 10.1042/cs0740621. [DOI] [PubMed] [Google Scholar]
- 511.Stevenson RN, Umachandran V, Ranjadayalan K, Roberts RH, Timmis AD. Early exercise testing after treatment with thrombolytic drugs for acute myocardial infarction: importance of reciprocal ST segment depression. BMJ . 1994;308(6938):1189–1192. doi: 10.1136/bmj.308.6938.1189. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 512.Margonato A, Chierchia SL, Xuereb RG, Xuereb M, Fragasso G, Cappelletti A, et al. Specificity and sensitivity of exercise-induced st segment elevation for detection of residual viability: Comparison with fluorodeoxyglucose and positron emission tomography. J Am Coll Cardiol . 1995;25(5):1032–1038. doi: 10.1016/0735-1097(94)00539-3. https://doi.org/10.1016/0735-1097 (94)00539-3 . [DOI] [PubMed] [Google Scholar]
- 513.Gussak I, Wright RS, Kopecky SL, Hammill SC. Exercise-Induced ST Segment Elevation in Q Wave Leads in Postinfarction Patients: Defining Its Meaning and Utility in Today's Practice. Cardiology . 2000;93(4):205–209. doi: 10.1159/000007028. [DOI] [PubMed] [Google Scholar]
- 514.Figueras J, Domingo E, Ferreira I, Bellera N, Lidón RM, Garcia-Dorado D. Angina without significant coronary stenosis of non vasospastic origin. Clinical profile and long-term follow-up of patients with vs patients without stress induced ST segment depression. Int J Cardiol . 2012;161(1):53–55. doi: 10.1016/j.ijcard.2012.06.044. [DOI] [PubMed] [Google Scholar]
- 515.Castelló R, Alegría E, Merino A, Hidalgo R, Aparici M, Martínez-Caro D. Stress Testing in Patients with Coronary Spasm: Comparison of Those With and Without Fixed Coronary Artery Disease. Angiology . 1989;40(8):724–729. doi: 10.1177/000331978904000807. [DOI] [PubMed] [Google Scholar]
- 516.Ghaffari S, Asadzadeh R, Tajlil A, Mohammadalian A, Pourafkari L. Predictive Value of Exercise Stress Test-Induced ST-Segment Changes in Leads V 1 and avR in Determining Angiographic Coronary Involvement. Ann Noninvasive Electrocardiol . 2017;22(1):e12370. doi: 10.1111/anec.12370. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 517.Wagener M, Abächerli R, Honegger U, Schaerli N, Prêtre G, Twerenbold R, et al. Diagnostic and Prognostic Value of Lead aVR During Exercise Testing in Patients Suspected of Having Myocardial Ischemia. Am J Cardiol . 2017;119(7):959–966. doi: 10.1016/j.amjcard.2016.11.056. [DOI] [PubMed] [Google Scholar]
- 518.Bodí V, Sanchis J, Llàcer À, López-Lereu MP, Losada A, Pellicer M, et al. Significance of exercise-induced ST segment elevation in Q leads in patients with a recent myocardial infarction and an open infarct-related artery. Int J Cardiol . 2005;103(1):85–91. doi: 10.1016/j.ijcard.2004.08.022. [DOI] [PubMed] [Google Scholar]
- 519.Kligfield P, Ameisen O, Okin PM. Heart rate adjustment of ST segment depression for improved detection of coronary artery disease. Circulation . 1989;79(2):245–255. doi: 10.1161/01.CIR.79.2.245. [DOI] [PubMed] [Google Scholar]
- 520.Detrano R, Gianrossi R, Mulvihill D, Lehmann K, Dubach P, Colombo A, et al. Exercise-induced st segment depression in the diagnosis of multivessel coronary disease: A meta analysis. J Am Coll Cardiol . 1989;14(6):1501–1508. doi: 10.1016/0735-1097(89)90388-4. https://doi.org/10.1016/0735-1097 (89)90388-4 . [DOI] [PubMed] [Google Scholar]
- 521.Lalonde F, Poirier P, Sylvestre M-P, Arvisais D, Curnier D. Exercise-induced ischemic preconditioning detected by sequential exercise stress tests: A meta-analysis. Eur J Prev Cardiol . 2015;22(1):100–112. doi: 10.1177/2047487313502447. [DOI] [PubMed] [Google Scholar]
- 522.Hauser TH, Dorbala S, Sulaiman A, Di Carli MF. Quantitative relation of ST-segment depression during exercise to the magnitude of myocardial ischemia as assessed by single-photon emission computed tomographic myocardial perfusion imaging. Am J Cardiol . 2004;94(6):703–708. doi: 10.1016/j.amjcard.2004.06.001. [DOI] [PubMed] [Google Scholar]
- 523.Malhotra S, Follansbee WP, Soman P. Predictors of an ischemic electrocardiographic response in patients with exercise-induced myocardial ischemia. J Nucl Cardiol . 2011;18(4):678–684. doi: 10.1007/s12350-011-9409-5. [DOI] [PubMed] [Google Scholar]
- 524.Desai MY, Crugnale S, Mondeau J, Helin K, Mannting F. Slow upsloping ST-segment depression during exercise: Does it really signify a positive stress test? Am Heart J . 2002;143(3):482–487. doi: 10.1067/mhj.2002.120771. [DOI] [PubMed] [Google Scholar]
- 525.Rijneke RD, Ascoop CA, Talmon JL. Clinical significance of upsloping ST segments in exercise electrocardiography. Circulation . 1980;61(4):671–678. doi: 10.1161/01.CIR.61.4.671. [DOI] [PubMed] [Google Scholar]
- 526.Polizos G, Ellestad MH. The Value of Upsloping ST Depression in Diagnosing Myocardial Ischemia. Ann Noninvasive Electrocardiol . 2006;11(3):237–240. doi: 10.1111/j.1542-474X.2006.00109.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 527.Hajduczki I, Berenyi I, Enghoff E, Malmberg P, Erikson U. Qualitative and quantitative evaluation of the exercise electrocardiogram in assessing the degree of coronary heart disease. J Electrocardiol . 1985;18(1):55–62. doi: 10.1016/s0022-0736(85)80035-2. https://doi.org/10.1016/S0022-0736 (85)80035-2 . [DOI] [PubMed] [Google Scholar]
- 528.Miranda CP, Lehmann KG, Froelicher VF. Correlation between resting ST segment depression, exercise testing, coronary angiography, and long-term prognosis. Am Heart J . 1991;122(6):1617–1628. doi: 10.1016/0002-8703(91)90279-q. https://doi.org/10.1016/0002-8703 (91)90279-Q . [DOI] [PubMed] [Google Scholar]
- 529.Fearon WF, Lee DP, Froelicher VF. The effect of resting ST segment depression on the diagnostic characteristics of the exercise treadmill test. J Am Coll Cardiol . 2000;35(5):1206–1211. doi: 10.1016/s0735-1097(00)00518-0. https://doi.org/10.1016/S0735-1097 (00)00518-0 . [DOI] [PubMed] [Google Scholar]
- 530.Muzzarelli S, Pfisterer ME, Müller-Brand J, Zellweger MJ. Interrelation of ST-segment depression during bicycle ergometry and extent of myocardial ischaemia by myocardial perfusion SPECT. Eur J Nucl Med Mol Imaging . 2009;36(1):1842–1850. doi: 10.1007/s00259-009-1167-0. [DOI] [PubMed] [Google Scholar]
- 531.Weinsaft JW, Wong FJ, Walden J, Szulc M, Okin PM, Kligfield P. Anatomic Distribution of Myocardial Ischemia as a Determinant of Exercise-Induced ST-Segment Depression. Am J Cardiol . 2005;96(10):1356–1360. doi: 10.1016/j.amjcard.2005.07.038. [DOI] [PubMed] [Google Scholar]
- 532.Miranda CP. Comparison of Silent and Symptomatic Ischemia during Exercise Testing in Men. Ann Intern Med . 1991;114(8):649. doi: 10.7326/0003-4819-114-8-649. [DOI] [PubMed] [Google Scholar]
- 533.Watanabe T, Harumi K, Akutsu Y, Yamanaka H, Michihata T, Okazaki O, et al. Correlation between exercise-induced ischemic ST-segment depression and myocardial blood flow quantified by positron emission tomography. Am Heart J . 1998;136(3):533–542. doi: 10.1016/s0002-8703(98)70232-7. https://doi.org/10.1016/S0002-8703 (98)70232-7 . [DOI] [PubMed] [Google Scholar]
- 534.Watanabe T, Harumi K, Akutsu Y, Yamanaka H, Okazaki O, Michihata T, et al. Significance of Downsloping ST- Segment Depression Induced by Low-level Exercise in Severe Coronary Artery Disease. Assessment with Myocardial Ischemia and Collateral Perfusion. Assessment with Myocardial Ischemia and Collateral Perfusion. Jpn Heart J . 1997;38(2):207–218. doi: 10.1536/ihj.38.207. [DOI] [PubMed] [Google Scholar]
- 535.Chow R, Fordyce CB, Gao M, Chan S, Gin K, Bennett M. The significance of early post-exercise ST segment normalization. J Electrocardiol . 2015;48(5):803–808. doi: 10.1016/j.jelectrocard.2015.06.007. [DOI] [PubMed] [Google Scholar]
- 536.Rich JD, Chen S, Ward RP. Comparison of High Risk Stress Myocardial Perfusion Imaging Findings in Men With Rapid Versus Prolonged Recovery of ST-Segment Depression After Exercise Stress Testing. Am J Cardiol . 2010;105(10):1361–1364. doi: 10.1016/j.amjcard.2009.12.061. [DOI] [PubMed] [Google Scholar]
- 537.Lanza GA. Diagnostic and prognostic value of ST segment depression limited to the recovery phase of exercise stress test. Heart . 2004;90(12):1417–1421. doi: 10.1136/hrt.2003.031260. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 538.Soto JR, Watson DD, Beller GA. Incidence and significance of ischemic ST-segment depression occurring solely during recovery after exercise testing. Am J Cardiol . 2001;88(6):670–672. doi: 10.1016/s0002-9149(01)01812-4. https://doi.org/10.1016/S0002-9149 (01)01812-4 . [DOI] [PubMed] [Google Scholar]
- 539.Katheria R, Setty SK, Arun BS, Bhat P, Jagadeesh HV, Manjunath CN. Significance of 'recovery ST-segment depression' in exercise stress test. Indian Heart J . 2021;73(6):693–696. doi: 10.1016/j.ihj.2021.10.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 540.Rywik TM, O'Connor FC, Gittings NS, Wright JG, Khan AA, Fleg JL. Role of Nondiagnostic Exercise-Induced ST-Segment Abnormalities in Predicting Future Coronary Events in Asymptomatic Volunteers. Circulation . 2002;106(22):2787–2792. doi: 10.1161/01.CIR.0000039329.47437.3B. [DOI] [PubMed] [Google Scholar]
- 541.Hagnäs MJ, Lakka TA, Kurl S, Rauramaa R, Mäkikallio TH, Savonen K, et al. Cardiorespiratory fitness and exercise-induced ST segment depression in assessing the risk of sudden cardiac death in men. Heart . 2017;103(5):383–389. doi: 10.1136/heartjnl-2015-309217. [DOI] [PubMed] [Google Scholar]
- 542.Delorenzo A, Hachamovitch R, Kang X, Gransar H, Sciammarella M, Hayes S, et al. Prognostic value of myocardial perfusion SPECT versus exercise electrocardiography in patients with ST-segment depression on resting electrocardiography. J Nucl Cardiol . 2005;12(6):655–661. doi: 10.1016/j.nuclcard.2005.08.005. [DOI] [PubMed] [Google Scholar]
- 543.Lindow T, Ekström M, Brudin L, Carlén A, Elmberg V, Hedman K. Typical angina during exercise stress testing improves the prediction of future acute coronary syndrome. Clin Physiol Funct Imaging . 2021;41(3):281–291. doi: 10.1111/cpf.12695. [DOI] [PubMed] [Google Scholar]
- 544.Abdelmoneim SS, Ball CA, Mantovani F, Hagen ME, Eifert-Rain S, Wilansky S, et al. Prognostic Utility of Stress Testing and Cardiac Biomarkers in Menopausal Women at Low to Intermediate Risk for Coronary ARTery Disease (SMART Study): 5-Year Outcome. J Womens Health . 2018;27(5):542–551. doi: 10.1089/jwh.2017.6506. [DOI] [PubMed] [Google Scholar]
- 545.Sapin PM, Koch G, Blauwet MB, McCarthy JJ, Hinds SW, Gettes LS. Identification of false positive exercise tests with use of electrocardiographic criteria: A possible role for atrial repolarization waves. J Am Coll Cardiol . 1991;18:127–135. doi: 10.1016/s0735-1097(10)80228-1. https://doi.org/10.1016/S0735-1097 (10)80228-1 . [DOI] [PubMed] [Google Scholar]
- 546.Michaelides AP, Raftopoulos LG, Aggeli C, Liakos C, Antoniades C, Fourlas C, et al. Correlation of ST-segment "hump sign" during exercise testing with impaired diastolic function of the left ventricle. J Electrocardiol . 2010;43(2):167–172. doi: 10.1016/j.jelectrocard.2009.09.001. [DOI] [PubMed] [Google Scholar]
- 547.Lima EV, Moffa PJ, Bellotti G, Camargo PA, Júnior, Pereyra PL, Chalela WA, et al. [Value of computerized exercise stress test in the differential diagnosis of ischemic phenomena of obstructive versus nonobstructive origin] Arq Bras Cardiol . 1994;63:13–19. PMID: 7857206. [PubMed] [Google Scholar]
- 548.Michaelides AP, Stamatopoulos I, Antoniades C, Anastasakis A, Kotsiopoulou C, Theopistou A, et al. ST Segment "Hump" during Exercise Testing and the Risk of Sudden Cardiac Death in Patients with Hypertrophic Cardiomyopathy. Ann Noninvasive Electrocardiol . 2009;14(2):158–164. doi: 10.1111/j.1542-474X.2009.00291.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 549.Madias JE. Difficulties in assessing the presence, duration, severity, extent, and evolution of acute myocardial ischemia and infarction: ischemic ST-segment counterpoise as a plausible explanation. J Electrocardiol . 2006;39(2):156–159. doi: 10.1016/j.jelectrocard.2005.09.005. [DOI] [PubMed] [Google Scholar]
- 550.Madias JE. Discordance of diagnosis of ventricular aneurysm made by the electrocardiogram and myocardial imaging: "ST-segment counterpoise" as a hypothetical mechanism. J Electrocardiol . 2006;39(3):340–341. doi: 10.1016/j.jelectrocard.2006.02.009. [DOI] [PubMed] [Google Scholar]
- 551.Hopenfeld B, Stinstra JG, Macleod RS. Mechanism for ST Depression Associated with Contiguous Subendocardial Ischemia. J Cardiovasc Electrophysiol . 2004;15(10):1200–1206. doi: 10.1046/j.1540-8167.2004.04072.x. [DOI] [PubMed] [Google Scholar]
- 552.Hamasaki S, Nakano F, Arima S, Tahara M, Kamekou M, Fukumoto N, et al. A New Criterion Combining ST/HR Slope and ?ST/?HR Index for Detection of Coronary Artery Disease in Patients on Digoxin Therapy. Am J Cardiol . 1998;81(9):1100–1104. doi: 10.1016/s0002-9149(98)00124-6. https://doi.org/10.1016/S0002-9149 (98)00124-6 . [DOI] [PubMed] [Google Scholar]
- 553.Okin PM, Kligfield P. Heart Rate adjustment of ST segment depression and performance of the exercise electrocardiogram: A critical evaluation. J Am Coll Cardiol . 1995;25(7):1726–1735. doi: 10.1016/0735-1097(95)00085-i. https://doi.org/10.1016/0735-1097 (95)00085-I . [DOI] [PubMed] [Google Scholar]
- 554.Okin PM, Ameisen O, Kligfield P. A modified treadmill exercise protocol for computer-assisted analysis of the ST segment/heart rate slope: Methods and reproducibility. J Electrocardiol . 1986;19(4):311–318. doi: 10.1016/s0022-0736(86)81058-5. https://doi.org/10.1016/S0022-0736 (86)81058-5 . [DOI] [PubMed] [Google Scholar]
- 555.Sato I, Keta K, Aihara N, Ohe T, Shimomura K, Hasegawa Y. Improved Accuracy of the Exercise Electrocardiogram in Detection of Coronary Artery and Three-Vessel Coronary Disease. Chest . 1988;94(4):737–744. doi: 10.1378/chest.94.4.737. [DOI] [PubMed] [Google Scholar]
- 556.Okin PM, Kligfield P, Ameisen O, Goldberg HL, Borer JS. Improved accuracy of the exercise electrocardiogram: Identification of three-vessel coronary disease in stable angina pectoris by analysis of peak rate-related changes in ST segments. Am J Cardiol . 1985;55(4):271–276. doi: 10.1016/0002-9149(85)90359-5. https://doi.org/10.1016/0002-9149 (85)90359-5 . [DOI] [PubMed] [Google Scholar]
- 557.Sharif S, E Alway S. The diagnostic value of exercise stress testing for cardiovascular disease is more than just st segment changes: A review. J Integr Cardiol . 2016;2(4):41–55. doi: 10.15761/JIC.1000173. [DOI] [Google Scholar]
- 558.Massoure P-L, Sbardella F, Blanc P, Roudaut R, Douard H. Étude comparative de l'ischémie d'effort entre patients coronariens et patients atteints de rétrécissement aortique. Ann Cardiol Angéiologie . 2008;57(4):213–218. doi: 10.1016/j.ancard.2008.05.015. [DOI] [PubMed] [Google Scholar]
- 559.Galassi A. Accuracy of exercise testing in the assessment of the severity of myocardial ischemia as determined by means of technetium-99m tetrofosmin SPECT scintigraphy. J Nucl Cardiol . 2000;7(6):575–583. doi: 10.1067/mnc.2000.108731. [DOI] [PubMed] [Google Scholar]
- 560.Sundqvist K, Jogestrand T, Nowak J. The effect of digoxin on the electrocardiogram of healthy middle-aged and elderly patients at rest and during exercise[mdash ]A comparison with the ECG reaction induced by myocardial ischemia. J Electrocardiol . 2002;35(3):213–221. doi: 10.1054/elc.2002.33767. [DOI] [PubMed] [Google Scholar]
- 561.Taniai S, Koide Y, Yotsukura M, Nishimura T, Kachi E, Sakata K, et al. A New Application of the ST-HR Loop to Evaluate the Exercise-Induced Reversible Ischemia in Healed Anterior Wall Myocardial Infarction. Am J Cardiol . 2006;98(3):346–351. doi: 10.1016/j.amjcard.2006.01.103. [DOI] [PubMed] [Google Scholar]
- 562.Kronander H, Fischer-Colbrie W, Nowak J, Brodin L-Å, Elmqvist H. Exercise electrocardiography for diagnosis of coronary artery disease: impact of sampling rate on the diagnostic performance of ST/HR-loop based on data from early recovery phase. Clin Physiol Funct Imaging . 2008;28(2):96–100. doi: 10.1111/j.1475-097X.2007.00780.x. [DOI] [PubMed] [Google Scholar]
- 563.Lehtinen R, Sievänen H, Viik J, Turjanmaa V, Niemelä K, Malmivuo J. Accurate detection of coronary artery disease by integrated analysis of the ST-segment depression/heart rate patterns during the exercise and recovery phases of the exercise electrocardiography test. Am J Cardiol . 1996;78(9):1002–1006. doi: 10.1016/s0002-9149(96)00524-3. https://doi.org/10.1016/S0002-9149 (96)00524-3 . [DOI] [PubMed] [Google Scholar]
- 564.Viik J, Lehtinen R, Malmivuo J. Detection of coronary artery disease using maximum value of ST/HR hysteresis over different number of leads. J Electrocardiol . 1999;32(Suppl 1):70–83. doi: 10.1016/s0022-0736(99)90046-8. https://doi.org/10.1016/S0022-0736 (99)90046-8 . [DOI] [PubMed] [Google Scholar]
- 565.Kronander H, Hammar N, Fischer-Colbrie W, Nowak J, Brodin L-Å, Elmqvist H. Analysis of ST/HR hysteresis improves long-term prognostic value of exercise ECG test. Int J Cardiol . 2011;148(1):64–69. doi: 10.1016/j.ijcard.2009.10.025. [DOI] [PubMed] [Google Scholar]
- 566.Bailón R, Mateo J, Olmos S, Serrano P, García J, del Río A, et al. Coronary artery disease diagnosis based on exercise electrocardiogram indexes from repolarisation, depolarisation and heart rate variability. Med Biol Eng Comput . 2003;41(5):561–571. doi: 10.1007/BF02345319. [DOI] [PubMed] [Google Scholar]
- 567.Kronander H, Fischer-Colbrie W, Nowak J, Brodin L-Å, Elmqvist H. Diagnostic performance and partition values of exercise electrocardiographic variables in the detection of coronary artery disease - improved accuracy by using ST/HR hysteresis. Clin Physiol Funct Imaging . 2010;30(2):98–106. doi: 10.1111/j.1475-097X.2009.00909.x. [DOI] [PubMed] [Google Scholar]
- 568.Rabkin SW. Nomenclature, categorization and usage of formulae to adjust QT interval for heart rate. World J Cardiol . 2015;7(6):315–325. doi: 10.4330/wjc.v7.i6.315. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 569.Sundaram S, Carnethon M, Polito K, Kadish AH, Goldberger JJ. Autonomic effects on QT-RR interval dynamics after exercise. Am J Physiol-Heart Circ Physiology . 2008;294(1):H490–H497. doi: 10.1152/ajpheart.00046.2007. [DOI] [PubMed] [Google Scholar]
- 570.Andršová I, Hnatkova K, Šišáková M, Toman O, Smetana P, Huster KM, et al. Influence of heart rate correction formulas on QTc interval stability. 14269 Sci Rep . 2021;11(1) doi: 10.1038/s41598-021-93774-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 571.Indik JH, Pearson EC, Fried K, Woosley RL. Bazett and Fridericia QT correction formulas interfere with measurement of drug-induced changes in QT interval. Heart Rhythm . 2006;9(3):1003–1007. doi: 10.1016/j.hrthm.2006.05.023. [DOI] [PubMed] [Google Scholar]
- 572.Salama G, Bett GCL. Sex differences in the mechanisms underlying long QT syndrome. Am J Physiol-Heart Circ Physiology . 2014;307(5):H640–H648. doi: 10.1152/ajpheart.00864.2013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 573.Davey P. A new physiological method for heart rate correction of the QT interval. Heart . 1999;82(2):183–186. doi: 10.1136/hrt.82.2.183. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 574.Bhandari B. Effect of Sub Maximal Dynamic and Static Exercises on QTc interval in Healthy Young Men. J Clin Diagn Res . 2015;9(6):CC01–CC04. doi: 10.7860/JCDR/2015/12048.6006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 575.Kligfield P, Lax KG, Okin PM. QT interval-heart rate relation during exercise in normal men and women: Definition by linear regression analysis. J Am Coll Cardiol . 1996;28(6):1547–1555. doi: 10.1016/s0735-1097(96)00351-8. https://doi.org/10.1016/S0735-1097 (96)00351-8 . [DOI] [PubMed] [Google Scholar]
- 576.Gravel H, Jacquemet V, Dahdah N, Curnier D. Clinical applications of QT/RR hysteresis assessment: A systematic review. Ann Noninvasive Electrocardiol . 2018;23(1):e12514. doi: 10.1111/anec.12514. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 577.Gravel H, Curnier D, Dahdah N, Jacquemet V. Categorization and theoretical comparison of quantitative methods for assessing QT/RR hysteresis. Ann Noninvasive Electrocardiol . 2017;22(4):e12463. doi: 10.1111/anec.12463. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 578.Wong JA, Gula LJ, Klein GJ, Yee R, Skanes AC, Krahn AD. Utility of Treadmill Testing in Identification and Genotype Prediction in Long-QT Syndrome. Circ Arrhythm Electrophysiol . 2010;3(2):120–125. doi: 10.1161/CIRCEP.109.907865. [DOI] [PubMed] [Google Scholar]
- 579.Pelchovitz DJ, Ng J, Chicos AB, Bergner DW, Goldberger JJ. QT-RR hysteresis is caused by differential autonomic states during exercise and recovery. Am J Physiol-Heart Circ Physiology . 2012;302(12):H2567–H2573. doi: 10.1152/ajpheart.00041.2012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 580.Chauhan VS, Krahn AD, Walker BD, Klein GJ, Skanes AC, Yee R. Sex differences in QTc interval and QT dispersion: Dynamics during exercise and recovery in healthy subjects. Am Heart J . 2002;144(5):858–864. doi: 10.1067/mhj.2002.125619. [DOI] [PubMed] [Google Scholar]
- 581.Lax KG, Okin PM, Kligfield P. Electrocardiographic repolarization measurements at rest and during exercise in normal subjects and in patients with coronary artery disease. Am Heart J . 1994;128(2):271–280. doi: 10.1016/0002-8703(94)90479-0. https://doi.org/10.1016/0002-8703 (94)90479-0 . [DOI] [PubMed] [Google Scholar]
- 582.Korantzopoulos P, Letsas KP, Christogiannis Z, Kalantzi K, Massis I, Milionis HJ, et al. Exercise-Induced Repolarization Changes in Patients With Stable Coronary Artery Disease. Am J Cardiol . 2011;107(1):37–40. doi: 10.1016/j.amjcard.2010.08.038. [DOI] [PubMed] [Google Scholar]
- 583.Demirtas AO, Urgun OD. Can QT interval prolongation or dispersion detected in a positive exercise ECG test predict critical coronary artery disease? Arch Med Sci Atheroscler Dis . 2019;4:e7–e12. doi: 10.5114/amsad.2019.83299. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 584.Yi G, Crook R, Guo X-H, Staunton A, Camm AJ, Malik M. Exercise-induced changes in the QT interval duration and dispersion in patients with sudden cardiac death after myocardial infarction. Int J Cardiol . 1998;63(3):271–279. doi: 10.1016/s0167-5273(97)00318-5. https://doi.org/10.1016/S0167-5273 (97)00318-5 . [DOI] [PubMed] [Google Scholar]
- 585.Lauer MS, Pothier CE, Chernyak YB, Brunken R, Lieber M, Apperson-Hansen C, et al. Exercise-induced QT/R-R-interval hysteresis as a predictor of myocardial ischemia. J Electrocardiol . 2006;39(3):315–323. doi: 10.1016/j.jelectrocard.2005.12.005. [DOI] [PubMed] [Google Scholar]
- 586.Zhang Y, Bao M, Dai M, Zhong H, Li Y, Tan T. QT Hysteresis Index Improves the Power of Treadmill Exercise Test in the Screening of Coronary Artery Disease. Circ J . 2014;78(12):2942–2949. doi: 10.1253/circj.CJ-14-0697. [DOI] [PubMed] [Google Scholar]
- 587.Koide Y, Yotsukura M, Yoshino H, Ishikawa K. Usefulness of QT dispersion immediately after exercise as an indicator of coronary stenosis independent of gender or exercise-induced ST-segment depression. Am J Cardiol . 2000;86(12):1312–1317. doi: 10.1016/s0002-9149(00)01233-9. https://doi.org/10.1016/S0002-9149 (00)01233-9 . [DOI] [PubMed] [Google Scholar]
- 588.Charisopoulou D, Koulaouzidis G, Law LF, Rydberg A, Henein MY. Exercise Induced Worsening of Mechanical Heterogeneity and Diastolic Impairment in Long QT Syndrome. 37 J Clin Med . 2020;10(1) doi: 10.3390/jcm10010037. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 589.Takenaka K, Ai T, Shimizu W, Kobori A, Ninomiya T, Otani H, et al. Exercise Stress Test Amplifies Genotype-Phenotype Correlation in the LQT1 and LQT2 Forms of the Long-QT Syndrome. Circulation . 2003;107(6):838–844. doi: 10.1161/01.CIR.0000048142.85076.A2. [DOI] [PubMed] [Google Scholar]
- 590.Sy RW, Chattha IS, Klein GJ, Gula LJ, Skanes AC, Yee R, et al. Repolarization Dynamics During Exercise Discriminate Between LQT1 and LQT2 Genotypes. J Cardiovasc Electrophysiol . 2010;21(11):1242–1246. doi: 10.1111/j.1540-8167.2010.01788.x. [DOI] [PubMed] [Google Scholar]
- 591.Schwartz PJ, Crotti L. QTc Behavior During Exercise and Genetic Testing for the Long-QT Syndrome. Circulation . 2011;124(20):2181–2184. doi: 10.1161/CIRCULATIONAHA.111.062182. [DOI] [PubMed] [Google Scholar]
- 592.Sy RW, van der Werf C, Chattha IS, Chockalingam P, Adler A, Healey JS, et al. Derivation and Validation of a Simple Exercise-Based Algorithm for Prediction of Genetic Testing in Relatives of LQTS Probands. Circulation . 2011;124(20):2187–2194. doi: 10.1161/CIRCULATIONAHA.111.028258. [DOI] [PubMed] [Google Scholar]
- 593.Crisel RK, Farzaneh-Far R, Na B, Whooley MA. First-degree atrioventricular block is associated with heart failure and death in persons with stable coronary artery disease: data from the Heart and Soul Study. Eur Heart J . 2011;32(15):1875–1880. doi: 10.1093/eurheartj/ehr139. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 594.Tanaka Y, Tada H, Hamaya R, Patel RB, Hayashi K, Yamagami K, et al. First-degree atrioventricular block is significantly associated with incident atrial fibrillation in the population predominantly including participants aged = 60 years. Heart Vessels . 2021;36(9):1401–1409. doi: 10.1007/s00380-021-01805-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 595.Nikolaidou T, Ghosh JM, Clark AL. Outcomes Related to First-Degree Atrioventricular Block and Therapeutic Implications in Patients With Heart Failure. JACC Clin Electrophysiol . 2016;2(2):181–192. doi: 10.1016/j.jacep.2016.02.012. [DOI] [PubMed] [Google Scholar]
- 596.Jackson LR, Ugowe F. Epidemiology and Outcomes Associated with PR Prolongation. Card Electrophysiol Clin . 2021;13(4):661–669. doi: 10.1016/j.ccep.2021.06.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 597.Chan YH, Hai JJ, Lau KK, Li SW, Lau CP, Siu CW, et al. PR interval prolongation in coronary patients or risk equivalent: excess risk of ischemic stroke and vascular pathophysiological insights. 233 BMC Cardiovasc Disord . 2017;17(1) doi: 10.1186/s12872-017-0667-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 598.Carruthers S, McCall B, Cordell B, Wu R. Relationships between heart rate and PR interval during physiological and pharmacological interventions. Br J Clin Pharmacol . 1987;23(3):259–265. doi: 10.1111/j.1365-2125.1987.tb03043.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 599.Soliman EZ, Rautaharju PM. Heart rate adjustment of PR interval in middle-aged and older adults. J Electrocardiol . 2012;45(1):66–69. doi: 10.1016/j.jelectrocard.2011.06.003. [DOI] [PubMed] [Google Scholar]
- 600.Atterhög J-H, Loogna E. PR interval in relation to heart rate during exercise and the influence of posture and autonomic tone. J Electrocardiol . 1977;10(4):331–336. doi: 10.1016/s0022-0736(77)80005-8. https://doi.org/10.1016/S0022-0736 (77)80005-8 . [DOI] [PubMed] [Google Scholar]
- 601.Barold SS, Ilercil A, Leonelli F, Herweg B. First-degree atrioventricular block: Clinical manifestations, indications for pacing, pacemaker management & consequences during cardiac resynchronization. J Interv Card Electrophysiol . 2007;17(2):139–152. doi: 10.1007/s10840-006-9065-x. [DOI] [PubMed] [Google Scholar]
- 602.Epstein AE, DiMarco JP, Ellenbogen KA, Estes NAM, Freedman RA, Gettes LS, et al. ACC/AHA/HRS 2008 Guidelines for Device-Based Therapy of Cardiac Rhythm Abnormalities. J Am Coll Cardiol . 2008;51(21):e1–62. doi: 10.1016/j.jacc.2008.02.032. [DOI] [PubMed] [Google Scholar]
- 603.Nieminen T, Verrier RL, Leino J, Nikus K, Lehtinen R, Lehtimäki T, et al. Atrioventricular conduction and cardiovascular mortality: Assessment of recovery PR interval is superior to pre-exercise measurement. Heart Rhythm . 2010;7(6):796–801. doi: 10.1016/j.hrthm.2010.02.029. [DOI] [PubMed] [Google Scholar]
- 604.Hansom SP, Golian M, Green MS. The Wenckebach Phenomenon. Curr Cardiol Rev . 2021;17(1):10–16. doi: 10.2174/1573403X16666200719022142. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 605.Zeppilli P, Fenici R, Sassara M, Pirrami MM, Caselli G. Wenckebach second-degree A-V block in top-ranking athletes: an old problem revisited. Am Heart J . 1980;100(3):281–294. doi: 10.1016/0002-8703(80)90140-4. https://doi.org/10.1016/0002-8703 (80)90140-4 . [DOI] [PubMed] [Google Scholar]
- 606.McClaskey D, Lee D, Buch E. Outcomes among Athletes with Arrhythmias and Electrocardiographic Abnormalities: Implications for ECG Interpretation. Sports Med . 2013;43(10):979–991. doi: 10.1007/s40279-013-0074-5. [DOI] [PubMed] [Google Scholar]
- 607.Grossman M. Second degree heart block with Wenckebach phenomenon: Its occurrence over a period of several years in a young healthy adult. Am Heart J . 1958;56(4):607–610. doi: 10.1016/0002-8703(58)90089-9. https://doi.org/10.1016/0002-8703 (58)90089-9 . [DOI] [PubMed] [Google Scholar]
- 608.Shaw DB. Is Mobitz type I atrioventricular block benign in adults? Heart . 2004;90(2):169–174. doi: 10.1136/hrt.2003.017806. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 609.Tandon A, Simpson L, Assar MD. Unusual Origin of Type 1 Atrioventricular Block with Comments on Wenckebach's Contribution. Bayl Univ Med Cent Proc. . 2011;24(1):9–12. doi: 10.1080/08998280.2011.11928674. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 610.Bonikowske AR, Barout A, Fortin-Gamero S, Lara MIB, Kapa S, Allison TG. Frequency and characteristics of exercise-induced second-degree atrioventricular block in patients undergoing stress testing. J Electrocardiol . 2019;54:54–60. doi: 10.1016/j.jelectrocard.2019.03.009. [DOI] [PubMed] [Google Scholar]
- 611.Barold SS, Hayes DL. Second-Degree Atrioventricular Block: A Reappraisal. Mayo Clin Proc . 2001;76(1):44–57. doi: 10.4065/76.1.44. [DOI] [PubMed] [Google Scholar]
- 612.Peller OG, Moses JW, Kligfield P. Exercise-induced atrioventricular block: Report of three cases. Am Heart J . 1988;115(6):1315–1317. doi: 10.1016/0002-8703(88)90031-2. https://doi.org/10.1016/0002-8703 (88)90031-2 . [DOI] [PubMed] [Google Scholar]
- 613.Ezzeddine FM, Mulpuru SK, Borlaug BA. A Tough Time Running Around the Block. Circ Heart Fail . 2020;13(8):e007182. doi: 10.1161/CIRCHEARTFAILURE.120.007182. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 614.Wander GS, Khurana SB, Chawla LS. Prognostic significance of transient type II second degree atrioventricular block induced during exercise testing. Indian Heart J . 1990;42(3):193–194. PMID: 2258206. [PubMed] [Google Scholar]
- 615.Özder AB, Küçükoglu S, Dogar H, Karcier SM, Demiroglu C. Exercise-induced AV block. Am Heart J . 1989;117(6):1407–1408. doi: 10.1016/0002-8703(89)90451-1. https://doi.org/10.1016/0002-8703 (89)90451-1 . [DOI] [PubMed] [Google Scholar]
- 616.Toeda T, Suetake S, Tsuchida K, Takahashi K, Miida T, Oda H, et al. Exercise Induced Atrioventricular Block with Gap Phenomenon in Atrioventricular Conduction. Pacing Clin Electrophysiol . 2000;23(4):527–529. doi: 10.1111/j.1540-8159.2000.tb00840.x. Pt 1. [DOI] [PubMed] [Google Scholar]
- 617.Tasaki H, Nagao S, Nakamizo R, Matsumoto Y, Ashizawa N, Doi Y, et al. Correlation between Transient Hypotension and Exclusively Exercise-induced Symptoms of Two-to-One Atrioventricular Block. Intern Med . 2021;60(6):891–896. doi: 10.2169/internalmedicine.5261-20. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 618.Park MY, Shin WS, Shim B, Lee SJ, Park JH, Koh Y-S, et al. Exercise-Induced Intranodal Atrioventricular Block. 698 Korean Circ J . 2012;42(10) doi: 10.4070/kcj.2012.42.10.698. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 619.Martí-Almor J, Cladellas M, Bruguera J. Atrioventricular Block Induced by Exercise Is Not Always Infrahisian. Rev Esp Cardiol Engl Ed . 2005;58(10):1247–1248. https://doi.org/10.1016/S1885-5857 (06)60408-8 . [PubMed] [Google Scholar]
- 620.Hemann BA, Jezior MR, Atwood JE. Exercise-induced Atrioventricular Block: a report of 2 cases and review of the literature. J Cardpulm Rehabil . 2006;26(5):314–318. doi: 10.1097/00008483-200609000-00007. [DOI] [PubMed] [Google Scholar]
- 621.Sumiyoshi M, Nakata Y, Yasuda M, Tokano T, Ogura S, Nakazato Y, et al. Clinical and electrophysiologic features of exercise-induced atrioventricular block. Am Heart J . 1996;132(6):1277–1281. doi: 10.1016/s0002-8703(96)90476-7. https://doi.org/10.1016/S0002-8703 (96)90476-7 . [DOI] [PubMed] [Google Scholar]
- 622.Shetty RK, Agarwal S, Ganiga Sanjeeva, NC, Rao MS. Trifascicular block progressing to complete AV block on exercise: a rare presentation demonstrating the usefulness of exercise testing. Case Rep . 2015;2015:bcr2014209180-bcr2014209180. doi: 10.1136/bcr-2014-209180. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 623.Baruteau AE, Pass RH, Thambo JB, Behaghel A, Le Pennec S, Perdreau E, et al. Congenital and childhood atrioventricular blocks: pathophysiology and contemporary management. Eur J Pediatr . 2016;175(9):1235–1248. doi: 10.1007/s00431-016-2748-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 624.Karpawich PP, Gillette PC, Garson A, Hesslein PS, Porter C-B, McNamara DG. Congenital complete atrioventricular block: Clinical and electrophysiologic predictors of need for pacemaker insertion. Am J Cardiol . 1981;48(6):1098–1102. doi: 10.1016/0002-9149(81)90326-x. https://doi.org/10.1016/0002-9149 (81)90326-X . [DOI] [PubMed] [Google Scholar]
- 625.Bordachar P, Zachary W, Ploux S, Labrousse L, Haissaguerre M, Thambo J-B. Pathophysiology, clinical course, and management of congenital complete atrioventricular block. Heart Rhythm . 2013;10(5):760–766. doi: 10.1016/j.hrthm.2012.12.030. [DOI] [PubMed] [Google Scholar]
- 626.Reybrouck T, Eynde BV, Dumoulin M, Van der Hauwaert LG. Cardiorespiratory response to exercise in congenital complete atrioventricular block. Am J Cardiol . 1989;64(14):896–899. doi: 10.1016/0002-9149(89)90838-2. https://doi.org/10.1016/0002-9149 (89)90838-2 . [DOI] [PubMed] [Google Scholar]
- 627.Michaëlsson M, Jonzon A, Riesenfeld T. Isolated Congenital Complete Atrioventricular Block in Adult Life: A Prospective Study. Circulation . 1995;92(3):442–449. doi: 10.1161/01.CIR.92.3.442. [DOI] [PubMed] [Google Scholar]
- 628.Kumar V, Venkataraman R, Aljaroudi W, Osorio J, Heo J, Iskandrian AE, et al. Implications of Left Bundle Branch Block in Patient Treatment. Am J Cardiol . 2013;111(2):291–300. doi: 10.1016/j.amjcard.2012.09.029. [DOI] [PubMed] [Google Scholar]
- 629.Tan NY, Witt CM, Oh JK, Cha YM. Left Bundle Branch Block: Current and Future Perspectives. Circ Arrhythm Electrophysiol . 2020;13(4):e008239. doi: 10.1161/CIRCEP.119.008239. [DOI] [PubMed] [Google Scholar]
- 630.Rowe DW, Oquendo I, Depuey EG, de Castro CM, Garcia E, Burdine JA, et al. The noninvasive diagnosis of coronary artery disease in patients with left bundle-branch block. Tex Heart Inst J . 1982;9(4):397–406. PMID: 15226883; PMCID: PMC351658. [PMC free article] [PubMed] [Google Scholar]
- 631.Surkova E, Badano LP, Bellu R, Aruta P, Sambugaro F, Romeo G, et al. Left bundle branch block: from cardiac mechanics to clinical and diagnostic challenges. EP Eur . 2017;19(8):1251–1271. doi: 10.1093/europace/eux061. [DOI] [PubMed] [Google Scholar]
- 632.Biagini E, Shaw LJ, Poldermans D, Schinkel AFL, Rizzello V, Elhendy A, et al. Accuracy of non-invasive techniques for diagnosis of coronary artery disease and prediction of cardiac events in patients with left bundle branch block: a meta-analysis. Eur J Nucl Med Mol Imaging . 2006;33(12):1442–1451. doi: 10.1007/s00259-006-0156-9. [DOI] [PubMed] [Google Scholar]
- 633.Sgarbossa EB, Pinski SL, Barbagelata A, Underwood DA, Gates KB, Topol EJ, et al. Electrocardiographic Diagnosis of Evolving Acute Myocardial Infarction in the Presence of Left Bundle-Branch Block. N Engl J Med . 1996;334(8):481–487. doi: 10.1056/NEJM199602223340801. [DOI] [PubMed] [Google Scholar]
- 634.Dodd KW, Elm KD, Smith SW. Comparison of the QRS Complex, ST-Segment, and T-Wave Among Patients with Left Bundle Branch Block with and without Acute Myocardial Infarction. J Emerg Med . 2016;51(1):1–8. doi: 10.1016/j.jemermed.2016.02.029. [DOI] [PubMed] [Google Scholar]
- 635.Birnbaum Y, Ye Y, Smith SW, Jneid H. Rapid Diagnosis of STEMI Equivalent in Patients With Left Bundle-Branch Block: Is It Feasible? J Am Heart Assoc . 2021;10(18):e023275. doi: 10.1161/JAHA.121.023275. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 636.Smith SW, Dodd KW, Henry TD, Dvorak DM, Pearce LA. Diagnosis of ST-Elevation Myocardial Infarction in the Presence of Left Bundle Branch Block With the ST-Elevation to S-Wave Ratio in a Modified Sgarbossa Rule. Ann Emerg Med . 2012;60(6):766–776. doi: 10.1016/j.annemergmed.2012.07.119. [DOI] [PubMed] [Google Scholar]
- 637.Di Marco A, Rodriguez M, Cinca J, Bayes-Genis A, Ortiz-Perez JT, Ariza-Solé A, et al. New Electrocardiographic Algorithm for the Diagnosis of Acute Myocardial Infarction in Patients With Left Bundle Branch Block. J Am Heart Assoc . 2020;9(14):e015573. doi: 10.1161/JAHA.119.015573. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 638.Meyers HP, Limkakeng AT, Jaffa EJ, Patel A, Theiling BJ, Rezaie SR, et al. Validation of the modified Sgarbossa criteria for acute coronary occlusion in the setting of left bundle branch block: A retrospective case-control study. Am Heart J . 2015;170(6):1255–1264. doi: 10.1016/j.ahj.2015.09.005. [DOI] [PubMed] [Google Scholar]
- 639.Sillanmäki S, Lipponen JA, Tarvainen MP, Laitinen T, Hedman M, Hedman A, et al. Relationships between electrical and mechanical dyssynchrony in patients with left bundle branch block and healthy controls. J Nucl Cardiol . 2019;26(4):1228–1239. doi: 10.1007/s12350-018-1204-0. [DOI] [PubMed] [Google Scholar]
- 640.De Pooter J, El Haddad M, Kamoen V, Kallupurackal TT, Stroobandt R, De Buyzere M, et al. Relation between electrical and mechanical dyssynchrony in patients with left bundle branch block: An electro- and vectorcardiographic study. Ann Noninvasive Electrocardiol . 2018;23(4):e12525. doi: 10.1111/anec.12525. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 641.Sze E, Daubert JP. Left bundle branch block-induced left ventricular remodeling and its potential for reverse remodeling. J Interv Card Electrophysiol . 2018;52(3):343–352. doi: 10.1007/s10840-018-0407-2. [DOI] [PubMed] [Google Scholar]
- 642.Duncan AM, Francis DP, Gibson DG, Henein MY. Limitation of exercise tolerance in chronic heart failure: distinct effects of left Bundle-Branch block and coronary artery disease. J Am Coll Cardiol . 2004;43(9):1524–1531. doi: 10.1016/j.jacc.2003.10.065. [DOI] [PubMed] [Google Scholar]
- 643.Bazoukis G, Tsimos K, Korantzopoulos P. Episodic Left Bundle Branch Block-A Comprehensive Review of the Literature: Episodic Bundle Branch Block. Ann Noninvasive Electrocardiol . 2016;21(2):117–125. doi: 10.1111/anec.12361. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 644.Naz A, Kansara T, Ruiz Santillan M, Saeed M. Transient Left Bundle Branch Block in the Setting of Hyperkalemia. Cureus . 2021;13(7):e16602. doi: 10.7759/cureus.16602. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 645.Williams MA, Esterbrooks DJ, Nair CK, Sailors MM, Sketch MH. Clinical significance of exercise-induced bundle branch block. Am J Cardiol . 1988;61(4):346–348. doi: 10.1016/0002-9149(88)90942-3. https://doi.org/10.1016/0002-9149 (88)90942-3 . [DOI] [PubMed] [Google Scholar]
- 646.Xiao HB, Gibson DG. Effects of intermittent left bundle branch block on left ventricular diastolic function: a case report. Int J Cardiol . 1994;46(1):85–88. doi: 10.1016/0167-5273(94)90123-6. https://doi.org/10.1016/0167-5273 (94)90123-6 . [DOI] [PubMed] [Google Scholar]
- 647.Tanaka H, Hiraishi M, Miyoshi T, Tsuji T, Kaneko A, Ryo K, et al. Exercise-induced left bundle branch block and subsequent mechanical left ventricular dyssynchrony -resolved with pharmacological therapy. 4 Cardiovasc Ultrasound . 2011;9(1) doi: 10.1186/1476-7120-9-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 648.Candell Riera J, Oller Martínez G, Vega J, Gordillo E, Ferreira I, Peña C, et al. Exercise-induced left bundle-branch block in patients with coronary artery disease versus patients with normal coronary arteries. Rev Esp Cardiol . 2002;55(5):474–480. PMID: 12015926. [PubMed] [Google Scholar]
- 649.Vasey C, O'Donnell J, Morris S, McHenry P. Exercise-induced left bundle branch block and its relation to coronary artery disease. Am J Cardiol . 1985;56(13):892–895. doi: 10.1016/0002-9149(85)90777-5. https://doi.org/10.1016/0002-9149 (85)90777-5 . [DOI] [PubMed] [Google Scholar]
- 650.Hamilton MD, Ezeh E, Suliman M, Saylor J, Thompson E. Stress Test-Induced Left Bundle Branch Block. Cureus . 2021;13(8):e17384. doi: 10.7759/cureus.17384. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 651.Michaelides AP, Kartalis AN, Aigyptiadou MNK, Toutouzas PK. Exercise-induced left bundle branch block accompanied by chest pain. J Electrocardiol . 2004;37(4):325–328. doi: 10.1016/j.jelectrocard.2004.07.007. [DOI] [PubMed] [Google Scholar]
- 652.Sroubek J, Tugal D, Zimetbaum PJ, Shvilkin A, Buxton AE. Treatment of painful left bundle branch block syndrome with cardiac resynchronization therapy or right-ventricular pacing. Heart Case Rep . 2019;5(6):321–324. doi: 10.1016/j.hrcr.2019.03.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 653.Gould L, Ramana Reddy CV, Singh B, Bujung Zen. T-Wave Changes With Intermittent Left Bundle Branch Block. Angiology . 1980;31(1):66–68. doi: 10.1177/000331978003100110. [DOI] [PubMed] [Google Scholar]
- 654.Seibolt L, Maestas C, Lazkani M, Fatima U, Loli A, Chesser M. Rate-related left bundle branch block and cardiac memory in a patient with bradycardia: Case report and literature review. Clin Cardiol . 2018;41(8):1097–1102. doi: 10.1002/clc.22997. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 655.Chiale P, Etcheverry D, Pastori J, Fernandez P, Garro H, González M, et al. The Multiple Electrocardiographic Manifestations of Ventricular Repolarization Memory. Curr Cardiol Rev . 2014;10(3):190–201. doi: 10.2174/1573403X10666140514102021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 656.Costantini M. G Ital Cardiol . 1. Vol. 15. Roma: 2014. Blocco di branca intermittente: un modello clinico per lo studio di fenomeni elettrofisiologici; pp. 25–36. [DOI] [PubMed] [Google Scholar]
- 657.Byrne R, Filippone L. Benign persistent T-wave inversion mimicking ischemia after left bundle-branch block-cardiac memory. Am J Emerg Med . 2010;28(6):747.e5–747.e6. doi: 10.1016/j.ajem.2009.10.003. [DOI] [PubMed] [Google Scholar]
- 658.Hertzeanu H, Aron L, Shiner RJ, Kellermann J. Exercise dependent complete left bundle branch block. Eur Heart J . 1992;13(11):1447–1451. doi: 10.1093/oxfordjournals.eurheartj.a060084. [DOI] [PubMed] [Google Scholar]
- 659.Perin E, Petersen F, Massumi A. Rate-related left bundle branch block as a cause of non-ischemic chest pain. Cathet Cardiovasc Diagn . 1991;22(1):45–46. doi: 10.1002/ccd.1810220111. [DOI] [PubMed] [Google Scholar]
- 660.Bounhoure JP, Donzeau JP, Doazan JP, Queyreau JM, Galinier M, Estrabaud M, et al. Complete bundle branch block during exercise test. Clinical and coronary angiographic data. Arch Mal Coeur Vaiss. . 1991;84(2):167–71. PMID: 2021277. [PubMed] [Google Scholar]
- 661.Elizari MV, Acunzo RS, Ferreiro M. Hemiblocks Revisited. Circulation . 2007;115(9):1154–1163. doi: 10.1161/CIRCULATIONAHA.106.637389. [DOI] [PubMed] [Google Scholar]
- 662.Rimoldi SF, de Marchi SF, Gertsch M, Delacrétaz E. Diagnostic accuracy of exercise electrocardiogram in patients with left anterior hemi-block. Swiss Med Wkly . 2008 37-38;138:557–562. doi: 10.4414/smw.2008.12317. [DOI] [PubMed] [Google Scholar]
- 663.Boran KJ, Oliveros RA, Boucher CA, Beckmann CH, Seaworth JF. Ischemia-associated intraventricular conduction disturbances during exercise testing as a predictor of proximal left anterior descending coronary artery disease. Am J Cardiol . 1983;51(7):1098–1102. doi: 10.1016/0002-9149(83)90352-1. https://doi.org/10.1016/0002-9149 (83)90352-1 . [DOI] [PubMed] [Google Scholar]
- 664.Ruiz-Pizarro V, Palacios-Rubio J, Cobos-Gil MÁ. Exercise-induced left fascicular block: A forgotten sign of coronary disease. Rev Port Cardiol Engl Ed . 2021;40(9):695.e1–695.e4. doi: 10.1016/j.repce.2018.02.025. [DOI] [PubMed] [Google Scholar]
- 665.Shiran A, Halon DA, Merdler A, Makhoul N, Khader N, Ben-David J, et al. Accuracy of Exercise-Induced Left Axis QRS Deviation as a Specific Marker of Left Anterior Descending Coronary Artery Disease. Cardiology . 1998;89(4):297–302. doi: 10.1159/000006802. [DOI] [PubMed] [Google Scholar]
- 666.Chandrashekhar Y, Kalita HC, Anand IS. Left anterior fascicular block: an ischaemic response during treadmill testing. Heart . 1991;65(1):51–52. doi: 10.1136/hrt.65.1.51. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 667.Uchida AH, Moffa PJ, Riera ARP, Ferreira BMA. Exercise-induced left septal fascicular block: an expression of severe myocardial ischemia. Indian Pacing Electrophysiol J . 2006;6(2):135–138. PMID:1694390S. [PMC free article] [PubMed] [Google Scholar]
- 668.Bobba P, Salerno JA, Casari A. Transient Left Posterior Hemiblock: Report of Four Cases Induced by Exercise Test. Circulation . 1972;46(5):931–938. doi: 10.1161/01.CIR.46.5.931. [DOI] [PubMed] [Google Scholar]
- 669.Marcadet DM, Genet P, Assayag P, Valère PE. Significance of exercise-induced left hemiblock. Am J Cardiol . 1990;66(19):1390–1392. doi: 10.1016/0002-9149(90)91179-a. https://doi.org/10.1016/0002-9149 (90)91179-A . [DOI] [PubMed] [Google Scholar]
- 670.Kodama K, Hamada M, Hiwada K. Transient Leftward QRS Axis Shift During Treadmill Exercise Testing or Percutaneous Transluminal Coronary Angioplasty Is a Highly Specific Marker of Proximal Left Anterior Descending Coronary Artery Disease. Am J Cardiol . 1997;79(11):1530–1534. doi: 10.1016/s0002-9149(97)00187-2. https://doi.org/10.1016/S0002-9149 (97)00187-2 . [DOI] [PubMed] [Google Scholar]
- 671.Eriksson P, Hansson P-O, Eriksson H, Dellborg M. Bundle-Branch Block in a General Male Population: The Study of Men Born 1913. Circulation . 1998;98(22):2494–2500. doi: 10.1161/01.CIR.98.22.2494. [DOI] [PubMed] [Google Scholar]
- 672.Bussink BE, Holst AG, Jespersen L, Deckers JW, Jensen GB, Prescott E. Right bundle branch block: prevalence, risk factors, and outcome in the general population: results from the Copenhagen City Heart Study. Eur Heart J . 2013;34(2):138–146. doi: 10.1093/eurheartj/ehs291. [DOI] [PubMed] [Google Scholar]
- 673.Gaba P, Pedrotty D, De Simone CV, Bonikowske AR, Allison TG, Kapa S. Mortality in Patients With Right Bundle-Branch Block in the Absence of Cardiovascular Disease. J Am Heart Assoc . 2020;9(19):e017430. doi: 10.1161/JAHA.120.017430. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 674.Calò L, Martino A, Goanta E, Okumura Y, de Ruvo E. Right bundle branch block and conduction disturbances in Brugada syndrome and arrhythmogenic right ventricular cardiomyopathy. J Interv Card Electrophysiol . 2018;52(3):307–313. doi: 10.1007/s10840-018-0386-3. [DOI] [PubMed] [Google Scholar]
- 675.Wada T, Nagase S, Morita H, Nakagawa K, Nishii N, Nakamura K, et al. Incidence and Clinical Significance of Brugada Syndrome Masked by Complete Right Bundle-Branch Block. Circ J . 2015;79(12):2568–2575. doi: 10.1253/circj.CJ-15-0618. [DOI] [PubMed] [Google Scholar]
- 676.Susmano A, Teran JC. Value of Treadmill Exercise Testing in Patients With Complete Bundle Branch Block. Angiology . 1979;30(6):395–406. doi: 10.1177/000331977903000603. [DOI] [PubMed] [Google Scholar]
- 677.Cortigiani L, Bigi R, Rigo F, Landi P, Baldini U, Mariani PR, et al. Diagnostic value of exercise electrocardiography and dipyridamole stress echocardiography in hypertensive and normotensive chest pain patients with right bundle branch block: J Hypertens . 2003;21(11):2189–2194. doi: 10.1097/00004872-200311000-00030. [DOI] [PubMed] [Google Scholar]
- 678.Yen RS, Miranda C, Froelicher VF. Diagnostic and prognostic accuracy of the exercise electrocardiogram in patients with preexisting right bundle branch block. Am Heart J . 1994;127(6):1521–1525. doi: 10.1016/0002-8703(94)90380-8. https://doi.org/10.1016/0002-8703 (94)90380-8 . [DOI] [PubMed] [Google Scholar]
- 679.Hesse B, Diaz LA, Snader CE, Blackstone EH, Lauer MS. Complete bundle branch block as an independent predictor of all-cause mortality: report of 7,073 patients referred for nuclear exercise testing. Am J Med . 2001;110(4):253–259. doi: 10.1016/s0002-9343(00)00713-0. https://doi.org/10.1016/S0002-9343 (00)00713-0 . [DOI] [PubMed] [Google Scholar]
- 680.Kligfield P, Hochreiter C, Okin PM, Borer JS. Transient loss of complete bundle branch block patterns during exercise. Am J Cardiol . 1995;75(7):523–525. doi: 10.1016/s0002-9149(99)80598-0. https://doi.org/10.1016/S0002-9149 (99)80598-0 . [DOI] [PubMed] [Google Scholar]
- 681.Bauer GE. Transient Bundle-Branch Block. Circulation . 1964;29:730–738. doi: 10.1161/01.CIR.29.5.730. [DOI] [PubMed] [Google Scholar]
- 682.Enriquez A, Chiale PA, Baranchuk A. Exercise-induced right bundle branch block progressive resolution. Europace . 2014;16(12):1758–1758. doi: 10.1093/europace/eut432. [DOI] [PubMed] [Google Scholar]
- 683.Nielsen JC, Lin YJ, de Oliveira Figueiredo MJ, Sepehri Shamloo A, Alfie A, Boveda S, et al. European Heart Rhythm Association (EHRA)/Heart Rhythm Society (HRS)/Asia Pacific Heart Rhythm Society (APHRS)/Latin American Heart Rhythm Society (LAHRS) expert consensus on risk assessment in cardiac arrhythmias: use the right tool for the right outcome, in the right population. Europace . 2020;22(8):1147–1148. doi: 10.1093/europace/euaa065. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 684.Babayigit E. Important tips reflected in our daily practice from the American College of Cardiology Electrophysiology Council report on premature ventricular contractions. Anatol J Cardiol . 2020;23(4):196–203. doi: 10.14744/AnatolJCardiol.2020.91572. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 685.Panizo JG, Royal Papworth Hospital NHS Foundation Trust, Cambridge University Health Partners. Barra S, Royal Papworth Hospital NHS Foundation Trust, Cambridge University Health Partners . Arrhythmia Electrophysiol Rev . 2. Vol. 7. Cambridge, UK: 2018. Premature Ventricular Complex-induced Cardiomyopathy; pp. 128–134. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 686.Sousa PA, Pereira S, Candeias R, de Jesus I. Taquicardia de QRS largos - importância eletrocardiográfica no diagnóstico diferencial. Rev Port Cardiol . 2014;33(3):165–173. doi: 10.1016/j.repc.2013.07.016. [DOI] [PubMed] [Google Scholar]
- 687.Ng GA. Treating patients with ventricular ectopic beats. Heart . 2006;92(11):1707–1712. doi: 10.1136/hrt.2005.067843. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 688.Beckerman J, Mathur A, Stahr S, Myers J, Chun S, Froelicher V. Exercise-Induced Ventricular Arrhythmias and Cardiovascular Death. Ann Noninvasive Electrocardiol . 2005;10(1):47–52. doi: 10.1111/j.1542-474X.2005.00599.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 689.Mora S, Redberg RF, Cui Y, Whiteman MK, Flaws JA, Sharrett AR, et al. Ability of Exercise Testing to Predict Cardiovascular and All-Cause Death in Asymptomatic Women: A 20-Year Follow-up of the Lipid Research Clinics Prevalence Study. JAMA . 2003;290(12):1600–1607. doi: 10.1001/jama.290.12.1600. [DOI] [PubMed] [Google Scholar]
- 690.Katritsis DG, Boriani G, Cosio FG, Hindricks G, Jaïs P, Josephson ME, et al. European Heart Rhythm Association (EHRA) consensus document on the management of supraventricular arrhythmias, endorsed by Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS), and Sociedad Latinoamericana de Estimulación Cardiaca y Electrofisiologia (SOLAECE) Europace . 2017;19(13):465–511. doi: 10.1093/europace/euw301. [DOI] [PubMed] [Google Scholar]
- 691.Dewey FE. Ventricular Arrhythmias During Clinical Treadmill Testing and Prognosis. Arch Intern Med . 2008;168(2):225–234. doi: 10.1001/archinte.168.2.225. [DOI] [PubMed] [Google Scholar]
- 692.Lee V, Perera D, Lambiase P. Prognostic significance of exercise-induced premature ventricular complexes: a systematic review and meta-analysis of observational studies. Heart Asia . 2017;9(1):14–24. doi: 10.1136/heartasia-2016-010854. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 693.Elhendy A, Sozzi FB, van Domburg RT, Bax JJ, Valkema R, Roelandt JRTC. Relation between exercise-induced ventricular arrhythmias and myocardial perfusion abnormalities in patients with intermediate pretest probability of coronary artery disease. Eur J Nucl Med Mol Imaging . 2000;27(3):327–332. doi: 10.1007/s002590050041. [DOI] [PubMed] [Google Scholar]
- 694.Biffi A, Pelliccia A, Verdile L, Fernando F, Spataro A, Caselli S, et al. Long-term clinical significance of frequent and complex ventricular tachyarrhythmias in trained athletes. J Am Coll Cardiol . 2002;40(3):446–452. doi: 10.1016/s0735-1097(02)01977-0. https://doi.org/10.1016/S0735-1097 (02)01977-0 . [DOI] [PubMed] [Google Scholar]
- 695.D'Ascenzi F, Zorzi A, Alvino F, Bonifazi M, Corrado D, Mondillo S. The prevalence and clinical significance of premature ventricular beats in the athlete. Scand J Med Sci Sports . 2017;27(2):140–151. doi: 10.1111/sms.12679. [DOI] [PubMed] [Google Scholar]
- 696.Zipes DP, Link MS, Ackerman MJ, Kovacs RJ, Myerburg RJ, Estes NAM. Eligibility and Disqualification Recommendations for Competitive Athletes With Cardiovascular Abnormalities: Task Force 9: Arrhythmias and Conduction Defects: A Scientific Statement From the American Heart Association and American College of Cardiology. Circulation . 2015;132(22):e315–e325. doi: 10.1161/CIR.0000000000000245. [DOI] [PubMed] [Google Scholar]
- 697.Baine WB, Yu W, Weis KA. Trends and Outcomes in the Hospitalization of Older Americans for Cardiac Conduction Disorders or Arrhythmias, 1991-1998. J Am Geriatr Soc . 2001;49(6):763–770. doi: 10.1046/j.1532-5415.2001.49153.x. [DOI] [PubMed] [Google Scholar]
- 698.D'Souza A, Trussell T, Morris GM, Dobrzynski H, Boyett MR. Supraventricular Arrhythmias in Athletes: Basic Mechanisms and New Directions. Physiology . 2019;34(5):314–326. doi: 10.1152/physiol.00009.2019. [DOI] [PubMed] [Google Scholar]
- 699.Blomström-Lundqvist C, Scheinman MM, Aliot EM, Alpert JS, Calkins H, et al. ACC/AHA/ESC Guidelines for the Management of Patients With Supraventricular Arrhythmias-Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Supraventricular Arrhythmias) Circulation . 2003;108(15):1871–1909. doi: 10.1161/01.CIR.0000091380.04100.84. [DOI] [PubMed] [Google Scholar]
- 700.Khurshid S, Choi SH, Weng L-C, Wang EY, Trinquart L, Benjamin EJ, et al. Frequency of Cardiac Rhythm Abnormalities in a Half Million Adults. Circ Arrhythm Electrophysiol . 2018;11(7):e006273. doi: 10.1161/CIRCEP.118.006273. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 701.Porter MJ, Morton JB, Denman R, Lin AC, Tierney S, Santucci PA, et al. Influence of age and gender on the mechanism of supraventricular tachycardia. Heart Rhythm . 2004;4(1):393–396. doi: 10.1016/j.hrthm.2004.05.007. [DOI] [PubMed] [Google Scholar]
- 702.Orejarena LA, Vidaillet H, De Stefano F, Nordstrom DL, Vierkant RA, Smith PN, et al. Paroxysmal Supraventricular Tachycardia in the General Population. J Am Coll Cardiol . 1998;31(1):150–157. doi: 10.1016/s0735-1097(97)00422-1. https://doi.org/10.1016/S0735-1097 (97)00422-1 . [DOI] [PubMed] [Google Scholar]
- 703.Whinnett ZI, Sohaib SMA, Davies DW. Diagnosis and management of supraventricular tachycardia. BMJ . 2012;345(7887):e7769–e7769. doi: 10.1136/bmj.e7769. [DOI] [PubMed] [Google Scholar]
- 704.Duckeck W, Kuck KH. Syncope in supraventricular tachycardia. Incidence, pathomechanism and consequences. Herz . 1993;18(3):175–181. PMID: 8330852. [PubMed] [Google Scholar]
- 705.Haghjoo M, Arya A, Heidari A, Fazelifar AF, Sadr-Ameli MA. Electrophysiologic characteristics and results of radiofrequency catheter ablation in elderly patients with atrioventricular nodal reentrant tachycardia. J Electrocardiol . 2007;40(2):208–213. doi: 10.1016/j.jelectrocard.2006.05.002. [DOI] [PubMed] [Google Scholar]
- 706.Güleç S, Ertaþ F, Karaoouz R, Güldal M, Alpman A, Oral D. Value of ST-segment depression during paroxysmal supraventricular tachycardia in the diagnosis of coronary artery disease. Am J Cardiol . 1999;83(3):458–460. doi: 10.1016/s0002-9149(98)00888-1. https://doi.org/10.1016/S0002-9149 (98)00888-1 . [DOI] [PubMed] [Google Scholar]
- 707.Takayanagi K, Hoshi H, Shimizu M, Inoue T, Sakai Y, Morooka S, et al. Pronounced ST-Segment Depression during Paroxysmal Supraventricular Tachycardia. Jpn Heart J . 1993;34(3):269–278. doi: 10.1536/ihj.34.269. [DOI] [PubMed] [Google Scholar]
- 708.Jaber J, Cirenza C, Amaral A, Jaber J, Oliveira JA, Filho, de Paola AAV. Correlation Between Heart Rate Control During Exercise and Exercise Capacity in Patients With Chronic Atrial Fibrillation. Clin Cardiol . 2011;34(9):533–536. doi: 10.1002/clc.20948. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 709.She F, Ma Y, Li Y, Li L, Xu W, Wang H, et al. Influence of heart rate control on exercise capacity and quality of life in patients with permanent atrial fibrillation. 308 BMC Cardiovasc Disord . 2019;19(1) doi: 10.1186/s12872-019-01293-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 710.Bouzas-Mosquera A, Peteiro J, Broullón FJ, Álvarez-García N, Mosquera VX, Casas S, et al. Effect of Atrial Fibrillation on Outcome in Patients With Known or Suspected Coronary Artery Disease Referred for Exercise Stress Testing. Am J Cardiol . 2010;105(9):1207–1211. doi: 10.1016/j.amjcard.2009.12.037. [DOI] [PubMed] [Google Scholar]
- 711.Kato Y, Suzuki S, Kano H, Semba H, Matsuno S, Takai H, et al. Prognostic significance of exercise capacity and resting heart rate: Comparison between atrial fibrillation and sinus rhythm. Int J Cardiol . 2016;203:561–563. doi: 10.1016/j.ijcard.2015.10.227. [DOI] [PubMed] [Google Scholar]
- 712.Gilge JL, Prystowsky EN, Padanilam BJ. Atrioventricular Conduction During Atrial Flutter. Circulation . 2020;142(18):1783–1786. doi: 10.1161/CIRCULATIONAHA.120.050257. [DOI] [PubMed] [Google Scholar]
- 713.Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, Blomström-Lundqvist C, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS) Eur Heart J . 2020;42(5):373–498. doi: 10.1093/eurheartj/ehaa612. [DOI] [PubMed] [Google Scholar]
- 714.Pandey A, Khera R, Park B, Haykowsky M, Borlaug BA, Lewis GD, et al. Relative Impairments in Hemodynamic Exercise Reserve Parameters in Heart Failure With Preserved Ejection Fraction. JACC Heart Fail . 2018;6(2):117–126. doi: 10.1016/j.jchf.2017.10.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 715.Ueshima K, Myers J, Ribisl PM, Atwood JE, Morris CK, Kawaguchi T, et al. Hemodynamic determinants of exercise capacity in chronic atrial fibrillation. Am Heart J . 1993;125(5):1301–1305. doi: 10.1016/0002-8703(93)90998-o. Pt 1. https://doi.org/10.1016/0002-8703 (93)90998-O . [DOI] [PubMed] [Google Scholar]
- 716.Kato Y, Suzuki S, Uejima T, Semba H, Nagayama O, Hayama E, et al. The relationship between resting heart rate and peak VO 2: A comparison of atrial fibrillation and sinus rhythm. Eur J Prev Cardiol . 2016;23(13):1429–1436. doi: 10.1177/2047487316633885. [DOI] [PubMed] [Google Scholar]
- 717.Elshazly MB, Senn T, Wu Y, Lindsay B, Saliba W, Wazni O, et al. Impact of Atrial Fibrillation on Exercise Capacity and Mortality in Heart Failure With Preserved Ejection Fraction: Insights From Cardiopulmonary Stress Testing. J Am Heart Assoc . 2017;6(11):e006662. doi: 10.1161/JAHA.117.006662. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 718.Pardaens K, Van Cleemput J, Vanhaecke J, Fagard RH. Atrial fibrillation is associated with a lower exercise capacity in male chronic heart failure patients. Heart . 1997;78(6):564–568. doi: 10.1136/hrt.78.6.564. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 719.Nucifora G, Schuijf JD, van Werkhoven JM, Trines SA, Kajander S, Tops LF, et al. Relationship between obstructive coronary artery disease and abnormal stress testing in patients with paroxysmal or persistent atrial fibrillation. Int J Cardiovasc Imaging . 2011;27(6):777–785. doi: 10.1007/s10554-010-9725-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 720.Atwood JE, Myers JN, Tang XC, Reda DJ, Singh SN, Singh BN. Exercise capacity in atrial fibrillation: A substudy of the Sotalol-Amiodarone Atrial Fibrillation Efficacy Trial (SAFE-T) Am Heart J . 2007;153(4):566–572. doi: 10.1016/j.ahj.2006.12.020. [DOI] [PubMed] [Google Scholar]
- 721.Burkhart R, Gerasimon G. Atrial Flutter With Exercise-Induced 1:1 Atrioventricular Conduction. J Am Osteopath Assoc . 2018;118(5):337–340. doi: 10.7556/jaoa.2018.065. [DOI] [PubMed] [Google Scholar]
- 722.Turitto G, Akhrass P, Leonardi M, Saponieri C, Sette A, El-Sherif N. Atrial flutter with spontaneous 1:1 atrioventricular conduction in adults: an uncommon but frequently missed cause for syncope/presyncope. Pacing Clin Electrophysiol . 2009;32(1):82–90. doi: 10.1111/j.1540-8159.2009.02180.x. [DOI] [PubMed] [Google Scholar]
- 723.Waldo AL. Inter-Relationships Between Atrial Flutter and Atrial Fibrillation. Pacing Clin Electrophysiol . 2003;26(7):1583–1596. doi: 10.1046/j.1460-9592.2003.t01-1-00236.x. Pt 2. [DOI] [PubMed] [Google Scholar]
- 724.Waldo AL, Feld GK. Inter-Relationships of Atrial Fibrillation and Atrial Flutter. J Am Coll Cardiol . 2008;51(8):779–786. doi: 10.1016/j.jacc.2007.08.066. [DOI] [PubMed] [Google Scholar]
- 725.Atwood JE, Myers J, Sullivan M, Forbes S, Friis R, Pewen W, et al. Maximal exercise testing and gas exchange in patients with chronic atrial fibrillation. J Am Coll Cardiol . 1988;11(3):508–513. doi: 10.1016/0735-1097(88)91524-0. https://doi.org/10.1016/0735-1097 (88)91524-0 . [DOI] [PubMed] [Google Scholar]
- 726.Goette A, Kalman JM, Aguinaga L, Akar J, Cabrera JA, Chen SA, et al. EHRA/HRS/APHRS/SOLAECE expert consensus on atrial cardiomyopathies: definition, characterization, and clinical implication. Europace . 2016;18(10):1455–1490. doi: 10.1093/europace/euw161. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 727.Kottkamp H. Fibrotic Atrial Cardiomyopathy: A Specific Disease/Syndrome Supplying Substrates for Atrial Fibrillation, Atrial Tachycardia, Sinus Node Disease, AV Node Disease, and Thromboembolic Complications. J Cardiovasc Electrophysiol . 2012;23(7):797–799. doi: 10.1111/j.1540-8167.2012.02341.x. [DOI] [PubMed] [Google Scholar]
- 728.Krahn AD, Yee R, Klein GJ, Morillo C. Inappropriate Sinus Tachycardia: Evaluation and Therapy. J Cardiovasc Electrophysiol . 1995;6(12):1124–1128. doi: 10.1111/j.1540-8167.1995.tb00391.x. [DOI] [PubMed] [Google Scholar]
- 729.Aranyó J, Bazan V, Lladós G, Dominguez MJ, Bisbal F, Massanella M, et al. Inappropriate sinus tachycardia in post-COVID-19 syndrome. 298 Sci Rep . 2022;12(1) doi: 10.1038/s41598-021-03831-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 730.Ståhlberg M, Reistam U, Fedorowski A, Villacorta H, Horiuchi Y, Bax J, et al. Post-COVID-19 Tachycardia Syndrome: A Distinct Phenotype of Post-Acute COVID-19 Syndrome. Am J Med . 2021;134(12):1451–1456. doi: 10.1016/j.amjmed.2021.07.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 731.Sheldon RS, Grubb BP, Olshansky B, Shen W-K, Calkins H, Brignole M, et al. 2015 Heart Rhythm Society Expert Consensus Statement on the Diagnosis and Treatment of Postural Tachycardia Syndrome, Inappropriate Sinus Tachycardia, and Vasovagal Syncope. Heart Rhythm . 2015;12(6):e41–e63. doi: 10.1016/j.hrthm.2015.03.029. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 732.Chadda KR, Blakey EE, Huang CL-H, Jeevaratnam K. Long COVID-19 and postural orthostatic tachycardia syndrome- is dysautonomia to be Blamed. 860198 Front Cardiovasc Med . 2022;9 doi: 10.3389/fcvm.2022.860198. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 733.Peyrol M, Lévy S. Clinical presentation of inappropriate sinus tachycardia and differential diagnosis. J Interv Card Electrophysiol . 2016;46(1):33–41. doi: 10.1007/s10840-015-0051-z. [DOI] [PubMed] [Google Scholar]
- 734.Raj S, Sheldon R. Management of Postural Tachycardia Syndrome, Inappropriate Sinus Tachycardia and Vasovagal Syncope. 122 Arrhythmia Electrophysiol Rev . 2016;5(2) doi: 10.15420/AER.2016.7.2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 735.Kim ESH, Ishwaran H, Blackstone E, Lauer MS. External Prognostic Validations and Comparisons of Age- and Gender-Adjusted Exercise Capacity Predictions. J Am Coll Cardiol . 2007;50(19):1867–1875. doi: 10.1016/j.jacc.2007.08.003. [DOI] [PubMed] [Google Scholar]
- 736.Gulati M, Black HR, Shaw LJ, Arnsdorf MF, Merz CNB, Lauer MS, et al. The Prognostic Value of a Nomogram for Exercise Capacity in Women. N Engl J Med . 2005;353(5):468–475. doi: 10.1056/NEJMoa044154. [DOI] [PubMed] [Google Scholar]
- 737.Kokkinos P, Faselis C, Myers J, Sui X, Zhang J, Blair SN. Age-Specific Exercise Capacity Threshold for Mortality Risk Assessment in Male Veterans. Circulation . 2014;130(8):653–658. doi: 10.1161/CIRCULATIONAHA.114.009666. [DOI] [PubMed] [Google Scholar]
- 738.Morris CK, Myers J, Froelicher VF, Kawaguchi T, Ueshima K, Hideg A. Nomogram based on metabolic equivalents and age for assessing aerobic exercise capacity in men. J Am Coll Cardiol . 1993;22(1):175–182. doi: 10.1016/0735-1097(93)90832-l. https://doi.org/10.1016/0735-1097 (93)90832-L . [DOI] [PubMed] [Google Scholar]
- 739.Fine NM, Pellikka PA, Scott CG, Gharacholou SM, McCully RB. Characteristics and Outcomes of Patients Who Achieve High Workload (=10 Metabolic Equivalents) During Treadmill Exercise Echocardiography. Mayo Clin Proc . 2013;88(12):1408–1419. doi: 10.1016/j.mayocp.2013.07.021. [DOI] [PubMed] [Google Scholar]
- 740.Smith L, Myc L, Watson D, Beller GA, Bourque JM. A high exercise workload of = 10 METS predicts a low risk of significant ischemia and cardiac events in older adults. J Nucl Cardiol . 2020;27(5):1486–1496. doi: 10.1007/s12350-018-1376-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 741.Kokkinos P, Myers J, Faselis C, Panagiotakos DB, Doumas M, Pittaras A, et al. Exercise Capacity and Mortality in Older Men: A 20-Year Follow-Up Study. Circulation . 2010;122(8):790–797. doi: 10.1161/CIRCULATIONAHA.110.938852. [DOI] [PubMed] [Google Scholar]
- 742.Myers J, Prakash M, Froelicher V, Do D, Partington S, Atwood JE. Exercise Capacity and Mortality among Men Referred for Exercise Testing. N Engl J Med . 2002;346(11):793–801. doi: 10.1056/NEJMoa011858. [DOI] [PubMed] [Google Scholar]
- 743.Bruce RA, Kusumi F, Hosmer D. Maximal oxygen intake and nomographic assessment of functional aerobic impairment in cardiovascular disease. Am Heart J . 1973;85(4):546–562. doi: 10.1016/0002-8703(73)90502-4. https://doi.org/10.1016/0002-8703 (73)90502-4 . [DOI] [PubMed] [Google Scholar]
- 744.Keyser RE, Peralta L, Cade WT, Miller S, Anixt J. Functional aerobic impairment in adolescents seropositive for HIV: A quasiexperimental analysis. Arch Phys Med Rehabil . 2000;81(11):1479–1484. doi: 10.1053/apmr.2000.17810. [DOI] [PubMed] [Google Scholar]
- 745.Bruce RA, Hossack KF, Belanger L, DeRouen TA, Sobolewski JS, Hofer V, et al. A computer terminal program to evaluate cardiovascular functional limits and estimate coronary event risks. West J Med . 1981;135(4):342–350. PMID: 7342465; PMCID: PMC1273203. [PMC free article] [PubMed] [Google Scholar]
- 746.Ivey FM, Stookey AD, Hafer-Macko CE, Ryan AS, Macko RF. Higher Treadmill Training Intensity to Address Functional Aerobic Impairment after Stroke. J Stroke Cerebrovasc Dis . 2015;24(11):2539–2546. doi: 10.1016/j.jstrokecerebrovasdis.2015.07.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 747.Carreira MAM, Nogueira AB, Pena FM, Kiuchi MG, Rodrigues RC, Rodrigues R, et al. Heart Rate Variability Correlates to Functional Aerobic Impairment in Hemodialysis Patients. Arq Bras Cardiol . 2015;104(6):493–500. doi: 10.5935/abc.20150039. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 748.Hase H, Nakamura R, Ebine K, Akaike M, Tsuyuki K, Yoneda I. Exercise physical characteristics and laboratory findigs in Japanese elite judo athletes. Jpn J Phys Fit Sports Med . 1990;39(5):341–349. doi: 10.7600/jspfsm1949.39.341. [DOI] [Google Scholar]
- 749.Fukushima K. Prediction of late restenosis using early treadmill exercise testing after PTCA. Kokyu To Junkan . 1991;39(11):1145–1150. PMID:1775746. [PubMed] [Google Scholar]
- 750.Zdrenghea D, Vlad C, Predescu D, Timis D. The correlation between Doppler data and effort capacity in mitral stenosis. Rom J Intern Med . 1995;33(3-4):189–193. PMID: 8646190. [PubMed] [Google Scholar]
- 751.Inishi Y. Long-term study of functional aerobic capacity after PTCA and CABG. Kokyu To Junkan . 1991;39(4):361–366. PMID: 2068390. [PubMed] [Google Scholar]
- 752.Bonikowske AR, Lopez-Jimenez F, Barillas-Lara MI, Barout A, Fortin-Gamero S, Sydo N, et al. Added value of exercise test findings beyond traditional risk factors for cardiovascular risk stratification. Int J Cardiol . 2019;292:212–217. doi: 10.1016/j.ijcard.2019.04.030. [DOI] [PubMed] [Google Scholar]
- 753.Lipinski M, Do D, Froelicher V, Osterberg L, Franklin B, West J, et al. Comparison of Exercise Test Scores and Physician Estimation in Determining Disease Probability. Arch Intern Med . 2001;161(18):2239. doi: 10.1001/archinte.161.18.2239. [DOI] [PubMed] [Google Scholar]
- 754.Ashley E, Myers J, Froelicher V. Exercise testing scores as an example of better decisions through science. Med Sci Sports Exerc . 2002;34(8):1391–1398. doi: 10.1097/00005768-200208000-00023. [DOI] [PubMed] [Google Scholar]
- 755.Shetler K, Karlsdottir A, Froelicher V. Assessing Patients with Possible Heart Disease Using Scores: Sports Med. 2001;31(6):387–408. doi: 10.2165/00007256-200131060-00001. [DOI] [PubMed] [Google Scholar]
- 756.Fearon WF, Gauri AJ, Myers J, Raxwal VK, Atwood JE, Froelicher VF. A comparison of treadmill scores to diagnose coronary artery disease. Clin Cardiol . 2002;25(3):117–122. doi: 10.1002/clc.4960250307. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 757.Gibbons RJ. Myocardial Ischemia in the Management of Chronic Coronary Artery Disease: Past and Present. Circ Cardiovasc Imaging . 2021;14(1):e011615. doi: 10.1161/CIRCIMAGING.120.011615. [DOI] [PubMed] [Google Scholar]
- 758.Acar Z, Korkmaz L, Agac MT, Erkan H, Dursun I, Kalaycioglu E, et al. Relationship between Duke Treadmill Score and coronary artery lesion complexity. 2012;35(6):365. doi: 10.25011/cim.v35i6.19208. [DOI] [PubMed] [Google Scholar]
- 759.Günaydin ZY, Bektas O, Gürel YE, Karagöz A, Kaya A, Kiris T, et al. The value of the Duke treadmill score in predicting the presence and severity of coronary artery disease. Kardiol Pol . 2016;74(2):127–134. doi: 10.5603/KP.a2015.0143. [DOI] [PubMed] [Google Scholar]
- 760.Guerreiro SL, Ferreira JM, Calqueiro JM, Mendes MS. Prognostic value of electrocardiogram exercise testing for risk stratification in asymptomatic coronary artery disease. Coron Artery Dis . 2017;28(8):664–669. doi: 10.1097/MCA.0000000000000526. [DOI] [PubMed] [Google Scholar]
- 761.Dzenkeviciute V, Sapoka V, Kasiulevicius V, Rinkuniene E, Steponeniene R, Einikyte R, et al. Value of Duke treadmill score in predicting coronary artery lesion and the need for revascularisation. Kardiol Pol . 2017;75(5):439–444. doi: 10.5603/KP.a2017.0032. [DOI] [PubMed] [Google Scholar]
- 762.Mark DB. Exercise Treadmill Score for Predicting Prognosis in Coronary Artery Disease. Ann Intern Med . 1987;106(6):793–800. doi: 10.7326/0003-4819-106-6-793. [DOI] [PubMed] [Google Scholar]
- 763.Alexander KP, Shaw LJ, De Long ER, Mark DB, Peterson ED. Value of exercise treadmill testing in women. J Am Coll Cardiol . 1998;32(6):1657–1664. doi: 10.1016/s0735-1097(98)00451-3. https://doi.org/10.1016/S0735-1097 (98)00451-3 . [DOI] [PubMed] [Google Scholar]
- 764.Zaman M, Fatima N, Zaman A, Zaman U, Tahseen R, Zaman S. Higher event rate in patients with high-risk Duke Treadmill Score despite normal exercise-gated myocardial perfusion imaging. World J Nucl Med . 2018;17(3):166–170. doi: 10.4103/wjnm.WJNM_43_17. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 765.Villella M, Villella A, Santoro L, Santoro E, Franzosi MG, Maggioni AP. Ergometric score systems after myocardial infarction: Prognostic performance of the Duke Treadmill Score, Veterans Administration Medical Center Score, and of a novel score system, GISSI-2 Index, in a cohort of survivors of acute myocardial infarction. Am Heart J . 2003;145(3):475–483. doi: 10.1067/mhj.2003.162. [DOI] [PubMed] [Google Scholar]
- 766.Michaelides AP, Tousoulis D, Raftopoulos LG, Antoniades C, Tsiachris D, Stefanadis CI. The impact of novel exercise criteria and indices for the diagnostic and prognostic ability of exercise testing. Int J Cardiol . 2010;143(2):119–123. doi: 10.1016/j.ijcard.2010.02.033. [DOI] [PubMed] [Google Scholar]
- 767.Campen CMCV, Visser FC, Visser CA. lschaemic heart disease: The QRS score: a promising new exercise score for detecting coronary artery disease based on exercise-induced changes of Q-, R- and S-waves: a relationship with myocardial ischaemia. Eur Heart J . 1996;17(5):699–708. doi: 10.1093/oxfordjournals.eurheartj.a014936. [DOI] [PubMed] [Google Scholar]
- 768.Michaelides AP, Aigyptiadou MNK, Andrikopoulos GK, Richter DJ, Kartalis A, Tapanlis E, et al. The prognostic value of a QRS score during exercise testing. Clin Cardiol . 2005;28(8):375–380. doi: 10.1002/clc.4960280806. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 769.Toth A, Marton Z, Czopf L, Kesmarky G, Halmosi R, Juricskay I, et al. QRS Score: A Composite Index of Exercise-Induced Changes in the Q, R, and S Waves During Exercise Stress Testing in Patients with Ischemic Heart Disease. Ann Noninvasive Electrocardiol . 2001;6(4):310–318. doi: 10.1111/j.1542-474X.2001.tb00124.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 770.Michaelides AP, Triposkiadis FK, Boudoulas H, Spanos AM, Papadopoulos PD, Kourouklis KV, et al. New coronary artery disease index based on exercise-induced QRS changes. Am Heart J . 1990;120(2):292–302. doi: 10.1016/0002-8703(90)90072-6. https://doi.org/10.1016/0002-8703 (90)90072-6 . [DOI] [PubMed] [Google Scholar]
- 771.Alvi R, Sklyar E, Gorski R, Atoui M, Afshar M, Bella JN. Athens QRS Score as a Predictor of Coronary Artery Disease in Patients With Chest Pain and Normal Exercise Stress Test. J Am Heart Assoc . 2016;5(6):e002832. doi: 10.1161/JAHA.115.002832. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 772.Michaelides AP, Fourlas CA, Chatzistamatiou EI, Andrikopoulos GK, Soulis D, Psomadaki ZD, et al. QRS score improves diagnostic ability of treadmill exercise testing in women. Coron Artery Dis . 2007;18(4):313–318. doi: 10.1097/MCA.0b013e3281689a69. [DOI] [PubMed] [Google Scholar]
- 773.Michaelides AP, Psomadaki ZD, Andrikopoulos GK, Aigyptiadou M-NK, Dilaveris PE, Richter DJ, et al. A QRS score versus ST-segment changes during exercise testing: which is the most reliable ischaemic marker after myocardial revascularisation?: Coron Artery Dis . 2003;14(8):527–532. doi: 10.1097/00019501-200312000-00002. [DOI] [PubMed] [Google Scholar]
- 774.Michaelides AP, Papapetrou D, Aigyptiadou MNK, Psomadaki ZD, Andrikopoulos GK, Kartalis A, et al. Detection of Multivessel Disease Post Myocardial Infarction Using an Exercise-Induced QRS Score. Ann Noninvasive Electrocardiol . 2004;9(3):221–227. doi: 10.1111/j.1542-474X.2004.93551.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 775.Raxwal V, Shetler K, Morise A, Do D, Myers J, Atwood JE, et al. Simple Treadmill Score To Diagnose Coronary Disease. Chest . 2001;119(6):1933–1940. doi: 10.1378/chest.119.6.1933. [DOI] [PubMed] [Google Scholar]
- 776.Morise AP, Jalisi F. Evaluation of pretest and exercise test scores to assess all-cause mortality in unselected patients presenting for exercise testing with symptoms of suspected coronary artery disease. J Am Coll Cardiol . 2003;42(5):842–850. doi: 10.1016/s0735-1097(03)00837-4. https://doi.org/10.1016/S0735-1097 (03)00837-4 . [DOI] [PubMed] [Google Scholar]
- 777.Chase P, Arena R, Myers J, Abella J, Peberdy MA, Guazzi M, et al. Prognostic Usefulness of Dyspnea Versus Fatigue as Reason for Exercise Test Termination in Patients With Heart Failure. Am J Cardiol . 2008;102(7):879–882. doi: 10.1016/j.amjcard.2008.05.031. [DOI] [PubMed] [Google Scholar]
- 778.Criqui MH, McClelland RL, McDermott MM, Allison MA, Blumenthal RS, Aboyans V, et al. The Ankle-Brachial Index and Incident Cardiovascular Events in the MESA (Multi-Ethnic Study of Atherosclerosis) J Am Coll Cardiol . 2010;56(18):1506–1512. doi: 10.1016/j.jacc.2010.04.060. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 779.McDermott MM, Guralnik JM, Tian L, Liu K, Ferrucci L, Liao Y, et al. Associations of Borderline and Low Normal Ankle-Brachial Index Values With Functional Decline at 5-Year Follow-Up. J Am Coll Cardiol . 2009;53(12):1056–1062. doi: 10.1016/j.jacc.2008.09.063. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 780.Aboyans V, Ricco JB, Bartelink MLEL, Björck M, Brodmann M, Cohnert T, et al. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS) Eur Heart J . 2018;39(9):763–816. doi: 10.1093/eurheartj/ehx095. [DOI] [PubMed] [Google Scholar]
- 781.Gerhard-Herman MD, Gornik HL, Barrett C, Barshes NR, Corriere MA, Drachman DE, et al. 2016 AHA/ACC Guideline on the Management of Patients With Lower Extremity Peripheral Artery Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation . 2017;135(12):e726–e779. doi: 10.1161/CIR.0000000000000471. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 782.Curry SJ, Krist AH, Owens DK, Barry MJ, Caughey AB, et al. Screening for Peripheral Artery Disease and Cardiovascular Disease Risk Assessment With the Ankle-Brachial Index: US Preventive Services Task Force Recommendation Statement. JAMA . 2018;320(2):177–183. doi: 10.1001/jama.2018.8357. [DOI] [PubMed] [Google Scholar]
- 783.Chen H, Wei F, Wang L, Wang Z, Meng J, Yu H, et al. Abnormal ankle-brachial index and risk of cardiovascular or all-cause mortality in patients with chronic kidney disease: a meta-analysis. J Nephrol . 2017;30(4):493–501. doi: 10.1007/s40620-017-0376-z. [DOI] [PubMed] [Google Scholar]
- 784.Velescu A, Clara A, Martí R, Ramos R, Perez-Fernandez S, Marcos L, et al. Abnormally High Ankle-Brachial Index is Associated with All-cause and Cardiovascular Mortality: The REGICOR Study. Eur J Vasc Endovasc Surg . 2017;54(3):370–377. doi: 10.1016/j.ejvs.2017.06.002. [DOI] [PubMed] [Google Scholar]
- 785.Nie F, He J, Cao H, Hu X. Predictive value of abnormal ankle-brachial index in patients with diabetes: A meta-analysis. 108723 Diabetes Res Clin Pract . 2021;174 doi: 10.1016/j.diabres.2021.108723. [DOI] [PubMed] [Google Scholar]
- 786.Alqahtani KM, Bhangoo M, Vaida F, Denenberg JO, Allison MA, Criqui MH. Predictors of Change in the Ankle Brachial Index with Exercise. Eur J Vasc Endovasc Surg . 2018;55(3):399–404. doi: 10.1016/j.ejvs.2017.12.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 787.Armstrong DWJ, Tobin C, Matangi MF. Predictors of an abnormal postexercise ankle brachial index: Importance of the lowest ankle pressure in calculating the resting ankle brachial index. Clin Cardiol . 2017;40(11):1163–1168. doi: 10.1002/clc.22808. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 788.Tehan PE, Barwick AL, Sebastian M, Chuter VH. Diagnostic accuracy of the postexercise ankle-brachial index for detecting peripheral artery disease in suspected claudicants with and without diabetes. Vasc Med . 2018;23(2):116–125. doi: 10.1177/1358863X17751259. [DOI] [PubMed] [Google Scholar]
- 789.Stein R, Hriljac I, Halperin JL, Gustavson SM, Teodorescu V, Olin JW. Limitation of the resting ankle-brachial index in symptomatic patients with peripheral arterial disease. Vasc Med . 2006;11(1):29–33. doi: 10.1191/1358863x06vm663oa. [DOI] [PubMed] [Google Scholar]
- 790.Criqui MH, Matsushita K, Aboyans V, Hess CN, Hicks CW, Kwan TW, et al. Lower Extremity Peripheral Artery Disease: Contemporary Epidemiology, Management Gaps, and Future Directions: A Scientific Statement From the American Heart Association. Circulation . 2021;144(9):e171–e191. doi: 10.1161/CIR.0000000000001005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 791.Aboyans V, Criqui MH, Abraham P, Allison MA, Creager MA, Diehm C, et al. Measurement and Interpretation of the Ankle-Brachial Index: A Scientific Statement From the American Heart Association. Circulation . 2012;126(24):2890–2909. doi: 10.1161/CIR.0b013e318276fbcb. [DOI] [PubMed] [Google Scholar]
- 792.Feringa HHH, Bax JJJ, van Waning VH, Boersma E, Elhendy A, Schouten O, et al. The Long-term Prognostic Value of the Resting and Postexercise Ankle-Brachial Index. Arch Intern Med . 2006;166(5):529–535. doi: 10.1001/archinte.166.5.529. [DOI] [PubMed] [Google Scholar]
- 793.Sheikh MA, Bhatt DL, Li J, Lin S, Bartholomew JR. Usefulness of Postexercise Ankle-Brachial Index to Predict All-Cause Mortality. Am J Cardiol . 2011;107(5):778–782. doi: 10.1016/j.amjcard.2010.10.060. [DOI] [PubMed] [Google Scholar]
- 794.Abraham P, Ramondou P, Hersant J, Sempore WY, Feuilloy M, Henni S. Investigation of arterial claudication with transcutaneous oxygen pressure at exercise: Interests and limits. Trends Cardiovasc Med . 2021;31(4):218–223. doi: 10.1016/j.tcm.2020.03.003. [DOI] [PubMed] [Google Scholar]
- 795.Stivalet O, Paisant A, Belabbas D, Le Faucheur A, Landreau P, Le Pabic E, et al. Combination of Exercise Testing Criteria to Diagnose Lower Extremity Peripheral Artery Disease. 759666 Front Cardiovasc Med . 2021;8 doi: 10.3389/fcvm.2021.759666. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 796.McDermott MM, Criqui MH, Liu K, Guralnik JM, Greenland P, Martin GJ, et al. Lower ankle/brachial index, as calculated by averaging the dorsalis pedis and posterior tibial arterial pressures, and association with leg functioning in peripheral arterial disease. J Vasc Surg . 2000;32(6):1164–1171. doi: 10.1067/mva.2000.108640. [DOI] [PubMed] [Google Scholar]
- 797.Norgren L, Hiatt WR, Dormandy JA, Nehler MR, Harris KA, Fowkes FGR. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II) J Vasc Surg . 2007;45:S5–67. doi: 10.1016/j.jvs.2006.12.037. [DOI] [PubMed] [Google Scholar]
- 798.Xu D, Zou L, Xing Y, Hou L, Wei Y, Zhang J, et al. Diagnostic Value of Ankle-Brachial Index in Peripheral Arterial Disease: A Meta-analysis. Can J Cardiol . 2013;29(4):492–498. doi: 10.1016/j.cjca.2012.06.014. [DOI] [PubMed] [Google Scholar]
- 799.Laing S, Greenhalgh RM. The detection and progression of asymptomatic peripheral arterial disease. Br J Surg . 2005;70(10):628–630. doi: 10.1002/bjs.1800701017. [DOI] [PubMed] [Google Scholar]
- 800.Hammad TA, Hiatt WR, Gornik HL, Shishehbor MH. Prognostic value of an increase in post-exercise ankle-brachial index. Vasc Med . 2017;22(3):204–209. doi: 10.1177/1358863X16676902. [DOI] [PubMed] [Google Scholar]
- 801.Nicolaï SPA, Viechtbauer W, Kruidenier LM, Candel MJJM, Prins MH, Teijink JAW. Reliability of treadmill testing in peripheral arterial disease: A meta-regression analysis. J Vasc Surg . 2009;50(2):322–329. doi: 10.1016/j.jvs.2009.01.042. [DOI] [PubMed] [Google Scholar]
- 802.Aday AW, Kinlay S, Gerhard-Herman MD. Comparison of different exercise ankle pressure indices in the diagnosis of peripheral artery disease. Vasc Med . 2018;23(6):541–548. doi: 10.1177/1358863X18781723. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 803.Liefde II de, Verhagen HJ, Stolker RJ, Domburg RT van, Poldermans D. The value of treadmill exercise test parameters together in patients with known or suspected peripheral arterial disease. Eur J Prev Cardiol . 2012;19(2):192–198. doi: 10.1177/1741826711399986. [DOI] [PubMed] [Google Scholar]
- 804.Nitzan M, Romem A, Koppel R. Pulse oximetry: fundamentals and technology update. Med Devices Evid Res . 2014;7(1):231–239. doi: 10.2147/MDER.S47319. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 805.Jubran A. Pulse oximetry. 272 Crit Care . 2015;19(1) doi: 10.1186/s13054-015-0984-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 806.McMorrow RC, Mythen MG. Pulse oximetry: Curr Opin Intern Med . 2006;12(3):269–271. doi: 10.1097/01.ccx.0000224873.16700.78. [DOI] [PubMed] [Google Scholar]
- 807.McGovern JP, Sasse SA, Stansbury DW, Causing LA, Light RW. Comparison of Oxygen Saturation by Pulse Oximetry and Co-oximetry During Exercise Testing in Patients With COPD. Chest . 1996;109(5):1151–1155. doi: 10.1378/chest.109.5.1151. [DOI] [PubMed] [Google Scholar]
- 808.Chan ED, Chan MM, Chan MM. Pulse oximetry: Understanding its basic principles facilitates appreciation of its limitations. Respir Med . 2013;107(6):789–799. doi: 10.1016/j.rmed.2013.02.004. [DOI] [PubMed] [Google Scholar]
- 809.Yamaya Y, Bogaard HJ, Wagner PD, Niizeki K, Hopkins SR. Validity of pulse oximetry during maximal exercise in normoxia, hypoxia, and hyperoxia. J Appl Physiology . 2002;92(1):162–168. doi: 10.1152/japplphysiol.00409.2001. [DOI] [PubMed] [Google Scholar]
- 810.Dipla K, Boutou AK, Markopoulou A, Pitsiou G, Papadopoulos S, Chatzikosti A, et al. Exertional Desaturation in Idiopathic Pulmonary Fibrosis: The Role of Oxygen Supplementation in Modifying Cerebral-Skeletal Muscle Oxygenation and Systemic Hemodynamics. Respiration . 2021;100(6):463–475. doi: 10.1159/000514320. [DOI] [PubMed] [Google Scholar]
- 811.ATS/ACCP Statement on Cardiopulmonary Exercise Testing Am J Respir Crit Care Med . 2003;167(2):211–277. doi: 10.1164/rccm.167.2.211. [DOI] [PubMed] [Google Scholar]
- 812.Saxer S, Calendo L-R, Lichtblau M, Carta A, Müller J, Gautschi F, et al. Effect of oxygen therapy on exercise performance in patients with cyanotic congenital heart disease: Randomized-controlled trial. Int J Cardiol . 2022;348:65–72. doi: 10.1016/j.ijcard.2021.11.066. [DOI] [PubMed] [Google Scholar]
- 813.Leczycki P, Banach M, Maciejewski M, Bielecka-Dabrowa A. Heart Failure Risk Predictions and Prognostic Factors in Adults With Congenital Heart Diseases. 692815 Front Cardiovasc Med . 2022;9 doi: 10.3389/fcvm.2022.692815. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 814.Kelly KL, Carlson AR, Allison TG, Johnson BD. A comparison of finger and forehead pulse oximeters in heart failure patients during maximal exercise. Heart Lung . 2020;49(3):259–264. doi: 10.1016/j.hrtlng.2019.10.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 815.Mengelkoch LJ, Martin D, Lawler J. A Review of the Principles of Pulse Oximetry and Accuracy of Pulse Oximeter Estimates During Exercise. Phys Ther . 1994;74(1):40–49. doi: 10.1093/ptj/74.1.40. [DOI] [PubMed] [Google Scholar]
- 816.Ascha M, Bhattacharyya A, Ramos JA, Tonelli AR. Pulse Oximetry and Arterial Oxygen Saturation during Cardiopulmonary Exercise Testing. Med Sci Sports Exerc . 2018;50(10):1992–1997. doi: 10.1249/MSS.0000000000001658. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 817.Luks AM, Swenson ER. Pulse Oximetry for Monitoring Patients with COVID-19 at Home. Potential Pitfalls and Practical Guidance. Ann Am Thorac Soc . 2020;17(9):1040–1046. doi: 10.1513/AnnalsATS.202005-418FR. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 818.Cabanas AM, Fuentes-Guajardo M, Latorre K, León D, Martín-Escudero P. Skin Pigmentation Influence on Pulse Oximetry Accuracy: A Systematic Review and Bibliometric Analysis. 3402 Sensors . 2022;22(9) doi: 10.3390/s22093402. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 819.Batchelder PB, Raley DM. Maximizing the Laboratory Setting for Testing Devices and Understanding Statistical Output in Pulse Oximetry. Anesth Analg . 2007;105(6) Suppl:S85–S94. doi: 10.1213/01.ane.0000268495.35207.ab. [DOI] [PubMed] [Google Scholar]
- 820.Paridon SM, Alpert BS, Boas SR, Cabrera ME, Caldarera LL, Daniels SR, et al. A Statement From the American Heart Association Council on Cardiovascular Disease in the Young, Committee on Atherosclerosis, Hypertension, and Obesity in Youth. Circulation . 2006;113(15):1905–1920. doi: 10.1161/CIRCULATIONAHA.106.174375. [DOI] [PubMed] [Google Scholar]
- 821.Hansen CH, Cwikiel J, Bratseth V, Arnesen H, Flaa A, Seljeflot I. Effect of Revascularization on Exercise-Induced Changes in Cardiac and Prothrombotic Biomarkers in Patients with Coronary Artery Disease. 107602962210940 Clin Appl Thromb . 2022;28 doi: 10.1177/10760296221094029. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 822.Cwikiel J, Seljeflot I, Fagerland MW, Wachtell K, Arnesen H, Berge E, et al. High-sensitive cardiac Troponin T and exercise stress test for evaluation of angiographically significant coronary disease. Int J Cardiol . 2019;287:1–6. doi: 10.1016/j.ijcard.2019.04.019. [DOI] [PubMed] [Google Scholar]
- 823.Cwikiel J, Seljeflot I, Berge E, Wachtell K, Flaa A. P826 Increase in cardiac biomarkers during exercise stress test in patients with angiographically verified coronary artery disease. Eur Heart J . 2018;39(Suppl 1) doi: 10.1093/eurheartj/ehy564.P826. [DOI] [Google Scholar]
- 824.Liebetrau C, Gaede L, Dörr O, Hoffmann J, Wolter JS, Weber M, et al. High-sensitivity cardiac troponin T and copeptin assays to improve diagnostic accuracy of exercise stress test in patients with suspected coronary artery disease. Eur J Prev Cardiol . 2015;22(6):684–692. doi: 10.1177/2047487314529691. [DOI] [PubMed] [Google Scholar]
- 825.Lima BB, Hammadah M, Kim JH, Uphoff I, Shah A, Levantsevych O, et al. Relation of High-sensitivity Cardiac Troponin I Elevation With Exercise to Major Adverse Cardiovascular Events in Patients With Coronary Artery Disease. Am J Cardiol . 2020;136:1–8. doi: 10.1016/j.amjcard.2020.09.019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 826.Costache AD, Leon-Constantin MM, Roca M, Ma?taleru A, Anghel RC, Zota IM, et al. Cardiac Biomarkers in Sports Cardiology. 453 J Cardiovasc Dev Dis . 2022;9(12) doi: 10.3390/jcdd9120453. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 827.Wlodarczyk M, Kusy K, Slominska E, Krasinski Z, Zielinski J. Change in Lactate, Ammonia, and Hypoxanthine Concentrations in a 1-Year Training Cycle in Highly Trained Athletes: Applying Biomarkers as Tools to Assess Training Status. J Strength Cond Res . 2020;34(2):355–364. doi: 10.1519/JSC.0000000000003375. [DOI] [PubMed] [Google Scholar]
- 828.Lombardo B, Izzo V, Terracciano D, Ranieri A, Mazzaccara C, Fimiani F, et al. Laboratory medicine: health evaluation in elite athletes. Clin Chem Lab Med CCLM . 2019;57(10):1450–1473. doi: 10.1515/cclm-2018-1107. [DOI] [PubMed] [Google Scholar]
- 829.Mahanty A, Xi L. Utility of cardiac biomarkers in sports medicine: Focusing on troponin, natriuretic peptides, and hypoxanthine. Sports Med Health Sci . 2020;2(2):65–71. doi: 10.1016/j.smhs.2020.05.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 830.Vilela EM, Rita BS, Nunes JPL, Ribeiro VG. BNP and NT-proBNP elevation after running - a systematic review. Acta Cardiol . 2015;70(5):501–509. doi: 10.1080/AC.70.5.3110509. [DOI] [PubMed] [Google Scholar]
- 831.Beneke R, Leithäuser RM, Ochentel O. Blood Lactate Diagnostics in Exercise Testing and Training. Int J Sports Physiol Perform . 2011;6(1):8–24. doi: 10.1123/ijspp.6.1.8. [DOI] [PubMed] [Google Scholar]
- 832.Cerexhe L, Easton C, Macdonald E, Renfrew L, Sculthorpe N. Blood lactate concentrations during rest and exercise in people with Multiple Sclerosis: A systematic review and meta-analysis. 103454 Mult Scler Relat Disord . 2022;57 doi: 10.1016/j.msard.2021.103454. [DOI] [PubMed] [Google Scholar]
- 833.Finsterer J. Reproducibility of the lactate stress test. Metab Brain Dis . 2003;18(2):155–160. doi: 10.1023/A:1023867104002. [DOI] [PubMed] [Google Scholar]
- 834.Boning D. Differences Between Whole Blood And Plasma Lactate Concentrations Have To Be Considered When Comparing Various Studies. Med Sci Sports Exerc . 2001;33(8):1411–1412. doi: 10.1097/00005768-200108000-00026. [DOI] [PubMed] [Google Scholar]
- 835.Löllgen H, Leyk D. Exercise Testing in Sports Medicine. Dtsch Ärztebl Int . 2018;115(24):409–416. doi: 10.3238/arztebl.2018.0409. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 836.Goodwin ML, Harris JE, Hernández A, Gladden LB. Blood Lactate Measurements and Analysis during Exercise: A Guide for Clinicians. J Diabetes Sci Technol . 2007;1(4):558–569. doi: 10.1177/193229680700100414. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 837.Caen K, Pogliaghi S, Lievens M, Vermeire K, Bourgois JG, Boone J. Ramp vs. step tests: valid alternatives to determine the maximal lactate steady-state intensity? Eur J Appl Physiology . 2021;121(7):1899–1907. doi: 10.1007/s00421-021-04620-9. [DOI] [PubMed] [Google Scholar]
- 838.Niemeyer M, Gündisch M, Steinecke G, Knaier R, Beneke R. Is the maximal lactate steady state concept really relevant to predict endurance performance? Eur J Appl Physiology . 2022;122(10):2259–2269. doi: 10.1007/s00421-022-05001-6. [DOI] [PubMed] [Google Scholar]
- 839.Perret C, Kurzen J. Test Protocol Optimization of the Heart Rate-based Lactate Minimum Test. Int J Sports Med . 2022;43(5):427–433. doi: 10.1055/a-1618-5588. [DOI] [PubMed] [Google Scholar]
- 840.Hwang J, Moon NR, Heine O, Yang WH. The ability of energy recovery in professional soccer players is increased by individualized low-intensity exercise. PLoS One . 2022;17(6):e0270484. doi: 10.1371/journal.pone.0270484. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 841.Yang W-H, Park H, Grau M, Heine O. Decreased Blood Glucose and Lactate: Is a Useful Indicator of Recovery Ability in Athletes? Int J Environ Res Public Health . 2020;17(15):5470. doi: 10.3390/ijerph17155470. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 842.Stickland MK, Lindinger MI, Olfert IM, Heigenhauser GJF, Hopkins SR. Pulmonary Gas Exchange and Acid-Base Balance During Exercise. Compr Physiol . 2013;3(2):693–739. doi: 10.1002/cphy.c110048. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 843.Azizi M. The comparison of aerobic training on blood gases in athlete and non-athlete high school girls. Procedia - Soc Behav Sci . 2011;15:1556–1560. doi: 10.1016/j.sbspro.2011.03.330. [DOI] [Google Scholar]
- 844.Dukic L, Milevoj Kopcinovic L, Dorotic A, Baršic I. Blood gas testing and related measurements: National recommendations on behalf of the Croatian Society of Medical Biochemistry and Laboratory Medicine. Biochem Medica . 2016;26(3):318–336. doi: 10.11613/BM.2016.036. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 845.Sauty A, Uldry C, Debetaz L, Leuenberger P, Fitting J. Differences in PO2 and PCO2 between arterial and arterialized earlobe samples. Eur Respir J . 1996;2(9):186–189. doi: 10.1183/09031936.96.09020186. [DOI] [PubMed] [Google Scholar]
- 846.Byrne AL, Bennett M, Chatterji R, Symons R, Pace NL, Thomas PS. Peripheral venous and arterial blood gas analysis in adults: are they comparable? A systematic review and meta-analysis: Systematic review of PVBG and ABG analysis. Respirology . 2014;19(2):168–175. doi: 10.1111/resp.12225. [DOI] [PubMed] [Google Scholar]
- 847.Wagner PD. The physiological basis of pulmonary gas exchange: implications for clinical interpretation of arterial blood gases. Eur Respir J . 2015;45(1):227–243. doi: 10.1183/09031936.00039214. [DOI] [PubMed] [Google Scholar]
- 848.Berend K, Duits AJ. The role of the clinical laboratory in diagnosing acid-base disorders. Crit Rev Clin Lab Sci . 2019;56(3):147–169. doi: 10.1080/10408363.2019.1568965. [DOI] [PubMed] [Google Scholar]
- 849.Phillips DB, Collins SÉ, Stickland MK. Measurement and Interpretation of Exercise Ventilatory Efficiency. 659 Front Physiology . 2020;11 doi: 10.3389/fphys.2020.00659. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 850.Agostoni P, Dumitrescu D. How to perform and report a cardiopulmonary exercise test in patients with chronic heart failure. Int J Cardiol . 2019;288:107–113. doi: 10.1016/j.ijcard.2019.04.053. [DOI] [PubMed] [Google Scholar]
- 851.Balmain BN, Tomlinson AR, MacNamara JP, Sarma S, Levine BD, Hynan LS, et al. Physiological dead space during exercise in patients with heart failure with preserved ejection fraction. J Appl Physiol . 2022;132(3):632–640. doi: 10.1152/japplphysiol.00786.2021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 852.Weatherald J, Sattler C, Garcia G, Laveneziana P. Ventilatory response to exercise in cardiopulmonary disease: the role of chemosensitivity and dead space. 1700860 Eur Respir J . 2018;51(2) doi: 10.1183/13993003.00860-2017. [DOI] [PubMed] [Google Scholar]
- 853.Wasserman K, Zhang YY, Gitt A, Belardinelli R, Koike A, Lubarsky L, et al. Lung Function and Exercise Gas Exchange in Chronic Heart Failure. Circulation . 1997;96(7):2221–2227. doi: 10.1161/01.CIR.96.7.2221. [DOI] [PubMed] [Google Scholar]
- 854.Elbehairy AF, Ciavaglia CE, Webb KA, Guenette JA, Jensen D, Mourad SM, et al. Pulmonary Gas Exchange Abnormalities in Mild Chronic Obstructive Pulmonary Disease. Implications for Dyspnea and Exercise Intolerance. Am J Respir Crit Care Med . 2015;191(12):1384–1394. doi: 10.1164/rccm.201501-0157OC. [DOI] [PubMed] [Google Scholar]
- 855.Bishop P, Martino M. Blood Lactate Measurement in Recovery as an Adjunct to Training: Practical Considerations. Sports Med . 1993;16(1):5–13. doi: 10.2165/00007256-199316010-00002. [DOI] [PubMed] [Google Scholar]
- 856.Van Schuylenbergh R, Vanden Eynde B, Hespel P. Correlations Between Lactate and Ventilatory Thresholds and the Maximal Lactate Steady State in Elite Cyclists. Int J Sports Med . 2004;25(6):403–408. doi: 10.1055/s-2004-819942. [DOI] [PubMed] [Google Scholar]
- 857.Ferguson BS, Rogatzki MJ, Goodwin ML, Kane DA, Rightmire Z, Gladden LB. Lactate metabolism: historical context, prior misinterpretations, and current understanding. Eur J Appl Physiol . 2018;118(4):691–728. doi: 10.1007/s00421-017-3795-6. [DOI] [PubMed] [Google Scholar]
- 858.Scherr J, Wolfarth B, Christle JW, Pressler A, Wagenpfeil S, Halle M. Associations between Borg's rating of perceived exertion and physiological measures of exercise intensity. Eur J Appl Physiol . 2013;113(1):147–155. doi: 10.1007/s00421-012-2421-x. [DOI] [PubMed] [Google Scholar]
- 859.Urhausen A, Gabriel H, Kindermann W. Blood Hormones as Markers of Training Stress and Overtraining. Sports Med . 1995;20(4):251–276. doi: 10.2165/00007256-199520040-00004. [DOI] [PubMed] [Google Scholar]
- 860.Le Meur Y, Hausswirth C, Natta F, Couturier A, Bignet F, Vidal PP. A multidisciplinary approach to overreaching detection in endurance trained athletes. J Appl Physiol . 2013;114(3):411–420. doi: 10.1152/japplphysiol.01254.2012. [DOI] [PubMed] [Google Scholar]
- 861.Nielsen HB. Arterial desaturation during exercise in man: implication for O2 uptake and work capacity. Scand J Med Sci Sports . 2003;13(6):339–358. doi: 10.1046/j.1600-0838.2003.00325.x. [DOI] [PubMed] [Google Scholar]
- 862.Wencker M, Konietzko N. Blood gases at rest and during exercise in patients with a1-Pi deficiency. Respir Med . 2000;94(12):1177–1183. doi: 10.1053/rmed.2000.0947. [DOI] [PubMed] [Google Scholar]
- 863.Agostoni P, Pellegrino R, Conca C, Rodarte JR, Brusasco V. Exercise hyperpnea in chronic heart failure: relationships to lung stiffness and expiratory flow limitation. J Appl Physiol . 2002;92(4):1409–1416. doi: 10.1152/japplphysiol.00724.2001. [DOI] [PubMed] [Google Scholar]
- 864.Chuang ML, Hsieh BYT, Lin IF. Resting Dead Space Fraction as Related to Clinical Characteristics, Lung Function, and Gas Exchange in Male Patients with Chronic Obstructive Pulmonary Disease. Int J Gen Med . 2021;14:169–177. doi: 10.2147/IJGM.S291555. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 865.Evans WN, Acherman RJ, Collazos JC, Castillo WJ, Rollins RC, Kip KT, et al. Dextrocardia: Practical Clinical Points and Comments on Terminology. Pediatr Cardiol . 2010;31(1):1–6. doi: 10.1007/s00246-009-9516-0. [DOI] [PubMed] [Google Scholar]
- 866.Rao PS, Rao NS. Diagnosis of Dextrocardia with a Pictorial Rendition of Terminology and Diagnosis. 1977 Children . 2022;9(12) doi: 10.3390/children9121977. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 867.Tripathi S, Ajit Kumar VK. Comparison of Morphologic Findings in Patients with Dextrocardia with Situs Solitus vs Situs Inversus: a Retrospective Study. Pediatr Cardiol . 2019;40(2):302–309. doi: 10.1007/s00246-018-2007-4. [DOI] [PubMed] [Google Scholar]
- 868.Jacobs JP, Anderson RH, Weinberg PM, Walters HL, Tchervenkov CI, Duca DD, et al. The nomenclature, definition and classification of cardiac structures in the setting of heterotaxy. Cardiol Young . 2007;17(Suppl 2):1–28. doi: 10.1017/S1047951107001138. [DOI] [PubMed] [Google Scholar]
- 869.Mozayan C, Levis JT. ECG Diagnosis: Dextrocardia. Perm J . 2019;23:18–244. doi: 10.7812/TPP/18.244. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 870.Perloff JK. The Cardiac Malpositions. Am J Cardiol . 2011;108(9):1352–1361. doi: 10.1016/j.amjcard.2011.06.055. [DOI] [PubMed] [Google Scholar]
- 871.Edenbrandt L, Rittner R. Recognition of lead reversals in pediatric electrocardiograms. Am J Cardiol . 1998;82(10):1290–1292. doi: 10.1016/s0002-9149(98)00621-3. https://doi.org/10.1016/S0002-9149 (98)00621-3 . [DOI] [PubMed] [Google Scholar]
- 872.Rapoport Y, Fox CJ, Khade P, Fox ME, Urman RD, Kaye AD. Perioperative implications and management of dextrocardia. J Anesth . 2015;29(5):769–785. doi: 10.1007/s00540-015-2019-7. [DOI] [PubMed] [Google Scholar]
- 873.Lakkireddy D. Dextrocardia: When Right is Wrong! 2222 J Atr Fibrillation . 2020;13(2) doi: 10.4022/jafib.2222. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 874.Garg N, Agarwal BL, Modi N, Radhakrishnan S, Sinha N. Dextrocardia: an analysis of cardiac structures in 125 patients. Int J Cardiol . 2003 2-3;88:143–155. doi: 10.1016/s0167-5273(02)00539-9. https://doi.org/10.1016/S0167-5273 (02)00539-9 . [DOI] [PubMed] [Google Scholar]
- 875.Maldjian PD, Saric M. Approach to Dextrocardia in Adults: Review. Am J Roentgenol . 2007;188(6) Suppl:S39–S49. doi: 10.2214/AJR.06.1179. [DOI] [PubMed] [Google Scholar]
- 876.Malik LH, Singh GD, Amsterdam EA. Chagas Heart Disease: An Update. Am J Med . 2015;128(11):1251.e7–1251.e9. doi: 10.1016/j.amjmed.2015.04.036. [DOI] [PubMed] [Google Scholar]
- 877.Silva RS, Mendes FSNS, Fleg JL, Rodrigues LF, Junior, Vieira MC, Xavier IGG, et al. The association of exercise test variables with long-term mortality in patients with chronic Chagas disease. 972514 Front Med . 2022;9 doi: 10.3389/fmed.2022.972514. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 878.Santacruz D, Rosas F, Hardy CA, Ospina D, Rosas AN, Camargo JM, et al. Advanced management of ventricular arrhythmias in chronic Chagas cardiomyopathy. Heart Rhythm O2 . 2021;2(6Part B):807–818. doi: 10.1016/j.hroo.2021.10.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 879.Nunes MCP, Beaton A, Acquatella H, Bern C, Bolger AF, Echeverría LE, et al. Chagas Cardiomyopathy: An Update of Current Clinical Knowledge and Management: A Scientific Statement From the American Heart Association. Circulation . 2018;138(12):e169–e209. doi: 10.1161/CIR.0000000000000599. [DOI] [PubMed] [Google Scholar]
- 880.Andrade JP de, Marin JA, Neto, Paola AAV de, Vilas-Boas F, Oliveira GMM, Bacal F, et al. I Diretriz Latino-Americana para o diagnóstico e tratamento da cardiopatia chagásica: resumo executivo. Arq Bras Cardiol . 2011;96(6):434–442. doi: 10.1590/S0066-782X2011000600002. [DOI] [PubMed] [Google Scholar]
- 881.Rocha ALL, Lombardi F, da Costa Rocha MO, Barros MVL, Val Barros V da C, Reis AM, et al. Chronotropic Incompetence and Abnormal Autonomic Modulation in Ambulatory Chagas Disease Patients. Ann Noninvasive Electrocardiol . 2006;11(1):3–11. doi: 10.1111/j.1542-474X.2006.00054.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 882.Rassi A, Rassi A, Marin-Neto JA. Chagas disease. Lancet . 2010;375(9723):1388–1402. doi: 10.1016/S0140-6736(10)60061-X. https://doi.org/10.1016/S0140-6736 (10)60061-X . [DOI] [PubMed] [Google Scholar]
- 883.Costa HS, Lima MMO, Costa FSM da, Chaves AT, Nunes MCP, Figueiredo PHS, et al. Reduced functional capacity in patients with Chagas disease: a systematic review with meta-analysis. Rev Soc Bras Med Trop . 2018;51(4):421–426. doi: 10.1590/0037-8682-0158-2018. [DOI] [PubMed] [Google Scholar]
- 884.Simões MV, Ayres EM, Santos JL, Schmidt A, Pintya AO, Maciel BC, et al. [Detection of myocardial ischemia in chronic Chagas disease patients with atypic precordial pain by exercise and Holter test. Arq Bras Cardiol . 1993;60:315–319. PMID:8311747. [PubMed] [Google Scholar]
- 885.Viotti R. Exercise stress testing as a predictor of progression of early chronic Chagas heart disease. Heart . 2005;92(3):403–404. doi: 10.1136/hrt.2005.064444. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 886.Rassi A, Rassi A, Rassi SG. Predictors of Mortality in Chronic Chagas Disease: A Systematic Review of Observational Studies. Circulation . 2007;115(9):1101–1108. doi: 10.1161/CIRCULATIONAHA.106.627265. [DOI] [PubMed] [Google Scholar]
- 887.Costa HS, Lima MMO, Figueiredo PHS, Lima VP, Ávila MR, Menezes KKP de, et al. Exercise tests in Chagas cardiomyopathy: an overview of functional evaluation, prognostic significance, and current challenges. Rev Soc Bras Med Trop . 2020;53:e20200100. doi: 10.1590/0037-8682-0100-2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 888.Mendes FSN, Mediano MFF, de Castro e Souza FC, da Silva PS, Carneiro FM, de Holanda MT, et al. Effect of Physical Exercise Training in Patients With Chagas Heart Disease (from the PEACH STUDY) Am J Cardiol . 2020;125(9):1413–1420. doi: 10.1016/j.amjcard.2020.01.035. [DOI] [PubMed] [Google Scholar]
- 889.Dias JCP, Alves RV, Gontijo ED, Luquetti A, Coura JR, Torres RH, et al. II Consenso Brasileiro em Doença de Chagas, 2015. Epidemiol E Serviços Saúde . 2016;25(spe):1–10. doi: 10.5123/S1679-49742016000500002. [DOI] [PubMed] [Google Scholar]
- 890.Rojas LZ, Glisic M, Pletsch-Borba L, Echeverría LE, Bramer WM, Bano A, et al. Electrocardiographic abnormalities in Chagas disease in the general population: A systematic review and meta-analysis. PLoS Negl Trop Dis . 2018;12(6):e0006567. doi: 10.1371/journal.pntd.0006567. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 891.Salles GF, Xavier SS, Sousa AS, Hasslocher-Moreno A, Cardoso CRL. T-wave axis deviation as an independent predictor of mortality in chronic Chagas' disease. Am J Cardiol . 2004;93(9):1136–1140. doi: 10.1016/j.amjcard.2004.01.040. [DOI] [PubMed] [Google Scholar]
- 892.Silva WT, Costa HS, Figueiredo PHS, Lima MMO, Lima VP, Costa FSM da, et al. Determinantes da Capacidade Funcional em Pacientes com Doença de Chagas. Arq Bras Cardiol . 2021;117(5):934–941. doi: 10.36660/abc.20200462. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 893.Mady C, Salemi VMC, Ianni BM, Ramires FJA, Arteaga E. Capacidade funcional máxima, fração de ejeção e classe funcional na cardiomiopatia chagásica: existe relação entre estes índices? Arq Bras Cardiol . 2005;84(2):152–155. doi: 10.1590/S0066-782X2005000200011. [DOI] [PubMed] [Google Scholar]
- 894.Mady C, Ianni BM, Arteaga E, Salemi VMC, de Carvalho Frimm C. Maximal functional capacity in patients with Chagas' cardiomyopathy without congestive heart failure. J Card Fail . 2000;6(3):220–224. doi: 10.1054/jcaf.2000.8828. [DOI] [PubMed] [Google Scholar]
- 895.Rocha ALL, Rocha MOC, Teixeira BOS, Lombardi F, Abreu CDG, Bittencourt RJ, et al. Índice cronotrópico-metabólico na doença de Chagas. Rev Soc Bras Med Trop . 2005;38(5):373–376. doi: 10.1590/S0037-86822005000500001. [DOI] [PubMed] [Google Scholar]
- 896.Marin-Neto JA, Cunha-Neto E, Maciel BC, Simões MV. Pathogenesis of Chronic Chagas Heart Disease. Circulation . 2007;115(9):1109–1123. doi: 10.1161/CIRCULATIONAHA.106.624296. [DOI] [PubMed] [Google Scholar]
- 897.Costa HS, Nunes MCP, Souza AC de, Lima MMO, Carneiro RB, Sousa GR de, et al. Exercise-induced ventricular arrhythmias and vagal dysfunction in Chagas disease patients with no apparent cardiac involvement. Rev Soc Bras Med Trop . 2015;48(2):175–180. doi: 10.1590/0037-8682-0295-2014. [DOI] [PubMed] [Google Scholar]
- 898.Alvarado-Tapias E, Miranda-Pacheco R, Rodríguez-Bonfante C, Velásquez G, Loyo J, Gil-Oviedo M, et al. Electrocardiography repolarization abnormalities are characteristic signs of acute chagasic cardiomyopathy. Invest Clin . 2012;53(4):378–394. PMID:23543488. [PubMed] [Google Scholar]
- 899.Ribeiro ALP, Marcolino MS, Prineas RJ, Lima-Costa MF. Electrocardiographic Abnormalities in Elderly Chagas Disease Patients: 10-Year Follow-Up of the Bambuí Cohort Study of Aging. J Am Heart Assoc . 2014;3(1):e000632. doi: 10.1161/JAHA.113.000632. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 900.Healy C, Viles-Gonzalez JF, Sáenz LC, Soto M, Ramírez JD, d'Avila A. Arrhythmias in Chagasic Cardiomyopathy. Card Electrophysiol Clin . 2015;7(2):251–268. doi: 10.1016/j.ccep.2015.03.016. [DOI] [PubMed] [Google Scholar]
- 901.de Paola AA, Gomes JA, Terzian AB, Miyamoto MH, Martinez Fo EE. Ventricular tachycardia during exercise testing as a predictor of sudden death in patients with chronic chagasic cardiomyopathy and ventricular arrhythmias. Heart . 1995;74(3):293–295. doi: 10.1136/hrt.74.3.293. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 902.Keegan R, Yeung C, Baranchuk A. Sudden Cardiac Death Risk Stratification and Prevention in Chagas Disease: A Non-systematic Review of the Literature. Arrhythmia Electrophysiol Rev . 2020;9(4):175–181. doi: 10.15420/aer.2020.27. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 903.Pedrosa RC, Salles JHG, Magnanini MMF, Bezerra DC, Bloch KV. Prognostic Value of Exercise-Induced Ventricular Arrhythmia in Chagas' Heart Disease: Chagas Heart Disease:Exercise Induced Arrhytmia. Pacing Clin Electrophysiol . 2011;34(11):1492–1497. doi: 10.1111/j.1540-8159.2011.03171.x. [DOI] [PubMed] [Google Scholar]
- 904.Bestetti RB, Freitas OC, Muccillo G, Oliveira JSM. Clinical and morphological characteristics associated with sudden cardiac death in patients with Chagas' disease. Eur Heart J . 1993;14(12):1610–1614. doi: 10.1093/eurheartj/14.12.1610. [DOI] [PubMed] [Google Scholar]
- 905.Vieira MC, Mendes F, Silva PS, Silva GMS, Mazzoli-Rocha F, Sousa AS, et al. The association between variables of cardiopulmonary exercise test and quality of life in patients with chronic Chagas cardiomyopathy (Insights from the PEACH STUDY) PLoS One . 2022;17(12):e0279086. doi: 10.1371/journal.pone.0279086. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 906.Hiatt WR, Rogers RK, Brass EP. The Treadmill Is a Better Functional Test Than the 6-Minute Walk Test in Therapeutic Trials of Patients With Peripheral Artery Disease. Circulation . 2014;130(1):69–78. doi: 10.1161/CIRCULATIONAHA.113.007003. [DOI] [PubMed] [Google Scholar]
- 907.Song P, Rudan D, Zhu Y, Fowkes FJI, Rahimi K, Fowkes FGR, et al. Global, regional, and national prevalence and risk factors for peripheral artery disease in 2015: an updated systematic review and analysis. Lancet Glob Health . 2019;7(8):e1020–e1030. doi: 10.1016/S2214-109X(19)30255-4. https://doi.org/10.1016/S2214-109X (19)30255-4 . [DOI] [PubMed] [Google Scholar]
- 908.Hiatt WR. Medical Treatment of Peripheral Arterial Disease and Claudication. N Engl J Med . 2001;344(21):1608–1621. doi: 10.1056/NEJM200105243442108. [DOI] [PubMed] [Google Scholar]
- 909.Manfrini O, Amaduzzi PL, Cenko E, Bugiardini R. Prognostic implications of peripheral artery disease in coronary artery disease. Curr Opin Pharmacol . 2018;39:121–128. doi: 10.1016/j.coph.2018.04.005. [DOI] [PubMed] [Google Scholar]
- 910.Henkin S, McBane RD, Rooke TW, Wysokinski WE, Casanegra AI, Liedl DA, et al. Major adverse events associated with inducible cardiac ischemia during treadmill exercise testing for peripheral artery disease. J Vasc Surg . 2021;74(4):1335–1342.e2. doi: 10.1016/j.jvs.2021.03.041. [DOI] [PubMed] [Google Scholar]
- 911.Morris DR, Rodriguez AJ, Moxon JV, Cunningham MA, McDermott MM, Myers J, et al. Association of Lower Extremity Performance With Cardiovascular and All-Cause Mortality in Patients With Peripheral Artery Disease: A Systematic Review and Meta-Analysis. J Am Heart Assoc . 2014;3(4):e001105. doi: 10.1161/JAHA.114.001105. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 912.van den Houten MML, Jansen S, van der Laan L, Vriens PWHE, Willigendael EM, Koelemay MJW, et al. The Effect of Arterial Disease Level on Outcomes of Supervised Exercise Therapy for Intermittent Claudication: A Prospective Cohort Study. Ann Surg . 2022;275(3):609–616. doi: 10.1097/SLA.0000000000004073. [DOI] [PubMed] [Google Scholar]
- 913.Sabino-Carvalho JL, Fisher JP, Vianna LC. Autonomic Function in Patients With Parkinson's Disease: From Rest to Exercise. 626640 Front Physiol . 2021;12 doi: 10.3389/fphys.2021.626640. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 914.Pechstein AE, Gollie JM, Guccione AA. Fatigability and Cardiorespiratory Impairments in Parkinson's Disease: Potential Non-Motor Barriers to Activity Performance. J Funct Morphol Kinesiol . 2020;5(4):78. doi: 10.3390/jfmk5040078. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 915.Zhang Z, Chen SD. Autonomic Dysfunctions in Parkinson's Disease: Prevalence, Clinical Characteristics, Potential Diagnostic Markers, and Treatment. Parkinsons Dis. . 2020;2020 doi: 10.1155/2020/8740732. 8740732. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 916.Chen Z, Li G, Liu J. Autonomic dysfunction in Parkinson's disease: Implications for pathophysiology, diagnosis, and treatment. 104700 Neurobiol Dis . 2020;134 doi: 10.1016/j.nbd.2019.104700. [DOI] [PubMed] [Google Scholar]
- 917.Xing Y, Li Q, Xu E, Zeng J, Li Q, Mei S, et al. Impaired Cerebral Autoregulation in Parkinson's Disease: An Orthostatic Hypotension Analysis. Front Neurol. . 2022;13 doi: 10.3389/fneur.2022.811698. 811698. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 918.Palma J-A, Kaufmann H. Orthostatic Hypotension in Parkinson Disease. Clin Geriatr Med . 2020;36(1):53–67. doi: 10.1016/j.cger.2019.09.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 919.Fanciulli A, Jordan J, Biaggioni I, Calandra-Buonaura G, Cheshire WP, Cortelli P, et al. Consensus statement on the definition of neurogenic supine hypertension in cardiovascular autonomic failure by the American Autonomic Society (AAS) and the European Federation of Autonomic Societies (EFAS): Endorsed by the European Academy of Neurology (EAN) and the European Society of Hypertension (ESH) Clin Auton Res . 2018;28(4):355–362. doi: 10.1007/s10286-018-0529-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 920.Sabino-Carvalho JL, Vianna LC. Altered cardiorespiratory regulation during exercise in patients with Parkinson's disease: A challenging non-motor feature. SAGE Open Med. . 2020;(8) doi: 10.1177/2050312120921603. 205031212092160. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 921.Saba RA, Maia DP, Cardoso FEC, Borges V, F. Andrade LA, Ferraz HB, et al. Guidelines for Parkinson's disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology - motor symptoms. Arq Neuropsiquiatr . 2022;80(3):316–329. doi: 10.1590/0004-282x-anp-2021-0219. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 922.Sabino-Carvalho JL, Teixeira AL, Samora M, Daher M, Vianna LC. Blunted cardiovascular responses to exercise in Parkinson's disease patients: role of the muscle metaboreflex. J Neurophysiol. . 2018;120(4):1516–24. doi: 10.1152/jn.00308.2018. [DOI] [PubMed] [Google Scholar]
- 923.Bryant MS, Jackson GR, Hou JG, Protas EJ. Treadmill exercise tests in persons with Parkinson's disease: responses and disease severity. Aging Clin Exp Res. . 2016;28(5):1009–14. doi: 10.1007/s40520-015-0498-x. [DOI] [PubMed] [Google Scholar]
- 924.Xu Q, Park Y, Huang X, Hollenbeck A, Blair A, Schatzkin A, et al. Physical activities and future risk of Parkinson disease. Neurology . 2010;75(4):341–348. doi: 10.1212/WNL.0b013e3181ea1597. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 925.Ganesan M, Pal PK, Gupta A, Sathyaprabha TN. Treadmill gait training improves baroreflex sensitivity in Parkinson's disease. Clin Auton Res . 2014;24(3):111–118. doi: 10.1007/s10286-014-0236-z. [DOI] [PubMed] [Google Scholar]
- 926.Mavrommati F, Collett J, Franssen M, Meaney A, Sexton C, Dennis-West A, et al. Exercise response in Parkinson's disease: insights from a cross-sectional comparison with sedentary controls and a per-protocol analysis of a randomised controlled trial. BMJ Open . 2017;7(12):e017194. doi: 10.1136/bmjopen-2017-017194. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 927.Penko AL, Zimmerman NM, Crawford M, Linder SM, Alberts JL. Effect of Aerobic Exercise on Cardiopulmonary Responses and Predictors of Change in Individuals With Parkinson's Disease. Arch Phys Med Rehabil . 2021;102(5):925–931. doi: 10.1016/j.apmr.2020.12.011. [DOI] [PubMed] [Google Scholar]
- 928.Maron BJ, Zipes DP. Introduction: Eligibility recommendations for competitive athletes with cardiovascular abnormalities-general considerations. J Am Coll Cardiol . 2005;45(8):1318–1321. doi: 10.1016/j.jacc.2005.02.006. [DOI] [PubMed] [Google Scholar]
- 929.Lancellotti P, Magne J, Piérard LA. The role of stress testing in evaluation of asymptomatic patients with aortic stenosis. Curr Opin Cardiol . 2013;28(5):531–539. doi: 10.1097/HCO.0b013e3283632b41. [DOI] [PubMed] [Google Scholar]
- 930.Morise AP. Exercise Testing in Nonatherosclerotic Heart Disease: Hypertrophic Cardiomyopathy, Valvular Heart Disease, and Arrhythmias. Circulation . 2011;123(2):216–225. doi: 10.1161/CIRCULATIONAHA.109.914762. [DOI] [PubMed] [Google Scholar]
- 931.Booher AM, Bach DS. Exercise Hemodynamics in Valvular Heart Disease. Curr Cardiol Rep . 2011;13(3):226–233. doi: 10.1007/s11886-011-0169-2. [DOI] [PubMed] [Google Scholar]
- 932.Bhattacharyya S, Hayward C, Pepper J, Senior R. Risk stratification in asymptomatic severe aortic stenosis: a critical appraisal. Eur Heart J . 2012;33(19):2377–2387. doi: 10.1093/eurheartj/ehs190. [DOI] [PubMed] [Google Scholar]
- 933.Rafique AM, Biner S, Ray I, Forrester JS, Tolstrup K, Siegel RJ. Meta-Analysis of Prognostic Value of Stress Testing in Patients With Asymptomatic Severe Aortic Stenosis. Am J Cardiol . 2009;104(7):972–977. doi: 10.1016/j.amjcard.2009.05.044. [DOI] [PubMed] [Google Scholar]
- 934.Banovic M, Iung B, Brkovic V, Nikolic S, Mitrovic P, Van Camp G, et al. Silent coronary artery disease in asymptomatic patients with severe aortic stenosis and normal exercise testing. Coron Artery Dis . 2020;31(2):166–173. doi: 10.1097/MCA.0000000000000801. [DOI] [PubMed] [Google Scholar]
- 935.Taniguchi T, Morimoto T, Shiomi H, Ando K, Kanamori N, Murata K, et al. Prognostic Impact of Left Ventricular Ejection Fraction in Patients With Severe Aortic Stenosis. JACC Cardiovasc Interv . 2018;11(2):145–157. doi: 10.1016/j.jcin.2017.08.036. [DOI] [PubMed] [Google Scholar]
- 936.Magne J, Lancellotti P, Piérard LA. Exercise Testing in Asymptomatic Severe Aortic Stenosis. JACC Cardiovasc Imaging . 2014;7(2):188–199. doi: 10.1016/j.jcmg.2013.08.011. [DOI] [PubMed] [Google Scholar]
- 937.Amato MCM. Treatment decision in asymptomatic aortic valve stenosis: role of exercise testing. Heart . 2001;86(4):381–386. doi: 10.1136/heart.86.4.381. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 938.Saeed S, Chambers JB. Exercise Testing in Aortic Stenosis: Safety, Tolerability, Clinical Benefits and Prognostic Value. 4983 J Clin Med . 2022;11(17) doi: 10.3390/jcm11174983. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 939.Redfors B, Pibarot P, Gillam LD, Burkhoff D, Bax JJ, Lindman BR, et al. Stress Testing in Asymptomatic Aortic Stenosis. Circulation . 2017;135(20):1956–1976. doi: 10.1161/CIRCULATIONAHA.116.025457. [DOI] [PubMed] [Google Scholar]
- 940.Saeed S, Mancia G, Rajani R, Seifert R, Parkin D, Chambers JB. Exercise Treadmill Testing in Moderate or Severe Aortic Stenosis: The Left Ventricular Correlates of an Exaggerated Blood Pressure Rise. J Am Heart Assoc . 2018;7(22):e010735. doi: 10.1161/JAHA.118.010735. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 941.Basile C, Fucile I, Lembo M, Manzi MV, Ilardi F, Franzone A, et al. Arterial Hypertension in Aortic Valve Stenosis: A Critical Update. J Clin Med . 2021;10(23):5553. doi: 10.3390/jcm10235553. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 942.Das P, Rimington H, Chambers J. Exercise testing to stratify risk in aortic stenosis. Eur Heart J . 2005;26(13):1309–1313. doi: 10.1093/eurheartj/ehi250. [DOI] [PubMed] [Google Scholar]
- 943.Dulgheru R, Magne J, Capoulade R, Davin L, Vinereanu D, Pierard LA, et al. Impact of global hemodynamic load on exercise capacity in aortic stenosis. Int J Cardiol . 2013;168(3):2272–2277. doi: 10.1016/j.ijcard.2013.01.205. [DOI] [PubMed] [Google Scholar]
- 944.Fishbein GA, Fishbein MC. Pathology of the Aortic Valve: Aortic Valve Stenosis/Aortic Regurgitation. 81 Curr Cardiol Rep . 2019;21(8) doi: 10.1007/s11886-019-1162-4. [DOI] [PubMed] [Google Scholar]
- 945.Bekeredjian R, Grayburn PA. Valvular Heart Disease: Aortic Regurgitation. Circulation . 2005;112(1):125–134. doi: 10.1161/CIRCULATIONAHA.104.488825. [DOI] [PubMed] [Google Scholar]
- 946.Lee JKT, Franzone A, Lanz J, Siontis GCM, Stortecky S, Gräni C, et al. Early Detection of Subclinical Myocardial Damage in Chronic Aortic Regurgitation and Strategies for Timely Treatment of Asymptomatic Patients. Circulation . 2018;137(2):184–196. doi: 10.1161/CIRCULATIONAHA.117.029858. [DOI] [PubMed] [Google Scholar]
- 947.Chen J, Okin PM, Roman MJ, Hochreiter C, Devereux RB, Borer JS, et al. Combined rest and exercise electrocardiographic repolarization findings in relation to structural and functional abnormalities in asymptomatic aortic regurgitation. Am Heart J . 1996;132(2):343–347. doi: 10.1016/s0002-8703(96)90431-7. Pt 1. https://doi.org/10.1016/S0002-8703 (96)90431-7 . [DOI] [PubMed] [Google Scholar]
- 948.Misra M, Thakur R, Bhandari K, Puri VK. Value of the treadmill exercise test in asymptomatic and minimally symptomatic patients with chronic severe aortic regurgitation. Int J Cardiol . 1987;15(3):309–316. doi: 10.1016/0167-5273(87)90336-6. https://doi.org/10.1016/0167-5273 (87)90336-6 . [DOI] [PubMed] [Google Scholar]
- 949.Michel PL, Mandagout O, Vahanian A, Cormier B, Iung B, Luxereau P, et al. Ventricular arrhythmias in aortic valve disease before and after aortic valve replacement. Acta Cardiol . 1992;47(2):145–156. PMID: 1615741. [PubMed] [Google Scholar]
- 950.Forteza Albertí JF, Noris Mora M, Carrillo López A, Pericàs P, Pasamar Márquez L, Calderón Montero FJ, et al. Changes in the severity of aortic regurgitation at peak effort during exercise. Int J Cardiol . 2017;228:145–148. doi: 10.1016/j.ijcard.2016.11.168. [DOI] [PubMed] [Google Scholar]
- 951.Chatrath N, Papadakis M. Physical activity and exercise recommendations for patients with valvular heart disease. Heart . 2022;108(24):1938–1944. doi: 10.1136/heartjnl-2021-319824. [DOI] [PubMed] [Google Scholar]
- 952.Pierard LA, Lancellotti P. Stress testing in valve disease. Heart . 2007;93(6):766–772. doi: 10.1136/hrt.2005.074815. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 953.Al-Taweel A, Almahmoud MF, Khairandish Y, Ahmad M. Degenerative mitral valve stenosis: Diagnosis and management. Echocardiography . 2019;36(10):1901–1909. doi: 10.1111/echo.14495. [DOI] [PubMed] [Google Scholar]
- 954.Gohlke-Bärwolf C. In: Cardiovasc. Prev. Rehabil . Perk J, Gohlke H, Hellemans I, Sellier P, Mathes P, Monpère C, et al., editors. London: Springer London; 2007. Exercise Testing in Valvular Heart Disease; pp. 110–120. [DOI] [Google Scholar]
- 955.Ueshima K, Chiba I, Saitoh M, Kobayashi N, Sato M, Hayashida K, et al. Factors Affecting ST Depression During Cardiopulmonary Exercise Testing in Patients With Mitral Stenosis Without Significant Coronary Lesions. Jpn Heart J . 2004;45(2):251–255. doi: 10.1536/jhj.45.251. [DOI] [PubMed] [Google Scholar]
- 956.Hsu TS, Lee YS. Endpoints of treadmill exercise testing for functional evaluation of patients with mitral stenosis. Int J Cardiol . 1991;31(1):81–87. doi: 10.1016/0167-5273(91)90271-p. https://doi.org/10.1016/0167-5273 (91)90271-P . [DOI] [PubMed] [Google Scholar]
- 957.Song JK, Kang DH, Lee CW, Lee SG, Cheong SS, Hong MK, et al. Factors determining the exercise capacity in mitral stenosis. Am J Cardiol . 1996;78(9):1060–1062. doi: 10.1016/s0002-9149(96)00539-5. https://doi.org/10.1016/S0002-9149 (96)00539-5 . [DOI] [PubMed] [Google Scholar]
- 958.Aluru JS, Barsouk A, Saginala K, Rawla P, Barsouk A. Valvular Heart Disease Epidemiology. 32 Med Sci . 2022;10(2) doi: 10.3390/medsci10020032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 959.Coats AJS, Anker SD, Baumbach A, Alfieri O, von Bardeleben RS, Bauersachs J, et al. The management of secondary mitral regurgitation in patients with heart failure: a joint position statement from the Heart Failure Association (HFA), European Association of Cardiovascular Imaging (EACVI), European Heart Rhythm Association (EHRA), and European Association of Percutaneous Cardiovascular Interventions (EAPCI) of the ESC. Eur Heart J . 2021;42(13):1254–1269. doi: 10.1093/eurheartj/ehab086. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 960.Picano E, Pibarot P, Lancellotti P, Monin JL, Bonow RO. The Emerging Role of Exercise Testing and Stress Echocardiography in Valvular Heart Disease. J Am Coll Cardiol . 2009;54(24):2251–2260. doi: 10.1016/j.jacc.2009.07.046. [DOI] [PubMed] [Google Scholar]
- 961.Bakkestrøm R, Banke A, Christensen NL, Pecini R, Irmukhamedov A, Andersen M, et al. Hemodynamic Characteristics in Significant Symptomatic and Asymptomatic Primary Mitral Valve Regurgitation at Rest and During Exercise. Circ Cardiovasc Imaging . 2018;11(2):e007171. doi: 10.1161/CIRCIMAGING.117.007171. [DOI] [PubMed] [Google Scholar]
- 962.Bertrand PB, Schwammenthal E, Levine RA, Vandervoort PM. Exercise Dynamics in Secondary Mitral Regurgitation: Pathophysiology and Therapeutic Implications. Circulation . 2017;135(3):297–314. doi: 10.1161/CIRCULATIONAHA.116.025260. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 963.Onishi H, Izumo M, Naganuma T, Nakamura S, Akashi YJ. Dynamic Secondary Mitral Regurgitation: Current Evidence and Challenges for the Future. 883450 Front Cardiovasc Med . 2022;9 doi: 10.3389/fcvm.2022.883450. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 964.Galusko V, Sekar B, Ricci F, Wong K, Bhattacharyya S, Mullen M, et al. Mitral regurgitation management: a systematic review of clinical practice guidelines and recommendations. Eur Heart J Qual Care Clin Outcomes . 2022;8(5):481–495. doi: 10.1093/ehjqcco/qcab082. [DOI] [PubMed] [Google Scholar]
- 965.Deferm S, Bertrand PB, Verbrugge FH, Verhaert D, Rega F, Thomas JD, et al. Atrial Functional Mitral Regurgitation. J Am Coll Cardiol . 2019;73(19):2465–2476. doi: 10.1016/j.jacc.2019.02.061. [DOI] [PubMed] [Google Scholar]
- 966.Supino PG, Borer JS, Schuleri K, Gupta A, Hochreiter C, Kligfield P, et al. Prognostic Value of Exercise Tolerance Testing in Asymptomatic Chronic Nonischemic Mitral Regurgitation. Am J Cardiol . 2007;100(8):1274–1281. doi: 10.1016/j.amjcard.2007.05.046. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 967.Hochreiter C, Borer JS, Yin A, Supino PG, Herrold EM, Krieger K, et al. Ventricular arrhythmias in mitral regurgitation: frequency, clinical and prognostic importance, management before and after mitral valve surgery. Adv Cardiol . 2004;41:108–111. doi: 10.1159/000079789. [DOI] [PubMed] [Google Scholar]
- 968.Mentias A, Alashi A, Naji P, Gillinov AM, Rodriguez LL, Mihaljevic T, et al. Exercise capacity in asymptomatic patients with significant primary mitral regurgitation: independent effect of global longitudinal left ventricular strain. Cardiovasc Diagn Ther . 2018;8(4):460–468. doi: 10.21037/cdt.2018.05.03. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 969.Boudoulas KD, Boudoulas H. Floppy Mitral Valve (FMV)/Mitral Valve Prolapse (MVP) and the FMV/MVP Syndrome: Pathophysiologic Mechanisms and Pathogenesis of Symptoms. Cardiology . 2013;126(2):69–80. doi: 10.1159/000351094. [DOI] [PubMed] [Google Scholar]
- 970.Miller MA, Dukkipati SR, Turagam M, Liao SL, Adams DH, Reddy VY. Arrhythmic Mitral Valve Prolapse. J Am Coll Cardiol . 2018;72(23):2904–2914. doi: 10.1016/j.jacc.2018.09.048. Pt A. [DOI] [PubMed] [Google Scholar]
- 971.Delling FN, Vasan RS. Epidemiology and Pathophysiology of Mitral Valve Prolapse: New Insights Into Disease Progression, Genetics, and Molecular Basis. Circulation . 2014;129(21):2158–2170. doi: 10.1161/CIRCULATIONAHA.113.006702. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 972.Basso C, Perazzolo Marra M, Rizzo S, De Lazzari M, Giorgi B, Cipriani A, et al. Arrhythmic Mitral Valve Prolapse and Sudden Cardiac Death. Circulation . 2015;132(7):556–566. doi: 10.1161/CIRCULATIONAHA.115.016291. [DOI] [PubMed] [Google Scholar]
- 973.Bonow RO, Nishimura RA, Thompson PD, Udelson JE. Eligibility and Disqualification Recommendations for Competitive Athletes With Cardiovascular Abnormalities: Task Force 5: Valvular Heart Disease: A Scientific Statement From the American Heart Association and American College of Cardiology. Circulation . 2015;132(22):e292–e297. doi: 10.1161/CIR.0000000000000241. [DOI] [PubMed] [Google Scholar]
- 974.Cavarretta E, Peruzzi M, Versaci F, Frati G, Sciarra L. How to manage an athlete with mitral valve prolapse. Eur J Prev Cardiol . 2021;28(10):1110–1117. doi: 10.1177/2047487320941646. [DOI] [PubMed] [Google Scholar]
- 975.Boudoulas KD, Pitsis AA, Boudoulas H. Floppy Mitral Valve (FMV) - Mitral Valve Prolapse (MVP) - Mitral Valvular Regurgitation and FMV/MVP Syndrome. Hellenic J Cardiol . 2016;57(2):73–85. doi: 10.1016/j.hjc.2016.03.001. [DOI] [PubMed] [Google Scholar]
- 976.Peighambari MM, Alizadehasl A, Totonchi Z. Electrocardiographic Changes in Mitral Valve Prolapse Syndrome. J Cardiovasc Thorac Res . 2014;6(1):21–23. doi: 10.5681/JCVTR.2014.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 977.Drory Y, Fisman EZ, Fines A, Kellermann JJ. Exercise Response in Young Women with Mitral Valve Prolapse. Chest . 1989;96(5):1076–1080. doi: 10.1378/chest.96.5.1076. [DOI] [PubMed] [Google Scholar]
- 978.Agarwal M, Mehta PK, Bairey Merz CN. Nonacute Coronary Syndrome Anginal Chest Pain. Med Clin North Am . 2010;94(2):201–216. doi: 10.1016/j.mcna.2010.01.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 979.Michaelides AP, Liakos CI, Antoniades C, Tsiachris DL, Soulis D, Dilaveris PE, et al. ST-segment depression in hyperventilation indicates a false positive exercise test in patients with mitral valve prolapse. Cardiol Res Pract . 2010;2010:1–7. doi: 10.4061/2010/541781. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 980.Basso C, Iliceto S, Thiene G, Perazzolo Marra M. Mitral Valve Prolapse, Ventricular Arrhythmias, and Sudden Death. Circulation . 2019;140(11):952–964. doi: 10.1161/CIRCULATIONAHA.118.034075. [DOI] [PubMed] [Google Scholar]
- 981.Crea F, Bairey Merz CN, Beltrame JF, Berry C, Camici PG, Kaski JC, et al. Mechanisms and diagnostic evaluation of persistent or recurrent angina following percutaneous coronary revascularization. Eur Heart J . 2019;40(29):2455–2462. doi: 10.1093/eurheartj/ehy857. [DOI] [PubMed] [Google Scholar]
- 982.Cho SW, Yang JH, Park TK, Lee JM, Song YB, Hahn JY, et al. Clinical Implications of Early Exercise Treadmill Testing after Percutaneous Coronary Intervention in the Drug-eluting Stent Era. J Korean Med Sci . 2020;35(27):e229. doi: 10.3346/jkms.2020.35.e229. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 983.Lawton JS, Tamis-Holland JE, Bangalore S, Bates ER, Beckie TM, Bischoff JM, et al. 2021 ACC/AHA/SCAI Guideline for Coronary Artery Revascularization. J Am Coll Cardiol . 2022;79(2):e21–129. doi: 10.1016/j.jacc.2021.09.006. [DOI] [PubMed] [Google Scholar]
- 984.Bradley SM, Hess E, Winchester DE, Sussman JB, Aggarwal V, Maddox TM, et al. Stress Testing After Percutaneous Coronary Intervention in the Veterans Affairs HealthCare System: Insights from the Veterans Affairs Clinical Assessment, Reporting, and Tracking Program. Circ Cardiovasc Qual Outcomes . 2015;8(5):486–492. doi: 10.1161/CIRCOUTCOMES.114.001561. [DOI] [PubMed] [Google Scholar]
- 985.Shah BR, Cowper PA, O'Brien SM, Jensen N, Drawz M, Patel MR, et al. Patterns of Cardiac Stress Testing After Revascularization in Community Practice. J Am Coll Cardiol . 2010;56(16):1328–1334. doi: 10.1016/j.jacc.2010.03.093. [DOI] [PubMed] [Google Scholar]
- 986.Park DW, Kang DY, Ahn JM, Yun SC, Yoon YH, Hur SH, et al. Routine Functional Testing or Standard Care in High-Risk Patients after PCI. N Engl J Med . 2022;387(10):905–915. doi: 10.1056/NEJMoa2208335. [DOI] [PubMed] [Google Scholar]
- 987.Valeur N. The prognostic value of pre-discharge exercise testing after myocardial infarction treated with either primary PCI or fibrinolysis: a DANAMI-2 sub-study. Eur Heart J . 2004;26(12):119–127. doi: 10.1093/eurheartj/ehi057. [DOI] [PubMed] [Google Scholar]
- 988.Mintale I, Zabunova M, Lurina D, Narbute I, Jegere S, Zakke I, et al. In: Advances. Electrocardiograms - Clinical Application . Millis R, editor, editor. InTech; 2012. The Role of Exercise Test After Percutaneous Coronary Intervention. internet. [DOI] [Google Scholar]
- 989.Wenaweser P, Surmely J-F, Windecker S, Roffi M, Togni M, Billinger M, et al. Prognostic Value of Early Exercise Testing After Coronary Stent Implantation. Am J Cardiol . 2008;101(6):807–811. doi: 10.1016/j.amjcard.2007.10.046. [DOI] [PubMed] [Google Scholar]
- 990.Milo M, Nerla R, Tarzia P, Infusino F, Battipaglia I, Sestito A, et al. Coronary microvascular dysfunction after elective percutaneous coronary intervention: Correlation with exercise stress test results. Int J Cardiol . 2013;168(1):121–125. doi: 10.1016/j.ijcard.2012.09.059. [DOI] [PubMed] [Google Scholar]
- 991.Brilakis ES, Rao SV, Banerjee S, Goldman S, Shunk KA, Holmes DR, et al. Percutaneous Coronary Intervention in Native Arteries Versus Bypass Grafts in Prior Coronary Artery Bypass Grafting Patients. JACC Cardiovasc Interv . 2011;4(8):844–850. doi: 10.1016/j.jcin.2011.03.018. [DOI] [PubMed] [Google Scholar]
- 992.Brilakis ES, O'Donnell CI, Penny W, Armstrong EJ, Tsai T, Maddox TM, et al. Percutaneous Coronary Intervention in Native Coronary Arteries Versus Bypass Grafts in Patients With Prior Coronary Artery Bypass Graft Surgery. JACC Cardiovasc Interv . 2016;9(9):884–893. doi: 10.1016/j.jcin.2016.01.034. [DOI] [PubMed] [Google Scholar]
- 993.Shah BR, McCoy LA, Federspiel JJ, Mudrick D, Cowper PA, Masoudi FA, et al. Use of Stress Testing and Diagnostic Catheterization After Coronary Stenting. J Am Coll Cardiol . 2013;62(5):439–446. doi: 10.1016/j.jacc.2013.02.093. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 994.Dori G, Denekamp Y, Fishman S, Bitterman H. Exercise stress testing, myocardial perfusion imaging and stress echocardiography for detecting restenosis after successful percutaneous transluminal coronary angioplasty: a review of performance. J Intern Med . 2003;253(3):253–262. doi: 10.1046/j.1365-2796.2003.01101.x. [DOI] [PubMed] [Google Scholar]
- 995.Izzo P, Macchi A, De Gennaro L, Gaglione A, Di Biase M, Brunetti ND. Recurrent angina after coronary angioplasty: mechanisms, diagnostic and therapeutic options. Eur Heart J Acute Cardiovasc Care . 2012;1(2):158–169. doi: 10.1177/2048872612449111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 996.Cook CM, Ahmad Y, Howard JP, Shun-Shin MJ, Sethi A, Clesham GJ, et al. Impact of Percutaneous Revascularization on Exercise Hemodynamics in Patients With Stable Coronary Disease. J Am Coll Cardiol . 2018;72(9):970–983. doi: 10.1016/j.jacc.2018.06.033. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 997.Monnink SHJ, Tio RA, Veeger NJGM, Amoroso G, van Boven AJ, van Gilst WH. Exercise-Induced Ischemia after Successful Percutaneous Coronary Intervention Is Related to Distal Coronary Endothelial Dysfunction. J Investig Med . 2003;51(4):221–226. doi: 10.1136/jim-51-04-23. [DOI] [PubMed] [Google Scholar]
- 998.Chin ASL, Goldman LE, Eisenberg MJ. Functional testing after coronary artery bypass graft surgery: a meta-analysis. Can J Cardiol . 2003;19(7):802–808. PMID:1281.364. [PubMed] [Google Scholar]
- 999.Chalela WA, Kreling JC, Falcão AM, Hueb W, Moffa PJ, Pereyra PLA, et al. Exercise stress testing before and after successful multivessel percutaneous transluminal coronary angioplasty. Braz J Med Biol Res . 2006;39(4):475–482. doi: 10.1590/S0100-879X2006000400007. [DOI] [PubMed] [Google Scholar]
- 1000.Efrati S, Cantor A, Goldfarb B, Ilia R. The Predictive Value of Exercise QRS Duration Changes for Post-PTCA Coronary Events. Ann Noninvasive Electrocardiol . 2003;8(1):60–67. doi: 10.1046/j.1542-474X.2003.08110.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1001. Priscila A, Kondo NN, Guillermo M, Gomes PR, Silva PF da . 2017. [DOI] [Google Scholar]
- 1002.Dhoot A, Liu S, Savu A, Cheema ZM, Welsh RC, Bainey KR, et al. Cardiac Stress Testing After Coronary Revascularization. Am J Cardiol . 2020;136:9–14. doi: 10.1016/j.amjcard.2020.08.051. [DOI] [PubMed] [Google Scholar]
- 1003.Mudrick DW, Shah BR, McCoy LA, Lytle BL, Masoudi FA, Federspiel JJ, et al. Patterns of Stress Testing and Diagnostic Catheterization After Coronary Stenting in 250 350 Medicare Beneficiaries. Circ Cardiovasc Imaging . 2013;6(1):11–19. doi: 10.1161/CIRCIMAGING.112.974121. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1004.Uchida A, Murad A, Chalela WA. Ergometria: Teoria e Prática . São Paulo: Editora Manole; 2012. 978-85.204.4450-7 [Google Scholar]
- 1005.Evans CH, White RD.editors . Exercise Stress Testing for Primary Care and Sports Medicine . New York, NY: 2009. [DOI] [Google Scholar]
- 1006.Visser FC, van Campen L, de Feyter PJ. Value and limitations of exercise stress testing to predict the functional results of coronary artery bypass grafting. Int J Card Imaging . 1993;9(Suppl 1):41–47. doi: 10.1007/BF01143145. [DOI] [PubMed] [Google Scholar]
- 1007.Ivert T, Holmgren A, Landou C. Exercise Tolerance Five Years after Coronary Bypass Surgery in Relation to Clinical and Angiographic Findings. Scand J Thorac Cardiovasc Surg . 1981;15(2):179–185. doi: 10.3109/14017438109101044. [DOI] [PubMed] [Google Scholar]
- 1008.Weiner DA, Ryan TJ, Parsons L, Fisher LD, Chaitman BR, Sheffield LT, et al. Prevalence and prognostic significance of silent and symptomatic ischemia after coronary bypass surgery: A report from the Coronary Artery Surgery Study (CASS) randomized population. J Am Coll Cardiol . 1991;18(2):343–348. doi: 10.1016/0735-1097(91)90584-v. https://doi.org/10.1016/0735-1097 (91)90584-V . [DOI] [PubMed] [Google Scholar]
- 1009.Gohlke H, Gohlke-Bärwolf C, Samek L, Stürzenofecker P, Schmuziger M, Roskamm H. Serial exercise testing up to 6 years after coronary bypass surgery: Behavior of exercise parameters in groups with different degrees of revascularization determined by postoperative angiography. Am J Cardiol . 1983;51(8):1301–1306. doi: 10.1016/0002-9149(83)90302-8. https://doi.org/10.1016/0002-9149 (83)90302-8 . [DOI] [PubMed] [Google Scholar]
- 1010.Oliveira M, Galrinho A, Rosário L, Cacela D, Ferreira R, Ferreira M, et al. [Significance of the exercise test in the assessment of graft patency after myocardial revascularization with arteries only] Rev Port Cardiol Orgao Of Soc Port Cardiol Port J Cardiol Off J Port Soc Cardiol . 1996;15(9):633–638. 611-612 PMID: 9081316. [PubMed] [Google Scholar]
- 1011.McArdle WD, Katch FI, Katch VL. Exercise physiology: nutrition, energy, and human performance . Eighth. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins; 2015. ISSN-13: 9781451191554. [Google Scholar]
- 1012.Ross R, Blair SN, Arena R, Church TS, Després J-P, Franklin BA, et al. Importance of Assessing Cardiorespiratory Fitness in Clinical Practice: A Case for Fitness as a Clinical Vital Sign: A Scientific Statement From the American Heart Association. Circulation . 2016;134(24):e653–e699. doi: 10.1161/CIR.0000000000000461. [DOI] [PubMed] [Google Scholar]
- 1013.Ganesananthan S, Rajkumar CA, Foley M, Thompson D, Nowbar AN, Seligman H, et al. Cardiopulmonary exercise testing and efficacy of percutaneous coronary intervention: a substudy of the ORBITA trial. Eur Heart J . 2022;43(33):3132–3145. doi: 10.1093/eurheartj/ehac260. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1014.Davies LC, Wensel R, Georgiadou P, Cicoira M, Coats AJS, Piepoli MF, et al. Enhanced prognostic value from cardiopulmonary exercise testing in chronic heart failure by non-linear analysis: oxygen uptake efficiency slope. Eur Heart J . 2006;27(6):684–690. doi: 10.1093/eurheartj/ehi672. [DOI] [PubMed] [Google Scholar]
- 1015.Pereira CA de C, Sato T, Rodrigues SC. Novos valores de referência para espirometria forçada em brasileiros adultos de raça branca. J Bras Pneumol . 2007;33(4):397–406. doi: 10.1590/S1806-37132007000400008. [DOI] [PubMed] [Google Scholar]
- 1016.Prata TA, Mancuzo E, Pereira CA de C, Miranda SS de, Sadigursky LV, Hirotsu C, et al. Spirometry reference values for Black adults in Brazil. J Bras Pneumol . 2018;44(6):449–455. doi: 10.1590/s1806-37562018000000082. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1017.Stanojevic S, Kaminsky DA, Miller MR, Thompson B, Aliverti A, Barjaktarevic I, et al. ERS/ATS technical standard on interpretive strategies for routine lung function tests. 2101499 Eur Respir J . 2022;60(1) doi: 10.1183/13993003.01499-2021. [DOI] [PubMed] [Google Scholar]
- 1018.Datta D, Normandin E, ZuWallack R. Cardiopulmonary exercise testing in the assessment of exertional dyspnea. Ann Thorac Med . 2015;10(2):77–86. doi: 10.4103/1817-1737.151438. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1019.Kano H, Koike A, Hoshimoto-Iwamoto M, Nagayama O, Sakurada K, Suzuki T, et al. Abnormal End-Tidal PO2and PCO2at the Anaerobic Threshold Correlate Well With Impaired Exercise Gas Exchange in Patients With Left Ventricular Dysfunction. Circ J . 2012;76(1):79–87. doi: 10.1253/circj.CJ-11-0599. [DOI] [PubMed] [Google Scholar]
- 1020.Matsumoto A, Itoh H, Eto Y, Kobayashi T, Kato M, Omata M, et al. End-tidal CO2 pressure decreases during exercise in cardiac patients. J Am Coll Cardiol . 2000;36(1):242–249. doi: 10.1016/s0735-1097(00)00702-6. https://doi.org/10.1016/S0735-1097 (00)00702-6 . [DOI] [PubMed] [Google Scholar]
- 1021.Mezzani A, Agostoni P, Cohen-Solal A, Corrà U, Jegier A, Kouidi E, et al. Standards for the use of cardiopulmonary exercise testing for the functional evaluation of cardiac patients: a report from the Exercise Physiology Section of the European Association for Cardiovascular Prevention and Rehabilitation. Eur J Cardiovasc Prev Rehabil . 2009;16(3):249–267. doi: 10.1097/HJR.0b013e32832914c8. [DOI] [PubMed] [Google Scholar]
- 1022.Sun X-G, Hansen JE, Oudiz RJ, Wasserman K. Gas Exchange Detection of Exercise-Induced Right-to-Left Shunt in Patients With Primary Pulmonary Hypertension. Circulation . 2002;105(1):54–60. doi: 10.1161/hc0102.101509. [DOI] [PubMed] [Google Scholar]
- 1023.Chaudhry S, Arena R, Wasserman K, Hansen JE, Lewis GD, Myers J, et al. Exercise-Induced Myocardial Ischemia Detected by Cardiopulmonary Exercise Testing. Am J Cardiol . 2009;103(5):615–619. doi: 10.1016/j.amjcard.2008.10.034. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1024.Belardinelli R. Exercise-induced myocardial ischaemia detected by cardiopulmonary exercise testing. Eur Heart J . 2003;24(14):1304–1313. doi: 10.1016/s0195-668x(03)00210-0. https://doi.org/10.1016/S0195-668X (03)00210-0 . [DOI] [PubMed] [Google Scholar]
- 1025.Ramos PS, Araújo CGS. Cardiorespiratory optimal point during exercise testing as a predictor of all-cause mortality. Rev Port Cardiol . 2017;36(4):261–269. doi: 10.1016/j.repc.2016.09.017. [DOI] [PubMed] [Google Scholar]
- 1026.Laukkanen JA, Kunutsor SK, Araújo CG, Savonen K. Cardiorespiratory optimal point during exercise testing is related to cardiovascular and all-cause mortality. Scand J Med Sci Sports . 2021;31(10):1949–1961. doi: 10.1111/sms.14012. [DOI] [PubMed] [Google Scholar]
- 1027.Hollenberg M, Tager IB. Oxygen uptake efficiency slope: an index of exercise performance and cardiopulmonary reserve requiring only submaximal exercise. J Am Coll Cardiol . 2000;36(1):194–201. doi: 10.1016/s0735-1097(00)00691-4. https://doi.org/10.1016/S0735-1097 (00)00691-4 . [DOI] [PubMed] [Google Scholar]
- 1028.Sun X-G, Hansen JE, Stringer WW. Oxygen uptake efficiency plateau: physiology and reference values. Eur J Appl Physiology . 2012;112(3):919–928. doi: 10.1007/s00421-011-2030-0. [DOI] [PubMed] [Google Scholar]
- 1029.Baba R, Kubo N, Morotome Y, Iwagaki S. Reproducibility of the oxygen uptake efficiency slope in normal healthy subjects. J Sports Med Phys Fitness . 1999;39(3):202–206. PMID: 10573661. [PubMed] [Google Scholar]
- 1030.Myers J, Arena R, Dewey F, Bensimhon D, Abella J, Hsu L, et al. A cardiopulmonary exercise testing score for predicting outcomes in patients with heart failure. Am Heart J . 2008;156(6):1177–1183. doi: 10.1016/j.ahj.2008.07.010. [DOI] [PubMed] [Google Scholar]
- 1031.Ritt LE, Myers J, Stein R, Arena R, Guazzi M, Chase P, et al. Additive prognostic value of a cardiopulmonary exercise test score in patients with heart failure and intermediate risk. Int J Cardiol . 2015;178:262–264. doi: 10.1016/j.ijcard.2014.10.025. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1032.Corrà U. Exercise oscillatory ventilation in heart failure. Int J Cardiol . 2016;206:S13–S15. doi: 10.1016/j.ijcard.2016.02.122. [DOI] [PubMed] [Google Scholar]
- 1033.Arena R, Myers J, Abella J, Peberdy MA, Pinkstaff S, Bensimhon D, et al. Prognostic Value of Timing and Duration Characteristics of Exercise Oscillatory Ventilation in Patients With Heart Failure. J Heart Lung Transplant . 2008;27(3):341–347. doi: 10.1016/j.healun.2007.11.574. [DOI] [PubMed] [Google Scholar]
- 1034.Agostoni P, Emdin M, De Martino F, Apostolo A, Masè M, Contini M, et al. Roles of periodic breathing and isocapnic buffering period during exercise in heart failure. Eur J Prev Cardiol . 2020;27(2_suppl):19–26. doi: 10.1177/2047487320952029. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1035.Laethem CV, De Sutter J, Peersman W, Calders P. Intratest reliability and test-retest reproducibility of the oxygen uptake efficiency slope in healthy participants. Eur J Cardiovasc Prev Rehabil . 2009;16(4):493–498. doi: 10.1097/HJR.0b013e32832c88a8. [DOI] [PubMed] [Google Scholar]
- 1036.Scrutinio D, Passantino A, Lagioia R, Napoli Francesco, Ricci A, Rizzon P. Percent achieved of predicted peak exercise oxygen uptake and kinetics of recovery of oxygen uptake after exercise for risk stratification in chronic heart failure. Int J Cardiol . 1998;64(2):117–124. doi: 10.1016/s0167-5273(98)00019-9. https://doi.org/10.1016/S0167-5273 (98)00019-9 . [DOI] [PubMed] [Google Scholar]
- 1037.Bailey CS, Wooster LT, Buswell M, Patel S, Pappagianopoulos PP, Bakken K, et al. Post-Exercise Oxygen Uptake Recovery Delay. JACC Heart Fail . 2018;6(4):329–339. doi: 10.1016/j.jchf.2018.01.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1038.Cohen-Solal A. A non-invasively determined surrogate of cardiac power ('circulatory power') at peak exercise is a powerful prognostic factor in chronic heart failure. Eur Heart J . 2002;23(10):806–814. doi: 10.1053/euhj.2001.2966. [DOI] [PubMed] [Google Scholar]
- 1039.Forman DE, Guazzi M, Myers J, Chase P, Bensimhon D, Cahalin LP, et al. Ventilatory Power: A Novel Index That Enhances Prognostic Assessment of Patients With Heart Failure. Circ Heart Fail . 2012;5(5):621–626. doi: 10.1161/CIRCHEARTFAILURE.112.968529. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1040.Loftin M, Sothern M, Warren B, Udall J. Comparison of VO2Peak during Treadmill and Cycle Ergometry in Severely Overweight Youth. J Sports Sci Med . 2004;3(4):554–560. PMID: 24624011; PMCID: PMC3938064. [PMC free article] [PubMed] [Google Scholar]
- 1041.Meyer K, Westbrook S, Schwaibold M, Hajric R, Peters K, Roskamm H. Short-term reproducibility of cardiopulmonary measurements during exercise testing in patients with severe chronic heart failure. Am Heart J . 1997;134(1):20–26. doi: 10.1016/s0002-8703(97)70102-9. https://doi.org/10.1016/S0002-8703 (97)70102-9 . [DOI] [PubMed] [Google Scholar]
- 1042.Grossman GB, Sellera CAC, Hossri CAC, Carreira LTF, Avanza AC, Albuquerque PF de, et al. Posicionamento do Departamento de Ergometria, Exercício, Cardiologia Nuclear e Reabilitação Cardiovascular (DERC/SBC) sobre a Atuação Médica em suas Áreas Durante a Pandemia por COVID-19. Arq Bras Cardiol . 2020;115(2):284–291. doi: 10.36660/abc.20200797. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1043.Coeckelberghs E, Buys R, Goetschalckx K, Pattyn N, Vanhees L, Cornelissen V. Test-Retest Reliability of Maximal and Submaximal Gas Exchange Variables in Patients With Coronary Artery Disease. J Cardiopulm Rehabil Prev . 2016;36(4):263–269. doi: 10.1097/HCR.0000000000000158. [DOI] [PubMed] [Google Scholar]
- 1044.Myers J, Voodi L, Umann T, Froelicher VF. A Survey of Exercise Testing: Methods, Utilization, Interpretation, and Safety in the VAHCS. J Cardpulm Rehabil . 2000;20(4):251–258. doi: 10.1097/00008483-200007000-00007. [DOI] [PubMed] [Google Scholar]
- 1045.Bacal F, Marcondes-Braga FG, Rohde LEP, Xavier JL, Júnior, Brito F de S, Moura LAZ, et al. 3a Diretriz Brasileira de Transplante Cardíaco. Arq Bras Cardiol . 2018;111(2):230–289. doi: 10.5935/abc.20180153. [DOI] [PubMed] [Google Scholar]
- 1046.Guimarães GV, Silva MSV da, d'Avila VM, Ferreira SMA, Silva CP, Bocchi EA. VO2 pico e inclinação VE/VCO2 na era dos betabloqueadores na insuficiência cardíaca: uma experiência brasileira. Arq Bras Cardiol . 2008;91(1):42–48. doi: 10.1590/S0066-782X2008001300007. [DOI] [Google Scholar]
- 1047.Mancini DM, Eisen H, Kussmaul W, Mull R, Edmunds LH, Wilson JR. Value of peak exercise oxygen consumption for optimal timing of cardiac transplantation in ambulatory patients with heart failure. Circulation . 1991;83(3):778–786. doi: 10.1161/01.CIR.83.3.778. [DOI] [PubMed] [Google Scholar]
- 1048.Francis D. Cardiopulmonary exercise testing for prognosis in chronic heart failure: continuous and independent prognostic value from VE/VCO2slope and peak VO2. Eur Heart J . 2000;21(2):154–161. doi: 10.1053/euhj.1999.1863. [DOI] [PubMed] [Google Scholar]
- 1049.Weber KT, Kinasewitz GT, Janicki JS, Fishman AP. Oxygen utilization and ventilation during exercise in patients with chronic cardiac failure. Circulation . 1982;65(6):1213–1223. doi: 10.1161/01.CIR.65.6.1213. [DOI] [PubMed] [Google Scholar]
- 1050.Arena R, Myers J, Aslam SS, Varughese EB, Peberdy MA. Peak VO2and VE/VCO2slope in patients with heart failure: a prognostic comparison. Am Heart J . 2004;147(2):354–360. doi: 10.1016/j.ahj.2003.07.014. [DOI] [PubMed] [Google Scholar]
- 1051.Gitt AK, Wasserman K, Kilkowski C, Kleemann T, Kilkowski A, Bangert M, et al. Exercise Anaerobic Threshold and Ventilatory Efficiency Identify Heart Failure Patients for High Risk of Early Death. Circulation . 2002;106(24):3079–3084. doi: 10.1161/01.CIR.0000041428.99427.06. [DOI] [PubMed] [Google Scholar]
- 1052.Dhakal BP, Lewis GD. Exercise oscillatory ventilation: Mechanisms and prognostic significance. World J Cardiol . 2016;8(3):258–266. doi: 10.4330/wjc.v8.i3.258. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1053.Arena R, Myers J, Abella J, Peberdy MA, Bensimhon D, Chase P, et al. Development of a Ventilatory Classification System in Patients With Heart Failure. Circulation . 2007;115(18):2410–2417. doi: 10.1161/CIRCULATIONAHA.107.686576. [DOI] [PubMed] [Google Scholar]
- 1054.Guazzi M, Raimondo R, Vicenzi M, Arena R, Proserpio C, Sarzi Braga S, et al. Exercise Oscillatory Ventilation May Predict Sudden Cardiac Death in Heart Failure Patients. J Am Coll Cardiol . 2007;50(4):299–308. doi: 10.1016/j.jacc.2007.03.042. [DOI] [PubMed] [Google Scholar]
- 1055.Arena R, Myers J, Abella J, Pinkstaff S, Peberdy MA, Bensimhon D, et al. Prognostic characteristics of heart rate recovery according to sex in patients with heart failure. Int J Cardiol . 2010;145(2):293–294. doi: 10.1016/j.ijcard.2009.09.562. [DOI] [PubMed] [Google Scholar]
- 1056.Lavie CJ, Milani RV, Mehra MR. Peak exercise oxygen pulse and prognosis in chronic heart failure. Am J Cardiol . 2004;93(5):588–593. doi: 10.1016/j.amjcard.2003.11.023. [DOI] [PubMed] [Google Scholar]
- 1057.Sinagra G, Carriere C, Clemenza F, Minà C, Bandera F, Zaffalon D, et al. Risk stratification in cardiomyopathy. Eur J Prev Cardiol . 2020;27(2_suppl):52–58. doi: 10.1177/2047487320961898. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1058.Burstein DS, Menachem JN, Opotowsky AR. Exercise testing for assessment of heart failure in adults with congenital heart disease. Heart Fail Rev . 2020;25(4):647–655. doi: 10.1007/s10741-019-09867-1. [DOI] [PubMed] [Google Scholar]
- 1059.Ferreira Reis J, Gonçalves A, Brás P, Moreira R, Pereira-da-Silva T, Timóteo AT, et al. The prognostic value of the cardiorespiratory optimal point during submaximal exercise testing in heart failure. Rev Port Cardiol . 2022;41(9):751–758. doi: 10.1016/j.repc.2021.06.023. [DOI] [PubMed] [Google Scholar]
- 1060.Van Laethem C, Bartunek J, Goethals M, Nellens P, Andries E, Vanderheyden M. Oxygen uptake efficiency slope, a new submaximal parameter in evaluating exercise capacity in chronic heart failure patients. Am Heart J . 2005;149(1):175–180. doi: 10.1016/j.ahj.2004.07.004. [DOI] [PubMed] [Google Scholar]
- 1061.Sun X-G, Hansen JE, Stringer WW. Oxygen Uptake Efficiency Plateau Best Predicts Early Death in Heart Failure. Chest . 2012;141(5):1284–1294. doi: 10.1378/chest.11-1270. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1062.Adachi H, Koike A, Niwa A, Sato A, Takamoto T, Marumo F, et al. Percutaneous Transluminal Coronary Angioplasty Improves Oxygen Uptake Kinetics During the Onset of Exercise in Patients With Coronary Artery Disease. Chest . 2000;118(2):329–335. doi: 10.1378/chest.118.2.329. [DOI] [PubMed] [Google Scholar]
- 1063.Barmeyer A, Meinertz T. Anaerobic Threshold and Maximal Oxygen Uptake in Patients with Coronary Artery Disease and Stable Angina before and after Percutaneous Transluminal Coronary Angioplasty. Cardiology . 2002;98(3):127–131. doi: 10.1159/000066320. [DOI] [PubMed] [Google Scholar]
- 1064.Klainman E, Fink G, Lebzelter J, Zafrir N. Assessment of Functional Results after Percutaneous Transluminal Coronary Angioplasty by Cardiopulmonary Exercise Test. Cardiology . 1998;89(4):257–262. doi: 10.1159/000006797. [DOI] [PubMed] [Google Scholar]
- 1065.Popovic D, Guazzi M, Jakovljevic DG, Lasica R, Banovic M, Ostojic M, et al. Quantification of coronary artery disease using different modalities of cardiopulmonary exercise testing. Int J Cardiol . 2019;285:11–13. doi: 10.1016/j.ijcard.2019.03.012. [DOI] [PubMed] [Google Scholar]
- 1066.Dominguez-Rodriguez A, Abreu-Gonzalez P, Gomez MA, Garcia-Baute M del C, Arroyo-Ucar E, Avanzas P, et al. Myocardial perfusion defects detected by cardiopulmonary exercise testing: Role of VE/VCO2 slope in patients with chest pain suspected of coronary artery disease. Int J Cardiol . 2012;155(3):470–471. doi: 10.1016/j.ijcard.2011.12.063. [DOI] [PubMed] [Google Scholar]
- 1067.Munhoz EC, Hollanda R, Vargas JP, Silveira CW, Lemos AL, Hollanda RMK, et al. Flattening of Oxygen Pulse during Exercise May Detect Extensive Myocardial Ischemia. Med Sci Sports Exerc . 2007;39(8):1221–1226. doi: 10.1249/mss.0b013e3180601136. [DOI] [PubMed] [Google Scholar]
- 1068.Belardinelli R, Lacalaprice F, Tiano L, Muçai A, Perna GP. Cardiopulmonary exercise testing is more accurate than ECG-stress testing in diagnosing myocardial ischemia in subjects with chest pain. Int J Cardiol . 2014;174(2):337–342. doi: 10.1016/j.ijcard.2014.04.102. [DOI] [PubMed] [Google Scholar]
- 1069.Kavanagh T, Mertens DJ, Hamm LF, Beyene J, Kennedy J, Corey P, et al. Peak oxygen intake and cardiac mortality in women referred for cardiac rehabilitation. J Am Coll Cardiol . 2003;42(12):2139–2143. doi: 10.1016/j.jacc.2003.07.028. [DOI] [PubMed] [Google Scholar]
- 1070.Kavanagh T, Mertens DJ, Hamm LF, Beyene J, Kennedy J, Corey P, et al. Prediction of Long-Term Prognosis in 12 169 Men Referred for Cardiac Rehabilitation. Circulation . 2002;106(6):666–671. doi: 10.1161/01.CIR.0000024413.15949.ED. [DOI] [PubMed] [Google Scholar]
- 1071.Li N, Liu J, Ren Y, Cheng J. Diagnostic value of the cardiopulmonary exercise test in coronary artery disease. J Thorac Dis . 2022;14(3):607–613. doi: 10.21037/jtd-22-24. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1072.Sorajja P, Allison T, Hayes C, Nishimura RA, Lam CSP, Ommen SR. Prognostic Utility of Metabolic Exercise Testing in Minimally Symptomatic Patients With Obstructive Hypertrophic Cardiomyopathy. Am J Cardiol . 2012;109(10):1494–1498. doi: 10.1016/j.amjcard.2012.01.363. [DOI] [PubMed] [Google Scholar]
- 1073.Masri A, Pierson LM, Smedira NG, Agarwal S, Lytle BW, Naji P, et al. Predictors of long-term outcomes in patients with hypertrophic cardiomyopathy undergoing cardiopulmonary stress testing and echocardiography. Am Heart J . 2015;169(5):684–692.e1. doi: 10.1016/j.ahj.2015.02.006. [DOI] [PubMed] [Google Scholar]
- 1074.Finocchiaro G, Haddad F, Knowles JW, Caleshu C, Pavlovic A, Homburger J, et al. Cardiopulmonary Responses and Prognosis in Hypertrophic Cardiomyopathy. JACC Heart Fail . 2015;3(5):408–418. doi: 10.1016/j.jchf.2014.11.011. [DOI] [PubMed] [Google Scholar]
- 1075.Rodrigues T, Raposo SC, Brito D, Lopes LR. Prognostic relevance of exercise testing in hypertrophic cardiomyopathy. A systematic review. Int J Cardiol . 2021;339:83–92. doi: 10.1016/j.ijcard.2021.06.051. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1076.Magrì D, Santolamazza C. Cardiopulmonary Exercise Test in Hypertrophic Cardiomyopathy. Ann Am Thorac Soc . 2017;14(Supplement_1):S102–S109. doi: 10.1513/AnnalsATS.201611-884FR. [DOI] [PubMed] [Google Scholar]
- 1077.Bayonas-Ruiz A, Muñoz-Franco FM, Ferrer V, Pérez-Caballero C, Sabater-Molina M, Tomé-Esteban MT, et al. Cardiopulmonary Exercise Test in Patients with Hypertrophic Cardiomyopathy: A Systematic Review and Meta-Analysis. 2312 J Clin Med . 2021;10(11) doi: 10.3390/jcm10112312. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1078.van Le D, Jensen GVH, Carstensen S, Kjøller-Hansen L. Cardiopulmonary Exercise Testing in Patients with Asymptomatic or Equivocal Symptomatic Aortic Stenosis: Feasibility, Reproducibility, Safety and Information Obtained on Exercise Physiology. Cardiology . 2016;133(3):147–156. doi: 10.1159/000441292. [DOI] [PubMed] [Google Scholar]
- 1079.Poirier P, Bastien M, Auclair A, Nadreau É, Clavel M-A, Pibarot P, et al. The Physiological Burden of the 6-Minute Walk Test Compared With Cardiopulmonary Exercise Stress Test in Patients With Severe Aortic Stenosis. CJC Open . 2021;3(6):769–777. doi: 10.1016/j.cjco.2021.02.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1080.Le VD, Jensen GV, Kjøller-Hansen L. Prognostic Usefulness of Cardiopulmonary Exercise Testing for Managing Patients With Severe Aortic Stenosis. Am J Cardiol . 2017;120(5):844–849. doi: 10.1016/j.amjcard.2017.05.047. [DOI] [PubMed] [Google Scholar]
- 1081.Arena R, Sietsema KE. Cardiopulmonary Exercise Testing in the Clinical Evaluation of Patients With Heart and Lung Disease. Circulation . 2011;123(6):668–680. doi: 10.1161/CIRCULATIONAHA.109.914788. [DOI] [PubMed] [Google Scholar]
- 1082.Zafar MA, Tsuang W, Lach L, Eschenbacher W, Panos RJ. Dynamic Hyperinflation Correlates with Exertional Oxygen Desaturation in Patients with Chronic Obstructive Pulmonary Disease. Lung . 2013;191(2):177–182. doi: 10.1007/s00408-012-9443-3. [DOI] [PubMed] [Google Scholar]
- 1083.Gille T, Laveneziana P. Cardiopulmonary exercise testing in interstitial lung diseases and the value of ventilatory efficiency. 200355 Eur Respir Rev . 2021;30(162) doi: 10.1183/16000617.0355-2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1084.The Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS) endorsed by the International Society of Heart and Lung Transplantation (ISHLT) Galie N, Hoeper MM, Humbert M, Torbicki A, Vachiery J-L, et al. Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Respir J . 2009;34(6):1219–1263. doi: 10.1183/09031936.00139009. [DOI] [PubMed] [Google Scholar]
- 1085.Kovacs G, Berghold A, Scheidl S, Olschewski H. Pulmonary arterial pressure during rest and exercise in healthy subjects: a systematic review. Eur Respir J . 2009;34(4):888–894. doi: 10.1183/09031936.00145608. [DOI] [PubMed] [Google Scholar]
- 1086.Pasnick SD, Carlos WG, Arunachalam A, Celestin FM, Parsons JP, Hallstrand TS, et al. Exercise-induced Bronchoconstriction. Ann Am Thorac Soc . 2014;11(10):1651–1652. doi: 10.1513/AnnalsATS.201409-427OT. [DOI] [PubMed] [Google Scholar]
- 1087.Bandera F, Generati G, Pellegrino M, Donghi V, Alfonzetti E, Gaeta M, et al. Role of Right Ventricle and Dynamic Pulmonary Hypertension on Determining ?VO2/?Work Rate Flattening: Insights From Cardiopulmonary Exercise Test Combined With Exercise Echocardiography. Circ Heart Fail . 2014;7(5):782–790. doi: 10.1161/CIRCHEARTFAILURE.113.001061. [DOI] [PubMed] [Google Scholar]
- 1088.Oudiz RJ, Midde R, Hovanesyan A, Sun X-G, Roveran G, Hansen JE, et al. Usefulness of Right-to-Left Shunting and Poor Exercise Gas Exchange for Predicting Prognosis in Patients With Pulmonary Arterial Hypertension. Am J Cardiol . 2010;105(8):1186–1191. doi: 10.1016/j.amjcard.2009.12.024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1089.Zhai Z, Murphy K, Tighe H, Wang C, Wilkins MR, Gibbs JSR, et al. Differences in Ventilatory Inefficiency Between Pulmonary Arterial Hypertension and Chronic Thromboembolic Pulmonary Hypertension. Chest . 2011;140(5):1284–1291. doi: 10.1378/chest.10-3357. [DOI] [PubMed] [Google Scholar]
- 1090.Deboeck G, Scoditti C, Huez S, Vachiéry J-L, Lamotte M, Sharples L, et al. Exercise testing to predict outcome in idiopathic versus associated pulmonary arterial hypertension. Eur Respir J . 2012;40(6):1410–1419. doi: 10.1183/09031936.00217911. [DOI] [PubMed] [Google Scholar]
- 1091.Wensel R, Opitz CF, Anker SD, Winkler J, Höffken G, Kleber FX, et al. Assessment of Survival in Patients With Primary Pulmonary Hypertension: Importance of Cardiopulmonary Exercise Testing. Circulation . 2002;106(3):319–324. doi: 10.1161/01.CIR.0000022687.18568.2A. [DOI] [PubMed] [Google Scholar]
- 1092.Yasunobu Y, Oudiz RJ, Sun X-G, Hansen JE, Wasserman K. End-tidal Pco2Abnormality and Exercise Limitation in Patients With Primary Pulmonary Hypertension. Chest . 2005;127(5):1637–1646. doi: 10.1378/chest.127.5.1637. [DOI] [PubMed] [Google Scholar]
- 1093.Deboeck G, Niset G, Lamotte M, Vachiéry J, Naeije R. Exercise testing in pulmonary arterial hypertension and in chronic heart failure. Eur Respir J . 2004;23(5):747–751. doi: 10.1183/09031936.04.00111904. [DOI] [PubMed] [Google Scholar]
- 1094.Jain CC, Borlaug BA. Performance and Interpretation of Invasive Hemodynamic Exercise Testing. Chest . 2020;158(5):2119–2129. doi: 10.1016/j.chest.2020.05.552. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1095.Yu-Wei Chiu, Wei-Chun Huang. Cardiopulmonary Exercise Test and Rehabilitation for Pulmonary Hypertension Patients. Acta Cardiol Sin . 2022;38(6):663–666. doi: 10.6515/ACS.202211_38. 6. 20220603A. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1096.Weatherald J, Farina S, Bruno N, Laveneziana P. Cardiopulmonary Exercise Testing in Pulmonary Hypertension. Ann Am Thorac Soc . 2017;14(Suppl 1):S84–S92. doi: 10.1513/AnnalsATS.201610-788FR. [DOI] [PubMed] [Google Scholar]
- 1097.Farina S, Correale M, Bruno N, Paolillo S, Salvioni E, Badagliacca R, et al. The role of cardiopulmonary exercise tests in pulmonary arterial hypertension. Eur Respir Rev . 2018;27(148):170134. doi: 10.1183/16000617.0134-2017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1098.Paolillo S, Farina S, Bussotti M, Iorio A, Filardi PP, Piepoli MF, et al. Exercise testing in the clinical management of patients affected by pulmonary arterial hypertension. Eur J Prev Cardiol . 2012;19(5):960–971. doi: 10.1177/1741826711426635. [DOI] [PubMed] [Google Scholar]
- 1099.Stringer WW. Cardiopulmonary exercise testing: current applications. Expert Rev Respir Med . 2010;4(2):179–188. doi: 10.1586/ers.10.8. [DOI] [PubMed] [Google Scholar]
- 1100.Plantier L, Delclaux C. Increased physiological dead space at exercise is a marker of mild pulmonary or cardiovascular disease in dyspneic subjects. 1492842 Eur Clin Respir J . 2018;5(1) doi: 10.1080/20018525.2018.1492842. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1101.Barron A, Francis DP, Mayet J, Ewert R, Obst A, Mason M, et al. Oxygen Uptake Efficiency Slope and Breathing Reserve, Not Anaerobic Threshold, Discriminate Between Patients With Cardiovascular Disease Over Chronic Obstructive Pulmonary Disease. JACC Heart Fail . 2016;4(4):252–261. doi: 10.1016/j.jchf.2015.11.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1102.Marcondes-Braga FG, Moura LAZ, Issa VS, Vieira JL, Rohde LE, Simões MV, et al. Atualização de Tópicos Emergentes da Diretriz Brasileira de Insuficiência Cardíaca - 2021. Arq Bras Cardiol . 2021;116(6):1174–1212. doi: 10.36660/abc.20210367. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1103.Corrà U, Agostoni PG, Anker SD, Coats AJS, Crespo Leiro MG, de Boer RA, et al. Role of cardiopulmonary exercise testing in clinical stratification in heart failure. A position paper from the Committee on Exercise Physiology and Training of the Heart Failure Association of the European Society of Cardiology: Cardiopulmonary exercise testing and prognosis in HF. Eur J Heart Fail . 2018;20(1):3–15. doi: 10.1002/ejhf.979. [DOI] [PubMed] [Google Scholar]
- 1104.Hall A, Thomas M, Sandhu G, Hull JH. Exercise-induced laryngeal obstruction: a common and overlooked cause of exertional breathlessness. Br J Gen Pract . 2016;66(650):e683–e685. doi: 10.3399/bjgp16X687001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1105.Short KR, Sedlock DA. Excess postexercise oxygen consumption and recovery rate in trained and untrained subjects. J Appl Physiology . 1997;83(1):153–159. doi: 10.1152/jappl.1997.83.1.153. [DOI] [PubMed] [Google Scholar]
- 1106.Djokovic D, Nikolic M, Muric N, Nedeljkovic I, Simovic S, Novkovic L, et al. Cardiopulmonary Exercise Test in the Detection of Unexplained Post-COVID-19 Dyspnea: A Case Report. Int Heart J . 2021;62(5):1164–1170. doi: 10.1536/ihj.21-069. [DOI] [PubMed] [Google Scholar]
- 1107.Sonnweber T, Sahanic S, Pizzini A, Luger A, Schwabl C, Sonnweber B, et al. Cardiopulmonary recovery after COVID-19: an observational prospective multicentre trial. 2003481 Eur Respir J . 2021;57(4) doi: 10.1183/13993003.03481-2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1108.Herdy AH, Ritt LEF, Stein R, Araújo CGS de, Milani M, Meneghelo RS, et al. Cardiopulmonary Exercise Test: Fundamentals, Applicability and Interpretation. Arq Bras Cardiol . 2016;107(5):467–481. doi: 10.5935/abc.20160171. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1109.Kim C, Kwok YS, Heagerty P, Redberg R. Pharmacologic stress testing for coronary disease diagnosis: A meta-analysis. Am Heart J . 2001;142:934–944. doi: 10.1067/mhj.2001.119761. [DOI] [PubMed] [Google Scholar]
- 1110.Chalela WA, Moffa PJ, Meneghetti JC. Estresse cardiovascular: princípios e aplicações clínicas . São Paulo, SP: Roca; 2004. 8572415130 [Google Scholar]
- 1111.Henzlova MJ, Duvall WL, Einstein AJ, Travin MI, Verberne HJ. ASNC imaging guidelines for SPECT nuclear cardiology procedures: Stress, protocols, and tracers. J Nucl Cardiol . 2016;23(3):606–639. doi: 10.1007/s12350-015-0387-x. [DOI] [PubMed] [Google Scholar]
- 1112.Al Moudi M, Sun Z, Lenzo N. Diagnostic value of SPECT, PET and PET/CT in the diagnosis of coronary artery disease: A systematic review. Biomed Imaging Interv J . 2011;7(2):e9. doi: 10.2349/biij.7.2.e9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1113.Mahmarian JJ, Shaw LJ, Filipchuk NG, Dakik HA, Iskander SS, Ruddy TD, et al. A Multinational Study to Establish the Value of Early Adenosine Technetium-99m Sestamibi Myocardial Perfusion Imaging in Identifying a Low-Risk Group for Early Hospital Discharge After Acute Myocardial Infarction. J Am Coll Cardiol . 2006;48(12):2448–2457. doi: 10.1016/j.jacc.2006.07.069. [DOI] [PubMed] [Google Scholar]
- 1114.Cerci MSJ, Cerci JJ, Cerci RJ, Cunha Pereira C, Neto, Trindade E, Delbeke D, et al. Myocardial Perfusion Imaging Is a Strong Predictor of Death in Women. JACC Cardiovasc Imaging . 2011;4(8):880–888. doi: 10.1016/j.jcmg.2011.06.009. [DOI] [PubMed] [Google Scholar]
- 1115.Dilsizian V, Gewirtz H, Paivanas N, Kitsiou AN, Hage FG, Crone NE, et al. Serious and potentially life threatening complications of cardiac stress testing: Physiological mechanisms and management strategies. J Nucl Cardiol . 2015;22(6):1198–1213. doi: 10.1007/s12350-015-0141-4. [DOI] [PubMed] [Google Scholar]
- 1116.Geleijnse ML, Elhendy A, Fioretti PM, Roelandt JRTC. Dobutamine stress myocardial perfusion imaging. J Am Coll Cardiol . 2000;36(7):2017–2027. doi: 10.1016/s0735-1097(00)01012-3. https://doi.org/10.1016/S0735-1097 (00)01012-3 . [DOI] [PubMed] [Google Scholar]
- 1117.Issa A, De Lorenzo A, Oliveira B, Pellini M, Lima R. Comparison between accelerated and conventional dobutamine stress protocols for myocardial perfusion scintigraphy. Int J Cardiovasc Imaging . 2012;28(7):1823–1828. doi: 10.1007/s10554-011-0002-4. [DOI] [PubMed] [Google Scholar]
- 1118.Vitola J. Exercise supplementation to dipyridamole prevents hypotension, improves electrocardiogram sensitivity, and increases heart-to-liver activity ratio on Tc- 99 m sestamibi imaging. J Nucl Cardiol . 2001;8(6):652–659. doi: 10.1067/mnc.2001.117204. [DOI] [PubMed] [Google Scholar]
- 1119.Iskandrian A, Bateman T, Belardinelli L, Blackburn B, Cerqueira M, Hendel R, et al. Adenosine versus regadenoson comparative evaluation in myocardial perfusion imaging: Results of the ADVANCE phase 3 multicenter international trial. J Nucl Cardiol . 2007;14(5):645–658. doi: 10.1016/j.nuclcard.2007.06.114. [DOI] [PubMed] [Google Scholar]
- 1120.Thomas G, Tammelin B, Schiffman G, Marquez R, Rice D, Milikien D, et al. Safety of regadenoson, a selective adenosine A2A agonist, in patients with chronic obstructive pulmonary disease: A randomized, double-blind, placebo-controlled trial (RegCOPD trial) J Nucl Cardiol . 2008;15(3):319–328. doi: 10.1016/j.nuclcard.2008.02.013. [DOI] [PubMed] [Google Scholar]
- 1121.Morhy SS, Barberato SH, Lianza AC, Soares AM, Leal GN, Rivera IR, et al. Posicionamento sobre Indicações da Ecocardiografia em Cardiologia Fetal, Pediátrica e Cardiopatias Congênitas do Adulto - 2020. Arq Bras Cardiol . 2020;115(5):987–1005. doi: 10.36660/abc.20201122. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1122.Silva CES, Tasca R, Weitzel LH, Moisés VA, Ferreira LDC, Tavares GMP, et al. Normatização dos Equipamentos e Técnicas de Exame para Realização de Exames Ecocardiográficos. Arq Bras Cardiol . 2004;82(supl 2) doi: 10.1590/S0066-782X2004000800001. [DOI] [PubMed] [Google Scholar]
- 1123.Neskovic AN, Flashskampf FA. Stress echocardiography essential guide and DVD . New York: CRC Press; 2009. 192p. ISBN-13: 9780415422246. [Google Scholar]
- 1124.Mattoso AAA, Tsutsui JM, Kowatsch I, Cruz VYL, Sbano JCN, Ribeiro HB, et al. Prognostic value of dobutamine stress myocardial perfusion echocardiography in patients with known or suspected coronary artery disease and normal left ventricular function. Plos One . 2017;12(12):e0172280. doi: 10.1371/journal.pone.0172280. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1125.Pingitore A, Picano E, Colosso MQ, Reisenhofer B, Gigli G, Lucarini AR, et al. The atropine factor in pharmacologic stress echocardiography. J Am Coll Cardiol . 1996;27(5):1164–1170. doi: 10.1016/0735-1097(95)00586-2. https://doi.org/10.1016/0735-1097 (95)00586-2 . [DOI] [PubMed] [Google Scholar]
- 1126.Picano E, Molinaro S, Pasanisi E. The diagnostic accuracy of pharmacological stress echocardiography for the assessment of coronary artery disease: a meta-analysis. Cardiovasc Ultrasound . 2008;6 doi: 10.1186/1476-7120-6-30. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 1127.Picano E, Bedetti G, Varga A, Cseh E. The comparable diagnostic accuracies of dobutamine-stress and dipyridamole-stress echocardiographies: a meta-analysis. Coron Artery Dis . 2000;11(12):151–159. doi: 10.1097/00019501-200003000-00010. [DOI] [PubMed] [Google Scholar]
- 1128.Porter TR, Mulvagh SL, Abdelmoneim SS, Becher H, Belcik JT, Bierig M, et al. Clinical Applications of Ultrasonic Enhancing Agents in Echocardiography: 2018 American Society of Echocardiography Guidelines Update. J Am Soc Echocardiogr . 2018;31(3):241–274. doi: 10.1016/j.echo.2017.11.013. [DOI] [PubMed] [Google Scholar]
- 1129.Conselho Federal de Medicina Resolução No 2.217, de 27 de setembro de 2018. Aprova o Código de Ética Médica . https://sistemas.cfm.org.br/normas/visualizar/resolucoes/BR/2018/2217 . [Google Scholar]
- 1130.Conselho Federal de Medicina . Diário Oficial da União . Brasília: Sep 13, 2023. Resolução CFM No 2.336/2023. Dispõe sobre publicidade e propaganda médicas. Edição: 175. Seção: 1. Página: 312. [Google Scholar]
- 1131.Brasil. Presidência da República . Diário Oficial da União . Brasília: Jan 10, 2002. Lei No 10.406/2002 - Institui o Código Civil. [Google Scholar]
- 1132.Brasil. Presidência da República . Diário Oficial da União . Brasília: 09=?? 11, 1990. Lei No 8.078/1990 - Dispõe sobre a proteção do consumidor e dá outras providências. Código de Defesa do Consumidor (CDC) [Google Scholar]