Abstract
目的
分析枯草杆菌二联活菌肠溶胶囊(LCBE)对2型糖尿病合并昼夜节律紊乱糖脂代谢的影响以及作用机制。
方法
将KM小鼠随机分为3组,正常组8只,给予正常饲料喂养,高脂组8只,给予高脂饲料喂养,节律干预组16只,给予节律干预和高脂喂养,8 周后给予链脲佐菌素100 mg/kg腹腔注射,将节律干预糖尿病造模成功的小鼠随机分为2组,灌胃干预的2型糖尿病合并昼夜节律紊乱组(n=8)和2型糖尿病合并昼夜节律紊乱对照组(n=8),给予灌胃干预组225 mg/kg的LCBE灌胃干预,其余3组给予等体积的生理盐水,持续8 周。使用鱼跃血糖仪测小鼠血糖,ELISA法检测Bmal 1、PER 2、胰岛素、C肽和血脂水平,HE染色观察小鼠结肠变化,油红O染色观察对肝脏脂代谢的影响,液相色谱-质谱法检测粪便短链脂肪酸的水平,qPCR和Western blotting法检测小鼠GPR43和GLP-1基因及蛋白表达情况。
结果
与CRD-DM组比较,LCBE-CRD-DM组体质量、周期节律调节因子2(PER2)、胰岛素、C肽、T-CHO、TC和LDL-C水平明显下降(P<0.001),Bmal 1和HDL-C水平明显升高(P<0.001);灌胃干预后,LCBE-CRD-DM组短链脂肪酸、GPR43和GLP-1基因和蛋白表达水平明显高于CRD-DM组(P<0.001)。
结论
LCBE能够降低节律紊乱2型糖尿病的体质量,改善小鼠的血脂水平,LCBE对节律紊乱2型糖尿病小鼠糖脂代谢的影响可能与SCFAs/GPR43/GLP-1通路有关。
Keywords: 2型糖尿病, 昼夜节律, 枯草杆菌二联活菌肠溶胶囊, 短链脂肪酸, 糖脂代谢
Abstract
Objective
To investigate the effects of live combined Bacillus subtilis and Enterococcus faecium (LCBE) on glucose and lipid metabolism in mice with type 2 diabetes mellitus (T2DM) and circadian rhythm disorder (CRD) and explore the possible mechanisms.
Methods
KM mice were randomized into normal diet (ND) group (n=8), high-fat diet (HFD) group (n=8), and rhythm-intervention with HFD group (n=16). After 8 weeks of feeding, the mice were given an intraperitoneal injection of streptozotocin (100 mg/kg) to induce T2DM. The mice in CRD-T2DM group were further randomized into two equal groups for treatment with LCBE (225 mg/kg) or saline by gavage; the mice in ND and HFD groups also received saline gavage for 8 weeks. Blood glucose level of the mice was measured using a glucometer, and serum levels of Bmal1, PER2, insulin, C-peptide and lipids were determined with ELISA. Colon morphology and hepatic lipid metabolism of the mice were examined using HE staining and Oil Red O staining, respectively, and fecal short-chain fatty acids (SCFAs) was detected using LC-MS; GPR43 and GLP-1 expression levels were analyzed using RT-qPCR and Western blotting.
Results
Compared with those in CRD-T2DM group, the LCBE-treated mice exhibited significant body weight loss, lowered levels of PER2, insulin, C-peptide, total cholesterol (TC) and LDL-C, and increased levels of Bmal1 and HDL-C levels. LCBE treatment significantly increased SCFAs, upregulated GPR43 and GLP-1 expressions at both the mRNA and protein levels, and improved hepatic steatosis and colon histology.
Conclusion
LCBE ameliorates lipid metabolism disorder in CRD-T2DM mice by reducing body weight and improving lipid profiles and circadian regulators possibly via the SCFAs/GPR43/GLP-1 pathway.
Keywords: type 2 diabetes mellitus, circadian rhythm, live combined Bacillus subtilis and Enterococcus faecium , short-chain fatty acids, glucolipid metabolism
2型糖尿病是一种常见的慢性代谢性疾病[1],全球范围内患病率持续上升,预计到2030年糖尿病患者人数将增至6.43亿[2]。糖尿病及其并发症给患者带来了沉重的心理和经济负担,因此其治疗和管理成为研究热点[3-5]。
昼夜节律和肠道菌群在2型糖尿病(T2DM)的发病机制中发挥着重要作用[6-8]。昼夜节律通过调控代谢相关基因的表达,影响胰岛素敏感性和葡萄糖代谢;而肠道菌群则通过产生短链脂肪酸(SCFAs)等代谢产物,调节宿主的胰岛素敏感性和能量代谢[9-13]。研究表明,昼夜节律紊乱可导致糖耐量异常和胰岛素分泌节律的改变[14-18],而肠道菌群失调则与2型糖尿病的发生和发展密切相关[9-11, 19]。流行病学调查进一步支持了这一关联,发现轮班工作与2型糖尿病的发病率显著相关。与未经历轮班工作的人群相比,轮班工作者患2型糖尿病的风险增加约9%[20-23]。此外,倒班工作还与2型糖尿病患者的血糖控制恶化显著相关,倒班工作者的糖化血红蛋白(HbA1c)水平较日间工作者平均升高0.2%~0.3%[24, 25]。然而,尽管已有研究揭示了昼夜节律和肠道菌群在2型糖尿病中的独立作用,关于昼夜节律-肠道菌群-代谢紊乱三者之间的相互作用机制尚未完全阐明[26-30],目前缺乏系统性研究验证益生菌干预对2型糖尿病合并昼夜节律紊乱的治疗效果,这为未来的研究方向提供了重要启示。
本研究首次将昼夜节律紊乱作为中介变量,结合益生菌干预,探索肠道菌群调节昼夜节律紊乱的新机制,并通过动物实验验证LCBE对2型糖尿病合并昼夜节律紊乱的治疗效果。研究旨在探讨LCBE对2型糖尿病合并昼夜节律紊乱小鼠糖脂代谢的影响,并分析其可能的作用机制,为肠道益生菌对2型糖尿病合并昼夜节律紊乱的治疗提供新的理论依据。
1. 材料和方法
1.1. 实验材料
1.1.1. 实验动物
4周龄SPF级KM小鼠(北京维通利华实验动物技术有限公司),许可证号SYXK(冀)2023-001。饲养于河北工程大学附属医院中心实验室SPF级动物饲养中心。本研究经河北工程大学附属医院医学伦理委员会审核批准(伦理批号:IACUC-Hebeu-2023-0033)。
1.1.2. 药物与试剂
LCBE(枯草杆菌二联活菌肠溶胶囊,北京韩美有限责任公司)。普通饲料与高脂饲料(北京华阜康生物科技股份有限公司);链脲佐菌素(STZ,邯郸市西丹贸易有限公司);小鼠胰岛素ELISA试剂盒、小鼠C肽ELISA试剂盒、小鼠芳香烃受体核转位因子样蛋白ELISA试剂盒和小鼠昼夜节律蛋白2 ELISA试剂盒(上海茁彩生物科技有限公司);小鼠总胆固醇测定试剂盒、三甘油三酯测定试剂盒、低密度脂蛋白胆固醇测定试剂盒和高密度脂蛋白胆固醇测定试剂盒(南京建成生物工程研究所);qPCR相关试剂(上海圣尔科技有限公司);BCA蛋白定量试剂盒(碧云天);GPR43抗体(Affinity Biosciences,1∶2000)。
1.1.3. 实验仪器
血糖仪(鱼跃);分析天平(梅特勒-托利多);离心机(西格玛);酶标仪(伯腾);冷冻切片机(徕卡);岛津高效液相色谱仪(LC-2050C 3D);色谱柱:资生堂(CAPCELL PAK C18 MGII 250×4.6 mm,5 μm);电泳仪(伯乐)。
1.2. 实验方法
1.2.1. 模型建立
雄性KM小鼠,适应性喂养1周后,按体质量随机分为节律干预组、高脂组和空白组。空白组和高脂组整个试验间在正常光照条件(光照:8∶00~20∶00,黑暗:20∶00~8∶00)下饲喂;节律干预组小鼠采用轮回颠倒的光照周期暴露,即在造模第1~3天的光照条件为(黑暗:8∶00~20∶00,光照:20∶00~8∶00),在第4~6天调整光照条件为(光照:8∶00~20∶00,黑暗:20∶00~8∶00),同时在光照时间进行小鼠睡眠剥夺仪进行睡眠剥夺,6 d为一轮回。空白组给予普通饲料连续喂养8 周后。节律干预组和高脂组给予高脂饲料持续喂养8 周,按照100 mg/kg腹腔注射STZ柠檬酸钠缓冲液(pH=4.5),连续3次空腹血糖≥16.9 mmol/L,表明造模成功。
1.2.2. 分组与给药
将造模成功的节律干预的糖尿病小鼠随机分为2组,CRD-DM:2型糖尿病组合并昼夜节律紊乱组和LCBE-CRD-DM:LCBE灌胃2型糖尿病组合并昼夜节律紊乱组;继续给予节律干预。LCBE-CRD-DM组(n=8)给予LCBE 225 mg/kg[31],溶于生理盐水中,空白对照组(NC)(n=8)、糖尿病对照组(DM)(n=8)和2型糖尿病组合并昼夜节律紊乱组(CRD-DM)(n=8)给予等体积的生理盐水灌胃。连续灌胃8 周。
1.2.3. 糖耐量测定
小鼠灌胃8周后,进行葡萄糖耐量实验。将小鼠禁食过夜(12 h),自由饮水。按照2 g/kg的剂量给小鼠灌胃葡萄糖溶液。检测灌胃后的0、15、30、60、120 min小鼠血糖水平,并绘制血糖变化曲线。
1.2.4. 小鼠血清生化指标测定
末次给药后,所有小鼠禁食不禁水12 h,麻醉后,小鼠心脏取血,4 ℃沉降过夜,3000 r/min离心10 min,取上清。按照ELISA试剂盒说明测定各组小鼠的血脂生化指标TC、TG、LDL-C、HDL-C水平,同时检测小鼠INS、C肽和脑与肌肉芳基碳氢受体核转位蛋白样1(Bmal-1)、周期节律调节因子2(PER2)水平。
1.2.5. 结肠HE染色
处死小鼠后,快速收集各组小鼠结肠组织,剪去多余的脂肪组织,用PBS冲洗结肠,滤纸擦干后放入10%中性固定液中固定。将固定好的结肠组织进行预处理、苏木素染色、伊红染色、脱水封片等步骤,最后用光学显微镜和图像采集分析结果,观察病理改变。
1.2.6. 肝脏油红O染色
处死小鼠后,快速收集小鼠肝脏组织,修剪肝脏组织,肝脏油红O染色,取小鼠肝脏组织,需10%中性固定液中固定24 h。经切片染色等处理后,电镜下观察油红O染色结果。
1.2.7. 短链脂肪酸含量检测
取50 mg粪便样本,解冻后加入溶解液及提取液,涡旋混匀后置于40 ℃反应1 h,待反应完成后,离心15 min,取上清进行液相色谱-质谱检测。
1.2.8. qPCR测定小鼠结肠GPR43和GLP-1基因表达水平
所选基因引物由生工合成,表1为用于qPCR分析选定的引物序列。使用RNA提取试剂盒进行总RNA提取,测定RNA浓度后使用反转录试剂盒进行反转录,从RNA合成cDNA。qPCR扩增采用三步法,采用2-ΔΔCT方法计算相对表达量。整个实验设置3个生物重复和3个技术重复。
表1.
GPR43/GLP-1通路基因的引物序列
Tab. 1 Primer sequences for genes in the GPR43/GLP-1 pathway
| Primer name | Primer sequence (5' to3') | |
|---|---|---|
| Forward primer | Reverse primer | |
| GPR43 | CTTCTTTCTTGGCAATTACTGGC | CCGAAATGGTCAGGTTTAGCAA |
| GCG | AAGAGGAACCGGAACAACATTG | GCCCTCCAAGTAAGAACTCACA |
| GAPDH | AGGTCGGTGTGAACGGATTTG | TGTAGACCATGTAGTTGAGGTCA |
1.2.9. Western blotting法测小鼠结肠GPR43和GLP-1蛋白表达水平
取结肠组织样品20 mg,加入组织裂解液200 μL,提取蛋白。BCA法测定样本蛋白浓度。制胶并电泳、转膜、封闭、孵育一抗,(GPR43、GLP-1稀释比例为1∶3500,β-actin稀释比例1∶30 000,4℃孵育过夜),洗膜,孵育二抗(1∶2000),洗膜后滴加显影液(1∶1)并置于化学发光仪中显影成像。以β-actin为内参,使用ImageJ分析并计算各蛋白灰度值。
1.3. 统计学分析
采用GraphPad Prism 8.0.2软件对实验数据进行处理分析,数据以均数±标准差表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析;P<0.05为差异具有统计学意义。
2. 结果
2.1. 昼夜节律紊乱模型验证
经过小鼠睡眠剥夺干预后,高脂饮食+昼夜节律干预组小鼠的Bmal 1水平低于空白组和高脂饮食组(P<0.05),而PER 2水平高于空白组和高脂饮食组(P<0.05)。
图1.

小鼠节律因子水平
Fig. 1 Levels of rhythmic factors in different groups. A: Level of Bmal 1 in the mice. B: Level of Per 2 in the mice. *P<0.05 vs NC.
2.2. 各组小鼠体质量及糖耐量比较
经过灌胃干预,LCBE-CRD-DM组小鼠体质量呈下降趋势,与DM组相比差异具有统计学意义(P<0.001,图2)。此外,LCBE-CRD-DM组小鼠体质量低于CRD-DM组小鼠。灌胃干预8周后,LCBE-CRD-DM组在0、15、30、60和120 min的血糖水平均低于CRD-DM组(P<0.001)和DM组(P<0.001),高于NC组(P<0.001,图3)。
图2.
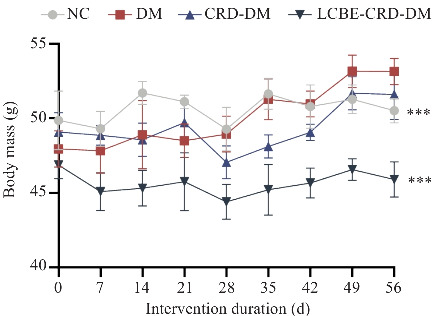
小鼠体质量变化趋势图
Fig. 2 Trends of body mass changes of the mice. ***P<0.001 vs DM group.
图3.

小鼠糖耐量曲线
Fig.3 Glucose tolerance curves in different groups. **P<0.01, ***P<0.001 vs CRD-DM group.
2.3. 各组小鼠血液生化结果比较
2.3.1. 各组小鼠节律因子比较
与NC组相比,DM组、CRD-DM组和LCBE-CRD-DM组Bmal-1水平明降低(P<0.001),且LCBE-CRD-DM组的Bmal-1水平高于DM组和CRD-DM组(P<0.001)。此外,相较于NC组,DM组、CRD-DM组和LCBE-CRD-DM组PER 2水平升高(P<0.001),且LCBE-CRD-DM组PER 2水平低于DM组(P=0.021)和CRD-DM组(P<0.001)。DM组Bmal-1、PER 2水平与NC组有差异(P<0.001,图4)。
图4.

各组小鼠节律因子水平
Fig. 4 Levels of rhythmic factors in the mice in each group. A: Level of Bmal 1 in the mice. B: Level of Per 2 in the mice. **P<0.001 vs NC group; ## P<0.001.
2.3.2. 各组小鼠胰岛素和C肽水平比较
经过灌胃干预,相较于NC组,DM组和CRD-DM组胰岛素和C肽水平升高(P<0.001),而LCBE-CRD-DM组胰岛素和C肽的水平与NC组差异无统计学意义(P=0.998,图5)
图5.

各组小鼠胰岛素和C肽水平
Fig. 5 Insulin (A) and C-peptide (B) levels of the mice in each group. **P<0.001 vs NC group; ## P<0.001.
2.3.3. 各组小鼠血脂水平比较
经过灌胃干预,与NC组比较,DM组、CRD-DM组和LCBE-CRD-DM组总胆固醇(T-CHO)、甘油三酯(TG)和低密度脂蛋白胆固醇(LDL-C)水平均升高(P<0.001),高密度脂蛋白胆固醇(HDL-C)水平降低(P<0.001)。此外,与DM组和CRD-DM组比较,LCBE-CRD-DM组的T-CHO、TG和LDL-C均下降(P<0.001),而LCBE-CRD-DM组的HDL-C水平相对于DM组(P=0.001)和CRD-DM组(P<0.001,图6)升高。
图6.

各组小鼠血脂水平比较
Fig.6 Comparison of lipid levels among the groups. A: Total cholesterol levels of the mice in each group. B: Triglyceride levels of the mice in each group. C: Low-density lipoprotein cholesterol levels of the mice in each group. D: High-density lipoprotein cholesterol levels of the mice in each group. **P<0.001 vs NC group; ## P<0.001.
2.4. 各组小鼠结肠HE染色结果比较
经过灌胃干预后,在NC组小鼠结肠组织中,腺体结构完整,排列整齐,形态规则,且上皮组织完整,隐窝深度较深。相比之下,DM组由于长期的高脂干预,表现出杯状细胞减少,腺体排列轻度紊乱,肠道黏膜由少量炎症细胞浸润。CRD-DM组在长期的高脂及节律干预的环境下,肠道黏膜炎症细胞浸润显著增加,腺体结构紊乱加重,杯状细胞减少,隐窝深度明显变浅。与之相比,LCBE-CRD-DM组结肠隐窝深度及杯状细胞数目显著增多,上皮较为完整,腺体排列胶CRD-DM组相比更为整齐(图7)。
图7.

各组结肠HE染色结果比较
Fig. 7 HE staining of the colon tissue in each group.
2.5. 各组小鼠肝脏油红O染色结果比较
在NC组中,脂类沉积相对较少,图中红色染色斑点(脂滴)数量较少,且呈现较为分散的分布形式,表明正常条件下脂类堆积较少,脂质代谢较为平衡。相比之下,DM组脂质沉积增加,红色脂滴的面积和数量均明显高于NC组。CRD-DM组的脂质沉积依然显著,红色脂滴数量较多且分布广泛;LCBE-CRD-DM组的脂质沉积状况有所改善,红色脂滴数量相比CRD-DM组有所减少,提示其对脂质沉积的干预效果(图8)。
图8.

各组肝脏油红O染色结果比较
Fig. 8 Oil red O staining of the liver tissue in each group.
2.6. LCBE对SCFAs/GPR43/GLP-1通路的影响
2.6.1. 对小鼠粪便短链脂肪酸含量的影响
与NC组相比,LCBE-CRD-DM组的乙酸、丙酸、丁酸和正丁酸水平无差异无统计学意义(P>0.05);然而,与CRD-DM组相比,LCBE-CRD-DM组的乙酸、丙酸、丁酸和正丁酸含量升高(P<0.001,图9)
图9.

各组短链脂肪酸结果比较
Fig. 9 Fecal levels of short-chain fatty acid in each group. A: Acetic acid level. B: Propanoic acid level. C: Butyric acid level. D: Pentanoic acid level. *P<0.05, **P<0.001 vs NC group; # P<0.05, ## P<0.001.
2.6.2. 对小鼠结肠GPR43/GLP-1基因表达的影响
与NC组相比,DM组和CRD-DM组的GPR43和GLP-1基因表达水平下降(P<0.001)。在LCBE-CRD-DM组中,GPR43基因的表达水平与NC组差异无统计学意义,而GLP-1的表达水平则明显低于NC组(P<0.001)。此外,与CRD-DM组相比,LCBE-CRD-DM组的GPR43和GLP-1(P<0.001)基因表达水平上调(P<0.001,图10)。
图10.

各组结肠GPR43和GLP-1基因表达结果
Fig.10 Colonic GPR43 (A) and GLP-1 (B) mRNA expression in each group. **P<0.001 vs NC group; ## P<0.001.
2.6.3. 对小鼠结肠GPR43/GLP-1蛋白水平的影响
与NC组相比,DM组和CRD-DM组的GPR43和GLP-1蛋白的表达水平降低(P<0.001);而LCBE-CRD-DM组中,GLP-1水平与NC组之间差异无统计学意义(P>0.05),GPR43水平则高于NC组(P=0.033)。此外,与CRD-DM组相比,LCBE-CRD-DM组中GPR43和GLP-1蛋白表达水平明显升高(P<0.001,图11)。
图11.
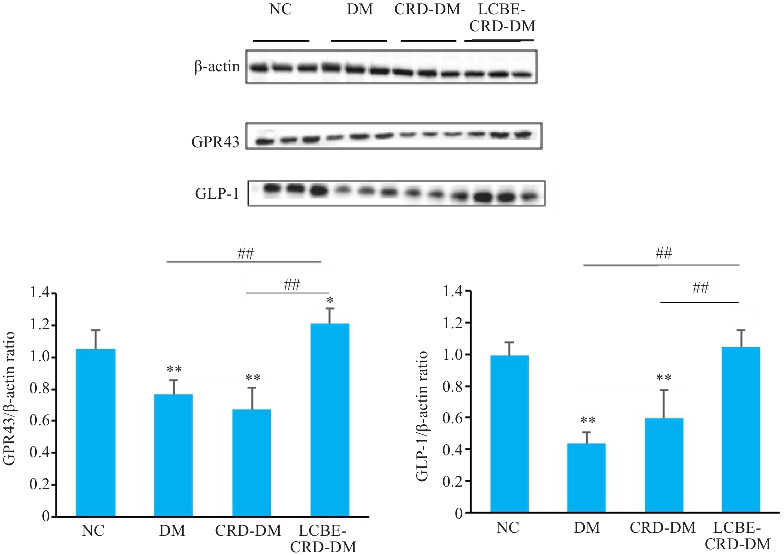
各组小鼠结肠GPR43和GLP-1蛋白水平结果
Fig. 11 GPR43 and GLP-1 protein levels in the colon of the mice in each group detected by Western blotting. *P<0.05, **P<0.001 vs NC group; ## P<0.001.
3. 讨论
本研究从SCFAs对GPR43/GLP-1信号通路的角度,系统揭示了LCBE改善糖脂代谢紊乱的分子机制。尽管已有研究表明益生菌可通过调节肠道菌群改善代谢功能[32],但其具体作用机制,尤其是SCFAs受体介导的下游信号传导仍不明确。本研究发现LCBE显著提升乙酸、丙酸及丁酸水平,并通过激活GPR43受体的方式促进GLP-1的分泌,这与先前报道的SCFAs直接刺激L细胞分泌GLP-1的结论一致,但首次明确了益生菌-菌群-SCFAs-GPR43-GLP-1的级联作用链。这一发现填补了益生菌干预代谢性疾病分子机制的研究空白,为开发基于SCFAs通路的精准治疗策略提供了理论依据。
昼夜节律紊乱是代谢性疾病的重要诱因[33],但其与肠道菌群及SCFAs代谢的关联尚未阐明。本研究通过构建昼夜节律紊乱小鼠模型,发现LCBE可同步恢复节律因子Bmal 1和PER 2水平,且增加粪便SCFAs含量,提示菌群可能通过“菌群-宿主生物钟对话”改善代谢。这与Zarrinpar等[34]提出的“菌群驱动生物钟同步化”假说相呼应,但首次在益生菌干预中证实该机制。这一发现为昼夜节律紊乱相关代谢疾病的干预提供了新靶点。
研究表明,LCBE 通过降低厚壁菌门与拟杆菌门的比率以及炎症相关细菌和产生 LPS 的细菌的比例来调节肠道菌群的组成,从而重新排列肠道菌群的结构[35]。LCBE 可以通过改变肠道微生物群的组成来降低小鼠模型中的胆固醇水平,从而改善宿主健康[36,37]。本研究发现,LCBE可以降低小鼠血脂水平,从而达到缓解糖脂代谢的效果。
本研究通过揭示LCBE调节SCFAs对GPR43/GLP-1通路改善糖脂代谢紊乱的分子机制,为益生菌干预代谢性疾病提供了新的理论支持。这一发现不仅深化了对肠道菌群与代谢性疾病关系的理解,也为未来基于肠道菌群的精准治疗方案设计奠定了基础。同时,本研究为益生菌制剂的开发和应用提供了科学依据,具有重要的理论意义和临床应用价值。
基金资助
河北省医学科学研究课题(20241988);河北省高等学校科学技术研究项目(BJK2024152)
利益冲突声明
The authors declare no competing interests.
参考文献
- 1. Malone JI, Hansen BC. Does obesity cause type 2 diabetes mellitus (T2DM)? Or is it the opposite[J]? Pediatr Diabetes, 2019, 20(1): 5-9. doi: 10.1111/pedi.12787 [DOI] [PubMed] [Google Scholar]
- 2. Sun H, Saeedi P, Karuranga S, et al. IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045[J]. Diabetes Res Clin Pract, 2022, 183: 109119. doi: 10.1016/j.diabres.2023.110945 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. Snoek FJ, Bremmer MA, Hermanns N. Constructs of depression and distress in diabetes: time for an appraisal[J]. Lancet Diabetes Endocrinol, 2015, 3(6): 450-60. doi: 10.1016/s2213-8587(15)00135-7 [DOI] [PubMed] [Google Scholar]
- 4. Perrin NE, Davies MJ, Robertson N, et al. The prevalence of diabetes-specific emotional distress in people with Type 2 diabetes: a systematic review and meta-analysis[J]. Diabet Med, 2017, 34(11): 1508-20. doi: 10.1111/dme.13448 [DOI] [PubMed] [Google Scholar]
- 5. Cole JB, Florez JC. Genetics of diabetes mellitus and diabetes complications[J]. Nat Rev Nephrol, 2020, 16(7): 377-90. doi: 10.1038/s41581-020-0278-5 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. Ding L, Xiao XH. Gut microbiota: closely tied to the regulation of circadian clock in the development of type 2 diabetes mellitus[J]. Chin Med J: Engl, 2020, 133(7): 817-25. doi: 10.1097/cm9.0000000000000702 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. Butler TD, Gibbs JE. Circadian host-microbiome interactions in immunity[J]. Front Immunol, 2020, 11: 1783. doi: 10.3389/fimmu.2020.01783 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8. 赵国杰, 卢 悦, 崔 博, 等. 昼夜节律紊乱对大鼠肠道菌群及肠道屏障的影响[J]. 现代预防医学, 2022, 49(8): 1495-500. [Google Scholar]
- 9. Abildinova GZ, Benberin VV, Vochshenkova TA, et al. Global trends and collaborative networks in gut microbiota-insulin resistance research: a comprehensive bibliometric analysis (2000-2024)[J]. Front Med: Lausanne, 2024, 11: 1452227. doi: 10.3389/fmed.2024.1452227 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. Qin J, Li Y, Cai Z, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes[J]. Nature, 2012, 490(7418): 55-60. doi: 10.1038/nature11450 [DOI] [PubMed] [Google Scholar]
- 11. Karlsson FH, Tremaroli V, Nookaew I, et al. Gut metagenome in European women with normal, impaired and diabetic glucose control[J]. Nature, 2013, 498(7452): 99-103. doi: 10.1038/nature12198 [DOI] [PubMed] [Google Scholar]
- 12. Sanders ME, Merenstein DJ, Reid G, et al. Author correction: probiotics and prebiotics in intestinal health and disease: from biology to the clinic[J]. Nat Rev Gastroenterol Hepatol, 2019, 16(10): 642. doi: 10.1038/s41575-019-0199-6 [DOI] [PubMed] [Google Scholar]
- 13. Xie K, Tashkin DP, Luo MZ, et al. Pharmacokinetic study of thymol after intravenous injection and high-dose inhalation in mouse model[J]. Pharmacol Res Perspect, 2019, 7(5): e00515. doi: 10.1002/prp2.515 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. Altaha B, Heddes M, Pilorz V, et al. Genetic and environmental circadian disruption induce weight gain through changes in the gut microbiome[J]. Mol Metab, 2022, 66: 101628. doi: 10.1016/j.molmet.2022.101628 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15. Hutchison AT, Wittert GA, Heilbronn LK. Matching meals to body clocks-impact on weight and glucose metabolism[J]. Nutrients, 2017, 9(3): E222. doi: 10.3390/nu9030222 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. Bhadra U, Thakkar N, Das P, et al. Evolution of circadian rhythms: from bacteria to human[J]. Sleep Med, 2017, 35: 49-61. doi: 10.1016/j.sleep.2017.04.008 [DOI] [PubMed] [Google Scholar]
- 17. Shi SQ, Ansari TS, McGuinness OP, et al. Circadian disruption leads to insulin resistance and obesity[J]. Curr Biol, 2013, 23(5): 372-81. doi: 10.1016/j.cub.2013.01.048 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18. Reitmeier S, Kiessling S, Clavel T, et al. Arrhythmic gut microbiome signatures predict risk of type 2 diabetes[J]. Cell Host Microbe, 2020, 28(2): 258-72. e6. doi: 10.1016/j.chom.2020.06.004 [DOI] [PubMed] [Google Scholar]
- 19. Bishehsari F, Voigt RM, Keshavarzian A. Circadian rhythms and the gut microbiota: from the metabolic syndrome to cancer[J]. Nat Rev Endocrinol, 2020, 16(12): 731-9. doi: 10.1038/s41574-020-00427-4 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20. Gan Y, Yang C, Tong X, et al. Shift work and diabetes mellitus: a meta-analysis of observational studies[J]. Occup Environ Med, 2015, 72(1): 72-8. doi: 10.1136/oemed-2014-102150 [DOI] [PubMed] [Google Scholar]
- 21. Xie F, Hu K, Fu R, et al. Association between night shift work and the risk of type 2 diabetes mellitus: a cohort-based meta-analysis[J]. BMC Endocr Disord, 2024, 24(1): 268. doi: 10.1186/s12902-024-01808-w [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22. Leung GKW, Huggins CE, Ware RS, et al. Time of day difference in postprandial glucose and insulin responses: Systematic review and meta-analysis of acute postprandial studies[J]. Chronobiol Int, 2020, 37(3): 311-26. doi: 10.1080/07420528.2019.1683856 [DOI] [PubMed] [Google Scholar]
- 23. Viklund A, Andersson T, Selander J, et al. Night and shift work patterns and incidence of type 2 diabetes and hypertension in a prospective cohort study of healthcare employees[J]. Scand J Work Environ Health, 2023, 49(6): 439-48. doi: 10.5271/sjweh.4104 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24. Mokhlesi B, Temple KA, Tjaden AH, et al. Association of self-reported sleep and circadian measures with glycemia in adults with prediabetes or recently diagnosed untreated type 2 diabetes[J]. Diabetes Care, 2019, 42(7): 1326-32. doi: 10.2337/dc19-0298 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25. Gao Y, Gan T, Jiang L, et al. Association between shift work and risk of type 2 diabetes mellitus: a systematic review and dose-response meta-analysis of observational studies[J]. Chronobiol Int, 2020, 37(1): 29-46. doi: 10.1080/07420528.2019.1683570 [DOI] [PubMed] [Google Scholar]
- 26. Voigt RM, Forsyth CB, Green SJ, et al. Circadian disorganization alters intestinal microbiota[J]. PLoS One, 2014, 9(5): e97500. doi: 10.1371/journal.pone.0097500 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27. Thaiss CA, Levy M, Elinav E. Chronobiomics: the biological clock as a new principle in host-microbial interactions[J]. PLoS Pathog, 2015, 11(10): e1005113. doi: 10.1371/journal.ppat.1005113 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28. Fatima N, Rana S. Metabolic implications of circadian disruption[J]. Pflügers Arch Eur J Physiol, 2020, 472(5): 513-26. doi: 10.1007/s00424-020-02381-6 [DOI] [PubMed] [Google Scholar]
- 29. Fan Y, Pedersen O. Gut microbiota in human metabolic health and disease[J]. Nat Rev Microbiol, 2021, 19(1): 55-71. doi: 10.1038/s41579-020-0433-9 [DOI] [PubMed] [Google Scholar]
- 30. Jayedi A, Aletaha A, Zeraattalab-Motlagh S, et al. Comparative efficacy and safety of probiotics, prebiotics, and synbiotics for type 2 diabetes management: a systematic review and network meta-analysis[J]. Diabetes Metab Syndr Clin Res Rev, 2024, 18(1): 102923. doi: 10.1016/j.dsx.2023.102923 [DOI] [PubMed] [Google Scholar]
- 31. 李宜航. 四君子汤改善CKD小鼠肠道微生态的作用机制研究[D]. 沈阳: 辽宁中医药大学, 2023. [Google Scholar]
- 32. Everard A, Belzer C, Geurts L, et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity[J]. Proc Natl Acad Sci USA, 2013, 110(22): 9066-71. doi: 10.1073/pnas.1219451110 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33. Reutrakul S, Van Cauter E. Sleep influences on obesity, insulin resistance, and risk of type 2 diabetes[J]. Metabolism, 2018, 84: 56-66. doi: 10.1016/j.metabol.2018.02.010 [DOI] [PubMed] [Google Scholar]
- 34. Zarrinpar A, Chaix A, Yooseph S, et al. Diet and feeding pattern affect the diurnal dynamics of the gut microbiome[J]. Cell Metab, 2014, 20(6): 1006-17. doi: 10.1016/j.cmet.2014.11.008 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35. Jiang J, Xiong J, Ni JB, et al. Live combined B. subtilis and E. faecium alleviate liver inflammation, improve intestinal barrier function, and modulate gut microbiota in mice with non-alcoholic fatty liver disease[J]. Med Sci Monit, 2021, 27: 931143-1 -931143-12. doi: 10.12659/msm.931143 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36. Pi X, Teng W, Fei D, et al. Effects of live combined Bacillus subtilis and Enterococcus faecium on gut microbiota composition in C57BL/6 mice and in humans[J]. Front Cell Infect Microbiol, 2022, 12: 821662. doi: 10.3389/fcimb.2022.821662 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37. Huang JL, Xu YF, Wang MH, et al. Enterococcus faecium R-026 combined with Bacillus subtilis R-179 alleviate hypercho-lesterolemia and modulate the gut microbiota in C57BL/6 mice[J]. FEMS Microbiol Lett, 2023, 37010. 1093: femsle. doi: 10.1093/femsle/fnad118 [DOI] [PubMed] [Google Scholar]


