Abstract
Functional Electrical Stimulation on Paraplegic Patients. We report on clinical and physiological effects of 8 months Functional Electrical Stimulation (FES) of quadriceps femoris muscle on 16 paraplegic patients. Each patient had muscle biopsies, CT-muscle diameter measurements, knee extension strength testing carried out before and after 8 months FES training. Skin perfusion was documented through infrared telethermography and xenon clearance, muscle perfusion was recorded through thallium scintigraphy. After 8 months FES training baseline skin perfusion showed 86 % increase, muscle perfusion was augmented by 87 %. Muscle fiber diameters showed an average increase of 59 % after 8 months FES training. Muscles in patients with spastic paresis as well as in patients with denervation showed an increase in aerob and anaerob muscle enzymes up to the normal range. Even without axonal neurotropic substances FES was able to demonstrate fiberhypertrophy, enzyme adaptation and intracellular structural benefits in denervated muscles. The increment in muscle area as visible on CT-scans of quadriceps femoris was 30 % in spastic paraplegia and 10 % in denervated patients respectively. FES induced changes were less in areas not directly underneath the surface electrodes. We strongly recommend the use of Kern’s current for FES in denervated muscles to induce tetanic muscle contractions as we formed a very critical opinion of conventional exponential current. In patients with conus-cauda-lesions FES must be integrated into modern rehabilitation to prevent extreme muscle degeneration and decubital ulcers. Using FES we are able to improve metabolism and induce positive trophic changes in our patients lower extremities. In spastic paraplegics the functions „rising and walking“ achieved through FES are much better training than FES ergometers. Larger muscle masses are activated and an increased heart rate is measured, therefore the impact on cardiovascular fitness and metabolism is much greater. This effectively addresses and prevents all problems which result from inactivity in paraplegic patients.
Key words: Paraplegia, Functional Electrical Stimulation (FES), muscle biopsy, fiber size, histochemical changes, enzyme-activity, force-measurement, Xenon 133, Thallium 201, IR-Thermography
Kurzfassung
Die klinischen und physiologischen Auswirkungen einer 8 monatigen Funktionellen Elektrostimulation (= FES) im M. quadriceps wurden an 16 Paraplegikern verifiziert. Dazu wurden Muskelbiopsien, CT-Muskelflächenbestimmungen und Kraftmessungen VOR und NACH der 8monatigen FES-Trainingsperiode bei jedem Probanden durchgeführt. Die Durchblutungsförderung der FES wurde mittels Xenon-Clearance und Infrarot-Telethermographie für die Haut sowie Thallium-Szintigraphie für die Muskulatur bestimmt. Nach 8monatiger täglicher FES der Oberschenkelmuskulatur fand sich eine Erhöhung der Haut-Ruhedurchblutung um ca. 86 % sowie eine Erhöhung der Muskeldurchblutung um durchschnittlich 87 % gegenüber den Ausgangswerten. Die Muskelfaserquerschnitte nahmen nach 8monatiger FES im Median um 59 % zu. Die Erhöhung der anaeroben und der aeroben Enzyme bis in den Normbereich gesunder Muskulatur wurde bei spastisch gelähmten und bei denervierten Muskeln erreicht. Die Funktionelle Elektrostimulation war auch ohne neurotrope Substanzen in der Lage, bei denervierten Muskeln eine Faserhypertrophie, eine Enzymadaptation und eine intrazelluläre Strukturverbesserung auszulösen. Die Vergrößerung der computertomographischen Quadriceps-Fläche betrug bei den spastisch gelähmten Patienten ca. 30 % und bei den denervierten Patienten ca. 10 %. Im Muskelareal zwischen den Elektroden war bei denervierter Muskulatur ein viel geringerer Trainingseffekt festzustellen.
Für die praktische Durchführung der Funktionellen Elektrostimulation bei denervierter Muskulatur muss ein spezieller Schwellstrom nach Kern für tetanische Muskelkontraktionen gefordert und der herkömmliche Exponentialstrom kritisch betrachtet werden.
Die Funktionelle Elektrostimulation bei denervierten Conus-Cauda-Patienten muß als integrierter Bestandteil der modernen Querschnittsrehabilitation gefordert werden, um die extreme Muskeldegeneration zu verhindern und die nachgewiesenen klinischen Effekte zur Dekubitusprophylaxe auszunützen.
Die Funktionelle Elektrostimulation ist bei den spastisch gelähmten Patienten mit den Funktionen “Aufstehen” und “Gehen” den Trainingsformen der FES-Ergometrie hinsichtlich Aktivierung größerer Muskelmassen und Herzfrequenz-Steigerung überlegen und fördert den Gesamtmetabolismus, die kardiovaskuläre Fitness und die Prävention aller Bewegungsmangelsyndrome bei querschnittgelähmten Paraplegikern. Die FES soll als zusätzliche Trainingsform und als sportliche Bewegungsaktivierung, mind. 3-4 x wöchentlich, in der Rehabilitation spastisch-gelähmter Patienten eingesetzt werden.
Schlüsselwörter: Paraplegie, Funktionelle Elektrostimulation (FES), Muskelbiopsie, Faserhypertrophie, aerobe und anaerobe Enzyme, Computertomographie, Xenon 133, Thallium 201, IR-Thermographie.
-
EINLEITUNG
Zur Geschichte der Funktionellen Elektrostimulation
Elektrostimulation in der Physikalischen Medizin und Rehabilitation
-
GRUNDLAGEN UND STAND DES WISSENS
-
Aufgaben und Ziele der Funktionellen Elektrostimulation bei Paraplegie
Trophik und Metabolismus
Mögliche Funktionen mit FES bei Paraplegie
-
Erste klinische Anwendungen der “Wiener Systeme”:
-
Die FES mit Oberflächenelektroden - Unsere klinischen Erfahrungen
Spastische Patienten
Denervierte Patienten
Weltweit erste Implantation eines Beinschrittmachers
-
Fragestellung zur Untersuchung
-
-
METHODIK
Versuchsanordnung und Patienten
-
Technische Voraussetzungen und Ausrüstung
Oberflächenstimulationsgeräte und Zubehör
Stimulationsparameter und Trainingsanweisungen
-
Zur Methodik der nuklearmedizinischen Durchblutungsmessung:
Xenon-133-Clearance für die Hautdurchblutung B) Thallium-Szintigraphie für die Muskeldurchblutung
Zur infrarot-telethermographischen Untersuchung
Zur computertomographischen Bestimmung der Muskelquerschnittsflächen
Methodik der Kraftmessung im M. quadriceps femoris gelähmter Patienten
-
Methodik der Muskelbiopsien:
Histologie
Enzymchemie
-
ERGEBNISSE UND DISKUSSION
-
Ergebnisse der technischen Vorversuche und Entwicklung
Technische Ausrüstung und Optimierung der Stimulation
Technische Empfehlungen für die Praxis der FES
-
Ergebnisse der nuklearmedizinischen Durchblutungsmessungen
Ergebnisse der Xenon-Clearance B) Ergebnisse der Thallium-Szintigraphie
Ergebnisse der Infrarot-Telethermographie
Ergebnisse der CT-Muskelflächenbestimmung
Ergebnisse und Diskussion der Kraftmessung
-
Ergebnisse der Muskelbiopsie
-
Histologie:
Faserdurchmesser
Fasertypisierung
Enzymchemie
-
-
ZUSAMMENFASSUNG
LITERATURVERZEICHNIS
I EINLEITUNG
1. Zur Geschichte der Funktionellen Elektrostimulation
Berühmt sind die physiologischen Experimente von Galvani, der um 1791 mit Hilfe der “Berührungselektrizität” Froschmuskeln zur Kontraktion brachte. Aber schon viel früher wurde natürlich vorkommende Elektrizität zu Heilzwecken eingesetzt. Überliefert sind die Heilungsversuche des römischen Arztes Scribonius Largos bei verschiedenen Schmerzzuständen mit Hilfe der elektrisierenden Schläge des Zitterrochens.
In Deutschland bemühten sich in der ersten Hälfte des 18. Jahrhunderts Kratzenstein, Krüger, Klyn, nach der Erfindung der Elektrisiermaschine, besonders bei peripheren und zentralen Lähmungen Heilung durch Elektrizität zu erreichen. 1801 entdeckte Ritter die Bedeutung des raschen Anstieges eines elektrischen Impulses für die Auslösung einer Muskelkontraktion. 1831 wurde durch Michael Faraday die elektromagnetische Maschine “Wed” entwickelt. Diese ist der Vorläufer für viele in der Elektrotherapie gebräuchliche Geräte. Die Entdeckungen von Galvani 1789 (79) und Volta 1800 sowie Ritter und Faraday waren Grundlagen für die wissenschaftliche Bearbeitung und die medizinische Anwendung der Elektrizität, der “Elektrotherapie” durch Duchenne, Erb, Remarck, Du Bois Reymond im 19. Jahrhundert. Nach Entdeckung der tetanisierenden Impulsfolgen zur Muskelstimulation wurde der Begriff “Elektrogymnastik” (Bergonie) geprägt. Seither wird die Elektrostimulation für verschiedene Indikationen im Bereich der Medizin eingesetzt, wobei Erfolge und Ansehen einen eher wellenförmigen geschichtlichen Verlauf nahmen. Vor allem, weil die Dosierung, die richtige Indikationsstellung, die technischen Voraussetzungen sowie die wissenschaftlichen Überprüfungen und Dokumentation noch unzureichend waren. In den letzten Jahrzehnten wurde die Bedeutung der Elektrostimulation durch die Arbeiten von Kowarschik, Jantsch (139), Schuhfried, Nemec, Wyss und Hufschmidt gefestigt. Die klinischen Hauptanwendungsgebiete der Elektrostimulation in der Praxis sind die Schmerztherapie und die Kräftigung atropher Muskulatur in der posttraumatischen und orthopädischen Rehabilitation, insbesondere postoperativ und bei Immobilisation. In der Rehabilitation nach Kapselbandverletzungen des Kniegelenkes oder nach Menisektomie wird Electrostimulation während der Immobilisationsphase und Rehabilitation von Eriksson et al. 1981 (71), Gould 1983 (91), Kern und Wagner 1982 (153, 154) und anderen eingesetzt und empfohlen. Im Sport wird die Elektrostimulation seit ca. 1971 u.a. von Kots (163, 164), Ikai (136), Morrissey (211), Nowakowska (224), Kern (155) und teilweise früher als zusätzliches Training und als alternative Trainingsform bei umschriebenen Muskelschwächen nach Verletzungen und nach Immobilisation, aber auch zur Leistungssteigerung eingesetzt. Der Einsatz der Elektrostimulation als “Funktionelle Elektro Stimulation” hat erst eine kurze Geschichte von ca. 30 Jahren. Mitte der 60er Jahre machte erstmals Liberson (176) einfache klinische Experimente mit Stimulation von Muskeln der oberen und unteren Extremität, um z. B. eine Dorsalflexion des Fußes oder der Hand oder einfache Greiffunktionen zu erhalten. Mehrere Untersucher fanden Interesse an seiner Arbeit, und einige Jahre später entwickelte Long 1963, ein Experte in der Handrehabilitation, ein Behandlungsprogramm durch Elektrostimulation kombiniert mit einer speziellen Handorthese. Mit zunehmender Entwicklung der Technik, speziell der Mikroelektronik, entstanden die Grundlagen für klinische Einsatzmöglichkeiten der Funktionellen Elektrostimulation. Nach ersten transthorakalen Erfolgen im Bereich der Herz schrittmacher von Zoll 1952 (322), Furman und Schwedel 1958 (78) in den fünfziger Jahren wurde der erste voll implantierbare Herzschrittmacher von Senning 1958 (282) eingesetzt. Derzeit wird ca. alle 5 Minuten ein Herzschrittmacher weltweit implantiert, so daß die Gesamtzahl bei über 1 Million Implantaten liegt. Glenn (87, 267) berichtet 1966 von ersten Anwendungen der Elektrostimulation der Nervi phrenici bei Patienten mit Ateminsuffizienz als Vorläufer des Atem-schrittmachers. Das moderne Rettungswesen mit Notarztwagen und Hubschrauber läßt auch Patienten mit kompletter Zwerchfellatmung bei hohen Querschnitten C1-C3 rechtzeitig die intensivmedizinische Versorgung erreichen. Bei hoher Tetraplegie ist ein Atmen mit der vorderen Halsmuskulatur, Mm. skaleni und M. sternocleidomastoideus bds, Platysma und den kleinen geraden Halsmuskeln als axillare Atemmuskulatur möglich. Dabei wird der Kopf mit Hilfe des M. levator scapulae und M. trapezius stabilisiert bzw. retroflektiert und mit der ventralen Atemhilfsmuskulatur ein Anheben des Thorax zum aktiven Einatmen erreicht. Wird eine solche Atemtechnik vom Patienten nicht oder nicht ausreichend erlernt, ist eine weitere maschinelle Beatmung oder der Einsatz des Atemschrittmachers notwendig. Laut Gerner et al 1979 (83) ist in der posttraumatischen Versorgung eine maschinelle Beatmung unumgänglich, wenn bei erwachsenen Tetraplegikern ein Atemzugvolumen unter 300 ml, ein pO2 unter 60 mm Hg und ein pCO2 über 60 mm Hg vorliegt. Bereits 1978 berichtet Glenn (87) von weltweit über 180 klinischen Einsätzen seines Systems bei einer Vielzahl von Patienten mit verschieden gradiert Ateminsuffizienz, bis 1991 wurden bereits mehr als 800 Implantationen von Atemschrittmachern durchgeführt. Der Wiener Atemschrittmacher, von Holle und Thoma (114) entwickelt, verwendet die Methode der Karussell-Stimulation über Epineuralelektroden des N. phrenicus intrathorakal. Der erste klinische Einsatz erfolgte 1983, die längste Beatmungszeit bisher sind 6 Jahre. Baer und Talonen (297) verwendeten die Sequenz-stimulation als Abwandlung der Karussellstimulation, wobei jeweils mit 4 Elektroden durch verschiedene Kombinationen die Kathode salvatorisch um den Nerv herum geschaltet wird. Eine weitere klinische Anwendungsmöglichkeit der Elektrostimulation ist die Behandlung progressiver idiopathischer Skoliosen, die 75-80 % aller Skoliosen ausmachen. Bis zur Mitte der 70er Jahre bestand die Therapie der Skoliosen ausschließlich in einem konservativen Vorgehen mit Heilgymnastik und einer Miederversorgung, welches 23 Stunden tgl. getragen werden musste. Diese sehr belastende, auch psychisch belastende Behandlungsform führte zur Suche nach neuen Therapiemöglichkeiten, wie z. B. die Electrostimulation der paravertebralen Muskulatur zur Hintanhalten der Skolioseprogression. Bobechko 1979 (21) implantierte erstmals Elektroden zur Kräftigung der paravertebralen Muskulatur, die Erfolgsquote betrug 83 %. Axelgaard 1983 führte die Behandlung idiopathischer Skoliosen von 20-45 Grad mit Oberflächen-elektroden ein, die Erfolgsquote war ebenfalls 84 %. Die Elektro-stimulation erwies sich als gute Alternative zur Miederbehandlung bei idiopathischen Skoliosen bei Kindern und Jugendlichen. Bereits in den 60er Jahren gab es die ersten klinischen Anwendungen von Stimulationsgeräten mit Oberflächenelektroden zur Peronaeusaktivierung bei Hemiplegikern sowie die ersten Einsätze von implantierbaren Stimulatoren. Zur Gangkorrektur bei Hemiplegie wurde im Rahmen der Elektrostimulationsgruppe in Ljubljana (Kralj (164, 165), Vodovnik (308); Stanic und Acimovic (289), Rebersek (250), Merletti (203, 204)) ein Einkanal-Implantat zur Stimulation des N. peronaeus entwickelt. Ein Fersenschalter aktiviert die Stimulation, sobald die Ferse vom Untergrund abgehoben wird. Ein externes batteriebetriebenes Steuergerät versorgt eine auf der Hautoberfläche liegende Sendespule, welche das Implantat mit einem Hochfrequenz-Trägersignal versorgt, aus dem jeweils ein Stimulationsimpuls induziert wird. Stimulationen bis 10 mA und 500 msec sowie 15-30 Hz sind möglich. Dadurch wird ein Anheben des Vorderfußes beim Nach vorne Schwingen des Beines und damit ein verbessertes Gangbild erreicht. Nach Weiterentwicklung dieses Systems wurde zwischen 1981 und 1990 bei 34 Patienten dieses System eingesetzt; davon zeigten 15 Patienten eine wesentliche Verbesserung des Gangbildes, der Gehgeschwindigkeit und eine Vergrößerung der Gehstrecke. Mitte der 70er Jahre beschäftigten sich 2 bekannte Arbeitsgruppen, eine in Ljubljana in Jugoslawien, eine andere in Dayton in Ohio, mit der Erforschung der Funktionellen Elektrostimulation, insbesondere bei Patienten mit Verletzungen des Rückenmarks, und mit dem Einsatz von Oberflächenstimulation an der unteren Extremität. Mit der laufenden Entwicklung der Gerätetechnik, eng verknüpft mit dem allgemeinen technischen Fortschritt, gab es immer bessere Möglichkeiten der klinischen Anwendung der Funktionellen Elektrostimulation.
Seit ca. 15 Jahren erlebten die experimentelle Elektrostimulation und der klinische Einsatz weltweit unter dem Oberbegriff “Funktionelle Elektrostimulation” neue Forschungsimpulse, die u. a. von Hudlicka (126-131), Pette (241-243), Vrbova (312), Reichmann (252-257), Hoppeler (119-123), Lomo (179-182) u.v.a. von der experimentell-physiologischen Seite und von der klinischen und biotechnischen Seite u.a. von Holle (112-115), Thoma (300-304), Mayr (194-198), Frey (75), Stöhr (292-294), Kern (146-155) mit der weltweit ersten Implantation eines Beinschrittmachers für paraplegische Patienten 1982 in Wien, um nur einige zu nennen, getragen wurden. Seit 1982 ist die Wiener Arbeitsgruppe besonders auf dem Gebiet der Beinschrittmacher weltweit führend.
In anderen Forschungsgruppen von Vodovnik (309-311), Krajl und Bajd (165, 166) in Laibach; Peckham (231-233), Mortimer, Marsolais (189), Kobetic (160) in Cleveland; Petrofsky (235-240) in Dayton/Ohio; Vossius in Karlsruhe werden Oberflächen-Elektroden und nur teilweise Implantate bzw. transcutane Elektroden eingesetzt. Die Implantation von Elektroden bringt jedoch auch verschiedene Nachteile. Marsolais 1988 berichtet über eine 45 %-Fehlerquote 3 Monate nach Implantation seiner speziellen transcutanen Einstich-Elektroden sowie 60 % nach 6 Monaten aufgrund auftretender Infektionen und Stromschädigungen.
Die Bedeutung des Einsatzes der Funktionellen Elektrostimulation bei Para- und Tetraplegikern zur Erhaltung und Förderung der Allgemeinen Gesundheit und Fitness wird in den letzten Jahren zunehmend erkannt.
Ausdauertraining mit z. B. FES-Ergometrie, kombiniert mit Arm-Ergometrie, steigert die lokalmuskuläre und die cardiorespiratorische Ausdauer und hilft bei regelmäßiger Anwendung, die Gesundheit länger zu erhalten und die sekundären Komplikationen zu verringern (Ragnarsson 1988 (249), Pollak 1989 (244), Arnold 1992 (8), Petrofsky 1992 (240), Hooker 1992 (118), Taylor 1993 (299), Krauss 1992 (167) etc.)
Die Elektrostimulation ist oft die einzige Möglichkeit, spezielle Aufgaben und Funktionen der Muskulatur zu erreichen.
Bei Rückenmarksverletzungen in bzw. ab Höhe C5/6 kommt es zu einem Ausfall der Greiffunktionen der Hand. Zur Reaktivierung der Greiffunktion wurde von der Gruppe Peckham, Marsolais, Mortimer (231, 232, 234) ein System zur Stimulation der Unterarm-Muskulatur entwickelt.
Das System basiert auf einem 8-Kanal-Implantat mit telemetrischer Versorgung und Steuerung. Das System wurde 1988 erstmals klinisch implantiert, 1991 wurden 3 weitere Implantationen durchgeführt. Nach entsprechendem Koordinationstraining sind die Patienten in der Lage, verschiedene Alltagsgegenstände, wie Tasse, Besteck, Telefon, Papier usw., zu nehmen und zu handhaben. Bewegungssensoren an der Schulter erlauben dem Patienten die willkürliche Kontrolle der Greifbewegungen; Smith und Peckham et al. (285).
Zurzeit wird an verschiedenen Regelsystemen gearbeitet. Einerseits wurden mit Kraft- und Positionssensoren erste geschlossene Regelkreise aufgebaut, andererseits wurde mit kognitivem Feedback, Riso 1991 (260) und Crago 1991 (51, 52), experimentiert, indem die Stimulationsintensität über sensible Reizung im Schulterbereich dem Patienten zugänglich gemacht wird.
Die Gruppe um Perkins, Brindley und Donaldson entwickelte einen 11-Kanal-Multiplex-Stimulator, der über Joystickbewegungen der kontralateralen Hand sowie Schulter- und Ellbogenbewegungen gesteuert wird. Die Energie-Versorgung und Steuerung erfolgen telemetrisch, einige Elektroden sind in nächster Umgebung der Nerven befestigt, die anderen an den Muskeloberflächen.
Für C-4 Tetraplegiker entwickelte Nathan (218, 219) einen sprachgesteuerten 24-Kanal-Stimulator unter Verwendung von Oberflächenelektroden. Das System basiert auf einem Mikrocomputer, mit dessen Hilfe die individuellen Stimulationsparameter für drei verschiedene Greiffunktionen gespeichert werden.
Die Gruppe um N. Hoshimiya (124) entwickelte ein respiratorisch gesteuertes System mit percutanen Elektroden. Zur Erstellung der Stimulationsparameter wurden EMG-Daten von gesunden Personen verwendet.
Die Entdeckung, daß auch voll differenzierte Muskelfasern das Potential in sich haben, auf geänderte funktionelle Anforderungen mit spezifischen Anpassungsvorgängen zu reagieren, hat zur klinischen Anwendung in Form der Cardiomyoplastie, die von Carpentier et al. 1985 (41, 42) erstmals eingesetzt wurde, geführt. Dem 1. Patienten mußte ein ca. 1,8 kg schwerer Tumor des Herzmuskels entfernt werden, anschließend wurde eine Plastik mit einem gesteilten Latissimus-Präparat durchgeführt.
Das Prinzip dieser Methode besteht darin, daß ein Muskellappen aus dem M. latissimus dorsi mit intakter Nerven-Gefäßversorgung durch ein Rippenfenster in den Thorax Raum geführt und um den Ventrikel geschlungen und fixiert wird. 30 Tage nach der Operation wurde mit dem Auftrainieren des Muskels über schrittweises Steigern der Stimulationsrate gegenüber der Herzfrequenz bis schließlich zu einem Verhältnis 1:1 begonnen. Dadurch kommt es zu einem kompletten Muskelumbau mit vorwiegend aerobem Stoffwechsel und den notwendigen Ausdauereigenschaften für den Herzmuskelersatz. Carpentier wies eine trainingsbedingte Steigerung der Leistung des linken Ventrikels von 23 % über das Echocardiogramm nach. Inzwischen hat Carpentier mehrere ähnliche klinische Eingriffe erfolgreich durchgeführt.
Seit 1985 sind mehr als 250 klinische Einsätze der Cardiomyoplastie nach der Methode Carpentier durchgeführt worden. Als Indikationen werden hochgradige Herzinsuffizienz und schwerer Myokardinfarkt gesehen, wobei die Cardiomyoplastien vielleicht eine Alternative zur Herztransplantation sein könnten. Von Vorteil wäre, nicht auf ein Spenderherz angewiesen zu sein und keine Immunsupression zu benötigen.
Eine weitere Einsatzmöglichkeit der Funktionellen Elektrostimulation wurde die blasen- und beckenbodenstimulation bei Patienten mit Blasenentleerungsstörungen und/oder Inkontinenz. Ein besonderes und sehr häufiges Problem sind diese Störungen bei Patienten mit Rückenmarksverletzung.
Die ersten Experimente zur Reaktivierung der Blasenfunktion mit Hilfe der Elektrostimulation wurden in den 50er und 60er Jahren durchgeführt. Der überwiegende Teil der Forschungsgruppen bewirkt ein Urinieren über Stimulation der Sakralwurzeln oder über die direkte Stimulation des Detrusors, also der Blase selbst. Andere Arbeiten diskutieren die Stimulation des Beckenbodens und der sakralen Nerven, Glenn (87).
Die zur Zeit bekannten Forschungsgruppen, die auch klinisch Implantate einsetzen, sind die Gruppe um Brindley (31) in London sowie die Gruppe um Tanagho (297, 298) in San Franzisko. Beide Gruppen verfügen über ein telemetrisch versorgtes, voll implantierbares System, das geeignet ist, die Sacralwurzeln über Cuff-Elektroden zu reizen. Brindley hat zwischen 1979 und 1985 über 50 Implantationen durchgeführt, inzwischen ist die Gesamtzahl der in den verschiedenen Zentren (z. B. Sauerwein (268), Bad Wildungen sowie Madersbacher (185), Innsbruck) durchgeführten Implantationen auf mehrere 100 gestiegen. Aufgrund der Komplexität der Innervation von Detrusor und Sphincter vesicae müssen intraoperative Stimulationsversuche durchgeführt und neben einer dorsalen Rhizotomie (Durchtrennung der Hinterwurzel) auch selektive periphere motorische Nervendurchtrennungen (Neurotomie) durchgeführt werden. Die Gefahr des Verlustes der Reflexerektion und Reflexejakulation werden durch mikrochirurgische Techniken vermindert.
Brindley nutzt die Trägheit der glatten Detrusor-Muskulatur für seine Intervallstimulation mit Einfluß in den Stimulationspausen. Tanagho reduziert die zum Sphincter führenden Fasern des N. pudendus und erreicht so eine schnellere Ermüdbarkeit gegenüber dem Detrusor bei der Stimulation.
Neben der Blasenentleerung und Kontinenz kann das System Brindley bei einem Teil der Patienten zusätzlich die Darmentleerung unterstützen oder eine elektrisch induzierte Erektion erzeugen.
Die Darmentleerungs- sowie Sexualfunktion (Erektion) erfolgt über die Sacralwurzelstimulation S2 - S4. Beim System von Brindley erfolgt die Stimulation der motorischen Vorderwurzel über Cuff-Elektroden kombiniert mit teilweiser Durchtrennung der Hinterwurzel, um spastische Aktivierungen zu vermeiden. Bei diesen implantierten Stimulatoren wird durch Reizung der Wurzel S1, S2 eher die Blasenentleerung stimuliert und bei unterschiedlichen Kombinationen der Wurzel S3 und S4 die Darmentleerung bzw. die Erektion ausgelöst. Die optimale Stimulation bzw. die optimale Kombination von stimulierten Vorderwurzeln muss jedoch nach wie vor intraoperativ ausgetestet werden.
Zur Verbesserung analer Inkontinenz mit einer dynamischen Musculus gracilis Plastik wurde die Elektrostimulation von Baeten et al. 1988 (13), Seccia et al. 1991 (280) und Williams et al. 1989, 1990 (317, 318) erstmalig eingesetzt. Dabei wird der M. gracilis um den Analkanal fixiert und mit einem implantierten Stimulator chronisch erregt. Für die Defäkation schaltet der Patient mittels Magneten den Stimulator ab.
Einen heroischen Ansatz zeigt die Funktionelle Elektrostimulation beim “Kunstlichen Auge”. Dabei werden über an die Sehrinde implantierte Elektroden und deren Stimulation Lichtblitze induziert. Von einem Prozessor wird ein Videobild, die Kamera ist an der Lesebrille seitlich montiert, in dunkle und helle Felder entsprechend der Anzahl der implantierten Elektroden aufgeteilt, um so schattenhafte Umrisse darstellen zu können. Die Vorversuche wurden von Brindley (30), Collins (48), Polan und Dobelle (57, 58) durchgeführt. Dobelle erreichte mit einem seiner Patienten die Sichtbarmachung einzelner Punkt-Kombinationen der Brail-Blindenschrift durch Stimulation der Hirnrinde entsprechend der Brail-Punkte. Diese Versuche wurden in den letzten 2 Jahrzehnten durchgeführt und bedürfen noch sehr intensiver Anstrengungen.
Ein weiterer Einsatz der Funktionellen Elektrostimulation sind die Cochlea-Implantate bei völliger Taubheit und Innenohrschädigung, selten auch bei Mittelohrschädigungen, einsetzbar. Dabei können akustische Signale nicht mehr übertragen bzw. in Reize der Hörnervenfasern umgewandelt werden. Die einzige Möglichkeit, Laut-Eindrücke hervorzurufen bzw. wieder hörbar zu machen, ist in diesen Fällen die Umwandlung der einwirkenden Töne, Geräusche und Laute in elektrische Impulse und die Übertragung mit einem implantierten Stimulator auf die Cochlea und den N. accusticus. Mit Mehrkanal-Elektroden soll eine Tonhöhencodierung nach dem Ort- oder Tonotopie-Prinzip verschiedene Anteile des Hörnervens (basal, in der Nähe des runden Fensters, für hohe Töne und apical für tiefe Töne) erreicht werden.
Nach dem Prinzip der Periodizität werden unterschiedliche Reizfrequenzen so übertragen, daß durch Überlagerung der Aktionspotentiale die ursprüngliche Signalfrequenz erreicht wird.
Moderne Implantate nutzen beide Prinzipien, Hoch-Mair (109-111) Innsbruck/Wien, und erreichen damit eine Geräuscherkennung mit Lippenlesen bis zu einem Sprachverständnis ohne Lippenlesen. Dafür ist jedoch ein Lernprozess notwendig, um die neuen Stimulationsmuster über den N. accusticus sinngemäß zu interpretieren. Es gibt derzeit ca. weltweit 30 verschiedene Implantat typen, die von mehr als 4000 Patienten verwendet werden.
I/2 Elektrostimulation in der Physikalischen Medizin und Rehabilitation
Dieses Kapitel soll eine kurze Übersicht über die derzeit in der alltäglichen klinischen Praxis meist durchgeführten Anwendungsgebiete und Zielsetzungen der Elektrostimulation in der Physikalischen Medizin und Rehabilitation geben.
Die Elektrotherapie im Rahmen der Physikalischen Medizin und Rehabilitation wird vor allem zur Schmerztherapie, Tonus Regulation, Innervationsschulung und zur Kräftigung atropher bzw. gelähmter Muskulatur in Form von Reflextherapie bzw. indirekter oder direkter Muskelstimulation eingesetzt.
Für die Tonusregulation und Schmerztherapie sei der Einsatz von galvanischen Gleichströmen (konstante Galvanisation und Iontophorese) sowie verschiedener Impulsströme nach Jantsch/Schuhfried (139) erwähnt, die häufig bei Muskelhartspann und Myogelosen neben anderen physikalischen Therapieformen eingesetzt werden. Dabei kommt es durch niederdosierte, längerdauernde, teilweise geschwellte und oft wiederholte Stimulationen zu einer Detonisierung der Muskulatur. Durch kurze und kräftige Reize wird dagegen eine Tonus Steigerung erreicht.
Die Schmerzreduktion beruht auf spinaler Ebene auf der bekannten Gate-Control-Theorie von Melzak und Wall 1965 (203), wobei durch die Erregung schneller Afferenzen aus der Haut und Unterhaut das „Tor“ für die langsamen Schmerzfasern aus demselben Areal geschloßen wird. Dabei kommt es durch präsynaptisch hemmende Interneurone oder Zwischenzellen zur Behinderung der Umschaltung der Schmerzafferenz aus den langsamen C-Fasern und Weiterleitung im Tractus spinothalamicus im Bereich der Substantia gelatinosa. Dieser Mechanismus wird segmentale afferente Hemmung nach der Gate-Control-Theorie bezeichnet.
Der zweite bekannte Mechanismus beruht auf einer supraspinalen deszendierenden Hemmung, wobei durch schnelleitende deszendierende Fasern im Bereich der Pyramidenbahn die segmentalen synaptischen Eingänge der Schmerzbahnen kontrolliert bzw. moduliert werden.
Die deszendierenden analgetischen Bahnen stammen aus dem Nucleus raphe und weiteren im Bereich der Formatio reticularis und enden in den Schichten der Substantia gelatinosa.
Diese Mechanismen der selektiven zentralen Blockaden oder zumindest teilweisen Hemmung für nozizeptive Erregungen aus der Peripherie wurden von Hosobuchi et al. 1977 (125) am Menschen nachgewiesen.
Die Mechanismen der endogenen biochemischen Schmerzkontrolle durch Substanz P, endogene Opiate, insbesondere Encephalon, Endorphin, Serotonin und GABA, sind durch experimentelle Beobachtungen sehr wahrscheinlich, bei der Elektrostimulation am Menschen jedoch noch nicht sicher geklärt. (Willis 1984 (320), Hughes und andere 1981 (132) und Yaksh et al. 1984 (321)) Zur Innervationsschulung bzw. Reflextherapie bei peripheren Lähmungen oder bei Funktionsstörungen, sei die Stimulation der Peronaeusmuskulatur erwähnt, die bei gleichzeitiger willkürlicher Mitarbeit des Patienten dem muskulären Ungleichgewicht zwischen M. tibialis posterior und der Peronealgruppe entgegenwirken soll und speziell in der Rehabilitation nach lateralen Seitenbandverletzungen durchgeführt wird. Boonstra 1987 (25) erreichte durch Elektrostimulation 2x täglich, 7x pro Woche mit insgesamt 60 Kontraktionen täglich bei Patienten mit peripheren Nervenläsionen, daß die Gruppe mit Stimulation früher höhere Kraftwerte erreichte. In der stimulierten und nicht stimulierten Gruppe war jedoch nach einem längeren Beobachtungszeitraum die Anzahl der gut gebesserten Patienten gleich, d. h., daß durch die Elektrostimulation keine schädigende Nebenwirkung auf die Nerven-Regeneration ausgeübt wurde.
Zur Kräftigung atropher oder gelähmter Muskeln werden Schwellströme, mittelfrequente Ströme oder Exponentialströme eingesetzt. Jedoch begnügte man sich bisher in der Rehabilitation, sichtbare Muskelkontraktionen in rhythmischer Abfolge über eine Therapiezeit von ca. 5 bis 15 Minuten dreimal wöchentlich zu erreichen.
Für den Effekt der Elektrostimulation zur Kräftigung atrophierter Muskulatur, nach Verletzung oder Immobilisation, gibt es etliche Studien, z. B. von Eriksson et al. 1981 (71) oder Gould et al. 1983 (91), etc. Auch sie zeigten, daß die Atrophie des M. quadriceps während der Immobilisation durch Elektrostimulation beträchtlich verringert werden kann. Kraftverlust bzw. Muskelschwäche und damit Aktivitätsverlust tritt nicht nur bei Inaktivität bzw. nach Verletzung und Operation mit nachfolgender Immobilisation auf, sondern auch bei neurologischen Erkrankungen wie Multipler Sklerose, Verletzungen des ZNS, des Rückenmarks und bei muskulären Erkrankungen wie Duchenn’scher Muskelatrophie.
Scott et al. 1986, 1990 (277, 278) Dubowitz 1988 (60) zeigten gute Ergebnisse bei Duchenn’scher Muskelatrophie mit niederfrequenter Stimulation. Es kam zu einer Verlangsamung des Krankheitsprozesses. Ähnliche Ergebnisse wurden auch bei Patienten mit verschiedenen primären Muskelerkrankungen von Gregoric et al. 1988 (95), Milner-Brown 1973 (208), erzielt. Jedoch müßen noch viele Fragen bezüglich Stimulationsmuster und Ausmaß der Aktivität gelöst werden.
Munsat et al. 1976 (216) stimulierten den M. quadriceps an 5 Patienten mit verschiedenen neurologischen Erkrankungen mit um den N. femoralis implantierter Elektroden. Sie übten unter isometrischen Bedingungen 4 Stunden pro Tag 5-12 Wochen. Die Biopsien, unmittelbar vor und nach Stimulation zeigten eine Vermehrung des Anteils der Typ I-Fasern sowie eine Zunahme der oxidativen Enzymspiegel.
Peckham et al. 1975 (232) beobachtete in einer Gruppe von Patienten mit Quadriplegie, daß bei Stimulation die Kraft und Ermüdungsresistenz paretischer Muskulatur wiederhergestellt werden konnte. Ähnlich befriedigende Ergebnisse erzielten mit nicht invasiven Methoden Vrbova et al. 1986 (312) und Gordon et al. 1990 (89) bei Stimulation paretischer Muskeln. Dabei war es möglich, bei Läsionen des ersten Motoneurons die Kraft sowie die Ermüdungsresistenz zu erhalten.
Die Effekte der Elektrostimulation werden über Reaktivierung vorhandener Regelkreise, Bildung neuer neuronaler Verschaltungen (Interneurone) und Aktivierung vorhandener und neuer Reflexbogen sowie Synchronisation der Muskelkontraktion durch gleichzeitige Reizung an der nicht myelinisierten Endstrecke des motorischen Nervens oder durch Reizung fast aller sensiblen und sensorischen Afferenzen aus dem Therapieareal erklärt. Bei der Elektrostimulation der Muskulatur unterscheiden wir reflektorische und direkte Wirkungsmechanismen.
Die reflektorische Wirkung der Elektrostimulation beruht auf einer von der Effektivstromstärke und der Impulsform abhängigen Erregung sensibler, insbesondere für Berührung und Druck/Vibration, Propriozeption und Nozizeption, sensorischer und gamma-motorischer Nerven. Diese sensiblen Impulse erzeugen wahrscheinlich über hemmende bzw. fördernde Interneurone im Rückenmark auf Segmentebene eine reflektorische stimulierende oder hemmende Wirkung auf die Vorderhornzellen und somit auf die periphere Arbeitsmuskulatur. Dadurch gelingt es, die Koordination der Vorderhornzellen und somit der motorischen Einheiten und das motorische Wiedererlernen eines Bewegungsablaufes zu verbessern.
So gelingt es mit der reflektorischen Wirkung in der posttraumatischen Rehabilitation, die von den Gelenken und anderen passiven Strukturen ausgehenden Schmerzhemmungen von Muskelarealen zu kompensieren bzw. zu beseitigen (Kern, (155), Bochdansky (22), Eriksson (70)).
Bei der direkten Wirkung der Elektrostimulation auf die Muskulatur muss es durch den elektrischen Impuls zu einer Kontraktion der Muskulatur kommen. Je nach Häufigkeit, Intensität, Pause und Wiederholungsanzahl wird ein Kräftigungs- bzw. Ausdauertrainingseffekt erzielt. Es wird somit entweder ein Hypertrophiereiz auf die atrophe Muskulatur oder ein transformierender Reiz auf die bestehende Faserpopulation, je nach verwendeter Stromform, erfolgen.
Genau diese Überlegungen sind es, die immer wieder Anlaß gegeben haben, die Elektrostimulation nicht nur in der Rehabilitation, sondern auch im Sport als zusätzliche Trainingshilfe zur Leistungssteigerung und zur Verkürzung bzw. zur Verbesserung der Rehabilitation einzusetzen.
II GRUNDLAGEN UND STAND DES WISSENS
II 1. Aufgaben und Ziele der Funktionellen Elektrostimulation bei Paraplegie
Der Begriff Elektrostimulation umfaßt alle in der Medizin angewandten elektrischen Ströme zu Heilzwecken in Behandlung und Diagnostik. Unter Funktioneller Elektrostimulation (= FES) verstehe ich den elektrisch ausgelösten Teilersatz und/oder die Unterstützung einer teilweise verlorenen Organfunktion. Dazu zählt auch die isolierte Muskelkontraktion einzelner Muskeln und die Bewegung in einzelnen Gelenken (z.B. Kniestreckung bei denervierten Patienten und spastischen Patienten) Das bereits klassische Beispiel dafür ist der Herzschrittmacher, dessen erste vollständige Implantation 1958 erfolgte (siehe Kapitel I/1). Zahlreiche Einsatzmöglichkeiten der Funktionellen Elektrostimulation wurden bisher bei Hemiplegie, Skoliose, Plexusparese, Blasenatonie, Sphinkterschwäche, Impotenz, völliger Blindheit und Innenohr Taubheit, Zwerchfelllähmung sowie verlorener Greiffunktion der Hände versucht und entwickelt. Die erfolgreiche Anwendung gestaltet sich jedoch nach wie vor äußerst schwierig. Die Erfolge werden langsam und schrittweise erreicht.
In dieser Arbeit möchte ich mich nur mit den Aufgaben und Zielen der Funktionellen Elektrostimulation bei Paraplegie auseinandersetzen und unsere eigenen Untersuchungen und Erfahrungen neben einer internationalen Literaturübersicht präsentieren.
Meiner Meinung nach muß man bei der Funktionellen Elektrostimulation bei Paraplegie prinzipiell zwei große therapeutische Zielbereiche unterscheiden, die je nach Lähmungshöhe, Lähmungsart (denerviert oder spastisch) und Lähmungsqualität (komplett oder inkomplett) unterschiedlich hohe Bedeutung für Prävention, Prophylaxe und Therapie bei den Patienten aufweisen:
-
Trophik und Metabolismus (denerviert, spastisch)
Trophik der Haut, Decubitusprophylaxe und lokale Durchblutung
Allgemeiner und lokaler Stoffwechsel
Maße und Qualität der Muskulatur
Kosmetik
Trophik und Funktion von Sehnen, Knochen, Bändern, Knorpel
neurale Adaptierungen
Herz-Kreislauf-Funktion und körperliche Fitness
-
Funktion bei Paraplegie
Funktion als Mittel zum Zweck
Trophikverbesserung
Trainingswirksame tetanische Muskelkontraktion
Aktives Aufstehen und aktives Stehen
Gehen in der Ebene, auf glattem Boden und am Feldweg,
Aktives Radfahren, FES-Ergometer bzw. im Freien
Stiegensteigen
sportliches Training des gesamten Körpers
Blasen-, Darm- und Sexualfunktion
Spasmuskontrolle und neurale Adaptierung
Trophik und Metabolismus sowie Funktion sind kein Gegensatz, sondern eine sinnvolle Symbiose im Wirkungsbereich der Funktionellen Elektrostimulation.
II/1/A TROPHIK UND METABOLISMUS
Zu Trophik der Haut und Decubitusprophylaxe
Para- und Tetraplegiker leiden aufgrund ihrer Inaktivität und sitzenden Lebensweise unter verschiedensten Beschwerden, Leiden und Krankheiten, welche die Lebensqualität stark verringern und letztendlich auch zur Todesursache werden können.
Eines der Hauptprobleme ist die Gefahr von Decubitalulcera. Die Prävalenz von Decubitalulcera bei Patienten mit Querschnittsymptomatik wird in einigen Studien mit bis zu 20 % angegeben. In der Glutäalregion ist die häufigste Lokalisation der Ulcera, wo die höchsten Auflagedrücke gemessen werden.
Gestörte Trophik der Haut kann zusammen mit der durch Reglosigkeit bedingten Druckischämie innerhalb von Stunden zu Decubitalgeschwüren führen. Neben der Gewebetoleranz und Trophik sind in der Pathogenese von Decubitalulcera auch die Kontinenz, der Ernährungszustand, die Lähmungsart, die Qualität der Rehabilitation sowie die körperliche Aktivität und Compliance der Patienten besonders entscheidende Faktoren.
Die Schwierigkeiten und der grosse medizinische Aufwand bei der Sanierung von Decubitalulcera sowie die Kosten des langen stationären Aufenthaltes und die Beeinträchtigung der Lebensqualität der betroffenen Patienten verdeutlichen die Bedeutung aller prophylaktischen Maßnahmen, die zur Vorbeugung und Verhinderung von Decubitalulcera eingesetzt werden können.
Jegliche Art der Prophylaxe ist sinnvoller und kostengünstiger als die beste Therapie!!!
Dahingehend waren auch die sehr kostenintensiven und langen Bemühungen in den Rehabilitationszentren zu verstehen, den Patienten mit relativ tiefer Querschnittsymptomatik zur aktiven Mobilisierung mit zwei Stützkrücken und Beinorthesen zu verhelfen. Die Vielzahl neuer, jedoch nicht verwendeter Stützapparate zeugte von der zu geringen Akzeptanz und Motivation der Patienten, diese sicherlich sinnvolle sportliche Decubitusprophylaxe zu akzeptieren.
Große Bedeutung kommt der Mitarbeit und Disziplin der Patienten zu, welche durch regelmäßiges, mehrmals stündliches Entlasten der Glutäalregion durch Hochstützen mit den Armen (Sitzentlastung) und durch Verwendung spezieller Sitzkissen sowie durch sportliche Alltagsaktivitäten wesentlich zur Decubitusprophylaxe beitragen können.
Die Verwendung von Elektrostimulation zur Reduktion des Auflagedruckes im Gesäßbereich wurde im Jahre 1989 von Levine et al. vorgeschlagen. Die Druckreduktion war durch Stimulierung der Glutäalmuskulatur bei Querschnittspatienten mit stabiler Rumpfkontrolle im allgemeinen geringer als 20 mm Hg.
Ferguson et al. 1992 (73) stimulierten dagegen bei 4 Tetraplegikern und 5 Paraplegikern den M. quadriceps bei fixiertem Unterschenkel, um den Druck auf die Gesäßmuskulatur zu vermindern. Die Messung des Auflagedruckes erfolgte über ca. 7 cm2 große Drucksensoren unter den Tubera ossis ischii.
Der durchschnittliche Auflagedruck der Patienten in Ruhe betrug rechts 99 mm Hg, links 76 mm Hg. Durch Stimulation kam es zu einer signifikanten Verminderung des Auflagedruckes: Rechts auf 55 mm Hg, links auf 49 mm Hg. Der durchschnittliche Druckabfall betrug auf der rechten Seite 44 mm Hg, auf der linken 27 mm Hg (= 35 %). Diese Art der Funktionellen Elektrostimulation ersetzt nur teilweise die übliche Methode der Sitzentlastung durch Hochstützen mit den Armen.
Meiner Meinung nach ist in diesem Fall die Funktionelle Elektrostimulation über einen Zeitraum von 30 min pro Tag (= Stimulationszeitraum) zu kurz angewendet, um eine sinnvolle Sitzentlastung und Decubitusprophylaxe zu bewirken. Durch diese Stimulation im Sitzen ist nur eine Druckreduktion um ca. 30 bis 50 % möglich, wodurch die Durchblutung von Haut und Subkutis weiterhin eingeschränkt bleiben. Außerdem ist diese Anwendungsform zu kompliziert, um als alltägliches Rehabilitationsmittel angenommen zu werden.
Vielmehr empfiehlt es sich, die übliche Form der Sitzentlastung im Rollstuhl bei Paraplegikern durch Aufstützen mit beiden Armen weiterzupflegen und mit FES ein aktives Steh- oder aktives Gehtraining durchzuführen, wodurch nicht nur ein vermehrtes Herz-Kreislauftraining, sondern auch eine komplette Entlastung der Sitzfläche bewirkt wird.
Zur therapeutischen Stimulation der Glutäalregion empfehlen wir unseren Patienten die Stimulation in Bauchlage, um so unter Druckentlastung eine maximale Hyperämie in Haut, Unterhaut und Muskulatur bewirken zu können. Siehe auch Kapitel: Ergebnisse der Xenon-Clearance, Thallium-Szintigraphie und Infrarotthermographie.
Bei einigen unserer berufstätigen Patienten, die längere unfreiwillige Sitzzeiten im Rollstuhl bis 14 Stunden auf sich nehmen müssen, hat sich eingebürgert, daß sie bei Auftreten einer leichten Rötung am Gesäß die Funktionelle Elektrostimulation sehr intensiv einsetzen, um so zur raschen Abheilung der gefährdeten Stelle beizutragen.
Kardiovaskuläre Fitness und Gesundheit
Pulmonale und kardiovaskuläre Erkrankungen sind aufgrund der sitzenden Lebensweise und Inaktivität die Haupttodesursachen bei Paraplegikern und Tetraplegikern. Die Hauptsymptome und Gesundheitsprobleme sind eine verringerte kardiovaskuläre Fitness, respiratorische Funktion, Muskelmasse und Ausdauer, verringerte Serum-HDL-Proteinfraktion, Knochendichte, Osteoporosebildung sowie eine verringerte Endorphinproduktion und Auftreten von Depressionen. Zusätzlich kommt es zu einer Verminderung der Stresstoleranz sowie der Insulinsensibilität.
Um die kardiovaskuläre, metabolische und humorale Fitness zu erhöhen, muss ein Ausdauertraining mit entsprechend hohen Herzfrequenzen durchgeführt werden. Es ist bekannt, dass für ein effektives Ausdauertraining die willkürlich aktivierbare Muskelmasse bei Paraplegikern und insbesondere bei Tetraplegikern zu gering ist, um trainingswirksame Herzfrequenzen zwischen 120 und 140 Schlägen pro Minute zu erreichen. Bei Paraplegikern sind Übungen mit der oberen Extremität (Zirkeltraining, Wagerltraining, Sport und Spiel, Marathon sowie diverse Sprintbewerbe) sinnvoll und wertvoll.
Zur Aktivierung der grossen Muskelmassen der unteren Extremitäten bietet sich die funktionelle Elektrostimulation an. Dadurch werden die Übungsprogramme für Herzfrequenz-, Blutdruckregulation, vegetatives Nervensystem, allgemeinen Stoffwechsel und Hormonregulation (Insulin, Glucagon, Adrenalin), Fettstoffwechsel, Blutzuckerregulation sowie lokale Durchblutungs- und Ausdauerverbesserung effektiver gestaltet.
Bezüglich der Verbesserung der kardiovaskulären Fitness bei Paraplegikern ist auch nach Jahren der Lähmung der Körper durch ein gezieltes FES-Ergometertraining mit ausreichend hohem cardiorespiratorischen Trainingsreiz noch trainierbar und dafür die FES laut Petrofsky 1991 (239, 240) sinnvoll einsetzbar.
Alle Studien mit Paraplegikern, zumeist an einem FES-Ergometer durchgeführt, zeigten eine Erhöhung der aeroben Kapazität, der Ausdauer, der VO2 max sowie eine höhere Herzfrequenz bei maximaler Sauerstoffaufnahme (Ragnarsson 1988 (249), Pollak 1989 (244), Arnold 1992 (8), Petrofsky 1992 (240), Hooker 1992 (118), Ashley 1993 (9), Krauss 1992 (167), Glaser 1989, Faghri 1992 (72)).
FES-Ergometrie
Auch unsere Arbeitsgruppe hat in den Jahren 1987 und 1988 FES-Ergometrien durchgeführt, wobei M. glutaeus und M. quadriceps stimuliert wurden. Ein ursprünglich zum FES-Radfahren in der Ebene erfolgreich eingesetztes Fahrrad wurde zu einem Trainingsgerät (Home-Trainer) umgebaut, das auch gleichzeitig als Ergometer genützt werden konnte. Dazu wurde das linke hintere Rad durch eine kugelgelagerte Stütze ersetzt, um zusätzliche Stabilität zu erreichen. Das rechte Hinterrad wurde auf 2 Rollen aufgesetzt, wobei die vordere Rolle auf der Achse eines Gleichstromnebenschlußmotors aufgesetzt war, sodaß der Patient mit mehr oder weniger Motorunterstützung Rad fahren konnte. Der zusätzliche Motor für den Ergometerantrieb war notwendig, um die Aufwärmarbeit für den aktiven und passiven Bewegungsapparat zu ermöglichen und die mechanische Reibung des Ergometers zu kompensieren. Die Steuerung der Elektrostimulation erfolgte durch Positionsgeber, die die Stimulationsperioden je nach Beinstellung bzw. Tretkurbel-stellung vorgaben.
Die Stimulation erfolgte über die FES-2-Kanalgürtel und üblichen Elektroden an Oberschenkel und Glutealmuskulatur. Durch ein weiteres Steuergerät konnten wir die Höhe der Amplitude und die Anstiegsteilheit des Impulses verändern. Bei der Ergometrie erfolgte damit eine 5minütige passive Aufwärmphase mit ca. 60 Umdrehungen pro Minute. Neben der günstigsten physiologischen Drehmomenterzeugung erwies sich diese Drehzahl günstig, um einen runden Bewegungsablauf und eine ausreichende Spasmushemmung zu gewährleisten. Nach der Aufwärmphase schalteten wir die geringste Stimulationsintensität, die eine Leistung hervorbrachte, zu (20 Volt) und steigerten bis zum sinnvollen Maximum (ca. 60 Volt Spitze/Spitze). Reziprok zur Stimulationsintensität wurde die Motor-unterstützung zurückgeregelt, um die absolute Leistung und das Tempo gleichzuhalten. Nach Eichung der Ergometrieeinheit ergaben die mechanischen Leistungsdifferenzen von Motor und Ergometer die Leistung des Patienten.
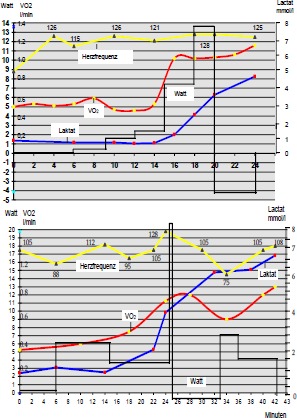
Die Ergometrien wurden mit stufenförmiger Steigerung bis zu einer Höchstdauer von 30-40 min durchgeführt. Jedoch stand die am Ergometer physikalisch messbare Leistung in keinem Verhältnis zu der tatsächlichen Muskelarbeit, die dem kontinuierlichen treppenförmig ansteigenden Blutlaktat und der Sauerstoffaufnahme (siehe Tab. 1 und 2) entsprach.
Tab. 1 u. 2:
Fahrrad-Spiroergometrie zweier spastisch gelähmter Patienten mit tlw. erheblichem Laktatanstieg und gesteigerter Sauerstoffaufnahme, jedoch geringer Trainings-herzfrequenz und extrem niedriger mechanischer Leistung.
 |
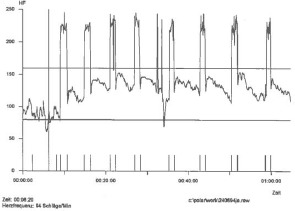
Tab. 3:
Die Herzfrequenzkurve beim stimulierten 4-Punkte-Gang zeigt Pulswerte zwischen 120 und 150 sowie Artefakte durch die Stimulation.
 |
Die Probleme der FES-Ergometrie, die bei allen Arbeitsgruppen auftreten (maximal werden ca. 20-40 Watt meßbare Leistung angegeben), sind die langsame Relaxation spastisch aktivierter Beinmuskulatur und die Mitstimulation der Antagonisten durch zu große elektrische Felder bei höherer Intensität. Als Beweis dafür siehe die computertomographischen Ergebnisse bei spastischen, aber insbesondere bei denervierten Patienten, wo trotz fehlender Nerven durch die Quadriceps-Stimulation ein Training der Oberschenkelbeugemuskulatur und eine Muskel-Flächenvergrößerung um ca. 11 % bewirkt wurde. Es ist somit beim FES-Radfahren bzw. bei der FES-Ergometrie stets eine Beeinträchtigung der physikalisch messbaren Leistung durch die Mitstimulation der Antagonisten zu erwarten.
Erwähnen möchte ich auch die Beobachtung von Ashley 1993 (9), daß es bei Patienten mit Rückenmarksverletzungen aufgrund der autonomen Dysreflexie durch Elektrostimulation auch zu unerwarteten Effekten mit massivem Anstieg von Blutdruck und massivem Abfall der Herzfrequenz kommen kann.
Die autonome Dysreflexie ist ein Syndrom mit unkontrollierten Reflexen aufgrund sympathischer Fehlsteuerungen bei Querschnittspatienten mit Läsionen oberhalb des Splanchnicusgebietes (ca. Th6). Als Antwort auf nozizeptive Reizung unterhalb der Läsion kann es zu einer Bradykardie mit sekundärer Hypertonie, Angstgefühl, Schweiß-ausbrüchen, Kopfschmerzen, Piloerektion sowie dem damit verbundenen Anstieg des Noradrenalinspiegels im Blut kommen. Laut Ashley kann es auch durch Reizung der Barorezeptoren im Aortenbogen und Carotis sinus und in weiterer Folge der vagalen Zentren zur Bradykardie kommen. Die deszendierenden inhibitorischen Fasern mit vasodilatatorischem Effekt können jedoch die spinale Läsion nicht überqueren, dadurch kann der kompensatorische Blutdruckabfall unterhalb der Läsion nicht auftreten und die Hypertonie bleibt oder steigt weiter an. Sofort nach Beendigung der Elektrostimulation und damit der nozizeptiven Afferenzen kann es zu einem Rebound-Phänomen kommen.
Überwachung der Herzfrequenz, des Blutdruckes und der klinischen Reaktionen des Patienten ist am Beginn eines FES-Trainings, besonders bei völlig untrainierten Paraplegikern und besonders bei Läsionen in der oberen BWS, sicherlich notwendig. Mit Zunahme des Trainingszustandes kann der Patient zumeist selbst seine vegetativen Reaktionen abschätzen und die Trainingsbelastung und die Pausen danach abstimmen. Wetterfühligkeit und Luftdruckschwankungen, aber auch feuchte Übergangswetterlagen können die momentane Trainingsbelastbarkeit bei Paraplegikern erheblich beeinflußen. Diese Probleme wirken sich jedoch nicht auf den Gesamttrainingsplan aus, da sie zumeist nur vorübergehende Störgrößen der Tagesverfassung sind und mit zunehmender Gesamttrainingsdauer (nach ca. 3-6 Monaten) nicht oder nicht mehr störend oder gefährdend auftreten.
Hybrid-Ergometrie
Eine Vermehrung der eingesetzten Muskelmasse führt zweifellos zu einer höheren cardio-respiratorische Belastung und Trainingswirksamkeit.
Daher sind die von Hooker 1992 (118), Faghri und Glaser 1992 (72) und Krauß 1992 (167) beschriebenen Hybrid-Ergometrien, die im Leistungssport von Hoppeler (119-123) und in der Raumfahrt als 4-Extremitäten-Ergometrie beim österreichischen “MIR-Projekt” von Bachl (10) angewandt werden, in ihrer Trainingseffektivität deutlich höher einzuschätzen als FES-Ergometrie alleine oder Arm-Ergometrie (armcranking) alleine. Durch die Kombination der Ergometrie der oberen und unteren Extremitäten entstehen entsprechend der größeren Muskelmasse größere cardiorespiratorische Trainingsreize und damit vermehrte und deutlichere Anpassungsreaktionen.
Der apparative Aufwand dafür ist jedoch relativ hoch und nur in einem Rehabilitationszentrum, jedoch keinesfalls in der ambulanten Therapie bzw. in der Therapie zu Hause sinnvoll bzw. ökonomisch einsetzbar.
Bessere Ergebnisse könnten durch Änderung der Trainingsbelastungen möglich sein. Neben der FES-Ergometrie oder Hybridergometrie bzw. Oberschenkelstimulation im Sitzen bewirken die mittels FES ausgelösten Funktionen FES-Aufstehen und FES-Gehen mit spastischer Kokontraktion der Oberschenkelbeuger- und Wadenmuskulatur einen noch größeren Trainingseffekt auf die Muskulatur selbst und durch Aktivierung größerer Muskelmassen einen besseren Effekt auf das kardiovaskuläre System und den Fettstoffwechsel (siehe Tab. 3).
Tab. Imp. 1:
Jahresübersicht der weltweit 1. Implantation
| Funktionelle Elektrostimulation | ||||||
| Monate | 2 | 3,5 | 5 | 6 | 9 | 1 Jahr |
| OP Einheilungszeit | Muskeltraining | Erste Stehversuche | Erste Schritte | Gangschulung zwei Krücken | Ergeb. | |
| Kraftmessung | * | * | * | * | * | |
Daher hat unsere Arbeitsgruppe den Bereich des FES-Ergometertrainings verlassen, und wir ziehen das aktiv stimulierte Aufsteh- und Stehtraining und das Gehen mittels Funktioneller Elektrostimulation im 4-Punkt-Gang, teilweise auch im Schwunggang, insbesondere bei jüngeren Patienten dem Radtraining vor.
Die Vorteile des Geh- und Stehtrainings gegenüber dem Radtraining sind Einsatz von noch größerer Muskelmasse, besseres Kreislauf- und Orthostasetraining, vermehrte Belastung der passiven Knorpel-, Knochen-, Sehnen und Bandstrukturen durch Impulskräfte, die die Knochenneubildung anregen. Weitere Vorteile sind:
leichterer Einsatz des Steh- und Gehtrainings, ohne großen Aufwand auch zu Hause jederzeit möglich
keine aufwendige Ergometer-Apparatur notwendig
vermehrte Stabilitätsarbeit mit dem Rumpf
größere Motivation durch Mobilität des Patienten
bessere Decubitusprophylaxe durch völlige Druckentlastung
Kontrakturprophylaxe, insbesondere für die Hüftextension und Knieextension sowie Sprunggelenksbeweglichkeit
Osteoporoseprophylaxe, Knochenneubildung
Vergrößerung und Training aktiv arbeitender Muskelmassen
Der routinemäßige Einsatz von FES-Steh- und Gehtraining erscheint uns funktioneller und überall, bei minimiertem technischem Aufwand, möglich.
Muskelmasse, Kosmetik, Histologie bei Paraplegie
Bereits 1841 wurde von Reid (258) die Electrostimulation zur Therapie gelähmter Muskel vorgeschlagen. Es dauerte aber ca. 120 Jahre bis zum ersten Einsatz der Funktionellen Stimulation.
Die quantitativen und qualitativen Auswirkungen der FES auf Muskelmasse und Histologie sind erst in den letzten 10 Jahren Gegenstand einzelner Forschungen.
Wurde in früheren Jahren insbesondere bei gelähmter Muskulatur das Muskelgewicht im Tierexperiment als relevante Größe herangezogen, so werden nunmehr bioptische, chemisch analytische, immunologische und moderne radiologische sowie thermologische Nachweismethoden im Bereich der Rehabilitation von Querschnittgelähmten eingesetzt. Zahlreich sind die Versuche im Tierexperiment bei und nach Immobilisation, nach Nervenläsion und nach Elektrostimulation u. a. von:
Pette, Vrbova (241), Hudlicka (126), Reichmann (252), Heilig (104, 105), Kernell (156, 157), Green (94), Eerbeeck (66), Donselaar (59), Carraro et al. (44), Wakim und Krusen in den 50er Jahren, Hoppeler (119, 123), Lomo (179, 182), Magyarosy (186), um nur einige wichtige Autoren aufzuzählen.
Viel weniger bzw. kaum vorhanden sind die Aussagen für den Humanbereich: Söderlund (287), Salmons (264, 265), Gollnick (88), Gibson (85), Eriksson (70, 71), Duchateau und Hainaut (61, 62), Lake (169). Diese Autoren bearbeiteten den Therapiebereich nach Immobilisation und bei Elektrostimulation.
Nur mehr vereinzelt gibt es Veröffentlichungen über Histologie, Zellstruktur und Leistungsphysiologie bei Paraplegie, die erst in den letzten Jahren international bearbeitet werden: Solomonow (288, 289), Kern (145, 146), Rabischong (247, 248), Greve (96), Taylor (299), Gordon (89).
Im Jahre 1984 untersuchten Mayer (193) et al. bei Katzen mit iatrogener, hoher BWS Querschnittläsion die histochemischen Eigenschaften der betroffenen Muskulatur. Er fand eine Abnahme der Zahl der Typ IIa- und Typ I-Fasern sowie eine relative Zunahme der Typ IIb-Fasern.
Aufgrund der veränderten Muskelaktivität durch Spastizität und Immobilisation kommt es zu einer Veränderung in der Fasertypenzusammensetzung der motorischen Einheiten in Richtung schneller ermüdbarer Fasern.
Diese im Tierexperiment beobachtete Veränderung der Fasertypenzusammensetzung ist auch bei Menschen mit traumatischer Rückenmarksläsion zutreffend: Greve et al. 1993 (96), Kern et al. 1986 (144, 145). Die Fasertypenverteilung wurde meistens bioptisch mit der ATPase-Technik bestimmt.
Durch Messung des Faserdurchmessers sowie Abzählen der Fasern jeder Probe kann ein Atrophie Index bestimmt werden. Bei Patienten mit spastischgelähmter Muskulatur beträgt der Muskelfaserdurchmesser im Durchschnitt weniger als 50 µm, unabhängig vom Fasertypus. Bei Gesunden liegt die Faser-Größe zwischen 60 und 100 µm.
Im Gegensatz zu unseren sehr positiven ersten Versuchen und unserer klinischen Erfahrung mit Funktioneller Elektrostimulation seit 1982 konnte Greve 1993 (96) bei seinen Untersuchungen mit relativ kurzfristiger FES (6 Wochen) keine Veränderung der Fasergröße und auch keine makroskopisch sichtbare Hypertrophie finden. Daher galt es die langfristigen Auswirkungen der Funktionellen Elektrostimulation über 8 Monate in dieser Arbeit zusammenfassend darzustellen bzw. mit unserer Stimulations-Methodik zu verifizieren.
Auch zeigten einige Studien mit FES-Ergometrie eine Zunahme der Muskelmasse des M. quadriceps sowie weniger Fetteinlagerungen nach dem Training. Die Überprüfung erfolgte entweder durch Messung des Umfanges (Arnold 1992 (8)), mittels Computertomographie (Ragnarsson 1988 (249), Pollak 1989 (244), Bremner 1992 (29), Pacy 1988 (225)) oder mittels Tiefenmessung der Muskulatur mit Ultraschall (Taylor et al. 1993 (299)).
Bei Patienten mit Verletzungen des Rückenmarkes verläuft die Atrophie der Muskulatur sehr schnell und dramatisch. Taylor konnte 1993 bei Patienten mit frischen Verletzungen des Rückenmarkes und mittels Ultraschallmessung den Verlauf der Atrophie der Muskulatur dokumentieren. Innerhalb des ersten bis fünften Tages kam es zu einer Muskelreduktion von 16 % sowie zu einer subkutanen Fettreduktion von 6,5 %. Zwischen dem 5. und 20. Tag verloren die Patienten 42 % der Muskeltiefe des M. quadriceps, ab dem 40. Tag kam es kaum mehr zu weiteren Veränderungen.
Ein Trainingsprogramm mit Elektrostimulation des M. quadriceps verhinderte diese Atrophie weitgehend und förderte die Zunahme der Muskelkraft (Taylor et al. 1993 (299), Rabischong et al. 1992 (247), Bremner et al. 1992 (29)).
Die Atrophie ist in den ersten 3 Wochen nach Verletzung am massivsten ausgeprägt und führt bis zum 20. Tag zu einem ca. 50%igen Muskelverlust sowie zu einem 40%igen Fettverlust.
Mit Funktioneller Elektrostimulation kommt es neben der Erhöhung der Muskelkraft und der Erhaltung bzw. Vermehrung der Muskelmasse zur Verbesserung des kosmetischen Erscheinungsbildes und zu vermehrter Erwärmung der Beine, die eine Verbesserung der Hautdurchblutung in der Peripherie anzeigt. Das kosmetisch befriedigende Erscheinungs-bild ist für einige Patienten ein sehr wesentlicher Motivationsfaktor.
Durchblutungsförderung
Der positive Effekt der Elektrostimulation, den die Paraplegiker subjektiv durch Erwärmung ihrer Beine erfahren, kann mittels Messung der Durchblutung plethysmographisch vor und nach FES-Training objektiviert werden, Taylor et al. 1993 (299). Die Durchblutung des Oberschenkels, die vor dem Training um ca. 1/3 des Normalwertes vermindert war, kann durch Training fast normalisiert werden. Dieser Effekt ist unabhängig vom Herz-minutenvolumen und daher ein lokaler Effekt.
Eine signifikante Abnahme des totalen peripheren Widerstandes zeigt eine periphere zirkulatorische Adaptation (vermehrte Kapillarisierung) nach Training an, Hooker et al. 1992 (118).
Zur Durchblutungsförderung durch FES siehe die Kapitel Methodik und Ergebnisse der Xenon-Clearance und Thallium-Szintigraphie sowie der Infrarot-Telethermographie.
Knochen, Knorpel, Bänder
Ein Training mit Mitaktivierung der unteren Extremitäten neben den Übungen der oberen Extremität hat den Vorteil, daß sekundäre degenerative Erscheinungen an den Knochen und Sehnen der oberen Extremitäten infolge Überanstrengung (Tendinitis, Bursitis, CTS, etc.) vermieden werden können und auch die Knorpel-, Knochen- und Bandstrukturen sowie die Muskulatur der unteren Extremität aktiv miteinbezogen werden. Bei Paraplegikern kommt es zu einer Abnahme der Knochendichte, die beim Femurschaft je nach Dauer der Lähmung bis 33 %, im Bereich der distalen Tibia sogar bis 98 % des Normalwertes nach Pacy et al. 1988 (225) ausmachen kann.
Bis jetzt gibt es keine Daten über den Verlauf des Knochendichteverlustes des Femurs oder der Tibia bei Paraplegikern. Pacy fand nach 20 Wochen Stimulation des M. quadriceps mit Oberflächenelektroden keine signifikanten Änderungen der Knochendichte bei einer Übungsdauer von 15 min täglich. Einige Studien (Kreuler et al. 1983,) konnten jedoch durch ein regelmäßiges Übungsprogramm einen Knochendichteanstieg erzielen.
Wir selbst haben zu wenige Verlaufsbeobachtungen hinsichtlich Knochendichte beim aktiven FES-Steh- und Gehtraining durchgeführt. Daher können wir noch keine statistisch abgesicherten und effektiven Therapievorschläge mit exakten Angaben zur Verzögerung bzw. zum Wiederaufbau der Knochendichte bei paraplegischen Patienten machen. Der Wechsel der Druckbelastungen des Knochens bei unserer Therapiemethode “FES-Gehen” erzielt sicherlich den positivsten Therapieeffekt, da dadurch wieder völlig physiologische Belastungsgrößen der unteren Extremitäten im statischen und langsamen dynamischen Bereich erreicht werden können.
II1/B Mögliche Funktionen mit FES bei Paraplegie
Die Auslösung bestimmter Funktionen wie Aufstehen, Stehen, Gehen, Stiegen Steigen erachte ich als zusätzlich mögliche Trainingshilfe und sportliches Betätigungsfeld. Die Funktion an sich wird bei Paraplegikern in absehbarer Zeit nie Selbstzweck sein, sondern erfüllt als “Mittel zum Zweck” einen besonderen therapeutischen Aufgabenbereich zur Förderung von Trophik und Metabolismus in den gelähmten Körperabschnitten.
Trophik und Metabolismus sowie Funktion sind kein Gegensatz, sondern eine sinnvolle Symbiose im Wirkungsbereich der Funktionellen Elektrostimulation.
Entsprechend der Läsionshöhe, die die Lähmungsart (spastisch oder schlaff), die Reststabilität des Oberkörpers und die mögliche Stützfunktion der Arme und des Rumpfes bestimmt sowie nach der Lähmungs-qualität (komplett oder inkomplett), können verschieden hohe therapeutische Ziele in den Teilbereichen Trophik und Metabolismus sowie Funktion erreicht werden.
Für die Funktionelle Elektrostimulation stehen Implantate bzw. implantierbare oder eingestochene transcutane Elektroden oder die Stimulation mittels Oberflächenelektroden zur Verfügung.
Alle unten angeführten funktionellen Ziele können derzeit nur als zusätzliche therapeutische Aktivitäten zur sportlichen Freizeitgestaltung, für Fitness und zur Bewegungsaktivierung größerer Muskelmassen an den Beinen, für das Herz-Kreislauftraining, zur allgemeinen Prävention und Prophylaxe für Diabetes, Bluthochdruck, Hyperlipidämie sowie zur Förderung der Trophik und des Metabolismus bei spastischen Paraplegikern eingesetzt werden. Auch ist es möglich, bei spastisch gelähmter und denervierter Muskulatur gewisse kosmetische Aspekte durch die Funktionelle Elektrostimulation zu erfüllen.
Bei der Conus-Cauda-Läsion mit den denervierten unteren Extremitäten ist die Funktionelle Elektrostimulation hingegen die einzige Möglichkeit zur Förderung der peripheren Durchblutung und Trophik zur Decubitusprophylaxe.
Ziele bei spastischer und denervierter Paraplegie mit FES:
Funktion als „Mittel zum Zweck“ zur Förderung von:
Trophik und Metabolismus
Durchblutung und Decubitusprophylaxe.
Trainingswirksame tetanische Muskelkontraktionen
Aktives Aufstehen und aktives Stehen
Gehen in der Ebene, auf glattem Boden und
unebenem Feldweg,
Aktives Radfahren, FES-Ergometer bzw. im Freien
Stiegensteigen
sportliches Training des gesamten Körpers
Blasen-, Darm- und Sexualfunktion
Spasmus Kontrolle und neurale Adaptierung
Spasmus Kontrolle durch FES
Über neurale Adaptierungen und Spasmus Regulation durch Funktionelle Elektrostimulation gibt es keine oder kaum internationale Informationen. Unsere eigenen Erfahrungen sprechen für eine noch zu erforschende Intelligenz und Lernfähigkeit des infraläsionären Rückenmarksegmentes.
Ausdrücklich betonen möchte ich, daß dieses Kapitel über neurale Adaptierungen und Spasmus Kontrolle mittels FES meine subjektive Erfahrung und Beobachtungen der letzten 15 Jahre mit Funktioneller Elektrostimulation bei paraplegischen Patienten darstellt. Da die Erfolge sehr gering, kleinschrittig und, wenn überhaupt, nicht vorhersehbar sind, zudem die Objektivierung schwierig ist, haben wir bisher noch keine wissenschaftlichen Verlaufs-beobachtungen veröffentlicht. Die teilweise fast unglaublichen Beobachtungen werden im Kapitel Reinnervation als rein klinischer Erfahrungsbericht wiedergegeben.
Über die Entstehungsmechanismen der Spastizität herrscht nach wie vor Unklarheit. Der Ausfall der extrapyramidalen und pyramidalen Kontrolle alleine genügt heute als Erklärung nicht mehr. Vielmehr scheint die Theorie des spinalen sproutings im Bereich der Läsionshöhe, welches als Regenerationsversuch des Organismus zu werten ist, als zusätzliche Ursache für die Entstehung der Spastizität verantwortlich zu sein. Dass dieser Prozeß jedoch einige Wochen, Monate bzw. Jahre nach der Läsion nicht unbeeinflußbar abgeschlossen ist, möchte ich durch meine klinischen Beobachtungen in den nächsten Kapiteln über neurale Adaptierung und Spasmus-Beeinflussung vermitteln.
Es gibt eine Reihe verschiedener Faktoren, die die Auslösung der Spastizität beeinflussen können:
* Alle sensiblen, sensorischen und besonders vegetativen Afferenzen über physiologische Fazilitation und Inhibition
-
* Externe, zumeist nozizeptive Faktoren, wie z. B.:
Harnwegsinfekte und allgemeine Infekte
Druckgeschwüre und andere Entzündungen
Muskel- und Gelenksläsionen wie Kontrakturen,
Zerrungen etc.
Heterotope Ossifikationen
Tiefe Venenthrombose und Hämorrhoiden
Elektrostimulation
Starke Spastizität kann die Lebensqualität beträchtlich senken, die Funktionen, Bewegungen und Alltags- aktivitäten beträchtlich erschweren oder sogar verhindern. Neben medikamentöser Therapie wird derzeit hauptsächlich Heilgymnastik in der Patienten-behandlung angewandt.
Zu wenig Bedeutung wird bisher der Funktionellen Elektrostimulation in der Spasmuskontrolle, Kralj (166), Bowman (27, 28), Kristjan (168), beigemessen. Tonolyt (Dr. Schuhfried, Wien) und Spasmotron wurden in unserer Generation schon wieder vergessen.
Bei gut trainierten und durch Funktionelle Elektrostimulation ausbelasteten und ausgelasteten Muskeln erreicht auch der Patient mit hoher Spasmus Neigung ein längeres Spasmus freies Intervall bis zu einem Tag.
Spasmus Kontrolle bzw. Spasmus-Unterbrechung durch kurze agnostische Stimulation (beim Streckspasmus der unteren Extremität durch kurze Stimulation des M. quadriceps) für weniger als 1 Sekunde oder durch Stimulation der Antagonisten sind Phänomene, die einer gründlichen wissenschaftlichen Bearbeitung bedürfen.
Die Wirkung der Elektrostimulation auf das vegetative Nervensystem und die Erhöhung der Streßtoleranz bei Paraplegikern verhält sich wie bei trainierten Normal-personen (Twist et al. 1992 (306)).
Spasmus Häufigkeit
Fest steht, daß durch regelmäßige Funktionelle Elektrostimulation beider unteren Extremitäten die Spasmen nicht häufiger, sondern sogar seltener auftreten. Vergleiche auch Kralj (165, 166) und Acimovic (2). Diese Reduzierung der Häufigkeit der Spasmen ist nur durch eine tägliche muskuläre Ausbelastung, durch eine tägliche “effektive Stimulation” zu erreichen. Treten hingegen Spasmen auf, wenn auch seltener, so wirkt sich die erhöhte Muskelkraft teilweise negativ in Form stärkerer Spasmen aus. Nur 2 von ca. 42 Patienten mussten bisher auf Grund ihrer zunehmenden Spasmen die Elektrostimulation abbrechen. 1 Patient davon war in dieser Versuchsserie die Nr. 12, wodurch wir keine zweiten Kontrollwerte erhalten konnten.
“Intelligenz” bzw. neurale Adaptierung der infraläsionären Rückenmarks-Segmente
Wir können durch gezielten Einsatz der Funktionellen Elektrostimulation bereits in der vorbereitenden Krafttrainingsphase und besser noch in der Aufsteh- und Standphase behindernde Beugespasmen der Patienten in Strecksynergien verwandeln. Diese spastische Aktivierung in das Streckmuster wird vorwiegend elektrisch induziert und bleibt dann weiterhin bestehen (eigene Beobachtungen).
Für das Aufstehen und Gehen mittels Funktioneller Elektrostimulation sind Beugespasmen absolut hinderlich und müßen durch Strecksynergien, die die Sicherheit der Patienten im Stehen und Gehen erhöhen, ersetzt werden. Die störende spastische Aktivierung wird somit zur Synergie und nicht zum Hindernis. Welche neurale Adaptierungen und synaptischen Verschaltungen auf Rückenmarksebene dazu führen, muss noch geklärt werden!
Außerhalb des Bereiches der Funktionellen Elektrostimulation werden derzeit unter dem Titel „Spinale Lokomotion“ von Wernig und Müller 1992 und 195 (314-316) sowie Barbeau 1989 (12) die tierexperimentellen Ergebnisse von Grillner 1981 (97) und Edgerton (Lovely et al 1986, 183) bei inkompletten querschnittgelähmten Patienten in der Therapie eingesetzt. Dabei wird am Laufband versucht spinale Bewegungsmuster zu reaktivieren und Gangautomatismen zu induzieren. Dieses Laufbandtraining bei inkompletten querschnittgelähmten Patienten wird auch von Dietz (56) unter EMG-Beobachtungen eingesetzt.
Diese wichtigen experimentellen Forschungen über die Funktion der infraläsionären Rückenmarks-Segmente werden in Zukunft sicherlich auch für den Einsatz der Funktionellen Elektrostimulation ausgewertet werden können. Mit FES könnte der Trigger der Bewegungsund Schreitmuster möglich sein. Aber auch hier sind Forschungsarbeiten für die nächste Zukunft notwendig, um diese moderne Möglichkeit der Rehabilitation für inkomplette und evtl. auch für komplett querschnittgelähmte Patienten umzusetzen.
Reinnervation
Völlig komplett gelähmte Paraplegiker sind durch die Verbesserung der posttraumatischen Versorgung relativ selten. Vielmehr bestehen bei fast allen Patienten oft unbemerkte geringe Restsensibilitäten und Restmotorik, die jedoch für eine Funktion völlig unzureichend sind. In der Regenerationsphase dürften jedoch die dendritischen Verbindungen im Rückenmark durch zuwenig funktionelle Reize teilweise verloren gegangen bzw. nicht mehr im entsprechenden Ausmaß gebildet worden sein. Nur so ist es zu verstehen, daß auch Jahre nach der Läsion durch konsequente Elektrostimulation, deren Wirkung ich hier als “bahnende Reflextherapie” bezeichnen möchte, kleine, aber für die Stellreflexe und Motivation der Patienten ungeheuer wichtige sensible und motorische Verbesserungen auftreten.
Sensibilität
Auch gestörte Sensibilität an den unteren Extremitäten ist eine besonders wichtige Fähigkeit für die Decubitusprophylaxe. Nur so werden unwillkürliche Stellreflexe ausgelöst, die helfen, einen zu langen Dauerdruck und somit eine Durchblutungs-verminderung zu verhindern.
Die von mir öfters beobachtete Sensibilitätsverbesserung beginnt oft mit Dysästhesien und Hyperästhesie, die an einem kleinem Hautareal der unteren Extremität beginnen und sich langsam nach distal und proximal ausbreiten können. Erst langsam lernt der Patient wieder zu diskriminieren. Zumeist wird jedoch keine normale Sensibilität erreicht, und es bleiben Parästhesien bestehen.
Die Sensibilitätsverbesserungen durch Elektrostimulation, die auf einer Reaktivierung vorhandener, aber nicht genützter Nervenbahnen und/oder auf der Auslösung neuer Verschaltungen beruhen könnten, sind zumeist auch mit einer vegetativen Verbesserung verbunden. Diese oft auch nur minimalen und segmentförmigen vegetativen Verbesserungen schaffen neben einer verbesserten Hauttrophik auch eine bessere periphere Durchblutungsreaktion bis in die Zehenspitzen hinein (siehe unterschiedliche Durchblutungsreaktionen auf FES mittels Infrarot-Telethermographie bei denervierten und spastischen Patienten). Oft genügen scheinbar geringe Verbesserungen in der vegetativen Innervation, um eine ausreichende trophische Verbesserung beider Füsse hervorzurufen!
Auch eine minimale Verbesserung der sensiblen und vegetativen Innervation schafft für den Patienten neben ungeheuerlicher Motivation auch eine wesentliche trophische Verbesserung und läßt die Decubitusgefahr sinken.
Motorik
Die motorische Besserung fällt, wenn überhaupt, stets geringer aus als die sensible und vegetative. Auch hier ist der Weg der neuen motorischen Bahnung völlig unklar. Es dürfte sich jedoch bei der motorischen Verbesserung, wie im sensiblen und vegetativen Bereich, um die Reaktivierung von vorhandenen, jedoch nicht genützten Bahnen bzw. neue segmentale Verschaltungen handeln. Der Prozeß der motorischen Reinnervation erfolgt ganz langsam und in kleinen Schritten. Diese langsame Besserung läßt nicht auf eine plötzliche Reaktivierung, sondern auf eine zunehmende Aktivierung und neue synaptische Verschaltung auf Rückenmarksebene schließen. Vom Zustand des Rückenmarks kann auch in der Kernspintomographie nicht auf eine mögliche motorische Verbesserung rückgeschloßen werden.
Zwei inkomplette Patienten, die im Rollstuhl zu uns kamen, haben durch konsequente Stimulation und durch konsequentes Üben einen Zustand erreicht, in dem sie aus dem Rollstuhl aufstehen, über eine Wegstrecke von 50-100 m und über Stiegen mit Hilfe zweier bzw. eines Gehstockes gehen können. Die funktionelle Besserung wurde jedoch langsam zum Teil durch Förderung und Hemmung von Reflexaktivitäten mit FES und Unterwasser-Therapie über 2-3 Jahre erreicht. Bewegungsmuster, die anfänglich überhaupt nicht möglich oder spastisch erheblich gestört waren, konnten durch bahnende Reflextherapie mit FES (Peronaeusreflex, Oberschenkelstreckung, Hüftbeugung, aber auch Dorsalextension des Fußes beim Gehen in der Ebene und beim Stiegen steigen) ausgelöst, verbessert und eingeübt werden.
Aus diesen Einzelbeobachtungen möchte ich nur ableiten, daß die Rehabilitation bes. bei inkompletten querschnittgelähmten Patienten nicht nach ½ bzw. ¾ Jahr abgeschlossen ist. Auch sind die Aufenthalte zum Wiederholungstraining alle 2 Jahre sicherlich zu kurz und zu selten, um eine effektive Ausnützung der Restfunktion auf neuraler Ebene bzw. die Bahnung neuer neuraler Verschaltungen auf Rücken-marksebene zu erreichen. Der kontralaterale Transfer und die Bahnung neuer Bewegungsmuster sollten bei inkompletten Patienten, bei denen das Willkür-training nicht den gewünschten Erfolg gesetzt hat, durch Funktionelle Elektrostimulation als bahnende Reflextherapie unterstützt werden.
Daher wage ich zu behaupten, daß ein konsequentes Training 3-4 x wöchentlich über 1-2 Jahre, durchaus mit einer Latenz von einigen Monaten zum Rehabilitationsaufenthalt, aber in Ergänzung zu diesem, durchgeführt werden sollte. Erst wenn im Abstand von mindestens 2-3 Jahren zur posttraumatischen Rehabilitation und nach monatelanger kombinierter physikalischer Therapie, evtl. im Intervall, bestehend aus Funktioneller Elektrostimulation, mentalem Training, Heilgymnastik, funktionellem Üben und allen Arten von Reflextherapien wie Bürsten, Massagen und unspezifischer Elektrostimulation, Thermo-stimulation etc. kein Erfolg eingetreten ist, kann von keiner weiteren Verbesserung der neuralen Leistungen (Sensibilität, vegetative Steuerung und Motorik) ausgegangen werden.
Ein intervallmässiges Fortsetzen der Therapie bis zu 5 Jahren nach dem Trauma, bei kleinen Besserungsschritten im ersten Jahr, scheint sinnvoll zu sein. Danach ist meiner Meinung nach mit keiner weiteren Besserung zu rechnen.
Aufstehen, Stehen, Gehen mit FES
Wichtig erscheint mir, daß derzeit alle Arten der Fortbewegung mit Funktioneller Elektrostimulation nur sportlich therapeutische Aktivitäten sein können, die als zusätzliches Training, als aktive Freizeitgestaltung und zusätzliche Möglichkeit der sportlichen Bewegungsaktivierung eingesetzt werden können, um besonders bei spastischer Paraplegie vorrangig als “Mittel zum Zweck” zur Förderung von Trophik und Metabolismus zu dienen.
Seit ca. 15-20 Jahren, mit dem Fortschritt der Technologie und Mikroelektronik, erlebte der klinische Einsatz der Funktionellen Elektrostimulation durch Forschungsarbeiten mehrerer Arbeitsgruppen zahlreiche neue Impulse.
Die Forschungsgruppe von Marsolais, Mortimer und Peckham in Cleveland ist besonders erfolgreich bei der Mobilisierung spastischer Paraplegiker mit transcutanen Elektroden, die von Marsolais von der Innenseite der Oberschenkel nahe der Leiste bis zu den motorischen Nerven der Bein- und Glutäalmuskulatur eingestochen werden. Dabei konnte ein relativ schnelles Gangbild mit Rollator und das Stiegen steigen aufwärts und abwärts erreicht werden. Diese direkte Nervenstimulation bewirkt, genauso wie die FES mit Implantaten, eine selektive Stimulation einzelner Muskeln und Muskelgruppen und somit eine größtmögliche Funktion ohne wesentliche spastische Störeinflüße. Nachteile dieser transcutanen Stimulation sind die hohe Infektionsrate und die Elektroden-dislokation, wodurch ein häufiger Elektrodenwechsel notwendig wird. Die hervorragenden Arbeiten von der Gruppe Marsolais in Cleveland sind die Grundlagen zukünftiger FESBewegungsmuster mit implantierten Beinschrittmachern. Die Akzeptanz der Implantate und transcutanen Elektroden ist jedoch weitaus geringer als die der Oberflächenstimulation.
1982 wurde in Wien die weltweit erste Implantation eines Beinschrittmachers für paraplegische Patienten durchgeführt (112, 150, 300). Seither ist die Wiener Arbeitsgruppe (siehe oben) auf dem Gebiet der klinischen Anwendung der 8-Kanal-Implantate als Beinschrittmacher weltweit führend. Die 8-Kanal-Implantate mit Epineuralelektroden sind im Rahmen der Arbeitsgruppe bisher 4x als Beinschrittmacher zur Reaktivierung der gelähmten Beine von Paraplegikern und 16x als Atemschrittmacher tetraplegischer Patienten für das elektrostimulierte Zwerchfell erfolgreich eingesetzt worden. Mit Hilfe der Beinschrittmacher-Systeme ist es für die Patienten möglich, selbständig aufzustehen und mit Unterarm-Stützkrücken kurze Strecken zu gehen.
In jüngerer Vergangenheit wurden zunehmend Methoden der Oberflächenstimulation angewendet und entwickelt (Arbeitsgruppe in Laibach mit Kralj und Bajd, Vodovnik; Rabischong in Montpellier; Petrofsky in Dayton; Vossius in Karlsruhe und Kern in Wien).
Erreichbar sind eine Knie- und Hüftstreckung mittels Stimulation des M. quadriceps femoris und des M. glutaeus maximus sowie eine Reflexbeugung von Knie und Hüfte durch Stimulation des N. peronaeus, die über kleine Elektroden unter dem Fibulaköpfchen und kurze, kräftige Stimulation ausgelöst werden.
Da möglichst viele Paraplegiker zur Erhaltung der kardiovaskulären Fitness und Gesundheit mit Funktioneller Elektrostimulation betreut werden sollen, ist die Stimulation mit Oberflächenelektroden die ökonomisch sinnvolle und einfachere Form der Funktionellen Elektrostimulation.
Kralj veröffentlichte 1989 seine großen Erfahrungen (166) und eine 9jährige Studie mit über 500 Patienten mit Rückenmarksverletzungen und dem Einsatz der Funktionellen Elektrostimulation zum Gehen mit Oberflächenstimulation. Von den 500 Verletzten wurden 76 Patienten für die Studie ausgewählt, 50 davon hatten eine komplette Querschnitts-symptomatik zwischen Th4 und Th12. 25 Patienten konnten letztendlich mit Einsatz der Funktionellen Elektrostimulation mit Oberflächen-Elektroden gehen (5 %), 16 Patienten (= 3,2 % aller Patienten) waren noch nach 9 Jahren dabei und übten regelmäßig das Gehen.
Para- und Tetraplegiker leiden unter verschiedensten Symptomen, die aufgrund ihrer sitzenden Lebensweise und Inaktivität auftreten, wie z.B. eine verringerte kardiovaskuläre Ausdauer, eine verringerte respiratorische Funktion, verringerte HDL-Protein-Fraktionen im Serum, etc.. Die Haupttodesursachen sind sekundäre Erkrankungen aufgrund ihrer sitzenden Lebensweise.
Ausdauertraining mit z. B. FES-Ergometrie, kombiniert mit Arm-Ergometrie, steigert die lokalmuskuläre und cardiorespiratorische Ausdauer und hilft bei regelmäßiger Anwendung, die Gesundheit länger zu erhalten und die sekundären Komplikationen zu verringern; Ragnarsson 1988 (249), Pollak 1989 (244), Arnold 1992 (8), Petrofsky 1991 (239), Hooker 1992 (118), Taylor 1993 (299), Krauss 1992 (167) etc.
Kriterien zur Auswahl von Patienten für ein Übungsprogramm mit dem Ziel “Gehen”:
Paraplegie mit Läsion des zentralen Neurons Höhe Th4-Th11, ca. 25 % aller Rücken-marksverletzten entsprechen diesen Kriterien;
Tetraplegiker und schlaffe Paresen sind derzeit dafür nicht geeignet (55 % der Querschnittgelähmten sind Tetraplegiker, ca. 20 % schlaffe Paresen);
mäßige Spastik und relativ normale Gelenksbeweglichkeit;
gute Gesundheit und belastbare obere Extremitäten;
Patienten mit allgemein gesundheitlichen Problemen, Adipositas, höherem Alter etc. sind nicht geeignet;
Motivation und Compliance;
regelmäßige Betreuung und Kontrolle der Patienten muss möglich sein.
Anforderungen an die technische Ausrüstung:
Sicherheit der Stimulation und Elektroden (Verbrennungen!)
Miniaturisierung und Automatisierung
Einfache Handhabung zur besseren Compliance (Patienten brauchen täglich ca. 1-2 Stunden zum Anlegen, Stimulieren und Ablegen der Elektroden)
Akzeptable Kosten
Sicherlich bedeutet das Training mit Funktioneller Elektrostimulation für die Patienten viel Geduld, Ausdauer und Disziplin. Die neuen sportlichen Aktivitäten und das zeitweise Wiedererlangen der vollen Körpergröße schaffen unglaubliche Motivation und Freude bei den Patienten.
Da die Funktionen Gehen in der Ebene und Stiegensteigen nur das sportliche Ziel und der Weg dahin bereits das therapeutische Ziel darstellen (siehe Kapitel II/1 Trophik und Metabolismus), könnten noch sehr viel mehr Patienten von der FES profitieren. Zur Dokumentation der Funktionen mit FES siehe das nächste Kapitel II/2, Anwendung der Wiener Systeme.
Blasen-, Darm- und Sexualfunktion
Die Blasen-, Darm- und Sexualfunktion ist bei einer Rückenmarksläsion immer gestört. Die Betroffenen erleiden eine starke Einschränkung der Lebensqualität, es kann zum Auftreten schwerer Harnwegsinfektionen und Nierenschädigungen durch Harnrückstau kommen.
Bei Querschnittläsionen kommt es zu folgenden Haupttypen von Miktionsstörungen:
a) Reflektorisch neurogene Blase (Automat. Blase):
Die sakralen Zentren sowie Efferenzen und Afferenzen sind intakt. Hingegen besteht eine anatomische oder funktionelle Unterbrechung der suprasegmentalen Reflexbahn. Dies ist der Fall bei Rückenmarksläsionen oberhalb des Conus. Die Blase entleert sich bei einem gewissen Füllungsgrad reflektorisch oder wird dazu durch “Klopfen” angeregt, wobei relativ wenig Restharn zurückbleibt.
b) Denervierter Blase (autonome Blase):
Beide Schenkel des Reflexbogens sind durch eine Läsion des spinalen Blasenzentrums im Conus terminalis lädiert. Es kommt zu einer schlaffen gedehnten Überlaufblase. Die Entleerung erfolgt zumeist durch Pressen mit der Bauchpresse.
Die Stimulation von Detrusor und Sphincter vesicae und der Darmentleerung sowie der Sexualfunktion (Erektion) erfolgt über die Sacralwurzelstimulation S2-S4. Beim System von Brindley (31) erfolgt die Stimulation der motorischen Vorderwurzel über Cuff-Elektroden, kombiniert mit teilweiser Durchtrennung der Hinterwurzeln, um spastische Aktivierungen zu vermeiden. Bei diesen implantierten Stimulatoren wird durch Reizung der Wurzel S1, S2 eher die Blasenentleerung stimuliert und bei unterschiedlichen Kombinationen der Wurzel S3 und S4 die Darmentleerung bzw. die Erektion ausgelöst. Die optimale Stimulation bzw. die optimale Kombination von stimulierten Vorderwurzeln muss jedoch nach wie vor intraoperativ ausgetestet werden.
Meiner Meinung nach ist die zukünftige Kombination von Blasen- und Beinschrittmacher ein durchaus akzeptabler Weg, um dem Patienten bei geringem technischem Aufwand bei vegetativen und/oder motorischen Dysfunktionen helfen zu können.
II/2 Erste klinische Anwendungen der „Wiener Systeme“
Unter “Funktioneller Elektrostimulation“ (FES) verstehen wir den Einsatz hochentwickelter Technologie und Elektronik, um eine verlorengegangene bzw. eingeschränkte Körperfunktion wenigstens teilweise zu ersetzen, zu verbessern bzw. funktionell zu kompensieren.
Die Funktionelle Elektrostimulation bei Querschnittgelähmten kann sowohl im Sinne einer Therapeutischen Stimulation als auch im Sinne einer Substitution verlorengegangener Bewegungsfunktionen als „Muskelschrittmacher“ angewendet werden (Kern 1984 (150, 151), Mayr 1992 (198)).
Therapieziele sind die periphere Durchblutung und Trophik, die Spasmus Regulation sowie das Körpertraining und zuletzt die Fortbewegung als eigentliche Funktion. Man denke an die Bewältigung einiger Stufen ohne entsprechende Begleitperson, das Einsteigen in öffentliche Verkehrsmittel, z. B. Autobus, Eisenbahn oder Flugzeug usw. oder die kurzen Wegstrecken z. B. zwischen Auto und Arbeitsplatz, Auto und Wohnung. Diese vor einigen Jahren noch völlig unrealistischen Vorstellungen könnten mit Hilfe der Funktionellen Elektrostimulation realisiert werden.
Der Rollstuhl kann in absehbarer Zeit sicher nicht ersetzt werden!
Anwendungsmöglichkeiten bzw. Therapieziele mit FES:
“Mit den Fingern gehen lernen!”
Aktives Aufstehen
“Gehen” über kürzere Strecken
Überwinden kleiner Hinderniße (enge Tür, Stufen?)
Spasmen mit kurzer Stimulation unterbrechen
Trainingsmöglichkeiten: Oberkörper-, Rumpf- und Beinmuskulatur,
Herz-Kreislauf, Skelett
Decubitusprophylaxe
Günstige Nebenwirkungen: Periphere Durchblutung und Trophik, warme Füße, Blasenfunktion
Rollstuhl und “FES”
Die oben erwähnten Therapieziele können sowohl mit Oberflächenstimulation als auch mit Implantaten erreicht werden. Die Implantation eines Beinschrittmachers bei paraplegischen Patienten wurde weltweit erstmalig und bisher exklusiv von unserer Wiener Forschungsgruppe 1982 und 1984 durchgeführt.
Die Elektrostimulation bei paraplegischen Patienten mit Oberflächenelektroden wird von unserer Arbeitsgruppe seit 1978 im Sinne der Förderung von Trophik und Metabolismus, aber auch zum Funktionsgewinn eingesetzt.
II/2/A Die FES mit Oberflächenelektroden - Unsere klinischen Erfahrungen
Die Funktionelle Elektrostimulation mit Oberflächen-elektroden wird von unserer Forschungsgruppe seit 1978 bei paraplegischen Patienten eingesetzt und ist für spastisch gelähmte und denervierten Muskulatur geeignet. Siehe auch Kapitel “Geschichte der FES”.
Zu Beginn der Forschungsaktivitäten standen die technische Entwicklung und die Erarbeitung der Methodik im Vordergrund. In den letzten Jahren gewannen neben der praktischen Anwendung der Wirkungsnachweis des Stimulationseffektes und die physiologischen Veränderungen durch die FES zunehmend an Bedeutung.
Die FES ist für spastisch gelähmte Patienten zumeist ein zusätzliches Training und sportliche Aktivität, um im Bereich der Prävention und Therapie für Funktion, Metabolismus und Trophik eingesetzt zu werden.
Patienten mit denervierter Muskulatur, im speziellen Paraplegiker mit Conus-Cauda-Läsionen, können nur durch funktionelle Elektrostimulation ihre periphere Trophik, Durchblutung und ihren Stoffwechsel verbessern. Entscheidend ist, daß auch erste funktionelle Ergebnisse bei denervierter Muskulatur durch unsere Arbeitsgruppe erreicht werden konnten. Die Oberflächenstimulation bei Paraplegie setzen wir bei angeborener Querschnittläsion (Meningomyelocele-Kinder) und bei erworbener Querschnittlähmung ein.
Wir unterscheiden reflektorische Wirkungen der Elektrostimulation von direkten muskeltrainierenden Effekten. Die reflektorische Wirkung der Elektrostimulation mit dem erhofften Ziel der Reinnervationsförderung und Reaktivierung vorhandener, aber nicht aktivierter Muskelareale steht zu Beginn der Rehabilitationsphase im Vordergrund.
Mit zunehmender Lähmungsdauer und besonders bei denervierter Muskulatur ist jedoch auf die Erhaltung der kontraktilen Eigenschaften, insbesondere des Membranpotentials und der metabolischen, aber auch strukturelle Zellfunktionen zu achten.
Ca. 2-3 Jahre nach der Läsion ist mit keiner oder nur mehr geringer Verbesserung der Reinnervation und/oder der Willkürmotorik zu rechnen. Ab diesem Zeitpunkt ist für denervierten und spastisch-gelähmte Paraplegiker die Funktionelle Elektrostimulation die einzige Möglichkeit, ihre gelähmten Körperabschnitte entsprechend therapeutisch zu fördern und bestimmte Bewegungsfunktionen auszuführen.
Kaum beachtet wird die Trophik und Wachstumsförderung durch die Elektrostimulation gelähmter Kinder. Physiologisch steuert das Nervensystem den Muskel und die richtige Muskelfunktion, und die muskulär gesteuerte Belastung löst das richtige Knochenwachstum aus. Ein hoher Prozentsatz knöcherner Fehlformen ist durch fehlende bzw. gestörte Innervation bedingt. Daher ist es unser Ziel, auch bei Kindern mit angeborenen oder erworbenen Nervenläsionen oder Fußdeformitäten die Elektrostimulation als Reflextherapie und zur Förderung von Trophik und Wachstum einzusetzen. Dies geschieht üblicherweise mit Therapiegeräten, die der Patient oder die Eltern zu Hause zumindest zweimal täglich 30 Minuten anwenden. Die Therapie von Kindern mit Meningomyelocele oder geburtstraumatischer Plexusläsion oder mit peripheren Nervenlähmungen ist jedoch nicht Gegenstand dieser Monographie und wird daher hier nicht weiter behandelt.
Diese Arbeit soll meine Erfahrungen und meine experimentellen Ergebnisse mit der Funktionellen Elektrostimulation bei erworbener Paraplegie mit Oberflächenelektroden wiedergeben. Getrennt werden wir nur die spastische Lähmung und die denervierte Conus-Cauda-Läsion behandeln.
Spastisch gelähmte Patienten
Bei Läsionen im Thorakalmark zwischen Th3/4 und Th11 kommt es zur spastischen Paraplegie. Läsionen oberhalb von Th3 sind zumeist mit zusätzlicher Schädigung der Wurzeln C7, C8 oder höher verbunden und können so bereits zu Ausfällen an der oberen Extremität (Tetraplegie) führen.
Bei den spastisch gelähmten Patienten, die bereits nach dem Aufenthalt im Rehabilitationszentrum als „rehabilitierte“ Paraplegiker zu uns gelangen, versuchen wir zu Beginn der Behandlungen, die Beinstreckkraft durch Elektrostimulation der Quadriceps Muskulatur im Sitzen zu erhöhen und eine Spasmus Änderung in Richtung Strecksynergien zu fördern.
Im Gegensatz zu anderen Forschungsgruppen versuchen wir möglichst frühzeitig mit diesen Patienten auch aufzustehen. Bei der FES-Kraftmessung der Oberschenkelmuskulatur sollte ein Drehmoment von zumindest 25 Nm vorhanden sein. Mit Hilfe der Arme und mit der entsprechenden Technik gelingt es allen Patienten, eine relativ sichere Standposition im Barren zu erreichen. Diese kann dann, je nach Ausdauerfähigkeit der Muskulatur, unterschiedlich lang gehalten werden.
Die Elektrostimulation der Quadricepsmuskulatur wird anfänglich im Sitzen ohne Widerstand bis zur völligen Kniestreckung durchgeführt. Anschließend wird eine Gewichtsbelastung von 2, 3 oder 5 kg um die Knöchel fixiert. Schafft der Patient mit 5 kg Gewichtsbelastung 6-8 Wiederholungen bis zur vollständigen Knie-streckung, so kann mit dem Aufstehtraining bzw. Stehtraining begonnen werden.
Aktives Stehtraining
Ziel und Zweck des aktiven Stehtrainings bzw. des Aufstehens mit der eigenen Muskulatur ist die Kreislaufregulation, die Blutdruckregulation, das Training des vegetativen Nervensystems und des Gesamtkörper metabolismus sowie die Verbesserung speziell der Trophik und der Durchblutung an den unteren Extremitäten und im Glutäalbereich.
Dazu ist die Versorgung der Patienten mit zwei 2-Kanal-Stimulationseinheiten für Quadriceps- und Glutaeus Stimulation beidseits notwendig. Für das aktive Stehen und relativ physiologische Standbild ist die Aktivierung der Hüftstreckung durch die Stimulation der Glutealmuskulatur notwendig. Diese fördert die Stabilität und führt zur Entlastung des stützenden Oberkörpers und der Arme der Patienten. Beim Aufstehvorgang ist jedoch ein zeitliches Delay zwischen der Quadriceps- und der Glutaeus-Stimulation einzuplanen. Ca. 0,2 sec vor der Glutäalstimulation sollte der M. Quadriceps einsetzen, um den Abduktionseffekt der Glutäalmuskulatur bei bereits auf den Boden fixierten Beinen zu verhindern bzw. zu verringern. Als Schuhwerk genügt meistens ein gut sitzender Turnschuh. Ein orthopädischer Schuh ist nur selten notwendig. Beim Aufstehen kann der querschnittgelähmte Patient durch die entsprechende Technik erheblich mit den Oberarmen mithelfen.
Als Aufstehhilfe zu Beginn wird ein kleiner Barren empfohlen, den wir den Patienten zur Verfügung stellen. Einige haben sich selbst ev. durch Halbierung eines Sproßenwandelementes gut funktionierende Barren für zu Hause gebaut.
Diese Art des Funktionsgewinnes genügt jenen Patienten, die entweder durch extraartikuläre Exostosenbildungen in ihrem Bewegungsumfang eingeschränkt sind oder keine weiteren sportlichen Aktivitäten auf sich nehmen wollen.
Gehen im 4-Punkte Gang
Die Funktionelle Elektrostimulation mit Oberflächenelektroden kann den 4-Punkte Gang relativ schön auslösen. Dazu verwendet der Patient nun zwei 3-Kanal-Gürtel-Stimulationssysteme, wobei neben dem M. Quadriceps und M. Glutaeus maximus auf jeder Seite auch der Nervus peronaeus zur reflektorischen Auslösung der Hüftbeugung stimuliert wird. Der “Peronaeusreflex” ist oft etwas schwierig zu finden und nur mit genauer Elektrodenplazierung exakt auslösbar, jedoch in seiner Zuverlässigkeit durchaus ausreichend, um eine ausreichende Funktion (gleichzeitige Hüftbeugung, Kniebeugung und Dorsalextension des Fusses) zu erzielen.
Bei der dafür entwickelten 3-Kanal-Gürtelversion sind die Verzögerungen zwischen den Stimulationsbereichen sowie deren Dauer unabhängig voneinander einzustellen. Damit kann ein einfaches Schnittmuster erzeugt werden, welches einen stabilen 4-Punkt-Gang ermöglicht, Franke, Kern (77).
Mögliche Fehler bei Versagen des Peronaeus-Reflexes, wodurch eine zu geringe Hüftbeugung ausgelöst wird, sind zumeist Fehler in der Elektrodenleitung, im Elektroden-Haut-Kontakt und/oder in der genauen Platzierung der Elektroden.
Beim Stehen und Gehen erfolgt zumeist eine spastische Mit-Aktivierung der Streck- und Beuge Muskulatur des gesamtes Beines und somit eine fast physiologische Verriegelung des Kniegelenkes. Durch gleichzeitige elektrische und teilweise spastische Aktivierung der Oberschenkelbeuger wird ein pathologisches Überstrecken verhindert (siehe Querschnittzunahme der ischiocruralen Muskulatur in Abb. 20). Sehr selten erfolgt die Stabilisierung beim Gehen und Stehen durch passive Verriegelung mittels Erstreckung des Kniegelenkes und Streckung des Hüftgelenkes. Für viele Poliopatienten und Patienten mit Muskeldystrophien ist dies, bei fast völliger Lähmung der unteren Extremitäten, über Jahre und Jahrzehnte die einzig mögliche Gangart, ohne dass es zu vorzeitigen schweren Arthrosen geführt hätte (eigene Beobachtung).
Abb. 20:
Computertomographischer Muskelquerschnitt (Q2) beim einem spastischen Patienten NACH der FES-Trainingsperiode.
Je nach körperlicher Fitness, Trainingszustand, Gleichgewichtsgefühl und Willen ist es Patienten mit Läsionen zwischen Th3 und Th10 mit Funktioneller Oberflächenstimulation der Beinmuskulatur möglich, entweder im Barren, am Barren mit einer Krücke, mit 2 Krücken in der Ebene oder sogar mit Rollator auf dem Feldweg zu gehen. Hier muss der Peronaeusreflex gut funktionieren, um auch im unebenen Gelände eine normale Schrittfunktion zu erreichen. Bisher haben wir keine Abnahme oder Verschwinden des Peronäusreflexes für die Hüftbeugung, Kniebeugen und Dorsalextension des Fußes bemerkt, obwohl dies von einigen Autoren befürchtet wird.
Schwunggang, Gehen am Barren, Gehen mit Krücken oder Rollator
Nochmals möchte ich darauf hinweisen, dass das Gehen im Barren oder sogar am Feldweg stets Mittel zum Zweck ist, um als sportliche Zusatzbetätigung Trophik und Metabolismus zu fördern und andererseits die Freude an der Bewegung und am aufrechten Gang zu vermitteln. Die ungeheure Motivation, die dadurch bei vielen Patienten ausgelöst werden kann, sollte neben den physiologischen Leistungsverbesserungen ein Hauptgrund für die Indikation der funktionellen Elektrostimulation bei querschnittgelähmten Patienten sein.
Im Vergleich zur FES-Ergometrie oder Hybridergometrie bzw. Oberschenkelstimulation im Sitzen bewirken die Funktionen „Aufstehen“ und „Gehen“ mit der aktiven elektrisch und/oder spastisch ausgelösten Kokontraktion der Oberschenkelbeugemuskulatur einen größeren Trainingseffekt auf die Beinmuskulatur selbst und durch Aktivierung größerer Muskelmassen einen besseren Effekt auf das cardiovaskuläre System (↑ HF bis 160/min ↓) und auf den Fettstoffwechsel.
Bei gut funktionierender Oberflächenstimulation sollte im Einzelfall weiterhin die Möglichkeit einer Implantation ins Auge gefasst werden. Dabei wäre es in Zukunft sinnvoll, neben M. quadriceps und M. glutaeus maximus den M. iliopsoas für die Hüftbeugung über die Wurzel L3 zu stimulieren sowie eine Unterschenkel- und Fußkontrolle durch Karussellstimulation am N. ischiadicus zu erreichen.
Sinnvoll erscheint mir zukünftig die Kombination von Beinschrittmacher mit Blasen- und Darmstimulation Dafür sollten Mehrkanalimplantate zweizeitig implantiert werden, die neben der Beinschrittmacherfunktion der einen Seite auch die Sacralwurzelstimulation für Blase, Darm und eventuelle Erektion beinhalten. Vom dorsalen Zugang ausgehend, könnte man auch über die Wurzel L3 den M. iliopsoas erreichen, der die für das Schrittmuster äußerst notwendige Hüftbeugung auslösen kann. Sollte die Darm- und Blasenstimulation mit dem Implantat der einen Seite nicht funktionieren, so wäre bei der Implantation der zweiten Beinschrittmacherhälfte, im Abstand von 2-3 Monaten zur Erstimplantation, eine weitere Gelegenheit, die Sacralwurzeln mit einem neuerlichen Anschluß entsprechend dem Prinzip von Brindley zu revidieren.
Denervierte Patienten
Die funktionelle Elektrostimulation denervierter Muskulatur steckt sicherlich in den Kinderschuhen! Teilweise von Vorurteilen geprägt wird die Stimulation in vielen Rehabilitationszentren mit der Begründung, keine Chance auf Reinnervation zu besitzen, absolut abgelehnt. Außerdem haben Patienten mit einer Conus-Cauda-Läsion zumeist gute Stabilität und Funktionen im Oberkörper, sodaß auch ein um Monate kürzerer Rehabilitationsaufenthalt von max. 5-6 Monaten die Regel ist. Wie wichtig jedoch die periphere Trophik und Metabolismus sind, erkennen viele erst dann, wenn die ersten Decubitalulcera, mit wochen- bis monatelangen stationären Aufenthalten verbunden, operativ saniert werden müßen.
Der routinemäßige Einsatz der funktionellen Elektrostimulation bei denervierter Muskulatur wäre im Vergleich zur operativen oder konservativen Versorgung von Debikutalgeschwüren bei weitem billiger und humaner.
Ich erlaube mir hier ein Beispiel aus der Praxis aufzuzeigen, das einige der Gegenargumente von vornherein abschwächen wird. Einige unserer Patienten mit Conus Cauda Läsionen, die berufstätig sind und lange im Rollstuhl sitzen, deren Sitzflächenentlastung und Stimulation nicht immer regelmäßig ausfällt, stimulieren beim Auftreten einer Hauptverbfärbung einige Tage besonders fleißig, um die lokale Regeneration zu fördern. “Rote Flecken” verschwinden nach Angabe dieser Patienten nach einigen Tagen Elektrostimulation viel rascher als ohne FES. Für mich langfristig medizinisch problematisch, aber Realität.
Ich hoffe sehr, daß die Ergebnisse dieser Arbeit im histologischen, enzymatischen und Durchblutungsbereich dazu Anlass geben, daß der prophylaktische und therapeutische Einsatz der funktionellen Elektrostimulation besonders bei denervierter Muskulatur überdacht und geändert wird.
Jedoch sind dazu spezielle Stimulationsparameter erforderlich und auch von den Patienten eine beachtliche Portion Fleiss aufzubringen. Der bekannte Exponentialstrom oder ähnliche, aus Geschäftsgründen angepriesene Stromformen sind sicherlich nicht dafür geeignet.
Empfehlungen für die Stimulation denervierter Muskulatur in der Praxis
Unsere Patienten erhalten in der Eingewöhnungs Phase von 1-3 Monaten, aber auch nach intensiver mündlicher Aufklärung zur Überprüfung der Compliance für die ersten drei Monate ein Leihstimulationsgerät. Anschließend wird dem Patienten ein speziell adaptiertes Gerät, das wir von einer Firma herstellen lassen, verordnet. Wir stimulieren mit biphasische Rechteck-Impulsen und möglichst großflächig den gesamten Muskelverlauf bedeckenden Elektroden. Für die optimale Ausnutzung der in die Stimulation investierten Zeit empfehlen wir anfangs die Stimulation mit folgenden Elektrodenlagen:
Glutaeus-Hamstrings bds.
Quadriceps-Wade bds.
beide Sohlen in Gegenschaltung
oder:
Glutaeus bds.
Oberschenkel vorne und hinten bds. sowie
Wade - Sohle bds.
Jede Elektrodenanlage muss beiderseits, zweimal täglich 15 Minuten, mit optimierter Stimulation durchgeführt werden.
Darunter verstehen wir die Anpassung der Stimulationsparameter an die Reaktivierung der Muskulatur. Durch das Elektrostimulationstraining normalisieren sich die Membraneigenschaften (Lomo (180-183)) der denervierten Muskelzelle, wodurch deren Erregbarkeit und die Kontraktilität deutlich verbessert bzw. zunehmend normalisiert werden. Augenfällig ist, daß sich der Zuckungscharakter der denervierten Muskulatur vom langsamen, trägen, wurmförmigen Verlauf in eine rasche, blitzartig schnelle Zuckung rückverwandelt. Bei der Elektrodiagnostik ist die Akkommodation fast wieder normal und die Chronaxie beträgt ca. 2-7 msec. Dadurch ist die Erregbarkeit der Membran auch für kürzere Impulse wieder gegeben (Kern). Daher hängt es von der Degeneration der Muskelfasern, insbesondere von der Dauer der Denervation ab, mit welchen Stimulationsparametern stimuliert werden kann:
Bei schon länger zurückliegenden (1 bis 3 Jahre) denervierten Muskeln ist damit zu rechnen, daß mit ca. 100-150 msec langen Rechteck-Einzelimpulsen mit jeweils 300 msec - 400 msec Pause begonnen werden muss, da die denervierte Muskulatur einen so großen Reizzeitbedarf aufweist und die Spannung entsprechend den Sicherheitsüberlegungen nicht über 100 Volt aufgeregelt werden darf.
Auch das Training mit den Einzelimpulsen muss zweimal täglich 15-30 Minuten durchgeführt werden. Nach wenigen Wochen bereits ist eine deutliche Reduktion des Reizzeitbedarfes feststellbar und eine Veränderung des Zuckungscharakters sichtbar. Es wird nun stetig die Impulsdauer reduziert, ebenso die Pausendauer.
Nach 3-4 Monaten intensiver Stimulation sollte ein Bereich von ca. 30 msec Impulsdauer und 30 msec Impulspause erreicht sein. Ab diesem Zeitpunkt sind bereits ca. 15-16 Hz möglich. Dadurch wird die untere Grenze der tetanischen Verschmelzungsfrequenz erreicht. Eine weitere Reduktion der Pause schafft dann bei 30 msec Impulsdauer und 20 msec Pause bereits 20 Hz eine relativ günstige Stromform, um auch denervierte Muskulatur zu tetanischen Kontraktionen anzuregen. Dieser von mir bezeichnete “Schwellstrom für denervierte Muskulatur” ist nicht mit dem herkömmlich bekannten Schwellstrom zu verwechseln!!
Tetanische Kontraktion für denervierte Muskulatur!
Durch die vorher beschriebene Normalisierung der Membranpotentiale und das Erreichen einer fast normalen Kontraktionsphysiologie wird bei denervierter Muskulatur die Voraussetzung geschaffen, tetanisierbare Stromformen einzusetzen. Der Reizzeitbedarf bei diesen Stromformen wird jedoch nie den Bereich der spastisch gelähmten Patienten (also innervierter Muskulatur) erreichen. Die innervierte Muskulatur wird stets über die nichtmyelinisierte Endstrecke, also über den Nerv erregt, wozu ca. 0,1-1 msec lange Impulse, in Abhängigkeit von der Spannung (Volt), notwendig sind. Dagegen werden für denervierte Muskeln, bei noch schlechtem Trainingszustand 150 bis 200 msec lange Impulse benötigt. Bei fleissig stimulierenden Patienten kann der Reizzeitbedarf auf 20 bis max. 10 msec reduziert werden. Jedenfalls bleibt eine Differenz der Impulsdauer im Verhältnis von 1:10 bis 1:100 innervierter zu denervierter Muskulatur auch weiterhin bestehen.
Bei einer Impulsdauer von 20 msec und gleich langer Pausendauer können auch denervierte Muskeln mit 25 Hz erregt und beübt werden. Erst ab diesem Zeitpunkt werden jene Trainingsintensitäten (= tetanische Zugspannung und Muskelleistung) erreicht, die eine optimale Adaptation an die Stimulation erlauben (siehe Ergebnisse der Muskelbiopsie bei denervierten Patienten!).
Klinische Effekte der funktionellen Elektro-stimulation bei denervierten Patienten
Die bisherigen Beobachtungen zeigen auch erhebliche klinische Veränderungen, die neben wärmeren Extremitäten eine Trophikförderung der Haut beinhalten. Ist die denervierte Haut am Anfang dünn atrophe und leicht verletzlich, so adaptiert sich die gesamte Kutis an die elektrische Hautbelastung, und es entsteht eine für den Patienten fühlbar dickere Hornschicht. Sollten bis zu diesem Zeitpunkt durch die Elektrostimulation rote Flecken oder sogar Bläschen verursacht worden sein, so sind nach erfolgter Hautadaptation diese Veränderungen nicht mehr zu beobachten bzw. zu befürchten.
Jedenfalls muss die Stimulation in entlasteter Stellung, also in Rücken- oder Bauchlage mit fixierten, aber nicht belasteten Elektroden, durchgeführt werden.
Neben der Trophikförderung für die Haut, der Verbesserung der muskulären, kutanen und sakralen Durchblutung ist entsprechend der tetanischen Muskelkontraktion bei unseren Patienten bisher eine Kniestreckung mit denervierter Muskulatur möglich gewesen.
Erst tetanische Kontraktionen können in der denervierten Muskulatur jene mechanischen Zugbelastungen auslösen, die für einen Hypertrophiereiz notwendig sind. Auch die metabolische Adaptierung wird durch die erhöhte Arbeitsleistung der Muskulatur gefördert.
Entsprechend unserer in dieser Arbeit dokumentierten Ergebnisse hinsichtlich Faserhypertrophie und Durchblutungs- und Kontraktionsverbesserung glaube ich fest daran, dass die ersten Schritte mit denervierter Muskulatur in den Rehabilitationszentren in naher Zukunft gemacht werden können.
II/2/B Weltweit erste Implantation eines Beinschrittmachers
Mit Hilfe implantierbarer Technik sollte es querschnittgelähmten Patienten möglich sein, mit den Fingern die Oberschenkel- und Hüftmuskulatur so zu steuern, dass ein stimuliertes Aufstehen und schrittweises Gehen über kürzere Distanzen möglich wird.
Es sei explizit darauf hingewiesen, daß die FES der Oberschenkel- und Hüftmuskulatur nicht eine isolierte physiologische Organfunktion wiederherstellen soll, sondern verbunden mit der erreichbaren funktio-nellen Anwendung einen weiteren “Schritt” in der Rehabilitation paraplegischer Patienten darstellt.
1982 erfolgte die weltweit erste Implantation eines “Beinschrittmachers” bei paraplegischen Patienten mit komplettem Querschnitt durch unsere Wiener Arbeitsgruppe.
Der Empfängerteil wurde zwischen Muskelfaszie und subkutanem Fettgewebe beiderseits ca. 5 cm medial und proximal der Spina iliaca anterior superior implantiert (Abb. 2).
Abb. 2:
Röntgenbild des weltweit ersten Beinschrittmachers, der 1982 in Wien implantiert wurde.
Von dem Implantat führten je 4 gewandelte Edelstahlelektroden, die in Silikonkautschuk eingebettet waren, subkutan zum N. femoralis in die Leistenbeuge und nach dorsal zum N. glutaeus inferior. Die nicht isolierten Elektrodenenden waren als kleine Ösen ausgebildet und wurden mit 6/0 Prolene-Fäden an das Epineurium im Quadrat und etwas längs verschoben fixiert (Abb.8).
Abb. 8:
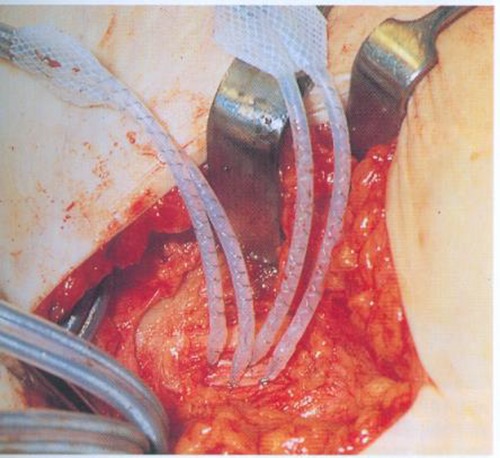
Elektrodenimplantation und Naht von 4 Elektroden für die Karussellstimulation an das Epineurium.
Im Tierexperiment konnten Rosenkranz et al. 1980 (261), Koller et al. 1992 (161), Girsch et al. 1991 (86) in monatelangen Versuchsreihen nachweisen, daß zwar an der Implantationsstelle geringe histologische Veränderungen des Nerven (Zellvermehrung, Bindegewebsvermehrung) aufgetreten waren, dass aber auch bei Dauerstimulation über ein Jahr mehr als 85 % aller angeschloßenen Nerven stimulierbar blieben. Damit wurde der Langzeitnachweis erbracht, dass die verwendeten Stromformen zum Einsatz bei paraplegischen Patienten geeignet sind.
Sowohl die Energieübertragung als auch die Impulssteuerung erfolgte durch transkutane Hochfrequenzankoppelung über eine außerhalb des Körpers über dem Implantat gelegene Sendespule.
Die beiden Sendespulen waren mit einem kleinen, tragbaren, frei programmierbaren Steuergerät verbunden. Dessen Größe betrug 170/120/50 mm, das Gewicht inklusive Akkumulatoren betrug 1450 Gramm und es wurde am Rücken getragen. Die netzunabhängige Stimulationszeit war 6 Stunden.
Um die Ermüdbarkeit der motorischen Endplatten und der Muskulatur zu reduzieren, wurde zur Stimulation die von H. Thoma entwickelte und patentierte “Karussellstimulation” verwendet. Dadurch wurden, in Anlehnung an die physiologischen Verhältnisse, abwechselnd unterschiedliche Nervenfasern depolarisiert. So waren Kontraktionen der Muskulatur über längere Zeit möglich.
Der Vorteil der indirekten Muskelstimulation lag nicht nur in der größeren Kraftentfaltung, da der ganze Muskel stimuliert werden konnte, sondern auch im größeren Nutzeffekt. Das heißt, daß viel kleinere Strommengen ausreichen, um gleiche Muskelaktivität auszulösen, als bei direkter Muskelreizung mit Oberflächenelektroden oder mit in den Muskeln implantierten Elektroden. Weitere Vorteile der implantierten Stimulation waren die Vermeidung von möglichen Hautschäden, die selektive Reizung einzelner Muskeln und die Vermeidung der antagonistischen Hemmung.
Stimulation von M. quadriceps und M. glutaeus max.
Es war sinnvoll, das Konzept der FES paraplegischer Patienten möglichst einfach zu halten. Für die Funktionen “Aufstehen” aus dem Sessel und Fortbewegung im “Schwung- bzw. 4-Punkte-Gang” reichte die Stimulation der Oberschenkelstreckmuskulatur und der Hüftstreckung aus.
Dadurch konnte nicht nur die Funktion eines Schienen-Schellen-Apparates zur Beinstabilisierung ersetzt werden, sondern ein zusätzlicher Faktor der Sicherheit, die Hüftstabilisierung, erreicht werden. Die damit versorgten Patienten waren nicht mehr allein auf die Hyperlordosierung mit Hüft-verriegelung durch das Ligamentum iliofemorale angewiesen, sondern konnten “aktiv” die Hüftstreckung herbeiführen. Immer war jedoch eine zusätzliche Aktivierung des M. latissimus dorsi notwendig, um die einseitige Hüfthebung als Voraussetzung für den 4-Punkte-Gang zu gewährleisten.
Erste Implantation und Training
Für die weltweit erste Implantation waren zwei freiwillige Patientinnen (41 bzw. 25 Jahre alt) mit einer Läsionshöhe von Th9 und Th10, jeweils motorisch, sensibel und vegetativ komplett, ausgewählt worden. Die Implantation erfolgte nur unter Sedierung und Lokalanästhesie.
Am 18.10.1982 erfolgte im Sprossenwandviereck der weltweit erste implantiert-stimulierte Stehversuch (siehe Abb. 9). Kurzzeitig war ein selbständiges Stehen mit geringem Abstützen der Hände möglich, allerdings trat relativ rasch periphere muskuläre Ermüdung ein.
Abb. 9:

Weltweit erster Stehversuch mit implantiertem Beinschrittmacher, Wien 1982.
Ziele der ersten Übungsperiode (siehe Tab. Imp. 1) waren die Kraftvermehrung und Anhebung der Kraftausdauer Fähigkeit. Die Patienten stimulierten abwechselnd den M. glutaeus maximus und den M. quadriceps zuerst rechts und dann links.
Die Stimulationszeit betrug 5 sec, die Pause war durch die abwechselnde Stimulation der einzelnen Muskeln mit 15 sec gegeben und somit ausreichend lang. Alle 16 Möglichkeiten der Karussellstimulation wurden pro Nerv eingesetzt. Außerdem hatten die Patienten die Anweisung, mit 70-80 % der isometrisch ermittelten Maximalkraft zu üben. Dazu verwendeten sie Gewichtsmanschetten um die Knöchel. Sie sollten je nach möglicher Wiederholungsanzahl das Trainings-gewicht pro Woche steigern.
Nach Intensivtrainingswochen im Rehabilitationszentrum Bad Häring 4-5 Monate postoperativ war eine Kraftsteigerung um ca. 100 % bei beiden Patientinnen zu verzeichnen. Funktionell war die eine Patientin, die fast nie mit Stützapparaten gegangen war und deren körperlicher Trainingszustand anfangs als mäßig zu bezeichnen war, am Ende des Aufenthaltes in der Lage, im Rollbarren den Durchschwunggang und 4-Punkte-Gang (Abb. 5) koordinativ richtig über 20 Meter auszuführen. Für das Gehen mit 2 Krücken fehlte die Sicherheit im Gleichgewicht und die muskuläre Ausdauer.
Abb. 5:

4-Punkte-Gang mit Peronaeusreflex im Barren. Die Glutäalmuskulatur, der M. qua-driceps und der N. peronaeus werden im Schrittmuster stimuliert.
Die zweite Patientin konnte als Höhepunkt der Rehabilitationsbemühungen (Abb.10) aus ihrem Auto stimuliert außteigen und im Schwunggang 2x50 Meter zurücklegen. Der 4-Punkte-Gang war in der Schrittlänge begrenzt und musste im Rollbarren ausgeführt werden.
Abb. 10:

Nach 4monatigem Aufbautraining ist die Patientin im Frühjahr 1983 in der Lage, aus dem Auto auszusteigen und im Schwunggang einige 100 m zurückzulegen.
Neun Monate nach der Implantation war die Kraft der Beinmuskulatur um ca 400 % vermehrt. Zu diesem Zeitpunkt war es einer Patientin möglich, eine ca. 10 cm hohe Stufe zu überwinden. Um eine normal hohe Stufe meistern zu können, muß in Zukunft zusätzlich die Hüftflexion stimuliert werden.
Zur Verbesserung der Funktionalität wurde 1983 ein Dreirad technisch so adaptiert, daß mittels von der jeweiligen Tretkurbelstellung abhängiger Stimulationsbereiche für den M. glutaeus max. und M. quadriceps ein stimuliertes Fahren in der Ebene möglich war (siehe Abb.11). Die Möglichkeit, ein Fahrrad mit der Oberschenkel- und Glutäal-muskulatur anzutreiben, fördert die funktionelle Anwendung der FES und ist sicherlich ein Mittel zur sozialen Integration, siehe auch Veltink (308).
Abb. 11:

Die zweite implantierte Patientin war 1983 und 1984 in der Lage, mit dem Beinschrittmacher in der Ebene Rad zu fahren.
Erfolge mit implantierter Funktioneller Elektrostimulation bei paraplegischen Patienten im Jahr 1983
Diese Patienten konnten selbständig aus jedem Sessel, nur gestützt auf zwei Krücken, aufstehen.
Sie konnten über kürzere Wege im 4-Punkte-Gang oder besser im Schwunggang gehen.
Sie konnten radfahren und
kleine Hindernisse überwinden.
Natürlich diente auch die funktionelle Elektrostimulation dem Training von Oberkörper, Kreislauf, Stütz- und Bewegungsapparat und vor allem der Rumpf- und Beinmuskulatur für Trophik und Metabolismus.
Mit Hilfe der FES war es den weltweit ersten beiden Patienten innerhalb von 10 Monaten möglich, sowohl den Schwunggang als auch den 4-Punkte-Gang stimuliert auszuführen und im stimulierten Stehen große Sicherheit zu gewinnen. Die Kraft im Oberschenkel war dazu vervierfacht und die Ausdauer auf über 5-10 min Gehen verbessert worden. Die Häufigkeit der Spasmen blieb gleich oder konnte durch eine ausreichende Stimulation reduziert werden. Die Stärke hingegen nahm entsprechend dem Muskelzuwachs zu.
Trotz teilweiser Skepsis hat die FES die Erwartungen und Zielsetzungen der weltweit ersten Implantation bei weitem übertroffen. Sie ist jedoch derzeit nicht kritiklos für alle Paraplegiker einsetzbar. Die Patienten werden entscheiden, ob dieser Weg der “technisierten” Rehabilitation ein “gangbarer” sein wird! “Auch der Weg über 1000 Meilen beginnt mit dem ersten Schritt” (chinesisches Sprichwort).
II/3 Fragestellung zur Untersuchung
Die Elektrostimulation Paraplegischer Patienten wird erst seit ca. 10-15 Jahren und weltweit nur in einigen wenigen Rehabilitationszentren eingesetzt. Vorrangiges Ziel der Forschungen in den ersten 20 Jahren war die Auslösung bzw. Wiederherstellung einiger anfänglich sehr primitiver Steh- und Gangmuster, sowohl mit Oberflächenelektroden (Laibach, Wien) als auch von unserer Arbeitsgruppe in Wien mit Implantaten.
Von der Gruppe Marsolais in Cleveland wurden mit transcutanen, bis an den motorischen Nerv platzierten Einstichelektroden und tragbaren Computer Stimulatoren, bei Verwendung eines Rollators als Gehhilfe, relative schnelle Gangmuster, aber auch das Stiegensteigen erreicht.
Der Vorteil der selektiven Stimulation über den motorischen Nerv, wie sie mit Einstichelektroden oder unseren Implantaten erreicht werden konnte, ist eine selektive Reizung und Dosierung der Muskelkraft für bestimmte Bewegungsabschnitte. Der Nachteil dieser Methoden ist die aufwendige Implantations-Technik und die selten mögliche und/oder schwierige Revision der Elektroden am Nerv und die Infektionsgefahr bei den Einstichelektroden, verbunden mit einer kurzen Haltbarkeit.
Bei der Wiener Arbeitsgruppe wurden die Probleme der Elektrodendislokation und Elektrodenauswahl durch die Verwendung einer Karussellstimulation nach Thoma und Holle (115, 304) kompensiert, um mehrere Elektrodenkombinationen für die Stimulation zur Verfügung zu haben. Für die Zukunft wird sich die Verwendung von jeweils 5 Elektroden pro Nerv, die zirkulär und leicht versetzt ans Epineurium angenäht werden, durchsetzen.
Demgegenüber ist die Funktionelle Elektrostimulation mit Oberflächenelektroden nicht so präzise in ihrer funktionellen Auswirkung, jedoch ungleich leichter und komplikationsloser zu applizieren bzw. bei Schwierigkeiten zu ändern. Mögliche Sekundärinfektionen und hämatogene Besiedelung der Implantat Oberfläche (die verwendeten Elektroden bestehen weltweit aus mit Silicon isoliertem Edelstahl) sind somit nicht gegeben.
Nach der international ersten Forschungsphase (ca. 1970-1986) zur Funktionsverbesserung und Erarbeitung geeigneter Stimulationsmethoden ist in den letzten Jahren der Nachweis der physiologischen Effekte und Adaptationsmechanismen, aber auch die Frage nach Muskelkraft, Muskelquerschnitt und Muskelhistologie sowie lokaler Durchblutung in den Vordergrund des Interesses getreten.
Daher war mein Interesse, die physiologischen Auswirkungen der FES auf Durchblutung, Trophik, aber auch auf Muskelkraft, Morphologie und Leistungshistologie, wie z.B. Faserhypertrophie bzw. Fasertransformation, Enzymmuster und Mitochondrien Volumina zu überprüfen.
Folgende Fragestellungen waren zu beantworten:
Kann die Art und Weise der Elektrostimulation, wie sie in der Physikalischen Medizin derzeit verwendet wird, für die Funktionelle Elektrostimulation optimiert werden, um bei gleichem Aufwand (oder bei geringerem Aufwand) bessere Muskelkräfte und funktionelle Bewegungen erzielen zu können. Diese Fragestellung enthält eine Reihe von experimentellen Gesichtspunkten, wie z. B. die Optimierung der Elektroden, die Reduktion der Mitaktivierung der Antagonisten und die Vermeidung zu rascher Ermüdung durch entsprechende Variation von Stimulationsdauer, Impulsdauer und Stimulationszyklen etc.. Dazu sollte neben der entsprechenden Gerätekonstruktion und Elektroden-Optimierung das Ermüdungs-verhalten der Muskulatur bei Stimlation in Vorversuchen analysiert werden.
Kann durch gezielte Elektrostimulation jene Kraftausdauer der Oberschenkel-Muskulatur erreicht werden, die einerseits zur Gelenkstabilität und Gelenksicherung über längere Zeit notwendig und andererseits für Aufstehen, Stehen und Schrittfolge evtl. Stufensteigen ausreichend ist? Weiteres mußte untersucht werden, ob die zu erwartende Verbesserung im Kraftausdauerbereich morphologisch und metabolisch nachgewiesen werden kann.
Ermöglichen die histologischen Veränderungen Rückschlüße auf die bekannten Therapie- und Rehabilitationsmethoden bei querschnittgelähmten Paraplegikern bzw. bei gelähmter Muskulatur? Können neue praktische Empfehlungen für die Funktionelle Elektrostimulation mit Oberflächen-Elektroden bei Paraplegikern abgeleitet werden?
Kann durch unsere experimentellen Untersuchungen ein Beitrag zur Klärung erfolgen, durch welchen Effekt die Fasertransformation ausgelöst wird? Dafür bestehen derzeit verschiedene Hypothesen, die jedoch bei näherer Beleuchtung nicht schlüssig sind.
-
Ist beim Menschen denervierte Muskulatur überhaupt trainierbar? Erste positive Veröffentlichungen stammen von Gutmann aus 1962. Ein histologisch bzw. biochemisch exakter Nachweis wurde bisher nur im Tierexperiment, aber nicht beim Menschen geführt. Daher war auch das Ausmaß der Trainierbarkeit bzw. der Adaptierung denervierter Muskulatur beim Menschen zu beantworten.
Ein besonders wichtiger Teilaspekt bei denervierter Muskulatur war, ob die Elektrostimulation in unserer optimierten Form alleine, ohne neurotrope Substanzen genügt, um strukturelle und metabolische Adaptierungen in der denervierten Muskulatur auszulösen.
Wird ein schädigender Effekt durch die Elektrostimulation auf gelähmte Muskulatur (spastisch und denervierte) ausgeübt?
Gehen die histologischen Veränderungen auch mit metabolisch-enzymatischen Veränderungen bzw. Adaptation einher?
Besteht eine Korrelation zwischen der computertomographischen Querschnitts-Flächenbestimmung der Muskulatur und der Verbesserung der Histologie? Sind in Zukunft Rehabilitationsmaßnahmen bzw. Trainings-effekte, aber auch die Compliance der Patienten mittels Computertomographie überprüfbar?
Können die klinisch verifizierbare Erwärmung der Haut mittels Xenon und Infrarot-thermographie nachgewiesen werden? Erreicht die Durchblutungssteigerung durch Muskel-stimulation so ein Ausmaß, daß diese zur Decubitusprophylaxe und Trophikförderung der gelähmten Extremitäten therapeutisch eingesetzt werden kann?
Welche klinischen Effekte können durch eine 8monatige Langzeitelektrostimulation gelähmter Muskulatur beobachtet bzw. ausgelöst werden?
Zur Klärung der klinischen Fragen wurden folgende Untersuchungen vor und nach einer 8monatigen funktionellen Elektrostimulationsbehandlung durchgeführt:
Xenon-Clearance
Thallium-Szintigraphie
Infrarotthermographie
CT-Muskelquerschnittuntersuchungen
Kraftmessung der Oberschenkelmuskulatur
Versuch einer FES-Ergometrie
Muskelbiopsien aus dem Vastus lat. bds.
Enzymbestimmungen aus der Muskelbiopsie
III) METHODIK
III/1 Versuchsanordnung und Patienten
Für diese Untersuchung standen uns 16 freiwillige Versuchspersonen (14 Männer und 2 Frauen) mit einem Durchschnittsalter von 24,6 Jahren zur Verfügung. Die Mitarbeit an unserem Forschungsprojekt und der Beginn der Stimulation waren im Durchschnitt 3,4 Jahre nach der Querschnittläsion. 10 Personen waren spastisch-gelähmte Paraplegiker (Th4 – Th11 komplett), und 6 Patienten wiesen eine komplette Conus-Cauda-Läsion mit denervierter Muskulatur der unteren Extremitäten auf. Inkomplette Läsionen (Differenzierung mit Nadel-EMG und Reizstromdiagnostik) wurden in diese Studie nicht aufgenommen. Alle Probanden waren rehabilitierte Paraplegiker, die ein mehr oder weniger regelmäßiges Rehabilitationstraining (Kontrakturprophylaxe, Decubitusprophylaxe und teilweise Stehtraining) 3-4 x pro Woche durchführten.
Die Elektrostimulation der spastisch-gelähmten Quadricepsmuskulatur wurde anfänglich im Sitzen mit Kniestreckung ohne Belastung, abwechselnd rechts und links, durchgeführt. Je nach Fortschritt der Kräftigung wurden 2, 3 bzw. 5 kg (teilweise 15 kg) Gewichtsbelastung am Knöchel entsprechend 60-70 % Kmax. verwendet.
Die Patienten mit denervierter Muskulatur führten die Elektrostimulation der Oberschenkelmuskulatur eben-falls im Sitzen oder im Liegen aus, wobei anfänglich kräftige Einzelzuckungen ausgelöst wurden. Erst mit fortschreitendem Trainingseffekt und Normalisierung des Zuckungscharakters und der Muskel-Membran-Erregbarkeit und möglicher Reduktion der Impuls-dauer (Reiz-Zeit-Bedarf laut I/t-Kurve) konnten auch tetanische Kontraktionen durch einen speziellen Schwellstrom für denervierte Muskulatur nach Kern 1985 (148, 151) mit ca. 30 msec Impulsdauer ca. 20 msec Impulspause; einer Schwelldauer von 2-3 sec sowie 5 sec Schwellpause verwendet werden.
Alle Probanden hatten den Auftrag, ihre normalen Alltagsaktivitäten weiter zu führen und die Elektrostimulation als zusätzliches Training anfänglich 2 x 15 min, anschließend 2 x 30 min pro Tag durchzuführen. Jeder Patient erhielt einen Elektrostimulations-Gürtel und ein Paar anatomisch geformte Elektroden (siehe Abb. 12 und 14). Dabei waren die Elektroden anatomisch so gestaltet, daß eine möglichst große und flächendeckende Stimulation der Quadricepsmuskulatur an beiden Beinen möglich war.
Abb. 12:
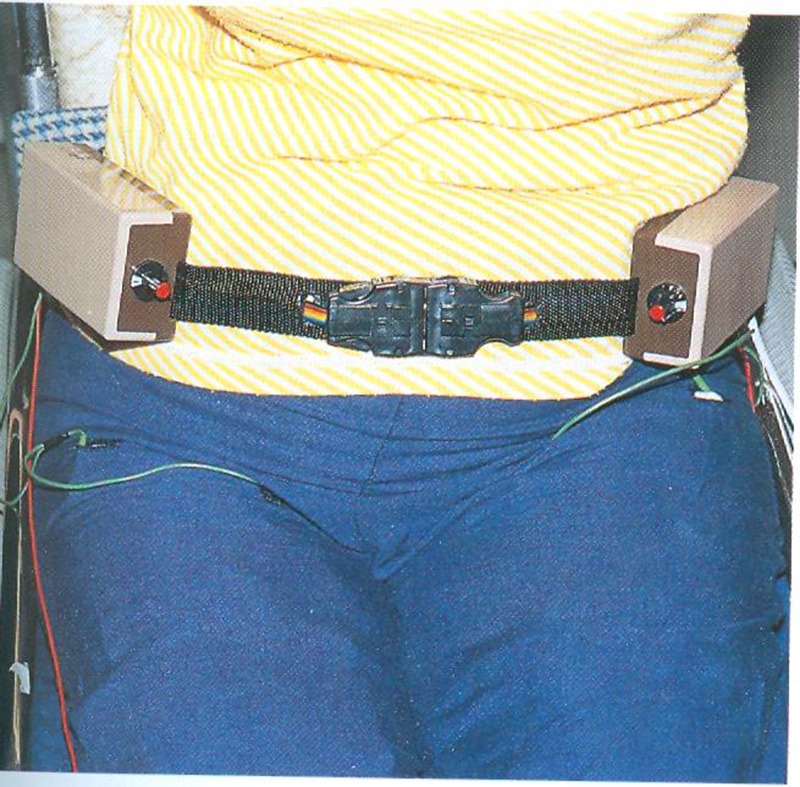
Oberflächenstimulationsgürtel
Abb. 14:

Große, anatomisch geformte Elektroden, die mit Kontaktgel direkt auf die Haut gelegt werden.
Vor der Ausgangsmessung der stimulierten isometrischen Oberschenkelstreckkraft fanden keine regelmäßigen Stimulationen statt.
In einem eigenen Trainingsprotokoll wurden sämtliche Stimulationszeiten morgens und am Abend eingetragen. Mit einem angeschlossenen Impulszähler und Stimulationszeitenzähler wurden die Angaben der Probanden überprüft. Nach der stimuliert-isometrischen Muskelkraftmessung wurden die CT-Untersuchungen zur Muskelquerschnittsbestimmung, die Infrarotthermographie, die Xenon-133-Clearance und Thallium-201-Szintigraphie der Oberschenkelmuskulatur in zufälliger Reihenfolge durchgeführt. Als Abschluss der Voruntersuchungen wurden Muskelbiopsien aus dem M. quadriceps vom Vastus lateralis mit der Bergström-Punktionsnadel unter OP-Bedingungen entnommen und nach 10 Tagen Heilungszeit mit der Elektrostimulation für 8 Monate begonnen.
Am Ende der Stimulationsperiode wurden zuerst die Thallium-201-Szintigraphie und die Xenon-133-Clearance, die CT-Untersuchung und die isometrische FES-Kraftkontrollmessung und die Infrarot-Thermographie-Messung durchgeführt. Als letzte Kontrolluntersuchung erfolgte die zweite Muskelbiopsie aus derselben Region im Vastus lateralis an beiden Oberschenkeln.
Wegen zum Teil technischer Schwierigkeiten oder anderer Probleme mußten pro Untersuchungsmethode 1-2 Patienten ausgeschieden werden: Punktion von vorwiegend Bindegewebe, Fett und Blut bei einer Biopsie; 2 Patienten willigten nicht zur 2. Biopsie ein; 1 Patient hatte besonders geringen Trainingsumfang und Compliance; 2 Patienten hatten schon längere Stimulationszeiten vor Studienbeginn absolviert, so daß sie nur für die Zweit-Untersuchung der CT-Fläche, Thallium- und Xenon-Untersuchung, Infrarot-Telethermographie sowie Kraftmessung herangezogen werden konnten. Alle 6 Untersuchungsmethoden wurden nur von 10 Patienten (4 denervierte und 6 spastische) zufriedenstellend und erfolgreich absolviert.
III/2 Technische Voraussetzungen und Ausrüstung
Zur Durchführung der Funktionellen Elektrostimulation waren umfangreiche technische Entwicklungen vor der Stimulationsserie notwendig, wie z. B. die Fertigung geeigneter Oberflächenstimulationsgeräte, die Elektrodenentwicklung, die Platzierung und Befestigung der Elektroden während der Funktion, die Konstruktion der Steuereinheiten wie Krückenschalter oder Barrenschalter etc. sowie die Erforschung der richtigen Stimulationsmethodik hinsichtlich Frequenz, Impulsdauer, Impulsform, Frequenz, Schwelldauer, Schwellpause, Ermüdungsverhalten etc.
Diese umfangreichen technischen Entwicklungen und Vorarbeiten wurden vor dieser physiologischen Untersuchungsserie durchgeführt. (Siehe Kapitel II/2). Während der Trainingsperiode wurden alle technischen Geräte und Materialien bei allen Patienten gleich gehalten.
III/2/A Oberflächenstimulationsgeräte und Zubehör
1) 2-Kanal-Gürtelversion für spastisch gelähmte Patienten
Die Stimulationseinheit wurde von uns im Eigenbau hergestellt, um bei dem sensibel und motorisch komplett gelähmten Patienten die erhöhten Sicherheitsauflagen (netzunabhängiger Batteriebetrieb etc.) zu erfüllen. Der einzige für die Patienten über ein Drehpotentiometer verstellbare Parameter war die Stimulationsintensität, wobei die Patienten die Anweisung hatten, im Rollstuhl sitzend bis zur völligen Kniestreckung (spastische Gruppe) zu stimulieren.
Der Oberflächenstimulationsgürtel ist zweiteilig und besteht aus je einem Stimulationsmodul für die linke und für die rechte Seite. Beide Module befinden sich auf einem Gürtel, der durch einen Stecker geschloßen wird; dieser Stecker fungiert gleichzeitig als Gürtelschnalle. Dadurch ist sowohl eine mechanische Fixierung als auch eine elektrische Verbindung zwischen den beiden Modulen gegeben. Die Gürtellänge kann hinter dem rechten Stimulator stufenlos variiert werden.
Die Zweimodul-Ausführung ermöglicht dem Patienten optimale Bewegungsfreiheit bei späteren Aufstehe und/oder Gehversuchen und vermeidet ungleiche Lastverteilungen. Beide Module sind nur bei geschlossener Gürtelschnalle funktionsfähig. Stimu-lationsspannung, Impulsdauer und Impulsfrequenz können für jedes Modul getrennt eingestellt werden.
2) 3-Kanal-Gürtelversion für spastische Patienten
Die 3-Kanal-Version erlaubt die Auslösung des Peronaeus-Reflexes durch Stimulation hinter dem Fibulaköpfchen. Die Stimulationsbereiche und die zeitlichen Verzögerungen dazwischen können einzeln geregelt werden. Sonst ist das Gerät technisch der 2-Kanal-Version sehr ähnlich, Franke, Kern (77).
3) Oberflächenstimulationsgerät für denervierte Muskulatur
Bei der Oberflächenstimulation denervierter Muskulatur werden großflächig anatomisch geformte Elektroden, die den ganzen Muskelverlauf bedecken, eingesetzt. Da keine Nerven zur Erregungsübertragung vorhanden sind, ist die großflächige Elektrodenlage besonders entscheidend!
Der Reizzeitbedarf denervierter Muskulatur ist zumindest um den Faktor 10-100 größer als von spastisch-gelähmter Muskulatur. Daher waren zu Beginn der Stimulation bei längerer Denervationzeit und somit großen Muskeldegeneration Impulsgrößen von ca. 100-200 msec Dauer (0,5 Hz) notwendig.
Die Impulsgrößen von 100-200 msec Dauer, mit einer Amplitude von 60-100 Volt und großflächig anatomisch geformten Elektroden sind mit einer Batterie betriebenen Version nicht mehr möglich. Daher sind für Patienten mit Conus-Cauda-Läsionen speziell entwickelte Geräte notwendig, die zu Beginn des elektrischen Muskeltrainings 100-200 msec lange biphasische Rechteckimpulse mit Pausen von ca. 500-600 msec abgeben können.
Nach der ersten Trainingsphase und Normalisierung der Muskelmembranerregbarkeit reduzierte sich der Reizzeitbedarf auf ca. 20-30 msec. Erst zu diesem Zeitpunkt konnten wir bei einem Impulspausenverhältnis von 1:1 beginnen, einen Schwellstrom für denervierte Muskulatur nach Kern mit 20 bzw. 25 Hz einzusetzen, wodurch tetanische Muskelkontraktionen auslösbar waren. Dazu mußte das Gerät auch kürzere Einzelimpulse und Pausen sowie Schwellzyklen von 2-5 sec und Schwellpausen zwischen 2 und 20 sec erzeugen können.
Daher entwickelten wir das Oberflächenstimulationsgerät für denervierte Muskulatur mit Netzbetrieb. Diese Stimulationseinheit kann nur am Stromnetz angeschlossen betrieben werden, da die abgegebene Leistung für einen Akkubetrieb zu hoch ist. Dieses Standgerät kann Impulse zwischen 5 und 200 msec Dauer bei einer Impulspause von 5-1000 msec und variablen Schwellzyklen von 0,5 bis 10 sec Dauer und eine Schwellpause von 0,5 bis zu 60 sec abgeben.
4) Stimulationsfrequenz und Impulse
Die Stimulationsfrequenz und Impulsdauer bei der OF-Stimulation für spastische Patienten können mit einem Regler nur vom Techniker mit Hilfe eines Spezialschlüssels zwischen 15 und 65 Hz bzw. zwischen 0,2 und 1,4 msec Impulsdauer stufenlos variiert werden. Für den Patienten ist eine Verstellung unmöglich. Bei dieser Versuchsserie wurde ein biphasische Impuls mit 1,2 msec Impulsdauer und 27 Hz Stimulationsfrequenz verwendet. Vergleiche auch Peckham 1976 (232).
Für denervierte Muskeln war die Impulsdauer zw. 5-200 msec bei ca. gleich langer Pause. Die Stimulationsfrequenz war daher 0,5-25 Hz.
Bei den Impulsen handelt es sich um biphasische Rechteckimpulse, die gegenüber monophasischen Impulsen bei gleicher Amplitude zu stärkeren Muskelkontraktionen führen. An der distalen Elektrode beginnt die Stimulation mit positiver Spannung gegenüber der proximalen Elektrode. Die positive und die negative Impulsphase sind völlig symmetrisch geformt und weisen die gleiche Impulsdauer auf.
Die Gesamtimpulsdauer (positive und negative Flanke zusammen) kann zwischen 0,2 und 1,4 msec bei der 2-Kanal-Gürtelversion stufenlos eingestellt werden. Für die denervierte Muskulatur beträgt die Impulsdauer 5 bis 150-200 msec.
5) Strom/Spannung
Die Oberflächenstimulator-2-Kanal-Gürtelversion und das Standgerät für denervierte Muskulatur sind Geräte mit konstanter Spannung. Die Amplitude kann an der Vorderseite durch Verdrehen des Potentiometers zwischen +20 und +65 Volt stufenlos eingestellt werden. Dieser Drehknopf dient auch zum Ein- und Ausschalten des Stimulationsmoduls. Bei früheren Geräten reichte der Amplitudenbereich bis +100 Volt. Da die Impedanz der neu entwickelten Elektroden gegenüber den anfangs verwendeten deutlich verringert wurde, ist diese hohe Amplitude nicht mehr erforderlich.
Die am Potentiometer eingestellte Amplitude stellt einen Maximalwert dar. Die tatsächliche Ausgangsamplitude kann über externe Steuergeräte (Handregler, Zyklen-Timer, etc.) definiert werden. Diese Zusatzgeräte liefern eine Steuerspannung im Bereich 0 bis 5 Volt, die die Stimulationsamplitude zwischen 0 Volt und dem am Gürtel eingestellten Maximalwert variiert. Eine Stimulation ohne angeschlossene Steuergeräte ist nicht möglich.
Das bei diesem Versuch verwendete Steuergerät war anfangs ein Handschieberegler und später ein automatischer Stimulationszyklen-Timer, für den die Wer-te 3 sec on 3 sec off oder 5 sec on 5 sec off vom Patienten wählbar waren.
Die hohe Amplitude der Stimulationsimpulse wird über einen Impuls-Transformator erzeugt. Dadurch wird zuverlässig verhindert, daß Gleichstromanteile dem Impulsmuster überlagert werden können, die unter Umständen zu elektrolytischen Hautschädigungen führen könnten. Dies ist vor allem auch bei Störungen in der Elektronik aus Sicherheitsgründen wichtig.
6) Spannungsversorgung
Das Standgerät für denervierte Muskulatur muss vom Stromnetz versorgt werden.
Der Stimulationsgürtel ist mit eingebauten Nickel-Cadmium-Akkumulatoren ausgerüstet. Dadurch ist es möglich, die Stimulation orts- und netzspannungsunabhängig durchzuführen. Die Kapazität der Akkus reicht im Normalbetrieb aus, den Gürtel und die angeschlossenen mitversorgten Geräte (z. B. Impulszähler, Timer usw.) mind. 1-3 Stunden zu betreiben. Die max. Stimulationszeit hängt neben den angeschlossenen Geräten auch von den Elektroden und den eingestellten Impulsparametern ab. Sinkt die Akkuspannung unter einen für den Betrieb notwendigen Wert ab, ertönt ein akustisches Alarmsignal. Die Patienten mussten die Stimulationseinheit mit einem Ladegerät über Nacht aufladen. Bei voll entladenen Akkus beträgt die Ladezeit ca. 14 Stunden, längere Ladezeiten bewirken keine Akkuschädigungen.
7) Intervall-Timer
Der Intervall-Timer ist ein externes Trainingsgerät, das für diese Versuchsserie entwickelt wurde. Dadurch konnte bei allen Patienten nach der indivi-duellen 1. Phase ein standardisiertes Trainingspro-gramm mit definierter Stimulationsdauer und Pause durchgeführt werden. Der Timer wird über die Steuerbuchse mit dem Stimulationsgerät verbunden. Stimulationsdauer und Stimulationspause können getrennt in Sekundenstufen zwischen 1 und 10 Sekunden eingestellt werden. Sie waren aber für diesen Versuch auf 3/3 sec bzw. 5/5 sec fixiert.
Der Timer wurde so programmiert, daß sowohl der Beginn als auch das Ende der Stimulationssequenzen nicht sprunghaft erfolgen, sondern die Amplitude entlang einer Rampe ansteigt bzw. abfällt. Die Dauer beider Rampen kann über getrennte Einstellregler nur vom Techniker mit Hilfe eines Spezialschlüssels zwischen 0 und 2 Sekunden eingestellt werden. Bei diesem Versuch betrug die Rampenzeit 0,2 Sekunden.
8) Handregler
Es handelt sich um ein externes Gerät, das über die Steuerbuchse am Stimulationsgürtel angeschloßen wird. Der Handregler dient zur stufenlosen Amplitudenverstellung im Trainingsbetrieb. Es kann zwischen der Ansteuerung des linken Moduls, beider Module oder des rechten Moduls gewählt werden. Die Amplitude wird durch einen Schieberegler verstellt. Mit Hilfe einer Rückstellfeder, die über eine Umlenkrolle geführt wird, stellt sich der Schieberegler automatisch auf 0 zurück.
9) Impulszähler
Der Impulszähler ist ein Ergänzungsgerät, das zusätzlich am Gürtel angebracht wird und ebenfalls für die Stimulation der FES-Patienten entwickelt wurde. Es war damit möglich, die Impulsdauer und -frequenz, Stimulationsspannung und -strom, Uhrzeit, Datum und Dauer der Stimulation zu erfassen. Alle Parameter konnten über einen PC eingelesen, gespeichert, statistisch verarbeitet und ausgedruckt werden.
Für den Betrieb des Impulszählers mußte dieser mit beiden Modulen verbunden werden, und zwar wurde er in die Steueranschluss- und in die Spannungs-Elektrodenleitungen eingeschlieft. Um ein Löschen der Stimulationsdaten zu verhindern, war eine Backup-Batterie eingebaut. Die Betriebsspannung erhielt der Timer aus dem Oberflächenstimulationsgürtel.
10) Elektrodenvergleichsuntersuchungen zur Optimierung der Stimulation
Als technische Vorversuche haben wir u. a. die Elektroden in Material und Form optimiert, da für eine erfolgreiche Elektrostimulationstherapie die Elektroden von entscheidender Bedeutung sind. Deshalb haben wir Blei- und Zinnblechelektroden mit Wettex mit den Gummielektroden sowie die Kraftentfaltung in Abhängigkeit von der Stimulationsintensität verglichen. Die Selektivität der elektrischen Reizung bzw. die Mit Stimulation der Antagonisten wurde analysiert (siehe Abb. 13).
Für die Vergleichsmessungen wurde der M. quadriceps femoris von freiwilligen Probanden stimuliert. Es wurden Bleielektroden mit einer Fläche von 200 cm2 einmal mit einem Frotteetuch und einmal mit Wettex sowie Gummielektroden mit Gel und Gummi-elektroden mit Wettex angelegt. Bei verschiedenen Stimulationsspannungen wurden anschließend die Stimulationsströme und die entstehenden Knie-streckmomente gemessen. Dabei wurde das Kniegelenk bei einem Winkel von 90 Grad fixiert.
Außerdem wurden die Impedanzen und Impulsleistungen errechnet. Die Impulsdauer und die Impulsfrequenz wurden nicht variiert (Impulsdauer 0,5 msec, Impulsfrequenz 25 Hz).
Die Messung wurde an beiden Beinen durchgeführt. Pro Tag wurde, um Ermüdungserscheinungen zu vermeiden, die Messung lediglich mit einem Elektrodentyp pro Bein vorgenommen. Die Stimulationsspannung wurde, beginnend bei 5 Volt, in 5 Volt-Schritten so lange gesteigert, bis ein Kniestreckmoment von ca. 250 Nm erreicht wurde. Um Messungenauigkeiten zu vermeiden, wurden bei jedem eingestellten Spannungswert 10 Messungen vorgenommen und die Ergebnisse anschließend gemittelt.
Klinisch übliche Elektrodenanlage
Für die Funktionelle Elektrostimulation bei querschnittgelähmten Paraplegikern werden ca. 200-250 cm2 große, flexible Leitgummielektroden für den M. quadriceps verwendet. Beim M. Glutaeus max. und med. sind je zwei ca. 100 cm2 große Elektroden auf jeder Seite funktionell unter der Radfahrhose zu plazieren. Aus Gründen der Potentialverteilung weisen diese Elektroden an einer Längsseite 3 Anschlußnoppen für die 2-mm-Bananen-Stecker der Elektrodenleitungen auf.
Um eine möglichst homogene Feldverteilung zu erreichen und überhöhte lokale Stromdichten zu vermeiden, wird zwischen der Elektrode und der Haut entweder Elektroden-Gel aufgebracht oder ein ca. 5 mm dickes, mit Wasser durchtränktes Schwammtuch eingelegt.
Die Fixierung der Elektroden erfolgt über eine adaptierte Radfahrerhose mit Reißverschluß bzw. mit Leggings. Für das Positionieren der Elektroden wurden entsprechende Kunststoff-Reißverschlüsse am Oberschenkel dorsal längs angebracht. Das elastische Gewebe gewährleistet einen gleichmäßigen Anpressdruck über die gesamte Elektrodenfläche, auch bei Formänderungen durch die kontrahierende Muskulatur oder bei Lage- und Positions-änderungen. Derzeit werden Leggings ohne Reißver-schlüsse verwendet.
Die Impulsparameter wurden laut unseren Vorversuchen vom Techniker eingestellt, die Möglichkeit der Intensitätsregelung über das Potentiometer war die einzige Beeinflussungsmöglichkeit durch den Patienten. Die Bedienung der Geräte und die Elektrodenplazierung waren sehr einfach, so dass auch bei Unachtsamkeit eine effiziente Stimulation fortgeführt werden konnte. Einige Versuchspersonen sind während der Stimulation fallweise eingeschlafen und haben entsprechend unseren Sicherheitsvorkehrungen keine Schäden durch die automatisch weiterlaufende Stimulation davongetragen.
III/2/B Zu Stimulationsparameter und Trainingsanweisungen
Die Patienten hatten die Aufgabe, 2x täglich anfänglich 15 min, später während der gesamten Stimulationszeit 2 x 30 min täglich zu stimulieren.
Es wurde ein Kraftausdauertraining gewählt, um Muskelmasse und Faserquerschnitt zu vergrößern, die Membranerregbarkeit denervierter Muskulatur zu steigern und um bei allen Patienten die periphere Trophik und Durchblutung zu verbessern. Für spastische und denervierte Muskulatur wurden unterschiedliche Stimulationsprotokolle verwendet.
1) Stimulationsmethodik spastisch gelähmter Muskulatur
Die Patienten hatten den Auftrag, bis zur Kniestreckung zu stimulieren, anfangs mittels Schieberegler und ohne Gewichtsbelastung und danach mit automatischer Stimulation. Um die maximale Wiederholungsanzahl zu reduzieren, wurde bei fortschreitender Kräftigung eine Gewichtsbelastung von 2-3-5 kg (1 Patient 15 kg) als Manschette um den Knöchel verwendet. Maximal waren 80 % der maximalen Wiederholungsanzahl pro Serie erlaubt. Zwischen den Serien waren 5 min Pause einzuhalten. Pro Sitzung mußten 4-6 Serien durchgeführt werden.
Die Stimulation erfolgte mit 27 Hz, Impulsdauer 1,2 msec, biphasische Rechteckimpulsen, 2 sec Schwelldauer, 5 sec Schwellpause, Polwendung nach je 5 Schwellzyklen oder nach je 5 Schwellzyklen 15 sec Pause.
Empfohlen wurden ca. 75 % der maximalen Wiederholungsanzahl, d. h. zumeist 25-30 Wiederholungen, in 6 Serien, 1x täglich, später 2x täglich.
In den ersten 2 Monaten hatten die Patienten bei zunehmender Muskelkraft die Aufgabe, zuerst die Stromstärke für eine kräftige Knieextension zu erhöhen, anschließend die Stimulationsdauer von 2 auf 3 und später auf 4 sec zu steigern, wobei die Schwellpausen mit 5 sec gleich blieben. Nach 2 Monaten Aufbautraining erfolgte die Stimulation, die anfänglich nur 1x täglich durchgeführt wurde, 2x täglich.
2) Stimulationsmethodik für denervierte Muskulatur
Der Reizzeitbedarf denervierter Muskulatur ist zumindest um den Faktor 10-100 größer als der von spastisch-gelähmter Muskulatur. Daher sind zu Beginn der Stimulation, wenn die Lähmung bereits einige Jahre bestanden hat, Impulse von biphasische ca. 100-200 msec Dauer bei 0,5 Hz notwendig.
Durch die konsequente Elektrostimulation denervierter Muskulatur normalisiert sich deren Erregbarkeit und der Zuckungscharakter. Durch diese Normalisierung des Membranstoffwechsels und somit des Membranpotentials gelingt es, immer kürzere Impulse einzusetzen. Ab ca. 20-30 msec Impulsdauer und 20 msec Impulspause wird eine Frequenz von 20-25 Hz erreicht. Dadurch gelingt es auch, wie wir in Vorversuchen zum Teil bereits 1985 veröffentlichen konnten (Kern 1985 (148, 150)), eine spezielle Schwell-Strom Applikation für denervierte Muskulatur zu erreichen, um so tetanische Muskelkontraktionen bei denervierter Muskulatur auszulösen. Diese tetanischen Kontraktionen können zu einer funktionellen Kniestreckung führen.
Meiner Meinung nach muss die zukünftige Therapie denervierter Muskulatur diesen Ergebnissen folgen. Es kann die bekannte Exponentialstrom-Therapie nur mehr als reflektorische Elektrotherapie eingesetzt werden. Eine direkte Beeinflussung der Muskelgröße, der Membranerregbarkeit und der Funktionstüchtigkeit der Muskulatur kann nur durch tetanische Kontraktionen in einem für Typ IIa-Fasern notwendigen Ausmaß von ca. 30.000-50.000 Stimuli pro Tag erreicht werden.
Für die Funktionelle Stimulation von komplett gelähmten Conus-Cauda-Patienten ist durch die hohen Stromstärken und die besonders gestörte Trophik der Haut und des Unterhautgewebes äußerste Vorsicht zu Beginn der Stimulation geboten.
Die Trophik fördernde Wirkung der Elektrostimulation regt jedoch eine deutliche Abhärtung und Dickenzunahme der Haut an, wodurch die anfänglich teilweise vorkommenden kleinflächigen Rötungen und Hautirritationen nach ca. 1monatiger Stimulation völlig vermieden werden können.
Unterschiedliche Stimulationsempfehlungen je nach Muskelerregbarkeit bei denervierter Muskulatur:
a) Einzelzuckungen
Schon länger gelähmte Muskulatur musste mit 120 bis 150 msec Dauer mit biphasische Impulsen mit einem Impulspausenverhältnis von 1 zu 3 erregt werden. Die Stimulation sollte 30 min, in der Aufbau-phase 1-2x täglich durchgeführt werden.
Bei einer Denervationzeit unter ca. 1,5 Jahren konnten bereits Impulsbreiten von 50 msec eingesetzt werden. Das Impulspausenverhältnis betrug anfänglich 1:3, anschließend 1:1 durch 30 min 2x täglich. Je nach Ermüdungsverhalten der Muskulatur wurde das Impulspausenverhältnis von 1:3 auf 1:1 gekürzt.
Die Patienten hatten den Auftrag, die Intensität soweit zu erhöhen, daß kräftige Muskelzuckungen sichtbar und fühlbar wurden.
b) Schwellstrom für denervierte Muskulatur nach Kern
Wie o. a. bessern sich die Erregbarkeit und die Membraneigenschaften der denervierten Muskulatur mit zunehmendem Stimulationszeitraum. Bei 20/20 msec Impuls/Pause konnte mit 25 Hz stimuliert werden.
Die Schwellzyklen betrugen 3 sec on und 5 sec off; anfangs nach je 5 Schwellzyklen 15 sec Pause; später wurde auf je 30 Wiederholungen pro Serie gesteigert, mit anschließender 3-5 min Pause. Die Patienten hatten den Auftrag, 6-8 Serien 2x täglich durchzuführen.
Die Elektrostimulation im Kraftausdauerbereich hatte folgende Ziele: Muskelmasse, Faserquerschnitt, Membranerregbarkeit, Trophik.
STIMULATIONSPARAMETER
-
spastisch gelähmt
2”/5” (Polwenden alle 5x oder nach 5 Schwellungen 15 sec Pause)
25-30 Wiederholungen
6-8 Serien
1 x täglich
-
Steigerung:
Stromstärke erhöhen
Stimulationszeit steigern: 2-3-4 sec
1 -> 2x täglich
denerviert
20-150 msec Impulsdauer
-
Einzelzuckungen:
120 msec Dauer; Impuls-Pausenverhält. 1:3 später 50-70msec mit einem Impuls:
Pausenverhältnis von 1:1
30 Minuten
2x täglich
-
Schwellstrom “Denerviert”
30/30 später
30/20-20 Hz oder
20/20-25 Hz
3”/5” anfangs nach 5 Schwellungen Pause, später
30 Wiederholungen pro Serie
(3-5 min Pause), 6-8 Serien,2x täglich
III/3 Zur Methodik der Nuklearmedizinischen Durchblutungsmessung
III/3/A Zur Xenon-133-Clearance für die Hautdurchblutung
Zur Quantifizierung der Änderungen der Hautdurchblutung haben wir die Xenon-133-Clearance eingesetzt.
Von Harrys (103), Moore (210), Kostuik, Sapirstein (266) wurde die Hautdurchblutungsmessung mit Xenon-133 zur Beurteilung der Amputationshöhe und der Heilungschancen bei Durchblutungsstörungen der unteren Extremität angegeben. Sejersen (280, 281) hat in zahlreichen Arbeiten ein Modell für die Verwendung der Xenon-133-Clearance zur Messung der Hautdurchblutung entworfen. Er hat in seinen Arbeiten gezeigt, daß die semilogarithmische Aufzeichnung der Xenon-Radioaktivität als Funktion der Zeit eine Zweikomponentenkurve zur Darstellung bringt. Autoradiographisch weist er nach, daß die zwei Compartment in Serie geschaltet sind. Das erste Compartment entspricht der Dermis, das zweite Compartment dem subcutanen Fettgewebe. Dementsprechend darf nur der initiale Abfall der washout-Kurve zur Berechnung der Hautdurchblutung herangezogen werden.
Nach Chimoskey (45) korrelieren die dadurch erhaltenen Werte auch gut mit den plethysmographisch Messungen, wodurch ausgeschlossen werden konnte, daß es sich dabei um einen Artefakt (Mikrotrauma durch Injektion des Xenons (132) handelte.
Daly und Henry (55) stellten in ihrer Arbeit über die quantitative Messung der Hautdurchblutung mit Xenon-133 fest, daß diese Methode praktische Vorteile gegenüber anderen Methoden aufweist. Sie merkten jedoch bei ihrer Arbeit kritisch an, daß die Umgebungstemperatur eine wichtige Variable bei der Messung der Hautdurchblutung darstellt.
Spezielle Methodik
Die Patienten wurden in entspannter Rückenlage auf einem Untersuchungsbett gelagert, wobei die unteren Extremitäten entblösst waren. Die Raumtemperatur betrug 25 Grad. Nach einer 20-min-Anpassungszeit an das Raumklima wurden die Elektroden an einem Bein im Bereich des proximalen und distalen Oberschenkels angelegt.
Die Patienten stimulierten mit den für sie optimalen Trainingsparametern. Nach 12 min Stimulationsdauer wurden in das Hautareal zwischen den Elektroden 3 Quaddeln entsprechend 50 µCi Xenon 133 intrakutan appliziert. Das Xenongas ist dabei in maximal 0,1 ml physiologischer Kochsalzlösung aufgelöst. Die 3 Quaddeln wurden in einem Hautareal von etwa 2x2 cm gleichmäßig verteilt. Als Vergleich diente die nicht stimulierte, kontralaterale Extremität. Auch dort wurden an korrespondierender Stelle 3 Quaddeln mit Xenon 133 gesetzt. Die Elektrostimulation wurde für weitere 3 min fortgesetzt.
Während dieser Zeit wurde die Xenon-133-Clearance an einem 2-Kanal-Messplatz aufgenommen. Bei dieser Messung befanden sich die Sonden des 2-Kanal-Messplatzes in einem Abstand von ca. 15 cm über der Hautoberfläche der zu messenden Extremitäten. Die Kurven wurden über einen Ratemeter auf semilogarithmischem Papier aufgezeichnet. Der Abfall der monoexponentiellen Kurve wird als Messparameter herangezogen.
Die Hautdurchblutung berechnete sich laut Mostbeck (212, 213) aus: Flow = k. λ. 100 [ml/100g/min]; wobei k den Anstieg der monoexponentiellen Kurve (pro Minute) und λ den Partitionskoeffizient (0,7 für Haut) darstellt.
Nach insgesamt 15 min Stimulation werden die Elektroden entfernt, die ursprünglichen 2 Quaddeln mit Blei abgedeckt und neuerlich 3 Quaddeln Xenon 133 in das Areal unter den Elektroden (= Galvanisches Erythem) intrakutan appliziert und neuerlich registriert. Gleichzeitig wurde auf der kontralateralen, nichtstimulierten Seite die alte Quaddel abgedeckt und neue Quaddeln am Oberschenkel gesetzt. Die Messung wurde für weitere 5-15 min fortgesetzt.
III/3/B Zur Thallium-Szintigraphie für die Muskeldurchblutung
Wir haben die Thallium-Szintigraphie der Xenon-Clearance zur Bestimmung der Muskeldurchblutung vorgezogen, da wir wie Kjellmer (159) und Tönnessen (305) überzeugt sind, daß bei gelähmter Muskulatur mit hohem Fettanteil die Xenon-Clearance wegen der hohen Fettaffinität von Xenon nicht geeignet ist, die Muskeldurchblutung zu quantifizieren.
Die Thallium-Szintigraphie ist aus der Routineuntersuchung zur Durchblutungsmessung der Herzmuskulatur Creutzig 1985 (53), Büll (35), Mc Killop (200, 201) bekannt. In neuerer Zeit wird die Thallium-Szintigraphie auch zur Beurteilung der regionalen Durchblutung der Extremitäten-Muskulatur, Burt (38) und Siegel (285), herangezogen. Die einzelnen Arbeiten beschäftigen sich aber vorwiegend mit der Darstellung der Beinmuskelperfusion bei Patienten mit peripherer arterieller Verschlußkrankheit.
Thallium wird von der Muskulatur weitgehend propor-tional der regionalen Perfusion aufgenommen und aktiv statt K+ in die Muskelzelle transportiert (Gehring (82). Die Transportkapazität der Zelle für Thallium 201 wird erst bei sehr hohen flow Raten zum limitierenden Faktor. Im aeroben Bereich der Muskelleistung (Lactat unter 2 mmol/l) und bei intaktem Gefäßsystem korreliert die Thallium-Aufnahme direkt mit der Durchblutung. Wir glauben daher, in Übereinstimmung mit Strauss (295) und Mostbeck (216), dass die Thallium-201-Szintigraphie sehr gut mit dem tatsächlichen blood flow im stimulierten Muskel korreliert.
Da bei der Thallium-Szintigraphie keine Absolutwerte der Durchblutung gemessen werden können, sondern nur die regionale Verteilung der Perfusion, war für den Langzeitvergleich eine Bezugsgröße notwendig.
Wir haben das Gehirn als inneren Standard und Bezugspunkt genommen und einen Quotienten Muskel/Gehirn gebildet. Durch diesen Quotienten werden unterschiedliche Dosen des applizierten Thalliums korrigiert und die regionale Muskeldurchblutung erfaßt.
Spezielle Stimulationsmethode für spastisch und denervierte Muskulatur
Die Patienten werden mit unbekleideten Extremitäten in entspannter Rückenlage auf dem Untersuchungstisch gelagert. Die Raumtemperatur beträgt durchschnittlich 25 Grad. Nach 20minütiger Anpassungszeit an das Raumklima wurde der M. quadriceps mit der optimalen Stromform aus einem von uns entwickelten Universalstimulationsgerät stimuliert. Als Elektroden kamen grossflächige, anatomisch angepasste Oberflächenelektroden aus leitendem Siliconkautschuk zur Anwendung.
Bei Patienten mit spastisch gelähmter Muskulatur wurde der M. quadriceps mit biphasischen Rechteckströmen von 1,2 msec Impulsdauer und einer Frequenz von 25 Hz stimuliert. Die Stimulationsmethodik war bei den spastisch gelähmten Patienten bei Erst- und Abschlußuntersuchung gleich!
Bei den Patienten mit denervierter Muskulatur wurden bei der Erstuntersuchung Einzelzuckungen mit Rechteckimpulsen von 150 msec Dauer und 750 msec Pause ausgelöst. Die Erstuntersuchung dokumentiert die maximale Möglichkeit der Muskel-aktivierung vor der Trainingsperiode. Erst bei zunehmender Verbesserung der Muskelmembran-Erregbarkeit konnte auf 30 msec Stimulationsdauer und 30 msec Stimulationspause zurückgegangen werden. Bei der zweiten Messung wurde mit Schwellstrom für denervierte Muskulatur stimuliert, um die gesamte Muskelmasse des M. quadriceps optimal zu erfassen und somit wieder die maximale Muskelleistung zu dokumentieren.
Die intravenöse Gabe von 2 mCi Thallium 201 erfolgte nach einer Stimulationsdauer von 12 Minuten. Nach weiteren 3 min wurde die Stimulation beendet. Die Thallium-201-Aufnahme in das Muskelgewebe wurde mit einem Gamma-Kamera-Computersystem (64x64 Matrix, 200.000 Counts) registriert. Über ROIS (Regions of Interest) wurde die Aktivität im stimulierten und nicht stimulierten Muskel (Oberschenkel und Unterschenkel) sowie über dem Gehirn registriert.
Als Parameter für die regionale Muskeldurchblutung diente der Quotient Muskel/Gehirn.
III/4 Zur Infrarot-Telethermographischen Untersuchung
Die Infrarotthermographie wird in vielen Bereichen der Medizin zur Diagnostik (Hensel (108), Engel (69), Aalam (1), Kainz (142, 143), Ammer (4)) eingesetzt. Neben der Thermographie der weiblichen Brust wird die Infrarotthermographie in der Thrombosediagnostik, in der Diagnostik autonomer Neuropathien, funktioneller Störungen des Achsenorgans, der primär chronischen Polyarthritis, des Morbus Sudeck, des Morbus Raynaud und der Tendovaginitis verwendet.
Unsere Methodik
Die thermographische Untersuchung erfolgte an 14 Querschnittpatienten (6 mit denervierter und 8 mit spastisch gelähmter Muskulatur).
Die Untersuchung erfolgte so wie u. a. die Xenon-133-Clearance und Thallium-201-Szintigraphie zu Beginn und nach 8monatiger Therapie jeweils mit gleicher Methodik.
Die Patienten mit spastisch gelähmter Muskulatur stimulierten ihren M. quadriceps vor der Thermographieaufnahme mit biphasischen Rechteckimpulsen von 1,2 msec Dauer bei einer Frequenz von 25 Hz. Die Intensität wurde dabei so gewählt, daß eine möglichst kräftige Kontraktion erzielt werden konnte. Zur Reduktion der Stromdichte als auch zur homogenen Stromverteilung der relativ hohen Intensitäten wurden anatomisch angepaßte, möglichst großflächige Silicon Kautschuk Elektroden verwendet.
Die Patienten mit schlaff gelähmter Muskulatur arbeiteten zu Beginn mit Rechteckimpulsen von 150 msec Dauer und 750 msec Pause. Bis zur Zweituntersuchung nach 8 Monaten konnte sukzessive auf 30 msec Stimulationsdauer und 30 msec Stimulationspause zurückgegangen werden. Auch hier wurde versucht, möglichst kräftige Muskelzuckungen und später bei der 2. Untersuchung tetanische Kontraktionen zu erzielen um einen optimalen Trainingsreiz zu erzielen.
Die Aufzeichnung der Oberflächentemperatur der stimulierten Areale erfolgte unter Beachtung der Richtlinien für die thermographische Untersuchung Aalam et al. 1986 (1), d. h. der Patient verbrachte zunächst 20 min mit unbekleideten unteren Extremitäten auf der Untersuchungsliege im Thermographieraum. Dieser Raum wies eine standardisierte Temperatur von 25 Grad C auf.
Nach der Anpassungszeit erfolgte eine 10minütige Stimulation eines Oberschenkels. Nach Entfernen der Elektroden wurden die Veränderungen der Oberflächentemperatur sowohl der stimulierten als auch der nicht stimulierten Seite über einen Zeitraum von 1 h aufgezeichnet (Bildfolge alle 5 min). Zur Aufzeichnung verwendeten wir eine rechnergestützte Thermographieanlage der Firma AGEMA. Dabei errechneten wir über Regions of Interest die durchschnittliche sowie die maximale Temperaturerhöhung des betroffenen Gebietes. Die statistische Berechnung erfolgte im Vergleich der jeweiligen Regionen zu den Ergebnissen des Leerversuches sowie im Vergleich der Regionen zueinander. Zur Anwendung kam dabei der Test nach Wilcoxon.
Hyperämie bei Entlastung der Sitzfläche
Den Hyperämieverlauf in der Haut im Anschluss an die “Sitzentlastung” der glutäalen Region haben wir bei den denervierten und teilweise bei den spastischgelähmten Patienten überprüft. Der Druck beim Sitzen im Rollstuhl ohne reflexbedingte Lage-bzw. Belastungsänderungen bedingt die von vielen Patienten befürchtete Ischämie und die dadurch bedingte Decubitusgefahr (Bochdansky und Spahn, persönliche Mitteilungen). Die übliche Rehabilitationsmaßnahme besteht darin, daß sich querschnittgelähmte Patienten im Rollstuhl hochstützen oder bei höheren Läsionen durch Lageänderung des Oberkörpers zur Seite eine völlige oder zumindest teilweise Entlastung der Sitzfläche bewirken. Die bei Entlastung auftretende Hyperämie sollte rasch die Sauerstoffschuld und das Ernährungsdefizit des Gewebes abbauen.
Um das Ausmaß der Hyperämie zu dokumentieren, haben wir Patienten unmittelbar nach Überwechseln vom Rollstuhl in Bauchlage gelagert und thermographisch die Glutäal- und Oberschenkelregion bis 60 min lang überprüft. Dazu wurden in den ersten 10 min pro Minute ein Bild und anschließend pro 5 min ein Dokumentationsbild aufgenommen. Die Berechnung der thermographischen Werte erfolgte entsprechend der bereits o. a. Methodik.
III/5 Zur computertomographischen Bestimmung der Muskelquerschnittsfläche
Computertomographische Querschnittanalysen der Oberschenkelmuskulatur bei Paraplegie, insbeson-dere zur Athrophie Bestimmung, sind in den letzten Jahren von Ragnarsson (249), Pollak (244), Bremner (29) und Pacy (225) eingesetzt worden. Wir wollten den Trainingseffekt unserer 8monatigen Stimulationsserie mit Muskelbiopsie und Computertomographie nachweisen und wenn möglich eine Korrelation zwischen beiden Untersuchungsmethoden herstellen.
Bei 14 Paraplegikern (2 weiblichen, 12 männlichen Geschlechts), 6 mit schlaffer, 8 mit spastischer Lähmung, wurde eine Computertomographie zur Querschnittsberechnung der Glutäal- und Oberschenkelmuskulatur angefertigt.
Vor Beginn der Stimulation wurde ein Ausgangsbefund erhoben. (2 Patienten wurden erstmals nach längerer Stimulation untersucht.) Die Patienten wurden nach 8 Monaten Stimulation einer Kontrollcomputertomographie unterzogen.
Als Vergleichskollektiv wurden bei 12 freiwilligen, gesunden Probanden (6 weiblich, 6 männlich) mit einem Durchschnittsalter von 22 a (weiblich) bzw. 27,6 a (männlich) die Muskelquerschnitte bestimmt. Die computertomographischen Muskelquerschnittsmessungen im freiwilligen gesunden Vergleichskollektiv wurden laut unserer Messmethodik in 3 Oberschenkelebenen gemessen, die jeweils in 10 cm distal der Trochanterspitze gelegt wurden. Obwohl sich Männer und Frauen 20-40 % im Muskelquerschnitt unterscheiden und besonders der distale Quadriceps schnitt (Q3 = 30 cm distal des Trochanter major) bis zu 90 % differiert, da bei kürzerer Oberschenkellänge nur mehr der Muskelsehnenübergang oder bereits nur mehr die Sehnen im Schnittbild erscheinen, wurden Männer und Frauen zusammen berechnet.
Bewusst haben wir als Vergleichskollektiv 6 Männer und 6 Frauen mit durchschnittlicher Alltags- und Trainingsbelastung gewählt, um gegenüber den atrophen querschnittgelähmten Patienten ein Normvergleichskollektiv mit unserer eigenen Methode zu erhalten.
Spezielle Methodik der CT-Meßung
Da die Oberschenkelmuskulatur nie zylinderförmig, sondern eher spindelförmig bzw. faßförmig angelegt ist, ist eine exakte CT-Schnittplazierung notwendig, um individuelle Vergleiche anstellen zu können. Wir haben daher die Trochanterspitze als individuelle Referenz-Marke gewählt, die mittels Topogramm im a.p.-Strahlengang jeweils festgelegt wurde. Ein Verdrehen der Körperachse war nicht erlaubt, und die Referenzlinie mußte durch beide Trochanterspitzen gelegt werden. Nur so war es möglich, einen individuellen Vergleich in einem Oberschenkel, aber auch einen Rechts-Links-Vergleich pro Individuum überhaupt zu ermöglichen.
Da jedoch die individuellen Schwankungen der Quadricepsfläche durch die Länge des Oberschenkels, den Körperbautyp individuellen Muskelbesatz und Trainingszustand extrem unterschiedlich sind, haben wir den Erfolg der Stimulation nicht in Bezug zum Vergleichskollektiv gemessen, sondern nur die individuelle Verbesserung oder Verminderung der Muskelquerschnittsfläche (Differenz) in cm2 oder in Prozent des Ausgangswertes gewertet.
Die Untersuchungen wurden mittels eines Computer-Tomographien der 3. Generation (Soma Tom DR 3, Fa. Siemens) an der Universitätsklinik für Radiodiagnostik (Vorstand Univ. Prof. Dr. Pokieser) von Dr. Schurawitzky und Doz. Dr. W. Kumpan und im Zentralröntgen-Institut am Wilhelminenspital (Vorstand Univ. Prof. Dr. H. Umek) von OA Dr. W. Richter durchgeführt. Die Patienten wurden in Rückenlage in Position „feet-first” parallel zur Tischachse gelagert. Die Unterschenkel waren leicht innenrotiert und bei den spastisch gelähmten Patienten mit einem Gurt fixiert.
Zuerst wurde ein Topogramm der zu untersuchenden Region im a.p.-Strahlengang angefertigt. Der 1. Schnitt wurde genau durch die Spitze des Trochanter major gelegt. 3 weitere Schnitte wurden jeweils im Abstand von 100 mm nach distal im Oberschenkelbereich angefertigt.
In jeder Schnittebene wurde unter Verwendung eines hochauflösenden Rechenprogramms die rechte und linke Extremität gesondert ausgewertet, der Zoom-Faktor war 2,5. Zur exakten Abgrenzbarkeit der Muskulatur gegen Fett wurde ein Weichteilfenster (window 350, Center 50) gewählt. Die Untersuchungen wurde ohne i.v.-KM-Applikation durchgeführt. Mittels Light-pen und eines speziellen Rechenprogrammes wurden die Querschnitte folgender Muskelgruppen planimetriert und errechnet.
Schnitt: (GL) M. glutaeus max. Q1
Schnitt: M. quadriceps femoris Q1 und Hamstrings sowie Adduktoren gemeinsam (H1)
Schnitt: M. quadriceps femoris (Q2) sowie alle Beuger und Adduktoren gemeinsam (H2)
Schnitt: M. Quadriceps femoris (Q3) und Hamstrings (H2) (soweit möglich)
Zusätzlich wurde der Gesamtquerschnitt sowie die Gesamtfläche der Beugemuskulatur und teilweise die Dichte bestimmt. Bei sehr atrophen Beinen ist jedoch der Fettanteil zwischen und in der Muskulatur so gross und wird zusätzlich von der Ernährungs-situation beeinflusst, daß eine exakte Dichte-bestimmung bzw. deren statistischer Vergleich völlig unmöglich ist. Wir haben uns daher auf die exaktere Aussage der Muskelbiopsie verlassen.
Wir haben die Oberschenkelbeugemuskulatur und Adduktoren gemeinsam berechnet, da sie nicht direkt stimuliert, sondern nur soweit trainiert wurden, wie sie im elektrischen Feld miterregt bzw. spastisch mitkontrahiert wurden. Auf eine Auswertung der Einzelmuskeln nach Vorliegen der Rohdaten haben wir verzichtet und nur die Gesamtfläche der Beuger und Adduktoren der Quadricepsfläche gegenübergestellt.
III/6 Zur Methodik der Kraftmessung im M. quadriceps femoris gelähmter Patienten
Vor und nach der Stimulationsserie wurden alle Patienten einer isometrischen FES-Kraftmessung auf dem Kniedynamometer unterzogen. Obwohl unser Kniedynamometer isokinetisch-konzentrische und isokinetisch-exzentrische Bewegungen hydraulikgesteuert erlaubt, haben wir uns zur isometrischen Messung entschlossen, da sie international häufig verwendet wird und daher leichte Vergleiche möglich sind. Der Hauptgrund war jedoch, jegliche spastische Aktivierung und somit Störung des Versuches durch Bewegung zu vermeiden.
Der störende Einfluss durch Mitstimulation der Oberschenkelbeugemuskulatur war zwar individuell unterschiedlich, ist jedoch bei allen Messungen und beim täglichen funktionellen Training gleich groß. Dies beeinflusst nicht nur die FES-Kraftmessung, sondern auch sämtliche Formen der FES-Ergometrie (siehe dort). Prinzipiell wird durch Verlängerung der Impulszeit auf 1,2 msec und durch möglichst geringe Intensität eine Konzentration des elektrischen Feldes auf die Oberschenkelstreckmuskulatur erreicht. So wirken sich nicht nur bei der Kraftmessung, sondern auch bei den täglichen Funktionsabläufen eine Impulszeitverlängerung und Reduktion der Intensität auf das Streckmoment des Kniegelenkes stets positiv aus.
Die Patienten wurden mit Becken und Oberkörpergurt in einer definierten Sitzposition fixiert, die individuell für alle Messungen gleich war (Abb. 1). Zwei seitliche Haltegriffe dienten der aktiven Stabilisierung von Arm und Oberkörper. Die Messung des Drehmomentes erfolgte über Dehnmessstreifen und elektronische Verstärkerkarte. Eine Kontrolleichung wurde vor jeder Messserie vorgenommen. Die Unterschenkelmanschette war in einem definierten Abstand zum Drehpunkt fixiert und ermöglichte für die Unterschenkel-Rotation in verschiedenen Kniebeugewinkeln die entsprechenden rotatorischen Freiheiten.
Abb. 1.:

Galvani demonstriert die elektrische Reizung am Froschmuskel.
Das isometrische Drehmoment wurde jeweils bei 90, 60 und 30 Grad Kniegelenkswinkel in Abhängigkeit von der Stimulationsamplitude ermittelt. Insgesamt wurden für jeden Winkel jeweils 10-14 Einzelwerte in 5-Volt-Schritten erfasst und die Amplitude, solange eine Kraftsteigerung auftrat, schrittweise erhöht. Die Auswertung erfolgte im Vergleich der beiden unteren Extremitäten und im Vergleich vor und nach der Stimulationsserie.
Da bei allen Patienten das Kraftmaximum bei 60 Grad erreicht wurde, haben wir in diesem Winkel die 12 Messungen pro Bein, vor und nach der Stimulation, also insgesamt 48 Messungen pro Patient ausgewertet. Außerdem wurden alle Messwerte summiert und das gemittelte Ergebnis vor und nach Stimulation verglichen.
Die Auswertung der Muskelkraftmessungen konnte natürlich nur bei den spastisch-gelähmten Patienten erfolgen, da bei denervierter Muskulatur der tetanische Ausgangswert 0 und am Ende der Stimulationsperiode teilweise gerade eine Kniestreckung gegen die Schwerkraft, aber nicht gegen Widerstand erreicht werden konnte.
III/7 Zur Methodik der Muskelbiopsie
Muskelfasergewinnung - gleiche Biopsiestelle - innerer Standard
Die Variabilität der Fasertypenverteilung ist höher bei verschiedenen Biopsiestellen eines Muskels als bei gleicher Biopsiestelle bei verschiedenen Probanden; siehe Blomstrand (20). In Anlehnung an eine Studie von Elder 1982 ist die Variabilität der FT-Fasern bei 4 unabhängigen Subproben unter 8 %. Bezüglich der oxidativen Kapazität ist die experimentelle Fehlerwahrscheinlichkeit geringer, da die oxidative Kapazität individueller Muskelfasern nur um 3 % differiert (Hoppeler (119, 121, 122)).
Nadelbiopsie
Die Nadelbiopsie ist schonender und einfacher als die offene (chirurgische) Biopsie. Der Nachteil der Nadelbiopsie ist das stark kontrahierte Muskelmaterial und der Verlust der Faseranordnung durch die Präparation, was die Volumenfraktion nicht verändert, wohl aber die Bestimmung der Talergröße und Kapillardichte etwas verfälscht.
Vor- und Nachteile der Analyse von Muskelproben im Querschnitt:
Vorteile
quantitative Analysen der strukturellen Komponenten des Energiemetabolismus (Kapillaren, Diffusionsprozesse von Mitochondrien zu Kapillaren und Mitochondrien zu Myofibrillen)
Einschätzung von Kapillar-Parametern
bei niedrigen Vergrößerungen (1.500 x) Kapillaren, Fasergrößen
bei hoher Vergrößerung (20.000 x) Beurteilung von Mitochondrienvolumina und (100.000 x) Oberflächen von Membransystemen.
Unterscheidung zwischen subsarcolemmalen und interfibrillären Mitochondrien.
Nachteile
keine ultrastrukturelle Fasertypisierung möglich (außer durch zusätzliche histochemische Methoden)
keine Bestimmung der Sarcomer-Länge, der Z-Band-Weite und des Ausmaßes des T-Tubulus-Systems und des Kontraktionsgrades möglich
III/7/A Spezielle Methodik der Muskelbiopsie bei der von uns verwendeten Versuchsanordnung
Bei jedem Probanden wurden 1 Woche vor und 1 Tag nach der Elektrostimulationsserie eine Nadelbiopsie aus dem M. vastus lateralis entnommen (Bergström 1975 (18)). Es wurden an beiden Oberschenkeln je 1 Biopsie vor und 1 Biopsie nach der Stimulationsserie durchgeführt.
Bei der Nadelbiopsie aus atrophiert Muskulatur, wie sie bei querschnittgelähmten Patienten ohne Elektrostimulation vorliegt, ist besondere Sorgfalt geboten, um tatsächlich Muskelgewebe zu gewinnen und nicht nur Fett- oder Bindegewebe zu biopsieren. Durch die deutliche Atrophie, besonders bei denervierten Patienten auf ca. ¼ oder weniger der Muskelmasse von Normalpersonen mit kompensatorischen Fetteinlagerungen zwischen den Muskeln und zwischen den einzelnen Muskelfaserbündeln, ist die Nadelbiopsie deutlich schwieriger als üblich. Obwohl wir diesen Umstand bei der Biopsie berücksichtigt haben, konnten wir bei einem Patienten gerade noch 229 Fasern auszählen und bei einem Patienten (Nr. 14) die 1. Biopsie nicht verwerten.
Unter sterilen Bedingungen wurde nach Lokalanaesthesie und einer kleinen Stichinzision die Biopsienadel normal zur Muskelfaserrichtung eingeführt und unter Sogwirkung kleine Muskelgewebsstücke (je ca. 50-100 mg) entnommen. Von jedem Probanden wurden je 4 solcher Biopsiestücke zur histologischen und histochemischen Untersuchung an das Anatomische Institut der Universität Wien, Prof. Dr. H. Gruber, übersandt.
Pro Patient wurden bis zu vier Nadelbiopsien mit einer Größe von ca. 0,5 x 0,5 x 0,8 cm entnommen und sofort in 2-Methylbutan (2-Methylisopentan) bei einer Temperatur von ca. -70 Grad C schockgefroren. Um eine möglichst parallele Ausrichtung der Muskelfasern zu gewährleisten, wurde das Muskelstück unter leichter Spannung für ca. 1 min in flüssiges 2-Methylbutan (Uvaso 1R, Fa. E. Merck, Darmstadt) gehalten, bis keine Gasblasen mehr aufstiegen. Anschließend wurden die gefrorenen Präparate in beschriftete Küvetten gegeben und in flüssigem Stickstoff bis zum Ende des Experiments und für den Transport zwischengelagert.
Am Institut für Anatomie III der Universität Wien wurden die Präparate in einer Gefriertruhe bei -80 Grad C aufbewahrt (-80 Grad C CL Hetofrig, HETO High Technology of Scandinavia, Fa. Aigner). Schließlich wurden Schnitte mit 10 µm Dicke an einem Kryostat (Kryostat 1720, Fa. Leitz) angefertigt.
Färbung
Die Präparate wurden nach einer vom Institut für Anatomie etwas modifizierten Methode von Guth und Samaha (L. Guth, F.J. Samaha: Procedure for the Histochemical Demonstration of Actomyosin ATPase, Experimental Neurology 28, 365-367 (1970)) zur Differenzierung der Muskelfasertypen aufgrund und ihrer unterschiedlichen Actomyosin ATPase Stabilität im sauren bzw. alkalischen Milieu gefärbt.
Pro Präparat wurden somit zwei ATPase Färbungen angefertigt:
Die Alkal. Actomyosin-ATPase-Färbung (pH 10,4) und die saure Actomyosin-ATPase-Färbung, wobei die getrockneten Gefrierschnitte in saurem Milieu pH 4,3 vorinkubiert wurden. In der Färbung mit pH 4,3 erscheinen die Typ I-Fasern schwarz, während die Typ II-Fasern hellbraun imponieren, bei pH 10,4 ist es genau umgekehrt.
Zusätzlich wurden pro Patient eine Hämatoxylin-Eosin-Färbung zur Bestimmung der Kerne, Muskelfaserform, Kapillaren etc. und eine NADH-Färbung für Mitochondrien durchgeführt. Eine PAS-Färbung wurde nur von manchen Patienten angefertigt, um den Glykogen-Haushalt zu beurteilen. Diese Färbung wurde jedoch nicht ausgewertet.
Morphometrische Analyse der Muskelfasern
Die Präparate wurden in einem Durchlichtmikroskop (ZEISS AXIOMAT, Carl Zeiss, 7082 Oberkochen, Deutschland) bei 100facher Vergrößerung 10er Objektiv analysiert. Eine Videokamera (Sony CCD/RGB Color Video Kamera Model DXC - 15 I P), am Mikroskop montiert, transferierte das vergrößerte Bild auf einen mit einem PC (IBM) verbundenen Farbmonitor. Mit Hilfe eines halbautomatischen Bildanalysesystems (Sysgraph, IBM PS2) wurden pro Präparat mehrere Bildausschnitte ausgewertet. Dabei fand die Färbung mit der alkalischen ATPase (pH 4,3) Verwendung.
Zur Auswertung und Berechnung pro Bildausschnitt wurden jeweils der kleinste Faserdurchmesser, die Fläche der Equivalentdiameter (entspricht dem Durchmesser eines flächengleichen Kreises) und der Perimeter bestimmt.
Teilweise wurden auch elektronenmikroskopische Bilder zur Beurteilung der Mitochondrien, der Sarkomere sowie von Degenerationszeichen, wie z. B. Fetteinlagerung, Sarkomerbrüchen sowie der zentralen Kerne und der Basalmembranen gefertigt.
Beurteilung und Auswertung pro Patient
Prinzipiell ist bei der Analyse von Muskelbiopsien vor und nach der Elektrostimulation zwischen der strukturellen Adaptation auf Grund der mechanischen Zugbelastung, also der Faserdickenzunahme oder ev. Faserdickenabnahme, und der metabolischen Adaptation entsprechend der Aktivierungshäufigkeit pro Tag (= Stimuli pro Tag), die die Fasertypenausprägung bestimmt, zu unterscheiden.
Ich bin überzeugt, dass entsprechend der mechanischen Zugbelastung der einzelnen Muskelfasern ein struktureller Reiz gesetzt wird, wodurch die Faserhypertrophie (= strukturelle Adaptation) ausgelöst wird. Entsprechend der Anzahl der Stimuli pro Tag = Anzahl der Aktivierungen der Muskelzelle pro Tag wird ein vorwiegend metabolischer Reiz gesetzt, wodurch die Muskelfasertypen-Ausprägung (= metabolische Adaptierung) erfolgt.
Für die Faserhypertrophie, insbesonders bei denervierter Muskulatur, war es notwendig, durch geeignete Stimulationsparameter tetanische Kontraktionen auszulösen (siehe III/2 b Stimulationsparameter und Trainingsanweisungen).
Bei den denervierten und bei den spastisch gelähmten Patienten wurde der Faserdurchmesser vor und nach der Elektrostimulation bestimmt, jeweils getrennt für die Typ I- und die Typ II-Fasern.
Verglichen wurde der Faserdurchmesser der spastisch gelähmten und denervierten Patienten im Einzelnen und zusammen jeweils vor und nach 8 Monaten Elektrostimulation. Gemessen wurde jeweils der kleinste Faserdurchmesser im Präparat, um bei Längsschnitten den exakten Wert zu erfassen bzw. der Equivalentdiameter bei polygonaler Faserausprägung.
Die eventuelle Zunahme der Muskelfaserdicke sollte mit der Kraftzunahme, aber auch mit der Querschnittsvergrößerung in der Computertomographie korreliert werden.
Die Muskelfasertypisierung erfolgt nach der ATPase-Reaktion (pH 4,3). Zur Muskelfasertypisierung wurden bei den denervierten Patienten ca. 1000 Fasern pro Biopsie und bei den spastisch gelähmten Patienten 700 Fasern pro Biopsie ausgezählt.
Die Fasertypisierung, besser gesagt die Ausprägung der Muskelfasertypen, erfolgt meiner Meinung nach entsprechend der metabolischen Aktivität pro Tag (= Stimuli pro Tag). Die verwendete Stimulation verursacht ca. 50.000 Stimuli pro Tag, wodurch ein deutlicher metabolischer Reiz für IIa-Fasern gesetzt wird, wie wir in Vorversuchen an Normalpersonen, Kern 1994 (151) feststellen konnten.
Eine besonders wichtige Frage und zu beurteilen war, ob sich denervierte Muskulatur genauso verhält wie innervierte, spastisch gelähmte Muskulatur.
Weiters war zu klären, ob für die metabolische und strukturelle Adaptierung von denervierter Muskulatur der elektrische Impuls alleine genügt oder ob der trophische Effekt aus dem axonalen Fluss für die Muskelfaserfunktion und die Fasertypisierung entscheidend ist. In einer Pilotstudie fanden wir den Hinweis, daß die elektrische Aktivierung der Muskulatur alleine für deren Ausprägung und Funktion genügen könnte.
Sollte die Elektrostimulation die entscheidende Größe sein, so sollten bei der denervierten Muskulatur sowohl Typ I- und Typ II-Fasern mit einer gleich großen Hypertrophie reagieren, da sie ausschließlich entsprechend der elektrischen Rekrutierung, bei den denervierten Muskeln die einzige Aktivierungsordnung, erregt werden. Bei den spastisch-gelähmten Muskeln ist die Situation komplizierter. Hier entspricht die FES einer zusätzlichen Aktivierung, neben der spastischen Rekrutierung, die dem Innervationsprinzip nach Hennemann möglicherweise auch nicht entspricht. Dadurch wäre aber ebenfalls eine etwa gleich große Faserhypertrophie, aber mit etwas größerer Zunahme bei dem Typen II-Fasern zu erwarten.
Die Fasertransformation müßte bei denervierten Muskeln, entsprechend dem Stimulationsschema (3.000 bis 28.000 Stimuli/Tag), in Richtung Typ II gehen, da keinerlei Nerven vorhanden sind.
Bei denervierter Muskulatur scheidet jedoch jene Muskelfasertransformationhypothese aus (Kern 1994 (155)), die die Typ II-Fasertransformation durch Elektrostimulation auf Grund zeitlich früherer bzw. bevorzugter und leichterer Erregung der dick myelinisierten Nervenfasern erklärt, Benton (16, 17), Mayer et al. 1984 (196), Appell und Cabric (6, 7).
Entsprechend unseren Erkenntnissen über die Fasertransformation, Kern 1994 (155) und den bioptischen Ergebnissen aus Studien am Tier von Mayer et al. 1984 (196) sowie Greve et al. 1993 (96), beim Menschen, wäre mit einer deutlichen Typ I-Atrophie und Fasertransformation in Richtung Typ II zu rechnen.
III/7/B Zur Methodik der Muskelenzym-bestimmung
Die Auswertung einzelner Enzymaktivitäten des aeroben sowie anaeroben Stoffwechsels vor und nach 8 Monaten Elektrostimulation erfolgte im Muskellabor der Neurologischen Klinik der Universität Würzburg durch Prof. Dr. H. Reichmann und Mitarbeiter. Dazu wurden die Muskelproben sofort tiefgefroren und in einem mit flüssigem Stickstoff gefüllten Dewar-Transportgefäß nach Würzburg geschickt.
Die von diesem Labor für den Gesamtmuskel (alle Fasertypen zusammen) angegebenen Normwerte sind geschlechtsunabhängig und muskelfasertypenunabhängig und zeigen demnach hohe Standardab-weichungen.
Um die Güte der Biopsie Technik und der technischen Präparation zu überprüfen und um damit eigene Normwerte zu erhalten, wurden an 12 freiwilligen Probanden, die ebenfalls einer Elektrostimulationsserie unterzogen wurden, vor deren Stimulationsbeginn aus beiden Oberschenkeln vom M. Vastus lateralis in gleicher Technik eine Muskelbiopsie entnommen; für die Werte siehe Tabelle E 7 bei den Ergebnissen.
Tab. E7:
Muskel-Enzyme Gesunder Probanden
| AEROB | ANAEROB | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Normwerte | CS (5,5 +- 2 U/g) | Cyt. c. Ox. (5,8 +- 3,0 U/g) | HAD (5,4 +- 2 U/g) | Phos (13,9 +- 4,4 U/g) | PFK (30,0 +- 17,1 U/g) | |||||
| re | li | re | li | re | li | re | li | re | li | |
| Pat. 1 | 12,38 | 6,98 | 5,29 | 8,28 | 20,56 | 16,45 | 17,17 | 11,48 | 18,72 | 23,56 |
| Pat. 2 | 5,05 | 6,27 | 4,73 | 4,41 | 9,27 | 6,04 | 6,68 | 2,02 | 13,83 | 10,78 |
| Pat. 3 | 9,27 | 12,08 | 5,32 | 6,84 | 26,25 | 29,33 | 9,08 | 10,24 | 9,03 | 10,29 |
| Pat. 4 | 3,30 | 4,13 | 6,84 | 6,32 | 11,02 | 13,55 | 21,90 | 12,14 | 11,40 | 19,58 |
| Pat. 5 | 9,67 | 10,16 | 3,81 | 5,08 | 16,0 | 21,76 | 11,46 | 24,85 | 18,34 | 8,31 |
| Pat. 6 | 12,7 | 13,34 | 5,04 | 6,2 | 8,91 | 14,55 | 13,5 | 14,25 | 10,26 | 10,59 |
| Pat. 7 | 5,19 | 6,37 | 3,54 | 3,55 | 11,92 | 13,61 | 8,69 | 3,21 | 14,05 | 13,13 |
| Pat. 8 | 7,1 | 7,56 | 5,17 | 5,19 | 13,79 | 14,49 | 10,73 | 15,92 | 23,64 | 50,37 |
| Pat. 9 | 8,19 | 10,34 | 5,55 | 5,26 | 17,01 | 14,85 | 10,88 | 12,34 | 21,16 | 23,52 |
| Pat. 10 | 8,08 | 8,4 | 1,73 | 2,81 | 10,20 | 21,45 | 5,0 | 13,35 | 14,79 | 23,1 |
| Pat. 11 | 9,16 | 6,12 | 4,92 | 3,11 | 13,11 | 10,58 | 13,05 | 12,34 | 15,97 | 22,76 |
| Pat. 12 | 7,69 | 7,59 | 4,66 | 4,35 | 16,22 | 10,80 | 12,03 | 12,04 | 23,50 | 18,98 |
| x | 8,21 | 4,91 | 15,07 | 11,85 | 17,9 | |||||
| SD | ± 2,69 | ± 1,42 | ± 5,53 | ± 5,08 | ± 8,72 | |||||
Bestimmt wurden für den aeroben intramitochondrialen Stoffwechsel die Enzymaktivitäten der Cytratsynthetase und der Fumarase als Enzyme des Zitronensäure-Zyklus, der Succinat-Dehydrogenase und der Cytochrom-C-Oxydase als Enzyme der Atmungskette sowie der Hydroxyacyl-Co A-Dehydrogenase, ein Enzym der Betaoxydation der Fettsäuren.
Für den anaeroben Stoffwechsel wurden die Phosphorylase als Enzym des Glykogenabbaus sowie die Phosphofructokinase, Pyruvatkinase und Laktatdehydrogenase als Enzyme der Glykolyse bestimmt.
Spezielle Extraktion und Enzymbestimmung
Die Muskelproben (10-15 mg) wurden bei -160 Grad in einem speziellen Mikromörser, Pette und Reichmann 1982 (255), zerkleinert und in 15 Volumsanteile Phosphatpuffer bei 0 Grad Celsius (0,1 mol, pH 7,2) mit 2 mmol EDTA aufgelöst. Anschließend wurde die Suspension in einem Elektromixer 6x jeweils 10 sec homogenisiert. Sofort nach der Zerkleinerung wurde die Lösung in aliquote Teile für die verschiedenen Enzymaktivitätsbestimmungen aufgeteilt. Für die Stabilisierung der Phosphofructokinase wurde ein Anteil mit Fructose 1,6 Diphosphat bis zu einer Konzentration von 0,5 mmol versetzt. Für die komplette Extraktion der Hexokinase wurde 1%iges Triton x 100 zugefügt. Danach wurden alle Muskelaufschwemmungen mit Ultraschall zerkleinert und komplett homogenisiert sowie in der Beckman-Zentrifuge 15 min bei 13000 Umdrehungen pro Minute zentrifugiert. Aus dem klaren Überstand wurde die Enzymaktivität bei 30 Grad in einem Gilford-Spektralphotometer (340 nm) bestimmt, indem 0,5 ml der u.a. speziellen Lösungen verwendet wurden:
Hexokinase (HK): 50 mol Triäthanolamin - HCL, 5 mmol EDTA, 8 mmol MgCl2, 1,3 mmol NADH, 2mmol Glucose, 2mmol ATP, 7 U/ml Glucose-6-phosphat Dehydrogenase, pH 7,6; nach der Zugabe von ATP.
Phosphofructokinase (PFK): 50 mmol Triäthanolamin - HCL, 5 mmol EDTA, 8 mmol MgSO4, 0,28 mmol NADH, 3 mmol Fructose 6-Phosphat, 1,5 mmol ATP, 50 U/ml Triosephosphat, 0,3 U/ml Aldolase, 1,7 U/ml Glycerophosphat Dehydrogenase, pH 7,6; nach Zugabe von ATP.
Pyruvat-Kinase (PK): 50 mmol Triäthanolamin-HCl, 5 mmol EDTA, 8 mmol MgSO4, 75 mmol KCL, 0,28 mmol NADH, 1,5 mmol ADP, 2 mmol Phosphoenolpyruvat, 27 U/ml Laktat Dehydrogenase, pH 7,6; nach Zugabe von Gewebeextrakt.
Laktat Dehydrogenase (LDH): 50 mmol Triäthanolamin-HCl, 5 mmol EDTA, 0,28 mmol NADH, 2,4 mmol Pyruvat, pH 7,6; nach Zugabe von Pyruvat.
Citrat Synthetase (CS): 100 mmol Tris, 2,5 mmol EDTA, 45 mmol NAD, 60 mmol L-Malat 0,02 mg/ml fettsäurefreies Rinderserum-Albumin, (BSA), 0,3 mmol Acetyl-CoA, 60 U/ml Malat Dehydrogenase, pH 8,0; nach Zugabe von Acetyl-CoA.
3-Hydroxy-Acyl-Dehydrogenase (HAD): 100 mmol Triäthanolamin-HCl, 5 mmol, EDTA, 0,28 mmol NADH, 0,25 mmol Acetoacetyl-CoA, pH 7,0; nach Zugabe von Acetoacetyl-CoA.
Glucose-6-Phosphat Dehydrogenase (G6PDH): 50 mmol Tris-HCl, 5 mmol EDTA, 0,5 mmol NADP, 2 mmol Glucose-6-Phosphat, pH 7,6; nach Zugabe von Gewebeextrakt.
Fumarase (FUM): 50 mmol K, Na-Phosphatpuffer, 5 mmol EDTA, 70 mmol L-Malat, pH 7,4; nach Zugabe von Gewebeextrakt.
IV) Ergebnisse und Diskussion
IV/1 Ergebnisse der technischen Vorversuche und Entwicklung
IV/1/A Technische Ausrüstung und Optimierung der Stimulation
Die Suche nach der geeigneten Stimulationsmethode für die Funktionelle Elektrostimulation mit Oberflächenelektroden mußte viele technische Probleme, die Optimierung der Stimulationsmethode und die Praktikabilität und Akzeptanz durch die Patienten berücksichtigen.
Außerdem mußte die Selektivität der Stimulation durch Auswahl der Stromform, der Elektrodengröße und Intensität bei geringer spastischer Mitreaktion (tolerierbare sensible Afferenzen) optimiert werden und die Ermüdung durch geeignete Frequenz-, Stimulations- und Pausenverhältnisse möglichst gering gehalten werden.
Stimulationen über die motorischen Punkte mit kleinen Elektroden weisen zu hohe Stromdichten auf und führen bei Querschnittgelähmten zu großer Hautbelastung. Dabei besteht die Gefahr der thermischen Hautirritation und, bei zu starker Reizung sensibler Afferenzen, die Auslösung einer störenden spastischen Mitreaktion.
Eine zu rasche lokale Muskelermüdung bzw. spastisch antagonistische Hemmung während der Elektrostimulation kann durch folgende Fehler-quellen hervorgerufen werden:
zu kleine Elektrodenflächen
ungenügend lange Pausendauer während der Stimulationsserien (besonders Typ IIb-Ermüdung)
rasche neurale Ermüdung durch zu hohe (unnötig hohe) Reizfrequenz, wodurch es zu einem erhöhten Transmitterverlust bei Erregung in der relativen Refraktärperiode und zu Repolarisationsstörungen kommt
zu große Intensität und somit Mitstimulation des Antagonisten
zu große sensible Afferenz mit zu großer spastischer Aktivierung, die den Bewegungsablauf verzögert oder funktionell erheblich stört
a) Elektrodengrößen
Beim Vergleich unterschiedlicher Elektrodengrößen hinsichtlich Kraftentwicklung in Abhängigkeit von der Effektivstromdichte sehen wir, daß z. B. bei 0,2 mA pro cm2 eine dreifach höhere Kraftentwicklung mit anatomisch geformten 200-300-cm2-Elektroden (Lechner und Kainz (172, 173)) gegenüber den üblicherweise in der Therapie verwendeten 100-cm2 Elektroden erreicht werden kann (siehe Tab. 4).
Tab. 4:
Kraftmoment in % der max. Willkürkraft bei verschiedenen Elektrodengrößen und Effektiv-stromdichten.
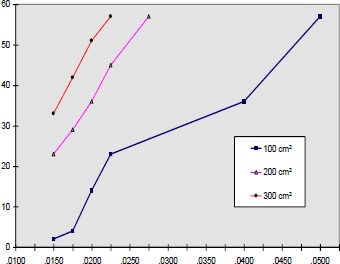 |
Die Effektivstromdichte ist jene technische Größe, die unmittelbar mit der sensiblen Reizung der Haut korreliert und somit die Größe der sensiblen Afferenzen, die eine negative spastische Aktivierung auslösen können, bestimmt.
Die großflächige Stimulation mit geringer Effektivstromdichte führt zu geringeren sensiblen Afferenzen aus dem entsprechenden Hautdermatom, die jedoch für die neurale Adaptation Umkehr des Beuge- in den Streckspasmus wichtig sind. Zu hohe Intensitäten führen jedoch zu pathologischer Spasmusaktivierung und Behinderung der Funktion.
Bei den denervierten Conus-Cauda-Patienten müßen die Elektroden den ganzen Muskel bedecken (siehe Abb.14), da eine neurale Weiterleitung der Stimulation innerhalb der Muskulatur nicht möglich ist.
Bei Verwendung der großflächigen Elektroden sind auch die Gefahr des Verrutschens und der Stimulationsbeeinträchtigung viel geringer. Die größeren Elektroden können durch die Stretchhose leichter gehalten werden. Den Unterschied zwischen groß- und kleinflächigen Elektroden und deren praktische Handhabung sehen wir täglich bei der Stimulation der Glutäalmuskulatur im Vergleich zur Oberschenkel Muskulatur.
Die praktische Empfehlung (siehe Abb.14) lautet:
Möglichst große, anatomisch geformte Elektroden, die den gesamten Muskel bedecken und größtmögliche sensible Verträglichkeit und homogene Stimulation des darunterliegenden Muskels gewährleisten, d. h. alle Muskelfasern des stimulierten Areals erfassen.
b) Elektroden-Material
Die Elektroden müßen bei der FES möglichst gut an modellierbar sein, einen gleichmäßigen Auflagedruck und den nötigen elektrischen Querwiderstand aufweisen, damit es zu einer Homogenisierung des elektrischen Feldes unter der Elektrode kommt (Mayr 1985, 197). Als sehr günstig haben sich Silicon-Kautschuk-Elektroden mit einem spezifischen elektrischen Widerstand von etwa 20 Ohm pro cm2/cm erwiesen, die mit Elektroden-Gel oder H2O getränktem Schwammtuch direkt auf die Haut aufgelegt werden können.
Elektrodenvergleichsmessungen
Obwohl Bleielektroden einen Widerstand von annähernd Null Ohm haben, ergibt sich durch die Frottee- bzw. Wettexschicht, die sich zwischen der Elektrode und der Haut befindet und für ein homogenes elektrisches Feld sorgt, ein widerstand der Gummielektroden ist, obwohl die Gummielektroden alleine eine wesentlich höhere Impedanz aufweisen. Die niedrigsten Impedanzen ergaben sich bei Gummielektroden mit Elektroden-Gel!
Eine niedrige Impedanz, bei gleichzeitig erhaltenem homogenen Feld, hat den Vorteil, dass für die Stimulation niedrigere Stimulationsspannungen notwendig sind, dadurch Gefahren für den Körper ausgeschlossen und die Stimulation auf einzelne Muskeln konzentriert werden können.
Für kurze Trainingssequenzen ist wahrscheinlich eine Wettex-Zwischenlage geeigneter, da so ein rasches Anbringen und Entfernen der Elektroden möglich ist. Dafür müßen allerdings höhere Stimulationsamplituden aufgrund der höheren Impedanz verwendet werden.
Aufsteh- oder Gehversuche bei querschnittgelähmten Patienten sollten nur mit Leitgummielektroden und Elektroden-Gel durchgeführt werden, da diese Trainingsübungen länger dauern und ein Aus-trocknen der Wettex-Zwischenschicht unvermeidbar wäre, was wiederum zu Steigerungen der Stimulationsspannungen führen würde. Zusätzlich “kleben” die Elektroden durch das Gel auf der Haut, wodurch auch ein Verrutschen neben der notwendigen Fixierung verhindert wird.
Außerdem werden die bekannten Nachteile der Bleielektrode wie zum Beispiel das Gewicht oder die schlechte Anpassung an die Extremität vermieden.
Der Vorteil der Leitgummi-Gel-Elektroden ist, dass lokale Stromdichten vermieden werden können, wie sie nach wie vor bei Verrutschen der Blei- oder Zinnblechplatten öfters vorkommen und zu erheblichen Nekrosen der Haut durch Verbrennung und durch Verätzungen führen. Diese kombinierten Verbrennungs- und Verätzungswunden sind äußerst unschöne, schmierig belegte und langsam heilende Wunden.
N.B.: Bekanntlich tritt bei direktem Hautkontakt mit der Metallelektrode neben der hohen Stromdichte die Säure- und Laugenproduktion am Übergang vom Leiter erster zum Leiter zweiter Ordnung in den Vordergrund und schafft somit eine kombinierte Hautverletzung durch Verbrennung (= hohe Stromdichte) und chemische Verätzung
c) Impulsparameter, Polung und Pausenvariation
Es ist klar, dass bei Verlängerung der Pausenintervalle zwischen den Stimulationsserien die Reizantwort des Maximalkraftmomentes größer wird. Aber auch die Richtung des elektrischen Stromes ist für die Kraft-entfaltung maßgebend. Das größte durchschnittliche Kraftmoment wird bei Änderung der Stromrichtung nach jeder fünften Schwellung erreicht.
Kombiniert man Pausenvariation und Polwendung, so erhält man bei gleicher Stromintensität den geringsten Kraftverlust, wenn man zwei Sekunden stimuliert, anschließend zwei Sekunden Pause einschaltet, fünf solche Wiederholungen pro Serie zulässt und dann 20 Sekunden zwischen den Serien pausiert (Kainz 143, 145).
Damit ist es möglich, über einen Zeitraum von 50 Schwellungen 93 % des maximalen Anfangs-Kraftmomentes aufrecht zu erhalten. Fast genauso gut ist die Kombination 2 sec Stimulation und 5 sec Pause (84 % der Anfangskraft).
Diese Optimierung der Muskelkraftentfaltung ist notwendig, um in der Aufbauphase der Funktionellen Elektrostimulation möglichst rasch die Muskelkraft soweit zu steigern, daß ca. 1 Nm pro Kilogramm Körpergewicht Drehmoment der Oberschenkel Muskulatur erreicht wird. Dadurch ist jener funktionelle Kraftlevel erreicht, der für das Aufstehen, Niedersetzen und Gehen notwendig ist. Es darf jedoch nicht Maximalkraft, sondern nur im Kraftausdauerbereich trainiert werden, um auch die oxydative Kapazität zum Gehen über längere Zeit zu fördern.
Impulsdauer
Hinsichtlich der Einzelimpulsdauer haben sich biphasische Impulse von 0,5 - 0,6 msec pro Phase = Gesamtimpulsbreite von bis 1,2 msec zur Muskelstimulation bei möglichst großer Selektivität der Stimulation als günstig erwiesen. In dieser Zeit werden gerade ausreichend elektrische Ladungen verschoben, um den besten Depolarisationseffekt auf dem gesamten Muskelquerschnitt zu erzielen (Lechner et al. (173)).
Durch die relativ lange Einzelimpulsdauer von ca. 1,0 msec gelingt es, die Stimulationsamplitude, somit die Ausdehnung des elektrischen Feldes auf den zu stimulierenden Muskel zu beschränken. Dieser Umstand ist insbesondere in der funktionellen Elektrostimulation wichtig, um die agonistische Stimulation (M. Quadriceps) nicht durch gleichzeitige Mitstimulation (über zu große elektrische Felder) der Antagonisten und/oder spastische Aktivierung in ihrer effektiven Funktion, z. B. Kniestreckung, zu reduzieren. Die Impulsbreite und die Stimulationsintensität sind neben der Elektrodengröße und der Elektrodenanlage die wichtigsten variablen Parameter zur optimalen funktionellen Stimulation einzelner Muskeln.
Impulsform
Rechteck- und Dreieckimpulse werden in der Therapie seit langem verwendet. Eine neuere Entwicklung, die bereits von Leduc angeregt und von Eichhorn 1980, David und Schubert (273) sowie Peckham (233) und Kern (149) wieder aufgegriffen wurde, ist der biphasische Rechteckimpuls, der durch den Hyperpolarisationseffekt eine größere Reizwirksamkeit gewährleistet. Ein weiterer Vorteil dieser Impulsform ist, daß die Ladungsverschiebung schon während des Einzelimpulses ausgeglichen wird und somit keine elektrolytischen Schädigungen der Haut auftreten können.
Frequenz
Die Variation der Frequenz bei konstanter Impulsdauer und Intensität zeigt einen kontinuierlichen Kraftanstieg, der zwischen 20 Hz und 60 Hz relativ linear erfolgt. Ab 60 Hz wird dieser sehr flach und exponentiell bis ca 90-100 Hz. Eine Elektrostimulation im klassischen Niederfrequenzbereich ist ab ca. 20 bis max. 50 Hz sinnvoll. Unter 20 Hz werden nur mehr Schüttelfrequenzen und keine tetanischen Kontraktionen erreicht, während eine Stimulation über 60 Hz zu einer unnötig starken neuralen Ermüdung führt.
Spannung
Bei steigender Spannung und damit auch steigendem Strom nahm bei verschiedenen Elektrodentypen (siehe S. 30, Pkt. 6 und auch Tab. 4) bei der Untersuchung Gesunder das Kniestreckmoment bis ca. 150 Nm annähernd linear zu. Bei Kniestreckmomenten oberhalb 150 Nm flachen alle Kurven unterschiedlich stark ab. Als Ursache ist folgendes wahrscheinlich:
Bei steigender Stimulationsspannung werden zunehmend auch tiefere Muskelschichten mitstimuliert. Dies bedeutet, daß nicht nur der M. quadriceps femoris stimuliert wird, sondern auch die tieferliegenden Antagonisten. Dadurch vermindert sich das Kniestreckmoment proportional zur steigenden Spannung.
IV/1/B Technische Empfehlungen für die Praxis der FES
Sind herkömmliche Impulsströme für die Therapie gelähmter und atropher Muskeln sowie zur Innervationsschulung, Reflextherapie, Schmerzreduktion, Muskeldetonisierung und Durchblutungsverbesserung ausreichend und gut geeignet, so müßen wir bei den modernen Wegen der Querschnittsrehabilitation und der Therapie von peripheren Lähmungen spezielle Kriterien beachten:
Die Elektroden sind möglichst großflächig (je 200-300 cm2) und anatomisch richtig anzulegen, um bei geringer Stromdichte, welche gute sensible Reizung und kompaktere elektrische Feldgröße garantiert, ein ausreichend hohes Kraftmoment zu entwickeln.
Die Leitgummielektroden mit Gel haben sich sowohl für die muskuläre Aufbauphase als auch für die Funktionsstimulation durch die gute Anmodellierbarkeit und den flachen Aufbau, der auch Aufstehen, Niedersetzen und Sitzen mit angelegten Elektroden ermöglicht, bestens bewährt.
Zu rasche lokale Ermüdung in der anfänglichen Krafttrainingsphase muß durch genügend lange Pausen zwischen den Stimulationszyklen (2 sec/5 sec oder 3 sec/3 sec oder 5 sec/5 sec) und/oder zwischen den Stimulationsserien (je 5 Stimulationszyklen eine 20 sec “lohnende” Pause) und durch Änderung der Stromrichtung = Polwendung nach je fünf Schwellungen vermieden werden.
Der biphasische Impuls führt durch Hyperpolarisation zu einer verbesserten Reizwirksamkeit in den tieferen Muskelschichten. Außerdem wird dabei die Gefahr einer elektrolytischen Hautschädigung ausgeschlossen.
Bei der Elektrostimulation zum Kraftausdauertraining, aber auch zum Erhalt der erreichten Funktionen muß auf die entsprechende Häufigkeit und Dauer der Therapie, zwei- bis dreimal täglich 10 bis 30 Minuten je nach Trainingsphase und Art der Lähmung (denerviert oder spastisch), und auf die entsprechende koordinative Mitarbeit des Patienten mit der Restmuskulatur geachtet werden.
Die unterschiedlichen Ziele, wie die Verbesserung der Muskelkraft oder die Förderung der Ausdauerleistungsfähigkeit bedingen unterschiedliche Stimulationsparameter, z. B. Schwelldauer und Schwellpause und Stimulationsfrequenz etc.
IV/2 Ergebnisse der nuklearmedizinischen Durchblutungsmessungen
IV/2/A Xenon-Clearance
Zur Bestimmung der Hautdurchblutung wurde jeweils VOR und NACH 8-monatiger FES-Trainingsperiode eine 15-minütige Versuchs-stimulation durchgeführt (siehe Methodik).
Vor Trainingsbeginn findet man als durchschnittliche Hautruhedurchblutung im Median 2,25 ml/100 g/Minute. Dabei war kein signifikanter Unterschied zwischen allen 14 spastisch und schlaff gelähmten Patienten feststellbar. Durch die 15minütige Versuchsstimulation stieg bei den noch untrainierten Patienten die Hautdurchblutung auf durchschnittlich 3,97 ml/100 g/min an (p<0,025). Das entspricht einer Steigerung um 76,4 % des Ausgangswertes. Fünf Minuten nach Stimulationsende sank die Hautdurchblutung im stimulierten Bein wieder auf Werte knapp über dem Ruhewert ab.
Nach 8 Monaten Stimulation war die Hautruhedurchblutung im Median 4,18 ml/100 g/min vor der Versuchsstimulation.
Für die Messung wurde anschließend wieder für 15 min stimuliert (siehe Methodik). Dabei kam es zwischen den Elektroden zu einer Erhöhung der Hautdurchblutung im Median auf 5,98 ml/100 g/min (+ 43 %), unter den Elektroden im geröteten Hautareal (= Galvanisches Erythem) auf 8,8 ml/100 g/min (+ 111 %) und auf der kontralateralen Seite auf 6,22 ml/100 g/Minute nach Stimulationsende.
Der Median der Hautdurchblutung ohne Stimulation und der Median im galvanischen Erythem unterscheiden sich signifikant im Wilcoxon-Test mit p<0,05 (Median 4,18 bzw. 8,8). Alle anderen Werte der Hautdurchblutung nach 8monatiger Stimulation unterscheiden sich wegen der hohen Streuung nicht signifikant voneinander. Nur die Steigerung der Hautruhedurchblutung vor und nach 8monatiger Elektrostimulation (von 2,25 ml auf 4,18 ml = + 86 % auf der stimulierten Seite erreicht gerade die Signifikanzschranke von p<0,05.
Diskussion
Es konnte gezeigt werden, dass durch eine 15 minütige Elektrostimulation der Muskulatur sofort eine deutliche Erhöhung der Hautdurchblutung erreicht werden kann. Durch 8 Monate regelmäßige funktionelle Elektrostimulation läßt sich die Ruhedurchblutung der Haut erhöhen.
Es läßt sich jedoch nicht präzisieren, wieweit sich die Durchblutungswerte unserer Patienten nach Absolvierung des Trainingsprogrammes an die Werte gesunder Probanden angleichen, da die Normalwerte für die Hautruhedurchblutung in der internationalen Literatur (2 ml/100 g/min bis 14,7 ml/100 g/min) sehr weit gestreut sind.
Selbst Chimosky (45), der in seiner Untersuchungsreihe eine ähnliche Versuchsanordnung traf, gibt bei 26 Grad Raumtemperatur für gesunde Probanden eine Hautdurchblutung von 1-12 ml/100 g/min an. Auch die Angaben über die Mindesthautdurchblutung zur Erhaltung der Trophik schwanken zwischen 0,6 ml/100 g/min und 2,7 ml/100 g/min.
Darüber hinaus war es uns aus ethischen Gründen nicht möglich gewesen, vollkommen gesunde Probanden der Belastung einer nuklearmedizinischen Untersuchung auszusetzen, um eine eigene Referenzgruppe aufstellen zu können. Es erscheint auch nicht sinnvoll, die von uns gemessenen Werte in Beziehung zu den hoch gestreuten Durchblutungswerten gesunder Vergleichsprobanden aus der Literatur zu setzen.
Trotz der großen Schwankungsbreite in den Ergebnissen (Variabilität der Individuen) scheint die Xenon-133-Clearance Methode ein geeignetes Untersuchungsverfahren zu sein, um die Hautdurchblutung größenordnungsmäßig zu quantifizieren (Behmke (13), Hardy (102), Hensel (108), Larsen (170).
Unsere Ergebnisse weisen auf 2 Effekte hin: Auf eine Hyperämie nach 15 minütiger Versuchs-Stimulation (siehe Tabelle) und auf einen langfristigen Trainingseffekt der Hautruhedurchblu-tung. Die gemessenen Differenzen der Hautdurchblu-tung sind jedoch wegen der hohen Streuung nicht signifikant.
Jedenfalls haben wir einen quantifizierbaren Hinweis mit der Xenon-Clearance erhalten, daß die Hautdurchblutung der Paraplegiker durch FES sowohl im Stimulationsversuch als auch als Langzeittherapie-Effekt verbessert werden kann. Die Ruhehautdurchblutung konnte vom untersten Rand der angegebenen Norm auf Werte deutlich über der, teilweise auch angezweifelten (Mostbeck (212, 213)), Mindesthautdurchblutung zur Trophikerhaltung angehoben werden. Die Ergebnisse der Xenon-Clearance sind als Bestätigung für die Infrarottelethermo-graphischen Beobachtungen zu werten.
IV/2/B Ergebnisse der Durchblutungsmessung mit der Thallium-Szintigraphie
Quotient stimulierter und nicht stimulierter Muskel/Gehirn bei allen Patienten (1-14)
Bei allen 14 untersuchten Patienten fand sich vor Beginn der Stimulationsperiode im Seitenvergleich stimulierter zu nicht stimulierter Seite ein Median der Quotienten Oberschenkel/Gehirn auf der nicht stimulierten Seite von 0,44 und auf der stimulierten Seite von 1,89. Die beiden Werte sind statistisch signifikant unterschiedlich p<0,001 und weisen auf eine Mehrdurchblutung der elektrostimulierten Arbeitsmuskulatur um das 4,3-fache hin.
Bei der Messung nach 8 Monaten Stimulation war der Median der Quotienten auf der nicht stimulierten Seite mit 0,56 fast gleich geblieben und vom Ausgangswert nicht signifikant zu unterscheiden (siehe Tab. Tl 2).
Tab. Tl 2:
Median der Muskeldurchblutung (Quotient Oberschenkel / Gehirn) aller Patienten zu Beginn und nach 8Monaten FES
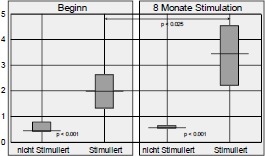 |
Dagegen stieg der Median auf der stimulierten Seite auf 3,45 an. Das entspricht einer 6,16fachen Durchblutung auf der stimulierten Seite gegenüber der nicht stimulierten Seite.
Die Steigerung der Muskeldurchblutung durch FES nach 8 Monaten Training war signifikant (p<0,025) größer als zu Beginn der Trainingsperiode.
Durchblutungsunterschiede bei denervierter und spastisch gelähmter Muskulatur
Durch die 15minütige Versuchsstimulation nimmt die Muskeldurchblutung sowohl bei denervierter als auch bei spastisch gelähmter Muskulatur zu. Der Durch-blutungsanstieg ist bei der spastisch gelähmten Gruppe signifikant p<0,025 höher als bei der denervierten Gruppe (siehe Tab. Tl 3 und Tl 4).
Tab. Tl 3:
Thallium-Szintigraphie der Oberschenkel Muskulatur VOR/NACH 8 Monaten Elektrostimulation, Quotient OS/Gehirn
| Denerviert N = 6 | Spastisch N = 8 | |||||||
|---|---|---|---|---|---|---|---|---|
| vor | nach | vor | nach | |||||
| n.stim. | stim. | stim. | n. stim. | n.stim. | stim. | stim | n. stim. | |
| unt.Quart. | 0,42 | 0,9 | 1,7 | 0,30 | 0,40 | 2,63 | 4,1 | 0,56 |
| Median | 0,43 | 1,07 | 2,15 | 0,45 | 0,5 | 2,73 | 4,75 | 0,61 |
| ob. Quart. | 0,58 | 1,4 | 2,4 | 0,54 | 0,92 | 3,5 | 5,8 | 0,85 |
| Durchbl.Stei gerung | 2,49 fach | 4,77-fach | 5,46-fach | 7,79 fach | ||||
| %Zunahme VOR/NACH | + 100,93 % | + 73,99 % | ||||||
| Durchbl. Steigerung | !___! 5 - fach |
I___I 9,5 - fach |
||||||
Tab. Tl 4:
Mediane der Muskeldurchblutung (Quotient Oberschenkel / Gehirn) bei denervierten und spastischen Patienten zu Beginn und nach 8 Monaten FES.
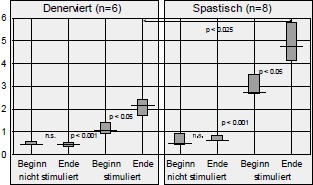 |
Spastische Patienten
Bei den spastischen Patienten betrug auf der nicht stimulierten Seite der Median aus den Quotienten Oberschenkel/Gehirn vor der Stimulation 0,5 und nach der Stimulation 0,61 (nicht signifikant, siehe Tab. Tl 3). Am Beginn wurde durch die 15minütige Versuchselektrostimulation die Durchblutung im stimulierten Oberschenkel auf einen Median 2,73 der Quotienten Oberschenkel/Gehirn erhöht. Das entspricht einer Steigerung um das 5,46-fache auf der stimulierten zu der nicht stimulierten Seite.
Nach 8 Monaten Trainingsperiode beträgt der Median 4,75, was einer 7,79-fachen Mehrdurchblutung gegenüber der nicht stimulierten Seite entspricht.
Daher (siehe Tab. Tl 3) ergibt der Vergleich der Mediane der Quotienten stimulierter Oberschenkel/Gehirn vor und nach der FES-Stimulationsserie eine Durchblutungssteigerung um 74 % (p<0,001).
Wenn man die nicht stimulierte Seite zu Beginn der Stimulationsserie als Ausgangswert für die Muskelruhedurchblutung mit der stimulierten Seite nach 8 Monaten FES vergleicht, so zeigt sich die 9,5fache Muskeldurchblutung gegenüber dem Ausgangswert.
Die Mitaktivierung der Unterschenkel im Stimulationsversuch über den N. ischiadicus wird durch den Median von 1,08 bestätigt. Die Verbesserung nach 8 Monaten (Median 1,23) gegenüber der Ausgangsuntersuchung um 13,9 % war statistisch nicht signifikant, weist jedoch auf die Mitreaktion der Unterschenkelmuskulatur bei den spastisch gelähmten Patienten über den N. ischiadicus bzw. N. tibialis, N. peronaeus hin.
Denervierte Patienten
Zu Beginn der Trainingsperiode war der Median der Quotienten Oberschenkel/Gehirn auf der nicht stimulierten Seite 0,43 und auf der stimulierten Seite 1,07. Das entspricht einer 2,49-fachen Mehrdurchblutung durch die 15minütige Probestimulation am Beginn der Trainingsserie (siehe Tab. TI 3 und 4).
Nach 8 monatigem FES-Training blieb die Durchblutungssituation auf der nicht stimulierten Seite mit dem Median 0,45 praktisch gleich, während der Median der Quotienten stimulierte Oberschenkelmuskeln/Gehirn auf 2,15 erhöht war. Dies entspricht einer Durchblutungssteigerung um das 4,77-fache durch die Probestimulation (p<0,001).
Vergleicht man bei der denervierten Muskulatur die Mediane vor und nach der Stimulation, so ergibt dies eine Steigerung der Muskeldurchblutung von 101 % nach 8monatiger FES-Trainingsperiode.
Wieder ein Hinweis, wie gut denervierte Muskulatur bei richtiger Stimulation adaptiert und nicht nur eine Muskelfaserhypertrophie, sondern auch die nötige Mehrdurchblutung erfolgt.
Keine Korrelation konnte zwischen der Steigerung der Muskeldurchblutung und der Muskelfaserhypertrophie nachgewiesen werden. Ebenfalls bestand zwischen der Muskeldurchblutung und der Muskelflächenzunahme in der Computertomographie keine Korrelation.
Die physiologische Seitendifferenz der Muskeldurchblutung von 5-7 % beim Gesunden dürfte bei der blood flow Steigerung, die wir bei unseren Patienten beobachtet haben, keine Rolle spielen.
Diskussion
Zur Durchblutungsmessung der Oberschenkel-Muskulatur haben wir die Thallium-Szintigraphie verwendet, da die Xenon-Clearance, bei der zwar Absolutwerte messbar wären, durch den unterschiedlichen Fettgehalt der gelähmten Muskulatur wesentlich beeinflusst und verfälscht wäre.
Zur besseren Orientierung seien hier die Dimensionen der Absolutwerte für die Muskeldurchblutung mit der Xenon-Clearance-Methode bei gesunden Probanden angeführt. Dabei beträgt die Ruhedurchblutung im Muskel ca. 2-3 ml/100g/min. Durch eine 5minütige Arbeit unter Ischämiebedingungen wird die Muskeldurchblutung auf ca. 50 ml/100g/min gesteigert. Bei maximaler Arbeitsbelastung sind bis zu 100 ml/100g Muskelgewebe/Minute möglich.
Die Ruhemuskeldurchblutung unterscheidet sich beim denervierten und spastischen Patienten weder zu Beginn noch nach 8monatiger Elektrostimulation.
Die Steigerung der Muskeldurchblutung durch die Versuchsstimulation war nach 8 Monaten FES-Training signifikant (p<0,05) größer als zu Beginn der Trainingsperiode (Tab. Tl 4).
So erreichte beim denervierten Muskel die Versuchs-Stimulation VOR der Trainingsperiode die 2,5fache und NACH 8monatigem Training die 4,8fache Durchblutungssteigerung gegenüber der nicht stimulierten Seite.
Beim spastisch Gelähmten ist die Durchblutungssteigerung zu Beginn der Trainingsperiode auf das 5,4-fache im Vergleich zum nicht stimulierten Oberschenkelmuskel erhöht und stieg nach 8 Monaten Training auf das 7,8fache an. Die Durchblutungssteigerung bei den spastischen Patienten ist sowohl zu Beginn als auch am Ende der Trainingsperiode deutlich höher als bei den Denervierten.
Vergleicht man die Steigerung der Muskeldurchblutung bei den spastisch gelähmten Patienten von durchschnittlich + 74 % und die Steigerung bei den denervierten Patienten + 101 %, so ist der Unterschied damit zu begründen, dass bei den denervierten Muskeln die Ausgangssituation deutlich schlechter war. Die Hypertrophie der Muskelfasern war im Median + 81 % ebenfalls größer ausgefallen als bei der spastisch gelähmten Gruppe. Zusätzlich hat eine enorme intrazelluläre Strukturverbesserung stattgefunden, sodaß die prozentuelle Steigerung der Muskeldurchblutung und der Muskelfaservergrößerung größenordnungsmäßig zwar ähnlich war, aufgrund der großen Streuung aber keine Korrelationen zwischen Durchblutung und Muskelfaserhypertrophie nachgewiesen werden konnten.
Hinweis für die Praxis der FES
Die muskelspezifische Durchblutungsmessung mit Thallium 201 in verschiedenen Positionen (Bauchoder Rückenlage) brachte uns auch den logischen Hinweis, daß bei der Muskelstimulation zur Durchblutungsförderung eine richtige Lagerung, d. h. Entlastung der stimulierten Muskelanteile notwendig ist. Die therapeutisch einfachere Stimulationsmethode, bei der die Patienten auf den Elektroden liegen, bewirkt eine bis zu 80 % geringere Muskeldurchblutung. Diese Beobachtung schmälert den Einsatzbereich der Elektrostimulation im Bereich der Decubitusprophylaxe und Decubitustherapie, da hier nicht einfach die Stimulation während der Nacht, bei schlafenden Patienten, propagiert werden kann, sondern vielmehr auf die Entlastung der zu stimulierenden Muskelareale bedacht genommen werden muß. Bed-Rest-Studien zur trophikverbesernden Wirkung der Elektrostimulation bzw. Versuche beim sitzenden Patienten durch Stimulation der Glutäalmuskulatur scheinen daher von vornherein nur einen geringen therapeutischen Stellenwert zu besitzen (siehe auch Ferguson et al. 1992 (73), über die Stimulation der Oberschenkel bei fixiertem Unterschenkel).
Eine gesteigerte Haut- und Muskeldurchblutung kann nur dann erfolgen, wenn diese Organe nicht von außen komprimiert sind. Sitzt der Patient im Rollstuhl, so können im Glutäalbereich, welcher durch das Körpergewicht belastet ist, keine Durchblutungssteigerungen erzielt werden, Mostbeck (212, 213) und Partsch 1979 (229, 230). Die Hautdurchblutung der mit dem Körpergewicht belasteten Fußsohle ist fast Null. Sobald das Bein entlastet wird, beginnt die Wiederdurchblutung, um neuerlich zu stoppen, wenn der Patient das Gewicht wieder auf dieses Bein verlagert.
Kurzgefasst kann man sagen, daß die Durchblutung durch die Teststimulation nach 8monatiger FES-Trainingsperiode der spastisch gelähmten Quadriceps-Muskulatur um 74 % und der denervierten um 101 % gegenüber den Ausgangswerten gesteigert werden konnte. Dies entspricht größenordnungsmäßig der Zunahme der Muskelfaserquerschnitte, zeigte aber keine signifikante Korrelation.
Da die Stimulationsmethodik vor und nach der Trainingsperiode gleich war, ist die Durchblutungsvermehrung auf Änderungen in der Muskulatur zurückzuführen. Durch die geringere Muskelmasse ist der Ausgangswert signifikant niedriger (p<0,05) als der Wert nach 8monatigem FES-Training.
Der sinnvolle prophylaktische und therapeutische Einsatz der FES bei gelähmter Muskulatur, insbesondere in der Glutäalregion und an den Füssen zur Decubitusprophylaxe, konnte durch die Durchblutungsmessungen mit der Thallium-201-Szintigraphie ausreichend belegt werden.
IV/3 Ergebnisse der Infrarot-Telethermographie
Bei der Erstuntersuchung der spastisch gelähmten Patienten ergab sich am stimulierten Oberschenkel ein durchschnittlicher Temperaturanstieg von 1,41 Grad C + 0,21, gemessen über einen Zeitraum von der 5. bis zur 60. min. Ab der 10. min bis zur 60. min war diese durchschnittliche Temperaturerhöhung statistisch signifikant (p<0,05). Der Temperaturanstieg nach Stimulation erfolgte relativ rasch, erreicht aber erst nach 25 min die maximale Steigerung. Der verzögerte Temperaturanstieg war durch die Verdunstungskälte nach Abnahme der Stimulationselektroden bedingt. Ein Trockenreiben war nicht erlaubt, um das Hyperämieausmaß nicht zu verfälschen.
Der kontralaterale, nicht stimulierte Oberschenkel zeigte ebenfalls eine Temperaturerhöhung von durchschnittlich 0,55 Grad C. Wobei dieser Temperaturanstieg bei der Erstuntersuchung erst ab der 50. min Signifikanz erreichte (p<0,05) und bis zu 60 min signifikant gegenüber dem Ausgangswert erhöht blieb. Die Wärmeausbreitung vom stimulierten Oberschenkel setzte sich nur bei den spastischen Patienten auch nach distal fort, wobei am Unterschenkel der stimulierten Seite eine durchschnittliche Temperaturerhöhung von 0,42 Grad C gemessen werden konnte. Dieser Anstieg der Temperatur erreichte nach 25 min statistische Signifikanz (p<0,05).
Der Temperaturverlauf am Unterschenkel der nicht stimulierten Seite verlief leicht schwankend, ohne jemals einen signifikanten Unterschied zu erreichen. Auch der Vergleich der Unterschenkeltemperaturverlaufskurve der stimulierten und nicht stimulierten Seite ergab keine statistische Signifikanz, ebenso wie der Vergleich des nicht stimulierten Oberschenkels mit dem Unterschenkel der nicht stimulierten Seite.
Die telethermographisch gemessenen Hauttemperaturänderungen bei denervierten Patienten nach Elektrostimulation fielen im Oberschenkelbereich quantitativ etwas geringer aus, zeigten jedoch die Tendenz zu einem protrahierteren Verlauf gegenüber den spastisch gelähmten Patienten (Tab. IR 2).
Tab. IR 2:
Mittelwerte der Medianen -. Oberschenkelregion (ROI) in Grad C, Denervierte Patienten, 0-60 min
| Minuten | stimuliert | n. stimuliert |
|---|---|---|
| sofort | -0,53 | -0,1 |
| 5 | 0,3 | 0,46 |
| 10 | 0,96 | 0,43 |
| 15 | 1,13 | 0,5 |
| 20 | 1,3 | 0,6 |
| 25 | 1,26 | 0,73 |
| 30 | 1,4 | 0,76 |
| 35 | 1,53 | 0,9 |
| 40 | 1,5 | 1 |
| 50 | 1,6 | 1,03 |
| 60 | 1,6 | 1,13 |
Die Temperaturerhöhung am kontralateralen, nicht stimulierten Oberschenkel war mit durchschnittlich 0,66 Grad C etwas ausgeprägter als bei der spastisch gelähmten Gruppe. Eine Erklärung dafür bzw. über die allgemeine Thermoregulation bei denervierter Extremität kann derzeit noch nicht gegeben werden.
Trotz messbarer Mitreaktion des kontralateralen Oberschenkels zeigten die denervierten Unterschenkel der stimulierten und der nicht stimulierten Seite keinerlei Veränderungen der Wärmeabstrahlung bzw. der Temperatur.
Dies steht im deutlichen Gegensatz zur spastisch gelähmten Gruppe, wo sowohl auf der stimulierten als auch auf der nicht stimulierten Seite eine Temperaturerhöhung über 60 min hinaus beobachtet werden konnte. Für die therapeutische Konsequenz dieser Beobachtungen siehe Diskussion.
Bei der Zweituntersuchung nach 8 Monaten fanden sich etwa gleiche Ergebnisse bei den thermographischen Untersuchungen der Hauthyperämie wie bei der Erstuntersuchung. Jedoch war die Temperaturerhöhung bei der spastisch gelähmten Gruppe an Ober- und Unterschenkel an der kontralateralen Seite wesentlich früher, nämlich ab der 20. min statistische Signifikanz erreichte (p<0,05).
An der stimulierten Seite war bei der Erstuntersuchung eine anfängliche Abkühlung trotz sichtbarer Hautrötung durch die Verdunstungskälte von der Elektrodenfeuchtigkeit bedingt. Die Signifikanzschranke wurde ab der 10. bis 15. min überschritten und bis Untersuchungsende in der 60. Minute aufrecht erhalten. Die maximale Temperaturerhöhung (+ 1,57 Grad), die mit der Infrarotthermographie-Kamera gemessen werden konnte, wurde ebenfalls um die 25. Minute erreicht.
Der Einfluss der Verdunstungskälte verhindert somit eine exakte Aussage über die Wärmeabstrahlung durch Hauthyperämie in den ersten 25 Minuten. Eine Fortleitung in die Unterschenkel bis in den Fussbereich war bei der spastisch gelähmten Gruppe gleich gut ausgeprägt, während die denervierten Patienten diesen Effekt auch nach 8 Monaten Elektrostimulation nicht aufwiesen.
Mit der Infrarot-Telethermographie konnte kein Trainings- bzw. Gewöhnungseffekt außer den hier beschriebenen Beobachtungen nachgewiesen werden. D. h., daß der Körper die Durchblutungsreaktion auf das notwendige Minimum (Ökonomie!) reduziert und nur nach den entsprechenden Erfordernissen steigert. Zur Quantifizierung der Hauthyperämie haben wir die Xenon Clearance durchgeführt.
Hyperämie bei Druckentlastung der Sitzregion
Durch Dauerdruck beim Sitzen im Rollstuhl auf die Glutäalregion wird eine Ischiämie erzeugt, die durch therapeutische Entlastungen behoben werden soll. Unmittelbar nach Entlastung der Sitzfläche tritt eine gewaltige Hyperämie auf, die in der 3. min ein Maximum von + 3,5 Grad C erreicht. Diese Hyperämie fällt jedoch relativ rasch bis zur 15. min ab, um nach ca. 30 min wieder den Bereich der Umgebungshautareale zu erreichen. Die Hyperämie der Glutäalregion nach Druckentlastung durch die entsprechenden Rehabilitationstechniken dauert im Gegensatz zur Hyperämie nach Elektrostimulation wesentlich kürzer (max. ¼ der Zeit als nach Elektrostimulation), weist jedoch einen mehr als doppelt so hohen Temperaturanstieg (max + 3,5 Grad C) in der 3. min nach Sitzentlastung auf. Die quantitative Analyse dieser Hyperämie nach Druckentlastung mit der Xenon-Clearance ergab einen ca. 5 fachen Wert (4,5 ml/100g/min) der Hautruhedurchblutung, welche durchschnittlich 0,9 + 0,33 ml / 100 g Gewebe/Min betrug.
Die FES-Muskelstimulation zeigte sich jedoch der “Sitzentlastung” quantitativ (Xenon 133) überlegen, da dabei die Zunahme der maximalen Durchblutung um 20 % höher lag und die Hyperämiedauer bis 90 min nach Stimulationsende nachweisbar war (teilweise über 120 min). Über den zeitlichen Verlauf der Durchblutungssituation in der Haut ist jedoch wegen der Diffusion und der großen Fettaffinität von Xenon 133 keine exakte Angabe zu machen. Deshalb wurde der zeitliche Verlauf der Hautdurchblutung mittels Thermographie bestimmt.
Diskussion
Auch die Ergebnisse der Infrarotthermographie fügen sich in das Bild der anderen Untersuchungen ein. Eine Zunahme der Oberflächentemperatur von durchschnittlich 1,57 Grad, die über 60 min nachweisbar ist, kann als therapeutisch günstige Situation für die Verbesserung der peripheren Trophik bewertet werden.
Die Werte der Oberschenkelhaut entsprechen auch unseren Messungen an der Sitzfläche, die wir in Relation zur Hyperämie nach Sitzentlastung verifiziert haben. Da jedoch diese Stimulationsserie an der Oberschenkelmuskulatur für 8 Monate durchzuführen war, um auch entsprechende muskelbioptische und computertomographische Ergebnisse nachweisen zu können, wurde in dieser Untersuchungsserie auf die Hautdurchblutungsmessung und Infrarot-Tele-Thermographie der Glutäalregion verzichtet. Teilergebnisse wurden bereits publiziert (Kern 1988 (152)).
Jedenfalls bewirkt eine 30 minütige Stimulation eine Oberflächentemperaturerhöhung, die über 90 min beobachtbar, jedoch nur zwischen der 10. und 60. min statistisch signifikant erhöht war.
Eine solche Stimulation zur Decubitusprophylaxe bedingt jedoch eine Stimulation in entlasteter Stellung und nicht unter Belastung, wie es bei sitzenden Patienten auch Ferguson 1992 (73) versucht hat. Dieser wollte bei fixierten Unterschenkeln durch Stimulation der Quadricepsmuskulatur die Sitzfläche entlasten, konnte jedoch nur eine Druckreduktion um 30-50 % ermöglichen.
Somit könnte durch die Infrarot-Tele-Thermographie und Xenon Clearance der Haut der therapeutische Hinweis abgeleitet werden, daß eine Stimulation im Sitzen oder in Rückenlage dem stimulierten Aufstehen, stimulierten Stehen und stimulierten Gehen bei weitem unterlegen ist. D. h. für die Rehabilitation spastisch gelähmter Paraplegiker ist das FES-Stehen und FES-Gehen als Therapiemittel zur Decubitusprophylaxe und Trophikförderung der Haut der Beine und Sitzregion aus infrarotthermographischer Sicht zu empfehlen.
Die Ausbreitung der Temperaturerhöhung über die distalen Anteile der untersuchten Extremität bei spastisch gelähmter Patienten spricht dafür, daß es sich nicht um eine lokale Stauung und dadurch bedingte Hyperämie, sondern tatsächlich um eine durchblutungsfördernde, trophikverbessernde Therapieform handelt.
Die denervierten Unterschenkel der stimulierten und der nicht stimulierten Seite zeigten dagegen keine Temperaturänderung während bzw. nach der Elektrostimulation der Oberschenkelmuskulatur.
Aus diesen Beobachtungen leite ich ab, daß zur trophikverbessernden Wirkung der Elektrostimulation bei denervierten Patienten die Elektrostimulation nur mit mehreren Elektrodenanlagen sinnvoll durchgeführt werden kann. D. h., dass bei der Elektrostimulation zur Durchblutungsförderung bei denervierten Extremitäten mehrere Elektrodenanlagen gleichzeitig oder hintereinander benützt werden müßen, um einen günstigen trophischen Effekt auf die Gesamtextremität zu bewirken (siehe auch Ergebnisse der Computertomographie).
Zumindest müßen bei Conus-Cauda-Patienten, die eine Elektrostimulation in Massenbehandlung anstreben, die Stimulationsanlagen „Glutaeus-Quadriceps” und „Sohle-Wade” an beiden Extremitäten als äusserstes Minimum einer sinnvollen Elektrostimulation angesehen werden. Dies bedeutet aber auch, daß für diese therapeutisch schwierigste Querschnittpatientengruppe die Forderung nach entsprechenden Stimulationschemata und Elektroden für die Langzeitstimulation eventuell in der Nacht zur effektiven Decubitusprophylaxe entwickelt werden müssen.
Für die Rehabilitation schlaff gelähmter Paraplegiker, bei dieser Gruppe ist die Decubitusgefahr am größten, empfiehlt sich neben den bekannten dynamischen Sitzauflagen aus telethermographischer Sicht unbedingt die leider allzuoft vernachlässigte Druckentlastung durch Hochstützen oder Überwechseln in die Bauchlage. Da das Maximum der Hyperämie erst nach ca. 3 min erreicht ist, ist ein kurzfristiges Hochstützen von weniger als 10 sec von relativ geringem therapeutischen Effekt und sollte besser zumindest 10x hintereinander je 20 sec wiederholt werden.
Besser erscheint das Überwechseln in Bauchlage und somit die völlige Entlastung der glutäalen Region für ca. 20 min. Längeres Liegen als ½ Stunde ist nicht notwendig, da bereits nach 30 min die Ausgangsruhedurchblutung erreicht wird. Sinnvoll scheint hier eine Entlastungszeit von ca. 20 min 2-3x täglich.
Sollte es jedoch bereits zu einer Hautrötung gekommen sein, so hat es sich in der Praxis bei unseren Patienten der Forschungsgruppe als zweck-mäßig erwiesen, mehrere Tage 2-3x täglich in Bauchlage zu stimulieren, um eine ausreichende Regeneration des Glutäalbereiches zu erreichen.
Aus infrarot-telethermographischen Beobachtungen der entsprechenden Rehabilitationstechniken und unseren Forschungsergebnissen scheint sich eine Reihenfolge der Rehabilitationsmaßnahmen zur Decubitus-Prophylaxe zu ergeben bzw. können bekannte Rehabilitationsschemata bestätigt werden.
Die Notwendigkeit eines dynamischen Sitzkissens scheint gegeben.
Die Entlastung durch Hochstützen im Rollstuhl sollte ½ stündlich, dabei mehrmals hintereinander je 10-20 sec, durchgeführt werden.
2-3x täglich 20 min Bauchlage fördern die Hyperämie und Trophik im Glutäalbereich besser als das Hochstützen, ohne dieses ersetzen zu können.
FES der Glutäalregion in Bauchlage scheint die optimalste Methode zur Durchblutungsverbesserung und Trophikförderung in der Glutäalregion.
IV/4 Ergebnisse der CT-Muskelflächen Bestimmungen
Gesunde Probanden
Wir haben 12 freiwillige männliche und weibliche Versuchspersonen einer computertomographischen Kontrolluntersuchung mit derselben Methode unterzogen, um geometrisch idente Muskelvergleichswerte zu erzielen.
Der M. quadriceps bei Gesunden weist in den 3 gemessenen Abschnitten einen spindelförmigen bzw. fassförmigen Verlauf auf, der im proximalen Schnitt (Q1) ca. x=50 cm2, im mittleren Schnitt (Q2) x=61 cm2 und im dritten distalen Schnitt (Q3) x=45 cm2 beträgt (siehe Tab. CT 1 und CT 5).
CT 1:
Muskelanteile der Patienten in % von gesunden Probanden (Vergleich der Mittelwerte)
| Denerviert | Spastisch | Gesund | |
|---|---|---|---|
| Gl | 64 % | 68 % | 100 % |
| Q1 | 31 % | 64 % | 100 % |
| H1 | 50 % | 80 % | 100 % |
| Q2 | 42 % | 65 % | 100 % |
| H2 | 41 % | 66 % | 100 % |
| Q3 | 48 % | 69 % | 100 % |
| H3 | 33 % | 71 % | 100 % |
| x | 45 % | 70 % | 100 % |
| x | ½ | 2/3 | 3/3 |
Tab. CT 5:
CT-Muskelfläche in cm2 von 12 gesunden Probanden
| Patient | 1 | 2 | 3 | 4 | 5 | 6 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Schnitt | re | li | re | li | re | li | re | li | re | li | re | li |
| Glut | 25,28 | 25,6 | 25,92 | 24,8 | 25,92 | 24 | 40 | 38,4 | 35,52 | 40,8 | 30,08 | 28,8 |
| Q1 | 33,6 | 30,4 | 24,8 | 27,2 | 33,92 | 30,4 | 55,04 | 46,56 | 56,8 | 52,8 | 40,64 | 41,76 |
| H1 | 38,88 | 40,1 | 44,8 | 51,2 | 27,36 | 35,36 | 63,36 | 75,68 | 76,32 | 81,3 | 55,36 | 59,2 |
| Q2 | 40,64 | 37,6 | 37,6 | 46,56 | 33,76 | 30,72 | 70,56 | 64,32 | 68,64 | 71,84 | 53,28 | 54,3 |
| H2 | 28,8 | 34,5 | 43,2 | 51,2 | 35,2 | 32,96 | 39,04 | 53,44 | 63,2 | 64,32 | 49,6 | 51,6 |
| Q3 | 26,88 | 24 | 27,2 | 35,68 | 30 | 30,5 | 39,68 | 42,24 | 41,76 | 49,6 | 33,6 | 37,74 |
| H3 | 17,6 | 23 | 26,3 | 28 | 22,5 | 23,75 | 32 | 34,08 | 39,84 | 42,24 | 24,64 | 24,7 |
| Patient | 7 | 8 | 9 | 10 | 11 | 12 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Schnitt | re | li | re | li | re | li | re | li | re | li | re | li |
| Glut | 31,2 | 30,72 | 44,16 | 49,6 | 44,8 | 42,88 | 35,2 | 36,8 | 90,23 | 74,91 | 73,79 | 63,91 |
| Q1 | 38,56 | 41,6 | 67,2 | 54,8 | 76,8 | 66,78 | 37,6 | 38,08 | 61,17 | 64,04 | 78,39 | 74,76 |
| H1 | 48,1 | 49,6 | 76,8 | 64,32 | 71,68 | 71,16 | 46,08 | 52,8 | 72,74 | 73,38 | 93,38 | 87,37 |
| Q2 | 46,4 | 48 | 65,84 | 65,6 | 70,8 | 66,42 | 49,6 | 49,8 | 107 | 106 | 134 | 128 |
| H2 | 31,04 | 28,8 | 76,3 | 73,6 | 68,9 | 70,31 | 35,36 | 40,32 | 76,13 | 77,5 | 102 | 106 |
| Q3 | 29,28 | 29,12 | 67,2 | 60 | 68,9 | 66,7 | 28,48 | 21,56 | 63,05 | 60,67 | 89,82 | 92,40 |
| H3 | 21,6 | 19,12 | 56,52 | 49,93 | 54,3 | 56,46 | 25,6 | 20,42 | 55,12 | 52,18 | 75,61 | 74,57 |
Die Oberschenkelbeugemuskulatur und Adduktoren (CT-Schnitt: H1, H2, H3) weisen einen kegelförmigen Verlauf mit proximal ca. x=60 cm2, im mittleren Abschnitt (H2) x=55 cm2 und im distalen Schnitt (H3) x=37 cm2 auf.
Diese beiden räumlich unterschiedlichen Muskelformen sind bei denervierter und spastisch gelähmter Muskulatur erhalten und zeigen auch bei diesen Patienten den typischen fassförmigen und kegelförmigen Verlauf beider Muskelgruppen. Auch bei sehr starker Atrophie ist diese räumliche Form erhalten. Diese Geometrie ist für das mögliche Ausmaß der Hypertrophie oder Atrophie mitverantwortlich.
Schmidt et al. 1990 (272) und Beneke et al. 1990 (15) fanden bei einzelnen Leistungsportlern Quadriceps-flächen zwischen 44 und 97 cm2. Unsere stärkste Kontrollperson hatte im mittleren Quadriceps 137 cm2 (siehe Abb. 18). Die beiden Autoren fanden Querschnittsflächenvergrößerungen um bis zu 10 cm2 im M. quadriceps nach 2 Monaten intensiven Maximalkrafttrainings. In ihrer Aussage über die gezielte Rehabilitation bei Leistungssportlern durch genaue Differenzierung des Atrophiegrades überschätzt Schmidt et al. 1990 die Computertomographie und vernachlässigt die intramuskuläre Strukturverbesserung durch Krafttraining.
Abb. 18:
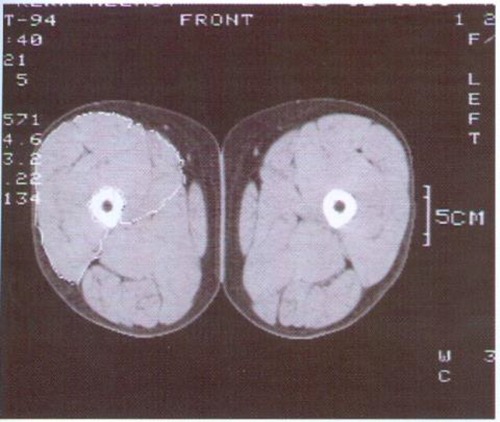
Computertomographie im mittleren Quadriceps einer gesunden Versuchsperson.
Ein Geschlechtsvergleich zwischen gesunden Probanden zeigt einen zwischen 20 und 40 % größeren Muskelquerschnitt bei den Männern. Der 2. Quadricepsschnitt (20 cm distal des Trochanter major) ergibt bei den männlichen Probanden einen um 90 % größeren Querschnitt. Dies ist durch die bei Männern größere Kraft und teilweise größere Länge des Oberschenkels bedingt.
Vergleich der Muskelquerschnittflächen (CT) von Patienten und Gesunden
Beim Vergleich der Muskelflächen zwischen Patienten und gesunden Probanden zeigt sich, daß die spastisch gelähmte Gruppe sowohl im Quadriceps als auch in den Hamstrings ca. 2/3 der Muskelmasse gesunder, nicht bis mäßig trainierter Probanden aufweist (siehe Tab. CT 1 und CT 7).
Tab. CT 7:
Spastisch gelähmte Patienten 5-8 und 9-11
| Pat | 5 | 6 | 7 | 8 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Schnitt | vor | nach | vor | nach | vor | nach | vor | nach | ||||||||
| re | li | re | li | re | li | re | li | re | li | re | li | re | li | re | li | |
| GL | 29,08 | 16,48 | 28,72 | 26,20 | 38,75 | 40,25 | 50,49 | 55,59 | 24,5 | 21,26 | 30,25 | 27,75 | 17 | 21,37 | 22,5 | 27,5 |
| Q1 | 21,82 | 17,53 | 32,35 | 25,8 | 33,75 | 35 | 51,51 | 58,14 | 43,75 | 31,4 | 45,91 | 40,62 | 20 | 21,75 | 30 | 34,5 |
| H1 | 38,60 | 38,95 | 56,90 | 45,36 | 62,40 | 65 | 92,31 | 79,50 | 52,5 | 50,1 | 53,91 | 51,7 | 29,37 | 35,5 | 36,25 | 42,5 |
| Q2 | 26,20 | 28,02 | 40,72 | 39,61 | 40,5 | 44,25 | 84,96 | 84,46 | 52,5 | 52,98 | 54,25 | 58,75 | 22,5 | 26,25 | 36,87 | 35,62 |
| H2 | 32,6 | 23,03 | 43,49 | 31,34 | 33,12 | 33,8 | 48,01 | 42,07 | 46,12 | 49,9 | 50 | 55,5 | 25,52 | 25 | 35,3 | 33,8 |
| Q3 | 13,45 | 21,72 | 19,10 | 28,24 | 39,25 | 39,5 | 67,83 | 73,18 | 40,25 | 40,6 | 37,5 | 41 | 15,3 | 13,75 | 22,5 | 16,75 |
| H3 | 29,5 | 26,5 | 41,41 | 39,94 | 28,75 | 29,81 | 30,75 | 37,25 | 15,5 | 17,5 | 24,25 | 25 | ||||
| Pat | 9 | 10 | 11 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Schnitt | vor | nach | vor | nach | vor | nach | ||||||
| re | li | re | li | re | li | re | li | re | li | re | li | |
| GL | 36,25 | 37,6 | 31,1 | 35 | 23,33 | 24,99 | 25,04 | 24,84 | 33,61 | 31,70 | 37,85 | 38,30 |
| Q1 | 35,25 | 30,62 | 35 | 30,25 | 41,83 | 38 | 41,98 | 40,2 | 31,44 | 31,14 | 38,10 | 37,59 |
| H1 | 57,5 | 50 | 52,5 | 43,75 | 60,42 | 46,97 | 53,57 | 41,3 | 55,84 | 58,81 | 66,17 | 66,98 |
| Q2 | 52,5 | 47,5 | 50 | 47,6 | 40,21 | 41,73 | 56,34 | 52,66 | 42,58 | 41,37 | 53,17 | 51,10 |
| H2 | 22,5 | 29,37 | 28,55 | 32,12 | 42,38 | 39,71 | 57,9 | 51,8 | 51,60 | 55,9 | 63,45 | 63,9 |
| Q3 | 42,5 | 37,5 | 42,85 | 40 | 33,66 | 38,7 | 47,4 | 49,14 | 34,02 | 31,04 | 38,7 | 36,76 |
| H3 | 35 | 30 | 35 | 32,5 | ||||||||
Die durchschnittliche Atrophie der Glutäal-muskulatur beträgt 64-68 % (= ebenfalls ca. 2/3 !) gesunder Muskulatur.
Die Atrophie der denervierten Muskulatur ist deutlicher ausgeprägt und weist im Durchschnitt nur 41 % der Muskelmasse Gesunder auf (= Atrophie auf ca. 40 % der Muskelmasse nach 2 Jahren Denervation). (siehe Tab CT 1 und CT 6).
Tab. CT 6:
Denervierte Patienten 1-4 und 13,14
| Pat | 1 | 2 | 3 | 4 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Sch | vor | nach | vor | nach | vor | nach | vor | nach | ||||||||
| re | li | re | li | re | li | re | li | re | li | re | li | re | li | re | li | |
| GL | 34,12 | 24,94 | 34,97 | 24,89 | 30,64 | 25,75 | 28,17 | 31,44 | 25,4 | 27,5 | 23,57 | 27,5 | 18,75 | 20,5 | 18,75 | 19,7 |
| Q1 | 17,69 | 14,71 | 20,31 | 16,53 | 16,38 | 13,45 | 20 | 17,38 | 12,25 | 15,75 | 16,25 | 20 | 13,75 | 13,61 | 17 | 14,37 |
| H1 | 32,3 | 35,7 | 33,36 | 37,1 | 28,52 | 38,5 | 35,7 | 36,5 | 26,62 | 27,54 | 30,32 | 31,5 | 35 | 35 | 37,5 | 40 |
| Q2 | 30,64 | 27,77 | 31,44 | 29,63 | 34,27 | 30,34 | 31,65 | 33,86 | 27 | 28,34 | 27,5 | 27,5 | 20 | 18,75 | 20 | 21,3 |
| H2 | 25,25 | 22,78 | 27,36 | 26,71 | 33,7 | 32,15 | 31,80 | 29,13 | 14,27 | 17,85 | 17,45 | 20,81 | 17,85 | 14,75 | 20,4 | 16,11 |
| Q3 | 30,13 | 25,70 | 34,22 | 26,3 | 19,6 | 16,68 | 21,3 | 18,6 | 22,5 | 25 | 25 | 25,25 | 17,5 | 20 | 18,75 | 21,87 |
| H3 | 13,75 | 10 | 12,5 | 13,75 | 11,75 | 13,25 | 13,75 | 14,12 | ||||||||
| Pat. | 13 | 14 | ||||||
|---|---|---|---|---|---|---|---|---|
| Schnitt | vor | nach | vor | nach | ||||
| re | li | re | li | re | li | re | li | |
| GL | 22,5 | 25 | 22,5 | 20 | 28 | 26,5 | 21,12 | 21,32 |
| Q1 | 10 | 10,25 | 12,5 | 13,75 | 16,25 | 18,75 | 15 | 13,75 |
| H1 | 13 | 7,5 | 10,5 | 18,75 | 17,5 | 21,25 | 17,5 | 20 |
| Q2 | 16,75 | 18 | 17,5 | 21,62 | 22,5 | 18,75 | 18,75 | 20 |
| H2 | 12,9 | 17,75 | 18 | 18,77 | 24,65 | 25 | 21,5 | 25 |
| Q3 | 10 | 16,5 | 10 | 16,4 | 23,5 | 20 | 25 | 22 |
| H3 | 15,5 | 16,75 | 13,50 | 15,4 | 11,25 | 13,75 | 13,75 | 11,25 |
Erschwerend zu dieser flächenmäßigen Atrophie kommt noch die strukturelle Degeneration denervierter Muskulatur mit erheblich vermehrter Fetteinlagerung, Aufbrechen der Parallelanordnung der Sarkomere, Atrophie bis fast völligem Verlust an Mitochondrien (keine Cristae und/oder vakuolige Auftreibung) und zahlreiche randständige dichte Kerne.
Neben dieser flächenmäßigen Atrophie sind auch makroskopisch im CT sichtbare Fetteinlagerungen in der Muskulatur zu finden, die die Muskelfläche verfälschen (siehe Abb. 22).
Abb. 22:
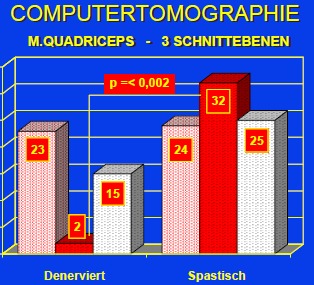
Muskelquerschnittszunahme in % bei spastischen und denervierten Patienten in den 3 Quadriceps-Schnittebenen NACH 8 Monaten FES (Prozent-Werte siehe Tab. CT 2)
Veränderungen der Muskelquerschnitte im CT bei Querschnittpatienten mit spastisch und schlaff gelähmter Muskulatur nach 8 Monaten Funktioneller Elektrostimulation
Spastisch-gelähmte Patienten
Die Ergebnisse vor und nach Stimulation ergaben bei den spastisch gelähmten Patienten in den einzelnen Muskelschnitten folgende Werte:
Der Schnitt 1 (GL), der durch die beiden Trochanterspitzen als Referenzlinie gelegt wurde, diente auch zur Planimetrie des M. Glutaeus maximus. Dabei zeigt sich, daß die Glutäalmuskulatur spastisch (und auch schlaff) gelähmter Patienten nur 64-80 % gesunder Probanden aufweist. Während der 8-monatigen Elektrostimulation (es wurde nur der M. quadrizeps stimuliert) kam es bei den spastischen Patienten sicherlich durch die spastische Mitreaktion der gesamten Beinmuskulatur zu einer Vermehrung um 16,36 %.
Hingegen nahm die Glutäalmuskulatur bei den denervierten Patienten sogar um 4,04 % ab!
Im Schnitt 2 (Q1 und H1) nahm bei den spastisch gelähmten Patienten der M. quadriceps am rechten Oberschenkel (siehe Tabellen CT 6 und CT7) um 20,68 % und am linken Oberschenkel um 20,32 % zu, im Durchschnitt also um 20,51 %.
Andererseits waren in diesem Schnitt in der Adduktoren- und Oberschenkelbeugemuskulatur Änderungen von nur 17,05 % rechts und 7,31 % an der linken Extremität zu verzeichnen, im Durchschnitt sind das 12,18 %.
Im Schnitt 3 (Q2 und H2), also ungefähr in der Mitte des M. Quadriceps, war naturgemäß die größte Querschnittszunahme von bis zu 41,69 % rechts und 32,77 % links zu verzeichnen, rechts und links zusammen gerechnet von 33,40 %.
Im mittleren Schnitt der Oberschenkelbeugemuskulatur und Adduktoren (H2) betrugen die Verbesserungen rechts 28,76 % und links 20,97 %, durchschnittlich 24,83 %, ein Ausmaß, welches durch die großflächige Stimulation mit großer elektrischer Feldausbreitung sowie durch die spastische Mitreaktion bedingt war.
Vergleicht man die Absolutwerte der Muskelquerschnittsflächen (Cave: diese variieren durch die Länge des Oberschenkels bei vorgegebener Schnittebene individuell sehr stark!), so schwanken diese in Q2 bei den spastischen Patienten vor der Stimulation zwischen 22,5 und 53 cm2, im Mittelwert 40 cm2, und nach der Stimulation zwischen 35,62 und 84,96 cm2, im Mittel 53,34 cm2. Der Wert der gesunden Probanden dagegen ist x= 61,18 cm2.
In den spastischen Oberschenkelbeugern finden sich vor Stimulation Werte zwischen 22,5-55,9 cm2 im x=36.47 cm2, nachher zwischen 28,55 bis 63,9 cm2, im Mittelwert 45,53 cm2. Die Fläche der Gesunden beträgt x= 55,05 cm2.
Im Schnitt 4 (Q3 und H3) war die Quadricepszunahme besonders schwankend, da hier nur entsprechend der vorhandenen Muskelmasse eine Verbesserung erzielt werden konnte. Rechts kam es zu einer Zunahme von 29.97 %, links von 27,18 %; also durchschnittlich von 28,58 %.
Die Beugemuskulatur nahm rechts um 26,01 %, links um 31,82 %, zusammen um 28,9 % zu. Absolutes Ausmaß der CT-Flächen siehe Tab. CT 3.
Tab. CT 3:
Varianzanalyse der CT-Flächen der Ober-schenkelmuskulatur von denervierten und spastischen Patienten sowie Gesunden, vor und nach 8 Monaten FES
| Gesund/Denerv. | Gesund/Spast | Denerv./Spast. | ||
|---|---|---|---|---|
| GL | vor | n.s. | n.s. | n.s. |
| nach | 0,05 | 0,05 | n.s. | |
| Q1 | vor | 0,001 | 0,01 | 0,05 |
| nach | 0,001 | n.s. | 0,05 | |
| H1 | vor | 0,001 | n.s. | 0,05 |
| nach | 0,01 | n.s. | 0,05 | |
| Q2 | vor | 0,001 | 0,02 | n.s. |
| nach | 0,002 | n.s. | 0,002 | |
| H2 | vor | 0,005 | 0,05 | n.s. |
| nach | 0,005 | n.s. | 0,05 | |
| Q3 | vor | 0,02 | n.s. | n.s. |
| nach | 0,05 | n.s. | n.s. | |
| H3 | vor | 0,05 | n.s. | n.s. |
| nach | 0,05 | n.s. | n.s. |
Es sei nochmals darauf hingewiesen, daß die Biopsie-Stelle aus dem Vastus lateralis nicht mit der 4. CT-Schnittstelle übereinstimmen kann, da die Festlegung der CT-Schnittstelle genau in 300 mm Entfernung von der Trochanterspitze erfolgte, während die Punktions-stelle sich nach der klinischen Ausprägung des Vastus lateralis und der international üblichen Biopsie Methodik orientierte.
Denervierte Patienten
Bei den Patienten mit schlaffer Lähmung betrug vor der Stimulation die durchschnittliche Quadricepsfläche 40,33 % von Normalpersonen.
Die Absolutwerte (cm2) waren vor und nach Stimulation in einem Bereich zwischen 10 und 34 cm2 relativ weit gestreut (siehe Tab. CT 6 und 7). Der fassförmige Verlauf im M. quadriceps war vor und nach der FES-Trainingsperiode gegeben, wobei die Werte im mittleren Schnitt (Q2) größer waren als die übrigen Werte.
Bei der Flächenberechnung nach 8 Monaten war auffallend, daß der nicht-stimulierte M. glutaeus sogar um ca. 4 % abgenommen hatte.
Der stimulierte proximale M. quadriceps (Q1) jedoch nahm um 11,64 %, ebenso die Hamstrings proximal (H1) um 7,25 % und der distale M. quadriceps (Q3) um 8,16 % zu (siehe Tab. CT 2). Dagegen veränderte sich der mittlere Quadricepsschnitt (Q2), der zwischen den Elektroden gelegen ist, nur um 1,28 %. Dies weist auf eine deutlich bessere Stimulation und Muskelerregung und somit besseren Trainingseffekt unter den Elektroden hin. Die Erregungsausbreitung kann bei denervierter Muskulatur nur entlang depolarisierter Muskelfasern erfolgen, jedoch durch die fehlende Nervenleitung nicht auf benachbarte Muskelfasern überspringen.
Tab. CT 2:
Querschnittsfläche der Oberschenkelmuskulatur VOR und NACH 8 Monaten Elektrostimulation in cm2, Differenzen und Prozente
| Denerviert | Spastisch | Gesund | Denerviert | Spastisch | |||
|---|---|---|---|---|---|---|---|
| vor / nach | vor / nach | cm2 | Diff.cm2 | Diff.% | Diffcm2 | Diff.% | |
| G1 | 26,21 / 25,15 | 28,30 / 32,95 | 40,87 | -1,06 | -4,04 | 4,64 | 16,36 |
| Q1 | 15,29 / 17,07 | 30,95 / 37,29 | 48,9 | 1,78 | 11,64 | 6,35 | 20,51 |
| H1 | 29,79 / 31,95 | 50,17 / 55,94 | 60,70 | 2,16 | 7,25 | 5,77 | 11,49 |
| Q2 | 25,84 / 26,17 | 39,98 / 53,34 | 61,18 | 0,33 | 1,28 | 13,35 | 33,40 |
| H2 | 22,86 / 23,63 | 36,47 / 45,53 | 55,05 | 0,77 | 3,36 | 9,05 | 24,83 |
| Q3 | 22,06 / 23,84 | 31,53 / 40,02 | 45,55 | 1,78 | 8,16 | 8,55 | 27,18 |
| H3 | 12,33 / 13,22 | 26,57 / 33,29 | 37 | 0,89 | 7,22 | 6,71 | 25,27 |
Dagegen wiesen die spastisch gelähmten Patienten, die mit derselben Elektrodenform und ebenfalls optimierter Stimulation trainiert wurden, gerade in diesem Quadricepsabschnitt die stärkste Vergröße-rung von 33,4 %, entsprechend dem fassförmigen Verlauf des M.quadriceps auf. D. h., daß bei gleicher Methodik ein unterschiedlicher Trainingseffekt auf den mittleren Quadricepsabschnitt ausgeübt wurde (siehe Abb. 22).
Im statistischen Vergleich (Varianzanalyse) der denervierten und spastischen Patienten findet man vor der Stimulation im Schnitt Q2 keinen signifikanten Flächenunterschied, während nach der Stimulation eine Signifikanz auf p<0,002 besteht (siehe Tab.CT 3).
Genauso wie im M. quadriceps war auch im mittleren Schnitt der Oberschenkelbeuger (H2) eine deutlich geringere Zunahme von nur 3,36 % zu verzeichnen. Die Verbesserung ist etwas größer als im M. quadriceps. Durch die Größe des elektrischen Feldes bei großflächigen, anatomisch geformten Elektroden und durch die homogenere elektrische Feldverteilung in der Tiefe wird bei der Quadricepsstimulation auch die Oberschenkelrückseite erreicht. Dadurch wird gleichzeitig ein deutlicher Trainingseffekt auf die ischiocrurale Muskulatur ausgeübt. (Siehe Kapitel II/1/A über die negative Beeinflussung der FES-Egometrie durch Mitaktivierung der Oberschenkelbeugemuskulatur.) Der geringen Zunahme von 3,36 % bei den denervierten Patienten steht, mit gleicher Methodik, eine 24,83% Steigerung bei den spastisch gelähmten Patienten gegenüber.
Varianzanalyse der CT-Flächen der Oberschenkel-Muskulatur
Beim Vergleich der 3 Gruppen (denervierte - spastische Patienten und gesunde Probanden) vor und nach 8 Monaten Elektrostimulation zeigt sich ein deutlich signifikanter Unterschied beim Vergleich gesunder zu denervierter Muskulatur. Die Unterschiede sind vor und nach Stimulation gleich signifikant (siehe Tab. CT 3).
Beim Vergleich gesunder Probanden zu spastisch gelähmten Patienten findet sich nur teilweise ein signifikanter Unterschied. Bemerkenswert ist, daß im Bereich Q2 und H2 vor der Stimulation auf 5 % Niveau ein deutlicher Unterschied besteht, der durch die Verbesserung nach der Stimulation jedoch aufgehoben wird.
Weitere Unterschiede bestehen im proximalen Quadricepsabschnitt. Im distalen Bereich wird auf Grund der unterschiedlichen Oberschenkellänge teilweise weniger Muskel und mehr Sehnenmuskelanteil geschnitten. Daher besteht im distalen Abschnitt keinerlei Signifikanz.
Beim Vergleich denervierter zu spastisch gelähmter Muskulatur fand man vor der Stimulation im proximalen Abschnitt, wo sich die größten Muskelmassen am Oberschenkel befinden, einen statistisch signifikanten Unterschied zwischen denervierten und spastischen Patienten. Im mittleren und distalen Abschnitt besteht vor der Stimulation kein statistischer Unterschied zwischen denervierten und spastisch gelähmten Patienten.
Nach der Stimulation wird durch die deutlichere Verbesserung der spastischen Patienten im mittleren Schnitt (Q2 und H2) ein hochsignifikanter Unterschied (p<0,002) trotz gleicher Stimulationsmethodik erzielt. Die distalen Abschnitte sind weder vor noch nach der Stimulation bei spastischen bzw. bei denervierten Patienten voneinander zu unterscheiden.
Zunahme der CT-Flächen VOR / NACH 8 Monaten Stimulation bei denervierter und spastisch gelähmter Muskulatur
Im Vergleich der Differenzen (CT-Fläche nach minus Fläche vor der Stimulation) von denervierter und spastisch gelähmter Muskulatur finden sich im proximalen und distalen Quadricepsabschnitt keine statistisch signifikanten Unterschiede. D. h., daß das Ausmaß der Flächenvergrößerung bei denervierter und spastisch gelähmter Muskulatur durch geeignete Elektrostimulation sowohl in Prozentwerten als auch in Absolutwerten (cm2) nicht signifikant unterschiedlich war.
Nur im mittleren Oberschenkelabschnitt kommt es bei der denervierten Muskulatur zu einer deutlich geringeren Flächenzunahme, die sowohl im Quadriceps (Q2) als auch in der ischiocruralen Muskulatur (Schnittebene H2) statistisch signifikant ist. Der unterschiedliche Trainingseffekt ist sowohl beim Vergleich der Differenzen vor/nach Stimulation in cm2 und % (siehe Tab. CT 4) als auch bei der Varianzanalyse der CT-Flächen (siehe Tab. CT 3) der Oberschenkelmuskulatur von denervierten und spastischen Patienten signifikant. Der Unterschied weist auf die Faserhypertrophie unter den Elektroden, also im Bereich guter bzw. ausreichender Elektrostimulation hin. Zwischen den Elektroden wird nur bei spastisch gelähmten Muskeln durch die nervale Weiterleitung der Impulse eine deutliche Hypertrophie erreicht.
Tab. CT 4:
Vergleich der CT-Querschnittzunahme (Diff in cm2) pro Bein sowie Signifikanz der Differenzen von denervierten u. spastischen Patienten in cm2 und Prozent.
| Schnittebene | Denerviert | Spastisch | Sign. d. Diff. Den.- Spast. | |||
|---|---|---|---|---|---|---|
| cm2 | % | cm2 | % | cm2 | % | |
| GL re | - 1,7 +-3,11 | -6,1 | 3,36 +- 10,08 | 12,97 | 0,05 | n.s. |
| li | -0,08 +- 2,68 | -0,36 | 5,9 +- 12,43 | 24,12 | 0,05 | n.s. |
| Q1 re | 2,43 +-1,47 | +15,8 | 6,73 +- 7,28 | 20,68 | n.s. | n.s. |
| li | 1,14 +-3,07 | + 7,65 | 5,96 +- 9,32 | 20,32 | n.s. | n.s. |
| H1 re | 2,9 +- 2,78 | + 9,9 | 7,8 +- 13,09 | 17,05 | n.s. | n.s. |
| li | 1,42 +- 3,1 | 4,29 | 3,7 +- 7,6 | 7,31 | n.s. | n.s. |
| Q2 re | - 1,0 +- 2,02 | - 3,9 | 14,13 +- 6,7 | 41,69 | 0,05 | 0,05 |
| li | 1,66 +- 1,64 | 7,04 | 12,59+-13,01 | 32,77 | 0,06 | 0,05 |
| H2 re | 0,54 +- 2,89 | 5,2 | 10,43+- 4,28 | 28,76 | 0,01 | 0,01 |
| li | 1,0 +- 2,74 | 6,49 | 7,69 +-2,91 | 20,97 | 0,05 | 0,01 |
| Q3 re | 2,22 +- 1,15 | 9,44 | 8,2 +- 10,39 | 29,97 | n.s. | n.s. |
| li | 1,34 +- 0,82 | 6,88 | 8,9 +- 11,41 | 27,18 | n.s. | n.s. |
| H3 re | 1,07 +- 2,06 | 9,88 | 5,68 +- 5,60 | 26,01 | n.s. | n.s. |
| li | 0,7 +- 3,15 | 8,63 | 7,75 +- 4,5 | 31,82 | n.s. | n.s. |
Diskussion
Durch die computertomographische Flächenvergrößerung im M. quadriceps bei der spastisch gelähmten Gruppe von durchschnittlich 27 % und der deutlicheren Muskelfaservergrößerung von im Median 47,91 % ergibt sich der Hinweis auf eine Strukturverbesserung des Muskelgewebes (= Abnahme von Fett und Bindegewebe), die als zusätzlicher Trainingseffekt der Elektrostimulation querschnittgelähmter Patienten bewertet werden muß. Dabei muß es noch zu keiner sichtbaren Veränderung des Oberflächenmuskelreliefs gekommen sein. Somit kann behauptet werden, daß Umfangmessungen bzw. klinische Tastbefunde zwar erlaubte, aber unzulängliche klinische Qualitätskontrollen der Elektrostimulation querschnittgelähmter Patienten darstellen.
Vielmehr sei der positive Rückschluß erlaubt, daß bereits sichtbare und klinisch verifizierte Änderungen im Muskelvolumen bzw. -relief eine 2-10fach so große morphologische Änderung und intramuskuläre Strukturverbesserung zur Grundlage haben!
Bei der denervierten Muskulatur betrug, im Gegensatz zu der nur 8%igen Vergrößerung der Quadricepsfläche im CT (Q 3; aus diesem Bereich wurde auch biopsiert), die histologische Faservergrößerung im Mittel ca. 50 % (x= 48,55 % und Median = 66,15 %).
Da denervierte Muskulatur naturgemäß einem größeren Atrophieprozeß unterworfen ist als spastisch gelähmte, ist die intramuskuläre Strukturverbesserung und Reduktion der fettigen Degeneration denervierter Muskeln im Vergleich Faserdickenzunahme zu CT-Querschnittvergrößerung offensichtlich und nicht verwunderlich.
Auch hier kann man positiv formulieren, daß bereits geringe klinische Veränderungen eine zumindest 5 bis 10mal so große intramuskuläre Strukturverbesserung hervorrufen!!! Als Erklärung dazu genügen die histo-logischen Übersichtsbilder denervierter Muskulatur vor und nach 8monatiger Elektrostimulation (Abb. 23 und 24).
Abb. 23:
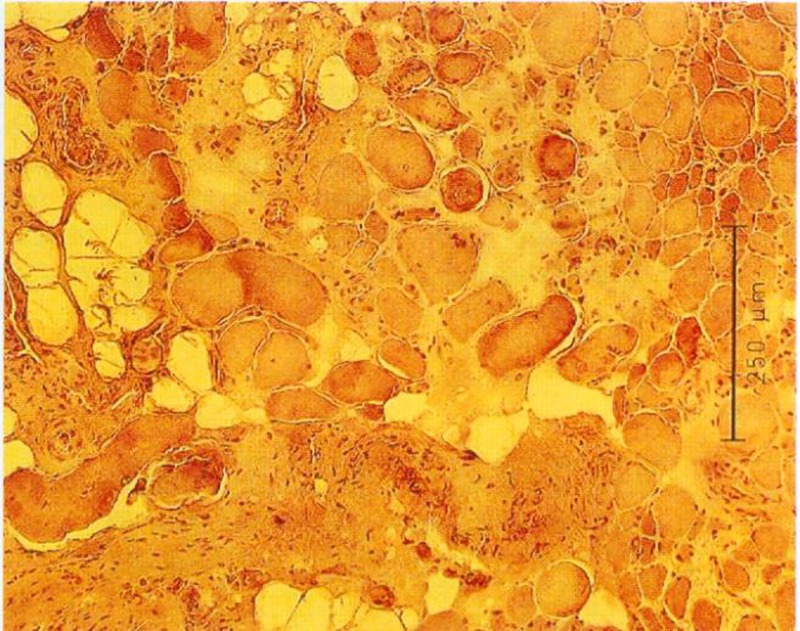
Lupenvergrößerung denervierter Muskulatur mit deutlichen Degenerationszeichen: Atrophie (tlw. 5-15 µm!), Fetteinlagerung, Bindegewebsvermehrung, Aufbrechen der Muskelfaserstrukturen, 3,2 Jahre nach Denervation.
Abb. 24:
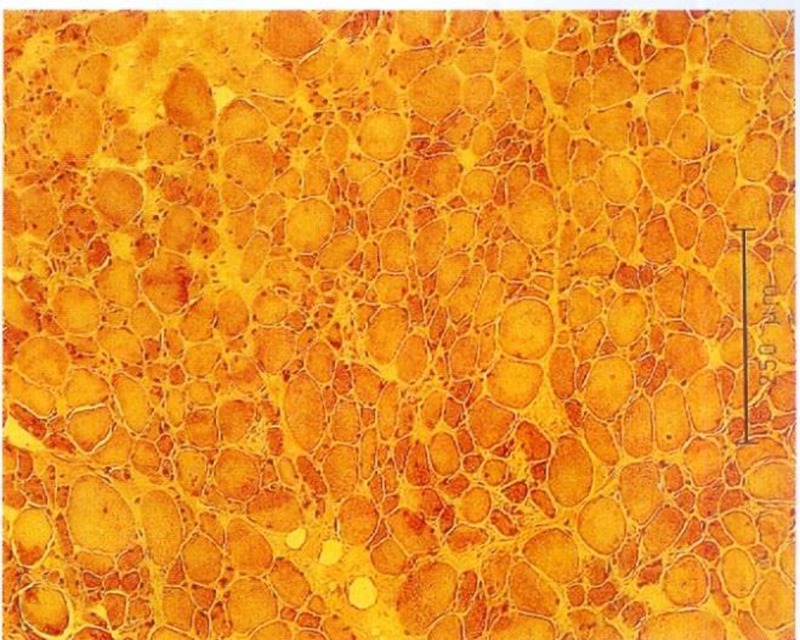
Lupenvergrößerung denervierter Muskulatur (desselben Patienten wie Abb. 23) nach 8 Monaten FES. Fast völliges Verschwinden der Degenerationszeichen wie Fetteinlagerung, Binde-gewebsvermehrung; Polymorphie erhalten, tlw. 10-20 µm, größtenteils jedoch 30-50 µm Faserdicke.
Die geringe Flächenzunahme im mittleren Quadriceps um 1,28 % ist daher mit einer (s. o.) intramuskulären Strukturverbesserung verbunden. Das heißt, daß der Trainingseffekt auch den mittleren Anteil des M. quadriceps zwar geringer, aber noch zufriedenstellend positiv ausgefallen war.
Die 3-Teilung des Trainingseffektes der Elektrostimulation auf die denervierte Quadricepsmuskulatur ist besonders bemerkenswert, jedoch durch die Anatomie, Histologie und Elektrophysiologie erklärbar. Da die nervale Weiterleitung der Erregung im Muskel fehlt und nur entlang der bis zu 10 cm langen Muskelfasern übertragen werden kann sowie die größte Depolarisationswirkung durch die hohe Stromdichte unter den Elektroden erfolgt und die Erregung nur teilweise bis in die Mitte des Oberschenkels geleitet wird, ist es nicht verwunderlich, daß zwischen den Elektroden ein geringerer, aber noch nachweisbarer Trainingsreiz ausgelöst wurde.
Jedenfalls wird durch dieses Ergebnis bestätigt, daß bei denervierter Muskulatur eine anatomisch geformte und den ganzen Muskelverlauf bedeckende Elektrode notwendig ist, um einen optimalen Trainingseffekt auf die gesamte denervierte Muskelmasse zu bewirken.
Weiters ist dadurch auch erklärbar, daß zur Verbesserung von Trophik und Metabolismus bei denervierten Patienten mehrere Elektrodenanlagen pro Bein erforderlich sind, um die Gesamttrophik des Beines zu verbessern. Als minimale Forderung würde ich hier die Stimulation von Sohle-Wade und Quadriceps-Glutaeus empfehlen. Einleuchtend hingegen ist, daß bei mehreren Elektrodenanlagen, die natürlich mehr Therapiezeit pro Tag benötigen, ein besserer trophischer Effekt auf das gesamte gelähmte Bein ausgelöst werden kann.
Die CT-Ergebniße zeigen, daß die Computer Tomographie als nichtinvasives Verfahren mit äußerst niedriger Strahlenbelastung gut geeignet ist, die deutliche Atrophie der Muskulatur und die Zunahme des subcutanen Fettmantels, aber auch deren Veränderungen durch die Funktionelle Elektrostimu-lation bei Paraplegikern zu erfassen. Ebenso lassen sich die therapeutisch bedingten Verbesserungen bei Einhaltung eines genau definierten Untersuchungsprogrammes gut erfassen und quantifizieren. Bemerkenswert ist, daß die computer-tomographischen Änderungen der Querschnittsfläche mit einer 5-10fach so großen intramuskulären Strukturverbesserung einhergehen, welche nur muskelbioptisch zu erfassen sind. Mit diesem Nachweisverfahren kann, bei exakter Einhaltung der Methodik, auf die Mitarbeit und Compliance der Patienten rückgeschlossen werden. Außerdem könnten teure Versorgungstechniken von den Sozialversiche-rungen nur nach klinischer und nicht invasiver Objektivierung mittels Computertomographie zugelassen bzw. bezahlt werden.
Zwischen der Vergrößerung der Faserdurchmesser und der Flächenzunahme in den computer tomographischen Muskelschnitten zeigte sich wegen der intrafusalen Strukturverbesserung keine Korrelation! Daraus folgt, daß zur genauen wissenschaftlichen Überprüfung von Trainingseffekten mit exakten Aussagen über Morphologie und muskuläre Verbesserungen natürlich die Muskelbiopsie erforderlich ist.
Die Ergebnisse der computertomographischen Muskelflächenbestimmung sind ein wichtiger Hinweis auf die Trainierbarkeit denervierter Muskulatur und bestätigen diese signifikant. Die Trainierbarkeit ist jedoch von der Stimulationsmethodik und der Elektrodenform und - lage abhängig! Für die Praxis erfolgt daraus der Hinweis, daß die übliche Form der Exponentialstromreizung denervierter Muskulatur mit 2 kleinen Elektroden („Schwellstromklötzchen”) als obsolet zu betrachten ist und nur mehr großflächige, anatomisch geformte, den gesamten Muskelverlauf bedeckende Elektroden in der Therapie zum Einsatz kommen sollten. Nur diese großflächigen Elektroden verursachen auch eine strukturelle und metabolische Verbesserung der gelähmten, denervierten Muskulatur. Die Stimulation mit ungenügend großen Elektroden oder ungenügenden Stromformen ist nur als “reflektorische Elektrotherapie” zu werten und sollte nur bei bereits gebesserten peripheren Lähmungen oder bei inkompletten Läsionen in Kombination mit Intensions-übungen nach Förster bzw. zur „reflektorischen“ Reaktivierung ca. 3x wöchentlich eingesetzt werden.
IV/5 Ergebnisse und Diskussion der Kraftmessung vor und nach Elektrostimulation
Der Mittelwert der FES-Kraftmessung bei den Querschnittpatienten vor der Elektrostimulation zeigte das Maximum bei 60 Grad Kniebeugewinkel und betrug x=34,82 Nm SD 16,57.
Nach 8 Monaten FES-Training im Kraftausdauerbereich verbesserte sich die durchschnittliche Streckkraft der Quadricepsmuskulatur bei 60 Grad Kniebeugewinkel auf x=50,72 Nm SD 23,03, wobei links 53,43 und rechts 48,0 Nm im Durchschnitt erreicht wurden (siehe Tab. K 1).
Tab. K 1:
Mittelwerte von K max. VOR / NACH FES in Nm, Differenzen in Nm und %, Signifikanzen
| rechts | rechts u. links | links | |
|---|---|---|---|
| Kmax. vor | 33,4 +- 16,7 | 34,82 +- 16,57 | 36,25 +- 16,41 |
| Kmax. nach | 48,0 +- 24,15 | 50,72 +- 23,03 | 53,43 +- 21,93 |
| Diff. in Nm | 14,6 Nm | + 15,90 Nm +10,9 | 17,18 Nm |
| Steig. in % | 43, 71 % | + 45,66 % | 47,59 % |
| Signifikanz | p<0,02 | p<0,02 | p<0,02 |
Das Kraftmaximum vor der Stimulation wurde bei 45 Volt und nach der Stimulation zwischen 40 und 50 jeweils durch Aktivierung der Antagonisten zu einer Kraftreduktion (siehe Tab. K 2).
Tab. K 2:
Kraft - Spannung - Vor Stimulation in Nm, Kniebeugewinkel 60°
| Volt | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Patient | li | re | li | re | li | re | li | re | li | re | li | re | li | re | li | re |
| 5 | 1,8 | 0,6 | 3,6 | 0,7 | 11,1 | 4,2 | 16,7 | 6,1 | 18,6 | 11,0 | 21,7 | 15,4 | 27,8 | 16,1 | 28,7 | 17,3 |
| 6 | 1,1 | 1,7 | 6,9 | 8,1 | 20,2 | 20,0 | 34,5 | 31,0 | 48,5 | 45,1 | 53,5 | 50,1 | 54,5 | 56 | ||
| 7 | 2,9 | 2,5 | 8,7 | 10,3 | 18,9 | 22,2 | 26,7 | 27,1 | 29,6 | 33,2 | 30,6 | 34,7 | ||||
| 8 | 5,6 | 8,5 | 12,7 | 15,8 | 16,1 | 16,4 | 16,5 | 15,9 | 14,7 | 15,8 | 14,7 | 15,9 | 14,0 | 15,6 | ||
| 9 | 0,8 | 0,0 | 3,5 | 2,5 | 9,0 | 6,4 | 20,0 | 14,9 | 26,0 | 19,6 | 29,0 | 21,6 | 29,0 | 26,5 | ||
| 10 | 1,2 | 0,2 | 20,0 | 18,4 | 22,2 | 21,0 | 26,8 | 25,0 | 46,2 | 30,2 | 51,2 | 40,2 | 58,2 | 50,0 | ||
| x | 2,25 | 9,27 | 15,64 | 21,77 | 28,2 | 31,55 | 34,77 | 23 | ||||||||
Der Kraftgewinn durch 8 Monate Elektrostimulation im Kraftausdauerbereich betrug 15,9 Nm SD 10,9 Nm. Das entsprach einer Steigerung von durchschnittlich +45,66 %. Absolut gesehen war dies jedoch nur ca. ein Viertel (¼ !) der Streckkraft unserer gleich alten, nicht trainierten Vergleichs-gruppe (208,69 Nm)!
FES-Kraftmessung und Spannung
Entsprechend der Stimulationsmethode (in 5-Voltschritten von 15 Volt bis zu keiner weiteren Kraftsteigerung, mit 27 Hz und 1,2 msec Impulsdauer) zeigt sich ein fast linearer Anstieg zwischen 15 und 35 Volt. Anschließend verflacht die Kurve. Ab ca. 50 Volt nimmt die gemessene Streckkraft wieder deutlich ab. Sicherlich durch Mitstimulation der Antagonisten und/oder durch geringe spastische Aktivierung (siehe Tab. K 1 und Tab. 6).
Tab. Xe 2:
Xenon-Clearance nach 8Monaten Elektrostimula-tion am Oberschenkel (ml/100 g/Minute)
| Oberschenkel Vor Stim. | Nach Stim. zw. Elektr. | Galv. - OS - Erythem | kontralat. OS nach Stim. | |
|---|---|---|---|---|
| vor | nach | nach | nach | |
| x= | 4,78 +- 3,96 | 6,01 +- 2,44 | 7,71 +- 3,29 | 6,03 +- 2,78 |
| Med | 4,18 | 5,98 | 8,8 | 6,22 |
| Quart | 1,16/7,6 | 3,8/7,7 | 4,36/9,9 | 3,46/8,08 |
Die Differenz der Kraftmessungen in 60 Grad Kniebeugewinkel vor und nach 8 monatiger Elektrostimulation in Abhängigkeit von der verwendeten Spannung zeigt nur bei 30-40 Volt eine statistisch signifikante Differenz (p<0,05,). Zwischen 30 und 45 Volt beträgt die Kraftsteigerung jeweils ca. 50 %.
Die statistische Aussage über die Kraftzunahme bei gleicher Stimulationsspannung und gleicher Stimulationsmethode ist bei querschnittgelähmten Patienten durchaus möglich, jedoch wird eine objektive Kraftmessung durch Mitstimulation der Antagonisten und mögliche spastische Aktivierung teilweise erheblich gestört, was zu den hohen Standard-abweichungen führt.
Der Kraftgewinn beträgt im Mittel ca. + 50 % und verhält sich etwa wie die Zunahme des Muskelfaser-Durchmessers. Es besteht jedoch statistisch, wegen der geringen Fallzahl, keine Korrelation zwischen dem Kraftgewinn von x=+45,66 % und dem Muskelfaser-Durchmesser von ca +50 % und/oder der CT-gemessenen Querschnittsvergrößerung in der Quadri-cepsmuskulatur.
Die FES-Kraftmessung ist zu unexakt und von zu vielen äußeren Faktoren beeinflußbar und abhängig, als daß eine signifikante Korrelation der Fasertypenveränderungen und des Kraftgewinns zu erwarten gewesen wäre, obwohl größenordnungsmäßig eine Beziehung durchaus beobachtet werden konnte.
Diskussion der Kraftmessung
Unsere Messungen stimmen nur teilweise mit den Angaben der internationalen Literatur überein, z. B. Rabischong et Ohanna (247) fanden 1992 25,78 Nm + 11,15 Nm vor der Stimulation und 42,21 Nm + 11,73 Nm nach der Stimulation und somit eine Kraftsteigerung von maximal 63,73 %, die absolute Kraftdifferenz betrug aber ebenfalls nur 16,43 Nm. Die Absolutwerte von Rabischong sind ca. 20 % niedriger als unsere Patienten erreichen konnten.
Die Kraft im M. quadriceps war bei unseren Patienten, so wie in unserem gesunden Vergleichskollektiv durch aktivere bzw. nicht aktive Lebensführung bedingt, relativ weit gestreut. Bei der FES-Kraftmessung bei den querschnittgelähmten Patienten wird die relativ hohe Streuung der Messwerte, durch die Spasmushäufigkeit, deren Stärke, die sportliche Aktivierung, das Stehtraining und div. Rehabilitationsmaßnahmen etc. beeinflußt.
Bemerkenswert war der Kraftgewinn besonders bei 60 Grad Kniebeugewinkel. Diese Beobachtung deckte sich mit unseren Erfahrungen bei Normalpersonen und kann durch 2 Ursachen bedingt sein.
Die Patienten wurden aufgefordert, bis in die Streckung hinein den gesamten Kniebeugewinkel zu durchfahren, übten aber zumeist im Sitzen aus 70-80 Grad Kniewinkel.
Die zweite Möglichkeit besteht in den günstigen biomechanischen Verhältnissen im Kniestreck-Apparat bei ca. 60°, wobei die Patella bekanntlich nicht nur als Sesambein zur Kraftumlenkung dient, sondern auch als Hebel zur Steigerung der Streckkraft des M. quadriceps. Bekanntlich wandert die Kontaktfläche zum Femur bei verschiedenen Kniebeugewinkeln entlang der Patellarückfläche, sodaß bei 60 Grad gebeugtem Knie ein relativ großer Kraftarm gebildet wird, der zusammen mit der Oberschenkelmuskulatur ein erhebliches Streck-moment bewirken kann. Ich neige hier zur letzteren Auffassung, die durch die Druckmessungen von Huberti (Saarluis) bestätigt wurde.
Im Gegensatz zu Rabischong et Ohanna 1992 (247) fanden wir bei vergleichbaren Messungen an Normalpersonen (Kern 1994 (155)) fast doppelt so hohe Drehmomente bis 280 Nm, im Durchschnitt 208,68 +- 56,89. Die hohe Streuung deutet auf eine Abhängigkeit vom Trainingszustand hin.
Unsere Kontrollgruppe erzielte bei 60 Grad das größte Drehmoment. Dies steht ebenfalls im Gegensatz zu den Ergebnissen von Rabischong (247, 248), der bei 90 Grad das höchste Drehmoment für die Kniestreckung bei Normalpersonen messen konnte. Unsere Ergebnisse werden jedoch von Bochdansky (22, 24) bestätigt, der ebenfalls bei 60 Grad die größte Muskelkraftentfaltung im iso-metrischen und im langsam dynamischen Bereich (10 Grad Winkelgeschwindigkeit) bei Normalpersonen feststellen konnte.
Prinzipielle Problematik der FES-Kraftmessung vom M. quadriceps und der FES-Ergometrie
Die exakte FES-Kraftmessung spastisch gelähmter Querschnittpatienten erscheint mir problematisch, da die elektrische Mitstimulation oder eine spastische Aktivierung der Antagonisten durch zu große elektrische Felder, die unterschiedliche Stromverteilung im Gewebe, besonders im Unterhaut-Fettgewebe, einen zu großen Unsicherheitsfaktor darstellen, um international vergleichbare Werte messen zu können. Bisher ist nicht einmal im Ansatz versucht worden, für die FES-Kraftmessung bzw. FES-Ergometrie einheitliche Stimulationsprotokolle zu empfehlen. Alle Messungen wurden mit unterschiedlichen Stimulationsparametern ausgeführt und sind somit keinesfalls vergleichbar! Über die antagonistische Hemmung siehe Kapitel FES-Ergometrie (Seite 12)
Um die Mitstimulation der Antagonisten zu verhindern, muß bei der Funktionellen Elektrostimulation mit Oberflächenelektroden die Intensität und die Impuls-breite, entsprechend der I/t-Kurve, beachtet werden.
Für die Praxis folgt daraus, daß bei fehlender Kniestreckung (Verharren z. B. in 25 Grad Kniebeugewinkel) die Intensität der Stimulation nicht erhöht werden darf. Vielmehr ist angezeigt, die Impulsbreite zu verlängern und dafür die Intensität der Stimulation zurückzunehmen. Dadurch gelingt es, das elektrische Feld auf die Oberschenkelstreckmus-kulatur besser zu konzentrieren und deren Funktion (= Streckkraft) zu optimieren. Stimulationsintensitäten oberhalb von 25-30 Volt Spannung sollten womöglich vermieden werden, wenn relativ niederohmige Kon-taktgel bzw. mit Gel beschichtete Leitgummi-elektroden zur Anwendung gelangen. (Siehe auch Elektrodenvergleichsuntersuchung.)
Bei Vergleichsuntersuchungen an Normalpersonen von Kern (155) wurde mit Leitgummielektroden bei 20 Volt Spannung ein maximales Drehmoment über 200 Nm erreicht. Bis zu 15 Volt Spannung und 150 Nm Drehmoment kam es zu einem linearen Kraftanstieg ohne antagonistische Hemmung. Erst über 150 Nm Streckkraft und weitere Spannungserhöhung über 15 Volt hinaus, bei Verwendung der niederohmigen Gummigel-Elektroden, wie sie auch bei querschnitt-gelähmten Patienten verwendet werden, zeigte sich eine leichte Verflachung durch antagonistische Hem-mung (= Mitstimulation der Antagonisten) im zu großen elektrischen Feld.
Die vergleichsweise geringen Kraftmomente bei querschnittgelähmten Patienten und die relativ hohen dafür notwendigen Spannungen weisen auch auf die deutliche Atrophie und den vermehrten Stromschluß im Unterhautfettgewebe sowie auf die Mitstimulation der Antagonisten hin. Siehe v. a. die Ergebnisse der FES-Messung mit Normalpersonen bei Spannungen über ca. 20-25 Volt.
Unser Ziel in dieser experimentellen Stimulations-serie war es, nicht die maximale Kraft zu steigern, sondern durch unser Stimulationsschema die Kraft und die oxydative Kapazität der Muskulatur zu erhöhen, um für die Funktionelle Elektrostimulation brauchbar und für längere Gehstrecken geeignet zu sein.
Wir finden diese Fragestellung durch die FESKraftanalyse, durch die histologischen Ergebnisse und die planimetrischen CT-Messungen (siehe dort) voll bestätigt. Wir sind uns aber auch bewusst, dass noch Versuche notwendig sein werden, um die genaue Trainingswirksamkeit der verschiedenen Stimulationsmethoden und Impulsparameter in Richtung Kraftausdauer und funktioneller Einsetz-barkeit zu optimieren.
Die Probleme, die bei der FES-Kraftmessung und FES-Ergometrie durch elektrische Mitstimulation der antagonistischen Muskulatur und spastische Aktivierung zu beobachten sind, werden auch in Zukunft exakte Messergebnisse in diesen Bereichen negativ beeinflussen und so schwer vergleichbar machen.
IV/6 Ergebnisse der Muskelbiopsie
Die histologischen Fasertypenbestimmungen und die Planimetrien wurden nach der ATPase-Reaktion (pH 4,3) an Gefrierschnitten vorgenommen. Pro Schnitt wurden von beiden Beinen durchschnittlich 1000 Fasern bei den denervierten und ca. 700 Fasern bei den spastisch gelähmten Patienten ausgezählt und ausgewertet. Jeweils der kleinste Faserdurchmesser bzw. der Equivalentdiameter wurde zur Berechnung herangezogen.
Aufgrund der enormen Atrophie einiger Muskelfasern kam es zur zweigipfeligen Verteilungskurve im Histogramm, sodass zur Berechnung der durchschnittlichen Fasergrößen und Verbesserungen vor und nach FES-Training die Medianwerte für die statistische Berechnung herangezogen wurden.
Größenordnungsmäßig sind jedoch die Mittelwerte fast ident. Die statistischen Berechnungen wurden mit dem T-Test für gepaarte Untersuchungskollektive vom Institut für medizinische Statistik der Universität Wien von Frau Univ. Prof. Dr. L. Havelec vorgenommen.
IV/6/A Faserdurchmesser
1) Bei den spastisch gelähmten Patienten stieg der Faserdurchmesser bei Typ I-Fasern im Median von 33,9 µm SD 19,28 auf 55,94 µm SD 22,67. Dies Die Zunahme des Faserdurchmessers betrug bei den Typ II-Fasern 36,58 % (p < 0,05), wobei die durchschnittliche Fasergröße von 51,37 µm SD 4,58 auf 70,16 µm SD 12,31 zunahm. Die geringere prozentuelle Zunahme bei den Typ II-Fasern war durch den höheren Ausgangswert bedingt.
Die absolute Zunahme der Faserdurchmesser in µm war sowohl bei den Typ I- als auch bei den Typ II-Fasern der spastischen Patienten fast ident. (siehe Tabelle M 1). Die Zunahme der Typ I-Fasern betrug 22,04 µm und der Typ II-Fasern 18,79 µm. Zwischen den beiden Differenzen war statistisch kein Unterschied.
Tab. M1:
Mediane der Faserdurchmesser in µm, VOR und NACH 8 Monaten FES, Differenzen und Steigerung in % sowie Signifikanz der Differenz
| SPASTISCHE PATIENTEN 5-10 | |||
|---|---|---|---|
| Typ I | Typ II | Typ I + II | |
| vor | 33,9 +-19,28 | 51,37 +-4,58 | 42,63 +-8,91 |
| nach | 55,94 +-22,67 | 70,16 +-12,31 | 63,05 +-15,15 |
| Differenz in µm | 22,04 µm | 18,79 µm | 20,42 µm |
| + % Faserdicke | 65,01 % | 36,58 % | 47,91 % |
| Sign. d. Diff. | p < 0,05 | p < 0,05 | p < 0,05 |
Der Vergleich rechtes und linkes Bein ergab keinen signifikanten Unterschied, ebenso der Vergleich der Differenzen und der Verbesserungen in Prozent. Die bei einer zweigipfeligen Verteilungskurve statistisch weniger geeigneten Mittelwerte sind in den Tabellen M 3 und M6 ersichtlich. Strukturverbesserung, Hyperthrophie, Homogeni-sierung der Fasergröße.
Tab. M3:
Vergleich der Patienten DENERVIERT u. SPASTISCH, in Median und Mittelwert der Faserdurchmesser in µm, der Differenzen und Steigerungen in %, VOR / NACH Stimulation.
| Denerviert | Spastisch | Signifikanz:. Den. - Spast. | |
|---|---|---|---|
| Mittelwerte | |||
| x I + II vor | 26,69 +-1,59 | 44,86 +-7,37 | 0,001 |
| x I + II nach | 39,66 +-3,92 | 60,94 +-14,83 | 0,05 |
| Diff. vor/nach in µm | 12,96 | 16,1 | n.s. |
| % der Diff. vor/nach | + 48,55 % | + 35,87 % | n.s. |
| MEDIAN | |||
| Median I + II vor | 23,99 +-3,07 | 42,63 +-8,91 | 0,001 |
| Median I + II nach | 39,86 +-5,42 | 63,05 +-15,15 | 0,05 |
| Diff. vor/nach in µm | 15,87 | 20,42 | n.s. |
| % der Diff. vor/nach | +66,15 % | + 47,91 % | n.s. |
Tab. M6:
Muskelfaser-Querschnitte in µm VOR / NACH 8 Monaten Elektrostimulation Differenzen, Prozente und Signifikanzen, Mediane und Mittelwerte
| DENERVIERT | SPASTISCH | Vergleich Den. - Spast. | ||||||
|---|---|---|---|---|---|---|---|---|
| vor nach | Differenz in µm | Differenz % | vor nach | Differenz in µm | Differenz % | Sign. Diff. in µm | Sign. Diff.in% | |
| x I | 25,60 +-3,7 37,37 +-8,0 |
11,77 | 45,97 | 38,412 +-15,19 53,94 +-21,54 |
15,53 | 40,43 | n.s. | n.s. |
| x II | 27,78 +-5,16 41,947 +-3,1 |
14,17 | 50,997 | 51,3 +-6,1 67,95 +-10,68 |
16,65 | 32,46 | n.s. | n.s. |
| Median. I | 23,61 +-6,69 37,30 +-8,91 |
13,69 | 57,98 | 33,9 +-19,28 55,94 +-22,67 |
22,04 | 65,01 | n.s. | n.s. |
| Median. II | 24,37 +-6,82 42,41 +-6,92 |
18,04 | 74,02 | 51,37 +-4,58 70,16 +-12,31 |
18,79 | 36,58 | n.s. | n.s. |
| x I + II | 26,69 +-1,59 39,66 +-3,92 |
12,97 | 48,58 | 44,86 +-7,37 60,94 +-14,83 |
16,09 | 35,87 | n.s. | n.s. |
| Median I+II | 23,99 +-3,07 39,86 +-5,42 |
15,87 | 66,15 | 42,63 +-8,91 63,05 +-15,15 |
20,42 | 47,91 | n.s. | n.s. |
Am Ende der Stimulationsserie erreichen beide Fasertypen eine gleich große Steigerung (siehe Diff. in Tab. M 1) und fast gleich große Faserdurchmesser; und zwar die Typ I-Fasern 56 µm bzw. die Typ II 70 µm. Einige Fasern bleiben aber sehr klein (siehe Diskussion). Daraus folgt, daß die Elektrostimulation beide Fasertypen mechanisch etwa gleich beansprucht und trainiert hat, jedoch die Typ II-Fasern bei der spastischen Muskulatur etwas überwiegen.
2) Bei den Patienten mit denervierter Muskulatur (siehe Tab. M2) stieg der Faserdurchmesser im Median bei den Typ I-Fasern von 23,61 µm SD 6,69 vor Stimulation auf 37,30 µm SD 8,91 nach der Stimulation.
Tab. M2:
Mediane der Faserdurchmesser in µm, VOR / NACH 8 Monaten FES, Differenzen und Steigerung in %.
| DENERVIERTE PATIENTEN 1-4 | |||
|---|---|---|---|
| Typ I | Typ II | Typ I + II | |
| vor | 23,61 +-6,69 | 24,37 +-6,82 | 23,99 +-3,07 |
| nach | 37,30 +-8,91 | 42,41 +-6,92 | 39,86 +-5,42 |
| Differenz in µm | 13,69 | 18,04 | 15,87 |
| + % Faserdicke | +57,98 % | +74,02 % | +66,15 % |
Bei den Typ II-Fasern, die einen ähnlich hohen Atrophiegrad wie die Typ I-Fasern zu Beginn der Stimulation aufwiesen, vergrößerte sich der Median der Faserdurchmesser von 24,37 µm SD 6,82 auf 42,41µm SD 6,92 nach der Stimulation.
Die prozentuelle Zunahme der Faserndicke bei den Typ I-Fasern betrug demnach 58 % während sie bei den Typ II-Fasern 74 % betrug. Diese fast gleiche prozentuelle und absolute Steigerung in µm der Faserdurchmesser wird durch die praktisch idente Trainingszugbelastung auf beide Fasertypen durch die Elektrostimulation (siehe Diskussion) erklärt. Beide Fasertypen werden gleichermaßen erregt und somit gleich großen mechanischen Zugbelastungen, die den Hyperthrophiereiz darstellen, ausgesetzt.
3) Mediane und Mittelwerte bei denervierten und spastischen Patienten für Typ I + II zusammen VOR und NACH 8 Monaten FES-Training:
Die durchschnittlichen Fasergrößen von denervierter und spastisch gelähmter Muskulatur (Typ I- und Typ II-Fasern zusammen) unterscheiden sich, wie erwartet, im Mittelwert und deutlicher im Median, sowohl vor der Stimulation (p<0,001) und auch nach der Stimulation (p<0,005) signifikant (siehe Tab. M3).
Vergleicht man die Zunahme (= Differenzen) der Faserquerschnitte bei denervierten und spastischen Patienten, so zeigt der Median und der Mittelwert der Differenzen der Faserflächen sowohl bei den Typ I-als auch bei den Typ II-Fasern keinen signifikanten Unterschied (siehe Tab. M3), also eine Steigerung bei beiden Lähmungsarten
Die absolute Zunahme im Median schwankt zwischen 16 und 20 µm. Das heißt, daß der absolute Flächen-zuwachs bei denervierter und spastischer Muskulatur statistisch gleich groß war und somit ein fast identer Trainingseffekt durch die Elektrostimulation auf die gelähmte Muskulatur, nahezu unabhängig von der Lähmungsart, erzeugt wurde!
4) Rechnet man alle denervierten und spastisch gelähmten Patienten (Pat. 1-10) zusammen und betrachtet einzeln die Typ I- und II-Fasern, so ergab sich für die Typ I-Fasern eine Steigerung des Faserdurchmessers im Durchschnitt 62,14 %, und bei den Typ II-Fasern um 56,94 % (siehe Tab. M4).
Tab. M4:
Median der Faserquerschnitte vor/nach 8 Monaten Elektrostimulation aller Patienten (1-10) in µm, Differenzen, % und Signifikanzen
| Typ I | Typ II | Typ I+II | Sign. Diff. I und II | |
|---|---|---|---|---|
| vor | 28,76 | 35,86 | 32,31 | n.s. |
| nach | 46,63 | 56,28 | 51,45 | n.s. |
| Diff. | 17,87 | 20,42 | 19,14 | n.s. |
| Sign.der Verbesserung | p<0,02 | p<0,001 | p<0,02 | n.s. |
| Diff.in % | 62,14 % | 56,94 % | 59,22 % |
Bei allen Patienten (spastisch und denerviert) unterschieden sich die Fasergrößen der Typ I- und die Typ II-Fasern sowohl vor als nach der Stimulation nicht signifikant voneinander. Der Zuwachs für die Typ I-Fasern +17,87 µm und für die Typ II-Fasern +20,42 µm war jedoch hochsignifikant (p<0,02 bzw. p<0,001). Das heißt, das Ausmaß der Verbesserung pro Fasertyp war hochsignifikant und gleich groß, so daß hier keine statistische Unterscheidung möglich war.
Daraus folgt, daß die Verbesserungen von dener-vierter und spastisch gelähmter Muskulatur durch Elektrostimulation gleich groß waren und nur von der Mitarbeit der Patienten und von der richtigen Stimulationsmethodik, jedoch nicht bzw. weniger vom Lähmungstyp abhängig waren!!!
IV/6/B Fasertypisierung
Bei den spastisch gelähmten Patienten waren vor der Stimulation 16,18 % Typ I-Fasern und somit ein Fasertypenverhältnis von 1: 5,18 vorhanden. Dies entsprach dem bekannten Phänomen der vermehrten Typ I-Faseratrophie und Transformation in Typ II- bei fehlender bzw. geringer muskulärer Aktivierung.
Nach der Stimulation war das Fasertypenverhältnis uneinheitlich geändert. So konnte bei drei spastisch gelähmten Patienten eine Abnahme des Typ I- zu Typ II-Verhältnisses und bei drei Patienten eine Zunahme gefunden werden. Wertete man alle 4.214 ausgezählten Muskelfasern der spastisch gelähmten Patienten, so ergab sich nach der Stimulation ein Faserverhältnis von 1:5,33. Dies entsprach einer Änderung um 2,35 % und lag unterhalb der statistischen Aussagekraft. Vergleicht man einzelne Patienten, so findet man bei den Patienten Nr. 5 (siehe Tab. 11 und 12), 7 und 8 eine Typ I- Faservermehrung um fast 50 %.
Tab. 11:
Fasertypen-Verteilung beim spastischem Patient Nr. 5, in der Biopsie (1) VOR Training
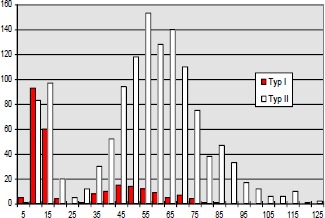 |
Tab. 12:
Fasertypen-Verteilung bei spast. Patient Nr. 5 in der Biopsie (2) NACH 8 Monaten FES: Typ I-Transformation!
 |
Bei den anderen drei spastisch gelähmten Patienten tritt genau der gegenteilige Effekt ein, also eine Typ II- Fasertransformation durch die Elektrostimulation, wie wir sie auch bei einer gesunden Vergleichsgruppe, (Kern, 1994 (155)) gefunden haben. Ein Erklär-ungsversuch dafür könnte die zusätzliche spastische Aktivierung sein, die zu wenig beachtet wurde, oder ein doppelt so großer Trainingseifer, oder eine genetische Disposition. Letztere Annahme in Kom-bination mit den anderen ist die wahrscheinlichste Ursache.
Die Fasertypenverteilung war bei den denervierten Patienten vor Stimulation 27,4 % Typ I-Fasern und 72,6 % Typ II-Fasern, was ein Verhältnis von 1:2,65 bedeutete.
Das Verhältnis Typ I-Fasern zu Typ II-Fasern wurde durch die Elektrostimulation neuerlich um 32,09 % zum Nachteil der Typ I-Fasern verschoben, wodurch nach der Stimulation 18,61 % Typ I- und 81,39 % Typ II-Fasern vorhanden waren. Also eine Änderung des Fasertypen-Verhältnisses auf 1:4,37. Die Typ I-Fasern nahmen bei den denervierten Patienten um 32,09 % auf 67,91 % des Ausgangswertes ab.
Zählt man die denervierte und spastisch gelähmte Gruppe zusammen, so findet man ähnliche Verhältnisse. Die Fasertypenverteilung war anfänglich 21,68 % Typ I- und 77,3 % Typ II-Faser vor der Stimulation. Durch die Stimulation wurde das Fasertypenverhältnis um 20,77 % in Richtung Typ II-Fasern verschoben. Dies ergibt ein Verhältnis von 17,20 % zu 82,70 % Typ I- zu Typ II-Fasern. Also ein Fasertypenverhältnis von 1:4,81 Typ I- zu Typ II-nach der Stimulation. Vor Stimulation betrug es noch 1:3,61.
Diskussion
Nach meinen Erkenntnissen ist die Anzahl der Stimuli pro Tag für die metabolische Adaptierung und somit für die Fasertypisierung verantwortlich (Kern, 151, 155), während die rekrutierte Zugspannung für die Hypertrophie der Muskelfaser die entscheidende Größe und Ursache darstellt.
Die Ausprägung der Muskelfasertypisierung (= Stoffwechsel) und die strukturelle Adaptierung (= Faserhypertrophie) erfolgten in unserer Untersuchung entsprechend dem FES-Stimulationsschema.
Diskussion der Fasertypisierung
Zur Erhaltung ihres täglichen Stoffwechsels und ihrer enzymatischen Ausprägung benötigen die Typ I-Fasern zumindest 300.000 - 400.000 Stimuli pro Tag. Die Typ IIa-Fasern hingegen werden schätzungsweise 80.000 - 100.000 mal pro Tag aktiviert, während die Typ IIb-Fasern mit maximal 5.000 - 10.000 Stimuli pro Tag auskommen.
Die Theorie der Fasertypenausprägung entsprechend den Stimuli pro Tag erklärt auch die bei Immobilisation und Nichtbeanspruchung bzw. bei Lähmung deutlichere Atrophie der Typ I-Fasern.
Durch unsere FES wurden zusätzlich zur Normalbelastung ca. 48.600 Stimuli pro Tag appliziert. Diese ca. 48.600 Stimuli pro Tag machen für die Typ II-Fasern eine fast 60-100%ige Leistungssteigerung aus, während sie bei den Typ I-Fasern nur eine ca. 15%ige zusätzliche Leistung für den Faserstoffwechsel, ausgehend von der täglichen normalen Rekrutierungsrate, darstellen. Die Typ IIb-Fasern wurden durch dieses Stimulationsschema, das einer 10-fachen Tagesbeanspruchung entspricht, metabo- lisch überfordert und transformieren sofort in Richtung IIa.
Durch die deutlichere Atrophie der Typ I- Fasern nach Querschnittslähmung und die weitere Ausprägung der vorhandenen Typ II-Fasern durch die zusätzliche Elektrostimulation entsteht eine überwiegende Typ II-Faser-Population. Die Typ II-Fasern waren jedoch nicht bei allen Patienten so ausgeprägt, wie vermutet werden hätte können. Ein Grund dafür dürfte die small group Atrophie sowohl der Typ I- als auch der Typ II-Fasern sein (bevorzugt Typ I-Fasern), welche durch die Elektrostimulation nicht mehr beeinflusst werden konnten, da die Fasern bereits zu stark atrophiert waren.
Diskussion der Verbesserung des Faserdurchmessers
In den Muskelbiopsien vor und nach Elektrostimulation findet man auch stark atrophierte Muskelfasern mit deutlich weniger als 15 µm Faserdurchmesser. Diese sehr dünnen, wahrscheinlich denervierten Fasern, die in der ATPase-Färbung pH 4,3 und in der HE-Färbung deutlich zu sehen sind, reagieren auf Elektrostimulation nur wenig. Insbesondere die Anzahl der Fasern unter 5 - 10 µm ist nach 8 Monaten Elektrostimulation zwar verringert und im Histogramm nach rechts verschoben, aber noch vorhanden. Dadurch kommt ein zweigipfeliger Kurvenverlauf im Histogramm zum Ausdruck. Für die statistische Auswertung bedeutete dies, daß wir den Median statt dem Mittelwert verwendet haben.
Die Zunahme der Muskelfaserquerschnitte sind bei denervierten und spastisch gelähmten Patienten sowohl im Mittelwert als auch im Median statistisch nicht voneinander zu unterscheiden und daher gleich groß. Die Verbesserung war daher vom Lähmungstyp unabhängig! Unsere optimierte Elektrostimulation war daher für beide Patientengruppen (denerviert, spastisch) und für beide Muskelfasertypen (Typ I- und Typ II) gleich trainierend. D. h. sowohl die mechanische Zugbelastung als auch die metabolische Beanspruchung war für beide Fasertypen etwa gleich (siehe oben).
Diese Beobachtungen stimmen mit der Tatsache überein, daß die Elektrostimulation bei denervierter Muskulatur beider Fasertypen gleich erregt (direkte Erregung der Muskelfasermembran) und bei spastisch-gelähmten Patienten über die nicht myelinisierte Nerven-Endstrecke auf den Muskel erregend wirkt und so die normale Rekrutierungsordnung durch den elektrischen Strom durchbrochen wird. Sämtliche motorische Nervenfasern (denerviert = Muskelfasern), die im ausreichend starken elektrischen Feld liegen, werden depolarisiert. Dadurch wurden die Typ I- und die Typ II-Fasern gleichermaßen erregt und eine etwa gleiche Endkonfiguration der Faseradaptation (= gleiche Faserdicke), entsprechend der täglichen Belastung erreicht. Die mechanische Zugbelastung und somit der Hypertrophie-Reiz waren bei den Paraple-gikern für die Typ I- und für die Typ II-Fasern etwa gleich groß (siehe Tabelle M 3 und M 4).
Die absolut und prozentuell höhere Zunahme des Faserdurchmessers bei den spastischen Typ I-Fasern war durch die größere Atrophie bei Stimulationsbeginn bedingt. Würde man der Theorie der Faser-rekrutierung nach der Dicke der Myelinisierung folgen, wären vorwiegend Typ II-Fasern beansprucht worden und somit auch die Typ II-Fasern hypertrophiert!
Dasselbe Stimulationsschema führte bei Sportstudenten über einen Zeitraum von 7 Wochen zu einer 16%igen Steigerung der Volumsprozente der IIa-Fasern, jedoch zu keiner Vergrößerung des Muskelfaserquerschnittes, Kern 1994 (156). Bei Normalpersonen haben zusätzliche 50.000 Stimuli pro Tag zwar einen erheblichen metabolischen Effekt auf die Typ II-Faserpopulation (+ 22 % Typ II-a-Fasern), die elektrisch ausgelöste mechanische Zugbelastung von ca. 60 % der Maximalkraft führte aber zu keiner weiteren Kraftsteigerung.
Die Zugbelastungen des täglichen Lebens dieser Sportstudenten stellten an sich bereits einen größeren Trainigsreiz für die Muskelfaserdicke dar, als unsere experimentelle Elektrostimulation auslösen konnte.
Aufgrund dieser Ergebnisse halte ich die Anzahl der Stimuli pro Tag für die auslösende Komponente für die metabolische Adaptierung zur Fasertypisierung, während die tägliche Zugspannung für den Hypertrophiereiz und damit für die Muskelfaserdicke den entscheidenden Parameter darstellt.
Ergebnisse der Muskelenzymchemie
Bei den spastisch gelähmten Patienten betrugen die absoluten Ausgangswerte der Enzymaktivitäten für den aeroben Stoffwechsel (in U/g) im Durchschnitt für die Citratsynthetase 4,21+-6,5, Cytochrom-C-Oxydase 2,5+-2 und für die Hydroxyacyl-CoA-Dehydrogenase 5,4+-5,6 Units/g. Mit Ausnahme eines Patienten (Patient Nr. 7: CS 17,3 U/g und die HAD 14,8 U/g) lagen sämtliche Enzymwerte aller anderen Patienten weit unter den Normwerten bzw. unter den Werten unserer gesunden Vergleichsgruppe.
Die Ausgangswerte für die anaeroben Enzyme waren
Phosphorylase 10,64+-9 U/g; Phosphofruktokinase 23,4+-19,5 U/g; Pyruvatkinase 167+-138,2 und Laktat-Dehydrogenase 201+- 69,4 U/g.
Insgesamt gesehen lagen sämtliche Werte des aeroben als auch anaeroben Stoffwechsels unterhalb bzw. an der unteren Normwertgrenze. Einzelne, extrem hohe anaerobe Werte, vor allem eines Patienten, bedingen die hohen Standard-abweichungen.
Bei den Patienten mit denervierter Muskulatur betrugen die Ausgangswerte (U/g) vor der Stimulationsserie für die aeroben Enzyme: Cytratsynthetase 2,8+-1,75; Cytochrom-C-Oxydase 1,85+-0,73; Hydroxyacyl-CoA-Dehydrogenase 3,9+-3,6; Fumarase 11,5+-2,9; und für die Succinat-Dehydrogenase 1,52+-0,46 Units/g und für die anaeroben Enzyme: Phosphorylase 4,1+-3,6; Phosphofruktokinase 20,3+-8,9; Pyruvatkinase 139+-57,2 und Laktatdehydrogenase 123,75+-6,3 U/g.
Der Ausgangswert der Enzyme in der denervierten Muskulatur war niedriger, verglichen mit den Ausgangswerten der spastisch gelähmten Patienten. Aerobe und anaerobe Enzyme lagen ebenfalls unterhalb der Normwertgrenze gesunder Probanden.
Nach der Stimulationsserie
Bei den spastisch gelähmten Patienten und bei den Patienten mit denervierter Muskulatur (!) kommt es zu einem erheblichen Anstieg der Absolutwerte der aeroben und der anaeroben Enzyme nach 8monatiger Elektrostimulation in der Oberschenkelmuskulatur. Im einzelnen betrug die absolute Zunahme der Enzymaktivitäten
Aerobe und anaerobe Enzyme - Statistische Berechnungen
im aeroben und anaeroben Stoffwechsel ca. den Betrag des halben bis ganzen Normbereiches. Für die Einzelwerte siehe Tabellen E3 bis E 6.
Tab. E 3:
Spastische Patienten VOR - NACH 8 Monaten FES
| Norm werte | CS (5,5 +- 2 U/g) | Cyt.c.OX (5,8 +- 3,0 U/g) | HAD (5,4 +- 2 U/g) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| vor | nach | Diff. | vor | nach | Diff. | vor | nach | Diff. | |
| Pat.5 | 1,0 | 7,7 | 6,7 | 4,3 | 9,2 | 4,9 | 3,0 | 7,0 | 4,0 |
| Pat.6 | 3,44 | 6,12 | 2,68 | 1,64 | 3,79 | 2,15 | 10 | 8,67 | 1,33 |
| Pat.7 | 17,3 | 11,41 | -5,89 | 3,29 | 3,96 | 0,67 | 14,8 | 16,23 | 1,43 |
| Pat. 8 | 0,1 | 0,18 | 0,08 | 0,24 | 0,47 | 0,23 | 1,1 | 1,85 | 0,75 |
| Pat. 9 | 1,02 | 1,08 | 0,06 | 0,28 | 0,32 | 0,04 | 1,16 | 1,21 | 0,05 |
| Pat.10 | 2,4 | 12,2 | 5,0 | 5,0 | 5,8 | 0,8 | 2,6 | 17,0 | 14,4 |
| x | 4,21 | 6,4 | 1,4 | 2,5 | 4,0 | 1,5 | 5,4 | 8,7 | 3,7 |
| SD | ⌖6,5 | ⌖5,0 | ⌖4,5 | ⌖2,0 | ⌖3,4 | ⌖1,8 | ⌖5,6 | ⌖6,8 | ⌖5,4 |
Tab. E6:
Denervierte Patienten VOR - NACH 8 Monaten FES
| Normwerte | Phos (13,9 +- 4,4 U/g) | PFK (30,0 +- 17,1 U/g) | PK (163 +- 77 U/g) | LDH (170 +- 53 U/g) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| vor | nach | Diff. | vor | nach | Diff. | vor | nach | Diff. | vor | nach | Diff. | |
| Pat.1 | 0,58 | 2,11 | 1,53 | 12,9 | 29,0 | 16,1 | 100 | 222 | 122 | 55 | 113 | 58 |
| Pat.2 | 2,0 | 9,1 | 7,1 | 13,7 | 33,3 | 19,6 | 94 | 231 | 137 | 85 | 231 | 146 |
| Pat.3 | 8,7 | 7,37 | -1,33 | 32,1 | 33,31 | 1,21 | 218 | 243 | 25 | 179 | 189 | 10 |
| Pat.4 | 5,1 | 3,36 | 1,74 | 22,6 | 34,25 | 11,65 | 144 | 189 | 45 | 176 | 201 | 25 |
| x | 4,1 ⌖ | 5,5 ⌖ | 2,3 ⌖ | 20,3 ⌖ | 32,4 ⌖ | 12,1 ⌖ | 139 ⌖ | 221,3 ⌖ | 82,3 ⌖ | 123,75 ⌖ | 183,5 ⌖ | 59,8 ⌖ |
| SD | 3,6 | 3,3 | 3,5 | 8,9 | 2,4 | 8,0 | 57,2 | 23,2 | 55,5 | 6,3 | 50,2 | 60,9 |
Die prozentmäßige Zunahme der aeroben Enzyme betrug bei den spastisch gelähmten Patienten insgesamt 54 %, bei den Patienten mit denervierten Muskeln sogar ca. 65 %.
Die anaeroben Enzyme stiegen um 51 % in den spastischen bzw. ca. 56 % in den denervierten Muskeln. Die etwas größere prozentuelle Zunahme bei den denervierten Muskeln ist durch den niedrigeren Ausgangswert bedingt.
Die Erhöhung der Enzyme ist bei denervierter und spastisch gelähmter Muskulatur beim Vergleich der Differenzen etwa gleich groß. Das Ausmaß der Erhöhung ist von denerviert und spastisch statistisch nicht zu unterscheiden. Ein ähnliches Ergebnis gibt es auch bei den Muskelfaserquerschnittzunahmen, die innerhalb der einzelnen Lähmungsgruppen hochsignifikant sind. Es konnte jedoch kein statistischer Unterschied im Ausmaß der Verbesserungen zwischen denervierter und spastisch gelähmter Muskulatur nachgewiesen werden (siehe Kapitel: Muskelbiopsie Tab. M3).
Dies bestätigt den etwa gleichen Trainingseffekt bei optimierter Stimulation auf spastisch gelähmte und denervierte Muskulatur. Ein weiteres Argument für die Trainierbarkeit der denervierten Muskulatur!
Die aeroben und anaeroben Enzyme in der gelähmten (denervierten und spastischen) Muskulatur sind vor der Elektrostimulation deutlich vermindert und erreichen nach FES-Training den Bereich gesunder Muskeln. Beim statistischen Vergleich ergeben sich jedoch Unterschiede zwischen den aeroben und anaeroben Enzymen.
Aerobe Enzyme
Bei der Varianzanalyse (Tab. E 1) der aeroben Enzyme bei denervierten und spastischen Patienten sowie gesunden Probanden zeigt sich vor der Stimulation ein signifikanter Unterschied p<0,01.
Tabelle E 1:
Varianzanalyse der Enzym-Mittelwerte von
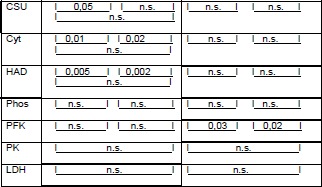 |
Nach der Stimulation besteht durch die Erhöhung bis in den Normbereich gesunder Muskeln kein statistisch signifikanter Unterschied mehr zwischen den 3 Gruppen. Damit wird auch die Trainierbarkeit der denervierten Muskulatur statistisch bestätigt.
Anaerobe Enzyme
Durch die Lähmungsart bzw. die Immobilisation überwiegen bei den querschnittgelähmten Patienten die Typ II-Fasern, die ca. doppelt so groß wie die Typ I-Fasern sind. Dieses Verhältnis wird auch durch die wenigen spastischen Alltagserregungen sowie die im Verhältnis geringe Stimuli-Anzahl pro Tag bei der Elektrostimulation nicht geändert. Daher war zu vermuten, daß die anaeroben Enzyme für die Energiebereitstellung der gelähmten Muskulatur überwiegen.
Bei der Varianzanalyse der 3 Gruppen (denerviert, spastisch, gesund) hinsichtlich der anaeroben Enzyme war vor und nach der Elektrostimulation kein signifikanter Unterschied, obwohl die Absolutwerte im Enzymgehalt deutlich anstiegen (denervierte Muskeln + 50-100 %, spastisch gelähmte Muskeln 50-120 %). Verfälscht wird dieser statistische bzw. %mäßige Vergleich der anaeroben Enzyme durch die sehr hohen Ausgangswerte für die Phosphofruktokinase bei 2 Patienten (Nr. 6 und 7), die bereits vor der Stimulation ca. 50 % über dem Normwert lagen. Dies dürfte durch die teilweise deutliche Ausprägung des anaeroben Stoffwechsels bei gelähmter Muskulatur bedingt sein. Die zusätzliche Aktivierung durch die Elektrostimulation mit ca. 50.000 Stimuli pro Tag stellt vom Umfang her und von der relativ langen Pausengestaltung bei der Stimulation (Schwellpause 2-5 sec) eine zusätzliche Förderung der anaeroben Energie bereitstellung dar.
Vergleich der Mittelwerte der Enzyme von allen Patienten 1-10 zu gesunden Probanden
Vergleicht man das gesamte Patientenkollektiv (1-10) mit den 12 gesunden Probanden, so findet sich vor der Stimulation ein signifikanter Unterschied in den Mittelwerten der aeroben Enzyme p<0,01 bis p<0,05. Die aneroben Enzyme weisen auch hier vor der Stimulation keine signifikante Unterschiedlichkeit auf.
Nach der Stimulation ist der Enzymgehalt der gelähmten Patienten nicht mehr vom Enzymgehalt gesunder Probanden statistisch zu unterscheiden, außer PFK p<0,05 (siehe Tab. E 2). Dies bedeutet, daß auch im Gesamtkollektiv der gelähmten Paraplegiker durch die deutliche Enzymerhöhung, bis in den Normbereich gesunder Muskulatur, die Trainierbarkeit, die Adaptierbarkeit und die Verbesserung des Zellstoffwechsel gelähmter Muskeln durch Elektrostimulation bestätigt wurde.
Tabelle E 2:
Signifikanz der Enzym-Mittelwerte im Vergleich Patienten ((1-10)) VOR-NACH Stimulation zu Gesunden
 |
Diskussion
Vergleicht man vor der Stimulationsserie die Absolutwerte der spastisch gelähmten und denervierten Patienten mit den Normalwerten Gesunder, so sieht man bei sämtlichen Patienten eine Herabsetzung sowohl der aeroben als auch anaeroben Enzymaktivitäten (teilweise ausgenommen PFK) unterhalb des Normalbereiches gesunder Muskeln.
Die Patienten mit denervierter Muskulatur haben noch niedrigere Ausgangswerte als Patienten mit spastisch gelähmter Muskulatur, wie aufgrund der stärkeren Atrophie zu erwarten war.
Am Ende der Stimulationsserie kommt es sowohl bei den spastisch gelähmten Patienten als auch bei den Patienten mit denervierter Muskulatur zu einem Anstieg sämtlicher Enzymaktivitäten des aeroben und anaeroben Stoffwechsels in den
Normbereich gesunder Muskulatur !!!
Dies stimmt mit der Zunahme des Muskelfaserdurchmessers überein, die bei den denervierten Muskeln bei den Typ I-Fasern x=45,97 %, bei den Typ II-Fasern x= 51,0 %, bei den spastisch gelähmten Muskeln, jedoch nur x=40,43 % bei den Typ I und x=32,46 % bei den Typ II-Fasern betrug.
Die prozentuell höhere Zunahme des Faserdurchmessers bei den Typ II-Fasern sowie der anaeroben Enzyme bei den denervierten Muskeln ist durch den niedrigeren Ausgangswert bedingt.
Diese enzymchemischen Befunde bestätigen die Trainierbarkeit querschnittgelähmter Muskeln, insbesondere die „Trainierbarkeit denervierter Muskulatur mit FES”, die bisher beim Menschen, in dieser Form, noch nie histologisch und enzymchemisch nachgewiesen wurde.
V/ ZUSAMMENFASSUNG
Der Stand des Wissens und die Ziele der Funktionellen Elektrostimulation werden für Trophik und Metabolismus, für Funktion und Bewegung, für cardiovaskuläre Fitness, Spasmusregulation und Muskeltraining bei spastisch-gelähmten und denervierten Paraplegikern zusammengefasst. Nach wie vor bestehen Wissenslücken über den Zusammenhang von Morphologie und Biochemie sowie neuraler Steuerung und Trainierbarkeit spastisch gelähmter und denervierter Muskulatur, sodaß viele klinische Fragen derzeit offen sind, u. a.: Ist spastisch gelähmte und insbesondere denervierte Muskulatur trainierbar? Ist dieser Trainingseffekt mittels Computertomographie, bioptischer Muskelhistologie und biochemischer Enzymdiagnostik nachweisbar?
Kann die Elektrostimulation einen durchblutungs- und trophikfördernden Effekt auf Haut und Muskulatur zur Decubitusprophylaxe entfalten?
Kann die Funktionelle Elektrostimulation mit Oberflächenelektroden technisch und methodisch optimiert werden?
Sind aus unseren experimentellen Ergebnissen neue praktische Empfehlungen für die FES bei Paraplegikern ableitbar?
Als Untersuchungskollektiv standen uns 14 männliche und 2 weibliche querschnittgelähmte Paraplegiker, davon 6 mit denervierter Muskulatur wegen Conus-Cauda-Läsion, zur Verfügung. Bei allen freiwilligen Patienten wurden an beiden Beinen VOR und NACH 8monatiger Elektrostimulation Muskelbiopsien für Histologie und Enzymbestimmungen, computertomographische Quadricepsschnitte, isometrische Kraftmessungen, Xenon-Clearance und Thallium-Szintigraphien und Infrarotthermographien zur Durchblutungsmessung durchgeführt. Wegen technischer Schwierigkeiten, geringer Compliance oder Ablehnung der zweiten Biopsie mußten pro Untersuchung ca. 1-2 Patienten ausgeschieden werden. Die Funktionelle Elektrostimulation erfolgte mittels eines 2-Kanal-Constant-Voltage-Stimulator, der von unserer Arbeitsgruppe für die Mobilisation spastischquerschnittgelähmter Patienten entwickelt wurde. Die Stimulationsparameter, Geräte und Elektroden etc. wurden zuvor in Versuchsreihen optimiert.
Die Stimulationsfrequenz betrug 27 Hz, die für eine ausreichend kräftige tetanische Kontraktion bei relativ geringer neuraler und muskulärer Ermüdung geeignet waren. Es wurden biphasische Rechteckimpulse mit 1,2 msec Impulsdauer verwendet. Die Gesamtzahl der Stimuli (= Muskelerregungen) lag bei ca. 48.000 Stimuli pro Tag, dementsprechend bei ca. 325.000 Stimuli pro Woche. Die Stimulation erstreckte sich über einen Zeitraum von 8 Monaten, 2 x 30 min täglich, an 7 Tagen in der Woche.
Die Patienten hatten den Auftrag, bis zur völligen Kniestreckung abwechselnd beide Oberschenkel zu stimulieren und entsprechend der Maximalkraft zusätzliche Gewichte am Knöchel zu fixieren.
Die Patienten mit denervierter Muskulatur führten die Elektrostimulation der Oberschenkelmuskulatur im Sitzen oder im Liegen aus, wobei anfänglich kräftige Einzelzuckungen ausgelöst wurden. Erst mit fortschreitendem Trainingseffekt und mit Normalisierung des Zuckungscharakters sowie der Muskel-Membranerregbarkeit und der dadurch erst möglichen Reduktion der Impulsdauer (Reiz-Zeit-Bedarf laut I/t-Kurve geringer) konnten auch tetanische Kontraktionen durch einen speziellen Schwellstrom für denervierte Muskulatur nach Kern mit ca. 30 msec Impulsdauer, biphasisch, und ca. 20 msec Impulspause sowie einer Schwelldauer von 2-3 sec und 5 sec Schwellpause verwendet werden.
Die Patienten führten die Elektrostimulation jeweils an beiden Oberschenkeln mittels zweier leitender Gummielektroden (spezifischer Widerstand ca. 20 Ohm cm2/cm) mit einer Elektrodenfläche von je ca. 200 cm2 selbständig zu Hause durch. Jeder führte ein genaues Stimulationsprotokoll.
Die Stimulation wurde am M. quadriceps durchgeführt, weil dieser Muskel leicht zugänglich und sehr gut mit Oberflächenelektroden stimulierbar und für das Aufstehen aus dem Rollstuhl für Paraplegiker der entscheidende Muskel neben dem M. glutaeus ist. Außerdem ist der Vastus lateralis des M. quadriceps femoris der international leistungshistologisch, histochemisch, morphometrisch und enzymchemisch am besten analysierte menschliche Skelettmuskel, sodass Vergleiche mit der Muskulatur Gesunder möglich sind.
Bei querschnittgelähmten Patienten ist jedoch von einem unterschiedlich hohen Atrophiegrad auszugehen. Der Faserdurchmesser beträgt bei denervierter Muskulatur ca. 25 % der Faserdicke von Normalpersonen und bei spastisch gelähmter Muskulatur ca. 50 % der Faserdicke von Normalpersonen. Die starke Atrophie und teilweise Fettgewebsvermehrung im Interstitium bzw. zwischen den Muskelgruppen erklärt die besonderen Schwierigkeiten bei der Gewinnung von Muskelstücken mit der Nadelbiopsie bei querschnittgelähmten Patienten.
Von jedem Patienten wurden je 4 Muskelbiopsien aus dem Vastus lateralis (je ein Präparat aus beiden Beinen vor und nach Stimulation) zur histologischen und elektronenmikroskopischen Untersuchung sowie zur Muskel-Enzymbestimmung entnommen. Die Muskelbiopsien erfolgten symmetrisch aus beiden Beinen entsprechend der, auch im Sport üblichen, internationalen Methodik (Bergström, Hoppeler).
Einige Tage zuvor wurden die CT-Untersuchung, Xenon-Clearance und Thallium-201-Szintigraphie sowie die Infrarot-Telethermographie und die Kraftmessung durchgeführt.
Nach 8monatiger Elektrostimulation konnte eine max. isometrische Kraftsteigerung von x=35 Nm auf x=51 Nm, bei etwa gleicher Stimulationsstärke, erreicht werden. Dies entsprach einer Zunahme von 16 Nm und einer prozentuellen Steigerung um 45,7 %. Die geringen Absolutwerte der messbaren Kraft der Oberschenkelmuskulatur bzw. die geringe Leistungsabgabe bei der FES-Ergometrie dürften durch die elektrisch induzierte Mitstimulation der Antagonisten und/oder eine spastische Aktivierung der Antagonisten, in diesem Fall der Hamstrings, verursacht werden.
Die histologischen Veränderungen zeigten eine Zunahme der Faserdurchmesser der Typ I- und Typ II-Fasern bei den denervierten Patienten im Median 58 % bzw. 74 %, während bei den spastisch gelähmten Patienten die Typ II-Fasern eine 37%ige, die Typ I-Fasern eine 65%ige Querschnittsver-größerung aufzeigten (p < 0,05).
Unser Stimulationsschema mit ca. 48.000 Stimuli pro Tag, 2x30 min, bewirkte eine Erhöhung der Enzymkonzentration des aeroben, aber auch des anaeroben Zellstoffwechsels um durchschnittlich 60 % bei denervierter und 53 % bei spastisch-gelähmter Muskulatur bis in den Normbereich gesunder Muskulatur.
Die computertomographischen Muskelquerschnittsflächen zeigten eine Größenzunahme von 27 % bei den spastisch-gelähmten Patienten. Bei den denervierten Patienten war am proximalen Oberschenkel eine Muskelvergrößerung um 12 % und am distalen um 8 % feststellbar. In der Mitte des Oberschenkels zwischen den Elektroden war die Verbesserung nur 1,8 %. Dieses überraschende Ergebnis weist darauf hin, daß bei fehlender neuraler Versorgung die Erregungs-leitung nur entlang bzw. in einer Muskel-faser möglich ist und daher die therapeutische Stimulation denervierter Muskulatur möglichst groß-flächig, anatomisch den gesamten Muskel bedeckend, erfolgen muß. Der bessere Trainingseffekt und die bessere Muskeladaptation erfolgten unter den Elektroden, wo die hohe Stromdichte die stärkste Kontraktion auslösen konnte.
Bemerkenswert ist, daß die computertomographischen Änderungen der Querschnittsfläche mit 5-10-fach so großen intramuskulären Strukturverbesserungen einhergegangen sind, welche nur muskelbioptisch zu erfassen waren.
Die Xenon-Clearance der Haut zeigte eine Durchblutungserhöhung von 76 % nach 15 min FES zu Beginn der Trainingsperiode. Nach 8 Monaten kam es zu einer signifikanten Erhöhung der Ruhedurchblutung der Haut auf 4,78 ml/100g/min, was einer 86-%-Steigerung entsprach. Zusätzlich fördert die FES nach 8monatiger Stimulation die Hautdurchblutung auf der stimulierten Seite (+ 43 %) und bei den spastisch gelähmten Patienten auch auf der kontralateralen Seite.
Die Muskeldurchblutung mit der Thallium-Szintigraphie ist nicht in Absolutwerten anzugeben. Wir ha-ben daher den Quotienten zur Gehirndurchblutung gebildet, die innerhalb eines Jahres keiner allzu großen Variation unterliegt.
8 Monate Funktionelle Elektrostimulation bewirken im M. quadriceps bei denervierter Muskulatur eine hoch signifikante 5fache Oberschenkel-Durchblutung und bei spastisch gelähmter Muskulatur sogar eine 9,5fache Oberschenkeldurchblutung. Eine geringe Erhöhung im Unterschenkel beidseits ist nicht signifikant.
Die in der Infrarot-Thermographie nachgewiesene Hyperämie (+ 1,57 Grad C) der Haut breitete sich bei spastisch gelähmten Patienten langsam vom stimulierten Oberschenkel auf die kontralaterale Seite und bis in den Fußbereich aus, um auch dort nach 25 min eine statistisch signifikante Differenz zum Ausgangswert zu erreichen. Diese Erhöhung war bis zu einer Stunde nach Stimulation auf der stimulierten und nicht stimulierten Seite nachweisbar.
Denervierte Patienten zeigten ebenfalls eine hyperämische Reaktion am kontralateralen Oberschenkel, es fehlte jedoch auf beiden Seiten die Ausbreitung der Hyperämie bis in den Unterschenkel und Fußbereich.
Zusammenfassend kann für die Xenon-Clearance und Infrarot-Telethermographie der Hinweis festgehalten werden, dass die funktionelle Elektrostimulation eine deutliche Durchblutungserhöhung der Haut während der Stimulation, aber auch einen Langzeiteffekt bewirkt. Diese Verbesserung der Hautdurchblutung sollte zur Decubitusprophylaxe genützt werden.
Als neue Empfehlung für die praktische Durchführung der Funktionellen Elektrostimulation bei denervierter Muskulatur ist die Notwendigkeit der großflächigen, anatomisch, den gesamten Muskelverlauf bedeckenden Elektroden für die Therapie besonders hervorzuheben. Da eine muskelfaserüberspringende Erregungsleitung im denervierten Muskel nicht vorkommt, muß das elektrische Feld die einzelnen Muskelfasern direkt depolarisieren.
Der Einsatz von Exponentialstrom ist in Zukunft nur als Reflextherapie sinnvoll!
Die Adaptierung der Muskelfasern an die geforderte Leistung erfolgt einerseits durch die Anzahl der Stimuli pro Tag in Richtung Fasertypenausprägung und andererseits in Richtung Faserhypertrophie durch die Größe der täglichen mechanischen Zugbeanspruchung der Muskelfasern. Daraus kann für die moderne Elektrotherapie gelähmter Muskulatur abgeleitet werden, dass die Muskelkräftigung oder die metabolische Fasertransformation nur durch geeignete Elektrostimulationsmethodik ausgelöst werden können. Die Trainierbarkeit denervierter Muskulatur konnte durch die Muskelbiopsie (Faserdickenzunahme im Median + 66 % und Flächenzunahme der Muskulatur im CT unter den Elektroden + 10 %) sowie durch die Erhöhung der aeroben und anaeroben Enzyme bis in den Normbereich gesunder Muskeln nachgewiesen werden!
Die große CT-Flächenzunahme und die szintigraphisch gemessene Thallium-Durchblutungssteigerung sind weitere Beweise für die Trainierbarkeit denervierter Muskulatur beim Menschen durch spezielle Funktionelle Elektrosti-mulation. Diese Ergebnisse sind nur mit dem Schwellstrom für denervierte Muskulatur nach Kern erreichbar, da nur so tetanische Kontraktionen mit genügend großer Zugspannung ausgelöst werden können, die eine Hypertrophie der gelähmten Mus-kulatur bewirken.
Aus den trainingsbedingten Adaptierungen der denervierten Muskulatur leite ich die Forderung an die Querschnittsrehabilitationszentren ab, für Patienten mit Conus-Cauda-Läsionen, welche bekanntlich besonders Decubitus gefährdet sind, möglichst frühzeitig ein elektrisches Muskeltraining zu ermöglichen, um die periphere Trophik, Metabolismus und Durchblutung zu verbessern und so einen sinnvollen Beitrag zur Decubitusprophylaxe zu leisten.
FES-Aufsteh- und FES-Gehtraining mit Oberflächenstimulation sind für spastisch gelähmte Paraplegiker ein probates Mittel zur Durchblutungsförderung, Trophikverbesserung, Muskelfaserhypertrophie und Muskelquerschnittsvergrößerung sowie zur intrazellulären Strukturverbesserung. Aktives Aufsteh- und Gehtraining ist der aufwendigeren FES-Ergometrie aus ökonomischen und methodischen Gründen (einfachere Handhabung und überall mögliche Einsetzbarkeit) vorzuziehen.
Die Auslösung bestimmter Funktionen mit FES wie Aufstehen, Stehen, Gehen, Stiegensteigen erachte ich als zusätzlich mögliches Training und sportliches Betätigungsfeld. Die Funktion an sich wird bei Paraplegikern in absehbarer Zeit nicht Selbstzweck sein, sondern fördert, als “Mittel zum Zweck” mit beachtlichen physiologischen Verbesserungen, teilweise bis in den Bereich gesunder Muskulatur, Trophik und Metabolismus in den gelähmten Körperabschnitten.
Abb. 3:
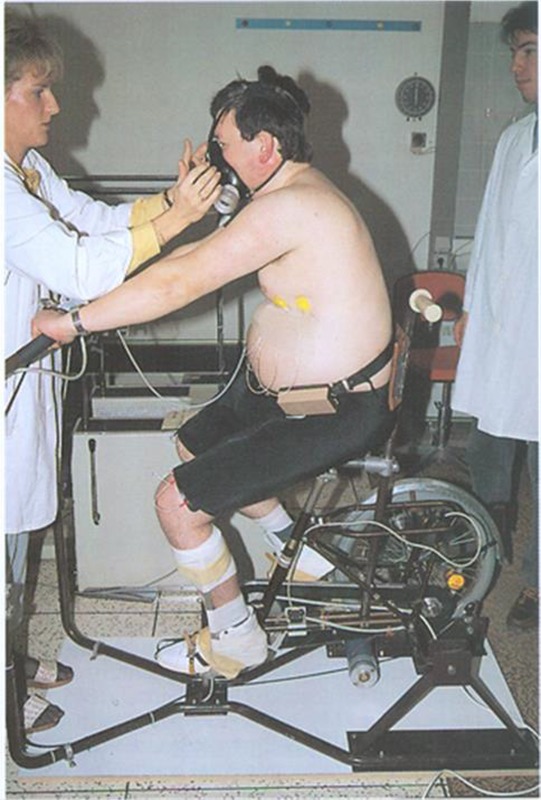
FES-Spiroergometrie eines paraplegischen Patienten am Ergometer-Fahrrad, das mit einem Hilfsmotor ausgestattet ist (Erklärung siehe Text).
Abb. 4:
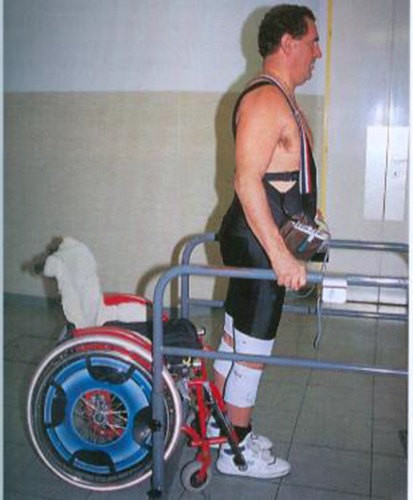
Aktives Stehen im Barren mit Oberflächen-stimulation vom M. glutaeus, M. quadriceps bds.
Abb. 5a:

4-Punkte-Gang mit Rollator und 6-Kanal-Stimulation wie bei Abb. 5.
Abb. 6:
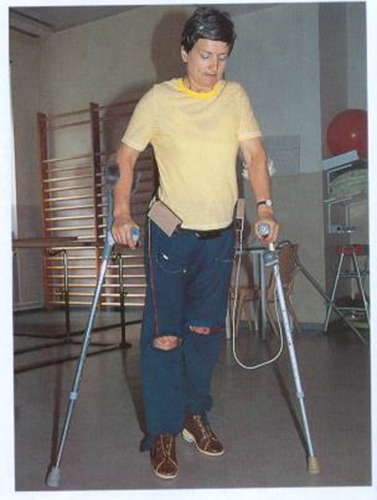
Gehen im 4-Punkte-Gang mit 2 Krücken mit oder ohne Peronaeus reflex.
Abb. 7:
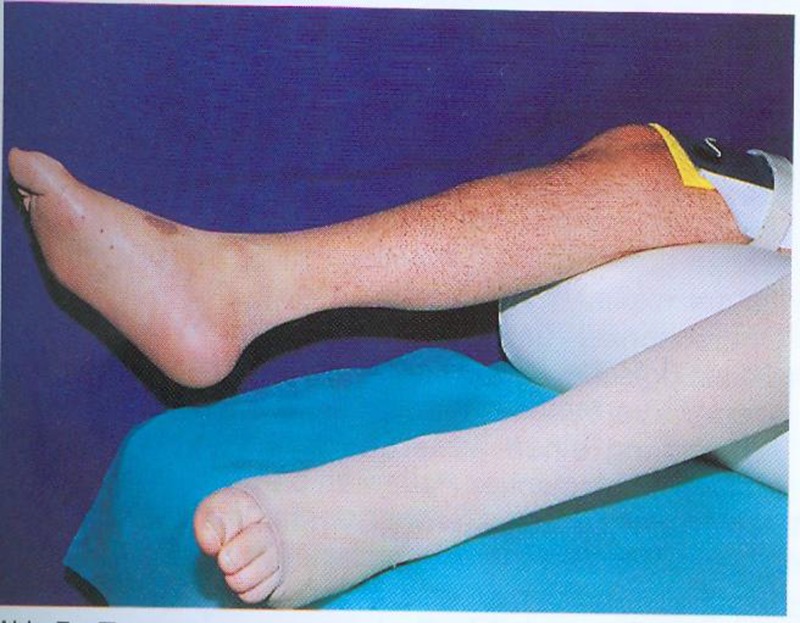
Tetanische Kontraktion bei denervierten M. quadriceps mit Abheben des Unterschenkels von der Unterlage.
Abb. 13:
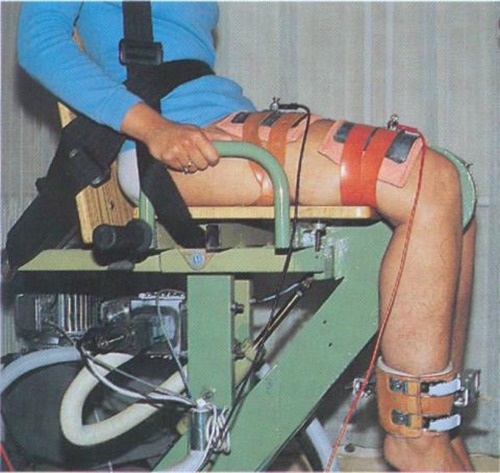
Elektroden-Vergleichsuntersuchungen am Kraftmessstuhl. Mit gleicher Methodik wurde auch die FES-Kraftmessung durchgeführt.
Abb. 15:
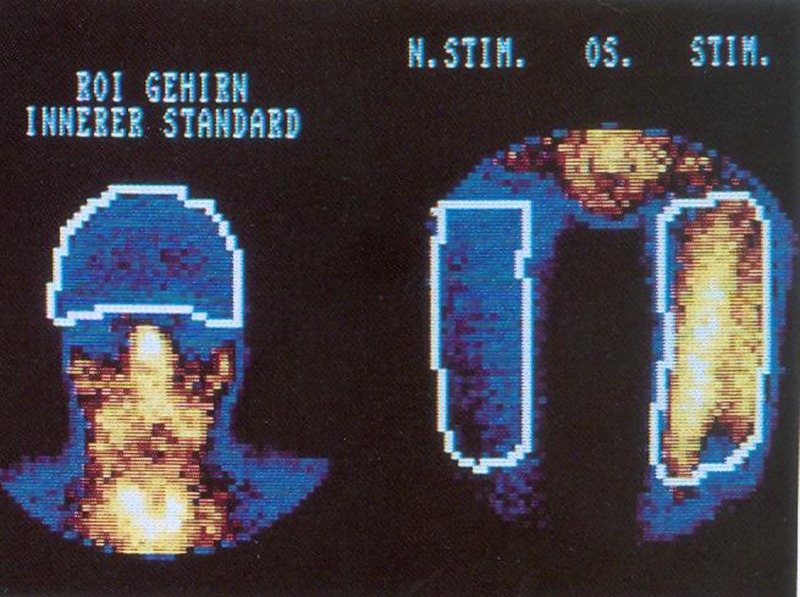
Thallium-Szintigraphie der stimulirte und noch stimulirte Oberschenkelmuskulatur
Abb. 16:
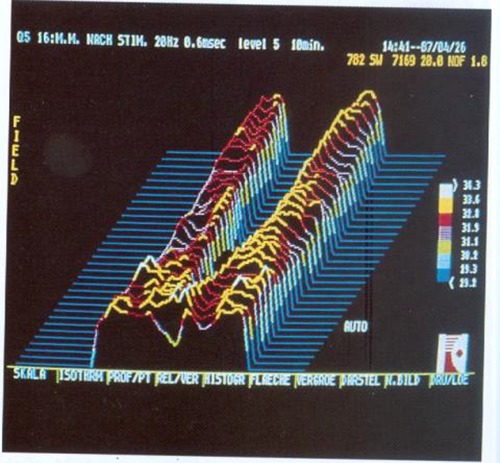
Thermographische Aufnahme vom Becken, Bein und Fuß nach Elektrostimulation
Abb. 17:
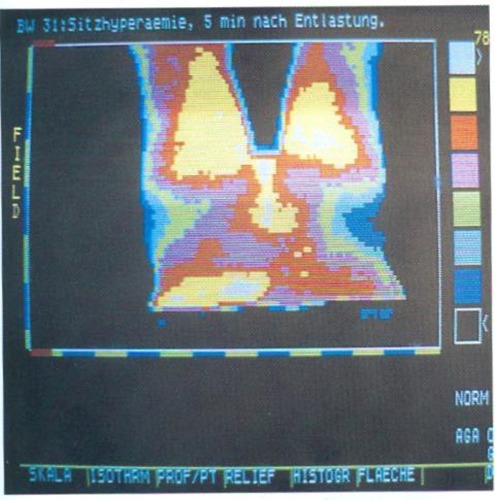
Hyperämie an der Sitzfläche nach Entlastung.
Abb. 19:
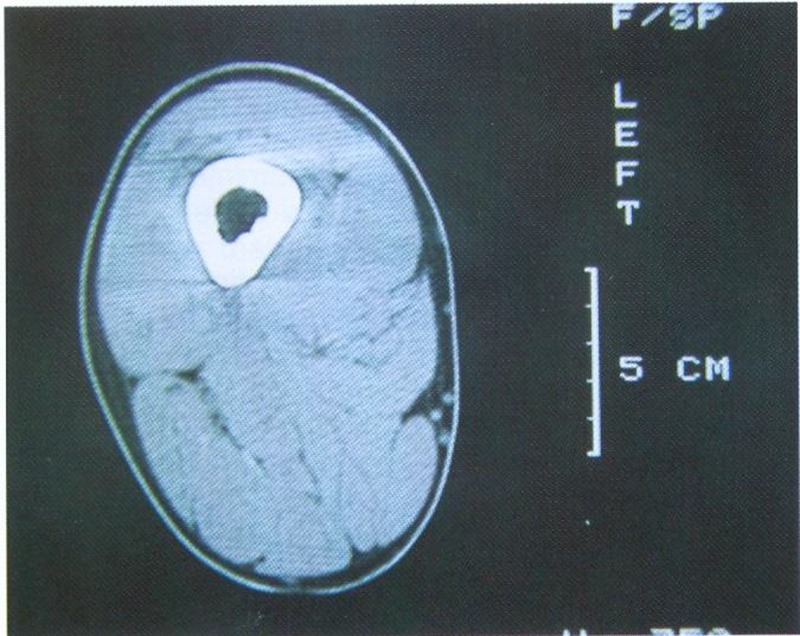
Computertomographischer Querschnitt im mittleren Quadriceps (Q2) VOR der Trainingsperiode.
Abb. 21:
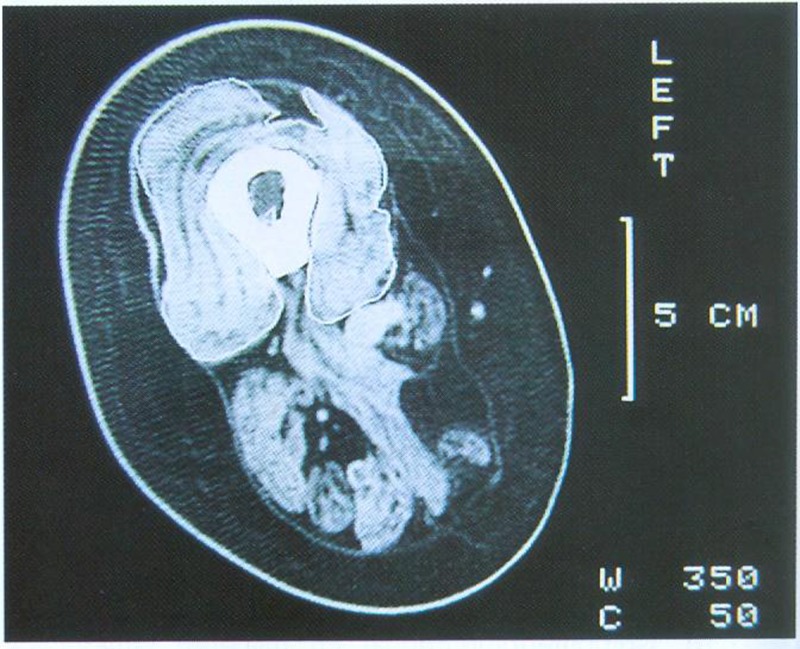
Computertomographie (Q2) aus dem mittleren Quadriceps bei denerviertem Conus-Cauda-Patienten mit deutlicher Athrophie, intermuskulärer und subcutaner Fetteinlagerung
Abb. 25:
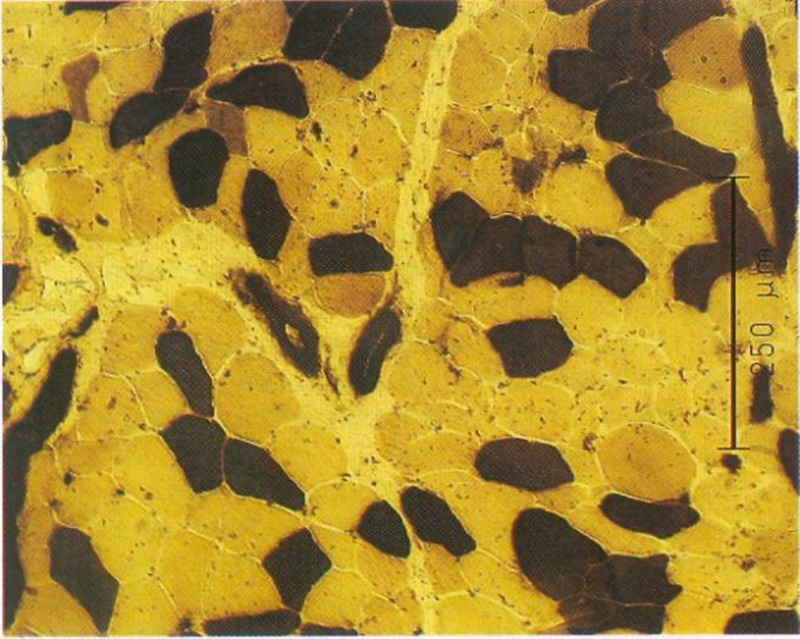
Muskelbiopsie eines spastischen Patienten VOR FES, ATPase Färbung pH 4,3, deutliche Atrophie, unregelmäßige Faserform besonders der Typ I-Fasern, teilweise bindegewebige Septen.
Abb. 26:
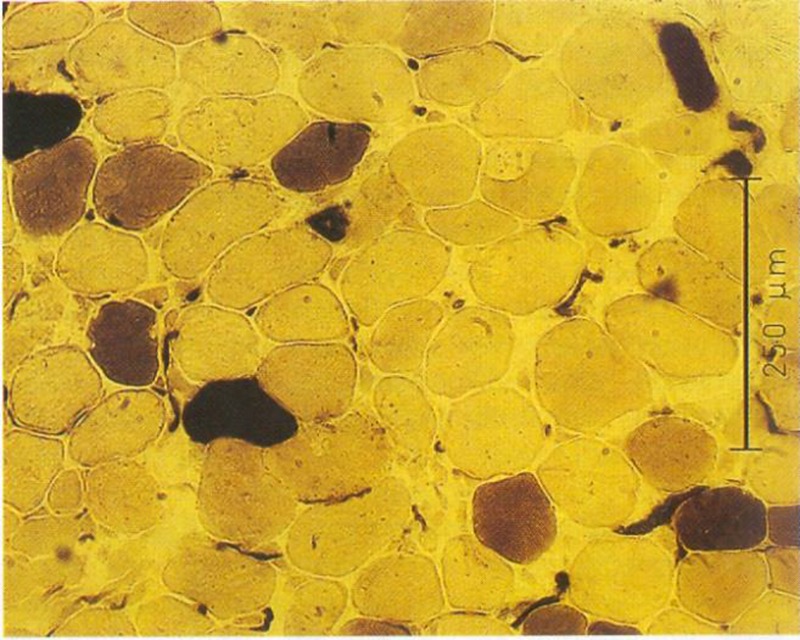
Muskelbiopsie desselben Patienten aus Abb. 25 nach 8 Monaten FES mit deutlicher
Abb. 27:
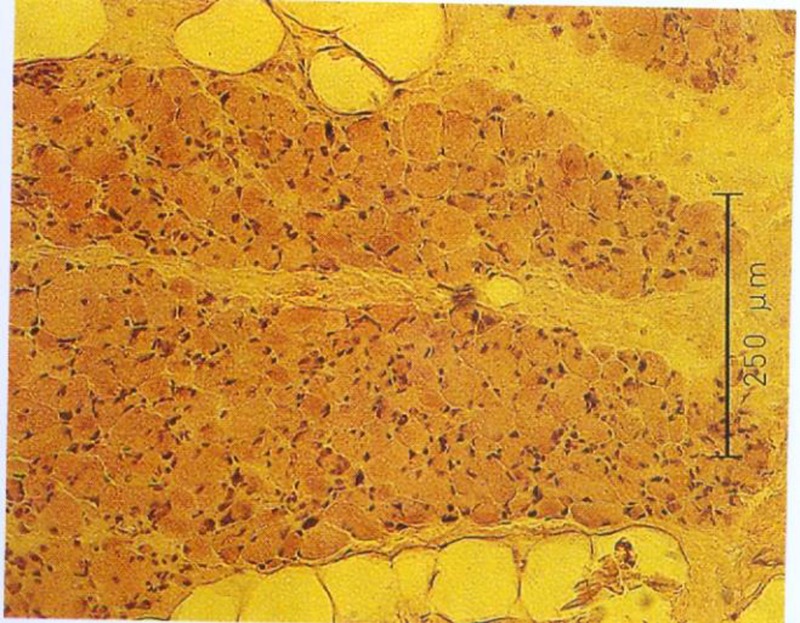
Eines denervierten Patienten vor Trainingsperiode, HE-Färbung, erhebliche Bindegewebsproliferation und Fetteinlagerung, Polymorphie 5-20 µM!
Abb. 28:
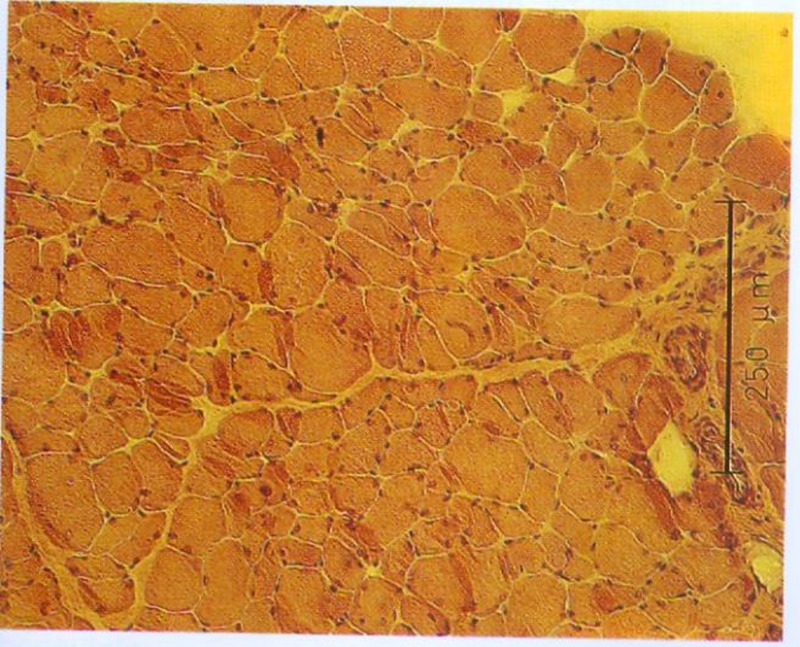
Patienten von Abb. 27 nach 8 Monaten funktioneller Elektro-stimulation. Auffällig die deutliche Fasergrößenzunahme, Abnahme des interstitiellen Bindegewebes und der Fettein-lagerungen.
Tab. Xe 1:
Hautdurchblutung mit 133 Xe Clearance in Mediane und Quartile
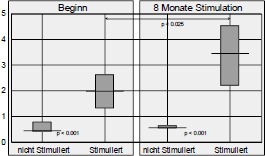 |
Tab. TI 1:
Thallium-201-Szintigraphie der Oberschenkelmuskulatur aller Patienten, N = 14
| VOR Beginn | NACH 8 Monaten | |||
|---|---|---|---|---|
| stimuliert | nicht stimuliert | stimuliert | nicht stimuliert | |
| unt. Quartile | 1,3 | 0,40 | 2,19 | 0,52 |
| Median | 1,89 | 0,44 | 3,45 | 0,56 |
| ob. Quartile | 2,63 | 0,78 | 4,54 | 0,64 |
| Durchbl.Steig. | 4,3 - fach | 6,16 - fach | ||
Tab. IR 1:
Zunahme der Hauttemperatur in Mittelwerten der Mediane (ROI) in Grad C, Spastische Patienten, 0-60 min.
| Minuten | Obersch. stimuliert | Obersch. nicht stim. | Untersch. stimuliert | Untersch nicht stim. |
|---|---|---|---|---|
| sofort | -0,5 | -0,1 | -0,05 | -0,4 |
| 5 | 0,38 | 0,03 | 0,01 | -0,6 |
| 10 | 0,92 | 0,07 | 0,12 | - 0,87 |
| 15 | 1,42 | 0,35 | 0,3 | - 0,42 |
| 20 | 1,58 | 0,55 | 0,42 | - 0,65 |
| 25 | 1,70 | 0,67 | 0,66 | 0,12 |
| 30 | 1,67 | 0,77 | 0,4 | 0,17 |
| 35 | 1,70 | 0,75 | 0,77 | 0,27 |
| 40 | 1,60 | 0,75 | 0,85 | 0,35 |
| 50 | 1,60 | 0,77 | 0,7 | 0,57 |
| 60 | 1,45 | 0,82 | 0,7 | 0,55 |
Tab. 6:
Mittelwert der Kraftmaxima bei unterschiedlicher Stimulationsspannung. Deutlicher Kraft-abfall bei Mitaktivierung der Hamstrings durch höhere Spannungen.
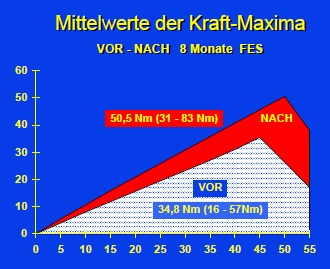 |
Tab. K 3:
Kraft - Spannung - Nach 8 Monaten Stimulation in Nm und Differenzen VOR / NACH, KBW 60°
| Volt | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Patient | li | re | li | re | li | re | li | re | li | re | li | re | li | re | li | re |
| 5 | 0,7 | 0,7 | 3,2 | 1,1 | 11,1 | 4,4 | 21,2 | 7,8 | 29,6 | 12,4 | 35,3 | 16,7 | 40,8 | 17,2 | 40,8 | 19,2 |
| 6 | 0,0 | 0,0 | 9,3 | 7,1 | 25,0 | 32,6 | 49,0 | 63,0 | 49,3 | 63,2 | 49,4 | 64,0 | 73,2 | 78,7 | 83,5 | 83,4 |
| 7 | 1,7 | 0,0 | 21,9 | 6,8 | 32,3 | 17,0 | 47,7 | 29,6 | 62,0 | 40,2 | 66,4 | 54,1 | ||||
| 8 | 9,0 | 10,6 | 20,8 | 22,0 | 27,9 | 26,4 | 29,5 | 27,8 | 31,0 | 28,1 | 38,0 | 36,1 | ||||
| 9 | 0,0 | 0,0 | 2,3 | 2,8 | 9,4 | 15,2 | 20,0 | 29,6 | 29,0 | 36,2 | 31,6 | 39,6 | ||||
| 10 | 3,3 | 0,3 | 13,7 | 20,4 | 36,3 | 25,4 | 51,4 | 27,7 | 67,1 | 45,0 | 65,0 | 48,0 | 67,0 | 54,2 | 67,3 | 61,6 |
| x | 2,21 | 10,95 | 21,92 | 33,69 | 41,09 | 47,01 | 55,18 | 59,64 | ||||||||
| Diff.Nm | - 0,04 | 1,68 | 6,28 | 11,92 | 12,89 | 15,46 | 20,41 | 36,64 | ||||||||
| % | -1,6 | 18,12 | 40,15 | 54,75 | 45,7 | 49,0 | 58,7 | |||||||||
| Sign. der Diff. | n.s. | n.s. | 0,05/n.s. | 0,02/0,01 | 0,05 | 0,05 | n.s. Anzahl | n.s. Anzahl | ||||||||
Tab. 7:
Muskelfasergröße VOR-NACH 8 Monaten FES bei den spastischen Patienten (5-10), deutliche Zunahme der Fasergröße bis 63 µm im Median.
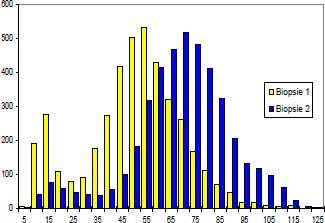 |
Tab. 8:
Muskelfasergröße VOR-NACH 8 Monaten FES bei den denervierten Patienten (1-4); Median NACH: 40 µm.
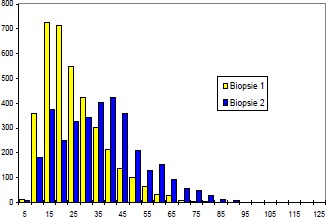 |
Tab. 9:
Muskelfasertypen - Verteilung vor FES bei allen spastischen Patienten
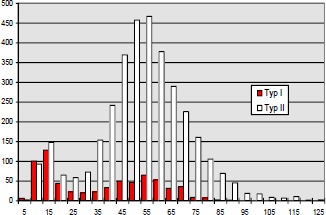 |
Tab. 10:
Muskelfasertypen - Verteilung nach FES bei allen spastischen Patienten
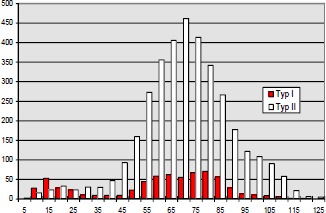 |
Tab. 13:
Fasertypen-Verteilung bei allen denervierten Patienten VOR Training
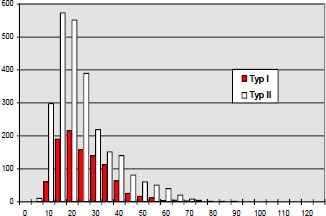 |
Tab. 14:
Fasertypenverteilung nach 8 Monaten FES bei allen denervierten Patienten: Typ II-Faser-Transformation
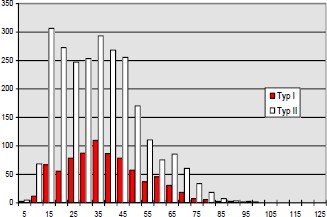 |
Tab. 15:
Adaptierung der Muskelfaser in Faserdicke und Metabolismus je nach mechanischer Zugbelastung bzw. Anzahl der Erregungen pro Tag.
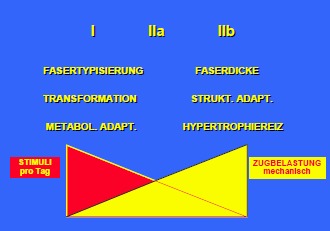 |
Tab. M5:
Geschätzte physiologische Rekrutierung der Muskelfasern pro Tag beim Menschen:
| natürliche Rekrutierung pro Tag | zusätzl. Anzahl der Elektr.Stimuli/ Tag | Stimulations-Training in% der Alltagsbelastung | |
|---|---|---|---|
| I | 300.000-400.000 | + 50.000 | + 15 % |
| IIa | 80-100.000 | + 50.000 | + 50-60 % |
| IIb | 5.000-10.000 | + 50.000 | + >500 % |
Tab. E4:
Spastische Patienten VOR - NACH 8 Monaten FES
| Normwerte | Phos (13,9 ± 4,4 U/g) | PFK (30,0 ± 17,1 U/g) | PK (163 ± 77 U/g) | LDH (170 ± 53 U/g) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| vor | nach | Diff. | vor | nach | Diff. | vor | nach | Diff. | vor | nach | Diff. | |
| Pat.5 | 13,2 | 21,3 | 8,1 | 19,6 | 42,2 | 22,6 | 207 | 643 | 436 | 178 | 272 | 94 |
| Pat.6 | 20,7 | 14,65 | 6,05 | 47,3 | 54,6 | 7,3 | 253 | 326 | 73 | 273 | 342 | 69 |
| Pat.7 | 19,5 | 22,2 | 2,7 | 40,1 | 55,61 | 15,51 | 351 | 370 | 19 | 473 | 499 | 26 |
| Pat.8 | 0,12 | 0,15 | 0,03 | 1,19 | 1,25 | 0,06 | 5,1 | 5,4 | 0,3 | 24,7 | 25,9 | 1,2 |
| Pat.9 | 0,22 | 0,27 | 0,05 | 1,26 | 1,46 | 0,2 | 4,8 | 5,08 | 0,28 | 23,2 | 25,6 | 2,4 |
| Pat.10 | 10,1 | 17,5 | 7,4 | 31 | 35,8 | 4,8 | 182 | 460 | 278 | 235 | 655 | 420 |
| x | 10,64 | 12,7 | 4,1 | 23,4 | 31,8 | 8,4 | 167,1 | 301 | 134,4 | 201,1 | 303,3 | 102,1 |
| ⌖ | ⌖ | ⌖ | ⌖ | ⌖ | ⌖ | ⌖ | ⌖ | ⌖ | ⌖ | ⌖ | ⌖ | |
| SD | 9 | 10,0 | 3,6 | 19,5 | 5,6 | 2,9 | 138,2 | 254 | 181,5 | 169,4 | 252,4 | 160,0 |
Tab. E5:
Denervierte Patienten VOR - NACH 8 Monaten FES
| Normwerte | CS (5,5 +- 2U/g) | Cyt. c. Ox (5,8 +- 3,0 U/g) | HAD (5,4 +- 2U/g) | FUM (18,5 +- 10,9 U/g) | SDH (4,2 +- 1,7 U/g) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| vor | nach | Diff. | vor | nach | Diff. | vor | nach | Diff. | vor | nach | Diff. | vor | nach | Diff. | |
| Pat.1 | 0,7 | 4,8 | 4,1 | 1,8 | 3,9 | 2,1 | 0,9 | 3,9 | 3 | 13,8 | 21,2 | 7,4 | 2,2 | 2,44 | 0,24 |
| Pat.2 | 2,1 | 6.6 | 4,5 | 2,9 | 3,32 | 0,42 | 0,8 | 9,4 | 8,6 | 7,2 | 15,6 | 8,4 | 1,4 | 1,65 | 0,25 |
| Pat.3 | 4,65 | 3,99 | -0,66 | 1,42 | 2,13 | 0,71 | 6,1 | 6,73 | 0,63 | 12,7 | 17,6 | 4,9 | 1,2 | 1,8 | 0,6 |
| Pat.4 | 3,75 | 5,62 | 1,87 | 1,3 | 2,15 | 0,085 | 7,9 | 11,71 | 3,81 | 12,3 | 19,5 | 7,2 | 1,31 | 2,0 | 0,63 |
| x | 2,8 | 5,3 | 2,5 | 1,85 | 2,9 | 0,8 | 3,9 | 7,9 | 4,0 | 11,5 | 18,5 | 7,0 | 1,52 | 2,0 | 0,4 |
| ⌖ | ⌖ | ⌖ | ⌖ | ⌖ | ⌖ | ⌖ | ⌖ | ⌖ | ⌖ | ⌖ | ⌖ | ⌖ | ⌖ | ⌖ | |
| SD | 1,75 | 1,1 | 2,4 | 0,73 | 0,9 | 0,9 | 3,6 | 3,4 | 3,3 | 2,9 | 2,4 | 1,5 | 0,46 | 0,3 | 0,2 |
Acknowledgements
Für Marina, Michael, Mathias und Sabina!
Dank an alle mutigen Patienten für ihre aktive und wegweisende Mitarbeit. Bei allen Mitarbeitern, die mich bei diesen Forschungen technisch, medizinisch und schriftlich unterstützt haben, besonders bei Dr. B. Biber, Dr. A. Kainz, M. Pilecky, J. Lechner, R. Birkelbach, M. Ransmayr, E. Patrman, bedanke ich mich herzlichst. Dank an alle Mitglieder der Wiener FES-Forschungsgruppe: Univ.Prof. Dr. J. Holle, Univ.Prof. Dr. H. Thoma, Univ.Prof. Dr. M. Frey, Univ.Doz. Dr. H. Stöhr, Dr. W. Mayr, Dr. G. Schwanda und die Herren Ing. M. Franke, F. Spitaler, H. Schmalleger, Ch. Schmutterer, Altrichter und Gludovac sowie an Sr. H. Wallner. Herzlichen Dank an Univ. Prof. Dr. A. Mostbeck, Sr. M. Mrazek, Sr. B. Braunschmid, Sr. G. Kordac für die nuklearmedizinischen Untersuchungen. Für die Ausarbeitung der Muskelbiopsien der Probanden und Patienten bedanke ich mich bei Univ. Prof. Dr. H. Gruber, Dr. W. Happak und cand. med. Ch. Neumayer, Universität Wien. Bei Herrn Univ. Prof. Dr. H. Reichmann, Neurologische Klinik der Universität Würzburg, und Mitarbeiter bedanke ich mich herzlichst für die Ausarbeitung der Muskel-Enzyme. Für die computertomographischen Messungen danke ich sehr den Herren Dr. Schurawitzky, Univ. Doz. Dr. W. Kumpan und Univ.Prof. Dr. Pokieser, Universitätsklinik für Radiodiagnostik sowie OA Dr. W. Richter und Univ.Prof. Dr. H. Umek, Zentralröntgeninstitut Wilhelminenspital der Stadt Wien. Für die Kooperation bei der FES-Ergometrie bedanke ich mich bei Univ.Prof. Dr. Dr. L. Prokop sowie Univ.Prof. Dr. N. Bachl, Institut für Sportwissenschaften der Universität Wien. Besonderen Dank an Frau Univ. Prof. Dr. L. Havelec, Institut für medizinische Statistik, Universität Wien, für ihre exakten statistischen Berechnungen und wohlwollende Unterstützung.
References
- [1].Aalam M., Marchlewski W.: Methodische Standardisierung der Thermovision und Thermographie in der Extremitätendiagnostik. Z.f.Phys.Med. 1, 33, 1986. [Google Scholar]
- [2].Acimovic-Janezic R., Gregoric M., Simic V., Strojnik P.: Three years of experiences on the implantable peroneal underknee stimulator, Cell Biology and Clinical Management in Functional Electrostimulation of Neurones and Muscles, Int. Symposium Abano Terme, 1985. [Google Scholar]
- [3].Adrian E.D., Bronk D.W.: The discharge of impulses in motor nerve fibres. Part.2 The frequency of discharge in reflex and voluntary contraction. J.Physiol 67: 119-151, 1929. [PMC free article] [PubMed] [Google Scholar]
- [4].Ammer K.: Industrielle Anwendung der Infrarot-thermographie, Thermologie Österreich 4/4, 1994. [Google Scholar]
- [5].Andrianowa G.G., Kots J.M., Martjanow W.A., Chwilon W.A.: The use of electrostimulation for muscle-power training. USSR Research Institute for Physical Culture, Moscow, 1974. [Google Scholar]
- [6].Appell H.J., Cabric M.: Über den Einsatz der Elektrostimulation zur Muskelkräftigung in Therapie und Rehabilitation, Physikalische Therapie 8, 474-479, 1987. [Google Scholar]
- [7].Appell H.J., Cabric M., Resic A.: Fine structural changes in electrostimulated human skeletal muscle. Evidenz for predominant effects on fast muscle fibers, Eur.J.Appl. Physiol., 1987. [DOI] [PubMed] [Google Scholar]
- [8].Arnold P.B., McVey P., Farrell W.J., Deurloo T.M., Grasso A.R.: Functional Electric Stimulation: Its Efficacy and Safety in Improving Pulmonary Function and Musculoskeletal Fitness. Arch.Phys.Med.-Rehabil.Vol 73: 665, 1992. [PubMed] [Google Scholar]
- [9].Ashley E.A., Laskin J.J., Olenik L.M., Burnham R., Steadward R.D., Cumming D.C., Wheeler G.D.: Evidence of autonomic dysreflexia during functional electrical stimulation in individuals with spinal cord injuries. Intern. Society of Paraplegia 31: 593-605, 1993. [DOI] [PubMed] [Google Scholar]
- [10].Bachl N., Baron R., Tschan H., Mossaheb M., Bumba W., Hildebrand F., Knauf M., Witt M., Albrecht R., Kozlovskaya I., Charitonov N.: Grundlagen der muskulären Leistungsfähigkeit unter Bedingungen der Schwerelosigkeit, Wiener Medizinische Wochenschrift 23/24, 143, 588-610, 1993. [PubMed] [Google Scholar]
- [11].Banfai P., Hortmann G., Karczag A., Kubic S., Wustrow F.,: Results with eight-channel cochlear implants, Adv.Audiol., Vol.2, 1-18, 1984. [Google Scholar]
- [12].Barbeau H, Rossignol S.: Recovery of loxomotion after chronic spinalization in the adult cat., Brain Res., 412: 844-895, 1987. [DOI] [PubMed] [Google Scholar]
- [13].Baeten C, Spaans F, Fluks A: An implanted neuromuscular stimulator for fecal incontinence following previously implanted gracilis muscle. Report of a case. Dis Colon Rectum 31: 134-137. [DOI] [PubMed] [Google Scholar]
- [14].Behmke A.R., Willmon T.L.: Cutaneous diffusion of helium in relation to peripheral blood flow and the absorption of athmospheric nitrogen through the skin. Am.J.Physiol. 131, 627, 1940/1941. [Google Scholar]
- [15].Bell R.D., Mac Dougall J.D., Billeter R., Howald H.: Muscle fiber types and morphometric analysis of skeletal muscle in 6-year-old children. Med. and Sci. in Sports and Exerc. 12, 28-31, 1980. [PubMed] [Google Scholar]
- [16].Beneke R., Brüggemann G.P., Bohdorf K., Ritzdorf W., Hollmann W.: Die Bedeutung der Computertomographie in der Muskelkraftdiagnostik. Dt. Z. Sportmed. 41, 160-168, 1990. [Google Scholar]
- [17].Benton L.A., et al.: Functional Electrical Stimulation. Rancho Los Amigos Hospital, Downey, 1981. [Google Scholar]
- [18].Benton L.K., Baker L., Bowman B., Walter R.: Funktionelle Elektrostimulation, Steinkopff-Verlag, Darmstadt: 1983. [Google Scholar]
- [19].Bergström M, Hultman E: Relaxationtime during intermittent isometric contraction in subjects with different capacity for oxidative work. Acta Physiol Scand 127: 107-110, 1986. [DOI] [PubMed] [Google Scholar]
- [20].Blomstrand E., Ekblom B.: The needle biopsy technique for fibre type determination in human skeletal muscle - a methodological study. Acta Physiol. Scand 116: 437-442, 1982. [DOI] [PubMed] [Google Scholar]
- [21].Bobechko W.P., Herbert M.A., Friedman H.G.: Electrospinal Instrumentation for Scoliosis - Current Status. Orthop. Clin.N.Amer. 10: 917, 1979. [PubMed] [Google Scholar]
- [22].Bochdansky T, Lechner H, Kern H: Messmethodik der Muskelkraft. Z.Physiotherapie 38: 17-24, 1986. [Google Scholar]
- [23].Bochdansky Th., Kern H., Frey M., Holle J., Schwanda G., Stöhr H., Thoma H.: Functional Electric Stimulation of Paraplegic Patients - A Challenge to Rehabilitation. Proc. 1st Vienna International Workshop on Functional Electrostimulation, Viennna, October 1983. [Google Scholar]
- [24].Bochdansky Th.: Die dynamometrische Beurteilung der Muskelkraft bei konzentrischer und exzentrischer Muskelarbeit. Suppl. ÖZPM. 4, 1994. [Google Scholar]
- [25].Boonstra A.M., Va Weerden T.W., Eisma W.H., Pahlplatz V.B.M., Oosterhuis H.J.G.H.: The effect of low-frequency electrical stimulation on denervation atrophy in man. Scand J Rehab Med 19: 127-134, 1987. [PubMed] [Google Scholar]
- [26].Bösiger P., Geser H.M.: A Thermodynamic Model for Thermographic Analysis of Tissue Perfusion and Ist Regulation, Thermology 3/3, 191-198, 1990. [Google Scholar]
- [27].Bowman B., Nelson H., Smith M., Waters R.: Electrode effectiveness during transcutaneous motor stimulation. Arch. Phys. Med. rehabil. 1979. [PubMed] [Google Scholar]
- [28].Bowman B.R., Bajd T.: Influence of electrical stimulation on skeletal muscle spasticity. Proc.Adv.Ext. Control Human Extremities, Dubrovnik: 567-576, 1981. [Google Scholar]
- [29].Bremner L.A., Sloan K.E., Day R.E., Scull E.R., Ackland T.: A clinical exercise system of paraplegics using funtional electrical stimulation. Paraplegia 30: 647-655, 1992. [DOI] [PubMed] [Google Scholar]
- [30].Brindley G.S., Donaldson P.E.K., Falconer M.A., Rushton D.N.: The extent of the region of occipital cortex that when stimulated gives phosphenes fixed in the visual field. J. Physiol., London 225: 57P-58P, 1972. [PubMed] [Google Scholar]
- [31].Brindley G.S.: The finetech-Brindley bladder controller: Notes for surgeons and physicians, Finetech Ltd, Herts., England [Google Scholar]
- [32].Brown J.M.C., Henriksson J, Salmons S: Restoration of fast muscle characteristics following cessation of chronic stimulation: physiological, histochemical and metabolic changes during slow-to-fast transformation. Proc R Soc Lond(Biol) 235: 321-346, 1989. [DOI] [PubMed] [Google Scholar]
- [33].Brown M., Cotter M., Hudlicka O., et al. : The effect of long- term stimulation of fast muscle on their blood flow, metabolism and ability to withstand fatigue. Pflügers Arch. 369: 141-149, 1977. [DOI] [PubMed] [Google Scholar]
- [34].Buchegger A, Nemeth P, Pette D, Reichmann H: Effects of chronic stimulation on the metabolic heterogenity of the fibre population in rabbit tibialis anterior muscle. J.Physiol. 350: 109-119, 1984. [DOI] [PMC free article] [PubMed] [Google Scholar]
- [35].Büll U., Niendorf H.P., Strauer B.E.: Evaluation of myocardial function with the Thallium-201 scintimetry in various diseases of the heart. Eur.J.Nucl.Med. 1(3), 125, 1976. [DOI] [PubMed] [Google Scholar]
- [36].Burke R.E., Edgerton V.R.: Motor Unit Properties and Selective Involvement im Movement. Exercise and Sport Sci. Rev. 3: 31, 1975. [PubMed] [Google Scholar]
- [37].Burke R.E.: Motor units: anatomy, physiology and functional organization. Handbook of Physiology - The Nervous System II, part. 1, (ed) Brooks V.B. Bethesda. MD: American Physiological Society, pp. 345-422, 1981. [Google Scholar]
- [38].Burt R.W.: Leg perfusion evaluated by delayed administration of Thallium-201. Radiology, 151: 219-224 (3), 1984. [DOI] [PubMed] [Google Scholar]
- [39].Bütikofer R., Lawrence P.: Elektrocutaneous nerve stimulation II: Stimulus waveform selection, IEEE Trans. Biomedical Eng, 26: 69-75, 1979. [DOI] [PubMed] [Google Scholar]
- [40].Cabric M., Appell H.J.: Effect of electrical stimulation of high and low frequency on maximum isometric force and some morphological characteristics in men, Int. J. Sports Med. 8, 256-260, 1987. [DOI] [PubMed] [Google Scholar]
- [41].Carpentier A.: Myocardial substitution with a stimulated skeletal muscle: First successful clinical case. The Lancet 1: 1267, 1985. [DOI] [PubMed] [Google Scholar]
- [42].Carpentier A, Chachques J.C.: Myocardial substitution with a stimulated skeletal muscle: first successful clinical case. Lancet 1: 1267, 1985. [DOI] [PubMed] [Google Scholar]
- [43].Carraro U, Catani C, Belluco S, Cantini M, Marchioro L: Slow-like electrostimulation switches on slow myosin in denervated fast muscle. Exp Neurol 94: 537-553, 1986. [DOI] [PubMed] [Google Scholar]
- [44].Carraro U, Catani C, Saggin L, Zrunek M, Szabolcs M, Gruber H, Streinzer W., Mayr W, Thoma H: Isomyosin changes after functional electrostimulation of denervated sheep muscle. Muscle Nerve 11: 1016-1028, 1988. [DOI] [PubMed] [Google Scholar]
- [45].Chimoskey J.E.: Skin blood flow by Xenon-133 disappearance validated by venous occlusion plethysmography. J. Appl. Physio. 32, 3, 1972. [DOI] [PubMed] [Google Scholar]
- [46].Chouard C.H., Meyer B., Chabolle F., Alcaras N., Gegu D.: Sound signal processing, Acta Otolaryngol, Suppl. 411, 95-104, 1986. [PubMed] [Google Scholar]
- [47].Clemente R.F., Matulionis D.H., Barron K.W., Currier D.P.: Effect of motor neuromuscular electrical stimulation on microvascular perfusion of stimulated rat skeletal muscle. Physical Therapy 71: 397-406, 1991. [DOI] [PubMed] [Google Scholar]
- [48].Collins C.C.: A portable seeing aid prototype. J. Biomed. Systems 5: 3-10, 1971. [Google Scholar]
- [49].Cook W.A.: Effects of low frequency stimulation on the monosynaptic reflex (H reflex) in man. Neurology 18: 47-51, 1968. [DOI] [PubMed] [Google Scholar]
- [50].Cotter M, Hudlicka O, Pette D, Staudte H, Vrbova G: Changs of capilary density and enzyme pattern in fast rabbit muscles during long-term stimulation. J Physio (Lond) 230: 34P-35P, 1972. [PubMed] [Google Scholar]
- [51].Crago P.E., Nakai R.J., Chizeck H.J.: Feedback Regulation of Hand Grasp Opening and Contact Force During Stimulation of Paralized Muscle. IEEE Trans.biomed. Eng. 38, 17-28, 1991. [DOI] [PubMed] [Google Scholar]
- [52].Crago P.E.: Closed Loop Control of Force During Electrical Stimulation, IEEE Trans. on BME., 27: 306-312, 1980. [DOI] [PubMed] [Google Scholar]
- [53].Creutzig H., Creutzig A., Alexander K., Hundeshagen H.: Herz- und Skelettmuskelszintigraphie mit Thallium-201, Z. Kardiol. 74, 1, 1985. [PubMed] [Google Scholar]
- [54].Cughlan J.K., Robinson C.E., Newmarch B, Jackson G.: Lower extremitiy bracing in paraplegia - a follow-up study, Paraplegia 18, 25, 1980. [DOI] [PubMed] [Google Scholar]
- [55].Daly M.J., Henry R.E.: Quantitative measurement of skin perfusion with Xenon-133, J.Nucl.Med., 21(2), 156-160, 1987. [PubMed] [Google Scholar]
- [56].Dietz V., Colombo G., Jensen L.: Locomotor activity in spinal man, The Lancet, Vol. 344, Nov. 5, 1260-1263, 1994. [DOI] [PubMed] [Google Scholar]
- [57].Dobelle W.H., Mladejovsky M.G., Girvin J.P.: Artificial vision for the blind: Electrical stimulation of visual cortex offers hope for a functional prosthesis. Science 183: 444-449, 1974. [DOI] [PubMed] [Google Scholar]
- [58].Dobelle W.H., Mladejovsky M.G., Evans J.R., Roberts T.S., Girvin J.P.: Braille Reading by a blind volunteer by visual cortex stimulation. Nature 259: 111-112, 1976. [DOI] [PubMed] [Google Scholar]
- [59].Donselaar Y, Eerbeek O, Kernell D, Verhey B.A.: Fibre sizes and histochemical staining characteristics in normal and chronically stimulated fast muscle of cat. J.Physiol. 382: 237-254 1987. [DOI] [PMC free article] [PubMed] [Google Scholar]
- [60].Dubowitz V: Responses of diseased muscle to electrical and mechanical intervention. Plasticity of the neuromuscular system. Ciba Found Symp, Wiley & Sons, Chichester, pp 240-255, 1988. [DOI] [PubMed] [Google Scholar]
- [61].Duchateau J., Hainaut K.: Effects of immobilization on contractile properties, recruitment and firing rates of human motor units. J.Physiol. 442: 55-65, 1990. [DOI] [PMC free article] [PubMed] [Google Scholar]
- [62].Duchateau J., Hainaut K.: Training effects on muscle fatigue in man. Eur.J.Appl.Physiol. 53: 248-252, 1984 [DOI] [PubMed] [Google Scholar]
- [63].Edel H: Fibel der Elektrodiagnostik und Elektrotherapie. Müller und Steinicke, München: 1983. [Google Scholar]
- [64].Eddington D.K.: Speech discrimination in deaf subjects with cochlear implants, J.Acoust.Soc.Am., Vol. 68, 885-891, 1980. [DOI] [PubMed] [Google Scholar]
- [65].Edgerton V.R., Roy R.R., Hodgson J. A., Gregor R.J., De Guzman C.P.: Recovery of full weight-supporting locomotion of the hindlimbs after complete thoracic spinalization of adult and neonatal cats. In: Wernig A. Plasticity of Motoneuronal Connections. Restorative Neurology Vol. 5 pp 405-418, Elssevier, Amsterdam, 1991. [Google Scholar]
- [66].Eerbeek O, Kernell D, Verhey B.A.: Effects of fast and slow patterns of tonic longterm stimulation on contractile properties of fast muscle in the cat. J.Physiol. 352: 73-90 1984. [DOI] [PMC free article] [PubMed] [Google Scholar]
- [67].Eidelberg E., Walden J.G., Nguyen L.H.: Locomotor control in macaque monkeys. Brain 104: 647-663, 1981. [DOI] [PubMed] [Google Scholar]
- [68].Eisenberg B.R., Brown J.M.C., Salmons S.: Restoration of fast muscle characteristics following cessation of chronic stimulation. The ultrastructure of slow to fast transformation. Cell. Tissue Res. 238: 221-230, 1984. [DOI] [PubMed] [Google Scholar]
- [69].Engel J.M.: 20 Jahre Thermographie des Bewegungsapparates, Thermomed 6/1-3, 3-5, 1990. [Google Scholar]
- [70].Eriksson E., Haggmark T.: Comparison of isometric training and electrical stimulation supplementing isometric muscle training in the recovery after major knee ligament surgery. Am.J.Sports Med. 7: 169-171, 1979. [DOI] [PubMed] [Google Scholar]
- [71].Eriksson E, Haggmark T, Kiessling K.H., Karlsson J: Effect of electrical stimulation on human skeletal muscle. International Journal of Sports Medicine 2: 18-22, 1981. [DOI] [PubMed] [Google Scholar]
- [72].Faghri P., Glaser R.M., Figoni St.: Functional Electrical Stimulation Leg Cycle Ergometer Exercise: Training Effects on Cardiorespiratory Responses of Spinal Cord Injured Subjects at Rest and During Submaximal Exercise. Arch.Phys.Med.Rehabil. 73: 1085-1093, 1992. [PubMed] [Google Scholar]
- [73].Ferguson A.C., Keating J.F., Delargy M.A., Andrews B.J.: Reduction of seating pressure using FES in patients with spinal cord injury. A preliminary report. Intern. Medical Society of Paraplegia 30: 474-478, 1992. [DOI] [PubMed] [Google Scholar]
- [74].Fleury M, Lagasse P: Influence of functional electrical stimulation training on premotor and motor reaction time, Perceptual and Motor Skills 48: 387-393, 1979. [DOI] [PubMed] [Google Scholar]
- [75].Frey M., Thoma H., Holle J., Gruber H., Stöhr H., Wolner E.: Neue Wege zur Mobilisation Querschnittgelähmter durch funktionelle Elektrostimulation über ein implantierbares Gerät. Schreiber HW.(Ed.): Chirurgisches Forum für experimentelle und klinische Forschung. Springer, Berlin-Heidelberg: 259-262, 1983. [Google Scholar]
- [76].Fukunaga T., Ikai M.: A study of training effect on strength per unit cross-section-area of muscle by means of ultrasonic measurement. Int. Z. angew. Physiol. 28: 172, 1970. [DOI] [PubMed] [Google Scholar]
- [77].Franke M., Kern H., Mayr W.: Bewegungsablauf mit 6-Kanal Oberflächenstimulationsgürtel in der Rehabilitation von Paraplegikern. Biomed. Technik, Band 35, Ergänzungsband, 69-70, 1990. [PubMed] [Google Scholar]
- [78].Furman S., Schwedel J.B.: Cardiac pacing with endocavitary electrodes, N. Engl J. Med., 261:943-948, 1959. [DOI] [PubMed] [Google Scholar]
- [79].Galvani A.: De viribus electricitatis in motu musculari; Commentarius de Bononiensi Scientarium et Artium Instituto adque Academia Commentarii 7: 363, 1791. [Google Scholar]
- [80].Garnett R, Stephens J.A.: Changes in the Recruitment threshold of motor units produced by cutaneous stimulation in man. J. Physiol. 311: 463-473, 1979. [DOI] [PMC free article] [PubMed] [Google Scholar]
- [81].Gauthier J.M., Theriault R., Theriault G., Gelinas Y., Simoneau J.: Electrical stimulation-induced changes in skeletal muscle enzymes of men and women, Journal of the American College of Sports Medicine, 1252-1256, 1992. [PubMed] [Google Scholar]
- [82].Gehring P.J.: The interrelationship between Thallium and Potassium in animals. J.Pharmakol Exp. Ther. 155:187-201, 1967. [PubMed] [Google Scholar]
- [83].Gerner H.J., Rauda D.W., Witterstätter K.: Die soziale Situation von Querschnittgelähmten - eine empirische Untersuchung. Rehabilitation 18: 135-149, 1979. [PubMed] [Google Scholar]
- [84].Gerner H.J., Kluger P.: Ateminsuffizienz bei Querschnittlähmung, in Schirmer M.: Querschnittlähmung, Springer Verlag Berlin-Heidelberg, 490-499, 1986. [Google Scholar]
- [85].Gibson J.N., Morrison W.L., Scrimgeour C.M., Smith K., Stoward P.J., Rennie M.J.: Effects of therapeutic percutaneous electrical stimulation of atrophic human quadriceps on muscle composition, protein synthesis and contractile properties. Europ. Journal of Clin. Investigation 19: 206-212, 1989. [DOI] [PubMed] [Google Scholar]
- [86].Girsch W., Koller R., Gruber H., Holle J., Liegl Ch., Losert U., Mayr W., Thoma H.: Histological assessment of nerve lesions caused by epineural electrode application in rat sciatic nerve, Journal of Neurosurgery, Vol. 74, 636-642, April 1991. [DOI] [PubMed] [Google Scholar]
- [87].Glenn W.W.L.: Diaphragm pacing: Present status, Pace 1: 357-370, 1978. [DOI] [PubMed] [Google Scholar]
- [88].Gollnick P.D., Matoba H: The muscle fiber composition of skeletal muscle as a predictor of athletic success, American J. of Sports Med, 12: 212-217, 1984. [DOI] [PubMed] [Google Scholar]
- [89].Gordon T., Stein R.B., Martin T.: Physiological and histochemical changes in human muscle produced by electrical stimulation after spinal cord injury, J Neurol Sci 98, Suppl. 141, 1990. [Google Scholar]
- [90].Gould N., Donnermeyer D., Pope M., Ashigaka I.: Transcutaneous muscle stimulation as a methode to retard disuse atrophy, Clin. Orthop 164, 215-220, 1982. [PubMed] [Google Scholar]
- [91].Gould N., Donnermeyer D., Gammon G.G., Pope M., Ashikaga T.: Transcutaneous muscle stimulation to retard disuse atrophy after open menisectomy. Clinical Orthopedics and Related Research 178: 190-197, 1983. [PubMed] [Google Scholar]
- [92].Gracanin F.: Functional Electrical Stimulation, Chapter in: Krusen’s Handbook in Physical Medicine and Rehabilitation, by Kottke FJ, Stillwell GK, Lehmann JF, Saunders Company: 372-385, 1982. [Google Scholar]
- [93].Granat M.H., Ferguson A., Andrews B.J., Delargy M.: The role of functional electrical stimulation in the rehabilitation of patients with incomplete spinal cord injury - observed benefits during gait studies. Paraplegia 31: 207-215, 1993. [DOI] [PubMed] [Google Scholar]
- [94].Green H.J., Reichmann H., Pette D.: Fibre type specific transformations in the enzyme activity pattern of rat vastus lateralis muscle by prolonged endurance training. Pflügers Arch 399: 216-222, 1983. [DOI] [PubMed] [Google Scholar]
- [95].Gregoric M.V., Valencic V., Zupan A., Klemen A.: Effects of electrical stimulation on muscles of patients with progressive muscular disease. In: Wallinga WH, Boom BK, de Vries J. (eds) Electrophysiological kinesiology. Proceedings of the 7th Congress of the International Society of Electrophysiological Kinesiology. Excerpta Medica, Amsterdam, pp 385-389, 1988. [Google Scholar]
- [96].Greve J.M., Muszkat R., Schmidt B., Chiovatto J., Barros T.E., Batisttella L.R.: Functional electrical stimulation (FES): muscle histochemical analysis. Paraplegia 31: 764-770, 1993. [DOI] [PubMed] [Google Scholar]
- [97].Grillner S: Control of loxomotion in bipeds, tetrapods, and fish. In: Brookhart J.E., Mountcastle V.B., Brooks V.B., Geiger S.R., Handbook of Physiology, Section 1, Vol. 2, Part 2 pp, American Physiological Society, Bethesda: 1127-1236, 1981. [Google Scholar]
- [98].Grimby L., Hannerz J.: Disturbances in Voluntary Recruitment order of Low and High Frequency Motor Units on Blockades of Proprioceptive Afferent Activity. Acta Physiol. Scand. 96: 207, 1976. [DOI] [PubMed] [Google Scholar]
- [99].Gruber H., Frey M., Thoma H., Havel M., Steiner E., Weis S.: Morphological and Biochemical Effects of Chronical Indirect Stimulation of Psoas Muscles. Proc. 1st Vienna International Workshop on Functional Electrostimulation, Vienna, October 1983. [Google Scholar]
- [100].Hannerz J.: Discharge Properties of Motor Units in Relation to Recruitment Order in Voluntary Contraction. Acta Physiol. Scand. 91: 374, 1974. [DOI] [PubMed] [Google Scholar]
- [101].Happak W., Koller R., Girsch W., et al. : Histological examination after epineural electrode application, in Wallinga W., Boom HBK, de Vries J. (eds): Electrophysiological Kinesiology, Excerpta Medica, Amsterdam, pp 75-78, 1988. [Google Scholar]
- [102].Hardy J.D., Söderstrom G.F.: Heat loss from the nude body and peripheral blood flow at temperature from 22-350. J.Nutr. 16, 493, 1938. [Google Scholar]
- [103].Harris J.P., et al.: Skin blood flow measurement with Xenon-133 to predict healing of lower extremity amputations. Aust.N.Z.J. Surg. 56, 413, 1986. [DOI] [PubMed] [Google Scholar]
- [104].Heilig A., Pette D.: Changes in transcriptional activity of chronically stimulated fast-twitch muscle. FEBS Lett. 151: 211-214, 1983. [DOI] [PubMed] [Google Scholar]
- [105].Heilig A., Pette D.: Changes induced in the enzyme activity pattern by electrical stimulation of fast-twitch muscle. In: Pette D. (ed): Plasticity of muscle. De Gruyter, Berlin, pp. 409-420, 1980. [Google Scholar]
- [106].Heilmann C., Müller W., Pette D.: Correlation between ultrastructural and functional changes in sacroplasmic reticulum during chronic stimulation of fast muscle. J. Membr. Biol. 59: 143-149, 1981. [DOI] [PubMed] [Google Scholar]
- [107].Henneman E., Olson C.B.: Relations between structure and function in the design of skeletal muscles. J. Neurophysiol. 28: 581, 1965. [DOI] [PubMed] [Google Scholar]
- [108].Hensel H.: Meßkopf zur Durchblutungsregistrierung an Oberflächen. Arch.Ges.Physiol. 268, 604, 1959. [DOI] [PubMed] [Google Scholar]
- [109].Hochmair-Desoyer I.J.: Entwicklungsstand von auf elektrischer Stimulation beruhenden Innenohrprothesen, Biomedizinische Technik, 34, Heft 7-8, 1989. [DOI] [PubMed] [Google Scholar]
- [110].Hochmair E.S., Hochmair-Desoyer I.J.: Percepts elicited by differenz speech coding strategies, annals of New York academy of Science, Vol. 405, 268-279, 1983. [DOI] [PubMed] [Google Scholar]
- [111].Hochmair I., Hochmair E.: Advances in cochlear implants, Manz Verlag Wien, ISBN 3-85094-4, 1994. [Google Scholar]
- [112].Holle J., Frey M., Gruber H., Kern H., Stöhr H., Thoma H.: Functional electrostimulation of paraplegics (experimental investigations and first clinical experience with an implantable stimulation device). J. Orthopedics 7: 1145-1155, 1984. [DOI] [PubMed] [Google Scholar]
- [113].Holle J., Frey M., Gruber H., Kern H., Stöhr H., Thoma H., Reiner E.: Funktionelle Elektrostimulation: Ein Schrittmacher für Paraplegiker. Münchner Med. Wochenschrift 15: 462-464, 1984. [Google Scholar]
- [114].Holle J., Moritz E., Thoma H., Lischka A.: Die Karussellstimulation, eine neue Methode zur elektrophrenischen Langzeitbeatmung. Wien.klin. Wschr. 86/1: 23-27, 1974. [PubMed] [Google Scholar]
- [115].Holle J., Thoma H., Frey M., Gruber H., Kern H., Schwanda G.: Epineural Electrode Implantation for Electrically induced Mobiliation of Paraplegics. Proc. 1 st Vienna International Workshop on Functional Electrostimulation, Vienna, October 1983. [Google Scholar]
- [116].Holle J., Thoma H., Frey M., Gruber H., Kern H., Schwanda G.: Walking with an implantable stimulation system for paraplegics. Proc. 2nd Internat. Conference on Rehabilitation Engineering, Ottawa, Canada, 551-552, 1984. [Google Scholar]
- [117].Hooker S.: Effects of low- and moderate intensitiv training in spinal cord injuried persons, Med. Sci Sports Exerc., 21: 18-22, 1989. [DOI] [PubMed] [Google Scholar]
- [118].Hooker S., Stephen Ph., Figoni F., Rodgers M., Glaser R.M., Mathews T., Suryaprasad A.G., Gupta S.C.: Physiologic Effects of Electrical Stimulation Leg Cycle Exercise Training in Spinal Cord Injured Persons. Arch.Phys.Med.Rehabil. Vol 73: 470-476, 1992. [PubMed] [Google Scholar]
- [119].Hoppeler H., Hudlicka O., Uhlmann E.: Relationship between mitochondria and oxygen consumption in isolated cat muscles. J Physiol (Lond.) 385: 661-675, 1987. [DOI] [PMC free article] [PubMed] [Google Scholar]
- [120].Hoppeler H.: Der Muskelkater - Schaden an der Skelettmuskulatur. Wander Sport Forum 6: 47-57, [Google Scholar]
- [121].Hoppeler H.: Exercise-induced structural changes of skeletal muscle. Isi Atlas of Science, Biochemistry, 247-255, 1988. [Google Scholar]
- [122].Hoppeler H.: Exercise-induced ultrastructural changes in skeletal muscle. Int.J.Sports Med. 7, 187-204, 1986. [DOI] [PubMed] [Google Scholar]
- [123].Hoppeler H.: The range of mitochondrial adaptation in muscle fibers In: Pette D. (ed) The dynamic state of muscle fibers. De Gruyter, Berlin, pp 567-586, 1990. [Google Scholar]
- [124].Hoshimiya N., Naito A., Yajima M., Handa Y.: A Multichannel FES System for the Restoration of Motor Functions in High Spinal Cord Injury Patients: A Respiration-Controlled System for Multijoint Upper Extremity. IEEE Trans. Biomed. Eng. 36, 754-760, 1989. [DOI] [PubMed] [Google Scholar]
- [125].Hosobuchi Y., Adams J.E., Linchitz R.: Pain relief by electrical stimulation of the central gray matter in humans and its reversal by nalosone. Science 197: 183-186, 1977. [DOI] [PubMed] [Google Scholar]
- [126].Hudlicka O., Aitman T., Heilig A., Leberer E., Tyler K.R., Pette D.: Effects of different patterns of long-term stimulation on blood flow, fuel uptake and enzyme activities in rabbit fast skeletal muscles. Pflügers Arch. 402: 306-311 1984. [DOI] [PubMed] [Google Scholar]
- [127].Hudlicka O., Brown M., Cotter M., Smith M., Vrbova G.: The effect of longterm stimulation of fast muscles on their blood flow, metabolism and ability to withstand fatigue. Pflügers Arch 369: 141-149, 1977. [DOI] [PubMed] [Google Scholar]
- [128].Hudlicka O., Dodd L., Renkin E.M., Gray S.D.: Early changes in fiber profile and capillary density in long-term stimulated muscles. Am J Physiol 243: H528-H535, 1982b. [DOI] [PubMed] [Google Scholar]
- [129].Hudlicka O., Tyler K.R., Srihari T., Heilig A., Pette D.: The effect of different patterns of long-term stimulation on contractile properties and myosin light chains in rabbit fast muscles. Pflügers Arch. 393: 164-170 1982a. [DOI] [PubMed] [Google Scholar]
- [130].Hudlicka O., Tyler K.R.: The effect of long-term high-frequency stimulation on capillary density and fibre types in rabbit fast muscles. J Physiol (Lond) 353: 435-445, 1984. [DOI] [PMC free article] [PubMed] [Google Scholar]
- [131].Hudlicka O., Tyler K.R.: Importance of different patterns of frequency in the development of contractile properties and histochemical characteristics of fast skeletal muscle. J.Phys. (Lond.) Proc. 1980. [Google Scholar]
- [132].Hughes G.B., Bottomy M.B., Jackson C.G., et al. : Myelin and axon degeneration following direct current peripheal nerve stimulation. A Prospective controlled experimental study. Otolaryngol Head Neck Surg. 89: 767-775, 1981. [DOI] [PubMed] [Google Scholar]
- [133].Hultman E., Sjöholm H.: Energy metabolism and contraction force of human skeletal muscle in situ during electrical stimulation. J. Physiol. 345: 525-532, 1983. [DOI] [PMC free article] [PubMed] [Google Scholar]
- [134].Hultman E., Spriet L.L.: Skeletal muscle metabolism, contraction force and glycogen utilization during prolonged electrical stimulation in humans. J. Physiol. 374: 493-501, 1986. [DOI] [PMC free article] [PubMed] [Google Scholar]
- [135].Huxley H.: The mechanism of muscular contraction. Science, 164: 1356-1366, 1969. [PubMed] [Google Scholar]
- [136].Ikai M., Fukunaga T.: A study on training effect on strength per unit cross-sectional area of muscle by means of ultrasonic measurements. Int.Z.angew.-Physiol. 28: 173-180, 1970. [DOI] [PubMed] [Google Scholar]
- [137].Irnich W.: The Fundamental Law of Electrostimulation. Proc. of the 2nd Vienna International Workshop on Functional Electrostimulation. Bioengineering Laboratory, University of Vienna, 1986. [Google Scholar]
- [138].Isakov E., Douglas R., Berns P.: Ambulation using the reciprocation gait orthosis and functional electrical stimulation. Paraplegia 30: 239-245, 1992. [DOI] [PubMed] [Google Scholar]
- [139].Jantsch H., Schuhfried F.: Niederfrequente Ströme zur Diagnostik und Therapie, Maudrich, Wien-München, 1974. [Google Scholar]
- [140].Jonas U., Jones E.A., Tanagho E.A.: Spinal cord versus detrusor stimulation. A comparative study in six acute dogs, Invest. Urol. 13: 171, 1975. [PubMed] [Google Scholar]
- [141].Jonas U., Tanagho E.A.: Studies on vesicourethral reflexes. II. Urethral sphincteric responses to spinal cord stimulation. Invest. Urol. 13: 278, 1976. [PubMed] [Google Scholar]
- [142].Kainz A., Lechner J., Aslan A., Kern H.: Das Ermüdungsverhalten der Muskulatur während der Schwellstromapplikation bei Veränderung von Polarität und Schwellpause. Z.Phys.Med.Baln.Klim. 5: 1985. [Google Scholar]
- [143].Kainz A., Ehn A., Bily W.: Thermographische Objektivierung der Manualtherapie bei Patienten mit Wirbelsäulenbeschwerden (Objective evaluation by thermography of manipulation in patients with spine disorders), Thermologie Österreich 4/4, Heft 1, 30, 1992. [Google Scholar]
- [144].Kainz A., Futuri J., Ammer K.: Niederfrequente Ströme zur Schmerztherapie, ÖZPM 3/3, 87, 1993. [Google Scholar]
- [145].Kern H., Kainz A., Lechner J., Tausch F., Koppelent I., Ransmayr M., Gruber H., Happak W., Straßegger H., Kumpan W., Schurawitzky J., Mayr W., Schwanda G., Stöhr H., Mostbeck A., Reichmann H.: Morphologic and enzymatic changes of the muscles of paraplegics caused by electrical stimulation. Proc. 2nd Vienna International Workshop on Functional Electro-stimulation, Vienna; 105-108, 1986. [Google Scholar]
- [146].Kern H., Kainz A., Lechner J., Tausch F., Mayr W., Franke H., Schmutterer R., Schwanda G., Stöhr H., Kumpan W., Schurawitzky J., Mostbeck A., Gruber H.: Auswirkung elektrisch induzierter Bewegungstherapie. Z.Phys.Med.Baln.Med.Klim. 15: 317-318, 1986. [Google Scholar]
- [147].Kern H., Mitarbeiter: Functional electrostimulation on paraplegic patients. 3 Abstracts, Artificial Organs, Vol 8: 378, 385, 392, 1984. [Google Scholar]
- [148].Kern H., Aslan A., Frey M., Holle J., Mayr W., Schwanda G., Stöhr H., Stranzky G., Thoma H.: Funktionelle Elektrostimulation querschnittgelähmter Patienten. Z.Phys.Med.Baln.Med.Klim. 5, 1985. [Google Scholar]
- [149].Kern H., Bochdansky Th., Frey M., Holle J., Schwanda G., Stöhr H., Thoma H.: Muscle Training of Paraplegic Patients by FES Device. Proc. 1st Vienna International Workshop on Functional Electrostimulation, Vienna October 1983. [Google Scholar]
- [150].Kern H., Frey M., Holle J., Schwanda G., Stöhr H., Thoma H.: Funktionelle Elektrostimulation querschnittgelähmter Patienten 1 Jahr praktische Anwendung, Erfolge der Patienten und Erfahrungen. Z.f. Orthopädie 1: 123, 1-12, 1985. [DOI] [PubMed] [Google Scholar]
- [151].Kern H., Mayr W., Frey M., Holle J., Schwanda G., Stöhr H., Thoma H.: Elektrostimulation bei vollständig gelähmter Muskulatur. Praktische Orthopädie 16: 441-456, 1984. [Google Scholar]
- [152].Kern H., Mostbeck A., Kainz A., Lechner J., Tausch F.: Der Nuklearmedizinische und thermographische Nachweis der Durchblutungsförderung in Haut und Muskulatur denervierter und spastisch gelähmter Patienten mittels Funktioneller Elektrostimulation. Wiener medizinische Wochenschrift, Sonderheft 138: 51-57, 1988. [Google Scholar]
- [153].Kern H., Wagner M.: Kapsel-Band-Verletzungen des Kniegelenkes, Wilhelm-Maudrich-Verlag; Wien, 1981. [Google Scholar]
- [154].Kern H., Wagner M.: Kapselbandverletzungen des Kniegelenkes - Neue Aspekte der physikalischen Therapie in Zusammenarbeit mit der Traumatologie Z.f.Phys.Med., 1, 72-74, 1982. [Google Scholar]
- [155].Kern H.: Elektrostimulation im Sport und Rehabilitation, Dissertation, Universität Wien, 1994. [Google Scholar]
- [156].Kernell D., Eerbeek O., Verhey B.A., Donselaar Y.: Effects of physiological amounts of high- and low-rate chronic stimulation on fast-twitch muscle of the cat hindlimb: I. Speed- and force related properties. J Neurophysiol 58: 598-613, 1987a. [DOI] [PubMed] [Google Scholar]
- [157].Kernell D., Eerbeek O.: Physiological effects of different patterns of chronic stimulation on muscle properties. In: Rose FC, Jones R. (eds) Neuromuscular stimulation. Demos, New York, pp 193-200, 1989. [Google Scholar]
- [158].Kim J.H., Mannelidis E.E., Glenn W.W.L., Kaneyniki T.: Diaphragm Pacing Histopathologic Changes in the Phrenic Nerve following Long-term Electrical Stimulation. J.Thorac. Cardiovasc. Surg. 72: 602, 1976. [PubMed] [Google Scholar]
- [159].Kjellmer I., Lindberg I., Preovsky I., Tonnessen H.: The relatio between blood flow in an isolated muscle measured with Xenon-133 clearance and the direct recording technique. Acta Physiol.Scand. 69, 69, 1967. [DOI] [PubMed] [Google Scholar]
- [160].Kobetic R., Carroll S.G., Marsolais E.B.: Paraplegic stair climbing assisted by electrical stimulation in Proc. 39th Annu Conf.Eng.Med.Biol., Chevy Chase, 256, 1986. [Google Scholar]
- [161].Koller R., Girsch W., Liegl Ch., Gruber H., Holle J., Losert U., Mayr W., Thoma H.: Long-term results of nervous tissue alterations caused by epineurial electrode application: An experimental study in rat sciatic nerve. Pacing and Clin.Electrophysiology, Vol. 15, No 1, 108-115, January 1992. [DOI] [PubMed] [Google Scholar]
- [162].Komi P.V., Rauramaa R., Vihko V., Viitasalo J.T.: Effect of isometric strength training on mechanical, electrical, and metabolic aspects of muscle function. Europ. J.Appl. Physio. 40: 45, 1978. [DOI] [PubMed] [Google Scholar]
- [163].Kots Y.M.: Canadian-soviet exchange symposium on electrostimulation of skeletal muscles, Concordia University, 1977. [Google Scholar]
- [164].Kots Y.M., Chilon V.A.: The training of muscular power by method of electrical stimulation, State Central Institute of Physical Culture, Moscow, 1975. [Google Scholar]
- [165].Kralj A., Bajd T., Turk R., Krajnik J., Benko H.: Gait Restoration in Paraplegic Patients: A Feasibility Demonstration using Multichannel Surface FES. J. of Rehabilitation R & D: 20, 3-20, 1983. [PubMed] [Google Scholar]
- [166].Kralj A.R., Bajd T.,: Functional Electrical Stimulation: Standing and Walking after Spinal Cord Injury., CRC Press, Boca Raton, 1989. [Google Scholar]
- [167].Krauss J.C., Robergs R.A., Depaepe J.L., Kopriva L.M., Aisenbury J.A., Anderson M.A., Lange E.K.: Effects of electrical stimulation and upper body training after spinal cord injury. Official Journal of the American College of Sports Medicine, 1054-1061, 1992. [PubMed] [Google Scholar]
- [168].Kristjan T., Ragnarsson M.D.: Functional electrical stimulation and suppression of spasticity following spinal cord injury. Bull.N.Y. Acad.Med. Vol 68, N. 2: 351-364. [PMC free article] [PubMed] [Google Scholar]
- [169].Lake D.A.: Neuromuscular Electrical Stimulation. An Overview and its Application in the Treatment of Sports Injuries. Sports Medicine 13(5): 320-336, 1992. [DOI] [PubMed] [Google Scholar]
- [170].Larsen B.: On the pathogenesis of bedsores. Scand.J.Plast.Reconstr. Surg. 13: 347-350, (7), 1979. [DOI] [PubMed] [Google Scholar]
- [171].Lechner H., Bochdansky T., Kern H.: Kraftmessung und Kniestreckung. Österr. J.f. Sportmedizin 4:11-25, 1983. [Google Scholar]
- [172].Lechner J., Kainz A., Ehn H., Kern H.: Eignen sich “Hochvolt”-Impulse zur Muskelstimulation? Z Phys-Med Baln Med Klim, 5, 1985. [Google Scholar]
- [173].Lechner J., Kainz A., Mayr W., Schwanda G., Kern H.: Einfluß der Elektrodengröße auf die Kraftentwicklung des M. quadriceps femoris. Z.Phys.Med.Baln.Med.-Klim., 5, 1985. [Google Scholar]
- [174].Lenman A.J., Tulley F.M., Vrbova G., Dimitrijevic M.R., Towle J.A.: Muscle fatigue in some neurological disorders, Muscle Nerve 12, 938-942, 1989. [DOI] [PubMed] [Google Scholar]
- [175].Levy M., Kushnir T., Mizrahi J., Itzchak Y: In Vivo 31P NMR Studies of Paraplegics’ Muscles Activated by Functional Electrical Stimulation. 53-58, 1993. [DOI] [PubMed] [Google Scholar]
- [176].Liberson W.T., Holmquest H.J., Scott D., Dow A. Functional electrotherapy stimulation of the peroneal nerve synchronized with the swing phase of the gait in hemiplegiec patients, Arch.Phys.Med.Rehabil. 42, ICH, 1961. [PubMed] [Google Scholar]
- [177].Liddell E.G.T., Sherrington C.S.: Recruitement and some other features of reflex inhibition. Proc. Roy. Soc. Med. 97: 488, 1925. [Google Scholar]
- [178].Lloyd T.H., De Domenico, Strauss G.R., Singer K.: A review of the use of eletromotor stimulation in human muscles. Australian Journal of Physiotherapy, 18-29, 1986. [DOI] [PubMed] [Google Scholar]
- [179].Lomo T., Gundersen K., Hennig R., Westgaard R.: The role of impulse patterns in maintaining and regulating contractile properties in intact and chronically denervated and stimulated rat skeletal muscles. In: Eccles J.C., Dimitrijevic M.R. (eds): Recent achievements in restorative neurology. 1 Upper motor neuron functions and dysfunctions. Karger, Basel, pp. 249-262, 1985. [Google Scholar]
- [180].Lomo T., Westgaard R.H., Dahl H.A.: Contractile properties of muscle: control by pattern of muscle activity in the rat. Proc. R. Soc. Lond. (Biol) 187: 99-103, 1974. [DOI] [PubMed] [Google Scholar]
- [181].Lomo T., Westgaard R.H., Engebretsen L.: Different stimulation patterns affect contractile properties of denervated rat soleus muscles. In: Pette D. (ed) Plasticity of muscle. De Gruyter, Berlin, pp. 297-309, 1980. [Google Scholar]
- [182].Lomo T., Westgaard R.H., Engebretsen L.: Different stimulation patterns affect contractile properties of denervated rat soleus muscles. In: Pette D. (ed) Plasticity of muscle. De Gruyter, Berlin, pp. 297-309, 1980. [Google Scholar]
- [183].Lovely R.G., Gregor R.J., Roy R.R., Edgerton V.R.: Effects of training on the recovery of full weight-bearing stepping in the spinal adult cat. Exp.Neurol. 92: 421-435, 1986. [DOI] [PubMed] [Google Scholar]
- [184].Macoviak J.: Electrical conditioning of in situ skeletal muscle for replacement of myocardium, J.Surg.Res. 32: 429, 1982. [DOI] [PubMed] [Google Scholar]
- [185].Madersbacher H., Fischer H., Ebner A.: Anterior sacral root stimulator (Brindley): Experiences especially in women with neurogenic urinary incontinence, Neurology & Urodynamics, 7, 593-601, 1988. [Google Scholar]
- [186].Magyarosy I, Schnizer W: Muskeltraining durch Elektrostimulation. Fortschritt Med. 108: 121-124, 1990. [PubMed] [Google Scholar]
- [187].Maier A, Gambke B, Pette D.: Degenerationregeneration as a mechanism contribution to the fast to slow conversion of chronically stimulated fast-twitch rabbit muscle. Cell Tissue Res 244: 635-643, 1986. [DOI] [PubMed] [Google Scholar]
- [188].Malezic M., Krajnik J., Stanic U., Gros N., Acimovic-Janezic R., Pirnat P., Stopar M., Kljajic M.: Long-term effects of multichannel stimulation on pathological gait. Proc.Symp. on External Control of Human Extremities, Dubrovnik, 409-419, 1981. [Google Scholar]
- [189].Marsolais E.B., Mortimer J.T., Peckham P.H.: Alteration in the force and fatigability of skeletal muscle in quadriplegic humans following exercise induced by chronic electrical stimulation. Clin. Orthop. and Rel.Res. 114: 326-334, 1976. [PubMed] [Google Scholar]
- [190].Marsolais E.B., Kobetic R.: Implantation techniques and experience with percoulaneaus intramuscular eletrodes in the lewer extremities, J. Rehabil. Res.Dev., 23, 1, 1986. [PubMed] [Google Scholar]
- [191].Massey B.H., Nelson R.C., Sharkey B.C., et al. : Effects of high frequency electrical stimulation on the size and strength of skeletal muscle. J.Sports Med.Phys. Fitness 5: 136-144, 1965. [PubMed] [Google Scholar]
- [192].Massey B.H.: The effect of involuntary training with high frequency electrical stimulation upon strengh and muscle size. 11th Annual Meeting of the American College of Sportsmedicine, Hollywood 1964. [Google Scholar]
- [193].Mayer R.F., Burke R.E., et al. : The effect of spinal cord transaction on motor units in cat medial gastrocnemius muscle. Muscle Nerve 7: 23-30, 1984. [DOI] [PubMed] [Google Scholar]
- [194].Mayr W., Frey M., Gruber H., Kern H., Schwanda G., Stöhr H., Thoma H.: Functionally stimulated psoas muscle as a power source for implanted systems - in vitro modeling. Proc. 2nd Vienna International Workshop on Functional Electrostimulation, Vienna, 235-238, 1986. [Google Scholar]
- [195].Mayr W., Burian K., Carraro U., Gruber H., Kern H., Streinzer W., Szabolcs M., Thoma H., Zrunek M.: Functional electrical stimulation (FES) of denervated muscles, an experimental study on posterior cricoarytenoid muscle (PCM) of sheep. 32nd Annual Meeting of American Society for Artificial, International Organs, Anaheim, California, 1986. Artificial Organs, Raven Press, in Druck. [Google Scholar]
- [196].Mayr W., Frey M., Holle J., Schwanda G., Stöhr H., Thoma H.: Technical training aids for paraplegics using an implantable stimulation device. Life Support Systems W.B. Saunders Company, Vol 2: 41, 1984. [Google Scholar]
- [197].Mayr W., Kern H., Kainz A., Krausler S., Lechner J., Schwanda G., Stöhr H., Thoma H.: Gradient-Electrodes for improved effectiveness and selectivity of transcutaneous electrical stimulation. Proc. of Intern. Symposium on Rehab. Abano Terme, Italien, 1985. [Google Scholar]
- [198].Mayr W.: Reaktivierung von gelähmten Muskeln durch Elektrostimulation mit Implantaten. Dissertation, Techn. Universität Wien., 1992. [Google Scholar]
- [199].McDougall J.D., Elder G.C., Sale D.G., Moroz J.R., Sutton J.R.: Effects of strength training and immobilization on human muscle fibers. European Journal of Applied Physiology 43: 25-34, 1980. [DOI] [PubMed] [Google Scholar]
- [200].McKillop J.D.: Thallium-201 scintigraphy (medical progress). West.J.Med., 133, 26-43 (6), 1980. [PMC free article] [PubMed] [Google Scholar]
- [201].McKillop J.H., Bessent R.G., Murray R.G., et al.: A quantitative approach to the analysis of the normal Thallium-201 myocardial image. Eur.J.Nucl.Med. 3(4), 223, 1978. [DOI] [PubMed] [Google Scholar]
- [202].McNeal D.R.: 2000 Years of electrical stimulation, Functional Electrical Stimulation, Marcel Dekker Inc., N.Y., ISBN 0-8247-6632-6, 3-35, 1977. [Google Scholar]
- [203].Melzack R., Wall P.D.: Pain mechanisms: A new theory, Science 150, 971-979, 1965. [DOI] [PubMed] [Google Scholar]
- [204].Merletti R., Acimovic R., Grobelnik S., Cvilak G.: Multichannel functional electrical stimulation of the upper extremity in hemiplegic patients - A feasibility Study. Arch.Phys.Med.Rehabil: 56, 507, 1975. [PubMed] [Google Scholar]
- [205].Merletti R., Zelaschi F., Latella D., Galli M, Angeli S., Belluci-Sessa A.M.: A control study of muscle force recovery in hemiparetic patients during treatment with functional electrical stimulation. Scand.J.Rehab.Med. 10: 147-154, 1978. [PubMed] [Google Scholar]
- [206].Merzenich M.M.: Cochlear implant device, Cochlear Implants, Raven Press, New York, 121-129, 1985. [Google Scholar]
- [207].Miller C., Thepaut-Mathieu C.: Comparison d’entrainements effectues sous electrostimulation et par contraction volontaire: rendement et adaptations physiologiques. Science et Motricite 11: 16-27, 1990. [Google Scholar]
- [208].Milner-Brown H.S., Stein R.B., Yemm R.: Changes in Firing Rate of Human Motor Units During Linearly Changing Voluntary Contractions. J. Physiol. 230: 371-390, 1973. [DOI] [PMC free article] [PubMed] [Google Scholar]
- [209].Milner-Brown H.S., Stein R.B., Lee R.G.: Synchronization of human motor units: possible roles of exercize and supraspinal reflexes. Electroencephalography and Clinical Neurophysiology 38: 245-254, 1975. [DOI] [PubMed] [Google Scholar]
- [210].Moore W.S.: Determination of amputation level measurment of skin blood flow with Xenon-133, Arch.-Surg. Vol. 107, 1973. [DOI] [PubMed] [Google Scholar]
- [211].Morrissey M.C.: Electromyostimulation from a clinical perspective. Sports Medicine 6: 29-41, 1988. [DOI] [PubMed] [Google Scholar]
- [212].Mostbeck A.: Durchblutungsmessung mit Xenon 133 und Thalium 201 - Methodik und klinische Wertigkeit, persönliche Mitteilung; 1994. [Google Scholar]
- [213].Mostbeck A.: Die Durchblutung der belasteten Fußsohle, persönliche Mitteilung, 1994. [Google Scholar]
- [214].Müller E.A: Das Arbeitsmaximum bei statischer Halte-arbeit. Arbeitsphysiologie 5: 605, 1932. [Google Scholar]
- [215].Müller R.G., Green A.T., Moussavi R.S., Carson P.J., Weiner M.W.: Excessive muscular fatigue in patients with spastic paraparesis. Neurology 40:1271-1274,1990 [DOI] [PubMed] [Google Scholar]
- [216].Munsat T.L., McNeal D., Waters R.: Effects of nerve stimulation on human muscle. Arch Neurol 33: 608-617, 1976. [DOI] [PubMed] [Google Scholar]
- [217].Nashold B.S., jr, Friedman H., Glenn J.F., Grimes J.H., Barry W.F., Avery R.: Electromicturition in paraplegia. Archives of Surgery 104: 195-202, 1972. [DOI] [PubMed] [Google Scholar]
- [218].Nathan R.H.: Fatigue of electrically stimulated Muscle. Proc. 1st Vienna International Workshop on Functional Electrostimulation, Vienna, Oct. 1983. [Google Scholar]
- [219].Nathan R.H.: Electrostimulation of the Upper Limb: Programmed Hand Function. Proceed. 2nd Vienna Int. Workshop on Functional Electrical Stimulation, Department of Biomedical Engineering, pp. 109-115, 1986. [Google Scholar]
- [220].Nikolakis M., Kainz A.: Thermographie bei sympathischer Reflexdystrophie, Thermologie Österreich, Heft 2, 55, 1992. [Google Scholar]
- [221].Nix W.A.: Zum Wandel der motorischen Einheiten bei Änderung des Aktivitätsmusters durch elektrische Reizung - Elektrostimulation und ihre klinischen Einsatzmöglichkeiten. Fortschr. Neurol.Psychiat. 57: 94-106, 1989. [DOI] [PubMed] [Google Scholar]
- [222].Nix W.A.: The plasticity of motor units in regard to electrically imposed activity patterns- electrical stimulation and its possible clinical application. Fortschr.Neurol.Psychiat. 57: 94-106, 1989. [DOI] [PubMed] [Google Scholar]
- [223].Nöcker J.: Physiologie der Leibesübungen. Enke-Verlag, Stuttgart: 1976. [Google Scholar]
- [224].Nowakowska A.: Influence of experimental training by electric current stimulation of skeletal muscle. Acta physiol. pol. 12: 32, 1962. [PubMed] [Google Scholar]
- [225].Pacy P.J., Hesp R., Halliday D.A., Katz D., Cameron G., Reeve J.: Muscle and bone in paraplegic patients, and the effect of functional electrical stimulation. Clin.Science 75: 481-487, 1988. [DOI] [PubMed] [Google Scholar]
- [226].Paeslack V.: Modell “Tetraplegie” Extrem- und Grenzfall körperlicher Behinderung und ihre Kompensation durch technische Hilfen. Proc. Workshop “Raumfahrttechnologie für Behinderte”, Gießen, Dezember: 1982. [Google Scholar]
- [227].Paeslack V., Schlüter H.: Physiotherapie in der Rehabilitation Querschnittgelähmter. Springer-Verlag; Berlin, Heidelberg, New York, 1980. [Google Scholar]
- [228].Papp M.D.: Experimental use of intrcostal muscle flaps for repair of induced cardiac defects, J.Thorac. Cardiovasc.Surg. 90: 261, 1985. [PubMed] [Google Scholar]
- [229].Partsch H.: Telethermographischer Nachweis der autonomen Neuropathie beim Mal perforant du pied. In Engel J.M. (Hrsg): Thermographie-Fachberichte 4, Baden-Baden: pp 1-2. [Google Scholar]
- [230].Partsch H., Mostbeck A.: Beeinflussung der Fußdurchblutung durch Lageänderung. Hrsg. Ehringer H., Betz E., Bollinger A., Deutsch E. S 377, Witzstrock, Baden-Baden-Köln-New York, 1979. [Google Scholar]
- [231].Peckham P.H., Marsolais E.B., Mortimer J.T.: Intramuscular stimulation: applications to upper extremity orthotics. Proc. of 4th Annual Meeting Biomed. Engn. Soc., 1973. [Google Scholar]
- [232].Peckham P.H., Mortimer J.T., Marsolais E.B.: Alteration in the force and fatiguability of skeletal muscle in quadriplegic humans following exercise induced by chronic electrical stimulation. Clin Orthop 114: 326-334, 1975. [PubMed] [Google Scholar]
- [233].Peckham P.H.: Control of Contraction Strength of Electrically Stimulated Muscle by Pulse Width and Frequency Modulation, Eng.Med.Biol., 18: 116, 1976. [Google Scholar]
- [234].Peckham P.H., Creasey G.H.: Neural prostheses: clinical application of functional electrical stimulation in spinal cord injury. Paraplegia 30: 96-101, 1992. [DOI] [PubMed] [Google Scholar]
- [235].Petrofsky J.S., Phillips C.A.: The Influence of Recruitment Order Muscle in Cat, Medical and Biol. Engr. and Computing, 18: 381-390, 1980. [DOI] [PubMed] [Google Scholar]
- [236].Petrofsky J.S., Phillips C.A.: Influence of Temperature, Initial Length and Recriutment Order on the Velocity of Contraction of Skeletal Muscle in the Cat., J. Biomechanics, 14: 297-306, 1981. [DOI] [PubMed] [Google Scholar]
- [237].Petrofsky J.S., Phillips C.A.: Computer Controlled Walking in the Paralyzed Individual. J. Neuro. and Ortho. Surg., 4: 153-164, 1983. [Google Scholar]
- [238].Petrofsky J.S., Phillips C.A.: Active Physical Therapy: A Modern Approach for Rehabilitation of the Disabled. J. Neuro. and Ortho. Surg., 4 165-173, 1983. [Google Scholar]
- [239].Petrofsky J.S., Smith J.B.: Physiologic Costs of Computer-Controlled Walking in Persons with Paraplegia Using a Reciprocating-Gait Orthosis, Arch.Phys.Med.Rehabil, 72: 890-896, 1991. [DOI] [PubMed] [Google Scholar]
- [240].Petrofsky J.S., Stacy R.: The effect of training on endurance and the cardiovascular responses of individuals with paraplegia during dynamic exercise induced by functional electrical stimulation, Eur.Appl.Physiol, 64: 487-492, 1992. [DOI] [PubMed] [Google Scholar]
- [241].Pette D., Vrbova G.: Invited review: neural control of phenotypic expression in mammalian muscle fibres, Muscle Nerve, 8: 676-689, 1985. [DOI] [PubMed] [Google Scholar]
- [242].Pette D.: Activity-induced fast to slow transitions in mammalian muscle. Medicine and Science in Sports and Exercise. Vol. 16, No.6, pp. 517-528, 1984. [PubMed] [Google Scholar]
- [243].Pette D.: Skeletal Muscle Adaptation in Response to Chronic Stimulation. In: Electrical Stimulation and Neuromuscular Disorders. Ed. by Nix W.A., Vrbova G. Springer-Verlag, Berlin, 1986. [Google Scholar]
- [244].Pollack S.F., et al. : Aerobic training effects of electrically induced lower extremity exercises in spinal cord injured people. Arch.Phys.Med.Rehab 70: 214-219, 1989. [PubMed] [Google Scholar]
- [245].Pongrel A., Yen C.K., Tylor R.: Thermography in Assessment of the Vascularity of Soft Tissue Flaps, Thermology 3/3, 187-190, 1990. [Google Scholar]
- [246].Prewitt U., Salafski B.: Effect of cross innervation on biochemical characteristics of skeletal muscles. Amer.J. Physiol. 213: 295, 1967. [DOI] [PubMed] [Google Scholar]
- [247].Rabischong E., Ohanna F.: Effects of functional electrical stimulation (FES) on evoked muscular output in paraplegic quadriceps muscle. Intern. Medical Society of Paraplegia 30: 467-473, 1992. [DOI] [PubMed] [Google Scholar]
- [248].Rabischong P.J., Woloszko F.J., Micalle P., Saint-Pierre B., Gilbert B., Benezech J., Graille J.: Intrafascicular Nerve Stimulation to Restore Locomotion in Paraplegics. Proc. 1st Vienna International Workshop on Functional Electrostimulation, Vienna, October 1983. [Google Scholar]
- [249].Ragnarsson K.T., Pollack S., et al. : Clinical evaluation of computerized electrical stimulation after spinal cord injury: A multicenter pilot studie. Arch.Phys.Med.Rehab. 69: 272-277, 1988. [PubMed] [Google Scholar]
- [250].Ragnarsson K.T.: FES und Suppresion of spastic following spinal carol injury, Vol. 68, Nr. 2, in Bree N.Y., Acord.Med., 1989. [Google Scholar]
- [251].Rebersek S., Vodovnik L., Gros N., Stefanovska A., Acimovic R.: Electrotherapy of spastic muscles in hemiplegia. Advances Ext. Control Human Extremities, ETAN, Belgrade, 217-228, 1981. [Google Scholar]
- [252].Reichmann H., Green H.J., Pette D.: Single fiber response to a heavy training protocol in rat vastus lateralis muscle. Medicine and science in Sports and Exercise Vol 16, N. 2, Abstract Book: American College of Sports Medicine, 144, 1984. [Google Scholar]
- [253].Reichmann H., Hoppeler H., Mathieu-Costello L., Von Bergen F., Pette D.: Biochemical and ultrastrucutral changes of skeletal muscle mitochondria after chronic electrical stimulation in rabbits. Pflügers Arch 404: 1-9, 1985. [DOI] [PubMed] [Google Scholar]
- [254].Reichmann H., Pette D.: Enzyme activities and activity profiles in muscle fibers of dystrophic, immaturenormal, and adult-normal bl6 mice. Muscle & Nerve 7: 121-126, 1984. [DOI] [PubMed] [Google Scholar]
- [255].Reichmann H., Pette D.: A comparative microphotometric st.udy of succinate dehydrogenase acitivty levels in type I, IIa and IIb fibres of mammalian and human muscles. Histochemistry 74: 27-41, 1982. [DOI] [PubMed] [Google Scholar]
- [256].Reichmann H., Pette D.: Biochemische Effekte indirekter Dauerstimulation auf Muskelfaserpopulationen. in Seitz D, Vogel P. (Hrsg.): Verhandlungen der deutschen Gesellschaft für Neurologie Band 2, Springer; Verlag Heidelberg, 824-828, 1983. [Google Scholar]
- [257].Reichmann H., Srihari T., Pette D.: Ipsi- and contralateral fibre transformation by crossreinnervation. A principle of symmetry. Pflügers Arch. 397: 202-208, 1983. [DOI] [PubMed] [Google Scholar]
- [258].Reid N.: London and Edinburgh Monthly J. Med. Sc. 1:320, 1841. [Google Scholar]
- [259].Richter H.: Ausgewählte sportmethodische Gesichtspunkte beim Sport mit Querschnittgelähmten. Med. und Sport 21: 377-378, 1981. [Google Scholar]
- [260].Riso R.R., Ignagni A.R., Keith M.W.: Cognitive Feedback for Use with FES Upper Extremity Neuroprostheses, IEEE Trans. Biomed. Eng, 38, 29-38, 1991. [DOI] [PubMed] [Google Scholar]
- [261].Rosenkranz D., Fenzel G., Lack W., Lipp W., Losert U., Thoma H.: Histologische Untersuchungen von Nerven an Elektrodenanschlußstellen. Proc. Der 5. Jahrestagung der Österr. Gesellschaft für Biomed Technik, Wien, Juni 1980. [Google Scholar]
- [262].Rosenkranz D., Fenzl G., Holle J., et al. : Influence of longterm low direct current on rat ischiatic nerves. Appl Neurophysiol 49: 42-52, 1986. [DOI] [PubMed] [Google Scholar]
- [263].Sabo A.: Diplomarbeit, Inst.f.Sport- und Leistungs-physiologie., Universität Wien, 1987. [Google Scholar]
- [264].Salmons S., Sreter F.A.: Significance of impulse activity in the transformation of skeletal muscle type. Nature 263: 30-34, 1976. [DOI] [PubMed] [Google Scholar]
- [265].Salmons S., Henriksson J.: The adaptative response of skeletal muscle to increased use. Muscle and Nerve 4: 94-105, 1981. [DOI] [PubMed] [Google Scholar]
- [266].Sapirstein L.A.: Regional Bloodflow by fractional distribution of indicators. Am.J.Physiol. 193: 161-168 (10), 1958. [DOI] [PubMed] [Google Scholar]
- [267].Sato G., Glenn W.L.: The Phrenic Nerve: Electrically Induced Fatigue. Surgery 68: 817-826, 1970. [PubMed] [Google Scholar]
- [268].Sauerwein D.: Funktionelle Elektrostimulation der Harnblase: Erste Erfahrungen mit sakraler Deafferentation und Vorderwurzelstimulation nach Brindley in Deutschland, Vg. Dtsch.Ges.Urol., 39, 595-597, 1988. [Google Scholar]
- [269].Schindl L., Kainz A., Kern H.: Effect of low level laser irradiation on indolent ulcers caused by buerger’s disease; A Preliminary Report, in Oshiro T., Calderhead R.G. editors, Progress in Lasertherapie, Verlag: John Wiley & Sons, 130-137, 1991. [Google Scholar]
- [270].Schlegel M., Koch I., Pirrwitz A., Jaschke B.: Die Bedeutung des körperlichen Trainings für querschnittgelähmte Rollstuhlfahrer. Med. und Sport 21: 366-373, 1981. [Google Scholar]
- [271].Schliack H.: Viszeroreflektorische Krankheitszeichen auf der Haut, Thermomed 6/1-3, 12-16, 1990. [Google Scholar]
- [223].Schmidt H., Kraft W., Rotte K.-H., Hagen H.: Pilotstudie zur Diagnostik von Muskelflächen des Oberschenkels mittels Computertomographie (CT). Medizin und Sport 30, 70-72, 1990. [Google Scholar]
- [273].Schubert W.: Funktionelles Training schlaff gelähmter Muskulatur. Biomed. Technik 30, 115, 1985. [DOI] [PubMed] [Google Scholar]
- [245].Schwanda G., Bochdansky Th., Frey M., Holle J., Kern H., Stöhr H., Thoma H., Bergmann H., Gilly H., Kenner Th., Schuy St., Steinbereithner K.: Funktionelle Elektrostimulation an Querschnittgelähmten – Verlaufskontrolle. Monitoring in der Anaestesiologie und Intensivmedizin, Verlag Maudrich, Wien-München-Bern: 416-429, 1983. [Google Scholar]
- [275].Schwanda G., Losert U., Stöhr H., Thoma H., Frey M.: Further progress in the development of implantable units for functional electrostimulation. Proc. of the International Society for Artificial Organs (ISAO), Rostock, Sept. 1982. [Google Scholar]
- [276].Scott O.M., Vrbova G., Hyde S.A., Dubowitz V.: Effect of chronic low frequency electrical stimulation on normal tibialis anterior muscle. Journal of Neurology. Neurosurgery and psychiatry 48: 774-781, 1985. [DOI] [PMC free article] [PubMed] [Google Scholar]
- [277].Scott O.M., Vrbova G., Hyde S.A., Dubowitz V.: Responses of muscles of patients with Duchenne muscular distrophy to chronic electrical stimulation, J. Neurol Neurosurg. Psychiatry 49, 1427-1434, 1986. [DOI] [PMC free article] [PubMed] [Google Scholar]
- [278].Scott O.M., Hyde S.A., Vrbova G., Dubowitz V.: Therapeutic possibilities of low frequency electrical stimulation in childeren with Duchenne muscular distrophy, J. Neurol. Sci. 95, 171-182, 1990. [DOI] [PubMed] [Google Scholar]
- [279].Seccia M., Tortora A., Menconi C., Cavina E.: Electrostimulated neo-sphincter after abdominoperineal resection for rectal cancer: functional results in 41 cases. In: Carraro U, Salmons S. (eds) Basic and applied myology: perspectives for the 90’s Unipress, Padova, pp 301-304, 1991. [Google Scholar]
- [280].Sejersen P.: Atraumatic local labeling of skin by invert gas: Epicutaneous application of Xenon-133. J.Appl.Physiol. 24: 570-572 (13) 1968. [DOI] [PubMed] [Google Scholar]
- [281].Sejersen P.: Bloodflow in cutaneous tissue in man studied by wash-out of radio-active Xenon. 2Circ.Res. 25: 215-229, 169. [Google Scholar]
- [283].Senning A.: Implantable Cardiac pacemaker, Mal. Cardiovas. 4:503-512, 1963. [Google Scholar]
- [283].Siebert W., Kohn D., Wirth C.J.: Thermographische Aspekte bei der orthopädischen Untersuchung des Kniegelenks, Thermomed 6/1-3, 17-19, 1990. [Google Scholar]
- [284].Siebert W., Böck C., Siebert B., Wirth C.J.: Das lumbale Wurzelkompressions-Syndrom im infrarot-thermographischen Bild, Thermomed 6/1-3, 20-23, 1990. [Google Scholar]
- [285].Siegel M.: A new approach to peripheral vascular diseases: Thallium-201 leg scans. Am.J.Roentgenol. 131: 827-830, November 1978. [DOI] [PubMed] [Google Scholar]
- [286].Smith B., Peckham P.H., Keith M.W., Roscoe D.D.: An Externally Powered, Multichannel, Implantable Stimulator for Versatile Control of Paralyzed Muscle, IEEE Trans. Biomed. Eng., 34, 499-508, 1987. [DOI] [PubMed] [Google Scholar]
- [287].Söderlund K., Hultman E.: ATP content in single fibres from human skeletal muscle after electrical stimulation and during recovery. Acta Physiol.Scand 139 459-466, 1990. [DOI] [PubMed] [Google Scholar]
- [288].Solomonow J., et al. : Proportional Control of Paralyzed Muscle. Fed. Proc. 37: 215, 1978. [Google Scholar]
- [289].Solomonow M.: Fatigue considerations of muscle force during high frequency stimulation, Am.J.Physiol.Med. 62: 47-122, 1983. [PubMed] [Google Scholar]
- [290].Stanic U., Acimovic R., Gros N., Trnkoczy A., Bajd T., Kljajic M.: Multichannel electrical stimulation for correction of hemiplegic gait. Scand. J. Rehab.Med. 10: 75-92, 1978. [PubMed] [Google Scholar]
- [291].Staron R.S., Pette D.: Nonuniform myosin expression along single fibers of chronically stimulated and contralateral rabbit tibialis anterior muscles. Pflügers Arch 409: 67-73, 1987a. [DOI] [PubMed] [Google Scholar]
- [292].Stöhr H., Bochdansky T., Frey M., Holle J., Kern H., Schwanda G., Thoma H.: Functional Electrostimulation makes Paraplegic Patients Walk again. Proc. 1st Vienna International Workshop on functional Electrostimulation, Vienna, October 1983. [Google Scholar]
- [293].Stöhr H., Frey M., Holle J., Kern H., Mayr W., Schwanda G., Thoma H.: Customized intergrated circiut design used in implantable nerve stimulation systems. Bioengineering, IEEE 1: 109-111, 1985. [Google Scholar]
- [294].Stöhr H., Frey M., Losert U., Rosenkranz D., Thoma H.: Reaction on the electrode nerve connection on lowest DC-currents and high peak voltages 3rd Annual Meeting of the International Society for Artificial Organs (ISAO), Paris, July 1981. [Google Scholar]
- [295].Strauss H.W., Harrision K., Pitt B.: Thallium-201: Non-invasive determination of regional distribution of cardiac output. J.Nucl.Med. 18, 1167, 1977. [PubMed] [Google Scholar]
- [296].Talonen P.P., Baer G.A., et al. : Neurophysiological and technical considerations for the design of an implantable phrenic nerve stimulator, Med. & Biol.Eng. & Comput. 28: 31-37, 1990. [DOI] [PubMed] [Google Scholar]
- [297].Tanagho E.A., Schmidt R.A.: Electrical stimulation in the clinical management of the neurogenic bladder, The Journal of Urology 140: 1331-1406, 1988. [DOI] [PubMed] [Google Scholar]
- [298].Tanagho E.A., Schmidt R.A., Orvis B.R.: Neural stimulation for control of voiding dysfunction: A preliminary report in 22 patients with serious neuropathic voiding disorders, Journal of Urology, 142, 340-345, 1989. [DOI] [PubMed] [Google Scholar]
- [299].Taylor P.N., Ewins D.J., Fox B., Grundy D., Swain ID.: Limb blood flow, cardiac output and quadriceps muscle bulk following spinal cord injury and the effect of training for the Odstock functional electrical stimulation standing system. Paraplegia 31: 303-310, 1993. [DOI] [PubMed] [Google Scholar]
- [300].Thoma H., Frey M., Gruber H., Holle J., Kern H., Reiner E., Schwanda G., Stöhr H.: First implantation of a 16-Channel electric stimulation device in human. American Society of Artifical Internal Organs, Transactions, Vol. XXIX: 301-306, Toronto, 1983. [PubMed] [Google Scholar]
- [301].Thoma H., Frey M., Holle J., Kern H., Reiner E., Schwanda G., Stöhr H.: Paraplegics should learn to walk with fingers. Proc. 5th Annual Conference, Engineering in Medicine and Biology Society, Ohio, IEEE, 579-582, 1983. [Google Scholar]
- [302].Thoma H., Frey M., Holle J., Kern H., Schwanda G., Stöhr H.: Beitrag zur integralen Betreuung Behinderter. Proc. Workshop “Raumfahrttechnik für Behinderte”, Gießen, BRD, Dez. 1982. [Google Scholar]
- [303].Thoma H., Holle J., Frey M., Kern H., Mayr W., Schwanda G., Stöhr H.: Gehen mit Händen - Praktische Anwendung der Elektrostimulation am Beispiel einer Patientin. Film C 1901/5. Österr. Bundes-institut für den wissenschaftlichen Film, Begleitveröffentlichung von Kern H., Wiss.Fil 36/37: 71-74, 1987. [Google Scholar]
- [304].Thoma H.: Vorrichtung zur örtlich und zeitlich variablen elektrischen Reizstrom-Langzeitstimulation eines Reizobjekts, wie Nerven und Muskeln. Österr. Patentschrift Nr. 330342. [Google Scholar]
- [305].Tönnessen K.H., Sejrsen P.: Wash-out of Xenon-133 after intramuscular injection and direct measurment of blood flow in skeletal muscle. J.Clin.Lab.Invest. 25, 71, 1970. [DOI] [PubMed] [Google Scholar]
- [306].Twist D.J., Culpepper-Morgan J.A., Ragnarsson K.T., Petrillo C.R., Kreek M.J.: Neuroendocrine changesduring functional electrical stimulation. Am J. Phys.Med.Rehabil. 71: 156-163, 1992. [DOI] [PubMed] [Google Scholar]
- [307].Veltink P.H., Franken H.M., Van Alste J.A., Boom H.B.: Modelling the optimal control of cyclical leg movements induced by functional electrical stimulation, Intern. Journal of Artificial Organs, 15: 746-755, 1992. [PubMed] [Google Scholar]
- [308].Vetter C., Reichmann H., Pette D.: Microphotometric determination of enzyme activities in type-grouped fibres of reinnervated rat muscle. Histochemistry 80: 347-351, 1984. [DOI] [PubMed] [Google Scholar]
- [309].Vodovnik L., Stanic U., Kralj A., Acimovic R., Gracanin F., Grobelnik S., Suhel P., Godes C., Plevnik S.: Functional Electrical Stimulation in Ljubljana, Projects, Problems, Perspectives, in: Hambrecht, Tl, Reswick J., (ED): Functional Electrical Stimulation. Marcel Dekker Inc., New York - Basel: 1977. [Google Scholar]
- [310].Vodovnik L., Bajd T., Kralj A., Gracanin F., Strojnik P.: Functional electrical stimulation for control of locomotor systems. CRC Critical Reviews in Bioengineering: 63-131, 1981. [PubMed] [Google Scholar]
- [311].Vodovnik L.: Technische Entwicklungswege der funktionellen Elektrostimulation. Biomedizinische Technik 18: 167-171, 1973. [PubMed] [Google Scholar]
- [312].Vrbova G.: The role of activity in the development of the mammalian motor unit. In: Electrical Stimulation and Neuromuscular Disorders. Ed. by Nix W.A., Vrbova G. Springer-Verlag, Berlin, 1986. [Google Scholar]
- [313].Vrbova G., Dimitrijevic M.M., Partidge M., Halter J., Verhagen-Metman L.: Reversal of increased muscle fatigue in paraplegic patients by electrical stimulation, 17 meeting of the Society of Neuroscience, 1987. [Google Scholar]
- [314].Wernig A., Müller S.: Improvement of walking in spinal cord injured persons after treadmill training. In: Wernig A., Plasticity of Motoneuronal Connections. Restorative Neurology Vol. 5 pp 475-485. Elsevier, Amsterdam, 1991. [Google Scholar]
- [315].Wernig A., Müller S.: Laufband locomotion with body weight support improved walking in persons with spinal cord injuries. Paraplegia 30: 229-238, 1992. [DOI] [PubMed] [Google Scholar]
- [316].Wernig A., Müller S., Nanasy A., Cagol E.: Laufband Therapie Based on „Rules of Spinal Locomotion“ is Effective in Spinal Cord Injured Persons. European Journal of Neuroscience, Vol. 7, 823-829, 1995. [DOI] [PubMed] [Google Scholar]
- [317].Williams N.S., Hallan R.I., Koeze T., Pilot M.A., Watkins E.S.: Construction of neoanal sphincter by transposition of the gracilis muscle and prolonged neuromuscular stimulation for the treatment of faecal incontinence. Ann R Coll Surg Engl 72: 108-113, 1990. [PMC free article] [PubMed] [Google Scholar]
- [318].Williams N.S., Hallan R.I., Koeze T.H., Watkins E.S.: Construction of a neorectum and neoanal sphincter following previous proctocolectomy. Br J Surg 76: 1191-1194, 1989. [DOI] [PubMed] [Google Scholar]
- [319].Williams P., Watt P., Bicik V., Goldspink G.: Effect of stretch combined with electrical stimulation on the type of sarcomeres produced at the ends of muscle fibers. Exp. Neurol 93: 500-509, 1986. [DOI] [PubMed] [Google Scholar]
- [320].Willis W.D.: Modulation of primate spinothalamic tract discharges. Adv. in Pain Res. and Therapy Vol. 6/Eds.: Kruger, Liebeskind JC: 217-236, 1984. [Google Scholar]
- [321].Yaksh T.L., Harty C., Howe J.R.: Pharmacology in spinal pain: Modulatory systems. Adv. in Pain Res & Therap. Vol. 7: 57-69, 1984. [Google Scholar]
- [322].Zoll P.M., Resuscitation of the heart in ventricular standstill by edeanal electric stimulation, N. Engl.J.Med. 247, 768, 1952. [DOI] [PubMed] [Google Scholar]
- [323].Zrunek M., Streinzer W., Mayr W., Burian K., Thoma H., Gruber H., Kern H.: Funktionelle Elektrostimulation (FES) der Stimmritzenöffner-Muskulatur bei beidseitiger Recurrensparese: Eine Tierexperimentelle Studie. Biomed. Technik, Karlsruhe, Ergänzungsband 31: 56-57, 1986. [Google Scholar]


