Zusammenfassung
Das retikuläre Muster in der Dünnschicht-CT umfasst als Hauptkomponenten die verdickten interlobulären und intralobulären Septen sowie das Honeycombing. Wenn verdickte interlobuläre Septen bzw. Honeycombing CT-morphologisch im Vordergrund stehen, ist eine weitgehende differenzialdiagnostische Eingrenzung der in Frage kommenden interstitiellen Lungenerkrankungen möglich. Hierbei ist wichtig, eine genaue Analyse von morphologischen Charakteristika (z. B. glatt oder nodulär verdickte interlobuläre Septen) und der Befundlokalisation (z. B. peripher, basal und subpleural lokalisiertes Honeycombing) vorzunehmen. Verdickte intralobuläre Septen sind, wie auch Parenchymbänder, subpleurale Linien und das sog. „Grenzflächenzeichen“ dagegen eher unspezifische Befunde, die jedoch in Zusammenschau mit weiteren CT-morphologischen Charakteristika ebenfalls eine weitgehende differenzialdiagnostische Einschätzung ermöglichen.
Schlüsselwörter: HRCT, Honigwabenbildung, Interlobuläre Septen, Intralobuläre Septen, Interstitielle Lungenerkrankungen
Abstract
Major constituents of a reticular pattern in thin-section CT are thickened interlobular and intralobular septa as well as honeycombing. When thickening of the interlobular septa or honeycombing are visible as predominant features, these patterns have a limited differential diagnosis. In this context, a detailed analysis of morphologic characteristics (e.g., smooth or nodular interlobular septal thickening) and of the pattern localisation (e.g., peripheral, basal and subpleural honeycombing) is required. Thickened intralobular septa, parenchymal bands, subpleural lines and the “interface sign” are all rather non-specific findings. However, if interpreted in the context of other CT findings, a differential diagnosis may also frequently be reported.
Keywords: HRCT, Honeycombing, Interlobular septa, Intralobular septa, Interstitial lung diseases
Mini-Kurs HRCT.
Dies ist der 2. von 4 CME-Beiträgen zum Thema HRCT. Der erste Beitrag mit dem Titel „Mustererkennung im HRCT der Lunge“ von M. Reuter und J. Biederer erschien in der Ausgabe 02/2009 von „Der Radiologe“. Es folgen Arbeiten zum Thema „Noduläre Muster“ und „Transparenzminderungen und -vermehrungen“.
Der Ausdruck „retikuläres Muster“ gründet sich ursprünglich auf der konventionellen Thoraxdiagnostik. Hier führt der Summationseffekt beim Vorliegen unzähliger kleinster linearer Strukturen zu einem netzartigen Bild. Die Dünnschicht-CT kann die Einzelkomponenten des
Zum retikulären Muster tragen v. a. verdickte inter- und intralobuläre Septumlinien sowie das sog. „Honeycombing“ bei
retikulären Musters, welches üblicherweise Ausdruck einer interstitiellen Lungenparenchymerkrankung ist, besser darstellen. Diese sind gemäß aktuellem Glossar der Fleischner Society v. a. verdickte inter- und intralobuläre Septumlinien sowie das sog. „Honeycombing“ („Honigwabenbildung“; [8]). Häufig wird das retikuläre Muster mit sog. „linearen Strukturen“ gemeinsam genannt, wobei diese linearen Strukturen CT-morphologische Befunde wie z. B. Verdickungen des peribronchovaskulären Interstitiums, Parenchymbänder, subpleurale Linien oder das sog. „Grenzflächenzeichen“ umfassen [29, 35].
In der vorliegenden Übersicht sollen die wichtigsten Komponenten eines retikulären Musters beschrieben und aufgezeigt werden, inwieweit anhand dieser Befunde eine CT-basierte Differenzialdiagnostik möglich ist.
Verdickte interlobuläre Septumlinien
Die interlobulären Septen messen als Begrenzung des sekundären pulmonalen Lobulus etwa 10–20 mm und verlaufen in der Lungenperipherie mehr oder weniger rechtwinklig zur Pleura. Sie bestehen aus Bindegewebe und beinhalten Lymphgefäße und pulmonale Venolen. Ihre Dicke von nur etwa 0,1 mm bedingt, dass sie in der gesunden Lunge CT-morphologisch kaum sichtbar sind. Erst die Verdickung einer oder mehrerer Komponenten der interlobulären Septen bewirkt, dass diese klar erkennbar werden [35]. Grundsätzlich sind
Verdickte interlobuläre Septen sind ein Zeichen einer interstitiellen Lungenerkrankung
verdickte interlobuläre Septen ein Zeichen einer interstitiellen Lungenerkrankung. Häufig treten sie gemeinsam mit anderen Komponenten des retikulären oder linearen Musters auf, dominieren sie das Bild, kann die Differenzialdiagnose jedoch recht gut eingeschränkt werden.
Man unterscheidet glatt, nodulär und irregulär verdickte interlobuläre Septen.
Häufigste Ursache für glatt verdickte interlobuläre Septen ist das interstitielle Ödem
Häufigste Ursache für glatt verdickte interlobuläre Septen ist das interstitielle Ödem. Hier liegen häufig noch mehr oder weniger ausgeprägte Milchglastrübungen vor ([33]; Abb. 1). Ein sehr ähnliches Bild liefert die pulmonale Hämorrhagie [4]. Patienten mit einer Lymphangiosis carcinomatosa zeigen ebenfalls überwiegend glatt, manchmal aber auch nodulär verdickte interlobuläre Septen [23, 32]. Gleiches gilt für andere lymphoproliferative Erkrankungen wie z. B. die lymphozytäre interstitielle Pneumonie, wobei hier häufig Zusatzbefunde wie kleinste Noduli vorliegen, was die CT-differenzialdiagnostische Abgrenzung erleichtert ([11, 14, 21]; Tab. 1). Wenige Pneumonien zeigen als Leitbefunde verdickte interlobuläre Septen – hier ist z. B. die Pneumocystis-jiroveci-Pneumonie zu nennen, die jedoch zusätzlich üblicherweise mit ausgedehnten Milchglastrübungen einhergeht [35].
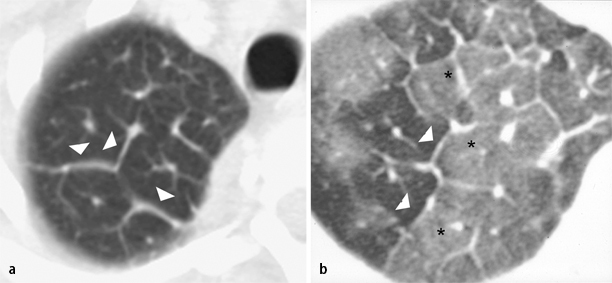
Lymphangiosis carcinomatosa
| Morphologie | Erkrankung |
|---|---|
|
Glatt verdickte interlobuläre Septen
|
Interstitielles Ödem |
| Pulmonale Hämorrhagie | |
| Lymphangiosis carcinomatosa | |
| Lymphoproliferative Erkrankungen, z. B. lymphozytäre interstitielle Pneumonie | |
| Pneumonien (z. B. Pneumocystis jiroveci-Pneumonie) | |
|
Nodulär verdickte interlobuläre Septen
|
Lymphangiosis carcinomatosa |
| Pulmonales Lymphom | |
| Sarkoidose | |
|
Irregulär verdickte interlobuläre Septen
|
Asbestose Silikose Talkose |
| Chronische Hypersensitivitätspneumonitis |
Pneumocystis-jiroveci-Pneumonie
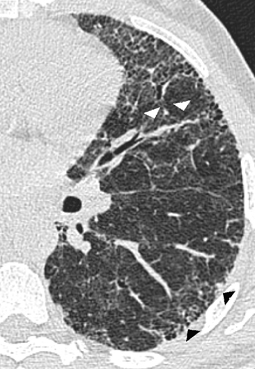
Nodulär verdickte interlobuläre Septen finden sich als Hauptbefunde v. a. bei Patienten mit Lymphangiosis carcinomatosa (Abb. 2) bzw. beim Lymphombefall der Lunge [23, 32]. Liegen zusätzlich peribronchovaskuläre und subpleurale kleine Noduli oder auch zu größeren Konglomeraten konfluierende noduläre Strukturen vor, kann die Diagnose einer Sarkoidose mit großer Sicherheit gestellt werden (Abb. 3).
Nodulär verdickte interlobuläre Septen
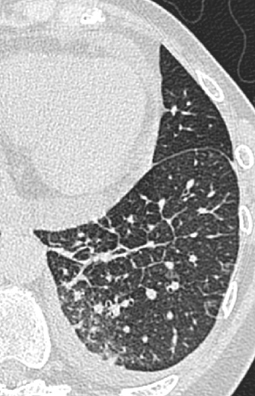
Sarkoidose
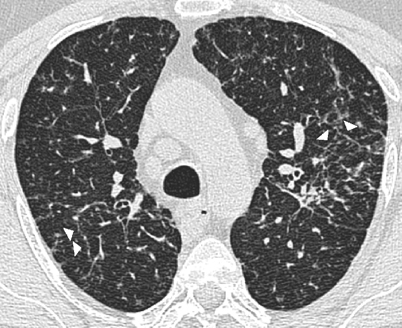
Irregulär verdickte interlobuläre Septen zeigen häufig einen fortgeschrittenen fibrotischen Prozess an
Irregulär verdickte interlobuläre Septen hingegen zeigen häufig einen fortgeschrittenen fibrotischen Prozess an (Abb. 4, Abb. 5), z. B. bei Patienten mit inhalativ bedingten Lungenerkrankungen (Silikose, Talkose, Asbestose u. a.; [35]). Liegt eine grobe Architekturstörung mit Honeycombing vor, sollte im Rahmen einer weiterführenden klinisch-laborchemischen Diagnostik eine chronische Hypersensitivitätspneumonitis ausgeschlossen werden. Patienten mit dem klinischen Bild einer idiopathischen pulmonalen Fibrose (histopathologisch v. a. einer „usual interstitial pneumonia“ entsprechend) zeigen hingegen weit seltener irregulär verdickte interlobuläre Septen als CT-Leitbefunde: Bei diesen Patienten bzw. generell bei Vorliegen einer fortgeschrittenen Fibrose werden die verdickten interlobulären Septen durch die oft im Vordergrund stehenden, massiven Architekturstörungen mit Honeycombing schlechter differenzierbar ([35]; Tab. 2).
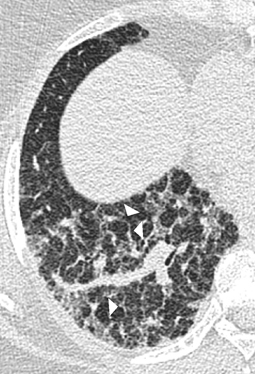
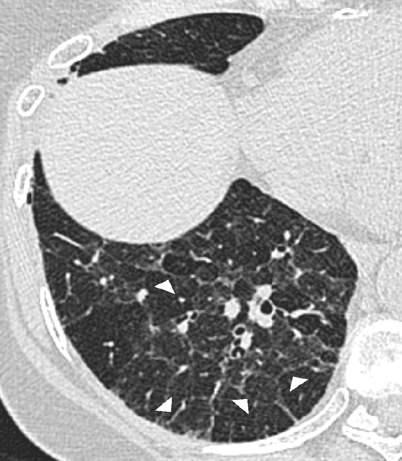
„Usual interstitial pneumonia“
| Prädominanz | Erkrankung |
|---|---|
|
Peripher, basal, subpleural
|
„Usual interstitial pneumonia“ (UIP) bzw. idiopathische pulmonale Fibrose als klinisches Korrelat |
| Asbestose | |
| Mittlere Lungenabschnitten | Chronische Hypersensitivitätspneumonitis |
| Apikal | Sarkoidose |
| Ventral | Lungenfibrose nach adultem Respiratory-distress-Syndrom (ARDS) |
Eine Kombination aus verdickten interlobulären Septen und ausgedehnten Milchglastrübungen nennt man „crazy paving“ . Einst als fast pathognomonisch für das Vorliegen einer Alveolarproteinose betrachtet ([24]; Abb. 6), ist inzwischen deutlich geworden, dass dieses Muster bei einer Reihe diffuser infiltrativer Lungenerkrankungen beobachtet werden kann. Diese können infektiöser (z. B. Pneumocystis-jiroveci-Pneumonie), neoplastischer (z. B. bronchioalveoläres Karzinom), granulomatöser (z. B. Sarkoidose) oder inhalativer Genese sein (z. B. Lipoidpneumonie), kommen aber auch im Rahmen einer organisierenden Pneumonie („organizing pneumonia“) oder einer nichtspezifischen interstitiellen Pneumonie (NSIP, „nonspecific interstitial pneumonia“) vor [30].
„Crazy paving“
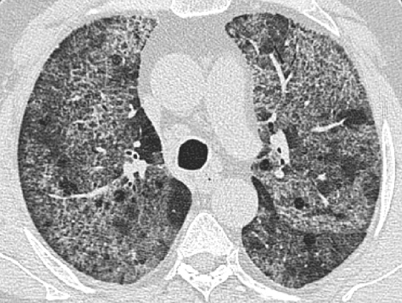
Verdickte intralobuläre Septen
Eine Verdickung des intralobulären bzw. distalen peribronchovaskulären Interstitiums erscheint CT-morphologisch als sehr feines, netzartiges Muster, wobei die einzelnen Linienstrukturen nur wenige mm voneinander separiert verlaufen ([35]; Abb. 6). Dieses Muster kann im Rahmen einer interstitiellen Fibrose vorkommen und ist dann meist mit dilatierten kleinsten Bronchiolen, sog. Traktionsbronchiolektasen, sowie mit irregulär verdickten interlobulären Septen assoziiert. Alternativ sind verdickte intralobuläre Septen aber manchmal auch Zeichen eines diffusen, infiltrativen interstitiellen Prozesses ohne Fibrose. Dies bedingt, dass
Verdickte intralobuläre Septen sind ein eher unspezifisches Zeichen
verdickte intralobuläre Septen generell ein eher unspezifisches Zeichen sind, die für sich selbst oft keine weitere differenzialdiagnostische Einordnung gestatten.
Patienten mit idiopathischen interstitiellen Pneumonien (IIP) zeigen unterschiedlich oft verdickte intralobuläre Septen. Eine Studie von Johkoh et al., die allerdings die Reklassifikation der IIP aus dem Jahr 2002 noch nicht berücksichtigen konnte, belegt eine Häufigkeit verdickter intralobulärer Septen bei 97% der Patienten mit UIP („usual interstitial pneumonia“), 93% der Patienten mit NSIP („nonspecific interstitial pneumonia“), 78% der Patienten mit DIP („desquamative interstitial pneumonia“) und 71% der Patienten mit OP („organizing pneumonia“, früher Bronchiolitis obliterans mit organisierender Pneumonie, BOOP; [13]).
Idiopathische interstitielle Pneumonie
Finden sich verdickte intralobuläre Septen gemeinsam mit Verdickungen der intralobulären Septen, gelten die selben differenzialdiagnostischen Erwägungen wie beim alleinigen Vorkommen verdickter interlobulärer Septen (s. oben). Häufige Ursachen sind hier v. a. die Lymphangiosis carcinomatosa [23] und das interstitielle Ödem [35]. Ferner können
Verdickte intralobuläre Septen mit Milchglastrübungen oder Crazy-paving-Muster können im Rahmen einer Alveolarproteinose auftreten
verdickte intralobuläre Septen gemeinsam mit Milchglastrübungen oder einem Crazy-paving-Muster auftreten, z. B. im Rahmen einer Alveolarproteinose (Abb. 6), pulmonalen Hämorrhagie oder bestimmten Pneumonien (Pneumocystis-jiroveci-Pneumonie, Zytomegalie u. a.; [35]).
Honeycombing
Der Begriff „Honeycombing“, fälschlicherweise oft synonym mit dem Begriff „retikuläres Muster“ verwendet, bezeichnet destruiertes und fibrotisches Lungenparenchym mit zahllosen zystischen Hohlräumen, welche von dicken fibrösen Wänden begrenzt werden.
Honeycombing ist gekennzeichnet durch den kompletten Verlust der azinären Architektur
Honeycombing findet sich im Rahmen des Endstadiums zahlreicher Lungenparenchymerkrankungen und ist gekennzeichnet durch den kompletten Verlust der azinären Architektur [8]. Die entstandenen zystischen Hohlräume sind von variabler Größe und werden von metaplastischem Bronchialepithel ausgekleidet [7, 8]. CT-morphologisch zeigen sich in mehreren Schichten angeordnete zystische Läsionen v. a. subpleural mit einer Größe von 3–10 mm, gelegentlich bis 2,5 cm (Abb. 7).
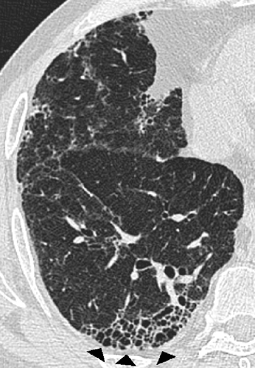
Das Vorliegen von Honeycombing ist als Zeichen einer signifikanten Lungenfibrose häufig mit Befunden wie Architekturstörung, Traktionsbronchiektasen und -bronchiolektasen, verdickten intralobulären Septen und irregulären Septumlinien assoziiert. Bei Patienten mit dem generellen Befund einer Lungenfibrose sollte der Nachweis von Honeycombing dazu veranlassen, die Diagnose einer UIP bzw. dem klinischen Korrelat einer idiopathischen pulmonalen Fibrose zu stellen (Abb. 8). Mögliche Ursachen sind – neben der häufigsten idiopathischen Genese – Erkrankungen wie die rheumatoide Arthritis, die Asbestose sowie medikamentös bedingte fibrotische Lungenparenchymerkrankungen [35]. Wie im Glossar der Fleischner Society explizit erwähnt, sollte der Begriff „Honeycombing“ sehr bewusst verwendet werden, da
Das Honeycombing-Muster gilt als spezifisch für das Vorliegen einer „usual interstitial pneumonia“
dieses Muster als spezifisch für das Vorliegen einer UIP gilt und somit das Patientenmanagement potenziell stark beeinflussen kann [8].
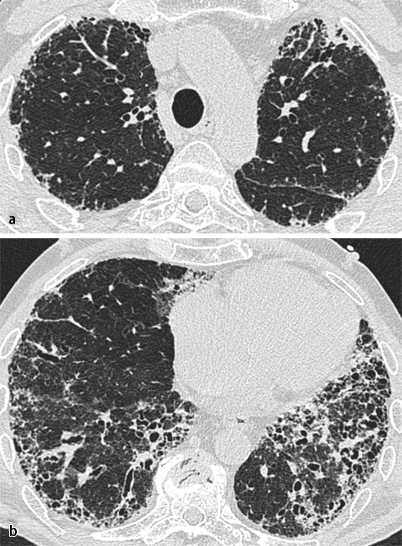
Zahlreiche Studien zum Stellenwert der CT-Diagnostik bei Patienten mit unterschiedlichen diffusen Lungenparenchymerkrankungen belegen, dass die Diagnose einer UIP mit hinreichender Sicherheit allein basierend auf der CT-Morphologie gestellt werden kann, was eine bioptische Abklärung in der ganz überwiegenden Anzahl von Fällen unnötig werden lässt [17, 20, 26, 27, 34]. Hierbei sind einerseits der Nachweis und andererseits die Lokalisation des Honeycombings für die Diagnosestellung entscheidend, denn
Bei Patienten mit UIP ist das Honeycombing typischerweise betont basal, peripher und subpleural lokalisiert
bei Patienten mit UIP ist das Honeycombing typischerweise betont basal, peripher und subpleural lokalisiert (Abb. 8). Eine neuere Studie belegt, dass der Nachweis von Honeycombing in den Lungenunterlappen eine Sensitivität von 79,3%, eine Spezifität von 69,4%, einen positiven Vorhersagewert von 83% und einen negativen Vorhersagewert von 71,1% für die Diagnose einer UIP aufweist [10]. Lynch et al. konnten zudem zeigen, dass die Ausdehnung des Honeycombings einen wichtigen Prädiktor für die Mortalität darstellt [19]. Als gewisse Einschränkung muss allerdings gelten, dass etwa 30% der Patienten mit UIP atypische CT-Befunde aufweisen, sodass die differenzialdiagnostische Abgrenzung v. a. zur NSIP schwierig und z. T. unmöglich sein kann. Dies ist besonders dann der Fall, wenn ausgedehntere Milchglastrübungen vorliegen, welche bei Patienten mit UIP üblicherweise eher wenig ausgeprägt sind.
Auch bei Patienten mit einer Asbestose zeigt sich eine periphere, basale und subpleurale Prädominanz des Honeycombings im fortgeschrittenen Erkrankungsstadium [5]. Hier muss zur differenzialdiagnostischen Abgrenzung gegenüber der UIP nach asbestassoziierten Brückenbefunden gesucht werden. Hingegen weisen Patienten mit der seltenen chronischen Verlaufsform einer Hypersensitivitätspneumonitis eine gewisse Prädominanz des Honeycombings in den mittleren Lungenabschnitten auf [2, 28]. Wesentlich seltener findet sich manifestes Honeycombing bei Patienten mit Sarkoidose, zeigt in diesen Fällen jedoch häufig eine Prädominanz in den apikalen Lungenparenchymabschnitten [35]. Eine Lungenfibrose als Folge eines adulten Respiratory-distress-Syndroms (ARDS) geht hingegen mit einer auffälligen Prädominanz des Honeycombings in den anterioren Lungenparenchymabschnitten einher [6].
Asbestose
Hypersensitivitätspneumonitis
Verdickungen des peribronchovaskulären Interstitiums
Das peribronchovaskuläre Interstitium erstreckt sich als bindegewebige Scheide von den Lungenhili zur Peripherie und umschließt dort die zentrilobulären Arteriolen und Bronchiolen [35]. Zahlreiche Erkrankungen führen zu einer Verdickung des peribronchovaskulären Interstitiums, wobei sich deren Differenzialdiagnose auf Grund der anatomischen Kontinuität mit der Differenzialdiagnose der verdickten interlobulären Septen überschneidet (s. oben). Ebenso wie die Verdickung interlobulärer Septen kann auch die Verdickung des peribronchovaskulären Interstitiums glatt, nodulär oder irregulär konfiguriert sein. So führt
Das interstitielle Ödem führt zu einer glatten Verdickung des peribronchovaskulären Interstitiums
das interstitielle Ödem zu einer glatten Verdickung des peribronchovaskulären Interstitiums, während die Lymphangiosis carcinomatosa, ebenso wie das pulmonale Lymphom, die Leukämie oder andere lymphoproliferative Erkrankungen, zu einer glatten oder auch nodulären Form der peribronchovaskulären Verdickung führen ([9, 11, 12, 14, 16, 21, 23, 32]; Abb. 9). Lymphoproliferative Erkrankungen wie z. B. die lymphozytäre interstitielle Pneumonie weisen aber häufig noch weitere CT-Befunde wie intrapulmonale Zysten oder kleine Noduli auf, wodurch die Differenzialdiagnostik erleichtert wird [11, 14, 21].
Patienten mit Sarkoidose zeigen typischerweise noduläre Verdickungen des peribronchovaskulären Interstitiums
Patienten mit Sarkoidose zeigen typischerweise noduläre Verdickungen des peribronchovaskulären Interstitiums. Im Einzelfall kann die Differenzialdiagnose zur Lymphangiosis carcinomatosa ausgesprochen schwierig sein. Hilfreich ist hier allerdings der Nachweis typischer weiterer Parenchymbefunde wie subpleuraler kleinster pulmonaler Noduli usw. [22]. Auch die Silikose zeigt noduläre Verdickungen des peribronchovaskulären Interstitiums, nicht selten liegen hier zusätzlich Konglomerattumoren als Ausdruck einer progressiven massiven Fibrose vor [35].
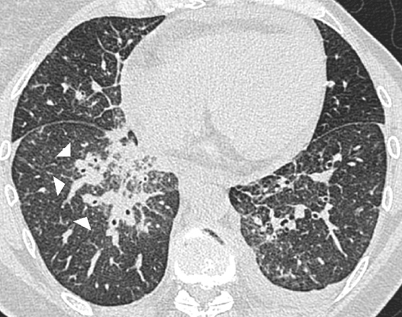
Ist die dann zumeist irreguläre Verdickung des peribronchovaskulären Interstitiums mit den CT-Befunden einer manifesten Lungenfibrose (s. oben) assoziiert, kommen verschiedene idiopathische interstitielle Pneumonien (UIP, NSIP), die Sarkoidose (Abb. 10) und auch die chronische Hypersensitivitätspneumonitis in Betracht. Allerdings ist die Verdickung des peribronchovaskulären Interstitiums selten der dominierende Befund bei diesen Patienten [2, 15].
Häufige assoziierte Befunde sind Traktionsbronchiektasen und -bronchiolektasen
Häufige assoziierte Befunde sind Traktionsbronchiektasen und -bronchiolektasen als Zeichen der Architekturstörung bzw. Fibrose.
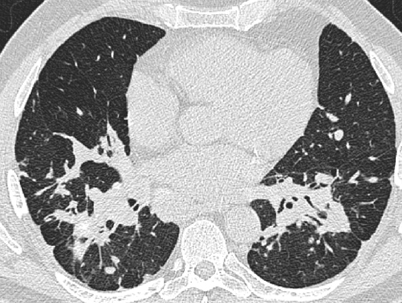
Parenchymbänder
Diese linearen, wenige mm breiten und etwa 2–5 cm langen Strukturen sind häufig subpleural lokalisiert und treten bei Patienten mit Atelektasen, pulmonaler Fibrose oder anderen interstitiellen Parenchymerkrankungen auf [35]. Sind sie von verdickten interlobulären Septen ausgehend kontinuierlich zu verfolgen, kommen differenzialdiagnostisch die entsprechenden Erkrankungen in Frage (s. oben).
Meist entsprechen Parenchymbänder einer peribronchovaskulären Fibrose, Narbensträngen oder Atelektasen
Meist jedoch entsprechen Parenchymbänder einer peribronchovaskulären Fibrose, Narbensträngen oder Atelektasen mit angrenzender pleuraler Fibrose [35], erkennbar an einer oft signifikanten Architekturstörung des angrenzenden Lungenparenchyms. Entsprechend häufig treten Parenchymbänder bei Patienten mit Asbestose bzw. asbestassoziierter Pleuraerkrankung auf (Abb. 11). Aberle et al. beschrieben hier eine Häufigkeit von 66% [1]. Bei asbestexponierten Patienten treten Parenchymbänder häufig gemeinsam mit Pleuraplaques auf und zeigen eine basale Prädominanz [1, 18]. Sarkoidose und Silikose (v. a. mit assoziierter progressiver massiver Fibrose) sind weitere Erkrankungen, die mit der Ausbildung von Parenchymbändern einhergehen, ebenso wie die Tuberkulose [35].
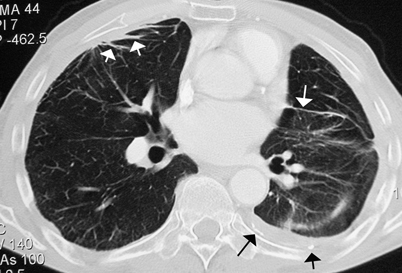
Tuberkulose
Subpleurale Linien
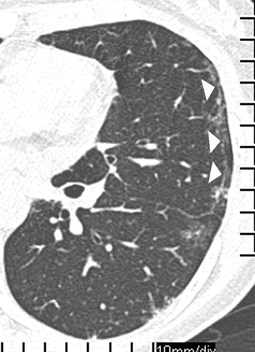
Auch die subpleuralen Linien, d. h. bogig verlaufende, wenige mm dicke, weniger als 1 cm von der Pleura entfernt und parallel zu ihr verlaufende Strukturen (Abb. 12),
Subpleurale Linien sind häufig bei Patienten mit Asbestose zu finden
sind häufig bei Patienten mit Asbestose zu finden, obgleich sie grundsätzlich einen eher unspezifischen und differenzialdiagnostisch eingeschränkt hilfreichen Befund darstellen. Aberle et al. fanden subpleurale Linien bei 41% ihrer Patienten mit Asbestose [1]. Andere fibrotische Lungenparenchymerkrankungen, z. B. die UIP oder eine Fibrose im Rahmen einer Kollagenose, scheinen weniger häufig mit subpleuralen Linien einherzugehen [3, 31].
Grenzflächenzeichen
Das Grenzflächenzeichen kann bei der überwiegenden Mehrzahl von Patienten mit interstitiellen Lungenparenchymerkrankungen erhoben werden
Das Grenzflächenzeichen (engl. „interface sign“), d. h. eine irreguläre Grenzfläche zwischen dem belüfteten Lungenparenchym und den Bronchien, Gefäßen bzw. der viszeralen Pleura, ist ein unspezifischer Befund, der bei der ganz überwiegenden Mehrzahl von Patienten mit interstitiellen Lungenparenchymerkrankungen erhoben werden kann ([36]; Abb. 13). Zerhouni et al. beobachteten dieses Zeichen bei 89% der Patienten mit diversen interstitiellen Lungenparenchymerkrankungen. Nishimura et al. fanden bei 94% bzw. 98% der Patienten mit idiopathischer pulmonaler Fibrose irreguläre Grenzflächen zwischen Lungenparenchym und Pleura bzw. zwischen Lungenparenchym und Gefäßstrukturen [25, 36]. Das Grenzflächenzeichen ist daher differenzialdiagnostisch wenig hilfreich und nur im Zusammenhang mit weiteren CT-Befunden zu verwerten.
Fazit für die Praxis
Die sorgfältige Analyse der Hauptkomponenten eines retikulären Musters in der Dünnschicht-CT erlaubt in vielen Fällen eine differenzialdiagnostische Eingrenzung der zugrunde liegenden interstitiellen Lungenparenchymerkrankung. Besonders der Nachweis verdickter interlobulärer Septen oder das Vorliegen von Honeycombing als jeweils dominierende Befunde erlaubt eine Einschränkung der in Frage kommenden Differenzialdiagnosen auf wenige relevante Entitäten, wenn morphologische Charakteristika bzw. die vorwiegende Lokalisation der Befunde berücksichtigt werden. Weitere Komponenten des retikulären bzw. linearen Musters wie verdickte intralobuläre Septen, Parenchymbänder, subpleurale Linien oder das Grenzflächenzeichen sind unspezifischerer Natur und nur im Zusammenhang mit anderen CT-Befunden differenzialdiagnostisch zu interpretieren.
CME-Fragebogen
Welche Erkrankung zeichnet sich durch peripheres, basales und subpleurales Honeycombing aus?
Die chronische Hypersensitivitätspneumonitis.
Die Sarkoidose.
Die UIP („usual interstitial pneumonia“).
Die NSIP („non-specific interstitial pneumonia“).
Die Silikose.
Nodulär verdickte interlobuläre Septen sind typisch für...
die Lymphangiosis carcinomatosa.
das interstitielle Ödem.
die idiopathische pulmonale Fibrose.
die Asbestose.
die pulmonale venookklusive Erkrankung (PVOD).
Welche Aussage zum „crazy paving“ trifft nicht zu?
Als „crazy paving“ bezeichnet man die Kombination verdickter interlobulärer Septen und Milchglastrübungen.
„Crazy paving“ ist ein spezifischer Befund bei der Alveolarproteinose.
„Crazy paving“ tritt bei pulmonaler Hämorrhagie auf.
Die Differenzialdiagnose des „crazy paving“ umfasst auch die Lipoidpneumonie.
„Crazy paving“ findet man z. B. beim bronchoalveolären Karzinom.
Welche Aussage zum retikulären Muster trifft nicht zu?
Der Begriff „retikuläres Muster“ gründet sich ursprünglich auf der konventionellen Thoraxdiagnostik.
Die 3 Hauptkomponenten des retikulären Musters sind verdickte interlobuläre und intralobuläre Septen sowie Honeycombing.
Der Begriff des retikulären Musters ist gleichbedeutend mit dem Begriff der Lungenfibrose.
Ein retikuläres Muster kann nur CT-morphologisch genauer differenziert werden.
Ein retikuläres Muster ist ein Hinweis auf eine interstitielle Lungenparenchymerkrankung.
Das verdickte peribronchovaskuläre Interstitium...
findet sich betont subpleural.
ist nodulär, glatt oder irregulär konfiguriert.
ist Zeichen einer Lungenfibrose.
ist ein spezifischer Befund bei Patienten mit UIP („usual interstitial pneumonia“).
ist atypisch für ein pulmonales Lymphom.
Das Grenzflächenzeichen...
findet sich am häufigsten bei Patienten mit interstitiellem Ödem.
ist ein spezifischer Befund bei Asbestose.
ist ein häufiger, unspezifischer Befund bei Patienten mit einer Lungenfibrose.
zeigt einen entzündlichen Prozess an.
ist differenzialdiagnostisch wegweisend.
CT-morphologische Kriterien einer Lungenfibrose sind nicht :
Honeycombing
Architekturstörung
Subpleurale Linien
Traktionsbronchiektasen
Traktionsbronchiolektasen
Parenchymbänder finden sich nicht gehäuft bei...
Asbestose
Lymphangiosis carcinomatosa
Tuberkulose
Silikose
Sarkoidose
Nur sehr wenige Pneumonien zeigen als Leitbefund u. a. verdickte interlobuläre Septen. Welche gehört dazu?
S. pneumoniae.
M. avium-intracellulare.
Pneumocystis jiroveci.
Candida.
Varizella-Zoster-Virus.
Typische Befunde bei einer Asbestose sind nicht :
Parenchymbänder
Subpleurale Linien
Manifeste Fibrose mit Honeycombing
„Crazy paving“
Pleuraplaques
Acknowledgments
Interessenkonflikt
Der korrespondierende Autor gibt an, dass kein Interessenkonflikt besteht.
Literatur
- 1.Aberle Radiology. 1988;166:729. doi: 10.1148/radiology.166.3.3340770. [DOI] [PubMed] [Google Scholar]
- 2.Adler Radiology. 1992;185:91. doi: 10.1148/radiology.185.1.1523340. [DOI] [PubMed] [Google Scholar]
- 3.Al-Jarad Thorax. 1992;47:645. doi: 10.1136/thx.47.8.645. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Cassart AJR Am J Roentgenol. 1993;160:759. doi: 10.2214/ajr.160.4.8456659. [DOI] [PubMed] [Google Scholar]
- 5.Copley Radiology. 2003;229:731. doi: 10.1148/radiol.2293020668. [DOI] [PubMed] [Google Scholar]
- 6.Desai Radiology. 1999;210:29. [Google Scholar]
- 7.Genereux Radiology. 1975;116:279. doi: 10.1148/116.2.279. [DOI] [PubMed] [Google Scholar]
- 8.Hansell Radiology. 2008;246:697. doi: 10.1148/radiol.2462070712. [DOI] [PubMed] [Google Scholar]
- 9.Heyneman AJR Am J Roentgenol. 2000;174:517. doi: 10.2214/ajr.174.2.1740517. [DOI] [PubMed] [Google Scholar]
- 10.Hunninghake Chest. 2003;124:1215. doi: 10.1378/chest.124.4.1215. [DOI] [PubMed] [Google Scholar]
- 11.Ichikawa J Comput Assist Tomogr. 1994;18:745. doi: 10.1097/00004728-199409000-00012. [DOI] [PubMed] [Google Scholar]
- 12.Johkoh AJR Am J Roentgenol. 1992;145:505. [Google Scholar]
- 13.Johkoh Radiology. 1999;211:55. [Google Scholar]
- 14.Johkoh Radiology. 1999;212:567. doi: 10.1148/radiology.212.2.r99au05567. [DOI] [PubMed] [Google Scholar]
- 15.Kim AJR Am J Roentgenol. 1998;171:1645. doi: 10.2214/ajr.171.6.9843306. [DOI] [PubMed] [Google Scholar]
- 16.Lee AJR Am J Roentgenol. 1997;168:339. doi: 10.2214/ajr.168.2.9016202. [DOI] [PubMed] [Google Scholar]
- 17.Leung AJR Am J Roentgenol. 1991;157:693. doi: 10.2214/ajr.157.4.1892019. [DOI] [PubMed] [Google Scholar]
- 18.Lynch Radiology. 1988;160:603. doi: 10.1148/radiology.169.3.3186982. [DOI] [PubMed] [Google Scholar]
- 19.Lynch Am J Respir Crit Care Med. 2005;172:488. doi: 10.1164/rccm.200412-1756OC. [DOI] [PubMed] [Google Scholar]
- 20.Mathieson Radiology. 1989;171:111. doi: 10.1148/radiology.171.1.2928513. [DOI] [PubMed] [Google Scholar]
- 21.McGuinness Radiology. 1995;197:59. doi: 10.1148/radiology.197.1.7568855. [DOI] [PubMed] [Google Scholar]
- 22.Müller AJR Am J Roentgenol. 1989;152:1179. doi: 10.2214/ajr.152.6.1179. [DOI] [PubMed] [Google Scholar]
- 23.Munk Radiology. 1988;166:705. doi: 10.1148/radiology.166.3.3340765. [DOI] [PubMed] [Google Scholar]
- 24.Murch Clin Radiol. 1989;40:240. doi: 10.1016/S0009-9260(89)80180-1. [DOI] [PubMed] [Google Scholar]
- 25.Nishimura Radiology. 1992;182:337. doi: 10.1148/radiology.182.2.1732946. [DOI] [PubMed] [Google Scholar]
- 26.Nishimura Chest. 1993;104:1149. doi: 10.1378/chest.104.4.1149. [DOI] [PubMed] [Google Scholar]
- 27.Padley Clin Radiol. 1991;44:222. doi: 10.1016/S0009-9260(05)80183-7. [DOI] [PubMed] [Google Scholar]
- 28.Primack SL, Hartman TE, Hansell DM. End-stage lung disease: CT findings in 61 patients. Radiology. 1993;189:681–686. doi: 10.1148/radiology.189.3.8234691. [DOI] [PubMed] [Google Scholar]
- 29.Reuter M (2009) Mustererkennung im HRCT der Lunge. Radiologe (im Druck) [DOI] [PubMed]
- 30.Rossi Radiographics. 2003;23:1509. doi: 10.1148/rg.236035101. [DOI] [PubMed] [Google Scholar]
- 31.Schurawitzki Radiology. 1990;176:755. doi: 10.1148/radiology.176.3.2389033. [DOI] [PubMed] [Google Scholar]
- 32.Stein Radiology. 1987;162:371. doi: 10.1148/radiology.162.2.3797649. [DOI] [PubMed] [Google Scholar]
- 33.Storto AJR Am J Roentgenol. 1995;165:817. doi: 10.2214/ajr.165.4.7676973. [DOI] [PubMed] [Google Scholar]
- 34.Swensen Radiology. 1997;205:229. doi: 10.1148/radiology.205.1.9314990. [DOI] [PubMed] [Google Scholar]
- 35.Webb RW, Müller NL, Naidich DP (2001) High-resolution computed tomography findings of lung disease. In: Webb RW, Müller NL, Naidich DP (Hrsg) High-resolution CT of the lung. Lippincott Williams & Wilkins, Philadelphia, USA, p 72
- 36.Zerhouni J Thorac Imaging. 1985;1:54. doi: 10.1097/00005382-198512000-00008. [DOI] [PubMed] [Google Scholar]


