Abstract
目的
研究长期抗阻训练对大鼠慢性咬肌机械痛觉敏感性的影响,为临床慢性咀嚼疼痛的非药物治疗提供理论依据。
方法
选用16只雄性Sprague-Dawley大鼠(220~250 g),随机分为空白对照组、抗阻训练组、慢性咬肌痛组、慢性咬肌痛抗阻训练组4个组,每组4只,慢性咬肌痛大鼠(慢性咬肌痛组和慢性咬肌痛抗阻训练组)采用咬合干扰模型建模,抗阻训练大鼠(抗阻训练组和慢性咬肌痛抗阻训练组)采用食物诱导法进行负重蹲起训练,每次30 min,每日1次,每周训练5 d,总计14周。每天记录大鼠抗阻训练情况,采用改良电子测痛仪每周测定各组大鼠双侧咬肌机械刺激反应阈值,每周记录体重变化。长期抗阻训练结束后,采用自制抓力计测定大鼠后肢抓力,分离后肢肌肉(腓肠肌和比目鱼肌)及腓骨,测定肌肉质量和腓骨长度,计算后肢肌肉质量、肌肉质量/体重比和肌肉质量/腓骨长度比。
结果
空白对照组和抗阻训练组第0~4周双侧咬肌机械刺激反应阈值差异无统计学意义(P>0.05), 第5~14周抗阻训练组的阈值较空白对照组高(P<0.05)。慢性咬肌痛组和慢性咬肌痛抗阻训练组在第0~6周双侧咬肌机械刺激反应阈值均先下降后上升,组间阈值差异无统计学意义(P>0.05), 第7~14周慢性咬肌痛抗阻训练组的阈值较慢性咬肌痛组的显著增高(P<0.05)。14周抗阻训练后,非抗阻训练大鼠体重明显大于抗阻训练大鼠[(462±6) g vs.(418±14) g, P<0.05], 大鼠后肢抓力在抗阻训练组明显更高[(6.75±0.13) N vs.(5.41±0.15) N, P<0.01]。
结论
长期抗阻训练可降低健康大鼠和慢性咬肌痛觉过敏大鼠双侧咬肌机械痛觉敏感性,为长期抗阻训练临床治疗慢性咀嚼肌痛提供了基础研究证据。
Keywords: 抗阻训练, 咬合干扰, 慢性咀嚼肌痛, 机械痛觉过敏
Abstract
Objective
To investigate the effect of long-term resistance exercise of hindlimb on mechan-ical hyperalgesia of bilateral masseter muscle in rats with or without occlusal interference.
Methods
Six-teen male Sprague-Dawley rats (220-250 g) were randomly divided into four groups: the naive control group, naïve exercise group, occlusal interference control group, and occlusal interference exercise group. The rats in occlusal interference groups (occlusal interference control group and occlusal interference exercise group) obtained occlusal interference with 0.4 mm-thick crowns bonded to the right maxillary first molars. The rats in exercise groups (naïve exercise group and occlusal interference exercise group) performed squat-type resistance exercises for 30 minutes, once a day, 5 days/week, lasting for 14 weeks. Resistance exercise was recorded every day. Mechanical withdrawal thresholds of bilateral masseter muscle were tested per week by use of modified electronic von-frey anesthesiometer. The rats were weighed per week. After the 14-week exercise, the muscle strength of the hindlimb was tested with a grip strength meter. Muscle (gastrocnemius and soleus) weight of bilateral hindlimb and length of bilateral fibula of the rats were obtained. The muscle-mass/body-mass ratios and muscle-mass/fibula-length ratios were calculated.
Results
Between the naïve control group and naïve exercise group, there was no sig-nificant difference in the mechanical withdrawal thresholds of bilateral masseter muscle for the 0-4 weeks (P>0.05). During the 5-14 weeks, the mechanical withdrawal thresholds of the rats in the naïve exercise group were higher than those in the naïve control group (P<0.05). Between the occlusal interference control group and occlusal interference exercise group, there was no significant difference in the mechanical withdrawal thresholds of bilateral masseter muscle for the 0-6 weeks (P>0.05). During the 7-14 weeks, the mechanical withdrawal thresholds of rats in the naïve exercise group were higher than those in the occlusal interference control group (P<0.05). After the 14-week exercise, the body mass of the rats in non-exercise group (the naïve control group and occlusal interference control group) were larger than those in exercise group [(462±6) g vs. (418±14) g, P<0.05]. And the muscle strength of hindlimb of the rats in exercise group were bigger than those in non-exercise group [(6.75±0.13) N vs. (5.41±0.15) N, P<0.01].
Conclusion
Long-term resistance exercise can increase mechanical withdrawal thresholds of the bilateral masseter muscle in rats with or without masseter muscle mechanical hyperalgesia.
Keywords: Resistance exercise, Occlusal interference, Chronic masticatory muscle pain, Mechanical hyperalgesia
慢性疼痛疾病发病率高,对患者身心健康造成极大的负面影响。目前,药物是慢性疼痛疾病常用的治疗手段之一,但其花费高昂且存在不同程度的毒副作用[1,2,3,4]。抗阻训练(resistance exercise,RE)是一种抵抗阻力训练肌肉的方法,研究发现抗阻训练可以缓解疼痛,降低人对疼痛刺激的敏感性(exercise-induced hypoalgesia,EIH)[5,6,7,8,9]。
慢性咀嚼肌痛(chronic masticatory muscle pain)是在口腔颌面部较为常见的一种慢性疼痛疾病。本课题组前期建立了大鼠咬合干扰致大鼠慢性咀嚼肌疼痛模型,并进行了有关机制的研究[10,11,12]。抗阻训练能否降低健康大鼠咀嚼肌机械疼痛的敏感性,能否减轻实验性慢性咀嚼肌痛觉过敏大鼠咀嚼肌机械疼痛的敏感性,目前尚未见文献报道。本研究旨在建立大鼠后肢抗阻训练模型,探索抗阻训练对咀嚼肌机械痛觉敏感性的影响,为抗阻训练治疗慢性疼痛疾病提供理论依据。
1. 材料与方法
1.1. 实验动物与分组
实验动物:健康雄性Sprague-Dawley大鼠16只,初始体重220~250 g,24 h昼夜交替,室温25 ℃,自由饮水,控制饮食,单独喂养。本研究开始前经过北京大学生物医学伦理委员会实验动物福利伦理分会审查批准(LA2017055)。
实验分组:大鼠前3 d熟悉抗阻训练仪器及人员,消除紧张情绪。当大鼠主动进入抗阻训练仪器内并获取食物即开始分组,随机分为空白对照组(A组)、抗阻训练组(B组)、慢性咀嚼肌痛组(C组)和慢性咀嚼肌痛抗阻训练组(D组),每组4只。B组和D组经过2周训练,成功建立抗阻训练模型。在第3周抗阻训练开始前,C组和D组建立咬合干扰模型。建模后B组和D组抗阻训练再持续12周,共计14周。
1.2. 实验方法
抗阻训练方法:食物诱导法抗阻训练模型(图1)由Klitgaard[13]于1988年建立,并由Norenberg等[14]于2003年加以改进。本研究自制大鼠抗阻训练仪器,包括垂直放置于双层底座上的有机玻璃圆筒,底面直径10 cm,高30 cm,筒的前部有拱形门,高10 cm。筒内放置有机玻璃活塞,活塞可沿筒内壁上下自由移动,活塞内有孔,直径3 cm或3.5 cm,似颈圈,允许大鼠将头伸入。当大鼠头部完全伸入颈圈时,负重位于大鼠的肩膀。活塞左右两侧各连接一水平金属杆,右侧杆连接负重砝码,左侧杆与测距装置相连,活塞的垂直移动距离显示于电子显示屏上。食块(约150 mg)经橡胶管固定于约30 cm长的金属杆上,金属杆连接于筒的顶部。调节活塞的初始高度和食块高度,以适应不同的大鼠。一个完整的过程包括:大鼠进入筒内,头伸入颈圈,克服重力,向上推动活塞及砝码获取食物,记录下负重和垂直位移。大鼠抗阻训练分为4个阶段:第1阶段,大鼠在筒内伸展后肢,获取杆上食块;第2阶段,食块及活塞距离底座5 cm高,食块逐渐抬高,活塞保持约5 cm高不变,大鼠头逐渐深入颈圈,克服一定阻力,而后,大鼠头完全伸入颈圈,完全克服活塞阻力(约180 g), 抬升约4~5 cm高,第3阶段,以大鼠能忍受的最大速度增加负重(约50 g/d),经过2周训练,大鼠能够抬升1.5~2.0倍体重的负重;第4阶段,保持负重在体重的1.5~2.0倍,抬升高度约4~5 cm,进行后续12周的抗阻训练。
1.
大鼠抗阻训练
Rat is taking resistance exercise
Rats were trained to enter the acrylic cylinder through the door, place their head through the collar, and extend their hindlimbs to obtain a food pellet attached to a metal rod.

训练与喂养模式:周日至下周四为训练日,每日下午18:00~22:00,每只大鼠训练0.5 h;周五、周六为休息日,周六下午18:00开始禁食24 h。训练日,每完成一次抗阻训练可以获得食块。当日训练结束后,计算抗阻训练组大鼠的平均进食量,非抗阻训练组大鼠获得等量的食物补充。每天训练结束后,除训练所获食物,每只大鼠补充约11 g食物。每周第5天训练结束后,所有大鼠补充50 g食物。根据预实验结果,这样的喂养使得大鼠有动力继续完成训练,保证实验过程中体重的增加,也满足了保持每天的能量消耗,每100 g体重消耗食物约5 g。
大鼠咬合干扰模型的建立:在第3周抗阻训练开始前,慢性咬肌痛组、慢性咬肌痛抗阻训练组施加咬合干扰。参考Cao等[10]实验方法,大鼠经乙醚轻度麻醉,取上颌藻酸盐(Heraeus-Kulzer,German)印模、灌制硬石膏模型,制作右侧上颌第一磨牙镍铬合金(Heraeus-Kulzer, German)牙冠。用游标卡尺确定厚度0.4 mm,对铸件进行打磨、抛光。大鼠于1%(质量分数)戊巴比妥钠(40 mg/kg,Sigma,USA)麻醉下采用树脂粘接剂(Panavia F,Kuraray,Japan)将牙冠粘接于右上第一磨牙。
大鼠咬肌机械刺激反应阈值的测定:实验采用盲法,测试者不清楚实验分组情况。使用头端改良的电子测痛仪(IITC life science, CA, USA)参考Cao等[10]方法测定大鼠双侧咬肌机械刺激反应阈值。在抗阻训练前、施加咬合干扰前、施加咬合干扰后每周1次测定大鼠双侧咬肌机械刺激反应阈值,共14次。测试时间固定于周六(10:00 ~12:00), 实验动物处于相同的环境内,每个位点重复测量5次,测量间隔1 min,取平均值。
做功量的计算:大鼠抗阻训练的做功量与克服负重的大小、垂直抬升的距离和抬升的次数相关。训练时的负重包括砝码、活塞的重力和连接于活塞的测距仪提供的阻力,砝码重50 g、100 g、200 g不等,活塞根据内孔直径大小不同分为140 g、180 g,测距仪阻力约240 g。每天训练时记录每只大鼠当天负重大小,垂直抬升距离精确记录于电子显示仪器。每天的做功量即为负重值乘抬升距离的总和。每周记录大鼠的体重,计算负重/体重比。
大鼠后肢肌力测定:借鉴De等[15]采用的抓力计原理和测试方法,自行设计并制作了大鼠抓力计(图2)。大鼠前肢及躯体放置于测试者左手,控制大鼠,后肢放置于抓网上。大鼠在被牵拉尾根部向后移动时会本能地抓住抓网以阻止后退,直到拉力超过大鼠后肢的抓力,自动记录抓力的最大值。在抗阻训练的最后一周每天重复测量3次,间隔5 min,连续测量3 d,取平均值。在抗阻训练结束后,用1%戊巴比妥钠麻醉大鼠,解剖双侧大鼠腓肠肌、比目鱼肌、腓骨,分离后称量肌肉质量、腓骨长度,计算肌肉质量/体重比、肌肉质量/腓骨长度比。
2.
大鼠后肢抓力计(A)及测试方法(B)
A grip strength meter (A) and the method of measurement (B)
The forelimbs and body of rat was held in the left hand. The hindlimbs was placed on the metal mesh. When the base of the tail was pulled gently by the right hand, the hindlimbs of rat would grip the metal mesh. The force was recorded by a force transducer connected to the metal mesh.
1.3. 统计学分析
使用SPSS 20.0统计软件,计量资料以均数±标准误表示,对各组不同时间点的机械刺激反应阈值采用重复测量方差分析,做Tukey后检验;对各组相同时间点的机械刺激反应阈值进行多元方差分析进行两两比较;大鼠后肢肌肉的评价结果采用多元方差分析。P<0.05认为差异有统计学意义。
2. 结果
2.1. 抗阻训练情况
经过初期2周抗阻训练建模,平均可抬升负重约(411±26) g,平均负重/体重比为175%±10%,组间(B组与D组)比较差异无统计学意义(P>0.05)。训练结束时,平均抬升负重约(599±80) g,平均负重/体重比为156%±15%,组间(B组与D组)比较差异无统计学意义(P>0.05)。大鼠平均每天抬升负重(35.4±8.8)次,平均每次抬升高度(4.69±0.23) cm。在抗阻训练第3周,大鼠平均做功量为(8.26±1.87) J/d,在抗阻训练的第14周,大鼠平均做功量为(9.11±2.50) J/d。
2.2. 各组大鼠双侧咬肌机械刺激反应阈值的变化
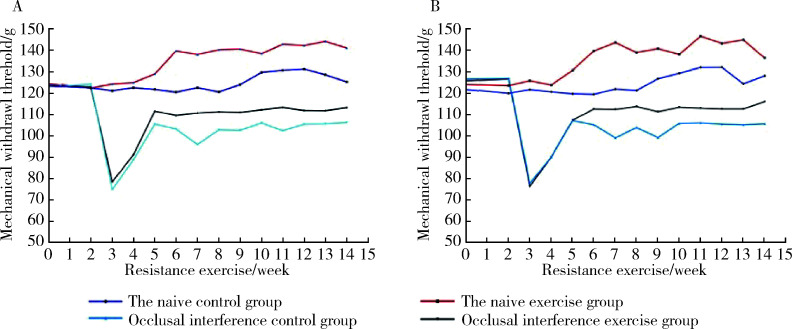
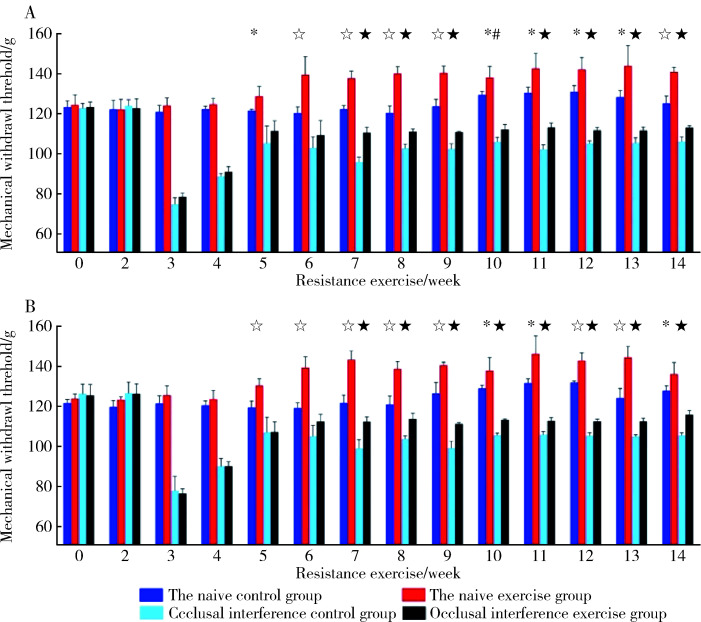
各组大鼠咬合干扰侧和非干扰侧咬肌机械刺激反应阈值差异无统计学意义(P>0.05,图3)。第2周施加0.4 mm咬合干扰后,第3~14周慢性咬肌痛组和慢性咬肌痛抗阻训练组大鼠阈值均出现明显下降(P<0.05),之后回升,但仍然分别与空白对照组和抗阻训练组差异有统计学意义(P<0.05)。抗阻训练组阈值在第5周开始大于空白对照组(P<0.05), 慢性咬肌痛抗阻训练组阈值在第7周开始大于慢性咬肌痛组(P<0.05), 直至抗阻训练第14周。各组双侧侧咬肌机械刺激反应阈值见图4。
3.
大鼠双侧咬肌机械刺激反应阈值的时间变化曲线(n=4)
Mechanical withdrawal threshold-time variation cure of bilateral masseter muscle(n=4)。。。
A, left masseter; B, right masseter.
4.
大鼠双侧咬肌机械刺激反应阈值。。。
Mechanical withdrawal thresholds of bilateral masseter muscle
A, left masseter; B, right masseter. * P<0.05, a significant difference between the naive control group and naive exercise group. ☆ P<0.01, a significant difference between the naïve control group and naïve exercise group. # P<0.05, a significant difference between the occlusal interference control group and occlusal interference exercise group. ★ P<0.01, a significant difference between the occlusal interference control group and occlusal interference exercise group. n=4.
2.3. 体重与后肢肌肉的评价
评价后肢肌肉时,大鼠分为抗阻训练大鼠(B+D组)和非抗阻训练大鼠(A组+C组)。抗阻训练结束后,体重与后肢抓力结果见表1,肌肉质量、肌肉/体重比和肌肉/腓骨长度比见表2。在实验开始时,抗阻训练大鼠和非抗阻训练大鼠间大鼠体重差异无统计学意义[非抗阻训练(240±2) g,抗阻训练(233±4) g, P>0.05]。14周的抗阻训练后,非抗阻训练大鼠体重明显大于抗阻训练大鼠(P<0.05),慢性咬肌痛大鼠(C组,D组)与非慢性咬肌痛大鼠(A组,B组)间体重差异无统计学意义(P>0.05),抗阻训练大鼠后肢抓力明显更高(P<0.01)。腓肠肌质量、比目鱼肌质量和腓骨长度在抗阻训练大鼠和非抗阻训练大鼠间差异无统计学意义(P>0.05), 抗阻训练大鼠的腓肠肌质量/体重比、比目鱼肌质量/体重比、腓肠肌质量/腓骨长度比明显更高(P<0.05), 抗阻训练大鼠的比目鱼肌质量/腓骨长度比均值更高,但右侧差异无统计学意义(P>0.05)。
1.
长期抗阻训练后体重和后肢抓力结果比较
Body mass and muscle strength of hindlimbs after long-term resistance exercise
| Items | Non-exercise group | Exercise group | P |
| n=8; * P<0.05, a significant difference. | |||
| Body mass/g, x±sx | 462±6 | 418±14 | 0.017* |
| Muscle strength/N, x±sx | 5.41±0.15 | 6.75±0.13 | <0.001* |
2.
后肢肌肉性能评价结果
The evaluation results of hindlimbs muscle
| Items | Left hindlimb | Right hindlimb | ||||
| Non-exercise group | Exercise group | P | Non-exercise group | Exercise group | P | |
| n=8; values are x±sx. Gast, gastrocnemius; Sol, soleus; * P<0.05, a significant difference. | ||||||
| Gast/mg | 2 799±86 | 2 947±97 | 0.278 | 2 831±75 | 2 977±80 | 0.232 |
| Sol/mg | 232±12 | 254±9 | 0.148 | 250±12 | 253±9 | 0.843 |
| Length of fibula/mm | 27.13±0.40 | 26.25±0.45 | 0.204 | 27.15±0.42 | 26.25±0.47 | 0.207 |
| Gast-mass/body-mass ratios/(mg/g) | 6.07±0.19 | 7.06±0.15 | 0.001* | 6.13±0.15 | 7.14±0.17 | 0.001* |
| Sol-mass/body-mass ratio/(mg/g) | 0.50±0.02 | 0.61±0.01 | <0.001* | 0.54±0.02 | 0.61±0.01 | 0.018* |
| Gast-mass/fibula-length ratios/(mg/mm) | 103±3 | 112±3 | 0.043* | 104±2 | 113±3 | 0.035* |
| Sol-mass/fibula-length ratios/(mg/mm) | 8.56±0.44 | 9.69±0.32 | 0.043* | 9.22±0.45 | 9.65±0.31 | 0.447 |
3. 讨论
几十年来人们建立了多种大鼠抗阻训练模型,尽可能仿照人的锻炼,用以研究骨骼肌与心肌的适应性改变、糖尿病患者体内的物质代谢水平和慢性疼痛症状的改善等[16,17,18,19]。常用的模型有尾部负重爬高法、上身负重蹲起法、深水法等,这些方法对大鼠有明显的束缚,或者对大鼠有不同程度的刺激,存在潜在的生理或心理应激反应。慢性疼痛与心理状态密切相关,在研究慢性疼痛时,需要一种心理应激反应小的抗阻训练模型[20,21,22]。食物诱导法是对饥饿大鼠给予食物奖赏来诱导负重练习,对大鼠损害小,造成的生理和心理应激微弱。因此,本研究采用食物诱导法建立大鼠抗阻训练模型,研究慢性咀嚼肌痛。
本研究的假设是,抗阻训练不但可以引起局部的肌肉适应性改变,还可以引起更高层次,如中枢神经系统的适应性改变,进而对慢性疼痛产生调节。因此,实验设计采用肌肉训练的方法,试图缓解慢性咬肌机械痛觉过敏。抗阻训练控制负重在体重的150%~200%,并且尽可能增加负荷。但是实验中发现,负重的增加很容易引起大鼠抗阻训练积极性的下降,并且,随着大鼠体重的增加,尽管负重/体重比不变,绝对负重仍明显增加。所以,既要维持负重/体重比在一定水平,又要保证积极性来完成一定时间内足够的训练量,是本研究在训练过程中时刻考虑权衡的问题。
本研究结果显示长期抗阻训练后,抗阻训练大鼠体重较非抗阻训练大鼠轻,与既往报道相一致[13,14]。抗阻训练大鼠后肢抓力明显较非抗阻训练大鼠高,提示大鼠运动能力的提高。而抗阻训练大鼠与非抗阻训练大鼠间肌肉质量和腓骨长度差异无统计学意义,肌肉/体重比的差异可能来源于大鼠体重的差异,与Norenberg等[14]的研究相一致。这提示14周的抗阻训练可能是通过改变肌肉收缩性能,而非肌肉的质量引起大鼠后肢运动能力的提高。Klitgaard[13]研究发现经过36周的抗阻训练,比目鱼肌和跖肌质量明显提高。在非食物诱导法建立的抗阻训练模型研究中,发现抗阻训练后跖肌、腓肠肌质量、拇长屈肌质量、肌纤维数目明显较非抗阻训练大鼠高,这可能与抗阻训练模型和训练时长不同有关[16,23-24]。食物诱导法为基础建立的模型,抗阻训练强度在14周内无法引起足够的肌肉质量改变,可能与肌纤维的种类及分布改变相关[14]。
本课题组前期动物实验发现,超过6 d的咬合干扰将引起不可逆的咀嚼肌机械痛觉过敏,咀嚼肌疼痛由急性转化为慢性[12,25]。大鼠施加咬合干扰后,初期在咬肌有P物质等表达,可能存在外周敏化机制[26],随着刺激时间延长,外周敏化进一步引起中枢敏化。中枢敏化主要指神经元的兴奋性改变,敏化的发生与不同形式、不同水平的神经元可塑性相关[27]。Cao等[11]前期研究发现在咬合干扰引起咀嚼肌痛觉过敏的同期,三叉神经脊束核尾侧亚核神经元反应高度活跃,中枢敏化参与了咬合干扰致大鼠慢性咀嚼肌疼痛的过程。近年来也有研究非神经元细胞,如胶质细胞在疼痛的产生与维持中发挥的作用[28,29]。在三叉神经神经病理性疼痛模型中,已证实三叉神经脊束核尾侧亚核区的胶质细胞被激活[30]。
大量研究证实EIH存在广泛的外周和中枢机制[9,31-33]。在神经病理性疼痛的动物模型研究中,采用跑步机法或游泳法抗阻训练,发现了在外周神经中TNF-α和IL-1β水平下调[34,35]。Katsuya等[36]研究跑步机法抗阻训练对神经病理性疼痛的影响,发现了γ-氨基丁酸(gamma-aminobutyric acid, GABA)的反应性变化。抗阻训练上调了脊髓背角区GABA的表达,通过GABA的抑制作用,降低了对疼痛刺激的敏感性。在脑干水平,存在以中脑导水管周围灰质(midbrain periaqueductal grey,PAG)和延脑头端腹内侧区(rostroventral medulla,RVM)为核心的内源性下行抑制通路[37],该通路向下调节脊髓背角区GABA能神经元,进而调节伤害的感受。研究也发现了脑干区存在5-羟色胺(5-HT)下行通路,可以产生下行抑制或下行易化。Bobinski等[38]研究跑步机法抗阻训练对神经病理性疼痛的影响,发现抗阻训练可以提高5-HT及其受体水平,提示EIH可能与5-HT下行抑制通路相关。本研究发现,抗阻训练组双侧咬肌机械刺激反应阈值在第5周开始大于空白对照组(P<0.05),慢性咬肌痛抗阻训练组阈值在第7周开始大于慢性咬肌痛组(P<0.05)。健康大鼠和慢性咬肌痛觉过敏大鼠在长期抗阻训练后,双侧咬肌机械痛觉敏感性均降低,可能是由于口颌面部疼痛存在类似于GABA或者5-HT的下行抑制通路,抗阻训练可以调节这一通路。但是,对于慢性咬肌痛觉过敏大鼠,抗阻训练后双侧咬肌机械刺激反应阈值尚未恢复到正常水平,这需要后续实验增加抗阻训练强度进一步观察影响程度。
综上所述,长期抗阻训练可以降低健康大鼠和慢性咬肌痛觉过敏大鼠双侧咬肌机械痛觉敏感性。
Funding Statement
北京市自然科学基金(7174364)
Supported by Beijing Natural Science Foundation(7174364)
Footnotes
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
Contributor Information
杨 广聚 (Guang-ju YANG), Email: 15201304340@163.com.
谢 秋菲 (Qiu-fei XIE), Email: xieqiuf@163.com.
References
- 1.Soyannwo OA. Improved neuropathic pain treatment in developing countries-a critical review of WHO essential list. Pain. 2015;156(5):763–764. doi: 10.1097/j.pain.0000000000000140. [DOI] [PubMed] [Google Scholar]
- 2.Cavalieri TA. Management of pain in older adults. J Am Osteopath Assoc. 2005;105(Suppl 3):12–19. [PubMed] [Google Scholar]
- 3.Dworkin RH, O’Connor AB, Audette J, et al. Recommendations for the pharmacological management of neuropathic pain: an overview and literature update. Mayo Clin Proc. 2010;85(3):S3–S14. doi: 10.4065/mcp.2009.0649. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.O’Connor AB, Dworkin RH. Treatment of neuropathic pain: an overview of recent guidelines. Am J Med. 2009;122(Suppl 10):S22–S32. doi: 10.1016/j.amjmed.2009.04.007. [DOI] [PubMed] [Google Scholar]
- 5.Latham N, Liu C. Strength training in older adults: the benefits for osteoarthritis. Clin Geriatr Med. 2010;26(3):445–459. doi: 10.1016/j.cger.2010.03.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Jansen M J, Viechtbauer W, Lenssen AF, et al. Strength training alone, exercise therapy alone, and exercise therapy with passive manual mobilisation each reduce pain and disability in people with knee osteoarthritis: a systematic review. J Physiother. 2011;57(1):11–20. doi: 10.1016/S1836-9553(11)70002-9. [DOI] [PubMed] [Google Scholar]
- 7.Strasser B, Leeb G, Strehblow C, et al. The effects of strength and endurance training in patients with rheumatoid arthritis. Clin Rheumatol. 2011;30(5):623–632. doi: 10.1007/s10067-010-1584-2. [DOI] [PubMed] [Google Scholar]
- 8.Harts CC, Helmhout PH, de Bie RA, et al. A high-intensity lumbar extensor strengthening program is little better than a low-intensity program or a waiting list control group for chronic low back pain: a randomised clinical trial. Aust J Physiother. 2008;54(1):23–31. doi: 10.1016/s0004-9514(08)70062-x. [DOI] [PubMed] [Google Scholar]
- 9.Kami K, Tajima F, Senba E. Exercise-induced hypoalgesia: potential mechanisms in animal models of neuropathic pain. Anat Sci Int. 2017;92(1):79–90. doi: 10.1007/s12565-016-0360-z. [DOI] [PubMed] [Google Scholar]
- 10.Cao Y, Xie QF, Li K, et al. Experimental occlusal interference induces long-term masticatory muscle hyperalgesia in rats. Pain. 2009;144(3):287–293. doi: 10.1016/j.pain.2009.04.029. [DOI] [PubMed] [Google Scholar]
- 11.Cao Y, Li K, Fu KY, et al. Central sensitization and MAPKs are involved in occlusal interference-Induced facial pain in rats. J Pain. 2013;14(8):793–807. doi: 10.1016/j.jpain.2013.02.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.李 雪姣, 曹 烨, 谢 秋菲, et al. 牙合干扰致大鼠咀嚼肌机械痛觉过敏的特点研究. 中华口腔医学杂志. 2014;49(10):596–599. [PubMed] [Google Scholar]
- 13.Klitgaard H. A model for quantitative strength training of hindlimb muscles of the rat. J Appl Physiol. 1988;64(4):1740–1745. doi: 10.1152/jappl.1988.64.4.1740. [DOI] [PubMed] [Google Scholar]
- 14.Norenberg KM, Fitts RH. Contractile responses of the rat gastrocnemius and soleus muscles to isotonic resistance exercise. J Appl Physiol. 2004;97(6):2322–2332. doi: 10.1152/japplphysiol.00955.2003. [DOI] [PubMed] [Google Scholar]
- 15.De LA, Pierno S, Liantonio A, et al. Enhanced dystrophic progression in mdx mice by exercise and beneficial effects of taurine and insulin-like growth factor-1. J Pharmacol Exp Ther. 2003;304(1):453–463. doi: 10.1124/jpet.102.041343. [DOI] [PubMed] [Google Scholar]
- 16.Jr HT, Farrar RP. Physiological hypertrophy of the FHL muscle following 8 weeks of progressive resistance exercise in the rat. Can J Appl Physiol. 2004;29(1):16–31. doi: 10.1139/h04-002. [DOI] [PubMed] [Google Scholar]
- 17.Alves JP, Nunes RB, Stefani GP, et al. Resistance training improves hemodynamic function, collagen deposition and inflammatory profiles: experimental model of heart failure. PLoS One. 2014;9(10):e110317. doi: 10.1371/journal.pone.0110317. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Lee S, Farrar RP. Resistance training induces muscle-specific changes in muscle mass and function in rat. J Exerc Physiol Online. 2003;6(2):80–87. [Google Scholar]
- 19.Safarzade A, Talebigarakani E. Short term resistance training enhanced plasma apoA-I and FABP4 levels in streptozotocin-induced diabetic rats. J Diabetes Metab Disord. 2014;13(1):41. doi: 10.1186/2251-6581-13-41. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Gerrits MM, Van Oppen P, Leone SS, et al. Pain, not chronic disease, is associated with the recurrence of depressive and anxiety disorders. BMC psychiatry. 2014;14(1):187–198. doi: 10.1186/1471-244X-14-187. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Yazdi M, Yilmaz Z, Renton T, et al. Psychological morbidity in chronic orofacial pain and headaches. Oral Surgery. 2012;5(4):173–181. [Google Scholar]
- 22.Weisberg JN, Boatwright BA. Mood, anxiety and personality traits and states in chronic pain. Pain. 2007;133(1/2/3):1–2. doi: 10.1016/j.pain.2007.10.005. [DOI] [PubMed] [Google Scholar]
- 23.Tamaki T, Uchiyama S, Nakano S. A weight-lifting exercise model for inducing hypertrophy in the hindlimb muscles of rats. Med Sci Sports Exerc. 1992;24(8):881–886. [PubMed] [Google Scholar]
- 24.Legerlotz K, Schjerling P, Langberg H, et al. The effect of running, strength, and vibration strength training on the mechanical, morphological, and biochemical properties of the Achilles tendon in rats. J Appl Physiol. 2007;102(2):564–572. doi: 10.1152/japplphysiol.00767.2006. [DOI] [PubMed] [Google Scholar]
- 25.刘 存瑞, 徐 啸翔, 曹 烨, et al. 咬合干扰时间因素对大鼠咀嚼肌机械痛觉敏感的影响. 北京大学学报(医学版) 2016;48(1):51–56. [PubMed] [Google Scholar]
- 26.曹 烨, 李 锴, 傅 开元, et al. 咬合干扰致大鼠咬肌组织蛋白基因产物及P物质表达变化. 北京大学学报(医学版) 2010;42(1):50–55. [PubMed] [Google Scholar]
- 27.Merrill RL. Central mechanisms of orofacial pain. Dent Clin North Am. 2007;51(1):45–59. doi: 10.1016/j.cden.2006.09.010. [DOI] [PubMed] [Google Scholar]
- 28.刘 念, 臧 凯凯, 张 玉秋. 外周神经损伤小鼠不同脊髓节段小胶质细胞和星形胶质细胞的激活状态. 生理学报. 2015;67(6):571–582. [PubMed] [Google Scholar]
- 29.高 永静, 纪 如荣. 星形胶质细胞调节慢性疼痛的分子机制. 中国疼痛医学杂志. 2013;19(9):545–552. [Google Scholar]
- 30.Piao ZG, Cho IH, Park CK, et al. Activation of glia and microglial p38 MAPK in medullary dorsal horn contributes to tactile hypersensitivity following trigeminal sensory nerve injury. Pain. 2006;121(3):219–231. doi: 10.1016/j.pain.2005.12.023. [DOI] [PubMed] [Google Scholar]
- 31.Kuphal KE, Fibuch EE, Taylor BK. Extended swimming exercise reduces inflammatory and peripheral neuropathic pain in rodents. J Pain. 2007;8(12):989–997. doi: 10.1016/j.jpain.2007.08.001. [DOI] [PubMed] [Google Scholar]
- 32.Shen J, Fox LE, Cheng J. Swim therapy reduces mechanical allodynia and thermal hyperalgesia induced by chronic constriction nerve injury in rats. Pain Med. 2013;14(4):516–525. doi: 10.1111/pme.12057. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Koltyn KF, Brellenthin AG, Cook DB, et al. Mechanisms of exercise-induced hypoalgesia. J Pain. 2014;15(12):1294–1304. doi: 10.1016/j.jpain.2014.09.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Chen YW, Li YT, Chen YC, et al. Exercise training attenuates neuropathic pain and cytokine expression after chronic constriction injury of rat sciatic nerve. Anesth Analg. 2012;114(6):1330–1337. doi: 10.1213/ANE.0b013e31824c4ed4. [DOI] [PubMed] [Google Scholar]
- 35.Bobinski F, Martins DF, Bratti T, et al. Neuroprotective and neuroregenerative effects of low-intensity aerobic exercise on sciatic nerve crush injury in mice. Neuroscience. 2011;194:337–348. doi: 10.1016/j.neuroscience.2011.07.075. [DOI] [PubMed] [Google Scholar]
- 36.Katsuya K, Taguchi MS, Fumihiro T, et al. Improvements in impaired GABA and GAD65/67 production in the spinal dorsal horn contribute to exercise-induced hypoalgesia in a mouse model of neuropathic pain [J/OL]. Mol Pain, 2016, 12[2018-10-01]. https://doi.org/10.1177/1744806916629059.
- 37.Millan MJ. Descending control of pain. Prog Neurobiol. 2002;66(6):355–474. doi: 10.1016/s0301-0082(02)00009-6. [DOI] [PubMed] [Google Scholar]
- 38.Bobinski F, Taa F, Córdova MM, et al. Role of brainstem serotonin in analgesia produced by low-intensity exercise on neuropathic pain after sciatic nerve injury in mice. Pain. 2015;156(12):2595–2606. doi: 10.1097/j.pain.0000000000000372. [DOI] [PMC free article] [PubMed] [Google Scholar]