Abstract
Introducción
El seguimiento telefónico es una posible alternativa para la atención médica de niños con COVID-19. Nuestro objetivo es describir la experiencia del seguimiento telemático realizado en un hospital terciario.
Pacientes y métodos
Estudio descriptivo retrospectivo de los niños con diagnóstico confirmado o probable de COVID-19 atendidos en la consulta de seguimiento del Hospital La Paz entre marzo y junio del 2020. Se realizaron llamadas cada 48 h hasta desaparecer los síntomas y posteriormente semanales hasta estar 14 días asintomáticos.
Resultados
Se incluyó a 72 niños con una mediana de edad de 83,5 meses (RIC = 16,3-157,5); 46 eran varones (63,9%) y 14 tenían comorbilidades (19,4%); 32 pacientes (44,4%) habían requerido ingreso hospitalario. Se confirmó diagnóstico de COVID-19 en 33 niños por PCR y en 7 por serología. De los confirmados por PCR, seroconvirtió el 67,7%. Se demostraron otras etiologías en 7 pacientes (5 Mycoplasma pneumoniae, uno parvovirus y uno citomegalovirus).
La mediana de duración de síntomas fue 25,5 días (RIC = 13,8-37), con mediana de tiempo de seguimiento de 28 días (RIC = 21-39). Se realizó una mediana de 6 llamadas (RIC = 4-8) por niño; 19 pacientes (26,4%) refirieron empeoramiento en el seguimiento, precisando 14 (19,4%) ser revaluados en Urgencias. Un niño necesitó reingresar, siendo la evolución favorable.
Conclusiones
Ante sospecha de COVID-19, es recomendable el seguimiento médico por la prolongada duración de síntomas y el riesgo de empeoramiento. Las consultas telefónicas son útiles y seguras para el seguimiento de casos leves y pacientes hospitalizados tras el alta, permitiendo reducir controles presenciales y el consumo de otros recursos.
Palabras clave: Pediatría, Telemedicina, Infección por coronavirus, Test serológicos
Abstract
Introduction
Telemedicine is an attractive option for the follow-up of paediatric patients with SARS-CoV-2 infection. The aim of this article is to describe the experience with telephone consultations in a tertiary hospital.
Patients and methods
Retrospective descriptive study of children with confirmed or probable diagnosis of COVID-19 attended by telephone consultations in Hospital La Paz (Madrid) between March and June 2020. Patients were referred from the Emergency Department after being discharged from the hospital. Telephone consultations were made every 48 hours until symptoms resolved, then weekly until completing 14 days without symptoms.
Results
A total of 72 children were included, with median age of 83.5 months (IQR = 16.3-157.5). Of those 46 (63.9%) were male, and 14 (19.4%) had comorbidities. There were 32 (44.4%) hospital admissions. COVID-19 diagnosis was confirmed in 33 children by RT-PCR, and in 7 by serology tests. The seroconversion rate was 67.7% in those patients with a positive RT-PCR. Other infections were found in 7 patients (5 Mycoplasma pneumoniae, 1 parvovirus, and 1 cytomegalovirus).
Median symptom duration was 25.5 days (IQR = 13.8-37), while median follow-up duration was 28 days (IQR = 21-39). The median number of telephone consultations per patient was 6 (IQR = 4-8). Clinical worsening was reported in 19 (26.4%) during follow-up, and 14 (19.4%) were re-evaluated in the Emergency Department. One patient required hospital admission, but he had a favourable outcome.
Conclusions
Children with suspected SARS-CoV-2 infection should be followed-up due to prolonged duration of symptoms, and the risk of clinical deterioration. Telephone consultations are a useful and safe alternative for the follow-up of patients with mild symptoms, and for children discharged from the hospital.
Keywords: Paediatrics, Telemedicine, Coronavirus infections, Serological tests
Introducción
Desde diciembre del 2019, la infección por SARS-CoV-2 (COVID-19) se ha extendido rápidamente por todo el mundo originando una pandemia1. Tras la epidemia inicial en China, Europa se convirtió en el epicentro de la pandemia2. Los datos publicados sugieren que el curso clínico es habitualmente leve en niños, aunque un pequeño porcentaje puede evolucionar de forma grave precisando incluso ingreso en unidades de Cuidados Intensivos3, 4, 5.
España ha sido uno de los países más castigados, con 285.430 casos confirmados a fecha del 30 de julio del 2020, siendo la Comunidad de Madrid (CAM) la que ha acumulado el mayor número de casos6. En el momento álgido de la epidemia, la asistencia pediátrica en la CAM se limitó únicamente al Hospital Universitario La Paz (HULP) y al Hospital Universitario Infantil Niño Jesús7, redistribuyendo el resto de urgencias pediátricas y plantas de hospitalización de otros hospitales a la atención de adultos con COVID-19.
Debido a la sobrecarga asistencial generada por la pandemia, y en un intento de limitar la diseminación de la infección, se ha propuesto en múltiples guías clínicas8, 9, 10 el seguimiento telefónico como alternativa para el manejo de casos leves de COVID-19 que no precisan ingreso y para continuar la atención médica de los pacientes hospitalizados tras el alta.
Los objetivos de este trabajo son describir y evaluar la experiencia del seguimiento telemático de los pacientes con diagnóstico o sospecha de COVID-19 y detallar las características y la evolución clínica de estos menores.
Pacientes y Métodos
Estudio descriptivo retrospectivo. Se revisaron los informes médicos de la historia clínica de los pacientes de 0 a 18 años con diagnóstico confirmado o probable de COVID-19 atendidos en la consulta de seguimiento telefónico del HULP del 20 de marzo del 2020 al 20 de junio del 2020. El estudio fue aprobado por el Comité Ético de Investigación Clínica del HULP (código PI-4212). Se solicitó consentimiento telefónico para participar en el estudio, quedando registrado en la historia clínica. Todos los datos extraídos de la historia clínica informatizada fueron anonimizados en la base de datos previo a su análisis.
Se incluyó a todos los pacientes atendidos en la consulta de seguimiento telefónico con diagnóstico confirmado o probable de COVID-19 cuyos padres, o ellos mismos en caso de ser menores maduros, aceptaron participar en el estudio. Se excluyó a los niños en los que no fue posible realizar el seguimiento telefónico.
Se consideró diagnóstico confirmado (COVID-19 confirmado) cuando existía PCR de SARS-CoV-2 positiva en exudado nasofaríngeo o resultado positivo de serología de SARS-CoV-2.
Se consideró diagnóstico probable (COVID-19 no confirmado) cuando se cumplieron al menos 2 de los siguientes criterios:
-
–
Criterio clínico: cualquiera de los siguientes:
-
a.
Infección respiratoria aguda.
-
b.
Síndrome febril sin foco o acompañado de cefalea intensa o anosmia/disgeusia o lesiones distales acroisquémicas.
-
c.
Cuadro clínico compatible con síndrome inflamatorio pediátrico multisistémico temporalmente asociado a SARS-CoV-2 (PIMS), según los criterios definidos por la OMS11.
-
–
Criterio analítico: analítica de sangre con al menos 2 hallazgos característicos de infección por COVID-19 (dímero D elevado, linfopenia, hiperferritinemia o aumento de interleucina-6).
-
–
Criterio radiológico: prueba de imagen torácica con hallazgos indicativos de COVID-19.
-
–
Criterio epidemiológico: contacto reciente y estrecho (más de 15 min a menos de 2 m de distancia) con algún paciente con diagnóstico confirmado de COVID-19 o con personal sanitario con exposición de alto riesgo.
Se consideraron los siguientes síndromes según las manifestaciones clínicas predominantes: síndrome respiratorio, fiebre sin foco, PIMS, síndrome constitucional (febrícula prolongada, astenia intensa o cefalea), asintomático, otros.
La consulta telefónica se habilitó dentro del área de consultas externas del Servicio de Pediatría, Enfermedades Infecciosas y Tropicales del HULP. Fue creada específicamente para el seguimiento de estos pacientes el 20 de marzo del 2020. Los menores eran citados en la consulta desde urgencias pediátricas o al ser dados de alta del hospital. Desde urgencias pediátricas solamente se derivaba a pacientes seleccionados por ser grupos de riesgo o precisar seguimiento estrecho, mientras que todos los menores que habían estado ingresados eran citados en la consulta. Las entrevistas telefónicas se realizaron siguiendo un cuestionario estructurado (anexo 2) sobre sintomatología y tratamiento recibido quedando registrado en la historia clínica informatizada. Las llamadas fueron realizadas por un facultativo pediatra entrenado del Servicio de Enfermedades Infecciosas Pediátricas.
Se realizaron llamadas cada 24-72 h, mientras el paciente presentaba sintomatología activa o estaba recibiendo algún tratamiento específico, y posteriormente cada 5-7 días hasta cumplir 14 días asintomáticos. Se facilitó a las familias un teléfono de contacto por si necesitaban consultar o adelantar la cita telefónica. En caso de considerarlo necesario, el facultativo recomendó nueva valoración presencial en Urgencias Pediátricas o realización de exploraciones complementarias.
Se ofreció a todos los pacientes la realización de serología de SARS-CoV-2 para confirmar el diagnóstico o comprobar si se había producido seroconversión. Se empleó un test de quimioluminiscencia de las casas comerciales Abbott, Siemens y Vircell.
Análisis estadístico
Se estudiaron las variables epidemiológicas de los pacientes, la sintomatología y su duración, las pruebas complementarias realizadas, los tratamientos empleados, el tiempo de seguimiento, el número de llamadas realizadas y la evolución clínica durante el seguimiento. Se evaluó el empeoramiento de los pacientes según lo referido por los familiares y la necesidad de ser atendido de nuevo en urgencias pediátricas o reingresar. Los resultados de las variables cualitativas se expresaron con porcentajes. Los resultados de las variables cuantitativas se describieron con medianas y rangos intercuartílicos.
Se compararon las características de los pacientes con diagnóstico confirmado de COVID-19 y los pacientes con diagnóstico probable. Las diferencias entre grupos en variables categóricas se analizaron mediante el test exacto de Fisher. En variables continuas se analizaron las diferencias con el test no paramétrico U de Mann-Whitney. Se consideró un nivel de significación estadística del 5% (p ≤ 0,05).
El análisis estadístico se realizó con el programa IBM SPSS Statistics (SPSS Statistics for Windows, Versión 22.0; IBM Corp. Armonk, NY, EE. UU.).
Resultados
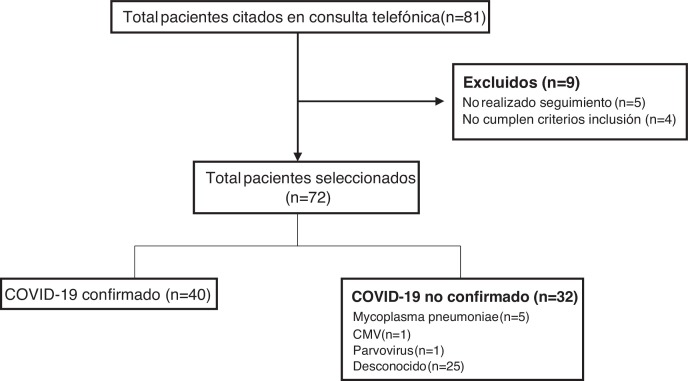
Durante el periodo de estudio se citaron en la consulta de seguimiento telemático un total de 81 pacientes, de los cuales 72 cumplieron criterios, realizaron el seguimiento y fueron incluidos en el estudio (fig. 1 ). En 40 pacientes (55,5%) se confirmó el diagnóstico de COVID-19 (33 por PCR SARS-CoV-2 y 7 por serología), mientras que en 25 niños (34,7%) no se identificó ningún agente causal. Otras etiologías encontradas fueron Mycoplasma pneumoniae en 5 pacientes (6,9%), citomegalovirus (CMV) en un paciente (1,4%) y parvovirus en un paciente (1,4%).
Figura 1.
Diagrama de selección de pacientes.
En la tabla 1 están resumidas las características epidemiológicas y las manifestaciones clínicas de los pacientes. Las pruebas complementarias y tratamientos empleados se muestran en la tabla 2 . Se observó un mayor porcentaje de ingresos hospitalarios en aquellos con diagnóstico confirmado de COVID-19 (p ≤ 0,004). Además, los pacientes con diagnóstico confirmado de COVID-19 presentaron valores significativamente mayores de lactato deshidrogenasa (p ≤ 0,038) y procalcitonina (p ≤ 0,018). No se encuentran diferencias significativas entre grupos en el resto de variables.
Tabla 1.
Características epidemiológicas y cuadro clínico de los pacientes
| Total | COVID-19 confirmado | COVID-19 no confirmado | p | |
|---|---|---|---|---|
| N.° pacientes, n (%) | 72 (100) | 40 (55,5) | 32 (44,5) | |
| Sexo, n (%) | 0,622 | |||
| Hombre | 46 (63,9) | 27 (67,5) | 19 (59,4) | |
| Mujer | 26 (36,1) | 13 (32,5) | 13 (40,6) | |
| Edad (meses); mediana (RIC) | 83,5 (16,3-157,5) | 76,5 (3,5-161,5) | 94 (33-129,8) | 0,642 |
| Comorbilidad, n (%) | ||||
| Cualquiera | 14 (19,4) | 6 (15) | 8 (25) | 0,373 |
| Cardiopatía | 4 (5,6) | 3 (7,5) | 1 (3,1) | |
| Neumopatía o Asma | 4 (5,6) | 1 (2,5) | 1 (3,1) | |
| Nefropatía | 2 (2,8) | 1 (2,5) | 3 (9,4) | |
| Otros | 4 (5,6) | 1 (2,5) | 3 (9,4) | |
| Ingreso, n (%) | ||||
| En planta | 32 (44,4) | 24 (60) | 8 (25) | 0,004 |
| En UCIP | 3 (4,2) | 3 (7,5) | 0 | 0,249 |
| Síndrome, n (%) | ||||
| Respiratorio | 48 (66,7) | 26 (65) | 22 (68,8) | a |
| Síndrome «constitucional» | 8 (11,1) | 2 (5) | 6 (18,8) | |
| Fiebre sin foco | 7 (9,7) | 4 (10) | 3 (9,4) | |
| PIMS | 2 (2,8) | 2 (5) | 0 | |
| Asintomático | 1 (1,4) | 1 (2,5) | 0 | |
| Otros | 6 (8,3) | 5 (12,5) | 1 (3,1) | |
| Síntomas, n (%) | ||||
| Fiebre/Febrícula | 59 (81,9) | 32 (80) | 27 (84,4) | 0,762 |
| Tos | 57 (79,2) | 30 (75) | 27 (84,4) | 0,392 |
| Cefaleab | 28 (56) | 16 (64) | 12 (46,2) | 0,154 |
| Diarrea | 36 (50) | 20 (50) | 16 (50) | 1,000 |
| Rinorrea | 29 (40,3) | 17 (42,5) | 12 (37,5) | 0,810 |
| Dificultad respiratoria | 23 (31,9) | 12 (30) | 11 (34,4) | 0,801 |
| Lesiones cutáneas | 19 (26,4) | 10 (25) | 9 (28,1) | 0,794 |
| Mialgiasb | 15 (29,4) | 9 (36) | 6 (23) | 0,353 |
| Vómitos | 15 (20,8) | 10 (25) | 5 (15,6) | 0,392 |
| Astenia | 15 (20,8) | 7 (17,5) | 8 (25) | 0,562 |
| Dolor abdominal | 13 (18,3) | 7 (17,9) | 6 (18,8) | 1,000 |
| Odinofagiab | 12 (22,6) | 8 (33,3) | 4 (16) | 0,196 |
| Anosmia/disgeusiab | 11 (22,4) | 5 (20,8) | 6 (24) | 1,000 |
| Neurológico (otros) | 4 (5,6) | 2 (5) | 2 (6,3) | 1,000 |
Test exacto de Fisher no aplicable por variable de más de 2 categorías.
Las variables cefalea, mialgias y anosmia/disgeusia se consideraron como valores perdidos en menores de 3 años. La variable odinofagia se consideró como valor perdido en menores de 2 años.
Tabla 2.
Pruebas complementarias y tratamientos administrados
| Total | COVID-19 confirmado | COVID-19 no confirmado | p | |
|---|---|---|---|---|
| N.° pacientes, n (%) | 72 (100) | 40 (55,5) | 32 (44,5) | |
| Radiografía tórax, n (%) | ||||
| Normal | ||||
| Infiltrado intersticial | 19 (26,4) | 10 (25) | 9 (28,1) | a |
| Neumonía unilateral | 28 (38,9) | 15 (37,5) | 13 (40,6) | |
| Neumonía bilateral | 10 (13,9) | 6 (15) | 4 (12,5) | |
| No realizada | 6 (8,3) | 2 (5) | 4 (12,5) | |
| 9 (12,5) | 7 (17,5) | 2 (6,3) | ||
| Analítica de sangre; mediana (RIC) | ||||
| Linfocitos (cel/mm3) | 2260 (1445-3422,5) | 1880 (1000-3360) | 2410 (1750-3610) | 0,390 |
| Dímero D (ng/ml) | 725 (442,5-1387) | 844 (639-1612,3) | 620 (390-1040) | 0,064 |
| LDH (UI/l) | 304 (271-385) | 345 (285-404) | 284 (270,3-311,8) | 0,038 |
| Ferritina (ng/ml) | 62,5 (39,3-143,3) | 112 (38,8-571,5) | 45,5 (38-126,8) | 0,274 |
| PCR (mg/l) | 7,45 (0,5-41,8) | 7,45 (0,6-56,45) | 9,6 (0,5-41,6) | 0,363 |
| PCT (ng/ml) | 0,09 (0,05-0,15) | 0,11 (0,07-0,18) | 0,05 (0,03-0,11) | 0,018 |
| Linfopenia, n (%) | 20 (32,3) | 14 (40) | 6 (22,2) | 0,176 |
| Oxigenoterapia, n (%) | ||||
| No | ||||
| Gafas nasales | 56 (77,8) | 28 (70) | 28 (87,5) | 0,093 |
| Reservorio | 16 (22,2) | 12 (30) | 4 (12,5) | 0,093 |
| Oxígeno alto flujo | 3 (4,2) | 3 (7,5) | 0 | 0,249 |
| VMNIb | 1 (1,4) | 1 (2,5) | 0 | 1,000 |
| 1 (1,4) | 1 (2,5) | 0 | 1,000 | |
| Tratamiento, n (%) | ||||
| Antiviral | ||||
| Hidroxicloroquina | 36 (50) | 24 (60) | 12 (37,5) | 0,096 |
| Lopinavir/ritonavir | 1 (1,4) | 1 (2,5) | 0 | 1,000 |
| Remdesivir | 1 (1,4) | 1 (2,5) | 0 | 1,000 |
| Antibiótico | ||||
| Azitromicina | 17 (23,6) | 9 (22,5) | 8 (25) | 1,000 |
| Otros antibióticos | 32 (44,4) | 21 (52,5) | 11 (34,4) | 0,155 |
| Inmunomodulador | ||||
| Tocilizumab | 2 (2,8) | 2 (5) | 0 | 0,499 |
| Corticoide | 1 (1,4) | 1 (2,5) | 0 | 1,000 |
| Gammaglobulina | 1 (1,4) | 1 (2,5) | 0 | 1,000 |
| Antiagregante | ||||
| Ácido acetilsalicílico | 1 (1,4) | 1 (2,5) | 0 | 1,000 |
Test exacto de Fisher no aplicable por variable de más de 2 categorías.
VMNI: ventilación mecánica no invasiva; RIC: rango intercuartílico; LDH: lactato deshidrogenasa; PCR: proteína C reactiva; PCT: procalcitonina; COVID-19: enfermedad por SARS-CoV-2.
El resultado de las pruebas microbiológicas realizadas para el diagnóstico de COVID-19 se muestra en la tabla 3 . Se realizó PCR de SARS-CoV-2 a 71 pacientes (98,6%), siendo positiva en 33 (46,5%). Se realizó serología de SARS-CoV-2 a 67 niños (93,1%), detectándose anticuerpos en 28 de ellos (41,8%). De los 31 menores con PCR de SARS-CoV-2 positiva a los que se realizó serología, se observó seroconversión en 21 (67,7%). Además, el estudio serológico permitió llegar al diagnóstico de COVID-19 en 4 niños con PCR de SARS-CoV-2 negativa y en 3 con PCR SARS-CoV-2 indeterminada.
Tabla 3.
Pruebas microbiológicas para diagnóstico de COVID-19
| PCR SARS-CoV-2 no realizada: 1 | PCR SARS-CoV-2 indeterminada: 8 (11,3%) | PCR SARS-CoV-2 negativa: 30 (42,3%) | PCR SARS-CoV-2 positiva: 33 (46,4%) | |
|---|---|---|---|---|
| Serología no realizada: 5 | 0 | 0 | 3 | 2 |
| Serología negativa: 39 (58,2%) | 1 | 5 | 23 | 10 |
|
Serología positiva: 28 (41,8%) IgM positiva, IgG negativa 1 (1,4%) IgM positiva, IgG positiva 5 (6,9%) gM negativa, IgG positiva 22 (30,6%) |
0 | 3 | 4 | 21 |
Respecto al seguimiento telefónico (tabla 4 ), se observó una duración total de los síntomas significativamente mayor en los pacientes sin diagnóstico confirmado de COVID-19 (p ≤ 0,005). Ser mujer se asoció con mayor tasa de empeoramiento (p ≤ 0,028) y más visitas a urgencias (p ≤ 0,027) durante el seguimiento. Treinta niños (41,7%) refirieron aparición de síntomas nuevos durante el seguimiento: 14 síntomas digestivos (diarrea o dolor abdominal), 6 síntomas respiratorios, 4 síntomas cutáneos (exantema, descamación o acrovasculitis), 3 reaparición de fiebre y 7 otros síntomas. En 12 de los 14 pacientes con síntomas digestivos (85,7%) se sospechó que la causa fue un efecto secundario de amoxicilina/clavulánico o hidroxicloroquina. Un total de 14 niños (19,4%) precisaron ser valorado de nuevo en Urgencias Pediátricas durante el seguimiento. Un paciente de 3 años, en seguimiento por el Servicio de Reumatología por cojera y fiebre recurrente, necesitó reingresar un mes después de finalizar el seguimiento telefónico por un cuadro clínico indicativo de PIMS. No se confirmó el diagnóstico de COVID-19 y la evolución fue favorable sin precisar tratamiento específico. Ningún otro paciente precisó ser hospitalizado de nuevo.
Tabla 4.
Seguimiento telefónico
| Total | COVID-19 confirmado | COVID-19 no confirmado | p | |
|---|---|---|---|---|
| Duración fiebre/febrícula (días), mediana (RIC) | 6 (2-13,8) | 4 (1,3-11,5) | 8,5 (2,3-28) | 0,128 |
| Duración síntomas (días), mediana (RIC) | 25,5 (13,8-37) | 17 (10-32) | 30 (20-48) | 0,005 |
| Tiempo seguimiento (días), mediana (RIC) | 28 (21-39) | 29 (21-39) | 25 (20,3-37,3) | 0,764 |
| Llamadas realizadas; mediana (RIC) | 6 (4-8) | 6 (4-8) | 6 (4,3-8,8) | 0,533 |
| Síntomas nuevos en el seguimiento, n (%) | 30 (41,6) | 16 (40) | 14 (43,8) | 0,812 |
| Reacciones adversas fármacos, n (%) | 12 (16,7) | 7 (18) | 5 (15,6) | 1,000 |
| Empeoramiento en el seguimiento, n (%) | 19 (26,4) | 9 (22,5) | 10 (31,3) | 0,432 |
| Revisita urgencias, n (%) | 14 (19,4) | 6 (15) | 8 (25) | 0,373 |
| Reingreso, n (%) | 1 (1,4) | 0 | 1 (3,1) | 0,444 |
Ocho pacientes (11,1%) presentaron un cuadro clínico compatible con síndrome constitucional. Dos fueron diagnosticados de COVID-19 y otro de infección por parvovirus, siendo la etiología desconocida en el resto de los casos. Los menores con síndrome constitucional se caracterizaron por manifestaciones clínicas significativamente más prolongadas (p ≤ 0,005), con una mediana de duración de la febrícula de 53,5 días (RIC = 12,3-64,5) y del conjunto de los síntomas de 60 días (RIC = 37-70). Eran adolescentes o preadolescentes con mediana de edad de 142 meses (RIC = 117,8-166,8) y sin predominancia de ningún sexo (50% varones). Comparado con el resto de los pacientes, en las pruebas complementarias presentaron menores alteraciones analíticas y radiológicas, y ninguno precisó ingreso. En 3 (37,5%) de estos menores se empleó algún tratamiento médico (hidroxicloroquina, azitromicina o betalactámicos). Además, necesitaron un seguimiento más prolongado (p ≤ 0,018) con una mediana de tiempo de seguimiento de 52,5 días (RIC = 25-60,5) y una mediana de 11 llamadas (RIC = 6,3-19) por paciente. Cuatro (50%) refirieron empeoramiento durante el seguimiento y acudieron a Urgencias. La evolución fue favorable en todos los casos.
Respecto al tratamiento empleado, el uso de hidroxicloroquina se asoció a una menor duración de la fiebre (p ≤ 0,023), un menor empeoramiento durante el seguimiento (p ≤ 0,016) y un menor número de nuevas visitas a Urgencias Pediátricas (p ≤ 0,017). Por el contrario, se observó una mayor duración de los síntomas en los pacientes en los que se empleó azitromicina (p ≤ 0,037).
Discusión
Hasta el momento, existe escasa experiencia en el seguimiento telemático de pacientes pediátricos con sospecha de COVID-19. Nuestro estudio describe el seguimiento telefónico satisfactorio y seguro realizado a 72 menores desde un hospital terciario. Resulta llamativa la larga duración de los síntomas, con una mediana de 25,5 días y el empeoramiento referido por 19 (26,4%) de los pacientes, precisando 14 (19,4%) una nueva valoración presencial. Todo esto explica que el tiempo de seguimiento fuese prolongado y que se realizasen una mediana de 6 consultas telefónicas por niño. No obstante, la tasa de reingreso fue muy baja y asociada a otras comorbilidades y la evolución de todos los pacientes fue favorable.
A la hora de analizar nuestros datos, hay que tener en cuenta que los pacientes provenían de Urgencias Pediátricas, desde donde se derivaban solamente los casos con mayor riesgo de presentar peor evolución, o tras hospitalización. Por lo tanto, es esperable que en nuestro estudio predominen menores más sintomáticos y con cuadros más graves que en otros que incluyan todo el espectro de pacientes atendidos en Urgencias Pediátricas, en Atención Primaria o en estudios de contactos. Esto explicaría que objetivemos una prevalencia de síntomas superior en comparación con lo referido en otras publicaciones3, 4, 5, 12.
De forma similar a otras series pediátricas3, 4, 5, el cuadro clínico respiratorio fue el más habitual en niños infectados por SARS-CoV-2, siendo la fiebre y la tos los síntomas más frecuentes. La cefalea y la diarrea fueron otros síntomas habituales, aunque esta última se relacionó en algunos casos con los fármacos empleados. Al comparar los pacientes con diagnóstico confirmado de COVID-19 y los que no lo tienen, no encontramos diferencias en la aparición de síntomas descritos en la literatura como característicos de COVID-19, como son la anosmia y determinadas lesiones cutáneas (descamación o lesiones acroisquémicas en manos y pies)13, 14, 15, 16.
El subgrupo de pacientes cuyo cuadro clínico hemos denominado síndrome constitucional destaca especialmente por la larga duración de los síntomas. Estos menores precisaron un seguimiento significativamente más prolongado, fueron valorados más frecuentemente en Urgencias y se les realizó un estudio ampliado (incluyendo serologías de virus de Epstein-Barr, CMV, toxoplasma, etc.), a pesar de lo cual solamente se alcanzó un diagnóstico etiológico en 3 de ellos. Resulta llamativa la gran repercusión funcional que ocasionó la cefalea y la astenia intensas referida por algunos de estos menores, mientras otros únicamente presentaban febrícula persistente bien tolerada sin ningún otro síntoma. Es posible que algunas de estas manifestaciones, como la cefalea o la astenia, fuesen exacerbadas por el estrés y la ansiedad ocasionados por la pandemia y el confinamiento prolongado17. Existen publicaciones18, 19 en adultos en los que también se describen síntomas persistentes en pacientes con COVID-19, siendo los más frecuentes la astenia, la cefalea y los síntomas respiratorios.
En nuestra cohorte, hay un mayor porcentaje de ingresos entre los niños con diagnóstico confirmado de COVID-19. Esto podría deberse a la mayor carga viral en nasofaringe en pacientes con cuadros clínicos graves20, lo cual aumentaría la capacidad diagnóstica de la PCR. Sin duda, también habrá influido que, en el inicio de la pandemia, ante el desconocimiento de la enfermedad, el dintel para ingresar a pacientes diagnosticados de COVID-19 era más bajo. Al contrario, en los pacientes sin diagnóstico confirmado de COVID-19 nos hemos encontramos una duración significativamente mayor de los síntomas. Esto podría relacionarse con una mayor ansiedad generada por la incertidumbre de la enfermedad.
A pesar de que en la mayoría de nuestros pacientes existía una elevada sospecha clínica, solamente se obtuvo un resultado positivo de la PCR de SARS-CoV-2 en 33 (46,5%) de los casos. La PCR de SARS-CoV-2 es la prueba diagnóstica más empleada para el diagnóstico en fase aguda de COVID-19. Es una prueba con una elevada especificidad, pero la sensibilidad es variable según distintos factores (tipo de muestra adquirida, tiempo de evolución del cuadro clínico, carga viral del paciente, técnica de recogida, transporte y procesamiento de la muestra) pudiendo encontrarnos falsos negativos21, 22, 23. Por lo tanto, es posible que haya pacientes con COVID-19 en nuestra cohorte que no hayamos sido capaces de diagnosticar.
Dado que el pico de carga viral se produce cuando comienzan los síntomas o pocos días después20, la detección de anticuerpos puede ser útil para diagnosticar a pacientes a los que no se realizó PCR de SARS-CoV-2 en las fases iniciales de la infección24, 25. En nuestro estudio, la serología de SARS-CoV-2 nos ha permitido diagnosticar a 7 pacientes (18,4%) con PCR negativa o indeterminada. Sin embargo, solamente se objetivó seroconversión en 21 (67,7%) de los 31 niños con PCR positiva a los se realizó serología. Este dato es muy inferior a lo referido en otras publicaciones en adultos26, 27, en las cuales en prácticamente la totalidad de los infectados se detectan anticuerpos. Por lo tanto, podemos deducir que la serología de SARS-CoV-2 es de menor utilidad en pacientes pediátricos que en adultos en el diagnóstico de COVID-19. No obstante, la ausencia de anticuerpos no significa necesariamente ausencia de respuesta inmunitaria adaptativa, puesto que estudios recientes han demostrado la presencia de inmunidad celular específica frente a SARS-CoV-2 en pacientes con serología negativa28, 29.
La hidroxicloroquina fue el fármaco más empleado en nuestra cohorte. Aunque evaluar su eficacia no era el objetivo de nuestro estudio; en los niños que lo recibieron se observó una menor duración de la fiebre y un menor empeoramiento durante el seguimiento. Los estudios más recientemente publicados30, 31, 32 parecen indicar que este fármaco no es beneficioso en la COVID-19, por lo que es posible que lo que hemos observado sea el efecto placebo del tratamiento. Por otro lado, haber recibido tratamiento con azitromicina se asoció significativamente con una mayor duración de los síntomas. Seguramente esto se debe a que este antibiótico se emplea frecuentemente como tratamiento de rescate en pacientes con síntomas respiratorios prolongados y no a que empeore la evolución de la enfermedad. Es decir, como consecuencia de una mayor duración de los síntomas se prescribe más el tratamiento con azitromicina.
La principal limitación de nuestro estudio ha sido no poder identificar el agente etiológico en 25 (34,7%) de nuestros pacientes. Como hemos comentado previamente, esto posiblemente se debe en parte a las propias limitaciones de las pruebas microbiológicas disponibles actualmente para el diagnóstico de COVID-19. Es posible que haya más pacientes con COVID-19 que no hemos sido capaces de diagnosticar. Además, debido a la sobrecarga del sistema sanitario durante el pico de la epidemia, no fue posible realizar un estudio etiológico completo a muchos de los pacientes, por lo que seguramente no hemos detectado algunas infecciones o coinfecciones por otros microorganismos.
Nuestra muestra de pacientes no es representativa de todo el espectro de enfermedad ocasionada por SARS-CoV-2 en niños, puesto que no incluye a los pacientes más leves que fueron seguidos desde Atención Primaria. De la misma forma, hay algunos pacientes con comorbilidades que fueron controlados por sus respectivos especialistas y, por lo tanto, tampoco se incluyeron en nuestra cohorte.
Hay que tener también en cuenta que las propias características del estudio telefónico incluyen una subjetividad por parte de los familiares entrevistados que puede haber influido en la interpretación de los síntomas y su gravedad. Por otro lado, la ausencia de grupo control impide demostrar que la evolución de nuestros pacientes haya sido mejor o que hayamos evitado visitas a Urgencias gracias al seguimiento telefónico.
Conclusiones
Es recomendable el seguimiento médico de los niños con sospecha de COVID-19, dado que la duración de los síntomas suele ser prolongada y hasta el 26,4% presenta empeoramiento durante su evolución. Las consultas telemáticas son una herramienta útil y segura que permite reducir las consultas presenciales y el consumo de otros recursos. Supone una alternativa válida para el manejo de los casos leves de COVID-19 y el seguimiento de los pacientes hospitalizados una vez son dados de alta.
La serología puede ayudarnos en el diagnóstico de niños con cuadros indicativos de COVID-19 y PCR de SARS-CoV-2 negativa, aunque su utilidad es menor que en adultos por la menor tasa de seroconversión.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Footnotes
Congresos: ha sido aceptado como comunicación tipo póster en el I Congreso Nacional COVID-19, que tuvo lugar del 13 al 19 de septiembre en formato virtual.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.anpedi.2020.10.017.
Anexo 1. Miembros del Grupo de Trabajo de SARS-COV-2 del Servicio de Pediatría del Hospital Universitario La Paz
Laura García Espinosa, Clara Buitrago Gil, María de Ceano-Vivas La Calle, Teresa del Rosal Rabes, Ana Mendez-Echevarría, Fernando Baquero Artigao, Talía Sainz Costa, María José Mellado Peña.
Anexo 2. Material adicional
Bibliografía
- 1.WHO Director-General's opening remarks at the media briefing on COVID-19. 11 March 2020 [Fecha de consulta 07 Jul 2020]. Disponible en: https://www.who.int/dg/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19---11-march-2020
- 2.WHO Director-General's opening remarks at the media briefing on COVID-19. 13 March 2020. World Health Organization [Fecha de consulta 07 Jul 2020]. Disponible en: https://www.who.int/dg/speeches/detail/who-director-general-s-opening-remarks-at-the-mission-briefing-on-covid-19---13-march-2020
- 3.Dong Y., Mo X., Hu Y., Qi X., Jiang F., Jiang Z. Epidemiology of COVID-19 among children in China. Pediatrics. 2020;145:e20200702. doi: 10.1542/peds.2020-0702. [DOI] [PubMed] [Google Scholar]
- 4.Otto W.R., Geoghegan S., Posch L.C., Bell L.M., Coffin S.E., Sammons J.S. The epidemiology of SARS-CoV-2 in a Pediatric Healthcare Network in the United States. J Pediatric Infect Dis Soc. 2020;piaa074 doi: 10.1093/jpids/piaa074. [published online ahead of print, 2020 Jun 19] [Fecha de consulta 07 Jul 2020]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Götzinger F., Santiago-García B., Noguera-Julián A., Lanaspa M., Lancella L., Calò Carducci COVID-19 in children and adolescents in Europe: A multinational, multicentre cohort study. Lancet Child Adolesc Health. 2020;S2352–4642:30177–30182. doi: 10.1016/S2352-4642(20)30177-2. [published online ahead of print, 2020 Jun 25] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Actualización n.° 174. Enfermedad por el coronavirus (COVID-19). 30 de julio del 2020. Centro de Coordinación de Alertas y Emergencias Sanitarias. Dirección General de Salud Pública. Ministerio de Sanidad de España [Fecha de consulta 07 Jul 2020]. Disponible en: https://www.mscbs.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov-China/documentos/Actualizacion_174_COVID-19.pdf
- 7.Comunicado reorganización de la atención pediátrica urgente. 21 de marzo del 2020. Consejería de Sanidad de la Comunidad de Madrid. Disponible en: https://www.comunidad.madrid/sites/default/files/doc/sanidad/comu/200321_comunicado_sanidad_coronavirus_centros_urgencias_atencion_pediatrica_0.pdf
- 8.Documento de manejo clínico del paciente pediátrico con infección por SARS-CoV-2. AEP-SEIP-SEUP-SECIP [actualizado 24 Mayo 2020] [Fecha de consulta 07 Jul 2020]. Disponible en: https://www.aeped.es/sites/default/files/24_5-_aep-seip-secip-seup._document_o_de_manejo_clinico_del_paciente_pediaitrico_-_extracto_del_documento_del_ministerio_propuestas_1.pdf
- 9.Manejo pediátrico en atención primaria del COVID-19. Versión del 18 de junio de 2020. Centro de Coordinación de Alertas y Emergencias Sanitarias. Dirección General de Salud Pública. Ministerio de Sanidad de España [Fecha de consulta 07 Jul 2020]. Disponible en: https://www.mscbs.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov-China/documentos/Manejo_pediatria_ap.pdf
- 10.COVID-19 Treatment guidelines panel. Coronavirus disease 2019 (COVID-19) treatment guidelines. National Institutes of Health [Fecha de consulta 07 Jul 2020]. Disponible en https://www.covid19treatmentguidelines.nih.gov/ [PubMed]
- 11.Multisystem inflammatory syndrome in children and adolescents temporally related to COVID-19. 15 May 2020 Scientific Brief: World Health Organization [Fecha de consulta 07 Jul 2020]. Disponible en: https://www.who.int/news-room/commentaries/detail/multisystem-inflammatory-syndrome-in-children-and-adolescents-with-covid-19
- 12.Hoang A., Chorath K., Moreira A., Evans M., Burmeister-Morton F., Burmeister F. COVID-19 in 7780 pediatric patients: A systematic review. EClinicalMedicine. 2020;24:100433. doi: 10.1016/j.eclinm.2020.100433. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Colmenero I., Santonja C., Alonso-Riaño M., Noguera-Morel L., Hernández-Martín A., Andina D. SARS-CoV-2 endothelial infection causes COVID-19 chilblains: Histopathological, immunohistochemical and ultraestructural study of 7 paediatric cases. Br J Dermatol. 2020 doi: 10.1111/bjd.19327. [published online ahead of print, 2020 Jun 20] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Gottlieb M., Long B. Dermatologic manifestations and complications of COVID-19. Am J Emerg Med. 2020;38:1715–1721. doi: 10.1016/j.ajem.2020.06.011. [published online ahead of print, 2020 Jun 6] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Meng X., Deng Y., Dai Z., Meng Z. COVID-19 and anosmia: A review based on up-to-date knowledge. Am J Otolaryngol. 2020;41:102581. doi: 10.1016/j.amjoto.2020.102581. [published online ahead of print, 2020 Jun 2] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Spinato G., Fabbris C., Polesel J., Cazzador D., Borsetto D., Hopkins C. Alterations in smell or taste in mildly symptomatic outpatients with SARS-CoV-2 infection. JAMA. 2020;323:2089–2090. doi: 10.1001/jama.2020.6771. [published online ahead of print, 2020 Apr 22] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Guessoum S.B., Lachal J., Radjack R., Carretier E., Minassian S., Benoit L. Adolescent psychiatric disorders during the COVID-19 pandemic and lockdown. Psychiatry Res. 2020;291:113264. doi: 10.1016/j.psychres.2020.113264. [published online ahead of print, 2020 Jun 29] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Tenforde M.W., Kim S.S., Lindsell C.J., Billig Rose E., Shapiro N.I., Files D.C. Symptom duration and risk factors for delayed return to usual health among outpatients with COVID-19 in a Multistate Health Care Systems Network-United States. MMWR Morb Mortal Wkly Rep. 2020;69:993–998. doi: 10.15585/mmwr.mm6930e1. March-June 2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Poncet-Megemont L., Paris P., Tronchere A., Salazard J.P., Pereira B., Dallel R. High prevalence of headaches during Covid-19 infection: A retrospective cohort study. Headache. 2020 doi: 10.1111/head.13923. [published online ahead of print 2020 Aug 5] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Walsh K.A., Jordan K., Clyne B., Rohde D., Drummond L., Byrne P. SARS-CoV-2 detection, viral load and infectivity over the course of an infection. J Infect. 2020;S0163-4453:30449–30457. doi: 10.1016/j.jinf.2020.06.067. [published online ahead of print, 2020 Jun 29] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Wikramaratna P., Paton R.S., Ghafari M., Lourenco J. Estimating false-negative detection rate of SARS-CoV-2 by RT-PCR. medRxiv. 2020 doi: 10.2807/1560-7917.ES.2020.25.50.2000568. 2020.2004.2005.20053355. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Bwire G.M., Majigo M.V., Njiro B.J., Mawazo A. Detection profile of SARS-CoV-2 using RT-PCR in different types of clinical specimens: A systematic review and meta-analysis. J Med Virol. 2020 doi: 10.1002/jmv.26349. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Li Y., Yao L., Li J., Chen L., Song Y., Cai Z. Stability issues of RT-PCR testing of SARS-CoV-2 for hospitalized patients clinically diagnosed with COVID-19. J Med Virol. 2020;92:903–908. doi: 10.1002/jmv.25786. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Younes N., al-Sadeq D.W., al-Jighefee H., Younes S., al-Jamal O., Daas H.I. Challenges in laboratory diagnosis of the novel coronavirus SARS-CoV-2. Viruses. 2020;12:582. doi: 10.3390/v12060582. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Lisboa Bastos M., Tavaziva G., Abidi S.K., Campbell J.R., Haraoui L.P., Johnston J.C. Diagnostic accuracy of serological tests for covid-19: Systematic review and meta-analysis. BMJ. 2020;370:m2516. doi: 10.1136/bmj.m2516. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Pollán M., Pérez-Gómez B., Pastor-Barriuso R., Oteo J., Hernán M.A., Pérez-Olmeda M. Prevalence of SARS-CoV-2 in Spain (ENE-COVID): A nationwide, population-based seroepidemiological study. Lancet. 2020;S0140-6736:31483–31485. doi: 10.1016/S0140-6736(20)31483-5. [published online ahead of print, 2020 Jul 3] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Wajnberg A., Mansour M., Leven E., Bouvier N.M., Patel G., Firpo A. Humoral response and PCR positivity in patients with COVID-19 in the New York City region, USA: an observational study. Lancet Microbe. 2020;1(7):e283–e289. doi: 10.1016/S2666-5247(20)30120-8. 2020.2004.2030.20085613. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Sekine T., Perez-Potti A., Rivera-Ballesteros O., Strålin K., Gorin J.-B., Olsson A. Robust T cell immunity in convalescent individuals with asymptomatic or mild COVID-19. Cell. 2020;183(1):158–168.e14. doi: 10.1016/j.cell.2020.08.017. 2020.2006.2029.174888. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Gallais F., Velay A., Wendling M.-J., Nazon C., Partisani M., Sibilia J. Intrafamilial Exposure to SARS-CoV-2 induces cellular immune response without seroconversion. medRxiv. 2020 doi: 10.3201/eid2701.203611. 2020.2006.2021.20132449. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Rosenberg E.S., Dufort E.M., Udo T., Wilberschied L.A., Kumar J., Tesoriero J. Association of treatment with hydroxychloroquine or azithromycin with in-hospital mortality in patients with COVID-19 in New York State. JAMA. 2020;323:2493–2502. doi: 10.1001/jama.2020.8630. [published online ahead of print, 2020 May 11] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Cavalcanti A.B., Zampieri F.G., Rosa R.G., Azevedo L.C.P., Veiga V.C., Avezum A. Hydroxychloroquine with or without azithromycin in mild-to-moderate Covid-19. N Engl J Med. 2020;383(21):2041–2052. doi: 10.1056/NEJMoa2019014. [published correction appears in N Engl J Med. 2020 Nov 19;383(21):e119]. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.RECOVERY Collaborative Group, Horby P, Mafham M, Linsell L, Bell JL, Staplin N, Emberson JR, et al. Effect of Hydroxychloroquine in Hospitalized Patients with Covid-19. N Engl J Med. 2020 Nov 19;383(21):2030-2040. [DOI] [PMC free article] [PubMed]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.