Abstract
CONTEXTE:
Il existe très peu de données directes sur l’administration de corticostéroïdes aux patients atteints de la maladie à coronavirus 2019 (COVID-19). Les données indirectes sur des maladies associées devront donc guider les conclusions quant aux bénéfices et aux préjudices associés à cette pratique. Dans le but d’appuyer la rédaction d’une ligne directrice sur la prise en charge de la COVID-19, nous avons réalisé des revues systématiques sur les effets des corticostéroïdes dans le traitement de la COVID-19 et de maladies respiratoires aiguës sévères associées.
MÉTHODES:
Dans des bases de données biomédicales chinoises et internationales et des sources de prépublications, nous avons cherché les essais randomisés et contrôlés (ERC) et les études d’observation comparant des patients atteints de la COVID-19, du syndrome respiratoire aigu sévère (SRAS) ou du syndrome respiratoire du Moyen-Orient (SRMO) ayant reçu des corticostéroïdes à des patients semblables n’ayant pas reçu ce type de médicaments. Pour le syndrome de détresse respiratoire aiguë (SDRA), l’influenza et la pneumonie extrahospitalière (PEH), nous avons mis à jour les revues systématiques rigoureuses les plus récentes. Nous avons réalisé des méta-analyses à effets aléatoires pour cerner les risques relatifs, puis nous avons utilisé le risque de référence des patients atteints de la COVID-19 pour calculer les effets absolus.
RÉSULTATS:
Pour le SDRA, selon 1 petite étude de cohorte sur des patients atteints de la COVID-19 et 7 ERC sur des patients atteints d’une autre maladie (risque relatif : 0,72, intervalle de confiance [IC] de 95 % 0,55–0,93, différence entre les moyennes [DM] 17,3 % plus faible, données de faible qualité), les corticostéroïdes pourraient réduire le risque de mortalité. Chez les patients atteints d’une forme grave de COVID-19 sans SDRA, 2 études d’observation ont généré des données directes de très faible qualité montrant une augmentation du risque de mortalité avec l’administration de corticostéroïdes (rapport de risques 2,30, IC de 95 % 1,00–5,29, DM 11,9 % plus élevé). C’est aussi le cas de données observationnelles sur l’influenza. Des données observationnelles de très faible qualité sur le SRAS et le SRMO montrent peu ou pas de réduction dans le risque de mortalité. Des essais randomisés et contrôlés sur la PEH suggèrent que les corticostéroïdes pourraient réduire le risque de mortalité (risque relatif 0,70, IC de 95 % 0,50–0,98, DM 3,1 % plus faible, données de très faible qualité), et augmenter le risque d’hyperglycémie.
INTERPRÉTATION:
Les corticostéroïdes pourraient réduire le risque de mortalité pour les patients atteints de la COVID-19 avec SDRA. Pour les patients atteints d’une forme grave de COVID-19 sans SDRA, les données sur les bénéfices provenant de différentes sources sont incohérentes et de très faible qualité.
Le 11 mars 2020, l’Organisation mondiale de la Santé a qualifié de pandémie la maladie à coronavirus 2019 (COVID-19)1. La propagation mondiale de la COVID-19 est une grande menace à la santé humaine.
Les médecins traitent souvent les patients atteints de la COVID-19 par l’administration de corticostéroïdes2. Cette pratique est toutefois controversée : 2 publications récentes dans The Lancet ont fait état de points de vue divergents fondés en partie sur des études portant sur le syndrome respiratoire aigu sévère (SRAS), le syndrome respiratoire du Moyen-Orient (SRMO) et l’influenza. Une étude déconseillait l’administration de corticostéroïdes dans le traitement de la COVID-19, alors que l’autre la recommandait pour certains patients3,4.
La formulation de recommandations sur l’administration de corticostéroïdes aux patients atteints de la COVID-19 exige un examen systématique des données disponibles. Ainsi, pour appuyer un guide de pratique clinique sur la prise en charge des patients atteints de la COVID-195, nous avons mené une série de revues systématiques. Comme nous anticipions un manque de données directes pour la COVID-19, nous avons inclus les données disponibles portant sur l’administration de corticostéroïdes dans le traitement du syndrome de détresse respiratoire aiguë (SDRA), du SRAS, du SRMO, de l’influenza et de la pneumonie extrahospitalière (PEH), des sources de données indirectes pouvant nous guider dans la détermination de l’efficacité et de l’innocuité des corticostéroïdes dans le traitement de la COVID-19.
Méthodes
Pour le SDRA, nous avons utilisé les définitions des études admissibles, et celle de l’Organisation mondiale de la Santé pour les formes graves de COVID-19 (fièvre ou suspicion d’infection respiratoire, ainsi qu’un des signes suivants : fréquence respiratoire > 30 cycles/min, intense détresse respiratoire ou saturation en oxygène [SpO2] ≤ 93 % en air ambiant6).
Pour la COVID-19, le SRAS et le SRMO, nous avons inclus toutes les études primaires admissibles à nos revues systématiques. Pour le SDRA, l’influenza et la PEH, nous avons choisi les revues systématiques rigoureuses les plus récentes et les études primaires admissibles récentes. Le choix des paramètres a été encadré par notre protocole préliminaire, par les conseils du groupe de travail pour la ligne directrice et par les conclusions des études admissibles.
Stratégies de recherche et critères de sélection
L’annexe 1 (accessible en anglais au www.cmaj.ca/lookup/suppl/doi:10.1503/cmaj.200645/-/DC1) présente le protocole établi avant d’entamer les revues systématiques, qui suit le modèle PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses)7.
COVID-19, SRAS et SRMO
Avec l’aide d’une bibliothécaire médicale (R.J.C.), nous avons cherché les documents publiés dans MEDLINE, Embase, PubMed et le Cochrane Central Register of Controlled Trials du début de la couverture de ces bases de données jusqu’au 19 avril 2020, et dans medRxiv, jusqu’au 25 avril 2020. Pour les études portant sur des patients atteints de la COVID-19, nous avons aussi cherché dans des bases de données chinoises, notamment la China National Knowledge Infrastructure (CNKI), Wanfang, Chongqing VIP Information (CQVIP) et ChinaXiv. L’annexe 2 (accessible en anglais au www.cmaj.ca/lookup/suppl/doi:10.1503/cmaj.200645/-/DC1) présente la stratégie de recherche complète.
Nous avons inclus les essais randomisés et contrôlés (ERC), les études de cohorte et les études cas–témoins comparant les patients atteints de la COVID-19, du SRAS ou du SRMO ayant reçu des corticostéroïdes à ceux qui n’en ont pas reçu. Nous n’avons inclus que les études de cohorte et les études cas–témoins qui comportaient une analyse ajustée, sauf si aucune étude ne présentait ce type d’analyse. Dans ce dernier cas, nous avons inclus les analyses non ajustées. Pour les études présentant des recoupements (utilisant les mêmes sources de données), nous n’avons inclus que l’étude la plus importante, à moins qu’une plus petite étude comprenne des analyses supplémentaires utiles.
SDRA, influenza et PEH
Nous avons réalisé des recherches séparées pour le SDRA, l’influenza et la PEH, en utilisant un processus en 2 étapes (voir l’annexe 2 pour connaître la stratégie de recherche). Nous avons d’abord cherché à repérer les revues systématiques s’intéressant aux effets des corticostéroïdes sur les patients atteints d’un SDRA, de l’influenza ou d’une PEH dans MEDLINE, Embase, la Cochrane Database of Systematic Reviews et Epistemonikos et avons choisi la revue systématique rigoureuse la plus récente. Ensuite, nous avons cherché les études publiées après la recherche de ces revues dans MEDLINE, Embase et ClinicalTrials.gov pour le SDRA et la PEH, et dans MEDLINE, Embase, PubMed et le Cochrane Central Register of Controlled Trials pour l’influenza. Pour le SDRA et la PEH, nous n’avons inclus que des ERC. Pour l’influenza, nous avons inclus des ERC et des études de cohorte.
Pour toutes les recherches, 2 personnes ont parcouru de manière indépendante les titres et les résumés, puis le texte complet des études prometteuses pour déterminer leur admissibilité. Les désaccords ont été résolus par une discussion ou, si nécessaire, par l’opinion d’une troisième personne. Il n’y avait aucune restriction de langue.
Analyse de données
Deux personnes ont extrait de manière indépendante les paramètres des études, une troisième personne réglant les désaccords au besoin. Les paramètres comprennent le risque de mortalité, la durée du séjour aux soins intensifs, la durée du séjour à l’hôpital, la durée de la ventilation mécanique, la nécessité d’une ventilation mécanique, la détection d’acide ribonucléique (ARN) viral, l’intervalle de temps où le virus était libéré, le risque d’hyperglycémie grave, le risque de surinfection, la faiblesse neuromusculaire et les saignements gastro-intestinaux.
Nous avons calculé des estimations sommaires à l’aide de Stata ou de Review Manager, et les effets relatifs (rapports des cotes [RC], risques relatifs et rapports de risque) et les intervalles de confiance (IC) de 95 % pour les paramètres dichotomiques, ainsi que les différences entre moyennes (DM) et les IC de 95 % pour les paramètres continus à l’aide d’un modèle à effets aléatoires. Pour les paramètres continus et les estimations ajustées, nous avons utilisé la méthode de l’inverse de la variance (DerSimonian et Laird), et la méthode de Mantel–Haenszel pour les paramètres dichotomiques des ERC. Lorsqu’il y avait des incohérences entre les études, nous avons tranché en évaluant la différence entre les estimations ponctuelles et le chevauchement des intervalles de confiances, ainsi que la statistique I2. Pour les paramètres dichotomiques, nous avons calculé les effets absolus des traitements en appliquant les effets relatifs au risque chez les patients n’ayant pas reçu de corticostéroïdes dans 2 groupes : les patients atteints d’une forme grave de COVID-19 et les patients atteints de la COVID-19 avec SDRA. Le risque de mortalité de référence pour les patients atteints de la COVID-19 et du SDRA a été déterminé grâce à une étude d’observation portant sur des patients atteints de la COVID-19 et du SDRA8, et celui pour les patients atteints d’une forme grave de COVID-19, grâce à une étude d’observation portant sur des patients atteints de COVID-19 grave2. Pour les autres paramètres, nous nous sommes fondés sur le risque de référence de la médiane des groupes n’ayant pas reçu de corticostéroïdes dans les études incluses.
Évaluation du risque de biais
Nous avons utilisé ROBIS, un outil d’évaluation du risque de biais9, pour choisir les revues systématiques les plus rigoureuses à mettre à jour. Nous avons utilisé une version modifiée de l’outil d’évaluation du risque de biais de Cochrane10 pour évaluer le risque de biais dans les ERC et une version révisée de l’échelle de Newcastle–Ottawa11,12 pour les études d’observation (détails accessibles au www.evidencepartners.com/resources/methodological-resources/). Deux personnes ont évalué de manière indépendante le risque de biais, en résolvant les désaccords avec l’aide d’une troisième personne au besoin.
Classement de la qualité des données
Nous avons utilisé l’approche GRADE (Grading of Recommendations Assessment, Development and Evaluation) pour classer la qualité des données comme élevée, modérée, faible ou très faible pour chaque paramètre13. L’évaluation porte sur les éléments suivants : risque de biais14, imprécisions15, incohérences16, données indirectes17 et biais de publication18. En cas de problème important dans l’un ou l’autre de ces domaines (par exemple, pour le risque de biais), nous avons réduit la cote de qualité des données. Parce que les effets des corticostéroïdes pourraient différer pour les personnes atteintes de la COVID-19 et celles atteintes d’autres maladies, et comme nous utilisons une approche indirecte, nous avons réduit la cote de qualité des données d’un niveau pour les bénéfices chez les patients atteints du SRAS et du SRMO, et de 2 niveaux pour les patients atteints du SDRA, de l’influenza ou d’une PEH. Parce que nous avons considéré que les préjudices étaient plus susceptibles de s’appliquer à la population cible que les bénéfices, pour toutes les populations, nous avons réduit la cote de qualité des données d’un niveau.
Approbation éthique
L’approbation éthique n’avait pas à être demandée pour cette revue systématique.
Résultats
L’annexe 3 (accessible en anglais au www.cmaj.ca/lookup/suppl/doi:10.1503/cmaj.200645/-/DC1) présente le processus de sélection des études. Notre recherche pour la COVID-19, le SRAS et le SRMO a donné 5120 résultats. Après avoir retiré les duplicata, parcouru les titres et les résumés et consulté les textes complets, nous avons finalement inclus 1 étude de cohorte8 portant sur 84 patients atteints de la COVID-19 et du SDRA, 5 études de cohorte19–23 portant sur 679 patients atteints de la COVID-19, sans SDRA, 3 études (2 études de cohorte24,25 et 1 ERC26) portant sur 7087 patients atteints du SRAS et 2 études de cohorte27,28 portant sur 623 patients atteints du SRMO.
Notre recherche de revues systématiques sur le SDRA a donné 836 résultats. Nous avons finalement choisi de mettre à jour une revue systématique publiée en 201929. Notre recherche d’études primaires a permis de trouver 1 nouvel ERC admissible publié en 202030. Avec les 6 ERC contenus dans la revue systématique, nous avons inclus 7 ERC30–36 portant sur 851 patients.
Notre recherche de revues systématiques sur l’influenza a donné 525 résultats. Nous avons choisi de mettre à jour une revue systématique publiée en 201937. Notre recherche d’études primaires a permis de trouver 1 nouvelle étude admissible publiée en 202038. Avec les 30 études présentées dans la revue systématique, nous avons relevé 31 études admissibles39–69, parmi lesquelles 21 portant sur 9536 patients ont été incluses aux méta-analyses41,43–47,50,52,53,55–61,63–65,68,69.
Notre recherche de revues systématique sur la PEH a donné 346 résultats. Nous avons choisi de mettre à jour une revue systématique publiée en 201570. Notre recherche d’études primaires a permis de trouver 1 nouvelle étude admissible publiée en 201671. En incluant les 12 ERC inclus dans la revue systématique, nous nous sommes intéressés à 13 ERC71–83 portant sur 2095 patients.
L’annexe 4 (accessible en anglais au www.cmaj.ca/lookup/suppl/doi:10.1503/cmaj.200645/-/DC1) présente les paramètres des études incluses. L’annexe 5 (accessible en anglais au www.cmaj.ca/lookup/suppl/doi:10.1503/cmaj.200645/-/DC1) présente l’évaluation du risque de biais pour chaque étude. Des graphiques en forêts des résultats des méta-analyses pour le risque de mortalité sont présentés aux figures 1 à 5, et, pour les autres paramètres, à l’annexe 6 (accessible en anglais au www.cmaj.ca/lookup/suppl/doi:10.1503/cmaj.200645/-/DC1).
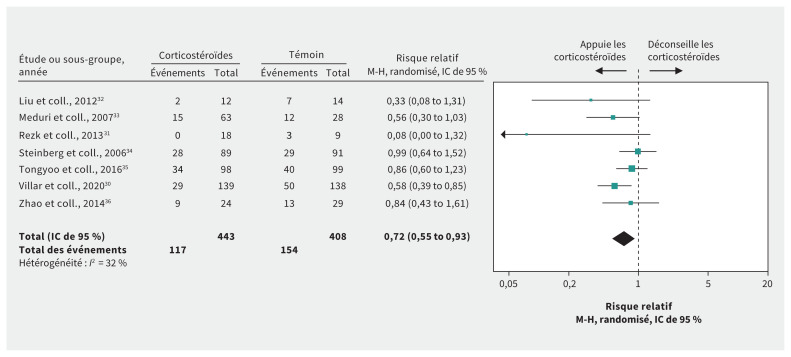
Figure 1:
Effet des corticostéroïdes sur le risque de mortalité chez les patients atteints du syndrome de détresse respiratoire aiguë sans maladie à coronavirus 2019. Remarque : IC = intervalle de confiance, M-H = Mantel–Haenszel.
SDRA
Les données pour les patients atteints de la COVID-19 et d’un SDRA étaient disponibles dans 1 étude d’observation portant sur 84 patients8. Elles suggéraient que l’administration de corticostéroïdes pourrait grandement réduire le risque de mortalité comparativement à l’absence de ce médicament (rapport de risque : 0,41, IC de 95 % 0,20–0,83, DM 29,2 % plus faible, données de très faible qualité) (tableau 1).
Tableau 1:
Résumé des conclusions et cote GRADE : effets des corticostéroïdes chez les patients atteints de la COVID-19 et du SDRA, selon les données directes d’études d’observation sur des patients atteints de la COVID-19 et du SDRA
| Résultats | Effets relatifs | Estimations des effets absolus | Qualité des données probantes | Résumé en langage simple | |
|---|---|---|---|---|---|
| Risque de référence du groupe témoin* (%) | Écart (IC de 95 %) (%) | ||||
| Risque de mortalité | HR 0,41 (IC de 95 % 0,20–0,83) Selon les données d’une étude d’observation8 portant sur 84 patients atteints de la COVID-19 et du SDRA |
61,8 | −29,2 (−44,3 à −6,8) | Très faible (imprécision importante†) | Les effets des corticostéroïdes sur le risque de mortalité sont très incertains. |
Remarque : COVID-19 = maladie à coronavirus 2019, GRADE = Grading of Recommendations Assessment, Development and Evaluation, HR = rapport de risques (Hazard Ratio), IC = intervalle de confiance, SDRA = syndrome de détresse respiratoire aiguë.
Risque de mortalité de référence pour les patients atteints de la COVID-19 avec SDRA n’ayant pas reçu de corticostéroïdes8.
Étude d’observation aux données de faible qualité. Bien que l’IC semble restreint, la petite taille de l’échantillon et le grand effet peu plausible ont mené au retrait d’un niveau de qualité pour imprécision.
Les données pour les patients atteints du SDRA sans COVID-19 provenaient de 7 ERC30–36 portant sur 851 patients (tableau 2). Nous avons considéré que les données pour la plupart des paramètres étaient de qualité élevée pour le SDRA. Après avoir réduit de 2 niveaux la cote de qualité des données en raison des données indirectes, elles étaient de faible qualité pour la COVID-19. Ces ERC semblent indiquer que les corticostéroïdes pourraient réduire de manière importante le risque de mortalité (risque relatif 0,72, IC de 95 % 0,55–0,93, DM 17,3 % plus faible, données de faible qualité) (figure 1). La très faible qualité des données soulève la possibilité que les corticostéroïdes auraient peu ou pas d’effets sur la durée du séjour aux soins intensifs32–34 (DM 0,1 jour de plus, IC de 95 % 3,0 jours de moins à 3,2 jours de plus), mais pourraient réduire la durée du séjour à l’hôpital33,34,36 (DM 3,6 jours de moins, IC de 95 % 0,02–7,2 jours de moins). Des données de faible qualité montrent que l’administration de corticostéroïdes pourrait réduire la durée de la ventilation mécanique (DM −4,8 jours, IC de 95 % −7,0 à −2,6)30,31,33–36, mais augmenter le risque d’hyperglycémie grave (augmentation du risque de 8,1 %, IC de 95 % 0,7 %–16,2 %)30,33,35, avec peu ou pas d’effets négatifs sur la faiblesse neuromusculaire33,34, les saignements gastro-intestinaux35,36 et le risque de surinfection30,33–36.
Tableau 2:
Résumé des conclusions et cote GRADE : effets des corticostéroïdes chez les patients atteints de la COVID-19 et d’un SDRA, selon les données indirectes d’essais randomisés et contrôlés sur des patients atteints d’un SDRA sans COVID-19
| Résultats | Effets relatifs | Estimations des effets absolus | Qualité des données probantes | Résumé en langage simple | |
|---|---|---|---|---|---|
| Risque de référence du groupe témoin* | Écart (IC de 95 %) | ||||
| Risque de mortalité | RR 0,72 (IC de 95 % 0,55–0,93) Selon les données de 7 ERC30–36 portant sur 851 patients atteints du SDRA |
61,8 % | −17,3 % (−27,8 % à −4,3 %) | Faible (données très indirectes†) | Les corticostéroïdes pourraient entraîner une diminution importante du risque de mortalité. |
| Durée du séjour aux soins intensifs | Selon les données de 3 ERC32–34 portant sur 297 patients | Durée médiane du séjour aux soins intensifs : 8,0 jours | DM 0,1 jour (−3,0 à 3,2) | Très faible (grande incohérence, données très indirectes et imprécision importante‡) | Les effets des corticostéroïdes sur la durée du séjour aux soins intensifs sont très incertains. |
| Durée du séjour à l’hôpital | Selon les données de 3 ERC33,34,36 portant sur 324 patients | Durée médiane du séjour à l’hôpital : 18,0 jours | DM −3,6 jours (−7,2 à −0,02) | Très faible (données très indirectes et imprécision importante§) | Les effets des corticostéroïdes sur la durée du séjour à l’hôpital sont très incertains. |
| Durée de la ventilation mécanique | Selon les données de 6 ERC30,31,33–36 portant sur 888 patients | Durée médiane de la ventilation mécanique : 14,5 jours | DM −4,8 jours (−7,0 à −2,6) | Faible (données très indirectes†) | Les corticostéroïdes pourraient réduire la durée de la ventilation mécanique. |
| Hyperglycémie grave | RR 1,12 (IC de 95 % 1,01–1,24) Selon les données de 3 ERC30,33,35 portant sur 565 patients |
67,6 % | 8,1 % (0,7 %–16,2 %) | Faible (données très indirectes et imprécision importante¶) | Les corticostéroïdes pourraient augmenter le risque d’épisodes d’hyperglycémie grave. |
| Faiblesse neuromusculaire | RR 0,85 (IC de 95 % 0,62–1,18) Selon les données de 2 ERC33, 34 portant sur 271 patients |
26,4 % | −3.9 % (−10 % à 4.7 %) | Faible (données très indirectes, imprécision importante**) | Les corticostéroïdes pourraient ne pas augmenter la faiblesse neuromusculaire. |
| Saignements gastro-intestinaux | RR 0,71 (IC de 95 % 0,30–1,73) Selon les données de 2 ERC35, 36 portant sur 250 patients |
14,0 % | −4.0 % (−9.8 % à 10.2 %) | Faible (données très indirectes, imprécision importante**) | Les corticostéroïdes pourraient ne pas augmenter le risque de saignements gastro-intestinaux. |
| Surinfection | RR 0,82 (IC de 95 % 0,67–1,02) Selon les données de 5 ERC30,33–36 portant sur 798 patients |
33,0 % | −5.9 % (−10.8 % à 0.6 %) | Modérée (données indirectes††) | Les corticostéroïdes n’augmentent probablement pas le risque de surinfection. |
Remarque : COVID-19 = maladie à coronavirus 2019, DM = différence entre les moyennes, ERC = essai randomisé et contrôlé, GRADE = Grading of Recommendations Assessment, Development and Evaluation, IC = intervalle de confiance, RR = risque relatif, SDRA = syndrome de détresse respiratoire aiguë.
Risque de mortalité de référence pour les patients atteints de la COVID-19 et du SDRA n’ayant pas reçu de corticostéroïdes8. Les risques de référence pour la durée du séjour aux soins intensifs, la durée du séjour à l’hôpital, la durée de la ventilation mécanique et les préjudices ont été obtenus grâce à l’estimation de la médiane du groupe témoin dans les ERC inclus.
Deux niveaux ont été retirés en raison des données indirectes. La cause du SDRA n’est pas la même pour toutes les études et pourrait ne pas représenter la population atteinte de la COVID-19.
Deux niveaux ont été retirés en raison des données indirectes, un pour l’incohérence (I2 = 73 %, p pour l’hétérogénéité = 0,03) et un pour l’imprécision parce que l’estimation des effets est cohérente avec les bénéfices et les préjudices.
Deux niveaux ont été retirés en raison des données indirectes, et un pour imprécision en raison de l’IC incluant une réduction négligeable de la durée du séjour à l’hôpital.
Un niveau a été retiré en raison des données indirectes puisque nous ne nous attendons pas à ce que la population atteinte de la COVID-19 diffère beaucoup des autres populations pour les préjudices comme pour les bénéfices. Un autre niveau a été retiré pour l’imprécision en raison de la limite inférieure de l’IC, 0,7 % étant une augmentation négligeable du risque d’hyperglycémie.
Un niveau a été retiré en raison des données indirectes puisque nous ne nous attendons pas à ce que la population atteinte de la COVID-19 diffère beaucoup des autres populations pour les préjudices comme pour les bénéfices. Un autre niveau a été retiré pour imprécision puisque les estimations des effets sont cohérentes pour les bénéfices et les préjudices.
Un niveau a été retiré en raison des données indirectes puisque nous ne nous attendons pas à ce que la population atteinte de la COVID-19 diffère beaucoup des autres populations pour les préjudices comme pour les bénéfices. Nous n’avons pas retiré de niveau pour imprécision parce que le plus important degré de méfait cohérent avec les données est de 7 pour 1000, ce que nous considérons comme négligeable.
Forme grave de COVID-19 : données directes d’études d’observation
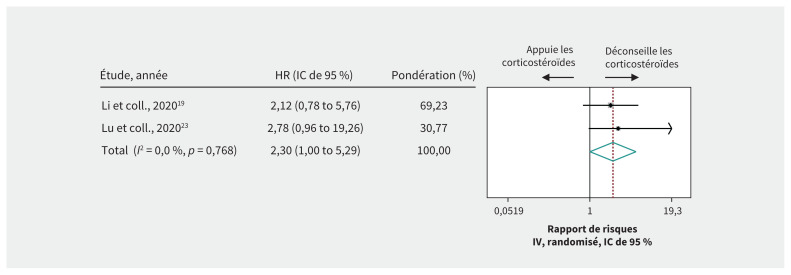
Des données de très faible qualité de 2 études de cohorte19,23 portant sur 331 patients atteints d’une forme grave de COVID-19 ont soulevé la possibilité que les corticostéroïdes augmentent le risque de mortalité comparativement à la non-administration de ce médicament (rapport de risques 2,30, IC de 95 % 1,00–5,29, DM 11,9 % plus élevé) (tableau 3, figure 2). Une étude de cohorte20 a rapporté une augmentation du risque de mortalité, toutes populations confondues ou de l’admission aux soins intensifs des patients à qui on administre des corticostéroïdes. De plus, 2 études de cohorte21,22 ont suggéré que l’administration de corticostéroïdes serait associée à une période plus longue avant la clairance du virus (données de très faible qualité).
Tableau 3:
Résumé des conclusions et cote GRADE : effets des corticostéroïdes chez les patients atteints d’une forme grave de COVID-19, selon les données directes d’études d’observation sur des patients atteints de COVID-19 grave
| Résultats | Effets relatifs | Estimations des effets absolus | Qualité des données probantes | Résumé en langage simple | |
|---|---|---|---|---|---|
| Risque de référence du groupe témoin* (%) | Écart (IC de 95 %) (%) | ||||
| Risque de mortalité | HR 2,30 (IC de 95 % 1,00–5,29) Selon les données de 2 études d’observation19, 23 portant sur 331 patients atteints d’une forme grave de COVID-19 |
10,4 | 11,9 (0–33,7) | Très faible (imprécision importante†) | Les effets des corticostéroïdes sur le risque de mortalité sont très incertains. |
Remarque : COVID-19 = maladie à coronavirus 2019, GRADE = Grading of Recommendations Assessment, Development and Evaluation, HR = rapport de risques (Hazard Ratio), IC = intervalle de confiance.
Risque de référence d’une étude sur des patients atteints d’une forme grave de COVID-19 n’ayant pas reçu de corticostéroïdes2.
Étude d’observation aux données de faible qualité. Un niveau a été retiré en raison d’une imprécision importante (IC large).
Figure 2:
Effet des corticostéroïdes sur le risque de mortalité chez les patients atteints de la forme grave de la maladie à coronavirus 2019. La pondération provient des analyses à effets aléatoires. Remarque : IC = intervalle de confiance, HR = rapport de risques (Hazard Ratio), IV = inverse de la variance.
Forme grave de COVID-19 : données indirectes d’études d’observation et d’un essai randomisé sur des patients atteints du SRAS
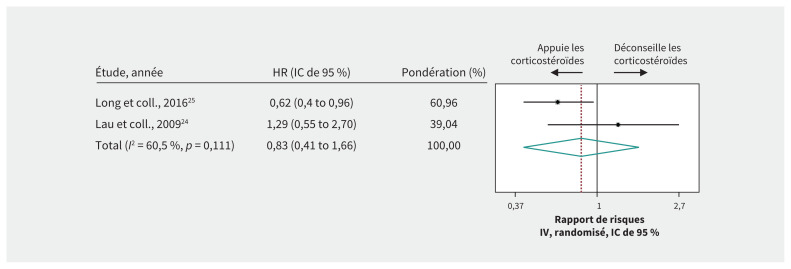
Deux études de cohorte24,25 portant sur 6129 patients atteints du SRAS ont fourni des données de faible qualité sur l’effet des corticostéroïdes sur le risque de mortalité; la cote de qualité des données est encore moindre avec l’ajustement en raison des données indirectes (rapport de risques 0,83, IC de 95 % 0,41–1,66, données de très faible qualité) (tableau 4, figure 3). Un ERC26 pour lequel on a étudié 16 patients atteints du SRAS traités à la ribavirine ayant reçu ou non des corticostéroïdes a soulevé la possibilité qu’un traitement précoce (< 7 jours de maladie) à l’hydrocortisone augmenterait la durée médiane avant laquelle l’ARN du coronavirus associé au SRAS (SRAS-CoV) est indétectable dans le plasma (DM 4,0 jours de plus, IC de 95 % 2,0–6,0 jours, données de très faible qualité pour le SRAS, avec les ajustements en raison des données indirectes) (tableau 4).
Tableau 4:
Résumé des conclusions et cote GRADE : effets des corticostéroïdes chez les patients atteints d’une forme grave de COVID-19, selon les données indirectes d’essais randomisés contrôlés et d’études d’observation sur des patients atteints du SRAS admis à l’hôpital
| Résultats | Effets relatifs | Estimations des effets absolus | Qualité des données probantes | Résumé en langage simple | |
|---|---|---|---|---|---|
| Risque de référence du groupe témoin | Écart (IC de 95 %) | ||||
| Risque de mortalité | HR 0,83 (IC de 95 % 0,41–1,66) Selon les données de 2 études d’observation24, 25 portant sur 6129 patients atteints du SRAS |
10,4 %* | −1.7 % (−6.0 % à 6.3 %) | Très faible (données très indirectes et imprécision importante†) | Les effets des corticostéroïdes sur le risque de mortalité sont très incertains. |
| Temps médian après lequel l’ARN du SRAS-CoV devient indétectable dans le plasma | Selon les données d’une ERC26 portant sur 16 patients | 8,0 days‡ | DM 4,0 jours (2,0–6,0) | Très faible (risque de biais important, données très indirectes et imprécisions importantes§) | Les effets des corticostéroïdes sur le temps après lequel l’ARN du SRAS-CoV est indétectable dans le plasma sont très incertains. |
Remarque : ARN = acide ribonucléique, COVID-19 = maladie à coronavirus 2019, DM = différence entre les moyennes, ERC = essai randomisé et contrôlé, GRADE = Grading of Recommendations Assessment, Development and Evaluation, HR = rapport de risques (Hazard Ratio), IC = intervalle de confiance, SRAS = syndrome respiratoire aigu sévère, SRAS-CoV = coronavirus associé au SRAS.
Risque de référence d’une étude sur des patients atteints d’une forme grave de COVID-19 n’ayant pas reçu de corticostéroïdes2.
Études d’observation aux données de faible qualité. Un niveau a été retiré en raison des données indirectes (nous avons appliqué les résultats aux patients atteints de la COVID-19, mais les effets relatifs ont été dérivés des résultats de patients atteints du SRAS) et un pour imprécision importante (l’IC inclut un bienfait important et un méfait important).
Risque de référence d’un ERC ayant rapporté le temps médian après lequel l’ARN du SRAS-CoV devient indétectable dans le plasma pour le groupe n’ayant pas reçu de corticostéroïdes26.
Essai randomisé et contrôlé aux données de qualité élevée. Des niveaux ont été retirés en raison du risque important de biais, des données indirectes (nous avons appliqué les résultats aux patients atteints d’une forme grave de COVID-19, mais les effets relatifs ont été dérivés des résultats de patients atteints du SRAS) et d’une imprécision importante (en raison de la petite taille de l’échantillon).
Figure 3:
Effet des corticostéroïdes sur le risque de mortalité chez les patients atteints du syndrome respiratoire aigu sévère. La pondération provient des analyses à effets aléatoires. Remarque : IC = intervalle de confiance, HR = rapport de risques (Hazard Ratio), IV = inverse de la variance.
Forme grave de COVID-19 : données indirectes d’études d’observation sur des patients atteints du SRMO
Une étude de cohorte28 portant sur 290 patients atteints du SRMO suggère une possible réduction du risque de mortalité associée à l’administration de corticostéroïdes (rapport de cotes 0,75, IC de 95 % 0,52–1,07, données de très faible qualité pour le SRMO, avec considérations supplémentaires en raison des données indirectes) (tableau 5). Les données de 189 patients de la même étude28 suggèrent que l’administration de corticostéroïdes pourrait être associée à un retard dans la clairance de l’ARN du coronavirus responsable du syndrome respiratoire du Moyen-Orient (CoV-SRMO) (rapport de risques 0,35, IC de 95 % 0,17–0,72, données de très faible qualité pour le SRMO, avec les considérations supplémentaires en raison des données indirectes) (tableau 5).
Tableau 5:
Résumé des conclusions et cote GRADE : effets des corticostéroïdes chez les patients atteints d’une forme grave de COVID-19, selon les données indirectes d’études d’observation sur des patients atteints du SRMO admis à l’hôpital
| Résultats | Effets relatifs | Estimations des effets absolus | Qualité des données probantes | Résumé en langage simple | |
|---|---|---|---|---|---|
| Risque de référence du groupe témoin (%) | Écart (IC de 95 %) | ||||
| Risque de mortalité | RC 0,75 (IC de 95 % : 0,52–1,07) Selon les données d’une étude d’observation28 portant sur 290 patients atteints du SRMO |
10,4* | −2,4 (−4,7 à 0,6) | Très faible (données très indirectes et imprécision importante§) | Les effets des corticostéroïdes sur le risque de mortalité sont très incertains. |
| Clairance de l’ARN du CoV SRMO | HR 0,35 (IC de 95 % : 0,17–0,72) Selon les données d’une étude d’observation28 portant sur 189 patients atteints du SRMO |
29,8† | −18,2 (−24,0 à −7,3) | Très faible (données très indirectes et imprécision importante¶) | Les effets des corticostéroïdes sur le délai de clairance de l’ARN du CoV-SRMO sont très incertains. |
Remarque : ARN = acide ribonucléique, COVID-19 = maladie à coronavirus 2019, CoV-SRMO = coronavirus associé au syndrome respiratoire du Moyen-Orient, GRADE = Grading of Recommendations Assessment, Development and Evaluation, HR = rapport de risques (Hazard Ratio), IC = intervalle de confiance, RC = rapport de cotes, SRMO = syndrome respiratoire du Moyen-Orient.
Risque de référence d’une étude sur des patients atteints d’une forme grave de COVID-19 n’ayant pas reçu de corticostéroïdes2.
Risque de référence d’une étude d’observation ayant rapporté la détection de l’ARN du CoV-SRMO pour le groupe n’ayant pas reçu de corticostéroïdes28.
Étude d’observation aux données de faible qualité. Un niveau a été retiré en raison des données indirectes (nous avons appliqué les résultats aux patients atteints d’une forme grave de COVID-19, mais les effets relatifs ont été dérivés des résultats de patients atteints du SRMO), et un niveau en raison d’une imprécision importante (l’IC comprend un effet négligeable et un effet important).
Étude d’observation aux données de faible qualité. Un niveau a été retiré en raison des données indirectes (nous avons appliqué les résultats aux patients atteints d’une forme grave de COVID-19, mais les effets relatifs ont été dérivés des résultats de patients atteints du SRMO) et un pour imprécision importante en raison de la petite taille de l’échantillon.
Forme grave de COVID-19 : données indirectes d’études d’observation sur des patients atteints de l’influenza
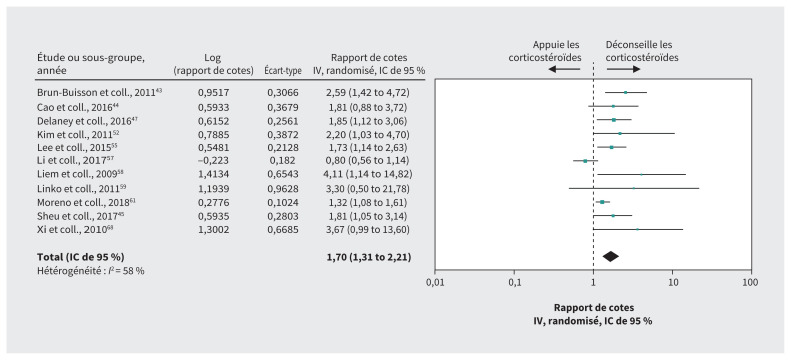
Les données pour l’influenza provenant de 11 études de cohorte43–45,47,52,55,57–59,61,68 portant sur 8530 patients avec des estimations ajustées pour le risque de mortalité suggèrent que les corticostéroïdes pourraient accroître le risque de mortalité (rapport de cotes 1,70, IC de 95 % 1,31–2,21, DM 6,1 % plus élevé, données de faible qualité pour l’influenza et considérées comme très faible pour la COVID-19 en raison des données indirectes) (tableau 6, figure 4). Des données de très faible qualité pour l’influenza avec les considérations supplémentaires en raison des données indirectes qui proviennent d’études de cohorte ne comportant pas d’analyses ajustées ont soulevé la possibilité que les corticostéroïdes augmentent le risque de surinfection (rapport de cotes 2,74, IC de 95 % 1,51–4,95)43,44,47,52,55,57,65 et le nombre de patients nécessitant une ventilation mécanique (rapport de cotes 5,54, IC de 95 % 1,83–16,80) 52,57,59,61 (tableau 6).
Tableau 6:
Résumé des conclusions et cote GRADE : effets des corticostéroïdes chez les patients atteints d’une forme grave de COVID-19, selon les données indirectes d’études d’observation sur des patients atteints d’influenza admis à l’hôpital
| Résultats | Effets relatifs | Estimations des effets absolus | Qualité des données probantes | Résumé en langage simple | |
|---|---|---|---|---|---|
| Risque de référence du groupe témoin (%) | Écart (IC de 95 %) (%) | ||||
| Risque de mortalité | RC 1,70 (IC de 95 % 1,31–2,21) Selon les données de 11 études d’observation43–45,47,52,55,57–59,61,68 portant sur 8530 participants |
10,4* | 6,1 (2,8–10,0) | Très faible (données indirectes‡) | Les effets des corticostéroïdes sur le risque de mortalité sont très incertains. |
| Surinfection | RC 2,74 (IC de 95 % 1,51–4,95) Selon les données de 7 études d’observation43,44,47,52,55,57,65 portant sur 6114 participants |
7,2† | 10,3 (3,3–20,5) | Très faible (risque de biais important et données indirectes§) | Les effets des corticostéroïdes sur le risque de surinfection sont très incertains. |
| Ventilation mécanique | RC 5,54 (IC de 95 % 1,83–16,80) Selon les données de 4 études d’observation52,57,59,61 portant sur 4364 participants |
41,8§ | 38,1 (15,0–50,6) | Très faible (risque de biais important et données indirectes†) | Les effets des corticostéroïdes sur la nécessité d’une ventilation mécanique sont très incertains. |
Remarque : COVID-19 = maladie à coronavirus 2019, GRADE = Grading of Recommendations Assessment, Development and Evaluation, IC = intervalle de confiance, RC = rapport de cotes.
Risque de référence d’une étude sur des patients atteints d’une forme grave de COVID-19 n’ayant pas reçu de corticostéroïdes2.
Risque de référence de l’effet médian sur le groupe témoin pour les études incluses.
Études d’observation aux données de faible qualité. Les autres facteurs étaient les données indirectes (nous avons appliqué les résultats aux patients atteints d’une forme grave de COVID-19, mais les effets relatifs ont été dérivés des résultats de patients atteints d’influenza admis à l’hôpital).
Études d’observation aux données de faible qualité. Les autres facteurs étaient le risque élevé de biais de confusion en raison des estimations non ajustées et les données indirectes (nous avons appliqué les résultats aux patients atteints d’une forme grave de COVID-19, mais les effets relatifs ont été dérivés des résultats de patients atteints d’influenza admis à l’hôpital).
Figure 4:
Effet des corticostéroïdes sur le risque de mortalité chez les patients atteints d’influenza. Remarque : IC = intervalle de confiance, IV = inverse de la variance.
Forme grave de COVID-19 : données indirectes d’essais randomisés sur des patients atteints d’une PEH
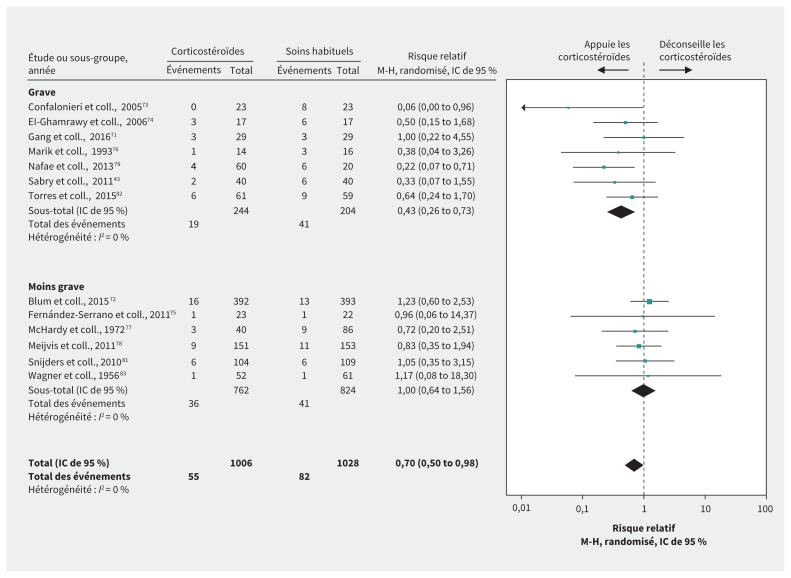
En tout, 13 ERC71–83 portant sur 2034 patients atteints d’une PEH se sont intéressés à plusieurs paramètres importants d’efficacité. Pour les patients atteints d’une PEH, en général, les données étaient de qualité élevée à faible. Après avoir retiré 2 niveaux en raison des données indirectes, toutes les données étaient donc de faible ou de très faible qualité. Les corticostéroïdes étaient associés à une réduction du risque de mortalité (risque relatif 0,70, IC de 95 % 0,50–0,98, DM 3,1 % de moins), de la nécessité d’une ventilation mécanique72,75,76,79,82 (différence des risques [DR] 10,4 %, IC de 95 % 4,3 %–13,8 %), de la durée de la ventilation mécanique71,73,74,79,80 (DM 3,5 jours de moins, IC de 95 % 1,8–5,2 jours), de la durée du séjour aux soins intensifs72–76,78,79,82 et de la durée du séjour à l’hôpital71–76,78,79,81,82,84 (tableau 7, figure 5). Une méta-analyse de 8 ERC71,72,75,78,79,81,82,84 a montré que les corticostéroïdes pourraient faire augmenter le risque d’hyperglycémie grave (DR 5,7 %, IC de 95 % 0,18 %–15.3 %, données de qualité modérée pour la PEH, données de faible qualité après ajustement en raison des données indirectes).
Tableau 7:
Résumé des conclusions et cote GRADE : effets des corticostéroïdes chez les patients atteints d’une forme grave de COVID-19, selon les données indirectes d’essais randomisés et contrôlés sur des patients atteints d’une pneumonie extrahospitalière admis à l’hôpital
| Résultats | Effets relatifs | Estimations des effets absolus | Qualité des données probantes | Résumé en langage simple | |
|---|---|---|---|---|---|
| Risque de référence du groupe témoin* | Écart (IC de 95 %) | ||||
| Risque de mortalité | RR 0,70 (IC de 95 % 0,50–0,98) Selon les données de 13 ERC71–83 portant sur 2034 patients |
10,4 % | −3.1 % (−0.2 % à −5.2 %) | Très faible (données très indirectes† et grande incohérence) | Les effets des corticostéroïdes sur le risque de mortalité sont très incertains. |
| Durée du séjour aux soins intensifs | Selon les données de 8 ERC72–76,78,79,82 portant sur 1376 patients | Durée médiane du séjour aux soins intensifs : 8,3 jours | DM −1,7 jour (−3,4 à 0,1) | Très faible (grande incohérence, données très indirectes et imprécision importante‡) | Les effets des corticostéroïdes sur la durée du séjour aux soins intensifs sont très incertains. |
| Durée du séjour à l’hôpital | Selon les données de 10 ERC71–76,78,79,81,82,84 portant sur 1636 patients | Durée médiane du séjour à l’hôpital : 14,3 jours | DM −1,8 jour (−2,8 à −0,8) | Très faible (grande incohérence, données très indirectes et imprécision importante§) | Les effets des corticostéroïdes sur la durée du séjour à l’hôpital sont très incertains. |
| Nécessité d’une ventilation mécanique | RR : 0,42 (IC de 95 % : 0,23 0,76) Selon les données de 5 ERC72,75,76,79,82 portant sur 1017 patients |
18,0 % | −10,4 % (−13,8 % à −4,3 %) | Faible (données très indirectes†) | Les corticostéroïdes pourraient réduire la nécessité d’une ventilation mécanique. |
| Durée de la ventilation mécanique | Selon les données de 5 ERC71,73,74,79,80 portant sur 199 patients | Durée médiane de la ventilation mécanique : 11,3 jours | DM −3,5 jours (−5,2 à −1,8) | Très faible (risque important de biais et données très indirectes¶) | Les effets des corticostéroïdes sur la durée de la ventilation mécanique sont très incertains. |
| Hyperglycémie grave | RR 1,62 (IC de 95 % 1,02–2,67) Selon les données de 8 ERC71,72,75,78,79,81,82,84 portant sur 1476 patients |
9,2 % | 5,7 % (0,18 % à 15,3 %) | Faible (données très indirectes et imprécision importante**) | Les corticostéroïdes pourraient augmenter le risque d’épisodes d’hyperglycémie grave. |
| Saignements gastro-intestinaux | RR 0,99 (IC de 95 % 0,43 2,24) Selon les données de 8 ERC71–75,79,80,82 portant sur 1228 patients |
3,0 % | −0,03 % (−1,7 % à 3,7 %) | Faible (données très indirectes et imprécision importante**) | Les corticostéroïdes pourraient avoir peu ou pas d’effet sur les saignements gastro-intestinaux. |
| Incidents neuropsychiatriques | RR 1,91 (IC de 95 % 0,68 5,39) Selon les données de 4 ERC72,81,82,84 portant sur 1142 patients |
1,6 % | 1,4 % (−0,5 % à 7 %) | Faible (données très indirectes et imprécision importante¶) | Les corticostéroïdes pourraient provoquer une légère augmentation des incidents neuropsychiatriques. |
| Superinfection | RR 1,31 (IC de 95 % 0,69 2,50) Selon les données de 8 ERC71–74,78,81,82,84 portant sur 1500 patients |
3,7 % | 1,1 % (−1,1 % à 5,5 %) | Faible (données très indirectes et imprécision importante¶) | Les corticostéroïdes pourraient provoquer une petite augmentation ou aucune augmentation des incidents de surinfection. |
Remarque : COVID-19 = maladie à coronavirus 2019, DM = différence entre les moyennes, ERC = essai randomisé contrôlé, IC = intervalle de confiance, GRADE = Grading of Recommendations Assessment, Development and Evaluation, PEH = pneumonie extrahospitalière, RR = risque relatif.
Risque de mortalité de référence pour des patients atteints de la COVID-19 et d’un SDRA n’ayant pas reçu de corticostéroïdes2. Les risques de référence pour la durée du séjour aux soins intensifs, la durée du séjour à l’hôpital, la durée de la ventilation mécanique et les événements négatifs ont été obtenus à l’aide de la médiane des effets sur le groupe témoin dans les ERC inclus.
Deux niveaux ont été retirés en raison des données indirectes. La cause de la pneumonie n’est pas la même pour toutes les études et pourrait ne pas être représentative de la population atteinte de la COVID-19. Un niveau a aussi été retiré pour les incohérences en raison d’un possible effet sur un sous-groupe qui suggère une diminution du risque de mortalité pour les personnes atteintes d’une pneumonie grave.
Deux niveaux ont été retirés en raison des données indirectes, un pour les incohérences (I2 = 76 %, p pour l’hétérogénéité = 0,0001) et un pour l’imprécision en raison des estimations des effets qui sont cohérents pour les préjudices et les bénéfices importants.
Deux niveaux ont été retirés en raison des données indirectes, un pour l’incohérence (I2 = 47 %, p pour l’hétérogénéité = 0,006) et un pour l’imprécision parce que la limite inférieure de l’IC comprend d’importants bénéfices et d’importants préjudices.
Un niveau a été retiré en raison du risque de biais et deux niveaux en raison des données indirectes. Nous n’avons pas retiré de niveau en raison de l’incohérence : les estimations des effets allaient dans le même sens, malgré un I2 de 54 % et un p de 0,07.
Un niveau a été retiré en raison des données indirectes, comme nous ne nous attendons pas à ce que la population atteinte de la COVID-19 diffère beaucoup des autres populations pour les bénéfices et les préjudices, et un niveau pour imprécision parce que les estimations des effets ne sont pas cohérentes avec les bénéfices et les préjudices.
Figure 5:
Effet des corticostéroïdes sur le risque de mortalité chez les patients atteints d’une pneumonie extrahospitalière. Remarque : IC = intervalle de confiance, M-H = Mantel–Haenszel.
Les résultats suggèrent que les corticostéroïdes pourraient faire augmenter le risque de mortalité pour un sous-groupe selon la gravité de la pneumonie (forme grave de pneumonie, risque relatif 0,43, IC de 95 % 0,26–0,73; forme moins grave de pneumonie, risque relatif 1,00, IC de 95 % 0,64–1,56; pour l’interaction, p = 0,02). Les différences sont toutefois habituellement relevées entre les études plutôt qu’au sein d’une même étude, différence qui provient en grande partie des résultats d’une petite étude73 ayant fait l’objet d’un arrêt précoce en raison de ce genre de bénéfices, et dont les données représentent presque certainement une grande surestimation des effets et n’apparaissent pour aucun autre paramètre. Ainsi l’effet sur le sous-groupe est peu crédible.
Pour les autres événements indésirables (incidents neuropsychiatriques72,81,82,84, surinfection71–74,78,81,82,84 et saignements gastro-intestinaux71–75,79,80,82), pour la PEH, les données étaient de qualité modérée pour des préjudices mineurs ou incertains, et de faible qualité après l’ajustement en raison des données indirectes (tableau 7).
Interprétation
Cette série de revues systématiques a guidé la rédaction d’une ligne directrice sur la prise en charge des patients atteints de la COVID-195. Les données directes d’une étude d’observation8 portant sur 84 patients atteints de la COVID-19 et d’un SDRA concordent avec les conclusions de notre revue systématique des ERC portant sur des patients atteints d’une maladie autre que la COVID-19, qui suggéraient que les corticostéroïdes pourraient réduire de plus de 15 % le risque de mortalité chez les patients atteints de la COVID-19 et d’un SDRA et la durée de la ventilation mécanique. Les données semblent indiquer que les corticostéroïdes pourraient faire augmenter le risque d’hyperglycémie grave, bien qu’ils ne semblent avoir aucune incidence en matière d’autre effet indésirable important. Les données pour ces effets sont principalement de faible qualité.
Pour les patients atteints d’une forme grave de COVID-19, mais dont l’état n’est pas critique, les données directes de très faible qualité des études d’observation ont montré une augmentation du risque de mortalité avec la prise de corticostéroïdes. Pour le SRAS et le SRMO, les données observationnelles soulèvent la possibilité d’une réduction modeste du risque de mortalité associé à l’administration de corticostéroïdes, mais aussi une période plus importante avant la clairance du virus. Pour la PEH, les données des ERC suggèrent aussi une réduction du risque de mortalité associée à l’administration de corticostéroïdes ainsi que d’autres bénéfices, notamment la réduction de la durée du séjour à l’hôpital et aux soins intensifs, de la nécessité d’une ventilation mécanique et de la durée de celleci. Des données de faible qualité suggèrent une augmentation probable de l’hyperglycémie et une possible augmentation mineure des incidents neuropsychiatriques et de surinfections, mais pas des saignements gastro-intestinaux. Les études d’observation sur l’influenza ont donné des résultats incohérents, soulevant la possibilité d’une augmentation marquée du risque de mortalité, du risque de surinfection et de la nécessité d’une ventilation mécanique associés à l’administration de corticostéroïdes.
Les forces de cette revue comprennent l’exhaustivité de la recherche, la sélection indépendante des études, l’abstraction des données, l’évaluation du risque de biais par 2 personnes et la présentation des effets absolus pour les paramètres dichotomiques. Nous avons classé la qualité des données selon l’approche GRADE, en portant attention aux enjeux méthodologiques majeurs, comme la différence dans les effets des données indirectes sur les préjudices et les bénéfices. Nous sommes plus hésitants quant à l’application des conclusions concernant les bénéfices constatés pour d’autres maladies aux patients atteints de la COVID-19, par rapport à l’application des conclusions concernant les préjudices. Pour les études d’observation, nous avons inclus, autant que possible, uniquement celles qui comportaient des analyses ajustées. Enfin, une force importante est la présentation d’une évaluation complète de toutes les données indirectes, notamment celles pour le SDRA, le SRAS, le SRMO, l’influenza et la PEH, dans un seul document.
Nous avons comparé notre revue à une autre revue systématique publiée portant sur l’administration de corticostéroïdes dans le traitement de la COVID-1985. Mis à part la COVID-19, le SRAS et le SRMO, notre revue portait sur 3 autres populations : les patients atteints d’un SDRA, d’une PEH et de l’influenza. Notre revue est à jour jusqu’au 19 avril, et inclut des données publiées après la revue systématique qui était à jour au 15 mars8,19–23. De plus, nous avons inclus, autant que possible, uniquement des études de cohorte et des études cas–témoins comportant des estimations des effets ajustées. Enfin, nous avons utilisé l’approche GRADE pour classer la qualité des données.
Pour le SDRA, notre revue a donné des résultats similaires à 1 autre revue systématique publiée29 qui comportait les dernières études publiées. Pour la PEH, les résultats sur lesquels nous nous concentrons sont similaires à ceux d’autres revues récentes86–89 qui montraient que les corticostéroïdes pourraient réduire le risque de mortalité et la durée du séjour à l’hôpital, et faire augmenter le risque d’hyperglycémie.
Nos conclusions sur l’influenza concordent avec les autres revues systématiques précédentes90–92 qui montraient aussi une augmentation du risque de mortalité associée à l’administration de corticostéroïdes. Une revue90 portant uniquement sur les patients atteints d’une pneumonie d’origine grippale, excluant ceux atteints d’une forme modérée de la maladie ou aux soins intensifs, montre que les corticostéroïdes seraient associés à un plus grand risque de mortalité. À l’inverse, une autre revue92 portant sur les formes graves de l’influenza rapporte que, parmi les études ayant des estimations ajustées, les résultats ne montraient aucune différence statistiquement significative entre le groupe recevant des corticostéroïdes et le groupe témoin.
Limites de l’étude
Les limites de cette étude sont essentiellement celles des données sous-jacentes, qui sont pour la plupart de faible qualité ou de très faible qualité pour les bénéfices. On pourrait nous reprocher de ne pas avoir élargi nos sources de données indirectes. Nous aurions pu, par exemple, inclure des données sur la pneumonie à Pneumocystis jiroveci, qui appuient l’administration de corticostéroïdes. Notre critère était l’inclusion de patients atteints d’une pneumonie d’origine virale dans les populations, ce qui est clairement le cas pour le SRAS, le SRMO et l’influenza, mais aussi pour le SDRA et la PEH.
De même, pour ce qui est des préjudices, la prise en compte des données provenant d’ERC sur l’administration à court terme de corticostéroïdes pour d’autres maladies pourrait avoir renforcé nos conclusions. Nous avons toutefois des données de qualité modérée pour les patients atteints du SDRA ne montrant aucune augmentation importante du risque de surinfection et des données de faible qualité sur l’augmentation de l’hyperglycémie grave. Des données de faible qualité suggèrent une possible augmentation mineure du nombre d’incidents neuropsychiatriques. Pour ce paramètre, les données d’autres maladies pourraient avoir été particulièrement utiles.
Conclusion
En raison du manque de données directes et des limites des données indirectes, il est essentiel pour les médecins et les chercheurs de coopérer à la réalisation d’études de grande qualité, particulièrement d’ERC rigoureux à grande échelle, pour évaluer les effets des corticostéroïdes chez les patients atteints de la COVID-19 et d’un SDRA et chez les patients atteints d’une forme grave de COVID-19 qui ne sont pas dans un état critique. Heureusement, des ERC, dont certaines qui portent sur le traitement par corticostéroïdes, sont en cours.
Remerciements
Quazi Ibrahim, Lehana Thabane, Diane Heels-Ansdell, Jason Busse et Li Wang ont offert de l’aide et des suggestions pour l’analyse statistique. Yingqi Xiao bénéficie de l’aide du Conseil des bourses de Chine.
Footnotes
Voir la version anglaise de l’article ici : www.cmaj.ca/lookup/doi/10.1503/cmaj.200645; voir un article connexe (en anglais) ici : www.cmaj.ca/lookup/doi/10.1503/cmaj.200648
Intérêts concurrents: Bram Rochwerg est un chercheur participant à un essai financé par une subvention des Instituts de recherche en santé du Canada qui évalue les effets des corticostéroïdes chez les patients atteints de la COVID-19. Aucun autre intérêt concurrent déclaré.
Cet article a été révisé par des pairs.
Collaborateurs: Zhikang Ye et Gordon Guyatt ont contribué à la conception des travaux. Zhikang Ye, Ying Wang, Luis Enrique Colunga-Lozano, Manya Prasad et Gordon Guyatt ont contribué à l’élaboration des travaux. Rachel Couban, Zhikang Ye, Ying Wang, Luis Enrique Colunga-Lozano, Manya Prasad, Wimonchat Tangamornsuksan, Liang Yao, Shahrzad Motaghi, Maryam Ghadimi, Malgorzata Bala, Huda Gomaa, Fang et Yingqi Xiao ont contribué à la collecte, l’analyse et l’interprétation des données. Zhikang Ye, Ying Wang, Luis Enrique Colunga-Lozano et Manya Prasad ont participé à la rédaction du manuscrit. Tous les auteurs ont révisé de façon critique le contenu intellectuel important, ont donné leur approbation finale pour la version destinée à être publiée et assument l’entière responsabilité de tous les aspects du travail. Zhikang Ye, Ying Wang, Luis Enrique Colunga-Lozano et Manya Prasad sont les auteurs principaux.
Financement: Aucun.
Partage des données: Les données extraites des études incluses sont présentées à la section Résultats; toutefois, les tableaux complets de données extraites sont disponibles auprès de l’auteur-ressource.
Références
- 1.WHO Director-General’s opening remarks at the media briefing on COVID-19 — 11 March 2020. Geneva: World Health Organization; 2020. Accessible ici : www.who.int/dg/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19---11-march-2020 (consulté le 23 avril 2020). [Google Scholar]
- 2.Guan WJ, Ni ZY, Hu Y, et al. Clinical characteristics of Coronavirus disease 2019 in China. N Engl J Med 2020;382:1708–1720. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Russell CD, Millar JE, Baillie JK. Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury. Lancet 2020;395:473–5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Shang L, Zhao J, Hu Y, et al. On the use of corticosteroids for 2019-nCoV pneumonia. Lancet 2020;395:683–4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Ye Z, Rochwerg B, Wang Y, et al. Treatment of patients with nonsevere and severe coronavirus disease 2019: an evidence-based guideline. CMAJ 2020;192: E536–E545. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Clinical management of severe acute respiratory infection (SARI) when COVID-19 disease is suspected [interim guidance]. Geneva: World Health Organization; 13 Mars 2020. [Google Scholar]
- 7.Moher D, Liberati A, Tetzlaff J, et al. PRISMA Group. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. Ann Intern Med 2009;151:264–9, W64. [DOI] [PubMed] [Google Scholar]
- 8.Wu C, Chen X, Cai Y, et al. Risk factors associated with acute respiratory distress syndrome and death in patients with Coronavirus disease 2019 pneumonia in Wuhan, China. JAMA Intern Med 2020; 13 Mars [Cyberpublication avant impression]. 10.1001/jamainternmed.2020.0994. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Whiting P, Savovic J, Higgins JP, et al. ROBIS: a new tool to assess risk of bias in systematic reviews was developed. J Clin Epidemiol 2016;69:225–34. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Guyatt GH, Busse JW. Modification of Cochrane Tool to assess risk of bias in randomized trials. Ottawa: Evidence Partners; Accessible ici : www.evidencepartners.com/resources/methodological-resources/ (consulté le 29 avril 2020). [Google Scholar]
- 11.Busse JW, Guyatt GH. Tool to assess risk of bias in cohort studies. Ottawa: Evidence Partners; Accessible ici : www.evidencepartners.com/resources/methodological-resources/ (consulté le 29 avril 2020). [Google Scholar]
- 12.Busse JW, Guyatt GH. Tool to assess risk of bias in case-control studies. Ottawa: Evidence Partners; Accessible ici : www.evidencepartners.com/resources/methodological-resources/ (consulté le 29 avril 2020). [Google Scholar]
- 13.Guyatt GH, Oxman AD, Vist GE, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ 2008;336:924–6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Guyatt GH, Oxman AD, Vist G, et al. GRADE guidelines: 4. Rating the quality of evidence–study limitations (risk of bias). J Clin Epidemiol 2011;64:407–15. [DOI] [PubMed] [Google Scholar]
- 15.Guyatt GH, Oxman AD, Kunz R, et al. GRADE guidelines 6. Rating the quality of evidence–imprecision. J Clin Epidemiol 2011;64:1283–93. [DOI] [PubMed] [Google Scholar]
- 16.Guyatt GH, Oxman AD, Kunz R, et al. GRADE guidelines: 7. Rating the quality of evidence–inconsistency. J Clin Epidemiol 2011;64:1294–302. [DOI] [PubMed] [Google Scholar]
- 17.Guyatt GH, Oxman AD, Kunz R, et al. GRADE guidelines: 8. Rating the quality of evidence–indirectness. J Clin Epidemiol 2011;64:1303–10. [DOI] [PubMed] [Google Scholar]
- 18.Guyatt GH, Oxman AD, Montori V, et al. GRADE guidelines: 5. Rating the quality of evidence–publication bias. J Clin Epidemiol 2011;64:1277–82. [DOI] [PubMed] [Google Scholar]
- 19.Li X, Xu S, Yu M, et al. Risk factors for severity and mortality in adult COVID-19 inpatients in Wuhan. J Allergy Clin Immunol 2020; 12 Avril [Cyberpublication avant impression]. pii S0091-6749(20)30495-4. 10.1016/j.jaci.2020.04.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Wang D, Wang J, Jiang Q, et al. No clear benefit to the use of corticosteroid as treatment in adult patients with Coronavirus disease 2019: a retrospective cohort study. medRxiv 24 Avril 2020. 10.1101/2020.04.21.20066258. [DOI] [Google Scholar]
- 21.Xu K, Chen Y, Yuan J, et al. Factors associated with prolonged viral RNA shedding in patients with COVID-19. Clin Infect Dis 2020; 9 Avril [Cyberpublication avant impression]. pii ciaa351. 10.1093/cid/ciaa351. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Yan D, Liu X, Zhu Y, et al. Factors associated with prolonged viral shedding and impact of lopinavir/ritonavir treatment in patients with SARS-CoV-2 infection. medRxiv 2020; 30 Mars. 10.1101/2020.03.22.20040832. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Lu X, Chen T, Wang Y, et al. Adjuvant corticosteroid therapy for critically ill patients with COVID-19. medRxiv 2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Lau EHY, Cowling BJ, Muller MP, et al. Effectiveness of Ribavirin and corticosteroids for severe acute respiratory syndrome. Am J Med 2009;122:1150.e11–.e21. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Long Y, Xu Y, Wang B, et al. Clinical recommendations from an observational study on MERS: glucocorticoids was benefit in treating SARS patients. Int J Clin Exp Med 2016;9:8865–73. [Google Scholar]
- 26.Lee N, Allen Chan KC, Hui DS, et al. Effects of early corticosteroid treatment on plasma SARS-associated coronavirus RNA concentrations in adult patients. J Clin Virol 2004;31:304–9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Alfaraj SH, Al-Tawfiq JA, Assiri AY, et al. Clinical predictors of mortality of Middle East respiratory syndrome coronavirus (MERS-CoV) infection: a cohort study. Travel Med Infect Dis 2019;29:48–50. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Arabi YM, Mandourah Y, Al-Hameed F, et al. Corticosteroid therapy for critically ill patients with Middle East respiratory syndrome. Am J Respir Crit Care Med 2018;197:757–67. [DOI] [PubMed] [Google Scholar]
- 29.Lewis SR, Pritchard MW, Thomas CM, et al. Pharmacological agents for adults with acute respiratory distress syndrome. Cochrane Database Syst Rev 2019;7:CD004477. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Villar J, Ferrando C, Martinez D, et al. Dexamethasone treatment for the acute respiratory distress syndrome: a multicentre, randomised controlled trial. Lancet Respir Med 2020;8:267–76. [DOI] [PubMed] [Google Scholar]
- 31.Abdelsalam Rezk N, Mohamed Ibrahim A. Effects of methyl prednisolone in early ARDS. Egyptian J Chest Dis Tuberc 2013;62:167–72. [Google Scholar]
- 32.Liu L, Li J, Huang YZ, et al. The effect of stress dose glucocorticoid on patients with acute respiratory distress syndrome combined with critical illness-related corticosteroid insuficiency. Zhonghua Nei Ke Za Zhi 2012;51:599–603. [PubMed] [Google Scholar]
- 33.Meduri GU, Golden E, Freire AX, et al. Methylprednisolone infusion in early severe ARDS: results of a randomized controlled trial. Chest 2007;131:954–63. [DOI] [PubMed] [Google Scholar]
- 34.Steinberg KP, Hudson LD, Goodman RB, et al. Efficacy and safety of corticosteroids for persistent acute respiratory distress syndrome. N Engl J Med 2006;354:1671–84. [DOI] [PubMed] [Google Scholar]
- 35.Tongyoo S, Permpikul C, Mongkolpun W, et al. Hydrocortisone treatment in early sepsis-associated acute respiratory distress syndrome: results of a randomized controlled trial. Crit Care 2016;20:329. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Zhao WB, Wan S, Gu DF, et al. Therapeutic effect of glucocorticoid inhalation for pulmonary fibrosis in ARDS patients. Med J Chinese People’s Liberation Army 2014;39:741–5. [Google Scholar]
- 37.Lansbury LE, Rodrigo C, Leonardi-Bee J, et al. Corticosteroids as adjunctive therapy in the treatment of influenza: an updated Cochrane systematic review and meta-analysis. Crit Care Med 2019; 15 Novembre [Cyberpublication avant impression]. 10.1097/CCM.0000000000004093. [DOI] [PubMed] [Google Scholar]
- 38.Tsai M-J, Yang K-Y, Chan M-C, et al. Impact of corticosteroid treatment on clinical outcomes of influenza-associated ARDS: a nationwide multicenter study. Ann Intensive Care 2020;10:26. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Al-Busaidi M, Al Maamari K, Al’Adawi B, et al. Pandemic influenza A (H1N1) in Oman: epidemiology, clinical features, and outcome of patients admitted to Sultan Qaboos University Hospital in 2009. Oman Med J 2016;31:290–7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Annane D. Pro: the illegitimate crusade against corticosteroids for severe H1N1 pneumonia. Am J Respir Crit Care Med 2011;183:1125–6. [DOI] [PubMed] [Google Scholar]
- 41.Balaganesakumar SR, Murhekar MV, Swamy KK, et al. Risk factors associated with death among influenza A (H1N1) patients, Tamil Nadu, India, 2010. J Postgrad Med 2013;59:9–14. [DOI] [PubMed] [Google Scholar]
- 42.Boudreault AA, Xie H, Leisenring W, et al. Impact of corticosteroid treatment and antiviral therapy on clinical outcomes in hematopoietic cell transplant patients infected with influenza virus. Biol Blood Marrow Transplant 2011;17:979–86. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Brun-Buisson C, Richard J-CM, Mercat A, et al. Group R-SAHNvR. Early corticosteroids in severe influenza A/H1N1 pneumonia and acute respiratory distress syndrome. Am J Respir Crit Care Med 2011;183:1200–6. [DOI] [PubMed] [Google Scholar]
- 44.Cao B, Gao H, Zhou B, et al. Adjuvant corticosteroid treatment in adults with influenza A (H7N9) viral pneumonia. Crit Care Med 2016;44:e318–28. [DOI] [PubMed] [Google Scholar]
- 45.Sheu C-C, Chang W-A, Tsai M-J, et al. Early corticosteroid treatment in patients with influenza-associated acute respiratory distress syndrome. Am J Respir Crit Care Med 2017;195:A2769. [Google Scholar]
- 46.Chawla R, Kansal S, Chauhan M, et al. Predictors of mortality and length of stay in hospitalized cases of 2009 influenza A (H1N1): experiences of a tertiary care center. Indian J Crit Care Med 2013;17:275–82. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Delaney JW, Pinto R, Long J, et al. The influence of corticosteroid treatment on the outcome of influenza A(H1N1pdm09)-related critical illness. Crit Care 2016;20:75. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Delgado-Rodríguez M, Castilla J, Godoy P, et al. Prognosis of hospitalized patients with 2009 H1N1 influenza in Spain: influence of neuraminidase inhibitors. J Antimicrob Chemother 2012;67:1739–45. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Han K, Ma H, An X, et al. Early use of glucocorticoids was a risk factor for critical disease and death from pH1N1 infection. Clin Infect Dis 2011;53:326–33. [DOI] [PubMed] [Google Scholar]
- 50.Huang S-F, Fung C-P, Perng D-W, Wang F-D. Effects of corticosteroid and neuraminidase inhibitors on survival in patients with respiratory distress induced by influenza virus. J Microbiol Immunol Infect 2017;50:586–94. [DOI] [PubMed] [Google Scholar]
- 51.Jain S, Kamimoto L, Bramley AM, et al. Hospitalized patients with 2009 H1N1 influenza in the United States, April–June 2009. N Engl J Med 2009;361:1935–44. [DOI] [PubMed] [Google Scholar]
- 52.Kim S-H, Hong S-B, Yun S-C, et al. Corticosteroid treatment in critically ill patients with pandemic influenza A/H1N1 2009 infection: analytic strategy using propensity scores. Am J Respir Crit Care Med 2011;183:1207–14. [DOI] [PubMed] [Google Scholar]
- 53.Kinikar AA, Kulkarni RK, Valvi CT, et al. Predictors of mortality in hospitalized children with pandemic H1N1 influenza 2009 in Pune, India. Indian J Pediatr 2012;79:459–66. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Kudo K, Takasaki J, Manabe T, et al. Systemic corticosteroids and early administration of antiviral agents for pneumonia with acute wheezing due to influenza A(H1N1)pdm09 in Japan. PLoS One 2012;7:e32280. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Lee N, Leo Y-S, Cao B, et al. Neuraminidase inhibitors, superinfection and corticosteroids affect survival of influenza patients. Eur Respir J 2015;45:1642–52. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Li F, Chen G, Wang J, et al. A case-control study on risk factors associated with death in pregnant women with severe pandemic H1N1 infection. BMJ Open 2012;2. pii: e000827. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Li H, Yang S-G, Gu L, et al. Effect of low-to-moderate-dose corticosteroids on mortality of hospitalized adolescents and adults with influenza A(H1N1)pdm09 viral pneumonia. Influenza Other Respir Viruses 2017;11:345–54. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Liem NT, Tung CV, Hien ND, et al. Clinical features of human influenza A (H5N1) infection in Vietnam: 2004–2006. Clin Infect Dis 2009;48:1639–46. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Linko R, Pettilä V, Ruokonen E, et al. Corticosteroid therapy in intensive care unit patients with PCR-confirmed influenza A(H1N1) infection in Finland. Acta Anaesthesiol Scand 2011;55:971–9. [DOI] [PubMed] [Google Scholar]
- 60.Mady A, Ramadan OS, Yousef A, et al. Clinical experience with severe 2009 H1N1 influenza in the intensive care unit at King Saud Medical City, Saudi Arabia. J Infect Public Health 2012;5:52–6. [DOI] [PubMed] [Google Scholar]
- 61.Moreno G, Rodríguez A, Reyes LF, et al. Corticosteroid treatment in critically ill patients with severe influenza pneumonia: a propensity score matching study. Intensive Care Med 2018;44:1470–82. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Ono S, Ono Y, Matsui H, et al. Factors associated with hospitalization for seasonal influenza in a Japanese nonelderly cohort. BMC Public Health 2016;16:922. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Patel KK, Patel AK, Mehta PM, et al. Clinical outcome of novel H1N1 (swine flu)-infected patients during 2009 pandemic at tertiary referral hospital in Western India. J Glob Infect Dis 2013;5:93–7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.Sertogullarindan B, Ozbay B, Gunini H, et al. Clinical and prognostic features of patients with pandemic 2009 influenza A (H1N1) virus in the intensive care unit. Afr Health Sci 2011;11:163–70. [PMC free article] [PubMed] [Google Scholar]
- 65.Viasus D, Paño-Pardo JR, Cordero E, et al. Effect of immunomodulatory therapies in patients with pandemic influenza A (H1N1) 2009 complicated by pneumonia. J Infect 2011;62:193–9. [DOI] [PubMed] [Google Scholar]
- 66.Wirz SA, Blum CA, Schuetz P, et al. Pathogen-and antibiotic-specific effects of prednisone in community-acquired pneumonia. Eur Respir J 2016;48:1150–9. [DOI] [PubMed] [Google Scholar]
- 67.Wu U-I, Wang J-T, Ho Y-C, et al. Factors associated with development of complications among adults with influenza: a 3-year prospective analysis. J Formos Med Assoc 2012;111:364–9. [DOI] [PubMed] [Google Scholar]
- 68.Xi X, Xu Y, Jiang L, et al. Hospitalized adult patients with 2009 influenza A(H1N1) in Beijing, China: risk factors for hospital mortality. BMC Infect Dis 2010;10:256. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69.Yu H, Yang Y, Zhang Q. Clinical characteristics and risk factors of severe patients with novel pandemic influenza A H1N1. Chinese J Integr Tradit West Med Intentive Crit Care 2011;18:142–5. [Google Scholar]
- 70.Siemieniuk RA, Meade MO, Alonso-Coello P, et al. Corticosteroid therapy for patients hospitalized with community-acquired pneumonia: a systematic review and meta-analysis. Ann Intern Med 2015;163:519–28. [DOI] [PubMed] [Google Scholar]
- 71.Gang LI, Chengdong GU, Zhang S, et al. Value of glucocorticoid steroids in the treatment of patients with severe community-acquired pneumonia complicated with septic shock. Chinese Crit Care Med 2016;28:780–4. [Google Scholar]
- 72.Blum CA, Nigro N, Briel M, et al. Adjunct prednisone therapy for patients with community-acquired pneumonia: a multicentre, double-blind, randomised, placebo-controlled trial. Lancet 2015;385:1511–8. [DOI] [PubMed] [Google Scholar]
- 73.Confalonieri M, Urbino R, Potena A, et al. Hydrocortisone infusion for severe community-acquired pneumonia: a preliminary randomized study. Am J Respir Crit Care Med 2005;171:242–8. [DOI] [PubMed] [Google Scholar]
- 74.El-Ghamrawy AH, Shokeir MH, Esmat AA. Effects of low-dose hydrocortisone in ICU patients with severe community-acquired pneumonia. Egyptian J Chest Dis Tuberc 2006;55:91–9. [Google Scholar]
- 75.Fernández-Serrano S, Dorca J, Garcia-Vidal C, et al. Effect of corticosteroids on the clinical course of community-acquired pneumonia: a randomized controlled trial. Crit Care 2011;15:R96. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 76.Marik P, Kraus P, Sribante J, et al. Hydrocortisone and tumor necrosis factor in severe community-acquired pneumonia: a randomized controlled study. Chest 1993;104:389–92. [DOI] [PubMed] [Google Scholar]
- 77.McHardy VUSM. Ampicillin dosage and use of prednisolone in treatment of pneumonia: co-operative controlled trial. BMJ 1972;4:569–73. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 78.Meijvis SC, Hardeman H, Remmelts HH, et al. Dexamethasone and length of hospital stay in patients with community-acquired pneumonia: a randomised, double-blind, placebo-controlled trial. Lancet 2011;377:2023–30. [DOI] [PubMed] [Google Scholar]
- 79.Nafae RM, Ragab MI, Amany FM, et al. Adjuvant role of corticosteroids in the treatment of community-acquired pneumonia. Egyptian J Chest Dis Tuberc 2013;62:439–45. [Google Scholar]
- 80.Sabry NA, Omar E-D. Corticosteroids and ICU course of community-acquired pneumonia in Egyptian settings. Pharmacol Pharmacy 2011;2:73–81. [Google Scholar]
- 81.Snijders D, Daniels JM, de Graaff CS, et al. Efficacy of corticosteroids in community-acquired pneumonia: a randomized double-blinded clinical trial. Am J Respir Crit Care Med 2010;181:975–82. [DOI] [PubMed] [Google Scholar]
- 82.Torres A, Sibila O, Ferrer M, et al. Effect of corticosteroids on treatment failure among hospitalized patients with severe community-acquired pneumonia and high inflammatory response: a randomized clinical trial. JAMA 2015;313:677–86. [DOI] [PubMed] [Google Scholar]
- 83.Wagner HN, Jr, Bennett I, Jr, Lasagna L, et al. The effect of hydrocortisone upon the course of pneumococcal pneumonia treated with penicillin. Bull Johns Hopkins Hosp 1956;98:197–215. [PubMed] [Google Scholar]
- 84.Mikami K, Suzuki M, Kitagawa H, et al. Efficacy of corticosteroids in the treatment of community-acquired pneumonia requiring hospitalization. Lung 2007;185:249–55. [DOI] [PubMed] [Google Scholar]
- 85.Yang Z, Liu J, Zhou Y, et al. The effect of corticosteroid treatment on patients with coronavirus infection: a systematic review and meta-analysis. J Infect 2020; 10 Avril [Cyberpublication avant impression]. pii S0163-4453(20)30191-2. 10.1016/j.jinf.2020.03.062. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 86.Huang J, Guo J, Li H, et al. Efficacy and safety of adjunctive corticosteroids therapy for patients with severe community-acquired pneumonia: A systematic review and meta-analysis. Medicine (Baltimore) 2019;98:e14636. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 87.Jiang S, Liu T, Hu Y, et al. Efficacy and safety of glucocorticoids in the treatment of severe community-acquired pneumonia: a meta-analysis. Medicine (Baltimore) 2019;98:e16239. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 88.Stern A, Skalsky K, Avni T, et al. Corticosteroids for pneumonia. Cochrane Database Syst Rev 2017;(12):CD007720. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 89.Wu WF, Fang Q, He GJ. Efficacy of corticosteroid treatment for severe community-acquired pneumonia: a meta-analysis. Am J Emerg Med 2018;36:179–84. [DOI] [PubMed] [Google Scholar]
- 90.Ni Y-N, Chen G, Sun J, et al. The effect of corticosteroids on mortality of patients with influenza pneumonia: a systematic review and meta-analysis. Crit Care 2019;23:99. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 91.Zhang Y, Sun W, Svendsen ER, et al. Do corticosteroids reduce the mortality of influenza A (H1N1) infection? A meta-analysis. Crit Care 2015;19:46. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 92.Zhou Y, Fu X, Liu X, et al. Use of corticosteroids in influenza-associated acute respiratory distress syndrome and severe pneumonia: a systemic review and meta-analysis. Sci Rep 2020;10:3044. [DOI] [PMC free article] [PubMed] [Google Scholar]