Abstract
L’infection liée au SARS-CoV-2 entraîne des lésions qui prédominent largement, mais pas exclusivement, au niveau de l’arbre respiratoire. Leur analyse a largement bénéficié des études autopsiques. Ainsi, des lésions ont pu être observées dans les différents organes, tissus ou cellules de l’organisme. Ces observations ont permis d’améliorer rapidement la connaissance des différents mécanismes physiopathologiques associés à cette maladie émergente. Le virus et ses différentes composantes peuvent être détectés à partir de tissus fixés et inclus en paraffine, par immunohistochimie, hybridation in situ, biologie moléculaire et/ou microscopie électronique. Plusieurs inconnues persistent sur le rôle direct joué par le SARS-CoV-2 dans les différentes lésions observées, notamment au niveau cardiaque, cérébral, hépatique, digestif, cutané et rénal. Il est donc primordial de multiplier les analyses tissulaires et cellulaires chez ces patients afin de mieux comprendre les conséquences de la maladie liée à la COVID-19, en particulier selon les facteurs épidémiologiques et les co-morbidités. La connaissance de cette maladie doit permettre, plus particulièrement, de participer au développement des stratégies thérapeutiques. Cette revue décrit les principales lésions histologiques et cellulaires associées à l’infection par le SARS-CoV-2.
Mots clés: COVID-19, Pathologie, Autopsie, Physiopathologie, Études ancillaires
Abstract
The infection due to the SARS-CoV-2 leads lesions mainly observed at the respiratory tract level, but not exclusively. The analyses of these lesions benefited from different autopsy studies. Thus, these lesions were observed in different organs, tissues and cells. These observations allowed us to rapidly improve the knowledge of the pathophysiological mechanisms associated with this emergent infectious disease. The virus can be detected in formalin fixed paraffin embedded tissues using immunohistochemistry, in situ hybridization, molecular biology and/or electron microscopy approaches. However, many uncertainties are still present concerning the direct role of the SARS-CoV-2 on the different lesions observed in different organs, outside the lung, such as the heart, the brain, the liver, the gastrointestinal tract, the kidney and the skin. In this context, it is pivotal to keep going to increase the different tissue and cellular studies in the COVID-19 positive patients aiming to better understanding the consequences of this new infectious disease, notably considering different epidemiological and co-morbidities associated factors. This could participate to the development of new therapeutic strategies too. The purpose of this review is to describe the main histological and cellular lesions associated with the infection due to the SARS-CoV-2.
Keywords: COVID-19, Pathology, Autopsy, Pathophysiology, Ancillary tools
Introduction
Les pathologistes ont été de tout temps confrontés à l’analyse des lésions histologiques et cytologiques associées à des maladies émergentes, en particulier d’origine infectieuse. Ils participent ainsi très fortement à la compréhension physiopathologique de ces maladies et, au moins en partie, à la mise en place de certaines stratégies thérapeutiques. L’un des rôles essentiels du pathologiste face à une nouvelle maladie est de faire la cartographie des différentes atteintes d’organe grâce à la pratique des autopsies. Ce n’est que grâce à la réalisation de séries autopsiques bien conduites et très complètes que l’ensemble des lésions associées à une nouvelle maladie peut être évaluée [1], [2], [3]. L’amélioration des différentes méthodes complémentaires, incluant les approches immunohistochimiques, d’hybridation in situ, de biologie moléculaire et de microscopie électronique, autorise maintenant leur utilisation sur des tissus fixés au formol et inclus en paraffine. Ces approches permettent ainsi une localisation précise des agents pathogènes, et en particulier des virus, dans les différents organes et dans leur cible cellulaire.
C’est dans ce contexte que les pathologistes ont été immédiatement sollicités afin de comprendre les différentes conséquences tissulaires, en particulier au niveau pulmonaire, d’une nouvelle maladie infectieuse virale due au SARS-CoV-2. Ces lésions ont donc été décrites surtout grâce à la pratique des autopsies [4], [5], [6]. D’autres échantillons tissulaires ou cytologiques, prélevés du vivant du patient ont pu être aussi examinés, apportant également des informations importantes concernant cette maladie.
Cette revue aborde les différentes lésions histologiques induites par l’infection liée au SARS-CoV-2, ainsi que les outils actuellement à la disposition du pathologiste permettant de localiser ce virus dans les tissus fixés.
Lésions broncho-pulmonaires
Les lésions liées à une atteinte broncho-pulmonaire par le SARS-CoV-2 ont été initialement rapportées essentiellement grâce à la réalisation d’autopsies [5], [7], [8], [9], [10], [11], [12], [13], [14], [15], [16]. Ces lésions se sont avérées en fait peu ou pas spécifiques de cette infection virale sur les coupes tissulaires colorées par l’hématoxyline éosine car pouvant se voir aussi dans d’autres étiologies d’origine virale ou non. Les images observées sont variables devant faire distinguer celles induites :
-
•
directement par le virus ;
-
•
par la réponse inflammatoire et immunitaire déclenchée par le virus ;
-
•
par une défaillance fonctionnelle en particulier du système cardiovasculaire ou du système nerveux central ;
-
•
par les manœuvres de réanimation et d’assistance respiratoire ;
-
•
par les différents traitements médicamenteux ;
-
•
par une surinfection bactérienne ou bien différentes maladies associées.
Lésions parenchymateuses pulmonaires
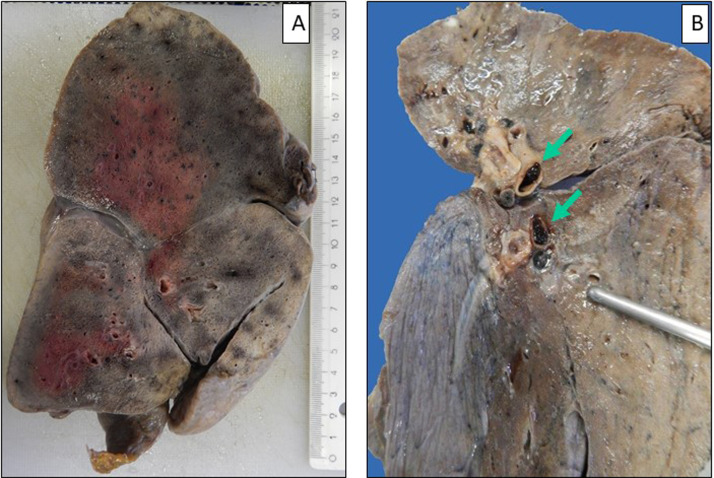
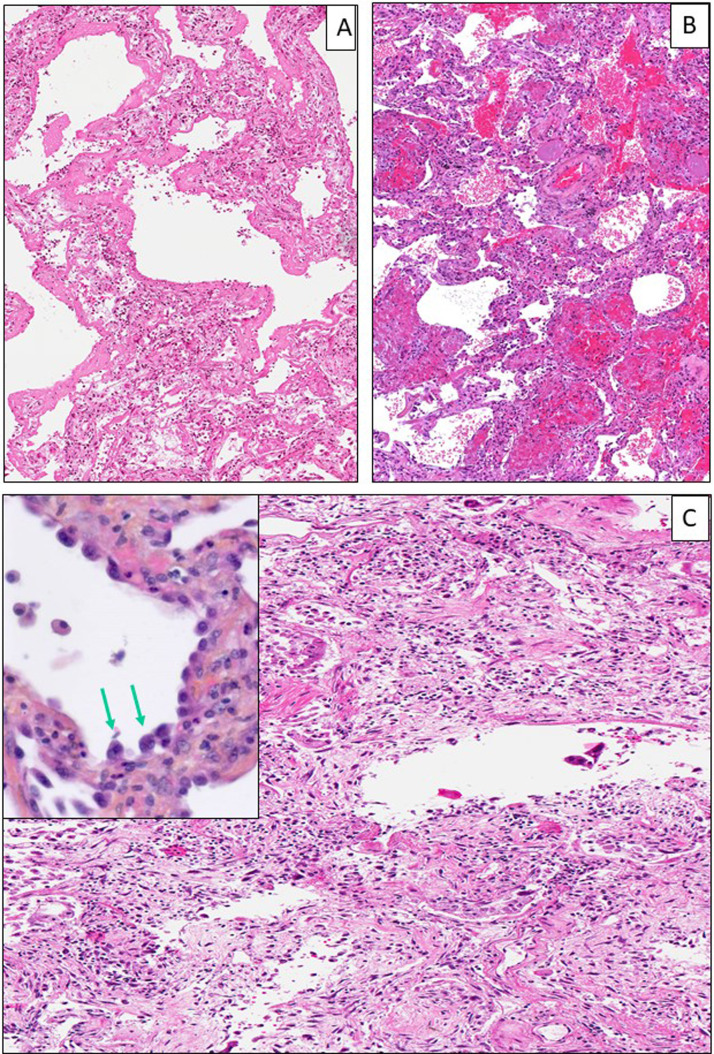
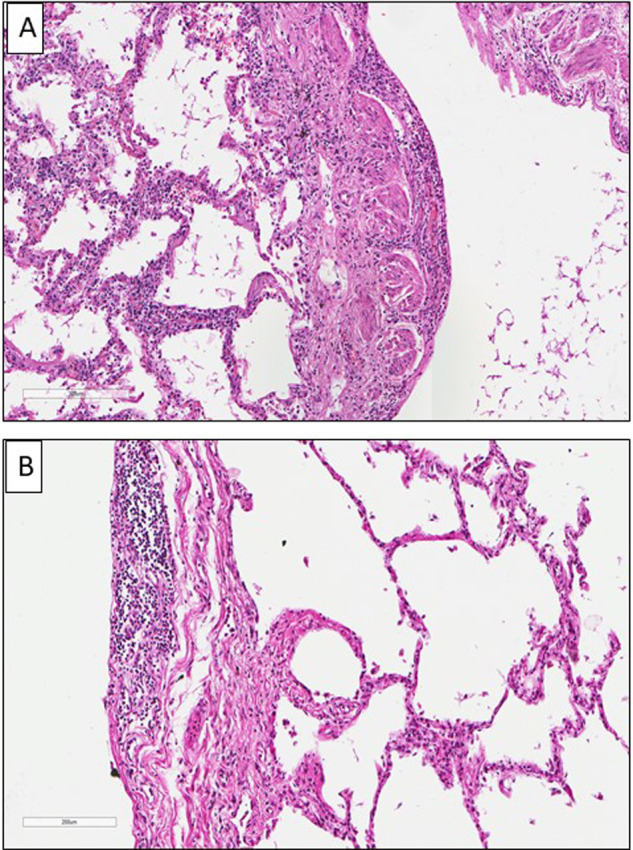
Les lésions macroscopiques des poumons lors des autopsies ne sont pas spécifiques et correspondent à des foyers hémorragiques ou d’infarctus, ou à des territoires de condensation parenchymateuses (Fig. 1A). De façon plus fréquente, on peut observer de façon assez caractéristique la présence de thombi dans différents vaisseaux pulmonaire (Fig. 1B). Les images décrites pour une grande majorité de patients correspondent à des lésions de dommage alvéolaire diffus (DAD) et de pneumopathie organisée fibrineuse aiguë [7], [8], [9], [10], [11], [12], [13], [14], [15], [16], [17]. Il existe ainsi des membranes hyalines tapissant la surface des alvéoles, souvent associées à des exsudats cellulaires fibro-myxoïdes, à une desquamation des pneumocytes, et à des images habituellement notées dans les phases précoces d’un syndrome aigu de détresse respiratoire (Fig. 2A) [18], [19], [20]. Ces lésions de DAD sont assez similaires à celles décrites dans d’autres circonstances étiologiques pouvant induire de telles lésions [21]. La fréquence élevée des lésions de DAD notées dans l’infection liée au SARS-CoV-2 était déjà observée dans d’autres infections virales de l’arbre respiratoire notamment celles associées au SARS et au virus H1N1 [22]. Une pneumonie aiguë organisée et fibrineuse est aussi fréquente, ainsi que des foyers plus ou moins étendus d’infarctus pulmonaire, en particulier dans les formes très sévères de la maladie (Fig. 2B). Plusieurs images peuvent être associées d’une façon plus ou moins complète à ces lésions ; il s’agit d’un important œdème interstitiel, de foyers hémorragiques intra-alvéolaires, d’une infiltration de polynucléaires neutrophiles intra-alvéolaires, d’une hyperplasie des pneumocytes de type II, d’une infiltration interstitielle lymphocytaire ou bien pleurale, de la présence de pneumocytes atypiques de grande taille et de cellules syncytiales multinucléées munies de nucléoles volumineux et de granulations cytoplasmiques amphophiles faisant évoquer un effet cytopathique d’origine viral, et d’une augmentation du nombre de cellules du stroma (fibroblastes) (Fig. 2C et Fig. 3A et B). On peut parfois observer chez certains patients décédés après une période assez prolongée dans le service des soins intensifs, une fibrose interstitielle inflammatoire, associée à une hyperplasie pneumocytaire avec quelques pneumocytes binucléés (Fig. 2C, encart).
Figure 1.
A et B. Pièces autopsiques de pneumonectomie. A. Patiente de 88 ans, diabétique, décédée brutalement. Parenchyme pulmonaire condensé et « hépatisé » dans son ensemble. B. Patient de 70 ans, ayant un diabète et une hypertension, décédé brutalement. Présence de thrombi (flèches) dans les vaisseaux pulmonaires (A et B).
(A and B). Lung resection specimens during an autopsy (A). Woman of 88-year-old, with diabetes and who suddendly died. Global densification of the lung parenchyma. (B). Man of 70 year-old, with hypertension and diabetes who suddendly died. Presence of thrombi (arrows) in pulmonary vessels.
Figure 2.
A. Patiente de 74 ans, hospitalisée pour une dyspnée aiguë avec de la fièvre et étant rapidement décédée. Dommage alvéolaire diffus. B et C. Patients de 64 ans (B) et de 71 ans (C), hospitalisés pour une fièvre avec une toux et décédés après une semaine (B) et trois semaines (C) de réanimation. B et C. Images de pneumopathie organisée fibrineuse aiguë avec fibrose interstitielle débutante ou constituée. C. Encart : présence d’une hyperplasie des pneumocytes avec quelques cellules binucléées (flèches) et une fibrose interstitielle. (A, B, C, hématoxyline éosine safran, × 100).
(A). 74-year-old woman, admitted to the hospital for an acute dyspnea with fever who rapidly died. Diffuse alveolar damage. (B) et (C). Men of 64-year-old and of 71-year-old, hospitalized for a high fever and a cough who died one week (B) or three weeks in intensive care unit. (B) and (C). Acute fibrinous and organizing pneumonia (“AFOP”) with early and late stage fibrosis. C. Inset : pneumocytes hyperplasia with some binucleated cells (arrows) and fibrosis (A, B, C, hematoxylin eosin safran, × 100).
Figure 3.
A et B. Femme de 77 ans, présentant une toux fébrile (40 °C) décédée quelques heures après son admission à l’hôpital. Inflammation lymphocytaire présente dans les cloisons inter alvéolaires (A) ou au niveau de la plèvre viscérale (B). (A et B, hematoxyline éosine safran, × 100).
(A et B). 77-year-old women with fever (40 °C) and cough, who died a few hours after hospital admission. Lymphocytic inflammation infiltrating the inter alveolar septa (A) or the visceral pleura (B). (A and B, hematoxylin eosin safran, × 100).
Lésions vasculaires
Les lésions vasculaires pulmonaires sont l’une des caractéristiques associées à une infection par le SARS-CoV-2 [23], [24], [25]. Ces lésions semblent plus fréquemment décrites dans les infections liées aux coronavirus que dans les autres infections virales, comme celle dues au virus H1N1 [22]. Il s’agit souvent au début des lésions, d’une accumulation massive et diffuse de polynucléaires neutrophiles dans la lumière des vaisseaux (Fig. 4A). Les lésions concernent des structures vasculaires de taille variée, comme les capillaires et les artérioles, mais aussi les veinules, les veines, et plus rarement les grosses artères (Fig. 4B et C). Elles sont parfois minimes se limitant à une congestion des différents vaisseaux. Il peut s’agir aussi de thrombi récents ou hyalins, parfois en voie d’organisation fibreuse, mais aussi d’une inflammation pariétale avec une endothélite ou une capillarite. Ces lésions vasculaires seraient la conséquence :
-
•
d’une atteinte directe des cellules endothéliales par le virus ;
-
•
d’un « orage cytokinique » induit par une réponse immunitaire innée inadaptée à l’infection virale ;
-
•
d’une formation brutale induite par le virus de « NETs » (pour « neutrophilic extracellular traps ») [26].
Figure 4.
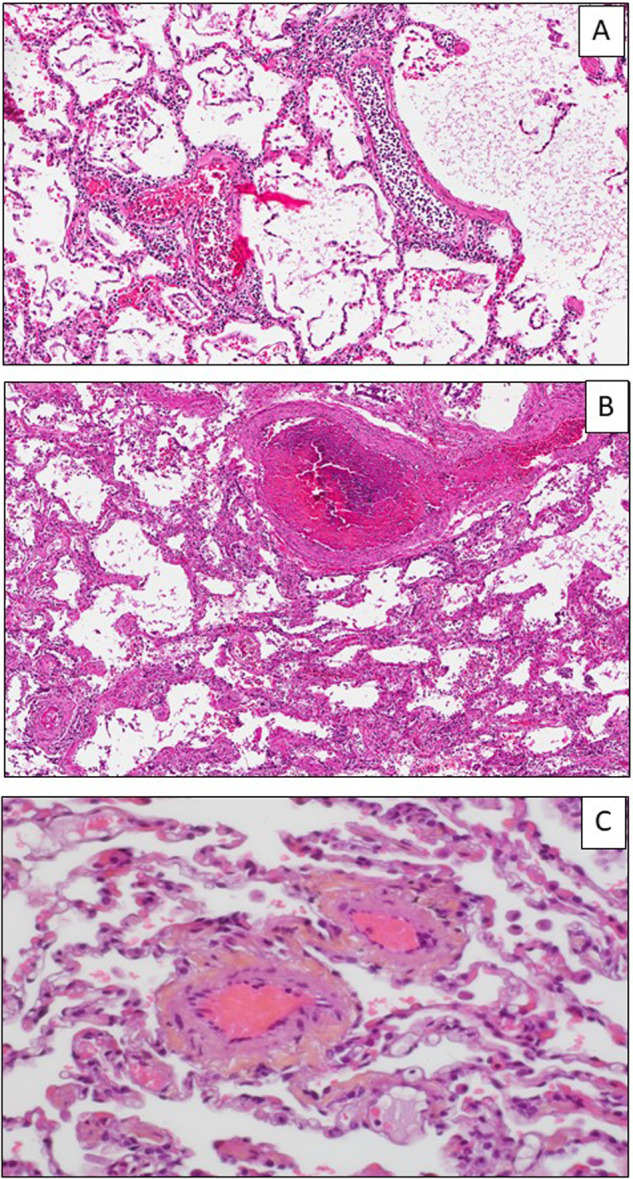
A–C. Lésions vasculaires pulmonaires. A–C. Homme de 58 ans, sans antécédent médical, hospitalisé pour une fièvre à 39 °C et une insuffisance respiratoire aigüe. A. Accumulation intravasculaire de polynucléaires neutrophiles. B. Thrombus récent d’une veine. C. Thrombi en voie d’organisation dans des veinules. (A et C, hématoxyline éosine safran, × 100 ; B, hématoxyline éosine safran, × 200).
(A–C) Pulmonary vascular lesions. (A–C). 58-year-old man, without any medical history, hospitalized with 39 °C fever and an acute respiratory distress. (A). Presence of numerous neutrophils into the vessels (A). B. Venule thrombosis. (C). Thrombi in small venules. (A et C, hematoxylin eosin safran, × 100 ; B, hematoxylin eosin safran, × 200).
Ces structures correspondent à des filaments extracellulaires de chromatine (avec une association d’ADN et d’histones) décondensée, recouverts par de nombreuses protéines d’origine principalement granulaire [26], [27]. L’implication des « NETs » dans la physiopathologie de la thrombose a été clairement démontrée depuis plusieurs années dans différents modèles animaux de thrombose veineuse profonde [28]. L’effet procoagulant des « NETs » est sous-tendu par leur structure en réseau filamentaire, qui constitue un support facilitant l’adhésion et l’activation plaquettaire. Ainsi les « NETs » constituent un composant abondant des thrombi et ils ont un caractère thrombogène majeur souligné par l’effet protecteur de l’administration de DNase [28]. Les « NETS » peuvent infiltrer les compartiments vasculaires mais peuvent être aussi observés au niveau de l’arbre respiratoire et des espaces interstitiels [29]. Les images vasculaires peuvent s’associer à une infiltration de cellules inflammatoires de composition variable, essentiellement d’origine lymphoïde, avec ou sans la présence d’une nécrose fibrinoïde pariétale des petits vaisseaux.
Examens cytologiques
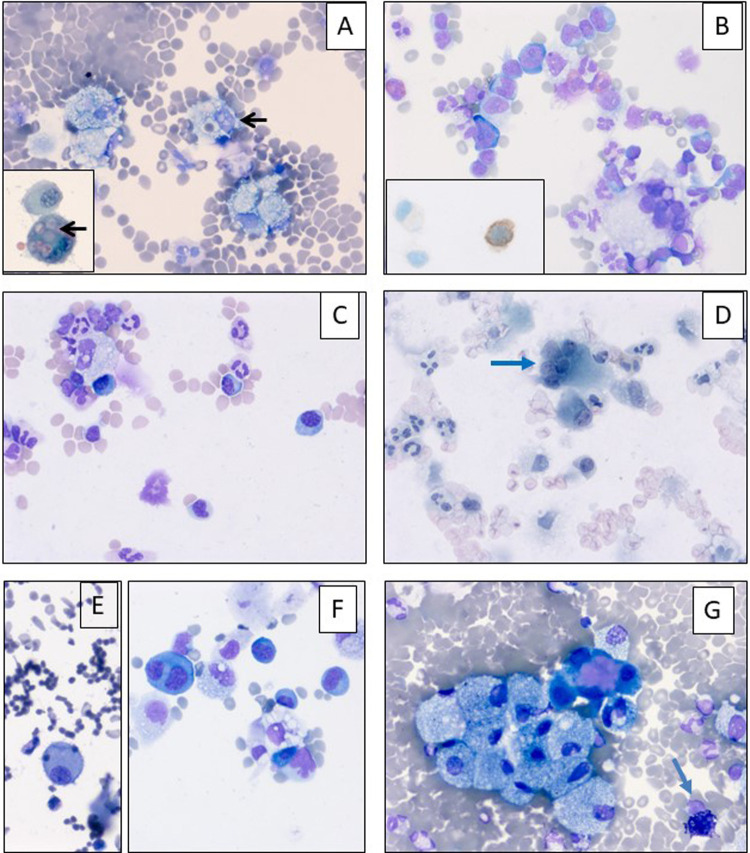
Les échantillons cytologiques, notamment les liquides de lavage broncho-alvéolaire (LBA) recueillis chez des patients infectés par le SARS-CoV-2, montrent parfois des lésions évocatrices d’une infection virale, mais elles ne sont pas spécifiques (Fig. 5 ). Une première étude montrait qu’il existait dans les LBA de ces patients de très nombreux plasmocytes associés surtout à des lymphocytes T et à quelques lymphocytes B [30]. Une augmentation du nombre des macrophages, des pneumocytes, et plus rarement des cellules en métaplasie malpighienne ou bien des cellules binucléées ou multinucléées sont plus rarement notées dans ces LBA ou bien dans les crachats (Fig. 5). Une étiologie virale pouvait être parfois suspectée sur des anomalies morphologiques cytoplasmiques et/ou nucléaires, certaines cellules présentant alors des noyaux volumineux avec des inclusions de taille variée et/ou un cytoplasme vacuolisé avec des vacuoles claires périnucléaires (Fig. 5) [31]. Des images d’érythrophagocytose peuvent êtres notés chez certains patients (Fig. 5). Bien que la prévalence des épanchements pleuraux soit très variable selon les études, allant de 9 % à 59 %, les images observées sur les cyto-blocs sont peu spécifiques montrant des cellules mésothéliales associées à une population modérée et polymorphe de cellules inflammatoires.
Figure 5.
Examens cytologiques à partir de liquides de lavage broncho-alvéolaire (A–H). A. Homme de 65 ans présentant une dypnée fébrile. Liquide hémorragique avec des images d’érythrophagocytose (flèche). A. Encart : macrophage alvéolaire avec image d’érythrophagocytose (flèche) (hématoxyline éosine, × 400 ; encart, coloration de Papanicolaou, x 600). B. Femme de 80 ans, diabétique. Inflammation riche en lymphocytes (May Grunwald Giemsa, × 400 ; B. Encart, immunocytochimie (anti-CD8, × 400). C. Homme de 70 ans présentant une fièvre à 39 °C. Présence de nombreux plasmocytes et de polynucléaires neutrophiles (May Grunwald Giemsa, × 400). D–F. Homme de 78 ans, fébrile et hypertendu. D. Cellules épithéliales multinucléées (flèche) (coloration de Papanicolaou, × 400). E–F. Desquamation de pneumocytes dystrophiques isolées (E), parfois plus nombreux et binucléées (F) (E et F, May Grunwald Giemsa, × 400). G. Présence de macrophages et de mastocytes (flèche) (May Grunwald Giemsa, × 400).
Cytological aspects from broncho-alveolar lavages (A–H). (A). 65-year-old man with fever and dyspnea. Hemorrhagic liquid with erythrophagocytosis features (arrow). A. Inset: alveolar macrophage with erythrophagocytosis (arrow) (hematoxylin eosin, × 400; Inset, Papanicolaou staining × 600). (B). 80-year-old woman with diabetes. Rich lymphocytes inflammation (May Grunwald Giemsa, × 400; Inset, immunoperoxidase, anti-CD8 antibody, × 400. (C). 70-year-old man with 39 °C fever. Numerous plasmocytes and neutrophils (May Grunwald Giemsa, × 400). (D–F). 78-year-old man with hypertension and fever (D). Multinucleated epithelial cells (arrow) (Papanicolaou staining × 400). (E–F). Desquamative pneumocytes which can be isolated and rare (E) or more numerous and binucleated (F). (E et F, May Grunwald Giemsa, × 400). (G). Presence of macrophages and of some mastocytes (arrow) (May Grunwald Giemsa, × 400).
La valeur diagnostique des examens cytologiques semble donc assez limitée en cas d’infection par le SARS-CoV-2. Ces examens permettent cependant d’éliminer certains diagnostics différentiels. Compte tenu des précautions imposées par les mesures sanitaires et de protection du personnel technique au sein des laboratoires de pathologie, la réalisation de ces examens chez un patient atteint de la COVID-19 doit donc se discuter selon la présentation clinique, en concertation avec le pneumologue ou le réanimateur [32].
Immunopathologie pulmonaire
Les échantillons tissulaires recueillis lors des autopsies permettent aussi de mieux comprendre l’immunopathologie associée à l’infection par le SARS-CoV-2, en donnant la possibilité de réaliser des analyses transcriptomiques [33]. Une étude récente a montré des profils transcriptomiques différents selon la présentation clinique, la sévérité des symptômes respiratoires et les lésions histologiques observées au niveau pulmonaire [33]. Ainsi un profil transcriptomique montrait une forte expression locale de différents gènes stimulés par l’interféron et de différentes cytokines, associé à une importante charge virale et des lésions pulmonaires limitées. Le deuxième profil montrait des lésions pulmonaires très sévères, une faible expression des gènes stimulés par l’interféron, un abondant infiltrat parenchymateux par des lymphocytes CD8 activés et des macrophages. De façon surprenante les patients présentant un profil avec une forte expression des différents gènes stimulés par l’interféron décédaient plus rapidement après leur hospitalisation [33].
Lésions des autres organes
Bien que le tractus respiratoire soit la principale cible du SARS-CoV-2, plusieurs tableaux cliniques décrits chez ces patients ont rapidement orienté vers la recherche de lésions tissulaires intéressant différents sites anatomiques, en particulier le coeur, le système nerveux central, le tractus gastrointestinal, la peau, le rein ou le foie (Fig. 6 ). Il est encore difficile d’affirmer que toutes ces atteintes soient directement liées au virus ou bien qu’elles soient associées aux conséquences de la réponse immunitaire, de la défaillance cardio-respiratoire, des troubles de la coagulation, ou bien aux effets des différents traitements. Considérant que le récepteur du SARS-CoV-2, l’ACE2, est largement exprimé sur de nombreuses cellules il ne serait pas surprenant que certaines lésions observées soient dues à une atteinte virale directe [34], [35].
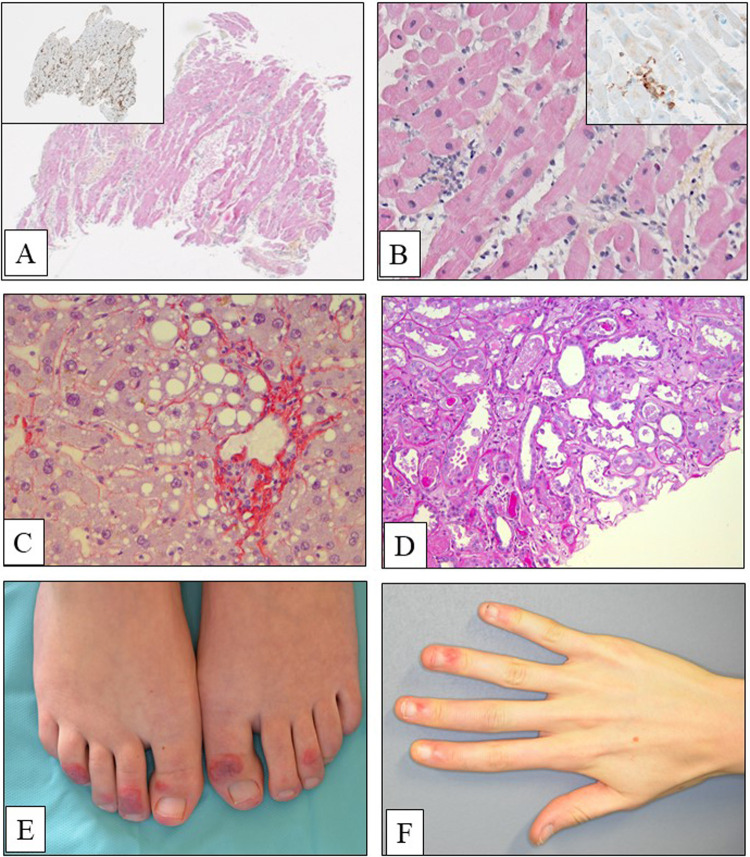
Figure 6.
A–D. Lésions extra-pulmonaires associées à une infection liée au SARS-CoV-2. A et B. Homme de 40 ans, fébrile avec une élévation de la troponine. A. Lésions multifocales de myocardite avec un infiltrat riche en macrophages (A, hématoxyline éosine safran, × 80 ; A. Encart, immunopéroxydase anti-CD68, × 80). B. Œdème interstitiel associé à un infiltrat périvasculaire riche en macrophages et en cellules lymphocytaires CD8 positives (hématoxyline éosine safran, × 200 ; B. Encart, immunoperoxydase anti-CD8, × 200). C. Lésions de stéatose macro et microvacuolaire (rouge Syrius, × 200). D. Lésions de nécrose épithéliale des tubules rénaux (coloration par le PAS, × 200). E et F. Lésions d’engelures (ou de « pseudo-engelures ») cutanées. E. Lésions purpuriques avec une évolution nécrotique centrale caractéristique au niveau des orteils chez une femme de 25 ans. F. Lésions des mains chez une jeune fille de 17 ans.
(A–D) Extra pulmonary lesions associated with an infection due to the SARS-CoV-2. (A and B). 40-year-old man with fever and elevated level of troponin. (A). Multifocal myocarditis with macrophages (A, hematoxylin eosin safran, × 80; Inset, immunoperoxidase anti-CD68, × 80). (B). Interstitial edema associated with a perivascular infiltration rich in macrophages and in CD8 positive lymphocytes (hematoxylin eosin safran, × 200; Inset, immunoperoxidase anti-CD8, × 200). (C). Macro and microvacuolar steatosis (Syrius red stain, × 200). (D). Necrotic lesions of the kidney tubules (PAS stain, × 200). (E) et (F) : Chilblain (« or chilblain-like ») cutaneous lesions. (E). Purpuric lesions of the toes showing a typical central necrotic evolution in a 25-year-old woman. (F). Chilblain of the hands in a 17-year-old young woman.
Lésions cardiaques
Les symptômes cardiaques décrits au cours de la pandémie liée à la COVID-19 associent un infarctus, des troubles du rythme et/ou une insuffisance cardiaque, mais chez certains patients, les signes cliniques et radiologiques correspondent à une myocardite, même si dans la grande majorité des cas rapportés la preuve histologique n’est pas apportée [36], [37], [38]. Des images d’inflammation lymphocytaire au niveau myocardique, avec parfois une nécrose cardiomyocytaire et la présence de corps apoptotiques peuvent s’observer [39]. Des lésions de myocardite modérée avec une infiltration interstitielle de lymphocytes et de macrophages ont été récemment rapportées chez des patients infectés par le SARS-CoV-2 présentant une défaillance cardiaque brutale (Fig. 6A et B) [40], [41]. L’infiltrat inflammatoire est constitué de macrophages et de lymphocytes, majoritairement de phénotype CD8 (Fig. 6A et B). Un cas a été récemment rapporté de défaillance cardiaque liée à des lésions de myocardite apparaissant plusieurs semaines après le diagnostic initial d’une infection par le SARS-CoV-2 [41]. Ces images ont été observées sur des biopsies endomyocardiques. Des particules virales étaient détectées en microscopie électronique dans le cytoplasme des macrophages interstitiels, mais pas dans les cardiomyocytes [40].
Lésions du système nerveux
À ce jour, les données publiées ne permettent pas d’affirmer la physiopathologie de l’atteinte du système nerveux par le virus. Deux hypothèses sont actuellement émises :
-
•
la diffusion hématogène du virus qui, se fixant aux récepteurs ACE2 des cellules endothéliales des différents vaisseaux du parenchyme cérébral, traverserait la barrière hémato-encéphalique ;
-
•
la diffusion neurogène du virus à partir du bulbe olfactif, voire à partir des nerfs périphériques [42].
Les images radiologiques ou histologiques, bien que peu spécifiques, illustrent principalement des lésions d’ordre vasculaire avec une hyperhémie, des micro-thrombi, des infarctus, des lésions ischémiques aiguës, des foyers de microhémorragie, un œdème et des neurones dégénératifs [43], [44], [45], [46], [47], [48]. Des tableaux d’encéphalomyélite ont été rapportés sur des images radiologiques, ainsi que la présence d’un infiltrat lymphocytaire T périvasculaire et d’une activation microgliale méningée et cérébrale [14], [49], [50]. Une observation a été rapportée avec des lésions analogues à celles observées dans les encéphalomyélites aiguës disséminées (connues sous l’acronyme anglophone ADEM), associant un infiltrat macrophagique dans la substance blanche sous-corticale et dans les territoires péri-vasculaires dans le parenchyme et des lésions de dommages axonaux et de démyélinisation [51]. La description des lésions neuropathologiques induites par le virus est rendue difficile par le fait que ce sont des données autopsiques chez des patients ayant des comorbidités, ou bien une ventilation artificielle importante et/ou un traitement par corticoïdes. Afin d’avancer dans la connaissance et la compréhension de l’infection du système nerveux central par le SARS-Cov-2, un programme européen regroupant des observations et réalisant la collecte des tissus neuropathologiques a été lancé par la Société Internationale de Neuropathologie [52].
Lésions du tractus digestif
Les lésions histologiques sont peu spécifiques avec, de façon focale, une infiltration lymphocytaire au niveau de l’épithélium malpighien de l’œsophage, des images dégénératives de l’épithélium gastrique, avec parfois des images de nécrose épithéliale [53], [54]. Des images de congestion des petits vaisseaux, associées à un œdème de la lamina propria et de la sous-muqueuse œsophagienne avec une infiltration de lymphocytes, de monocytes et de plasmocytes sont parfois notées. Au niveau intestinal, on peut observer une sténose de l’intestin grêle avec une dilatation segmentaire dans l’une des études rapportées [53]. De nombreux plasmocytes et lymphocytes sont observés au niveau de la lamina propria de l’estomac, du duodénum, et du colon [54]. L’ARN du SARS-CoV-2 et les protéines virales sont détectés dans les cellules glandulaires de l’estomac, du duodénum et du rectum [54].
Lésions hépatiques et pancréatiques
Au niveau hépatique les lésions observées sont complexes, de sévérité variable et leur étiopathogénie est souvent multifactorielle faisant intervenir les défaillances multiviscérales, les troubles immunologiques systémiques, les différentes toxicités médicamenteuses, notamment pendant les périodes de réanimation, et une atteinte directe par SARS CoV-2 [55], [56], [57], [58], [59]. Ainsi, les lésions hépatiques peuvent combiner de façon variable une stéatose (macrovacuolaire, microvacuolaire, ou de type mixte), des lésions inflammatoires lobulaires et/ou portales, souvent à prédominance lymphocytaire, des lésions hépatocytaires nécrotiques et/ou apoptotiques et/ou des images d’hépatocytes binucléés (Fig. 6C) [59]. Des particules virales ont été récemment mise en évidence dans le cytoplasme des hépatocytes [59]. Des lésions biliaires sont fréquentes, notamment avec de nombreux thrombi visibles dans les petits canaux biliaires associés parfois à une prolifération ductulaire [55], [56], [57], [58]. Enfin, des nodules de régénération hépatocytaire avec des foyers de fibrose, des dilatations des sinusoïdes, et des thrombi vasculaires peuvent être présents [55], [56], [58].
Au niveau du pancréas, des images de cellules dégénératives ont été décrites au niveau des îlots de Langherans [60]. Plusieurs cas de pancréatite aigüe ont été également rapportés [61]. Des lésions pancréatiques directement due à l’infection par le SARS CoV-2 sont suspectées par certains auteurs, mais la pathologie pancréatique peut être aussi la conséquence d’une défaillance cardio-pulmonaire et d’un état de choc, d’une atteinte médicamenteuse et/ou de troubles de la coagulation associées à l’infection [60], [61], [62].
Lésions rénales
Les lésions rénales peuvent concerner les glomérules, les tubes et/ou les vaisseaux [63], [64], [65], [66], [67], [68]. Au niveau glomérulaire, on observe des lésions assez variées associant des foyers d’ischémie, une vacuolisation des podocytes, une glomérulo-sclérose segmentaire et focale, et des images d’accumulation plasmatique dans les espaces de Bowman. Plus récemment a été rapportée, notamment dans chez les patients afro-américains, des lésions de « collapsus glomérulaire » associées à une hyperplasie et à une hypertophie des podocytes [66]. Plus de 37 % des patients hospitalisés pour une infection liée au SARS-CoV-2 présentent des lésions d’atteinte tubulaire aiguë de sévérité variable [66], [67]. Il existe parfois une perte de la bordure en brosse au niveau des tubes proximaux, des images dégénératives vacuolaires avec des images de résorption protéique, des dilatations micro kystiques, voire des cellules tubulaires nécrotiques aboutissant à une nécrose tubulaire aiguë (Fig. 6D)[63], [66]. Des agrégats de globules rouges peuvent obstruer la lumière des capillaires, avec des dépôts d’hémosidérine, une hyalinose des artérioles, une artériosclérose des artères de moyen calibre, des thrombi fibrineux et un rétrécissement du floculus capillaire des glomérules. Des images non spécifiques d’infiltrat inflammatoire lymphocytaire tubulo-interstitiel et d’artériolosclérose sont souvent observées [64], [67], [68].
Lésions cutanées
Les manifestations cutanées associées à une infection par le SARS-CoV-2 sont très variées [69], [70], [71], [72]. Les signes les plus fréquents correspondent à un exanthème maculo-papulaire (présent dans plus de 30 % des patients ayant une symptomatologie cutanée) [69], [70], [71]. Des rashs papulo-vésiculaires, des lésions d’urticaire, des papules rouges et douloureuses des extrémités, un livedo, et/ou des pétéchies peuvent aussi s’observer [72]. La majorité de ces lésions est localisée sur le tronc, mais elles peuvent survenir au niveau des mains et des pieds. Il n’existe pas en général d’association entre la sévérité des lésions pulmonaires et la présence de ces lésions cutanées qui peuvent parfois être inaugurales de la maladie [72]. Ces lésions cutanées peuvent guérir spontanément et sans séquelles. On observe également de façon relativement fréquente la présence d’engelures ou de « pseudo engelures » chez certains patients [73], [74], [75], [76]. Ces lésions sont assez reproductibles d’un patient à l’autre, avec sur le plan symptomatique, un prurit et des douleurs initiales des orteils, plus rarement des doigts, puis l’apparition rapide de papules ou de plaques évoluant vers des lésions purpuriques violacées, puis bulleuses et nécrotiques (Fig. 6E et F). Les lésions histologiques sont assez peu spécifiques essentiellement caractérisées par un infiltrat lymphoïde dense avec des images de vascularite lymphocytaire [73], [74], [75], [76]. La relation causale entre ces lésions et l’infection par le SARS-CoV-2 est parfois difficile à établir, car beaucoup de patients ont un test de RT-PCR négatif, et ont uniquement une sérologie SARS-CoV-2 positive [75]. Cependant, sur le plan épidémiologique, il est intéressant de noter que ces lésions surviennent la plupart du temps chez des adolescents ou de jeunes adultes, sans antécédents médicaux connus [75]. Ces engelures suggèrent fortement, par leur présentation clinique et histologique, une symptomatologie proche des lésions induites par une « interferonopathie » de type I liée à une infection virale [77]. Au niveau épidermique, des lésions de parakératose, d’acanthose, et de dyskératose peuvent également s’observer [70]. Il peut aussi exister des images de nécrose des kératinocytes et une acantholyse. Certains kératinocytes peuvent apparaître multinucléés avec un cytoplasme « ballonnisé » d’allure « pseudo-herpétique » [78]. On peut aussi observer un infiltrat riche en polynucléaires éosinophiles [78]. Des images d’hyperplasie des cellules de Langherans intra épidermiques ont été rapportées [78]. Au niveau du derme, on peut noter des thrombi dans la lumière des capillaires et un infiltrat inflammatoire péri-vasculaire, parfois associés à des images de nécrose fibrinoïde [79], [80]. Une étude a montré une vascularite des petits vaisseaux cutanés avec des images d’infiltration de la paroi vasculaire par des polynucléaires neutrophiles avec une karyorrhexie, une leucocytoclasie, des images d’extravasation de globules rouges et une nécrose fibrinoïde [81].
Autres organes
Des lésions peu spécifiques se traduisant par des infiltrats lymphoïdes ont été décrit dans d’autres tissus [82], [83]. Une destruction des cellules germinales, un épaississement des membranes basales avec une fibrose péritubulaire et une congestion vasculaire ont été notés au niveau testiculaire chez des patients infectés par les coronavirus, l’expression du récepteur cellulaire du SARS-CoV-2, l’ACE2 ayant été mis en évidence à la surface des cellules de Sertoli et des cellules germinales [84]. Cependant une étude récente a montré l’absence du SARS-CoV-2 au niveau testiculaire chez les patients infectés [83]. Des protéines et l’ARN viral ont été détectés au niveau de la conjonctive des patients, et des images ultrastructurales ont été aussi en faveur d’une atteinte conjonctivale par le SARS-CoV-2 [85]. Cependant, ce virus n’a pas été mis en évidence à ce jour dans les différentes structures intra-oculaires [85]. Au niveau du placenta il peut exister des lésions d’inflammation lymphocytaire des villosités ou entre les villosités, mais elles sont peu spécifiques [86], [87], [88]. Des lésions vasculaires placentaires semblent plus fréquentes en cas d’infection de la mère par le SARS-CoV-2, avec des images de thrombi et de nécrose fibrinoïde [87]. Le SARS-CoV-2 a été mis en évidence au niveau placentaire par RT-PCR, immunohistochimie et hybridation in situ, plus spécifiquement dans les cellules du syncytiotrophoblaste [89]. L’analyse ultrastructurale a permis de détecter des particules virales dans le cytoplasme des cellules du syncytiotrophoblaste et du cytotrophoblaste, des cellules fibroblastiques et endothéliales [89]. Des lésions buccales ont été rapportées associant des lésions souvent peu spécifiques, comme une perte des papilles linguales, une atrophie de la langue, une chéilite, des plaques rougeâtres et des pétéchies du palais et de l’intérieur des joues [90]. Enfin des atteintes musculaires ont été décrites à type de myosite, de rhabdomyosite et de rhabdomyolyse [91]. Les cellules musculaires squelettiques expriment l’ACE2, l’hypothèse d’une atteinte directe de ces cellules par le SARS-CoV-2 a été émise [91]. D’autres organes examinés sur des prélèvements autopsiques comme la thyroïde ou l’hypophyse n’ont pas montré de lésions particulières ou n’ont pas fait l’objet d’une description histologique précise [92].
Mise en évidence du SARS-CoV-2 sur des échantillons fixés
Le diagnostic de la maladie liée au SARS-CoV-2 est réalisé en routine dans les laboratoires de biologie par une technique de PCR, à partir essentiellement d’échantillons cytologiques recueillis lors des grattages cytologiques du nasopharynx. La mise en évidence du SARS-CoV-2 (ARN, protéines virales ou virus entier) peut aussi se faire sur du tissu fixé grâce à des techniques immunohistochimiques (IHC), d’hybridation in situ (HIS), de biologie moléculaire et/ou de microscopie électronique. La recherche du virus sur ces échantillons fixés provenant de différents organes peut permettre d’associer des lésions souvent non spécifiques (inflammation lymphocytaire, nécrose cellulaire) à une atteinte virale, et d’éliminer les autres causes possibles responsables de ces lésions (défaillance cardiovasculaire, respiratoire ou neurologique, conséquences des soins de réanimation ou des traitements médicamenteux, autres infections associées).
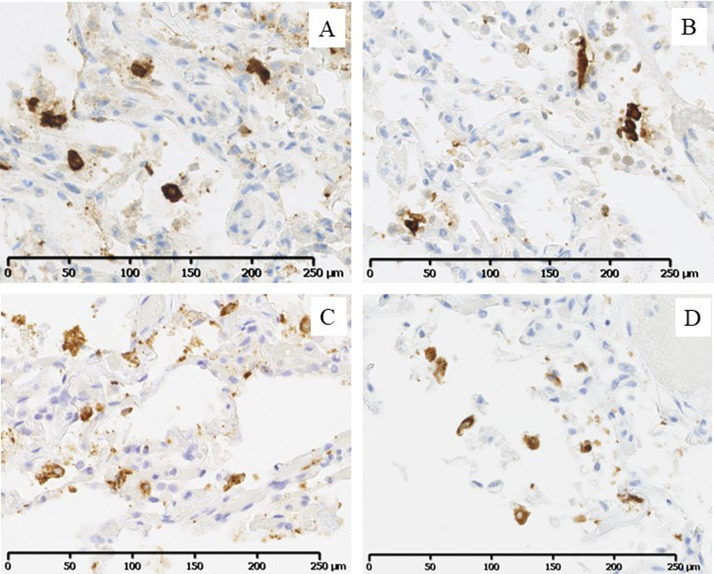
Immunohistochimie et hybridation in situ (HIS)
Un certain nombre d’anticorps, dont certains sont disponibles dans le commerce, permet de détecter sur des coupes tissulaires déparaffinées les protéines virales du SARS-CoV-2 [35], [93], [94], [95] (Fig. 7 ). Il peut s’agir d’anticorps dirigés contre les protéines de la nucléocapside ou bien contre d’autres protéines, comme la protéine spike ou bien la protéine Rp-3 NP [95] (Fig. 7). Les antigènes viraux ont été mis en évidence dans le cytoplasme de plusieurs types cellulaires, essentiellement les cellules épithéliales ciliées de l’arbre respiratoire, présentes depuis le nasopharynx jusqu’aux bronches (Fig. 6). Ces protéines virales peuvent être aussi localisées dans les cellules alvéolaires ou glandulaires pulmonaires, et, dans les cellules endothéliales du parenchyme pulmonaire [35], [96]. Une étude récente a montré que les antigènes viraux étaient mis en évidence dans les phases aiguës de la maladie respiratoire, mais pas au stade chronique et secondaire [97]. Ces protéines virales ont été également détectées dans d’autres organes et tissus, au niveau des cellules endothéliales ou dans d’autres cellules comme par exemple les cellules des glandes eccrines de la peau ou les cellules placentaires [79], [89]. Les techniques d’HIS ont permis de détecter des fragments d’ARN du SARS-CoV-2 dans le cytoplasme des cellules épithéliales ciliées de l’arbre respiratoire ou bien dans les cellules d’autres organes [89], [94]. En combinant l’IHC et l’HIS il est possible d’identifier simultanément les protéines et l’ARN du virus [94].
Figure 7.
Analyses immunohistochimiques anti-SARS. Cellules du parenchyme pulmonaire marquées avec, A : l’anticorps polyclonal de lapin anti-SARS Coronavirus (Invitrogen ; × 200), B : l’anticorps anti-SARS-CoV-2 (2019-nCoV) monoclonal de lapin ciblant la nucleoproteine virale (Sino Biological ; × 200), C : l’anticorps monoclonal recombinant ciblant la nucléocapside du SARS coronavirus (CorisBio, × 200), et D : l’anticorps anti-protéine spike du SARS-CoV-2 (clone 1A9, × 200).
Anti-SARS immunohistochemistry. Cells from the lung parenchyma stained with, (A) The SARS Coronavirus nucleocapsid rabbit polyclonal antibody (Invitrogen; × 200), (B) The SARS-CoV-2 (2019-nCoV) nucleoprotein/NP rabbit monoclonal antibody (Sino Biological, × 200), (C) The SARS-nucleocapsid protein human recombinant monoclonal antibody (CorisBio, × 200), and, (D) The SARS-CoV/SARS-CoV-2 spike antibody (clone 1A9, × 200).
Biologie moléculaire
Les techniques de RT-PCR ont été mises au point pour être utilisées sur des échantillons tissulaires ou cellulaires fixés, et permettent de démontrer la présence du SARS-CoV-2 dans plusieurs sites anatomiques, en particulier l’arbre respiratoire, mais aussi le système nerveux central, le cœur, le foie, le rein, l’intestin, la peau, le placenta ou la rate [34], [56], [80], [89], [98]. Ces techniques doivent être impérativement effectuées en utilisant des témoins positifs et des témoins négatifs, compte tenu de l’éventualité de faux résultats positifs ou négatifs. Les résultats faussement négatifs sont liés à une dégradation de l’ARN viral consécutive à la fixation formolée, ou bien à une faible quantité d’ARN viral à amplifier ou à une altération de l’ARN viral consécutive à des conditions de stockage inadaptées des blocs de paraffine. Des résultats faussement positifs ont été également rapportés, surtout en cas d’utilisation d’une méthodologie de PCR quantitative. La détection du SARS-CoV-2 par biologie moléculaire doit toujours être confrontée à l’analyse histologique, en particulier à la présence d’une réaction inflammatoire et/ou de lésions nécrotiques, permettant ainsi de faire le lien entre la présence du virus et son effet pathogène.
Microscopie électronique
L’approche ultra-structurale présente l’avantage de pouvoir apprécier la réplication du SARS dans les cellules [99]. La mise en évidence de l’ARN ou des protéines virales n’est pas forcément le reflet de la présence de particules virales intactes et infectieuses, ces dernières étant uniquement détectables par microscopie électronique [100]. Des études récentes ont montré des particules virales, le plus souvent intracytoplasmiques, chez des patients atteints de la COVID-19 [100]. Cependant, l’identification des coronavirus dans les tissus n’est pas aussi évidente à réaliser que sur des cultures cellulaires infectées par ces virus, et d’autres structures assez semblables peuvent conduire à de fausses interprétations positives [80]. Des particules d’allure virale ont été identifiées dans des cellules épithéliales (cellules épithéliales bronchiques et cellules alvéolaires de type II), mais aussi dans des cellules endothéliales et diverses cellules comme les macrophages, les cellules du syncytio et du cytotrophoblaste, et les fibroblastes [40], [79], [89], [96]. La première mise en évidence du SARS-CoV-2 en microscopie électronique a été faite au niveau des cellules épithéliales respiratoires isolées d’un LBA [101]. Ces particules ont été ensuite mises en évidence dans différentes cellules en dehors du parenchyme pulmonaire, en particulier au niveau de l’épithélium des tubes rénaux et des podocytes, des hépatocytes et dans différents organes, dont le cœur, au niveau des cellules endothéliales [37], [56], [65], [102]. Plusieurs controverses ont ensuite été formulées par la suite quant à la réalité d’une infection par le SARS-CoV-2 sur les images observées, ces dernières pouvant en fait correspondre à des structures « virus-like » [66], [103]. Les virions ont une taille régulière et correspondent à des particules enveloppées ayant un diamètre de 60 à 140 nm avec une morphologie caractéristique des coronavirus, possédant souvent une couronne périphérique munie « d’épines » [100], [101]. Selon la conservation tissulaire et la fixation formolée entraînant parfois une dégradation des structures histologiques et cellulaires, cette couronne périphérique peut être peu ou non visible. La microscopie électronique à transmission ou à balayage ne permet pas souvent d’affirmer définitivement que les virions observés correspondent au SARS-CoV-2. En effet les images ultrastructurales des infections liées aux autres coronavirus (SARS, MERS, etc.) sont similaires. Des techniques d’immunomarquage en microscopie électronique par « immunogold » utilisant des anticorps anti-protéines du SARS-CoV-2, permettraient d’identifier avec précision ce virus et d’écarter le diagnostic d’autres infections virales ou bien de structures appelées « virales-like » mimant des virions, comme les « coated vesicles », les corps multi-vésiculaires, les inclusions tubulo-réticulaires intra-endothéliales, ou des sections du réticulum endoplasmique granuleux [100], [103]. Ces différentes structures nécessitent pour leur identification précise une analyse à fort grandissement (> 90,000) sur des tissus parfaitement conservés.
Conclusion
Les lésions histopathologiques associées à une infection par le SARS-CoV-2 ont fait l’objet récemment de nombreuses études et elles sont encore rapportées de mois en mois, essentiellement grâce à des études autopsiques [6]. De tout temps la pratique des autopsies a permis de mieux comprendre les nouvelles maladies et pouvoir réaliser régulièrement des autopsies en période d’épidémie ou de pandémie liée à l’émergence d’un agent infectieux est une nécessité, voire une obligation scientifique [3], [5], [6], [104], [105]. Les lésions décrites permettent alors de mieux comprendre la physiopathologie, les symptômes, les complications induites, et leur étude participe à l’application des nouveaux traitements. Ceci est à nouveau très important au cours de la période de pandémie liée à la COVID-19 [4]. Un des exemples de découverte autopsique chez les patients infectés par le SARS-CoV-2 a été la mise en évidence inattendue de nombreux thrombi vasculaires pulmonaires, ayant conduit très rapidement à la mise en place des traitements anticoagulants. Les autopsies permettent de réaliser aussi une cartographie très complète des lésions sur tous les organes, et de donner la possibilité de mettre en évidence l’agent pathogène dans plusieurs types cellulaires ou plusieurs organes. Cependant, la pratique des autopsies a progressivement baissé, en particulier en France, et l’expertise des nouvelles générations de pathologistes pourrait ainsi faire défaut à l’avenir en cas d’émergence de nouvelles maladies infectieuses [106]. Dans ce contexte, il est aussi impératif que les salles d’autopsies soient conformes aux normes sanitaires répondant aux recommandations internationales, et toute autopsie doit se réaliser dans un environnement de type BSL-3 [31], [104]. En parallèle, les jeunes pathologistes doivent être formés aux mesures d’hygiène et sécurité associées à ces pratiques.
Les lésions cytologiques associées à l’infection par le COVID-19 sont peu spécifiques et ne permettent pas, à ce jour, d’orienter vers cette infection virale, plutôt que vers une autre pathologie, comme celle de la grippe. Le développement des méthodes complémentaires peut permettre d’envisager dans un futur proche de venir compléter l’approche diagnostique sur ces échantillons cytologiques, notamment les LBA. La pandémie liée à la COVID-19 met à nouveau en lumière la nécessité d’avoir une formation importante des pathologistes en pathologie infectieuse afin de pouvoir identifier rapidement des lésions due à des agents pathogènes, et de répondre aux demandes des cliniciens, notamment sur l’origine de certains symptômes ou défaillances d’organe [56]. Il est donc nécessaire de prendre en charge les échantillons cytologiques et tissulaires des patients infectés par le SARS-CoV-2, en optimisant les mesures sanitaires au sein des laboratoires de pathologie, tout en maintenant l’activité normale de ces laboratoires dans le cadre du diagnostic des autres maladies, en particulier chez les patients atteints de cancer [107], [108], [109]. En effet, l’impact de la première vague de la pandémie liée au COVID-19 sur l’activité régulière des laboratoires de pathologie et de biologie moléculaire a été important dans la majorité des pays, notamment en Europe [109], [110].
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Remerciements
Les auteurs remercient Sarah De Clercq (Hôpital Erasme-ULB, Bruxelles) Justine Allard (Diapath -CMMI-ULB, Bruxelles) pour les analyses immunohistochimiques, le Fonds Erasme-ULB et le Fonds Yvonne Boel pour le financement du développement des tests immunohistochimiques.
Références
- 1.Burton J.L., Underwood J. Clinical, educational, and epidemiological value of autopsy. Lancet. 2007;369:1471–1480. doi: 10.1016/S0140-6736(07)60376-6. [DOI] [PubMed] [Google Scholar]
- 2.Cooper H., Lucas S.B. The value of autopsy, believe it or not. Lancet. 2007;370:27. doi: 10.1016/S0140-6736(07)61042-3. [DOI] [PubMed] [Google Scholar]
- 3.De Cock K.M., Zielinski-Gutiérrez E., Lucas S.B. Learning from the Dead. N Engl J Med. 2019;381:1889–1891. doi: 10.1056/NEJMp1909017. [DOI] [PubMed] [Google Scholar]
- 4.Barth R.F., Xu X., Buja L.M. A call to action: the need for autopsies to determine the full extent of organ involvement associated with COVID-19. Chest. 2020;158:43–44. doi: 10.1016/j.chest.2020.03.060. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Hanley B., Lucas S.B., Youd E., Swift B., Osborn M. Autopsy in suspected COVID-19 cases. J Clin Pathol. 2020;73:239–242. doi: 10.1136/jclinpath-2020-206522. [DOI] [PubMed] [Google Scholar]
- 6.Sapino A., Facchetti F., Bonoldi E., Gianatti A., Barbareschi M. The autopsy debate during the COVID-19 emergency: the Italian experience. Virchows Arch. 2020;476:821–823. doi: 10.1007/s00428-020-02828-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Barton L.M., Duval E.J., Stroberg E., Ghosh S., Mukhopadhyay S. COVID-19 autopsies, Oklahoma, USA. Am J Clin Pathol. 2020;153:725–733. doi: 10.1093/ajcp/aqaa062. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Basso C., Calabrese F., Sbaraglia M., Del Vecchio C., Carretta G., Saieva A. Feasibility of postmortem examination in the era of COVID-19 pandemic: the experience of a Northeast Italy University Hospital. Virchows Arch. 2020:1–7. doi: 10.1007/s00428-020-02861-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Borczuk A.C., Salvatore S.P., Seshan S.V., Patel S.S., Bussel J.B., Mostyka M. COVID-19 pulmonary pathology: a multi-institutional autopsy cohort from Italy and New York City. Mod Pathol. 2020;33:2156–2168. doi: 10.1038/s41379-020-00661-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Bösmüller H., Traxler S., Bitzer M., Häberle H., Raiser W., Nann D. The evolution of pulmonary pathology in fatal COVID-19 disease: an autopsy study with clinical correlation. Virchows Arch. 2020;477:349–357. doi: 10.1007/s00428-020-02881-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Buja L.M., Wolf D.A., Zhao B., Akkanti B., McDonald M., Lelenwa The emerging spectrum of cardiopulmonary pathology of the coronavirus disease 2019 (COVID-19): report of 3 autopsies from Houston, Texas, and review of autopsy findings from other United States cities. Cardiovasc Pathol. 2020;48:107233. doi: 10.1016/j.carpath.2020.107233. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Calabrese F., Pezzuto F., Fortarezza F., Hofman P., Kern I., Panizo A. Pulmonary pathology and COVID-19: lessons from autopsy. The experience of European Pulmonary Pathologists. Virchows Arch. 2020;477:359–372. doi: 10.1007/s00428-020-02886-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Carsana L., Sonzogni A., Nasr A., Rossi R.S., Pellegrinelli A., Zerbi P. M. Pulmonary post-mortem findings in a series of COVID-19 cases from northern Italy: a two-centre descriptive study. Lancet Infect Dis. 2020;20:1135–1140. doi: 10.1016/S1473-3099(20)30434-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Copin M.C., Parmentier E., Duburcq T., Poissy J., Mathieu D. Time to consider histologic pattern of lung injury to treat critically ill patients with COVID-19 infection. Intensive Care Med. 2020;46:1124–1126. doi: 10.1007/s00134-020-06057-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Hanley B., Naresh K.N., Roufosse C., Nicholson A.G., Weir J., Cooke G.S. Histopathological findings and viral tropism in UK patients with severe fatal COVID-19: a post-mortem study. Lancet Microbe. 2020;1:e245–e253. doi: 10.1016/S2666-5247(20)30115-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Menter T., Haslbauer J.D., Nienhold R., Savic S., Hopfer H., Deigendesch N. Postmortem examination of COVID-19 patients reveals diffuse alveolar damage with severe capillary congestion and variegated findings in lungs and other organs suggesting vascular dysfunction. Histopathology. 2020;77:198–209. doi: 10.1111/his.14134. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Heinrich F., Sperhake J.P., Heinemann A., Mushumba H., Lennartz M., Nörz D. Germany's first COVID-19 deceased: a 59-year-old man presenting with diffuse alveolar damage due to SARS-CoV-2 infection. Virchows Arch. 2020;477:335–339. doi: 10.1007/s00428-020-02872-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Mohanty S.K., Satapathy A., Naidu M.M., Mukhopadhyay S., Sharma S., Barton L.M. Severe acute respiratory syndrome coronavirus-2 (SARS-CoV-2) and coronavirus disease 19 (COVID-19) – anatomic pathology perspective on current knowledge. Diagn Pathol. 2020;15:103. doi: 10.1186/s13000-020-01017-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Pernazza A., Mancini M., Rullo E., Bassi M., De Giacomo T., Rocca C.D. Early histologic findings of pulmonary SARS-CoV-2 infection detected in a surgical specimen. Virchows Arch. 2020:1–6. doi: 10.1007/s00428-020-02829-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Xu Z., Shi L., Wang Y., Zhang J., Huang L., Zhang C. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir Med. 2020;8:420–422. doi: 10.1016/S2213-2600(20)30076-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Konopka K.E., Nguyen T., Jentzen J.M., Rayes O., Schmidt C.J., Wilson A.M. Diffuse alveolar damage (DAD) resulting from coronavirus disease 2019 infection is morphologically indistinguishable from other causes of DAD. Histopathology. 2020;77:570–578. doi: 10.1111/his.14180. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Hariri L.P., North C.M., Shih A.R., Israel R.A., Maley J.H., Villalba J.A. Lung histopathology in COVID-19 as compared to SARS and H1N1 influenza: a systematic review. Chest. 2020 doi: 10.1016/j.chest.2020.09.259. [S0012-3692(20)34868-6] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Ackermann M., Verleden S.E., Kuehnel M., Haverich A., Welte T., Laenger F. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in COVID-19. N Engl J Med. 2020;383:120–128. doi: 10.1056/NEJMoa2015432. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Becker R.C. COVID-19-associated vasculitis and vasculopathy. J Thromb Thrombolysis. 2020;50:499–511. doi: 10.1007/s11239-020-02230-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Lax S.F., Skok K., Zechner P., Kessler H.H., Kaufmann N., Koelblinger C. Pulmonary arterial thrombosis in COVID-19 with fatal outcome: results from a prospective, single-center, clinicopathologic case series. Ann Intern Med. 2020;173:350–361. doi: 10.7326/M20-2566. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Zuo Y., Yalavarthi S., Shi H., Gockman K., Zuo M., Madison J.A. Neutrophil extracellular traps in COVID-19. JCI Insight. 2020;5:e138999. doi: 10.1172/jci.insight.138999. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Barnes B.J., Adrover J.M., Baxter-Stoltzfus A., orczuk A., Cools-Lartigue J., Crawford J.M. Targeting potential drivers of COVID-19: Neutrophil extracellular traps. J Exp Med. 2020;217:e20200652. doi: 10.1084/jem.20200652. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Thiam H.R., Wong S.L., Wagner D.D., Waterman C.M. Cellular mechanisms of NETosis. Annu Rev Cell Dev Biol. 2020;36:191–218. doi: 10.1146/annurev-cellbio-020520-111016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Radermecker C., Detrembleur N., Guiot J., Cavalier E., Henket M., d’Emal C. Neutrophil extracellular traps infiltrate the lung airway, interstitial, and vascular compartments in severe COVID-19. J Exp Med. 2020;217:e20201012. doi: 10.1084/jem.20201012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Giani M., Seminati D., Lucchini A., Foti G., Pagni F. Exuberant plasmocytosis in bronchoalveolar lavage specimen of the first patient requiring extracorporeal membrane oxygenation for SARS-CoV-2 in Europe. J Thorac Oncol. 2020;15:e65–e66. doi: 10.1016/j.jtho.2020.03.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Pambuccian S.E. The COVID-19 pandemic: implications for the cytology laboratory. J Am Soc Cytopathol. 2020;9:202–211. doi: 10.1016/j.jasc.2020.03.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Hofman P. Challenges and issues surrounding the use for translational research of human samples obtained during the COVID-19 pandemic from lung cancer patients. Transl Lung Cancer Research. 2020;9:1543–1553. doi: 10.21037/tlcr-20-594. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Nienhold R., Ciani Y., Koelzer V.H., Tzankov A., Haslbauer J.D., Menter T. Two distinct immunopathological profiles in autopsy lungs of COVID-19. Nat Commun. 2020;11:5086. doi: 10.1038/s41467-020-18854-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Remmelink M., De Mendonça R., D’Haene N., De Clercq S., Verocq C., Lebrun L. Unspecific post-mortem findings despite multiorgan viral spread in COVID-19 patients. Crit Care. 2020;24:495. doi: 10.1186/s13054-020-03218-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Skok K., Stelzl E., Trauner M., Kessler H.H., Lax S.F. Post-mortem viral dynamics and tropism in COVID-19 patients in correlation with organ damage. Virchows Arch. 2020:1–11. doi: 10.1007/s00428-020-02903-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Doyen D., Moceri P., Ducreux D., Dellamonica J. Myocarditis in a patient with COVID-19: a cause of raised troponin and ECG changes. Lancet. 2020;395:1516. doi: 10.1016/S0140-6736(20)30912-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Unudurthi S.D., Luthra P., Bose R.J.C., McCarthy J.R., Kontaridis M.I. Cardiac inflammation in COVID-19: lessons from heart failure. Life Sci. 2020;260:118482. doi: 10.1016/j.lfs.2020.118482. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Zeng J.H., Liu Y.X., Yuan J., Wang F.X., Wu W.B., Li J.X. First case of COVID-19 complicated with fulminant myocarditis: a case report and insights. Infection. 2020;48:773–777. doi: 10.1007/s15010-020-01424-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Lindner D., Fitzek A., Bräuninger H., Aleshcheva G., Edler C., Meissner K. Association of cardiac infection with SARS-CoV-2 in confirmed COVID-19 autopsy cases. JAMA Cardiol. 2020:e203551. doi: 10.1001/jamacardio.2020.3551. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Tavazzi G., Pellegrini C., Maurelli M., Belliato M., Sciutti F., Bottazzi A. Myocardial localization of coronavirus in COVID-19 cardiogenic shock. Eur J Heart Fail. 2020;22:911–915. doi: 10.1002/ejhf.1828. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Nicol M., Cacoub L., Baudet M., Nahmani Y., Cacoub P., Cohen-Solal A. Delayed acute myocarditis and COVID-19-related multisystem inflammatory syndrome. ESC Heart Fail. 2020 doi: 10.1002/ehf2.13047. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Li Z., Liu T., Yang N., Han D., Mi X., Li Y. Neurological manifestations of patients with COVID-19: potential routes of SARS-CoV-2 neuroinvasion from the periphery to the brain. Front Med. 2020;14:533–541. doi: 10.1007/s11684-020-0786-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Al-Sarraj S., Troakes C., Hanley B., Osborn M., Richardson M.P., Hotopf M. Invited review: the spectrum of neuropathology in COVID-19. Neuropathol Appl Neurobiol. 2020 doi: 10.1111/nan.12667. [DOI] [PubMed] [Google Scholar]
- 44.Baig A.M., Khaleeq A., Ali U., Syeda H. Evidence of the COVID-19 virus targeting the CNS: tissue distribution, host-virus interaction, and proposed neurotropic mechanisms. ACS Chem Neurosci. 2020;11:995–998. doi: 10.1021/acschemneuro.0c00122. [DOI] [PubMed] [Google Scholar]
- 45.Matschke J., Lütgehetmann M., Hagel C., Sperhake J.P., Schröder A.S., Edler C. Neuropathology of patients with COVID-19 in Germany: a post-mortem case series. Lancet Neurol. 2020;19:919–929. doi: 10.1016/S1474-4422(20)30308-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Radmanesh A., Derman A., Lui Y.W., Raz E., Loh J.P., Hagiwara M. COVID-19-associated diffuse leukoencephalopathy and microhemorrhages. Radiology. 2020;297:E223–E227. doi: 10.1148/radiol.2020202040. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Solomon I.H., Normandin E., Bhattacharyya S., Mukerji S.S., Keller K., Ali A.S. Neuropathological features of COVID-19. N Engl J Med. 2020;383:989–992. doi: 10.1056/NEJMc2019373. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Wölfel R., Corman V.M., Guggemos W. Nervous system involvement after infection with COVID-19 and other coronaviruses. Brain Behav Immun. 2020 doi: 10.1016/j.bbi.2020.03.031. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Deigendesch N., Sironi L., Kutza M., Wischnewski S., Fuchs V., Hench J. Correlates of critical illness-related encephalopathy predominate postmortem COVID-19 neuropathology. Acta Neuropathol. 2020;140:583–586. doi: 10.1007/s00401-020-02213-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Parsons T., Banks S., Bae C., Gelber J., Alahmadi H., Tichauer M. COVID-19-associated acute disseminated encephalomyelitis (ADEM) J Neurol. 2020;267:2799–2802. doi: 10.1007/s00415-020-09951-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Reichard R.R., Kashani K.B., Boire N.A., Constantopoulos E., Guo Y., Lucchinetti C.F. Neuropathology of COVID-19: a spectrum of vascular and acute disseminated encephalomyelitis (ADEM)-like pathology. Acta Neuropathol. 2020;140:1–6. doi: 10.1007/s00401-020-02166-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.http://www.intsocneuropathol.com/2020/04/accessing-covid-19-brain-tissue/
- 53.Su S., Shen J., Zhu L., Qiu Y., He J.S., Tan J.Y. Involvement of digestive system in COVID-19: manifestations, pathology, management and challenges. Therap Adv Gastroenterol. 2020;13 doi: 10.1177/1756284820934626. [1756284820934626] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Xiao F., Tang M., Zheng X., Liu Y., Li X., Shan H. Evidence for gastrointestinal infection of SARS-CoV-2. Gastroenterology. 2020;158:1831–1833. doi: 10.1053/j.gastro.2020.02.055. [e3] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Jothimani D., Venugopal R., Abedin M.F., Kaliamoorthy I., Rela M. COVID-19 and the liver. J Hepato. 2020;73:1231–1240. doi: 10.1016/j.jhep.2020.06.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Lagana S.M., Kudose S., Iuga A.C., Lee M.J., Fazlollahi L., Remotti H.E. Hepatic pathology in patients dying of COVID-19: a series of 40 cases including clinical, histologic, and virologic data. Mod Pathol. 2020;13:1–9. doi: 10.1038/s41379-020-00649-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Li Y., Xiao S.Y. Hepatic involvement in COVID-19 patients: pathology, pathogenesis, and clinical implications. J Med Virol. 2020 doi: 10.1002/jmv.25973. [DOI] [PubMed] [Google Scholar]
- 58.Nardo A.D., Schneeweiss-Gleixner M., Bakail M., Dixon E.D., Lax S.F., Trauner M. Pathophysiological mechanisms of liver injury in COVID-19. Liver Int. 2020 doi: 10.1111/liv.14730. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Wang Y., Liu S., Liu H., Li W., Lin F., Jiang L. SARS-CoV-2 infection of the liver directly contributes to hepatic impairment in patients with COVID-19. J Hepatol. 2020;73:807–816. doi: 10.1016/j.jhep.2020.05.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Gupta R., Meena K., Patnaik I., Kumar A. Pancreas. ACE2 expression in the pancreas and association with COVID-19. Infection. 2020 doi: 10.1097/MPA.0000000000001698. [DOI] [PubMed] [Google Scholar]
- 61.de-Madaria E., Capurso G. COVID-19 and acute pancreatitis: examining the causality. Nat Rev Gastroenterol Hepatol. 2020;17:1–2. doi: 10.1038/s41575-020-00389-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Mukherjee R., Smith A., Sutton R. Covid-19-related pancreatic injury. Br J Surg. 2020;107:e190. doi: 10.1002/bjs.11645. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Chueh T.I., Zheng C.M., Hou Y.C., Lu K.C. Novel evidence of acute kidney injury in COVID-19. J Clin Med. 2020;9:3547. doi: 10.3390/jcm9113547. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.Farkash E.A., Wilson A.M., Jentzen J.M. Ultrastructural evidence for direct renal infection with SARS-CoV-2. J Am Soc Nephrol. 2020;31:1683–1687. doi: 10.1681/ASN.2020040432. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 65.Martinez-Rojas M.A., Vega-Vega O., Bobadilla N.A. Is the kidney a target of SARS-CoV-2? Am J Physiol Renal Physiol. 2020;318:F1454–F1462. doi: 10.1152/ajprenal.00160.2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Nasr S.H., Alexander M.P., Cornell L.D., Herrera L.H., Fidler M.E., Said S.M. Kidney biopsy findings in patients with COVID-19, kidney injury, and proteinuria. Am J Kidney Dis. 2020 doi: 10.1053/j.ajkd.2020.11.002. [S0272-6386(20)31120-3] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 67.Puelles V.G., Lütgehetmann M., Lindenmeyer M.T., Sperhake J.P., Wong M.N., Allweiss L. Multiorgan and renal tropism of SARS-CoV-2. N Engl J Med. 2020;383:590–592. doi: 10.1056/NEJMc2011400. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.Su H., Yang M., Wan C., Yi L.X., Tang F., Zhu H.Y. Renal histopathological analysis of 26 postmortem findings of patients with COVID-19 in China. Kidney Int. 2020;98:219–227. doi: 10.1016/j.kint.2020.04.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69.Català A., Galván-Casas C., Carretero-Hernández G., Rodríguez-Jiménez P., Fernández-Nieto D., Rodríguez-Villa A. Maculopapular eruptions associated to COVID-19: a subanalysis of the COVID-Piel study. Dermatol Ther. 2020;10:e14170. doi: 10.1111/dth.14170. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 70.Galván Casas C., Català A., Carretero Hernández G., Rodríguez-Jiménez P., Fernández-Nieto D., Rodríguez-Villa Lario A. Classification of the cutaneous manifestations of COVID-19: a rapid prospective nationwide consensus study in Spain with 375 cases. Br J Dermatol. 2020;183:71–77. doi: 10.1111/bjd.19163. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 71.Marzano A.V., Cassano N., Genovese G., Moltrasio C., Vena G.A. Cutaneous manifestations in patients with COVID-19: a preliminary review of an emerging issue. Br J Dermatol. 2020;183:431–442. doi: 10.1111/bjd.19264. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 72.Sachdeva M., Gianotti R., Shah M., Bradanini L., Tosi D., Veraldi S. Cutaneous manifestations of COVID-19: report of three cases and a review of literature. J Dermatol Sci. 2020;98:75–81. doi: 10.1016/j.jdermsci.2020.04.011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 73.El Hachem M., Diociaiuti A., Concato C., Carsetti R., Carnevale C., Ciofi Degli Atti M. A clinical, histopathological and laboratory study of 19 consecutive Italian paediatric patients with chilblain-like lesions: lights and shadows on the relationship with COVID-19 infection. J Eur Acad Dermatol Venereol. 2020;31:10. doi: 10.1111/jdv.16682. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 74.Herman A., Peeters C., Verroken A., Tromme I., Tennstedt D., Marot L. Evaluation of chilblains as a manifestation of the COVID-19 pandemic. JAMA Dermatol. 2020;156:998–1003. doi: 10.1001/jamadermatol.2020.2368. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 75.Hubiche T., Cardot-Leccia N., Le Duff F., Seitz-Polski B., Giordana P., Chiaverini C., JAMA Dermatol, 2020, 10.1001/jamadermatol, 2020;e204324. doi: 10.1001/jamadermatol.2020.4324
- 76.Kanitakis J., Lesort C., Danset M., Jullien D. J Chilblain-like acral lesions during the COVID-19 pandemic (“COVID toes”): histologic, immunofluorescence, and immunohistochemical study of 17 cases. Am Acad Dermatol. 2020;83:870–875. doi: 10.1016/j.jaad.2020.05.145. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 77.Eleftheriou D., Brogan P.A. Genetic interferonopathies: an overview. Best Pract Res Clin Rheumatol. 2017;31:441–459. doi: 10.1016/j.berh.2017.12.002. [DOI] [PubMed] [Google Scholar]
- 78.Gianotti R., Zerbi P., Dodiuk-Gad R.P. Clinical and histopathological study of skin dermatoses in patients affected by COVID-19 infection in the Northern part of Italy. J Dermatol Sci. 2020;98:141–143. doi: 10.1016/j.jdermsci.2020.04.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 79.Colmenero I., Santonja C., Alonso-Riaño M., Noguera-Morel L., Hernández-Martín A., Andina D. SARS-CoV-2 endothelial infection causes COVID-19 chilblains: histopathological, immunohistochemical and ultrastructural study of seven paediatric cases. Br J Dermatol. 2020;183:729–737. doi: 10.1111/bjd.19327. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 80.Jamiolkowski D., Mühleisen B., Müller S., Navarini A.A., Tzankov A., Roider E. SARS-CoV-2 PCR testing of skin for COVID-19 diagnostics: a case report. Lancet. 2020;396:598–599. doi: 10.1016/S0140-6736(20)31754-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Dominguez-Santas M., Diaz-Guimaraens B., Garcia Abellas P., Moreno-Garcia Del Real C., Burgos-Blasco P., Suarez-Valle A. Cutaneous small-vessel vasculitis associated with novel 2019 coronavirus SARS-CoV-2 infection (COVID-19) J Eur Acad Dermatol Venereol. 2020;34:e536–e537. doi: 10.1111/jdv.16663. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 82.Luga A.C., Marboe C.C., Yilmaz M.M., Lefkowitch J.H., Gauran C., Lagana S.M. Adrenal vascular changes in COVID-19 autopsies. Arch Pathol Lab Med. 2020 doi: 10.5858/arpa.2020-0248-LE. [DOI] [PubMed] [Google Scholar]
- 83.Song C., Wang Y., Li W., Hu B., Chen G., Xia P. Absence of 2019 novel coronavirus in semen and testes of COVID-19 patients. Biol Reprod. 2020;103:4–6. doi: 10.1093/biolre/ioaa050. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 84.Shen Q., Xiao X., Aierken A., Yue W., Wu X., Liao M. The ACE2 expression in Sertoli cells and germ cells may cause male reproductive disorder after SARS-CoV-2 infection. J Cell Mol Med. 2020;24:9472–9477. doi: 10.1111/jcmm.15541. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 85.Lauermann P., Storch M., Weig M., Tampe B., Winkler M., Hoerauf H. There is no intraocular affection on a SARS-CoV-2 - Infected ocular surface. Am J Ophthalmol Case Rep. 2020;20:100884. doi: 10.1016/j.ajoc.2020.100884. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 86.Menter T., Mertz K.D., Jiang S., Chen H., Monod C., Tzankov A. Placental pathology findings during and after SARS-CoV-2 infection: features of villitis and malperfusion. Pathobiology. 2020:1–9. doi: 10.1159/000511324. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 87.Shanes E.D., Mithal L.B., Otero S., Azad H.A., Miller E.S., Goldstein J.A. Placental pathology in COVID-19. Am J Clin Pathol. 2020;154:23–32. doi: 10.1093/ajcp/aqaa089. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 88.Sharps M.C., Hayes D.J.L., Lee S., Zou Z., Brady C.A., Almoghrabi Y. A structured review of placental morphology and histopathological lesions associated with SARS-CoV-2 infection. Placenta. 2020;101:13–29. doi: 10.1016/j.placenta.2020.08.018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 89.Hosier H., Farhadian S.F., Morotti R.A., Deshmukh U., Lu-Culligan A., Campbell K.H. SARS-CoV-2 infection of the placenta. J Clin Invest. 2020;130:4947–4953. doi: 10.1172/JCI139569. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 90.Díaz Rodríguez M., Jimenez Romera A., Villarroel M. Oral manifestations associated to Covid-19. Oral Dis. 2020 doi: 10.1111/odi.13555. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 91.Paliwal V.K., Garg R.K., Gupta A., Tejan N. Neuromuscular presentations in patients with COVID-19. Neurol Sci. 2020;41:3039–3056. doi: 10.1007/s10072-020-04708-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 92.Vasquez-Bonilla W.O., Orozco R., Argueta V., Sierra M., Zambrano L.I., Muñoz-Lara F. A review of the main histopathological findings in coronavirus disease 2019. Hum Pathol. 2020;105:74–83. doi: 10.1016/j.humpath.2020.07.023. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 93.Best Rocha A., Stroberg E., Barton L.M., Duval E.J., Mukhopadhyay S., Yarid N. Detection of SARS-CoV-2 in formalin-fixed paraffin-embedded tissue sections using commercially available reagents. Lab Invest. 2020;9:1–5. doi: 10.1038/s41374-020-0464-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 94.Liu J., Babka A.M., Kearney B.J., Radoshitzky S.R., Kuhn J.H., Zeng X. Molecular detection of SARS-CoV-2 in formalin-fixed, paraffin-embedded specimens. JCI Insight. 2020;5:e139042. doi: 10.1172/jci.insight.139042. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 95.Zhang H., Zhou P., Wei Y., Yue H., Wang Y., Hu M. Histopathologic changes and SARS-CoV-2 immunostaining in the lung of a patient with COVID-19. Ann Intern Med. 2020;172:629–632. doi: 10.7326/M20-0533. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 96.Varga Z., Flammer A.J., Steiger P., Haberecker M., Andermatt R., Zinkernagel A.S. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020;395:1417–1418. doi: 10.1016/S0140-6736(20)30937-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 97.Schaefer I.M., Padera R.F., Solomon I.H., Kanjilal S., Hammer M.M., Hornick J.L. In situ detection of SARS-CoV-2 in lungs and airways of patients with COVID-19 M. Mod Pathol. 2020;33:2104–2114. doi: 10.1038/s41379-020-0595-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 98.Wang W., Xu Y., Gao R., Lu R., Han K., Wu G. Detection of SARS-CoV-2 in different types of clinical specimens. JAMA. 2020;323:1843–1844. doi: 10.1001/jama.2020.3786. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 99.Perlman S., Netland J. Coronaviruses post-SARS: update on replication and pathogenesis. Nat Rev Microbiol. 2009;7:439–450. doi: 10.1038/nrmicro2147. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 100.Hopfer H., Herzig M.C., Gosert R., Menter T., Hench J., Tzankov A. Hunting coronavirus by transmission electron microscopy–a guide to SARS-CoV-2-associated ultrastructural pathology in COVID-19 tissues. Histopathology. 2020 doi: 10.1111/his.14264. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 101.Zhu N., Zhang D., Wang W., Li X., Yang B., Song J. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med. 2020;382:727–733. doi: 10.1056/NEJMoa2001017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 102.Dolhnikoff M., Ferreira Ferranti J., de Almeida Monteiro R.A., Duarte-Neto A.N., Soares Gomes-Gouvêa M., Viu Degaspare N. SARS-CoV-2 in cardiac tissue of a child with COVID-19-related multisystem inflammatory syndrome. Lancet Child Adolesc Health. 2020;4:790–794. doi: 10.1016/S2352-4642(20)30257-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 103.Goldsmith C.S., Miller S.E., Martines R.B., Bullock H.A., Zaki S.R. Electron microscopy of SARS-CoV-2: a challenging task. Lancet. 2020;395:e99. doi: 10.1016/S0140-6736(20)31188-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 104.Hofman P., Saint-Paul M.C., Battaglione V., Michiels J.F., Loubière R. Autopsy findings in the acquired immunodeficiency syndrome (AIDS). A report of 395 cases from the south of France. Pathol Res Pract. 1999;195:209–217. doi: 10.1016/S0344-0338(99)80037-5. [DOI] [PubMed] [Google Scholar]
- 105.Tzankov A., Jonigk D. Unlocking the lockdown of science and demystifying COVID-19: how autopsies contribute to our understanding of a deadly pandemic. Virchows Arch. 2020;477:331–333. doi: 10.1007/s00428-020-02887-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 106.Hofman P., Lucas S., Jouvion G., Tauziède-Espariat A., Chrétien F., Cathomas G. Pathology of infectious diseases: what does the future hold? Virchows Arch. 2017;470:483–492. doi: 10.1007/s00428-017-2082-6. [DOI] [PubMed] [Google Scholar]
- 107.Gosney J.R., Hofman P., Troncone G., Lopez-Rios F. Cellular pathology in the COVID-19 era: a European perspective on maintaining quality and safety. J Clin Pathol. 2020 doi: 10.1136/jclinpath-2020-206789. [jclinpath-2020-206789] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 108.Troncone G., Hofman P. Pathologists and the coronavirus distraction effect. J Clin Pathol. 2020 doi: 10.1136/jclinpath-2020-206807. [jclinpath-2020-206807] [DOI] [PubMed] [Google Scholar]
- 109.Hofman P., Ilie M., Chamorey E., Brest P., Schiappa R., Nakache V. Clinical and molecular practice of European thoracic pathology laboratories during the COVID-19 pandemic The past and the near future. ESMO Open. 2020 doi: 10.1136/esmoopen-2020-001119. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 110.Vigliar E., Cepurnaite R., Alcaraz-Mateos E., Ali S.Z., Baloch Z.W., Bellevicine C. Global impact of the COVID-19 pandemic on cytopathology practice: results from an international survey of laboratories in 23 countries. Cancer Cytopathol. 2020;128:885–894. doi: 10.1002/cncy.22373. [DOI] [PubMed] [Google Scholar]