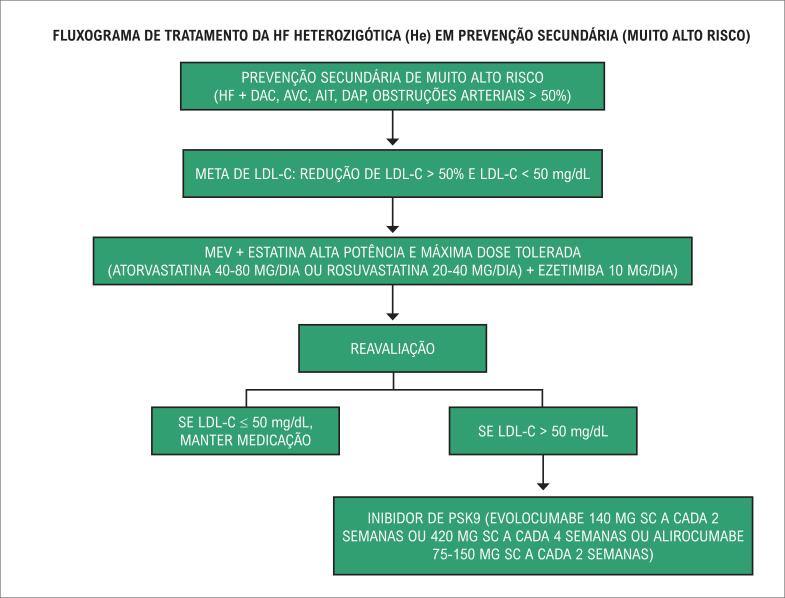
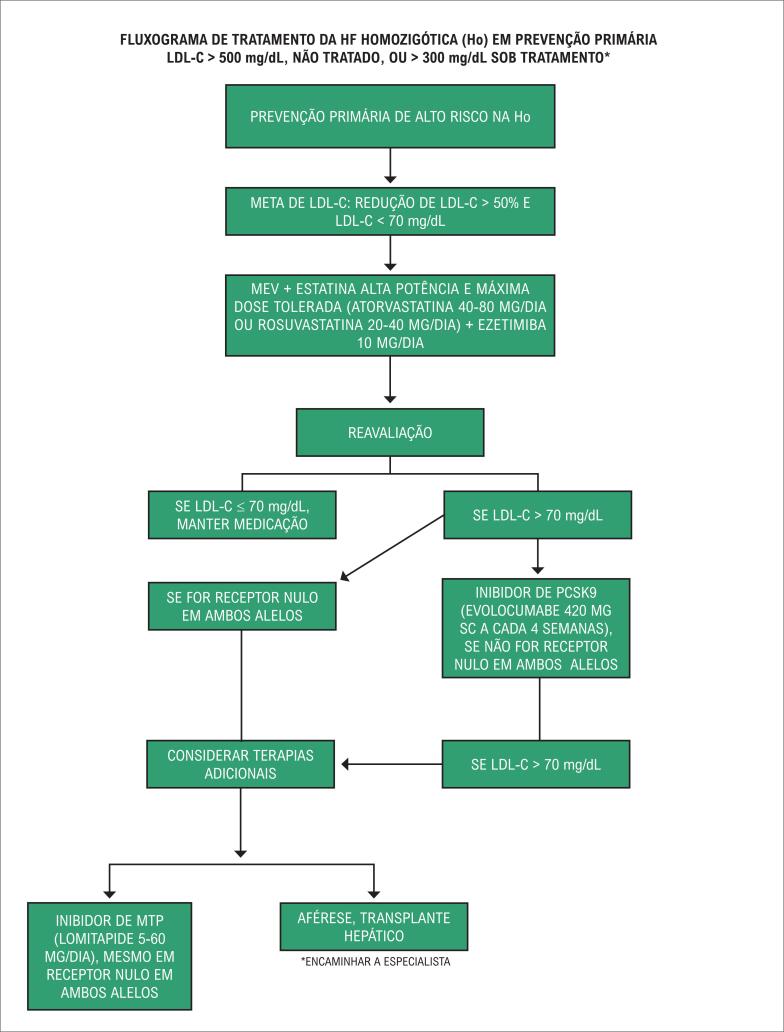
| Atualização da Diretriz Brasileira de Hipercolesterolemia Familiar – 2021 | |
|---|---|
| O relatório abaixo lista as declarações de interesse conforme relatadas à SBC pelos especialistas durante o período de desenvolvimento deste posicionamento, 2020/2021. | |
| Especialista | Tipo de relacionamento com a indústria |
| Adriana Bertolami | Nada a ser declarado |
| Ana Maria Lottenberg | Declaração financeira |
| Nada a ser declarado | |
| Ana Paula M. Chacra | Nada a ser declarado |
| Andre Arpad Faludi | Nada a ser declarado |
| Andrei C. Sposito | Outros relacionamentos |
| Financiamento de atividades de educação médica continuada, incluindo viagens, hospedagens e inscrições para congressos e cursos, provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Sanofi: Aula médica. | |
| Antônio Carlos Palandri Chagas | Declaração financeira |
| A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Instituto de Vita: Membro do conselho científico; Novo Nordisk: Diabetes/obesidade; Pfizer/ Upjohn: Hipolipemiante. | |
| Cinthia Elim Jannes | Nada a ser declarado |
| Cristiane Kovacs Amaral | Nada a ser declarado |
| Daniel Branco de Araújo | Declaração financeira |
| A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Novo Nordisk/ Merk do Brasil: Diabetes; Novartis: Dislipidemia. | |
| Outros relacionamentos | |
| Financiamento de atividades de educação médica continuada, incluindo viagens, hospedagens e inscrições para congressos e cursos, provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Sanofi: Dislipidemia. | |
| Dennys Esper Cintra | Nada a ser declarado |
| Elaine dos Reis Coutinho | Declaração financeira |
| A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Novartis: Atividade não promocional. | |
| Fernando Cesena | Declaração financeira |
| A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Libbs/ Novartis: Dislipidemia; Abbott/ Novo Nordisk: Diabetes; Pfizer: Anticoagulação. | |
| Outros relacionamentos | |
| Financiamento de atividades de educação médica continuada, incluindo viagens, hospedagens e inscrições para congressos e cursos, provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Novartis; Novo Nordisk: Diabetes. | |
| Francisco Antonio Helfenstein Fonseca | Declaração financeira |
| A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Novo Nordisk: Semaglutida; AstraZeneca: Rosuvastatina, Metoprolol, Candesartana; Libbs: Rosuvastatina, Ezetimiba; Sanofi. | |
| Outros relacionamentos | |
| Financiamento de atividades de educação médica continuada, incluindo viagens, hospedagens e inscrições para congressos e cursos, provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - AstraZeneca/ Novo Nordisk: Congresso virtual. | |
| Hermes Toros Xavier | Declaração financeira |
| A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Torrent do Brasil: Colesterol; Bayer: Aterotrombose. | |
| Outros relacionamentos | |
| Financiamento de atividades de educação médica continuada, incluindo viagens, hospedagens e inscrições para congressos e cursos, provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Torrent do Brasil: Colesterol. | |
| Isabela Cardoso Pimentel Mota | Declaração financeira |
| A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - PTC Therapheutics: Doenças raras. | |
| Isabela de Carlos Back Giuliano | Declaração financeira |
| B - Financiamento de pesquisas sob sua responsabilidade direta/pessoal (direcionado ao departamento ou instituição) provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Genzyme do Brasil: Mipomersen. | |
| José Francisco Kerr Saraiva | Nada a ser declarado |
| José Rocha Faria Neto | Declaração financeira |
| A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - AstraZeneca: Diabetes; Boehringer Ingelheim: Diabetes, Fibrilação atrial; Sanofi/ Medley: Dislipidemia; Novartis. | |
| Outros relacionamentos | |
| Financiamento de atividades de educação médica continuada, incluindo viagens, hospedagens e inscrições para congressos e cursos, provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Sanofi/ Medley: Dislipidemia. | |
| Juliana Tieko Kato | Nada a ser declarado |
| Luciana Ribeiro Bahia | Declaração financeira |
| A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Novo Nordisk: Obesidade; AstraZeneca: Diabetes. | |
| Outros relacionamentos | |
| Financiamento de atividades de educação médica continuada, incluindo viagens, hospedagens e inscrições para congressos e cursos, provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Novo Nordisk: Obesidade. | |
| Marcelo Chiara Bertolami | Declaração financeira |
| A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Abbott: Lipidil; Sanofi: Zinpass e Zinpass eze, Libbs: Plenance eze. | |
| Outros relacionamentos | |
| Financiamento de atividades de educação médica continuada, incluindo viagens, hospedagens e inscrições para congressos e cursos, provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Novo Nordisk: Ozempic; EMS: Hipolipemiantes; Aché: Trezate. | |
| Marcelo Heitor Vieira Assad | Declaração financeira |
| A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - AstraZeneca: Prevenção cardiovascular; Boehringerr: Diabetes/anticoagulação; Novo Nordisk: Diabetes. | |
| Outros relacionamentos | |
| Financiamento de atividades de educação médica continuada, incluindo viagens, hospedagens e inscrições para congressos e cursos, provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Boehringer; Novo Nordisk: Diabetes | |
| Marcio Hiroshi Miname | Declaração financeira |
| A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Amgen: Repatha; Novo Nordisk: Ozempic; Libbs. | |
| B - Financiamento de pesquisas sob sua responsabilidade direta/pessoal (direcionado ao departamento ou instituição) provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Kowa: Pemafibrato. | |
| Outros relacionamentos | |
| Financiamento de atividades de educação médica continuada, incluindo viagens, hospedagens e inscrições para congressos e cursos, provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Novo Nordisk: Ozempic. | |
| Maria Cristina de Oliveira Izar | Declaração financeira |
| A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Amgen: Evolocumabe; Amryt: Lomitapide; Aché: Rosuvastatina, Ezetimiba; Libbs. | |
| B - Financiamento de pesquisas sob sua responsabilidade direta/pessoal (direcionado ao departamento ou instituição) provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Novartis; PTC Bio; Amgen: Dislipidemia. | |
| C - Financiamento de pesquisa (pessoal), cujas receitas tenham sido provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - PTC Bio; Amgen: Dislipidemia. | |
| Maria Helane Costa Gurgel Castelo | Declaração financeira |
| A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - PTC: Palestra e Advisory board sobre SQF; Amgen: Estuco clinico nos últimos 2 anos - Houser; | |
| B - Financiamento de pesquisas sob sua responsabilidade direta/pessoal (direcionado ao departamento ou instituição) provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Amgen: Estudo Houser; Novertis: Estudo Orion. | |
| Maria Sílvia Ferrari Lavrador | Nada a ser declarado |
| Patrícia Guedes de Souza | Nada a ser declarado |
| Raul Dias dos Santos Filho | Declaração financeira |
| A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Abbott; Amgen: Dislipidemia; AstraZeneca: Diabetes; EMS; GETZ Pharma; Kowa; Merck; MSD; Novo Nordisk; Novartis; PTC; Pfizer; Hypera; Sanofi. | |
| B - Financiamento de pesquisas sob sua responsabilidade direta/pessoal (direcionado ao departamento ou instituição) provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Amgen, Sanofi; Esperion: Dislipidemia; Kowa. | |
| Renato Jorge Alves | Declaração financeira |
| A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Amgen: Evolocumabe; PTC: Volanesorsen; Pfizer: Apixaban. | |
| Roberta Marcondes Machado | Declaração financeira |
| Nada a ser declarado | |
| Outros relacionamentos | |
| Financiamento de atividades de educação médica continuada, incluindo viagens, hospedagens e inscrições para congressos e cursos, provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - PTC: Nutricionista. | |
| Tania L. R. Martinez | Nada a ser declarado |
| Valeria Arruda Machado | Nada a ser declarado |
| Viviane Zorzanelli Rocha Giraldez | Declaração financeira |
| A - Pagamento de qualquer espécie e desde que economicamente apreciáveis, feitos a (i) você, (ii) ao seu cônjuge/ companheiro ou a qualquer outro membro que resida com você, (iii) a qualquer pessoa jurídica em que qualquer destes seja controlador, sócio, acionista ou participante, de forma direta ou indireta, recebimento por palestras, aulas, atuação como proctor de treinamentos, remunerações, honorários pagos por participações em conselhos consultivos, de investigadores, ou outros comitês, etc. Provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Novo Nordisk: Agonistas de receptor de GLP1; AstraZeneca: Dapagliflozina; Amgen: Inibidores de PCSK9. | |
| Outros relacionamentos | |
| Financiamento de atividades de educação médica continuada, incluindo viagens, hospedagens e inscrições para congressos e cursos, provenientes da indústria farmacêutica, de órteses, próteses, equipamentos e implantes, brasileiras ou estrangeiras: | |
| - Novo Nordisk: Agonistas de receptor de GLP1. | |
| Wilson Salgado Filho | Nada a ser declarado |
Definição de graus de recomendação e níveis de evidência
Classes (graus) de recomendação:
Classe I – Condições para as quais há evidências conclusivas, ou, na sua falta, consenso de que o procedimento é seguro e útil/eficaz.
Classe II – Condições para as quais há evidências conflitantes e/ou divergência de opinião sobre segurança e utilidade/eficácia do procedimento.
Classe IIA – Peso ou evidência/opinião a favor do procedimento. A maioria aprova.
Classe IIB – Segurança e utilidade/eficácia menos bem estabelecida, não havendo predomínio de opiniões a favor.
Classe III – Condições para as quais há evidências e/ou consenso de que o procedimento não é útil/eficaz e, em alguns casos, pode ser prejudicial.
Níveis de evidência:
Nível A – Dados obtidos a partir de múltiplos estudos randomizados de bom porte, concordantes, e/ou de meta-análise robusta de estudos clínicos randomizados.
Nível B – Dados obtidos a partir de meta-análise menos robusta, de um único estudo randomizado ou de estudos não randomizados (observacionais).
Nível C – Dados obtidos de opiniões consensuais de especialistas.
Introdução
A hipercolesterolemia familiar (HF) é uma causa genética comum de doença coronariana prematura, especialmente de infarto do miocárdio, devido à exposição ao longo da vida a concentrações elevadas de colesterol da lipoproteína de baixa densidade (LDL-c). Caracteriza-se por ser uma forma grave de dislipidemia de base genética, em que aproximadamente 85% dos homens e 50% das mulheres podem ter um evento coronariano antes de completar os 65 anos de idade, se não tratados adequadamente.
A HF é considerada um problema de saúde pública, devido à sua alta prevalência (em torno de 1:200 a 1:300 indivíduos da população geral) e à sua associação com doença arterial coronariana (DAC) precoce, com redução da expectativa de vida observada em várias famílias. Além disso, cerca de 200.000 pessoas no mundo vão a óbito a cada ano por ataques cardíacos precoces devido à doença, os quais poderiam ser evitados com tratamentos apropriados. Se a HF não for tratada, homens e mulheres com a forma heterozigótica desenvolverão DAC antes dos 55 e 60 anos, respectivamente. Já os homozigotos comumente desenvolvem DAC muito cedo na vida e, se não tratados, podem morrer antes dos 20 anos de idade. No entanto, quando o diagnóstico é feito e o tratamento é instituído, pode-se modificar a história natural da doença aterosclerótica.
O diagnóstico precoce é fundamental, pois torna possível o início antecipado da medicação hipolipemiante e a mudança na história natural da doença, devendo ser guiado por diretrizes e podendo ser facilitado pelo uso de algoritmos. A identificação dos casos de maior gravidade e o cuidado integrado são estratégias para minimizar o impacto da HF na doença cardiovascular. A abordagem diagnóstica, as medidas nutricionais e o emprego de fármacos potentes, como o tratamento com estatinas de alta intensidade, a combinação de medicamentos e o uso de novos agentes hipolipemiantes, podem modificar a história natural da doença nesses indivíduos.
É importante também o reconhecimento da HF como condição genética autossômica dominante, pois o rastreamento em cascata de familiares de indivíduos afetados é imperativo, uma medida custo-efetiva e que propicia o reconhecimento precoce e a instituição de terapêutica que vise retardar ou impedir o aparecimento da doença aterosclerótica. Atenção especial a crianças e adolescentes, gestantes e HF grave são assuntos abordados nesta diretriz.
O Departamento de Aterosclerose e os maiores especialistas do país reuniram-se com o objetivo de transmitir as melhores informações disponíveis para melhoria da prática clínica no Brasil, de forma clara e objetiva, para a prevenção e o tratamento da doença aterosclerótica cardiovascular prematura e para tranquilizar famílias afetadas por essa condição.
Sinceramente,
Profa. Dra. Maria Cristina de Oliveira Izar, MD, PhD
1. História Natural da Hipercolesterolemia Familiar
1.1. Definição
A HF é uma doença genética do metabolismo das lipoproteínas, cujo modo de herança é autossômico codominante. Caracteriza-se por níveis muito elevados do LDL-c e pela presença de sinais clínicos específicos, como xantomas tendíneos, arco corneal e doença aterosclerótica cardiovascular (DASCV) antes dos 45 anos. 1,2
As primeiras observações sobre a doença foram feitas pelo patologista Harbitz em meados do século XVIII, quando relatou casos de morte súbita em portadores de xantomas. E em 1938, Müller 3 descreveu a HF como uma entidade clínica e observou que a associação de hipercolesterolemia, xantomas e manifestações de DAC eram achados comuns em algumas famílias e herdados como um traço dominante. Cerca de 50 anos mais tarde, Brown e Goldstein, 4-6 ao estudarem pacientes e culturas de células, elucidaram a complexa via da síntese endógena do colesterol e identificaram o defeito na internalização da lipoproteína de baixa densidade (LDL, do inglês, low density lipoprotein ) ligada ao seu receptor. Em 1983, esse gene foi clonado e mapeado no braço curto do cromossomo 19, 7 sendo então denominado gene do receptor da LDL, ou gene LDLR , em 1989. 8
A HF tinha uma prevalência “histórica” estimada de 1:500 indivíduos afetados na forma heterozigótica e de 1:1.000.000 na forma homozigótica. 9,10 Khachadurian 10 foi quem discriminou essas duas manifestações da HF. No entanto, estudos mais recentes sugerem que a prevalência da doença seja maior, 1:200 a 1:300 na HF heterozigótica (HFHe) e 1:160.000 a 1:300.000 na HF homozigótica (HFHo), com base em critérios clínicos e moleculares. 11,12
As concentrações plasmáticas de LDL-c nos indivíduos com HFHe são, em geral, duas a três vezes maiores do que em pessoas sem a doença, e os portadores da afecção apresentam maior probabilidade de desenvolver DASCV prematura na segunda ou terceira décadas de vida. Já aqueles com HFHo têm concentrações de LDL-c cerca de seis a oito vezes maiores e desenvolvem DASCV muito cedo em sua vida, frequentemente morrendo até a idade de 20 anos, se não tratados. 9,13
O fenótipo clínico de HF é geralmente decorrente de defeitos no gene LDLR , que codifica o LDLR, 5,10 sede de mais de 2.251 mutações descritas até o momento. 14 Mutações pontuais, ou por substituição de uma única base (polimorfismo de nucleotídeo único [SNP, do inglês, single nucleotide polymorphism ]), são responsáveis por mais de 84% das mutações, enquanto rearranjos maiores ocorrem em 16% de todas as mutações descritas no gene LDLR .
O fenótipo clínico da HF pode também ser secundário a defeitos no gene APOB, que codifica a apolipoproteína B-100 (Apo B-100) 15 – quando defeituosa, apresenta menor afinidade pelo LDLR –, ou ainda quando existe catabolismo acelerado do LDLR devido a mutações com ganho de função no gene proproteína convertase subutilisina/kexina tipo 9 ( PCSK9 ), que codifica a proteína NARC-1, 16 a qual participa do catabolismo do LDLR.
Na maioria dos casos, a HF é causada por mutações em genes que codificam proteínas envolvidas na captação e no catabolismo do LDLR. Os genes LDLR , apolipoproteína-B ( APOB ) e PCSK9 são considerados genes ligados ao desenvolvimento de HF, resultando na homeostase defeituosa das partículas de LDL e, consequentemente, na elevação das concentrações plasmáticas de LDL-c. Desse modo, frequentemente, pacientes com diagnóstico molecular de HF apresentam variantes patogênicas no gene LDLR, 17 enquanto as mutações dos genes APOB e PCSK9 respondem por menor percentual da HF na forma autossômica dominante (ADH). 18 A HF autossômica recessiva (ARH), por outro lado, é uma forma rara e ocorre quando os indivíduos herdam mutações patogênicas em ambas as cópias do gene low-density lipoprotein adaptor protein 1 ( LDLRAP1 ), que codifica a proteína adaptadora do receptor de LDL. 19 No entanto, sabe-se ainda que a HF pode ser decorrente de variantes patogênicas em genes não conhecidos, ou mesmo de vários genes, sendo conhecida como HF poligênica. 20
O fenótipo clínico é muito semelhante entre as formas mais comuns de HF; porém, os defeitos do gene APOB são mais comuns entre algumas populações europeias (1:300 a 1:700 na Europa Central), enquanto mutações do gene PCSK9 não têm uma frequência estabelecida (em geral, ~1%). A HF apresenta penetração elevada; 20-22 assim, a maioria dos portadores de mutações causais para a doença apresentam o fenótipo clínico. Pelo seu modo de herança autossômico codominante, a metade dos descendentes em primeiro grau de um indivíduo afetado serão portadores do defeito genético e apresentarão níveis elevados de LDL-c desde o nascimento e ao longo de sua vida, sendo homens e mulheres igualmente afetados. 9,22
Os heterozigotos possuem metade dos receptores de LDL funcionantes, enquanto, nos homozigotos, por defeito no LDLR , ambos os receptores têm perda de função ou função nula 23 . A importância do diagnóstico genético reside no fato de que os critérios clínicos/laboratoriais muitas vezes não são conhecidos pelos pacientes, dificultando a confirmação diagnóstica.
De acordo com normatização recente, 23 a HF inclui múltiplos fenótipos, devido a diferentes etiologias moleculares e fatores genéticos adicionais. Os níveis de LDL-c, o número de mutações e fatores adicionais protetores ou patogênicos determinam o risco de DAC; portanto, indivíduos sob risco pela história familiar, bem como aqueles com fenótipo de HF, devem ser genotipados. Os resultados desse teste podem fornecer três categorias de indivíduos:
Genótipo positivo, fenótipo negativo
Genótipo positivo, fenótipo positivo
Genótipo negativo, fenótipo positivo.
Em alguns casos, outras etiologias moleculares devem ser pesquisadas, 23 como mutações no gene apo (a) , LIPA , que codifica a lipase ácida lisossomal, além da forma poligênica. O risco de DAC é maior em portadores de mutações patogênicas, se comparado àqueles sem mutações para qualquer valor de LDL-c. Acima de 190 mg/dl, o risco de DAC chega a ser mais de 3 vezes maior para um mesmo nível de LDL-c nos portadores de mutações causais, comparado aos não portadores de mutações; isso provavelmente em função da exposição ao longo da vida a níveis muito elevados de LDL-c. 24
A HF é considerada um problema de saúde pública devido à elevada prevalência de doença coronariana precoce e à redução da expectativa de vida observada em várias famílias. Aproximadamente 85% dos homens e 50% das mulheres podem ter um evento coronariano antes de completarem os 65 anos de idade, se não tratados adequadamente. Estudos revelam que cerca de 200.000 pessoas no mundo vão a óbito a cada ano por ataques cardíacos precoces devido à HF, os quais poderiam ser evitados com tratamentos apropriados. 20
1.2. Epidemiologia da Doença Aterosclerótica Cardiovascular
A DASCV e suas complicações no Brasil e no mundo são um grave problema de saúde pública. Segundo dados fornecidos pelo Departamento de Informática do Sistema Único de Saúde (DATASUS), as doenças cardiovasculares (DCV) são a principal causa de morte no país, com aproximadamente 27,65% do total de óbitos. 25 Analisando-se a mortalidade específica por doenças do aparelho circulatório, as afecções isquêmicas do coração são responsáveis por 32% das mortes. 25 Dados publicados em 2016 por Ribeiro et al. 26 mostram que o sistema público financiou 940.323 hospitalizações para DCV em 2012. No período de 2008 a 2012, as taxas de internações por insuficiência cardíaca congestiva e hipertensão arterial foram reduzidas, enquanto aquelas motivadas por angioplastia e infarto agudo do miocárdio (IAM) aumentaram. 26
No mundo, dentre as dez principais causas de morte, estão as doenças isquêmicas do coração e o acidente vascular encefálico (AVE), que ocupam o primeiro e segundo lugares, respectivamente, e juntos são responsáveis por mais de 15,2 milhões de óbitos. Essas afecções permanecem líderes globais de morte nos últimos 15 anos. 27 Em estudo realizado nos Estados Unidos de 1989 a 1998, 51% das mulheres e 41% dos homens com morte súbita cardíaca faleceram antes do primeiro contato médico. As síndromes coronarianas agudas foram responsáveis por 27% dessas mortes. 28
A maioria dos óbitos por IAM ocorre nas primeiras horas de manifestação da doença, sendo 40 a 65% na primeira hora e aproximadamente 80% nas primeiras 24 horas. 29 Entre os sobreviventes, 19% em média evoluem com insuficiência cardíaca, importante causa de internações e morbidade. 30,31
Embora conhecidos fatores de risco cardiovascular sejam responsáveis pela maioria dos casos de DASCV e suas complicações, 32-36 existem condições clínicas que aumentam o risco e antecipam sua ocorrência, como a HF. 37-40
1.3. Aspectos Epidemiológicos da Hipercolesterolemia Familiar no Mundo e no Brasil
A HF tem uma prevalência dita histórica de 1:500 na população geral. 22 No entanto, atualmente, sabe-se que, com base nos dados do Copenhagen General Population Study , a prevalência estimada da doença é de 1:223 por critérios clínicos 37 e de 1:217 utilizando teste genético. 38 Um relato do governo da Dinamarca concluiu que, com uma prevalência de 1:200 a 250, apenas 11 a 13% dos portadores de HFHe seriam identificados (a falha no diagnóstico é particularmente importante nas crianças).
Na forma homozigótica, estimava-se sua prevalência em 1:1.000.000 de indivíduos; porém, hoje se sabe que ela pode acometer 1 em cada 300.000 pessoas, podendo ser maior (1:160.000) quando há um efeito “fundador”. Isso significa que a HFHo pode ser mais prevalente em algumas populações, como os sul-africanos (1:100.000), libaneses (1:170.000), franco-canadenses (1:270.000) e finlandeses, devido à presença de casamentos consanguíneos. 13,14
Assim, dada a estimativa do estudo dinamarquês, uma prevalência de HFHe de 1:220 se traduz em uma frequência alélica de 1:440, assumindo-se uma frequência de HFHo de 1:193.600 casos. Com base nessas estimativas, são preditos cerca de 28 casos de HFHo na Dinamarca; porém, na verdade, bem poucos são reconhecidos, 38,39 e na maioria dos países, a entidade permanece não diagnosticada (menos de 1% no Brasil). 14 Estima-se que no mundo todo existam mais de 34.000.000 indivíduos portadores de HF. 9,14 No entanto, menos de 10% tem diagnóstico conhecido, e menos de 25% recebe tratamento hipolipemiante. 38 Assumindo-se a mesma prevalência no Brasil, o país deve ter cerca de 1.033 casos de HFHo.
Não existem dados objetivos sobre a prevalência da HF no Brasil. Com base nos dados clínicos e laboratoriais e na história familiar, obtidos a partir do estudo ELSA-Brasil, da população adulta das instituições participantes, e adotando-se os critérios da Dutch Lipid Clinic Network (DLCN), há uma estimativa de casos de HF de 1:263, o que corresponde a uma população afetada de 766.000 indivíduos no Brasil. 41 Essa prevalência ainda varia com o gênero (0,38% em mulheres e 0,30% em homens), a raça (0,25% em brancos, 0,47% em etnia mista e 0,67% em negros) e com a idade (0,10% de 35 a 45 anos; 0,42% de 46 a 55 anos; 0,60% de 56 a 65 anos; e 0,26% de 66 a 75 anos). 41 Recentemente, dados de meta-análise, demonstraram a prevalência global da HF na população geral de 1:311, sendo 18 vezes maior entre os indivíduos com doença cardiovascular aterosclerótica. 42 Outra meta-análise evidenciou maior prevalência da HF naqueles com doença isquêmica do coração, doença cardíaca isquêmica prematura e hipercolesterolemia grave, em 10, 20 e 23 vezes, respectivamente. 43
1.4. Impacto da Hipercolesterolemia Familiar na Doença Aterosclerótica Cardiovascular
A HF é uma causa genética comum de doença coronariana prematura, especialmente de infarto do miocárdio (IAM) e angina pectoris , devido à exposição a concentrações elevadas de LDL-c ao longo da vida. 44,45 Se não for tratada, homens e mulheres com HFHe e colesterol total de 310 a 580 mg/dl desenvolverão DAC antes dos 55 e 60 anos, respectivamente. Os homozigotos com colesterol total entre 460 a 1.160 mg/dl geralmente desenvolvem DAC muito cedo na vida e, se não tratados, podem morrer antes dos 20 anos de idade. No entanto, quando o diagnóstico é feito e o tratamento é instituído, pode-se modificar a história natural da doença aterosclerótica. 46
Embora não existam dados a respeito do risco de DASCV ou da taxa de tratamento hipolipemiante na HF, em uma grande amostra da população geral de Copenhage, na Dinamarca, a prevalência de DAC entre aqueles com diagnóstico provável ou certeza de HF (segundo a DLCN) foi de 33%, 37 dos quais apenas 48% recebiam estatinas. O risco de DAC aumentou em 13 vezes (IC 95%: 10 a 17 vezes) em indivíduos com HF provável ou com certeza que não recebiam estatinas. Dados semelhantes foram observados em outras coortes com HF. 47
Por outro lado, o aumento do risco de DASCV em portadores de HF recebendo estatinas é 10 vezes maior (IC 95%: 8 a 14 vezes), o que sugere que as doses de estatinas resultaram em tratamento hipolipemiante insuficiente, ou foram introduzidas tarde na vida, quando a aterosclerose já se desenvolvia de maneira grave. Outros estudos sugerem os mesmos dados sobre o tratamento. 48-50
Na HF, o risco de DASCV prematura é muito elevado, e 5 a 10% dos eventos coronarianos ocorrem antes dos 50 anos. 47,51 Sem tratamento, portadores de HF jovens apresentam um risco de morte 90 vezes maior. 47,51 A doença é ainda responsável por número significativo de internações hospitalares e perda de produtividade, em função da alta incidência de DASCV. 47
Por isso, o diagnóstico precoce é fundamental, pois torna possível o início antecipado da medicação hipolipemiante e a mudança na história natural da doença, devendo ser guiado por diretrizes 52-54 e podendo ser facilitado pelo uso de algoritmos. 55 Além disso, a identificação dos casos de maior gravidade 56,57 e o cuidado integrado à HF 58 são estratégias para minimizar o impacto da HF na doença cardiovascular.
2. Metabolismo Lipídico na Hipercolesterolemia Familiar
A quantidade de colesterol circulante depende, por um lado, do balanço, principalmente, entre sua síntese hepática e sua absorção intestinal, e por outro, de sua excreção, especialmente pelas vias biliares. Quando ocorre desequilíbrio nesse processo, como ocorre na HF, o colesterol pode elevar-se significativamente e formar depósitos como xantomas e aterosclerose mais precoce. 22 A entrada e a saída do colesterol corpóreo são reguladas por sistema de retroalimentação, em que o aumento da sua absorção na dieta determina diminuição da síntese hepática. Ao contrário das gorduras alimentares, que são absorvidas pelo intestino quase completamente, o colesterol é absorvido de modo parcial, e quando sua quantidade na dieta aumenta, a absorção diminui proporcionalmente. No homem, a LDL transporta a maior parte do colesterol. As LDL são produto de metabolismo das lipoproteínas de densidade muito baixa (VLDL, do inglês, very low density lipoprotein ), ricas em triglicerídeos, mas que, sobretudo como remanescentes (lipoproteína de densidade intermediária [IDL, do inglês, intermediate-density lipoprotein ]), fornecem também colesterol para formação das placas. Além disso, ao serem deslipidadas em seu conteúdo de triglicerídeos, originam LDL menores e mais densas, consideradas muito aterogênicas. As LDL são removidas da circulação para o interior das células por receptores da membrana celular que reconhecem a Apo B-100, única proteína existente na LDL. Remanescentes e IDL são removidos também por esses receptores, mas de maneira bem mais rápida que a LDL. Isso acontece porque essas partículas, além da Apo B-100, têm Apo E na superfície, a qual apresenta afinidade bem maior pelos receptores do que a Apo B-100.
Na HF também ocorrem defeitos genéticos que afetam o receptor da LDL e que resultam em diminuição da endocitose da lipoproteína. 59 A existência da endocitose da LDL mediada por receptor e os defeitos que resultam em deficiência da função dos receptores e em hipercolesterolemia foram descritos por Brown e Goldstein na década de 1970. As várias centenas de polimorfismos no gene do receptor podem afetar tanto a estrutura do receptor que liga a Apo B-100 da LDL quanto outros domínios da proteína e até mesmo a recirculação dos receptores que normalmente são reciclados após a endocitose, voltando à membrana celular. Entretanto, apenas parte desses polimorfismos do receptor LDL se associam ao fenótipo da HF. Defeitos da Apo B e aqueles relacionados com ganho de função da PCSK9 que participa do catabolismo do receptor da LDL constituem aproximadamente 5%, e menos de 1% do fenótipo de HF. 2
Outra possibilidade ainda muito mais rara é o defeito em homozigose da proteína adaptadora do receptor de LDL, uma vez que esse polimorfismo é recessivo. Entretanto, estima-se entre 5 e 30% os pacientes com fenótipo de HF em que não se encontra o gene causal, sugerindo uma origem a partir de genes não identificados ou pela combinação (poligênica). Assim, a HF resulta da incapacidade de remoção eficiente do colesterol das LDL, determinando sua elevação plasmática e depósitos nos vasos e tecidos. 59
A HF resulta geralmente da transmissão de gene de um dos pais, como herança monogênica autossômica dominante, determinando mais frequentemente sua forma heterozigótica, estimada em 1:200 a 1:250 na Europa e ao redor de 1:250 no Brasil. Entretanto, não é infrequente a concomitância de aumento da lipoproteína (a) (Lp[a]) ou ainda a concomitância de defeito no metabolismo de triglicerídeos, determinando gravidade ainda maior da dislipidemia.
A ocorrência de xantomas na infância ou adolescência, junto com níveis muito elevados de LDL-c (> 500 mg/dl), doença aterosclerótica prematura e estenose valvar aórtica, sugere a forma homozigótica da HF, de muito maior gravidade e dificuldade no tratamento. 13 Nessa situação, a maioria dos indivíduos tem os pais com HFHe, geralmente por mutações no gene LDLR , mas que também podem ocorrer nos outros genes ( APOB ou PCSK9 ). Pode haver ainda a combinação de polimorfismos de diferentes genes ( LDLR , APOB , PCSK9 ou LDLRAP-1 ). Na forma homozigótica também é frequente a concomitância de baixos níveis de colesterol da lipoproteína de alta densidade (HDL-c), possivelmente por remoção acelerada da Apo A-I ou defeito no efluxo de colesterol. Manifestações homozigóticas também devem ser suspeitadas por elevações menos marcantes de LDL-c (> 300 mg/dl) na ocorrência de xantomas antes dos 10 anos. 13
3. Diagnóstico Clínico da Hipercolesterolemia Familiar
Os critérios clínicos e laboratoriais para o diagnóstico da HF são arbitrários e baseiam-se nos seguintes dados:
Sinais clínicos de depósitos extravasculares de colesterol
Taxas elevadas de LDL-c ou colesterol total no plasma
História familiar de hipercolesterolemia e/ou doença aterosclerótica prematura
Identificação de mutações e polimorfismos genéticos que favoreçam o desenvolvimento da HF.
Alguns critérios têm sido propostos na tentativa de uniformizar e formalizar o diagnóstico de HF, como os do US Make Early Diagnosis Prevent Early Death Program ( USA MEDPED ), 60 os da DLCN (Dutch MEDPED, ver Tabela 1 ), 61 e os do Simon Broome Register Group.62 No Brasil é utilizado o Dutch MEDPED .
Tabela 1. Critérios diagnósticos de HF heterozigótica com base nos critérios da Dutch Lipid Clinic Network (Dutch MEDPED) 61 .
| Parâmetro | Pontos |
|---|---|
| História familiar | |
| Parente de primeiro grau portador de doença vascular/coronariana prematura (homens com menos de 55, mulheres com menos de 60 anos) OU Parente adulto com colesterol total > 290 mg/dl * |
1 |
| Parente de primeiro grau portador de xantoma tendíneo e/ou arco corneano OU Parente de primeiro grau < 16 anos com colesterol > 260 mg/dl * |
2 |
| História clínica | |
| Paciente portador de doença coronariana prematura (homens com menos de 55, mulheres com menos de 60 anos) | 2 |
| Paciente portador de doença cerebral ou periférica prematura (homens com menos de 55, mulheres com menos de 60 anos) | 1 |
| Exame físico | |
| Xantoma tendíneo | 6 |
| Arco corneano < 45 anos | 4 |
| Níveis de LDL-c (mg/dl) | |
| ≥ 330 | 8 |
| 250 a 329 | 5 |
| 190 a 249 | 3 |
| 155 a 189 | 1 |
| Análise do DNA | |
| Presença de mutação funcional do gene do receptor de LDL, Apo B-100 ou PCSK9 * | 8 |
| Diagnóstico de HF | |
| Certeza se | > 8 |
| Provável se | 6 a 8 |
| Possível se | 3 a 5 |
Modificado de Dutch Lipid Clinic Network, adotando um critério do Simon Broome Register Group. 62 LDL-c: colesterol da lipoproteína de baixa densidade; DNA: ácido desoxirribonucleico; HF: hipercolesterolemia familiar.
Essa diretriz recomenda a utilização de critérios simples para a suspeita diagnóstica de HF e para a decisão de se iniciar o tratamento (ver adiante). Um algoritmo com base no Dutch MEDPED pode ser empregado para melhor precisão diagnóstica, embora não esteja disponível até o momento validação para a população brasileira.
3.1. Anamnese
Dada a alta prevalência de HF na população geral e o seu grande impacto nas taxas de doença cardiovascular e mortalidade, toda anamnese deve incluir a pesquisa de histórico familiar de hipercolesterolemia, de uso de medicamentos hipolipemiantes e de doença aterosclerótica prematura, incluindo a idade de acometimento. A possibilidade de HF é sempre reforçada com história familiar de hipercolesterolemia e/ou doença aterosclerótica prematura.
3.2. Exame Físico
A pesquisa pelos sinais clínicos da HF (xantomas, xantelasmas e arco córneo) deve fazer parte do exame físico rotineiro e pode ser complementada por exames subsidiários, como o ultrassom de tendão, em casos selecionados. Tais sinais clínicos não são muito sensíveis, mas podem ser bastante específicos, ou seja, embora não haja necessidade deles para o diagnóstico da HF, quando identificados, sugerem fortemente essa etiologia.
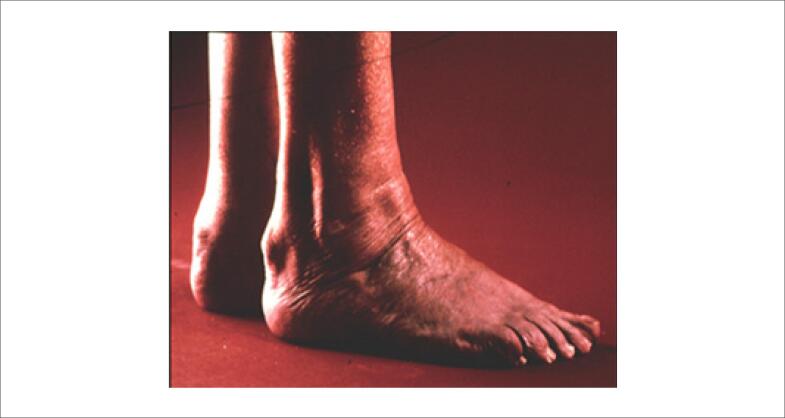
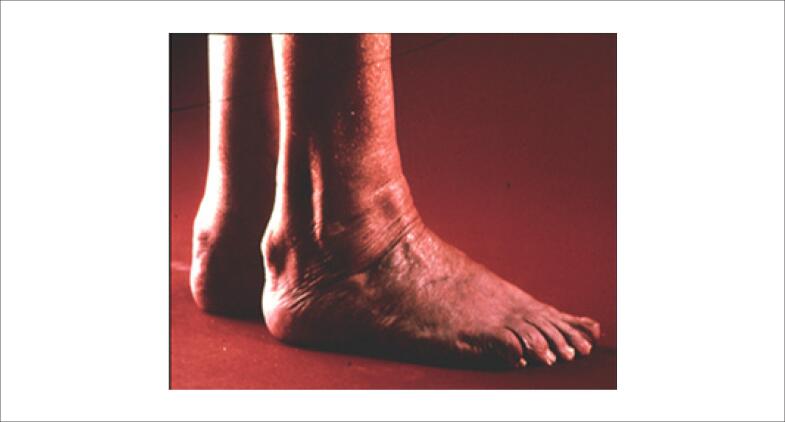
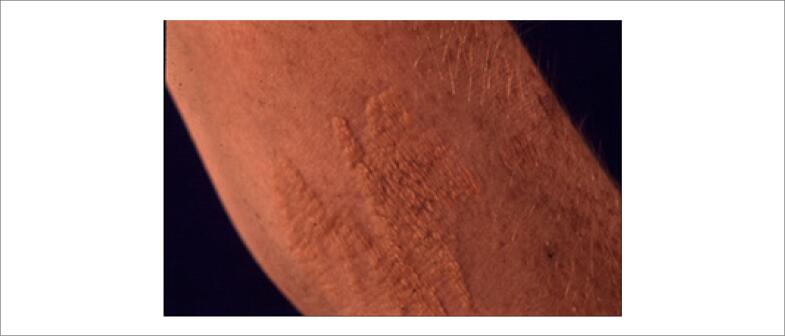
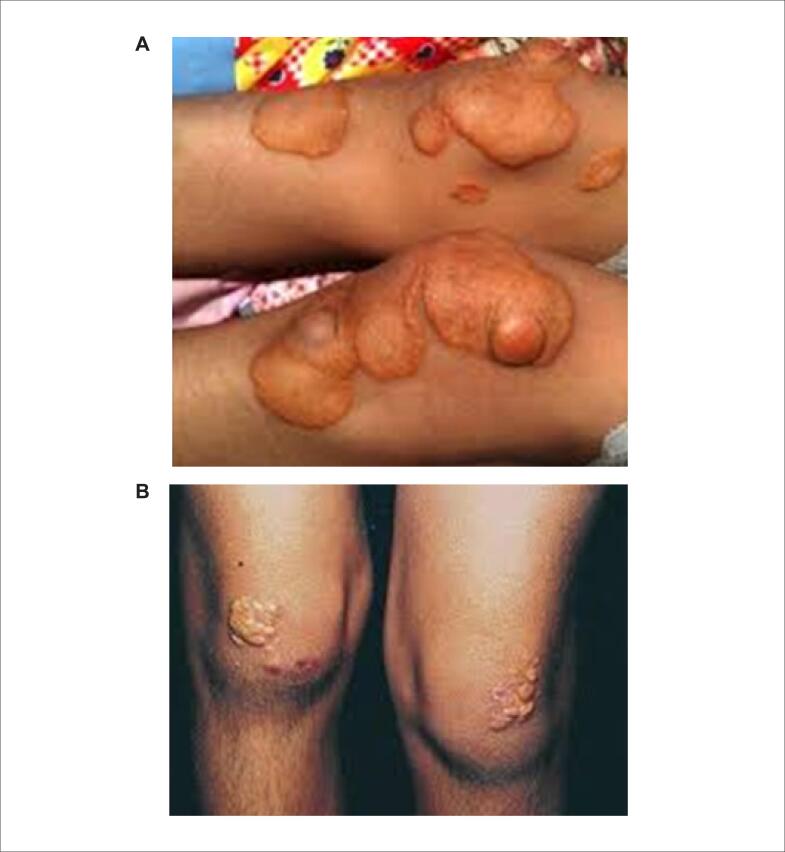
Os xantomas tendinosos ( Figura 1 ) são mais comumente observados no tendão de Aquiles e nos tendões extensores dos dedos, mas também podem ser encontrados nos tendões patelar e do tríceps. Eles devem ser pesquisados não só pela inspeção visual, mas também pela palpação. São praticamente patognomônicos de HF, mas ocorrem em menos de 50% dos casos. 63 Podem ocorrer também xantomas planares intertriginosos, especialmente na HF homozigótica ( Figura 2 ).
Figura 1. Xantoma tendinoso em tendão calcâneo.
Figura 2. Xantoma plano.
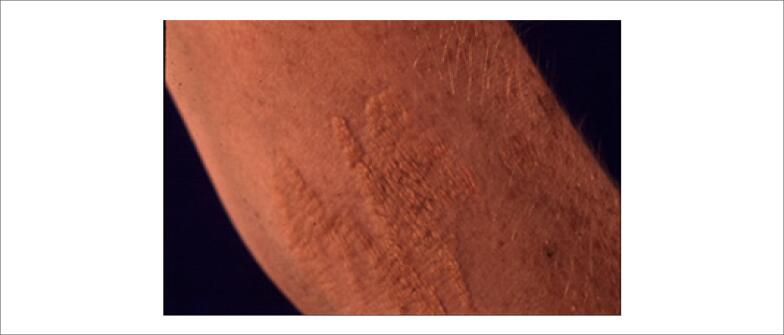
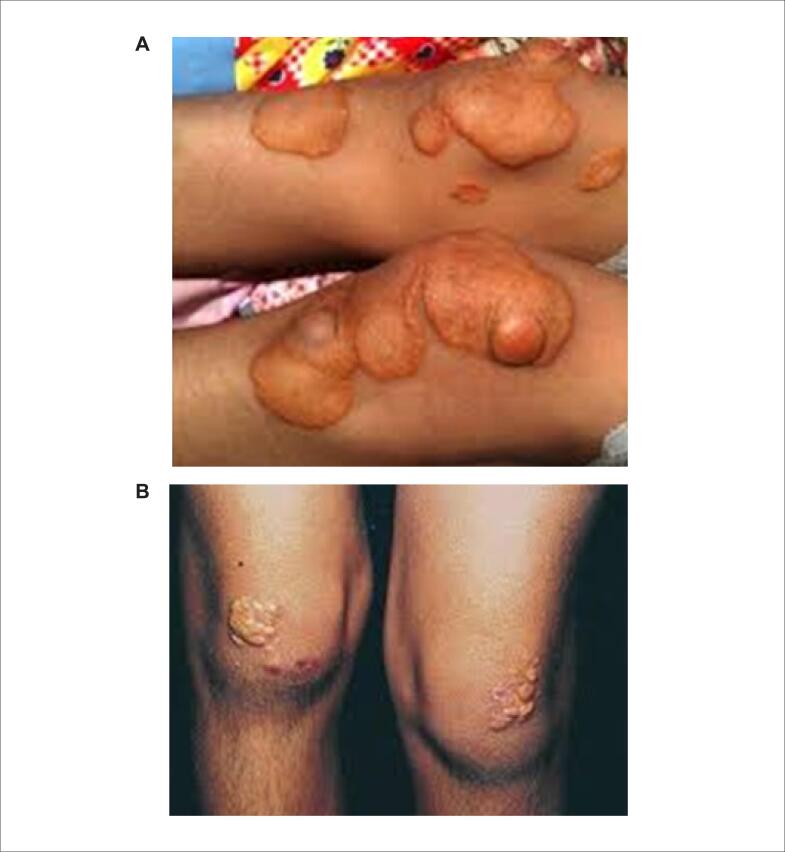
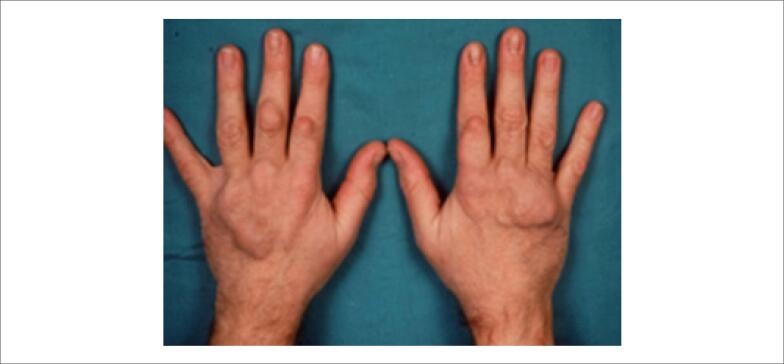
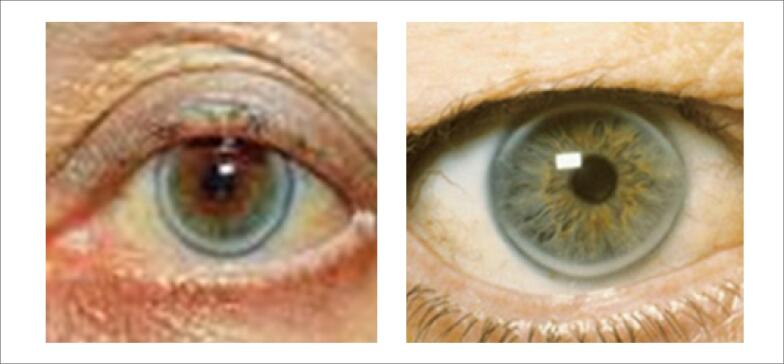
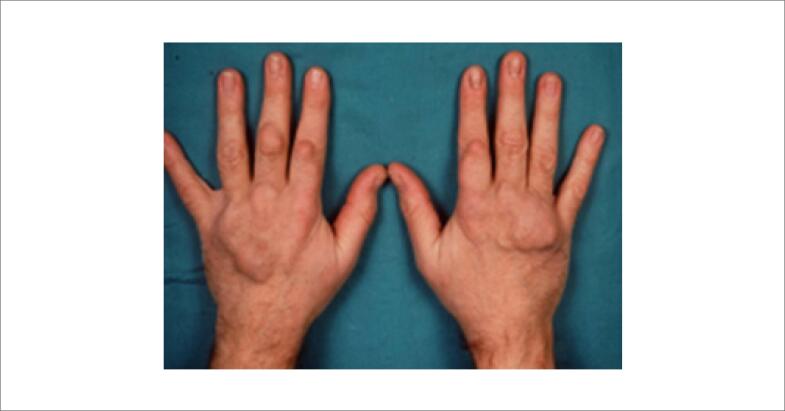
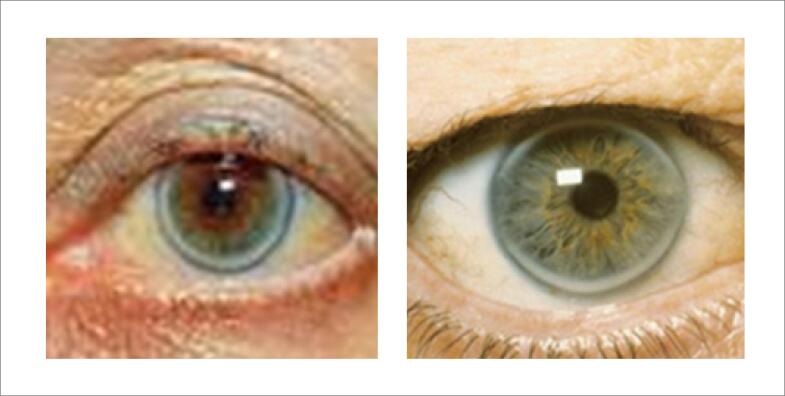
Os xantomas tuberosos amarelo-alaranjados (Figuras 3 e 4 ) e os xantelasmas de pálpebras não são específicos de HF e devem ser valorizados quando encontrados em pacientes com idade em torno de 20 a 25 anos. A presença de arco córneo, parcial ou total, sugere HF quando observada antes dos 45 anos de idade ( Figura 5 ). Portadores da forma homozigótica da HF podem apresentar também sopro sistólico ejetivo decorrente de estenose da valva aórtica e da região supra-aórtica.
Figura 3 (A e B). Xantomas tuberosos em joelhos.
Figura 4. Xantomas tuberosos em mãos.
Figura 5. Arco córneo.
3.3. Rastreamento e Níveis Lipídicos
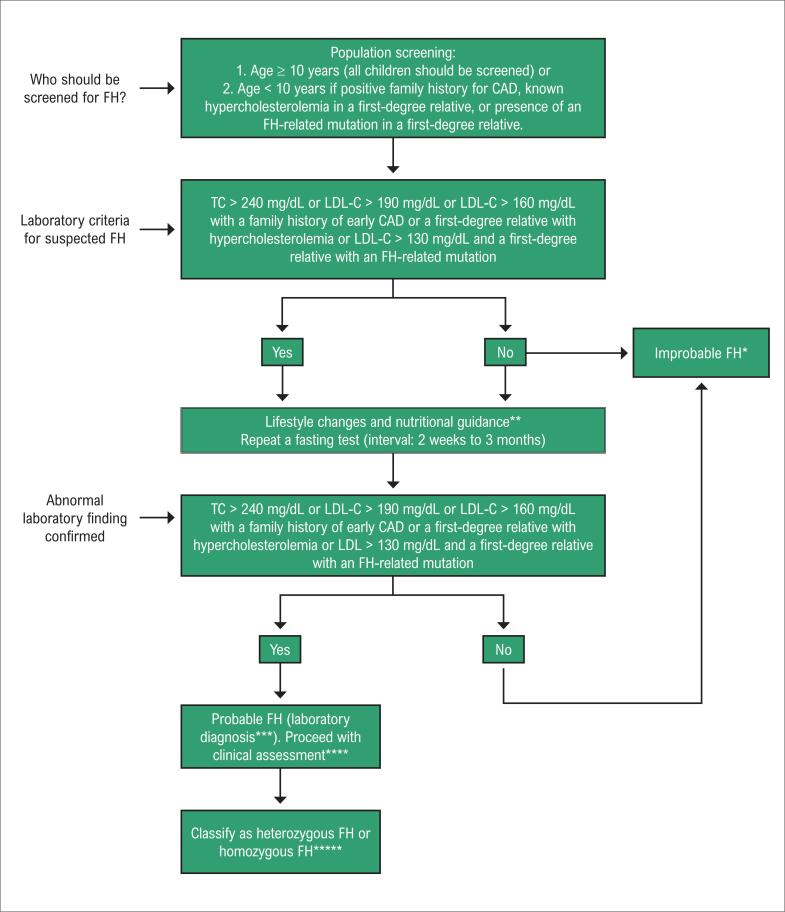
A coleta de sangue para determinação das taxas de colesterol total e LDL-c visando rastrear a HF é de fundamental importância para o diagnóstico do maior número possível de casos e, consequentemente, para reduzir o impacto da doença sobre a morbimortalidade cardiovascular na população geral. Esse rastreamento pode ser realizado por meio de dois métodos: o chamado rastreamento universal e o rastreamento em cascata. 23,52
3.3.1. Rastreamento Universal
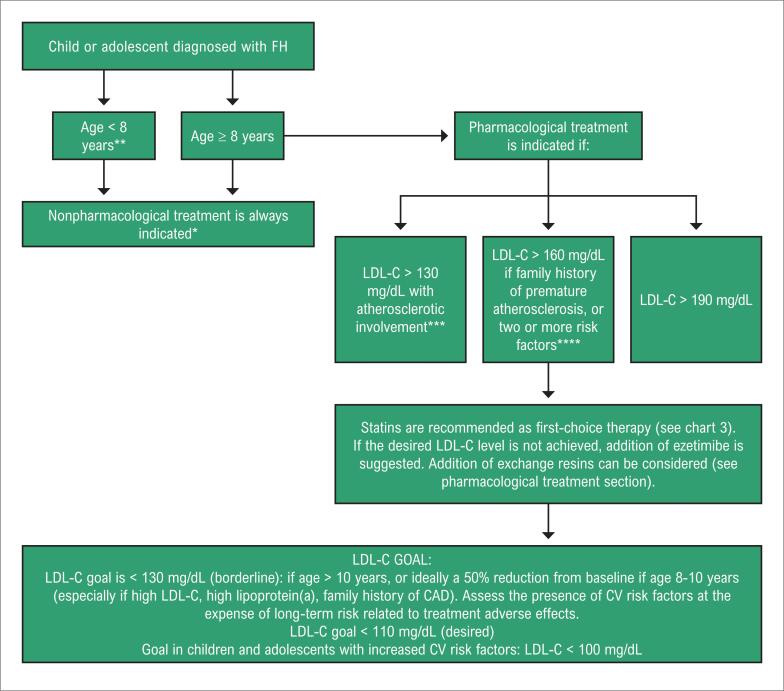
Todas as pessoas acima dos 10 anos de idade devem ser submetidas à análise do perfil lipídico. 52 A obtenção dos lípides plasmáticos também deve ser considerada a partir dos 2 anos de idade nas seguintes situações: 52
Quando houver história familiar de doença aterosclerótica prematura (homens com menos de 55 anos ou mulheres com menos de 65 anos) e/ou dislipidemia.
Se a própria criança apresentar xantomas ou arco córneo, fatores de risco (hipertensão arterial, diabetes melito, obesidade) ou doença aterosclerótica.
A periodicidade recomendada para a determinação dos lípides plasmáticos é motivo de debate. Em geral, se o perfil lipídico for normal, mas existirem outros critérios de possível HF, como história familiar de doença aterosclerótica precoce ou hipercolesterolemia significativa, o exame poderá ser repetido após um ano. Na ausência desses fatores, o exame pode ser repetido em até cinco anos. Alguns dados, como idade, presença de outros fatores de risco para aterosclerose, grau de controle dos fatores de risco, hábitos de vida e eventual uso de medicamentos que possam interferir no metabolismo lipídico, podem ser considerados para individualizar a periodicidade das dosagens lipídicas.
O diagnóstico positivo de HF deve sempre ser suspeitado em adultos (≥ 20 anos) com valores de LDL-c ≥ 190 mg/dl. Na população geral, a probabilidade de ter a doença é de aproximadamente 80% no caso de LDL-c ≥ 250 mg/dl em indivíduos com 30 anos ou mais, ou LDL-c ≥ 220 mg/dl em pessoas entre 20 e 29 anos, ou LDL-c ≥ 190 mg/dl nos que têm menos de 20 anos. 61 O diagnóstico de HF é também mais provável em portadores de LDL-c ≥ 190 mg/dl cujas famílias são caracterizadas por distribuição bimodal do LDL-c, nas quais alguns membros apresentam taxas tipicamente baixas (LDL-c < 130 mg/dl), enquanto outros (os afetados por HF) exibem taxas tipicamente elevadas, ≥ 190 mg/dl. 62
Antes do diagnóstico de HF, no entanto, devem ser afastadas causas secundárias de hipercolesterolemia, incluindo hipotireoidismo e síndrome nefrótica. Deve-se ressaltar também que a presença de hipertrigliceridemia não exclui o diagnóstico de HF.
No Brasil, desde 2017 os laudos laboratoriais destacam valores de colesterol total ≥ 310 mg/dl em adultos e ≥ 230 mg/dl em crianças e adolescentes como sugestivos de HF. 64
Por fim, deve-se considerar que a determinação do perfil lipídico está sujeita a uma série de variações relacionadas tanto ao método e aos procedimentos utilizados como a fatores peculiares do indivíduo, como estilo de vida, uso de medicações e doenças associadas. Desse modo, a confirmação de alteração laboratorial com nova amostra, idealmente coletada com intervalo mínimo de uma semana após a primeira coleta, aumenta a precisão diagnóstica.
3.3.2. Rastreamento em Cascata
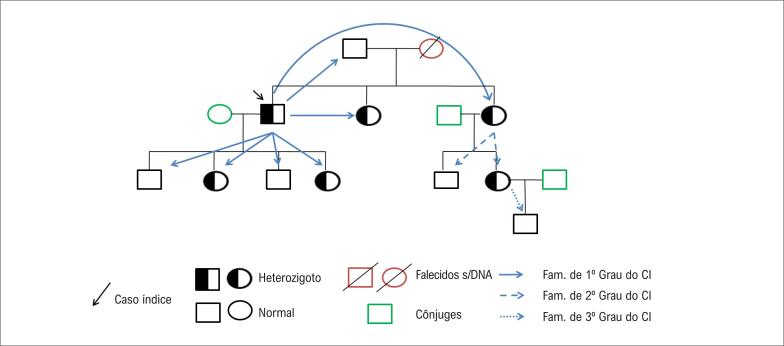
O rastreamento em cascata envolve a determinação do perfil lipídico em todos os parentes de primeiro grau (pai, mãe e irmãos) dos pacientes diagnosticados com HF. As chances de identificação de outros portadores da doença a partir de um caso-índice são: 50% nos familiares de primeiro grau, 25% nos de segundo grau e 12,5% nos de terceiro grau. 63 À medida que novos casos vão sendo identificados, novos parentes vão sendo recomendados para o rastreamento. Essa medida é considerada a que tem a melhor relação custo-eficácia para a identificação de portadores de HF.
3.3.2.1. Rastreamento Genético em Cascata
O rastreamento genético é custo-efetivo e pode ser realizado em todos os pacientes e familiares em primeiro grau das pessoas com diagnóstico de HF. O rastreamento em cascata mais custo-efetivo é o que utiliza informação genética de indivíduos afetados nos quais uma mutação causadora da doença tenha sido identificada. 63
3.3.2.2. Cascata Reversa
Trata-se da investigação de familiares de primeiro, segundo e terceiro graus a partir de uma criança como caso-índice e, portanto, de maneira reversa. Muitas vezes, a criança com HF é a primeira a ser diagnosticada pelo pediatra, e seus pais desconhecem se são também portadores dessa condição. Portanto, é uma oportunidade de identificação e de tratamento de pai(s) afetados assintomáticos e que nunca utilizaram medicação. 23
3.3.2.3. Diagnóstico Oportunístico
É a situação em que o rastreamento do perfil lipídico se faz no momento da imunização. No Brasil, essa não é uma prática comum, mas seria uma oportunidade de diagnóstico precoce de crianças assintomáticas. 23,59
3.3.3. Hipercolesterolemia Familiar Homozigótica
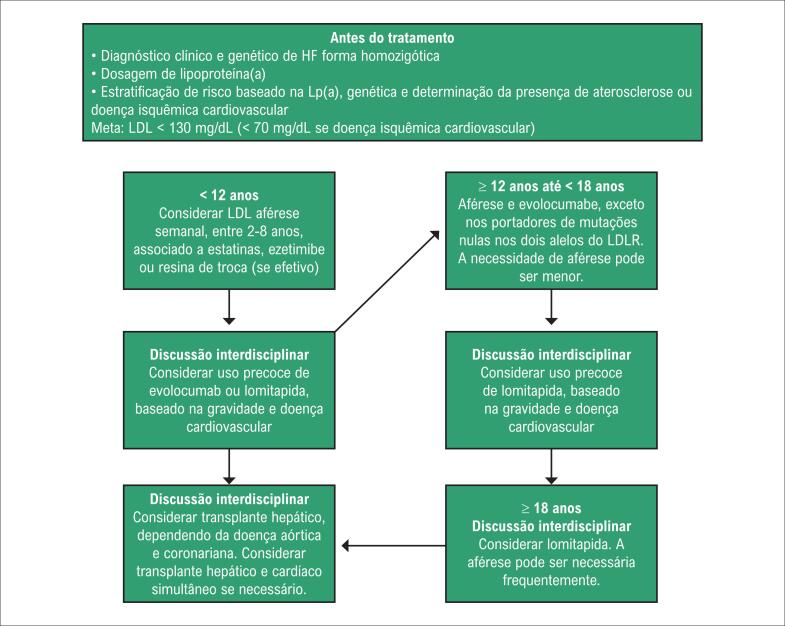
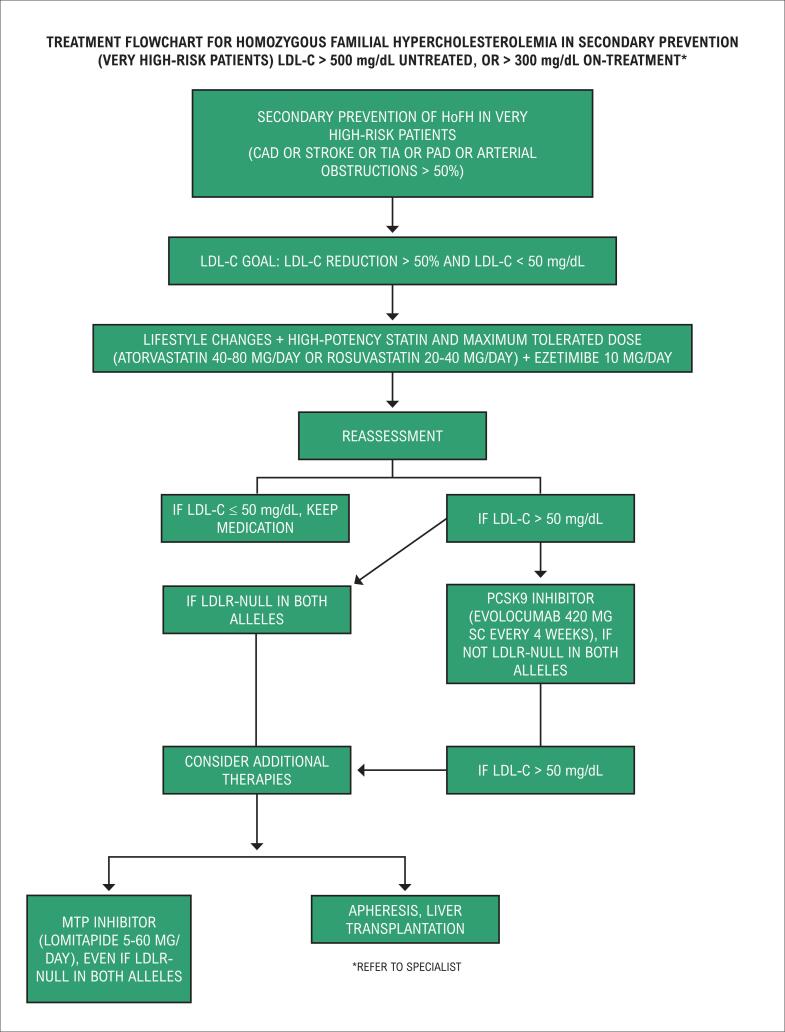
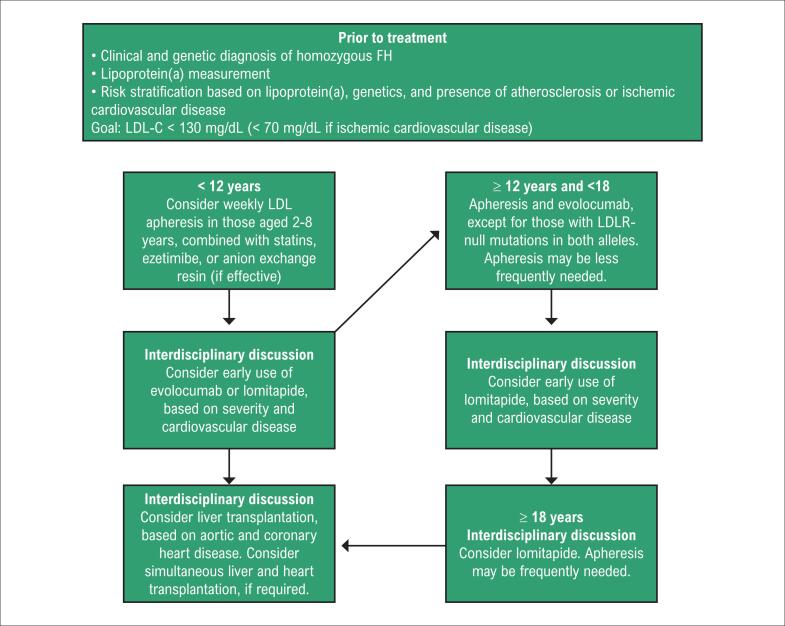
Historicamente, a prevalência da HFHo é muito rara, estimada em 1:1.000.000 de indivíduos na população ao redor do mundo. Entretanto, atualmente, são registradas prevalências maiores do que as inferidas em uma população geral, que variam de 1:160.000 a 1:300.000. 13,52 Os critérios diagnósticos de HFHo são apresentados no Quadro 1 .
Quadro 1. Critérios diagnósticos na hipercolesterolemia familiar homozigótica (HFHo).
| 1. Confirmação genética de dois alelos mutantes nos genes LDLR , APOB , PSCK9 , ou no lócus do gene LDLRAP1 OU |
| 2. LDL-c sem tratamento > 500 mg/dl ou LDL-c tratada > 300 mg/dl mais algum dos seguintes critérios: |
| xantomas cutâneos ou tendinosos antes dos 10 anos OU |
| valores de LDL-c elevados consistentes com HF heterozigótica em ambos os pais * |
Exceto no caso de hipercolesterolemia autossômica recessiva. HF: hipercolesterolemia familiar; LDL-c: colesterol da lipoproteína de baixa densidade. Os valores de LDL-c são apenas indicativos de HF homozigótica, mas devem ser considerados valores menores para o diagnóstico de heterozigotos compostos ou duplos, na presença de outros critérios.
3.4. Recomendações
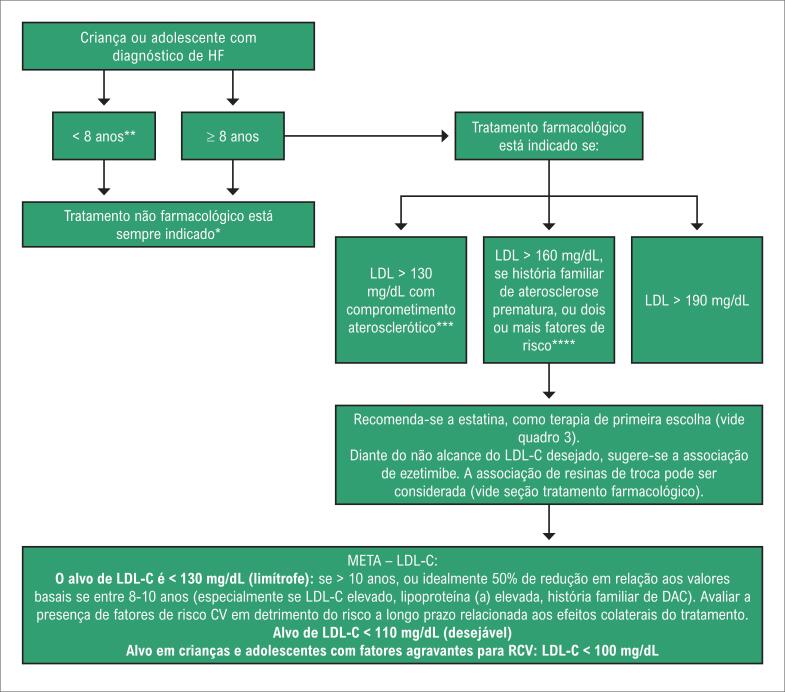
Sinais clínicos de HF e história familiar de doença aterosclerótica precoce e/ou dislipidemia devem ser pesquisados em todos os indivíduos (recomendação classe I, nível de evidência C).
O perfil lipídico deve ser obtido em todos os indivíduos acima dos 10 anos de idade (recomendação classe I, nível de evidência C).
A determinação do perfil lipídico deve ser considerada a partir dos 2 anos de idade na presença de fatores de risco, sinais clínicos de HF ou doença aterosclerótica, bem como no caso de história familiar de doença aterosclerótica prematura e/ou de dislipidemia (recomendação classe I, nível de evidência C).
O perfil lipídico deve ser obtido em todos os parentes de primeiro grau dos indivíduos diagnosticados como portadores de HF (recomendação classe I, nível de evidência C).
4. Teste Genético para Hipercolesterolemia Familiar
A HF é uma doença autossômica codominante. É causada, principalmente, por alterações genéticas capazes de provocar perda de função no receptor da LDL, na APOB e, com menos frequência, quando ocorrem alterações que promovem ganho de função na proteína PCSK9, responsável pela degradação do receptor da LDL.
4.1. Receptor da LDL, Apo B, PCSK9 e Remoção da LDL Circulante
O receptor da LDL está localizado na superfície das células hepáticas e de outros órgãos, ligando-se à LDL via Apo B. Isso leva à sua captação, realizada por um mecanismo de internalização e endocitose do complexo LDL/Apo B/LDLR. Esse processo é mediado pela proteína adaptadora do LDLR tipo 1 (LDLRAP1) presente nas depressões revestidas com clatrina ( clathrin-coated pits ). Após internalização, a partícula de LDL e o LDLR separam-se no endossoma, e o LDLR pode sofrer degradação lisossomal facilitada pela PCSK9 ou ser transferido de volta à superfície da célula, sendo o colesterol liberado na célula para metabolismo ou eliminação. Alternativamente, o LDLR pode ser degradado via ligação da PCSK9 exógena ao LDLR na superfície celular, na qual é internalizada e processada para degradação lisossomal. 16 Quando os LDLR apresentam alguma alteração genética que modifique sua estrutura ou função, o nível de remoção de LDL do plasma diminui e, consequentemente, o nível plasmático de LDL-c aumenta em proporção inversa ao número de receptores funcionais presentes. 65
4.2. Herança Autossômica Dominante
Classicamente a HF é causada por variantes patogênicas nos genes LDLR , APOB e PCSK9 . O gene que codifica o receptor de LDL ( LDLR ) compreende aproximadamente 45.000 pares de bases de DNA e localiza-se no cromossomo 19, sendo formado por 18 éxons e 17 íntrons. O LDLR é uma proteína composta de 839 aminoácidos, incluindo um peptídeo sinal de 21 aminoácidos com vários domínios funcionais.
A análise das mutações descritas no gene LDLR demonstra que não existem regiões principais em sua sequência ( hot spots ) para o aparecimento de alterações. 66,67 Apesar disso, mutações no éxon 4, responsável pela ligação à LDL via Apo B, parecem estar correlacionadas a fenótipos mais graves da doença. 66-70 De modo interessante,, mutações “de novo” no gene LDLR parecem ser raras. 71 A produção é finamente regulada por um mecanismo de retroalimentação sofisticado, que controla a transcrição do gene LDLR em resposta a variações no conteúdo intracelular de esteróis e da demanda celular de colesterol. 72
Existem cerca de 2.900 alterações genéticas associadas à HF, 73 e aproximadamente 85 a 90% ocorrem no gene LDLR . A HF é mais comumente atribuível a alterações no gene LDLR (incluindo missense, nonsense e inserções e deleções), resultando em LDLR com reduções funcionais (parcial a completa) em sua capacidade de remover a LDL da circulação. Dependendo do impacto da mutação sobre a proteína resultante, o indivíduo pode ser receptor-negativo, que expressa pouco ou nenhum LDLR, ou receptor-defeituoso, que expressa isoformas de LDLR com afinidade reduzida para LDL na superfície dos hepatócitos. 70,74-77
Em indivíduos heterozigotos, um alelo com alteração patogênica é herdado de um dos pais, e um alelo normal, do outro. Como dois alelos funcionais são necessários para manter o nível plasmático normal de LDL-c, a ausência de um funcional pode causar um aumento no nível de LDL para aproximadamente duas vezes o normal já na infância. 72 Os indivíduos homozigotos herdam dois alelos com variantes patogênicas; consequentemente, os LDLR têm funcionalidade muito reduzida, e os pacientes são portadores de uma hipercolesterolemia muito grave (400 a 1.000 mg/dl). 72
Existem cinco principais classes de alterações no gene LDLR: 70,76
Classe I (mutações nulas): essas alterações afetam a região promotora ou a região codificante do gene, o que resulta na total ausência de síntese do LDLR ou na síntese de um receptor não funcional.
Classe II: ocasionadas por defeitos no processamento pós-tradução ou falha no transporte do LDLR do retículo endoplasmático para o complexo de Golgi, resultando em menor expressão na superfície celular.
Classe III: a LDL não se liga corretamente ao LDLR na superfície da célula, graças a um defeito no domínio de ligação do substrato ou no domínio que apresenta homologia estrutural ao Fator de Crescimento Epidérmico (EGF), presentes no LDLR.
Classe IV: o LDLR liga-se normalmente à LDL, mas esta não é internalizada eficientemente pelo mecanismo de endocitose via depressões revestidas com clatrina ( clathrin-coated pits ).
Classe V: o LDLR não é reciclado de volta para a superfície celular.
O gene APOB tem 42 kb, é formado por 29 éxons e 28 íntrons, e dá origem a duas isoformas de proteínas: uma pequena, denominada Apo B-48, e uma grande, chamada de Apo B-100. A primeira é produzida no intestino, sendo um componente dos quilomícrons e seus remanescentes; a segunda é produzida no fígado e é um componente de várias lipoproteínas, como VLDL, IDL, LDL e lipoproteína(a) [Lp(a)]. A hipercolesterolemia, devido à mutação no gene APOB , resulta em um fenótipo clínico de HF semelhante ao causado por mutações em outros genes, sendo referida classicamente como defeito familiar da APOB (FDB, do inglês, familial defective Apo B ). 15 Entretanto, é importante enfatizar que, atualmente, o FDB é considerado um dos tipos de HF, e sua distinção é feita apenas do ponto de vista acadêmico.
Em contraste com o gene LDLR , apenas 353 variantes estão descritas para o gene APOB, 80 e a maioria delas encontra-se no éxon 26. 78-80 A mutação mais comum no gene APOB é a substituição Arg3500Gln, que causa o rompimento da estrutura da proteína. Essa variante corresponde a 5 a 10% dos casos de HF nas populações do norte da Europa, sendo, porém, rara em outras populações. 79,80
Outra possível condição que leva a um fenótipo da HF é o aumento da atividade de PCSK9, também chamada de HF3, na qual mutações com ganho de função levam a maior degradação do LDLR. 16,80,81 Essa é a causa menos comum de HF, representando 1 a 3% dos casos de HF clinicamente diagnosticados. 80,81 O gene PCSK 9 tem 25 kb, contém 12 éxons e dá origem a uma proteína de 692 aminoácidos.
4.3. Hipercolesterolemia Autossômica Recessiva
Além dos genes descritos anteriormente, tem-se considerado como uma das causas do fenótipo da HFHo alterações da LDLRAP1. Diferentemente da HF clássica, esses distúrbios têm herança autossômica recessiva, sendo essa forma denominada hipercolesterolemia autossômica recessiva (ARH, do inglês, autosomal recessive hypercholesterolemia ). Nela a expressão reduzida da LDLRAP1 dificulta a associação do LDLR nas depressões revestidas com clatrina da superfície celular, 82,83 consequentemente reduzindo ou impedindo a internalização do complexo LDL/LDLR no hepatócito. O gene LDLRAP1 tem 25 kb, é composto por nove éxons e dá origem a uma proteína de 308 aminoácidos. Apenas indivíduos com mutações no gene em homozigose ou heterozigose composta são afetados; os heterozigotos simples são considerados apenas portadores, pois geralmente não apresentam hipercolesterolemia. Entretanto, existem casos descritos na literatura de portadores com níveis de LDL-c mais altos que outros membros da família e que não apresentam nenhuma alteração. 84
4.4. Outros Genes Candidatos
Além dos genes apresentados, outros candidatos a serem causadores de HF são: APOE, IDOL (MYLIP), HCHOLA4, STAP1 e LIP A. 85
Formas raras de ARH (também denominadas fenocópias da HF) incluem sitosterolemia ou fitosterolemia, em razão de mutações em dois genes adjacentes e com orientações opostas ( ABCG5 e ABCG8 ), que codificam proteínas transportadoras da família ABC ( ATP-binding cassette ), denominadas esterolina-1 e esterolina-2. 86 Elas estão envolvidas na eliminação de esteróis de plantas, que não podem ser utilizados pelas células humanas, e na deficiência de colesterol 7-alfa hidroxilase (CYP7A1), que é a enzima da primeira etapa na síntese de ácidos biliares, resultando em colesterol intra-hepático e aumentado e expressão reduzida de LDLR na superfície do hepatócito. A deficiência de CYP7A1 é a menos comum das condições autossômicas recessivas que podem causar graves hipercolesterolemias. 87
4.5. Variabilidade do Fenótipo na Hipercolesterolemia Familiar
Estudos atuais mostram que a HF engloba um espectro de fenótipos clínicos com base, em parte, na gama de variantes patogênicas. Assim, indivíduos com mais de uma alteração no mesmo gene e em alelos diferentes (heterozigotos compostos em trans, geralmente do LDLR ) podem ter um fenótipo similar ao de um homozigoto verdadeiro (mesma variante em dois alelos). 23,88 A Tabela 2 mostra a variabilidade da distribuição dos valores pré-tratamento de LDL-c para vários genótipos de HF. 23
Tabela 2. Variabilidade no fenótipo da hipercolesterolemia familiar por ordem decrescente de concentrações de LDL-c.
| Valores de LDL-c | Genótipos possíveis |
|---|---|
| 400 a 1.000 mg/dl | Variantes patogênicas em homozigose |
| Homozigoto LDLR “nulo” | |
| Verdadeiro homozigoto LDLR | |
| Heterozigoto composto LDLR | |
| 130 a 450 mg/dl | Variantes patogênicas em heterozigose |
| LDLR “nulo” | |
| LDLR defeituoso | |
| Ganho de função da PCSK9 | |
| APOB | |
| Formas poligênicas (múltiplos SNP que elevam o LDL-c) | |
| Lipoproteína (a) elevada | |
| 130 a 200 mg/dl | Hipercolesterolemia comum |
Adaptada de Sturm et al. 23 LDL-c: colesterol da lipoproteína de baixa densidade; LDLR: receptor da LDL; PCSK9: proproteína convertase subutilisina/kexina tipo 9; APOB: apolipoproteína B; SNP: polimorfismo de nucleotídeo único.
É importante ressaltar que já foram descritos níveis normais de LDL-c em indivíduos com alterações patogênicas em famílias portadoras de HF, e nem sempre é identificada alteração patogênica em pessoas com fenótipo da doença. Desse modo, a presença de um fenótipo compatível com HF sem identificação de alteração patogênica nos clássicos genes LDLR , APOB e PCSK9 pode estar ligada à herança poligênica. Talmud et al. 89 descreveram conjuntos de 12 polimorfismos em diferentes genes em indivíduos hipercolesterolêmicos em que não foi encontrada uma alteração causal. 89 Segundo os autores, a herança poligênica explicaria até 88% dos casos de hipercolesterolemia em geral e cerca de 20% daqueles com fenótipo de HF na ausência de causas monogênicas clássicas. 90
4.6. Racional para Realização do Rastreamento em Cascata
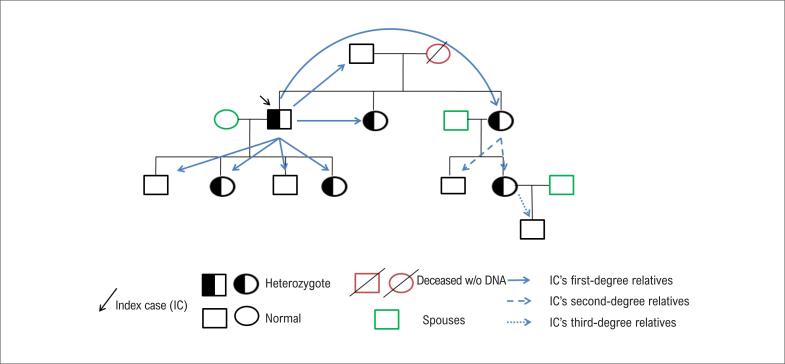
Na HF, o rastreamento genético em cascata vem sendo utilizado como ferramenta para a identificação de novos indivíduos afetados. As alterações patogênicas correlacionadas à doença podem ser identificadas em 30 a 80% dos pacientes, dependendo dos critérios de inclusão e da sensibilidade dos métodos utilizados para o rastreamento. 91,92 A técnica nada mais é do que o sequenciamento das alterações em parentes de primeiro grau de indivíduos identificados com HF. 93 Em rodadas de rastreamento, os parentes de primeiro grau identificados com a afecção passam a ser os casos-índices, e seus respectivos parentes começam a ser rastreados ( Figura 6 ).
Figura 6. Exemplo de rastreamento genético em cascata. DNA: ácido desoxirribonucleico.
A cascata genética é a estratégia mais custo-efetiva para a identificação de indivíduos portadores de HF. 93-95 Marks et al. 93 analisaram essa custo-efetividade, e foi determinado que o custo incremental por ano de vida adquirido era de £ 3.300 por vida ao ano. O programa foi o mais custo-efetivo na Dinamarca, e o custo por vida ao ano foi de US$ 8.700,00, demonstrando uma estimativa de custos menor que o gasto com prevenção secundária em indivíduos não portadores de HF. 96
Estudos mostram que pouquíssimos indivíduos com HF são diagnosticados. Em geral, estima-se que aproximadamente 20% dos pacientes com a doença recebem diagnóstico, e menos de 10% têm tratamento adequado. 10 Assim, o rastreamento em cascata aumenta o número de diagnósticos e diminui a idade com que o indivíduo é diagnosticado, oferecendo-lhe maior chance de tratamento precoce e diminuição do risco cardiovascular global.
O teste genético geralmente não é necessário para diagnóstico ou tratamento clínico de um caso-índice, mas pode ser útil quando o diagnóstico é incerto e para a identificação de familiares de um indivíduo afetado. O método de rastreamento em cascata tem sido utilizado por vários países, como Espanha, 96 Inglaterra, Holanda, 97 Portugal 98 e, mais recentemente, no Brasil, 99 como ferramenta bastante custo-efetiva na identificação de novos portadores de HF.
Em publicação realizada em um consórcio de estudos genéticos, 24 a presença de uma variante patogênica causadora da HF foi encontrada em 2% dos casos graves (LDL-c > 190 mg/dl encontrado em cerca de 7% da população). Indivíduos com a variante monogênica causadora da HF tinham um risco 22 vezes maior de eventos cardiovasculares do que os normolipidêmicos sem alterações genéticas e 4 vezes maior do que os hipercolesterolêmicos sem alterações. 24 Essa elevação foi atribuída principalmente à exposição dos portadores de HF a colesterol alto desde o nascimento, diferentemente da hipercolesterolemia poligênica, que pode manifestar-se mais tardiamente. Esses dados sugerem fortemente que a presença de variante genética patogênica causadora da HF tem implicação prognóstica.
Além disso, a identificação de uma alteração causal pode fornecer uma motivação adicional para alguns pacientes iniciarem o tratamento adequado, e o teste genético é padrão-ouro para o diagnóstico de certeza de HF. Pode ser particularmente útil nos casos de familiares com diagnóstico clínico equivocado ou apenas com nível de LDL-c sugestivo da doença. Testes genéticos também podem ser importantes para a identificação de uma alteração causal em famílias recém-identificadas ou com forte suspeita de HF. Ademais, quando encontrada a alteração, o teste fornece uma resposta simples e definitiva para o diagnóstico da HF, tornando-se ferramenta incontestável para a doença como traço familiar. 23
No entanto, os testes genéticos têm limitações. Entre os pacientes hipercolesterolêmicos com diagnóstico de possível HF, a taxa de identificação de uma alteração causal por meio do teste genético é de 50% ou menos, enquanto, em pacientes com HF definitiva segundo critérios clínicos, a taxa de identificação da mutação pode ser tão alta quanto 86%. 23,100 Desse modo, é importante ressaltar que um teste genético negativo não exclui a HF. Além disso, indivíduos com LDL-c elevado permanecem em alto risco cardiovascular e devem ser tratados de acordo com diretrizes aceitas, independentemente dos resultados dos testes genéticos.
4.7. Metodologias para Diagnóstico Genético
O defeito no gene causal do fenótipo da HF, se LDLR , APOB , PCSK9 ou LDLRAP1 , além dos outros mais raros já citados, não pode ser determinado clinicamente, sendo necessário um teste genético para sua verificação. Assim, por conta da variabilidade de genes e do grande número de mutações possíveis, o método de diagnóstico genético deve incluir o sequenciamento da região codificadora de todos os genes possivelmente ligados à etiologia da doença. 101
Para que seja possível esse sequenciamento em grande escala, de modo que um grupo de genes seja sequenciado (painel de genes-alvo), é necessária a utilização da tecnologia de sequenciamento de nova geração (NGS, do inglês, next-generation sequencing ). Nessa técnica, é feito um painel contendo todos os genes a serem sequenciados, os quais são colocados em um chip. Outro enfoque mais amplo é a utilização do sequenciamento de exomas, o qual possibilita determinar a sequência da região codificante de praticamente todos os genes presentes no genoma em questão. Contudo, apesar de esse enfoque fornecer uma extensa cobertura do genoma, muitos genes podem não ser sequenciados perfeitamente. Assim, em casos específicos de doenças monogenéticas, como é o caso da HF, painéis contendo os genes-alvo configuram-se como uma alternativa mais custo-efetiva, além de mais precisa.
A tecnologia NGS apresenta muitas vantagens em relação ao sequenciamento Sanger, considerado padrão-ouro nessa técnica. Dentre as vantagens, podem ser citados: a velocidade de obtenção de resultados, a quantidade de material necessário utilizado na reação, o custo do sequenciamento por base, a quantidade de informação gerada e a precisão dos resultados obtidos. Resumidamente, para o estudo genético, é efetuada coleta de sangue periférico em tubo contendo ácido etilenodiamino tetra-acético (EDTA, do inglês, ethylenediamine tetraacetic acid ), obtendo-se o DNA genômico de leucócitos. A primeira etapa na preparação do material consiste na geração de uma biblioteca de fragmentos de DNA flanqueados por adaptadores específicos. As regiões de interesse dos genes em estudo são amplificadas por meio da reação em cadeia da polimerase em larga escala, em reações multiplexadas, com centenas de pares de oligonucleotídeos em um mesmo tubo de reação. A partir destas reações, são construídas bibliotecas com códigos de barras para identificar cada paciente analisado. Os fragmentos gerados são amplificados, por clonagem, em esferas por reação em cadeia da polimerase em emulsão, as quais são aplicadas em um chip e inseridas no equipamento de NGS. Uma vez gerados, os dados são transferidos para uma plataforma, na qual as leituras são mapeadas com o genoma humano (hg19/GRCh37) e é realizada a interpretação das variantes.
Cerca de 10% das alterações genéticas no gene do LDLR não são pontuais, 99 mas sim grandes deleções ou duplicações de éxons do LDLR . Portanto, caso não seja identificada nenhuma alteração por NGS, é importante realizar a técnica de amplificação multiplex de sondas dependente de ligação 102 (MLPA, do inglês, multiplex ligation-dependent probe amplification ) (MCR-Holland) para identificar prováveis deleções e ou duplicações.
O rastreamento em cascata é custo-efetivo e deve ser realizado em todos os pacientes e familiares em primeiro grau de indivíduos com diagnóstico de HF. O mais custo-efetivo é o que utiliza informação genética de pessoas nas quais uma mutação causadora da doença tenha sido identificada. O rastreamento clínico/bioquímico deve ser realizado mesmo quando a realização de teste genético não é possível. 103-105
Um resumo dos benefícios e das limitações para realização do teste genético em cascata pode ser visto no Quadro 2 , adaptado de Sturm et al. 23
Quadro 2. Benefícios e limitações do teste genético em cascata. 23 .
| Benefícios |
| 1. Fornece diagnóstico definitivo para a HF. |
| 2. Fornece informações prognósticas e a capacidade de realizar estratificação de risco refinado, porque a detecção de uma variante patogênica indica maior risco cardiovascular. |
| 3. Resultados de testes genéticos positivos mostraram aumentar a iniciação da terapia hipolipemiante, a adesão à terapia e as reduções nos níveis de LDL-c. |
| 4. A detecção precoce oferece a oportunidade para modificações mais precoces no tratamento e no estilo de vida. |
| 5. Quando o teste genético no probando é positivo, leva a testes genéticos em cascata em membros da família em risco com alta sensibilidade e especificidade. |
| 6. Pode excluir HF nos membros da família em risco que não herdam a(s) variante(s) patogênica(s). |
| 7. O teste genético proporciona discriminação a nível molecular entre indivíduos com HFHe, HFHe composta, HF de duplo heterozigoto, HFHo, HF autossômica recessiva e os sujeitos sem uma variante patogênica identificável, mas com o fenótipo de HF. Os riscos de recorrência para parentes e as implicações para o planejamento familiar diferem entre esses cenários. |
| 8. O teste genético possibilita a identificação potencial de “fenocópias” de HF que podem requerer terapias específicas e ter padrões de herança diferentes dos da HF. |
| 9. Pode fornecer motivação adicional para os indivíduos terem maior aderência aos medicamentos prescritos. |
| 10. Fornece uma explicação para o fracasso da dieta e exercício de controle para controlar níveis elevados de lipídios |
| 11. Fornece uma explicação útil para a história familiar de doença cardíaca prematura e níveis de LDL-c difíceis de tratar. |
| Limitações |
| 1. O teste genético para a HF não é completamente sensível ou específico. |
| 2. Nem todos os pacientes com diagnóstico clínico de HF terão variante(s) patogênica(s) identificável(s) |
| 3. Alguns pacientes terão uma variante de significância incerta (VUS, do inglês, variant of uncertain significance ) identificada, que pode ser reclassificada como patogênica ou benigna ao longo do tempo, à medida que mais informações são obtidas. |
| Custo |
| 1. Indivíduos podem querer passar por testes genéticos, mas o custo deles pode ser um fator limitante. |
Adaptado de Sturm et al. 23
HF: hipercolesterolemia familiar; HFHe: HF heterozigótica; HFHo: HF homozigótica; LDL-c: colesterol da lipoproteína de baixa densidade.
4.8. Recomendação
Triagem laboratorial: Todo indivíduo com suspeita de HF (caso-índice) deverá ter seus familiares de primeiro grau testados para hipercolesterolemia. Caso o resultado seja positivo, deverá ser realizada uma triagem em cascata em outros familiares (de segundo e terceiro graus). Grau de recomendação: I, nível de evidência: A.
Triagem genética: O teste genético deverá ser oferecido para o caso-índice; se positivo, deverá ser realizado em seus familiares de primeiro grau. Caso o resultado seja positivo, deverá ser realizada uma triagem em cascata em outros familiares (de segundo e terceiro graus). Grau de recomendação: II, nível de evidência: A.
5. Estratificação de Risco Cardiovascular
5.1. Epidemiologia do Risco Cardiovascular na Hipercolesterolemia Familiar
A associação entre HFHe e DAC está bem estabelecida. 51,105 isso porque, na ausência de terapia hipolipemiante, existe um risco cumulativo de doença coronariana fatal e não fatal de aproximadamente 50% em homens e 33% em mulheres até 60 anos. 51 No estudo do Simon Broome Register Group , realizado no período de 1980 até 1995, apesar do tratamento, constatou-se aumento do risco relativo de evento coronariano fatal de 125 vezes entre mulheres com HF e de 20 a 39 anos (mortalidade anual de 0,17%) em relação à população geral da Inglaterra e do País de Gales. Em homens com HF e idade entre 20 e 39 anos, o risco relativo aumentou em 48 vezes (mortalidade anual de 0,46%). 4
Estudos mais recentes corroboram o risco aumentado de DAC entre indivíduos com HF (LDL-c ≥ 190 mg/dl), seja de causa monogênica ou poligênica. No estudo de Khera et al., 24 observou-se risco aumentado de eventos cardiovasculares entre indivíduos com LDL-c ≥ 190 mg/dl, mesmo na ausência de mutação para HF identificada, em relação àqueles com colesterol normal. 24 De 1.386 pessoas com LDL-c ≥ 190 mg/dL (6,7% do total), apenas 24 (1,7%) tinham mutação detectada. Aquelas com LDL-c ≥ 190 mg/dL e sem mutação apresentaram seis vezes mais risco de DAC em relação ao grupo-controle (LDL-c < 130 mg/dL e sem mutação), enquanto as com LDL-c ≥ 190 mg/dL e com mutação demonstraram 22 vezes mais risco. 24
Em outro estudo recente, entre pacientes com HF de diagnóstico clínico, a presença de uma causa monogênica da doença se mostrou associada a risco cardiovascular significativamente aumentado (HR ajustado 1,96; IC 95% 1,24 a 3,12; p = 0,004), enquanto o risco cardiovascular em pacientes com hipercolesterolemia poligênica não foi diferente em comparação àqueles sem causa genética identificada. No entanto, a presença de escore poligênico em indivíduos com HF monogênica aumentou ainda mais o seu risco cardiovascular (HR ajustado 3,06; IC 95% 1,56 a 5,99; p = 0,001). 106
A despeito do risco aumentado de DAC nos pacientes com HF, o tratamento com estatina associa-se a significativa redução do risco de eventos cardiovasculares. O estudo de Versmissen et al. 46 mostrou que indivíduos tratados com a substância apresentaram uma redução de 76% (HR 0,24; IC 95% 0,18 a 0,30; p < 0,001) no risco de eventos coronarianos em relação aos “não tratados” (com atraso no início do tratamento). No entanto, apesar da importante queda nas chances de eventos cardiovasculares com terapia hipolipemiante, pesquisas recentes evidenciam risco residual de eventos nesses pacientes. Em estudo com 821 pacientes com HF (mediana de idade 47,4; 35,3 a 58,3) em uso de terapia hipolipemiante por período de 9,5 anos (5,1 a 14,2), 102 pacientes (12%) apresentaram DCV. Os pacientes mais propensos tinham histórico de evento cardiovascular prévio, história familiar prematura de DCV, hipertensão, maior LDL-c e menor HDL-c sob tratamento, além de serem mais tabagistas em relação a indivíduos sem evento cardiovascular. 107
O registro CASCADE FH avaliou desfechos cardiovasculares de pacientes com HF nos EUA. Em uma coorte de 1.900 indivíduos com idade média de 56 ±15 anos, seguimento médio de 20 ±11 anos e prevalência de DCV aterosclerótica prévia de 37%, apenas 48% alcançaram LDL-c < 100 mg/dL e 22% alcançaram LDL-c < 70 mg/dL, apesar do uso de terapia hipolipemiante em 92,8%. Um total de 107 eventos ateroscleróticos ocorreram em 69 (3,6%) do total de pacientes durante o seguimento, correspondendo a uma incidência anual de eventos de 2,2/100 pacientes-ano. 108 Desse modo, portadores de HF apresentam risco aumentado de eventos ateroscleróticos mesmo sob tratamento hipolipemiante. Esse risco é variável, a depender do controle do LDL-c e da presença de diversos outros fatores, sugerindo a importância da estratificação desses pacientes.
5.1.1. Recomendações para Estratificação de Risco na HF
O risco cardiovascular na HF é maior. No entanto, embora aumentado, ele é variável de acordo com a presença de fatores de risco. Portanto, recomenda-se a estratificação de risco nesses pacientes (recomendação classe I, nível de evidência B).
5.2. Papel dos Fatores de Risco na Hipercolesterolemia Familiar
Os fatores de risco clássicos para DAC na HF são de grande importância na estratificação dessa população. Por exemplo, assim como na população geral, o risco cardiovascular entre pacientes com HF é maior em homens do que em mulheres, como demonstrado em diferentes pesquisas. O estudo de coorte holandês de Jansen et al. 109 observou que o risco de um evento cardiovascular foi quase três vezes maior em homens em comparação às mulheres (RR 2,82, IC 95% 2,37 a 3,36). 109 Uma meta-análise recente que incluiu 27 estudos e 41.831 participantes quantificou a associação entre vários fatores de risco e DCV em indivíduos com HF. Nela, o risco para homens com DCV foi de cerca de 2 vezes maior (OR: 1,95; CI 95% 1,68 a 2,23). 110 Nessa meta-análise e em outros estudos, o tabagismo também apresenta forte associação com o desenvolvimento de DAC em pacientes com HF, com risco em torno de 1,7 a 1,8 vezes maior. 109-111
O diabetes melito é um importante fator de risco cardiovascular na população geral. Em meta-análise do Emerging Risk Factors Collaboration , com 102 estudos prospectivos, a doença foi associada a um aumento duas vezes maior de DCV, independentemente de outros fatores de risco. 112 Como esperado, o diabetes em indivíduos com HF também está ligado a risco aumentado em comparação a pacientes com HF sem a doença. A meta-análise de Akioyamen et al. 110 encontrou uma relação duas vezes maior entre diabetes e DCV nesses pacientes (OR: 1,95; IC 95% 1,33 a 2,57), assim como a hipertensão arterial (OR: 2,11; IC 95% 1,64 a 2,58). O tabagismo, a hipertensão e o diabetes foram responsáveis por mais de um quarto do risco cardiovascular em indivíduos com HF nesse estudo. 110
Além de fatores de risco tradicionais, outros também aumentam o risco de eventos em indivíduos com HF, como os antecedentes familiares de DCV, que se mostraram associados a maior risco de DCV em indivíduos com HF. Na meta-análise de Akioyamen et al., 110 o risco foi quase duas vezes maior entre indivíduos com história familiar de DCV (OR: 1,83; IC 95% 1,58 a 2,07).
Alguns estudos prévios falharam em demonstrar a associação entre LDL-c e DCV em HF, apesar de o LDL-c elevado ser a principal característica dessa condição. Contudo, existem várias explicações para isso. Por exemplo, a comparação entre indivíduos com LDL-c alto e aqueles com LDL-c similarmente elevado pode não ter eficácia para mostrar efeitos das diferenças de LDL-c, em especial quando a comparação envolve pequeno número de participantes. Além disso, pacientes com LDL-c mais elevado são, em geral, tratados mais agressivamente, introduzindo um fator de confusão nas análises. No entanto, na meta-análise recente de Akioyamen et al., 110 análises de metarregressão demonstraram que níveis mais altos de colesterol total e LDL-c não tratados estavam associados a maior risco de DCV, com aumento de 51% para cada aumento de 1 mmol/L de colesterol. Além disso, níveis baixos de HDL-c (< 1 mmol/L) também estiveram relacionados a risco cardiovascular aumentado em indivíduos com HF, ao contrário dos triglicerídeos séricos e das apolipoproteínas A-I e B.
5.2.1. Recomendação sobre o Papel dos Fatores de Risco na HF
Vários fatores apresentam importante papel no risco cardiovascular de pacientes com HF e devem ser pesquisados ativamente nessa população (recomendação classe I, nível de evidência A).
5.3. Papel de Outros Fatores no Risco Cardiovascular da Hipercolesterolemia Familiar: Lipoproteína (a), Xantoma de Tendão de Aquiles, Proteína C Reativa
A lipoproteína (a), ou Lp(a), consiste em uma lipoproteína composta por partícula semelhante a LDL, cuja Apo B se encontra covalentemente ligada a uma apolipoproteína (a).
De acordo com evidência acumulada ao longo de vários anos, a Lp(a) elevada é considerada um fator de risco cardiovascular independente na população geral, inclusive com implicação causal. 112-114 Em indivíduos com HF, a condição também consiste em fator de risco adicional, observação de grande relevância nesse grupo, considerando-se o potencial para níveis elevados de Lp(a) nessa população.
5.3.1. Recomendação
A dosagem de Lp(a) deve ser considerada em indivíduos com HF (recomendação classe IIa, nível de evidência B).
O xantoma de tendão de Aquiles é um sinal peculiar da FH e faz parte dos seus critérios diagnósticos. Cerca de 30 a 50% dos indivíduos com HFHe e diagnóstico genético apresentam xantoma tendinoso. Estudo de Civeira et al. 115 mostrou que pessoas com HF e portadores de xantomas apresentam maior prevalência de DCV prematura em comparação àquelas sem xantomas (36,7% versus 13,8%, p = 0,001). 115 Na meta-análise de Oosterveer et al., 116 em indivíduos com HF geneticamente confirmada, observou-se um risco três vezes maior de DCV entre os portadores de xantoma tendinoso. 116
Um estudo brasileiro mais recente também avaliou a associação de xantomas de tendão de Aquiles com a presença e carga de aterosclerose subclínica em indivíduos com HFHe. Nele, os indivíduos com xantomas (21%) apresentavam concentrações mais elevadas de LDL-c e Lp(a), assim como escore de cálcio mais elevado. Além disso, a associação de xantoma com escore de cálcio persistiu positiva e independente após ajustes para idade, sexo, tabagismo, hipertensão arterial, uso prévio de estatina, HDL-C, LDL-c e Lp(a). 117
Apesar da associação positiva entre xantomas e DCV em estudos prévios, na recente meta-análise de Akioyamen et al., 110 os dados disponíveis não apontaram os xantomas de tendão como fatores de risco na HF.
Outras recomendações incluem:
O xantoma de tendão de Aquiles parece estar relacionado com risco cardiovascular mais alto na HF. Como sua pesquisa se baseia geralmente apenas no exame físico, deve ser estimulada (recomendação classe IIA, nível de evidência B).
A associação da proteína C reativa com doença cardiovascular na HF é pautada em estudos pequenos de sua associação com aterosclerose subclínica e com resultados controversos. 118,119
Não existe evidência para dosagem rotineira de PCR na HF (recomendação classe IIB, nível de evidência C).
5.4. Estratificação de Risco Cardiovascular na Hipercolesterolemia Familar: Uso dos Escores Clínicos para Estratificação de Risco
A estratificação de risco habitual utilizando escores clínicos amplamente empregados, como o escore de Framingham, o de Framingham Global, o da AHA/ACC, entre outros, não foi elaborada para pacientes portadores de HF. 22 De fato, um indivíduo com longa exposição a elevados níveis de colesterol ao longo do tempo (“ cholesterol years score ”) não pode ser abordado como eventual baixo risco cardiovascular ao se utilizar um desses escores tradicionais.
Portanto, estudos atuais sobre estratificação de risco na HF precisam considerar, se possível, um desenho prospectivo, o diagnóstico molecular e os efeitos atenuantes pelo uso prévio de estatina. Nessa perspectiva, Paquete et al. 120 estabeleceram o escore de risco de Montreal para portadores de HF, avaliando 670 indivíduos com diagnóstico molecular confirmado e submetidos a tratamento prévio com estatina. 120 Os fatores sexo masculino, idade, hipertensão e tabagismo foram associados de maneira independente com a incidência da DCV aterosclerótica. Mais recentemente, os autores validaram sua equação de risco em outra população de 718 portadores de diagnóstico molecular de HF com boa discriminação estatística; 121 entretanto, esses estudos são ainda considerados limitados pelo seu desenho retrospectivo e pela incidência relativamente pequena de eventos.
Perez de Isla et al., 122 utilizando o registro prospectivo SAFEHEART ( Spanish Familial Hypercholesterolemia ), estabeleceram uma nova equação, acrescentando aos marcadores de risco definidos no escore de Montreal: presença de evento cardiovascular aterosclerótico, índice de massa corporal (IMC) elevado (> 30 kg/m2 ), concentração de LDL-c residual elevada (> 100 ou > 160 mg/dl) e níveis de Lp(a) acima de 50 mg/dL. 122 O uso desses parâmetros revelou associação independente com um primeiro evento cardiovascular aterosclerótico ou sua recorrência. De fato, o SAFEHEART escore mostrou um bom índice de discriminação (0,85 global e 0,81 na prevenção primária), com excelente calibração para as prevenções primárias e secundárias. Entretanto, ele foi limitado pela incidência relativamente baixa de eventos (5,6%), pela existência de um possível efeito confundidor, pelo uso prévio de estatina e por um período relativamente curto de seguimento. Finalmente, de modo semelhante ao escore de Montreal para HF, a equação do registro SAFEHEART se mostrou limitada pela falta de validação em outras populações com HF. 123
5.4.1. Recomendação
Uso do escore de Montreal para HF: recomendação classe IIb, nível de evidência B.
Uso do escore SAFEHEART: recomendação classe IIa, nível de evidência B.
Uso do escore de Framingham ou de outros escores clínicos na HF: recomendação classe III, nível de evidência B.
5.5. Escore de Cálcio Coronário
O escore de cálcio coronário (CAC) é uma forma de quantificar a carga total de placa aterosclerótica coronariana: quanto maior o escore de cálcio, maior a carga de placa que o indivíduo apresenta. A maneira mais difundida de avaliar o CAC é pelo método de Agatston, que corresponde à soma ponderada das lesões com densidade acima de 130 unidades Hounsfied (UH). Então, multiplica-se a área do cálcio por um fator relacionado à atenuação máxima da placa: fator 1 – se atenuação máxima < 200 UH; fator 2 – se atenuação máxima entre 200 e 300 UH; fator 3 – se atenuação máxima entre 300 e 400 UH; fator 4 – se atenuação máxima ≥ 400 UH. 124
Existem diversos estudos que demonstraram a associação de CAC elevado com evento coronariano. 125,126 Uma meta-análise publicada em 2004 por Pletcher et al. 127 mostra uma relação linear entre a quantidade de CAC e o risco de eventos coronarianos. Aqueles com uma pontuação CAC > 400 unidades Agatston (UA) apresentavam risco mais alto de eventos cardiovasculares. Os estudos mais emblemáticos a respeito da associação de CAC com a predição de DAC são o MESA 125 e o Heinz Nixdorf Recall Study (HNR), 126 os quais mostraram que CAC é um marcador independente de morte e infarto do miocárdio. O escore não apenas adicionou poder discriminativo, mas também melhorou a reclassificação de risco para DAC comparado aos fatores de risco clássicos. No estudo MESA, uma avaliação prospectiva de 6.814 pacientes seguidos por uma média de 3,8 anos, as taxas de risco para um evento coronariano foram 7,73 para aqueles com pontuação CAC 101 a 300 UA e 9,67 para CAC ≥ 300 UA (P < 0,001) em comparação àqueles com CAC ausente. 125 Em contrapartida, CAC zero está associado a baixa taxa de eventos coronarianos mesmo em médio prazo (11 anos). 128
Não há estudos randomizados para tratamento do perfil lipídico guiado por CAC, mas existem estudos observacionais demonstrando que indivíduos portadores de CAC mais elevado apresentam maior benefício da terapêutica com estatinas. 129,130 A Diretriz Brasileira de Dislipidemia de 2017 recomenda que indivíduos de prevenção primária com escore de cálcio elevado (> 100 UA) sejam considerados como de alto risco cardiovascular e tratados com metas lipídicas pertinentes para tal categoria de risco. 52 A diretriz do American College of Cardiology/American Heart Association de 2018 dá um passo adiante e coloca a possibilidade de adiar tratamento com estatina em pacientes de prevenção primária, idade entre 40 e 75 anos, sem diabetes melito, com LDL-c entre 70 e 189 mg/dl e que apresentam CAC zero. 53
Os pacientes portadores de HF apresentam CAC mais elevado em comparação aos não HF pareados por sexo e idade. 118 Os determinantes da calcificação coronariana na HF são os fatores de risco clássicos para aterosclerose. De fato, Martinez et al. 118 demonstraram que a carga de exposição ao LDL-c correspondente ao LDL years score (LDL-c multiplicado pela idade), escore de Framingham e sexo masculino estavam associados ao CAC. Um estudo francês também mostrou associação de CAC com colesterol years score (colesterol total multiplicado pela idade). 131
As diretrizes de tratamento da dislipidemia consideram os pacientes portadores de HF como pelo menos de alto risco cardiovascular por apresentarem LDL-c elevado desde a infância. 52,132 Desse modo, um questionamento que ficaria nesse contexto seria a utilidade do CAC na estratificação de risco da HF, em se tratando de uma população de alto risco cardiovascular. Uma subanálise do estudo MESA mostra associação de CAC com DCV mesmo no contexto de LDL-c elevado (LDL-c > 190 mg/dl). Os pacientes com CAC zero apresentaram baixa taxa de eventos cardiovasculares (risco em 10 anos: 3,7%, risco por ano: 0,4%) quando comparados aos portadores de CAC > 0 (risco em 10 anos: 20%; risco por ano: 2,0%). Os fatores associados a CAC zero foram: idade < 65 anos, sexo feminino e ausência de diabetes melito. A análise da associação de CAC com evento cardiovascular foi feita em uma coorte brasileira de indivíduos portadores de HF com diagnóstico molecular comprovado e em prevenção primária. Esse estudo mostra associação de CAC com evento cardiovascular na HF, mesmo sob tratamento com estatinas de alta potência. 133 A média de idade foi de 45 anos, e foram documentados 15 eventos cardiovasculares. A taxa anual de eventos por 1.000 pacientes para CAC zero, 1 a 100 e > 100 foi, respectivamente: 0; 26,4 (IC 95% 12,9 a 51,8) e 44,1 (IC 95% 26,0 a 104,1). Apesar de ser um estudo com tamanho amostral pequeno (n = 206) e tempo de seguimento relativamente curto (mediana 3,7 anos), demonstra que possivelmente CAC zero também pode ser utilizado como marcador de bom prognóstico na população com HF. 133
Desse modo, o CAC pode ser considerado uma ferramenta adicional na estratificação de risco de pacientes com HFHe de prevenção primária (classe IIb, nível de evidência B).
5.6. Angiotomografia de Coronárias
Comparada ao escore de cálcio, a angiotomografia de coronárias é um exame que apresenta como vantagens a visualização de placas não calcificadas e estimativas do grau de estenose luminal. 134 Contudo, as desvantagens seriam: necessidade de infusão de contraste endovenoso, custo mais elevado e dose maior de radiação.
O uso da angiotomografia de coronárias apresenta claros benefícios em pacientes sintomáticos de baixo risco para DAC, tanto na emergência como no âmbito ambulatorial. Isso porque afasta a doença como causadora dos sintomas. 135 Entretanto, o benefício dessa metodologia sobre o CAC na estratificação de risco de pacientes assintomáticos é bem discutível. O registro CONFIRM, por exemplo, não demonstrou vantagem da angiotomografia de coronárias sobre o CAC nos indivíduos assintomáticos. 136 Porém, dois “subestudos” do CONFIRM mostraram que o exame poderia melhorar a estratificação em relação ao CAC em pacientes de maior risco, em particular nos mais idosos 137 e naqueles com CAC de valor intermediário. 138
Estudos prévios demonstraram que portadores de HF apresentam maior carga de placas ateroscleróticas na angiotomografia de coronárias, o que é representado por maior número de pacientes com placas, estenose luminal e segmentos com placas, quando comparado a controles normolipidêmicos. 139,140 Essa condição está associada a maior risco de desfechos cardiovasculares em população não portadora de HF. 141 A dúvida, então, seria a utilidade da angiotomografia de coronárias nos portadores de HF assintomáticos de prevenção primária. Assim, um pequeno estudo japonês com 101 pacientes portadores de HF demonstrou que um escore tomográfico com base em segmentos com estenose na angiotomografia de coronárias estava associado a eventos cardíacos maiores. 142 No entanto, esse estudo não deu uma resposta definitiva devido ao pequeno tamanho da amostra, ao desenho retrospectivo e ao fato de muitos eventos terem ocorrido próximo à realização do exame, o que possivelmente leva à possibilidade de muitos eventos de revascularização terem sido “provocados” por ele. O único estudo clínico randomizado para avaliar influência da angiotomografia de coronárias em desfechos clínicos em pacientes assintomáticos foi realizado em uma população diabética e não demonstrou benefício. 143 Diante disso, por enquanto, não é recomendada a realização de angiotomografia de coronárias em portadores de HFHe assintomáticos de prevenção primária (classe III, nível de evidência B).
Entretanto, a utilidade da angiotomografia de coronárias na HFHo merece outro ponto de vista. Isso porque a doença está associada a aterosclerose acelerada e pode cursar com evento cardiovascular e estenose aórtica supravalvar de modo muito precoce. 13 Existem estudos com tamanho amostral pequeno demonstrando que a HFHo pode evoluir com aterosclerose coronariana e acometimento aterosclerótico de raiz de aorta detectada pela angiotomografia de coronárias em idade prematura. 144,145
O exame pode ser realizado em portadores de HFHo mesmo assintomáticos desde o diagnóstico, para melhor avaliação do seu perfil de risco cardiovascular, e repetido a critério clínico (recomendação classe IIa, nível de evidência B).
5.7. Espessura Íntima Média Carotídea
A espessura íntima média carotídea (EIMC) é definida como a distância entre a interface lúmen-íntima e média-adventícia. Está ligada a fatores de risco cardiovasculares, prevalência e incidência de DCV e grau de aterosclerose em diferentes sítios arteriais. Sua progressão pode ser revertida ou atenuada com intervenção em fatores de risco, em associação a redução de eventos cardiovasculares, 146 achados que colocam a EIMC como potencial marcador substituto de aterosclerose. A EIMC já foi estudada na população com HF por Martinez et al., 118 que demonstrou maior valor dela no grupo com HF em relação aos controles.
A EIMC foi utilizada na população com HF como um marcador substituto de aterosclerose para avaliação de progressão de aterosclerose com medicação hipolipemiante. 147,148 Mesmo na infância, foi demonstrada maior EIMC nas crianças com HF, se comparadas às não afetadas. Além disso, estudo prévio com pessoas de 8 a 18 anos mostra uma tendência à regressão da EIMC com pravastatina, enquanto uma tendência à progressão foi observada no grupo placebo. 149 O uso da rosuvastatina em crianças a partir de 6 anos de idade foi capaz de desacelerar a progressão da EIMC, chegando a igualar os valores após 2 anos de tratamento, em comparação às crianças não afetadas. 150
Entretanto, a potencial utilização da EIMC na prática clínica esbarra na variabilidade da metodologia para sua aferição, que inclui: local da medida, influência do ciclo cardíaco (não houve padronização se medida na sístole ou diástole nos diferentes estudos), utilização de medida média ou máxima, definição de EIMC alterada, entre outras dificuldades na uniformização do método. 151 Além disso, o estudo MESA comparou a reclassificação de risco entre diversos biomarcadores em pacientes de risco intermediário e encontrou baixo poder de reclassificação da EIMC em comparação ao CAC: net reclassification improvement (NRI) da EIMC foi de 0,060, e de CAC foi de 0,406, demonstrando a superioridade deste último método. 152
Outra informação que o ultrassom de carótidas pode fornecer é se há placas carotídeas. O risco relativo da presença delas varia de maneira ampla, de 1,16 a 6,71 em diferentes estudos, possivelmente em decorrência das suas diferentes definições: EIMC >1,2 mm; EIMC >1,0 mm com protrusão para lúmen; análise subjetiva; espessamento focal > 50% da EIMC ao redor ou >1,5 mm; entre outras. Além disso, considerar apenas presença ou ausência de placa carotídea pode ser simplista demais frente à diversidade dos fenótipos de placa (calcificada, não calcificada, focal etc.). 153 Desse modo, o ultrassom doppler de carótidas em portadores de HF assintomáticos para avaliação da EIMC e pesquisa de placa carotídea pode ser considerado para otimizar sua estratificação de risco cardiovascular (classe IIb, nível de evidência B).
5.8. Pesquisa de Isquemia Miocárdica
A pesquisa de isquemia miocárdica com teste ergométrico é indicada em indivíduos que iniciarão atividade esportiva de alta intensidade e/ou competitiva. Estudo prévio com 639 portadores de HFHe diagnosticados por critério clínico encontrou 9% de testes positivos para isquemia miocárdica. Ele também demonstrou que parâmetros do teste ergométrico, como menor capacidade de exercício, atraso na redução da frequência cardíaca no primeiro minuto da recuperação e aumento no pico da pressão de pulso, foram preditores de eventos coronarianos. 154 Outro estudo com 194 indivíduos com HF detectou 21% de testes ergométricos positivos. 155
Apesar de não haver estudos randomizados com teste ergométrico na HF e de os poucos que existem utilizarem critério diagnóstico clínico, a realização de teste ergométrico periodicamente na HFHe pode ser útil para os indivíduos assintomáticos que desejam iniciar atividade física recreativa ou competitiva, bem como para aqueles que apresentam fatores de risco adicional para doença coronariana ou com início de tratamento hipolipemiante tardio, podendo ser repetido a cada 3 a 5 anos (classe IIb, nível de evidência C). Com base nessas informações, podem ser considerados fatores ou marcadores adicionais de risco em portadores de HF os apresentados na Tabela 3 .
Tabela 3. Fatores/marcadores de risco cardiovascular na hipercolesterolemia familiar.
| Fator/marcador de risco | Grau de recomendação | Nível de evidência |
|---|---|---|
| Diabetes melito | I | B |
| Hipertensão arterial sistêmica | I | B |
| Tabagismo | I | B |
| História familiar de DAC prematura em parentes de 1º grau (homens < 55 anos e mulheres < 60 anos) | I | B |
| Início de tratamento hipolipemiante após os 40 anos de idade | IIa | B |
| HDL-c < 40 mg/dl | I | B |
| Lipoproteína (a) > 50 mg/dL (ou > 125 nmol/L) | IIa | B |
| Xantoma de tendão de Aquiles | IIb | B |
| Escore de cálcio > 100 UA ou > percentil 75 | IIa | B |
| Presença de placa aterosclerótica com obstrução > 50% em qualquer território arterial | IIa | C |
DAC: doença arterial coronariana; HDL-c: colesterol da lipoproteína de alta densidade.
5.9. Como Fazer a Estratificação de Risco Cardiovascular dos Pacientes com Hipercolesterolemia Familiar na Prática Clínica
Conforme discutido previamente, os pacientes com HF apresentam elevado risco de evento cardiovascular na prevenção primária, comparados aos não portadores da doença. Contudo, a presença dos fatores de risco clássicos para DAC aumenta mais ainda esse risco, o que acaba por contribuir para a sua heterogeneidade. Mesmo no cenário da prevenção secundária, existe evidência de que o risco de recorrência de evento cardiovascular é mais do que duas vezes maior na HF após evento-índice, quando comparado ao não portador de HF. 156
Santos et al. 56 consideraram os portadores de HF de acordo com a presença de fatores de risco adicionais: idade > 40 anos e sem tratamento, tabagismo, sexo masculino, lipoproteína (a) > 50 mg/dl (ou > 125 nmol/L), HDL-c < 40 mg/dL, hipertensão arterial, diabetes melito, história familiar de DAC prematura em parentes de 1o grau (homens < 55 anos e mulheres < 60 anos), doença renal crônica (taxa de filtração glomerular [TFG] < 60 ml/min) e IMC > 30 kg/m2 –, que caracterizam situação de maior risco.
Com base na presença de doença aterosclerótica manifesta ou subclínica significativa, fatores de risco adicionais, LDL-c muito elevado, os indivíduos portadores de HF poderão ser classificados em três categorias de risco, conforme a seguir. 132
5.9.1. Muito Alto Risco
Quando diante de doença aterosclerótica clinicamente manifesta, assim definida como: infarto prévio do miocárdio, angina pectoris , revascularização miocárdica prévia, acidente vascular isquêmico ou transitório ou claudicação intermitente.
Na presença de doença subclínica aterosclerótica avançada diagnosticada com: escore de cálcio superior a 100 UA ou 75% do percentil para a idade e sexo, ou angiotomografia computadorizada coronariana apresentando obstruções coronárias em mais de 50% ou a presença de placas não obstrutivas em mais de um vaso.
5.9.2. Alto Risco
Na prevenção primária da HFHe, com LDL-c > 400 mg/dl, mesmo sem fatores de risco.
Na prevenção primária da HFHe, mas com fatores adicionais de risco.
Obs.: se o LDL-c for > 310 mg/dl com uma das situações de alto risco; LDL-c > 190 mg/dl com duas das condições de alto risco.
5.9.3. Risco Intermediário
Na prevenção primária da HFHe, sem fatores adicionais de risco.
6. Recomendações Nutricionais
O seguimento de padrão alimentar saudável é fundamental no tratamento da HF, uma vez que a dieta inadequada pode amplificar o risco cardiovascular já estabelecido nesses pacientes. 157 A última diretriz para o tratamento dietético da doença, elaborada em conjunto com o American College of Cardiology (ACC), a American Heart Association (AHA) e outras sociedades americanas, 53 é embasada na diretriz publicada por essas mesmas sociedades em 2013. 158 Recomenda-se o seguimento de padrões alimentares saudáveis, com valor calórico adequado, exclusão de ácidos graxos Trans , adequação de ácidos graxos saturados (SAT) e estímulo ao consumo de ácidos graxos monoinsaturados (MONO) e poli-insaturados (POLI) em quantidades adequadas. 158 As ações desses ácidos graxos sobre o colesterol plasmático foram exaustivamente avaliadas em diversos estudos experimentais, clínicos e epidemiológicos. 158,159 Muitos dos resultados controversos encontrados foram devido às diferenças quanto à duração dos estudos, ao tamanho da amostra e ao tipo de nutriente utilizado para comparação. 132 Além disso, os diferentes ácidos graxos são provenientes de diversas matrizes alimentares, como carnes, leite, óleos ou alimentos industrializados, podendo, assim, induzir efeitos distintos sobre os lípides do plasma. 160
Nos últimos anos, o tipo de alimento consumido tem sido mais valorizado que o nutriente utilizado isoladamente. Desse modo, padrões alimentares como a dieta do Mediterrâneo 161,162 e a dieta DASH, 163 que contemplam a inclusão de alimentos como grãos, frutas, hortaliças, carnes magras, produtos lácteos com menor teor de gorduras e frutas oleaginosas (nozes e castanhas), passaram a ser recomendados pelas principais diretrizes internacionais. Além disso, indica-se para o preparo dos alimentos o uso moderado de óleos vegetais ricos em POLI (ômega 3 e ômega 6) e MONO (ômega 9). 53 A recomendação deles no preparo dos alimentos é evidenciada em dois importantes estudos. O recente Cohorts for Heart and Aging Research in Genomic Epidemiology (CHARGE) mostrou que a concentração plasmática e tecidual de biomarcadores de ácidos graxos ômega 6 associou-se a menos eventos cardiovasculares. 164 O mesmo resultado foi observado com biomarcadores plasmáticos das séries ômega 3 e ômega 6, que se associaram a menor risco cardiovascular. 165
A Diretriz da European Society of Cardiology (ESC), elaborada em conjunto com a European Atherosclerosis Society (EAS), 132 reitera essas recomendações e adverte que alimentos como óleo de palma, óleo de coco, bacon, biscoitos, produtos de panificação ricos em gordura e produtos lácteos integrais devem ser consumidos ocasionalmente e em quantidades mínimas por indivíduos com HF. 53
6.1. Colesterol Alimentar
Nos últimos anos, tanto as diretrizes da AHA 53,158 como o Guia Alimentar Americano (2015-2020) 166 não mais estabelecem limite máximo de consumo de colesterol, em razão das poucas evidências associando sua ingestão a doença ateroslerótica 167 e DAC. 168 Apesar disso, no Guia Alimentar Americano, é sugerida a importância de considerar o colesterol da dieta no sentido de estabelecer padrões alimentares saudáveis, o que vai ao encontro das recomendações do Instituto de Medicina, 169 que ressaltaram o benefício do baixo consumo de colesterol.
O colesterol alimentar apresenta menor ação hipercolesterolêmica quando comparado aos ácidos graxos saturados, razão pela qual os guias alimentares enfatizaram suas orientações para redução do consumo desse ácido graxo. Assim, a diminuição de saturados de origem animal garante menor taxa de colesterol, uma vez que ambos se encontram nos mesmos alimentos. De modo geral, o balanço entre ingestão e síntese endógena de colesterol é responsável pela homeostase da colesterolemia; 170 entretanto, o aumento da sua ingestão pode contribuir significativamente para a elevação da concentração plasmática de LDL-c, 171 resposta sujeita a grande variabilidade interpessoal, dependente de fatores metabólicos e genéticos. 170,172,173
De fato, a Diretriz 2018 AHA/ACC/Guideline on the Management of Blood Cholesterol, que referencia o mesmo documento publicado em 2014, informa não haver evidência para determinar se a redução do colesterol alimentar reduz o LDL-c. 158
Os estudos observacionais e as meta-análises que avaliaram a influência do colesterol da dieta no risco de desenvolvimento de diabetes tipo 2, DAC e AVE não são claros, 168,171,173-177 ou mostram ausência de associação com DCV e mortalidade. 178 No entanto, uma pesquisa que avaliou o banco de dados dos estudos Atherosclerosis Risk in Communities (ARIC), Coronary Artery Risk Development in Young Adults (CARDIA), Framingham Heart Study (FHS), Framingham Offspring Study (FOS), Jackson Heart Study (JHS) e Multi-ethnic Study of Atherosclerosis (MESA) mostrou que o aumento do consumo de colesterol está ligado de forma dose-dependente ao aumento de DCV e de mortalidade total, 179 possivelmente em razão de seu impacto nas concentrações de LDL-c. 180
Com relação ao ovo, apesar de ser fonte de colesterol, é também altamente nutritivo, com perfil excelente de proteínas de alto valor biológico, vitaminas e minerais, além de grande viabilidade econômica. Diante de tais qualidades nutricionais, recomenda-se sua inclusão na dieta, desde que integrante de um padrão alimentar saudável.
O aumento de mortalidade e de eventos cardiovasculares em decorrência de maior consumo de colesterol total e de ovo é independente da qualidade da dieta consumida. Portanto, recomenda-se moderação no consumo de ovos e outras fontes de colesterol, 179 especialmente entre indivíduos com maior concentração de lipídios plasmáticos e entre aqueles hiper-responsivos ao consumo de colesterol.
6.2. Ação dos Ácidos Graxos sobre a Colesterolemia
6.2.1. Saturados
Os ácidos graxos classificam-se em SAT, MONO, POLI ou Trans e influenciam de forma distinta a concentração plasmática de colesterol total e LDL-c. Dentre os principais ácidos graxos saturados presentes nos alimentos em geral, têm-se: láurico (12:0), mirístico (14:0), palmítico (16:0) e esteárico (18:0), mas apenas o palmítico é encontrado amplamente na natureza. O óleo de coco é fonte exuberante dos ácidos láurico e mirístico, enquanto as carnes apresentam conteúdo elevado de palmítico, e o leite, de esteárico e mirístico. Produtos de origem vegetal, como a palma e o cacau, também apresentam, de forma respectiva, conteúdo elevado dos ácidos graxos palmítico e esteárico. 181,182 Os ácidos graxos pentadecílico (15:0) e magárico (17:0) são encontrados, em pequena quantidade, em derivados lácteos, e a sua concentração plasmática é um marcador de consumo deles. 183,184 Além disso, os alimentos também fornecem ácidos graxos de cadeia mais longa, como araquídico (20:0), behênico (22:0) e lignocérico (24:0), os quais são encontrados em frutas oleaginosas, como amendoim e macadâmia. 185,186
Diversos estudos clínicos e epidemiológicos mostraram aumento do risco cardiovascular com maior consumo de SAT, 186-188 por induzirem aumento nas concentrações plasmáticas de colesterol total e LDL-c. 159 Vários mecanismos foram propostos para justificar essa ação, como: (a) apresentam cadeia retilínea de carbono, empacotando-se no centro das lipoproteínas, o que possibilita a acomodação de maior quantidade de colesterol; 189 (b) em associação ao colesterol, SAT reduz a atividade, a proteína e o mRNA do LDLR, 190-192 alteração que diminui a metabolização das partículas de LDL. 193,194
A Organização Mundial da Saúde (OMS) publicou uma revisão sistemática de estudos clínicos (consumo médio de SAT: 9,8%) e mostrou que a substituição isocalórica de ácidos graxos saturados por POLI ou MONO reduziu as concentrações plasmáticas de colesterol total e de LDL-c. 159 Além disso, foi demonstrado que a substituição de carboidratos por ácido palmítico, mirístico ou láurico também induziu uma elevação dos mesmos parâmetros lipídicos, efeito não observado com ácido esteárico. Isso reforça a afirmação de que ácidos graxos saturados se comportam diferentemente em relação ao seu efeito sobre os lipídios plasmáticos. O ácido esteárico não eleva o colesterol do plasma porque é rapidamente convertido a ácido oleico sob ação da enzima hepática Stearoil CoA Dessaturase 1 (SCD1). 195
O estudo Prospective Urban Rural Epidemiology (PURE) 196 avaliou a dieta de 135.000 pessoas em 18 países, mostrando que o maior consumo de gorduras (35% das calorias) está relacionado com menor mortalidade, em comparação com o menor consumo (10% das calorias). Vale ressaltar que esse percentual de gorduras está dentro da faixa de recomendação (25 a 35% do valor calórico total, VCT) que vem sendo preconizada nas últimas décadas, e que a mediana do consumo variou entre 2,8 e 13,2% das calorias. Nesse estudo, foi demonstrado que o aumento do consumo de SAT associou-se à elevação do LDL-c. 196
Uma revisão sistemática publicada pela Biblioteca Cochrane em 2015, que avaliou os dados de estudos clínicos randomizados, totalizando 59.000, mostrou que a diminuição do consumo de saturados em relação à dieta habitual reduziu em 17% os eventos cardiovasculares. 197 Além disso, os resultados evidenciaram redução dos mesmos eventos em 27% quando SAT é substituído por POLI.
Se determinados ácidos graxos saturados relacionam-se com maior risco cardiovascular, outros apresentam associação inversa, como o pentadecílico (15:0) e o magárico (17:0), 183 bem como aqueles de cadeia muito longa, como lignocérico, behênico e araquídico. 185
Assim, recomenda-se consumo de até 10% das calorias na forma de ácidos graxos saturados, com limite de 7% para indivíduos hipercolesterolêmicos, de acordo com a ESC/EAS 2019 132,158 e o ACC/AHA.
6.2.2. Insaturados
O principal ácido graxo monoinsaturado é o ácido oleico (18:1), cujas fontes são azeite de oliva, óleo de canola e frutas e sementes oleaginosas. Os ácidos graxos poli-insaturados da série ômega 6 são: o linoleico (18:2), encontrado nos óleos de milho, girassol, soja e canola, e o araquidônico (20:4), presente em ovos, óleo de peixe e carne. 198 Os ácidos graxos da série ômega 3 podem ser de fonte vegetal ou animal, sendo o α -linolênico (18:3) encontrado nos óleos vegetais, como de linhaça, canola e soja, e o eicosapentaenoico (20:5) e docosa-hexaenoico (20:6) encontrados em peixes de águas muito frias.
Em substituição aos saturados, os MONO e POLI não elevam a concentração plasmática de colesterol e de LDL-c, um benefício que parece ser maior com POLI, uma vez que ácidos graxos monoinsaturados exibem ação neutra sobre a colesterolemia. 158
6.2.3. Ácidos Graxos Ômega 3
Diversos estudos clínicos mostram que a suplementação com doses farmacológicas (2 a 4 g) de ácidos graxos eicosapentaenoico (EPA) e docosahexaenoico (DHA) ao dia pode diminuir as concentrações plasmáticas de triglicerídeos em até 25 a 30%, além de aumentar discretamente as de HDL-c (1 a 3%). Pode também elevar as concentrações de LDL-c em até 5 a 10%, com pouca ou nenhuma diferença sobre o colesterol total sérico. 199-202
No entanto, quando utilizadas formulações contendo exclusivamente ácidos graxos ômega 3 purificados, esse aumento de LDL-c pode não ocorrer, conforme demonstrado no Japan EPA Lipid Intervention Study (JELIS). 203,204 Pesquisas sobre o efeito do ômega 3 em pacientes com HF ainda são muito escassas, e parece que sua suplementação pode influenciar a progressão da aterosclerose nesses pacientes de alto risco, carecendo de mais investigação. 205-207
6.2.4. Ácidos Graxos Trans
O consumo de ácidos graxos Trans presentes nos alimentos industrializados aumenta o risco cardiovascular porque induz um perfil lipídico aterogênico por elevar a concentração plasmática de LDL-c, diminuir o catabolismo de Apo B, 208 reduzir o HDL-c e induzir aumento do catabolismo da Apo A-I. 209 Além disso, os ácidos graxos Trans aumentam a gravidade das lesões ateroscleróticas na DAC 209 e induzem disfunção endotelial. 210
Os resultados de estudos controlados discutidos em uma meta-análise mostraram que, a cada 1% de substituição das calorias de Trans por saturados, poli-insaturados ou monoinsaturados, houve redução da razão Col/HDL, respectivamente, em 0,31, 0,54 e 0,67. 211 Já a avaliação dos estudos prospectivos da mesma pesquisa revelou que, a cada 2% de substituição de Trans pelos demais ácidos graxos, diminui em 17% o risco de DAC. 211 Posteriormente, demonstrou-se que o maior consumo de Trans observado em um período de 10 anos em diversos países está associado a um aumento de 4% na mortalidade por doença coronariana. 212 Em outro estudo, foi avaliada a taxa de mortalidade atribuída à dieta em 195 países, e observou-se considerável número de mortes por causa cardiovascular atribuídas ao consumo de ácidos graxos Trans . 213 Além dos efeitos adversos sobre o metabolismo lipídico, o Trans é capaz de induzir perfil pró-inflamatório, agravando ainda mais os seus efeitos deletérios. 214 Por todas as suas ações adversas, os ácidos graxos Trans utilizados em alimentos industrializados devem ser excluídos da dieta. 53,158,208,213,215
6.2.5. Fitosteróis
Os fitosteróis, fitostanóis e seus ésteres são componentes bioativos presentes em alimentos vegetais, cuja estrutura química é muito similar à do colesterol. 216 Seu efeito hipocolesterolemiante está bem documentado na literatura científica. Após incorporação às micelas, os fitosteróis são transportados para o interior do enterócito via proteína transportadora NPC1-L1, e, sequencialmente, a maior parte retorna ao lúmen intestinal por meio dos transportadores ABCG5/ABCG8, 217 mantendo baixas as suas concentrações plasmáticas. O mecanismo de redução da concentração plasmática de colesterol total e LDL-c é explicado pela maior solubilidade dos fitosteróis nas micelas, o que desloca colesterol, promovendo sua excreção. O consumo médio de fitosterol na população é de 100 a 400 mg/dia, mas um estudo brasileiro revelou um consumo médio de 160 mg/dia. 218 Já se demonstrou que a suplementação diária de 2 g de fitosteróis reduz as concentrações plasmáticas de LDL-c entre 8 e 10%. 217,219 Apesar do seu efeito pequeno sobre a redução da colesterolemia, a diretriz atual do ESC/EAS 53 indica que seu uso pode ser benéfico para adultos e crianças com elevação moderada de colesterol. 217 Entretanto, é importante salientar que nem todos os indivíduos respondem igualmente ao uso de fitosteróis; portanto, sua eficácia deve ser avaliada individualmente. 220
Os fitosteróis podem ser administrados por meio de cápsulas contendo entre 650 e 900 mg ou creme vegetal; duas colheres de sopa fornecem a dose recomendada. Seu uso deve ser acompanhado de alimentação e hábitos de vida saudáveis para obtenção dos efeitos almejados. O consumo do fitosterol junto das refeições principais parece ser a melhor opção, em razão do mecanismo de ação de competição na absorção do colesterol da dieta. 221
Em pacientes portadores de HF, o uso de fitosterol pode auxiliar no alcance de metas para o LDL-c, quando usado em associação com estatina/ezetimiba. 222 Dados de meta-análise sobre o efeito dos fitoesteróis em crianças demonstraram redução do colesterol total (7 a 11%) e do LDL-c (10 a 15%). 223 De acordo com o Expert Panel on Integrated Guidelines for Cardiovascular Health and Risk Reduction in Children and Adolescents , a suplementação de fitosteróis (2 g/dia) pode ser boa opção para crianças e adolescentes com HF que ainda não podem receber tratamento farmacológico, 224 pois eles são bem tolerados e não apresentam efeitos adversos significativos. No Brasil, os fitosteróis são aprovados para uso pediátrico a partir dos 5 anos de idade; porém, poucos estudos testaram o seu uso na gestação e lactação, sendo recomendada cautela nesses casos. 225 É importante salientar que seu uso é contraindicado para os portadores de sitosterolemia.
6.2.6. Fibras
O consumo alimentar de fibras parece estar associado à redução significativa do colesterol total, por meio de mecanismos que envolvem: 1) redução da absorção de colesterol induzida pela viscosidade; 226 2) aumento da excreção fecal de colesterol e ácido biliar, 227 induzindo maior atividade da 7 α -hidroxilase, 228 enzima-chave na formação de ácidos biliares a partir de colesterol; 229 3) redução da atividade da 3-hidroxi-3- metilglutaril coenzima A (HMG-CoA) redutase; 230 4) redução do conteúdo hepático de colesterol; 231 5) alteração da composição da microbiota intestinal, levando a maior produção de ácidos graxos de cadeia curta e aumento da excreção de esteroides neutros e ácidos biliares; 232 ou mesmo associação entre os mecanismos descritos.
Uma meta-análise de estudos que investigaram o efeito do consumo de fibra solúvel ( β -glucana) sobre lipídios plasmáticos verificou que a sua ingestão (> 3 g/dia) promoveu modesta redução das concentrações plasmáticas de colesterol total e LDL-c (11,6 e 9,6 mg/dl, respectivamente, em relação ao controle), sem efeito em HDL-c e triglicerídeos. 233 Revisão sistemática da Biblioteca Cochrane 234 avaliou o efeito das fibras na prevenção primária de DCV e observou redução de colesterol total e LDL-c (7,7 e 8,5 mg/dl, respectivamente) devido ao aumento do consumo de fibras. Todavia, os autores ressaltam que estudos de coorte randomizados, bem conduzidos e com maior tempo de duração são fundamentais para se determinar com segurança o efeito das fibras na saúde cardiovascular. 234
Em consonância com a atual diretriz do ESC/EAS, 53 recomenda-se uma dieta rica em fibras, especialmente solúveis. Elas estão presentes em legumes, frutas, verduras e grãos integrais, contemplando um padrão alimentar saudável.
6.2.7. Soja
Os resultados controversos dos estudos que avaliaram a ação da suplementação de proteína de soja, livre de gorduras, com ou sem isoflavonas, sobre as concentrações plasmáticas de colesterol total e LDL-c podem, em parte, ser atribuídos às diferentes metodologias utilizadas nos estudos, à presença de outras substâncias, como fibras e fosfolipídios e à utilização de diferentes concentrações de proteína de soja ou isoflavonas. 235,236 As evidências sugerem ser a proteína da soja a responsável pela modesta redução alcançada (~3%) nas concentrações plasmáticas de colesterol, e não a isoflavona isolada. 237 De toda forma, não há evidência para a indicação de suplementos de isoflavona no tratamento da hipercolesterolemia. No entanto, produtos derivados de soja têm baixas concentrações de saturados e são ricos em fibras, vitaminas, minerais e ácidos graxos insaturados, podendo fazer parte de um plano alimentar saudável.
6.2.8. Chocolate
O cacau é extraído da semente do cacaueiro (Theobromacacao L.), originário principalmente da América do Sul e Costa Oeste da África. O chocolate é obtido a partir da mistura de derivados de cacau (massa de cacau, cacau em pó ou manteiga de cacau) com outros ingredientes, como açúcar, leite, lecitina, castanhas e frutas. Desse modo, além de ter alta densidade calórica, ele é também rico em gorduras e açúcares. Cerca de 60% da gordura do cacau é constituída pelos ácidos graxos saturados esteárico e palmítico, e aproximadamente 30% estão sob a forma de ácido oleico. Os poli-insaturados compreendem em torno de 3 a 5% dos ácidos graxos presentes no cacau. 238 Já está descrito que o alto consumo de saturados eleva as concentrações plasmáticas de colesterol; entretanto, os resultados de duas meta-análises mostraram que o chocolate, rico em cacau (escuro), parece não exercer ação hipercolesterolêmica, 239,240 possivelmente pelo fato de o esteárico, principal ácido graxo do cacau, ser rapidamente convertido a ácido oleico por meio da ação da SCD1 no fígado. 241 Contudo, é importante ressaltar que o chocolate pode ser importante fonte de açúcar simples e calorias; por isso, seu consumo deve ser orientado com cautela, de modo que não contribua para o ganho de peso. Além disso, o chocolate é normalmente produzido com outras fontes de gorduras.
6.2.9. Óleos Tropicais
6.2.9.1. Óleo de Coco
O óleo de coco ( Coco nucifera ) é composto principalmente por gordura saturada (82%), da qual 42% estão sob a forma de ácido láurico, 16% como mirístico, 9% como palmítico, e o restante é composto por caprílico, cáprico e esteárico. 242 O óleo de coco contém baixa concentração de insaturados e não apresenta o ácido graxo essencial α -linolênico (18:3). 181,243 Quando comparado ao consumo de óleo de oliva 244 e cártamo, 245 o óleo de coco aumenta as concentrações plasmáticas de colesterol total e LDL-c. Estudo em indivíduos normolipidêmicos habitantes do Sri Lanka evidenciou que a substituição isocalórica do óleo de coco por óleo de soja reduziu as concentrações plasmáticas de colesterol total, LDL-c e triglicerídeos. 246 Resultados semelhantes foram observados em indivíduos dislipidêmicos, com substituição do óleo de coco por óleo de milho. 247 O aumento das concentrações de HDL-c observado com o consumo de óleo de coco foi acompanhado de elevação concomitante de LDL-c, um dos principais fatores de risco cardiovascular. 248
Além disso, por ser rico em ácido láurico, 249 o óleo de coco pode acionar vias de sinalização inflamatória, por meio da ativação de receptores ligados à resposta imune inata, os toll-like receptors (TLR). 249-251 Estudo em macrófagos observou que o ácido láurico aumentou a expressão de ciclo-oxigenase 2 (COX 2) por meio da ativação das vias NF- κ B/TLR 2 e 4. 252 Com relação à capacidade oxidativa, não foi observada diferença no metabolismo energético e oxidação lipídica ao se comparar o efeito agudo do consumo de óleo de coco ou azeite de oliva em mulheres com sobrepeso. 253
6.2.9.2. Óleo de Palma
Apesar de se tratar de óleo vegetal, cerca de 50% do óleo de palma é composto por ácidos graxos saturados (45% de palmítico e 5% de esteárico), e o restante, por insaturados (40% oleico e 10% linoleico). Com isso, sua maior ingestão, seja adicionado ao preparo de alimentos ou por meio do consumo de produtos industrializados, eleva as concentrações de saturados na dieta. O consumo de óleo de palma, quando comparado ao de óleos vegetais ricos em insaturados, aumenta as concentrações plasmáticas de colesterol total e LDL-c. 254 Resultados de meta-análise que comparou o consumo de óleo de palma ao de óleos vegetais, como de canola, soja e oliva, mostraram que o óleo de palma elevou as concentrações de colesterol total, LDL-c e HDL-c, este último de forma modesta. 255 Isso mostrou que, em relação aos lipídios plasmáticos, o óleo de palma se comporta de maneira análoga às gorduras de origem animal, a qual é rica em saturados. 255,256 Sendo assim, seu consumo deve ser mantido dentro do percentual de recomendação de consumo de saturados.
Até o momento, em linha com diretrizes do ACC/AHA 158 e da ESC/EAS, 53 o uso dos óleos tropicais em substituição aos óleos vegetais ricos em ácidos graxos insaturados não é indicado.
6.2.10. Lácteos
O leite e seus derivados são importantes fontes de cálcio e proteína de alto valor biológico. Contudo, o consumo dos integrais eleva a ingestão de ácidos graxos saturados, especialmente mirístico, que apresenta forte correlação com o aumento da concentração plasmática de colesterol. 159 Entretanto, no estudo MESA, o consumo de lácteos foi associado a redução do risco cardiovascular 183 e não se associou ao aumento do risco de AVE. 257 Mais recentemente, dados do estudo European Prospective Investigation into Cancer and Nutrition (EPIC) – Italy, conduzido em 45.009 indivíduos com seguimento de 14,9 anos, mostraram que o consumo de 160 mL a 200 mL de leite está ligado a menor mortalidade por todas as causas, mas esse benefício se perde com ingestão superior a 200 mL. 258 No mesmo estudo, demonstrou-se que o consumo de leite desnatado está relacionado com menor mortalidade por causa cardiovascular.
6.2.11. Manteiga
Em uma porção de manteiga (10 g), cerca de 51,5% dos ácidos graxos encontram-se sob a forma de saturados, com predomínio de palmítico (24%), esteárico (10%), mirístico (8%) e láurico (2%). Já os monoinsaturados contribuem com cerca de 22% dos ácidos graxos da manteiga, e os insaturados, com apenas 1,5%. 259
Um estudo randomizado demonstrou que o consumo de manteiga aumentou as concentrações plasmáticas de colesterol total, LDL-c e Apo B, comparado ao consumo do mesmo percentual de insaturados. 260 O estudo de coorte Multi-Ethnic Study of Atherosclerosis (MESA), que acompanhou por 20 anos cerca de 6.800 indivíduos não diabéticos, sem DCV prévia, 181 o maior consumo de manteiga (até 5 g/dia) não se associou a DCV. Estudo conduzido em idosos mostrou resultado semelhante. 261 O consumo de manteiga foi ainda inversamente associado à incidência de diabetes melito 2 em estudo de coorte prospectivo. 262 Seu efeito foi avaliado em revisão sistemática de estudos de coorte de alto grau de evidência, o qual mostrou que o consumo médio de 14 g/dia não se associou a riscos de DCV. 263
O uso de manteiga deve respeitar as recomendações de consumo de saturados, permanecendo menos de 10% do VCT e ainda mais reduzido (menos de 7%) para pessoas com hipercolesterolemia (EAS/ESC 2019). 53 Além disso, a fim de evitar ganho de peso e desenvolvimento de obesidade, é preciso levar em consideração as calorias contidas no produto, cujo consumo deve estar inserido em padrão alimentar saudável, rico em frutas, verduras, legumes e grãos integrais. 53
6.3. Recomendações de Consumo Alimentar no Controle da Hipercolesterolemia Familiar
As recomendações de consumo alimentar em pacientes com hipercolesterolemia familiar são apresentadas na Tabela 4 .
Tabela 4. Recomendações de consumo alimentar no controle da hipercolesterolemia familiar.
| Recomendação | Grau de recomendação | Nível de evidência |
|---|---|---|
| Seguimento de padrão alimentar saudável: adequação calórica, inclusão de grãos, frutas, hortaliças, carnes magras e produtos lácteos com menor teor de gorduras | I | A |
| Colesterol alimentar: < 300 mg/dia | IIa | A |
| Ácidos graxos saturados: < 7% do VCT | I | A |
| Ácidos graxos Trans: deve ser excluído da dieta | III | A |
| Chocolate: quando rico em cacau, não está relacionado com o aumento do colesterol | I | B |
| Óleos tropicais: consumo ocasional, em porções mínimas | III | B |
| Ovo: consumo moderado, não excedendo as recomendações diárias de colesterol | IIa | A |
| Fitosterol: 2 g/dia proporciona redução moderada do colesterol (↓~10%) | I | A |
| Fibras: redução do colesterol total e LDL-C (↓~5%) | I | A |
VCT: valor calórico total; LDL-c: colesterol da lipoproteína de baixa densidade.
7. Tratamento Farmacológico da Hipercolesterolemia Familiar Heterozigótica
O tratamento dos portadores de HF grave é um ponto crucial. Considerando-se as complicações oriundas da evolução da doença e da precocidade com que algumas delas ocorrem, deve ser iniciado o mais rápido possível após o diagnóstico. O conceito do colesterol cumulativo ao longo da vida justifica essa abordagem.
7.1. Metas Terapêuticas para o LDL-c
É fundamental considerar a existência de condições de alto risco, assim discriminadas: idade superior a 40 anos sem tratamento prévio, tabagismo, sexo masculino, Lp (a) maior que 50 mg/dL (> 125 nmol/L), HDL-c < 40 mg/dL, percentil do escore de cálcio coronário (CAC) calculado pelo critério do MESA.
Dessa maneira, foi proposto que as metas para tratamento do LDL-c sejam assim contempladas: para HF de alto risco, LDL-c > 400 mg/dL ou LDL-c > 310 mg/dL com uma das situações de alto risco anteriormente descritas, * ou LDL-c > 190 mg/dL com duas das condições de alto risco. 56 ** Dessa forma, deve-se buscar reduzir o LDL-c em pelo menos 50%, sendo ideal a meta de LDL-c < 70 mg/dL.
Assim, o risco cardiovascular e as metas lipídicas são avaliados de acordo com a presença de DASCV, fatores de risco maiores ou níveis basais de LDL-c, e classificados conforme a seguir.
7.1.1. Metas Terapêuticas no Muito Alto Risco
Quando diante de doença aterosclerótica clinicamente manifesta, assim definida quando houver infarto prévio do miocárdio, angina pectoris , revascularização miocárdica prévia, acidente vascular isquêmico ou transitório ou claudicação intermitente, devem ser consideradas reduções de no mínimo 50%, sendo ideal obter valores de LDL-c < 50 mg/dL. 132
Na presença de doença subclínica aterosclerótica avançada, diagnosticada como CAC superior a 100 UA ou 75% do percentil para idade e sexo, ou angiotomografia computadorizada coronariana apresentando obstruções coronárias > 50% ou a presença de placas não obstrutivas em mais de um vaso, deve-se buscar reduzir o LDL-c em ao menos 50%, sendo o ideal atingir níveis < 50 mg/dL.
7.1.2. Metas Terapêuticas no Alto Risco
Na prevenção primária da HFHe com LDL-c > 400 mg/dL, mesmo sem fatores de risco, deve-se buscar reduzir o LDL-c em ao menos 50%, sendo ideal chegar a níveis < 70 mg/dL.
Na prevenção primária da HFHe com fatores adicionais de risco, 56 devem ser consideradas reduções de no mínimo 50%, sendo ideais os valores de LDL-c < 70 mg/dL. 132
Obs.: Se LDL-c for > 310 mg/dL com uma das situações de alto risco; LDL-c > 190 mg/dL com duas das condições de alto risco. 56
7.1.3. Metas Terapêuticas no Risco Intermediário
Na prevenção primária da HFHe sem fatores adicionais de risco, 1 devem ser consideradas reduções de no mínimo 50%, sendo ideais valores de LDL-c < 100 mg/dL. É preciso reavaliar periodicamente para verificar a instalação de fatores de risco.
7.2. Tratamento Farmacológico
7.2.1. Estatinas
As estatinas – inibidores da hidroximetilglutaril-coenzima A redutase – são os fármacos de primeira escolha no tratamento da HFHe. Mesmo na ausência de evidências científicas de estudos que tenham avaliado o benefício do uso de estatinas exclusivamente em pacientes HFHe, é plenamente reconhecida a contribuição dos pacientes com HFHe para o entendimento atual do metabolismo do LDL-c e a sua expressiva participação nos grandes ensaios clínicos 264 (grau de recomendação: I; nível de evidência: C).
Os objetivos terapêuticos recomendados aos portadores de HFHe, enquanto pacientes classificados como de alto e muito alto risco, são reduções percentuais ≥ 50% nos níveis de LDL-c prévios ao tratamento, e o alcance das metas preconizadas de acordo com o risco estratificado. Na HFHe, as estatinas de alta intensidade, como rosuvastatina e atorvastatina, nas doses máximas toleradas são as opções preferenciais e devem ser utilizadas (grau de recomendação: I; nível de evidência: A). 53
São propriedades farmacológicas desejáveis das estatinas: inibição enzimática potente e reversível, seletividade pelos hepatócitos, baixa biodisponibilidade para reduzir efeitos adversos sistêmicos, meia-vida de eliminação prolongada e mínimo ou nenhum metabolismo hepático para evitar interações droga-droga. Seu mecanismo de ação se dá pela inibição enzimática, que, ao reduzir a síntese endógena do colesterol intra-hepático, promove o estímulo à síntese e expressão dos receptores de LDL-c, aumentando a captação do LDL pelos hepatócitos, diminuindo as concentrações plasmáticas. 22
O tratamento com estatinas demonstrou reduzir eventos isquêmicos coronários, necessidade de revascularização do miocárdio, AVE e mortalidade por causas cardiovasculares em todos os subgrupos, incluindo aqueles com aterosclerose manifesta, diabéticos, hipertensos, idosos e mulheres, diminuindo ainda a mortalidade total em pacientes de alto e muito alto risco cardiovascular (grau de recomendação: I; nível de evidência: A). Esses benefícios são atribuídos à redução dos níveis de LDL-c e considerados um efeito da classe terapêutica. 52
As estatinas são seguras, apresentando como efeito colateral mais frequente a mialgia, com ou sem elevação da creatinoquinase (CK). Rabdomiólise é a ação adversa mais grave e a mais rara, cujo risco se incrementa quando da associação aos fibratos. A frequência de efeitos adversos é proporcional às doses utilizadas. 265
Quando a eficácia não é suficientemente obtida com o uso de estatina isolada, a possibilidade de se incrementarem as reduções do LDL-c pode ser contemplada com a associação de outras terapias adjuvantes.
7.2.2. Terapia Adjuvante às Estatinas
Pacientes com HF são considerados de alto risco cardiovascular, e estatinas potentes em altas doses permanecem como o pilar no tratameto da dislipidemia e na terapêutica para redução do risco destes pacientes. 266-269 Entretanto, a maioria dos pacientes com HF permanecerá fora das metas, apesar da máxima terapêutica tolerada com estatina. Em um estudo transversal de 1.249 pacientes com HFHe confirmada na Holanda, país com a maior taxa de diagnóstico de HF, apenas 21% apresentavam LDL-c < 100 mg/dl, embora 96% dessa amostra estivessem em uso de estatina. 270 Portanto, frequentemente será necessária a adição de um ou mais hipolipemiantes que não a estatina para alcançar as metas desejadas. 271
7.2.2.1. Ezetimiba
A ezetimiba reduz seletivamente a absorção intestinal do colesterol dietético e biliar, agindo no transportador Niemann-Pick C1-Like 1 (NPC1L1) no enterócito. Após a ingestão de ezetimiba, ocorre rápida absorção (2 a 3 horas), e no fígado sofre um processo de glicuronidação, transformando-se em glicuronídeo ativo que se localiza na borda do enterócito e retorna à circulação entero-hepática (20%). O glicuronídeo conjugado é hidrolisado e absorvido e é igualmente efetivo na inibição da absorção do esterol. A reciclagem entero-hepática é responsável pela meia-vida de mais de 22 horas, inibindo especificamente a absorção intestinal do colesterol dietético e biliar, sem interferir na absorção de vitaminas lipossolúveis (A, D, E, K), ácidos graxos ou sais biliares.
A redução do afluxo do colesterol a partir do intestino para o fígado resulta em aumento compensador da expressão de receptores hepáticos de LDL e aumento da captura das partículas de LDL circulantes. A redução final de LDL-c obtida com o uso de 10 mg/dia de ezetimiba (dose única preconizada), isoladamente ou em associação com a estatina, fica em torno de 15 a 25%. 272 Em uma meta-análise que incluiu cinco estudos clínicos randomizados (5.039 pacientes), em que a ezetimiba foi comparada a placebo em adição à estatina já em uso, a redução média de LDL-c foi de 23,6%, sem qualquer aumento nos efeitos adversos. 273 Essa potencialização do efeito hipolipemiante está demonstrada também na população de pacientes com HFHe. 274,275 Embora os dados sejam obviamente mais escassos na literatura, a eficácia hipolipemiante da ezetimiba está também evidenciada na população com HFHo. 276
O uso da associação estatina e ezetimiba já se mostrou eficaz na redução de desfechos substitutos 277 e de eventos isquêmicos analisados como desfecho secundário. 278 Entretanto, a eficácia da combinação na redução de eventos cardiovasculares maiores foi demonstrada no estudo IMPROVE-IT, 279 que comparou a associação ezetimiba/sinvastatina à sinvastatina isolada em pacientes estáveis após episódio de síndrome coronária aguda (SCA) e com LDL-c dentro das metas preconizadas. O desfecho primário foi composto por morte cardiovascular, síndrome coronariana aguda (IAM não fatal, angina instável necessitando internamento) e acidente vascular cerebral não fatal. Os pacientes que receberam ezetimiba associada à estatina apresentaram, após um ano, uma redução de LDL-c de 24% em comparação ao grupo de estatina isolada. Em um seguimento médio de 7 anos, a redução no risco relativo no desfecho cardiovascular primário, composto por morte cardiovascular, síndrome coronariana aguda (IAM não fatal, angina instável necessitando internamento) e acidente vascular cerebral não fatal foi de 6,4%. Esta redução de risco foi proporcional à redução obtida de LDL-c e comparável à redução de risco obtida para uma redução da mesma magnitude se obtida com o uso de estatina. 280 Portanto, a ezetimiba deve ser utilizada como terapia adjuvante às estatinas de alta intensidade quando estas, em sua dose máxima ou na máxima dose tolerada, não são suficientes para se atingir a meta de LDL-c (recomendação: classe I; nível de evidência: B).
7.2.2.2. Inibidores de PCSK9
A PCSK9 é uma protease que regula a atividade do receptor de LDL, induzindo à sua degradação lisossomal. Dessa forma, ao reduzir a quantidade de LDLR na superfície do hepatócito e diminuir a atividade desses receptores, a PCSK9 aumenta a concentração plasmática de LDL-c. 281 A utilização de anticorpos monoclonais para bloquear a ligação da PCSK9 com o LDLR é a forma mais avançada de inibir a atividade dessa enzima. Esses anticorpos se ligam ao sítio alostérico do LDLR e bloqueiam a ligação PCSK9-LDLR. Consequentemente, aumentam a recirculação do receptor e reduzem os níveis séricos de LDL-c. Meta-análises já publicadas apontam para uma redução consistente de cerca de 50% dos níveis séricos do LDL-c em diversos cenários clínicos, isoladamente ou em combinação com máxima terapêutica tolerada. 282
Estão disponíveis no mercado nacional dois anticorpos, ambos na forma de solução injetável, em “canetas” prontas para injeção, que não permitem fracionamento da dose: evolocumabe, na apresentação de 140 mg, e alirocumabe, na apresentação de 75 e 150 mg. Ambos são utilizados de maneira semelhante, com injeção subcutânea a cada duas semanas (embora evolocumabe possa ser também usado na dose de 420 mg, 1 vez ao mês). Os dois fármacos foram testados no cenário da HFHe, em adição à máxima terapêutica tolerada com estatina com ou sem outros hipolipemiantes associados, com semelhante redução de LDL-c entre 50 e 60%. 283-285 Na HF, 300 pacientes (106 com HFHo, incluindo adolescentes entre 14 -18 anos de idade, na inclusão) receberam evolocumabe 420 mg a cada 4 semanas por um tempo (mediana) de 4,1 anos. A redução do LDL-c do basal à semana 12 foi de 21,2% (-59.8 mg/dL) em pacientes com HFHo e de 54,9% (-104.4 mg/dL) naqueles com HFHe grave. Esse resultado se manteve com o tempo. Dos 48 pacientes com HFHo que receberam dose titulada para 420 mg a cada duas semanas, a redução de LDL-c aumentou de -19,6% na semana 12 a -29,7%, 12 semanas após a dose de 420 mg a cada duas semanas. 285 Evolocumabe foi também testado em pacientes com HFHo na dose de 420 mg, via subcutânea (SC), 1 vez ao mês, com redução média de LDL-c de cerca de 21%. 286 Por essa razão, evolocumabe é também aprovado para uso na HFHo.
A redução de desfechos cardiovasculares com inibidores de PCSK9 foi demonstrada em populações de alto risco cardiovascular, com doença aterosclerótica clínica estabelecida. No estudo FOURIER, 287 foram avaliados 27.564 pacientes com DCV estabelecida (doença coronariana, cerebrovascular ou doença arterial periférica), que, apesar da máxima terapêutica tolerada, permaneciam fora da meta de LDL < 70 mg/dl. Após um tempo mediano de seguimento de 2,2 anos, o uso de evolocumabe esteve associado a uma redução de 15% no desfecho primário de morte cardiovascular, IAM, AVE, hospitalização por angina instável ou necessidade de procedimento de revascularização miocárdica. Já no estudo ODYSSEY Outcomes, 288 que envolveu 18.924 pacientes após síndrome coronariana aguda recente (1 a 12 meses antes da inclusão no estudo) com LDL ≥ 70 mg/dl apesar da máxima terapêutica tolerada com estatina associada ou não a outros hipolipemiantes, o uso de alirocumabe reduziu em 15% o desfecho primário composto de morte coronariana, IAM não fatal, AVE fatal ou não ou angina instável com necessidade de hospitalização. O tempo mediano de seguimento foi de 2,8 anos.
Portanto, considerando a eficácia hipolipemiante nos pacientes com HF e a demonstração de redução de desfechos cardiovasculares em populações de alto risco, o uso de inibidores de PCSK9 está indicado nos pacientes que, apesar da terapêutica com estatina de alta intensidade, ou na máxima dose tolerada, preferencialmente já associada a ezetimiba, permanecem fora da meta de LDL-c (recomendação: classe I; nível de evidência: A).
7.2.2.3. Colestiramina
A colestiramina é uma resina que se liga aos ácidos biliares no intestino, formando um complexo insolúvel que é excretado nas fezes. Com o aumento da sua excreção, a síntese de ácidos biliares aumenta no hepatócito à custa de uma elevação na síntese do colesterol, mas principalmente por um aumento na expressão dos LDLR que retiram LDL da circulação, reduzindo seu nível plasmático. 289 O efeito hipolipemiante da colestiramina é variável, podendo chegar até cerca de 30% de redução de LDL-c na dose máxima. 290 A colestiramina é apresentada em envelopes de 4 g, e sua posologia inicial é de 4 g ao dia, podendo-se alcançar no máximo 24 g/dia, embora posologias superiores a 16 g sejam dificilmente toleradas.
Os principais efeitos colaterais relacionam-se ao aparelho digestivo (plenitude gástrica, náuseas), interferindo na motilidade intestinal e causando obstipação e meteorismo. O fármaco diminui a absorção de vitaminas lipossolúveis (A, D, K, E) e de ácido fólico, sendo eventualmente necessária a suplementação desses elementos. A colestiramina deve ser utilizada uma hora antes ou três horas após a ingestão de outros medicamentos, para não diminuir a absorção deles. A redução de desfechos cardiovasculares com colestiramina foi demonstrada na fase pré-estatina. Ela também reduziu a incidência de infarto do miocárdio em 19% em homens hipercolesterolêmicos em prevenção primária, em 7 anos de seguimento, no estudo Lipid Research Clinics. 291
A colestiramina pode ser utilizada como terapia adjuvante quando a terapêutica de alta intensidade com estatina, preferencialmente já associada a ezetimiba e/ou um inibidor de PCSK9, não é suficiente para se chegar à meta de LDL-c (recomendação: classe IIa; nível de evidência: B). O fármaco pode ser especialmente útil em crianças com menos de 8 anos que ainda não podem receber estatinas e em gestantes.
8. Terapias Alternativas para Tratamento da Hipercolesterolemia Familiar Bypass Ileal Parcial
A cirurgia de bypass ileal parcial começou a ser realizada para tratamento da hipercolesterolemia na década de 1960, proporcionando redução sustentada do LDL-c por mais de 20 anos. 292 A operação foi avaliada no ensaio clínico randomizado Program on the Surgical Control of the Hyperlipidemias (POSCH), envolvendo 838 pacientes sobreviventes de IAM, com LDL-c médio de 179 mg/dl. Em relação ao grupo controle, os participantes submetidos à operação apresentaram redução do LDL-c de 38% e diminuição do desfecho combinado de morte coronariana ou IAM não fatal de 35%. 293
Em um pequeno estudo com 11 portadores de HFHe, a cirurgia de bypass ileal parcial resultou em redução do LDL-c de aproximadamente 20% após 2 anos. 294
O principal efeito colateral dessa cirurgia é a diarreia (média de mais de três evacuações diárias após a operação). Litíase renal e biliar também são relatadas como eventos adversos. 292,293
Com a introdução das estatinas na prática clínica nas décadas de 1980/1990, e posteriormente de outros medicamentos hipolipemiantes, a cirurgia de bypass ileal parcial deixou de ser utilizada no tratamento da hipercolesterolemia. O papel desse procedimento no manejo da HF e na prevenção da DCV na vigência da terapia farmacológica atual é desconhecido.
Vale ressaltar que algumas técnicas contemporâneas de cirurgia bariátrica que resultam em redução expressiva do peso, como a cirurgia de bypass gástrico em Y de Roux e a derivação biliopancreática, também promovem redução do LDL-c. 295
8.1. Recomendação
Embora a cirurgia de bypass ileal tenha mostrado redução do LDL-c e de eventos cardiovasculares, não se recomenda de rotina esse procedimento em portadores de HF, dada a existência de várias outras modalidades de tratamento eficazes, não invasivas e de menor risco (recomendação: classe IIB; nível de evidência: B).
8.2. Plasmaférese e LDL-aférese
LDL-aférese (LA) e plasmaférese são duas opções de tratamento a partir de filtração sanguínea extracorpórea. Ambas envolvem sessões com duração de 2 a 3 horas, semanais ou quinzenais. A principal diferença entre os dois procedimentos é a especificidade. No procedimento de plasmaférese, ocorre separação das células do sangue e plasma do paciente, de modo que as sanguíneas são retidas e misturadas em um fluido de reposição para retornar ao paciente, enquanto o plasma juntamente com as proteínas (incluindo o HDL-C) é descartado. Os efeitos colaterais envolvem suscetibilidade a infecções, náusea, hipertensão, hipotensão e urticária. 296
Já na LA, o plasma não é descartado, mas passa por um filtro de precipitação para a remoção seletiva de colesterol de LDL, VLDL e Lp(a). Os efeitos colaterais mais frequentes incluem hipotensão, anemia, náusea, rubor e cefaleia, além de intercorrências com o acesso venoso. 297
Existem vários métodos de aférese, incluindo adsorção de celulose sulfato de dextrano, precipitação de LDL-c extracorpórea induzida por heparina, imunoadsorção e dupla aférese de plasma de lipoproteínas. Ao se compararem os métodos disponíveis em relação à sua capacidade de redução de lipídios, apenas pequenas diferenças foram observadas. Via de regra, esses métodos seletivos reduzem os valores de LDL-c do plasma em média de 50 a 70% após tratamento único. 298,299 O intervalo de tempo para retorno ao nível basal de LDL-c varia entre quatro dias e três a quatro semanas.
Pela especificidade, a LA é mais bem tolerada com menor taxa de efeitos colaterais comparada à plasmaferése (2% versus 12%, respectivamente) e mais eficaz em reduzir o LDL-c (60 a 65% versus 50%, respectivamente); porém, com menor disponibilidade e custo duas vezes maior. 300
8.3. LDL-aférese em Crianças Homozigóticas ou Heterozigóticas Compostas
Os critérios recomendados para indicação de LA ou plasmaferese após dieta associada à farmacoterapia otimizada, em pacientes pediátricos homozigóticos e heterozigóticos compostos, incluem:
Redução menor do que 50% em relação ao LDL-c basal ou valores de LDL-c mantidos acima de 360 mg/dl: esses critérios são modificáveis de acordo com o contexto clínico de cada paciente, que envolve, dentre outros aspectos, a progressão da doença aterosclerótica. Estudos retrospectivos e de segmento longitudinais demonstram que a terapia com LA em crianças resultou em redução e/ou desaparecimento dos xantomas cutâneos, retardo da evolução de estenose valvar aórtica e supra-aórtica, e regressão de lesão coronariana. 301-305 A dieta e farmacoterapia devem ser continuadas com os procedimentos de aférese, já que as estatinas, quando associadas, reduzem o LDL-c em até 70% ou mais. As estatinas também retardam o efeito rebote de elevação dos níveis de LDL-c pós-aférese.
Idade de início da LA: o prognóstico cardiovascular depende do início do tratamento; quanto mais precoce, melhor. A idade para início da LA é a partir de 5 anos, preferivelmente antes dos 8 anos de idade. Em casos mais graves, pode-se iniciar em idades mais precoces. 303 A partir de 10 anos, a LA não se mostrou tão benéfica nos estudos de seguimento e retrospectivos. 303
Monitoramento da progressão da aterosclerose: a presença de aterosclerose progressiva é um dos critérios para escolha de tratamentos invasivos. Exames de imagem como ecocardiograma transtorácico para avaliação da presença e/ou progressão da doença valvar aórtica e arco aórtico, ultrassom de carótidas para mensurar o espessamento médio-intimal e de placas de ateroma, teste ergométrico devem ser realizados no início do tratamento e a cada 2 anos durante o seguimento. 303,304
Contra-indicações para aférese: diátases hemorrágicas, resistência à adequada coagulação e hipersensibilidade à heparina.
Efeitos colaterais: a anemia ferropriva é o efeito colateral mais frequente, hipotensão e dificuldades de acesso venoso também são reportados com menor frequência.
-
Segurança: é um procedimento seguro e tolerável para crianças e adolescentes, em centros especializados. 306
Numerosos estudos de casos e avaliações clínicas demonstraram que crianças submetidas à LA por muitos anos (até 20 anos) se desenvolveram normalmente. 306-308
8.4. LDL-aférese em Pacientes Adultos com HFHo ou HFHe Graves
Nos pacientes com HFHo ou HFHe graves, após 6 meses sem resposta adequada 309 à máxima terapêutica medicamentosa, que inclui estatinas, ezetimiba e inibidores do PCSK9, ou intolerância medicamentosa, a LA é indicada nas seguintes situações:
HFHo funcionais com colesterol LDL-c ≥ 300 mg/dl (ou colesterol não HDL ≥ 330 mg/dl).
HFHe funcionais com colesterol LDL-c ≥ 300 mg/dl (ou colesterol não HDL ≥ 330 mg/dl) e um ou nenhum fator de risco.
HFHe funcionais com colesterol LDL-c ≥ 200 mg/dl (ou colesterol não HDL ≥ 230 mg/dl) e dois ou mais fatores de risco ou Lp (a) alta, ≥ 50 mg/dl.
HFHe funcionais com colesterol LDL-c ≥ 160 mg/dl (ou não HDL colesterol ≥ 190 mg/dl) e presença de DCV clínica ou subclínica ou fatores de risco como diabetes e tabagismo).
Vários ensaios clínicos confirmaram os benefícios de LA na prevenção e redução da progressão da doença aterosclerótica. 310-317 Outros efeitos com comprovado benefício também são relatados, como melhora da função endotelial, 318 vasodilatação coronariana, 319 melhora no fluxo microvascular 320 e perfusão miocárdica. 321 A LA é o único tratamento que reduz consistentemente os níveis de Lp (a) em mais de 50%. 322,323
Apesar de a LA ser o tratamento mais viável para certos pacientes homozigóticos e heterozigóticos graves, o procedimento está disponível em poucos centros no mundo, em função do alto custo.
8.5. Recomendação para a Indicação de LDL-aférese em Adultos com HFHo ou HFHe Graves e Crianças com HFHo
Estudos retrospectivos ou coortes de segmento a longo prazo demonstram que pacientes com HFHo ou HFHe graves dificilmente alcançam as metas preconizadas de LDL-c, apesar das doses máximas da terapêutica otimizada associadas a sessões semanais ou quinzenais de LA. Estudos demonstram que, apesar das dificuldade na redução do colesterol, pacientes que apresentaram valores mais baixos de LDL-c tiveram melhor sobrevida e menos eventos cardiovasculares do que aqueles com níveis mais elevados. Esse benefício foi independente do tipo de tratamento realizado. Portanto, a extensão da redução lipídica, bem como seu início precoce, determinaram os resultados clínicos de modo independente. 324 Sendo a LA o procedimento que mais reduz os valores de LDL-c, ela é recomendada para adultos e crianças (recomendação: classe I; nível de evidência: C).
8.6. Transplante Hepático
O transplante hepático pode ser uma alternativa para pacientes HF refratários ao tratamento farmacológico 325 e está indicado especialmente para os portadores de HFHo. Entretanto, deve-se sempre discutir com pacientes e familiares para que sejam esclarecidos os riscos e os benefícios do procedimento (recomendação: classe IIB; nível de evidência: C).
9. Algoritmos de tratamento na Hipercolesterolemia Familiar em Adultos
Visando facilitar a abordagem terapêutica da hipercolesterolemia familiar no adulto (> 18 anos) tanto na forma heterozigótica, como na homozigótica e, considerando o risco cardiovascular, cinco algoritmos de tratamento são apresentados nas Figuras 7 a 11 .
Figura 7. Fluxograma de tratamento da HF heterozigótica (He) em prevenção secundária (muito alto risco).
AIT: ataque isquêmico transitório; AVC: acidente vascular cerebral; DAC: doença arterial coronariana; DAP: doença arterial periférica; HF: hipercolesterolemia familiar; LDL-C: colesterol da lipoproteína de baixa densidade; MEV: mudança de estilo de vida.
Figura 11. Fluxograma de tratamento da HF homozigótica (Ho) em prevenção primária. AIT: ataque isquêmico transitório; AVC: acidente vascular cerebral; DAC: doença arterial coronariana; DAP: doença arterial periférica; HF: hipercolesterolemia familiar; LDL-C: colesterol da lipoproteína de baixa densidade; MEV: mudança de estilo de vida; MTP: proteína de transferência de triglicerídeos microssomal.
A Figura 7 mostra o fluxograma de tratamento na hipercolesterolemia familiar heterozigótica de muito alto risco, as metas e a sequência terapêutica proposta para o alcance dessas metas. Estatinas potentes, ezetimiba e inibidores de PCSK9 visando a redução de LDL-c > 50% e o alcance de LDL-c < 50 mg/dL são recomendados para o alcance de metas de forma escalonada.
Na Figura 8 observamos o fluxograma de tratamento na hipercolesterolemia familiar heterozigótica de alto risco, as metas propostas e o fluxo de tratamento para o alcance das metas. Estatinas potentes, ezetimiba e inibidores de PCSK9 visando a redução de LDL-c > 50% e o alcance de LDL-c < 70 mg/dL são recomendados para o alcance de metas de forma escalonada.
Figura 8. Fluxograma de tratamento da HF heterozigótica (He) em prevenção primária (alto risco). HF: hipercolesterolemia familiar; LDL-C: colesterol da lipoproteína de baixa densidade; SC: subcutâneo.
*São considerados fatores de risco adicionais na HF: 56 idade > 40 anos e sem tratamento, tabagismo, sexo masculino, Lp(a) > 50 mg/dL, HDL-c < 40 mg/ dL, hipertensão arterial, diabetes melito, história familiar de DAC prematura em parentes de 1º grau (homens < 55 anos e mulheres < 60 anos), doença renal crônica (TFG < 60 ml/min) e IMC > 30 kg/m2.
Na Figura 9 é apresentado o fluxograma de tratamento da hipercolesterolemia familiar heterozigótica de risco intermediário, as metas propostas e o fluxo de tratamento para o alcance das metas. Estatinas potentes, ezetimiba e inibidores de PCSK9, visando a redução > 50% no LDL-c e o alcance de LDL-c < 100 mg/dL são recomendados para o alcance de metas de forma escalonada.
Figura 9. Fluxograma de tratamento da HF heterozigótica (He) em prevenção primária (risco intermediário). HF: hipercolesterolemia familiar; LDL-C: colesterol da lipoproteína de baixa densidade; SC: subcutâneo.
*São considerados fatores de risco adicionais na HF: 56 idade > 40 anos e sem tratamento, tabagismo, sexo masculino, Lp(a) > 50 mg/dL, HDL-c < 40 mg/ dL, hipertensão arterial, diabetes melito, história familiar de DAC prematura em parentes de 1º grau (homens < 55 anos e mulheres < 60 anos), doença renal crônica (TFG < 60 ml/min) e IMC > 30 kg/m2.
Na Figura 10 vê-se o fluxograma de tratamento na hipercolesterolemia familiar homozigótica em prevenção secundária, as metas terapêuticas e a sequência terapêutica proposta para o alcance dessas metas. O alvo é alcançar redução > 50% no LDL-c e meta de LDL-c < 50 mg/dL. Estatinas potentes, ezetimiba são recomendados como primeira linha, além de inibidores de PCSK9, se para o alcance de metas uma redução de LDL-c < 30% for suficiente e não for homozigoto para receptor de LDL nulo; se o LDL-c permanecer > 50 mg/dL ou se o paciente for homozigoto para receptor de LDL nulo, terapias adicionais como o inibidor de MTP (lomitapide), podem permitir alcance de metas com redução adicional de LDL-c de 50%. Outras terapias adicionais, como aférese e transplante hepático são incluídas no fluxograma e estes pacientes devem sempre ser encaminhados e acompanhados por especialista.
Figura 10. Fluxograma de tratamento da HF homozigótica (Ho) em prevenção secundária. AIT: ataque isquêmico transitório; AVC: acidente vascular cerebral; DAC: doença arterial coronariana; DAP: doença arterial periférica; HF: hipercolesterolemia familiar; LDL-C: colesterol da lipoproteína de baixa densidade; MEV: mudança de estilo de vida.
Na Figura 11 vê-se o fluxograma de tratamento na hipercolesterolemia familiar homozigótica em prevenção primária, as metas terapêuticas e a sequência terapêutica proposta para o alcance dessas metas. O alvo é alcançar redução > 50% no LDL-c e meta de LDL-c < 70 mg/dL. Estatinas potentes, ezetimiba são recomendados como primeira linha, além de inibidores de PCSK9, se para o alcance de metas uma redução de LDL-c < 30% for suficiente e não for homozigoto para receptor de LDL nulo; se o LDL-c permanecer > 70 mg/dL ou se o paciente for homozigoto para receptor de LDL nulo, terapias adicionais como o inibidor de MTP (lomitapide), podem permitir alcance de metas com redução adicional de LDL-c de 50%. Outras terapias adicionais, como aférese e transplante hepático são incluídas no fluxograma e estes pacientes devem sempre ser encaminhados e acompanhados por especialista.
10. Hipercolesterolemia Familiarna Criança
10.1. Triagem
A suspeição da criança ou do adolescente para HFéde extrema importância; afinal, estima-se que no mundo, a cada minuto, nasça uma criança com HF. No entanto, o diagnóstico nesse grupoéum desafio na prática clínica. 59
Diversos fatores contribuem para o subdiagnóstico dessa condição. Ressalta-se o desconhecimento quantoàs recomendações da idade ideal para o rastreio laboratorial e uma tendência clínica a avaliar o perfil lipídico em crianças com sobrepeso/obesidade ou diabetes melito (crianças com HF são, em sua maioria, eutróficas e, em geral, não são portadoras de diabetes). Além disso, háfalhas na obtenção de uma anamnese detalhada desde a primeira consulta de puericultura, em busca de história de DCV prematura ou de níveis elevados de colesterol, sabidamente conhecidos, em parentes de primeiro grau.
Desse modo, as crianças assintomáticas com HFHe são geralmente identificadaspor meio do perfil lipídico sérico, que é realizadona presença de um parente próximo com diagnóstico confirmado de HF. 57 Nesse contexto, exceto em condições específicas na qual um rastreio precoce estárecomendado, a triagem laboratorial de crianças e adolescentes para dislipidemia, incluindo a HF,érecomendada de maneira universal a partir dos 10 anos de idade (recomendação: classe I; nível de evidência: A).
A ferramenta laboratorial inicial de rastreio neste grupoéo perfil lipídico, a partir da análise dos valores de colesterol total e do LDL-c. No entanto,éimportante ressaltar:
No rastreio universal, operfil lipídico pode ser realizado sem a necessidade de jejum, uma vez que o estado alimentar não influencia as concentrações de colesterol total, LDL-c e não-HDL-c.
Uma medida isolada de LDL-c não ésuficiente para o diagnóstico de dislipidemia em criança ou adolescente. Estudos demonstram ampla variação do LDL quando de sua repetição no período mínimo de 2 semanas. 326
10.2. Valores do Perfil Lipídico para a Suspeição da Hipercolesterolemia Familiar
O algoritmo da triagem laboratorial de crianças ou adolescentes com HF está descrito na Figura 12 (recomendação: classe I; nível de evidência: A).
Ressalta-se que, na vigência de níveis de LDL-c > 400 mg/dl, HFHe grave ou HFHo devem ser suspeitadas 59 (recomendação: classe I; nível de evidência: A).
Figura 12. Algoritmo de triagem laboratorial de hipercolesterolemia familiar em crianças e adolescentes. Adaptado de Expert panel on integrated guidelines for cardiovascular health and risk reduction in children and adolescents; 224 Wiegman A, et al. 327 .
DAC: Doença arterial coronariana; HF: hipercolesterolemia familiar; CT: Colesterol total; LDL: Low-density lipoprotein.
*Improvável HF: a ausência de critérios laboratoriais para HF não significa que outra dislipidemia não esteja presente. A criança ou adolescente com níveis de perfil lipídico fora do valor de referência para sua faixa etária deverá seguir com avaliação clínica. Importante avaliar causas secundárias nesta faixa etária: disfunção renal, tireoidiana, HIV, doenças auto-imunes, diabetes e obesidade, dentre outras.
**Mudança de estilo de vida e orientação nutricional; vide seção terapia não farmacológica.
***Quando disponível o teste genético deve ser ofertado.
****Avaliação clínica: sinais clínicos como xantomas, xantelasma, arco corneano e espessamento de tendões devem ser avaliados. Descartar condições clínicas não HF que cursam com hipercolesterolemia. Escores de Dutch devem ser aplicados nesta etapa.
*****Vide seção: Particularidades no manejo do paciente com HFo
10.3. Fatores Relacionados ao Aumento do Risco Cardiovascular
Em geral, pacientes com HF são considerados de alto risco cardiovascular, que pode seelevar dependendo da presença de outros fatores. 139,328,329 Dentre estes, destacam-se: níveis reduzidos de HDL-c, níveis elevados de triglicerídeos, níveis elevados de Lp (a) e fatores de estilo de vida, incluindo tabagismo, dietaaterogênicae sedentarismo. 56
Ainda nesse grupo, devem ser lembradas condições específicas relacionadas com desenvolvimento de DAC prematura, dentre eslas: diabetes melito tipos 1 e 2, doença renal crônica, transplantados cardíacos, doença de Kawasaki, doença inflamatória crônica,paciente vivendo com vírus da imunodeficiência humana (HIV), síndrome nefrótica e crianças que foram submetidas a tratamento para neoplasias. 224
10.3.1. Triagem para o Diagnóstico de Hipercolesterolemia Familiar Além do Perfil Lipídico Laboratorial
Dada a gravidade dos pacientes e a precocidade das lesões cardíacas, há necessidade de monitoramento das complicações, idealmente a partir do diagnóstico, o que normalmente acontece após os 2 anos de idade. Consiste na determinação de marcadores da aceleração da progressão da aterosclerose, da função cardíaca e de lesões valvares e da raiz aórtica.
Em relação ao monitoramento da aterosclerose, deve-se determinar a estrutura e a função arterial periodicamente, o que pode ser utilizado na tomada de decisões do manejo medicamentoso e das metas de LDL-c. A espessura médio-intimal tem sido considerada a forma ideal e de mais fácil realização de avaliação estrutural da parede vascular em crianças portadoras de HF, especialmente nas com mais de 8 anos, utilizando-se os critérios validados internacionalmente para a idade 330 (recomendação: classe IIa; nivel de evidencia: B). Recentemente, tem-se demonstrado que a tomografia axial computadorizada pode ser ainda mais sensível, mas seu uso parece ser reservado para os pacientes com HFHo 144 (recomendação: classe IIa; nivel de evidência: C).
Existem várias formas de avaliação de função endotelial descritas para esses pacientes, entre as quais: distensibilidade mediada por fluxo (por tonometria digital), hiperemia reativa pós-oclusivae velocidade de onda de pulso . Ainda não há consenso de qual a forma de avaliação mais sensível e específica, sendo então sugerida a utilização do método que for mais validado localmente 331,332 (recomendação: classe IIa; nível de evidencia: C).
O strain global do ventrículo esquerdo parece estar diminuído em crianças com dislipidemias graves; por isso, deve-se avaliar periodicamente as funções ventriculares destes pacientes, utilizando-se inicialmente a ecocardiografia convencional. Também é importante realizar a avaliação das valvas cardíacas e da raiz aórtica, no intuito de afastar possibilidade de disfunções, dilatações ou calcificações. O método que tem se mostrado mais sensível para isso é também a tomografia axial computadorizada 333 (recomendação: classe IIa; nível de evidência: C).
10.4. Tratamento
A indicação, o manejo e as metas a serem alcançadas com a instituição dos tratamentos não farmacológico e farmacológico estão descritos na Figura 13 (recomendação: classe II; nível de evidência: A).
Figura 13. Algoritmo do Manejo da hipercolesterolemia familiar em crianças e adolescentes. Adaptado de Expert panel on integrated guidelines for cardiovascular health and risk reduction in children and adolescents; 224 Wiegman A, et al. 327 .
HF: hipercolesterolemia familiar; LDL: Low-density lipoprotein; DAC: Doença Arterial Coronariana; RCV: Risco Cardiovascular.
*Todas as crianças devem ser submetidas a terapia não farmacológica: Vide seção terapia não farmacológica.
**Em crianças menores de 8 anos a decisão por terapia farmacológica deverá ser avaliada de forma individualizada, em geral, para pacientes heterozigotos graves ou homozigotos.
***Se LDL > 130 mg/dL, sem comprometimento aterosclerótico, optar por tratamento não-farmacológico.
****Vide seção fatores relacionados ao aumento do RCV.
10.4.1. Tratamento Não Farmacológico
Mesmo em crianças com HF, a modificação do estilo de vida é parte fundamental do tratamento. O manejo da dislipidemia deve ser, preferencialmente, com o apoio de uma equipe interdisciplinar . Deve-se associar o combate ao fumo, primário ou passivo, além do controle intensivo de hipertensão arterial e sobrepeso ou obesidade em todos os pacientes, logo a partir do diagnóstico.
10.4.1.1. Dieta
Sabe-se que, na HF, a dieta tem efeito parcial, pelas suas características fisiopatológicas. Apesar disso, recomenda-se a dieta a partir do diagnóstico. Isso porque há um efeito ainda significativo sobre as lipoproteínas e apolipoproteínas, além de haver evidência de diminuição do padrão inflamatório desses pacientes, tanto menor quanto maior a ingestão de ácidos graxos poli-instaurados, e maior quanto maior a ingestão de calorias e colesterol. 334,335
Como em todas as crianças da população geral, deve-se diminuir a ingestão de ácidos graxos saturados e aumentar a ingestão de ácidos graxos mono e poli-insaturados, que devem ser majoritariamente de origem vegetal, sendo o óleo de canola o de melhor resultado. Deve-se também eliminar os ácidos graxos Trans , aumentar a ingestão de frutas e verduras (estimulando ao máximo o consumo de fibras, mas preferencialmente as dos alimentos) e restringir a ingestão de açúcar adicionado 334,335 (recomendação: classe IIa; nível de evidência: B).
Mesmo na criança, a forma de tratamento dietético inicial segue as orientações denominadas dieta tipo I, sendo calculadas a partir do volume calórico total segundo volume de calorias, macro e micronutrientes para proporcionar um adequado crescimento e desenvolvimento 334,335 (recomendação: classe I; nível de evidência: B).
Caso não haja a resposta adequada à dieta tipo I, institui-se a dieta tipo II, recomendando-se fortemente o manejo por um especialista em nutrição (nutricionista ou nutrólogo), pois o risco de desnutrição, de macro ou micronutrientes (principalmente de vitaminas lipossolúveis), é muito grande, sendo os pacientes menores e em uso de ezetimiba ou resinas de troca os de risco máximo 336 (recomendação: classe I; nível de evidência: B).
10.4.1.2 Atividade Física
Para crianças com idade entre6 e 17 anos, recomendam-se 60 minutos ou mais por dia de atividade aeróbica, de grauintenso a vigoroso. Sãorecomendadas também atividadesde força muscular e muscle-strengthening and bone-loading pelo menos três vezes por semana (recomendação: classe IIa; nível de evidência: B). 337,338
As crianças pré-escolares devem permanecer ativas ao longo do dia, para estimular o crescimento, o desenvolvimento e adquirir um repertório de capacidades motoras.Deve-se atingir um total de pelo menos 3 horas ativas por dia (recomendação: IIa; evidência: B).
Mesmo não havendo consenso sobre a quantidade de atividade física necessária para o controle do impacto da dislipidemia em crianças, sabe-se que o comportamento ativo melhoraa função endotelial edetermina regressão de espessamento médio-intimal 339 (recomendação: IIa; evidência: B).
Pacientes com dislipidemia, especialmente com HF, podem necessitar de um programa de reabilitação cardiopulmonar e metabólico de modo integrado e interdisciplinar. Mesmo na infância, por vezes é mais seguro instituir inicialmente uma atividade física supervisionada, mesmo porque se sabe que esse tipo de abordagem pode determinar melhor controle dos fatores de risco cardiovasculares e regressão da aterosclerose subclínica 340 (recomendação: IIa; evidência: A).
10.4.2. Tratamento Farmacológico
Recomenda-se que, seguindo rigorosamente os crité rios descritos adiante e apó s mudança de estilo de vida, a terapia hipolipemiante seja iniciada apó s os 8 anos de idade. O tratamento em menores de8 anos pode ser indicado em casos graves e apó s avaliação individualizada. Tem como objetivo a redução de pelo menos 50% no LDL-c e, se possível, o alcance da meta de valores < 110 mg/dl de LDL-c (desej á vel), ou no m í nimo de 130 mg/dl (lim í trofe), além da redução de xantomatose e prevenção do aparecimento de DAC (recomendação: I; evidência: A).
10.4.2.1. Estatinas
O uso de estatinas diminui significativamente colesterol total, LDL-c e Apo B, sem aparente ocorrê ncia significativa de efeitos adversos, relacionados a desenvolvimento sexual, toxicidade muscular ou hep á tica. O fármaco pode ser utilizado a partir dos8 anos de idade (em casos individualizados, pode ser prescrito em menores de8 anos). 59,341,342 As estatinas podem diminuir o LDL-c em cerca de 30% e aumentar o HDL-c em 5% 343-348 (recomendação: IIa; evidência: A).
Recentes publicações evidenciaram que as estatinas, alé m da redução de colesterol total e LDL-c nessa faixa et á ria, promoveram melhora da funçã o endotelial, diminui ção da espessura íntima-mé dia da caró tida e regressão de xantomas (recomendaçã o: IIa; evidê ncia: B). 349 As doses usualmente utilizadas dos hipolipemiantes em crianças e adolescentes são descritas no Quadro 3 .
Quadro 3. Doses de hipolipemiantes utilizados em crianças e adolescentes.
| Fármaco | Doses (mg) |
|---|---|
| Lovastatina | 10 a 40 |
| Pravastatina | 10 a 40 |
| Sinvastatina | 10 a 40 |
| Rosuvastatina | 5 a 40 |
| Atorvastatina | 10 a 40 |
| Colestiramina * | 4 a 16 |
| Ezetimiba | 10 |
Em gramas.
Doses maiores que as descritas podem ser utilizadas apó s aná lise individual do risco em crianças/adolescentes. Nesse grupo, sugere-se a utilização inicial da menor dose poss í vel de estatinas (recomendação: IIa; evidência: C). Nas situações em que a meta de LDL-c não for atingida com a dose m áxima tolerada de estatina, o uso de ezetimiba est á indicado como segunda escolha associada ao tratamento (recomendação: II; evidência: C).
10.4.2.2. Inibidores da Absorção do Colesterol
O uso do ezetimiba como monoterapia diminui em cerca de 28% os valores de LDL-c em crianças com HFHe. Recomenda-se seu uso como monoterapia a partir dos 5 anos e, em associação com estatina, em crianças acima de 8 anos 342,350 (recomendação: IIb; evidência: C).
10.4.2.3. Sequestrantes dos Ácidos Biliares
Os sequestrantes dos á cidos biliares podem ser utilizados em qualquer idade. Diminuem em mé dia, como monoterapia, cerca de 10 a 15% dos n í veis de LDL-c. Podem ser també m associados com estatinas ou ezetimiba , mas em hor á rios de administração diferentes. Pelo risco de desnutrição relacionadoà s vitaminas lipossol ú veis, recomenda-se monitoramento nutricional e suplementação segundo crité rios objetivos de deficiencia. 351 Para aumentar a tolerância das crianças, sugere-se associar suco de maçã ao sequestrante, para melhorar a palatabilidade (recomendação: I; evidência: B).
10.4.2.4 Suplementos
Suplementa ção de 1,2 a 1,5 g de fitosteró is pode diminuir os n í veis de colesterol total e LDL-c em crianças portadoras de HFHe em cerca de 10% 352 (recomendação: IIb; evidência: B). É importante lembrar que suplementos à base de ômega 3, como os encontrados em derivados do óleo de peixe, não são recomendados para crianças com HF, pois podem aumentar os níveis de LDL-c 329 (recomendação: III; evidência: B).
10.4.3. Novos Tratamentos
Neste grupo encontram-se medicamentos como lomitapide, mipomersen e inibidores da PCSK9 (alirocumabe e evolucumabe). O evolocumabe na dose de 420 mg SC a cada 4 semanas foi estudado na população pediátrica com HFHe (n=170) de 10 a 17 anos, não controlados com o tratamento padrão que incluía estatina e/ou ezetimiba. Foram 104 pacientes randomizados para evolocumabe e 53 para placebo. O evolocumabe reduziu o LDL-c na semana 24 em 44,5%, com uma redução absoluta de 77,5 mg/dL. Houve redução das demais variáveis lipídicas. 353 Já o alirocumabe foi estudado no Odissey kids para definição de dose, 354 porém os dados do estudo ainda não foram finalizados.
Apesar da aprovação de alguns desses fármacos para uso na população adulta, na população pediátrica o uso desses agentes pode ser considerado caso a caso 59 (recomendação: IIa; evidência: C). No entanto, até o momento, os dados de segurança de longo prazo disponíveis e publicados provêm de estudos em adultos (18 anos ou mais), sendo ainda escassos dados em crianças com HF. 355-357
10.4.4. Particularidades no Manejo da Hipercolesterolemia Familiar Homozigótica
O grupo de maior desafio no manejo e, ao mesmo tempo, de maior impacto no tratamento desde a infância é o composto por crianças e adolescentes com HFHo. Nestes, por serem homozigotos para o gene do LDLR ou por defeitos genéticos associados, os quais fenotipicamente têm concentrações de LDL-c bastante elevadas, há necessidade de intervenção a partir do momento do diagnóstico, independentemente da idade, para que se evitem manifestações ateroscleróticas, às vezes na primeira década. Pelas características fisiopatológicas, o uso de resinas de troca frequentemente não se mostra efetivo, em especial nos pacientes homozigóticos para mutações que levam a atividade nula no LDLR. 351 A Figura 14 representa o algoritmo utilizado para o manejo de tais crianças e adolescentes 358 (recomendação: IIa; evidência: C). Esses pacientes devem ser encaminhados a especialista em lípides.
Figura 14. Algoritmo de tratamento de crianças e adolescentes com hipercolesterolemia familiar homozigótica. 358 HF: hipercolesterolemia familiar.
Em adolescentes graves com aterosclerose clinicamente manifesta, h á indicação de revasculariza ção do mioc árdio. 359,360 No caso de doenç a aó rtica decorrente de dislipidemia grave, a troca por homoenxerto pulmonar (cirurgia de Ross-Konno) 361 pode ser uma opção interessante para o adolescente, por sua durabilidade (recomendação: IIb; evidência: C).
10.5. Monitora mento do Tratamento
Recomenda-se que os fármacos isolados ou associados devem ser usados de forma contínua 362 (recomendação: I; evidência: C). Uma ampla revisão sistemática (incluiu apenas ensaios clínicos randomizados controlados), que avaliou o uso de estatinas em crianças e adolescentes, demonstrou que o risco de eventos adversos neste grupo foi semelhante aos observados em adultos tratados com estatina, pelo menos a curto prazo. Os estudos avaliados analisaram o efeito da terapia com estatina quanto ao impacto no desenvolvimento sexual, crescimento, nutrição, toxicidade hepática ou renal. Para a maioria desses parâmetros, não houve diferença estatisticamente significativa entre os grupos de tratamento e placebo. Não houve relatos de eventos adversos graves. Elevação das transaminases hepáticas e da enzima creatina fosfoquinase (CPK), que são particularmente preocupantes em adultos, não diferiram nos grupos estudados. 362
Recomenda-se a avaliação basal de CPK, transaminases (TGO, TGP) e HbA1C (pelo risco de diabetes com o uso de estatinas). O seguimento laboratorial deve ser realizado a cada 4 a 8 semanas, até a estabilização das doses utilizadas, e, em seguida, de 6 em 6 meses 59,329 (recomendação: I; evidência: C). Para pacientes com sintomas possivelmente relacionados às estatinas é recomendável prosseguir com avaliação laboratorial na vigência dos sintomas, o que pode auxiliar o pediatra a discernir se há de fato relação com o medicamento. Além disso, o grupo de adolescentes deve ser orientado quanto a medidas de contracepção, em virtude do potencial teratogênico das estatinas 331 (recomendação: I; evidência: C).
Caso anormalidades laboratoriais (níveis de transaminases elevadas mais de 3 vezes; e ou níveis de CPK > 3 a 10 vezes em pacientes assintomáticos; ou níveis de CPK > 10 vezes em pacientes assintomáticos) sejam detectadas a estatina deve ser interrompida e um novo teste realizado após 2 semanas. Diante da normalização laboratorial a estatina pode ser reiniciada com a devida monitoração 331 (recomendação: I; evidência: C).
10.6. Aspectos Psicoló gicos
O tratamento farmacológico parece n ão impactar na qualidade de vida ou na ansiedade de crianças portadoras de hipercolesterolemia familiar. Cerca de 40% das crianças sofrem por serem portadoras da condição, mas utilizar hipolipemiantes confere maior segurança em cerca de 60%. Mais de 50% fazem dieta, e 79% dos pais sofrem porque os filhos tê m HF 363 (recomendação: IIb; evidência: B).
11. Tratamento da Hipercolesterolemia Familiar na Gravidez
Durante a gravidez e a lactação, as opções terapêuticas da HF são bastante limitadas, já que estatinas, ezetimiba, inibidores de PCSK9 e ácido nicotínico não devem ser prescritos de modo a evitar potenciais efeitos adversos no feto associados ao uso desses agentes (respectivamente categorias X, C, B e C). Isso pode ser preocupante, considerando-se o aumento das taxas plasmáticas de lipídios que ocorre geralmente durante a gravidez, de 25 a 50% dos níveis de colesterol e 150 a 300% de triglicerídeos, em adição a concentrações basais de colesterol já bastante elevadas em razão da HF. 364
O uso de outras medicações hipolipemiantes, mais especificamente das resinas, é possível quando há necessidade clara da manutenção de terapêutica medicamentosa com provável benefício. As resinas, como o colesevelam e a colestiramina, são agentes da categoria B na gravidez e lactação e, portanto, podem ser consideradas para tratamento da HF nessas condições, desde que sob supervisão médica. 365 A LA é uma modalidade de tratamento que também pode ser utilizada em casos especiais, em que o risco cardiovascular da paciente, na ausência de tratamento, é muito alto, como em pacientes com HFHo ou com HFHe e doença aterosclerótica grave. 366
As mulheres portadoras de HF em idade fértil e que desejem engravidar devem receber aconselhamento pré-gravidez e suspender estatinas, ezetimiba e ácido nicotínico, pelo menos quatro semanas antes de interromperem o método contraceptivo utilizado. É importante destacar que o uso de anticoncepcional oral geralmente não é contraindicado para a maioria de mulheres com HF 367 e não interfere na eficácia das estatinas. 368 Mulheres com risco aumentado de eventos cardiovasculares devem discutir outros métodos contraceptivos além do anticoncepcional oral. 367
As pacientes que engravidaram de forma não programada devem suspender esses hipolipemiantes imediatamente e procurar acompanhamento obstétrico. Alguns poucos estudos avaliaram mulheres com HF que engravidaram em uso de estatinas, com resultados controversos, em relação à incidência de malformações fetais. Em série relatada pela Food and Drug Administration (FDA) em 2004, foram avaliados 52 casos selecionados de exposição gestacional a estatinas, entre os quais 20 tinham defeitos estruturais fetais, especialmente neurológicos e esqueléticos. 369
A escassez relativa de tratamentos seguros e eficazes para redução das taxas de colesterol plasmático nessas pacientes se associa à preocupação em relação a efeitos adversos pela própria hiperlipidemia. De fato, alguns trabalhos sugerem risco aumentado de prematuridade em grávidas com taxas elevadas de colesterol. 370,371 Trabalho recente realizado na Noruega, que avaliou 2.319 nascimentos de 1.093 mulheres com HF, não detectou diferença em relação à prematuridade entre mulheres com diagnóstico genético de HF e mulheres da população geral. 364 Quanto ao baixo peso ao nascer, em geral também não parece haver diferença significativa entre recém-nascidos de mulheres com ou sem o diagnóstico de HF. A frequência de malformações congênitas em fetos de mulheres com HF também não parece maior em comparação a mulheres da população geral, respectivamente, 3,3 e 3,2%. Toleikyte et al. 364 também não encontraram diferenças em prematuridade, baixo peso e malformações segundo diferentes tipos de mutação genética.
Embora a maioria dos estudos disponíveis não demonstre eventos adversos fetais significativos em associação à presença de HF, é recomendável o acompanhamento conjunto das gestantes portadoras da doença pelo especialista em lipídios e pelo obstetra. Deve-se estar atento à possível presença de lesões valvares, em particular de estenose aórtica, e de doença coronária prematura nessas pacientes. 372 Do ponto de vista obstétrico, também é importante a pesquisa de insuficiência vascular uteroplacentária. 373,374
11.1. Conclusões
O uso de medicações hipolipemiantes em gestantes com HF incluindo estatinas, ezetimiba, ácido nicotínico, fibratos, inibidores PCSK9 não é recomendado (recomendação: classe III; nível de evidência: B). Apenas as resinas (recomendação: classe IIB; nível de evidência: B) e aférese (recomendação: classe IIB; nível de evidência: B) podem ser utilizadas durante a gestação.
11.2. Classificação dos Agentes Quanto a Possíveis Efeitos no Feto Segundo a FDA
Categoria A: estudos adequados e controlados não demonstraram risco ao feto no primeiro trimestre da gravidez (e não há evidência de risco nos trimestres seguintes).
Categoria B: estudos de reprodução em animais não demonstraram risco ao feto, e não há estudos adequados e controlados em mulheres grávidas.
Categoria C: estudos de reprodução em animais demonstraram efeito adverso ao feto, mas não há estudos adequados e controlados em mulheres grávidas.
Categoria D: existe evidência de risco ao feto humano baseada em dados de reação adversa provenientes de estudos em humanos ou experiência de marketing ou investigativa. Os benefícios do uso do agente em mulheres grávidas podem ser superiores ao seu risco em algumas situações.
Categoria X: estudos em animais ou humanos demonstraram anormalidades fetais e/ou existe evidência de risco fetal humano baseado em dados de efeitos adversos provenientes de experiência de marketing ou investigativa. Os riscos do uso do agente em mulheres grávidas superam claramente potenciais benefícios.
12. Terapias Hipolipemiantes para as Formas Graves de Hipercolesterolemia Familiar
A HF é uma patologia de difícil tratamento e que provoca eventos cardiovasculares em idade precoce. Os indivíduos acometidos podem apresentar-se de duas formas: HFHe e HFHo.
A meta de LDL-c preconizada em diretrizes não é geralmente alcançada por terapias convencionais, mesmo com a utilização de estatinas de alta potência em doses máximas, havendo necessidade da introdução de terapêutica adjuvante. Por outro lado, a redução de 50% do LDL-c, meta também preconizada, pode ser alcançada com estatinas de alta potência. 9 Metas individualizadas para HFHe e HFHo de acordo com as respectivas categorias de risco foram discutidas nas seções 7 e 9.
Hipolipemiantes adicionais à administração de estatinas são geralmente necessários no tratamento da HF e, apesar de seus efeitos colaterais, são empregados para a redução de LDL-c e, principalmente, de desfechos robustos cardiovasculares, tais como IAM fatal ou não, AVE fatal ou não e morte cardiovascular. Entre eles, estão:
Anticorpos monoclonais antiPCSK9.
Inibidor microssomal da proteína de transferência de triglicerídeos (MTP) (lomitapida).
Oligonucleotídeo antissentido.
12.1. Anticorpos Monoclonais AntiPCSK9 na Hipercolesterolemia Familiar
Em estudos de genética mendeliana clássica, pesquisadores identificaram uma região no cromossomo 1 que estava ligada à presença de HF, responsável pela transcrição do gene PCSK9, cujo polimorfismo transmite a doença de forma autossômica dominante. 16,375 Estudos mecanísticos subsequentes demonstraram que a PCSK9 funciona como chaperona do LDLR e que, uma vez ligada ao receptor, previne a alteração conformacional necessária para prevenir a sua degradaço no lisossoma. 3,76 Como consequência, o LDLR que pode recircular cerca de 100 vezes é degradado precocemente, reduzindo a remoção da LDL da circulação sanguínea. Consistentemente, mutações com ganho de função da PCSK9 se associam com aumento do LDL-c e do risco cardiovascular e aquelas com perda de função com níveis reduzidos de LDL-c e com baixo risco cardiovascular. 377,378
Anticorpos monoclonais foram desenvolvidos para reduzir a biodisponibilidade da PCSK9, impedindo assim sua ligação ao receptor da LDL. Dentre eles, o evolocumabe e alirocumabe foram aprovados para uso clínico. Ambos são anticorpos monoclonais totalmente humanos e são administrados por via subcutânea. O evolocumabe pode ser administrado na dose de 140 mg a cada duas semanas ou em 420 mg por mês. Nas duas posologias, o evolocumabe reduz LDL-c em aproximadamente 60%, quando administrado isoladamente ou sobre o tratamento com outros hipolipemiantes. 377,379
Em indivíduos com HFHe, uma redução semelhante foi observada; 283,284 porém, em homozigotos, a redução alcançada foi de 38%. 286 Naturalmente, o grau de resposta dependerá do tipo e número de mutações. Nos indivíduos com dois alelos mutados defeituosos (captação de LDL de 2 a 25%), o tratamento pode reduzir LDL-c em até 47%. 286 Naqueles com um alelo defeituoso e um alelo negativo, ou seja, sem produção do LDLR (captação de LDL < 2%), o efeito máximo esperado é de 25%. 286 Por fim, nos indivíduos com dois alelos negativos (nenhuma captação de LDL), nenhuma resposta é obtida com o tratamento. 286 Os dados do estudo TESLA B foram amplificados pela análise interina do estudo TAUSSIG, no qual foram incluídos 106 portadores de HFHo. 380 Nesse estudo aberto, após 12 semanas de uso mensal de evolocumabe 420 mg, a redução média do LDL-c foi de 21% (desvio padrão 24%). Da mesma maneira como no estudo TESLA B, houve variabilidade da resposta dependente em parte do defeito genético causador do fenótipo da HF. Homozigotos que apresentavam defeitos nos genes APOB ou LDLRAP1 (causador da hipercolesterolemia autossômica recessiva com fenótipo similar ao da HFHo) tiveram reduções médias de 47 e 15%, respectivamente. As respostas foram sustentadas até 4 anos de tratamento, e os eventos adversos mais frequentes foram sintomas de nasofaringite e resfriado comum.
Assim, a terapia com evolocumabe deve ser tentada em indivíduos com HFHo, exceto naqueles homozigotos para mutações nulas no LDLR. No entanto, esses pacientes provavelmente irão requerer terapias adicionais.
O alirocumabe foi testado nas doses de 75 mg e 150 mg a cada duas semanas. Na dose mais baixa é esperada uma redução de LDL-c de 45 a 50%, e na dose mais alta, 60%. 284,381,382 Na posologia de 300 mg mensais, o alirocumabe reduz o LDL-c em 55 a 60%. 383 À semelhança do evolocumabe, o alirocumabe reduz o LDL-c em pacientes com HFHe em aproximadamente 40 a 60%. 384 Igualmente consistente, em pacientes com HFHo, as reduções de LDL-c dependem do genótipo e variam de 7 a 64%. 385 O alirocumabe foi aprovado para a HFHo pelo FDA, mas aguarda a aprovação na Agência Regulatória Européia (EMA) e no Brasil (ANVISA).
Três ensaios cardiovasculares randomizados, duplo-cegos e controlados por placebo avaliaram a eficácia da terapia com inibidores da PCSK9 no risco de eventos cardiovasculares. Embora nenhum desses ensaios tenha sido dirigido a pacientes com HF, seus resultados são extrapoláveis a essa população. No estudo FOURIER, o evolocumabe foi testado contra placebo em 27.564 pacientes com DCV aterosclerótica clinicamente evidente caso apresentassem LDL-c ≥ 70 mg/dl, a despeito de terapia hipolipemiante otimizada. 386 De um valor basal de LDL-c de 92 mg/dl, os pacientes arrolados para evolocumabe reduziram para um nível médio de 30 mg/dl, que foi mantido ao longo do tempo (mediana de seguimento de 2,2 anos). 287 A terapia com evolocumabe reduziu o risco do desfecho combinado de morte cardiovascular, infarto do miocárdio, AVE, revascularização coronariana ou hospitalização por angina instável em 15% (HR 0,85, IC 95% 0,79 a 0,92). O desfecho principal secundário, composto de morte cardiovascular, infarto do miocárdio ou AVE, foi reduzido em 20% (HR 0,80, IC 95% 0,73 a 0,88) 287 . À semelhança dos estudos com estatinas, o benefício clínico aumentou progressivamente com o tempo de tratamento. 287 Em um subestudo neurocognitivo, 1.974 pacientes do estudo FOURIER foram avaliados antes e após a intervenção para que se pudesse avaliar a segurança sobre a função cognitiva. 387 Não foram observadas diferenças entre grupos na função cognitiva, e não houve associação entre os níveis de LDL-c e alterações cognitivas.
Nos estudos SPIRE-1 e SPIRE-2, 388 o bococizumabe foi administrado a 27.438 pacientes com evento cardiovascular prévio ou história de diabetes, doença renal crônica ou doença vascular periférica. O estudo foi interrompido prematuramente após a constatação de que o efeito do bococizumabe não foi sustentado devido ao desenvolvimento de anticorpos neutralizantes. 389 O nível basal de LDL-c foi de 109 mg/dl, e 85% dos indivíduos estavam recebendo terapia com estatina de alta intensidade. O bococizumabe diminuiu o LDL-c em 59% em 14 semanas, mas esse efeito foi atenuado para 38% em 2 anos. 389 No estudo SPIRE-2, que teve um seguimento mais longo, o bococizumabe reduziu em 21% (HR 0,79, IC 95% 0,65 a 0,97; p = 0,02) o risco do desfecho primário composto de morte cardiovascular, infarto do miocárdio, AVE ou revascularização coronariana. 390 Um subestudo do programa SPIRE mostrou que não houve heterogeneidade na redução do risco cardiovascular entre indivíduos com e sem HF com o uso do bococizumabe. 390
Por fim, o estudo ODYSSEY Outcomes arrolou 18.924 pacientes 1 a 12 meses após infarto do miocárdio ou angina instável para tratamento com alirocumabe ou placebo. 391 A dose de alirocumabe foi titulada para atingir um nível de LDL-c de 25 a 50 mg/dl, e o medicamento deveria ser interrompido se o nível de LDL-c fosse persistentemente inferior a 15 mg/dl. O alirocumabe diminuiu o LDL-c em 57% em 4 semanas, mas esse efeito foi atenuado progressivamente para 36% no final do estudo, presumivelmente devido ao esquema de titulação de doses. 288 O desfecho primário composto de morte cardiovascular, infarto do miocárdio, AVE isquêmico ou hospitalização por angina instável foi reduzido em 15% (HR 0,85, IC 95% 0,78 a 0,93; p = 0,003). 288 Foi observada uma redução de 15% (HR 0,85, IC 95% 0,73 a 0,98) na mortalidade por todas as causas com tratamento com alirocumabe em comparação com placebo. 288 No entanto, por não haver redução significante de dois desfechos hierarquicamente prioritários nessa análise, mortalidade cardiovascular e coronariana, o resultado foi considerado de valor exploratório, e não uma evidência.
12.2. Inibidor Microssomal da Proteína de Transferência de Triglicerídeos (Lomitapida)
A MTP é uma proteína transferidora de lipídios encontrada no retículo endoplasmático de hepatócitos e enterócitos, que atua na montagem de lipoproteínas que contêm Apo B. 392
A lomitapida é uma pequena molécula que inibe a MTP, reduzindo a formação de quilomícrons no intestino e de VLDL no fígado. É terapia adicional às estatinas, utilizada na redução das concentrações de LDL-c, principalmente em indivíduos portadores de HF.
Por ser a VLDL precursora metabólica de LDL, as concentrações plasmáticas de LDL seriam reduzidas. 393 Na ausência ou disfunção da MTP, semelhante ao que ocorre na hipo ou abetalipoproteinemia recessiva, não há produção de VLDL e, consequentemente, das demais lipoproteínas que contêm Apo B, tais como LDL, IDL e Lp(a). Atualmente, seu uso tem aprovação da FDA e da Agência Regulatória Europeia como terapia adjuvante em adultos com HFHo; entretanto, já está documentado seu uso em criança. 394 Recentemente a lomitapida foi aprovada em nosso país em 2020 pela Agência Nacional de Vigilância Sanitária (ANVISA) para uso em adultos na hipercolesterolemia familiar homozigótica.
A lomitapida é administrada por via oral, na dose inicial de 5 mg/dia e pode chegar a 60 mg/dia, sendo que a dose deve ser individualizada de acordo com as metas terapêuticas e com a resposta e tolerância individual ao tratamento. Estudo de fase 3 em pacientes com HFHo, em doses iniciais de 5 mg/dia e tituladas até 60 mg/dia, associadas à terapia de base, mostrou reduções adicionais de 50% no LDL-c e de 49% na Apo B. 395 Ainda não foram descritas alterações em concentrações de HDL-c e Lp(a) com a manutenção do tratamento com lomitapida após 78 semanas, exceto discretas flutuações de HDL-c. 396
Estudo de fase 3 com 26 semanas de tratamento com lomitapide avaliou o alcance de metas da European Atherosclerosis Society e da ocorrência de eventos cardiovasculares maiores (MACE). O alcance de meta de LDL-c < 100 mg/dL foi de 51% e < 70 mg/dL foi de 28% nas primeiras 26 semanas. 397 Na fase de extensão, nos pacientes que continuaram com lomitapide após 176 semanas (N=19), 74% alcançaram meta de LDL-c < 100 mg/dL e 58% < 70 mg/dL em pelo menos uma dosagem. O LDL-c sob tratamento com lomitapide alcançado foi de 166 mg/dL. Houve dois eventos cardiovasculares, uma morte cardíaca e uma revascularização do miocárdio, equivalente a 1,7 eventos por 1000 pacientes por mês de tratamento. Esses valores são muito menores do que os observados entre as coortes de pacientes com HF antes do uso das novas terapias. 398
Dados de mundo real, com 18 pacientes com HFHo em tratamento adjuvante com lomitapide em dose média de 19 mg/dia num seguimento de 32,3 ± 29,7 meses mostraram redução de LDL-c de 68,2 ± 24,8% e na visita final, 60% dos pacientes alcançaram meta de LDL-c < 100 mg/dL e, 46,6% < 70 mg/dL; 80% dos pacientes deixaram de necessitar LDL-aférese, devido aos valores alcançados de LDL-c. A redução do LDL-c foi variável (13-95%), independente do genótipo. 392 No seguimento, 53,3% tiveram eventos adversos, mas nenhum grave. Não houve aumento de transaminases > 5x o LSN e nenhum paciente interrompeu a medicação por eventos adversos. Cinco pacientes realizaram ultrassom hepático e fibroscan ou ressonância nuclear magnética com espectroscopia e nenhum deles apresentou indícios de dano hepático. 399
Dados de registro de 5 anos em pacientes com HFHo que iniciaram lomitapide (N=187) foram consistentes quanto à eficácia e segurança nos estudos de fase 3, apesar do uso de uma dose mais baixa (10 mg vs 40 mg) nos estudos de fase 3. Não houve novos achados de segurança e a incidência de eventos adversos, eventos adversos sérios, elevações de alanina aminotransferase foi menor do que nos estudos de fase 3, provavelmente relacionados à menor dose utilizada. 400
Os efeitos adversos mais comuns foram gastrintestinais, como náuseas, flatulência e diarreia. Eles podem ser minimizados pela redução da ingesta de gordura ou pela titulação escalonada do medicamento. 398 Tem sido descrito, em alguns pacientes, aumento das transaminases, em geral reversível com a redução ou a descontinuação do fármaco, ou mesmo transitório com a manutenção do tratamento.
Na maioria das vezes, não foram descritos elevação concomitante das bilirrubinas, fosfatase alcalina e surgimento de sintomas. Entretanto, o efeito adverso mais preocupante com uso da lomitapida, devido ao seu mecanismo de ação, é a esteatose hepática, que seria dose dependente e que se atenua com a redução da dosagem diária. Pode ser detectada especialmente por ressonância magnética. Outro efeito colateral relevante é o aparecimento de esteatorreia. 397-401
Estudos com ressonância magnética em pacientes com HFHo demonstraram acúmulo de gordura hepática. Porém, isso pode variar individualmente, sendo acentuado por consumo de álcool. Os efeitos desse acúmulo de gordura no fígado, em longo prazo, decorrentes da intervenção medicamentosa poderiam ser deletérios e até ocasionar cirrose hepática. 399
Pelo fato de a inibição da MTP levar não apenas à redução hepática da síntese de VLDL, mas também da produção intestinal de quilomícrons, o uso de lomitapida poderia causar redução da absorção de ácidos graxos essenciais e vitaminas lipossolúveis, em especial vitamina E, que é transportada principalmente por LDL. No entanto, esse achado não foi confirmado em portadores de HF após seu uso no tratamento. 402
Além disso, pesquisas não demonstraram nenhum efeito significativo do tratamento com lomitapida sobre os níveis plasmáticos de vitaminas A e D. 399 Contudo, com a finalidade de prevenir deficiências nutricionais, podem ser suplementados ácidos graxos essenciais e vitaminas lipossolúveis ao tratamento.
Pelo fato de a lomitapida ser amplamente metabolizada pelo CYP3A4, deve-se ter precaução com sua coadministração com inibidores do CYP3A4 (antifúngicos, diltiazem, verapamil, antibióticos como ciprofloxacino, claritromicina e eritromicina, e os inibidores de protease). O uso associado da lomitapida 60 mg/dia com a sinvastatina 40 mg/dia aumentou a exposição a sinvastatina em 1,7 vez comparada à sinvastatina isolada, aumentando o risco de efeito colateral pela sinvastatina. 403 Entretanto, estudos com outros hipolipemiantes não demonstraram interações significativas. Outro possível evento adverso provocado por sua abrupta interrupção seria a elevação das concentrações de LDL-c, devido ao efeito rebote na secreção de VLDL.
A lomitapida está contraindicada na gravidez, e não há, até o momento, alguma prova que o seu uso seja seguro nesta ocasião. Sem dúvida, esse questionamento deveria ser colocado antes do seu emprego, em casos de risco, caso fosse necessário. Por fim, sua eficácia hipolipemiante foi demonstrada em estudos prévios que mostraram efeito de dose-resposta na redução de LDL-c, em que 10, 25 e 50 mg diários reduziram LDL-c em 30, 55 e 70%, respectivamente. 392
12.3. Oligonucleotídeo Antissentido
12.3.1. Inibidores da Síntese de Apo B (Antissentido AntiApo B)
A tecnologia do oligonucleotídeo antissentido pode ser utilizada para bloquear a síntese de determinada proteína alvo. O mipomerseno é um oligonucleotídeo antissentido de segunda geração que se liga ao RNAm que codifica a Apo B-100, levando à sua degradação por ação da enzima RNAase, reduzindo, assim, a produção de Apo B-100, 404 Desse modo, inibe a síntese hepática de Apo B-100 e, consequentemente, reduz as concentrações plasmáticas de VLDL, IDL, LDL e Lp(a). 405-407 Sua aplicação se dá por injeção SC, administrada uma vez por semana na dose de 200 mg. 406
Em ensaios clínicos de pacientes com HFHo ou HFHe graves, o mipomerseno reduziu o LDL-c em 25 e 28%, respectivamente. Seus eventos adversos incluem: mialgia, fadiga, lesão no local de aplicação, sintoma semelhante à gripe, além do depósito de gordura hepática (esteatose).
O elevado custo dessa tecnologia e seus efeitos colaterais foram impeditivos de seu uso de forma mais ampla; uma possível indicação terapêutica seria em condição extremamente grave e rara de dislipidemia genética, como a HFHo.
O mipomerseno foi analisado em estudo clínico randomizado fase 3, que alocou pacientes portadores de HFHo. A redução média do LDL-c foi significativamente maior no grupo mipomerseno (-24,7%, IC95% 31,6 a 17,7%) do que no grupo placebo (-3,3%, IC95% 12,1 a 5,5%; p = 0,0003). Nesse estudo, o efeito colateral mais comum foi reação local no sítio de aplicação (76% no grupo mipomerseno versus 24% no placebo). 406
Em 2013, a FDA aprovou o uso do mipomersen para tratamento da HFHo em adultos, faltando informações sobre seu uso em crianças. 408 Porém, em 2018 houve interrupção de sua comercialização.
Estudos fase 3 mostraram que a eficácia do produto é bastante variável, com reduções de 25 a 37%, em média, dependendo das características das populações estudadas (formas homozigóticas ou heterozigóticas da HF, hipercolesterolemias graves ou pacientes de alto risco cardiovascular).
12.4. RNA Pequeno de Interferência (siRNA)
Outra forma de inibir a ação da PCSK9 é reduzir sua produção tecidual. Os small interfering RNA (siRNA) impedem a tradução do RNA mensageiro. 409 O inclisiran é um siRNA sintético que inibe a síntese hepática da PCSK9. O fármaco foi testado no programa ORION, administrado por via subcutânea como primeiro na classe, avaliando sua eficácia e segurança na redução do LDL-c. Estudos de fase II e fase III demonstraram redução de LDL-c de cerca de 50% com uma dose infrequente, uma aplicação a cada seis meses, em pacientes com doença aterosclerótica cardiovascular estabelecida, ou de alto risco cardiovascular, incluindo pacientes com HF. Estudos de fase III em andamento irão determinar evidências de segurança e eficácia em longo prazo e, na HFHo. Além disso, o estudo ORION-4 irá avaliar o impacto do inclisiran nos eventos cardiovasculares. Sua eficácia já foi demonstrada (em estudo fase 1 e confirmada em estudo fase 2), com redução de 52.6% do LDL-c. 410 No estudo ORION-9, um estudo de fase III com pacientes portadores de HFHe, o inclisiran na dose de 300 mg reduziu em 39,7% as concentrações de LDL-c no dia 510 (vs. aumento de 8,2% no grupo placebo) e entre os dias 90 e 540, houve redução de 38,1%. As reduções foram robustas em todos os genótipos encontrados. 411 A medicação ainda não foi aprovada para uso.
12.5. Anticorpo Monoclonal Anti-ANGPTL3
Outra terapia promissora especialmente para as formas refratárias de HF e para os portadores de HFHo envolve a inibição da ANGPTL3 ( angiopoietin-like 3 peptide ), com o anticorpo monoclonal anti-ANGPTL3, o evinacumabe. Na HFHO o evinacumabe reduziu em 47% o LDL-c administrado por via endovenosa na dose de 15 mg/kg de peso a cada 4 semanas. 412 O evinacumabe foi efetivo tanto nos pacientes com mutações nulas para o LDLR (redução de LDL-c de 43,4%), como para as outras variantes (redução de LDL-c de 49,1%).
Nas formas graves e refratárias de hipercolesterolemia o evinacumabe foi testado por via subcutânea e endovenosa em várias doses e intervalos posológicos, mostrando redução de LDL-c superior a 50%. 413 O evinacumab foi recentemente aprovado para uso em pacientes com HFHo pelo FDA.
12.6. Ácido Bempedóico
O ácido bempedóico é uma pequena molécula que atua na redução do LDL-c pela inibição de uma enzima-chave na via de biossíntese do colesterol, a ATP citrato liase, que atua um passo antes da 3-hydroxy-3-metilglutaril-coenzima A. Diferente das estatinas, tem ação específica no fígado, sem interferência nos músculos esqueléticos. 414 Num estudo randomizado de fase III, um total de 779 pacientes com doença aterosclerótica cardiovascular, hipercolesterolemia familiar heterozigótica ou ambos, e com LDL-c tratado > 70 mg/dL foram incluídos. O ácido bempedóico reduziu o LDL-c em 15,1%, além de reduzir o colesterol não-HDL, colesterol total, apoB e proteína C-reativa de alta sensibilidade, em comparação ao placebo. 415 Já no estudo usando combinação fixa de ácido bempedóico 180 mg e ezetimiba 10 mg em pacientes com hipercolesterolemia recebendo dose máxima tolerada de estatina e de alto risco cardiovascular, a redução de LDL-c foi de 36%, comparada à ezetimibe isolada (-23,2%) e ácido bempedóico isolado (-17,2%). 416 A redução com o ácido bempedóico / ezetimiba foi semelhante entre os grupos recebendo estatina de alta ou média intensidade e naqueles sem estatina. Os outros lípides e a PCR-us também tiveram redução maior com a terapia combinada.
Esta classe de fármacos é associada a elevações modestas no nível de ácido úrico, explicada pela competição do metabólito do medicamento e do ácido úrico para os mesmos transportadores renais envolvidos na excreção desses compostos. Dados de segurança com exposição prolongada, bem como de desfechos cardiovasculares, estão sendo avaliados em estudo de fase 3, ainda sem resultados publicados.
13. Custo-efetividade do Rastreamento e Tratamento da Hipercolesterolemia Familiar
13.1. Introdução
Na atualidade, os recursos para a saúde são escassos para atender a todas as demandas da sociedade. A medicina contemporânea se depara com uma avalanche de terapias que comprovadamente acrescentam um benefício clínico em relação às terapias já incorporadas, mas geralmente vem associadas a um determinado custo incremental.
Tradicionalmente, quando se avaliam as diversas intervenções médicas, tanto do ponto de vista clínico quanto de política de saúde, a preocupação é estabelecer a eficácia e segurança de uma intervenção, que pode ser alcançada quando aplicada em condições ideais (ensaios clínicos controlados e randomizados). A efetividade mostrará o real efeito da intervenção quando utilizada nas circunstâncias usuais (estudos de mundo real). Entretanto, há ainda o conceito de eficiência das intervenções, que considera não apenas a efetividade de cada intervenção, mas também os recursos necessários para que a mesma seja implementada.
Esse panorama tem despertado o interesse da comunidade e seus diversos segmentos na busca de soluções. A Economia da Saúde é uma área do conhecimento interdisciplinar que pode auxiliar médicos, gestores e formuladores de políticas de saúde na difícil tarefa de tomar decisões em ambiente de escassez de recursos.
13.2. Estudo de Custo da Doença
Para análise do impacto de uma doença ou um tratamento específico em um cenário (p. ex., país, sistema de saúde, hospital), há necessidade do conhecimento do custo da doença. Esse tipo de estudo econômico é um método descritivo que associado aos dados de prevalência, incidência, morbidade e mortalidade, auxilia na mensuração do impacto para a sociedade de uma doença específica.
O estudo do custo da doença não é categorizado como análise econômica, pois não compara intervenções e não avalia desfechos em saúde. O objetivo é estimar a carga ou o impacto de uma doença para priorizar a alocação de recursos em políticas públicas de saúde, orientar fundos para pesquisa e identificar as doenças que mais comprometem o orçamento da saúde, além de fornecer informações para análises econômicas.
13.3. Análises Econômicas em Saúde
As análises econômicas comparam as opções para a alocação dos recursos escassos destinados à área de saúde, entre alternativas que competem pelo seu uso. Todas as formas de análise econômica envolvem o uso de recursos e os benefícios de saúde de intervenções terapêuticas, preventivas ou mesmo de programas de saúde. Essas análises proporcionam a comparação entre as alternativas e facilitam o processo de escolha do uso apropriado dos recursos de saúde.
A análise de custo-efetividade (ACE) é o tipo de análise mais utilizado em saúde e mensura o custo em unidades monetárias dividido por uma unidade não monetária, chamada unidade natural , como, por exemplo, anos de sobrevida ou eventos evitados após uma determinada intervenção em saúde. 417
Uma intervenção em saúde é dita custo-efetiva se produz um benefício clínico justificável para o seu custo. A determinação do quanto a efetividade adicional justifica o custo extra é tomada pela sociedade e depende de valores sociais e da disponibilidade de recursos. A OMS recomenda o valor de um a três vezes o produto interno bruto (PIB) per capita do país onde a análise foi realizada, como limite de custo-efetividade justificável para aquele contexto. 418 No cenário brasileiro, não foi definido um valor explícito do limiar de custo-efetividade para o Sistema Único de Saúde (SUS) ou sistema suplementar de saúde, ou seja, a definição do valor monetário a partir do qual se considera uma intervenção custo-efetiva (limiar de custo-efetividade). A definição desse valor é contexto-específica, depende da riqueza local, das características do sistema de saúde, da disponibilidade e capacidade de pagar, bem como das preferências sociais. Além disso, o uso desse limiar deverá sempre ser feito em conjunto com outros critérios que agreguem “valor” e tem sido discutido nos últimos anos.
13.4. Custos da Hipercolesterolemia Familiar
As DCV são as principais causas de morte e de custos da população adulta no Brasil, e provavelmente esse impacto aumentará com o aumento da expectativa de vida. A HF é um importante fator de risco para a doença aterosclerótica, aumentando o risco de eventos precoces.
Siqueira et al., 419 estimaram os custos das DCV no Brasil na perspectiva do SUS durante 5 anos, incluindo os custos diretos com hospitalizações, atendimentos ambulatoriais e benefícios concedidos pela previdência, além dos custos indiretos com a perda de renda causada pela mortalidade da DCV. Esta representou 28% do total de óbitos ocorridos no Brasil e atingiu 38% dos óbitos na faixa etária produtiva (18 a 65 anos). Os custos estimados por DCV foram de R$ 37,1 bilhões no ano de 2015, com um aumento percentual de 17% no período de 2010 a 2015. Os custos estimados pela morte prematura por DCV representam 61% do total de custo por DCV; os custos diretos com internações e consultas foram de 22%, e os custos pela perda da produtividade relacionados à doença foram de 15% do total. Os gastos com saúde no Brasil foram estimados em 9,5% do PIB, e o custo médio das DCV foi estimado em 0,7% do PIB.
Bahia et al. 420 estimaram os custos das hospitalizações por DAC atribuíveis à presença de HF na população adulta brasileira na perspectiva do SUS no período de 2012 a 2014. Utilizando dados da literatura internacional sobre a prevalência de HF e o risco relativo de eventos, foram calculadas as frações atribuíveis populacionais (FAP) e aplicadas sobre os custos das hospitalizações em todas as unidades de saúde do SUS por meio da base de dados SIH-SUS. Um total de 245.981 hospitalizações foram registradas em um ano, sendo que, entre 7.249 (2,9%) e 12.915 (5,2%), seriam atribuíveis a presença de HF, dependendo da prevalência considerada. O custo total dessas hospitalizações foi de R$ 985.919.299, sendo que R$ 29.053.500 a R$ 51.764.175 seriam atribuíveis à presença de HF e poderiam ser minimizados caso houvesse um controle adequado desse fator de risco na população com tratamento adequado.
13.5. Custo-efetividade do Rastreamento e Tratamento da Hipercolesterolemia Familiar
Estima-se que menos de 25% dos indivíduos com HF tenham diagnóstico, com a maioria sendo incorretamente tratada. 421 As implicações clínicas e econômicas desse baixo número de diagnósticos são significativas, já que uma importante parcela da população com HF não tratada precocemente irá evoluir para DCV aterosclerótica. Com isso, um importante ponto de discussão é a custo-efetividade do rastreamento populacional da HF para um diagnóstico e tratamento precoces. Rosso et al. 422 realizaram uma revisão sistemática de análises econômicas do rastreamento genético da HF (custo-efetividade, custo-utilidade, custo-benefício e custo-minimização). Sete avaliações econômicas foram realizadas na Europa entre 2002 e 2015 com foco nos parentes de casos índice com diagnóstico genético ou clínico de HF (rastreamento em cascata), mas não comparando com uma estratégia de não rastreamento. Na perspectiva do sistema de saúde pagador, apenas os custos diretos foram analisados, o que evidencia estimativas de impacto conservadoras, pois não levaram em consideração os custos indiretos da DCV (absenteísmo, licenças, aposentadorias e mortes precoces). Em todos os contextos, o rastreamento em cascata foi custo-efetivo, exceto em estudo norte-americano que não mostrou evidência de benefício econômico do rastreamento genético em comparação com a recomendação vigente de manejo das dislipidemias. 423
A efetividade e custo-efetividade do tratamento com estatinas de indivíduos com HF já foi claramente demonstrada em diferentes contextos para prevenção secundária. 424,425 Para a prevenção primária, a custo-efetividade dependerá do risco cardiovascular e idade da população, com resultados que suportam o valor do tratamento mais agressivo em indivíduos de maior risco. 426 No Brasil, uma análise de custo-efetividade de três esquemas de dosagem (baixa, intermediária e alta intensidade) das estatinas foi realizada na perspectiva do SUS. Com base nos preços de aquisição governamental, o esquema terapêutico com estatinas de potência intermediária (p. ex., atorvastatina 10 mg e sinvastatina 40 mg) foi o que apresentou melhor relação de custo-efetividade e foi sugerida como a abordagem econômica mais atrativa para o SUS tanto na prevenção primária (população de alto risco CV), quanto secundária. 427
As novas abordagens de tratamento com os inibidores da PCSK-9 necessitam de análises econômicas contextualizadas, já que são medicamentos que demonstram eficácia adicional ao tratamento de indivíduos de alto risco com risco residual, porém com um custo de tratamento muito elevado. A relação custo-efetividade dessas novas terapias é importante à medida que os custos dos serviços de saúde aumentam significativamente, e informações precisas sobre o valor e comparação entre os benefícios potenciais entre as terapias são essenciais para análises de impacto orçamentário.
Nos EUA, três estudos de modelagem demonstraram que o tratamento com inibidores de PCSK9 em indivíduos com DCV estabelecida excedeu os limites de custo-efetividade geralmente aceitos e poderiam aumentar significativamente os custos da assistência médica. 428-430 O custo médio de tratamento anual considerado nos modelos foi de US$ 14.000 a 15.000, e os autores sugerem que a redução do custo deveria ser de mais de 50% por ano para que a terapia fosse considerada custo-efetiva para a redução de eventos cardiovasculares.
13.6. Considerações Finais
A contribuição dos estudos de custo da doença e das análises econômicas é instrumentalizar os médicos e gestores para o processo de tomada de decisão, momento no qual se decide o que, quanto, para quem, a que custo, e qual o benefício da ação que está sendo produzido, possibilitando guiar o processo de decisão de modo racional e com vistas a alcançar o maior benefício coletivo com os recursos disponíveis.
Constantemente, são feitas escolhas entre tratamentos, com custos e efetividades diferentes, para uma mesma finalidade clínica. É importante, portanto, procurar a “melhor evidência” para o tratamento da enfermidade em questão e analisar o benefício proporcionado ao paciente, idealmente aquele que proporcione a melhor relação custo-efetividade. Na prática clínica do mundo real, onde existe escassez de recursos e desigualdade no acesso à saúde, o uso dos estudos da área de economia da saúde pode auxiliar muito nos processos decisórios.
Footnotes
No caso de doença subclínica aterosclerótica avançada diagnosticada como CAC superior a 100 UA ou 75% do percentil para idade e sexo, ou angiotomografia computadorizada coronariana apresentando obstruções coronárias em mais de 50%, ou presença de placas não obstrutivas em mais de um vaso, deve-se buscar reduzir o LDL-c em ao menos 50%, sendo ideal chegar a níveis < 50 mg/dL.
São considerados fatores de risco adicionais na HF: 56 idade > 40 anos e sem tratamento, tabagismo, sexo masculino, Lp(a) > 50 mg/dL, HDL-c < 40 mg/dL, hipertensão arterial, diabetes melito, história familiar de DAC prematura em parentes de 1º grau (homens < 55 anos e mulheres < 60 anos), doença renal crônica (TFG < 60 ml/min) e IMC > 30 kg/m2.
Nota:
Estas atualizações se prestam a informar e não a substituir o julgamento clínico do médico que, em última análise, deve determinar o tratamento apropriado para seus pacientes.
Referências
- 1.Burns FS. A contribution to the study of the etiology of xanthoma multiplex. Arch Derm Syphilol. 1920;2(4):415–429. [Google Scholar]; Burns FS. A contribution to the study of the etiology of xanthoma multiplex. Arch Derm Syphilol. 1920; 2(4):415-29.
- 2.Ose L. An update on familial hypercholesterolaemia. Ann Med. 1999;31(Suppl 1):13–18. [PubMed] [Google Scholar]; Ose L. An update on familial hypercholesterolaemia. Ann Med. 1999; 31(Suppl 1):13-8. [PubMed]
- 3.Müller C. Xanthomata, hypercholesterolemia and angina pectoris. Acta Med Scand Suppl. 1938;89:75–84. [Google Scholar]; Müller C. Xanthomata, hypercholesterolemia and angina pectoris. Acta Med Scand Suppl. 1938; 89:75-84.
- 4.Brown MS, Goldstein JL. Analysis of a mutant strain of human fibroblasts with a defect in the internalization of receptor bound low density lipoprotein. Cell. 1976;9(4 Pt 2):663–674. doi: 10.1016/0092-8674(76)90130-6. [DOI] [PubMed] [Google Scholar]; Brown MS, Goldstein JL. Analysis of a mutant strain of human fibroblasts with a defect in the internalization of receptor bound low density lipoprotein. Cell. 1976; 9(4 Pt 2):663-74. [DOI] [PubMed]
- 5.Brown MS, Goldstein JL. Receptor-mediated control of cholesterol metabolism. Science. 1976;191(4223):150–154. doi: 10.1126/science.174194. [DOI] [PubMed] [Google Scholar]; Brown MS, Goldstein JL. Receptor-mediated control of cholesterol metabolism. Science. 1976; 191(4223):150-4. [DOI] [PubMed]
- 6.Goldstein JL, Brown MS. Regulation of the mevalonate pathway. Nature. 1990;343(6257):425–430. doi: 10.1038/343425a0. [DOI] [PubMed] [Google Scholar]; Goldstein JL, Brown MS. Regulation of the mevalonate pathway. Nature. 1990; 343(6257):425-30. [DOI] [PubMed]
- 7.Russell DW, Yamamoto T, Schneider WJ, et al. c-DNA cloning of the bovine low-density lipoprotein receptor: feedback regulation of a receptor mRNA. Proc Natl Acad Sci USA. 1983;80(24):7501–7505. doi: 10.1073/pnas.80.24.7501. [DOI] [PMC free article] [PubMed] [Google Scholar]; Russell DW, Yamamoto T, Schneider WJ et al. c-DNA cloning of the bovine low-density lipoprotein receptor: feedback regulation of a receptor mRNA. Proc Natl Acad Sci USA. 1983; 80(24):7501-5. [DOI] [PMC free article] [PubMed]
- 8.Motulski AG. Genetic aspects of familial hypercholesterolemia and its diagnosis. Arteriosclerosis. 1989;9(1 Suppl):I3–I7. [PubMed] [Google Scholar]; Motulski AG. Genetic aspects of familial hypercholesterolemia and its diagnosis. Arteriosclerosis. 1989; 9(1 Suppl):I3-7. [PubMed]
- 9.Nordestgaard BG, Chapman MJ, Humphries SE, et al. Familial hypercholesterolemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: consensus statement of the European Atherosclerosis Society. Eur Heart J. 2013;34(45):3478a–3490a. doi: 10.1093/eurheartj/eht273. [DOI] [PMC free article] [PubMed] [Google Scholar]; Nordestgaard BG, Chapman MJ, Humphries SE et al. Familial hypercholesterolemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: consensus statement of the European Atherosclerosis Society. Eur Heart J. 2013; 34(45):3478-90a. [DOI] [PMC free article] [PubMed]
- 10.Khachadurian AK. The inheritance of essential familial hypercholesterolemia. Am J Med. 1964;37:402–407. doi: 10.1016/0002-9343(64)90196-2. [DOI] [PubMed] [Google Scholar]; Khachadurian AK. The inheritance of essential familial hypercholesterolemia. Am J Med. 1964; 37:402-7. [DOI] [PubMed]
- 11.Sjouke B, Kusters DM, Kindt I, et al. Homozygous autosomal dominant hypercholesterolemia in the Netherlands: prevalence, genotype-phenotype relationship, and clinical outcome. Eur Heart J. 2015;36(9):560–565. doi: 10.1093/eurheartj/ehu058. [DOI] [PubMed] [Google Scholar]; Sjouke B, Kusters DM, Kindt I et al. Homozygous autosomal dominant hypercholesterolemia in the Netherlands: prevalence, genotype-phenotype relationship, and clinical outcome. Eur Heart J. 2015; 36(9):560-5. [DOI] [PubMed]
- 12.Hobbs HH, Brown MS, Goldstein JL. Molecular genetics of the LDL receptor gene in familial hypercholesterolemia. Hum Mutat. 1992;1(6):445–466. doi: 10.1002/humu.1380010602. [DOI] [PubMed] [Google Scholar]; Hobbs HH, Brown MS, Goldstein JL. Molecular genetics of the LDL receptor gene in familial hypercholesterolemia. Hum Mutat. 1992; 1(6):445-66. [DOI] [PubMed]
- 13.Cuchel M, Bruckert E, Ginsberg HN, et al. Homozygous familial hypercholesterolemia: new insights and guidance for clinicians to improve detection and clinical management. A position paper from the Consensus Panel on Familial Hypercholesterolemia of the European Atherosclerosis Society. Eur Heart J. 2014;35:2146–2157. doi: 10.1093/eurheartj/ehu274. [DOI] [PMC free article] [PubMed] [Google Scholar]; Cuchel M, Bruckert E, Ginsberg HN et al. Homozygous familial hypercholesterolemia: new insights and guidance for clinicians to improve detection and clinical management. A position paper from the Consensus Panel on Familial Hypercholesterolemia of the European Atherosclerosis Society. Eur Heart J. 2014; 35:2146-57. [DOI] [PMC free article] [PubMed]
- 14.Stenson PD, Ball EV, Mort M, et al. Human gene mutation database (HGMD): 2003 update. Hum Mutat. 2003;21(6):577–581. doi: 10.1002/humu.10212. [DOI] [PubMed] [Google Scholar]; Stenson PD, Ball EV, Mort M et al. Human gene mutation database (HGMD): 2003 update. Hum Mutat. 2003; 21(6):577-81. [DOI] [PubMed]
- 15.Soria LF, Ludwig EH, Clarke HR, et al. Association between a specific apoprotein B mutation and familial defective apo B 100. Proc Natl Acad Sci USA. 1989;86(2):587–591. doi: 10.1073/pnas.86.2.587. [DOI] [PMC free article] [PubMed] [Google Scholar]; Soria LF, Ludwig EH, Clarke HR et al. Association between a specific apoprotein B mutation and familial defective apo B 100. Proc Natl Acad Sci USA. 1989; 86(2):587-91. [DOI] [PMC free article] [PubMed]
- 16.Abifadel M, Varret M, Rabès JP, et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nat Genet. 2003;34(2):154–156. doi: 10.1038/ng1161. [DOI] [PubMed] [Google Scholar]; Abifadel M, Varret M, Rabès JP et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nat Genet. 2003; 34(2):154-6. [DOI] [PubMed]
- 17.Henderson R, O’Kane M, McGilligan V, et al. The genetics and screening of familial hypercholesterolemia. J Biomed Sci. 2016;23(1):39–39. doi: 10.1186/s12929-016-0256-1. [DOI] [PMC free article] [PubMed] [Google Scholar]; Henderson R, O’Kane M, McGilligan V et al. The genetics and screening of familial hypercholesterolemia. J Biomed Sci. 2016; 23(1):39. [DOI] [PMC free article] [PubMed]
- 18.Medeiros AM, Alves AC, Bourbon M. Mutational analysis of a cohort with clinical diagnosis of familial hypercholesterolemia: considerations for genetic diagnosis improvement. Genet Med. 2016;18(4):316–324. doi: 10.1038/gim.2015.71. [DOI] [PubMed] [Google Scholar]; Medeiros AM, Alves AC, Bourbon M. Mutational analysis of a cohort with clinical diagnosis of familial hypercholesterolemia: considerations for genetic diagnosis improvement. Genet Med. 2016; 18(4):316-24. [DOI] [PubMed]
- 19.Zuliani G, Arca M, Signore A, et al. Characterization of a new form of inherited hypercholesterolemia: familial recessive hypercholesterolemia. Arterioscler Thromb Vasc Biol. 1999;19(3):802–809. doi: 10.1161/01.atv.19.3.802. [DOI] [PubMed] [Google Scholar]; Zuliani G, Arca M, Signore A et al. Characterization of a new form of inherited hypercholesterolemia: familial recessive hypercholesterolemia. Arterioscler Thromb Vasc Biol. 1999; 19(3):802-9. [DOI] [PubMed]
- 20.Brænne I, Kleinecke M, Reiz B, et al. Systematic analysis of variants related to familial hypercholesterolemia in families with premature myocardial infarction. Eur J Hum Genet. 2016;24(2):191–197. doi: 10.1038/ejhg.2015.100. [DOI] [PMC free article] [PubMed] [Google Scholar]; Brænne I, Kleinecke M, Reiz B et al. Systematic analysis of variants related to familial hypercholesterolemia in families with premature myocardial infarction. Eur J Hum Genet. 2016; 24(2):191-7. [DOI] [PMC free article] [PubMed]
- 21.Abul-Husn NS, Manickam K, Jones LK, et al. Genetic identification of familial hypercholesterolemia within a single U.S. health care system. Science. 2016;354(6319) doi: 10.1126/science.aaf7000. aqf7000. [DOI] [PubMed] [Google Scholar]; Abul-Husn NS, Manickam K, Jones LK et al. Genetic identification of familial hypercholesterolemia within a single U.S. health care system. Science. 2016; 354(6319):aqf7000. [DOI] [PubMed]
- 22.Santos RD, Gagliardi AC, Xavier HT, et al. First brazilian guidelines for familial hypercholesterolemia. Arq Bras Cardiol. 2012;99(2 Suppl 2):1–28. doi: 10.5935/abc.20120202. [DOI] [PubMed] [Google Scholar]; Santos RD, Gagliardi AC, Xavier HT et al. First brazilian guidelines for familial hypercholesterolemia. Arq Bras Cardiol. 2012; 99(2 Suppl 2):1-28. [DOI] [PubMed]
- 23.Sturm AC, Knowles JW, Gidding SS, et al. Convened by the Familial Hypercholesterolemia Foundation. Clinical Genetic Testing for Familial Hypercholesterolemia: JACC Scientific Expert Panel. J Am Coll Cardiol. 2018;72(6):662–680. doi: 10.1016/j.jacc.2018.05.044. [DOI] [PubMed] [Google Scholar]; Sturm AC, Knowles JW, Gidding SS et al. Convened by the Familial Hypercholesterolemia Foundation. Clinical Genetic Testing for Familial Hypercholesterolemia: JACC Scientific Expert Panel. J Am Coll Cardiol. 2018; 72(6):662-80. [DOI] [PubMed]
- 24.Khera AV, Won HH, Peloso GM, et al. Diagnostic yield and clinical utility of sequencing familial hypercholesterolemia genes in patients with severe hypercholesterolemia. J Am Coll Cardiol. 2016;67(22):2578–2589. doi: 10.1016/j.jacc.2016.03.520. [DOI] [PMC free article] [PubMed] [Google Scholar]; Khera AV, Won HH, Peloso GM et al. Diagnostic yield and clinical utility of sequencing familial hypercholesterolemia genes in patients with severe hypercholesterolemia. J Am Coll Cardiol. 2016; 67(22):2578-89. [DOI] [PMC free article] [PubMed]
- 25.Brasil. Ministério da Saúde Departamento de Informática do Sistema Único de Saúde (Datasus) [Acesso em: 8 fev 2019]. Disponível em: http://tabnet.datasus.gov.br/cgi/tabcgi.exe?sim/cnv/obt10uf.def.; Brasil. Ministério da Saúde. Departamento de Informática do Sistema Único de Saúde (Datasus). Disponível em: http://tabnet.datasus.gov.br/cgi/tabcgi.exe?sim/cnv/obt10uf.def. Acesso em: 8 fev 2019.
- 26.Ribeiro AL, Duncan BB, Brant LC, et al. Cardiovascular health in Brazil: trends and perspectives. Circulation. 2016;133(4):422–433. doi: 10.1161/CIRCULATIONAHA.114.008727. [DOI] [PubMed] [Google Scholar]; Ribeiro AL, Duncan BB, Brant LC et al. Cardiovascular health in Brazil: trends and perspectives. Circulation. 2016; 133(4):422-33. [DOI] [PubMed]
- 27.World Health Organization (WHO) The top 10 causes of death. Geneva: 2016. [Google Scholar]; World Health Organization (WHO). The top 10 causes of death. Geneva; 2016.
- 28.Zheng ZJ, Croft JB, Giles WH, et al. Sudden cardiac death in the United States, 1989 to 1998. Circulation. 2001;104(18):2158–2163. doi: 10.1161/hc4301.098254. [DOI] [PubMed] [Google Scholar]; Zheng ZJ, Croft JB, Giles WH et al. Sudden cardiac death in the United States, 1989 to 1998. Circulation. 2001; 104(18):2158-63. [DOI] [PubMed]
- 29.Piegas LS, Timerman A, Feitosa GS, et al. V Diretriz da Sociedade Brasileira de Cardiologia sobre Tratamento do Infarto Agudo do Miocárdio com Supradesnível do Segmento ST. Arq Bras Cardiol. 2015;105(2):1–105. doi: 10.5935/abc.20150107. [DOI] [PubMed] [Google Scholar]; Piegas LS, Timerman A, Feitosa GS et al. V Diretriz da Sociedade Brasileira de Cardiologia sobre Tratamento do Infarto Agudo do Miocárdio com Supradesnível do Segmento ST. Arq Bras Cardiol. 2015; 105(2):1-105. [DOI] [PubMed]
- 30.O’Gara PT, Kushner FG, Ascheim DD, et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2013;61(4):e78–e140. doi: 10.1016/j.jacc.2012.11.019. [DOI] [PubMed] [Google Scholar]; O’Gara PT, Kushner FG, Ascheim DD et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2013; 61(4):e78-e140. [DOI] [PubMed]
- 31.Benjamin EJ, Blaha MJ, Chiuve SE, et al. Heart disease and stroke statistics - 2017 update: a report from the American Heart Association. Circulation. 2017;135(10):e146–e603. doi: 10.1161/CIR.0000000000000485. [DOI] [PMC free article] [PubMed] [Google Scholar]; Benjamin EJ, Blaha MJ, Chiuve SE et al. Heart disease and stroke statistics - 2017 update: a report from the American Heart Association. Circulation. 2017; 135(10):e146-e603. [DOI] [PMC free article] [PubMed]
- 32.Kannel WB, Castelli WP, Gordon T, et al. Serum cholesterol, lipoproteins, and the risk of coronary heart disease. The Framingham Study. Ann Intern Med. 1971;74(1):1–12. doi: 10.7326/0003-4819-74-1-1. [DOI] [PubMed] [Google Scholar]; Kannel WB, Castelli WP, Gordon T et al. Serum cholesterol, lipoproteins, and the risk of coronary heart disease. The Framingham Study. Ann Intern Med. 1971; 74(1):1-12. [DOI] [PubMed]
- 33.Assmann G, Schulte H. The Prospective Cardiovascular Münster (PROCAM) Study: prevalence of hyperlipidemia in persons with hypertension and/or diabetes mellitus and the relationship to coronary heart disease. Am Heart J. 1988;116(6 Pt 2):1713–1724. doi: 10.1016/0002-8703(88)90220-7. [DOI] [PubMed] [Google Scholar]; Assmann G, Schulte H. The Prospective Cardiovascular Münster (PROCAM) Study: prevalence of hyperlipidemia in persons with hypertension and/or diabetes mellitus and the relationship to coronary heart disease. Am Heart J. 1988; 116(6 Pt 2):1713-24. [DOI] [PubMed]
- 34.Yusuf S, Hawken S, Ounpuu S, et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (Interheart Study): case control study. Lancet. 2004;364(9438):937–952. doi: 10.1016/S0140-6736(04)17018-9. [DOI] [PubMed] [Google Scholar]; Yusuf S, Hawken S, Ounpuu S et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (Interheart Study): case control study. Lancet. 2004; 364(9438):937-52. [DOI] [PubMed]
- 35.Lanas F, Avezum A, Bautista LE, et al. Risk factors for acute myocardial infarction in Latin America: the Interheart Latin American Study. Circulation. 2007;115(9):1067–1074. doi: 10.1161/CIRCULATIONAHA.106.633552. [DOI] [PubMed] [Google Scholar]; Lanas F, Avezum A, Bautista LE et al. Risk factors for acute myocardial infarction in Latin America: the Interheart Latin American Study. Circulation. 2007; 115(9):1067-74. [DOI] [PubMed]
- 36.O’Donnell MJ, Xavier D, Liu L, et al. Risk factors for ischemic and intracerebral hemorrhagic stroke in 22 countries (the INTERSTROKE study): a case-control study. Lancet. 2010;376(9735):112–123. doi: 10.1016/S0140-6736(10)60834-3. [DOI] [PubMed] [Google Scholar]; O’Donnell MJ, Xavier D, Liu L et al. Risk factors for ischemic and intracerebral hemorrhagic stroke in 22 countries (the INTERSTROKE study): a case-control study. Lancet. 2010; 376(9735):112-23. [DOI] [PubMed]
- 37.Benn M, Watts GF, Tybjaerg-Hansen A, et al. Familial hypercholesterolemia in the Danish general population: prevalence, coronary artery disease, and cholesterol-lowering medication. J Clin Endocrinol Metab. 2012;97(11):3956–3964. doi: 10.1210/jc.2012-1563. [DOI] [PubMed] [Google Scholar]; Benn M, Watts GF, Tybjaerg-Hansen A et al. Familial hypercholesterolemia in the Danish general population: prevalence, coronary artery disease, and cholesterol-lowering medication. J Clin Endocrinol Metab. 2012; 97(11):3956-64. [DOI] [PubMed]
- 38.Benn M, Watts GF, Tybjaerg-Hansen A, et al. Mutations causative of familial hypercholesterolemia: screening of 98 individuals from the Copenhagen General Population Study estimated a prevalence of 1 in 217. Eur Heart J. 2016;37(17):1384–1394. doi: 10.1093/eurheartj/ehw028. [DOI] [PubMed] [Google Scholar]; Benn M, Watts GF, Tybjaerg-Hansen A et al. Mutations causative of familial hypercholesterolemia: screening of 98 individuals from the Copenhagen General Population Study estimated a prevalence of 1 in 217. Eur Heart J. 2016; 37(17):1384-94. [DOI] [PubMed]
- 39.Vallejo-Vaz AJ, De Marco M, Stevens CAT, et al. Overview of the current status of familial hypercholesterolemia care in over 60 countries - the EAS Familial Hypercholesterolemia Studies Collaboration (FHSC) Atherosclerosis. 2018;277:234–255. doi: 10.1016/j.atherosclerosis.2018.08.051. [DOI] [PubMed] [Google Scholar]; Vallejo-Vaz AJ, De Marco M, Stevens CAT et al. Overview of the current status of familial hypercholesterolemia care in over 60 countries - the EAS Familial Hypercholesterolemia Studies Collaboration (FHSC). Atherosclerosis. 2018; 277:234-55. [DOI] [PubMed]
- 40.World Health Organization (WHO) Report of a second WHO consultation. Geneva: 1998. Familial hypercholesterolemia (FH). [Google Scholar]; World Health Organization (WHO). Familial hypercholesterolemia (FH). Report of a second WHO consultation. Geneva; 1998.
- 41.Harada P, Miname MH, Bensenor IM, et al. Familial hypercholesterolemia prevalence in an admixed racial society: Sex and race matter. The ELSA-Brazil. Atherosclerosis. 2018;277:273–277. doi: 10.1016/j.atherosclerosis.2018.08.021. [DOI] [PubMed] [Google Scholar]; Harada P, Miname MH, Bensenor IM et al. Familial hypercholesterolemia prevalence in an admixed racial society: Sex and race matter. The ELSA-Brazil. Atherosclerosis. 2018; 277:273-7. [DOI] [PubMed]
- 42.Hu P, Dharmayat KI, Stevens CAT, et al. Prevalence of familial hypercholesterolemia among the general population and patients with atherosclerotic cardiovascular disease: a systematic review and meta-analysis. Circulation. 2020;141(22):1742–1759. doi: 10.1161/CIRCULATIONAHA.119.044795. [DOI] [PubMed] [Google Scholar]; Hu P, Dharmayat KI, Stevens CAT et al. Prevalence of familial hypercholesterolemia among the general population and patients with atherosclerotic cardiovascular disease: a systematic review and meta-analysis. Circulation. 2020;141(22):1742–59. [DOI] [PubMed]
- 43.Beheshti SO, Madsen CM, Varbo A, Nordestgaard BG. Worldwide Prevalence of Familial Hypercholesterolemia: Meta-Analyses of 11 Million Subjects. J Am Coll Cardiol. 2020;75(20):2553–2566. doi: 10.1016/j.jacc.2020.03.057. [DOI] [PubMed] [Google Scholar]; Beheshti SO, Madsen CM, Varbo A, Nordestgaard BG. Worldwide Prevalence of Familial Hypercholesterolemia: Meta-Analyses of 11 Million Subjects. J Am Coll Cardiol. 2020; 75(20):2553-66. [DOI] [PubMed]
- 44.Goldstein JK, Hobbs HH, Brown MS. In: The metabolic & molecular basis of inherited disease. 8th ed. Scriver CR, Beaudet AL, Sly WS, Valle D, editors. New York: McGraw-Hill; 2001. Familial hypercholesterolemia; pp. 2863–2913. [Google Scholar]; Goldstein JK, Hobbs HH, Brown MS. Familial hypercholesterolemia. In: Scriver CR, Beaudet AL, Sly WS, Valle D (eds.). The metabolic & molecular basis of inherited disease. 8th ed. New York: McGraw-Hill; 2001. p. 2863-913.
- 45.Austin MA, Hutter CM, Zimmern RL, et al. Genetic causes of monogenic heterozygous familial hypercholesterolemia: a HuGe prevalence review. Am J Epidemiol. 2004;160(5):407–420. doi: 10.1093/aje/kwh236. [DOI] [PubMed] [Google Scholar]; Austin MA, Hutter CM, Zimmern RL et al. Genetic causes of monogenic heterozygous familial hypercholesterolemia: a HuGe prevalence review. Am J Epidemiol. 2004; 160(5):407-20. [DOI] [PubMed]
- 46.Versmissen J, Oosterveer DM, Yazdanpanah M, et al. Efficacy of statins in familial hypercholesterolemia: a long-term cohort. BMJ. 2008;337:a2423–a2423. doi: 10.1136/bmj.a2423. [DOI] [PMC free article] [PubMed] [Google Scholar]; Versmissen J, Oosterveer DM, Yazdanpanah M et al. Efficacy of statins in familial hypercholesterolemia: a long-term cohort. BMJ. 2008; 337:a2423. [DOI] [PMC free article] [PubMed]
- 47.Neil A, Cooper J, Betteridge J, et al. Reductions in all-cause, cancer, and coronary mortality in statin-treated patients with heterozygous familial hypercholesterolemia: a prospective registry study. Eur Heart J. 2008;29(21):2625–2633. doi: 10.1093/eurheartj/ehn422. [DOI] [PMC free article] [PubMed] [Google Scholar]; Neil A, Cooper J, Betteridge J et al. Reductions in all-cause, cancer, and coronary mortality in statin-treated patients with heterozygous familial hypercholesterolemia: a prospective registry study. Eur Heart J. 2008; 29(21):2625-33. [DOI] [PMC free article] [PubMed]
- 48.Mortality in treated heterozygous familial hypercholesterolemia: implications for clinical management. Scientific Steering Committee on behalf of the Simon Broome Register Group. Atherosclerosis. 1999;142(1):105–112. [PubMed] [Google Scholar]; Mortality in treated heterozygous familial hypercholesterolemia: implications for clinical management. Scientific Steering Committee on behalf of the Simon Broome Register Group. Atherosclerosis. 1999; 142(1):105-12. [PubMed]
- 49.Huijgen R, Vissers MN, Defesche JC, et al. Familial hypercholesterolemia: current treatment and advances in management. Expert Rev Cardiovasc Ther. 2008;6(4):567–581. doi: 10.1586/14779072.6.4.567. [DOI] [PubMed] [Google Scholar]; Huijgen R, Vissers MN, Defesche JC et al. Familial hypercholesterolemia: current treatment and advances in management. Expert Rev Cardiovasc Ther. 2008; 6(4):567-81. [DOI] [PubMed]
- 50.de Ferranti SD, Rodday AM, Mendelson MM, et al. Prevalence of familial hypercholesterolemia in the 1999 to 2012 United States National Health and Nutrition Examination Surveys (NHANES) Circulation. 2016;133(11):1067–1072. doi: 10.1161/CIRCULATIONAHA.115.018791. [DOI] [PubMed] [Google Scholar]; de Ferranti SD, Rodday AM, Mendelson MM et al. Prevalence of familial hypercholesterolemia in the 1999 to 2012 United States National Health and Nutrition Examination Surveys (NHANES). Circulation. 2016; 133(11):1067-72. [DOI] [PubMed]
- 51.Stone NJ, Levy RI, Fredrickson DS, et al. Coronary artery disease in 116 kindred with familial type II hyperlipoproteinemia. Circulation. 1974;49(3):476–488. doi: 10.1161/01.cir.49.3.476. [DOI] [PubMed] [Google Scholar]; Stone NJ, Levy RI, Fredrickson DS et al. Coronary artery disease in 116 kindred with familial type II hyperlipoproteinemia. Circulation. 1974; 49(3):476-88. [DOI] [PubMed]
- 52.Faludi AA, Izar MCO, Saraiva JFK, et al. Atualização da Diretriz Brasileira de Dislipidemias e Prevenção da Aterosclerose – 2017. Arq Bras Cardiol. 2017;109(2 Supl 1):1–76. doi: 10.5935/abc.20170121. [DOI] [PubMed] [Google Scholar]; Faludi AA, Izar MCO, Saraiva JFK et al. Atualização da Diretriz Brasileira de Dislipidemias e Prevenção da Aterosclerose – 2017. Arq Bras Cardiol. 2017; 109(2 Supl 1):1-76. [DOI] [PubMed]
- 53.Grundy SM, Stone NJ, Bailey AL, et al. 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA guideline on the management of blood cholesterol: a report of the American College of Cardiology/American Heart Association task force on clinical practice guidelines. Circulation. 2019;139(25):e1082–e1143. doi: 10.1161/CIR.0000000000000625. [DOI] [PMC free article] [PubMed] [Google Scholar]; Grundy SM, Stone NJ, Bailey AL et al. 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA guideline on the management of blood cholesterol: a report of the American College of Cardiology/American Heart Association task force on clinical practice guidelines. Circulation. 2019; 139(25):e1082-e1143. [DOI] [PMC free article] [PubMed]
- 54.Landmesser U, Chapman MJ, Stock JK, et al. 2017 update of ESC/EAS task force on practical clinical guidance for proprotein convertase subtilisin/kexin type 9 inhibition in patients with atherosclerotic cardiovascular disease or in familial hypercholesterolemia. Eur Heart J. 2018;39(14):1131–1143. doi: 10.1093/eurheartj/ehx549. [DOI] [PubMed] [Google Scholar]; Landmesser U, Chapman MJ, Stock JK et al. 2017 update of ESC/EAS task force on practical clinical guidance for proprotein convertase subtilisin/kexin type 9 inhibition in patients with atherosclerotic cardiovascular disease or in familial hypercholesterolemia. Eur Heart J. 2018; 39(14):1131-43. [DOI] [PubMed]
- 55.Sociedade Brasileira de Cardiologia Calculadora para diagnóstico de hipercolesterolemia familiar. [Acesso em 9 jun 2019]. Disponível em: http://departamentos.cardiol.br/sbc-da/2015/CALCULADORAHF2017/etapa1.htmlda/2015/CALCULADORAHF2017/etapa1.html.; Sociedade Brasileira de Cardiologia. Calculadora para diagnóstico de hipercolesterolemia familiar. Disponível em: http://departamentos.cardiol.br/sbc-da/2015/CALCULADORAHF2017/etapa1.htmlda/2015/CALCULADORAHF2017/etapa1.html. Acesso em 9 jun 2019.
- 56.Santos RD, Gidding SS, Hegele RA, et al. International Atherosclerosis Society Severe Familial Hypercholesterolemia Panel. Defining severe familial hypercholesterolemia and the implications for clinical management: a consensus statement from the International Atherosclerosis Society Severe Familial Hypercholesterolemia Panel. Lancet Diabetes Endocrinol. 2016;4(10):850–861. doi: 10.1016/S2213-8587(16)30041-9. [DOI] [PubMed] [Google Scholar]; Santos RD, Gidding SS, Hegele RA et al. International Atherosclerosis Society Severe Familial Hypercholesterolemia Panel. Defining severe familial hypercholesterolemia and the implications for clinical management: a consensus statement from the International Atherosclerosis Society Severe Familial Hypercholesterolemia Panel. Lancet Diabetes Endocrinol. 2016; 4(10):850-61. [DOI] [PubMed]
- 57.Humphries SE, Cooper JA, Capps N, et al. Simon broome familial hyperlipidemia register Group. Coronary heart disease mortality in severe vs. non-severe familial hypercholesterolemia in the simon broome register. Atherosclerosis. 2019;281:207–212. doi: 10.1016/j.atherosclerosis.2018.11.014. [DOI] [PMC free article] [PubMed] [Google Scholar]; Humphries SE, Cooper JA, Capps N et al. Simon broome familial hyperlipidemia register Group. Coronary heart disease mortality in severe vs. non-severe familial hypercholesterolemia in the simon broome register. Atherosclerosis. 2019; 281:207-12. [DOI] [PMC free article] [PubMed]
- 58.Watts GF, Gidding S, Wierzbicki AS, et al. Integrated guidance on the care of familial hypercholesterolemia from the International FH Foundation. Int J Cardiol. 2014;171(3):309–325. doi: 10.1016/j.ijcard.2013.11.025. [DOI] [PubMed] [Google Scholar]; Watts GF, Gidding S, Wierzbicki AS et al. Integrated guidance on the care of familial hypercholesterolemia from the International FH Foundation. Int J Cardiol. 2014; 171(3):309-25. [DOI] [PubMed]
- 59.Wiegman A, Gidding SS, Watts GF, et al. European Atherosclerosis Society Consensus Panel. Familial hypercholesterolemia in children and adolescents: gaining decades of life by optimizing detection and treatment. Eur Heart J. 2015;36(36):2425–2437. doi: 10.1093/eurheartj/ehv157. [DOI] [PMC free article] [PubMed] [Google Scholar]; Wiegman A, Gidding SS, Watts GF et al. European Atherosclerosis Society Consensus Panel. Familial hypercholesterolemia in children and adolescents: gaining decades of life by optimizing detection and treatment. Eur Heart J. 2015; 36(36):2425-37. [DOI] [PMC free article] [PubMed]
- 60.World Health Organization (WHO) Human Genetics Programme (1999) Familial hypercholesterolemia (FH): report of a second WHO consultation; Geneva: 1999. [Google Scholar]; World Health Organization (WHO). Human Genetics Programme (1999). Familial hypercholesterolemia (FH): report of a second WHO consultation. Geneva; 1999.
- 61.Williams RR, Hunt SC, Schumacher MC, et al. Diagnosing heterozygous familial hypercholesterolemia using new practical criteria validated by molecular genetics. Am J Cardiol. 1993;72(2):171–176. doi: 10.1016/0002-9149(93)90155-6. [DOI] [PubMed] [Google Scholar]; Williams RR, Hunt SC, Schumacher MC et al. Diagnosing heterozygous familial hypercholesterolemia using new practical criteria validated by molecular genetics. Am J Cardiol. 1993; 72(2):171-6. [DOI] [PubMed]
- 62.National Collaborating Centre for Primary Care (UK) Identification and management of familial hypercholesterolemia (FH) London: Royal College of General Practitioners (UK); 2008. Disponível em: http://www.nice.org.uk/CG71. 29 abr 2018. [PubMed] [Google Scholar]; National Collaborating Centre for Primary Care (UK). Identification and management of familial hypercholesterolemia (FH). London: Royal College of General Practitioners (UK); 2008. Disponível em: http://www.nice.org.uk/CG71. 29 abr 2018.
- 63.Hopkins PN, Toth PP, Ballantyne CM, et al. National Lipid Association Expert Panel on Familial Hypercholesterolemia. Familial hypercholesterolemias: prevalence, genetics, diagnosis and screening recommendations from the National Lipid Association Expert Panel on Familial Hypercholesterolemia. J Clin Lipidol. 2011;5(3 Suppl):S9–S17. doi: 10.1016/j.jacl.2011.03.452. [DOI] [PubMed] [Google Scholar]; Hopkins PN, Toth PP, Ballantyne CM et al. National Lipid Association Expert Panel on Familial Hypercholesterolemia. Familial hypercholesterolemias: prevalence, genetics, diagnosis and screening recommendations from the National Lipid Association Expert Panel on Familial Hypercholesterolemia. J Clin Lipidol. 2011; 5(3 Suppl):S9-S17. [DOI] [PubMed]
- 64.Scartezini M, Ferreira CEDS, Izar MCO, et al. Posicionamento sobre a flexibilização do jejum para o perfil lipídico. Arq Bras Cardiol. 2017;108(3):195–197. [Google Scholar]; Scartezini M, Ferreira CEDS, Izar MCO et al. Posicionamento sobre a flexibilização do jejum para o perfil lipídico. Arq Bras Cardiol. 2017; 108(3):195-7. [DOI] [PMC free article] [PubMed]
- 65.Seidah NG, Awan Z, Chrétien M, et al. PCSK9: a key modulator of cardiovascular health. Circ Res. 2014;114(6):1022–1036. doi: 10.1161/CIRCRESAHA.114.301621. [DOI] [PubMed] [Google Scholar]; Seidah NG, Awan Z, Chrétien M et al. PCSK9: a key modulator of cardiovascular health. Circ Res. 2014; 114(6):1022-36. [DOI] [PubMed]
- 66.Usifo E, Leigh SE, Whittall RA, et al. Low-density lipoprotein receptor gene familial hypercholesterolemia variant database: update and pathological assessment. Ann Hum Genet. 2012;76(5):387–401. doi: 10.1111/j.1469-1809.2012.00724.x. [DOI] [PubMed] [Google Scholar]; Usifo E, Leigh SE, Whittall RA et al. Low-density lipoprotein receptor gene familial hypercholesterolemia variant database: update and pathological assessment. Ann Hum Genet. 2012; 76(5):387-401. [DOI] [PubMed]
- 67.Humphries SE, Whittall RA, Hubbart CS, et al. Genetic causes of familial hypercholesterolemia in patients in the UK: relation to plasma lipid levels and coronary heart disease risk. J Med Genet. 2006;43(12):943–949. doi: 10.1136/jmg.2006.038356. [DOI] [PMC free article] [PubMed] [Google Scholar]; Humphries SE, Whittall RA, Hubbart CS et al. Genetic causes of familial hypercholesterolemia in patients in the UK: relation to plasma lipid levels and coronary heart disease risk. J Med Genet. 2006; 43(12):943-9. [DOI] [PMC free article] [PubMed]
- 68.Heath KE, Gudnason V, Humphries SE, et al. The type of mutation in the low-density lipoprotein receptor gene influences the cholesterol-lowering response of the HMG-CoA reductase inhibitor simvastatin in patients with heterozygous familial hypercholesterolemia. Atherosclerosis. 1999;143(1):41–54. doi: 10.1016/s0021-9150(98)00274-3. [DOI] [PubMed] [Google Scholar]; Heath KE, Gudnason V, Humphries SE et al. The type of mutation in the low-density lipoprotein receptor gene influences the cholesterol-lowering response of the HMG-CoA reductase inhibitor simvastatin in patients with heterozygous familial hypercholesterolemia. Atherosclerosis. 1999; 143(1):41-54. [DOI] [PubMed]
- 69.Gudnason V, Day IN, Humphries SE. Effect on plasma lipid levels of different classes of mutations in the low-density lipoprotein receptor gene in patients with familial hypercholesterolemia. Arterioscler Thromb. 1994;14(11):1717–1722. doi: 10.1161/01.atv.14.11.1717. [DOI] [PubMed] [Google Scholar]; Gudnason V, Day IN, Humphries SE. Effect on plasma lipid levels of different classes of mutations in the low-density lipoprotein receptor gene in patients with familial hypercholesterolemia. Arterioscler Thromb. 1994; 14(11):1717-22. [DOI] [PubMed]
- 70.Hobbs HH, Brown MS, Goldstein JL. Molecular genetics of the LDL receptor gene in familial hypercholesterolemia. Hum Mutat. 1992;1(6):445–466. doi: 10.1002/humu.1380010602. [DOI] [PubMed] [Google Scholar]; Hobbs HH, Brown MS, Goldstein JL. Molecular genetics of the LDL receptor gene in familial hypercholesterolemia. Hum Mutat. 1992; 1(6):445-66. [DOI] [PubMed]
- 71.Pisciotta L, Cantafora A, De Stefano F, et al. A “de novo” mutation of the LDL-receptor gene as the cause of familial hypercholesterolemia. Biochim Biophys Acta. 2002;1587(1):7–11. doi: 10.1016/s0925-4439(02)00047-9. [DOI] [PubMed] [Google Scholar]; Pisciotta L, Cantafora A, De Stefano F et al. A “de novo” mutation of the LDL-receptor gene as the cause of familial hypercholesterolemia. Biochim Biophys Acta 2002; 1587(1):7-11. [DOI] [PubMed]
- 72.Goldstein JL, Brown MS. In: The metabolic basis of inherited disease. Scriver CR, Beaudet AL, Sly WS, Valle D, editors. New York (NY): McGraw-Hill; 1989. Familial hypercholesterolemia; pp. 1195–1250. [Google Scholar]; Goldstein JL, Brown MS. Familial hypercholesterolemia. In: Scriver CR, Beaudet AL, Sly WS, Valle D (eds.). The metabolic basis of inherited disease. New York (NY): McGraw-Hill; 1989. p. 1195-250.
- 73.Iacocca MA, Chora JR, Carrié A, et al. ClinVar database of global familial hypercholesterolemia-associated DNA variants. Hum Mutat. 2018;39(11):1631–1640. doi: 10.1002/humu.23634. [DOI] [PMC free article] [PubMed] [Google Scholar]; Iacocca MA, Chora JR, Carrié A et al. ClinVar database of global familial hypercholesterolemia-associated DNA variants. Hum Mutat. 2018; 39(11)1631-40. [DOI] [PMC free article] [PubMed]
- 74.Horsthemke B, Dunning A, Humphries S. Identification of deletions in the human low-density lipoprotein receptor gene. J Med Genet. 1987;24(3):144–147. doi: 10.1136/jmg.24.3.144. [DOI] [PMC free article] [PubMed] [Google Scholar]; Horsthemke B, Dunning A, Humphries S. Identification of deletions in the human low-density lipoprotein receptor gene. J Med Genet. 1987; 24(3):144-7. [DOI] [PMC free article] [PubMed]
- 75.Hobbs HH, Leitersdorf E, Goldstein JL, et al. Multiple crm-mutations in familial hypercholesterolemia. Evidence for 13 alleles, including four deletions. J Clin Invest. 1988;81(3):909–917. doi: 10.1172/JCI113402. [DOI] [PMC free article] [PubMed] [Google Scholar]; Hobbs HH, Leitersdorf E, Goldstein JL et al. Multiple crm-mutations in familial hypercholesterolemia. Evidence for 13 alleles, including four deletions. J Clin Invest. 1988; 81(3):909-17. [DOI] [PMC free article] [PubMed]
- 76.Hobbs HH, Russell DW, Brown MS, et al. The LDL receptor locus in familial hypercholesterolemia: mutational analysis of a membrane protein. Annu Rev Genet. 1990;24:133–170. doi: 10.1146/annurev.ge.24.120190.001025. [DOI] [PubMed] [Google Scholar]; Hobbs HH, Russell DW, Brown MS et al. The LDL receptor locus in familial hypercholesterolemia: mutational analysis of a membrane protein. Annu Rev Genet. 1990; 24:133-70. [DOI] [PubMed]
- 77.Langlois S, Kastelein JJ, Hayden MR. Characterization of six partial deletions in the low-density-lipoprotein (LDL) receptor gene causing familial hypercholesterolemia (FH) Am J Hum Genet. 1988;43(1):60–68. [PMC free article] [PubMed] [Google Scholar]; Langlois S, Kastelein JJ, Hayden MR. Characterization of six partial deletions in the low-density-lipoprotein (LDL) receptor gene causing familial hypercholesterolemia (FH). Am J Hum Genet. 1988; 43(1):60-8. [PMC free article] [PubMed]
- 78.Iacocca MA, Chora JR, Carrié A, et al. ClinGen FH Variant Curation Expert Panel. ClinVar database of global familial hypercholesterolemia-associated DNA variants. Hum Mutat. 2018;39(11):1631–1640. doi: 10.1002/humu.23634. [DOI] [PMC free article] [PubMed] [Google Scholar]; Iacocca MA, Chora JR, Carrié A et al. ClinGen FH Variant Curation Expert Panel. ClinVar database of global familial hypercholesterolemia-associated DNA variants. Hum Mutat. 2018; 39(11):1631-40. [DOI] [PMC free article] [PubMed]
- 79.Villéger L, Abifadel M, Allard D, et al. The UMD-LDLR database: additions to the software and 490 new entries to the database. Hum Mutat. 2002;20(2):81–87. doi: 10.1002/humu.10102. [DOI] [PubMed] [Google Scholar]; Villéger L, Abifadel M, Allard D et al. The UMD-LDLR database: additions to the software and 490 new entries to the database. Hum Mutat. 2002; 20(2):81-7. [DOI] [PubMed]
- 80.Varret M, Abifadel M, Rabès JP, et al. Genetic heterogeneity of autosomal dominant hypercholesterolemia. Clin Genet. 2008;73(1):1–13. doi: 10.1111/j.1399-0004.2007.00915.x. [DOI] [PubMed] [Google Scholar]; Varret M, Abifadel M, Rabès JP et al. Genetic heterogeneity of autosomal dominant hypercholesterolemia, Clin Genet. 2008; 73(1):1-13. [DOI] [PubMed]
- 81.Horton JD, Cohen JC, Hobbs HH. Molecular biology of PCSK9: its role in LDL metabolism. Trends Biochem Sci. 2007;32(2):71–77. doi: 10.1016/j.tibs.2006.12.008. [DOI] [PMC free article] [PubMed] [Google Scholar]; Horton JD, Cohen JC, Hobbs HH. Molecular biology of PCSK9: its role in LDL metabolism. Trends Biochem Sci. 2007; 32(2):71-7. [DOI] [PMC free article] [PubMed]
- 82.Garcia CK, Wilund K, Arca M, et al. Autosomal recessive hypercholesterolemia caused by mutations in a putative LDL receptor adaptor protein. Science. 2001;292(5520):1394–1398. doi: 10.1126/science.1060458. [DOI] [PubMed] [Google Scholar]; Garcia CK, Wilund K, Arca M et al. Autosomal recessive hypercholesterolemia caused by mutations in a putative LDL receptor adaptor protein. Science. 2001; 292(5520):1394-8. [DOI] [PubMed]
- 83.He G, Gupta S, Yi M, et al. ARH is a modular adaptor protein that interacts with the LDL receptor, clathrin, and AP-2. J Biol Chem. 2002;277(46):44044–44049. doi: 10.1074/jbc.M208539200. [DOI] [PubMed] [Google Scholar]; He G, Gupta S, Yi M et al. ARH is a modular adaptor protein that interacts with the LDL receptor, clathrin, and AP-2. J Biol Chem. 2002; 277(46):44044-9. [DOI] [PubMed]
- 84.Pisciotta L, Priore Oliva C, Pes GM, et al. Autosomal recessive hypercholesterolemia (ARH) and homozygous familial hypercholesterolemia (FH): a phenotypic comparison. Atherosclerosis. 2006;188(2):398–405. doi: 10.1016/j.atherosclerosis.2005.11.016. [DOI] [PubMed] [Google Scholar]; Pisciotta L, Priore Oliva C, Pes GM et al. Autosomal recessive hypercholesterolemia (ARH) and homozygous familial hypercholesterolemia (FH): a phenotypic comparison. Atherosclerosis. 2006; 188(2):398-405. [DOI] [PubMed]
- 85.Brautbar A, Leary E, Rasmussen K, et al. Genetics of familial hypercholesterolemia. Curr Atheroscler Rep. 2015;17(4):491–491. doi: 10.1007/s11883-015-0491-z. [DOI] [PubMed] [Google Scholar]; Brautbar A, Leary E, Rasmussen K et al. Genetics of familial hypercholesterolemia. Curr Atheroscler Rep. 2015; 17(4):491. [DOI] [PubMed]
- 86.Wang J, Joy T, Mymin D, et al. Phenotypic heterogeneity of sitosterolemia. J Lipid Res. 2004;45(12):2361–2367. doi: 10.1194/jlr.M400310-JLR200. [DOI] [PubMed] [Google Scholar]; Wang J, Joy T, Mymin D et al. Phenotypic heterogeneity of sitosterolemia. J Lipid Res. 2004; 45(12):2361-7. [DOI] [PubMed]
- 87.Soutar AK, Naoumova RP. Mechanisms of disease: genetic causes of familial hypercholesterolemia. Nat Clin Pract Cardiovasc Med. 2007;4(4):214–225. doi: 10.1038/ncpcardio0836. [DOI] [PubMed] [Google Scholar]; Soutar AK, Naoumova RP. Mechanisms of disease: genetic causes of familial hypercholesterolemia. Nat Clin Pract Cardiovasc Med. 2007; 4(4):214-25. [DOI] [PubMed]
- 88.Foody JM, Vishwanath R. Familial hypercholesterolemia/autosomal dominant hypercholesterolemia: molecular defects, the LDL-C continuum, and gradients of phenotypic severity. J Clin Lipidol. 2016;10(4):970–986. doi: 10.1016/j.jacl.2016.04.009. [DOI] [PubMed] [Google Scholar]; Foody JM, Vishwanath R. Familial hypercholesterolemia/autosomal dominant hypercholesterolemia: molecular defects, the LDL-C continuum, and gradients of phenotypic severity. J Clin Lipidol. 2016; 10(4):970-86. [DOI] [PubMed]
- 89.Talmud PJ, Shah S, Whittall R, et al. Use of low-density lipoprotein cholesterol gene score to distinguish patients with polygenic and monogenic familial hypercholesterolaemia: a case-control study. Lancet. 2013;381(9874):1293–1301. doi: 10.1016/S0140-6736(12)62127-8. [DOI] [PubMed] [Google Scholar]; Talmud PJ, Shah S, Whittall R et al. Use of low-density lipoprotein cholesterol gene score to distinguish patients with polygenic and monogenic familial hypercholesterolaemia: a case-control study. Lancet. 2013; 381(9874):1293-301. [DOI] [PubMed]
- 90.Futema M, Shah S, Cooper JA, et al. Refinement of variant selection for the LDL cholesterol genetic risk score in the diagnosis of the polygenic form of clinical familial hypercholesterolemia and replication in samples from 6 countries. Clin Chem. 2015;61(1):231–238. doi: 10.1373/clinchem.2014.231365. [DOI] [PMC free article] [PubMed] [Google Scholar]; Futema M, Shah S, Cooper JA et al. Refinement of variant selection for the LDL cholesterol genetic risk score in the diagnosis of the polygenic form of clinical familial hypercholesterolemia and replication in samples from 6 countries. Clin Chem. 2015; 61(1):231-8. [DOI] [PMC free article] [PubMed]
- 91.Leren TP. Cascade genetic screening for familial hypercholesterolemia. Clin Genet. 2004;66(6):483–487. doi: 10.1111/j.1399-0004.2004.00320.x. [DOI] [PubMed] [Google Scholar]; Leren TP. Cascade genetic screening for familial hypercholesterolemia. Clin Genet. 2004; 66(6):483-7. [DOI] [PubMed]
- 92.Fouchier SW, Defesche JC, Umans-Eckenhausen MW, et al. The molecular basis of familial hypercholesterolemia in The Netherlands. Hum Genet. 2001;109(6):602–615. doi: 10.1007/s00439-001-0628-8. [DOI] [PubMed] [Google Scholar]; Fouchier SW, Defesche JC, Umans-Eckenhausen MW et al. The molecular basis of familial hypercholesterolemia in The Netherlands. Hum Genet. 2001; 109(6):602-15. [DOI] [PubMed]
- 93.Marks D, Wonderling D, Thorogood M, et al. Screening for hypercholesterolemia versus case finding for familial hypercholesterolemia: a systematic review and cost-effectiveness analysis. Health Technol Assess. 2000;4(29):1–123. [PubMed] [Google Scholar]; Marks D, Wonderling D, Thorogood M et al. Screening for hypercholesterolemia versus case finding for familial hypercholesterolemia: a systematic review and cost-effectiveness analysis. Health Technol Assess. 2000; 4(29):1-123. [PubMed]
- 94.Watts GF, Sullivan DR, Poplawski N, et al. Familial hypercholesterolemia: a model of care for Australasia. Atheroscler Suppl. 2011;12(2):221–263. doi: 10.1016/j.atherosclerosissup.2011.06.001. [DOI] [PubMed] [Google Scholar]; Watts GF, Sullivan DR, Poplawski N et al. Familial hypercholesterolemia: a model of care for Australasia. Atheroscler Suppl. 2011; 12(2):221-63. [DOI] [PubMed]
- 95.Watts GF, van Bockxmeer FM, Bates T, et al. A new model of care for familial hypercholesterolemia from Western Australia: closing a major gap in preventive cardiology. Heart Lung Circ. 2010;19(7):419–422. doi: 10.1016/j.hlc.2010.02.002. [DOI] [PubMed] [Google Scholar]; Watts GF, van Bockxmeer FM, Bates T et al. A new model of care for familial hypercholesterolemia from Western Australia: closing a major gap in preventive cardiology. Heart Lung Circ. 2010; 19(7):419-22. [DOI] [PubMed]
- 96.Pocovi M, Civeira F, Alonso R, et al. Familial hypercholesterolemia in Spain: case-finding program, clinical and genetic aspects. Semin Vasc Med. 2004;4(1):67–74. doi: 10.1055/s-2004-822988. [DOI] [PubMed] [Google Scholar]; Pocovi M, Civeira F, Alonso R et al. Familial hypercholesterolemia in Spain: case-finding program, clinical and genetic aspects. Semin Vasc Med. 2004; 4(1):67-74. [DOI] [PubMed]
- 97.Kusters DM, Huijgen R, Defesche JC, et al. Founder mutations in the Netherlands: geographical distribution of the most prevalent mutations in the low-density lipoprotein receptor and apolipoprotein B genes. Neth Heart J. 2011;19(4):175–182. doi: 10.1007/s12471-011-0076-6. [DOI] [PMC free article] [PubMed] [Google Scholar]; Kusters DM, Huijgen R, Defesche JC et al. Founder mutations in the Netherlands: geographical distribution of the most prevalent mutations in the low-density lipoprotein receptor and apolipoprotein B genes. Neth Heart J. 2011; 19(4):175-82. [DOI] [PMC free article] [PubMed]
- 98.Bourbon M, Alves AC, Medeiros AM, et al. Investigators of Portuguese FH Study. Familial hypercholesterolemia in Portugal. Atherosclerosis. 2008;196(2):633–642. doi: 10.1016/j.atherosclerosis.2007.07.019. [DOI] [PubMed] [Google Scholar]; Bourbon M, Alves AC, Medeiros AM et al. Investigators of Portuguese FH Study. Familial hypercholesterolemia in Portugal. Atherosclerosis. 2008; 196(2):633-42. [DOI] [PubMed]
- 99.Jannes CE, Santos RD, de Souza Silva PR, et al. Familial hypercholesterolemia in Brazil: cascade screening program, clinical and genetic aspects. Atherosclerosis. 2015;238(1):101–107. doi: 10.1016/j.atherosclerosis.2014.11.009. [DOI] [PubMed] [Google Scholar]; Jannes CE, Santos RD, de Souza Silva PR et al. Familial hypercholesterolemia in Brazil: cascade screening program, clinical and genetic aspects. Atherosclerosis. 2015; 238(1):101-7. [DOI] [PubMed]
- 100.Pollex RL, Hegele RA. Genomic copy number variation and its potential role in lipoprotein and metabolic phenotypes. Curr Opin Lipidol. 2007;18(2):174–180. doi: 10.1097/MOL.0b013e32802e6c12. [DOI] [PubMed] [Google Scholar]; Pollex RL, Hegele RA. Genomic copy number variation and its potential role in lipoprotein and metabolic phenotypes. Curr Opin Lipidol. 2007; 18(2):174-80. [DOI] [PubMed]
- 101.Leren TP, Manshaus T, Skovholt U, et al. Application of molecular genetics for diagnosing familial hypercholesterolemia in Norway: results from a family-based screening program. Semin Vasc Med. 2004;4(1):75–85. doi: 10.1055/s-2004-822989. [DOI] [PubMed] [Google Scholar]; Leren TP, Manshaus T, Skovholt U et al. Application of molecular genetics for diagnosing familial hypercholesterolemia in Norway: results from a family-based screening program. Semin Vasc Med. 2004; 4(1):75-85. [DOI] [PubMed]
- 102.MRC-Holland. MLPA (multiplex ligation-dependent probe amplification).® DNA general protocol instructions. General protocol for the detection and quantification DNA sequences. Disponível em: mrcolland.com/products/4838/MLPA%20PROTOCOL%20MDP-v007.pdf. [Google Scholar]; MRC-Holland. MLPA (multiplex ligation-dependent probe amplification).®DNA general protocol instructions. General protocol for the detection and quantification DNA sequences. Disponível em: mrcolland.com/products/4838/MLPA%20PROTOCOL%20MDP-v007.pdf.
- 103.Wonderling D, Umans-Eckenhausen MA, Marks D, et al. Cost-effectiveness analysis of the genetic screening program for familial hypercholesterolemia in The Netherlands. Semin Vasc Med. 2004;4(1):97–104. doi: 10.1055/s-2004-822992. [DOI] [PubMed] [Google Scholar]; Wonderling D, Umans-Eckenhausen MA, Marks D et al. Cost-effectiveness analysis of the genetic screening program for familial hypercholesterolemia in The Netherlands. Semin Vasc Med. 2004; 4(1):97-104. [DOI] [PubMed]
- 104.Johannesson M, Jönsson B, Kjekshus J, et al. Cost effectiveness of simvastatin treatment to lower cholesterol levels in patients with coronary heart disease. Scandinavian Simvastatin Survival Study Group. N Engl J Med. 1997;336(5):332–336. doi: 10.1056/NEJM199701303360503. [DOI] [PubMed] [Google Scholar]; Johannesson M, Jönsson B, Kjekshus J et al. Cost effectiveness of simvastatin treatment to lower cholesterol levels in patients with coronary heart disease. Scandinavian Simvastatin Survival Study Group. N Engl J Med. 1997; 336(5):332-6. [DOI] [PubMed]
- 105.Slack J. Risks of ischaemic heart-disease in familial hyperlipoproteinemic states. Lancet. 1969;2(7635):1380–1382. doi: 10.1016/s0140-6736(69)90930-1. [DOI] [PubMed] [Google Scholar]; Slack J. Risks of ischaemic heart-disease in familial hyperlipoproteinemic states. Lancet. 1969; 2(7635):1380-2. [DOI] [PubMed]
- 106.Trinder M, Li X, DeCastro ML, et al. Risk of premature atherosclerotic disease in patients with monogenic versus polygenic familial hypercholesterolemia. J Am Coll Cardiol. 2019;74(4):512–522. doi: 10.1016/j.jacc.2019.05.043. [DOI] [PubMed] [Google Scholar]; Trinder M, Li X, DeCastro ML et al. Risk of premature atherosclerotic disease in patients with monogenic versus polygenic familial hypercholesterolemia. J Am Coll Cardiol. 2019; 74(4):512-22. [DOI] [PubMed]
- 107.Galema-Boers AM, Lenzen MJ, Engelkes SR, et al. Cardiovascular risk in patients with familial hypercholesterolemia using optimal lipid-lowering therapy. J Clin Lipidol. 2018;12(2):409–416. doi: 10.1016/j.jacl.2017.12.014. [DOI] [PubMed] [Google Scholar]; Galema-Boers AM, Lenzen MJ, Engelkes SR et al. Cardiovascular risk in patients with familial hypercholesterolemia using optimal lipid-lowering therapy. J Clin Lipidol. 2018; 12(2):409-16. [DOI] [PubMed]
- 108.Ray KK, Watts GF. FH Hypercholesterolemia Studies Collaboration. Improving the global care of familial hypercholesterolemia: starting the ball rolling. Atherosclerosis. 2018;277:230–233. doi: 10.1016/j.atherosclerosis.2018.09.002. [DOI] [PubMed] [Google Scholar]; Ray KK, Watts GF. FH Hypercholesterolemia Studies Collaboration. Improving the global care of familial hypercholesterolemia: starting the ball rolling. Atherosclerosis. 2018; 277:230-3. [DOI] [PubMed]
- 109.Jansen AC, van Aalst-Cohen ES, Tanck MW, et al. The contribution of classical risk factors to cardiovascular disease in familial hypercholesterolaemia: data in 2400 patients. J Intern Med. 2004;256(6):482–490. doi: 10.1111/j.1365-2796.2004.01405.x. [DOI] [PubMed] [Google Scholar]; Jansen AC, van Aalst-Cohen ES, Tanck MW et al. The contribution of classical risk factors to cardiovascular disease in familial hypercholesterolaemia: data in 2400 patients. J Intern Med. 2004; 256(6):482-90. [DOI] [PubMed]
- 110.Akioyamen LE, Genest J, Chu A, et al. Risk factors for cardiovascular disease in heterozygous familial hypercholesterolemia: a systematic review and meta-analysis. J Clin Lipidol. 2019;13(1):15–30. doi: 10.1016/j.jacl.2018.10.012. [DOI] [PubMed] [Google Scholar]; Akioyamen LE, Genest J, Chu A et al. Risk factors for cardiovascular disease in heterozygous familial hypercholesterolemia: a systematic review and meta-analysis. J Clin Lipidol. 2019; 13(1):15-30. [DOI] [PubMed]
- 111.Alonso R, Mata N, Castillo S, et al. Cardiovascular disease in familial hypercholesterolemia: influence of low-density lipoprotein receptor mutation type and classic risk factors. Atherosclerosis. 2008;200(2):315–321. doi: 10.1016/j.atherosclerosis.2007.12.024. [DOI] [PubMed] [Google Scholar]; Alonso R, Mata N, Castillo S et al. Cardiovascular disease in familial hypercholesterolemia: influence of low-density lipoprotein receptor mutation type and classic risk factors. Atherosclerosis. 2008; 200(2):315-21. [DOI] [PubMed]
- 112.Di Angelantonio E, Gao P, Pennells L, et al. Emerging Risk Factors C. Lipid-related markers and cardiovascular disease prediction. JAMA. 2012;307(23):2499–2506. doi: 10.1001/jama.2012.6571. [DOI] [PMC free article] [PubMed] [Google Scholar]; Di Angelantonio E, Gao P, Pennells L et al. Emerging Risk Factors C. Lipid-related markers and cardiovascular disease prediction. JAMA. 2012; 307(23):2499-506. [DOI] [PMC free article] [PubMed]
- 113.Clarke R, Peden JF, Hopewell JC, et al. Genetic variants associated with Lp(a) lipoprotein level and coronary disease. N Engl J Med. 2009;361(26):2518–2528. doi: 10.1056/NEJMoa0902604. [DOI] [PubMed] [Google Scholar]; Clarke R, Peden JF, Hopewell JC et al. Genetic variants associated with Lp(a) lipoprotein level and coronary disease. N Engl J Med. 2009; 361(26):2518-28. [DOI] [PubMed]
- 114.Langested A, Kamstrup PR, Tybjaerg-Hansen A, et al. High lipoprotein(a) as a possible cause of clinical familial hypercholesterolemia: a prospective cohort study. Lancet Diabetes Endocrinol. 2016;4(7):577–587. doi: 10.1016/S2213-8587(16)30042-0. [DOI] [PubMed] [Google Scholar]; Langested A, Kamstrup PR, Tybjaerg-Hansen A et al. High lipoprotein(a) as a possible cause of clinical familial hypercholesterolemia: a prospective cohort study. Lancet Diabetes Endocrinol. 2016; 4(7):577-87. [DOI] [PubMed]
- 115.Civeira F, Castillo S, Alonso R, et al. Tendon xanthomas in familial hypercholesterolemia are associated with cardiovascular risk independently of the low-density lipoprotein receptor gene mutation. Arterioscler Thromb Vasc Biol. 2005;25(9):1960–1965. doi: 10.1161/01.ATV.0000177811.14176.2b. [DOI] [PubMed] [Google Scholar]; Civeira F, Castillo S, Alonso R et al. Tendon xanthomas in familial hypercholesterolemia are associated with cardiovascular risk independently of the low-density lipoprotein receptor gene mutation. Arterioscler Thromb Vasc Biol. 2005; 25(9):1960-5. [DOI] [PubMed]
- 116.Oosterveer DM, Versmissen J, Yazdanpanah M, et al. Differences in characteristics and risk of cardiovascular disease in familial hypercholesterolemia patients with and without tendon xanthomas: a systematic review and meta-analysis. Atherosclerosis. 2009;207(2):311–317. doi: 10.1016/j.atherosclerosis.2009.04.009. [DOI] [PubMed] [Google Scholar]; Oosterveer DM, Versmissen J, Yazdanpanah M et al. Differences in characteristics and risk of cardiovascular disease in familial hypercholesterolemia patients with and without tendon xanthomas: a systematic review and meta-analysis. Atherosclerosis. 2009; 207(2):311-7. [DOI] [PubMed]
- 117.Mangili LC, Miname MH, Silva PRS, et al. Achilles tendon xanthomas are associated with the presence and burden of subclinical coronary atherosclerosis in heterozygous familial hypercholesterolemia: A pilot study. Atherosclerosis. 2017;263:393–397. doi: 10.1016/j.atherosclerosis.2017.04.025. [DOI] [PubMed] [Google Scholar]; Mangili LC, Miname MH, Silva PRS et al. Achilles tendon xanthomas are associated with the presence and burden of subclinical coronary atherosclerosis in heterozygous familial hypercholesterolemia: A pilot study. Atherosclerosis. 2017; 263:393-7. [DOI] [PubMed]
- 118.Martinez LR, Miname MH, Bortolotto LA, et al. No correlation and low agreement of imaging and inflammatory atherosclerosis’ markers in familial hypercholesterolemia. Atherosclerosis. 2008;200(1):83–88. doi: 10.1016/j.atherosclerosis.2007.12.014. [DOI] [PubMed] [Google Scholar]; Martinez LR, Miname MH, Bortolotto LA et al. No correlation and low agreement of imaging and inflammatory atherosclerosis’ markers in familial hypercholesterolemia. Atherosclerosis. 2008; 200(1):83-8. [DOI] [PubMed]
- 119.Ye ZX, Cheng HM, Chiou KR, et al. Relation of coronary artery calcium to flow-mediated dilation and C-reactive protein levels in asymptomatic patients with heterozygous familial hypercholesterolemia. Am J Cardiol. 2007;100(7):1119–1123. doi: 10.1016/j.amjcard.2007.05.034. [DOI] [PubMed] [Google Scholar]; Ye ZX, Cheng HM, Chiou KR et al. Relation of coronary artery calcium to flow-mediated dilation and C-reactive protein levels in asymptomatic patients with heterozygous familial hypercholesterolemia. Am J Cardiol. 2007; 100(7):1119-23. [DOI] [PubMed]
- 120.Paquette M, Dufour R, Baass A. The Montreal-FH-score: a new score to predict cardiovascular events in familial hypercholesterolemia. J Clin Lipidol. 2017;11(1):80–86. doi: 10.1016/j.jacl.2016.10.004. [DOI] [PubMed] [Google Scholar]; Paquette M, Dufour R, Baass A. The Montreal-FH-score: a new score to predict cardiovascular events in familial hypercholesterolemia. J Clin Lipidol. 2017; 11(1):80-6. [DOI] [PubMed]
- 121.Paquette M, Brisson D, Dufour R, et al. Cardiovascular disease in familial hypercholesterolemia: validation and refinement of the Montreal-FH-SCORE. J Clin Lipidol. 2017;11(5):1161e3–1167e3. doi: 10.1016/j.jacl.2017.07.008. [DOI] [PubMed] [Google Scholar]; Paquette M, Brisson D, Dufour R et al. Cardiovascular disease in familial hypercholesterolemia: validation and refinement of the Montreal-FH-SCORE. J Clin Lipidol. 2017; 11(5):1161-7e3. [DOI] [PubMed]
- 122.Perez de Isla L, Alonso R, Mata N, et al. Predicting cardiovascular events in familial hypercholesterolemia: the Safeheart Registry (Spanish Familial Hypercholesterolemia Cohort Study) Circulation. 2017;135(22):2133–2144. doi: 10.1161/CIRCULATIONAHA.116.024541. [DOI] [PubMed] [Google Scholar]; Perez de Isla L, Alonso R, Mata N et al. Predicting cardiovascular events in familial hypercholesterolemia: the Safeheart Registry (Spanish Familial Hypercholesterolemia Cohort Study). Circulation. 2017; 135(22):2133-44. [DOI] [PubMed]
- 123.Miname MH, Bittencourt MS, Nasir K, et al. Subclinical coronary atherosclerosis and cardiovascular risk stratification in heterozygous familial hypercholesterolemia patients undergoing statin treatment. Curr Opin Lipidol. 2019;30(2):82–87. doi: 10.1097/MOL.0000000000000573. [DOI] [PubMed] [Google Scholar]; Miname MH, Bittencourt MS, Nasir K et al. Subclinical coronary atherosclerosis and cardiovascular risk stratification in heterozygous familial hypercholesterolemia patients undergoing statin treatment. Curr Opin Lipidol. 2019; 30(2):82-7. [DOI] [PubMed]
- 124.Neves PO, Andrade J, Moncao H. Coronary artery calcium score: current status. Radiolo Bras. 2017;50(3):182–189. doi: 10.1590/0100-3984.2015.0235. [DOI] [PMC free article] [PubMed] [Google Scholar]; Neves PO, Andrade J, Moncao H. Coronary artery calcium score: current status. Radiolo Bras. 2017; 50(3):182-9. [DOI] [PMC free article] [PubMed]
- 125.Detrano R, Guerci AD, Carr JJ, et al. Coronary calcium as a predictor of coronary events in four racial or ethnic groups. N Engl J Med. 2008;358(13):1336–1345. doi: 10.1056/NEJMoa072100. [DOI] [PubMed] [Google Scholar]; Detrano R, Guerci AD, Carr JJ et al. Coronary calcium as a predictor of coronary events in four racial or ethnic groups. N Engl J Med. 2008; 358(13):1336-45. [DOI] [PubMed]
- 126.Erbel R, Mohlenkamp S, Moebus S, et al. Coronary risk stratification, discrimination, and reclassification improvement based on quantification of subclinical coronary atherosclerosis: the Heinz Nixdorf Recall Study. J Am Coll Cardiol. 2010;56(17):1397–1406. doi: 10.1016/j.jacc.2010.06.030. [DOI] [PubMed] [Google Scholar]; Erbel R, Mohlenkamp S, Moebus S et al. Coronary risk stratification, discrimination, and reclassification improvement based on quantification of subclinical coronary atherosclerosis: the Heinz Nixdorf Recall Study. J Am Coll Cardiol. 2010; 56(17):1397-406. [DOI] [PubMed]
- 127.Pletcher MJ, Tice JA, Pignone M, et al. Using the coronary artery calcium score to predict coronary heart disease events: a systematic review and meta-analysis. Arch Int Med. 2004;164(12):1285–1292. doi: 10.1001/archinte.164.12.1285. [DOI] [PubMed] [Google Scholar]; Pletcher MJ, Tice JA, Pignone M et al. Using the coronary artery calcium score to predict coronary heart disease events: a systematic review and meta-analysis. Arch Int Med. 2004; 164(12):1285-92. [DOI] [PubMed]
- 128.Malik S, Zhao Y, Budoff M, et al. Coronary artery calcium score for long-term risk classification in individuals with type 2 diabetes and metabolic syndrome from the Multi-Ethnic Study of Atherosclerosis. JAMA cardiology. 2017;2(12):1332–1340. doi: 10.1001/jamacardio.2017.4191. [DOI] [PMC free article] [PubMed] [Google Scholar]; Malik S, Zhao Y, Budoff M et al. Coronary artery calcium score for long-term risk classification in individuals with type 2 diabetes and metabolic syndrome from the Multi-Ethnic Study of Atherosclerosis. JAMA cardiology. 2017; 2(12):1332-40. [DOI] [PMC free article] [PubMed]
- 129.Mitchell JD, Fergestrom N, Gage BF, et al. Impact of statins on cardiovascular outcomes following coronary artery calcium scoring. J Am Coll Cardiol. 2018;72(25):3233–3242. doi: 10.1016/j.jacc.2018.09.051. [DOI] [PMC free article] [PubMed] [Google Scholar]; Mitchell JD, Fergestrom N, Gage BF et al. Impact of statins on cardiovascular outcomes following coronary artery calcium scoring. J Am Coll Cardiol. 2018; 72(25):3233-42. [DOI] [PMC free article] [PubMed]
- 130.Arad Y, Spadaro LA, Roth M, et al. Treatment of asymptomatic adults with elevated coronary calcium scores with atorvastatin, vitamin C, and vitamin E: the St. Francis Heart Study Randomized Clinical Trial. J Am Coll Cardiol. 2005;46(1):166–172. doi: 10.1016/j.jacc.2005.02.089. [DOI] [PubMed] [Google Scholar]; Arad Y, Spadaro LA, Roth M et al. Treatment of asymptomatic adults with elevated coronary calcium scores with atorvastatin, vitamin C, and vitamin E: the St. Francis Heart Study Randomized Clinical Trial. J Am Coll Cardiol. 2005; 46(1):166-72. [DOI] [PubMed]
- 131.Gallo A, Giral P, Carrie A, et al. Early coronary calcifications are related to cholesterol burden in heterozygous familial hypercholesterolemia. J Clin Lipidol. 2017;11(3):704e2–711e2. doi: 10.1016/j.jacl.2017.03.016. [DOI] [PubMed] [Google Scholar]; Gallo A, Giral P, Carrie A et al. Early coronary calcifications are related to cholesterol burden in heterozygous familial hypercholesterolemia. J Clin Lipidol. 2017; 11(3):704-11e2. [DOI] [PubMed]
- 132.Mach F, Baigent C, Catapano AL, et al. ESC Scientific Document Group. 2019 ESC/EAS Guidelines for the management of dyslipidemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020;41(1):111–186. doi: 10.1093/eurheartj/ehz455. [DOI] [PubMed] [Google Scholar]; Mach F, Baigent C, Catapano AL et al. ESC Scientific Document Group. 2019 ESC/EAS Guidelines for the management of dyslipidemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020; 41(1):111-86. [DOI] [PubMed]
- 133.Miname MH, Bittencourt MS, Moraes SR, et al. Coronary artery calcium and cardiovascular events in patients with familial hypercholesterolemia receiving standard lipid-lowering therapy. JACC Cardiovascular imaging. 2019;12(9):1797–1804. doi: 10.1016/j.jcmg.2018.09.019. [DOI] [PubMed] [Google Scholar]; Miname MH, Bittencourt MS, Moraes SR et al. Coronary artery calcium and cardiovascular events in patients with familial hypercholesterolemia receiving standard lipid-lowering therapy. JACC Cardiovascular imaging. 2019; 12(9):1797-804. [DOI] [PubMed]
- 134.Hsiao EM, Rybicki FJ, Steigner M. CT coronary angiography: 256-slice and 320-detector row scanners. Curr Cardiol Rep. 2010;12(1):68–75. doi: 10.1007/s11886-009-0075-z. [DOI] [PMC free article] [PubMed] [Google Scholar]; Hsiao EM, Rybicki FJ, Steigner M. CT coronary angiography: 256-slice and 320-detector row scanners. Curr Cardiol Rep. 2010; 12(1):68-75. [DOI] [PMC free article] [PubMed]
- 135.Investigators S-H. CT coronary angiography in patients with suspected angina due to coronary heart disease (SCOT-HEART): an open-label, parallel-group, multicentre trial. Lancet. 2015;385(9985):2383–2391. doi: 10.1016/S0140-6736(15)60291-4. [DOI] [PubMed] [Google Scholar]; Investigators S-H. CT coronary angiography in patients with suspected angina due to coronary heart disease (SCOT-HEART): an open-label, parallel-group, multicentre trial. Lancet. 2015; 385(9985):2383-91. [DOI] [PubMed]
- 136.Cho I, Chang HJ, Sung JM, et al. Coronary computed tomographic angiography and risk of all-cause mortality and nonfatal myocardial infarction in subjects without chest pain syndrome from the Confirm Registry (coronary CT angiography evaluation for clinical outcomes: an international multicenter registry) Circulation. 2012;126(3):304–313. doi: 10.1161/CIRCULATIONAHA.111.081380. [DOI] [PubMed] [Google Scholar]; Cho I, Chang HJ, Sung JM et al. Coronary computed tomographic angiography and risk of all-cause mortality and nonfatal myocardial infarction in subjects without chest pain syndrome from the Confirm Registry (coronary CT angiography evaluation for clinical outcomes: an international multicenter registry). Circulation. 2012; 126(3):304-13. [DOI] [PubMed]
- 137.Han D, Hartaigh BO, Gransar H, et al. Incremental prognostic value of coronary computed tomography angiography over coronary calcium scoring for major adverse cardiac events in elderly asymptomatic individuals. Eur Heart J Cardiovasc Imaging. 2018;19(6):675–683. doi: 10.1093/ehjci/jex150. [DOI] [PMC free article] [PubMed] [Google Scholar]; Han D, Hartaigh BO, Gransar H et al. Incremental prognostic value of coronary computed tomography angiography over coronary calcium scoring for major adverse cardiac events in elderly asymptomatic individuals. Eur Heart J Cardiovasc Imaging. 2018; 19(6):675-83. [DOI] [PMC free article] [PubMed]
- 138.Cho I, Chang HJ, Hartaigh BO, et al. Incremental prognostic utility of coronary CT angiography for asymptomatic patients based upon extent and severity of coronary artery calcium: results from the Coronary CT Angiography Evaluation for Clinical Outcomes International Multicenter (CONFIRM) Study. Eur Heart J. 2015;36(8):501–508. doi: 10.1093/eurheartj/ehu358. [DOI] [PMC free article] [PubMed] [Google Scholar]; Cho I, Chang HJ, Hartaigh BO et al. Incremental prognostic utility of coronary CT angiography for asymptomatic patients based upon extent and severity of coronary artery calcium: results from the Coronary CT Angiography Evaluation for Clinical Outcomes International Multicenter (CONFIRM) Study. Eur Heart J. 2015; 36(8):501-8. [DOI] [PMC free article] [PubMed]
- 139.Miname MH, Ribeiro MS, Parga J, Filho, et al. Evaluation of subclinical atherosclerosis by computed tomography coronary angiography and its association with risk factors in familial hypercholesterolemia. Atherosclerosis. 2010;213(2):486–491. doi: 10.1016/j.atherosclerosis.2010.10.001. [DOI] [PubMed] [Google Scholar]; Miname MH, Ribeiro MS, Parga Filho J et al. Evaluation of subclinical atherosclerosis by computed tomography coronary angiography and its association with risk factors in familial hypercholesterolemia. Atherosclerosis. 2010; 213(2):486-91. [DOI] [PubMed]
- 140.Neefjes LA, Ten Kate GJ, Rossi A, et al. CT coronary plaque burden in asymptomatic patients with familial hypercholesterolemia. Heart. 2011;97(14):1151–1157. doi: 10.1136/hrt.2010.220699. [DOI] [PubMed] [Google Scholar]; Neefjes LA, Ten Kate GJ, Rossi A et al. CT coronary plaque burden in asymptomatic patients with familial hypercholesterolemia. Heart. 2011; 97(14):1151-7. [DOI] [PubMed]
- 141.Chow BJ, Small G, Yam Y, et al. Incremental prognostic value of cardiac computed tomography in coronary artery disease using CONFIRM: coronary computed tomography angiography evaluation for clinical outcomes: an International Multicenter Registry. Circulation Cardiovasc Imaging. 2011;4(5):463–472. doi: 10.1161/CIRCIMAGING.111.964155. [DOI] [PubMed] [Google Scholar]; Chow BJ, Small G, Yam Y et al. Incremental prognostic value of cardiac computed tomography in coronary artery disease using CONFIRM: coronary computed tomography angiography evaluation for clinical outcomes: an International Multicenter Registry. Circulation Cardiovasc Imaging. 2011; 4(5):463-72. [DOI] [PubMed]
- 142.Tada H, Kawashiri MA, Okada H, et al. Assessment of coronary atherosclerosis in patients with familial hypercholesterolemia by coronary computed tomography angiography. Am J Cardiol. 2015;115(6):724–729. doi: 10.1016/j.amjcard.2014.12.034. [DOI] [PubMed] [Google Scholar]; Tada H, Kawashiri MA, Okada H et al. Assessment of coronary atherosclerosis in patients with familial hypercholesterolemia by coronary computed tomography angiography. Am J Cardiol. 2015; 115(6):724-9. [DOI] [PubMed]
- 143.Muhlestein JB, Lappe DL, Lima JA, et al. Effect of screening for coronary artery disease using CT angiography on mortality and cardiac events in high-risk patients with diabetes: the FACTOR-64 randomized clinical trial. JAMA. 2014;312(21):2234–2243. doi: 10.1001/jama.2014.15825. [DOI] [PubMed] [Google Scholar]; Muhlestein JB, Lappe DL, Lima JA et al. Effect of screening for coronary artery disease using CT angiography on mortality and cardiac events in high-risk patients with diabetes: the FACTOR-64 randomized clinical trial. JAMA. 2014; 312(21):2234-43. [DOI] [PubMed]
- 144.Luirink IK, Kuipers IM, Hutten BA, et al. Coronary computed tomography angiography and echocardiography in children with homozygous familial hypercholesterolemia. Atherosclerosis. 2019;285:87–92. doi: 10.1016/j.atherosclerosis.2019.04.219. [DOI] [PubMed] [Google Scholar]; Luirink IK, Kuipers IM, Hutten BA et al. Coronary computed tomography angiography and echocardiography in children with homozygous familial hypercholesterolemia. Atherosclerosis. 2019; 285:87-92. [DOI] [PubMed]
- 145.Santos RD, Miname MH, Martinez LR, et al. Non-invasive detection of aortic and coronary atherosclerosis in homozygous familial hypercholesterolemia by 64 slice multi-detector row computed tomography angiography. Atherosclerosis. 2008;197(2):910–915. doi: 10.1016/j.atherosclerosis.2007.08.017. [DOI] [PubMed] [Google Scholar]; Santos RD, Miname MH, Martinez LR et al. Non-invasive detection of aortic and coronary atherosclerosis in homozygous familial hypercholesterolemia by 64 slice multi-detector row computed tomography angiography. Atherosclerosis. 2008; 197(2):910-5. [DOI] [PubMed]
- 146.de Groot E, Hovingh GK, Wiegman A, et al. Measurement of arterial wall thickness as a surrogate marker for atherosclerosis. Circulation. 2004;109(23 Suppl 1):III33–III38. doi: 10.1161/01.CIR.0000131516.65699.ba. [DOI] [PubMed] [Google Scholar]; de Groot E, Hovingh GK, Wiegman A et al. Measurement of arterial wall thickness as a surrogate marker for atherosclerosis. Circulation. 2004; 109(23 Suppl 1):III33-8. [DOI] [PubMed]
- 147.Kastelein JJ, Akdim F, Stroes ES, et al. Simvastatin with or without ezetimibe in familial hypercholesterolemia. N Engl J Med. 2008;358(14):1431–1443. doi: 10.1056/NEJMoa0800742. [DOI] [PubMed] [Google Scholar]; Kastelein JJ, Akdim F, Stroes ES et al. Simvastatin with or without ezetimibe in familial hypercholesterolemia. N Engl J Med. 2008; 358(14):1431-43. [DOI] [PubMed]
- 148.Smilde TJ, van Wissen S, Wollersheim H, et al. Effect of aggressive versus conventional lipid lowering on atherosclerosis progression in familial hypercholesterolemia (ASAP): a prospective, randomized, double-blind trial. Lancet. 2001;357(9256):577–581. doi: 10.1016/s0140-6736(00)04053-8. [DOI] [PubMed] [Google Scholar]; Smilde TJ, van Wissen S, Wollersheim H et al. Effect of aggressive versus conventional lipid lowering on atherosclerosis progression in familial hypercholesterolemia (ASAP): a prospective, randomized, double-blind trial. Lancet. 2001; 357(9256):577-81. [DOI] [PubMed]
- 149.Wiegman A, Hutten BA, de Groot E, et al. Efficacy and safety of statin therapy in children with familial hypercholesterolemia: a randomized controlled trial. JAMA. 2004;292(3):331–337. doi: 10.1001/jama.292.3.331. [DOI] [PubMed] [Google Scholar]; Wiegman A, Hutten BA, de Groot E et al. Efficacy and safety of statin therapy in children with familial hypercholesterolemia: a randomized controlled trial. JAMA. 2004; 292(3):331-7. [DOI] [PubMed]
- 150.Braamskamp M, Langslet G, McCrindle BW, et al. Effect of rosuvastatin on carotid intima-media thickness in children with heterozygous familial hypercholesterolemia: the Charon Study (hypercholesterolemia in children and adolescents taking rosuvastatin open label) Circulation. 2017;136(4):359–366. doi: 10.1161/CIRCULATIONAHA.116.025158. [DOI] [PubMed] [Google Scholar]; Braamskamp M, Langslet G, McCrindle BW et al. Effect of rosuvastatin on carotid intima-media thickness in children with heterozygous familial hypercholesterolemia: the Charon Study (hypercholesterolemia in children and adolescents taking rosuvastatin open label). Circulation. 2017; 136(4):359-66. [DOI] [PubMed]
- 151.Polak JF, Post WS, Carr JJ, et al. Associations of common carotid intima-media thickness with coronary heart disease risk factors and events vary with distance from the carotid bulb. J Am Soc Echocardiography. 2014;27(9):991–997. doi: 10.1016/j.echo.2014.04.019. [DOI] [PMC free article] [PubMed] [Google Scholar]; Polak JF, Post WS, Carr JJ et al. Associations of common carotid intima-media thickness with coronary heart disease risk factors and events vary with distance from the carotid bulb. J Am Soc Echocardiography. 2014; 27(9):991-7. [DOI] [PMC free article] [PubMed]
- 152.Yeboah J, McClelland RL, Polonsky TS, et al. Comparison of novel risk markers for improvement in cardiovascular risk assessment in intermediate-risk individuals. JAMA. 2012;308(8):788–795. doi: 10.1001/jama.2012.9624. [DOI] [PMC free article] [PubMed] [Google Scholar]; Yeboah J, McClelland RL, Polonsky TS et al. Comparison of novel risk markers for improvement in cardiovascular risk assessment in intermediate-risk individuals. JAMA. 2012; 308(8):788-95. [DOI] [PMC free article] [PubMed]
- 153.Naqvi TZ, Lee MS. Carotid intima-media thickness and plaque in cardiovascular risk assessment. JACC Cardiovasc Imaging. 2014;7(10):1025–1038. doi: 10.1016/j.jcmg.2013.11.014. [DOI] [PubMed] [Google Scholar]; Naqvi TZ, Lee MS. Carotid intima-media thickness and plaque in cardiovascular risk assessment. JACC Cardiovasc Imaging. 2014; 7(10):1025-38. [DOI] [PubMed]
- 154.Pitsavos CH, Chrysohoou C, Panagiotakos DB, et al. Exercise capacity and heart rate recovery as predictors of coronary heart disease events, in patients with heterozygous familial hypercholesterolemia. Atherosclerosis. 2004;173(2):347–352. doi: 10.1016/j.atherosclerosis.2003.12.027. [DOI] [PubMed] [Google Scholar]; Pitsavos CH, Chrysohoou C, Panagiotakos DB et al. Exercise capacity and heart rate recovery as predictors of coronary heart disease events, in patients with heterozygous familial hypercholesterolemia. Atherosclerosis. 2004; 173(2):347-52. [DOI] [PubMed]
- 155.Michaelides AP, Fourlas CA, Pitsavos C, et al. Exercise testing in asymptomatic patients with heterozygous familial hypercholesterolemia. Coron Artery Dis. 2004;15(8):461–465. doi: 10.1097/00019501-200412000-00001. [DOI] [PubMed] [Google Scholar]; Michaelides AP, Fourlas CA, Pitsavos C et al. Exercise testing in asymptomatic patients with heterozygous familial hypercholesterolemia. Coron Artery Dis. 2004; 15(8):461-5. [DOI] [PubMed]
- 156.Nanchen D, Gencer B, Muller O, et al. Prognosis of patients with familial hypercholesterolemia after acute coronary syndromes. Circulation. 2016;134(10):698–709. doi: 10.1161/CIRCULATIONAHA.116.023007. [DOI] [PubMed] [Google Scholar]; Nanchen D, Gencer B, Muller O et al. Prognosis of patients with familial hypercholesterolemia after acute coronary syndromes. Circulation. 2016; 134(10):698-709. [DOI] [PubMed]
- 157.Anderson TJ, Grégoire J, Pearson GJ, et al. 2016 Canadian Cardiovascular Society Guidelines for the Management of Dyslipidemia for the Prevention of Cardiovascular Disease in the Adult. Can J Cardiol. 2016;32(11):1263–1282. doi: 10.1016/j.cjca.2016.07.510. [DOI] [PubMed] [Google Scholar]; Anderson TJ, Grégoire J, Pearson GJ et al. 2016 Canadian Cardiovascular Society Guidelines for the Management of Dyslipidemia for the Prevention of Cardiovascular Disease in the Adult. Can J Cardiol. 2016; 32(11):1263-82. [DOI] [PubMed]
- 158.Eckel RH, Jakicic JM, Ard JD, et al. American College of Cardiology/American Heart Association Task Force on Practice Guidelines. 2013 AHA/ACC guideline on lifestyle management to reduce cardiovascular risk: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014;129(25 Suppl 2):S76–S99. doi: 10.1161/01.cir.0000437740.48606.d1. [DOI] [PubMed] [Google Scholar]; Eckel RH, Jakicic JM, Ard JD et al. American College of Cardiology/American Heart Association Task Force on Practice Guidelines. 2013 AHA/ACC guideline on lifestyle management to reduce cardiovascular risk: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014; 129(25 Suppl 2):S76-99. [DOI] [PubMed]
- 159.Mensink RP. Effects of saturated fatty acids on serum lipids and lipoproteins: a systematic review and regression analysis. Geneva: World Health Organization (WHO); 2016. [Google Scholar]; Mensink RP. Effects of saturated fatty acids on serum lipids and lipoproteins: a systematic review and regression analysis. Geneva: World Health Organization (WHO); 2016.
- 160.World Health Organization (WHO) Draft guidelines on dietary saturated and trans fatty acids: time for a new approach? BMJ. 2019;366:l5683–l5683. doi: 10.1136/bmj.l5683. [DOI] [PubMed] [Google Scholar]; World Health Organization (WHO). Draft guidelines on dietary saturated and trans fatty acids: time for a new approach? BMJ. 2019; 366:l5683. [DOI] [PubMed]
- 161.Estruch R, Ros E, Salas-Salvado J, et al. Retraction and republication: primary prevention of cardiovascular disease with a Mediterranean diet. N Engl J Med. 2018;378(25):2441–2442. doi: 10.1056/NEJMc1806491. [DOI] [PubMed] [Google Scholar]; Estruch R, Ros E, Salas-Salvado J et al. Retraction and republication: primary prevention of cardiovascular disease with a Mediterranean diet. N Engl J Med. 2018; 378(25):2441-2. [DOI] [PubMed]
- 162.Echouffo-Tcheugui JB, Ahima RS. Does diet quality or nutrient quantity contribute more to health? J Clin Invest. 2019;129(10):3969–3970. doi: 10.1172/JCI131449. [DOI] [PMC free article] [PubMed] [Google Scholar]; Echouffo-Tcheugui JB, Ahima RS. Does diet quality or nutrient quantity contribute more to health? J Clin Invest. 2019; 129(10):3969-70. [DOI] [PMC free article] [PubMed]
- 163.Moore TJ, Vollmer WM, Appel LJ, et al. Effect of dietary patterns on ambulatory blood pressure: results from the dietary approaches to stop hypertension (DASH) trial. DASH Collaborative Research Group. Hypertension. 1999;34:472–477. doi: 10.1161/01.hyp.34.3.472. [DOI] [PubMed] [Google Scholar]; Moore TJ, Vollmer WM, Appel LJ et al. Effect of dietary patterns on ambulatory blood pressure: results from the dietary approaches to stop hypertension (DASH) trial. DASH Collaborative Research Group. Hypertension. 1999; 34:472-7. [DOI] [PubMed]
- 164.Marklund M, Wu JHY, Imamura F, et al. Cohorts for heart and aging research in genomic epidemiology (CHARGE) fatty acids and outcomes research consortium (FORCE). Biomarkers of dietary omega-6 fatty acids and incident cardiovascular disease and mortality. Circulation. 2019;139(21):2422–2436. doi: 10.1161/CIRCULATIONAHA.118.038908. [DOI] [PMC free article] [PubMed] [Google Scholar]; Marklund M, Wu JHY, Imamura F et al. Cohorts for heart and aging research in genomic epidemiology (CHARGE) fatty acids and outcomes research consortium (FORCE). Biomarkers of dietary omega-6 fatty acids and incident cardiovascular disease and mortality. Circulation. 2019; 139(21):2422-36. [DOI] [PMC free article] [PubMed]
- 165.Wu JH, Lemaitre RN, King IB, et al. Circulating omega-6 polyunsaturated fatty acids and total and cause-specific mortality: the Cardiovascular Health Study. Circulation. 2014;130(15):1245–1253. doi: 10.1161/CIRCULATIONAHA.114.011590. [DOI] [PMC free article] [PubMed] [Google Scholar]; Wu JH, Lemaitre RN, King IB et al. Circulating omega-6 polyunsaturated fatty acids and total and cause-specific mortality: the Cardiovascular Health Study. Circulation. 2014; 130(15):1245-53. [DOI] [PMC free article] [PubMed]
- 166.U. S. Department of Agriculture and U. S . Department of Health and Human Services Dietary Guidelines for Americans. 8. ed. Washington, DC: U. S. Government Printing Office; 2015. [Google Scholar]; U. S. Department of Agriculture and U. S. Department of Health and Human Services Dietary Guidelines for Americans. 8. ed. Washington, DC: U. S. Government Printing Office; 2015. [DOI] [PMC free article] [PubMed]
- 167.Rhee EJ, Ryu S, Lee JY, et al. The association between dietary cholesterol intake and subclinical atherosclerosis in Korean adults: the Kangbuk Samsung Health Study. J Clin Lipidol. 2017;11:432–441. doi: 10.1016/j.jacl.2017.01.021. [DOI] [PubMed] [Google Scholar]; Rhee EJ, Ryu S, Lee JY et al. The association between dietary cholesterol intake and subclinical atherosclerosis in Korean adults: the Kangbuk Samsung Health Study. J Clin Lipidol. 2017; 11:432-41. [DOI] [PubMed]
- 168.Virtanen JK, Mursu J, Tuomainen TP, et al. Egg consumption and risk of incident type 2 diabetes in men: the Kuopio Ischaemic Heart Disease Risk Factor Study. Am J Clin Nutr. 2015;101(5):1088–1096. doi: 10.3945/ajcn.114.104109. [DOI] [PubMed] [Google Scholar]; Virtanen JK, Mursu J, Tuomainen TP et al. Egg consumption and risk of incident type 2 diabetes in men: the Kuopio Ischaemic Heart Disease Risk Factor Study. Am J Clin Nutr. 2015; 101(5):1088-96. [DOI] [PubMed]
- 169.Institute of Medicine . Dietary reference intakes for energy, carbohydrate, fiber, fat, fatty acids, cholesterol, protein, and amino acids. Washington, DC: The National Academies Press; 2002. [DOI] [PubMed] [Google Scholar]; Institute of Medicine. Dietary reference intakes for energy, carbohydrate, fiber, fat, fatty acids, cholesterol, protein, and amino acids. Washington, DC: The National Academies Press; 2002. [DOI] [PubMed]
- 170.McNamara DJ, Kolb R, Parker TS, et al. Heterogeneity of cholesterol homeostasis in man. Response to changesin dietary fat quality and cholesterol quantity. J Clin Invest. 1987;79(6):1729–1739. doi: 10.1172/JCI113013. [DOI] [PMC free article] [PubMed] [Google Scholar]; McNamara DJ, Kolb R, Parker TS et al. Heterogeneity of cholesterol homeostasis in man. Response to changesin dietary fat quality and cholesterol quantity. J Clin Invest. 1987; 79(6):1729-39. [DOI] [PMC free article] [PubMed]
- 171.Berger S, Raman G, Vishwanathan R, et al. Dietary cholesterol and cardiovascular disease: a systematic review and meta-analysis. Am J Clin Nutr. 2015;102(2):276–294. doi: 10.3945/ajcn.114.100305. [DOI] [PubMed] [Google Scholar]; Berger S, Raman G, Vishwanathan R et al. Dietary cholesterol and cardiovascular disease: a systematic review and meta-analysis. Am J Clin Nutr. 2015; 102(2):276-94. [DOI] [PubMed]
- 172.Freeman AM, Morris PB, Barnard N, et al. Trending cardiovascular nutrition controversies. J Am Coll Cardiol. 2017;69(9):1172–1187. doi: 10.1016/j.jacc.2016.10.086. [DOI] [PubMed] [Google Scholar]; Freeman AM, Morris PB, Barnard N et al. Trending cardiovascular nutrition controversies. J Am Coll Cardiol. 2017; 69(9):1172-87. [DOI] [PubMed]
- 173.Blesso CN, Fernandez ML. Dietary cholesterol, serum lipids, and heart disease: Are eggs working for or against you? Nutrients. 2018;10(4):426–426. doi: 10.3390/nu10040426. [DOI] [PMC free article] [PubMed] [Google Scholar]; Blesso CN, Fernandez ML. Dietary cholesterol, serum lipids, and heart disease: Are eggs working for or against you? Nutrients. 2018; 10(4):426. [DOI] [PMC free article] [PubMed]
- 174.Radzeviciene L, Ostrauskas R. Egg consumption and the risk of type 2 diabetes mellitus: a case-control study. Pub Health Nutr. 2012;15(8):1437–1441. doi: 10.1017/S1368980012000614. [DOI] [PubMed] [Google Scholar]; Radzeviciene L, Ostrauskas R. Egg consumption and the risk of type 2 diabetes mellitus: a case-control study. Pub Health Nutr. 2012; 15(8):1437-41. [DOI] [PubMed]
- 175.Djoussé L, Gaziano JM, Buring JE, et al. Egg consumption and risk of type 2 diabetes in men and women. Diabetes Care. 2009;32(2):295–300. doi: 10.2337/dc08-1271. [DOI] [PMC free article] [PubMed] [Google Scholar]; Djoussé L, Gaziano JM, Buring JE et al. Egg consumption and risk of type 2 diabetes in men and women. Diabetes Care. 2009; 32(2):295-300. [DOI] [PMC free article] [PubMed]
- 176.Cheng P, Pan J, Xia J, et al. Dietary cholesterol intake and stroke risk: a meta-analysis. Oncotarget. 2018;9(39):25698–25707. doi: 10.18632/oncotarget.23933. [DOI] [PMC free article] [PubMed] [Google Scholar]; Cheng P, Pan J, Xia J et al. Dietary cholesterol intake and stroke risk: a meta-analysis. Oncotarget. 2018; 9(39):25698-707. [DOI] [PMC free article] [PubMed]
- 177.Larsson SC, Åkesson A, Wolk A. Egg consumption and risk of heart failure, myocardial infarction, and stroke: results from 2 prospective cohorts. Am J Clin Nutr. 2015;102(5):1007–1013. doi: 10.3945/ajcn.115.119263. [DOI] [PubMed] [Google Scholar]; Larsson SC, Åkesson A, Wolk A. Egg consumption and risk of heart failure, myocardial infarction, and stroke: results from 2 prospective cohorts. Am J Clin Nutr. 2015; 102(5):1007-13. [DOI] [PubMed]
- 178.Xu L, Lam TH, Qiang C, et al. Egg consumption and the risk of cardiovascular disease and all-cause mortality: Guangzhou Biobank Cohort Study and meta-analyses. Eur J Nutr. 2018;58(2):785–796. doi: 10.1007/s00394-018-1692-3. [DOI] [PubMed] [Google Scholar]; Xu L, Lam TH, Qiang C et al. Egg consumption and the risk of cardiovascular disease and all-cause mortality: Guangzhou Biobank Cohort Study and meta-analyses. Eur J Nutr. 2018; 58(2):785-96. [DOI] [PubMed]
- 179.Zhong VW, van Horn L, Cornelis MC, et al. Associations of dietary cholesterol or egg consumption with incident cardiovascular disease and mortality. JAMA. 2019;321(11):1081–1095. doi: 10.1001/jama.2019.1572. [DOI] [PMC free article] [PubMed] [Google Scholar]; Zhong VW, Van Horn L, Cornelis MC et al. Associations of dietary cholesterol or egg consumption with incident cardiovascular disease and mortality. JAMA. 2019; 321(11):1081-95. [DOI] [PMC free article] [PubMed]
- 180.Eckel RH. Reconsidering the Importance of the Association of Egg Consumption and Dietary Cholesterol with Cardiovascular Disease Risk. JAMA. 2019;321(11):1055–1056. doi: 10.1001/jama.2019.1850. [DOI] [PubMed] [Google Scholar]; Eckel RH. Reconsidering the Importance of the Association of Egg Consumption and Dietary Cholesterol with Cardiovascular Disease Risk. JAMA. 2019; 321(11):1055-6. [DOI] [PubMed]
- 181.Orsavova J, Misurcova L, Ambrozova JV, et al. Fatty acids composition of vegetable oils and its contribution to dietary energy intake and dependence of cardiovascular mortality on dietary intake of fatty acids. Int J Mol Sci. 2015;16(6):12871–12890. doi: 10.3390/ijms160612871. [DOI] [PMC free article] [PubMed] [Google Scholar]; Orsavova J, Misurcova L, Ambrozova JV et al. Fatty acids composition of vegetable oils and its contribution to dietary energy intake and dependence of cardiovascular mortality on dietary intake of fatty acids. Int J Mol Sci. 2015; 16(6):12871-90. [DOI] [PMC free article] [PubMed]
- 182.Tvrzicka E, Kremmyda LS, Stankova B, et al. Fatty acids as biocompounds: theirrole in human metabolism, health and disease ‒ a review. Part 1: classification, dietary sources and biological functions. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2011;155(2):117–130. doi: 10.5507/bp.2011.038. [DOI] [PubMed] [Google Scholar]; Tvrzicka E, Kremmyda LS, Stankova B et al. Fatty acids as biocompounds: theirrole in human metabolism, health and disease ‒ a review. Part 1: classification, dietary sources and biological functions. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2011; 155(2):117-30. [DOI] [PubMed]
- 183.de Oliveira Otto MC, Mozaffarian D, Kromhout D, et al. Dietary intake of saturated fat by food source and incident cardiovascular disease: the Multi-Ethnic Study of Atherosclerosis. Am J Clin Nutr. 2012;96(2):397–404. doi: 10.3945/ajcn.112.037770. [DOI] [PMC free article] [PubMed] [Google Scholar]; de Oliveira Otto MC, Mozaffarian D, Kromhout D et al. Dietary intake of saturated fat by food source and incident cardiovascular disease: the Multi-Ethnic Study of Atherosclerosis. Am J Clin Nutr. 2012; 96(2):397-404. [DOI] [PMC free article] [PubMed]
- 184.Forouhi NG, Koulman A, Sharp SJ, et al. Differences in the prospective association between individual plasma phospholipid saturated fatty acids and incident type 2 diabetes: the EPIC-InterAct case-cohort study. Lancet Diabetes Endocrinol. 2014;2(10):810–818. doi: 10.1016/S2213-8587(14)70146-9. [DOI] [PMC free article] [PubMed] [Google Scholar]; Forouhi NG, Koulman A, Sharp SJ et al. Differences in the prospective association between individual plasma phospholipid saturated fatty acids and incident type 2 diabetes: the EPIC-InterAct case-cohort study. Lancet Diabetes Endocrinol. 2014; 2(10):810-8. [DOI] [PMC free article] [PubMed]
- 185.Lemaitre RN, McKnight B, Sotoodehnia N, et al. Circulating verylong-chain saturated fatty acids and heart failure: the cardiovascular healthstudy. J Am Heart Assoc. 2018;7(21):e010019. doi: 10.1161/JAHA.118.010019. [DOI] [PMC free article] [PubMed] [Google Scholar]; Lemaitre RN, McKnight B, Sotoodehnia N et al. Circulating verylong-chain saturated fatty acids and heart failure: the cardiovascular healthstudy. J Am Heart Assoc. 2018; 7(21):e010019. [DOI] [PMC free article] [PubMed]
- 186.Mozaffarian D, Micha R, Wallace S. Effects on coronary heart disease of increasing polyunsaturated fat in place of saturated fat: a systematic review and meta-analysis of randomized controlled trials. PLoS Med. 2010;7:e1000252. doi: 10.1371/journal.pmed.1000252. [DOI] [PMC free article] [PubMed] [Google Scholar]; Mozaffarian D, Micha R, Wallace S. Effects on coronary heart disease of increasing polyunsaturated fat in place of saturated fat: a systematic review and meta-analysis of randomized controlled trials. PLoS Med. 2010; 7:e1000252. [DOI] [PMC free article] [PubMed]
- 187.Astrup A, Dyerberg J, Elwood P, et al. The role of reducing intakes of saturated fatin the prevention of cardiovascular disease: where does the evidence stand in 2010? Am J Clin Nutr. 2011;93(4):684–688. doi: 10.3945/ajcn.110.004622. [DOI] [PMC free article] [PubMed] [Google Scholar]; Astrup A, Dyerberg J, Elwood P et al. The role of reducing intakes of saturated fatin the prevention of cardiovascular disease: where does the evidence stand in 2010? Am J Clin Nutr. 2011; 93(4):684-8. [DOI] [PMC free article] [PubMed]
- 188.Sacks FM, Lichtenstein AH, Wu JHY, et al. American Heart Association. Dietary fats and cardiovascular disease: a presidential advisory from the American Heart Association. Circulation. 2017;136(3):e1–e23. doi: 10.1161/CIR.0000000000000510. [DOI] [PubMed] [Google Scholar]; Sacks FM, Lichtenstein AH, Wu JHY et al. American Heart Association. Dietary fats and cardiovascular disease: a presidential advisory from the American Heart Association. Circulation. 2017; 136(3):e1-e23. [DOI] [PubMed]
- 189.Spritz N, Mishkel MA. Effects of dietary fats on plasma lipids and lipoproteins: an hypothesis for the lipid-lowering effect of unsaturated fatty acids. J Clin Invest. 1969;48(1):78–86. doi: 10.1172/JCI105976. [DOI] [PMC free article] [PubMed] [Google Scholar]; Spritz N, Mishkel MA. Effects of dietary fats on plasma lipids and lipoproteins: an hypothesis for the lipid-lowering effect of unsaturated fatty acids. J Clin Invest. 1969; 48(1):78-86. [DOI] [PMC free article] [PubMed]
- 190.Horton JD, Cuthbert JA, Spady DK. Dietary fatty acids regulate hepatic low-density lipoprotein (LDL) transport by altering LDL receptor protein and mRNA levels. J Clin Invest. 1993;92(2):743–749. doi: 10.1172/JCI116645. [DOI] [PMC free article] [PubMed] [Google Scholar]; Horton JD, Cuthbert JA, Spady DK. Dietary fatty acids regulate hepatic low-density lipoprotein (LDL) transport by altering LDL receptor protein and mRNA levels. J Clin Invest. 1993; 92(2):743-9. [DOI] [PMC free article] [PubMed]
- 191.Srivastava RA, Ito H, Hess M, et al. Regulation of low-density lipoprotein receptor gene expression in HepG2 and Caco2 cells bypalmitate, oleate, and 25-hydroxycholesterol. J Lipid Res. 1995;36(7):1434–1446. [PubMed] [Google Scholar]; Srivastava RA, Ito H, Hess M et al. Regulation of low-density lipoprotein receptor gene expression in HepG2 and Caco2 cells bypalmitate, oleate, and 25-hydroxycholesterol. J Lipid Res. 1995; 36(7):1434-46. [PubMed]
- 192.Mustad VA, Etherton TD, Cooper AD, et al. Reducing saturated fat intake is associated with increased levels of LDL receptors on mononuclear cells in healthy men and women. J Lipid Res. 1997;38(3):459–468. [PubMed] [Google Scholar]; Mustad VA, Etherton TD, Cooper AD et al. Reducing saturated fat intake is associated with increased levels of LDL receptors on mononuclear cells in healthy men and women. J Lipid Res. 1997; 38(3):459-68. [PubMed]
- 193.Nicolosi RJ, Stucchi AF, Kowala MC, et al. Effect of dietary fat saturation and cholesterol on LDL composition and metabolism. In vivo studies of receptor and nonreceptor-mediated catabolism of LDL in cebus monkeys. Arteriosclerosis. 1990;10(1):119–128. doi: 10.1161/01.atv.10.1.119. [DOI] [PubMed] [Google Scholar]; Nicolosi RJ, Stucchi AF, Kowala MC et al. Effect of dietary fat saturation and cholesterol on LDL composition and metabolism. In vivo studies of receptor and nonreceptor-mediated catabolism of LDL in cebus monkeys. Arteriosclerosis. 1990; 10(1):119-28. [DOI] [PubMed]
- 194.Bennett AJ, Billett MA, Salter AM, et al. Modulation of hepatic apolipoprotein B,3-hydroxy-3-methylglutaryl-CoA reductase and low-density lipoprotein receptor mRNA and plasma lipoprotein concentrations by defined dietary fats. Comparison of trimyristin, tripalmitin, tristearin and triolein. Biochem J. 1995;311(Pt 1):167–173. doi: 10.1042/bj3110167. [DOI] [PMC free article] [PubMed] [Google Scholar]; Bennett AJ, Billett MA, Salter AM et al. Modulation of hepatic apolipoprotein B,3-hydroxy-3-methylglutaryl-CoA reductase and low-density lipoprotein receptor mRNA and plasma lipoprotein concentrations by defined dietary fats. Comparison of trimyristin, tripalmitin, tristearin and triolein. Biochem J. 1995; 311(Pt 1):167-73. [DOI] [PMC free article] [PubMed]
- 195.Piccinin E, Cariello M, De Santis S, et al. Role of oleic acid in the gut-liver axis: from diet to the regulation of its synthesis via stearoyl-CoA desaturase 1 (SCD1) Nutrients. 2019;11(10):2283–2283. doi: 10.3390/nu11102283. [DOI] [PMC free article] [PubMed] [Google Scholar]; Piccinin E, Cariello M, De Santis S et al. Role of oleic acid in the gut-liver axis: from diet to the regulation of its synthesis via stearoyl-CoA desaturase 1 (SCD1). Nutrients. 2019; 11(10):2283. [DOI] [PMC free article] [PubMed]
- 196.Mente A, Dehghan M, Rangarajan S, et al. Prospective Urban Rural Epidemiology (PURE) Study investigators. Association of dietary nutrients with blood lipids and blood pressure in 18 countries: a cross-sectional analysis from the PURE study. Lancet Diabetes Endocrinol. 2017;5(10):774–787. doi: 10.1016/S2213-8587(17)30283-8. [DOI] [PubMed] [Google Scholar]; Mente A, Dehghan M, Rangarajan S et al. Prospective Urban Rural Epidemiology (PURE) Study investigators. Association of dietary nutrients with blood lipids and blood pressure in 18 countries: a cross-sectional analysis from the PURE study. Lancet Diabetes Endocrinol. 2017; 5(10):774-87. [DOI] [PubMed]
- 197.Hooper L, Martin N, Abdelhamid A, et al. Reduction in saturated fat intake for cardiovascular disease. Cochrane Database Syst Rev. 2015;6 doi: 10.1002/14651858.CD011737. CD011737. [DOI] [PubMed] [Google Scholar]; Hooper L, Martin N, Abdelhamid A et al. Reduction in saturated fat intake for cardiovascular disease. Cochrane Database Syst Rev. 2015; 6:CD011737. [DOI] [PubMed]
- 198.Forsyth S, Gautier S, Salem N., Jr Dietary intakes of arachidonic acid and docosahexaenoic acid in early life - with a special focus on complementary feeding in developing countries. Ann Nutr Metab. 2017;70(3):217–227. doi: 10.1159/000463396. [DOI] [PMC free article] [PubMed] [Google Scholar]; Forsyth S, Gautier S, Salem N Jr. Dietary intakes of arachidonic acid and docosahexaenoic acid in early life - with a special focus on complementary feeding in developing countries. Ann Nutr Metab. 2017; 70(3):217-27. [DOI] [PMC free article] [PubMed]
- 199.Balk EM, Lichtenstein AH, Chung M, et al. Effects of omega-3 fatty acids on serum markers of cardiovascular disease risk: a systematic review. Atherosclerosis. 2006;189(1):19–30. doi: 10.1016/j.atherosclerosis.2006.02.012. [DOI] [PubMed] [Google Scholar]; Balk EM, Lichtenstein AH, Chung M et al. Effects of omega-3 fatty acids on serum markers of cardiovascular disease risk: a systematic review. Atherosclerosis. 2006; 189(1):19-30. [DOI] [PubMed]
- 200.Harris WS. n-3 fatty acids and serum lipoproteins: human studies. Am J Clin Nutr. 1997;65(5 Suppl):1645S–1654S. doi: 10.1093/ajcn/65.5.1645S. [DOI] [PubMed] [Google Scholar]; Harris WS. n-3 fatty acids and serum lipoproteins: human studies. Am J Clin Nutr. 1997; 65(5 Suppl):1645S-1654S. [DOI] [PubMed]
- 201.Hartweg J, Perera R, Montori V, et al. Omega-3 polyunsaturated fatty acids (PUFA) for type 2 diabetes mellitus. Cochrane Database Syst Rev. 2008;(1) doi: 10.1002/14651858.CD003205.pub2. CD003205. [DOI] [PMC free article] [PubMed] [Google Scholar]; Hartweg J, Perera R, Montori V et al. Omega-3 polyunsaturated fatty acids (PUFA) for type 2 diabetes mellitus. Cochrane Database Syst Rev. 2008; (1):CD003205. [DOI] [PMC free article] [PubMed]
- 202.Abdelhamid AS, Brown TJ, Brainard JS, et al. Omega-3 fatty acids for the primary and secondary prevention of cardiovascular disease. Cochrane Database Syst Rev. 2018;11 doi: 10.1002/14651858.CD003177.pub4. CD003177. [DOI] [PMC free article] [PubMed] [Google Scholar]; Abdelhamid AS, Brown TJ, Brainard JS et al. Omega-3 fatty acids for the primary and secondary prevention of cardiovascular disease. Cochrane Database Syst Rev. 2018; 11:CD003177. [DOI] [PMC free article] [PubMed]
- 203.Brinton EA, Mason RP. Prescription omega-3 fatty acid products containing highly purified eicosapentaenoic acid (EPA) Lipids Health Dis. 2017;16(1):23–23. doi: 10.1186/s12944-017-0415-8. [DOI] [PMC free article] [PubMed] [Google Scholar]; Brinton EA, Mason RP. Prescription omega-3 fatty acid products containing highly purified eicosapentaenoic acid (EPA). Lipids Health Dis. 2017; 16(1):23. [DOI] [PMC free article] [PubMed]
- 204.Yokoyama M, Origasa H, Matsuzaki M, et al. Effects of eicosapentaenoic acid on major coronary events in hypercholesterolemic patients (JELIS): a randomized open-label, blinded endpoint analysis. Lancet. 2007;369(9567):1090–1098. doi: 10.1016/S0140-6736(07)60527-3. [DOI] [PubMed] [Google Scholar]; Yokoyama M, Origasa H, Matsuzaki M et al. Effects of eicosapentaenoic acid on major coronary events in hypercholesterolemic patients (JELIS): a randomized open-label, blinded endpoint analysis. Lancet. 2007; 369(9567):1090-8. [DOI] [PubMed]
- 205.Engler MM, Engler MG, Malloy M, et al. Docosahexaenoic acid restores endothelial function in children with hyperlipidemia: results from the EARLY Study. Int J Clin Pharmacol Ther. 2004;42(12):672–679. doi: 10.5414/cpp42672. [DOI] [PubMed] [Google Scholar]; Engler MM, Engler MG, Malloy M et al. Docosahexaenoic acid restores endothelial function in children with hyperlipidemia: results from the EARLY Study. Int J Clin Pharmacol Ther. 2004; 42(12):672-9. [DOI] [PubMed]
- 206.Balestrieri GP, Maffi V, Sleiman I, et al. Fish oil supplementation in patients with heterozygous familial hypercholesterolemia. Recenti Prog Med. 1996;87(3):102–105. [PubMed] [Google Scholar]; Balestrieri GP, Maffi V, Sleiman I et al. Fish oil supplementation in patients with heterozygous familial hypercholesterolemia. Recenti Prog Med. 1996; 87(3):102-5. [PubMed]
- 207.Malhotra A, Shafiq N, Arora A, et al. Dietary interventions (plant sterols, stanols, omega-3 fatty acids, soy protein and dietary fibers) for familial hypercholesterolemia. Cochrane Database Syst Rev. 2014;(6) doi: 10.1002/14651858.CD001918.pub3. CD001918. [DOI] [PMC free article] [PubMed] [Google Scholar]; Malhotra A, Shafiq N, Arora A et al. Dietary interventions (plant sterols, stanols, omega-3 fatty acids, soy protein and dietary fibers) for familial hypercholesterolemia. Cochrane Database Syst Rev. 2014; (6):CD001918. [DOI] [PMC free article] [PubMed]
- 208.Matthan NR, Welty FK, Barrett PH, et al. Dietary hydrogenated fat increases high-density lipoprotein Apo A-I catabolism and decreases low-density lipoprotein Apo B-100 catabolism in hypercholesterolemic women. Arterioscler Thromb Vasc Biol. 2004;24(6):1092–1097. doi: 10.1161/01.ATV.0000128410.23161.be. [DOI] [PubMed] [Google Scholar]; Matthan NR, Welty FK, Barrett PH et al. Dietary hydrogenated fat increases high-density lipoprotein Apo A-I catabolism and decreases low-density lipoprotein Apo B-100 catabolism in hypercholesterolemic women. Arterioscler Thromb Vasc Biol. 2004; 24(6):1092-7. [DOI] [PubMed]
- 209.Ahmed S, Kharroubi W, Kaoubaa N, et al. Correlation of trans fatty acids with the severity of coronary artery disease lesions. Lipids Health Dis. 2018;17(1):52–52. doi: 10.1186/s12944-018-0699-3. [DOI] [PMC free article] [PubMed] [Google Scholar]; Ahmed S, Kharroubi W, Kaoubaa N et al. Correlation of trans fatty acids with the severity of coronary artery disease lesions. Lipids Health Dis. 2018; 17(1):52. [DOI] [PMC free article] [PubMed]
- 210.Zapolska-Downar D, Kosmider A, Naruszewicz M. Trans fatty acids induce apoptosis in human endothelial cells. J Physiol Pharmacol. 2005;56(4):611–625. [PubMed] [Google Scholar]; Zapolska-Downar D, Kosmider A, Naruszewicz M. Trans fatty acids induce apoptosis in human endothelial cells. J Physiol Pharmacol. 2005; 56(4):611-25. [PubMed]
- 211.Mozaffarian D, Clarke R. Quantitative effects on cardiovascular risk factors and coronary heart disease risk of replacing partially hydrogenated vegetable oils with other fats and oils. Eur J Clin Nutr. 2009;63(Suppl 2):S22–S33. doi: 10.1038/sj.ejcn.1602976. [DOI] [PubMed] [Google Scholar]; Mozaffarian D, Clarke R. Quantitative effects on cardiovascular risk factors and coronary heart disease risk of replacing partially hydrogenated vegetable oils with other fats and oils. Eur J Clin Nutr. 2009; 63(Suppl 2):S22-33. [DOI] [PubMed]
- 212.Wang Q, Afshin A, Yakoob MY, et al. Global Burden of Diseases Nutrition and Chronic Diseases Expert Group (NutriCoDE). Impact of nonoptimal intakes of saturated, polyunsaturated, and trans fat on global burdens of coronary heart disease. J Am Heart Assoc. 2016;5(1):e002891. doi: 10.1161/JAHA.115.002891. [DOI] [PMC free article] [PubMed] [Google Scholar]; Wang Q, Afshin A, Yakoob MY et al. Global Burden of Diseases Nutrition and Chronic Diseases Expert Group (NutriCoDE). Impact of nonoptimal intakes of saturated, polyunsaturated, and trans fat on global burdens of coronary heart disease. J Am Heart Assoc. 2016; 5(1):pii:e002891. [DOI] [PMC free article] [PubMed]
- 213.GBD 2017 diet collaborators Health effects of dietary risks in 195 countries, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2019;393(10184):1958–1972. doi: 10.1016/S0140-6736(19)30041-8. [DOI] [PMC free article] [PubMed] [Google Scholar]; GBD 2017 diet collaborators. Health effects of dietary risks in 195 countries, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2019; 393(10184):1958-72. [DOI] [PMC free article] [PubMed]
- 214.Han SN, Leka LS, Lichtenstein AH, et al. Effect of hydrogenated and saturated, relative to polyunsaturated, fat on immune and inflammatory responses of adults with moderate hypercholesterolemia. J Lipid Res. 2002;43(3):445–452. [PubMed] [Google Scholar]; Han SN, Leka LS, Lichtenstein AH et al. Effect of hydrogenated and saturated, relative to polyunsaturated, fat on immune and inflammatory responses of adults with moderate hypercholesterolemia. J Lipid Res. 2002; 43(3):445-52. [PubMed]
- 215.Mensink RP, Zock PL, Kester AD, et al. Effects of dietary fatty acids and carbohydrates on the ratio of serum total to HDL cholesterol and on serum lipids and apolipoproteins: a meta-analysis of 60 controlled trials. Am J Clin Nutr. 2003;77(5):1146–1155. doi: 10.1093/ajcn/77.5.1146. [DOI] [PubMed] [Google Scholar]; Mensink RP, Zock PL, Kester AD et al. Effects of dietary fatty acids and carbohydrates on the ratio of serum total to HDL cholesterol and on serum lipids and apolipoproteins: a meta-analysis of 60 controlled trials. Am J Clin Nutr. 2003; 77(5):1146-55. [DOI] [PubMed]
- 216.Largada MJ, García-llatas G, Farré R. Analysis of phytosterols in foods. J Pharm Biomed Anal. 2006;41(1):1486–1496. doi: 10.1016/j.jpba.2006.02.052. [DOI] [PubMed] [Google Scholar]; Largada MJ, García-llatas G, Farré R. Analysis of phytosterols in foods. J Pharm Biomed Anal. 2006; 41(1):1486-96. [DOI] [PubMed]
- 217.Gylling H, Plat J, Turley S, et al. Plant sterols and plant stanols in the management of dyslipidemia and prevention of cardiovascular disease. Atherosclerosis. 2014;232(2):346–360. doi: 10.1016/j.atherosclerosis.2013.11.043. [DOI] [PubMed] [Google Scholar]; Gylling H, Plat J, Turley S et al. Plant sterols and plant stanols in the management of dyslipidemia and prevention of cardiovascular disease. Atherosclerosis 2014; 232(2):346-60. [DOI] [PubMed]
- 218.Martins CM, Fonseca FA, Ballus CA, et al. Common sources and composition of phytosterols and their estimated intake by the population in the city of Sao Paulo, Brazil. Nutrition. 2013;29(6):865–871. doi: 10.1016/j.nut.2012.12.017. [DOI] [PubMed] [Google Scholar]; Martins CM, Fonseca FA, Ballus CA et al. Common sources and composition of phytosterols and their estimated intake by the population in the city of Sao Paulo, Brazil. Nutrition. 2013; 29(6):865-71. [DOI] [PubMed]
- 219.Lottenberg AM, Nunes VS, Nakandakare ER, et al. The human cholesteryl ester transfer protein I405V polymorphism is associated with plasma cholesterol concentration and its reduction by dietary phytosterol esters. J Nutr. 2003;133(6):1800–1805. doi: 10.1093/jn/133.6.1800. [DOI] [PubMed] [Google Scholar]; Lottenberg AM, Nunes VS, Nakandakare ER et al. The human cholesteryl ester transfer protein I405V polymorphism is associated with plasma cholesterol concentration and its reduction by dietary phytosterol esters. J Nutr. 2003; 133(6):1800-5. [DOI] [PubMed]
- 220.Lottenberg AM, Nunes VS, Nakandakare ER, et al. Food phytosterol ester efficiency on the plasma lipid reduction in moderate hypercholesterolemic subjects. Arq Bras Cardiol. 2002;79(2):139–142. doi: 10.1590/s0066-782x2002001100005. [DOI] [PubMed] [Google Scholar]; Lottenberg AM, Nunes VS, Nakandakare ER et al. Food phytosterol ester efficiency on the plasma lipid reduction in moderate hypercholesterolemic subjects. Arq Bras Cardiol. 2002; 79(2):139-42. [DOI] [PubMed]
- 221.Noakes M, Clifton P, Ntanios F, et al. An increase in dietary carotenoids when consuming plant sterols or stanols is effective in maintaining plasma carotenoid concentrations. Am J Clin Nutr. 2002;75(1):79–86. doi: 10.1093/ajcn/75.1.79. [DOI] [PubMed] [Google Scholar]; Noakes M, Clifton P, Ntanios F et al. An increase in dietary carotenoids when consuming plant sterols or stanols is effective in maintaining plasma carotenoid concentrations. Am J Clin Nutr. 2002; 75(1):79-86. [DOI] [PubMed]
- 222.Machado VA, Fonseca FA, Fonseca HA, et al. Plant sterol supplementation on top of lipid-lowering therapies in familial hypercholesterolemia. Int J Cardiol. 2015;184:570–572. doi: 10.1016/j.ijcard.2015.03.063. [DOI] [PubMed] [Google Scholar]; Machado VA, Fonseca FA, Fonseca HA et al. Plant sterol supplementation on top of lipid-lowering therapies in familial hypercholesterolemia. Int J Cardiol. 2015; 184:570-2. [DOI] [PubMed]
- 223.Moruisi KG, Oosthuizen W, Opperman AM. Phytosterols/stanols lower cholesterol concentrations in familial hypercholesterolemic subjects: a systematic review with meta-analysis. J Am Coll Nutr. 2006;25(1):41–48. doi: 10.1080/07315724.2006.10719513. [DOI] [PubMed] [Google Scholar]; Moruisi KG, Oosthuizen W, Opperman AM. Phytosterols/stanols lower cholesterol concentrations in familial hypercholesterolemic subjects: a systematic review with meta-analysis. J Am Coll Nutr. 2006; 25(1):41-8. [DOI] [PubMed]
- 224.Expert Panel on Integrated Guidelines for Cardiovascular Health and Risk Reduction in Children and Adolescents; National Heart, Lung, and Blood Institute Expert panel on integrated guidelines for cardiovascular health and risk reduction in children and adolescents: summary report. Pediatrics. 2011;128(Suppl 5):S213–S256. doi: 10.1542/peds.2009-2107C. [DOI] [PMC free article] [PubMed] [Google Scholar]; Expert Panel on Integrated Guidelines for Cardiovascular Health and Risk Reduction in Children and Adolescents; National Heart, Lung, and Blood Institute. Expert panel on integrated guidelines for cardiovascular health and risk reduction in children and adolescents: summary report. Pediatrics. 2011; 128(Suppl 5):S213-56. [DOI] [PMC free article] [PubMed]
- 225.Laitinen K, Isolauri E, Kaipiainen L, et al. Plant stanol ester spreads as components of a balanced diet for pregnant and breast-feeding women: evaluation of clinical safety. Br J Nutr. 2009;101(12):1797–1804. doi: 10.1017/S0007114508133608. [DOI] [PubMed] [Google Scholar]; Laitinen K, Isolauri E, Kaipiainen L et al. Plant stanol ester spreads as components of a balanced diet for pregnant and breast-feeding women: evaluation of clinical safety. Br J Nutr. 2009; 101(12):1797-804. [DOI] [PubMed]
- 226.Vuksan V, Jenkins AL, Rogovik AL, et al. Viscosity rather than quantity of dietary fibre predicts cholesterol-lowering effect in healthy individuals. Br J Nutr. 2011;106(9):1349–1352. doi: 10.1017/S0007114511001711. [DOI] [PubMed] [Google Scholar]; Vuksan V, Jenkins AL, Rogovik AL et al. Viscosity rather than quantity of dietary fibre predicts cholesterol-lowering effect in healthy individuals. Br J Nutr. 2011; 106(9):1349-52. [DOI] [PubMed]
- 227.Gunness P, Michiels J, Vanhaecke L, et al. Reduction in circulating bile acid and restricted diffusion across the intestinal epithelium are associated with a decrease in blood cholesterol in the presence of oat β-glucan. Faseb J. 2016;30(12):4227–4238. doi: 10.1096/fj.201600465R. [DOI] [PubMed] [Google Scholar]; Gunness P, Michiels J, Vanhaecke L et al. Reduction in circulating bile acid and restricted diffusion across the intestinal epithelium are associated with a decrease in blood cholesterol in the presence of oat β -glucan. Faseb J. 2016; 30(12):4227-38. [DOI] [PubMed]
- 228.Garcia-Diez F, Garcia-Mediavilla V, Bayon JE, et al. Pectin feeding influences fecal bile acid excretion, hepatic bile acid and cholesterol synthesis and serum cholesterol in rats. J Nutr. 1996;126(7):1766–1771. doi: 10.1093/jn/126.7.1766. [DOI] [PubMed] [Google Scholar]; Garcia-Diez F, Garcia-Mediavilla V, Bayon JE et al. Pectin feeding influences fecal bile acid excretion, hepatic bile acid and cholesterol synthesis and serum cholesterol in rats. J Nutr. 1996; 126(7):1766-71. [DOI] [PubMed]
- 229.Wang Y, Harding SV, Thandapilly SJ, et al. Barley β-glucan reduces blood cholesterol levels via interrupting bile acid metabolism. Br J Nutr. 2017;118(10):822–829. doi: 10.1017/S0007114517002835. [DOI] [PubMed] [Google Scholar]; Wang Y, Harding SV, Thandapilly SJ et al. Barley β -glucan reduces blood cholesterol levels via interrupting bile acid metabolism. Br J Nutr. 2017; 118(10):822-9. [DOI] [PubMed]
- 230.Tong LT, Zhong K, Liu L, et al. Effects of dietary hull-less barley β-glucan on the cholesterol metabolism of hypercholesterolemic hamsters. Food Chem. 2015;169:344–349. doi: 10.1016/j.foodchem.2014.07.157. [DOI] [PubMed] [Google Scholar]; Tong LT, Zhong K, Liu L et al. Effects of dietary hull-less barley β -glucan on the cholesterol metabolism of hypercholesterolemic hamsters. Food Chem. 2015; 169:344-9. [DOI] [PubMed]
- 231.Hsieh YL, Yao HT, Cheng RS, et al. Chitosan reduces plasma adipocytokines and lipid accumulation in liver and adipose tissues and ameliorates insulin resistance in diabetic rats. J Med Food. 2012;15(5):453–460. doi: 10.1089/jmf.2011.1882. [DOI] [PubMed] [Google Scholar]; Hsieh YL, Yao HT, Cheng RS et al. Chitosan reduces plasma adipocytokines and lipid accumulation in liver and adipose tissues and ameliorates insulin resistance in diabetic rats. J Med Food. 2012; 15(5):453-60. [DOI] [PubMed]
- 232.Thandapilly SJ, Ndou SP, Wang Y, et al. Barley β-glucan increases fecal bile acid excretion and short chain fatty acid levels in mildly hypercholesterolemic individuals. Food Funct. 2018;9(6):3092–3096. doi: 10.1039/c8fo00157j. [DOI] [PubMed] [Google Scholar]; Thandapilly SJ, Ndou SP, Wang Y et al. Barley β -glucan increases fecal bile acid excretion and short chain fatty acid levels in mildly hypercholesterolemic individuals. Food Funct. 2018; 9(6):3092-6. [DOI] [PubMed]
- 233.Whitehead A, Beck EJ, Tosh S, et al. Cholesterol-lowering effects of oat β-glucan: a meta-analysis of randomized controlled trials. Am J Clin Nutr. 2014;100(6):1413–1421. doi: 10.3945/ajcn.114.086108. [DOI] [PMC free article] [PubMed] [Google Scholar]; Whitehead A, Beck EJ, Tosh S et al. Cholesterol-lowering effects of oat β-glucan: a meta-analysis of randomized controlled trials. Am J Clin Nutr. 2014; 100(6):1413-21. [DOI] [PMC free article] [PubMed]
- 234.Hartley L, May MD, Loveman E, et al. Dietary fibre for the primary prevention of cardiovascular disease. Cochrane Database Syst Rev. 2016;(1) doi: 10.1002/14651858.CD011472.pub2. CD011472. [DOI] [PMC free article] [PubMed] [Google Scholar]; Hartley L, May MD, Loveman E et al. Dietary fibre for the primary prevention of cardiovascular disease. Cochrane Database Syst Rev. 2016; (1):CD011472. [DOI] [PMC free article] [PubMed]
- 235.McVeigh BL, Dillingham BL, Lampe JW, et al. Effect of soy protein varying in isoflavone content on serum lipids in healthy young men. Am J Clin Nutr. 2006;83(2):244–251. doi: 10.1093/ajcn/83.2.244. [DOI] [PubMed] [Google Scholar]; McVeigh BL, Dillingham BL, Lampe JW et al. Effect of soy protein varying in isoflavone content on serum lipids in healthy young men. Am J Clin Nutr. 2006; 83(2):244-51. [DOI] [PubMed]
- 236.Høie LH, Morgenstern EC, Gruenwald J, et al. A double-blind placebo-controlled clinical trial compares the cholesterol-lowering effects of two different soy protein preparations in hypercholesterolemic subjects. Eur J Nutr. 2005;44(2):65–71. doi: 10.1007/s00394-004-0492-0. [DOI] [PubMed] [Google Scholar]; Høie LH, Morgenstern EC, Gruenwald J et al. A double-blind placebo-controlled clinical trial compares the cholesterol-lowering effects of two different soy protein preparations in hypercholesterolemic subjects. Eur J Nutr. 2005; 44(2):65-71. [DOI] [PubMed]
- 237.Sacks FM, Lichtenstein A, van Horn L, Harris W, Kris-Etherton P, Winston M. American Heart Association Nutrition Committee. Soy protein, isoflavones, and cardiovascular health: an American Heart Association Science Advisory for professionals from the Nutrition Committee. Circulation. 2006;113(7):1034–1044. doi: 10.1161/CIRCULATIONAHA.106.171052. [DOI] [PubMed] [Google Scholar]; Sacks FM, Lichtenstein A, Van Horn L, Harris W, Kris-Etherton P, Winston M, American Heart Association Nutrition Committee. Soy protein, isoflavones, and cardiovascular health: an American Heart Association Science Advisory for professionals from the Nutrition Committee. Circulation. 2006; 113(7):1034-44. [DOI] [PubMed]
- 238.Torres-Moreno M, Torrescasana E, Salas-Salvadó J, et al. Nutritional composition and fatty acids profile in cocoa beans and chocolates with different geographical origin and processing conditions. Food Chem. 2015;166:125–132. doi: 10.1016/j.foodchem.2014.05.141. [DOI] [PubMed] [Google Scholar]; Torres-Moreno M, Torrescasana E, Salas-Salvadó J et al. Nutritional composition and fatty acids profile in cocoa beans and chocolates with different geographical origin and processing conditions. Food Chem. 2015; 166:125-32. [DOI] [PubMed]
- 239.Jia L, Liu X, Bai YY, et al. Short-term effect of cocoa product consumption on lipid profile: a meta-analysis of randomized controlled trials. Am J Clin Nutr. 2010;92(1):218–225. doi: 10.3945/ajcn.2009.28202. [DOI] [PubMed] [Google Scholar]; Jia L, Liu X, Bai YY et al. Short-term effect of cocoa product consumption on lipid profile: a meta-analysis of randomized controlled trials. Am J Clin Nutr. 2010; 92(1):218-25. [DOI] [PubMed]
- 240.Tokede OA, Gaziano JM, Djoussé L. Effects of cocoa products/dark chocolate on serum lipids: a meta-analysis. Eur J Clin Nutr. 2011;65(8):879–886. doi: 10.1038/ejcn.2011.64. [DOI] [PubMed] [Google Scholar]; Tokede OA, Gaziano JM, Djoussé L. Effects of cocoa products/dark chocolate on serum lipids: a meta-analysis. Eur J Clin Nutr. 2011; 65(8):879-86. [DOI] [PubMed]
- 241.Grundy SM. Influence of stearic acid on cholesterol metabolism relative to other long-chain fatty acids. Am J Clin Nutr. 1994;60(6 Suppl):986S–990S. doi: 10.1093/ajcn/60.6.986S. [DOI] [PubMed] [Google Scholar]; Grundy SM. Influence of stearic acid on cholesterol metabolism relative to other long-chain fatty acids. Am J Clin Nutr. 1994; 60(6 Suppl):986S-990S. [DOI] [PubMed]
- 242.U. S. Department of Agriculture Agricultural Research Service. SR legacy, fats and oils - FDC ID:171142 NDB number: 4047. [Acesso em: 12 fev 2020]. Disponível em: https://fdc.nal.usda.gov/fdc-app.html#/food-details/171412/nutrients.; U. S. Department of Agriculture. Agricultural Research Service. SR legacy, fats and oils - FDC ID:171142 NDB number: 4047. Disponível em: https://fdc.nal.usda.gov/fdc-app.html#/food-details/171412/nutrients. Acesso em: 12 fev 2020.
- 243.Eyres L, Eyres MF, Chisholm A, et al. Coconut oil consumption and cardiovascular risk factors in humans. Nutr Rev. 2016;74(4):267–280. doi: 10.1093/nutrit/nuw002. [DOI] [PMC free article] [PubMed] [Google Scholar]; Eyres L, Eyres MF, Chisholm A et al. Coconut oil consumption and cardiovascular risk factors in humans. Nutr Rev. 2016; 74(4):267-80. [DOI] [PMC free article] [PubMed]
- 244.Voon PT, Ng TK, Lee VK, et al. Diets high in palmitic acid (16:0), lauric and myristic acids (12:0 + 14:0), or oleic acid (18:1) do not alter postprandial or fasting plasma homocysteine and inflammatory markers in healthy Malaysian adults. Am J Clin Nutr. 2011;94(6):1451–1457. doi: 10.3945/ajcn.111.020107. [DOI] [PubMed] [Google Scholar]; Voon PT, Ng TK, Lee VK et al. Diets high in palmitic acid (16:0), lauric and myristic acids (12:0 + 14:0), or oleic acid (18:1) do not alter postprandial or fasting plasma homocysteine and inflammatory markers in healthy Malaysian adults. Am J Clin Nutr. 2011; 94(6):1451-7. [DOI] [PubMed]
- 245.Cox C, Sutherland W, Mann J, et al. Effects of dietary coconut oil, butter and safflower oil on plasma lipids, lipoproteins and lathosterol levels. Eur J Clin Nutr. 1998;52(9):650–654. doi: 10.1038/sj.ejcn.1600621. [DOI] [PubMed] [Google Scholar]; Cox C, Sutherland W, Mann J et al. Effects of dietary coconut oil, butter and safflower oil on plasma lipids, lipoproteins and lathosterol levels. Eur J Clin Nutr. 1998; 52(9):650-4. [DOI] [PubMed]
- 246.Mendis S, Kumarasundaram R. The effect of daily consumption of coconut fat and soya-bean fat on plasma lipids and lipoproteins of young normolipidaemic men. Br J Clin Nutr. 1990;63(3):547–552. doi: 10.1079/bjn19900141. [DOI] [PubMed] [Google Scholar]; Mendis S, Kumarasundaram R. The effect of daily consumption of coconut fat and soya-bean fat on plasma lipids and lipoproteins of young normolipidaemic men. Br J Clin Nutr. 1990; 63(3):547-52. [DOI] [PubMed]
- 247.Maki KC, Hasse W, Dicklin MR, et al. Corn oil lowers plasma cholesterol compared with coconut oil in adults with above-desirable levels of cholesterol in a randomized crossover trial. J Nutr. 2018;148(10):1556–1563. doi: 10.1093/jn/nxy156. [DOI] [PMC free article] [PubMed] [Google Scholar]; Maki KC, Hasse W, Dicklin MR et al. Corn oil lowers plasma cholesterol compared with coconut oil in adults with above-desirable levels of cholesterol in a randomized crossover trial. J Nutr. 2018; 148(10):1556-63. [DOI] [PMC free article] [PubMed]
- 248.Feranil AB, Duazo PL, Kuzawa CW, et al. Coconut oil is associated with a beneficial lipid profile in pre-menopausal women in the Philippines. Asia Pac J Clin Nutr. 2011;20(2):190–195. [PMC free article] [PubMed] [Google Scholar]; Feranil AB, Duazo PL, Kuzawa CW et al. Coconut oil is associated with a beneficial lipid profile in pre-menopausal women in the Philippines. Asia Pac J Clin Nutr. 2011; 20(2):190-5. [PMC free article] [PubMed]
- 249.Lee JY, Sohn KH, Rhee SH, et al. Saturated fatty acids, but not unsaturated fatty acids, induce the expression of cyclooxygenase-2 mediated through Toll-like receptor 4. J Biol Chem. 2001;276(20):16683–16689. doi: 10.1074/jbc.M011695200. [DOI] [PubMed] [Google Scholar]; Lee JY, Sohn KH, Rhee SH et al. Saturated fatty acids, but not unsaturated fatty acids, induce the expression of cyclooxygenase-2 mediated through Toll-like receptor 4. J Biol Chem. 2001; 276(20):16683-9. [DOI] [PubMed]
- 250.Velloso LA, Folli F, Saad MJ. TLR4 at the crossroads of nutrients, gut microbiota, and metabolic inflammation. Endocr Rev. 2015;36(3):245–271. doi: 10.1210/er.2014-1100. [DOI] [PubMed] [Google Scholar]; Velloso LA, Folli F, Saad MJ. TLR4 at the crossroads of nutrients, gut microbiota, and metabolic inflammation. Endocr Rev. 2015; 36(3):245-71. [DOI] [PubMed]
- 251.Weatherill AR, Lee JY, Zhao L, et al. Saturated and polyunsaturated fatty acids reciprocally modulate dendritic cell functions mediated through TLR4. J Immunol. 2005;174(9):5390–5397. doi: 10.4049/jimmunol.174.9.5390. [DOI] [PubMed] [Google Scholar]; Weatherill AR, Lee JY, Zhao L et al. Saturated and polyunsaturated fatty acids reciprocally modulate dendritic cell functions mediated through TLR4. J Immunol. 2005; 174(9):5390-7. [DOI] [PubMed]
- 252.Lee JY, Ye J, Gao Z, et al. Reciprocal modulation of toll-like receptor-4 signaling pathways involving MyD88 and phosphatidylinositol 3-kinase/AKT by saturated and polyunsaturated fatty acids. J Biol Chem. 2003;278(39):37041–37051. doi: 10.1074/jbc.M305213200. [DOI] [PubMed] [Google Scholar]; Lee JY, Ye J, Gao Z et al. Reciprocal modulation of toll-like receptor-4 signaling pathways involving MyD88 and phosphatidylinositol 3-kinase/AKT by saturated and polyunsaturated fatty acids. J Biol Chem. 2003; 278(39):37041-51. [DOI] [PubMed]
- 253.Valente FX, Cândido FG, Lopes LL, et al. Effects of coconut oil consumption on energy metabolism, cardiometabolic risk markers, and appetitive responses in women with excess body fat. Eur J Nutr. 2017;57(4):1627–1637. doi: 10.1007/s00394-017-1448-5. [DOI] [PubMed] [Google Scholar]; Valente FX, Cândido FG, Lopes LL et al. Effects of coconut oil consumption on energy metabolism, cardiometabolic risk markers, and appetitive responses in women with excess body fat. Eur J Nutr. 2017; 57(4)1627-37. [DOI] [PubMed]
- 254.Karupaiah T, Chuah KA, Chinna K, et al. Comparing effects of soybean oil- and palm olein-based mayonnaise consumption on the plasma lipid and lipoprotein profiles in human subjects: a double-blind randomized controlled trial with cross-over design. Lipids Health Dis. 2016;15:131–131. doi: 10.1186/s12944-016-0301-9. [DOI] [PMC free article] [PubMed] [Google Scholar]; Karupaiah T, Chuah KA, Chinna K et al. Comparing effects of soybean oil- and palm olein-based mayonnaise consumption on the plasma lipid and lipoprotein profiles in human subjects: a double-blind randomized controlled trial with cross-over design. Lipids Health Dis. 2016; 15:131. [DOI] [PMC free article] [PubMed]
- 255.Sun Y, Neelakantan N, Wu Y, et al. Palm oil consumption increases LDL-CC cholesterol compared with vegetable oils low in saturated fat in a meta-analysis of clinical trials. J Nutr. 2015;145(7):1549–1558. doi: 10.3945/jn.115.210575. [DOI] [PubMed] [Google Scholar]; Sun Y, Neelakantan N, Wu Y et al. Palm oil consumption increases LDL-CC cholesterol compared with vegetable oils low in saturated fat in a meta-analysis of clinical trials. J Nutr. 2015; 145(7):1549-58. [DOI] [PubMed]
- 256.Tholstrup T, Hjerpsted J, Raff M. Palm olein increases plasma cholesterol moderately compared with olive oil in healthy individuals. Am J Clin Nutr. 2011;94(6):1426–1432. doi: 10.3945/ajcn.111.018846. [DOI] [PubMed] [Google Scholar]; Tholstrup T, Hjerpsted J, Raff M. Palm olein increases plasma cholesterol moderately compared with olive oil in healthy individuals. Am J Clin Nutr. 2011; 94(6):1426-32. [DOI] [PubMed]
- 257.Yakoob MY, Shi P, Hu FB, et al. Circulating biomarkers of dairy fat and risk of incident stroke in U. S. men and women in 2 large prospective cohorts. Am J Clin Nutr. 2014;100(6):1437–1447. doi: 10.3945/ajcn.114.083097. [DOI] [PMC free article] [PubMed] [Google Scholar]; Yakoob MY, Shi P, Hu FB et al. Circulating biomarkers of dairy fat and risk of incident stroke in U. S. men and women in 2 large prospective cohorts. Am J Clin Nutr. 2014; 100(6):1437-47. [DOI] [PMC free article] [PubMed]
- 258.Pala V, Sieri S, Chiodini P, et al. Associations of dairy product consumption with mortality in the European Prospective Investigation into Cancer and Nutrition (EPIC) -Italy cohort. Am J Clin Nutr. 2019;110(5):1220–1230. doi: 10.1093/ajcn/nqz183. [DOI] [PubMed] [Google Scholar]; Pala V, Sieri S, Chiodini P et al. Associations of dairy product consumption with mortality in the European Prospective Investigation into Cancer and Nutrition (EPIC) -Italy cohort. Am J Clin Nutr. 2019; 110(5):1220-30. [DOI] [PubMed]
- 259.Universidade Estadual de Campinas (Unicamp) Tabela brasileira de composição de alimentos - TACO. 4. ed. Campinas: Unicamp/NEPA; 2011. [Acesso em: 12 fev 2019]. pp. 161–161. Disponível em: http://www.unicamp.br/nepa/taco/tabela. [Google Scholar]; Universidade Estadual de Campinas (Unicamp). Tabela brasileira de composição de alimentos - TACO. 4. ed. Campinas: Unicamp/NEPA; 2011. 161 p. Disponível em: http://www.unicamp.br/nepa/taco/tabela. Acesso em: 12 fev 2019.
- 260.Brassard D, Tessier-Grenier M, Allaire J, et al. Comparison of the impact of SFAs from cheese and butter on cardiometabolic risk factors: a randomized controlled trial. Am J Clin Nutr. 2017;105(4):800–809. doi: 10.3945/ajcn.116.150300. [DOI] [PubMed] [Google Scholar]; Brassard D, Tessier-Grenier M, Allaire J et al. Comparison of the impact of SFAs from cheese and butter on cardiometabolic risk factors: a randomized controlled trial. Am J Clin Nutr. 2017; 105(4):800-9. [DOI] [PubMed]
- 261.Avalos EE, Barrett-Connor E, Kritz-Silverstein D, et al. Is dairy product consumption associated with the incidence of CHD? Public Health Nutr. 2013;16(11):2055–2063. doi: 10.1017/S1368980012004168. [DOI] [PMC free article] [PubMed] [Google Scholar]; Avalos EE, Barrett-Connor E, Kritz-Silverstein D et al. Is dairy product consumption associated with the incidence of CHD? Public Health Nutr. 2013; 16(11):2055-63. [DOI] [PMC free article] [PubMed]
- 262.Ericson U, Hellstrand S, Brunkwall L, et al. Food sources of fat may clarify the inconsistent role of dietary fat intake for incidence of type 2 diabetes. Am J Clin Nutr. 2015;101(5):1065–1080. doi: 10.3945/ajcn.114.103010. [DOI] [PubMed] [Google Scholar]; Ericson U, Hellstrand S, Brunkwall L et al. Food sources of fat may clarify the inconsistent role of dietary fat intake for incidence of type 2 diabetes. Am J Clin Nutr. 2015; 101(5):1065-80. [DOI] [PubMed]
- 263.Pimpin L, Wu JHY, Haskelberg H, et al. Is butter back? A systematic review and meta-analysis of butter consumption and risk of cardiovascular disease, diabetes, and total mortality. Plos One. 2016;11:e0158118. doi: 10.1371/journal.pone.0158118. [DOI] [PMC free article] [PubMed] [Google Scholar]; Pimpin L, Wu JHY, Haskelberg H et al. Is butter back? A systematic review and meta-analysis of butter consumption and risk of cardiovascular disease, diabetes, and total mortality. Plos One. 2016; 11:e0158118. [DOI] [PMC free article] [PubMed]
- 264.Gidding SS, Champagne MA, de Ferranti SD, et al. The agenda for familial hypercholesterolemia: a scientific statement from the American Heart Association. Circulation. 2015;132(22):2167–2192. doi: 10.1161/CIR.0000000000000297. [DOI] [PubMed] [Google Scholar]; Gidding SS, Champagne MA, de Ferranti SD et al. The agenda for familial hypercholesterolemia: a scientific statement from the American Heart Association. Circulation. 2015; 132(22):2167-92. [DOI] [PubMed]
- 265.Sposito AC, Faria JR, Neto, Carvalho LSF, et al. On behalf of the Luso-Latin American Consortium on statin-associated muscle symptoms. Statin-associated muscle symptoms: position paper from the Luso-Latin American Consortium. Curr Med Res Opin. 2017;33(2):239–251. doi: 10.1080/03007995.2016.1252740. [DOI] [PubMed] [Google Scholar]; Sposito AC, Faria Neto JR, Carvalho LSF et al. On behalf of the Luso-Latin American Consortium on statin-associated muscle symptoms. Statin-associated muscle symptoms: position paper from the Luso-Latin American Consortium. Curr Med Res Opin. 2017; 33(2):239-51. [DOI] [PubMed]
- 266.Cholesterol treatment trialists (CTT) collaboration, Baigent C, Blackwell L et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomized trials. Lancet. 2010;376(9753):1670–1681. doi: 10.1016/S0140-6736(10)61350-5. [DOI] [PMC free article] [PubMed] [Google Scholar]; Cholesterol treatment trialists (CTT) collaboration, Baigent C, Blackwell L et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomized trials. Lancet. 2010; 376(9753):1670-81. [DOI] [PMC free article] [PubMed]
- 267.O’ Regan C, Wu P, Arora P, et al. Statin therapy in stroke prevention: a meta-analysis involving 121,000 patients. Am J Med. 2008;121(1):24–33. doi: 10.1016/j.amjmed.2007.06.033. [DOI] [PubMed] [Google Scholar]; O’Regan C, Wu P, Arora P et al. Statin therapy in stroke prevention: a meta-analysis involving 121,000 patients. Am J Med. 2008; 121(1):24-33. [DOI] [PubMed]
- 268.Cholesterol treatment trialists (CTT) The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomized trials. Lancet. 2012;380(9841):P581–P590. doi: 10.1016/S0140-6736(12)60367-5. [DOI] [PMC free article] [PubMed] [Google Scholar]; Cholesterol treatment trialists (CTT). The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomized trials. Lancet. 2012; 380(9841):P581-590. [DOI] [PMC free article] [PubMed]
- 269.Kearney PM, Blackwell L, Collins R, et al. Efficacy of cholesterol-lowering therapy in 18,686 people with diabetes in 14 randomized trials of statins: a meta-analysis. Lancet. 2008;371(9607):117–125. doi: 10.1016/S0140-6736(08)60104-X. [DOI] [PubMed] [Google Scholar]; Kearney PM, Blackwell L, Collins R et al. Efficacy of cholesterol-lowering therapy in 18,686 people with diabetes in 14 randomized trials of statins: a meta-analysis. Lancet. 2008; 371(9607):117-25. [DOI] [PubMed]
- 270.Pijlman AH, Huijgen R, Verhagen SN, et al. Evaluation of cholesterol lowering treatment of patients with familial hypercholesterolemia: a large cross-sectional study in The Netherlands. Atherosclerosis. 2010;209(1):189–194. doi: 10.1016/j.atherosclerosis.2009.09.014. [DOI] [PubMed] [Google Scholar]; Pijlman AH, Huijgen R, Verhagen SN et al. Evaluation of cholesterol lowering treatment of patients with familial hypercholesterolemia: a large cross-sectional study in The Netherlands. Atherosclerosis. 2010; 209(1):189-94. [DOI] [PubMed]
- 271.Ito MK, McGowan MP, Moriarty PM. Management of familial hypercholesterolemia in adult patients: recommendations from the National Lipid Association Expert Panel on Familial Hypercholesterolemia. J Clin Lipidol. 2011;5(3 Suppl):S38–S45. doi: 10.1016/j.jacl.2011.04.001. [DOI] [PubMed] [Google Scholar]; Ito MK, McGowan MP, Moriarty PM. Management of familial hypercholesterolemia in adult patients: recommendations from the National Lipid Association Expert Panel on Familial Hypercholesterolemia. J Clin Lipidol. 2011; 5(3 Suppl):S38-45. [DOI] [PubMed]
- 272.Turley SD. Cholesterol metabolism and therapeutic targets: rationale for targeting multiple metabolic pathways. Clin Cardiol. 2004;27(6 Suppl 3):III16–III21. doi: 10.1002/clc.4960271506. [DOI] [PMC free article] [PubMed] [Google Scholar]; Turley SD. Cholesterol metabolism and therapeutic targets: rationale for targeting multiple metabolic pathways. Clin Cardiol. 2004; 27(6 Suppl 3):III16-21. [DOI] [PMC free article] [PubMed]
- 273.Mikhailidis DP, Sibbring GC, Ballantyne CM, et al. Meta-analysis of the cholesterol-lowering effect of ezetimibe added to ongoing statin therapy. Curr Med Res Opin. 2007;23(8):2009–2026. doi: 10.1185/030079907x210507. [DOI] [PubMed] [Google Scholar]; Mikhailidis DP, Sibbring GC, Ballantyne CM et al. Meta-analysis of the cholesterol-lowering effect of ezetimibe added to ongoing statin therapy. Curr Med Res Opin. 2007; 23(8):2009-26. [DOI] [PubMed]
- 274.Kastelein JJP, Akdim F, Stroes ESG, et al. Simvastatin with or without ezetimibe in familial hypercholesterolemia. N Engl J Med. 2008;358(14):1431–1443. doi: 10.1056/NEJMoa0800742. [DOI] [PubMed] [Google Scholar]; Kastelein JJP, Akdim F, Stroes ESG et al. Simvastatin with or without ezetimibe in familial hypercholesterolemia. N Engl J Med. 2008; 358(14):1431-43. [DOI] [PubMed]
- 275.Stein E, Stender S, Mata P, et al. Achieving lipoprotein goals in patients at high risk with severe hypercholesterolemia: efficacy and safety of ezetimibe co-administered with atorvastatin. Am Heart J. 2004;148(3):447–455. doi: 10.1016/j.ahj.2004.03.052. [DOI] [PubMed] [Google Scholar]; Stein E, Stender S, Mata P et al. Achieving lipoprotein goals in patients at high risk with severe hypercholesterolemia: efficacy and safety of ezetimibe co-administered with atorvastatin. Am Heart J. 2004; 148(3):447-55. [DOI] [PubMed]
- 276.Gagné C, Gaudet D, Bruckert E. Efficacy and safety of ezetimibe coadministered with atorvastatin or simvastatin in patients with homozygous familial hypercholesterolemia. Circulation. 2002;105(21):2469–2475. doi: 10.1161/01.cir.0000018744.58460.62. [DOI] [PubMed] [Google Scholar]; Gagné C, Gaudet D, Bruckert E. Efficacy and safety of ezetimibe coadministered with atorvastatin or simvastatin in patients with homozygous familial hypercholesterolemia. Circulation. 2002; 105(21):2469-75. [DOI] [PubMed]
- 277.Fleg JL, Mete M, Howard BV, et al. Effect of statins alone versus statins plus ezetimibe on carotid atherosclerosis in type 2 diabetes: the SANDS (Stop Atherosclerosis in Native Diabetics Study) trial. J Am Coll Cardiol. 2008;52(25):2198–2205. doi: 10.1016/j.jacc.2008.10.031. [DOI] [PMC free article] [PubMed] [Google Scholar]; Fleg JL, Mete M, Howard BV et al. Effect of statins alone versus statins plus ezetimibe on carotid atherosclerosis in type 2 diabetes: the SANDS (Stop Atherosclerosis in Native Diabetics Study) trial. J Am Coll Cardiol. 2008; 52(25):2198-205. [DOI] [PMC free article] [PubMed]
- 278.Rossebo AB, Pedersen TR, Boman K, et al. Intensive lipid lowering with simvastatin and ezetimibe in aortic stenosis. N Engl J Med. 2008;359(13):1343–1356. doi: 10.1056/NEJMoa0804602. [DOI] [PubMed] [Google Scholar]; Rossebo AB, Pedersen TR, Boman K et al. Intensive lipid lowering with simvastatin and ezetimibe in aortic stenosis. N Engl J Med. 2008; 359(13):1343-56. [DOI] [PubMed]
- 279.Cannon CP, Blazing MA, Giugliano RP, et al. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med. 2015;372(25):2387–2397. doi: 10.1056/NEJMoa1410489. [DOI] [PubMed] [Google Scholar]; Cannon CP, Blazing MA, Giugliano RP et al. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med. 2015; 372(25):2387-97. [DOI] [PubMed]
- 280.Baigent C, Landray MJ, Reith C, et al. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomized placebo-controlled trial. Lancet. 2011;377(9784):2181–2192. doi: 10.1016/S0140-6736(11)60739-3. [DOI] [PMC free article] [PubMed] [Google Scholar]; Baigent C, Landray MJ, Reith C et al. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomized placebo-controlled trial. Lancet. 2011; 377(9784):2181-92. [DOI] [PMC free article] [PubMed]
- 281.Lambert G, Sjouke B, Choque B, et al. The PCSK9 decade. J Lip Res. 2012;53(12):2515–2524. doi: 10.1194/jlr.R026658. [DOI] [PMC free article] [PubMed] [Google Scholar]; Lambert G, Sjouke B, Choque B et al. The PCSK9 decade. J Lip Res. 2012; 53(12):2515-24. [DOI] [PMC free article] [PubMed]
- 282.Navarese EP, Kolodziejczak M, Schulze V, et al. Effects of proprotein convertase subtilisin/kexin type 9 antibodies in adults with hypercholesterolemia: a systematic review and meta-analysis. Ann Intern Med. 2015;163(1):40–51. doi: 10.7326/M14-2957. [DOI] [PubMed] [Google Scholar]; Navarese EP, Kolodziejczak M, Schulze V et al. Effects of proprotein convertase subtilisin/kexin type 9 antibodies in adults with hypercholesterolemia: a systematic review and meta-analysis. Ann Intern Med. 2015; 163(1):40-51. [DOI] [PubMed]
- 283.Raal FJ, Stein EA, Dufour R, et al. PCSK9 inhibition with evolocumab (AMG 145) in heterozygous familial hypercholesterolemia (RUTHERFORD-2): a randomized, double-blind, placebo-controlled trial. Lancet. 2015;385(9965):331–340. doi: 10.1016/S0140-6736(14)61399-4. [DOI] [PubMed] [Google Scholar]; Raal FJ, Stein EA, Dufour R et al. PCSK9 inhibition with evolocumab (AMG 145) in heterozygous familial hypercholesterolemia (RUTHERFORD-2): a randomized, double-blind, placebo-controlled trial. Lancet. 2015; 385(9965):331-40. [DOI] [PubMed]
- 284.Kastelein JJ, Ginsberg HN, Langslet G, et al. ODYSSEY FH I and FH II: 78 week results with alirocumab treatment in 735 patients with heterozygous familial hypercholesterolemia. Eur Heart J. 2015;36(43):2996–3003. doi: 10.1093/eurheartj/ehv370. [DOI] [PMC free article] [PubMed] [Google Scholar]; Kastelein JJ, Ginsberg HN, Langslet G et al. ODYSSEY FH I and FH II: 78 week results with alirocumab treatment in 735 patients with heterozygous familial hypercholesterolemia. Eur Heart J. 2015; 36(43):2996-3003. [DOI] [PMC free article] [PubMed]
- 285.Santos RD, Stein EA, Hovingh GK, et al. Long-term evolocumab in patients with familial hypercholesterolemia. J Am Coll Cardiol. 2020;75(6):565–574. doi: 10.1016/j.jacc.2019.12.020. [DOI] [PubMed] [Google Scholar]; Santos RD, Stein EA, Hovingh GK et al. Long-term evolocumab in patients with familial hypercholesterolemia. J Am Coll Cardiol. 2020;75(6):565-574. [DOI] [PubMed]
- 286.Raal FJ, Hovingh GK, Blom D, et al. Long-term treatment with evolocumab added to conventional drug therapy, with or without apheresis, in patients with homozygous familial hypercholesterolemia: an interim subset analysis of the open-label TAUSSIG study. Lancet Diabetes Endocrinol. 2017;5(4):280–290. doi: 10.1016/S2213-8587(17)30044-X. [DOI] [PubMed] [Google Scholar]; Raal FJ, Hovingh GK, Blom D et al. Long-term treatment with evolocumab added to conventional drug therapy, with or without apheresis, in patients with homozygous familial hypercholesterolemia: an interim subset analysis of the open-label TAUSSIG study. Lancet Diabetes Endocrinol. 2017; 5(4):280-90. [DOI] [PubMed]
- 287.Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med. 2017;376(18):1713–1722. doi: 10.1056/NEJMoa1615664. [DOI] [PubMed] [Google Scholar]; Sabatine MS, Giugliano RP, Keech AC et al. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med. 2017; 376(18):1713-22. [DOI] [PubMed]
- 288.Schwartz GG, Steg PG, Szarek M, et al. Alirocumab and cardiovascular outcomes after acute coronary syndrome. N Engl J Med. 2018;379(22):2097–2107. doi: 10.1056/NEJMoa1801174. [DOI] [PubMed] [Google Scholar]; Schwartz GG, Steg PG, Szarek M et al. Alirocumab and cardiovascular outcomes after acute coronary syndrome. N Engl J Med. 2018; 379(22):2097-107. [DOI] [PubMed]
- 289.Einarsson K, Ericsson S, Ewerth S, et al. Bile acid sequestrants: mechanisms of action on bile acid and cholesterol metabolism. Eur J Clin Pharmacol. 1991;40(Suppl 1):S53–S58. [PubMed] [Google Scholar]; Einarsson K, Ericsson S, Ewerth S et al. Bile acid sequestrants: mechanisms of action on bile acid and cholesterol metabolism. Eur J Clin Pharmacol. 1991; 40(Suppl 1):S53-8. [PubMed]
- 290.Feingold KR, Anawalt B, Boyce A, et al. Endotext. South Dartmouth (MA): MDText.Com, Inc; 2000-2020. Cholesterol lowering drugs. [Google Scholar]; Feingold KR, Anawalt B, Boyce A et al. In: Cholesterol lowering drugs. Endotext. South Dartmouth (MA): MDText.Com, Inc.; 2000-2020.
- 291.The lipid research clinics coronary primary prevention trial results The relationship of reduction in incidence of coronary heart disease to cholesterol lowering. JAMA. 1984;251(3):365–374. [PubMed] [Google Scholar]; The lipid research clinics coronary primary prevention trial results. II. The relationship of reduction in incidence of coronary heart disease to cholesterol lowering. JAMA. 1984; 251(3):365-74. [PubMed]
- 292.Buchwald H, Fitch LL, Campos CT. Partial ileal bypass in the treatment of hypercholesterolemia. J Fam Pract. 1992;35(1):69–76. [PubMed] [Google Scholar]; Buchwald H, Fitch LL, Campos CT. Partial ileal bypass in the treatment of hypercholesterolemia. J Fam Pract. 1992; 35(1):69-76. [PubMed]
- 293.Buchwald H, Varco RL, Matts JP, et al. Effect of partial ileal bypass surgery on mortality and morbidity from coronary heart disease in patients with hypercholesterolemia. Report of the Program on the Surgical Control of the Hyperlipidemias (POSCH) N Engl J Med. 1990;323(14):946–955. doi: 10.1056/NEJM199010043231404. [DOI] [PubMed] [Google Scholar]; Buchwald H, Varco RL, Matts JP et al. Effect of partial ileal bypass surgery on mortality and morbidity from coronary heart disease in patients with hypercholesterolemia. Report of the Program on the Surgical Control of the Hyperlipidemias (POSCH). N Engl J Med. 1990; 323(14):946-55. [DOI] [PubMed]
- 294.Ohri SK, Keane PF, Swift I, et al. Reappraisal of partial ileal bypass for the treatment of familial hypercholesterolemia. Am J Gastroenterol. 1989;84(7):740–743. [PubMed] [Google Scholar]; Ohri SK, Keane PF, Swift I et al. Reappraisal of partial ileal bypass for the treatment of familial hypercholesterolemia. Am J Gastroenterol. 1989; 84(7):740-3. [PubMed]
- 295.Heffron SP, Parikh A, Volodarskiy A, et al. Changes in lipid profile of obese patients following contemporary bariatric surgery: a meta-analysis. Am J Med. 2016;129(9):952–959. doi: 10.1016/j.amjmed.2016.02.004. [DOI] [PMC free article] [PubMed] [Google Scholar]; Heffron SP, Parikh A, Volodarskiy A et al. Changes in lipid profile of obese patients following contemporary bariatric surgery: a meta-analysis. Am J Med. 2016; 129(9):952-9. [DOI] [PMC free article] [PubMed]
- 296.Health Quality Ontario Low-density lipoprotein apheresis: an evidence-based analysis. Ont Health Technol Assess Ser. 2007;7(5):1–101. [PMC free article] [PubMed] [Google Scholar]; Health Quality Ontario. Low-density lipoprotein apheresis: an evidence-based analysis. Ont Health Technol Assess Ser. 2007; 7(5):1-101. [PMC free article] [PubMed]
- 297.Winters JL. Lipid apheresis, indications, and principles. J Clin Apheresis. 2011;26(5):269–275. doi: 10.1002/jca.20299. [DOI] [PubMed] [Google Scholar]; Winters JL. Lipid apheresis, indications, and principles. J Clin Apheresis. 2011; 26(5):269-75. [DOI] [PubMed]
- 298.Wang A, Richhariya A, Gandra SR, et al. Systematic review of low-density lipoprotein cholesterol apheresis for the treatment of familial hypercholesterolemia. J Am Heart Assoc. 2016;5(7):e003294. doi: 10.1161/JAHA.116.003294. [DOI] [PMC free article] [PubMed] [Google Scholar]; Wang A, Richhariya A, Gandra SR et al. Systematic review of low-density lipoprotein cholesterol apheresis for the treatment of familial hypercholesterolemia. J Am Heart Assoc. 2016; 5(7):e003294. [DOI] [PMC free article] [PubMed]
- 299.Thompson GR, Catapano A, Saheb S, et al. Severe hypercholesterolemia: therapeutic goals and eligibility criteria for LDL apheresis in Europe. Curr Opin Lipidol. 2010;21(6):492–496. doi: 10.1097/MOL.0b013e3283402f53. [DOI] [PubMed] [Google Scholar]; Thompson GR, Catapano A, Saheb S et al. Severe hypercholesterolemia: therapeutic goals and eligibility criteria for LDL apheresis in Europe. Curr Opin Lipidol. 2010; 21(6):492-6. [DOI] [PubMed]
- 300.Julius U, Fischer S, Schatz U, et al. Why an apheresis center should offer more than one lipoprotein apheresis method. Ther. Apher. Dial. 2013;17(2):179–184. doi: 10.1111/j.1744-9987.2012.01129.x. [DOI] [PubMed] [Google Scholar]; Julius U, Fischer S, Schatz U et al. Why an apheresis center should offer more than one lipoprotein apheresis method. Ther. Apher. Dial. 2013; 17(2):179-84. [DOI] [PubMed]
- 301.Thompson GR, Barbir M, Davies D, et al. Recommendations for the use of LDL apheresis. Atherosclerosis. 2008;98(2):247–255. doi: 10.1016/j.atherosclerosis.2008.02.009. [DOI] [PubMed] [Google Scholar]; Thompson GR, Barbir M, Davies D et al. Recommendations for the use of LDL apheresis. Atherosclerosis. 2008; 98(2):247-55. [DOI] [PubMed]
- 302.Harada-Shiba M, Arai H, Oikawa S, et al. Guidelines for the management of familial hypercholesterolemia. J Atheroscler Thromb. 2012;19(12):1043–1060. doi: 10.5551/jat.14621. [DOI] [PubMed] [Google Scholar]; Harada-Shiba M, Arai H, Oikawa S et al. Guidelines for the management of familial hypercholesterolemia. J Atheroscler Thromb. 2012; 19(12):1043-60. [DOI] [PubMed]
- 303.Goldberg AC, Hopkins PN, Toth PP, et al. National Lipid Association Expert Panel on Familial Hypercholesterolemia. Familial hypercholesterolemia: screening, diagnosis and management of pediatric and adult patients – clinical guidance from the National Lipid Association Expert Panel on Familial Hypercholesterolemia. J Clin Lipidol. 5(3 Suppl):S1–S8. doi: 10.1016/j.jacl.2011.04.003. 2001. [DOI] [PubMed] [Google Scholar]; Goldberg AC, Hopkins PN, Toth PP et al. National Lipid Association Expert Panel on Familial Hypercholesterolemia. Familial hypercholesterolemia: screening, diagnosis and management of pediatric and adult patients – clinical guidance from the National Lipid Association Expert Panel on Familial Hypercholesterolemia. J Clin Lipidol. 201; 5(3 Suppl):S1-S8. [DOI] [PubMed]
- 304.Stefanutti C, Julius U. Lipoprotein apheresis: state of the art and novelties. Atherosclerosis Suppl. 2013;14(1):19–27. doi: 10.1016/j.atherosclerosissup.2012.10.021. [DOI] [PubMed] [Google Scholar]; Stefanutti C, Julius U. Lipoprotein apheresis: state of the art and novelties. Atherosclerosis Suppl. 2013; 14(1):19-27. [DOI] [PubMed]
- 305.Schuff-Werner P, Fenger S, Kohlschein P. Role of lipid apheresis in changing times. Clin Res Cardiol Suppl. 2012;7(Suppl 1):7–14. doi: 10.1007/s11789-012-0049-3. [DOI] [PMC free article] [PubMed] [Google Scholar]; Schuff-Werner P, Fenger S, Kohlschein P. Role of lipid apheresis in changing times. Clin Res Cardiol Suppl. 2012; 7(Suppl 1):7-14. [DOI] [PMC free article] [PubMed]
- 306.Keller C, Grutzmacher P, Bahr F, et al. LDL-apheresis with dextran sulphate and anaphylactoid reactions to ACE inhibitors. Lancet. 1993;341(8836):60–61. doi: 10.1016/0140-6736(93)92542-2. [DOI] [PubMed] [Google Scholar]; Keller C, Grutzmacher P, Bahr F et al. LDL-apheresis with dextran sulphate and anaphylactoid reactions to ACE inhibitors. Lancet. 1993; 341(8836):60-1. [DOI] [PubMed]
- 307.Stefanutti C, Morozzi C, Petta A. Lipid and low-density-lipoprotein apheresis. Effects on plasma inflammatory profile and on cytokine pattern in patients with severe dyslipidemia. Cytokine. 2011;56(3):842–849. doi: 10.1016/j.cyto.2011.08.027. [DOI] [PubMed] [Google Scholar]; Stefanutti C, Morozzi C, Petta A. Lipid and low-density-lipoprotein apheresis. Effects on plasma inflammatory profile and on cytokine pattern in patients with severe dyslipidemia. Cytokine. 2011; 56(3):842-9. [DOI] [PubMed]
- 308.Coker M, Ucar SK, Simsek DG, et al. Low density lipoprotein apheresis in pediatric patients with homozygous familial hypercholesterolemia. Ther Apher Dial. 2009;13(2):121–128. doi: 10.1111/j.1744-9987.2009.00666.x. [DOI] [PubMed] [Google Scholar]; Coker M, Ucar SK, Simsek DG et al. Low density lipoprotein apheresis in pediatric patients with homozygous familial hypercholesterolemia. Ther Apher Dial. 2009; 13(2):121-8. [DOI] [PubMed]
- 309.Goldberg AC, Hopkins PN, Toth PP, et al. Familial hypercholesterolemia: screening, diagnosis and management of pediatric and adult patients clinical guidance from the National Lipid Association Expert Panel on Familial Hypercholesterolemia. J Clin Lipidol. 2011;5(3 Suppl):S1–S8. doi: 10.1016/j.jacl.2011.04.003. [DOI] [PubMed] [Google Scholar]; Goldberg AC, Hopkins PN, Toth PP et al. Familial hypercholesterolemia: screening, diagnosis and management of pediatric and adult patients clinical guidance from the National Lipid Association Expert Panel on Familial Hypercholesterolemia. J Clin Lipidol. 2011; 5(3 Suppl): S1-S8. [DOI] [PubMed]
- 310.Thompson GR. LDL apheresis. Atherosclerosis. 2003;167(1):1–13. doi: 10.1016/s0021-9150(02)00251-4. [DOI] [PubMed] [Google Scholar]; Thompson GR. LDL apheresis. Atherosclerosis. 2003; 167(1):1-13. [DOI] [PubMed]
- 311.Tatami R, Inoue N, Itoh H, et al. Regression of coronary atherosclerosis by combined LDL-apheresis and lipid-lowering drug therapy in patients with familial hypercholesterolemia: a multicenter study. The LARS Investigators. Atherosclerosis. 1992;95(1):1–13. doi: 10.1016/0021-9150(92)90170-l. [DOI] [PubMed] [Google Scholar]; Tatami R, Inoue N, Itoh H et al. Regression of coronary atherosclerosis by combined LDL-apheresis and lipid-lowering drug therapy in patients with familial hypercholesterolemia: a multicenter study. The LARS Investigators. Atherosclerosis. 1992; 95(1):1-13. [DOI] [PubMed]
- 312.Waidner T, Franzen D, Voelker W, et al. The effect of LDL apheresis on progression of coronary artery disease in patients with familial hypercholesterolemia. Results of a multicenter LDL apheresis study. Clin Investig. 1994;72(11):858–863. doi: 10.1007/BF00190741. [DOI] [PubMed] [Google Scholar]; Waidner T, Franzen D, Voelker W et al. The effect of LDL apheresis on progression of coronary artery disease in patients with familial hypercholesterolemia. Results of a multicenter LDL apheresis study. Clin Investig. 1994; 72(11):858-63. [DOI] [PubMed]
- 313.Schuff-Werner P, Gohike H, Bartmann U, et al. The HELP-LDL-apheresis multicentre study, an angiographically assessed trial on the role of LDL-apheresis in the secondary prevention of coronary heart disease. II. Final evaluation of the effect of regular treatment on LDL-cholesterol plasma concentrations and the course of coronary heart disease. The HELP-Study Group. Heparin induced extra-corporeal LDL-precipitation. Eur J Clin Invest. 1994;24(11):724–732. doi: 10.1111/j.1365-2362.1994.tb01068.x. [DOI] [PubMed] [Google Scholar]; Schuff-Werner P, Gohike H, Bartmann U et al. The HELP-LDL-apheresis multicentre study, an angiographically assessed trial on the role of LDL-apheresis in the secondary prevention of coronary heart disease. II. Final evaluation of the effect of regular treatment on LDL-cholesterol plasma concentrations and the course of coronary heart disease. The HELP-Study Group. Heparin induced extra-corporeal LDL-precipitation. Eur J Clin Invest. 1994; 24(11):724-32. [DOI] [PubMed]
- 314.Thompson GR, Maher VM, Matthews S, et al. Familial Hypercholesterolemia Regression Study: a randomized trial of low-density-lipoprotein apheresis. Lancet. 1995;345(8953):811–816. doi: 10.1016/s0140-6736(95)92961-4. [DOI] [PubMed] [Google Scholar]; Thompson GR, Maher VM, Matthews S et al. Familial Hypercholesterolemia Regression Study: a randomized trial of low-density-lipoprotein apheresis. Lancet. 1995; 345(8953):811-6. [DOI] [PubMed]
- 315.Kroon AA, Aengevaeren WR, van den Werf T, et al. LDL-Apheresis Atherosclerosis Regression Study (LAARS). Effect of aggressive versus conventional lipid lowering treatment of coronary atherosclerosis. Circulation. 1996;93(10):1826–1835. doi: 10.1161/01.cir.93.10.1826. [DOI] [PubMed] [Google Scholar]; Kroon AA, Aengevaeren WR, van den Werf T et al. LDL-Apheresis Atherosclerosis Regression Study (LAARS). Effect of aggressive versus conventional lipid lowering treatment of coronary atherosclerosis. Circulation. 1996; 93(10):1826-35. [DOI] [PubMed]
- 316.Mabuchi H, Koizumi J, Shimizu M, et al. Long-term efficacy of low-density lipoprotein apheresis on coronary heart disease in familial hypercholesterolemia. Hokuriku-FH-LDL-Apheresis Study Group. Am J Cardiol. 1998;82(12):1489–1495. doi: 10.1016/s0002-9149(98)00692-4. [DOI] [PubMed] [Google Scholar]; Mabuchi H, Koizumi J, Shimizu M et al. Long-term efficacy of low-density lipoprotein apheresis on coronary heart disease in familial hypercholesterolemia. Hokuriku-FH-LDL-Apheresis Study Group. Am J Cardiol. 1998; 82(12):1489-95. [DOI] [PubMed]
- 317.Ritcher WO, Donner MG, Hofling B, et al. Long-term effect of low-density lipoprotein apheresis on plasma lipoproteins and coronary heart disease in native vessels and coronary bypass in severe heterozygous familial hypercholesterolemia. Metabolism. 1998;47(7):863–868. doi: 10.1016/s0026-0495(98)90127-5. [DOI] [PubMed] [Google Scholar]; Ritcher WO, Donner MG, Hofling B et al. Long-term effect of low-density lipoprotein apheresis on plasma lipoproteins and coronary heart disease in native vessels and coronary bypass in severe heterozygous familial hypercholesterolemia. Metabolism. 1998; 47(7):863-8. [DOI] [PubMed]
- 318.Tamai O, Matsuoka H, Itabe H, et al. Single LDL apheresis improves endothelium-dependent vasodilation in hypercholesterolemic humans. Circulation. 1997;95(1):76–82. doi: 10.1161/01.cir.95.1.76. [DOI] [PubMed] [Google Scholar]; Tamai O, Matsuoka H, Itabe H et al. Single LDL apheresis improves endothelium-dependent vasodilation in hypercholesterolemic humans. Circulation. 1997; 95(1):76-82. [DOI] [PubMed]
- 319.Igarashi K, Tsuji M, Nishimura M, et al. Improvement of endothelium-dependent coronary vasodilation after a single LDL apheresis in patients with hypercholesterolemia. J Clin Apher. 2004;19(1):11–16. doi: 10.1002/jca.20000. [DOI] [PubMed] [Google Scholar]; Igarashi K, Tsuji M, Nishimura M et al. Improvement of endothelium-dependent coronary vasodilation after a single LDL apheresis in patients with hypercholesterolemia. J Clin Apher. 2004; 19(1):11-6. [DOI] [PubMed]
- 320.Sato M, Amano I. Changes in oxidative stress and microcirculation by low-density lipoprotein apheresis. Ther Apher Dial. 2003;7(4):419–424. doi: 10.1046/j.1526-0968.2003.00078.x. [DOI] [PubMed] [Google Scholar]; Sato M, Amano I. Changes in oxidative stress and microcirculation by low-density lipoprotein apheresis. Ther Apher Dial. 2003; 7(4):419-24. [DOI] [PubMed]
- 321.Kobayashi K, Yamashita K, Tasaki H, et al. Evaluation of improved coronary flow velocity reserve using transthoracic doppler echocardiography after single LDL apheresis. Ther Apher Dial. 2004;8(5):383–389. doi: 10.1111/j.1526-0968.2004.00172.x. [DOI] [PubMed] [Google Scholar]; Kobayashi K, Yamashita K, Tasaki H et al. Evaluation of improved coronary flow velocity reserve using transthoracic doppler echocardiography after single LDL apheresis. Ther Apher Dial. 2004; 8(5):383-9. [DOI] [PubMed]
- 322.Keller C. Apheresis in coronary heart disease with elevated Lp(a): a review of Lp(a) as a risk factor and its management. Ther Apher Dial. 2007;11(1):2–8. doi: 10.1111/j.1744-9987.2007.00449.x. [DOI] [PubMed] [Google Scholar]; Keller C. Apheresis in coronary heart disease with elevated Lp(a): a review of Lp(a) as a risk factor and its management. Ther Apher Dial. 2007; 11(1):2-8. [DOI] [PubMed]
- 323.Bambauer R. Is lipoprotein(a)-apheresis useful? Ther Apher Dial. 2005;9(2):142–147. doi: 10.1111/j.1774-9987.2005.00236.x. [DOI] [PubMed] [Google Scholar]; Bambauer R. Is lipoprotein(a)-apheresis useful? Ther Apher Dial. 2005; 9(2):142-7. [DOI] [PubMed]
- 324.Thompson GR, Blom DJ, Marais AD, et al. Survival in homozygous familial hypercholesterolemia is determined by the on-treatment level of serum cholesterol. Eur Heart J. 2018;39(14):1162–1168. doi: 10.1093/eurheartj/ehx317. [DOI] [PubMed] [Google Scholar]; Thompson GR, Blom DJ, Marais AD et al. Survival in homozygous familial hypercholesterolemia is determined by the on-treatment level of serum cholesterol. Eur Heart J. 2018; 39(14):1162-8. [DOI] [PubMed]
- 325.Barbir M, Khaghani A, Kehely A, et al. Normal levels of lipoproteins including lipoprotein(a) after liver-heart transplantation in a patient with homozygous familial hypercholesterolemia. Q J Med. 1992;85(307-308):807–812. [PubMed] [Google Scholar]; Barbir M, Khaghani A, Kehely A et al. Normal levels of lipoproteins including lipoprotein(a) after liver-heart transplantation in a patient with homozygous familial hypercholesterolemia. Q J Med. 1992; 85(307-308):807-12. [PubMed]
- 326.Gidding SS, Daniels SR, Kavey RE. Expert Panel on Cardiovascular Health and Risk Reduction in Youth. Developing the 2011 integrated pediatric guidelines for cardiovascular risk reduction. Pediatrics. 2012;129(5):e1311–e1319. doi: 10.1542/peds.2011-2903. [DOI] [PubMed] [Google Scholar]; Gidding SS, Daniels SR, Kavey RE. Expert Panel on Cardiovascular Health and Risk Reduction in Youth. Developing the 2011 integrated pediatric guidelines for cardiovascular risk reduction. Pediatrics. 2012; 129(5):e1311-9. [DOI] [PubMed]
- 327.Wiegman A, Gidding SS, Watts GF, Chapman MJ, Ginsberg HN, Cuchel M, et al. Familial hypercholesterolaemia in children and adolescents: gaining decades of life by optimizing detection and treatment. Eur Heart J. 2015;36(36):2425–2437. doi: 10.1093/eurheartj/ehv157. [DOI] [PMC free article] [PubMed] [Google Scholar]; Wiegman A, Gidding SS, Watts GF, Chapman MJ, Ginsberg HN, Cuchel M, et al. Familial hypercholesterolaemia in children and adolescents: gaining decades of life by optimizing detection and treatment. Eur Heart J. 2015;36(36):2425-37. [DOI] [PMC free article] [PubMed]
- 328.Mata P, Alonso R, Ruiz A, et al. Diagnosis and treatment of familial hypercholesterolemia in Spain: consensus document. Aten Primaria. 2015;47(1):56–65. doi: 10.1016/j.aprim.2013.12.015. [DOI] [PMC free article] [PubMed] [Google Scholar]; Mata P, Alonso R, Ruiz A et al. Diagnosis and treatment of familial hypercholesterolemia in Spain: consensus document. Aten Primaria. 2015; 47(1):56-65. [DOI] [PMC free article] [PubMed]
- 329.Caballero P, Alonso R, Rosado P, et al. Detection of subclinical atherosclerosis in familial hypercholesterolemia using non-invasive imaging modalities. Atherosclerosis. 2012;222(2):468–472. doi: 10.1016/j.atherosclerosis.2012.02.043. [DOI] [PubMed] [Google Scholar]; Caballero P, Alonso R, Rosado P et al. Detection of subclinical atherosclerosis in familial hypercholesterolemia using non-invasive imaging modalities. Atherosclerosis. 2012; 222(2):468-72. [DOI] [PubMed]
- 330.Dalla Pozza R, Ehringer-Schetitska D, Fritsch P, et al. Association for European Paediatric Cardiology Working Group Cardiovascular Prevention. Intima media thickness measurement in children: a statement from the Association for European Paediatric Cardiology (AEPC) Working Group on Cardiovascular Prevention endorsed by the Association for European Paediatric Cardiology. Atherosclerosis. 2015;238(2):380–387. doi: 10.1016/j.atherosclerosis.2014.12.029. [DOI] [PubMed] [Google Scholar]; Dalla Pozza R, Ehringer-Schetitska D, Fritsch P et al. Association for European Paediatric Cardiology Working Group Cardiovascular Prevention. Intima media thickness measurement in children: a statement from the Association for European Paediatric Cardiology (AEPC) Working Group on Cardiovascular Prevention endorsed by the Association for European Paediatric Cardiology. Atherosclerosis. 2015; 238(2):380-7. [DOI] [PubMed]
- 331.Narverud I, Retterstøl K, Iversen PO, et al. Markers of atherosclerotic development in children with familial hypercholesterolemia: a literature review. Atherosclerosis. 2014;235(2):299–309. doi: 10.1016/j.atherosclerosis.2014.05.917. [DOI] [PubMed] [Google Scholar]; Narverud I, Retterstøl K, Iversen PO et al. Markers of atherosclerotic development in children with familial hypercholesterolemia: a literature review. Atherosclerosis. 2014; 235(2):299-309. [DOI] [PubMed]
- 332.Riggio S, Mandraffino G, Sardo MA, et al. Pulse wave velocity and augmentation index, but not intima-media thickness, are early indicators of vascular damage in hypercholesterolemic children. Eur J Clin Invest. 2010;40(3):250–257. doi: 10.1111/j.1365-2362.2010.02260.x. [DOI] [PubMed] [Google Scholar]; Riggio S, Mandraffino G, Sardo MA et al. Pulse wave velocity and augmentation index, but not intima-media thickness, are early indicators of vascular damage in hypercholesterolemic children. Eur J Clin Invest. 2010; 40(3):250-7. [DOI] [PubMed]
- 333.Vitarelli A, Martino F, Capotosto L, et al. Early myocardial deformation changes in hypercholesterolemic and obese children and adolescents: a 2D and 3D speckle tracking echocardiography study. Medicine (Baltimore) 2014;93(12):e71. doi: 10.1097/MD.0000000000000071. [DOI] [PMC free article] [PubMed] [Google Scholar]; Vitarelli A, Martino F, Capotosto L et al. Early myocardial deformation changes in hypercholesterolemic and obese children and adolescents: a 2D and 3D speckle tracking echocardiography study. Medicine (Baltimore). 2014; 93(12):e71. [DOI] [PMC free article] [PubMed]
- 334.Lebars MA, Rieu D, Girardet JP. Dietary recommendations for children with hypercholesterolemia. Arch Pediatr. 2010;17(7):1126–1132. doi: 10.1016/j.arcped.2010.04.014. [DOI] [PubMed] [Google Scholar]; Lebars MA, Rieu D, Girardet JP. Dietary recommendations for children with hypercholesterolemia. Arch Pediatr. 2010; 17(7):1126-32. [DOI] [PubMed]
- 335.Shafiq N, Singh M, Kaur S, et al. Dietary treatment for familial hypercholesterolemia. Cochrane Database Syst Rev. 2010;(1) doi: 10.1002/14651858.CD001918.pub2. CD001918. [DOI] [PubMed] [Google Scholar]; Shafiq N, Singh M, Kaur S et al. Dietary treatment for familial hypercholesterolemia. Cochrane Database Syst Rev. 2010; (1):CD001918. [DOI] [PubMed]
- 336.Sánchez-Bayle M, Soriano-Guillén L. Influence of dietary intervention on growth in children with hypercholesterolemia. Acta Paediatr. 2003;92(9):1043–1046. doi: 10.1080/08035250310004775. [DOI] [PubMed] [Google Scholar]; Sánchez-Bayle M, Soriano-Guillén L. Influence of dietary intervention on growth in children with hypercholesterolemia. Acta Paediatr. 2003; 92(9):1043-6. [DOI] [PubMed]
- 337.Piercy KL, Troiano RP, Ballard RM, et al. The Physical Activity Guidelines for Americans. JAMA. 2018;320(19):2020–2028. doi: 10.1001/jama.2018.14854. [DOI] [PMC free article] [PubMed] [Google Scholar]; Piercy KL, Troiano RP, Ballard RM et al. The Physical Activity Guidelines for Americans. JAMA. 2018; 320(19):2020-8. [DOI] [PMC free article] [PubMed]
- 338.Dias KA, Green DJ, Ingul CB, et al. Exercise and vascular function in child obesity: a meta-analysis. Pediatrics. 2015;136(3):e648–e659. doi: 10.1542/peds.2015-0616. [DOI] [PubMed] [Google Scholar]; Dias KA, Green DJ, Ingul CB et al. Exercise and vascular function in child obesity: a meta-analysis. Pediatrics. 2015; 136(3):e648-59. [DOI] [PubMed]
- 339.Vázquez MA, Vázquez BY, Intaglietta M, et al. Nonobese, exercising children diagnosed with dyslipidemia have normal C-reactive protein. Vasc Health Risk Manag. 2009;5(1):65–69. quiz 70-2. [PMC free article] [PubMed] [Google Scholar]; Vázquez MA, Vázquez BY, Intaglietta M et al. Nonobese, exercising children diagnosed with dyslipidemia have normal C-reactive protein. Vasc Health Risk Manag. 2009; 5(1):65-9; quiz 70-2. [PMC free article] [PubMed]
- 340.Ambrosetti M, Malfatto G, Cremona MA, et al. Familial hypercholesterolemia in cardiac rehabilitation: a new field of interest. Monaldi Arch Chest Dis. 2014;82(2):87–92. doi: 10.4081/monaldi.2014.49. [DOI] [PubMed] [Google Scholar]; Ambrosetti M, Malfatto G, Cremona MA et al. Familial hypercholesterolemia in cardiac rehabilitation: a new field of interest. Monaldi Arch Chest Dis. 2014; 82(2):87-92. [DOI] [PubMed]
- 341.Avis HJ, Vissers MN, Stein EA, et al. A systematic review and meta-analysis of statin therapy in children with familial hypercholesterolemia. Arterioscler Thromb Vasc Biol. 2007;27(8):1803–1810. doi: 10.1161/ATVBAHA.107.145151. [DOI] [PubMed] [Google Scholar]; Avis HJ, Vissers MN, Stein EA et al. A systematic review and meta-analysis of statin therapy in children with familial hypercholesterolemia. Arterioscler Thromb Vasc Biol. 2007; 27(8):1803-10. [DOI] [PubMed]
- 342.Martin AC, Gidding SS, Wiegman A, et al. Knowns and unknowns in the care of pediatric familial hypercholesterolemia. J Lipid Res. 2017;58(9):1765–1776. doi: 10.1194/jlr.S074039. [DOI] [PMC free article] [PubMed] [Google Scholar]; Martin AC, Gidding SS, Wiegman A et al. Knowns and unknowns in the care of pediatric familial hypercholesterolemia. J Lipid Res. 2017; 58(9):1765-76. [DOI] [PMC free article] [PubMed]
- 343.Arambepola C, Farmer AJ, Perera R, et al. Statin treatment for children and adolescents with heterozygous familial hypercholesterolemia: a systematic review and meta-analysis. Atherosclerosis. 2007;195(2):339–347. doi: 10.1016/j.atherosclerosis.2006.09.030. [DOI] [PubMed] [Google Scholar]; Arambepola C, Farmer AJ, Perera R et al. Statin treatment for children and adolescents with heterozygous familial hypercholesterolemia: a systematic review and meta-analysis. Atherosclerosis. 2007; 195(2):339-47. [DOI] [PubMed]
- 344.Avis HJ, Hargreaves IP, Ruiter JP, et al. Rosuvastatin lowers coenzyme Q10 levels, but not mitochondrial adenosine triphosphate synthesis, in children with familial hypercholesterolemia. J Pediatr. 2011;158(3):458–462. doi: 10.1016/j.jpeds.2010.08.015. [DOI] [PubMed] [Google Scholar]; Avis HJ, Hargreaves IP, Ruiter JP et al. Rosuvastatin lowers coenzyme Q10 levels, but not mitochondrial adenosine triphosphate synthesis, in children with familial hypercholesterolemia. J Pediatr. 2011; 158(3):458-62. [DOI] [PubMed]
- 345.Avis HJ, Hutten BA, Gagné C, et al. Efficacy and safety of rosuvastatin therapy for children with familial hypercholesterolemia. J Am Coll Cardiol. 2010;55(11):1121–1126. doi: 10.1016/j.jacc.2009.10.042. [DOI] [PubMed] [Google Scholar]; Avis HJ, Hutten BA, Gagné C et al. Efficacy and safety of rosuvastatin therapy for children with familial hypercholesterolemia. J Am Coll Cardiol. 2010; 55(11):1121-6. [DOI] [PubMed]
- 346.Clauss SB, Holmes KW, Hopkins P, et al. Efficacy and safety of lovastatin therapy in adolescent girls with heterozygous familial hypercholesterolemia. Pediatrics. 2005;116(3):682–688. doi: 10.1542/peds.2004-2090. [DOI] [PubMed] [Google Scholar]; Clauss SB, Holmes KW, Hopkins P et al. Efficacy and safety of lovastatin therapy in adolescent girls with heterozygous familial hypercholesterolemia. Pediatrics. 2005; 116(3):682-8. [DOI] [PubMed]
- 347.Ferreira WP, Bertolami MC, Santos SN, et al. One-month therapy with simvastatin restores endothelial function in hypercholesterolemic children and adolescents. Pediatr Cardiol. 2007;28(1):8–13. doi: 10.1007/s00246-005-1304-x. [DOI] [PubMed] [Google Scholar]; Ferreira WP, Bertolami MC, Santos SN et al. One-month therapy with simvastatin restores endothelial function in hypercholesterolemic children and adolescents. Pediatr Cardiol. 2007; 28(1):8-13. [DOI] [PubMed]
- 348.Gandelman K, Glue P, Laskey R, et al. An eight-week trial investigating the efficacy and tolerability of atorvastatin for children and adolescents with heterozygous familial hypercholesterolemia. Pediatr Cardiol. 2011;32(4):433–441. doi: 10.1007/s00246-011-9885-z. [DOI] [PMC free article] [PubMed] [Google Scholar]; Gandelman K, Glue P, Laskey R et al. An eight-week trial investigating the efficacy and tolerability of atorvastatin for children and adolescents with heterozygous familial hypercholesterolemia. Pediatr Cardiol. 2011; 32(4):433-41. [DOI] [PMC free article] [PubMed]
- 349.Xavier HT, Izar MC, Faria JR, Neto, et al. V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis. Arq. Bras. Cardiol. 2013;101(4 Suppl 1):1–20. doi: 10.5935/abc.2013S010. [DOI] [PubMed] [Google Scholar]; Xavier HT, Izar MC, Faria Neto JR et al. V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis. Arq. Bras. Cardiol. 2013; 101(4 Suppl 1):1-20. [DOI] [PubMed]
- 350.Clauss S, Wai KM, Kavey RE, et al. Ezetimibe treatment of pediatric patients with hypercholesterolemia. J Pediatr. 2009;154(6):869–872. doi: 10.1016/j.jpeds.2008.12.044. [DOI] [PubMed] [Google Scholar]; Clauss S, Wai KM, Kavey RE et al. Ezetimibe treatment of pediatric patients with hypercholesterolemia. J Pediatr. 2009; 154(6):869-72. [DOI] [PubMed]
- 351.Davidson MH. A systematic review of bile acid sequestrant therapy in children with familial hypercholesterolemia. J Clin Lipidol. 2011;5(2):76–81. doi: 10.1016/j.jacl.2011.01.005. [DOI] [PubMed] [Google Scholar]; Davidson MH. A systematic review of bile acid sequestrant therapy in children with familial hypercholesterolemia. J Clin Lipidol. 2011; 5(2):76-81. [DOI] [PubMed]
- 352.Amundsen AL, Ose L, Nenseter MS, et al. Plant sterol ester-enriched spread lowers plasma total and LDL cholesterol in children with familial hypercholesterolemia. Am J Clin Nutr. 2002;76(2):338–344. doi: 10.1093/ajcn/76.2.338. [DOI] [PubMed] [Google Scholar]; Amundsen AL, Ose L, Nenseter MS et al. Plant sterol ester-enriched spread lowers plasma total and LDL cholesterol in children with familial hypercholesterolemia. Am J Clin Nutr. 2002; 76(2):338-44. [DOI] [PubMed]
- 353.Santos RD, Ruzza A, Hovingh GK, et al. HAUSER-RCT Investigators. Evolocumab in pediatric heterozygous familial hypercholesterolemia. N Engl J Med. 2020;383(14):1317–1327. doi: 10.1056/NEJMoa2019910. [DOI] [PubMed] [Google Scholar]; Santos RD, Ruzza A, Hovingh GK et al; HAUSER-RCT Investigators. Evolocumab in pediatric heterozygous familial hypercholesterolemia. N Engl J Med. 2020;383(14):1317-1327. [DOI] [PubMed]
- 354.Daniels S, Caprio S, Chaudhari U, et al. PCSK9 inhibition with alirocumab in pediatric patients with heterozygous familial hypercholesterolemia: The ODYSSEY KIDS study. J Clin Lipidol. 2020;14(3):322.e5–330.e5. doi: 10.1016/j.jacl.2020.03.001. [DOI] [PubMed] [Google Scholar]; Daniels S, Caprio S, Chaudhari U et al. PCSK9 inhibition with alirocumab in pediatric patients with heterozygous familial hypercholesterolemia: The ODYSSEY KIDS study. J Clin Lipidol. 2020;14(3):322-330.e5. [DOI] [PubMed]
- 355.Sabatine MS, Giugliano RP, Wiviott SD, et al. Open-Label Study of Long-Term Evaluation against LDL Cholesterol (OSLER) Investigators. Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. N Engl J Med. 2015;372(16):1500–1509. doi: 10.1056/NEJMoa1500858. [DOI] [PubMed] [Google Scholar]; Sabatine MS, Giugliano RP, Wiviott SD et al. Open-Label Study of Long-Term Evaluation against LDL Cholesterol (OSLER) Investigators. Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. N Engl J Med 2015; 372(16):1500-9. [DOI] [PubMed]
- 356.Robinson JG, Farnier M, Krempf M, et al. Odyssey long term investigators. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med. 2015;372(16):1489–1499. doi: 10.1056/NEJMoa1501031. [DOI] [PubMed] [Google Scholar]; Robinson JG, Farnier M, Krempf M et al. Odyssey long term investigators. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med. 2015; 372(16):1489-99. [DOI] [PubMed]
- 357.Vuorio A, Watts GF, Petri T. Initiation of PCSK9 inhibition in patients with heterozygous familial hypercholesterolemia entering adulthood: a new design for living with a high-risk condition? Eur Heart J. 2016;37(17):1353–1356. doi: 10.1093/eurheartj/ehw010. [DOI] [PubMed] [Google Scholar]; Vuorio A, Watts GF, Petri T. Initiation of PCSK9 inhibition in patients with heterozygous familial hypercholesterolemia entering adulthood: a new design for living with a high-risk condition? Eur Heart J. 2016; 37(17):1353-6. [DOI] [PubMed]
- 358.France M, Rees A, Datta D, et al. Heart UK Medical Scientific and Research Committee. HEART UK statement on the management of homozygous familial hypercholesterolaemia in the United Kingdom. Atherosclerosis. 2016;255:128–139. doi: 10.1016/j.atherosclerosis.2016.10.017. [DOI] [PubMed] [Google Scholar]; France M, Rees A, Datta D et al. Heart UK Medical Scientific and Research Committee. HEART UK statement on the management of homozygous familial hypercholesterolaemia in the United Kingdom. Atherosclerosis. 2016; 255:128-39. [DOI] [PubMed]
- 359.Nemati MH, Astaneh B, Joubeh A. Triple coronary artery bypass graft in a 10-year-old child with familial hypercholesterolemia. Gen Thorac Cardiovasc Surg. 2009;57(2):94–97. doi: 10.1007/s11748-008-0335-7. [DOI] [PubMed] [Google Scholar]; Nemati MH, Astaneh B, Joubeh A. Triple coronary artery bypass graft in a 10-year-old child with familial hypercholesterolemia. Gen Thorac Cardiovasc Surg. 2009; 57(2):94-7. [DOI] [PubMed]
- 360.Winkler B, Kuhn S, Kunzmann S, et al. Severe hypertriglyceridemia in a 6-year-old boy with ALL relapse: successfully treated with plasmapheresis. Klin Padiatr. 2013;225(6):364–365. doi: 10.1055/s-0033-1355371. [DOI] [PubMed] [Google Scholar]; Winkler B, Kuhn S, Kunzmann S et al. Severe hypertriglyceridemia in a 6-year-old boy with ALL relapse: successfully treated with plasmapheresis. Klin Padiatr. 2013; 225(6):364-5. [DOI] [PubMed]
- 361.Bilal MS, Aydemir NA, Turan T. Rosskono procedure and postal pasty in a child with homozygous hypercholesterolemia: case report. J Heart Valve Dis. 2005;14(6):855–858. [PubMed] [Google Scholar]; Bilal MS, Aydemir NA, Turan T. Rosskono procedure and postal pasty in a child with homozygous hypercholesterolemia: case report. J Heart Valve Dis. 2005; 14(6):855-8. [PubMed]
- 362.Radaelli G, Sausen G, Cesa CC, et al. Statin treatments and dosages in children with familial hypercholesterolemia: meta-analysis. Arq Bras Cardiol. 2018;111(6):810–821. doi: 10.5935/abc.20180180. [DOI] [PMC free article] [PubMed] [Google Scholar]; Radaelli G, Sausen G, Cesa CC et al. Statin treatments and dosages in children with familial hypercholesterolemia: meta-analysis. Arq Bras Cardiol. 2018; 111(6):810-21. [DOI] [PMC free article] [PubMed]
- 363.de Jongh S, Kerckhoffs MC, Grootenhuis MA, et al. Quality of life, anxiety and concerns among statin-treated children with familial hypercholesterolemia and their parents. Acta Pediatr. 2003;92(9):1096–1101. doi: 10.1080/08035250310004298. [DOI] [PubMed] [Google Scholar]; de Jongh S, Kerckhoffs MC, Grootenhuis MA et al. Quality of life, anxiety and concerns among statin-treated children with familial hypercholesterolemia and their parents. Acta Pediatr. 2003; 92(9):1096-101. [DOI] [PubMed]
- 364.Toleikyte I, Retterstøl K, Leren TP, et al. Pregnancy outcomes in familial hypercholesterolemia: a registry-based study. Circulation. 2011;124(15):1606–1614. doi: 10.1161/CIRCULATIONAHA.110.990929. [DOI] [PubMed] [Google Scholar]; Toleikyte I, Retterstøl K, Leren TP et al. Pregnancy outcomes in familial hypercholesterolemia: a registry-based study. Circulation. 2011; 124(15):1606-14. [DOI] [PubMed]
- 365.Ito MK, McGowan MP, Moriarty PM. National Lipid Association Expert Panel on Familial Hypercholesterolemia. Management of familial hypercholesterolemia in adult patients: recommendations form the National Lipid Association Expert Panel on Familial Hypercholesterolemia. J Clin Lipidol. 2011;5(3Suppl):S38–S45. doi: 10.1016/j.jacl.2011.04.001. [DOI] [PubMed] [Google Scholar]; Ito MK, McGowan MP, Moriarty PM; National Lipid Association Expert Panel on Familial Hypercholesterolemia. Management of familial hypercholesterolemia in adult patients: recommendations form the National Lipid Association Expert Panel on Familial Hypercholesterolemia. J Clin Lipidol. 2011; 5(3Suppl):S38-45. [DOI] [PubMed]
- 366.Klingel R, Göhlen B, Schwarting A, et al. Differential indication of lipoprotein apheresis during pregnancy. Ther Apher Dial. 2003;7(3):359–364. doi: 10.1046/j.1526-0968.2003.00066.x. [DOI] [PubMed] [Google Scholar]; Klingel R, Göhlen B, Schwarting A et al. Differential indication of lipoprotein apheresis during pregnancy. Ther Apher Dial. 2003; 7(3):359-64. [DOI] [PubMed]
- 367.Thorogood M, Seed M, De Mott K. Guideline Development Group. Management of fertility in women with familial hypercholesterolemia: summary of NICE guidance. BJOG. 2009;116(4):478–479. doi: 10.1111/j.1471-0528.2008.02084.x. [DOI] [PubMed] [Google Scholar]; Thorogood M, Seed M, De Mott K; Guideline Development Group. Management of fertility in women with familial hypercholesterolemia: summary of NICE guidance. BJOG. 2009; 116(4):478-9. [DOI] [PubMed]
- 368.Simonson SG, Martin PD, Warwick MJ, et al. The effect of rosuvastatin on oestrogen & progestin pharmacokinetics in healthy women taking an oral contraceptive. Br J Clin Pharmacol. 2004;57(3):279–286. doi: 10.1046/j.1365-2125.2003.02015.x. [DOI] [PMC free article] [PubMed] [Google Scholar]; Simonson SG, Martin PD, Warwick MJ et al. The effect of rosuvastatin on oestrogen & progestin pharmacokinetics in healthy women taking an oral contraceptive. Br J Clin Pharmacol. 2004; 57(3):279-86. [DOI] [PMC free article] [PubMed]
- 369.Kusters DM, Homsma SJ, Hutten BA, et al. Dilemmas in treatment of women with familial hypercholesterolemia during pregnancy. Neth J Med. 2010;68(1):299–303. [PubMed] [Google Scholar]; Kusters DM, Homsma SJ, Hutten BA et al. Dilemmas in treatment of women with familial hypercholesterolemia during pregnancy. Neth J Med. 2010; 68(1):299-303. [PubMed]
- 370.Catov JM, Bodnar LM, Kip KE, et al. Early pregnancy lipid concentrations and spontaneous preterm birth. Am J Obstet Gynecol. 2007;197(6):610.e1-7–610.e1-7. doi: 10.1016/j.ajog.2007.04.024. [DOI] [PubMed] [Google Scholar]; Catov JM, Bodnar LM, Kip KE et al. Early pregnancy lipid concentrations and spontaneous preterm birth. Am J Obstet Gynecol. 2007; 197(6):610.e1-7. [DOI] [PubMed]
- 371.Amundsen AL, Khoury J, Iversen PO, et al. Marked changes in plasma lipids and lipoproteins during pregnancy in women with familial hypercholesterolemia. Atherosclerosis. 2006;189(2):451–457. doi: 10.1016/j.atherosclerosis.2006.01.002. [DOI] [PubMed] [Google Scholar]; Amundsen AL, Khoury J, Iversen PO et al. Marked changes in plasma lipids and lipoproteins during pregnancy in women with familial hypercholesterolemia. Atherosclerosis. 2006; 189(2):451-7. [DOI] [PubMed]
- 372.Hameed AB, Tummala PP, Goodwin TM, et al. Unstable angina during pregnancy in two patients with premature coronary atherosclerosis and aortic stenosis in association with familial hypercholesterolemia. Am J Obstet Gynecol. 2000;182(5):1152–1155. doi: 10.1067/mob.2000.103210. [DOI] [PubMed] [Google Scholar]; Hameed AB, Tummala PP, Goodwin TM et al. Unstable angina during pregnancy in two patients with premature coronary atherosclerosis and aortic stenosis in association with familial hypercholesterolemia. Am J Obstet Gynecol. 2000; 182(5):1152-5. [DOI] [PubMed]
- 373.Khoury J, Amundsen AL, Tonstad S, et al. Evidence for impaired physiological decrease in the uteroplacental vascular resistance in pregnant women with familial hypercholesterolemia. Acta Obstet Gynecol Scand. 2009;88(2):222–226. doi: 10.1080/00016340802503047. [DOI] [PubMed] [Google Scholar]; Khoury J, Amundsen AL, Tonstad S et al. Evidence for impaired physiological decrease in the uteroplacental vascular resistance in pregnant women with familial hypercholesterolemia. Acta Obstet Gynecol Scand. 2009; 88(2):222-6. [DOI] [PubMed]
- 374.Liguori A, D’Armiento FP, Palagiano A, et al. Effect of gestational hypercholesterolemia on omental vasoreactivity, placental enzyme activity and transplacental passage of normal and oxidised fatty acids. BJOG. 2007;114(12):1547–1556. doi: 10.1111/j.1471-0528.2007.01510.x. [DOI] [PubMed] [Google Scholar]; Liguori A, D’Armiento FP, Palagiano A et al. Effect of gestational hypercholesterolemia on omental vasoreactivity, placental enzyme activity and transplacental passage of normal and oxidised fatty acids. BJOG. 2007; 114(12):1547-56. [DOI] [PubMed]
- 375.Varret M, Rabes JP, Saint-Jore B, et al. A third major locus for autosomal dominant hypercholesterolemia maps to 1p34.1-p32. Am J Hum Genet. 1999;64(5):1378–1387. doi: 10.1086/302370. [DOI] [PMC free article] [PubMed] [Google Scholar]; Varret M, Rabes JP, Saint-Jore B et al. A third major locus for autosomal dominant hypercholesterolemia maps to 1p34.1-p32. Am J Hum Genet. 1999; 64(5):1378-87. [DOI] [PMC free article] [PubMed]
- 376.Horton JD, Cohen JC, Hobbs HH. PCSK9: a convertase that coordinates LDL catabolism. J Lipid Res. 2009;50(Suppl):S172–S177. doi: 10.1194/jlr.R800091-JLR200. [DOI] [PMC free article] [PubMed] [Google Scholar]; Horton JD, Cohen JC, Hobbs HH. PCSK9: a convertase that coordinates LDL catabolism. J Lipid Res. 2009; 50 (Suppl):S172-7. [DOI] [PMC free article] [PubMed]
- 377.Maxwell KN, Fisher EA, Breslow JL. Overexpression of PCSK9 accelerates the degradation of the LDLR in a post-endoplasmic reticulum compartment. Proc Natl Acad Sci USA. 2005;102(6):2069–2074. doi: 10.1073/pnas.0409736102. [DOI] [PMC free article] [PubMed] [Google Scholar]; Maxwell KN, Fisher EA, Breslow JL. Overexpression of PCSK9 accelerates the degradation of the LDLR in a post-endoplasmic reticulum compartment. Proc Natl Acad Sci USA. 2005; 102(6):2069-74. [DOI] [PMC free article] [PubMed]
- 378.Cohen JC, Boerwinkle E, Mosley TH, Jr, et al. Sequence variations in PCSK9, low LDL, and protection against coronary heart disease. N Engl J Med. 2006;354(12):1264–1272. doi: 10.1056/NEJMoa054013. [DOI] [PubMed] [Google Scholar]; Cohen JC, Boerwinkle E, Mosley TH Jr. et al. Sequence variations in PCSK9, low LDL, and protection against coronary heart disease. N Engl J Med. 2006; 354(12):1264-72. [DOI] [PubMed]
- 379.Robinson JG, Nedergaard BS, Rogers WJ, et al. Effect of evolocumab or ezetimibe added to moderate or high-intensity statin therapy on LDL-C lowering in patients with hypercholesterolemia: the LAPLACE-2 randomized clinical trial. JAMA. 2014;311(18):1870–1882. doi: 10.1001/jama.2014.4030. [DOI] [PubMed] [Google Scholar]; Robinson JG, Nedergaard BS, Rogers WJ et al. Effect of evolocumab or ezetimibe added to moderate or high-intensity statin therapy on LDL-C lowering in patients with hypercholesterolemia: the LAPLACE-2 randomized clinical trial. JAMA. 2014; 311(18):1870-82. [DOI] [PubMed]
- 380.Raal FJ, Honarpour N, Blom DJ, et al. Inhibition of PCSK9 with evolocumab in homozygous familial hypercholesterolemia (TESLA Part B): a randomized, double-blind, placebo-controlled trial. Lancet. 2015;385(9965):341–350. doi: 10.1016/S0140-6736(14)61374-X. [DOI] [PubMed] [Google Scholar]; Raal FJ, Honarpour N, Blom DJ et al. Inhibition of PCSK9 with evolocumab in homozygous familial hypercholesterolemia (TESLA Part B): a randomized, double-blind, placebo-controlled trial. Lancet. 2015; 385(9965):341-50. [DOI] [PubMed]
- 381.Roth EM, Taskinen MR, Ginsberg HN, et al. Monotherapy with the PCSK9 inhibitor alirocumab versus ezetimibe in patients with hypercholesterolemia: results of a 24 week, double-blind, randomized Phase 3 trial. Int J Cardiol. 2014;176(1):55–61. doi: 10.1016/j.ijcard.2014.06.049. [DOI] [PubMed] [Google Scholar]; Roth EM, Taskinen MR, Ginsberg HN et al. Monotherapy with the PCSK9 inhibitor alirocumab versus ezetimibe in patients with hypercholesterolemia: results of a 24 week, double-blind, randomized Phase 3 trial. Int J Cardiol. 2014; 176(1):55-61. [DOI] [PubMed]
- 382.Cannon CP, Cariou B, Blom D, et al. Efficacy and safety of alirocumab in high cardiovascular risk patients with inadequately controlled hypercholesterolemia on maximally tolerated doses of statins: the ODYSSEY COMBO II randomized controlled trial. Eur Heart J. 2015;36(19):1186–1194. doi: 10.1093/eurheartj/ehv028. [DOI] [PMC free article] [PubMed] [Google Scholar]; Cannon CP, Cariou B, Blom D et al. Efficacy and safety of alirocumab in high cardiovascular risk patients with inadequately controlled hypercholesterolemia on maximally tolerated doses of statins: the ODYSSEY COMBO II randomized controlled trial. Eur Heart J. 2015; 36(19):1186-94. [DOI] [PMC free article] [PubMed]
- 383.Roth EM, Moriarty PM, Bergeron J, et al. A phase III randomized trial evaluating alirocumab 300 mg every 4 weeks as monotherapy or add-on to statin: ODYSSEY CHOICE I. Atherosclerosis. 2016;254:254–262. doi: 10.1016/j.atherosclerosis.2016.08.043. [DOI] [PubMed] [Google Scholar]; Roth EM, Moriarty PM, Bergeron J et al. A phase III randomized trial evaluating alirocumab 300 mg every 4 weeks as monotherapy or add-on to statin: ODYSSEY CHOICE I. Atherosclerosis. 2016; 254:254-62. [DOI] [PubMed]
- 384.Ginsberg HN, Rader DJ, Raal FJ, et al. Efficacy and safety of alirocumab in patients with heterozygous familial hypercholesterolemia and LDL-C of 160 mg/dl or higher. Cardiovasc Drugs Ther. 2016;30(5):473–483. doi: 10.1007/s10557-016-6685-y. [DOI] [PMC free article] [PubMed] [Google Scholar]; Ginsberg HN, Rader DJ, Raal FJ et al. Efficacy and safety of alirocumab in patients with heterozygous familial hypercholesterolemia and LDL-C of 160 mg/dl or higher. Cardiovasc Drugs Ther. 2016; 30(5):473-83. [DOI] [PMC free article] [PubMed]
- 385.Hartgers ML, Defesche JC, Langslet G, et al. Alirocumab efficacy in patients with double heterozygous, compound heterozygous, or homozygous familial hypercholesterolemia. J Clin Lipidol. 2018;12(2):390e8–396e8. doi: 10.1016/j.jacl.2017.12.008. [DOI] [PubMed] [Google Scholar]; Hartgers ML, Defesche JC, Langslet G et al. Alirocumab efficacy in patients with double heterozygous, compound heterozygous, or homozygous familial hypercholesterolemia. J Clin Lipidol. 2018; 12(2):390-6e8. [DOI] [PubMed]
- 386.Sabatine MS, Giugliano RP, Keech A, et al. Rationale and design of the further cardiovascular outcomes research with PCSK9 inhibition in subjects with elevated risk trial. Am Heart J. 2016;173:94–101. doi: 10.1016/j.ahj.2015.11.015. [DOI] [PubMed] [Google Scholar]; Sabatine MS, Giugliano RP, Keech A et al. Rationale and design of the further cardiovascular outcomes research with PCSK9 inhibition in subjects with elevated risk trial. Am Heart J. 2016; 173:94-101. [DOI] [PubMed]
- 387.Giugliano RP, Mach F, Zavitz K, et al. EBBINGHAUS Investigators. Cognitive function in a randomized trial of evolocumab. N Engl J Med. 2017;377(7):633–643. doi: 10.1056/NEJMoa1701131. [DOI] [PubMed] [Google Scholar]; Giugliano RP, Mach F, Zavitz K et al; EBBINGHAUS Investigators. Cognitive function in a randomized trial of evolocumab. N Engl J Med. 2017; 377(7):633-43. [DOI] [PubMed]
- 388.Ridker PM, Revkin J, Amarenco P, et al. Cardiovascular efficacy and safety of bococizumab in high-risk patients. N Engl J Med. 2017;376(16):1527–1539. doi: 10.1056/NEJMoa1701488. [DOI] [PubMed] [Google Scholar]; Ridker PM, Revkin J, Amarenco P et al. Cardiovascular efficacy and safety of bococizumab in high-risk patients. N Engl J Med. 2017; 376(16):1527-39. [DOI] [PubMed]
- 389.Ridker PM, Tardif JC, Amarenco P, et al. Lipid-reduction variability and antidrug-antibody formation with bococizumab. N Engl J Med. 2017;376(16):1517–1526. doi: 10.1056/NEJMoa1614062. [DOI] [PubMed] [Google Scholar]; Ridker PM, Tardif JC, Amarenco P et al. Lipid-reduction variability and antidrug-antibody formation with bococizumab. N Engl J Med. 2017; 376(16):1517-26. [DOI] [PubMed]
- 390.Ridker PM, Rose LM, Kastelein JJP, et al. Cardiovascular event reduction with PCSK9 inhibition among 1578 patients with familial hypercholesterolemia: results from the SPIRE randomized trials of bococizumab. J Clin Lipidol. 2018;12(4):958–965. doi: 10.1016/j.jacl.2018.03.088. [DOI] [PubMed] [Google Scholar]; Ridker PM, Rose LM, Kastelein JJP et al. Cardiovascular event reduction with PCSK9 inhibition among 1578 patients with familial hypercholesterolemia: results from the SPIRE randomized trials of bococizumab. J Clin Lipidol. 2018; 12(4):958-65. [DOI] [PubMed]
- 391.Schwartz GG, Bessac L, Berdan LG, et al. Effect of alirocumab, a monoclonal antibody to PCSK9, on long-term cardiovascular outcomes following acute coronary syndromes: rationale and design of the ODYSSEY outcomes trial. Am Heart J. 2014;168(5):682–689. doi: 10.1016/j.ahj.2014.07.028. [DOI] [PubMed] [Google Scholar]; Schwartz GG, Bessac L, Berdan LG et al. Effect of alirocumab, a monoclonal antibody to PCSK9, on long-term cardiovascular outcomes following acute coronary syndromes: rationale and design of the ODYSSEY outcomes trial. Am Heart J. 2014; 168(5):682-9. [DOI] [PubMed]
- 392.Neef D, Berthold HK, Gouni-Berthold I. Lomitapide for use in patients with homozygous familial hypercholesterolemia: a narrative review. Expert Rev Clin Pharmacol. 2016;9(5):655–663. doi: 10.1586/17512433.2016.1162095. [DOI] [PubMed] [Google Scholar]; Neef D, Berthold HK, Gouni-Berthold I. Lomitapide for use in patients with homozygous familial hypercholesterolemia: a narrative review. Expert Rev Clin Pharmacol. 2016; 9(5):655-63. [DOI] [PubMed]
- 393.Hussain MM, Rava P, Walsh M, et al. Multiple functions of microsomal triglyceride transfer protein. Nutr Metab (Lond) 2012;9(14):1–16. doi: 10.1186/1743-7075-9-14. [DOI] [PMC free article] [PubMed] [Google Scholar]; Hussain MM, Rava P, Walsh M et al. Multiple functions of microsomal triglyceride transfer protein. Nutr Metab (Lond). 2012; 9(14):1-16. [DOI] [PMC free article] [PubMed]
- 394.Chacra APM, Ferrari MC, Rocha VZ, et al. Case report: the efficiency and safety of lomitapide in a homozygous familial hypercholesterolemic child. J Clin Lipidol. 2019;13(3):397–401. doi: 10.1016/j.jacl.2019.03.001. [DOI] [PubMed] [Google Scholar]; Chacra APM, Ferrari MC, Rocha VZ et al. Case report: the efficiency and safety of lomitapide in a homozygous familial hypercholesterolemic child. J Clin Lipidol. 2019; 13(3):397-401. [DOI] [PubMed]
- 395.Cuchel M, Meagher EA, du Toit Theron H, et al. Phase 3 HoFH Lomitapide Study investigators. Efficacy and safety of a microsomal triglyceride transfer protein inhibitor in patients with homozygous familial hypercholesterolemia: a single-arm, open-label, phase 3 study. Lancet. 2013;381(9860):40–46. doi: 10.1016/S0140-6736(12)61731-0. [DOI] [PMC free article] [PubMed] [Google Scholar]; Cuchel M, Meagher EA, du Toit Theron H et al; Phase 3 HoFH Lomitapide Study investigators. Efficacy and safety of a microsomal triglyceride transfer protein inhibitor in patients with homozygous familial hypercholesterolemia: a single-arm, open-label, phase 3 study. Lancet. 2013; 381(9860):40-6. [DOI] [PMC free article] [PubMed]
- 396.Chandler CE, Wilder DE, Pettini JL, et al. CP346086: an MTP inhibitor that lowers plasma cholesterol and triglycerides in experimental animals and in humans. J Lipid Res. 2003;44(10):1887–1901. doi: 10.1194/jlr.M300094-JLR200. [DOI] [PubMed] [Google Scholar]; Chandler CE, Wilder DE, Pettini JL et al. CP346086: an MTP inhibitor that lowers plasma cholesterol and triglycerides in experimental animals and in humans. J Lipid Res. 2003; 44(10):1887-901. [DOI] [PubMed]
- 397.Blom DJ, Cuchel M, Ager M, Phillips H. Target achievement and cardiovascular event rates with lomitapide in homozygous familial hypercholesterolaemia. Orphanet J Rare Dis. 2018;13(1):96–96. doi: 10.1186/s13023-018-0841-3. [DOI] [PMC free article] [PubMed] [Google Scholar]; Blom DJ, Cuchel M, Ager M, Phillips H. Target achievement and cardiovascular event rates with lomitapide in homozygous familial hypercholesterolaemia. Orphanet J Rare Dis. 2018;13(1):96. [DOI] [PMC free article] [PubMed]
- 398.Blom DJ, Averna MR, Meagher EA, et al. Long-term efficacy and safety of the microsomal triglyceride transfer protein inhibitor lomitapide in patients with homozygous familial hypercholesterolemia. Circulation. 2017;136(3):332–335. doi: 10.1161/CIRCULATIONAHA.117.028208. [DOI] [PubMed] [Google Scholar]; Blom DJ, Averna MR, Meagher EA et al. Long-term efficacy and safety of the microsomal triglyceride transfer protein inhibitor lomitapide in patients with homozygous familial hypercholesterolemia. Circulation. 2017; 136(3):332-5. [DOI] [PubMed]
- 399.D’Erasmo L, Cefalu AB, Noto D, et al. Efficacy of lomitapide in the treatment of familial homozygous hypercholesterolemia: results of a real-world clinical experience in Italy. Adv Ther. 2017;34(5):1200–1210. doi: 10.1007/s12325-017-0531-x. [DOI] [PubMed] [Google Scholar]; D’Erasmo L, Cefalu AB, Noto D et al. Efficacy of lomitapide in the treatment of familial homozygous hypercholesterolemia: results of a real-world clinical experience in Italy. Adv Ther. 2017;34(5):1200-1210. [DOI] [PubMed]
- 400.Underberg JA, Cannon CP, Larrey D, et al. Long-term safety and efficacy of lomitapide in patients with homozygous familial hypercholesterolemia: Five-year data from the Lomitapide Observational Worldwide Evaluation Registry (LOWER) J Clin Lipidol. 2020;14(6):807–817. doi: 10.1016/j.jacl.2020.08.006. [DOI] [PubMed] [Google Scholar]; Underberg JA, Cannon CP, Larrey D et al. Long-term safety and efficacy of lomitapide in patients with homozygous familial hypercholesterolemia: Five-year data from the Lomitapide Observational Worldwide Evaluation Registry (LOWER). J Clin Lipidol. 2020;14(6):807-817. [DOI] [PubMed]
- 401.Santos RD, Valenti L, Romeo S. Does nonalcoholic fatty liver disease cause cardiovascular disease? Current knowledge and gaps. Atherosclerosis. 2019;282:110–120. doi: 10.1016/j.atherosclerosis.2019.01.029. [DOI] [PubMed] [Google Scholar]; Santos RD, Valenti L, Romeo S. Does nonalcoholic fatty liver disease cause cardiovascular disease? Current knowledge and gaps. Atherosclerosis. 2019; 282:110-20. [DOI] [PubMed]
- 402.Roeters van Lennep J, Averna M, Alonso R. Treating homozygous familial hypercholesterolemia in a real-world setting: experiences with lomitapide. J Clin Lipidol. 2015;9(4):607–617. doi: 10.1016/j.jacl.2015.05.001. [DOI] [PubMed] [Google Scholar]; Roeters van Lennep J, Averna M, Alonso R. Treating homozygous familial hypercholesterolemia in a real-world setting: experiences with lomitapide. J Clin Lipidol. 2015; 9(4):607-17. [DOI] [PubMed]
- 403.Tuteja S, Duffy D, Dunbar RL, et al. Pharmacokinetic interactions of the microsomal triglyceride transfer protein inhibitor, lomitapide, with drugs commonly used in the management of hypercholesterolemia. Pharmacotherapy. 2014;34(3):227–239. doi: 10.1002/phar.1351. [DOI] [PubMed] [Google Scholar]; Tuteja S, Duffy D, Dunbar RL et al. Pharmacokinetic interactions of the microsomal triglyceride transfer protein inhibitor, lomitapide, with drugs commonly used in the management of hypercholesterolemia. Pharmacotherapy. 2014; 34(3):227-39. [DOI] [PubMed]
- 404.Rader DJ, Kastelein JJ. Lomitapide and mipomersen: two first-in-class drugs for reducing low-density lipoprotein cholesterol in patients with homozygous familial hypercholesterolemia. Circulation. 2014;129(9):1022–1032. doi: 10.1161/CIRCULATIONAHA.113.001292. [DOI] [PubMed] [Google Scholar]; Rader DJ, Kastelein JJ. Lomitapide and mipomersen: two first-in-class drugs for reducing low-density lipoprotein cholesterol in patients with homozygous familial hypercholesterolemia. Circulation. 2014; 129(9):1022-32. [DOI] [PubMed]
- 405.Goldberg AC. Novel therapies and new targets of treatment for familial hypercholesterolemia. J Clin Lipidol. 2010;4(5):350–356. doi: 10.1016/j.jacl.2010.08.015. [DOI] [PubMed] [Google Scholar]; Goldberg AC. Novel therapies and new targets of treatment for familial hypercholesterolemia. J Clin Lipidol. 2010; 4(5):350-6. [DOI] [PubMed]
- 406.Raal FJ, Santos RD, Blom DJ, et al. Mipomersen, an apolipoprotein B synthesis inhibitor, for lowering of LDL cholesterol concentrations in patients with homozygous familial hypercholesterolemia: a randomized, double-blind, placebo-controlled trial. Lancet. 2010;375(9719):998–1006. doi: 10.1016/S0140-6736(10)60284-X. [DOI] [PubMed] [Google Scholar]; Raal FJ, Santos RD, Blom DJ et al. Mipomersen, an apolipoprotein B synthesis inhibitor, for lowering of LDL cholesterol concentrations in patients with homozygous familial hypercholesterolemia: a randomized, double-blind, placebo-controlled trial. Lancet. 2010; 375(9719):998-1006. [DOI] [PubMed]
- 407.Santos RD, Raal FJ, Catapano AL, et al. Mipomersen, an antisense oligonucleotide to apolipoprotein B-100, reduces lipoprotein(a) in various populations with hypercholesterolemia: results of 4 phase III. trials. Arterioscler Thromb Vasc Biol. 2015;35(3):689–699. doi: 10.1161/ATVBAHA.114.304549. [DOI] [PMC free article] [PubMed] [Google Scholar]; Santos RD, Raal FJ, Catapano AL et al. Mipomersen, an antisense oligonucleotide to apolipoprotein B-100, reduces lipoprotein(a) in various populations with hypercholesterolemia: results of 4 phase III. trials. Arterioscler Thromb Vasc Biol. 2015; 35(3):689-99. [DOI] [PMC free article] [PubMed]
- 408.Miller M, Wright CC, Browne B. Lipid-lowering medications for children and adolescents. J Clin Lipidol. 2015;9(Suppl 5):S67–S76. doi: 10.1016/j.jacl.2015.06.013. [DOI] [PubMed] [Google Scholar]; Miller M, Wright CC, Browne B. Lipid-lowering medications for children and adolescents. J Clin Lipidol. 2015; 9( Suppl 5):S67-S76. [DOI] [PubMed]
- 409.Brandts J, Ray KK. Clinical implications and outcomes of the ORION Phase III trials. Future Cardiol. 2020 doi: 10.2217/fca-2020-0150. Online ahead of print. [DOI] [PubMed] [Google Scholar]; Brandts J, Ray KK. Clinical implications and outcomes of the ORION Phase III trials. Future Cardiol. 2020. doi: 10.2217/fca-2020-0150. Online ahead of print. [DOI] [PubMed]
- 410.Ray KK, Landmesser U, Leiter LA, et al. Inclisiran in Patients at High Cardiovascular Risk with Elevated LDL Cholesterol. N Engl J Med. 2017;376(15):1430–1440. doi: 10.1056/NEJMoa1615758. [DOI] [PubMed] [Google Scholar]; Ray KK, Landmesser U, Leiter LA et al. Inclisiran in Patients at High Cardiovascular Risk with Elevated LDL Cholesterol. N Engl J Med. 2017;376(15):1430-40. [DOI] [PubMed]
- 411.Raal FJ, Kallend D, Ray KK, et al. Inclisiran for the treatment of heterozygous familial hypercholesterolemia. N Engl J Med. 2020;382(16):1520–1530. doi: 10.1056/NEJMoa1913805. [DOI] [PubMed] [Google Scholar]; Raal FJ, Kallend D, Ray KK et al. Inclisiran for the treatment of heterozygous familial hypercholesterolemia. N Engl J Med 2020; 382(16):1520-1530. [DOI] [PubMed]
- 412.Raal FJ, Rosenson RS, Reeskamp LF, et al. Evinacumab for homozygous familial hypercholesterolemia. N Engl J Med. 2020;383(8):711–720. doi: 10.1056/NEJMoa2004215. [DOI] [PubMed] [Google Scholar]; Raal FJ, Rosenson RS, Reeskamp LF et al. Evinacumab for homozygous familial hypercholesterolemia. N Engl J Med 2020; 383(8):711-720. [DOI] [PubMed]
- 413.Rosenson RS, Burgess LJ, Ebenbichler CF, et al. Evinacumab in patients with refractory hypercholesterolemia. N Engl J Med. 2020;383(24):2307–2319. doi: 10.1056/NEJMoa2031049. [DOI] [PubMed] [Google Scholar]; Rosenson RS, Burgess LJ, Ebenbichler CF et al. Evinacumab in patients with refractory hypercholesterolemia. N Engl J Med 2020; 383(24):2307-2319. [DOI] [PubMed]
- 414.Pinkosky SL, Newton RS, Day EA, Ford RJ, Lhotak S, Austin RC, et al. Liver-specific ATP-citrate lyase inhibition by bempedoic acid decreases LDL-C and attenuates atherosclerosis. Nat Commun. 2016;7(1):13457–13457. doi: 10.1038/ncomms13457. [DOI] [PMC free article] [PubMed] [Google Scholar]; Pinkosky SL, Newton RS, Day EA, Ford RJ, Lhotak S, Austin RC, et al. Liver-specific ATP-citrate lyase inhibition by bempedoic acid decreases LDL-C and attenuates atherosclerosis. Nat Commun 2016;7(1):13457. [DOI] [PMC free article] [PubMed]
- 415.Goldberg AC, Leiter LA, Stroes ESG, et al. Effect of bempedoic acid vs placebo added to maximally tolerated statins on low-density lipoprotein cholesterol in patients at high risk for cardiovascular disease: The CLEAR Wisdom randomized clinical trial. JAMA. 2019;322(18):1780–1788. doi: 10.1001/jama.2019.16585. [DOI] [PMC free article] [PubMed] [Google Scholar]; Goldberg AC, Leiter LA, Stroes ESG et al. Effect of bempedoic acid vs placebo added to maximally tolerated statins on low-density lipoprotein cholesterol in patients at high risk for cardiovascular disease: The CLEAR Wisdom randomized clinical trial. JAMA. 2019;322(18):1780-1788. [DOI] [PMC free article] [PubMed]
- 416.Ballantyne CM, Laufs U, Ray KK, et al. Bempedoic acid plus ezetimibe fixed-dose combination in patients with hypercholesterolemia and high CVD risk treated with maximally tolerated statin therapy. Eur J Prev Cardiol. 2020;27(6):593–603. doi: 10.1177/2047487319864671. [DOI] [PMC free article] [PubMed] [Google Scholar]; Ballantyne CM, Laufs U, Ray KK et al. Bempedoic acid plus ezetimibe fixed-dose combination in patients with hypercholesterolemia and high CVD risk treated with maximally tolerated statin therapy. Eur J Prev Cardiol. 2020;27(6):593-603. [DOI] [PMC free article] [PubMed]
- 417.Detsky AS, Naglie G. A clinician’s guide to cost-effectiveness analysis. Ann Inter Med. 1990;113:147–154. doi: 10.7326/0003-4819-113-2-147. [DOI] [PubMed] [Google Scholar]; Detsky AS, Naglie G. A clinician’s guide to cost-effectiveness analysis. Ann Inter Med. 1990; 113:147-54. [DOI] [PubMed]
- 418.World Health Organization (WHO) Macroeconomics and health: investing in health for economic development. Report of the Commission on Macroeconomics and Health; Geneva: 2001. [Google Scholar]; World Health Organization (WHO). Macroeconomics and health: investing in health for economic development. Report of the Commission on Macroeconomics and Health. Geneva; 2001.
- 419.Siqueira ASE, Siqueira AG, Filho, Land MGP. Analysis of the economic impact of cardiovascular diseases in the last five years in Brazil. Arq Bras Cardiol. 2017;109(1):39–46. doi: 10.5935/abc.20170068. [DOI] [PMC free article] [PubMed] [Google Scholar]; Siqueira ASE, Siqueira-Filho AG, Land MGP. Analysis of the economic impact of cardiovascular diseases in the last five years in Brazil. Arq Bras Cardiol. 2017; 109(1):39-46. [DOI] [PMC free article] [PubMed]
- 420.Bahia LR, Rosa RS, Santos RD, et al. Estimated costs of hospitalization due to coronary artery disease attributable to familial hypercholesterolemia in the Brazilian public health system. Arch Endocrinol Metab. 2018;62(3):303–308. doi: 10.20945/2359-3997000000030. [DOI] [PMC free article] [PubMed] [Google Scholar]; Bahia LR, Rosa RS, Santos RD et al. Estimated costs of hospitalization due to coronary artery disease attributable to familial hypercholesterolemia in the Brazilian public health system. Arch Endocrinol Metab. 2018; 62(3):303-8. [DOI] [PMC free article] [PubMed]
- 421.Neil HA, Hammond T, Huxley R, et al. Extent of underdiagnosis of familiar hypercholesterolemia in routine practice: prospective registry study. BMJ. 2000;321(7254):148–148. doi: 10.1136/bmj.321.7254.148. [DOI] [PMC free article] [PubMed] [Google Scholar]; Neil HA, Hammond T, Huxley R et al. Extent of underdiagnosis of familiar hypercholesterolemia in routine practice: prospective registry study. BMJ. 2000; 321(7254):148. [DOI] [PMC free article] [PubMed]
- 422.Rosso A, Pitini E, D’Andrea E, et al. The cost-effectiveness of genetic screening for familial hypercholesterolemia: a systematic review. Ann Ig. 2017;29(5):464–480. doi: 10.7416/ai.2017.2178. [DOI] [PubMed] [Google Scholar]; Rosso A, Pitini E, D’Andrea E et al. The cost-effectiveness of genetic screening for familial hypercholesterolemia: a systematic review. Ann Ig. 2017; 29(5):464-80. [DOI] [PubMed]
- 423.Chen CH, Hay JW. Cost-effectiveness analysis of alternative screening and treatment for heterozygous familial hypercholesterolemia in the United States. Int J Cardiol. 2015;181:417–424. doi: 10.1016/j.ijcard.2014.12.070. [DOI] [PubMed] [Google Scholar]; Chen CH, Hay JW. Cost-effectiveness analysis of alternative screening and treatment for heterozygous familial hypercholesterolemia in the United States. Int J Cardiol. 2015; 181:417-24. [DOI] [PubMed]
- 424.Nherera L, Calvert NW, Demott K, et al. Cost-effectiveness analysis of the use of a high-intensity statin compared to a low-intensity statin in the management of patients with familial hypercholesterolemia. Curr Med Res Opin. 2010;26(3):529–536. doi: 10.1185/03007990903494934. [DOI] [PubMed] [Google Scholar]; Nherera L, Calvert NW, Demott K et al. Cost-effectiveness analysis of the use of a high-intensity statin compared to a low-intensity statin in the management of patients with familial hypercholesterolemia. Curr Med Res Opin. 2010; 26(3):529-36. [DOI] [PubMed]
- 425.Odden MC, Pletcher MJ, Coxson PG, et al. Cost-effectiveness and population impact of statins for primary prevention in adults aged 75 years or older in the United States. Ann Intern Med. 2015;162(8):533–541. doi: 10.7326/M14-1430. [DOI] [PMC free article] [PubMed] [Google Scholar]; Odden MC, Pletcher MJ, Coxson PG et al. Cost-effectiveness and population impact of statins for primary prevention in adults aged 75 years or older in the United States. Ann Intern Med. 2015; 162(8):533-41. [DOI] [PMC free article] [PubMed]
- 426.Ward S, Lloyd Jones M, Pandor A, et al. A systematic review and economic evaluation of statins for the prevention of coronary events. Health Technol Ass. 2007;11(14):1–160. doi: 10.3310/hta11140. [DOI] [PubMed] [Google Scholar]; Ward S, Lloyd Jones M, Pandor A et al. A systematic review and economic evaluation of statins for the prevention of coronary events. Health Technol Ass. 2007; 11(14):1-160. [DOI] [PubMed]
- 427.Ribeiro R, Duncan BB, Ziegelman PK, et al. Cost-effectiveness of high, moderate and low-dose statins in the prevention of vascular events in the Brazilian Public Health System. Arq Bras Cardiol. 2015;104(1):32–44. doi: 10.5935/abc.20140173. [DOI] [PMC free article] [PubMed] [Google Scholar]; Ribeiro R, Duncan BB, Ziegelman PK et al. Cost-effectiveness of high, moderate and low-dose statins in the prevention of vascular events in the Brazilian Public Health System. Arq Bras Cardiol. 2015; 104(1):32-44. [DOI] [PMC free article] [PubMed]
- 428.Fonarow GC, Keech AC, Pedersen TR, et al. Cost-effectiveness of evolocumab therapy for reducing cardiovascular events in patients with atherosclerotic cardiovascular disease. JAMA Cardiol. 2017;2(10):1069–1078. doi: 10.1001/jamacardio.2017.2762. [DOI] [PMC free article] [PubMed] [Google Scholar]; Fonarow GC, Keech AC, Pedersen TR et al. Cost-effectiveness of evolocumab therapy for reducing cardiovascular events in patients with atherosclerotic cardiovascular disease. JAMA Cardiol. 2017; 2(10):1069-78. [DOI] [PMC free article] [PubMed]
- 429.Kazi DS, Moran AE, Coxson PG. Cost-effectiveness of PCSK9 inhibitor therapy in patients with heterozygous familial hypercholesterolemia or atherosclerotic cardiovascular disease. JAMA. 2016;316(7):743–753. doi: 10.1001/jama.2016.11004. [DOI] [PubMed] [Google Scholar]; Kazi DS, Moran AE, Coxson PG. Cost-effectiveness of PCSK9 inhibitor therapy in patients with heterozygous familial hypercholesterolemia or atherosclerotic cardiovascular disease. JAMA. 2016; 316(7):743-53. [DOI] [PubMed]
- 430.Arrieta H, Page TF, Veledar E, et al. Economic evaluation of PCSK9 inhibitors in reducing cardiovascular risk from health system and private payer perspectives. PLoS One. 2017;12(1):e0169761. doi: 10.1371/journal.pone.0169761. [DOI] [PMC free article] [PubMed] [Google Scholar]; Arrieta H, Page TF, Veledar E et al. Economic evaluation of PCSK9 inhibitors in reducing cardiovascular risk from health system and private payer perspectives. PLoS One. 2017; 12(1):e0169761. [DOI] [PMC free article] [PubMed]