DDG-Praxisempfehlungen Download
Auf der Webseite der Deutschen Diabetes Gesellschaft (https://www.deutsche-diabetes-gesellschaft.de/behandlung/leitlinien) befinden sich alle PDF zum kostenlosen Download.
Infobox 1: Inhaltliche Änderungen gegenüber der Vorjahresfassung
Änderung 1: Die wichtigste Neuerung ist aus praktischen Gründen die Aufteilung der Praxisempfehlung in 2 Teile: Teil 1 für den schnellen Leser und für den Praxisalltag mit den Algorithmen zur Therapie des Typ-2-Diabetes. Die Algorithmen zur Therapie von Begleiterkrankungen und zur Therapie (ohne Insulin) wurden geringfügig geändert, insbesondere wurde der Algorithmus ergänzt für Menschen mit einer eGFR < 30 ml/min.
Neu ist eine ausführlichere Thematisierung der partizipativen Entscheidungsfindung (PEF), die in der Nationalen VersorgungsLeitlinie Typ-2-Diabetes erstmals und sehr ausführlich diskutiert wird und die die Autoren für die Betreuung sehr wichtig finden.
Begründung: Praktikabilität der Praxisempfehlung
Stützende Quellenangabe: Konsensus aller Autoren der Praxisempfehlung. Die partizipative Entscheidungsfindung wird ausführlich in der Teilpublikation der NVL zur Therapie des Typ-2-Diabetes thematisiert; sie ist ein Kernstück der NVL [1].
Änderung 2: Neu sind auch eine kritische Stellungnahme zur Beurteilung des Gesamtrisikos des Menschen mit Typ-2-Diabetes (Tab. 3) über die einzelnen Risikofaktoren und Tab. 4, eine Analyse der heterogenen Einschlusskriterien in wichtige Studien zur Therapie des Typ-2-Diabetes.
| Diabetesdauer (> 10 Jahre) |
| (Biologisches) Alter |
| Geschlecht (männlich > weiblich) |
| Lebensstil: unausgewogene Ernährung/körperliche Inaktivität |
| Familienanamnese mit frühzeitigen kardiovaskulären Erkrankungen |
| (Männer < 55 Jahre; Frauen < 60 Jahre) |
| Hypertonie oder antihypertensive Therapie |
| Dyslipidämie oder lipidsenkende Therapie |
| Adipositas (> 30 kg/m2) |
| Niereninsuffizienz (eGFR < 60 ml/min) |
| Albuminurie (> 30 mg/g U‑Kreatinin) |
| Raucher und Exraucher |
| Subklinische Arteriosklerose oder kardiovaskuläre Erkrankung |
| Linksventrikuläre Hypertrophie |
| Obstruktives Schlafapnoe-Syndrom |
| Kriterium | Häufigkeit (n) | Häufigkeit (%) | Kommentar |
|---|---|---|---|
| Alter ≥ 50, 55 oder 60 Jahre | 6 | 100 | Basiskriterium, erfordert zusätzliche Risikofaktoren |
| Plus reduzierte Nierenfunktion (eGFR 25–59,9 ml/min) | 1 | 17 | Kommt auch als KHK-Äquivalent vor |
| Plus ≥ 1 (n = 4) oder ≥ 2 (n = 2) weitere Risikofaktoren (s. unten) | 6 | 100 | Weitere Risikofaktoren (s. unten) |
| Diabetesdauer ≥ 10 Jahre | 1 | 17 | Hauptkriterium nach ESC |
| Arterielle Hypertonie (> 140 und > 90 mm Hg oder antihypertensive Medikation) | 3 | 50 | Erstaunlich gering bewertet |
| Rauchen/Gebrauch von Tabak | 3 | 50 | Erstaunlich gering bewertet |
| Mikro- oder Makroalbuminurie | 5 | 83 | Zentrales und aussagekräftiges Kriterium |
| HDL-Cholesterin niedrig (z. B. < 1 mmol/l oder 42,5 mg/dl) | 2 | 33 | Erstaunlich gering bewertet |
| LDL-Cholesterol erhöht (z. B. > 3,36 mmol/l/oder 130 mg/dl) | 2 | 33 | Erstaunlich gering bewertet |
| Lipidmodifizierende Therapie | 1 | 17 | Erstaunlich gering bewertet |
| Linksventrikuläre Hypertrophie (bei arterieller Hypertonie) | 3 | 50 | Hypertonie mit Endorganschaden |
| Linksventrikuläre systolische oder diastolische Dysfunktion | 3 | 50 | Herzinsuffizienz |
| „Ankle brachial index“ < 0,9 (≥ 1 Bein betroffen) | 3 | 50 | Wird auch für eine bereits manifeste pAVK verwendet |
| Adipositas | 1 | 17 | Erstaunlich gering bewertet |
| Erstgradige(r) Verwandte(r) mit koronarer Herzerkrankung mit Manifestation ≤ 55 Jahren (Männer) oder ≤ 65 Jahren (Frauen) | 1 | 17 | Selten erwähnt |
6 von 12 kardiovaskulären sog. Outcomestudien haben Patienten ohne manifeste Erkrankung aufgrund von Risikofaktoren rekrutiert. Die Prozentzahlen beziehen sich auf diese Gesamtzahl (6 Studien). Kriterien, die übereinstimmend oft (≥ 50 %) verwandt wurden, sind fett hinterlegt. Alle anderen Kriterien wurden bei maximal 33 % der Studien vorgeschlagen
Begründung: Es gibt auch international (bisher) keinen Risiko-Score, der die Vielzahl der Risikofaktoren gewichtet. Daher soll für jeden Menschen mit einem Typ-2-Diabetes das Gesamtrisiko abgeschätzt werden und je nach individuellem Therapieziel und der Multimorbidität eine adäquate evidenzbasierte Therapie eingesetzt werden. Die unterschiedlichen Einschlusskriterien bei den wichtigen RCT der letzten Jahre sind wenig hilfreich für eine individualisierte Therapieentscheidung.
Stützende Quellenangabe: Die großen RCT im Literaturverzeichnis [2–14]
Änderung 3: Teil 2 enthält Tab. 6 zur Anamnese und zu den relevanten klinischen Untersuchungen sowie Tab. 7 zum Monitoring der Menschen mit Typ-2-Diabetes. In beide Tabellen wurde erstmals auch die Mundgesundheit (Parodontose/Parodontitis) aufgenommen.
| Anamnese/Untersuchung | |
|---|---|
| Anamnese: Zu beachten ist, dass der Typ-2-Diabetes initial symptomarm ist bzw. dass die Symptome häufig verkannt werden | Übergewicht/Adipositas |
| Hoher Blutdruck | |
| Fettstoffwechselstörungen | |
| Durst | |
| Häufiges Wasserlassen | |
| Ungewollte Gewichtsabnahme | |
| Infektionsneigung – insbesondere Entzündungen der Haut oder Schleimhäute | |
| Abgeschlagenheit, Müdigkeit, Schwäche | |
| Körperliche Aktivität | |
| Medikamenteneinnahme (z. B. Glukokortikoide, Psychopharmaka) | |
| Alkoholkonsum | |
| Rauchen | |
| Depressive Verstimmung | |
| Belastungsdyspnoe | |
| NYHA-Klasse | |
| Anginasymptomatik | |
| Claudicatio intermittens (Gehstrecke) | |
| Störungen der Merk- und Konzentrationsfähigkeit | |
| Sehstörungen, Retinopathie | |
| Parodontose/Parodontitis | |
| Erektile Dysfunktion | |
| Geburt von Kindern > 4000 g | |
| Familienanamnese | Diabetes |
| Übergewicht | |
| Bluthochdruck | |
| Fettstoffwechselstörungen | |
| Retinopathie | |
| Herzinfarkt | |
| Schlaganfall | |
| Nierenerkrankung | |
| Amputation | |
| Körperliche Untersuchung | Größe |
| Gewicht (BMI) | |
| Taillenumfang (in der Mitte zwischen unterem Rippenbogen und oberem Beckenkamm bei mittlerer Atemlage) | |
| Kardiovaskuläres System | |
| Blutdruck | |
| Periphere Arterien, Pulsstatus [277] | |
| Peripheres Nervensystem [278] | |
| Haut | |
| Mundgesundheit (Parodontose, Parodontitis; [266]) | |
| Augenuntersuchungen [279] | |
| Fußuntersuchungen [280] | |
| Laborwerte fakultativ GAD-Antikörper bei schwieriger Abgrenzung zum Typ-1-Diabetes bzw. LADA sowie Insulin oder besser C‑Peptid (mit HOMA2‑B und HOMA2-IR) bei unklarer Differenzialdiagnose bzw. zur näheren Subtypisierung, wenn sich daraus eine therapeutische Konsequenz ergibt (s. auch die Praxisempfehlung Definition, Klassifikation und Diagnostik des Diabetes mellitus in diesem Supplement) | Plasmaglukose |
| Blutbild | |
| HbA1c | |
| Kreatinin | |
| eGFR | |
| Kalium | |
| Lipidprofil | |
| Gamma-GT | |
| AST | |
| ALT [281] | |
| Harnsäure [282] | |
| Urinanalysen inkl. Albuminurie bzw. UACR (Albumin mg/g Kreatinin), Ketonkörper im Urin oder Blut (nur bei hohen Glukosewerten; bei SGLT-2-Inhibitor-Therapie auch bei Plasmaglukosewerten < 250 mg/dl [13,9 mmol/l]) | |
| Technische Untersuchungen | Ruhe- und Belastungs-EKG [283, 284] |
| Echokardiographie mit oder ohne pharmakologische Belastung als Alternative zum Belastungs-EKG; Frage nach Herzinsuffizienz (HFpEF/HFrEF) | |
| Abdomensonographie (Fettleber u. a.) | |
| Augenärztliche Untersuchung | |
| Knöchel-Arm-Index bei nicht oder nur schwach tastbaren Fußpulsen (cave: Mediasklerose) | |
| Anamnese/Untersuchung/Screening | |
|---|---|
| Anamnese | Diabetesdauer |
| Gewicht/BMI, ggf. Taillen-Größen-Relation (Gewichtsverlauf, Übergewicht) | |
| Blutdruck | |
| Fußstatus | |
| Bisherige Therapie (möglichst vollständiger Medikationsplan) | |
| Körperliche Aktivität | |
| Ernährungsgewohnheiten | |
| Rauchen | |
| Durchgeführte Diabetesschulung, Selbstkontrolle der Blutglukose | |
| Hypoglykämien (Frequenz und Schwere) | |
| Angstzustände | |
| Depression | |
| Erektile Dysfunktion | |
| Körperliche Untersuchungen | Gewicht |
| Blutdruck | |
| Kardiovaskuläres System | |
| Lungen | |
| Untersuchung der Injektionsstellen bei mit Insulin und/oder mit GLP-1-RA behandelten Menschen mit Diabetes | |
| Untersuchung der FGM-/CGM-Einstich- oder Implantationsstellen | |
|
Laborwerte Screening auf Mundgesundheit |
HbA1c |
| Kreatininclearance (eGFR) | |
| Lipidprofil einschließlich LDL-, HDL-Cholesterin | |
| Harnsäure | |
| Urinanalysen inkl. Albuminurie bzw. UACR (Albumin mg/g Kreatinin), Ketonkörper im Urin oder Blut (nur bei hohen Blutglukosewerten; evtl. bei SGLT-2-Inhibitor-Therapie) | |
| Menschen mit Typ-2-Diabetes sollten regelmäßig auf Parodontose/Parodontitis untersucht werden | |
| Screening auf diabetische Neuropathie [278] | Menschen mit Typ-2-Diabetes sollen ab dem Zeitpunkt der Diagnosestellung 1‑mal jährlich auf eine sensomotorische und autonome Neuropathie untersucht werden |
| Screening auf Fußläsionen [280] | Menschen mit Typ-2-Diabetes und keinen klinischen Befunden einer sensomotorischen Neuropathie sollen mindestens 1‑mal jährlich auf Fußläsionen untersucht werden. Liegen bereits klinische Befunde einer sensomotorischen Neuropathie vor, sollen regelmäßige Untersuchungen auf Fußläsionen alle 3–6 Monate erfolgen |
| Screening auf eine Nephropathie [285] | Bei Menschen mit Typ-2-Diabetes soll mindestens 1‑mal jährlich auf eine Albuminurie untersucht werden, da dies eine wesentliche zusätzliche Risikoabschätzung für kardiovaskuläre und renale Folgeerkrankungen erlaubt. Zusätzlich soll die eGFR bestimmt werden, wobei sich die Frequenz der Messung nach dem Stadium der Nierenerkrankung und möglichen renalen Komplikationen (renal toxische Substanzen, Kontrastmittel, Hypovolämie) richtet |
| Screening auf Netzhautkomplikationen [279] |
Ein augenärztliches Screening soll durchgeführt werden: Bei Typ-2-Diabetes bei Diagnosestellung (Erstuntersuchung) |
|
Wenn keine diabetische Netzhautveränderung festgestellt wird, soll das Screeningintervall Bei bekanntem geringem Risiko (kein ophthalmologisches Risiko und kein allgemeines Risiko) 2 Jahre Für alle anderen Risikokonstellationen 1 Jahr betragen | |
| Sind dem Augenarzt die allgemeinen Risikofaktoren nicht bekannt, soll der Patient von ihm so behandelt werden, als ob ein ungünstiges allgemeines Risikoprofil vorläge. Patienten mit diabetischen Netzhautveränderungen (ophthalmologisches Risiko) sollen je nach Befund jährlich oder häufiger untersucht werden | |
| Bei neu auftretenden Symptomen wie Sehverschlechterung, verzerrtes Sehen, Verschwommensehen und/oder sog. Rußregen vor den Augen soll zeitnah eine Untersuchung beim Augenarzt erfolgen | |
| Abschätzung des makro- und mikrovaskulären Gesamtrisikos | Menschen mit Typ-2-Diabetes sollen mindestens 1‑mal jährlich auf vaskuläre Risiken (Hypertonie) untersucht und der Raucherstatus soll erfragt werden. Darüber hinaus sollen HbA1c, Lipide, Harnsäure und Kreislaufparameter (Blutdruckmessung sowie Pulsmessung an verschiedenen Orten) kontrolliert und eine Mikro‑/Makroalbuminurie ausgeschlossen bzw. quantifiziert werden. Erfassung von Symptomen einer Herzinsuffizienz mindestens 2‑mal jährlich |
Begründung: Parodontose und Parodontitis sind unabhängige Risikofaktoren für Typ-2-Diabetes, und die Prävalenzen sind insbesondere bei schlechter Stoffwechseleinstellung wesentlich größer.
Stützende Quellenangabe: [15]
Änderung 4: Die Beschreibung der einzelnen glukosespiegelsenkenden Medikamente wurde in Teil 2 aktualisiert.
Begründung: Aufgrund neuer RCT ist eine Aktualisierung notwendig
Die Praxisempfehlungen der Deutschen Diabetes Gesellschaft (DDG) lehnen sich an die Inhalte der Nationalen VersorgungsLeitlinie (NVL) Typ-2-Diabetes an [1]. Die in den vorliegenden Praxisempfehlungen der DDG vorgenommenen Modifikationen in der Therapie und deren Begründungen wurden auf der Basis neuer randomisierter, kontrollierter Studien (RCT) und Metaanalysen aktualisiert.
Um die Arbeit mit der umfangreichen Praxisempfehlung in der Praxis zu verbessern, entschieden sich die Autoren, die einzelnen glukosespiegelsenkenden Pharmaka und einige Algorithmen in der aktuellen Praxisempfehlung in einen ausführlichen Anhang zu verschieben. Das entsprechende Literaturverzeichnis findet sich ebenfalls im Anhang.
Definition des Typ-2-Diabetes
Der Typ-2-Diabetes ist eine chronische, sehr heterogene, multifaktorielle, progrediente Erkrankung, die u. a. durch vererbte und erworbene Insulinresistenz und durch qualitative und quantitative Insulinsekretionsstörungen charakterisiert ist.
Beeinflussbare und nicht beeinflussbare Risikofaktoren des Typ-2-Diabetes sind in Infobox 2Risikofaktoren für kardiovaskuläre Erkrankungen und Typ-2-Diabetes aufgelistet. Kriterien für das metabolische Syndrom sind in Infobox 3 zu finden.
Therapieziele
In den vorliegenden Empfehlungen werden Zielkorridore angegeben, die – mit unterschiedlich hoher Evidenzstärke – den Arzt und den Patienten evidenz- und konsensbasiert darüber informieren, welcher Zielkorridor/Zielwert (z. B. HbA1c-, Blutdruck‑, LDL-Cholesterin-Werte) nach heutigem medizinischem Wissensstand im Regelfall angestrebt werden sollte. Unberührt davon bleibt das übergeordnete Ziel, primär gemeinsam mit dem Patienten und evtl. zusammen mit den Angehörigen individuell vereinbarte mittelbare und übergeordnete Therapieziele zu finden und am besten quartalsweise schriftlich zu vereinbaren (z. B. im Gesundheitspass Diabetes). Nach Elwyn u. Vermunt [16] sollte man die 3 Zielkategorien, übergeordnete Ziele (z. B. Erhaltung der Lebensqualität oder Unabhängigkeit erhalten), funktionsbezogene Ziele (z. B. Sehkraft und Arbeitsplatz erhalten) sowie krankheitsbezogene Ziele (z. B. Schmerzen beseitigen, Stoffwechsel verbessern) im Sinne einer partizipativen Entscheidungsfindung diskutieren und priorisieren.
Allgemeine und spezifische Therapieziele
Die Therapieziele der Menschen mit Typ-2-Diabetes hängen ab von der Patientenpräferenz, der Komorbidität, von Alter und Lebenserwartung, Lebensqualität, kulturellen Voraussetzungen, den psychosozialen Umständen und Möglichkeiten sowie Fähigkeiten der betroffenen Personen. Aufgrund der für die Betroffenen nicht selten als schwere Lebenseinschränkung erlebten Diagnose Typ-2-Diabetes sollte eine Strategie der Zustimmung und der langsamen Therapieintensivierung (Ausnahme: schwere Stoffwechseldekompensation) verfolgt werden.
In der NVL Typ-2-Diabetes [1] wurde erstmals ein Kapitel zur partizipativen Entscheidungsfindung (PET) und Teilhabe in allen relevanten Lebensbereichen erarbeitet. Folgende Empfehlungen mit hohem Empfehlungsgrad [1] sollen bei der Betreuung von Menschen mit Diabetes umgesetzt werden:
Menschen mit Typ-2-Diabetes und ihre Ärztin/ihr Arzt sollen initial und wiederholt im Erkrankungsverlauf gemeinsam individuelle Therapieziele vereinbaren und priorisieren.
Individuell mit der Patientin/dem Patienten vereinbarte Therapieziele sollen im Lauf der Behandlung regelmäßig und je nach Bedarf evaluiert und entsprechend den Ergebnissen verfolgt oder angepasst werden.
Die Ärztin oder der Arzt soll die individuellen Therapieziele und ggf. ihr begründetes Nichterreichen – nachvollziehbar für die Patientin/den Patienten und betreuende Berufsgruppen – dokumentieren und zur Verfügung stellen. Dies gilt auch für die Evaluation der Therapiezielerreichung.
Bei der Aufklärung über Diagnose- und Behandlungsmöglichkeiten des Typ-2-Diabetes sollen die unterschiedlichen Optionen mit ihren Vor- und Nachteilen umfassend und in verständlicher Form dargestellt werden.
Bei anstehenden gesundheitsbezogenen Entscheidungen bezüglich des Typ-2-Diabetes soll die Gesprächsführung entsprechend dem Konzept der partizipativen Entscheidungsfindung erfolgen.
Bei der Vereinbarung und Priorisierung der individuellen Therapieziele und der Evaluation der Therapiestrategie sollen personen- und umweltbezogene Kontextfaktoren berücksichtigt werden.
Die Auswirkungen auf die Teilhabe in allen relevanten Lebensbereichen sollen berücksichtigt werden.
Bei Nichterreichung individueller Therapieziele, die nach dem Konzept der partizipativen Entscheidungsfindung vereinbart wurden, soll strukturiert vorgegangen werden [1, 16]. Eine ausführliche Diskussion der partizipativen Entscheidungsfindung ist im Kapitel Grundlagen des Diabetesmanagements in diesem Supplement dargestellt.
Bei Menschen mit Typ-2-Diabetes sollen für folgende vaskuläre Risikoparameter individualisierte Therapieziele vereinbart werden (Infobox 4Allgemeine Behandlungs- und Betreuungsziele; Tab. 1):
Lebensstil
Blutdruck
Glukosestoffwechsel
Lipidstatus
Körpergewicht
| Indikator | Orientierungsgrößen der Therapieziele | |
|---|---|---|
| mg/dl | mmol/l | |
| Nüchtern-/präprandiale Plasmaglukose (venös) | 100–125 | 5,6–6,9 |
| Postprandiale Plasmaglukose (venös) 1–2 h postprandial | 140–199 | 7,8–11,0 |
| Indikator | Individualisierung der Therapieziele | |
| HbA1c | HbA1c-Zielkorridor von 6,5–7,5 % (48–58 mmol/mol Hb) zur Prävention von Folgekomplikationen und Vermeidung von schweren Hypoglykämien. Bei multimorbiden älteren Menschen und Menschen mit stark eingeschränkter Lebenserwartung HbA1c-Wert < 8,0 % (< 64 mmol/mol Hb), seltener < 8,5 % (< 69 mmol/mol Hb). Falls nur antidiabetische Medikationen ohne intrinsisches Hypoglykämierisiko eingesetzt werden, können auch niedrigere HbA1c-Wert-Ziele vereinbart werden | |
| Harnsäure | Serumspiegel ≤ 6,0 mg/dl (357 μmol/l; [17]) | |
| Lipide |
LDL-Cholesterin-Senkung: Sehr hohes Risiko in der Primär- und Sekundärprävention: ≥ 50 % LDL-C-Reduktion von der Basis vor lipidsenkender Therapie und ein LDL-C-Ziel < 1,4 mmol/l (< 55 mg/dl) Hohes Risiko: ≥ 50 % LDL-C-Reduktion von der Basis und ein LDL-C < 1,8 mmol/l (< 70 mg/dl) |
|
| Gewichtsabnahme bei Übergewicht | Bei BMI von 27–35 kg/m2: > 5 % Gewichtsabnahme; bei BMI > 35 kg/m2: > 10 % Gewichtsabnahme | |
| Blutdruck | Systolischer Blutdruck: 120–140 mm Hg (≥ 65 Jahre 130–140 mm Hg; ≤ 65 Jahre 120–129 mm Hg); diastolischer Blutdruck: < 80 mm Hg (nicht < 70 mm Hg); wenn die Therapie ohne relevante Nebenwirkungen ist [20] | |
Priorisierung des Therapieziels auf der Basis des persönlichen Risikoprofils
Leitend für die Wahl der geeigneten Therapiestrategie sind die gemeinsam priorisierten Therapieziele sowie die Wahrscheinlichkeit, aufgrund der persönlichen Krankheitsfaktoren von einer bestimmten Therapie zu profitieren. Auf der Grundlage der derzeit vorliegenden Evidenz eröffnen sich dabei prinzipiell 2 Wege:
Reduktion von Folgeerkrankungen des Diabetes primär durch die Kontrolle des HbA1c-Werts als Surrogat für die Stoffwechseleinstellung;
primäre Reduktion der Wahrscheinlichkeit eines speziell kardiovaskulären und renalen Ereignisses durch die Gabe von Medikamenten, die diese Endpunkte reduzieren.
Es sei dabei erwähnt, dass die oben genannten Wege sich nicht gegenseitig ausschließen, sondern idealerweise ergänzen.
Diagnostik
Anamnestische und klinische Untersuchungen sowie das Monitoring von Menschen mit Typ-2-Diabetes sind im Anhang dieser Praxisempfehlung zusammengestellt.
Die Sicherung der Diagnose erfolgt durch standardisierte und qualitätsgesicherte Laboruntersuchungen sowohl für die Plasmaglukose als auch für HbA1c. Verwender von Geräten zur Selbstmessung (POCT-Systeme) müssen erfolgreich an externer Qualitätssicherung teilnehmen, sonst sind sie für die Diagnostik ungeeignet. Da sich bei der Diagnostik eines Diabetes zunehmend eine Vielzahl von präanalytischen, analytischen und interpretatorischen Problemen ergeben hat, wird u. a. auf die aktualisierte und detaillierte Praxisempfehlung zur Diabetesdiagnostik verwiesen [21–24].
Bei der Differenzialdiagnose der heterogenen Krankheit Typ-2-Diabetes werden in zunehmendem Maße Subtypen des Diabetes definiert und praktisch klinisch berücksichtigt [25–27].
Therapie
Basistherapie
Die Anpassung an einen gesunden Lebensstil ist von entscheidender Bedeutung nicht nur zur Prävention eines Typ-2-Diabetes, sondern auch zur Reduktion der komplexen Pharmakotherapie und der Entstehung und Progression diabetischer Komplikationen des Typ-2-Diabetes. Dabei ist es sinnvoll, nicht nur einen, sondern möglichst viele Risikofaktoren durch Lebensstilmodifikation anzugehen [28].
Schulung
Allen von Diabetes mellitus Betroffenen sowie ggf. ihren Angehörigen sollen als unverzichtbarer Bestandteil der Diabetesbehandlung strukturierte, evaluierte und zielgruppen- und themenspezifische Schulungs- und Behandlungsprogramme und, falls erforderlich, problemorientierte Wiederholungsschulungen angeboten werden [29].
Plasmaglukoseselbstmessung
Bei einer Indikationsstellung zur Plasmaglukoseselbstmessung sollten die in Tab. 2 aufgeführten Situationen bei Menschen mit Typ-2-Diabetes berücksichtigt werden. Aus den Messungen sollten sich jedoch Verhaltens- und Therapiekonsequenzen ergeben.
| Klinisch definierte Situationen | |
|---|---|
| Diabetesstadium | – Neu diagnostiziert, Einstellphase |
| Diabetes im Verlauf |
– Labil mit häufigen Unterzuckerungen (dann vor allen Mahlzeiten bis zur Erreichung des gewählten Therapieziels, danach Rückkehr zu gezielten, tagesablaufdefinierten Gelegenheitsmessungen) – Therapieintensivierung – Vorübergehend nach Umstellung von einer Insulintherapie auf eine Behandlung mit oralen Antidiabetika |
| Zusätzliche Erkrankungen/Interventionen |
– Schwere Infektionen – Geplante Operationen – Psychische Erkrankungen mit unzuverlässiger Medikamenteneinnahme – Wenn bei Sport/Bewegung unter blutglukosespiegelsenkenden Substanzen, die mit Hypoglykämien assoziiert sein können, entsprechende Symptome auftreten – Krankheitsbedingte akute Änderungen der Ernährung (z. B. Durchfall/Erbrechen) |
| Diabetestherapie |
– Orale Antidiabetika (OAD) mit Hypoglykämiepotenzial (Sulfonylharnstoffe, Glinide – dann Gelegenheitsmessungen) – Insulintherapie und Notwendigkeit von Selbstanpassung der Insulindosis – Intensivierte konventionelle Insulintherapie (vor allen Mahlzeiten, gelegentlich nachts) – Insulinpumpentherapie (vor allen Mahlzeiten, gelegentlich nachts, [1]) – Situationen mit besonderer Gefahr (z. B. Schichtarbeit, Führen von Lastkraftwagen, Bussen, Kränen usw.) |
aG‑BA-Beschluss vom 16.06.2016 (BAnz AT 06.09.2016 B3): Kontinuierliche interstitielle Glukosemessungen mit Real-Time-Messgeräten (rtCGM) zur Therapiesteuerung bei Patientinnen und Patienten mit insulinbehandeltem Diabetes mellitus können unter besonderen Bedingungen als vertragsärztliche Leistungen zulasten der Krankenkassen erbracht werden. Die Kosten für FGM („flash glucose monitoring“), auch als „intermittent-scanning continuous glucose monitoring“ (iscCGM) werden in der Zwischenzeit auch von Kostenträgern übernommen
Uringlukoseanalysen
Sie sind kein Standard in der Diagnostik, der Therapieentscheidung und -überwachung, denn die Uringlukose wird nur positiv bei hohen Blutglukosewerten (renale Glukosetransportkapazität intra- und interindividuell sehr unterschiedlich, altersabhängig, bei verminderter Nierenfunktion nicht systematisch untersucht, bei bestimmten Erkrankungen erniedrigt und nicht verwertbar bei Schwangerschaft und beim Einsatz von Medikamenten wie SGLT-2-Inhibitoren). Bei der Beurteilung einer hyperglykämischen Stoffwechselentgleisung ist die Messung der Ketonurie jedoch therapieentscheidend.
Ernährungstherapie und -beratung
Ernährungsempfehlungen für Menschen mit Typ-2-Diabetes sollen folgende Eckpunkte berücksichtigen, wobei hier nur einige Empfehlungen gegeben werden sollen:
Motivation zu gesunden, ausgewogenen Kostformen unter Berücksichtigung der bisherigen Ernährungsroutine des Patienten und zur Energierestriktion. Dabei sollte die Freude am Essen erhalten bleiben.
So weit wie möglich Verzicht auf industrielle Lebensmittelfertigprodukte und Begrenzung der Aufnahme von Saccharose (WHO-Empfehlung < 25 g/Tag). Die DGE empfiehlt, den Mono- und Disaccharidverzehr auf < 10 % der täglich zugeführten Energie zu begrenzen.
Kein generelles Zuckerverbot, jedoch Vermeiden von großen Mengen an Haushaltszucker, Fruchtzucker, Zuckeralkoholen (z. B. Sorbit, Xylit) bzw. von Getränken, die diese Stoffe enthalten.
Die Einschätzung von Art (z. B. glykämischer Index) und Menge der Kohlenhydrate der jeweiligen Mahlzeiten sollte bei Menschen mit Typ-2-Diabetes, die Insulin spritzen, als wesentliche Strategie zur Stoffwechselkontrolle eingesetzt werden.
Menschen mit Typ-2-Diabetes ohne Insulintherapie sollte vermittelt werden, Blutglukose erhöhende Nahrungsmittel erkennen zu können.
Menschen mit Typ-2-Diabetes und Niereninsuffizienz sollte eine tägliche Eiweißzufuhr von 0,8 g/kg empfohlen werden. Im Stadium der Dialysetherapie sollte die Eiweißzufuhr auf 1,2–1,3 g/kg erhöht werden.
Menschen mit Typ-2-Diabetes sollten im Rahmen der individuellen Beratung über einen differenzierten Umgang mit Alkohol beraten werden.
Praktische Empfehlungen für eine gesunde und ausgewogene Ernährung am besten im Sinne einer mediterranen Ernährung [30–34]
Große Portionen und häufigen Verzehr von fetten Lebensmitteln, z. B. fettes Fleisch, fette Wurstwaren, fetter Käse, fette Backwaren, fette Fertigprodukte, fettes Fast Food, Sahne, Schokolade, Chips usw., vermeiden
Pflanzliche Fette bevorzugen, z. B. Öle, Nüsse, Samen
Lebensmittel, die reich an Ballaststoffen sind, in die Ernährung einplanen, z. B. Gemüse, frisches Obst, Vollkorngetreideprodukte
Es kommt bei der Effektivität der Gewichtsabnahme und der Verbesserung des vaskulären Risikoprofils immer darauf an – wie auch immer die Diät gestaltet wird: Low Carb, vegan oder mediterran –, wie gut die Akzeptanz und Adhärenz sowie das langfristige Management der Ernährungsumstellung gelingen [34, 35].
Gewichtsreduktion
Gewichtsreduktion bei übergewichtigen und adipösen Menschen mit Typ-2-Diabetes unterstützt die Verminderung des vaskulären Risikos, steigert das Selbstwertgefühl, die Lebensqualität, und es kann in der Frühphase eines Typ-2-Diabetes zu einer Remission kommen [33, 36–39].
Körperliche Aktivität und Bewegung (siehe Anhang; Abb. 4)
Vermehrte körperliche Bewegung und Sport sind essenzielle therapeutische Maßnahmen bei allen Formen des Diabetes. Körperliche Aktivität ist aus einer Reihe von Gründen insbesondere für Menschen mit Typ-2-Diabetes von großem Vorteil [40–42]. Das strukturierte Vorgehen ist in dem Stufenprogramm der NVL dargelegt (siehe Anhang). Umfangreiche praktische Empfehlungen finden Sie in diesem Supplementband [43].
In Kürze:
Menschen mit Typ-2-Diabetes sollen motiviert werden, ihre körperliche Aktivität zu steigern.
Individuell soll entschieden werden, welche Bewegungs- oder Sportarten für den Menschen mit Typ-2-Diabetes geeignet sind.
Aerobes Ausdauertraining und Krafttraining zum Aufbau und Erhalt der Muskulatur sollten als strukturierte Bewegungsprogramme angeboten werden.
Empfohlen werden mindestens 150 min Bewegung mittlerer Intensität pro Woche [44].
Ein niedrigeres Intensitätstraining zeigt geringere Drop-out-Raten und scheint auf Dauer erfolgreicher zu sein als ein Bewegungstraining mit hoher Intensität weder im Intervall noch kontinuierlich [45]. Insbesondere Menschen mit Typ-2-Diabetes in der 2. Lebenshälfte soll empfohlen werden, Geschicklichkeit, Reaktionsfähigkeit, Koordination, Gelenkigkeit und Beweglichkeit zu trainieren.
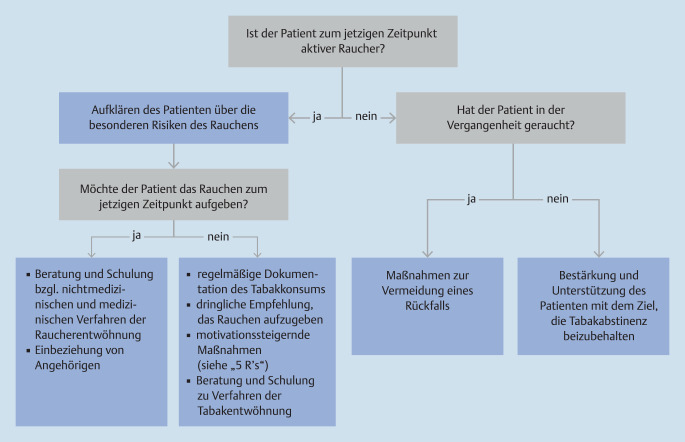
Tabakentwöhnung
Aktives und passives Rauchen sind neben dem vermeidbaren Grund für eine deutlich erhöhte Morbidität und Mortalität auch ein signifikanter Risikofaktor für einen Typ-2-Diabetes [46]. In einer kürzlich publizierten Metaanalyse zeigte sich, dass Rauchen ein unabhängiger Risikofaktor für die Progression einer Albuminurie ist [47]. Die Albuminurie ist einer der stärksten Prädiktoren für die Entwicklung und Progression kardiovaskulärer Komplikationen. Raucher sollen daher immer, wenn dies situativ angemessen erscheint, über die besonderen Risiken des Rauchens für den Typ-2-Diabetes, für mikro- und makrovaskuläre Folgeerkrankungen und Lungenerkrankungen aufgeklärt und spezifisch beraten werden. Ihnen soll dringlich geraten werden, das Tabakrauchen aufzugeben.
Weitere Informationen zur Tabakentwöhnung und zur Unterstützung des Rauchstopps finden Sie in der S3-Leitlinie Rauchen und Tabakabhängigkeit: Screening, Diagnostik und Behandlung [48] und im Tabakatlas Deutschland [49].
Änderungswillige Raucher sollen hinsichtlich möglicher Verfahren zur Tabakentwöhnung regelmäßig beraten werden (s. Anhang; Abb. 5).
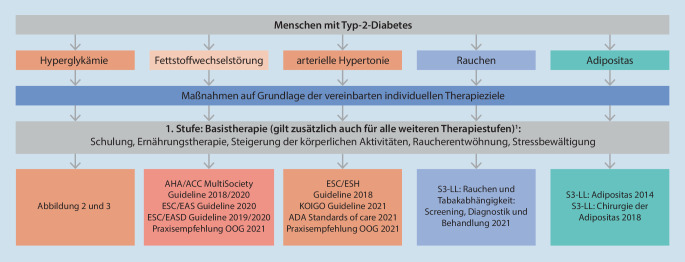
Lebensstilmodifizierende, nichtmedikamentöse Therapiemaßnahmen stellen auf jeder Therapiestufe die Basistherapie dar, sind aber häufig allein nicht ausreichend. Bei Patienten, bei denen mit lebensstilmodifizierenden Maßnahmen keine ausreichenden Erfolge abzusehen sind (aufgrund des Schweregrads der Stoffwechselentgleisung, Adhärenzproblemen, Multimorbidität), sollten diese Maßnahmen mit Metformin und bei Kontraindikation oder Unverträglichkeit mit einem anderen Antidiabetikum kombiniert werden. Bei den meisten Menschen mit einem Typ-2-Diabetes bestehen eine Multimorbidität und damit je nach individuellem Therapieziel die Notwendigkeit einer Polypharmazie mit Priorisierung je nach Schwere der vaskulären Risiken (Abb. 1).
Pharmakotherapie
Das im Therapiealgorithmus (Abb. 1 und 2) vorgesehene stufenweise Vorgehen bezieht sich auf den Zeitpunkt der klinischen Diagnose eines Typ-2-Diabetes im Stadium einer relativen Stoffwechselkompensation. Neu diagnostizierte Patienten mit Stoffwechseldekompensation sollten gleichzeitig eine Basis- und eine der Stoffwechselsituation angepasste Pharmakotherapie (z. B. auch Insulin) erhalten.
Risikoabschätzung
Vor Beginn einer medikamentösen Behandlung ist eine detaillierte Risikoeinschätzung unbedingt erforderlich, denn diese entscheidet über die Wahl und die eventuelle Kombination der antidiabetischen und organprotektiven Pharmaka. In Tab. 3 sind in Anlehnung an die NVL wichtige Risikofaktoren aufgelistet:
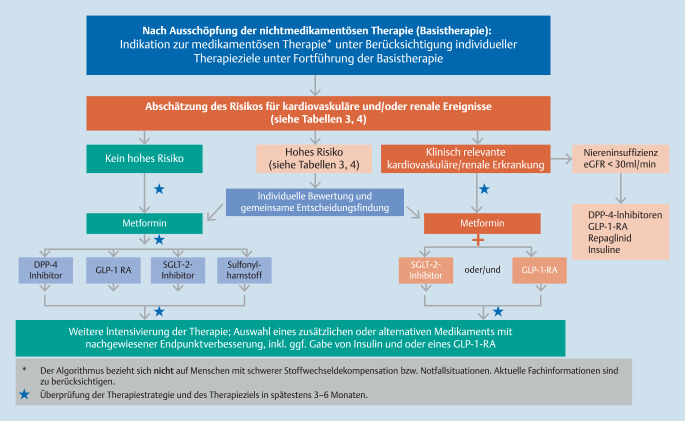
Die Risikoabschätzung ist aufgrund der Komplexität und der Vielzahl von Risikofaktoren (Tab. 3), die in ihrer Gesamtheit nicht evaluiert wurden, nicht in Form von Scores abzubilden. Die Analyse wichtiger RCT zeigt eindrücklich, wie heterogen die Einschlusskriterien für die Studienteilnehmer waren (Tab. 4). Zudem werden in den meisten RCT (strikte Ein- und Ausschlusskriterien) nur maximal 4–50 % der Real-World-Patienten abgebildet. Um die Wirksamkeit von Interventionen in RCT in Real-World-Settings zu beurteilen, sind daher pragmatische und Registerstudien mit jeweils den gleichen Patientencharakteristika wie bei korrespondierenden RCT notwendig. Deshalb hilft derzeit nur eine individuelle sorgfältige Abschätzung des Risikos für kardiovaskuläre und renale Erkrankungen vor Implementierung des entsprechenden Therapiealgorithmus (Abb. 2 und 3).
Übersicht im Hinblick auf metabolische Wirkungen und klinische Endpunkte
Tab. 5 erlaubt eine schnelle, orientierende Übersicht im Hinblick auf metabolische Wirkungen und klinische Endpunkte der in dieser Praxisempfehlung diskutierten Pharmaka – abgesehen vom oralen Semaglutid, das, gemessen an klinischen Endpunkten, dem s.c. Semaglutid nicht unterlegen war. Die Tabelle ist eine sorgfältige Interpretation der verfügbaren Evidenz aus randomisierten, kontrollierten Studien und Metaanalysen, die vom ärztlichen Zentrum für Qualität in der Medizin und der NVL-Arbeitsgruppe erstellt und konsentiert wurde (www.leitlinien.de/nvl/diabetes; AWMF-Register-Nr. 001; [1]) und aufgrund neuer Studienergebnisse von der Autorengruppe dieser Praxisempfehlung ergänzt wurde.
| Medikament | Gesamtmortalität | Kardiovaskuläre Endpunkte | Mikrovaskuläre Endpunktea | Renale Endpunkte | Hypoglykämien | HbA1c, Gewicht | Anmerkungen/ausgewählte Sicherheitshinweise |
|---|---|---|---|---|---|---|---|
| Metformin | 0 | 0 | 0 | 0 | ↔ ↑ |
HbA1c ↓↓ Gewicht: ↔↓ |
Risiko der Laktatazidose, bei Krankheit („sick days“) pausieren |
| SGLT-2-Inhibitoren | Risiko genitaler Infektionen, atypischer Ketoazidose, Fournier-Gangrän | ||||||
| Bei Krankheit („sick days“) pausieren | |||||||
| Gewichtsreduktion (bei „frailty“ unerwünscht) | |||||||
| Dapagliflozin | 0* senkt bei Pat. mit HF |
MACE: 0 CV-Tod: 0 HHI: ↓ senkt |
k. A.: Retinopathie, Neuropathie Amputationen: 0 |
↓ senkt | ↔ |
HbA1c ↓↓ Gewicht: ↓ |
– |
| Empagliflozin | ↓ senkt* |
MACE: ↓ senkt CV-Tod: ↓ senkt HHI: ↓ senkt |
k. A. | ↓ senkt | ↔ |
HbA1c ↓↓ Gewicht: ↓ |
– |
| Ertugliflozin | – |
MACE: 0 CV-Tod: 0 HHI: ↓ senkt |
– |
0 (eGFR-Abnahme wird reduziert) |
– | – | – |
| GLP-1-RA | Gastrointestinale Nebenwirkungen, Gallensteine | ||||||
| Geringes Risiko für Pankreatitis | |||||||
| Injektionen notwendig | |||||||
| Gewichtsreduktion (bei „frailty“ unerwünscht) | |||||||
| Dulaglutid | 0 |
MACE: ↓ senkt CV-Tod: 0 HHI: 0 |
Retinopathie: 0 k. A.: Amputation, Neuropathie |
↓ senkt | ↔ |
HbA1c ↓↓ Gewicht: ↓ |
– |
| Exenatid | ↓ senkt* |
MACE: 0 CV-Tod: 0 HHI: 0 |
Amputation: 0 | k. A. | ↔ |
HbA1c ↓↓ Gewicht: ↓ |
– |
| Liraglutid | ↓ senkt* |
MACE: ↓ senkt CV-Tod: ↓ senkt HHI: 0 |
Retinopathie: 0 k. A.: Neuropathie, Amputationen |
↓ senkt | ↔ |
HbA1c ↓↓ Gewicht: ↓ |
– |
| Lixisenatid | 0* |
MACE: 0 CV-Tod: 0 HHI: 0 |
k. A. zu: Retinopathie, Amputation, Neuropathie | k. A. | ↔ |
HbA1c ↓↓ Gewicht: ↓ |
– |
| Semaglutid | 0* |
MACE: ↓ senkt CV-Tod: 0 HHI: 0 bei Semaglutid oral MACE: 0 CV-Tod: ↓ HHI: 0 |
Retinopathien: ↑ k. A.: Neuropathie, Amputationen |
↓ senkt | ↔ |
HbA1c ↓↓ Gewicht: ↓ |
Cave bei vorbestehender Retinopathie |
| Sulfonylharnstoffe | (0) |
MACE: (0)* CV-Tod: (0) HHI: (0) |
(0 bis ↓) | (0 bis ↓) | ↑↑ |
HbA1c ↓↓ Gewicht: ↑ |
Risiko schwerer prolongierter Hypoglykämien |
| CVOT-Studie: kein Unterschied im primären CV-Endpunkt bei direktem Vergleich zum CV-neutralen Linagliptin | |||||||
| DPP-4-Inhibitoren | (0) |
MACE: (0) sicher CV-Tod: (0) HHI: (0) |
(0) | (0) | ↔ |
HbA1c ↓ Gewicht: ↔ |
Sehr seltene Beobachtung: Pankreatitis, entzündliche Darmerkrankungen |
| CVOT liegen für Sitagliptin, Saxagliptin und Linagliptin vor | |||||||
| Vildagliptin hat keine CVOT | |||||||
| Saxagliptin wird nicht empfohlen bei vorbestehender Herzinsuffizienz | |||||||
| Ggf. ab Stufe 3 des Algorithmus | |||||||
| Insulin | (0) | (0) | (↓) | (0) | ↑↑ |
HbA1c ↓↓ (dosisabhängig) Gewicht: ↑↑ |
Risiko für Hypoglykämien, besonders zu Therapiebeginn |
| Lipohypertrophien | |||||||
Endpunkt Gesamtmortalität *: Die Studie war nicht für den Endpunkt Gesamtmortalität gepowert. Im Vergleich zu Linagliptin in CVOT: Dapagliflozin und Ertugliflozin sind zur Behandlung der chronischen Herzinsuffizienz zugelassen. Dies betrifft Patienten mit einer eingeschränkten linksventrikulären Funktion (HFrEF). Dann können Dapagliflozin bis zu einer eGFR von 30 ml/min und Empagliflozin bis zu einer eGFR von 20 ml/min gegeben werden. Aufgeführte Sicherheitsaspekte und Effekte stellen den Diskussionsstand der vorliegenden Evidenz in der Expertengruppe dar und sind nicht als umfassende Darstellung zu betrachten
Effekte auf Endpunkte: ↓ positiver Effekt (Endpunkt wurde in den Studien seltener erreicht), ↑ negativer Effekt (Endpunkt wurde in den Studien häufiger erreicht), 0 der Endpunkt wurde in den betrachteten Studien nicht beeinflusst, Annahmen in Klammern stammen aus Studien mit niedriger methodischer Qualität oder es lag nicht ausreichend Evidenz zur Beurteilung vor, Hypoglykämien: ↑ erhöhtes Risiko, ↔ geringes Risiko; HbA1c: ↓ Senkung; Gewicht: ↑ Gewichtszunahme, ↓ Gewichtsabnahme
MACE kardiovaskulärer Tod, Schlaganfall, Myokardinfarkt (genaue Definition s. kardiovaskuläre Endpunktstudien), CV-Tod kardiovaskulärer Tod, HHI Hospitalisierung aufgrund von Herzinsuffizienz, CVOT kardiovaskuläre Outcomestudien, k. A. keine Angabe (die Effektgrößen wurden in der Hauptpublikation nicht oder ohne Konfidenzintervall angegeben)
aMikrovaskuläre Endpunkte: Retinopathie, Neuropathie, Amputationen
Begründung zur Therapiestufe nichtmedikamentöse Basistherapie
Die Basistherapie umfasst alle lebensstilmodifizierenden, nichtmedikamentösen Maßnahmen. Dazu zählen Schulung und Training des Patienten, Ernährungstherapie, Steigerung der körperlichen Aktivität und Nichtrauchen sowie Stressbewältigungsstrategien. Ein wichtiges Ziel ist die Stärkung des Willens zu einer gesunden Lebensweise (auf das Rauchen verzichten, diabetesgerechte Ernährung, verstärkte körperliche Bewegung, Einschränkung des Alkoholkonsums; Abb. 2 und 3). Digitale Hilfsmittel und telemedizinische Unterstützung werden immer wichtiger für die Umsetzung einer personalisierten Basistherapie [52].
Da sehr viele Menschen mit Typ-2-Diabetes neben der chronischen Hyperglykämie eine Vielzahl von weiteren vaskulären Risikofaktoren oder bereits kardiovaskuläre, renale und weitere Erkrankungen haben, ist die Behandlung dieser Menschen komplex und soll alle vaskulären Risikofaktoren und manifesten klinischen Krankheiten individuell berücksichtigen. Um dies deutlicher hervorzuheben, wurde der bisherige Therapiealgorithmus erweitert, um wesentliche kardiovaskuläre Risiken detaillierter zu adressieren.
Begründung zur Therapiestufe Pharmakotherapie
Die Basistherapie spielt bei jeder weiteren Stufe der Therapiemodifikation eine wichtige Rolle. Falls diese vom Menschen mit Diabetes nicht oder unzureichend umsetzbaren lebensstilmodifizierenden Maßnahmen auch in absehbarer Zeit (2–3 Monate) nicht erfolgreich oder nicht sinnvoll sind, ist eine Pharmakotherapie zur Erreichung der individuellen Therapieziele angezeigt. Wenn immer möglich sollte wegen einiger Vorteile mit Metformin (s. Anhang) in langsam aufsteigender Dosierung begonnen werden (z. B. beginnend mit 500 mg zur Hauptmahlzeit und Steigerung um weitere 500 mg jede Woche bis zu einer Gesamtdosis von 2‑mal 1000 mg pro Tag).
Bei Kontraindikationen (eGFR!) oder schlechter Verträglichkeit von Metformin (hauptsächlich dosisabhängige gastrointestinale Beschwerden) stehen andere Optionen zur Monotherapie zur Verfügung, deren Einsatz nach dem Patientenrisikoprofil (kardiorenale Risiken und Morbidität) und dem anderen patientenrelevanten Nutzen (Einfluss auf Körpergewicht, Hypoglykämiegefahr, metabolische Effekte, Nebenwirkungsprofil und klinische Endpunkte) erfolgen sollte. Dabei sollten die Patientenpräferenzen unbedingt berücksichtigt werden, denn nur so ist eine gute Therapieadhärenz gewährleistet.
Bei Patienten mit kardiovaskulären oder renalen Erkrankungen oder einem sehr hohen kardiovaskulären Risiko (Tab. 3) sollen meist in Kombination mit Metformin (eGFR > 30 ml/min!) primär Substanzen eingesetzt werden, die evidenzbasiert kardiovaskuläre und renale Erkrankungen sowie die Mortalität reduzieren (SGLT-2-Inhibitoren, GLP-1-Rezeptor-Agonisten). Bei Menschen mit Typ-2-Diabetes mit deutlich außerhalb des individuellen Glukosezielbereichs liegenden HbA1c-Werten (z. B. > 1,5 % über dem Zielbereich) bei Diagnosestellung ist eine initiale Pharmakotherapie, ggf. auch unter Verwendung von Mehrfachkombinationen einschließlich Insulin, gerechtfertigt. Nach HbA1c-Zielwerterreichung soll die Therapie in individuell vereinbarten Intervallen unbedingt adjustiert werden.
Begründung zu Kombinationstherapien
Eine Zweifachkombination ist für viele Patienten aus metabolischen Gründen notwendig und günstiger im Hinblick auf Nebenwirkungen der Einzelsubstanzen, da in der Kombination teilweise niedriger dosiert werden kann.
Eine frühzeitige Kombinationstherapie sollte angestrebt werden, um die Stoffwechselparameter nicht erst weit aus dem vereinbarten Zielbereich entgleisen zu lassen [53, 54]. Eine Überprüfung der Zielwerte sollte meist in 3‑monatigen Abständen erfolgen. Für die Auswahl der Kombinationen gibt es inzwischen eine Vielzahl von Publikationen mit guter Evidenz. Auch dabei spielen Patientenpräferenzen, individuelle Therapieziele, Einfachheit der Behandlung, vorhandene kardiovaskuläre Erkrankungen und eventuelle Kontraindikationen eine wichtige Rolle. Falls aufgrund der Komplexität der Therapie, der vaskulären Risikofaktoren oder der Komorbiditäten (u. a. COPD, Depression, chronische Schmerzzustände usw.) die Zahl oraler Medikamente zu komplex wird, sollen, wo immer möglich, Fixkombinationen verwendet werden. Es können auch parenterale Blutglukosespiegel senkende Prinzipien (GLP-1-RA, Insuline) sinnvoll und für diese Patienten hilfreich sein und die Therapieadhärenz deutlich steigern. Je höher der HbA1c-Wert, desto wahrscheinlicher ist ein Einsatz von Insulin, was jedoch nicht bedeutet, dass die initiale Insulintherapie nach Stoffwechselrekompensation fortgesetzt werden muss. Deeskalationsstrategien sollten bei jedem Patienten bedacht werden.
Die Gabe von mehr als 2 oralen Antidiabetika kann individuell sinnvoll sein, wenn die Therapie mit einem GLP-1-RA oder einem Insulin noch nicht indiziert ist (Abb. 3), der Patient mit einer Injektionstherapie noch nicht einverstanden ist oder aus anderen Gründen diese Therapie hinausgezögert werden soll.
Eine orale Dreifachtherapie in der Kombination von Metformin, einem DPP-4-Inhibitor und einem SGLT-2-Hemmer ist eine sichere, effektive und einfache Therapie. Eine Potenzierung von Nebenwirkungen wurde unter oraler Dreifachkombination nicht beobachtet; sie entsprechen im Wesentlichen denjenigen, die bei Monotherapie für die jeweilige Substanz beobachtet werden.
Bei Nichtansprechen einer Therapie (sog. Non-Responder) ist immer die Therapietreue mit dem Patienten zu besprechen, bevor eine Dosiserhöhung oder Umstellung der Behandlung erfolgt.
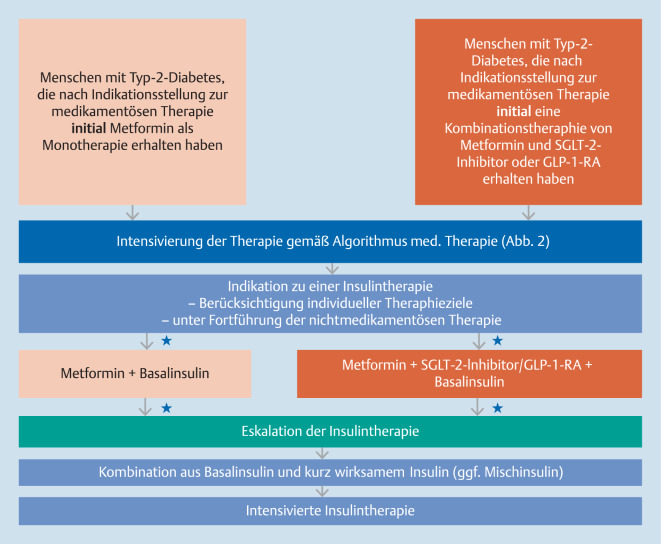
Begründung zu einer Injektionstherapie
Aufgrund der niedrigeren Hypoglykämieraten und eines günstigen Körpergewichtsverlaufs (im Vergleich zu einer intensivierten Insulintherapie) empfiehlt sich für die meisten Fälle der Beginn mit einer GLP-1-RA-unterstützen Therapie (GUT) oder einem Basalinsulin (BOT) in Kombination mit oralen Antidiabetika (Abb. 3).
An eine Insulindosisreduktion soll bei Verschlechterung der Nierenfunktion unbedingt gedacht werden, um schwere Hypoglykämien zu vermeiden.
Eine Kombination von GLP-1-RA mit oralen Antidiabetika (außer DPP-4-Hemmern) ist eine effektive Behandlung, wenn das individuelle Therapieziel mit den bisherigen oralen Antidiabetika in Mono- oder Mehrfachkombinationen nicht erreicht wurde oder Nebenwirkungen zwingend eine neue Therapiestrategie notwendig machen. Prinzipiell sollte der Einsatz von GLP-1-RA vor Beginn einer Therapie mit Insulin erwogen werden, v. a. aufgrund des sehr niedrigen Hypoglykämierisikos der Substanzklasse, des günstigen Gewichtsverlaufs und der vorteilhaften kardiovaskulären und renalen Outcomedaten dieser Substanzen.
Kombinationen eines GLP-1-RA mit einem Basalinsulin führen zu einer signifikanten Verzögerung der Intensivierung der antidiabetischen Therapie (z. B. Eskalation der Basalinsulindosis oder zusätzliche Gabe von prandialem Insulin), zu signifikant besserer Stoffwechselkontrolle ohne wesentliche Steigerung des Hypoglykämierisikos und zu günstigen Gewichtseffekten [55–59].
Erst wenn diese Kombinationstherapien nicht mehr ausreichend wirksam oder indiziert sind, wird in einem nächsten Schritt eine weitere Intensivierung der Insulintherapie durch prandiales Insulin geboten sein.
Flexibilität der Therapieentscheidungen aufgrund der Heterogenität des Typ-2-Diabetes und der individuellen Therapieziele ist in jeder Stufe der Behandlung notwendig. Meist sind Überzeugungsarbeit zur Akzeptanz einer Injektionsbehandlung und ein(e) ausführliche(s) Schulung/Training des Patienten notwendig. In Einzelfällen ist bei unzureichender Therapiezielerreichung unter ICT eine CSII indiziert.
Therapie der Dyslipidämie
Eine Dyslipidämie ist bei Menschen mit Typ-2-Diabetes häufig und ein wichtiger vaskulärer Risikofaktor. Detaillierte Angaben zur Behandlung der Dyslipidämie finden sich in der ESC/EAS-Leitlinie [19] und in der Praxisempfehlung dieses Supplements [60].
Therapie der arteriellen Hypertonie
Die arterielle Hypertonie ist ein wichtiger kardiovaskulärer und renaler Risikofaktor, der unbedingt frühzeitig und konsequent behandelt werden soll. Hilfreich sind strukturierte Schulungen zur Hypertonie einschließlich des praktischen Trainings der Patienten zum Selbstmonitoring auch des Blutdrucks [61]. Detaillierte Angaben zur Behandlung der Hypertonie wurden u. a. in Leitlinien [20, 62–64] und weiteren Publikationen diskutiert [65, 66].
Infobox 2: Risikofaktoren für kardiovaskuläre Erkrankungen und Typ-2-Diabetes
Nicht beeinflussbar
Höheres Lebensalter
Geschlecht (Männer > Frauen)
Ethnizität
Diabetes in der Familie
Gestationsdiabetes (in der Anamnese)
Intrauterine Entwicklung (fetale Programmierung)
Beeinflussbar
Viszerale Adipositas
Fettleber
Depression
Obstruktive Schlafapnoe (OSA)
Körperliche Inaktivität
Energiereiche, ballaststoffarme Nahrung
Starker Zuckerkonsum (Softdrinks usw.)
Übermäßiger Alkoholgenuss (Fettleber)
Rauchen
Diabetogene Medikamente
Diabetogene Umwelt (u. a. Deprivation: Benachteiligung durch Mangel an Ressourcen, übermäßigen chronischen Lärm und Luftverschmutzung)
Infobox 3: Metabolisches Syndrom [67]
Mindestens 3 von 5 Kriterien müssen erfüllt sein:
Abdominelle Adipositas (Taillenumfang): Männer* > 94 cm; Frauen** > 80 cm
Triglyzeride***: ≥ 150 mg/dl bzw. ≥ 1,7 mmol/l
HDL-Cholesterin***: Männer < 40 mg/dl bzw. < 1,03 mmol/l; Frauen: < 50 mg/dl bzw. < 1,29 mmol/l
Erhöhter Blutdruck***: ≥ 130/≥ 85 mm Hg
Nüchternplasmaglukosewert***: ≥ 100 mg/dl bzw. ≥ 5 mmol/l oder präexistierender Diabetes
*/**Menschen aus Südostasien oder China: 90/80 cm; Japaner: 90/85 cm
***Pharmakologische Intervention ist ein alternatives Kriterium
Infobox 4: Allgemeine Behandlungs- und Betreuungsziele
Erhaltung bzw. Wiederherstellung der Lebensqualität
Kompetenzsteigerung (Empowerment) der Betroffenen im Umgang mit der Erkrankung und ihren Komplikationen
Verminderung eines Krankheitsstigmas
Behandlungszufriedenheit
Förderung der Therapieadhärenz
Reduktion des Risikos für kardiale, renale und zerebrovaskuläre und weitere makrovaskuläre Folgekomplikationen
Vermeidung und Behandlung der mikrovaskulären und neurologischen Folgekomplikationen
Vermeidung und Behandlung des diabetischen Fußsyndroms
Behandlung und Besserung von Begleitkrankheiten
Minimierung der Nebenwirkungen der Therapie (z. B. schwere Hypoglykämien, Gewichtszunahme)
Minimierung der Belastungen durch komplexe Therapien (Polypharmazie, Medikamenteninteraktionen)
Reduktion von Morbidität
Normalisierung der verkürzten Lebenserwartung bei guter Lebensqualität
Anhang
Anamnese und klinische Untersuchungen
Die Anamnese und klinische Untersuchungen bei Menschen mit Typ-2-Diabetes sind in Tab. 6 dargestellt.
Monitoring von Menschen mit Typ-2-Diabetes
Das Monitoring von Menschen mit Typ-2-Diabetes ist in Tab. 7 dargestellt.
Körperliche Bewegung
Diese hat insbesondere für Menschen mit Typ-2-Diabetes bei regelmäßiger Durchführung einen hohen Stellenwert [68–75].
Die Vorteile einer regelmäßigen körperlichen Aktivität sind in Tab. 8 dargestellt.
| Senkt den Blutdruck |
| Senkt die Herzfrequenz in Ruhe und unter Belastung |
| Verbessert die Dyslipidämie |
| Reduziert das kardiovaskuläre Risiko |
| Verringert die Insulinresistenz |
| Unterstützt eine Gewichtsabnahme |
| Verbessert die Fließeigenschaft des Blutes und damit die Versorgung von Muskeln und Organen |
| Senkt das Thromboserisiko |
| Lindert chronische Schmerzen |
| Beugt bestimmten Krebserkrankungen vor |
| Stärkt das Immunsystem |
| Stärkt das Vertrauen in die eigene Leistungsfähigkeit und somit das Selbstbewusstsein |
| Hebt die Stimmungslage und reduziert Stress |
| Fördert die Beweglichkeit und die Koordination insbesondere bei älteren Menschen |
| Fördert das allgemeine Wohlbefinden |
Lebensstilmaßnahmen: Abbildung
Das Stufenprogramm für körperliche Aktivität ist in Abb. 4 dargestellt.
Tabakentwöhnung
Der Algorithmus zum Vorgehen beim Rauchen ist in Abb. 5 dargestellt.
Kritische Darstellung der einzelnen antidiabetischen Pharmaka
Metformin
Aufgrund seiner guten Effektivität, den HbA1c-Wert zu senken, des bekannten Sicherheitsprofils, der Zulassungsbedingungen anderer Substanzen mit positiven Effekten in CVOT, der langen Erfahrung und der geringen Kosten ist Metformin weiterhin das Antidiabetikum der ersten Wahl zur Behandlung eines Typ-2-Diabetes. Vorteilhaft sind zudem das geringe Hypoglykämierisiko (cave: gleichzeitiger Alkoholkonsum) und der vorteilhafte Effekt, das Gewicht leicht zu senken. Die Indikation als Mono- und in Kombinationstherapie mit Metformin wurde aufgrund umfangreicher Publikationen im Februar 2017 erweitert [76]:
Patienten können bis zu einer Nierenfunktionseinschränkung Grad 3b (eGFR bis 30 ml/min) mit Metformin behandelt werden, wenn keine anderen Kontraindikationen vorliegen.
Maximale Tagesdosis ist 1000 mg (500-0-500 mg) bei einer eGFR von 30–44 ml/min. Bei dieser eGFR sollte eine Metformintherapie möglichst nicht neu begonnen werden.
Maximale Tagesdosis ist 2000 mg bei einer eGFR von 45–59 ml/min.
Sicherheitshalber kann bei einer eGFR von 30–44 ml/min eine Dosisreduktion auf 500 mg täglich durchgeführt werden, da sich die eGFR gerade in diesem Bereich insbesondere bei älteren Menschen mit einer Exsikkose oder durch nierentoxische Pharmaka akut verschlechtern kann.
Für und Wider einer Metformintherapie bei einer eGFR von 30–44 ml/min sollten dem Patienten unbedingt erläutert werden.
In der bevölkerungsbasierten großen Studie mit 75.413 Patienten des Geisinger-Health-Systems erfolgte eine Analyse aller Patienten in Bezug auf Hospitalisierung wegen einer Azidose. Es konnten 2335 Hospitalisierungen wegen einer Azidose im Zeitraum von 2004–2017 (mediane Follow-up-Zeit von 5,7 Jahre) gefunden werden. In diesem klinischen Real-World-Setting war Metformin im Vergleich zu anderen Antidiabetika (ausgenommen Insulin) nur dann mit einer Laktatazidose assoziiert, wenn die eGFR < 30 ml/min war [77].
Was klinische Endpunkte betrifft, ist die Datenlage trotz der häufigen Anwendung von Metformin nicht gesichert. Es finden sich positive Daten aus der UKPDS bei einer relativ kleinen Zahl übergewichtiger Patienten und aus mehreren kleinen Studien. In einer kürzlichen Metaanalyse wurden weder signifikante positive noch negative Effekte von Metformin auf kardiovaskuläre Endpunkte gefunden [78]; allerdings räumen die Autoren ein, dass auch für die Metaanalyse die Zahlen zu gering sind und eine große kontrollierte Studie nötig wäre (die sicherlich nicht zu erwarten ist), um die Frage zu klären. Entsprechend gibt es auch keine Hinweise für einen Vorteil von Metformin für eine bestimmte Kombinationstherapie im Hinblick auf kardiovaskuläre Endpunkte und Gesamtmortalität [79, 80]. In den Leitlinien der European Society of Cardiology wurde die primäre Therapie mit Metformin ersetzt durch SGLT-2-Hemmer und GLP-1-RA bei Patienten mit neu diagnostiziertem Typ-2-Diabetes und bereits arteriosklerotischen kardiovaskulären Erkrankungen, da es für Metformin bei diesem Kollektiv keine kardiovaskuläre Endpunktstudie gibt. Zudem zeigen weitere Analysen von Endpunktstudien mit GLP-1-RA oder SGLT-2-Hemmern, dass die Einnahme von Metformin auf den kardioprotektiven Effekt dieser Substanzen keinen modulierenden Einfluss zeigte [81]. Es gibt jedoch keine definitive Evidenz für den Vorteil dieser Empfehlung, da es bisher keine kontrollierten Studien dazu gibt [82]. Unter strikter Beachtung der Kontraindikationen für Metformin sollte man daher weiterhin mit Metformin als Primärtherapie beginnen und bei klinischer Indikation (manifeste kardiovaskuläre und renale Erkrankungen oder Patienten mit einem hohen kardiorenalen Risiko; Teil 1; Tab. 3 und 4) frühzeitig (innerhalb von 1–2 Monaten) eine Kombinationstherapie mit SGLT-2-Inhibitoren und/oder GLP1-RA starten.
Metformin gewinnt derzeit aufgrund interessanter pleiotroper Effekte, die Änderungen des Epigenoms und der Genexpression beeinflussen und so potenziell protektiv u. a. gegen Karzinome wirken sollen, großes Interesse [83–91].
Metformin und COVID-19
Eine Reihe von Beobachtungsstudien zeigte, dass bei Menschen mit Diabetes unter einer prästationären Metformintherapie eine stationär behandelte COVID-19-Infektion mit einer signifikant geringeren Mortalität assoziiert ist [92, 93]. Dies konnte in einer aktuellen Metaanalyse bestätigt werden, bei der eine signifikante Reduktion der „odds ratio“ für Mortalität bei COVID-19-Patienten mit Diabetes unter einer Therapie mit Metformin im Vergleich zu nicht mit Metformin Therapierten gefunden wurde: OR: 0,62; 95 %-KI: 0,43–0,89 [94]. In den Untersuchungen wurden die Confounder z. T. nicht oder nur unzureichend berücksichtigt. Solange keine kontrollierten Studien vorliegen, ist daher bei schwerkranken, mit COVID-19 infizierten stationären Patienten wegen der Gefahr von Azidosen größte Vorsicht geboten, Metformin einzusetzen bzw. eine Metforminbehandlung beizubehalten [95, 96].
Zusammenfassung zur Therapie mit Metformin
Die Nierenfunktion muss regelmäßig kontrolliert werden (alle 3–6 Monate). Cave: Metformin muss sofort abgesetzt werden, wenn die eGFR auf < 30 ml/min fällt.
Vorsicht bei Erkrankungen, die das Risiko für eine Laktatazidose erhöhen (z. B. akute Verschlechterung der Nierenfunktion infolge Gastroenteritis, respiratorische Insuffizienz, akute Erkrankungen und Infektionen oder nichtsteroidale Antiphlogistika).
Vorsicht bei der Einleitung einer Therapie mit ACE-Hemmern oder AT-1-Rezeptor-Blockern, Diuretika, zu Beginn einer Therapie mit nichtsteroidalen Antiphlogistika.
Bei Gabe von Röntgenkontrastmitteln, vor interventionellen oder größeren chirurgischen Eingriffen sollte Metformin vorher abgesetzt und mit der Wiederaufnahme der Einnahme erst 48 h nach dem Eingriff begonnen werden, jedoch nur, wenn sich die eGFR postoperativ nicht wesentlich verschlechtert hat und der Patient wieder oral Nahrung aufnehmen kann.
Bei kardiovaskulären und renalen Hochrisikopersonen oder Menschen mit manifesten kardiorenalen Erkrankungen ist größte Vorsicht geboten.
Sulfonylharnstoffe
Sulfonylharnstoffe werden seit Jahrzehnten eingesetzt, da sie die Blutglukosespiegel effektiv senken, gut verträglich und kostengünstig sind. Sulfonylharnstoffe führen meist zu einer moderaten Gewichtszunahme.
Aufgrund ihrer Eigenschaft, die Insulinsekretion durch Inhibierung der Kaliumkanäle der β‑Zellen glukoseunabhängig zu steigern, besitzen sie unter allen oralen Antidiabetika das höchste Hypoglykämiepotenzial mit der Gefahr z. T. schwerer und prolongierter Hypoglykämien, insbesondere bei älteren Menschen mit eingeschränkter Nierenfunktion und Polypharmazie. Sulfonylharnstoffe sind bei nachlassender Nierenfunktion (eGFR < 30 ml/min) mit der Ausnahme von Gliclazid und Gliquidon weitgehend kontraindiziert. Wegen der starken Gefährdung der Patienten insbesondere mit kardiovaskulären und renalen Komplikationen durch schwere Hypoglykämien sollten Sulfonylharnstoffe bei diesen Menschen nicht eingesetzt werden.
Günstige Effekte auf mikrovaskuläre Endpunkte fanden sich in der UKPDS mehr als 6 Jahre nach Therapiebeginn für Chlorpropamid und Glibenclamid (hauptsächlich reduzierte Rate an Photokoagulation). In der ADVANCE-Studie fanden sich für Gliclazid positive Effekte auf mikrovaskuläre Komplikationen, vornehmlich durch Reduktion einer Nephropathie [97, 98].
In der prospektiven, randomisierten, kontrollierten CAROLINA-Studie (mittlere Beobachtungszeit 6,3 Jahre, in jeder Studiengruppe ca. 3000 Patienten; in beiden Studiengruppen litten bereits zu Studienbeginn 42 % der Teilnehmer an klinisch manifesten kardiovaskulären Komplikationen) erfolgte ein Vergleich zwischen Linagliptin (5 mg/Tag) und Glimepirid (1–4 mg/Tag) in Bezug auf kardiovaskuläre Endpunkte, Hypoglykämien und Gewichtsverlauf. Es zeigte sich kein Unterschied beim Vergleich der beiden Studiengruppen für 3P-MACE, 4P-MACE, Gesamt- und kardiovaskuläre Morbidität und Mortalität bei insgesamt vergleichbarem HbA1c-Wert [99]. Der Gewichtsverlauf war unter Linagliptin günstiger im Vergleich zu Glimepirid (−1,54 kg), und die Raten aller, der moderaten, schweren und hospitalisierungsnotwendigen, Hypoglykämien waren signifikant niedriger unter Linagliptin im Vergleich zu Glimepirid in allen Dosierungen zwischen 1 und 4 mg (1 mg: HR: 0,23; 95 %-KI: 0,21–0,26; p < 0,0001, 2 mg: HR: 0,18; 95 %-KI: 0,15–0,21; p < 0,0001, 3 mg: HR: 0,15; 95 %-KI: 0,08–0,29; p < 0,0001, 4 mg: HR: 0,07; 95 %-KI: 0,02–0,31; p = 0,0004). Die Autoren folgerten aus den Daten der CAROLINA-Studie, dass es außer den geringeren Kosten für Glimepirid keine Gründe gibt, Glimepirid bevorzugter als Linagliptin in der antidiabetischen Therapie einzusetzen [99].
In mehreren retrospektiven Beobachtungsstudien, in einer großen randomisierten, pragmatischen Studie, Analysen aus Registerdaten und deren Metaanalysen sowie Cochrane-Reviews zeigte sich, dass Sulfonylharnstoffe keine Vorteile im Hinblick auf makrovaskuläre Endpunkte haben, weder in der Mono- noch in einer Kombinationstherapie. Es wurden eher eine gesteigerte kardiovaskuläre Morbidität und Mortalität beschrieben [83, 100–108].
Repaglinid
Aufgrund eines Beschlusses des G‑BA erfolgte ab 01.07.2016 eine umfangreiche Verordnungseinschränkung für Glinide. Die Verordnungseinschränkung lautet: „Ausgenommen ist die Behandlung von niereninsuffizienten Patienten mit einer Kreatinin-Clearance < 25 ml/min mit Repaglinid, soweit keine anderen oralen Antidiabetika infrage kommen und eine Insulintherapie nicht angezeigt ist.“ Trotz einer ausführlichen evidenzbasierten Stellungnahme (s. a. https://www.deutsche-diabetes-gesellschaft.de/politik/stellungnahmen) gegenüber G‑BA und BMG hat der G‑BA-Beschluss nach wie vor Bestand.
DPP-4-Hemmer
DPP-4-Hemmer ersetzen in zunehmendem Maße die Therapie mit Sulfonylharnstoffen. Die Gründe sind ein günstiges Sicherheitsprofil auch bei progredienter Niereninsuffizienz und die gute Verträglichkeit, was insbesondere bei älteren Menschen von großer Wichtigkeit ist. Die Therapieadhärenz und -persistenz der Therapie mit DDP-4-Hemmern (bei 594,138 Patienten) waren trotz der guten Verträglichkeit suboptimal: Nach 1 Jahr der Therapie betrug die Adhärenz 56,9 % (95 %-KI: 49,3–64,4) und nach 2 Jahren 44,2 % (95 %-KI: 36,4–52,1, [109]).
Bis auf Linagliptin müssen alle im Handel befindlichen DPP-4-Hemmer in der Dosierung an die Nierenfunktion angepasst werden. Zusätzlich zeigen DPP-4-Inhibitoren weitgehend gewichtsneutrale Effekte bei ähnlichem antihyperglykämischem Effekt und niedrige Hypoglykämieraten. DPP-4-Hemmer scheinen länger eine bessere metabolische Kontrolle auszuüben als Sulfonylharnstoffe (Beobachtungszeitraum 104 Wochen; [110]).
Die Ergebnisse der CAROLINA-Studie [99] (siehe Kapitel Sulfonylharnstoffe) wurden in einer Real-World-Studie mit Einschlusskriterien wie bei der CAROLINA-Studie in einem „propensity score matching“ (PSM) untersucht [111]. Es konnten 24.131 Studienpaare für Linagliptin und Glimepirid analysiert werden. Wie in der CAROLINA-Studie fanden sich keine Unterschiede im Hinblick auf die kardiovaskuläre Sicherheit.
Die Ergebnisse der RCT SAVOR TIMI 53® (Saxagliptin [112]), EXAMINE® (Alogliptin [113]), TECOS® (Sitagliptin [114]), CARMELINA® (Linagliptin [115, 116]) zum Effekt von DPP-4-Inhibitoren auf kardiovaskuläre und renale Endpunkte zeigten in ihrem primären Endpunkt jeweils kardiovaskuläre Sicherheit über alle eGFR-Bereiche (< 30–> 60 ml/min) des untersuchten DPP-4-Inhibitors, was sich auch in umfangreichen Metaanalysen bestätigte [117–123]. In einer großen US-Datenbank zeigte sich in einem 3‑Jahres-Follow-up, dass DDP-4-Hemmer das Risiko des zusammengesetzten klinischen Endpunktes (eGFR-Abnahme > 50 %, terminale Niereninsuffizienz oder Gesamtmortalität) im Vergleich zu Sulfonylharnstoffen deutlicher reduzierten, aber weniger effektiv waren als GLP-1-RA und SGLT-2-Inhibitoren [124].
DPP-4-Inhibitoren sind daher nebenwirkungsarme, effektive Antidiabetika, die sehr gut als Mono- und Kombinationstherapie eingesetzt werden können, wenn Kontraindikationen zum Einsatz von Metformin vorliegen und eine entsprechende Patientenpräferenz besteht. Ein weiterer Vorteil ist, dass DPP-4-Hemmer weitgehend gewichtsneutral agieren, kaum Hypoglykämien induzieren und der Einsatz von Linagliptin auch bei (prä)terminaler Niereninsuffizienz nicht kontraindiziert ist.
Eine Hospitalisierung wegen Herzinsuffizienz war beim Einsatz von DPP-4-Inhibitoren nicht erhöht, außer für Saxagliptin (SAVOR TIMI 53). In einer umfangreichen Metaanalyse zum Risiko von DPP-4-Inhibitoren im Hinblick auf eine Herzinsuffizienz oder eine Hospitalisierung wegen Herzinsuffizienz unter Einbeziehung von RCT und Beobachtungsstudien kamen die Autoren zu dem Schluss, dass der Effekt von DPP-4-Hemmern auf eine Herzinsuffizienz ungewiss bleibt (wegen relativ kurzer Beobachtungszeiten und insgesamt schwacher Datengrundlage, [119]). Eine neuere Metaanalyse über Alogliptin, Linagliptin, Saxagliptin und Sitagliptin zeigte einen neutralen Effekt auf Myokardinfarkt, Schlaganfall, Herzinsuffizienz (OR: 1,06; 95 %-KI: 0,96–1,18) und kardiovaskulären Tod [125].
Basierend auf Studien zu NAFLD und NASH mit bildgebenden Verfahren und der Leberhistologie zeigten – im Gegensatz zu GLP-1-RA oder SGLT-2-Hemmern – DPP-4-Hemmer keinen signifikanten Benefit bei Menschen mit Typ-2-Diabetes und NAFLD [126].
DPP-4-Hemmer bei stationären Patienten
Der Einsatz von DPP-4-Inhibitoren bei Menschen mit einem Typ-2-Diabetes und moderater, relativ stabiler Hyperglykämie zeigte in einer Reihe von RCT ein gutes Sicherheitsprofil, eine effektive Blutglukosespiegelsenkung und ein Einsparen von Insulin bei einer Komedikation mit Insulin [127].
DPP-4-Inhibitoren können möglicherweise das überaktivierte Immunsystem bei Menschen mit einer Sars-CoV-2-Infektion bremsen und so zu einem günstigeren kardiovaskulären Outcome beitragen [128]. Da bisher keine randomisierten Studien vorliegen, liefern die bisher vorliegenden Beobachtungsstudien jedoch keine belastbare Evidenz, DPP-4-Inhibitoren bei COVID-19-Infektionen einzusetzen [129].
Sicherheitsaspekte
In der Metaanalyse der 3 RCT über DPP-4-Inhibitoren (SAVOR TIMI 53, EXAMINE und TECOS) fand sich eine erhöhte Inzidenz von akuter Pankreatitis im Vergleich zu entsprechenden Kontrollen („odds ratio“: 1,79; 95 %-KI: 1,13–2,82; p = 0,013), wobei das absolute Risiko einer akuten Pankreatitis insgesamt gering und unter DPP-4-Inhibitoren absolut nur um 0,13 % höher war [130]. In einer neueren Metaanalyse fand sich eine Assoziation zwischen DPP-4-Hemmern und dem Risiko für eine akute Pankreatitis (OR: 1,72; 95 %-KI: 1,18–2,53). Die Autoren gaben jedoch an, dass die Fallzahl zu gering war, um eine eindeutige Aussage zu machen [131]. Daher ist bei Menschen mit Typ-2-Diabetes und einer Pankreatitis in der Anamnese oder einem entsprechenden Risiko beim Einsatz der DPP-4-Inhibitoren große Vorsicht geboten.
In einer Reihe von Fällen wurde eine eindeutige Assoziation zwischen einer DPP-4-Hemmer-Therapie und einem bullösen Pemphigoid gesehen [132].
Es konnte auch gezeigt werden, dass DPP-4-Inhibitoren nicht mit einer höheren Karzinomrate assoziiert sind [133].
DPP-4-Hemmer waren in einer umfangreichen populationsbasierten Studie mit einer deutlich höheren Inzidenz entzündlicher Darmerkrankungen bei Typ-2-Diabetes assoziiert (HR: 1,75; 95 %-KI: 1,22–2,49, [134]). Diese Assoziation war 3–4 Jahre nach der Therapie mit DPP-4-Hemmern am höchsten, wurde danach aber deutlich geringer. Die Assoziation startete 2–4 Jahre nach Beginn der Therapie. In einer kürzlich erschienenen Metaanalyse von 13 Studien fand sich jedoch keine Assoziation zwischen DPP-4-Hemmern und entzündlichen Darmerkrankungen [135].
In Kombination mit Metformin wurde Sitagliptin vom G‑BA ein geringer Zusatznutzen bescheinigt (BAnz AT 29.04.2019). Weder in der Monotherapie noch in einer Kombinationstherapie wurde Saxagliptin jedoch ein Zusatznutzen zuerkannt (BAnz AT 18.01.2017, BAnz AT 13.03.2018 B2). Auch der Kombination von Linagliptin und Empagliflozin bescheinigte der G‑BA keinen Zusatznutzen (BAnz AT 24.12.2019 B3).
SGLT-2-Inhibitoren
SGLT-2-Inhibitoren (Canagliflozin, Dapagliflozin, Empagliflozin, Ertugliflozin, Sotagliflozin) sind effektive antihyperglykämische Substanzen in der Therapie des Typ-2-Diabetes sowohl in der Mono- als auch in der Kombinationstherapie mit allen anderen glukosespiegelsenkenden Medikamenten.
Ihr Wirkungsprofil ist günstig, auch weil das Hypoglykämierisiko gering ist, die Patienten Gewicht reduzieren und es zu einer klinisch relevanten Absenkung des systolischen Blutdrucks kommt [136–146].
In Deutschland zugelassen: Dapagliflozin, Empagliflozin und Ertugliflozin
In Deutschland nicht zugelassen: Canagliflozin und Sotagliflozin
Sicherheitsaspekte
Es besteht jedoch ein deutlich erhöhtes Risiko für Genitalinfektionen unter SGLT-2-Hemmern in RCT [147, 148]. Das relative Risiko der SGLT-2-Inhibitoren für Genitalinfektionen war mehr als 3fach höher gegenüber Placebo (RR: 3,37; 95 %-KI: 2,89–3,93) und fast 4fach höher als bei aktiver Vergleichsmedikation (RR: 3,89; 95 %-KI: 3,14–4,82). Das Risiko für Harnwegsinfekte hingegen wurde durch SGLT-2-Inhibitoren im Vergleich zu Placebo (RR: 1,03; 95 %-KI: 0,96–1,11) oder einer aktiven Vergleichstherapie (RR: 1,08; 95 %-KI: 0,93–1,25) nicht signifikant erhöht. In einer großen retrospektiven Kohortenstudie einer US-Datenbank fand sich ein etwa 3fach höheres Risiko für eine Genitalinfektion unter SGLT-2-Hemmern im Vergleich zu DPP-4-Inhibitoren, beginnend in den ersten 4 Wochen der Therapie und solange die Therapie fortgesetzt wurde [149]. Vergleichbare Ergebnisse zeigten sich auch in der Real-World-Analyse von Menschen mit Diabetes in relativ hohem Alter (71,8 ± 5 Jahre, [150]). Patienten mit Genitalinfektionen in der Anamnese waren unter SGLT-2-Hemmern besonders infektionsgefährdet [151].
Eine nekrotisierende Fasziitis des Perineums und des Genitales (Fournier-Gangrän) ist eine sehr seltene, schwere Infektion mit der Notwendigkeit einer sofortigen antibiotischen und meist chirurgischen Intervention. Diabetes ist einer der Risikofaktoren. Mit Einführung der SGLT-2-Hemmer-Therapie wurden einige wenige Fälle einer Fournier-Gangrän unter einer SGLT-2-Hemmer-Therapie beschrieben. In Abstimmung mit der europäischen Arzneimittelagentur (EMA) und dem Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) wurde in einem Rote-Hand-Brief über das Risiko einer Fournier-Gangrän (nekrotisierende Fasziitis des Perineums) bei der Anwendung von SGLT-2-Inhibitoren („sodium-glucose-co-transporter-2-inhibitor“) aufgeklärt.
In einer kürzlich publizierten Real-World-Studie wurde die Inzidenz einer Fournier-Gangrän bei Patienten nach Beginn einer Therapie mit SGLT-2-Hemmern (n = 93,197) oder mit DPP-4-Hemmern untersucht. Es fand sich kein erhöhtes Risiko für diese Gangrän bei SGLT-2-Hemmer-Therapie im Vergleich zu Personen mit einer DPP-4-Inhibitoren-Behandlung [152].
In einer aktuellen Metaanalyse aller randomisierten, kontrollierten SGLT-2-Hemmer-Studien (n = 84) von Patienten mit Typ-2-Diabetes fanden sich keine Unterschiede des Risikos für Fournier-Gangrän, Abszess, Zellulitis oder Erysipel unter SGLT-2-Inhibitoren vs. vergleichende Substanzen oder Placebo. Die Rate einer Fournier-Gangrän war mit 3,53 pro 100.000 Patientenjahre sehr niedrig [153].
Die European Medicines Agency (EMA) hat einen Reviewprozess gestartet, um der Frage nachzugehen, ob die Therapie mit Canagliflozin zu einer erhöhten Rate von Amputationen (meist Zehen) führt: Im Jahr 2016 hat das Pharmacovigilance Risk Assessment Committee (PRAC) der EMA das Review auf Dapagliflozin und Empagliflozin erweitert [154].
Die Canagliflozinstudien CANVAS-Programm [2] bestätigten die Vermutung eines höheren Risikos für Amputationen (vorwiegend im Zehen- und im Metatarsalbereich) unter Canagliflozin im Vergleich zu Placebo (Ereignisrate 6,3 vs. 3,4 Personen per 1000 Patientenjahre; HR: 1,97; 95 %-KI: 1,41–2,75; p < 0,001). Zu SGLT-2-Hemmern fanden sich in Bezug auf Amputationen in RCT auch höhere Raten in Pharmakovigilanzberichten [155]. Dagegen fanden sich in aktuellen Studien und Recherchen keine höheren Amputationsraten unter Dapagliflozin [156] und Empagliflozin [157]. Auch in der großen CREDENCE-Studie mit Canagliflozin fand sich kein Signal für eine erhöhte Amputationsrate [158]. Die Metaanalyse von Huang u Lee [159] fand auch keine Hinweise dafür, dass SGLT-2-Hemmer mit einem erhöhten Amputationsrisiko assoziiert waren.
Die FDA gab außerdem eine Warnung vor einem erhöhten Frakturrisiko infolge reduzierter Knochendichte unter Canagliflozin heraus (http://www.fda.gov/Drugs/DrugSafety/ucm461449.htm). In der Tat lag die Frakturereignisrate signifikant höher unter Canagliflozin im Vergleich zu Placebo: 15,4 vs. 11,9 pro 1000 Patientenjahre (p = 0,02, [160]). Die sorgfältige Ausarbeitung der CANVAS- und CANVAS-R-Daten zeigte jedoch eine signifikante Heterogenität des Frakturrisikos in beiden Studien: In der CANVAS-Studie (n = 4330: HR: 1,55; 95 %-KI: 1,21–1,97) war das Risiko deutlich erhöht, während sich dies in der CANVAS-R-Studie (n = 5812: HR: 0,86; 95 %-KI: 0,62–1,19) nicht belegen ließ [161]. In der kürzlich publizierten großen RCT (CREDENCE-Studie) mit Canagliflozin fand sich auch kein Signal für ein erhöhtes Frakturrisiko [162].
Eine aktuelle Frakturanalyse von Menschen mit Typ-2-Diabetes (n ≥ 12.000), die mit Empagliflozin behandelt wurden (gepoolte Daten aus placebokontrollierten Studien und einer Head-to-Head-Studie vs. Glimepirid), ergab keine signifikant erhöhte Rate von Frakturen [163]. Zahlreiche Metaanalysen zeigten auch keine signifikante Erhöhung der Frakturraten unter der Therapie mit SGLT-2-Hemmern [164–166].
Auch Real-World-Studien und Analysen aus Versorgungsdaten zeigten keine erhöhte Frakturrate unter einer SGLT-2-Hemmer-Therapie [167].
Beim Einsatz von SGLT-2-Inhibitoren wurden vereinzelt Ketoazidosen bei Menschen mit Typ-2-Diabetes beobachtet [168, 169]. Die SGLT-2-Inhibitoren-Hersteller in Deutschland haben Ärzte und Apotheker bereits 2015 über den Sachverhalt informiert.
Eine umfangreiche Analyse aller Berichte über Ketoazidosen mit einem möglichen Zusammenhang mit SGLT-2-Inhibitoren, die in der Zeit von Januar 2014 bis Oktober 2016 im US Food and Drug Administration Adverse Event Reporting System (FAERS) gelistet wurden, ist publiziert worden [170]. Dabei fand sich eine „proportional reporting ratio“ (PPR) von 7,9 (95 %-KI: 7,5–8,4). Die PRR ist das Verhältnis spontaner Berichte für ein bestimmtes Medikament (in diesem Fall SGLT-2-Inhibitoren), das mit einer spezifischen Nebenwirkung (Ketoazidose) verknüpft ist, dividiert durch das korrespondierende Verhältnis für alle oder einige andere Medikamente mit dieser Nebenwirkung. Die PPR beschreibt aber nicht ein relatives Risiko, d. h. das wirkliche Risiko für eine Ketoazidose. Die detaillierte Analyse von 2397 Berichten von Ketoazidosen im FAERS zeigte eine Dominanz bei Menschen mit Typ-1-Diabetes, bei Frauen, in einem großen Alters- und Körpergewichtsbereich und eine hohe Variabilität in der Dauer der SGLT-2-Inhibitor-Therapie. 37 Menschen (1,54 %) starben an einer Ketoazidose. In den großen randomisierten, kontrollierten Studien mit SGLT-2-Inhibitoren war das Risiko für eine Ketoazidose unter SGLT-2-Inhibitoren bei Typ-2-Diabetes zwar signifikant erhöht, lag aber unter 1 %. Die letztes Jahr publizierte Metaanalyse (39 RCT mit 60.580 Patienten) bestätigte erneut eine statistisch signifikant erhöhte Ketoazidoserate unter SGLT-2-Hemmern (0,18 %) im Vergleich zu Kontrollen (0,09 %) mit einer OR von 2,13 (95 %-KI: 1,38–3,27). Dabei spielten höheres Alter und längere Einnahme von SGLT-2-Hemmern eine Rolle [171].
Eine Normo- oder leichte Hyperglykämie schließt eine Ketoazidose unter SGLT-2-Inhibitoren nicht aus. Risikofaktoren für die Entwicklung einer (euglykämischen) Ketoazidose unter SGLT-2-Inhibitoren waren u. a. eine rasche und deutliche Reduktion der Insulindosis, Exsikkose und Alkoholkonsum; beinahe alle Patienten mit Ketoazidose befanden sich in einem katabolen Zustand (Operationen, Myokardinfarkt, schwere Infektionen, langes Fasten, übermäßige körperliche Belastung, Kokainkonsum).
Daher empfiehlt die DDG, im Umgang mit SGLT-2-Inhibitoren Folgendes zu beachten:
Absetzen von SGLT-2-Inhibitoren mindestens 3 Tage (entspricht ca. 5 Halbwertszeichen, entspricht 11–13 h) vor einer größeren elektiven Operation [172, 173], unmittelbares Pausieren der SGLT-2-Inhibitor-Therapie bei Notfällen und akuten Erkrankungen,
Vorsicht bei laufender Insulintherapie (Vermeiden einer signifikanten Reduktion oder des Absetzens einer Insulintherapie),
Vermeidung bei längeren Fastenperioden, bei ketogenen/extrem kohlenhydratarmen Kostformen und einem exzessiven Alkoholkonsum,
die Kombination von SGLT-2-Hemmern mit Metformin erhöht das Risiko für Ketoazidosen [174] und
bei entsprechenden Symptomen an die Möglichkeit einer euglykämischen Ketoazidose denken und eine entsprechende Diagnostik einleiten (Plasmaglukose und Ketone im Blut, ggf. auch venöse Blutgase).
Effekte auf kardiovaskuläre und renale Endpunkte
Dapagliflozin
In DECLARE TIMI 58 mit Dapagliflozin [3] wurden 6974 Patienten (40,6 %) mit bekannten kardiovaskulären Erkrankungen und 10.186 (59,4 %) mit multiplen Risikofaktoren für arteriosklerotische kardiovaskuläre Krankheiten eingeschlossen. Das Follow-up der Patienten betrug im Median 4,2 Jahre. Insgesamt stoppten 3962 Patienten vorzeitig die Studie (5,7 % pro Jahr): 1811 der 8574 Patienten (21,1 %) unter Dapagliflozin und 2151 von 8569 (25,1 %) in der Kontrollgruppe. Dapagliflozin resultierte in einer signifikant niedrigeren Hospitalisierungsrate wegen Herzinsuffizienz im Vergleich zu Placebo (HR: 0,73; 95 %-KI: 0,61–0,88). Es fand sich kein Unterschied zwischen der Dapagliflozin- und der Placebogruppe bei der Rate von 3P-MACE (8,8 vs. 9,4 %; HR: 0,93; 95 %-KI: 0,84–1,03; p = 0,17), der kardiovaskulären Mortalität (HR: 0,98, 95 %-KI: 0,82–1,17) und der Gesamtmortalität (HR: 0,93, 95 %-KI: 0,82–1,04). Beim renalen zusammengesetzten sekundären Endpunkt (≥ 40 % Verminderung der eGFR, neu entstandene terminale Niereninsuffizienz oder Tod renaler oder kardialer Genese) führte Dapagliflozin zu einer deutlichen Reduktion renaler Endpunkte (HR: 0,76; 95 %-KI: 0,67–0,87).
In umfangreichen Subanalysen der DECLARE TIMI 58-Population wurden die günstigen Effekte von Dapagliflozin auf die Entwicklung und Progression renaler [175] und kardiovaskulärer Endpunkte [4, 5] bestätigt.
In der DAPA-HF-Studie wurde bei einer mittleren Beobachtungszeit von 18,2 Monaten von 2373 Studienteilnehmern der primäre Kompositendpunkt, nämlich Verschlechterung einer Herzinsuffizienz (Hospitalisierung oder i.v. Therapie einer Herzinsuffizienz) oder kardiovaskulärer Tod, in der Dapagliflozingruppe bei 386 (16,3 %) und 502 (21,2 %) in der Placebogruppe erreicht: HR: 0,74, 95 %-KI: 0,65–0,85; p < 0,001. Die primären Endpunkte waren zwischen Menschen mit (42 % der Studienpopulation) und ohne Diabetes vergleichbar (HR: 0,75, 95 %-KI: 0,63–0,90 vs. HR: 0,73, 95 %-KI: 0,60–0,88). Unter Dapagliflozin kam es zur Reduktion zahlreicher sekundärer Endpunkte wie Gesamtzahl der Hospitalisierung wegen Herzinsuffizienz (erstmals und wiederholt), Senkung der Gesamtmortalität und Verbesserung der Lebensqualität [176].
In der kürzlich veröffentlichten multizentrischen RCT DAPA-CKD [177] wurden Patienten (n = 4304; 68 % der Patienten hatten einen Typ-2-Diabetes) mit einem Albumin-Kreatinin-Verhältnis von 200–5000 mg/g und einer eGFR von 25–75 ml/min 1:1 randomisiert auf Dapagliflozin (10 mg/Tag) oder Placebo. Der Median des Follow-ups betrug 2,4 Jahre. Der primäre Endpunkt war zusammengesetzt aus einer Abnahme der eGFR von mehr als 50 %, terminaler Niereninsuffizienz, renalem oder kardiovaskulärem Tod. Sekundäre Endpunkte waren der primäre Endpunkt außer kardiovaskulärem Tod, ein Kompositendpunkt aus kardiovaskulärem Tod oder Hospitalisierung wegen Herzinsuffizienz und Gesamtmortalität. Die relative Risikoreduktion des primären Endpunktes war mit Dapagliflozin konsistent zwischen Patienten mit Diabetes (HR: 0,64, 95 %-KI: 0,52–0,79) und Patienten ohne Diabetes (HR: 0,50, 0,35–0,72). Vergleichbare Ergebnisse zeigten sich bei dem nierenspezifischen sekundären Endpunkt (0,57 [0,45–0,73] vs. 0,51 [0,34–0,75]), kardiovaskulärem Tod oder Hospitalisierung wegen Herzinsuffizienz (0,70 [0,53–0,92] vs. 0,79 [0,40–1,55]) und Gesamtmortalität (0,74 [0,56–0,98] vs. 0,52 [0,29–0,93]).
Die 3 SGLT-2-Hemmer Empagliflozin (EMPA-REG OUTCOME), Canagliflozin (CANVAS-Programm und CREDENCE-Studie) und Dapagliflozin (DECLARE TIMI 58) mit insgesamt 38.723 Studienteilnehmern führten in der Metaanalyse von Neuen et al. [178] zu einer deutlichen Risikoreduktion für Dialyse, Nierentransplantation oder Mortalität wegen Niereninsuffizienz (RR: 0,67, 95 %-KI: 0,52–0,86, p = 0,0019). SGLT-2-Inhibitoren reduzierten auch das Risiko für eine terminale Niereninsuffizienz (RR: 0,65, 95 %-KI: 0,53–0,81, p < 0,0001) sowie ein akutes Nierenversagen (RR: 0,75, 95 %-KI: 0,66–0,85, p < 0,0001) über alle Studien hinweg. Es zeigte sich ein klarer Vorteil aller 3 SGLT-2-Hemmer über alle eGFR-Subgruppen hinweg und auch unabhängig vom Grad der Albuminurie zu Beginn der Studien. Eine neue Metaanalyse von 11 Studien mit 93.502 Patienten zeigte ähnlich positive Effekte der SGLT-2-Inhibitoren bei älteren Menschen mit Typ-2-Diabetes (> 65 Jahre) auf MACE (HR: 0,90; 95 %-KI: 0,83–0,98), Hospitalisierung wegen Herzinsuffizienz (HR: 0,62; 95 %-KI: 0,51–0,76) und den zusammengesetzten renalen Endpunkt (HR: 0,57; 95 %-KI: 0,43–0,77; [179]). In der Metaanalyse von Bae et al. [180] von 17 Studien mit 87.263 Patienten reduzierten SGLT-2-Hemmer signifikant renale Risiken wie Mikroalbuminurie (OR: 0,64; 95 %-KI: 0,41–0,93), Makroalbuminurie (OR: 0,48; 95 %-KI: 0,24–0,72), Verschlechterung der Nierenfunktion (OR: 0,65; 95 %-KI: 0,44–0,91) und terminale Niereninsuffizienz (OR: 0,65; 95 %-KI: 0,46–0,98) verglichen mit Placebo. In der umfangreichsten Metaanalyse von 736 Studien mit insgesamt 421.346 Patienten führten SGLT-Hemmer zu einer belastbaren signifikanten Senkung der Gesamt- und kardiovaskulären Mortalität, nichttödlicher Herzinfarkte und der Niereninsuffizienz, aber auch, wie zu erwarten, zu vermehrten Genitalinfektionen. SGLT-2-Inhibitoren hatten eine weniger belastbare Evidenz in Bezug auf eine Gewichtsreduktion. Eine schwache oder keine Evidenz fand sich für positive Effekte von SGLT-1-Hemmern für Amputationen, Retinopathie oder Erblindung, neuropathische Schmerzen und gesundheitsrelevante Lebensqualität. Der absolute Benefit von SGLT-2-Inhibitoren fand sich in einem breiten Spektrum bei Patienten mit niedrigem und hohem kardiovaskulärem und renalem Outcome [181].
Empagliflozin
Die Auswirkungen einer SGLT-2-Inhibitor-Therapie auf klinische Endpunkte wurden für Empagliflozin in einer großen, 2015 publizierten RCT untersucht (EMPA-REG OUTCOME-Studie [6]). Patienten mit einem Typ-2-Diabetes und bereits manifesten kardiovaskulären Erkrankungen zeigten in einem Beobachtungszeitraum von im Mittel 3,1 Jahren unter Empagliflozin im Vergleich zu Placebo weniger kardiovaskuläre Ereignisse (10,5 vs. 12,1 %; HR: 0,86; 95 %-KI: 0,74–0,99; p < 0,04 für Überlegenheit). Es gab keinen Unterschied in der Rate von Myokardinfarkten und Schlaganfällen, aber eine signifikant niedrigere Ereignisrate für kardiovaskuläre Mortalität (3,7 vs. 4,1 %; HR: 0,62; 95 %-KI: 0,49–0,77; p < 0,001), für Gesamtmortalität (5,7 vs. 8,3 %; HR: 0,68; 95 %-KI: 0,57–0,82; p < 0,001) und Hospitalisierung wegen Herzinsuffizienz (2,7 vs. 4,1 %; HR: 0,65; 95 %-KI: 0,50–0,85; p = 0,002). Das Risiko für kardiovaskuläre Ereignisse war größer, wenn die kardiovaskulären Risikofaktoren zu Beginn der Studie weniger gut kontrolliert waren. Der kardioprotektive Effekt von Empagliflozin war jedoch signifikant assoziiert, unabhängig vom Grad der Risikofaktorkontrolle [182]. Bei der Analyse von rekurrierenden Ereignissen (u. a. Outcome von koronaren Ereignissen, Hospitalisierung wegen Herzinsuffizienz, Hospitalisierung aus anderen Gründen) und kardiovaskulärer Mortalität zeigten sich signifikante Reduktionen unter Empagliflozin im Vergleich zu Placebo [183].
In zusätzlichen Analysen der EMPA-REG OUTCOME-Studie [184] konnte gezeigt werden, dass Empagliflozin die Entwicklung und Progression einer Nephropathie bei Patienten mit einer eGFR initial von ≥ 30 ml/min verlangsamt: Beginn oder Progression der Nephropathie unter Empagliflozin im Vergleich zur Standardtherapie: 12,7 vs. 18,8 %; HR: 0,61; 95 %-KI: 0,53–0,70; p < 0,001.
Der post-hoc-renale Endpunkt (Verdopplung des S‑Kreatinins, Nierenersatztherapie oder Tod durch Nierenerkrankung) war signifikant niedriger unter Empagliflozin im Vergleich zu Placebo (HR: 0,54; 95 %-KI: 0,40–0,75; p < 0,001). In einer Analyse der kurzzeitigen und langfristigen Effekte (164 Wochen) von Empagliflozin auf die Albuminausscheidung zeigte sich unabhängig von der Höhe der Ausgangsalbuminurie eine signifikante Senkung in der Mikroalbuminuriegruppe im Mittel um 22 % und in der Makroalbuminuriekohorte um 29 % [185]. Basierend auf 1738 Teilnehmern der EMPA-REG OUTCOME-Studie mit einer koronaren Bypassanamnese zu Beginn der Studie reduzierte Empagliflozin das Risiko für Gesamtmortalität um 43 %, für kardiovaskuläre Mortalität um 48 %, die Hospitalisierungsrate wegen Herzinsuffizienz um 50 % und für eine Nephropathie (beginnend oder verschlechternd) um 35 % [186].
In die EMPEROR-REDUCED-Studie [187] wurden 3730 Patienten (50 % mit Diabetes) mit einer Herzinsuffizienz der funktionellen Klassen II, III oder IV und einer Ejektionsfraktion ≤ 40 % eingeschlossen und neben der leitliniengerechten Therapie einer Herzinsuffizienz entweder mit Empagliflozin (10 mg/Tag) oder Placebo (1:1) behandelt. Der Median der Studie betrug 16 Monate. Unter Empagliflozin trat der primäre zusammengefasste Endpunkt (kardiovaskulärer Tod oder Hospitalisierung wegen Verschlechterung der Herzinsuffizienz) bei 19,4 % der Patienten vs. 24,7 % unter Placebo auf. Die „hazard ratio“ betrug 0,75; 95 %-KI: 0,65–0,86; p < 0,001. Die Wirkung von Empagliflozin auf den primären Endpunkt war unabhängig davon, ob Patienten einen oder keinen Diabetes hatten. Die Gesamtzahl von Krankenhausaufenthalten war niedriger in der Empagliflozin- im Vergleich zur Placebogruppe (HR: 0,70; 95 %-KI: 0,58–0,85; p < 0,001). Die jährliche Abnahme der eGFR war niedriger in der Empagliflozin- vs. der Placebogruppe (−0,55 vs. −2,28 ml/min/Jahr; p < 0,001). Die Rate schwerwiegender renaler Komplikationen war mit Empagliflozin ebenfalls geringer: HR: 0,50 (0,32–0,77).
Für den SGLT-2-Inhibitor Empagliflozin – wie auch für die anderen Gliflozine – sind klinisch sehr relevante Wirkungen auf die Gesamtmortalität sowie auf kardiovaskuläre und renale Endpunkte bei entsprechenden Risikopopulationen belegt und in Metaanalysen bestätigt [188–191].
Die zugrunde liegenden Mechanismen der kardialen und renalen Protektion von SGLT-2-Hemmern sind Gegenstand umfangreicher Studien [192–196].
Empagliflozin wurde in der Nutzenbewertung durch den Gemeinsamen Bundesausschuss (G-BA) 2016 ein Anhaltspunkt für einen beträchtlichen Zusatznutzen bei Patienten mit Typ-2-Diabetes mit manifester kardiovaskulärer Erkrankung in der Kombinationstherapie mit Metformin attestiert (https://www.g-ba.de/downloads/39-261-2694/b05ae64bf8a3345f762992f7be9785bb/2016-09-01_AM-RL-XII_Empagliflozin_D-214_BAnz.pdf). Dementsprechend wurde in die Neuauflage des Disease-Management-Programms für Typ-2-Diabetes im Jahr 2017 dieser Zusatznutzen aufgenommen [197].
Ertugliflozin
Die kardiovaskuläre Sicherheit von Ertugliflozin wurde in der VERTIS CV-Studie untersucht. Das Studiendesign und auch die Charakteristika der Studienpopulation zu Beginn der Studie waren ähnlich wie in der EMPA-REG OUTCOME-Studie, v. a. in Bezug auf bereits bestehende kardiovaskuläre Vorerkrankungen [7]. In jede der 3 Studiengruppen (Standardtherapie/Placebo; 5 mg Ertugliflozin, 15 mg Ertugliflozin tgl.) waren ca. 2750 Patienten eingeschlossen und wurden über ca. 3,5 Jahre beobachtet. Der MACE war in den Ertugliflozingruppen etwas niedriger im Vergleich zur Placebogruppe (HR: 0,97; 95,6 %-KI: 0,85–1,11; p < 0,001 für Nichtunterlegenheit). Auch die Daten zu kardiovaskulärem Tod oder Hospitalisierung wegen Herzinsuffizienz (Ertugliflozin vs. Placebo: 8,1 % vs. 9,1 % [HR: 0,88; 95,8 %-KI: 0,75–1,03; p = 0,11 für Überlegenheit]), die Analysen zu kardiovaskulärem Tod (0,92 [95,8 %-KI: 0,77–1,11]), Tod aus renaler Ursache, Nierenersatztherapie oder Verdopplung des Serumkreatinins (0,81 [95,8 %-KI: 0,63–1,04]) waren nicht signifikant. Amputationen wurden unter einer Ertugliflozin-5 mg-Therapie bei 2 % und bei 15-mg-Dosierung bei 1,6 % berichtet. Die Amputationsrate bei Placebo betrug ebenfalls 1,6 % [198]. In einer Post-hoc-Analyse der Studien VERTIS MET [199] und VERTIS SU [200] reduzierte Ertugliflozin die eGFR in den ersten 6 Wochen, kehrte aber nach 104 Wochen wieder zum Ausgangswert zurück und führte daher zu einer Konservierung der Nierenfunktion. Die eGFR war unter den beiden Ertugliflozindosierungen (5 und 15 mg) etwas höher als bei Patienten, die kein Ertugliflozin erhielten. Ertugliflozin reduzierte bei Menschen, die zu Beginn der Studie eine Albuminurie hatten (21 %), die Albuminexkretionsrate signifikant um 30 % bzw. 38 % [201]. In einer weiteren Analyse der VERTIS CV-Studie konnte gezeigt werden, dass bei einem Follow-up von im Mittel 3,5 Jahren der explorative kompositrenale Endpunkt (Zeit bis zur Verdoppelung des Serumkreatinins, Dialyse, Nierentransplantation oder renaler Tod) unter Ertugliflozin im Vergleich zu Placebo signifikant gesenkt werden (HR: 0,66; 95 %-KI: 0,50–0,88). Die Nierenfunktion und die Albuminexkretionsraten konnten stabilisiert werden [202].
Im VERTIS-Programm wurde eine Reihe von Studien mit Ertugliflozin publiziert, die Kombinationstherapien mit Metformin, Metformin plus Sitagliptin, Insulin oder Sulfonylharnstoffen analysiert hatten, die kürzlich in einem Review zusammengefasst wurden [203].
Ertugliflozin ist in Deutschland nur in Fixkombination mit Sitagliptin zugelassen (VERTIS-FACTORAL-Studie). Nach dem Beschluss des G‑BA vom 01.11.2018 besteht kein Zusatznutzen dieser Fixkombination. Auch der Kombination von Linagliptin und Empagliflozin bescheinigte der G‑BA keinen Zusatznutzen (BAnz AT 24.12.2019 B3).
Canagliflozin
Aktuelle Outcome-RCT-Daten zu Canagliflozin ([2]; CANVAS-Programm) zeigten eine signifikante Senkung des Kompositendpunkts (kardiovaskulärer Tod, nichttödlicher Myokardinfarkt und Schlaganfall) durch Canagliflozin im Vergleich zu Placebo um 14 % (HR: 0,86; 95 %-KI: 0,75–0,97), Rückgang der Hospitalisierungsrate aufgrund einer Herzinsuffizienz um 33 % (HR: 0,67; 95 %-KI: 0,52–0,87) und renaler Outcomedaten mit einer Reduktion der Progression einer Albuminurie um 27 % (HR: 0,73; 95 %-KI: 0,67–0,79) und des Kompositendpunkts (40 % Reduktion der eGFR, Nierenersatztherapie, renaler Tod) um 40 % (HR: 0,60; 95 %-KI: 0,47–0,77, [158]). Eine weitere große RCT (CREDENCE-Studie) wurde mit Canagliflozin in Bezug auf einen primären kombinierten renalen Endpunkt durchgeführt [162]. Die Patienten hatten bereits bei Randomisierung eine Niereninsuffizienz, eine signifikante Proteinurie und mussten bereits mit einem ACE-Hemmer oder AT-Blocker behandelt sein. Es zeigte sich, dass Canagliflozin (100 mg pro Tag) das relative Risiko für den Kompositendpunkt (Dialyse, Transplantation oder eine dauerhafte eGFR < 15 ml/min), eine Verdoppelung des Serumkreatinins, Tod durch renale oder kardiovaskuläre Gründe signifikant reduzierte (HR: 0,70, 95 %-KI: 0,59–0,82; p = 0,00001).
In der kürzlich publizierten Post-hoc-Analyse des CANVAS-Programms und der CREDENCE-Studie zeigte sich, dass Canagliflozin nicht mit einer Reduktion von Myokardinfarkten in den Studienpopulationen assoziiert war [204].
Canagliflozin ist trotz positiver patientenrelevanter Endpunkte derzeit auf dem deutschen Markt nicht erhältlich.
Sotagliflozin
Sotagliflozin ist ein dualer SGLT-1- und SGLT-2-Inhibitor. Für die Therapie des Typ-2-Diabetes wurden 2 große Studien bisher publiziert. In der SOLOIST-WHF-Studie wurden bei Menschen mit Typ-2-Diabetes und dekompensierter Herzinsuffizienz Sotagliflozin (n = 608) oder Placebo (n = 614) über einen Median von 9 Monaten untersucht. Die mittlere Ejektionsfraktion (EF) betrug 35 %, und die Basistherapie der Herzinsuffizienz war in beiden Gruppen gleich. Unter Sotagliflozin kam es im Vergleich zu Placebo zu einer signifikanten Reduktion des zusammengesetzten primären Endpunktes (kardiovaskulärer Tod und Hospitalisierung oder akute stationäre Behandlung wegen Herzinsuffizienz: „hazard ratio“ [HR]: 0,67, 95 %-KI: 0,52–0,85, p < 0,001). Da die Studie wegen COVID-19 und mangelnder finanzieller Unterstützung abgebrochen werden musste, wurden die berechneten Ereignisraten nicht erreicht, sodass die Daten dieser Studie insgesamt nicht ausreichend belastbar sind [205].
In der randomisierten, kontrollierten SCORED-Studie [206] wurden 10.584 Patienten mit Typ-2-Diabetes und einer Niereninsuffizienz (eGFR 25–60 ml/min) und kardiovaskulären Risikofaktoren 1:1 randomisiert (Sotagliflozin:Placebo). Das mediane Follow-up betrug 16 Monate. Der primäre Endpunkt wurde im Verlauf der Studie geändert zu einem zusammengesetzten Endpunkt (kardiovaskuläre Gesamtmortalität, Hospitalisierung wegen oder akute Betreuung wegen Herzinsuffizienz). Der primäre Endpunkt war unter Sotagliflozin deutlich geringer im Vergleich zu Placebo: „hazard ratio“ 0,74; 95 %-KI: 0,63–0,88; p < 0,001. Auch diese Studie musste aus finanziellen Gründen vorzeitig beendet werden.
Sotagliflozin ist derzeit nur für die Kombinationstherapie mit Insulin bei Menschen mit Typ-1-Diabetes zugelassen.
GLP-1-Rezeptor-Agonisten (RA)
GLP-1-RA sind Antidiabetika zur subkutanen oder oralen Therapie des Typ-2-Diabetes. Sie können die Plasmaglukosespiegel im Mittel stärker senken als die klassischen oralen Antidiabetika und weisen zudem blutdrucksenkende (gering), gewichtsreduzierende [207] und spezifische kardio- und renoprotektive (s. unten) Effekte auf. Bei Nichterreichen des individuellen Therapieziels sind GLP-1-RA sinnvolle Kombinationspartner zu Metformin, anderen OAD (außer DPP-4-Hemmern) und/oder Basalinsulinen. GLP-1-RA haben selbst zudem ein geringes Hypoglykämierisiko.
Humane GLP-1-RA
In Deutschland zugelassen: Dulaglutid, Liraglutid, Semaglutid
In Deutschland nicht erhältlich: Albiglutid
Exendinbasierte GLP-1-RA
In Deutschland zugelassen: Exenatid, Lixisenatid (nur in der Fixkombination mit Insulin glargin)
In Deutschland nicht erhältlich: Efpeglenatid
Humane GLP-1-RA
Dulaglutid
Im AWARD-Studienprogramm zeigten sich für Dulaglutid eine effektive Blutglukose- und Gewichtssenkung sowie eine niedrige Hypoglykämieinzidenz, wenn Dulaglutid als Mono- und Kombinationstherapie mit prandialem und basalem Insulin eingesetzt wurde. Eingeschlossen waren auch Patienten mit verschiedenen Graden einer chronischen Niereninsuffizienz [208]. Die multizentrische (371 Studienzentren in 24 Ländern), randomisierte, doppelblinde, placebokontrollierte Studie über die kardiorenalen Effekte einer Dulaglutidtherapie (REWIND-Studie; 1,5 mg s.c. wöchentlich) wurde kürzlich publiziert [8, 209]. Eingeschlossen wurden 9901 Patienten mit Typ-2-Diabetes (mittleres Alter 66 Jahre, HbA1c-Wert im Mittel 7,2 %). Diese Untersuchung unterscheidet sich von den bisher veröffentlichten Studien zum kardiovaskulären und renalen Outcome unter GLP-1-RA durch folgende wichtige Punkte: längere Beobachtungsdauer (im Median 5,4 Jahre); 69 % der Studienteilnehmer hatten zwar kardiovaskuläre Risikofaktoren, aber keine klinisch manifesten kardiovaskulären Vorerkrankungen; und das Verhältnis zwischen Frauen und Männern war ziemlich ausgewogen (46 % Frauen). Im Vergleich zu Placebo konnte Dulaglutid den medianen HbA1c-Ausgangswert von 7,2 % über die gesamte Studie senken (HbA1c: −0,46 % für Dulaglutid, +0,16 % für Placebo; Körpergewicht: −2,95 kg Dulaglutid, −1,49 kg Placebo). Darüber hinaus zeigte Dulaglutid eine Reduktion des sekundären kombinierten mikrovaskulären Endpunktes (HR: 0,87; 95 %-KI: 0,79–0,95), wobei diese Reduktion vorwiegend das renale Outcome betraf (HR: 0,85; 95 %-KI: 0,77–0,93; p = 0,0004). Der primäre Endpunkt 3P-MACE wurde unter Dulaglutid signifikant gesenkt (HR: 0,88; 95 %-KI: 0,79–0,99; p = 0,026), ebenso wie das Risiko eines nichttödlichen Schlaganfalls (HR: 0,76; 95 %-KI: 0,61–0,95; p = 0,017). Es fanden sich keine Risikoreduktionen für folgende Endpunkte: nichttödlicher und tödlicher Myokardinfarkt, tödlicher Schlaganfall, kardiovaskulärer Tod, Gesamtmortalität sowie Hospitalisierung wegen Herzinsuffizienz. Im Vergleich zu Placebo gab es unter Dulaglutid keine Unterschiede in Bezug auf relevante Nebenwirkungen: Krebserkrankungen (Pankreas, medulläres Schilddrüsenkarzinom, andere Schilddrüsenkarzinome), akute Pankreatitis oder Pankreasenzymerhöhungen, Lebererkrankungen, Herzrhythmusstörungen und Hypoglykämierate.
In einer explorativen Analyse der REWIND-Daten [209], renale Outcomedaten betreffend, fand sich unter Dulaglutid eine signifikante Risikoreduktion für den zusammengefassten renalen Endpunkt (neu aufgetretene Makroalbuminurie, eGFR-Senkung von ≥ 30 % oder chronische Nierenersatztherapie; HR: 0,85; 95 %-KI: 0,77–0,93; p = 0,0004) mit dem eindeutigsten Effekt in Bezug auf die Makroalbuminuriekomponente (HR: 0,77; 95 %-KI: 0,68–0,87; p < 0,0001).
In einer Post-hoc-Analyse der REWIND-Studie betrug die Inzidenz von MACE (kardiovaskulärer Tod, nichttödlicher Herzinfarkt oder nichttödlicher Schlaganfall) oder nichtkardiovaskulärem Tod in der Dulaglutidgruppe 35,8 und in der Placebogruppe 40,3 pro 1000 Personenjahre (HR: 0,90, 95 %-KI: 0,82–0,98, p = 0,020). Die Inzidenzdaten zu einem komplexeren MACE (MACE plus Herzinsuffizienz, instabile Angina oder Revaskularisierung) waren eindrücklicher: Dulaglutid vs. Placebo 67,1 vs. 74,7 pro 1000 Personenjahre: HR: 0,93 (95 %-KI: 0,87–0,99) p = 0,023 [210].
Im G‑BA-Beschluss vom 16.07.2020 wurde Dulaglutid ein Anhaltspunkt für einen geringen Zusatznutzen zuerkannt bei Menschen mit Typ-2-Diabetes, bei denen Diät und Bewegung und die Behandlung mit Insulin (mit oder ohne einem anderen Antidiabetikum) die Blutglukosekonzentration nicht ausreichend kontrollieren, sowohl bei Patienten ohne Niereninsuffizienz als auch bei Patienten mit moderater oder schwerer Niereninsuffizienz (CKD-Stadium 3 und 4).
Liraglutid
In einer randomisierten Studie bei adipösen Patienten führte bei allen intensivbehandelten Patienten zu einem größeren Gewichtsverlust als Placebo: Liraglutid (3 mg/Tag) im Vergleich zu körperlicher Aktivität allein: 8 Wochen nach einer Niedrigkaloriendiät zu einem Gewichtsverlust von 13,1 kg. Zum Ende der Studie (nach 1 Jahr) betrug der Gewichtsverlust bei vermehrter körperlicher Bewegung −4,1 kg (95 %-KI: −7,8–−0,4; p = 0,03); in der Liraglutidgruppe −6,8 kg (95 %-KI: −10,4–−3,1; p < 0,001); in der Kombination körperliche Aktivität plus Liraglutid −9,5 kg (95 %-KI: −13,1–−5,9; p < 0,001). Die Kombinationstherapie führte auch zu einer Reduktion der Körperfettmasse um 3,9 %, was ca. 2-mal höher war als in der körperlicher Aktivitätsgruppe (−1,7 %; 95 %-KI: −3,2–−0,2; p = 0,02) und in der Liraglutidgruppe allein (−1,9 %; 95 %-KI: −3,3–−0,5; p = 0,009, [211]). Für den GLP-1-Rezeptor-Agonisten (RA) Liraglutid zeigte die RCT (LEADER-Studie) positive Effekte auf klinisch relevante Endpunkte [212]. Das Follow-up der 9340 Patienten betrug im Median 3,8 Jahre. Der zusammengefasste primäre Endpunkt (Erstereignis für kardiovaskulären Tod, nichttödlichen Myokardinfarkt, nichttödlichen Schlaganfall) war unter Liraglutid im Vergleich zu Placebo signifikant niedriger (13 vs. 14,9 %; HR: 0,87; 95 %-KI: 0,78–0,97; p < 0,001 für Nichtunterlegenheit und p = 0,01 für Überlegenheit). Weniger Patienten starben aus kardiovaskulären Gründen (4,7 vs. 6,0 %; HR: 0,78; 95 %-KI: 0,66–0,93; p = 0,007). Die Gesamtmortalität war unter Liraglutid ebenfalls geringer (8,2 vs. 9,6 %; HR: 0,85; 95 %-KI: 0,74–0,97; p = 0,02). Damit konnte erstmals auch für einen GLP-1-RA in einer RCT ein positiver Effekt auf patientenrelevante Endpunkte nachgewiesen werden.
In einer Subanalyse der LEADER-Studienpopulation zeigte sich, dass 72 % der Patienten eine Gefäßerkrankung zu Beginn der Studie hatten. 23 % dieser Subpopulation hatten eine polyvaskuläre und 77 % eine monovaskuläre Erkrankung. Liraglutid führte im 54-monatigen Follow-up zu einer Reduktion von MACE: bei polyvaskulärer Krankheit (HR: 0,82; 95 %-KI: 0,66–1,02) und bei monovaskulärer Erkrankung (HR: 0,82; 95 %-KI: 0,71–0,95) im Vergleich zu Placebo. Bei Patienten ohne Gefäßkomplikationen fanden sich keine positiven Effekte von Liraglutid [213]. In die gleiche Richtung deutet die Analyse von Marso et al. [214], die bei Patienten mit hohem vaskulärem Risiko eine Reduktion von Myokardinfarkten unter Liraglutid nachweisen konnten. In der von Duan et al. 2019 publizierten Metaanalyse [215] fanden sich bei Patienten in der Liraglutidgruppe im Vergleich zu den Kontrollgruppen niedrigere Risiken für: MACE (RR: 0,89, 95 %-KI: 0,82–0,96, p = 0,002), akuten Myokardinfarkt (RR = 0,85, 95 %-KI: 0,74–0,99, p = 0,036), Gesamtmortalität (RR: 0,84, 95 %-KI: 0,74–0,96, p = 0,009) und kardiovaskulären Tod (RR: 0,77, 95 %-KI: 0,65–0,91, p = 0,002). Die Schlaganfallinzidenz konnte in der Liraglutidgruppe jedoch nicht reduziert werden (RR: 0,86, 95 %-KI: 0,70–1,04, p = 0,124).
In der Analyse sekundärer renaler Endpunkte in der LEADER-Studie war Liraglutid im Vergleich zu Placebo mit einer niedrigeren Rate der Entwicklung und Progression des renalen Kompositendpunkts (HR: 0,78; 95 %-KI: 0,67–0,92; p = 0,003) und der Persistenz einer Makroalbuminurie (HR: 0,74; 95 %-KI: 0,60–0,91; p = 0,004) assoziiert [216].
Der G‑BA erkannte in seiner Entscheidung vom 17.01.2019 (BAnz AT 22.03.2019 B5) Liraglutid einen Zusatznutzen zu und nahm es in die strukturierten Behandlungsprogramme für Typ-2-Diabetes auf.
Die Metaanalyse von Kristensen et al. [217] zeigte eine signifikante Reduktion von MACE von 12 % (HR: 0,88; 95 %-KI: 0,82–0,94; p < 0,0001) unter GLP-1-RA. Die „hazard ratios“ waren für Tod durch kardiovaskuläre Ereignisse 0,88 (95 %-KI: 0,81–0,96; p = 0,003), für tödlichen und nichttödlichen Schlaganfall 0,84 (95 %-KI: 0,76–0,93; p < 0,0001) und 0,91 (95 %-KI: 0,84–1,00; p = 0,043) für nichttödlichen und tödlichen Myokardinfarkt. GLP-1-RA führten zu einer Senkung der Gesamtmortalität von 12 % (HR: 0,88; 95 %-KI: 0,83–0,95; p = 0,001) und zur Reduktion der Hospitalisierung wegen Herzinsuffizienz von 9 % (HR: 0,91; 95 %-KI: 0,83–0,99; p = 0,028). Der zusammengesetzte renale Endpunkt (Entwicklung einer neuen Makroalbuminurie, Reduktion der eGFR, Progression zur terminalen Niereninsuffizienz) verringerte sich um 17 % (HR: 0,83; 95 %-KI: 0,78–0,89; p < 0,0001), hauptsächlich durch die Reduktion der Albuminurie. Es wurde unter GLP-1-RA nicht über ein erhöhtes Risiko für Hypoglykämien, Pankreatitis oder Pankreaskarzinome berichtet.
Zu einem vergleichbaren Ergebnis kam auch die sehr ausführliche und kritische Metaanalyse von Liu et al. [218]. Die Gesamtmortalität war etwas geringer unter GLP-1-RA im Vergleich zu Kontrolltherapien: OR: 0,89 (95 %-KI: 0,80–0,98).
Die Assoziation von GLP-2-RA mit renalen Ereignissen unter Real-World-Bedingungen wurde in einer großen skandinavischen Studie analysiert [9]. 38.731 Nutzer von GLP-1-RA (Liraglutid 92,5 %, Exenatid 6,2 %, Lixisenatid 0,7 %, Dulaglutid 0,6 %) wurden 1:1 in einer „propensity matched“ Kontrollgruppe unter DPP-4-Hemmern untersucht. Der primäre Kompositendpunkt (Nierenersatztherapie, renal bedingter Tod und Hospitalisierung wegen renaler Komplikationen) war unter GLP-1-RA deutlich niedriger als unter DPP-4-Inhibitor-Therapie: HR: 0,76 (95 %-KI: 0,68–0,85). Insbesondere die Nierenersatztherapie (HR: 0,73, 95 %-KI: 0,62–0,87) und die Hospitalisierungsrate (HR: 0,73, 95 %-KI: 0,65–0,83) waren mit GLP-1-RA signifikant niedriger [9].
Semaglutid
Semaglutid s.c.
Semaglutid 1‑mal wöchentlich s.c. zeigte im Vergleich zu anderen GLP-1-RA eine stärkere HbA1c-Wert-Senkung (−0,4 %) und einen größeren Gewichtsverlust (−2,5 kg, [219]).
In der STEP-1-Studie mit Semaglutid (1-mal wöchentlich s.c.) wurde in dem Beobachtungszeitraum von 68 Wochen eine mittlere Gewichtsabnahme von −14,9 % im Vergleich zu Placebo von nur −2,4 % beobachtet. Die Differenz der Gewichtabnahme von −12,4 % war hochsignifikant. Mehr Patienten in der Semaglutidgruppe als in der Placebogruppe erzielten Gewichtsabnahmen von ≥ 5 % (86,4 % vs. 31,5 %), ≥ 10 % (69,1 % vs. 12,0 %) und ≥ 15 % (50,5 % vs. 4,9 %), wobei die Werte alle mit einem p = 0,001 hochsignifikant waren [220]. In den Studien STEP 3 und STEP 4 zeigten sich ähnlich günstige Effekte von Semaglutid auf den Gewichtsverlauf [221, 222].
In der SUSTAIN 6-Studie wurde der kardiovaskuläre Nutzen durch signifikante Reduzierung des primären Endpunkts 3P-MACE gegenüber der Kontrollgruppe belegt. Bei Patienten mit hohem kardiovaskulärem Risiko fand sich in der Semaglutidgruppe im Vergleich zu Placebo für den primären Endpunkt (kardiovaskulärer Tod, nichttödlicher Myokardinfarkt oder nichttödlicher Schlaganfall) eine signifikante Risikoreduktion (HR: 0,74; 95 %-KI: 0,58–0,95, [10]). In der kürzlich erschienen Post-hoc-Analyse der SUSTAIN 6-Studie fand sich für Semaglutid 1‑mal wöchentlich s.c. vs. Placebo eine Risikoreduktion von MACE in allen Studienteilnehmern unabhängig von Geschlecht, Alter oder dem zu Studienbeginn vorhandenen kardiovaskulären Risikoprofil [223].
Semaglutid oral
In der PIONEER 6-Studie mit oralem Semaglutid 1‑mal tägl. (n = 3183 Patienten, 84,7 % > 50 Jahre mit kardiovaskulären oder chronischen renalen Komplikationen; Beobachtungszeit im Mittel 15,9 Monate) fanden sich folgende Ergebnisse: MACE wurden bei 3,8 % in der oralen Semaglutid- und 4,8 % in der Placebogruppe gefunden (HR: 0,79; 95 %-KI: 0,57–1,11; p < 0,001 für Nichtunterlegenheit); kardiovaskulärer Tod (HR: 0,49; 95 %-KI: 0,27–0,92); nichttödlicher Herzinfarkt (HR: 1,18; 95 %-KI: 0,73–1,90); nichttödlicher Schlaganfall (HR: 0,74; 95 %-KI: 0,35–1,57); Gesamtmortalität (HR: 0,51; 95 %-KI: 0,31–0,84, [11]). In der 2020 publizierten Metaanalyse zeigte sich, dass oral appliziertes Semaglutid gegenüber Placebo zu einer Risikoreduktion der Gesamt- (OR 0,58, 95 %-KI: 0,37–0,92) und der kardiovaskulären Mortalität (OR 0,55, 95 %-KI: 0,31–0,98) führte. Es zeigte aber einen neutralen Effekt im Hinblick auf Myokardinfarkt, Schlaganfall und schwere Hypoglykämien [224].
In einer kombinierten Post-hoc-Analyse der beiden kardiovaskulären Outcomestudien SUSTAIN 6 und PIONEER 6 wurde der Effekt von Semaglutid bei Patienten mit einem Kontinuum des anfänglichen kardiovaskulären Risikos analysiert. Dabei zeigte Semaglutid im Vergleich zu Vergleichstherapien eine signifikante absolute und relative Risikoreduktion von MACE (kardiovaskulärer Tod, nichttödlicher Herzinfarkt, nichttödlicher Schlaganfall) über das gesamte Spektrum des kardiovaskulären Risikos. Dies fand sich auch bei den einzelnen Komponenten von MACE [225].
In der kürzlich erschienenen erneuten Analyse der Studien SUSTAIN 6 und PIONEER 6 [226] stellten die Autoren die Analysen jedoch in einem breiteren Kontext zu den Ergebnissen der anderen Studien SUSTAIN 1–5 und PIONEER 1–5, 7–8 dar. Die „hazard ratio“ für MACE betrug 0,85 mit einem großen Konfidenzintervall (95 %-KI: 0,55–1,33) wegen der geringen Eventraten in den meisten Studien.
Die Behandlung mit GLP-1-RA oder SGLT-2-Hemmern war im Vergleich zu DPP-4-Inhibitoren oder anderen Antidiabetika oder keiner Therapie in der Metaanalyse von Zheng et al. mit einer signifikant niedrigeren Gesamtmortalität verbunden (HR: 0,88; 95 %-KI: 0,81–0,94 bzw. HR: 0,80; 95 %-KI: 0,71–0,89). Ähnliche Daten fand man auch für die kardiovaskuläre Mortalität sowie für den Myokardinfarkt und die Herzinsuffizienz im Vergleich zu den Kontrollgruppen [227].
In der 2017 erschienenen Metaanalyse der GLP-1-RA Exenatid, Liraglutid, Lixisenatid, Albiglutid, Dulaglutid und Semaglutid ergab sich eine signifikante Reduktion der Inzidenz einer Nephropathie im Vergleich zu anderen Antidiabetika (OR: 0,74; 95 %-KI: 0,60–0,92; p = 0,005, [228]). Die Post-hoc-Analyse von Mann et al. [229] der Studien SUSTAIN 1–7 zeigte, dass Semaglutid initial zu einer Verminderung der eGFR bei normaler und leicht eingeschränkter Nierenfunktion (in der SUSTAIN 6-Studie mit 1,0 mg Semaglutid) führte. Ab der Woche 30 fand sich in den Studien SUSTAIN 1–5 und in SUSTAIN 7 und in Woche 104 für SUSTAIN 6 kein Unterschied der eGFR zwischen den Semaglutid- vs. den Placebogruppen. In den Studien SUSTAIN 1–6 sank die Albuminurie bei Patienten mit Mikro- und Makroalbuminurie. Bei Patienten mit Normoalbuminurie fand sich kein Unterschied der Albuminurie vom Beginn der Studie bis zu deren Ende.
Semaglutid und G-BA
In einer ausführlich begründeten Stellungnahme der Deutschen Diabetes Gesellschaft (DDG), der Deutschen Gesellschaft für Kardiologie (DGK), der Deutschen Gesellschaft für Atheroskleroseforschung (DGAF), der Deutschen Ophthalmologischen Gesellschaft (DOG), der Retinologischen Gesellschaft (RG), des Berufsverbands der Augenärzte (BVA), der Forschergruppe Diabetes e. V. am Helmholtz-Zentrum München und des Bundesverbands der Niedergelassenen Diabetologen (BVND) zur Dossierbewertung (A20–93, Version 1.0, Stand 28.01.2021) des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) zur Nutzenbewertung von Semaglutid in Form einer subkutanen Applikation sowie in einer oralen Darreichungsform für die Behandlung von Patienten mit Diabetes mellitus Typ 2 kamen die Experten der Fachgesellschaften zu dem Schluss, dass die negative Bewertung von Semaglutid (oral und s.c.) des IQWiG unberechtigt ist [www.deutsche-diabetes-gesellschaft.de/politik/stellungnahmen/]. Dennoch wurde mit dem Beschluss des Gemeinsamen Bundesausschusses vom 15.04.2021 Semaglutid kein Zusatznutzen zuerkannt (BAnz AT 02.06.2021 B5).
Albiglutid
Sicherheits- und kardiorenale Outcomedaten wurden für Albiglutid publiziert [230, 231]. Die kardiovaskulären Endpunktdaten zu Albiglutid (HARMONY-Outcomes-Trial [12]) wurden im Jahr 2018 analysiert und publiziert. Zu diesem Zeitpunkt war Albiglutid weltweit bereits aus dem Handel genommen worden (Juli 2017). In die HARMONY-Studie wurden 9463 Patienten eingeschlossen und randomisiert (Albiglutid 30–50 mg, n = 4731; Placebo n = 4732). Der Beobachtungszeitraum betrug im Median lediglich 1,6 Jahre. Es fanden sich keine Hinweise für einen Unterschied in den beiden Studiengruppen bezüglich wichtiger Nebenwirkungen. Im 3P-MACE zeigte sich bereits nach dieser kurzen Studiendauer eine signifikante Risikoreduktion mit Albiglutid (HR: 0,78; 95 %-KI: 0,68–0,90; Nichtunterlegenheit p = 0,0001, Überlegenheit p = 0,0006).
In einer kürzlich erschienenen Publikation berichteten die Autoren, dass Albiglutid bei Patienten mit Typ-2-Diabetes unter einer Basis-Bolus-Insulintherapie in 54 % der Studienteilnehmer prandiales Insulin vollständig ersetzen konnte mit gleichzeitiger Verbesserung der Stoffwechseleinstellung, Reduktion von Hypoglykämien und des Körpergewichts [232].
Exendinbasierte GLP-1-RA
Exenatid
In der EXSCEL-Studie mit 14.752 Patienten (73,1 % mit kardiovaskulärer Erkrankung) wurde im Median 3,2 Jahre mit 2,0 mg Exenatid 1‑mal wöchentlich therapiert. Patienten mit oder ohne kardiovaskuläre Erkrankung zeigten keinen signifikanten Unterschied in der Inzidenz von MACE im Vergleich zu denen, die Exenatid oder Placebo erhielten. Kritisch für die Auswertung der Effekte in der EXSCEL-Studie ist die sehr hohe Abbruchrate von über 40 %. Im Vergleich zur Kontrollgruppe ergaben sich ferner keine Unterschiede bei der kardiovaskulären Mortalität, beim nichttödlichen oder tödlichen Herzinfarkt oder Schlaganfall, bei der Hospitalisierung wegen Herzinsuffizienz sowie der Inzidenz von akuter Pankreatitis, Pankreaskarzinom, medullärem Schilddrüsenkarzinom oder anderen schwerwiegenden Nebenwirkungen [13].
In der EXSCEL-Studie konnten die Vorteile von Exenatid, nämlich Risikoreduktion der Gesamtmortalität (−14 %) und der Ersthospitalisierung wegen einer Herzinsuffizienz (−11 %), nur bei den Studienteilnehmern gesehen werden, die zu Beginn der Studie keine Herzinsuffizienz hatten [233]. Die Risikoreduktion für die Gesamtmortalität ließ sich in einer kürzlich erschienenen Metaanalyse bestätigen [234].
Die Kombination von Exenatid (1-mal wöchentlich) plus Dapagliflozin führte im Vergleich zu Exenatid plus Placebo zu einer signifikanten Senkung des HbA1c-Werts (−1,7 % vs. −1,29 %); bei Dapagliflozin plus Placebo sank der HbA1c-Wert im gleichen Zeitraum von 104 Wochen um −1,06 %. Es zeigten sich auch klinisch relevante positive Änderungen für Nüchternglukose, 2‑h-postprandiale Glukose, Körpergewicht und systolischen Blutdruck. Schwere Hypoglykämien wurde in keiner der Therapiegruppen beobachtet [235].
In der Metaanalyse von Bethel et al. [236] wurden die 4 großen RCT ELIXA (Lixisenatid), LEADER (Liraglutid), EXSCEL (Exenatid 1‑mal wöchentlich) und SUSTAIN 6 (Semaglutid) ausgewertet. Verglichen mit Placebo zeigten die GLP-1-RA eine signifikante Risikoreduktion (HR: 0,90; 95 %-KI: 0,82–0,99; p = 0,033) beim primären Endpunkt (kardiovaskuläre Mortalität, nichttödlicher Myokardinfarkt, nichttödlicher Schlaganfall), eine relative Risikoreduktion (RRR) von 13 % für die kardiovaskuläre Mortalität (HR: 0,87; 95 %-KI: 0,79–0,96; p = 0,007) und für die Gesamtmortalität von 12 % (HR: 0,88; 95 %-KI: 0,81–0,95; p = 0,002). Die statistische Heterogenität zwischen den Studien war jedoch groß. Es fanden sich keine signifikanten Reduktionen durch GLP-1-RA für nichttödlichen oder tödlichen Myokardinfarkt, für Schlaganfall, Hospitalisierung wegen instabiler Angina oder Herzinsuffizienz.
Exenatid 1‑mal wöchentlich führte im Vergleich mit einer Vergleichsgruppe zu einer signifikanten Senkung der Albuminausscheidung um 26 rel.% (95 %-KI: −39,5–−10). Im Vergleich zu oralen Antidiabetika betrug die Senkung der Albuminurie −29,6 % (95 %-KI: −47,6–−5,3), bei Insulintherapie betrug der Wert −23,8 rel.% (95 %-KI: −41,8–−0,2, [237]).
Lixisenatid
Nachdem dieser GLP-1-RA in der ELIXA-Studie nur nicht inferiore Effekte auf kardiovaskuläre Endpunkte gezeigt hatte [14] und damit anderen GLP-1-RA unterlegen ist, wurde jetzt die Kombination aus Insulin glargin mit Lixisenatid (iGlarLixi) untersucht [238]. Es wurden in einer Metaanalyse 8 Studien (Studiendauer: 24–30 Wochen) mit 3538 Teilnehmern ausgewertet. Dabei war iGlarLixi einer Therapie mit Kombinationsinsulin: −0,50 %-units (95 %-KI: −0,93–−0,06), einer Basal-Bolus-Therapie: −0,35 % (−0,89–+0,13) und einer Basal-plus-Therapie: −0,68 % (−1,18–−0,17) überlegen. Beim Vergleich mit einer Therapie mit Komb.-Insulin zeigten sich weniger symptomatische Hypoglykämien und weniger Gewichtszunahmen. Analysen zu kardiovaskulären oder renalen Endpunkten wurden nicht berichtet.
Efpeglenatid
Efpeglenatid ist ein exendinbasierter GLP-1-RA, der kürzlich in großen RCT (multizentrisch und international) bei 4076 Patienten mit Typ-2-Diabetes und einer kardiovaskulären Krankengeschichte oder einer Niereninsuffizienz (eGFR 25,0–59,9 ml/min) plus einem anderen kardiovaskulären Risikofaktor untersucht wurde. Die Patienten wurden 1:1:1 (Efpeglenatid 4 mg: Efpeglenatid 6 mg: Placebo) randomisiert und nach einer medianen Beobachtungszeit von 1,8 Jahren analysiert. Der primäre Endpunkt war MACE. Dieser wurde bei 7,0 % mit Efpeglenatid und 9,2 % mit Placebo gefunden: HR: 0,73; 95 %-KI: 0,58–0,92; p < 0,001 für Nichtunterlegenheit; p = 0,007 für Überlegenheit. Der zusammengesetzte renale Endpunkt (Verminderung der eGFR oder Makroalbuminurie) fand sich bei 13 % in der Efpeglenatid- und 18,4 % in der Placebogruppe: HR: 0,68; 95 %-KI: 0,57–0,79; p < 0,001 [239].
Kombinationspeptide in der nahen Zukunft
Tirzepatid
Tirzepatid ist ein dualer Rezeptoragonist (RA), basierend auf dem glukoseabhängigen insulinotropen Peptid (GIP) und Dulaglutid, das 1‑mal wöchentlich appliziert wird. Er vereint die Wirkungen beider Substanzen in einem neuen Molekül [240, 241]. In den kürzlich publizierten Ergebnissen der RCT-Studie SURPASS 1 war Tirzepatid in allen Dosierungen (5 mg, n = 121; 10 mg, n = 121; 15 mg, n = 121) im Vergleich zu Placebo (n = 115) am Ende der Studie (40 Wochen) überlegen: Der mittlere HbA1c-Wert sank vom Ausgangspunkt um 1,87 % (20 mmol/mol Hb), 1,89 % (21 mmol/mol Hb) bzw. 2,07 % (23 mmol/mol Hb) ab. Es fand sich kein erhöhtes Risiko für Hypoglykämien. Unter Placebo stieg der Wert um 0,04 % (+0,4 mmol/mol Hb). Tirzepatid führte dosisabhängig zu einem Gewichtsverlust von 7,0–9,5 kg [242]. Beim Vergleich der metabolischen Effekte war Tirzepatid Semaglutid nicht unterlegen, sondern überlegen in Bezug auf Reduktion des HbA1c-Werts und des Körpergewichts [243]. Als erstes Peptid einer neuen Substanzklasse steht bald eine weitere Therapieoption zur Therapie des Typ-2-Diabetes, der Adipositas und der Fettleber zur Verfügung [244, 245].
In einem Review wurden die potenziellen Vorteile – SURPASS-Studien – dieses kombinierten Peptids gegenüber Dulaglutid diskutiert [246].
Sicherheitsaspekte von GLP-1-RA
Eine Retinopathie blieb unter GLP-1-RA unverändert bis auf Semaglutid, das einen negativen Einfluss auf Augenhintergrundveränderungen aufwies (OR: 1,75; 95 %-KI: 1,10–2,78; p = 0,018, [228]). Ob dies mit der raschen Optimierung des Stoffwechsels im Zusammenhang steht, wird diskutiert [247]. Im Übrigen waren nur Patienten mit vorbestehender Retinopathie betroffen. Eine entsprechende Studie zur Klärung des Retinopathierisikos unter Semaglutid wurde aufgelegt (ClinicalTrials.gov, Nummer NCT03 811 561). Die Metaanalyse von Avgerinos et al. über orales Semaglutid zeigte jedoch keinen Hinweis auf eine höhere Rate von Retinopathien [224].
Pankreatitis und Cholezystolithiasis sowie Neoplasien: Von 113 Studien, die in die Analyse von Monami et al. eingeschlossen wurden, fanden sich in 13 Studien keine Angaben zu Pankreatitis. In 72 Studien wurden keine Pankreatitis- und Pankreaskarzinomereignisse berichtet. Bei den verbliebenen Studien (n = 28) war die Inzidenz von Pankreatitis und Pankreaskarzinomen unter GLP-1-RA vergleichbar mit den Vergleichsmedikationen (Pankreatitis: OR: 0,93; 95 %-KI: 0,65–1,34; p = 0,71; Pankreaskarzinome: OR: 0,94; 95 %-KI: 0,52–1,70; p = 0,84). Das Risiko für Gallensteine war jedoch erhöht (OR: 1,30; 95 %-KI: 1,01–1,68; p = 0,041, [248]). In der 2020 publizierten umfangreichen Analyse von RCT mit inkretinbasierten Therapien (SAVOR TIMI 53 [Saxagliptin], EXAMINE [Alogliptin], TECOS [Sitagliptin], ELIXA [Lixisenatid] sowie Liraglutid in LEADER und Semaglutid in SUSTAIN-6) konnte im Gegensatz zu Therapien mit DPP-4-Inhibitoren keine signifikante Risikosteigerung für Pankreatitis und Pankreaskarzinome für GLP-1-RA gefunden werden [249]. In der Metaanalyse von Cao et al. fand sich ebenfalls kein Hinweis für ein erhöhtes Krebsrisiko unter der Therapie mit GLP-1-RA [250]. In der 2018 publizierten Metaanalyse von Bethel et al. [236] fanden sich keine Unterschiede in Bezug auf Pankreatitis, Pankreaskarzinom und medulläres Schilddrüsenkarzinom bei Patienten unter GLP-1-RA-Therapie im Vergleich zu mit Placebo behandelten Studienteilnehmern. Auch die große multinationale populationsbasierte Kohortenstudie mit 1.532.513 Patienten, die vom 01.01.2007 bis zum 30.06.2013 eingeschlossen und bis 30.06.2014 nachverfolgt wurden, zeigte keine Assoziation mit einem höheren Risiko für eine Pankreatitis unter inkretinbasierten Therapien im Vergleich mit anderen OAD [251]. Diese Daten passen zu den Ergebnissen einer Metaanalyse von Real-World-Daten, die ebenfalls keinen Hinweis für ein höheres Risiko für eine Pankreatitis unter inkretinbasierten Therapien fand [252].
Die Rate von Cholangiokarzinomen war unter inkretinbasierter Therapie in einer großen kürzlich erschienen Kohortenstudie nicht erhöht [253]. Auch in einer aktuellen Metaanalyse fand sich kein Hinweis für ein höheres Risiko für Mammaneoplasien unter GLP-1-RA-Therapie [254].
Inkretinbasierte Therapien und Fettleber
Nichtalkoholische Fettleber (NASH) ist ein Risikofaktor für die Manifestation eines Typ-2-Diabetes, ist häufig bei Menschen mit Typ-2-Diabetes vorhanden und ist mit einer höheren Morbidität und Mortalität assoziiert. In einer kürzlich erschienenen Studie mit einer Beobachtungsdauer von 72 Wochen wurden 380 Patienten mit NASH und einer Fibrose F2 und F3 randomisiert und erhielten Semaglutid s.c. (0,1 mg; n = 80 oder 0,2 mg; n = 78 oder 0,4 mg; n = 82) oder Placebo (n = 80). Im Gegensatz zu Placebo fand sich eine Rückbildung der Fettleber ohne Progredienz der Fibrose bei Semaglutid: 40 % in der 0,1-mg-Gruppe, 36 % in der 0,2-mg-Gruppe und 59 % in der 0,4-mg-Gruppe. In der Placebogruppe betrug die Verbesserung nur 17 % (p < 0,001 für Semaglutid 0,4 mg vs. Placebo). Neoplasien (benigne, maligne oder nicht spezifiziert) wurden jedoch bei 15 % der Patienten in der Semaglutid- und bei 8 % in der Placebogruppe gefunden, wobei keine spezifischen Organmanifestationen beobachtet wurden [255].
Kombination von GLP-1-Rezeptor-Agonisten und SGLT-2-Inhibitoren
Verglichen mit einer GLP-1-RA-Monotherapie war bei 7 analysierten Studien (n = 1913 Patienten) der HbA1c-Wert um 0,61 % (95 %-KI: −1,09–−0,14 %, 4 Studien) niedriger, die Körpergewichtsreduktion betrug (−2,59 kg, −3,68–−1,51 kg, 3 Studien) und die Senkung des systolische Blutdrucks (−4,13 mm Hg, −7,28–−0,99 mm Hg, 4 Studien). Die Monotherapie mit SGLT-2-Hemmern führte zu einer Reduktion des HbA1c-Werts um 0,85 % (−1,19–−0,52 %, 6 Studien) und des systolischen Blutdrucks (−2,66 mm Hg, −5,26–−0,06 mm Hg, 6 Studien). Das Körpergewicht war in 5 analysierbaren Studien unverändert (−1,46 kg, −2,94–0,03 kg). Die Kombinationstherapie führte nicht zu vermehrten schweren Hypoglykämien. Daten zu klinischen Endpunkten waren unzureichend [256].
Insuline
Bei den vielfältigen Möglichkeiten der oralen antidiabetischen Therapie mit oder ohne Kombination mit GLP-1-RA kann eine Insulintherapie in vielen Fällen in spätere Erkrankungsphasen verschoben werden. Eine notwendige Insulingabe sollte dann jedoch nicht – wie teilweise zu beobachten – um Jahre verzögert werden [257]. Dabei ist die Insulintherapie gut mit anderen Antidiabetika kombinierbar, und die Vielzahl der Insuline und Injektionshilfen erleichtert eine Individualisierung der Therapie.
Eine umfangreiche Diskussion über neue Insuline würde jedoch den Rahmen dieser Praxisempfehlungen bei Weitem sprengen. Aber als Beitrag zu 100 Jahren Insulin wurde kürzlich ein umfangreicher Review publiziert [258].
In den Praxisempfehlungen konzentrierten sich die Autoren auf wenige Aspekte neuer Insulinpräparationen.
Basalinsulinanaloga
Insulin degludec (n = 3818) ist Insulin glargin 100 (n = 3819) in der Therapie bei Menschen mit Typ-2-Diabetes mit hohem Risiko für kardiovaskuläre Ereignisse im Hinblick auf MACE nicht unterlegen. Die HbA1c-Werte waren in beiden Gruppen über den Beobachtungszeitraum von 2 Jahren identisch (7,5 ± 1,2 %), die Nüchternplasmaglukosewerte waren aber unter Insulin degludec signifikant niedriger. Die „hazard ratio“ betrug 0,91 (95 %-KI: 0,78–1,06) für den primären Endpunkt (kardiovaskulärer Tod, nichttödlicher Myokardinfarkt, nichttödlicher Schlaganfall). Dagegen war die Rate schwerer Hypoglykämien (sekundärer Endpunkt) unter Insulin degludec (4,9 %) signifikant niedriger als unter Insulin glargin 100 (6,6 %; HR: 0,60; 95 %-KI: 0,48–0,76; p < 0,001). Die Rate schwerer Nebenwirkungen wie benigne und maligne Neoplasien war vergleichbar (DEVOTE [259]). In der DEVOTE-Studie konnte erneut gezeigt werden, dass nachgewiesene schwere Hypoglykämien in einem Zeitraum von 15–365 Tagen vor dem klinischen Endpunkt mit einer erhöhten Rate der Gesamtmortalität assoziiert waren [260].
Pharmakokinetische und pharmakodynamische Studien zeigten, dass Insulin glargin 300 ein flacheres Wirkprofil besitzt, dass die Wirkung etwas länger anhält und die Tag-zu-Tag-Variabilität geringer ist als unter Insulin glargin 100. Die metabolischen Kontrollen waren unter beiden Insulinen vergleichbar, während die Rate nächtlicher Hypoglykämien unter Insulin glargin 300 signifikant niedriger war als unter Insulin glargin 100 [261–263].
Insulin glargin 100-Biosimilar: Pharmakokinetik und -dynamik sind für Insulin glargin 100 und Insulin glargin 100-Biosimilar bei Menschen ohne und mit Typ-2-Diabetes vergleichbar [264, 265]. In der Metaanalyse von Yamada et al. [266] fanden sich keine Unterschiede zwischen Biosimilarinsulinen und den Originalinsulinen in Bezug auf: HbA1c-Wert, Fastenplasmaglukose, Hypoglykämien, Injektionsstellenreaktionen, Insulinantikörper, allergische Reaktionen und Mortalität.
Beim Vergleich verschiedener Insulinanaloga (Insulin glargin und Insulin degludec) mit Humaninsulin fand sich in einer großen Kohortenstudie aus Dänemark, Finnland, Norwegen, Schweden und Großbritannien kein Hinweis für ein erhöhtes Karzinomrisiko, weder für Insulin glargin noch für Insulin degludec im Vergleich zu Humaninsulin für die 10 untersuchten Karzinome in einer mittleren Beobachtungszeit von 4,6 Jahren [267].
Kombinationen von lang wirkendem Insulin plus GLP-1-RA
Die fixe Kombination von lang wirkendem Insulin plus GLP-1-RA oder freie Kombinationen simultan oder konsekutiv haben Vorteile im Vergleich zu einer intensivierten Insulintherapie mit prandialem und basalem Insulin in Bezug auf Therapieadhärenz, Rate von Unterzuckerungen, den Gewichtsverlauf und den Verbrauch von Insulin. Im Vergleich zu einer intensivierten Insulintherapie traten mit GLP-1-RA jedoch häufiger gastrointestinale Nebenwirkungen auf [268–270]. In einer aktuellen Metaanalyse kamen die Autoren zu dem Schluss, dass Kombinationen von Basalinsulin mit lang wirkenden GLP-1-RA in Bezug auf Gewichtsreduktion, HbA1c-Wert-Senkung, niedrigere Nüchternglukosewerte und Vorteilen in Bezug auf gastrointestinale Nebenwirkungen den Kombinationen von Basalinsulin mit kurz wirksamen GLP-1-RA überlegen waren [271].
Die erste in Deutschland zugelassene Fixkombination ist Insulin glargin (100 I.E./ml) und Lixisenatid (s. oben).
Schnell wirkende Insulinanaloga
Insulin lispro 200 zeigt potenzielle Vorteile eines höher konzentrierten Insulins v. a. bei starker Insulinresistenz (z. B. Adipositas), da weniger Volumen bei gleicher Menge Insulin injiziert werden muss. Im Vergleich zu Insulin lispro 100 zeigte Insulin lispro 200 signifikante Verbesserungen der Variabilität der Nüchternglukose, des HbA1c-Werts, der Hypoglykämierate und der Zufriedenheit mit der Therapie. Gleichzeitig konnten 20 % Insulin eingespart werden [272].
Das ultraschnelle Insulin aspart hat infolge rascherer Absorption eine doppelt so schnelle Anflutung im Blut und damit insbesondere in den ersten 30 min nach Injektion eine etwa 50 % höhere Insulinwirkung mit signifikant niedrigeren postprandialen Blutglukosewerten. Wegen des schnelleren Wirkungseintritts ist es noch besser steuerbar, insbesondere bei Menschen mit Typ-1-Diabetes und solchen mit einer Insulinpumpentherapie [273]. Ultraschnelles Insulin aspart zeigte im Vergleich zu Insulin aspart bei Menschen mit Typ-2-Diabetes eine vergleichbare Reduktion des HbA1c-Werts (Beobachtungszeit 26 Wochen); die Glukosewerte 1 h postprandial waren nach Injektion von schnellem Insulin aspart signifikant niedriger, aber nicht die 2–4 h nach einer Testmahlzeit. Die Gesamtraten schwerer Hypoglykämien waren nicht unterschiedlich zwischen den beiden Insulinpräparationen. Das relative Risiko von Hypoglykämien 0–2 h postprandial war unter schnellem Insulin aspart jedoch signifikant höher (RR: 1,60; 95 %-KI: 1,13–2,27, [274]). Ultraschnell wirkendes Insulin lispro (URLI: „ultra rapid lispro insulin“) zeigte eine 6,4fach schnellere Anflutung in den ersten 15 min nach Injektion im Vergleich zu Insulin lispro (p < 0,0001). Die Insulinwirkung von URLi war 13 min signifikant schneller und 4,2fach größer in den ersten 30 min als die von Insulin lispro [275].
Einhaltung ethischer Richtlinien
Interessenkonflikt
R. Landgraf erklärt als Erstautor folgende potenziellen Interessenkonflikte: „advisory boards“: Lilly Deutschland, Novo Nordisk Pharma; Vortragshonorare: AstraZeneca, Bayer Vital, Berlin Chemie, Lilly Deutschland, Novo Nordisk Pharma. Andere Aktivitäten: Bevollmächtigter des Vorstands der Deutschen Diabetes-Stiftung, Steuerungsgruppe für die Entwicklung und Aktualisierung der Nationalen VersorgungsLeitlinien Diabetes. J. Aberle erklärt als Mitglied in Beratungsgremien und als Referent Honorare erhalten zu haben von: AstraZeneca, Berlin-Chemie, Boehringer-Ingelheim, Eli Lilly & Co, Novo Nordisk, Roche Diabetes Care. Institutionelle Forschungsförderung: AstraZeneca. A.L. Birkenfeld erklärt als Mitautor, Mitglied in Beratungsgremien und als Referent Honorare erhalten zu haben von: Amgen, AstraZeneca, Boehringer-Ingelheim, Eli Lilly & Co, Merck Sharp & Dohme, Novo Nordisk, Sanofi. Institutionelle Forschungsförderung: Boehringer Ingelheim. B. Gallwitz erklärt als Mitautor folgende potenziellen Interessenkonflikte in den letzten 3 Jahren: „advisory boards“/Beratertätigkeit: AstraZeneca, Bayer Vital, Boehringer Ingelheim, Eli Lilly & Co, Merck Sharp & Dohme, Novo Nordisk; Vortragstätigkeiten: AstraZeneca, Bristol Myers Squibb, Boehringer-Ingelheim, Eli Lilly & Co, Merck Sharp & Dohme, Novo Nordisk. Firmenanteile/Aktien: keine. M. Kellerer erklärt als Mitautorin folgende potenziellen Interessenkonflikte: Forschungsunterstützung (RCT): AstraZeneca; Lilly; Novo Nordisk. Mitgliedschaft in Beratungsgremien: Abbott, AstraZeneca, Bayer, Boehringer Ingelheim, Lilly, MSD, Novo Nordisk, Sanofi. Vortragstätigkeit: Bayer, Boehringer Ingelheim, BMS, Novartis, MSD, Novo Nordisk. H.H. Klein erklärt als Mitautor folgende potenziellen Interessenkonflikte: Beratungsgremium: AstraZeneca, Janssen Cilag, Boehringer Ingelheim; Vortragshonorar: Berlin-Chemie. D. Müller-Wieland erklärt als Mitautor folgende potenziellen Interessenkonflikte: Mitglied im „advisory boards“ und Vortragshonorare in den letzten 3 Jahren von folgenden Firmen erhalten zu haben: Amarin, Amgen, AstraZeneca, Boehringer Ingelheim, Lilly, MSD, Novartis, Novo Nordisk, Roche Diabetes Care, Sanofi. M.A. Nauck erklärt als Mitautor folgende potenziellen Interessenkonflikte: Mitgliedschaft in Beratungsgremien oder Beraterhonorare: Berlin Chemie, Boehringer Ingelheim, Eli Lilly & Co, MSD, Novo Nordisk; Vortragshonorare: AstraZeneca, Berlin Chemie, Boehringer Ingelheim, Eli Lilly & Co., Medscape, MSD, Novo Nordisk, Forschungsunterstützung: Eli Lilly & Co., MSD, Novo Nordisk. T. Wiesner ist Mitglied in den jeweiligen „advisory boards“ und erhielt Vortragshonorare von folgenden Firmen: Amgen, AstraZeneca, Boehringer Ingelheim, Lilly, MSD, Sanofi, Berlin Chemie; Novo Nordisk. E. Siegel erklärt als Mitautor, dass er während der letzten 3 Jahre keine wirtschaftlichen oder persönlichen Verbindungen in Bezug auf das Manuskript hatte.
Footnotes
Dieser Beitrag wurde erstpubliziert in Diabetologie und Stoffwechsel (2021) 16 (Suppl 2): S168–206, 10.1055/a-1394-2313. Nachdruck mit freundl. Genehmigung von Georg Thieme Verlag KG. Die Urheberrechte liegen bei den Autoren.
Aktualisierungshinweis
Die DDG-Praxisempfehlungen werden regelmäßig zur zweiten Jahreshälfte aktualisiert. Bitte stellen Sie sicher, dass Sie jeweils die neueste Version lesen und zitieren.

QR-Code scannen & Beitrag online lesen
Literatur
- 1.Nationale VersorgungsLeitlinien NVL-2-Diabetes – Teilpublikation, 2. Aufl.
- 2.Neal B, Perkovic V, Mahaffey KW, CANVAS Program Collaborative Group et al. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med. 2017;377:644–657. doi: 10.1056/NEJMoa1611925. [DOI] [PubMed] [Google Scholar]
- 3.Wiviott SD, Raz I, Bonaca MP, et al. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2019;380(04):347–357. doi: 10.1056/NEJMoa1812389. [DOI] [PubMed] [Google Scholar]
- 4.Furtado RHM, Bonaca MP, Raz I. Dapagliflozin and cardiovascular outcomes in patients with type 2 diabetes mellitus and previous myocardial infarction. Circulation. 2019;139(22):2516–2527. doi: 10.1161/CIRCULATIONAHA.119.039996. [DOI] [PubMed] [Google Scholar]
- 5.Kato ET, Silverman MG, Mosenzon O, et al. Effect of dapagliflozin on heart failure and mortality in type 2 diabetes mellitus. Circulation. 2019;139(22):2528–2536. doi: 10.1161/CIRCULATIONAHA.119.040130. [DOI] [PubMed] [Google Scholar]
- 6.Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med. 2015;373:2117–2128. doi: 10.1056/NEJMoa1504720. [DOI] [PubMed] [Google Scholar]
- 7.Cannon CP, McGuire DK, Pratley R, VERTIS-CV Investigators et al. Design and baseline characteristics of the evaluation of ertugliflozin efficacy and safety cardiovascular outcomes trial (VERTIS-CV) Am Heart J. 2018;206:11–23. doi: 10.1016/j.ahj.2018.08.016. [DOI] [PubMed] [Google Scholar]
- 8.Gerstein HC, Colhoun HM, Dagenais GR, et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet. 2019;394:121–130. doi: 10.1016/S0140-6736(19)31149-3. [DOI] [PubMed] [Google Scholar]
- 9.Pasternak B, Wintzell V, Eliasson B, et al. Use of glucagon like peptide 1 receptor agonists and risk of serious renal events: Scandinavian cohort study. Diabetes Care. 2020;43:1326–1335. doi: 10.2337/dc19-2088. [DOI] [PubMed] [Google Scholar]
- 10.Marso SP, Bain SC, Consoli A, et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med. 2016;375(19):1834–1844. doi: 10.1056/NEJMoa1607141. [DOI] [PubMed] [Google Scholar]
- 11.Husain M, Birkenfeld AL, Donsmark M, PIONEER 6 Investigators et al. Oral semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med. 2019;381(9):841–851. doi: 10.1056/NEJMoa1901118. [DOI] [PubMed] [Google Scholar]
- 12.Hernandez AF, Green JB, Janmohamed S, et al. Harmony outcomes committees and investigators. Albiglutide and cardiovascular outcomes in patients with type 2 diabetes and cardiovascular disease (Harmony Outcomes): a double-blind, randomized placebo-controlled trial. Lancet. 2018;392:1519–1529. doi: 10.1016/S0140-6736(18)32261-X. [DOI] [PubMed] [Google Scholar]
- 13.Holman RR, Bethel MA, Mentz RJ, et al. Effects of once-weekly exenatide on cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2017;377(13):1228–1239. doi: 10.1056/NEJMoa1612917. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Pfeffer MA, Claggett B, Diaz R, et al. Lixisenatide in patients with type 2 diabetes and acute coronary syndrome. N Engl J Med. 2015;373:2247–2257. doi: 10.1056/NEJMoa1509225. [DOI] [PubMed] [Google Scholar]
- 15.Preshaw PM, Alba AL, Herrera D, et al. Periodontitis and diabetes: a two-way relationship. Diabetologia. 2012;55:21–31. doi: 10.1007/s00125-011-2342-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Elwyn G, Vermunt NPCA. Goal-based shared decision-making: developing an integrated model. J Patient Exp. 2019 doi: 10.1177/2374373519878604. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Wang R, Song Y, Yan Y, et al. Elevated serum uric acid and risk of cardiovascular or all-cause mortality in people with suspected or definite coronary artery disease: a meta-analysis. Atherosclerosis. 2016;254:193–199. doi: 10.1016/j.atherosclerosis.2016.10.006. [DOI] [PubMed] [Google Scholar]
- 18.Parhofer KG, Birkenfeld AL, Krone W, et al. Lipidtherapie bei Patienten mit Diabetes mellitus. Diabetologie. 2020;15(1):S160–S165. [Google Scholar]
- 19.Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020;41(1):111–188. doi: 10.1093/eurheartj/ehz455. [DOI] [PubMed] [Google Scholar]
- 20.The Task Force for the management of arterial hypertension of the European Society of cardiology (ESC) European Society of Hypertension (ESH) 2018 ESC/ESH guidelines for the management of arterial hypertension. Eur Heart J. 2018;39:3021–3104. doi: 10.1093/eurheartj/ehy339. [DOI] [PubMed] [Google Scholar]
- 21.Heinemann L, Kaiser P, Freckmann G, et al. HbA1c-Messung in Deutschland: Ist die Qualität ausreichend für Verlaufskontrolle und Diagnose? Diabetologie. 2018;13:46–53. doi: 10.1055/s-0043-125187. [DOI] [Google Scholar]
- 22.Landgraf R, Nauck M, Freckmann G, et al. Fallstricke bei der Diabetesdiagnostik: Wird zu lax mit Laborwerten umgegangen? Dtsch Med Wochenschr. 2018;143:1549–1555. doi: 10.1055/a-0673-2156. [DOI] [PubMed] [Google Scholar]
- 23.Nauck M, Gerdes C, Petersmann A, et al. Definition, Klassifikation und Diagnostik des Diabetes mellitus. Update 2020. Diabetologie. 2020;15(1):S9–S17. [Google Scholar]
- 24.Landgraf R. HbA1c in der Diabetesdiagnostik. Der Goldstandard? Diabetes Aktuell. 2021;19:22–29. doi: 10.1055/a-1306-8016. [DOI] [Google Scholar]
- 25.Ahlqvist E, Storm P, Käräjämäki A, et al. Novel subgroups of adult-onset diabetes and their association with outcomes: a data-driven cluster analysis of six variables. Lancet Diabetes Endocrinol. 2018;6(5):361–369. doi: 10.1016/S2213-8587(18)30051-2. [DOI] [PubMed] [Google Scholar]
- 26.Zaharia OP, Strassburger K, Strom A, German Diabetes Study Group et al. Risk of diabetes-associated diseases in subgroups of patients with recent-onset diabetes: a 5-year follow-up study. Lancet Diabetes Endocrinol. 2019;7(9):684–694. doi: 10.1016/S2213-8587(19)30187-1. [DOI] [PubMed] [Google Scholar]
- 27.Dennis JM, Shields BM, Henley WE, et al. Disease progression and treatment response in data-driven subgroups of type 2 diabetes compared with models based on simple clinical features: an analysis using clinical trial data. Lancet Diabetes Endocrinol. 2019;7(6):442–451. doi: 10.1016/S2213-8587(19)30087-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Zhang Y, Pan XF, Chen J, et al. Combined lifestyle factors and risk of incident type 2 diabetes and prognosis among individuals with type 2 diabetes: a systematic review and meta-analysis of prospective cohort studies. Diabetologia. 2020;63:21–3316. doi: 10.1007/s00125-019-04985-9. [DOI] [PubMed] [Google Scholar]
- 29.Nationale VersorgungsLeitlinie (NVL) (2018) Diabetes – Strukturierte Schulungsprogramme. www.leitlinien.de/nvl/diabetes/schulungsprogramme
- 30.Forouhi NG, Misra A, Mohan V, et al. Dietary and nutritional approaches for prevention and management of type 2 diabetes. BMJ. 2018;361:k2234. doi: 10.1136/bmj.k2234. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Serra-Majem L, Román-Viñas B, Sanchez-Villegas A, et al. Benefits of the Mediterranean diet: epidemiological and molecular aspects. Mol Aspects Med. 2019;67:1–55. doi: 10.1016/j.mam.2019.06.001. [DOI] [PubMed] [Google Scholar]
- 32.Taylor R, Al-Mrabeh A, Sattar N. Understanding the mechanisms of reversal of type 2 diabetes. Lancet Diabetes Endocrinol. 2019;7(9):726–736. doi: 10.1016/S2213-8587(19)30076-2. [DOI] [PubMed] [Google Scholar]
- 33.Evert AB, Dennison M, Gardner CD, et al. Nutrition therapy for adults with diabetes or prediabetes: a consensus report. Diabetes Care. 2019;42(5):731–754. doi: 10.2337/dci19-0014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Hauner H (2021) Evidenz in der Ernährungstherapie des Diabetes mellitus. Diabetologe (published online 29.06.2021)
- 35.Chester B, Babu JR, Greene MW, et al. The effects of popular diets on type 2 diabetes management. Diabetes Metab Res Rev. 2019;35:e3188. doi: 10.1002/dmrr.3188. [DOI] [PubMed] [Google Scholar]
- 36.Kempf K, Altpeter B, Berger J, et al. Efficacy of the telemedical lifestyle intervention program TeLiPro in advanced stages of type 2 diabetes: a randomized controlled trial. Diabetes Care. 2017;40(7):863–871. doi: 10.2337/dc17-0303. [DOI] [PubMed] [Google Scholar]
- 37.Lean MEJ, Leslie WS, Barnes AC, et al. Durability of a primary care-led weight-management intervention for remission of type 2 diabetes: 2-year results of the DiRECT open-label, cluster-randomized trial. Lancet Diabetes Endocrinol. 2019;7:344–355. doi: 10.1016/S2213-8587(19)30068-3. [DOI] [PubMed] [Google Scholar]
- 38.Adipositas – Prävention und Therapie (AWMF-Register Nr. 050-001)
- 39.Aberle J, Lautenbach A, Meyhöfer S, et al. Adipositas und Diabetes. Diabetologe. 2021;16(2):S290–S298. [Google Scholar]
- 40.Yang D, Yang Y, Li Y, et al. Physical exercise as therapy for type 2 diabetes mellitus: from mechanism to orientation. Ann Nutr Metab. 2019;74(4):313–321. doi: 10.1159/000500110. [DOI] [PubMed] [Google Scholar]
- 41.Tarp J, Støle AP, Blond K, et al. Cardiorespiratory fitness, muscular strength and risk of type 2 diabetes: a systematic review and metaanalysis. Diabetologia. 2019;62:1129–1142. doi: 10.1007/s00125-019-4867-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Liu Y, Ye W, Chen Q, et al. Resistance exercise intensity is correlated with attenuation of HbA1c and insulin in patients with type 2 diabetes: a systematic review and meta-analysis. Int J Environ Res Public Health. 2019;16(01):140. doi: 10.3390/ijerph16010140. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Esefeld K, Kress S, Behrens M, et al. Diabetes, Sport und Bewegung. Diabetologe. 2021;16(2):S299–S307. [Google Scholar]
- 44.Piercy KL, Richard P, Troiano RP, et al. The physical activity guidelines for Americans. JAMA. 2018;320(19):2020–2028. doi: 10.1001/jama.2018.14854. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Jabardo-Camprubí G, Donat-Roca R, Sitjà-Rabert M, et al. Drop-out ratio between moderate to high-intensity physical exercise treatment by patients with, or at risk of, type 2 diabetes mellitus: a systematic review and meta-analysis. Physiol Behav. 2020;215:112786. doi: 10.1016/j.physbeh.2019.112786. [DOI] [PubMed] [Google Scholar]
- 46.Pan A, Wang Y, Talaei M, et al. Relation of active, passive, and quitting smoking with incident diabetes: a meta-analysis and systematic review. Lancet Diabetes Endocrinol. 2015;3(12):958–996. doi: 10.1016/S2213-8587(15)00316-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Kar D, Gillies C, Nath M, et al. Association of smoking and cardiometabolic parameters with albuminuria in people with type 2 diabetes mellitus: a systematic review and meta-analysis. Acta Diabetol. 2019;56:839–850. doi: 10.1007/s00592-019-01293-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.S3-Leitlinie Rauchen und Tabakabhängigkeit: Screening, Diagnostik und Behandlung (Langversion AWMF-Register Nr. 076-006)
- 49.DKFZ Tabakatlas Deutschland 2020. www.dkfz.de/de/tabakkontrolle/download/Publikationen/sonstVeroeffentlichungen/Tabakatlas-Deutschland-2020_dp.pdf
- 50.Nationale VersorgungsLeitlinien NVL-2-Diabetes – Teilpublikation, 2. Aufl.
- 51.Ärztliches Zentrum für Qualität in der Medizin. Bundesärztekammer. Kassenärztliche Bundesvereinigung. Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften et al. Nationale VersorgungsLeitlinie Typ-2-Diabetes. 2 2020. [Google Scholar]
- 52.Fleming GA, Petrie JR, Bergenstal RM, et al. Diabetes digital app technology: benefits, challenges, and recommendations. A consensus report by the European association for the study of diabetes (EASD) and the American diabetes association (ADA) diabetes technology working group. Diabetes Care. 2020;43(01):250–260. doi: 10.2337/dci19-0062. [DOI] [PubMed] [Google Scholar]
- 53.Khunti K, Gomes MB, Pocock S, et al. Therapeutic inertia in the treatment of hyperglycaemia in patients with type 2 diabetes: a systematic review. Diabetes Obes Metab. 2018;20:427–437. doi: 10.1111/dom.13088. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Matthews DR, Paldánius PM, Proot P, VERIFY study group et al. Glycaemic durability of an early combination therapy with vildagliptin and metformin versus sequential metformin monotherapy in newly diagnosed type 2 diabetes (VERIFY): a 5-year, multicentre, randomised, double-blind trial. Lancet. 2019;394:1519–1529. doi: 10.1016/S0140-6736(19)32131-2. [DOI] [PubMed] [Google Scholar]
- 55.Gough SC, Bode B, Woo V, et al. Efficacy and safety of a fixed-ratio combination of insulin degludec and liraglutide (IDegLira) compared with its components given alone: results of a phase 3, open-label, randomised, 26-week, treat-to-target trial in insulin-naive patients with type 2 diabetes. Lancet Diabetes Endocrinol. 2014;2(11):885–893. doi: 10.1016/S2213-8587(14)70174-3. [DOI] [PubMed] [Google Scholar]
- 56.Diamant M, Nauck MA, Shaginian R, et al. Glucagon-like peptide 1 receptor agonist or bolus insulin with optimized basal insulin in type 2 diabetes. Diabetes Care. 2014;37(10):2763–2773. doi: 10.2337/dc14-0876. [DOI] [PubMed] [Google Scholar]
- 57.Ahmann A, Rodbard HW, Rosenstock J, et al. Efficacy and safety of liraglutide versus placebo added to basal insulin analogues (with or without metformin) in patients with type 2 diabetes: a randomized, placebo controlled trial. Diabetes Obes Metab. 2015;17:1056–1064. doi: 10.1111/dom.12539. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Montvida O, Klein K, Kumar S, et al. Addition of or switch to insulin therapy in people treated with glucagon-like peptide-1 receptor agonists: a real-world study in 66 583 patients. Diabetes Obes Metab. 2017;19(01):108–117. doi: 10.1111/dom.12790. [DOI] [PubMed] [Google Scholar]
- 59.Billings LK, Doshi A, Gouet D, et al. Efficacy and safety of IDegLira versus basal-bolus insulin therapy in patients with type 2 diabetes uncontrolled on metformin and basal insulin: the DUAL VII randomized clinical trial. Diabetes Care. 2018;41(05):1009–1016. doi: 10.2337/dc17-1114. [DOI] [PubMed] [Google Scholar]
- 60.Parhofer KG. Lipidtherapie. Diabetologe. 2021;16(02):S312–S317. [Google Scholar]
- 61.Mengden T, Weisser B. Therapieüberwachung bei arterieller Hypertonie. Dtsch Arztebl. 2021;118(27):473–478. doi: 10.3238/arztebl.m2021.0158. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Nationale VersorgungsLeitlinie (2018) Nierenerkrankungen bei Diabetes im Erwachsenenalter. www.leitlinien.de/nvl/diabetes/nierenerkrankungen
- 63. ESC/ESH Guidelines 2018. Management der arteriellen Hypertonie. www.dgk.de; www.hochdruckliga.de
- 64.American Diabetes Association Cardiovascular disease and risk management: standards of medical care in diabetes—2021. Diabetes Care. 2021;44(1):S125–S150. doi: 10.2337/dc21-S010. [DOI] [PubMed] [Google Scholar]
- 65.The SPRINT Research Group A randomized trial of intensive versus standard blood-pressure control. N Engl J Med. 2015;373:2103–2116. doi: 10.1056/NEJMoa1511939. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Banegas JR, Ruilope LM, de la Sierra A, et al. Relationship between clinic and ambulatory blood-pressure measurements and mortality. N Engl J Med. 2018;378:1509–1520. doi: 10.1056/NEJMoa1712231. [DOI] [PubMed] [Google Scholar]
- 67.Alberti KGMM, Eckel RH, Grundy SM, et al. Harmonizing the metabolic syndrome. Circulation. 2009;120:1640–1645. doi: 10.1161/CIRCULATIONAHA.109.192644. [DOI] [PubMed] [Google Scholar]
- 68.The Look AHEAD Research Group Cardiovascular effects of intensive lifestyle intervention in type 2 diabetes. N Engl J Med. 2013;369:145–154. doi: 10.1056/NEJMoa1212914. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69.Unick JL, Gaussoin SA, Hill JO, et al. Objectively assessed physical activity and weight loss maintenance among individuals enrolled in a lifestyle intervention. Obesity (Silver Spring) 2017;25(11):1903–1909. doi: 10.1002/oby.21971. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 70.The Look AHEAD Research Group Association of the magnitude of weight loss and changes in physical fitness with long-term cardiovascular disease outcomes in overweight or obese people with type 2 diabetes: a post-hoc analysis of the Look AHEAD randomized clinical trial. Lancet Diabetes Endocrinol. 2016;4:913–921. doi: 10.1016/S2213-8587(16)30162-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 71.Gregg EW, Lin J, Bardenheier B, et al. Impact of intensive lifestyle intervention on disability-free life expectancy: the look AHEAD study. Diabetes Care. 2018;41:1040–1048. doi: 10.2337/dc17-2110. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 72.Chao AM, Wadden TA, Berkowitz RI, Look AHEAD Research Group et al. Weight change 2 years after termination of the intensive lifestyle intervention in the look AHEAD study. Obesity. 2020;28:893–890. doi: 10.1002/oby.22769. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 73.Yang D, Yang Y, Li Y, et al. Physical exercise as therapy for type 2 diabetes mellitus: from mechanism to orientation. Ann Nutr Metab. 2019;74(04):313–321. doi: 10.1159/000500110. [DOI] [PubMed] [Google Scholar]
- 74.Tarp J, Støle AP, Blond K, et al. Cardiorespiratory fitness, muscular strength and risk of type 2 diabetes: a systematic review and metaanalysis. Diabetologia. 2019;62:1129–1142. doi: 10.1007/s00125-019-4867-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 75.Liu Y, Ye W, Chen Q, et al. Resistance exercise intensity is correlated with attenuation of HbA1c and insulin in patients with type 2 diabetes: a systematic review and meta-analysis. Int J Environ Res Public Health. 2019;16(01):E140. doi: 10.3390/ijerph16010140. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 76.BfArM (2017) Metformin zur Behandlung des Typ-2-Diabetes: Umsetzung der Durchführungsbeschlüsse der EU. www.bfarm.de/SharedDocs/Risikoinformationen/Pharmakovigilanz/DE/RV_STP/m-r/metformin.html
- 77.Lazarus B, Wu A, Shin JI, et al. Association of metformin use with risk of lactic acidosis across the range of kidney function. A community-based cohort study. JAMA Intern Med. 2018;178(07):903–910. doi: 10.1001/jamainternmed.2018.0292. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 78.Griffin SJ, Leaver JK, Irving GJ, et al. Impact of metformin on cardiovascular disease: a meta-analysis of randomized trails among people with type 2 diabetes. Diabetologia. 2017;60:1620–1629. doi: 10.1007/s00125-017-4337-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 79.Palmer SC, Mavridis D, Nicolucci A, et al. Comparison of clinical outcomes and adverse events associated with glucose-lowering drugs in patients with type 2 diabetes. A meta-analysis. JAMA. 2016;316(03):313–324. doi: 10.1001/jama.2016.9400. [DOI] [PubMed] [Google Scholar]
- 80.Madsen KS, Kähler P, Kähler LKA, et al. Metformin and second- or third generation sulphonylurea combination therapy for adults with type 2 diabetes mellitus. Cochrane Database Syst Rev. 2019;4:CD012368. doi: 10.1002/14651858.CD012368.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Sattar N, McGuire DK. Prevention of CV outcomes in antihyperglycemic drug-naive patients with type 2 diabetes with, or at elevated risk of, ASCVD: to start or not to start with metformin. Eur Heart J. 2021;42:2574–2576. doi: 10.1093/eurheartj/ehaa879. [DOI] [PubMed] [Google Scholar]
- 82.Rena G, Mordi IR, Lang CC. Metformin: still the sweet spot for CV protection in diabetes? Curr Opin Pharmacol. 2020;54:202–208. doi: 10.1016/j.coph.2020.10.018. [DOI] [PubMed] [Google Scholar]
- 83.Mallik R, Chowdhury TA. Metformin in cancer. Diabetes Res Clin Pract. 2018;143:409–419. doi: 10.1016/j.diabres.2018.05.023. [DOI] [PubMed] [Google Scholar]
- 84.Thakur S, Daley B, Klubo-Gwiezdzinska J (2019) The role of the antidiabetic drug metformin in the treatment of endocrine tumors. J Mol Endocrinol. DOI: JME-19–0083.R1 [DOI] [PMC free article] [PubMed]
- 85.De A, Kuppusamy G. Metformin in breast cancer: preclinical and clinical evidence. Curr Probl Cancer. 2020;44(1):100488. doi: 10.1016/j.currproblcancer.2019.06.003. [DOI] [PubMed] [Google Scholar]
- 86.Rahmani J, Manzari N, Thompson J, et al. The effect of metformin on biomarkers associated with breast cancer outcomes: a systematic review, meta-analysis, and dose-response of randomized clinical trials. Clin Transl Oncol. 2019 doi: 10.1007/s12094-019-02108-9. [DOI] [PubMed] [Google Scholar]
- 87.Fong W, To KKW. Drug repurposing to overcome resistance to various therapies for colorectal cancer. Cell Mol Life Sci. 2019 doi: 10.1007/s00018-019-03134-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 88.Aljofan M, Riethmacher D. Anticancer activity of metformin: a systematic review of the literature. Future Sci OA. 2019;5(08):FSO410. doi: 10.2144/fsoa-2019-0053. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 89.Feng Z, Zhou X, Liu N, et al. Metformin use and prostate cancer risk: a meta-analysis of cohort studies. Medicine. 2019;98(12):e14955. doi: 10.1097/MD.0000000000014955. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 90.Park YMM, Bookwalter DB, O’Brien KM, et al. A prospective study of type 2 diabetes, metformin use, and risk of breast cancer. Ann Oncol. 2021;32:351–359. doi: 10.1016/j.annonc.2020.12.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 91.Lv Z, Guo Y. Metformin and its benefits for various diseases. Front Endocrinol. 2020;11:191. doi: 10.3389/fendo.2020.00191. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 92.Khunti K, Knighton P, Zaccardi F, et al. Prescription of glucose-lowering therapies and risk of COVID-19 mortality in people with type 2 diabetes: a nationwide observational study in England. Lancet Diabetes Endocrinol. 2021;9:293–303. doi: 10.1016/S2213-8587(21)00050-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 93.Wargny M, Potier L, Gourdy P, et al. Predictors of hospital discharge and mortality in patients with diabetes and COVID-19: updated results from the nationwide CORONADO study. Diabetologia. 2021;64:778–794. doi: 10.1007/s00125-020-05351-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 94.Kow CS, Hasan SS. Mortality risk with preadmission metformin use in patients with COVID-19 and diabetes: a meta-analysis. J Med Virol. 2021;93:695–697. doi: 10.1002/jmv.26498. [DOI] [PubMed] [Google Scholar]
- 95.Lim S, Bae JH, Kwon H-S, Nauck MA. COVID-19 and diabetes mellitus: from pathophysiology to clinical management. Nat Rev Endocrinol. 2021;17:11–13. doi: 10.1038/s41574-020-00435-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 96.Bornstein SR, Rubino F, Khunti K, et al. Practical recommendations for the management of diabetes in patients with COVID-19. Lancet Diabetes Endocrinol. 2020;8:546–550. doi: 10.1016/S2213-8587(20)30152-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 97.Oshima M, Jun M, Ohkuma T, et al. The relationship between eGFR slope and subsequent risk of vascular outcomes and all-cause mortality in type 2 diabetes: the ADVANCE-ON study. Diabetologia. 2019;62:1988–1997. doi: 10.1007/s00125-019-4948-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 98.The ADVANCE Collaborative Group Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med. 2008;358:2560–2572. doi: 10.1056/NEJMoa0802987. [DOI] [PubMed] [Google Scholar]
- 99.Rosenstock J, Kahn SE, Johansen OE, CAROLINA Investigators et al. Effect of linagliptin vs. glimepiride on major adverse cardiovascular outcomes in patients with type 2 diabetes: the CAROLINA randomized clinical trial. JAMA. 2019;322(12):1155–1166. doi: 10.1001/jama.2019.13772. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 100.Rados DV, Pinto LC, Remonti LR, et al. The association between sulfonylurea use and all-cause and cardiovascular mortality: a meta-analysis with trial sequential analysis of randomized clinical trials. PLoS Med. 2016;13(4):e1001992. doi: 10.1371/journal.pmed.1001992. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 101.Azoulay L, Suissa S. Sulfonylureas and the risks of cardiovascular events and death: a methodological meta-regression analysis of the observational studies. Diabetes Care. 2017;40:706–714. doi: 10.2337/dc16-1943. [DOI] [PubMed] [Google Scholar]
- 102.Bain S, Druyts E, Balijepalli C, et al. Cardiovascular events and all-cause mortality associated with sulphonylureas compared with other antihyperglycaemic drugs: a Bayesian meta-analysis of survival data. Diabetes Obes Metab. 2017;19(03):329–335. doi: 10.1111/dom.12821. [DOI] [PubMed] [Google Scholar]
- 103.Zhuang XD, He X, Yang DY, et al. Comparative cardiovascular outcomes in the era of novel anti-diabetic agents: a comprehensive network meta-analysis of 166 371 participants from170 randomized controlled trials. Cardiovasc Diabetol. 2018;17(01):79. doi: 10.1186/s12933-018-0722-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 104.Powell WR, Christiansen CL, Miller DR. Meta-analysis of sulfonylurea therapy on long-term risk of mortality and cardiovascular events compared to other oral glucose-lowering treatments. Diabetes Ther. 2018;9(04):1431–1440. doi: 10.1007/s13300-018-0443-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 105.Simpson SH, Lee J, Choi S, et al. Mortality risk among sulfonylureas: a systematic review and network meta-analysis. Lancet Diabetes Endocrinol. 2015;3(01):43–51. doi: 10.1016/S2213-8587(14)70213-X. [DOI] [PubMed] [Google Scholar]
- 106.Hemmingsen B, Schroll JB, Lund SS, et al. Sulphonylurea monotherapy for patients with type 2 diabetes mellitus. Cochrane Database Syst Rev. 2013;4:CD009008. doi: 10.1002/14651858.CD009008.pub2. [DOI] [PubMed] [Google Scholar]
- 107.Hemmingsen B, Schroll JB, Wetterslev J, et al. Sulfonylurea versus metformin monotherapy in patients with type 2 diabetes: a Cochrane systematic review and meta-analysis of randomized clinical trials and trial sequential analysis. CMAJ Open. 2014;2(03):E162–E175. doi: 10.9778/cmajo.20130073. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 108.Vaccaro O, Masulli M, Nicolucci M, et al. Effects on the incidence of cardiovascular events of the addition of pioglitazone versus sulfonylureas in patients with type 2 diabetes inadequately controlled with metformin (TOSCA.IT): a randomized, multicenter trial. Lancet Diabetes Endocrinol. 2017;5:887–897. doi: 10.1016/S2213-8587(17)30317-0. [DOI] [PubMed] [Google Scholar]
- 109.Ogundipe O, Mazidi M, Chin KL, et al. Real-world adherence, persistence, and in-class switching during use of dipeptidyl peptidase-4 inhibitors: a systematic review and meta-analysis involving 594,138 patients with type 2 diabetes. Acta Diabetol. 2021;58:39–46. doi: 10.1007/s00592-020-01590-w. [DOI] [PubMed] [Google Scholar]
- 110.Chen K, Kang D, Yu M, et al. Direct head-to-head comparison of glycaemic durability of dipeptidyl peptidase-4 inhibitors and sulphonylureas in patients with type 2 diabetes mellitus: A meta-analysis of long-term randomized controlled trials. Diabetes Obes Metab. 2018;20:1029–1033. doi: 10.1111/dom.13147. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 111.Patorno E, Schneeweiss S, Gopalakrishnan C, et al. Using real-world data to predict findings of an ongoing phase IV cardiovascular outcome trial: cardiovascular safety of linagliptin versus glimepiride. Diabetes Care. 2019;42:2204–2210. doi: 10.2337/dc19-0069. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 112.Scirica BM, Bhatt DL, Braunwald E, et al. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med. 2013;369(14):1317–1326. doi: 10.1056/NEJMoa1307684. [DOI] [PubMed] [Google Scholar]
- 113.White WB, Cannon CP, Heller SR, et al. Alogliptin after acute coronary syndrome in patients with type 2 diabetes. N Engl J Med. 2013;369(14):1327–1335. doi: 10.1056/NEJMoa1305889. [DOI] [PubMed] [Google Scholar]
- 114.Green JB, Bethel MA, Armstrong PW, TECOS Study Group et al. Effect of sitagliptin on cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2015;373(03):232–242. doi: 10.1056/NEJMoa1501352. [DOI] [PubMed] [Google Scholar]
- 115.Rosenstock J, Perkovic V, Johansen OE, et al. Effect of linagliptin vs placebo on major cardiovascular events in adults with type 2 diabetes and high cardiovascular and renal risk: the CARMELINA randomized clinical trial. JAMA. 2019;321(01):69–79. doi: 10.1001/jama.2018.18269. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 116.Perkovic V, Toto R, Cooper ME, et al. Effects of linagliptin on cardiovascular and kidney outcomes in people with normal and reduced kidney function: secondary analysis of the CARMELINA randomized trial. Diabetes Care. 2020;43:1803–1812. doi: 10.2337/dc20-027. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 117.Monami M, Ahrén B, Dicembrini I, et al. Dipeptidyl peptidase-4 inhibitors and cardiovascular risk: a meta-analysis of randomized clinical trials. Diabetes Obes Metab. 2013;15:112–120. doi: 10.1111/dom.12000. [DOI] [PubMed] [Google Scholar]
- 118.Xu S, Zhang X, Tang L, et al. Cardiovascular effects of dipeptidylpeptidase-4 inhibitor in diabetic patients with and without established cardiovascular disease: a meta-analysis and systematic review. Postgrad Med. 2017;129:205–215. doi: 10.1080/00325481.2017.1255537. [DOI] [PubMed] [Google Scholar]
- 119.Zheng SL, Roddick AJ, Aghar-Jaffar R, et al. Association between use of sodium-glucose cotransporter 2 inhibitors, glucagon-like peptide 1 agonists, and dipeptidyl peptidase 4 inhibitors with all-cause mortality in patients with type 2 diabetes. A systematic review and meta-analysis. JAMA. 2018;319(15):1580–1591. doi: 10.1001/jama.2018.3024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 120.Ling J, Cheng P, Ge L, et al. The efficacy and safety of dipeptidyl peptidase-4 inhibitors for type 2 diabetes: a Bayesian network meta-analysis of 58 randomized controlled trials. Acta Diabetol. 2019;56:249–272. doi: 10.1007/s00592-018-1222-z. [DOI] [PubMed] [Google Scholar]
- 121.Li L, Li S, Deng K, et al. Dipeptidyl peptidase-4 inhibitors and risk of heart failure in type 2 diabetes: systematic review and meta-analysis of randomized and observational studies. BMJ. 2016;352:i610. doi: 10.1136/bmj.i610. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 122.Guo WQ, Li L, Su Q, et al. Effect of dipeptidylpeptidase-4 inhibitors on heart failure: a network meta-analysis. Value Health. 2017;20:1427–1430. doi: 10.1016/j.jval.2017.04.010. [DOI] [PubMed] [Google Scholar]
- 123.Nauck MA, Meier JJ, Cavender MA, et al. Cardiovascular actions and clinical outcomes with glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors. Circulation. 2017;136(09):849–870. doi: 10.1161/CIRCULATIONAHA.117.028136. [DOI] [PubMed] [Google Scholar]
- 124.Xie YY, Bowe B, Gibson AK, et al. Comparative effectiveness of SGLT2 inhibitors, GLP-1 receptor agonists, DPP-4 inhibitors, and sulfonylureas on risk of kidney outcomes: emulation of a target trial using health care databases. Diabetes Care. 2020;43:2859–2869. doi: 10.2337/dc20-1890. [DOI] [PubMed] [Google Scholar]
- 125.Sinha B, Ghosal S. Meta-analyses of the effects of DPP-4 inhibitors, SGLT2 inhibitors and GLP1 receptor analogues on cardiovascular death, myocardial infarction, stroke and hospitalization for heart failure. Diabetes Res Clin Pract. 2019;150:8–16. doi: 10.1016/j.diabres.2019.02.014. [DOI] [PubMed] [Google Scholar]
- 126.Dougherty J, Guirguis E, Thornby KA, et al. A systematic review of newer antidiabetic agents in the treatment of nonalcoholic fatty liver disease. Ann Pharmacother. 2021;55(1):65–79. doi: 10.1177/1060028020935105. [DOI] [PubMed] [Google Scholar]
- 127.Koufakis T, Mustafa OG, Zebekakis P, Kotsa K. Oral antidiabetes agents for the management of inpatient hyperglycaemia: so far, yet so close T. Diabet Med. 2020;37:1418–1426. doi: 10.1111/dme.14329. [DOI] [PubMed] [Google Scholar]
- 128.Du H, Wang DW, Chen C. The potential effects of DPP-4 inhibitors on cardiovascular system in COVID-19 patients. J Cell Mol Med. 2020;24:10274–10278. doi: 10.1111/jcmm.15674. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 129.Bonora BM, Avogaro A, Fadini GP. Disentangling conflicting evidence on DPP-4 inhibitors and outcomes of COVID-19: narrative review and meta-analysis. J Endocrinol Invest. 2021;44(7):1379–1386. doi: 10.1007/s40618-021-01515-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 130.Tkáč I, Raz I. Combined analysis of three large interventional trials with gliptins indicates increased incidence of acute pancreatitis in patients with type 2 diabetes. Diabetes Care. 2017;40:284–286. doi: 10.2337/dc15-1707. [DOI] [PubMed] [Google Scholar]
- 131.Pinto LC, Rados DV, Barkann SS, et al. Dipeptidyl peptidase-4 inhibitors, pancreatic cancer and acute pancreatitis: a meta-analysis with trial sequential analysis. Sci Rep. 2018;8(01):782. doi: 10.1038/s41598-017-19055-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 132.Tasanen K, Varpuluoma O, Nishie W. Dipeptidyl peptidase-4 inhibitor-associated bullous pemphigoid. Front Immunol. 2019;10:1238. doi: 10.3389/fimmu.2019.01238. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 133.Overbeek JA, Bakker M, van der Heijden AAWA, et al. Risk of dipeptidyl peptidase-4 (DPP-4) inhibitors on site specific cancer: a systematic review and meta-analysis. Diabetes Metab Res Rev. 2018;34:e3004. doi: 10.1002/dmrr.3004. [DOI] [PubMed] [Google Scholar]
- 134.Abrahami D, Douros A, Yin H, et al. Dipeptidyl peptidase-4 inhibitors and incidence of inflammatory bowel disease among patients with type 2 diabetes: population based cohort study. BMJ. 2018;360:k872. doi: 10.1136/bmj.k872. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 135.Li G, Crowley MJ, Tang H, et al. Dipeptidyl peptidase 4 inhibitors and risk of inflammatory bowel disease among patients with type 2 diabetes: a meta-analysis of randomized controlled trials. Diabetes Care. 2019;42(07):e119–e121. doi: 10.2337/dc18-1578. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 136.Storgaard H, Gluud LL, Bennett C, et al. Benefits and harms of sodium-glucose co-transporter 2 inhibitors in patients with type 2 diabetes: a systematic review and meta-analysis. PLoS ONE. 2016;11(11):e0166125. doi: 10.1371/journal.pone.0166125. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 137.Monami M, Liistro F, Scatena A, et al. Short and medium-term efficacy of sodium glucose co-transporter-2 (SGLT-2) inhibitors: a meta-analysis of randomized clinical trials. Diabetes Obes Metab. 2018;20(05):1213–1222. doi: 10.1111/dom.13221. [DOI] [PubMed] [Google Scholar]
- 138.Usman MS, Siddiqi TJ, Memon MM, et al. Sodium-glucose co-transporter 2 inhibitors and cardiovascular outcomes: a systematic review and meta-analysis. Eur J Prev Cardiol. 2018;25(05):495–502. doi: 10.1177/2047487318755531. [DOI] [PubMed] [Google Scholar]
- 139.Mishriky BM, Tanenberg RJ, Sewell KA, et al. Comparing SGLT-2 inhibitors to DPP-4 inhibitors as an add-on therapy to metformin in patients with type 2 diabetes: a systematic review and meta-analysis. Diabetes Metab. 2018;44(02):112–120. doi: 10.1016/j.diabet.2018.01.017. [DOI] [PubMed] [Google Scholar]
- 140.Seidu S, Kunutsor SK, Cos X, et al. SGLT2 inhibitors and renal outcomes in type 2 diabetes with or without renal impairment: a systematic review and meta-analysis. Prim Care Diabetes. 2018;12(03):265–283. doi: 10.1016/j.pcd.2018.02.001. [DOI] [PubMed] [Google Scholar]
- 141.Rådholm K, Wu JH, Wong MG, et al. Effects of sodium-glucose cotransporter-2 inhibitors on cardiovascular disease, death and safety outcomes in type 2 diabetes—a systematic review. Diabetes Res Clin Pract. 2018;140:118–128. doi: 10.1016/j.diabres.2018.03.027. [DOI] [PubMed] [Google Scholar]
- 142.Sinha B, Ghosal S. Meta-analyses of the effects of DPP-4 inhibitors, SGLT2 inhibitors and GLP1 receptor analogues on cardiovascular death, myocardial infarction, stroke and hospitalization for heart failure. Diabetes Res Clin Pract. 2019;150:8–16. doi: 10.1016/j.diabres.2019.02.014. [DOI] [PubMed] [Google Scholar]
- 143.Zheng SL, Roddick AJ, Aghar-Jaffar R, et al. Association between use of sodium-glucose cotransporter 2 inhibitors, glucagon-like peptide 1 agonists, and dipeptidyl peptidase 4 inhibitors with all-cause mortality in patients with type 2 diabetes: a systematic review and meta-analysis. JAMA. 2018;319(15):1580–1591. doi: 10.1001/jama.2018.3024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 144.Aronson R, Frias J, Goldman A, et al. Long-term efficacy and safety of ertugliflozin monotherapy in patients with inadequately controlled T2DM despite diet and exercise: VERTIS MONO extension study. Diabetes Obes Metab. 2018;20:1453–1460. doi: 10.1111/dom.13251. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 145.Hollander P, Hill J, Johnson J, et al. Results of VERTIS SU extension study: safety and efficacy of ertugliflozin treatment over 104 weeks compared to glimepiride in patients with type 2 diabetes mellitus inadequately controlled on metformin. Curr Med Res Opin. 2019;35(08):1335–1343. doi: 10.1080/03007995.2019.1583450. [DOI] [PubMed] [Google Scholar]
- 146.Zelniker TA, Wiviott SD, Raz I, et al. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet. 2019;393(10166):31–39. doi: 10.1016/S0140-6736(18)32590-X. [DOI] [PubMed] [Google Scholar]
- 147.Puckrin R, Saltiel MP, Reynier P, et al. SGLT-2 inhibitors and the risk of infections: a systematic review and meta-analysis of randomized controlled trials. Acta Diabetol. 2018;55(05):503–514. doi: 10.1007/s00592-018-1116-0. [DOI] [PubMed] [Google Scholar]
- 148.Lega IC, Bronskill SE, Campitelli MA, et al. Sodium glucose cotransporter 2 inhibitors and risk of genital mycotic and urinary tract infection: a population-based study of older women and men with diabetes. Diabetes Obes Metab. 2019 doi: 10.1111/dom.13820. [DOI] [PubMed] [Google Scholar]
- 149.Dave CV, Schneeweiss S, Patorno E. Comparative risk of genital infections associated with sodium glucose co-transporter-2 inhibitors. Diabetes Obes Metab. 2019;21:434–438. doi: 10.1111/dom.13531. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 150.Lega IC, Bronskill SE, Campitelli MA, et al. Sodium glucose cotransporter 2 inhibitors and risk of genital mycotic and urinary tract infection: a population-based study of older women and men with diabetes. Diabetes Obes Metab. 2019;21:2394–2404. doi: 10.1111/dom.13820. [DOI] [PubMed] [Google Scholar]
- 151.McGovern AP, Hogg M, Shields BM, et al. Risk factors for genital infections in people initiating SGLT2 inhibitors and their impact on discontinuation. BMJ Open Diab Res Care. 2020;8:e001238. doi: 10.1136/bmjdrc-2020-001238. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 152.Yang JY, Wang T, Pate V, et al. Real-world evidence on sodium-glucose cotransporter-2 inhibitor use and risk of Fournier’s gangrene. BMJ Open Diab Res Care. 2020;8:e000985. doi: 10.1136/bmjdrc-2019-000985. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 153.Silverii GA, Dicembrini I, Monami M, et al. Fournier’s gangrene and sodium-glucose co-transporter-2 inhibitors: a meta-analysis of randomized controlled trials. Diabetes Obes Metab. 2020;22:272–275. doi: 10.1111/dom.13900. [DOI] [PubMed] [Google Scholar]
- 154.EMA (2017) SGLT2 inhibitors (previously canagliflozin). www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/referrals/SGLT2_inhibitors_(previously_Canagliflozin)/human_referral_prac_000059.jsp&mid=WC0b01ac05805c5
- 155.Scheen AJ. Does lower limb amputation concern all SGLT2 inhibitors? Nat Rev Endocrinol. 2018;14(06):326–328. doi: 10.1038/s41574-018-0001-9. [DOI] [PubMed] [Google Scholar]
- 156.Fioretto P, Del Prato S, Buse JB, et al. Efficacy and safety of dapagliflozin in patients with type 2 diabetes and moderate renal impairment (CKD stage 3A): the DERIVE study) Diabetes Obes Metab. 2018 doi: 10.1111/dom.13413. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 157.Inzucchi SE, Iliev H, Pfarr E, et al. Empagliflozin and assessment of lower limb amputations in the EMPA-REG OUTCOME trial. Diabetes Care. 2018;41:e4–e5. doi: 10.2337/dc17-1551. [DOI] [PubMed] [Google Scholar]
- 158.Perkovic V, Jardine MJ, Neal B, et al. Canagliflozin and renal outcomes in type 2 diabetes and nephropathy. N Engl J Med. 2019;380:2295–2306. doi: 10.1056/NEJMoa1811744. [DOI] [PubMed] [Google Scholar]
- 159.Huang CY, Lee JK. Sodium-glucose co-transporter-2 inhibitors and major adverse limb events: a trial-level meta-analysis including 51 713 individuals. Diabetes Obes Metab. 2020;22:2348–2355. doi: 10.1111/dom.14159. [DOI] [PubMed] [Google Scholar]
- 160.Zhou Z, Jardine M, Perkovic V, et al. Canagliflozin and fracture risk in individuals with type 2 diabetes: results from the CANVAS program. Diabetologia. 2019;62(10):1854–1867. doi: 10.1007/s00125-019-4955-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 161.Perkovic V, Jardine MJ, Neal N, et al. Canagliflozin and renal outcomes in type 2 diabetes and nephropathy. N Engl J Med. 2019;380:2295–2306. doi: 10.1056/NEJMoa1811744. [DOI] [PubMed] [Google Scholar]
- 162.Mahaffey KW, Jardine MJ, Bompoint S, et al. Canagliflozin and cardiovascular and renal outcomes in type 2 diabetes mellitus and chronic kidney disease in primary and secondary cardiovascular prevention groups. Circulation. 2019;140:739–750. doi: 10.1161/CIRCULATIONAHA.119.042007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 163.Kohler S, Kaspers S, Salsali A, et al. Analysis of fractures in patients with type 2 diabetes treated with empagliflozin in pooled data from placebo-controlled trials and a head-to-head study versus glimepiride. Diabetes Care. 2018;41(08):1809–1816. doi: 10.2337/dc17-1525. [DOI] [PubMed] [Google Scholar]
- 164.Ruanpeng D, Ungprasert P, Sangtian J, et al. Sodium-glucose cotransporter 2 (SGLT2) inhibitors and fracture risk in patients with type 2 diabetes mellitus: a meta-analysis. Diabetes Metab Res Rev. 2017 doi: 10.1002/dmrr.2903. [DOI] [PubMed] [Google Scholar]
- 165.Tang HL, Li DD, Zhang JJ, et al. Lack of evidence for a harmful effect of sodium-glucose co-transporter 2 (SGLT2) inhibitors on fracture risk among type 2 diabetes patients: a network and cumulative meta-analysis of randomized controlled trials. Diabetes Obes Metab. 2016;18(12):1199–1206. doi: 10.1111/dom.12742. [DOI] [PubMed] [Google Scholar]
- 166.Li X, Li T, Cheng Y, et al. Effects of SGLT2 inhibitors on fractures and bone mineral density in type 2 diabetes: an updated meta-analysis. Diabetes Metab Res Rev. 2019;35:e3170. doi: 10.1002/dmrr.3170. [DOI] [PubMed] [Google Scholar]
- 167.Hidayat K, Du X, Shi BM. Risk of fracture with dipeptidyl peptidase-4 inhibitors, glucagon-like peptide-1 receptor agonists, or sodium-glucose cotransporter-2 inhibitors in real-world use: systematic review and meta-analysis of observational studies. Osteoporos Int. 2019;30:1923–1940. doi: 10.1007/s00198-019-04968-x. [DOI] [PubMed] [Google Scholar]
- 168.Fralick M, Schneeweiss S, Patorno E. Risk of diabetic ketoacidosis after initiation of an SGLT2 inhibitor. N Engl J Med. 2017;376:2300–2303. doi: 10.1056/NEJMc1701990. [DOI] [PubMed] [Google Scholar]
- 169.Monami M, Nreu B, Zannoni S, et al. Effects of SGLT2 inhibitors on diabetic ketoacidosis: a meta-analysis of randomised controlled trials. Diabetes Res Clin Pract. 2017;130:53–60. doi: 10.1016/j.diabres.2017.04.017. [DOI] [PubMed] [Google Scholar]
- 170.Fadini GP, Bonora BM, Avogaro A. SGLT2 inhibitors and diabetic ketoacidosis: data from the FDA adverse event reporting system. Diabetologia. 2017;60:1385–1389. doi: 10.1007/s00125-017-4301-8. [DOI] [PubMed] [Google Scholar]
- 171.Liu J, Li L, Li S, et al. Sodium-glucose co-transporter-2 inhibitors and the risk of diabetic ketoacidosis in patients with type 2 diabetes: a systematic review and meta-analysis of randomized controlled trials. Diabetes Obes Metab. 2020;22:1619–1627. doi: 10.1111/dom.14075. [DOI] [PubMed] [Google Scholar]
- 172.Thiruvenkatarajan V, Meyer EJ, Nanjappa N, et al. Perioperative diabetic ketoacidosis associated with sodium-glucose co-transporter-2 inhibitors: a systematic review. Br J Anaesth. 2019;123(01):27–36. doi: 10.1016/j.bja.2019.03.028. [DOI] [PubMed] [Google Scholar]
- 173.Milder DA, Milder TY, Kam PCA. Sodium-glucose co-transporter type-2 inhibitors: pharmacology and perioperative considerations. Anaesthesia. 2018;73:1008–1018. doi: 10.1111/anae.14251. [DOI] [PubMed] [Google Scholar]
- 174.Donnan K, Segar L. SGLT2 inhibitors and metformin: dual antihyperglycemic therapy and the risk of metabolic acidosis in type 2 diabetes. Eur J Pharmacol. 2019;846:23–29. doi: 10.1016/j.ejphar.2019.01.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 175.Mosenzon O, Wiviott SD, Cahn A, et al. Effects of dapagliflozin on development and progression of kidney disease in patients with type 2 diabetes: an analysis from the DECLARE-TIMI 58 randomised trial. Lancet Diabetes Endocrinol. 2019;7(08):606–617. doi: 10.1016/S2213-8587(19)30180-9. [DOI] [PubMed] [Google Scholar]
- 176.McMurray JJV, Solomon SD, Inzucchi SE, et al. Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med. 2019;381:1995–2008. doi: 10.1056/NEJMoa1911303. [DOI] [PubMed] [Google Scholar]
- 177.Wheeler DC, Stefánsson BV, Jongs N, et al. Effects of dapagliflozin on major adverse kidney and cardiovascular events in patients with diabetic and non-diabetic chronic kidney disease: a prespecified analysis from the DAPA-CKD trial. Lancet Diabetes Endocrinol. 2021;9:22–31. doi: 10.1016/S2213-8587(20)30369-7. [DOI] [PubMed] [Google Scholar]
- 178.Neuen BL, Young T, Heerspink HJL. SGLT2 inhibitors for the prevention of kidney failure in patients with type 2 diabetes: a systematic review and meta-analysis. Lancet Diabetes Endocrinol. 2019;7:845–854. doi: 10.1016/S2213-8587(19)30256-6. [DOI] [PubMed] [Google Scholar]
- 179.Karagiannis T, Tsapas A, Athanasiadou E, et al. GLP-1 receptor agonists and SGLT2 inhibitors for older people with type 2 diabetes: a systematic review and meta-analysis. Diabetes Res Clin Pract. 2021;174:108737. doi: 10.1016/j.diabres.2021.108737. [DOI] [PubMed] [Google Scholar]
- 180.Bae JH, Park EG, Kim S, et al. Comparative renal effects of dipeptidyl peptidase-4 inhibitors and sodium-glucose cotransporter 2 inhibitors on individual outcomes in patients with type 2 diabetes: a systematic review and network meta-analysis. Endocrinol Metab (Seoul) 2021;36(2):388–400. doi: 10.3803/EnM.2020.912. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 181.Palmer SC, Tendal B, Mustafa RA, et al. Sodium-glucose cotransporter protein-2 (SGLT-2) inhibitors and glucagon-like peptide-1 (GLP-1) receptor agonists for type 2 diabetes: systematic review and network meta-analysis of randomised controlled trials. BMJ. 2021;372:m4573. doi: 10.1136/bmj.m4573. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 182.Inzucchi SE, Khunti K, Fitchett DH, et al. Cardiovascular benefit of empagliflozin across the spectrum of cardiovascular risk factor control in the EMPA-REG OUTCOME trial. J Clin Endocrinol Metab. 2020;105(9):3025–3035. doi: 10.1210/clinem/dgaa321. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 183.McGuire DK, Zinman B, Inzucchi SE, et al. Effects of empagliflozin on first and recurrent clinical events in patients with type 2 diabetes and atherosclerotic cardiovascular disease: a secondary analysis of the EMPA-REG OUTCOME trial. Lancet Diabetes Endocrinol. 2020;8:949–959. doi: 10.1016/S2213-8587(20)30344-2. [DOI] [PubMed] [Google Scholar]
- 184.Wanner C, Inzucchi SE, Zinman B. Empagliflozin and progression of kidney disease in type 2 diabetes. N Engl J Med. 2016;375:323–334. doi: 10.1056/NEJMoa1515920. [DOI] [PubMed] [Google Scholar]
- 185.Cherney DZI, Zinman B, Inzucchi SE, et al. Effects of empagliflozin on the urinary albumin-to-creatinine ratio in patients with type 2 diabetes and established cardiovascular disease: an exploratory analysis from the EMPA-REG OUTCOME randomised, placebo-controlled trial. Lancet Diabetes Endocrinol. 2017;5:610–621. doi: 10.1016/S2213-8587(17)30182-1. [DOI] [PubMed] [Google Scholar]
- 186.Verma S, Mazer CD, Fitchett D, et al. Empagliflozin reduces cardiovascular events, mortality and renal events in participants with type 2 diabetes after coronary artery bypass graft surgery: sub-analysis of the EMPA-REG OUTCOME® randomized trial. Diabetologia. 2018;61:1712–1723. doi: 10.1007/s00125-018-4644-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 187.Packer M, Anker SD, Butler J, et al. Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med. 2020;383:1413–1424. doi: 10.1056/NEJMoa2022190. [DOI] [PubMed] [Google Scholar]
- 188.Zou CY, Liu XK, Sang YQ, et al. Effects of SGLT2 inhibitors on cardiovascular outcomes and mortality in type 2 diabetes. A meta-analysis. Medicine. 2019;98(49):e18245. doi: 10.1097/MD.0000000000018245. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 189.Salah HM, Al’Aref SJ, Khan MS, et al. Effects of sodium-glucose cotransporter 1 and 2 inhibitors on cardiovascular and kidney outcomes in type 2 diabetes: a meta-analysis update. Am Heart J. 2021;233:86–91. doi: 10.1016/j.ahj.2020.12.007. [DOI] [PubMed] [Google Scholar]
- 190.Qiu M, Ding L, Zhou H. Effects of SGLT2 inhibitors on cardiovascular and renal outcomes in type 2 diabetes: a meta-analysis with trial sequential analysis. Medicine. 2021;100(10):e25121. doi: 10.1097/MD.0000000000025121. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 191.Palmer SC, Tendal B, Mustafa RA, et al. Sodium-glucose cotransporter protein-2 (SGLT-2) inhibitors and glucagon-like peptide-1 (GLP-1) receptor agonists for type 2 diabetes: systematic review and network meta-analysis of randomised controlled trials. BMJ. 2021;372:m4573. doi: 10.1136/bmj.m4573. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 192.Sattar N, McLaren J, Kristensen SL, et al. SGLT2 inhibition and cardiovascular events: why did EMPA-REG outcomes surprise and what were the likely mechanisms? Diabetologia. 2016;59:1333–1339. doi: 10.1007/s00125-016-3956-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 193.Ferrannini E, Mark M, Mayoux E, et al. CV protection in the EMPA-REG OUTCOME trial: a „thrifty substrate“ hypothesis. Diabetes Care. 2016;39:1108–1114. doi: 10.2337/dc16-0330. [DOI] [PubMed] [Google Scholar]
- 194.Dutka M, Bobiński R, Ulman-Włodarz I, et al. Sodium glucose cotransporter 2 inhibitors: mechanisms of action in heart failure. Heart Fail Rev. 2021;26:603–622. doi: 10.1007/s10741-020-10041-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 195.Thomas MC, Cherney DZI. The actions of SGLT2 inhibitors on metabolism, renal function and blood pressure. Diabetologia. 2018;61:2098–2210. doi: 10.1007/s00125-018-4669-0. [DOI] [PubMed] [Google Scholar]
- 196.Yurista SR, Chong CR, Badimon JJ, et al. Therapeutic potenzial of ketone bodies for patients with cardiovascular disease: JACC state-of-the-art review. J Am Coll Cardiol. 2021;77(13):1660–1669. doi: 10.1016/j.jacc.2020.12.065. [DOI] [PubMed] [Google Scholar]
- 197.https://www.gba.de/downloads/40-268-4342/2017-04-20_DMPARL_Aenderung-Anlage-1_DMP-Diabetes-mellitus_TrG.pdf
- 198.Cannon CP, Pratley R, Dagogo-Jack S, et al. Cardiovascular outcomes with ertugliflozin in type 2 diabetes. N Engl J Med. 2020;383:1425–1435. doi: 10.1056/NEJMoa2004967. [DOI] [PubMed] [Google Scholar]
- 199.Rosenstock J, Frias J, Páll D, et al. Effect of ertugliflozin on glucose control, body weight, blood pressure and bone density in type 2 diabetes mellitus inadequately controlled on metformin monotherapy (VERTIS MET) Diabetes Obes Metab. 2018;20(3):520–529. doi: 10.1111/dom.13103. [DOI] [PubMed] [Google Scholar]
- 200.Hollander P, Liu J, Hill J, et al. Ertugliflozin compared with glimepiride in patients with type 2 diabetes mellitus inadequately controlled on metformin: the VERTIS SU randomized study. Diabetes Ther. 2018;9(1):193–207. doi: 10.1007/s13300-017-0354-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 201.Cherney DZI, Heerspink HJL, Frederich R, et al. Effects of ertugliflozin on renal function over 104 weeks of treatment: a post hoc analysis of two randomised controlled trials. Diabetologia. 2020;63:1128–1140. doi: 10.1007/s00125-020-05133-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 202.Cherney DZI, Charbonnel B. Cosentino F effects of ertugliflozin on kidney composite outcomes, renal function and albuminuria in patients with type 2 diabetes mellitus: an analysis from the randomised VERTIS CV trial; VERTIS CV investigators. Diabetologia. 2021;64(6):1256–1267. doi: 10.1007/s00125-021-05407-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 203.Marrs JC, Anderson SL. Ertugliflozin in the treatment of type 2 diabetes mellitus. Drugs Context. 2020;9:2020-7-4. doi: 10.7573/dic.2020-7-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 204.Yu J, Li J, Leaver PJ, et al. Effects of canagliflozin on myocardial infarction: a post hoc analysis of the CANVAS program and CREDENCE trial. Cardiovasc Res. 2021 doi: 10.1093/cvr/cvab128. [DOI] [PubMed] [Google Scholar]
- 205.Bhatt DL, Szarek M, Steg PG, et al. Sotagliflozin in patients with diabetes and recent worsening heart failure. N Engl J Med. 2021;384:117–128. doi: 10.1056/NEJMoa2030183. [DOI] [PubMed] [Google Scholar]
- 206.Bhatt DL, Szarek M, Pitt B, et al. Sotagliflozin in patients with diabetes and chronic kidney disease. N Engl J Med. 2021;384:129–139. doi: 10.1056/NEJMoa2030186. [DOI] [PubMed] [Google Scholar]
- 207.Levin PA, Nguyen H, Wittbrodt ET, et al. Glucagon-like peptide-1 receptor agonists: a systematic review of comparative effectiveness research. Diabetes Metab Syndr Obes. 2017;10:123–139. doi: 10.2147/DMSO.S130834. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 208.MacIsaac RJ. Dulaglutide and insulin: how can the AWARD studies help guide clinical practice? Diabetes Ther. 2020;11:1627–1638. doi: 10.1007/s13300-020-00863-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 209.Gerstein HC, Colhoun HM, Dagenais GR, et al. Dulaglutide and renal outcomes in type 2 diabetes: an exploratory analysis of the REWIND randomized, placebo-controlled trial. Lancet. 2019;394:131–138. doi: 10.1016/S0140-6736(19)31150-X. [DOI] [PubMed] [Google Scholar]
- 210.Dagenais GR, Rydén L, Leiter LA, et al. Total cardiovascular or fatal events in people with type 2 diabetes and cardiovascular risk factors treated with dulaglutide in the REWIND trail: a post hoc analysis. Cardiovasc Diabetol. 2020;19:199. doi: 10.1186/s12933-020-01179-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 211.Lundgren JR, Janus C, Jensen SBK, et al. Healthy weight loss maintenance with exercise, liraglutide, or both combined. N Engl J Med. 2021;384:1719–1730. doi: 10.1056/NEJMoa2028198. [DOI] [PubMed] [Google Scholar]
- 212.Marso SP, Daniels GH, Brown-Frandsen K, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2016;375:311–322. doi: 10.1056/NEJMoa1603827. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 213.Verma S, Bhatt DL, Bain SC, et al. Effect of liraglutide on cardiovascular events in patients with type 2 diabetes mellitus and polyvascular disease. Circulation. 2018;137(20):2179–2183. doi: 10.1161/CIRCULATIONAHA.118.033898. [DOI] [PubMed] [Google Scholar]
- 214.Marso SP, Nauck MA, Monk Fries T, et al. Myocardial infarction subtypes in patients with type 2 diabetes mellitus and the effect of liraglutide therapy (from the LEADER trial) Am J Cardiol. 2018;121:1467–1470. doi: 10.1016/j.amjcard.2018.02.030. [DOI] [PubMed] [Google Scholar]
- 215.Duan CM, Wan TF, Wang Y, et al. Cardiovascular outcomes of liraglutide in patients with type 2 diabetes. A systematic review and meta-analysis. Medicine. 2019;98(46):e17860. doi: 10.1097/MD.0000000000017860. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 216.Mann JFE, Ørsted DD, Buse JB. Liraglutide and renal outcomes in type 2 diabetes. N Engl J Med. 2017;377:839–848. doi: 10.1056/NEJMoa1616011. [DOI] [PubMed] [Google Scholar]
- 217.Kristensen SL, Rørth R, Jhund PS. Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet Diabetes Endocrinol. 2019;7(10):776–785. doi: 10.1016/S2213-8587(19)30249-9. [DOI] [PubMed] [Google Scholar]
- 218.Liu J, Li L, Deng K, et al. Incretin based treatments and mortality in patients with type 2 diabetes: systematic review and meta-analysis. BMJ. 2017;357:j2499. doi: 10.1136/bmj.j2499. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 219.Mishriky BM, Cummings DM, Powell JR, et al. Comparing once-weekly semaglutide to incretin-based therapies in patients with type 2 diabetes: a systematic review and meta-analysis. Diabetes Metab. 2019;45:102–109. doi: 10.1016/j.diabet.2018.09.002. [DOI] [PubMed] [Google Scholar]
- 220.Wilding JPH, Batterham RL, Calanna S, STEP 1 Study Group et al. Once-weekly semaglutide in adults with overweight or obesity. N Engl J Med. 2021;384(11):989. doi: 10.1056/NEJMoa2032183. [DOI] [PubMed] [Google Scholar]
- 221.Wadden TA, Bailey TS, Billings LK, STEP 3 Investigators et al. Effect of subcutaneous semaglutide vs placebo as an adjunct to intensive behavioral therapy on body weight in adults with overweight or obesity: the STEP 3 randomized clinical trial. JAMA. 2021;325(14):1403–1413. doi: 10.1001/jama.2021.1831. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 222.Rubino D, Abrahamsson N, Davies M, STEP 4 Investigators et al. Effect of continued weekly subcutaneous semaglutide vs placebo on weight loss maintenance in adults with overweight or obesity: the STEP 4 randomized clinical trial. JAMA. 2021;325(14):1414–1425. doi: 10.1001/jama.2021.3224. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 223.Leiter LA, Bain SC, Hramiak I, et al. Cardiovascular risk reduction with once-weekly semaglutide in subjects with type 2 diabetes: a post hoc analysis of gender, age, and baseline CV risk profile in the SUSTAIN 6 trial. Cardiovasc Diabetol. 2019;18:73. doi: 10.1186/s12933-019-0871-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 224.Avgerinos I, Michailidis T, Liakos A, et al. Oral semaglutide for type 2 diabetes: a systematic review and meta-analysis. Diabetes Obes Metab. 2020;22:335–345. doi: 10.1111/dom.13899. [DOI] [PubMed] [Google Scholar]
- 225.Husain M, Bain SC, Holst AG, Mark T, Rasmussen S, Lingvay I. Effects of semaglutide on risk of cardiovascular events across a continuum of cardiovascular risk: combined post hoc analysis of the SUSTAIN and PIONEER trials. Cardiovasc Diabetol. 2020;19(1):156. doi: 10.1186/s12933-020-01106-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 226.Nauck MA, Quast DR. Cardiovascular safety and benefits of semaglutide in patients with type 2 diabetes: findings from SUSTAIN 6 and PIONEER 6. Front Endocrinol (Lausanne) 2021;12:645566. doi: 10.3389/fendo.2021.645566. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 227.Zheng SL, Roddick AJ, Aghar-Jaffar R, et al. Association between use of sodium-glucose cotransporter 2 inhibitors, glucagon-like peptide 1 agonists, and dipeptidyl peptidase 4 inhibitors with all-cause mortality in patients with type 2 diabetes. A systematic review and meta-analysis. JAMA. 2018;319(15):1580–1591. doi: 10.1001/jama.2018.3024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 228.Dicembrini I, Nreu B, Scatena A, et al. Microvascular effects of glucagon-like peptide-1 receptor agonists in type 2 diabetes: a meta-analysis of randomized controlled trials. Acta Diabetol. 2017;54:933–941. doi: 10.1007/s00592-017-1031-9. [DOI] [PubMed] [Google Scholar]
- 229.Mann JFE, Hansen T, Idorn T, et al. Effects of once-weekly subcutaneous semaglutide on kidney function and safety in patients with type 2 diabetes: a post-hoc analysis of the SUSTAIN 1–7 randomised controlled trials. Lancet Diabetes Endocrinol. 2020;11:880–893. doi: 10.1016/S2213-8587(20)30313-2. [DOI] [PubMed] [Google Scholar]
- 230.Home PD, Ahrén B, Reusch JEB, et al. Three-year data from 5 HARMONY phase 3 clinical trials of albiglutide in type 2 diabetes mellitus: longterm efficacy with or without rescue therapy. Diabetes Res Clin Pract. 2017;131:49–60. doi: 10.1016/j.diabres.2017.06.013. [DOI] [PubMed] [Google Scholar]
- 231.Ahrén B, Carr MC, Murphy K, et al. Albiglutide for the treatment of type 2 diabetes mellitus: an integrated safety analysis of the HARMONY phase 3 trials. Diabetes Res Clin Pract. 2017;126:230–239. doi: 10.1016/j.diabres.2017.02.017. [DOI] [PubMed] [Google Scholar]
- 232.Rosenstock J, Nino A, Soffer J, et al. Impact of a weekly glucagon-like peptide 1 receptor agonist, albiglutide, on glycemic control and on reducing prandial insulin use in type 2 diabetes inadequately controlled on multiple insulin therapy: a randomized trial. Diabetes Care. 2020;43:2509–2518. doi: 10.2337/dc19-2316. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 233.Fudim M, White J, Pagidipati NJ, et al. Effect of once-weekly exenatide in patients with type 2 diabetes mellitus with and without heart failure and heart failure-related outcomes. Insights from the EXSCEL trial. Circulation. 2019;140:1613–1622. doi: 10.1161/CIRCULATIONAHA.119.041659. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 234.Bonora BM, Avogaro A, Fadini GP. Effects of exenatide long-acting release on cardiovascular events and mortality in patients with type 2 diabetes: a systematic review and meta-analysis of randomized controlled trials. Acta Diabetol. 2019;56:1051–1060. doi: 10.1007/s00592-019-01347-0. [DOI] [PubMed] [Google Scholar]
- 235.Jabbour SA, Frías JP, Ahmed A, et al. Efficacy and safety over 2 years of exenatide plus dapagliflozin in the DURATION-8 study: a multicenter, double-blind, phase 3, randomized controlled trial. Diabetes Care. 2020;43(10):2528–2536. doi: 10.2337/dc19-1350. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 236.Bethel MA, Patel RA, Merrill P, et al. Cardiovascular outcomes with glucagon-like peptide-1 receptor agonists in patients with type 2 diabetes: a meta-analysis. Lancet Diabetes Endocrinol. 2018;6:105–113. doi: 10.1016/S2213-8587(17)30412-6. [DOI] [PubMed] [Google Scholar]
- 237.van der Aart—van der Beek AB, van Raalte DH, Guja C, et al. Exenatide once weekly decreases urinary albumin excretion in patients with type 2 diabetes and elevated albuminuria: pooled analysis of randomized active controlled clinical trials. Diabetes Obes Metab. 2020;22:1556–1566. doi: 10.1111/dom.14067. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 238.Home P, Blonde L, Kalra S, et al. Insulin glargine/lixisenatide fixed-ratio combination (iGlarLixi) compared with premix or addition of meal-time insulin to basal insulin in people with type 2 diabetes: a systematic review and Bayesian network meta-analysis. Diabetes Obes Metab. 2020;22(11):2179–2188. doi: 10.1111/dom.14148. [DOI] [PubMed] [Google Scholar]
- 239.Gerstein HC, Sattar N, Rosenstock J, et al. Cardiovascular and renal outcomes with efpeglenatide in type 2 diabetes. N Engl J Med. 2021;385(10):896–907. doi: 10.1056/NEJMoa2108269. [DOI] [PubMed] [Google Scholar]
- 240.Frias JP, Nauck MA, Van J, et al. Efficacy and tolerability of tirzepatide, a dual glucose-dependent insulinotropic peptide and glucagon-like peptide-1 receptor agonist in patients with type 2 diabetes: A 12-week, randomized, double-blind, placebo-controlled study to evaluate different dose-escalation regimens. Diabetes Obes Metab. 2020;22:938–946. doi: 10.1111/dom.13979. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 241.Nauck MA, Wefers J, Meier JJ. Treatment of type 2 diabetes: challenges, hopes, and anticipated successes. Lancet Diabetes Endocrinol. 2021;9(8):525–544. doi: 10.1016/S2213-8587(21)00113-3. [DOI] [PubMed] [Google Scholar]
- 242.Rosenstock J, Wysham C, Frías JP, et al. Efficacy and safety of a novel dual GIP and GLP-1 receptor agonist tirzepatide in patients with type 2 diabetes (SURPASS-1): a double-blind, randomised, phase 3 trial. Lancet. 2021;398(10295):143–155. doi: 10.1016/S0140-6736(21)01324-6. [DOI] [PubMed] [Google Scholar]
- 243.Frías JP, Davies MJ, Rosenstock J. Tirzepatide versus semaglutide once weekly in patients with type 2 diabetes; SURPASS-2 investigators. N Engl J Med. 2021 doi: 10.1056/NEJMoa2107519. [DOI] [PubMed] [Google Scholar]
- 244.Hartman ML, Sanyal AJ, Loomba R, et al. Effects of novel dual GIP and GLP-1 receptor agonist tirzepatide on biomarkers of nonalcoholic steatohepatitis in patients with type 2 diabetes. Diabetes Care. 2020;43:1352–1355. doi: 10.2337/dc19-1892. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 245.Wilson JM, Nikooienejad A, Robins DA, et al. The dual glucose-dependent insulinotropic peptide andglucagon-like peptide-1 receptor agonist, tirzepatide, improves lipoprotein biomarkers associated with insulin resistance and cardiovascular risk in patients with type 2 diabetes. Diabetes Obes Metab. 2020;22:2451–2459. doi: 10.1111/dom.14174. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 246.Min T, Bain SC. The role of tirzepatide, dual GIP and GLP-1 receptor agonist, in the management of type 2 diabetes: the SURPASS clinical trials. Diabetes Ther. 2021;12:143–157. doi: 10.1007/s13300-020-00981-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 247.Vilsbøll T, Bain SC, Leiter LA, et al. Semaglutide, reduction in glycated haemoglobin and the risk of diabetic retinopathy. Diabetes Obes Metab. 2018;20:889–897. doi: 10.1111/dom.13172. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 248.Monami M, Nreu B, Scatena A, et al. Safety issues with glucagon-like peptide-1 receptor agonists (pancreatitis, pancreatic cancer and cholelithiasis): data from randomized controlled trials. Diabetes Obes Metab. 2017;19(09):1233–1241. doi: 10.1111/dom.12926. [DOI] [PubMed] [Google Scholar]
- 249.Abd El Aziz M, Cahyadi O, Meier JJ, et al. Incretin-based glucose-lowering medications and the risk of acute pancreatitis and malignancies: a meta-analysis based on cardiovascular outcomes trials. Diabetes Obes Metab. 2020;22:699–704. doi: 10.1111/dom.13924. [DOI] [PubMed] [Google Scholar]
- 250.Cao C, Yang S, Zhou Z. GLP-1 receptor agonists and risk of cancer in type 2 diabetes: an updated meta-analysis of randomized controlled trials. Endocrine. 2019;66:157–165. doi: 10.1007/s12020-019-02055-z. [DOI] [PubMed] [Google Scholar]
- 251.Azoulay L, Filion KB, Platt RW, et al. Association between incretin-based drugs and the risk of acute pancreatitis. JAMA Intern Med. 2016;176(10):1464–1473. doi: 10.1001/jamainternmed.2016.1522. [DOI] [PubMed] [Google Scholar]
- 252.Wang T, Wang F, Gou Z, et al. Using real-world data to evaluate the association of incretin-based therapies with risk of acute pancreatitis: a meta-analysis of 1324 515 patients from observational studies. Diabetes Obes Metab. 2015;17:32–41. doi: 10.1111/dom.12386. [DOI] [PubMed] [Google Scholar]
- 253.Ueda P, Wintzell V, Melbye M, et al. Use of incretin-based drugs and risk of cholangiocarcinoma: Scandinavian cohort study. Diabetologia. 2021 doi: 10.1007/s00125-021-05508-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 254.Piccoli GF, Mesquita LA, Stein C, et al. Do GLP-1 receptor agonists increase the risk of breast cancer? A systematic review and meta-analysis. J Clin Endocrinol Metab. 2021;106(3):912–921. doi: 10.1210/clinem/dgaa891. [DOI] [PubMed] [Google Scholar]
- 255.Newsome PN, Buchholtz K, Cusi K, et al. A placebo-controlled trial of subcutaneous semaglutide in nonalcoholic steatohepatitis. N Engl J Med. 2021;384:1113–1124. doi: 10.1056/NEJMoa2028395. [DOI] [PubMed] [Google Scholar]
- 256.Mantsiou C, Karagiannis T, Kakotrichi P, et al. Glucagon-like peptide-1 receptor agonists and sodium-glucose co-transporter-2 inhibitors as combination therapy for type 2 diabetes: a systematic review and meta-analysis. Diabetes Obes Metab. 2020;22(10):1857–1868. doi: 10.1111/dom.14108. [DOI] [PubMed] [Google Scholar]
- 257.Russell-Jones D, Pouwer F, Khunti K. Identification of barriers to insulin therapy and approaches to overcoming them. Diabetes Obes Metab. 2018;20:488–496. doi: 10.1111/dom.13132. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 258.Landgraf R, Aberle J. Hundert Jahre – Insulin bleibt aktuell und notwendig. Diabetologie. 2021;16:1–13. [Google Scholar]
- 259.Marso SP, McGuire DK, Zinman B, et al. Efficacy and safety of degludec versus glargine in type 2 diabetes. N Engl J Med. 2017;377(08):723–732. doi: 10.1056/NEJMoa1615692. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 260.Pieber TR, Marso SP, McGuire DK, et al. DEVOTE 3: temporal relationships between severe hypoglycaemia, cardiovascular outcomes and mortality. Diabetologia. 2018;61:58–65. doi: 10.1007/s00125-017-4422-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 261.Lau IT, Lee KF, So WY, et al. Insulin glargine 300 U/mL for basal insulin therapy in type 1 and type 2 diabetes mellitus. Diabetes Metab Syndr Obes. 2017;10:273–284. doi: 10.2147/DMSO.S131358. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 262.Ritzel R, Roussel R, Giaccari A, et al. Better glycaemic control and less hypoglycaemia with insulin glargine 300 U/mL vs glargine 100 U/mL: 1-year patient-level meta-analysis of the EDITION clinical studies in people with type 2 diabetes. Diabetes Obes Metab. 2018;20:541–548. doi: 10.1111/dom.13105. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 263.Bonadonna RC, Renard E, Cheng A, et al. Switching to insulin glargine 300 U/mL: Is duration of prior basal insulin therapy important? Diabetes Res Clin Pract. 2018;142:19–25. doi: 10.1016/j.diabres.2018.03.041. [DOI] [PubMed] [Google Scholar]
- 264.Linnebjerg H, Lam EC, Seger ME, et al. Comparison of the pharmacokinetics and pharmacodynamics of LY2963 016 insulin glargine and EU and US-approved versions of lantus insulin glargine in healthy subjects: three randomized euglycemic clamp studies. Diabetes Care. 2015;38:2226–2233. doi: 10.2337/dc14-2623. [DOI] [PubMed] [Google Scholar]
- 265.Rosenstock J, Hollander P, Bhargava A, et al. Similar efficacy and safety of LY2963 016 insulin glargine and insulin glargine (Lantus®) in patients with type 2 diabetes who were insulin-naïve or previously treated with insulin glargine: a randomized, double-blind controlled trial (ELEMENT 2 study) Diabetes Obes Metab. 2015;17:734–741. doi: 10.1111/dom.12482. [DOI] [PubMed] [Google Scholar]
- 266.Yamada T, Kamata R, Ishinohachi K, et al. Biosimilar vs originator insulins: systematic review and meta-analysis. Diabetes Obes Metab. 2018;20:1787–1792. doi: 10.1111/dom.13291. [DOI] [PubMed] [Google Scholar]
- 267.But A, De Bruin ML, Bazelier MT, et al. Cancer risk among insulin users: comparing analogues with human insulin in the CARING five-country cohort study. Diabetologia. 2017;60:1691–1703. doi: 10.1007/s00125-017-4312-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 268.Maiorino MI, Chiodini P, Bellastella G, et al. Insulin and glucagon-like peptide1 receptor agonist combination therapy in type 2 diabetes: a systematic review and meta-analysis of randomized controlled trials. Diabetes Care. 2017;40:614–624. doi: 10.2337/dc16-1957. [DOI] [PubMed] [Google Scholar]
- 269.Guja C, Frías JP, Somogyi A, et al. Effect of exenatide QW or placebo, both added to titrated insulin glargine, in uncontrolled type 2 diabetes: the DURATION-7 randomized study. Diabetes Obes Metab. 2018;20:1602–1161. doi: 10.1111/dom.13266. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 270.Rodbard HW, Lingvay I, Reed J, et al. Semaglutide added to basal insulin in type 2 diabetes (SUSTAIN 5): a randomized, controlled trial. J Clin Endocrinol Metab. 2018;103(06):2291–2301. doi: 10.1210/jc.2018-00070. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 271.Huthmacher JA, Meier JJ, Nauck MA. Efficacy and safety of short- and long-acting glucagon-like peptide 1 receptor agonists on a background of basal insulin in type 2 diabetes: a meta-analysis. Diabetes Care. 2020;43:2303–2312. doi: 10.2337/dc20-0498. [DOI] [PubMed] [Google Scholar]
- 272.Gentile S, Fusco A, Colarusso S, et al. A randomized, open-label, comparative, crossover trial on preference, efficacy, and safety profiles of lispro insulin U-100 versus concentrated lispro insulin U-200 in patients with type 2 diabetes mellitus: a possible contribution to greater treatment adherence. Expert Opin Drug Saf. 2018;17(05):445–450. doi: 10.1080/14740338.2018.1453495. [DOI] [PubMed] [Google Scholar]
- 273.Heise T, Hövelmann U, Brøndsted L, et al. Faster-acting insulin aspart: earlier onset of appearance and greater early pharmacokinetic and pharmacodynamic effects than insulin aspart. Diabetes Obes Metab. 2015;17:682–688. doi: 10.1111/dom.12468. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 274.Bowering K, Case C, Harvey J, et al. Faster aspart versus insulin aspart as part of a basal-bolus regimen in inadequately controlled type 2 diabetes: the ONSET 2 trial. Diabetes Care. 2017;40(07):951–957. doi: 10.2337/dc16-1770. [DOI] [PubMed] [Google Scholar]
- 275.Leohr J, Dellva MA, Coutant DE, et al. Pharmacokinetics and glucodynamics of ultra rapid lispro (URLi) versus Humalog(®) (lispro) in patients with type 2 diabetes mellitus: a phase I randomized, crossover study. Clin Pharmacokinet. 2020;59(12):1601–1610. doi: 10.1007/s40262-020-00901-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 276.Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) (2013) Nationale VersorgungsLeitlinie Therapie des Typ-2-Diabetes – Langfassung. www.dm-therapie.versorgungsleitlinien.de. Zugegriffen: 15. Aug. 2018. 10.6101/AZQ/000213 (1. Auflage. Version 4)
- 277.Lawall H, Huppert P, Rümenapf G, et al. Periphere arterielle Verschlusskrankheit (PAVK), Diagnostik, Therapie und Nachsorge. 2015. [Google Scholar]
- 278.Nationale VersorgungsLeitlinie (2016) Neuropathie bei Diabetes im Erwachsenenalter. www.leitlinien.de/mdb/downloads/nvl/diabetesmellitus/dm-neuropathie
- 279.Nationale VersorgungsLeitlinie (2016) Prävention und Therapie von Netzhautkomplikationen bei Diabetes. www.leitlinien.de/nvl/html/netz.hautkomplikationen
- 280.Nationale VersorgungsLeitlinie (2018) Typ-2-Diabetes Präventions- und Behandlungsstrategien für Fußkomplikationen. www.leitlinien.de/nvl/diabetes/fusskomplikationen
- 281.Roeb E, Steffen HM, Bantel H, et al. S2k-Leitlinie: Nicht-alkoholische Fettlebererkrankungen. 2015. [DOI] [PubMed] [Google Scholar]
- 282.Wang R, Song Y, Yan Y, et al. Elevated serum uric acid and risk of cardiovascular or all-cause mortality in people with suspected or definite coronary artery disease: a meta-analysis. Atherosclerosis. 2016;254:193–199. doi: 10.1016/j.atherosclerosis.2016.10.006. [DOI] [PubMed] [Google Scholar]
- 283.Nationale VersorgungsLeitlinie (2020) Chronische Herzinsuffizienz. https://www.leitlinien.de/nvl/html/nvl-chronische-herzinsuffizienz
- 284.Nationale VersorgungsLeitlinie (2019) Chronische Koronare Herzerkrankung (KHK). https://www.leitlinien.de/mdb/downloads/nvl/khk/
- 285.Nationale VersorgungsLeitlinie (2018) Nierenerkrankungen bei Diabetes im Erwachsenenalter. www.leitlinien.de/nvl/diabetes/nierenerkrankungen