Abstract
11号染色体三体嵌合体临床罕见,决策困难。本研究综合运用非侵入性产前检测、染色体核型分析、染色体微阵列分析、染色体拷贝数变异测序、荧光原位杂交等技术,对2例11号染色体三体嵌合体病例进行检测及遗传咨询。2例病例获得不同的妊娠结局,11号染色体三体的限制性胎盘嵌合胎儿表现为严重生长受限,孕25+3周终止妊娠,胎盘嵌合比例达44%;而11号染色体三体的胎儿真性低比例嵌合体,排除了单亲二倍体且超声无异常,经慎重的产前咨询后,选择继续妊娠至足月分娩,新生儿随访一年余,发育未见异常,妊娠结局良好。非侵入性产前检测对限制性胎盘嵌合具有一定的检测效能,但也可能漏诊胎儿真性嵌合体病例,非侵入性产前检测结果阳性而侵入性产前检测未发现异常的病例,需重视咨询并加强妊娠期管理。
Keywords: 11号染色体三体嵌合体, 胎儿真性嵌合体, 限制性胎盘嵌合体, 非侵入性产前检测, 侵入性产前检测
Abstract
Trisomy 11 mosaicism is clinically rare, for which making diagnostic and treatment decisions can be challenging. In this study, we used noninvasive prenatal testing, chromosome karyotype analysis, chromosome microarray analysis, copy number variation sequencing and fluorescence in situ hybridization for detecting trisomy 11 mosaicism in two cases and provided them with genetic counseling. In one of the cases, the fetus with confined placental mosaicism trisomy 11 presented with severe growth restriction and a placental mosaic level of 44%, and pregnancy was terminated at 25+3 weeks of gestation. In the other case with true low-level fetal mosaicism of trisomy 11, the pregnancy continued after exclusion of the possibility of uniparental disomy and structural abnormalities and careful prenatal counseling. The newborn was followed up for more than one year, and no abnormality was found. Noninvasive prenatal testing is capable of detecting chromosomal mosaicism but may cause missed diagnosis of true fetal mosaicism. For cases with positive noninvasive prenatal testing but a normal karyotype of the fetus, care should be taken in prenatal counseling and pregnancy management.
Keywords: trisomy 11 mosaicism, true fetal mosaicism, confined placental mosaicism, noninvasive prenatal testing, invasive prenatal testing
染色体嵌合体是指在同一个个体内存在两个或多个染色体不同的细胞系,与遗传疾病、流产和植入前胚胎损耗有关[1]。人类胚胎在早期细胞分裂时容易出现错误,导致嵌合的发生[2, 3]。随着非侵入性产前检测(NIPT)、染色体微阵列分析(CMA),染色体拷贝数变异测序(CNV-seq)、荧光原位杂交(FISH)等检测技术在产前诊断中的日益广泛的应用,性染色体嵌合体的检出已有较多报道[4, 5],常染色体嵌合病例较少[6, 7]。11号染色体为常染色体中较大的染色体,11号染色体三体胚胎无法存活,仅在妊娠早期的流产组织中被检出。11号染色体三体胎儿真性嵌合体(TFM)病例非常罕见,截止目前仅有少数个案报道,临床结局轻重不一[8, 9];另外11号染色体涉及印记基因,11p15区域携带父源印记基因IGF2和KCNQ10T1以及母源印记基因H19和CDKNIC,父源性及母源性11号染色体单亲二倍体(UPD)病例均可能导致不良妊娠结局[8]。11号染色体限制性胎盘嵌合体(CPM)也非常罕见,对胎儿的预后的影响可借鉴的资料很少[10]。涉及11号染色体嵌合体的胎儿预后存在不确定性,遗传咨询、临床决策存在很大困难,是临床需要关注的挑战和难题。新的产前诊断技术的应用,为常染色体嵌合体病例提供了更多的研究手段,本文对1例11号染色体TFM和1例11号染色体CPM病例的胎儿结局及遗传学检测进行分析,以期为此类病例的研究及临床处理提供参考。
1. 资料和方法
1.1. 资料
2例病例均于本研究单位进行孕期检查、遗传学分析并随访结局,研究已获得孕妇及其家人的知情同意,并获得伦理委员会批准(S2019-112-01)。
1.2. 染色体核型分析
超声引导下羊膜腔穿刺抽取羊水20 mL,进行细胞培养,观察到细胞生长到5~6个大的克隆时即可收获细胞,行常规G显带染色体核型分析。使用北昂医药公司的图像分析软件V4.20,分析制备至少30组良好的中期分裂像,细胞核型图按人类遗传学国际命名法要求进行分析。
1.3. 单核苷酸多态性微阵列(SNP array)及数据分析
留取7~10 mL羊水提取DNA,将提取的DNA用TE缓冲液溶解至约50 ng/μL。采用琼脂糖凝胶电泳和NanoDropTM分光光度计(Thermo Fisher Scientific Inc., USA)测定提取DNA的数量和质量。质控合格的样品用于后续SNP array。实验流程包括:DNA消化和连接、PCR扩增和纯化、定量和片段化、标记、微阵列杂交、洗染和扫描,将数据导入ChAS 4.0(Affymetrix)软件中进行分析,报告阈值设为≥25探针/25 Kb,参考数据库包括UCSC、OMIM、DECIPHER、DGV和PubMed。
1.4. CNV-seq
留取10~15 mL羊水,提取基因组DNA,经过酶切、末端修复、纯化等步骤后使用PCR技术扩增,完成建库并测序。对所得数据进行质量评估,经过标准化等步骤对数据进行矫正,最后得到最终的cnv结果。下机数据经过序列比对、去重、GC与窗口矫正后,通过统计算法进行CNV变异分析,得到变异分析结果,结果质控后,结合OMIM、HGMD、DGV等数据库对变异结果进行注释及变异半自动化分类,输出信息分析结果表格,对变异进行解读判定。
1.5. 间期FISH
将羊水穿刺采集的10 mL样本经过离心、消化、低渗、固定等处理后制片,使用雅培公司提供的试剂盒探针进行检测后分析,探针定位于11p11.1-q11.1(绿色)。镜检使用图像分析软件Cytovision,20倍镜下找到可计数的细胞,转换到高倍镜下观察细胞内信号,每个杂交区至少计数30个细胞,如遇到低比例嵌合情况相应加大计数,信号不明确需要重复实验。
1.6. NIPT
抽取5 mL孕妇外周血经双重离心法处理。所得胎儿游离DNA(cfDNA)质控合格后,使用NIFTY®全因1.0试剂盒(华大基因)进行文库制备,然后使用BGISEQ-500高通量测序仪进行测序。测序数据质控和去接头后,比对到人类参考基因组(hg19)上,采用Z检验判断待检样本与正常样本是否存在显著性差异,来判断是否存在染色体非整倍性。
2. 结果
2.1. 病例1
孕妇35岁,G3P1,既往月经规律,自然妊娠,12+6周NT超声未见异常,胎儿大小与停经周数相符(头臀长6.3 cm)。孕15周NIPT提示11号染色体数目增多(Z= 9.139),18+3周超声提示胎儿偏小约5 d(表 1),同天行羊水穿刺,行胎儿染色体核型分析及CMA检测,结果未见异常,孕22+5周超声提示胎儿偏小2周(小于10 th),胎儿中上腹部肠管轻度增宽(图 1A),宽约0.76 cm,长约4.7 cm,肠管蠕动不明显,肠壁回声增强。查风湿免疫相关化验及TORCH检查均未见异常,血压血糖正常。25+2周超声提示胎儿偏小4周(小于1 th),胎儿脐动脉舒张期血流缺失,大脑中动脉舒张期血流速度增高,血流阻力降低(图 1B、C)。考虑胎儿为早发型严重FGR,预后不良,孕妇决定引产,25+3周行羊膜腔注射利凡诺引产,胎儿娩出后体质量为450 g,身长29 cm,外观未见异常。胎盘母体面及胎儿面不同区域各取4块样本,进行CNV-seq验证提示为11号染色体三体嵌合,嵌合比例为44%(图 2)。
表 1.
T11 CPM病例不同孕周胎儿超声测量值
Ultrasonographic measurements of the CPM11 fetal at different gestational ages
| Weeks | BPD(cm) | FL(cm) | AC(cm) | HC(cm) | weight(g) |
| BPD: Biparietal diameter; FL: Femur length; AC: Abdomen circumference; HC: Head circumference. | |||||
| 18+3 | 4.1 | 2.1 | - | - | - |
| 22+5 | 4.9 | 3.1 | 15.5 | 18.2 | 345 |
| 25+2 | 5.3 | 3.3 | 16.8 | 20.2 | 414 |
图 1.

T11限制性胎盘嵌合病例超声图像
Ultrasound image of the CPM11. A: Fetal bowel dilatation; B: Disappearance of the diastolic blood flow spectrum; C: Decreased blood flow resistance of the middle cerebral artery.
图 2.

T11 CPM胎盘验证结果:纵轴为待测样本拷贝数与参照物拷贝数之比,正常二倍体为1.0;11号染色体未达到染色体三体的水平(1.5),嵌合比例约44%
Placental testing of the CPM 11. The vertical axis is the ratio of the copy number of the tested sample to the reference (the ratio of diploid is 1.0). Chromosome 11 does not reach the level of trisomy (1.5), and the mosaic level for T11 was 44%.
2.2. 病例2
孕妇23岁,G1P0,自然妊娠,16+5周血清学筛查提示T18高风险,风险值1∶225,咨询后要求先行NIPT,结果未提示异常,后行羊水穿刺染色体核型为47,XN,+11[5]/46,XN,i(11)(q10)[1]/46,XN[44](图 3A),11号染色体嵌合比例12%。排畸超声未见异常,经咨询后要求观察,建议FISH进一步确定嵌合比例,26周再次取羊水行11号染色体FISH检测及CMA检测,同时脐血穿刺。羊水间期FISH提示11号染色体三体嵌合比例20%(图 3B、C),脐血间期FISH提示嵌合比例7%,家系CMA未提示胎儿存在嵌合及UPD。孕期超声未见明显异常,告知不排除胎儿出生后智力及生长发育异常。经咨询后选择继续妊娠,足月分娩一活男婴,新生儿出生评分好,体质量4000 g,身长52 cm,查体未见异常。生后口腔拭子间期FISH检测11号染色体嵌合比例14%。胎盘母体面及胎儿面不同区域各取4块样本,进行FISH验证,11号染色体三体嵌合比例1%~5%。新生儿随访1年余生长发育正常。
图 3.
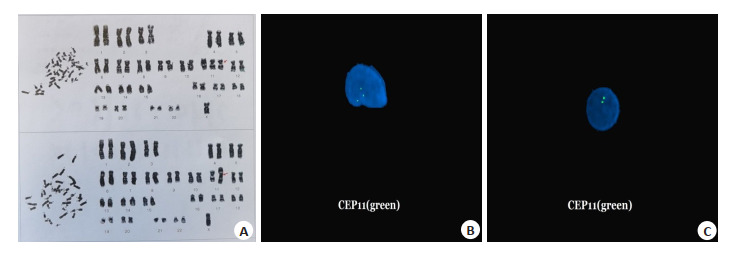
T11真性胎儿嵌合体染色体核型及FISH
Karyotype and FISH of the true fetal mosaicism of trisomy 11. A: Karyotyping of trisomy 11 mosaicism showing 47, XN, +11 (upper) and 46, XN, i (11)(q10) (lower). B: FISH of trisomy 11. C: FISH of diploid 11.
3. 讨论
常染色体非整倍体嵌合体在临床上非常罕见,常面临困难的产前咨询。产前诊断中最早可在孕早期采集绒毛时发现染色体非整倍体嵌合体,检出率约1%~2%[11]。但绒毛取样的细胞中检出的嵌合存在胎儿和胎盘单位之间不一致的可能性,区分限制性胎盘嵌合体和胎儿真性嵌合体对于判断胎儿预后具有重要的临床意义。11号染色体三体嵌合体目前仅有个案报道,临床上对于此类病例的认识非常有限。
3.1. 限制性胎盘嵌合体病例的妊娠结局分析
局限于胎盘的染色体嵌合体被称为限制性胎盘嵌合体,即胎儿和胎盘之间的染色体存在差异,胎儿染色体为正常的二倍体[1]。限制性胎盘嵌合体对于妊娠是否存在影响长期以来一直存在争议。有的研究中没有观察到胎儿异常,也有的研究认为CPM与胎儿生长受限、早产、胎儿器官畸形等妊娠结局存在相关关系。近几年的研究发现,CPM的不良妊娠结局取决于所涉及的染色体,当存在2、3、7、13、15、16或22号染色体三体的CPM时,尤其是16号染色体,不良妊娠结局的风险高;CPM的嵌合比例以及携带印记基因的UPD也被证实与不良妊娠结局具有显著的相关性[12]。CPM引起不良妊娠结局的机制可能与胎盘梗死和蜕膜血管病变明显增加有关[13]。本研究中病例1即为11号染色体限制性胎盘嵌合体,但不是由绒毛取样发现,而是排除了母体因素后,由引产后胎盘验证确诊。该病例超声发现胎儿肠管回声增强肠管蠕动慢,胎儿发育与正常儿差距越来越大,至25周时胎儿已出现严重FGR,脐动脉舒张期血流消失。引产后胎盘验证11号染色体存在44%的三体嵌合。虽然文献中并未强调11号染色体CPM与不良妊娠结局的关系,但此例提示11号染色体CPM嵌合比例较高时也会引起胎盘功能下降,甚至导致胎儿严重不良妊娠结局。
3.2. NIPT对于染色体嵌合体的检测效能
NIPT是最近几年发展起来的一种产前筛查方法,因其无创、高通量等优势,目前在临床上广泛应用于对T21、T18、T13的筛查。这项技术是基于对胎儿游离细胞DNA片段的分析,cfDNA来源于绒毛细胞滋养层释放入母血的凋亡细胞,是母体血浆循环中的一部分。NIPT类似于绒毛样本的短期培养,反映的是胎盘细胞滋养层的遗传构成。因此,NIPT可以在正常胎儿中检出异常的结果,限制性胎盘嵌合是NIPT假阳性的原因之一[14]。本研究病例1胎盘验证的结果证实存在11号染色体的限制性胎盘嵌合现象,此例中NIPT对于胎儿的假阳性结果提示的是真阳性的胎盘嵌合。由此可见,NIPT对于胎盘嵌合确实具有一定的检测效能,对于NIPT提示染色体非整倍体,尤其是侵入性产前检测未发现异常的病例,需要警惕存在胎盘嵌合并对胎盘功能造成影响,在孕期加强妊娠管理和妊娠监测。
NIPT对于胎儿/胎盘嵌合的检测也具有一定的局限性。病例2经羊水证实为11号染色体三体胎儿真性嵌合体,产后胎盘验证也存在一定比例的胎盘嵌合,但NIPT并未提示11号染色体异常。从母血中cfDNA的来源可以推测,当细胞滋养层存在嵌合细胞系时NIPT可能会有阳性结果,当细胞滋养层不存在嵌合细胞系,比如CPMII型(间充质核心存在嵌合)和TFM V型(间充质核心与羊水细胞同时存在嵌合),NIPT将是阴性的结果。TFM V型是导致NIPT假阴性的原因之一[15, 16]。NIPT未提示异常也可能与胎盘嵌合比例较低有关。
3.3. 11号染色体三体胎儿真性嵌合体的妊娠结局分析
胎儿真性嵌合体病例非常少见,绒毛中检出的嵌合病例约72%~85%羊水染色体核型为正常。11号染色体三体的真性嵌合体目前仅有几例个案报道。11号染色体存在印记基因,母源性UPD11与生长迟缓、发育不全、一侧肢体较短以及Silver-Russell综合征有关,父源性UPD11与高胰岛素血症、过度生长、肿瘤的风险以及Beckwith-Wiedemann综合征有关。因此,11号染色体三体的真性嵌合体还需要进行UPD的检测。Chen等[8, 17-19]分别报道了4例11号染色体三体真性嵌合体的病例,核型分析体外培养10~25个细胞克隆中,仅有1个克隆为11号染色体三体,剩余正常染色体的克隆排除了UPD,4例病例均妊娠结局良好。Daniel等[20]报道了一例羊水中11号染色体三体嵌合6%的病例,血液中核型正常,生后随访发育正常。Basel-Vanagaite等[21]报道了一例羊水中11号染色体三体26%嵌合的病例,脐血核型正常,出生时血液、皮肤和尿中细胞核型正常,随访1年生长发育正常,因此推测11号染色体三体嵌合可能为一个良性发现。但也有不良妊娠结局的报道,Balasubramanian等[9]报道了一例双侧肾脏发育不全和严重羊水过少的胎儿引产后皮肤样本中检出11号染色体三体嵌合,嵌合比例23%。
本研究中的病例1在未培养的羊水细胞中使用两种以上的检测方法,明确了胎儿存在11号染色体三体嵌合,并排除了UPD。脐血(7%)和羊水(20%)中嵌合比例存在一定差异,脐血中较低,可能因脐血细胞来源不如羊水细胞来源广泛[22, 23],脐血仅能提示中胚层中嵌合比例较低。孕期由有经验的超声科医生进行详细的超声检查未发现胎儿结构异常。经与孕妇及其家人进行了反复多次咨询,其决定继续妊娠。新生儿生后口腔拭子同样存在嵌合,但生长发育正常,预后良好。因此,11号染色体三体低比例嵌合的病例,排除UPD后未发现超声结构异常,胎儿可能存在良好的妊娠结局,但此类病例咨询需非常慎重,目前尚无嵌合比例低于多少胎儿预后良好的结论。
本研究通过2个病例丰富了临床对11号染色体嵌合体的认识。11号染色体三体的CPM可能影响胎盘功能,导致胎儿不良妊娠结局,而11号染色体三体的胎儿真性低比例嵌合体,排除UPD且超声无异常,可能获得良好的妊娠结局。但由于产前诊断中取材的受限,无法直接获知胎儿重要器官组织中的嵌合情况,且产前无法全面获知胎儿异常表型,如神经系统发育异常以及生长发育异常,因此,此类病例的产前咨询要充分,要使孕妇充分了解目前产前诊断技术对于嵌合病例诊断的意义及局限性,慎重考虑后再进行决策。NIPT对CPM具有一定的检测效能,但也可能漏诊胎儿真性嵌合体病例,CPM是NIPT假阳性及假阴性的原因之一,NIPT阳性结果需行侵入性产前诊断确诊。对于NIPT提示染色体非整倍体,而侵入性产前检测未发现异常的病例,要警惕存在胎盘嵌合对胎盘功能造成影响,在孕期需加强妊娠管理和妊娠监测。
Biography
谢潇潇,硕士,主治医师,E-mail: x11505764@126.com
Funding Statement
国家重点研发计划(2021YFC1005300);军队计生专项课题(19JSZ16)
Contributor Information
谢 潇潇 (Xiaoxiao XIE), Email: x11505764@126.com.
卢 彦平 (Yanping LU), Email: luyp301@163.com.
References
- 1.Taylor TH, Gitlin SA, Patrick JL, et al. The origin, mechanisms, incidence and clinical consequences of chromosomal mosaicism in humans. Hum Reprod Update. 2014;20(4):571–81. doi: 10.1093/humupd/dmu016. [DOI] [PubMed] [Google Scholar]
- 2.Mertzanidou A, Wilton L, Cheng J, et al. Microarray analysis reveals abnormal chromosomal complements in over 70% of 14 normally developing human embryos. Hum Reprod. 2013;28(1):256–64. doi: 10.1093/humrep/des362. [DOI] [PubMed] [Google Scholar]
- 3.van Echten-Arends J, Mastenbroek S, Sikkema-Raddatz B, et al. Chromosomal mosaicism in human preimplantation embryos: a systematic review. Hum Reprod Update. 2011;17(5):620–7. doi: 10.1093/humupd/dmr014. [DOI] [PubMed] [Google Scholar]
- 4.Ma N, Xi H, Chen J, et al. Integrated CNV-seq, karyotyping and SNP-array analyses for effective prenatal diagnosis of chromosomal mosaicism. BMC Med Genomics. 2021;14(1):56. doi: 10.1186/s12920-021-00899-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Zheng JL, Yang XY, Lu HY, et al. Prenatal diagnosis of sex chromosome mosaicism with two marker chromosomes in three cell lines and a review of the literature. Mol Med Rep. 2019;19(3):1791–6. doi: 10.3892/mmr.2018.9798. [DOI] [PubMed] [Google Scholar]
- 6.Chen CP, Su YN, Su JW, et al. Mosaic trisomy 12 at amniocentesis: prenatal diagnosis and molecular genetic analysis. Taiwan J Obstet Gynecol. 2013;52(1):97–105. doi: 10.1016/j.tjog.2013.01.012. [DOI] [PubMed] [Google Scholar]
- 7.Chen CP, Wang KG, Ko TM, et al. Mosaic trisomy 14 at amniocentesis: prenatal diagnosis and literature review. Taiwan J Obstet Gynecol. 2013;52(3):446–9. doi: 10.1016/j.tjog.2013.07.001. [DOI] [PubMed] [Google Scholar]
- 8.Chen CP, Wang LK, Chern SR, et al. Prenatal diagnosis of mosaicism for double trisomies of trisomy 11 and trisomy 12 in a single colony at amniocentesis in a pregnancy with a favorable outcome. Taiwan J Obstet Gynecol. 2020;59(3):443–5. doi: 10.1016/j.tjog.2020.03.020. [DOI] [PubMed] [Google Scholar]
- 9.Balasubramanian M, Peres LC, Pelly D. Mosaic trisomy 11 in a fetus with bilateral renal agenesis: co-incidence or new association? Clin Dysmorphol. 2011;20(1):47–9. doi: 10.1097/MCD.0b013e32833ff2e9. [DOI] [PubMed] [Google Scholar]
- 10.Webb A, Beard J, Wright C, et al. A case of paternal uniparental disomy for chromosome 11. Prenat Diagn. 1995;15(8):773–7. doi: 10.1002/pd.1970150816. [DOI] [PubMed] [Google Scholar]
- 11.Lund ICB, Becher N, Christensen R, et al. Prevalence of mosaicism in uncultured chorionic villus samples after chromosomal microarray and clinical outcome in pregnancies affected by confined placental mosaicism. Prenat Diagn. 2020;40(2):244–59. doi: 10.1002/pd.5584. [DOI] [PubMed] [Google Scholar]
- 12.Eggenhuizen GM, Go A, Koster MPH, et al. Confined placental mosaicism and the association with pregnancy outcome and fetal growth: a review of the literature. Hum Reprod Update. 2021;27(5):885–903. doi: 10.1093/humupd/dmab009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Wilkins-Haug L, Quade B, Morton CC. Confined placental mosaicism as a risk factor among newborns with fetal growth restriction. Prenat Diagn. 2006;26(5):428–32. doi: 10.1002/pd.1430. [DOI] [PubMed] [Google Scholar]
- 14.Benn P. Non-invasive prenatal testing using cell free DNA in maternal plasma: recent developments and future prospects. J Clin Med. 2014;3(2):537–65. doi: 10.3390/jcm3020537. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Lim PT, Yang LY, Tan WC. Impact of true fetal mosaicism on prenatal screening and diagnosis. Ann Acad Med Singap. 2021;50(7):578–9. doi: 10.47102/annals-acadmedsg.2021122. [DOI] [PubMed] [Google Scholar]
- 16.Neofytou M. Predicting fetoplacental mosaicism during cfDNAbased NIPT. Curr Opin Obstet Gynecol. 2020;32(2):152–8. doi: 10.1097/GCO.0000000000000610. [DOI] [PubMed] [Google Scholar]
- 17.Chen CP, Hsieh CE, Chern SR, et al. Prenatal diagnosis of trisomy 11 in a single colony of cultured amniocytes at amniocentesis in a pregnancy with a favorable outcome. Taiwan J Obstet Gynecol. 2021;60(3):540–2. doi: 10.1016/j.tjog.2021.03.028. [DOI] [PubMed] [Google Scholar]
- 18.Chen CP, Chern SR, Chen SW, et al. Prenatal diagnosis of mosaicism for trisomy 11 in a single colony at amniocentesis in a twin pregnancy with a favorable outcome. Taiwan J Obstet Gynecol. 2021;60(6):1136–8. doi: 10.1016/j.tjog.2021.09.032. [DOI] [PubMed] [Google Scholar]
- 19.Chen CP, Weng SL, Chern SR, et al. Prenatal diagnosis of mosaicism for trisomy 11 in a single colony at amniocentesis in a pregnancy with a favorable outcome. Taiwan J Obstet Gynecol. 2020;59(2):331–3. doi: 10.1016/j.tjog.2020.01.027. [DOI] [PubMed] [Google Scholar]
- 20.Daniel A, Wu ZH, Darmanian A, et al. Issues arising from the prenatal diagnosis of some rare trisomy mosaics: the importance of cryptic fetal mosaicism. Prenat Diagn. 2004;24(7):524–36. doi: 10.1002/pd.936. [DOI] [PubMed] [Google Scholar]
- 21.Basel-Vanagaite L, Davidov B, Friedman J, et al. Amniotic trisomy 11 mosaicism: is it a benign finding? Prenat Diagn. 2006;26(9):778–81. doi: 10.1002/pd.1501. [DOI] [PubMed] [Google Scholar]
- 22.Levy B, Hoffmann ER, McCoy RC, et al. Chromosomal mosaicism: origins and clinical implications in preimplantation and prenatal diagnosis. Prenat Diagn. 2021;41(5):631–41. doi: 10.1002/pd.5931. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Grati FR, Malvestiti F, Branca L, et al. Chromosomal mosaicism in the fetoplacental unit. Best Pract Res Clin Obstet Gynaecol. 2017;42:39–52. doi: 10.1016/j.bpobgyn.2017.02.004. [DOI] [PubMed] [Google Scholar]


