Abstract
Гипопаратиреоз — эндокринное заболевание, характеризующееся сниженной продукцией паратиреоидного гормона околощитовидными железами или резистентностью тканей к его действию, что сопровождается нарушениями фосфорно-кальциевого обмена.Основной этиологией гипопаратиреоза является повреждение или удаление околощитовидных желез во время хирургического вмешательства на органах шеи. Ввиду распространенности рака щитовидной железы, первичного гиперпаратиреоза и других патологий органов шеи, радикальное лечение которых может привести к развитию гипопаратиреоза, прогнозируется неуклонный рост и увеличение числа больных с этой патологией. Аутоиммунный гипопаратиреоз — вторая по распространенности форма заболевания, встречающаяся, как правило, в рамках аутоиммунного полигландулярного синдрома 1 типа. Гипопаратиреоз в рамках этого синдрома возникает в детском возрасте и, как правило, характеризуется более тяжелым течением, особенно в случае сопутствующего синдрома мальабсорбции.Развитие хронического гипопаратиреоза любой этиологии требует пожизненного назначения многокомпонентной терапии, а также тщательного мониторинга и индивидуального подхода к ведению заболевания. В отсутствие адекватного динамического наблюдения развиваются множественные осложнения со стороны жизненно важных органов, в частности кальцификация мочевыделительной системы (нефрокальциноз, нефролитиаз с развитием почечной недостаточности), мягких тканей и головного мозга; сердечно-сосудистые нарушения; зрительные расстройства; патология костно-мышечной системы со снижением костного ремоделирования и потенциальным риском переломов, а также развитием нейрокогнитивных расстройств и резким снижением качества жизни пациентов.Своевременная диагностика, рационально подобранная лекарственная терапия и грамотное ведение пациента позволят снизить риски развития осложнений, позволят улучшить прогноз, снизить частоту госпитализаций и инвалидизаций пациентов с данным заболеванием.В статье изложены основные тезисы клинических рекомендаций по ведению пациентов с гипопаратиреозом, утвержденных Минздравом России в 2021 г. Изложены алгоритмы диагностики, лечения и динамического наблюдения за пациентами с данной нозологией. Отдельные разделы посвящены купированию острой гипокальциемии, а также ведению беременности у пациенток с гипопаратиреозом.
Keywords: эпидемиология, гипопаратиреоз, паратиреоидный гормон, кальций, витамин D, терапия
Abstract
Hypoparathyroidism is a rare disorder characterized by the absent or inappropriately decreased serum parathyroid hormone in the parathyroid glands, which is accompanied by impaired calcium-phosphorus metabolism.The main etiology of hypoparathyroidism remains damage or removal of the parathyroid glands during neck surgery. In view of the incidence of thyroid cancer, primary hyperparathyroidism and other pathologies of the neck organs, which radical treatment can lead to the parathyroid gland impairment, an increased number of patients with hypoparathyroidism is expected. Autoimmune hypoparathyroidism is the second most common form of the disease, usually occurring as part of type 1 autoimmune polyglandular syndrome. Autoimmune hypoparathyroidism usually occurs in childhood and is characterized by a severe course of the disease, especially in the case of concomitant malabsorption syndrome.Chronic hypoparathyroidism of any etiology requires lifelong multicomponent therapy, as well as careful monitoring and an individual approach to choose the optimal treatment strategy. In the absence of adequate follow-up, the risks of long-term complications significantly increase, particularly in the renal, cardiovascular systems; in the soft tissues and in the brain, it could lead to visual disturbances; pathology of the musculoskeletal system with a decreased bone remodeling and a potential risk of fractures, as well as to the neurocognitive disorders and an impaired health-related quality of life.Timely diagnosis, rational medical therapy and management strategy may reduce the risks of short-term and long-term complications, frequency of hospitalizations and disability of patients, as well as improve the prognosis.This review covers the main issues of Russian guidelines for the management of chronic hypoparathyroidism, approved in 2021, including laboratory and instrumental evaluation, treatment approaches and follow-up. This guidelines also include the recommendations for special groups of patients: with acute hypocalcemia, hypoparathyroidism during pregnancy.
ВВЕДЕНИЕ
Гипопаратиреоз — состояние, характеризующееся сниженной продукцией паратиреоидного гормона (ПТГ) околощитовидными железами (ОЩЖ) или резистентностью тканей к его действию, что сопровождается нарушениями фосфорно-кальциевого обмена.
При гипопаратиреозе отсутствие или недостаточность ПТГ неизбежно сопровождается развитием гипокальциемии. К основным патогенетическим механизмам относятся: снижение активности остеокластов с уменьшением высвобождения кальция из костей; повышение экскреции кальция с мочой; подавление синтеза кальцитриола в почках и снижение абсорбции кальция из кишечника. Дефицит ПТГ приводит к гиперфосфатемии как напрямую посредством увеличения почечной тубулярной реабсорбции фосфатов, так и косвенно за счет гипокальциемии. Хроническая гиперфосфатемия у пациентов с гипопаратиреозом, как было показано, ассоциирована с повышением в крови уровня фактора роста фибробластов 23.
ЭТИОЛОГИЯ
Хирургическое вмешательство на органах шеи — самая распространенная причина развития гипопаратиреоза, обуславливающая около 75% всех случаев данного заболевания. Послеоперационный гипопаратиреоз может быть обусловлен как непосредственным удалением, так и интраоперационной травмой или нарушением кровоснабжения ОЩЖ. Риск хронического гипопаратиреоза тесно связан с количеством оставшихся in situ функционирующих ОЩЖ во время операции: 16% при сохраненных 1–2 железах, 6% — при 3 железах и 2,5% — при 4 [1][2].
Аутоиммунный гипопаратиреоз — вторая по распространенности форма гипопаратиреоза, обусловленная иммуноопосредованным разрушением клеток ОЩЖ [3]. Он может быть изолированным заболеванием, однако значительно чаще встречается в рамках наследственного аутоиммунного полигландулярного синдрома (АПС) 1-го типа [4]. АПС 1-го типа — моногенное аутосомно-рецессивное заболевание, в основе которого лежит нарушение структуры гена аутоиммунного регулятора (AIRE). В основе патогенеза заболевания лежит аутоиммунная деструкция различных эндокринных желез, включая ОЩЖ. Для АПС 1-го типа характерна классическая триада: слизисто-кожный кандидоз, гипопаратиреоз, хроническая надпочечниковая недостаточность. Заболевание дебютирует, как правило, в детском возрасте.
Другие более редкие наследственные формы гипопаратиреоза встречаются как в изолированном варианте, так и в составе поликомпонентных генетических заболеваний (синдром ДиДжорджи, Бараката, Кенни–Каффи и др.) [5–10].
В случае нарушения обмена магния развивается функциональный гипопаратиреоз, который является обратимой формой заболевания с восстановлением функции ОЩЖ после коррекции гипо-/гипермагниемии [5][11].
В редких случаях причиной гипопаратиреоза могут стать инфильтративные заболевания, такие как саркоидоз, амилоидоз, тиреоидит Риделя и метастатическое поражение ОЩЖ [12–15]. Ткань ОЩЖ относительно не восприимчива к лучевому повреждению, тем не менее в литературе описаны очень редкие случаи радиационно-индуцированного гипопаратиреоза [16–19]. Отложения минералов в ткани ОЩЖ — например, меди при болезни Вильсона и железа при гемохроматозе — являются редкими причинами развития гипопаратиреоза. Описаны случаи развития гипопаратиреоза вследствие массивных повторяющихся трансфузий у пациентов с талассемией [20–24].
ЭПИДЕМИОЛОГИЯ
Гипопаратиреоз — это редкое заболевание с распространенностью 0,25 на 1000 населения. Имеющиеся данные о распространенности гипопаратиреоза основаны на крупных эпидемиологических исследованиях, проведенных в США, Дании, Норвегии и Италии. Полученные результаты относительно сходны и свидетельствуют о распространенности гипопаратиреоза в диапазоне 23–37 на 100 000 населения [3][25–28].
Послеоперационный гипопаратиреоз чаще встречается среди женщин, что связано с более частой патологией щитовидной железы и, следовательно, тиреоидэктомией [29][30]. Распространенность наследственных форм гипопаратиреоза не различается у мужчин и женщин [27]. В российской популяции крупных эпидемиологических исследований с целью оценки распространенности гипопаратиреоза не проводилось.
Классификация гипопаратиреоза [31].
* — случаев развития гипопаратиреоза в рамках аутоиммунного полигландулярного синдрома 2 типа (АПС 2 типа) не описано.
ЖАЛОБЫ И КЛИНИЧЕСКАЯ КАРТИНА
Основные клинические проявления гипопаратиреоза обусловлены наличием гипокальциемии. Усиление чувствительности сенсорного (чувствительного) нейрона проявляется в виде парестезий в конечностях и в околоротовой области; моторного (двигательного) нейрона — мышечными спазмами, вплоть до тетании; от классического карпопедального спазма до жизнеугрожающего ларингоспазма [32]. Тяжелая гипокальциемия ассоциирована как с локальными, так и генерализованными судорогами тонико-клонического типа.
Степень выраженности симптомов зависит от уровня кальция в сыворотке крови, а также от скорости прогрессирования гипокальциемии. Для хронического течения заболевания характерна адаптация к низким уровням кальция сыворотки крови с отсутствием выраженной клинической картины даже при тяжелой гипокальциемии. Провоцирующими факторами ухудшения состояния в таких случаях могут являться возрастание физической активности, медицинские процедуры, беременность и лактация [16][33].
Самой частой жалобой пациентов с гипопаратиреозом является наличие судорог и/или парестезий в мышцах верхних и нижних конечностей, околоротовой области. Пациенты с длительным анамнезом гипопаратиреоза предъявляют жалобы на «мозговой туман», снижение памяти и концентрации внимания. Основные жалобы пациентов с гипопаратиреозом представлены в табл. 1.
Клинические проявления хронического гипопаратиреоза различны и затрагивают почти все системы организма (табл. 2). Клинические симптомы хронического гипопаратиреоза могут быть ассоциированы как с эпизодами гипо-, так и гиперкальциемии, гиперфосфатемии [16].
Таблица 1. Симптомы гипопаратиреоза [34]
| Симптом | Частота, % |
| Физические симптомы | |
| Усталость | 82 |
| Боль в мышцах/мышечные спазмы | 78 |
| Парестезии | 76 |
| Тетания | 70 |
| Боли в костях и суставах | 67 |
| Расстройства кишечника | 46 |
| Хрупкость/ломкость ногтей | 44 |
| Непереносимость жары | 44 |
| Головные боли | 42 |
| Сухость кожи и ее повышенная травматизация | 40 |
| Зябкость | 37 |
| Выпадение волос | 33 |
| Тошнота | 30 |
| Проблемы с зубами | 29 |
| Нейропатия | 27 |
| Чувствительность к солнцу | 26 |
| Отеки | 23 |
| Проблемы с дыханием | 22 |
| Снижение слуха | 11 |
| Когнитивные симптомы | |
| «Мозговой туман»/умственная летаргия | 72 |
| Невозможность концентрировать внимание | 65 |
| Снижение памяти/забывчивость | 61 |
| Нарушение сна | 57 |
| Эмоциональные симптомы | |
| Тревожность/страх/внутреннее беспокойство | 59 |
| Снижение настроения/грусть/депрессия | 53 |
| Эмоциональная чувствительность | 47 |
| Социальная изоляция | 32 |
Таблица 2. Клинические симптомы гипопаратиреоза
| Системы органов | Клинические проявления |
| Периферическая нервная система | Парестезии, фибриллярные подергивания, тонические судороги, тетания, карпопедальный спазм, симптомы Хвостека и Труссо |
| Центральная нервная система | Невроз, снижение памяти, бессонница, депрессия |
| Дыхательная система | Ларингоспазм и бронхоспазм |
| Желудочно-кишечный тракт | Дисфагия, рвота, диарея и запоры |
| Сердечно-сосудистая система | Удлинение интервала Q–T и неспецифические изменения зубца T, дилатационная гипокальциемическая кардиомиопатия |
| Почки | Нефролитиаз/нефрокальциноз, снижение функции почек |
| Скелетно-мышечная система и зубы | Миопатия скелетных мышц, спондилоартропатия, гипоплазия зубной эмали, укорочение корней, гипоплазия или отсутствие зубов |
| Органы зрения | Субкапсулярная катаракта, папиллоэдема |
| Кожные покровы | Сухость кожи, хрупкость ногтей, онихолизис, пустулезный псориаз |
ЖАЛОБЫ И АНАМНЕЗ
Комментарии. Следующие факторы позволяют заподозрить у пациента наличие гипокальциемии и гипопаратиреоза:
- проведение хирургического вмешательства в области шеи;
- наличие парестезий в области лица, верхних и нижних конечностей;
- наличие фибриллярных подергиваний отдельных мышц, судорог в проксимальных мышцах;
- выявление кальцификации головного мозга;
- при нарушениях сердечного ритма.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
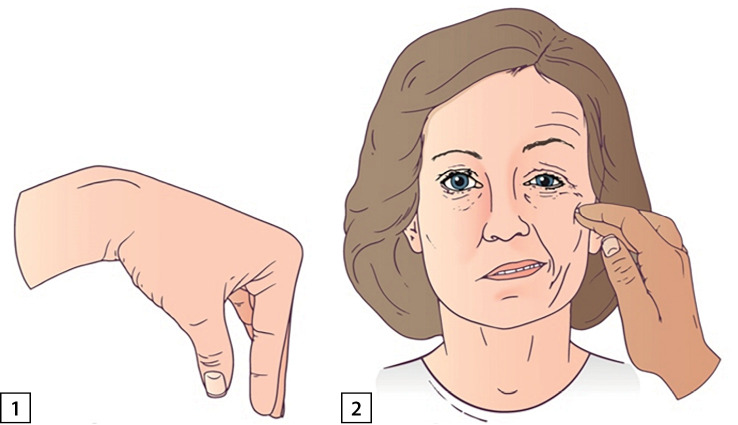
Комментарии. Положительный симптом Труссо — появление судорог в кисти («рука акушера») через 1–3 минуты после сдавления плеча манжетой при измерении артериального давления. Данный симптом — высокочувствительный и специфичный признак гипокальциемии — выявляется у 94% пациентов с гипокальциемией и у 1% людей с нормокальциемией. Cимптом Хвостека — сокращение мышц лица при постукивании в месте выхода лицевого нерва — менее чувствительный и специфичный признак. Отрицательный симптом Хвостека наблюдается у 30% пациентов, имеющих гипокальциемию, положительный — у 10% людей без данной патологии (рис. 1).
Рисунок 1. 1 — проба Труссо, «рука акушера»; 2 — симптом Хвостека.
Диагноз гипопаратиреоза основывается на результатах лабораторного обследования!
Критерии установления диагноза гипопаратиреоз.
Комментарии. Наиболее распространенным тестом для диагностики гипокальциемии является измерение уровня общего кальция. Корректировка кальция на уровень альбумина крови необходима с целью исключения ложноотрицательных или ложноположительных результатов кальциемии при изменении концентрации плазменных белков.
Формулы для расчета альбумин-скорректированного кальция.
- Общий кальций плазмы (ммоль/л) = измеренный уровень кальция плазмы (ммоль/л) + 0,02 × (40 — измеренный уровень альбумина плазмы (г/л))
- Общий кальций плазмы (мг/дл) = измеренный уровень кальция плазмы (мг/дл) + 0,8 × (4 — измеренный уровень альбумина плазмы (г/дл))
- Коэффициент пересчета: [кальций] мг/дл × 0,25 ==> [кальций] ммоль/л.
Комментарии. Динамический мониторинг общего кальция, альбумина (с расчетом альбумин-скорректированного кальция), фосфора, магния, креатинина с расчетом СКФ в случае компенсации заболевания рекомендовано проводить с частотой 1 раз в 3–6 месяцев. При отсутствии компенсации гипопаратиреоза и/или коррекции доз стандартной терапии рекомендована более частая оценка показателей фосфорно-кальциевого обмена, до нескольких раз в неделю, для оценки адекватности подобранной терапии.
Динамический мониторинг суточной экскреции кальция рекомендовано проводить 1 раз в 6–12 месяцев. В случае выявления гиперкальциурии и/или назначении тиазидов контрольное исследование уровня кальция в суточной моче рекомендовано выполнить через 1,5–2 месяца для оценки адекватности проводимого лечения.
ИНСТРУМЕНТАЛЬНЫЕ ДИАГНОСТИЧЕСКИЕ ИССЛЕДОВАНИЯ
Комментарии. У пациентов с хроническим гипопаратиреозом на фоне приема терапии препаратами витамина D и его производными и препаратами кальция значимо повышается риск развития нефролитиаза/нефрокальциноза.
Комментарии. Пациентам с длительным анамнезом гипопаратиреоза (более 3–5 лет) показан периодический осмотр у врача-офтальмолога с целью своевременной диагностики развития катаракты и определения потребности в специализированном ее лечении.
Комментарии. Клинические проявления кальцификации различных отделов центральной нервной системы у пациентов с длительным анамнезом гипопаратиреоза неспецифичны. К наиболее распространенным относятся двигательные нарушения: ригидность мышц, паркинсонизм, гиперкинезы (хорея, тремор, дистония, атетоз, орофациальная дискинезия); когнитивные расстройства; мозжечковые симптомы и нарушения речи. В ряде случаев отмечаются эпилептические приступы, деменция. Нередко наблюдается сочетание различных клинических симптомов. Вопрос о наличии патогенетической взаимосвязи между неврологической симптоматикой и объемом, локализацией обызвествлений остается противоречивым. При возникновении данных симптомов и/или выявлении кальцификации базальных ганглиев по данным КТ головного мозга показана консультация врача-невролога.
Комментарии. При гипопаратиреозе костный обмен замедлен, таким образом отсутствуют предпосылки к снижению МПК с течением времени в отсутствие сопутствующих факторов риска, таких как терапия глюкокортикоидами. Для оценки состояния костной ткани пациентам с хроническим гипопаратиреозом желательно проведение комплексного обследования, включающего определение маркеров костного обмена и рентгенографию костей.
ИНЫЕ ДИАГНОСТИЧЕСКИЕ ИССЛЕДОВАНИЯ
Комментарии:
-пациентам с изолированным гипопаратиреозом неясной этиологии, возникшим после первого года жизни, рекомендуется подробный сбор анамнеза и жалоб пациента, исследование гена AIRE для исключения АПС 1-го типа. Наследственные формы заболевания представлены в таблице 3.
Таблица 3. Наследственные формы гипопаратиреоза [40]
| Заболевания | Наследование | Локализация | Ген |
| Синдромальный гипопаратиреоз | |||
| Синдром ДиДжорджи 1 типа | AD | 22q11.2 | TBX1 |
| Синдром ДиДжорджи 2 типа | AD | 10p13–14 | NEBL |
| CHARGE синдром | AD | 8q12.2 | CHD7 |
| АПС 1 типа | AR | 21q22.3 | AIRE |
| HDR-синдром | AD | 10p15 | GATA3 |
| Синдром Кернса–Сейра | Митохондр. | NA | Митохондр. ДНК |
| Синдром MELAS | Митохондр. | NA | Митохондр. ДНК |
| Синдром дефицита MTP | AR | 2p23 | HADHB |
| Синдром Кенни–Каффи 1 типа | AR | 1q42.3 | TBCE |
| Синдром Кенни–Каффи 2 типа | AD | 11q12.1 | FAM111A |
| Синдром Саньяд–Сакати | AR | 1q42.3 | TBCE |
| Дисплазия «тонких» костей | AD | 11q12.1 | FAM111A |
| Аутосомно-доминантная гипокальциемия | |||
| Аутосомно-доминантная гипокальциемия 1 типа и синдром Бартера 5 типа | AD | 3q21.1 | CASR |
| Аутосомно-доминантная гипокальциемия 2 типа | AD | 19p13.3 | GNA11 |
| Изолированный гипопаратиреоз | |||
| Аутосомный гипопаратиреоз | AD или AR | 6p24.2 и 11p15 | GCM2 и PTH |
| Х-связанный гипопаратиреоз | XR | Xq26–27 | SOX31 |
ЦЕЛИ ЛЕЧЕНИЯ И МОНИТОРИНГА ГИПОПАРАТИРЕОЗА
Основные цели долгосрочной терапии гипопаратиреоза представлены в таблице 4.
Таблица 4. Основные цели долгосрочной терапии гипопаратиреоза
| Уровень альбумин-скорректированного кальция крови | Поддержание на нижней границе или несколько ниже нижней границы референсного диапазона (2,11–2,65 ммоль/л) у пациентов без клинических симптомов гипокальциемии | 2,1−2,3 ммоль/л |
| Уровень суточной экскреции кальция (исследование уровня кальция в суточной моче) | Поддержание в пределах целевого диапазона | Мужчины: <7,5 ммоль/сут Женщины: <6,25 ммоль/сут |
| Уровень фосфора сыворотки крови | Поддержание в пределах референсного диапазона | 0,8−1,4 ммоль/л |
| Уровень магния сыворотки крови | В пределах референсного диапазона | 0,7−1,05 ммоль/л |
| Уровень 25(ОН)витамина D | Как в общей популяции | 30–60 нг/мл (75–150 нмоль/л) |
| Общее самочувствие и качество жизни | Персонализированное лечение | |
| Информированность/образование | Информирование пациента о симптомах гипокальциемии и гиперкальциемии, осложнениях заболевания |
Комментарии. Терапевтические цели — уровень альбумин-скорректированного кальция крови в пределах 2,1–2,3 ммоль/л или ионизированного кальция в пределах 1,05–1,15 ммоль/л — основаны на поддержании физиологических процессов в организме. Некоторые пациенты могут, однако, нуждаться в более высоких уровнях кальция сыворотки крови для устранения симптомов гипокальциемии.
Комментарии.
- Для больных с гипопаратиреозом, так же как и для общей популяции, в большинстве случаев характерно наличие недостатка или дефицита витамина D. В связи с чем для его коррекции целесообразно использование нативных форм витамина D (колекальциферол**).
- Для российской популяции оптимальные уровни 25(ОН)D установлены в диапазоне 30–60 нг/мл (75–150 нмоль/л). Уровни 25(ОН)D более 100 нг/мл (250 нмоль/л) могут стать причиной токсического воздействия витамина D на организм и не рекомендуются.
- Терапия альфакальцидолом**, кальцитриолом** не оказывает существенного влияния на уровень 25(ОН)D сыворотки крови.
Комментарии. В таблице 6 представлена клиническая симптоматика, о которой следует информировать пациентов, чтобы они могли самостоятельно заподозрить у себя гипо- или гиперкальциемию на ранней стадии (табл. 5).
Таблица 5. Клиническая симптоматика, о которой следует информировать пациентов, чтобы они могли самостоятельно заподозрить у себя гипо- или гиперкальциемию на ранней стадии
| Органы/системы | Гипокальциемия | Гиперкальциемия |
| Центральная нервная система | ДепрессияРаздражительностьСпутанность сознания и дезориентацияСудороги | СлабостьГоловная больСонливостьСпутанность сознания и дезориентацияСнижение памяти и концентрации внимания |
| Нейро-мышечная система | Онемения и покалывания (парестезии) в пальцах рук и ног, околоротовой области | Мышечная слабость |
| Сердечно-сосудистая система | Частый, аритмичный пульсСимптомы сердечной недостаточности | Частый, аритмичный пульсАртериальная гипертензия |
| Желудочно-кишечный тракт | Боль в животе | Потеря аппетитаТошнота, рвотаБоль в животеЗапоры |
| Почки | ПолиурияСухость во рту, жажда | |
| Органы дыхания | Затруднения дыханияСвистящее дыханиеЧувство «сдавления» в горле |
Таблица 6. Лекарственные препараты для лечения гипопаратиреоза
| Международное непатентованное наименование лекарственного препарата | Средняя суточная доза | Единицы измерения | Кратность приема |
| Альфакальцидол** | 1,0–4,0 | мкг | 1–3 р/сут |
| Кальцитриол** | 0,25–2,0 | мкг | 1–3 р/сут |
| Препараты, содержащие кальция карбонат3 | 1000–3000 | мг | 1–4 р/сут |
| Колекальциферол** | 400–8002 | МЕ | 1 р/сут |
| Гидрохлортиазид** [80, 88–90] | 12,5–100 | мг | 1–2 р/сут |
| Хлорталидон1 [90, 91] | 50–100 | мг | 1 р/сут |
| Комбинации различных солей магния | 300–400 | мг | 1–3 р/сут |
ЛЕЧЕНИЕ ГИПОПАРАТИРЕОЗА
Лекарственные препараты, используемые для лечения гипопаратиреоза представлены в таблице 6.
Комментарии.
- Стандартная терапия гипопаратиреоза включает в себя препараты витамина D и его производные (альфакальцидол**, кальцитриол**) и препараты кальция. Кальциемический эффект кальцитриола** превышает таковой у альфакальцидола** примерно вдвое.
- Для поддержания уровня кальция крови в пределах целевого уровня рекомендуется титрация доз препаратов витамина D и его производных, разделение суммарной дозы препарата в 2–3 приема. Титрация дозы обычно производится с шагом в 0,5 (или 0,25) мкг для альфакальцидола** и 0,25 мкг для кальцитриола**. Больший шаг изменения доз может потребоваться при выраженных гипо/гиперкальциемии. Рекомендуемый временной интервал для коррекции доз препарата витамина D и его производных (альфакальцидол**, кальцитриол**) составляет 2–3 дня, что обусловлено их фармакокинетикой и как следствие, адекватной оценкой проведенных изменений. При малосимптомном течении и умеренных колебаниях показателей кальциемии лабораторная оценка адекватности скорректированных доз может быть произведена через 7–10 дней. Для оценки клинической эффективности подобранной терапии и достижения стабильных значений кальциемии может потребоваться около 2–3 месяцев, особенно для пациентов с высокой потребностью в препаратах витамина D и его производных.
- Изолированное назначение солей кальция патогенетически не оправдано и вызывает лишь кратковременное повышение показателей кальциемии сыворотки крови.
-Пациентам с гипопаратиреозом рекомендуется использовать диету с высоким потреблением кальцийсодержащих продуктов.
- Для лечения гипопаратиреоза используются различные препараты кальция. Как правило применяется препараты, содержащие кальция карбонат (40% элементарного кальция), в том числе в составе комбинированного препарата «кальция карбонат + колекальциферол» в среднесуточных дозах 1–3 г (могут быть использованы и более высокие дозы). Также могут быть использованы пищевые добавки кальция цитрата (21% элементарного кальция). При назначении необходимо учитывать особенности фармакокинетики различных препаратов: кальция карбонат лучше всасывается в кислой среде желудка, поэтому более предпочтителен прием вместе с пищей; кальция цитрат рекомендован пациентам с ахлоргидрией или получающих лечение ингибиторами протонового насоса.
- Высокие дозы препаратов кальция могут снизить потребность в витамине D и его производных и улучшить контроль за поддержанием целевого уровня фосфора сыворотки крови, связывая фосфор в кишечнике.
ПРОФИЛАКТИКА
Комментарии. Несмотря на то что в настоящее время не разработаны четкие временные критерии для забора крови на ПТГ и показатели кальция в послеоперационном периоде, проведенные исследования демонстрируют ценность измерения данных параметров в течение первых 24 ч после операции на органах шеи. Уровень ПТГ менее 15 пг/мл в первый день после операции рассматривается как предиктор развития послеоперационного гипопаратиреоза (чувствительность 97,7%, специфичность 82,6%). Послеоперационная оценка лабораторных показателей фосфорно-кальциевого обмена — необходимое условие для своевременного назначения препаратов витамина D и его производных и препаратов кальция.
Комментарии. Минимальная рекомендуемая суточная доза пероральных препаратов кальция составляет не менее 3000 мг на срок не менее 2 недель с последующей оценкой показателей фосфорно-кальциевого обмена и определением потребности в продолжении терапии.
Комментарии. К независимым предикторам послеоперационной гипокальциемии относят тиреоидэктомию, особенно с центральной и/или боковой лимфодиссекцией, повторную операцию на органах шеи, интраоперационное повреждение ОЩЖ, а также низкий интра- и послеоперационный уровень ПТГ.
Минимальная рекомендуемая суточная доза пероральных препаратов кальция составляет не менее 3000 мг в сочетании с терапией препаратами витамина D и его производных (#кальцитриол** 1 мкг в сутки) на срок не менее 2 недель с последующей оценкой показателей фосфорно-кальциевого обмена и определением потребности в продолжении терапии [119].
ЛЕЧЕНИЕ ОСТРОЙ ГИПОКАЛЬЦИЕМИИ
Для купирования острой гипокальциемии рекомендуется установка центрального венозного катетера, что позволит предотвратить склерозирование периферических вен вследствие инфузии кальция. Предпочтительно использование кальция глюконата**, так как кальция хлорид имеет серьезные осложнения в виде некроза мягких тканей, в случае выхода раствора из сосудистого русла.
В зависимости от ситуации могут быть использованы следующие варианты парентерального введения препаратов кальция.
1. Введение кальция глюконата** внутривенно болюсно в количестве 20–60 мл — быстро без разведения 0,9% раствором NaCl** (или в 5% раствора декстрозы). Метод используется при выраженных симптомах гипокальциемии (пациенты с клинической картиной «страха смерти» или в бессознательном состоянии). Доза вводимого кальция определяется по появлению диспепсических жалоб.
2. Введение половины дозы кальция глюконата** внутривенно болюсно без разведения (40–50 мл 10% раствора кальция глюконата**), остальная доза кальция (50–60 мл 10% раствора кальция глюконата**) вводится внутривенно медленно в разведенном состоянии (0,9% раствора NaCl** или 5% декстрозы**) со скоростью для инфузомата 0,5–1,5 мкг/кг/ч. Данный способ введения является самым частым для купирования острой гипокальциемии, позволяющим быстро нормализовать клиническое состояние пациента.
3. Введение всей дозы парентеральных препаратов кальция (80–100 мл 10% раствора кальция глюконата**), разведенного в растворе (0,9% NaCl** или 5% декстрозы**). Метод используется преимущественно для поддержания адекватного уровня кальция с целью профилактики развития острой гипокальциемии.
Парентеральное введение препаратов кальция всегда прекращается при появлении диспептических жалоб (тошнота, рвота).
Внутривенное введение кальция требует осторожности у больных с гипокалиемией и у пациентов, принимающих дигоксин**, в связи с повышенным риском аритмий.
Одновременно назначаются пероральные препараты кальция и препараты витамина D и его производных (альфакальцидол**, кальцитриол**). Цель терапии — купирование симптомов острой гипокальциемии и нормализация показателей общего и ионизированного кальция на нижней границе референсных значений или несколько ниже в отсутствие клинических симптомов гипокальциемии. Для коррекции терапии необходим частый контроль уровня кальция крови (каждые 6–12 ч в начале лечения, после стабилизации состояния пациента — каждые 24 ч).
Стоить отметить, что при наличии у пациента выраженной гипомагниемии показана ее коррекция с использованием как пероральных препаратов (препараты комбинации различных препаратов магния 300–400 мг/сут), так и внутривенных форм — внутривенно струйно 2 г магния сульфата** в течение 10–20 минут, внутривенно капельно 25% раствор магния сульфата** 2–4 г в 150–200 мл физиологического раствора NaCl**.
ВЕДЕНИЕ БЕРЕМЕННОСТИ ПРИ ГИПОПАРАТИРЕОЗЕ
Рекомендации по ведению беременности у пациентки с хроническим гипопаратиреозом:
ЗАКЛЮЧЕНИЕ
Гипопаратиреоз является относительно редким эндокринным заболеванием, требующим многокомпонентной лекарственной терапии и тщательного наблюдения для контроля над заболеванием и снижения рисков развития осложнений. Создание клинических рекомендаций — необходимая инициатива, направленная на улучшение качества оказания медицинской помощи пациентам с данной нозологией.
ПРИЛОЖЕНИЕ А. МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
| УДД | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
| УДД | Расшифровка |
| 1 | Систематический обзор РКИ с применением метаанализа |
| 2 | Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа |
| 3 | Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
| УУР | Расшифровка |
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| B | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| C | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
ПРИЛОЖЕНИЕ Б. АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
1 — в том числе в составе комбинированного препарата «кальция карбонат + колекальциферол»
Footnotes
The authors declare that there are no conflicts of interest present.
Contributor Information
Е. В. Ковалева, Email: elen.v.kovaleva@gmail.com.
А. К. Еремкина, Email: a.lipatenkova@gmail.com.
Ю. А. Крупинова, Email: j.krupinova@gmail.com.
С. С. Мирная, Email: svetlanamirnaya@yahoo.com.
И. В. Ким, Email: ilyakim@yandex.ru.
Н. С. Кузнецов, Email: kuznetsov-enc@yandex.ru.
Е. Н. Андреева, Email: e.n.andreeva@mail.ru.
Т. Л. Каронова, Email: karonova@mail.ru.
И. В. Крюкова, Email: kiv200877@yandex.ru.
А. М. Мудунов, Email: ali.mudunov@inbox.ru.
И. В. Слепцов, Email: newsurgery@yandex.ru.
Г. А. Мельниченко, Email: teofrast2000@mail.ru.
Н. Г. Мокрышева, Email: parathyroid.enc@gmail.com.
И. И. Дедов, Email: dedov@endocrincentr.ru.
References
- Grodski Simon, Serpell Jonathan. Evidence for the Role of Perioperative PTH Measurement after Total Thyroidectomy as a Predictor of Hypocalcemia. World Journal of Surgery. 2008 Mar;32(7):1367–1373. doi: 10.1007/s00268-008-9545-5. [DOI] [PubMed] [Google Scholar]
- Lorente-Poch L, Sancho J J, Ruiz S, Sitges-Serra A. Importance of in situ preservation of parathyroid glands during total thyroidectomy. British Journal of Surgery. 2015 Jan;102(4):359–367. doi: 10.1002/bjs.9676. [DOI] [PubMed] [Google Scholar]
- Powers Julia, Joy Karen, Ruscio Aimee, Lagast Hjalmar. Prevalence and Incidence of Hypoparathyroidism in the United States Using a Large Claims Database. Journal of Bone and Mineral Research. 2013 Jun;28(12):2570–2576. doi: 10.1002/jbmr.2004. [DOI] [PubMed] [Google Scholar]
- Cutolo Maurizio. Autoimmune polyendocrine syndromes. Autoimmunity Reviews. 2013 Sep;13(2):85–89. doi: 10.1016/j.autrev.2013.07.006. [DOI] [PubMed] [Google Scholar]
- Butters Robert R., Chattopadhyay Naibedya, Nielsen Palle, Smith Craig P., Mithal Ambrish, Kifor Olga, Bai Mei, Quinn Steven, Goldsmith Paul, Hurwitz Shmuel, Krapcho Karen, Busby James, Brown Edward M.. Cloning and Characterization of a Calcium-Sensing Receptor from the Hypercalcemic New Zealand White Rabbit Reveals Unaltered Responsiveness to Extracellular Calcium. Journal of Bone and Mineral Research. 2006 Apr;12(4):568–579. doi: 10.1359/jbmr.1997.12.4.568. [DOI] [PubMed] [Google Scholar]
- Grigorieva Irina V., Thakker Rajesh V.. Transcription factors in parathyroid development: lessons from hypoparathyroid disorders. Annals of the New York Academy of Sciences. 2011 Nov;1237(1):24–38. doi: 10.1111/j.1749-6632.2011.06221.x. [DOI] [PubMed] [Google Scholar]
- Veronese FM, et al. A comparison of three fluorophores (ThT, ANS, bis-ANS) for the detection of amyloid fibers and prefibrillar oligomeric assemblies. Clin. Orthop. Relat. Res. 2015;22(4):244-258.25344403
- Goldmuntz Elizabeth. DiGeorge Syndrome: New Insights. Clinics in Perinatology. 2007 Jan;32(4):963–978. doi: 10.1016/j.clp.2005.09.006. [DOI] [PubMed] [Google Scholar]
- Hannah M. Genetic developments in hypoparathyroidism For personal use only. Reproduce with permission from The Lancet Publishing Group. 2001. Vol. 357. P. 974–976. [DOI] [PubMed] [Google Scholar]
- Sanjad S A, Sakati N A, Abu-Osba Y K, Kaddoura R, Milner R D. A new syndrome of congenital hypoparathyroidism, severe growth failure, and dysmorphic features. Archives of Disease in Childhood. 2008 Dec;66(2):193–196. doi: 10.1136/adc.66.2.193. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Blaine Judith, Chonchol Michel, Levi Moshe. Renal Control of Calcium, Phosphate, and Magnesium Homeostasis. Clinical Journal of the American Society of Nephrology. 2014 Oct;10(7):1257–1272. doi: 10.2215/cjn.09750913. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Saeed A., Khan M., Irwin S., Fraser A.. Sarcoidosis presenting with severe hypocalcaemia. Irish Journal of Medical Science. 2009 Jan;180(2):575–577. doi: 10.1007/s11845-009-0277-9. [DOI] [PubMed] [Google Scholar]
- Anderson T. J., Ewen S. W. B.. Amyloid in normal and pathological parathyroid glands. Journal of Clinical Pathology. 2007 Jun;27(8):656–663. doi: 10.1136/jcp.27.8.656. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Yasmeen T.. Riedel's Thyroiditis: Report of a Case Complicated by Spontaneous Hypoparathyroidism, Recurrent Laryngeal Nerve Injury, and Horner's Syndrome. Journal of Clinical Endocrinology & Metabolism. 2004 Feb;87(8):3543–3547. doi: 10.1210/jc.87.8.3543. [DOI] [PubMed] [Google Scholar]
- Horwitz Charles A., Myers W.P.Laird, Foote Frank W.. Secondary malignant tumors of the parathyroid glands. The American Journal of Medicine. 2004 Apr;52(6):797–808. doi: 10.1016/0002-9343(72)90086-1. [DOI] [PubMed] [Google Scholar]
- Shoback Dolores. Hypoparathyroidism. New England Journal of Medicine. 2008 Jul;359(4):391–403. doi: 10.1056/nejmcp0803050. [DOI] [PubMed] [Google Scholar]
- Glazebrook George A.. Effect of decicurie doses of radioactive iodine 131 on parathyroid function. The American Journal of Surgery. 2004 Apr;154(4):368–373. doi: 10.1016/0002-9610(89)90006-8. [DOI] [PubMed] [Google Scholar]
- Winslow Catherine P., Meyers Arlen D.. Hypocalcemia as a complication of radioiodine therapy. American Journal of Otolaryngology. 2004 Mar;19(6):401–403. doi: 10.1016/s0196-0709(98)90045-x. [DOI] [PubMed] [Google Scholar]
- Guven Aytekin, Salman Serpil, Boztepe Harika, Yarman Sema, Tanakol Refik, Azizlerli Halil, Alagol Faruk. Parathyroid changes after high dose radioactive iodine in patients with thyroid cancer. Annals of Nuclear Medicine. 2009 May;23(5):437–441. doi: 10.1007/s12149-009-0270-4. [DOI] [PubMed] [Google Scholar]
- Carpenter Thomas O., Carnes David L., Anast Constantine S.. Hypoparathyroidism in Wilson's Disease. New England Journal of Medicine. 2010 Jul;309(15):873–877. doi: 10.1056/nejm198310133091501. [DOI] [PubMed] [Google Scholar]
- Joshi PrathameshVijay, Lele VikramRamchandra, Kapoor JitenS. Dual ectopic thyroid - noninvasive diagnosis on radionuclide thyroid scan with SPECT/CT correlation: A case report and brief review of literature. Indian Journal of Endocrinology and Metabolism. 2013 Mar;17(2):359. doi: 10.4103/2230-8210.109687. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Belhoul Khawla M., Bakir Maisam L., Saned Mohamed-SalahEldin, Kadhim Ahmed M. A., Musallam Khaled M., Taher Ali T.. Serum ferritin levels and endocrinopathy in medically treated patients with β thalassemia major. Annals of Hematology. 2012 Jan;91(7):1107–1114. doi: 10.1007/s00277-012-1412-7. [DOI] [PubMed] [Google Scholar]
- Chern Jimmy P.S., Lin Kai-Hsin. Hypoparathyroidism in Transfusion-Dependent Patients With β-Thalassemia. Journal of Pediatric Hematology/Oncology. 2003 Apr;24(4):291–293. doi: 10.1097/00043426-200205000-00014. [DOI] [PubMed] [Google Scholar]
- Aleem Aamer, Al-Momen Abdul-Kareem, Al-Harakati Mohammed S., Hassan Asim, Al-Fawaz Ibrahim. Hypocalcemia Due to Hypoparathyroidism in β-Thalassemia Major Patients. Annals of Saudi Medicine. 2017 May;20(5-6):364–366. doi: 10.5144/0256-4947.2000.364. [DOI] [PubMed] [Google Scholar]
- Clarke Bart L., Brown Edward M., Collins Michael T., Jüppner Harald, Lakatos Peter, Levine Michael A., Mannstadt Michael M., Bilezikian John P., Romanischen Anatoly F., Thakker Rajesh V.. Epidemiology and Diagnosis of Hypoparathyroidism. The Journal of Clinical Endocrinology & Metabolism. 2016 Mar;101(6):2284–2299. doi: 10.1210/jc.2015-3908. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Astor Marianne C., Løvås Kristian, Debowska Aleksandra, Eriksen Erik F., Evang Johan A., Fossum Christian, Fougner Kristian J., Holte Synnøve E., Lima Kari, Moe Ragnar B., Myhre Anne Grethe, Kemp E. Helen, Nedrebø Bjørn G., Svartberg Johan, Husebye Eystein S.. Epidemiology and Health-Related Quality of Life in Hypoparathyroidism in Norway. The Journal of Clinical Endocrinology & Metabolism. 2016 May;101(8):3045–3053. doi: 10.1210/jc.2016-1477. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Underbjerg Line, Sikjaer Tanja, Mosekilde Leif, Rejnmark Lars. The Epidemiology of Nonsurgical Hypoparathyroidism in Denmark: A Nationwide Case Finding Study. Journal of Bone and Mineral Research. 2015 Mar;30(9):1738–1744. doi: 10.1002/jbmr.2501. [DOI] [PubMed] [Google Scholar]
- Rosato Lodovico, Avenia Nicola, Bernante Paolo, De Palma Maurizio, Gulino Giuseppe, Nasi Pier Giorgio, Pelizzo Maria Rosa, Pezzullo Luciano. Complications of Thyroid Surgery: Analysis of a Multicentric Study on 14,934 Patients Operated on in Italy over 5 Years. World Journal of Surgery. 2004 Mar;28(3):271–276. doi: 10.1007/s00268-003-6903-1. [DOI] [PubMed] [Google Scholar]
- Underbjerg Line, Sikjaer Tanja, Mosekilde Leif, Rejnmark Lars. Postsurgical Hypoparathyroidism-Risk of Fractures, Psychiatric Diseases, Cancer, Cataract, and Infections. Journal of Bone and Mineral Research. 2014 May;29(11):2504–2510. doi: 10.1002/jbmr.2273. [DOI] [PubMed] [Google Scholar]
- Davies Louise, Welch H. Gilbert. Current Thyroid Cancer Trends in the United States. JAMA Otolaryngology–Head & Neck Surgery. 2014 Mar;140(4):317. doi: 10.1001/jamaoto.2014.1. [DOI] [PubMed] [Google Scholar]
- Cianferotti Luisella. Classification of Hypoparathyroid Disorders. Parathyroid Disorders. 2018. Nov, pp. 127–138. [DOI] [PubMed]
- Chou Courtney T., Siegel Bianca, Mehta Deepak. Stridor and apnea as the initial presentation of primary hypoparathyroidism. International Journal of Pediatric Otorhinolaryngology. 2015 Nov;80:30–32. doi: 10.1016/j.ijporl.2015.11.023. [DOI] [PubMed] [Google Scholar]
- Bilezikian John P, Khan Aliya, Potts John T, Brandi Maria Luisa, Clarke Bart L, Shoback Dolores, Jüppner Harald, D'Amour Pierre, Fox John, Rejnmark Lars, Mosekilde Leif, Rubin Mishaela R, Dempster David, Gafni Rachel, Collins Michael T, Sliney Jim, Sanders James. Hypoparathyroidism in the adult: Epidemiology, diagnosis, pathophysiology, target-organ involvement, treatment, and challenges for future research. Journal of Bone and Mineral Research. 2011 Aug;26(10):2317–2337. doi: 10.1002/jbmr.483. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Hadker Nandini, Egan Jacqueline, Sanders James, Lagast Hjalmar, Clarke Bart L.. Understanding the Burden of Illness Associated with Hypoparathyroidism Reported Among Patients in the Paradox Study. Endocrine Practice. 2014 Jan;20(7):671–679. doi: 10.4158/ep13328.or. [DOI] [PubMed] [Google Scholar]
- Maeda Sergio Setsuo, Moreira Carolina Aguiar, Borba Victória Zeghbi Cochenski, Bandeira Francisco, Farias Maria Lucia Fleiuss de, Borges João Lindolfo Cunha, Paula Francisco José Albuquerque de, Vanderlei Felipe Augusto Brasileiro, Montenegro Fábio Luiz de Menezes, Santos Rodrigo Oliveira, Ferraz-de-Souza Bruno, Lazaretti-Castro Marise. Diagnosis and treatment of hypoparathyroidism: a position statement from the Brazilian Society of Endocrinology and Metabolism. Archives of Endocrinology and Metabolism. 2018 Jun;62(1):106–124. doi: 10.20945/2359-3997000000015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Khan Aliya A, Koch Christian A, Van Uum Stan, Baillargeon Jean Patrice, Bollerslev Jens, Brandi Maria Luisa, Marcocci Claudio, Rejnmark Lars, Rizzoli Rene, Shrayyef M Zakarea, Thakker Rajesh, Yildiz Bulent O, Clarke Bart. Standards of care for hypoparathyroidism in adults: a Canadian and International Consensus. European Journal of Endocrinology. 2018 Dec;180(3):P1–P22. doi: 10.1530/eje-18-0609. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Brandi Maria Luisa, Bilezikian John P., Shoback Dolores, Bouillon Roger, Clarke Bart L., Thakker Rajesh V., Khan Aliya A., Potts John T.. Management of Hypoparathyroidism: Summary Statement and Guidelines. The Journal of Clinical Endocrinology & Metabolism. 2016 Mar;101(6):2273–2283. doi: 10.1210/jc.2015-3907. [DOI] [PubMed] [Google Scholar]
- Maeda Sergio S., Fortes Erika M., Oliveira Ulisses M., Borba Victoria C.Z., Lazaretti-Castro Marise. Hypoparathyroidism and pseudohypoparathyroidism. Arquivos Brasileiros de Endocrinologia & Metabologia. 2006 Dec;50(4):664–673. doi: 10.1590/s0004-27302006000400012. [DOI] [PubMed] [Google Scholar]
- Shoback Dolores M., Bilezikian John P., Costa Aline G., Dempster David, Dralle Henning, Khan Aliya A., Peacock Munro, Raffaelli Marco, Silva Barbara C., Thakker Rajesh V., Vokes Tamara, Bouillon Roger. Presentation of Hypoparathyroidism: Etiologies and Clinical Features. The Journal of Clinical Endocrinology & Metabolism. 2016 Mar;101(6):2300–2312. doi: 10.1210/jc.2015-3909. [DOI] [PubMed] [Google Scholar]
- Vokes T. et al. Hypoparathyroidism. Prim. Metab. Bone Dis. Disord. Miner. Metab. 2018;51:654-660.
- Meola A., Vignali E., Matrone A., Cetani F., Marcocci C.. Efficacy and safety of long-term management of patients with chronic post-surgical hypoparathyroidism. Journal of Endocrinological Investigation. 2018 Mar;41(10):1221–1226. doi: 10.1007/s40618-018-0857-5. [DOI] [PubMed] [Google Scholar]
- Asari Reza. Hypoparathyroidism After Total Thyroidectomy. Archives of Surgery. 2008 Feb;143(2):132. doi: 10.1001/archsurg.2007.55. [DOI] [PubMed] [Google Scholar]
- Edafe O, Antakia R, Laskar N, Uttley L, Balasubramanian S P. Systematic review and meta-analysis of predictors of post-thyroidectomy hypocalcaemia. British Journal of Surgery. 2014 Jan;101(4):307–320. doi: 10.1002/bjs.9384. [DOI] [PubMed] [Google Scholar]
- Selberherr Andreas, Scheuba Christian, Riss Philipp, Niederle Bruno. Postoperative hypoparathyroidism after thyroidectomy: Efficient and cost-effective diagnosis and treatment. Surgery. 2014 Dec;157(2):349–353. doi: 10.1016/j.surg.2014.09.007. [DOI] [PubMed] [Google Scholar]
- Abbas Afroze. Diagnosis and Management of Hypocalcaemia in Adults. Endocrinology and Diabetes. 2015. Mar, pp. 133–140. [DOI]
- Hannan F. M., Thakker R. V.. Investigating hypocalcaemia. BMJ. 2013 May;346(may09 1):f2213–f2213. doi: 10.1136/bmj.f2213. [DOI] [PubMed] [Google Scholar]
- Bollerslev Jens, Rejnmark Lars, Marcocci Claudio, Shoback Dolores M, Sitges-Serra Antonio, van Biesen Wim, Dekkers Olaf M. European Society of Endocrinology Clinical Guideline: Treatment of chronic hypoparathyroidism in adults. European Journal of Endocrinology. 2015 Jul;173(2):G1–G20. doi: 10.1530/eje-15-0628. [DOI] [PubMed] [Google Scholar]
- Ammirati Adriano Luiz. Chronic Kidney Disease. Revista da Associação Médica Brasileira. 2020 Jan;66(suppl 1):s03–s09. doi: 10.1590/1806-9282.66.s1.3. [DOI] [PubMed] [Google Scholar]
- Pocock S J, Ashby D, Shaper A G, Walker M, Broughton P M. Diurnal variations in serum biochemical and haematological measurements. Journal of Clinical Pathology. 2007 Jun;42(2):172–179. doi: 10.1136/jcp.42.2.172. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Agus ZS. DISEASE OF THE MONTH, Hypomagnesemia. J Am Soc Nephrol. 1999;151:1616-1622. [DOI] [PubMed]
- Pearce S. H., Cheetham T. D. Diagnosis and management of vitamin D deficiency. BMJ. 2010 Jan;340(jan11 1):b5664–b5664. doi: 10.1136/bmj.b5664. [DOI] [PubMed] [Google Scholar]
- Kihara Minoru, Yokomise Hiroyasu, Miyauchi Akira, Matsusaka Kenichi. Recovery of Parathyroid Function After Total Thyroidectomy. Surgery Today. 2003 Feb;30(4):0333–0338. doi: 10.1007/s005950050596. [DOI] [PubMed] [Google Scholar]
- Boyce Alison M., Shawker Thomas H., Hill Suvimol C., Choyke Peter L., Hill Michael C., James Robert, Yovetich Nancy A., Collins Michael T., Gafni Rachel I.. Ultrasound is Superior to Computed Tomography for Assessment of Medullary Nephrocalcinosis in Hypoparathyroidism. The Journal of Clinical Endocrinology & Metabolism. 2013 Jan;98(3):989–994. doi: 10.1210/jc.2012-2747. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Colombo Giulia, Solbiati Monica. Ultrasonography versus computed tomography for suspected nephrolithiasis. Internal and Emergency Medicine. 2015 Jan;10(4):515–516. doi: 10.1007/s11739-015-1192-x. [DOI] [PubMed] [Google Scholar]
- Underbjerg Line, Sikjaer Tanja, Mosekilde Leif, Rejnmark Lars. Cardiovascular and renal complications to postsurgical hypoparathyroidism: A Danish nationwide controlled historic follow-up study. Journal of Bone and Mineral Research. 2013 May;28(11):2277–2285. doi: 10.1002/jbmr.1979. [DOI] [PubMed] [Google Scholar]
- Sorensen Mathew D., Thiel Jeff, Dai Jessica C., Bailey Michael R., Dunmire Barbrina, Samson Patrick C., Chang Helena, Hall M. Kennedy, Gutierrez Brianna, Sweet Robert M., Harper Jonathan D.. In-Office Ultrasound Facilitates Timely Clinical Care at a Multidisciplinary Kidney Stone Center. Urology Practice. 2019 Jul;7(3):167–173. doi: 10.1097/upj.0000000000000082. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Sternberg Kevan M., Littenberg Benjamin. Trends in Imaging Use for the Evaluation and Followup of Kidney Stone Disease: A Single Center Experience. Journal of Urology. 2017 Feb;198(2):383–388. doi: 10.1016/j.juro.2017.01.072. [DOI] [PubMed] [Google Scholar]
- Valencia Victoria, Moghadassi Michelle, Kriesel Dana R., Cummings Steve, Smith-Bindman Rebecca. Study of Tomography Of Nephrolithiasis Evaluation (STONE): Methodology, approach and rationale. Contemporary Clinical Trials. 2014 Apr;38(1):92–101. doi: 10.1016/j.cct.2014.03.006. [DOI] [PubMed] [Google Scholar]
- Brisbane Wayne, Bailey Michael R., Sorensen Mathew D.. An overview of kidney stone imaging techniques. Nature Reviews Urology. 2016 Sep;13(11):654–662. doi: 10.1038/nrurol.2016.154. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Kambadakone Avinash, Andrabi Yasir, Patino Manuel, Das ChandanJ, Eisner Brian, Sahani DushyantV. Advances in CT imaging for urolithiasis. Indian Journal of Urology. 2015 May;31(3):185. doi: 10.4103/0970-1591.156924. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Carter MR, Green BR. Renal calculi: emergency department diagnosis and treatment. Emerg. Med. Pract. United States. 2011;13(7):1-17. [PubMed]
- Ather Mohammad Hammad, Memon Wasim, Aziz Wajahat, Sulaiman Mohammad Nasir. Non-contrast CT in the Evaluation of Urinary Tract Stone Obstruction and Haematuria. Computed Tomography - Advanced Applications. 2017. Aug, [DOI]
- Arlt W, Fremerey C, Callies F, Reincke M, Schneider P, Timmermann W, Allolio B. Well-being, mood and calcium homeostasis in patients with hypoparathyroidism receiving standard treatment with calcium and vitamin D. European Journal of Endocrinology. 2005. Jan, pp. 215–222. [DOI] [PubMed]
- Saha Soma, Gantyala Shiva Prasad, Aggarwal Sameer, Sreenivas Vishnubhatla, Tandon Radhika, Goswami Ravinder. Long-term outcome of cataract surgery in patients with idiopathic hypoparathyroidism and its relationship with their calcemic status. Journal of Bone and Mineral Metabolism. 2016 Jul;35(4):405–411. doi: 10.1007/s00774-016-0767-6. [DOI] [PubMed] [Google Scholar]
- Goswami Ravinder, Sharma Raju, Sreenivas Vishnubhatla, Gupta Nandita, Ganapathy Arthi, Das Sathi. Prevalence and progression of basal ganglia calcification and its pathogenic mechanism in patients with idiopathic hypoparathyroidism. Clinical Endocrinology. 2012 Jan;77(2):200–206. doi: 10.1111/j.1365-2265.2012.04353.x. [DOI] [PubMed] [Google Scholar]
- Aggarwal Sameer, Kailash Suparna, Sagar Rajesh, Tripathi Manjari, Sreenivas Vishnubhatla, Sharma Raju, Gupta Nandita, Goswami Ravinder. Neuropsychological dysfunction in idiopathic hypoparathyroidism and its relationship with intracranial calcification and serum total calcium. European Journal of Endocrinology. 2013 Mar;168(6):895–903. doi: 10.1530/eje-12-0946. [DOI] [PubMed] [Google Scholar]
- Petrarca Marco, Scipioni Rosa, Di Giosia Paolo, Giorgini Paolo, Ferri Claudio. A case of brain calcifications in postsurgical hypoparathyroidism. Internal and Emergency Medicine. 2016 Mar;12(1):113–115. doi: 10.1007/s11739-016-1430-x. [DOI] [PubMed] [Google Scholar]
- Seedat Faheem, Daya Reyna, Bhana Sindeep A.. Hypoparathyroidism Causing Seizures: When Epilepsy Does Not Fit. Case Reports in Medicine. 2018 Apr;2018:1–4. doi: 10.1155/2018/5948254. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Takamura Yuuki, Miyauchi Akira, Yabuta Tomonori, Kihara Minoru, Ito Yasuhiro, Miya Akihiro. Attenuation of Postmenopausal Bone Loss in Patients with Transient Hypoparathyroidism After Total Thyroidectomy. World Journal of Surgery. 2013 Sep;37(12):2860–2865. doi: 10.1007/s00268-013-2207-2. [DOI] [PubMed] [Google Scholar]
- Silva B. C., Rubin M. R., Cusano N. E., Bilezikian J. P.. Bone imaging in hypoparathyroidism. Osteoporosis International. 2016 Aug;28(2):463–471. doi: 10.1007/s00198-016-3750-0. [DOI] [PubMed] [Google Scholar]
- Rubin Mishaela R, Dempster David W, Zhou Hua, Shane Elizabeth, Nickolas Thomas, Sliney James, Silverberg Shonni J, Bilezikian John P. Dynamic and Structural Properties of the Skeleton in Hypoparathyroidism. Journal of Bone and Mineral Research. 2008 Aug;23(12):2018–2024. doi: 10.1359/jbmr.080803. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Chen Qingxiang, Kaji Hiroshi, Iu Mei-Fway, Nomura Rikako, Sowa Hideaki, Yamauchi Mika, Tsukamoto Tatsuo, Sugimoto Toshitsugu, Chihara Kazuo. Effects of an Excess and a Deficiency of Endogenous Parathyroid Hormone on Volumetric Bone Mineral Density and Bone Geometry Determined by Peripheral Quantitative Computed Tomography in Female Subjects. The Journal of Clinical Endocrinology & Metabolism. 2003 Oct;88(10):4655–4658. doi: 10.1210/jc.2003-030470. [DOI] [PubMed] [Google Scholar]
- Orlova Elizaveta M., Bukina Anna M., Kuznetsova Elvira S., Kareva Maria A., Zakharova Ekaterina U., Peterkova Valentina A., Dedov Ivan I.. Autoimmune Polyglandular Syndrome Type 1 in Russian Patients: Clinical Variants and Autoimmune Regulator Mutations. Hormone Research in Paediatrics. 2010 Apr;73(6):449–457. doi: 10.1159/000313585. [DOI] [PubMed] [Google Scholar]
- Bruserud Ø. et al. Polyendocrine syndrome type 1. 2016. № June. P. 1–10.
- MEAGER A, WADHWA M, DILGER P, BIRD C, THORPE R, NEWSOM-DAVIS J, WILLCOX N. Anti-cytokine autoantibodies in autoimmunity: preponderance of neutralizing autoantibodies against interferon-alpha, interferon-omega and interleukin-12 in patients with thymoma and/or myasthenia gravis. Clinical and Experimental Immunology. 2004 Dec;132(1):128–136. doi: 10.1046/j.1365-2249.2003.02113.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Meloni Antonella, Furcas Maria, Cetani Filomena, Marcocci Claudio, Falorni Alberto, Perniola Roberto, Pura Mikuláš, Bøe Wolff Anette S., Husebye Eystein S., Lilic Desa, Ryan Kelli R., Gennery Andrew R., Cant Andrew J., Abinun Mario, Spickett Gavin P., Arkwright Peter D., Denning David, Costigan Colm, Dominguez Maria, McConnell Vivienne, Willcox Nick, Meager Anthony. Autoantibodies against Type I Interferons as an Additional Diagnostic Criterion for Autoimmune Polyendocrine Syndrome Type I. The Journal of Clinical Endocrinology & Metabolism. 2008 Aug;93(11):4389–4397. doi: 10.1210/jc.2008-0935. [DOI] [PubMed] [Google Scholar]
- Sozaeva L S. The new immunological methods for diagnostics of type 1 autoimmune polyendocrine syndrome. Problems of Endocrinology. 2015 Dec;61(3):43–46. doi: 10.14341/probl201561343-46. [DOI] [Google Scholar]
- Zhang Junyu, Liu Hongbin, Liu Zhiyuan, Liao Yong, Guo Luo, Wang Honglian, He Lin, Zhang Xiaodong, Xing Qinghe. A Functional Alternative Splicing Mutation in AIRE Gene Causes Autoimmune Polyendocrine Syndrome Type 1. PLoS ONE. 2013 Jan;8(1):e53981. doi: 10.1371/journal.pone.0053981. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Rathod Anita, Bonny Olivier, Guessous Idris, Suter Paolo M., Conen David, Erne Paul, Binet Isabelle, Gabutti Luca, Gallino Augusto, Muggli Franco, Hayoz Daniel, Péchère-Bertschi Antoinette, Paccaud Fred, Burnier Michel, Bochud Murielle. Association of Urinary Calcium Excretion with Serum Calcium and Vitamin D Levels. Clinical Journal of the American Society of Nephrology. 2014 Dec;10(3):452–462. doi: 10.2215/cjn.12511213. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Mitchell Deborah M., Regan Susan, Cooley Michael R., Lauter Kelly B., Vrla Michael C., Becker Carolyn B., Burnett-Bowie Sherri-Ann M., Mannstadt Michael. Long-Term Follow-Up of Patients with Hypoparathyroidism. The Journal of Clinical Endocrinology & Metabolism. 2012 Oct;97(12):4507–4514. doi: 10.1210/jc.2012-1808. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Rodriguez-Ortiz M. E., Canalejo A., Herencia C., Martinez-Moreno J. M., Peralta-Ramirez A., Perez-Martinez P., Navarro-Gonzalez J. F., Rodriguez M., Peter M., Gundlach K., Steppan S., Passlick-Deetjen J., Munoz-Castaneda J. R., Almaden Y.. Magnesium modulates parathyroid hormone secretion and upregulates parathyroid receptor expression at moderately low calcium concentration. Nephrology Dialysis Transplantation. 2013 Oct;29(2):282–289. doi: 10.1093/ndt/gft400. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Mutnuri Sangeeta, Fernandez Isaac, Kochar Tina. Suppression of Parathyroid Hormone in a Patient with Severe Magnesium Depletion. Case Reports in Nephrology. 2016 Apr;2016:1–3. doi: 10.1155/2016/2608538. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Streeten Elizabeth A., Mohtasebi Yasaman, Konig Manige, Davidoff Lisa, Ryan Kathleen. Hypoparathyroidism: Less Severe Hypocalcemia With Treatment With Vitamin D2 Compared With Calcitriol. The Journal of Clinical Endocrinology & Metabolism. 2017 Apr;102(5):1505–1510. doi: 10.1210/jc.2016-3712. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Holick Michael F, Chen Tai C. Vitamin D deficiency: a worldwide problem with health consequences. The American Journal of Clinical Nutrition. 2018 Feb;87(4):1080S–1086S. doi: 10.1093/ajcn/87.4.1080s. [DOI] [PubMed] [Google Scholar]
- Holick Michael F.. The vitamin D deficiency pandemic: Approaches for diagnosis, treatment and prevention. Reviews in Endocrine and Metabolic Disorders. 2017 May;18(2):153–165. doi: 10.1007/s11154-017-9424-1. [DOI] [PubMed] [Google Scholar]
- Bischoff-Ferrari Heike A, Giovannucci Edward, Willett Walter C, Dietrich Thomas, Dawson-Hughes Bess. Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes. The American Journal of Clinical Nutrition. 2018 Feb;84(1):18–28. doi: 10.1093/ajcn/84.1.18. [DOI] [PubMed] [Google Scholar]
- Bilezikian John P., Brandi Maria Luisa, Cusano Natalie E., Mannstadt Michael, Rejnmark Lars, Rizzoli René, Rubin Mishaela R., Winer Karen K., Liberman Uri A., Potts John T.. Management of Hypoparathyroidism: Present and Future. The Journal of Clinical Endocrinology & Metabolism. 2016 Mar;101(6):2313–2324. doi: 10.1210/jc.2015-3910. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Li Dan-feng, Gao Yu-lu, Liu Hong-chao, Huang Xiao-chen, Zhu Rui-fang, Zhu Chang-tai. Use of thiazide diuretics for the prevention of recurrent kidney calculi: a systematic review and meta-analysis. Journal of Translational Medicine. 2020 Feb;18(1) doi: 10.1186/s12967-020-02270-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Santos Fernando. Hypercalciuria Associated With Long-term Administration of Calcitriol (1,25-Dihydroxyvitamin D3) American Journal of Diseases of Children. 2011 Nov;140(2):139. doi: 10.1001/archpedi.1986.02140160057032. [DOI] [PubMed] [Google Scholar]
- Bilezikian John P., Brandi Maria Luisa, Cusano Natalie E., Mannstadt Michael, Rejnmark Lars, Rizzoli René, Rubin Mishaela R., Winer Karen K., Liberman Uri A., Potts John T.. Management of Hypoparathyroidism: Present and Future. The Journal of Clinical Endocrinology & Metabolism. 2016 Mar;101(6):2313–2324. doi: 10.1210/jc.2015-3910. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Porter Robert H., Cox Brian G., Heaney David, Hostetter Thomas H., Stinebaugh Bobby J., Suki Wadi N.. Treatment of Hypoparathyroid Patients with Chlorthalidone. New England Journal of Medicine. 2010 Jul;298(11):577–581. doi: 10.1056/nejm197803162981101. [DOI] [PubMed] [Google Scholar]
- Khan Maryam I., Waguespack Steven G., Hu Mimi I.. Medical Management Of Postsurgical Hypoparathyroidism. Endocrine Practice. 2010 Dec;17:18–25. doi: 10.4158/ep10302.ra. [DOI] [PubMed] [Google Scholar]
- Davies M., Taylor C.M., Hill L.F., Stanbury S.W.. 1,25-DIHYDROXYCHOLECALCIFEROL IN HYPOPARATHYROIDISM. The Lancet. 2004 May;309(8002):55–59. doi: 10.1016/s0140-6736(77)91077-7. [DOI] [PubMed] [Google Scholar]
- HILL L. F., DAVIES M., TAYLOR C. M., STANBURY S. W.. TREATMENT OF HYPOPARATHYROIDISM WITH 1,25-DIHYDROXYCHOLECALCIFEROL. Clinical Endocrinology. 2008 Mar;5(s1):s167–s173. doi: 10.1111/j.1365-2265.1976.tb03824.x. [DOI] [PubMed] [Google Scholar]
- KANIS J. A., RUSSELL R. G. G., SMITH R.. PHYSIOLOGICAL AND THERAPEUTIC DIFFERENCES BETWEEN VITAMIN D, ITS METABOLITES AND ANALOGUES. Clinical Endocrinology. 2008 Mar;7(s1):191s–201s. doi: 10.1111/j.1365-2265.1977.tb03381.x. [DOI] [PubMed] [Google Scholar]
- OKANO KAZUTOSHI, FURUKAWA YOHTARO, MORII HIROTOSHI, FUJITA TAKUO. Comparative Efficacy of Various Vitamin D Metabolites in the Treatment of Various Types of Hypoparathyroidism. The Journal of Clinical Endocrinology & Metabolism. 2009 Jul;55(2):238–243. doi: 10.1210/jcem-55-2-238. [DOI] [PubMed] [Google Scholar]
- Straub Deborah A.. Calcium Supplementation in Clinical Practice: A Review of Forms, Doses, and Indications. Nutrition in Clinical Practice. 2008 May;22(3):286–296. doi: 10.1177/0115426507022003286. [DOI] [PubMed] [Google Scholar]
- Klein R, et al. The New England Journal of Medicine Downloaded from nejm.org at UNIVERSITY OF CHICAGO LIBRARIES on August 20, 2013. For personal use only. No other uses without permission. From the NEJM Archive. Copyright © 2010 Massachusetts Medical Society. All rights. 1981.
- Kurzel Richard, Hagen Garrett. Use of Thiazide Diuretics to Reduce the Hypercalciuria of Hypoparathyroidism During Pregnancy. American Journal of Perinatology. 2008 Nov;7(04):333–336. doi: 10.1055/s-2007-999516. [DOI] [PubMed] [Google Scholar]
- Newman G. H., Wade M., Hosking D. J.. Effect of bendrofluazide on calcium reabsorption in hypoparathyroidism. European Journal of Clinical Pharmacology. 2006 Apr;27(1):41–46. doi: 10.1007/bf02395204. [DOI] [PubMed] [Google Scholar]
- PARFITT A. M.. Thiazide-Induced Hypercalcemia in Vitamin D-Treated Hypoparathyroidism. Annals of Internal Medicine. 2013 Apr;77(4):557. doi: 10.7326/0003-4819-77-4-557. [DOI] [PubMed] [Google Scholar]
- Murdoch DL, Forrest G, Davies DL, McInnes GT. A comparison of the potassium and magnesium-sparing properties of amiloride and spironolactone in diuretic-treated normal subjects. British Journal of Clinical Pharmacology. 2012 Jul;35(4):373–378. doi: 10.1111/j.1365-2125.1993.tb04153.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Santos Fernando. Hypercalciuria Associated With Long-term Administration of Calcitriol (1,25-Dihydroxyvitamin D3) American Journal of Diseases of Children. 2011 Nov;140(2):139. doi: 10.1001/archpedi.1986.02140160057032. [DOI] [PubMed] [Google Scholar]
- Underbjerg Line, Sikjaer Tanja, Rejnmark Lars. Long-Term Complications in Patients With Hypoparathyroidism Evaluated by Biochemical Findings: A Case-Control Study. Journal of Bone and Mineral Research. 2017 Dec;33(5):822–831. doi: 10.1002/jbmr.3368. [DOI] [PubMed] [Google Scholar]
- Cannata-Andia J. B., Rodriguez-Garcia M.. Hyperphosphataemia as a cardiovascular risk factor - how to manage the problem. Nephrology Dialysis Transplantation. 2012 Feb;17(suppl 11):16–19. doi: 10.1093/ndt/17.suppl_11.16. [DOI] [PubMed] [Google Scholar]
- Bandeira Leonardo C., Rubin Mishaela R., Cusano Natalie E., Bilezikian John P. Vitamin D and Hypoparathyroidism. Frontiers of Hormone Research. 2018. Mar, pp. 114–124. [DOI]
- Pigarova Ekaterina A., Rozhinskaya Ludmila Ya., Belaya Janna E., Dzeranova Larisa K., Karonova Tatiana L., Ilyin Alexanrd V., Melnichenko Galina A., Dedov Ivan I.. Russian Association of Endocrinologists recommendations for diagnosis, treatment and prevention of vitamin D deficiency in adults. Problems of Endocrinology. 2016 Oct;62(4):60–84. doi: 10.14341/probl201662460-84. [DOI] [Google Scholar]
- Erbil Yeşim, Ozbey Nese Colak, Sari Serkan, Unalp Haluk Recai, Agcaoglu Orhan, Ersöz Feyzullah, Issever Halim, Ozarmagan Selçuk. Determinants of postoperative hypocalcemia in vitamin D–deficient Graves’ patients after total thyroidectomy. The American Journal of Surgery. 2011 May;201(5):685–691. doi: 10.1016/j.amjsurg.2010.04.030. [DOI] [PubMed] [Google Scholar]
- Erbil Yeşim, Barbaros Umut, Temel Berna, Turkoglu Umit, İşsever Halim, Bozbora Alp, Özarmağan Selçuk, Tezelman Serdar. The impact of age, vitamin D3 level, and incidental parathyroidectomy on postoperative hypocalcemia after total or near total thyroidectomy. The American Journal of Surgery. 2009 Mar;197(4):439–446. doi: 10.1016/j.amjsurg.2008.01.032. [DOI] [PubMed] [Google Scholar]
- Erbil Yeşim. Predictive Value of Age and Serum Parathormone and Vitamin D3 Levels for Postoperative Hypocalcemia After Total Thyroidectomy for Nontoxic Multinodular Goiter. Archives of Surgery. 2007 Dec;142(12):1182. doi: 10.1001/archsurg.142.12.1182. [DOI] [PubMed] [Google Scholar]
- Alkhalili Eyas, Ehrhart Mark D., Ayoubieh Houriya, Burge Mark R.. Does Pre-Operative Vitamin D Deficiency Predict Postoperative Hypocalcemia After Thyroidectomy? Endocrine Practice. 2016 Sep;23(1):5–9. doi: 10.4158/ep161411.or. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Unsal Ilknur Ozturk, Calapkulu Murat, Sencar Muhammed Erkam, Hepsen Sema, Sakiz Davut, Ozbek Mustafa, Cakal Erman. Preoperative Vitamin D Levels as a Predictor of Transient Hypocalcemia and Hypoparathyroidism After Parathyroidectomy. Scientific Reports. 2020 Jun;10(1) doi: 10.1038/s41598-020-66889-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Carvalho Genival Barbosa de, Giraldo Lina Restrepo, Lira Renan Bezerra, Macambira Isabela Bergh Martins, Tapia Marcel Adalid, Kohler Hugo Fontan, Novoa Joel Arévalo, Kowalski Luiz Paulo. Preoperative vitamin D deficiency is a risk factor for postoperative hypocalcemia in patients undergoing total thyroidectomy: retrospective cohort study. Sao Paulo Medical Journal. 2019 Jul;137(3):241–247. doi: 10.1590/1516-3180.2018.0336140319. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Malik Muhammad Z, Mirza Ahsan A, Farooqi Sarosh A, Chaudhary Noman A, Waqar Mahnoor, Bhatti Hamza W. Role of Preoperative Administration of Vitamin D and Calcium in Postoperative Transient Hypocalcemia after Total Thyroidectomy. Cureus. 2019. May, [DOI] [PMC free article] [PubMed]
- Kirkby-Bott James, Markogiannakis Haridimos, Skandarajah Anita, Cowan Matthew, Fleming Bill, Palazzo Fausto. Preoperative Vitamin D Deficiency Predicts Postoperative Hypocalcemia After Total Thyroidectomy. World Journal of Surgery. 2010 Dec;35(2):324–330. doi: 10.1007/s00268-010-0872-y. [DOI] [PubMed] [Google Scholar]
- Chang Yuk Kwan, Lang Brian H. H.. To identify or not to identify parathyroid glands during total thyroidectomy. Gland Surgery. 2017 Dec;6(S1):S20–S29. doi: 10.21037/gs.2017.06.13. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Hallgrimsson P., Nordenström E., Almquist M., Bergenfelz A. O. J.. Risk Factors for Medically Treated Hypocalcemia after Surgery for Graves’ Disease: A Swedish Multicenter Study of 1,157 Patients. World Journal of Surgery. 2012 Apr;36(8):1933–1942. doi: 10.1007/s00268-012-1574-4. [DOI] [PubMed] [Google Scholar]
- Bergenfelz A., Jansson S., Kristoffersson A., Mårtensson H., Reihnér E., Wallin G., Lausen I.. Complications to thyroid surgery: results as reported in a database from a multicenter audit comprising 3,660 patients. Langenbeck's Archives of Surgery. 2008 Jul;393(5):667–673. doi: 10.1007/s00423-008-0366-7. [DOI] [PubMed] [Google Scholar]
- Alhefdhi Amal, Mazeh Haggi, Chen Herbert. Role of Postoperative Vitamin D and/or Calcium Routine Supplementation in Preventing Hypocalcemia After Thyroidectomy: A Systematic Review and Meta-Analysis. The Oncologist. 2013 May;18(5):533–542. doi: 10.1634/theoncologist.2012-0283. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Grzegory Anna, Pomorski Lech. Perioperative calcium and vitamin D supplementation in patients undergoing thyroidectomy – literature review. Polish Journal of Surgery. 2018 Jun;90(4):34–38. doi: 10.5604/01.3001.0012.0975. [DOI] [PubMed] [Google Scholar]
- Bai Binglong, Chen Zhiye, Chen Wuzhen. Risk factors and outcomes of incidental parathyroidectomy in thyroidectomy: A systematic review and meta-analysis. PLOS ONE. 2018 Nov;13(11):e0207088. doi: 10.1371/journal.pone.0207088. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Cui Qiuxia, Li Zhihua, Kong Deguang, Wang Kun, Wu Gaosong. A prospective cohort study of novel functional types of parathyroid glands in thyroidectomy. Medicine. 2016 Dec;95(52):e5810. doi: 10.1097/md.0000000000005810. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Oran Ebru, Yetkin Gurkan, Mihmanli Mehmet, Celayir Fevzi, Aygun Nurcihan, Coruh Bestegul, Peker Evren, Uludag Mehmet. The risk of hypocalcemia in patients with parathyroid autotransplantation during thyroidectomy. Turkish Journal of Surgery. 2015 Apr;32(1):6–10. doi: 10.5152/ucd.2015.3013. [DOI] [PMC free article] [PubMed] [Google Scholar]