









Le infezioni correlate all’assistenza (ICA) e la resistenza agli antibiotici (Antimicrobial Resistance, AMR) rappresentano una vera e propria emergenza sanitaria, con un impatto rilevante in termini clinici, sociali ed economici [1].
L’utilizzo eccessivo e inappropriato di farmaci antimicrobici è uno dei principali fattori di insorgenza della resistenza agli antibiotici nei patogeni umani, a causa di mutazioni o scambi genetici che ne facilitano la sopravvivenza. Gli effetti della resistenza, ovvero l’incapacità di un antibiotico, somministrato alle dosi terapeutiche, di ridurre la sopravvivenza o inibire la replicazione di un batterio patogeno, comportano gravi rischi di salute pubblica a livello globale, con aumento di mortalità per infezioni e ingenti costi sanitari e sociali. L’antibiotico-resistenza è un fenomeno multifattoriale e multisettoriale, contro il quale interventi singoli e sporadici mostrano un impatto limitato [1, 2]. Una delle più importanti conseguenze derivanti da tale fenomeno è rappresentata dalle ICA che, assenti al momento del ricovero, si manifestano in un individuo durante la degenza in ospedale o in un qualsiasi contesto assistenziale, con una sempre più crescente selezione di ceppi di patogeni Multi-Drug Resistant (MDR).
A livello europeo, ogni anno, le ICA colpiscono circa 4 milioni di pazienti e sono causa di oltre 37.000 decessi, di cui solo 10.000 in Italia. I costi per la gestione di queste infezioni, inoltre, superano il miliardo di €/anno, con un impatto economico notevole anche in termini di prolungamento dei tempi di degenza e maggior impiego di antibiotici. I dati provenienti dagli ospedali italiani mostrano un’incidenza di ICA del 5 ± 10%, con un tasso di mortalità fino al 20 ± 30% [1-6].
L’Organizzazione per la Cooperazione e lo Sviluppo Economico (OCSE) ha inoltre stimato che, tra il 2015 e il 2050, circa 2.4 milioni di persone potrebbero morire in Europa, Nord America e Australia a causa di infezioni da superbatteri, con la perdita di circa 1.75 milioni di anni di vita aggiustati per la disabilità (disability-adjusted life years, DALYs). Solo in Italia, sempre il modello OCSE stima 500.000 vite e 31.100 DALYs persi a causa delle resistenze microbiche [3-6].
Ancor di più negli ultimi anni, pertanto, la lotta alla resistenza antimicrobica e alle ICA è al centro dell’attenzione delle principali istituzioni internazionali, quali l’Organizzazione Mondiale della Sanità (OMS), la Commissione Europea, il Centro Europeo per il Controllo delle Malattie Infettive (European Center for Disease Prevention and Control, ECDC) che, in sinergia con autorità competenti e stakeholder internazionali, si propongono di coordinare e rafforzare tutte le azioni di contrasto dei rischi che hanno origine dall’interfaccia tra ambiente, animali e uomo, riconoscendo l’importanza di un approccio ‘One Health’ [7].
Nel processo di contaminazione del paziente negli ambienti di cura e di assistenza, il contesto ambientale ricopre un ruolo fondamentale come reservoirs per i microrganismi, in particolare le superfici di confinamento e di arredo, aumentando il rischio di contaminazione crociata attraverso il contatto diretto e/o indiretto con il paziente [8].
Numerosi studi hanno infatti dimostrato che le superfici ospedaliere sono persistentemente contaminate da numerosi patogeni multiresistenti, tra cui, i più frequenti, sono Staphylococcus spp. (incluso Staphylococcus aureus meticillino-resistente, MRSA), Enterobacteriaceae (Escherichia coli, Klebsiella pneumoniae) e Pseudomonas spp [6, 8].
Un ambiente pulito e igienico è considerato una delle componenti centrali dei programmi di prevenzione e controllo delle infezioni, con procedure di igienizzazione di tutti gli arredi e gli oggetti che interagiscono con gli individui [6, 8].
Il ruolo dell’igiene nelle strutture ospedaliere, dunque, per la riduzione delle ICA e della trasmissione infettiva, è di fondamentale importanza.
Comunemente, la disinfezione tradizionale si basa su sostanze chimiche, i cui fattori determinanti per l’efficacia biocida sono:
tempo di contatto;
concentrazione;
temperatura;
ph;
presenza di materiale organico;
tipo di microrganismo.
Tuttavia, tali sostanze, oltre a mostrare un elevato impatto ambientale, si rilevano di scarsa efficienza nella decontaminazione, in quanto non ne riescono a prevenire la ricontaminazione. Inoltre, l’ampio impiego di disinfettanti, associato a un uso eccessivo di antibiotici, determina una forte pressione selettiva sui microrganismi, con maggiore diffusione di specie resistenti e conseguenti infezioni difficilmente trattabili dal punto di vista farmacologico [6, 8-13].
I principali svantaggi a essi riconducibili, dunque, sono:
limitata efficacia biocida nel tempo (fino a 20-30 minuti dopo l’applicazione), con successiva crescita esponenziale degli agenti microbiologici;
diversa efficacia del disinfettante in funzione delle caratteristiche fisico–chimiche del materiale trattato;
capacità di sviluppo di mutazioni responsabili di fenomeni di biocida resistenza anche crociata;
problemi allergenici e di inquinamento ambientale.
Tutto ciò comporta un processo di selezione naturale dei ceppi microbici patogeni, sempre più resistenti alle comuni tecniche di disinfezione [6, 8, 12, 14].
Siamo testimoni di un’epoca in cui la rivoluzione scientifica, tecnologica e digitale sta impattando in modo dirompente settori fondamentali della società umana come quello della salute, creando i presupposti per una sanità di qualità, sostenibile e di precisione [15, 16]. Tuttavia, in molti contesti locali, incluse molte regioni italiane, il passaggio all’innovazione è ancora limitato e disomogeneo e lo sviluppo e la disponibilità di tecnologie sanitarie più innovative non sono accompagnati da omogenee opportunità di accesso e garanzie di sostenibilità su tutto il territorio. Se da un lato, infatti, l’innovazione dirompente offre nuove opportunità, dall’altro pone la necessità di un urgente shift culturale e organizzativo [16].
Per far sì che si sviluppi una vera e propria trasformazione della sanità e che i cittadini abbiano accesso alle innovazioni, è necessario un cambio di paradigma che deve partire da una visione olistica e strategica della salute a livello di Sistema Paese. Oggi più che mai, dovrà essere implementato un approccio globale, integrato e coordinato che ponga la persona e il suo benessere al centro con il coinvolgimento di tutti gli stakeholder.
L’innovazione può essere categorizzata sulla base del suo impatto sugli stakeholder come non dirompente o incrementale (non-disruptive o sustaining) o dirompente (disruptive) [16]. Le innovazioni dirompenti si riferiscono a innovazioni la cui introduzione mette de facto in discussione i vecchi sistemi, creando nuovi attori nel palcoscenico del sistema e rispondendo ai bisogni di nuovi gruppi di persone ovvero fornendo alle medesime persone nuovi prodotti, marginalizzando quelli vecchi e apportando valore agli stakeholder attivi nell’implementazione dell’innovazione, adattandosi con successo al cambiamento. L’innovazione dirompente richiede una nuova cultura professionale da sviluppare. Contrariamente all’innovazione dirompente, un’innovazione incrementale non crea nuovi mercati o reti di valore, ma modifica solo le maglie di quelle esistenti apportando un limitato incremento di valore, consentendo alle imprese interne di competere contro i miglioramenti sostenuti dall’uno e dall’altro. Un’innovazione incrementale può essere “discontinua” (cioè “trasformazionale” o “rivoluzionaria” o “radicale”) o “continua” (cioè “evolutiva”) [16].
Una solida conoscenza dei punti di forza e di debolezza degli attuali modelli organizzativi, unita alla capacità di trasformare dati rilevanti in informazioni pertinenti, consentiranno ai manager dei sistemi sanitari di prendere decisioni appropriate, basate su prove di efficacia concrete, garantendo ai cittadini un accesso equo e tempestivo a trattamenti/tecnologie innovativi/e [17].
In tale contesto, al fine di coniugare sostenibilità e accesso all’innovazione secondo la prospettiva della Value Based Health Care (VBHC), appare indispensabile introdurre, diffondere e implementare strumenti evidence-based, come l’Health Technology Assessment (HTA), orientati alla razionalizzazione delle risorse disponibili, secondo logiche di equità sociale e, soprattutto, di efficienza allocativa [18, 19]. L’HTA è riconosciuto come lo strumento principe per bilanciare l’esigenza di raggiungere la più ampia accessibilità/copertura possibile al netto degli alti costi che l’innovazione registra all’affaccio sul mercato, utilizzato con l’obiettivo di accertare il valore complessivo di una tecnologia con riferimento all’utilità sociale del trattamento [20].
L’HTA, inteso come la valutazione sistematica e multidimensionale di una nuova tecnologia nel settore sanitario, ha un ruolo chiave nel fornire le informazioni evidence based necessarie affinché i decision maker prendano le giuste decisioni al fine di promuovere la vera innovazione ad alto valore [20, 21].
L’HTA, inoltre, è impiegato oggi come strumento di supporto alle decisioni politiche e gestionali in tema di salute e si configura come strumento di governance, in quanto consente di guidare in maniera razionale i sistemi sanitari [18]. In tale prospettiva appare evidente come anche la Sanità Pubblica, ossia la scienza che si occupa di promuovere la salute della comunità dei cittadini, debba avvalersi di tale strumento per supportare scelte di valore per l’intera popolazione.
Pertanto, l’HTA rappresenta uno strumento evidence-based fondamentale per supportare scelte di valore anche in un ambito complesso e di assoluta priorità in Sanità Pubblica, come quello relativo alla gestione delle infezioni correlate all’assistenza e della resistenza agli antibiotici che comportano elevati oneri sociali ed economici per il nostro Servizio Sanitario Nazionale (SSN) e per l’intera società.
Il rischio infettivo, ossia il rischio per i pazienti, visitatori e operatori di contrarre un’infezione durante la permanenza in ospedale o in strutture di residenza assistita, è uno dei principali problemi di gestione negli ambienti sanitari. In Italia, nel 2016 la prevalenza di pazienti con almeno un’infezione correlata all’assistenza era pari all’8,03% (1.186 casi), calcolata come numero di pazienti con almeno una ICA sul totale dei pazienti eleggibili [22].
Le cause sono molteplici e tra le principali ricordiamo: la progressiva introduzione di nuove tecnologie sanitarie, con l’uso prolungato di dispositivi medici invasivi e gli interventi chirurgici complessi, che, pur migliorando le possibilità terapeutiche e l’esito della malattia, possono favorire l’ingresso di microrganismi in sedi corporee normalmente sterili; l’indebolimento del sistema di difesa dell’organismo (immunosoppressione) o gravi patologie concomitanti; la scarsa applicazione di misure di igiene ambientale e di prevenzione e controllo delle infezioni in ambito assistenziale; l’emergenza di ceppi batterici resistenti agli antibiotici, dovuta soprattutto all’uso scorretto o eccessivo di questi farmaci, che complica ulteriormente il decorso di molte ICA [1].
Queste infezioni hanno un impatto clinico ed economico rilevante. Secondo il primo rapporto globale dell'OMS [23], le ICA provocano un prolungamento della durata di degenza, disabilità a lungo termine, aumento della resistenza dei microrganismi agli antibiotici, un carico economico aggiuntivo per i sistemi sanitari e per i pazienti e le loro famiglie e una significativa mortalità in eccesso. In Europa, le ICA provocano ogni anno 16 milioni di giornate aggiuntive di degenza, 37.000 decessi attribuibili, 110.000 decessi per i quali l’infezione rappresenta una concausa. I costi vengono stimati in approssimativamente 7 miliardi di Euro, includendo solo i costi diretti [24].
Secondo l'ECDC ogni anno nell’Unione Europea, circa 4 milioni di pazienti contraggono un’infezione in ospedale e circa 37.000 di loro ne muoiono come diretta conseguenza. I tipi più comuni di infezione sono le infezioni del tratto urinario, la polmonite, le infezioni del sito chirurgico, le infezioni del sangue e le infezioni gastro-intestinali [24].
Gli ambienti sanitari svolgono un ruolo importante nella trasmissione delle ICA e, pertanto, adeguati ed efficienti processi di sanificazione sono fondamentali per il controllo di questo tipo di infezioni.
La limitazione di eventuali danni per la salute e per l’ambiente, negli ultimi anni, ha spinto la ricerca sperimentale a proporre nuovi approcci rispetto alla disinfezione chimica convenzionale (Conventional Chemical Cleaning, CCC) [6, 8]. Tra questi, grazie ai risultati di studi condotti negli anni 2012-2013 in alcuni ospedali italiani e nell’ospedale di Lokeren, in Belgio, è stato proposto un nuovo sistema di igienizzazione basato sui principi della modulazione del microbiota, analogamente a quanto già ampiamente riportato per la salute dell’uomo e denominato Probiotic Cleaning Hygiene System (PCHS) [8].
L’utilizzo di tale sistema, basato su detergenti ecosostenibili (fully ecolabelled) contenenti selezionate spore di batteri probiotici appartenenti al genere Bacillus, è in grado di ridurre stabilmente la contaminazione patogena sulle superfici trattate, inducendo un decremento fino a 2 Log delle resistenze precedentemente osservabili e senza indurre selezione di AMR [25-28]. Questi batteri sono, infatti, in grado di colonizzare le superfici su cui vengono applicati, contrastando la proliferazione delle altre specie batteriche e/o fungine potenzialmente patogene (legge di Gause), grazie a un’azione competitiva [8].
Il meccanismo d’azione è duplice: il principale si basa sull’esclusione competitiva che i Bacillus del PCHS sono in grado di esercitare sulle specie patogene, l’altro sulla loro capacità di produrre composti antimicrobici capaci di inibire la crescita di batteri Gram-positivi e Gram-negativi, con conseguente effetto positivo sia sull’AMR sia sulla incidenza di ICA [6, 29, 30].
Il sistema PCHS agisce sulla rimodulazione stabile del microbiota ospedaliero presentando, nell’arco di diverse settimane, un effetto “riequilibrante”, aspecifico e graduale [8]. Tuttavia, presentandosi la necessità di attaccare in modo specifico e rapido determinati tipi di contaminazione (come, ad esempio, in caso di focolai epidemici, o di pazienti colonizzati da specifici ceppi batterici), si è preso in considerazione il possibile uso di batteriofagi litici come decontaminanti ambientali. I batteriofagi sono, infatti, virus in grado di attaccare solo le cellule batteriche (quindi sicuri per tutti gli organismi eucariotici), sono specifici (ogni tipo di fago è diretto contro un solo tipo di batterio) e agiscono rapidamente [31, 32].
I primi studi riguardanti i batteriofagi e la loro azione antibatterica risalgono già a partire dagli anni ’20 del secolo scorso, e dagli anni ’30 in poi numerose pubblicazioni evidenziarono la validità dei fagi nel trattamento di infezioni da Shigella e Salmonella, nelle peritoniti, nelle infezioni cutanee e chirurgiche, nella setticemia, nelle infezioni del tratto urinario e nelle infezioni otorinolaringoiatriche. I risultati delle sperimentazioni condotte fino a oggi hanno dimostrato come il trattamento delle superfici con fagi, in aggiunta al PCHS, promuova, dunque, ulteriormente le capacità stabilizzanti dei probiotici presenti nel sistema, garantendo una rapida e specifica decontaminazione dall’agente bersaglio [31, 32].
Gli interventi ambientali basati sulla modulazione del microbiota con sistema PCHS sono stati oggetto di recenti pubblicazioni scientifiche, con vantaggi significativi nella limitazione della diffusione di AMR e nella riduzione del rischio di infezioni e del consumo di antibiotici e dei costi associati. I risultati a oggi descritti dimostrano, infatti, che il PCHS è in grado di ridurre costantemente i patogeni di superficie fino al 90% in più rispetto ai disinfettanti convenzionali, senza indurre la selezione di ceppi resistenti ai farmaci e come dimostrato dalle analisi molecolari dell’interno resistoma del microbiota presente sulle superfici trattate [6]. Nello studio multicentrico condotto nel 2018 da Caselli et al. [33] il sistema PCHS, rispetto ai dati ascrivibili alla disinfezione chimica, ha mostrato ridurre l’incidenza cumulativa di ICA dal 4,8 al 2,3%. Inoltre, sempre Caselli et al., nel 2019, hanno descritto una riduzione fino al 99% dei geni di resistenza antimicrobica contenuti nei microbi di superficie [28].
L’analisi economica riportata, invece, ha mostrato una riduzione del costo medio di gestione di un singolo episodio di ICA, durante la sperimentazione clinica con PCHS, da € 213,7 ± 915,3 a € 116,3 ± 249,9, con una riduzione complessiva dei costi del 45,6%. Anche l’impatto economico riguardante i farmaci antimicrobici associati alle ICA è diminuito da € 60.062,17 a € 14.767,00 con una riduzione del 75,4% dei costi totali a esse associati [28].
Nello studio di Tarricone et al. del 2020 [6], che riprende i dati di uno studio multicentrico, precedentemente condotto, pre-post [33], di tipo interventistico, sono stati confrontati gli attuali scenari di utilizzo della CCC con possibili scenari futuri che considerano un aumentato utilizzo del PCHS, dal 5 al 50% nei prossimi cinque anni, nella prospettiva ospedaliera italiana.
Lo studio ha riportato un’incidenza cumulativa di ICA diminuita significativamente dal 4,6 al 2,4% [6]. Dall’analisi è emerso, inoltre, che il costo del trattamento farmacologico per un paziente con ICA è diminuito da € 272 nel periodo di utilizzo di sistema CCC a € 110 con il successivo impiego di PCHS, con una riduzione del 59,8% per paziente. Il costo complessivo dei farmaci associati ai trattamenti delle ICA è risultato pari a € 52.004 nella fase CCC e pari a € 10.954 nella fase PCHS, con riduzione dei costi totali dei farmaci del 78,9%. Anche il trattamento delle ICA resistenti agli antibiotici ha registrato un risparmio dell’84%. Il costo medio per il trattamento di ogni singolo paziente resistente agli antibiotici, infatti, è risultato pari a € 859,98 e € 288,23, rispettivamente per CCC e PCHS, con una riduzione dei costi del 66% [6].
L’impiego di PCHS ha determinato, dunque, una riduzione del numero di pazienti con ICA resistenti ai farmaci e dei costi farmacologici a esse associati. Gli autori, infine, stimano che l’introduzione del solo PCHS come sistema di sanificazione ordinaria in 5 anni porterebbe a risparmi variabili da 14 a 457,5 milioni di euro per i sistemi sanitari [6].
Nel pieno della pandemia COVID-19, infine, un nuovo studio condotto dal Centro Ricerche CIAS dell’Università di Ferrara [33], ha testato la capacità antivirale del sistema di sanificazione PCHS, con l’obiettivo di poterlo utilizzare anche per la prevenzione della diffusione del nuovo coronavirus. I risultati hanno mostrato una buona attività di riduzione su tutti i virus inviluppati testati, incluso il SARS-CoV-2. Inoltre, è stato dimostrato come l’attività antivirale del sistema PCHS, a differenza di quella dei disinfettanti chimici che si esaurisce dopo solo 1 ora dall’applicazione, permanga stabilmente sulle superfici trattate fino a 24 ore dal trattamento [34].
I risultati, con ulteriori e sempre più approfondite indagini da eseguire a supporto, rappresentano dunque una possibile e valida azione strategica nella lotta al contrasto delle resistenze antimicrobiche e delle infezioni a esse associate, non solo in ambito sanitario ma anche in contesti comunitari.
Oggi risulta, quindi, necessario attuare una strategia preventiva efficace, migliorando la gestione dei diversi presidi contro le ICA e, quindi, garantendo gli strumenti più appropriati per la sanificazione degli ambienti ospedalieri e non, e implementando l’uso di sistemi innovativi sempre più efficaci, sicuri (per sé e per l’ambiente circostante) e sostenibili. In tale contesto, al fine di coniugare sostenibilità e accesso all’innovazione secondo la prospettiva della Value Based Health Care, appare indispensabile applicare strumenti evidence-based come l’HTA, anche a queste tecnologie al fine di razionalizzare le risorse disponibili, secondo logiche di equità sociale e, soprattutto, di efficienza allocativa.
Sulla base delle premesse descritte, il presente report si pone come obiettivo principale quello di analizzare e sistematizzare, secondo la metodologia Health Technology Assessment (HTA), le evidenze scientifiche a supporto del PCHS, fornendo una visione d’insieme sull’impatto clinico, economico, etico e organizzativo del suo utilizzo nel contesto di cura italiano.
Tale valutazione affronta le seguenti tematiche:
epidemiologia delle ICA in Italia e loro impatto per la salute pubblica;
sistemi di sanificazione attualmente disponibili in Italia;
il PCHS: caratteristiche della tecnologia, aspetti di efficacia e sicurezza;
un sistema di sanificazione a base di probiotici per la riduzione delle infezioni correlate all’assistenza e la resistenza antimicrobica: analisi dell’impatto sul budget;
impatto ambientale per la Salute Pubblica degli attuali sistemi di sanificazione di ambienti/superfici in setting assistenziale e comunitario e potenziali benefici dei nuovi sistemi innovativi;
analisi delle principali raccomandazioni nazionali su sanificazione e disinfezione degli ambienti sanitari;
valutazione etica dell’utilizzo del PCHS in Italia.
Il report si chiude, infine, con gli elementi chiave per il processo decisionale che sintetizzano quanto descritto nel report. L’elaborazione di questo report è avvenuta, secondo la metodologia HTA, attraverso la creazione di un gruppo di lavoro multidisciplinare che ha identificato, analizzato e, successivamente, sintetizzato tutte le evidenze disponibili sull’argomento. Sono state, quindi, eseguite revisioni della letteratura scientifica e le evidenze sono state selezionate secondo criteri di inclusione precostituiti, organizzate sulla base dei domini HTA seguendo il Core Model® dell’European Network per l’Health Technology Assessment (EuNetHTA) [35].
Coerentemente con l’approccio dell’HTA, la stesura del presente report ha previsto, inoltre, la definizione e l’attivazione di un tavolo multidisciplinare di esperti per discutere e approfondire le tematiche legate alla tecnologia sanitaria oggetto di valutazione HTA. Questa attività ha rappresentato una fase di appraisal, in cui i risultati della ricerca effettuata per l’elaborazione del report sono stati sottoposti all’attenzione di un expert panel che ha fornito indicazioni utili a rifinire e sistematizzare i risultati dello studio e delle evidenze prodotte.
Le infezioni correlate all’assistenza (ICA) sono una tipologia di infezioni che si sviluppano in un paziente durante un processo di cura, in qualsiasi ambito assistenziale (reparti ospedalieri, day-hospital/day-surgery, ambulatori, reparti di lungodegenza, strutture residenziali territoriali e assistenza domiciliare), che non erano presenti o in incubazione al momento del ricovero [1].
Le ICA sono un grave problema di salute pubblica e rappresentano un “evento avverso” frequente durante l’erogazione delle cure, causando esiti diversi tra i quali una degenza ospedaliera prolungata, potenziali disabilità a lungo termine, un aumento dei decessi e costi aggiuntivi per i sistemi sanitari [2].
A livello europeo, ogni anno, le ICA colpiscono circa 4 milioni di pazienti, con circa 16 milioni di giornate di degenza aggiuntive e sono causa di oltre 37.000 decessi, di cui solo 10.000 in Italia. I costi per la gestione di queste infezioni, inoltre, superano il miliardo di €/anno, con un impatto economico notevole anche in termini di prolungamento dei tempi di degenza e maggior impiego di antibiotici [3, 4].
In Italia si verificano ogni anno circa 450-700 mila casi di ICA nei pazienti ospedalizzati [5]. Anche se il 30% di esse sono ritenuti evitabili [5] e diversi interventi hanno dimostrato efficaci risultati nel ridurre il carico di tali infezioni, le ICA e la resistenza antimicrobica (AMR), fenomeni tra loro correlati, sono causa di un trend epidemiologico in costante crescita, con un grave impatto sia in termini di salute che in termini economici [6].
Studi recenti, condotti dall’Organizzazione per la Cooperazione e lo Sviluppo Economico (OCSE) hanno stimato che in assenza di interventi efficaci, il numero di ICA complicate da AMR entro il 2050, potrebbe provocare la morte di 10 milioni di persone l’anno [3, 7-8].
Inoltre, una revisione sistematica delle infezioni causate da batteri resistenti agli antibiotici nell’Unione Europea (UE), ha stimato circa 670.000 casi nel 2015, di cui il 63,5% associato all’assistenza sanitaria, con circa 33.000 decessi e 870.000 anni di vita aggiustati per la disabilità (Disability-Adjusted Life Years, DALYs) attribuibili a queste infezioni [9].
Naturalmente tutto questo si riflette sul piano economico, non solo su perdita di vite ma anche di giornate lavorative e su un maggiore utilizzo di risorse sanitarie. È stato stimato, infatti, che le 16 milioni di giornate aggiuntive di degenza comportano un costo approssimativo di 7 miliardi di euro [9-10].
Per tali ragioni, negli ultimi anni si è assistito a un vero e proprio segnale di allarme contro le infezioni associate all’assistenza sanitaria e la resistenza antimicrobica da parte delle principali istituzioni internazionali, quali l’Organizzazione Mondiale della Sanità (OMS), la Commissione Europea, il Centro Europeo per il Controllo delle Malattie Infettive (European Center for Disease Prevention and Control, ECDC), con l’unico obiettivo di coordinare e rafforzare tutte le misure di prevenzione e controllo di tali fenomeni in costante aumento [11].
A tal proposito, inoltre, nel 2016, l’OMS ha condiviso un framework per la valutazione della prevenzione e controllo delle infezioni nelle strutture sanitarie per acuti, ma estendibile anche a tutte le altre strutture di ricovero, al fine di supportare l’implementazione delle principali linee guida condivise a livello internazionale e delle loro componenti essenziali di prevenzione delle infezioni. Si tratta di uno strumento di strategia multimodale che, nonostante le differenze strutturali e organizzative esistenti tra i Paesi ad alto, medio e basso reddito, può essere applicato a livello globale, rivelandosi utile in un’ottica di pianificazione di azioni di miglioramento e di monitoraggio del raggiungimento di standard e requisiti definiti a livello internazionale [12].
Per quanto riguarda il contesto italiano, invece, il Piano Nazionale di Prevenzione (PNP) 2020-2025 e il Piano Nazionale di Contrasto dell’Antimicrobico-Resistenza (PNCAR) 2017-2020, prorogato al 2021, sottolineano l’importanza di raccogliere dati sulle ICA e sul consumo di antibiotici in tutte le unità sanitarie, al fine di contrastare la diffusione di microrganismi multiresistenti, in particolar modo in seguito alla pandemia da COVID-19, responsabile di un ulteriore incremento di tali fenomeni e di un rallentamento dei sistemi di sorveglianza [13-14].
Tuttavia, attualmente non è ancora disponibile un sistema di sorveglianza nazionale delle ICA e i dati relativi sono limitati agli studi di prevalenza puntuale [15].
La prima regione italiana che ha coordinato attività volte a valutare la fattibilità di un programma di sorveglianza nazionale delle ICA secondo i protocolli europei è stata l’Emilia-Romagna, nel 2006. Tuttavia, l’obiettivo di estendere tale programma nelle diverse regioni italiane non è stato raggiunto, registrando un’adesione volontaria solo da parte di alcune regioni e ospedali. Al fine di far fronte a tale disomogeneità nazionale, il Centro per la Prevenzione e il Controllo delle Malattie (CCM) ha avviato, insieme all’Istituto Superiore di Sanità (ISS) e in collaborazione con altre unità operative, un progetto denominato “Sostegno alla Sorveglianza delle infezioni correlate all’assistenza anche a supporto del PNCAR” (2019), così da predisporre e implementare un piano per un sistema nazionale dedicato alla sorveglianza delle ICA. Tale progetto si pone, inoltre, l’obiettivo di attribuire la responsabilità delle attività di sorveglianza a personale dedicato, di istituire percorsi formativi specialistici e utilizzare i risultati così ottenuti per programmare interventi di miglioramento [14, 16].
L’attuale programma di sorveglianza italiano, in accordo con quanto previsto dall’ECDC, si articola nei seguenti punti:
sistema di sorveglianza nazionale delle infezioni del sito chirurgico (SNICh);
sistema di sorveglianza nazionale delle infezioni in terapia intensiva (SITIN);
studio di prevalenza delle infezioni correlate all’assistenza negli ospedali per acuti, e nelle strutture residenziali per anziani, coordinati da ECDC.
Accanto a questi sistemi ve ne sono altri definiti dal PNCAR 2017-2020: sorveglianza delle infezioni da C. Difficile e la sorveglianza delle infezioni da MRSA, che sono in corso di implementazione [17].
La più recente indagine italiana sulla prevalenza puntuale (PPS) delle ICA negli acuti, condotta nel 2016 nell’ambito dell’indagine dell’ECDC sulle ICA nell’UE e nello Spazio economico europeo (SEE), ha riscontrato che la prevalenza di pazienti con almeno una ICA era dell’8% [17].
Diversi sono i fattori di rischio associati allo sviluppo delle ICA, quali [18]:
età del paziente (anziani o neonati, specie se prematuri);
indebolimento delle difese immunitarie;
infezioni o malattie concomitanti;
malnutrizione;
obesità;
scarsa igiene ambientale ospedaliera;
inadeguata igiene delle mani degli operatori;
utilizzo prolungato di dispositivi medici invasivi;
durata del ricovero (più è lunga maggiore è il rischio);
assunzione prolungata di antibiotici e/o antibiotico-resistenza.
Diverse sono anche le tipologie di infezioni correlate all’assistenza sanitaria. Recenti studi hanno evidenziato che le ICA più frequenti sono le infezioni del torrente ematico associate alla linea centrale (CLABSI) (14,0-35,8%), le infezioni del tratto urinario associate al catetere (CAUTI) (23,6-30,9%), le infezioni del sito chirurgico (SSI) (12,2%) e la polmonite associata al ventilatore (VAP) (15-28,6%) [19-20]. La diversa tipologia di infezioni dipende, anche, dalla diversa tipologia di microrganismi che le determinano. Fin dall’inizio degli anni ’80, le ICA erano dovute principalmente a batteri Gram-negativi (come ad esempio, E. coli e K. pneumoniae). Poi, a causa dell’utilizzo sempre maggiore e/o inappropriato della terapia antibiotica, sono aumentate le infezioni sostenute da patogeni Gram-positivi (soprattutto Enterococchi e Stafilococcus epidermidis) e quelle da miceti (soprattutto Candida), mentre sono diminuite quelle sostenute da Gram-negativi. Tuttavia, recentemente, alcuni Gram-negativi, come gli enterobatteri produttori carbapenemasi (CPE) e Acinetobacter spp, sono diventati molto più frequenti in ambito assistenziale [21].
La prevenzione e il controllo delle ICA sono necessarie per il rilevamento di nuovi casi di infezione [22, 23]. Occorre però pianificare e attuare programmi di controllo a diversi livelli (nazionale, regionale, locale), per garantire l’implementazione di quelle misure che si sono dimostrate efficaci nel ridurre al minimo il rischio di complicanze infettive. Sebbene le ICA siano comunemente attribuibili ai fattori intrinseci del paziente e alla qualità di assistenza fornita, è stato dimostrato che un sistema organizzativo specifico contribuirebbe a prevenirle [14].
A tal fine è stato istituito il Comitato per il contrasto delle infezioni ospedaliere (CIO), strumento che consente di mantenere un alto il livello di attenzione, di definire dimensioni e caratteristiche del problema, indirizzare gli interventi, monitorare i progressi mediante l’utilizzo di indicatori specifici e individuare tempestivamente eventi sentinella ed epidemie [24].
Conoscere i dati più aggiornati sul burden epidemiologico delle ICA è di fondamentale importanza per comprendere meglio il problema e individuare i fattori di rischio a esso correlati. Tutto ciò permette di istituire e/o implementare sistemi di sorveglianza nazionali, che siano uniformi e conformi con gli attuali protocolli europei, al fine di pianificare le più idonee misure di prevenzione per il contenimento e la riduzione dell’impatto sociale ed economico notevole di questa grave minaccia per la salute pubblica.
Sulla base delle premesse sopra descritte, l’obiettivo di questo capitolo è quello di analizzare e sistematizzare le evidenze attualmente disponibili sul burden epidemiologico delle ICA, con un focus particolare sul setting italiano, anche al fine di descrivere lo stato dell’arte delle misure di prevenzione e sorveglianza messe in atto a livello nazionale.
Al fine di raccogliere le evidenze riguardanti il burden epidemiologico delle ICA in Europa, e più nello specifico in Italia, è stata condotta una revisione sistematica di letteratura, consultando due differenti database elettronici (Pubmed e Web of Science), per ciascuno dei quali è stata elaborata una stringa di ricerca, come riportato in Tabella I.
Stringhe di ricerca.
| Database | Stringa di ricerca | Filtri applicati |
|---|---|---|
| PubMed | ((“health care associated infections”[All Fields] OR “health care associated infection”[All Fields] OR “HAI”[All Fields] OR “HAIs”[All Fields] OR “HCAIs”[All Fields] OR “HCAI”[All Fields] OR “nosocomial infections”[All Fields] OR “nosocomial infection”[All Fields] OR “cross infection”[All Fields] OR “cross infections”[All Fields] OR “hospital acquired infection”[All Fields] OR “hospital acquired infections”[All Fields]) AND (“survey”[All Fields] OR “surveys”[All Fields] OR “survey”[MeSH Terms] OR “epidemiologies”[All Fields] OR “epidemiology”[All Fields] OR “epidemiology”[MeSH Terms] OR “incidence”[All Fields] OR “incidence”[MeSH Terms] OR “prevalence”[All Fields] OR “prevalence”[MeSH Terms]) AND (“europe”[MeSH Terms] OR “europe”[All Fields])) AND ((y_10[Filter]) AND (english[Filter])) | Last 10 years, English |
| Web of Science | ((ALL=((“health care associated infection” OR “HAI” OR “HCAI” OR “health care associated infections” OR “HAIs” OR “HCAIs” OR “nosocomial infections” OR “nosocomial infection” OR “cross infection” OR “cross infections” OR “hospital acquired infection” OR “hospital acquired infections”))) AND ALL=((“Epidemiology” OR “incidence” OR “prevalence” OR “survey”))) AND ALL=(Europe) | 2012-2022, English |
I record trovati sono stati inseriti in un foglio di lavoro Excel dedicato, per essere, successivamente, valutati secondo specifici criteri di inclusione/esclusione. Dopo la rimozione dei duplicati, si è proceduto con uno screening per titolo e abstract e, successivamente, con la lettura dei full text degli articoli ritenuti eleggibili. Gli articoli sono stati, inoltre, sottoposti a un processo di snowballing, esaminando i riferimenti bibliografici e le citazioni presenti, al fine di identificare ulteriori articoli rispondenti ai criteri di inclusione.
Sono stati definiti eleggibili tutti gli studi contenenti dati sul burden epidemiologico delle ICA in Europa e informazioni riguardanti la tipologia e la frequenza dei principali microrganismi patogeni, i fattori di rischio implicati nell’insorgenza delle ICA ed eventuali attività di prevenzione condotte nei setting assistenziali.
Sono stati inclusi articoli originali e revisioni sistematiche, scritti esclusivamente in lingua inglese e condotti nei 27 Paesi membri dell’UE (Austria, Belgio, Bulgaria, Cipro, Croazia, Danimarca, Estonia, Finlandia, Francia, Germania, Grecia, Irlanda, Italia, Lettonia, Lituania, Lussemburgo, Malta, Paesi Bassi, Polonia, Portogallo, Repubblica Ceca, Romania, Slovacchia, Slovenia, Spagna, Svezia e Ungheria), e gli studi condotti negli ultimi 10 anni (2012-2022) sia su popolazione adulta sia su popolazione pediatrica, e pubblicati fino al 5 marzo 2022, data di avvio della revisione.
Per ogni database consultato, sono stati applicati dei filtri preimpostati resi disponibili dai database stessi (Tab. I).
Sono stati, invece, esclusi studi che riportavano dati inerenti al burden epidemiologico delle ICA in contesti extra-Europei, oltre ad articoli di cui non era possibile reperire il full text o privi di informazioni pertinenti o sufficienti per le finalità della ricerca.
La revisione sistematica della letteratura è stata condotta secondo le linee guida “Preferred Reporting Items for Systematic Reviews and Meta-Analysis (PRISMA) 2009” [25].
Tre ricercatori (F.D’A., F.P., A.M.) hanno esaminato, in modo indipendente, gli articoli esitati dalla ricerca bibliografica. In caso di dubbi riguardanti l’inclusione/esclusione di un lavoro, gli stessi sono stati risolti mediante discussione con un ricercatore senior (G.E.C.). Sulla base degli articoli inclusi, al fine di delineare un quadro epidemiologico delle ICA nel contesto italiano e procedere con un confronto a livello europeo, i lavori sono stati inizialmente classificati per Paese, separandoli per setting italiano e setting europeo.
Successivamente, sia i lavori svolti a livello italiano sia quelli condotti negli altri Paesi dell’UE, sono stati suddivisi in base alla popolazione analizzata (popolazione generale, adulta, neonatale-pediatrica). Ciascuno di essi, poi, è stato inserito in specifiche tabelle contenenti: la prima, informazioni sul nome del primo autore e anno di pubblicazione, paese, disegno di studio, durata dello studio, popolazione target e setting; la seconda, invece, dati epidemiologici, tipo di ICA, tipo di microrganismo e fattori di rischio.
In una prima fase del lavoro, sono stati considerati unicamente gli articoli condotti in Italia, al fine di delineare il burden epidemiologico delle ICA a livello nazionale e confrontarlo, successivamente, con i dati europei. Si riporta, pertanto, la descrizione di quanto emerso dalle evidenze scientifiche italiane disponibili.
Dalla revisione di letteratura condotta sono stati selezionati un totale di 2883 articoli rispondenti all’obiettivo della ricerca e focalizzati sul contesto italiano. Dopo la rimozione dei duplicati e una prima selezione per titolo e abstract, sono stati valutati 127 full-text. Gli articoli sono stati, inoltre, sottoposti a un processo di snowballing, portando all’inclusione finale di 26 articoli (Fig. 1).
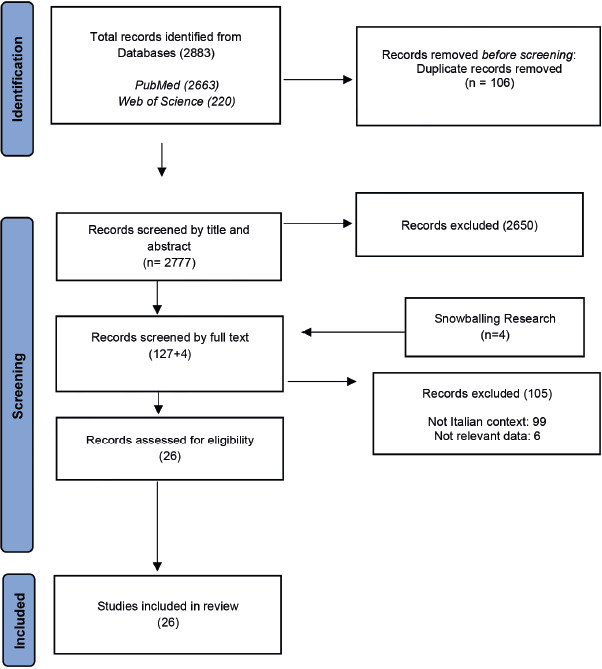
PRISMA statement flow diagram.
Per l’estrazione e l’analisi dei dati, gli articoli sono stati classificati sulla base della popolazione target oggetto di studio. In particolare, dei 26 articoli inclusi, il 23,1% (N = 6) riporta dati riferiti alla popolazione generale, senza alcuna stratificazione per età; il 53,8% (N = 14) prende in esame adulti di età > 19 anni; il 15,4% (N = 4) valuta il burden epidemiologico delle ICA in popolazioni neonatali-pediatriche, da 0 mesi a 18 anni; infine, il 7,7% (N = 2) riporta dati stratificati per età, da cui è stato possibile estrapolare informazioni specifiche sia per popolazione adulta sia per quella neonatale-pediatrica.
Il 23,1% (6/26) [19, 20, 26-29] degli studi inclusi nella revisione di letteratura, dunque, riguarda la popolazione italiana generale, con un range di età 0-100 anni, e dati riguardanti le ICA non stratificati per età (Tab. II). Tra questi studi, tre sono stati condotti nella Regione Lazio, uno in Sicilia, uno in Liguria e uno condotto in più centri dislocati a livello nazionale, tutti basati su dati ospedalieri.
Studi italiani condotti sulla popolazione generale.
A. Principali caratteristiche degli studi italiani inclusi, condotti sulla popolazione generale.
| Primo autore, anno di pubblicazione [Ref] | Regione/città italiana e/o ospedale di riferimento | Disegno di studio | Durata dello studio | Popolazione target (n. pazienti, età media, genere) | Setting |
|---|---|---|---|---|---|
| Sinatra I., 2013 [28] | Ospedale Universitario “Paolo Giaccone” di Palermo, Sicilia | Studio trasversale | Settembre 2011 | Tot: 328 0-10 mesi: 21 pazienti Età media F: 61,8 anni (DS 19,4 anni) M: 60,4 anni (DS 18,8 anni) |
Dipartimenti clinici di Medicina, Dipartimenti chirurgici, UTI |
| Marani A., 2016 [26] | Ospedale “Sant’Andrea” di Roma, Lazio | Studio trasversale | 2007-2015 | Tot: 2.840 M: 53,42% F: 46,8% |
Reparti di Medicina e Chirurgia (fatta eccezione per UTI, Unità di Emergenza, Psichiatria, day hospital e day surgery) |
| Sticchi C., 2018 [20] | Liguria | Studio osservazionale | Marzo-aprile 2016 | Tot: 3.647 0-54 anni: 934 (25,61%) > 54 anni: 2.713 (74,39%) |
Reparti di Medicina, Geriatria, Riabilitazione, Pediatria e Neonatologia, Ginecologia e Ostetricia, Ortopedia e Traumatologia, Chirurgia, UTI |
| Santino I., 2019 [27] | Lazio | Studio osservazionale | Aprile 2015- dicembre 2018 |
Tot: 1.601 | Reparti di Medicina, Chirurgia e UTI |
| Barbato D., 2019 [19] | Policlinico “Umberto I” di Roma, Lazio | Studio trasversale | 5-23 novembre 2018 | Tot: 799 < 1 mesi: 25 (3,1%) 1-11 mesi: 7 (0,9%) 1-17 anni: 27 (3,4%) 18-64 anni: 311 (38,9%) 65-84 anni: 342 (42,8%) ≥ 85 anni: 87 (10,9%) |
Geriatria, Ginecologia e Ostetricia, UTI, Medicina, Pediatria, Riabilitazione, Chirurgia |
| Bordino V., 2021 [29] | 56 Ospedali italiani | Studio trasversale | 2016 | Tot: 14.773 | Non specificato |
UTI: Unità di Terapia Intensiva.
Burden epidemiologico, tipo di ICA, agenti patogeni e fattori di rischio riportati negli studi italiani inclusi, condotti sulla popolazione generale.
| Primo autore, anno di pubblicazione [Ref] | ICA (%) | Tipo di ICA (%) | Agenti patogeni (%) | Fattori di rischio | ||
|---|---|---|---|---|---|---|
| Incidenza | Prevalenza | Mortalità | ||||
| Sinatra I., 2013 [28] | - | 12 (3,6%) | CVC 7,1% BSI 7 casi/14 UTI 4 casi/14 Polmoniti SSI GI 2 casi/14 |
Enterobacteriaceae (Enterobacter cloacae) Enterococci (E. faecalis e Enterococcus faecium) Cytomegalovirus C. albicans A. baumannii |
Device invasivi | |
| Marani A., 2016 [26] | - | 180 (6,34%) | - | RTI 63 (35%) SSI 40 (22,2%) BSI 31 (17,2%) UTI 35 (19,4%) Altre 11 (6,1%) |
K. pneumoniae 32,1% P. aeruginosa 10,4% E. faecalis 8,5% C. albicans 8,5% MRSA 7,5% |
Procedure invasive a rischio: Chirurgia CRI CVC |
| Sticchi C., 2018 [20] | - | 10,3% | - | RTI 2,6% UTI 2,4% BSI 2% SSI 1,2% Sepsi 0,8% Altre 1,7% |
Batteri Gram-negativi: 51,2% Batteri Gram-positivi: 40,3% Funghi: 8,1% Virus: 0,4% |
CRI PVC CVC Intubazione tracheale o tracheotomia |
| Santino I., 2019 [27] | - | Reparti di Medicina: 54,9% Reparti di Chirurgia: 30,6% UTI: 14,5% |
- | CDI 27,2% RTI 21,3% UTI 16,9% SSI 15,5% BSI 12,5% Ulcere 3,6% Altre 3,0% |
MRSA 19,5% C. difficile 25,6% Enterococcus spp. 0,7% Acinetobacter spp. 15,2% E. coli resistente ai carbapenemi 2,4% Klebsiella spp. resistente ai carbapenemi 25,6% Pseudomonas spp. 10,2% Altri Gram-negativi 0,7% |
Intervento chirurgico CRI Ventilazione meccanica PICC CVC |
| Barbato D., 2019 [19] | - | 13,3% | - | BSI 30,9% UTI 25,2% Polmoniti 19,5% SSI 13,8% GI 4,9% Meningiti 0,8% Osteomieliti 0,8% Sinusiti 0,8% Altre/non note 3,3% |
K. pneumoniae 20% P. aeruginosa 12,8% S. aureus 8% E. faecalis 7,2% E. coli 6,4% A. baumannii 5,6% C. albicans 8% |
CVC PCV CRI Ventilazione meccanica Chirurgia |
| Bordino V., 2021 [29] | 1.058,39 per 100.000 abitanti |
- | 48,53 per 100.000 abitanti | PNEU BSI UTI SSI CDI |
Non specificato | Non specificato |
BSI (Bloodstream infection): infezioni del torrente ematico; CAUTI (Catheter-Associated Urinary Tract Infection): infezioni urinarie catetere-correlate; CDI: infezione da C. difficile; CLABSI (Central Line-Associated Blood Stream Infection): infezioni del torrente ematico associate alla linea centrale; CRI (Catheter-Related Infection): infezioni correlate al catetere; CVC (Central Venous Catheter): catetere venoso centrale; EENT (Eye, Ear, Nose or Mouth Infection): infezione occhio-orecchio-naso-bocca; GI: infezioni gastrontestinali; MRSA: S. aureus meticillino-resistente; NEC (Necrotizing Enterocolitis): enterocolite necrotizzante; LRTI (Lower Respiratory Tract Infection): infezioni del basso tratto respiratorio; RTI (Respiratory Tract Infections): infezioni del tratto respiratorio; SSI (Surgical Site Infections): infezioni del sito chirurgico; UTI (Urinary Tract Infections): infezioni delle vie urinarie; VAP (Ventilator Associated Pneumonia): polmoniti associate al ventilatore.
Lo studio di Marani et al., del 2016 [26], descrive un’indagine di prevalenza della durata di 9 anni (2007-2015) e finalizzata a indagare il trend della prevalenza delle ICA nei reparti di medicina e chirurgia di un ospedale universitario romano, su un campione di 2.840 pazienti. Nel complesso, 136 pazienti (4,79%) hanno sviluppato 180 (6,4%) ICA, con una maggiore frequenza, nell’ordine, di infezioni del tratto respiratorio (35%), infezioni del sito chirurgico (22,2%), del torrente ematico (17,2%), infezioni urinarie (19,4%) e infezioni di altro tipo (6,1%), attribuibili nel 63,2% dei casi a patogeni Gram-negativi [26].
Sempre nel Lazio, nel 2019, sono stati invece analizzati dati provenienti da sistemi di sorveglianza per microrganismi “alert”, raccolti nel periodo aprile 2015-dicembre 2018. Dei 1.601 pazienti inclusi nello studio, il 48,8% ha sviluppato un episodio di ICA, prevalentemente in reparti di medicina (54,9%). Le infezioni da C. difficile (CDI) (27,2%) sono risultate le più comuni, seguite dalle infezioni delle vie respiratorie (21,3%), UTI (16,9%), SSI (15,5%), setticemie (12,5%), ulcere (3,6%) e infezioni di altro tipo (3,0%) [27].
Barbato et al. [19] descrivendo i risultati di un’indagine di prevalenza puntuale, condotta nel novembre 2018 in un altro ospedale universitario romano, riportano una prevalenza di almeno una ICA tra i pazienti ospedalizzati, pari al 13,3%. Le infezioni del torrente ematico sono risultate essere le più frequenti, attestandosi al 30,9% del totale delle infezioni, seguite da infezioni del tratto urinario (25,2%), polmoniti (19,5%) e SSI (13,8%). L’analisi multivariata condotta, inoltre, ha evidenziato un’associazione significativa tra la presenza di ICA e l’utilizzo di device (OR = 34,30; 95% IC: 3,69-318,66), durata di degenza (OR = 1,01; 95% IC: 1,00-1,02) ed esposizione a profilassi antimicrobica (OR = 0,23; 95% IC: 0,11-0,47).
Anche lo studio condotto in Sicilia da Sinatra et al., sebbene più datato e con una minore prevalenza di ICA, pari al 3,6%, sottolinea il ruolo determinante di dispositivi invasivi quali, ad esempio, cateteri vascolari e urinari, nella loro insorgenza [28].
Un’indagine regionale condotta in Liguria da Sticchi et al. [20] ha invece riportato valori di prevalenza di circa il 10,3% (95% IC: 9,4-11,3), con variazioni considerevoli tra gli ospedali per acuti arruolati, oscillando dall’1,7% (95% IC: 0,0-9,2) al 30,6% (95% IC: 19,6-43,7).
Il recente studio di Bordino et al. [29] infine, rappresenta uno dei primi lavori italiani a stimare il burden delle ICA in termini di DALY, utilizzando i dati raccolti da un’indagine nazionale di prevalenza puntuale condotta nel 2016. Gli autori riportano 641.065 nuovi casi ogni anno e 29.375 morti in Italia. Partendo da tali valori, si è stimato un notevole burden clinico delle ICA, corrispondente a circa 424.657,45 (95% UI 346.240,35-513.357,28) DALYs annuali e 702,53 DALY (95% UI 575,22-844,66) per 100.000 abitanti, di cui sono maggiormente responsabili le infezioni del torrente ematico per il 59% dei casi, seguite da quelle polmonari (29%), del sito chirurgico (9%), CDI (2%) e UTI che, invece, ne rappresentavano meno dell’1%.
Il 61,5% degli studi (16/26) si focalizza, invece, sul burden delle ICA in popolazioni adulte [1, 5, 30-41] (Tab. III), includendo due articoli con dati stratificati per fasce d’età e, dunque, utili anche per l’analisi sulla popolazione pediatrica [42, 43]. Nel complesso, per questa popolazione target, si stima una prevalenza di ICA tra il 5 [1] e il 10% circa [5].
Studi italiani inclusi, condotti sulla popolazione adulta.
A. Principali caratteristiche degli studi italiani inclusi, condotti sulla popolazione adulta.
| Primo autore, anno di pubblicazione [Ref] | Regione/città italiana e/o ospedale di riferimento | Disegno di studio | Durata dello studio | Popolazione target (n. pazienti, età media, genere) | Setting |
|---|---|---|---|---|---|
| Agodi A., 2013 [31] | 65 UTI italiane | Studio trasversale | Novembre 2006-aprile 2007 (1a survey) Ottobre 2008-marzo 2009 (2a survey) Ottobre 2010-marzo 2011 (3a survey) |
Tot. Survey 1: 3053 Tot. Survey 2: 2163 Tot. Survey 3: 2478 Età media: 2006-2007: 63,7 anni 2008-2009: 66,0 anni 2010-2011: 67,1 anni |
UTI |
| Charriel L., 2014 [42] | 58 ospedali pubblici Piemonte |
Studio trasversale | Dicembre 2009- gennaio 2010 |
Tot: 7841 Età media: 64,5 ± 22,1 anni < 58 anni: 25% < 72 anni: 50% < 81 anni: 75% |
Tutti i reparti, fatta eccezione per i day hospital, day surgery e pronto soccorso |
| Marchi M., 2014 [43] | Italia | Studio trasversale | 2009-2011 | Tot: 83.127 interventi chirurgici Età media: 53 anni |
Reparti di Chirurgia |
| Vincitorio D., 2014 [34] | Ospedale “U. Sestilli” di Ancona, Marche | Studio trasversale | Ottobre 2011- aprile 2012 |
Tot: 2773 Età: ≥ 65 anni |
Reparti di Geriatria, Medicina e Chirurgia |
| Agodi A. 2015 [32] | Azienda Ospedaliero-Universitaria Policlinico “Vittorio Emanuele’’ di Catania, Sicilia | Studio trasversale | 12 mesi | Tot: 249 M: 50,2% Età media: 52,4 ± 16,2 anni |
Dipartimento di Chirurgia Digestiva e Colorettale |
| Chelazzi C. 2015 [35] | Università di Firenze, Toscana | Studio osservazionale retrospettivo | Gennaio 2012- dicembre 2013 |
Tot: 494 Età media: 69,6 ± 13,9 anni |
UTI |
| Luzzati R. 2016 [38] | 6 ospedali italiani (Trieste, Udine, Venezia, Padova, Verona, e PA Bolzano) | Studio osservazionale retrospettivo multicentrico | Gennaio 2011- dicembre 2013 |
Tot: 686 Età media: 70 ± 15 anni |
Reparti di Medicina (Unità di Medicina Interna e Unità Mediche Specializzate) Reparti chirurgici e UTI |
| Grasselli G. 2017 [39] | Unità di Terapia Intensiva dell’Ospedale “San Gerardo” di Monza, Lombardia | Studio osservazionale retrospettivo | Gennaio 2010- novembre 2015 |
Tot: 92 Età media: 48,5 (37-56) anni |
Centro medico chirurgico ECMO UTI |
| Agodi A., 2018 [33] | 55 ospedali italiani | Studio osservazionale prospettico multicentrico | 2008-2017 | Tot: 13512 Età media: 66 ± 16,3 anni M: 8690 |
UTI |
| Bianco A 2018 [36] | Università “Magna Græcia” di Catazaro, Calabria | Studio osservazionale prospettico | 1° maggio 2013-31 dicembre 2016 | Tot: 1283 Età media: 66 (±12) anni |
UTI |
| Caselli E. 2018 [40] | 6 ospedali pubblici italiani | Studio osservazionale prospettico multicentrico | 1° gennaio 2016-30 giugno 2017 | Tot: 11.842 Pre-intervento < 65 anni: 1.518 (25,6%) 65-74 anni: 1.261 (21,3%) 75-84 anni: 1.821 (30,7%) > 85 anni: 1.330 (22,4%) Post-intervento < 65 anni: 1.265 (22,9%) 65-74 anni: 1.177 (21,3%) 75-84 anni: 1.753 (31,7%) ≥ 85 anni: 1.336 (24,2%) |
Reparti di Medicina Interna |
| Cristina ML., 2018 [37] | 3 ospedali pubblici per acuti Liguria |
Studio osservazionale retrospettivo multicentrico | Gennaio 2013- dicembre 2014 |
Tot: 213 F: 74 M: 139 Età media: 72 (61-78) anni |
UTI Reparti di Medicina Reparti chirurgici Reparti di Riabilitazione |
| Antonioli P., 2020 [5] | Ospedale Universitario di Ferrara, Emilia-Romagna |
Studio trasversale | 14-30 novembre 2016 12-23 novembre 2018 |
Tot: 1102 Età media: 71 (56-82) anni |
Reparti post-acuzie di Chirurgia, Medicina, Geriatria, UTI, Ginecologia/Ostetricia, Pediatria/Neonatologia, Riabilitazione |
| Gentili A., 2020 [1] | Fondazione Policlinico Universitario “A. Gemelli” IRCCS (FPG) di Roma, Lazio |
Studio trasversale | 2013-2018 | Tot: 6263 Età media: 57,86 ± 23,05 anni F: 87 ± 23,00 anni M: 58,88 ± 23,05 anni |
Reparti chirurgici Reparti di Medicina Interna Unità di Pediatria, Geriatria, Riabilitazione, Ginecologia e Ostetricia- Area critica |
| Gugliotta C., 2020 [30] | Ospedale Universitario di Sassari, Sardegna | Studio trasversale | 26 novembre 2018- 1 dicembre 2018 |
Tot: 588 Età media: 65,7 ± 16,1 anni |
UTI Unità di Lungodegenza Reparti di Medicina Interna Reparti di Chirurgia Generale Reparti di Ortopedia |
| Barchitta M., 2020 [41] | Sicilia | Studio trasversale | 2016-2018 | Tot: 18.852 2016 N: 6.448 Età media: 58,6 (24,7) anni M: 50,3% 2017 N: 5974 Età media: 58,5 (25,3) anni M: 51,0% 2018 N: 6.430 Età media: 62,4 (22,2) anni M: 50,5% |
Ospedali per acuti |
* UTI: Unità di Terapia Intensiva.
Burden epidemiologico, tipo di ICA, agenti patogeni e fattori di rischio riportati negli studi italiani, condotti sulla popolazione adulta.
| Primo autore, anno di pubblicazione | ICA (%) | Tipo di ICA (%) | Agenti patogeni (%) | Fattori di rischio | ||
|---|---|---|---|---|---|---|
| Incidenza | Prevalenza | Mortalità | ||||
| Agodi A., 2013 [31] | 1ª survey: 19,8% 2ª survey: 19,9% 3ª survey: 22,3% |
- | 1ª survey: 17,7% 2ª survey: 18,3% 3ª survey: 18,2% |
Polmoniti: 1ª survey: 53,6% 2ª survey: 47,3% 3ª survey: 51,7% BSI: 1ª survey: 23,4% 2ª survey: 22,5% 3ª survey: 25,7% UTI: 1ª survey: 16,7% 2ª survey: 22,3% 3ª survey: 15,6% CRI: 1ª survey: 6,3% 2ª survey: 7,9% 3ª survey: 7,1% |
A. baumannii: 1ª survey: 7,6% 2ª survey: 14,3% 3ª survey: 16,9% P. aeruginosa: 1ª survey: 19,4% 2ª survey: 16,9% 3ª survey: 14,4% E. coli: 1ª survey: 6,4% 2ª survey: 5,9% 3ª survey: 10,6% K. pneumoniae: 1ª survey: 5,3% 2ª survey: 8,6% 3ª survey: 9,3% S. epidermidis: 1ª survey: 6,9% 2ª survey: 3,8% 3ª survey: 6,4% S. aureus: 1ª survey: 9,6% 2ª survey: 5,5% 3ª survey: 5,4% |
CVC Intubazione |
| Charriel L., 2014 [42] | - | 6,77 | - | UTI 2,0% BSI 0,7% RTI 1,6% SSI 0,7% Altre 1,7% |
S. aureus oxacillina-resistente: 59 Enterobacteriaceae ESBL-produttori: 30 P. aeruginosa non-multiresistenti: 66 P. aeruginosa produttori di carbapenemasi: 29,5 P. aeruginosa resistente ai carbapenemi: 9 A. baumannii resistente ai carbapenemi: 20 |
Ventilazione meccanica Nutrizione parenterale PVC CVC CRI Procedure chirurgiche |
| Marchi M., 2014 [43] | 16-45 anni: 1,7/100 procedure 46-65 anni: 2,8/100 procedure 66-85 anni: 3,7/100 procedure ≥ 85 anni: 3,3/100 procedure |
- | - | SSI 2,6% | - | Procedure chirurgiche |
| Vincitorio D., 2014 [34] | 78 (16,1%) | - | 19,2% | CAUTI 14,7/1.000 giorni-catetere |
E. coli 27% C. albicans 17% K. pneumoniae 13% |
Età avanzata (> 90 anni) Lunga degenza prima dell’inserzione di catetere |
| Agodi A., 2015 [32] | Incidenza SSI: 3,2/100 procedure chirurgiche Densità di incidenza SSI: 7,2/1000 giorni di degenza postoperatoria |
- | - | - | Non specificato | SSI |
| Chelazzi C., 2015 [35] | - | 46 (9,3%) | 12,65% | Tratto respiratorio 60% Batteriemia catetere-correlata 20% Batteriemia non correlata al catetere 13% Infezioni cutanee (incluse ferite del sito chirurgico) 7% |
K. pneumoniae 30% A. baumannii 20% E. coli 20% P. aeruginosa 17% Altri batteri Gram-negativi, tra cui S. maltophilia, K. oxytoca, Haemophilus influenzae e Enterobacter spp. 13% |
Ventilazione meccanica Durata degenza in UTI (10,26 ± 2,43 vs 4,42 ± 2,37) |
| Luzzati R., 2016 [38] | - | - | Mortalità a 30 giorni: 36,3% | Non specificato |
C. albicans 55% C. parapsilosis 13,5% C. glabrata 13% C. tropicalis 10,5% Altre Candida spp. (C. guilliermondii, C. famata, C. krusei, C. lusitaniae, C. dubliniensis) 8% |
CVC CRI Dialisi Ventilazione meccanica Chirurgia maggiore Nutrizione parenterale periferica Nutrizione parenterale totale |
| Grasselli G., 2017 [39] | 50,4/1.000 giorni-ECMO | - | 13,0 morti/1.000 ECMO-giorni-paziente | VAP 31% UTI 7,8% BSI 4,8% CLABSI 2,9% |
A. baumannii 9 (17%) Pseudomonas spp. 6 (12%) Enterobacteriaceae 4 (8%) K. pneumoniae 4 (8%) Altri 2 (4%) Enterococcus spp. 8 (15%) S. aureus 6 (12%) Stafilococchi coagulasi-negativi 1 (2%) Altri 3 (6%) Aspergillus spp. 6 (12%) Candida spp. 3 (6%) |
Ventilazione meccanica CRI |
| Agodi A., 2018 [33] | 22,7/100 pazienti | - | 370 (46,0%) | Polmoniti 45,3% BSI 31,5% CRI 14,8% UTI 8,4% |
A. baumannii 15,9% K. pneumoniae 15,9% P. aeruginosa 13,1% |
Non specificato |
| Bianco A., 2018 [36] | 9,2/100 pazienti | - | - | VAP 38,1% CLABSI 34,7% CAUTI 7,5% |
K. pneumoniae 17,8% A. baumannii 10,2% E. coli 8,5% P. aeruginosa 5% S. epidermidis 10% |
Ventilazione meccanica CRI CLABSI |
| Caselli E. 2018 [40] | Range pre-intervento: 1,3-3,7% | - | - | UTI (3-1,2%) BSI (0,9-0,6%) Sepsi (0,4-0,1%) GI (0,3-0,1%) Infezioni della cute e tessuti molli (0,3-0,1%) |
S. aureus
Staphylococcus spp. Enterococcus spp. Streptococcus spp. C. difficile E. coli Klebsiella spp. Proteus mirabilis P. aeruginosa Enterobacter spp., Citrobacter spp. A. baumannii Morganella spp. Altre Enterobacteriaceae Candida spp. Virus Altri |
Ventilazione meccanica Nutrizione parenterale CRI CVC |
| Cristina ML., 2018 [37] | BSI da K. pneumoniae resistente ai carbapenemi: 1,35 episodi per 10.000 giorni-pazienti |
A: 65,3 B: 14,1 C: 20,6 |
26,29 (a 15 giorni) |
BSI da K. pneumoniae resistenti ai carbapenemi: UTI: 46,95 Reparti di Medicina: 34,27 Reparti di Chirurgia: 12,68 Reparti di Riabilitazione: 6,10 |
K. pneumoniae | Ventilazione meccanica CVC Procedure chirurgiche |
| Antonioli P. 2020 [5] | - | 115 (10,4%) | Malattia fatale 35 (31,5%) Malattia rapidamente fatale 46 (41,5%) |
Polmoniti 41 (29,9%) BSI 26 (19,0%) UTI 21 (15,4%) GI 14 (10,2%) SSI 11 (8,0%) Sepsi 8 (5,8%) EENT 6 (4,4%) Cellulite, infezioni di ferrite e di tessuti molli profondi che non coinvolgono l’osso e non correlate alla chirurgia 4 (2,9%) LRTI 3 (2,2%) Altre 3 (2,2%) |
C. difficile 16,9% K. pneumoniae 11,9% C. albicans 8,5% E. coli 8,5% S. epidermidis 8,5% S. aureus 6,8% S. maltophilia 6,8% |
PVC CRI CVC Ventilazione meccanica |
| Gentili A. 2020 [1] | - | 328 (5,24%) | - | RTI 93 (1,48%) SSI 89 (1,42%) UTI 67 (1,07%) BSI 65 (1,04%) CDI 20 (0,32%) SNC 14 (0,22%) |
Non specificato | Ventilazione meccanica CRI CVC PVC Chirurgia Nutrizione parenterale |
| Gugliotta C. 2020 [30] | - | 7,3% | - | UTI 14 (28,6%) Polmoniti 13 (26,5%) BSI 4 (8,2%) CRI 8 (16,3%) EENT 2 (4,1%) SSI 7 (14,3%) GI 1 (2,0%) |
E. coli 6 (16,7%) K. pneumoniae 6 (16,7%) Altre Klebsiella supp. 1 (2,8%) P. aeruginosa 4 (11,1%) Proteus spp. 1 (2,8%) Serratia spp. 2 (5,6%) E. faecalis 3 (8,3%) S. aureus 4 (11,1%) S. epidermidis 3 (8,3%) C. albicans 1 (2,8%) C. parapsilosis 1 (2,8%) Altre Candida 1 (2,8%) |
Ventilazione meccanica CRI Chirurgia |
| Barchitta M., 2020 [41] | - | 2016: 5,1% 2017: 4,7% 2018: 5,1% | - | 2016-2018 Polmoniti: 29,6% UTI: 19,1% SSI: 13,3% 2016: Polmoniti: 28,5% UTI: 20,3% SSI: 15,0% BSI: 5,1% GI: 4,0% EENT:1,1% SSTI: 5,4% RTI: 5,4% SNC: 0,3% Infezioni tratto riproduttivo: 0,3% Infezioni CV: 2,0% Infezioni ossa e articolazioni: 2,8% 2017 Polmoniti: 28,4% UTI: 14,5% SSI: 14,2% BSI: 6,6% GI: 9,2% EENT: 1,9% SSTI: 9,2% RTI: 3,8% SNC: 0,3% Infezioni tratto riproduttivo: 0,3% Infezioni CV: 1,3% Infezioni ossa e articolazioni: 1,6% 2018 Polmoniti: 31,5% UTI: 21,8% SSI: 11,1% BSI: 7,0% GI: 4,9% EENT: 1,6% SSTI: 3,8% RTI: 5,9% SNC: 0,8% Infezioni tratto riproduttivo: 0,3% Infezioni CV: 1,6% Infezioni ossa e articolazioni: 1,9% |
Non specificato | Gravità della malattia Dispositivi invasivi Antibioticoterapia |
BSI (Bloodstream Infection): Infezioni del torrente ematico; CAUTI (Catheter-Associated Urinary Tract Infection): infezioni urinarie catetere-correlate; CDI: infezione da C. difficile; CLABSI (Central Line-Associated Blood Stream Infection): infezioni del torrente ematico associate alla linea centrale; CRI (Catheter-Related Infection): infezioni correlate al catetere; CVC (Central Venous Catheter): catetere venoso centrale; EENT (Eye, Ear, Nose or Mouth Infection): infezione occhio-orecchio-naso-bocca; GI: infezioni gastrontestinali; MRSA: S. aureus meticillino-resistente; NEC (Necrotizing Enterocolitis): enterocolite necrotizzante; LRTI (Lower Respiratory Tract Infection): infezioni del basso tratto respiratorio; RTI (Respiratory Tract Infections): infezioni del tratto respiratorio; SNC: Sistema Nervoso Centrale; SSI (Surgical Site Infections): infezioni del sito chirurgico; SSTIs (Skin and Soft Tissues Infections): infezioni della cute e dei tessuti molli; UTI (Urinary Tract Infections): infezioni delle vie urinarie; VAP (Ventilator Associated Pneumonia): polmoniti associate al ventilatore.
Il valore maggiore è descritto nella survey condotta da Antonioli et al. [5], con raccolta dati e valutazioni svolte in un arco temporale di 15 giorni, e ripetute in due anni (nel 2016 e nel 2018), su una popolazione anziana con un’età media di 71 anni [IQR 56-82]. Tra tutti i pazienti ricoverati, i fattori indipendentemente associati all’aumento del rischio di ICA sono stati la presenza di dispositivi medici (PVC, CVC, catetere urinario a permanenza o ventilazione assistita meccanicamente) e una durata della degenza ospedaliera superiore a 6 giorni. La prevalenza complessiva di almeno un caso di ICA nei pazienti inclusi nello studio è del 10,4%, con valori del 10,0% nel 2016 e dell’11,0% nel 2018. Nei reparti di terapia intensiva tale prevalenza è risultata del 9,9% nel 2016 (9,2% nei reparti medici, 7,6% nei reparti chirurgici, 35,0% nei reparti di terapia intensiva) e dell’11,8% nel 2018 (12,4% nei reparti medici, 6,8% nei reparti chirurgici, 36,8% in terapia intensiva). Nei reparti di riabilitazione, invece, la prevalenza è risultata del 12,1% nel 2016 e del 5,8% nel 2018. I patogeni più frequentemente responsabili di ICA sono stati il C. difficile (16,9%), K. pneumoniae (11,9%), C. albicans (8,5%), E. coli e S. epidermidis (8,5%), S. aureus e S. maltophilia (6,8%).
Una indagine di prevalenza puntuale di ICA, della durata di sei anni, è stata invece condotta in un grande ospedale universitario da Gentili et al. [1], rilevando una prevalenza generale del 5,24%, con valori dal 6,64% nel 2013 al 3,16% dopo 6 anni (2017). L’indagine si è basata sulle cartelle cliniche di circa 6.263 pazienti, con un’età media di 57,86 ± 23,05 anni (56,87 ± 23,00 per le femmine e 58,88 ± 23,05 per i maschi) e una prevalenza del sesso femminile (50,84%), reclutati da reparti chirurgici (30,00%), di medicina interna (41,02%) e dalle unità di terapia intensiva (7,44%). Il genere maschile è risultato essere quello più colpito (6,20% vs 4,30% del genere femminile), soprattutto da infezioni del sangue e del sito chirurgico mentre, nel complesso, le infezioni del tratto respiratorio (26,72%) sono state le più frequenti, seguite da quelle del sito chirurgico (25,57%), dalle UTI (19,25%), dalle infezioni del torrente ematico (18,68%), dalle infezioni da Clostridium difficile (5,75%) e infezioni del sistema nervoso centrale (4,02%). Tra i pazienti con ICA, inoltre, è stato registrato, al momento della rilevazione dell’infezione, una durata media della degenza di circa 25,09 ± 27,97 giorni [1]. Dati simili sono emersi dal lavoro di Barchitta et al. [41], analizzando i risultati ottenuti dalla prima indagine di prevalenza puntuale promossa dalla Regione Sicilia, nell’ambito di un programma regionale di sorveglianza e controllo ICA. Da tale indagine, condotta per tre anni consecutivi, dal 2016 al 2018, su un campione di 18.852 pazienti ricoverati in ospedali per acuti, gli autori hanno calcolato valori di prevalenza di pazienti con almeno un’ICA pari al 5,1% nel 2016, al 4,7% nel 2017 e al 5,1% nel 2018. Nonostante una riduzione, non significativa, evidenziata nel 2017, dunque, il trend si è mostrato stabile nei tre anni considerati. Le polmoniti, le UTI e le infezioni del sito chirurgico hanno rappresentato le tre infezioni più frequentemente riportate, con valori, rispettivamente del 29,6%, 19,1% e 13,3%. Sempre nello stesso arco temporale, per quanto riguarda le altre tipologie di infezioni rilevate, si è notato un aumento, non significativo, di infezioni del torrente ematico e di quelle riguardanti gli organi di senso, che, nell’ambito di un ranking formulato dagli autori, sono passate dalla sesta alla quarta posizione le prime, e dalla tredicesima alla decima le seconde. Le infezioni sistemiche e quelle della cute e dei tessuti molli sono invece diminuite, passando, rispettivamente, dall’ottava alla dodicesima posizione e dalla quarta all’ottava. Tra i principali fattori di rischio analizzati, infine, un aumento delle infezioni è stato correlato con la gravità del quadro clinico dei pazienti, l’impiego di device invasivi e l’assunzione di antimicrobici [41].
Anche nel lavoro di Gugliotta et al. [30] nel 2020, si riporta una prevalenza del 7,3% nei reparti per acuti di un ospedale, soprattutto a carico di UTI, e una prevalenza nell’uso degli antibiotici del 44,6%.
Nell’ambito di indagini di sorveglianza nazionali, Agodi et al. 2013 [31], dai dati di 65 unità operative di terapia intensiva italiane, raccolti attraverso tre surveys di un progetto della durata di sei anni, avevano registrato, nell’ultima valutazione, un aumento del rischio di infezioni acquisite in terapia intensiva rispetto alle precedenti analisi (rischio relativo: 1,215; 95% IC: 1,059-1,394), almeno in parte spiegato dalle condizioni cliniche più gravi dei pazienti. Lo stesso gruppo, negli anni seguenti, ha poi condotto studi nazionali specifici sul rischio di infezioni del sito chirurgico [32] e sepsi [33].
Per le prime, da uno studio prospettico di 12 mesi condotto in un ospedale del Sud Italia, è stata descritta un’incidenza cumulativa di SSI di 3,2 per 100 procedure chirurgiche eseguite (8 su 252) e una densità di incidenza di 7,2 per 1000 giorni di durata ospedaliera postoperatoria (8 su 1113) [32]. Per quanto riguarda la sepsi [33], invece, in seguito a un progetto di sorveglianza prospettica delle infezioni nosocomiali in Unità di Terapia Intensiva (SPIN-UTI), dal 2008 al 2017 è stato descritto che il 47,0% delle ICA rilevate ha determinato tale condizione in 832 pazienti, con il 22,5% di casi classificati come shock settico e il 20,5% come casi gravi. Come tipologia più comune di infezione responsabile di sepsi è stata descritta la polmonite (45,3%), seguita da infezioni del torrente ematico (31,5%), infezioni correlate ai cateteri (14,8%) e UTI (8,4%).
Anche lo studio di Vincitorio et al. [34], ha descritto uno specifico tipo di ICA, concentrandosi sulle CAUTIs, su una popolazione di età pari o superiore a 65 anni in un ospedale geriatrico. Complessivamente, il tasso di cateterizzazione era di 16,7 per 100 giorni-paziente, più alto nei reparti chirurgici, e in particolari urologici (31,3 per 1000 giorni di catetere; 95% IC, 10,2-71,4), mentre, tra i reparti medici, valori maggiori sono stati riscontrati in ambito riabilitativo (25,9 per 1000 giorni di catetere; 95% IC, 9,5-55,4). Il tasso di incidenza complessivo di CAUTI è stato di 14,7/1000 catetere-giorni (al 95% IC, 11,7-18,3/1000).
Una valutazione sul rischio di contrarre ICA nelle terapie intensive è stata svolta anche nello studio osservazionale di Chelazzi et al. [35], rilevando tali infezioni nel 9,3% dei pazienti trattati, con una predominanza di ceppi batterici Gram-negativi (65,2% delle infezioni acquisite in terapia intensiva), tra cui K. pneumoniae (30%), A. baumannii (20%), di cui il 90,4% erano forme multiresistenti, E. coli (20%), P. aeruginosa (17%) e nel 13% dei casi altri batteri Gram-negativi. I principali siti di infezione comprendevano il tratto respiratorio (60%), seguito da batteriemia correlata al catetere (20%), batteriemia non correlata al catetere (13%) e infezioni cutanee (compresa la ferita chirurgica) (7%).
Bianco et al. [36], sempre nell’ambito delle terapie intensive riportano, invece, un’incidenza cumulativa di ICA di 9,2 per 100 pazienti, in un periodo di 4 anni, e un tasso di incidenza di 17,4 per 1000 giorni-paziente, con prevalenza di episodi di polmonite acquisita, per il 72,7% correlati all’intubazione.
Tra i batteri Gram-negativi, la resistenza ai carbapenemi è stata riscontrata nel 91,6% degli isolati di A. baumannii e nel 28,5% degli isolati di K. pneumoniae, come anche nello studio di Cristina et al. [37].
Luzzati et al. [38] descrivono casi di candidemia nosocomiale, con una mortalità a 30 giorni del 36,3%, mentre Grasselli et al. [39], riportano un 55% di casi infezioni nosocomiali in pazienti trattati con ECMO in terapia intensiva. Una prospettiva diversa è offerta dallo studio di Caselli et al. [40], che evidenzia il ruolo chiave svolto dalla contaminazione delle superfici nella trasmissione delle ICA, non solo in reparti di alta intensità di cura. Gli autori, infatti, in uno studio interventistico multicentrico di 18 mesi (dal 1° gennaio 2016 al 30 giugno 2017), svolto in sei ospedali italiani, sperimentano l’impiego di innovativi sistemi di sanificazione a base di probiotici, riportando una diminuzione dell’incidenza cumulativa di ICA rispetto alla fase pre-intervento, dal 4,8 al 2,3% (P < 0,0001), e del tasso di incidenza di ICA per 1.000 giorni-paziente dal 5,4 al 2,4, con un tasso di incidenza di 0,45 (95% IC, 0,36-0,54). A seguito dell’intervento, inoltre, si è registrata una diminuzione dell’incidenza cumulativa di tutte le ICA più frequenti: UTI, dal 3% (179/5.930) all’1,2% (70/5.531); infezioni del torrente ematico-BSI, dallo 0,9% (54/5.930) allo 0,6% (31/5.531); sepsi clinica, dallo 0,4% (22/5.930) allo 0,1% (5/5.531); infezioni gastro-intestinali dallo 0,3% (17/5.930) allo 0,1% (6/5.531); e infezioni della pelle/tessuti molli, dallo 0,3% (16/5.930) allo 0,1% (6/5.531). Invece, a una riduzione significativa del numero di microrganismi associati a ICA, non si è associato un cambio nelle percentuali relative di microrganismi isolati: E. coli, E. faecalis, S. aureus, P. mirabilis e P. aeruginosa sono stati, infatti, i patogeni più frequentemente rilevati in entrambe le fasi del progetto.
Il 23,1% (6/26) [44-47] degli studi inclusi, invece, riporta dati riguardanti indagini di prevalenza condotte nella popolazione neonatale-pediatrica (Tab. IV). Due, dei sei articoli analizzati, riportando dati puntuali stratificati per fasce età [42, 43], rivelandosi dunque utili per la stima del burden epidemiologico delle ICA sia nella popolazione adulta sia in quella neonatale-pediatrica. La Tabella IV ne sintetizza i principali risultati.
Studi italiani inclusi, condotti sulla popolazione neonatale-pediatrica.
A. Principali caratteristiche degli studi inclusi, condotti sulla popolazione neonatale-pediatrica.
| Primo autore, anno di pubblicazione [Ref] | Regione/città italiana e/o ospedale di riferimento | Disegno di studio | Durata dello studio | Popolazione target (n. pazienti, età media, genere) | Setting |
|---|---|---|---|---|---|
| Ciofi degli Atti M.L., 2012 [47] | Un ospedale pediatrico Lazio |
Studio osservazionale retrospettivo | 2007-2010 | Tot: 1.506 < 2 mesi > 12 anni M: 846 F: 660 |
Reparti di Medicina Reparto di Chirurgia UTI |
| Charriel L., 2014 [42] |
58 ospedali pubblici Piemonte |
Studio trasversale | Dicembre 2009- gennaio 2010 |
Tot: 326 14-17 anni |
Tutti i reparti, fatta eccezione per i day hospital, day surgery e pronto soccorso |
| Folgori L. 2014 [44] |
Ospedale pediatrico Bambino Gesù di Roma, Lazio | Studio osservazionale retrospettivo | 12 mesi (anno 2011) |
Età media: 1,1 anni | Unità intensiva cardiologica TIN, TIped, Pediatria, Chirurgia pediatrica Ematologia/Oncologia |
| Marchi M., 2014 [43] |
Italia | Studio trasversale | 2009-2011 | 0-15 anni | Ospedale |
| Crivaro V., 2015 [45] |
Campania | Studio osservazionale retrospettivo | 2006-2010 | Tot: 1.699 | TIN |
| Scamardo M., 2020 [46] |
Campania | Studio osservazionale retrospettivo | 2013-2017 | Tot: 1.265 | TIN |
* TIN: Terapia Intensiva neonatale; TIped: Terapia Intensiva pediatrica.
Burden epidemiologico, tipo di ICA, agenti patogeni e fattori di rischio riportati negli studi inclusi, condotti sulla popolazione neonatale-pediatrica.
| Primo autore, anno di pubblicazione [Ref] | ICA (%) | Tipo di ICA (%) | Agenti patogeni (%) | Fattori di rischio | ||
|---|---|---|---|---|---|---|
| Incidenza | Prevalenza | Mortalità | ||||
| Ciofi degli Atti M.L., 2012 [47] | - | 6,8% | - | BSI 2,3% Polmoniti/LRTI 1,7% UTI 0,8% SSI 0,8% Altre 1,2% |
P. aeruginosa Stafilococchi coagulasi-negativi S. aureus K. pneumoniae E. coli Enterococcus spp. Candida C. difficile |
CVC CRI Ventilazione meccanica Interventi chirurgici |
| Charriel L., 2014 [42] | - | 5,3% | - | UTI 0,7% BSI 1,4% Altre 3,2% |
- | Ventilazione meccanica Nutrizione parenterale PCV CVC CRI Procedure chirurgiche |
| Folgori L. 2014 [44] | 0,65/1.000 giorni di ospedalizzazione | - | - | BSI 67,6% |
K. pneumoniae 37 (27%) E. coli 26 (19%) P. aeruginosa 21 (15%) Serratia marcescens 3 (9,6%) Stenotrophomonas maltophilia 9 (6,6%) Enterobacter supp. 6 (4,4%) Pseudomonas supp. 6 (4,4%) Acinetobacter supp. 5 (3,7%) Klebsiella oxytoca 4 (3%) Citrobacter supp. 2 (1,5%) Altre specie 7 (5,1%) |
Non specificato |
| Marchi M., 2014 [43] | 0-1 anno:1,8/100 procedure 2-5 anni: 1,3/100 procedure 6-15 anni: 2,4/100 procedure |
- | - | SSI | - | Procedure chirurgiche |
| Crivaro V., 2015 [45] | 3,5/1.000 giorni di degenza ospedaliera | 9,0% | - | Sepsi 44,4% Polmoniti 25,5% UTI 28,8% Meningiti 1,3% |
P. aeruginosa 17,0% C. parapsilosis 16,3% E. coli 13,1% C. albicans 10,5% K. pneumoniae non produttore di beta-lattamasi a spettro esteso 7,8% Stafilococchi coagulasi-negativi 5,2% Enterobacteriaceae, specie di Candida, S. aureus o altri cocci Gram-positivi 23% |
Catetere ombelicale CVC Ventilazione meccanica |
| Scamardo M., 2020 [46] | 3,2 per 1.000 giorni-paziente | - | 19,4% | CLABSI 69,6% VAP 20% UTI 8,8% NEC 1,6% |
CLABSI Stafilococchi coagulasi-negativi 25,3% C. parapsilosis 21,8% P. aeruginosa 5,7% C. albicans 4,6% E. coli 3,4% E. coli ESBL+ 3,4% K. pneumoniae 3,4% K. pneumoniae produttore di beta-lattamasi a spettro esteso 3,4% S. aureus 2,3% Enterococcus faecalis 2,3% Streptococcus sanguinis: 1,1% Kocuria kristinae 1,1% C. pelliculosa 1,1% VAP: P. aeruginosa 28% Stafilococchi coagulasi-negativi 20% Stenotrophomonas maltophilia 20% S. aureus 8% A. baumannii 8% E. cloacae 4% K. pneumoniae produttore di beta-lattamasi a spettro esteso 4% Polimicrobiche (P. aeruginosa + C. parapsilosis) 4% Polimicrobiche (P. aeruginosa + K. pneumoniae produttore di beta-lattamasi a spettro esteso) 4% |
CVC Ventilazione meccanica |
BSI (Bloodstream infection): Infezioni del torrente ematico; CAUTI (Catheter-Associated Urinary Tract Infection): infezioni urinarie catetere-correlate; CDI: infezione da C. difficile; CLABSI (Central Line-Associated Blood Stream Infection): infezioni del torrente ematico associate alla linea centrale; CRI (Catheter-Related Infection): infezioni correlate al catetere; CVC (Central Venous Catheter): catetere venoso centrale; EENT (Eye, Ear, Nose or Mouth Infection): infezione occhio-orecchio-naso-bocca; GI: infezioni gastrontestinali; MRSA: S. aureus meticillino-resistente; NEC (Necrotizing Enterocolitis): enterocolite necrotizzante; LRTI (Lower Respiratory Tract Infection): infezioni del basso tratto respiratorio; RTI (Respiratory Tract Infections): infezioni del tratto respiratorio; SNC: Sistema Nervoso Centrale; SSI (Surgical Site Infections): infezioni del sito chirurgico; SSTIs (Skin and Soft Tissues Infections): infezioni della cute e dei tessuti molli; UTI (Urinary Tract Infections): infezioni delle vie urinarie; VAP (Ventilator Associated Pneumonia): polmoniti associate al ventilatore.
Folgori et al. [44], in uno studio retrospettivo condotto su una coorte di pazienti con confermata batteriemia da germi Gram-negativi ed età media di 1,1 anni (IC: 0,2-6,5 anni), di cui il 29,9% di età compresa tra 3 mesi-2 anni, hanno riportato un’incidenza cumulativa di infezioni del 5,4/1000 ricoveri ospedalieri e un tasso di infezione di 0,65/1000 giorni di degenza ospedaliera. Tra queste, il 67,6% dei casi è stato classificato come ICA.
Valutazioni su neonati sono state condotte anche da Crivaro et al. [45], nel periodo 2006-2010, che oltre a un tasso di infezione totale del 9% e a una densità di incidenza totale di 3,5 per 1000 giorni di degenza, mostrano come i pazienti con peso ≤ 1000 g alla nascita siano i più colpiti (45,8% di tutte le ICA). Nel complesso, la sepsi si è rivelata l’infezione più frequente (44,4%), seguita da infezioni delle vie urinarie (28,8%), polmonite (25,5%) e meningite (1,3%). Le infezioni associate a dispositivo (ossia BSI associate alla linea centrale, BSI associate al catetere ombelicale e VAP) ne rappresentato invece il 64,1% del totale.
Questi stessi risultati di Crivaro et al. [45], sono stati poi confrontati con dati raccolti nel periodo successivo, 2013-2017, nella stessa terapia intensiva neonatale, nello studio di Scamardo et al. [46].
Il numero complessivo di ICA registrate durante il periodo di studio è stato di 125, corrispondenti a un tasso di infezione totale del 9,9% e una densità di incidenza totale di 3,2 per 1000 giorni-paziente, con un tasso grezzo di mortalità dei pazienti sotto sorveglianza del 5,45% e un tasso di mortalità dei pazienti infetti del 19,4%. Le ICA si sono sviluppate nei neonati di tutte le classi di peso corporeo, ma nel 60,8% dei casi in pazienti di peso ≤ 1000 g alla nascita. Inoltre, è stata osservata una significativa tendenza decrescente della densità di incidenza delle ICA per 1000 giorni-paziente dalle classi di peso corporeo più basse a quelle più alte (7,44, 4,1, 2,16, 2,13 e 0,94 in, rispettivamente, classi di peso corporeo ≤ 750 g, 751-1000 g, 1001-1500 g, 1501-2500 g e ≥ 2501 g, p < 0,001). Le infezioni associate al dispositivo (ad es. CLABSI e VAP) hanno rappresentavano l’89,6% delle ICA totali, seguite da UTI (8,8%) ed enterocolite necrotizzante (NEC) (1,6%).
I patogeni più frequenti responsabili delle CLABSI sono stati: Stafilococchi coagulasi negativi (CONS) (25,3%), Candida parapsilosi (21,8%), Candida albicans (4,6). %), Pseudomonas aeruginosa (5,7%), E. coli e K. pneumoniae (6,8%).
Nel periodo 2013-2017, dunque, il tasso di infezione totale e la densità di incidenza totale per 1000 giorni-paziente di ICA sono risultati simili a quelli riscontrati nel periodo 2006-2010 (9,9% e 3,2 contro 9% e 3,5).
Analogamente alle ICA verificatesi durante il periodo di studio precedente, nella stessa terapia intensiva neonatale, le infezioni più frequenti si sono registrate nei gruppi di neonati a basso peso alla nascita (60,8% nelle classi < 1000 g; 37,6% in quella < 750 g e 23,20% tra i neonati di 750-1000 g).
La densità di incidenza di CLABSI non ha mostrato differenze tra il 2006 e il 2010 e il 2013-2017, mentre la densità di incidenza di VAP per la classe 751-100 g di peso corporeo è stata maggiore nel periodo 2006-2010 rispetto al periodo 2013-2017 (p = 0,006). In quest’ultimo intervallo, è stata osservata una maggiore incidenza di CLABSI causata da batteri Gram-positivi (p = 0,002) o da eziologia indeterminata (p = 0,01) rispetto al periodo 2006-2010, mentre un’incidenza significativamente inferiore di VAP causata da batteri Gram-negativi è stata riscontrata nel periodo 2013-2017 rispetto al periodo 2006-2010 (p = 0,007) [46].
Infine, lo studio di Ciofi degli Atti et al. [47] ha esaminato i risultati delle indagini annuali sulla prevalenza delle infezioni associate all’assistenza sanitaria, tra il 2007 e il 2010, in un ospedale pediatrico di cure terziarie in Italia. Grazie all’introduzione e all’implementazione di strategie di prevenzione, quali misure di isolamento, bundle assistenziali, igiene delle mani e prescrizione appropriata di antibiotici, lo studio ha registrato riduzioni significative (P < 0,001) della prevalenza di pazienti con ICA (da 7,6 a 4,3%) e della loro prevalenza totale (da 8,6 a 4,3 per 100 pazienti). Tra i fattori indipendentemente associati all’aumento del rischio di ICA, si riscontravano il ricovero in terapia intensiva, la durata della degenza > 30 giorni, la presenza di dispositivo invasivo ed età 6-11 anni.
Sia lo studio di Charrier et al. [42], sia quello di Marchi et al. [43], in conclusione, hanno invece riportato alcuni dati inerenti al burden epidemiologico delle ICA con riferimenti a classi di età pediatriche e adulte.
Nel primo studio [42], ad esempio, nell’ambito di un’indagine di prevalenza regionale nella Regione Piemonte, è stata descritta una prevalenza complessiva del 6,77% (95% IC 6,2-7,3) di ICA, con valori specifici del 6,4% (95% IC 3,8-9,1) nei pazienti in età pediatrica.
Marchi et al. [43], invece, hanno descritto i principali risultati del programma istituito dal Sistema Nazionale Sorveglianza Infezioni del Sito Chirurgico (SNICh), per il periodo 2009-2011 in Italia. Tale studio ha rilevato il 2,6% di casi di SSI, di cui il 60% diagnosticato attraverso la sorveglianza a 30 giorni dalla dimissione. Stratificando i risultati per classe d’età, in quella pediatrica si sono registrati valori del 2,4% nella fascia 6-15 anni e dell’1,3% tra i 2-5 anni.
Nella seconda fase del lavoro, si è proceduto con la valutazione dei lavori che riportavano dati epidemiologici delle ICA in Europa. Partendo dai 2883 articoli inclusi nella revisione sistematica, dopo la rimozione dei duplicati e dei lavori riguardanti il contesto italiano, perché già oggetto di precedente valutazione, sono stati considerati 127 full-text. Il processo di selezione dei lavori scientifici, sottoposti anche a una fase di snowballing, ha portato all’inclusione finale di 66 articoli (Fig. 2).
PRISMA statement flow diagram
Anche in questa seconda fase della revisione sistematica, gli articoli sono stati classificati sulla base della popolazione target oggetto di studio. In particolare, dei 66 articoli inclusi, il 33,3% (N = 22) riporta dati riferiti alla popolazione generale [48-69]; il 56,1% (N = 37) prende in esame adulti di età > 19 anni [70-106]; infine, il 10,6% (N = 7) valuta il burden epidemiologico delle ICA in popolazioni neonatali-pediatriche [107-113].
Si riporta, pertanto, la descrizione di quanto emerso dalle evidenze scientifiche disponibili riguardanti i rimanenti 26 Paesi membri UE, dopo il focus italiano.
Il 33,3% (22/66) degli studi inclusi nella revisione di letteratura europea riguarda la popolazione generale, con un range di età compreso tra 0-120 anni, e dati sulle ICA non stratificati per età (Tab. V). Tra questi studi, 2 sono surveys europee [48, 49]. Dei 20 studi rimanenti, tutti basati su dati ospedalieri, 5 sono stati condotti in Germania [50-54], 2 in Francia [55, 56], 2 in Polonia [57, 58], 2 in Svezia [59, 60], 2 in Finlandia [61, 62], 1 in Austria [63], 1 in Croazia [64], 1 in Danimarca [65], 1 in Belgio [66], 1 in Grecia [67], 1 in Spagna [68] e 1 in Portogallo [69].
Studi europei inclusi, condotti sulla popolazione generale.
A. Principali caratteristiche degli studi europei inclusi, condotti sulla popolazione generale.
| Primo autore, anno di pubblicazione [Ref] | Paese europeo | Disegno di studio | Durata dello studio | Popolazione target (n. pazienti, età media, genere) | Setting |
|---|---|---|---|---|---|
| Zarb P., 2012 [48] | Europa | Studio trasversale | 2010 | Tot: 19.888 | Ospedali |
| Bogdanic B., 2013 [64] |
Croazia | Studio osservazionale prospettico | Dicembre 2009- giugno 2011 | Tot: 832 procedure | Centro Universitario Ospedaliero |
| Carbonne A., 2013 [55] |
Francia | Studio trasversale | 2002-2010 | Non specificato | Strutture sanitarie |
| Tomaszewski D., 2013 [57] | Polonia | Studio trasversale | 25 giugno 2014 | Tot: 205 M: 120 (58,5%) F: 85 (41,5%) < 18 anni: 193 (94,1%) > 18 anni: 12 (5,9%) |
UTI |
| Hammarskjöld F., 2014 [59] | Svezia | Studio osservazionale prospettico | 2004-2009 | Tot: 1.674 M: 57% Età media: 65 (range, 0,2-99) anni |
UTI |
| Deptuła A., 2015 [58] |
Polonia | Studio trasversale | 2012-2013 | Tot: 16.598 Età media: 51,4 anni |
Ospedali per acuti |
| Huttunen R., 2015 [61] |
Finlandia | Studio osservazionale retrospettivo | 1999-2001 2005-2010 |
Tot: 1.843 M: 58% Range età: 0-100 anni Età media: 56 anni |
Ospedali |
| Leistner R. 2015 [50] |
Germania | Studio trasversale | 2007-2012 | Range età: 0-120 anni | Ospedali |
| Maechler F., 2015 [51] |
Germania | Studio trasversale | Gennaio 2013- febbraio 2014 |
Tot: 5.171 casi | UTI |
| Segagni Lusignani L., 2016 [63] | Austria | Studio trasversale | Maggio-giugno 2012 | M: 2.010 (46,5%) F: 2.311 (53,11%) < 1 anni: 3,5% 1-44 anni: 21,0% ≥ 45 anni: 75,5% |
Unità di Medicina, Chirurgia, Ginecologia e Ostetricia, UTI, Pediatria e Psichiatria |
| Condell O., 2016 [65] |
Danimarca | Studio trasversale | 2010-2014 | Non specificato | Ospedali |
| Behnke M., 2017 [52] |
Germania | Studio trasversale | Maggio-giugno 2016 | Non specificato | Ospedali |
| Kritsotakis E.I., 2017 [67] | Grecia | Studio longitudinale di coorte | Giugno 2012 | Tot: 8.247 M: 54,4% Età media: 63 (range 38-76 anni) |
Unità di Medicina e Chirurgia, Dipartimenti di Pediatria, Ginecologia e Ostetricia, UTI |
| Suetens C., 2018 [49] |
Europa | Studio trasversale | 2016-2017 | Tot ospedali per acuti: 18.287 Tot ospedali di lungodegenza: 3.780 |
Ospedali per acuti Ospedali di lungodegenza |
| Messler S., 2018 [53] |
Germania | Studio trasversale | Pre-intervento: gennaio 2012- aprile 2013 Post-intervento: agosto 2013- marzo 2014 |
Pre-intervento Tot: 2.485 Post-intervento Tot: 1.246 |
UTI |
| Aghdassi S.J.S., 2019 [54] | Germania | Studio trasversale | Agosto 2017- febbraio 2018 |
Tot: 687 M: 52% Età media: 57 |
Ospedali di cure terziarie |
| Blot K., 2019 [66] | Belgio | Studio trasversale | 2000-2014 | Tot: 56.450 | Ospedali |
| Tammelin A, 2019 [60] |
Svezia | Studio trasversale | 2008-2014 | Tot: 1.216 | Ospedali |
| Colomb-Cotinat M., 2019 [56] | Francia | Studio osservazionale | 2010-2017 | Non specificato | Unità di lungodegenza/Riabilitazione Unità di Geriatria |
| Cantón R., 2020 [68] |
Spagna | Studio osservazionale | 2017 | Non specificato | Non specificato |
| Åttman E., 2021 [62] |
Finlandia | Studio trasversale | 2006-2016 | Tot: 2.296 Età media: 60 anni (range 0-97 anni) |
Ospedali |
| Teixeira H., 2021 [69] |
Portogallo | Studio osservazionale retrospettivo |
2014-2017 | Tot: 318.218 Range: 0-109 anni Giovani (0-19 anni): 4,7% Adulti (19-64 anni): 18,1% Anziani (> 65 anni): 77,2% Età media M: 79,0 (20,0) anni Età media F: 81,0 (17,0) anni |
Ospedali |
UTI: Unità di Terapia Intensiva.
Burden epidemiologico, tipo di ICA, agenti patogeni e fattori di rischio riportati negli studi europei inclusi, condotti sulla popolazione generale.
| Primo autore, anno di pubblicazione [Ref] | ICA (%) | Tipo di ICA (%) | Agenti patogeni (%) | Fattori di rischio | ||
|---|---|---|---|---|---|---|
| Incidenza | Prevalenza | Mortalità | ||||
| Zarb P., 2012 [48] |
- | 7,1% | - | RTI 25,7% SSI 18,9% UTI 17,2% BSI 14,2% GI 7,8% |
C. difficile 1,4% | Catetere Intubazione |
| Bogdanic B., 2013 [64] | 1,44% | - | - | - |
E. coli Stafilococchi coagulasi-negativi E. faecium K. pneumoniae (beta-lattamasi a spettro esteso) |
Chirurgia aperta |
| Carbonne A., 2013 [55] | 2010 Incidenza MRSA: 0,40/1.000 giorni-paziente Incidenza ESBL: 0,39/1.000 giorni-paziente 2003-2010 Incidenza MRSA (per 1.000 giorni-paziente): -43% Incidenza ESBL (per 1000 giorni-paziente): +182% |
- | - | - |
E. coli 59,7% K. pneumoniae 17,5% Enterobacter aerogenes 3,6% E. cloacae 11,3% |
Non specificato |
| Tomaszewski D., 2013 [57] | - | 49,3% | - | BSI 9,8% UTI 8,3 % Infezioni polmonari: 35,1% Infezioni addominali: 7,3% |
Gram-positivi 31,8% Gram-negativi 64,1% Funghi 4,1% |
Ventilazione meccanica CVC Catetere urinario |
| Hammarskjöld F., 2014 [59] | Incidenza di colonizzazione: 7,0 per 1.000 giorni-catetere centrale venoso Incidenza infezioni CRI: 1,2 per 1.000 giorni-catetere centrale venoso Incidenza CRSBI: 0,6 per 1.000 giorni-catetere centrale venoso |
- | - | CRI 2,5% CRBSI 1,5% |
Stafilococchi coagulasi-negativi (31%) C. albicans 24% S. aureus 19% E. faecalis 9% C. glabrata 3% |
Tempo di cateterizzazione Emodialisi CVC in giugulare interna |
| Deptuła, A., 2015 [58] |
- | Generale: 6% < 1 anno: 13,3% 1-4 anni: 6,1% 5-14 anni: 3,4% 15-24 anni: 3,2% 25-34 anni: 2,3% 35-44 anni: 4,2% 45-54 anni: 4,9% 55-64 anni: 5,7% 65-74 anni: 6,7% 75-84 anni: 7,6% ≥ 85 anni: 7,9% |
- | UTI 15,4% RTI 29,4% BSI 12,4% SSI: 20,1% |
- | Device invasivi |
| Huttunen R., 2015 [61] | 0,99 per 1.000 giorni-paziente | - | - | BSI causate da SSI 27% UTI 27% GI 13% RTI 12% |
Organismi Gram-positivi 64% Organismi Gram-negativi 30% Organismi fungini 6% |
CVC Cancro Chirurgia Degenza in UTI Emodialisi Trapianto d’organo |
| Leistner R., 2015 [50] |
- | 7% | - | SSI 15% Infezioni in UTI: RTI 14,3% UTI 13,1% BSI 16,5% |
E. coli 14,1% K. pneumoniae 13,5% |
Non specificato |
| Maechler F., 2015 [51] |
Bacilli Gram-negativi multiresistenti: 1,78 per 100 pazienti CRO: 0,29 per 100 pazienti MRSA: 1,60 per 100 pazienti VRE: 0,43 per 100 pazienti |
- | - | Polmoniti 36% UTI 27% SSI 14% Batteriemia 9% Bronchite 6% Infezioni cute 7% Altre 8% |
Organismi Gram-negativi multiresistenti 15% S. aureus multiresistente 36% Enterococcus Vancomicina-resistente 8% |
Non specificato |
| Segagni Lusignani L, 2016 [63] |
- | 6,2% | - | UTI 21,3% Polmoniti 20,6% SSI 17,4 % GI 10,5% Infezione sistemica 9,1% BSI 7,7% CRI 6,3% Infezioni cute e tessuti molli 3,8% EENT 1% Infezioni ossa e articolazioni 1% LRTI 0,7% Infezioni Sistema cardiovascolare 0,3% Infezioni apparato riproduttivo 0,3% |
E. coli (14,8%) Enterococcus spp. 13,1% P. aeruginosa 11,4% |
Intervento chirurgico al momento dell’ammissione ospedaliera CVC PVC CRI Intubazione |
| Condell O., 2016 [65] |
UTI: 42,2 per 10.000 giorni-rischio | Prevalenza media giornaliera UTI: 4,9% | - | Diagnosi UTI confermate: 69.628 | Non specificato | CRI |
| Behnke M., 2017 [52] |
- | 4,6% | - | SSI 24,1% UTI 23,2% LRTI 21,7% Sepsi 5,7% CDI 6,4% GI 4,6% Infezioni cute e tessuti molli 2,4% EENT 1,2% Infezioni ossa e articolazioni 1,8% Infezioni sistema cardiovascolare 0,7% Infezioni apparato riproduttivo 0,5% Infezioni SNC 0,5% |
E. coli 18% C. difficile 8,1% S. aureus 13,1% Enterococci 13,2% |
Ventilazione meccanica Chirurgia CRI CV |
| Kritsotakis E.I., 2017 [67] | Incidenza annuale: 5,2% | Generale: 9,1% 0-14 anni: 5,0% (3,0-8,0) 15-34 anni: 5,7% (4,1-7,8) 35-54 anni: 8,9% (7,3-10,8) 55-74 anni: 10,0% (8,7-11,5) +75 anni: 11,1 (9,1-13,3) |
Mortalità a 30 giorni: 9,7% Mortalità a 90 giorni: 23,2% |
Polmoniti/LRT 2,6% BSI 2,0% SSI 1,0% UTI 1,7% Infezioni sistemiche 0,7% Altro 1,8% |
Klebsiella spp. 17,6% P. aeruginosa 16,8% Acinetobacter spp. 16,8% Staphylococcus spp. (9,2%, incluso 2,7% S. aureus) Enterococcus spp. 8,9% E. coli 8,3% |
Device invasivi UTI Malattie di base |
| Suetens C., 2018 [49] |
- | Ospedali per acuti: 5,9% Ospedali di lungodegenza: 3,7% |
- | Ospedali per acuti RTI 21,4% UTI 18,9% SSI 18,4% BSI 10,8% GI 8,9% Ospedali di lungodegenza RTI 33,2% UTI 32% Infezioni della cute 21,5% |
Ospedali per acuti E. coli 16,1% S. aureus 11,6% Klebsiella spp. 10,4% Enterococcus spp. 9,7% P. aeruginosa 8% C. difficile 7,3% Ospedali di lungodegenza E. coli 30,7% S. aureus 12,3% Klebsiella spp. 11,4% Enterococcus spp. 9,7% P. aeruginosa 7,1% C. difficile 4,4% |
Non specificato |
| Messler S., 2018 [53] |
Pre- Intervento: 7,53/100 giorni-paziente Post-Intervento: 2,61/100 giorni-paziente |
- | - | BSI |
Enterobacteriaceae Stafilococchi coagulasi-negativi S. aureus C. albicans Enterococci (VRE-E. faecium) Bacillus cereus |
Non specificato |
| Aghdassi S.J.S., 2019 [54] | 0,6/1.000 giorni- PVC device | - | - | BSI Infezione locale |
S. aureus | PVC |
| Blot K., 2019 [66] |
1,6/1.000 pazienti ospedalizzati 1,8/1.000 pazienti in UTI |
- | - | BSI 24,2% UTI 14,9% Polmonite 9,7% |
Stafilococchi coagulasi-negativi 18,6% E.coli 18,0% S. aureus 11,6% Enterococcus 7,8% Klebsiella 7,1% Enterobacter 6,1% Candida 5,7% Pseudomonas supp. 5,6% |
Non specificato |
| Tammelin A, 2019 [60] | - | 8,3% | - | - | Non specificato | Non specificato |
| Colomb-Cotinat M., 2019 [56] | 3,6 casi per 10.000 giorni-paziente 2010-2016 + 14% annualmente |
- | - | Non specificato | C. difficile | Non specificato |
| Cantón R., 2020 [68] |
- | 19,4% | 37,8% | Non specificato |
K. pneumoniae 8% P. aeruginosa 9,6% A. baumannii 1,8% |
Non specificato |
| Åttman E., 2021 [62] |
- | - | 5,2%/7 giorni 11,4%/28 giorni |
BSI 10% UTI 3,1% GI 1,3% Cute 2,1% |
S. epidermidis 73% Enterococcus faecalis 14% E. faecium 82% |
Emodialisi cronica CVC |
| Teixeira H., 2021 [69] | - | - | - | CLABSI 5,8% Infezioni intestinali 1,1% Polmoniti 58,0% SSI 3,5% UTI 31,7% |
C. difficile 1,7% | Non specificato |
BSI (Bloodstream infection): Infezioni del torrente ematico; CAUTI (Catheter-Associated Urinary Tract Infection): infezioni urinarie catetere-correlate; CDI: infezione da C. difficile; CLABSI (Central Line-Associated Blood Stream Infection): infezioni del torrente ematico associate alla linea centrale; CRI (Catheter-Related Infection): infezioni correlate al catetere; CRO (Carbapenem-Resistant Organisms): organismi resistenti ai carbapenemi; CVC (Central Venous Catheter): catetere venoso centrale; EENT (Eye, Ear, Nose or Mouth Infection): infezione occhio-orecchio-naso-bocca; GI: infezioni gastrontestinali; MRSA: S. aureus meticillino-resistente; NEC (Necrotizing Enterocolitis): enterocolite necrotizzante; LRTI (Lower Respiratory Tract Infection): infezioni del basso tratto respiratorio; RTI (Respiratory Tract Infections): infezioni del tratto respiratorio; SNC: Sistema Nervoso Centrale; SSI (Surgical Site Infections): infezioni del sito chirurgico; SSTIs (Skin and Soft Tissues Infections): infezioni della cute e dei tessuti molli; UTI (Urinary Tract Infections): infezioni delle vie urinarie; UTI: Unità di Terapia Intensiva; VAP (Ventilator Associated Pneumonia): polmoniti associate al ventilatore; VRE (Vancomycin-Resistant Enterococci): enterococco resistente alla vancomicin.
Lo studio di Zarb et al. [48], del 2012, descrive un’indagine di sorveglianza sul C. difficile svoltasi nel 2010 in 23 Paesi UE. Su un totale di 19.888 pazienti arruolati e provenienti da 66 ospedali, 1.408 (7,1%) hanno sviluppato una ICA, con una maggiore frequenza, nell’ordine, di infezioni del tratto respiratorio (25,7%), infezioni del sito chirurgico (18,92%), infezioni urinarie (UTI) (17,2%), del torrente ematico (14,2%) e infezioni gastrointestinali (7,8%).
La seconda survey europea condotta, tra il 2016 e il 2017, da Suetens et al. [49] confronta i dati di ospedali per acuti con quelli di strutture di lungodegenza, riportando una prevalenza di ICA, rispettivamente, di 5,9% e 3,7%. In entrambi i gruppi di studio è stata riportata una maggiore frequenza di infezioni del tratto respiratorio (21,4% vs 33,2%) e di infezioni del tratto urinario (18,9% vs 32%), dovute principalmente a batteri Gram-negativi, come ad esempio E. coli (16,1% vs 30,7%) e Klebsiella spp. (10,4% vs 11,4%) e batteri Gram-positivi, tra cui Staphilococcus aureus (11,6% vs 12,3%).
Tra i 5 studi condotti in Germania, quello di Leistner et al. [50] del 2015 riassume i dati provenienti da un sistema di sorveglianza nazionale tedesco, tra gli anni 2007-2012, finalizzati ad analizzare il trend nazionale e regionale delle ICA dovute a Enterobatteriacee con beta-lattamasi a spettro esteso (ESBL). La percentuale maggiore di ICA era riferita alle infezioni del sito chirurgico (11,46-15,38%), alle infezioni del tratto urinario (9,36-16,56%) e alle infezioni delle basse vie respiratorie (11,91-14,70%).
Allo stesso modo, sempre dai dati di sorveglianza nazionale raccolti tra gennaio 2013-febbraio 2014, Maechler et al. [51] analizzano le segnalazioni di 341 unità di terapia intensiva di 247 ospedali, riportando 5.171 casi di batteri Gram-negativi multiresistenti, di cui il 16% rappresentato da organismi resistenti ai carbapenemi (CRO).
Lo studio di prevalenza nazionale descritto da Behnke et al. [52] nel 2017, include circa l’8% degli ospedali per acuti tedeschi, riportando nel complesso una prevalenza di infezioni nosocomiali del 5,1%. Un maggior tasso di prevalenza ICA (18,6%) è stato registrato nelle unità di terapia intensiva mentre, tra le infezioni, le più frequentemente riportate sono risultate quelle del sito chirurgico (24,3%), le infezioni delle vie urinarie (23,2%), le infezioni delle basse vie respiratorie (21,7%), seguite dalle infezioni da C. difficile (6,4%) e dalla sepsi (5,7%).
Dopo un incremento di casi di infezioni causati da patogeni VRE (Vancomycin-Resistant Enterococcus) nelle unità di terapia intensiva, lo studio di Messler et al. [53] descrive l’efficacia dell’implementazione di misure di prevenzione e controllo in ambito ospedaliero. In particolare, potenziando i sistemi di sorveglianza attiva per VRE, sensibilizzando gli operatori sanitari sull’importanza del lavaggio delle mani e dell’impiego dei dispositivi di protezione, intensificando le procedure di pulizia e disinfezione delle stanze di degenza e delle superfici, oltre all’utilizzo, per ciascun paziente, di disinfettanti per il corpo a base di octenidina, gli autori hanno documentato una riduzione dell’incidenza di patogeni da 7,53/100 giorni-pazienti ospedalizzati, nella fase pre-intervento, a 2,61/100 giorni pazienti-ospedalizzati nella fase post-intervento.
Nell’ambito di un’analisi riguardante i fattori di rischio correlati alle ICA, l’indagine di prevalenza puntuale di Aghdassi et al. [54], condotta tra il 2017 e il 2018, ha valutato una prevalenza del 33% di pazienti sottoposti al posizionamento di cateteri periferici venosi, in un campione di 2.092 pazienti, evidenziando come un uso spropositato di tali dispositivi, unito a una scarsa gestione e a controlli poco frequenti possano contribuire a un aumentato rischio di infezioni a essi correlate.
Alla luce dell’alto tasso di prevalenza di S. aureus resistente alla meticillina (MRSA) in Francia, a metà degli anni ’90, la sorveglianza e la prevenzione dei microrganismi multiresistenti sono diventate una priorità nazionale nel programma nazionale di controllo delle ICA.
Simile al lavoro tedesco precedentemente descritto di Leistner et al. [50], dunque, quello di Carbonne et al. [55] descrive il trend temporale di incidenza di microrganismi multiresistenti agli antibiotici tra il 2003 e il 2010 nelle strutture sanitarie francesi. Nel complesso, l’incidenza di MRSA per 1000 pazienti si è ridotta del 43% (range 40-60%), passando dallo 0,044/1000 giorni-pazienti allo 0,038/1000 giorni-pazienti. Al contrario, si è registrato un incremento nel tempo del 182% (range 80-210%) per gli ESBL, con un’incidenza prima dello 0,006/1000 giorni-pazienti e poi dello 0,031/1000 giorni-pazienti.
Sempre in Francia, invece, Colomb-Cotinat et al. [56] hanno descritto un’incidenza di infezioni da C. difficile di 3,6 casi/10.000 giorni-pazienti nel 2016, con un incremento tra il 2010 e il 2016 del 14%.
Lo studio polacco di Deptula et al. [58] si propone di valutare i fattori di rischio correlati a un’elevata prevalenza di ICA tra i pazienti ricoverati in ospedali per acuti. Da un’analisi dei dati stratificati per età e riguardanti una popolazione complessiva di 16,598 pazienti, si è rilevata una prevalenza di ICA maggiore (13,3%) nella fascia pediatrica di età < 1 anno, seguiti dalla popolazione 1-4 anni (6,1%) e 5-14 anni (3,4%). Tra gli adulti, invece, si è registrata una prevalenza del 7,9% negli over 85 anni e del 7,5% nella fascia 75-84 anni. Nel complesso, le infezioni più frequenti sono state le infezioni del tratto respiratorio (29,4%), le infezioni del sito chirurgico (20,1%), quelle urinarie (15,4%) e le infezioni del torrente ematico (12,4%).
Anche l’altro studio polacco di Tomaszewski et al. [57] ha rilevato, su un totale di 205 pazienti esaminati, 101 individui con ICA (51,30% tra gli adulti e 16,70% tra la popolazione pediatrica). Le infezioni più frequenti sono risultate quelle respiratorie (53,73%), le infezioni del sito chirurgico (18,65%) e quelle del torrente ematico (14,92%). La maggior parte di esse sono state causate da batteri Gram-negativi (64,10%), tra cui Enterobacteriaceae (44,7%) S. aureus (MRSA), seguiti da Gram-positivi (31,80%) e funghi (4,10%). Nello studio, la ventilazione meccanica, i cateteri venosi centrali e i cateteri urinari sono stati considerati fattori di rischio per le infezioni, soprattutto nei pazienti critici.
L’importanza della formazione del personale sanitario e dei programmi di prevenzione delle infezioni correlate ai cateteri venosi centrali (CVC) è sottolineata anche dal lavoro svedese di Hammarskjöld et al. [59], del 2014. Gli autori, con uno studio osservazionale condotto tra il 2004 e il 2009, dopo la costituzione di un team formato da infermieri e anestesisti per il posizionamento, la cura e la rimozione dei CVC, hanno descritto una bassa incidenza di colonizzazione del dispositivo (7,0/1.000 CVC-giorni), di infezioni correlate al catetere (1,2/1.000 CVC-giorni) e di infezioni del torrente ematico correlate a tali device (0,6/1.000 CVC-giorni), in un periodo di 6 anni, nell’ambito di un’intera popolazione di pazienti ospedalizzati. Un tempo di cateterizzazione superiore ai 14 giorni (range 1-645) ha rappresentato uno dei principali fattori di rischio di infezione, seguito dalla necessità di emodialisi nei pazienti e dall’uso di CVC in vena giugulare.
Più in generale, invece, un altro studio svedese di Tammelin et al. [60] riporta una prevalenza di ICA nazionale dell’8,3-13,1%.
In un ospedale di cure terziarie finlandese, nel 2015, Huttunen et al. [61] hanno analizzato 2.175 casi di infezioni del torrente ematico in 1843 pazienti, verificatesi tra il 1999-2001 e il 2005-2010. L’incidenza complessiva è stata di 0,99/1000 giorni-pazienti. Tra i principali agenti eziologici, si sono riscontrati patogeni Gram-negativi (23-35%), Gram-positivi (54-60%), funghi (2-8%) e altri microrganismi (6-16%).
Lo studio finlandese di Åttman et al. [62] del 2021, invece, si focalizza sulla prevalenza di infezioni del torrente ematico correlate all’assistenza in una popolazione oncoematologica di 2.296 pazienti (range di età 0-97 anni), riportando come principali diagnosi sottostante la leucemia mieloide acuta (35%) e il linfoma non-Hodgkin (22%). Tra i patogeni responsabili delle infezioni, tra il 2006 e il 2016, il 46-60% era rappresentato da batteri Gram-positivi, mentre il 24-36% da Gram-negativi.
Lo studio di Segagni Lusignani et al. [63] ha coinvolto circa il 4,7 % degli ospedali austriaci, riportando una prevalenza di ICA del 6,2%, con il 18,3% attribuibile alle solo terapie intensive. Tale prevalenza è risultata maggiore nelle ospedalizzazioni di durata superiore a 3 giorni e nei pazienti con quadro clinico più grave. Se confrontate con i valori dell’UE, le infezioni del tratto urinario rilevate sono state più numerose in Austria (21,3% vs 19%), seguite da polmoniti (20,6% vs 19,4%), infezioni del sito chirurgico (17,4% vs 19,4%), infezioni gastro-intestinali (10,5% vs 7,6%) e infezioni sistemiche (10,5% vs 7,6%). Tra i microrganismi, E. coli (14,8%), Enterococcus (13,1%) e P. aeruginosa (11,4%) hanno rappresentato i patogeni più frequentemente rilevati.
Bogdanic et al. [64], nel 2013, hanno analizzato l’incidenza di infezioni del sito chirurgico in un ospedale croato, riportando valori, nel complesso, dell’1,44% in pazienti sottoposti a interventi di colecistectomia. Nello specifico, l’incidenza è stata maggiore negli interventi di chirurgia tradizionale (6,06%) rispetto ai casi di tecniche laparoscopiche (0,60%). Gli agenti patogeni maggiormente responsabili di tali infezioni sono risultati i batteri Gram-negativi, tra cui E. coli, K. pneumoniae e Enterococcus faecium.
Un’analisi di prevalenza più specifica è stata invece condotta da Condell et al. [65], nel 2016 in Danimarca, rilevando valori medi giornalieri del 4,9% per le infezioni del tratto urinario, tra il 2010-2014.
Lo studio di Blot et al. [66] nel 2019, invece, esamina tutti i dati relativi a infezioni nosocomiali del torrente ematico raccolti dal sistema di sorveglianza belga in un arco temporale di 15 anni (2000-2014), rilevandone un totale di 59,941 casi. Tali infezioni sono state principalmente associate a cause derivanti da cateterismi centrali (24,2%), dalle vie urinarie (14,9%), polmonari (9,7%) o da agenti eziologici non noti (27,8%), con un tasso di infezione 6 volte superiore in terapia intensiva.
I microrganismi più comuni sono risultati gli stafilococchi coagulasi negativi (18,6%), E. coli (18,0%) e S. aureus (11,6%), seguiti da Enterococcus (7,8%), Klebsiella (7,1%), Enterobacter (6,1%), Candida (5,7%) e Pseudomonas supp.(5,6%).
Lo scopo dello studio di Kritsotakis et al. [67], invece, è stato quello di delineare stime nazionali sulla prevalenza e incidenza delle ICA negli ospedali per acuti in Grecia.
Dall’arruolamento di 37 ospedali e una coorte iniziale di 8.247 pazienti ricoverati all’inizio della survey, ne è emersa una prevalenza del 9,1% (95% IC 7,8-10,6%), maggiore per il sesso maschile rispetto a quello femminile (9,8% vs 8,3%). Gli autori forniscono anche dati di dettaglio riguardo la prevalenza di ICA per fasce d’età, riportando valori del 5,0% (3,0-8,0%) nella popolazione 0-14 anni, del 5,7% (4,1-7,8%) nella fascia 15-34 anni e dell’8,9% (7,3-10,8%) in quella 35-54 anni. Valori maggiori si registrano poi negli over 75 anni [11,1% (9,1-13,3%)], seguiti dalla fascia 55-74 anni [10,0% (8,7-11,5%)].
Nel complesso, invece, le tipologie più frequenti di infezioni rilevate sono state quelle del basso tratto respiratorio (2,7 infezioni/100 pazienti), seguite da infezioni del torrente ematico (2,1 infezioni/100 pazienti), UTI (1,7 infezioni/100 pazienti), infezioni del sito chirurgico (3,8 infezioni/100 pazienti operati) e infezioni sistemiche (0,7 infezioni/100 pazienti). Tra i patogeni isolati sono invece emersi Klebsiella (17,6%), P. aeruginosa (1,8%), Acinetobacter (16,8%), Staphylococcus (9,2%, di cui S. aureus 2,7%), Enterococcus (8,9%) ed E. coli (8,3%).
Tra i principali fattori di rischio, pazienti ricoverati in terapia intensiva (32,7%, IC 95% 27,4-38,4), pazienti ricoverati per una malattia grave (30,5%, IC 95% 25, 0-36,7) e quelli che utilizzano 3-4 dispositivi invasivi (47,9%, IC 95% 42,3-53,5) sono stati definiti come le categorie maggiormente predisposte a insorgenza di ICA e con maggior rischio di mortalità.
Per quanto riguarda, infine, l’incidenza annuale stimata di individui che acquisiscono almeno una ICA in un anno, sono stati descritti valori del 5,2% (95% IC 4,4-5,3%), corrispondente a un numero assoluto di 121.142 pazienti (95% IC 103.522-123.738). Studi più recenti sono stati invece condotti in Spagna e Portogallo [68, 69]. Canton et al. [68], nel 2020, hanno delineato il burden clinico-epidemiologico di ICA dovute a patogeni Gram-negativi resistenti ai carbapenemi in Spagna, nell’anno 2017. Gli autori hanno stimato circa 376.346 casi di ICA, di cui il 9,6% causato da P. aeruginosa, l’8% da K. pneumoniae e l’1,8% da A. baumannii. I pazienti con infezioni da P. aeruginosa, K. pneumoniae e A. baumannii hanno costituito il 19,4% del numero totale di pazienti con infezioni nosocomiali.
Infine, lo studio retrospettivo portoghese condotto da Teixeira et al. [69], nel 2021, analizza l’incidenza di ICA dal 2014 al 2017. Sono stati registrati 79.555 episodi medi annui di ICA, corrispondenti a circa 1.525 casi a settimana. Il patogeno maggiormente isolato è stato il C. difficile, responsabile di infezioni respiratorie (58%), infezioni del tratto urinario (31,7%) e infezioni del sito chirurgico (3,5%). Nel complesso, tra i pazienti privi di comorbidità, le infezioni del sito chirurgico sono risultate le più frequente (54,3%). Al contrario, le infezioni del tratto urinario sono state più comuni tra i pazienti con almeno una comorbidità (77,7%) mentre quelle del torrente ematico correlate al catetere si sono maggiormente sviluppate nei pazienti con tre o più patologie preesistenti (36,9%).
Il 56,1% degli studi inclusi (37/66), riporta dati riferiti a soggetti di età > 19 anni, delineando, invece, un quadro epidemiologico delle ICA, a livello europeo, tra la popolazione adulta (Tab. VI). Molti dei lavori selezionati, circa il 20% (12/37), sono stati condotti in Polonia [70-81].
Studi europei inclusi, condotti sulla popolazione adulta.
A. Principali caratteristiche degli studi europei inclusi, condotti sulla popolazione adulta.
| Primo autore, anno di pubblicazione [Ref] | Paese europeo | Disegno di studio | Durata dello studio | Popolazione target (n. pazienti, età media, genere) | Setting |
|---|---|---|---|---|---|
| Almirante B., 2012 [82] |
Spagna | Studio trasversale | 2007-2010 | Tot: 2977 > 18 anni |
40 Ospedali G1: > 500 letti G2: 200-500 letti G3: < 200 letti Singola specialità |
| Cotter M., 2012 [95] |
Irlanda | Studio trasversale | Giugno 2010 | Tot: 4170 Range età: ≥ 85 anni - < 85 anni |
Strutture di lungodegenza |
| Eilers R., 2012 [92] |
Paesi Bassi | Studio trasversale | Maggio- giugno 2010 |
Tot: 1429 Popolazione anziana > 85 anni: 540 |
Case di cura |
| Heudorf U., 2012 [90] |
Germania | Studio trasversale | Gennaio- marzo 2011 |
Tot: 3732 Popolazione anziana > 85 anni: 1912 |
Case di cura |
| Vrijens F., 2012 [102] |
Belgio | Studio trasversale | 2005 | Tot: 754 Età media: 74 anni |
Ospedali per acuti |
| Pujol M., 2012 [83] |
Spagna | Studio trasversale | 2007-2010 | Tot 10.104 procedure chirurgiche Età media: 69 ± 12 anni |
Ospedali |
| Apostolopoulou E. 2013 [103] | Grecia | Studio osservazionale prospettico | Luglio 2009- giugno 2010 |
Tot: 294 Età media: 71 (IQR 60-78) anni |
UTI |
| Ott E., 2013 [91] |
Germania | Studio osservazionale | Marzo-aprile 2010 | Tot: 226 > 59 anni: 57 |
UTI, Reparti di Medicina Interna, Chirurgia e Neurologia |
| Gregor M., 2014 [100] |
Repubblica Ceca | Studio trasversale | Gennaio 2007- dicembre 2011 |
Tot: 21937 Età ≤ 60 anni: 19919 > 60 anni: 2018 |
Reparti di Ginecologia e Ostetricia |
| Puhto T., 2015 [98] |
Finlandia | Studio osservazionale | 2011-2013 | Tot: 78211 | Ospedale di cure terziarie |
| Wałaszek M., 2015 [72] |
Polonia | Studio osservazionale retrospettivo | 2003-2012 | Tot: 13351 M: 7076 (53%) F: 6253 (47%) Età media: 52 anni |
Reparto di neurochirurgia |
| Martelius T., 2016 [99] |
Finlandia | Studio trasversale | 1999-2013 | Tot: 13459 > 65 anni |
Ospedale per acuti Ospedale di cure secondarie Ospedale di cure terziarie |
| Roche F., 2016 [96] |
Irlanda | Studio trasversale | Maggio 2013 | Tot: 1060 > 85 anni |
Strutture di lungodegenza |
| Deptuła A., 2017 [70] |
Polonia | Studio trasversale | 2012-2014 | Tot: 945 M: 64,2% F: 35,8% Età media: 64,4 ± 16,0 anni |
UTI |
| Medina-Polo J., 2017 [85] |
Spagna | Studio osservazionale prospettico | 2012-2015 | Tot: 6.546 Età media: 66,4 ± 14,89 anni |
Reparti di Urologia |
| Baldesi O., 2017 [86] |
Francia | Studio longitudinale di coorte prospettico | 2004-2013 | Tot: 246.459 Età media: 65 (IQR 54-75) anni |
UTI |
| Pomorska-Wesołowska M., 2017 [71] |
Polonia | Studio longitudinale di coorte retrospettivo | Gennaio 2013- dicembre 2013 |
TOT: 613 M: 324 F: 289 60-74 anni: 311 75-85 anni: 272 ≥ 85 anni: 30 |
Strutture di assistenza ambulatoriale, ospedali, strutture di lungodegenza |
| Eikelenboom-Boskamp A., 2018 [93] |
Paesi Bassi | Studio trasversale | 2010-2017 | Range Tot: 1571-2185 Età media: 84 anni |
Case di cura |
| Hijas-Gomes A.I., 2018 [84] | Spagna | Studio longitudinale di coorte prospettico | 2008-2016 | Tot 1.969 Età media: 71,7±7,2 anni |
Ospedale Universitario |
| Pailhoriès H., 2018 [87] |
Francia | Studio osservazionale retrospettivo | 2010-2017 | Tot: 120 Pazienti con A. pittii e/o A. nosocomialis: 63 anni Pazienti con A. baumannii: 69 anni |
Ospedale |
| Rafter N., 2018 [97] |
Irlanda | Studio trasversale | 2011-2012 | Tot: 247 > 18 anni |
Ospedali per acuti pubblici |
| Kolpa M., 2018 [76] |
Polonia | Studio trasversale | 2007-2016 | Tot: 1.847 Età media: 57 (IQR 52,8-56,1) anni |
UTI |
| Kolpa M., 2018 [77] |
Polonia | Studio trasversale | 2012-2016 | Tot: 159.028 Età media: 56 ± 26,5 anni |
Ospedali |
| Krutova M., 2018 [101] |
Repubblica Ceca | Studio osservazionale multicentrico | 2015 | Tot: 490 Età media: 76 anni |
Ospedali |
| Wałaszek M., 2018 [73 |
Polonia | Studio osservazionale retrospettivo | 2013-2015 | Tot: 2.547 Età media: 63 anni |
UTI |
| Wałaszek M., 2018 [74] |
Polonia | Studio osservazionale retrospettivo | 2013-2015 | Tot: 2.547 Età media: 63 anni F: 67 anni M: 60 anni |
UTI |
| Wałaszek M., 2018 [75] |
Polonia | Studio osservazionale retrospettivo | 2013-2015 | Tot: 2.547 Età media: 63 anni |
UTI |
| Bassetti M., 2019 [106] |
9 nazioni europee (Italia, Francia, Grecia, Belgio, Repubblica Ceca, Germania, Irlanda, Portogallo, Spagna, Paesi Bassi, UK) |
Studio osservazionale retrospettivo multicentrico | Gennaio 2015- dicembre 2016 |
Tot: 80.645 Età media: 66 (55-75) anni |
UTI |
| Kołpa M., 2019 [78] | Polonia | Studio trasversale | 2003-2017 | Tot: 10.332 | Unità di Neurochirurgia |
| Forget V., 2020 [89] |
Francia | Studio longitudinale caso-controllo | 1° gennaio 2012-30 aprile 2015 | Tot 10.132 Età media: 70,3 (IQR 57-84,6) anni |
Chirurgia ortopedia e traumatological |
| Kolpa M., 2020 [79] |
Polonia | Studio osservazionale retrospettivo | 2009-2018 | Tot: 15.678 | Reparto ortopedico |
| Hopmans T.E.M., 2020 [94] | Paesi Bassi | Studio trasversale | 2007-2016 | Non specificato | Ospedali |
| Massart N., 2020 [88] |
Francia | Studio osservazionale retrospettivo | Gennaio 2016- settembre 2017 |
Tot: 3.861 Età media: 62,1 (IQR 51-71) anni |
UTI |
| Voidazan S., 2020 [104] |
Romania | Studio trasversale | 2017-2018 | Tot: 228.782 Età media: 60,6 ± 19,45 anni |
Ospedali |
| Litwin A., 2021 [80] |
Polonia | Studio osservazionale | 1° gennaio 2011-31 giugno 2019 | Tot: 4.010 Età media: 60,9 ±17 anni |
UTI |
| Rafa E., 2021 [81] |
Polonia | Studio trasversale | 2016-2019 | Tot: 540 Età media: 59 (95% IC 58-61) anni |
UTI |
| Gregersen M., 2021 [105] |
Danimarca | Studio longitudinale di coorte retrospettivo | 15 settembre- 19 dicembre 2016 nei vecchi reparti 15 settembre- 19 dicembre 2017 nei nuovi reparti |
Tot: 446 Età media Stanze in condivisione: 85,1 ± 6,9 anni Stanze singole: 83,2 ± 7,9 anni |
Reparto geriatrico |
UTI: Unità di Terapia Intensiva.
Burden epidemiologico, tipo di ICA, agenti patogeni e fattori di rischio riportati negli studi europei inclusi, condotti sulla popolazione adulta.
| Primo autore, anno di pubblicazione [Ref] | ICA (%) | Tipo di ICA (%) | Agenti patogeni (%) | Fattori di rischio | ||
|---|---|---|---|---|---|---|
| Incidenza | Prevalenza | Mortalità | ||||
| Almirante B., 2012 [82] | 0,26/1.000 giorni di ospedalizzazione | - | - | CRSBI | Gram-negativi G1 (26%) G2 (23%) G3 (29%) Singola specialità (5%) Gram-positivi: G1 (68%) G2 (70%) G3 (65%) Singola specialità (93%) Lieviti G1 (6%) G2 (7%) G3 (6%) Singola specialità (2%) |
CVC PVC PICC |
| Cotter M., 2012 [95] |
- | 3,7% | - | RTI 28% UTI 40% Infezioni della cute 20% |
Non specificato | Catetere urinario Incontinenza Piaghe da decubito Chirurgia nei precedenti 30 giorni |
| Eilers R., 2012 [92] |
- | 2,8% | - | RTI: 0,7% | Non specificato | Catetere urinario |
| Heudorf S., 2012 [90] |
- | 4,3% | - | UTI 1,2% RTI 1,1% Infezioni della cute 0,7% Micosi della cute 0,5% Occhi 0,4% GI 0,3% Bocca 0,1% |
Non specificato | Catetere urinario Incontinenza Piaghe da decubito Chirurgia nei precedenti 30 giorni Catetere vascolare |
| Vrijens F., 2012 [102] |
6,2/100 ammissioni ospedaliere | 6,2% | 2,8% | UTI 26,7% SSI 15,8% BSI 14,2% GI 10,1% LRI 15,7% Altro 17,7% |
Non specificato | Non specificato |
| Pujol M., 2012 [83] |
- | - | - | SSI 20,8% | Non specificato | Tipo di chirurgia |
| Apostolopoulou E. 2013 [103] | 34,1/1.000 giorni | 51,7% | - | VAP 56,1% CLABSI 32,2% CAUTI 11,7% |
A. baumanni 47% K. pneumonia 19,8% P. aeruginosa 12,6% Candida spp. 7,5% |
Ventilazione meccanica Catetere centrale Catetere urinario |
| Ott E., 2013 [91] |
- | 50% | - | SSI 29% GI 26% RTI 19% UTI 16% Sepsi primaria 4% Altre infezioni nosocomiali 6% |
E. coli 19% Stafilococchi coagulasi-negativi 18% Candida spp. 15% E. faecium 13% P. aeruginosa 10% Enterococcus faecalis 8% Norovirus 4% C. difficile 4% Streptococcus spp. 4% K. pneumoniae 3% S. aureus 2% Altri patogeni 20% Patogeni non identificati 18% Infezioni polimicrobiche 30% |
Tipo di malattia di base Device Trattamento antibiotico Chirurgia Presenza di ferite Dialisi |
| Gregor M., 2014 [100] |
- | 0,86% | - | SSI 84,3% UTI 3,6% RTI 0,5% GI 2,0% BSI 3,0% Infezioni della cute 1,5% Articolazioni 1,0% Tessuti molli 0,5% Origine sconosciuta 3,6% |
S. aureus 7,6% Stafilococchi coagulasi-negativi 8,7% Beta-hemolytic streptococchi 5,8% Enterococcus spp. 8,7% S. agalactiae 4,6% Peptostreptococcus spp. 4,1% Corynebacterium spp. 2,3% Altri batteri Gram-positivi 7% E. coli 25% Klebsiella spp. 5,2% ESBL 0,6% Enterobacter spp. 2,9% Bacteroides spp. 5,8% Proteus spp. 4,1% Altri batteri Gram-negativi 7,6% |
Chirurgia Intubazione Catetere vascolare |
| Puhto T., 2015 [98] |
15,8 per 1.000 giorni-paziente | - | - | SSI (tessuti profondi e superficiali) 27,8% Polmoniti 15,7% UTI 12,2% EENT 11,5% GI 9,1% Sepsi (incluso febbre neutropenica) 8,8% BSI 3,8% Infezioni da catetere 3,5% Infezioni della cute e dei tessuti molli 2,9% CLABSI 1,7% LRTI/polmoniti 1,2% Infezioni dell’apparato riproduttivo 0,8% Altre 1,0% |
Non specificato | Device medici |
| Wałaszek M., 2015 [72] | - | 3,11% | Incidenza cumulativa SSI 1,7% BSI 0,96% Polmoniti 1,02% UTI 0,58% GI 0,23% Infezioni della cute e dei tessuti molli 0,07% |
BSI S. aureus 34% S. epidermidis 22% S. hominis 12% Polmoniti A. baumannii 32% S. aureus 13% E. coli 12% UTI E. coli 40% P. aeruginosa 15% C. albicans funghi 13% |
CVC Chirurgia Intubazione |
|
| Martelius T., 2016 [99] |
0,75 BSI/1.000 giorni-paziente | - | - | BSI in cure terziarie Anni 1999-2001: 79-84% Anni 2011-2013: 63-66% |
E.coli 14% K. pneumoniae 4% |
CVC Chirurgia Cancro Trapianto d’organo Emodialisi |
| Roche F., 2016 [96] |
- | 4,3% | - | RTI 1,6% Cute/ferite 1,6% UTI 0,6% Altro 0,6% |
- | Catetere urinario Catetere vascolare Piaghe da decubito Recente intervento chirurgico Altre ferite |
| Deptuła A., 2017 [70] |
- | 39,2% | - | RTI 45,1% BSI 14,2% SSI 13,3% UTI 11,6% Sepsi 4,7% GI 3,5% C. difficile 2,3% Altro 5,4% |
A. baumannii
P. aeruginosa K. pneumoniae E. coli S. aureus E. cloacae P. mirabilis |
Device |
| Medina-Polo J., 2017 [85] | 6,3% | - | - | UTI 70,5% SSI 22,1% |
E. coli 25,1% Enterococcus spp. 17,5% Klebsiella spp. 13,5% P. aeruginosa 12,3% S. aureus 7% C. albicans 6% Enterobacter supp. 5% S. epidermidis 4% Proteus spp. 2% Morganella spp. 1% Altri 5% |
Chirurgia |
| Baldesi O., 2017 [86] |
0,3 per 1.000 giorni-paziente | - | 52,4% | Candidemie acquisite in UTI: 9,4% BSI: 9.087 casi |
C. albicans 61,4% C. glabrata 14,3% C. parapsilosis 8% C. tropicalis 5,6% C. krusei 3,6% Stafilococchi coagulasi- negativi 23,8% S. aureus 16,4% Pseudomonas spp. 12,9% E. coli 11,7% Enterococcus spp. 9,8% |
Intubazione endotracheale CVC |
| Pomorska-Wesołowska M., 2017 [71] | - | - | - | Polmoniti 7,67% BSI 6,04% Infezioni della cute e dei tessuti molli 67,86% Infezioni oculari 10,11% Altre 8,32% |
MRSA: 105 casi MSSA: 508 casi |
Non specificato |
| Eikelenboom-Boskamp A., 2018 [93] | - | 3,1% | - | UTI 1,5% Polmonite 1,0% BSI 0,1% GI 0,2% Congiuntivite batterica 0,2% |
Catetere uretrale Catetere suprapubico Endoscopia Dispositivo intravascolare |
|
| Hijas-Gomes A.I., 2018 [84] | 1% | SSI 1% |
S. epidermidis 45% S. aureus 30% |
Cancro Rimozione peli Drenaggi |
||
| Pailhoriès H., 2018 [87] | - | 73 casi | Mortalità a 30 giorni per A. pittii e/o A. nosocomialis: 9,1%/ Mortalità a 30 giorni: A. baumannii 10,3% |
Infezioni correlate a device 42,5% Infezione intra-addominale 9,6% RTI 6,8% UTI 6,8% Chirurgia 1,4% |
A. pittii 54,8% A. baumannii 39,7% A. nosocomialis 5,5% Enterobacteriaceae, Enterococcus faecalis, Streptococcus spp., Staphylococci coagulasi negativi, Stenotrophomonas maltophilia e S. aureus |
Non specificato |
| Rafter N., 2018 [97] |
3,8 per 100 ammissioni | 4,4% | 7% | Polmoniti/LRTI 31% SSI 27% UTI 2% BSI 15% GI 19% Infezione sistemica 1% Infezioni della cute e dei tessuti molli 3% |
E. coli 11% S. aureus 16% Enterococcus spp. 6% C. difficile 16% P. aeruginosa 11% Bacilli Gram-negativi Enterobacteriaceae non specificato 4% |
Non specificato |
| Kolpa M., 2018 [76] |
27,6/ 100 pazienti ammessi | - | - | Incidenza (%)/100 pazienti Polmoniti 9,9% BSI 8,6% UTI 2,9% GI 2,1% SSI 1,8% Infezioni della cute e dei tessuti molli 1,4% Altro 1,0% |
A. baumannii 25% Stafilococchi coagulasi-negativi 15% E. coli 9% P. aeruginosa 8% K. pneumoniae 7% C. albicans 6% |
Catetere centrale Catetere arterioso Intubazione Ventilazione meccanica Catetere uretrale Sonda gastrica Plasma Drenaggio pleurico Tracheostomia PEG Plasma Broncoscopia Nutrizione parenterale Gastroscopia |
| Kolpa M., 2018 [77] |
1,4% | - | - | GI 28,9% SSI 23% BSI 16,1 |
S. aureus 18,3% Stafilococchi coagulasi-negativi 9,5% Enterococcus spp. 8,7% Streptococcus spp. 1,5% E. coli 19,3% Klebsiella spp. 8,1% Proteus supp. 4,6% Serratia supp. 0,8% A. baumanni 10,4% P. Aeruginosa 4,3% Morganella morganii 2% Candida spp. 5,6% Altro 2,2% |
Tipo di procedura Device medici |
| Krutova M., 2018 [101] |
5,2/10.000 giorni di allettamento-paziente | Non specificato | C. difficile | Non specificato | ||
| Wałaszek M., 2018 [73] | Densità di incidenza VAP: 12,3 per 1.000 giorni di ospedalizzazione-persona | - | - | Non specificato |
S. aureus 16,1% Stafilococchi coagulasi-negativi 0,6% Enterococcus spp. 1,2% S. pneumoniae 3% Citrobacter spp. 0,6% Enterobacter spp. 1,8% E. coli 7,1% K. pneumoniae 18,5% Proteus spp. 3,6% Seratia spp. 3,6% A. baumannii 20,2% P. aeruginosa 6% Stenotrothomonas maltophilia 1,2% Hemophilus spp. 2,4% Altro 22% |
- |
| Wałaszek M., 2018 [74] | 22,6% | - | 10,8% | Incidenza: Polmoniti 8% BSI 7,2% UTI 4,7% |
S. aureus 44,4% Enterococcus spp. 16,7% S. pneumoniae 24,4% Enterobacteriaceae 43,9% E. coli 37,7% Klebsiella 23,1% Acinetobacter spp. 36,6% P. aeruginosa 52,1% |
Device |
| Wałaszek M., 2018 [73] | Incidenza BSI: 7,2% per 100 ammissioni Densità di incidenza: BSI: 9,2 per 1.000 giorni di ospedalizzazione- persona |
- | 20% | CVC 35,3% Polmoniti 37,9% UTI 55,2% SSI 3,4% Infezioni della cute e dei tessuti molli 3,4% Origine sconosciuta 17,4% |
Stafilococchi coagulasi-negativi 20,8% A. baumannii 34,5% S. aureus 13,4% Enterococcus spp. 7,3% S. pneumoniae 2,4% E. coli 10,4% K. pneumoniae 15,2% Serratia marcescens 6,7% Enterobacter spp. 3% Proteus spp. 5,5% P. aeruginosa 4,3% Candida spp. 1,2% |
CV Chirurgia Intubazione |
| Bassetti M., 2019 [106] |
7,07 episodi per 1.000 ammissioni in UTI | - | 42%/30 giorni | Candidemia 65% Candida intra-addominale 29% Candida intra-addominale + candidemia 5% |
C. albicans 57% C. glabrata 21% C. parapsilosis 13% |
Non specificato |
| Kołpa M., 2019 [78] |
4,6% | - | - | SSI 33% Polmoniti 24,8% BSI 20,4% UTI 13,2% GI 6,9% Infezioni della cute e dei tessuti molli 1,7% |
S. aureus 25,2% Stafilococchi coagulasi-negativi 7,1% Streptococcus spp. 3,6% E. coli 9% Klebsiella spp. 6,1% Enterobacter spp. 6,7% Proteus spp. 2,9% Serratia spp. 1,1% A. baumannii 13,9% P. aeruginosa 4,2% M. morganii 1,1% C. difficile 1,9% Candida spp. 2,1% |
Chirurgia (impianto spinale, craniotomia, laminectomia, impianto shunt-ventricolare) Ventilazione meccanica |
| Forget V., 2020 [89] |
SSI 1,8% | S. aureus 0,7% | Cancro Device invasivi Fratture |
|||
| Kolpa M., 2020 [79] |
1,7% | - | - | SSI 62% |
S. aureus 45,4% Stafilococchi coagulasi-negativi 14,1% E. faecium 4,3% Enterococcus faecalis 2,5% Streptococcus spp. 0,6% E. coli 4,3% E. cloacae 3,7% K. pneumoniae 5,5% A. baumanii 4,9% P. mirabilis 1,8% P. aeruginosa 1,2% Serratia spp. 0,6% |
Tipo di chirurgia |
| Hopmans T.E.M., 2020 [94] | - | 2007: 6,1% 2016: 3,6% |
- | SSI (2007: 1,6% - 2016: 0,8%) UTI (2007: 2,1% - 2016: 0,6%) CAUTI (2007: 1,4% - 2016: 0,4%) LRTI (2007: 1,4% - 2016: 1,2%) VAP (2007: 0,5% - 2016: 0,2%) BSI (2007: 0,9% - 2016: 0,7%) CLABSI (2007: 0,3% - 2016: 0,1%) GI (2007: 0,3% - 2016: 0,2%) Altro (2007: 0,7% - 2016: 0,4%) |
Non specificato | Intubazione CVC PVC |
| Massart N., 2020 [88] |
0,46 per 100 ammissioni | 6,1 | 33,3% | Polmoniti 53,3% BSI 46,6% |
Enterobacteriaceae 32,4% P. aeruginosa 17,8% |
Chirurgia Intubazione |
| Voidazan S., 2020 [104] | - | 0,44% | 1,1% | Bronchopneumonia 25,3% Enterocolitis con C. difficile 23,3% SSi/infezioni dei tessuti molli 16,6% Sepsi 16,0% UTI 12,8% Infezioni CVC 3,4% Virus influenza tipo B 0,3% Altre infezioni 2,2% |
C. difficile 22,3% A. baumannii 16,7% K. pneumoniae 14,8% P. aeruginosa 11,2% S. aureus 10,7% E. coli 4,7% Altri germi 19,5% |
CVC Intubazione Chirurgia |
| Litwin A., 2021 [80] |
17,62 ± 1,98/1000 giorni-paziente | 19,9% | VAP 50,9% UTI 37,4% CLABSI 15% |
Batteri Gram-negativi 71,3% Batteri Gram-positivi e funghi 21,5% P. aeruginosa 25,3% |
Device | |
| Rafa E., 2021 [81] |
17,8% | - | 15,9% | BSI 38,7% Polmoniti 24,2% UTI 20,3% LRI 7,9% GI 4,6% Infezioni della cute e dei tessuti molli 2,7% Infezione sistemica 1,2% |
K. pneumoniae 16,4% A. baumannii 14,4% S. aureus 11,8% E. coli 11,4% |
Device |
| Gregersen M., 2021 [105] | Sistemazione in stanze multiple: 30,5 per 1000 giorni di ospedalizzazione Sistemazione in stanze single: 21,2 per 1.000 giorni di ospedalizzazione |
Sistemazione in stanze multiple: 30% Sistemazione in stanze single: 20% |
- | Stanze multiple: UTI 18,6% Polmoniti 11,4% GI 1,4% Sepsi 2,3% Altre infezioni 3,5% Stanze single: UTI 9,3% Polmoniti 12,4% GI 2,2% Sepsi 0,4% Altre infezioni 1,8% |
Non specificato | Non specificato |
BSI (Bloodstream infection): Infezioni del torrente ematico; CVC (Central Venous Catheter): catetere venoso centrale; EENT (Eye, Ear, Nose or Mouth Infection): infezione occhio-orecchio-naso-bocca; GI: infezioni gastrontestinali; MRSA: S. aureus meticillino-resistente; MSSA: S. aureus meticillino-sensibile; NEC (Necrotizing Enterocolitis): enterocolite necrotizzante; LRTI (Lower Respiratory Tract Infection): infezioni del basso tratto respiratorio; PICC (Peripherally-inserted central venous catheter): catetere venoso a inserzione periferica; PVC (Peripheral venous catheter): catetere venoso periferico; RTI (Respiratory Tract Infections): infezioni del tratto respiratorio; SNC: Sistema Nervoso Centrale; SSI (Surgical Site Infections): infezioni del sito chirurgico; SSTIs (Skin and Soft Tissues Infections): infezioni della cute e dei tessuti molli; UTI (Urinary Tract Infections): infezioni delle vie urinarie; UTI: Unità di Terapia Intensiva; VAP (Ventilator associated pneumonia): polmoniti associate al ventilatore; VRE (Vancomycin-resistant enterococci): enterococco resistente alla vancomicin.
Lo studio multicentrico di Deptuła et al. [70], nel 2016, partendo dai dati raccolti dall’indagine di prevalenza puntuale europea promossa dall’ECDC, negli anni 2012-2014, ha analizzato la prevalenza di ICA nelle unità di terapia intensiva polacche, rilevandone un valore pari al 39,2%. Tra i pazienti arruolati nello studio, per il 64,5% di sesso maschile e con un’età media di 64,6 anni, le infezioni del tratto respiratorio sono state quelle maggiormente riportate (45,1%), soprattutto in pazienti intubati nelle 48 ore precedenti alla comparsa dei sintomi (86,5%) e in seguito a operazioni chirurgiche (60,1%).
Altre infezioni segnalate sono state quelle del torrente ematico, con una prevalenza di circa il 14,2%, seguite da quelle del sito chirurgico (13,3%) e dalle UTI (11,6%). Le infezioni da C. difficile, invece, con una prevalenza generale riportata del 2,3%, si sono verificate nel 60,0% dei casi nel sesso femminile.
Lo studio retrospettivo di Pomorska-Wesołowska et al. [71] si focalizza invece sulle infezioni nosocomiali da S. aureus meticillino-resistente (MRSA), prendendo in esame una popolazione adulta di 613 pazienti di età ≥ 65 anni. Le infezioni del torrente ematico hanno rappresentato il 6% di tutte le forme segnalate, con una frequenza due volte maggiore nel sesso maschile rispetto a quello femminile (p = 0,0231, OR 2,25, 95% IC 1,098-4,604). La prevalenza maggiore di MRSA si è registrata nella fascia più adulta del campione in esame (≥ 85 anni), con un valore del 26,7%, seguita dal 19,5% nel gruppo 75-85 anni e dal 14% nella fascia 60-74 anni.
Al fine di individuare strategie prioritarie per la prevenzione delle ICA in ambito ospedaliero, Walaszek et al. hanno condotto diverse indagini epidemiologiche, di cui 4 incluse nella nostra revisione sistematica [72-75].
Lo studio meno recente risale al 2015 [72] e include 13,351 pazienti adulti ospedalizzati in un reparto di neurochirurgia polacco (53% uomini e 47% donne) tra il 2003 e il 2012. Gli autori hanno stimato un’incidenza cumulativa di infezioni del 3,86%, più alta nel 2004 (6,03%) e in diminuzione nel 2008 (2,92%). Le infezioni verificatesi con maggiore incidenza sono state quelle del sito chirurgico (1,72%), seguite dalle infezioni del torrente ematico e dalle polmoniti, con un’incidenza cumulativa, rispettivamente, dello 0,96% e dell’1,02%. Meno frequenti sono risultate, invece, le UTI (0,58%), le infezioni gastrointestinali (0,23%) e quelle riguardanti la cute e i tessuti molli (0,07%). Tra gli agenti eziologici isolati dai pazienti con infezioni del sito chirurgico, i più comuni sono stati S. aureus (56%), Acinetobacter baumannii (14%) ed Enterobacter cloacae (7%).
Nel 2018, è stato invece condotto uno studio più specifico su 7 unità di terapia intensiva polacche, per calcolare l’incidenza cumulativa delle polmoniti da ventilazione meccanica stimata, tra il 2013 e il 2015, all’8,0%, con eziologia da Enterobacteriaceae (32,6%) e batteri Gram-negativi (27,6%) [73].
Nello stesso anno, sempre il gruppo di lavoro di Walaszek et al. [74] ha poi pubblicato uno studio nato sulla base dei dati di sorveglianza attiva del 2013-2015 e raccolti, su raccomandazione dell’ECDC, nelle terapie intensive della Polonia del Sud.
L’incidenza generale di ICA riportata da Walaszek et al. [74] è stata del 22,6% e, tra queste, un valore dell’8,0% è stato attribuito alle polmoniti, 7,2% alle infezioni del torrente ematico e 3,7% alle UTI.
Infine, l’ultimo studio incluso di Walaszek et al. [75], pubblicato sempre nel 2018, fornisce informazioni sul burden epidemiologico delle infezioni del torrente ematico tra i pazienti di terapia intensiva, elaborate sulla base dei dati raccolti nel periodo 2013-2015. Tali infezioni, nel 65% dei casi derivanti da cateteri venosi centrali, hanno registrato un’incidenza di 7,2/100 ammissioni ospedaliere e una densità di incidenza di 9,2/1000 giorni di ospedalizzazione-persone.
Tra gli altri lavori polacchi inclusi, quattro appartengono al gruppo di lavoro di Kolpa et al. [76-79].
Lo studio pubblicato nel 2018 [76] riassume i principali risultati ottenuti da un’indagine di sorveglianza della durata di 10 anni (2007-2016), condotta in un reparto di terapia intensiva. Con un tempo medio stimato di 22,9 giorni tra il ricovero ospedaliero in terapia intensiva e l’insorgenza di ICA nei pazienti, gli autori ne hanno descritto un tasso di incidenza del 27,6%. In particolare, è stata rilevata un’incidenza del 9,9% per le infezioni polmonari, dell’8,9% per le infezioni del torrente ematico e del 2,9% per le UTI. L’utilizzo di device e l’esecuzione di procedure mediche invasive, quali tracheotomie, broncoscopie e drenaggi pleurici, hanno rappresentato, nello studio, i principali fattori di rischio per l’insorgenza delle infezioni.
Nello stesso ospedale, un altro studio pubblicato sempre nel 2018 da Kolpa et al. [77], riporta invece i risultati di una indagine di sorveglianza condotta tra il 2012 e il 2016, al fine di evidenziare i punti di forza e le criticità del sistema di rilevazione ICA. Nei 5 anni considerati, il tasso di incidenza complessivo di infezioni correlate all’assistenza è risultato essere dell’1,4%, maggiore nelle terapie intensive (16,9%) e con valori inferiori nelle unità pediatriche (1,8%), nei reparti chirurgici (1,3%) e nei reparti non chirurgici (1,0%). Nelle rilevazioni, le infezioni gastrointestinali hanno costituito il 28,3% di tutte le ICA segnalate, mentre S. aureus ed E. coli sono risultati i patogeni responsabili di circa il 37,6% di tutte le forme infettive [77].
Più recente è lo studio di Kolpa et al. del 2019 [78], finalizzato a valutare, in un arco temporale di 15 anni, il burden epidemiologico di infezioni in pazienti ricoverati in reparti di neurochirurgia. Lo studio ha evidenziato un’incidenza di ICA del 4,6%, soprattutto infezioni del sito chirurgico (33%), seguite da infezione del tratto respiratorio (24,8%) e del torrente ematico (20,4%), causate maggiormente da S. aureus (25%) e batteri Gram-negativi. Nel periodo di studio considerato, inoltre, dal 2003 al 2017, si è assistito a una riduzione di infezioni diversa a seconda della tipologia di intervento chirurgico eseguito: laminectomia (4,5% vs 0,8%), fusione spinale (11,8% vs 0,8%) e infine craniotomia (10,1% vs 0,4%).
Nel 2020, infine, gli autori Kolpa et al. [79] hanno pubblicato uno studio riguardante l’efficacia di programmi multidisciplinari di prevenzione delle infezioni del sito chirurgico dopo esecuzione di interventi di chirurgia ortopedica, in un periodo di dieci anni (2009-2018). Tra le diverse tipologie di interventi eseguiti, con un tasso di incidenza generale di ICA dell’1,1%, è stata notata una riduzione significativa, negli anni considerati, delle sole infezioni insorte dopo chirurgie di riduzione delle fratture, passando da 2,1% a 0,7%.
Gli ultimi due recenti studi condotti in Polonia sono stati pubblicati da Litwin et al. [80] e da Rafa et al. [81], entrambi con valutazioni riguardanti il rischio di ICA nei pazienti ricoverati in terapia intensiva.
Litwin et al. [80] hanno riportato un tasso di incidenza di ICA correlate all’utilizzo di device di 17,62 ± 1,98/1000 giorni-pazienti, con il 50,9% di casi di polmoniti associate all’uso di ventilatore meccanico, 37,4% di UTI e 15,01% di infezioni del torrente ematico correlate a cateterismo centrale. I patogeni Gram-negativi sono stati gli agenti eziologici di circa il 71,38% di tutte le infezioni e, tra queste, il 16,46% attribuibile a P. aeruginosa.
Infine, nell’indagine di sorveglianza condotta tra il 2016 e il 2019 nelle terapie intensive di tre ospedali polacchi, Rafa et al. [81] hanno descritto un valore di incidenza di ICA del 17,8% e una densità di incidenza di 20,3/1000 giorni-pazienti. Le tipologie di infezioni più frequentemente rilevate sono state quelle del torrente ematico (6,9%), seguite da polmoniti (4,3%) e UTI (3,6%), causate principalmente da K. pneumoniae (16,4%), A. baumannii (14,4%), S. aureus (11,8%) ed E. coli (11,4%).
Tra gli studi spagnoli (4/37, 10,8%), i più datati risalgono al 2012 ed entrambi fanno riferimento al programma di sorveglianza nazionale ICA (VINCat Program) [82, 83].
Almirante et al. [82] hanno descritto i risultati riguardanti un’indagine sulle infezioni del torrente ematico correlate all’impiego di cateteri, raccolti dal 2007 al 2010. L’incidenza cumulativa calcolata per tali infezioni è stata di 0,26 episodi/1,000 giorni di ospedalizzazione. Tra queste, circa il 76% delle infezioni è stata attribuita al posizionamento di cateteri venosi centrali, il 19% a quelli periferici e il rimanente 5% a cateteri venosi centrali a inserzione periferica (PICC). Le caratteristiche e le dimensioni degli ospedali si sono mostrati fattori fortemente condizionanti la frequenza di tali infezioni. Infatti, strutture ospedaliere con un numero di posti letto > 500 hanno registrato una frequenza media di 0,36 episodi/1,000 giorni-pazienti, mentre strutture con 200-500 posti letto, < 200 posti letto e centri monospecialistici, rispettivamente, valori di 0,17, 0,09 e 0,12/1,000 giorni-pazienti.
Nello stesso arco temporale, Pujol et al. [83], invece, hanno analizzato i dati delle infezioni del sito chirurgico post interventi colorettali eseguiti presso 49 differenti centri spagnoli, riportando un’incidenza cumulativa del 20,8% (95% IC: 20,03-21,63) su un totale di 10,104 operazioni chirurgiche.
L’incidenza delle infezioni del sito chirurgico è stata oggetto di studio anche nel lavoro scientifico di Hijas-Gomez et al. [84], analizzando, in 9 anni (2008-2016), circa 1969 pazienti, di età media di 71,7 anni, sottoposti a chirurgia ortopedica del ginocchio in un ospedale di cure terziarie. Il rischio globale stimato per il campione oggetto di studio è stato dell’1,1%, con un trend in diminuzione dall’1,8% del 2009 allo 0,4% del 2016.
Lo studio osservazionale di Medina-Polo et al. [85], condotto su un totale di 1701 pazienti ospedalizzati presso un dipartimento urologico di Madrid, tra il 2011 e il 2012, ha riportato invece una incidenza di ICA del 6,7% e, nello specifico, UTI (66,1%), infezioni del sito chirurgico (16,5%), infezioni addominali (10,4%) e batteriemia da catetere venoso centrale (6,1%). Tra i fattori di rischio considerati, gli autori hanno sottolineato il peso di precedenti comorbidità, quali ad esempio ipertensione, diabete, problemi cardiovascolari e stati di immunosoppressione, oltre a numero di giornate di cateterizzazione urinaria e precedenti interventi chirurgici in anamnesi.
Tra gli articoli inclusi nella nostra revisione, altri 4 (circa l’11% del totale) sono stati invece condotti in Francia [86-89].
L’indagine prospettica di Baldesi et al. [84], svolta a livello nazionale su 246.459 pazienti ricoverati in 277 terapie intensive francesi, tra il 2004 e il 2013, ha rilevato un’incidenza di candidemie correlate all’assistenza di 3,45/1000 ricoveri in terapia intensiva, o 0,3/1000 giorni-pazienti, con un aumento medio di 0,14 all’anno [0,01-0,28]. Tra le specie più isolate, C. albicans ha costituito il 61,4% dei casi, seguita da C. glabrata (14,3%), C. parapsilosis (8%), C. tropicalis (5,6%) e C. krusei (3,6%). Da un’analisi del campione, è inoltre emerso che i principali fattori di rischio per l’insorgenza di infezioni sono stati una prolungata degenza ospedaliera, la gravità della malattia, lo stato immunitario del paziente, l’assunzione di terapia antimicrobica al momento del ricovero in terapia intensiva e l’uso di procedure invasive, quali tracheotomie e cateteri venosi centrali.
Più specifico sulle infezioni del torrente ematico correlate all’assistenza e causate da Acinetobacter calcoaceticus-Acinetobacter baumannii complex (ACB) è invece lo studio di Pailhoriès et al. [87], del 2018, che ha esaminato 73 casi di batteriemia verificatisi in 7 anni di indagini di sorveglianza ospedaliera. Tra questi, il 42,5% è stato associato a infezioni correlate all’uso di device, il 9,6% a infezioni addominali, il 6,8%, in egual misura, a infezioni respiratorie e infezioni urinarie e, infine, l’1,4% a interventi chirurgici. È stato inoltre notato che i casi più frequenti di batteriemie da ACB si sono verificati in pazienti ricoverati in reparti clinici (53,4%) e in reparti di cura o riabilitazione (15,1%), e in misura minore in quelli in terapia intensiva (15,1%), nei reparti chirurgici (13,7%) e nelle unità di emergenza (2,7%).
Allo stesso modo, Massart et al. [88] si sono focalizzati sulle infezioni da bacilli Gram-negativi produttori di beta-lattamasi a spettro esteso (ESBL-GNB), arruolando pazienti ricoverati in tre terapie intensive francesi da due o più giorni, dal gennaio 2016 al settembre 2017, e rilevando un tasso di incidenza di 0,46/100 ammissioni ospedaliere (0,26-0,7) e 0,58/1000 giorni-pazienti (0,49-0,68).
Infine, lo studio di Forget et al. [89], del 2020, ha identificato, su un totale di 7.438 interventi ortopedici e traumatologici eseguiti tra gennaio 2012 e aprile 2015, un’incidenza media dello 0,7% di infezioni del sito chirurgico da S. aureus, soprattutto tra pazienti fumatori e non, sottoposti a procedure antisettiche pre operatorie.
Tra i due studi tedeschi, il meno recente è quello di Heudorf et al. [90] che, sulla scia di un progetto europeo proposto per la sorveglianza epidemiologica delle ICA nelle strutture di lungodegenza, nel 2008, analizza i dati delle infezioni provenienti da strutture assistenziali di Francoforte, in Germania.
L’indagine, svoltasi tra gennaio e marzo del 2011, ha coinvolto 3732 pazienti residenti in 40 strutture di assistenza di lungodegenza, di cui il 51,2% di età > 85 anni, evidenziando una prevalenza puntuale di ICA del 4,3%, comprendente infezioni del tratto urinario (1,2%), infezioni respiratorie (1,1%), infezioni della cute (0,7%), micosi (0,5%), infezioni degli occhi (0,4%), infezioni gastrointestinali (0,3%) e della bocca (0,1%).
Ott et al. [91], nel 2013, riportano invece una prevalenza di insorgenza di ICA dell’11,2%, con una maggiore frequenza, nell’ordine, di infezioni del sito chirurgico (29%), infezioni gastrointestinali (26%) infezioni respiratorie (19%) e infezioni del tratto urinario (16%), prevalentemente nei reparti di terapia intensiva (28,2%, 95% IC 20,2-37,7), in quelli di medicina interna (11,4%, 95% IC 7,8-15,7) e nei reparti chirurgici (9,1%, 95% IC 6,8-11,8) di un ospedale universitario tedesco, nel 2010.
Partendo dalle indicazioni dello stesso progetto europeo per la sorveglianza epidemiologica delle ICA nelle strutture di lungodegenza, promosso dall’ECDC e descritto nello studio tedesco di Heudorf et al. [90], anche Eilers et al. [92], nel 2012, hanno analizzato i dati correlati alle ICA di pazienti, per il 40% ultra ottantacinquenni, ricoverati in 10 strutture di lungodegenza nei Paesi Bassi. La prevalenza di infezioni riportata è stata del 2,8%, (range 0,10-5,6%) e, tra queste, le infezioni urinarie si sono mostrate le più comuni, con una prevalenza dello 0,7%.
Allo stesso modo, un altro studio olandese di Eikelenboom-Boskamp et al. [93], nel 2018, ha analizzato la prevalenza di ICA in strutture di lungodegenza, mediante un’indagine di prevalenza puntuale condotta tra il 2010 e il 2017.
I valori riportati variano tra le diverse strutture considerate (0,0-37,0%), con una prevalenza del 6,7% nei primi 4 anni di indagine e del 2,2% negli ultimi 6. La maggior parte delle ICA si è verificata nei reparti di riabilitazione e, anche in questo caso, le infezioni urinarie, in una popolazione con un’età media di 83 anni e con una predominanza del sesso femminile (69%), hanno registrato una prevalenza dell’1,5%.
Il terzo studio olandese, infine, condotto da Hopmans et al. [94], nel 2020, ha condiviso i risultati di una survey di prevalenza puntuale condotta a livello nazionale, mostrando un decremento della prevalenza annuale di ICA dal 6,1% nel 2007 al 3,6% nel 2016 e una riduzione della durata media di degenza ospedaliera da 10 a 7 giorni.
Tre studi inclusi nella nostra revisione sistematica europea forniscono, invece, informazioni sul burden epidemiologico delle ICA in Irlanda [95-97].
Sempre nell’ambito della sorveglianza epidemiologica svolta all’interno delle strutture di lungodegenza si inseriscono due dei tre studi considerati [95, 96]. Nel primo, Cotter et al. [95], nel 2012, hanno riportato una prevalenza di ICA del 2,4% (range: 0-14,8%), più specificatamente UTI (40%), infezioni del tratto respiratorio (28%) e infezione della cute (20%), su un campione di 4170 pazienti, di cui il 34,3% ultra ottantacinquenne.
Qualche anno dopo, nel 2016, su un campione con età media di 56 anni e nel 91% dei casi residenti in tali strutture da almeno un anno, Roche et al. [96] hanno rilevato una prevalenza di ICA simile a quella di Cotter et al. (2,2%) [26], con l’1,6% dei pazienti interessati da infezioni respiratorie e della cute.
Rafter et al. [97], nel 2018, hanno invece sottolineato i costi elevati, diretti e indiretti, derivanti dalle ICA in Irlanda, con una prevalenza di eventi avversi, in termini di prolungata degenza, riammissioni ospedaliere, reinfezioni e trattamenti invasivi a esse correlati del 4,4% (95% IC 3,1-6,1%) e con una incidenza di 3,8/100 ammissioni ospedaliere (95% IC 2,5-5,2), rispetto a una prevalenza generale di ICA, nel Paese, del 5,2%.
Lo studio di coorte del 2015, condotto da Puhto et al. [98], ha analizzato l’incidenza di ICA nei reparti di medicina interna, chirurgici e oncoematologici di un ospedale di cure terziarie in Finlandia, descrivendone una riduzione, nei tre anni considerati (2011-2013), dal 16,1 al 15,4/1000 giorni-pazienti.
Martelius et al. [99], invece, basandosi sui dati di sorveglianza ospedaliera delle infezioni del torrente ematico raccolti da 17 ospedali per acuti finlandesi, nel periodo 1999-2013, hanno mostrato un incremento dallo 0 al 17% di tali infezioni causate da batteri produttori di ESBL, in particolare E. coli (14%) e K. pneumoniae (4%), con una incidenza di infezioni del torrente ematico di 0,75/1000 giorni-pazienti.
Due sono gli studi condotti in Repubblica Ceca [100, 101]. Nel primo, una survey di Gregor et al. [100] per valutare l’incidenza di ICA in reparti ginecologici e ostetrici tra il 2007 e il 2011, è stato rilevato lo 0,86% dei casi di infezione, con una incidenza maggiore nelle pazienti con problemi ginecologici (1,31%) rispetto alle donne in gravidanza (0,60%), per le quali, invece, l’incidenza è aumentata in caso di parti con taglio cesareo (3,63% vs 0,36% del parto naturale). Il secondo, invece, rappresenta uno studio sull’epidemiologia delle ICA causate da C. difficile, nel 2015, in 28 ospedali della Repubblica Ceca. L’incidenza media riferita da Krutova et al. [101] è stata di 5,2/10.000 giorni-pazienti [IC 95% 4,2-6,2], con un decorso grave dell’infezione nel 21,2% dei casi. Nel 2012, dopo aver stimato un burden nazionale di ICA su un totale di 17.000 pazienti provenienti da quasi la metà degli ospedali belgi, con valori di prevalenza di circa 6,2%, Vrijens et al. [102] hanno stimato che, ogni anno, le infezioni correlate all’assistenza colpiscono 125.000 pazienti in Belgio e 3500 vanno incontro a decesso, soprattutto per infezioni respiratorie (23,7%), del torrente ematico (15,0%) e per infezioni gastrointestinali (14,5%). La gestione di tali infezioni, inoltre, può comportare costi aggiuntivi per l’assistenza sanitaria pubblica di 290 milioni di euro.
In Grecia, Apostolopoulou et al. [103], hanno invece stimato la frequenza di ICA associate all’utilizzo di device invasivi, analizzando i dati di pazienti ricoverati nelle terapie intensive di 3 ospedali, tra il 2009 e il 2010. Dal campione, per il 55% di sesso maschile e con età medi di 71 anni, è emerso che tali infezioni sono insorte nel 51,7% dei pazienti (34,1/1000 giorni di ricovero in terapia intensiva). Tra le infezioni, le più comuni sono risultate essere le polmoniti associate a ventilazione meccanica (56,1%), seguite da batteriemie da catetere centrale (32,2%) e infezioni urinarie correlate all’uso di cateteri (11,7%). Tra i patogeni, invece, quello maggiormente isolato è stato l’A. baumanni (47%), seguito da K. pneumonia (19,8%) e P. aeruginosa (12,6%), mentre, tra i miceti, Candida spp. (66,7%).
In Romania, Voidazan et al. [104], nel 2020, hanno condotto uno studio multicentrico di due anni (2017-2018), arruolando una popolazione ricoverata in 7 ospedali pubblici della nazione. Il 58,1% delle ICA è stato segnalato negli uomini e il 48,4% nei pazienti in terapia intensiva. Broncopolmoniti (25,3%) ed enterocoliti da Clostridioides difficile (23,3%) sono risultate le infezioni più rilevate, mentre i cinque patogeni più isolati sono stati Clostridioides difficile, A. baumannii, K. pneumoniae, P. aeruginosa e S. aureus.
La degenza in stanze singole, una migliore gestione degli spazi per l’esecuzione di procedure mediche e la ventilazione degli ambienti si sono infine mostrati efficaci nel ridurre il rischio di ICA in uno studio danese del 2021 [105]. Gli autori Gregersen et al. [105], hanno infatti confrontato una coorte di 222 pazienti adulti ricoverati in stanze multiple con 226 pazienti residenti in stanze singole di un ospedale geriatrico, riportando un tasso di infezione, per i primi, di 30,5/1,000 giorni di ospedalizzazione rispetto al 21,2/1,000 dei secondi e con una predominanza di infezioni urinarie (18,6% vs 9,3%).
È stato, infine, incluso in questa revisione sistematica un grande studio retrospettivo multicentrico, condotto tra il 2015 e il 2016 in 23 terapie intensive di 22 ospedali di cure terziarie europei e, nello specifico, 9 in Italia, 4 in Francia, 2 in Grecia, 1 in Belgio, 1 in Repubblica Ceca, 1 in Germania, 1 in Irlanda 1 in Portogallo, 1 in Spagna, 1 in Olanda e 1 in UK [106]. Nel periodo in esame, è stata riferita un’incidenza di infezioni da Candida pari a 7,07 episodi/1000 ricoveri in terapia intensiva (6,67 e 7,47, rispettivamente, nel 2015 e nel 2016), con 5,52/1000 per le candidemie e 1,84/1000 per le candidosi intra-addominali. Tali incidenze sono risultate maggiori in terapie intensive cliniche rispetto a quelle chirurgiche e le condizioni basi del paziente, l’età avanzata e le comorbidità presenti si sono dimostrati tutti fattori fortemente condizionanti il decorso clinico delle infezioni, mostrando dunque la necessità di programmi coordinati e condivisi di controllo delle ICA e interventi di stewardship per una maggiore sicurezza dell’assistenza ospedaliera [106].
Infine, l’11,6% degli articoli inclusi (7/66) delinea il burden epidemiologico europeo delle ICA nella popolazione neonatale-pediatrica (Tab. VII).
Studi europei inclusi, condotti sulla popolazione neonatale pediatrica.
A. Principali caratteristiche degli studi europei inclusi, condotti sulla popolazione neonatale pediatrica.
| Primo autore, anno di pubblicazione [Ref] | Paese europeo | Disegno di studio | Durata dello studio | Popolazione target (n. pazienti, età media, genere) | Setting |
|---|---|---|---|---|---|
| Verstraete E., 2014 [108] | Belgio | Studio osservazionale retrospettivo | 1992-2011 | Tot: 9.829 < 28 giorni di vita |
TIN |
| Viqueira A.Q., 2014 [109] | Spagna | Studio longitudinale di coorte prospettico | 2010-2012 | Tot: 1.079 Età media: 8,9 anni |
Chirurgia ortopedica pediatrica |
| Garcia I.J., 2015 [110] | Spagna | Studio osservazionale prospettico multicentrico | 2008-2012 | Tot: 90 Età media (mesi): 8 (3-18) mesi |
TIped |
| Baptista MI., 2016 [111] | Portogallo | Studio trasversale multicentrico | 2005-2010 | Tot: 44 | TIN |
| Zingg W., 2017 [107] | Europa | Studio trasversale | Maggio- giugno 2011 Settembre-ottobre 2011 Maggio- giugno 2012 Settembre-novembre 2012 |
Tot: 17.273 Range età: < 1 mese - ≥ 11 anni |
Unità pediatriche, chirurgia pediatrica, TIped, TIN |
| Kouni S., 2019 [112] | Grecia | Studio trasversale | Giugno 2016- febbraio 2017 | Non specificato | TIN e TIped |
| Luthander J., 2020 [113] | Svezia | Studio osservazionale retrospettivo | Luglio 1998- giugno 2018 | < 18 anni | TIN Reparti medici Reparti chirurgici |
TIN: Terapia Intensiva neonatale; TIped: Terapia Intensiva pediatrica.
Burden epidemiologico, tipo di ICA, agenti patogeni e fattori di rischio riportati negli studi europei inclusi, condotti sulla popolazione neonatale-pediatrica.
| Primo autore, Anno di pubblicazione [Ref] | ICA (%) | Tipo di ICA (%) | Agenti patogeni (%) | Fattori di rischio | ||
|---|---|---|---|---|---|---|
| Incidenza | Prevalenza | Mortalità | ||||
| Verstraete E., 2014 [108] |
BSI 3,1/1.000 giorni di ospedalizzazione |
6,9% | 6,1% | BSI 3,1% | Stafilococchi coagulasi-negativi 57,7% Enterobacteriaceae 6,4% S. aureus 10,6% Klebsiella supp. 3,1% Enterococchi 5,9% E. coli 4,9% Pseudomonas spp. 2,4% Candida 1,1% Altri patogeni Gram-positivi 6% Altri patogeni Gram-negativi 2% |
Non specificato |
| Viqueira AQ., 2014 [109] |
2,8% | - | - | SSI |
S. aureus 28,6% S. epidermidis 9,5% E. cloacae 7,1% MRSA 7,1% |
Intervento chirurgico |
| Garcia I.J., 2015 [110] |
- | 2,45% | - | CLABSI 3,8/1.000 giorni-CVC VAP 7,5/1.000 giorni-intubazione endotracheale CAUTI 4,1/1.000 giorni-catetere urinario |
Batteri Gram-negativi 63,6% Batteri Gram-positivi 19,2% Candida spp. 17,2% |
CVC CRI Intubazione endotracheale Ventilazione meccanica |
| Baptista MI., 2016 [111] |
0,42/100 ammissioni ospedaliere | - | - | Infezioni fungine invasive | Candida supp. 20,45% | CVC Basso peso alla nascita Età gestazionale |
| Zingg W., 2017 [107] |
- | 4,2% [3,7-4,8] < 1 mese: 5,1%; 1-11 mesi: 6,5%; 1-4 mesi: 2,2%; 5-10 mesi: 2,1%; ≥ 11 mesi: 2,8% |
- | BSI 44,6% LRTI 22,2% GI 8,3% EENT 7,1% UTI 4,8% SSI 4,4% |
Stafilococchi coagulasi-negativi 21% S. aureus 10,5% E. coli 9,5% Klebsiella spp. 9,5% Enterobacter spp. 6,9% P. aeruginosa 6,7% Candida spp. 5,9% Virus 5,4% Enterococcus spp. 5,1% Streptococcus spp. 4,6% Stenotrophomonas malthophilia 3,1% Serratia marcescens 2,1% A. baumannii 1,8% C. difficile 1% H. influenzae 1% Moraxella catarrhalis 1% P. mirabilis 1% Aspergillus fumigatus 0,8% Altro 3,1% |
CVC PVC CRI Chirurgia Ventilazione |
| Kouni S., 2019 [112] |
CLABSI per 1.000 giorni di catetere centrale: TIN (6,02) TIped (6,09) Unità ONC (2,78) |
- | - | CLABSI: 111 episodi |
Enterobacteriaceae 36% Gram-positivi cocci 29% Batteri Gram-negativi non fermentanti 16% Altri batteri Gram-negativi 2% Funghi 16% |
Cateteri linea centrale |
| Luthander J., 2020 [113] |
1998-2018 Generale: -0,45 3 mesi-2 anni: -0,59 Sepsi neonatale: -0,44 0-2 mesi: 34,4% |
- | 5,7% | BSI: 2.079 casi |
S. aureus 31,6% S. pneumoniae 8,6% Enterococcus spp. 9,3% S. pyogenes 2,8% S. agalactiae 5,5% L. monocytes 0,2% Altri Gram-positivi 1,8% E. coli 10,4% Klebsiella spp. 5,9% Salmonella 2,3% Altre enterobacteriaceae 5,8% P. aeruginosa 4,1% Neisseria meningitidis 1,0% Altri Gram-negativi 5,8% Candida spp. 4,9% |
Malattie di base Età precoce Device invasivi |
CAUTI (Catheter-Associated Urinary Tract Infection): infezioni urinarie catetere-correlate; CDI: infezione da C. difficile; CLABSI (Central Line-Associated Blood Stream Infection): infezioni del torrente ematico associate alla linea centrale; CRI (Catheter-Related Infection): infezioni correlate al catetere; CVC (Central Venous Catheter): catetere venoso centrale; EENT (Eye, Ear, Nose or Mouth Infection): infezione occhio-orecchio-naso-bocca; GI: infezioni gastrontestinali; MRSA: S. aureus meticillino-resistente; MSSA: S. aureus meticillino-sensibile; NEC (Necrotizing Enterocolitis): enterocolite necrotizzante; LRTI (Lower Respiratory Tract Infection): infezioni del basso tratto respiratorio; PICC (Peripherally-inserted central venous catheter): catetere venoso a inserzione periferica; PVC (Peripheral venous catheter): catetere venoso periferico; RTI (Respiratory Tract Infections): infezioni del tratto respiratorio; SNC: Sistema Nervoso Centrale; SSI (Surgical Site Infections): infezioni del sito chirurgico; SSTIs (Skin and Soft Tissues Infections): infezioni della cute e dei tessuti molli; UTI (Urinary Tract Infections): infezioni delle vie urinarie; UTI: Unità di Terapia Intensiva; VAP (Ventilator associated pneumonia): polmoniti associate al ventilatore; VRE (Vancomycin-resistant enterococci): enterococco resistente alla vancomicin.
Dai dati ottenuti dall’indagine di prevalenza puntuale 2011/2012, promossa dall’ECDC in tutta Europa, lo studio di Zingg et al. [107] elabora le informazioni riguardanti circa 17,273 pazienti pediatrici ospedalizzati (il 7,5% dell’intera popolazione coinvolta) in 29 nazioni e 618 ospedali differenti. Nel complesso, nel campione analizzato, si è registrata una prevalenza di ICA del 4,2% e con un range, tra le diverse nazioni, che varia dall’1,2 al 10,4%. Nello specifico, da un’analisi per fasce d’età, è emersa una prevalenza del 5,1% nel gruppo di età < 1 mese; del 6,5% (5,7-7,2%) nella fascia 1-11 mesi; del 2,2% (1,6-2,7) nel gruppo 1-4 anni; del 2,1% (1,4-2,8%) nella popolazione 5-10 anni; infine, del 2,8% (2,0-3,5%) nella popolazione ≥ 11 anni. Le infezioni del torrente ematico sono risultate le più frequenti [44,6% (41,0-48,1%)], seguite dalle infezioni del tratto respiratorio inferiore [22,2% (19,3-25,2%)], del tratto gastrointestinale [8,3% (6,4-10,3%)], del distretto occhi-naso-gola [7,1% (5,3-9,0%)], dalle UTI [4,8% (3,3-6,3%)] e da quelle del sito chirurgico [4,4% (3,0-5,9%)]. La maggior parte delle ICA (592/770, 76,9%) si è verificata nei primi 11 mesi di vita e, tra queste, in particolare le infezioni del torrente ematico nei neonati (57,1%), nei primi 11 mesi di vita (44,3%), tra 1-4 anni di età (25,4%) e nei bambini ≥ 11 anni (25,9%). Le infezioni del tratto respiratorio inferiore si sono rilevate invece le più comuni solo nella fascia di età compresa tra i 5-10 anni (26,2%), mentre le UTI, più rare nei neonati rispetto ai gruppi di età più avanzata (0,7% vs 6,9-9,9%), così come le infezioni del sito chirurgico, sono diventate gradualmente più frequenti con l’aumentare dell’età. I due gruppi più comuni di microrganismi rilevati sono stati le Enterobacteriaceae (20,9%) e S. aureus (10,5%). Infine, per quanto riguarda i fattori di rischio riportati, si riscontrano una prolungata durata della degenza ospedaliera (> 4 giorni) e il ricorso a dispositivi medici invasivi.
Lo studio più datato di Verstraete et al. [108], nel 2014, si focalizza su un’analisi del trend di incidenza delle infezioni del torrente ematico, e dei relativi patogeni responsabili, in un lungo arco temporale di quasi 20 anni, dal 1992 al 2011, nell’ambito di unità di terapie intensive pediatriche.
Il tasso di densità di incidenza totale medio annuo di tali infezioni è stato di 3,1/1.000 giorni di ricovero ospedaliero (range 0,9-5,3).
Allo stesso modo, lo studio di Viqueira et al. [109] si è concentrato su una stima dell’incidenza di infezioni del sito chirurgico in un reparto di ortopedia pediatrica in Spagna. Su un totale di 1079 pazienti, con un’età media di 8,9 anni, gli autori hanno riportato un’incidenza cumulativa del 2,8%. Inoltre, alla luce dell’implementazione dei programmi di sorveglianza ospedaliera, è stata mostrata una diminuzione dell’incidenza delle infezioni del sito chirurgico dal 4% nel 2010 al 3,2% nel 2011, seguita da un’ulteriore diminuzione al 2,4% nel 2012.
Un altro lavoro multicentrico spagnolo del 2015, condotto da Garcia et al. [110], riporta invece i risultati di un’indagine di sorveglianza su ICA multiresistenti, condotta per 5 anni, dal 2008 al 2012, in un’unità di terapia intensiva pediatrica. Tra i pazienti, con età media di 8 mesi, di cui il 56,1% di sesso maschile, è stato registrato il 2,45% di infezioni. Nei 5 anni considerati, il tasso medio per ciascuna delle infezioni considerate è stato di 3,8/1000 giorni per le infezioni del torrente ematico, 7,5/1000 giorni per le infezioni correlate all’impiego del ventilatore e 4,1/1000 giorni per le infezioni correlate a cateteri. Anche in questo caso, i dispositivi invasivi e i giorni di degenza ospedaliera hanno rappresentato i fattori di rischio più importanti per l’insorgenza delle infezioni.
Uno studio multicentrico portoghese di Baptista et al. [111], condotto tra il 2005 e il 2010, si focalizza su un’analisi delle infezioni fungine nelle terapie intensive neonatali. L’incidenza cumulativa rilevata è stata, nel complesso, di 0,42/100 ammissioni ospedaliere (95% IC 0,309-0,559), con una frequenza annuale che variava da 3/100 nel 2006 a 12/100 nel 2005 e nel 2010, con valori maggiori tra i 29 casi presenti di neonati con basso peso alla nascita (4,125%; 95% IC 2,833-5,795). Tutti i pazienti infetti presentavano un CVC da almeno 20 giorni, inserito nelle prime 48 ore dalla nascita nel 90,9% dei casi. Tra gli isolati, Candida spp. (20,45%) ha rappresentato l’unico agente patogeno fungino identificato.
Kouni et al. [112], invece, hanno valutato il burden epidemiologico nazionale delle infezioni del torrente ematico correlate a cateteri venosi centrali nei neonati in Grecia, in particolare nelle unità di terapia intensiva neonatale, pediatrica e nelle unità di oncologia pediatrica, al fine di attuare strategie per ridurle e migliorare la qualità della vita dei pazienti. La sorveglianza, della durata di 9 mesi, ha rilevato un tasso medio di infezioni del torrente ematico correlate a cateteri della linea centrale di 4,41 infezioni per 1000 giorni di catetere centrale, con valori di 6,02/1000 nelle unità intensive neonatali, di 6,12/1000 in quelle pediatriche e di 2,78/1000 nelle unità oncologiche.
Tassi più alti, inoltre, sono stati registrati nei neonati con peso alla nascita ≤ 750 g (15,29/1000). I patogeni più comuni sono stati le Enterobatteriaceae (36%), seguite da Gram-positivi (29%), Gram-negativi (16%) e funghi (16%).
Infine, uno studio retrospettivo svedese della durata di 20 anni (1998-2018), di Lunthander et al. [113], si è proposto di indagare la variazione dell’incidenza delle infezioni del torrente ematico in una popolazione di età < 18 anni. L’incidenza complessiva di tali infezioni, nei bambini di età compresa tra 0-17 anni, è diminuita nel periodo 1998-2018 (τ = -0,45, P = 0,016), con una riduzione più evidente per i bambini di età compresa tra 3 mesi e 2 anni (τ = -0,59, P = 0,0006) e per episodi di sepsi neonatale nei neonati di 0-7 giorni di vita (τ = -0,44, P = 0,0069).
Secondo gli autori, nella fascia pediatrica 3 mesi- 2 anni, la diminuzione delle ICA, di circa il 75%, trova una plausibile spiegazione anche nell’introduzione dell’immunizzazione contro S. pneumoniae del 2007, riducendosi, nel periodo considerato, da 22,5/100.000 casi a 5,5/100.000.
L’incidenza di infezioni del torrente ematico è invece risultata più alta tra i bambini di età 0-2 mesi (34,4%). Nel complesso, dunque, tali infezioni hanno interessato neonati e bambini < 2 anni di età e, tra i fattori di rischio principali sono stati inclusi la presenza di comorbidità, la nascita prematura con assistenza nelle terapie intensive e l’utilizzo di dispositivi invasivi. I patogeni responsabili sono invece risultai S. aureus (31,6%), Streptococcus pneumoniae (8,6%), Enterococcus spp. (9,3%), Streptococcus pyogenes (2,8%), Streptococcus agalactiae (5,5%) e Candida spp. (4,9%) [113].
Dalle evidenze scientifiche consultate e dai dati esaminati in questo capitolo emerge un burden epidemiologico considerevole delle ICA, che rappresentano uno dei problemi principali per la sicurezza dei pazienti, nonché un onere economico significativo per i sistemi sanitari, con rilevanti impatti diretti e indiretti sui pazienti e sulla società in tutta Europa [7, 102].
Le prime indagini di prevalenza puntuale condotte a livello europeo e promosse dall’ECDC stimano che circa 4 milioni di pazienti acquisiscono una ICA ogni anno in tutti gli Stati membri dell’UE, causa di oltre 37.000 decessi e con una prevalenza di almeno una ICA, per i pazienti ricoverati negli ospedali per acuti, del 6,0% [1].
Nel contesto italiano, la prima indagine europea, condotta negli anni 2011-2012, ha mostrato una prevalenza di ICA del 6,3%, in linea dunque con la media europea, e un notevole impatto di microrganismi multiresistenti a esse correlati [1, 27].
La più recente survey di prevalenza puntuale condotta nei setting acuti italiani, invece, risale al 2016, come parte della sorveglianza dell’ECDC nell’UE e nei Paesi dell’Area Economica Europea, e riporta una prevalenza di pazienti con almeno una ICA dell’8% [6]. Tra le infezioni più comuni, sono state indicate polmoniti (20,3%), infezioni del torrente ematico (18,3%), infezioni delle vie urinarie (18%), infezioni del sito chirurgico (14,4%) e infezioni gastrointestinali (8,5%) [6, 7].
I dati di prevalenza delle ICA, sebbene ancora limitati, emersi dai lavori di letteratura scientifica inclusi in questa revisione, sia a livello italiano sia nei diversi Paesi europei, risultano abbastanza in linea con la media calcolata dall’ECDC (6,8%) [27], nonostante la variabilità degli studi e delle metodologie non standardizzate adottate per la raccolta e l’analisi dei dati, oltre alla fruibilità ancora limitata di banche dati nazionali, che rendono più complesso un confronto accurato.
Sia per il focus italiano, oggetto di interesse di questo capitolo, sia per un’analisi più generale del setting ospedaliero e assistenziale europeo, ci si è focalizzati sul burden epidemiologico di tali infezioni nelle rispettive popolazioni adulte e neonatali pediatriche, cogliendone le relative differenze.
Dai 26 articoli inclusi nella revisione sistematica per l’analisi epidemiologica delle ICA in Italia, sono emersi, tra la popolazione generale non stratificata per età, valori di prevalenza variabili dal 3,6 al 13,3% [20, 28], con maggiori segnalazioni riguardanti infezioni del tratto respiratorio (2,6-35%), infezioni del torrente ematico (2,0-30,9%), infezioni del tratto urinario (2,4-25,2%) e infezioni del sito chirurgico (1,2-15,5%) [19, 20, 26-29].
Per quanto riguarda la popolazione adulta, la prevalenza delle ICA, rilevata sulla base di dati provenienti da reparti ospedalieri medici e chirurgici, varia dal 5,24 al 10,4% [1, 5]. Più esigui sono, invece, i dati di incidenza, per lo più specifici per alcune tipologie di infezioni, come ad esempio quelle del sito chirurgico, con un’incidenza cumulativa di 3,2 per 100 procedure chirurgiche nello studio di Agodi et al. [32], e infezioni del torrente ematico da K. pneumoniae resistente ai carbapenemi, con un’incidenza di 1,35 episodi per 10.000 giorni-paziente dalle rilevazioni di Cristina et al. [37].
Le ICA più frequentemente segnalate sono risultate le infezioni del tratto respiratorio (1,6-60%), seguite dalle UTI (2-28%), dalle infezioni del torrente ematico (0,7-31,5%) e, infine, da quelle del sito chirurgico (0,7-14,3%).
Tra i batteri Gram-negativi rilevati dall’analisi microbiologica dei campioni, i patogeni più comunemente isolati sono stati K. pneumoniae, A. baumannii, E. coli e P. aeruginosa. Tra i batteri Gram-positivi, invece, Staphylococcus epidermidis ne ha rappresentato l’agente patogeno principale, mentre quasi tutti i lieviti sono stati classificati come specie di Candida spp. [1, 5]. Le infezioni del tratto respiratorio, nell’adulto, sono spesso associate a procedure di ventilazione meccanica eseguite nei reparti di terapia intensiva. Oltre all’età avanzata e alle condizioni cliniche dei pazienti, infatti, soprattutto l’impiego di device invasivi e una prolungata degenza ospedaliera rappresentano i fattori di rischio maggiormente caratterizzanti l’insorgenza di infezioni [5, 31-38].
A tal proposito, lo studio di Vincitorio et al. [34], focalizzandosi principalmente sull’incidenza di infezioni del tratto urinario associate al catetere (CAUTI) in un reparto per acuti geriatrico, ha evidenziato come, nonostante l’età avanzata dei pazienti e una prolungata degenza prima dell’inserimento dei cateteri urinari, un’accurata gestione dei pazienti e l’implementazione di programmi di formazione e controllo delle procedure eseguite nei setting assistenziali, possano ridurre morbilità, mortalità, costi per servizi sanitari correlati alle ICA e, soprattutto, evitare un impatto negativo sulla qualità della vita dei pazienti. Anche le infezioni del sito chirurgico (SSI) rappresentano una delle principali complicanze nei pazienti sottoposti a intervento chirurgico, con importanti implicazioni in termini di morbilità, tra cui procedure chirurgiche aggiuntive o trasferimento in unità di terapia intensiva, mortalità, maggiore durata della degenza ospedaliera e importanti oneri economici. Come riportato dagli studi di Agodi et al. [31] e Marchi et al. [43], una parte considerevole delle SSI potrebbe essere evitata mediante l’attuazione di adeguate strategie preventive. Per tale motivo, negli ultimi quattro decenni sono stati implementati numerosi sistemi di sorveglianza delle SSI nazionali, volti a raccogliere dati e costruire programmi per ridurne l’incidenza. Le surveys condotte da Agodi et al. [33] e da Marchi et al. [43], così come le indagini su sepsi e CAUTI condotte, rispettivamente, da Agodi et al. nel 2015 [32], e Vincitorio et al. [34], rappresentano utili esempi di sistemi di sorveglianza attiva su specifiche ICA, che sottolineano anche il ruolo cruciale dell’educazione e della formazione degli operatori sanitari nella riduzione del relativo burden, con interventi basati sull’evidenza.
Gli studi italiani condotti sul burden e sugli esiti clinici delle ICA nella popolazione pediatrica sono ancora limitati e ne riportano una prevalenza che oscilla tra il 5,3% e il 9,0%, frequentemente causate da patogeni Gram-negativi multiresistenti agli antibiotici, tra cui K. pneumoniae, E. coli e P. aeruginosa [42, 44, 45]. I dati raccolti mostrano un burden più elevato nel primo anno di vita [44-47], indicando le infezioni del torrente ematico come le più frequenti nella popolazione pediatrica (1,4-69,9%) [44-47]. Da indagini condotte per la rilevazione di ICA in terapie intensive neonatali, inoltre, emergono valori di densità di incidenza totale pari a 3,2-3,5 per 1000 giorni-paziente [45, 46].
Le infezioni del tratto respiratorio inferiore (1,7-28,8%) e le infezioni del tratto urinario (0,8-28,8%), invece, sono risultate maggiormente frequenti nelle fasce più avanzate della popolazione pediatrica e con una distribuzione simile a quella riportata negli adulti [46, 47]. Anche per la popolazione pediatrica, i principali fattori di rischio per le ICA sono rappresentati da procedure invasive e dall’utilizzo di device, quali cateteri venosi centrali, cateteri ombelicali e cateteri urinari [42, 45, 47]. Inoltre, come riportato in due degli studi inclusi, i neonati con basso peso alla nascita hanno mostrato una maggiore densità di incidenza delle ICA (3,2-3,5/1000 giorni di ricovero), in particolare per setticemie e infezioni associate a dispositivi (ad es. CLABSI e VAP) [45, 46].
Più variabile è invece il quadro epidemiologico europeo delineato dall’analisi dei 66 articoli di letteratura scientifica definiti eleggibili per tale finalità. In termini di incidenza, data l’eterogeneità degli studi, risulta difficile stimarne un intervallo puntuale nell’ambito della popolazione generale, con ampi range di età. Per quel che riguarda la prevalenza complessiva di ICA, invece, essa varia da un valore minimo di circa 4,6% [52] a un valore massimo di 49,3% [57], con una maggiore predominanza di infezioni del tratto respiratorio (12-29,4%) [58, 61], infezioni del tratto urinario (1,7-27%) [61, 67], infezioni del sito chirurgico (1-27%) e infezioni del torrente ematico (2,0-14,2%) [48, 67].
Un ampio range di prevalenza è stato poi riscontrato nella popolazione adulta europea, con valori compresi tra 0,44% e 51,7% [103, 104]. Tra le forme più comuni di infezioni segnalate dopo i 19 anni di età si riscontrano quelle del sito chirurgico (1-84,3%) [84, 100], le UTI (0,58-70,5%) [72-85], le infezioni del torrente ematico (0,1-46,6%) [88, 93] e quelle del tratto respiratorio (0,5-45,1%) [70, 100]. Valori variabili sono stati riportati anche in termini di incidenza di ICA tra gli adulti, con un ampio range che oscilla tra 0,3-34,1% su 1000 giorni di ospedalizzazione [86, 103]. Più nello specifico, ad esempio, è stata calcolata un’incidenza di polmoniti da ventilazione meccanica pari al 12,3% su 1000 giorni di ospedalizzazione e un valore di circa l’1% di infezioni del torrente ematico su 1000 giorni di degenza ospedaliera [73, 99].
Rispetto agli studi italiani, condotti nella maggior parte dei casi su iniziativa delle singole realtà ospedaliere, diversi sono gli studi inclusi nella nostra revisione, derivanti da programmi di prevenzione e indagini di prevalenza puntuale svolti dall’ECDC, con un’analisi di dettaglio per ciascun Paese. Dopo l’avvio, nel periodo 2009-2011, ad esempio, del programma HALT (Health-care related instances in long-term care facilities), finalizzato a sviluppare o implementare protocolli di sorveglianza per ICA e antibiotico resistenza nelle strutture di lungodegenza europea, diversi Paesi hanno condiviso i propri risultati. In tale ambito si inseriscono lo studio tedesco di Heudorf et al. [90], con dati provenienti da strutture assistenziali di Francoforte, quelli olandesi di Eilers et al. [92] e Eikelenboom-Boskamp et al. [93] e due studi irlandesi di Cotter et al. [95] e Roche et al. [96]. Quasi tutti i lavori [90, 92, 93, 95] prendono in esame pazienti over ottantacinquenni, per i quali le UTI risultano le infezioni più frequenti (1,2-40%). Fa eccezione lo studio di Roche et al. [96], del 2016, che, arruolando una popolazione più giovane con età media di 56 anni, rileva l’1,6% di infezioni respiratorie e della cute.
Dalla revisione di letteratura che abbiamo condotto, tra i principali fattori di rischio per l’insorgenza di ICA, un ruolo determinante è attribuito a una prolungata degenza ospedaliera, soprattutto nelle unità di terapie intensive, alle condizioni di base del paziente, per gravità della malattia sottostante, eventuali comorbidità e stato immunitario generale [91] e all’esecuzione di procedure mediche invasive, tra cui il posizionamento di device [74-77, 80, 81, 82, 86, 91, 98, 100, 103, 104]. A tal proposito, diversi studi hanno dimostrato che la procedura di cateterizzazione centrale, il tempo di permanenza del dispositivo e la sua rimozione rappresentano momenti cruciali per l’insorgenza di infezioni del torrente ematico correlate a dispositivi [82, 54, 59]. Come sottolineato da Hammarskjöld et al. [59], sempre più urgenti risultano infatti interventi di formazione e sensibilizzazione per il personale sanitario, al fine di migliorare l’uso e la corretta gestione dei device, implementando programmi di sorveglianza e controllo, con sistemi di alert, check-list e linee guida per gli operatori.
Per quanto riguarda l’eziologia delle infezioni, da un punto di vista microbiologico, i batteri Gram-negativi, tra cui P. aeruginosa e produttori di beta-lattamasi a spettro esteso, seguiti da S. aureus meticillino-resistente (MRSA) e funghi responsabili di candidemie, rappresentano le forme maggiormente isolate nei campioni analizzati [71, 80, 88], con un incremento, negli ultimi anni, fino al 17% di batteri produttori di ESBL, in particolare E. coli e K. pneumoniae [99].
Come per l’Italia, gli studi riguardanti il burden epidemiologico delle ICA nella popolazione neonatale pediatrica europea rappresentano solo l’11% circa di tutti gli articoli inclusi, con valori di prevalenza compresi tra 2,45 e 6,9% [108, 110] e, tra questi, quasi tutti riguardanti infezioni del torrente ematico (3,1-44,6%) [107, 108, 110-113]. Tali infezioni si sono dimostrate più frequenti nella fascia più piccola della popolazione, in particolare in neonati e bambini di età < 2 anni e, tra i fattori di rischio principali, la presenza di comorbidità, la nascita prematura con necessità di trattamento in terapia intensiva e l’utilizzo di dispositivi invasivi ne rappresentano i principali [107, 110, 113]. Anche i pochi dati di incidenza raccolti, quando disponibili, confermano valori più alti di infezioni del torrente ematico soprattutto tra bambini al di sotto del primo anno di età. Il recente studio di Luthander et al. [113], ad esempio, nell’ambito di un’analisi sulla variazione dell’incidenza, nel periodo 1998-2018, delle infezioni del torrente ematico in una popolazione di età < 18 anni, ne riporta una incidenza pari al 34,4% nei primi due mesi di vita.
Le infezioni del tratto respiratorio inferiore si sono invece rilevate le forme più comuni dopo i primi anni di vita, così come le UTI e le infezioni del sito chirurgico, che diventano gradualmente più frequenti con l’aumentare dell’età [107]. I principali patogeni rilevati nei campioni pediatrici, infine, sono stati S. aureus, stafilococchi coagulasi negativi, S. pneumoniae, Enterococcus spp., S. pyogenes, S. agalactiae e Candida spp. [113].
Nel complesso, l’eterogeneità dei numerosi studi analizzati, sia in termini di metodologia usata per la raccolta dei dati, sia delle definizioni e dei protocolli adottati per la definizione e la rilevazione dei casi (in accordo, ad esempio, con l’ECDC, il National Healthcare Safety Network, NHSN e il Krankenhaus-Infektions-Surveillance-System, KISS), ha sicuramente costituito un limite di questa revisione sistematica [114]. Tuttavia, l’obiettivo principale del nostro lavoro era quello di fornire un’overview generale sul burden epidemiologico delle ICA a livello europeo e, più specificatamente, a livello italiano, per meglio comprenderne l’impatto per la salute pubblica.
Alla luce di quanto emerso da questa revisione sistematica, infatti, le attività di sorveglianza risultano indispensabili per conoscere l’epidemiologia dei microrganismi responsabili delle ICA e modulare politiche di prevenzione più efficaci, ancor di più in un paese come l’Italia, caratterizzato da una importante eterogenità interregionale in termini di aspetti organizzativi e gestionali in ambito sanitario [41].
Le numerose indagini di prevalenza puntuale riscontrate in letteratura, inoltre, nonostante le variabilità metodologiche citate, rappresentano spesso delle valide alternative a modelli di sorveglianza prospettica, fornendo stime delle ICA anche in condizioni di risorse limitate [1, 5, 29]. Inoltre, gli studi di prevalenza puntuale, quando periodicamente ripetuti, forniscono una grande quantità di informazioni sulla dimensione del fenomeno, evidenziando i potenziali effetti delle strategie adottate [1]. Pochi, sia a livello italiano sia a livello europeo, sono gli studi che riportano le azioni preventive introdotte nei diversi setting assistenziali considerati e soprattutto le strategie implementate alla luce dei risultati ottenuti [5, 32, 40, 47]. In Italia, lo studio di Ciofi degli Atti et al. [47], ad esempio, partendo dalla descrizione di una serie di azioni attuate per migliorare la gestione delle ICA in un ospedale pediatrico, evidenzia come la condivisone dei risultati delle indagini di prevalenza interna, la promozione dell’igiene delle mani e l’implementazione di strategie comunicative per pazienti e visitatori, oltre a costanti attività di controllo e monitoraggio dati e all’aggiornamento puntuale di linee guida, abbiano contribuito a una riduzione significativa della prevalenza di pazienti con ICA tra gli anni 2007-2010. Anche Antonioli et al. [5], con un’indagine puntuale di prevalenza condotta nel 2016 e nel 2018, analizzano i dati di sorveglianza delle ICA alla luce dell’attuazione di programmi di miglioramento organizzativo tra il personale sanitario coinvolto.
Nel setting europeo, il lavoro danese di Gregersen et al. [105] ha descritto una riduzione di ICA in un reparto geriatrico, focalizzandosi sull’efficacia della degenza ospedaliera dei pazienti in stanze singole e non in condivisione, di una migliore gestione degli spazi per l’esecuzione di procedure mediche e sull’importanza della ventilazione degli ambienti. L’attuazione di programmi di formazione continua per il personale sanitario, così come l’istituzione di team multidisciplinari responsabili della prevenzione ospedaliera e l’aggiornamento di programmi e protocolli di gestione della sicurezza del paziente, in particolare nel corso di procedure di posizionamento di cateteri venosi centrali, si sono invece dimostrati strategie efficaci per ridurre al minimo il rischio di insorgenza di ICA, in particolar modo delle infezioni del torrente ematico [54].
Tali strategie, tra l’altro, risultano in linea con quanto promosso dall’OMS, che promuove l’attuazione di approcci multimodali, che integrino aspetti di formazione, pratica clinica, osservazione e reporting delle strutture sanitarie e del personale coinvolto, al fine di ridurre il rischio di contaminazione e migliorare le pratiche di assistenza sanitaria [12]. L’importanza dell’intensificazione di procedure di pulizia e disinfezione delle stanze di degenza e delle superfici ospedaliere, oltre all’utilizzo di disinfettanti per il corpo a base di octenidina per ciascun paziente, all’impiego di dispositivi di protezione e all’implementazione del lavaggio delle mani, sono invece suggeriti dall’articolo tedesco di Messler et al. [53], nell’ambito di azioni volte alla riduzione di infezioni causate da patogeni vancomicina-resistenti. Tuttavia, il lavoro italiano di Caselli et al. [40] tra tutti gli articoli inclusi, rappresenta l’unico con dati reali riguardanti l’insorgenza delle ICA e il ruolo dell’igiene nelle strutture ospedaliere e di tutti gli arredi e gli oggetti che interagiscono con gli individui. Nel processo di contaminazione del paziente negli ambienti di cura e di assistenza, il contesto ambientale ricopre, infatti, un ruolo fondamentale come reservoirs per i microrganismi, aumentando il rischio di contaminazione crociata attraverso il contatto diretto e/o indiretto con il paziente [40]. Ancor di più alla luce della recente e ancora attuale emergenza pandemica da nuovo Coronavirus, e della sua trasmissibilità attraverso le superfici, l’applicazione di buone pratiche di assistenza e di misure di prevenzione e controllo delle infezioni, in ogni ambito assistenziale, rappresenta una priorità per il mondo scientifico, per ridurne l’impatto e, più in generale, per contrastare la diffusione di microrganismi antibiotico-resistenti.
Il quadro epidemiologico italiano ed europeo delle ICA, delineato dalla nostra revisione sistematica, mostra l’importanza, dunque, della raccolta, della sistematizzazione e della condivisione dei dati, al fine di agevolare la conoscenza dell’entità del problema e incoraggiare una maggiore e più mirata formazione in tema di sicurezza dei pazienti, dei visitatori e di tutto il personale dedicato all’assistenza, promuovendo politiche di prevenzione più efficaci [115]. Sarebbero inoltre auspicabili maggiori studi riguardanti il ruolo cruciale della sanificazione ambientale nella trasmissione delle infezioni in tutti i setting assistenziali, implementando tali pratiche nei programmi di prevenzione e controllo, con strumenti convenzionali e nuove tecnologie per prevenire e limitare la diffusione di agenti patogeni [116].
Con il termine sanificazione vanno intesi tutti i procedimenti e operazioni di pulizia e/o disinfezione finalizzati a rendere sicuro dal punto di vista igienico sanitario un oggetto o una superficie o un ambiente in relazione al suo utilizzo, mediante interventi di pulizia/detersione, disinfezione e sterilizzazione e se necessaria, disinfestazione [1].
La sanificazione, dunque, assicura l’igiene e protegge le persone, svolgendo una prevenzione eziologica delle malattie infettive, attraverso l’azione sui determinanti ambientali di queste.
Si riportano di seguito i principali sistemi di sanificazione attualmente disponibili in Italia.
Con il termine detersione si intende la pulizia ovvero il complesso di procedimenti e di operazioni finalizzato a rimuovere e asportare lo sporco generalmente definito sporco visibile, di qualsiasi natura esso sia, dalle superfici e dagli ambienti, effettuata con la rimozione manuale o meccanica dello sporco mediante sostanze detergenti usate nelle dosi e nei tempi indicati dal produttore.
La disinfezione è un trattamento per abbattere la carica microbica di ambienti, superfici e materiali (mediante utilizzo di disinfettanti chimici o agenti fisici) che comporta l’eliminazione di tutte le forme vegetative dei microrganismi patogeni e del maggior numero di microrganismi presenti in un ambiente o su di un substrato. Questa ha una bassa attività sulle spore batteriche; la riduzione della contaminazione da spore si ottiene soprattutto mediante l’azione meccanica e il risciacquo.
Nessun disinfettante è adeguatamente efficace se impiegato su materiali non preventivamente puliti. L’operazione di pulizia/detersione di superfici e ambienti è un’operazione preliminare e indispensabile alla successiva disinfezione [1].
I detergenti sono composti a base di tensioattivi (anionici, cationici, non ionici e anfoteri) e sostanze complementari quali acido etilendiamminotetraacetico (EDTA), enzimi, solventi organici etc. che facilitano la rimozione dello sporco dalle superfici.
I detergenti sono combinazioni di sostanze chimiche che aumentano l’azione pulente dell’acqua rimuovendo lo sporco dalle superfici senza rovinarle e senza causare danno a chi le usa.
Sono composti da agenti tensioattivi ed emulsionanti, agenti sequestranti e vari sali per il controllo del pH [2].
L’attività dei detergenti è condizionata da 4 fattori che costituiscono il cosiddetto cerchio fattoriale:
azione meccanica e abrasiva;
azione chimica;
tempo di azione;
temperatura.
In mancanza di uno dei quattro fattori, gli altri andranno rinforzati. I quattro fattori sono influenzati di volta in volta dal tipo di substrato, dal tipo di sporco e dalla durezza dell’acqua.
I detergenti oltre a essere efficaci devono sempre soddisfare le seguenti condizioni:
non devono mai intaccare le superfici da pulire;
devono essere atossici;
non devono emanare eccessive esalazioni, possibili cause di disagio per l’operatore;
non devono rappresentare un rischio per l’operatore;
devono assicurare il pH desiderato ed esercitare un effetto tampone;
devono essere eliminabili con il semplice risciacquo ed essere biodegradabili;
devono possedere un’eventuale azione biocida (se contengono un principio attivo battericida).
Per quanto riguarda il meccanismo d’azione i detergenti possono agire:
diminuendo la tensione superficiale;
ammorbidendo lo sporco o sciogliendolo (solvatazione);
aumentando la penetrazione negli interstizi tra superfici e sporco;
emulsionando olii e grassi;
disperdendo e inglobando lo sporco (solubilizzazione);
limitandone il ritorno;
facilitando l’azione del disinfettante successivo.
I detergenti sono classificabili come: detergenti a pH acido, basico e neutro [2].
I primi hanno un’azione disincrostante, i detergenti alcalini hanno un’azione principalmente sgrassante, quelli a pH neutro sono poco aggressivi e quindi adatti anche alle superfici più delicate.
I detergenti enzimatici sono composti che derivano dall’associazione di sostanze tensioattive ed enzimi proteolitici. Questi sono usati esclusivamente per il lavaggio dei ferri chirurgici e degli strumenti a fibre ottiche.
In funzione del loro impiego i detergenti possono essere:
detergenti fortemente alcalini: formulati a base di soda e/o potassa caustica da utilizzarsi per la rimozione dello sporco grasso, in particolare di quello alimentare; sono impiegati principalmente per la pulizia di pavimenti, superfici e attrezzature in acciaio;
detergenti manutentori: tutti i detergenti utilizzati per le operazioni di pulizia quotidiana generalmente caratterizzati dal fatto di non essere particolarmente aggressivi nei confronti delle varie superfici; ad esempio i prodotti pronti all’uso per la pulizia e la spolveratura degli ingombri e degli arredi;
deceranti: generalmente prodotti basici (pH 8-14) specifici per l’asportazione della cera metallica;
detergenti combinati con cere: anche denominati “lavaincera”. Sono formati da tensioattivi, da cere (e/o emulsioni) e da altri ingredienti che hanno il compito di combinare l’azione pulente con quella protettiva, conferendo un buon effetto estetico. Esistono due tipi di lavaincera: rilucidabili a base di cere lucidabili e autolucidanti a base di emulsione metallizzata;
detergenti neutri: caratterizzati dalla scarsa aggressività chimica sulle molecole dello sporco pur consentendo un ottimo livello di detersione senza lasciare residui. Generalmente per consentire un’azione sinergica si utilizzano in combinazione a sanitizzanti come per esempio sali di ammonio quaternari. Sono indicati per la pulizia di tutte le superfici dure: pavimenti, piastrelle, lavandini, ecc;
detergenti a base alcolica: caratterizzati dalla presenza di tensioattivi anionici, tensioattivi non ionici e alcoli. Sono utilizzati per esempio con sistema “trigger” con vaporizzatore per la rimozione delle impronte, per la pulizia di vetri e tutte le superfici lucidabili. Sono prodotti volatili per la presenza di alcoli che asciugano rapidamente e non lasciano aloni;
detergenti sgrassanti: caratterizzati da un pH alcalino, contrastano con la natura chimica acida delle sostanze grasse. Sono utilizzati per esempio con sistema “trigger” con vaporizzatore per sgrassare tutte le superfici dei sanitari, ceramiche, rubinetterie, superfici in acciaio inox, tavoli. Anche per i detergenti sgrassanti è frequente l’associazione con principi attivi ad azione battericida. Sono prodotti che non intaccano i metalli per cui vengono utilizzati anche su leghe leggere come l’alluminio;
detergenti acidi e disincrostanti: reagiscono con carbonati e ossidi di calcio, magnesio e ferro, presenti per esempio nello sporco di incrostazioni calcaree nelle toilette, sulle macchie di ruggine, sui residui di cemento, sulle macchie che si formano sul grés e cotto, su sporchi inorganici in genere, con cui formano i rispettivi sali che sono facilmente solubili in acqua e quindi facilmente risciacquabili. Esistono formulati preparati con diversi tipi di acidi. Tra gli acidi più utilizzati in campo ospedaliero troviamo: l’acido citrico e l’acido solfammico (acidi poco aggressivi) e l’acido fosforico. Esistono formulati per esempio a base di acido fosforico arricchiti con specifici agenti tamponanti (inibitori di corrosione e di volatilità) che rendono meno pericolosa l’azione dell’acido sulle superfici e rispetto agli operatori. In commercio vi sono formulazioni di disincrostanti acidi, utilizzati in particolare per sanitari, piastrelle e ceramiche contenenti tensioattivi ionici che possono tenere in sospensione le particelle di sporco disciolte e facilitarne l’asportazione con il successivo risciacquo;
detergenti disinfettanti: hanno nella loro composizione anche principi attivi disinfettanti come per esempio cloro attivo da ipoclorito di sodio. Il detergente con il principio attivo disinfettante consente, da una parte, di migliorare l’efficacia germicida aumentando il potere bagnante delle soluzioni, dall’altra di combinare in un’unica operazione disinfezione e detersione. Possono essere utilizzati, opportunamente diluiti, in campo ospedaliero (sale operatorie, ambulatori, sale d’aspetto, stanze di degenza, corsie, cucine e laboratori) e anche per la disinfezione di biancheria infetta.
Le modalità di azione dei detergenti sono riassumibili in tre momenti:
diminuire la tensione superficiale dell’acqua favorendone il contatto con lo sporco;
rimuovere lo sporco;
mantenere lo sporco in superficie evitando che si ridepositi sulle superfici.
I disinfettanti, non devono mai essere confusi con i detergenti che come tali non hanno azione battericida, ma solo pulente.
Un disinfettante è un composto chimico in grado di eliminare dopo trattamento i microrganismi presenti su materiale inerte con la sola eccezione di alcune spore batteriche. Il disinfettante “ideale” deve pertanto possedere funzione biocida ad ampio spettro, cioè la capacità di aggredire e uccidere gli agenti microbiologici contro i quali viene impiegato [2]. L’azione biocida può essere influenzata da numerosi fattori, tra i quali:
il substrato da cui si desidera eliminare il microrganismo;
la natura e le caratteristiche del microrganismo e la sua capacità di interagire con la sostanza disinfettante;
l’elevata carica microbica che riduce l’azione del disinfettante;
la concentrazione del principio attivo nel formulato e le diluizioni previste, che permettono l’efficacia di utilizzo ed evitano eventuali fenomeni di resistenza;
la temperatura, che se non corretta può interferire con l’efficacia del disinfettante;
il pH;
i coloranti aggiuntivi;
la durata dell’esposizione (tanto è maggiore, tanto superiore risulterà l’attività del disinfettante fino al raggiungimento del tempo massimo ottimale);
le forme del materiale da trattare;
la presenza di materiale organico;
l’utilizzo di acque dure per la diluizione del disinfettante;
la qualità del prodotto commerciale.
In generale un disinfettante deve avere i seguenti requisiti: un ampio spettro di azione, essere efficace in tempi rapidi e avere un’azione residua, capacità di agire anche in presenza di sostanze organiche (sangue, fluidi biologici, residui alimentari etc), non deve essere corrosivo, tossico ed essere di facile applicazione ed economico. Deve inoltre avere buona stabilità chimica, elevato potere di penetrazione e non indurre resistenze.
Requisiti complementari dei disinfettanti devono soddisfare le seguenti indicazioni: un’elevata capacità di applicazione, non causare fenomeni di irritazione, non alterare i materiali con cui vengono in contatto, devono poter essere miscelati con altri liquidi.
I disinfettanti chimici si dividono in: disinfettanti di alto livello (DAL), disinfettante di medio livello e disinfettante di basso livello [2]. Nella Tabella I sono riportati alcuni di questi.
I DAL sono classificati dalla Food and Drug Administration (FDA) come agenti disinfettanti/sterilizzanti per la loro attività contro i batteri in forma vegetativa, i virus (inclusi quelli non-rivestiti), i miceti e i micobatteri. Con tempi di contatto prolungati possono essere efficaci contro alcune spore batteriche. I DAL vengono utilizzati per disinfettare dispositivi sensibili al calore classificati come i dispositivi semicritici ad es. endoscopi flessibili, laringoscopi etc., secondo la classificazione di Spaulding. In ambito ospedaliero i DAL più utilizzati sono le aldeidi (glutaraldeide) e gli ossidanti (perossido di idrogeno e acido peracetico). Le aldeidi non sono corrosive e sono sicure per l’utilizzo sulla maggior parte dei dispositivi. Tuttavia, possono favorire l’adesione dei residui organici alla superficie, pertanto, è particolarmente importante rimuovere ogni residuo prima del processo di disinfezione. Se non adeguatamente formulati e non correttamente utilizzati, gli ossidanti possono essere corrosivi. Tuttavia possono avere azione più rapida, non fissativa e più sicura per l’ambiente rispetto alle aldeidi.
A seconda della temperatura, i DAL richiedono di solito dai 10 ai 45 minuti di contatto. Dopo la disinfezione, i dispositivi richiedono un lavaggio accurato con acqua sterile o microfiltrata per rimuovere qualsiasi sostanza chimica residua.
I disinfettanti di medio livello sono attivi contro i batteri in forma vegetativa, i micobatteri, i miceti e la maggior parte dei virus ma non sono efficaci sulle spore. Vengono approvati dell’Environmental Protection Agency (EPA) come disinfettanti ospedalieri se hanno un’azione tubercolicida. Questi disinfettanti vengono utilizzati per lo più nella pulizia di piani di lavoro (ad es. banconi di laboratorio).
I disinfettanti di basso livello (ad es. composti dell’ammonio quaternario) sono attivi contro i batteri in forma vegetativa (a eccezione dei micobatteri), alcuni miceti e solo alcuni virus. Questi vengono utilizzati la disinfezione di dispositivi non critici, in accordo alla classificazione di Spaulding, quali: termometri, stampelle per la deambulazione, carrozzine etc.
La disinfezione fisica mediante raggi ultravioletti (UV), prodotti da speciali lampade, ha un forte effetto germicida. Può essere utilizzata per sterilizzare l’aria di ambienti delimitati (sale operatorie, laboratori farmaceutici, cappe biologiche, impianti di depurazione ecc.). L’effetto germicida delle radiazioni UV si estende a batteri, virus, spore, funghi muffe e acari; esso è dovuto soprattutto all’effetto distruttivo esercitato dalle radiazioni sul DNA dei microrganismi. I raggi UV hanno un potere di penetrazione, comunque, molto modesto (non passano per esempio attraverso il vetro) per cui agiscono solo su superfici esposte.
In merito agli aspetti normativi, per i detergenti l’aspetto da considerare è l’indice di biodegradabilità che esprime la capacità di un composto chimico di decomporsi per mezzo di batteri ossia il tempo che la natura impiega a smaltire i nostri rifiuti. La biodegradabilità riguarda i tensioattivi contenuti nel detergente ed è disciplinata da appositi regolamenti comunitari come il Regolamento 648/04/CEE e successivi aggiornamenti.
La biodegradabilità è [3]:
di tipo primario: modifica strutturale di un tensioattivo da parte di microrganismi che ne provocano la perdita delle proprietà tensioattive a causa della degradazione della sostanza madre;
aerobica completa: il livello di biodegradazione ottenuto quando un tensioattivo viene eliminato completamente dai microrganismi in presenza di ossigeno che ne provocano la scomposizione in biossido di carbonio, acqua e sali minerali (mineralizzazione).
La biodegradabilità primaria è misurata dalla determinazione del livello residuo di tensioattivi originale in soluzioni biodegradate e si considera soddisfacente a un livello minimo dell’80% misurato secondo la metodologia accettata dal regolamento vigente. La biodegradabilità del tensioattivo si considera soddisfacente se il livello di biodegradabilità (mineralizzazione) è almeno del 60% entro un termine di 28 giorni.
Tra i detergenti al momento in commercio sono da considerarsi di buon livello quelli che hanno una biodegradabilità primaria di oltre il 90% [2].
Gli aspetti normativi in materia di disinfezione riguardano i mezzi chimici ad azione biocida e sono redatti nel Regolamento (UE) n. 528/2012 Biocidi (BPR) [4]. Tale regolamento è volto a migliorare la libera circolazione dei biocidi all’interno dell’Unione, assicurando nel contempo un livello elevato di tutela sia della salute umana e animale sia dell’ambiente. Il regolamento inoltre disciplina la creazione, a livello di UE, di un elenco di principi attivi utilizzabili nei biocidi, l’autorizzazione all’immissione sul mercato dei prodotti biocidi, il riconoscimento reciproco delle autorizzazioni all’interno della UE. L’autorizzazione viene rilasciata dalla Commissione Europea oppure, come si verifica più frequentemente, dal Ministero della Salute, previa valutazione tecnico-scientifica dei dossier da parte dell’Istituto Superiore di Sanità (ISS). Per la disinfezione umana e per quella delle superfici il BPR identifica due distinte tipologie di prodotti (Product Type, PT):
PT1 per l’igiene umana: la tipologia di prodotto PT1 include tutti quei “prodotti applicati sulla pelle o il cuoio capelluto, o a contatto con essi, allo scopo principale di disinfettare la pelle o il cuoio capelluto”;
PT2 per i prodotti destinati alla disinfezione delle superfici: la tipologia di prodotto PT2 comprende i “prodotti disinfettanti non destinati all’applicazione diretta sull’uomo o sugli animali”.
Il BPR identifica anche altri tipi di disinfettanti quali quelli per l’igiene veterinaria (PT3), per le superfici a contatto con gli alimenti (PT4) e per le acque potabili (PT5).
Ciascun prodotto, per essere commercializzato, deve avere avuto la registrazione/autorizzazione come PMC/biocida da parte dell’Autorità competente e deve riportare in etichetta il numero di registrazione/autorizzazione.
I principi attivi maggiormente utilizzati nei prodotti disinfettanti autorizzati a livello nazionale (Presidi Medico Chirurgici; PMC) ed Europeo (biocidi), sono: l’etanolo, i sali di ammonio quaternario (ad es. cloruro di didecil dimetilammonio, DDAC, cloruro di alchil dimetilbenzilammonio, ADBAC), il perossido d’idrogeno, il sodio ipoclorito e altri principi attivi. Le concentrazioni da utilizzare e i tempi di contatto da rispettare per ottenere una efficace azione disinfettante sono dichiarati sull’etichetta apposta sui prodotti disinfettanti stessi, sotto la responsabilità del produttore.
A seguito dell’attuale emergenza da SARS-CoV-2, l’ISS ha emanato delle raccomandazioni specifiche riguardo la tipologia e l’efficacia dei principi attivi maggiormente utilizzati nei prodotti disinfettanti il cui utilizzo è autorizzato nella sanificazione delle superfici [5-8].
In accordo a quanto indicato dall’Organizzazione Mondiale della Sanità (OMS) [9], l’ISS raccomanda l’utilizzo dei seguenti disinfettanti:
alcol etilico 70% o altro disinfettante a provata attività virucida saggiata in accordo con la norma ISO EN 14476 per gli strumenti e i dispositivi medici;
detersione con acqua e detergente comune seguita da disinfezione con ipoclorito di sodio a 0,1% di cloro attivo per i pavimenti;
detersione con acqua e detergente comune seguita da disinfezione con ipoclorito di sodio a 0,5% di cloro libero per le superfici ad alta frequenza di contatto (sponde del letto, comodini, piani di appoggio, maniglie, pulsantiere, tutte le superfici dei bagni).
In alternativa possono essere impiegati perossido di idrogeno allo 0,5% o altro disinfettante a provata attività virucida saggiata in accordo con la norma ISO EN 14476.
Poiché le indicazioni si basano sulle evidenze scientifiche a oggi disponibili in letteratura, soggette a continui aggiornamenti, prendendo in rassegna le recenti informazioni evidence based, l’ISS ha concluso che anche altri metodi possono essere efficaci nelle attività di sanificazione, tra queste, l’ozonizzazione può rappresentare una valida tecnologia per l’inattivazione dei virus in fomiti e/o sospesi nell’aria, ivi incluso il virus SARS-CoV-2.
Questa procedura si basa sull’uso di ozono generato in situ a partire da ossigeno il quale rappresenta un principio attivo ad azione “biocida” in revisione ai sensi del BPR come disinfettante per le superfici (PT2 e PT4) e dell’acqua potabile (PT5) e per impiego nelle torri di raffreddamento degli impianti industriali (PT11). Sebbene la valutazione non sia stata completata, è disponibile un’ampia base di dati che ne conferma l’efficacia microbiocida anche sui virus. In attesa dell’autorizzazione a livello europeo, la commercializzazione dell’ozono in Italia come PMC con un claim “disinfettante” non è consentita data l’impossibilità (generazione in situ – produzione fuori officina) di individuare un sito specifico da autorizzare come previsto dalla normativa nazionale. Pertanto, in questa fase, l’ozono può essere considerato un “sanitizzante”.
Come nel caso dell’ozono, il trattamento mediante Cloro attivo non può vantare azione “disinfettante” (DPR n. 392/98) fino all’inclusione della sostanza fra i principi attivi biocidi autorizzati, trattandosi di una generazione in situ (produzione fuori officina) e non potendo essere autorizzato come PMC a livello nazionale. Può comunque essere presente sul mercato nazionale in libera vendita con un claim di azione “sanitizzante”.
Per quanto riguarda la disinfezione con mezzi fisici, dal punto di vista normativo, si fa presente che, poiché l’attività disinfettante della radiazione ultravioletta, si attua mediante un’azione di natura fisica, i sistemi di disinfezione basati su UV-C non ricadono nel campo di applicazione del Regolamento (UE) n. 528/2012 Biocidi (BPR) [4] che esclude espressamente dalla definizione di biocida, i prodotti che agiscano mediante azione fisica e meccanica. Anche a livello nazionale non rientrano, secondo il DPR 6 ottobre 1998, n. 392 sui PMC, i prodotti la cui attività disinfettante operi mediante azione fisica o meccanica.
Gli ospedali sono gli ambienti che maggiormente necessitano dell’utilizzo di idonei e adeguati processi di sanificazione per poter garantire la salvaguardia dei degenti, degli operatori sanitari e di tutti coloro che, numerosi, ogni giorno vi si rivolgono. Infatti, il Ministero della Sanità con la Circolare n. 52/1985, “lotta contro le malattie nosocomiali”, ha dato delle indicazioni sulla sanificazione ambientale finalizzate a garantire la sicurezza igienica degli ospedali. In base a consolidate evidenze sperimentali, la sanificazione degli ambienti e le modalità di utilizzo dei prodotti sanificanti sono raccomandate in tutte le linee guida internazionali e nazionali.
È ormai certo che, nei casi di endemia ospedaliera, se non si interviene anche sull’ambiente, difficilmente si riuscirà a risolvere la problematica. La sanificazione rappresenta, pertanto, una importante procedura utile a prevenire e contenere gli eventi infettivi.
Gli interventi di sanificazione sono stabiliti sulla base del rischio. L’ospedale è in genere diviso in differenti aree di rischio infettivo: alto, medio e basso rischio [2, 3].
Le aree ad alto rischio sono ambienti che necessitano di bassa carica microbica dove vengono eseguite procedure altamente invasive (ad es. Blocchi Operatori) e/o manipolazione di materiali critici (ad es. Unità Farmaci Antiblastici). Tra le aree ad alto rischio vi sono anche quegli ambienti in cui vengono effettuate procedure assistenziali ad alta intensità e complessità di cura, degenze con pazienti immunocompromessi o infetti (ad es. camere di isolamento, reparti oncologici, terapie intensive etc.).
In queste zone gli interventi di sanificazione devono essere eseguiti sulla base di procedure stabilite da norme sanitarie o da requisiti di accreditamento a esse conformi nonché sulla base di specifiche procedure ospedaliere interne che indichino mansioni, addetti e responsabili, ed eseguite da operatori dedicati e opportunamente formati.
Nelle aree a medio rischio vengono svolti processi di diagnosi e cura a pazienti non particolarmente a rischio (ad es. aree di degenza ordinarie, day hospital, medicherie, le strutture per diagnosi strumentali).
Le aree a basso rischio comprendo aree comuni, studi medici, segreterie, spogliatoi, bagni e antibagni riservati al personale e visitatori, corridoi etc.
Le operazioni di pulizia si possono suddividere come [2]:
pulizie ordinarie: comprendono attività di pulizia di carattere continuativo e routinario;
pulizie periodiche: comprendono attività di pulizia più profonda a periodicità più lunga da svolgersi con frequenze prestabilite;
pulizie straordinarie: comprendono interventi imprevedibili richiesti per esigenze occasionali che possono comprendere attività di tipo quotidiano e periodico.
Ogni struttura ospedaliera dovrebbe redigere specifiche procedure di sanificazione evidence-based ovvero basate sull’evidenza scientifica, su linee guida e, se presente, sulla normativa vigente. Queste procedure devono specificare la frequenza degli interventi di sanificazione (ad es. pulizia della sala operatoria dopo ogni intervento chirurgico), il tipo di detergenti e di disinfettanti da utilizzare, la concentrazione e il tempo di contatto dei disinfettanti per assicurare l’efficacia della loro azione e infine le modalità con cui gli interventi di pulizia devono essere effettuati (ad es. dalle zone più pulite verso le zone più sporche), per ciascuna tipologia di area di rischio.
Per quanto riguarda il controllo ambientale delle infezioni nelle strutture sanitarie, a livello internazionale, indicazioni tecniche utili ai fini della predisposizione di piani di monitoraggio ambientale sono presenti nelle Linee guida dei Centers for Disease Control and Prevention (CDC, 2003).
Di seguito si riportano, in particolare, così come descritte nel documento suddetto, alcune indicazioni di carattere generale per la progettazione di un corretto piano di campionamento su superfici ambientali.
Preliminarmente al campionamento, è necessario: acquisire informazioni di background in materia, consultando la letteratura scientifica e, in particolare, i risultati di eventuali studi epidemiologici condotti nel campo; localizzare opportunamente nell’ambiente la superficie da sottoporre a monitoraggio; selezionare le tecniche più appropriate di campionamento (qualitativo e/o quantitativo) e analisi dei campioni (da cui dipende la significatività dei risultati), il numero dei campioni da raccogliere, la necessità di repliche e di eventuali “campioni di controllo” o di comparazione adeguatamente prelevati (per poter escludere la presenza di contaminanti estranei) e i parametri microbiologici da analizzare; disporre in anticipo di una stima del numero massimo o del tipo di microrganismo accettabili e di un piano di azioni correttive.
Il campionamento di superfici può essere condotto a scopo di ricerca o come parte di una indagine epidemiologica (per verificare se la superficie rappresenta un potenziale serbatoio di patogeni o una fonte di contaminazione o per analizzare la sopravvivenza dei microrganismi sulla superficie stessa) oppure come controllo di routine per l’assicurazione di qualità. Se il campionamento è condotto come parte di uno studio epidemiologico, in caso di epidemie, è preferibile l’isolamento microbico a livello di specie e la caratterizzazione oltre il livello di specie.
L’efficacia del campionamento richiede la presenza di umidità, ottenuta, se non presente sulla superficie, tramite umidificazione del dispositivo di prelievo (ad es. tampone imbevuto con soluzione fisiologica) – e l’utilizzo di neutralizzanti nel diluente o nel mezzo di coltura – se si sospetta la presenza di residui di disinfettanti.
Una superficie che non ha prodotto crescite microbiche non rappresenta una superficie sterile: bisogna, infatti, considerare il livello di sensibilità del metodo adottato.
La sanificazione degli ambienti e le modalità di utilizzo dei prodotti sanificanti sono raccomandate in tutte le linee guida internazionali e nazionali.
Tuttavia le normali procedure di disinfezione lasciano sulle superfici trattate materia organica, carboidrati e proteine in grado di sostenere una veloce ricolonizzazione. Se pur sanificata si ottiene una “superficie libera” con sufficienti nutrienti, che possono essere utilizzati anche da un solo potenziale patogeno per avviare una veloce ricolonizzazione in un periodo di tempo molto limitato (un solo microrganismo è in grado di moltiplicarsi per dare vita a una popolazione di un milione di cellule entro 8 ore). Proprio a causa della persistente contaminazione delle superfici ospedaliere e del loro ruolo nella possibile trasmissione di patogeni, sono stati proposti e studiati diversi metodi per migliorare la pulizia e la disinfezione delle superfici.
Generalmente, la maggior parte delle tecniche proposte si è basata sull’uso di composti chimici, i quali provocano un impatto ambientale non trascurabile, inoltre, benché le procedure convenzionali siano efficaci nell’abbattimento a breve termine della maggior parte dei patogeni, esse non sono in grado di prevenire i fenomeni di ricontaminazione. Molti dei patogeni clinicamente rilevanti correlati alle Infezione Correlate all’Assistenza (ICA) sono multiresistenti e l’uso di prodotti chimici potrebbe esacerbare tale aspetto inducendo ulteriori resistenze negli organismi oggetto delle procedure di pulizia/disinfezione. Per queste ragioni, data la recente e rapida diffusione di patogeni multiresistenti nelle strutture sanitarie, esiste un bisogno urgente di trovare alternative ai prodotti di disinfezione chimici impiegati oggi, che siano efficaci ed economicamente sostenibili.
Elenco (non esaustivo) dei disinfettanti e relativa attività [2].

|
Attualmente, l’inquinamento ambientale e l’antimicrobico resistenza (AMR) sono due tra i maggiori problemi a livello mondiale.
Secondo i dati dell’ECDC ogni anno in Europa almeno 4 milioni di persone sono colpite da infezioni antibiotico-resistenti, causando oltre 40.000 decessi, di cui 10.000 soltanto in Italia [1]. L’Organizzazione Mondiale della Sanità (OMS) stima almeno 10.000 milioni di morti entro il 2050, se non verranno messe in atto contromisure efficaci per contenere il fenomeno [2].
Ciò è particolarmente importante per quanto riguarda le infezioni contratte in ambiente ospedaliero, in quanto in tale ambiente i microrganismi contaminanti sono costantemente a contatto con composti antimicrobici e sviluppano conseguentemente le maggiori resistenze.
È noto, infatti, che gli ambienti costruiti e confinati (incluso quello ospedaliero) possono essere considerati come super-organismi, dotati di un loro proprio microbioma, e che all’aumento del grado di confinamento dell’ambiente, corrisponde una minore biodiversità del microbioma (che diventa essenzialmente di origine antropica) e una maggiore resistenza dei microrganismi persistenti [3-5].
Il microbioma ospedaliero rappresenta il reservoir dei microrganismi responsabili dell’insorgenza delle infezioni associate all’assistenza (ICA), e l’elevata pressione selettiva esercitata dal continuo e massiccio uso dei disinfettanti e farmaci, seleziona specie patogene dotate di AMR. Il fenomeno è diventato un problema globale e in continua allarmante crescita, tanto che in una recente nota l’OMS ha sottolineato che il massiccio uso di disinfettanti utilizzati per la gestione dell’emergenza pandemica da SARS-CoV-2 potrebbe aumentare il rischio di una futura pandemia da AMR [2].
Poiché il controllo della contaminazione microbica, soprattutto in ambito ospedaliero, è essenziale, fino a ora questo è stato affrontato mediante uso di disinfettanti chimici (alcool, ipoclorito di sodio, composti dell’ammonio quaternario), che tuttavia mostrano alcune importanti limitazioni quali:
non prevengono la ricontaminazione, che avviene in modo continuo a causa della dispersione di microrganismi da parte delle persone che frequentano gli ambienti;
hanno un elevato impatto ambientale;
possono favorire l’ulteriore comparsa e selezione di AMR [6, 7], contribuendo, potenzialmente, in modo significativo al peggioramento del problema.
Il sistema di sanificazione PCHS (Probiotic Cleaning Hygiene System), al contrario, non contiene disinfettanti, ma si basa su detergenti ecosostenibili (fully ecolabelled) contenenti selezionate spore di batteri probiotici appartenenti al genere Bacillus.
A eccezione di due specie note (B. anthracis e B. cereus), i batteri appartenenti a tale genere sono apatogeni per l’uomo, e classificati nel gruppo di rischio 1 dall’EFSA [8-10].
I batteri apatogeni del genere Bacillus sono ubiquitari, essendo normali colonizzatori del suolo, delle acque e anche dell’organismo umano (dove sono frequentemente presenti a livello intestinale).
Tutti i batteri di tale genere sono sporigeni, in grado cioè di produrre endospore come forme di resistenza in condizioni ambientali avverse. Tali spore sono forme dormienti estremamente resistenti, utilizzate dai batteri per sopravvivere ad agenti fisico-chimici anche estremi, e pertanto ben si prestano a essere utilizzate in detergenti concentrati, dove le forme vitali vegetative perderebbero rapidamente la vitalità.
Le spore di numerose specie appartenenti al genere Bacillus sono state negli anni comunemente utilizzate in modo sicuro per competere con microrganismi patogeni o ripristinare le idonee condizioni di equilibrio del microbiota sano, sia in ambito umano (ad es. per la preparazione di cibi [11] oppure come probiotici intestinali quali Enterogermina che contiene spore di Bacillus clausii [12]), che in ambito zootecnico e agricolo [13, 14] (Fig. 1).
Usi delle spore di Bacillus.
Il meccanismo di azione del PCHS si basa sulla capacità delle spore di Bacillus di germinare sulle superfici sanificate con il prodotto diluito in acqua (condizione che permette appunto la germinazione delle spore): le cellule batteriche vegetative così generate sono in grado di competere efficacemente con gli altri microrganismi presenti, sottraendo loro spazio e nutrienti, e quindi gradualmente spiazzandoli e rimpiazzandoli sulle superfici trattate [15]. Contemporaneamente, le specie di Bacillus contenute nel PCHS producono sostanze antimicrobiche in grado di ridurre fino al 90% la crescita di batteri e funghi [15], limitandone fortemente la diffusione. Inoltre, i Bacillus del PCHS producono una serie di sostanze ad azione enzimatica in grado di degradare e rimuovere proteine e lipidi e in generale lo sporco organico [16].
Ciò consente una graduale riduzione di microrganismi indesiderati sulle superfici trattate, con un contemporaneo incremento di batteri del genere Bacillus, che mantengono nel tempo l’equilibrio raggiunto, portando a una rimodulazione stabile del microbiota sulle superfici trattate [17, 18].
Tale rimodulazione è stabile nel tempo e porta alla riduzione del potenziale infettivo associato alla presenza di microrganismi pericolosi per la salute dell’uomo negli ambienti sanificati [19]. Questo aspetto risulta particolarmente importante in ambiente ospedaliero, in quanto in grado di abbassare il rischio infettivo per i pazienti ospedalizzati.
I ceppi di Bacillus presenti nel PCHS sono stati analizzati per la presenza di plasmidi coniugativi, che potrebbero potenzialmente portare a scambio genico con altri microrganismi e che sono stati trovati assenti; recentemente, i Bacillus del PCHS sono stati completamente sequenziati, ed è stata confermata l’assenza di plasmidi coniugativi (dati non ancora pubblicati).
I Bacillus del PCHS sono stati altresì analizzati per la presenza di geni codificanti AMR, mediante analisi in microarray in real time PCR in grado di evidenziare simultaneamente 87 diversi geni per resistenza (Qiagen, Resistance genes), mostrando la sola presenza costante di un gene cromosomico non trasferibile mediante meccanismi di scambio genico (msrA), codificante la resistenza ai macrolidi.
Gli studi sono stati condotti essenzialmente presso l’Università di Ferrara. I test sono stati condotti in vitro su diversi ceppi di batteri Gram-positivi, Gram-negativi e funghi potenzialmente patogeni per l’uomo [15, 20].
In particolare, sono stati utilizzati:
S. aureus (Gram-positivo);
S. pyogenes(Gram-positivo);
E. coli (Gram-negativo);
P. aeruginosa (Gram-negativo);
Proteus (Gram-negativo);
Enterobacter cloacae (Gram-negativo);
Serratia marcescens (Gram-negativo);
C. albicans (micete lievitiforme).
Sono stati effettuati test di crescita competitiva in saggi di co-coltivazione, che hanno dimostrato una capacità inibitoria della crescita dei batteri Gram-positivi, Gram-negativi a dei miceti fino al 99% rispetto ai controlli non co-coltivati con Bacillus [15] (Fig. 2).
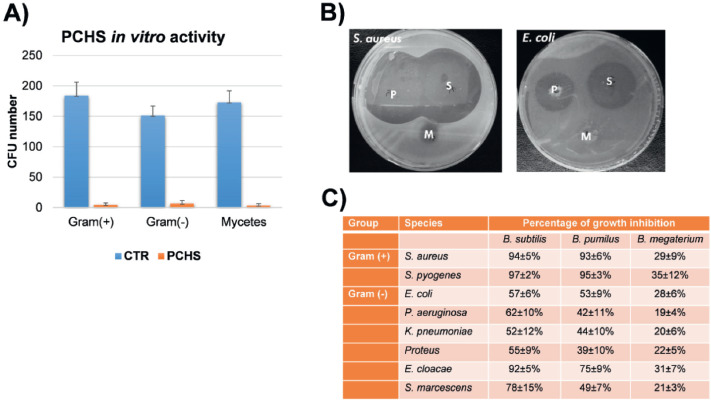
Efficacia del PCHS in vitro. A) Inibizione della crescita di batteri Gram-positivi (S. aureus), Gram-negativi (E. coli) e miceti (C. albicans). B) Stab overlay assay per la dimostrazione della produzione di batteriocine da parte dei Bacillus del PCHS. C) Inibizione della crescita dei microrganismi indicati da parte dei composti antibatterici rilasciati dai Bacillus del PCHS.
È stata inoltre testata la capacità dei ceppi di Bacillus del PCHS di produrre composti antimicrobici in grado di ridurre la crescita dei microrganismi target, mostrando una riduzione fino al 97%, sia in saggi di semina su piastra (stab overlay assay) che in saggi di crescita in terreno condizionato (suspension assay) [15].
I Bacillus del PCHS sono stati anche caratterizzati per la loro azione enzimatica, responsabile della rimozione dei composti organici e della parziale o totale inattivazione di alcuni microrganismi, mediante saggi API-ZYM system (BioMérieux, Firenze, Italia), mostrando la capacità di sintetizzare e liberare i seguenti enzimi [16]:
Alkaline phosphatase;
esterase;
esterase lipase;
leucine arylamidase;
valine arylamidase;
α-chimotrypsin;
acid phosphatase;
naphtol-phosphohydrolase;
α-galactosidase;
β-galactosidase;
α-glucosidase;
β-glucosidase;
N-acetyl-β-glucosamidase;
α-mannosidase.
Infine, in vitro è stata valutata anche la azione antivirale del PCHS, utilizzando come bersagli i seguenti virus dotati di inviluppo pericapsidico, tra cui il virus pandemico SARS-CoV-2 [16]:
modified Vaccinia virus Ankara (MVA), ATCC VR-1508;
herpes simplex virus type 1 (HSV-1), ATCC VR-260
human alpha-coronavirus 229E (hCoV-229E), ATCC VR-740;
human beta-coronavirus SARS-CoV-2;
human H3N2 influenza virus 2 A/Wisconsin/67/2005;
avian H10N1 influenza virus 2 A/mallard/Italy/4518/2012;
swine H1N2 influenza virus 2 A/swine/Italy/4159/2006.
I test sono stati condotti sia in saggi in sospensione che su superficie, secondo le rispettive normative UNI EN 14476:2019 e UNI EN 16777:2019.
Pur non essendo un disinfettante, in quanto non in grado di ridurre il titolo iniziale dei virus testati > 4 log (-99,99%) entro 1 ora come richiesto dalle sopra indicate normative, i risultati hanno mostrato una attività antivirale del PCHS nei confronti di tutti i virus testati, con inattivazione > 4 Log rispetto al titolo iniziale (-99,99%) ma 1-2 ore di tempo di contatto a temperatura ambiente [16].
Da notare che mentre i disinfettanti comuni utilizzati come controllo (etanolo, ipoclorito di sodio) hanno mostrato di perdere attività entro un massimo di 2 ore dal trattamento delle superfici, il PCHS si è mostrato in grado di mantenere le superfici decontaminate fino a 24 ore dopo il trattamento (Fig. 3) [16].
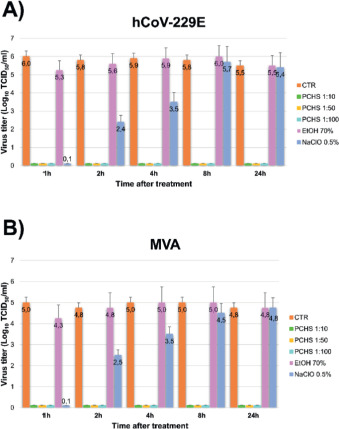
Mantenimento della azione antivirale del PCHS nel tempo. hCoV-229E (human alpha coronavirus), MVA (modified Vaccina virus Ankara).
Il PCHS è stato testato su campo in diversi settings ospedalieri in Italia e all’estero, coinvolgendo diverse Università (Ferrara, Udine, Pavia, Messina, Roma, Trieste) e portando alla pubblicazione di numerosi lavori scientifici.
In generale, gli scopi degli studi effettuati comprendevano:
verificare l’abbattimento dei patogeni sulle superfici trattate, analogamente a quanto osservato in vitro;
verificare la stabilità dell’abbattimento dei patogeni sulle superfici trattate (prevenzione dei fenomeni di ricontaminazione);
verificare l’assenza di selezione di ceppi resistenti;
verificare l’assenza di rischio di scambio genico con i patogeni circostanti;
verificare l’assenza di rischio infettivo per i pazienti ospedalizzati;
verificare l’impatto sulla incidenza delle infezioni ospedaliere;
verificare l’impatto sui consumi di farmaci antimicrobici legati a ICA.
Nel complesso, gli studi sono iniziati a partire dal 2010 e sono poi stati pubblicati a partire dal 2014 su riviste peer-reviewed di rilevanza internazionale con impact factor.
Sono stati arruolati almeno 10 ospedali pubblici e privati Italiani e 1 ospedale in Belgio.
Gli studi sono stati condotti essenzialmente nei reparti di medicina interna per adulti, per periodi di tempo da 2 a 18 mesi [17-19]. Uno studio è stato invece effettuato nel reparto di Pronto Soccorso di un ospedale pediatrico durante il periodo pandemico COVID-19 [21].
Gli studi sono stati di tipo pre-post negli stessi reparti, oppure di tipo caso-controllo in reparti paralleli con caratteristiche sovrapponibili.
Sono stati coinvolti ospedali con caratteristiche diverse (numero di posti letto, collocazione geografica) e in momenti stagionali diversi, nel tentativo di limitare gli eventuali bias legati a tali fattori.
In tutti i test su campo sono state mantenute tutte le usuali misure per il contenimento del rischio infettivo usualmente praticate, senza variare nulla a eccezione della introduzione del sistema PCHS in sostituzione del sistema convenzionale.
Tutti gli studi, indipendentemente dalla sede e dal periodo in cui sono stati svolti, hanno mostrato una generale e omogenea conferma dei dati ottenuti in vitro sulla capacità inibitoria della diffusione dei microrganismi potenzialmente patogeni.
Le analisi microbiologiche sono state condotte sia mediante tecniche convenzionali (misurazione delle CFU/m2 attraverso metodi colturali) che mediante metodologie molecolari volte a identificare e quantificare la popolazione microbica (real-time PCR microarray, NGS) che il resistoma della popolazione microbica (real-time PCR microarray).
Negli studi volti a valutare l’impatto della romodulazione microbica ambientale sulla frequenza di infezioni ospedaliere (ICA), sono state valutate simultaneamente e in continuum sia la contaminazione microbica ambientale (bioburden) che l’incidenza delle ICA [19, 22].
Nel complesso, i risultati di tutti gli studi condotti hanno mostrato che la sostituzione dei sistemi di sanificazione convenzionali con il PCHS si associa a (Fig. 4):
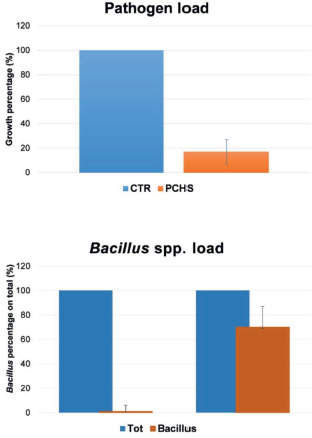
Diminuzione del carico di patogeni del gruppo ESKAPE (pannello superiore) e contemporaneo incremento dei Bacillus del PCHS (pannello inferiore) sulle superfici trattate.
riduzione stabile dei patogeni del gruppo ESKAPE (Escherichia, Staphylococcus, Klebsiella, Acinetobacter, Pseudomonas, Enterococcus) in tutti i setting trattati, fino al 85% in più rispetto a quanto osservato con i detergenti/disinfettanti convenzionali [17-19]; i risultati sono stati confermati in uno studio effettuato dall’Università di Messina [23];
aumento di Bacillus nella popolazione residente sulle superfici trattate, fino a rappresentare > 70% di tutta la popolazione, rispetto a quanto osservato durante la sanificazione convenzionale [17, 19];
riduzione fino a 3 Log di tutte le resistenze geniche presenti nella popolazione contaminante prima dell’implementazione del PCHS (Fig. 5) [19, 22, 24]; uno studio effettuato dal Charitè di Berlino ha confermato la capacità dei detergenti probiotici di indurre una significativa diminuzione dei geni codificanti AMR rispetto ai detergenti e disinfettanti convenzionali [25].

Diminuzione della presenza di ARG (Antibiotic Resistance Genes) nella popolazione microbica prima e dopo l’introduzione del PCHS come sistema di cleaning.
Negli studi in cui è stata valutata l’incidenza di ICA e il consumo di antimicrobici ICA-associato si è inoltre dimostrata:
riduzione di circa il 50% delle ICA nel periodo di osservazione (Fig. 6) [19], confermata anche dopo matching di tutti i pazienti ospedalizzati nel periodo di osservazione [22];
riduzione pari a circa il 60% del consumo di farmaci antimicrobici nel periodo di introduzione del PCHS rispetto a quello di controllo con uso di sanificazione convenzionale [19, 22, 24];
riduzione del 79% circa del costo legato alle terapie ICA [19, 22, 24].
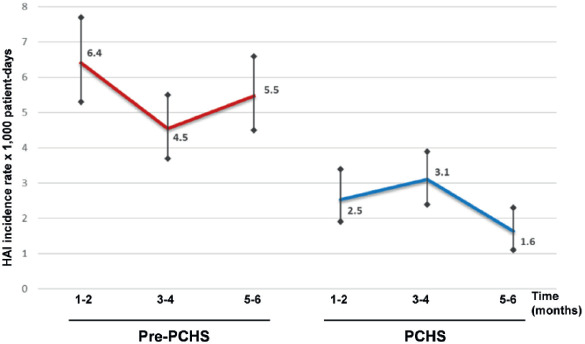
Diminuzione dell’incidenza di ICA a seguito dell’introduzione del PCHS come sistema di cleaning.
Infine, in uno studio effettuato nel reparto di Pronto Soccorso durante la pandemia COVID-19, si è anche osservata una efficace azione anti-SARS-CoV-2 del PCHS, come dimostrato dall’assenza di virus nei reparti trattati, pur in documentata presenza di soggetti infetti [21].
Recentemente il sistema è anche stato applicato come metodo di sanificazione dei mezzi pubblici durante il periodo pandemico, sui treni della metropolitana di Milano ATM, confermando la sua capacità di abbattere la presenza di patogeni e dei loro geni di resistenza con un’efficacia > 85%, e contemporaneamente la efficacia anti-SARS-CoV-2, rispetto alla igienizzazione convenzionale effettuata mediante cloro e alcool (dati non ancora pubblicati).
Ciò suggerisce un possibile impiego del sistema PCHS esteso ad ambienti non sanitari in cui sia necessaria una sanificazione stabile.
Dal punto di vista della sicurezza d’uso, i Bacillus del PCHS sono considerati patogeni nell’uomo (Risk Class = 1, EFSA) [9], e hanno una lunga storia di utilizzo sicuro nell’uomo senza manifestazioni di eventi avversi.
Sono infatti regolarmente utilizzati come integratori alimentari per il riequilibrio del microbiota intestinale, come additivi per la preparazione di cibi fermentati, come integratori in zootecnia e come fortificanti e fungicidi in agricoltura [15].
Numerosi studi hanno verificato l’assenza di rischio per quanto riguarda l’uso di probiotici appartenenti al genere Bacillus nell’uomo [26-28].
Presso l’Università di Ferrara sono inoltre stati effettuati specifici studi in vitro, volti a verificare nei Bacillus del PCHS l’assenza di:
resistenze ad antibiotico multiple e trasferibili;
plasmidi coniugativi in grado di trasferire caratteri di resistenza ai batteri circostanti.
I risultati delle analisi effettuate mediante real-time PCR microarray sui ceppi di Bacillus inclusi nel PCHS hanno mostrato la presenza comune in tutti i ceppi del gene cromosomico non trasferibile msrA (che conferisce la resistenza a macrolidi), la presenza meno frequente di pochi altri geni cromosomici non trasferibili codficanti resistenza a eritromicina e oxacilline (ermC, OXA51, AAC(6), SFC-1), e l’assenza di multiresistenza plasmidica [17, 19].
Oltre agli studi in vitro, lo stesso tipo di analisi effettuata su oltre 300 ceppi di Bacillus da PCHS, isolati dalle superfici trattate in circa 10 anni di applicazione, ha mostrato totale assenza di acquisizione di nuovi geni di resistenza da parte dei Bacillus nonostante il continuo contatto con patogeni multiresistenti sulle superfici trattate, evidenziando una elevata stabilità genetica dei Bacillus del PCHS [17-19].
Su campo, inoltre, in tutti gli studi è stata implementata in tutti i centri arruolati una sorveglianza microbiologica identificando i Bacillus come microrganismi “alert”, in modo da monitorare costantemente la presenza di eventi di infezione accidentale causata da Bacillus del PCHS o la loro eventuale presenza in campioni clinici (sangue, urine) come testimonianza di diffusione sistemica di tali batteri nei pazienti ospedalizzati con o senza ICA. I risultati di oltre 10 anni di osservazioni hanno mostrato la totale assenza di infezioni causate da Bacillus del PCHS nei pazienti ospedalizzati. In uno studio pubblicato nel 2016, su > 32.000 campioni clinici analizzati (corrispondenti a circa 90.000 pazienti e 800.000 giorni di ospedalizzazione) nessun campione è stato trovato positivo per la presenza di Bacillus del PCHS, né con metodi microbiologici né con metodi molecolari più sensibili [29].
La sorveglianza microbiologia viene comunque tuttora implementata in modo automatico e continuo in ogni centro che introduce il sistema di sanificazione PCHS, e nessun evento avverso è mai stato registrato.
È inoltre tuttora in corso l’analisi mediante NGS dell’intero resistoma e viruloma dei Bacillus del PCHS (in collaborazione con Sanger Institute, London, UK), inclusi gli isolati da superfici ospedaliere, per verificare e confermare con tale metodo di indagine la stabilità genetica dei Bacillus utilizzati nel PCHS.
Rispetto ai sistemi di cleaning e disinfezione convenzionali, basati sull’utilizzo di composti chimici, il PCHS mostra i seguenti importanti vantaggi:
basso livello ambientale (ecolabel);
effetto decontaminante stabile nel tempo: azione stabile anche antivirale fino a 24 ore;
prevenzione dei fenomeni di ricontaminazione;
nessuna selezione o induzione di antibiotico-resistenza;
riduzione dei patogeni dotati di AMR fino al 99,9%.
Queste caratteristiche si associano a:
riduzione dell’incidenza di ICA;
riduzione del consumo di farmaci antimicrobici;
riduzione della spesa correlata alla necessità di uso di farmaci antimicrobici.
Queste caratteristiche rendono il sistema particolarmente utile nella lotta all’AMR, anche alla luce dei parametri di riduzione previsti dal PNCAR.
La Tabella I sintetizza i principali risultati degli studi condotti sul PCHS.
Risultati dei principali studi condotti sul PCHS.
| Primo Autore, Anno [ref] | Titolo | Disegno di studio | Setting/Target | Durata dello studio | Obiettivo | Risultati | Prospettive future |
|---|---|---|---|---|---|---|---|
| Soffritti I., 2022 [21] | Introduction of Probiotic-Based Sanitation in the Emergency Ward of a Children’s Hospital During the COVID-19 Pandemic | Studio sperimentale | Reparti di emergenza di un ospedale pediatrico italiano | 2 mesi | Valutazione dell’effetto del PCHS nei reparti di emergenza pediatrica durante la pandemia COVID-19 | (i) L’impiego del PCHS ha determinato una diminuzione dell’80% dei patogeni di superficie rispetto ai livelli rilevati con la disinfezione chimica (p < 0,01), e una diminuzione fino a 2 Log di geni codificanti AMR (pc < 0,01) (ii) Il genoma SARS-CoV-2 non è stato rilevato né nella fase pre-PCHS né nel periodo della sua applicazione |
I dati raccolti possono supportare l’impiego futuro del sistema PCHS come potenziale alternativa, efficace ed ecologica, alle procedure chimiche di sanificazione convenzionale |
| D’Accolti M., 2021 [16] | Potential of an Eco-Sustainable Probiotic-Cleaning Formulation in Reducing Infectivity of Enveloped Viruses | Studio in vitro | Alpha-coronavirus 229E (hCoV-229E), Beta-coronavirus SARS-CoV-2, Herpes simplex virus 1 (HSV-1), virus influenza suina (H1N2), virus influenza aviaria (H10N1), Vaccinia Virus Ankara inoculati in cellule target |
- | Valutazione di: (i) potenziale azione antivirale di PCHS contro virus con envelope (ii) Stabilità a lungo termine dell’attività di PCHS nella prevenzione della contaminazione da virus |
(i) PCHS è in grado di inattivare il 99,9% di virus testati entro 1-2h dal contatto, sia in sospensione che in superficie (ii) PCHS ha azione antivirale prolungata anche dopo 24h dalla sua applicazione |
La sanificazione con PCHS può essere considerata una prospettiva nuova e sicura per il controllo e la prevenzione della diffusione di virus con envelope anche alla luce della mancanza di effetti collaterali negativi sull’ambiente e sulla resistenza antimicrobica |
| D’Accolti M., 2021 [30] | Effective elimination of Staphylococcal contamination from hospital surfaces by a bacteriophage–probiotic sanitation strategy: a monocentric study | Studio sperimentale | 8 toilette di un reparto ospedaliero di Medicina Interna (4 bagni: Intervention group; 4 bagni: Control group) |
23 giorni | Analisi della potenziale efficacia e fattibilità della procedura PCHS integrata con batteriofagi contro contaminazione stafilococcica | L’applicazione quotidiana di batteriofagi mediante nebulizzazione induce una diminuzione di Staphylococcus spp. sulle superfici trattate fino al 97% in più rispetto al solo PCHS (p < 0,001) | Un sistema con batteriofagi potrebbe essere utile per contrastare focolai di patogeni specifici ed essere preso in considerazione per l’implementazione di strategie di prevenzione e controllo delle infezioni correlare all’assistenza |
| Tarricone R., 2020 [22] | A Probiotic-Based Sanitation System for the Reduction of Healthcare Associated Infections and Antimicrobial Resistances: A Budget Impact Analysis | Studio sperimentale + Analisi di budget impact |
Reparti di medicina interna/geriatria e neurologia di 5 ospedali pubblici italiani (+ 1 di controllo) |
18 mesi
|
Valutazione di: (i) Numero di ICA per 1000 giorni/paziente (ii) Esiti delle ICA (iii) Consumo di farmaci per il trattamento delle ICA e relativi costi (iv) Identificazione dei casi di antibiotico-resistenza e stima dei relativi costi di trattamento |
(i) Incidenza cumulativa di ICA diminuita dal 4,6% (CCC) al 2,4% (PCHS) (p < 0,0001) (ii) Fase CCC: 54,6% moderata-grave; 1,5% grave (morte o disabilità grave); %restante lievi o nulle; Fase PCHS: 43,4% moderata-grave; 0,9% grave (morte o disabilità grave); %restante lievi o nulle (iii) Riduzione dei costi per il trattamento farmacologico delle ICA del 59,8% (272€ nella fase CCC vs 110€ nella fase PCHS) (iv) Riduzione dei costi per il trattamento dell’antibiotico-resistenza dell’84% (40.419€ nella fase CCC vs 6.341€ nella fase PCHS) |
Un maggiore utilizzo del PCHS rispetto ai sistemi di disinfezione chimica convenzionale, nei dipartimenti di medicina interna/geriatria e neurologia, potrebbero evitare circa 31.000 ICA e 8500 forme resistenti agli antibiotici, con un risparmio in Italia, in un orizzonte temporale di 5 anni, di almeno 14 milioni di euro, di cui 11,6 per il trattamento delle ICA resistenti |
| Caselli E., 2019 [24] |
Impact of a probiotic-based hospital sanitation on antimicrobial resistance and HAI-associated antimicrobial consumption and costs: a multicenter study | Studio sperimentale | Reparti di medicina interna/geriatria e neurologia di 5 ospedali pubblici italiani (+ 1 di controllo) | 18 mesi
|
(i) Analisi caratteristiche di resistenza agli antimicrobici (AMR) del microbiota ospedaliero prima e dopo PCHS (ii) Valutazione impatto del PCHS sulle AMR e degli effetti a esso correlati (consumo e costi dei farmaci antimicrobici) |
(i) Diminuzione fino al 99% dei geni codificanti AMR nel microbiota presente sulle superfici ospedaliere (pc < 0,01) e diminuzione del 33-100% dei ceppi resistenti a seconda del tipo di antibiotico (ii) Riduzione globale del 60,3% del consumo di farmaci antimicrobici associati a ICA e diminuzione del 75,4% dei costi associati |
La modulazione del microbiota potrebbe diventare parte integrante delle strategie di prevenzione e controllo delle ICA |
| Caselli E., 2018 [19] |
Reducing healthcare-associated infections incidence by a probiotic-based sanitation system: A multicentre, prospective, intervention study | Studio sperimentale | Reparti di medicina interna di 6 ospedali pubblici italiani | 18 mesi
|
(i) Valutare l’incidenza di ICA nelle fasi pre- e post-intervento (ii) Effettuare un’analisi qualitativa e quantitativa della contaminazione delle superfici ambientali |
(i) Incidenza cumulativa di ICA diminuita dal 4,8 al 2,3% (range 1,3-3,7%) (p < 0,0001); tasso di incidenza di ICA per 1000 giorni-pz diminuita da 5,4 a 2,3 con un valore di incidenza di 0,45 (95% IC, 0,36-0,54) (ii) Decremento stabile dei patogeni su superfici dell’83% (range 70-96%) accompagnato da un simultaneo decremento fino a 2log dei geni di antibiotico-resistenza del microbiota |
Sulla base di indagini più ampie, l’approccio PCHS potrebbe essere considerato come parte di strategie di prevenzione e controllo delle ICA |
| D’Accolti M., 2018 [31] | Efficient removal of hospital pathogens from hard surfaces by a combined use of bacteriophages and probiotics: potential as sanitizing agents | Studio in vitro | Test in vitro e in situ contro ceppi di S. aureus, E. coli e P. aeruginosa sensibili e resistenti ai farmaci | - | Valutazione dell’efficacia di un uso combinato di batteriofagi e probiotici nella rimozione di patogeni associati alle ICA su superfici resistenti | L’uso combinato ha mostrato: (i) riduzione rapida dei batteri bersaglio (94 ± 4%) entro 1h (ii) persistenza della riduzione delle CFU batteriche anche dopo 15 giorni (99 ± 1%) |
I prodotti chimici contenuti nel PCHS potrebbero stabilizzare i fagi a temperatura ambiente, favorire il contatto tra il fago e le cellule batteriche bersaglio, facilitandone l’ingresso e l’azione Il PCHS, pertanto, rappresenta un sistema innovativo volto alla prevenzione e alla gestione delle infezioni trasmesse da superfici contaminate in ambiente ospedaliero |
| Caselli E., 2016 [17] |
Impact of a Probiotic-Based Cleaning Intervention on the Microbiota Ecosystem of the Hospital Surfaces: Focus on the Resistome Remodulation | Studio sperimentale | Ospedale privato Quisisana (Ferrara, Italia) | 4 mesi | (i) Valutazione impatto dell’approccio PCHS addizionato di probiotici del genere Bacillus sull’ecosistema del microbiota che contamina le superfici ospedaliere (ii) Studio della sicurezza d’uso del PCHS, monitorando sia la potenziale acquisizione nel tempo di resistenze genetiche agli antibiotici sia la loro presenza in pazienti con ICA nel periodo studiato |
(i) Il numero di CFU/m2 del microbiota ospedaliero è diminuito fino al 98% rispetto ai numeri di CFU rilevati a T0 (cioè prima del trattamento PCHS). Tali differenze sono statisticamente significative (p ≤ 0,0001) in ogni momento testato (T2, T3, T4) rispetto a T0 per tutti i gruppi microbici a eccezione del gruppo delle Enterobacteriaceae (ii) La procedura PCHS non ha selezionato specie microbiche resistenti, al contrario ha indotto una diminuzione dei geni resistenti agli antibiotici nella popolazione microbica contaminante. Durante l’intero periodo di studio (4 mesi), solo 6 soggetti (su un totale di 159) hanno mostrato segni clinici attribuibili alle ICA |
La procedura a base di probiotici è attiva non solo nel controllo della contaminazione microbica superficiale ma anche nella riduzione delle specie resistenti ai farmaci, suggerendo che può avere implicazioni cliniche e terapeutiche rilevanti per la gestione delle ICA |
| La Fauci V., 2015 [23] | An Innovative Approach to Hospital Sanitization Using Probiotics: In Vitro and Field Trials | Studio in vitro | Sperimentazione in vitro condotta su 3 superfici in setting ospedaliero, quali: pavimento di un corridoio ospedaliero, tavolo in una stanza di degenza e su un lavabo |
- | Valutazione dell’efficacia di un sistema di sanificazione a base di probiotici | (i) In vitro: riduzione dei microrganismi rilevati dal 92,2 al 99,9% dopo 24h, senza ricontaminazione (ii) Sperimentazione clinica: eliminazione totale della carica batterica di Enterococcus faecalis e C. albicans e di quasi il 100% di P. aeruginosa, Acinetobacter baumannii e K. pneumoniae su tutte e tre le superfici dopo sole 6h, anche in caso di ricontaminazione |
Il PCHS ha un’azione durevole nel tempo grazie alla stabilizzazione di un biofilm in grado di ridurre e contenere la proliferazione di microrganismi patogeni. I probiotici sono, quindi, prodotti efficaci e innovativi per la sanificazione in setting ospedaliero |
| Vandini A., 2014 [18] | Hard Surface Biocontrol in Hospitals Using Microbial-Based Cleaning Products | Studio sperimentale | 2 ospedali italiani e 1 ospedale belga | 24 settimane | Valutazione dell’effetto di una nuova procedura di pulizia, basata sul meccanismo di biocontrollo, sulla presenza e sopravvivenza di diversi microrganismi responsabili di ICA, dopo applicazione su superfici ospedaliere resistenti | (i) Riduzione dei patogeni ICA-correlati del 50-89% rispetto ai metodi tradizionali (ii) Dopo circa 2 settimane, riduzione del 74 ± 21% dei patogeni coliformi e dell’89 ± 18% di E. coli (iii) Dopo 6 settimane, riduzione del 78 ± 15% di S. aureus (iv) Dopo 1 settimana, riduzione della carica C. albicans corrispondente all’82 ± 19% (v) Rapida riduzione, dopo 3 giorni, della carica di C. difficile del 55 ± 47% |
I primi risultati sulle percentuali di ICA negli ospedali, monitorati su base continua nello studio, si sono mostrati promettenti e potrebbero aprire la strada a una nuova strategia economicamente vantaggiosa per contrastare o (bio)controllare i patogeni correlati alle ICA |
| Vandini A., 2014 [20] | Reduction of the microbiological load on hospital surfaces through probiotic-based cleaning procedures: A new strategy to control nosocomial infections | Studio sperimentale | 2 reparti di medicina generale e setting ambulatoriale di 1 ospedale italiano | 4 mesi | Valutazione dell’efficacia di una nuova procedura di sanificazione con prodotti per la pulizia contenenti spore di Bacillus spp., rispetto a trattamenti tradizionali a base di cloro | (i) L’uso del probiotico ha determinato una significativa riduzione (> 80%) della carica microbica di S. aureus, batteri coliformi, Pseudomonas spp. e Candida spp., con effetto stabile nel tempo (ii) La ridotta carica microbica è stata mantenuta a valori stabilmente bassi per tutte le 24 ore successive all’applicazione, nonostante la presenza di continue e molteplici fonti di ricontaminazione microbica dovute a pazienti, visitatori, personale ospedaliero e materiali vari |
I detergenti a base di probiotici riducono significativamente la presenza di batteri patogeni sulle superfici contaminate, e supportano l’ipotesi di un meccanismo mediato dalla biostabilizzazione della carica microbica |
I potenziali svantaggi includono:
il tipo di azione del PCHS, basato sul principio di rimodulazione graduale del microbiota dell’ambiente trattato, che comporta tempi di applicazione di almeno 2 settimane per poter raggiungere l’equilibrio stabile del microbiota. Il sistema non può quindi essere utilizzato per le decontaminazioni rapide in emergenza. A questo scopo, sono stati disegnati specifici protocolli che prevedono l’utilizzo di disinfettanti rapidi per una immediata decontaminazione (in caso di sversamenti di liquidi biologici contaminati, ad es.), e il riposizionamento del PCHS a distanza di almeno 1 ora dalla disinfezione, per consentire la germinazione delle spore dei Bacillus del PCHS una volta che il disinfettante abbia perso attività sulle superfici trattate;
l’assenza di azione specifica, in quanto l’esclusione competitiva si manifesta verso tutti i tipo di microrganismi persistenti sulle superfici trattate. Pertanto in caso si desideri colpire soltanto un tipo di microrganismo (ad es. in caso di outbreak specifici), il sistema per sua natura non è in grado di essere selettivo;
la presenza di microrganismi vivi (spore di Bacillus), ancorché sicuri e apatogeni, rendono l’uso del PCHS non raccomandabile/applicabile negli ambienti dove sia necessaria la sterilità (sale operatorie, camere bianche), o dove siano presenti soggetti fortemente immunosoppressi non in grado di rispondere adeguatamente al contatto con qualsiasi tipo di microrganismo anche apatogeno (es: trapiantati).
Il presente capitolo ha presentato i principali studi condotti sulla tecnologia oggetto di approfondimento, concentrandosi sulle caratteristiche della stessa e sui principali dati di efficacia e sicurezza.
Il PCHS è stato testato su campo in diversi settings ospedalieri in Italia e all’estero. Gli studi sono stati condotti essenzialmente nei reparti di medicina interna per adulti, per periodi di tempo da 2 a 18 mesi [17-19]. Uno studio è stato invece effettuato nel reparto di Pronto Soccorso di un ospedale pediatrico durante il periodo pandemico COVID-19 [21]. In futuro, potrebbe essere utile l’esecuzione di ulteriori studi nell’ambito di altri setting assistenziali e mediante studi epidemiologici, al fine di produrre ulteriori evidenze utili per un eventuale reassessment della tecnologia.
Nel complesso, i risultati di tutti gli studi condotti hanno mostrato che la sostituzione dei sistemi di sanificazione convenzionali con il PCHS si associa a una riduzione stabile dei patogeni del gruppo ESKAPE (Escherichia, Staphylococcus, Klebsiella, Acinetobacter, Pseudomonas, Enterococcus) in tutti i setting trattati, fino al 85% in più rispetto a quanto osservato con i detergenti/disinfettanti convenzionali [17-19]; i risultati sono stati confermati in uno studio effettuato dall’Università di Messina [23]. Negli studi in cui è stata valutata l’incidenza di ICA è stata, inoltre, dimostrata una riduzione di circa il 50% delle ICA nel periodo di osservazione [19], confermata anche dopo matching di tutti i pazienti ospedalizzati nel periodo di osservazione [22]. Ulteriori studi saranno comunque utili per confermare i dati ottenuti dallo studio di Caselli et al. [19], auspicabilmente tenendo in considerazione anche un protocollo e definizioni standard, come quello proposto dall’ECDC [32], e da applicare anche in altre tipologie di reparti, oltre a quelli già testati.
Si specifica, inoltre, che nell’analisi degli studi effettuata non è stato fatto riferimento ai principali indicatori di Processo, di Risultato Microbiologico e di Esito considerati negli stessi. Si ricorda, in tal senso, l’importanza di tali indicatori così come proposti anche nelle “Linee di indirizzo sulla valutazione del processo di sanificazione ambientale nelle strutture ospedaliere e territoriali per il controllo delle Infezioni Correlate all’Assistenza (ICA)” del 2019 [33].
A ogni modo, sulla base dei dati a oggi disponibili, il PCHS mostra grandi potenzialità per un utilizzo in quegli ambienti in cui non sia necessaria una condizione di sterilità ma una sanificazione stabile, che porti a limitare la contaminazione patogena e farmaco-resistente correlata all’insorgenza di infezioni di difficile approccio terapeutico. Potrebbero, pertanto, essere inclusi, oltre a quello ospedaliero nei reparti a basso e medio rischio, anche gli ambienti domestici, comunitari e dei trasporti.
Agli ambienti per utilizzo umano, si potrebbero vantaggiosamente aggiungere anche quelli utilizzati per l’allevamento di animali e l’uso in agricoltura (peraltro già ampiamente diffuso), allo scopo di mettere in atto una strategia “one health” in linea con i princìpi indicati dalla Comunità Europea per la lotta all’AMR e nel rispetto delle indicazioni comunitarie di sostenibilità ecologica.
La resistenza antimicrobica (AntiMicrobial Resistance, AMR) si riferisce alla capacità dei microrganismi di resistere ai trattamenti antimicrobici. L’uso eccessivo o improprio degli antibiotici è stato collegato all’emergere e alla diffusione di microrganismi a essi resistenti, rendendo il trattamento inefficace e ponendo un grave rischio per la salute pubblica [1]. L’AMR attualmente preoccupa tutte le organizzazioni sanitarie in quanto ha impatti clinici, sociali ed economici, tanto da essere considerata una vera emergenza sanitaria del millennio. La pandemia di COVID-19 ha messo in luce le debolezze dei sistemi sanitari nazionali e l’interconnessione di paesi e continenti. La continuità degli sforzi per affrontare la resistenza antimicrobica è stata seriamente messa in discussione dal reimpiego degli operatori sanitari per supportare la risposta al COVID-19 in tutta la regione europea e gli effetti della pandemia sulle persone e sulla salute pubblica devono ancora essere completamente valutati.
Un articolo pubblicato sulla rivista The Lancet mostra che l’AMR è stata la causa diretta di almeno 1.27 milioni di morti nel 2019, un numero maggiore rispetto a quello relativo a patologie ampiamente riconosciute, come la malaria e l’HIV/AIDS [2]. Gli elevati livelli di AMR per diverse importanti combinazioni di specie batteriche e gruppi di antimicrobici registrati dall’European Antimicrobial Resistance Surveillance Network (EARS-Net) per il 2020 mostrano che l’AMR rimane una seria sfida in Europa. In effetti, la resistenza antimicrobica rappresenta una notevole minaccia per la salute pubblica, sia nell’Unione Europea sia nel mondo [3]. Stime basate sui dati EARS-Net mostrano che ogni anno in Europa si verificano più di 670.000 infezioni dovute a batteri resistenti agli antibiotici e che circa 33.000 persone muoiono come diretta conseguenza di queste infezioni, con oltre 10.000 decessi solo in Italia [4]. Il relativo costo per i sistemi sanitari dei paesi europei è stimato in circa 1,1 miliardi di euro [3]. In questo contesto, l’Italia riporta il costo più alto con 393 milioni di dollari spesi ogni anno dal sistema sanitario a seguito della diffusione delle AMR [5].
L’utilizzo inappropriato ed eccessivo di antibiotici è uno dei principali fattori dell’insorgenza delle antibiotico-resistenze nei patogeni umani. I microrganismi isolati in ospedale sono più resistenti agli antibiotici rispetto a quelli isolati nella collettività. Il motivo è legato all’utilizzo, in questo contesto, di una maggiore quantità di antibiotici che aumenta la probabilità che si sviluppino delle mutazioni genetiche che permettano ai batteri di sopravvivere nonostante la presenza di antimicrobici [6]. Un’importante conseguenza della resistenza agli antibiotici è rappresentata dalle infezioni correlate all’assistenza sanitaria (ICA). Le ICA si definiscono come infezioni dovute a batteri, funghi, virus o altri agenti patogeni meno comuni, contratte durante l’assistenza sanitaria, che possono verificarsi in qualsiasi contesto assistenziale (ospedali, ambulatori di chirurgia, centri di dialisi, lungodegenze, assistenza domiciliare, strutture residenziali territoriali) e che al momento dell’ingresso nella struttura o prima dell’erogazione dell’assistenza non erano manifeste clinicamente, né erano in incubazione [7]. Esiste una stretta correlazione tra AMR e ICA in quanto il 75% delle infezioni risulta essere resistente agli antibiotici [8]. Più di tre milioni di pazienti in Europa sono colpiti da ICA ogni anno e queste ICA causano circa 37.000 decessi, con un ruolo predominante e in crescita di agenti patogeni multi-resistenti [9, 10]. L’uso eccessivo di antibiotici non è l’unica causa di resistenza antimicrobica. La resistenza antimicrobica ha origini multifattoriali e deve essere affrontata con un approccio “One Health” [11, 12]. One Health è un approccio interdisciplinare, che esamina le molteplici connessioni tra salute umana, animale e ambientale al fine di valutare e gestire la complessità dei rischi per la salute. Pertanto, il quadro concettuale One Health deve essere considerato un importante supporto nell’attuazione delle azioni di salute pubblica per affrontare l’antibiotico resistenza a livello globale [13]. I principali fattori di resistenza agli antimicrobici includono l’uso improprio e l’uso eccessivo di antimicrobici, la mancanza di accesso ad acqua pulita e a servizi igienico-sanitari sia per l’uomo sia per gli animali, la scarsa prevenzione e controllo delle infezioni e delle malattie nelle strutture sanitarie e negli allevamenti, lo scarso accesso a medicinali, vaccini e diagnostica di qualità e a prezzi accessibili, la mancanza di consapevolezza, conoscenza e di applicazione della legislazione [1].
Una analisi dell’OCSE ha mostrato come semplici attività, come la promozione del lavaggio delle mani e una migliore igiene nelle strutture sanitarie, potrebbero più che dimezzare il rischio di morte e ridurre l’impatto sanitario dell’AMR [5]. Il programma di gestione dei soli aspetti “ospedalieri” (che include il miglioramento dell’igiene delle mani, programmi di gestione e maggiore attenzione all’igiene ambientale) potrebbe ridurre dell’85% l’impatto delle AMR, evitare circa 1.3 milioni di DALYs (disability-adjusted life years) e salvare 55.000 anni di vita nei 33 paesi considerati, generando risparmi di 4,1 USD pro capite l’anno.
Nelle strutture nosocomiali, il ruolo dell’igiene per la riduzione della trasmissione delle infezioni, anche correlate all’assistenza, ha una importanza fondamentale. La sanificazione tradizionale a base di sostanze chimiche è evidentemente di scarsa efficacia nella decontaminazione [14] in quanto non riesce a prevenire la ricontaminazione [15]; inoltre, la sanificazione di tipo chimico ha un elevato impatto ambientale e può portare allo sviluppo di agenti patogeni resistenti [16, 17].
Nel corso del tempo sono stati sviluppati nuovi approcci, tra cui superfici antimicrobiche, sistemi di dispersione automatizzati, utilizzo di vapore e disinfettanti [16], ma solo un minoranza di studi ha considerato l’impatto delle attività di igiene avanzate o alternative nella pratica corrente [18]. Diversi studi hanno dimostrato che il rischio di acquisire organismi multi-resistenti ai farmaci aumenta se una stanza è stata precedentemente occupata o utilizzata da una persona infettata da un batterio resistente [19]. La pulizia sistematica delle apparecchiature e dell’ambiente è quindi essenziale per ridurre la contaminazione microbica e il conseguente rischio di trasmissione, in particolare dopo la dimissione di un individuo infetto. Una migliore igiene ambientale può quindi rappresentare una strategia chiave di prevenzione della trasmissione. Ciò comprende la decontaminazione, la disinfezione, la pulizia e la sterilizzazione dell’ambiente circostante e delle attrezzature. Comprende inoltre lo smaltimento di oggetti che potrebbero essere entrati in contatto con persone infette. Una revisione sistematica della letteratura ha evidenziato che interventi volti al miglioramento dell’igiene ambientale possono ridurre i tassi di resistenza antimicrobica dal 26 al 49% [20].
Un intervento volto a migliorare l’igiene ambientale può comportare diverse azioni [18]: 1) sostituzione del disinfettante: ciò comporta il passaggio dal detergente al disinfettante o a un altro disinfettante che si presume abbia una maggiore efficacia (costo stimato pari a 14,2 USD PPP per persona all’anno); 2) pulizia senza contatto: ciò comporta l’uso di un dispositivo di pulizia automatizzato, che emette vapore di perossido di idrogeno o radiazioni ultraviolette, per disinfettare le stanze dopo la pulizia di routine (costo stimato di 65 USD PPP per persona all’anno); 3) migliorare l’efficacia della pulizia, che può includere: tempi di pulizia aggiuntivi attraverso l’assunzione di nuovo personale; audit, monitoraggio e feedback sulle pratiche di pulizia e completezza; formazione del personale e nuove tecniche di applicazione dei prodotti (costo stimato di 12,6 USD PPP per persona all’anno) [5].
Tra i nuovi approcci citiamo il Probiotic Cleaning Hygiene System (PCHS), basato su detergenti ecologicamente sostenibili contenenti selezionate spore di probiotici del genere Bacillus, che integra diversi fattori come procedure certificate, controllo microbiologico, tecnica di attivazione specifica per la competizione biologica e utilizzo di materiali specifici in microfibra (che combinano le attività di spazzatura e lavaggio). Questi fattori consentono di ottenere una limitata carica microbica e di mantenerla in modo stabile nel tempo, garantendo alti standard di efficacia. I protocolli PCHS, con cui vengono eseguite le operazioni di sanificazione, prevedono anche un piano di formazione specifico per il personale, con l’obiettivo di garantire l’efficacia del processo e dei risultati.
Alcuni studi sperimentali hanno evidenziato che il PCHS è in grado di ridurre i patogeni di superficie fino al 90% in più rispetto ai disinfettanti chimici tradizionali [21, 22]; inoltre, come è stato dimostrato dalle analisi molecolari sull’intero resistoma del microbiota presente sulle superfici trattate, il PCHS non induce la selezione di ceppi resistenti ai farmaci [22-24]. In uno studio multicentrico condotto recentemente, il sistema ha dimostrato di poter ridurre dal 4,8 al 2,3% (OR = 0,44, 95% IC 0,35-0,54) (p < 0,0001) l’incidenza cumulativa di ICA rispetto alla disinfezione tradizionale. Inoltre, i geni di resistenza antimicrobica contenuti nei microbi di superficie sono diminuiti fino al 99%, mentre il consumo di farmaci antimicrobici utilizzati per la gestione delle ICA ha mostrato una riduzione globale del 60,3%, con una riduzione del 75,4% dei costi associati [24, 25]. Queste evidenze sono state ricavate analizzando un numero molto elevato di pazienti (N = 11461) [25], tuttavia l’analisi è stata effettuata confrontando i gruppi di pazienti nei periodi pre-PCHS e PCHS senza imporre una uguaglianza delle caratteristiche dei pazienti stessi, portando così a possibili bias nei risultati [24]. Una successiva analisi [26] ha avuto l’obiettivo di colmare questa lacuna, confrontando i costi e gli outcomes del sistema PCHS rispetto alla disinfezione chimica convenzionale (DCT) dopo aver effettuato un “matching” dei pazienti nei due gruppi; inoltre, l’impatto del PCHS è stato misurato in termini di riduzione delle ICA, esiti delle ICA, tassi di resistenza agli antibiotici e costi. Il presente studio si pone l’obiettivo di fornire una valutazione aggiornata dei possibili benefici del PCHS a partire dalla metodologia già presentata [26].
Dal 1° gennaio 2016 al 30 giugno 2017 è stato condotto uno studio pre-post intervento in cinque ospedali pubblici italiani (più un ospedale di controllo) con l’obiettivo di valutare l’incidenza delle ICA [25]. Lo studio è stato condotto in due fasi: in una prima fase di 6 mesi gli ospedali hanno continuato a eseguire le procedure di disinfezione chimica tradizionale (DCT) basate sull’uso di prodotti a base di cloro (ipoclorito di sodio allo 0,1%), mentre in una seconda fase di altri 6 mesi, è stato utilizzato il sistema PCHS (contenente 107 probiotici/mL). Sia la DCT sia il PCHS sono stati utilizzati quotidianamente. Con l’obiettivo di ottenere un campione di pazienti omogenei per la stima dell’incidenza delle ICA, l’analisi ha considerato i reparti di medicina interna, geriatria e neurologia. Nelle fasi DCT e PCHS sono stati arruolati rispettivamente 5930 e 5531 pazienti. Per rendere comparabili i pazienti nei due gruppi, è stato applicato un “propensity score matching” (PSM) per tener conto dei possibili bias nella selezione [27-29]. Il matching è stato effettuato tenendo conto delle caratteristiche e dei fattori prognostici dei pazienti, selezionati tramite il consenso dei clinici coinvolti nello studio, focalizzando l’attenzione sui parametri che hanno riportato differenze statisticamente significative tra i due gruppi: età (p = 0,0001), sesso (p = 0,003), presenza di catetere urinario (p = 0,01), autosufficienza (p = 0,009), presenza di piaghe da decubito (p = 0,00001), presenza di ventilazione meccanica (p = 0,00001), uso di antibiotici nelle ultime due settimane (p = 0,00001), nutrizione parenterale (p = 0,00001), presenza al ricovero di microrganismi resistenti ai farmaci (p = 0,008). Il motivo del ricovero ospedaliero è stato escluso dall’insieme delle variabili utilizzate nel processo di matching poiché non è stato considerato rilevante per l’analisi delle ICA. Per eseguire il PSM è stato utilizzato il software STATA con il comando psmatch2 [30].
Gli “outcomes” valutati nello studio in entrambi i periodi DCT e PCHS sono stati:
numero di ICA per 1000 giorni/paziente;
esiti delle ICA;
consumo di farmaci per il trattamento delle ICA e relativi costi;
identificazione dei casi di antibiotico-resistenza e stima dei relativi costi di trattamento.
Per l’identificazione delle antibiotico-resistenze si è fatto riferimento al criterio che ipotizza l’insorgenza di una resistenza in caso di cambio di terapia, coerentemente con quanto riportato negli studi pubblicati nello stesso contesto [31-34]. I casi di antibiotico-resistenza per ogni paziente sono stati identificati quando il numero di antibiotici somministrati fosse superiore al numero di ICA per quel paziente (ad es. utilizzo di due farmaci per la gestione della stessa ICA).
Gli esiti delle ICA sono stati valutati in termini di gravità in base all’Australian Incident Monitoring System (AIMS) [35], che categorizza gli eventi avversi in base a 8 livelli di gravità da “nessun esito” a “conseguenze gravi/fatali”.
L’analisi economica ha avuto l’obiettivo di valutare i costi (EUR, 2019) delle terapie farmacologiche per il trattamento delle ICA nei gruppi DCT e PCHS, distinguendo i costi per la gestione delle antibiotico-resistenze. Il costo per il trattamento farmacologico è stato calcolato a partire dal costo giornaliero per paziente. Ogni ospedale ha fornito per i farmaci antimicrobici (antibiotici e antimicotici), il costo giornaliero per paziente considerando una dose standard, per le diverse vie di somministrazione. In caso di dati mancanti per un ospedale, è stato calcolato un costo medio basato sui dati forniti dagli altri ospedali per lo stesso farmaco. La Tabella I mostra per ogni farmaco il costo giornaliero e il range di variazione rilevato nei diversi ospedali, per le diverse vie di somministrazione. I casi con un singolo valore riportato indicano che il costo del farmaco era lo stesso per i diversi ospedali oppure che un solo centro clinico lo ha utilizzato (quest’ultimo caso è identificato da un asterisco). Il costo totale per paziente è stato ricavato moltiplicando il costo giornaliero per la durata del trattamento e sommando i costi dei diversi trattamenti a lui somministrati.
Costi giornalieri o intervallo minimo-massimo delle terapie farmacologiche antimicrobiche per paziente.
| Farmaco | Via endovenosa (€) | Inalazione (€) | Via orale (€) | Via parenterale (€) |
|---|---|---|---|---|
| Ambisome * | 246,71 | |||
| Amikacina | 1,2-3,06 | |||
| Amoxicillina | 0,09-0,6 | |||
| Amoxicillina/acido clavulanico | 2,58-5,9 | 0,05-0,33 | ||
| Ampicillina | 1,96-3,93 | 0,99 | ||
| Ampicillina/sulbactam | 4,44-7,86 | |||
| Anidulafungina * | 354 | |||
| Caspofungin * | 560,99 | |||
| Cefixima | 1,14-2,01 | |||
| Cefotaxima | 1,76 | |||
| Ceftazidima | 3,37 | 3,37 | ||
| Ceftriaxone | 0,9-1,32 | |||
| Ciprofloxacina | 0,11-3,96 | 0,11-0,88 | ||
| Claritromicina | 8,7 | 0,88 | ||
| Clindamicina | 1,64 | 0,84 | ||
| Colistina | 27 | 8,95 | ||
| Daptomicina * | 107,2 | |||
| Fluconazolo | 0,54-2 | 0,99-1,54 | ||
| Fosfomicina | 1,2-5,68 | |||
| Ganciclovir * | 13,6 | |||
| Gentamicina | 0,99-1,24 | |||
| Imipenem | 9,24 | |||
| Imipenem/cilastina | 9,4-13,58 | |||
| Levofloxacina | 0,7-0,96 | 0,2-1,2 | ||
| Linezolid | 10-151,32 | |||
| Meropenem | 9,9-13,16 | |||
| Metronidazolo | 0,9-1,8 | 0,09-0,23 | ||
| Nistatina * | 0,45 | |||
| Oxacillina * | 2,99 | |||
| Piperacillina/tazobactam | 4,43-6,6 | |||
| Teicoplanina | 5,16-57,75 | 5,16 | 36,8 | |
| Tigeciclina | 98,27-107,8 | |||
| Trimetoprim/sulfametossazolo | 13,89 | 0,14-0,22 | ||
| Vancomicina | 2,5-3,06 | 3-3,69 | ||
| Voriconazolo | 96,72-96,72 | 18,84-18,84 |
* Farmaco somministrato in seguito a ICA presso un’unica struttura ospedaliera.
Poiché analizzando una gara d’appalto pubblica nazionale, il costo della sanificazione degli ambienti ospedalieri è risultato equivalente per PCHS e DCT [36], il costo della sanificazione non è stato oggetto di analisi. L’Appendice mostra una stima dei costi della disinfezione chimica tradizionale rispetto al PCHS in termini di ore di lavoro, in base a tre tipi di aree e allo stesso elenco di attività di pulizia.
Una ulteriore analisi è stata condotta sulla durata della degenza ospedaliera per i pazienti nei gruppi DCT e PCHS, considerando anche il sottogruppo di pazienti che hanno sviluppato resistenza agli antibiotici, al fine di valutare eventuali differenze.
Un’analisi di impatto sul budget [37] è stata condotta per valutare le variazioni attese nel budget degli ospedali in Italia per il trattamento farmacologico delle ICA e delle eventuali antibiotico-resistenze, confrontando l’utilizzo del sistema PCHS rispetto alla sanificazione a base di prodotti chimici.
I dati più recenti riportano per l’Italia circa 1.273.000 [38] dimissioni ospedaliere all’anno (2019) considerando i reparti di medicina interna, geriatria e neurologia (cioè gli stessi reparti considerati nella nostra analisi). Dato che attualmente l’utilizzo del PCHS in Italia è molto limitato (meno del 5% degli ospedali secondo i dati forniti dal produttore), lo scenario attuale di distribuzione dei pazienti tra i due sistemi di sanificazione ha considerato il 100% di utilizzo della DCT. L’introduzione nella pratica clinica di nuove tecnologie, come il PCHS, è spesso difficoltosa, per ragioni personali (ad es. diffidenza) o professionali degli operatori coinvolti nel processo, oppure perché le strutture cliniche non sono interessate o pronte a recepirle, o ancora, perché queste non sono in grado di condurre trattative commerciali adeguate con i fornitori [39-41]. Per questi motivi, il modello ha considerato modesti tassi crescenti di utilizzo del PCHS nello scenario futuro pari al 5, 10, 15, 30 e 50% rispetto alle procedure di disinfezione convenzionale nei prossimi 5 anni. Il modello applica le variazioni delle quote di mercato considerando una coorte di pazienti incidenti all’anno.
Il costo per lo scenario attuale e futuro è stato stimato moltiplicando i costi annuali di ciascuna alternativa per la percentuale di popolazione gestita con tale alternativa e per il numero di pazienti nella popolazione considerata, tenendo conto di una coorte costante di pazienti incidenti.
La tecnica del propensity score matching, applicata a 11.461 pazienti totali inclusi nello studio [25], ha prodotto un campione di 8320 pazienti (4160 per gruppo) con caratteristiche cliniche sovrapponibili (riduzione del bias del 100% su tutte le variabili). La Tabella II mostra le caratteristiche delle popolazioni ottenute.
Caratteristiche delle popolazioni prima (unmatched) e dopo il matching (matched) (PCHS: Probiotic Cleaning Hygiene System, DCT: Disinfezione Chimica Tradizionale).
| Caratteristiche della popolazione | Unmatched/Matched | PCHS Valore medio | DCT Valore medio | % Bias |
|---|---|---|---|---|
| Età | U | 73.000 | 71.804 | 7,4 |
| M | 73.465 | 73.465 | 0 | |
| Sesso (proporzione di maschi) | U | 0,471 | 0,498 | -5,5 |
| M | 0,483 | 0,483 | 0 | |
| Proporzione di pazienti con catetere urinario | U | 0,211 | 0,231 | -4,8 |
| M | 0,200 | 0,200 | 0 | |
| Proporzione di pazienti autosufficienti | U | 0,649 | 0,626 | 4,9 |
| M | 0,678 | 0,678 | 0 | |
| Proporzione di pazienti con piaghe da decubito | U | 0,045 | 0,064 | -8,3 |
| M | 0,024 | 0,024 | 0 | |
| Proporzione di pazienti con ventilazione meccanica | U | 0,027 | 0,039 | -6,8 |
| M | 0,010 | 0,010 | 0 | |
| Proporzione di pazienti con uso di antibiotici nelle ultime due settimane | U | 0,058 | 0,091 | -12,7 |
| M | 0,032 | 0,032 | 0 | |
| Proporzione di pazienti con nutrizione parenterale | U | 0,023 | 0,036 | -7,1 |
| M | 0,008 | 0,008 | 0 | |
| Proporzione di pazienti con presenza all’accettazione del ricovero di organismi multi-resistenti | U | 0,015 | 0,022 | -5,0 |
| M | 0,002 | 0,002 | 0 |
I pazienti che hanno sviluppato almeno una ICA sono risultati 291, di cui 191 durante la fase DCT e 100 durante la fase PCHS, per un totale pari a 203 e 106 ICA rispettivamente. Con il passaggio dalla DCT al PCHS, l’incidenza cumulativa delle ICA (cioè, N. di pazienti con ICA/N. di pazienti arruolati) è diminuita in modo statisticamente significativo dal 4,6 al 2,4% (p < 0,0001) (OR = 0,47, 95% IC 0,37-0,60).
La Tabella III riporta il confronto dei diversi farmaci utilizzati nei due periodi, in termini di giorni di trattamento e numero di pazienti trattati. Il consumo di antimicrobici sintetici ad ampio spettro come chinoloni e fluorochinoloni (ad es. ciprofloxacina e levofloxacina) si è ridotto significativamente (da 508 a 70 giorni totali di terapia) con il passaggio dalla DCT al PCHS. Allo stesso tempo, nella fase PCHS si è verificato un aumento (da 34 a 104 giorni totali di terapia) dell’utilizzo di antibiotici di prima linea meno costosi (ad es. amoxicillina/acido clavulanico), mostrando che gli agenti eziologici batterici delle ICA erano sensibili a tali farmaci. La durata media del trattamento per paziente, calcolata dividendo i giorni totali di trattamento farmacologico per il numero di pazienti con ICA, è risultata per i periodi DCT e PCHS di 11,88 e 11,04 giorni, rispettivamente.
Farmaci utilizzati e durata dei trattamenti nei due periodi.
| Farmaco | DCT (N. ICA = 191) | PCHS (N. ICA = 100) | ||
|---|---|---|---|---|
| Giorni trattamento | N. pz trattati | Giorni trattamento | N. pz trattati | |
| Piperacillina/tazobactam | 395 | 45 | 406 | 39 |
| Levofloxacina | 269 | 42 | 15 | 4 |
| Ciprofloxacina | 239 | 33 | 55 | 11 |
| Teicoplanina | 183 | 15 | 63 | 6 |
| Ceftriaxone | 176 | 22 | 90 | 14 |
| Meropenem | 158 | 14 | 61 | 6 |
| Vancomicina | 133 | 15 | 38 | 4 |
| Colistina | 79 | 5 | 40 | 2 |
| Fluconazolo | 76 | 7 | 16 | 3 |
| Fosfomicina | 63 | 9 | 2 | 1 |
| Anidulafungina | 51 | 5 | 0 | 0 |
| Metronidazolo | 45 | 7 | 25 | 3 |
| Ampicillina/sulbactam | 40 | 5 | 8 | 1 |
| Amoxicillina/acido clavulanico | 34 | 5 | 104 | 11 |
| Imipenem | 30 | 2 | 26 | 3 |
| Linezolid | 30 | 2 | 58 | 4 |
| Tigeciclina | 28 | 3 | 18 | 2 |
| Cefixima | 23 | 1 | 3 | 1 |
| Trimetoprim/sulfametossazolo | 22 | 3 | 0 | 0 |
| Ambisome | 21 | 1 | 0 | 0 |
| Gentamicina | 20 | 2 | 2 | 1 |
| Voriconazolo | 19 | 3 | 0 | 0 |
| Ampicillina | 18 | 3 | 0 | 0 |
| Imipenem/cilastina | 16 | 2 | 8 | 1 |
| Amikacina | 15 | 2 | 25 | 1 |
| Caspofungin | 13 | 1 | 0 | 0 |
| Ganciclovir | 12 | 1 | 0 | 0 |
| Claritromicina | 11 | 3 | 14 | 2 |
| Penicillina | 10 | 1 | 0 | 0 |
| Daptomicina | 9 | 2 | 0 | 0 |
| Amoxicillina | 8 | 2 | 7 | 2 |
| Nistatina | 7 | 1 | 0 | 0 |
| Ceftazidima | 6 | 1 | 0 | 0 |
| Clindamicina | 5 | 1 | 0 | 0 |
| Cefotaxima | 0 | 0 | 11 | 1 |
| Oxacillina | 0 | 0 | 9 | 1 |
| Totale | 2264 | 1104 | ||
La Figura 1 riporta il dettaglio della durata media del trattamento nei due periodi per i diversi farmaci, mentre la Figura 2 evidenzia la variazione percentuale della durata del trattamento passando dal periodo DCT al periodo PCHS.
Durante il periodo DCT, dei 191 pazienti che hanno sviluppato una ICA, 47 sono stati identificati con una ICA resistente agli antibiotici secondo la metodologia riportata in letteratura [31]. Applicando la stessa metodologia, nel periodo PCHS, sono stati identificati 22 pazienti su 100 che hanno sviluppato una ICA antibiotico-resistente. Durante il periodo di utilizzo della disinfezione tradizionale e nel periodo di utilizzo del PCHS, rispettivamente l’1,13% e lo 0,53% dei pazienti (calcolati sul totale di 4160 pazienti in ciascun periodo) hanno mostrato resistenza agli antibiotici.
L’analisi degli esiti delle ICA ha evidenziato nella fase DCT 111 ICA con severità da moderata a significativa (54,6%); in 3 casi (1,5%), i pazienti hanno riportato un esito grave (decesso o invalidità grave), mentre le restanti infezioni hanno riportato conseguenze lievi o nulle. Per la fase PCHS, questi casi sono risultati rispettivamente pari a 46 (43,4%) e 1 (0,9%) (test di Fisher per il confronto, p = 0,486). Le differenze tra i due gruppi non sono risultate statisticamente significative.
Anche la durata media della degenza ospedaliera non ha evidenziato differenze statisticamente significative (test di Wilcoxon, p = 0,13) per i pazienti con ICA nei gruppi DCT (17,81 giorni) e PCHS (20,08 giorni) e per i pazienti che negli stessi gruppi hanno sviluppato antibiotico-resistenze (26,62 contro 30,05 giorni; test di Wilcoxon, p = 0,90).
L’analisi economica si è concentrata sui pazienti che hanno sviluppato almeno una ICA (291 in totale). Dall’analisi è emerso che il costo medio del trattamento farmacologico per un paziente con ICA è passato da € 272 nel periodo DCT a € 110 nella fase PCHS, con una riduzione del 59,8% per paziente. Il costo totale dei farmaci utilizzati per la gestione delle ICA è risultato nella fase DCT pari a € 52.004 e nella fase PCHS pari a € 10.954, dimostrando che il PCHS è in grado di ridurre i costi totali dei farmaci del 78,9% (costo medio per paziente calcolato sulla popolazione totale: € 2,63 verso € 12,50). La diminuzione dei costi per il periodo di utilizzo del PCHS è dovuta sia alla riduzione del numero di pazienti con ICA, sia all’utilizzo di farmaci meno costosi per la gestione delle infezioni (Tab. III).
Il costo del trattamento delle ICA resistenti agli antibiotici nei periodi DCT e PCHS è risultato rispettivamente pari a € 40.419 e € 6.341, evidenziando una diminuzione dell’84%. Il costo medio per il trattamento di un paziente resistente agli antibiotici è risultato pari a € 859,98 e € 288,23, rispettivamente per DCT e PCHS, con una riduzione dei costi del 66% (costo medio per paziente calcolato sulla popolazione totale: € 1,52 verso € 9,72). L’utilizzo del PCHS ha portato a una diminuzione del numero di pazienti con ICA resistenti ai farmaci e, a sua volta, a una diminuzione del costo per la terapia farmacologica. Anche in questo caso, come nel caso delle ICA, la riduzione del costo della terapia farmacologica è derivata anche dall’utilizzo di farmaci meno costosi per la gestione delle infezioni antibiotico-resistenti.
Applicando le frequenze di eventi riscontrate nei due gruppi di pazienti al numero totale annuo di ricoveri ospedalieri nei reparti di medicina interna, geriatria e neurologia (1.273.000) in Italia, il numero di ICA e di antibiotico-resistenze sarebbe 58.558 e 14.385 per la DCT rispetto a 30.552 e 6.747 per il PCHS, rispettivamente. Di queste, i casi di ICA severe sarebbero rispettivamente 919 e 306 per la DCT e il PCHS.
Dati i risultati clinici e considerando gli stessi costi di acquisto delle diverse tecniche di sanificazione (DCT e PCHS), un aumentato utilizzo del PCHS rispetto alla disinfezione chimica tradizionale comporterebbe notevoli risparmi sui costi sin dal primo anno di utilizzo della sanificazione innovativa. Rispetto allo scenario attuale che considera l’utilizzo al 100% di disinfettanti chimici, scenari futuri che considerano tassi di utilizzo del PCHS del 5, 10, 15, 30 e 50% rispetto alla sanificazione tradizionale potrebbero evitare circa 31.000 ICA e circa 8.400 antibiotico-resistenze nei prossimi 5 anni. Questo consentirebbe un risparmio di € 628.226 al primo anno, € 1.256.451 al secondo anno, € 1.884.677 al terzo anno, € 3.769.353 al quarto anno e € 6.282.255 al quinto anno (Fig. 3), considerando ogni anno nuove coorti di pazienti incidenti nei reparti ospedalieri. Il risparmio totale, per i prossimi 5 anni sarebbe di € 13.820.961. In questo contesto, il risparmio relativo alla gestione delle ICA antibiotico-resistenti, nei prossimi 5 anni sarebbe di circa € 11.5 milioni (83% del risparmio totale).
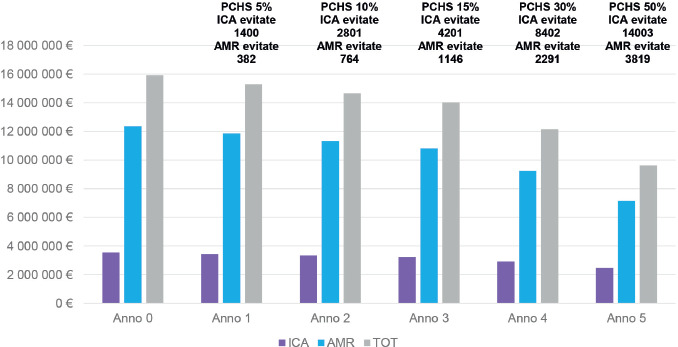
Impatto sul budget per lo scenario corrente (Anno 0) e per gli scenari futuri (Anno 1-5) (AMR = antibiotico-resistenze).
Le recenti evidenze pubblicate mostrano che i livelli di resistenza a singoli farmaci e a gruppi di farmaci delle specie microbiche sotto sorveglianza sono ancora molto elevati [42]. Nonostante i notevoli sforzi compiuti finora, come gli interventi per il controllo delle infezioni nelle strutture sanitarie e la promozione dell’utilizzo appropriato degli antibiotici, in Europa l’indice composito di resistenza antimicrobica dei batteri delle ICA, raggiunge il 31,6% negli ospedali per acuti [10].
Un’analisi condotta nel 2020 su 57.412 patogeni in venti regioni/province autonome in Italia ha evidenziato che le percentuali di resistenza alle principali classi di antibiotici per gli 8 patogeni sotto sorveglianza (S. aureus, S. pneumoniae, Enterococcus faecalis, Enterococcus faecium, E. coli, K. pneumoniae, P. aeruginosa e Acinetobacter species) si mantengono elevate anche se in qualche caso sono in diminuzione rispetto agli anni precedenti [43]. Nell’uomo il consumo di antibiotici nella popolazione è diminuito del 23%, in particolare durante la pandemia di COVID-19 in cui solo tra il 2019 e il 2020, si è rilevata una diminuzione di quasi il 18%. Negli animali da produzione alimentare il consumo di antibiotici dal 2011 al 2020 è diminuito del 43%. Nonostante questo, l’uso di antibiotici ad ampio spettro è aumentato, risultando 3,5 volte superiore al consumo di antibiotici a spettro ridotto che in genere dovrebbero essere usati come terapia di prima linea [44].
Un primo studio ha evidenziato i vantaggi del sistema PCHS proponendo un nuovo approccio per l’analisi della relazione tra ambiente, igiene, prevenzione e controllo delle infezioni [25]. Tuttavia lo studio aveva il limite di non aver effettuato un “matching” dei pazienti, portando quindi a possibili bias nei risultati. Le analisi iniziali sono state successivamente estese [26] con l’introduzione della tecnica del “propensity score matching” per rendere sovrapponibili i gruppi analizzati, con l’obiettivo di generare risultati robusti che possano supportare politiche volte a ridurre lo sviluppo delle ICA e della resistenza microbica [17, 45].
Nel 2017 il Ministero della Salute Italiano ha sviluppato il Piano Nazionale di Contrasto dell’Antimicrobico-Resistenza 2017-2020 (PNCAR), prorogato a tutto il 2021; il PNCAR rappresenta lo strumento per tradurre la strategia nazionale nella pratica, fornendo un indirizzo coordinato e sostenibile per contrastare il fenomeno dell’AMR a livello nazionale, regionale e locale, mediante un approccio multisettoriale “One Health” [46]. Alcuni indicatori sintetici sono stati selezionati con l’obiettivo di monitorare i progressi nell’ambito della sorveglianza dell’uso di antibiotici, delle infezioni correlate alle cure e relativi alla percentuale di microrganismi multi-resistenti. Per quanto riguarda l’utilizzo di antibiotici negli ospedali, il piano nazionale ha raccomandato una riduzione dell’uso di antibiotici sistemici superiore al 5% e una riduzione dei flurochinoloni superiore al 10% per il 2020 rispetto al 2016. In Italia, sia a livello territoriale sia in ambito ospedaliero, l’uso di queste molecole si è notevolmente ridotto e gli obiettivi stabiliti dal PNCAR in termini di riduzione dei consumi sono stati raggiunti [47]. Sebbene le misure comprese nel PNCAR includano l’igiene delle mani e la gestione della terapia antibiotica, non viene reso esplicito il possibile contributo della sanificazione degli ambienti ospedalieri. I risultati mostrati suggeriscono che un intervento di sanificazione degli ambienti ospedalieri può ridurre in modo significativo la frequenza delle ICA e delle AMR. In particolare, l’utilizzo del PCHS ha evidenziato una riduzione dell’incidenza di ICA del 48% e di ICA resistenti ai farmaci del 53% rispetto all’uso dei sistemi di sanificazione convenzionali. Inoltre, il PCHS ha mostrato di poter ridurre di circa il 67% la frequenza di ICA gravi (dall’1,57 all’1%). Quindi, il PCHS permetterebbe di ottenere dei risparmi nella prospettiva ospedaliera Italiana di circa € 14 milioni in 5 anni, di cui 11,5 relativi alla gestione farmacologica delle antibiotico-resistenze. Questi risultati sono migliorativi rispetto agli obiettivi del PNCAR, poiché con il PCHS è possibile ridurre l’utilizzo di antimicrobici ad ampio spettro come chinoloni e fluorochinoloni dell’86% in termini di giornate di trattamento, con una riduzione delle ICA resistenti ai farmaci del 53%.
La più recente indagine italiana sulla prevalenza puntuale delle ICA in contesti ospedalieri per acuti, condotta nel 2016, ha riscontrato che la prevalenza di pazienti con almeno una ICA era dell’8,0%. Questo valore era superiore alla prevalenza nell’area Europea nel 2016-2017 (5,9%) ed è aumentato dal 2011, quando la prima indagine italiana ha rilevato una prevalenza del 6,3% [48]. Poiché questi studi hanno preso in considerazione il contesto più ampio degli ospedali per acuti, l’incidenza di ICA del 4,6% stimata dallo studio su pazienti ricoverati nei soli reparti di medicina interna, geriatria e neurologia, può essere considerata una stima conservativa.
Se estendessimo i risultati a tutti i pazienti acuti ricoverati in Italia (6.416.981 nel 2019 [38]), considerando un orizzonte temporale di 5 anni, il risparmio totale per il trattamento farmacologico delle ICA sarebbe pari a circa € 69.7 milioni. Allo stesso modo, se il PCHS sostituisse interamente la DCT in tutti gli ospedali Italiani, i risparmi per i trattamenti farmacologici sarebbero pari a circa € 317 milioni nei prossimi 5 anni, senza costi aggiuntivi per il SSN. Ancora una volta, se estendessimo i risultati alla stima più recente del numero annuale di ICA per l’Italia, pari a 641.065 [48], l’impatto annuale delle ICA resistenti in termini di trattamenti farmacologici sarebbe di circa € 135 milioni. Questo importo rappresenta solo una parte del valore più ampio di € 319 milioni stimato per il costo dell’assistenza sanitaria diretta per la gestione delle resistenze antimicrobiche in Italia, che tiene conto delle giornate aggiuntive di ricovero per la gestione di un’infezione resistente rispetto a una degenza senza infezione [49]. Nel nostro studio, la durata media della degenza ospedaliera per i pazienti con ICA era di poco superiore per il gruppo PCHS (20,08 giorni) rispetto al gruppo DCT (17,81 giorni), tuttavia, questa differenza è da attribuirsi probabilmente alle cause specifiche dei ricoveri ospedalieri nei due periodi e non ai due sistemi di sanificazione, come dimostrato dalla durata media più breve del trattamento per paziente per ICA nel gruppo PCHS rispetto al gruppo DCT (11,04 giorni contro 11,88 giorni).
Il presente studio presenta punti di forza e limiti che devono essere sottolineati. Gli studi randomizzati controllati sono considerati il “gold standard” per la stima degli effetti di trattamenti o interventi. L’assegnazione casuale dell’intervento assicura infatti che tutti i pazienti abbiano la stessa probabilità di ricevere un dato intervento, pertanto, il suo effetto sugli esiti può essere stimato confrontando direttamente gli esiti tra soggetti con intervento e senza intervento. D’altra parte, si osserva un crescente interesse nell’utilizzo di studi osservazionali (o non randomizzati) per stimare gli effetti di interventi sanitari. Negli studi osservazionali, la selezione dell’intervento è spesso influenzata dalle caratteristiche del soggetto, di conseguenza, le caratteristiche di base dei soggetti con intervento spesso differiscono sistematicamente da quelle dei soggetti senza intervento. Pertanto, è necessario tener conto delle differenze sistematiche nelle caratteristiche di base tra i soggetti nei due gruppi quando si stima l’effetto dell’intervento. In questo contesto, la tecnica del “propensity score matching” consente di progettare e analizzare studi real-world in modo da imitare alcune caratteristiche degli studi randomizzati e controllati e fornire ai decisori risultati di alta qualità in meno tempo e con costi minori [50]. Nel nostro studio, è stata applicata questa metodologia al fine di selezionare due sottogruppi di pazienti, uno gestito con la disinfezione tradizionale e uno con il PCHS, aventi le stesse caratteristiche cliniche. Questo approccio ha consentito di confermare i risultati precedentemente pubblicati, per i quali le analisi erano state eseguite senza effettuare il “matching” dei pazienti [24, 25].
Inoltre, questo studio rientra tra le poche valutazioni pubblicate che hanno indagato gli aspetti clinici ed economici della gestione dei pazienti con ICA secondo sistemi di prevenzione e, più specificamente, le attività di sanificazione. Tra queste, Poli e colleghi [51], che hanno indagato l’impatto economico della gestione delle infezioni da C. difficile in 5 ospedali Italiani, hanno evidenziato che la durata dell’ospedalizzazione è il parametro con maggiore influenza sul costo totale (87%), mentre il costo relativo alla sanificazione degli ambienti ospedalieri ha un impatto più limitato (pari solo all’8%).
Per quanto riguarda i limiti dello studio, l’identificazione dei casi di antibiotico-resistenza è stata effettuata in base al numero di terapie assunte per la gestione delle ICA, in linea con quanto adottato in studi precedenti [31]. Tuttavia, stime più precise si sarebbero potute ottenere attraverso una raccolta completa di antibiogrammi eseguiti in caso di ICA durante lo studio [24, 25]. Lo studio, che ha effettuato un’analisi nella prospettiva ospedaliera, si è focalizzato sul consumo di farmaci per la gestione delle ICA e non ha considerato altre voci di costo come i trattamenti in terapia intensiva e i costi del personale sanitario, che potrebbero avere un elevato impatto nella gestione delle infezioni.
Sebbene l’utilizzo del PCHS consenta dei risparmi del 3% nel tempo dedicato alla sanificazione rispetto all’uso di disinfettanti chimici (Appendice), questo aspetto è stato escluso dall’analisi perché si è preferito adottare un approccio conservativo.
Un’analisi sui rimborsi assicurativi ha evidenziato che le infezioni ospedaliere incidono per il 7,4% sul numero totale dei sinistri e per l’8,6% sul costo totale, mostrando i costi medi più elevati per singola pratica, superiori a € 126.000 [52] tenendo conto anche dei casi di decesso; il costo medio per sinistro non fatale è risultato pari a circa € 44.000 [53]. Nel caso in cui si applicasse il rimborso per sinistro non fatale alle ICA gravi, l’utilizzo del PCHS in tutti i reparti di medicina, geriatria e neurologia in Italia potrebbe generare risparmi di circa 27 milioni di euro all’anno.
Un altro limite dello studio riguarda la stima della popolazione considerata nell’analisi di impatto sul budget. Nello scenario base, si è fatto riferimento al numero annuo di ricoveri a livello nazionale per i reparti considerati nello studio multicentrico pre-post e sono stati applicati i costi medi stimati per paziente per il trattamento delle ICA e delle ICA resistenti per il PCHS e per la disinfezione standard. In uno scenario esteso, sono stati applicati i risultati dello studio a tutti gli ospedali Italiani. Nonostante in Italia la gestione del rischio di infezioni nosocomiali sia implementata attraverso l’applicazione di linee guida nazionali [54], i diversi centri clinici possono presentare differenze nei piani organizzativi e nei processi di sanificazione [55]. Inoltre, a livello nazionale, una certa eterogeneità può essere riscontrata in base all’efficienza del processo di sanificazione, alla posizione degli ospedali (ad es. grandi città verso aree periferiche), alle caratteristiche del personale addetto alla sanificazione, all’utilizzo di specifici antibiotici, ecc. Questa eterogeneità potrebbe aver portato a possibili bias nei risultati delle analisi, limitandone la generalizzabilità. In futuro, studi che considereranno un insieme più esteso di reparti ospedalieri e una diversità di contesti ospedalieri potranno fornire stime più accurate della frequenza delle ICA e delle relative antibiotico-resistenze al fine di migliorare l’estensione dei risultati dell’analisi a tutti i ricoveri ospedalieri in Italia.
Sebbene le conclusioni del nostro studio derivino dall’analisi dei reparti di medicina interna, riteniamo che potrebbero essere estese anche alle unità di terapia intensiva, in cui sia la prevalenza di ICA (10%) sia la resistenza antimicrobica dei microrganismi correlati alle ICA (32% delle ICA totali) sono molto maggiori [56], con conseguenti ulteriori possibili risparmi. Ulteriori studi sono attualmente in fase di sviluppo per confermare tale generalizzabilità.
Infine, un recente studio pubblicato [57] ha verificato anche la capacità antivirale del sistema di sanificazione PCHS, nell’ottica di poterlo utilizzare per il controllo e la prevenzione della diffusione del COVID-19. L’effetto del PCHS è stato testato in un pronto soccorso di un ospedale pediatrico durante la pandemia sostituendo per 2 mesi la disinfezione chimica convenzionale durante la sanificazione di routine. L’utilizzo del PCHS è stato associato a una diminuzione stabile dell’80% dei patogeni di superficie rispetto ai livelli rilevati per la disinfezione chimica (p < 0,01), accompagnata da una diminuzione fino a 2 log dei geni di resistenza (Pc < 0,01). Infine, nessun campione ambientale positivo a SARS-CoV-2 è stato rilevato nei periodi pre-PCHS o PCHS dello studio, nonostante la presenza documentata di soggetti SARS-CoV-2 positivi, a conferma del basso rischio di trasmissione del virus attraverso le superfici e rinforzando la comprovata capacità del PCHS di inattivare i virus responsabili della pandemia. Inoltre, l’attività antivirale le del sistema PCHS permane stabilmente sulle superfici trattate fino a 24 ore dal trattamento, a differenza di quella dei disinfettanti chimici che si esaurisce dopo solo 1 ora dall’applicazione. Pertanto, i nuovi elementi emersi si sommano ai vantaggi già documentati finora e possono aprire la strada per considerare il PCHS come una potenziale alternativa efficace ed ecologica alla sanificazione chimica convenzionale anche nel contesto di pandemie.
In tutto il mondo stiamo assistendo alla rapida comparsa di batteri resistenti a una ampia gamma di agenti antinfettivi, che hanno salvato finora milioni di vite. Molti decenni dopo i primi trattamenti con antibiotici, le infezioni batteriche sono tornate a essere una minaccia. La resistenza agli antibiotici è stata attribuita all’uso eccessivo e improprio di questi farmaci, nonché alla mancanza di sviluppo di nuovi farmaci da parte dell’industria farmaceutica a causa della riduzione degli incentivi economici e dei requisiti normativi sfidanti. Il centro per la prevenzione e il controllo delle malattie ha classificato un certo numero di batteri come minacce urgenti, gravi e preoccupanti, molti dei quali sono già responsabili di imporre un onere clinico e finanziario sostanziale al sistema sanitario, ai pazienti e alle loro famiglie. Sono quindi estremamente necessari sforzi coordinati per attuare nuove politiche, rinnovare gli sforzi di ricerca e perseguire misure per gestire la crisi a livello mondiale [58].
La diffusione dell’impiego di sistemi di sanificazione ambientale sostenibili, come il PCHS, potrebbe ridurre drasticamente i tassi di ICA e AMR senza costi aggiuntivi per i sistemi sanitari. In effetti, l’introduzione del PCHS come pratica di sanificazione ordinaria in 5 anni potrebbe portare a risparmi che vanno da 13,8 (analisi del caso base) a € 452 milioni (analisi su ricoveri per acuti, inclusi rimborsi assicurativi per ICA gravi, con utilizzo al 100% del PCHS).
Durata media del trattamento (giorni) nei due periodi per i diversi farmaci.
Variazione percentuale della durata del trattamento nei due periodi (PCHS vs DCT).
Analisi fabbisogni manodopera – Tabella valori manodopera del Ministero del Lavoro.
| Livello | €/ora | Distribuzione % | Valore €/ora |
|---|---|---|---|
| 2° livello | € 15,88 | 85,00% | € 13,50 |
| 3° livello | € 16,65 | 12,00% | € 2,00 |
| 4° livello | € 17,52 | 3,00% | € 0,53 |
| TOTALE | € 16,02 | ||
| Voce | Componente di costo | VALORE €/ora | |
| Analisi fabbisogni “materiali” | |||
| Macchinari | 1,40% | € 0,22 | |
| Attrezzature | 1,80% | € 0,29 | |
| Prodotti pulizie | 2,50% | € 0,40 | |
| Materiale consumabile | 2,00% | € 0,32 | |
| Materiale economale | 4,00% | € 0,64 | |
| Analisi fabbisogni “accessori” | |||
| Spese generali | 7,00% | € 1,12 | |
| Utile | 3,00% | € 0,48 | |
| €/ora RICAVO LORDO | € 19,50 | ||
Estratto dall’Allegato 5 – Capitolato tecnico.
| Codice Area | Descrizione | Aree incluse |
|---|---|---|
| MR1 | Reparti con degenza-medio rischio | “Stanze di degenza, medicheria, Deposito di Reparto, Guardiole, stanza lavoro infermieri, tisaneria, cucinetta di reparto, sala ristoro, relativi ai seguenti reparti: Pronto soccorso o DEA, day hospital, e altri reparti non compresi nell’area omogenea AR0” |
| MR3 | Corridoi e sale d’attesa-medio rischio | “Corridoi, sale di attesa interne ai reparti di degenza e delle aree di diagnosi a medio rischio, ascensori per il trasporto pazienti, soggiorni interni ai reparti” |
| MR4 | Servizi igienici delle degenze, servizi igienici del personale o comunque aperti 7 giorni a settimana | Servizi igienici interni ai reparti di degenza, ai comparti operatori e alle aree di diagnosi, (indipendentemente dall’area di rischio di appartenenza) vuotatoi, e altri locali a essi assimilabili aperti 7 giorni a settimana |
Specifica delle attività e del tempo impiegato (ore) – MR1 – Esempio basato su una camera di degenza tipo con 2 letti (m2 25).
| Descrizione attività | Frequenza | DCT Tempo impiegato | PCHS Tempo impiegato | |
|---|---|---|---|---|
| Svuotatura dei cestini portarifiuti con chiusura e trasporto al punto di raccolta dei rifiuti solidi urbani o assimilabili agli urbani e sostituzione del sacchetto e/o del contenitore | 2 interventi al giorno | 0,025 | 0,025 | |
| Spolveratura a umido e detersione compresa l’asportazione di macchie di superfici orizzontali e verticali fino a 180 cm, su arredi, presidi sanitari (letti, comodini, testata letto, tende divisorie, piantane porta-flebo comprese le ruote, tavoli servitori, carrelli, barelle, carrozzine, deambulatori, supporti, ecc.) e punti di contatto comune (telefoni, interruttori e pulsantiere, apparecchi audiovisivi, maniglie, corrimano, ecc.) punti luce, fan coil, davanzali interni, porte, vetrate e altre superfici lavabili | Giornaliera | 0,1917 | 0,1917 | |
| Spazzatura a umido con asportazione della polvere e dei rifiuti di tutte le pavimentazioni, con garze monouso e/o aspirazione | Giornaliera | 0,0208 | * | |
| Lavaggio delle pavimentazioni, previo spostamento degli arredi facilmente rimovibili. Riposizionamento a pavimento asciutto di quanto in precedenza spostato. In caso di utilizzo di lavasciuga, rifinire con detersione manuale i punti non raggiunti dal lavaggio tramite macchina | Giornaliera | 0,05 | 0,05 | |
| Detersione e disinfezione dei cestini portarifiuti, dei carrelli porta-sacco e portarifiuti | Settimanale | 0,0143 | 0,0143 | |
| Manutenzione trattamenti protettivi dei pavimenti (spray cleaning o spray buffing) | Mensile | 0,0033 | 0,0033 | |
| Deceratura con asportazione totale o parziale del film e successiva ceratura dei pavimenti | Deceratura | Semestrale | 0,0046 | 0,0046 |
| Ceratura | 0,0009 | 0,0009 | ||
| Detersione lato esterno infissi, comprese superfici vetrose, cassonetti e davanzali esterni se accessibili dall’interno nel rispetto normative sicurezza | Trimestrale | 0,0003 | 0,0003 | |
| Totale ore lavoro ATTIVITÀ CONTINUATIVE su base giorno (7/7) | 0,2875 | 0,2667 | ||
| Totale ore lavoro ATTIVITÀ PERIODICHE (da settimanale ad annuale) su base giorno (7/7) | 0,0234 | 0,0234 | ||
| ORE GIORNO COMPLESSIVE | 0,3109 | 0,29 | ||
Specifica delle attività e del tempo impiegato (ore) – MR3 – Esempio su una sezione di corridoio di reparto (m2 30).
| Descrizione attività | Frequenza | DCT Tempo impiegato | PCHS Tempo impiegato | |
|---|---|---|---|---|
| Svuotatura dei cestini portarifiuti con chiusura e trasporto al punto di raccolta dei rifiuti solidi urbani o assimilabili agli urbani e sostituzione del sacchetto e/o del contenitore | 2 interventi al giorno | 0,0083 | 0,0083 | |
| Spolveratura a umido e detersione compresa l’asportazione di macchie di superfici orizzontali e verticali fino a 180 cm, su arredi, e punti di contatto comune (telefoni, interruttori e pulsantiere, maniglie, corrimano, ecc.), fan coil, davanzali, porte, parti interne degli infissi comprese superfici vetrate, e altre superfici lavabili | 2 interventi al giorno | 0,0333 | 0,0333 | |
| Spazzatura a umido con asportazione della polvere e dei rifiuti di tutte le pavimentazioni, con garze monouso e/o aspirazione | 2 interventi al giorno | 0,0376 | 0,0188* | |
| Lavaggio delle pavimentazioni, previo spostamento degli arredi facilmente rimovibili. Riposizionamento a pavimento asciutto di quanto in precedenza spostato. In caso di utilizzo di lavasciuga, rifinire con detersione manuale i punti non raggiunti dal lavaggio tramite macchina | Giornaliera | 0,05 | 0,05 | |
| Detersione e disinfezione dei cestini portarifiuti, dei carrelli porta-sacco e portarifiuti | Settimanale | 0,0048 | 0,0048 | |
| Manutenzione trattamenti protettivi dei pavimenti (spray cleaning o spray buffing) | Mensile | 0,004 | 0,004 | |
| Deceratura con asportazione totale o parziale del film e successiva ceratura dei pavimenti | deceratura | Semestrale | 0,0055 | 0,0055 |
| ceratura | 0,0011 | 0,0011 | ||
| Detersione lato esterno infissi, comprese superfici vetrose, cassonetti e davanzali esterni se accessibili dall’interno nel rispetto normative sicurezza | Trimestrale | 0,0003 | 0,0003 | |
| Totale ore lavoro ATTIVITÀ CONTINUATIVE su base giorno (7/7) | 0,1292 | 0,1104 | ||
| Totale ore lavoro ATTIVITÀ PERIODICHE (da settimanale ad annuale) su base giorno (7/7) | 0,0156 | 0,0156 | ||
| ORE GIORNO COMPLESSIVE | 0,1448 | 0,126 | ||
Specifica delle attività e del tempo impiegato (ore) – MR4 – Esempio di servizio igienico con un gabinetto, un bidet, un piatto doccia, un lavandino, uno specchio, una mensola (m2 4).
| Descrizione attività | Frequenza | DCT Tempo impiegato | PCHS Tempo impiegato |
|---|---|---|---|
| Svuotatura dei cestini portarifiuti con chiusura e trasporto al punto di raccolta dei rifiuti solido urbani o assimilabili agli urbani e sostituzione del sacchetto e/o del contenitore | 2 interventi al giorno | 0,0167 | 0,0167 |
| Detersione e disinfezione degli idrosanitari, docce, box doccia, pareti lavabili e tutti gli accessori e arredi sanitari presenti in queste zone (compresi scovolini e porta-scovolini) | 2 interventi al giorno | 0,3 | 0,3 |
| 0,15 | 0,15 | ||
| Detersione dei dispenser per il sapone, salviette, carta igienica | 2 interventi al giorno | 0,15 | 0,15 |
| 0,075 | 0,075 | ||
| Spolveratura a umido con l’ausilio di prodotti specifici di superfici orizzontali e fino a 180 cm, termosifoni, fan coil, davanzali interni, pulsantiere, maniglie, cristalli, specchi, mensole, arredi, ecc. | 2 interventi al giorno | 0,1833 | 0,1833 |
| Spazzatura a umido con asportazione di polvere e rifiuti dai pavimenti | 2 interventi al giorno | 0,0033 | * |
| 0,0033 | * | ||
| Lavaggio e disinfezione delle pavimentazioni | 2 interventi al giorno | 0,008 | 0,008 |
| 0,008 | 0,008 | ||
| Disincrostazione dei sanitari, rubinetterie e zone limitrofe | 2 interventi alla settimana | 0,0714 | 0,0714 |
| Deragnatura | Settimanale | 0,001 | 0,001 |
| Detersione dei cestini portarifiuti, carrelli porta-sacco contenitori per la biancheria | Settimanale | 0,0095 | 0,0095 |
| Pulizia a fondo pavimenti, se necessario eseguire la disincrostazione. Preventivamente trasportare eventuali arredi e suppellettili, previa pulizia a fondo, all’esterno del locale | Mensile | 0,0012 | 0,0012 |
| Spolveratura a umido di termoconvettori, caloriferi, apparecchi di condizionamento, bocchette di aerazione, cassonetti | Mensile | 0,0066 | 0,0066 |
| Aspirazione meccanica di tutte le zone non accessibili manualmente oltre cm. 180 compresi apparecchi di illuminazione, termoconvettori, caloriferi, canaline, cassonetti, bocche di aerazione, ecc. | Ogni 4 mesi | 0,0005 | 0,0005 |
| Detersione lato esterno infissi, comprese superfici vetrose, cassonetti e davanzali esterni se accessibili dall’interno nel rispetto normative sicurezza | Trimestrale | 0,0002 | 0,0002 |
| Totale ore lavoro ATTIVITÀ CONTINUATIVE su base giorno (7/7) | 0,9691 | 0,9624 | |
| Totale ore lavoro ATTIVITÀ PERIODICHE (da settimanale ad annuale) su base giorno (7/7) | 0,019 | 0,019 | |
| ORE GIORNO COMPLESSIVE | 0,9881 | 0,9815 | |
Calcolo dei costi considerando le aree con codice MR1, MR3 e MR4.
| Descrizione | DCT | PCHS |
|---|---|---|
| Totale ore lavoro ATTIVITÀ CONTINUATIVE su base giorno (7/7) (MR1+MR3+MR4) | 1,3858 | 1,3395 |
| Totale ore lavoro ATTIVITÀ PERIODICHE (da settimanale ad annuale) su base giorno (7/7) (MR1+MR3+MR4) | 0,058 | 0,058 |
| ORE GIORNO COMPLESSIVE | 1,4438 | 1,3975 |
| COSTO ORARIO | € 19,50 | € 19,50 |
| VALORIZZAZIONE SERVIZIO GIORNO | € 28,15 | € 27,25 |
| RISPARMI | € 0,90 (= 3,20%) |
* Operazione non erogata (o erogata parzialmente) in quanto superata dall’utilizzo del PCHS, che prevede l’uso di un panno che combina le attività di spazzatura e lavaggio.
Garantire l’igiene degli ambienti di vita, comunitari e ospedalieri e lottare contro le infezioni ospedaliere e comunitarie rappresenta un caposaldo della sanità pubblica, ancora più nel contesto odierno, caratterizzato da nuove sfide da parte di microorganismi emergenti, emergenze pandemiche, patogeni resistenti agli antibiotici. Questo scenario caratterizza il panorama mondiale della sanità, e interessa in particolare il contesto italiano, che è gravato in maniera massiccia proprio da fenomeni come l’Antibiotico resistenza, raggiungendo percentuali di frequenza tra le più alte in Europa [1].
A ciò si aggiunge la raggiunta consapevolezza che l’ottica in cui bisogna sviluppare e adottare nuove tecniche di sanificazione degli ambienti deve tenere conto anche della salute di tutti gli attori del sistema Pianeta, secondo la visione della One Health: interazione ambiente-animale-uomo e degli aspetti più vantaggiosi dal punto di vista organizzativo-gestionale.
Pertanto la ricerca di nuovi strumenti che vadano in tal senso e riescano a garantire anche gli aspetti sopracitati è in una fase cruciale, tanto più nel periodo di esperienza pandemica da COVID-19 che è ancora in atto a livello globale e solo attraverso strategie globali può pertanto essere affrontato.
Secondo il rapporto ISS COVID-19 n. 12/2021 [2] e le Linee guida per il corretto utilizzo degli antisettici – disinfettanti formulate dall’Associazione Nazionale dei Medici delle Direzioni Ospedaliere per la disinfezione dei pavimenti [3], si raccomanda l’uso di soluzioni disinfettanti a base di cloro alla concentrazione di 1000 ppm (0,1% di “Cloro Attivo”) e fino a 5 minuti di tempo di contatto, ma non meno di 2 minuti, dopo una prima fase di detersione; per la disinfezione delle superfici high touch e per l’area dei servizi igienici la concentrazione di cloro può salire fino a 5000 ppm e 5 minuti di tempo di contatto. È comunque possibile l’impiego di disinfettanti equipollenti a quelli a base di cloro, purché il prodotto abbia una attività virucida di documentata efficacia in accordo con la norma UNI EN 14476. Altri prodotti efficaci sono l’alcool al 70% in volume e 30-60 secondi di tempo di contatto e quelli che liberano ossigeno, quali il perossido di idrogeno alla concentrazione del 0,5% (5000 ppm) e 5 minuti di tempo di contatto per applicazioni e stesure con panno o carta monouso e 15000 ppm e 15 minuti di tempo di contatto per applicazioni con vaporizzatori. Per le superfici che possono essere danneggiate dall’ipoclorito di sodio, utilizzare prodotti disinfettanti pronti all’uso a base di alcool e/o altri principi attivi disinfettanti a dimostrata attività virucida ai sensi della norma UNI EN 14476.
Si evidenzia che il Report non consente, in atto, l’impiego del PCHS.
Le infezioni correlate all’assistenza (ICA) sono una rilevante problematica di sanità pubblica e contribuiscono in modo significativo a generare il fenomeno della resistenza antimicrobica (Antimicrobial Resistance, AMR). L’igiene dell’ambiente e della persona si dimostrano essere i punti focali per evitare tale trasmissione e per controllare il rischio infettivo [4]. Inoltre, gli ambienti ospedalieri sono un serbatoio essenziale per la trasmissione delle ICA e l’applicazione di procedure appropriate di disinfezione/sterilizzazione delle superfici e delle strumentazioni mediche, rimangono le strategie principali per il controllo di queste infezioni [5].
Secondo quanto riportato da Epicentro dell’Istituto Superiore di Sanità, la prevalenza di ICA in Europa è del 7% (2019) e in Italia del 8,03% (2016-2017) [6].
Nella maggior parte dei casi la sanificazione tradizionale si basa sull’utilizzo di sostanze chimiche; infatti, come riportato dal Centro Nazionale Sostanze Chimiche prodotti Cosmetici e protezione del Consumatore [7], dell’Istituto Superiore di Sanità, attualmente i disinfettanti più utilizzati in ambito ospedaliero sono:
l’alcol etilico;
l’ipoclorito di sodio;
il perossido di idrogeno;
i composti d’ammonio quaternario;
l’ossido di etilene.
Tali sostanze, tuttavia, presentano un elevato impatto ambientale, non sono utilizzabili su tutti i tipi di superficie e possono essere tossiche per gli esseri umani.
Sulla base del Rapporto ISS COVID-19 [8], “Indicazioni ad interim per la sanificazione degli ambienti interni nel contesto sanitario e assistenziale per prevenire la trasmissione di SARS-CoV-2” si evince che, i coronavirus possono essere inattivati efficacemente tramite procedure di sanificazione delle superfici per mezzo di disinfettanti chimici quali:
alcol etilico al 62-71%;
perossido di idrogeno allo 0,5%;
ipoclorito di sodio allo 0,1%.
Altri agenti biocidi, come benzalconio cloruro allo 0,05-0,2% o la clorexidina digluconato allo 0,02% hanno una minore efficacia [9].
Il Report, pur non citandolo direttamente ma limitandosi a fare riferimento “all’uso di un detergente neutro”, non riporta controindicazioni sull’uso del PCHS (Probiotic Cleaning Hygiene System) in aree ospedaliere, eccetto per i locali che sono stati frequentati da un caso sospetto o confermato di COVID-19.
Al fine di eseguire una valutazione dei punti di forza e di debolezza, nonché le opportunità e le minacce, del PCHS (SWOT Analysis) e dei comparatori (disinfettanti classici), nel presente capitolo è stata effettuata una revisione della letteratura scientifica sul database online PubMed, nonché una revisione della letteratura grigia tramite motore di ricerca Google. Sono state, inoltre, prese in considerazione le Linee Guida implementate a livello Nazionale, la Normativa Italiana vigente in materia di disinfezione e sanificazione, le Linee Guida Europee che regolamentano tali pratiche, nonché altre informazioni da Siti Istituzionali (Istituto Superiore di Sanità, Ministero della Salute, etc.). Infine, per ogni metodo di disinfezione e sanificazione sono state raccolte le informazioni reperite in una breve introduzione alla SWOT Analysis.
Negli ultimi anni, la progressiva diffusione dell’ottica della clinical governance e delle decisioni basate sull’evidenza scientifica ha reso sempre più necessaria una collaborazione attiva tra società scientifiche e organismi di politica sanitaria nazionali e regionali. L’attuale quadro normativo nazionale relativo alla gestione del rischio nelle strutture sanitarie ha posto ulteriormente l’accento sull’importanza della prevenzione del rischio infettivo attraverso il controllo dei processi di sanificazione ambientale e l’introduzione di sistemi e metodiche innovative di comprovata efficacia ed efficienza in termini di costo-beneficio.
Le attività di pulizia, disinfezione, disinfestazione, derattizzazione e sanificazione, in Italia sono disciplinati dalla Legge 82/1994 che stabilisce i requisiti che devono essere soddisfatti dalle imprese che intendono intraprendere le suddette attività.
L’articolo 1 del DM 274/1997 definisce cosa si debba intendere per pulizia, disinfezione, disinfestazione, derattizzazione e sanificazione stabilendo inoltre i requisiti (di capacità economico-finanziaria, tecnico organizzativi e di onorabilità) richiesti per l’esercizio di tali attività.
I prodotti biocidi (a livello nazionale/europeo) e i Presidi Medico Chirurgici (PMC) (a livello nazionale) comprendono i disinfettanti che vantano specifiche proprietà nei confronti di microrganismi e non devono essere confusi con altri prodotti quali i detergenti o igienizzanti.
Punto chiave di tali prodotti è l’efficacia che deve essere valutata sulla base di specifiche norme tecniche europee e/o nazionali (Norme EN/UNI).
I PMC per poter essere immessi in commercio sul mercato italiano, devono essere autorizzati dal Ministero della Salute ai sensi del DPR n. 392 del 6 ottobre 1998 e del Provvedimento 5 febbraio 1999, previa valutazione degli studi presentati dai richiedenti all’Istituto Superiore di Sanità, che valuta la composizione quali-quantitativa, l’efficacia nei confronti degli organismi target, la pericolosità e la stabilità. Il DPR 392/1998 prevede il rilascio da parte del Ministero della Salute dell’autorizzazione alla produzione dei presidi medico chirurgici.
Il Regolamento (UE) 528/2012, che ha sostituito la Direttiva Biocidi 98/8/CE, riguarda l’immissione sul mercato e l’uso di biocidi e di materiali o di articoli utilizzati per la tutela dell’uomo e degli animali, per combattere organismi nocivi, quali batteri o insetti, mediante l’azione di principi attivi contenuti nel prodotto biocida. Il Regolamento ha lo scopo di migliorare il funzionamento del mercato interno attraverso l’armonizzazione delle norme relative alla messa a disposizione sul mercato e all’uso dei biocidi, garantendo anche un elevato livello di tutela della salute umana e animale e dell’ambiente. Le disposizioni del Regolamento si fondano sul principio di precauzione ponendo particolare attenzione alle categorie di persone più vulnerabili.
Il regolamento del mercato, di cui sopra, può essere svolto dall’autorità competente degli Stati Membri o dall’autorità centrale l’Agenzia Europea per le Sostanze Chimiche (European Chemicals Agency, ECHA). In Italia, il Ministero della Salute, in qualità di Autorità Competente, svolge tale attività in collaborazione con l’Istituto Superiore di Sanità e con gli istituti zooprofilattici, tenendo conto anche delle indicazioni date dall’Istituto Superiore per la Protezione e la Ricerca Ambientale (ISPRA) e dal Ministero della Transazione Ecologica (MITE), ex Ministero dell’ambiente e della Tutela del Territorio e del Mare (MATTM).
Con il Decreto ministeriale MITE del 24 settembre 2021 (in G.U. n. 236 del 2 ottobre 2021) è stato modificato il Dm MATTM del 29 gennaio 2021, con il quale sono stati adottati i Criteri Ambientali Minimi (CAM) per l’affidamento del servizio di pulizia e sanificazione di edifici e ambienti a uso civile, sanitario e per i prodotti detergenti ed entrato in vigore a giugno 2021(3).
I CAM dedicati ai servizi e ai prodotti per la pulizia mirano innanzitutto alla riduzione delle sostanze pericolose. A tal fine impongono l’acquisto e l’uso di detergenti con formulazioni migliori sotto il profilo ambientale e della tutela della salute e, prescrivendo l’impiego di elementi tessili in microfibra, l’uso di sistemi di dosaggio e di diluizione tali da evitare che dosaggi e diluizioni siano effettuate in maniera arbitraria dagli operatori, consentono di razionalizzare il consumo di prodotti detergenti e disinfettanti. Una delle novità più importanti emerse negli ultimi CAM è la possibilità di impiegare formulazioni contenenti microrganismi come sistemi di sanificazione ambientale.
L’attuazione di tali sistemi di sanificazione deve sempre far riferimento al D.L.vo 81/08, in materia di tutela e alla sicurezza nei luoghi di lavoro.
D.Lgs. 81/2008 e successive modifiche e integrazioni.
D.Lgs. 46/97 come modificato dal D.Lgs. 37/2010 (Dispositivi Medici) (i disinfettanti per DM invasivi sono classificati in classe IIb e non più IIa).
Regolamento (UE) 2017/745 del Parlamento Europeo e del Consiglio del 5 aprile 2017 relativo ai dispositivi medici.
Regolamento UE 528/2012 (biocidi) (Regolamento UE 739/2013 posticipa i tempi al 2024; Regolamento 837/2013 modifica Allegato III).
DPR 392/1998 (Presidi Medico Chirurgici).
Linee Guida dello European Centre for Prevention and Disease (ECDC, Centro per la prevenzione e il controllo delle Malattie Europeo) del 2020.
Regolamento (UE) n. 528/2012 del Parlamento Europeo e del Consiglio del 22 maggio 2012 relativo alla messa a disposizione sul mercato e all’uso dei biocidi.
Indicazioni tecniche del consiglio del sistema nazionale a rete per la protezione dell’ambiente (SNPA) relativamente agli aspetti ambientali della pulizia degli ambienti esterni e dell’utilizzo di disinfettanti nel quadro dell’emergenza CoViD-19 e sue evoluzioni- 18/03/2020.
Rapporto ISS COVID-19 n. 12/2021.
“Raccomandazioni ad interim sulla sanificazione di strutture non sanitarie nell’attuale emergenza COVID-19: ambienti /superfici Aggiornamento del Rapporto ISS COVID-19 n. 25/2020 Versione del 20 maggio 2021”.
Rapporto ISS COVID-19 n. 19/2020 Rev.
Raccomandazioni ad interim sui disinfettanti nell’attuale emergenza COVID-19: presidi medico chirurgici e biocidi Gruppo di lavoro ISS Biocidi COVID-19 Rapporto ISS COVID-19 n. 19/2020 Rev. Versione del 13 luglio 2020.
Rapporto ISS COVID-19 n. 20/2020 Rev. 2.
Indicazioni ad interim per la sanificazione degli ambienti interni nel contesto sanitario e assistenziale per prevenire la trasmissione di SARS-CoV-2. Versione 7 luglio 2020.
Decreto Ministeriale n. 274 del 7 luglio 1997 (DM 274/1997).
Decreto del Presidente della Repubblica 6 ottobre 1998, n. 392.
Provvedimento 5 febbraio 1999 del Dirigente Generale del Dipartimento per la valutazione dei medicinali e la farmacovigilanza.
In base al Rapporto ISTISAN 21/23 del Centro Nazionale Sostanze Chimiche – Istituto Superiore di Sanità, il detergente viene definito come una qualsiasi sostanza/miscela (allo stato naturale o ottenuta mediante un processo di produzione) contenente saponi e/o altri tensioattivi (anionici, cationici, non ionici e anfoteri) e destinata ad attività di lavaggio e pulizia [10].
Tutti i tensioattivi usati nei detergenti devono essere completamente biodegradabili (biodegradazione aerobica), in quanto tale processo si rivela molto importante per ridurre il più possibile gli effetti negativi che tali sostanze possono avere sull’ambiente attraverso gli scarichi civili e industriali [11].
Attraverso l’azione fisica e/o meccanica, i detergenti hanno lo scopo di rimuovere e asportare lo sporco (depositi indesiderati) e gli organismi nocivi dalla superficie esposta; da non confondere con i disinfettanti, che hanno invece lo scopo di diminuire drasticamente la presenza di batteri, funghi, e/o virus dalla superficie trattata. Inoltre, i disinfettanti non sono di libera vendita come i detergenti, ma sono soggetti a una procedura autorizzativa armonizzata a livello nazionale ed europeo per la messa a disposizione sul mercato, garantendo un elevato livello di tutela della salute umana e animale e dell’ambiente [12].
I detergenti vengono definiti tali quando possiedono un’azione pulente ai sensi del Regolamento (CE) 648/2004 [13], e possono essere così classificati: a pH acido e azione disincrostante, a pH basico e azione sgrassante, a pH neutro poco aggressivo e quindi adatti anche alle superfici più delicate.
I detergenti enzimatici sono invece dei composti neutri, derivanti dall’associazione di sostanze tensioattive ed enzimi proteolitici, utilizzati prevalentemente per il lavaggio e la detersione di dispositivi medici (strumentario chirurgico, cateteri e sonde, strumenti a fibre ottiche, apparecchi per anestesia, terapia inalante, emodialisi, endoscopia, urologia, etc.).
Si riporta di seguito la Swot Analysis elaborata per i detergenti (Tab. I).
Swot Analysis dei detergenti.
|
Strenghts (Punti di forza) |
Weaknesses (Punti di debolezza) |
|---|---|
| Efficace Facile applicabilità Eliminabile con il risciacquo Biodegradabile |
Corrosivi Tossici nell’essere umano Non hanno azione disinfettante Inutilizzabili su tutte le superfici Inefficaci su tutte le superfici |
|
Opportunities
(Opportunità) |
Threats
(Minacce) |
| Basso costo Libero mercato |
Concorrenza sul mercato |
Si definisce disinfettante un composto chimico in grado di eliminare, dopo il trattamento, i microrganismi presenti su materiale inerte con la sola eccezione di alcune spore batteriche. In base all’attività espletata sui microrganismi, i disinfettanti possono essere divisi in basso, medio e alto livello.
I disinfettanti di basso livello sono quelli capaci di distruggere diversi batteri e alcuni virus e miceti, ma non sono in grado di eliminare i bacilli tubercolari e le spore batteriche. Vengono considerati disinfettanti di basso livello i composti dell’ammonio quaternario e i fenoli in soluzione detergente. Il tempo di contatto sufficiente è di 10 minuti.
I disinfettanti di livello intermedio sono quelli capaci di distruggere tutti i batteri in fase vegetativa, la maggior parte dei virus e dei miceti, nonché in grado di inattivare il Mycobacterium tubercolosis; non hanno però un’azione sicura sulle spore. Vengono considerati disinfettanti di livello intermedio gli alcoli (alcol etilico e isopropilico al 70-90%) e i derivati fenolici. Il tempo sufficiente di contatto varia da 5 a 10 minuti.
Ai disinfettanti di alto livello appartengono quei composti chimici capaci di distruggere tutti i microrganismi in qualsiasi forma organizzativa, a eccezione di alcune spore batteriche. Vengono considerati disinfettanti di alto livello la glutaraldeide al 2%, il perossido d’idrogeno al 6%, gli ipocloriti, l’acido peracetico allo 0,2%. Il tempo di contatto varia tra i 20 e i 45 minuti.
Si riporta di seguito la Swot Analysis elaborata per i disinfettanti chimici (Tab. II).
Swot Analysis dei disinfettanti chimici.
|
Strenghts (Punti di forza) |
Weaknesses (Punti di debolezza) |
|---|---|
| Alta efficacia Eliminabili con il risciacquo Facile applicabilità |
Inutilizzabili su tutte le superfici Tossici e allergenici per l’essere umano Alto impatto ambientale Efficacia dipendente da ph e temperatura Efficacia dipendente dal tempo di contatto Efficacia dipendente dalla concentrazione Efficacia varia in base alla tipologia e alla carica microbica Efficacia diminuita dalla presenza di biofilm o materiale organico Limitata efficacia biocida nel tempo |
|
Opportunities
(Opportunità) |
Threats
(Minacce) |
| Basso costo Libero mercato Economicità di gestione |
Crescente resistenza da parte dei microrganismi Inadatti per uno sviluppo sostenibile |
Le radiazioni ultraviolette, molto utilizzate per la disinfezione, in particolare quelle di lunghezza d’onda intorno ai 265 nm, sono in grado di distruggere molte specie batteriche, danneggiandone gli acidi nucleici (il DNA e l’RNA).
Le lampade UV utilizzate nei sistemi di sterilizzazione dell’aria, hanno generalmente una lunghezza d’onda intorno ai 253 nanometri (vengono utilizzati gli UV-C, che hanno una lunghezza d’onda compresa tra 100 e 280 nm), con filtraggio di quelle inferiori a 250 nm per prevenire il rischio di produzione di Ozono (lampade “ozone free”); per le lampade UV non “ozone free” devono essere applicate sia le misure di sicurezza per il trattamento con UV (schermatura mediante contenitore in plexiglas o vetro) che quelle per il trattamento con ozono; in condizioni reali il tempo di decadimento naturale dell’ozono necessario per rendere accessibili i locali è di al minimo 2 ore. Se possibile, è preferibile eseguire i trattamenti nelle ore notturne in modo che alla ripresa del lavoro la quantità di ozono ambientale si trovi entro i limiti di sicurezza sanitaria [14].
Gli emettitori di radiazioni UV-C che possono avere funzione di pulizia, igienizzazione o disinfezione, hanno dimostrato che la potenza della luce UV-C e il tempo in cui le superfici sono esposte a questa luce variavano considerevolmente tra i prodotti di pulizia UV-C commercializzati. Se le superfici sono esposte a una radiazione UV non sufficientemente intensa, ciò potrebbe comportare una disinfezione inadeguata e conseguenti problemi di sicurezza e prestazioni.
La radiazione UV-C può essere utilizzata in sicurezza in sistemi chiusi per disinfettare le superfici, in quanto hanno scarsa capacità di penetrazione, o gli oggetti in un ambiente chiuso in cui la luce UV non fuoriesce all’esterno. Basta infatti un contenitore di plexiglass o di vetro per schermare efficacemente la radiazione UV-C. Viceversa, i sistemi tradizionali con lampade UV-C installate a parete o a soffitto che generano luce UV-C in assenza di protezione dell’utente dall’esposizione, rappresentano un potenziale pericolo in funzione della lunghezza d’onda, dell’intensità e della durata di esposizione, in considerazione del fatto che la radiazione UV-C di per sé non può essere percepita dall’essere umano in quanto non dà alcuna sensazione termica e non è visibile.
La radiazione UV-C nell’intervallo 180 nm 280 nm è in grado di produrre gravi danni a occhi e cute. Inoltre, la radiazione UV-C è un cancerogeno certo per l’uomo per tumori oculari e cutanei (Gruppo 1 A IARC) [15]. Nei luoghi in cui vengono sistematicamente utilizzate questo tipo di sorgenti, per prevenire danni da esposizioni inconsapevoli delle persone, il personale addetto deve essere adeguatamente formato, gli ambienti dove sono attive lampade germicida devono essere segnalati con opportune avvertenze di pericolo; tutte le entrate devono essere collegate a sistemi automatici che in caso di apertura involontaria, spengono le sorgenti al fine di evitare qualsiasi esposizione accidentale, anche momentanea, alla radiazione UV-C.
In relazione all’efficacia dell’azione germicida e alla capacità di sterilizzare l’ambiente o le superfici, è indispensabile tenere presente che la presenza di polvere e sporcizia sia sulla lampada che nell’ambiente o sulla superficie riduce drasticamente l’azione germicida. Donskey et al. hanno dimostrato che l’efficacia della radiazione può diminuire di 3 Log10 se le condizioni di esposizione non sono ideali (direzione non ortogonale, superfici riflettenti o ruvide, presenza di sostanza organica, etc) [16]. Pertanto, la lampada germicida dovrebbe essere accesa solo dopo una accurata pulizia dei locali in assenza di persone, ed essere regolarmente pulita secondo le modalità indicate dal costruttore.
In genere l’emissione UV delle lampade e di conseguenza l’efficacia germicida decresce con il tempo di impiego della lampada; occorre quindi sostituirla periodicamente (in genere ogni 8000h). La manutenzione di tali apparati è estremamente importante ai fini dell’efficacia e della sicurezza. In caso di rottura della lampada germicida a mercurio è necessario ventilare l’ambiente ed evitare qualsiasi contaminazione per contatto e inalazione del vapore del mercurio contenuto nella lampada, che è altamente tossico. Occorre inoltre tenere presente che la lampada dismessa o rotta va trattata come rifiuto speciale a causa della presenza di mercurio che è altamente tossico anche per l’ambiente [17].
Negli ultimi anni si sta diffondendo l’utilizzo dei LED-UV, dispositivi in grado di emettere in varie bande dell’ultravioletto (265 nm, 280 nm), con luce monocromatica estremamente pura e a ridotto angolo di emissione. Rispetto alle classiche lampade UV-C, i LED non contengono mercurio, quindi hanno un ridotto impatto ambientale; inoltre non richiedono tempo per l’attivazione e all’accensione emettono subito alla massima irradianza, con un basso consumo energetico. Alcuni studi hanno dimostrato analoga efficacia dei LED-UVC rispetto alle lampade tradizionali, ma il loro costo oggi ne limita l’utilizzo [18, 19].
Altre forme di irraggiamento che potrebbero essere prese in considerazione sono le radiazioni ionizzanti (radiazioni elettromagnetiche a corta lunghezza d’onda e alta energia), in particolare i raggi ■ (Cobalto-60), i raggi X, gli elettroni (acceleratori elettronici). Il meccanismo d’azione e i costi elevati però, limitano il loro utilizzo ai soli processi industriali: come per i gas tossici, è difficile ipotizzare l’impiego di tale tecnologia nel settore commerciale. Lo svantaggio è che i raggi ■, per essere attivi anche sui virus, richiedono alte intensità di trattamento (kGy), tempi lunghi di applicazione (diverse ore) e sono più efficienti sulle spore e sulle specie batteriche in generale (ad es. impiego nell’industria alimentare) [20].
Si riporta di seguito la Swot Analysis elaborata per le radiazioni (Tab. III).
Swot Analysis delle radiazioni (disinfettanti fisici).
|
Strenghts (Punti di forza) |
Weaknesses (Punti di debolezza) |
|---|---|
| Germicida Anti odore: distrugge particelle dei cattivi odori Antinquinante Alta efficacia Efficacia Biocida nel tempo |
Necessità di evacuare la stanza durante l’utilizzo Efficacia dipendente da tempo di esposizione e intensità Efficacia dipendente dalla distanza di applicazione che ne determina anche la massima superficie di copertura La disinfezione non avviene nelle zone d’ombra Tempi di accensione varia a seconda della superficie da coprire, l’azione germicida che si intende avere Necessità di avere più fonti per un’ambiente Efficacia dipendente da velocità dell’aria e/o umidità dell’ambiente, inquinamento dell’aria, pulizia della fonte, suscettibilità intrinseca dei singoli microorganismi Plastica e apparati elettronici possono essere danneggiati da una lunga esposizione Necessità di manutenzione (costi) Necessità di apposita segnaletica |
|
Opportunities
(Opportunità) |
Threats
(Minacce) |
| Libero mercato | Tossicità per l’uomo e per l’ambiente in ambito produttivo e di smaltimento e per l’ambiente Genotossicità diretta e indiretta legata alla produzione di ROS |
Il trattamento con getto di vapore ad alta temperatura consiste nell’utilizzo di un dispositivo in grado di emettere vapore secco, surriscaldato a temperatura elevata. Il vapore viene generato all’interno di una caldaia ad alta pressione e ulteriormente surriscaldato in una camera di espansione dove raggiunge una temperatura compresa tra 120 e 190°C, in funzione del modello impiegato. All’atto dell’erogazione da un’apposita pistola o da un beccuccio, il vapore può essere miscelato con un tensioattivo che facilita l’asportazione di grassi e di altri depositi organici dalle superfici trattate.
Il getto di vapore ad alta temperatura causa uno shock termico a seguito del quale si ha una riduzione significativa della carica batterica e virale anche in aree difficili da raggiungere con altri dispositivi, sebbene non possa essere garantita la totale sterilizzazione all’interno del trattato. I sistemi a vapore perdono efficacia nel trattamento di aria a flusso libero, mentre sono prevalentemente efficaci su superfici o nei recessi altrimenti raggiungibili da altri sistemi.
Per la disinfezione e la sterilizzazione con calore secco è necessario tener conto di due parametri: temperatura; durata di applicazione. Più alta è la temperatura, più rapidamente si ottiene la distruzione dei germi. Se i germi sono termosensibili, sono già sufficienti temperature attorno ai 60 °C per almeno 30 minuti per ottenere la loro distruzione (il tempo e la temperatura variano in base al tipo di patogeno) [21].
Il vapore secco cede molto lentamente il calore agli oggetti con cui entra in contatto; è perciò necessario sottoporre il materiale a temperature elevate e per tempi piuttosto lunghi, anche in considerazione dello spessore dell’oggetto. Esistono numerosi apparecchi che utilizzano questo principio, adatto particolarmente per la disinfezione di superfici porose (abbigliamento, arredi in tessuto, ecc.) [14].
Al fine di assicurare la necessaria efficacia, devono essere specificate almeno le condizioni minime necessarie per le diverse tipologie di superfici: velocità di passaggio con il getto di vapore, numero di passaggi, distanza dalla superficie da trattare). Qualora il vapore sia utilizzato su grandi quantità di materiale e/o per periodi continuativi di tempo abbastanza lunghi, l’uso di vaporizzatori dovrebbe essere effettuato in locali separati, da ventilare abbondantemente dopo l’applicazione del vapore al fine di evitare il trasferimento di eventuali contaminanti dai tessuti trattati all’operatore mediante aerosol.
Si riporta di seguito la Swot Analysis elaborata per il calore (Tab. IV).
Swot Analysis del calore (disinfettante fisico).
|
Strenghts (Punti di forza) |
Weaknesses (Punti di debolezza) |
|---|---|
| Germicida Agisce contro acari e polvere Sicuro per l’ambiente Economico Agisce bene su superfici non porose ma utilizzabile anche su quelle porose Facile applicabilità |
Necessità di evacuare la stanza durante l’utilizzo e ventilare dopo l’applicazione Efficacia dipendente da temperatura, tempo di esposizione, distanza di applicazione e suscettibilità intrinseca dei singoli microorganismi Oggetto/superficie deve essere termoresistente e preferibilmente penetrabile al vapore Tempo necessario variabile in base anche allo spessore degli oggetti/superfici |
|
Opportunities
(Opportunità) |
Threats
(Minacce) |
| Libero mercato | - |
Per Probiotic Cleaning Hygiene System (PCHS) si intende un nuovo sistema di pulizia che prevede l’impiego di un prodotto sanificante, costituito da detergenti ecologicamente sostenibili e contenente selezionate spore di probiotici del genere Bacillus. Questi batteri sono in grado di colonizzare le superfici su cui vengono applicati, contrastando la proliferazione delle altre specie batteriche e/o fungine potenzialmente patogene, grazie a una azione di esclusione competitiva, garantendo stabilità nel tempo [22].
La ricerca sperimentale ha dimostrato che il PCHS è in grado di ridurre costantemente i patogeni di superficie fino al 90% in più rispetto ai disinfettanti convenzionali [23, 24] senza indurre la selezione di ceppi farmacoresistenti, come dimostrato dalle analisi molecolari dell’intero resistoma del microbiota presente sulle superfici trattate [24, 25]. In uno studio multicentrico, il sistema ha dimostrato di ridurre l’incidenza cumulativa di ICA da un 4,8% globale al 2,3%, rispetto alla disinfezione chimica. Inoltre, i geni di resistenza antimicrobica contenuti dai microbi di superficie sono diminuiti fino al 99% e costantemente il consumo di farmaci antimicrobici associato all’insorgenza di ICA ha mostrato una diminuzione globale del 60,3%, con una diminuzione del 75,4% dei costi associati [25, 26].
Secondo lo studio di Vandini et al., risalente all’anno 2014, le nuove strategie di sanificazione determinano dirette ricadute economiche, con risparmi di circa il 5-15% rispetto alle tradizionali tecniche di detersione e disinfezione chimica [22].
Uno studio più recente (2020), afferma che applicando gli stessi costi di acquisizione delle diverse tecniche di sanificazione (Conventional Chemical Cleaning, CCC e PCHS), il passaggio progressivo dalla disinfezione chimica al PCHS comporterebbe notevoli risparmi sui costi sin dal primo anno di implementazione della nuova tecnica. È stato stimato un risparmio di circa 14 milioni di euro nei reparti italiani di medicina interna/geriatra e neurologia, nei prossimi cinque anni [27].
In circa dieci anni di utilizzo della nuova tecnologia di sanificazione PCHS nelle strutture sanitarie, non sono state riscontrate infezioni da Bacillus nei pazienti ivi ricoverati [26, 28], compresi i pazienti anziani (età media > 70 anni), comunque caratterizzati da una lieve immunodeficienza età-correlata [25].
Tuttavia, come riportato dallo studio di Tarricone et al., per motivi precauzionali, non sono stati finora inclusi negli studi reparti che ospitano pazienti affetti da immunodeficienza grave, quali pazienti trapiantati o affetti da leucemia. Inoltre, nei campioni di Bacillus non è stata rilevata alcuna acquisizione di nuovi geni di resistenza, dimostrando la loro stabilità genetica elevata, nonostante il continuo contatto con agenti patogeni resistenti [27]. La stabilità genetica del PCHS risulterebbe quindi fondamentale nel prevenire lo svilupparsi di forme di Bacillus con resistenza antimicrobica (AMR).
Il PCHS si è dimostrato attivo ed efficace su numerose superfici, sia in vitro che in campo, su una vasta gamma di microrganismi, tra i quali S. aureus, P. aeruginosa, K. pneumoniae, E. faecalis, A. baumannii e C. albicans [23]. In particolare, in vitro è stato testato su materiali in ceramica, gomma, PVC e vetro-china, dimostrandosi efficace nel ridurre la carica batterica su tali superfici di 7 log entro 1 ora di tempo dall’applicazione; in campo, i probiotici si sono dimostrati efficaci nella sanificazione di corridoi, pavimenti, e lavelli di servizi igienici [23, 24, 29].
La compatibilità del PCHS con altri sistemi di sanificazione non è stata studiata. Tuttavia, essendo il PCHS un sistema di sanificazione basato sull’azione di probiotici, potrebbe essere incompatibile con altri sistemi di disinfezione chimici e/o fisici, mirati a distruggere indistintamente i microorganismi presenti sulle superfici oggetto di sanificazione.
L’utilizzo del PCHS agisce positivamente sull’impatto ambientale delle manovre di sanificazione in modo indiretto, riducendo l’impiego di disinfettanti chimici e fisici inquinanti. Attraverso il sistema PCHS, infatti, è possibile attuare una significativa riduzione dei consumi, secondo Vandini et al., stimata essere di: “Kg di rifiuti materiali -30/40%, Kg prodotti /detergenti -4/12%, Kg prodotti chimici pericolosi -40/50%, risorse idriche ed energetiche -15/28%” [22].
Il sistema PCHS è gestito tramite un apposito portale, il portale ACC (Always Connected Copma), che permette la gestione del sistema in maniera interattiva, pianificando e monitorando il processo di sanificazione in ogni sua fase, con trasparenza del processo di gestione e rendicontazione [22].
Da un punto di vista organizzativo, l’introduzione del PCHS non prevede alcuna modifica dell’operatività quotidiana e quindi nessuna interferenza con l’attività del reparto/servizio. È invece fondamentale la presentazione, da parte dell’azienda produttrice, dei protocolli operativi nonché delle nuove attrezzature utilizzate durante il tutto il processo di gestione oltre che la formazione specifica agli operatori per il corretto ed efficace utilizzo del nuovo sistema di sanificazione. Il sistema PCHS prevede anche un controllo microbiologico nelle aree a Medio Rischio come misura dell’esito finale del processo di sanificazione, attraverso specifici Indicatori di Risultato Microbiologico in conformità con le “Linee di indirizzo sulla valutazione del processo di sanificazione ambientale nelle strutture ospedaliere e territoriali per il controllo delle Infezioni Correlate all’Assistenza (ICA)” [30]. Per quanto concerne, invece, le procedure di smaltimento si specifica che i rifiuti prodotti dalle attività del gestore del servizio di pulizia vengono smaltiti dal gestore stesso attraverso aziende specializzate nello smaltimento e recupero rifiuti.
Si riporta di seguito la Swot Analysis elaborata per il PCHS (Tab. V).
Swot Analysis del PCHS.
|
Strenghts (Punti di forza) |
Weaknesses (Punti di debolezza) |
|---|---|
| Efficacia rispetto a disinfettanti convenzionali Azione innovativa Ecologicamente sostenibile Riduzione dell’impatto ambientale rispetto alle procedure di disinfezione classiche Non tossico per l’uomo Grande stabilità genetica, no AMR Utilizzabile su molte tipologie di superfici |
Non studiato il rischio in reparti ospitanti pazienti immunocompromessi (aree ad alto e altissimo rischio degli ospedali) Compatibilità con altri sistemi di disinfezione non studiata |
|
Opportunities
(Opportunità) |
Threats
(Minacce) |
| Basso costo Mercato in espansione Sensibilità salvaguardia ambiente Organizzazione semplice, programmazione puntuale Gestione interattiva e continuativa |
Presenza di nuova concorrenza |
Il PCHS è un sistema di sanificazione innovativo che agisce tramite applicazione di selezionate spore di probiotici del genere Bacillus (non patogeni per l’uomo), che colonizzano le superfici su cui viene applicato, impedendo la proliferazione di altri microrganismi con potenzialità patogene verso l’uomo.
Come emerge dall’analisi effettuata, il sistema PCHS presenta molti punti di forza e alcune debolezze.
I dati di efficacia [23, 24], stabilità (intesa come assenza di evidenza di mutazioni patogene o resistenti secondo i dati disponibili) [22, 25, 26] e assenza di patogenicità nell’uomo [26, 28], sottolineano la possibilità di impiegare questo nuovo metodo di sanificazione sia in ambito ospedaliero che civile.
I vantaggi dal punto di vista dell’assenza di patogenicità nell’uomo consentirebbero un chiaro vantaggio organizzativo-gestionale nell’estrinsecazione delle manovre di sanificazione: molti dei disinfettanti classici prevedono una prolungata ventilazione degli ambienti dopo l’uso e la necessità di ridurre o azzerare il personale presente all’interno dei locali durante tali manovre; questo non si renderebbe necessario durante l’applicazione del PCHS, mezzo che non richiede di vacare i locali durante le fasi di applicazione in quanto non presenta né tossicità né patogenicità per l’uomo.
Il dato di stabilità risulta essere molto importante, in quanto un prodotto volto a evitare lo svilupparsi di resistenze microbiche presenta innumerevoli vantaggi sia dal punto di vista economico, sia dal punto di vista della prevenzione di eventuali resistenze microbiche: la stabilità genetica dimostrata dal PCHS rende improbabili eventuali mutazioni, che potrebbe inoltre portare a una riduzione delle antibiotico-resistenze causate dall’uso dei disinfettanti classici. In considerazione del problema ingravescente legato alle resistenze microbiche sia dal punto di vista economico che di salute globale [31], il PCHS potrebbe offrire una valida alternativa di sanificazione mirata a prevenire lo svilupparsi di microrganismi resistenti alle terapie.
Oltre all’efficacia e alla stabilità, un altro importante vantaggio nell’impiego del PCHS è rappresentato dai costi, favorevoli rispetto a quelli dei disinfettanti classici, sia in maniera diretta, che attraverso la prevenzione dei costi dovuti allo sviluppo di patogeni resistenti, causato dall’impiego dei disinfettanti classici [22, 24, 25, 27].
Dal punto di vista gestionale-organizzativo, il PCHS può essere gestito tramite un apposito portale (ACC) in maniera interattiva, con pianificazione, monitoraggio e trasparenza, del processo di sanificazione e rendicontazione [22].
Un vantaggio rappresentato dal PCHS è quello di essere ecologicamente sostenibile e di ridurre notevolmente l’inquinamento ambientale prodotto dalle manovre di disinfezione che utilizzano i disinfettanti classici [22], riducendo sia l’impiego di inquinanti che lo spreco di risorse idriche ed energetiche.
Il PCHS presenta degli svantaggi: basandosi sul meccanismo competitivo innescato da probiotici, l’impiego in concomitanza di altri detergenti/disinfettanti nullificherebbe la sanificazione tramite PCHS; inoltre, sebbene la sicurezza sia stata testata, il rischio connesso all’utilizzo di PCHS non è stato testato in reparti con pazienti immunocompromessi.
In conclusione, oltre a essere efficace ed economicamente vantaggioso, il PCHS presenta dei punti di forza molto rilevanti nel panorama attuale, in cui assumono sempre più importanza le caratteristiche di sicurezza e biosostenibilità: oltre a ridurre il rischio di insorgenza di resistenze microbiche, infatti, il PCHS riduce notevolmente l’impatto ecologico delle manovre di sanificazione rispetto ai disinfettanti classici, garantendo, allo stesso tempo, la sicurezza di pazienti e lavoratori presenti nei locali in cui vengono applicate le procedure di sanificazione, visto l’impiego di probiotici non patogeni nell’uomo.
Tutti i punti sopracitati danno anche una indicazione sul framework organizzativo a cui è orientato questo tipo di prodotto: l’ottica di uno sviluppo sostenibile, intendendo non solo una sostenibilità di tipo economico ma anche ambientale.
Gli orizzonti futuri prevedono ormai di non poter più transigere su questi aspetti: la tutela dell’ambiente e la salute dell’intero pianeta, salvaguardando l’interazione tra l’uomo e le altre componenti essenziali presenti sulla Terra.
La Legge 24/2017 sulla sicurezza delle cure ha richiamato l’attenzione sull’importanza di consolidare, a livello istituzionale nazionale, l’attività di promulgazione di linee guida basate sull’evidenza scientifica e raccolte in raccomandazioni, al fine di meglio indirizzare le attività sanitarie di prevenzione e cura.
L’esercizio normativo ha aperto peraltro la prospettiva della valorizzazione e della condivisione di buone pratiche in quegli ambiti o argomenti ove non vi fosse ancora sufficiente sperimentazione scientifica a sostegno di evidenze da raccogliere in raccomandazioni.
Capita peraltro che locuzioni come raccomandazioni, linee guida e buone pratiche, pur comunemente utilizzate e strettamente interconnesse, siano spesso intese differentemente a seconda dei contesti e dei destinatari.
In questo quadro composito, s’inseriscono anche le raccomandazioni nazionali attualmente disponibili su sanificazione e disinfezione degli ambienti sanitari, in relazione alle quali è obiettivo di questo capitolo delineare alcuni punti e aspetti migliorabili alla luce di aggiornate evidenze scientifiche riguardanti nuove tecnologie, risultate sicure ed efficaci per la gestione del rischio legato alle infezioni correlate all’assistenza.
Il glossario del Ministero della Salute [2], riprendendo una precedente definizione IOM, parla di Linee guida basate sulle evidenze (evidence-based guidelines), definendole “raccomandazioni di comportamento clinico elaborate mediante un processo di revisione sistematica della letteratura e delle opinioni degli esperti, con lo scopo di aiutare clinici e pazienti a decidere le modalità assistenziali più appropriate in specifiche situazioni cliniche; precisando che la loro adozione consente di ridurre la variabilità nella pratica clinica e a migliorare gli esiti di salute”.
Nel contesto italiano la Legge 24/2017, all’articolo 5 “Buone pratiche clinico-assistenziali e raccomandazioni previste dalle linee guida”, si afferma che le linee guida e gli aggiornamenti delle stesse sono integrati nel Sistema nazionale per le linee guida (SNLG), e che l’Istituto Superiore di Sanità (ISS) pubblica nel proprio sito internet le linee guida e gli aggiornamenti delle stesse indicati dal SNLG. Nella presentazione del nuovo SNLG [3] si afferma che le LG di pratica clinica sono uno strumento di supporto decisionale finalizzato a consentire che, fra opzioni alternative, sia adottata quella che offre un migliore bilancio fra benefici ed effetti indesiderati, tenendo conto della esplicita e sistematica valutazione delle prove disponibili, commisurandola alle circostanze peculiari del caso concreto e condividendola, laddove possibile, con il paziente o i caregivers. Questa definizione si ritrova coerentemente sia nel glossario del Manuale operativo “Procedure di invio e valutazione di Linee Guida per la pubblicazione nell’SNLG [4] sia nel glossario dell’Osservatorio nazionale delle buone pratiche sulla sicurezza nella sanità [5].
Nel manuale metodologico per la produzione di linee guida di pratica clinica [6] predisposto dal Centro Nazionale per l’Eccellenza Clinica, la Qualità e la Sicurezza delle Cure dell’ISS, si ripropone la definizione IOM e si afferma che le LG, rappresentano il punto di riferimento più importante per molti medici e pazienti, uno standard di qualità dell’assistenza e uno strumento essenziale per prendere molte decisioni di politica sanitaria. Si precisa inoltre che, essendo il frutto di una revisione sistematica della letteratura con una valutazione esplicita della qualità delle prove e la formulazione di raccomandazioni la cui forza e direzione è basata su giudizi trasparenti, le LG si differenziano dalle conferenze di consenso, dai position papers, dai percorsi diagnostico-terapeutici assistenziali, dai protocolli tecnico-operativi, dai pareri di esperti come pure dai criteri di appropriatezza d’uso di tecnologie e dispositivi sanitari.
Infine, sempre nel Manuale operativo Procedure di invio e valutazione di Linee Guida per la pubblicazione nel SNLG, si parla di LG pubblicabile nel SNLG definito come un documento contenente raccomandazioni a contenuto clinico o clinico-organizzativo per la pratica professionale connessa all’esecuzione delle prestazioni sanitarie con finalità preventive, diagnostiche, terapeutiche, palliative, riabilitative e di medicina legale (art 5, comma 1, Legge 24/2017) sviluppate attraverso un processo sistematico di revisione critica delle evidenze disponibili e che offra una valutazione chiara dei rischi e dei benefici di opzioni alternative.
All’articolo 5 della Legge 24/2017, si afferma che gli esercenti le professioni sanitarie, nell’esecuzione delle prestazioni sanitarie con finalità preventive, diagnostiche, terapeutiche, palliative, riabilitative e di medicina legale, si attengono, salve le specificità del caso concreto, alle raccomandazioni previste dalle linee guida (...). In mancanza delle suddette raccomandazioni, gli esercenti le professioni sanitarie si attengono alle buone pratiche clinico-assistenziali.
Nella presentazione del nuovo SNLG [3] si afferma che sotto questa accezione possano essere considerati svariati documenti evidence o anche consensus based, nelle more della produzione di un sufficiente numero di LG, purché siano attentamente selezionate secondo criteri espliciti. Si specifica inoltre che nelle more della pubblicazione nel SNLG di LG adeguate per numero (e qualità) ai fabbisogni, si vuole contribuire a definire le buone pratiche clinico – assistenziali, come ad esempio LG internazionali di elevata qualità, position statements e raccomandazioni di agenzie e istituzioni nazionali/internazionali o di società scientifiche e low or negative value lists.
Nel Manuale operativo “Procedure di invio e valutazione di Linee Guida per la pubblicazione nell’ SNLG” [3] e nel glossario dell’Osservatorio nazionale delle buone pratiche sulla sicurezza nella sanità [6] per buone pratiche clinico-assistenziali si intendono tutte le pratiche clinico-assistenziali generalmente ritenute efficaci, sicure e appropriate dalla comunità scientifica internazionale perché basate su solide prove di efficacia o su un generale consenso sulle pratiche consolidate negli anni.
A questo punto occorre precisare che oltre alle buone pratiche clinico assistenziali, vi sono le buone pratica per la sicurezza dei pazienti, definite nel glossario dell’Osservatorio nazionale delle buone pratiche sulla sicurezza nella sanità [6] una pratica per la sicurezza dei pazienti – basata su e realizzata in conformità ai principi della scienza della sicurezza, dell’Evidence Based Practice (EBP), dell’ergonomia o del Miglioramento Continuo della Qualità (MCQ) – la cui efficacia nel migliorare la sicurezza e/o nel ridurre i rischi e i danni al paziente derivanti dall’assistenza sanitaria, sia dimostrata in più di una struttura, previo adattamento al contesto e alla situazione locale. Deve essere sostenibile (i costi di implementazione devono essere dichiarati) e rappresentata in accordo ai principi su cui si basa. Deve rispettare ed essere rispondente alle preferenze, ai bisogni e ai valori della persona.
Nel sito dell’Agenzia nazionale per i servizi sanitari regionali (Agenas) dedicato alla Call for good practice [7] si trova inoltre una descrizione delle pratiche per la sicurezza come pratiche/interventi/comportamenti che abbiano come finalità il miglioramento della sicurezza per i pazienti e/o la riduzione dei rischi e dei danni al paziente derivanti dall’assistenza sanitaria (o, più in generale, dovuti all’esposizione al sistema sanitario); tra queste, sulla base di criteri che includono efficacia, trasferibilità, sostenibilità, vengono individuate le buone pratiche.
Relativamente alle Raccomandazioni occorre distinguere quelle a cui si fa riferimento nelle linee guida, di cui all’art. 5 della legge 24/2017, da quelle prodotte da altri organismi nazionali o locali (Raccomandazioni del Ministero della Salute, Raccomandazioni regionali, eccetera).
Il Ministero della Salute nella premessa alla prima Raccomandazione per la prevenzione degli eventi sentinella [8] afferma che le c.d. “Raccomandazioni Ministeriali” costituiscono “un sistema di allerta per quelle condizioni cliniche e assistenziali a elevato rischio di errore, con l’obiettivo di mettere in guardia gli operatori sanitari riguardo alcune procedure potenzialmente pericolose (che possono causare gravi e fatali conseguenze ai pazienti), fornire strumenti efficaci per mettere in atto azioni che siano in grado di ridurre i rischi e promuovere l’assunzione di responsabilità da parte degli operatori per favorire il cambiamento di sistema. Si dichiara inoltre che lo scopo di queste Raccomandazioni è quello di offrire agli operatori sanitari informazioni su condizioni particolarmente pericolose, che possono causare gravi e fatali conseguenze ai pazienti e che esse si propongono di aumentare la consapevolezza del potenziale pericolo di alcuni eventi, indicando le azioni da intraprendere per ridurre gli errori”.
Lo stesso Ministero della Salute nel proprio sito web [9] dichiara che le Raccomandazioni del Ministero sono documenti specifici con l’obiettivo di offrire strumenti in grado di prevenire gli eventi avversi, promuovere l’assunzione di responsabilità e favorire il cambiamento di sistema. Il glossario dell’Osservatorio nazionale delle buone pratiche sulla sicurezza nella sanità [10] parla di Raccomandazioni per la prevenzione degli eventi avversi e le definisce come indicazioni clinico organizzativo assistenziali su condizioni/situazioni che possono causare gravi e/o fatali conseguenze ai pazienti. Hanno l’obiettivo di:
aumentare la consapevolezza del potenziale pericolo di alcune circostanze;
fornire strumenti per gestire il rischio clinico e prevenire gli eventi avversi;
promuovere l’assunzione di responsabilità da parte degli operatori e dei policy-makers; e costituiscono documenti di riferimento per la valutazione degli eventi sentinella.
Queste indicazioni pubblicate dall’ISS nel luglio 2020 hanno l’obiettivo di relazionare sui dati disponibili relativamente alle modalità di trasmissione del virus SARS-CoV-2, alla sua potenzialità di contaminare e persistere nell’ambiente e su superfici inanimate. Il documento riassume inoltre le conoscenze sull’attività dei disinfettanti nei confronti dei virus, e dei Coronavirus in particolare, e sottolinea l’importanza di integrare gli interventi di sanificazione ambientale fra le misure di prevenzione e controllo di COVID-19.
Il documento fornisce inoltre indicazioni circa le modalità di sanificazione dei locali che hanno ospitato pazienti affetti o sospetti di avere acquisito la malattia nel contesto sanitario, nelle strutture aperte al pubblico e nell’ambiente domestico.
Tra le evidenze scientifiche riportate nel documento e di particolare interesse risultano quelle che dimostrano che i coronavirus, tra cui gli agenti eziologici di SARS e di MERS, possono persistere sulle superfici inanimate come metalli, vetro o plastica per più di 9 giorni (Tab. I), ma possono essere inattivati efficacemente tramite procedure di disinfezione delle superfici per mezzo di:
Inattivazione dei coronavirus da parte di diversi tipi di agenti biocidi nei carrier test [11].
| Agente biocida | Conc. % | Virus | Ceppo/ Isolato | Volume/ materiale μL/acciaio inox | Carica organica | Tempo esposizione min | Riduzione infettività virale (log10) |
|---|---|---|---|---|---|---|---|
| Alcol etilico | 71 | TGEV | Non noto | 50 | Nessuna | 1 | 3,5 |
| 71 | MHV | Non noto | 50 | Nessuna | 1 | 2,0 | |
| 70 | TGEV | Non noto | 50 | Nessuna | 1 | 3,2 | |
| 70 | MHV | Non noto | 50 | Nessuna | 1 | 3,9 | |
| 70 | HCoV | Ceppo 229E | 20 | Siero 5% | 1 | > 3,0 | |
| 62 | TGEV | Non noto | 50 | Nessuna | 1 | 4,0 | |
| 62 | MHV | Non noto | 50 | Nessuna | 1 | 2,7 | |
| Benzalconio cloruro | 0,04 | HCoV | Ceppo 229E | 20 | Siero 5% | 1 | < 3,0 |
| Ipoclorito di sodio (Cloro attivo) | 0,5 | HCoV | Ceppo 229E | 20 | Siero 5% | 1 | > 3,0 |
| 0,1 | HCoV | Ceppo 229E | 20 | Siero 5% | 1 | > 3,0 | |
| 0,06 | TGEV | Non noto | 50 | Nessuna | 1 | 0,4 | |
| 0,06 | MHV | Non noto | 50 | Nessuna | 1 | 0,6 | |
| 0,01 | HCoV | Ceppo 229E | 20 | Siero 5% | 1 | < 3,0 | |
| Glutaraldeide | 2 | HCoV | Ceppo 229E | 20 | Siero 5% | 1 | > 3,0 |
| Orto-ftalaldeide | 0,55 | TGEV | Non noto | 50 | Nessuna | 1 | 2,3 |
| 0,55 | MHV | Non noto | 50 | Nessuna | 1 | 1,7 | |
| Perossido di idrogeno | Vapori a conc. non nota | TGEV | Ceppo Purdue tipo 1 | 20 | Nessuna | 2-3 h | 2,9-5,3* |
PVC: PolivinilCloruroVinile; Teflon® Politetrafluoroetilene; MERS: Sindrome Respiratoria Medio-Orientale; HCoV: coronavirus umano; TGEV: virus della gastroenterite trasmissibile; MHV: virus dell’epatite murina; SARS: Sindrome Respiratoria Severa Acuta.
alcol etilico al 62-71%;
perossido di idrogeno allo 0,5%;
ipoclorito di sodio allo 0,1% cloro attivo per almeno 1 minuto.
Altri agenti biocidi, come benzalconio cloruro allo 0,05-0,2% o la clorexidina digluconato allo 0,02% hanno mostrato una minore efficacia mentre tra i diversi germicidi sanitari, quelli con una concentrazione di etanolo al 70% si sono dimostrati più efficaci rispetto allo 0,06% di ipoclorito di sodio dopo un minuto di contatto su superfici dure. I test effettuati su SARS-CoV-1 hanno dimostrato che l’ipoclorito di sodio è efficace alle concentrazioni di 0,05 e 0,1% solo cinque minuti dopo il contatto. In letteratura però sono presenti evidenze secondo le quali una più alta diminuzione di carica virale e una più rapida tempistica di efficacia è raggiungibile anche grazie a una più alta concentrazione di cloro attivo (0,5%). Questo ultimo dato però non preclude l’importanza dell’ipoclorito, soprattutto in ambito ospedaliero, utilizzato per le grandi superfici, in quanto privo di infiammabilità e della rapida vaporabilità caratteristiche dell’etanolo. I prodotti disinfettanti a base fenolica diminuiscono significativamente il titolo di coronavirus solamente dopo 10 minuti dall’applicazione.
Risultati simili sono stati ottenuti utilizzando detergenti per la casa contenenti lauril etere solfato di sodio, poliglicosidi alchilici e cocamide dietanolammide. Anche i vapori di perossido di idrogeno risultano possedere attività virucida.
Pertanto, l’efficacia disinfettante è fortemente compromessa se prodotti germicidi non sono utilizzati seguendo le indicazioni della scheda tecnica e il tempo di contatto e inferiore a quello indicato.
Nel complesso, SARS-CoV-2 può essere altamente stabile in un ambiente favorevole, ma è anche suscettibile ai metodi di disinfezione standard, e sono applicabili tutti i prodotti di dimostrata efficacia secondo la norma ISO EN 14476. Per contro non si rilevano a oggi evidenze in letteratura che dimostrino l’efficacia della sanificazione mediante ozono su superfici contaminate da SARS-CoV-2.
La norma EN 14476 regolamenta le prove che un disinfettante deve sostenere per valutarne l’attività virucida e stabilisce di testare il prodotto su due virus di prova, uno dei quali è il poliovirus, virus nudo particolarmente resistente.
Questo documento offre una panoramica relativa all’ambito della sanificazione di superfici e ambienti interni non sanitari per la prevenzione della diffusione dell’infezione COVID-19. Le indicazioni si basano sulle più recenti evidenze scientifiche relative alla trasmissione del SARS-CoV-2. Presenta procedure e sistemi di sanificazione/disinfezione generati in situ e altre tecnologie utilizzabili per la sanificazione degli ambienti di strutture non sanitarie, compreso il miglioramento dell’aria degli ambienti. Per i diversi sistemi di sanificazione/disinfezione sono descritti gli aspetti tecnico-scientifici, l’ambito normativo e il pertinente uso.
Tra gli elementi di maggiore interesse si ricorda che le linee guida dello European Centre for Prevention and Disease (ECDC, Centro per la Prevenzione e il Controllo delle Malattie Europeo) del 2020 [13], di quello statunitense (Centers for Disease Control and Prevention; CDC) del 2019 [14] e delll’OMS nell’ambito del programma “Infection prevention and control” [15], avevano indicato come la pulizia con acqua e normali detergenti neutri associata all’utilizzo di prodotti disinfettanti fosse sufficiente per la decontaminazione delle superfici.
La “disinfezione” si riferisce al processo mediante il quale viene ridotta la carica microbica. La riduzione necessaria a far sì che un oggetto/superfici/ ecc. possa definirsi disinfettato varia a seconda dell’organismo target preso in considerazione – ad esempio per le superfici è richiesta una riduzione pari a 4 log (10.000 unità) per virus e batteri e 3 log (1.000 unità) per i funghi. In base alla BPR Guidance Vol. II B+C [16] quando si cita la “disinfezione degli ambienti” (room disinfection) si intende la disinfezione delle superfici e nello specifico l’abbattimento della carica microbica su pareti, soffitti, pavimenti, superfici esterne dell’arredamento/equipaggiamento presenti in locali dove un disinfettante/sanitizzante è applicato per via aerea (airborne) tramite diffusione per aerosolizzazione, fumigazione, vaporizzazione o in forma di gas, escluso il gas plasma. Il termine “disinfezione delle superfici” è chiaramente appropriato per prodotti applicati manualmente (spray, salviette imbibite, straccio, ecc.).
I principi attivi maggiormente utilizzati nei prodotti disinfettanti autorizzati a livello esclusivamente nazionale (Presidi Medico Chirurgici, PMC) e nazionale/europeo (biocidi) sono l’etanolo e altri alcoli, i sali di ammonio quaternario (ad es. cloruro di didecil dimetil ammonio, cloruro di alchil dimetilbenzilammonio), il perossido d’idrogeno e il sodio ipoclorito. Le concentrazioni da utilizzare e i tempi di contatto da rispettare per ottenere un’efficace azione disinfettante sono dichiarate sull’etichetta apposta sui prodotti disinfettanti stessi, sotto la responsabilità del produttore. Quest’ultimo, infatti deve presentare test di verifica dell’efficacia contro uno o più microorganismi bersaglio per l’autorizzazione del prodotto PMC/biocida. A oggi sul mercato, sono disponibili diversi disinfettanti autorizzati che garantiscono l’azione virucida. Pertanto, non è opportuno indicare a priori per un determinato principio attivo una concentrazione o un tempo di contatto efficaci poiché questi parametri sono dimostrati, verificati e, di conseguenza, individuati in funzione di ogni singolo prodotto. In merito al tipo di prodotti disinfettanti, è possibile trovare indicazioni più precise nel Rapporto ISS COVID-19 n. 19/2020 Rev. – Raccomandazioni ad interim sui disinfettanti nell’attuale emergenza COVID-19: presidi medico-chirurgici e biocidi. Versione del 13 luglio 2020.
Organismi nazionali e internazionali e i dati derivanti dai PMC attualmente autorizzati suggeriscono, come indicazioni generali per la disinfezione delle superfici, a seconda della matrice interessata, i principi attivi riportati in Tabella II.
Principi attivi per la disinfezione delle superfici suggeriti da Organismi nazionali e internazionali e derivanti dai PMC attualmente autorizzati. Il documento descrive vari sistemi per la disinfezione/sanificazione come quello mediante ozono, quello con cloro-attivo, con perossido di idrogeno [12].
| Superficie | Detergente |
|---|---|
| Superfici in pietra, metalliche o in vetro escluso il legno | Detergente neutro e disinfettante virucida - sodio ipoclorito 0,1% o etanolo (alcol etilico) al 70% o altra concentrazione, purché sia specificato virucida |
| Superfici in legno | Detergente neutro e disinfettante virucida (contro i virus) a base di etanolo (70%) o ammoni quaternari (ad es. cloruro di benzalconio; DDAC) |
| Servizi | Pulizia con detergente e disinfezione con disinfettante a base di sodio ipoclorito almeno allo 0,1% |
| Tessili (ad es. cotone, lino) | Lavaggio con acqua calda (90°C) e normale detersivo per bucato; in alternativa: lavaggio a bassa temperatura con candeggina o altri prodotti disinfettanti per il bucato |
Trattamento mediante Ozono. L’attività virucida dell’ozono si esplica rapidamente in seguito a ozonizzazione anche se richiede una somministrazione di gas a concentrazioni superiori rispetto a quella necessaria per i batteri. Come per molti altri prodotti usati nella disinfezione, non esistono informazioni specifiche validate sull’efficacia contro il SARS COV-2. Di contro sono disponibili diversi studi che ne supportano l’efficacia virucida (Norovirus) in ambienti sanitari e non. Anche a basse concentrazioni, con elevata umidità, l’ozono ha una elevata azione disinfettante virucida in aria.
Nel corso della pandemia da SARS-CoV-2, alcuni gruppi di lavoro hanno valutato l’efficacia dell’ozono sul virus in condizioni sperimentali. Lo studio di Percivalle et al. [17] ha rilevato percentuali di riduzione della vitalità del SARS-CoV-2 dal 40 all’80% in funzione del tempo di esposizione e del materiale testato (ad es. alluminio verniciato, alluminio non verniciato, maschera FFP2, camice chirurgico, vetro, plexiglas, plastica e acciaio inossidabile) dopo fumigazione con ozono gassoso a concentrazione di 0,5 ppm, 1 ppm e 2 ppm in condizioni di umidità relativa (55%) e temperatura (24°C) controllata e costante.
Una rassegna delle informazioni di letteratura disponibili è giunta alla conclusione che l’ozonizzazione può rappresentare una valida tecnologia per l’inattivazione dei virus in fomiti e sospesi nell’aria, incluso il SARS-CoV-2. Dallo studio emerge, tuttavia, che le incertezze di un uso diffuso dell’ozono gassoso per l’inattivazione dei virus sono, a oggi, significative. In particolare, è necessario approfondire la comprensione dei meccanismi di inattivazione, le condizioni ottimali di applicazione, l’effetto delle matrici e dei mezzi nel processo di inattivazione del virus e gli effetti e i danni sui materiali esposti all’ozono. Allo stesso modo, si rendono necessari ulteriori approfondimenti per testare questa tecnologia in applicazioni e ambienti reali, in particolare per la disinfezione dell’aria.
L’ozono non ha classificazione armonizzata secondo il Regolamento (CE) 1272/2008 (CLP) [18] ma, in ottemperanza al Regolamento (CE) 1907/2006 (REACH) [19], i registranti hanno notificato, in regime di autoclassificazione, l’ozono come sostanza che può provocare o aggravare un incendio; letale se inalata, provoca gravi ustioni cutanee e gravi lesioni oculari, provoca danni agli organi in caso di esposizione prolungata o ripetuta per via inalatoria, molto tossica per l’ambiente acquatico con effetti di lunga durata. Alcuni notificanti identificano l’ozono come sospetto mutageno. Le autorità competenti tedesche hanno manifestato nel 2016 all’ European Chemicals Agency (ECHA)l’intenzione di proporre per l’ozono una classificazione ed etichettatura armonizzate anche per le classi di pericolo di mutagenesi e di cancerogenesi (entrambi di categoria 2).
A livello industriale, l’ozono viene generato in situ mediante ozonizzatori, che devono essere adattati di volta in volta in relazione agli spazi (dimensioni, materiali coinvolti) e ai target. I generatori di ozono devono essere conformi alle direttive su bassa tensione (Direttiva 2014/35/CE), compatibilità elettromagnetica (Direttiva 2014/30/CE) e Direttiva 2011/65/CE (RoHS) sulla restrizione di sostanze pericolose.
Ai fini dell’uso sicuro di ozono in ambienti lavorativi, è necessario predisporre idonee misure di prevenzione e protezione di tipo tecnico e organizzativo che includono DPI. Complessivamente, tali misure devono riguardare sia gli operatori addetti al trattamento (lavoratori professionali che sono sottoposti a piani di sorveglianza sanitaria dedicata, formazione specifica sulle caratteristiche e sull’utilizzo dell’ozono, dotati di DPI nel caso sia necessario intervenire, ecc.) sia, ove necessario, i lavoratori che prestano la propria attività in ambienti che sono stati trattati con l’ozono.
Relativamente alle misure tecniche, organizzative e di protezione personale, e all’impatto dell’ozono sugli ambienti indoor e sui materiali, si faccia riferimento a Rapporto ISS COVID-19 n. 56/2020 del 23 luglio 2020 [20].
In merito alle altre misure non riportate nel presente documento, si raccomanda di fare riferimento a quanto riportato nel Rapporto ISS COVID-19 n. 56/2020 del 23 luglio 2020 [20].
Alla luce delle informazioni disponibili l’applicazione dell’ozono per la sanificazione può essere utile in diversi contesti ambientali. Tuttavia, in relazione alle sue proprietà pericolose e ai rischi associati, i generatori di ozono vanno utilizzati previa opportuna valutazione del rischio, adottando adeguate misure organizzative in modo da effettuare in totale sicurezza il processo di sanificazione. Per i motivi sopra richiamati ne è pertanto sconsigliato l’impiego in ambito domestico da parte di operatori non professionali.
L’ozono è un forte agente ossidante pertanto, può danneggiare sia dal punto di vista funzionale che estetico (colore, resistenza, durata, ecc.) materiali e attrezzature presenti nei luoghi di lavoro, creando nuovi rischi in relazione alla alterata funzionalità delle attrezzature di lavoro o generando costi aggiuntivi per le aziende in relazione alla necessità di ripristinare/sostituire i materiali o le attrezzature danneggiate.
In generale, deve essere evitata la pratica di rientrare nelle aree trattate entro un determinato periodo di tempo dalla fine dell’ozonizzazione in assenza di certezza di ripristino delle condizioni di sicurezza. Il rientro di operatori e astanti dovrà essere consentito non prima di almeno 2 ore. Infatti, in condizioni reali, questo è il tempo necessario per consentire il decadimento naturale dell’ozono, al fine di raggiungere una concentrazione residua inferiore alla soglia di percettibilità olfattiva per l’uomo (0,02-0,05 ppm) così da rendere accessibili i locali.
Se possibile, è preferibile eseguire i trattamenti nelle ore notturne in modo che alla ripresa del lavoro la quantità di ozono ambientale sia entro i limiti di sicurezza sanitaria. Ulteriori dettagli sull’uso dell’ozono nel Rapporto ISS COVID-19 n. 56/2020 del 23/07/2020.
La soglia di percettibilità olfattiva è compresa tra 0,02 ppm (40 μg/m3) e 0,05 ppm (100 μg/m3), è pari a circa 1/10 della soglia di 0,2 ppm definita sicura negli ambienti di lavoro per un tempo di esposizione massimo di 2 ore.
In merito alla nota del Ministero della Salute (protocollo n° 24482 del 31/7/1996) [21], lo stesso Ministero ha ribadito con Nota protocollo n. 28677 del 05.10.2009 che per finalità disinfettanti l’ozono è regolamentato dalla normativa sui biocidi. Si precisa che, in attesa del completamento della valutazione a livello europeo come biocida, il prodotto in questione può essere presente sul mercato nazionale come prodotto ad azione “sanitizzante” e non deve vantare azione disinfettante. Quanto sopra è chiaramente stabilito nella nota del Ministero della Salute del 22 febbraio 2019 (Ministero della Salute, 2019).
Trattamento mediante cloro attivo. Il principio attivo “Cloro attivo generato da cloruro di sodio mediante elettrolisi”, che era in fase di revisione ai sensi del BPR, è stato di recente approvato per diversi campi di applicazione, comprese le superfici. La valutazione è stata completata nel luglio 2020 e il principio attivo autorizzato con Regolamento di Esecuzione (UE) 2021/345 del 25 febbraio 2021 [22]. L’autorizzazione diventerà operativa dal 1° luglio 2021 (starting date).
In accordo con il Regolamento (UE) 528/2012 [23], il mantenimento sul mercato di prodotti contenenti principi attivi autorizzati è legato alla presentazione della domanda di autorizzazione (o di riconoscimento reciproco) di prodotti/sistemi che deve essere presentata entro due anni dalla data di approvazione del/dei principio/i attivo/i. A oggi, non sono disponibili su mercato prodotti biocidi autorizzati a base di cloro attivo generato in situ.
Nel periodo ad interim, sistemi per la generazione in situ di cloro attivo possono essere presenti sul mercato nazionale in libera vendita come sanitizzanti/sanificanti.
I sistemi per la produzione di cloro attivo utilizzano una soluzione salina a elevata purezza di cloruro di sodio (NaCl) per la produzione, mediante elettrolisi, di una soluzione acquosa di ione ipoclorito (OCl), acido ipocloroso (HOCl) e cloro (Cl2) che può essere direttamente impiegata in forma liquida, oppure nebulizzata, con una estrema adattabilità alle diverse condizioni operative.
Il cloro attivo ha attività battericida, fungicida, lievicida, sporicida e virucida e agisce mediante una modalità di azione ossidante non specifica che limita il verificarsi di fenomeni di resistenza nei microorganismi. In particolare, per quanto riguarda i virus, è stata descritta l’efficacia contro il virus della bronchite infettiva, l’adenovirus di tipo 5, l’HIV, il virus dell’influenza A (H1N1), orthopoxvirus e poliovirus. Sebbene dai dati presenti in letteratura e dai documenti ad accesso libero disponibili sul sito dell’ECHA, il cloro attivo generato per elettrolisi da sodio cloruro risulti attivo contro un’ampia gamma di organismi target, è prevista l’esecuzione di ulteriori studi di efficacia specifici, con particolare attenzione all’intervallo di pH e al carico organico sostenibile per mantenere l’efficacia del prodotto finale.
A causa dell’elevata instabilità del principio attivo, non è consigliato l’utilizzo del prodotto al di fuori (non in diretta connessione con la macchina generatrice) del sistema di produzione in situ, ad esempio mediante trasferimento della soluzione ottenuta in appositi flaconi.
Nello specifico, il trasferimento in flaconi da parte dell’utilizzatore finale potrebbe comportare un uso improprio con rischio di esposizione e/o intossicazione, qualora venissero utilizzati flaconi anonimi non correttamente etichettati.
Relativamente agli effetti sulla salute umana, i rischi sono legati al potenziale irritante per il sistema respiratorio, gli occhi e la pelle delle soluzioni di acido ipocloroso. La valutazione di tale aspetto ha condotto alla conclusione che il solo rischio non accettabile è legato a inalazione da parte di utilizzatori professionali durante la disinfezione di grandi superfici, laddove sia prevista una fase di applicazione del prodotto e una successiva pulitura manuale (“con straccio”).
Inoltre, poiché il prodotto può causare irritazione cutanea, va limitato l’utilizzo al solo personale formato provvisto di guanti e altri DPI.
Pertanto, nell’ambito di quanto di interesse in questo documento, il sistema costituito dal cloro attivo generato in situ può essere utilizzato, in accordo con le limitazioni previste per la tutela dei lavoratori e della salute umana, quale sanitizzante/disinfettante per applicazioni su superfici e ambienti.
Trattamento mediante perossido di idrogeno. Il perossido d’idrogeno in soluzione acquosa è un principio attivo biocida/disinfettante approvato ai sensi del Regolamento Biocidi (BPR). Alla luce dei dati disponibili nel Competent Authority Report, CAR (Relazione dell’autorità competente) presso ECHA risulta che il principio attivo è efficace contro numerosi microorganismi (batteri, lieviti, funghi e virus).
In questo paragrafo, viene considerata la sola applicazione mediante vaporizzazione/aerosolizzazione del perossido di idrogeno, forma in revisione come principio attivo.
Il meccanismo d’azione del perossido d’idrogeno è legato alle sue proprietà ossidanti e alla denaturazione dei componenti essenziali di microrganismi quali membrane lipidiche, proteine e acidi nucleici. L’attività antimicrobica scaturisce infatti dalla formazione di potenti ossidanti, quali i radicali idrossilici e i singlet dell’ossigeno. Tali specie reattive causano danni irreversibili ai componenti cellulari e al DNA.
Per la disinfezione delle superfici/ambienti, il perossido d’idrogeno può essere applicato mediante aerosol o vapore. La diffusione mediante aerosol, con apparecchiature in grado di produrre particelle nell’ordine di 0,3-0,5 μm, ne consente una diffusione uniforme nell’ambiente. Responsabili dell’azione biocida del prodotto sono i radicali ossidrilici OH-, altamente ossidanti.
L’applicazione di perossido d’idrogeno vaporizzato si è dimostrata efficace oltre che su un gran numero di microorganismi anche per il trattamento di ambienti ospedalieri che avevano ospitato pazienti affetti da virus Lassa ed Ebola.
Il perossido d’idrogeno si decompone rapidamente in acqua e ossigeno nei diversi distretti ambientali, quali acque di superficie, terreno e aria. Inoltre, si decompone già nei liquami prima di raggiungere il sistema fognario, con un basso impatto ambientale.
In merito alla pericolosità, il perossido di idrogeno è classificato in modo armonizzato secondo il CLP come: liquido comburente di categoria 1 [Ox. Liq. 1 – “può provocare un incendio o un’esplosione (forte ossidante)]”; corrosivo per la pelle di categoria 1 (Skin. Corr. 1A – “provoca gravi ustioni cutanee e gravi lesioni oculari”), è nocivo per ingestione e per inalazione di categoria 4 (Acute Tox. 4 – “nocivo se ingerito” e “nocivo se inalato”).
Considerata la classificazione del principio attivo, come anche il metodo di applicazione, l’utilizzo di perossido d’idrogeno vaporizzato/aerosolizzato è ristretto ai soli operatori professionali, definiti dalla normativa vigente (Legge 82/1994 e DM 274/1997). Per i trattamenti andranno pertanto osservate le precauzioni del caso (DL.vo 81/2008) ed è inoltre necessario rispettare i tempi per l’accesso ai locali e i tempi di decadimento.
Capacità di sviluppo di mutazioni responsabili di fenomeni di biocida resistenza anche crociata e successiva crescita esponenziale degli agenti microbiologici.
I due principali meccanismi che determinano la resistenza batterica a questa classe di antibiotici sono: 1) la produzione di enzimi in grado di distruggere l’anello β-lattamico, chiamati α-lattamasi; 2) la presenza di enzimi di sintesi della parete batterica alterati e di conseguenza non più inibiti dagli antibiotici.
I disinfettanti sono agenti chimici (sostanze e/o preparati) e come tali possono determinare un rischio per la sicurezza e la salute dei pazienti e/o dei lavoratori a causa delle loro proprietà chimico-fisiche o tossicologiche.
Limitata efficacia biocida nel tempo e necessità di rispettare i tempi per l’accesso ai locali e i tempi di decadimento: l’efficacia biocida permane fino a 20-30 minuti dopo l’applicazione.
Dermatiti da contatto irritativa occupazionale: la dermatite da contatto è un’infiammazione della pelle causata dal contatto diretto con sostanze irritanti (dermatite da contatto irritante) o allergeni (dermatite allergica da contatto). I sintomi comprendono prurito e talvolta dolore urente. Le alterazioni cutanee comprendono eritema, desquamazione, tumefazione cutanea e talvolta vesciche e ulcerazioni. La sede dipende dal punto di contatto.
La dermatite da contatto irritativa è una reazione infiammatoria aspecifica a sostanze tossiche che vengono a contatto con la cute. La probabilità di sviluppare una dermatite da contatto irritativa viene influenzata dalle proprietà dell’agente irritante (ad es. pH estremo, solubilità nel film lipidico cutaneo), dell’ambiente (ad es. basso grado di umidità, temperatura elevata, sfregamento intenso) e del paziente (ad es. molto giovane o molto anziano). I cardiovertitori-defibrillatori impiantabili possono spesso essere divisi in due categorie:
dermatite da contatto irritativa acuta: potenti irritanti, come sostanze chimiche caustiche, possono danneggiare immediatamente la pelle, manifestandosi tipicamente con bruciore acuto o dolore pungente;
dermatite da contatto irritativa cronica o cumulativa: sostanze irritanti meno potenti richiedono periodi di contatto cutaneo più lunghi (cronici) o ripetuti (cumulativi) per causare una dermatite da contatto irritativa; queste forme si manifestano tipicamente con prurito.
Istolesività da agenti aggressivi. La lesione della cute è un’area di danno tissutale con evoluzione necrotica che interessa l’epidermide, il derma e gli strati sottocutanei, nei casi più gravi può raggiungere la muscolatura.
Irritanti e nocivi per vie respiratorie se inalati. Il danno respiratorio è correlato alla concentrazione e alla idrosolubilità del gas e alla durata dell’esposizione.
I gas più idrosolubili (ad es. cloro, ammoniaca, anidride solforosa, acido cloridrico) si dissolvono nelle vie respiratorie superiori e provocano immediatamente irritazione delle mucose, e allertano le persone alla necessità di evitare l’esposizione. I danni permanenti a livello del tratto respiratorio superiore, delle vie aeree distali e del parenchima polmonare si verificano solo se la fuga dalla fonte di gas è impedita. Gas meno solubili (ad es. biossido di azoto, fosgene, ozono) non si possono dissolvere finché non penetrano nell’apparato respiratorio, raggiungendo spesso le vie aeree inferiori. Questi agenti sono meno in grado di causare segnali di allarme precosi (il fosgene a basse concentrazioni ha un odore piacevole), hanno un numero maggiore di probabilità di causare bronchiolite grave, e spesso hanno un ritardo di ≥ 12 h prima che i sintomi di edema polmonare si sviluppino. La complicanza più grave e immediata è la sindrome da distress respiratorio acuto, che di solito si verifica acutamente ma può essere ritardata fino a 24 h. I pazienti con un significativo coinvolgimento delle basse vie aeree possono sviluppare un’infezione batterica. Da 10 a 14 giorni dopo l’esposizione acuta ad alcuni agenti (ad es. ammoniaca, ossido di azoto, biossido di zolfo, mercurio), alcuni pazienti sviluppano bronchiolite obliterante che evolve in sindrome da distress respiratorio acuto. Si può verificare una bronchiolite obliterante che evolve in polmonite quando il tessuto di granulazione si accumula nelle vie aeree terminali e nei dotti alveolari, durante i processi riparativi dell’organismo. Una minoranza di questi pazienti sviluppa fibrosi polmonare tardiva.
Intossicazione. I sintomi dipendono dal gas o dalla sostanza chimica inalati, dalla profondità e dal tempo di inalazione. Possono comprendere irritazioni di occhi o naso, tosse, presenza di tracce ematiche nell’espettorato e respiro affannoso. Molti tipi di gas, come cloro, fosgene, diossido di zolfo, idrogeno solfidrico, biossido d’azoto e ammoniaca, possono essere improvvisamente rilasciati. Gas come cloro e ammoniaca si dissolvono facilmente e immediatamente irritano bocca, naso e gola. Le parti più in profondità all’interno dei polmoni sono interessate solo quando il gas viene inalato profondamente.
Alcuni gas, ad esempio, il biossido d’azoto, non si dissolvono facilmente. Pertanto, non producono subito segnali d’allarme di esposizione, come l’irritazione del naso e degli occhi, e sono più facilmente inalati in profondità nei polmoni. Questi gas possono causare l’infiammazione delle piccole vie aeree (bronchiolite) o determinare l’accumulo di liquido nei polmoni (edema polmonare).
L’inalazione di alcuni gas e sostanze chimiche può innescare una risposta allergica che porta all’infiammazione e, in alcuni casi, alla cicatrizzazione delle cavità polmonari (alveoli) e dei bronchioli polmonari. Questa condizione prende il nome di polmonite da ipersensibilità.
I gas solubili, come cloro, ammoniaca e acido idrofluorico, causano gravi ustioni a occhi, naso, gola, trachea e grandi vie aeree dopo pochi minuti dall’esposizione. Inoltre, causano spesso tosse ed emissione di sangue con l’espettorato (emottisi). Sono anche frequenti conati di vomito e respiro affannoso.
Sostanze meno solubili, come biossido d’azoto e ozono, causano respiro affannoso, talvolta grave, dopo 3-4 ore e talvolta fino a 12 ore dopo l’esposizione (vedere anche Malattia da inquinamento dell’aria). Con i gas meno solubili, può insorgere danno polmonare permanente e causare respiro sibilante e respiro affannoso cronici.
Inquinamento ambientale. I disinfettanti comunemente utilizzati riportano nella scheda d’uso, in riferimento agli effetti ambientali, diciture come: inquinante per le acque, tossico per gli organismi acquatici e per l’ecosistema marino.
Errata comunicazione. Rivendicando un’efficacia disinfettante non dimostrata, potrebbe indurre in errore l’utilizzatore comportando l’alleggerimento di altre precauzioni (rispetto della distanza interpersonale, mascherina, ecc.), contribuendo alla diffusione piuttosto che al contenimento della pandemia da SARS-CoV-2, e così per analogia anche la diffusione delle ICA.
L’evoluzione delle conoscenze scientifiche in materia di tecniche e prodotti per la sanificazione, rende necessaria una riflessione su un ampliamento della elaborazione, emanazione, implementazione e monitoraggio di raccomandazioni rivolte alla salubrità degli ambienti sanitari e non sanitari per quanto riguarda in particolare il rischio infettivo. L’obiettivo condiviso a livello di raccomandazioni nazionali è infatti quello di garantire il più possibile standard omogenei di prevenzione e sicurezza delle cure con ampia ricaduta applicativa delle raccomandazioni sulle aziende sanitarie. Sarebbe quindi opportuno riprendere un iter di revisione delle raccomandazioni esistenti e di individuazione e redazione di nuove alla luce delle più recenti evidenze scientifiche e considerandone la portata anche in termini organizzativi ed economici.
In proposito, nel documento di consenso su “Raccomandazioni, Linee Guida e Buone Pratiche: definizioni e percorsi di elaborazione”, prodotto nel febbraio 2020 dalla Sub Area Rischio Clinico della Commissione Salute della Conferenza delle Regioni e PA, si fa richiamo a una fase di rielaborazione e stesura delle raccomandazioni, seguita da emanazione, implementazione, monitoraggio e valutazione, nella prospettiva di un miglioramento continuo.
L’idea può quindi essere quella di riprendere e riesaminare le attuali raccomandazioni esistenti in materia di sanificazione estendendo i confronti con nuove tecniche e sistemi caratterizzati da evidenze scientifiche di sicurezza ed efficacia e considerando accuratamente anche ulteriori aspetti di valore come una analisi sistematica di tutti i sistemi di sanificazione alternativi ammissibili (in base a requisiti di efficacia e sicurezza evidence-based), e la valutazione del rapporto costo/beneficio tra sistemi alternativi messi a confronto.
Una tale revisione appare in linea anche con quanto direttamente evidenziato nei documenti di raccomandazione ISS che invitano all’estensione della sperimentazione mediante studi di efficacia e ammettono tra i limiti delle esistenti raccomandazioni il fatto che queste non siano al momento esaustive dei sistemi di sanificazione attualmente disponibili.
La revisione delle attuali raccomandazioni in materia di disinfezione/sanificazione è coerente anche con il recente decreto del Ministero dell’ambiente e della tutela del territorio e del mare del 29 gennaio 2021 dal titolo “Criteri ambientali minimi per l’affidamento del servizio di pulizia e sanificazione di edifici e ambienti a uso sanitario” [24].
Nel documento si sottolinea come in ambito ospedaliero, le attività di pulizia e sanificazione delle superfici ambientali hanno l’obiettivo di assicurare una situazione a rischio controllato, contenendo la carica microbica entro i limiti riportati nelle “Linee di Indirizzo sulla valutazione del processo di sanificazione ambientale nelle strutture ospedaliere e territoriali per il controllo delle infezioni correlate all’assistenza” [25], specifici per ciascuna tipologia di area di rischio, al fine di ridurre al minimo i fenomeni di ricolonizzazione dell’ambiente mantenendo la carica microbica potenzialmente patogena a livelli bassi e stabili nel tempo e riducendo significativamente i geni di resistenza dei principali patogeni presenti nel campo microbico. Nel documento si evidenzia anche che in ambito assistenziale è opportuno evitare l’abuso dei prodotti disinfettanti e utilizzare i più aggressivi solo quando strettamente necessario, anche al fine di prevenire lo sviluppo di resistenze; ciò può essere raggiunto tramite l’utilizzo di protocolli appropriati e anche attraverso tecniche innovative.
Per quanto riguarda le sopra citate Linee di Indirizzo [24, 25], si evidenzia come queste rappresentino delle Buone pratiche clinico-assistenziali in coerenza con la Legge 24/2017 e come previsto da questa, presenti nel Sistema nazionale per le linee guida (SNLG) proprio nella sezione “Buone Pratiche Clinico-Assistenziali”. Queste Linee di Indirizzo, sottoscritte dalle principali Società scientifiche e Associazioni della Sanità italiana, rappresentano un punto di riferimento per quanto riguarda indicazioni e raccomandazioni relative alla relazione tra igiene dell’ambiente e rischio di infezioni correlate all’assistenza con l’obiettivo di ridurle e contenere l’uso di antibiotico terapia, nella prospettiva di incidere anche sul rischio di sviluppo di antibiotico resistenza.
In queste Linee di Indirizzo si sottolinea la necessità per le Direzioni Sanitarie e le strutture socio-assistenziali di dare evidenza all’utilizzo di sistemi, tecniche e metodiche di sanificazione ambientale riconosciuti per efficacia, sicurezza, impatto ambientale e contenimento dei costi.
Nel documento si fa anche riferimento alla valutazione di tecniche e approcci innovativi, alla definizione dei percorsi paziente rischio-correlati e alla misurazione di efficacia del processo di sanificazione introducendo il controllo microbiologico anche nelle aree a Medio Rischio come misura dell’esito finale di un processo di sanificazione attraverso specifici Indicatori di Risultato Microbiologico.
Tra tutti i sistemi menzionati nelle raccomandazioni non figura ancora il Probiotic Cleaning Hygiene System (PCHS) – ideato e realizzato dalla società Copma in collaborazione con l’Università di Ferrara, basato sull’utilizzo di detergenti contenenti selezionate spore di probiotici del genere Bacillus – e, quindi, i detergenti microbici che sfruttano la naturale biocompetizione. A partire dal 2017, a conclusione di una ricerca multicentrica che ha coinvolto cinque Università, condotta su un campione di 11.461 pazienti di ben sette strutture ospedaliere [26], si è definitivamente consolidata la pratica di igiene con PCHS.
L’azienda che eroga il sistema di sanificazione PCHS riporta descrizione ed evidenze scientifiche secondo cui i Bacillus presenti nel sistema sono in grado di abbattere tutti gli altri batteri patogeni con esiti molto soddisfacenti come la riduzione del 52% della presenza di infezioni correlate all’assistenza.
È descritto peraltro come un sistema sicuro basato sulla naturale competizione biologica attivata con specifiche tecniche, che agisce in sinergia con altri fattori di controllo della contaminazione ambientale e che è regolato da un metodo di controllo economico, di processo e di qualità.
Si tratta di un sistema di igiene stabile nel tempo che supera il tradizionale concetto di igiene temporanea dei disinfettanti, e che sarebbe eleggibile per essere considerato all’interno di un iter di inclusione nelle raccomandazioni sulla sanificazione ambientale.
Secondo la letteratura di riferimento sull’utilizzo nelle aree no COVID [12], il PCHS risponde a tutta una serie una serie di requisiti che possono essere riassunti in:
lunga persistenza dell’efficacia di azione;
ampio spettro d’azione sui batteri patogeni grazie all’azione aspecifica dei Bacillus presenti nel detergente;
sicuro per l’uomo e non dannoso per i materiali da trattare;
facilità di applicazione;
qualità e sicurezza;
economicità di gestione.
Con il PCHS si garantisce una sostenibilità ambientale con meno rifiuti materiali, meno consumo di prodotti, meno impiego di prodotti chimici definiti pericolosi, minor utilizzo di risorse energetiche e idriche. Le performance ambientali sono state studiate e certificate nel rispetto dei CAM (Criteri Ambientali Minimi) e in coerenza con la Green Economy Legge 28 dicembre 2015. Una politica ambientale a impatto zero genera valore. Il modello prevede la massima riduzione di Co2 tramite l’identificazione dell’impronta climalterante e la misurazione dell’impatto sull’ambiente. Una strategia ecosostenibile limita al massimo le emissioni di Co2 e attiva misure compensative, come la piantumazione di alberi, l’acquisto di energia verde e la partecipazione a progetti internazionali contro l’effetto serra. Nello specifico, Copma è stata tra le prime in Italia a ottenere la certificazione ISO 14067 (Carbon Footprint Systematic Approach) per l’intero ciclo di vita del proprio servizio di pulizia in ambito sanitario potendolo così quantificare in termini di CO2-eq/m2 pulito annuo. L’azienda ha anche ottenuto il brand “I CARE APPENNINO” per l’impegno a realizzare o sostenere progetti a favore del territorio e della biodiversità delle comunità dell’Appennino Tosco Emiliano che compensano le emissioni di anidride carbonica del proprio servizio di pulizia.
Inoltre in data 14 novembre 2019, prima azienda in Italia, ha ottenuto la Certificazione Ecolabel del servizio di pulizia di ambienti sanitario sinonimo di qualità ecologica dei servizi che pur garantendo elevati standard prestazionali sono caratterizzati da un ridotto impatto ambientale durante l’intero ciclo di vita.
La certificazione determina un Sistema di Garanzia: il controllo di qualità si svolge a fronte di sistemi certificativi indicati nei Protocolli Operativi. Il servizio viene verificato sia a livello di processo che di risultato sulla base delle procedure di autocontrollo e della conformità a:
Sistema Qualità Uni En Iso 9001 – Soddisfazione del cliente;
Sistema di Gestione Salute e Sicurezza UNI ISO 45001 – Sistemi di gestione per la salute e sicurezza sul lavoro;
Sistema di Responsabilità Sociale SA 8000 – Tutela del lavoro per impresa e lavoratori;
Sistema di Gestione Ambientale ISO 14001 – Massima riduzione dei fattori inquinanti;
Standard ANMDO-Cermet – Buone pratiche di pulizia e sanificazione delle strutture sanitarie;
Indicatori di Risultato Microbiologico in conformità con “Linee di indirizzo sulla valutazione del processo di sanificazione ambientale nelle strutture ospedaliere e territoriali per il controllo delle Infezioni Correlate all’Assistenza (ICA)” [25].
Il portale ACC è uno strumento interattivo che permette lo scambio di informazioni fra cliente e personale tecnico specializzato, basato su 4 livelli di controllo: economico, tecnico, servizio e qualità.
In questo modo i tempi di comunicazione si riducono e l’indice di qualità dei servizi aumenta, il cliente accede sempre e da qualsiasi device a tutte le informazioni in totale trasparenza, gli utenti possono accedere solo alle informazioni di loro interesse, grazie a una registrazione che categorizza gli accessi.
Igiene biostabile PCHS:
controlla la contaminazione microbica ambientale e la produzione di igiene;
riduce in maniera stabile nel tempo la contaminazione patogena;
riduce la carica virale sulle superfici fino a 24 ore;
riduce le infezioni correlate all’assistenza (ICA);
abbatte le resistenze nell’ecosistema microbico;
riduce i costi delle terapie antimicrobiche.
Ideati e prodotti insieme a facoltà universitarie di spicco e aziende di produzione leader del settore, le attrezzature e i materiali offrono massima resa tecnica e migliore conformità ergonomica, da utilizzarsi come da Protocolli Operativi.
La flessibilità operativa di PWR CLEAN 100 permette risultati straordinari grazie alla massima evoluzione della microfibra. PWR DAMP 100 rende la scopatura un’operazione di alto valore e massima efficacia.
Obiettivo di un intervento di sanificazione è rendere sani determinati ambienti attraverso la riduzione e il contenimento della presenza di microorganismi. Il raggiungimento di tale obiettivo ha una rilevanza importante in ambito ospedaliero, nel quale le infezioni correlate all’assistenza (ICA) rappresentano la complicanza più frequente e grave. Le ICA sono infezioni dovute a batteri, funghi, virus o altri agenti patogeni meno comuni, contratte durante l’assistenza sanitaria, che possono verificarsi in qualsiasi contesto assistenziale e che, al momento dell’ingresso nella struttura o prima dell’erogazione dell’assistenza, non erano manifeste clinicamente, né erano in incubazione [1].
Come riportato nel Capitolo 2 (Epidemiologia delle infezioni correlate all’assistenza in Italia e loro impatto sulla per la pubblica), le ICA più frequenti sono le infezioni del torrente ematico associate alla linea centrale, seguite da infezioni del tratto urinario associate al catetere, infezioni del sito chirurgico e polmonite associata al ventilatore (VAP).
All’inizio degli anni ’80, le ICA erano dovute principalmente a batteri Gram-negativi; successivamente, a causa dell’utilizzo sempre maggiore e/o inappropriato della terapia antibiotica, sono aumentate le infezioni sostenute da patogeni Gram-positivi e miceti, mentre sono diminuite quelle sostenute da Gram-negativi. Di recente, alcuni Gram-negativi, quali enterobatteri produttori carbapenemasi (CPE) e Acinetobacter spp., sono diventati molto più frequenti in ambito assistenziale (Capitolo 2: Epidemiologia delle infezioni correlate all’assistenza in Italia e loro impatto sulla per la pubblica). Problema intrecciato a quello delle ICA sono le infezioni resistenti agli antibiotici. L’utilizzo inappropriato ed eccessivo di antibiotici è, infatti, uno dei principali fattori dell’insorgenza delle antibiotico-resistenze nei patogeni umani. Generalmente i microrganismi isolati in ospedale sono più resistenti agli antibiotici rispetto a quelli isolati nella collettività, a causa dell’utilizzo – in ambito ospedaliero – di una maggiore quantità di antibiotici, che aumenta la probabilità che si sviluppino mutazioni genetiche vantaggiose tali da permettere ai batteri di sopravvivere, nonostante la presenza di antimicrobici (Capitolo 5: Un sistema di sanificazione a base di probiotici per la riduzione delle infezioni correlate all’assistenza e alla resistenza antimicrobica: analisi dell’impatto sul budget).
Ogni anno, in Europa, le ICA colpiscono circa 4 milioni di pazienti, con circa 16 milioni di giornate di degenza aggiuntive e sono causa di oltre 37.000 decessi, di cui 10.000 solo in Italia; i costi che ne derivano superano il miliardo di €/anno, con un impatto economico importante anche in termini di prolungamento dei tempi di degenza e maggior impiego di antibiotici (Capitolo 2: Epidemiologia delle infezioni correlate all’assistenza in Italia e loro impatto per la salute pubblica).
In Italia, secondo uno studio – condotto nel periodo ottobre-novembre 2016 su 56 strutture per un totale di 14.773 pazienti distribuiti in vari reparti (medicina, chirurgia, terapia intensiva, ginecologia e ostetricia, pediatria, riabilitazione, neonatologia, geriatria, psichiatria, lungodegenze) – la prevalenza di pazienti con almeno una ICA è stata 8,03%. La media delle prevalenze degli ospedali è risultata invece del 6,5% [2].
Le ICA interessano sia la popolazione adulta, con prevalenza dal 5,24 al 10,4%, sia quella pediatrica, con prevalenza tra il 5,3 e il 9,0%; tra i neonati con basso peso alla nascita, l’incidenza di ICA è molto alta (3,2-3,5/1000 giorni di ricovero), in particolare per setticemie e infezioni associate al dispositivo (Capitolo 2: Epidemiologia delle infezioni correlate all’assistenza in Italia e loro impatto per la salute pubblica).
La antimicrobial resistance (AMR) è stata la causa diretta di almeno 1.27 milioni di morti nel 2019, e stime basate sui dati EARS-Net indicano che ogni anno in Europa si verificano più di 670,000 infezioni dovute a batteri resistenti agli antibiotici, con circa 33,000 decessi diretta conseguenza di queste infezioni, e con oltre 10,000 decessi solo in Italia. Il costo per i sistemi sanitari dei paesi europei è stimato in circa € 1,1 miliardi, con l’Italia che riporta il dato più elevato (393 milioni di dollari/anno) (Capitolo 5: Un sistema di sanificazione a base di probiotici per la riduzione delle infezioni correlate all’assistenza e la resistenza antimicrobica: analisi dell’impatto sul budget).
Nelle strutture ospedaliere, il maggiore resevoir di microorganismi sono le superfici di confinamento e degli arredi, per cui la loro pulizia è di fondamentale importanza. Come già detto, con il termine “sanificazione” vanno intesi tutti i procedimenti e operazioni di pulizia e/o disinfezione finalizzati a rendere sicuro dal punto di vista igienico sanitario un oggetto o una superfice o un ambiente in relazione al suo utilizzo, mediante interventi di pulizia/detersione, disinfezione e sterilizzazione e se necessaria, disinfestazione (Capitolo 3: Sistemi di sanificazione attualmente disponibili in Italia).
La detersione, in particolare, consiste nel complesso di procedimenti e di operazioni finalizzato a rimuovere e asportare lo sporco “visibile”, di qualsiasi natura esso sia, dalle superfici e dagli ambienti. La detersione può essere operata tramite rimozione manuale o meccanica dello sporco, mediante l’utilizzo di sostanze detergenti: esse non hanno quindi azione battericida, ma solo pulente. La disinfezione è, invece, un trattamento volto ad abbattere la carica microbica di ambienti, superfici e materiali, mediante utilizzo di disinfettanti chimici o agenti fisici, che comporta l’eliminazione di tutte le forme vegetative dei microrganismi patogeni e del maggior numero di microrganismi presenti in un ambiente o su di un substrato. La disinfezione ha, tuttavia, una bassa attività sulle spore batteriche: la riduzione della contaminazione da spore si ottiene soprattutto mediante l’azione meccanica e il risciacquo.
La disinfezione tradizionale si basa sull’uso di sostanze chimiche, anche se sono state sperimentate tecniche fisiche come l’utilizzo di raggi UV. I disinfettanti chimici lasciano sulle superfici trattate materia organica, come carboidrati e proteine, che può consentire anche a un solo patogeno di avviare una ricolonizzazione in un periodo di tempo molto limitato (un milione di cellule entro 8 ore) (Capitolo 3: Sistemi di sanificazione attualmente disponibili in Italia).
I microorganismi patogeni, oltre che verso gli antibiotici, hanno una forte tendenza a sviluppare resistenza nei confronti di qualsiasi sostanza che possa interferire con il loro sviluppo o essere letale, come appunto i disinfettanti, vanificando in questo modo gli interventi stessi. Gli attuali disinfettanti, inoltre, non sono selettivi, dal momento che possono eliminare dalle superfici anche microrganismi non patogeni. Per ovviare a questi problemi, sarebbe necessario aumentare – di continuo – la concentrazione e l’uso dei disinfettanti, con il rischio di un impatto dannoso sull’uomo e sull’ambiente.
Accanto alle modalità tradizionali, sono state sperimentate nuove metodologie di sanificazione, basate su detergenti ecosostenibili contenenti selezionate spore di batteri probiotici appartenenti al genere Bacillus. Attraverso un meccanismo di competizione biologica e di esclusione competitiva, i suddetti microorganismi – che hanno una carica microbica non patogena – colonizzano le superfici su cui vengono applicati e contrastano la proliferazione di altre specie batteriche patogene in modo duraturo nel tempo [3]. Poiché in ambienti molto contaminati, il solo meccanismo di esclusione competitiva non è sufficiente, è stato ideato il Probiotic Cleaning Hygiene System (PCHS) oggetto di questa valutazione etica nell’ambito di un processo di Health Technology Assessment (HTA).
Obiettivo dei programmi di HTA è valutare se una nuova tecnologia può essere introdotta in un sistema sanitario o rivalutare – nel tempo – una tecnologia già esistente e per la quale si sono rese disponibili ulteriori evidenze. Accanto ai dati di efficacia, sicurezza, impatto economico e organizzativo, il processo di HTA deve tenere in considerazione anche le questioni etiche: che ricadute avrà la tecnologia sulla vita, sulla salute e sulla qualità di vita del paziente? Quale sarà l’impatto sull’ambiente? È possibile renderla disponibile in modo equo? [4].
La valutazione etica in HTA è, infatti, uno degli elementi chiave già a partire dagli anni ’70. È quanto emerge anche dal modello di valutazione EUnetHTA che prevede 9 domain (Health problem and current use of technology; Description and technical characteristics of technology; Safety; Clinical effectiveness; Costs and economic evaluation; Ethical analysis; Organisational aspects; Patients and Social aspects; Legal aspects). Per quanto concerne il domain dell’etica, sono stati previsti 6 topic e 19 domande, con riferimento – tra le altre – al bilanciamento rischi/benefici, al rispetto della persona e del suo esercizio dell’autonomia, alla giustizia ed equità [5].
La presente valutazione etica si avvale di una metodologia che prevede tre step:
raccolta e analisi dei dati di efficacia e sicurezza della tecnologia (Step 1: Raccolta e analisi dei dati);
valutazione – alla luce dei principi di beneficialità/non maleficenza, rispetto dell’autonomia e giustizia –dell’impatto della tecnologia sulla vita, salute, ambiente, qualità della vita ed equità di accesso (Step 2: Valutazione etica);
l’elaborazione di un parere etico conclusivo alla luce delle evidenze raccolte, evidenziando le eventuali problematicità etiche che dovranno essere prese in considerazione nel momento in cui si dovrà valutare l’opportunità di impiegare la tecnologia in studio (Step 3: Elaborazione del parere) [6].
Il Probiotic Cleaning Hygiene System (PCHS) è un sistema integrato di processi e metodi per l’igiene degli ambienti, ideato da Copma scrl e che ha ottenuto l’Ecolabel UE il 14 novembre 2019. Il sistema integrato consiste nell’utilizzo, ai fini della sanificazione, di detergenti ecologicamente sostenibili basati su una miscela contenente 107 CFU/mL di probiotici del genere Bacillus, sotto forma vegetativa e sporigena e con carica microbica non patogena. Il meccanismo utilizzato è quello della sostituzione di batteri patogeni presenti sulle superfici con probiotici, mediante un antagonismo competitivo [7, 8].
L’utilizzo di una soluzione di Bacillus spp. viene integrato da una specifica tecnica di attivazione per la competizione biologica, dall’uso di specifici materiali in microfibra combinando attività di spolveratura e di lavaggio, da procedure certificate e controllo microbiologico. Le operazioni di sanificazione sono eseguite secondo i protocolli PCHS®, che prevedono un piano di addestramento dello staff alla cultura dell’igiene e al governo del processo attraverso il sistema informatico ACC (Always Connected Copma), in modo da aumentare l’efficacia di processo e i risultati [3, 9].
Nella fase valutativa, verranno analizzati: il rapporto rischi/benefici del ricorso al Probiotic Cleaning Hygiene System (PCHS); i vantaggi in termini di miglioramento della qualità della vita; l’impatto sulla salute umana e sull’ambiente; la possibilità di assicurare l’accesso al Probiotic Cleaning Hygiene System (PCHS) a tutte le strutture sanitarie.
Nell’analisi etica, il primo dato da analizzare è il rapporto rischi/benefici della tecnologia in esame. L’obiettivo principale di un intervento deve, infatti, essere quello di non causare danno, nella prospettiva di ottenere un beneficio. Il termine “rischio” si riferisce alla possibilità che il danno possa verificarsi, mentre il termine “beneficio” si riferisce a qualcosa di valore positivo relativo alla salute o al benessere del singolo o della società. È, quindi, eticamente accettabile tutto ciò che evita un male e che crea le premesse per garantire benessere.
Tra gli approcci utilizzati ai fini della riduzione delle ICA, il sistema integrato Probiotic Cleaning Hygiene System (PCHS) ha dimostrato di mantenere nel tempo la riduzione dei batteri patogeni come Staphylococcus spp., Enterobacteriaceae spp., Acinetobacter spp., Pseudomonas spp., Candida e Aspergillus spp., e C. difficile sporigeno, sulle superfici sottoposte al trattamento fino al 90% in più rispetto alla disinfezione convenzionale, non creando tra l’altro forme di resistenza [10, 11, 12]. Lo studio di Vandini et al. mette – ad esempio – in evidenza come attraverso il Probiotic Cleaning Hygiene System (PCHS) si ottenga la riduzione della conta di coliformi ed E. coli, raggiungendo un massimo effetto circa dopo due settimane di pulizia quotidiana. La riduzione media nel tempo è stata del 74 ± 21% per i coliformi e dell’89 ± 18% per E. coli. Tale obiettivo viene raggiunto dal Probiotic Cleaning Hygiene System (PCHS) attraverso la non selezione di ceppi resistenti a differenza di quanto avviene con l’utilizzo di detergenti e disinfettanti convenzionali [10, 13].
Il Probiotic Cleaning Hygiene System (PCHS) riduce l’utilizzo di detergenti e disinfettanti convenzionali, e –di conseguenza – la quantità di inquinanti chimici sia nei luoghi dove si adoperano, sia nell’ambiente più in generale [14]. La certificazione Ecolabel UE è stata, infatti, preceduta da uno studio finalizzato alla verifica dell’impatto ambientale di Probiotic Cleaning Hygiene System (PCHS). I risultati hanno evidenziato che con l’utilizzo di Probiotic Cleaning Hygiene System (PCHS) si ottiene la riduzione del consumo di sostanze chimiche (45%), dell’impronta di carbonio (35%) e dei consumi elettrici e idrici (29-33%). Il di Probiotic Cleaning Hygiene System (PCHS) riduce, inoltre, la presenza di batteri patogeni e lo sviluppo di varianti batteriche antimicrobico-resistenti. Il suo potenziale per il controllo degli odori sembra si traduca, infine, in un vantaggio competitivo rispetto ai tradizionali prodotti per la pulizia a base chimica.
La prevenzione delle ICA contribuisce indubbiamente al miglioramento della qualità della vita dei pazienti ricoverati in luoghi di assistenza e di cura. In base ai dati disponibili, il miglioramento delle condizioni igieniche impatta in modo positivo sul benessere mentale [15], oltre che sulla salute fisica. La riduzione delle ICA consente, inoltre, di ridurre condizioni di dolore, sofferenza, perdita di autosufficienza, conseguenti a possibili sovra-infezioni in soggetti già affetti da altre patologie. La possibilità di un bilancio positivo in termini di DALY (Disability-adjusted life year) a seguito degli interventi di sanificazione, consente di affermare che Probiotic Cleaning Hygiene System (PCHS) è un metodo utile al miglioramento della qualità della vita [9].
Per applicare, poi, una prospettiva economica all’impatto della sanificazione sulla qualità della vita è necessario chiarire a quale valore si vuole fare riferimento. In un’ottica utilitaristica, ciò che ha valore viene definito in base all’utilità per l’individuo o alla sua soddisfazione personale, nonché in base al vantaggio per la società. Si tratta di una valutazione soggettiva, che può essere condizionata da numerose variabili e non includere coloro che non sono ancora o non sono più in grado di fare tale valutazione. Nell’ottica personalista, il vantaggio in termini di vita e salute va ricercato a prescindere delle capacità di valutazione personale, attenzionando – allo stesso tempo – il risparmio non solo in termini di costi umani (malattia, dolore, sofferenza) ma anche di costi per l’assistenza.
Dall’analisi di Tarricone et al. del 2020, emerge che Probiotic Cleaning Hygiene System (PCHS) è in grado, rispetto al regime di sanificazione tradizionale, di ridurre il costo medio del trattamento farmacologico per paziente con ICA del 59,8%: da € 272 (sanificazione tradizionale) a € 110 (PCHS); inoltre, si è dimostrato che il PCHS consente una riduzione del costo totale dei farmaci del 78,9% (da € 52.004 nella fase tradizionale a € 10.954 nella fase PCHS). La diminuzione dei costi per il periodo di utilizzo di Probiotic Cleaning Hygiene System (PCHS) è riconducibile sia alla riduzione del numero di pazienti con ICA, sia all’utilizzo di farmaci meno costosi per la gestione delle infezioni. In termini di trattamento di infezioni antimicrobico-resistenti, nello stesso studio si evidenzia un risparmio del 66% sui costi medi per paziente in regime di sanificazione con Probiotic Cleaning Hygiene System (PCHS) rispetto al tradizionale (da € 859.98 in regime tradizionale a € 288.23 in regime PCHS) e un risparmio nel costo totale pari all’84% (da € 40,419 e € 6,341), dovuto alla diminuzione del numero di pazienti con ICA resistenti ai farmaci e a una riduzione dei costi dei farmaci stessi utilizzati, generalmente più economici quando si opera in regime di PCHS [9].
Nel Capitolo 5 (Un sistema di sanificazione a base di probiotici per la riduzione delle infezioni correlate all’assistenza e la resistenza antimicrobica: analisi dell’impatto sul budget) si riporta, inoltre, la stima per cui una graduale crescente adozione di Probiotic Cleaning Hygiene System (PCHS) nei prossimi 5 anni, dallo 0% attuale, dominato dall’utilizzo di disinfettanti chimici, fino ad arrivare al 50%, potrebbe portare a risparmi nel panorama ospedaliero italiano che vanno dai 14 ai 457.5 milioni di €, a seconda dei parametri presi in considerazione.
Il principio ispiratore di un sistema sanitario informato alla solidarietà, come il SSN (Servizio Sanitario Nazionale) in Italia, è quello di garantire la parità di accesso a interventi di prevenzione e a cure efficaci. La limitatezza delle risorse sanitarie rende, però, necessaria una valutazione di costo-efficacia e la definizione delle priorità delle politiche sanitarie.
Se si ha, però, a disposizione un trattamento di sanificazione come Probiotic Cleaning Hygiene System (PCHS) con un profilo di efficacia e sicurezza superiore agli standard, questo andrebbe messo a disposizione di tutte le strutture sanitarie. Il criterio etico, che deve guidare questa scelta, è il criterio dell’equità in base al quale va garantito l’accesso alle procedure di sanificazione a tutti i luoghi di assistenza e di cura. E, anche qualora la tecnica in esame – pur presentando un ottimo bilancio in termini di benefici ricercati – non fosse economicamente vantaggiosa, essa andrebbe comunque assicurata dal momento che il valore in gioco sono vite umane.
Nella valutazione costo/efficacia di una metodica di sanificazione vanno presi in considerazione – da una parte – i costi in termini di salute ed economici derivanti dalla maggiore diffusione di antimicrobico-resistenza tra i patogeni e la conseguente quota evitabile di ICA, e – dall’altra – i costi dell’introduzione della nuova metodica di sanificazione per il SSN. Le tipologie di costo che dovrebbero essere analizzate nel caso di una procedura di sanificazione sono i costi diretti derivanti dal peso delle ICA sulla comunità, i costi indiretti derivanti dalla perdita di giorni di lavoro per i pazienti e i loro caregivers e, infine, i costi intangibili derivanti da dolore e sofferenza generati dall’infezione. Non di minore importanza è la condizione di sicurezza del personale sanitario e addetto alla sanificazione a seguito dell’erogazione del nuovo sistema di sanificazione.
Dalla valutazione fin qui svolta emerge che il Probiotic Cleaning Hygiene System (PCHS) è efficace nella riduzione delle Infezioni Correlate all’Assistenza (ICA), più sicuro rispetto ai tradizionali prodotti per la pulizia a base chimica, e con un basso impatto ambientale. Se a questo si aggiungono le ricadute positive in termini di miglioramento della qualità di vita e il vantaggio economico sul lungo termine, il giudizio etico non può che essere positivo. Un ampio utilizzo del Probiotic Cleaning Hygiene System (PCHS) potrà consentire di raccogliere – nel tempo – ulteriori evidenze per confermarne efficacia e sicurezza e utili per un eventuale reassessment della tecnologia.
Dalle evidenze scientifiche consultate e dai dati esaminati in questo capitolo emerge un burden epidemiologico considerevole delle ICA. A livello europeo, ogni anno, le ICA colpiscono circa 4 milioni di pazienti, con circa 16 milioni di giornate di degenza aggiuntive e sono causa di oltre 37.000 decessi, di cui solo 10.000 in Italia. I costi per la gestione di queste infezioni, inoltre, superano il miliardo di €/anno, con un impatto economico notevole anche in termini di prolungamento dei tempi di degenza e maggior impiego di antibiotici. Una revisione sistematica delle infezioni causate da batteri resistenti agli antibiotici nell’Unione Europea (UE), ha stimato circa 670.000 casi nel 2015, di cui il 63,5% associato all’assistenza sanitaria, con circa 33.000 decessi e 870.000 anni di vita aggiustati per la disabilità (disability-adjusted life years, DALYs) attribuibili a queste infezioni. Naturalmente tutto questo si riflette sul piano economico, non solo su perdita di vite ma anche di giornate lavorative e su un maggiore utilizzo di risorse sanitarie. È stato stimato, infatti, che le 16 milioni di giornate aggiuntive di degenza comportano un costo approssimativo di 7 miliardi di euro.
In Italia si verificano ogni anno circa 450-700 mila casi di ICA nei pazienti ospedalizzati. Anche se il 30% di esse sono ritenuti evitabili e diversi interventi hanno dimostrato efficaci risultati nel ridurre il carico di tali infezioni, le ICA e la resistenza antimicrobica (AMR), fenomeni tra loro correlati, sono causa di un trend epidemiologico in costante crescita, con un grave impatto sia in termini di salute che in termini economici. Nel contesto italiano, la prima indagine europea, condotta negli anni 2011-2012, ha mostrato una prevalenza di ICA del 6,3%, in linea dunque con la media europea, e un notevole impatto di microrganismi multiresistenti a esse correlati. La più recente survey di prevalenza puntuale condotta nei setting acuti italiani, invece, risale al 2016, come parte della sorveglianza dell’ECDC nell’UE e nei Paesi dell’Area Economica Europea, e riporta una prevalenza di pazienti con almeno una ICA dell’8%. Tra le infezioni più comuni, sono state indicate polmoniti (20,3%), infezioni del torrente ematico (18,3%), infezioni delle vie urinarie (18%), infezioni del sito chirurgico (14,4%) e infezioni gastrointestinali (8,5%).
Diverse sono, quindi, le tipologie di ICA. Recenti studi hanno evidenziato che quelle più frequenti sono le infezioni del torrente ematico associate alla linea centrale (CLABSI) (14,0-35,8%), le infezioni del tratto urinario associate al catetere (CAUTI) (23,6-30,9%), le infezioni del sito chirurgico (SSI) (12,2 %) e la polmonite associata al ventilatore (VAP) (15-28,6%). La diversa tipologia di infezioni dipende, anche, dalla diversa tipologia di microrganismi che le determinano.
I dati di prevalenza delle ICA emersi dai lavori di letteratura scientifica inclusi in questa revisione, sia a livello italiano sia nei diversi Paesi europei, risultano abbastanza in linea con la media calcolata dall’ECDC (6,8%), nonostante la variabilità degli studi e delle metodologie adottate per la raccolta e l’analisi dei dati, oltre alla fruibilità ancora limitata di banche dati nazionali, che rendono più complesso un confronto accurato. Si specifica, infatti, che la revisione di letteratura condotta, pur analizzando un numero cospicuo di studi nazionali e internazionali, presenta alcuni limiti legati principalmente all’eterogeneità degli studi inclusi e della disomogeneità dei setting assistenziali considerati, delle popolazioni target esaminate nonché dei diversi protocolli e definizioni utilizzati negli studi e riferiti ai principali network internazionali quali ECDC, NHSN, KISS.
Dagli studi inclusi nella revisione sistematica per l’analisi epidemiologica delle ICA in Italia, sono emersi, tra la popolazione generale non stratificata per età, valori di prevalenza variabili dal 3,6 al 13,3%, con maggiori segnalazioni riguardanti infezioni del tratto respiratorio (2,6-35%), infezioni del torrente ematico (2,0-30,9%), infezioni del tratto urinario (2,4-25,2%) e infezioni del sito chirurgico (1,2-15,5%).
La prevalenza delle ICA nella popolazione adulta, invece, rilevata sulla base di dati provenienti da reparti ospedalieri medici e chirurgici, varia dal 5,24 al 10,4%. Le ICA più frequentemente segnalate sono risultate le infezioni del tratto respiratorio (1,6-60%), seguite dalle UTI (2-28%), dalle infezioni del torrente ematico (0,7-31,5%) ed, infine, da quelle del sito chirurgico (0,7-14,3%). Tra i batteri Gram-negativi rilevati dall’analisi microbiologica dei campioni, i patogeni più comunemente isolati sono stati K. pneumoniae, A. baumannii, E. coli e P. aeruginosa. Tra i batteri Gram-positivi, invece, S. epidermidis ne ha rappresentato l’agente patogeno principale, mentre quasi tutti i lieviti sono stati classificati come specie di Candida spp. Le infezioni del tratto respiratorio, nell’adulto, sono spesso associate a procedure di ventilazione meccanica eseguite nei reparti di terapia intensiva. Oltre all’età avanzata e alle condizioni cliniche dei pazienti, infatti, soprattutto l’impiego di device invasivi e una prolungata degenza ospedaliera rappresentano i fattori di rischio maggiormente caratterizzanti l’insorgenza di infezioni.
Gli studi italiani condotti sul burden delle ICA nella popolazione pediatrica italiana sono ancora limitati e ne riportano una prevalenza che oscilla tra il 5,3 e il 9,0%, frequentemente causate da patogeni Gram-negativi multiresistenti agli antibiotici, tra cui K. pneumoniae, E. coli e P. aeruginosa. I dati raccolti mostrano un burden più elevato nel primo anno di vita, indicando le infezioni del torrente ematico come le più frequenti nella popolazione pediatrica (1,4-69,9%). Le infezioni del tratto respiratorio inferiore (1,7-28,8%) e le infezioni del tratto urinario (0,8-28,8%), invece, sono risultate maggiormente frequenti nelle fasce più avanzate della popolazione pediatrica e con una distribuzione simile a quella riportata negli adulti. Anche per la popolazione pediatrica, i principali fattori di rischio per le ICA sono rappresentati da procedure invasive e dall’utilizzo di device, quali cateteri venosi centrali, cateteri ombelicali e cateteri urinari. Inoltre i neonati con basso peso alla nascita hanno mostrato una maggiore densità di incidenza delle ICA (3,2-3,5/1000 giorni di ricovero), in particolare per setticemie e infezioni associate a dispositivi (ad es. CLABSI e VAP).
Alla luce di quanto emerso da questa revisione sistematica, le attività di sorveglianza risultano indispensabili per conoscere l’epidemiologia dei microrganismi responsabili delle ICA e modulare le politiche di prevenzione più efficaci. Ridotti sono gli studi che riportano le azioni preventive introdotte nei diversi setting assistenziali e soprattutto le strategie implementate alla luce dei risultati ottenuti. Tra queste quelle principalmente riportate sono: l’implementazione del lavaggio delle mani, dell’impiego dei dispositivi di protezione e dell’intensificazione di procedure di pulizia e disinfezione delle stanze di degenza e delle superfici; migliore gestione degli spazi per l’esecuzione di procedure mediche; l’implementazione dei sistemi di ventilazione degli ambienti; costanti attività di controllo e monitoraggio dei dati nonché l’aggiornamento puntuale di linee guida dedicate; l’attuazione di programmi di formazione continua per il personale sanitario; l’istituzione di team multidisciplinari responsabili della prevenzione ospedaliera e l’aggiornamento di programmi e protocolli di gestione della sicurezza del paziente, in particolare nel corso di procedure di posizionamento di cateteri venosi centrali; l’implementazione di strategie comunicative per pazienti e visitatori.
Un solo lavoro italiano (Caselli et al., 2018) ha riportato dati reali riguardanti l’insorgenza delle ICA e il ruolo dell’igiene, mediante sistemi innovativi di sanificazione a base di probiotici, nelle strutture ospedaliere e di tutti gli arredi e oggetti che interagiscono con gli individui. Nel processo di contaminazione del paziente negli ambienti di cura e di assistenza, il contesto ambientale ricopre, infatti, un ruolo fondamentale come reservoirs per i microrganismi, aumentando il rischio di contaminazione crociata attraverso il contatto diretto e/o indiretto con il paziente. Ancor di più alla luce della recente e ancora attuale emergenza pandemica da nuovo coronavirus, e della sua trasmissibilità attraverso le superfici, l’applicazione di buone pratiche di assistenza e di misure di prevenzione e controllo delle infezioni, in ogni ambito assistenziale, rappresenta una priorità per il mondo scientifico, per ridurne l’impatto e, più in generale, per contrastare la diffusione di microrganismi antibiotico-resistenti.
Per la prevenzione e il controllo delle ICA è necessario un approccio multimodale che integri tutte le componenti principali raccomandate dall’Organizzazione Mondiale della Sanità nelle “Guidelines on core components of infection prevention and control (IPC) at the national and acute health care facility level” del 2016, con l’obiettivo di implementare strategie di prevenzione evidence-based a livello, locale, nazionale e internazionale.
Con il termine sanificazione vanno intesi tutti i procedimenti e operazioni di pulizia e/o disinfezione finalizzati a rendere sicuro dal punto di vista igienico sanitario un oggetto o una superfice o un ambiente in relazione al suo utilizzo, mediante interventi di pulizia/detersione, disinfezione e sterilizzazione e se necessaria, disinfestazione. La sanificazione, dunque, assicura l’igiene e protegge le persone, svolgendo una prevenzione eziologica delle malattie infettive, attraverso l’azione sui determinanti ambientali di queste.
La detersione è il complesso di procedimenti e di operazioni finalizzato a rimuovere e asportare lo sporco generalmente definito sporco visibile, di qualsiasi natura esso sia, dalle superfici e dagli ambienti, effettuata con la rimozione manuale o meccanica dello sporco mediante sostanze detergenti usate nelle dosi e nei tempi indicati dal produttore.
I detergenti sono combinazioni di sostanze chimiche che aumentano l’azione pulente dell’acqua rimuovendo lo sporco dalle superfici senza rovinarle e senza causare danno a chi le usa. Sono composti da agenti tensioattivi ed emulsionanti, agenti sequestranti e vari sali per il controllo del pH. L’attività dei detergenti è condizionata da 4 fattori che costituiscono il cosiddetto cerchio fattoriale: azione meccanica e abrasiva; azione chimica; tempo di azione; temperatura. I quattro fattori sono influenzati di volta in volta dal tipo di substrato, dal tipo di sporco e dalla durezza dell’acqua. I detergenti oltre a essere efficaci devono sempre soddisfare le seguenti condizioni: non devono mai intaccare le superfici da pulire; devono essere atossici; non devono emanare eccessive esalazioni, possibili cause di disagio per l’operatore; non devono rappresentare un rischio per l’operatore; devono assicurare il pH desiderato ed esercitare un effetto tampone; devono essere eliminabili con il semplice risciacquo ed essere biodegradabili; devono possedere un’eventuale azione biocida (se contengono un principio attivo battericida). I detergenti sono classificabili come: detergenti a pH acido, basico e neutro. I primi hanno un’azione disincrostante, i detergenti alcalini hanno un’azione principalmente sgrassante, quelli a pH neutro sono poco aggressivi e quindi adatti anche alle superfici più delicate.
In merito agli aspetti normativi, per i detergenti l’aspetto da considerare è l’indice di biodegradabilità che esprime la capacità di un composto chimico di decomporsi per mezzo di batteri ossia il tempo che la natura impiega a smaltire i nostri rifiuti. La biodegradabilità riguarda i tensioattivi contenuti nel detergente ed è disciplinata da appositi regolamenti comunitari come il Regolamento 648/04/CEE e successivi aggiornamenti.
La disinfezione è un trattamento per abbattere la carica microbica di ambienti, superfici e materiali (mediante utilizzo di disinfettanti chimici o agenti fisici) che comporta l’eliminazione di tutte le forme vegetative dei microrganismi patogeni e del maggior numero di microrganismi presenti in un ambiente o su di un substrato. Questa ha una bassa attività sulle spore batteriche; la riduzione della contaminazione da spore si ottiene soprattutto mediante l’azione meccanica e il risciacquo. Nessun disinfettante è adeguatamente efficace se impiegato su materiali non preventivamente puliti. L’operazione di pulizia/detersione di superfici e ambienti è un’operazione preliminare e indispensabile alla successiva disinfezione. La disinfezione può avvenire mediante mezzi chimici e mediante mezzi fisici.
I disinfettanti chimici non devono mai essere confusi con i detergenti che come tali non hanno azione battericida, ma solo pulente. Un disinfettante è un composto chimico in grado di eliminare dopo trattamento i microrganismi presenti su materiale inerte con la sola eccezione di alcune spore batteriche. Il disinfettante “ideale” deve pertanto possedere funzione biocida ad ampio spettro, cioè la capacità di aggredire e uccidere gli agenti microbiologici contro i quali viene impiegato. In generale un disinfettante deve avere i seguenti requisiti: un ampio spettro di azione, essere efficace in tempi rapidi e avere un’azione residua, capacità di agire anche in presenza di sostanze organiche (sangue, fluidi biologici, residui alimentari etc), non deve essere corrosivo, tossico ed essere di facile applicazione ed economico. Deve inoltre avere buona stabilità chimica, elevato potere di penetrazione e non indurre resistenze. Requisiti complementari dei disinfettanti devono soddisfare le seguenti indicazioni: un’elevata capacità di applicazione, non causare fenomeni di irritazione, non alterare i materiali con cui vengono in contatto, devono poter essere miscelati con altri liquidi. I disinfettanti chimici si dividono in: disinfettanti di alto livello (DAL), disinfettante di medio livello e disinfettante di basso livello (Tabella 1, Capitolo 3 del presente report).
La disinfezione fisica avviene mediante raggi ultravioletti (UV), prodotti da speciali lampade, ha un forte effetto germicida. Può essere utilizzata per sterilizzare l’aria di ambienti delimitati (sale operatorie, laboratori farmaceutici, cappe biologiche, impianti di depurazione ecc.). L’effetto germicida delle radiazioni UV si estende a batteri, virus, spore, funghi muffe e acari; esso è dovuto soprattutto all’effetto distruttivo esercitato dalle radiazioni sul DNA dei microrganismi. I raggi UV hanno un potere di penetrazione, comunque, molto modesto (non passano per esempio attraverso il vetro) per cui agiscono solo su superfici esposte.
Gli aspetti normativi in materia di disinfezione riguardano i mezzi chimici ad azione biocida e sono redatti nel Regolamento (UE) n. 528/2012 Biocidi (BPR). Per quanto riguarda la disinfezione con mezzi fisici, dal punto di vista normativo, si fa presente che, poiché l’attività disinfettante della radiazione ultravioletta si attua mediante un’azione di natura fisica, i sistemi di disinfezione basati su UV-C non ricadono nel campo di applicazione del Regolamento (UE) n. 528/2012 Biocidi (BPR) che esclude espressamente dalla definizione di biocida, i prodotti che agiscano mediante azione fisica e meccanica. Anche a livello nazionale non rientrano, secondo il DPR 6 ottobre 1998, n. 392 sui PMC, i prodotti la cui attività disinfettante operi mediante azione fisica o meccanica.
Poiché il controllo della contaminazione microbica, soprattutto in ambito ospedaliero, è essenziale, fino a ora questo è stato affrontato mediante uso di disinfettanti chimici (alcool, ipoclorito di sodio, composti dell’ammonio quaternario), che tuttavia mostrano alcune importanti limitazioni quali: non prevengono la ricontaminazione, che avviene in modo continuo a causa della dispersione di microrganismi da parte delle persone che frequentano gli ambienti; hanno un elevato impatto ambientale; possono favorire l’ulteriore comparsa e selezione di AMR, contribuendo, potenzialmente, in modo significativo al peggioramento del problema.
Il sistema di sanificazione PCHS (Probiotic Cleaning Hygiene System) non contiene disinfettanti ma consiste in un detergente ecosostenibile (fully ecolabelled) contenente selezionate spore di batteri probiotici appartenenti al genere Bacillus. A eccezione di 2 specie note (B. anthracis e B. cereus), i batteri appartenenti a tale genere sono apatogeni per l’uomo, e classificati nel gruppo di rischio 1 dall’EFSA. I batteri patogeni del genere Bacillus sono ubiquitari, essendo normali colonizzatori del suolo, delle acque e anche dell’organismo umano (dove sono frequentemente presenti a livello intestinale). Tutti i batteri di tale genere sono sporigeni, in grado cioè di produrre endospore come forme di resistenza in condizioni ambientali avverse. Tali spore sono forme dormienti estremamente resistenti, utilizzate dai batteri per sopravvivere ad agenti fisico-chimici anche estremi, e pertanto ben si prestano a essere utilizzate in detergenti concentrati, dove le forme vitali vegetative perderebbero rapidamente la vitalità.
Il meccanismo di azione del PCHS si basa sulla capacità delle spore di Bacillus di germinare sulle superfici sanificate con il prodotto diluito in acqua (condizione che permette appunto la germinazione delle spore): le cellule batteriche vegetative così generate sono in grado di competere efficacemente con gli altri microrganismi presenti, sottraendo loro spazio e nutrienti, e quindi gradualmente spiazzandoli e rimpiazzandoli sulle superfici trattate. Contemporaneamente, le specie di Bacillus contenute nel PCHS producono sostanze antimicrobiche in grado di ridurre fino al 90% la crescita di batteri e funghi, limitandone fortemente la diffusione. Inoltre, i Bacillus del PCHS producono una serie di sostanze ad azione enzimatica in grado di degradare e rimuovere proteine e lipidi e in generale lo sporco organico. Ciò consente una graduale riduzione di microrganismi indesiderati sulle superfici trattate, con un contemporaneo incremento di batteri del genere Bacillus, che mantengono nel tempo l’equilibrio raggiunto, portando a una rimodulazione stabile del microbiota sulle superfici trattate. Tale rimodulazione è stabile nel tempo e porta alla riduzione del potenziale infettivo associato alla presenza di microrganismi pericolosi per la salute dell’uomo negli ambienti sanificati. Questo aspetto risulta particolarmente importante in ambiente ospedaliero, in quanto in grado di abbassare il rischio infettivo per i pazienti ospedalizzati.
I ceppi di Bacillus presenti nel PCHS sono stati analizzati per la presenza di plasmidi coniugativi, che potrebbero potenzialmente portare a scambio genico con altri microrganismi e che sono stati trovati assenti; recentemente, i Bacillus del PCHS sono stati completamente sequenziati, ed è stata confermata l’assenza di plasmidi coniugativi (dati non ancora pubblicati). I Bacillus del PCHS sono stati altresì analizzati per la presenza di geni codificanti AMR, mediante analisi in microarray in real time PCR in grado di evidenziare simultaneamente 87 diversi geni per resistenza (Qiagen, Resistance genes), mostrando la sola presenza costante di un gene cromosomico non trasferibile mediante meccanismi di scambio genico (msrA), codificante la resistenza ai macrolidi.
Dati di efficacia in vitro: i test sono stati condotti in vitro su diversi ceppi di batteri Gram-positivi, Gram-negativi e funghi potenzialmente patogeni per l’uomo. In particolare, sono stati utilizzati: S. aureus (Gram-positivo), S. pyogenes (Gram-positivo), E. coli (Gram-negativo), P. aeruginosa (Gram-negativo), Proteus (Gram-negativo), Enterobacter cloacae (Gram-negativo), Serratia marcescens (Gram-negativo), C. albicans (micete lievitiforme). Sono stati effettuati test di crescita competitiva in saggi di co-coltivazione, che hanno dimostrato una capacità inibitoria della crescita dei batteri Gram-positivi, Gram-negativi a dei miceti fino al 99% rispetto ai controlli non co-coltivati con Bacillus. È stata inoltre testata la capacità dei ceppi di Bacillus del PCHS di produrre composti antimicrobici in grado di ridurre la crescita dei microrganismi target, mostrando una riduzione fino al 97%, sia in saggi di semina su piastra (stab overlay assay) che in saggi di crescita in terreno condizionato (suspension assay). I Bacillus del PCHS sono stati anche caratterizzati per la loro azione enzimatica, responsabile della rimozione dei composti organici e della parziale o totale inattivazione di alcuni microrganismi, mediante saggi API-ZYM system (BioMérieux, Firenze, Italia), mostrando la capacità di sintetizzare e liberare diversi enzimi. Infine, in vitro è stata valutata anche la azione antivirale del PCHS, utilizzando come bersagli diversi virus dotati di inviluppo pericapsidico, tra cui il virus pandemico SARS-CoV-2. I test sono stati condotti sia in saggi in sospensione che su superficie, secondo le rispettive normative UNI EN 14476:2019 e UNI EN 16777:2019. Pur non essendo un disinfettante, in quanto non in grado di ridurre il titolo iniziale dei virus testati di > 4 Log (-99,99%) entro 1 ora come richiesto dalle sopra indicate normative, i risultati hanno mostrato una attività antivirale del PCHS nei confronti di tutti i virus testati, con inattivazione di > 4 Log rispetto al titolo iniziale (-99,99%) ma 1-2 ore di tempo di contatto a temperatura ambiente. Da notare che mentre i disinfettanti comuni utilizzati come controllo (etanolo, ipoclorito di sodio) hanno mostrato di perdere attività entro un massimo di 2 ore dal trattamento delle superfici, il PCHS si è mostrato in grado di mantenere le superfici decontaminate fino a 24 ore dopo il trattamento.
Dati di efficacia su campo: il PCHS è stato testato su campo, a partire dal 2010, in diversi settings ospedalieri in Italia e all’estero. Gli studi sono stati condotti essenzialmente nei reparti di medicina interna per adulti, per periodi di tempo da 2 a 18 mesi. Uno studio è stato invece effettuato nel reparto di Pronto Soccorso di un ospedale pediatrico durante il periodo pandemico COVID-19. Gli studi sono stati di tipo pre-post negli stessi reparti, oppure di tipo caso-controllo in reparti paralleli con caratteristiche sovrapponibili. Tutti gli studi, indipendentemente dalla sede e dal periodo in cui sono stati svolti, hanno mostrato una generale e omogenea conferma dei dati ottenuti in vitro sulla capacità inibitoria della diffusione dei microrganismi potenzialmente patogeni. Negli studi volti a valutare l’impatto della rimodulazione microbica ambientale sulla frequenza delle ICA, sono state valutate simultaneamente e in continuum sia la contaminazione microbica ambientale (bioburden) che l’incidenza delle ICA. Nel complesso, i risultati di tutti gli studi condotti hanno mostrato che la sostituzione dei sistemi di sanificazione convenzionali con il PCHS si associa a: riduzione stabile dei patogeni del gruppo ESKAPE (Escherichia, Staphylococcus, Klebsiella, Acinetobacter, Pseudomonas, Enterococcus) in tutti i setting trattati, fino al 85% in più rispetto a quanto osservato con i detergenti/disinfettanti convenzionali (i risultati sono stati confermati in uno studio effettuato dall’Università di Messina); aumento di Bacillus nella popolazione residente sulle superfici trattate, fino a rappresentare > 70% di tutta la popolazione, rispetto a quanto osservato durante la sanificazione convenzionale; riduzione fino a 3 Log di tutte le resistenze geniche presenti nella popolazione contaminante prima dell’implementazione del PCHS; uno studio effettuato dal Charitè di Berlino ha confermato la capacità dei detergenti probiotici di indurre una significativa diminuzione dei geni codificanti AMR rispetto ai detergenti e disinfettanti convenzionali.
Negli studi in cui è stata valutata l’incidenza di ICA e il consumo di antimicrobici ICA-associato si è inoltre dimostrata: una riduzione di circa il 50% delle ICA nel periodo di osservazione, confermata anche dopo matching di tutti i pazienti ospedalizzati nel periodo di osservazione; una riduzione pari a circa il 60% del consumo di farmaci antimicrobici nel periodo di introduzione del PCHS rispetto a quello di controllo con uso di sanificazione convenzionale; una riduzione del 79% circa del costo legato alle terapie ICA.
Infine, in uno studio effettuato nel reparto di Pronto Soccorso durante la pandemia COVID-19, si è anche osservata una efficace azione anti-SARS-CoV-2 del PCHS, come dimostrato dall’assenza di virus nei reparti trattati, pur in documentata presenza di soggetti infetti.
Recentemente il sistema è anche stato applicato come metodo di sanificazione dei mezzi pubblici durante il periodo pandemico, sui treni della metropolitana di Milano ATM, confermando la sua capacità di abbattere la presenza di patogeni e dei loro geni di resistenza con un’efficacia > 85%, e contemporaneamente la efficacia anti-SARS-CoV-2, rispetto alla igienizzazione convenzionale effettuata mediante cloro e alcool (dati non ancora pubblicati). Ciò suggerisce un possibile impiego del sistema PCHS esteso ad ambienti non sanitari in cui sia necessaria una sanificazione stabile.
Dati di sicurezza: dal punto di vista della sicurezza d’uso, i Bacillus del PCHS sono considerati apatogeni nell’uomo (Risk Class = 1, EFSA), e hanno una lunga storia di utilizzo sicuro nell’uomo senza manifestazioni di eventi avversi. Numerosi studi hanno verificato l’assenza di rischio per quanto riguarda l’uso di probiotici appartenenti al genere Bacillus nell’uomo. Presso l’Università di Ferrara sono inoltre stati effettuati specifici studi in vitro. I risultati delle analisi effettuate mediante real-time PCR microarray sui ceppi di Bacillus inclusi nel PCHS hanno mostrato la presenza comune in tutti i ceppi del gene cromosomico non trasferibile msrA (che conferisce la resistenza a macrolidi), la presenza meno frequente di pochi altri geni cromosomici non trasferibili codficanti resistenza a eritromicina e oxacilline (ermC, OXA51, AAC(6), SFC-1), e l’assenza di multiresistenza plasmidica. Oltre agli studi in vitro, lo stesso tipo di analisi effettuata su oltre 300 ceppi di Bacillus da PCHS, isolati dalle superfici trattate in circa 10 anni di applicazione, ha mostrato totale assenza di acquisizione di nuovi geni di resistenza da parte dei Bacillus nonostante il continuo contatto con patogeni multiresistenti sulle superifci trattate, evidenziando una elevata stabilità genetica dei Bacillus del PCHS. Su campo, inoltre, in tutti gli studi è stata implementata in tutti i centri arruolati una sorveglianza microbiologica identificando i Bacillus come microrganismi “alert”, in modo da monitorare costantemente la presenza di eventi di infezione accidentale causata da Bacillus del PCHS o la loro eventuale presenza in campioni clinici (sangue, urine) come testimonianza di diffusione sistemica di tali batteri nei pazienti ospedalizzati con o senza ICA. I risultati di oltre 10 anni di osservazioni hanno mostrato la totale assenza di infezioni causate da Bacillus del PCHS nei pazienti ospedalizzati. In uno studio pubblicato nel 2016, su > 32.000 campioni clinici analizzati (corrispondenti a circa 90.000 pazienti e 800.000 giorni di ospedalizzazione) nessun campione è stato trovato positivo per la presenza di Bacillus del PCHS, né con metodi microbiologici né con metodi molecolari più sensibili. La sorveglianza microbiologia viene comunque tuttora implementata in modo automatico e continuo in ogni centro che introduce il sistema di sanificazione PCHS, e nessun evento avverso è mai stato registrato. È inoltre tuttora in corso l’analisi mediante NGS dell’intero resistoma e viruloma dei Bacillus del PCHS (in collaborazione con Sanger Institute, London, UK), inclusi gli isolati da superfici ospedaliere, per verificare e confermare con tale metodo di indagine la stabilità genetica dei Bacillus utilizzati nel PCHS.
Un’analisi di impatto sul budget è stata condotta per valutare le variazioni attese nel budget degli ospedali in Italia per il trattamento farmacologico delle ICA e delle eventuali antibiotico-resistenze, confrontando l’utilizzo del sistema PCHS rispetto alla sanificazione a base di prodotti chimici.
I dati più recenti riportano per l’Italia circa 1,273,000 dimissioni ospedaliere all’anno (2019) considerando i reparti di medicina interna, geriatria e neurologia (cioè gli stessi reparti considerati nella nostra analisi). Dato che attualmente l’utilizzo del PCHS in Italia è molto limitato (meno del 5% degli ospedali secondo i dati forniti dal produttore), lo scenario attuale di distribuzione dei pazienti tra i due sistemi di sanificazione ha considerato il 100% di utilizzo della DCT. Il modello ha considerato modesti tassi crescenti di utilizzo del PCHS nello scenario futuro pari al 5, 10, 15, 30 e 50% rispetto alle procedure di disinfezione convenzionale nei prossimi 5 anni. Il modello applica le variazioni delle quote di mercato considerando una coorte di pazienti incidenti all’anno. Il costo per lo scenario attuale e futuro è stato stimato moltiplicando i costi annuali di ciascuna alternativa per la percentuale di popolazione gestita con tale alternativa e per il numero di pazienti nella popolazione considerata, tenendo conto di una coorte costante di pazienti incidenti. L’analisi economica effettuata si è concentrata sui pazienti che hanno sviluppato almeno una ICA (291 in totale).
Dall’analisi è emerso che il costo medio del trattamento farmacologico per un paziente con ICA è passato da € 272 nel periodo DCT a € 110 nella fase PCHS, con una riduzione del 59,8% per paziente. Il costo totale dei farmaci utilizzati per la gestione delle ICA è risultato nella fase DCT pari a € 52.004 e nella fase PCHS pari a € 10.954, dimostrando che il PCHS è in grado di ridurre i costi totali dei farmaci del 78,9% (costo medio per paziente calcolato sulla popolazione totale: € 2,63 verso € 12,50). La diminuzione dei costi per il periodo di utilizzo del PCHS è dovuta sia alla riduzione del numero di pazienti con ICA, sia all’utilizzo di farmaci meno costosi per la gestione delle infezioni. Il costo del trattamento delle ICA resistenti agli antibiotici nei periodi DCT e PCHS è risultato rispettivamente pari a € 40,419 e € 6.341, evidenziando una diminuzione dell’84%. Il costo medio per il trattamento di un paziente resistente agli antibiotici è risultato pari a € 859,98 e € 288.23, rispettivamente per DCT e PCHS, con una riduzione dei costi del 66% (costo medio per paziente calcolato sulla popolazione totale: € 1,52 verso € 9,72). L’utilizzo del PCHS ha portato a una diminuzione del numero di pazienti con ICA resistenti ai farmaci e, a sua volta, a una diminuzione del costo per la terapia farmacologica. Anche in questo caso, come nel caso delle ICA, la riduzione del costo della terapia farmacologica è derivata anche dall’utilizzo di farmaci meno costosi per la gestione delle infezioni antibiotico-resistenti.
Applicando le frequenze di eventi riscontrate nei due gruppi di pazienti al numero totale annuo di ricoveri ospedalieri nei reparti di medicina interna, geriatria e neurologia (1.273.000) in Italia, il numero di ICA e di antibiotico-resistenze sarebbe 58.558 e 14.385 per la DCT rispetto a 30.552 e 6.747 per il PCHS, rispettivamente. Di queste, i casi di ICA severe sarebbero rispettivamente 919 e 306 per la DCT e il PCHS.
Dati i risultati clinici e considerando gli stessi costi di acquisto delle diverse tecniche di sanificazione (DCT e PCHS), un aumentato utilizzo del PCHS rispetto alla disinfezione chimica tradizionale comporterebbe notevoli risparmi sui costi sin dal primo anno di utilizzo della sanificazione innovativa. Rispetto allo scenario attuale che considera l’utilizzo al 100% di disinfettanti chimici, scenari futuri che considerano tassi di utilizzo del PCHS del 5, 10, 15, 30 e 50% rispetto alla sanificazione tradizionale potrebbero evitare circa 31.000 ICA e circa 8.400 antibiotico-resistenze nei prossimi 5 anni. Questo consentirebbe un risparmio di € 628.226 al primo anno, € 1.256.451 al secondo anno, € 1.884.677 al terzo anno, € 3.769.353 al quarto anno e € 6.282.255 al quinto anno, considerando ogni anno nuove coorti di pazienti incidenti nei reparti ospedalieri. Il risparmio totale, per i prossimi 5 anni sarebbe di € 13.820.961. In questo contesto, il risparmio relativo alla gestione delle ICA antibiotico-resistenti, nei prossimi cinque anni sarebbe di circa € 11.5 milioni (83% del risparmio totale).
Il presente studio presenta punti di forza e limiti che devono essere sottolineati. Gli studi randomizzati controllati sono considerati il “gold standard” per la stima degli effetti di trattamenti o interventi. L’assegnazione casuale dell’intervento assicura infatti che tutti i pazienti abbiano la stessa probabilità di ricevere un dato intervento, pertanto, il suo effetto sugli esiti può essere stimato confrontando direttamente gli esiti tra soggetti con intervento e senza intervento. D’altra parte, si osserva un crescente interesse nell’utilizzo di studi osservazionali (o non randomizzati) per stimare gli effetti di interventi sanitari. Negli studi osservazionali, la selezione dell’intervento è spesso influenzata dalle caratteristiche del soggetto, di conseguenza, le caratteristiche di base dei soggetti con intervento spesso differiscono sistematicamente da quelle dei soggetti senza intervento. Pertanto, è necessario tener conto delle differenze sistematiche nelle caratteristiche di base tra i soggetti nei due gruppi quando si stima l’effetto dell’intervento. In questo contesto, la tecnica del “propensity score matching” consente di progettare e analizzare studi real-world in modo da imitare alcune caratteristiche degli studi randomizzati e controllati e fornire ai decisori risultati di alta qualità in meno tempo e con costi minori. Nel nostro studio, è stata applicata questa metodologia al fine di selezionare due sottogruppi di pazienti, uno gestito con la disinfezione tradizionale e uno con il PCHS, aventi le stesse caratteristiche cliniche. Questo approccio ha consentito di confermare i risultati precedentemente pubblicati, per i quali le analisi erano state eseguite senza effettuare il “matching” dei pazienti. Inoltre, questo studio rientra tra le poche valutazioni pubblicate che hanno indagato gli aspetti clinici ed economici della gestione dei pazienti con ICA secondo sistemi di prevenzione e, più specificamente, le attività di sanificazione. Ancora, sebbene l’utilizzo del PCHS consenta dei risparmi del 3% nel tempo dedicato alla sanificazione rispetto all’uso di disinfettanti chimici, questo aspetto è stato escluso dall’analisi perché si è preferito adottare un approccio conservativo.
Per quanto riguarda i limiti dello studio, l’identificazione dei casi di antibiotico-resistenza è stata effettuata in base al numero di terapie assunte per la gestione delle ICA, in linea con quanto adottato in studi precedenti. Tuttavia, stime più precise si sarebbero potute ottenere attraverso una raccolta completa di antibiogrammi eseguiti in caso di ICA durante lo studio. Lo studio, che ha effettuato un’analisi nella prospettiva ospedaliera, si è focalizzato sul consumo di farmaci per la gestione delle ICA e non ha considerato altre voci di costo come i trattamenti in terapia intensiva e i costi del personale sanitario, che potrebbero avere un elevato impatto nella gestione delle infezioni. Un’analisi sui rimborsi assicurativi ha evidenziato che le infezioni ospedaliere incidono per il 7,4% sul numero totale dei sinistri e per l’8,6% sul costo totale, mostrando i costi medi più elevati per singola pratica, superiori a € 126.000 tenendo conto anche dei casi di decesso; il costo medio per sinistro non fatale è risultato pari a circa € 44.000. Nel caso in cui si applicasse il rimborso per sinistro non fatale alle ICA gravi, l’utilizzo del PCHS in tutti i reparti di medicina, geriatria e neurologia in Italia potrebbe generare risparmi di circa € 27 milioni all’anno. Un altro limite dello studio riguarda la stima della popolazione considerata nell’analisi di impatto sul budget. Nello scenario base, si è fatto riferimento al numero annuo di ricoveri a livello nazionale per i reparti considerati nello studio multicentrico pre-post e sono stati applicati i costi medi stimati per paziente per il trattamento delle ICA e delle ICA resistenti per il PCHS e per la disinfezione standard. In uno scenario esteso, sono stati applicati i risultati dello studio a tutti gli ospedali Italiani. Nonostante in Italia la gestione del rischio di infezioni nosocomiali sia implementata attraverso l’applicazione di linee guida nazionali, i diversi centri clinici possono presentare differenze nei piani organizzativi e nei processi di sanificazione. Inoltre, a livello nazionale, una certa eterogeneità può essere riscontrata in base all’efficienza del processo di sanificazione, alla posizione degli ospedali (ad es. grandi città verso aree periferiche), alle caratteristiche del personale addetto alla sanificazione, all’utilizzo di specifici antibiotici, ecc. Questa eterogeneità potrebbe aver portato a possibili bias nei risultati delle analisi, limitandone la generalizzabilità. In futuro, studi che considereranno un insieme più esteso di reparti ospedalieri e una diversità di contesti ospedalieri potranno fornire stime più accurate della frequenza delle ICA e delle relative antibiotico-resistenze al fine di migliorare l’estensione dei risultati dell’analisi a tutti i ricoveri ospedalieri in Italia.
Sebbene le conclusioni dell’analisi economica effettuata derivino dallo studio dei reparti di medicina interna, riteniamo che potrebbero essere estese anche alle unità di terapia intensiva, in cui sia la prevalenza di ICA (10%) sia la resistenza antimicrobica dei microrganismi correlati alle ICA (32% delle ICA totali) sono molto maggiori, con conseguenti ulteriori possibili risparmi. Ulteriori studi sono attualmente in fase di sviluppo per confermare tale generalizzabilità.
Al fine di eseguire una valutazione dei punti di forza e di debolezza, nonché le opportunità e le minacce, del PCHS (SWOT Analysis) e dei comparatori (disinfettanti classici), è stata effettuata una revisione della letteratura scientifica e sono state prese in considerazione le Linee Guida implementate a livello Nazionale, la Normativa Italiana vigente in materia di disinfezione e sanificazione, le Linee Guida Europee che regolamentano tali pratiche, nonché altre informazioni da Siti Istituzionali (Istituto Superiore di Sanità, Ministero della Salute, etc.).
Detergenti. Punti di forza: efficace, facile applicabilità, eliminabile con il risciacquo, biodegradabile. Punti di debolezza: inutilizzabili su tutte le superfici, tossici e allergenici per l’essere umano, alto impatto ambientale, efficacia dipendente dal ph e temperatura, efficacia dipendente dal tempo di contatto, efficacia dipendente dalla concentrazione, efficacia varia in base alla tipologia e alla carica microbica, efficacia diminuita dalla presenza di biofilm o materiale organico, limitata efficacia biocida nel tempo. Opportunità: basso costo, libero mercato. Minacce: concorrenza sul mercato.
Disinfettanti chimici. Punti di forza: alta efficacia, eliminabili con il risciacquo, facile applicabilità. Punti di debolezza: corrosivi, tossici nell’essere umano, non hanno azione disinfettante, inutilizzabili su tutte le superfici, inefficaci su tutte le superfici. Opportunità: basso costo, libero mercato, economicità di gestione. Minacce: crescente resistenza da parte dei microrganismi, inadatti per uno sviluppo sostenibile.
Disinfettanti fisici: radiazioni. Punti di forza: germicida, anti odore (distrugge particelle dei cattivi odori), antinquinante, alta efficacia, efficacia biocida nel tempo. Punti di debolezza: necessità di evacuare la stanza durante l’utilizzo, efficacia dipendente da tempo di esposizione e intensità, efficacia dipendente dalla distanza di applicazione che ne determina anche la massima superficie di copertura, la disinfezione non avviene nelle zone d’ombra, tempi di accensione varia a seconda della superficie da coprire, l’azione germicida che si intende avere, necessità di avere più fonti per un’ambiente, efficacia dipendente da velocità dell’aria e/o umidità dell’ambiente, inquinamento dell’aria, pulizia della fonte, suscettibilità intrinseca dei singoli microorganismi, plastica e apparati elettronici possono essere danneggiati da una lunga esposizione, necessità di manutenzione (costi), necessità di apposita segnaletica. Opportunità: libero mercato. Minacce: tossicità per l’uomo e per l’ambiente in ambito produttivo e di smaltimento e per l’ambiente, genotossicità diretta e indiretta legata alla produzione di ROS.
Disinfettanti fisici: calore. Punti di forza: germicida, agisce contro acari e polvere, sicuro per l’ambiente, economico, agisce bene su superfici non porose ma utilizzabile anche su quelle porose, facile applicabilità. Punti di debolezza: necessità di evacuare la stanza durante l’utilizzo e ventilare dopo l’applicazione, efficacia dipendente da temperatura, tempo di esposizione, distanza di applicazione e suscettibilità intrinseca dei singoli microorganismi, oggetto/superficie deve essere termoresistente e preferibilmente penetrabile al vapore, tempo necessario variabile in base anche allo spessore degli oggetti/superfici. Opportunità: libero mercato. Minacce: -.
PCHS. Punti di forza: efficacia rispetto a disinfettanti convenzionali, azione innovativa, ecologicamente sostenibile, riduzione dell’impatto ambientale rispetto alle procedure di disinfezione classiche, non tossico per l’uomo, grande stabilità genetica, no AMR, utilizzabile su molte tipologie di superfici. Punti di debolezza: non studiato il rischio in reparti ospitanti pazienti immunocompromessi (aree ad alto e altissimo rischio degli Ospedali), compatibilità con altri sistemi di disinfezione non studiata. Opportunità: basso costo, mercato in espansione, sensibilità salvaguardia ambiente, organizzazione semplice, programmazione puntuale, gestione interattiva e continuativa. Minacce: presenza di nuova concorrenza.
Per quanto concerne il PCHS, i dati di efficacia, la stabilità (intesa come assenza di evidenza di mutazioni patogene o resistenti secondo i dati disponibili) e l’assenza di patogenicità nell’uomo, sottolineano la possibilità di impiegare questo nuovo metodo di sanificazione sia in ambito ospedaliero che civile. I vantaggi dal punto di vista dell’assenza di patogenicità nell’uomo consentirebbero un chiaro vantaggio organizzativo-gestionale nell’estrinsecazione delle manovre di sanificazione: molti dei disinfettanti classici prevedono una prolungata ventilazione degli ambienti dopo l’uso e la necessità di ridurre o azzerare il personale presente all’interno dei locali durante tali manovre; questo non si renderebbe necessario durante l’applicazione del PCHS, mezzo che non richiede di vacare i locali durante le fasi di applicazione in quanto non presenta né tossicità né patogenicità per l’uomo. Il dato di stabilità risulta essere molto importante, in quanto un prodotto volto a evitare lo svilupparsi di resistenze microbiche presenta innumerevoli vantaggi sia dal punto di vista economico, sia dal punto di vista della prevenzione di eventuali resistenze microbiche: la stabilità genetica dimostrata dal PCHS rende improbabili eventuali mutazioni, che potrebbe inoltre portare a una riduzione delle antibiotico-resistenze causate dall’uso dei disinfettanti classici. In considerazione del problema ingravescente legato alle resistenze microbiche sia dal punto di vista economico che di salute globale, il PCHS potrebbe offrire una valida alternativa di sanificazione mirata a prevenire lo svilupparsi di microrganismi resistenti alle terapie.
Oltre all’efficacia e alla stabilità, un altro importante vantaggio nell’impiego del PCHS è rappresentato dai costi, favorevoli rispetto a quelli dei disinfettanti classici, sia in maniera diretta, che attraverso la prevenzione dei costi dovuti allo sviluppo di patogeni resistenti, causato dall’impiego dei disinfettanti classici.
Dal punto di vista gestionale-organizzativo, il PCHS può essere gestito tramite un apposito portale (ACC) in maniera interattiva, con pianificazione, monitoraggio e trasparenza, del processo di sanificazione e rendicontazione. Da un punto di vista organizzativo, la sua introduzione prevede solo la presentazione, da parte dell’azienda produttrice, dei protocolli operativi nonché delle nuove attrezzature utilizzate durante il tutto il processo di gestione oltre che la formazione specifica agli operatori per il corretto ed efficace utilizzo del nuovo sistema di sanificazione. Il sistema PCHS prevede anche un controllo microbiologico nelle aree a Medio Rischio come misura dell’esito finale del processo di sanificazione, attraverso specifici Indicatori di Risultato Microbiologico in conformità con “Linee di indirizzo sulla valutazione del processo di sanificazione ambientale nelle strutture ospedaliere e territoriali per il controllo delle Infezioni Correlate all’Assistenza (ICA)”. Per quanto concerne, invece, le procedure di smaltimento si specifica che i rifiuti prodotti dalle attività del gestore del servizio di pulizia vengono smaltiti dal gestore stesso attraverso aziende specializzate nello smaltimento e recupero rifiuti.
Un vantaggio rappresentato dal PCHS è quello di essere ecologicamente sostenibile e di ridurre notevolmente l’inquinamento ambientale prodotto dalle manovre di disinfezione che utilizzano i disinfettanti classici, riducendo sia l’impiego di inquinanti che lo spreco di risorse idriche ed energetiche.
Il PCHS presenta alcuni svantaggi: basandosi sul meccanismo competitivo innescato da probiotici, l’impiego in concomitanza di altri detergenti/disinfettanti nullificherebbe la sanificazione tramite PCHS; inoltre, sebbene la sicurezza sia stata testata, il rischio connesso all’utilizzo di PCHS non è stato testato in reparti con pazienti immunocompromessi.
L’evoluzione delle conoscenze scientifiche in materia di tecniche e prodotti per la sanificazione, rende necessaria una riflessione su un ampliamento della elaborazione, emanazione, implementazione e monitoraggio di raccomandazioni rivolte alla salubrità degli ambienti sanitari e non sanitari per quanto riguarda in particolare il rischio infettivo. L’obiettivo condiviso a livello di raccomandazioni nazionali è infatti quello di garantire il più possibile standard omogenei di prevenzione e sicurezza delle cure con ampia ricaduta applicativa delle raccomandazioni sulle aziende sanitarie. Sarebbe quindi opportuno riprendere un iter di revisione delle raccomandazioni esistenti e di individuazione e redazione di nuove alla luce delle più recenti evidenze scientifiche e considerandone la portata anche in termini organizzativi ed economici. In proposito, nel documento di consenso su “Raccomandazioni, Linee Guida e Buone Pratiche: definizioni e percorsi di elaborazione”, prodotto nel febbraio 2020 dalla Sub Area Rischio Clinico della Commissione Salute della Conferenza delle Regioni e PA, si fa richiamo a una fase di rielaborazione e stesura delle raccomandazioni, seguita da emanazione, implementazione, monitoraggio e valutazione, nella prospettiva di un miglioramento continuo.
Potrebbe, pertanto, essere utile riprendere e riesaminare le attuali raccomandazioni esistenti in materia di sanificazione estendendo i confronti con nuove tecniche e sistemi caratterizzati da evidenze scientifiche di sicurezza ed efficacia e considerando accuratamente anche ulteriori aspetti di valore come una analisi sistematica di tutti i sistemi di sanificazione alternativi ammissibili (in base a requisiti di efficacia e sicurezza evidence-based), e la valutazione del rapporto costo/beneficio tra sistemi alternativi messi a confronto. Una tale revisione appare in linea anche con quanto direttamente evidenziato nei documenti di raccomandazione ISS che invitano all’estensione della sperimentazione mediante studi di efficacia e ammettono tra i limiti delle esistenti raccomandazioni il fatto che queste non siano al momento esaustive dei sistemi di sanificazione attualmente disponibili.
La revisione delle attuali raccomandazioni in materia di disinfezione/sanificazione, è coerente anche con il recente decreto del Ministero dell’ambiente e della tutela del territorio e del mare del 29 gennaio 2021 dal titolo “Criteri ambientali minimi per l’affidamento del servizio di pulizia e sanificazione di edifici e ambienti a uso sanitario”. Nel documento si sottolinea come in ambito ospedaliero le attività di pulizia e sanificazione delle superfici ambientali hanno l’obiettivo di assicurare una situazione a rischio controllato, contenendo la carica microbica entro i limiti riportati nelle “Linee di Indirizzo sulla valutazione del processo di sanificazione ambientale nelle strutture ospedaliere e territoriali per il controllo delle infezioni correlate all’assistenza”, specifici per ciascuna tipologia di area di rischio, al fine di ridurre al minimo i fenomeni di ricolonizzazione dell’ambiente mantenendo la carica microbica potenzialmente patogena a livelli bassi e stabili nel tempo e riducendo significativamente i geni di resistenza dei principali patogeni presenti nel campo microbico. Nel documento si evidenzia anche che in ambito assistenziale è opportuno evitare l’abuso dei prodotti disinfettanti e utilizzare i più aggressivi solo quando strettamente necessario, anche al fine di prevenire lo sviluppo di resistenze; ciò può essere raggiunto tramite l’utilizzo di protocolli appropriati e anche attraverso tecniche innovative. Nel documento si fa anche riferimento alla valutazione di tecniche e approcci innovativi, alla definizione dei percorsi paziente rischio-correlati e alla misurazione di efficacia del processo di sanificazione introducendo il controllo microbiologico anche nelle aree a Medio Rischio come misura dell’esito finale di un processo di sanificazione attraverso specifici Indicatori di Risultato Microbiologico.
Il PCHS rappresenta un trattamento eleggibile ma non è ancora incluso nelle raccomandazioni nazionali. È un sistema di igiene stabile nel tempo che supera il tradizionale concetto di igiene temporanea a dei disinfettanti, e che sarebbe eleggibile per essere considerato all’interno di un iter di inclusione nelle raccomandazioni sulla sanificazione ambientale. Secondo la letteratura di riferimento sull’utilizzo nelle aree no COVID, il PCHS risponde tutta una serie di requisiti che possono essere riassunti in: lunga persistenza dell’efficacia di azione; ampio spettro d’azione sui batteri patogeni grazie all’azione aspecifica dei Bacillus presenti nel detergente; sicuro per l’uomo e non dannoso per i materiali da trattare; facilità di applicazione; qualità e sicurezza; economicità di gestione.
Inoltre, con il PCHS si garantisce la sostenibilità ambientale con meno rifiuti materiali, meno consumo di prodotti, meno impiego di prodotti chimici definiti pericolosi, minor utilizzo di risorse energetiche e idriche. Le performance ambientali sono state studiate e certificate nel rispetto dei CAM (Criteri Ambientali Minimi) e in coerenza con la Green Economy Legge 28 dicembre 2015. Una politica ambientale a impatto zero genera valore. Il modello prevede la massima riduzione di Co2 tramite l’identificazione dell’impronta climalterante e la misurazione dell’impatto sull’ambiente. Una strategia ecosostenibile limita al massimo le emissioni di Co2 e attiva misure compensative, come la piantumazione di alberi, l’acquisto di energia verde e la partecipazione a progetti internazionali contro l’effetto serra. Nello specifico, l’azienda produttrice del PCHS è stata tra le prime in Italia a ottenere la certificazione ISO 14067 (Carbon Footprint Systematic Approach) per l’intero ciclo di vita del proprio servizio di pulizia in ambito sanitario potendolo così quantificare in termini di CO2-eq/m2 pulito annuo. L’azienda ha anche ottenuto il brand “I CARE APPENNINO” per l’impegno a realizzare o sostenere progetti a favore del territorio e della biodiversità delle comunità dell’Appennino Tosco Emiliano che compensano le emissioni di anidride carbonica del proprio servizio di pulizia. Inoltre in data 14 novembre 2019, prima azienda in Italia, ha ottenuto la Certificazione Ecolabel del servizio di pulizia di ambienti sanitario sinonimo di qualità ecologica dei servizi.
La certificazione determina un Sistema di Garanzia: il controllo di qualità si svolge a fronte di sistemi certificativi indicati nei Protocolli Operativi. Il servizio viene verificato sia a livello di processo che di risultato sulla base delle procedure di autocontrollo e della conformità a: Sistema Qualità Uni En Iso 9001 – Soddisfazione del cliente; Sistema di Gestione Salute e Sicurezza UNI ISO 45001 – Sistemi di gestione per la salute e sicurezza sul lavoro; Sistema di Responsabilità Sociale SA 8000 – Tutela del lavoro per impresa e lavoratori; Sistema di Gestione Ambientale ISO 14001 – Massima riduzione dei fattori inquinanti; Standard Anmdo-Cermet – Buone pratiche di pulizia e sanificazione delle strutture sanitarie; Indicatori di Risultato Microbiologico in conformità con “Linee di indirizzo sulla valutazione del processo di sanificazione ambientale nelle strutture ospedaliere e territoriali per il controllo delle Infezioni Correlate all’Assistenza (ICA)”.
Il portale ACC del PCHS è uno strumento interattivo che permette lo scambio di informazioni fra cliente e personale tecnico specializzato, basato su 4 livelli di controllo: economico, tecnico, servizio e qualità. In questo modo i tempi di comunicazione si riducono e l’indice di qualità dei servizi aumenta, il cliente accede sempre e da qualsiasi device a tutte le informazioni in totale trasparenza, gli utenti possono accedere solo alle informazioni di loro interesse, grazie a una registrazione che categorizza gli accessi.
Biocompetizione: Igiene Biostabile PCHS: controlla la contaminazione microbica ambientale e la produzione di igiene, riduce in maniera stabile nel tempo la contaminazione patogena, riduce la carica virale sulle superfici fino a 24 ore, riduce le infezioni correlate all’assistenza (ICA), abbatte le resistenze nell’ecosistema microbico, riduce i costi delle terapie antimicrobiche.
I materiali e le attrezzature del PCHS garantiscono la massima resa tecnica. Ideati e prodotti insieme a facoltà universitarie di spicco e aziende di produzione leader del settore, le attrezzature e i materiali offrono massima resa tecnica e migliore conformità ergonomica, da utilizzarsi come da Protocolli Operativi. La flessibilità operativa di PWR CLEAN 100 permette risultati straordinari grazie alla massima evoluzione della microfibra. PWR DAMP 100 rende la scopatura un’operazione di alto valore e massima efficacia.
Step 1: Raccolta e analisi dei dati. Il PCHS è un sistema integrato di processi e metodi per l’igiene degli ambienti, ideato da Copma scrl e che ha ottenuto l’Ecolabel UE il 14 novembre 2019. Il sistema integrato consiste nell’utilizzo, ai fini della sanificazione, di detergenti ecologicamente sostenibili basati su una miscela contenente 107 CFU/mL di probiotici del genere Bacillus, sotto forma vegetativa e sporigena e con carica microbica non patogena. Il meccanismo utilizzato è quello della sostituzione di batteri patogeni presenti sulle superfici con probiotici, mediante un antagonismo competitivo. L’utilizzo di una soluzione di Bacillus spp. viene integrato da una specifica tecnica di attivazione per la competizione biologica, dall’uso di specifici materiali in microfibra combinando attività di spolveratura e di lavaggio, da procedure certificate e controllo microbiologico. Le operazioni di sanificazione sono eseguite secondo i protocolli PCHS, che prevedono un piano di addestramento dello staff alla cultura dell’igiene e al governo del processo attraverso il sistema informatico ACC Always Connected Copma, in modo da aumentare l’efficacia di processo e i risultati.
Step 2: Valutazione etica.
Efficacia e sicurezza. Tra gli approcci utilizzati ai fini della riduzione delle ICA, il sistema integrato PCHS ha dimostrato di mantenere nel tempo la riduzione dei batteri patogeni come Staphylococcus spp., Enterobacteriaceae spp., Acinetobacter spp., Pseudomonas spp., Candida e Aspergillus spp., e C. difficile sporigeno, sulle superfici sottoposte al trattamento fino al 90% in più rispetto alla disinfezione convenzionale, non creando tra l’altro forme di resistenza.
Impatto ambientale. Il PCHS riduce l’utilizzo di detergenti e disinfettanti convenzionali, e – di conseguenza – la quantità di inquinanti chimici sia nei luoghi dove si adoperano, sia nell’ambiente più in generale. La certificazione Ecolabel UE è stata, infatti, preceduta da uno studio finalizzato alla verifica dell’impatto ambientale del PCHS. I risultati hanno evidenziato che con l’utilizzo del PCHS si ottiene la riduzione del consumo di sostanze chimiche (45%), dell’impronta di carbonio (35%) e dei consumi elettrici e idrici (29-33%). Il PCHS riduce, inoltre, la presenza di batteri patogeni e lo sviluppo di varianti batteriche antimicrobico-resistenti. Il suo potenziale per il controllo degli odori sembra si traduca, infine, in un vantaggio competitivo rispetto ai tradizionali prodotti per la pulizia a base chimica.
Qualità della vita. La prevenzione delle ICA contribuisce indubbiamente al miglioramento della qualità della vita dei pazienti ricoverati in luoghi di assistenza e di cura. In base ai dati disponibili, il miglioramento delle condizioni igieniche impatta in modo positivo sul benessere mentale, oltre che sulla salute fisica. La riduzione delle ICA consente, inoltre, di ridurre condizioni di dolore, sofferenza, perdita di autosufficienza, conseguenti a possibili sovra-infezioni in soggetti già affetti da altre patologie. La possibilità di un bilancio positivo in termini di DALY (Disability-Adjusted Life Year) a seguito degli interventi di sanificazione, consente di affermare che il PCHS è un metodo utile al miglioramento della qualità della vita.
Giustizia ed equità degli interventi. Il principio ispiratore di un sistema sanitario informato alla solidarietà, come il SSN in Italia, è quello di garantire la parità di accesso a interventi di prevenzione e a cure efficaci. La limitatezza delle risorse sanitarie rende, però, necessaria una valutazione di costo-efficacia e la definizione delle priorità delle politiche sanitarie. Se si ha, però, a disposizione un trattamento di sanificazione come il PCHS, con un profilo di efficacia e sicurezza superiore agli standard, questo andrebbe messo a disposizione di tutte le strutture sanitarie. Il criterio etico, che deve guidare questa scelta, è il criterio dell’equità in base al quale va garantito l’accesso alle procedure di sanificazione a tutti i luoghi di assistenza e di cura. E, anche qualora la tecnica in esame – pur presentando un ottimo bilancio in termini di benefici ricercati - non fosse economicamente vantaggiosa, essa andrebbe comunque assicurata dal momento che il valore in gioco sono vite umane.
Step 3: Elaborazione del parere. Dalla valutazione svolta emerge che il PCHS è efficace nella riduzione delle ICA, più sicuro rispetto ai tradizionali prodotti per la pulizia a base chimica, e con un basso impatto ambientale. Se a questo si aggiungono le ricadute positive in termini di miglioramento della qualità di vita e il vantaggio economico sul lungo termine, il giudizio etico non può che essere positivo. Un ampio utilizzo del PCHS potrà consentire di raccogliere – nel tempo – ulteriori evidenze per confermarne efficacia e sicurezza e utili per un eventuale reassessment della tecnologia.
Le evidenze scientifiche raccolte nel presente HTA, evidenziano che a livello europeo, ogni anno, le Infezioni Correlate all’Assistenza (ICA) colpiscono circa 4 milioni di pazienti e sono causa di oltre 37.000 decessi, di cui solo 10.000 in Italia. I costi per la gestione di queste infezioni superano il miliardo di €/anno, con un impatto economico notevole anche in termini di prolungamento dei tempi di degenza e maggior impiego di antibiotici. Gli ambienti sanitari svolgono un ruolo importante nella trasmissione delle ICA e, pertanto, adeguati ed efficienti processi di sanificazione sono fondamentali per il controllo di queste infezioni.
Dalle evidenze analizzate si evince un burden epidemiologico considerevole delle ICA anche in Italia, con valori di prevalenza variabili dal 3,6 al 13,3% nella popolazione generale. Il controllo della contaminazione microbica è essenziale e, a oggi, è stato affrontato mediante uso di disinfettanti chimici che tuttavia non prevengono la ricontaminazione, hanno un elevato impatto ambientale e possono favorire l’ulteriore comparsa e selezione di AMR. Il sistema di sanificazione PCHS, al contrario, non contiene disinfettanti, ma si basa su detergenti ecosostenibili (fully ecolabelled) contenenti selezionate spore di probiotici del genere Bacillus, che integra diversi fattori come procedure certificate, specifici materiali in microfibra e un piano di formazione dedicato al personale. Il sistema PCHS prevede anche un controllo microbiologico nelle aree a Medio Rischio come misura dell’esito finale del processo di sanificazione, attraverso specifici Indicatori di Risultato Microbiologico in conformità con le “Linee di indirizzo sulla valutazione del processo di sanificazione ambientale nelle strutture ospedaliere e territoriali per il controllo delle Infezioni Correlate all’Assistenza (ICA)”.
I test sul PCHS sono stati condotti sia in saggi in sospensione che su superficie, secondo le rispettive normative UNI EN 14476:2019 e UNI EN 16777:2019. Rispetto ai sistemi di cleaning e sanificazione convenzionali, basati sull’utilizzo di composti chimici, il PCHS mostra i seguenti vantaggi: basso livello ambientale (ecolabel); effetto decontaminante stabile nel tempo (azione stabile anche antivirale fino a 24 ore); prevenzione dei fenomeni di ricontaminazione; nessuna selezione o induzione di antibiotico-resistenza; riduzione dei patogeni dotati di AMR fino al 99,9%. Queste caratteristiche si associano a: riduzione dell’incidenza di ICA, riduzione del consumo di farmaci antimicrobici, riduzione della spesa sanitaria.
Il PCHS è stato testato su campo in diversi setting ospedalieri in Italia e all’estero. Gli studi sono stati condotti essenzialmente nei reparti di medicina interna per adulti, e uno studio è stato effettuato nel reparto di Pronto Soccorso di un ospedale pediatrico durante il periodo pandemico COVID-19. Nessuno studio è stato condotto in reparti con pazienti immunocompromessi. Pertanto, in futuro, potrebbe essere utile l’esecuzione di ulteriori studi nell’ambito di altri setting assistenziali e mediante studi epidemiologici al fine di produrre ulteriori evidenze utili per un eventuale reassessment della tecnologia.
Dai dati presentati nel report si evince come la diffusione dell’impiego di sistemi di sanificazione ambientale sostenibili, come il PCHS, potrebbe ridurre i tassi di ICA e AMR senza costi aggiuntivi per i sistemi sanitari. In effetti, l’introduzione del PCHS come pratica di sanificazione ordinaria in 5 anni potrebbe portare a risparmi che vanno da 13,8 (analisi del caso base) a € 452 milioni (analisi su ricoveri per acuti, inclusi rimborsi assicurativi per ICA gravi, con utilizzo al 100% del PCHS).
Oltre a essere efficace ed economicamente vantaggioso, quindi, il PCHS presenta dei punti di forza molto rilevanti nel panorama attuale, in cui assumono sempre più importanza le caratteristiche di sicurezza e biosostenibilità. Infatti, oltre a ridurre il rischio di insorgenza di resistenze microbiche, il PCHS riduce notevolmente l’impatto ecologico delle manovre di sanificazione rispetto ai disinfettanti classici, garantendo, allo stesso tempo, la sicurezza di pazienti e lavoratori presenti nei locali in cui vengono applicate le procedure di sanificazione, visto l’impiego di probiotici non patogeni nell’uomo.
Inoltre, il giudizio etico sul PCHS risulta essere positivo, in funzione dell’efficacia nella riduzione delle ICA, dalla maggiore sicurezza rispetto ai tradizionali prodotti per la pulizia a base chimica, e in rapporto al suo basso impatto ambientale, a cui si aggiungono le ricadute positive in termini di miglioramento della qualità di vita e il vantaggio economico sul lungo termine. Pertanto, un ampio utilizzo del PCHS potrà consentire di raccogliere – nel tempo – ulteriori evidenze per confermarne efficacia e sicurezza e utili per un eventuale reassessment della tecnologia.
Sulla base dei dati a oggi disponibili, il PCHS mostra grandi potenzialità per un utilizzo in quegli ambienti in cui non sia necessaria una condizione di sterilità ma una sanificazione stabile, che porti a limitare la contaminazione patogena e farmaco-resistente correlata all’insorgenza di infezioni di difficile approccio terapeutico. Potrebbero, pertanto, essere inclusi, oltre a quello ospedaliero nei reparti a basso e medio rischio, anche gli ambienti domestici, comunitari e dei trasporti. Agli ambienti per utilizzo umano, si potrebbero aggiungere anche quelli utilizzati per l’allevamento di animali e l’uso in agricoltura (peraltro già ampiamente diffuso), allo scopo di mettere in atto una strategia “one health” in linea con i princìpi indicati dalla Comunità Europea per la lotta all’AMR e nel rispetto delle indicazioni comunitarie di sostenibilità ecologica.
In conclusione, le evidenze scientifiche raccolte nell’HTA dimostrano i rilevanti possibili benefici di una strategia preventiva efficace, migliorando la gestione dei diversi presidi contro le ICA e, quindi, garantendo gli strumenti più appropriati per la sanificazione degli ambienti ospedalieri e non, e implementando l’uso di sistemi innovativi, come il PCHS, sempre più efficaci, sicuri (per sé e per l’ambiente circostante) e sostenibili.