Abstract
目的
综述细胞衰老在骨关节炎(osteoarthritis,OA)发生、发展中的病理作用及潜在治疗靶点。
方法
查阅国内外相关文献,对软骨细胞衰老、滑膜细胞衰老、MSCs 衰老在 OA 中的作用及软骨细胞衰老发生的生物学机制和进展进行总结。
结果
现有证据已基本明确软骨细胞衰老、MSCs 衰老与软骨修复异常及 OA 的发生、发展存在一定因果关系,而滑膜细胞衰老,特别是滑膜巨噬细胞衰老在 OA 中的作用尚不明确。转录因子、表观遗传是调控衰老上游通路的主要机制,细胞间的信号交流可促进健康细胞出现衰老表型。定向清除衰老细胞和促进 MSCs 年轻化可有效延缓 OA 的进展。
结论
细胞衰老是 OA 发生、发展中的重要生物学现象及潜在治疗靶点,深入研究其生物学机制有助于 OA 的早期防治。
Keywords: 骨关节炎, 细胞衰老, 软骨细胞, 细胞年轻化
Abstract
Objective
To review the pathological effects of cellular senescence in the occurrence and development of osteoarthritis (OA) and potential therapeutic targets.
Methods
The role of chondrocyte senescence, synovial cell senescence, mesenchymal stem cells senescence in OA, and the biological mechanism and progress of chondrocyte senescence were summarized by consulting relevant domestic and abroad literature.
Results
The existing evidence has basically made clear that chondrocyte senescence, mesenchymal stem cells senescence, and cartilage repair abnormalities, and the occurrence and development of OA have a certain causal relationship, and the role of the senescence of synovial cells, especially synovial macrophages in OA is still unclear. Transcription factors and epigenetics are the main mechanisms that regulate the upstream pathways of cellular senescence. Signal communication between cells can promote the appearance of senescent phenotypes in healthy cells. Targeted elimination of senescent cells and promotion of mesenchymal stem cells rejuvenation can effectively delay the progress of OA.
Conclusion
Cellular senescence is an important biological phenomenon and potential therapeutic target in the occurrence and development of OA. In-depth study of its biological mechanism is helpful to the early prevention and treatment of OA.
Keywords: Osteoarthritis, cellular senescence, cartilage cells, cell rejuvenation
骨关节炎(osteoarthritis,OA)是由全身易感因素和局部机械因素相互作用导致的一种以关节软骨退变为主要病理特征的关节疾病,与衰老、性别、肥胖、创伤及遗传等多种因素相关[1]。OA 最常累及膝关节、髋关节及远端指间关节。研究显示 OA 在全球疾病负担中排名第 11 位,是引起关节疼痛与致残的首位关节疾病[2]。在我国,由于人口基数大、老龄化社会形成,该问题尤为突出。我国大型流行病学调查结果显示,40 岁以上人群双膝 OA 患病率达 15.6%[3]。研究显示,随着社会进步,膝关节 OA 患病率较早期工业时代升高了 2 倍[4]。OA 引起的疼痛、畸形及功能障碍严重影响患者的生产能力及生活质量,导致了巨大医疗卫生支出[5],我国每年因膝关节 OA 产生的医疗费用超过 5 万亿人民币(约占 2018 年 GDP 总量的 4%)。目前针对 OA 的治疗手段大多仅为对症处理,缺乏疾病干预性药物,绝大部分患者最终仍需通过关节置换术缓解疼痛、恢复关节功能。这严重制约了人口健康的发展,因而急需加强对调控 OA 发生、发展分子信号网络的研究,希望从根本上解决 OA 防治难题。本文将从细胞衰老的病理生理,软骨细胞衰老、滑膜细胞衰老及 MSCs 衰老与 OA 的潜在因果关系及机制方面进行综述。
1. 细胞衰老的病理生理
细胞衰老现象最早于 1961 年由微生物学家 Leonard Hayflick 与 Paul Moorhead 在进行体外成纤维细胞传代时发现。目前观点认为,细胞衰老是细胞在 DNA 损伤、端粒短缩、肿瘤基因激活、表观遗传改变、氧化应激等情况下出现的一种自我保护机制,表现为永久性的生长停滞,细胞分裂周期停滞于 G1 期或 S 期,以避免将异常基因传至下一代细胞,从而维持机体稳态[6-7]。根据引起衰老的原因,细胞衰老可分为复制性衰老与应激导致的早衰,后者可分为 DNA 损伤衰老、氧化应激衰老、表观遗传所致衰老、炎性衰老等多种类型[8]。
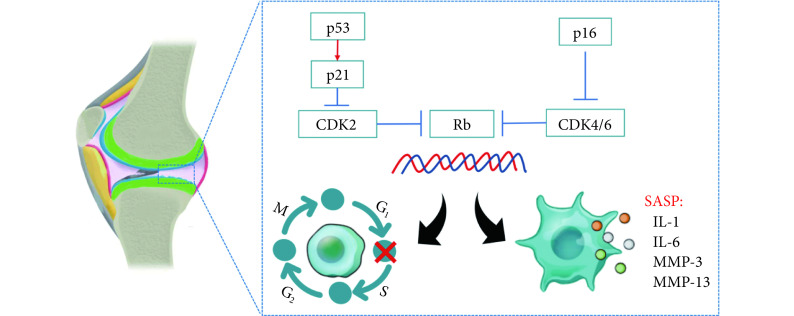
尽管各种衰老的始动因素不尽相同,但其最终的效应通路均一致,不同的是上游调控机制[9]。而调控最终效应的信号通路主要包括 p53-p21Cip1-视网膜母细胞瘤蛋白(retinoblastoma,Rb)通路(主要调控 S/G2 期)及 p16INK4A-Rb 通路(主要调控 G1/S 期)[9-10];p21Cip1、p16INK4A激活后编码的周期蛋白依赖性激酶抑制剂(cyclin-dependent kinase inhibitor,CDKi)1A 及 CDKi2A,可分别抑制周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)2 及 CDK4/6,从而抑制 Rb 蛋白去磷酸化。Rb 蛋白的活化可抑制 E2F 基因表达,从而阻止细胞进入分裂期(S 期)。细胞衰老的发生是一连续动态过程,在细胞衰老起始阶段,为了响应 DNA 双链断裂及端粒不稳定,激活 DNA 损伤反应,可通过共济失调毛细血管扩张突变蛋白(ATM)及酵母 Rad3 相关蛋白(ATR)介导的 p53 磷酸化,增强转录因子 p53 的稳定性,进一步上调 p21 的表达而抑制细胞周期。而在细胞衰老的维持阶段,p16 可在 p38 MAPK 及 ERK 信号通路的作用下表达上调,从而发生永久性的分裂停滞[11]。这两种效应通路激活的时空调控还受到外界刺激或应激种类及持续时间的影响。
衰老细胞的表型在不同器官和组织中存在较高异质性,寻找具有普适性和特异性的衰老细胞生物标志物,也一直是衰老领域研究的重点和难点;而这同时也限制了在体内及体外对衰老细胞的识别与分离。尽管如此,随着研究深入与技术发展,现有研究也发现了衰老细胞的部分共性特征,如 DNA 损伤、细胞周期停滞、凋亡抵抗、溶酶体功能异常等[8]。① DNA 损伤反应:γ-组蛋白 H2AX(γ-H2AX)免疫荧光染色可发现连续、未修复的 DNA 损伤,测量磷酸化 p53 水平也可反映 DNA 损伤反应[12]。② 细胞周期停滞:可通过 BrdU 或 EdU 测定 DNA 合成率或测定 p16、p21 基因水平来反映[13]。③ 溶酶体功能异常:β-半乳糖苷酶是反映溶酶体活性的最常用标志物,也是用于评估细胞衰老的主要指标[14]。另外,应用流式细胞技术及磁珠分选技术识别衰老细胞表面的分子标志物,如细胞间黏附分子 1(ICAM-1)、NOTCH 蛋白 3(NOTCH3),从而实现在不破坏细胞基础上分离细胞的目的[15]。这类细胞表面分子标记物的发现也有助于对衰老细胞的精准清除。
衰老细胞虽然停止了分裂,但仍具有代谢功能,可分泌一系列衰老相关因子(senescence-associated secretory phenotype,SASP),如细胞外基质金属蛋白酶(matrix metalloproteinases,MMP)、生长因子、促炎性细胞因子及趋化因子等,从而通过旁分泌方式影响周围的细胞和组织。急性细胞衰老有助于机体稳态的维持,分泌的生长因子可促进胚胎发育[16-17]、伤口愈合[18]及胰岛素分泌[19]。然而持续存在的衰老细胞将加速组织器官失功能而发生老年退行性疾病[20]。见图 1。
图 1.
Schematic diagram of the mechanism of cellular senescence in OA
细胞衰老在OA中作用机制示意图
2. 细胞衰老与 OA
2.1. 软骨细胞衰老与 OA
2.1.1. 软骨细胞衰老与 OA 间的因果关系
OA 是一种常见的老年退行性关节疾病,其病理改变可累及包括软骨、软骨下骨、滑膜、髌下脂肪垫等在内的全关节结构,主要病理特征是软骨细胞退变及细胞外基质崩解[1,21]。软骨细胞是关节软骨中的唯一细胞类型,它通过合成Ⅱ型胶原及聚集蛋白聚糖来控制细胞外基质的稳态。年龄是 OA 的主要危险因素之一,研究结果也发现 OA 发病率随年龄增加而升高[22];近年研究表明 OA 与年龄增加发生的软骨细胞衰老及后续的软骨损伤修复异常密切相关[23-25]。
关节软骨细胞是一类低增殖能力细胞,正常情况下处于静止状态[20]。关节损伤发生后,软骨细胞可恢复增殖能力以修复软骨,从而维持软骨稳态,但这类重新进入分裂周期的软骨细胞更容易发生细胞衰老,进而导致 OA 的发生、发展[26-27]。Gao 等[23]在膝关节 OA 受损软骨组织周围发现与衰老相关 β-半乳糖苷酶(senescence associated β galactosidase,SA-β-Gal)染色阳性的软骨细胞增多,且阳性细胞数量与 OA 严重程度密切相关。Xu 等[24]将体外构建的带荧光标记的衰老软骨细胞移植入野生型小鼠膝关节中,通过 18-脱氧葡萄糖 PET-CT 示踪衰老软骨细胞,发现移植衰老软骨细胞的小鼠表现出典型 OA 病理变化。Jeon 等[25]利用 p16-3MR 基因工程鼠定向调控软骨细胞衰老后,发现 p16 激活后的小鼠表现出更严重的 OA,而定向抑制 p16 激活可延缓 OA 进展;在 p16 激活的小鼠体内应用 UBX0101(一种促凋亡剂)清除衰老软骨细胞后同样可延缓 OA 进展。由此可见,软骨细胞衰老在 OA 病理生理过程中发挥了重要作用,但调控软骨细胞衰老的具体机制暂不明确。
同时,关于衰老软骨细胞与 OA 之间的因果关系也受到了部分学者质疑。Diekman 等[28]通过小鼠及人体标本体内外研究发现,p16INK4A基因在年老小鼠和人体膝关节软骨细胞中上调明显,而 p16INK4A阳性的人体软骨细胞增殖能力下降;而在小鼠体细胞中沉默 p16INK4A基因后,并未延缓因年龄增加和创伤导致的 OA。因此,作者指出 p16 的表达仅仅是软骨细胞增殖能力缺失的标志之一,而衰老细胞产生的 SASP 才是衰老软骨细胞与 OA 之间的驱动因素。
2.1.2. 软骨细胞衰老的生物学机制
过去 30 年,衰老研究已经从衰老表型识别过渡到表型背后的遗传机制研究。目前关于软骨细胞衰老的分子机制研究主要集中于 3 个方面:一是衰老发生共同通路的上游调控机制;二是衰老细胞产生 SASP 的调控机制;三是衰老细胞如何影响周围健康细胞的机制。而现有证据发现转录因子调控、表观遗传改变、胞浆环状鸟苷单磷酸酯-单磷酸腺苷合酶(cyclic GMP-AMP synthase,cGAS)-干扰素基因刺激物(stimulator of interferon genes,STING)通路调控 SASP、外泌体介导衰老细胞间信号交流在 OA 发生、发展中有着重要作用。
细胞外囊泡包括外泌体及微泡,是一种大小为 30 nm~1 μm 的膜微粒,主要作用是介导细胞间的信号交流。近年研究发现与正常细胞相比,衰老细胞会分泌更多细胞外囊泡[29]。而这些囊泡可作为交流信号介导邻近健康细胞衰老发生,这种现象在 OA 软骨细胞中也得到了证实。Jeon 等[30]发现人膝关节 OA 软骨细胞分泌的囊泡可被正常软骨细胞摄取,从而表现出 SA-β-Gal 染色阳性、蛋白聚糖分泌减少的衰老表型;这种作用与囊泡来源的软骨细胞衰老程度呈典型的剂量-效应关系。进一步分析这些囊泡内容物发现,衰老软骨细胞来源囊泡中的 miRNA 含量发生了变化,从而介导健康细胞的表观遗传改变及衰老发生,但具体机制仍有待进一步研究。同时,有研究发现衰老软骨细胞表面介导信号交流的细胞交流网络因子 1(CCN1)[31]、通道连接蛋白 Connexin43(Cx43)[32]表达增加,而抑制这些蛋白表达可逆转软骨细胞的衰老表型,促进软骨细胞的去分化和再分化。
SASP 分泌是衰老细胞的重要特征之一,这些蛋白质的基因编码方式虽然已明确,但对整个过程的初始阶段知之甚少。研究发现,cGAS-STING 通路在 SASP 产生及细胞衰老中至关重要[33-34]。cGAS-STING 是新发现的先天性免疫途径,主要通过识别释放到细胞质中的外源性及内源性 DNA 片段,激活下游信号转导级联反应,导致Ⅰ型干扰素和其他免疫介质的产生。目前虽然无直接证据显示 cGAS-STING 通路在软骨细胞衰老中的作用,但其在 MSCs 衰老中的作用或许能揭示其在软骨细胞中的潜在价值[33]。
在细胞衰老通路的上游信号调控网络中,miRNA 和转录因子发挥着重要作用。miRNA 能特异性地与 mRNA 结合,负向调控 mRNA 的翻译。目前已发现几十种 miRNA 与细胞衰老密切相关[35-36],主要作用于 p53/p21、p16/Rb 衰老细胞轴或 SASP 的产生。其中,与软骨细胞衰老密切相关的 miRNA 包括 miR-140、miR-24、miR-146 等[37-38],新发现的 miR-17-92 cluster 可能也参与软骨细胞衰老的调控。miR-17-92 cluster 主要功能是调控细胞周期,参与骨骼的生长发育,其表达异常与细胞衰老及肿瘤发生、发展密切相关[39];研究显示 MIR17HG 突变或其上游转录因子 MYCN 突变是骨软骨疾病 Feingold 综合征的新遗传机制,患者表现为小头畸形、四肢短小与手指畸形[40-41]。
转录因子是细胞衰老通路上游的重要调控环节,其中包括叉头框蛋白 O(forkhead-box class O,FoxO),FoxO 家族成员包括 FoxO1、FoxO3、FoxO4、FoxO6,FoxO 与生长发育、衰老及长寿密切相关[42]。FoxO 功能失调可导致老年性骨质疏松[43]与肌肉萎缩[44],其机制可能与调控细胞周期的 p16、p53/p21 有关。而近年研究发现,外源性应用 FoxO4 细胞穿膜肽能竞争性干扰 FoxO4-p53 的结合,从而诱导衰老细胞发生凋亡,维持机体稳态[45]。关节软骨中,通过对正常软骨及 OA 软骨的全基因组及转录组测序发现,FoxO 是差异最明显的信号通路之一[46];体外软骨标本的免疫组织化学研究也发现,老年关节软骨及 OA 软骨中 FoxO1、FoxO3 表达均降低[47];同时,体内条件性敲除软骨细胞 FoxO1/3/4 的小鼠表现出软骨发育异常、抗氧化应激能力降低及更严重的 OA 表型[48]。因此,深入探索以 FoxO 为核心的分子信号网络在软骨细胞衰老及 OA 中的病理作用,有助于疾病的精准防治。
2.2. 滑膜细胞衰老与 OA
滑膜作为关节结构中的重要组成部分,通过滑膜成纤维细胞分泌滑液及滑膜巨噬细胞分泌促炎因子和抗炎因子,共同维持局部微环境的稳定。近年来,越来越多研究开始关注滑膜在 OA 发生、发展中的重要病理生理作用,特别是滑膜局部常驻巨噬细胞及循环巨噬细胞组成的先天性免疫在 OA 局部炎症中的病理作用。最新研究通过三维荧光显微镜、谱系示踪、单细胞转录组测序等技术,在滑膜衬里层发现了一组 CX3CR1+ 组织驻留型巨噬细胞,覆盖于滑膜成纤维细胞上层,细胞间可通过紧密连接在滑膜毛细血管网与关节间隙之间构成动态的类膜结构,形成免疫屏障[49]。
目前关于滑膜细胞衰老与 OA 之间因果关系的研究尚处于起步阶段,Zhang 等[50]发现滑膜成纤维细胞在缺氧环境容易诱发细胞衰老,从而发生促炎因子及 MMP 分泌增加;Jeon 等[25]构建的 p16 基因工程鼠 OA 模型中可观察到滑膜中 p16 和 SA-β-Gal 染色阳性细胞数增加,但并未明确呈现 p16 阳性细胞是成纤维细胞还是巨噬细胞。而有研究发现 p16 和 SA-β-Gal 阳性的巨噬细胞可能是正常生理刺激下出现的细胞极化标志物[51],同时这种巨噬细胞仍然保持了向 M2 样巨噬细胞极化的潜能。这一结论在该团队的另一项研究中也得到了证实[52],作者通过向免疫缺陷小鼠腹腔注射藻酸盐包被的衰老细胞,分析衰老细胞周围的免疫细胞类型,发现主要是 F4/80 阳性的巨噬细胞,同时该群巨噬细胞也呈现出 p16 和 SA-β-Gal 阳性。但是,p16 与 SA-β-Gal 阳性滑膜巨噬细胞的分泌表型是否发生改变并未明确。
基于现有证据,滑膜巨噬细胞可通过以下两方面参与 OA 的发生、发展:一方面,衰老软骨细胞分泌的 SASP 及软骨分解的细胞外基质片段激活驻留的滑膜巨噬细胞,吞噬衰老细胞从而维持稳态。如应激原持续存在,增龄导致的巨噬细胞衰老可使其丧失免疫监视功能而加速软骨退变。另一方面,激活的巨噬细胞可高表达 NAD+降解酶 CD38,加速组织中 NAD 消耗[53],使得软骨组织能量代谢失衡而加速软骨退变。
2.3. MSCs 衰老与 OA
在膝关节的滑膜组织、髌下脂肪垫及软骨下骨等结构中,存在着一群具有自我更新能力及多向分化潜能的细胞,即 MSCs。根据其来源组织特异性又可分为滑膜来源 MSCs、关节液来源 MSCs、脂肪来源 MSCs (adipose-derived stem cells,ADSCs)及 BMSCs。现有观点认为,软骨下骨的 BMSCs 耗竭及修复能力异常参与了 OA 的发生、发展过程[54],通过其潜在的软骨分化能力、旁分泌作用及免疫调节作用,为 OA 治疗提供了可能[55]。
在 OA 中,衰老的软骨细胞可能影响 MSCs 的软骨分化潜能,而衰老的 MSCs 又因丧失免疫调节作用,促进 OA 发展,从而进入互相促进的恶性循环。Cao 等[56]探索了衰老软骨细胞与 BMSCs 之间的相互作用,结果发现衰老的软骨细胞可抑制 BMSCs 的分化潜能及增殖能力,而 BMSCs 可促进衰老软骨细胞凋亡。而另一项研究[57]则通过将体外诱导 p16INK4A阳性的人滑膜及软骨下骨 MSCs 与 OA 软骨细胞共培养,探索衰老 MSCs 对 OA 软骨细胞的作用,结果发现衰老 MSCs 并不能逆转 OA 软骨细胞的代谢表型。作者进一步通过 SAMP8 小鼠衰老模型诱导滑膜及软骨下骨 MSCs 衰老,同时将提取纯化的衰老 MSCs 注射到 C57 小鼠膝关节腔中,C57 小鼠可发展成典型 OA 表型。Huang 等[58]研究首先证实了人 OA 滑膜及非 OA 滑膜组织中 MSCs 的分布情况及功能,结果发现所有滑膜组织中均含有大量 CD90+/CD105+ MSCs,但 OA 滑膜组织来源 MSCs 呈现出更高的 SA-β-Gal 染色阳性、更低的增殖活性(Edu)及更多炎症介质(IL-1 及 IL-6)与 MMPs(MMP-1、MMP-13)。同时分别将 OA 来源及非 OA 来源的滑膜 MSCs 注射入正常小鼠关节腔,也发现正常滑膜 MSCs 可延缓 OA 进展,而 OA 样的滑膜 MSCs 可加重 OA 进展。进一步分析发现非经典 WNT 信号通路中的 WNT10A 上调,WNT10A 表现出抗衰老及促炎症因子释放的双重特点。另一方面,年龄本身也会导致细胞干性丢失而丧失软骨分化及损伤修复能力。Mazzotti 等[59]提取并对比了不同年龄马关节液中的 MSCs,发现随着年龄增长,关节液来源 MSCs 出现增殖能力降低及内质网应激、自噬减弱等衰老表型。而 Neybecker 等[60]进一步对比了 OA 患者中的滑膜、关节液来源 MSCs 和 BMSCs 的干性差异及软骨分化能力,结果也发现滑膜及关节液来源 MSCs 的软骨分化能力低于 BMSCs。这些研究揭示了 BMSCs、滑膜 MSCs、关节液 MSCs 衰老与 OA 发生、发展的潜在相关性,但均未明确两者之间的交流机制及衰老机制。
相较于 BMSCs 及滑膜 MSCs,包括髌下脂肪垫在内的 ADSCs 更易于获取[61];同时,年龄对 ADSCs 增殖能力、干性维持及多能性的影响更低[62]。最新研究发现,ADSCs 是软骨损伤修复的理想种子细胞[63-64]。通过将 ADSCs 条件培养基与 IL-1β 诱导的衰老软骨细胞进行间接共培养发现,SA-β-Gal 阳性软骨细胞减少,p53、p21 等基因表达下调,其机制可能与 Sirtuin1 介导 p53 乙酰化有关,但未明确这种保护作用应归功于条件培养基中何种物质[65]。而这也是目前外源性 MSCs 治疗 OA 的共性问题,MSCs 产生保护作用的机制可能更多来源于其分泌的各种细胞因子及免疫调节作用,而非直接定向分化修复。
骨骼干细胞(skeletal stem cells,SSCs)是近年来新鉴定出的一群组织特异性 MSCs,可向骨、软骨及间质分化,但不能分化为脂肪组织[66-67]。该群细胞被认为是骨、软骨损伤后自行修复的责任细胞,而最新研究进一步发现软骨中的 SSCs 衰老与 OA 密切相关[68]。Chan 等[68]应用不同颜色荧光标记小鼠体内不同来源的 MSCs(彩虹小鼠),对不同年龄段小鼠关节软骨中的 SSCs 进行分析后发现,SSCs 数量随年龄增长而显著减少,同时这些 SSCs 所在区域的蛋白聚糖分泌也显著降低。进一步通过微骨折刺激软骨 SSCs 后,可出现典型的软骨再生及 OA 进展延缓。这一研究揭示了 SSCs 衰老在 OA 中的重要病理作用,同时也为内源性 SSCs 治疗提供了新的研究方向。
3. 诊疗进展及展望
针对软骨细胞衰老在 OA 发生、发展中的病理环节,特异性清除衰老细胞、中和 SASP 中的促炎因子及蛋白酶、激活内源性 SSCs 的再年轻化,是 OA 治疗的重要途径。目前已发现可靶向清除的衰老细胞小分子化合物或天然植物提取物多达 10 余种,其中橄榄提取物橄榄苦苷[69]、Bcl-2 抑制剂 ABT-263[70]、小鼠双微体 2 同系物(MDM2)蛋白抑制剂 UBX0101[25]在 OA 治疗的实验研究中显示了较好疗效。Varela-Eirín 等[69]发现植物提取物可以下调 OA 软骨细胞 Cx43 基因表达,促进衰老软骨细胞再分化而延缓 OA 进展。而 Bcl2 抑制剂 ABT-263 可通过诱导 p16 高表达的衰老软骨细胞凋亡,从而抑制关节的炎症微环境,促进软骨修复[71]。UBX0101 主要作用于 MDM2,抑制其与 p53 的相互作用,促进 p53 通过泛素化途径降解而促进衰老细胞凋亡。体内研究显示,关节腔注射 UBX0101 后可减少软骨细胞外基质降解及疼痛等 OA 症状的发生[25],目前该小分子化合物已进入了Ⅱ期临床研究[72]。同时,最新研究显示嵌合抗原受体 T 细胞可识别衰老细胞表面的尿激酶型纤溶酶原激活物受体,从而定向清除肺腺癌组织及肝纤维组织中的衰老细胞[73]。这些新型治疗方式也为 OA 的治疗提供了新的视角。
通过清除衰老细胞,可避免邻近健康细胞进入衰老的恶性循环;而如何促进已存在的软骨损伤修复,是需要解决的另一重要问题。研究发现通过基因编辑工具 Crispr/cas9 或腺相关病毒技术上调 MSCs 年轻化因子 YAP、CBX4、DGCR8 的表达,可促进 MSCs 向软骨分化,达到修复软骨的目的[74]。未来除了深入研究不同来源 MSCs 对 OA 关节微环境的调节作用及与衰老软骨细胞之间的串话机制以外,探索 SSCs 衰老的分子机制可为 MSCs 年轻化及软骨损伤和 OA 原位修复提供新思路。
作者贡献:谢锦伟负责综述构思、资料搜集、观点形成、文章撰写及修改;余希杰负责综述立题、构思建议,文章初稿修改;鲁凌云对综述构思提出建议。
利益冲突:所有作者声明,在课题研究和文章撰写过程中不存在利益冲突。课题经费支持没有影响文章观点。
Funding Statement
国家自然科学基金资助项目(81902246);四川省科技厅重点研发专项(2020YFS0142);四川大学华西医院博士后研发基金(2018HXBH073);国家老年疾病临床研究中心项目(Z2018B11)
References
- 1.Glyn-Jones S, Palmer AJ, Agricola R, et al Osteoarthritis. Lancet. 2015;386(9991):376–387. doi: 10.1016/S0140-6736(14)60802-3. [DOI] [PubMed] [Google Scholar]
- 2.Cross M, Smith E, Hoy D, et al The global burden of hip and knee osteoarthritis: estimates from the global burden of disease 2010 study. Ann Rheum Dis. 2014;73(7):1323–1330. doi: 10.1136/annrheumdis-2013-204763. [DOI] [PubMed] [Google Scholar]
- 3.王欢, 孙贺, 张耀南, 等 中国 40 岁以上人群原发性膝骨关节炎各间室患病状况调查. 中华骨与关节外科杂志. 2019;12(7):528–532. doi: 10.3969/j.issn.2095-9958.2019.07.08. [DOI] [Google Scholar]
- 4.Wallace IJ, Worthington S, Felson DT, et al Knee osteoarthritis has doubled in prevalence since the mid-20th century. Proc Natl Acad Sci U S A. 2017;114(35):9332–9336. doi: 10.1073/pnas.1703856114. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.王锴, 董雪, 林剑浩 膝关节骨关节炎患者疾病医疗费用的调查. 中华医学杂志. 2017;97(1):29–32. doi: 10.3760/cma.j.issn.0376-2491.2017.01.008. [DOI] [Google Scholar]
- 6.Muñoz-Espín D, Serrano M Cellular senescence: from physiology to pathology. Nat Rev Mol Cell Biol. 2014;15(7):482–496. doi: 10.1038/nrm3823. [DOI] [PubMed] [Google Scholar]
- 7.Childs BG, Durik M, Baker DJ, et al Cellular senescence in aging and age-related disease: from mechanisms to therapy. Nat Med. 2015;21(12):1424–1435. doi: 10.1038/nm.4000. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Hernandez-Segura A, Nehme J, Demaria M Hallmarks of cellular senescence. Trends Cell Biol. 2018;28(6):436–453. doi: 10.1016/j.tcb.2018.02.001. [DOI] [PubMed] [Google Scholar]
- 9.Vinatier C, Domínguez E, Guicheux J, et al Role of the inflammation-autophagy-senescence integrative network in osteoarthritis. Front Physiol. 2018;9:706. doi: 10.3389/fphys.2018.00706. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Childs BG, Gluscevic M, Baker DJ, et al Senescent cells: an emerging target for diseases of ageing. Nat Rev Drug Discov. 2017;16(10):718–735. doi: 10.1038/nrd.2017.116. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.van Deursen JM The role of senescent cells in ageing. Nature. 2014;509(7501):439–446. doi: 10.1038/nature13193. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Sharpless NE, Sherr CJ Forging a signature of in vivo senescence . Nat Rev Cancer. 2015;15(7):397–408. doi: 10.1038/nrc3960. [DOI] [PubMed] [Google Scholar]
- 13.Wiley CD, Flynn JM, Morrissey C, et al Analysis of individual cells identifies cell-to-cell variability following induction of cellular senescence. Aging Cell. 2017;16(5):1043–1050. doi: 10.1111/acel.12632. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Lee BY, Han JA, Im JS, et al Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging Cell. 2006;5(2):187–195. doi: 10.1111/j.1474-9726.2006.00199.x. [DOI] [PubMed] [Google Scholar]
- 15.Althubiti M, Lezina L, Carrera S, et al Characterization of novel markers of senescence and their prognostic potential in cancer. Cell Death Dis. 2014;5:e1528. doi: 10.1038/cddis.2014.489. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Li Y, Zhao H, Huang X, et al Embryonic senescent cells re-enter cell cycle and contribute to tissues after birth. Cell Res. 2018;28(7):775–778. doi: 10.1038/s41422-018-0050-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Storer M, Mas A, Robert-Moreno A, et al Senescence is a developmental mechanism that contributes to embryonic growth and patterning. Cell. 2013;155(5):1119–1130. doi: 10.1016/j.cell.2013.10.041. [DOI] [PubMed] [Google Scholar]
- 18.Demaria M, Ohtani N, Youssef SA, et al An essential role for senescent cells in optimal wound healing through secretion of PDGF-AA. Dev Cell. 2014;31(6):722–733. doi: 10.1016/j.devcel.2014.11.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Helman A, Klochendler A, Azazmeh N, et al p16 (Ink4a)-induced senescence of pancreatic beta cells enhances insulin secretion. Nat Med. 2016;22(4):412–420. doi: 10.1038/nm.4054. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.He S, Sharpless NE Senescence in health and disease. Cell. 2017;169(6):1000–1011. doi: 10.1016/j.cell.2017.05.015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Appleton CT Osteoarthritis year in review 2017: biology. Osteoarthritis Cartilage. 2018;26(3):296–303. doi: 10.1016/j.joca.2017.10.008. [DOI] [PubMed] [Google Scholar]
- 22.Prieto-Alhambra D, Judge A, Javaid MK, et al Incidence and risk factors for clinically diagnosed knee, hip and hand osteoarthritis: influences of age, gender and osteoarthritis affecting other joints. Ann Rheum Dis. 2014;73(9):1659–1664. doi: 10.1136/annrheumdis-2013-203355. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Gao SG, Zeng C, Li LJ, et al Correlation between senescence-associated beta-galactosidase expression in articular cartilage and disease severity of patients with knee osteoarthritis. Int J Rheum Dis. 2016;19(3):226–232. doi: 10.1111/1756-185X.12096. [DOI] [PubMed] [Google Scholar]
- 24.Xu M, Bradley EW, Weivoda MM, et al Transplanted senescent cells induce an osteoarthritis-like condition in mice. J Gerontol A Biol Sci Med Sci. 2017;72(6):780–785. doi: 10.1093/gerona/glw154. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Jeon OH, Kim C, Laberge RM, et al Local clearance of senescent cells attenuates the development of post-traumatic osteoarthritis and creates a pro-regenerative environment. Nat Med. 2017;23(6):775–781. doi: 10.1038/nm.4324. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Loeser RF, Collins JA, Diekman BO Ageing and the pathogenesis of osteoarthritis. Nat Rev Rheumatol. 2016;12(7):412–420. doi: 10.1038/nrrheum.2016.65. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Ashraf S, Cha BH, Kim JS, et al Regulation of senescence associated signaling mechanisms in chondrocytes for cartilage tissue regeneration. Osteoarthritis Cartilage. 2016;24(2):196–205. doi: 10.1016/j.joca.2015.07.008. [DOI] [PubMed] [Google Scholar]
- 28.Diekman BO, Sessions GA, Collins JA, et al Expression of p16 (INK) (4a) is a biomarker of chondrocyte aging but does not cause osteoarthritis. Aging Cell. 2018;17(4):e12771. doi: 10.1111/acel.12771. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Effenberger T, von der Heyde J, Bartsch K, et al Senescence-associated release of transmembrane proteins involves proteolytic processing by ADAM17 and microvesicle shedding. FASEB J. 2014;28(11):4847–4856. doi: 10.1096/fj.14-254565. [DOI] [PubMed] [Google Scholar]
- 30.Jeon OH, Wilson DR, Clement CC, et al Senescence cell-associated extracellular vesicles serve as osteoarthritis disease and therapeutic markers. JCI Insight. 2019;4(7):e125019. doi: 10.1172/jci.insight.125019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Feng M, Peng H, Yao R, et al Inhibition of cellular communication network factor 1 (CCN1)-driven senescence slows down cartilage inflammaging and osteoarthritis. Bone. 2020;139:115522. doi: 10.1016/j.bone.2020.115522. [DOI] [PubMed] [Google Scholar]
- 32.Varela-Eirin M, Varela-Vazquez A, Guitian-Caamano A, et al Targeting of chondrocyte plasticity via connexin43 modulation attenuates cellular senescence and fosters a pro-regenerative environment in osteoarthritis. Cell Death Dis. 2018;9(12):1166. doi: 10.1038/s41419-018-1225-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Glück S, Guey B, Gulen MF, et al Innate immune sensing of cytosolic chromatin fragments through cGAS promotes senescence. Nat Cell Biol. 2017;19(9):1061–1070. doi: 10.1038/ncb3586. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Dou Z, Ghosh K, Vizioli MG, et al Cytoplasmic chromatin triggers inflammation in senescence and cancer. Nature. 2017;550(7676):402–406. doi: 10.1038/nature24050. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Overhoff MG, Garbe JC, Koh J, et al Cellular senescence mediated by p16INK4A-coupled miRNA pathways. Nucleic Acids Res. 2014;42(3):1606–1618. doi: 10.1093/nar/gkt1096. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Munk R, Panda AC, Grammatikakis I, et al Senescence-associated MicroRNAs. Int Rev Cell Mol Biol. 2017;334:177–205. doi: 10.1016/bs.ircmb.2017.03.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Philipot D, Guérit D, Platano D, et al p16INK4a and its regulator miR-24 link senescence and chondrocyte terminal differentiation-associated matrix remodeling in osteoarthritis. Arthritis Res Ther. 2014;16(1):R58. doi: 10.1186/ar4494. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Guan YJ, Li J, Yang X, et al Evidence that miR-146a attenuates aging- and trauma-induced osteoarthritis by inhibiting Notch1, IL-6, and IL-1 mediated catabolism. Aging Cell. 2018;17(3):e12752. doi: 10.1111/acel.12752. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Grillari J, Hackl M, Grillari-Voglauer R miR-17-92 cluster: ups and downs in cancer and aging. Biogerontology. 2010;11(4):501–506. doi: 10.1007/s10522-010-9272-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.de Pontual L, Yao E, Callier P, et al Germline deletion of the miR-17~92 cluster causes skeletal and growth defects in humans. Nat Genet. 2011;43(10):1026–1030. doi: 10.1038/ng.915. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Mirzamohammadi F, Kozlova A, Papaioannou G, et al Distinct molecular pathways mediate Mycn and Myc-regulated miR-17-92 microRNA action in Feingold syndrome mouse models. Nat Commun. 2018;9(1):1352. doi: 10.1038/s41467-018-03788-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Salih DA, Brunet A FoxO transcription factors in the maintenance of cellular homeostasis during aging. Curr Opin Cell Biol. 2008;20(2):126–136. doi: 10.1016/j.ceb.2008.02.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Rached MT, Kode A, Xu L, et al FoxO1 is a positive regulator of bone formation by favoring protein synthesis and resistance to oxidative stress in osteoblasts. Cell Metab. 2010;11(2):147–160. doi: 10.1016/j.cmet.2010.01.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Sandri M, Sandri C, Gilbert A, et al Foxo transcription factors induce the atrophy-related ubiquitin ligase atrogin-1 and cause skeletal muscle atrophy. Cell. 2004;117(3):399–412. doi: 10.1016/S0092-8674(04)00400-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Baar MP, Brandt RMC, Putavet DA, et al Targeted apoptosis of senescent cells restores tissue homeostasis in response to chemotoxicity and aging. Cell. 2017;169(1):132–147. doi: 10.1016/j.cell.2017.02.031. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Fisch KM, Gamini R, Alvarez-Garcia O, et al Identification of transcription factors responsible for dysregulated networks in human osteoarthritis cartilage by global gene expression analysis. Osteoarthritis Cartilage. 2018;26(11):1531–1538. doi: 10.1016/j.joca.2018.07.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Akasaki Y, Hasegawa A, Saito M, et al Dysregulated FOXO transcription factors in articular cartilage in aging and osteoarthritis. Osteoarthritis Cartilage. 2014;22(1):162–170. doi: 10.1016/j.joca.2013.11.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Matsuzaki T, Alvarez-Garcia O, Mokuda S, et al FoxO transcription factors modulate autophagy and proteoglycan 4 in cartilage homeostasis and osteoarthritis. Sci Transl Med. 2018;10(428):eaan0746. doi: 10.1126/scitranslmed.aan0746. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Culemann S, Grüneboom A, Nicolás-Ávila JÁ, et al Locally renewing resident synovial macrophages provide a protective barrier for the joint. Nature. 2019;572(7771):670–675. doi: 10.1038/s41586-019-1471-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Zhang Y, Zhou S, Cai W, et al Hypoxia/reoxygenation activates the JNK pathway and accelerates synovial senescence. Mol Med Rep. 2020;22(1):265–276. doi: 10.3892/mmr.2020.11102. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Hall BM, Balan V, Gleiberman AS, et al p16 (Ink4a) and senescence-associated β-galactosidase can be induced in macrophages as part of a reversible response to physiological stimuli. Aging (Albany NY) 2017;9(8):1867–1884. doi: 10.18632/aging.101268. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Hall BM, Balan V, Gleiberman AS, et al Aging of mice is associated with p16 (Ink4a)- and β-galactosidase-positive macrophage accumulation that can be induced in young mice by senescent cells. Aging (Albany NY) 2016;8(7):1294–1315. doi: 10.18632/aging.100991. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Covarrubias AJ, Kale A, Perrone R, et al Senescent cells promote tissue NAD+ decline during ageing via the activation of CD38+ macrophages . Nat Metab. 2020;2(11):1265–1283. doi: 10.1038/s42255-020-00305-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Čamernik K, Mihelič A, Mihalič R, et al Increased exhaustion of the subchondral bone-derived mesenchymal stem/stromal cells in primary versus dysplastic osteoarthritis. Stem Cell Rev Rep. 2020;16(4):742–754. doi: 10.1007/s12015-020-09964-x. [DOI] [PubMed] [Google Scholar]
- 55.Ha CW, Park YB, Kim SH, et al Intra-articular mesenchymal stem cells in osteoarthritis of the knee: A systematic review of clinical outcomes and evidence of cartilage repair. Arthroscopy. 2019;35(1):277–288. doi: 10.1016/j.arthro.2018.07.028. [DOI] [PubMed] [Google Scholar]
- 56.Cao X, Luo P, Huang J, et al Intraarticular senescent chondrocytes impair the cartilage regeneration capacity of mesenchymal stem cells. Stem Cell Res Ther. 2019;10(1):86. doi: 10.1186/s13287-019-1193-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Malaise O, Tachikart Y, Constantinides M, et al Mesenchymal stem cell senescence alleviates their intrinsic and seno-suppressive paracrine properties contributing to osteoarthritis development. Aging (Albany NY) 2019;11(20):9128–9146. doi: 10.18632/aging.102379. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Huang J, Chen C, Liang C, et al Dysregulation of the Wnt signaling pathway and synovial stem cell dysfunction in osteoarthritis development. Stem Cells Dev. 2020;29(7):401–413. doi: 10.1089/scd.2019.0260. [DOI] [PubMed] [Google Scholar]
- 59.Mazzotti E, Teti G, Falconi M, et al Age-related alterations affecting the chondrogenic differentiation of synovial fluid mesenchymal stromal cells in an equine model. Cells. 2019;8(10):1116. doi: 10.3390/cells8101116. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Neybecker P, Henrionnet C, Pape E, et al Respective stemness and chondrogenic potential of mesenchymal stem cells isolated from human bone marrow, synovial membrane, and synovial fluid. Stem Cell Res Ther. 2020;11(1):316. doi: 10.1186/s13287-020-01786-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Neri S, Guidotti S, Lilli NL, et al Infrapatellar fat pad-derived mesenchymal stromal cells from osteoarthritis patients: In vitro genetic stability and replicative senescence . J Orthop Res. 2017;35(5):1029–1037. doi: 10.1002/jor.23349. [DOI] [PubMed] [Google Scholar]
- 62.Beane OS, Fonseca VC, Cooper LL, et al Impact of aging on the regenerative properties of bone marrow-, muscle-, and adipose-derived mesenchymal stem/stromal cells. PLoS One. 2014;9(12):e115963. doi: 10.1371/journal.pone.0115963. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Li Q, Zhao F, Li Z, et al Autologous fractionated adipose tissue as a natural biomaterial and novel one-step stem cell therapy for repairing articular cartilage defects. Front Cell Dev Biol. 2020;8:694. doi: 10.3389/fcell.2020.00694.eCollection2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.Xu T, Yu X, Yang Q, et al Autologous micro-fragmented adipose tissue as stem cell-based natural scaffold for cartilage defect repair. Cell Transplant. 2019;28(12):1709–1720. doi: 10.1177/0963689719880527. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 65.Platas J, Guillén MI, Pérez Del Caz MD, et al Paracrine effects of human adipose-derived mesenchymal stem cells in inflammatory stress-induced senescence features of osteoarthritic chondrocytes. Aging (Albany NY) 2016;8(8):1703–1717. doi: 10.18632/aging.101007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Chan CK, Seo EY, Chen JY, et al Identification and specification of the mouse skeletal stem cell. Cell. 2015;160(1-2):285–298. doi: 10.1016/j.cell.2014.12.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 67.Chan CKF, Gulati GS, Sinha R, et al Identification of the human skeletal stem cell. Cell. 2018;175(1):43–56. doi: 10.1016/j.cell.2018.07.029. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.Murphy MP, Koepke LS, Lopez MT, et al Articular cartilage regeneration by activated skeletal stem cells. Nat Med. 2020;26(10):1583–1592. doi: 10.1038/s41591-020-1013-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69.Varela-Eirín M, Carpintero-Fernández P, Sánchez-Temprano A, et al Senolytic activity of small molecular polyphenols from olive restores chondrocyte redifferentiation and promotes a pro-regenerative environment in osteoarthritis. Aging (Albany NY) 2020;12(16):15882–15905. doi: 10.18632/aging.103801. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 70.Yang H, Chen C, Chen H, et al Navitoclax (ABT263) reduces inflammation and promotes chondrogenic phenotype by clearing senescent osteoarthritic chondrocytes in osteoarthritis. Aging (Albany NY) 2020;12(13):12750–12770. doi: 10.18632/aging.103177. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 71.Sessions GA, Copp ME, Liu JY, et al Controlled induction and targeted elimination of p16 INK4a-expressing chondrocytes in cartilage explant culture. FASEB J. 2019;33(11):12364–12373. doi: 10.1096/fj.201900815RR. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 72.Jamie D. A safety and tolerability study of UBX0101 in patients with osteoarthritis of the knee. https://clinicaltrials.gov/ct2/show/NCT03513016.
- 73.Amor C, Feucht J, Leibold J, et al Senolytic CAR T cells reverse senescence-associated pathologies. Nature. 2020;583(7814):127–132. doi: 10.1038/s41586-020-2403-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 74.Zhang J, Liu GH, Qu J, et al Treating osteoarthritis via gene therapy with rejuvenation factors. Gene Ther. 2020;27(7-8):309–311. doi: 10.1038/s41434-020-0149-5. [DOI] [PubMed] [Google Scholar]