Résumé
Le trouble du spectre de l’autisme (TSA) est un trouble neurodéveloppemental permanent qui se caractérise par des déficits de la communication sociale, un mode répétitif et restreint des comportements et des sensibilités ou des intérêts sensoriels inhabituels. Le TSA a des répercussions importantes sur la vie des enfants et de leur famille. À l’heure actuelle, sa prévalence estimative est de un cas sur 66 enfants et adolescents canadiens dans le groupe d’âge des cinq à 17 ans. Les pédiatres généraux, les médecins de famille et les autres professionnels de la santé rencontrent donc plus d’enfants ayant un TSA qu’auparavant dans leur pratique. Le diagnostic rapide de ce trouble et l’orientation des cas vers des interventions comportementales et éducationnelles intensives dès le plus jeune âge peuvent favoriser un meilleur pronostic clinique à long terme grâce à la neuroplasticité du cerveau à un plus jeune âge. Le présent docu-ment de principes contient des recommandations et des outils clairs, détaillés et fondés sur des données probantes pour aider les pédiatres communautaires et les autres dispensateurs de soins de première ligne à surveiller les tout premiers signes de TSA, ce qui constitue une étape importante vers un diagnostic précis et une évaluation détaillée des besoins pour planifier les interventions.
Keywords: Autism spectrum disorder, Developmental surveillance, Early identification, Screening
QU’EST-CE QUE LE TROUBLE DU SPECTRE DE L’AUTISME ET COMMENT EST-IL DÉFINI DANS LE DSM-5?
Le trouble du spectre de l’autisme (TSA), qui est d’origine neurodéveloppementale et se manifeste dans la petite enfance, est lié à un vaste éventail de symptômes et divers degrés de capacités. Comme le définit la cinquième édition du Manuel diagnostique et statistiques des troubles mentaux (DSM-5) (1), le TSA est une catégorie diagnostique globale qui inclut deux domaines de symptômes : 1) les déficits de la communication sociale et 2) des modes restreints et répétitifs des comportements et des intérêts. Les autres critères diagnostiques du TSA qui figurent dans le DSM-5 sont résumés au tableau 1.
Tableau 1.
Critères diagnostiques du trouble du spectre de l’autisme établis par le DSM-5
| Domaines | Critères (et exemples) |
|---|---|
| 1. Déficits de la communication et des interactions sociales (les trois critères doivent être observés) |
Réciprocité sociale et émotionnelle
• Difficulté à amorcer les interactions sociales ou à y répondre • Difficulté à partager spontanément des intérêts, des réalisations ou des émotions (p. ex., plaisir) Déficits des comportements de communication non verbaux • Contact visuel réduit pour communiquer • Utilisation réduite des gestes (p. ex., pointer, saluer de la main) • Expression faciale réduite, semble déconnecté • Utilisation possible de la main de quelqu’un d’autre pour obtenir un objet désiré, sans contact visuel Incapacité d’établir ou d’entretenir une relation • Intérêt réduit ou atypique envers les camarades • Difficulté à partager des jeux imaginatifs avec les camarades |
| 2. Caractère restreint et répétitif des comportements, des intérêts et des activités (deux des quatre critères doivent être observés) |
Caractère stéréotypé du langage et du comportement
• Répétition de mots ou d’expressions (p. ex., tirés d’émissions télévisées ou de films) • Activités répétitives avec des objets (p. ex., aligner des crayons, des figurines) • Mouvements répétitifs du corps, des bras, des mains ou des doigts (p. ex., tourner sur soi-même, battre des mains, claquer des doigts) • Postures rigides et transitoires des mains ou de tout le corps Intolérance ou résistance au changement • Port des mêmes vêtements (ou d’une seule couleur) chaque jour; consommation des mêmes aliments chaque jour • Détresse en cas de changement de trajet vers l’établissement préscolaire Intérêts restreints et fixes • Attachement inhabituellement intense ou restreint à des sujets ou des objets Hyperréactivité ou hyporéactivité aux stimulations sensorielles • Réactions inhabituelles (p. ex., détresse ou fascination envers les odeurs, les sons, les textures, les stimuli visuels et les goûts) |
| 3. Les signes ou symptômes doivent être présents dès les étapes précoces du développement, mais ne sont pas nécessairement pleinement manifestes avant que les demandes sociales n’excèdent les capacités limitées, ou ils peuvent être masqués plus tard par des stratégies apprises. | |
| 4. Les symptômes perturbent le fonctionnement quotidien. | |
| 5. Les symptômes ne sont pas mieux expliqués par un handicap intellectuel ou un retard global du développement. | |
| 6. Le TSA peut être associé ou non à des troubles médicaux, génétiques, neurodéveloppementaux, mentaux ou comportementaux ou à un déficit intellectuel ou une altération du langage | |
| 7. Le niveau de gravité de chacun des deux domaines peut contribuer à préciser le diagnostic : niveau 1 : nécessitant de l’aide; niveau 2 : nécessitant une aide importante; niveau 3 : nécessitant une aide très importante. Ces niveaux peuvent être difficiles à établir au moment du diagnostic de très jeunes enfants. |
Données adaptées de la référence 1 TSA trouble du spectre de l’autisme
LA PRÉVALENCE, L’ÉTIOLOGIE ET LES FACTEURS DE RISQUE DU TROUBLE DU SPECTRE DE L’AUTISME
La prévalence
La prévalence de TSA a augmenté, passant d’un nombre estimatif d’un cas sur 1 000 enfants en Nouvelle-Écosse il y a 30 ans (2) à une estimation actuelle d’un cas sur 66 enfants et adolescents canadiens dans le groupe d’âge des cinq à 17 ans (un cas sur 42 garçons et sur 165 filles) (3). On ne sait pas encore à quel point cette augmentation de la prévalence de TSA est attribuable à une réelle hausse des cas. L’amélioration du dépistage et du diagnostic et l’élargissement des critères dans les versions successives du DSM contribuent probablement aux modifications de la prévalence estimative (4). Selon les données probantes, on peut diagnostiquer le TSA avec fiabilité avant l’âge de deux ans chez certains enfants (5), mais il peut falloir plus de temps avant que les cas plus discrets se présentent pleinement. Malgré une meilleure connaissance des signes précoces, l’âge moyen du diagnostic se situe toujours entre quatre et cinq ans (6). Les garçons reçoivent un diagnostic de TSA quatre fois plus que les filles (4,5), mais il se peut que l’écart entre les sexes se rétrécisse. On s’aperçoit de plus en plus que certaines filles présentent des signes plus discrets que les garçons (7–9).
L’étiologie et les facteurs de risque
On ne comprend pas pleinement l’étiologie du TSA, mais d’après les observations récentes, il y aurait une interaction entre les facteurs génétiques, épigénétiques et environnementaux (10). Le sexe masculin et les antécédents familiaux font partie des facteurs de risque importants de TSA. Le risque de récurrence chez les jeunes frères et sœurs d’un enfant ayant un TSA se situerait entre 7 % et 19 % (11,12), par rapport à 1,5 % dans la population générale (4). La récurrence varie selon le degré de parenté. Dans une récente étude suédoise, le risque relatif est décuplé lorsqu’un membre de la fratrie directe a un diagnostic de TSA, mais doublé lorsqu’un cousin est touché (13). Les autres facteurs de risque sont résumés au tableau 2 (10–19). Les mécanismes entre l’exposition environnementale et le TSA peuvent inclure l’inflammation, le stress oxydatif ou la perturbation endocrinienne et être influencés par les effets liés aux gènes (15,16).
Tableau 2.
Les facteurs de risque de trouble du spectre de l’autisme
| Catégories | Facteurs de risque |
|---|---|
| Génétique ou familial | Syndromes génétiques spécifiques et variantes du risqueSexe masculin Parent du premier degré ayant un TSA ou autre antécédent familial de TSA |
| Prénatale | Parents plus âgés (≥35 ans) Obésité, diabète ou hypertension de la mère Exposition in utero au valproate, aux pesticides ou à la pollution de l’air liée à la circulation routière Infections de la mère (p. ex., rubéole) Grossesses très rapprochées (<12 mois) |
| Postnatale | Petit poids à la naissance Extrême prématurité |
Données tirées des références 10 à 19
TSA trouble du spectre de l’autisme
LES SIGNES ÉVOCATEURS ET LES PRÉSENTATIONS CLINIQUES DU TROUBLE DU SPECTRE DE L’AUTISME
On ne constate généralement pas de signes comportementaux évidents de TSA avant l’âge de six mois. Selon les études prospectives auprès de nourrissons à haut risque, un prodrome de TSA émerge pendant le deuxième semestre suivant la naissance, ce qui peut inclure un contrôle moteur tardif (p. ex., tête qui continue à basculer vers l’arrière), des troubles de l’alimentation et du sommeil ou une réactivité ou une passivité excessive (20,21).
Les symptômes des domaines centraux du TSA se manifestent généralement entre l’âge de 12 et 24 mois. Les présentations initiales varient et aucun signe comportemental ne peut confirmer ou infirmer un diagnostic de TSA. Les premières inquiétudes des parents peuvent comprendre un retard de langage, l’absence de réponse de l’enfant lorsqu’on l’appelle par son nom et un contact visuel limité.
Les autres signes évocateurs précoces à diverses étapes du développement sont résumés au tableau 3 (20–24). Les enfants ayant un TSA peuvent sembler relativement neurotypiques pour ce qui est de leur participation et de leur communication sociale, puis devenir renfermés ou présenter une régression de leurs capacités de communication ou de langage à l’âge de 18 mois (22). Chez certains enfants aux capacités langagières et cognitives plus avancées, les signes de TSA sont relativement discrets pendant la petite enfance, mais deviennent plus apparents à l’âge scolaire, lorsqu’ils commencent à éprouver des difficultés devant les exigences sociales croissantes (20–23).
Tableau 3.
Signes évocateurs précoces chez les enfants à risque de trouble du spectre de l’autisme
| Âge | Présentation clinique |
|---|---|
| De 6 à 12 mois |
• Caractère réduit ou limité des sourires ou des autres expressions joyeuses orientés vers les autres • Contacts visuels limités ou inexistants • Partage réciproque limité des sons, des sourires ou des expressions faciales • Gazouillement ou gestes (p. ex., pointer, atteindre, agiter la main pour dire « au revoir ») réduits, atypiques ou inexistants • Réponse limitée à son nom |
| De 9 à 12 mois |
• Émergence de comportements répétitifs (p. ex., tourner sur soi-même ou aligner des objets) • Jeux inhabituels (p. ex., exploration visuelle ou tactile intense des jouets) |
| De 12 à 18 mois |
• Incapacité de dire des mots • Absence de gestes compensatoires (comme pointer) • Absence de jeux imaginaires (faire semblant) • Déficit de l’attention conjointe (initiation ou réponse à un intérêt ou partage d’un intérêt) |
| De 15 à 24 mois | • Combinaison de deux mots significatifs limitée, atypique, non spontanée ou incohérente |
| Tout âge | • Inquiétude des parents ou d’autres personnes qui s’occupent de l’enfant quant à la possibilité de TSA |
| Tout âge | • Régression du développement (perte de capacités) : réduction de la fréquence ou perte des comportements sociaux (p. ex., diriger son regard vers les autres) et de la communication (paroles et gestes) par rapport à un plus jeune âge |
Données traduites des références 20 à 24
TSA trouble du spectre de l’autisme
LA SURVEILLANCE ET LE DÉPISTAGE DU DÉVELOPPEMENT
La surveillance du développement
La surveillance du développement est un processus flexible par lequel des cliniciens avertis rassemblent de l’information pertinente provenant de multiples sources (y compris les parents et l’observation directe) au fil du temps afin de déterminer les inquiétudes en matière de développement, y compris celles liées au TSA, et d’y répondre (25). La Société canadienne de pédiatrie (SCP) (26) et d’autres organisations professionnelles (27–38) recommandent la surveillance du développement à chaque bilan de santé planifié (qu’on appelle aussi visite de santé périodique) et chaque fois qu’un parent ou qu’une personne qui s’occupe de l’enfant soulève des inquiétudes au sujet du développement du langage ou d’autres capacités de l’enfant. La surveillance du développement inclut l’intégration de l’information obtenue à partir des questions sur les inquiétudes des parents et des observations cliniques, lesquelles englobent, dans la mesure du possible, des mesures standardisées (p. ex., questionnaires des parents) pour éclairer l’impression clinique et la prise de décision.
Le dépistage du développement
Le dépistage du développement consiste à procéder à une brève évaluation au moyen d’une mesure standardisée pour dépister les enfants plus vulnérables à un retard ou à un trouble. Les outils de dépistage varient selon la forme (p. ex., le compte rendu du parent plutôt qu’une évaluation directe de l’enfant) et la portée (le dépistage « à large spectre » couvre de multiples aspects du développement, par opposition à celui qui est propre à un domaine ou à un trouble). Le dépistage du développement varie également selon la population ciblée. Le dépistage systématique vise tous les enfants, quel que soit le degré d’inquiétude, tandis que le dépistage ciblé vise une sous-population en fonction de facteurs présélectionnés.
Au tableau 4 sont résumés le groupe d’âge, la durée d’exécution du questionnaire, les caractéristiques de classification (sensibilité et spécificité) et le rendement de certains tests de dépistage du développement à large spectre (39–44). Le tableau 5 présente des données similaires à l’égard de mesures visant à dépister les enfants vulnérables au TSA. Le dépistage inclut un critère de cotation, selon lequel les enfants qui obtiennent un score supérieur à un seuil préétabli sont classés comme plus à risque (dépistage « positif »). Les cliniciens peuvent recourir à leur jugement clinique lorsqu’ils envisagent de diriger l’enfant vers une évaluation plus approfondie, même lorsque son score au dépistage est « négatif ». Pour ce faire, il peut tenir compte de ses observations cliniques, des inquiétudes des parents et d’autres facteurs évocateurs, comme les antécédents familiaux.
Tableau 4.
Outils d’évaluation du développement général
| Questionnaires aux parents (à acheter, à moins d’un avis contraire) | |||||
|---|---|---|---|---|---|
| Outil de dépistage | Groupe d’âge | Durée d’exécution | Rendement | Échantillon | Commentaires |
| Questionnaires sur les étapes du développement (ASQ-3) (40) | De 1 mois à 5,5 ans | De 10 à 15 minutes | Se : de 70 % à 90 % (40) Sp : de 76 % à 91 % |
Enfants de diverses origines ethniques et socioéconomiques | Motricité globale et fine, fonctions du langage, développement socioaffectif, capacités adaptatives |
| Inventaire du développement de l’enfant (CDI) (41) | De 15 mois à 6 ans | De 30 à 40 minutes | Se : de 80 % à 100 % (41) Sp : de 94 % à 96 % |
Enfants surtout blancs et de milieu ouvrier | 300 points : huit aspects du fonctionnement, y compris la cognition et le langage |
| Brief Early Childhood Screening Assessment (ECSA) (42) | De 18 à 60 mois | De 1 à 5 minutes | Se : 89 % (42) Sp : 85 % |
Enfants en soins de première ligne | 22 points : évaluation du développement affectif et comportemental (gratuit) |
| Questionnaire de dépistage du district de Nipissing (43), devenu la Liste de vérification Looksee | De 1 mois à 6 ans | 5 minutes | Se : de 29 % à 68 % (43) Sp : de 58 % à 88 % |
Groupe dirigé vers une clinique à haut risque | Couramment utilisé en Ontario. Évaluation de 13 étapes du développement (gratuit en Ontario) |
| PEDS : Un outil de dépistage développemental (44) | De la naissance à 8 ans | De 2 à 10 minutes | Se : de 91 % à 97 % (44) Sp : de 73 % à 86 % |
Enfants de diverses origines ethniques et socioéconomiques | Langage expressif et réceptif et articulation; motricité globale, autonomie, développement socioaffectif, comportemental et global; cognition |
Se sensibilité; Sp spécificité.
Tableau 5.
Mesures des premiers symptômes de trouble du spectre de l’autisme, couramment utilisées et fondées sur des données probantes
| Outil de dépistage | Groupe d’âge | Durée d’exécution | Rendement | Échantillon | Description |
|---|---|---|---|---|---|
| Questionnaires (parents, enseignants) | |||||
| Modified Checklist for Autism in Toddlers, Revised with Follow-up (M-CHAT-R/F), en français (30,62) | De 16 à 30 mois | De 5 à 10 minutes | Se : 85 % (62) Sp : de 91 % à 99 % VPP : 48 % pour le TSA (20) VPP : 95 % pour tout RD (23) |
Tout-petits à faible risque faisant l’objet d’un dépistage lors du bilan de santé de l’enfant à 18 et 24 mois | Deux étapes : rapport en 20 points et entrevue de suivi (de 5 à 10 minutes). Évaluation du pointage protodéclaratif, réponse au nom, intérêt envers les camarades, présentation d’objets d’intérêt aux parents, imitation (gratuit) |
| Grille de développement de la communication chez le jeune enfant en bas âge (ITC) (47,50,62) | De 8 à 24 mois | De 5 à 10 minutes | Se : 93 % (23,50) Sp : 83 % VPP : de 71 % à 79 % VPN : de 88 % à 99 % |
Tout-petits de 9 à 24 mois provenant de la population générale | 24 points : Évaluation des gestes, du contact visuel, des expressions faciales, des vocalisations (gratuit) |
| Échelle de réciprocité sociale – 2e édition –préscolaire (SRS-2 – préscolaire) (30,63) | De 2,5 à 4,5 ans | De 15 à 20 minutes | Se : de 75 % à 78 % Sp : de 67 % à 96 % |
442 enfants ayant ou un non un TSA | 65 points : mesure de la conscience sociale, de la communication sociale réciproque, de l’anxiété sociale, des traits autistiques et préoccupations de type autistique |
| Autism Spectrum Rating Scales* (64) | De 2 à 15 ans | De 5 à 20 minutes | Se : 92 % (64) Sp : 89 % VPP : 91 % VPN : 89 % |
2 560 enfants d’un échantillon normatif | 70 points : évaluation des comportements sociaux et de la communication, de l’autorégulation; version courte disponible (15 points, de 2 à 15 ans) |
| Outil clinique interactif | |||||
| Outil de dépistage | Groupe d’âge | Durée d’exécution | Propriétés psychométriques | Échantillon | Description |
| Screening Tool for Autism in Two-Year-Olds* (STAT) (65) | De 24 à 36 mois | 20 minutes | Se : de 92 % à 95 % (65) Sp : de 73 % à 85 % VPP : 56 % VPN : 97 % |
71 enfants dont un frère ou une sœur plus âgé a un TSA ou envoyés en consultation à cause d’une crainte de TSA | Évaluation de la communication et des comportements sociaux; 12 activités observées pendant des séances de jeu de 20 minutes |
| Rapid Interactive Screening Test for Autism in Toddlers* (RITA-T) (66) | De 18 à 36 mois | 10 minutes | Se : 100 % (66) Sp : 84 % VPP : 88 % |
61 tout-petits d’une clinique de petite enfance | Distinction entre les tout-petits ayant un TSA et ceux ayant un RD, mais pas de TSA |
*Formation requise
RD retard de développement; Se sensibilité; Sp spécificité; TSA trouble du spectre de l’autisme; VPP valeur prédictive positive; VPN valeur prédictive négative
L’ÉTAT ACTUEL DES DONNÉES PROBANTES SUR LE DÉPISTAGE DU TROUBLE DU SPECTRE DE L’AUTISME
Plusieurs analyses détaillées ont permis d’évaluer les mesures utilisées pour dépister le TSA, particulièrement pour en déterminer l’exactitude auprès de populations particulières et dans des contextes donnés, ainsi que pour examiner les données probantes confirmant (ou infirmant) leurs effets sur l’âge du diagnostic, l’accès aux services d’intervention et le pronostic à long terme (21,23,45–47). Dans les directives antérieures sur l’évaluation du TSA (28,31,35) et le US Preventative Services Task Force (USPSTF) (48), on a également passé en revue les données probantes sur le dépistage du TSA.
Il est possible de tirer plusieurs conclusions de ces analyses. En premier lieu, les outils de dépistage du TSA ont été évalués dans des contextes communautaires (p. ex., en pédiatrie de première ligne) qui permettent de distinguer avec précision les tout-petits ayant ou non un TSA (voir le tableau 4). En deuxième lieu, par rapport à une question ouverte sur les inquiétudes des parents, certains outils de dépistage (p. ex., l’outil M-CHAT et la grille de développement de la communication chez le jeune enfant en bas âge [ITC]) permettent de dépister le TSA plus tôt et de manière plus constante (49,50). En troisième lieu, les essais cliniques contiennent peu de données probantes démontrant l’influence des outils de dépistage du TSA sur l’échéancier diagnostique et le pronostic à long terme. Un essai aléatoire et contrôlé (EAC) a établi que le dépistage précoce de l’autisme chez les tout-petits (51) s’associait à un plus jeune âge au diagnostic, mais cette différence était peut-être le reflet d’effets collatéraux (p. ex., participation des médecins communautaires) plutôt que du dépistage lui-même (52). L’USPSTF citait l’absence de données probantes tirées des essais cliniques devant des données insuffisantes pour soupeser les avantages et les inconvénients du dépistage du TSA chez les jeunes enfants à l’égard de qui ni les parents ni un clinicien ne s’inquiétaients (48).
Dans une récente étude faisant appel à des modèles de simu-lation, le dépistage systématique du TSA n’accélérait ni le diagnostic ni le traitement au sein du système de santé canadien (53). Au moment de rédiger le présent document, les retombées du dépistage ciblé du TSA n’avait pas été validées par des essais cliniques. Cependant, selon certaines données probantes, le dépistage du TSA permettrait de réduire les inégalités sociales en matière d’accès à des services spécialisés (54,55). Plusieurs auteurs (56–58) contestent que la prépondérance des preuves puisse justifier l’exclusion du dépistage de la pratique actuelle. Il reste à déterminer si des listes standardisées de symptômes du TSA comportent des avantages potentiels par rapport à des questions ouvertes sur les inquiétudes des parents.
RECOMMANDATIONS
Les recommandations suivantes visent à optimiser le diagnostic rapide du TSA et l’accès aux interventions, deux objectifs dont les effets positifs sur le pronostic sont démontrés. Elles favorisent également une utilisation responsable et efficiente des ressources de santé, sans oublier de tenir compte des risques de classifications erronées (le dépistage tardif des enfants ayant un TSA et un dépistage inapproprié des enfants sans TSA).
La surveillance générale du développement de tous les enfants canadiens devrait inclure un suivi des signes comportementaux précoces du trouble du spectre de l’autisme
Les pédiatres, les médecins de famille et les autres professionnels de la santé doivent connaître les caractéristiques comportementales précoces du TSA (voir le tableau 3) et, à chaque rendez-vous en cabinet, s’informer auprès des parents s’ils ont des inquiétudes à l’égard du développement de leur enfant. Dans un document de principes antérieur, la SCP a recommandé de procéder à l’évaluation du développement et à l’enseignement aux parents dans le cadre du bilan de santé amélioré à 18 mois, un moment crucial où les signes et symptômes de TSA commencent souvent à se manifester (26).
La surveillance du développement comprend la collecte d’information auprès des parents et des autres personnes qui s’occupent de l’enfant (p. ex., les grands-parents, les éducateurs en milieu de garde ou les animateurs de groupes de tout-petits) quant à leurs inquiétudes à l’égard du développement de celui-ci. Si on se fie uniquement aux questions ouvertes, on risque de sous-dépister les enfants présentant des retards ou des troubles. Les dispensateurs de soins pédiatriques peuvent utiliser le Relevé postnatal Rourke (RPR) pour consigner les observations relatives au développement global, à l’examen physique, à la vaccination, à l’alimentation et à d’autres étapes du développement (59).
Les dispensateurs de soins peuvent également intégrer des mesures à large spectre pour standardiser l’information sur le développement (tableau 4) dans leur pratique au quotidien. Cependant, puisque les essais aléatoires et contrôlés n’ont pas encore démontré que le dépistage systématique du développement des enfants n’ayant pas de risque préétabli améliore le pronostic, le Groupe d’étude canadien sur les soins de santé préventifs a conclu que les données probantes sont insuffisantes pour le recommander (20,60).
Il est important de souligner que les spécifités de l’enfant peuvent avoir une influence sur le moment où l’on constate ses premières caractéristiques comportementales et où on les distingue clairement. Par exemple, les enfants dont les symptômes sont moins envahissants et dont le développement est plus avancé ont tendance à être diagnostiqués plus tardivement (6). Ainsi, la surveillance des caractéristiques comportementales du TSA doit se poursuivre tout au long de l’enfance.
Les enfants considérés comme à plus haut risque de trouble du spectre de l’autisme devraient rapidement faire l’objet d’une évaluation ciblée pour déterminer s’ils ont besoin d’une évaluation diagnostique plus approfondie
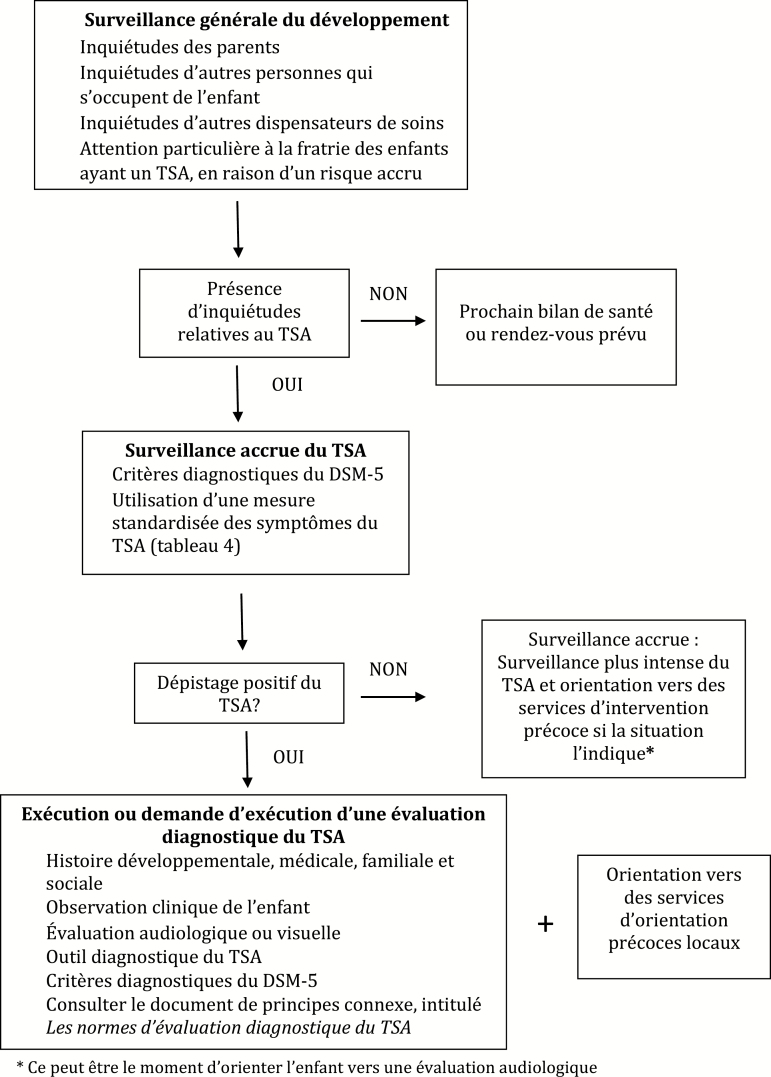
Lorsque la surveillance du développement indique un risque possible de TSA, il faut procéder à une évaluation plus approfondie. Il faut faire preuve de vigilance auprès des enfants ayant des facteurs de risque connus (tableau 2), car ils présentent une prévalence globale de TSA plus élevée. Cette étape de l’évaluation axée sur le TSA doit inclure une mesure standardisée des symptômes de TSA (tableau 5) (20,23,30,47,50,61–65). Le clinicien peut utiliser un questionnaire pour les parents (p. ex., M-CHAT-R/F ou ITC) ou, dans les milieux disposant de personnel formé, un outil interactif (p. ex., STAT). De l’information détaillée sur la symptomatologie complète les observations parentales et cliniques et contribue à orienter les étapes suivantes.
Les enfants qui répondent aux critères de cotation en fonction d'une mesure standardisée des symptômes de TSA ou dont la présentation clinique soulève un fort indice de suspicion de la part du professionnel de la santé, doivent faire l’objet d’une évaluation diagnostique effectuée par un pédiatre communautaire ou une équipe spécialisée (voir la figure 1 et le document de principes complémentaire, intitulé Les normes d’évaluation diagnostique du trouble du spectre de l’autisme, qui est également publié dans le présent numéro). Dans l’attente d’une évaluation diagnostique, les enfants à risque doivent également être orientés immédiatement vers des services d’intervention précoce (p. ex., développement du nourrisson, orthophonie, ergothérapie, appui préscolaire ciblé), en fonction du degré de besoin et du modèle de service local.
Figure 1.
Algorithme pour la surveillance du développement et le dépistage du trouble du spectre de l’autisme
DSM-5 Manuel diagnostique et statistique des troubles mentaux, 5e édition; TSA trouble du spectre de l’autisme
Pour s’assurer que l’évaluation diagnostique du TSA est opportune, précise et efficace, une trajectoire clinique flexible est proposée. Cette approche dépend de la complexité de la présentation clinique de l’enfant, de l’expérience personnelle et du jugement clinique du dispensateur de soins, ainsi que de l’accessibilité et de la portée des ressources de santé locales (figure 1). Un dispensateur de soins pédiatriques peut choisir de s’appuyer sur les critères du DSM-5 et sur son jugement clinique pour poser ou écarter un diagnostic de TSA ou de collaborer avec un autre professionnel (p. ex., spécialiste ou surspécialiste en pédiatrie ou pédopsychologue) pour confirmer un diagnostic (modèle de partage des soins).
Lorsque la présentation de l’enfant est compliquée par des inquiétudes concomitantes ou par une histoire médicale ou psychosociale complexe, le praticien communautaire peut orienter l’enfant vers une équipe d’experts. Il faut alors aviser les parents que leur enfant sera dirigé vers des interventions communautaires de soutien (tels que l’orthophonie, l’ergothérapie ou un programme préscolaire) qu’il recevra en attendant une évaluation diagnostique et qu’il poursuivra par la suite.
- • Au moment d’orienter un enfant vers une évaluation diagnostique du TSA, inclure les éléments suivants dans la lettre de demande de consultation :
- ◦ Les rapports des parents ou de professionnels de la santé sur les signes ou symptômes de TSA, les retards ou les inquiétudes en matière de développement, les étapes du développement non atteintes, les comportements anormaux et les résultats des tests de développement général ou de dépistage du TSA
- ◦ Les observations cliniques de signes ou symptômes de TSA
- ◦ L’histoire anténatale et périnatale
- ◦ Les étapes de développement atteintes
- ◦ Les facteurs de risque précis de TSA, s’il y a lieu
- ◦ Les antécédents médicaux et les explorations médicales
- ◦ L’information tirée des évaluations antérieures
• S’assurer d’expliquer aux parents à quoi ils devront s’attendre à chaque étape du processus d’évaluation. Les inviter à poser des questions, leur recommander des ressources imprimées ou en ligne et leur remettre les coordonnées de groupes locaux d’entraide familiale ou entre pairs.
• Discuter des inquiétudes, des craintes et des sentiments des parents à la perspective d’un diagnostic de TSA. Être sensi-ble à la détresse soulevée par les inquiétudes en matière de développement et aux répercussions potentielles sur la vie familiale. Être attentif à la vulnérabilité, aux craintes face à l’avenir et aux pressions financières de la famille tout au long du processus d’évaluation.
Pour connaître les autres étapes cliniques à prendre ou à amorcer avant l’obtention d’un diagnostic officiel, voir le document complémentaire intitulé Les normes d’évaluation diagnostique du TSA, publié dans le présent numéro.
Lorsque la surveillance du trouble du spectre de l’autisme ne justifie pas d’approfondir l’évaluation diagnostique, mais que d’autres inquiétudes demeurent en matière de développement, prendre les mesures suivantes :
• Aborder directement ces inquiétudes avec les parents et poursuivre la surveillance du développement, lorsque la situation l’indique.
• Diriger l’enfant et les parents vers des services ou des interventions précoces de soutien du développement, selon ce qui est le plus approprié.
• Réévaluer la nécessité de procéder à une surveillance du TSA lorsque la situation l’indique, ainsi qu’à la surveillance d’autres évaluations développementales à mesure que les inquiétudes évoluent.
Comment se préparer au premier rendez-vous en cabinet d’un enfant chez qui on soupçonne un trouble du spectre de l’autisme (66,67)
- • Envisager un appel téléphonique avec l’un des parents avant le premier rendez-vous, pour parler des aspects suivants de la vie de l’enfant:
- ◦ Histoire médicale et développementale et facteurs familiaux connexes
- ◦ Forces et difficultés
- ◦ Sensibilités sensorielles et quantité d’« espace personnel » nécessaire lors de la première rencontre
- ◦ Stratégies pour optimiser l’observance lors du rendez-vous clinique
• Envisager d’inviter à la fois le patient et le parent à une « visite d’essai » pour familiariser l’enfant au milieu de soins.
• Envisager d'attribuer le premier (ou le dernier) rendez-vous de la journée à l’enfant, lorsqu’il y a moins de gens dans la salle d’attente, pour réduire au minimum la période d’attente.
• Prévoir un rendez-vous plus long qu’avec un enfant neurotypique.
• Conseiller aux parents d’apporter quelques jouets ou aliments favoris pour distraire ou récompenser l’enfant, au besoin.
• Envisager de réaménager la salle d’examen pour l’adapter aux sensibilités sensorielles (p. ex., atmosphère calme, lumières douces).
Ressources recommandées
• ASD Video Glossary (distingue certaines caractéristiques du développement dans des vidéoclips d’enfants neurotypiques et d’enfants ayant un TSA, en anglais) : https://autismnavigator.com/asd-video-glossary/
• Autisme Canada : autismcanada.org/?lang=fr#home-row-1
• Autism Speaks : fr.autismspeaks.ca (site en français)
• BMJ Best Practice Autism Spectrum Disorder (en anglais) : https://bestpractice.bmj.com/topics/en-us/379
• Société canadienne de pédiatrie, site Soins de nos enfants – Le développement de votre enfant : (www.soinsdenosenfants.cps.ca/handouts/your_childs_development)
• Outils de dépistage de la SCP, en anglais : www.cps.ca/en/tools-outils/condition-specific-screening-tools-and-rating-scales
• Centers for Disease Control and Prevention (États-Unis) – CDC’s developmental milestones (en anglais) : www.cdc.gov/ncbddd/actearly/milestones/index.html
• Grille de développement de la communication chez le jeune enfant en bas âge (ITC) : https://firstwords.fsu.edu/pdf/CSBSDP_ITC_French.pdf
Financement
La production de ces lignes directrices a été rendue possible grâce du financement de l’Agence de la santé publique du Canada. Les points de vue exprimés ne reflètent pas nécessairement ceux de l’Agence de la santé publique du Canada.
Conflits d’intérêts potentiels
Le docteur Zwaigenbaum déclare recevoir des honoraires personnels du Comité indépendant de contrôle des données de Roche, hors du contexte du présent manuscrit. Il n’y a pas d’autres divulgations de conflits d’intérêts. Tous les auteurs ont soumis le formulaire de divulgation de conflits d’intérêts potentiels de l’International Committee of Medical Journal Editors. Les conflits que les directeurs de rédaction jugent pertinents dans le cadre du présent manuscrit sont indiqués.
GROUPE DE TRAVAIL DES DIRECTIVES SUR LE TROUBLE DU SPECTRE DE L’AUTISME DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE
Membres : Mark Awuku MD (section de la pédiatrie communautaire de la SCP), Jessica Brian Ph. D. (coprésidente), Susan Cosgrove, Pam Green IP, Elizabeth Grier MD (Le Collège des médecins de famille du Canada), Sophia Hrycko MD (Académie canadienne de psychiatrie de l’enfant et de l’adolescent), Angie Ip MD, James Irvine MD, Anne Kawamura MD (section de la pédiatrie du développement de la SCP), Sheila Laredo MD Ph. D. (Alliance canadienne du trouble du spectre de l’autisme), William Mahoney MD (section de la santé mentale de la SCP), Patricia Parkin MD, Melanie Penner MD, Mandy Schwartz MD, Isabel Smith Ph. D., Lonnie Zwaigenbaum MD (coprésident)
Auteurs principaux : Lonnie Zwaigenbaum MD, Jessica A. Brian Ph. D., Angie Ip MD
Références
- 1. American Psychiatric Association. Manuel diagnostique et statistique des troubles mentaux (DSM-5), 5e édition Elsevier Masson SAS, Issy-les-Moulineaux : APA, 2015. [Google Scholar]
- 2. Bryson SE, Clark BS, Smith IM. First report of a Canadian epidemiological study of autistic syndromes. J Child Psychol Psychiatry 1988;29(4):433–45. [DOI] [PubMed] [Google Scholar]
- 3. Gouvernement du Canada. Trouble du spectre de l’autisme chez les enfants et les adolescents au Canada 2018 : Un rapport du système national de surveillance du trouble du spectre de l’autisme www.canada.ca/fr/sante-publique/services/publications/maladies-et-affections/trouble-spectre-autisme-enfants-adolescents-canada-2018.html (consulté le 18 mars 2019).
- 4. Baio J, Wiggins L, Christensen DL et al. Prevalence of autism spectrum disorder among children aged 8 years – Autism and Developmental Disabilities Monitoring Network, 11 sites, United States, 2014. MMWR Surveill Summ 2018;67(6):1–23. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. Guthrie W, Swineford LB, Nottke C, Wetherby AM. Early diagnosis of autism spectrum disorder : Stability and change in clinical diagnosis and symptom presentation. J Child Psychol Psychiatry 2013;54(5):582–90. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. Daniels AM, Mandell DS. Explaining differences in age at autism spectrum disorder diagnosis : A critical review. Autism 2014;18(5):583–97. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. Kirkovski M, Enticott PG, Fitzgerald PB. A review of the role of female gender in autism spectrum disorders. J Autism Dev Disord 2013;43(11):2584–603. [DOI] [PubMed] [Google Scholar]
- 8. Lai MC, Lombardo MV, Auyeung B, Chakrabarti B, Baron-Cohen S. Sex/gender differences and autism: Setting the scene for future research. J Am Acad Child Adolesc Psychiatry 2015;54(1):11–24. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. Loomes R, Hull L, Mandy WPL. What is the male-to-female ratio in autism spectrum disorder? A systematic review and meta-analysis. J Am Acad Child Adolesc Psychiatry 2017;56(6):466–74. [DOI] [PubMed] [Google Scholar]
- 10. Fett-Conte AC, Bossolani-Martins AL, Rosan DBA. Etiology of autism: The complexity of risk factors in autism spectrum disorder. In: Fitzgerald M., éd. Autism Spectrum Disorder : Recent Advances, 2015. www.intechopen.com/books/autism-spectrum-disorder-recent-advances/etiology-of-autism-the-complexity-of-risk-factors-in-autism-spectrum-disorder (consulté le 18 mars 2019). [Google Scholar]
- 11. Grønborg TK, Schendel DE, Parner ET. Recurrence of autism spectrum disorders in full- and half-siblings and trends over time: A population-based cohort study. JAMA Pediatr 2013;167(10):947–53. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12. Ozonoff S, Young GS, Carter A et al. Recurrence risk for autism spectrum disorders: Baby Siblings Research Consortium Study. Pediatrics 2011;128(3):e488–95. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. Sandin S, Lichtenstein P, Kuja-Halkola R, Larsson H, Hultman CM, Reichenberg A. The familial risk of autism. JAMA 2014;311(17):1770–7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. Mandy W, Lai MC. Annual research review: The role of the environment in the developmental psychopathology of autism spectrum condition. J Child Psychol Psychiatry 2016;57(3):271–92. [DOI] [PubMed] [Google Scholar]
- 15. Masi A, Glozier N, Dale R, Guastella AJ. The immune system, cytokines, and biomarkers in autism spectrum disorder. Neurosci Bull 2017;33(2):194–204. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. Modabbernia A, Velthorst E, Reichenberg A. Environmental risk factors for autism: An evidence-based review of systematic reviews and meta-analyses. Mol Autism 2017;8:13. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17. Wu S, Wu F, Ding Y, Hou J, Bi J, Zhang Z. Advanced parental age and autism risk in children: A systematic review and meta-analysis. Acta Psychiatr Scand 2017;135(1):29–41. [DOI] [PubMed] [Google Scholar]
- 18. Conde-Agudelo A, Rosas-Bermudez A, Norton MH. Birth spacing and risk of autism and other neurodevelopmental disabilities: A systematic review. Pediatrics 2016;137(5):pii:e20153482. [DOI] [PubMed] [Google Scholar]
- 19. Emberti Gialloreti L, Mazzone L, Benvenuto A et al. Risk and protective environmental factors associated with autism spectrum disorder: Evidence-based principles and recommendations. J Clin Med 2019;8(2):pii:E217. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20. Anagnostou E, Zwaigenbaum L, Szatmari P et al. Autism spectrum disorder: Advances in evidence-based practice. CMAJ 2014;186(7):509–19. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21. Zwaigenbaum L, Bauman ML, Stone WL et al. Early identification of autism spectrum disorder: Recommendations for practice and research. Pediatrics 2015;136 (Suppl 1):S10–40. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22. Thurm A, Powell EM, Neul JL, Wagner A, Zwaigenbaum L. Loss of skills and onset patterns in neurodevelopmental disorders: Understanding the neurobiological mechanisms. Autism Res 2018;11(2):212–22. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23. Zwaigenbaum L, Penner M. Autism spectrum disorder: Advances in diagnosis and evaluation. BMJ 2018;361:k1674. [DOI] [PubMed] [Google Scholar]
- 24. Ozonoff S, Heung K, Byrd R, Hansen R, Hertz-Picciotto I. The onset of autism: Patterns of symptom emergence in the first years of life. Autism Res 2008;1(6):320–8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25. Dworkin PH. Detection of behavioral, developmental, and psychosocial problems in pediatric primary care practice. Curr Opin Pediatr 1993;5(5):531–6. [DOI] [PubMed] [Google Scholar]
- 26. Williams R, Clinton J; Société canadienne de pédiatrie, Groupe de travail de la petite enfance Bien faire ce qu’il faut à 18 mois : En appui au bilan de santé amélioré. Paediatr Child Health 2011;16(10):651–4. [Google Scholar]
- 27. Dua K. Standards and Guidelines for the Assessment and Diagnosis of Young Children with Autism Spectrum Disorder in British Columbia: An Evidence-based Report Prepared for the British Columbia Ministry of Health Planning, March 2003 www.phsa.ca/Documents/asd_standards_0318.pdf (consulté le 18 mars 2019).
- 28. Fondation Miriam. Dépistage, évaluation et diagnostic des troubles du spectre de l’autisme chez les enfants en bas âge : Guide des pratiques exemplaires canadiennes www.miriamfoundation.ca/DATA/TEXTEDOC/Handbook-french-webFINAL.pdf (consulté le 18 mars 2019).
- 29. New Zealand Ministy of Health. New Zealand Autism Spectrum Disorder Guideline, 2e éd., 2016. Wellington, NZ: www.moh.govt.nz/autismspectrumdisorder (consulté le 18 mars 2019). [Google Scholar]
- 30. Missouri Autism Guidelines Initiative. Autism Spectrum Disorders : Missouri Best Practice Guidelines for Screening, Diagnosis, and Assessment; A 2010 Consensus Publication www.autismguidelines.dmh.mo.gov (consulté le 18 mars 2019).
- 31. National Institute for Health and Care Excellence. Autism Spectrum Disorder in Under 19s: Recognition, Referral and Diagnosis (Clinical guideline 128). London, UK: NICE, 2011. (mise à jour en décembre 2017). www.nice.org.uk/guidance/cg128 (consulté le 18 mars 2019). [PubMed] [Google Scholar]
- 32. University of Connecticut School of Medicine and Dentistry. Connecticut Guidelines for a Clinical Diagnosis of Autism Spectrum Disorder, 2013. Articles – Patient Care, 45. http://digitalcommons.uconn.edu/pcare_articles/45 (consulté le 18 mars 2019).
- 33. New York State Department Of Health Bureau Of Early Intervention. Best Practice Protocol for Early Screening of Young Children for Autism Spectrum Disorders (ASDs) by Pediatric Primary Care Providers, July 2013 www.health.ny.gov/community/infants_children/early_intervention/autism/docs/best_practice_protocol.pdf (consulté le 25 mars 2019).
- 34. Volkmar F, Siegel M, Woodbury-Smith M, King B, McCracken J, State M; American Academy of Child and Adolescent Psychiatry (AACAP) Committee on Quality Issues (CQI) Practice parameter for the assessment and treatment of children and adolescents with autism spectrum disorder. J Am Acad Child Adolesc Psychiatry 2014;53(2):237–57. [DOI] [PubMed] [Google Scholar]
- 35. Johnson CP, Myers SM; Council on Children With Disabilities Identification and evaluation of children with autism spectrum disorders. Reaffirmed 134(5):E1520. Pediatrics 2007;120(5):1183–1215. [DOI] [PubMed]
- 36. Scottish Intercollegiate Guidelines Network (SIGN). Assessment, Diagnosis and Interventions for Autism Spectrum Disorders. Édimbourg, Écosse: 2016. www.sign.ac.uk (consulté le 18 mars 2019). [Google Scholar]
- 37. Whitehouse AJO, Evans K, Eapen V, Wray J.. A National Guideline for the Assessment and Diagnosis of Autism Spectrum Disorders in Australia. Brisbane, Australie: Autism Cooperative Research Centre (CRC), 2018. [Google Scholar]
- 38. HAS Haute autorité de santé. Autism spectrum disorder: Warning signs, Detection, Diagnosis and Assessment in Children and Adolescents. Best practice guidelines, février 2018. www.has-sante.fr/jcms/c_468812/en/autism-spectrum-disorder-warning-signsdetection-diagnosis-and-assessment-in-children-and-adolescents?cid=fc_1249601&userLang=en&portal=r_1482172&userLang=en (consulté le 2 août 2019). [Google Scholar]
- 39. Moodie S, Daneri P, Goldhagen S, Halle T, Green K, LaMonte L.. Early Childhood Developmental Screening and a Compendium of Measures for Children Ages Birth To Five. Early childhood developmental screening: A compendium of measures for children ages birth to five (OPRE Report 201411). Washington, DC: Office of Planning, Research and Evaluation, Administration for Children and Families, U.S. Department of Health and Human Services, 2014. [Google Scholar]
- 40. Squires J, Twombly E, Bricker D, Potter L.. ASQ-3 User’s Guide, 3e éd Baltimore, MD: Paul H. Brookes Publishing, 1999. [Google Scholar]
- 41. Doig KB, Macias MM, Saylor CF, Craver JR, Ingram PE. The child development inventory: A developmental outcome measure for follow-up of the high-risk infant. J Pediatr 1999;135(3):358–62. [DOI] [PubMed] [Google Scholar]
- 42. Fallucco EM, Wysocki T, James L, Kozikowski C, Williams A, Gleason MM. The brief early childhood screening assessment: Preliminary validity in pediatric primary care. J Dev Behav Pediatr 2017;38(2):89–98. [DOI] [PubMed] [Google Scholar]
- 43. Cairney J, Clinton J, Veldhuizen S. et coll. Evaluation of the revised Nipissing District Developmental Screening (NDDS) tool for use in general population samples of infants and children. BMC Pediatr 2016;16:42. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44. Glascoe FP. Parents’ Evaluation of Developmental Status (PEDS). Nashville, TN: Ellsworth & Vandermeer Press; 2006. [Google Scholar]
- 45. Hampton J, Strand PS. A review of level 2 parent-report instruments used to screen children aged 1.5-5 for autism: A meta-analytic update. J Autism Dev Disord 2015;45(8):2519–30. [DOI] [PubMed] [Google Scholar]
- 46. Stewart LA, Lee LC. Screening for autism spectrum disorder in low- and middle-income countries : A systematic review. Autism 2017;21(5):527–39. [DOI] [PubMed] [Google Scholar]
- 47. Towle PO, Patrick PA. Autism spectrum disorder screening instruments for very young children: A systematic review. Autism Res Treat 2016;2016:4624829. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48. U.S. Preventive Services Task Force. Final Recommendation Statement: Autism Spectrum Disorder in Young Children; Screening September 2017. www.uspreventiveservicestaskforce.org/Page/Document/RecommendationStatementFinal/autism-spectrum-disorder-in-young-children-screening (consulté le 18 mars 2019).
- 49. Robins DL. Screening for autism spectrum disorders in primary care settings. Autism 2008;12(5):537–56. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50. Wetherby AM, Brosnan-Maddox S, Peace V, Newton L. Validation of the infant-toddler checklist as a broadband screener for autism spectrum disorders from 9 to 24 months of age. Autism 2008;12(5):487–511. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51. Swinkels SH, Dietz C, van Daalen E, Kerkhof IH, van Engeland H, Buitelaar JK. Screening for autistic spectrum in children aged 14 to 15 months. I: The development of the Early Screening of Autistic Traits Questionnaire (ESAT). J Autism Dev Disord 2006;36(6):723–32. [DOI] [PubMed] [Google Scholar]
- 52. Oosterling IJ, Wensing M, Swinkels SH et al. Advancing early detection of autism spectrum disorder by applying an integrated two-stage screening approach. J Child Psychol Psychiatry 2010;51(3):250–8. [DOI] [PubMed] [Google Scholar]
- 53. Yuen T, Carter MT, Szatmari P, Ungar WJ. Cost-effectiveness of universal or high-risk screening compared to surveillance monitoring in autism spectrum disorder. J Autism Dev Disord 2018;48(9):2968–79. [DOI] [PubMed] [Google Scholar]
- 54. Durkin MS, Elsabbagh M, Barbaro J et al. Autism screening and diagnosis in low resource settings: Challenges and opportunities to enhance research and services worldwide. Autism Res 2015;8(5):473–6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55. Herlihy LE, Brooks B, Dumont-Mathieu T et al. Standardized screening facilitates timely diagnosis of autism spectrum disorders in a diverse sample of low-risk toddlers. J Dev Behav Pediatr 2014;35(2):85–92. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56. Coury DL. Babies, bathwater, and screening for autism spectrum disorder: Comments on the USPSTF recommendations for autism spectrum disorder screening. J Dev Behav Pediatr 2015;36(9):661–3. [DOI] [PubMed] [Google Scholar]
- 57. Pierce K, Courchesne E, Bacon E. To screen or not to screen universally for autism is not the question: Why the task force got it wrong. J Pediatr 2016;176:182–94. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58. Mandell D, Mandy W. Should all young children be screened for autism spectrum disorder? Autism 2015;19(8):895–6. [DOI] [PubMed] [Google Scholar]
- 59. Rourke L, Leduc D. Relevé postnatal Rourke www.cps.ca/fr/tools-outils/releve-postnatal-rourke (consulté le 18 mars 2019).
- 60.Tonelli M, Parkin P, Brauer et al. ; Groupe d’étude canadien sur les soins de santé préventifs. Recommendations on screening for developmental delay. CMAJ 2016;188(8):579–87. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61. Robins DL, Casagrande K, Barton M, Chen CM, Dumont-Mathieu T, Fein D. Validation of the modified checklist for autism in toddlers, revised with follow-up (M-CHAT-R/F). Pediatrics 2014;133(1):37–45. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62. Constantino JN, Gruber CP.. Social responsiveness scale – Second Edition (SRS-2). Los Angeles, CA: Western Psychological Services, 2012. [Google Scholar]
- 63. Goldstein S, Naglieri JA.. Autism Spectrum Rating Scales (ASRS): Product Overview. Multi-Health Systems, 2009, 2010. www.pearsonclinical.co.uk/Psychology/ChildMentalHealth/ChildAutisticSpectrumDisorders/AutismSpectrumRatingScales/Resources/ASRS-Product-Overview.pdf (consulté le 25 mars 2019) [Google Scholar]
- 64. Stone WL, McMahon CR, Henderson LM. Use of the screening tool for autism in two-year-olds (STAT) for children under 24 months: An exploratory study. Autism 2008;12(5):557–73. [DOI] [PubMed] [Google Scholar]
- 65. Choueiri R, Wagner S. A new interactive screening test for autism spectrum disorders in toddlers. J Pediatr 2015;167(2):460–6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66. Autisme Canada. Guide du médecin sur l’autisme : édition canadienne https://autismcanada.org/resources/physician-handbook/?lang=fr (consulté le 18 mars 2019).
- 67. HANDS in Autism. Toolkit for Medical Professionals: Tips and Supports for Working with Individuals with Autism Spectrum Disorders. Indianapolis, IN: Christian Sarkine Autism Treatment Center, Riley Child & Adolescent Psychiatry Clinic, Indiana University School of Medicine – Department of Psychiatry, 2008. https://handsinautism.iupui.edu/pdf/Toolkit-Intro.pdf (consulté le 18 mars 2019). [Google Scholar]